|
6.
|
Dodaju se sljedeća poglavlja od C.31. do C.46.: „C.31. TEST NA KOPNENOM BILJU: ISPITIVANJE NICANJA I RASTA KLIJANACA
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 208 (2006.). Ispitne se metode periodički preispituju u svjetlu znanstvenoga napretka i primjenjivosti za regulatorne svrhe. Ova ažurirana ispitna metoda namijenjena je ocjenjivanju mogućih učinaka kemikalija na nicanje i rast klijanaca. Kao takva ne obuhvaća kronične učinke ili učinke na razmnožavanje (tj. zametanje sjemena, formiranje cvjetova i sazrijevanje plodova). Kako bi se osigurao odabir primjerenih ispitnih metoda, mora se voditi računa o uvjetima izloženosti i svojstvima kemikalije koja će se ispitivati (npr. kada se ispituju metali/spojevi metala, treba voditi računa o učincima pH-vrijednosti i pripadajućim protuionima) (1). Ovom se ispitnom metodom ne ispituje bilje izloženo parama kemikalija. Ispitna se metoda može primijeniti za ispitivanje kemikalija u općoj uporabi, biocida i proizvoda za zaštitu usjeva (poznatih i kao sredstva za zaštitu bilja ili pesticidi). Razvijena je na temelju postojećih metoda (2) (3) (4) (5) (6) (7). Razmotrena je i ostala literatura koja se odnosi na ispitivanje bilja (8) (9) (10). Upotrijebljene definicije navedene su u Dodatku 1.
|
NAČELO ISPITIVANJA
|
2.
|
Ispitivanjem se ocjenjuju učinci na nicanje klijanaca i rani rast viših biljaka nakon izloženosti ispitivanoj kemikaliji u tlu (ili drugoj prikladnoj matrici tla). Sjeme se stavi u dodir sa zemljom koja je tretirana ispitivanom kemikalijom čiji se učinci ocjenjuju obično nakon 14 do 21 dana nakon što nikne 50 % klijanaca u kontrolnoj skupini. Krajnje točke koje se mjere jesu vizualna procjena nicanja klijanaca, masa suhe tvari izdanka (alternativno masa svježe tvari izdanka) i u određenim slučajevima visina izdanka, kao i procjena vidljivih štetnih učinaka na različite dijelove biljke. Ta se mjerenja i zapažanja uspoređuju s onima kod netretiranih kontrolnih biljaka.
|
|
3.
|
Ovisno o očekivanom putu izlaganja, ispitivana se kemikalija unosi u zemlju (ili eventualno u matricu umjetne zemlje) ili se primjenjuje na površinu zemlje, što pravilno predstavlja mogući put izlaganja kemikaliji. Kemikalija se unosi u zemlju tretiranjem zemlje u rasulu. Nakon primjene kemikalije zemlja se premješta u uzgojne posude, u koje se potom sije sjeme određene biljne vrste. Kod površinske primjene kemikalija se primjenjuje na zemlju u posudama u koju je već posijano sjeme. Ispitne jedinice (kontrole i tretirana zemlja plus sjeme) potom se stavljaju u odgovarajuće uvjete kako bi se potaknulo klijanje/rast biljaka.
|
|
4.
|
Ispitivanje se može provesti kako bi se odredila krivulja doza-odgovor ili kao granični test sa samo jednom koncentracijom / dozom primjene u skladu s ciljem studije. Ako rezultati dobiveni ispitivanjem sa samo jednom koncentracijom / dozom primjene premašuju određenu razinu toksičnosti (npr. uoče li se učinci veći od x %), provodi se ispitivanje za određivanje raspona kako bi se odredile gornja i donja granica toksičnosti, nakon čega se provodi ispitivanje s više koncentracija / doza primjene kako bi se dobila krivulja doza-odgovor. Odgovarajućom statističkom analizom izračunava se učinkovita koncentracija ECx ili učinkovita doza primjene ERx (npr. EC25, ER25, EC50, ER50) za najosjetljiviji parametar ili najosjetljivije parametre koji se ispituju. Osim toga, ovim se ispitivanjem može izračunati najviša koncentracija bez vidljivog učinka (NOEC) i najniža koncentracija s vidljivim učinkom (LOEC).
|
INFORMACIJE O ISPITIVANOJ KEMIKALIJI
|
5.
|
Sljedeće su informacije korisne za utvrđivanje očekivanog puta izloženosti kemikaliji i za planiranje ispitivanja: strukturna formula, čistoća, topljivost u vodi, topljivost u organskim otapalima, koeficijent razdjeljenja 1-oktanol/voda, sorpcijsko ponašanje u tlu, tlak para, kemijska stabilnost u vodi i na svjetlosti te biorazgradivost.
|
VALJANOST ISPITIVANJA
|
6.
|
Da bi ispitivanje bilo valjano, kontrole moraju zadovoljavati sljedeće kriterije uspješnosti:
|
—
|
nicanje klijanaca iznosi najmanje 70 %,
|
|
—
|
klijanci ne pokazuju vidljive fitotoksične učinke (npr. klorozu, nekrozu, uvenuće, deformacije lista i stabljike) i biljke pokazuju uobičajene varijacije u rastu i morfologiji za predmetnu vrstu,
|
|
—
|
srednja stopa preživljavanja izniklih kontrolnih klijanaca iznosi najmanje 90 % tijekom trajanja istraživanja,
|
|
—
|
okolišni su uvjeti za određenu vrstu identični, a uzgojni mediji sadržavaju istu količinu matrice tla, pomoćnih medija ili supstrata iz istog izvora.
|
|
REFERENTNA KEMIKALIJA
|
7.
|
Ispitivanjem referentne kemikalije u redovitim vremenskim razmacima može se provjeriti jesu li se provođenje ispitivanja i odgovor određenih ispitnih biljaka te uvjeti ispitivanja značajno promijenili tijekom vremena. Alternativno se mogu upotrijebiti prijašnja mjerenja biomase ili rasta kontrola kako bi se ocijenila uspješnost ispitnih sustava u pojedinim laboratorijima, a mogu poslužiti i za kontrolu kvalitete unutar laboratorija.
|
OPIS METODE
Prirodno tlo – umjetni supstrat
|
8.
|
Biljke se mogu uzgajati u posudama s pjeskovitom ilovačom, ilovastim pijeskom ili pjeskovito glinastom ilovačom koja sadržava do 1,5 % organskog ugljika (oko 3 % organske tvari). Može se upotrijebiti i komercijalna zemlja za lončanice ili sintetička mješavina zemlje koja sadržava do 1,5 % organskog ugljika. Ne smije se upotrijebiti glinovita zemlja ako je poznato da ispitivana kemikalija ima visoki afinitet za gline. Zemlju s polja treba prosijati na veličinu čestica 2 mm kako bi se homogenizirala i kako bi se uklonile grube čestice. Treba dokumentirati vrstu i teksturu, postotak organskog ugljika, pH te udio soli koji se mjeri kao električna vodljivost konačne pripremljene zemlje. Zemlju treba klasificirati prema standardnoj klasifikacijskoj shemi (11). Zemlja se može pasterizirati ili toplinski obraditi kako bi se smanjio učinak patogena iz tla.
|
|
9.
|
Uporaba prirodne zemlje može otežati tumačenje rezultata i povećati varijabilnost zbog varirajućih fizikalno-kemijskih svojstava i mikrobnih populacija. Te varijable mogu pak izmijeniti sposobnost zadržavanja vlažnosti, sposobnost vezanja kemikalija, dotok zraka te udio hranjivih sastojaka i elemenata u tragovima. Osim varijacija u navedenim fizikalnim faktorima, postojat će i varijacije u kemijskim svojstvima, kao što su pH-vrijednost i redoks-potencijal, koja mogu utjecati na bioraspoloživost ispitivane kemikalije (12) (13) (14).
|
|
10.
|
Umjetni se supstrati u pravilu ne upotrebljavaju za ispitivanje sredstava za zaštitu bilja, ali se mogu upotrijebiti za ispitivanje kemikalija u općoj uporabi ili kad se želi smanjiti varijabilnost prirodnih tala i povećati usporedivost rezultata ispitivanja. Upotrijebljeni se supstrati moraju sastojati od inertnih materijala koji u najvećoj mogućoj mjeri smanjuju interakciju s ispitivanom kemikalijom, nosačem otapala ili jednim i drugim. Pokazalo se da su kremeni pijesak ispran kiselinom, mineralna vuna i staklena zrnca (npr. promjera od 0,35 do 0,85 mm) prikladni inertni materijali koji minimalno apsorbiraju ispitivanu kemikaliju (15), čime se osigurava maksimalna dostupnost kemikalije klijancu putem korijena. Vermikulit, perlit i ostali jaki apsorbenti nisu prikladni supstrati. Potrebno je osigurati nutrijente za rast bilja kako bi se spriječio stres biljaka zbog nutritivnog deficita, koji gdje je moguće treba procijeniti kemijskom analizom ili vizualnim pregledom kontrolnih biljaka.
|
Kriteriji za odabir ispitnih vrsta
|
11.
|
Kako bi se dobio niz odgovora, raspon odabranih vrsta mora biti prilično širok, npr. u smislu njihove taksonomske raznolikosti u carstvu biljaka, njihove rasprostranjenosti, brojnosti, značajki životnog ciklusa koje su specifične za vrstu te područja prirodnog rasta (8) (10) (16) (17) (18) (19) (20). Pri odabiru potrebno je uzeti u obzir sljedeća svojstva mogućih ispitnih vrsta:
|
—
|
vrsta ima ujednačeno sjeme koje se može nabaviti iz pouzdanih izvora standardnog sjemena i koje klija redovito, pouzdano i ujednačeno te daje klijance ujednačenog rasta,
|
|
—
|
biljka se može ispitivati u laboratoriju i može dati pouzdane i obnovljive rezultate, kako unutar istog, tako i u različitim objektima u kojima se provodi ispitivanje,
|
|
—
|
osjetljivost ispitivane vrste mora biti u skladu s reakcijama biljaka koje se mogu pronaći u okolišu izloženom kemikaliji,
|
|
—
|
vrsta je u određenoj mjeri već bila upotrebljavana u prethodnim ispitivanjima toksičnosti i njezino ponašanje u primjerice biološkim ispitivanjima (biotestovima) herbicida, testovima probira na teške metale, testovima na salinitetni ili mineralni stres ili u istraživanjima alelopatije ukazuje na postojanje velikog broja stresora,
|
|
—
|
spojiva je s uvjetima rasta koji su predviđeni ispitnom metodom,
|
|
—
|
ispunjuje kriterije valjanosti ispitivanja.
|
Neke od vrsta koje su se najviše upotrebljavale u dosadašnjim ispitivanjima navedene su u Dodatku 2., a moguće nepoljoprivredne vrste navedene su u Dodatku 3.
|
|
12.
|
Broj vrsta koje će se ispitivati ovisi o odgovarajućim regulatornim zahtjevima pa taj broj nije određen u ovoj ispitnoj metodi.
|
Primjena ispitivane kemikalije
|
13.
|
Kemikaliju treba primijeniti u odgovarajućem nosaču (npr. vodi, acetonu, etanolu, polietilen glikolu, gumi arabici ili pijesku). Mogu se ispitivati i mješavine (formulirani proizvodi ili formulacije) koje sadržavaju aktivne sastojke i različita pomoćna sredstva.
|
Unošenje u tlo / umjetni supstrat
|
14.
|
Kemikalije koje su topljive ili suspendirane u vodi mogu se dodati u vodu, a otopina se potom pomiješa sa zemljom odgovarajućim uređajem za miješanje. Ova vrsta testa može biti primjerena ako do izlaganja kemikaliji dolazi kroz tlo ili pornu vodu i postoji rizik od njezina unošenja putem korijena. Dodavanjem ispitivane kemikalije ne smije se premašiti kapacitet tla za vodu. Količina dodane vode mora biti ista za svaku ispitnu koncentraciju, ali mora biti ograničena kako bi se spriječilo stvaranje grudastih nakupina zemlje.
|
|
15.
|
Kemikalije niske topljivosti u vodi treba otopiti u odgovarajućem hlapljivom otapalu (npr. acetonu, etanolu) te pomiješati s pijeskom. Otapalo se potom može ukloniti iz pijeska mlazom zraka uz stalno miješanje pijeska. Tretirani se pijesak pomiješa s pokusnom zemljom. Priprema se druga kontrola koja se sastoji samo od pijeska i otapala. Svim razinama tretmana i drugoj kontroli dodaju se jednake količine pijeska u koji je otapalo bilo umiješano i potom uklonjeno. U slučaju krutih, netopljivih ispitnih kemikalija u odgovarajućem se uređaju za miješanje pomiješaju suha zemlja i kemikalija. Potom se zemlja dodaje u uzgojne posude i odmah se sije sjeme.
|
|
16.
|
Kada se umjesto zemlje upotrebljava umjetni supstrat, kemikalije topljive u vodi mogu se otopiti u hranjivoj otopini netom prije početka ispitivanja. Kemikalije koje nisu topljive u vodi, ali se mogu suspendirati u vodi uporabom nosača otapala, treba u hranjivu otopinu dodati s nosačem. Kemikalije netopljive u vodi za koje ne postoji netoksični nosač topljiv u vodi potrebno je otopiti u odgovarajućem hlapljivom otapalu. Otopina se pomiješa s pijeskom ili staklenim kuglicama, stavi u okretni vakuumski isparivač gdje isprava, nakon čega na pijesku ili kuglicama ostaje ujednačen sloj kemikalije. Odmjereni dio kuglica ekstrahira se istim organskim otapalom te se odredi količina kemikalije prije punjenja uzgojnih posuda.
|
Površinska primjena
|
17.
|
U slučaju sredstava za zaštitu bilja ispitivana se kemikalija često primjenjuje raspršivanjem ispitne otopine po površini tla. Sva oprema koja se upotrebljava za provođenje ispitivanja, uključujući opremu za pripremanje i primjenu ispitivane kemikalije, mora biti takve izrade i kapaciteta da omogući ispravno provođenje ispitivanja uz obnovljivu pokrivenost. Pokrivenost mora biti ujednačena na svim površinama tla. Potrebno je voditi brigu o tome da se izbjegne mogućnost adsorpcije kemikalija na opremu ili njihove reakcije s opremom (npr. plastične cijevi i lipofilne kemikalije ili čelični dijelovi i elementi). Ispitivana se kemikalija raspršuje po površini tla simuliranjem tipične primjene s pomoću prskalice. Količine koje se raspršuju općenito moraju biti u rasponu količina koje se upotrebljavaju u uobičajenoj poljoprivrednoj praksi i treba ih zabilježiti (količina vode itd.). Treba odabrati takvu vrstu mlaznice koja će osigurati ujednačenu pokrivenost površine tla. Ako se primjenjuju otapala i nosači, treba uspostaviti još jednu skupinu kontrolnih biljaka koje će primati samo otapalo/nosač. To nije potrebno za sredstva za zaštitu bilja koja se ispituju kao formulacije.
|
Verifikacija koncentracije / doze primjene ispitivane kemikalije
|
18.
|
Odgovarajućom analitičkom verifikacijom moraju se potvrditi koncentracije / doze primjene. Za topljive se kemikalije verifikacija svih ispitnih koncentracija / doza primjene može potvrditi analizom ispitne otopine najveće koncentracije, s dokumentacijom o naknadnom razrjeđenju i uporabi kalibrirane opreme za primjenu (npr. kalibrirane analitičke staklene posude i kalibriranje opreme za primjenu škropiva). Za netopljive se kemikalije verifikacija mora poduprijeti masama ispitne kemikalije dodane tlu. Ako je potrebno dokazati homogenost, može biti potrebna analiza tla.
|
POSTUPAK
Plan ispitivanja
|
19.
|
Sjeme iste vrste posije se u uzgojne posude. Broj sjemenki posijanih u pojedinoj posudi ovisit će o vrsti, veličini posude i trajanju ispitivanja. Broj biljaka po posudi mora biti takav da omogući primjerene uvjete rasta i spriječi preveliku gustoću za vrijeme trajanja ispitivanja. Maksimalna gustoća sjemena iznosi oko tri do deset sjemenki na 100 cm2, ovisno o veličini sjemena. Na primjer, preporučuju se jedna do dvije biljke kukuruza, soje, rajčice, krastavca ili šećerne repe po posudi od 15 cm, tri biljke repe ili graška po posudi od 15 cm te pet do deset sjemenki luka, pšenice ili drugog sitnog sjemena po posudi od 15 cm. Broj sjemenki i ponavljanja (ponavljanje se definira kao jedna uzgojna posuda pa biljke u istoj posudi nisu ponavljanje) mora biti takav da osigura optimalnu statističku analizu (21). Valja napomenuti da će varijabilnost biti veća kod ispitnih vrsta za koje se upotrebljava manji broj velikih sjemenki po posudi (ponavljanju) u usporedbi s ispitnim vrstama kod kojih je moguće upotrijebiti veći broj manjih sjemenki po posudi. Sijanjem jednakog broja sjemenki u svaku posudu ta se varijabilnost može smanjiti.
|
|
20.
|
Kontrolne se skupine upotrebljavaju kako bi se osiguralo da se uočeni učinci povezuju isključivo s izloženošću ispitivanoj kemikaliji ili da se pripisuju isključivo toj izloženosti. Odgovarajuća kontrolna skupina mora u svakom pogledu biti identična ispitnoj skupini, osim izloženosti ispitivanoj kemikaliji. Unutar određenog ispitivanja sve ispitne biljke, uključujući kontrole, moraju biti iz istog izvora. Kako bi se izbjegla pristranost, ispitne i kontrolne uzgojne posude potrebno je odrediti slučajnim odabirom.
|
|
21.
|
Treba izbjegavati sjeme tretirano insekticidom ili fungicidom (tj. ‚obloženo’ sjeme). Međutim, neka regulatorna tijela dopuštaju primjenu određenih nesistemičnih kontaktnih fungicida (npr. kaptana i tirama) (22). Ako postoji zabrinutost zbog patogena koji se prenose sjemenjem, sjeme se može kratko namakati u slaboj petpostotnoj otopini hipoklorita i potom temeljito isprati tekućom vodom te osušiti. Nije dopušteno nikakvo kurativno tretiranje drugim sredstvom za zaštitu bilja.
|
Uvjeti ispitivanja
|
22.
|
Uvjeti ispitivanja moraju biti približni uvjetima koji su potrebni za normalan rast ispitivanih vrsta i sorti (u Dodatku 4. navedeni su primjeri uvjeta ispitivanja). Iznikle biljke potrebno je održavati u skladu s dobrom hortikulturnom praksom u kontroliranim uvjetima u komorama, fitotronima ili staklenicima. Ako se upotrebljavaju objekti za rast, ta praksa obično uključuje kontrolu i primjereno često (npr. dnevno) bilježenje temperature, vlažnosti, koncentracije ugljičnog dioksida, svjetlosti (intenzitet, valna duljina, fotosintetički aktivno zračenje) te razdoblja svjetlosti, načina zalijevanja itd. kako bi se osigurao dobar rast biljaka koji se ocjenjuje promatranjem kontrolnih biljaka odabranih vrsta. Temperature u stakleniku potrebno je kontrolirati sustavima ventilacije, grijanja i/ili hlađenja. Za ispitivanja u staklenicima općenito se preporučuju sljedeći uvjeti:
|
—
|
temperatura: 22 °C ± 10 °C;
|
|
—
|
fotoperiod: najmanje 16 sati svjetlosti;
|
|
—
|
intenzitet svjetlosti: 350 ± 50 μE/m2/s. Ako intenzitet padne ispod 200 μE/m2/s, valne duljine 400 – 700 nm, možda će biti potrebno dodatno osvjetljenje, osim za određene vrste čije su potrebe za svjetlošću manje.
|
Tijekom trajanja ispitivanja treba pratiti i bilježiti okolišne uvjete. Biljke je potrebno uzgajati u neporoznim plastičnim ili glaziranim posudama postavljenima na podložak ili tanjurić. Posude se mogu periodično premještati kako bi se smanjila varijabilnost rasta biljaka (zbog razlika u uvjetima ispitivanja unutar objekta za uzgoj). Posude moraju biti dovoljno velike da omoguće normalan rast.
|
|
23.
|
Hranjive tvari tla mogu se prema potrebi dopuniti kako bi se održao dobar vigor biljaka. Potreba za dodatnim hranjivim tvarima i vrijeme njihova dodavanja mogu se procijeniti promatranjem kontrolnih biljaka. Preporučuje se zalijevati ispitne posude odozdo (npr. uporabom vrpci od staklenih vlakana). Međutim, prvo zalijevanje može biti površinsko kako bi se potaknulo klijanje sjemena i, kad je riječ o sredstvu koje se primjenjuje po površini tla, kako bi se olakšalo prodiranje kemikalije u tlo.
|
|
24.
|
Specifični uvjeti rasta moraju biti primjereni za ispitnu vrstu i ispitivanu kemikaliju. Kontrolne i tretirane biljke moraju se držati u istim okolišnim uvjetima, ali treba poduzeti odgovarajuće mjere za sprječavanje unakrsne izloženosti (npr. zbog hlapljivih kemikalija) među različitim tretmanima, kao i izloženosti kontrola ispitivanoj kemikaliji.
|
Ispitivanje s jednom koncentracijom / dozom primjene
|
25.
|
Pri određivanju odgovarajuće koncentracije / doze primjene kemikalije koja će se upotrijebiti u testu s jednom koncentracijom ili dozom primjene (test izazova / granični test) mora se uzeti u obzir više faktora. Kad je riječ o kemikalijama u općoj uporabi, ti faktori uključuju njihova fizikalno-kemijska svojstva. Kad je riječ o sredstvima za zaštitu bilja, potrebno je uzeti u obzir fizikalno-kemijska svojstva i obrazac uporabe ispitivane kemikalije, njezinu maksimalnu koncentraciju ili dozu primjene, broj primjena po sezoni i/ili njezinu postojanost. Da bi se odredilo ima li kemikalija u općoj uporabi fitotoksična svojstva, može biti primjereno ispitati maksimalnu količinu od 1 000 mg/kg suhog tla.
|
Ispitivanje za određivanje raspona
|
26.
|
Prema potrebi može se provesti ispitivanje za određivanje raspona kako bi se dobile smjernice o tome koje bi koncentracije / doze primjene trebalo ispitati u glavnom istraživanju odnosa između doze i odgovora. Kod ispitivanja za određivanje raspona potrebno je odabrati ispitne koncentracije / doze primjene sa širokim intervalima (npr. 0,1, 1,0, 10, 100 i 1 000 mg/kg suhog tla). Ako je riječ o sredstvima za zaštitu bilja, koncentracije / doze primjene mogu se temeljiti na preporučenoj ili maksimalnoj koncentraciji odnosno dozi primjene, npr. 1/100, 1/10, 1/1 preporučene/maksimalne koncentracije ili doze primjene.
|
Ispitivanje s više koncentracija / doza primjene
|
27.
|
Svrha je ispitivanja s više koncentracija / doza primjene utvrditi odnos između doze i odgovora te odrediti vrijednost ECx ili ERx za nicanje, biomasu i/ili vizualne učinke u usporedbi s neizloženim kontrolama, kako to zahtijevaju regulatorna tijela.
|
|
28.
|
Broj i interval između koncentracija ili doza primjene moraju biti dovoljni da se može pouzdano utvrditi odnos između doze i odgovora i regresijska jednadžba te procijeniti vrijednost ECx. ili ERx.. Odabrane koncentracije / doze primjene moraju obuhvaćati vrijednosti ECx ili ERx koje je potrebno odrediti. Na primjer, ako se traži vrijednost EC50, poželjno je provesti ispitivanje s dozama primjene koje proizvode 20-postotni do 80-postotni učinak. Da bi se to postiglo, preporučuje se najmanje pet ispitnih koncentracija / doza primjene u geometrijskom nizu, plus netretirana kontrola, s faktorom ne većim od tri. Za svaku ispitnu i kontrolnu skupinu potrebna su najmanje četiri ponavljanja, a ukupan broj sjemenki mora iznositi najmanje 20. Za određene biljke koje imaju nizak stupanj klijavosti ili promjenjive značajke rasta ponekad je potrebno više ponavljanja kako bi se povećala statistička snaga ispitivanja. Ako se upotrebljava veći broj ispitnih koncentracija / doza primjene, broj ponavljanja može se smanjiti. Ako treba odrediti NOEC, možda će biti potrebno više ponavljanja kako bi se postigla željena statistička snaga (23).
|
Promatranja
|
29.
|
Razdoblje promatranja, tj. 14 do 21 dan nakon što nikne 50 % kontrolnih biljaka (i kontrola s otapalom, ako je primjenjivo), biljke se učestalo promatraju (najmanje jednom tjedno, a po mogućnosti svakodnevno) kako bi se provjerilo njihovo nicanje te ima li vidljivih znakova fitotoksičnosti i slučajeva uginuća. Na kraju ispitivanja treba zabilježiti izmjereni postotak nicanja te biomasu preživjelih biljaka, kao i štetne učinke vidljive na različitim dijelovima biljke. Štetni učinci uključuju anomalije u izgledu izniklih klijanaca, zakržljali rast, promjenu boje, uginuće te učinke na razvoj biljke. Konačna se biomasa može izmjeriti primjenom konačne prosječne mase suhe tvari izdanka preživjelih biljaka, i to tako da se izdanci uberu pri površini tla te suše do stalne mase na temperaturi od 60 °C. Alternativno, konačna se biomasa može izmjeriti na temelju mase svježe tvari. Druga krajnja točka može biti visina izdanka, ako to zahtijevaju regulatorna tijela. Za ocjenjivanje uočenih toksičnih odgovora potrebno je primjenjivati ujednačeni sustav ocjenjivanja. Praktični primjeri kvalitativnih i kvantitativnih vizualnih ocjenjivanja navedeni su u literaturi (23) (24).
|
PODACI I IZVJEŠĆIVANJE
Statistička analiza
Ispitivanje s jednom koncentracijom / dozom primjene
|
30.
|
Primjerenom statističkom metodom potrebno je analizirati podatke za svaku biljnu vrstu (21). Potrebno je izvijestiti o razini učinka pri ispitnoj koncentraciji / dozi primjene ili o nepostizanju određenog učinka pri ispitnoj koncentraciji / dozi primjene (npr. < x % učinka uočenog pri koncentraciji / dozi primjene y)
|
Ispitivanje s više koncentracija / doza primjene
|
31.
|
Odnos između doze i odgovora utvrđuje se regresijskom jednadžbom. Mogu se upotrijebiti različiti modeli: na primjer, za procjenu vrijednosti ECx ili ERx (npr. EC25, ER25, EC50, ER50) i njihovih granica pouzdanosti za nicanje, u obliku kvantalnih podataka, mogu biti prikladni modeli logit, probit i Weibull te Spearman-Karberova metoda i modificirana Spearman-Karberova metoda. Za rast klijanaca (masa i visina) kao stalnih krajnjih točaka, ECx ili ERx i njihove granice pouzdanosti mogu se procijeniti primjenom odgovarajuće regresijske analize (npr. Bruce-Versteegove nelinearne regresijske analize (25)). Kad je god moguće, vrijednost R2 trebala bi iznositi 0,7 ili više za najosjetljivije vrste, a upotrijebljene ispitne koncentracije / doze primjene moraju obuhvaćati 20 % do 80 % učinaka. Ako je potrebno procijeniti NOEC, poželjno je primijeniti snažne statističke testove koje treba odabrati na temelju distribucije podataka (21) (26).
|
Izvješće o ispitivanju
|
32.
|
U izvješću o ispitivanju potrebno je navesti rezultate ispitivanja te detaljan opis uvjeta ispitivanja, iscrpnu raspravu o rezultatima, analizu podataka i zaključke izvučene iz analize. Potrebno je navesti sažetak u obliku tablice i sintezu rezultata. Izvješće mora sadržavati sljedeće:
|
|
Ispitivana kemikalija:
|
—
|
podaci za identifikaciju kemikalije, relevantna svojstva ispitivane kemikalije (npr. log Pow, topljivost u vodi, tlak para te podaci o sudbini i ponašanju u okolišu, ako su dostupni),
|
|
—
|
pojedinosti o pripremi ispitne otopine i verifikaciji ispitnih koncentracija, kako je navedeno u stavku 18.
|
|
|
|
Ispitne vrste:
|
—
|
pojedinosti o ispitnom organizmu: vrsta/sorta, biljne porodice, znanstveni i uobičajeni nazivi, izvor i povijest sjemena što je moguće detaljnije (tj. ime dobavljača, postotak klijavosti, kategorija veličine sjemena, broj serije ili partije, sjemena godina ili vegetacijsko razdoblje u kojemu je prikupljeno, datum ocjenjivanja klijavosti), vitalnost itd.,
|
|
—
|
broj ispitanih vrsta jednosupnica i dvosupnica,
|
|
—
|
razlozi za odabir vrsta,
|
|
—
|
opis skladištenja, tretiranja i održavanja sjemena.
|
|
|
|
Uvjeti ispitivanja:
|
—
|
objekt u kojemu se provelo ispitivanje (npr. uzgojna komora, fitotron i staklenik),
|
|
—
|
opis ispitnog sustava (npr. dimenzije uzgojnih posuda, materijal od kojeg su napravljene uzgojne posude te količine zemlje),
|
|
—
|
svojstva zemlje (tekstura ili vrsta zemlje: distribucija i klasifikacija čestica zemlje, fizikalna i kemijska svojstva, uključujući postotak organske tvari, postotak organskog ugljika i pH);
|
|
—
|
priprema zemlje/supstrata (npr. tlo, umjetno tlo, pijesak i ostalo) prije ispitivanja,
|
|
—
|
opis hranjivog medija, ako je upotrijebljen,
|
|
—
|
primjena ispitivane kemikalije: opis metode primjene, opis opreme, doza izloženosti i količina, uključujući kemijski provjeru, opis metode umjeravanja i opis okolišnih uvjeta tijekom primjene,
|
|
—
|
uvjeti rasta: intenzitet svjetlosti (npr. PAR, fotosintetički aktivno zračenje), fotoperiod, najviše/najniže temperature, raspored i metoda zalijevanja, gnojenje,
|
|
—
|
broj sjemenki po uzgojnoj posudi, broj biljaka po dozi, broj ponavljanja (uzgojnih posuda) po dozi izloženosti,
|
|
—
|
vrsta i broj kontrola (negativne i/ili pozitivne kontrole te kontrola s otapalom, ako je upotrijebljena),
|
|
|
|
Rezultati:
|
—
|
tablica svih krajnjih točaka za svako ponavljanje, ispitnu koncentraciju / stupanj i vrstu,
|
|
—
|
broj i postotak izniklih klijanaca u usporedbi s kontrolama,
|
|
—
|
mjerenja biomase biljaka (suha ili svježa masa izdanaka) izražena kao postotak kontrola,
|
|
—
|
visine izdanaka biljaka izražene kao postotak kontrola, ako su izmjerene,
|
|
—
|
postotak vidljivih oštećenja te kvalitativan i kvantitativan opis vidljivih oštećenja (kloroza, nekroza, uvenuće, deformacije lista i stabljike, kao i svako nepostojanje učinaka) koje je uzrokovala ispitna kemikalija, u usporedbi s kontrolnim biljkama,
|
|
—
|
opis ljestvice ocjenjivanja primijenjene za procjenu vidljivih oštećenja, ako se izvješćuje o vizualnom ocjenjivanju,
|
|
—
|
za ispitivanja s jednom dozom primjene treba navesti postotak oštećenja,
|
|
—
|
vrijednosti ECx ili ERx (npr. EC50, ER50, EC25, ER25) i pripadajuće granice pouzdanosti. Ako se provodi regresijska analiza, navodi se standardna pogreška za regresijsku jednadžbu te standardna pogreška za procjenu pojedinačnih parametara (npr. nagiba, sjecišta),
|
|
—
|
vrijednosti NOEC (i LOEC) ako su izračunane,
|
|
—
|
opis primijenjenih statističkih postupaka i pretpostavki,
|
|
—
|
grafički prikaz navedenih podataka i odnosa između doze i odgovora ispitnih vrsta.
|
|
Odstupanja od postupaka opisanih u ovoj ispitnoj metodi i sve neuobičajene pojave tijekom ispitivanja.
|
LITERATURA
|
(1)
|
Schrader G., Metge K. i Bahadir M. (1998.) Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189 – 193.
|
|
(2)
|
International Organisation of Standards. (1993.) ISO 11269-1. Soil Quality – Determination of the Effects of Pollutants on Soil Flora – Part 1: Method for the Measurement of Inhibition of Root Growth.
|
|
(3)
|
International Organisation of Standards. (1995.) ISO 11269-2. Soil Quality – Determination of the Effects of Pollutants on Soil Flora – Part 2: Effects of Chemicals on the Emergence and Growth of Higher Plants.
|
|
(4)
|
American Standard for Testing Material (ASTM). (2002.) E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
US EPA. (1982.) FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
|
|
(6)
|
US EPA. (1996.) OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background – Non-target Plant Testing;
|
|
—
|
850.4025: Target Area Phytotoxicity;
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850.4225: Seedling Emergence, Tier II;
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR, X31-201. (1982.) Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1. (1993.) Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K. E. i Keddy, C. J. (1993.) Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No. 145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Canada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C. i Zwerger, P. (1997.) Effects of Plant Protection Products on Non-Target Organisms – A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. No. 48.
|
|
(10)
|
Hale, B., Hall, J. C., Solomon, K. i Stephenson, G. (1994.) A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario Canada.
|
|
(11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985.) i Soil Sc. Soc. Amer. Proc. 26:305 (1962.)
|
|
(12)
|
Audus, L. J. (1964.) Herbicide behaviour in the soil. In: Audus, L. J. ed. The Physiology and biochemistry of Herbicides, London, New York, Academic Press, NY, poglavlje 5., str. 163. – 206.
|
|
(13)
|
Beall, M. L., Jr. i Nash, R. G. (1969.) Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571-575.
|
|
(14)
|
Beetsman, G. D., Kenney, D. R. i Chesters, G. (1969.) Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247-250.
|
|
(15)
|
U. S. Food and Drug Administration (FDA). (1987.) Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, str. 14, FDA, Washington, DC.
|
|
(16)
|
McKelvey, R. A., Wright, J. P., Honegger, J. L. i Warren, L. W. (2002.) A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161-1174
|
|
(17)
|
Boutin, C.; Elmegaard, N. i Kjær, C. (2004.) Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349 – 369.
|
|
(18)
|
Boutin, C. i Rogers, C. A. (2000.) Patterns of sensitivity of plant species to various herbicides – An analysis with two databases. Ecotoxicology vol. 9(4):255-271.
|
|
(19)
|
Boutin, C. i Harper, J. L. (1991.) A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155-271.
|
|
(20)
|
Boutin, C., Lee, H. B., Peart, T. E., Batchelor, S. P. i Maguire, R. J.. (2000.) Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532 – 2541.
|
|
(21)
|
OECD (2006.) Draft Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment No. 54, Organisation for Economic Co-operation and Development, Paris.
|
|
(22)
|
Hatzios, K. K. i Penner, D. (1985.) Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1-63.
|
|
(23)
|
Hamill, P. B., Marriage, P. B. i Friesen, G. (1977.) A method for assessing herbicide performance in small plot experiments. Weed Science 25:386-389.
|
|
(24)
|
Frans, R. E. i Talbert, R. E. (1992.) Design of field experiments and the measurement and analysis of plant response. In: B. Truelove (Ed.) Research Methods in Weed Science, 2. izdanje, Southern weed Science Society, Auburn, 15 – 23.
|
|
(25)
|
Bruce, R. D. i Versteeg, D. J. (1992.) A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485 – 1492.
|
|
(26)
|
Poglavlje C.33. ovog Priloga: Test reproduktivne toksičnosti na gujavicama (Eisenia fetida/Eisenia andrei).
|
Dodatak 1.
Definicije
|
|
Aktivni sastojak (a. s.) (ili aktivna tvar (a. t.)): materijal namijenjen postizanju posebnog biološkog učinka (npr. suzbijanje kukaca, suzbijanje bolesti bilja, suzbijanje korova na području tretiranja), poznat i kao tehnički aktivni sastojak ili tehnička aktivna tvar.
|
|
|
Kemikalija znači tvar ili smjesa.
|
|
|
Proizvodi za zaštitu usjeva (PZU) ili sredstva za zaštitu bilja (SZB) ili pesticidi: materijali koji imaju specifično biološko djelovanje i namjerno se primjenjuju radi zaštite usjeva od nametnika (npr. gljivičnih bolesti, kukaca i kompetitivnih biljaka).
|
|
|
ECx. koncentracija s x-postotnim učinkom ili ERx. doza s x-postotnim učinkom: koncentracija ili doza koja dovodi do x-postotne neželjene promjene u ispitnoj krajnjoj točki koja se mjeri u odnosu na kontrolu (npr. 25-postotno ili 50-postotno smanjenje broja izniklih klijanaca, mase izdanaka, konačnog broja prisutnih biljaka ili 25-postotno ili 50-postotno povećanje vidljivih oštećenja daje EC25/ER25 odnosno EC50/ER50).
|
|
|
Nicanje: pojava koleoptila ili kotiledona iznad površine tla.
|
|
|
Formulacija: komercijalno formulirano sredstvo koje sadržava aktivnu tvar (aktivni sastojak), poznato i kao konačni pripravak (8) ili tipični proizvod za krajnju uporabu (eng. typical end-use product (TEP)).
|
|
|
LOEC (najniža koncentracija s vidljivim učinkom): najniža koncentracija ispitivane kemikalije pri kojoj je uočen učinak. U ovom ispitivanju koncentracija koja odgovara LOEC-u ima statistički značajan učinak (p < 0,05) unutar zadanog razdoblja izloženosti u usporedbi s kontrolom i veća je od vrijednosti NOEC-a.
|
|
|
Biljke koje ne pripadaju ciljanoj skupini: biljke izvan područja na kojemu se nalaze ciljane biljke. Kad je riječ o sredstvima za zaštitu bilja, to se obično odnosi na biljke izvan područja na kojemu se provodi tretiranje.
|
|
|
NOEC (najviša koncentracija bez vidljivog učinka): najviša koncentracija ispitivane kemikalije pri kojoj nije uočen nikakav učinak. U ovom ispitivanju koncentracija koja odgovara NOEC-u nema statistički značajan učinak (p < 0,05) unutar zadanog razdoblja izloženosti u usporedbi s kontrolom.
|
|
|
Fitotoksičnost: štetna odstupanja (prema izmjerenim vrijednostima ili vizualnoj procjeni) od normalnog izgleda i načina rasta biljaka koja se javljaju kao reakcija na određenu kemikaliju.
|
|
|
Ponavljanje: pokusna jedinica koja predstavlja kontrolnu skupinu i/ili skupinu koja se tretira. U ovom se ispitivanju uzgojna posuda definira kao ponavljanje.
|
|
|
Vizualna procjena: ocjenjivanje vidljivih oštećenja na temelju promatranja sklopa i vigora biljaka, deformacija, kloroze, nekroze i cjelokupnog izgleda u usporedbi s kontrolom.
|
|
|
Ispitivana kemikalija: bilo koja tvar ili smjesa ispitivana primjenom ove ispitne metode.
|
Dodatak 2.
Popis vrsta koje se obično upotrebljavaju u ispitivanjima na biljkama
|
Porodica
|
Vrsta
|
Uobičajeni nazivi
|
|
DICOTYLEDONAE
|
|
Apiaceae (Umbelliferae)
|
Daucus carota
|
Mrkva
|
|
Asteraceae (Compositae)
|
Helianthus annuus
|
Suncokret
|
|
Asteraceae (Compositae)
|
Lactuca sativa
|
Zelena salata
|
|
Brassicaceae (Cruciferae)
|
Sinapis alba
|
Gorušica bijela
|
|
Brassicaceae (Cruciferae)
|
Brassica campestris var. chinensis
|
Kineski kupus
|
|
Brassicaceae (Cruciferae)
|
Brassica napus
|
Uljana repica
|
|
Brassicaceae (Cruciferae)
|
Brassica oleracea var. capitata
|
Kupus
|
|
Brassicaceae (Cruciferae)
|
Brassica rapa
|
Postrna repa
|
|
Brassicaceae (Cruciferae)
|
Lepidium sativum
|
Vrtni borovnjak
|
|
Brassicaceae (Cruciferae)
|
Raphanus sativus
|
Rotkvica
|
|
Chenopodiaceae
|
Beta vulgaris
|
Šećerna repa
|
|
Cucurbitaceae
|
Cucumis sativus
|
Krastavac
|
|
Fabaceae (Leguminosae)
|
Glycine max (G. soja)
|
Soja za zrno
|
|
Fabaceae (Leguminosae)
|
Phaseolus aureus
|
Mungo grah
|
|
Fabaceae (Leguminosae)
|
Phaseolus vulgaris
|
Grah
|
|
Fabaceae (Leguminosae)
|
Pisum sativum
|
Grašak
|
|
Fabaceae (Leguminosae)
|
Trigonella foenum-graecum
|
Piskavica (grčka djetelina)
|
|
Fabaceae (Leguminosae)
|
Lotus corniculatus
|
Smiljkita roškasta
|
|
Fabaceae (Leguminosae)
|
Trifolium pratense
|
Djetelina crvena
|
|
Fabaceae (Leguminosae)
|
Vicia sativa
|
Grahorica jara
|
|
Linaceae
|
Linum usitatissimum
|
Lan
|
|
Polygonaceae
|
Fagopyrum esculentum
|
Heljda
|
|
Solanaceae
|
Solanum lycopersicon
|
Rajčica
|
|
MONOCOTYLEDONAE
|
|
Liliaceae (Amarylladaceae)
|
Allium cepa
|
Luk
|
|
Poaceae (Gramineae)
|
Avena sativa
|
Zob
|
|
Poaceae (Gramineae)
|
Hordeum vulgare
|
Ječam
|
|
Poaceae (Gramineae)
|
Lolium perenne
|
Ljulj engleski
|
|
Poaceae (Gramineae)
|
Oryza sativa
|
Riža
|
|
Poaceae (Gramineae)
|
Secale cereale
|
Raž
|
|
Poaceae (Gramineae)
|
Sorghum bicolor
|
Stočni sirak
|
|
Poaceae (Gramineae)
|
Triticum aestivum
|
Pšenica
|
|
Poaceae (Gramineae)
|
Zea mays
|
Kukuruz
|
Dodatak 3.
Popis mogućih nepoljoprivrednih vrsta
Vrste koje je prema OECD-u moguće upotrebljavati za ispitivanje toksičnosti za bilje
Napomena: U sljedećoj su tablici navedeni podaci za 52 nepoljoprivredne vrste (kod svakog je unosa u zagradama navedeno upućivanje na literaturu). Navedene stope nicanja uzete su iz objavljene literature i služe samo za opću orijentaciju. Pojedinačno iskustvo može varirati ovisno o izvoru sjemena i drugim faktorima.
|
PORODICA Botanički naziv vrste
(Uobičajeni hrvatski naziv)
|
Životni vijek (9) i stanište
|
Težina sjemena
(mg)
|
Fotoperiod za klijanje ili rast (10)
|
Dubina sadnje
(mm) (11)
|
Vrijeme potrebno za klijanje
(u danima) (12)
|
Posebna obrada (13)
|
Test toksičnosti (14)
|
Dobavljači sjemena (15)
|
Ostala upućivanja (16)
|
|
APIACEAE
Torilis japónica
(kimljen divlji)
|
J, D poremećena područja, živice, pašnjaci (16, 19)
|
1,7 – 1,9 (14, 19)
|
L = D (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
hladna stratifikacija (7, 14, 18, 19), može biti potrebno dozrijevanje (19), klijanje inhibirano tamom (1, 19), nikakva posebna obrada (5)
|
POST (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(tratinčica)
|
V
travnjaci, oranice, ledine (16, 19)
|
0,09 – 0,17 (4, 19)
|
L = D (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
zračenje ne utječe na klijanje (18, 19), nikakva posebna obrada (4, 14)
|
POST (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(različak)
|
J
polja, uz ceste, otvorena staništa (16)
|
4,1 – 4,9 (4, 14)
|
L = D (14)
|
0 – 3 (2, 4, 14)
|
14 – 21 (100 %) (14)
|
nikakva posebna obrada (2, 4)
|
POST (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(crna zečina)
|
V
polja, uz ceste, otvorena staništa (16, 19)
|
2,4 – 2,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
može biti potrebno dozrijevanje (18, 19), klijanje inhibirano tamom (19), nikakva posebna obrada (5, 14, 26)
|
POST (5, 22, 26)
|
A
|
|
|
Inula helenium
(pravi oman)
|
V
vlažna, poremećena mjesta
(16)
|
1 – 1,3 (4, 14, 29)
|
|
0
(4, 29)
|
|
nikakva posebna obrada (4)
|
POST (4)
|
A, F
|
|
|
Leontodon hispidus
(lavlji zub)
|
V
polja, uz ceste, poremećena područja (16, 19)
|
0,85 – 1,2 (14, 19)
|
L = D (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
klijanje inhibirano tamom (17, 18, 19), nikakva posebna obrada (5, 23)
|
POST (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(crnooka pupavica)
|
D, V poremećena područja
(16)
|
0,3 (4, 14)
|
L = D (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
nikakva posebna obrada
(4, 14, 33)
|
POST (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(gustocvjetna zlatnica)
|
V
pašnjaci, otvorena područja (16)
|
0,06 – 0,08 (4, 14)
|
L = D (11)
|
0
(4)
|
14 – 21
(11)
|
pomiješati s jednakom količinom pijeska i namakati u 500 ppm GA 24 sata (11), nikakva posebna obrada (4)
|
POST (4)
|
E, F
|
|
|
Xanthium pensylvanicum
(dikica)
|
J
polja, otvorena staništa (16)
|
25 – 61 (14, 29)
|
|
0 (1)
5 (29)
|
|
klijanje može biti inhibirano tamom (1), namakati u toploj vodi 12 sati (29)
|
PRE i POST (31)
|
A
|
|
|
Xanthium spinosum
(trnovita dikica)
|
J
otvorena staništa (16)
|
200 (14)
|
L = D (14)
L > D (6)
|
10
(6)
|
|
skarifikacija (14), nikakva posebna obrada (6)
|
PRE i POST (6)
|
A
|
|
|
Xanthium strumarium
(obična dikica)
|
J
polja, otvorena staništa (16)
|
67,4 (14)
|
L = D (14)
|
10 – 20 (6, 21)
|
|
nikakva posebna obrada
(6, 14, 21)
|
PRE i POST (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Cardamine pratensis
(livadna režuha)
|
V
polja, uz ceste, livade (16, 19)
|
0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
klijanje inhibirano tamom (18, 19), nikakva posebna obrada (5, 14, 22)
|
POST (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
(drijemnina)
|
V
(16)
|
0,21 (14)
|
L = D (14)
|
|
< 14 (100 %) (14, 25)
|
može biti potrebno dozrijevanje (18), nikakva posebna obrada (5, 14, 15, 22 – 26)
|
POST (5, 15, 22 – 26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(bijela loboda)
|
J
rubovi polja, poremećena područja (16, 19)
|
0,7 – 1,5 (14, 19, 34)
|
L = D (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
obrada se razlikuje ovisno o boji sjemena (19), dormantnost pri suhom skladištenju (19), klijanje inhibirano tamom (1, 18, 19), hladna stratifikacija (18), nikakva posebna obrada (14, 34)
|
PRE i POST (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(rupičasta pljuskavica)
|
V
polja, oranice, otvorena staništa (16, 19)
|
0,1 – 0,23
(14, 19)
|
L = D
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
klijanje inhibirano tamom (1, 18, 19),
nikakva posebna obrada (5, 14, 15, 25, 27)
|
POST
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
(vrtni slak)
|
J
uz ceste, otvorena staništa, kukuruzna polja (16)
|
28,2
(14)
|
L > D
(6, 10)
|
10 – 20
(6, 10, 21)
|
4 (100 %)
(10)
|
zračenje ne utječe na klijanje (1),
nikakva posebna obrada (6, 21)
|
PRE i POST
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
(okruglasti oštrik)
|
V
oranice, pašnjaci, uz ceste (16, 30)
|
0,2
(14)
|
L = D
(14)
|
0 (1)
10 – 20 (6, 10)
|
12 (91 %)
(10)
|
klijanje inhibirano tamom (1),
nikakva posebna obrada (6, 10, 14)
|
PRE i POST
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
(smiljkita roškasta)
|
V
travnata područja, uz ceste, otvorena staništa (16, 19)
|
1 – 1,67
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
skarifikacija (14, 19),
zračenje ne utječe na klijanje (18, 19), nikakva posebna obrada (23, 25)
|
POST
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(sena)
|
J
vlažne šume (16)
|
23 – 28
(9)
|
L = D (14)
L > D (9)
|
10 – 20
(6, 9)
|
|
namakati sjeme u vodi 24 sata (9),
skarifikacija (14), vijabilnost sjemena razlikuje se ovisno o boji (1), nikakva posebna obrada (6)
|
POST
(6, 9)
|
A
|
|
|
Sesbania exaltata
(konoplja)
|
J
aluvijalno tlo (16)
|
11 – 13
(9, 14)
|
L > D (9)
|
10 – 20
(9, 21)
|
|
namakati sjeme u vodi 24 sata (9),
zračenje ne utječe na klijanje (1), nikakva posebna obrada (21)
|
PRE i POST
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(djetelina crvena)
|
V
polja, uz ceste, oranice (16, 19)
|
1,4 – 1,7
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
skarifikacija (14, 18),
može biti potrebno dozrijevanje (19), zračenje ne utječe na klijanje (1, 19), nikakva posebna obrada (5)
|
POST
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(prava srčenica)
|
V
otvorena područja (16)
|
0,75 – 1,0
(4, 14)
|
L = D (14)
|
0
(4)
|
|
nikakva posebna obrada
(4, 14)
|
POST
(4)
|
F
|
|
|
Mentha spicata
(klasasta metvica)
|
V
vlažna područja (16)
|
2,21
(4)
|
|
0
(4)
|
|
nikakva posebna obrada
(4)
|
POST
(4)
|
F
|
|
|
Nepeta cataria
(prava mačja metvica)
|
V
poremećena područja (16)
|
0,54
(4, 14)
|
L = D (14)
|
0
(4)
|
|
nikakva posebna obrada
(2, 4, 14)
|
POST
(2, 4)
|
F
|
|
|
Prunella vulgaris
(obična celinščica)
|
V
oranice, travnata područja, poremećena mjesta (16, 19)
|
0,58 – 1,2
(4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
5 (50 %) (19)
7 (91 %) (18)
|
klijanje inhibirano tamom (18, 19),
veća klijavost kod većih sjemenki (1 ), nikakva posebna obrada (4, 14, 22)
|
POST
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(ljekoviti čistac)
|
V
travnjaci, rubovi polja (19)
|
14 – 18
(14, 19)
|
L = D (14)
|
|
7 (50 %)
(19)
|
nikakva posebna obrada
(5, 14, 22)
|
POST
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilón theophrasti
(Teofrastov mračnjak)
|
J
polja, otvorena staništa (16)
|
8,8
(14)
|
L = D (14)
|
10 – 20
(6, 10, 21)
|
4 (84 %)
(10)
|
skarifikacija (14),
nikakva posebna obrada (5, 10, 21)
|
PRE i POST
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(/)
|
J
polja, uz ceste (16)
|
3,8
(14)
|
L = D (14)
|
10 – 20
(6, 21)
|
|
skarifikacija (14),
zračenje ne utječe na klijanje (1), nikakva posebna obrada (6, 21)
|
PRE i POST
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(mak turčinak)
|
J
polja, oranice, poremećena mjesta (16, 19)
|
0,1 – 0,3
(4, 14, 19, 29)
|
L = D (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
hladna stratifikacija i skarifikacija (1, 19, 32),
nikakva posebna obrada (4, 14, 29)
|
POST
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis
(obična rosulja)
|
tratine, pašnjaci (16)
|
0,07 (14)
|
L > D (Ю)
|
20 (10)
|
10 (62 %) (10)
|
klijanje inhibirano tamom (1, 17 – 19), nikakva posebna obrada (10)
|
POST (10)
|
A, E
|
|
|
Alopecurus myosuroides
(poljski repak)
|
J
polja, otvorena staništa (16)
|
0,9 – 1,6
(29, 34)
|
L = D (14)
|
2
(29)
|
< 24 (30 %) (34)
|
skarifikacija (14), tretirati sa 101 mg/l KNO3 (14), topla stratifikacija (1) klijanje inhibirano tamom (1) nikakva posebna obrada (34)
|
PRE i POST
(28, 34)
|
A
|
32
|
|
Avena fatua
(štura zob)
|
J
obrađena područja, otvorena staništa (16)
|
7 – 37,5 (14, 30)
|
L = D (14)
L > D (6)
|
10 – 20 (6, 10)
|
3 (70 %) (18)
|
skarifikacija (7, 32), tama inhibira klijanje (1),
hladna stratifikacija (1, 18), nikakva posebna obrada (6, 10, 14)
|
PRE i POST (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(krovni ovsik)
|
J
polja, uz ceste, oranice (16)
|
0,45 – 2,28 (14, 29)
|
L = D (14)
|
3 (29)
|
|
razdoblje dozrijevanja (1, 7, 32), klijanje inhibirano svjetlošću (1), nikakva posebna obrada (14)
|
PRE i POST (28, 31)
|
A
|
|
|
Cynosurus cristatus
(livadni krestac)
|
V
polja, uz ceste, otvorena staništa (16, 19)
|
0,5 – 0,7 (14, 19, 29)
|
L = D (14)
|
0 (29)
|
3 (50 %) (19)
|
zračenje ne utječe na klijanje (19), nikakva posebna obrada (14, 29)
|
POST (5)
|
A
|
|
|
Digitaria sanguinalis
(ljubičasta svračica)
|
J
polja, ledine, otvorena staništa (16)
|
0,52 – 0,6 (14, 30)
|
L = D (14)
|
10 – 20 (21)
|
7 (75 %)
14 (94 %) (7)
|
skarifikacija, hladna stratifikacija i dozrijevanje (1, 7, 14, 32), tretirati sa 101 mg/L KNO3 (14), klijanje inhibirano tamom (1), nikakva posebna obrada (21)
|
PRE i POST (18, 25, 31)
|
A
|
|
|
Echinochloa crusgalli
(kokošje proso)
|
J
(16)
|
1,5 (14)
|
L = D (14)
L > D (3)
|
10 – 20 (7, 21)
|
|
skarifikacija (7, 32), zračenje ne utječe na klijanje (1), nikakva posebna obrada (3, 14, 21)
|
PRE i POST (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(kanadska pirika)
|
V
riječne obale, poremećena područja (16)
|
4 – 5 (14, 30)
|
L = D (11)
|
1
(11)
|
14 – 28
(11)
|
nikakva posebna obrada
(2, 11)
|
POST (2)
|
C, D, E
|
|
|
Festuca pratensis
(livadna vlasulja)
|
V
polja, vlažna područja (16, 19)
|
1,53 – 2,2 (16, 19)
|
L = D (14)
L > D (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
nikakva posebna obrada
(10, 19)
|
POST (10)
|
A
|
7
|
|
Hordeum pusilium
(mali ječam)
|
J
pašnjaci, uz ceste, otvorena staništa (16)
|
3,28 (14)
|
|
|
|
topla stratifikacija (1), zračenje ne utječe na klijanje (1)
|
PRE (31)
|
|
7
|
|
Phieum pratense
(mačji repak)
|
V
pašnjaci, oranice, poremećena mjesta (16, 19)
|
0,45 (14, 19)
|
L > D (10, 14)
|
0 – 10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
klijanje inhibirano tamom (19), zračenje ne utječe na klijanje (17), nikakva posebna obrada (10, 14, 17, 19)
|
POST (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(povijajuća heljda)
|
J
otvorena staništa, uz ceste (16)
|
5 – 8 (4, 14, 29)
|
L = D (20)
|
0 – 2 (4, 29)
|
|
hladna stratifikacija 4 – 8 tjedana (1, 2, 4, 20, 29), zračenje ne utječe na klijanje (1)
|
PRE i POST 1, 2, 20, 28, 31
|
A
|
32
|
|
Polygonum lapathifolium
(kiseličasti dvornik)
|
J
vlažno tlo (16)
|
1,8 – 2,5 (14)
|
L > D (6)
|
|
5 (94 %) (18)
|
zračenje ne utječe na klijanje (1), klijanje inhibirano tamom (18), hladna stratifikacija (1), nikakva posebna obrada (5)
|
PRE i POST (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
(/)
|
J
polja, otvorena staništa (16)
|
3,6 – 7 (14, 29)
|
|
2 (29)
|
|
hladna stratifikacija 4 tjedana na 0 – 5 °C (1, 29), klijanje inhibirano tamom (1)
|
PRE (31)
|
A, E
|
|
|
Polygonum periscaria
(pjegasti dvornik)
|
J
poremećena područja, oranice (16, 19)
|
2,1 – 2,3 (14, 19)
|
L > D (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
skarifikacija, hladna stratifikacija, tretiranje s GA (14), hladna stratifikacija, dozrijevanje (17 – 19) klijanje inhibirano tamom (19) nikakva posebna obrada (13)
|
POST (13)
|
A
|
32
|
|
Rumex crispus
(kovrčava kiselica)
|
V
oranice, uz ceste, otvorena područja (16, 19)
|
1,3 – 1,5 (4, 14, 19)
|
L = D (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
klijanje inhibirano tamom (18, 19), može biti potrebno dozrijevanje (18), nikakva posebna obrada (4, 14, 33)
|
POST (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
(modra krivičica)
|
J
oranice, otvorena područja, poremećena mjesta (16, 19)
|
0,4 – 0,5 (4, 14, 19)
|
L = D (14)
|
|
1 (50 %) (19)
|
hladna stratifikacija, tretiranje s GA (1,14, 18, 19, 32), za klijanje je potrebna svjetlost (1), nikakva posebna obrada (2, 4)
|
POST (2, 4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(žabnjak ljutić)
|
V
oranice, uz ceste, otvorena područja (16, 19)
|
1,5 – 2 (14, 19, 29)
|
L = D (14)
|
1
(29)
|
41 – 56 (19, 29)
|
nikakva posebna obrada
(5, 14, 22, 24 – 26)
|
POST (5, 22, 24 – 26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(pravi blaženak)
|
V
živice, vlažna područja
(16, 19)
|
0,8 – 1,5 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
klijanje inhibirano tamom (18, 19), topla stratifikacija (1), nikakva posebna obrada (5, 14, 22, 25, 26)
|
POST (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(čekinjasta broćika)
|
J
oranice, vlažna područja, poremećena mjesta (16, 19)
|
7 – 9 (14, 19)
|
L = D (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
hladna stratifikacija (1, 18, 19), zračenje ne utječe na klijanje (18, 19), svjetlost inhibira klijanje (1), nikakva posebna obrada (6, 14)
|
PRE i POST (6, 28)
|
A
|
32
|
|
Galium mollugo
(livadna broćika)
|
V
živice, otvorena područja (8)
|
7
(29)
|
L = D (14)
|
2
(29)
|
|
nikakva posebna obrada
(5, 14, 22, 24, 26, 29)
|
POST (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(grimizni naprstak)
|
J, V, živice, otvorena područja (16, 19)
|
0,1 – 0,6 (4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
6 (50 %) (19)
8 (99 %) (18)
|
klijanje inhibirano tamom (1, 17 – 19), nikakva posebna obrada (4, 22 – 26)
|
POST (4, 22 – 26)
|
D, G, F
|
|
|
Veronica persica
(perzijska čestoslavica)
|
J
oranice, otvorena područja, poremećena mjesta (16, 19)
|
0,5 – 0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (19)
5 (96 %) (18)
|
klijanje inhibirano tamom (18, 19), hladna stratifikacija (18), nikakva posebna obrada (14)
|
PRE i POST (28)
|
A
|
32
|
Navedeni dobavljači sjemena
|
Oznaka dobavljača
|
Podaci o dobavljaču
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ ENGLESKA +44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 SAD
|
|
(727) 344 – 4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla – Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 KANADA (519) 586 – 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 SAD (303) 431 – 7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 SAD
|
|
(800) 873 – 3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB ENGLESKA
|
|
+44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 KANADA (800) 274 – 7333
|
|
www.thompson-morgan.com
|
|
CITIRANA LITERATURA
|
(1)
|
Baskin, C. C. i Baskin, J. M. 1998. Seeds. Academic Press, Toronto
|
|
(2)
|
Blackburn, L. G. i Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271-285.
|
|
(3)
|
Boutin, C., Lee, H. B., Peart, T., Batchelor, P. S., i Maguire, R. J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
|
|
(4)
|
Boutin, C., Elmegaard, N. i Kjaer, C. 2004. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349-369.
|
|
(5)
|
Breeze, V., Thomas, G. i Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669-677.
|
|
(6)
|
Brown, R. A. i Farmer, D. 1991. Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. U: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J. W. Gorsuch, W. R. Lower, W. Wang i M.A. Lewis, ur. American Society for Testing & Materials, Philadelphia. str. 197. – 208.
|
|
(7)
|
Buhler, D. D. i Hoffman, M. L. 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
(8)
|
Clapham, A. R., Tutin, T. G. i Warburg, E. F. 1981. Excursion flora of the British Isles, 3. izdanje. Cambridge University Press, Cambridge
|
|
(9)
|
Clay, P. A. i Griffin, J. L. 2000. Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481-486.
|
|
(10)
|
Cole, J. F. H. i Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC – Weeds. str. 151. – 156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds). 2004. Osobna komunikacija. (www.ernstseed.com)
|
|
(12)
|
Fletcher, J. S., Johnson, F. L. i McFarlane, J. C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769-776.
|
|
(13)
|
Fletcher, J. S., Pfleeger, T. G., Ratsch, H.C. i Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189-1196.
|
|
(14)
|
Flynn, S., Turner, R. M. i Dickie, J. B. 2004. Seed Information Database (izdanje 6.0, listopad 2004.) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid)
|
|
(15)
|
Franzaring, J., Kempenaar, C., & van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21-28.
|
|
(16)
|
Gleason, H. A. i Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2. izdanje, New York Botanical Garden, Bronx, NY
|
|
(17)
|
Grime, J. P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555-558.
|
|
(18)
|
Grime, J. P., Mason, G., Curtis, A. V., Rodman, J., Band, S. R., Mowforth, M. A. G., Neal, A. M. i Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017-1059.
|
|
(19)
|
Grime, J. P., Hodgson, J. G. i Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London
|
|
(20)
|
Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453-459.
|
|
(21)
|
Klingaman, T. E., King, C. A. i Oliver, L. R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227-232.
|
|
(22)
|
Marrs, R. H., Williams, C. T., Frost, A. J. i Plant, R. A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71-86.
|
|
(23)
|
Marrs, R. H., Frost, A. J. & Plant, R. A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223-235.
|
|
(24)
|
Marrs, R. H., Frost, A. J. i Plant, R. A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25-42.
|
|
(25)
|
Marrs, R. H., Frost, A. J., Plant, R. A. i Lunnis, P. 1993. Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283-293.
|
|
(26)
|
Marrs, R. H. i Frost, A. J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369-388.
|
|
(27)
|
Marshall, E. J. P. i Bernie, J. E. 1985. Herbicide effects on field margin flora. BCPC – Weeds. str. 1021. – 1028.
|
|
(28)
|
McKelvey, R. A., Wright, J. P. i Honegger, J. L. 2002. A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161-1174.
|
|
(29)
|
Morton, S. (Herbiseed). 2004. Osobna komunikacija. (http://www.herbiseed.com)
|
|
(30)
|
USDA, NRCS. 2004. The Plants Database, verzija3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA
|
|
(31)
|
US EPA. 1999. One-Liner Database. [US EPA/Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
(32)
|
Webster, R. H. 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L. i Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Osobna komunikacija.
|
|
(34)
|
Zwerger, P. i Pestemer, W. 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711-718.
|
Dodatak 4.
Primjeri odgovarajućih uvjeta rasta za određene poljoprivredne vrste
Pokazalo se da su sljedeći uvjeti prikladni za deset poljoprivrednih vrsta i mogu služiti i kao smjernica za ispitivanja u uzgojnim komorama na nekim drugim vrstama:
|
|
Koncentracija ugljičnog dioksida: 350 ± 50 ppm;
|
|
|
Relativna vlažnost: 70 ± 5 % u razdobljima svjetla i 90 ± 5 % u razdobljima mraka;
|
|
|
Temperatura: 25 ± 3 °C tijekom dana, 20 ± 3 °C tijekom noći;
|
|
|
Fotoperiod: 16 sati svjetla / osam sati mraka, uz pretpostavku prosječne valne duljine od 400 do 700 nm;
|
|
|
Svjetlo: osvjetljenje od 350 ± 50 μE/m2/s, mjereno na vrhu nadzemnog dijela biljke.
|
Predmetne su poljoprivredne vrste:
|
—
|
rajčica (Solanum lycopersicon),
|
|
—
|
krastavac (Cucumis sativus),
|
|
—
|
zelena salata (Lactuca sativa),
|
|
—
|
kupus (Brassica oleracea var. capitata),
|
|
—
|
višegodišnji ljulj (Lolium perenne),
|
C.32. TEST REPRODUKTIVNE TOKSIČNOSTI NA ENHITREJAMA
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 220 (2004.). Namijenjena je procjeni učinaka kemikalija na reprodukcijsku uspješnost crva iz porodice enhitreja, Enchytraeus albidus Henle 1873., u tlu. Uglavnom se temelji na metodi koju je razvio Umweltbundesamt (Njemačka) (1) koja bila ispitana u prstenastom testu (2). Razmotrene su i druge metode ispitivanja toksičnosti kemikalija za enhitreje i gujavice (3) (4) (5) (6) (7) (8).
|
POČETNA RAZMATRANJA
|
2.
|
Kolutićavci koji žive u tlu i pripadaju rodu Enchytraeus ekološki su relevantne vrste za ekotoksikološka ispitivanja. Iako enhitreji često nastanjuju tla koja sadržavaju gujavice, njima isto tako obiluju i mnoga tla u kojima nema gujavica. Enhitreji se mogu upotrebljavati u laboratorijskim ispitivanjima, kao i u poluterenskim i terenskim istraživanjima. S praktične točke gledišta, enhitrejima je lako rukovati i lako ih je uzgajati te im je generacijsko vrijeme kraće nego kod gujavica. Stoga ispitivanje reproduktivne toksičnosti na erhitrejama traje samo četiri do šest tjedana, dok kod gujavica (Eisenia fetida) traje osam tjedana.
|
|
3.
|
Osnovne informacije o ekologiji i ekotoksikologiji enhitreja u kopnenom okolišu mogu se pronaći u literaturi (9) (10) (11) (12).
|
NAČELO ISPITIVANJA
|
4.
|
Odrasli crvi enhitreja izlažu se nizu koncentracija ispitivane kemikalije umiješane u umjetno tlo. Ispitivanje se može podijeliti u dvije faze: (a) ispitivanje za određivanje raspona, koje se provodi u slučaju kad nema dovoljno informacija i u kojem je smrtnost glavna krajnja točka koja se procjenjuje nakon dvotjedne izloženosti te (b) glavno ispitivanje reproduktivne toksičnosti u kojem se procjenjuje ukupan broj mladih po roditeljskoj životinji i preživljavanje roditeljskih životinja. Glavno ispitivanje traje šest tjedana. Nakon prva tri tjedna odrasli se crvi vade i bilježe se morfološke promjene. Nakon dodatna tri tjedna utvrđuje se broj potomaka koji su se izvalili iz kokona što su ih proizvele odrasle jedinke. Reprodukcijska uspješnost životinja izloženih ispitivanoj kemikaliji uspoređuje se s kontrolom odnosno kontrolama kako bi se odredila (i) najviša koncentracija bez vidljivog učinka (NOEC) i/ili (ii) ECx (npr. EC10, EC50) primjenom regresijskog modela kako bi se procijenila koncentracija koja bi izazvala x-postotno smanjenje reprodukcijske uspješnosti. Ispitne koncentracije moraju obuhvaćati ECx (npr. EC10, EC50) tako da se ECx potom može dobiti interpolacijom, a ne ekstrapolacijom.
|
INFORMACIJE O ISPITIVANOJ KEMIKALIJI
|
5.
|
Po mogućnosti moraju biti poznati topljivost u vodi, log Kow, koeficijent razdjeljenja između tla i vode (npr. poglavlje C.18. ili C.19. ovog Priloga) te tlak para ispitivane kemikalije. Poželjno je imati i dodatne informacije o sudbini ispitivane kemikalije u tlu, kao što su brzina fotolize i hidrolize.
|
|
6.
|
Ova se ispitna metoda može upotrebljavati za kemikalije koje su topljive, kao i za one koje nisu topljive u vodi. Ovisno o tome, razlikovat će se i način primjene ispitivane kemikalije. Ova ispitna metoda nije primjenljiva na hlapljive kemikalije, tj. kemikalije za koje su Henryjeva konstanta ili koeficijent razdjeljenja između zraka i vode veći od jedan ili kemikalije čiji je tlak para veći od 0,0133 Pa pri 25 °C.
|
VALJANOST ISPITIVANJA
|
7.
|
Da bi ispitivanje bilo valjano, kontrole moraju zadovoljavati sljedeće provedbene kriterije:
|
—
|
smrtnost odraslih jedinki ne smije biti veća od 20 % na kraju ispitivanja za određivanje raspona te nakon prva tri tjedna ispitivanja reproduktivne toksičnosti,
|
|
—
|
pod pretpostavkom da je ispitivanje započeto s 10 odraslih jedinki po posudi, na kraju ispitivanja mora biti prosječno najmanje 25 mladih jedinki po posudi.
|
|
—
|
koeficijent varijacije oko srednje vrijednosti broja mladih jedinki ne smije biti veći od 50 % na kraju ispitivanja reproduktivne toksičnosti.
|
Ako ispitivanje ne ispuni navedene kriterije valjanosti, potrebno ga je prekinuti, osim ako postoji opravdanje za njegov nastavak. To je opravdanje potrebno navesti u izvješću o ispitivanju.
|
REFERENTNA KEMIKALIJA
|
8.
|
Referentnu kemikaliju potrebno je ispitivati u redovitim vremenskim razmacima ili je se može uključiti u svaki test kako bi se provjerilo da se odgovor ispitnih organizama nije značajno promijenio tijekom vremena. Prikladna je referentna kemikalija karbendazim, za koji je dokazano da utječe na preživljavanje i razmnožavanje enhitreja (13) (14), a mogu se upotrebljavati i druge kemikalije za koje su podaci o toksičnosti dobro poznati. Formulacija karbendazima, poznata pod trgovačkim nazivom Derosal ™ koju isporučuje AgrEvo Company (Frankfurt, Njemačka) i koja sadržava 360 g/l (32,18 %) aktivnog sastojka, upotrijebljena je u prstenastom ispitivanju (2). Vrijednost EC50 za razmnožavanje koja je utvrđena prstenastim ispitivanjem bila je u rasponu od 1,2 ± 0,8 mg aktivnog sastojka (a. s.) / kg suhe mase (2). Ako se u ispitni niz uključi pozitivan toksični standard, upotrebljava se jedna koncentracija i jednak broj ponavljanja kao i kod kontrola. Za karbendazim se preporučuje ispitivanje 1,2 mg a. s. / kg suhe mase (ispitano u obliku tekuće formulacije).
|
OPIS ISPITIVANJA
Oprema
|
9.
|
Ispitne posude moraju biti od stakla ili drugog kemijski inertnog materijala. Prikladne su staklenke (npr. zapremina: 0,20 – 0,25 l; promjer: ≈ 6 cm). Posude moraju imati proziran poklopac (npr. od stakla ili polietilena) koji je tako napravljen da smanjuje isparavanje vode i istodobno omogućuje izmjenu plinova između tla i atmosfere. Poklopci moraju biti prozirni da omoguće prolaz svjetla.
|
|
10.
|
Potrebna je uobičajena laboratorijska oprema, a posebno:
|
—
|
prikladne precizne vage,
|
|
—
|
odgovarajuća oprema za kontrolu temperature,
|
|
—
|
odgovarajuća oprema za kontrolu vlage (nije nužna ako ispitne posude imaju poklopce),
|
|
—
|
inkubator ili manja prostorija opremljena klimatizacijskim uređajem,
|
|
—
|
pincete, kuke ili petlje,
|
|
—
|
kada za razvijanje fotografija.
|
|
Pripremanje umjetnog tla
|
11.
|
U ovom se ispitivanju upotrebljava umjetno tlo (5) (7) sljedećeg sastava (na bazi suhe mase, osušene do stalne mase pri 105 °C):
|
—
|
10 % sphagnum treseta, osušenog na zraku i fino usitnjenog (prihvatljive su čestice veličine 2 ± 1 mm); prije uporabe preporučljivo je provjeriti je li tlo koje je pripremljeno od svježe serije treseta prikladno za uzgoj crva,
|
|
—
|
20 % kaolinitske gline (sadržaj kaolinita po mogućnosti iznad 30 %),
|
|
—
|
približno 0,3 do 1,0 % kalcijeva karbonata (CaCO3, u prahu, analitičkog stupnja čistoće) da bi se dobio pH od 6,0 ± 0,5; količina kalcijeva karbonata koju je potrebno dodati može u prvom redu ovisiti o kvaliteti/prirodi treseta,
|
|
—
|
oko 70 % kremenog pijeska sušenog na zraku (ovisno o potrebnoj količini CaCO3), pretežno finog pijeska s više od 50 % čestica veličine između 50 i 200 mikrona.
|
Prije nego što se umjetno tlo upotrijebi u glavnom ispitivanju, preporučljivo je dokazati da je takvo tlo prikladno za uzgoj crva i da omogućuje ispunjenje kriterija valjanosti ispitivanja. Posebno se preporučuje izvršiti takvu provjeru kako bi se osiguralo da uspješnost ispitivanja neće biti ugrožena ako se smanji sadržaj organskog ugljika u umjetnom tlu, npr. smanjenjem sadržaja treseta na 4 do 5 % i odgovarajućim povećanjem sadržaja pijeska. Takvim smanjenjem sadržaja organskog ugljika može se smanjiti mogućnost adsorpcije ispitivane kemikalije u tlo (organski ugljik) te se može povećati dostupnost ispitivane kemikalije crvima. Pokazalo se da Enchytraeus albidus može ispuniti kriterije valjanosti koji se odnose na razmnožavanje kada se ispituje u tlima u kojima je sadržaj organskog ugljika manji od navedenog (npr. 2,7 %) (15), a iskustvo, iako ograničeno, pokazuje da se to može postići i s umjetnim tlom s 5 % treseta.
Napomena: Ako se u dodatnim ispitivanjima (npr. ispitivanjima višeg stupnja) upotrebljava prirodno tlo, isto je tako potrebno dokazati prikladnost tla i ispunjenje kriterija valjanosti ispitivanja.
|
|
12.
|
Suhi sastojci tla temeljito se izmiješaju (npr. u velikoj laboratorijskoj miješalici). To treba učiniti najmanje tjedan dana prije početka ispitivanja. Izmiješano tlo potrebno je držati pohranjeno dva dana kako bi se uravnotežila/stabilizirala kiselost. Za određivanje pH-vrijednosti upotrebljava se smjesa tla s otopinom 1 M kalijeva klorida (KCl) ili 0,01 M kalcijeva klorida (CaCl2) u omjeru 1: 5 (vidjeti (16) i Dodatak 3.). Ako kiselost tla nije unutar zahtijevanog raspona (vidjeti stavak 11.), može se prilagoditi dodavanjem odgovarajuće količine CaCO3. Ako je tlo previše lužnato, može se prilagoditi dodavanjem smjese iz stavka 11., ali bez CaCO3.
|
|
13.
|
Maksimalni vodni kapacitet (WHC) umjetnog tla određuje se u skladu s postupcima opisanima u Dodatku 2. Jedan ili dva dana prije početka ispitivanja suho se umjetno tlo vlaži dodavanjem dovoljno deionizirane vode da bi se dobilo otprilike pola konačnog sadržaja vode, tj. 40 do 60 % maksimalnog vodnog kapaciteta. Na početku ispitivanja prethodno navlaženo tlo dijeli se na onoliko dijelova koliko ima ispitnih koncentracija (prema potrebi uključujući i referentnu kemikaliju) i kontrola koje se upotrebljavaju za ispitivanje. Sadržaj vlage prilagođava se na 40 do 60 % maksimalnog WHC-a dodavanjem otopine ispitivane kemikalije i/ili dodavanjem destilirane ili deionizirane vode (vidjeti stavke od 19. do 21.). Sadržaj vlage određuje se na početku i na kraju ispitivanja (sušenjem do stalne mase na 105 °C) i trebao bi biti unutar optimalnog raspona za preživljavanje crva. Vlažnost tla može se ugrubo procijeniti laganim gnječenjem rukom: ako je sadržaj vlage ispravan, među prstima bi se trebale pojaviti kapljice vode.
|
Odabir i priprema ispitnih životinja
|
14.
|
Preporučena je ispitna vrsta Enchytraeus albidus Henle 1837 (bijeli crv), koja pripada porodici Enchytraeidae (red Oligochaeta, koljeno Annelida). E. albidus jedna je od najvećih enhitreja, kod koje su zabilježeni primjerci i do 35 mm duljine (17) (18). E. albidus rasprostranjena je diljem svijeta i može se naći u morskim, slatkovodnim i kopnenim staništima, uglavnom u organskoj tvari u raspadu (morska trava, kompost), a rijetko na livadama (9). Njezina velika ekološka tolerancija i neke morfološke varijacije mogući su znak postojanja više podvrsta.
|
|
15.
|
E. albidus dostupna je u trgovinama kao hrana za ribe. Treba provjeriti je li kultura onečišćena drugom, obično manjom vrstom (1) (19). Ako dođe do onečišćenja, sve crve treba oprati vodom u Petrijevoj zdjelici. Potom se veliki primjerci vrste E. albidus biraju (stereomikroskopom) za početak nove kulture, a svi se ostali crvi bacaju. E. albidus može se lako uzgajati u vrlo različitim organskim materijalima (vidjeti Dodatak 4.). E. albidus ima kratak životni ciklus jer zrelost postiže u dobi između 33 dana (na 18 °C) i 74 dana (na 12 °C). Za ispitivanje se upotrebljavaju samo kulture koje su najmanje pet tjedana (jedan naraštaj) držane u laboratoriju bez problema.
|
|
16.
|
Prikladne su i druge vrste iz roda Enchytraeus, npr. E. buchholzi Vejdovsky 1879 ili E. crypticus Westheide i Graefe 1992. (vidjeti Dodatak 5.). Ako se upotrebljavaju druge vrste Enchytraeus, treba ih jasno identificirati i u izvješću je potrebno navesti obrazloženje za odabir te vrste.
|
|
17.
|
Životinje koje se upotrebljavaju u ispitivanjima odrasli su crvi. Moraju imati jajašca (bijele točkice) u području kliteluma i biti otprilike iste veličine (dugi oko 1 cm). Sinkronizacija uzgojne kulture nije potrebna.
|
|
18.
|
Ako se enhitreje ne uzgajaju u istom tipu tla i u istim uvjetima (uključujući hranjenje) koji se primjenjuju za glavno ispitivanje, moraju proći razdoblje aklimatizacije od najmanje 24 sata do tri dana. Za početak je potrebno aklimatizirati veći broj odraslih životinja nego što ih je potrebno za provođenje ispitivanja, kako bi se mogli odbaciti primjerci koji su oštećeni ili nisu prikladni zbog drugih razloga. Na kraju razdoblja aklimatizacije za ispitivanje se odabiru samo crvi koji imaju jajašca i ne pokazuju anomalije u ponašanju (npr. pokušaj bijega iz tla). Crvi se pažljivo vade s pomoću draguljarske pincete, kukice ili petlje te se stavljaju u Petrijevu zdjelicu koja sadržava malu količinu svježe vode. U tu je svrhu poželjno upotrijebiti obrađenu vodu, kako se predlaže u poglavlju C.20. ovog Priloga (Test reproduktivne toksičnosti na vrsti Daphnia magna) jer bi deionizirana, demineralizirana ili vodovodna voda mogla biti štetna za crve. Crvi se pregledavaju stereomikroskopom te se odbacuju svi koji nemaju jajašca. Treba se pobrinuti da budu uklonjene sve grinje i skokuni kojima su možda zaražene kulture. Zdravi crvi koji se neće upotrijebiti za ispitivanje vraćaju se u matičnu kulturu.
|
Priprema ispitnih koncentracija
Ispitivana kemikalija topljiva u vodi
|
19.
|
Otopina ispitivane kemikalije priprema se u deioniziranoj vodi u količini dovoljnoj za sva ponavljanja jedne ispitne koncentracije. Preporučuje se upotrijebiti odgovarajuću količinu vode da se postigne potreban sadržaj vlage, tj. 40 do 60 % maksimalnog WHC-a (vidjeti stavak 13.). Svaka se otopina ispitivane kemikalije temeljito izmiješa s jednom šaržom prethodno navlaženog tla prije nego što se uvede u ispitnu posudu.
|
Ispitivana kemikalija netopljiva u vodi
|
20.
|
Ispitivana kemikalija koja nije topljiva u vodi, ali je topljiva u organskim otapalima, može se otopiti u najmanjoj mogućoj količini prikladnog nosača (npr. acetona). Treba upotrijebiti samo hlapljiva otapala. Nosač se poprska po maloj količini, npr. 2,5 g, finog kremenog pijeska ili se pomiješa s njom. Nosač se uklanja isparavanjem u digestoru najmanje jedan sat. Ta se smjesa kremenog pijeska i ispitivane kemikalije dodaje prethodno navlaženom tlu i temeljito se izmiješa nakon dodavanja odgovarajuće količine deionizirane vode da bi se dobio potreban sadržaj vlage. Konačna se smjesa unosi u ispitne posude.
|
|
21.
|
Za kemikalije koje su slabo topljive u vodi i u organskim otapalima, 2,5 g fino usitnjenog kremenog pijeska po ispitnoj posudi pomiješa se s količinom ispitivane kemikalije za dobivanje željene ispitne koncentracije. Ta se smjesa kremenog pijeska i ispitivane kemikalije doda prethodno navlaženom tlu i temeljito se izmiješa nakon dodavanja odgovarajuće količine deionizirane vode da bi se dobio potreban sadržaj vlage. Konačna se smjesa podijeli na ispitne posude. Navedeni se postupak ponavlja za svaku ispitnu koncentraciju, a pripremi se i odgovarajuća kontrola.
|
|
22.
|
Kemikalije se obično ne bi smjele ispitivati u koncentracijama većim od 1 000 mg/kg suhe mase tla. Međutim, određeni posebni ispitni ciljevi mogu zahtijevati primjenu viših koncentracija.
|
PROVEDBA ISPITIVANJA
Ispitne skupine i kontrole
|
23.
|
Za svaku se ispitnu koncentraciju u ispitnu posudu stavlja količina ispitnog tla koja odgovara količini od 20 g suhe mase (vidjeti stavke od 19. do 21.). Pripremaju se i kontrole bez ispitne kemikalije. U svaku se posudu dodaje hrana u skladu s postupcima opisanima u stavku 29. Deset crva nasumce se rasporedi u svaku ispitnu posudu. Crvi se pažljivo prenesu u svaku posudu i stavljaju na površinu tla s pomoću npr. draguljarske pincete, kukice ili petlje. Broj ponavljanja za ispitne koncentracije i kontrole ovisi o primijenjenom planu ispitivanja (vidjeti stavak 34.). Ispitne se posude nasumce rasporede po inkubatoru i svakog se tjedna nasumce premještaju.
|
|
24.
|
Ako se za primjenu ispitivane kemikalije upotrebljava nosač, uz ispitni je niz potrebno uključiti i jedan kontrolni niz koji sadržava kremeni pijesak poprskan otapalom ili pomiješan s njim. Koncentracija otapala ili dispergenta mora biti ista kao u ispitnim posudama koje sadržavaju ispitivanu kemikaliju. Kontrolni niz koji sadržava dodatni kremeni pijesak (2,5 g po posudi) potrebno je uključiti za kemikalije koje je potrebno primijeniti u skladu s postupcima opisanima u stavku 21.
|
Uvjeti ispitivanja
|
25.
|
Ispitna temperatura iznosi 20 ± 2 °C. Kako bi se spriječilo bježanje crva iz tla, ispitivanje se provodi u kontroliranim ciklusima izmjene svjetlosti i tame (po mogućnosti 16 sati svjetla i osam sati tame), uz osvjetljenje od 400 do 800 luksa u području ispitnih posuda.
|
|
26.
|
Radi provjere vlažnosti tla, posude se važu na početku ispitivanja i potom jednom tjedno. Gubitak težine nadoknađuje se dodavanjem odgovarajuće količine deionizirane vode. Valja napomenuti da se gubitak vode može smanjiti održavanjem visoke vlažnosti zraka (> 80 %) u inkubatoru.
|
|
27.
|
Sadržaj vlage i pH potrebno je izmjeriti na početku i na kraju ispitivanja za određivanje raspona i glavnog ispitivanja. Mjerenja je potrebno izvršiti u tretiranim (sve koncentracije) i kontrolnim uzorcima tla koji su pripremljeni i održavani na isti način kao ispitne kulture, ali ne sadržavaju crve. Tim uzrocima tla hranu je potrebno dodati samo na početku ispitivanja kako bi se omogućila mikrobna aktivnost. Količina dodane hrane mora biti jednaka količini dodanoj ispitnim kulturama. Tijekom ispitivanja u te posude više nije potrebno dodavati hranu.
|
Hranjenje
|
28.
|
Može se upotrebljavati hrana koja omogućuje održavanje populacije enhitreja. Pokazalo se da su prikladna hrana zobene pahuljice, po mogućnosti obrađene u autoklavu prije uporabe kako bi se spriječila kontaminacija mikroorganizmima (može se primijeniti i zagrijavanje).
|
|
29.
|
Hrana se prvo daje tako da se 50 mg mljevenih zobenih pahuljica pomiješa s tlom u svakoj posudi prije unošenja crva. Potom se hrana daje jednom tjedno do 21. dana. Hrana se ne daje 28. dana, jer su u toj fazi odrasli crvi već uklonjeni, a mladim je jedinkama otada potrebno relativno malo dodatne hrane. Tijekom ispitivanja hranjenje se provodi tako da se u svaku posudu doda 25 mg mljevenih zobenih pahuljica, koje se pažljivo stavljaju na površinu tla kako se crvi ne bi oštetili. Kako bi se smanjio rast gljivica, zobene pahuljice treba zatrpati prekrivajući ih malom količinom tla. Ako hrana ostane nepojedena, porcije hrane treba smanjiti.
|
Plan ispitivanja za određivanje raspona
|
30.
|
Ako je potrebno, provodi se ispitivanje za određivanje raspona s na primjer pet koncentracija ispitivane kemikalije: 0,1, 1,0, 10, 100 i 1 000 mg/kg (suhe mase tla). Dovoljno je jedno ponavljanje za svaki tretman i kontrolu.
|
|
31.
|
Ispitivanje za određivanje raspona traje dva tjedna. Na kraju ispitivanja procjenjuje se smrtnost crva. Crv se evidentira kao mrtav ako ne reagira na mehanički podražaj na prednjem kraju. Osim podataka o smrtnosti, korisno je raspolagati i drugim podacima kako bi se mogla donijeti odluka o rasponu koncentracija koje će se upotrebljavati u glavnom ispitivanju. Stoga je osim bilježenja prisutnosti mladih jedinki potrebno zabilježiti i promjene u ponašanju odraslih jedinki (npr. nesposobnost ukopavanja u tlo; nepomično pripijanje uz staklenu stijenku ispitne posude) i u njihovoj morfologiji (npr. prisutnost otvorenih rana). Prisutnost mladih jedinki može se odrediti metodom bojenja koja je opisana u Dodatku 6.
|
|
32.
|
Vrijednost LC50 može se približno odrediti izračunavanjem geometrijske sredine podataka o smrtnosti. Kod utvrđivanju raspona koncentracija za glavno ispitivanje polazi se od pretpostavke da su učinci na razmnožavanje manji od LC50 za faktor koji može iznositi do 10. Međutim, to je empirijski odnos koji u konkretnim slučajevima može biti drukčiji. Dodatna opažanja iz ispitivanja za određivanje raspona, kao što je prisutnost mladih jedinki, mogu omogućiti bolju prilagodbu raspona koncentracija ispitivane kemikalije koje će se upotrebljavati u glavnom ispitivanju.
|
|
33.
|
Za precizno određivanje vrijednosti LC50 preporučuje se provođenje ispitivanja s najmanje četiri ponavljanja po svakoj koncentraciji ispitne kemikalije i odgovarajućim brojem koncentracija koje će izazvati najmanje četiri različita statistički značajna srednja odgovora pri tim koncentracijama. Ako je primjenljivo, i za kontrole se upotrebljava isti broj koncentracija i ponavljanja.
|
Plan glavnog testa reproduktivne toksičnosti
|
34.
|
Predlažu se tri plana na temelju preporuka proizišlih iz prstenastog ispitivanja (2).
|
—
|
Za određivanje NOEC-a potrebno je ispitati najmanje pet koncentracija u geometrijskom nizu. Preporučuju se četiri ponavljanja za svaku ispitnu koncentraciju plus osam kontrola. Koncentracije se moraju razlikovati za faktor koji nije veći od 1,8.
|
|
—
|
Za određivanje vrijednosti ECx (npr. EC10, EC50) potrebno je ispitati najmanje pet koncentracija koje obuhvaćaju vrijednost ECx kako bi se vrijednost ECx mogla dobiti interpolacijom umjesto ekstrapolacijom. Preporučuju se najmanje četiri ponavljanja za svaku ispitnu koncentraciju i četiri kontrolna ponavljanja. Interval između koncentracija može se razlikovati, tj. može iznositi 1,8 ili manje za raspon koncentracija za koji se očekuje da će izazvati učinak te više od 1,8 kod viših i nižih koncentracija.
|
|
—
|
Kombinirani pristup omogućuje određivanje i NOEC-a i ECx. Potrebno je upotrijebiti osam ispitnih koncentracija u geometrijskom nizu. Preporučuju se četiri ponavljanja za svaki tretman plus osam kontrola. Koncentracije se moraju razlikovati za faktor koji nije veći od 1,8.
|
|
|
35.
|
Potrebno je upotrijebiti deset odraslih crva po ispitnoj posudi (vidjeti stavak 23.). Hrana se dodaje u ispitne posude na početku ispitivanja i potom jednom tjedno (vidjeti stavak 29.) do uključivo 21. dana. Na 21. dan uzorci tla pažljivo se ručno pretražuju te se živi odrasli crvi promatraju i prebrojavaju i bilježe se promjene u njihovu ponašanju (npr. nesposobnost ukopavanja u tlo, nepomično pripijanje uz staklenu stijenku ispitne posude) i u njihovoj morfologiji (npr. otvorene rane). Svi se odrasli crvi potom uklanjaju iz ispitnih posuda i ispitnog tla. Ispitno tlo koje sadržava kokone inkubira se tri dodatna tjedna u istim ispitnim uvjetima, osim što se hranjenje provodi samo 35. dana (25 mg mljevenih zobenih pahuljica po posudi).
|
|
36.
|
Nakon šest tjedana prebrojavaju se crvi izleženi iz kokona. Preporučuje se metoda bojenja bengalskim crvenilom (vidjeti Dodatak 6.), iako su se prikladnima pokazale i druge tehnike ekstrakcije i flotacije mokrim (ali ne toplinskim) postupkom (vidjeti Dodatak 6.) (4) (10) (11) (20). Preporučuje se bojenje bengalskim crvenilom jer ekstrakcija mokrim postupkom iz supstrata tla može biti onemogućena zbog zamućenja uzrokovanog suspendiranim česticama gline.
|
Granično ispitivanje
|
37.
|
Ako se u ispitivanju za određivanje raspona ne uoče učinci pri najvećoj koncentraciji (tj. 1 000 mg/kg), test reproduktivne toksičnosti može se provesti kao granični test s 1 000 mg/kg kako bi se dokazalo da je NOEC za razmnožavanje veći od te vrijednosti.
|
Sažetak i vremenski raspored ispitivanja
|
38.
|
Faze ispitivanja mogu se sažeto prikazati kako slijedi:
|
Vrijeme
|
Ispitivanje za određivanje raspona
|
Glavno ispitivanje
|
|
Dan –7. ili ranije
|
|
—
|
Pripremiti umjetno tlo (miješanje suhih sastojaka)
|
|
|
—
|
Pripremiti umjetno tlo (miješanje suhih sastojaka)
|
|
|
Dan –5.
|
|
—
|
Provjeriti pH-vrijednost umjetnog tla
|
|
—
|
Izmjeriti maksimalni WHC tla
|
|
|
—
|
Provjeriti pH-vrijednost umjetnog tla
|
|
—
|
Izmjeriti maksimalni WHC tla
|
|
|
Dan –5. do –3.
|
|
—
|
Razvrstati crve za aklimatizaciju
|
|
|
—
|
Razvrstati crve za aklimatizaciju
|
|
|
Dan – 3. do 0.
|
|
—
|
Aklimatizirati crve najmanje 24 sata
|
|
|
—
|
Aklimatizirati crve najmanje 24 sata
|
|
|
Dan –1.
|
|
—
|
Prethodno ovlažiti umjetno tlo i rasporediti ga u šarže
|
|
|
—
|
Prethodno ovlažiti umjetno tlo i rasporediti ga u šarže
|
|
|
Dan 0.
|
|
—
|
Pripremiti radne otopine
|
|
—
|
Primijeniti ispitivane kemikalije
|
|
—
|
Odmjeriti ispitni supstrat u ispitne posude
|
|
—
|
Izmjeriti pH-vrijednost i sadržaj vlage u tlu
|
|
|
—
|
Pripremiti radne otopine
|
|
—
|
Primijeniti ispitivane kemikalije
|
|
—
|
Odmjeriti ispitni supstrat u ispitne posude
|
|
—
|
Izmjeriti pH-vrijednost i sadržaj vlage u tlu
|
|
|
Dan 7.
|
|
—
|
Provjeriti sadržaj vlage u tlu
|
|
|
—
|
Provjeriti sadržaj vlage u tlu
|
|
|
Dan 14.
|
|
—
|
Odrediti smrtnost odraslih jedinki
|
|
—
|
Procijeniti broj mladih jedinki
|
|
—
|
Izmjeriti pH-vrijednost i sadržaj vlage u tlu
|
|
|
—
|
Provjeriti sadržaj vlage u tlu
|
|
|
Dan 21.
|
|
|
—
|
Promatrati ponašanje odraslih jedinki
|
|
—
|
Ukloniti odrasle jedinke
|
|
—
|
Odrediti smrtnost odraslih jedinki
|
|
—
|
Provjeriti sadržaj vlage u tlu
|
|
|
Dan 28.
|
|
|
—
|
Provjeriti sadržaj vlage u tlu
|
|
|
Dan 35.
|
|
|
—
|
Provjeriti sadržaj vlage u tlu
|
|
|
Dan 42.
|
|
|
—
|
Prebrojavanje mladih crva
|
|
—
|
Izmjeriti pH-vrijednost i sadržaj vlage u tlu
|
|
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
39.
|
Iako je u Dodatku 7. naveden opći pregled, u ovoj se ispitnoj metodi ne daje stroga statistička smjernica za analizu rezultata ispitivanja.
|
|
40.
|
U ispitivanju za određivanje raspona smrtnost je glavna krajnja točka. Međutim potrebno je zabilježiti i promjene u ponašanju odraslih jedinki (npr. nesposobnost ukopavanja u tlo, nepomično pripijanje uz staklenu stijenku ispitne posude) i u njihovoj morfologiji (npr. otvorene rane), kao i prisutnost mladih jedinki. Za određivanje vrijednosti LC50 u pravilu je potrebno primijeniti probit-analizu (21) ili logističku regresiju. Međutim, u slučajevima u kojima je ta metoda analize neprikladna (npr. ako imamo manje od tri koncentracije koje uzrokuju djelomičnu smrtnost), mogu se primijeniti alternativne metode. To mogu biti metoda pomičnih prosjeka (22), modificirana Spearman-Karberova metoda (23) ili jednostavna interpolacija (npr. geometrijska sredina vrijednosti LC0 i LC100, izračunana množenjem drugog korijena vrijednosti LC0 s vrijednošću LC100).
|
|
41.
|
U glavnom je ispitivanju krajnja točka plodnost (tj. broj nastalih mladih jedinki). Međutim i tu, kao i kod ispitivanja za određivanje raspona, u završnom izvješću potrebno je navesti sve ostale znakove koji ukazuju na štetno djelovanje. Da bi se izračunali rezultati koji se odnose na razmnožavanje, za statističku je analizu potrebno znati aritmetičku sredinu i standardnu devijaciju po tretmanu i po kontroli.
|
|
42.
|
Ako je provedena analiza varijance, standardna devijacija (s) i stupnjevi slobode (df) mogu se zamijeniti procjenom zajedničke (engl. pooled) varijance dobivenom ANOVA-om i njezinim stupnjevima slobode – pod uvjetom da varijanca ne ovisi o koncentraciji. U tom se slučaju upotrebljavaju pojedinačne varijance kontrole i tretmana. Te se vrijednosti obično izračunavaju s pomoću komercijalno dostupnog statističkog računalnog programa, pri čemu se rezultati dobiveni po posudi upotrebljavaju kao ponavljanja. Ako se čini da je razumnije združiti podatke za negativnu kontrolu i kontrolu s otapalom nego izračunati rezultate uspoređujući ih s jednom od tih dviju kontrola, te je podatke potrebno testirati kako bi se provjerilo da među njima nema značajnih razlika (za odgovarajuće testove vidjeti stavak 45. i Dodatak 7.).
|
|
43.
|
Daljnje statističko testiranje i zaključivanje ovisi o tome jesu li vrijednosti dobivene u ponavljanjima normalno distribuirane i jesu li im varijance homogene.
|
Procjena NOEC-a
|
44.
|
Poželjno je primijeniti snažne testove. Potrebno je koristiti se informacijama o tome jesu li podaci približno normalno distribuirani, npr. informacijama iz prijašnjeg iskustva s prstenastim ispitivanjem ili drugim podacima iz prethodno obavljenih ispitivanja. Od veće je važnosti homogenost varijance (homoskedastičnost). Iskustvo pokazuje da se varijanca često povećava kako se povećava srednja vrijednost. U tim bi se slučajevima homoskedastičnost mogla postići pretvorbom podataka. Međutim, ta se pretvorba mora temeljiti na podacima iz prethodno obavljenih ispitivanja, a ne na podacima koji se istražuju. S homogenim podacima potrebno je provesti t-testove višestruke usporedbe, kao što su Williamsov test (α = 0,05, jednosmjerni) (24) (25) ili u nekim slučajevima Dunnettov test (26) (27). Potrebno je napomenuti da se u slučaju nejednake replikacije tablične t-vrijednosti moraju ispraviti, kako to sugeriraju Dunnett i Williams. Ponekad zbog velike varijacije ne dolazi do redovitog povećanja/smanjenja odgovora. U slučaju takvog velikog odstupanja od monotoničnosti primjereniji je Dunnettov test. Ako postoje odstupanja od homoskedastičnosti, možda bi bilo uputno temeljitije istražiti moguće učinke na varijance kako bi se moglo utvrditi mogu li se t-testovi primijeniti a da ne izgube mnogo na svojoj snazi (28). Alternativno se mogu primijeniti višestruki U-test, npr. Bonferronijev U-test prema Holmu (29) ili, kada podaci pokazuju heteroskedastičnost, ali su inače u skladu s temeljnim monotoničnim odnosom između doze i odgovora, neki drugi neparametarski test [npr. Jonckheere-Terpstra (30) (31) ili Shirley (32) (33)], kojima bi općenito trebalo davati prednost u odnosu na t-testove nejednake varijance. (Vidi i shemu u Dodatku 7.)
|
|
45.
|
Ako je proveden granični test te su ispunjeni uvjeti koje zahtijevaju parametarski testovi (normalnost, homogenost), može se primijeniti Studentov t-test parova, a u drugim slučajevima Mann-Whitneyjev U-test (29).
|
Procjena vrijednosti ECx
|
46.
|
Za izračunavanje bilo koje vrijednosti ECx za regresijsku se analizu (linearnu ili nelinearnu) upotrebljavaju srednje vrijednosti po tretmanu, nakon što se dobije odgovarajuća funkcija doza-odgovor. Za rast crva kao kontinuirani odgovor vrijednosti ECx mogu se procijeniti odgovarajućom regresijskom analizom (35). Među prikladne funkcije za kvantalne podatke (smrtnost/preživljavanje i broj mladih jedinki) spadaju normalna sigmoidna funkcija, logistička funkcija ili Weibullova funkcija, koje sadržavaju dva do četiri parametra, od kojih neki mogu modelirati hermetičke odgovore. Ako je funkcija doza-odgovor prilagođena linearnom regresijskom analizom, značajni r2 (koeficijent određivanja) i/ili nagib potrebno je odrediti regresijskom analizom prije procjene vrijednosti ECx uvrštavanjem vrijednosti koja odgovara x-postotnoj kontrolnoj srednjoj vrijednosti u jednadžbu dobivenu regresijskom analizom. Granice pouzdanosti od 95 % izračunavaju se prema Fielleru (citirano u Finney (21)) ili u skladu s drugim odgovarajućim suvremenim metodama.
|
|
47.
|
Druga je mogućnost da se odgovor modelira kao postotak ili dio parametra modela koji se tumači kao kontrolni srednji odgovor. U tim se slučajevima normalna (logistička, Weibullova) sigmoidna krivulja često može lako prilagoditi rezultatima primjenom probit-regresije (21). U tim se slučajevima ponderacijska funkcija mora prilagoditi metričkim odgovorima prema Christensenu (36). Međutim, ako je uočena hormeza, probit-analizu potrebno je zamijeniti logističkom ili Weibullovom funkcijom s četiri parametra prilagođenom nelinearnom regresijom (36). Ako se prikladna funkcija doza-odgovor ne može prilagoditi podacima, mogu se primijeniti alternativne metode za procjenu vrijednosti ECx i njezinih granica pouzdanosti, kao što su metoda pomičnih prosjeka prema Thompsonu (22) i modificirana Spearman-Karberova metoda (23).
|
IZVJEŠĆE O ISPITIVANJU
|
48.
|
Izvješće o ispitivanju mora sadržavati slijedeće informacije:
|
|
Ispitivana kemikalija:
|
—
|
fizikalno stanje i, tamo gdje je relevantno, fizikalno-kemijska svojstva (npr. topljivost u vodi, tlak para),
|
|
—
|
kemijska identifikacija ispitivane kemikalije prema nomenklaturi IUPAC-a, CAS broj, proizvodna serija, šarža, strukturna formula i čistoća,
|
|
|
|
Ispitne vrste:
|
—
|
upotrijebljene ispitne životinje: vrsta, znanstveni naziv, izvor organizama i uvjeti uzgoja.
|
|
|
|
Uvjeti ispitivanja:
|
—
|
sastojci i priprema umjetnog tla,
|
|
—
|
metoda primjene ispitivane kemikalije,
|
|
—
|
opis uvjeta ispitivanja, uključujući temperaturu, sadržaj vlage, pH itd.,
|
|
—
|
potpun opis plana i postupaka pokusa.
|
|
|
|
Rezultati ispitivanja:
|
—
|
smrtnost odraslih crva nakon dva tjedna te broj mladih na kraju ispitivanja za određivanje raspona,
|
|
—
|
smrtnost odraslih crva nakon tri tjedna izloženosti i potpuna evidencija mladih na kraju glavnog ispitivanja,
|
|
—
|
svi uočeni fizički ili patološki simptomi i promjene ponašanja kod ispitnih organizama,
|
|
—
|
vrijednosti LC50, NOEC i/ili ECx (npr. EC50, EC10) za razmnožavanje, ako su neke od njih primjenjive, te njihovi intervali pouzdanosti, kao i graf prilagođenog modela upotrijebljenog za njihov izračun te sve informacije i opažanja korisna za tumačenje rezultata.
|
|
Odstupanja od postupaka opisanih u ovoj ispitnoj metodi i sve neuobičajene pojave tijekom ispitivanja.
|
LITERATURA
|
(1)
|
Römbke, J. (1989.) Entwicklung eines Reproduktionstests an Bodenorganismen – Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke, J. i Moser, T. (1999.) Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, str. 150. + 223.
|
|
(3)
|
Westheide, W. i Bethge-Beilfuss, D. (1991.) The sublethal enchytraeid test system: guidelines and some results, U: Modern Ecology: Basic and Applied Aspects. Uredili Esser, G. i Overdieck, D. str. 497. – 508. Elsevier, Amsterdam,
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R. i Notenboom, J. (1994.) Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. str. 46.
|
|
(5)
|
Poglavlje C.8. ovog Priloga, Toksičnost za gujavice.
|
|
(6)
|
ISO (International Organization for Standardization) (1993.) Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using Artificial Soil substrate, No. 11268-1. ISO, Geneve.
|
|
(7)
|
ISO (International Organization for Standardization) (1996.) Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(8)
|
Rundgren, S. i Augustsson, A. K. (1998.) Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). U: Løkke, H. i Van Gestel, C. A. M., Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73 – 94.
|
|
(9)
|
Kasprzak, K. (1982.) Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217 – 232.
|
|
(10)
|
Römbke, J. (1995.) Enchytraeen (Oligochaeta) als Bioindikator, UWSF – Z. Umweltchem. Ökotox. 7, 246 – 249.
|
|
(11)
|
Dunger, W. i Fiedler, H. J. (1997.) Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
(12)
|
Didden, W. A. M. (1993.) Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2 – 29.
|
|
(13)
|
Becker, H. (1991.) Bodenorganismen – Prüfungskategorien der Forschung. UWSF – Z. Umweltchem. Ökotox. 3, 19 – 24.
|
|
(14)
|
Römbke, J. i Federschmidt, A. (1995.) Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79 – 96.
|
|
(15)
|
Römbke, J., Riepert, F. i Achazi R. (2000.) Enchytraeen als Testorganismen. U: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. i Eisentraeger, A. (ur.). Spektrum Verl., Heidelberg. 59 – 81.
|
|
(16)
|
ISO (International Organization for Standardization) (1994.) Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
(17)
|
Bell, A. W. (1958.) The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1 – 13.
|
|
(18)
|
Nielsen, C. O. i Christensen, B. (1959.) The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8 – 9, 1 – 160.
|
|
(19)
|
Bouguenec, V. i Giani, N. (1987.) Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9 – 22.
|
|
(20)
|
Korinkova, J. i Sigmund, J. (1968.) The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300 – 305.
|
|
(21)
|
Finney, D. J. (1971.) Probit Analysis (3. izdanje), str. 19. – 76. Cambridge Univ. Press.
|
|
(22)
|
Finney, D. J. (1978.) Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
(23)
|
Hamilton, M. A., Russo, R. C. i Thurston, R. V. (1977.) Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714 – 719; Correction Environ. Sci. Technol. 12 (1998.), 417.
|
|
(24)
|
Williams, D. A. (1971.) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(25)
|
Williams, D. A. (1972.) The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(26)
|
Dunnett, C. W. (1955.) A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(27)
|
Dunnett, C. W. (1964.) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(28)
|
Hoeven, N. van der, (1998.) Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(29)
|
Holm, S. (1979.): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(30)
|
Jonckheere, A. R. (1954.); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133 – 145.
|
|
(31)
|
Terpstra, T. J. (1952.); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327 – 333.
|
|
(32)
|
Shirley, E. A., (1979.); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144 – 151.
|
|
(33)
|
Williams, D. A. (1986.); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183 – 186.
|
|
(34)
|
Sokal, R. R. i Rohlf, F. J. (1981.) Biometry. The Principle and practice of statistics in biological research. 2. izdanje. W. H. Freeman and Company. New York.
|
|
(35)
|
Christensen, E. R. (1984.) Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213 – 221.
|
|
(36)
|
Van Ewijk, P. H. i Hoekstra, J. A. (1993.) Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25 – 32.
|
Dodatak 1.
Definicije
Za potrebe ove ispitne metode primjenjuju se sljedeće definicije:
|
|
Kemikalija znači tvar ili smjesa.
|
|
|
ECx
(koncentracija s učinkom od x %): koncentracija koja u određenom razdoblju izloženosti izaziva x-postotni učinak na ispitne organizme u usporedbi s kontrolom. U ovom se ispitivanju koncentracije s učinkom iskazuju kao masa ispitivane kemikalije po suhoj masi ispitnog tla.
|
|
|
LC0
(nesmrtonosna koncentracija): koncentracija ispitivane kemikalije koja u određenom razdoblju ne izaziva smrt nijednog izloženog ispitnog organizma. U ovom se ispitivanju LC0 iskazuje kao masa ispitivane kemikalije po suhoj masi ispitnog tla.
|
|
|
LC50
(srednja smrtonosna koncentracija): koncentracija ispitivane kemikalije koja u određenom razdoblju izaziva smrt 50 % izloženih ispitnih organizama. U ovom se ispitivanju LC50 iskazuje kao masa ispitivane kemikalije po suhoj masi ispitnog tla.
|
|
|
LC100
(potpuno smrtonosna koncentracija): koncentracija ispitivane kemikalije koja u određenom razdoblju izaziva smrt 100 % izloženih ispitnih organizama. U ovom se ispitivanju LC100 iskazuje kao masa ispitivane kemikalije po suhoj masi ispitnog tla.
|
|
|
LOEC (najniža koncentracija s vidljivim učinkom): najniža koncentracija ispitivane kemikalije koja ima statistički značajan učinak (p < 0,05). U ovom se ispitivanju LOEC iskazuju kao masa ispitivane kemikalije po suhoj masi ispitnog tla. Sve ispitne koncentracije iznad LOEC-a u pravilu moraju imati učinak koji se statistički razlikuje od kontrole. Svako odstupanje od navedenoga pri određivanju LOEC-a mora biti obrazloženo u izvješću o ispitivanju.
|
|
|
NOEC (najviša koncentracija bez vidljivog učinka): najviša koncentracija ispitivane kemikalije neposredno ispod LOEC-a kod koje nije uočen nikakav učinak. U ovom ispitivanju koncentracija koja odgovara NOEC-u nema statistički značajan učinak (p < 0,05) u određenom razdoblju izloženosti u usporedbi s kontrolom.
|
|
|
Stopa razmnožavanja: srednji broj mladih crva dobivenih od određenog broja odraslih crva u razdoblju ispitivanja.
|
|
|
Ispitivana kemikalija: svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
|
Dodatak 2.
Određivanje maksimalnog vodnog kapaciteta
Određivanje vodnog kapaciteta umjetnog tla
Prikladnom se pokazala sljedeća metoda. Opisana je u Prilogu C normi ISO DIS 11268-2.
Odgovarajućom napravom (npr. svrdlom s epruvetom) uzme se određena količina (npr. 5 g) tla koje služi kao ispitni supstrat. Dno epruvete prekrije se komadom filtarskog papira te se nakon punjenja vodom epruveta postavi na stalak u vodenoj kupelji. Epruvetu je potrebno postupno uranjati sve dok razina vode ne bude iznad gornjeg dijela tla. Potom je treba ostaviti u vodi tri sata. Budući da tlo ne može zadržati svu vodu koju apsorbira kapilarama, uzorak tla potrebno je ostaviti dva sata da se ocijedi tako što se epruveta postavi na podlogu od vrlo mokrog fino usitnjenog kremenog pijeska u zatvorenoj posudi (da se spriječi sušenje). Uzorak je potom potrebno izvagati i osušiti do stalne mase na 105 °C. Vodni kapacitet (WHC) potom se može izračunati kako slijedi:
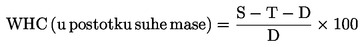 , ,
gdje je:
|
S
|
=
|
supstrat zasićen vodom + masa epruvete + masa filtarskog papira,
|
|
T
|
=
|
tara (masa epruvete + masa filtarskog papira),
|
|
D
|
=
|
suha masa supstrata.
|
UPUĆIVANJA:
ISO (International Organization for Standardization) (1996.) Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Ženeva.
Dodatak 3.
Određivanje ph-vrijednosti tla
Sljedeća se metoda određivanja pH-vrijednosti uzorka tla temelji na opisu navedenom u normi ISO 10390 (Kakvoća tla – određivanje pH-vrijednosti).
Definirana količina tla suši se na sobnoj temperaturi najmanje 12 sati. Potom se tlo (najmanje 5 grama) suspendira u pet puta većoj količini 1 M kalijeva klorida (KCl) analitičkog stupnja čistoće ili 0,01 M otopine kalcijeva klorida (CaCl2) analitičkog stupnja čistoće. Suspenzija se nakon toga protresa pet minuta. Nakon protresanja suspenzija se ostavlja da se taloži najmanje dva sata, ali ne dulje od 24 sata. Potom se pH-vrijednost tekuće faze izmjeri pH-metrom koji se prije svakog mjerenja kalibrira s pomoću odgovarajućeg niza puferskih otopina (npr. pH 4,0 i 7,0).
UPUĆIVANJA:
ISO (International Organization for Standardization) (1994.) Soil Quality – Determination of pH, No. 10390. ISO, Ženeva.
Dodatak 4.
Uvjeti uzgoja Enchytraeus sp.
Enhitreji vrste Enchytraeus albidus (kao i ostale vrste Enchytraeus) mogu se uzgajati u velikim plastičnim kutijama (npr. 30 × 60 × 10 cm) napunjenima mješavinom umjetnog tla i prirodnog, neonečišćenog vrtnog tla u omjeru 1:1. Mora se izbjegavati kompost jer može sadržavati toksične kemikalije poput teških metala. Prije uporabe iz tla potrebno je ukloniti faunu (npr. dubokim zamrzavanjem). Može se upotrebljavati i supstrat koji se sastoji isključivo od umjetnog tla, ali je moguće da će stopa razmnožavanja biti manja od one koja se postiže kod supstrata s miješanim tlom. pH supstrata mora iznositi 6,0 ± 0,5.
Kultura se drži u mraku na temperaturi od 15 do 20 °C ± 2 °C. Moraju se izbjegavati temperature iznad 23 °C. Tlo se mora održavati tako da bude vlažno, ali ne mokro. Na ispravan sadržaj vlage u tlu ukazuju sitne kapljice vode koje se pojave među prstima kad se tlo blago stisne rukom. Mora se izbjegavati stvaranje anoksičnih uvjeta, i to tako da se osigura da poklopci posuda za uzgoj omogućuju dovoljnu razmjenu plinova s atmosferom. Tlo je potrebno pažljivo promiješati jedanput tjedno da se omogući dozračivanje.
Crve se može hraniti zobenim pahuljicama. Zob je potrebno čuvati u zatvorenim posudama te je obraditi u autoklavu ili zagrijati prije uporabe kako bi se izbjegle infekcije grinjama iz brašna (npr. Glyzyphagus sp., Astigmata, Acarina) ili grabežljivim grinjama [npr. Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina]. Nakon toplinske obrade hranu je potrebno samljeti da bi se mogla lakše rasuti po površini tla. S vremena na vrijeme zobenim se pahuljicama mogu dodati vitamini, mlijeko i ulje jetre bakalara. Ostali su prikladni izvori hrane pekarski kvasac i riblja hrana ‚Tetramin’.
Hrana se daje otprilike dva puta tjedno. Odgovarajuća količina zobenih pahuljica pospe se po površini tla ili se pažljivo umiješa u supstrat prilikom miješanja tla radi dozračivanja. Apsolutna količina hrane koja se daje ovisi o broju crva prisutnih u supstratu. Za orijentaciju, količinu hrane potrebno je povećati ako se u cijelosti pojede u roku od jednog dana od davanja. I obratno, ako u trenutku sljedećeg hranjenja (tjedan kasnije) na površini tla još uvijek ima ostataka hrane, količinu je potrebno smanjiti. Hranu kontaminiranu gljivicama potrebno je ukloniti i zamijeniti. Nakon tri mjeseca crve je potrebno prenijeti u svježe pripremljen supstrat.
Smatra se da su uvjeti uzgoja zadovoljavajući ako crvi: (a) ne pokušavaju izići iz supstrata; (b) brzo se kreću kroz tlo; (c) imaju sjajnu vanjsku površinu na koju se ne lijepe čestice tla; (d) više-manje su bijele boje; (e) pokazuju različite raspone starosti u kulturama i (f) stalno se razmnožavaju.
Dodatak 5.
Provođenje ispitivanja s drugim vrstama Enchytraeus
Odabir vrste
Mogu se upotrebljavati i druge vrste osim E. albidus, ali u tom je slučaju potrebno na odgovarajući način prilagoditi ispitni postupak i kriterije valjanosti. Budući da su mnoge vrste Enchytraeus lako dostupne i može ih se na zadovoljavajući način održavati u laboratoriju, najvažniji je kriterij za odabir druge vrste umjesto E. albidus ekološka relevantnost i, dodatno, usporediva osjetljivost. Ponekad je promjena vrste potrebna zbog formalnih razloga. Na primjer, u državama u kojima nema E. albidus i ne može ih se uvoziti (npr. zbog ograničenja uvedenih zbog karantene) bit će nužno upotrijebiti drugu vrstu Enchytraeus.
Primjeri prikladnih alternativnih vrsta
|
—
|
Enchytraeus crypticus (Westheide i Graefe, 1992.): Zadnjih se godina ova vrsta često upotrebljava u ekotoksikološkim istraživanjima jer ju je lako uzgajati i ispitivati. Međutim, malena je pa je njome teže rukovati nego vrstom E. albidus (posebno u fazama prije primjene metode bojenja). Nije sa sigurnošću dokazano da E. crypticus nastanjuje polja, samo je opisana u kulturama gujavica. Stoga nisu poznati njezini ekološki zahtjevi.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky, 1879.): Ovaj naziv vjerojatno obuhvaća skupinu blisko povezanih vrsta koje je teško morfološki razlikovati. Ne preporučuje se upotrebljavati je za ispitivanja ako jedinke namijenjene ispitivanju nije moguće identificirati na razini vrste. E. buchholzi obično nastanjuje livade i poremećena mjesta poput pojasa uz ceste.
|
|
—
|
Enchytraeus luxuriosus: Ova vrsta, prvobitno poznata kao E. minutus, tek je nedavno opisana (1). Prvi ju je pronašao U. Graefe (Hamburg) na livadi u blizini St. Peter-Ordinga (Schleswig-Holstein, Njemačka). E. luxuriosus doseže otprilike polovicu veličine E. albidus, ali je veća od drugih vrsta o kojima se ovdje govori; stoga bi mogla biti dobra zamjena za E. albidus.
|
|
—
|
Enchytraeus bulbosus (Nielsen i Christensen, 1963.): Do danas postoje izvješća o prisutnosti ove vrste u njemačkim i španjolskim mineralnim tlima, u kojima je uobičajena, ali općenito ne i vrlo brojna. U usporedbi s drugim malim vrstama ovog roda, relativno ju je lako identificirati. Ne zna se ništa o njezinu ponašanju u laboratorijskim ispitivanjima ili njezinoj osjetljivosti na kemikalije. Međutim, pokazalo se da ju je lako uzgajati (E. Belotti, osobna komunikacija).
|
Uvjeti uzgoja
Sve navedene vrste Enchytraeus mogu se uzgajati u istim supstratima kao i E. albidus. S obzirom na to da su manje, mogu se uzgajati u manjim posudama te, iako se može upotrebljavati ista hrana, količinu hrane treba prilagoditi. Životni ciklus tih vrsta kraći je nego kod E. albidus pa se hranjenje mora provoditi češće.
Uvjeti ispitivanja
Uvjeti ispitivanja općenito su isti kao oni koji se primjenjuju na E. albidus, osim što:
|
—
|
posuda za uzgoj može (ali ne mora) biti manja,
|
|
—
|
test reproduktivne toksičnosti može (ali ne mora) trajati kraće, tj. četiri umjesto šest tjedana; međutim, trajanje ispitivanja za određivanje raspona ne bi se smjelo promijeniti,
|
|
—
|
s obzirom na to da su mladi crvi vrlo maleni, za njihovo se brojenje čvrsto preporučuje primjena metode bojenja,
|
|
—
|
kriterij valjanosti koji se odnosi na ‚broj mladih jedinki po ispitnoj posudi u kontroli’ potrebno je promijeniti na ‚50’.
|
UPUĆIVANJA
|
(1)
|
Schmelz, R. M. i Collado, R. (1999.) Enchytraeus luxuriosus sp. nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93 – 100.
|
Dodatak 6.
Detaljan opis ekstrakcijskih tehnika
Bojenje bengalskim crvenilom
Ova je metoda izvorno razvijena u limničkoj ekologiji (1), a njezinu primjenu za brojenje mladih enhitreja u ispitivanju reproduktivne toksičnosti na enhitrejama prvi je predložio W. de Coen (Sveučilište u Ghentu, Belgija). RIVM Bilthoven (2) (3) neovisno je razvio modificiranu verziju (bengalsko crvenilo pomiješano s formaldehidom umjesto s etanolom).
Na kraju glavnog ispitivanja (tj. nakon šest tjedana), tlo is ispitnih posuda prenosi se u plitku posudu. U tu svrhu mogu biti korisne posuda Bellaplast ili kada za razvijanje fotografija s rebrastim dnom, i to, kad je riječ o kadi, zbog toga što ‚rebra’ ograničavaju kretanje crva unutar područja promatranja. Mlade se jedinke fiksiraju etanolom (oko 5 ml po ponavljanju). Posude se potom napune vodom do visine od 1 do 2 cm. Dodaje se nekoliko kapi (200 do 300 μl) bengalskog crvenila (1-postotna otopina u etanolu) (ili 0,5 % eozina) te se ta dva sastojka pažljivo promiješaju. Nakon 12 sati crvi bi trebali poprimiti crvenkastu boju i trebalo bi ih biti lako izbrojiti jer će ležati na površini supstrata. Druga je mogućnost da se smjesa supstrata i alkohola ispere kroz sito (veličine otvora 0,250 mm) prije brojenja crva. Tim se postupkom ispere kaolinit, treset i nešto pijeska pa je lakše uočiti i izbrojiti crvenkasto obojene crve. Brojenje će olakšati i uporaba osvijetljenog povećala (veličina leće najmanje 100 × 75 mm s faktorom povećanja od dva do tri puta).
Tehnika bojenja smanjuje vrijeme brojenja na nekoliko minuta po posudi pa bi, za orijentaciju, jedna osoba mogla procijeniti sve posude iz jednog ispitivanja za najviše dva dana.
Ekstrakcija mokrim postupkom
Ekstrakciju mokrim postupkom potrebno je započeti odmah nakon završetka ispitivanja. Tlo iz svake ispitne posude stavlja se u plastična sita veličine otvora oko 1 mm. Sita se potom objese u plastične zdjele tako da ne dodiruju dno. Zdjele se pažljivo pune vodom sve dok uzorci u sitima ne budu potpuno ispod površine vode. Kako bi se osigurala stopa iskorištenja veća od 90 % prisutnih crva, razdoblje ekstrakcije mora trajati tri dana na temperaturi od 20 ± 2 °C. Na kraju razdoblja ekstrakcije sita se uklanjaju te se voda (osim male količine) polako dekantira, pazeći da se ne poremeti sediment na dnu zdjela. Plastične se zdjele potom lagano protresu kako bi se sediment suspendirao u vodi iznad sebe. Voda se prenosi u Petrijevu zdjelicu te se, nakon što se čestice tla stalože, enhitreji mogu identificirati, ukloniti i izbrojiti s pomoću stereomikroskopa i mekane čelične pincete.
Flotacija
Metodu koja se temelji na flotaciji opisao je u napomeni R. Kuperman (4). Nakon što se sadržaj ispitne posude fiksira etanolom, tlo se prelije Ludoxom (koloidna silika AM-30, 30 wt. % vodene suspenzije) do visine od 10 do 15 mm iznad površine tla. Nakon što se tlo temeljito miješa sa sredstvom za flotaciju dvije do tri minute, mladi crvi koji plutaju po površini mogu se lako izbrojiti.
Upućivanja
|
(1)
|
Korinkova, J. i Sigmund, J. (1968.) The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300 – 305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R. i Notenboom, J. (1994.) Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport No. 719102025. str. 46.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R. P. M. i Dirven-Van Breemen, E. M. (1997.) Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108 – 121.
|
|
(4)
|
Phillips, C. T., Checkai, R. T. i Kuperman, R. G. (1998.) An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, SAD. Abstract Book No. PMP069, str. 157.
|
Dodatak 7.
Pregled statističke procjene podataka (određivanje NOEC-a)

C.33. TEST REPRODUKTIVNE TOKSIČNOSTI NA GUJAVICAMA (EISENIA FETIDA/ EISENIA ANDREI)
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 222 (2004.). Namijenjena je procjeni učinaka kemikalija u tlu na reprodukcijsku uspješnost (i druge subletalne krajnje točke) gujavica vrste Eisenia fetida (Savigny, 1826.) ili Eisenia andrei (Andre, 1963.) (1)(2). Metoda je ispitana u prstenastom testu (3). Postoji ispitna metoda za ispitivanje akutne toksičnosti za gujavice (4). Objavljen je niz drugih međunarodnih i nacionalnih smjernica za ispitivanje akutne i kronične toksičnosti za gujavice (5) (6) (7) (8).
|
|
2.
|
Eisenia fetida /Eisenia andrei smatraju se predstavnicima faune tla, posebno gujavica. Osnovne informacije o ekologiji gujavica i njihovoj uporabi u ekotoksikologiji mogu se pronaći u literaturi (7) (9) (10) (11) (12).
|
NAČELO ISPITIVANJA
|
3.
|
Odrasle se gujavice izlažu nizu koncentracija ispitivane kemikalije umiješane u tlo ili, u slučaju pesticida, primijenjene u ili na tlo postupcima koji su u skladu s obrascem uporabe predmetne kemikalije. Metoda primjene ovisi o svrsi testa. Raspon ispitnih koncentracija bira se tako da obuhvaća one za koje postoji vjerojatnost da će u razdoblju od osam tjedana izazvati subletalne i letalne učinke. Smrtnost i učinci na rast odraslih gujavica utvrđuju se nakon četiri tjedna izloženosti. Odrasle se gujavice potom uklanjaju iz tla te se nakon dodatna četiri tjedna procjenjuju učinci na razmnožavanje brojenjem njihovih potomaka prisutnih u tlu. Reprodukcijska uspješnost gujavica izloženih ispitivanoj kemikaliji uspoređuje se s kontrolom odnosno kontrolama kako bi se odredila (i) najviša koncentracija bez vidljivog učinka (NOEC) i/ili (ii) ECx (npr. EC10, EC50) primjenom regresijskog modela kako bi se procijenila koncentracija koja bi izazvala x-postotno smanjenje reprodukcijske uspješnosti. Ispitne koncentracije moraju obuhvaćati ECx (npr. EC10, EC50) tako da se ECx potom može dobiti interpolacijom, a ne ekstrapolacijom (za definicije vidjeti dodatak 1.).
|
INFORMACIJE O ISPITIVANOJ KEMIKALIJI
|
4.
|
Potrebno je raspolagati sljedećim informacijama o ispitivanoj kemikaliji koje će pomoći u planiranju odgovarajućih ispitnih postupaka:
|
—
|
po mogućnosti informacije o sudbini i ponašanju u okolišu (npr. brzina fotolize i brzina hidrolize ako su ti parametri relevantni s obzirom na načine primjene).
|
|
|
5.
|
Ova se ispitna metoda može primijeniti na sve kemikalije, neovisno o njihovoj topljivosti u vodi. Ova ispitna metoda nije primjenjiva na hlapljive kemikalije, koje se ovdje definiraju kao kemikalije za koje su Henryjeva konstanta ili koeficijent razdjeljenja između zraka i vode veći od jedan, ili na kemikalije čiji je tlak para veći od 0,0133 Pa pri 25 °C.
|
|
6.
|
U ovoj se ispitnoj metodi ne uzima u obzir moguća razgradnja ispitivane kemikalije u razdoblju ispitivanja. Stoga se ne može pretpostaviti da će koncentracije izlaganja zadržati svoje početne vrijednosti tijekom cijelog ispitivanja. U tom se slučaju preporučuje provesti kemijsku analizu ispitivane kemikalije na početku i na kraju ispitivanja.
|
REFERENTNA KEMIKALIJA
|
7.
|
Moraju se odrediti NOEC i/ili ECx referentne kemikalije kako bi se zajamčilo da su uvjeti laboratorijskog ispitivanja odgovarajući te kako bi se potvrdilo da se odgovor ispitnih organizama statistički ne mijenja tijekom vremena. Preporučljivo je ispitati referentnu kemikaliju barem jednom godišnje ili, ako se ispitivanje provodi rjeđe, istovremeno s određivanjem toksičnosti ispitivane kemikalije. Prikladne su referentne kemikalije karbendazim ili benomil, za koje se pokazalo da utječu na razmnožavanje (3). Značajne učinke trebalo bi uočiti između (a) 1 i 5 mg aktivnog sastojka (a. s.) / kg suhe mase ili (b) 250 – 500 g/ha ili 25 – 50 mg/m2. Ako se u ispitni niz uključi pozitivan toksični standard, upotrebljava se jedna koncentracija i jednak broj ponavljanja kao i kod kontrola.
|
VALJANOST ISPITIVANJA
|
8.
|
Da bi se rezultat ispitivanja smatrao valjanim, kontrole moraju zadovoljavati sljedeće kriterije:
|
—
|
u svakom ponavljanju (koje sadržava deset odraslih jedinki) mora biti dobiveno ≥ 30 mladih do kraja ispitivanja,
|
|
—
|
koeficijent varijacije razmnožavanja mora biti ≤ 30 %,
|
|
—
|
smrtnost odraslih životinja tijekom prva četiri tjedna ispitivanja mora biti ≤ 10 %.
|
Ako ispitivanje ne ispuni navedene kriterije valjanosti, potrebno ga je prekinuti, osim ako postoji opravdanje za njegov nastavak. To se opravdanje mora navesti u izvješću.
|
OPIS ISPITIVANJA
Oprema
|
9.
|
Moraju se upotrebljavati ispitne posude od stakla ili drugog kemijski inertnog materijala zapremnine oko jedne do dvije litre. Površina poprečnog presjeka posude mora iznositi oko 200 cm2, tako da se dodavanjem 500 do 600 g suhe mase supstrata postigne dubina mokrog supstrata od oko 5 do 6 cm. Posuda mora biti izrađena na način da omogućuje razmjenu plinova između supstrata i atmosfere te pristup svjetla (npr. s pomoću perforiranog prozirnog poklopca) te istodobno sprječava bijeg gujavica. Ako je količina upotrijebljenog ispitnog supstrata značajno veća od 500 do 600 g po ispitnoj posudi, broj gujavica potrebno je razmjerno povećati.
|
|
10.
|
Potrebna je uobičajena laboratorijska oprema, a posebno:
|
—
|
prikladne precizne vage,
|
|
—
|
odgovarajuća oprema za kontrolu temperature,
|
|
—
|
odgovarajuća oprema za kontrolu vlage (nije nužna ako ispitne posude imaju poklopce),
|
|
—
|
inkubator ili manja prostorija opremljena klimatizacijskim uređajem,
|
|
—
|
pincete, kuke ili petlje,
|
|
Pripremanje umjetnog tla
|
11.
|
U ovom se ispitivanju upotrebljava umjetno tlo (5) (7) sljedećeg sastava (na bazi suhe mase, osušene do stalne mase pri 105 °C):
|
—
|
10 % Sphagnum treseta (što bliže pH području od 5,5 do 6,0, bez vidljivih ostataka biljaka, fino usitnjen, osušen do izmjerenog stupnja vlage),
|
|
—
|
20 % kaolinitske gline (sadržaj kaolinita po mogućnosti iznad 30 %),
|
|
—
|
0,3 do 1,0 % kalcijeva karbonata (CaCO3 u prahu, analitičkog stupnja čistoće) da se dobije početna pH-vrijednost od 6,0 ± 0,5.
|
|
—
|
70 % kremenog pijeska sušenog na zraku (ovisno o potrebnoj količini CaCO3), pretežno finog pijeska s više od 50 % čestica veličine između 50 i 200 mikrona.
|
Napomena 1.: Količina potrebnog CaCO3 ovisit će o sastojcima tla, uključujući hranu, i potrebno ju je odrediti mjerenjem poduzoraka tla neposredno prije ispitivanja. pH se mjeri na uzorku tla pomiješanog s 1 M otopinom kalijeva klorida (KCl) ili 0,01 M otopinom kalcijeva klorida (CaCl2) (13).
Napomena 2.: Sadržaj organskog ugljika u umjetnom tlu može se smanjiti, npr. smanjenjem sadržaja treseta na 4 do 5 % i sukladnim povećanjem sadržaja pijeska. Takvim smanjenjem sadržaja organskog ugljika može se smanjiti mogućnost adsorpcije ispitivane kemikalije u tlo (organski ugljik) te povećati dostupnost ispitivane kemikalije gujavicama. Pokazalo se da Eisenia fetida može ispuniti kriterije valjanosti koji se odnose na razmnožavanje kada se ispituje u tlima nižeg sadržaja organskog ugljika (2,7 %) (14), a iskustvo pokazuje da se to može postići i s umjetnim tlom s 5 % treseta. Stoga prije uporabe takvog tla u glavnom ispitivanju nije potrebno dokazati da je umjetno tlo prikladno za ispunjivanje kriterija valjanosti ispitivanja, osim ako se sadržaj treseta smanji više nego što je navedeno ranije u tekstu.
Napomena 3.: Ako se u dodatnim ispitivanjima (npr. ispitivanjima višeg stupnja) upotrebljava prirodno tlo, isto je tako potrebno dokazati prikladnost tla i ispunjenje kriterija valjanosti ispitivanja.
|
|
12.
|
Suhi sastojci tla temeljito se izmiješaju (npr. u velikoj laboratorijskoj miješalici) na dobro prozračenom mjestu. Prije početka ispitivanja suho umjetno tlo vlaži se dodavanjem dovoljne količine deionizirane vode da se dobije otprilike polovica konačnog sadržaja vode, tj. 40 % do 60 % maksimalnog vodnog kapaciteta (što odgovara sadržaju od 50 ± 10 % vlage po suhoj masi). Time se dobiva supstrat na kojemu ne leži voda ili iz kojeg ne istječe voda kad se zgnječi rukom. Maksimalni vodni kapacitet (WHC) umjetnog tla određuje se u skladu s postupcima opisanima u Dodatku 2., normi ISO 11274 (15) ili istovrijednoj normi EU-a.
|
|
13.
|
Ako se ispitivana kemikalija primjenjuje na površinu tla ili je umiješana u tlo bez vode, konačna količina vode može se umiješati u umjetno tlo tijekom pripreme tla. Ako se ispitivana kemikalija umiješa u tlo zajedno s određenom količinom vode, dodatna se voda može unijeti zajedno s ispitivanom kemikalijom.
|
|
14.
|
Sadržaj vlage u tlu određuje se na početku i na kraju ispitivanja u skladu s normom ISO 11465 (16) ili istovrijednom normom EU-a, a pH-vrijednost tla u skladu s Dodatkom 3. ili normom ISO 10390 (13) ili istovrijednom normom EU-a. Ta se određivanja provode na uzorku kontrolnog tla i na uzorku tla svake ispitne koncentracije. pH-vrijednost tla nije potrebno prilagođavati ako se ispituju kisele ili lužnate kemikalije. Sadržaj vlage potrebno je pratiti tijekom cijelog ispitivanja periodičnim vaganjem posuda (vidjeti stavke 26. i 30.).
|
Odabir i priprema ispitnih životinja
|
15.
|
U ispitivanju se upotrebljava vrsta Eisenia fetida ili Eisenia andrei (1) (2). Da bi se započelo s ispitivanjem, potrebne su odrasle gujavice stare između dva mjeseca i godinu dana s razvijenim klitelumom. Gujavice je potrebno izabrati iz sinkronizirane kulture relativno homogene dobne strukture (Dodatak 4.). Starost jedinki u istoj ispitnoj skupini ne bi se smjela razlikovati za više od četiri tjedna.
|
|
16.
|
Izabrane gujavice potrebno je aklimatizirati najmanje jedan dan u onoj vrsti umjetnog tla koja će se upotrebljavati u ispitivanju. U tom je razdoblju gujavice potrebno hraniti istom hranom kakva će se upotrebljavati u ispitivanju (vidjeti stavke od 31. do 33.).
|
|
17.
|
Na početku ispitivanja skupine od deset gujavica potrebno je pojedinačno izvagati i nasumično rasporediti u ispitne posude. Gujavice se prije vaganja operu (deioniziranom vodom) te se višak vode ukloni kratkim držanjem gujavica na filtarskom papiru. Mokra masa pojedinačnih gujavica mora iznositi između 250 i 600 mg.
|
Priprema ispitnih koncentracija
|
18.
|
Mogu se upotrijebiti dvije metode primjene ispitivane kemikalije: ispitivana se kemikalija može umiješati u tlo (vidjeti stavke 19. do 21.) ili primijeniti po površini tla (vidjeti stavke 22. do 24.). Odabir odgovarajuće metode ovisi o svrsi ispitivanja. Općenito se preporučuje umiješati ispitivanu kemikaliju u tlo. Međutim, možda će biti potrebno primijeniti postupke koji odgovaraju uobičajenoj poljoprivrednoj praksi (npr. raspršivanje tekuće formulacije ili uporaba posebnih formulacija pesticida poput granula ili sredstava za tretiranje sjemena). Otapala za lakše tretiranje tla ispitivanom kemikalijom potrebno je odabrati na temelju njihove niske toksičnosti za gujavice te je u plan ispitivanja potrebno uključiti odgovarajuću kontrolu tretiranu otapalom (vidjeti stavak 27.).
|
Miješanje ispitivane kemikalije u tlo
Ispitivana kemikalija topljiva u vodi
|
19.
|
Otopina ispitivane kemikalije priprema se u deioniziranoj vodi neposredno prije početka ispitivanja, u količini dovoljnoj za sva ponavljanja jedne koncentracije. Radi lakše pripreme ispitne otopine, ponekad je potrebno upotrijebiti suotapalo. Prikladno je pripremiti onu količinu otopine koja je potrebna da se postigne konačan sadržaj vlage (40 do 60 % maksimalnog vodnog kapaciteta). Otopina se temeljito izmiješa sa supstratom tla prije nego što se uvede u ispitnu posudu.
|
Ispitivana kemikalija netopljiva u vodi
|
20.
|
Ispitivana se kemikalija otopi u maloj količini odgovarajućeg organskog otapala (npr. acetona) te se rasprši po maloj količini finog kremenog pijeska ili se umiješa u njega. Otapalo se potom uklanja isparavanjem u digestoru najmanje nekoliko minuta. Tretirani se pijesak potom temeljito pomiješa s prethodno navlaženim umjetnim tlom. Potom se doda deionizirana voda (potrebna količina) kako bi se postigao konačan sadržaj vlage od 40 do 60 % maksimalnog vodnog kapaciteta i pomiješa se s tlom. Tlo je tada spremno za stavljanje u ispitne posude. Potrebno je voditi računa o tome da neka otapala mogu biti toksična za gujavice.
|
Ispitivana kemikalija netopljiva u vodi i organskim otapalima
|
21.
|
Pripremi se smjesa od 10 g fino usitnjenog industrijskog kremenog pijeska i onolike količine ispitivane kemikalije kolika je potrebna za postizanje ispitne koncentracije u tlu. Smjesa se temeljito pomiješa s prethodno navlaženim umjetnim tlom. Potom se doda deionizirana voda u količini potrebnoj da se postigne konačan sadržaj vlage od 40 do 60 % maksimalnog vodnog kapaciteta i pomiješa se s tlom. Tlo je tada spremno za stavljanje u ispitne posude.
|
Primjena ispitivane kemikalije na površinu tla
|
22.
|
Tlo se tretira nakon što se dodaju gujavice. Ispitne se posude prvo napune navlaženim supstratom tla i potom se na površinu stave izvagane gujavice. Zdrave se gujavice obično odmah ukopavaju u supstrat pa se prema tome sve gujavice koje se nakon 15 minuta još uvijek nalaze na površini smatraju oštećenima i moraju se zamijeniti. Ako se gujavice zamjenjuju, potrebno je izvagati nove i one koje su zamijenjene, tako da je na početku poznata ukupna živa masa izložene skupine gujavica i ukupna masa posude s gujavicama.
|
|
23.
|
Primjenjuje se ispitivana kemikalija. Ne smije se dodati u tlo unutar pola sata od unošenja gujavica (ili ako su gujavice prisutne na površini tla) kako bi se izbjegla izravna izloženost ispitivanoj kemikaliji putem dodira s kožom. Ako je ispitivana kemikalija pesticid, može je biti prikladno primijeniti na površinu tla raspršivanjem. Ispitivanu kemikaliju potrebno je primijeniti na površinu tla što je moguće ravnomjernije s pomoću laboratorijske prskalice prikladne za simuliranje raspršivanja na polju. Prije primjene potrebno je ukloniti poklopac posude i zamijeniti ga oplatom koja će štititi stranice posude od prskanja. Oplata može biti napravljena od ispitne posude kojoj je uklonjeno dno. Primjena se provodi pri temperaturi od 20 ± 2 °C te, ako je riječ o vodenim otopinama, emulzijama ili disperzijama, u dozi od 600 do 800 μl/m2. Dozu je potrebno provjeriti odgovarajućom kalibracijskom tehnikom. Posebne formulacije poput granula i sredstava za tretiranje sjemena potrebno je primijeniti onako kako se primjenjuju u poljoprivredi.
|
|
24.
|
Ispitne posude potrebno je ostaviti otvorenima sat vremena kako bi moglo ispariti hlapljivo otapalo povezano s primjenom ispitivane kemikalije. Potrebno je paziti da za to vrijeme iz ispitnih posuda ne pobjegne nijedna gujavica.
|
POSTUPAK
Ispitne skupine i kontrole
|
25.
|
Preporučuje se punjenje od deset gujavica u od 500 do 600 g suhe mase umjetnog tla (tj. od 50 do 60 g tla po gujavici). Ako se upotrebljavaju veće količine tla, kao što može biti slučaj ako se ispituju pesticidi koji zahtijevaju poseban načinom primjene, kao što su sredstva za tretiranje sjemena, punjenje od 50 do 60 g tla po gujavici može se održati povećanjem broja gujavica. Za svaku se kontrolnu i tretiranu posudu priprema deset gujavica. Gujavice se isperu vodom i osuše te nakratko postave na upijajući papir kako bi se ocijedio višak vode.
|
|
26.
|
Kako bi se izbjegle sustavne pogreške pri raspodjeli gujavica u ispitne posude, potrebno je utvrditi homogenost ispitne populacije pojedinačnim vaganjem 20 gujavica nasumično odabranih iz populacije iz koje će se uzeti ispitne gujavice. Nakon što se utvrdi homogenost, biraju se serije gujavica te se važu i nasumično raspoređuju u ispitne posude. Nakon dodavanja ispitnih gujavica, potrebno je izvagati svaku ispitnu posudu kako bi se dobila početna masa koja će služiti kao temelj za praćenje sadržaja vlage u tlu tijekom ispitivanja, kako je opisano u stavku 30. Ispitne se posude potom prekrivaju na način opisan u stavku 9. i stavljaju u ispitnu komoru.
|
|
27.
|
Za svaku metodu primjene ispitivane kemikalije opisanu u stavcima 18. do 24. pripremaju se odgovarajuće kontrole. Kontrole se pripremaju u skladu s odgovarajućim postupcima, osim što se ne dodaje ispitivana kemikalija. Prema tomu, kontrolama se prema potrebi dodaje organsko otapalo, kremeni pijesak ili drugi nosači u koncentracijama/količinama koje su u skladu s onima koje su upotrijebljene u tretmanima. Ako se ispitivana kemikalija dodaje s pomoću otapala ili nekog drugog nosača, potrebno je pripremiti dodatnu kontrolu bez nosača ili ispitivane kemikalije te je ispitati kako bi se osiguralo da nosač ne utječe na rezultat.
|
Uvjeti ispitivanja
|
28.
|
Ispitna temperatura iznosi 20 ± 2 °C. Ispitivanje se provodi uz kontrolirane cikluse izmjene svjetlosti i tame (po mogućnosti 16 sati svjetla i osam sati tame) uz osvjetljenje od 400 do 800 luksa u području ispitnih posuda.
|
|
29.
|
Ispitne se posude ne dozračuju tijekom ispitivanja, ali poklopci ispitnih posuda moraju biti takvi da omogućuju izmjenu plinova i istodobno ograničavaju isparavanje vlage (vidjeti stavak 9.).
|
|
30.
|
Sadržaj vode u supstratu u ispitnim posudama održava se tijekom cijelog ispitivanja periodičnim vaganjem ispitnih posuda (bez poklopca). Gubitci se prema potrebi nadoknađuju deioniziranom vodom. Sadržaj vode ne smije odstupati za više od 10 % u odnosu na vrijednost na početku ispitivanja.
|
Hranjenje
|
31.
|
Prihvatljivom se smatra svaka hrana čija je kvaliteta takva da omogućuje barem održavanje mase gujavica tijekom ispitivanja. Iskustvo je pokazalo da su za tu svrhu prikladni zobeno brašno te kravlji ili konjski gnoj. Potrebno je izvršiti provjere kako bi se osiguralo da se krave ili konji čiji je gnoj prikupljen ne liječe ili tretiraju kemikalijama poput pospješivača rasta, nematicida ili sličnih veterinarskih proizvoda koji bi mogli štetno utjecati na gujavice tijekom ispitivanja. Preporučuje se izravno prikupiti kravlji gnoj jer je iskustvo pokazalo da kravlji gnoj dostupan na tržištu kao vrtno gnojivo može imati štetne učinke na gujavice. Gnoj je potrebno osušiti na zraku, fino usitniti i pasterizirati prije uporabe.
|
|
32.
|
Prije nego što se upotrijebi u ispitivanju, svaku svježu seriju hrane potrebno je dati kulturi gujavica koja nije obuhvaćena ispitivanjem kako bi se osiguralo da je prikladne kvalitete. Rast i proizvodnja kokona ne smiju biti smanjeni u usporedbi s gujavicama koje se drže u supstratu koji ne sadržava novu seriju hrane (uvjeti su opisani u ispitnoj metodi C.8. (4)).
|
|
33.
|
Hrana se prvi put daje dan nakon unošenja gujavica i primjene ispitne kemikalije na tlo. Otprilike 5 g hrane nanese se po površini tla u svakoj posudi te se navlaži deioniziranom vodom (oko 5 ml do 6 ml po posudi). Potom se hrana daje jednom tjedno u razdoblju od četiri tjedna. Ako hrana ostane nepojedena, porcije hrane potrebno je smanjiti kako bi se spriječio rast gljivica ili plijesni. Odrasle se jedinke uklanjaju iz tla 28. dana ispitivanja. Potom se u svaku ispitnu posudu stavlja dodatnih 5 g hrane. Tijekom preostala četiri tjedna ispitivanja hrana se više ne daje.
|
Odabir ispitnih koncentracija
|
34.
|
Prethodno znanje o toksičnosti ispitivane tvari, npr. iz ispitivanja akutne toksičnosti i/ili istraživanja za određivanje raspona, trebalo bi pomoći u odabiru odgovarajućih ispitnih koncentracija. Ako je potrebno, provodi se ispitivanje za određivanje raspona s na primjer pet ispitnih koncentracija: 0,1, 1,0, 10, 100 i 1 000 mg/kg (suhe mase tla). Dovoljno je jedno ponavljanje za svaki tretman i kontrolu. Ispitivanje za određivanje raspona traje dva tjedna te se na kraju ispitivanja procjenjuje smrtnost.
|
Plan pokusa
|
35.
|
Budući da se za ovo ispitivanje ne može propisati jedinstvena zbirna statistika, ovom se ispitnom metodom predviđa određivanje NOEC-a i ECx. Regulatorna će tijela u doglednoj budućnosti najvjerojatnije zahtijevati NOEC. U skoroj bi budućnosti moglo doći do još šire primjene vrijednosti ECx zbog statističkih i ekoloških razloga. Stoga se predlažu tri plana na temelju preporuka proizišlih iz prstenastog ispitivanja testa reproduktivne toksičnosti za enhitreje (17).
|
|
36.
|
Kod određivanja raspona koncentracija potrebno je voditi računa o sljedećemu:
|
—
|
Za određivanje NOEC-a potrebno je ispitati najmanje pet/dvanaest koncentracija u geometrijskom nizu. Preporučuju se četiri ponavljanja za svaku ispitnu koncentraciju plus osam kontrola. Koncentracije se moraju razlikovati za faktor koji nije veći od 2,0.
|
|
—
|
Za određivanje ECx (npr. EC10, EC50) preporučuje se odgovarajući broj koncentracija koje će izazvati najmanje četiri statistički značajno različita srednja odgovora pri tim koncentracijama. Preporučuju se najmanje dva ponavljanja za svaku ispitnu koncentraciju i šest kontrolnih ponavljanja. Interval između koncentracija može se razlikovati, tj. može iznositi 1,8 ili manje u rasponu za koji se očekuje da će izazvati učinak te više od 1,8 kod viših i nižih koncentracija.
|
|
—
|
Kombinirani pristup omogućuje određivanje i NOEC-a i vrijednosti ECx. Potrebno je upotrijebiti osam ispitnih koncentracija u geometrijskom nizu. Preporučuju se četiri ponavljanja za svaki tretman plus osam kontrola. Koncentracije se moraju razlikovati za faktor koji nije veći od 1,8.
|
|
Trajanje ispitivanja i mjerenja
|
37.
|
Žive odrasle gujavice promatraju se i broje 28. dana. Bilježi se i svako neobično ponašanje (npr. nesposobnost ukopavanja u tlo, nepomično ležanje) te promjene u morfologiji (npr. otvorene rane). Sve se odrasle gujavice potom uklanjaju iz ispitnih posuda te se broje i važu. Odrasle jedinke lakše će se pronaći ako se prije procjene tlo u kojemu se nalaze gujavice prenese na čistu pliticu. Gujavice ekstrahirane iz tla potrebno je prije vaganja oprati (deioniziranom vodom) te višak vode ukloniti kratkim držanjem gujavica na filtarskom papiru. Sve gujavice koje nisu pronađene u ovoj fazi treba evidentirati kao uginule jer se mora pretpostaviti da su te gujavice uginule i da su se raspale prije ocjenjivanja.
|
|
38.
|
Ako je tlo uklonjeno iz posuda, vraća se u njih (bez odraslih gujavica, ali sa svim nastalim kokonima). Tlo se potom inkubira dodatna četiri tjedna u istim uvjetima ispitivanja, osim što se hranjenje provodi samo na početku ove faze ispitivanja (vidjeti stavak 33.).
|
|
39.
|
Na kraju drugog četverotjednog razdoblja primjenom postupaka opisanih u Dodatku 5. utvrđuje se broj mladih koji su se izlegli iz kokona u ispitnom tlu, kao i broj kokona. Tijekom cijelog razdoblja ispitivanja potrebno je bilježiti sve znakove oštećenja ili ozljeda gujavica.
|
Granično ispitivanje
|
40.
|
Ako se u ispitivanju za određivanje raspona ne uoče učinci pri najvećoj koncentraciji (tj. 1 000 mg/kg), provodi se test reproduktivne toksičnosti kao granični test s ispitnom koncentracijom od 1 000 mg/kg. Granično ispitivanje pruža mogućnost da se dokaže da je NOEC za razmnožavanje veći od granične koncentracije, uz minimalan broj gujavica upotrijebljenih u ispitivanju. Potrebno je upotrijebiti osam ponavljanja i za tretirano tlo i za kontrolu.
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
41.
|
Iako je u Dodatku 6. naveden opći pregled, u ovoj se ispitnoj metodi ne daje stroga statistička smjernica za analizu rezultata ispitivanja.
|
|
42.
|
Jedna je od krajnjih točaka smrtnost. Međutim, potrebno je zabilježiti i promjene u ponašanju odraslih jedinki (npr. nesposobnost ukopavanja u tlo, nepomično pripijanje uz staklenu stijenku ispitne posude) i u njihovoj morfologiji (npr. otvorene rane), kao i prisutnost mladih jedinki. Za određivanje vrijednosti LC50 u pravilu je potrebno primijeniti probit-analizu (18) ili logističku regresiju. Međutim, u slučajevima u kojima je ta metoda analize neprikladna (npr. ako imamo manje od tri koncentracije koje uzrokuju djelomičnu smrtnost) mogu se primijeniti alternativne metode. To mogu biti metoda pomičnih prosjeka (19), modificirana Spearman-Karberova metoda (20) ili jednostavna interpolacija (npr. geometrijska sredina vrijednosti LC0 i LC100, izračunana množenjem drugog korijena vrijednosti LC0 s vrijednošću LC100).
|
|
43.
|
Druga je krajnja točka plodnost (tj. broj nastalih mladih jedinki). Međutim, i tu je, kao i kod ispitivanja za određivanje raspona, u završnom izvješću potrebno navesti sve ostale znakove koji ukazuju na štetno djelovanje. Da bi se izračunali rezultati koji se odnose na razmnožavanje, za statističku je analizu potrebno znati aritmetičku sredinu

i standardnu devijaciju po tretmanu i po kontroli. |
|
44.
|
Ako je provedena analiza varijance, standardna devijacija (s) i stupnjevi slobode (df) mogu se zamijeniti procjenom zajedničke (engl. pooled) varijance dobivenom ANOVA-om i njezinim stupnjevima slobode – pod uvjetom da varijanca ne ovisi o koncentraciji. U tom se slučaju upotrebljavaju pojedinačne varijance kontrole i tretmana. Te se vrijednosti obično izračunavaju s pomoću komercijalno dostupnog statističkog računalnog programa, pri čemu se rezultati dobiveni po posudi upotrebljavaju kao ponavljanja. Ako se čini da je razumnije združiti podatke za negativnu kontrolu i kontrolu s otapalom nego izračunati rezultate uspoređujući ih s jednom od tih dviju kontrola, te je podatke potrebno testirati kako bi se provjerilo ima li među njima značajnih razlika (za odgovarajuće testove vidjeti stavak 47. i Dodatak 6.).
|
|
45.
|
Daljnje statističko testiranje i zaključivanje ovisi o tome jesu li vrijednosti dobivene u ponavljanjima normalno distribuirane i jesu li im varijance homogene.
|
Procjena NOEC-a
|
46.
|
Poželjno je primijeniti snažne testove. Potrebno je koristiti se informacijama o tome jesu li podaci približno normalno distribuirani, npr. informacijama iz prijašnjeg iskustva s prstenastim ispitivanjem ili drugim podacima iz prethodno obavljenih ispitivanja. Od veće je važnosti homogenost varijance (homoskedastičnost). Iskustvo pokazuje da se varijanca često povećava kako se povećava srednja vrijednost. U tim bi se slučajevima homoskedastičnost mogla postići pretvorbom podataka. Međutim, ta se pretvorba mora temeljiti na podacima iz prethodno obavljenih ispitivanja, a ne na podacima koji se istražuju. S homogenim podacima potrebno je provesti t-testove višestruke usporedbe, kao što su Williamsov test (α = 0,05, jednosmjerni) (21) (22) ili u nekim slučajevima Dunnettov test (23) (24). Potrebno je napomenuti da se u slučaju nejednake replikacije moraju ispraviti tablične t-vrijednosti, kako to sugeriraju Dunnett i Williams. Ponekad zbog velike varijacije ne dolazi do redovitog povećanja/smanjenja odgovora. U slučaju takvog velikog odstupanja od monotoničnosti primjereniji je Dunnettov test. Ako postoje odstupanja od homoskedastičnosti, možda bi bilo uputno temeljitije istražiti moguće učinke na varijance kako bi se moglo utvrditi mogu li se t-testovi primijeniti, a da ne izgube mnogo na svojoj snazi (25). Alternativno se mogu primijeniti višestruki U-test, npr. Bonferronijev U-test prema Holmu (26) ili, kada podaci pokazuju heteroskedastičnost, ali su inače u skladu s temeljnim monotoničnim odnosom između doze i odgovora, neki drugi neparametarski test (npr. Jonckheere-Terpstra (27) (28) ili Shirley (29) (30)), kojima bi općenito trebalo davati prednost u odnosu na t-testove nejednake varijance. (Vidjeti i shemu u Dodatku 6.)
|
|
47.
|
Ako je proveden granični test te su ispunjeni uvjeti koje zahtijevaju parametarski testovi (normalnost, homogenost), može se primijeniti Studentov t-test parova, a u drugim slučajevima Mann-Whitneyjev U-test (31).
|
Procjena vrijednosti ECx
|
48.
|
Za izračunavanje bilo koje vrijednosti ECx za regresijsku se analizu (linearnu ili nelinearnu) upotrebljavaju srednje vrijednosti po tretmanu, nakon što se dobije odgovarajuća funkcija doza-odgovor. Za rast gujavica kao kontinuirani odgovor, vrijednosti ECx mogu se procijeniti odgovarajućom regresijskom analizom (32). Među prikladne funkcije za kvantalne podatke (smrtnost/preživljavanje i broj mladih jedinki) spadaju normalna sigmoidna funkcija, logistička funkcija ili Weibullova funkcija, koje sadržavaju dva do četiri parametra, od kojih neki mogu modelirati hermetičke odgovore. Ako je funkcija doza-odgovor prilagođena linearnom regresijskom analizom, značajni r2 (koeficijent određivanja) i/ili nagib potrebno je odrediti regresijskom analizom prije procjene vrijednosti ECx uvrštavanjem vrijednosti koja odgovara x-postotnoj kontrolnoj srednjoj vrijednosti u jednadžbu dobivenu regresijskom analizom. Granice pouzdanosti od 95 % izračunavaju se prema Fielleru (citirano u Finney (18)) ili u skladu s drugim odgovarajućim suvremenim metodama.
|
|
49.
|
Druga je mogućnost da se odgovor modelira kao postotak ili dio parametra modela koji se tumači kao kontrolni srednji odgovor. U tim se slučajevima normalna (logistička, Weibullova) sigmoidna krivulja često može lako prilagoditi rezultatima primjenom probit-regresije (18). U tim se slučajevima ponderacijska funkcija mora prilagoditi metričkim odgovorima prema Christensenu (33). Međutim, ako je uočena hormeza, probit-analizu potrebno je zamijeniti logističkom ili Weibullovom funkcijom s četiri parametra prilagođenom nelinearnom regresijom (34). Ako se prikladna funkcija doza-odgovor ne može prilagoditi podacima, mogu se primijeniti alternativne metode za procjenu vrijednosti ECx i njezinih granica pouzdanosti, kao što su metoda pomičnih prosjeka prema Thompsonu (19) i modificirana Spearman-Karberova metoda (20).
|
IZVJEŠĆE O ISPITIVANJU
|
50.
|
Izvješće o ispitivanju mora sadržavati slijedeće informacije:
|
|
Ispitivana kemikalija:
|
—
|
jasan opis ispitivane kemikalije, šarža, serija i CAS broj, čistoća,
|
|
—
|
svojstva ispitivane kemikalije (npr. log Kow, topljivost u vodi, tlak pare, Henryjeva konstanta (H) i informacije o sudbini i ponašanju).
|
|
|
|
Ispitni organizmi:
|
—
|
upotrijebljene ispitne životinje: vrsta, znanstveni naziv, izvor organizama i uvjeti uzgoja,
|
|
—
|
starost, raspon veličina (mase) ispitnih organizama.
|
|
|
|
Uvjeti ispitivanja:
|
—
|
detalji o pripremi ispitnog tla,
|
|
—
|
maksimalan vodni kapacitet tla,
|
|
—
|
opis metode primjene ispitivane kemikalije na tlo,
|
|
—
|
pojedinosti o pomoćnim kemikalijama koje su upotrijebljene za primjenu ispitivane kemikalije,
|
|
—
|
prema potrebi, podaci o kalibraciji opreme za raspršivanje,
|
|
—
|
opis plana pokusa i radnog postupka,
|
|
—
|
veličina ispitnih posuda i količina ispitnog tla,
|
|
—
|
uvjeti ispitivanja: intenzitet svjetlosti, trajanje ciklusa svjetla i tame, temperatura,
|
|
—
|
opis režima hranjenja, vrsta i količina hrane upotrijebljene u ispitivanju, datumi hranjenja,
|
|
—
|
pH i sadržaj vode u tlu na početku i na kraju ispitivanja.
|
|
|
|
Rezultati ispitivanja:
|
—
|
smrtnost ( %) odraslih jedinki u svakoj ispitnoj posudi na kraju prva četiri tjedna ispitivanja,
|
|
—
|
ukupna masa odraslih jedinki u svakoj ispitnoj posudi na početku ispitivanja,
|
|
—
|
promjene tjelesne mase živih odraslih jedinki ( % početne mase) u svakoj ispitnoj posudi nakon prva četiri tjedna ispitivanja,
|
|
—
|
broj mladih u svakoj ispitnoj posudi na kraju ispitivanja,
|
|
—
|
opis očitih ili patoloških simptoma ili jasnih promjena ponašanja,
|
|
—
|
rezultati dobiveni s referentnom ispitivanom kemikalijom,
|
|
—
|
vrijednosti LC50, NOEC i/ili ECx (npr. EC50, EC10) za razmnožavanje, ako su neke od njih primjenjive, te njihovi intervali pouzdanosti, kao i graf prilagođenog modela upotrijebljenog za njihov izračun te sve informacije i opažanja korisna za tumačenje rezultata,
|
|
—
|
grafički prikaz odnosa između doze i odgovora,
|
|
—
|
rezultati dobiveni za svaku ispitnu posudu.
|
|
Odstupanja od postupaka opisanih u ovoj ispitnoj metodi i sve neuobičajene pojave tijekom ispitivanja.
|
LITERATURA
|
(1)
|
Jaenicke, J. (1982.) ‚Eisenia foetida’ is two biological species. Megadrilogica 4, 6 – 8.
|
|
(2)
|
Oien, N. i Stenerson, J. (1984.) Esterases of earthworm – III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277 – 282.
|
|
(3)
|
Kula, C. (1996.) Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei – comparison of two ringtests. U: Riepert, F., Kula, C. (1996.): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, str. 50. – 82.
|
|
(4)
|
Poglavlje C.8. ovog Priloga, Toksičnost za gujavice.
|
|
(5)
|
ISO (International Organization for Standardization) (1996.) Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Ženeva.
|
|
(6)
|
ISO (International Organization for Standardization) (1993.) Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using artificial soil substrate, No. 11268-1. ISO, Ženeva.
|
|
(7)
|
SETAC (1998.) Advances in Earthworm Ecotoxicology. Sheppard, S. C., Bembridge, J. D., Holmstrup, M., i Posthuma, L. (ur.). SETAC Press, str. 456.
|
|
(8)
|
EPA (1996.) Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, travanj 1996.
|
|
(9)
|
Bouché, M. B. (1972.) Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C. A. (1983.) Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN, Commission of European Communities.
|
|
(11)
|
Greig-Smith, P. W., Becker, H., Edwards, P. J. i Heimbach, F. (ur.) (1992.) Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C. A. i Bohlen, J. P. (1996.) Biology and ecology of Earthworms, 3. izdanje. Chapman and Hall, London.
|
|
(13)
|
(ISO (International Organization for Standardization) (1994.) Soil Quality – Determination of pH, No. 10390. ISO, Ženeva.
|
|
(14)
|
Hund-Rinke, K, Römbke, J., Riepert, F. i Achazi, R. (2000.): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. U: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. i Eisentraeger, A. (ur.). Spektrum Verl., Heidelberg. 59 – 81.
|
|
(15)
|
ISO (International Organization for Standardization) (1992.) Soil Quality – Determination of water retention characteristics – Laboratory methods, No. 11274. ISO, Ženeva.
|
|
(16)
|
ISO (International Organization for Standardization) (1993.) Soil Quality – Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Ženeva.
|
|
(17)
|
Römbke, J. i Moser, Th. (1999.) Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, str. 150. + 223.
|
|
(18)
|
Finney, D. J. (1971.) Probit Analysis (3. izdanje), str. 19. – 76. Cambridge Univ. Press.
|
|
(19)
|
Finney, D. J. (1978.) Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
|
|
(20)
|
Hamilton, M. A., Russo, R. C. i Thurston, R. V. (1977.) Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714 – 719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(21)
|
Williams, D. A. (1971.) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(22)
|
Williams, D. A. (1972.) The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(23)
|
Dunnett, C. W. (1955.) A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(24)
|
Dunnett, C. W. (1964.) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(25)
|
Hoeven, N. van der (1998.) Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(26)
|
Holm, S. (1979.): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(27)
|
Jonckheere, A. R. (1954.); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133 – 145.
|
|
(28)
|
Terpstra, T. J. (1952.); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327 – 333.
|
|
(29)
|
Shirley, E. A. (1979.); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144 – 151.
|
|
(30)
|
Williams, D. A. (1986.); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183 – 186.
|
|
(31)
|
Sokal, R. R. i Rohlf, F. J. (1981.) Biometry. The Principle and practice of statistics in biological research. 2. izdanje. W. H. Freeman and Company. New York.
|
|
(32)
|
Bruce, R. D. i Versteeg, D. J. (1992.) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485-1494
|
|
(33)
|
Christensen, E. R. (1984.) Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213 – 221.
|
|
(34)
|
Van Ewijk, P. H. i Hoekstra, J. A. (1993.) Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25 – 32.
|
Dodatak 1.
Definicije
Za potrebe ove ispitne metode primjenjuju se sljedeće definicije:
|
|
Kemikalija znači tvar ili smjesa.
|
|
|
ECx
(koncentracija s učinkom od x %): koncentracija koja u određenom razdoblju izloženosti izaziva x-postotni učinak na ispitne organizme u usporedbi s kontrolom. Na primjer, EC50 je koncentracija za koju se procjenjuje da proizvodi učinak na ispitivani parametar kod 50 % izložene populacije u definiranom razdoblju izloženosti. U ovom se ispitivanju koncentracije s učinkom iskazuju kao masa ispitivane kemikalije po suhoj masi ispitnog tla ili kao masa ispitivane kemikalije po jediničnoj površini tla.
|
|
|
LC0
(nesmrtonosna koncentracija): koncentracija ispitivane kemikalije koja u određenom razdoblju ne izaziva smrt nijednog izloženog ispitnog organizma. U ovom se ispitivanju LC0 iskazuje kao masa ispitivane kemikalije po suhoj masi ispitnog tla.
|
|
|
LC50
(srednja smrtonosna koncentracija): koncentracija ispitivane kemikalije koja u određenom razdoblju izaziva smrt 50 % izloženih ispitnih organizama. U ovom se ispitivanju LC50 iskazuje kao masa ispitivane kemikalije po suhoj masi ispitnog tla ili kao masa ispitivane kemikalije po jediničnoj površini tla.
|
|
|
LC100
(potpuno smrtonosna koncentracija): koncentracija ispitivane kemikalije koja u određenom razdoblju izaziva smrt 100 % izloženih ispitnih organizama. U ovom se ispitivanju LC100 iskazuje kao masa ispitivane kemikalije po suhoj masi ispitnog tla.
|
|
|
LOEC (najniža koncentracija s vidljivim učinkom): najniža koncentracija ispitivane kemikalije koja ima statistički značajan učinak (p < 0,05) U ovom se ispitivanju LOEC iskazuju kao masa ispitivane kemikalije po suhoj masi ispitnog tla ili kao masa ispitivane kemikalije po jediničnoj površini tla. Sve ispitne koncentracije iznad LOEC-a u pravilu moraju imati učinak koji se statistički razlikuje od kontrole. Svako odstupanje od navedenoga mora biti obrazloženo u izvješću o ispitivanju.
|
|
|
NOEC (najviša koncentracija bez vidljivog učinka): najviša koncentracija ispitivane kemikalije neposredno ispod LOEC-a kod koje nije uočen nikakav učinak. U ovom ispitivanju koncentracija koja odgovara NOEC-u nema statistički značajan učinak (p < 0,05) u određenom razdoblju izloženosti u usporedbi s kontrolom.
|
|
|
Stopa razmnožavanja: srednji broj mladih gujavica dobivenih od određenog broja odraslih gujavica u razdoblju ispitivanja.
|
|
|
Ispitivana kemikalija: svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
|
Dodatak 2.
Određivanje maksimalnog vodnog kapaciteta tla
Pokazalo se da je sljedeća metoda prikladna za određivanje maksimalnog vodnog kapaciteta tla. Opisana je u Prilogu C normi ISO DIS 11268-2 (1).
Odgovarajućom napravom (npr. svrdlom s epruvetom) uzme se određena količina (npr. 5 g) tla koje služi kao ispitni supstrat. Dno epruvete prekrije se komadom filtarskog papira te se nakon punjenja vodom epruveta postavi na stalak u vodenoj kupelji. Epruvetu je potrebno postupno uranjati sve dok razina vode ne bude iznad gornjeg dijela tla. Potom je treba ostaviti u vodi tri sata. Budući da tlo ne može zadržati svu vodu koju apsorbira kapilarama, uzorak tla potrebno je ostaviti dva sata da se ocijedi tako što se epruveta postavi na podlogu od vrlo mokrog fino usitnjenog kremenog pijeska u zatvorenoj posudi (da se spriječi sušenje). Uzorak je potom potrebno izvagati i osušiti do stalne mase na 105 °C. Vodni kapacitet (WHC) potom se može izračunati kako slijedi:
 , ,
gdje je:
|
S
|
=
|
supstrat zasićen vodom + masa epruvete + masa filtarskog papira,
|
|
T
|
=
|
tara (masa epruvete + masa filtarskog papira),
|
|
D
|
=
|
suha masa supstrata.
|
UPUĆIVANJA:
|
(1)
|
ISO (International Organization for Standardisation ) (1996.) Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Ženeva.
|
Dodatak 3.
Određivanje ph-vrijednosti tla
Sljedeća metoda za određivanje pH-vrijednosti tla temelji se na opisu navedenom u normi ISO DIS 10390: Kakvoća tla – Određivanje pH-vrijednosti (1).
Definirana količina tla suši se na sobnoj temperaturi najmanje 12 sati. Potom se tlo (najmanje 5 grama) suspendira u pet puta većoj količini 1 M otopine kalijeva klorida (KCl) analitičkog stupnja čistoće ili 0,01 M otopine kalcijeva klorida (CaCl2) analitičkog stupnja čistoće. Suspenzija se potom temeljito protresa pet minuta te se ostavi da se taloži najmanje dva sata, ali ne dulje od 24 sata. Potom se pH-vrijednost tekuće faze izmjeri pH-metrom koji se prije svakog mjerenja kalibrira s pomoću odgovarajućeg niza puferskih otopina (npr. pH 4,0 i 7,0).
UPUĆIVANJA:
|
(1)
|
ISO (International Organization for Standardization) (1994.) Kakvoća tla – Određivanje pH-vrijednosti, No. 10390. ISO, Ženeva.
|
Dodatak 4.
Uzgoj Eisenia fetida / Eisenia andrei
Ove bi vrste trebalo po mogućnosti uzgajati u klimatskim komorama na temperaturi od 20 °C ± 2 °C. Pri ovoj temperaturi i uz dovoljno hrane gujavice postaju zrele nakon otprilike dva do tri mjeseca.
Obje se vrste mogu uzgajati u širokom rasponu životinjskog otpada. Preporučeni medij za uzgoj je mješavina konjskog ili kravljeg gnoja i treseta u omjeru 50: 50. Potrebno je izvršiti provjere kako bi se osiguralo da se krave ili konji čiji je gnoj prikupljen ne liječe ili tretiraju kemikalijama poput pospješivača rasta, nematicida ili sličnih veterinarskih proizvoda koji bi mogli štetno utjecati na gujavice tijekom ispitivanja. Preporučuje se izravno prikupiti kravlji gnoj iz ‚ekološkog’ izvora, jer je iskustvo pokazalo da kravlji gnoj dostupan na tržištu kao vrtno gnojivo može imati štetne učinke na gujavice. Medij mora imati pH-vrijednost oko 6 do 7 (regulira se kalcijevim karbonatom), imati nisku ionsku provodljivost (manje od 6 mg ili 0,5 % koncentracije soli) i ne smije biti prekomjerno onečišćen amonijakom ili životinjskim urinom. Supstrat bi trebao biti vlažan, ali ne previše mokar. Prikladne su kutije za uzgoj volumena od 10 do 50 litara.
Da bi se dobili crvi standardne starosti i veličine (mase), najbolje je uzgoj započeti s kokonima. Nakon što se kultura uspostavi, održava se tako da se odrasle gujavice stavljaju u uzgojnu kutiju napunjenu svježim supstratom i u njoj drže 14 do 28 dana kako bi se mogli razviti novi kokoni. Odrasle se gujavice zatim vade, a mlade jedinke izležene iz kokona upotrebljavaju se kao osnova za sljedeću kulturu. Gujavice se kontinuirano hrane životinjskim otpadom i s vremena na vrijeme prenose u sveži supstrat. Iskustvo je pokazalo da su zobeno brašno ili fino usitnjena kravlja ili konjska balega osušena na zraku prikladna hrana. Potrebno je provjeriti da se krave ili konji čiji je gnoj prikupljen ne liječe kemikalijama, kao što su pospješivači rasta, koje bi mogle štetno utjecati na gujavice tijekom dugotrajnog uzgoja. Gujavice koje se izlegnu iz kokona upotrebljavaju se za ispitivanje kada su stare između dva mjeseca i 12 mjeseci te kada se smatra da su odrasle.
Može se smatrati da su gujavice zdrave ako se kreću kroz supstrat, ne pokušavaju izići iz supstrata i neprekidno se razmnožavaju. Ako se gujavice sporo kreću i stražnji im je dio žute boje, znači da je supstrat iscrpljen. U tom se slučaju preporučuje staviti svježi supstrat i/ili smanjiti gustoću populacije u kutijama.
Dodatak 5.
Tehnike brojenja mladih gusjenica koje su se izlegle iz kokona
Ručno razvrstavanje gujavica iz supstrata zahtijeva dosta vremena. Stoga se preporučuju dvije druge metode:
|
(a)
|
Ispitne se posude stave u vodenu kupelj, čija se početna temperatura od 40 °C povećava do 60 °C. Nakon dvadesetak minuta mlade bi se gujavice trebale pojaviti na površini supstrata, odakle ih je jednostavno izvaditi i izbrojiti.
|
|
(b)
|
Ispitno se tlo može isprati kroz sito metodom koju su razvili van Gestel i sur. (1), pod uvjetom da su treset i gnoj ili zobeno brašno usitnjeni u fini prah. Dva sita veličine otvora od 0,5 mm (promjera 30 cm) postavljaju se jedno na drugo. Sadržaj ispitne posude ispire se kroz sita pod snažnim mlazom vode iz slavine, pri čemu mlade gujavice i kokoni ostaju uglavnom na gornjem situ. Važno je napomenuti da tijekom ovog postupka cijela površina gornjeg sita mora biti mokra tako da mlade gujavice plutaju na tankom sloju vode, čime se sprječava da odgmižu kroz otvore sita. Najbolji se rezultati postižu kada se upotrijebi tuš.
|
Nakon što se cijeli supstrat ispere kroz sito, mlade gujavice i kokoni mogu se isprati iz gornjeg sita u zdjelu. Potom se sadržaj zdjele pusti da odstoji sve dok prazni kokoni ne počnu plutati po površini vode, a puni kokoni i mlade gujavice potonu na dno. Tada se voda iz zdjele može izliti, a mlade gujavice i kokoni prenijeti u Petrijevu zdjelicu napunjenu malom količinom vode. Da bi im se odredio broj, gujavice se mogu izvaditi iglom ili pincetom.
Iskustvo je pokazalo da je metoda (a) prikladnija za ekstrakciju mladih jedinki koje bi mogle biti isprane čak i kroz sito s otvorima od 0,5 mm.
Potrebno je uvijek utvrditi učinkovitost metode koja se primjenjuje za vađenje gujavica (i prema potrebi kokona) iz supstrata. Ako se mlade jedinke vade ručnim razvrstavanjem, preporučljivo je postupak izvesti dva puta na svim uzorcima.
Upućivanja:
|
(1)
|
C. A. M. Van Gestel, W. A. van Dis, E. M. van Breemen, P. M. Sparenburg (1988.) Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367-371.
|
Dodatak 6.
Pregled statističke procjene podataka (određivanje NOEC-a )

C.34. ODREĐIVANJE INHIBICIJE DJELOVANJA ANAEROBNIH BAKTERIJA – SMANJENJE PROIZVODNJE PLINA IZ ANAEROBNE RAZGRADNJE (OTPADNIH VODA) MULJA
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 224 (2007.). Kemikalije ispuštene u vodeni okoliš prolaze kroz aerobne i anaerobne zone u kojima se mogu razgraditi i/ili mogu inhibirati djelovanje bakterija; u nekim slučajevima u anaerobnim zonama mogu ostati neporemećene desetljećima ili dulje. Kod obrade otpadnih voda prva je faza, prethodno taloženje, aerobna u supernatantu i anaerobna u istaloženom mulju. Potom u drugoj fazi nastaje aerobna zona u aeracijskom bazenu s aktivnim muljem te anaerobna zona u istaloženom mulju u naknadnom taložniku. Mulj iz obje navedene faze obično se podvrgava anaerobnoj obradi pri kojoj nastaju metan i ugljikov dioksid koji se uglavnom upotrebljavaju za proizvodnju električne energije. U širem će okolišu kemikalije koje dospiju u sedimente u zaljevima, ušćima i moru najvjerojatnije trajno ostati u tim anaerobnim zonama, ako nisu biorazgradive. Neke će kemikalije u većim količinama dospjeti u te zone zbog svojih fizikalnih svojstava, kao što su slaba topljivost u vodi, visoka adsorpcija na suspendirane krute tvari te nemogućnost aerobne razgradnje.
|
|
2.
|
Iako je poželjno da kemikalije koje se ispuštaju u okoliš budu biorazgradive i u aerobnim i u anaerobim uvjetima, ključno je da te kemikalije ne inhibiraju djelovanje mikroorganizama ni u jednoj od tih zona. U Ujedinjenoj Kraljevini bilo je nekoliko slučajeva potpune inhibicije proizvodnje metana uzrokovane, na primjer, pentaklorfenolom iz industrijskih ispusta, što je dovelo do vrlo visokih troškova odvoza inhibiranog mulja iz digestora na ‚sigurna’ mjesta te dovoženja zdravog mulja iz susjednih postrojenja. Međutim, brojni su slučajevi u kojima nekoliko drugih kemikalija, uključujući alifatske halogene ugljikovodike (kemijsko čišćenje) i deterdžente, uzrokuju poremećaje u razgradnji koji su manje ozbiljni, ali značajno slabe učinkovitost digestora.
|
|
3.
|
Samo se jedna ispitna metoda, C.11. (1), bavi inhibicijom djelovanja bakterija (Disanje aktivnog mulja) i njome se procjenjuje učinak ispitivanih kemikalija na brzinu potrošnje kisika u prisutnosti supstrata. Ta je metoda u širokoj primjeni za rano upozoravanje na moguće štetne učinke kemikalija na aerobnu obradu otpadnih voda te za određivanje neinhibitornih koncentracija ispitivanih kemikalija koje će se upotrebljavati u različitim testovima biorazgradivosti. Ispitna metoda C.43. (2) nudi ograničenu mogućnost određivanja toksičnosti ispitivane kemikalije za proizvodnju plina iz anaerobnog mulja, razrijeđenog do jedne desetine njegove normalne koncentracije krutih tvari kako bi se postigla potrebna preciznost u procjeni postotka biorazgradnje. S obzirom na to da razrijeđeni mulj može biti osjetljiviji na inhibitorne kemikalije, grupacija ISO odlučila je pripremiti metodu u kojoj se upotrebljava nerazrijeđeni mulj. Proučena su najmanje tri teksta (iz Danske, Njemačke i Ujedinjene Kraljevine) te su na kraju pripremljene dvije ISO norme, jedna u kojoj se upotrebljava nerazrijeđeni mulj, ISO 13 641-1 (3), i druga u kojoj se upotrebljava mulj razrijeđen sto puta, ISO 13 641-2 (4), kako bi predstavljao blata i sedimente s malim bakterijskim populacijama. Obje su metode bile podvrgnute prstenastom ispitivanju (5); prva je bila potvrđena kao prihvatljiva norma, dok je oko druge bilo neslaganja. Ujedinjena Kraljevina smatrala je da je metodu potrebno dodatno istražiti s obzirom na to da je značajan broj sudionika prijavio vrlo malu ili nikakvu proizvodnju plina, djelomično zbog toga što je postotak plinskog prostora bio previsok (75 %) za optimalnu osjetljivost.
|
|
4.
|
U prijašnjim radovima objavljenima u Ujedinjenoj Kraljevini (6) (7) opisana je manometrijska metoda u kojoj se upotrebljava nerazrijeđeni mulj, plus sirovi kanalizacijski mulj kao supstrat, u tikvicama od 500 ml; aparatura je bila nezgrapna, a smrad sirovog mulja bio je oduran. Kasnije su kompaktniju i praktičniju aparaturu koju su razvili Shelton i Tiedje (8) te poboljšali Battersby i Wilson (9) uspješno primijenili Wilson i sur. (10). Kawahara i sur. (11) uspješno su u laboratoriju pripremili homogenije muljeve za uporabu u ispitivanjima anaerobne biorazgradivosti i inhibicije na brojnim kemikalijama. Isto tako, sirovi mulj kao supstrat zamijenjen je kako bi se test proveo s anaerobnim muljem razrijeđenim sto puta ili s blatom, sedimentima itd. niske bakterijske aktivnosti.
|
|
5.
|
Ova metoda može pružiti korisne informacije za predviđanje vjerojatnog učinka ispitivane kemikalije na proizvodnju plina u anaerobnim digestorima. Međutim, jedino dulja ispitivanja kojima se vjernije simulira funkcioniranje digestora mogu pokazati može li doći do prilagodbe mikroorganizama ispitivanoj kemikaliji ili mogu li kemikalije koje će se vjerojatno apsorbirati ili adsorbirati na mulj doseći toksičnu koncentraciju u razdoblju duljem od onog koje je ispitano u ovom testu.
|
NAČELO ISPITIVANJA
|
6.
|
Alikvote smjese anaerobnog mulja (od 20 g/l do 40 g/l ukupnih krutih tvari) i otopine razgradivog supstrata inkubiraju se pojedinačno i istodobno kad i niz koncentracija ispitivane kemikalije u nepropusno zatvorenim posudama do tri dana. Količina proizvedenog plina (metan plus ugljikov dioksid) mjeri se povećanjem tlaka (Pa) u bocama. Postoci inhibicije proizvodnje plina koji se mogu pripisati različitim koncentracijama ispitivane kemikalije izračunavaju se iz količina proizvedenih u odgovarajućim ispitnim i kontrolnim bocama. EC50 i druge učinkovite koncentracije izračunavaju se iz grafičkih prikaza postotka inhibicije u ovisnosti o koncentraciji ispitivanih kemikalija ili, češće, njezinu logaritmu.
|
INFORMACIJE O ISPITIVANOJ KEMIKALIJI
|
7.
|
Ispitivane se kemikalije obično moraju upotrebljavati u najčišćem lako dostupnom obliku, jer nečistoće u nekim kemikalijama, npr. klorofenoli, mogu biti znatno toksičnije od same ispitivane kemikalije. Međutim, potrebno je uzeti u obzir i potrebe da se kemikalije ispitaju u obliku u kojemu su proizvedene / komercijalno dostupne. Uporaba formuliranih proizvoda načelno se ne preporučuje, ali za slabo topljive ispitivane kemikalije može biti primjereno upotrijebiti formulirani materijal. Svojstva ispitivane kemikalije koja je potrebno poznavati uključuju topljivost u vodi i nekim organskim otapalima, tlak para, koeficijent adsorpcije, hidrolizu i biorazgradivost u anaerobnim uvjetima.
|
PRIMJENJIVOST METODE
|
8.
|
Test se može primijeniti kod kemikalija koje su topljive ili netopljive u vodi, uključujući hlapljive kemikalije. Međutim, potreban je poseban oprez u slučaju materijala niske topljivosti u vodi (vidjeti referencu (12)) i visokog stupnja hlapljivosti. Mogu se upotrijebiti i inokulumi podrijetlom s drugih anaerobnih mjesta, npr. blata, zasićenih tala, sedimenata. Anaerobni bakterijski sustavi koji su prethodno bili izloženi toksičnim kemikalijama mogu se prilagoditi tako da zadrže svoju aktivnost i u prisutnosti ksenobiotika. Inokulumi iz prilagođenih bakterijskih sustava mogu pokazivati veću toleranciju na ispitivane kemikalije u usporedbi s inokulumima iz neprilagođenih sustava.
|
REFERENTNE KEMIKALIJE
|
9.
|
Radi provjere postupka, u okviru uobičajenog ispitivanja paralelno se ispituje referentna kemikalija u odgovarajućim posudama; pokazalo se da je 3,5-diklorfenol tipičan inhibitor anaerobne proizvodnje plina, kao i potrošnje kisika aktivnog mulja te drugih biokemijskih reakcija. Pokazalo se da su u usporedbi s 3,5-diklorfenolom druge dvije kemikalije veći inhibitori proizvodnje metana, i to metilen bis-tiocijanat i pentaklorfenol, ali rezultati dobiveni s njima nisu validirani. Pentaklorfenol se ne preporučuje jer nije lako dostupan u čistom obliku.
|
OBNOVLJIVOST REZULTATA
|
10.
|
U međunarodnom prstenastom testu (5) kod deset je laboratorija koji su sudjelovali u njemu dobivena tek osrednja obnovljivost vrijednosti EC50 za 3,5-diklorfenol i 2-bromoetan sulfonsku kiselinu. (Za prvu je kemikaliju raspon iznosio od 32 mg/l do 502 mg/l, za drugu od 220 mg/l do 2 190 mg/l.)
|
Broj laboratorija
|
Kao mg/l
|
Kao mg/g mulja
|
|
srednja vrijednost
|
s. d.
|
cv (%)
|
srednja vrijednost
|
s. d.
|
cv (%)
|
|
|
3,5-diklorfenol
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
2-bromoetan sulfonska kiselina
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
Podaci za EC50 iz prstenastog testa – nerazrijeđeni mulj
|
11.
|
Visoki koeficijent varijacije među laboratorijima u velikoj mjeri odražava razlike u osjetljivosti mikroorganizama u mulju koje su rezultat prethodne izloženosti ili neizloženosti ispitivanoj kemikaliji ili drugim kemijski srodnim kemikalijama. Preciznost kojom je određena vrijednost EC50 koja se temelji na koncentraciji mulja bila je tek nešto bolja od one postignute za ‚volumetrijsku’ vrijednost (mg/l). U tri laboratorija koja su navela preciznost svojih vrijednosti EC50 za 3,5-diklorfenol koeficijenti varijacije bili su znatno niži (22, 9 i 18 % za EC50 mg/g) od onih za srednje vrijednosti svih deset laboratorija. Pojedinačne srednje vrijednosti za ta tri laboratorija iznosile su 3,1, 3,2 i 2,8 mg/g. Niži, prihvatljivi koeficijenti varijacije unutar laboratorija u usporedbi sa znatno višim koeficijentima među vrijednostima različitih laboratorija, to jest od 9 do 22 % u usporedbi s 92 %, ukazuju na to da postoje značajne razlike u svojstvima pojedinih muljeva.
|
OPIS METODE
Aparatura
|
12.
|
Potrebna je uobičajena laboratorijska oprema te sljedeće:
|
a)
|
inkubator – koji ne iskri i termostatiran je na 35 °C ± 2 °C;
|
|
b)
|
staklene ispitne posude otporne na tlak odgovarajuće nazivne veličine (17), opremljene plinonepropusnim obloženim septumom, koji može podnijeti tlak od oko 2 bara ili 2 × 105 Pa (za oblaganje se upotrebljava npr. PTFE = politetrafluoretilen). Preporučuju se staklene serum boce nazivnog obujma 125 ml i stvarnog obujma oko 160 ml, začepljene septumom namijenjenim serum-bocama (18) i aluminijskim prstenom na navoj; uspješno se mogu upotrijebiti i boce ukupnog obujma između 0,1 i 1 litre;
|
|
c)
|
precizni mjerač tlaka
(19)
i dodatak s iglama
Ukupna proizvodnja plina (metana plus ugljikovog dioksida) mjeri se mjeračem tlaka prilagođenim za mjerenje i ispuštanje proizvedenog plina. Prikladan je instrument na primjer ručni precizni mjerač tlaka spojen s injekcijskom iglom; trokraki plinonepropusni ventil omogućuje ispuštanje viška tlaka (Dodatak 1.). Potrebno je da unutarnja zapremnina cijevi i ventila pretvornika tlaka bude što je moguće niža, kako pogreške do kojih dolazi zbog zanemarivanja volumena opreme ne bi bile značajne;
|
|
d)
|
izolirane posude za prijevoz razgrađujućeg mulja;
|
|
e)
|
trokraki tlačni ventili;
|
|
f)
|
sito kvadratnih otvora veličine 1 mm;
|
|
g)
|
spremnik za mulj koji se razgrađuje, boca od stakla ili polietilena visoke gustoće, zapremnine od oko 5 litara, opremljena miješalicom i napravom koja omogućuje prolazak struje plinovitog dušika (vidjeti stavak 13.) kroz plinski prostor;
|
|
h)
|
membranski filtri (0,2 μm) za steriliziranje supstrata;
|
|
i)
|
mikrošprice za plinonepropusno povezivanje pretvornika tlaka (vidjeti stavak 12. točku (c)) s plinskim prostorom u bocama (vidjeti stavak 12. točku (b)); služe i za dodavanje netopljivih tekućih ispitnih materijala u boce;
|
|
j)
|
komora za rukovanje s pomoću rukavica (‚glove box’), nije obvezatna, ali se preporučuje, s blagim pozitivnim tlakom dušika.
|
|
Reagensi
|
13.
|
Tijekom cijelog testa potrebno je upotrebljavati reagense analitičke čistoće. Uvijek se mora upotrebljavati plinoviti dušik visoke čistoće s udjelom kisika manjim od 5 μl/l.
|
Voda
|
14.
|
Ako je u bilo kojoj fazi potrebno razrjeđivanje, upotrebljava se deionizirana, odzračena voda. Nisu potrebne analitičke kontrole te vode, ali se mora osigurati da je uređaj za deioniziranje redovito održavan. Deionizirana voda upotrebljava se i za pripremu radnih otopina. Prije nego što se u bilo koju otopinu ili razrjeđenje ispitnog materijala doda anaerobni inokulum, potrebno je osigurati da u njima nema kisika. To se možete učiniti upuhivanjem plinovitog dušika kroz vodu za razrjeđivanje (ili kroz razrjeđenja) tijekom jednog sata prije dodavanja inokuluma ili zagrijavanjem vode za razrjeđivanje do točke vrelišta i njezinim hlađenjem na sobnu temperaturu u atmosferi bez kisika.
|
Razgrađeni mulj
|
15.
|
Mulj koji se aktivno razgrađuje uzme se iz digestora u postrojenju za pročišćavanje otpadnih voda u kojemu se pretežno pročišćavaju komunalne otpadne vode ili alternativno iz laboratorijskog digestora. Praktične informacije o mulju iz laboratorijskog digestora mogu se pronaći u literaturi (11). Ako se namjerava upotrijebiti prilagođeni inokulum, može se predvidjeti uzimanje mulja koji se razgrađuje iz postrojenja za pročišćavanje industrijskih otpadnih voda. Za prikupljanje mulja upotrebljavaju se boce širokog grla, izrađene od polietilena visoke gustoće ili sličnog materijala, koje se mogu širiti. Boce za uzorkovanje napune se muljem do visine od oko 1 cm od vrha boce, hermetički zatvore, po mogućnosti s pomoću sigurnosnog ventila (stavak 12. točka (e)), i stave u izolirane posude (stavak 12. točka (d)) kako bi se smanjio temperaturni šok te se drže u njima do prebacivanja u inkubator termostatiran na 35 °C ± 2 °C. Pri otvaranju boca potrebno je ispustiti višak tlaka plina pažljivim i postupnim otvaranjem čepa ili s pomoću trokrakog ventila za ispuštanje tlaka (stavak 12. točka (e)). Poželjno je upotrijebiti mulj u roku od nekoliko sati od prikupljanja, a u protivnom se pohranjuje na 35 °C ± 2 °C pod plinskim prostorom napunjenim dušikom do tri dana, kada obično dolazi do malog gubitka aktivnosti.
Upozorenje – Mulj koji se razgrađuje proizvodi zapaljive plinove koji predstavljaju opasnost od požara i eksplozije: sadržava i potencijalno patogene organizme, stoga poduzmite odgovarajuće mjere opreza pri rukovanju muljem. Zbog sigurnosnih razloga ne upotrebljavajte staklene posude za prikupljanje mulja.
|
Inokulum
|
16.
|
Neposredno prije uporabe mulj se blago promiješa te prosije kroz sito s otvorima veličine 1 mm2 (stavak 12. točka (f)) u prikladnu bocu (stavak 12. točka (g)), kroz čiji se plinski prostor pušta struja dušika. Uzme se uzorak za mjerenje koncentracije ukupne suhe tvari (vidjeti npr. ISO 11 923 (13) ili istovrijednu normu EU-a). Općenito, mulj se upotrebljava bez razrjeđivanja. Koncentracija krutih tvari obično iznosi između 2 % i 4 % (w/v). Provjeri se pH-vrijednost mulja i prema potrebi prilagodi na 7 ± 0,5.
|
Ispitni supstrat
|
17.
|
Otopi se 10 g hranjivog bujona (npr. Oxoid), 10 g ekstrakta kvasca i 10 g D-glukoze u deioniziranoj vodi te razrijedi do 100 ml. Sterilizira se filtriranjem kroz membranski filtar od 0,2 μm (stavak 12. točka (h)) i odmah se upotrijebi ili pohrani na 4 °C najdulje jedan dan.
|
Ispitivana kemikalija
|
18.
|
Pripremi se posebna radna otopina za svaku kemikaliju topljivu u vodi tako da sadržava npr. 10 g/l kemikalije u vodi za razrjeđivanje bez kisika (stavak 14.). Odgovarajući volumeni tih radnih otopina upotrijebe se za pripremanje reakcijskih smjesa koje sadržavaju gradirane koncentracije. Druga je mogućnost da se pripremi niz razrjeđenja svake radne otopine tako da volumen koji se doda u ispitne boce bude jednak za svaku potrebnu konačnu koncentraciju. pH-vrijednost radnih otopina prema potrebi se prilagodi na 7 ± 0,2.
|
|
19.
|
Za ispitivane kemikalije koje su nedovoljno topljive u vodi pogledati normu ISO 10 634 (12) ili istovrijednu normu EU-a. Ako je potrebno upotrijebiti organsko otapalo, izbjegavaju se otapala kao što su kloroform i ugljikov tetraklorid, za koje je poznato da snažno inhibiraju proizvodnju metana. Pripremi se otopina odgovarajuće koncentracije kemikalije netopljive u vodi u prikladnom hlapljivom otapalu, na primjer acetonu ili dietil-eteru. Potrebni volumeni otopine s otapalom dodaju se u prazne ispitne boce (stavak 12. točka (b)) te otapalo ispari prije dodavanja mulja. Za ostale obrade treba slijediti normu ISO 10 634 (12) ili istovrijednu normu EU-a, ali treba biti na oprezu jer svaki surfaktant koji se upotrebljava za stvaranje emulzija može inhibirati anaerobnu proizvodnju plina. Ako se smatra da prisutnost organskih otapala i emulgatora uzrokuje artefakte, ispitivana se kemikalija može dodati izravno u ispitnu smjesu u obliku praha ili tekućine. Hlapljive kemikalije i tekuće ispitivane kemikalije koje nisu topljive u vodi mogu se ubrizgati u inokulirane serum-boce s pomoću mikrošprica (stavak 12. točka (i)).
|
|
20.
|
Ispitivane kemikalije dodaju se u boce tako da se dobije geometrijski niz koncentracija, na primjer 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l i 15,6 mg/l. Ako raspon toksičnosti nije poznat iz podataka o sličnim kemikalijama, prvo se provede preliminarno ispitivanje za određivanje raspona na koncentracijama od 1 000 mg/l, 100 mg/l i 10 mg/l kako bi se utvrdio odgovarajući raspon.
|
Referentna kemikalija
|
21.
|
Pripremi se vodena otopina 3,5-diklorfenola (10 g/l) postupnim dodavanjem minimalne količine od 5 mol/l otopine natrijeva hidroksida krutoj tvari, uz protresanje, dok se krutina ne otopi. Zatim se doda voda za razrjeđivanje iz koje je uklonjen kisik (stavak 14.) da se dobije potreban volumen; otapanje se može poboljšati sonikacijom. Druge se referentne kemikalije mogu upotrijebiti ako je u najmanje tri testa s različitim inokulumima (različiti izvori ili različita vremena prikupljanja) dobiven prosječni raspon vrijednosti EC50.
|
INTERFERENCIJA/POGREŠKE
|
22.
|
Neki bi sastojci mulja vjerojatno mogli reagirati s mogućim inhibitorima te ih učiniti nedostupnima mikroorganizmima i tako dovesti do niže ili nulte inhibicije. Isto tako, ako mulj već sadržava kemikaliju koja ima inhibitorni učinak, ispitivanjem s tom kemikalijom mogli bi se dobiti pogrešni rezultati. Osim navedenih mogućnosti, postoji čitav niz identificiranih faktora koji mogu dovesti do pogrešnih rezultata. Navedeni su u Dodatku 3., zajedno s metodama uklanjanja ili barem smanjenja pogrešaka.
|
POSTUPAK ISPITIVANJA
|
23.
|
Broj potrebnih ponavljanja ovisi o stupnju preciznosti koji je potreban za inhibicijske indekse. Ako su brtve na bocama dovoljno plinonepropusne tijekom cijelog ispitivanja, za svaku se potrebnu koncentraciju postavi se samo jedna serija (najmanje tri ponavljanja) ispitnih boca. Isto tako, pripremi se jedna serija boca s referentnom kemikalijom i jedan set kontrola. Međutim, ako su brtve na bocama pouzdane samo za jedno ili nekoliko bušenja, serija ispitnih boca (npr. tri ponavljanja) postavi se za svaki interval (t) za koji se traže rezultati za sve koncentracije ispitivane kemikalije koje treba ispitati. Isto tako, pripreme se ‚t’ serije boca za referentnu kemikaliju i za kontrole.
|
|
24.
|
Preporučuje se uporaba komore za rukovanje s pomoću rukavica (stavak 12. točka (j)). Najmanje 30 minuta prije početka ispitivanja kroz komoru za rukovanje s pomoću rukavica koja sadržava svu potrebnu opremu pusti se mlaz plinovitog dušika. Potrebno je osigurati da tijekom rukovanja i hermetičkog zatvaranja boca temperatura mulja iznosi 35 °C ± 2 °C.
|
Preliminarno ispitivanje
|
25.
|
Ako je aktivnost mulja nepoznata, preporučuje se provođenje preliminarnog ispitivanja. Pripreme se kontrole s koncentracijama suhe tvari od na primjer 10 g/l, 20 g/l i 40 g/l plus supstrat, ali bez ispitivane kemikalije. Isto tako, upotrijebe se različiti volumeni reakcijske smjese kako bi se dobila tri ili četiri omjera volumena plinovitog prostora i volumena tekućine. Na temelju rezultata o volumenu proizvedenog plina u različiti vremenskim intervalima biraju se najprikladniji uvjeti koji omogućuju dva dnevna mjerenja pri kojima se javljaju značajni volumeni plina i ispuštanje tlaka dnevno pri optimalnoj osjetljivosti (20) bez opasnosti od eksplozije.
|
Dodavanje ispitivanih kemikalija
|
26.
|
Ispitivane kemikalije topljive u vodi dodaju se u prazne ispitne boce (stavak 12. točka (b)) u obliku vodenih otopina (stavak 18.). Upotrijebe se setovi boca koji obuhvaćaju najmanje tri ponavljanja za svaku koncentraciju iz određenog raspona (stavak 20.). Ako je riječ o netopljivim ili slabo topljivim ispitivanim kemikalijama, njihove otopine u organskim otapalima ubrizgavaju se mikrošpricom u prazne boce kako bi se dobila serija ponavljanja pet koncentracija ispitivane kemikalije. Otapalo se ispari puštanjem mlaza plinovitog dušika preko površine otopina u ispitnim bocama. Druga je mogućnost da se odmjerene količine netopljivih krutih kemikalija dodaju izravno u ispitne boce.
|
|
27.
|
Ako se netopljive i slabo topljive tekuće ispitne kemikalije ne dodaju s pomoću otapala, potrebno ih je dodati mikrošpricom izravno u ispitne boce nakon dodavanja inokuluma i ispitnog supstrata (vidjeti stavak 30.). Na isti se način mogu dodati hlapljive ispitivane kemikalije.
|
Dodavanje inokuluma i supstrata
|
28.
|
Odgovarajuća količina prosijanog mulja koji se razgrađuje promiješa se (vidjeti stavak 16.) u boci od 5 l (stavak 12. točka (g)), kroz čiji se plinski prostor pušta struja plinovitog dušika. Ispitne boce koje sadržavaju vodenu otopinu ispitivane kemikalije ili otopinu ispitivane kemikalije u isparenom otapalu ispiru se strujom plinovitog dušika oko dvije minute da se ukloni zrak. Alikvote, npr. 100 ml, dobro promiješanog mulja dodaju se u ispitne boce pipetom s velikim nastavkom ili s pomoću mjernog cilindra. Ključno je odjednom napuniti pipetu točno potrebnom količinom mulja, jer se krute tvari u mulju lako talože. Ako se uzme više, pipetu je potrebno isprazniti i početi ispočetka.
|
|
29.
|
Zatim se doda dovoljno otopine supstrata (stavak 17.) da se dobije koncentracija od 2 g/l svakog sastojaka u smjesi, hranjivog bujona, ekstrakta kvasca i D-glukoze, dok i dalje traje ispiranje dušikom. U nastavku je naveden primjer ispitnih serija.
|
Konačna masena koncentracija ispitivane kemikalije u ispitnim bocama
(mg/l)
|
Volumen ispitivane kemikalije
(ml)
|
Reagensi i mediji
(ml)
|
|
Radna otopina a)10 g/lstavak 18.
|
Radna otopina b)1 g/lstavak 18.
|
Voda za razrjeđivanje
stavak 14.
|
Inokulum
stavak 16.
|
Supstrat
stavak 17.
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Ukupna zapremnina boce = 160 ml Volumen tekućine = 103 ml
Volumen plina = 57 ml ili 35,6 % ukupnog volumena.
|
|
|
30.
|
Na isti način plinovitim dušikom isperite dovoljno praznih ispitnih boca za eventualne hlapljive i netopljive tekuće ispitne kemikalije (vidjeti stavak 27.).
|
Kontrole i referentna kemikalija
|
31.
|
Pripreme se serije boca koje obuhvaćaju najmanje tri ponavljanja i sadržavaju samo mulj i supstrat te će služiti kao kontrola. Pripreme se dodatne boce za ponavljanja koje će sadržavati mulj i supstrat plus radnu otopinu referentne kemikalije, 3,5-diklorfenol (stavak 21.), tako da se dobije konačna koncentracija od 150 mg/l. Ta bi koncentracija trebala inhibirati proizvodnju plina za oko 50 %. Druga je mogućnost da se pripremi raspon koncentracija referentne kemikalije. Osim toga, pripreme se četiri dodatne boce za mjerenje pH-vrijednosti, koje sadržavaju mulj, deoksigeniranu vodu i supstrat. Ispitivana se kemikalija doda u dvije boce u najvećoj koncentraciji koja se ispituje, a u preostale dvije boce doda se deoksigenirana voda.
|
|
32.
|
Potrebno je osigurati da sve boce – ispitne i referentne kemikalije te kontrole – sadržavaju isti volumen (VR) tekućine; prema potrebi se dodaje deoksigenirana deionizirana voda (stavak 14.) da se dobije potreban volumen. Plinski prostor mora iznositi između 10 % i 40 % zapremnine boce, pri čemu se stvarna vrijednost odabire na temelju podataka dobivenih preliminarnim ispitivanjem. Nakon što su svi sastojci dodani u boce, uklanja se igla kojom se dovodi plin te se svaka boca začepi gumenim čepom i aluminijskom kapicom (stavak 12. točka (b)), pri čemu se čep navlaži kapljicom deionizirane vode radi lakšeg umetanja. Sadržaj svake boce promiješa se tresenjem.
|
Inkubiranje boca
|
33.
|
Boce se prenesu u termostatirani inkubator koji je po mogućnosti opremljen uređajem za tresenje i održavan na temperaturi od 35 °C ± 2 °C. Boce se inkubiraju u tami. Nakon otprilike jednog sata tlak u bocama izjednači se s atmosferskim tlakom uvođenjem injekcijske igle pričvršćene na mjerač tlaka (stavak 12. točka (c)) kroz čep na svakoj boci, otvori se ventil dok mjerač tlaka ne pokaže nulu i na kraju se ventil zatvori. Igla se uvodi pod kutom od oko 45° kako bi se spriječilo istjecanje plina iz boca. Ako se boce inkubiraju bez uređaja za tresenje, tresenje se provodi ručno dva puta dnevno tijekom cijele inkubacije kako bi se sustav uravnotežio. Boce se inkubiraju te se okreću naopako da se spriječi gubitak plina kroz septum. Međutim, okretanje nije primjereno u slučajevima kada netopljive kemikalije mogu prianjati za dno tikvice.
|
Mjerenje tlaka
|
34.
|
Kada temperatura boca dosegne 35 °C ± 2 °C, mjeri se i bilježi pH-vrijednost sadržaja dviju od četiri boce pripremljene u tu svrhu te se sadržaj baca; preostale se boce nastavljaju inkubirati u tami. Tlak u bocama mjeri se i bilježi dva puta dnevno tijekom sljedećih 48 do 72 sata uvođenjem igre mjerača tlaka kroz čep svake boce, jedne za drugom, i sušenjem igle između mjerenja. Svi se dijelovi boce drže na temperaturi inkubacije tijekom mjerenja, koje se mora izvesti što je moguće brže. Pričeka se da se očitanje tlaka stabilizira i zatim se bilježi. Potom se otvori ventil za ventilaciju te ponovno zatvori kada vrijednost tlaka dođe na nulu. Test obično traje 48 sati od trenutka prvog izjednačavanja tlaka, koji se označuje kao ‚vrijeme 0’. Broj očitavanja i ventilacija za hlapljive kemikalije potrebno je ograničiti na jedan (na kraju inkubacije) ili dva, kako bi se gubitak ispitivane kemikalije sveo na najmanju moguću mjeru (10).
|
|
35.
|
Ako je očitana vrijednost tlaka negativna, ventil se ne smije otvarati. Ponekad se u injekcijskoj igli i cijevi nakupi vlaga, na što ukazuje mala negativna vrijednost očitanog tlaka. U tom se slučaju igla ukloni, cijev protrese i osuši papirom te se postavi nova igla.
|
Mjerenje pH-vrijednosti
|
36.
|
Nakon konačnog mjerenja tlaka izmjeri se i zabilježi pH-vrijednost sadržaja svake boce.
|
PODACI I IZVJEŠĆIVANJE
Izražavanje rezultata
|
37.
|
Izračuna se zbroj i prosjek zabilježenih tlakova u svakom vremenskom intervalu za svaki set boca za ponavljana određivanja te se izračuna srednji kumulativni bruto tlak plina u svakom vremenskom intervalu za svaki set ponavljanja. Prikažu se krivulje srednje kumulativne proizvodnje plina (Pa) u ovisnosti o vremenu za kontrolne, ispitne i referentne boce. Odabere se vrijeme na linearnom dijelu krivulje, obično 48 sati, te se izračuna postotak inhibicije (I) za svaku koncentraciju prema jednadžbi [1]:
|
I = (1 – Pt/PC) × 100
|
[1],
|
gdje je:
|
I
|
=
|
postotak inhibicije, u %,
|
|
Pt
|
=
|
tlak plina proizveden s ispitnim materijalom u odabranom vremenu, u paskalima (Pa),
|
|
Pc
|
=
|
tlak plina proizveden u kontroli u istom vremenu, u paskalima (Pa).
|
Preporučljivo je izraditi dva grafička prikaza, tj. jedan grafički prikaz u ovisnosti o koncentraciji i drugi u ovisnosti o logaritmu, tako da se može odabrati krivulja koja je bliža linearnosti. Vrijednost EC50 (mg/l) određuje se vizualno ili regresijskom analizom iz krivulje koja je bliža linearnosti. U poredbene svrhe ponekad je korisnije izraziti koncentraciju kemikalije kao mg kemikalije / g ukupnih krutih tvari. Da bi se dobila ta koncentracija, volumetrijska koncentracija (mg/l) podijeli se s volumetrijskom koncentracijom suhe tvari u mulju (g/l) (stavak 16.).
|
|
38.
|
Izračuna se ili postotak inhibicije postignut jednom koncentracijom upotrijebljene referentne kemikalije ili EC50 ako je ispitan dovoljan broj koncentracija.
|
|
39.
|
Srednji tlak plina proizvedenog u kontroli Pc(Pa) pretvori se u volumen prema kalibracijskoj krivulji mjerača tlaka (Dodatak 2.) te se iz toga izračuna prinos plina, izražen kao volumen proizveden u 48 sati iz 100 ml nerazrijeđenog mulja pri koncentraciji suhe tvari od 2 % (20 g/l) do 4 % (40 g/l).
|
Kriteriji valjanosti
|
40.
|
Rezultati ISO-ovog međulaboratorijskog pokusa (5) pokazali su da referentna kemikalija (3,5-diklorfenol) izaziva 50-postotnu inhibiciju proizvodnje plina pri koncentracijama u rasponu od 32 mg/l do 510 mg/l, sa srednjom vrijednošću od 153 mg/l (stavak 10.). Taj je raspon toliko širok da nije moguće pouzdano utvrditi čvrste granice inhibicije koje bi mogle služiti kao kriteriji valjanosti; to će biti moguće tek kada se razviju tehnike proizvodnje konzistentnijih inokuluma. Volumeni plina proizvedenog u kontrolnim bocama u 48 sati kretali su se u rasponu od 21 ml/g suhe tvari mulja do 149 ml/g (srednja vrijednost 72 ml/g). Nije bilo očite povezanosti između volumena proizvedenog plina i odgovarajuće vrijednosti EC50. Konačna pH-vrijednost kretala se između 6,1 i 7,5.
|
|
41.
|
Ispitivanje se smatra valjanim ako se u referentnoj kontroli koja sadržava 150 mg/l 3,5-diklorfenola dobije inhibicija veća od 20 %, ako se u slijepoj probi proizvede više od 50 ml plina po gramu suhe tvari i ako je pH-vrijednost unutar raspona od 6,2 do 7,5 na kraju ispitivanja.
|
Izvješće o ispitivanju
|
42.
|
Izvješće o ispitivanju mora sadržavati slijedeće informacije:
|
|
Ispitivana kemikalija
|
—
|
uobičajeni naziv, kemijski naziv, CAS broj, strukturna formula i relevantna fizikalno-kemijska svojstva,
|
|
—
|
čistoća (nečistoće) ispitivane kemikalije.
|
|
|
|
Uvjeti ispitivanja
|
—
|
volumen tekućeg sadržaja i volumen plinskog prostora u ispitnim posudama,
|
|
—
|
opis ispitnih posuda i opreme za mjerenje plina (npr. vrsta mjerača tlaka),
|
|
—
|
primjena ispitivane kemikalije i referentne kemikalije na sustav ispitivanja, upotrijebljene ispitne koncentracije i uporaba otapala,
|
|
—
|
podaci o upotrijebljenom inokulumu: naziv postrojenja za pročišćavanje otpadnih voda, opis izvora pročišćavanih otpadnih voda (npr. radna temperatura, vrijeme zadržavanja mulja, pretežno komunalne otpadne vode ili industrijski otpad itd.), koncentracija krutih tvari, aktivnost proizvodnje plina anaerobnog digestora, prethodna izloženost ili moguća prethodna prilagodba toksičnim kemikalijama ili mjesto prikupljanja blata, sedimenta itd.,
|
|
—
|
temperatura inkubacije i raspon,
|
|
|
|
Rezultati
|
—
|
pH-vrijednosti na kraju ispitivanja,
|
|
—
|
sve vrijednosti izmjerene u ispitnim posudama, slijepim probama i kontrolnim posudama koje sadržavaju referentnu kemikaliju, ovisno o slučaju (npr. tlak u Pa ili milibarima) u obliku tablice,
|
|
—
|
postotak inhibicije u ispitnim i referentnim bocama te krivulje koje prikazuju inhibiciju u ovisnosti o koncentraciji,
|
|
—
|
izračun vrijednosti EC50, izraženih u mg/l i mg/g,
|
|
—
|
proizvodnja plina po gramu mulja u 48 sati,
|
|
—
|
obrazloženje odbijanja rezultata ispitivanja,
|
|
—
|
rasprava o rezultatima, uključujući sva odstupanja od postupaka navedenih u ovoj ispitnoj metodi, te rasprava o svim odstupanjima rezultata ispitivanja od očekivanih rezultata, a do kojih je došlo zbog interferencija i pogrešaka,
|
|
—
|
objašnjenje je li svrha ispitivanja bila izmjeriti toksičnost za mikroorganizme koji su bili prethodno izloženi ili za one koji nisu bili prethodno izloženi.
|
|
|
LITERATURA
|
(1)
|
Poglavlje C.11 ovog Priloga: Aktivni mulj, test inhibicije disanja (oksidacija ugljika i amonijaka)
|
|
(2)
|
Poglavlje C.43 ovog Priloga: Anaerobna biorazgradivost organskih spojeva u razgrađenom mulju: mjerenjem proizvodnje plina.
|
|
(3)
|
International Organisation for Standardisation (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1: General Test.
|
|
(4)
|
International Organisation for Standardisation (2003) ISO 13 641-2 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 2: Test for low biomass concentrations.
|
|
(5)
|
ISO (2000.) Ring test of ISO 13 641-1 and ISO 13 641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans, M. R., Painter, H. A. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
(6)
|
Swanwick, J. D., Foulkes, M. (1971.) Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Pollut. Control, 70, 58 – 70.
|
|
(7)
|
HMSO (1986.) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, u: Methods for the Examination of Waters and Associated Materials UK.
|
|
(8)
|
Shelton, D. R., Tiedje, J. M. (1984.) General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47 850-857.
|
|
(9)
|
Battersby, N. S. i Wilson, V (1988.) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441 – 2460.
|
|
(10)
|
Wilson, V., Painter, H. A. i Battersby, N. S. (1992.) A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Njemačka (1990.) Ur. Steinberg, C. i Kettrup, A., str. 117. – 132. (1992.)
|
|
(11)
|
Kawahara, K., Yakabe, Y., Chida, T. i Kida, K. (1999.) Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007 – 2018.
|
|
(12)
|
International Organization for Standardization (1995.) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(13)
|
International Organization for Standardization (1997.) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Dodatak 1.
Primjer aparature za mjerenje proizvodnje bioplina na temelju tlaka plina

Legenda:
|
1
|
–
|
mjerač tlaka
|
|
2
|
–
|
trokraki plinonepropusni ventil
|
|
3
|
–
|
injekcijska igla
|
|
4
|
–
|
plinonepropusna brtva (kapica na navoj i septum)
|
|
5
|
–
|
plinski prostor
|
|
6
|
–
|
inokulum od razgrađenog mulja
|
Ispitne posude održavane na temperaturi od 35 °C ± 2 °C
Dodatak 2.
Konverzija vrijednosti izmjerenih mjeračem tlaka
Vrijednosti očitane mjeračem tlaka mogu se dovesti u vezu s volumenima plina s pomoću standardne krivulje iz koje se može izračunati volumen plina proizveden po gramu suhog mulja po razdoblju od 48 sati. Indeks aktivnosti primjenjuje se kao jedan od kriterija za procjenu valjanosti ispitnih rezultata. Kalibracijska se krivulja dobije ubrizgavanjem poznatih volumena plina na 35 °C ± 2 °C u serum-boce koje sadržavaju volumen vode jednak onome u reakcijskoj smjesi, VR.
|
—
|
Alikvote od VR ml vode, održavane na 35 °C ± 2 °C, potrebno je uliti u pet serum-boca. Zabrtvite boce i stavite ih u vodenu kupelj na 35 °C ± 2 °C te ih ostavite u njoj jedan sat da se uravnoteže.
|
|
—
|
Uključite mjerač tlaka, pričekajte da se stabilizira te ga postavite na nulu.
|
|
—
|
Kroz brtvu jedne od boca uvedite injekcijsku iglu, otvorite ventil sve dok mjerač tlaka ne pokaže nulu i potom ga zatvorite.
|
|
—
|
Postupak ponovite s preostalim bocama.
|
|
—
|
U svaku bocu ubrizgajte1 ml zraka pri 35 °C ± 2 °C. Uvedite iglu (pričvršćenu na mjerač) kroz brtvu jedne od boca i pričekajte da se očitanje tlaka stabilizira. Zabilježite tlak, otvorite ventil dok tlak ne dođe na nulu i zatim zatvorite ventil.
|
|
—
|
Postupak ponovite s preostalim bocama.
|
|
—
|
Cijeli postupak ponavljajte primjenjujući volumen zraka od 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml i 50 ml.
|
|
—
|
Iscrtajte krivulju konverzije koja prikazuje tlak (Pa) u ovisnosti o volumenu ubrizganog plina (ml). Odgovor instrumenta linearan je u rasponu od 0 Pa do 70 000 Pa te od 0 ml do 50 ml proizvedenog plina.
|
Dodatak 3.
FAKTORI ZA KOJE JE UTVRĐENO DA MOGU DOVESTI DO POGREŠNIH REZULTATA
(a) Kvaliteta čepova na bocama
Na tržištu su dostupne različite vrste septuma za serum-boce; mnogi od njih, uključujući one od butilnog kaučuka, gube nepropusnost kad se probuše iglom u uvjetima ispitivanja. Ponekad se dogodi da tlak pada vrlo sporo nakon što se septum probuši injekcijskom iglom. Kako bi se izbjegla curenja, preporučuje se uporaba plinonepropusnih septuma (stavak 12. točka (b)).
(b) Vlaga u injekcijskoj igli
Ponekad se u injekcijskoj igli i cijevi nakupi vlaga, na što ukazuje mala negativna vrijednost očitanog tlaka. Da biste to ispravili, uklonite iglu, protresite cijev i osušite je papirom te postavite novu iglu.
(c) Kontaminacija kisikom
Kod anaerobnih metoda može doći do pogreške zbog kontaminacije kisikom, što može uzrokovati manju proizvodnju plina. U ovoj je metodi tu mogućnost potrebno svesti na najmanju moguću mjeru uporabom strogo anaerobnih tehnika, uključujući uporabu komore za rukovanje s pomoću rukavica.
(d) Grubi supstrati u mulju
Na anaerobnu proizvodnju plina i osjetljivost mulja utječu supstrati koji se zajedno s inokulumom prenesu u ispitne boce. Razgrađeni mulj iz domaćih anaerobnih digestora često još uvijek sadržava prepoznatljive tvari poput dlaka i celuloznih ostataka bilja, koji mogu otežati uzimanje reprezentativnih uzoraka. Grube netopljive tvari mogu se ukloniti iz mulja prosijavanjem, čime se povećava vjerojatnost da će uzeti uzorak biti reprezentativan (stavak 16.).
(e) Hlapljive ispitivane kemikalije
Hlapljive ispitivane kemikalije oslobađaju se u plinski prostor ispitnih boca. To može dovesti do njihova djelomičnog gubitka iz sustava tijekom ventilacije nakon mjerenja tlaka, što može dati pogrešno visoke vrijednosti EC50. Ta se pogreška može smanjiti tako da se odabere odgovarajući omjer volumena plinskog prostora i volumena tekućine te da se ne provodi ventilacija nakon mjerenja tlaka (10).
(f) Nelinearnost proizvodnje plina
Ako grafički prikaz srednje kumulativne proizvodnje plina u ovisnosti o trajanju inkubacije nije približno linearan tijekom razdoblja od 48 sati, točnost ispitivanja može biti smanjena. Da bi se to nadvladalo, preporučljivo je uzeti mulj koji se razgrađuje iz drugog izvora i/ili dodati povećanu koncentraciju ispitnog supstrata – hranjivog bujona, ekstrakta kvasca i glukoze (stavak 29.).
Dodatak 4.
Primjena na uzorke iz okoliša s niskom koncentracijom biomase – anaerobno blato, sedimente itd.
UVOD
A.1 Specifična mikrobna aktivnost (volumen plina proizvedenog po gramu suhe tvari) anaerobnih prirodnih blata, sedimenata, tala itd. općenito je mnogo slabija od one kod anaerobnog mulja dobivenog iz otpadnih voda. Stoga je potrebno izmijeniti neke od uvjeta pokusa kada je potrebno izmjeriti inhibitorne učinke kemikalija na te manje aktivne uzorke. Za te manje aktivne uzorke moguća su dva opća postupka:
|
(a)
|
provesti modificirano preliminarno ispitivanje (stavak 25.) s nerazrijeđenim uzorkom blata, tla itd. pri temperaturi od 35 °C ± 2 °C ili pri temperaturi mjesta uzimanja uzorka, radi točnije simulacije (kao u dijelu 1. norme ISO 13 641);
|
|
(b)
|
ili provesti ispitivanje s razrijeđenim (1 u 100) digestorskim muljem kako bi se simulirala niska aktivnost koja se očekuje od uzorka iz okoliša, ali uz održavanje temperature od 35 °C ± 2 °C (kao u dijelu 2. norme ISO 13 641).
|
A.2. Opcija (a) može se provesti u skladu s ovdje opisanom metodom (koja odgovara dijelu 1. norme ISO 13 641), ali je ključno provesti preliminarno ispitivanje (stavak 25.) kako bi se utvrdili optimalni uvjeti, osim ako su ti uvjeti poznati iz prijašnjih ispitivanja. Uzorak blata ili sedimenta potrebno je temeljito promiješati, npr. u miješalici, te ga po potrebi razrijediti malom količinom odzračene vode za razrjeđivanje (stavak 14.) tako da bude dovoljno fluidan da ga se može prenijeti pipetom s velikim nastavkom ili s pomoću mjernog cilindra. Ako se smatra da nedostaje nutrijenata, uzorak blata može se centrifugirati (u anaerobnim uvjetima) te ponovno suspendirati u mineralnom mediju koji sadržava ekstrakt kvasca (A.11.).
A.3. Opcija (b). Ovom se opcijom primjereno simulira niska aktivnost uzoraka iz okoliša, osim što nema visoke koncentracije suspendiranih krutih tvari koje su prisutne u tim uzrocima. Nije poznato koja je uloga tih tvari u inhibiciji, ali moguće je da bi reakcija između ispitivanih kemikalija i sastojaka blata te adsorpcija ispitivanih kemikalija na krute tvari mogli imati za posljedicu snižavanje toksičnosti ispitivane kemikalije.
A.4. Temperatura je drugi važan faktor: za strogu simulaciju ispitivanja je potrebno provoditi na temperaturi mjesta uzimanja uzorka, jer je poznato da različite skupine konzorcija metanogenih bakterija djeluju unutar različitih raspona temperatura, i to termofili (~ 30 – 35 °C), mezofili (20 – 25 °C) i psihrofili (< 20 °C), koji mogu pokazivati različite inhibitorne obrasce.
A.5. Trajanje. U općem ispitivanju, dio 1., s nerazrijeđenim muljem, uvijek je bilo proizvedeno dovoljno plina u razdoblju od dva do četiri dana, dok je u dijelu 2., s muljem razrijeđenim 100 puta, u tom razdoblju bilo proizvedeno nedovoljno plina u prstenastom ispitivanju. Opisujući tu drugu vrstu ispitivanja, Madsen i sur. (1996.) navode da je potrebno pričekati najmanje sedam dana.
Ispitivanje s niskom koncentracijom biomase (Opcija (b))
Potrebno je izvršiti sljedeće izmjene kojima se dopunjuju ili zamjenjuju neki od postojećih stavaka i podstavaka glavnog teksta.
A.6. Stavku 6. dodaje se: Načelo ispitivanja;
‚Ova se tehnika može primijeniti s anaerobnim muljem razrijeđenim 1: 100 kako bi se djelomično simulirala niska aktivnost blata i sedimenata. Temperatura inkubacije može biti 35 °C ili to može biti temperatura mjesta uzimanja uzorka. Budući da je aktivnost bakterija mnogo manja nego u nerazrijeđenom mulju, razdoblje inkubacije potrebno je produljiti na najmanje sedam dana.’
A.7. Stavku 12. točki (a) dodaje se:
‚inkubator mora moći raditi na nižim temperaturama sve do 15 °C.’
A.8. Iza stavka 13. dodaje se dodatni reagens:
‚Fosforna kiselina (H3PO4), 85 % masenog udjela u vodi.’
A.9. Na kraju stavka 16. dodaje se:
‚U ispitivanju se upotrebljava konačna koncentracija od 0,20 ± 0,05 g/l ukupne suhe tvari.’
A.10. Stavak 17. Ispitni supstrat
Ovaj se supstrat ne upotrebljava, nego se zamjenjuje ekstraktom kvasca (vidjeti stavke 17., A.11., A.12. i A.13.).
A.11. Anaerobni mulj mora se razrijediti mineralnim medijem koji sadržava i elemente u tragovima, a iz praktičnih razloga tom se mediju dodaje organski supstrat, ekstrakt kvasca.
Nakon stavka 17. dodaje se:
|
‚(a)
|
Ispitni mineralni medij, s ekstraktom kvasca.
|
Priprema se od deseterostruko koncentriranog ispitnog medija (stavak 17. točka (b); A.12.) s otopinom elemenata u tragovima (stavak 17. točka (c); A.13.). Upotrebljava se svježe pripremljeni natrij-sulfid-nonahidrat (stavak 17. točka (b); A.12.) ili se opere i osuši prije uporabe kako bi se osiguralo da ima dostatnu redukcijsku sposobnost. Ako se ispitivanje provodi bez uporabe komore za rukovanje s pomoću rukavica (stavak 12. točka (j)), koncentraciju natrijeva sulfida u radnoj otopini potrebno je povećati na 2 g/l (s 1 g/l). Natrijev sulfid može se dodati i iz odgovarajuće radne otopine kroz septum zatvorenih ispitnih boca, čime se smanjuje opasnost od oksidacije, da se dobije konačna koncentracija od 0,2 g/l. Druga je mogućnost uporaba titan(III)-citrata (stavak 17. točka (b)). Doda se kroz septum zatvorenih ispitnih boca da se dobije koncentracija od 0,8 mmol/l do 1,0 mmol/l. Titan(III)-citrat vrlo je djelotvorno redukcijsko sredstvo niske toksičnosti, a priprema se na sljedeći način: Otopi se 2,94 g trinatrijeva citrat dihidrata u 50 ml vode za razrjeđivanje bez kisika (stavak 14.) (čime se dobiva otopina od 200 mmol/l) te se doda 5 ml otopine titan(III)-klorida (15 g na 100 ml vode za razrjeđivanje). Neutralizira se na pH 7 ± 0,5 natrijevim karbonatom i ulije u odgovarajuću serum-bocu pod strujom plinovitog dušika. Koncentracija titan(III)-citrata u ovoj radnoj otopini iznosi 164 mmol/l. Ispitni se medij upotrijebi odmah ili se pohrani na 4 °C najdulje jedan dan.
|
A.12.
|
(b)
|
Deseterostruko koncentrirani ispitni medij pripremljen od sljedećih sastojaka:
|
bezvodni kalijev dihidrogenfosfat (KH2PO4)
|
2,7 g
|
|
dinatrijev hidrogenfosfat (Na2HPO4)
|
4,4 g
|
|
(ili 11,2 g dodekahidrata)
amonijev klorid (NH4Cl)
|
5,3 g
|
|
kalcijev klorid dihidrat (CaCl2 · 2H2O)
|
0,75 g
|
|
magnezijev klorid heksahidrat (MgCl2 · 6H2O)
|
1,0 g
|
|
željezov (II) klorid tetrahidrat (FeSO4 · 4H2O)
|
0,2 g
|
|
resazurin (redoks indikator)
|
0,01 g
|
|
natrijev sulfid nonahidrat (Na2S · 9H2O)
|
1,0 g
|
|
(ili titan(III)-citrat) konačna koncentracija
|
0,8 mmol/l do 1,0 mmol/l
|
|
otopina elemenata u tragovima (vidjeti stavak 17. točku (c); A.13.)
|
10,0 ml
|
|
ekstrakt kvasca
|
100 g
|
|
Otopiti u vodi za razrjeđivanje (stavak 14.) i nadopuniti do:
|
1 000 ml
|
|
|
A.13.
|
(c)
|
Otopina elemenata u tragovima pripremljena od sljedećih sastojaka:
|
magnezijev(II) klorid tetrahidrat (MnCl2 · 4H2O)
|
0,5 g
|
|
ortoborna kiselina (H3BO3)
|
0,05 g
|
|
cinkov klorid (ZnCl2)
|
0,05 g
|
|
bakrov(II) klorid (CuCl2)
|
0,03 g
|
|
natrijev molibdat dihidrat (Na2MoO4 · 2H2O)
|
0,01 g
|
|
kobaltov(II) klorid heksahidrat (CoCl2 · 6H2O)
|
1,0 g
|
|
niklov(II) klorid heksahidrat (NiCl2 · 6H2O)
|
0,1 g
|
|
dinatrijev selenit (Na2SeO3)
|
0,05 g
|
|
Otopiti u vodi za razrjeđivanje (stavak 14.) i nadopuniti do:
|
1 000 ml’
|
|
A.14. Stavak 25.: Preliminarno ispitivanje
Ključno je provesti preliminarno ispitivanje onako kako je opisano u stavku 24., osim što koncentracije krute tvari mulja moraju biti jednake stotom dijelu navedenih vrijednosti, to jest iznositi 0,1 g/l, 0,2 g/l i 0,4 g/l. Inkubacija mora trajati najmanje sedam dana.
Napomena: u prstenastom ispitivanju (5) volumen plinskog prostora bio je prevelik i iznosio je 75 % ukupnog volumena; mora biti u preporučenom rasponu od 10 % do 40 %. Relevantan je kriterij taj da se volumen plina proizvedenog pri inhibiciji od oko 80 % mora moći izmjeriti s prihvatljivom preciznošću (npr. od ± 5 % do ± 10 %).
A.15. Stavci 26. do 30.: Dodavanje ispitivane kemikalije, inokuluma i supstrata.
Dodavanja se provode na isti način kao što je opisano u tim stavcima, s tim da se otopina supstrata (stavak 17.) zamijeni ispitnim medijem kojemu je dodan ekstrakt kvasca (A.11.).
Isto tako, konačna koncentracija suhe tvari u mulju smanji se s 2 g/l do 4 g/l na 0,2 ± 0,05 g/l (A.9). U tablici A.1., koja zamjenjuje tablicu u stavku 29., navedena su dva primjera dodavanja sastojaka u ispitnu smjesu.
A.16. Stavak 33.: Inkubiranje boca
Zbog očekivane manje brzine proizvodnje plina, inkubacija traje najmanje sedam dana.
A.17. Stavak 34.: Mjerenja tlaka
Ako je potrebno izmjeriti količine u plinovitoj fazi, primjenjuje se isti postupak mjerenja tlaka u plinskom prostoru boca koji je opisan u stavku 34. Ako se mjere ukupne količine CO2 plus CH4, pH-vrijednost tekuće faze smanji se na pH-vrijednost oko 2 ubrizgavanjem H3PO4 u svaku relevantnu bocu i mjerenjem tlaka nakon protresanja u trajanju od 30 minuta na temperaturi ispitivanja. Međutim, više se informacija o kvaliteti inokuluma može dobiti mjerenjem tlaka u svakoj boci prije i nakon zakiseljavanja. Primjerice, ako je brzina proizvodnje CO2 mnogo veća od brzine proizvodnje metana, možda je promijenjena osjetljivost fermentativnih bakterija i/ili ispitivana kemikalija u prvom redu utječe na metanogene bakterije.
A.18. Stavak 36.: mjerenje pH-vrijednosti
Ako će se upotrebljavati H3PO4, mora se pripremiti nekoliko dodatnih boca bez dodanog H3PO4, koje će biti posebno namijenjene za mjerenje pH-vrijednosti.
IZVOR:
Madsen, T, Rasmussen, H. B. i Nilsson, L (1996.) Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No. 336, Water Quality Institute, Danish Environment Protection Agency, Copenhagen.
Tablica A.1.
Primjeri plana ispitivanja za ispitne serije
|
Sastojci reakcijske smjese
|
Primjer 1.
|
Primjer 2.
|
Uobičajeni redoslijed dodavanja
|
|
Koncentracija pripremljenog inokuluma (g/l)
|
0,42
|
2,1
|
—
|
|
Volumen dodanog inokuluma (ml)
|
45
|
9
|
4
|
|
Koncentracija inokuluma u ispitnim bocama (g/l)
|
0,20
|
0,20
|
—
|
|
Volumen dodanog ispitnog medija (ml)
|
9
|
9
|
2
|
|
Volumen dodane vode za razrjeđivanje (ml)
|
36
|
72
|
3
|
|
Koncentracija ekstrakta kvasca u ispitnim bocama (g/l)
|
9,7
|
9,7
|
—
|
|
Volumen radne otopine ispitivane kemikalije (ml)
|
3
|
3
|
1
|
|
Ukupan volumen tekućine (ml)
|
93
|
93
|
—
|
Dodatak 5.
Definicije
Za potrebe ove ispitne metode upotrebljavaju se sljedeće definicije:
|
|
Kemikalija znači tvar ili smjesa.
|
|
|
Ispitivana kemikalija znači svaka tvari ili smjesa koja se ispituju ovom ispitnom metodom.
|
C.53. ISPITIVANJE TOKSIČNOSTI NA LUMBRICULUS U SUSTAVU SEDIMENT-VODA UPORABOM SEDIMENTA OBRAĐENOG SPIKINGOM
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 225 (2007.). Endobentičke životinje koji se hrane sedimentom u opasnosti su od potencijalno visoke izloženosti kemikalijama povezanima sa sedimentom te im je stoga potrebno posvetiti posebnu pozornost, npr. (1), (2), (3). Među tim organizmima koji se hrane sedimentom vodeni oligoheti igraju važnu ulogu u sedimentima vodenih sustava. Bioturbacijom tla te stoga što služe kao plijen, te životinje mogu snažno utjecati na bioraspoloživost kemikalija drugim organizmima, npr. bentivornim ribama. Za razliku od epibentičkih organizama, endobentički vodeni oligoheti (npr. Lumbriculus variegatus) ruju po sedimentu i hrane se česticama ispod površine sedimenta. Tako je osigurana izloženost ispitnih organizama ispitivanoj kemikaliji svim mogućim putovima (npr. dodirom s kontaminiranim česticama sedimenta ili gutanjem takvih čestica, ali i putem porne vode i vode iznad sedimenta).
|
|
2.
|
Ova je ispitna metoda namijenjena procjeni učinaka produljenog izlaganja endobentičkog oligoheta Lumbriculus variegatus (Müller) kemikalijama povezanima sa sedimentom. Temelji se na postojećim protokolima za ispitivanje toksičnosti sedimenta i bioakumulacije, npr. (3), (4), (5), (6), (7), (8), (9), (10). Metoda je opisana za uvjete statičkog ispitivanja. Scenarij izlaganja koji se primjenjuje u ovoj ispitnoj metodi jest obogaćivanje sedimenta ispitivanom kemikalijom postupkom spikinga. Cilj uporabe sedimenta obrađenog spikingom jest simulirati sediment kontaminiran ispitivanom kemikalijom.
|
|
3.
|
Kemikalije koje je potrebno ispitati na organizmima koji žive u sedimentu obično opstaju u sedimentu tijekom duljih razdoblja. Organizmi iz sedimenta mogu se izlagati na razne načine. Relativna važnost svakog načina izlaganja i vrijeme potrebno da bi svaki od tih načina pridonio općim učincima toksičnosti ovise o fizikalno-kemijskim svojstvima predmetne kemikalije i njezinoj konačnoj sudbini u životinji. Za vrlo adsorptivne kemikalije (npr. s log Kow > 5) ili za kemikalije koje se vežu sa sedimentom kovalentnim vezama značajan način izlaganja može biti gutanje kontaminirane hrane. Kako se ne bi podcijenila toksičnost takvih kemikalija, hrana potrebna za razmnožavanje i rast ispitnih organizama dodaje se sedimentu prije primjene ispitivane kemikalije (11). Ova ispitna metoda pruža dovoljno detalja za provedbu ispitivanja, ali istodobno ostavlja dovoljno slobode za prilagođavanje plana pokusa ovisno o uvjetima u pojedinim laboratorijima i različitim svojstvima ispitivanih kemikalija.
|
|
4.
|
Cilj je ispitne metode utvrditi učinke ispitivane kemikalije na razmnožavanje i biomasu ispitnih organizama. Mjereni su biološki parametri ukupan broj preživjelih crva i biomasa (suha masa) na kraju izlaganja. Ti se podaci analiziraju bilo modelom regresijske analize s ciljem određivanja koncentracije koja bi izazvala učinak od x % (npr. EC50, EC25 i EC10) bilo testiranjem statističke hipoteze s ciljem određivanja najviše koncentracije bez vidljivog učinka (NOEC) i najniže koncentracije s vidljivim učinkom (LOEC).
|
|
5.
|
U poglavlju C.27. ovog Priloga, ‚Test toksičnosti trzalaca (Chironomidae) u vodi iz sedimenta sa sedimentom obrađenim spikingom’ (6), navedeni su brojni ključni i korisni podaci za provedbu prikazane metode ispitivanja toksičnosti sedimenta. Stoga je taj dokument poslužio kao osnova za izradu izmjena potrebnih za ispitivanje toksičnosti sedimenta s Lumbriculus variegatus. Ostali su dokumenti na koje se upućuje npr. ASTM Standard Guide for Determination of the Bioaccumulation of Sediment-Associated Contaminants by Benthic Invertebrates (ASTM-ov standardni vodič za određivanje bioakumulacije kontaminanata povezanih sa sedimentom u bentičkim beskralježnjacima) (3), U.S. EPA Methods for Measuring the Toxicity and Bioaccumulation of Sediment-Associated Contaminants with Freshwater Invertebrates (U.S. EPA-ine metode za mjerenje toksičnosti i bioakumulacije kontaminanata povezanih sa sedimentom na slatkovodnim beskralježnjacima) (7) i ASTM Standard Guide for Collection, Storage, Characterization, and Manipulation of Sediments for Toxicological Testing and for selection of samplers used to collect benthic invertebrates (ASTM-ov standardni vodič za prikupljanje, skladištenje, karakterizaciju i rukovanje sedimentima za toksikološka ispitivanja i za odabir naprava za uzorkovanje bentičkih beskralježnjaka (12). Osim toga, praktično iskustvo stečeno tijekom prstenastog ispitivanja ispitne metode ((13), izvješće o prstenastom ispitivanju) i podaci iz literature glavni su izvori informacija za sastavljanje ovog dokumenta.
|
OBVEZATNI I PREPORUČLJIVI PODACI
|
6.
|
Prije početka istraživanja potrebno je dobiti podatke o ispitivanoj kemikaliji, kao što su mjere opreza, ispravni uvjeti skladištenja i analitičke metode. Smjernice za ispitivanje kemikalija čija su fizikalno-kemijska svojstva takva da je zbog njih teško provesti ispitivanje nalaze se u literaturi pod točkom (14).
|
|
7.
|
Prije ispitivanja moraju biti poznate sljedeće informacije o ispitivanoj kemikaliji:
|
—
|
uobičajeni naziv, kemijski naziv (po mogućnosti IUPAC-ov naziv), strukturna formula, CAS-ov registarski broj, čistoća,
|
|
|
8.
|
Smatra se korisnim znati sljedeće dodatne podatke prije početka ispitivanja:
|
—
|
koeficijent razdjeljenja između oktanola i vode, Kow,
|
|
—
|
koeficijent razdjeljenja između organskog ugljika i vode, izražen kao Koc,
|
|
—
|
fototransformacija u vodi;
|
|
|
9.
|
Prije početka ispitivanja potrebno je dobiti podatke o određenim svojstvima sedimenta koji će biti upotrijebljen (7). Za detalje vidjeti stavke od 22. do 25.
|
NAČELO ISPITIVANJA
|
10.
|
Crvi sličnog fiziološkog stanja (sinkronizirani kako je opisano u Dodatku 5.) izlažu se nizu koncentracija toksičnih tvari primijenjenih na sedimentnu fazu sustava sediment-voda. Kao medij potrebno je upotrijebiti umjetni sediment i obrađenu vodu. Ispitne posude u koje nije dodana ispitivana kemikalija služe kao kontrola. Ispitivana kemikalija doda se u sediment postupkom spikinga u velikoj količini za svaku razinu koncentracije kako bi se smanjila varijabilnost među ponavljanjima te se potom ispitni organizmi unesu u ispitne posude u kojima su se uravnotežile koncentracije sedimenta i vode (vidjeti stavak 29.). Ispitne životinje izlažu se sustavu sediment-voda 28 dana. S obzirom na to da umjetni sediment sadržava male količine hranjivih tvari, potrebno ga je obogatiti nekim izvorom hrane (vidjeti stavke 22. do 23. i Dodatak 4.) kako bi se osiguralo da crvi rastu i razmnožavaju se u kontroliranim uvjetima. Na taj se način osigurava izlaganje ispitnih životinja preko vode i sedimenta, kao i preko hrane.
|
|
11.
|
Preferirana krajnja točka ove vrste istraživanja jest ECx (npr. EC50, EC25 i EC10; koncentracija s učinkom na x % ispitnih organizama) za razmnožavanje i biomasu u usporedbi s kontrolom. Međutim, potrebno je napomenuti da se s obzirom na visoku nesigurnost koja obilježava ECx niskih vrijednosti (npr. EC10, EC25) s izuzetno visokim granicama pouzdanosti od 95 % (npr. (15)) te statističku snagu izračunanu tijekom testiranja hipoteze smatra da je EC50 najpouzdanija krajnja točka. Osim toga, za biomasu i razmnožavanje mogu se izračunati najviša koncentracija bez vidljivog učinka (NOEC) i najniža koncentracija s vidljivim učinkom (LOEC), pod uvjetom da plan ispitivanja i podaci podržavaju te izračune (vidjeti stavke od 34. do 38.). Svrha istraživanja, ECx ili izračun NOEC-a određuju plan ispitivanja.
|
REFERENTNO ISPITIVANJE
|
12.
|
Očekuje se da će rezultati dobiveni s kontrolnim organizmima u dovoljnoj mjeri pokazati je li laboratorij sposoban provoditi ispitivanje te, ako su na raspolaganju podaci iz prijašnjih ispitivanja, je li ispitivanje ponovljivo. Osim toga, referentni testovi toksičnosti mogu se provoditi u redovitim vremenskim razmacima primjenom referentne toksične tvari kako bi se procijenila osjetljivost ispitnih organizama. Referentni testovi toksičnosti u vodi u trajanju od 96 sati mogu na zadovoljavajući način pokazati osjetljivost i stanje ispitnih životinja (4) (7). Informacije o toksičnosti pentaklorfenola (PCP) u potpunim testovima (28 dana izloženosti sedimentu obrađenom spikingom) navedeni su u Dodatku 6. i u izvješću o prstenastom ispitivanju ispitne metode (13). Akutna toksičnost PCP-a samo u vodi opisana je npr. u (16). Ti se podaci mogu upotrijebiti za usporedbu osjetljivosti ispitnog organizma u referentnim testovima s PCP-om kao referentnom toksičnom tvari. Kalijev klorid (KCl) ili bakrov sulfat (CuSO4) preporučeni su kao referentne toksične tvari za L. variegatus (4) (7). Za sada je teško utvrditi kriterije kvalitete na temelju podataka o toksičnosti za KCl zbog nedostatka podataka iz literature za L. variegatus. Informacije o toksičnosti bakra za L. variegatus mogu se pronaći u literaturi pod (17) do (21).
|
VALJANOST ISPITIVANJA
|
13.
|
Da bi ispitivanje bilo valjano, moraju biti ispunjeni sljedeći zahtjevi:
|
—
|
Prstenastim ispitivanjem (13) pokazano je da, kad je riječ o Lumbriculus variegatus, prosječan broj živih crva po ponavljanju u kontrolama mora biti veći najmanje za faktor 1,8 na kraju izlaganja u usporedbi s brojem crva po ponavljanju na početku izlaganja.
|
|
—
|
pH-vrijednost vode iznad sedimenta mora biti između 6 i 9 tijekom cijelog ispitivanja.
|
|
—
|
Tijekom ispitivanja koncentracija kisika u vodi iznad sedimenta ne smije biti manja od 30 % vrijednosti zasićenosti kisikom (ASV) na ispitnoj temperaturi.
|
|
OPIS ISPITNE METODE
Sustav ispitivanja
|
14.
|
Preporučuju se statički sustavi bez obnavljanja vode iznad sedimenta. Ako je omjer sedimenta i vode (vidjeti stavak 15.) primjeren, za održavanje kvalitete vode na razinama koje su prihvatljive za ispitne organizme obično je dovoljno blago dozračivanje (npr. postizanje maksimalnih razina otopljenog kisika i minimalnog nakupljanja proizvoda izlučivanja). Polustatični ili protočni sustavi sa stalnim ili isprekidanim obnavljanjem vode iznad sedimenta mogu se primijeniti samo u iznimnim slučajevima, jer se očekuje da će redovito obnavljanje vode iznad sedimenta utjecati na kemijsku ravnotežu (npr. gubitak ispitivane kemikalije iz ispitnog sustava).
|
Ispitne posude i aparatura
|
15.
|
Izlaganje je potrebno provoditi u staklenim laboratorijskim čašama od npr. 250 ml i promjera 6 cm. Mogu se upotrijebiti i druge prikladne staklene posude, ali se mora zajamčiti da je i u njima prikladna dubina sedimenta i vode iznad sedimenta. U svaku posudu potrebno je staviti sloj od oko 1,5 do 3 cm formuliranog sedimenta. Omjer dubine sloja sedimenta i dubine vode iznad sedimenta mora biti 1: 4. Posude moraju biti prikladne zapremnine u skladu s brzinom punjenja, tj. brojem ispitnih crva dodanih po jedinici mase sedimenta (vidjeti i stavak 39.).
|
|
16.
|
Ispitne posude i druga aparatura koja dolazi u dodir s ispitnom kemikalijom moraju biti u cijelosti izrađeni od stakla ili drugog kemijski inertnog materijala. Potrebno je obratiti posebnu pažnju na to da se za sve dijelove opreme izbjegava uporaba materijala koji se mogu otapati, adsorbirati ispitivanu kemikaliju ili propuštati druge kemikalije te imati negativan učinak na ispitne životinje. Za svu opremu koja dolazi u doticaj s ispitnim medijem potrebno je upotrebljavati politetrafluoretilen (PTFE), plemeniti čelik i/ili staklo. Za organske kemikalije za koje je poznato da adsorbiraju na staklo možda će biti potrebno silanizirano staklo. U tom se slučaju oprema mora baciti nakon uporabe.
|
Ispitne vrste
|
17.
|
Ispitna vrsta koja se upotrebljava u ovoj vrsti istraživanja jest slatkovodni oligohet Lumbriculus variegatus (Müller). Ta vrsta podnosi široku lepezu tipova sedimenata i naširoko se upotrebljava za ispitivanje toksičnosti i bioakumulacije u sedimentima [npr. (3), (5), (7), (9), (13), (15), (16), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34), (35)]. Potrebno je izvijestiti o podrijetlu ispitnih životinja, potvrđivanju identifikacije vrste (npr. (36)) i uvjetima uzgoja. Identifikacija vrste nije potrebna prije svakog ispitivanja ako organizmi potječu iz kulture uzgojene u laboratoriju.
|
Uzgoj kulture ispitnih organizama
|
18.
|
Kako bi se osigurao dovoljan broj crva za ispitivanje toksičnosti sedimenta, korisno je držati crve u trajnoj laboratorijskoj kulturi. Smjernice o metodama uzgoja laboratorijskih kultura za Lumbriculus variegatus te izvori početnih kultura navedeni su u Dodatku 5. Za detalje o uzgoju ove vrste vidjeti literaturu pod (3), (7) i (27).
|
|
19.
|
Kako bi se osiguralo da se ispitivanja provode na životinjama iste vrste, izričito se preporučuje uspostavljanje kultura pojedinačnih vrsta. Potrebno je uvjeriti se da kod kultura i posebno kod crva koji se upotrebljavaju u ispitivanjima nema vidljivih bolesti i anomalija.
|
Voda
|
20.
|
Preporučuje se da se kao voda iznad sedimenta u ispitivanjima upotrijebi voda obrađena u skladu s poglavljem C.1. ovog Priloga (37); može se upotrijebiti i za laboratorijske kulture crva (za pripremu vidjeti Dodatak 2.). Ako je potrebno, može se upotrijebiti prirodna voda. Odabrana voda mora biti takve kvalitete da omogućuje rast i razmnožavanje ispitne vrste za vrijeme aklimatizacije i razdoblja ispitivanja, a da pritom ne pokazuju nikakve anomalije u izgledu ili ponašanju. Pokazalo se da Lumbriculus variegatus preživljava, raste i razmnožava se u toj vrsti vode (30), koja omogućuje maksimalnu standardizaciju uvjeta ispitivanja i uzgoja. Ako se upotrebljava obrađena voda, potrebno je izvijestiti o njezinu sastavu i prije uporabe potrebno joj je utvrditi svojstva, i to barem pH-vrijednost, sadržaj kisika i tvrdoću (izraženu u mg CaCO3 / l). Korisne se informacije mogu dobiti analizom vode na mikroonečišćivače prije uporabe (vidjeti npr. Dodatak 3.).
|
|
21.
|
pH-vrijednost vode iznad sedimenta mora biti u rasponu od 6,0 do 9,0 (vidjeti stavak 13.). Ako se očekuje povećani nastanak amonijaka, smatra se korisnim održavati pH-vrijednost između 6,0 i 8,0. Za ispitivanje npr. slabih organskih kiselina preporučljivo je prilagoditi pH-vrijednost puferiranjem vode koja će se upotrebljavati u ispitivanju, kako je opisano npr. u (16). Ukupna tvrdoća vode koja će se upotrebljavati u ispitivanju mora biti između 90 i 300 mg CaCO3 po litri prirodne vode. U Dodatku 3. navedeni su dodatni kriteriji za prihvatljivu vodu za razrjeđivanje u skladu s OECD-ovom Smjernicom br. 210 (38).
|
Sediment
|
22.
|
Budući da je moguće da tijekom cijele godine neće biti dostupni nekontaminirani prirodni sedimenti iz određenog izvora te da prirođeni organizmi, kao i prisutnost mikroonečišćivača mogu utjecati na ispitivanje, poželjno je upotrebljavati formulirani sediment. Uporabom formuliranog sedimenta smanjuje se varijabilnost uvjeta ispitivanja i unošenje urođene faune. Sljedeći se formulirani sediment temelji na umjetnom sedimentu prema (6), (39) i (40). U ovoj se vrsti ispitivanja preporučuje za uporabu ((6), (10), (30), (41), (42), (43)):
|
(a)
|
4 do 5 % (suhe mase) sphagnum treseta; važno je upotrijebiti trest u obliku praha, ‚srednjeg’ stupnja raspadanja, fino usitnjen (veličine čestica ≤ 0,5 mm) i sušen isključivo na zraku;
|
|
(b)
|
20 ± 1 % (suhe mase) kaolinitske gline (sadržaj kaolinita po mogućnosti iznad 30 %);
|
|
(c)
|
75 do 76 % (suhe mase) kremenog pijeska (fini pijesak, veličine zrna: ≤ 2 mm, ali > 50 % čestica mora biti veličine između 50 i 200 μm);
|
|
(d)
|
deionizirana voda, 30 do 50 % suhe mase sedimenta, uz suhe sastojke sedimenta;
|
|
(e)
|
dodaje se kalcijev karbonat kemijski čiste kakvoće (CaCO3) kako bi se prilagodila pH-vrijednost konačne smjese sedimenta;
|
|
(f)
|
ukupan sadržaj organskog ugljika (TOC) u konačnoj smjesi mora iznositi 2 % (± 0,5 %) suhe mase sedimenta i potrebno ga je prilagoditi dodavanjem odgovarajućih količina treseta i pijeska prema (a) i (c);
|
|
(g)
|
hrana, npr. lišće velike koprive u prahu (Urtica sp., u skladu s farmaceutskim standardima, za prehranu ljudi) ili smjesa lišća Urtica sp. u prahu i alfa-celuloze (1: 1), u količini od 0,4 do 0,5 % suhe mase sedimenta, uz suhe sastojke sedimenta; za detalje vidjeti Dodatak 4.
|
|
|
23.
|
Izvor treseta, kaolinitske gline i pijeska mora biti poznat. Osim materijala iz točke (g), u poglavlju C.27. ovog Priloga (6) navedeni su alternativni biljni materijali koji se upotrebljavaju kao izvor hrane: osušeno lišće duda (Morus alba), bijele djeteline (Trifolium repens), špinata (Spinacia oleracea) ili žitne trave.
|
|
24.
|
Odabrani izvor hrane potrebno je dodati prije ili tijekom uvođenja ispitivane kemikalije u sediment postupkom spikinga. Odabrani izvor hrane mora omogućiti najmanje prihvatljivo razmnožavanje u kontrolama. Korisne bi se informacije mogle dobiti analizom umjetnog sedimenta ili njegovih sastojaka na mikroonečišćivače prije uporabe. Primjer pripreme formuliranog sedimenta opisan je u Dodatku 4. Miješanje suhih sastojaka također je prihvatljivo ako se pokaže da nakon dodavanja vode iznad sedimenta ne dolazi do razdvajanja sastojaka sedimenta (npr. lebdenje čestica treseta) i da su treset ili sediment prethodno dovoljno kondicioniran (vidjeti i stavak 25. te Prilog 4.). Za umjetni sediment potrebno je odrediti barem podrijetlo sastojaka, raspodjelu veličine čestica (postotak pijeska, praha i gline), ukupni sadržaj organskog ugljika (TOC), sadržaj vode i pH. Mjerenje redoks potencijala nije obvezatno.
|
|
25.
|
Prema potrebi, npr. za posebne ispitne svrhe, prirodni sedimenti s neonečišćenih mjesta mogu poslužiti kao ispitni sediment i/ili sediment za uzgoj kultura. Međutim, ako se upotrebljava prirodni sediment, potrebno mu je odrediti barem podrijetlo (mjesto uzimanja), pH i amonijak u pornoj vodi, ukupan sadržaj organskog ugljika (TOC) i sadržaj dušika, raspodjelu veličine čestica (postotak pijeska, praha i gline) i postotni sadržaj vode (7) te ne smije biti kontaminiran i u njemu ne smije biti nikakvih organizama koji bi se mogli natjecati s ispitnim organizmima ili kojima bi ispitni organizmi mogli biti plijen. Mjerenje redoks potencijala i kapaciteta izmjene kationa nije obvezatno. Isto se tako preporučuje da se prirodni sediment, prije nego što se u njega uvede ispitna kemikalija postupkom spikinga, kondicionira sedam dana u istim uvjetima koji prevladavaju i u sljedećem ispitivanju. Na kraju razdoblja kondicioniranja vodu iznad sedimenta potrebno je ukloniti i baciti.
|
|
26.
|
Sediment koji će se upotrebljavati mora biti takve kvalitete da omogućuje preživljavanje i razmnožavanje kontrolnih organizama tijekom razdoblja izloženosti, a da pritom ne pokazuju nikakve anomalije u izgledu ili ponašanju. Kontrolni crvi trebali bi rovati po sedimentu i jesti ga. Razmnožavanje u kontrolama mora biti barem u skladu s kriterijem valjanosti opisanim u stavku 13. Prisutnost ili odsutnost fekalnih peleta na površini sedimenta, koji ukazuju na to da crvi jedu sediment, potrebno je zabilježiti i ti podaci mogu pomoći pri tumačenju rezultata ispitivanja u pogledu putova izloženosti. Dodatne informacije o hranjenju sedimentom mogu se dobiti primjenom metoda opisanih u (24), (25), (44) i (45), kojima se utvrđuje hranjenje sedimentom ili odabir čestica u ispitnim organizmima.
|
|
27.
|
Načini postupanja s prirodnim sedimentima prije njihove uporabe u laboratoriju opisani su u (3), (7) i (12). Priprema i čuvanje umjetnog sedimenta čija se uporaba preporučuje u ispitivanju s Lumbriculus opisani su u Dodatku 4.
|
Primjena ispitivane kemikalije
|
28.
|
Ispitivanu kemikaliju treba unijeti u sediment spikingom. Budući da se očekuje da većina ispitivanih kemikalija ima slabu topljivost u vodi, potrebno ih je otopiti u odgovarajućem organskom otapalu (npr. acetonu, n-heksanu, cikloheksanu) u što je moguće manjem volumenu kako bi se pripremila radna otopina. Radne otopine potrebno je razrijediti istim otapalom kako bi se pripremile ispitne otopine. Glavni kriteriji za odabir odgovarajućeg otapajućeg sredstva trebali bi biti toksičnost i hlapljivost otapala te topljivost ispitivane kemikalije u odabranom otapalu. Za svaku je razinu koncentracije potrebno upotrijebiti isti volumen odgovarajuće otopine. Ispitivana kemikalija doda se u sediment postupkom spikinga u velikoj količini za svaku razinu koncentracije, kako bi se smanjila varijabilnost koncentracije ispitivane kemikalije među ponavljanjima. Potom se svaka od ispitnih otopina pomiješa s kremenim pijeskom na način opisan u stavku 22. (npr. 10 grama kremenog pijeska po ispitnoj posudi). Pokazalo se da je za potpuno namakanje kremenog pijeska dovoljan volumen od 0,20 do 0,25 ml po gramu pijeska. Otapalo se potom mora ispariti do suha. Kako bi se što je moguće više smanjili gubici ispitivane kemikalije do kojih dolazi zbog suisparavanja (npr. ovisno o tlaku para kemikalije), obloženi se pijesak mora upotrijebiti odmah nakon sušenja. Suhi se pijesak pomiješa s prikladnom količinom formuliranog sedimenta odgovarajuće koncentracije. Pri pripremi sedimenta potrebno je uzeti u obzir količinu pijeska koja se unosi smjesom ispitivane kemikalije i pijeska (tj. sediment je potrebno pripremiti s manje pijeska). Glavna je prednost ovog postupka u tome da se u tlo zapravo ne uvodi nimalo otapala (7). Druga je mogućnost, npr. ako je riječ o prirodnom sedimentu, da se ispitivana kemikalija doda spikingom u osušeni i fino usitnjeni dio sedimenta kako je ranije u tekstu opisano za kremeni pijesak ili da se ispitivana kemikalija pomiješa u vlažno tlo, uz naknadno isparavanje upotrijebljenog otapajućeg sredstva. Treba se pobrinuti da ispitivana tvar koja se dodaje u sediment bude temeljito i ravnomjerno raspoređena u sedimentu. Ako je potrebno, mogu se analizirati poduzorci kako bi se potvrdile ciljane koncentracije u sedimentu te odredio stupanj homogenosti. Isto tako može biti korisno analizirati poduzorke ispitnih otopina kako bi se potvrdile ciljane koncentracije u sedimentu. Budući da se za oblaganje kremenog pijeska ispitnom kemikalijom upotrebljava otapalo, potrebno je upotrijebiti kontrolu s otapalom koja se priprema s istom količinom otapala kao i ispitni sedimenti. Potrebno je izvijestiti o metodi koja se upotrijebila za spiking te o razlozima za odabir specifičnog postupka spikinga koji je drukčiji od opisanog ranije u tekstu. Metoda spikinga može se prilagoditi fizikalno-kemijskim svojstvima ispitivane kemikalije, npr. kako bi se izbjegli gubici zbog ishlapljivanja tijekom spikinga ili uravnoteženja. Dodatne smjernice o postupcima spikinga navedene su u Environment Canada (1995.) (46).
|
|
29.
|
Nakon što se sediment obradi spikingom, raspodijeli u ispitne posude i pokrije ispitnom vodom, poželjno je dopustiti razdiobu ispitivane tvari iz sedimenta u tekuće stanje (npr. (3) (7) (9)). To bi se po mogućnosti trebalo učiniti u uvjetima temperature i dozračivanja koji se primjenjuju u ispitivanju. Prikladno vrijeme uravnoteženja specifično je za svaki sediment i kemikaliju, a može se kretati od nekoliko sati pa sve do nekoliko dana, a u rijetkim slučajevima i do nekoliko tjedana (četiri do pet tjedana) (npr. (27) (47)). U ovom se ispitivanju ne čeka uravnoteženje, ali se preporučuje vrijeme uravnoteženja od 48 sati do sedam dana. Time se smanjuje vrijeme potrebno za razgradnju ispitivane kemikalije. Ovisno o cilju istraživanja, npr. kada je potrebno oponašati uvjete u okolišu, sediment obrađen postupkom spikinga može se ostaviti dulje vrijeme da se uravnotežuje ili ‚stari’.
|
|
30.
|
Na kraju tog razdoblja uravnoteženja potrebno je uzeti barem uzorke vode iznad sedimenta i samog sedimenta, i to barem kod najviše koncentracije i kod jedne niže, kako bi se analizirala koncentracija ispitivane kemikalije Ta analitička određivanja ispitivane kemikalije omogućuju izračun bilance mase i izražavanje rezultata na temelju izmjerenih početnih koncentracija. Općenito, uzorkovanjem se remeti i uništava sustav sediment-voda. Stoga obično nije moguće upotrijebiti ista ponavljanja za uzrokovanje sedimenta i crva. Moraju se postaviti dodatne ‚analitičke’ posude odgovarajućih dimenzija, koje se tretiraju na isti način (uključujući i prisutnost ispitnih organizama), ali se ne upotrebljavaju za biološka promatranja. Dimenzije posuda moraju biti takve da omoguće uzimanje onih količina uzoraka koje zahtijeva analitička metoda. Uzorkovanje je pobliže opisano u stavku 53.
|
PROVEDBA ISPITIVANJA
Preliminarno ispitivanje
|
31.
|
Ako nisu dostupne informacije o toksičnosti ispitivane kemikalije za Lumbriculus variegatus, može biti korisno provesti preliminarni pokus kako bi se odredio raspon koncentracija koje je potrebno ispitati u glavnom ispitivanju te kako bi se optimizirali ispitni uvjeti za glavno ispitivanje. U tu se svrhu primjenjuje niz široko razmaknutih koncentracija ispitivane tvari. Crvi se izlažu svakoj koncentraciji ispitivane kemikalije u razdoblju (npr. 28 dana kao u glavnom ispitivanju) koje omogućuje procjenu odgovarajuće ispitne koncentracije; ponavljanja nisu potrebna. Tijekom preliminarnog ispitivanja potrebno je promatrati i zabilježiti ponašanje crva, na primjer izbjegavanje sedimenta, koje je možda uzrokovano ispitnom kemikalijom i/ili sedimentom. U preliminarnom ispitivanju ne bi trebalo ispitivati koncentracije veće od 1 000 mg/kg suhe mase sedimenta.
|
Glavno ispitivanje
|
32.
|
U glavnom je ispitivanju potrebno upotrijebiti i odabrati najmanje pet koncentracija, npr. na temelju rezultata preliminarnog ispitivanja za određivanje raspona (stavak 31.) i kako je opisano u stavcima 35., 36., 37. i 38.
|
|
33.
|
Uz ispitni niz provodi se kontrola (za broj ponavljanja vidjeti stavke 36., 37. i 38.) koja sadržava sve sastojke osim ispitivane kemikalije. Ako se za primjenu ispitivane kemikalije upotrebljava otapajuće sredstvo, ono ne smije imati značajan učinak na ispitne organizme, što mora potvrditi kontrola s otapalom bez ispitivane kemikalije.
|
Plan ispitivanja
|
34.
|
Plan ispitivanja odnosi se na odabir broja i rasporeda ispitnih koncentracija, na broj posuda za svaku koncentraciju te na broj crva dodanih po posudi. Planovi za procjenu vrijednosti ECx, za procjenu NOEC-a i za provođenje graničnog ispitivanja opisani su u stavcima 35., 36., 37. i 38.
|
|
35.
|
Koncentracija s učinkom (npr. EC50 EC25, EC10) i raspon koncentracija u kojemu je učinak ispitivane kemikalije od interesa moraju obuhvaćati koncentracije uključene u ispitivanje. Potrebno je izbjegavati ekstrapolaciju ispod najniže koncentracije koja utječe na ispitne organizme ili iznad najviše ispitane koncentracije. Ako se u iznimnim slučajevima takva ekstrapolacija ipak provodi, u izvješću se mora navesti detaljno obrazloženje.
|
|
36.
|
Ako se procjenjuje ECx, potrebno je ispitati barem pet koncentracija i najmanje tri ponavljanja za svaku koncentraciju; preporučuje se šest ponavljanja za kontrolu ili, ako se upotrebljava, kontrolu samo s otapalom kako bi se poboljšala procjena varijabilnosti među kontrolama. U svakom se slučaju savjetuje uporaba dovoljnog broja ispitnih koncentracija kako bi se dobila dobra procjena modela. Faktor između koncentracija ne bi smio biti veći od dva (iznimka se može učiniti u slučajevima kada krivulja odgovora na koncentraciju ima plitak nagib). Broj ponavljanja po svakom tretmanu može se smanjiti ako se poveća broj ispitnih koncentracija s odgovorima u rasponu od 5 do95 %. Povećanje broja ponavljanja ili smanjenje intervala između ispitnih koncentracija obično dovodi do užih intervala pouzdanosti za ispitivanje.
|
|
37.
|
Ako se procjenjuje ECx, potrebno je ispitati barem pet koncentracija i najmanje četiri ponavljanja za svaku koncentraciju (preporučuje se šest ponavljanja za kontrolu ili, ako se upotrebljava, kontrolu samo s otapalom kako bi se poboljšala procjena varijabilnosti među kontrolama), a faktor između koncentracija ne bi smio biti veći od dva. U Dodatku 6. navedene su neke informacije o statističkoj snazi utvrđenoj tijekom testiranja hipoteze u prstenastom ispitivanju ispitne metode.
|
|
38.
|
Može se provesti granično ispitivanje (jedna ispitna koncentracija i kontrole) ako se ne očekuju učinci pri koncentracijama od 1 000 mg/kg suhe mase sedimenta (npr. prema preliminarnom ispitivanju za određivanje raspona) ili ako je ispitivanje sa samo jednom koncentracijom dovoljno za potvrđivanje relevantne vrijednosti NOEC-a. U tom drugom slučaju u izvješću o ispitivanju potrebno je navesti detaljno obrazloženje za odabir granične koncentracije. Svrha je graničnog ispitivanja provesti ispitivanje s koncentracijom koja je dovoljno visoka da donositeljima odluke omogući da isključe moguće toksične učinke kemikalije, a granica se postavlja na koncentraciju za koju se ne očekuje da će se pojaviti u bilo kojoj situaciji. Preporučuje se 1 000 mg/kg (suhe mase). Obično je potrebno najmanje šest ponavljanja i za tretman i za kontrole. U Dodatku 6. navedene su neke informacije o statističkoj snazi utvrđenoj tijekom testiranja hipoteze u prstenastom ispitivanju ispitne metode.
|
Uvjeti izloženosti
Ispitni organizmi
|
39.
|
Ispitivanje se provodi s najmanje deset crva za svako ponavljanje koje se upotrebljava za određivanje bioloških parametara. Taj broj crva odgovara količini od oko 50 do 100 mg mokre biomase. To znači da će, uz pretpostavku da udio suhe mase iznosi 17,1 % (48), svaka posuda sadržavati oko 9 do 17 mg suhe biomase. U.S. EPA (2000. (7)) preporučuje količinu punjenja od najviše 1: 50 (suha masa: TOC). Za formulirani sediment opisan u stavku 22. to odgovara količini od oko 43 g sedimenta (suha masa) na deset crva uz TOC od 2,0 % suhog sedimenta. U slučajevima kada se upotrebljava više od deset crva po posudi potrebno je na odgovarajući način prilagoditi količinu sedimenta i vode iznad sedimenta.
|
|
40.
|
Svi crvi koji se upotrebljavaju u ispitivanju moraju dolaziti iz istog izvora i biti sličnog fiziološkog stanja (vidjeti Dodatak 5.). Potrebno je odabrati crve slične veličine (vidjeti stavak 39.). Preporučuje se da se prije ispitivanja izvaže poduzorak serije ili zalihe crva radi procjene prosječne mase.
|
|
41.
|
Crvi koji se upotrebljavaju u ispitivanju vade se iz kulture (za detalje vidjeti Dodatak 5.). Velike (odrasle) životinje koje ne pokazuju znakove nedavne fragmentacije prenose se u staklene zdjelice (npr. Petrijeve zdjelice) koje sadržavaju čistu vodu. Potom se sinkroniziraju kako je opisano u Dodatku 5. Nakon regeneriranja u razdoblju od 10 do 14 dana za ispitivanje se uzimaju netaknuti čitavi crvi slične veličine koji aktivno plivaju ili gmižu nakon nježnog mehaničkog podražaja. Ako se uvjeti ispitivanja razlikuju od uvjeta uzgoja kulture (npr. u pogledu temperature, režima svjetlosti i vode iznad sedimenta), faza aklimatizacije od npr. 24 sata pri temperaturi i režimu svjetlosti te s vodom iznad sedimenta koji su jednaki onima koji će se upotrebljavati u ispitivanju trebala bi biti dovoljna da se crvi prilagode uvjetima ispitivanja. Prilagođeni se oligoheti nasumično rasporede u ispitne posude.
|
Hranjenje
|
42.
|
S obzirom na to da se hrana dodaje u sediment prije (ili tijekom) primjene ispitivane kemikalije, crvima se tijekom ispitivanja ne daje dodatna hrana.
|
Svjetlo i temperatura
|
43.
|
Tijekom uzgoja kulture i za vrijeme ispitivanja fotoperiod obično iznosi 16 sati (3), (7). Kako bi se oponašali prirodni uvjeti na površini sedimenta, intenzitet svjetlosti mora biti nizak (npr. 100 do 500 lx) i potrebno ga je izmjeriti najmanje jedanput tijekom razdoblja izloženosti. Temperatura mora iznositi 20 °C ± 2 °C cijelo vrijeme ispitivanja. Na dan mjerenja razlika u temperaturama ispitnih posuda ne smije biti veća od ± 1 °C. Ispitne posude potrebno je nasumično staviti u ispitni inkubator ili u ispitni prostor, npr. kako bi se pogodovanje razmnožavanju zbog položaja posuda svelo na najmanju moguću mjeru.
|
Dozračivanje
|
44.
|
Vodu iznad sedimenta u ispitnim posudama potrebno je blago dozračivati (npr. dva do četiri mjehurića u sekundi) staklenom konusnom pipetom postavljenom oko 2 cm iznad površine sedimenta tako da se što je moguće manje poremeti sediment. Potrebno je paziti da koncentracija otopljenog kisika ne padne ispod 30 % vrijednosti zasićenosti kisikom (ASV). Potrebno je kontrolirati dovod zraka te ga, ako je potrebno, prilagoditi najmanje jedanput dnevno za radnih dana.
|
Mjerenje kvalitete vode
|
45.
|
Potrebno je mjeriti sljedeće parametre kvalitete vode iznad sedimenta:
|
Temperatura:
|
najmanje u jednoj ispitnoj posudi za svaku razinu koncentracije i u jednoj kontrolnoj posudi jedanput tjedno te na početku i na kraju razdoblja izloženosti; po mogućnosti se može bilježiti i temperatura u okolnom mediju (okolnom zraku ili vodenoj kupelji), npr. u razmacima od jednog sata;
|
|
Sadržaj otopljenog kisika:
|
najmanje u jednoj ispitnoj posudi za svaku razinu koncentracije i u jednoj kontrolnoj posudi jedanput tjedno te na početku i na kraju razdoblja izloženosti; izražava se u mg/l i % ASV (vrijednosti zasićenosti kisikom);
|
|
Dovod zraka:
|
potrebno ga je kontrolirati najmanje jedanput dnevno za radnih dana te ga prema potrebi prilagoditi;
|
|
pH:
|
najmanje u jednoj ispitnoj posudi za svaku razinu koncentracije i u jednoj kontrolnoj posudi jedanput tjedno te na početku i na kraju razdoblja izloženosti;
|
|
Ukupna tvrdoća vode:
|
najmanje u jednoj kontrolnoj posudi i u jednoj ispitnoj posudi s najvećom koncentracijom na početku i na kraju razdoblja izloženosti; izražava se u mg/l CaCO3;
|
|
Ukupan sadržaj amonijaka:
|
najmanje u jednoj kontrolnoj posudi i u jednoj ispitnoj posudi za svaku razinu koncentracije na početku razdoblja izloženosti, a potom tri puta tjedno; izražava se u mg/l NH4
+ ili NH3 ili ukupnog amonijaka-N;
|
Ako je za mjerenje parametara kvalitete vode potrebno uzeti znatnu količinu vode iz posuda, bilo bi preporučljivo pripremiti posebne posude za mjerenje kvalitete vode kako se ne bi promijenio omjer volumena vode i sedimenta.
|
Biološka opažanja
|
46.
|
Tijekom izloženosti potrebno je promatrati ispitne posude kako bi se vizualno procijenile eventualne razlike u ponašanju crva (npr. izbjegavanje sedimenta, fekalni peleti vidljivi na površini sedimenta) u usporedbi s kontrolama. Opažanja je potrebno bilježiti.
|
|
47.
|
Na kraju ispitivanja pregledava se svaka ispitna posuda (dodatne posude namijenjene za kemijske analize mogu se izuzeti iz pregledavanja). Potrebno je primijeniti odgovarajuću metodu kako bi se svi crvi izvadili iz ispitnih posuda. Potrebno je paziti da pri vađenju nijedan crv ne bude oštećen. Prosijavanje je jedna je od mogućih metoda vađenja crva iz sedimenta. Može se upotrijebiti sito od nehrđajućeg čelika s otvorima odgovarajuće veličine. Većina vode iz sedimenta pažljivo se pretoči, a preostali se sediment i voda protresu kako bi se dobila tekuća kaša koja može proći kroz sito. Ako se upotrijebi sito veličine otvora 500 μm, većina čestica sedimenta proći će vrlo brzo kroz njega; međutim, prosijavanje je potrebno izvršiti brzo kako bi se spriječilo gmizanje crva u sito ili kroz njega. Ako se upotrijebi sito veličine otvora 250 μm, spriječit će se gmizanje crva u sito ili kroz njega; međutim, potrebno je paziti da na situ ostane što je moguće manje čestica sedimenta. Prosijana kaša iz svake posude može se još jedanput prosijati kako bi se osiguralo da su svi crvi izvađeni. Alternativna je metoda zagrijavanje sedimenta stavljanjem ispitnih posuda u vodenu kupelj na 50 do 60 °C; crvi će izići iz sedimenta te ih se može pokupiti pipetom širokog otvora poliranom plamenom. Druga je alternativna metoda pretvaranje sedimenta u tekuću kašu te izlijevanje te kaše u plitku posudu prikladne veličine. Crve se može izvaditi iz plitkog sloja kaše čeličnom iglom ili urarskom pincetom (koju treba upotrijebiti prije kao vilicu nego kao kliješta, da se crvi ne oštete) te ih prenijeti u čistu vodu. Nakon što se crvi odvoje od kašastog sedimenta, ispiru se u ispitnom mediju i izbroje.
|
|
48.
|
Neovisno o upotrijebljenoj metodi, laboratoriji moraju dokazati da je njihovo osoblje sposobno izvaditi prosječno najmanje 90 % organizama iz cijelog sedimenta. Primjerice, određeni broj ispitnih organizama može se dodati kontrolnom sedimentu ili ispitnim sedimentima te se nakon sat vremena može utvrditi broj izvađenih organizama (7).
|
|
49.
|
Potrebno je zabilježiti i ocijeniti ukupan broj živih i mrtvih jedinki po ponavljanju. Sljedeće skupine crva smatraju se mrtvima:
|
a)
|
ne reagiraju na nježan mehanički podražaj;
|
|
b)
|
uočavaju se znakovi raspadanja (u kombinaciji sa skupinom ‚a’);
|
Živi se crvi mogu dodatno svrstati u jednu od tri skupine:
|
a)
|
veliki kompletni crvi (odrasli) bez regeneriranih dijelova tijela:
|
|
b)
|
kompletni crvi s regeneriranim dijelovima tijela svjetlije boje (tj. s novim stražnjim dijelom, s novim prednjim dijelom ili s novim stražnjim i prednjim dijelovima):
|
|
c)
|
nekompletni crvi (tj. nedavno fragmentirani crvi s neregeneriranim dijelovima tijela).
|
Ta dodatna opažanja nisu obvezatna, ali mogu biti korisna za dodatno tumačenje bioloških rezultata (primjerice, veliki broj crva svrstan u skupinu c može ukazivati na kašnjenje u razmnožavanju ili regeneraciji u predmetnom tretmanu). Osim toga, ako se uoče bilo kakve razlike u izgledu (npr. lezije na integumentu, edematozni dijelovi tijela) između tretiranih i kontrolnih crva, potrebno ih je zabilježiti.
|
|
50.
|
Odmah nakon brojenja/ocjenjivanja, živi crvi pronađeni u svakom ponavljanju prenose se u osušene, prethodno izvagane i označene plitice za vaganje (jedna po ponavljanju) te se usmrćuju primjenom kapljice etanola po plitici za vaganje. Plitice za vaganje stavljaju se u sušionik na 100 ± 5 °C kako bi se sušile preko noći, potom se izvažu nakon hlađenja u eksikatoru te se određuje suha masa crva (po mogućnosti u gramima, na najmanje četiri decimalna mjesta).
|
|
51.
|
Osim ukupne suhe mase može se odrediti i suha masa bez pepela, kako je opisano u (49), kako bi se uzeli u obzir anorganski sastojci podrijetlom iz progutanog sedimenta koji su prisutni u probavnom traktu crva.
|
|
52.
|
Biomasa se određuje kao ukupna biomasa po ponavljanju, uključujući odrasle i mlade crve. Mrtvi se crvi ne uzimaju u obzir za određivanje biomase po ponavljanju.
|
Verifikacija koncentracije ispitivane kemikalije
Uzorkovanje
|
53.
|
Uzorke za kemijsku analizu ispitivane kemikalije potrebno je uzeti barem kod najveće koncentracije i jedne niže, najmanje na kraju faze uravnoteženja (prije dodavanja ispitnih organizama) i na kraju ispitivanja. Za analizu je potrebno uzrokovati najmanje sediment i vodu iznad sedimenta. Na svaki datum uzorkovanja potrebno je uzeti najmanje dva uzorka po matrici i tretmanu. Jedan od uzoraka uzetih u duplikatu može se pohraniti kao rezervni uzorak (koji će se analizirati npr. u slučaju kad su rezultati početne analize izvan raspona od ± 20 % nazivne koncentracije). U slučaju specifičnih kemijskih svojstava, npr. ako se očekuje brza razgradnja ispitivane kemikalije, plan analize može se prilagoditi (npr. češće uzorkovanje, analiza više razina koncentracije) na temelju stručne prosudbe. Uzorci se tada mogu uzimati u vrijeme između utvrđenih datuma uzorkovanja (npr. sedmog dana nakon početka izlaganja).
|
|
54.
|
Vodu iznad sedimenta potrebno je uzorkovati pažljivim pretakanjem ili isisavanjem tako da se remećenje sedimenta svede na najmanju moguću mjeru. Potrebno je zabilježiti volumen uzorka.
|
|
55.
|
Nakon što se voda iznad sedimenta ukloni, sediment je potrebno homogenizirati i prenijeti ga u prikladnu posudu. Treba zabilježiti masu uzorka mokrog sedimenta.
|
|
56.
|
Ako se dodatno zahtijeva i analiza ispitivane kemikalije u pornoj vodi, homogenizirane i izvagane uzorke sedimenta potrebno je centrifugirati kako bi se odvojila porna voda. Primjerice, oko 200 ml mokrog sedimenta može se staviti u čaše za centrifugiranje od 250 ml. Potom je uzorke potrebno centrifugirati bez filtriranja kako bi se izdvojila porna voda, npr. na 10 000 ± 600 × g u trajanju od 30 do 60 minuta pri temperaturi ne većoj od one koja se primjenjuje u ispitivanju. Supernatant se nakon centrifugiranja dekantira ili izvadi pipetom, pazeći da se ne unesu čestice sedimenta, te se bilježi volumen. Treba zabilježiti masu preostalog taloga sedimenta. Taj podatak može olakšati procjenu bilance mase ili iskorištenja ispitivanje kemikalije u sustavu voda-sediment ako se na svaki datum uzorkovanja odredi suha masa sedimenta. U nekim slučajevima možda neće biti moguće analizirati koncentracije u pornoj vodi jer je uzorak premalen.
|
|
57.
|
Ako se analiza ne obavi odmah, svi se uzorci moraju uskladištiti na prikladan način, npr. u preporučenim uvjetima skladištenja koji osiguravaju minimalnu razgradnju određene ispitivane kemikalije (npr. uzorci iz okoliša obično se čuvaju u tami na – 18 °C). Prije početka istraživanja treba pribaviti informacije o pravilnim uvjetima skladištenja predmetne ispitivane kemikalije – npr. trajanje i temperatura skladištenja, postupci ekstrakcije itd.
|
Analitička metoda
|
58.
|
Budući da čitav postupak uglavnom ovisi o točnosti, preciznosti i osjetljivosti analitičke metode koja se primjenjuje u odnosu na ispitivanu kemikaliju, potrebno je pokusima provjeriti jesu li preciznost i obnovljivost kemijske analize te izdvajanje ispitivane kemikalije iz vode i sedimenta zadovoljavajući za premetnu metodu, i to najmanje pri najnižim i najvišim ispitnim koncentracijama. Isto tako treba provjeriti može li se ispitivana kemikalija detektirati u kontrolnim posudama u koncentracijama većim od granice kvantifikacije. Ako je potrebno, nazivne se koncentracije ispravljaju kako bi se uzelo u obzir iskorištenje količina unesenih radi kontrole kvalitete (npr. ako iskorištenje nije u rasponu od 80 do 120 % unesene količine). Sa svim je uzorcima tijekom ispitivanja potrebno postupati tako da se na onečišćenja i gubici svedu na najmanju moguću mjeru (npr. nastali kao rezultat adsorpcije ispitivane kemikalije na uređaj za uzorkovanje).
|
|
59.
|
Potrebno je zabilježiti i u izvješće uključiti iskorištenje ispitivane kemikalije, granicu kvantifikacije te granicu detekcije u sedimentu i vodi.
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
60.
|
Biomasa i ukupan broj crva po ponavljanju glavne su obvezatne varijable odgovora u ispitivanju koje je potrebno statistički ocijeniti. Po izboru se mogu ocijeniti i razmnožavanje (povećanje broja crva) te rast (povećanje suhe biomase). U tom slučaju potrebno je procijeniti suhu masu crva na početku izlaganja, npr. mjerenjem suhe mase reprezentativnog poduzorka serije sinkroniziranih crva koji će se upotrebljavati u ispitivanju.
|
|
61.
|
Iako smrtnost nije krajnja točka ovog ispitivanja, trebalo bi je ocijeniti u mjeri u kojoj je to moguće. Kako bi se procijenila smrtnost, crve koji ne reagiraju na blagi mehanički podražaj ili koji pokazuju znakove raspadanja te crve koji nedostaju potrebno je smatrati mrtvima. Smrtnost bi trebalo barem zabilježiti te uzeti u obzir pri tumačenju rezultata ispitivanja.
|
|
62.
|
Koncentracije s učinkom potrebno je izraziti u mg/kg suhe mase sedimenta. Ako iskorištenje ispitivane kemikalije izmjereno u sedimentu, ili u sedimentu i vodi iznad sedimenta na početku izlaganja, iznosi između 80 i 120 % nazivnih koncentracija, koncentracije s učinkom (ECx, NOEC, LOEC) mogu se izraziti na temelju nazivnih koncentracija. Ako iskorištenje odstupa od nominalnih koncentracija za više od ± 20 %, koncentracije s učinkom (ECx, NOEC, LOEC) moraju se temeljiti na prvobitno izmjerenim koncentracijama na početku izlaganja, npr. uzimajući u obzir bilancu mase ispitivane kemikalije u ispitnom sustavu (vidjeti stavak 30.). U tim se slučajevima dodatne informacije mogu dobiti iz analize radnih otopina i/ili otopina za primjenu kako bi se potvrdilo da su ispitni sedimenti pravilno pripremljeni.
|
ECx
|
63.
|
Vrijednosti ECx za parametre opisane u stavku 60. izračunavaju se odgovarajućim statističkim metodama (npr. probit-analizom, logističkom ili Weibullovom funkcijom, modificiranom Spearman-Karberovom metodom ili jednostavnom interpolacijom). Smjernice o statističkom ocjenjivanju navedene su u literaturi pod (15) i (50). ECx dobiva se tako da se u dobivenu jednadžbu uvrsti vrijednost koja odgovara x postotku kontrolne srednje vrijednosti. Da bi se izračunao EC50 ili bilo koji drugi ECx, srednje vrijednosti izračunane za svaki tretman (

) potrebno je podvrgnuti regresijskoj analizi. |
NOEC/LOEC
|
64.
|
Ako se za određivanje NOEC-a namjerava primijeniti statistička analiza, potrebni su statistički podaci za svaku posudu (pojedinačne posude smatraju se ponavljanjima) Potrebno je primijeniti odgovarajuće statističke metode. Općenito, štetni učinci ispitivane kemikalije u usporedbi s kontrolom istražuju se jednosmjernim testiranjem hipoteza za p ≤ 0,05. U sljedećim se stavcima navode primjeri. Smjernice za odabir statističkih metoda navedene su u literaturi pod (15) i (50).
|
|
65.
|
Normalna distribucija podataka može se ispitati npr. Kolmogorov-Smirnovljevim testom prikladnosti, testom omjera raspona i standardne devijacije (R/s-test) ili Shapiro-Wilkovim testom, (dvosmjerni, p ≤ 0,05). Za testiranje homogenosti varijance mogu se upotrijebiti Cochranov test, Leveneov test ili Bartlettov test (dvosmjerni, p ≤ 0,05). Ako su ispunjeni uvjeti koje zahtijevaju parametarski testovi (normalnost, homogenost varijance), može se provesti jednosmjerna analiza varijance (ANOVA) i potom testovi višestruke usporedbe. Kako bi se izračunalo postoje li značajne razlike (p ≤ 0,05) između kontrola i različitih koncentracija ispitivane tvari, mogu se primijeniti usporedbe parova (npr. Dunnettov t-test) ili testovi trenda postupnim snižavanjem (npr. Williamsov test). Inače je za određivanje NOEC-a i LOEC-a potrebno primijeniti neparametarske metode (npr. Bonferronijev-U-test prema Holmu ili Jonckheere-Terpstrin test trenda).
|
Granično ispitivanje
|
66.
|
Ako je provedeno granično ispitivanje (usporedba kontrole i samo jednog tretmana) te su ispunjeni uvjeti koje zahtijevaju parametarski testovi (normalnost, homogenost), metrički odgovori (ukupan broj crva te biomasa kao suha masa crva) mogu se ocijeniti Studentovim testom (t-test). Ako ti zahtjevi nisu ispunjeni, može se primijeniti t-test nejednake varijance (Welchov t-test) ili neparametarski test, kao što je Mann-Whitheyjev U-test. U Dodatku 6. navedene su neke informacije o statističkoj snazi utvrđenoj tijekom testiranja hipoteze u prstenastom ispitivanju metode.
|
|
67.
|
Da bi se odredile značajne razlike između kontrola (kontrola i kontrola s otapalom), ponavljanja svake kontrole mogu se testirati kako je opisano za granično ispitivanje. Ako se tim testovima ne otkriju značajne razlike, sva ponavljanja kontrole i kontrole s otapalom mogu se združiti. U protivnom se svi tretmani moraju usporediti s kontrolom s otapalom.
|
Tumačenje rezultata
|
68.
|
Rezultate je potrebno tumačiti s oprezom ako je bilo odstupanja od ove ispitne metode i ako se izmjerene ispitne koncentracije kreću u blizini granice detekcije analitičke metode. Treba zabilježiti sva odstupanja od ove ispitne metode.
|
Izvješće o ispitivanju
|
69.
|
Izvješće o ispitivanju mora sadržavati najmanje sljedeće informacije:
|
—
|
Ispitivana kemikalija:
|
—
|
podaci za identifikaciju kemikalije (opći naziv, kemijski naziv, strukturna formula, CAS broj itd.), uključujući čistoću i analitičku metodu kvantifikacije ispitivane kemikalije; izvor ispitivane kemikalije, identitet i koncentracija upotrijebljenog otapala,
|
|
—
|
sve informacije o fizikalnom stanju i fizikalno-kemijskim svojstvima koje su dobivene prije početka ispitivanja (npr. topljivost u vodi, tlak para, koeficijent razdjeljenja u tlu (ili u sedimentu, ako postoji), log Kow, stabilnost u vodi itd.).
|
|
|
—
|
Ispitna vrsta:
|
—
|
znanstveni naziv, izvor, sve vrste prethodne obrade, aklimatizacija, uvjeti uzgoja itd.
|
|
|
—
|
Uvjeti ispitivanja:
|
—
|
primijenjeni ispitni postupak (npr. statički, polustatički ili protočni),
|
|
—
|
plan ispitivanja (npr. broj, materijal i veličina ispitnih komora, volumen vode po posudi, masa i volumen sedimenta po posudi, (za protočni ili polustatički postupak: brzina izmjene vode), svako dozračivanje prije i tijekom ispitivanja, broj ponavljanja, broj crva po ponavljanju na početku izlaganja, broj ispitnih koncentracija, trajanje razdoblja kondicioniranja, uravnoteženja i izlaganja, učestalost uzorkovanja),
|
|
—
|
dubina sedimenta i vode iznad sedimenta,
|
|
—
|
metoda prethodne obrade te uvođenja spikingom / primjene ispitivane kemikalije,
|
|
—
|
nazivne ispitne koncentracije, detalji o uzorkovanju za kemijsku analizu te analitičke metode kojima su dobivene koncentracije ispitivane kemikalije,
|
|
—
|
svojstva sedimenta kako je opisano u stavcima 24. i 25. te sva ostala mjerenja; priprema formuliranog sedimenta,
|
|
—
|
priprema ispitne vode (ako se upotrebljava obrađena voda) i svojstva (koncentracija kisika, pH, provodljivost, tvrdoća i sva druga izvršena mjerenja) prije početka ispitivanja,
|
|
—
|
detaljni podaci o hranjenju, uključujući i vrstu hrane, pripremu, količinu i režim hranjenja,
|
|
—
|
intenzitet svjetlosti i fotoperiod (fotoperiodi),
|
|
—
|
metode primijenjene za određivanja svih bioloških parametara (npr. uzorkovanje, pregled, vaganje ispitnih organizama) i svih abiotičkih parametara (npr. parametara kvalitete vode i sedimenta),
|
|
—
|
volumeni i/ili mase svih uzoraka za kemijsku analizu,
|
|
—
|
detaljni podaci o obradi svih uzoraka za kemijsku analizu, uključujući i pojedinosti o pripremi, skladištenju, postupcima spikinga, ekstrakciji i analitičkim postupcima (i preciznosti) za ispitivanu kemikaliju i iskorištenje ispitivane kemikalije.
|
|
|
—
|
Rezultati:
|
—
|
kakvoća vode u ispitnim posudama (pH, temperatura, koncentracija otopljenog kisika, tvrdoća, koncentracija amonijaka i sva druga izvršena mjerenja),
|
|
—
|
ukupan sadržaj organskog ugljika (TOC), omjer suhe i mokre mase, pH sedimenta i sva druga izvršena mjerenja,
|
|
—
|
ukupan broj te, ako je utvrđen, broj kompletnih i nekompletnih crva u svakoj ispitnoj komori na kraju ispitivanja,
|
|
—
|
suha masa crva u svakoj ispitnoj komori na kraju ispitivanja te, ako je izmjerena, suha masa poduzorka crva na početku ispitivanja,
|
|
—
|
svaka opažena anomalija u ponašanju u usporedbi s kontrolama (npr. izbjegavanje sedimenta, prisutnost ili odsutnost fekalnih peleta),
|
|
—
|
procjena toksičnih krajnjih točaka (npr. ECx, NOEC i/ili LOEC) i statističke metode koje su primijenjene za njihovo određivanje,
|
|
—
|
nazivne ispitne koncentracije, izmjerene ispitne koncentracije i rezultati svih analiza za određivanje koncentracije ispitivane kemikalije u ispitnim posudama,
|
|
—
|
sva odstupanja od kriterija valjanosti.
|
|
|
—
|
Vrednovanje rezultata:
|
—
|
sukladnost rezultata s kriterijima valjanosti navedenima u stavku 13.,
|
|
—
|
rasprava o rezultatima, uključujući i svaki utjecaj na ishod ispitivanja koji proizlazi iz odstupanja od ove ispitne metode.
|
|
|
LITERATURA
|
(1)
|
EC (2003.) Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I. – IV. Office for Official Publications of the EC (European Commission), Luxembourg.
|
|
(2)
|
OECD (2000.) Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(3)
|
ASTM International (2000.) Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. U: ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002.) Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. U: ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G. L., Ankley, G. T., Benoit, D. A. i Mattson, V. R. (1993.) Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269 – 279.
|
|
(6)
|
Poglavlje C.27 ovog Priloga, ‚Test toksičnosti trzalaca (Chironomidae) u vodi iz sedimenta sa sedimentom obrađenim spikingom’.
|
|
(7)
|
U.S. EPA (2000.) Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Drugo izdanje. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, ožujak 2000.
|
|
(8)
|
Environment Canada (1997.) Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. Prosinac 1997.
|
|
(9)
|
Hill, I. R., Matthiessen, P., Heimbach, F. (ur.), 1993., Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8. – 10. studenoga 1993., Renesse (NL).
|
|
(10)
|
BBA (1995.) Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Uredili M. Streloke i H.Köpp. Berlin 1995.
|
|
(11)
|
Riedhammer, C. i Schwarz-Schulz, B. (2001.) The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105 – 110.
|
|
(12)
|
ASTM International (2004.) Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H. J. i Gilberg, D. (2005.) Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. U suradnji s R. Nagel i B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No. 202 67 429.
|
|
(14)
|
OECD (2000.) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(15)
|
Environment Canada (2003.) Guidance Document on Statistical Methods for Environmental Toxicity Tests; fifth draft, March 2003; Report EPS 1/RM/___
|
|
(16)
|
Nikkilä, A., Halme, A., Kukkonen, J. V. K. (2003.) Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35 – 46.
|
|
(17)
|
Baily, H. C. i Liu, D. H. W. (1980.) Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. str. 205. – 215. U: J. C. Eaton, P. R. Parrish i A. C. Hendricks (ur.). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
(18)
|
Chapman, K. K., Benton, M. J., Brinkhurst, R. O. i Scheuerman, P. R. (1999.) Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271 – 278.
|
|
(19)
|
Meyer, J. S., Boese, C. J. i Collyard, S. A. (2002.) Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Part C 133:99-109.
|
|
(20)
|
Schubauer-Berigan, M. K., Dierkes, J. R., Monson, P. D. i Ankley, G. T. (1993.) pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxciol. Chem. 12(7):1261-1266.
|
|
(21)
|
West, C. W., Mattson, V. R. Leonard, E. N. Phipps, G. L. i Ankley, G. T. (1993.) Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57-63.
|
|
(22)
|
Ingersoll, C. G., Ankley, G. T., Benoit, D. A., Brunson, E. L., Burton, G. A., Dwyer, F. J., Hoke, R. A., Landrum, P. F., Norberg-King, T. J. i Winger, P. V. (1995.) Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885 – 1894.
|
|
(23)
|
Kukkonen, J. i Landrum, P. F. (1994.) Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(24)
|
Leppänen, M. T. i Kukkonen, J. V. K. (1998.a) Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196 – 2202.
|
|
(25)
|
Leppänen, M. T. i Kukkonen, J. V. K. (1998.b) Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183 – 194.
|
|
(26)
|
Landrum, P. F., Gedeon, M. L., Burton, G. A., Greenberg, M. S. i Rowland, C. D. (2002.) Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42: 292 – 302.
|
|
(27)
|
Brunson, E. L., Canfield, T. J., Ingersoll, C. J. i Kemble, N. E. (1998.) Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191 – 201.
|
|
(28)
|
Ingersoll, C. G., Brunson, E. L., Wang N., Dwyer, F. J., Ankley, G. T., Mount D. R., Huckins J., Petty. J. i Landrum, P. F. (2003.) Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872 – 885.
|
|
(29)
|
Rodriguez, P. i Reynoldson, T. B. (1999.) Laboratory methods and criteria for sediment bioassessment. U: A. Mudroch, J. M. Azcue i P. Mudroch (ur.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph. Oehlmann, J. i Knacker, Th. (2005.) Bioaccumulation of14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271 – 280.
|
|
(31)
|
Brust, K., Licht, O., Hultsch, V., Jungmann, D. i Nagel, R. (2001.) Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, str. 2000. – 2007.
|
|
(32)
|
Oetken, M., Ludwichowski, K.-U. & Nagel, R. (2000.) Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, ožujak 2000.
|
|
(33)
|
Leppänen, M. T. i Kukkonen J. V. K. (1998.) Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503 – 1508.
|
|
(34)
|
Dermott, R. i Munawar, M. (1992.) A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407 – 414.
|
|
(35)
|
Drewes, C. D. i Fourtner, C. R. (1990.) Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94 – 103.
|
|
(36)
|
Brinkhurst, R. O. (1971.) A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(37)
|
Poglavlje C.1. ovog Priloga, ‚Akutna toksičnost za ribe’.
|
|
(38)
|
OECD (1992.c) Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. i Nagel, R. (1997.) Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835 – 852.
|
|
(40)
|
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R., i Streit, B. (1998.) Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10 – 20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. i Studinger, G. (1999.) Workshop on ‚Bioaccumulation: Sediment test using benthic oligochaetes’, 26. – 27.4.1999., Hochheim/Main, Njemačka. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(42)
|
Suedel, B. C. i Rodgers, J. H. (1993.) Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163 – 1175.
|
|
(43)
|
Naylor, C. i Rodrigues, C. (1995.) Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291 – 3303.
|
|
(44)
|
Kaster, J. L., Klump, J. V., Meyer, J., Krezoski, J. i Smith, M. E. (1984.) Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181 – 184.
|
|
(45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J. I. i Navarro, E. (1999.) Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111 – 124.
|
|
(46)
|
Environment Canada (1995.) Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(47)
|
Landrum, P. F. (1989.) Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588 – 595.
|
|
(48)
|
Brooke, L. T., Ankley, G. T., Call, D. J. i Cook, P. M. (1996.) Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223 – 228.
|
|
(49)
|
Mount, D. R., Dawson, T. D. i Burkhard, L. P. (1999.) Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244 – 1249.
|
|
(50)
|
OECD 2006. Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment No. 54, OECD, Paris, France.
|
|
(51)
|
Liebig M., Meller M. i Egeler P. (2004.) Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. 24. – 25. ožujka, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Njemačka. str. 107. – 119.
|
Dodatna literatura o statističkim postupcima:
Dunnett, C. W. (1955.) A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096 – 1121.
Dunnett, C. W. (1964.) New tables for multiple comparisons with a control. Biometrics 20, 482 – 491.
Finney, D. J. (1971.) Probit Analysis (3. izd.), str. 19. – 76. Cambridge Univ. Press.
Finney, D. J. (1978.) Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M. A., Russo R. C. i Thurston, R. C. (1977.) Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714 – 719; Correction: Environ. Sci. Technol. 12 (1998.), 417.
Holm, S. (1979.) A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65 – 70.
Sokal, R. R. i Rohlf, F. J. (1981.) Biometry. The principles and practice of statistics in biological research. 2. izdanje. W. H. Freeman and Company. New York.
Miller, R. G., Jr. (1986.) Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro, S. S. i Wilk, M. B (1965.) An analysis of variance test for normality (complete samples). Biometrika 52: 591 – 611.
Williams, D. A. (1971.) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103 – 117.
Williams, D. A. (1972.) The comparison of several dose levels with a zero dose control. Biometrics 28, 519 – 531.
Dodatak 1.
Definicije
Za potrebe ove ispitne metode upotrebljavaju se sljedeće definicije:
|
|
Kemikalija znači tvar ili smjesa.
|
|
|
Razdoblje kondicioniranja primjenjuje se kako bi se stabilizirala mikrobna komponenta sedimenta te uklonio npr. amonijak koji potječe od sastojaka sedimenta; odvija se prije nego što se ispitivana kemikalija uvede u sediment postupkom spikinga. Voda iznad sedimenta obično se baca nakon kondicioniranja.
|
|
|
ECx
je koncentracija ispitivane kemikalije u sedimentu koja izaziva x-postotni (npr. 50 %) učinak na biološki parametar unutar određenog razdoblja izloženosti.
|
|
|
Razdoblje uravnoteženja primjenjuje se kako bi omogućila raspodjela ispitivane kemikalije između čvrste faze, porne vode i vode iznad sedimenta; odvija se nakon što se ispitivana kemikalija uvede u sediment postupkom spikinga i prije dodavanja ispitnih organizama.
|
|
|
Faza izloženosti vrijeme je tijekom kojega su ispitni organizmi izloženi ispitivanoj kemikaliji.
|
|
|
Formulirani sediment ili obrađeni, umjetni ili sintetički sediment smjesa je tvari koja se upotrebljava za oponašanje fizikalnih sastojaka prirodnog sedimenta.
|
|
|
Najniža koncentracija s vidljivim učinkom (LOEC) najniža je ispitana koncentracija ispitivane kemikalije kod koje je uočen značajan toksični učinak kemikalije (pri p ≤ 0,05) u usporedbi s kontrolom. Ipak, sve ispitne koncentracije iznad LOEC-a moraju imati jednak ili veći učinak od onoga koji je zabilježen pri LOEC-u. Ako se ova dva uvjeta ne mogu zadovoljiti, treba navesti detaljno obrazloženje za odabir LOEC-a (a time i NOEC-a).
|
|
|
Najviša koncentracija bez vidljivog učinka (NOEC) ispitna je koncentracija neposredno ispod LOEC-a koja unutar određenog razdoblja izlaganja nema statistički značajan učinak (p < 0,05) u usporedbi s kontrolom.
|
|
|
Koeficijent razdjeljenja između oktanola i vode (Kow; ponekad se izražava i kao Pow) omjer je topljivosti kemikalije u n-oktanolu i vodi u ravnoteži te predstavlja lipofilnost kemikalije (poglavlje A.24. ovog Priloga). Kow ili logaritam Kow (log Kow) služi kao pokazatelj bioakumulacijskog potencijala kemikalije kod vodenih organizama.
|
|
|
Koeficijent razdjeljenja između organskog ugljika i vode (Koc) omjer je koncentracije kemikalije u/na dijelu tla s organskim ugljikom i koncentracije kemikalije u vodi u ravnoteži.
|
|
|
Voda iznad sedimenta je voda koja u ispitnoj posudi pokriva sediment.
|
|
|
Porna voda ili međuprostorna voda je voda u prostoru između sedimenta i čestica tla.
|
|
|
Sediment obrađen spikingom je sediment u koji je dodana ispitivana kemikalija.
|
|
|
Ispitivana kemikalija znači svaka tvar ili smjesa koje se ispituju ovom ispitnom metodom.
|
Dodatak 2.
Sastav preporučene obrađene vode
(preuzeto iz poglavlja C.1. ovog Priloga (1))
|
(a)
|
Otopina kalcijeva klorida
Otopiti 11,76 g CaCl2 × 2 H2O u deioniziranoj vodi; nadopuniti deioniziranom vodom do 1 litre
|
|
(b)
|
Otopina magnezijeva sulfata
Otopiti 4,93 g MgSO4 × 7 H2O u deioniziranoj vodi; nadopuniti deioniziranom vodom do 1 litre
|
|
(c)
|
Otopina natrijeva bikarbonata
Otopiti 2,59 g NaHCO3 u deioniziranoj vodi; nadopuniti deioniziranom vodom do 1 litre
|
|
(d)
|
Otopina kalijeva klorida
Otopiti 0,23 g KCl u deioniziranoj vodi; nadopuniti deioniziranom vodom do 1 litre
|
Sve kemikalije moraju biti analitičkog stupnja čistoće.
Provodljivost destilirane ili deionizirane vode ne smije biti veća od 10 μScm– 1.
Pomiješati po 25 ml svake od otopina od (a) do (d) i nadopuniti deioniziranom vodom do 1 litre. Zbroj kalcijevih i magnezijevih iona u tim otopinama iznosi 2,5 mmol/l.
Omjer iona Ca i Mg je 4: 1, a iona Na i K je 10: 1. Kapacitet kiselosti KS4.3 te otopine iznosi 0,8 mmol/l.
Vodu za razrjeđivanje dozračivati dok se ne postigne zasićenje kisikom te je bez dozračivanja čuvati oko dva dana prije uporabe.
IZVOR
|
(1)
|
Poglavlje C.1. ovog Priloga, ‚Akutna toksičnost za ribe’.
|
Dodatak 3.
Fizikalno-kemijska svojstva prihvatljive vode za razrjeđivanje
|
Sastojak
|
Koncentracije
|
|
Lebdeće čestice
|
< 20 mg/l
|
|
Ukupni organski ugljik
|
< 2 μg/l
|
|
Neionizirani amonijak
|
< 1 μg/l
|
|
Rezidualni klor
|
< 10 μg/l
|
|
Ukupni organofosforni pesticidi
|
< 50 ng/l
|
|
Ukupni organofosforni pesticidi plus poliklorirani bifenili
|
< 50 ng/l
|
|
Ukupni organski klor
|
< 25 ng/l
|
|
(preuzeto iz OECD (1992.) (1))
|
Izvor
|
(1)
|
OECD (1992.) Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Pariz.
|
Dodatak 4.
Preporučeni umjetni sediment – smjernice za pripremu i čuvanje
Sastojci sedimenta
|
Sastojak
|
Svojstva
|
% suhe mase sedimenta
|
|
Treset
|
Tresetna mahovina (Sphagnum moss), stupanj raspadanja: ‚srednji’, sušen na zraku, bez vidljivih ostataka bilja, fino usitnjen (veličina čestica ≤ 0,5 mm)
|
5 ± 0,5
|
|
Kremeni pijesak
|
Veličina zrna: ≤ 2 mm, ali > 50 % mora biti veličine između 50 i 200 μm
|
75 – 76
|
|
Kaolinitska glina
|
Sadržaj kaolinita ≥ 30 %
|
20 ± 1
|
|
Izvor hrane
|
npr. kopriva u prahu (Folia urticae), listovi Urtica dioica (velika kopriva), fino usitnjeni (veličina čestica ≤ 0,5 mm); u skladu s farmaceutskim standardima, za prehranu ljudi; dodani suhom sedimentu
|
0,4 – 0,5 %
|
|
Organski ugljik
|
Prilagođava se dodavanjem treseta i pijeska
|
2 ± 0,5
|
|
Kalcijev karbonat
|
CaCO3, u prahu, kemijskog stupnja čistoće, dodan suhom sedimentu
|
0,05 – 1
|
|
Deionizirana voda
|
Provodljivost ≤ 10 μS/cm, dodana suhom sedimentu
|
30 – 50
|
Napomena: ako se očekuju povišene koncentracije amonijaka, npr. ako je poznato da ispitivana kemikalija inhibira nitrifikaciju, može biti korisno 50 % koprive u prahu bogate dušikom zamijeniti celulozom (npr. α-celulozom u prahu, kemijski čistom, veličine čestica ≤ 0,5 mm; (1) (2)).
Priprema
Treset se suši na zraku i usitnjava u fini prah. Pripremi se suspenzija potrebne količine treseta u prahu u deioniziranoj vodi s pomoću uređaja za homogenizaciju visoke djelotvornosti. pH te suspenzije prilagođava se na 5,5 ± 0,5 s pomoću CaCO3. Suspenzija se kondicionira najmanje dva dana blagim miješanjem na 20 ± 2 °C kako bi se stabilizirala pH-vrijednost i uspostavila stabilna mikrobna komponenta. pH-vrijednost ponovno se mjeri i trebala bi iznositi 6,0 ± 0,5. Potom se suspenzija treseta miješa s ostalim sastojcima (pijeskom i kaolinitskom glinom) i deioniziranom vodom da se dobije homogeni sediment sa sadržajem vode u području od 30 do 50 % suhe mase sedimenta. pH konačne smjese ponovno se mjeri i prema potrebi prilagođava na 6,5 do 7,5 s pomoću CaCO3. Međutim, ako se očekuje nastanak amonijaka, može biti korisno održavati pH sedimenta ispod 7,0 (npr. između 6,0 i 6,5). Uzimaju se uzorci sedimenta kako bi se odredili suha masa i sadržaj organskog ugljika. Ako se očekuje nastanak amonijaka, formulirani sediment može se kondicionirati sedam dana u istim uvjetima koji prevladavaju u sljedećem ispitivanju (npr. omjer sedimenta i vode 1: 4, visina sloja sedimenta kao i u ispitnim posudama) prije nego što se u njega uvede ispitna kemikalija postupkom spikinga, tj. potrebno ga je prekriti vodom koja mora biti dozračena. Na kraju razdoblja kondicioniranja vodu iznad sedimenta potrebno je ukloniti i baciti. Potom se kremeni pijesak koji je obrađen spikingom pomiješa sa sedimentom za svaku razinu tretmana, a sediment se raspodijeli po ispitnim posudama koje služe za ponavljanja i prekrije ispitnom vodom. Posude se zatim inkubiraju u istim uvjetima koji prevladavaju u sljedećem ispitivanju. Tada započinje razdoblje uravnoteženja. Vodu iznad sedimenta potrebno je dozračivati.
Odabrani izvor hrane potrebno je dodati prije ili tijekom uvođenja ispitivane kemikalije u sediment postupkom spikinga. Može se prethodno pomiješati sa suspenzijom treseta (vidjeti ranije u tekstu). Međutim, pretjerano raspadanje izvora hrane prije dodavanja ispitnih organizama – npr. u slučaju dugog razdoblja uravnoteženja – može se izbjeći tako što će se osigurati da vrijeme između dodavanja hrane i početka izlaganja bude što je moguće kraće. Kako bi se osiguralo da je ispitivana kemikalija unesena u hranu, izvor hrane potrebno je pomiješati sa sedimentom najkasnije na dan kad se ispitivana kemikalija unosi u sediment postupkom spikinga.
Skladištenje
Suhi sastojci umjetnog sedimenta mogu se skladištiti na suhom i hladnom mjestu ili na sobnoj temperaturi. Pripremljeni sediment u koji je ispitivana kemikalija unesena postupkom spikinga mora biti odmah upotrijebljen u ispitivanju. Uzorci sedimenta obrađenog spikingom mogu se skladištiti do analize u uvjetima preporučenima za određenu ispitivanu kemikaliju.
IZVORI
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H. J. & Gilberg, D. (2005.) Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. U suradnji s R. Nagel i B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No. 202 67 429.
|
|
(2)
|
Liebig M., Meller M. i Egeler P. (2004.) Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Njemačka. str. 107. – 119.
|
Dodatak 5.
Metode uzgoja Lumbriculus variegatus
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta, živi u slatkovodnim sedimentima i često se upotrebljava u ekotoksikološkim ispitivanjima. Može se lako uzgajati u laboratorijskim uvjetima. U nastavku su ukratko opisane metode uzgoja.
Metode uzgoja
Uvjeti uzgoja za Lumbriculus variegatus detaljno su opisani u Phipps i sur. (1993.) (1), Brunson i sur. (1998.) (2), ASTM (2000.) (3), US EPA (2000.) (4). Ti su uvjeti sažeto navedeni u nastavku. Glavna je prednost crva L. variegatus u tome da se brzo razmnožavaju, što dovodi do brzog povećanja biomase kod populacija uzgajanih u laboratoriju (npr. (1), (3), (4), (5)).
Crvi se mogu uzgajati u velikim akvarijima (57 – 80 l) na 23 °C pri fotoperiodu od 16 sati svjetla (100 – 1 000 lx) i osam sati tame te uz svakodnevno obnavljanje prirodne vode (45 do 50 l po akvariju). Supstrat se priprema tako da se smeđi neizbijeljeni papirnati ručnici izrežu na vrpce koje se potom mogu nekoliko sekundi miješati s vodom za uzgoj kulture kako bi se dobili komadići papirnatog supstrata. Taj se supstrat može izravno upotrijebiti za prekrivanje dna bazena u akvarijima za uzgoj crva Lumbriculus ili se može čuvati zamrznut u deioniziranoj vodi za kasniju uporabu. Novi supstrat u bazenu obično traje oko dva mjeseca.
Svaki uzgoj kulture crva započinje s 500 do 1 000 crva, koji se hrane suspenzijom od 10 ml koja sadržava 6 g početne hrane za pastrve, i to tri puta tjedno u uvjetima obnavljanja vode ili protočnim uvjetima. Za statičke ili polustatičke kulture potrebno je smanjiti brzinu hranjenja kako bi se spriječio rast bakterija i gljivica.
U tim se uvjetima broj jedinki u kulturi obično udvostruči za oko 10 do 14 dana.
Lumbriculus variegatus moguće je uzgajati i u sustavu koji se sastoji od sloja kremenog pijeska kakav se upotrebljava za umjetni sediment (debljine 1 do 2 cm) i obrađene vode. Spremnici od stakla ili nehrđajućeg čelika visine od 12 do 20 cm mogu se upotrijebiti kao uzgojne posude. Vodu treba blago dozračivati (npr. dva mjehurića u sekundi) Pasteurovom pipetom postavljenom oko 2 cm iznad površine sedimenta. Kako bi se izbjeglo nakupljanje npr. amonijaka, vodu iznad sedimenta treba mijenjati protočnim sustavom ili barem jedanput tjedno ručno. Oligoheti se mogu držati na sobnoj temperaturi pri fotoperiodu od 16 sati svjetla (intenziteta od 100 do 1 000 lx) i osam sati tame. Kod polustatičke kulture (obnavljanje vode jedanput tjedno) crve se dva puta tjedno hrani hranom TetraMin (npr. 0,6 do 0,8 mg po cm2 površine sedimenta), koja se može primijeniti u obliku suspenzije od 50 mg hrane TetraMin po mililitru deionizirane vode.
Lumbriculus variegatus mogu se izvaditi iz kulture npr. tako da se u posebnu laboratorijsku čašu prenese supstrat s pomoću fine mrežice ili da se organizmi prenesu s pomoću staklene pipete širokog otvora polirane plamenom (promjera oko 5 mm). Ako se istodobno prenosi i supstrat, laboratorijska čaša koja sadržava crve i supstrat ostavlja se preko noću u protočnim uvjetima u kojima će se iz čaše ukloniti supstrat, dok će crvi ostati na dnu posude. Crvi se potom mogu prenijeti u novopripremljene bazene za uzgoj ili se mogu dodatno obraditi za ispitivanje na način opisan u (3) i (4) ili u nastavku.
Kada se u testovima sa sedimentom upotrebljava L. variegatus, od ključne je važnosti voditi računa o njezinu načinu razmnožavanja (arhitomija ili morfalaksa, npr. (6)). Takvim nespolnim razmnožavanjem nastaju dva fragmenta koji ne uzimaju hranu određeno vrijeme dok im se ne regeneriraju glava ili rep (npr. (7), (8)). To znači da se kod L. variegatus izlaganje putem gutanja kontaminiranog sedimenta ne odvija neprekidno.
Stoga je potrebno provesti sinkronizaciju kako bi se u najvećoj mogućoj mjeri smanjilo nekontrolirano razmnožavanje i regeneriranje, a time i kasnija velika odstupanja u rezultatima ispitivanja. Do takvog odstupanja može doći kada su neke jedinke, koje su se fragmentirale i stoga određeno vrijeme ne uzimaju hranu, manje izložene ispitivanoj kemikaliji od drugih jedinki koje se nisu fragmentirale tijekom ispitivanja (9), (10), (11). Crve je potrebno umjetno fragmentirati (sinkronizacija) 10 do 14 dana prije početka izlaganja. Za sinkronizaciju je potrebno izabrati velike (odrasle) crve koji po mogućnosti ne pokazuju znakove nedavne morfalakse. Ti se crvi mogu staviti na stakalce u kapljicu vode za uzgoj kulture te skalpelom presjeći na sredini tijela. Potrebno je paziti da im stražnji dijelovi budu slične veličine. Potom je potrebno pustiti da se do početka izlaganja na stražnjim dijelovima regeneriraju glave u uzgojnoj posudi koja sadržava isti supstrat kao što je onaj koji se upotrebljava u uzgoju kulture te obrađenu vodu. Ako sinkronizirani crvi počnu rovati po supstratu, znači da je došlo do regeneracije glava (prisutnost regeneriranih glava može se potvrditi pregledom reprezentativnog poduzorka binokularnim mikroskopom). Tada se očekuje da su ispitni organizmi sličnog fiziološkog stanja. To znači da kada se tijekom ispitivanja sinkronizirani crvi razmnože morfalaksom, očekuje se da će gotovo sve životinje biti jednako izložene sedimentu obrađenom spikingom. Sinkronizirane crve treba nahraniti čim počnu rovati po supstratu ili sedam dana nakon disekcije. Režim hranjenja mora biti sličan onome kod uobičajenih kultura, ali bi bilo preporučljivo sinkronizirane crve hraniti istim izvorom hrane kao što je onaj koji će se upotrebljavati u ispitivanju. Crve je potrebno držati na ispitnoj temperaturi od 20 ± 2 °C. Nakon regeneracije, neoštećene kompletne crve koji na blagi mehanički podražaj aktivno plivaju ili gmižu treba upotrijebiti za ispitivanje. Potrebno je spriječiti ozljede ili autotomiju kod crva, npr. tako što će se za rukovanje crvima upotrijebiti pipete čiji su rubovi polirani plamenom ili zubarske pincete od nehrđajućeg čelika.
Izvori početnih kultura za Lumbriculus variegatus (adrese u SAD-u preuzete iz (4))
|
Europa
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Njemačka
|
|
|
Bayer Crop Science AG
|
|
Development – Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Njemačka
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Box 111
|
|
FIN-80101 Joensuu
|
|
Finska
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Njemačka
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
SAD
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
IZVORI:
|
(1)
|
Phipps, G. L., Ankley, G. T., Benoit, D. A. i Mattson, V. R. (1993.) Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269 – 279.
|
|
(2)
|
Brunson, E. L., Canfield, T. J., Ingersoll, C. J. i Kemble, N. E. (1998.) Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191 – 201.
|
|
(3)
|
ASTM International (2000.) Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
US EPA (2000.) Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, US Environmental Protection Agency, Duluth, MN, ožujak 2000.
|
|
(5)
|
Kukkonen, J. i Landrum, P. F. (1994.) Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457 – 1468.
|
|
(6)
|
Drewes C. D. i Fourtner C. R. (1990.) Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94 – 103.
|
|
(7)
|
Leppänen, M. T. i Kukkonen, J. V. K. (1998.a) Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196 – 2202.
|
|
(8)
|
Leppänen, M. T. i Kukkonen, J. V. K. (1998.b) Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183 – 194.
|
|
(9)
|
Brust, K., Licht, O., Hultsch, V., Jungmann D. i Nagel, R. (2001.) Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, str. 2000. – 2007.
|
|
(10)
|
Oetken, M., Ludwichowski, K.-U. i Nagel, R. (2000.) Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, ožujak 2000.
|
|
(11)
|
Leppänen, M. T. i Kukkonen, J. V. K. (1998.) Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503 – 1508.
|
Dodatak 6.
Sažetak rezultata prstenastog ispitivanja
‚Ispitivanje toksičnosti sedimenta s Lumbriculus variegatus’
Tablica 1.
Rezultati pojedinačnih ciklusa prstenastog ispitivanja: srednji broj crva u kontrolama i u kontrolama s otapalom na kraju ispitivanja; SD = standardna devijacija; CV = koeficijent varijacije.
|
|
Srednji broj crva u kontrolama
|
SD
|
CV (%)
|
n
|
Srednji broj crva u kontrolama s otapalom
|
SD
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
međulaboratorijska srednja vrijednost
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
minimalno
|
16,3
|
|
|
|
15,0
|
|
|
|
|
maksimalno
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Tablica 2.
Rezultati pojedinačnih ciklusa prstenastog ispitivanja: srednja ukupna suha masa crva po ponavljanju u kontrolama i kontrolama s otapalom na kraju ispitivanja; SD = standardna devijacija; CV = koeficijent varijacije.
|
|
ukupna suha masa crva po ponavljanju (u kontrolama)
|
SD
|
CV (%)
|
n
|
ukupna suha masa crva po ponavljanju (u kontrolama s otapalom)
|
SD
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
međulaboratorijska srednja vrijednost
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
minimalno
|
12,9
|
|
|
|
10,5
|
|
|
|
|
maksimalno
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Tablica 3.
Toksičnost PCP-a: sažeti prikaz krajnjih točaka u prstenastom ispitivanju; međulaboratorijska srednja vrijednost za EC50, NOEC i LOEC; SD = standardna devijacija; CV = koeficijent varijacije.
|
biološki parametar
|
|
međulaboratorijska srednja vrijednost (mg/kg)
|
minimalno
|
maksimalno
|
međulaboratorijski faktor
|
SD
|
CV (%)
|
geometrijska srednja vrijednost (mg/kg)
|
|
ukupan broj crva
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
MDD (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
ukupna suha masa crva
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
MDD (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
smrtnost/preživljavanje
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
razmnožavanje (povećanje broja crva po ponavljanju)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
MDD (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
rast (povećanje biomase po ponavljanju)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
MDD (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
MDD: minimalna razlika u odnosu na kontrolne vrijednosti koju je moguće otkriti tijekom testiranja hipoteze; upotrebljava se kao mjera statističke snage
|
IZVOR:
Egeler, Ph., Meller, M., Schallnaß, H. J. i Gilberg, D. (2005.) Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. U suradnji s R. Nagel i B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No. 202 67 429.
C.36. ISPITIVANJE REPRODUKTIVNE TOKSIČNOSTI U TLU ZA GRABEŽLJIVU GRINJU (HYPOASPIS (GEOLAELAPS) ACULEIFER)
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 226 (2008.). Ova je ispitna metoda namijenjena procjeni učinaka kemikalija u tlu na reprodukcijsku uspješnost grabežljive grinje u tlu vrste Hypoaspis (Geolaelaps) aculeifer Canestrini (Acari: Laelapidae) i omogućuje procjenu inhibicije brzine specifičnog rasta populacije (1), (2). Reprodukcijska uspješnost ovdje znači broj mladih jedinki na kraju razdoblja ispitivanja. H. aculeifer predstavlja dodatnu trofičku razinu vrstama za koje su ispitne metode već dostupne. Smatra se da je za potrebe ove ispitne metode dovoljno ispitati reproduktivnu toksičnost bez razlikovanja i kvantifikacije različitih faza reproduktivnog ciklusa. Za kemikalije za koje scenarij izlaganja ne uključuje tlo možda će bolje odgovarati neki drugi pristupi (3).
|
|
2.
|
Hypoaspis (Geolaelaps) aculeifer smatra se relevantnim predstavnikom faune tla, posebno grabežljivih grinja. Rasprostranjena je širom svijeta (5) te se može lako prikupljati i uzgajati u laboratoriju. Sažetak biologije vrste H. aculeifer naveden je u Dodatku 7. Osnovne informacije o ekologiji vrsta grinja i njihovoj uporabi u ekotoksikološkim ispitivanjima mogu se pronaći u literaturi (4), (5), (6), (7), (8), (9), (10), (11), (12).
|
NAČELO ISPITIVANJA
|
3.
|
Odrasle se ženke izlažu nizu koncentracija ispitivane kemikalije umiješane u tlo. Ispitivanje započinje s deset odraslih ženki po ispitnoj posudi. Mužjaci nisu uključeni u ispitivanje jer je iskustvo pokazalo da se u prisutnosti mužjaka ženke pare odmah ili brzo nakon izlaska iz faze deutonimfe. Osim toga, uključivanjem mužjaka ispitivanje bi se produljilo jer bi uključivalo i zahtjevan posao utvrđivanja faza razvoja. Stoga parenje samo po sebi nije obuhvaćeno ispitivanjem. Ženke se uvode u ispitivanje 28 do 35 dana nakon početka razdoblja polaganja jajašaca u procesu sinkronizacije (vidjeti Dodatak 4.), jer se može smatrati da su se ženke tada već parile i da su prošle fazu predovipozicije. Pri temperaturi od 20 °C ispitivanje završava 14. dana nakon uvođenja ženki (dan 0.), a to je razdoblje koje omogućuje da prvi potomci u kontrolama dosegnu fazu deutonimfe (vidjeti Dodatak 4.). Za glavnu mjerenu varijablu utvrđuje se broj mladih jedinki po ispitnoj posudi i, dodatno, broj preživjelih ženki. Reprodukcijska uspješnost grinja izloženih ispitivanoj kemikaliji uspoređuje se s onom u kontrolama kako bi se odredila vrijednost ECx (npr. EC10, EC50) ili najviša koncentracija bez vidljivog učinka (NOEC) (vidjeti dodatak 1. za definicije), ovisno o planu pokusa (vidjeti stavak 29.). U Dodatku 8. naveden je pregled vremenskog rasporeda ispitivanja.
|
INFORMACIJE O ISPITIVANOJ KEMIKALIJI
|
4.
|
Po mogućnosti, trebali bi biti poznati topljivost u vodi, log Kow, koeficijent razdjeljenja između tla i vode te tlak para ispitivane kemikalije. Poželjno je imati i dodatne informacije o sudbini ispitivane kemikalije u tlu, kao što su brzina biotičke i abiotičke razgradnje.
|
|
5.
|
Ova se ispitna metoda može upotrebljavati za kemikalije koje su topljive u vodi, kao i za one koje nisu topljive u vodi. Ovisno o tome, razlikovat će se i način primjene ispitivane kemikalije. Ova ispitna metoda nije primjenljiva na hlapljive kemikalije, tj. kemikalije za koje su Henryjeva konstanta ili koeficijent razdjeljenja između zraka i vode veći od jedan ili kemikalije čiji je tlak para veći od 0,0133 Pa pri 25 °C.
|
VALJANOST ISPITIVANJA
|
6.
|
Da bi se rezultat ispitivanja smatrao valjanim, netretirane kontrole moraju zadovoljavati sljedeće kriterije:
|
—
|
srednja smrtnost odraslih ženki na kraju ispitivanja ne smije biti viša od 20 %,
|
|
—
|
srednji broj mladih jedinki po ponavljanju (s uvedenih deset odraslih ženki) mora biti najmanje 50 na kraju ispitivanja,
|
|
—
|
koeficijent varijacije izračunan za broj mladih grinja po ponavljanju ne smije biti veći od 30 % na kraju glavnog ispitivanja.
|
|
REFERENTNA KEMIKALIJA
|
7.
|
Moraju se odrediti ECx i/ili NOEC referentne kemikalije kako bi se zajamčilo da su uvjeti laboratorijskog ispitivanja odgovarajući te kako bi se potvrdilo da se odgovor ispitnih organizama nije promijenio tijekom vremena. Dimetoat (CAS 60-51-5) prikladna je referentna kemikalija za koju je pokazano da utječe na veličinu populacije (4). Kao alternativna referentna kemikalija može se upotrijebiti borna kiselina (CAS 10043-35-3). S tom je kemikalijom stečeno manje iskustva. Moguća su dva plana pokusa:
|
—
|
Referentna se kemikalija može ispitivati usporedno s određivanjem toksičnosti svake ispitivane kemikalije u jednoj koncentraciji za koju se mora prethodno dokazati, istraživanjem odnosa između doze i odgovora, da za učinak ima smanjenje broja potomaka za > 50 %. U tom slučaju broj ponavljanja mora biti jednak broju ponavljanja u kontrolama (vidjeti stavak 29.).
|
|
—
|
Druga je mogućnost da se referentna kemikalija ispita jedan do dva puta godišnje u okviru ispitivanja odnosa između doze i odgovora. Ovisno o odabranom planu, razlikuju se broj koncentracija i ponavljanja te faktor razmaka (vidjeti stavak 29.), ali je potrebno postići odgovor od 10 do 90 % učinka (faktor razmaka od 1,8). Vrijednost EC50 za dimetoat, izračunana na temelju broja mladih jedinki, mora biti unutar raspona od 3,0 do 7,0 mg a. t. / kg tla (suha masa). Na temelju rezultata koji su do sada dobiveni s bornom kiselinom, vrijednost EC50 izračunana na temelju broja mladih jedinki mora biti unutar raspona od 100 do 500 mg / kg suhe mase tla.
|
|
OPIS ISPITIVANJA
Ispitne posude i oprema
|
8.
|
Potrebno je upotrebljavati ispitne posude promjera 3 do 5 cm (visina tla ≥ · 1,5 cm), izrađene od stakla ili drugog kemijski inertnog materijala te opremljene čvrsto prianjajućim poklopcem. Poželjno je da to budu poklopci na navoj te se u tom slučaju posude mogu dozračiti dvaput tjedno. Alternativno se mogu upotrijebiti poklopci koji omogućuju izravnu razmjenu plinova između supstrata i atmosfere (npr. gaza). Budući da se tijekom ispitivanja mora održavati dovoljno visok sadržaj vlage, ključno je tijekom ispitivanja provjeravati masu svake pokusne posude te prema potrebi nadopunjavati vodu. To može biti posebno važno ako poklopci na navoj nisu na raspolaganju. Ako se upotrebljava neprozirna ispitna posuda, poklopac mora biti izrađen od materijala koji propušta svjetlost (npr. perforirani prozirni poklopac) i istodobno sprječava izlazak grinja. Veličina i vrsta ispitne posude ovise o metodi ekstrakcije (za detalje vidjeti Dodatak 5.). Ako se ekstrakcija toplinskim postupkom primjenjuje izravno na ispitnu posudu, na dno se može staviti rešetka s otvorima odgovarajućih dimenzija (koja ostaje pričvršćena do ekstrakcije), a dubina tla mora biti dovoljna da omogući uspostavu gradijenta temperature i vlage.
|
|
9.
|
Potrebna je uobičajena laboratorijska oprema, a posebno:
|
—
|
po mogućnosti, staklene posude s poklopcima na navoj,
|
|
—
|
četke za prenošenje grinja,
|
|
—
|
prikladne precizne vage,
|
|
—
|
odgovarajuća oprema za kontrolu temperature,
|
|
—
|
odgovarajuća oprema za kontrolu vlažnosti zraka (nije nužna ako su ispitne posude pokrivene poklopcima),
|
|
—
|
inkubator ili manja prostorija s kontroliranom temperaturom,
|
|
—
|
oprema za ekstrakciju (vidjeti Dodatak 5.) (13),
|
|
—
|
viseća panel-svjetiljka s regulatorom svjetlosti,
|
|
—
|
staklenke za sakupljanje ekstrahiranih grinja.
|
|
Priprema umjetnog tla
|
10.
|
Za ovo se ispitivanje upotrebljava umjetno tlo. Umjetno tlo sadržava sljedeće sastojke (sve se vrijednosti temelje na suhoj masi):
|
—
|
5 % sphagnum treseta, sušenog na zraku i fino usitnjenog (prihvatljiva je veličina čestica od 2 ± 1 mm),
|
|
—
|
20 % kaolinitske gline (sadržaj kaolinita po mogućnosti iznad 30 %),
|
|
—
|
oko 74 % industrijskog pijeska sušenog na zraku (ovisno o potrebnoj količini CaCO3), pretežno finog pijeska s više od 50 % čestica veličine između 50 i 200 mikrona. Točna količina pijeska ovisi o količini CaCO3 (vidjeti u nastavku), zajedno bi trebali činiti 75 %,
|
|
—
|
< 1,0 % kalcijeva karbonata (CaCO3, u prahu, analitičkog stupnja čistoće) da bi se dobio pH od 6,0 ± 0,5; količina kalcijeva karbonata koju je potrebno dodati može u prvom redu ovisiti o kvaliteti/prirodi treseta (vidjeti napomenu 1.).
|
Napomena 1.: Količina potrebnog CaCO3 ovisit će o sastojcima supstrata tla i potrebno ju je odrediti mjerenjem pH-vrijednosti poduzoraka tla neposredno prije ispitivanja (14).
Napomena 2.: Sadržaj treseta u ovom umjetnom tlu drukčiji je nego kod drugih metoda ispitivanja na organizmima iz tla kod kojih se u većini slučajeva upotrebljava 10 % treseta (npr. (15)). Međutim, prema EPPO-u (16), tipično poljoprivredno tlo ima najviše 5 % organske tvari pa stoga smanjenje sadržaja treseta odražava smanjenu sorpcijsku sposobnost prirodnog tla da ispitivanu kemikaliju veže na organski ugljik.
Napomena 3.: Prema potrebi, npr. za posebne ispitne svrhe, prirodna tla s neonečišćenih mjesta mogu isto tako poslužiti kao ispitno tlo i/ili supstrat za uzgoj kultura. Međutim, ako se upotrebljava prirodno tlo, potrebno mu je odrediti barem podrijetlo (mjesto uzimanja), pH, teksturu (granulometrijski sastav) i sadržaj organske tvari. Ako postoje, treba navesti vrstu i naziv tla prema klasifikaciji tla i tlo ne smije biti kontaminirano. Ako je ispitivana kemikalija metal ili organometal, za prirodno tlo treba odrediti i kapacitet izmjene kationa (CEC). Posebnu pozornost treba posvetiti tomu da se ispune kriteriji valjanosti jer su referentne informacije o prirodnim tlima obično rijetke.
|
|
11.
|
Suhi sastojci tla temeljito se izmiješaju (npr. u velikoj laboratorijskoj miješalici). Za određivanje pH-vrijednosti upotrebljava se smjesa tla s otopinom 1 M kalijeva klorida (KCl) ili 0,01 M kalcijeva klorida (CaCl2) u omjeru 1: 5 (vidjeti (14) i Dodatak 3.). Ako kiselost tla nije unutar zahtijevanog raspona (vidjeti stavak 10.), može se prilagoditi dodavanjem odgovarajuće količine CaCO3. Ako je tlo previše lužnato, može se prilagoditi tako da se doda više smjese koja sadržava prva tri sastojka opisana u stavku 10., ali da se isključujući CaCO3.
|
|
12.
|
Maksimalni vodni kapacitet (WHC) umjetnog tla određuje se u skladu s postupcima opisanima u Dodatku 2. Dva do sedam dana prije početka ispitivanja suho umjetno tlo vlaži se dodavanjem dovoljno destilirane ili deionizirane vode da se dobije otprilike pola konačnog sadržaja vode, tj. 40 do 60 % maksimalnog vodnog kapaciteta. Sadržaj vlage prilagođava se na 40 do 60 % maksimalnog WHC-a dodavanjem otopine ispitivane kemikalije i/ili dodavanjem destilirane ili deionizirane vode (vidjeti stavke 16. do 18.). Vlažnost tla može se dodatno ugrubo procijeniti laganim gnječenjem rukom: ako je sadržaj vlage ispravan, među prstima bi se trebale pojaviti kapljice vode.
|
|
13.
|
Sadržaj vlage u tlu određuje se na početku i na kraju ispitivanja sušenjem na 105 °C do stalne mase u skladu s normom ISO 11465 (17), a pH-vrijednost tla u skladu s Dodatkom 3. ili normom ISO 10390 (14). Ta se određivanja provode na dodatnim uzorcima bez grinja, uzetima iz kontrolnog tla i iz tla svake ispitne koncentracije. pH-vrijednost tla nije potrebno prilagođavati ako se ispituju kisele ili lužnate kemikalije. Sadržaj vlage potrebno je pratiti tijekom cijelog ispitivanja periodičnim vaganjem posuda (vidjeti stavke 20. i 24.).
|
Odabir i priprema ispitnih životinja
|
14.
|
U ispitivanju se upotrebljava vrsta Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883.). Za početak ispitivanja potrebne su odrasle ženke grinja dobivene iz sinkronizirane skupine. Grinje je potrebno uvesti u ispitivanje otprilike sedam do 14 dana nakon što postanu odrasle, 28 do 35 dana nakon početka polaganja jajašaca u procesu sinkronizacije (vidjeti stavak 3. i Dodatak 4.). Potrebno je evidentirati izvor grinja ili dobavljača te održavanje kulture u laboratoriju. Ako se kultura održava u laboratoriju, preporučuje se identificirati vrstu najmanje jedanput godišnje. List za identifikaciju naveden je u Dodatku 6.
|
Priprema ispitnih koncentracija
|
15.
|
Ispitna se kemikalija umiješa u tlo. Organska otapala za lakše tretiranje tla ispitivanom kemikalijom potrebno je odabrati na temelju njihove niske toksičnosti za grinje te u plan ispitivanja treba uključiti odgovarajuću kontrolu s otapalom (vidjeti stavak 29.).
|
Ispitivana kemikalija topljiva u vodi
|
16.
|
Otopina ispitivane kemikalije priprema se u deioniziranoj vodi u količini dovoljnoj za sva ponavljanja jedne ispitne koncentracije. Preporučuje se upotrijebiti odgovarajuću količinu vode da se postigne potreban sadržaj vlage, tj. 40 do 60 % maksimalnog WHC-a (vidjeti stavak 12.). Svaka se otopina ispitivane kemikalije temeljito izmiješa s jednom šaržom prethodno navlaženog tla prije nego što se uvede u ispitnu posudu.
|
Ispitivana kemikalija netopljiva u vodi
|
17.
|
Ispitivana kemikalija koja nije topljiva u vodi, ali je topljiva u organskim otapalima, može se otopiti u najmanjoj mogućoj količini prikladnog nosača (npr. acetona). Trebalo bi upotrebljavati samo hlapljiva otapala. Ako se upotrebljavaju takvi nosači, sve ispitne koncentracije i kontrola moraju sadržavati istu minimalnu količinu nosača. Nosač se poprska po maloj količini, npr. 10 g, finog kremenog pijeska ili se pomiješa s njom. Ukupan sadržaj pijeska u supstratu potrebno je ispraviti kako bi se uzela u obzir ta količina. Nosač se uklanja isparavanjem u digestoru najmanje jedan sat. Ta se smjesa kremenog pijeska i ispitivane kemikalije dodaje prethodno navlaženom tlu i temeljito se izmiješa uz dodavanje odgovarajuće količine deionizirane vode da se dobije potreban sadržaj vlage. Konačna se smjesa unosi u ispitne posude. Potrebno je napomenuti da neka otapala mogu biti toksična za grinje. Stoga se preporučuje upotrijebiti dodatnu kontrolu s vodom bez nosača ako njegova toksičnost za grinje nije poznata. Ako se na primjeren način dokaže da otapalo (u koncentracijama koje će se primjenjivati) nema učinka, kontrola s vodom može se isključiti.
|
Ispitivana kemikalija koja je slabo topljiva u vodi i u organskim otapalima
|
18.
|
Za kemikalije koje su slabo topljive u vodi i u organskim otapalima, 2,5 g fino usitnjenog kremenog pijeska po ispitnoj posudi (npr. 10 g finog kremenog pijeska za četiri ponavljanja) pomiješa se s potrebnom količinom ispitivane kemikalije da se dobije željena ispitna koncentracija. Ukupan sadržaj pijeska u supstratu potrebno je ispraviti kako bi se uzela u obzir ta količina. Ta se smjesa kremenog pijeska i ispitivane kemikalije dodaje prethodno navlaženom tlu i temeljito se izmiješa nakon dodavanja odgovarajuće količine deionizirane vode da se dobije potreban sadržaj vlage. Konačna se smjesa podijeli na ispitne posude. Navedeni se postupak ponavlja za svaku ispitnu koncentraciju, a pripremi se i odgovarajuća kontrola.
|
POSTUPAK
Ispitne skupine i kontrole
|
19.
|
Za svaku kontrolnu posudu i posudu koja će se tretirati preporučuje se upotrijebiti deset odraslih ženki u 20 g suhe mase umjetnog tla. Ispitne organizme potrebno je dodati u roku od dva sata nakon pripreme konačnog ispitnog supstrata (tj. nakon primjene ispitivane tvari). U posebnim slučajevima (npr. kada se odležavanje smatra odlučujućim faktorom), vrijeme između pripreme konačnog ispitnog supstrata i dodavanja grinja može se produljiti (za detalje o takvom odležavanju vidi (18)). Međutim, u tim se slučajevima mora navesti znanstveno obrazloženje.
|
|
20.
|
Grinje se nahrane nakon dodavanja u tlo te se svaka ispitna posuda izvaže kako bi se dobila početna masa koja će služiti kao referentna vrijednost za praćenje sadržaja vlage u tlu tijekom ispitivanja, kako je opisano u stavku 24. Ispitne se posude potom prekrivaju na način opisan u stavku 8. i stavljaju u ispitnu komoru.
|
|
21.
|
Za svaku metodu primjene ispitivane kemikalije opisanu u stavcima od 15. do 18. pripremaju se odgovarajuće kontrole. Kontrole se pripremaju u skladu s odgovarajućim postupcima, osim što se ne dodaje ispitivana kemikalija. Prema tomu, kontrolama se prema potrebi dodaju organska otapala, kremeni pijesak ili drugi nosači u koncentracijama/količinama jednakima onima u tretmanima. Ako se ispitivana kemikalija dodaje s pomoću otapala ili nekog drugog nosača, potrebno je pripremiti i dodatnu kontrolu bez nosača ili ispitivane kemikalije te je ispitati ako toksičnost nosača nije poznata (vidjeti stavak 17.).
|
Uvjeti ispitivanja
|
22.
|
Ispitna temperatura mora iznositi 20 ± 2 °C. Temperaturu treba bilježiti najmanje jednom dnevno te je prilagoditi prema potrebi. Ispitivanje se provodi uz kontrolirane cikluse izmjene svjetlosti i tame (po mogućnosti 16 sati svjetla i osam sati tame) uz osvjetljenje od 400 do 800 luksa u području ispitnih posuda. Radi usporedivosti, ti su uvjeti jednaki onima koji se primjenjuju u drugim ekotoksikološkim ispitivanjima u tlu (npr. (15)).
|
|
23.
|
Izmjenu plinova potrebno je osigurati dozračivanjem ispitnih posuda najmanje dvaput tjedno ako se upotrebljavaju poklopci na navoj. Ako se za pokrivanje posuda upotrebljava gaza, posebnu pozornost treba posvetiti održavanju vlažnosti tla (vidjeti stavke 8. i 24.).
|
|
24.
|
Sadržaj vode u supstratu tla u ispitnim posudama održava se tijekom cijelog ispitivanja periodičnim vaganjem ispitnih posuda i, ako je potrebno, dodavanjem vode (npr. jednom tjedno). Gubici se prema potrebi nadoknađuju deioniziranom vodom. Tijekom ispitivanja sadržaj vlage ne smije varirati za više od ± 10 % početne vrijednosti.
|
Hranjenje
|
25.
|
Pokazalo se da su grinje sira (Tyrophagus putrescentiae (Schrank, 1781.)) prikladan izvor hrane. Mali skokuni (npr. mlade jedinke Folsomia candida Willem, 1902. ili Onychiurus fimatus (19), (20), enhitreji (npr. Enchytraeus crypticus Westheide i Graefe, 1992.) ili nematode (npr. Turbatrix silusiae de Man, 1913.)) mogu isto tako biti prikladni (21). Preporučuje se pregledati hranu prije nego što se upotrijebi u ispitivanju. Vrsta i količina hrane moraju osigurati dobivanje odgovarajućeg broja mladih jedinki kako bi kriteriji valjanosti bili ispunjeni (stavak 6.). Pri odabiru plijena treba uzeti u obzir način djelovanja ispitivane kemikalije (npr. akaricid može biti toksičan i za grinje koje služe kao hrana; vidjeti stavak 26.).
|
|
26.
|
Hranu treba davati ad libitum (tj. svaki put malu količinu (vrh lopatice)). U tu se svrhu može upotrijebiti i ekshaustor blage usisne moći kakav se predlaže u testu na skokunima ili fina četka. Obično je dovoljno dati hranu na početku ispitivanja te dva do tri puta tjedno. Ako se čini da je ispitivana tvar toksična za plijen, treba razmisliti o učestalijem hranjenju i/ili uporabi alternativnog izvora hrane.
|
Odabir ispitnih koncentracija
|
27.
|
Prethodno znanje o toksičnosti ispitivane kemikalije, npr. iz istraživanja za određivanje raspona, trebalo bi pomoći u odabiru odgovarajućih ispitnih koncentracija. Ako je potrebno, provodi se ispitivanje za određivanje raspona, i to s pet koncentracija ispitivane kemikalije u rasponu od 0,1 do 1 000 mg / kg suhog tla, s najmanje jednim ponavljanjem za tretmane i kontrolu. Ispitivanje za određivanje raspona traje 14 dana, nakon čega se određuje smrtnost odraslih grinja i broj mladih jedinki. Raspon koncentracija za konačno ispitivanje potrebno je po mogućnosti odabrati tako da uključuje koncentracije koje utječu na broj mladih jedinki, ali ne i na preživljavanje majčinske generacije. Međutim, to ponekad nije moguće kod kemikalija koje izazivaju letalne i subletalne učinke pri skoro sličnim koncentracijama. Koncentracija s učinkom (npr. EC50 EC25, EC10) i raspon koncentracija u kojemu je učinak ispitivane kemikalije od interesa moraju biti obuhvaćeni koncentracijama koje su uključene u ispitivanje. Ekstrapolaciju znatno ispod najniže koncentracije koja utječe na ispitne organizme ili iznad najviše ispitane koncentracije trebalo bi provoditi samo u iznimnim slučajevima, koje je u izvješću potrebno detaljno obrazložiti.
|
Plan pokusa
Ispitivanje odnosa između doze i odgovora
|
28.
|
Predlažu se tri plana ispitivanja na temelju preporuka proizašlih iz jednog drugog prstenastog ispitivanja (testa reproduktivne toksičnosti za enhitreje (22)). Opća prikladnost svih tih planova potvrđena je rezultatima validacije na H. aculeifer.
|
|
29.
|
Kod određivanja raspona koncentracija potrebno je voditi računa o sljedećemu:
|
—
|
Za određivanje vrijednosti ECx (npr. EC10, EC50) potrebno je ispitati dvanaest koncentracija. Preporučuju se najmanje dva ponavljanja za svaku ispitnu koncentraciju i šest kontrolnih ponavljanja. Interval između koncentracija može se razlikovati, tj. može iznositi 1,8 ili manje za raspon koncentracija za koji se očekuje da će izazvati učinak te više od 1,8 kod viših i nižih koncentracija.
|
|
—
|
Za određivanje NOEC-a treba ispitati najmanje pet koncentracija u geometrijskom nizu. Preporučuju se četiri ponavljanja za svaku ispitnu koncentraciju plus osam kontrola. Koncentracije se moraju razlikovati za faktor koji nije veći od 2,0.
|
|
—
|
Kombinirani pristup omogućuje određivanje i NOEC-a i vrijednosti ECx. Potrebno je upotrijebiti osam ispitnih koncentracija u geometrijskom nizu. Preporučuju se četiri ponavljanja za svaki tretman plus osam kontrola. Koncentracije se moraju razlikovati za faktor koji nije veći od 1,8.
|
|
Granično ispitivanje
|
30.
|
Ako se u ispitivanju za određivanje raspona ne uoče učinci pri najvećoj koncentraciji (tj. 1 000 mg / kg suhe mase tla), glavni test reproduktivne toksičnosti može se provesti kao granični test s ispitnom koncentracijom od 1 000 mg / kg suhe mase tla. Granično ispitivanje pruža mogućnost da se dokaže da su NOEC ili EC10 za razmnožavanje veći od granične koncentracije, uz minimalan broj grinja upotrijebljenih u ispitivanju. Potrebno je upotrijebiti osam ponavljanja i za tretirano i za kontrolu.
|
Trajanje ispitivanja i mjerenja
|
31.
|
Potrebno je zabilježiti sve uočene razlike između ponašanja i morfologije grinja u kontroli i onih u tretiranim posudama.
|
|
32.
|
Četrnaestog dana preživjele se grinje vade iz tla ekstrakcijom s pomoću topline/svjetlosti ili drugom primjerenom metodom (vidjeti Dodatak 5.). Mlade jedinke (tj. ličinke, protonimfe i deutonimfe) i odrasle jedinke prebrojavaju se odvojeno. Sve odrasle grinje koje nisu pronađene u ovoj fazi potrebno je evidentirati kao uginule, jer se pretpostavlja da su te grinje uginule i da su se raspale prije ocjenjivanja. Učinkovitost ekstrakcije mora se provjeriti jedanput ili dvaput godišnje u kontrolama koje sadržavaju poznat broj odraslih i mladih jedinki. Učinkovitost mora u prosjeku biti iznad 90 % zajedno za sve razvojne faze (vidjeti Dodatak 5.). Broj odraslih i broj mladih jedinki ne prilagođavaju se u ovisnosti o učinkovitosti.
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
33.
|
Informacije o statističkim metodama koje se mogu upotrijebiti za analizu rezultata ispitivanja navedene su u stavcima od 36. do 41. Osim toga, potrebno je služiti se OECD-ovim Dokumentom 54. pod naslovom ‚Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application’ (Trenutačni pristupi u statističkoj analizi podataka o ekotoksičnosti: smjernice za primjenu) (31).
|
|
34.
|
Glavna krajnja točka ispitivanja jest reprodukcijska uspješnost, odnosno broj nastalih mladih jedinki po ispitnoj posudi (u koje je bilo uvedeno deset odraslih ženki). Statistička analiza zahtijeva izračunavanje aritmetičke sredine (X) i varijance (s2) reprodukcijske uspješnosti po tretmanu i po kontroli. X i s2 primjenjuju se za postupke ANOVA kao što su Studentov t-test, Dunnettov test ili Williamsov test, kao i za izračunavanje intervala pouzdanosti od 95 %.
Napomena: Ta je glavna krajnja točka jednaka plodnosti izmjerenoj tako da je broj živih mladih jedinki nastalih tijekom ispitivanja podijeljen s brojem roditeljskih ženki uvedenih na početku ispitivanja.
|
|
35.
|
Broj preživjelih ženki u netretiranim kontrolama glavni je kriterij valjanosti te mora biti dokumentiran. Kao i kod ispitivanja za određivanje raspona, u završnom izvješću treba navesti i sve ostale znakove koji ukazuju na štetno djelovanje.
|
ECx
|
36.
|
Vrijednosti ECx i njihove niže i više 95-postotne granice pouzdanosti za parametar opisan u stavku 34. izračunavaju se odgovarajućim statističkim metodama (npr. probit-analizom, logističkom ili Weibullovom funkcijom, modificiranom Spearman-Karberovom metodom ili jednostavnom interpolacijom). ECx dobiva se tako da se u dobivenu jednadžbu uvrsti vrijednosti koja odgovara x postotku kontrolne srednje vrijednosti. Da bi se izračunao EC50 ili bilo koji drugi ECx, srednje vrijednosti po tretmanu (X) potrebno je podvrgnuti regresijskoj analizi.
|
NOEC/LOEC
|
37.
|
Ako se za određivanje NOEC-a/LOEC-a namjerava primijeniti statistička analiza, potrebni su statistički podaci za svaku posudu (pojedinačne posude smatraju se ponavljanjima). Potrebno je primijeniti odgovarajuće statističke metode (u skladu s OECD-ovim Dokumentom 54. pod naslovom ‚Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application’). Općenito, štetni učinci ispitivane tvari u usporedbi s kontrolom istražuju se jednosmjernim testiranjem hipoteze za p ≤ 0,05. U sljedećim se stavcima navode primjeri.
|
|
38.
|
Normalna distribucija podataka može se ispitati npr. Kolmogorov-Smirnovljevim testom prikladnosti, testom omjera raspona i standardne devijacije (R/s-test) ili Shapiro-Wilkovim testom, (dvosmjerni, p ≤ 0,05). Za ispitivanje homogenosti varijance može se primijeniti Cochranov test, Leveneov test ili Bartlettov test (dvosmjerni, p ≤ 0,05). Ako su ispunjeni uvjeti koje zahtijevaju parametarski testovi (normalnost, homogenost varijance), može se provesti jednosmjerna analiza varijance (ANOVA) i potom testovi višestruke usporedbe. Kako bi se izračunalo postoje li značajne razlike (p ≤ 0,05) između kontrola i različitih koncentracija ispitivane tvari, mogu se primijeniti testovi višestruke usporedbe (npr. Dunnettov t-test) ili testovi trenda postupnim snižavanjem (npr. Williamsov test u slučaju monotonog odnosa između doze i odgovora) (preporučeni se test bira u skladu s OECD-ovim Dokumentom 54. pod naslovom ‚Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application’). Inače, za određivanje NOEC-a i LOEC-a potrebno je primijeniti neparametarske metode (npr. Bonferronijev U-test prema Holmu ili Jonckheere-Terpstrin test trenda).
|
Granično ispitivanje
|
39.
|
Ako je provedeno granično ispitivanje (usporedba kontrole i samo jednog tretmana) te su ispunjeni uvjeti koje zahtijevaju parametarski testovi (normalnost, homogenost), metrički odgovori mogu se ocijeniti Studentovim testom (t-test). Ako ti zahtjevi nisu ispunjeni, može se primijeniti t-test nejednake varijance (Welchov t-test) ili neparametarski test, kao što je Mann-Whitheyjev U-test.
|
|
40.
|
Da bi se odredile značajne razlike između kontrola (kontrola i kontrola s otapalom), ponavljanja svake kontrole mogu se testirati na način opisan za granično ispitivanje. Ako se tim testovima ne otkriju značajne razlike, sva ponavljanja kontrole i kontrole s otapalom mogu se združiti. U protivnom se svi tretmani moraju usporediti s kontrolom s otapalom.
|
Izvješće o ispitivanju
|
41.
|
Izvješće o ispitivanju mora sadržavati barem sljedeće podatke:
|
—
|
Ispitivana kemikalija
|
—
|
identitet ispitivane kemikalije, naziv, šarža, serija i CAS broj, čistoća,
|
|
—
|
fizikalno-kemijska svojstva ispitivane kemikalije (npr. log Kow, topljivost u vodi, tlak pare, Henryjeva konstanta (H) i po mogućnosti informacije o sudbini ispitivane kemikalije u tlu).
|
|
|
—
|
Ispitni organizmi
|
—
|
identifikacija i dobavljač ispitnih organizama, opis uvjeta uzgoja,
|
|
—
|
raspon starosti ispitnih organizama.
|
|
|
—
|
Uvjeti ispitivanja
|
—
|
opis plana i postupka pokusa,
|
|
—
|
detalji o pripremi ispitnog tla; detaljna specifikacija ako je upotrijebljeno prirodno tlo (podrijetlo, povijest, granulometrijski sastav, pH-vrijednost, sadržaj organske tvari te, ako postoji, klasifikacija tla)
|
|
—
|
maksimalan vodni kapacitet tla,
|
|
—
|
opis metode primjene ispitivane kemikalije na tlo,
|
|
—
|
pojedinosti o pomoćnim kemikalijama koje su upotrijebljene za primjenu ispitivane kemikalije,
|
|
—
|
veličina ispitnih posuda i suha masa ispitnog tla po posudi,
|
|
—
|
uvjeti ispitivanja: intenzitet svjetlosti, trajanje ciklusa svjetla i tame, temperatura,
|
|
—
|
opis režima hranjenja, vrsta i količina hrane upotrijebljene u ispitivanju, datumi hranjenja,
|
|
—
|
pH-vrijednost i sadržaj vode u tlu na početku i tijekom ispitivanja (u kontroli i svakom tretmanu)
|
|
—
|
detaljan opis ekstrakcijske metode i ekstrakcijska učinkovitost.
|
|
|
—
|
Rezultati ispitivanja
|
—
|
broj mladih jedinki utvrđen u svakoj ispitnoj posudi na kraju ispitivanja,
|
|
—
|
broj odraslih ženki i smrtnost odraslih jedinki ( %) u svakoj ispitnoj posudi na kraju ispitivanja,
|
|
—
|
opis očitih simptoma ili jasnih promjena ponašanja,
|
|
—
|
rezultati dobiveni s referentnom ispitivanom kemikalijom,
|
|
—
|
sažeti statistički podaci (ECx i/ili NOEC ), uključujući 95-postotne granice pouzdanosti i opis metode izračuna,
|
|
—
|
grafički prikaz odnosa između koncentracije i odgovora,
|
|
—
|
odstupanja od postupaka opisanih u ovoj ispitnoj metodi i sve neuobičajene pojave tijekom ispitivanja.
|
|
|
LITERATURA
|
(1)
|
Casanueva, M. E. (1993.) Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21 – 46.
|
|
(2)
|
Tenorio, J. M. (1982.) Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259 – 274.
|
|
(3)
|
Bakker, F. M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. i van Stratum, P. (2003.) A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS – Journal of Soils and Sediments 3, 73 – 77.
|
|
(4)
|
Karg, W. (1993.) Die freilebenden Gamasina (Gamasides), Raubmilben. 2. izdanje U: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, str. 523.
|
|
(5)
|
Ruf, A. (1991.) Do females eat males?: Laboratory studies on the population development of Hypoaspis aculeifer (Acari: Parasitiformes). U: F. Dusbabek i V. Bukva (ur.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487 – 492
|
|
(6)
|
Ruf, A. (1995.) Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883.) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: str. 241. – 249.
|
|
(7)
|
Ruf, A. (1996.) Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994., Columbus, Ohio: str. 621. – 628.
|
|
(8)
|
Krogh, P. H. i Axelsen, J. A. (1998.) Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. U: Lokke, H. i van Gestel, C. A. M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, str. 239. – 251.
|
|
(9)
|
Løkke, H., Janssen, C. R., Lanno, R. P., Römbke, J., Rundgren, S. i van Straalen, N. M. (2002.) Soil Toxicity Tests – Invertebrates. U: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P. W., van Straalen, N. M. i Tarazona, J. V. (ur.). SETAC Press, Pensacola, SAD. str. 128.
|
|
(10)
|
Schlosser, H.-J. i Riepert, F. (1991./1992.) Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883. (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395 – 433.
|
|
(11)
|
Schlosser, H.-J. i Riepert, F. (1992.) Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N. F. 34, 413 – 433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K. i Krogh, P. H. (2005.) Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154 – 7157.
|
|
(13)
|
Petersen, H. (1978.) Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95 – 122.
|
|
(14)
|
ISO (International Organization for Standardization) (1994.) Soil Quality – Determination of pH, No. 10390. ISO, Ženeva.
|
|
(15)
|
Poglavlje C.8. ovog Priloga – Toksičnost za gujavice.
|
|
(16)
|
EPPO (2003.): EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195 – 209.
|
|
(17)
|
ISO (International Organization for Standardization) (1993.) Soil Quality – Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Ženeva.
|
|
(18)
|
Fairbrother, A., Glazebrock, P. W., van Straalen, N. M. i Tarazona, J. V. 2002. Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, SAD.
|
|
(19)
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges.allg..angew. Ent. 3:122-125.
|
|
(20)
|
Schlosser, H. J. i Riepert, F. (1992.) Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool. Beitr. N. F. 34(3):395-433.
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. i Krogh, P. H. (2007.) Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130-135.
|
|
(22)
|
Poglavlje C.32 ovoga Priloga – Test reproduktivne toksičnosti na erhitrejama.
|
|
(23)
|
ISO (International Organization for Standardization) (1994.) Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Ženeva.
|
|
(24)
|
Southwood, T. R. E. (1991.) Ecological methods. With particular reference to the study of insect populations. (drugo izdanje). Chapman & Hall, London, str. 524.
|
|
(25)
|
Dunger, W. i Fiedler, H. J. (1997.) Methoden der Bodenbiologie (drugo izdanje). G. Fischer, Jena, str. 539.
|
|
(26)
|
Lesna, I. i Sabelis, M. W. (1999.) Diet-dependent female choice for males with ‚good genes’ in a soil predatory mite. Nature 401, 581 – 583.
|
|
(27)
|
Ruf, A. (1989.) Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883.) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103 – 107.
|
|
(28)
|
Ruf, A. (1993.) Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883.) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
(29)
|
Ignatowicz, S. (1974.) Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11 – 59.
|
|
(30)
|
Kevan, D. K. McE. i Sharma, G. D. (1964.) Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647-658.
|
|
(31)
|
OECD (2006.c) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No. 54. ENV/JM/MONO(2006)18
|
Dodatak 1.
Definicije
Za potrebe ove ispitne metode primjenjuju se sljedeće definicije (u ovom se ispitivanju sve koncentracije s učinkom izražavaju kao masa ispitivane kemikalije po suhoj masi ispitnog tla):
|
|
Kemikalija je tvar ili smjesa.
|
|
|
NOEC (najviša koncentracija bez vidljivog učinka) je koncentracija ispitivane kemikalije kod koje nije uočen nikakav učinak. Kod ovog ispitivanja koncentracija koja odgovara NOEC-u nema statistički značajan učinak (p < 0,05) unutar određenog razdoblja izloženosti u usporedbi s kontrolom.
|
|
|
LOEC (najniža koncentracija s vidljivim učinkom) je najniža koncentracija ispitivane kemikalije koja ima statistički značajan učinak (p < 0,05) unutar određenog razdoblja izloženosti u usporedbi s kontrolom.
|
|
|
ECx
(koncentracija s učinkom od x %) je koncentracija koja izaziva x-postotni učinak na ispitne organizme u određenom razdoblju izloženosti u usporedbi s kontrolom. Na primjer, EC50 je koncentracija za koju se procjenjuje da proizvodi učinak na ispitivani parametar kod 50 % izložene populacije u definiranom razdoblju izloženosti.
|
|
|
Ispitivana kemikalija je svaka tvar ili smjesa koja se ispituje ovom ispitnom metodom.
|
Dodatak 2.
Određivanje maksimalnog vodnog kapaciteta tla
Sljedeća metoda određivanja maksimalnog vodnog kapaciteta tla smatra se primjerenom. Opisana je u Prilogu C normi ISO DIS 11268-2 (Kakvoća tla – Učinci onečišćivača na gujavice (Eisenia fetida). Dio 2.: Određivanje učinaka na razmnožavanje (23))
Odgovarajućom napravom (npr. svrdlom s epruvetom) uzme se određena količina (npr. 5 g) tla koje služi kao ispitni supstrat. Dno epruvete prekrije se komadom filtarskog papira, epruveta se napuni vodom te postavi na stalak u vodenoj kupelji. Epruvetu je potrebno postupno uranjati sve dok razina vode ne bude iznad gornjeg dijela tla. Potom je treba ostaviti u vodi oko tri sata. Budući da tlo ne može zadržati svu vodu koju apsorbira kapilarama, uzorak tla potrebno je ostaviti dva sata da se ocijedi tako što se epruveta postavi na podlogu od vrlo mokrog, fino usitnjenog kremenog pijeska u zatvorenoj posudi (da se spriječi sušenje). Uzorak je potom potrebno izvagati i osušiti do stalne mase na 105 °C. Vodni kapacitet (WHC) potom se može izračunati kako slijedi:
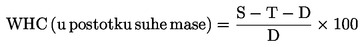
gdje je:
S= supstrat zasićen vodom + masa epruvete + masa filtarskog papira,
T= tara (masa epruvete + masa filtarskog papira),
D= suha masa supstrata.
Dodatak 3.
Određivanje pH-vrijednosti tla
Sljedeća metoda za određivanje pH-vrijednosti tla temelji se na opisu navedenom u normi ISO DIS 10390: Kakvoća tla – Određivanje pH-vrijednosti (16).
Definirana količina tla suši se na sobnoj temperaturi najmanje 12 sati. Potom se tlo (najmanje 5 grama) suspendira u pet puta većoj količini 1 M otopine kalijeva klorida (KCl) analitičkog stupnja čistoće ili 0,01 M otopine kalcijeva klorida (CaCl2) analitičkog stupnja čistoće. Suspenzija se potom temeljito protresa pet minuta te se ostavi da se taloži najmanje dva sata, ali ne dulje od 24 sata. Potom se pH-vrijednost tekuće faze izmjeri pH-metrom koji se prije svakog mjerenja kalibrira s pomoću odgovarajućeg niza puferskih otopina (npr. pH 4,0 i 7,0).
Dodatak 4.
Uzgoj Hypoaspis (Geolaelaps ) aculeifer i grinja za hranu te sinkronizacija kulture
Uzgoj Hypoaspis (Geolaelaps) aculeifer:
Kulture se mogu održavati u plastičnim posudama ili staklenkama napunjenima smjesom modelarskog gipsa i drvenog ugljena u prahu (9: 1). Prema potrebi, gips se može održavati mokrim dodavanjem nekoliko kapi destilirane ili deionizirane. Optimalna temperatura uzgoja iznosi 20 ± 2 °C, a režim izmjene svjetla i tame nije relevantan za ovu vrstu. Plijen mogu biti grinje Typrophagus putrescentiae ili Caloglyphus sp. (grinjama za hranu potrebno je rukovati pažljivo jer mogu izazvati alergije kod ljudi), ali i nematode, enhitreje i skokuni mogu biti prikladan plijen. Potrebno je evidentirati njihov izvor. Razvoj populacije može se započeti s jednom ženkom, jer se mužjaci razvijaju u neoplođenim jajašcima. Generacije se u velikoj mjeri preklapaju. Ženka može živjeti najmanje 100 dana i tijekom života može položiti oko 100 jajašaca. Maksimalna ovipozicija postiže se između 10. i 40. dana (u odrasloj dobi) i iznosi do 2,2 jaja/ženka– 1/dan– 1. Vrijeme razvoja od jajašca do odrasle ženke iznosi oko 20 dana na 20 °C. Potrebno je unaprijed uzgojiti i održavati više od jedne kulture.
Uzgoj Typrophagus putrescentiae:
Grinje se drže u staklenoj posudi napunjenoj pivskim kvascem u prahu, koja se stavlja u plastičnu kantu napunjenu otopinom KNO3 kako bi se spriječio bijeg životinja. Grinje za hranu stavljaju se na prah. Nakon toga lopaticom se pažljivo pomiješaju s prahom (koji se mora zamijeniti dvaput tjedno).
Sinkronizacija kulture:
Jedinke koje se upotrebljavaju u ispitivanju moraju biti slične dobi (otprilike sedam dana nakon što su postale odrasle). Pri temperaturi uzgoja od 20 °C to se postiže na sljedeći način:
Ženke se prenesu u čistu uzgojnu posudu u koju se doda dovoljno hrane.
|
—
|
Ostavi ih se dva do tri dana da polažu jajašca i potom se uklone.
|
|
—
|
Odrasle se ženke uzimaju za ispitivanje između 28. i 35. dana nakon što su odrasle ženke bile stavljene u čiste uzgojne posude.
|
Odrasle je ženke lako razlikovati od mužjaka i životinja u drugim razvojnim fazama po tome što su veće, napuhnutog su oblika i leđni im je štit smeđe boje (mužjaci su tanji i plosnatog su oblika), dok su nedorasle jedinke bijele do krem boje. Pri temperaturi od 20 °C grinje se razvijaju otprilike prema obrascu opisanom u nastavku (slika): jaja se razvijaju pet dana, ličinka dva dana, protonimfa pet dana, deutonimfa sedam dana, a razdoblje je predovipozicije ženki dva dana. Grinje su nakon toga odrasle.
Slika
Razvoj Hypoaspis (Geolaelaps) aculeifer na 20 °C. (uklanjanje = ženke koje se upotrebljavaju za ispitivanje)

Odrasle ispitne životinje uklanjaju se iz sinkronizirane kulture i stavljaju u ispitne posude između 28. i 35. dana nakon što su roditeljske ženke počele polagati jajašca (tj. sedam do 14 dana nakon što su postale odrasle). Time se osigurava da su ispitne životinje već prošle kroz razdoblje predovipozicije i parile su se s mužjacima koji su isto tako prisutni u posudi za uzgoj. Promatranjima laboratorijskih kultura došlo se do zaključka da se u prisutnosti mužjaka ženke pare odmah ili brzo nakon što postanu odrasle (Ruf, Vaninnen, osobna opažanja). Razdoblje od sedam dana odabrano je radi lakšeg uključivanja u laboratorijsku rutinu i ublažavanja pojedinačnih razlika u razviju grinja. Ovipoziciju potrebno je započeti s barem onoliko ženki koliko će ih na kraju biti potrebno za ispitivanje (ako je za ispitivanje potrebno primjerice 400 ženki, najmanje 400 ženki potrebno je ostaviti da polažu jajašca dva do tri dana). Kao polazište za sinkroniziranu populaciju potrebno je najmanje 1 200 jajašaca (omjer spolova oko 0,5, smrtnost oko 0,2). Kako bi se spriječio kanibalizam, poželjno je da u jednoj posudi ne bude više od 20 do 30 ženki koje su u fazi ovipozicije.
Dodatak 5.
Metode ekstrakcije
Za mikroartropode ekstrakcija toplinom primjerena je metoda odvajanja jedinki od tla/supstrata (vidi sliku u nastavku). Metoda se temelji na aktivnosti organizama pa će tako samo pokretne jedinke imati priliku biti zabilježene. Načelo ekstrakcije toplinom jest da se organizmima u uzorku postupno pogoršavaju uvjeti i time ih se potakne da napuste supstrat i upadnu u tekućinu za fiksiranje (npr. etanol). Ključne su točke trajanje ekstrakcije i stupnjevita promjena uvjeta koji će prvo biti dobri, potom osrednji, a na kraju loši za organizme. Ekstrakcija za ekotoksikološka ispitivanja mora trajati što je moguće kraće jer će svaki rast populacije tijekom ekstrakcije dovesti do pogrešnih rezultata. S druge strane, temperatura i vlaga u uzorku moraju uvijek biti u rasponu koji omogućuje kretanje grinja. Grijanje uzorka tla dovodi do isušivanja supstrata. Ako do isušivanja dođe prebrzo, i neke bi se grinje mogle isušiti prije nego što uspiju pobjeći.
Stoga se predlaže sljedeći postupak (24) (25):
|
|
Oprema: Tullgrenov lijevak ili usporedive metode kao što je npr. McFadyenova metoda (grijanje odozgo, uzorak se postavlja na lijevak)
|
|
|
Režim grijanja: 25 °C tijekom 12 sati, 35 °C tijekom 12 sati, 45 °C tijekom 24 sata (ukupno 48 sati). Temperaturu je potrebno mjeriti u supstratu.
|
|
|
Tekućina za fiksiranje: 70-postotni etanol
|
|
|
Detaljan opis: Uzmite staklenu bočicu koja je upotrijebljena za ispitivanje. Uklonite poklopac i otvor zatvorite bočicu komadom mrežice ili tkanine. Tkanina mora imati rupice veličine 1,0 do 1,5 mm. Učvrstite tkaninu gumicom. Pažljivo okrenite bočicu naopako i postavite je u napravu za ekstrakciju. Tkanina sprječava kapanje supstrata u tekućinu za fiksiranje, ali omogućuje grinjama da napuste uzorak. Nakon što postavite sve bočice, započnite režim grijanja. Ekstrakciju završite nakon 48 sati. Uklonite bočice za fiksiranje i prebrojite grinje s pomoću disekcijskog mikroskopa.
|
Ekstrakcijska učinkovitost odabrane metode mora se dokazati jednom ili dvaput godišnje uporabom posuda koje sadržavaju poznat broj mladih i odraslih grinja u netretiranom ispitnom supstratu. Učinkovitost mora u prosjeku biti iznad 90 % zajedno za sve razvojne faze.
Ekstrakcijska naprava tipa Tullgren

Kako pripremiti ispitnu bočicu nakon završenog ispitivanja, a prije ekstrakcije.

Dodatak 6.
Identifikacija Hypoaspis (Geolaelaps ) aculeifer
|
Podrazred/red/podred:
|
|
Porodica:
|
|
Rod/podrod/vrsta:
|
|
Acari/Parasitiformes/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Autor i datum:
|
dr. sc. F. Faraji, (MITOX), 23. siječnja 2007.
|
|
Upotrijebljena literatura:
|
Karg, W. (1993.) Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, 2. revidirano izdanje: 1 – 523.
Hughes, A. M. (1976.) The mites of stored food and houses. Ministry of Agriculture, Fisheries and Food, Technical Bulletin 9: str. 400.
Krantz, G. W. (1978.) A manual of Acarology. Oregon State University Book Stores, Inc., str. 509.
|
|
Odredbene značajke:
|
Tektum sa zaobljenim nazubljenim rubom; hipostomske brazde s više od šest zubića; kaudalne dorzalne dlake Z4 nisu previše duge; dorzalne dlake čekinjaste; genitalni štit normalan, ne previše povećan i ne doseže do analnog štita; stražnja polovica dorzalnog štita bez neparnih dlaka; noge II. i IV. s nekoliko debljih makrodlaka; dorzalne dlake Z5 oko dva puta dulje od J5; fiksni članak kliješta (helicera) s 12 do 14 zubi i pokretni članak s dva zuba; Idiosoma duga 520 do 685 μm.
Grinje Hypoaspis miles upotrebljavaju se i za biološko suzbijanje štetnika te ih se može brkati s grinjama H. aculeifer. Razlikuju se u sljedećem:
H. miles pripada podrodu Cosmolaelaps i dorzalne su joj dlake u obliku noža, dok H. aculeifer pripada podrodu Geolaelaps i ima čekinjaste dorzalne dlake.
|
Dodatak 7.
Osnovne informacije o biologiji grinja Hypoaspis (Geolaelaps) aculeifer
Grinje Hypoaspis aculeifer pripadaju porodici Lealapidae, redu Acari (grinje), razredu Arachnida, koljenu Arthropoda. Žive u svim vrstama tla i hrane se drugim grinjama, nematodama, enhitrejama i skokunima (26). U nedostatku hrane prelaze na kanibalizam (27). Tijelo grabežljive grinje segmentirano je na idiosomu i gnatosomu. Idiosoma nije jasno podijeljena na prosomu (glavu) i opistosomu (stražnje tijelo). Gnatosoma (vratni štit) sadržava dijelove tijela koji služe za hranjenje, kao što su pipala i kliješta. Kliješta se granaju u tri dijela i na njima se nalaze zubi različitih oblika. Osim što ih upotrebljavaju za uzimanje hrane, mužjaci se koriste kliještima uglavnom kako bi na ženke prenijeli spermatofore. Dorzalni štit prekriva skoro čitavu idiosomu. Kod ženki velik dio idiosome zauzimaju reproduktivni organi, koji se posebno ističu nedugo prije polaganja jajašaca. Ventralno se nalaze dva štita, sternalni i genitalni. Na svim se nogama nalaze oštre dlake i bodlje. Oštre dlake služe im za pričvršćivanje dok se kreću kroz tlo ili po površini tla. Prvi par nogu uglavnom služi kao osjetilo. Drugi par nogu ne služi samo za kretanje, nego i za hvatanje plijena. Bodlje na četvrtom paru nogu mogu služiti za zaštitu i kao ‚motor za kretanje’ (28). Mužjaci su dugi 0,55 do 0,65 mm i teški 10 do 15 μg. Ženke su duge 0,8 do 0,9 mm i teške 50 do 60 μg (8) (28) (Slika 1.).
Slika 1.
Ženka, mužjak, protonimfa i ličinka grinje H. aculeifer.

Pri temperaturi od 23 °C grinje postaju spolno zrele nakon 16 dana (ženke) odnosno18 dana (mužjaci) (6). Ženke prihvaćaju spermije preko spolnog otvora (solenostoma), odakle se prenose u jajnik. U jajniku spermiji dozrijevaju i odlažu se. Do oplodnje dolazi tek nakon što spermiji dozriju u jajniku. Ženke polažu oplođena ili neoplođena jaja u hrpicama ili odvojeno, najčešće u pukotine ili rupe. Ženke koje su kopulirale mogu nositi mlade obaju spolova, ali iz jaja ženki koje nisu kopulirale mogu se razviti samo jedinke muškog spola. Tijekom razvoja do odrasle dobi grinje prolaze kroz četiri razvojne faze (jaje – ličinka, ličinka – protonimfa, protonimfa – deutonimfa, deutonimfa – odrasla grinja).
Jaje je mliječno bijele boje, staklasto prozirno i eliptičnog oblika, dugo je oko 0,37 mm te ima čvrstu ljusku. Prema (8), ličinke su velike između 0,42 i 0,45 mm. Imaju samo tri para nogu. U području glave razvijena su pipala i kliješta. Kliješta, koja imaju tek nekoliko malih zubića, služe za izlijeganje iz jajeta. Nakon prvog presvlačenja, jedan do dva dana nakon izlijeganja, razvijaju se protonimfe. One su također bijele, velike su 0,45 do 0,62 mm (8) te imaju četiri para nogu. Na kliještima su prisutni kompletni zubi. Počevši od ove faze grinje počinju tražiti hranu. U tu svrhu kliještima probijaju kutikulu plijena i u plijen ispuštaju izlučevinu koja omogućuje izvanželučanu probavu. Grinja potom može usisati takvu kašastu hranu. Kliješta mogu služiti i za trganje većih čestica iz grumenaste hrane (28). Nakon još jednog presvlačenja razvijaju se deutonimfe. Velike su 0,60 do 0,80 mm (8) i žute do svjetlosmeđe boje. Počevši od te faze mogu se odvojiti na ženke i mužjake. Nakon još jednog presvlačenja, tijekom kojeg su životinje neaktivne i razvija im se smeđi štiti (otprilike nakon 14 dana), grinje postaju odrasle (28) (29) (30). Životni vijek im je između 48 i 100 dana na 25 °C (27).
Dodatak 8.
Sažeti prikaz i vremenski raspored glavnih aktivnosti koje je potrebno poduzeti pri provođenju ispitivanja na vrsti Hypoaspis
|
Vrijeme (dani)
početak ispitivanja = dan 0.
|
Aktivnost/zadaća
|
|
Dan –35.
do –28.
|
Prenijeti ženke iz radne kulture u čiste posude kako bi se započelo sa sinkronizacijom
Dva dana poslije: uklanjanje ženki
Dva ili tri puta tjedno: dodati dovoljnu količinu hrane
|
|
Dan –5. (+/– 2)
|
Pripremiti umjetno tlo
|
|
Dan –4. (+/– 2)
|
Odrediti WHC umjetnog tla
Sušiti preko noći
Sljedeći dan: izvagati uzorke te izračunati WHC
|
|
Dan –4. (+/– 2)
|
Prethodno navlažiti umjetno tlo da se postigne 20 do 30 % WHC-a
|
|
Dan 0.
|
Započeti ispitivanje: dodati ispitivanu kemikaliju u umjetno tlo
U svaku posudu unijeti deset ženki
Izvagati svaku posudu
Pripremiti abiotičke kontrole za mjerenje sadržaja vlage i pH-vrijednosti, dva ponavljanja za svaki tretman
Preko noći sušiti kontrole za mjerenje vlage
Sljedeći dan: izvagati kontrole za mjerenje vlage
Sljedeći dan: izmjeriti pH osušenih abiotičkih kontrola
|
|
Dan 3., 6., 9. i 12. (otprilike)
|
U svaku posudu unijeti dovoljnu količinu organizama koji će služiti kao plijen
Izvagati svaku posudu i prema potrebi dodati isparenu vodu
|
|
Dan 14.
|
Završiti ispitivanje, započeti ekstrakciju iz svih posuda i pripremiti kontrole za određivanje učinkovitosti ekstrakcije
Preko noći sušiti kontrole za mjerenje sadržaja vode
Sljedeći dan: izvagati kontrole za mjerenje sadržaja vode
Sljedeći dan: izmjeriti pH osušenih kontrola
|
|
Dan 16.
|
Završiti ekstrakciju
|
|
Dan 16.+
|
Zabilježiti broj odraslih i mladih jedinki u ekstrahiranom materijalu
Upisati rezultate u tablične obrasce
Upisati ispitni postupak u obrasce protokola ispitivanja
|
C.37. 21-DNEVNI TEST NA RIBAMA: KRATKOROČNI TEST PROBIRA NA ESTROGENSKU I ANDROGENSKU AKTIVNOST I INHIBICIJU AROMATAZE
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a TG 230 (2009.). Potreba za razvojem i potvrdom testa na ribama s pomoću kojeg je moguće otkriti određene endokrino aktivne kemikalije pojavila se zbog zabrinutosti da razine kemikalija u okolišu mogu štetno utjecati na ljude i životinje zbog interakcije tih kemikalija i endokrinog sustava. OECD je 1998. pokrenuo aktivnost visokog prioriteta radi revizije postojećih smjernica te razvoja novih smjernica za probir i ispitivanje potencijalnih endokrinih disruptora. Jedan element te aktivnosti bio je razvoj Smjernice za test probira kemikalija koje djeluju na endokrini sustav riba. 21-dnevni test probira endokrino aktivnih tvari na ribama podvrgnut je opsežnom programu validacije koji je uključivao međulaboratorijske studije s odabranim kemikalijama za dokazivanje relevantnosti i pouzdanosti testa u svrhu otkrivanja kemikalija inhibitora aromataze i estrogena (1, 2, 3, 4, 5) u trima ispitivanima ribljim vrstama (debeloglava gavčica Pimephales promelas, medaka Oryzias latipes i zebrica Danio rerio). Otkrivanje androgenske aktivnosti moguće je u debeloglave gavčice i medake, ali ne i u zebrice. Ovom ispitnom metodom nije moguće otkrivanje antiandrogenskih kemikalija. Vijeće stručnjaka koje su imenovali nacionalni koordinatori programa Smjernice za ispitivanje (6) stručno je ocijenilo validaciju. Test nije namijenjen za identifikaciju određenih mehanizama hormonalnih poremećaja jer pokusne životinje imaju netaknutu os hipotalamus-hipofiza-gonade (HPG) koja može reagirati na kemikalije koje na nju utječu na različitim razinama. Kratkoročni reprodukcijski test na ribama (OECD-ova smjernica za ispitivanje TG 229) uključuje plodnost te, ovisno o slučaju, histopatologiju gonada debeloglave gavčice te sve krajnje učinke uključene u tu ispitnu metodu. OECD-ovom smjernicom za ispitivanje TG 229 predviđen je probir kemikalija koje različitim mehanizmima, uključujući endokrine modalitete, utječu na reprodukciju. To je potrebno uzeti u obzir prije odabira najprimjerenije ispitne metode.
|
|
2.
|
Ovom se ispitnom metodom opisuje test probira in vivo pri čemu su spolno zreli mužjak i ženka u mrijestu zajedno izloženi kemikaliji tijekom ograničenog dijela životnog ciklusa (21 dan). Po završetku 21-dnevnog razdoblja izlaganja, ovisno o upotrijebljenoj vrsti, u mužjakâ i ženki mjeri se jedan ili dva krajnja učinka biomarkera kao pokazatelji estrogenske ili androgenske aktivnosti i inhibicije aromataze ispitivane kemikalije, a ti su krajnji učinci vitelogenin i sekundarna spolna obilježja. Vitelogenin se mjeri u debeloglave gavčice, medake i zebrice, a sekundarna spolna obilježja mjere se samo u debeloglave gavčice i medake.
|
|
3.
|
Ovaj biotest služi kao test probira in vivo za određene endokrine načine djelovanja, a njegova primjena trebala bi se promatrati u kontekstu ‚OECD-ova konceptualnog okvira za ispitivanje i procjenu endokrino disruptivnih kemikalija’ (28).
|
POČETNA RAZMATRANJA I OGRANIČENJA
|
4.
|
Vitelogenin u pravilu nastaje u jetri ženki kralježnjaka koje liježu jaja kao reakcija na cirkuliranje endogenog estrogena. Riječ je o prekursoru proteina u žumanjku koji, nakon nastanka u jetri, putuje krvotokom do jajnika, gdje ga preuzimaju i modificiraju jajašca u razvoju. Vitelogenin je gotovo nemoguće otkriti u plazmi nezrelih ženki i mužjaka riba zbog manjka estrogena u optoku; međutim, jetra je sposobna za sintezu i izlučivanje vitelogenina kao reakciju na egzogenu estrogensku simulaciju.
|
|
5.
|
Mjerenje vitelogenina namijenjeno je za otkrivanje kemikalija s različitim estrogenskim načinima djelovanja. Otkrivanje estrogenskih kemikalija moguće je mjerenjem indukcije vitelogenina u mužjaka riba te je opširno dokumentirano u stručno recenziranoj znanstvenoj literaturi (primjerice (7)). Indukcija vitelogenina dokazana je i nakon izlaganja aromatizirajućim androgenima (8, 9). Pad razine estrogena u optoku ženki, primjerice inhibicijom aromataze kojom se endogeni androgen pretvara u prirodni estrogen 17β-estradiol, uzrok je pada razine vitelogenina koji se upotrebljava za otkrivanje kemikalija sa svojstvima inhibicije aromataze (10, 11). Biološka važnost reakcije vitelogenina nakon estrogenske inhibicije / inhibicije aromataze utvrđena je i opširno dokumentirana. Međutim, moguće je da na nastajanje vitelogenina u ženki utječu i opća toksičnost te neendokrino toksični načini djelovanja, primjerice hepatotoksičnost.
|
|
6.
|
Za uobičajenu je upotrebu razvijeno i standardizirano nekoliko metoda mjerenja. Riječ je o metodama imunoenzimskog testa (engl. Enzyme-Linked Immunosorbent Assay, ELISA) specifičnima za pojedinu vrstu, kod kojih se imunokemija upotrebljava za kvantifikaciju vitelogenina nastalog u malim uzorcima krvi ili jetre prikupljenima od pojedinačnih riba (12, 13, 14, 15, 16, 17, 18). U svrhu mjerenja vitelogenina uzeti su uzorci krvi debeloglave gavčice i zebrice ili uzorci homogenata s glave/repa te uzorci jetre medake. U medake postoji dobra korelacija između vitelogenina izmjerenog u krvi i u jetri (19). U Dodatku 6. navedeni su preporučeni postupci za uzimanje uzoraka za analizu vitelogenina. Kompleti za mjerenje vitelogenina široko su dostupni, a trebali bi se temeljiti na potvrđenoj metodi ELISA specifičnoj za pojedinu vrstu.
|
|
7.
|
Sekundarna spolna obilježja mužjaka određenih ribljih vrsta izvana su vidljiva, može ih se kvantificirati te reagiraju na razine endogenih androgena u optoku; to je tako u slučaju debeloglave gavčice i medake, ali ne i zebrice, koja nema sekundarna spolna obilježja koja se mogu kvantificirati. Ženke zadržavaju sposobnost razvoja muških sekundarnih spolnih obilježja u slučaju izlaganja androgenim kemikalijama u vodi. U stručnoj literaturi dostupno je nekoliko studija u kojima je dokumentirana ta vrsta reakcije u debeloglave gavčice (20) i medake (21). Smanjenje sekundarnih spolnih obilježja u mužjaka potrebno je oprezno tumačiti zbog slabe statističke snage te je tumačenje potrebno temeljiti na stručnoj procjeni i težini dokaza. Postoje ograničenja u upotrebi zebrica u ovom testu zbog izostanka mjerljivih sekundarnih spolnih obilježja koja reagiraju na kemikalije s androgenim djelovanjem.
|
|
8.
|
U debeloglave gavčice glavni je pokazatelj egzogene androgene izloženosti broj izraslina na ustima spolno zrele ženke ribe. U medake broj papilarnih procesa glavni je pokazatelj egzogene izloženosti androgenim kemikalijama ženki riba. U dodacima 5.A i 5.B navedeni su preporučeni postupci za procjenu spolnih obilježja u debeloglave gavčice, odnosno medake.
|
|
9.
|
Definicije upotrijebljene u ovoj ispitnoj metodi navedene su u Dodatku 1.
|
NAČELO ISPITIVANJA
|
10.
|
Tijekom testa mužjaci i ženke riba u reproduktivnom statusu zajednički se izlažu u ispitnim posudama. Zahvaljujući njihovu odraslom i reproduktivnom statusu moguće je jasno razlikovanje spolova, a time i analiza svakog krajnjeg učinka koja se odnosi na spol te se osigurava njihova osjetljivost na egzogene kemikalije. Po završetku ispitivanja spol se potvrđuje makroskopskim pregledom gonada nakon otvaranja trbuha s pomoću škara. U Dodatku 2. naveden je pregled relevantnih uvjeta biotesta. Test u pravilu počinje uzimanjem uzorka riba iz populacije u mrijestu, a upotreba starih životinja nije dopuštena. Smjernice o starosti riba i reproduktivnom statusu navedene su u odjeljku o odabiru riba. Test se provodi s pomoću triju koncentracija izloženosti kemikaliji i kontrolnoj skupini s vodom i, po potrebi, kontrolnoj skupini s otapalom. Upotrebljavaju se dvije posude po tretiranoj skupini ili replike (u svakoj se posudi nalazi pet mužjaka i pet ženki) u slučaju medaka i zebrica, a u slučaju debeloglave gavčice četiri posude ili replike (u svakoj se posudi nalaze dva mužjaka i četiri ženke). Razlog za to je zadovoljavanje teritorijalnog ponašanja mužjaka debeloglave gavčice uz zadržavanje dostatne snage testa. Razdoblje izlaganja traje 21 dan, a uzorkovanje riba obavlja se dvadeset prvog dana.
|
|
11.
|
Pri uzorkovanju 21. dana sve se životinje usmrćuju na humani način. Sekundarna spolna obilježja mjere se u debeloglave gavčice i medake (vidjeti dodatke 5.A i 5.B), uzorci krvi uzimaju se radi utvrđivanja vitelogenina u zebrice i debeloglave gavčice, a osim toga, za utvrđivanje vitelogenina u zebrice može se uzeti glava / rep (Dodatak 6.), dok se za analizu vitelogenina u medake uzima jetra (Dodatak 6.)
|
KRITERIJI PRIHVATLJIVOSTI ISPITIVANJA
|
12.
|
Za prihvatljivost rezultata ispitivanja primjenjuju se sljedeći uvjeti:
|
—
|
smrtnost u kontrolnim skupinama s vodom (ili otapalom) ne smije premašiti 10 % na kraju razdoblja izlaganja;
|
|
—
|
tijekom razdoblja izlaganja koncentracija otopljenog kisika trebala bi iznositi najmanje 60 % vrijednosti zasićenja kisikom (engl. air saturation value, ASV);
|
|
—
|
razlike u temperaturi vode među ispitnim posudama ne bi ni u jednom trenutku tijekom razdoblja izlaganja trebale biti veće od ± 1,5 °C, a temperaturu vode potrebno je održavati unutar raspona od 2 °C unutar temperaturnih raspona za pokusne vrste (Dodatak 2.);
|
|
—
|
trebali bi postojati dokazi da su se koncentracije ispitivane kemikalije u otopini zadovoljavajuće kretale u rasponu od ± 20 % srednjih izmjerenih vrijednosti.
|
|
OPIS METODE
Oprema
|
13.
|
Uobičajena laboratorijska oprema, posebno:
|
(a)
|
mjerači kisika i pH vrijednosti;
|
|
(b)
|
oprema za određivanje tvrdoće i lužnatosti vode;
|
|
(c)
|
odgovarajući uređaji za regulaciju temperature i po mogućnosti stalno praćenje;
|
|
(d)
|
akvariji izrađeni od kemijski inertnog materijala i odgovarajuće veličine s obzirom na preporučeni prostor za određeni broj riba (vidi Dodatak 2.)
|
|
(e)
|
supstrat za mrijest debeloglave gavčice i zebrice (potrebni podaci navedeni su u Dodatku 4.)
|
|
(f)
|
vaga prikladne točnosti (odnosno točnost u rasponu od ± 0,5 mg).
|
|
Voda
|
14.
|
Kao ispitna voda može se upotrijebiti svaka voda koja je prikladna za dugoročno preživljavanje i rast pokusne vrste. Tijekom razdoblja ispitivanja kvaliteta vode treba biti stalna. pH-vrijednost vode trebala bi biti u rasponu od 6,5 do 8,5, ali tijekom predmetnog ispitivanja trebala bi biti u rasponu od ± 0,5 pH jedinica. Uzorke za analizu potrebno je uzimati u intervalima kako bi se osiguralo da voda za razrjeđivanje ne utječe pretjerano na rezultate ispitivanja (primjerice kombinacijom s ispitivanom kemikalijom). Mjerenja teških metala (primjerice Cu, Pb, Zn, Hg, Cd i Ni), glavnih aniona i kationa (primjerice Ca2+, Mg2+, Na+, K+, Cl– i SO42–), pesticida (primjerice ukupnih organofosfornih i ukupnih organoklorovih pesticida), ukupnog organskog ugljika i suspendirane krute tvari potrebno je obavljati, primjerice, svaka tri mjeseca ako se zna da je voda za razrjeđivanje relativno stalne kvalitete. Ako se dokaže da je kvaliteta vode stalna tijekom najmanje jedne godine, mjerenja se mogu prorijediti i intervali produljiti (primjerice svakih šest mjeseci). Neka kemijska svojstva prihvatljive vode za razrjeđivanje navedena su u Dodatku 3.
|
Ispitne otopine
|
15.
|
Ispitne otopine odabranih koncentracija pripremaju se razrjeđivanjem radne otopine. Radnu otopinu potrebno je po mogućnosti pripremiti jednostavnim miješanjem ili mućkanjem ispitivane kemikalije u vodi za razrjeđivanje mehaničkim sredstvima (primjerice mješačem ili ultrazvukom). Za postizanje odgovarajuće koncentracije radne otopine mogu se upotrebljavati kolone za zasićivanje (‚kolone za topljivost’). Upotreba pomoćnog otapala ne preporučuje se. Međutim, ako je potrebno otapalo, istovremeno je potrebno primijeniti i kontrolnu skupinu za otapalo u jednakoj koncentraciji kao i onoj upotrijebljenoj u skupinama tretiranima kemikalijom. Za složene ispitivane kemikalije otapalo je, u tehničkom smislu, najbolje rješenje, a potrebno je pročitati OECD-ovu Smjernicu o ispitivanju toksičnosti za vodu složenih tvari i smjesa (22). Odabir otapala bit će određen kemijskim svojstvima kemikalije. U OECD-ovoj smjernici preporučuje se najveća vrijednost od 100 μl/l, što je potrebno poštovati. Međutim, nedavnom su revizijom (23) naglašene dodatne dvojbe pri upotrebi otapala za ispitivanje endokrine aktivnosti. Stoga se preporučuje da se koncentracija otapala, ako je otapalo potrebno, svede na najmanju moguću mjeru kad god je to tehnički izvedivo (ovisno o fizikalno-kemijskim svojstvima ispitivane kemikalije).
|
|
16.
|
Za ispitivanje će se upotrijebiti protočni sustav. Tim se sustavom stalno ispušta i razrjeđuje radna otopina ispitivane kemikalije (primjerice pumpa za doziranje, proporcionalni razrjeđivač, zasićivač) kako bi u ispitne komore pritjecao niz koncentracija. Brzine protoka radnih otopina i vode za razrjeđivanje tijekom ispitivanja potrebno je provjeravati u intervalima, po mogućnosti jedanput dnevno, i one za vrijeme ukupnog trajanja ispitivanja ne smiju odstupati više od 10 %. Potrebno je paziti da se izbjegne upotreba nekvalitetnih plastičnih cijevi ili ostalih materijala koji mogu sadržavati biološki aktivne kemikalije. Pri odabiru materijala za protočni sustav potrebno je uzeti u obzir moguću adsorpciju ispitivane kemikalije na tom materijalu.
|
Držanje riba
|
17.
|
Pokusne ribe potrebno je odabrati među laboratorijskom populacijom, a po mogućnosti i iz istog matičnog jata, koje je najmanje dva tjedna prije ispitivanja držano u uvjetima koji su slični ispitnim uvjetima u smislu kvalitete vode i osvjetljenja. Važno je da se osigura dovoljan prostor tj. veličina akvarija koja za zadani broj odnosno masu riba (za definicije vidi Dodatak 1.) odgovara upotrijebljenoj pokusnoj vrsti (vidi Dodatak 2.).
|
|
18.
|
Nakon razdoblja prilagodbe od 48 sati bilježi se smrtnost uz primjenu sljedećih kriterija:
|
—
|
smrtnost veća od 10 % populacije u sedam dana: odbacuje se čitava serija,
|
|
—
|
smrtnost između 5 i 10 % populacije: prilagodba još sedam dana; ako je smrtnost tijekom drugih sedam dana veća od 5 %, čitava se serija odbacuje,
|
|
—
|
smrtnost manje od 5 % populacije u sedam dana: serija se prihvaća.
|
|
|
19.
|
Ribe se ne smije liječiti tijekom razdoblja prilagodbe, razdoblja prije izlaganja ili tijekom razdoblja izlaganja.
|
Razdoblje prije izlaganja i odabir riba
|
20.
|
Preporučuje se jednotjedno razdoblje prije izlaganja, pri čemu se životinje smještaju u posude slične pokusnima. Ribe je potrebno hraniti ad libitum tijekom razdoblja držanja i faze izlaganja. Faza izlaganja započinje spolno dimorfnom odraslom ribom iz laboratorijske skupine reproduktivno zrelih životinja (primjerice s jasno vidljivim sekundarnim spolnim obilježjima kad je riječ o debeloglavoj gavčici i medaki) koja je u aktivnom mrijestu. Prema općim smjernicama (koje se uzima u obzir uz promatranje stvarnog reproduktivnog statusa predmetne serije riba) debeloglave gavčice trebale bi biti stare približno 20 (± 2) tjedana pod pretpostavkom da su tijekom životnog vijeka uzgajane na temperaturi od 25 ± 2 °C. Medake bi trebale biti stare približno 16 (± 2) tjedana pod pretpostavkom da su tijekom životnog vijeka uzgajane na temperaturi od 25 ± 2 °C. Zebrice bi trebale biti stare približno 16 (± 2) tjedana pod pretpostavkom da su tijekom životnog vijeka uzgajane na temperaturi od 26 ± 2 °C.
|
PLAN ISPITIVANJA
|
21.
|
Upotrebljavaju se tri koncentracije ispitivane kemikalije, jedna kontrolna skupina (voda) te po potrebi jedna kontrolna skupina za otapala. Podaci se mogu analizirati radi utvrđivanja statistički značajnih razlika među tretiranim i kontrolnim skupinama. Zahvaljujući tim analizama utvrdit će se je li potrebno daljnje, dugotrajnije ispitivanje štetnih učinaka kemikalije (odnosno na preživljavanje, razvoj, rast i reprodukciju), umjesto u svrhu procjene rizika (24).
|
|
22.
|
U zebrica i medaka 21. dana pokusa uzimaju se uzorci mužjaka i ženki iz svake tretirane skupine svakom razinom kemikalije (pet mužjaka i pet ženki u svakoj od dviju replika) i iz kontrolne skupine u svrhu mjerenja vitelogenina i sekundarnih spolnih obilježja, tamo gdje je to primjenjivo. U debeloglave gavčice 21. dana izlaganja uzimaju se uzorci mužjaka i ženki (dva mužjaka i četiri ženke u svakoj od četiri replike) i kontrolne skupine u svrhu mjerenja vitelogenina i sekundarnih spolnih obilježja.
|
Odabir ispitnih koncentracija
|
23.
|
Za potrebe ovog ispitivanja najvišu ispitnu koncentraciju potrebno je odrediti s pomoću maksimalne tolerirane koncentracije (MTK) utvrđene tablicom ili s pomoću ostalih podataka o toksičnosti, ili 10 mg/l, ili maksimalne količine koja se može otopiti u vodi, što god od toga je najmanje. MTK se definira kao najviša ispitna koncentracija kemikalije čija je posljedica smrtnost manja od 10 %. Ovaj pristup pretpostavlja da postoje empirijski podaci o akutnoj toksičnosti ili ostali podaci o toksičnosti iz kojih se može procijeniti MTK. Procjena MTK-a može biti neprecizna pa je u pravilu potrebna stručna procjena.
|
|
24.
|
Potrebne su tri ispitne koncentracije, raspoređene s pomoću stalnog faktora koji ne premašuje 10 te kontrolna skupina s vodom (i po potrebi kontrolna skupina za otapalo). Preporučuje se raspon faktora raspoređivanja od 3,2 do 10.
|
POSTUPAK
Odabir i vaganje riba za ispitivanje
|
25.
|
Važno je da se razlike u težini riba na početku testa svedu na najmanju moguću mjeru. Odgovarajući rasponi veličina za različite vrste preporučene za ovo ispitivanje navedeni su u Dodatku 2. Za cijelu seriju riba koja se upotrebljava u ovom ispitivanju pojedinačne težine mužjaka i ženki na početku ispitivanja trebale bi se po mogućnosti kretati u rasponu od ± 20 % aritmetičke srednje težine za ribe istog spola. Prije početka ispitivanja preporučuje se vaganje pod-uzorka riblje populacije radi procjene srednje mase.
|
Uvjeti izlaganja
Trajanje
|
26.
|
Nakon razdoblja prije izlaganja ispitivanje traje 21 dan. Preporučuje se jednotjedno razdoblje prije izlaganja.
|
Hranjenje
|
27.
|
Ribe je potrebno hraniti ad libitum odgovarajućom hranom (Dodatak 2.) u količinama dovoljnima za zadržavanje tjelesne forme. Potrebno je paziti da ne dođe do povećanja broja mikroba i zamućenja vode. Opća je smjernica da se dnevna količina hrane može podijeliti u dvije ili tri jednake porcije za višekratno hranjenje tijekom dana, pri čemu razmak između hranjenja mora biti najmanje tri sata. Prihvatljiva je i jedna velika porcija, posebno tijekom vikenda. Ribe nije potrebno hraniti 12 sati prije uzorkovanja/seciranja.
|
|
28.
|
Hranu za ribe potrebno je procijeniti u smislu postojanja kontaminanata poput organoklorovih pesticida, policikličkih aromatskih ugljikovodika (PAH), polikloriranih bifenola (PCB). Potrebno je izbjegavati hranu s povišenom razinom fitoestrogena koji bi utjecali na reakciju na test na poznati agonist estrogena (primjerice 17-beta estradiol).
|
|
29.
|
Nepojedenu hranu i fekalije potrebno je uklanjati iz ispitnih akvarija najmanje dvaput tjedno, primjerice pažljivim čišćenjem dna svakog akvarija s pomoću sifona.
|
Svjetlo i temperatura
|
30.
|
Duljinu izlaganja svjetlu i temperaturu vode potrebno je prilagoditi ribljoj vrsti (vidjeti Dodatak 2.).
|
Učestalost analitičkih utvrđivanja i mjerenja
|
31.
|
Prije početka razdoblja izlaganja potrebno je osigurati pravilno funkcioniranje sustava dovoda kemikalije. Potrebno je utvrditi sve potrebne analitičke metode, uključujući dostatna saznanja o kemijskoj stabilnosti u ispitnom sustavu. Tijekom ispitivanja, koncentracije ispitivane kemikalije utvrđuju se u redovnim intervalima kako slijedi: stope protoka razrjeđivača i toksične radne otopine potrebno je provjeravati po mogućnosti svakodnevno, a najmanje dvaput tjedno; one ne bi trebale varirati više od 10 % tijekom ispitivanja. Preporučuje se mjerenje stvarnih koncentracija ispitivane kemikalije u svim akvarijima na početku ispitivanja, a potom svakog tjedna.
|
|
32.
|
Preporučuje se da se rezultati temelje na izmjerenim koncentracijama. Međutim, ako je tijekom ispitivanja koncentracija ispitivane kemikalije u otopini uspješno zadržana unutar 20 % nominalne koncentracije, tada se rezultati mogu temeljiti na nominalnim ili izmjerenim vrijednostima.
|
|
33.
|
U pojedinim je slučajevima uzorke potrebno filtrirati (primjerice s pomoću veličine pora 0,45 μm) ili centrifugirati. U slučaju potrebe preporučuje se centrifugiranje. Ipak, ako se ispitivani materijal ne adsorbira na filtre, prihvatljivo je i filtriranje.
|
|
34.
|
Tijekom ispitivanja potrebno je mjeriti otopljeni kisik, temperaturu i pH-vrijednost u svim ispitnim akvarijima najmanje jednom tjedno. Ukupnu tvrdoću i lužnatost potrebno je mjeriti najmanje jednom tjedno u kontrolnim skupinama i jednom akvariju s najvišom koncentracijom. Temperaturu po mogućnosti treba neprekidno pratiti u najmanje jednom ispitnom akvariju.
|
Zapažanja
|
35.
|
Brojne opće (primjerice preživljavanje) i temeljne biološke reakcije (primjerice razine vitelogenina) procjenjuju se tijekom testa ili po njegovu završetku. Mjerenje i procjena tih krajnjih učinaka i njihova korist opisuju se u nastavku.
|
Preživljavanje
|
36.
|
Ribe je tijekom razdoblja ispitivanja potrebno svakodnevno pregledavati i evidentirati smrtnost te u najkraćem mogućem roku uklanjati uginule ribe. Uginule ribe se ne nadomješta novima ni u kontrolnim ni u ispitnim posudama. Spol riba koje su uginule tijekom ispitivanja potrebno je utvrditi makroskopskom procjenom gonada.
|
Ponašanje i izgled
|
37.
|
Potrebno je evidentirati svako neuobičajeno ponašanje (u odnosu na kontrolne skupine), što može uključivati znakove opće toksičnosti, uključujući hiperventilaciju, nekoordinirano plivanje, manjak ravnoteže te atipično mirovanje ili hranjenje. Potrebno je evidentirati i vanjske abnormalnosti (poput krvarenja, gubitka boje). Pri tumačenju podataka sve znakove toksičnosti potrebno je pažljivo razmotriti jer mogu ukazivati na koncentracije pri kojima biomarkeri endokrine aktivnosti nisu pouzdani. Ta zapažanja ponašanja mogu biti i korisne informacije za određivanje potencijalnih budućih zahtjeva za ispitivanje na ribama. Primjerice, teritorijalna agresivnost u normalnih mužjaka ili maskuliniziranih ženki uočena je u debeloglave gavčice u slučajevima izloženosti androgenima, a karakteristično parenje i mrijest zebrica u zoru s pojavom svjetla smanjeno je ili narušeno nakon izloženosti estrogenima ili antiandrogenima.
|
|
38.
|
S obzirom na to da se neki aspekti izgleda (ponajprije boja) mogu pri hvatanju brzo promijeniti, važno je prije uklanjanja životinja iz ispitnog sustava obaviti zapažanja. Iz dosadašnjeg iskustva s debeloglavim gavčicama poznato je da neke endokrino aktivne kemikalije mogu u početku prouzročiti promjene u sljedećim vanjskim obilježjima: boji tijela (svijetla ili tamna), uzorcima boje (postojanje okomitih pruga) i obliku tijela (glava i prsno područje). Stoga je zapažanja o fizičkom izgledu riba potrebno obavljati tijekom ispitivanja i po završetku studije.
|
Humano usmrćivanje riba
|
39.
|
Po završetku izlaganja, odnosno 21. dana, ribe je potrebno usmrtiti odgovarajućom količinom anestetika trikaina (Tricaine metan sulfonat, Metacain, MS-222 (CAS 886-86-2), 100-500 mg/l puferiran s 300 mg/l NaHCO3 (natrijev bikarbonat, CAS 144-55-8) kako bi se smanjila iritacija sluznice; nakon toga, uzorci krvi i tkiva uzimaju se radi utvrđivanja vitelogenina, kako se opisuje u odjeljku o vitelogeninu.
|
Zapažanja u pogledu sekundarnih spolnih obilježja
|
40.
|
Neke endokrino aktivne kemikalije mogu prouzročiti promjene posebnih sekundarnih spolnih obilježja (broj izraslina u spolno zrelih mužjaka debeloglave gavčice, papilarni procesi u mužjaka medake). Naime, kemikalije s određenim načinom djelovanja mogu prouzročiti neuobičajenu pojavu sekundarnih spolnih obilježja u životinja suprotnog spola: primjerice agonisti receptora za androgene, poput trenbolona, metiltestosterona i dihidrotestosterona, u spolno zrelih ženki debeloglave gavčice mogu prouzročiti pojavu izraženih izraslina, te papilarnih procesa u ženki medake (11, 20, 21). Poznato je i da agonisti receptora estrogena mogu prouzročiti smanjenje broja izraslina i veličine jastučića na potiljku odraslih mužjaka (25, 26). Ta makromorfološka zapažanja ponašanja mogu biti i korisni kvalitativni i kvantitativni podaci za određivanje potencijalnih budućih zahtjeva za ispitivanje na ribama. Broj i veličina izraslina u spolno zrele debeloglave gavčice i papilarnih procesa u medake mogu se kvantificirati izravno ili praktičnije iz očuvanih uzoraka. Preporučeni postupci za procjenu sekundarnih spolnih obilježja u debeloglave gavčice i medake nalaze se u Dodatku 5.A, odnosno Dodatku 5.B.
|
Vitelogenin (VTG)
|
41.
|
Krv se uzima iz repne arterije/vene s pomoću heparinizirane mikrohematokritske kapilarne cjevčice ili punkcijom srca s pomoću šprice. Ovisno o veličini ribe, volumen krvi koja se uzima u pravilu se kreće od pet do 60 μl po jednoj debeloglavoj gavčici, odnosno od pet do 15 μl po jednoj zebrici. Plazma se odvaja od krvi centrifugiranjem te pohranjuje s inhibitorima proteaze na – 80 °C do analize vitelogenina. Druga je mogućnost upotreba jetre medake, odnosno homogenata s glave/repa zebrice kao izvora tkiva za utvrđivanje vitelogenina (Dodatak 6.). Mjerenje VTG-a trebalo bi se temeljiti na potvrđenoj odgovarajućoj metodi ELISA s pomoću odgovarajućeg standarda VTG-a i odgovarajućih antitijela. Preporučuje se primjena metode s pomoću koje se mogu otkriti niske razine VTG-a od nekoliko ng/ml plazme (ili ng/mg tkiva), što je osnovna razina u neizloženih mužjaka riba.
|
|
42.
|
Kontrola kvalitete analize vitelogenina obavljat će se s pomoću standarda, slijepih proba i najmanje dvostrukih analiza. Za svaku metodu ELISA potrebno je provesti ispitivanje za učinak matrice (učinak razrjeđivanja uzorka) radi utvrđivanja minimalnog faktora razrjeđivanja uzorka. Na svakoj pločici ELISA za testove vitelogenina trebali bi se nalaziti sljedeći uzorci za kontrolu kvalitete: najmanje šest kalibracijskih standarda kojima je obuhvaćen raspon očekivanih koncentracija vitelogenina i najmanje jedna nespecifična, obvezujuća testna prazna proba (analizira se dva takva kompleta). Apsorpcija tih praznina trebala bi biti manja od 5 % maksimalne apsorpcije pri standardnoj kalibraciji. Analizirat će se najmanje dva alikvota (duplikati jažica) svakog razrjeđivanja uzorka. Duplikate jažica koji se razlikuju više od 20 % potrebno je ponovno analizirati.
|
|
43.
|
Koeficijent korelacije (R2) za krivulje kalibracije trebao bi biti veći od 0,99. Međutim, visoka korelacija nije dostatna za jamstvo odgovarajućeg predviđanja koncentracije u svim rasponima. Osim što ima dovoljno visoku korelaciju za krivulju kalibracije, koncentracija svakog standarda prema izračunu iz krivulje kalibracije trebala bi se kretati od 70 do 120 % nominalne koncentracije. U slučaju udaljavanja nominalnih koncentracija od linije regresije kalibracije (primjerice pri nižim koncentracijama) može se pojaviti potreba za razdvajanjem krivulje kalibracije u niske i visoke raspone ili potreba za primjenom nelinearnog modela za odgovarajuće prilagođavanje podataka o apsorpciji. U slučaju razdvajanja krivulje, oba segmenta linije trebala bi imati R2 > 0,99.
|
|
44.
|
Granica otkrivanja (engl. limit of detection, LOD) definira se kao koncentracija najnižeg analitičkog standarda, dok se granica kvantitacije (engl. limit of quantitation, LOQ) definira kao koncentracija najnižeg analitičkog standarda pomnožena s najnižim faktorom razrjeđivanja.
|
|
45.
|
Svakog dana provođenja testova vitelogenina analizirat će se uzorak za utvrđivanje izrađen s pomoću referentnog standarda dobivenog ponavljanjem testa (inter-assay) (Dodatak 7.). Omjer očekivane i izmjerene koncentracije bilježit će se uz rezultate svakog kompleta testova provedenog tog dana.
|
PODACI I IZVJEŠĆIVANJE
Procjena reakcija biomarkera s pomoću analize varijance (ANOVA)
|
46.
|
Reakcije tretiranih i kontrolnih skupina uspoređuju se s pomoću analize varijance (ANOVA) radi identifikacije moguće endokrine aktivnosti kemikalije. U slučaju upotrebe kontrolne skupine za otapalo, potrebno je za svaki krajnji učinak provesti odgovarajuće statističko ispitivanje između kontrolnih skupina s vodom za razrjeđivanje i kontrolnih skupina s otapalom. Smjernice o načinu obrade podataka za kontrolne skupine s vodom za razrjeđivanje i otapalom u naknadnoj statističkoj analizi nalaze se u dokumentu OECD, 2006.c (27). Sve podatke o biološkim reakcijama potrebno je analizirati i o njima izvijestiti zasebno prema spolu. Ako nisu zadovoljene tražene pretpostavke za parametrijske metode – nenormalna distribucija (npr. Shapiro-Wilkov test) ili heterogena varijanca (Bartlettov test ili Leveneov), potrebno je razmotriti mogućnost da se prije provedbe ANOVA-e podaci preoblikuju radi homogenizacije varijanci ili provesti ponderiranu ANOVA-u. Za neujednačenu reakciju na dozu mogu se upotrijebiti Dunnettov test (parametrijski) na višestrukim usporedbama parova ili Mann-Whitneyev test s prilagodbom Bonferroni (neparametrijski). Ako je reakcija na dozu približno ujednačena, mogu se upotrijebiti ostali statistički testovi (primjerice, Jonckheere-Terpstrin ili Williamsov test). Statistički dijagram nalazi se u Dodatku 8. i pomoć je pri odabiru najprikladnijeg statističkog testa za upotrebu. Dodatne informacije nalaze se i u OECD-ovu Dokumentu o postojećim pristupima statističkoj analizi podataka o ekotoksičnosti (27).
|
Izvješćivanje o rezultatima ispitivanja
|
47.
|
Podaci o studiji trebali bi uključivati:
|
|
Ustanova u kojoj se obavlja ispitivanje:
|
—
|
odgovorne osobe i njihove odgovornosti tijekom studije,
|
|
—
|
svaki laboratorij treba biti dokazano stručan u upotrebi niza reprezentativnih kemikalija.
|
|
|
|
Ispitivana kemikalija:
|
—
|
karakterizaciju ispitivane kemikalije,
|
|
—
|
fizikalnu narav i relevantna fizikalno-kemijska svojstva,
|
|
—
|
metodu i učestalost pripreme ispitnih koncentracija,
|
|
—
|
informacije o stabilnosti i biorazgradivosti.
|
|
|
|
Otapalo:
|
—
|
karakterizaciju otapala (svojstva, upotrijebljena koncentracija),
|
|
—
|
obrazloženje odabira otapala (ako nije riječ o vodi).
|
|
|
|
Pokusne životinje:
|
—
|
dobavljača i njegov posebni objekt,
|
|
—
|
starost riba na početku ispitivanja i reproduktivni status / status mrijesta,
|
|
—
|
podatke o postupku aklimatizacije životinja,
|
|
—
|
tjelesnu masu riba na početku izlaganja (iz poduzorka upotrijebljenog ribljeg jata).
|
|
|
|
Ispitni uvjeti:
|
—
|
primijenjeni postupak ispitivanja (vrsta ispitivanja, broj i masa riba u odnosu na prostor odn. litražu akvarija itd.),
|
|
—
|
metodu pripreme radne otopine i stopu protoka,
|
|
—
|
nominalne ispitne koncentracije, tjedne izmjerene vrijednosti koncentracija ispitnih otopina i primijenjene analitičke metode, srednje izmjerene vrijednosti i standardna odstupanja u ispitnim posudama te dokaze da se izmjerene vrijednosti odnose na koncentracije ispitne kemikalije u stvarnoj otopini,
|
|
—
|
karakteristike vode za razrjeđivanje (uključujući pH-vrijednost, tvrdoću, lužnatost, temperaturu, koncentraciju otopljenog kisika, razine rezidualnog klora, ukupni organski ugljik, suspendirane krute tvari i sve ostale izmjerene vrijednosti),
|
|
—
|
kvalitetu vode u ispitnim akvarijima: pH-vrijednost, tvrdoću, temperaturu i koncentraciju otopljenog kisika,
|
|
—
|
precizne informacije o hranjenju (primjerice vrsti/vrstama hrane, porijeklu, količini i učestalosti hranjenja te analizu relevantnih kontaminanata, ako postoji (primjerice poliklorirani bifenili, policiklički aromatski ugljikovodici i organoklorovi pesticidi).
|
|
|
|
Rezultati:
|
—
|
dokaze da su kontrolne skupine u skladu s kriterijima prihvatljivosti ispitivanja,
|
|
—
|
podatke o smrtnosti u svim ispitnim koncentracijama i kontrolnim skupinama,
|
|
—
|
primijenjene statističke analitičke metode, obradu podataka i obrazloženje primijenjenih metoda,
|
|
—
|
podatke o biološkim zapažanjima makromorfologije, uključujući sekundarna spolna obilježja i vitelogenin,
|
|
—
|
rezultate analiza podataka, poželjno u tabličnom i grafičkom obliku,
|
|
—
|
pojavu neobičnih reakcija riba i sve vidljive učinke ispitivane kemikalije.
|
|
|
SMJERNICE ZA TUMAČENJE I PRIHVAĆANJE REZULTATA ISPITIVANJA
|
48.
|
U ovom se odlomku navode određena razmatranja koje treba uzeti u obzir pri tumačenju rezultata ispitivanja različitih izmjerenih krajnjih učinaka. Rezultate je potrebno oprezno tumačiti kad se čini da ispitivana kemikalija prouzročuje vidljivu toksičnost ili utječe na opće stanje pokusne životinje.
|
|
49.
|
Pri određivanju raspona ispitnih koncentracija, kako bi s moglo valjano tumačiti podatke, potrebno je paziti da se ne premaši maksimalna tolerirana koncentracija. Važno je da postoji najmanje jedna tretirana skupina na kojoj se ne pojavljuju znakovi toksičnih učinaka. Znakove bolesti i toksičnih učinaka potrebno je detaljno ocijeniti i o njima izvijestiti. Primjerice, moguće je da na nastajanje vitelogenina u ženki utječu i opća toksičnost te neendokrino toksični načini djelovanja, primjerice hepatotoksičnost. Međutim, u tumačenju učinaka postiže se veća sigurnost ako postoje druge tretirane skupine, tretirane različitim koncentracijama, koje nisu narušene sustavnom toksičnošću.
|
|
50.
|
Za prihvaćanje rezultata ispitivanja potrebno je razmotriti nekoliko aspekata. Primjerice, razine VTG-a u kontrolnim skupinama mužjaka i ženki trebale bi biti jasne i razlikovati se za približno tri reda veličine u debeloglave gavčice i zebrice, odnosno za jedan red veličine u medake. Primjeri raspona vrijednosti u kontrolnim i tretiranim skupinama nalaze se u izvješćima o validaciji (1, 2, 3, 4). Visoke vrijednosti VTG-a u mužjaka iz kontrolnih skupina mogu utjecati na osjetljivost testa i njegovu sposobnost otkrivanja slabih agonista estrogena. Niske vrijednosti VTG-a u ženki iz kontrolnih skupina mogu utjecati na osjetljivost testa i njegovu sposobnost otkrivanja inhibitora aromataze i antagonista estrogena. Validacijske studije upotrebljavale su se za izradu te smjernice.
|
|
51.
|
Ako laboratorij nije ranije proveo test ili ako je došlo do znatnih promjena (primjerice promjene riblje subpopulacije ili dobavljača), savjetuje se provedba studije tehničke osposobljenosti. Preporučuje se upotreba kemikalija kojima je obuhvaćen raspon načina djelovanja ili učinaka na brojne ispitne krajnje učinke. U praksi se svaki laboratorij potiče na izradu vlastitih povijesnih kontrolnih podataka za mužjake i ženke i na primjenu pozitivne kontrolne kemikalije za estrogensko djelovanje (primjerice 17β-estradiola pri 100 ng/l ili poznatog slabog agonista) čija je posljedica povećanje VTG-a u mužjaka riba, pozitivne kontrolne kemikalije za inhibiciju aromataze (primjerice fadrozol ili prokloraz pri 300 μg/l) čija je posljedica smanjenje VTG-a u ženki riba te pozitivne kontrolne kemikalije za androgensko djelovanje (primjerice 17β-trenbolon pri 5 μg/l) čija je posljedica indukcija sekundarnih spolnih obilježja u ženki debeloglave gavčice i medake. Svi ti podaci mogu se usporediti s dostupnim podacima iz validacijskih studija (1, 2, 3) kako bi se osigurala osposobljenost laboratorija.
|
|
52.
|
Općenito, vrijednosti vitelogenina smatraju se pozitivnima ako je došlo do statistički značajnog povećanja VTG-a u mužjaka (p < 0,05) ili statistički značajnog smanjenja u ženki (p < 0,05) najmanje pri najvećoj ispitivanoj dozi u usporedbi s kontrolnom skupinom te u izostanku znakova opće toksičnosti. Pozitivan rezultat dodatno je potkrijepljen demonstracijom biološki vjerojatnog odnosa između doze i krivulje reakcije. Kako je prethodno navedeno, smanjenje vitelogenina ne mora u potpunosti biti endokrinog podrijetla, ali pozitivan rezultat u pravilu bi trebalo tumačiti kao dokaz endokrinog djelovanja in vivo te je potrebno pokrenuti aktivnosti u svrhu dodatnih pojašnjenja.
|
LITERATURA
|
(1)
|
OECD (2006.a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006.)27.
|
|
(2)
|
OECD (2006.b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1 B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006.)29.
|
|
(3)
|
OECD (2007.). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007.)25.
|
|
(4)
|
Owens JW (2007.). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (pristupljeno: 18. rujna 2008.).
|
|
(5)
|
US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Neobjavljeno izvješće od 15. prosinca 2007. US Environmental Protection Agency, Washington, DC. str. 104.
|
|
(6)
|
OECD, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008.)21.
|
|
(7)
|
Sumpter and Jobling (1995.). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7:173-8 Review.
|
|
(8)
|
Pawlowski S, Sauer A, Shears JA, Tyler CR, Braunbeck T (2004.). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3): 277. – 91.
|
|
(9)
|
Andersen L, Goto-Kazato R, Trant JM, Nash JP, Korsgaard B, Bjerregaard P (2006.). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4): 343. – 52.
|
|
(10)
|
Ankley GT, Kahl MD, Jensen KM, Hornung MW, Korte JJ, Makynen EA, Leino RL (2002.). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences;67(1): 121. – 30.
|
|
(11)
|
Panter GH, Hutchinson TH, Hurd KS, Sherren A, Stanley RD, Tyler CR (2004.). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1): 11. – 21.
|
|
(12)
|
Parks LG, Cheek AO, Denslow ND, Heppell SA, McLachlan JA, LeBlanc GA, Sullivan CV (1999.). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2): 113. – 25.
|
|
(13)
|
Panter GH, Tyler CR, Maddix S, Campbell PM, Hutchinson TH, Länge R, Lye C, Sumpter JP, 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Bruxelles, Belgija.
|
|
(14)
|
Fenske M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001.). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217. – 232.
|
|
(15)
|
Holbech H, Andersen L, Petersen GI, Korsgaard B, Pedersen KL, Bjerregaard P. (2001.). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119. – 131
|
|
(16)
|
Rose J, Holbech H, Lindholst C, Noerum U, Povlsen A, Korsgaard B, Bjerregaard P. 2002. Vitellogenin induction by 17β-estradiol and 17β-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131: 531. – 539.
|
|
(17)
|
Brion F, Nilsen BM, Eidem JK, Goksoyr A, Porcher JM, Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699 – 1708.
|
|
(18)
|
Yokota H, Morita H, Nakano N, Kang IJ, Tadokoro H, Oshima Y, Honjo T, Kobayashi K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4: 87. – 98.
|
|
(19)
|
Tatarazako N, Koshio M, Hori H, Morita M and Iguchi T., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50: 301. – 308.
|
|
(20)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray LE (2003.). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350. – 60.
|
|
(21)
|
Seki M, Yokota H, Matsubara H, Maeda M, Tadokoro H, Kobayashi K (2004.). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3): 774. – 81.
|
|
(22)
|
OECD (2000.) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Pariz
|
|
(23)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006.a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; str. 69. – 92.
|
|
(24)
|
Hutchinson TH, Ankley GT, Segner H, Tyler CR, 2006.b. Screening and testing for endocrine disruption in fish-biomarkers as ‚signposts,’ not ‚traffic lights,’ in risk assessment. Environmental Health Perspectives;114 Suppl 1: 106. – 14.
|
|
(25)
|
Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure to 17Β-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129. – 145.
|
|
(26)
|
Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve and G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478. – 488.
|
|
(27)
|
OECD (2006.c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006.)18
|
|
(28)
|
OECD (2012.) OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No 150. ENV/JM/MONO(2012.)22
|
Dodatak 1.
Kratice i definicije
Kemikalija
: tvar ili smjesa.
CV
: koeficijent varijacije (engl. Coefficient of variation, CV).
ELISA
: Imunoenzimski test (engl. Enzyme-Linked Immunosorbent Assay).
Masa riba u odnosu na prostor
: mokra masa riba u odnosu na određenu količinu vode.
Broj riba u odnosu na prostor
: broj riba u odnosu na određenu količinu vode.
VTG (vitelogenin)
: fosfolipoglikoproteinski prekursor proteina žumanjka koji je u pravilu prisutan u spolno aktivnih ženki svih vrsta koje polažu jaja.
Os HPG
: os hipotalamus-hipofiza-gonade.
MTK
: maksimalna tolerirana koncentracija, iznosi približno 10 % LC50.
Ispitivana kemikalija
: sve tvari ili smjese koje se ispituju ovom ispitnom metodom.
Dodatak 2.
Eksperimentalni uvjeti za test probira endokrinog sustava riba
|
|
Debeloglava gavčica
(Pimephales promelas)
|
Medaka
(Oryzias latipes)
|
Zebrica
(Danio rerio)
|
|
|
Protok
|
Protok
|
Protok
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
4.
|
Kvaliteta osvjetljenja
|
|
Fluorescentne žarulje (široki spektar)
|
Fluorescentne žarulje (široki spektar)
|
Fluorescentne žarulje (široki spektar)
|
|
|
10 – 20 μE/m2/s, 540 – 1 000 luksa ili 50 – 100 ft-c (razine u laboratorijskim uvjetima)
|
10 – 20 μE/m2/s, 540 – 1 000 luksa ili 50 – 100 ft-c (razine u laboratorijskim uvjetima)
|
10 – 20 μE/m2/s, 540 – 1 000 luksa ili 50 – 100 ft-c (razine u laboratorijskim uvjetima)
|
|
6.
|
Fotoperiod (prijelazi iz zore u sumrak su mogući, ali ne smatraju se nužnima)
|
|
16 sati svjetla, 8 sati tame
|
12 – 16 sati svjetla, 12 – 8 sati tame
|
12 – 16 sati svjetla, 12 – 8 sati tame
|
|
7.
|
Masa riba u odnosu na prostor
|
|
< 5 g po l
|
< 5 g po l
|
< 5 g po l
|
|
8.
|
Veličina ispitne komore
|
|
Najmanje 10 l
|
Najmanje 2 l
|
Najmanje 5 l
|
|
9.
|
Volumen ispitne otopine
|
|
Najmanje 8 l
|
Najmanje 1,5 l
|
Najmanje 4 l
|
|
10.
|
Izmjene volumena ispitnih otopina
|
|
Najmanje šest puta dnevno
|
Najmanje pet puta dnevno
|
Najmanje pet puta dnevno
|
|
11.
|
Starost ispitnih organizama
|
|
Vidjeti stavak 20.
|
Vidjeti stavak 20.
|
Vidjeti stavak 20.
|
|
12.
|
Približna mokra masa odraslih riba (g)
|
|
Ženke: 1,5 ± 20 %
Mužjaci: 2,5 ± 20 %
|
Ženke: 0,35 ± 20 %
Mužjaci: 0,35 ± 20 %
|
Ženke: 0,65 ± 20 %
Mužjaci: 0,4 ± 20 %
|
|
13.
|
Broj riba po ispitnoj posudi
|
|
Šest (dva mužjaka i četiri ženke)
|
Deset (pet mužjaka i pet ženki)
|
Deset (pet mužjaka i pet ženki)
|
|
14.
|
Broj tretiranih skupina
|
|
= tri (uvećano za odgovarajuće kontrolne skupine)
|
= tri (uvećano za odgovarajuće kontrolne skupine)
|
= tri (uvećano za odgovarajuće kontrolne skupine)
|
|
15.
|
Broj posuda (akvarija) po tretiranoj skupini
|
|
Najmanje četiri
|
Najmanje dvije
|
Najmanje dvije
|
|
16.
|
Broj riba po ispitnoj koncentraciji
|
|
16 odraslih ženki i osam mužjaka (četiri ženke i dva mužjaka u svakoj posudi replici)
|
Deset odraslih ženki i deset mužjaka (pet ženki i pet mužjaka u svakoj posudi replici)
|
Deset odraslih ženki i deset mužjaka (pet ženki i pet mužjaka u svakoj posudi replici)
|
|
|
Živi ili zamrznuti Artemia račići ili njihove ličinke dva ili tri puta dnevno (ad libitum), komercijalno dostupna hrana ili kombinacija prethodno navedenoga
|
Ličinke Artemia račića dva ili tri puta dnevno (ad libitum), komercijalno dostupna hrana ili kombinacija prethodno navedenoga
|
Ličinke Artemia račića dva ili tri puta dnevno (ad libitum), komercijalno dostupna hrana ili kombinacija prethodno navedenoga
|
|
18.
|
Dozračivanje (aeracija)
|
|
Nikakvo, osim ako koncentracija otopljenog kisika padne ispod 60 % zasićenja kisikom
|
Nikakvo, osim ako koncentracija otopljenog kisika padne ispod 60 % zasićenja kisikom
|
Nikakvo, osim ako koncentracija otopljenog kisika padne ispod 60 % zasićenja kisikom
|
|
19.
|
Voda za razrjeđivanje
|
|
Čista površinska, izvorska ili voda dobivena miješanjem destilirane vode i odgovarajućeg masenog udjela minerala ili voda iz slavine iz koje je uklonjen klor
|
Čista površinska, izvorska ili voda dobivena miješanjem destilirane vode i odgovarajućeg masenog udjela minerala ili voda iz slavine iz koje je uklonjen klor
|
Čista površinska, izvorska ili voda dobivena miješanjem destilirane vode i odgovarajućeg masenog udjela minerala ili voda iz slavine iz koje je uklonjen klor
|
|
20.
|
Razdoblje prije izlaganja
|
|
Preporučuje se sedam dana
|
Preporučuje se sedam dana
|
Preporučuje se sedam dana
|
|
21.
|
Trajanje izlaganja kemikaliji
|
|
21 dan
|
21 dan
|
21 dan
|
|
22.
|
Biološki krajnji učinci
|
|
preživljavanje,
ponašanje,
spolna obilježja 2y,
VTG
|
preživljavanje,
ponašanje,
spolna obilježja 2y,
VTG
|
preživljavanje,
ponašanje,
VTG
|
|
23.
|
Prihvatljivost ispitivanja
|
|
Otopljeni kisik > 60 % zasićenosti; srednja temperatura od 25 ± 2 °C; 90 % preživljavanja riba u kontrolnim skupinama; izmjerene ispitne koncentracije unutar 20 % srednjih izmjerenih vrijednosti po razini tretmana.
|
Otopljeni kisik > 60 % zasićenosti; srednja temperatura od 25 ± 2 °C; 90 % preživljavanja riba u kontrolnim skupinama; izmjerene ispitne koncentracije unutar 20 % srednjih izmjerenih vrijednosti po razini tretmana.
|
Otopljeni kisik > 60 % zasićenosti; srednja temperatura od 25 ± 2 °C; 90 % preživljavanja riba u kontrolnim skupinama; izmjerene ispitne koncentracije unutar 20 % srednjih izmjerenih vrijednosti po razini tretmana.
|
Dodatak 3.
Neka kemijska svojstva prihvatljive vode za razrjeđivanje
|
Sastojak
|
KONCENTRACIJE
|
|
Lebdeće čestice
|
< 20mg/l
|
|
Ukupni organski ugljik
|
< 2 mg/l
|
|
Neionizirani amonijak
|
< 1 μg/l
|
|
Rezidualni klor
|
< 10 μg/l
|
|
Ukupni organofosforni pesticidi
|
< 50 ng/l
|
|
Ukupni organoklorovi pesticidi plus poliklorirani bifenili
|
< 50 ng/l
|
|
Ukupni organski klor
|
< 25 ng/l
|
Dodatak 4.A
Supstrat za mrijest zebrice
Ladica za mrijest
: staklena, dimenzija primjerice 22 × 15 × 5,5 cm (d × š × v), prekrivena pomičnom žičanom rešetkom od nehrđajućeg čelika (mreža širine 2 mm). Rešetka bi trebala prekrivati otvor posude ispod ruba.

Supstrat za mrijest potrebno je postaviti na rešetku. To bi trebao biti prostor u koji ribe mogu ulaziti. Primjerice, prikladno je umjetno akvarijsko bilje izrađeno od zelene plastike (napomena: potrebno je uzeti u obzir moguću adsorpciju ispitivane kemikalije na plastiku). Plastiku je potrebno dovoljno dugo ispirati dovoljnom količinom tople vode kako bi se osiguralo da ne dođe do otpuštanja kemikalija u ispitnu vodu. Pri upotrebi stakla potrebno je osigurati da ne dođe do ozljeda ili prikliještenja riba tijekom njihova energičnog kretanja.
Udaljenost između ladice i stakla trebala bi biti najmanje 3 cm kako bi se osiguralo da do mrijesta ne dođe izvan posude. Jajašca izmriještena u ladicu padaju kroz rešetku i uzorci se mogu uzeti od 45 do 60 minuta nakon početka osvjetljavanja. Prozirna se jajašca ne lijepe i mogu se jednostavno prebrojiti s pomoću transverzalnog svjetla. Pri upotrebi pet ženki po posudi, do 20 jajašaca dnevno može se smatrati malim brojem, do 100 srednjim, a više od 100 velikim. Ladicu za mrijest potrebno je maknuti, jajašca ukloniti i vratiti ladicu u ispitnu posudu što kasnije navečer ili vrlo rano ujutro. Razdoblje do vraćanja ladice ne smije trajati dulje od jednog sata jer u suprotnom supstrat za mrijest može prouzročiti pojedinačno parenje i mrijest u neuobičajeno doba. U slučaju potrebe za kasnijim vraćanjem ladice za mrijest to je potrebno učiniti najmanje devet sati nakon početka osvjetljavanja. U to kasno doba dana više nema mrijesta.
Dodatak 4.B
Supstrat za mrijest debeloglave gavčice
Dvije ili tri kombinirane pločice i ladice za mrijest od plastike/keramike/stakla ili nehrđajućeg čelika smještaju se u svaku ispitnu komoru (primjerice sivi polukružni oluk dugačak 80 mm koji se nalazi na ladici U-profila dugačkoj 130 mm (vidi sliku). Pravilno obrađene plastične ili keramičke pločice pokazale su se prikladnima za supstrat za mrijest (Thorpe et al, 2007.).
Preporučuje se abrazija pločica kako bi se poboljšalo prianjanje. Ladicu je potrebno pregledati kako bi se ribama spriječio pristup palim jajašcima, osim ako je prianjanje jajašaca dokazano za primijenjeni supstrat za mrijest.

Podloga služi zadržavanju svih jajašaca koja se nisu prilijepila za površinu pločice i koja bi pala na dno akvarija (ili jajašaca koja su položena izravno na ravnu plastičnu podlogu). Sve supstrate za mrijest prije upotrebe potrebno je ispirati u vodi za razrjeđivanje najmanje 12 sati.
UPUĆIVANJA
Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90. – 98.
Dodatak 5.A
Procjena sekundarnih spolnih obilježja u debeloglave gavčice radi otkrivanja određenih endokrino aktivnih kemikalija
Pregled
Potencijalno važna obilježja fizičkog izgleda u odraslih debeloglavih gavčica pri ispitivanju endokrinih disruptora uključuju boju tijela (odnosno svijetlu/tamnu boju), uzorke boje (odnosno postojanje ili izostanak okomitih pruga), oblik tijela (odnosno oblik glave i prsnog područja, izduženost abdomena) te posebna sekundarna spolna obilježja (odnosno broj i veličina izraslina spolno zrelih riba, veličina hrpta ispred leđne peraje i leglice).
Izrasline se nalaze na glavi (hrptu ispred leđne peraje) reproduktivno aktivnih mužjaka debeloglave gavčice te su u pravilu postavljeni u bočno simetričnom uzorku (Jensen et al., 2001.). U ženki iz kontrolnih skupina i mladih mužjaka i ženki nije uočen razvoj izraslina (Jensen et al., 2001.). Moguća je pojava do osam pojedinačnih izraslina oko očiju i između nosnica mužjaka. Najviše izraslina i najveće izrasline nalaze se u dvjema usporednim linijama neposredno ispod nosnica i iznad usta. U brojnih riba skupine izraslina nalaze se ispod donje čeljusti; jedan par izraslina u pravilu se nalazi najbliže ustima, dok se oko trbuha mogu nalaziti do četiri izrasline. Stvarni broj izraslina rijetko premašuje 30 (raspon od 18 do 28; Jensen et al., 2001.). Dominantne izrasline (u brojčanom smislu) prisutne su kao jedinstvena, relativno okrugla struktura čija je visina približno jednaka polumjeru. Većina reproduktivno aktivnih mužjaka ima i barem nekoliko izraslina koje su uvećane i izražene tako da ih je nemoguće razlikovati kao pojedinačne strukture.
Neke vrste endokrino disruptivnih kemikalija mogu prouzročiti neuobičajenu pojavu određenih sekundarnih spolnih obilježja u suprotnog spola; primjerice, agonisti receptora za androgene, poput 17β-metiltestosterona ili 17β-trenbolona, mogu prouzročiti razvoj izraslina u ženki debeloglave gavčice (Smith, 1974.; Ankley et al., 2001.; 2003.), dok agonisti receptora za estrogene mogu prouzročiti smanjenje broja ili veličine izraslina u mužjaka (Miles-Richardson et al., 1999.; Harries et al., 2000).
U nastavku se nalazi opis obilježja izraslina u spolno zrelih debeloglavih gavčica na temelju postupaka koji se primjenjuju u laboratoriju američke Agencije za zaštitu okoliša u Duluthu, Minnesota. Posebne proizvode i/ili opremu moguće je zamijeniti sličnim dostupnim materijalima.
Najbolji je pregled s pomoću osvijetljenog povećala ili stereoskopskog mikroskopa s osvjetljenjem i lećom objektiva od 3x. Promatrajte leđa i glave riba (glava prema gledatelju).
|
a)
|
Smjestite ribe u malu Petrijevu zdjelicu (primjerice promjera 100 mm) glavom prema naprijed i trbuhom prema dolje. Usmjerite tražilo kako biste prepoznali izrasline. Nježno i polako okrećite ribe s jedne na drugu stranu kako biste pronašli izrasline. Izbrojite i ocijenite izrasline.
|
|
b)
|
Pregledajte površinu trbušne strane glave tako da ribu u Petrijevoj zdjelici smjestite leđima prema naprijed.
|
|
c)
|
Promatranje svake ribe trebalo bi trajati najviše dvije minute.
|
Brojanje i ocjenjivanje izraslina
Utvrđeno je šest posebnih područja za ocjenu pojave i razvoja izraslina u odraslih debeloglavih gavčica. Izrađen je obrazac za evidentiranje mjesta i broja izraslina (vidi završetak ovog Dodatka). Broj se izraslina evidentira, a njihova se veličina ocjenjuje kao: 0 – izostanak, 1 – prisutne, 2 – uvećane i 3 – izražene za svaki organizam (slika 1.).
Ocjena 0 – izostanak izraslina. Ocjena 1 – prisutne odnosi se na sve izrasline s jednostrukim vrhom čija je visina gotovo jednaka njezinu polumjeru (promjeru). Ocjena 2 – uvećane odnosi se na tkivo koje nalikuje zvjezdici koje u pravilu ima veliku radijalnu osnovu s udubinama i brazdama koje se izdižu iz središta. Vrh izrasline često je više nazubljen, ali u nekim slučajevima može biti i zaobljen. Ocjena 3 – izražene odnosi se na prilično velike i zaobljene izrasline slabije definirane strukture. Te će izrasline u nekim slučajevima tvoriti jedinstvenu tvorbu duž jednog ili kombinacije područja (B, C i D, prema opisu u nastavku). Boja i uzorak nalikuju ocjeni 2, ali su u nekim slučajevima prilično neodređeni. Posljedica će primjene ovog sustava ocjenjivanja biti ukupne ocjene izraslina < 50 u normalnog kontrolnog mužjaka koji ima od 18 do 20 izraslina (Jensen et al., 2001.).
Slika 1.

Stvarni broj izraslina u nekih riba može premašivati broj polja u obrascu za određeno područje ocjenjivanja (Dodatak A). U tom slučaju moguće je dodatne ocjene navesti desno ili lijevo od polja. Stoga obrazac ne treba biti simetričan. Dodatna metoda mapiranja izraslina koje su u paru ili se nalaze u skupinama duž horizontalne ravnine usta jest dvostruko označavanje dviju točaka za ocjenjivanje izraslina u jednom polju.
Područja mapiranja:
A– izrasline oko očiju. Nalaze se s leđne i trbušne strane oko prednjeg ruba oka. Često višestruke u zrelih mužjaka iz kontrolnih skupina, nisu prisutne u ženki iz kontrolnih skupina, u pravilu u paru (po jedna blizu svakog oka) ili jednostruke u ženki izloženih androgenima.
B– izrasline između nosnica (pora osjetilnih kanala). U pravilu u parovima u mužjaka iz kontrolnih skupina na višim razinama (2 – uvećane ili 3 – izražene) razvoja. Izraslina nema u ženki iz kontrolnih skupina, dok je u ženki izloženih androgenima uočena njihova pojava i razvoj.
C– izrasline neposredno ispred nosnica, paralelno s ustima. U pravilu uvećane ili izražene u zrelih mužjaka iz kontrolnih skupina. Prisutne ili uvećane u slabije razvijenih mužjaka ili ženki tretiranih androgenima.
D– izrasline smještene paralelno duž linije ustiju. U pravilu se ocjenjuju kao razvijene u mužjaka iz kontrolnih skupina. Nema ih u ženki iz kontrolnih skupina, ali su prisutne u ženki izloženih androgenima.
E– izrasline na donjoj čeljusti, blizu usta, u pravilu malene i obično u parovima. Njihova pojava varira u mužjaka iz kontrolnih skupina, tretiranih mužjaka i tretiranih ženki.
F– izrasline s trbušne strane u odnosu na E. Obično malene i u parovima. Prisutne u mužjaka iz kontrolnih skupina i ženki izloženih androgenima.
UPUĆIVANJA
|
(1)
|
Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001.). Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20: 1276.–1290.
|
|
(2)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Hornung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray EL. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22: 1350.–1360.
|
|
(3)
|
Harries JE, Runnalls T, Hill E, Harris CA, Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34: 3003.–3011.
|
|
(4)
|
Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001.). Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128: 127.–141.
|
|
(5)
|
Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001.). Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59: 515.–523.
|
|
(6)
|
Miles-Richardson SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47: 129.–145.
|
|
(7)
|
Smith RJF. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52: 1031.–1038.
|
|
Obrazac za ocjenu izraslina
|
Brojčana ocjena
|
|
Oznaka
|
1 – prisutne
|
|
Datum
|
2 – uvećane
|
|
Ukupna ocjena
|
3 – izražene
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Dodatak 5.B
Procjena sekundarnih spolnih obilježja u medake radi otkrivanja određenih endokrino aktivnih kemikalija
U nastavku se opisuje mjerenje papilarnih procesa (21) koji su sekundarno spolno obilježje u medake (Oryzias latipes).
|
(1)
|
Nakon vađenja jetre (Dodatak 6.) truplo se stavlja u epruvetu s približno 10 ml 10-postotnog neutralnog puferiranog formalina (glavom prema gore). Ako je gonada fiksirana otopinom koja nije 10-postotni neutralni puferirani formalin, s pomoću skalpela napravite poprečni rez preko trupla između prednjeg dijela podrepne peraje i anusa, pazeći pritom da ne oštetite gonoporu i samu gonadu (slika 3.). Stavite glavu ribe u otopinu za fiksiranje radi očuvanja gonade, a rep u 10-postotni neutralni puferirani formalin prema prethodnom opisu.
|
|
(2)
|
Nakon što ste ribu stavili u 10-postotni neutralni puferirani formalin, pincetom uhvatite prednji dio podrepne peraje i držite ga presavijenog približno 30 sekundi kako biste otvorili podrepnu peraju. Pri hvatanju podrepne peraje pincetom uhvatite i nekoliko šipčica peraje u prednjem dijelu, pazeći pritom da ne ogrebete papilarne procese.
|
|
(3)
|
Nakon što je podrepna peraja bila otvorena 30 sekundi, pohranite tijelo ribe u 10-postotni neutralni puferirani formalin na sobnoj temperaturi do mjerenja papilarnih procesa (mjerenje je potrebno provesti nakon najmanje 24-satnog fiksiranja).
|
Mjerenje
|
(1)
|
Nakon fiksiranja tijela ribe u 10-postotnom neutralnom puferiranom formalinu u trajanju od najmanje 24 sata, izvadite truplo ribe iz epruvete i obrišite formalin filtarskim papirom (ili papirnatim ručnikom).
|
|
(2)
|
Položite ribu trbuhom prema gore. Škaricama pažljivo zarežite podrepnu peraju (poželjno je, osim podrepne peraje, odrezati i mali dio perajne potpore).
|
|
(3)
|
Pincetom uhvatite prednji dio odrezane podrepne peraje i stavite ga na stakalce s nekoliko kapi vode. Potom podrepnu peraju pokrijte pokrivnim stakalcem. Pazite da pri hvatanju podrepne peraje pincetom ne ogrebete papilarne procese.
|
|
(4)
|
Prebrojite kosti bodlje s papilarnim procesima s pomoću brojača pod biološkim mikroskopom (uspravni ili obrnuti mikroskop). Papilarni procesi uočavaju se kad je mala nakupina procesa vidljiva na stražnjem dijelu kosti bodlje. U obrazac zabilježite broj kosti bodlje s papilarnim procesima na svakoj šipčici peraje (primjerice, prva šipčica peraje: 0, druga šipčica peraje: 10, treća šipčica peraje: 12, itd.) te u tablicu u Excelu unesite zbroj tih brojeva prema pojedinačnim ribama. Po potrebi fotografirajte podrepnu peraju i na fotografiji prebrojite kosti bodlje s papilarnim procesima.
|
|
(5)
|
Nakon mjerenja stavite podrepnu peraju u epruvetu kako je opisano u točki (1) i pohranite je.
|
Slika 1.
Dijagram s prikazom spolnih razlika u obliku i veličini podrepne peraje. A, mužjak; B, ženka. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

Slika 2.
A – procesi na kostima bodlje šipčice podrepne peraje. J.P. – kost bodlje; A.S. – aksijalni prostor; P. – proces. B – krajnji dio šipčice peraje. Na vrhu se nalaze Actinotrichia (Act.). Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.
Slika 3.
Fotografija tijela ribe i prikaz mjesta reza kad je gonada fiksirana u otopini za fiksiranje koja nije 10-postotni neutralni puferirani formalin. U tom slučaju ostatak tijela odrezat će se između prednjeg dijela podrepne peraje i anusa s pomoću skalpela (crvena pruga); glava ribe stavit će se u otopinu za fiksiranje gonade, a rep u 10-postotni neutralni puferirani formalin.

Dodatak 6.
Preporučeni postupci za uzimanje uzoraka za analizu vitelogenina
Potrebno je paziti da ne dođe do unakrsne kontaminacije uzoraka VTG-a mužjaka i ženki.
Postupak 1.A: debeloglava gavčica, uzimanje krvi iz repne vene/arterije
Nakon anestezije, korijen repa se djelomično odvaja skalpelom i uzima se krv iz repne vene/arterije s pomoću heparinizirane mikrohematokritske kapilarne epruvete. Nakon uzimanja krvi plazma se brzo izolira centrifugom pri 15 000 g u trajanju od tri minute (ili centrifugom u trajanju od deset minuta pri 15 000g na 4 °C). Postotak hematokrita može se, po želji, utvrditi nakon centrifugiranja. Plazma se potom uklanja iz mikrohematokritske epruvete i pohranjuje u epruvetu za centrifugu uz 0,13 jedinica aprotinina (inhibitora proteaze) na – 80 °C do mogućnosti utvrđivanja vitelogenina. Ovisno o veličini debeloglave gavčice (koja ovisi o spolu), prikupljeni volumen plazme obično se kreće od pet do 60 mikrolitara po ribi (Jensen et al., 2001.).
Postupak 1.B debeloglava gavčica, uzimanje krvi iz srca
Druga je mogućnost uzimanje krvi punkcijom srca s pomoću heparinizirane šprice (1 000 jedinica heparina po ml). Krv se stavlja u Eppendorfove epruvete (koje se čuvaju na ledu) i potom centrifugira (pet minuta; 7 000 g, na sobnoj temperaturi). Plazmu treba premjestiti u čiste Eppendorfove epruvete (u alikvotima ako to dopušta volumen plazme) i odmah smrznuti na – 80 °C do analize (Panter et al., 1998.).
Postupak 2.A: japanska medaka, vađenje jetre u medake
Uklanjanje pokusne ribe iz ispitne posude
|
(1)
|
Pokusnu ribu potrebno je izvaditi iz ispitne posude malom mrežom u obliku žlice. Pazite da ne ispustite pokusnu ribu u ostale ispitne posude.
|
|
(2)
|
Pokusne ribe u pravilu je potrebno vaditi sljedećim redoslijedom: kontrolna skupina, kontrola skupina s otapalom (ako postoji), najniža koncentracija, srednja koncentracija, najviša koncentracija i pozitivna kontrolna skupina. Osim toga, iz ispitne posude treba izvaditi sve mužjake prije vađenja preostalih ženki.
|
|
(3)
|
Spol pokusnih riba utvrđuje se na temelju vanjskih sekundarnih spolnih obilježja (primjerice oblika podrepne peraje).
|
|
(4)
|
Stavite ribu u spremnik za transport i odnesite je do radne stanice radi vađenja jetre. Provjerite točnost oznaka na ispitnoj komori i spremniku za transport i provjerite je li broj riba koje su izvađene iz ispitne komore i broj riba preostalih u ispitnoj komori u skladu s očekivanjima.
|
|
(5)
|
Ako se spol ne može utvrditi iz vanjskog izgleda riba, izvadite sve ribe iz ispitne komore. Spol je u tom slučaju potrebno utvrditi promatranjem gonade ili sekundarnih spolnih obilježja pod stereoskopskim mikroskopom.
|
Vađenje jetre
|
(1)
|
Premjestite pokusnu ribu iz spremnika za transport u otopinu anestetika malom mrežom u obliku žlice.
|
|
(2)
|
Nakon anestezije pincetom (običnom) premjestite pokusnu ribu na filtarski papir (ili papirnati ručnik). Pri hvatanju pokusne ribe pincetom obuhvatite glavu kako ne bi došlo do kidanja repa.
|
|
(3)
|
Obrišite vodu s površine pokusne ribe filtarskim papirom (ili papirnatim ručnikom).
|
|
(4)
|
Položite ribu trbuhom prema gore. Potom škaricama napravite mali poprečni rez od leđnog dijela vrata do područja srednjeg trbuha.
|
|
(5)
|
Umetnite škarice u mali rez i zarežite trbuh od točke sa stražnje strane škržnog plašta do prednje strane anusa duž središnje linije abdomena. Pazite da škarice ne umetnete preduboko kako ne bi došlo do oštećenja jetre i gonade.
|
|
(6)
|
Obavite sljedeće postupke pod stereoskopskim mikroskopom.
|
|
(7)
|
Položite pokusnu ribu trbuhom prema gore na papirnati ručnik (pri ruci moraju biti i staklena Petrijeva zdjelica ili stakalce).
|
|
(8)
|
Proširite stijenke trbušne šupljine preciznom pincetom i izvadite unutarnje organe. Prihvatljivo je, po potrebi, i vađenje unutarnjih organa uklanjanjem jedne strane stijenke trbušne šupljine.
|
|
(9)
|
Otkrijte spojeni dio jetre i žučnog mjehura drugom preciznom pincetom. Potom uhvatite žučni kanal i odrežite žučni mjehur. Pazite da ne dođe do trganja žučnog mjehura.
|
|
(10)
|
Uhvatite jednjak i na isti način razdvojite probavni trakt od jetre. Pazite da ne dođe do izlijevanja sadržaja probavnog trakta. Odvojite stražnji dio probavnog trakta od anusa i izvadite ga iz trbušne šupljine.
|
|
(11)
|
Uklonite mast i ostala tkiva s vanjskog dijela jetre. Pazite da ne ogrebete jetru.
|
|
(12)
|
Preciznom pincetom uhvatite jetru i uklonite je iz trbušne šupljine.
|
|
(13)
|
Položite jetru na stakalce. Po potrebi, s površine jetre preciznom pincetom uklonite višak masti i okolnog tkiva (primjerice trbušnu ovojnicu).
|
|
(14)
|
Izvažite jetru s pomoću elektroničke analitičke vage i mikroepruvete od 1,5 ml kao tare. Zabilježite vrijednost u obrazac (očitanje: 0,1 mg). Potvrdite podatke o identifikaciji na naljepnici mikroepruvete.
|
|
(15)
|
Zatvorite poklopac mikroepruvete u kojoj se nalazi jetra. Pohranite je u stalak za hlađenje (ili stalak s ledom).
|
|
(16)
|
Nakon vađenja jedne jetre instrumente očistite ili ih zamijenite čistima.
|
|
(17)
|
Izvadite jetre svim ribama u spremniku za transport kako je prethodno opisano.
|
|
(18)
|
Nakon vađenja jetara svim ribama u spremniku za transport (odnosno svim mužjacima ili ženkama u ispitnoj komori) stavite sve uzorke jetara u stalak za epruvete s identifikacijskom oznakom i pohranite ih u zamrzivač. U slučaju uzimanja jetara za preliminarno tretiranje ubrzo nakon vađenja primjerci se do sljedeće radne stanice nose u stalku za hlađenje (ili stalku s ledom).
|
Nakon vađenja jetre truplo ribe podvrgava se mjerenju sekundarnih spolnih obilježja.
Uzorak
Pohranite uzorke jetara pokusnih riba na ≤ – 70 °C ako se one ne podvrgavaju preliminarnom tretiranju ubrzo nakon vađenja.
Slika 1.
Škarama se načini rez neposredno ispred prsnih peraja.

Slika 2.
Škarama se razreže središnja linija abdomena do točke približno 2 mm od kranijalne strane anusa.

Slika 3.
Pincetom se trbušne stijenke šire radi vađenja jetre i ostalih unutarnjih organa. (Druga je mogućnost bočno pričvrstiti trbušne stijenke).

Slika 4.
Jetra se izrezuje i vadi s pomoću pincete.

Slika 5.
Crijeva se nježno povlače pincetom.
Slika 6.
Škarama se režu oba kraja crijeva i sva mezenterička vezivna tkiva.

Slika 7. (ženka)
Postupak je jednak za ženke.

Slika 8.
Kraj postupka.

Postupak 2.B: japanska medaka (Oryzias latipes), preliminarno tretiranje jetre za analizu vitelogenina
Uzmite bocu homogenizacijskog pufera iz kompleta za analizu ELISA i ohladite je smrvljenim ledom (temperatura otopine: ≤ 4 °C). U slučaju upotrebe homogenizacijskog pufera iz sustava EnBio ELISA otopite otopinu na sobnu temperaturu, a potom bocu ohladite smrvljenim ledom.
Izračunajte volumen homogenizacijskog pufera za jetru na temelju njezine mase (dodajte 50 μl homogenizacijskog pufera po mg mase jetre za homogenat). Primjerice, ako masa jetre iznosi 4,5 μl, volumen homogenizacijskog pufera za jetru iznosi 225 μl. Sastavite popis volumena homogenizacijskog pufera za sve jetre.
Priprema jetre za preliminarno tretiranje
|
(1)
|
Neposredno prije tretiranja iz zamrzivača izvadite mikroepruvetu od 1,5 ml u kojoj se nalazi jetra.
|
|
(2)
|
Preliminarno tretiranje jetre mužjaka potrebno je obaviti prije ženki kako bi se izbjegla kontaminacija vitelogenina. Osim toga, preliminarno tretiranje ispitnih skupina potrebno je obaviti sljedećim redoslijedom: kontrolna skupina, kontrolna skupina za otapalo (ako postoji), najniža koncentracija, srednja koncentracija, najviša koncentracija i pozitivna kontrola.
|
|
(3)
|
Broj mikroepruveta od 1,5 ml s primjercima jetara izvađenih iz zamrzivača u određenom trenutku ne smije premašiti broj mikroepruveta koje je moguće istovremeno centrifugirati.
|
|
(4)
|
Poredajte mikroepruvete od 1,5 ml s primjercima jetara prema redoslijedu broja primjerka na stalku s ledom (jetre ne treba otapati).
|
Postupak preliminarnog tretiranja
1. Dodavanje homogenizacijskog pufera
|
(1)
|
Provjerite popis kako biste utvrdili koji je volumen homogenizacijskog pufera potrebno upotrijebiti za određeni uzorak jetre i podesite mikropipetu (raspon volumena: 100 – 1 000 μl) na odgovarajući volumen. Na mikropipetu stavite čisti vrh.
|
|
(2)
|
Uzmite homogenizacijski pufer iz boce s reagensom i dodajte pufer u mikroepruvetu od 1,5 ml u kojoj se nalazi jetra.
|
|
(3)
|
Dodajte homogenizacijski pufer u sve mikroepruvete od 1,5 ml u kojima se nalazi jetra prema prethodno opisanom postupku. Vrh mikropipete nije potrebno zamijeniti novim. Međutim, vrh je potrebno zamijeniti ako je kontaminiran ili se sumnja na kontaminaciju.
|
2. Homogenizacija jetre
|
(1)
|
Na homogenizator mikroepruveta stavite novi tučak za homogenizaciju.
|
|
(2)
|
Stavite tučak u mikroepruvetu od 1,5 ml. Držite homogenizator mikroepruveta tako da jetru pritišćete između površine tučka i unutarnje stijenke mikroepruvete od 1,5 ml.
|
|
(3)
|
Uključite homogenizator mikroepruveta na 10 do 20 sekundi. Tijekom postupka hladite mikroepruvetu od 1,5 ml smrvljenim ledom.
|
|
(4)
|
Izvadite tučak iz mikroepruvete i odložite je na približno deset sekundi. Potom vizualnim pregledom utvrdite stanje suspenzije.
|
|
(5)
|
Ako su u suspenziji vidljivi djelići jetre, ponovite postupke (3) i (4) kako biste pripremili zadovoljavajući homogenat jetre.
|
|
(6)
|
Ohladite suspendirani homogenat jetre na stalku s ledom do centrifugiranja.
|
|
(7)
|
Mijenjajte tučak za svaki homogenat.
|
|
(8)
|
Homogenizirajte sve jetre homogenizacijskim puferom prema prethodno opisanom postupku.
|
3. Centrifugiranje suspendiranog homogenata jetre
|
(1)
|
Provjerite je li temperatura rashlađene komore za centrifugiranje ≤ 5 °C.
|
|
(2)
|
Stavite mikroepruvete od 1,5 ml u kojima se nalazi suspendirani homogenat jetre u rashlađenu centrifugu (po potrebi prilagodite ravnotežu).
|
|
(3)
|
Centrifugirajte suspendirani homogenat jetre deset minuta pri 13 000 g na ≤ 5 °C. Međutim, u slučaju pravilne separacije supernatanta centrifugalnu silu i vrijeme moguće je prilagoditi po potrebi.
|
|
(4)
|
Nakon centrifugiranja provjerite jesu li supernatanti pravilno separirani (površina: lipidi, sredina: supernatant, donji sloj: tkivo jetre). U slučaju nepravilne separacije suspenziju ponovno centrifugirajte u istim uvjetima.
|
|
(5)
|
Iz rashlađene centrifuge izvadite sve uzorke i poredajte ih prema broju uzorka na stalku s ledom. Pazite da nakon centrifugiranja ne dođe do ponovne suspenzije separiranih slojeva.
|
4. Vađenje supernatanta
|
(1)
|
U stalak za epruvete stavite četiri mikroepruvete od 0,5 ml za pohranu supernatanta.
|
|
(2)
|
Mikropipetom izvadite 30 μl svakog supernatanta (separiranog kao srednji sloj) i stavite u jednu mikroepruvetu od 0,5 ml. Pazite da ne zahvatite lipid na površini ili tkivo jetre iz donjeg sloja.
|
|
(3)
|
Izvadite supernatant i stavite ga u druge dvije mikroepruvete od 0,5 ml na prethodno opisani način.
|
|
(4)
|
Mikropipetom izvadite ostatak supernatanta (po mogućnosti: ≥ 100 μl). Potom ga stavite u preostalu mikroepruvetu od 0,5 ml. Pazite da ne zahvatite lipid na površini ili tkivo jetre iz donjeg sloja.
|
|
(5)
|
Zatvorite poklopac mikroepruvete od 0,5 ml i na naljepnicu zapišite volumen supernatanta. Mikroepruvete potom odmah ohladite na stalku s ledom.
|
|
(6)
|
Mijenjajte vrh mikropipete za svaki supernatant. Ako se na vrhu nakupi velika količina lipida, odmah ga promijenite kako ne bi došlo do kontaminacije ekstrakta jetre mašću.
|
|
(7)
|
Stavite sav centrifugirani supernatant u četiri mikroepruvete od 0,5 ml prema prethodno opisanom postupku.
|
|
(8)
|
Sve mikroepruvete od 0,5 ml u kojima se nalazi supernatant stavite u stalak za epruvete s identifikacijskim oznakama i potom ih odmah zamrznite u zamrzivaču. U slučaju mjerenja koncentracija VTG-a neposredno nakon preliminarnog tretiranja ostavite jednu mikroepruvetu od 0,5 ml (u kojoj se nalazi 30 μl supernatanta) da se hladi u stalku za epruvete i odnesite je do radne stanice gdje se provodi test ELISA. U tom slučaju stavite preostale mikroepruvete u stalke za epruvete i zamrznite ih u zamrzivaču.
|
|
(9)
|
Nakon vađenja supernatanta ostatke zbrinite na odgovarajući način.
|
Čuvanje uzorka
Mikroepruvete od 0,5 ml u kojima se nalazi supernatant homogenata jetre čuvajte na ≤ – 70 °C do upotrebe za test ELISA.
Postupak 3.A: zebrica, uzimanje krvi iz repne vene/arterije
Neposredno nakon anestezije korijen repa poprečno se zarezuje i uzima se krv iz repne arterije/vene s pomoću heparinizirane mikrohematokritske kapilarne epruvete. Volumen krvi kreće se od pet do 15 μl ovisno o veličini ribe. Jednaki volumen pufera aprotinina (6 μgml u fiziološkoj otopini s fosfatnim puferom) dodaje se u mikrokapilarnu epruvetu, dok se plazma centrifugiranjem odvaja od krvi (pet minuta pri 600 g). Plazma se stavlja u ispitne epruvete i čuva na – 20 °C do analize vitelogenina ili ostalih proteina koji mogu biti od interesa.
Postupak 3.B: zebrica, uzimanje krvi punkcijom srca
Kako bi se izbjeglo zgrušavanje krvi i propadanje proteina, uzorci se uzimaju u fiziološkoj otopini s fosfatnim puferom koja sadržava heparin (1 000 jedinica/ml) i aprotinin (inhibitor proteaze) (2 TIU/ml). Kao sastojci za pufer preporučuju se amonijev heparin i liofilizirani aprotinin. Za uzimanje uzorka krvi preporučuje se šprica (1 ml) s fiksnom tankom iglom (primjerice Braun Omnikan-F). Špricu je potrebno prethodno napuniti puferom (približno 100 μl) kako bi se iz svake ribe u potpunosti eluirale male količine krvi. Uzorci krvi uzimaju se punkcijom srca. Ribi je prvo potrebno dati anestetik MS-222 (100 mg/l). Pri odgovarajućem stupnju anestezije korisnik može razlikovati otkucaje srca zebrice. Pri punkciji srca klip šprice treba biti blago napet. Izvađene količine krvi kreću se od 20 do 40 mikrolitara. Nakon punkcije srca smjesu krvi i pufera potrebno je staviti u ispitnu epruvetu. Plazma se odvaja od krvi centrifugiranjem (20 minuta; 5 000 g) i do analize čuva na – 80 °C.
Postupak 3.C: SOP: zebrica, homogenizacija glave i repa
|
(1)
|
Ribe se anesteziraju i usmrćuju u skladu s opisom ispitivanja.
|
|
(2)
|
Glava i rep režu se u skladu sa slikom 1.
|
Važno: Sve instrumente za seciranje i podlogu za rezanje potrebno je pravilno isprati i očistiti (primjerice 96-postotnim etanolom) između rukovanja svakom ribom kako bi se spriječilo da ženke ili inducirani mužjaci kontaminiraju neinducirane mužjake vitelogeninom.
Slika 1.
|
(1)
|
Težina odrezane glave i repa svake ribe mjeri se do najbližeg mg.
|
|
(2)
|
Dijelovi se nakon vaganja stavljaju u odgovarajuće epruvete (primjerice Eppendorfove epruvete od 1,5 ml) i zamrzavaju na – 80 °C do homogenizacije ili izravno homogeniziraju na ledu s pomoću dvaju plastičnih tučaka. (Ostale se metode mogu primjenjivati ako se provode na ledu, a rezultat je homogena smjesa). Važno: Epruvete je potrebno pravilno označiti brojevima kako bi se glava i rep mogli povezati s pripadajućim tijelom koje se upotrebljava za histologiju gonade.
|
|
(3)
|
Kad se dobije homogena smjesa, dodaje se (težinski) četiri puta toliko zamrznutog pufera za homogenizaciju (22). Nastavite raditi s tučcima dok smjesa ne postane homogena. Važna napomena: Za svaku se ribu upotrebljavaju novi tučci.
|
|
(4)
|
Uzorci se stavljaju na led do centrifugiranja na 4 °C pri 50 000 × g 30 minuta.
|
|
(5)
|
Pipetom stavite 20 μl supernatanta u najmanje dvije epruvete tako da vrh pipete umočite ispod površinskog sloja masti i pažljivo usišite supernatant bez masti ili dijelova taloga.
|
|
(6)
|
Epruvete se do upotrebe čuvaju na – 80 °C.
|
Dodatak 7.
Uzorci s pojačanom razinom vitelogenina i referentni standard među testovima
Svakog dana provođenja testova vitelogenina analizirat će se uzorak s pojačanom razinom izrađen s pomoću referentnog standarda među testovima. Vitelogenin za izradu referentnog standarda među testovima bit će iz različite serije od one za izradu standarda kalibracije za provođenje testa.
Uzorak s pojačanom razinom izradit će se dodavanjem poznate količine standarda među testovima uzorku plazme kontrolnih mužjaka. Uzorak se pojačava radi postizanja koncentracije vitelogenina koja je od 10 do 100 puta veća od očekivane koncentracije vitelogenina kontrolnih mužjaka riba. Uzorak plazme kontrolnih mužjaka koji se pojačava može potjecati od jedne ribe ili nekoliko riba.
Poduzorak nepojačane plazme kontrolnih mužjaka analizirat će se u najmanje dvije dvostruke jažice. I pojačani uzorak analizirat će se u najmanje dvije dvostruke jažice. Srednja količina vitelogenina iz dva nepojačana uzorka plazme kontrolnih mužjaka dodat će se izračunanoj količini vitelogenina koja je dodana uzorcima s pojačanom razinom; na taj se način određuje očekivana koncentracija. Omjer te očekivane i izmjerene koncentracije bilježit će se uz rezultate svakog kompleta testova provedenog tog dana.
Dodatak 8.
Grafikon odluke za statističku analizu

C.38. ANALIZA METAMORFOZE VODOZEMACA
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje (TG) 213 (2009.). Potreba za razvojem i potvrdom analize kojom se mogu otkriti aktivne kemikalije u tiroidnom sustavu kralježnjaka potječe iz zabrinutosti da razine kemikalija u okolišu mogu izazvati štetne učinke na ljude i na životinjski svijet. U 1998. OECD je započeo djelovanje visokog prioriteta radi revizije postojećih Smjernica za ispitivanje te radi razvoja novih Smjernica za preventivno ispitivanje i ispitivanje potencijalnih endokrinih ometača. Jedan od elementa aktivnosti bilo je razvijanje Smjernice za preventivno ispitivanje kemikalija koje djeluju na tiroidni sustav kralježnjaka. Predloženo je i poboljšanje 28-dnevnog ispitivanja oralne toksičnosti na glodavcima uz primjenu ponavljanih doza (Poglavlje B.7 ovog Priloga) i analize metamorfoze vodozemaca (AMA). Poboljšana ispitna metoda B.7 podvrgnuta je validaciji i izdana je revidirana ispitna metoda. Analiza metamorfoze vodozemaca (AMA) bila je podvrgnuta opsežnom programu validacije koji je uključivao intralaboratorijske i interlaboratorijske studije kojima su dokazane relevantnost i pouzdanost analize (1., 2.). Nakon toga validacija analiza bila je predmet recenzije skupine nezavisnih stručnjaka (3.). Ova ispitna metoda rezultat je iskustva stečenog tijekom validacijskih studija za otkrivanje kemikalija koje aktivno djeluju na štitnjaču i rada obavljenog na drugim mjestima u zemljama članicama OECD-a.
|
NAČELO ISPITIVANJA
|
2.
|
Analiza metamorfoze vodozemaca (AMA) jest preventivna analiza namijenjena empirijskoj identifikaciji kemikalija koje mogu ometati normalnu funkciju osovine hipotalamus-hipofiza-štitnjača (HPT). AMA predstavlja opći model kralježnjaka u onoj mjeri u kojoj se temelji na očuvanim strukturama i funkcijama HPT osovine. To je važna analiza jer metamorfoza vodozemaca pruža dobro proučavan proces ovisan o štitnjači, koji reagira na kemikalije aktivne u okviru HPT osovine te je jedina postojeća analiza kojom se otkriva aktivnost štitnjače u životinje koja prolazi morfološki razvoj.
|
|
3.
|
Opći plan pokusa podrazumijeva izlaganje 51. stadija Xenopus laevis punoglavaca najmanje trima različitim koncentracijama ispitivane kemikalije i kontroli s vodom za razrjeđenje za 21 dan. Postoje četiri ponavljanja svake ispitne obrade. Gustoća ličinaka na početku ispitivanja jest 20 punoglavaca po ispitnom spremniku za sve skupine obrade. Krajnji učinci promatranja jesu duljina stražnjih udova, duljina od vrha njuške do kloake (SVL), stadij razvoja, mokra masa, histologija štitnjače te svakodnevno promatranje smrtnosti.
|
OPIS METODE
Ispitne vrste
|
4.
|
Xenopus laevis rutinski se uzgaja u laboratorijima diljem svijeta i lako ju je nabaviti od komercijalnih dobavljača. Razmnožavanje ove vrste može se lako potaknuti cijele godine primjenom injekcija humanog korionskog gonadotropina (hCG) i rezultirajuće ličinke mogu se rutinski uzgajati do odabranih stadija razvoja u velikom broju kako bi se omogućila upotreba ispitnih protokola po određenim stadijima. Poželjno je da ličinke koje se upotrebljavaju u analizi potječu od odraslih jedinaka uzgojenih u laboratoriju. Kao druga mogućnost, iako to nije poželjan postupak, jajašca ili embriji mogu se poslati u laboratorij koji obavlja ispitivanja i može im se dopustiti da se aklimatiziraju; slanje u stadiju razvoja ličinke za upotrebu u ispitivanju neprihvatljivo je.
|
Oprema i potrepštine
|
5.
|
Za obavljanje ove analize potrebna je sljedeća oprema i potrepštine:
|
a)
|
sustav izlaganja (vidi opis u nastavku);
|
|
b)
|
akvariji od stakla ili nehrđajućeg čelika (vidi opis u nastavku);
|
|
d)
|
uređaji za kontroliranje temperature (npr. grijači ili hladnjaci (podesivi na 22 °± 1 °C));
|
|
f)
|
binokularni mikroskop za seciranje;
|
|
g)
|
digitalni fotoaparat s najmanje četirima megapikselima razlučivosti i mikrofunkcijom;
|
|
h)
|
softver za digitalizaciju slike;
|
|
i)
|
Petrijeva zdjelica (npr. 100 × 15 mm) ili prozirna plastična posuda usporedive veličine;
|
|
j)
|
analitička vaga s mogućnošću očitavanja do triju decimalnih mjesta (mg);
|
|
k)
|
mjerač otopljenog kisika;
|
|
l)
|
mjerač pH-vrijednosti;
|
|
m)
|
mjerač intenziteta svjetlosti s mogućnošću mjerenja u luksima;
|
|
n)
|
razne laboratorijske staklene posude i alati;
|
|
o)
|
podesive pipete (od 10 do 5 000 μl) ili razne pipete odgovarajućih veličina;
|
|
p)
|
ispitivana kemikalija u dostatnim količinama za provođenje studije, po mogućnosti od jedne serije;
|
|
q)
|
analitički instrumenti prikladni za kemikaliju na ispitivanju ili ugovorene analitičke usluge.
|
|
Kemijska ispitljivost
|
6.
|
AMA se temelji na protokolu vodenog izlaganja, pri čemu se ispitivana kemikalija uvodi u ispitne posude preko protočnog sustava. Međutim, protočnim metodama uvode se ograničenja na vrste kemikalija koje se mogu ispitati, kako je određeno fizikalno-kemijskim svojstvima kemikalije. Stoga, prije upotrebe ovog protokola potrebno je dobiti osnovne podatke o kemikaliji koja je bitna za određivanje ispitljivosti i potrebno je proučiti Smjernicu OECD-a o ispitivanju toksičnosti teških tvari i smjesa u vodi (4). Značajke koje ukazuju na to da može biti teško ispitati kemikaliju u vodenim sustavima uključuju: visoke koeficijente razdjeljenja oktanol/voda (log Kow), visoku hlapljivost, osjetljivost na hidrolizu i osjetljivost na fotolizu u laboratorijskim uvjetima okolnog osvjetljenja. Ostali faktori mogu biti jednako tako važni za određivanje ispitljivosti i potrebno ih je utvrditi za svaki slučaj zasebno. Ako uspješno ispitivanje nije moguće za kemikaliju primjenom protočnog sustava ispitivanja, može se upotrebljavati statički sustav s obnavljanjem. Ako nijedan sustav ne može prihvatiti ispitivanu kemikaliju, onda se podrazumijeva da se tu kemikaliju neće ispitivati s pomoću ovog protokola.
|
Sustav izlaganja
|
7.
|
Protočnom sustavu razrjeđivanja daje se prednost nad statičkim sustavom s obnavljanjem. Ako fizička i/ili kemijska svojstava bilo kojeispitivane kemikalije nisu prikladna za protočni sustav razrjeđivanja, tada se može primijeniti alternativni sustav izlaganja (npr. statički sustav s obnavljanjem). Sustavne komponente trebaju imati komponente koje su u dodiru s vodom od stakla, nehrđajućeg čelika i/ili politetrafluoroetilena. Međutim, mogu se upotrebljavati prikladni plastični materijali ako se time ne ugrožava studija. Spremnici za izlaganja trebali bi biti akvariji od stakla ili nehrđajućeg čelika, opremljeni cijevnim nastavcima koji rezultiraju približnim volumenom spremnika između 4,0 i 10,0 litara i minimalnom dubinom vode od 10 do 15 cm. Sustav bi trebao moći podržati sve koncentracije izlaganja i kontrolu s četirima ponavljanjima po obradi. Brzina protoka za svaki spremnik trebala bi biti konstantna s obzirom na održavanje bioloških uvjeta i izlaganje kemikalije (npr. 25 ml/min). Spremnike za obradu potrebno je nasumice rasporediti na položaj u sustavu izlaganja kako bi se smanjili potencijalni učinci položaja, uključujući manja odstupanja temperature, intenziteta svjetlosti itd. Fluorescentnu rasvjetu potrebno je upotrebljavati za dobivanje fotoperioda od 12 sati svjetla: 12 sati mraka uz intenzitet koji varira od 600 do 2 000 luksa (lumen/m2) na površini vode. Temperaturu vode potrebno je održavati na 22 ° ± 1 °C, pH-vrijednost održavati između 6,5 i 8,5, a koncentraciju otopljenog kisika (DO) > 3,5 mg/l (> 40 % zasićenosti kisikom) u svakom ispitnom spremniku. Kao minimalnu temperaturu vode, pH-vrijednost i otopljeni kisik potrebno je mjeriti tjedno; poželjno je stalno mjeriti temperaturu u najmanje jednoj ispitnoj posudi. U Dodatku 1. navode se pokusni uvjeti u skladu s kojima je potrebno izvršiti protokol. Za daljnje informacije o postavljanju protočnih sustava izlaganja i/ili statičkih sustava s obnavljanjem vidi Standardni vodič za provođenje ispitivanja akutne toksičnosti na ispitivanim materijalima s ribama, makrobeskralježnjacima i vodozemcima Američkog društva za testiranje i materijale (5) i opća toksikološka ispitivanja vode.
|
Kakvoća vode
|
8.
|
Može se upotrebljavati bilo koja lokalno dostupna voda (npr. izvorska voda ili voda iz slavine filtrirana aktivnim ugljenom) koja omogućava normalan rast i razvoj punoglavaca X. Laevis. Budući da se kakvoća lokalne vode može znatno razlikovati od jednog do drugog područja, potrebno je provesti analizu kakvoće vode, pogotovo ako nisu dostupni povijesni podaci o korisnosti vode za uzgoj Xenopusa. Posebno se treba pobrinuti da je voda bez bakra, klora i kloramina, koji su svi toksični za žabe i punoglavce. Nadalje se preporučuje analizirati vodu u vezi s pozadinskim razinama fluorida, perklorata i klorata (nusproizvodi dezinfekcije vode za piće) s obzirom na to da su svi ovi anioni supstrati nosača joda štitnjače i povećane razine svakog od ovih aniona mogu poremetiti rezultate studije. Analizu je potrebno obaviti prije početka ispitivanja, a ispitna voda obično ne bi trebala sadržavati te anione.
|
Koncentracija jodida u ispitnoj vodi
|
9.
|
Kako bi štitnjača sintetizirala TH, ličinkama treba biti dostupna dovoljna količina jodida putem kombinacije vode i prehrambenih izvora. Trenutačno ne postoje empirijski dobivene smjernice za minimalne koncentracije jodida. Međutim, dostupnost jodida može utjecati na reakciju tiroidnog sustava na aktivna sredstva i poznato je da modulira bazalnu aktivnost štitnjače, što je aspekt koji zaslužuje pozornost prilikom tumačenja rezultata histopatologije štitnjače. Dakle, potrebno je zabilježiti izmjerene koncentracije jodida u vodi iz ispitne vode. Na temelju dostupnih podataka iz validacijskih studija pokazalo se da protokol dobro funkcionira kada se koncentracije jodida (I-) ispitne vode kreću u rasponu između 0,5 i 10 ug/l. U idealnom slučaju minimalna koncentracija jodida u ispitnoj vodi trebala bi biti 0,5 μg/l. Ako se ispitna voda pomiješa s deioniziranom vodom, potrebno je dodati jod u minimalnoj koncentraciji od 0,5 μg/l. U izvješću je potrebno navesti sva naknadna dodavanja joda ili drugih soli ispitnoj vodi.
|
Držanje životinja
Njega i uzgoj odraslih životinja
|
10.
|
Njega i uzgoj odraslih životinja provode se u skladu sa standardnim smjernicama, a za detaljnije informacije čitatelja se upućuje na standardni vodič za obavljanje analize teratogeneze embrija žabe (FETAX) (6). Takvim standardnim smjernicama daje se primjer odgovarajuće njege i uzgojnih metoda, ali strogo pridržavanje nije potrebno. Kako bi se potaknuo uzgoj, parovima (3 – 5) odraslih ženki i mužjaka ubrizgava se humani korionski gonadotropin (hCG). Ženskim i muškim primjercima ubrizgava se oko 800 IU-1 000 IU i 600 IU-800 IU hCG-a otopljenog u 0,6 – 0,9 % slane otopine. Uzgojni parovi drže se u velikim spremnicima, neometano i pod statičkim uvjetima radi poticanja ampleksusa (vanjske oplodnje). Dno svakog spremnika za parenje trebalo bi imati lažno dno od nehrđajućeg čelika ili plastične mrežice, koja omogućava da mase jajašaca padnu na dno spremnika. Žabe kojima je hCG ubrizganu kasnim poslijepodnevnim satima obično će položiti većinu svojih jajašaca do sredine jutra sljedećeg dana. Nakon izbacivanja i oplodnje dovoljne količine jajašaca potrebno je ukloniti odrasle životinje iz spremnika za uzgoj.
|
Njega i odabir ličinaka
|
11.
|
Nakon uklanjanja odraslih životinja iz spremnika za uzgoj jajašca se skupljaju i ocjenjuje se njihova sposobnost preživljavanja na reprezentativnoj podskupini embrija iz svih spremnika za uzgoj. Najbolju pojedinačnu ikru, ili više njih, (preporučuje se 2 – 3 za procjenu kvalitete ikre) potrebno je zadržati na temelju sposobnosti preživljavanja embrija i prisutnosti odgovarajućeg broja (minimalno 1 500) embrija. Svi organizmi koji se upotrebljavaju u istraživanju trebali bi potjecati iz jednog mriještenja (tj. ikre se ne smiju miješati). Embriji se prebacuju u veliku ravnu zdjelu ili posudu, a sva očito mrtva ili nenormalna jajašca (vidi definiciju pod (5)) uklanjaju se s pomoću pipete ili kapaljke. Zdravi embriji iz svakog od triju mrijestova prenose se u tri odvojena spremnika za izleganje. Četiri dana nakon stavljanja u spremnike za izlijeganje odabire se najbolji mrijest na temelju sposobnosti preživljavanja i uspjeha izlijeganja, a ličinke se prenose u odgovarajući broj spremnika za uzgoj na 22° ± 1 °C. Osim toga, dodatne ličinke sele se u posebne spremnike za upotrebu kao zamjena u slučaju pojave smrtnosti u spremnicima za uzgoj tijekom prvog tjedna. Ovim postupkom održava se konzistentna gustoća organizma i time se smanjuju razvojna odstupanja u skupini jednog mrijesta. Sve spremnike za uzgoj potrebno je čistiti svakodnevno. Kao mjeru opreza poželjnije je upotrebljavati vinilne ili nitrilne rukavice nego gumene rukavice. Uginule ličinke potrebno je ukloniti svakodnevno i nadomjestiti zamjenskim ličinkama kako bi se održala gustoća organizama u prvom tjednu. Hranjenje se vrši najmanje dvaput dnevno.
|
|
12.
|
Tijekom faze prije izlaganja punoglavci se prilagođavaju uvjetima stvarne faze izlaganja, uključujući vrstu hrane, temperaturu, ciklus svjetla i mraka te hranjivu podlogu za uzgoj kulture. Stoga se preporučuje upotreba iste kulture/vode za razrjeđivanje tijekom faze prije izlaganja i faze izlaganja. Ako se upotrebljava sustav statične kulture za održavanje punoglavaca tijekom faze prije izlaganja, hranjivu podlogu za uzgoj kulture potrebno je potpuno zamijeniti najmanje dvaput tjedno. Naguravanje prouzročeno velikom gustoćom ličinaka u razdoblju prije izlaganja potrebno je izbjegavati jer takvi učinci mogu znatno utjecati na razvoj punoglavaca u sljedećoj fazi ispitivanja. Stoga gustoća uzgoja ne smije prelaziti oko četiri punoglavaca po litri hranjive podloge (sustav statičnog izlaganja) ili deset punoglavaca po litri hranjive podloge (s npr. 50 ml/min brzine protoka u sustavu prije izlaganja ili sustavu uzgoja). U tim uvjetima punoglavci bi se trebali razviti iz 45./46. stadija do 51. stadija u roku od dvanaest dana. Reprezentativne punoglavce ove matične populacije potrebno je pregledati svakodnevno zbog stadija razvoja kako bi se procijenila odgovarajuća vremenska točka za početak izlaganja. Potrebno je paziti da se stres i trauma u punoglavaca svedu na najmanju moguću mjeru, pogotovo za vrijeme kretanja, čišćenja akvarija i rukovanja ličinkama. Potrebno je izbjegavati stresne uvjete/aktivnosti kao što su glasna i/ili neprekidna buka, tapkanje po akvariju, vibracije u akvariju, prekomjerna aktivnost u laboratoriju i brze promjene sastavnica okoliša (dostupnost svjetla, temperatura, pH-vrijednost, DO, brzine protoka vode itd.). Ako se punoglavci ne razviju do 51. stadija u roku od 17 dana nakon oplodnje, prekomjerni stres potrebno je smatrati potencijalnim krivcem.
|
Hranjiva podloga i ishrana ličinaka
|
13.
|
Punoglavci se hrane npr. hranom za punoglavce koja je komercijalno dostupna i upotrebljava se u validacijskim studijama (vidi i Dodatak 1.) tijekom razdoblja prije izlaganja (nakon Nieuwkoop i Faberova (NF) 45./46. stadija (8)) i tijekom cijelog 21-dnevnog razdoblja ispitivanja ili drugom hranom za koju se pokazalo da pruža jednaku uspješnost analize metamorfoze vodozemaca. Režim hranjenja u razdoblju prije izlaganja potrebno je pažljivo prilagoditi kako bi se zadovoljile potrebe punoglavaca u razvoju. Prema tome, potrebno je osigurati male porcije hrane novo izleglim punoglavcima nekoliko puta dnevno (najmanje dvaput). Višak hrane potrebno je izbjegavati kako bi se i) zadržala kakvoća vode i ii) spriječilo začepljenje filtera česticama hrane i organskim otpacima. Za hranu za punoglavce koja se upotrebljava u validacijskim studijama, dnevne porcije potrebno je povećati s rastom punoglavca do otprilike 30 mg po životinji na dan neposredno prije početka ispitivanja. Validacijske studije pokazale su da se ovom komercijalno dostupnom hranom podržava pravilan rast i razvoj punoglavaca X. Laevis. To je fina čestica koja ostaje lebdjeti u vodenom stupcu dugo vremena i ispire se protokom vode. Ukupnu dnevnu količinu hrane stoga je potrebno podijeliti na manje porcije i upotrijebiti za hranjenje najmanje dvaput dnevno. Za ovu hranu režim hranjenja naveden je u tablici 1. Potrebno je zabilježiti količine hranjenja. To može biti suha hrana ili kao radna otopina pripremljena u vodi za razrjeđivanje. Takvu radnu otopinu potrebno je pripremiti svježu svaki drugi dan i spremiti na 4 °C kada se ne upotrebljava.
Tablica 1.
Režim hranjenja s hranom za punoglavce koja je komercijalno dostupna i koja se upotrebljava u validacijskim studijama za punoglavce X. Laevis tijekom dijela životnog ciklusa AMA-e u protočnim uvjetima
|
Dan istraživanja
|
Porcija hrane (mg hrane / životinja / dan)
|
|
0. – 4.
|
30
|
|
5. – 7.
|
40
|
|
8. – 10.
|
50
|
|
11. – 14.
|
70
|
|
15. – 21.
|
80
|
|
Analitička kemija
|
14.
|
Prije provođenja studije stabilnost ispitivane kemikalije potrebno je ocijeniti primjenom postojećih podataka o njezinoj topljivosti, razgradivosti i volatilnosti. Ispitne otopine iz svakog ponavljanja pri svakoj koncentraciji potrebno je uzorkovati za analitičke kemijske analize na početku ispitivanja (dan 0) i jednom tjedno tijekom ispitivanja za najmanje četiri uzorka. Preporučuje se i da se svaka ispitna koncentracija analizira tijekom pripreme sustava, prije početka ispitivanja, kako bi se provjerila učinkovitost sustava. Osim toga, preporučuje se analizirati radne otopine kada se mijenjaju, pogotovo ako se volumenom radne otopine ne osiguraju dovoljne količine kemikalije koja će obuhvatiti trajanje razdoblja rutinskog uzorkovanja. U slučaju kemikalija koje se ne mogu otkriti u nekima ili svim koncentracijama upotrijebljenih u ispitivanju, radne otopine potrebno je mjeriti i brzine protoka sustava zabilježiti kako bi se izračunale nazivne koncentracije.
|
Uvođenje kemikalije
|
15.
|
Metoda koja se upotrebljava za uvođenje ispitivane kemikalije u sustav može varirati ovisno o njezinim fizikalno-kemijskim svojstvima. Kemikalije topljive u vodi mogu se otopiti u alikvotima ispitne vode pri koncentraciji pri kojoj je moguća isporuka ciljane ispitivane koncentracije u protočnom sustavu. Kemikalije koje su u tekućem stanju na sobnoj temperaturi i djelomično topljive u vodi mogu se uvesti primjenom metoda za miješanje dviju tekućina do zasićenosti. Kemikalije koje su u krutom stanju na sobnoj temperaturi i djelomično topljive u vodi mogu se uvesti s pomoću kolone za zasićivanje od staklene vune (7). Prednost se daje upotrebi sustava ispitivanja bez nosača, međutim, različite ispitivane kemikalije imat će raznolika fizikalno-kemijska svojstva koja će vjerojatno zahtijevati različite pristupe za pripremu vode za izlaganje kemikaliji. Poželjno je uložiti napor u izbjegavanje otapala ili nosača jer: i) određena otapala sama po sebi mogu dovesti do toksičnosti i/ili nepoželjnih ili neočekivanih endokrinoloških reakcija, ii) ispitivanje kemikalija iznad njihove topljivosti u vodi (što se često javlja upotrebom otapala) može dovesti do pogrešnih određivanja učinkovitih koncentracija te iii) upotreba otapala u dugoročnim ispitivanjima može dovesti do znatnog stupnja ‚biofilma’ povezanog s mikrobiološkom aktivnošću. Za kemikalije koje se teško ispituju, otapalo se može upotrebljavati kao krajnje sredstvo i potrebno je proučiti Smjernicu OECD-a o ispitivanju toksičnosti teških tvari i smjesa u vodi (4) kako bi se utvrdila najbolja metoda. Izbor otapala odredit će se kemijskim svojstvima kemikalije. Otapala za koje je utvrđeno da su učinkovita za ispitivanje toksičnosti u vodi uključuju aceton, etanol, metanol, dimetilformamid i trietilenglikol. U slučaju da se upotrebljava otapalo nosač, koncentracije otapala trebale bi biti ispod kronične najviše koncentracije bez vidljivog učinka (NOEC); Smjernicom OECD-a predlaže se maksimalno 100 ul/l; najnovijim pregledom preporučuje se upotreba koncentracija otapala nižih od 20 ul/l vode za razrjeđivanje (12). Ako se upotrebljavaju otapala nosači, osim kontrolnih skupina s neotapalom (čista voda), potrebno je ocijeniti odgovarajuće kontrolne skupine s otapalom. Ako kemikaliju nije moguće primijeniti kroz vodu bilo zbog fizikalno-kemijskih svojstava (slabe topljivosti) bilo zbog ograničene dostupnosti kemikalije, može se razmotriti njezino uvođenje kroz hranu. Preliminarni radovi provedeni su na izlaganjima putem hrane; međutim, ovaj način izlaganja obično se ne upotrebljava Izbor metode potrebno je dokumentirati i analitički provjeriti.
|
Izbor ispitnih koncentracija
Utvrđivanje visoke ispitne koncentracije
|
16.
|
Za potrebe ovog ispitivanja visoke ispitne koncentracije potrebno je utvrditi granicom topljivosti ispitivane kemikalije; najviša prihvatljiva koncentracija (MTC) za akutno toksične kemikalije; ili 100 mg/l, ovisno o tome koja je najniža.
|
|
17.
|
MTC se definira kao najviša ispitna koncentracija kemikalije, koja izaziva manje od 10 % smrtnosti od kroničnih bolesti. Upotrebom ovog pristupa podrazumijeva se da već postoje empirijski podaci o smrtnosti od kroničnih bolesti iz kojih se može procijeniti MTC. Procjena MTC-a može biti netočna i obično je potrebno stručno mišljenje. Iako upotreba regresijskih modela može biti tehnički najzdraviji pristup procjene MTC-a, korisna srednja vrijednost MTC-a može se dobiti iz postojećih podataka o akutnim stanjima s pomoću 1/3 akutne vrijednosti LC50. Međutim, podaci o akutnoj toksičnosti mogu nedostajati za vrste na ispitivanju. Ako podaci o akutnoj toksičnosti specifični za određenu vrstu nisu dostupni, tada se 96-satno ispitivanje s pomoću LC50 može dovršiti s punoglavcima koji su predstavnici (tj. isti stadij) onih na ispitivanju u AMA-i. Fakultativno, ako su dostupni podaci o drugim vodenim vrstama (npr. studije LC50 u riba ili drugih vodozemaca), tada se može upotrebljavati stručno mišljenje da bi se procijenio mogući MTC temeljem ekstrapolacije vrsta.
|
|
18.
|
Kao druga mogućnost, ako kemikalija nije akutno toksična i ako je topljiva iznad 100 mg/l, tada je 100 mg/l potrebno smatrati kao najvišu ispitnu koncentraciju (HTC) s obzirom na to da se ova koncentracija obično smatra ‚praktički netoksičnom’.
|
|
19.
|
Iako to nije preporučeni postupak, statičke metode s obnavljanjem mogu se upotrebljavati ako protočne metode nisu dovoljne za postizanje MTC-a. Ako se upotrebljavaju statičke metode s obnavljanjem, tada je stabilnost koncentracije ispitivane kemikalije potrebno dokumentirati i zadržati unutar granica kriterija učinkovitosti. Preporučuju se 24-satna razdoblja obnavljanja. Razdoblja obnavljanja koja prelaze 72 sata nisu prihvatljiva. Osim toga, parametre kakvoće vode (npr. DO, temperatura, pH-vrijednost itd.) potrebno je mjeriti na kraju svakog razdoblja obnavljanja, neposredno prije obnavljanja.
|
Raspon ispitne koncentracije
|
20.
|
Potrebne su najmanje tri ispitne koncentracije i kontrola s čistom vodom (i kontrola s nosačem prema potrebi). Najmanja razlika ispitne kemikalije između najviše i najniže trebala bi biti oko jedan red veličine. Najveća je podjela doze 0,1, a najmanja je 0,33.
|
POSTUPAK
Početak i provođenje ispitivanja
0. dan
|
21.
|
Izlaganje bi trebalo započeti kada je dovoljan broj punoglavaca u matičnoj populaciji prije izlaganja dostigao 51. stadij razvoja prema Nieuwkoopu i Faberu (8), a koji su manji ili jednaki 17 dana starosti nakon oplodnje. Za odabir pokusnih životinja zdrave punoglavce normalnog izgleda matične populacije potrebno je skupiti u jednu posudu koja sadržava odgovarajuću količinu vode za razrjeđivanje. Za određivanje stadija razvoja punoglavce je potrebno pojedinačno ukloniti iz spremnika za sakupljanje s pomoću male mreže ili sita i prenijeti u prozirnu mjernu posudu (npr. 100 mm Petrijeve zdjelice) koja sadržava vodu za razrjeđivanje. Za određivanje stadija poželjno je ne upotrebljavati anesteziju, međutim, pojedinačno se mogu anestezirati punoglavci s pomoću 100 mg/l trikain metansulfonata (npr. MS-222), koji je primjereno puferiran natrijevim bikarbonatom (pH-vrijednost 7,0) prije rukovanja. Ako se upotrebljava, od iskusnih laboratorija potrebno je dobiti metodologiju za primjerenu upotrebu npr. MS-222 za anesteziju i prijaviti s rezultatima ispitivanja. Životinjama je potrebno pažljivo rukovati tijekom ovog prijenosa kako bi se smanjio stres zbog rukovanja i kako bi se izbjegle ozljede.
|
|
22.
|
Stadij razvoja životinja određuje se binokularnim mikroskopom za seciranje. Kako bi se smanjila krajnja promjenjivost u stadiju razvoja, ovo određivanje stadija važno je provesti što je moguće točnije. Prema Nieuwkoopu i Faberu (8) primarna razvojna oznaka za odabir 51. stadija organizama jest morfologija stražnjih udova. Morfološke karakteristike stražnjih udova potrebno je ispitati pod mikroskopom. Iako je za sveobuhvatne informacije o određivanju stadija punoglavaca potrebno proučiti cijeli Nieuwkoop i Faberov (8) vodič, stadij se može pouzdano odrediti s pomoću istaknutih morfoloških oznaka. Sljedeća tablica može se upotrebljavati za pojednostavnjivanje i standardiziranje procesa određivanja stadija tijekom studija prepoznavanjem tih istaknutih morfoloških oznaka povezanih s različitim stadijima, uz pretpostavku da je razvoj normalan.
Tablica 2.
Istaknute morfološke oznake za određivanje stadija razvoja temeljem Neuwkoop i Faberovih smjernica.
|
Istaknute morfološke oznake
|
Stadij razvoja
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Stražnji udovi
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Prednji udovi
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Kraniofacijalna struktura
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Morfologija olfaktornog živca
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Duljina repa
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
Za početak ispitivanja svi punoglavci trebali bi biti u 51. stadiju. Najistaknutija morfološka oznaka za određivanje ovog stadija jest morfologija stražnjih udova, prikazana na slici 1.
Slika 1.
Morfologija stražnjih udova 51. stadija punoglavca X. Laevis.

|
|
24.
|
Osim odabira stadija razvoja, može se odabrati fakultativna veličina pokusnih životinja. U tu svrhu potrebno je izmjeriti cijelu duljinu tijela (ne SVL) 0. dana za poduzorak od približno 20 NF punoglavaca 51. stadija. Nakon izračuna prosječne duljine cijelog tijela za ovu skupinu životinja mogu se postaviti najniže i najviše granične vrijednosti za duljinu cijelog tijela pokusnih životinja dopuštajući raspon srednje vrijednosti ± 3 mm (srednje vrijednosti raspona duljine cijelog tijela između 24,0 i 28,1 mm za punoglavce 51. stadija). Međutim, određivanje stadija razvoja jest primarni parametar u određivanju spremnosti svake pokusne životinje. Punoglavci u kojih su primijećene vrlo vidljive deformacije ili ozljede potrebno je isključiti iz ispitivanja.
|
|
25.
|
Punoglavci koji ispunjavaju prethodno navedene kriterije za određivanje stadija drže se u spremniku čiste vode iz koje je uklonjen klor dok se ne završi proces određivanja stadija. Nakon što se završi određivanje stadija, ličinke se nasumično raspoređuju na izlaganje u spremnike za obradu sve dok svaki spremnik ne sadržava 20 ličinaka. Zatim se u svakom spremniku za obradu provjeravaju životinje neuobičajenog izgleda (npr. ozljede, nenormalan način plivanja itd.). Punoglavce nezdravog izgleda potrebno je ukloniti iz spremnika za obradu i zamijeniti novo izabranim ličinkama iz spremnika za sakupljanje.
|
Opažanja
|
26.
|
Za temeljitije informacije o postupcima za završetak ispitivanja i obrade punoglavaca pogledati Smjernicu OECD-a o histologiji štitnjače vodozemaca (9).
|
Mjerenja 7. dana
|
27.
|
Sedmog dana uklanja se petoro nasumično odabranih punoglavaca iz svakog ispitnog spremnika. Upotrijebljen postupak nasumičnog odabira trebao bi pružiti svakom organizmu na ispitivanju jednaku vjerojatnost da bude izabran. To se može postići primjenom bilo koje metode nasumičnog odabira, ali potrebno je da svaki punoglavac bude umrežen. Punoglavci koji nisu odabrani vraćaju se u spremnike podrijetla, a odabrani punoglavci humano se usmrćuju s od 150 do 200 mg/l npr. MS-222, koji je primjereno puferiran natrijevim bikarbonatom kako bi se postigla pH-vrijednost od 7,0. Eutanazirani punoglavci ispiru se vodom i suše, nakon čega slijedi određivanje tjelesne težine do najbližeg miligrama. Za svakog punoglavca određuje se duljina stražnjih udova, duljina od vrha njuške do kloake i stadij razvoja (s pomoću binokularnog mikroskopa za seciranje).
|
Mjerenja 21. dana (završetak ispitivanja)
|
28.
|
Po završetku ispitivanja (21. dan) preostali punoglavci uklanjaju se iz ispitnih spremnika i humano usmrćuju s od 150 do 200 mg/l npr. MS-222, koji je primjereno puferiran natrijevim bikarbonatom, kako je prethodno opisano. Punoglavci se ispiru vodom i suše, nakon čega slijedi određivanje tjelesne težine do najbližeg miligrama. Za svakog punoglavca mjeri se stadij razvoja, SVL i duljina stražnjih udova.
|
|
29.
|
Sve ličinke smještaju se u Davidsonov fiksativ od 48 do 72 sata, bilo kao uzorci cijelog tijela bilo kao uzorci odrezanog tkiva glave koji sadržavaju donju čeljust za histološke procjene. Za histopatologiju ukupno pet punoglavaca potrebno je uzorkovati iz svakog ponavljanja. Budući da je visina folikularne stanica ovisna o stadiju (10), najprikladniji pristup uzorkovanja za histološke analize jest upotreba jedinaka poduranih stadija, kad god je moguće. Kako bi se odabrale jedinke podudarnih stadija, svim ličinkama prvo je potrebno odrediti stadij prije odabira i naknadne obrade radi prikupljanja i čuvanja podataka. To je potrebno jer će normalno odstupanje u razvoju rezultirati različitim podjelama po stadijima unutar svakog ponavljanja.
|
|
30.
|
Životinje odabrane za histopatologiju (n = 5 iz svakog ponavljanja) potrebno je povezati sa srednjom stadijem kontrola (skupna ponavljanja), kad god je moguće. Ako postoje ponavljanja s više od pet ličinaka u odgovarajućem stadiju, tada se nasumično odabire pet ličinaka.
|
|
31.
|
Ako postoje ponavljanja s manje od pet ličinkaka u odgovarajućem stadiju, tada je nasumično odabrane jedinke iz sljedećeg nižeg ili višeg stadija razvoja potrebno uzorkovati da bi se dobila ukupna veličina uzorka od pet ličinaka po ponavljanju. Po mogućnosti odluku o uzorkovanju dodatnih ličinaka bilo iz sljedećeg nižeg ili višeg stadija razvoja potrebno je temeljiti na ukupnoj procjeni raspodjele po stadijima u kontrolnim i kemijskim obradama. To jest, ako je kemijska obrada povezana s usporavanjem razvoja, tada je potrebno uzorkovati dodatne ličinke iz sljedećeg nižeg stadija. S druge strane, ako je kemijska obrada povezana s ubrzavanjem razvoja, tada je potrebno uzorkovati dodatne ličinke iz sljedećeg višeg stadija.
|
|
32.
|
U slučajevima ozbiljnih promjena razvoja punoglavca uslijed tretiranja ispitivanom kemikalijom možda ne dođe do preklapanja raspodjele po stadijima u kemijskim obradama s izračunanim kontrolim srednjim stadijem razvoja. Samo u tim slučajevima postupak odabira potrebno je mijenjati koristeći se stadijem različitim od kontrolnog srednjeg stadija kako bi se postiglo uzorkovanje ličinaka podudarnih po stadijima za histopatologiju štitnjače. Nadalje, ako su stadiji neodređeni (tj. asinkronija), tada je potrebno nasumično odabrati pet punoglavaca iz svakog ponavljanja za histološku analizu. Objašnjenje predmetnog uzorkovanja bilo kojih ličinaka koje nisu u stadiju koji je jednak kontrolnom srednjem stadiju razvoja potrebno je prijaviti.
|
Utvrđivanje bioloških krajnjih učinaka
|
33.
|
Tijekom 21-dnevne faze izlaganja mjerenje primarnih krajnjih učinaka provodi se 7. i 21. dana, međutim, pokusne životinje potrebno je svakodnevno promatrati. U tablici 3. nalazi se pregled mjerenja krajnjih učinaka i odgovarajućih vremenskih točaka promatranja. Detaljnije informacije o tehničkim postupcima za mjerenje apikalnih krajnjih učinaka i histoloških procjena dostupne su u smjernicama OECD-a (9).
Tablica 3.
Vremenske točke promatranja za primarne krajnje učinke u AMA-i.
|
Apikalni krajnji učinci
|
Svakodnevno
|
7. dan
|
21. dan
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Duljina stražnjih udova
|
|
|
ߦ
|
ߦ
|
|
—
|
Duljina od vrha njuške do kloake
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
|
|
|
ߦ
|
|
Apikalni krajnji učinci
|
34.
|
Stadij razvoja, duljina stražnjih udova, SVL i mokra masa jesu apikalni krajnji učinci AMA-e i svaka je ukratko objašnjena u nastavku. Daljnje tehničke informacije za prikupljanje tih podataka dostupne su u navedenim smjernicama uključujući postupke za računalno potpomognute analize koje se preporučuju za upotrebu.
|
Stadij razvoja
|
35.
|
Stadij razvoja punoglavca X. laevis određuje se s pomoću Nieuwkoop i Faberovih kriterija za određivanje stadija razvoja (8). Podaci o stadiju razvoja upotrebljavaju se kako bi se utvrdilo je li razvoj ubrzan, asinkron, zakašnjeli ili nepromijenjen. Ubrzani ili zakašnjeli razvoj određuje se usporedbom između srednjeg stadija postignutog u kontrolnim ili obrađenim skupinama. Asinkroni razvoj bilježi se kada ispitana tkiva nisu oštećena ili nenormalna, ali je relativni trenutak morfogeneze i razvoj različitih tkiva poremećen unutar pojedinog punoglavca.
|
Duljina stražnjih udova
|
36.
|
Razlika i rast stražnjih udova pod kontrolom su hormona štitnjače i glavne su razvojne oznake već upotrijebljene u određivanju stadija razvoja. Razvoj stražnjih udova upotrebljava se kvalitativno u određivanju stadija razvoja, ali ovdje se razmatra kao kvantitativni krajnji učinak. Stoga se duljina stražnjih udova mjeri kao krajnji učinak za otkrivanje učinaka na osovinu štitnjače (slika 2.). Radi dosljednosti duljina stražnjih udova mjeri se na lijevom stražnjem udu. Duljina stražnjih udova ocjenjuje se i 7. i 21. dana ispitivanja. Mjerenje duljine stražnjih udova 7. dana jednostavno je, kao što je prikazano na slici 2. Međutim, mjerenje stražnjih udova 21. dana složenije je zbog pregiba na udovima. Stoga bi mjerenja duljine stražnjih udova 21. dana trebala polaziti od trbušne stijenke i pratiti srednju liniju udova kroz sva kutna odstupanja. Promjene u duljini stražnjih udova 7. dana, čak i ako nisu očite 21. dana, još uvijek se smatraju važnima za potencijalnu tiroidnu aktivnost. Mjerenja duljine dobivaju se iz digitalnih fotografija s pomoću softvera za analizu slike, kao što je navedeno u Smjernici OECD-a o histologiji štitnjače vodozemaca (9).
|
Duljina tijela i mokra masa
|
37.
|
Određivanja duljine od vrha njuške do kloake (SVL) (slika 2.) i mokre mase uključena su u ispitni protokol kako bi se procijenili mogući učinci ispitivanih kemikalija na brzinu rasta punoglavaca u odnosu na kontrolnu skupinu te su korisni u otkrivanju opće toksičnosti ispitivane kemikalije. Budući da uklanjanje preostale vode za određivanja težine može izazvati stresne uvjete za punoglavce i dovesti do oštećenja kože, ta se mjerenja vrše 7. dana na poduzorkovanim punoglavcima, a u svih ostalih punoglavaca po završetku ispitivanja (21. dan). Zbog dosljednosti upotrebljava se kranijalni aspekt kloake kao repne granice mjerenja.
|
|
38.
|
Duljina od vrha njuške do kloake (SVL) upotrebljava se za procjenu rasta punoglavaca, kao što je prikazano na slici 2.
Slika 2.
(A) Vrste mjerenja duljine tijela i (B) Mjerenja duljine stražnjih udova za punoglavce X. laevis (1).

|
Histologija štitnjače
|
39.
|
Dok su stadij razvoja i duljina stražnjih udova važni krajnji učinci za procjenu promjena povezanih s izlaganjem u metamorfološkom razvoju, kašnjenje u razvoju samo po sebi ne može se smatrati dijagnostičkim pokazateljem antitiroidne aktivnosti. Neke se promjene mogu uočiti samo rutinskom histopatološkom analizom. Dijagnostički kriteriji uključuju hipertrofiju/atrofiju štitnjače, hipertrofiju folikularnih stanica, hiperplaziju folikularnih stanica te kao dodatni kvalitativni kriterij: područje lumena folikule, kvaliteta koloida i visina/oblik folikularnih stanica. Stupanj ozbiljnosti (4. stupanj) potrebno je prijaviti. Informacije o dobivanju i obradi uzoraka za histološku analizu i obavljanje histoloških analizira na uzorcima tkiva dostupne su u ‚Analizi metamorfoze vodozemaca: Dio 1. – Tehničke smjernice za morfološko uzorkovanja i histološku pripremu’ i ‚Analiza metamorfoze vodozemaca: Dio 2 – Pristup studijama, dijagnostičkim kriterijima, određivanju stupnja ozbiljnosti i atlasu’ (9). Laboratoriji koji obavljaju analizu po prvi put trebali bi potražiti savjet iskusnih patologa u svrhu izobrazbe prije poduzimanja histološke analize i procjene štitnjače. Očite i znatne promjene apikalnih krajnjih učinaka koje ukazuju na ubrani razvoj ili asinhroniju mogu isključiti potrebu za obavljanjem histopatološke analize štitnjače. Međutim, nedostatak očitih morfoloških promjena ili dokaza o zakašnjelom razvoju potvrđuje histološke analize.
|
Smrtnost
|
40.
|
Sve ispitne spremnike potrebno je provjeriti svakodnevno radi mrtvih punoglavaca i zabilježiti brojeve za svaki spremnik. Potrebno je zabilježiti datum, koncentraciju i broj spremnika za bilo koja promatranja smrtnosti. Mrtve životinje potrebno je ukloniti iz ispitnog spremnika čim se uoče. Stope smrtnosti veće od 10 % mogu ukazivati na neprimjerene uvjete ispitivanja ili toksične učinke ispitivane kemikalije.
|
Dodatna opažanja
|
41.
|
Potrebno je zabilježiti slučajeve nenormalnog ponašanja i vrlo vidljivih deformacija i lezija. Potrebno je zabilježiti datum, koncentraciju i broj spremnika za bilo koja promatranja neuobičajenog ponašanja, velikih deformacija ili lezija. Normalno ponašanje punoglavaca karakterizira lebdenje u stupcu vode s repom povišenim iznad glave, redovito i ritmičko udaranje repne peraje, redovito izranjanje na površinu, operkulacija i reagiranje na podražaj. Neuobičajeno ponašanje uključilo bi npr. plutanje na površini, ležanje na dnu spremnika, obrnuto ili nepravilno plivanje, neizlaženje na površinu i nereagiranje na poticaj. Osim toga, potrebno je zabilježiti velike razlike u potrošnji hrane između obrada. Grube malformacije i lezije mogu na primjer uključivati morfološke anomalije (npr. deformacije udova), hemoragijske lezije, bakterijske ili gljivične infekcije. Ta su određivanja kvalitativna i potrebno ih je smatrati srodnim kliničkim znakovima bolesti/stresa i usporediti s kontrolnim životinjama. Ako je pojavljivanje ili brzina pojavljivanja veća u izloženim spremnicima nego u kontrolnima, tada ih je potrebno smatrati dokazom očite toksičnosti.
|
PODACI I IZVJEŠĆIVANJE
Prikupljanje podataka
|
42.
|
Sve podatke potrebno je prikupiti elektroničkim ili ručnim sustavima, koji su u skladu s dobrom laboratorijskom praksom (GLP). Podaci o studiji trebali bi sadržavati:
|
|
Ispitivana kemikalija:
|
—
|
Karakterizacija ispitivane kemikalije: fizikalno-kemijska svojstva; informacije o stabilnosti i biorazgradivosti;
|
|
—
|
Informacije i podaci o kemikaliji: način i učestalost priprema razrjeđivanja. Informacije o ispitivanoj kemikaliji uključuju stvarne i nazivne koncentracije ispitivane kemikalije, a u nekim slučajevima nepolaznu kemikaliju ako je to prikladno. Mjerenja ispitivane kemikalije mogu biti potrebna za radne otopine, kao i za ispitne otopine;
|
|
—
|
Otapalo (ako nije voda): obrazloženje izbora otapala i karakterizacija otapala (prirodno, koncentracije koje se upotrebljavaju);
|
|
|
|
Uvjeti ispitivanja:
|
—
|
Radna evidencija: sastoji se od promatranja koja se odnose na funkcioniranje sustava ispitivanja te pratećeg okoliša i infrastrukture. Tipična evidencija uključuje: okolnu temperaturu, temperaturu ispitivanja, fotoperiod, status ključnih komponenata sustava izlaganja (npr. pumpe, brojači ciklusa, pritisci), brzine protoka, razine vode, promjene zaliha u bocama i evidenciju o hranjenju. Parametri opće kakvoće vode jesu: pH-vrijednost, DO, provodljivost, ukupan jod, lužnatost i tvrdoća;
|
|
—
|
Odstupanja od ispitne metode: ove informacije trebale bi uključiti bilo koje informacije ili narativne opise odstupanja od ispitne metode;
|
|
|
|
Rezultati:
|
—
|
Biološka promatranja i podaci: oni uključuju svakodnevna promatranja smrtnosti, potrošnju hrane, neuobičajen način plivanja, letargiju, gubitak ravnoteže, deformacije, lezije itd. Promatranja i podaci prikupljeni u unaprijed određenim razmacima uključuju: dob, duljinu stražnjih udova, duljinu od vrha njuška do kloake i mokru masu;
|
|
—
|
Statističko-analitičke tehnike i obrazloženje upotrijebljenih tehnika; rezultati statističke analize po mogućnosti u obliku tablice;
|
|
—
|
Histološki podaci: uključuju narativne opise, kao i stupanj ozbiljnosti i rezultate učestalosti određenih promatranja, kao što je navedeno u smjernicama o histopatologiji;
|
|
—
|
Ad hoc promatranja: ova promatranja trebala bi uključivati narativne opise studije koji se ne uklapaju u prethodno opisane kategorije.
|
|
|
Dostavljanje podataka
|
43.
|
Dodatak 2. sadržava tablice o svakodnevnom prikupljanju podataka koje mogu poslužiti kao smjernica za unos neobrađenih podataka i za izračune statističkog sažetka. Osim toga, predviđene su izvještajne tablice koje su pogodne za priopćavanje sažetaka podataka o krajnjim učincima. Izvještajne tablice za histološke procjene mogu se pronaći u Dodatku 2.
|
Kriteriji učinkovitosti i prihvatljivost/valjanost ispitivanja
|
44.
|
Općenito, velika odstupanja od ispitne metode rezultirat će neprihvatljivim podacima za tumačenje ili izvješćivanje. Stoga su sljedeći kriteriji u tablici 4. razvijeni kao smjernica za određivanje kvalitete obavljenog ispitivanja i opće učinkovitosti kontrolnih organizama.
Tablica 4.
Kriteriji učinkovitosti za AMA-u
|
Kriterij
|
Prihvatljive granice
|
|
Ispitne koncentracije
|
Održavane na ≤ 20 % CV (varijabilnost izmjerene ispitne koncentracije) preko 21 dana ispitivanja
|
|
Smrtnost u kontrolama
|
≤ 10 % – smrtnost u bilo kojem ponavljanju u kontrolama ne smije prelaziti dva punoglavca
|
|
Najmanja srednji stadij razvoja kontrola na kraju ispitivanja
|
57
|
|
Raspon stadija razvoja u kontrolnoj grupi
|
10. i 90. postotak distribucije stadija razvoja ne smije se razlikovati za više od četiri stadija
|
|
Otopljeni kisik
|
≥ 40 % zasićenosti kisikom (23)
|
|
pH-vrijednost
|
pH-vrijednost potrebno je održavati između 6,5 i 8,5. Razlike između ponavljanja / između obrada ne smiju biti veće od 0,5.
|
|
Temperatura vode
|
22° ± 1 °C – razlike između ponavljanja / između obrada ne smiju biti veće od 0,5 °C
|
|
Ispitne koncentracije bez očite toksičnosti
|
≥ 2
|
|
Učinkovitost ponavljanja
|
≤ 2 ponavljanja kroz ispitivanje može biti ugroženo
|
|
Posebni uvjeti za upotrebu otapala
|
Ako se upotrebljava otapalo nosač, i kontrolnu skupinu s otapalom i kontrolnu skupinu s čistom vodom potrebno je upotrebljavati i zabilježiti rezultate
|
|
Statistički značajne razlike između kontrolne skupine s otapalom i kontrolne skupine s vodom obrađuju se posebno. Vidi u nastavku za više informacija
|
|
Posebni uvjeti za statički sustav s obnavljanjem
|
Potrebno je zabilježiti reprezentativne kemijske analize prije i poslije obnavljanja
|
|
Razine amonijaka potrebno je izmjeriti odmah prije obnavljanja
|
|
Sve parametre kakvoće vode navedene u tablici 1. Dodatka 1. potrebno je izmjeriti odmah prije obnavljanja
|
|
Razdoblje obnavljanja ne smije biti dulje od 72 sata
|
|
Primjereni raspored hranjenja (50 % dnevne porcije hrane za punoglavce koja je u komercijalnoj upotrebi)
|
|
Valjanost ispitivanja
|
45.
|
Potrebno je ispuniti sljedeće uvjete da bi se ispitivanje smatralo prihvatljivim/važećim:
|
|
Važećim pokusom utvrđeno je da je test negativan na tiroidnu aktivnost:
|
(1)
|
Za bilo koju navedenu obradu (uključujući kontrole) smrtnost ne smije prelaziti 10 %. Za bilo koje navedeno ponavljanje smrtnost ne smije biti veća od tri punoglavca, u protivnom se ponavljanje smatra kompromitirano.
|
|
(2)
|
Najmanje dvije razine obrade sa sva četiri nekompromitirana ponavljanja trebala bi biti dostupna za analizu.
|
|
(3)
|
Najmanje dvije razine obrade s jasnim znakovima toksičnosti trebale bi biti dostupne za analizu.
|
|
|
|
Važećim pokusom utvrđeno je da je test pozitivan na tiroidnu aktivnost:
|
(1)
|
Može doći do smrtnosti najviše dva punoglavca/ponavljanja u kontrolnoj skupini.
|
|
|
Logika odlučivanja za obavljanje AMA-e
|
46.
|
Logika odlučivanja razvijena je za AMA-u kako bi osigurala logičku pomoć u vođenju i tumačenju rezultata bioanalize (vidi dijagram toka na slici 3.). U suštini, logika odlučivanja važe krajnje učinke u tom naprednom razvoju, asinkroni razvoj i histopatologija štitnjače važu se teško, dok se zakašnjeli razvoj, duljina od vrha njuške do kloake i mokra masa, tj. parametri na koje potencijalno može utjecati opća toksičnost, važu lakše.
Slika 3.
Logika odlučivanja za obavljanje AMA-e

|
Napredan razvoj (određen s pomoću stadija razvoja, SVL i HLL)
|
47.
|
Poznato je da se napredan razvoj javlja samo kroz učinke koji su povezani s hormonom štitnjače. To mogu biti učinci na periferno tkivo kao što je izravna interakcija s receptorima hormona štitnjače (kao što je s T4) ili učinci koji mijenjaju razine cirkulirajućeg hormona štitnjače. U svakom slučaju, to se smatra dostatnim dokazom koji upućuje da kemikalija ima tiroidnu aktivnost. Napredan razvoj procjenjuje se na jedan od dvaju načina. Prvo, opći stadij razvoja može se procijeniti s pomoću standardiziranog pristupa Nieuwkoop i Fabera (8). Drugo, specifične morfološke karakteristike mogu se kvantitativno odrediti kao što je duljina stražnjih udova i 7. i 21. dana, što je pozitivno povezano s agonističkim učinkom na receptore hormona štitnjače. Ako dođe do statistički znatnog napredovanja u razvoju ili duljini stražnjih udova, tada ispitivanje pokazuje da kemikalija aktivno djeluje na štitnjaču.
|
|
48.
|
Procjena pokusnih životinja na prisutnost ubrzanog razvoja u odnosu na kontrolnu populaciju temeljit će se na rezultatima statističke analize provedene na sljedeća četiri krajnja učinka:
|
—
|
duljina stražnjih udova (utvrđena SVL-om) 7. dana studije
|
|
—
|
duljina stražnjih udova (utvrđena SVL-om) 21. dana studije
|
|
—
|
stadij razvoja 7. dana studije
|
|
—
|
stadij razvoja 21. dana studije
|
|
|
49.
|
Statističke analize duljine stražnjih udova potrebno je obaviti na temelju mjerenja duljine lijevog stražnjeg uda. Duljina stražnjih udova utvrđuje se uzimanjem omjera duljine stražnjih udova i duljine od vrha njuške do kloake pojedine životinje. Zatim se prosjek utvrđene vrijednosti uspoređuje za svaku razinu obrade. Ubrzanje razvoja zatim karakterizira znatan porast prosječne duljine stražnjih udova (utvrđene) u skupini obrađenoj kemikalijom u usporedbi s kontrolnom skupinom 7. dana studije i/ili 21. dana studije (vidi Dodatak 3.).
|
|
50.
|
Statističke analize stadija razvoja potrebno je obaviti na temelju određivanja stadija razvoja prema morfološkim kriterijima Nieuwkoop i Fabera (8). Ubrzanje razvoja karakterizira kada višekvantalna analiza otkrije znatan porast vrijednosti stadija razvoja u skupini obrađenoj kemikalijom u usporedbi s kontrolnom skupinom 7. dana studije i/ili 21. dana studije.
|
|
51.
|
U ispitnoj metodi AMA-e znatan učinak na bilo koje od prethodno navedena četiri krajnja učinka smatra se dovoljnim za pozitivno otkrivanje ubrzanog razvoja. To jest, znatni učinci na duljinu stražnjih udova u određenoj vremenskoj točki ne zahtijevaju ni potvrdu znatnih učinaka na duljinu stražnjih udova u nekoj drugoj vremenskoj točki ni znatnih učinaka na stadij razvoja u toj određenoj vremenskoj točki. Po redoslijedu, znatni učinci na stadij razvoja u određenoj vremenskoj točki ne zahtijevaju ni potvrdu znatnih učinaka na stadij razvoja u nekoj drugoj vremenskoj točki ni znatnih učinaka na duljinu stražnjih udova u toj određenoj vremenskoj točki. Težina dokaza za ubrzani razvoj ipak se neće povećati ako se otkriju znatni učinci za više od jednog krajnjeg učinka.
|
Asinkroni razvoj (utvrđen s pomoću kriterija stadija razvoja)
|
52.
|
Asinkroni razvoj karakterizira poremećaj relativnog izbora trenutka morfogeneze ili razvoja različitih tkiva unutar pojedinog punoglavca. Nemogućnost jasnog utvrđivanja stadija razvoja organizma s pomoću niza morfoloških krajnjih učinaka koji se smatraju tipičnim za svaki navedeni stadij pokazuje da se tkiva razvijaju asinkrono kroz metamorfozu. Asinkroni razvoj je pokazatelj tiroidne aktivnosti. Jedini poznati načini djelovanja koji prouzročuju asinkroni razvoj jesu kroz učinke kemikalija na djelovanje perifernog hormona štitnjače i/ili metabolizma hormona štitnjače u razvoju tkiva, kao što je primijećeno kod inhibitora bez joda.
|
|
53.
|
Procjena pokusnih životinja na prisutnost asinkronog razvoja u odnosu na kontrolnu populaciju temeljit će se na makromorfološkoj procjeni pokusnih životinja 7. i 21. dana studije.
|
|
54.
|
Opis normalnog razvoja vrste Xenopus laevis Nieuwkoop i Fabera (8) pruža okvir za utvrđivanje sekvencijanog redoslijeda preoblikovanja normalnog tkiva. Pojam ‚asinkroni razvoj’ odnosi se posebno na ona odstupanja u makromorfološkom razvoju punoglavca koja ne odbacuju konačno određivanje stadija razvoja u skladu s kriterijima Nieuwkoop i Fabera (8) jer ključne morfološke oznake pokazuju značajke različitih stadija.
|
|
55.
|
Kao što implicira pojam ‚asinkroni razvoj’, samo slučajevi koji pokazuju odstupanja u procesu preoblikovanja pojedinih tkiva u odnosu na napredak preoblikovanja drugih tkiva potrebno je uzeti u obzir. Neki klasični fenotipovi uključuju kašnjenje ili odsustvo preobrazbe prednjeg uda unatoč normalnom ili naprednom razvoju stražnjih udova i repnog tkiva ili preuranjenu resorpciju škrga u odnosu na stadij morfogeneze stražnjih udova i resorpcije repa. Zabilježit će se da životinja pokazuje asinkroni razvoj ako se ne može svrstati u neki stadij jer ne ispunjava većinu kriterija razvojnih oznaka za određeni Niewkoop i Faberov stadij (8) ili ako postoji znatno kašnjenje ili ubrzanje jednog ili više ključnih obilježja (npr. rep je u potpunosti resorbiran, ali prednji udovi nisu se preobrazili). Ova procjena obavlja se kvalitetno i potrebno je ispitati cijeli niz znatnih obilježja koji su naveli Nieuwkoop i Faber (8). Međutim, nije potrebno bilježiti stanje razvoja različitih znatnih obilježja životinja koje se promatraju. Životinje u kojih je zabilježeno da pokazuju akinkroni razvoj nisu svrstane u Nieuwkoop i Faberov (8) stadij razvoja.
|
|
56.
|
Dakle, središnji kriterij za određivanje slučajeva nenormalnog morfološkog razvoja kao ‚asinkronog razvoja’ jest taj da je relativan izbor trenutka preoblikovanja tkiva i morfogeneze tkiva poremećen, dok morfologija zahvaćenih tkiva očito nije nenormalna. Jedan primjer za ilustraciju ovog tumačenja makromorfoloških anomalija jest da će zakašnjela morfogeneza stražnjih udova u odnosu na razvoj drugih tkiva ispuniti kriterij ‚asinkronog razvoja’, dok slučajeve koji pokazuju nepostojanje stražnjih udova, neprirodne brojke (npr. ektrodaktilija, polidaktilija) ili druge očite malformacije udova ne bi trebalo smatrati ‚asinkronim razvojem’.
|
|
57.
|
U tom kontekstu, glavne morforloške oznake koje je potrebno procijeniti u njihovu koordiniranom metamorfološkom napretku trebale bi uključivati morfogenezu stražnjih udova, morfogenezu prednjih udova, preobrazbu prednjih udova, stadij resorpcije repa (osobito resorpcije repne peraje) i morfologiju glave (npr. veličina škrga i stupanj resorpcije škrga, morfologija donje čeljusti, izbočenje Meckelove hrskavice).
|
|
58.
|
Ovisno o načinu kemijskog djelovanja, može doći do različitih makromorfoloških fenotipova. Neki klasični fenotipovi uključuju kašnjenje ili odsustvo preobrazbe prednjeg uda unatoč normalnom ili naprednom razvoju stražnjih udova i repnog tkiva, preuranjenu resporpciju škrga u odnosu na stražnje udove ili preoblikovanje repa.
|
Histopatologija
|
59.
|
Ako kemikalija ne prouzročuje očitu toksičnost i ne ubrzava razvoj ili prouzročuje asinkroni razvoj, tada se histopatologija štitnjače procjenjuje primjenom odgovarajuće smjernice (9). Zaostajanje u razvoju, u nedostatku toksičnosti, snažan je pokazatelj antitiroidne aktivnosti, ali analiza stadija razvoja manje je osjetljiva i manje dijagnostička od histopatološke analize štitnjače. Stoga je u ovom slučaju potrebno provesti histopatološke analize štitnjače. Učinci na histologiju štitnjače pokazani su u nedostatku razvojnih učinaka. Ako se pojave promjene histopatologije štitnjače, tada se smatra da kemikalija aktivno djeluje na štitnjaču. Ako nisu opažena kašnjenja u razvoju ili histološke lezije u štitnim žlijezdama, tada se smatra da kemikalija ne djeluje na štitnjaču. Razlog za ovu odluku jest taj da je štitnjača pod utjecajem TSH-a i svaka kemikalija koja mijenja cirkulirajući hormon štitnjače u mjeri dovoljnoj da promijeni izlučivanje TSH-a, rezultirat će histopatološkim promjenama štitnjače. Različiti načini i mehanizmi djelovanja mogu promijeniti cirkulirajući hormon štitnjače. Dakle, dok je razina hormona štitnjače pokazatelj učinka povezanog sa štitnjačom, to nije dovoljno da bi se utvrdilo koji je način ili mehanizam djelovanja povezan s reakcijom.
|
|
60.
|
Budući da ovaj krajnji učinak nije pogodan za osnovne statističke pristupe, utvrđivanje učinka povezanog s izlaganjem kemikaliji obavlja se putem stručnog mišljenja patologa.
|
Zakašnjeli razvoj (određen s pomoću stadija razvoja, HLL, BW, SVL)
|
61.
|
Zakašnjeli razvoj može se pojaviti kroz antitiroidne mehanizme i kroz neizravnu toksičnost. Blaga kašnjenja u razvoju s očitim znakovima toksičnosti vjerojatno ukazuju na nespecifičan toksički učinak. Procjena netiroidne toksičnosti bitan je element ispitivanja kako bi se smanjila vjerojatnost lažnih pozitivnih rezultata. Pretjerana smrtnost očit je pokazatelj pojave ostalih toksičnih mehanizama. Slično tome, blaga smanjenja rasta, kako je utvrđeno mokrom masom i/ili duljinom od vrha njuške do kloake, upućuju i na netiroidnu toksičnost. Očigledna povećanja rasta obično se promatraju s kemikalijama koje negativno utječu na normalan razvoj. Prema tome, prisutnost većih životinja nužno ne znači netirodinu toksičnost. Međutim, ne bi se smjelo nikada osloniti samo na rast kako bi se odredila tiroidna toksičnost. Umjesto toga potrebno je upotrebljavati rast zajedno stadijem razvoja i histopatologijom štitnjače kako bi se utvrdila tiroidna aktivnost. Potrebno je uzeti u obzir i druge krajnje učinke u određivanju očite toksičnosti, uključujući edeme, hemoragijske lezije, letargiju, smanjenu potrošnju hrane, nepravilan/izmijenjen način plivanja itd. Ako sve ispitne koncentracije pokazuju očite znakove toksičnosti, ispitivanu kemikaliju potrebno je ponovno procijeniti pri nižim ispitnim koncentracijama prije utvrđivanja mogućnosti aktivnog djelovanja kemikalije na štitnjaču.
|
|
62.
|
Statistički značajna kašnjenja u razvoju, u nedostatku drugih znakova očite toksičnosti, pokazuju da kemikalija aktivno djeluje na štitnjaču (antagonistički). U nedostatku čvrstih statističkih odgovora ovaj rezultat može se proširiti s rezultatima histopatologije štitnjače.
|
Statističke analize
|
63.
|
Statističke analize podataka trebale bi po mogućnosti poštovati postupke opisane u dokumentu Sadašnji pristupi u statističkoj analizi podataka o ekotoksičnosti: Smjernice za primjenu (11). Za sve trajne kvantitativne krajnje učinke (HLL, SVL, mokra masa) u skladu s reakcijom na monotoničnu dozu potrebno je primijeniti Jonckheere-Terpstrin test postupnim snižavanjem kako bi se uspostavio značajan učinak obrade.
|
|
64.
|
Za trajne krajnje učinke koji nisu u skladu s reakcijom na monotoničnu dozu podatke je potrebno procijeniti ispitivanjem normalnosti (po mogućnosti primjenom Shapiro-Wilkova ili Anderson-Darlingova testa) i homogenosti varijanci (po mogućnosti primjenom Leveneova testa). Oba ispitivanja provode se na ostacima iz ANOVA-e. Umjesto tih formalnih ispitivanja normalnosti i homogenosti varijanci, može se upotrebljavati stručna procjena iako su formalni testovi poželjni. Kada se utvrdi nenormalnost ili heterogenost varijanci, potrebno je potražiti normaliziranu pretvorbu za stabiliziranje varijanci. Ako su podaci (možda nakon pretvorbe) normalno distribuirani s homogenom varijancom, značajan učinak obrade utvrđuje se Dunnettovim testom. Ako su podaci (možda nakon pretvorbe) normalno distribuirani s heterogenom varijancom, značajan učinak obrade utvrđuje se Tamhane-Dunettovom ili T3 testom ili Mann-Whitney-Wilcoxonovim U testom. Kada se ne može pronaći normalizirana pretvorba, značajan učinak obrade utvrđuje se Mann-Whitney-Wilcoxonovim U testom s Bonferroni-Holmovim prilagođenim p-vrijednostima. Dunnettov test primjenjuje se neovisno od bilo kojeg ANOVA F-testa, a Mann-Whitneyov test primjenjuje se neovisno od bilo kojeg ukupnog Kruskall-Wallisovog testa.
|
|
65.
|
Ne očekuje se značajna smrtnost, ali potrebno ju je procijeniti Cochran-Armitageovim testom postupnog snižavanja tamo gdje su podaci u skladu s reakcijom na monotoničnu dozu, a u protivnom Fisherovim testom s Bonferroni-Holmovim prilagođenim p-vrijednostima.
|
|
66.
|
Značajan učinak obrade za razvojnu fazu utvrđuje se primjenom Jonckheere-Terpstrinog testa postupnog snižavanja, koji se primjenjuje na ponovljene srednje vrijednosti. Druga i preferirana mogućnost jest upotreba višekvantalnog Jonckheereova testa od 20. do 80. centila za određivanje učinka jer se njime uzimaju u obzir promjene u profilu distribucije.
|
|
67.
|
Odgovarajuća jedinica analize jest ponavljanje tako da se podaci sastoje od ponovljenih srednjih vrijednosti ako se upotrebljava Jonckheere-Terpstrin ili Mann-Whitneyev U test ili ponovljenih prosjeka ako se upotrebljava Dunnettov test. Reakcija na monotoničnu dozu može se vizualno procijeniti iz ponovljenih ili obrađenih prosjeka ili srednjih vrijednosti ili iz prethodno opisanih formalnih ispitivanja (11). S manje od pet ponavljanja po obradi ili kontroli potrebno je upotrebljavati točne verzije permutacije Jonckheere-Terpstrin i Mann-Whitneyeva testa ako su dostupni. Statistička značajnost svih navedenih ispitivanja ocjenjuje se na razini značajnosti 0,05.
|
|
68.
|
Slika 4. jest dijagram toka za obavljanje statističkih ispitivanja na kontinuiranim podacima.
Slika 4.
Dijagram toka za statističke pristupe za podatke o kontinuiranim reakcijama
|
Razmatranja analize posebnih podataka
Upotreba kompromitirajućih razina obrade
|
69.
|
Nekoliko čimbenika uzima se u obzir pri utvrđivanju pokazuje li ponavljanje ili cjelokupna obrada očitu toksičnost i je li potrebno ukloniti ih iz analize. Očita toksičnost definira se kao > 2 smrtnosti u svakom ponavljanju koje se samo može objasniti toksičnošću, a ne tehničkom pogreškom. Ostali znakovi očite toksičnosti uključuju krvarenje, neobična ponašanja, neuobičajene načine plivanja, anoreksiju i bilo koje druge kliničke znakove bolesti. Za subletalne znakove toksičnosti mogu biti potrebne kvalitativne procjene i uvijek ih je potrebno obaviti u odnosu na kontrolnu skupinu s čistom vodom.
|
Kontrolne skupine s otapalom
|
70.
|
Uporabu otapala potrebno je uzeti u obzir samo kao krajnje sredstvo, kada se razmotre sve druge opcije prijenosa kemikalije. Ako se upotrebljava otapalo, tada je kontrolu s čistom vodom potrebno obaviti zajedno. Na kraju ispitivanja potrebno je obaviti procjenu mogućih utjecaja otapala. To se radi kroz statističku usporedbu kontrolne skupine s otapalom i kontrolne skupine s čistom vodom. Najvažniji krajnji učinci za razmatranje u ovoj analizi jesu stadij razvoja, SVL i mokra masa, s obzirom na to da se na njih može utjecati kroz netiroidnu toksičnost. Ako se otkriju statistički značajne razlike u tim krajnjim učincima između kontrolnih skupina s čistom vodom i kontrolnih skupina s otapalom, odredite krajnje učinke studije za mjere reakcije primjenom kontrole s čistom vodom. Ako nema statistički značajnih razlika između kontrole s čistom vodom i kontrole s otapalom za sve izmjerene varijable reakcije, odredite krajnje učinke studije za mjere reakcije primjenom zajedničkih kontrolnih skupina s vodom za razrjeđivanje i kontrolnih skupina s otapalom.
|
Obrađene skupine koje su postigle 60. stadij razvoja i iznad
|
71.
|
Nakon 60. stadija punoglavci pokazuju smanjenje veličine i težine zbog resorpcije tkiva te smanjenje apsolutnog sadržaja vode. Dakle, mjerenja mokre mase i SVL-a ne mogu se primjereno upotrebljavati u statističkim analizama razlika u brzinama rasta. Stoga, podatke o mokroj masi i duljini organizama > NF60 potrebno je kritički osuditi i te ih nije moguće upotrebljavati u analizama ponavljanja prosjeka ili ponavljanja srednje vrijednosti. Mogu se upotrebljavati dva različita pristupa za analizu tih parametara povezanih s rastom.
|
|
72.
|
Jedan pristup jest razmotriti samo punoglavce sa stadijima razvoja nižima ili jednakima 60. stadiju za statističke analize mokre mase i/ili SVL-a. Vjeruje se da ovaj pristup pruža dovoljno čvrstih informacija o ozbiljnosti mogućih učinaka rasta sve dok je samo mali udio pokusnih životinja uklonjen iz analize (≤ 20 %). Ako povećan broj punoglavaca pokazuje razvoj iznad 60. stadija (≥ 20 %) u jednoj ili više nazivnih koncentracija, tada je potrebno provesti dvofaktorsku ANOVA-u s ugniježđenom strukturom varijance na sve punoglavce kako bi se procijenili učinci rasta zbog kemijskih obrada, uzimajući u obzir učinak kasnog stadija razvoja na rast. U Dodatku 3. daju se smjernice o dvofaktorskoj analizi varijance težine i duljine.
|
LITERATURA
|
(1)
|
OECD (2004.) Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 – Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. br. 77., Paris.
|
|
(2)
|
OECD (2007.) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 – Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. br. 76. Pariz
|
|
(3)
|
OECD (2008.) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. br. 92. Pariz
|
|
(4)
|
OECD (2000.) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. br. 23. Pariz
|
|
(5)
|
ASTM (2002.) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729-96(2002.), Philadelpia, PA
|
|
(6)
|
ASTM (2004.) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay – Xenopus (FETAX). E 1439-98
|
|
(7)
|
Kahl,M.D., Russom,C.L., DeFoe,D.L. & Hammermeister,D.E. (1999.) Saturation units for use in aquatic bioassays. Chemosphere 39, str. 539. – 551.
|
|
(8)
|
Nieuwkoop,P.D. & Faber, J. (1994.) Normal Table of Xenopus laevis. Garland Publishing, New York
|
|
(9)
|
OECD (2007.) Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. br. 82. Pariz
|
|
(10)
|
Dodd,M.H.I. & Dodd,J.M. (1976.) Physiology of Amphibia. Lofts,B. (ed.), Academic Press, New York, str. 467. – 599.
|
|
(11)
|
OECD (2006.) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment, br. 54. Pariz
|
|
(12)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; str. 69. – 92.
|
Dodatak 1.
Tablica 1.
Pokusni uvjeti za 21-dnevnu analizu metamorfoze vodozemaca
|
Pokusna životinja
|
Ličinka vrste Xenopus laevis
|
|
Početni stadij ličinke
|
51. stadij Nieuwkoop i Fabera
|
|
Vrijeme izlaganja
|
21 dan
|
|
Kriteriji odabira ličinaka
|
Razvojni stadij i ukupna duljina (fakultativno)
|
|
Ispitne koncentracije
|
Najmanje tri koncentracije u rasponu otprilike jedan red veličine
|
|
Režim izlaganja
|
Protočno (poželjno) i/ili statički s obnavljanjem
|
|
Sustav za ispitivanje brzine protoka
|
25 ml/min (potpuna zamjena količine otprilike svakih 2,7 sati)
|
|
Primarni krajnji učinci / Određivanje dana
|
Smrtnost
|
Svakodnevno
|
|
Razvojni stadij
|
D 7. i 21.
|
|
Duljina stražnjih udova
|
D 7. i 21.
|
|
Duljina od vrha njuške do kloake
|
D 7. i 21.
|
|
Mokra masa tijela
|
D 7. i 21.
|
|
Histologija štitnjače
|
D 21
|
|
Voda za razrjeđivanje / Laboratorijska kontrola
|
Voda iz slavine iz koje je uklonjen klor (filtrirana aktivnim ugljenom) ili jednakovrijedni laboratorijski izvor
|
|
Gustoća ličinaka
|
20 ličinaka / ispitna posuda (5/l)
|
|
Ispitna otopina / ispitna posuda
|
4 – 10 l (minimalno 10 – 15 cm vode) / ispitna posuda od stakla ili nehrđajućeg čelika (npr., 22,5 cm × 14 cm × 16,5 cm)
|
|
Ponavljanje
|
četiri ponavljanja ispitne posude / ispitna koncentracija i kontrola
|
|
Prihvatljive stope smrtnosti u kontrolama
|
≤ 10 % po ponavljanju ispitne posude
|
|
Fiksacija štitnjače
|
Utvrđen broj
|
Svi punoglavci (pet / ponavljanja se početno procjenjuju)
|
|
Regija
|
Glava ili cijelo tijelo
|
|
Tekućina za fiksiranje
|
Davidsonov fiksativ
|
|
Hranjenje
|
Hrana
|
Sera Micron® ili jednakovrijedni
|
|
Količina / učestalost
|
Vidi tablicu 1. za režim hranjenja uz Sera Micron®
|
|
Osvjetljenje
|
Razdoblje svjetla i tame
|
12 sati svjetla: 12 sati tame:
|
|
Intenzitet
|
od 600 do 2 000 luksa (izmjeren na površini vode)
|
|
Temperatura vode
|
22° ± 1 °C
|
|
pH-vrijednost
|
6,5 – 8,5
|
|
Koncentracija otopljenog kisika (DO)
|
> 3,5 mg/l (> 40 % zasićenosti kisikom)
|
|
Raspored uzorkovanja analitičke kemije
|
Jednom / tjedno (četiri uzorka događaja / ispitivanje)
|
Dodatak 2.
Izvještajne tablice za sirove podatke i sažetak podataka
Tablica 1.
Opće informacije o ispitivanoj kemikaliji
|
Informacije o kemikaliji
|
|
|
Unijeti ispitivanu kemikaliju, jedinice koncentracije i obrade
|
|
|
Ispitivana kemikalija:
|
|
|
|
|
Jedinice koncentracije:
|
|
|
|
|
Obrada 1.
|
|
|
|
|
Obrada 2.
|
|
|
|
|
Obrada 3.
|
|
|
|
|
Obrada 4.
|
|
|
|
|
|
|
|
|
|
Datum (0. dan):
|
|
Unijeti datum (dd/mm/gg)
|
|
|
Datum (7. dan):
|
|
Unijeti datum (dd/mm/gg)
|
|
|
Datum (21. dan):
|
|
Unijeti datum (dd/mm/gg)
|
Tablica 2.
Tablice za prikupljanje sirovih podataka za 7. i 21. dan
|
DAN X
DATUM 00/00/00
|
|
|
Koncentracija
|
Broj obrade
|
Broj ponavljanja
|
Pojedinačni broj
|
Pojedinačni identifikator
|
Stadij razvoja
|
Duljina od vrha njuške do kloake (mm)
|
Duljina stražnjih udova (mm)
|
Mokra masa cijelog organizma (mg)
|
|
REDAK
|
TRT
|
TRT#
|
REP
|
IND
|
ID#
|
STADIJ
|
BL
|
HLL
|
MASA
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Tablica 3.
Izračunani sažetci za podatke o krajnjim učincima od 7. do 21. dana
|
|
|
Stadij razvoja
|
SVL (mm)
|
Duljina stražnjih udova (mm)
|
Masa (mg)
|
|
TRT
|
REP
|
MINIMALNO
|
SREDNJE
|
MAKSIMALNO
|
PROSJEK
|
STANDARDNO ODSTUPANJE
|
PROSJEK
|
STANDARDNO ODSTUPANJE
|
PROSJEK
|
STANDARDNO ODSTUPANJE
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Napomena: Izračuni polja povezani su s unosima podataka u tablicu 2.
|
Tablica 4.
Podaci o dnevnoj smrtnosti
|
Dan ispitivanja
|
Datum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Broj ponavljanja
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Broj obrada
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Napomena: Izračuni polja povezani su s unosima podataka u tablicu 1.
|
Tablica 5.
Kriteriji kakvoće vode
Sustav izlaganja (protočan / statički s obnavljanjem):
Temperatura:
Jačina svjetlosti:
Ciklus svjetla i mraka:
Hrana:
Stopa hranjenja:
pH-vrijednost vode:
Koncentracija joda u ispitnoj vodi:
Tablica 6.
Sažetak kemijskih podataka
|
Naziv kemikalije:
|
|
Cas #:
|
|
Dan ispitivanja
|
Datum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Napomena: Izračuni polja povezani su s unosima podataka u tablicu 1.
|
Tablica 7.
Izvještajne tablice za ključne histopatološke kriterije
|
Datum:
|
Kemikalija:
|
|
|
Patolog:
|
|
|
Hipertrofija štitnjače
|
Atrofija štitnjače
|
Hipertrofija folikularnih stanica
|
Hiperplezija folikularnih stanica
|
|
Hipertrofija štitnjače
|
Atrofija štitnjače
|
Hipertrofija folikularnih stanica
|
Hiperplezija folikularnih stanica
|
|
Oznaka kontrolne životinje – ponavljanje 1.
|
|
|
|
|
|
Oznaka doze za životinju – ponavljanje 1.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kontrolna životinja ID – ponavljanje 2.
|
|
|
|
|
|
Doza za životinju ID – ponavljanje 2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ukupno:
|
|
|
|
|
Ukupno:
|
|
|
|
|
|
|
Hipertrofija štitnjače
|
Atrofija štitnjače
|
Hipertrofija folikularnih stanica
|
Hiperplezija folikularnih stanica
|
|
|
Hipertrofija štitnjače
|
Atrofija štitnjače
|
Hipertrofija folikularnih stanica
|
Hiperplezija folikularnih stanica
|
|
Oznaka doze za životinju – ponavljanje 1.
|
|
|
|
|
|
Oznaka doze za životinju – ponavljanje 1.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka doze za životinju – ponavljanje 2.
|
|
|
|
|
|
Oznaka doze za životinju – ponavljanje 2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ukupno:
|
|
|
|
|
Ukupno:
|
|
|
|
|
Tablica 8.
Dodatni histopatološki kriteriji
|
Datum:
|
Kemikalija:
|
|
|
Patolog:
|
|
|
|
|
|
|
|
|
Povećanje područja lumena folikula
|
Smanjenje područja lumena folikula
|
Povećanje područja lumena folikula
|
Smanjenje područja lumena folikula
|
|
Oznaka kontrolne životinje – ponavljanje 1.
|
|
|
|
Doza za životinju ID – ponavljanje 1.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka kontrolne životinje – ponavljanje 2.
|
|
|
|
Doza za životinju ID – ponavljanje 2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ukupno:
|
|
|
Ukupno:
|
|
|
|
|
Povećanje područja lumena folikula
|
Smanjenje područja lumena folikula
|
|
|
Povećanje područja lumena folikula
|
Smanjenje područja lumena folikula
|
|
Oznaka doze za životinju – ponavljanje 1.
|
|
|
|
Doza za životinju ID – ponavljanje 1.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka doze za životinju – ponavljanje 2.
|
|
|
|
Oznaka doze za životinju – ponavljanje 2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ukupno:
|
|
|
Ukupno:
|
|
|
Tablica 9.
Narativni opisi histopatoloških nalaza
|
Datum:
|
|
Kemikalija:
|
|
Patolog:
|
|
|
Narativni opis
|
|
Kontrolna životinja ID – ponavljanje 1.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka kontrolne životinje – ponavljanje 2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka doze za životinju – ponavljanje 1.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka doze za životinju – ponavljanje 2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka doze za životinju – ponavljanje 1.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka doze za životinju – ponavljanje 2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka doze za životinju – ponavljanje 1.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka doze za životinju – ponavljanje 2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tablica 10.
Obrazac sažetka izvještajnih tablica za dan x (7. ili 21.) AMA-e
|
|
|
Kontrola
|
Doza 1.
|
Doza 2.
|
Doza 3.
|
|
Krajnji učinak
|
Ponavljanje
|
Srednja vrijednost
|
SD
|
CV
|
N
|
Srednja vrijednost
|
SD
|
CV
|
N
|
p-vrijednost
|
Srednja vrijednost
|
SD
|
CV
|
N
|
p-vrijednost
|
Srednja vrijednost
|
SD
|
CV
|
N
|
p-vrijednost
|
|
Stražnji udovi Duljina
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Srednja vrijednost:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SVL
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Srednja vrijednost:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mokra masa
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Srednja vrijednost:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tablica 11.
Obrazac sažetka izvještajnih tablica za dan x (7. ili 21.) podataka o razvojnom stadiju za AMA-u
|
|
|
Kontrola
|
Doza 1.
|
Doza 2.
|
Doza 3.
|
|
|
Ponavljanje
|
Prosjek
|
Minimalno
|
Maksimalno
|
N
|
Prosjek
|
Minimalno
|
Maksimalno
|
N
|
p-vrijednost
|
Prosjek
|
Minimalno
|
Maksimalno
|
N
|
p-vrijednost
|
Prosjek
|
Minimalno
|
Maksimalno
|
Prosjek
|
p-vrijednost
|
|
Razvojni stadij
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Srednja vrijednost:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dodatak 3.
Alternativna analiza težine i duljine u slučaju da kasni stadij razvoja prelazi 20 % punoglavaca u jednoj ili više koncentracija
Ako povećan broj punoglavaca pokazuje razvoj iznad 60. stadija (≥ 20 %) u jednoj ili više nazivnih koncentracija, tada je potrebno provesti dvofaktorsku ANOVA-u s ugniježđenom strukturom varijance za sve punoglavce kako bi se procijenili učinci rasta zbog kemijskih obrada, uzimajući u obzir učinak kasnog stadija razvoja na rast.
Prijedlog je upotrebljavati sve podatke, ali uzeti u obzir učinak kasnog stadija razvoja. To se može učiniti dvofaktorskom ANOVA-om s ugniježđenom strukturom varijance. Definirati kasni stadij = „Da” za životinju ako je njezin stadij razvoja 61. ili veći. U protivnom definirati kasni stadij = „Ne”. Zatim se može provesti dvofaktorska ANOVA s koncentracijom i kasnim stadijem i njihovom interakcijom, s nasumičnim faktorom ponavljanja(koncentracija) i drugim nasumičnim faktorom punoglavci(ponavljanje). Time se još uvijek tretira ponavljanje kao jedinicu analize i dobivaju načelno isti rezultate kao ponderiranom analizom ponavljanja* prosjeka kasnog stadija, ponderiranom brojem životinja po prosjeku. Ako podaci ne ispunjavaju uvjete za ANOVA-u u smislu normalnosti distribucije ili homogenosti varijance, tada se može izvršiti normaliziracija transformiranjem apsolutnih podataka u raspored kako bi se otklonio taj prigovor.
Osim standardnih ANOVA F-testova za učinke koncentracije, kasnog stadija i njihove interakcije, interakcijski F-test može se podijeliti na dva dodatna ANOVA F-testa, jedan za srednje vrijednosti reakcija unutar koncentracija za kasniji stadij = „Ne” i drugi za srednje vrijednosti reakcija unutar koncentracija za kasni stadij = „Da.” Daljnje usporedbe srednjih vrijednosti obrada s kontrolom vrše se unutar svake razine kasnog stadija. Analiza vrste trenda može se obaviti primjernom odgovarajućih kontrasta ili jednostavnom usporedbom u paru ako postoji dokaz o reakciji na nemonotoničnu dozu unutar razine varijable kasne faze. Prilagođavanje p-vrijednostima Bonferroni-Holma vrši se samo ako odgovarajući F-test dijela nije značajan. To se može učiniti s pomoćuiSAS-a i, po mogućnosti, drugog softvera za statističku obradu. Komplikacije mogu nastati kada nema životinja kasnog stadija u nekim koncentracijama, ali te se situacije mogu riješiti na neposredan način.
Dodatak 4.
Definicije
Kemikalija
: Tvar ili smjesa
Ispitivana kemikalija
: Bilo koja tvar ili smjesa ispitivana primjenom ove ispitne metode.
C.39. ISPITIVANJE REPRODUKCIJE SKOKUNA U TLU
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje (TG) 232 (2009.). Ova ispitna metoda namijenjena je procjeni učinaka kemikalija na reproduktivnu uspješnost skokuna u tlu. Temelji se na postojećim postupcima (1) (2). Vrsta Folsomia Candida, koja se razmnožava bespolno i vrsta Folsomia fimetaria, koja se razmnožava spolno dvije su najpristupačnije vrste skokuna, mogu se kultivirati i komercijalno su dostupne. Kada treba procijeniti specifična staništa koja nisu nastanjena ovim dvjema vrstama, postupak se primjenjuje i na druge vrste skokuna ako mogu ispuniti validacijske kriterije ispitivanja.
|
|
2.
|
Skokuni koji žive u tlu ekološki su relevantne vrste za ispitivanje ekotoksičnosti. Skokuni su šesteronošci s tankim vanjskim kosturom vrlo propusnim za zrak i vodu te predstavljaju vrstu člankonožaca s različitim smjerom i različitom stopom izlaganja u odnosu na gujavice i enhitreje.
|
|
3.
|
Gustoća naseljenosti skokuna obično doseže 105 m– 2 u tlu i slojevima otpalog lišća u mnogim kopnenim ekosustavima (3) (4). Odrasle jedinke obično su velike 0,5 – 5 mm, njihov je doprinos ukupnoj biomasi životinja u tlu i disanju nizak; procjenjuje se da iznosi između 1 % i 5 % (5). Stoga bi njihova najvažnija uloga mogla biti uloga potencijalnih regulatora procesa kroz grabežljivce koji se hrane mikroorganizmima i mikrofaunom. Skokuni su životinje koje služe kao plijen raznim beskralježnjacima koji žive u dubinskom i površinskom sloju tla, kao što su crvi, stonoge, pauci, trčci i kusokrilci. Skokuni pridonose procesima raspadanja u kiselim tlima gdje mogu biti najvažniji beskralježnjaci u tlu pored enhitreja, s obzirom na to da gujavice i stonoge obično nisu prisutne.
|
|
4.
|
Vrsta F. fimetaria raširena je u cijelom svijetu i uobičajena u nekoliko vrsta tla, od pješčanog do ilovastog tla te od zrelih do sirovih humusa. To je skokun bez očiju i bez pigmenta. Nalazi se u poljoprivrednim zemljištima diljem Europe (6). Ima prehrambene navike svejeda i njegova hrana uključuje hife gljiva, bakterije, protozoe i organske otpatke. Uzajamno djeluje putem ispaše s infekcijama gljiva uzročnika bolesti biljaka (7) i može utjecati na mikorizu, kao što je to slučaj s vrstom F. candida. Kao većina vrsta skokuna, razmnožava se spolno uz stalnu prisutnost mužjaka za oplodnju jajašaca.
|
|
5.
|
Vrsta F. candida jednako je tako raširena po cijelom svijetu. Iako nije uobičajena u većini prirodnih tla, često se pojavljuje u vrlo velikom broju na humusom bogatim mjestima. To je skokun bez očiju i bez pigmenta. Ima dobro razvijenu odskočnu vilicu (organ za skakanje), aktivno se kreće i lako skače ako je uznemiren. Ekološka uloga vrste F. candida slična je ulozi vrste F. fimetaria, ali njezina su staništa tla bogatija humusom. Razmnožava se bespolno. Mužjaci se mogu pojaviti u manje od jednog promila.
|
NAČELO ISPITIVANJA
|
6.
|
Odrasli (F. fimetaria) ili mladi (F. candida) skokuni iste dobi izlažu se rasponu koncentracija ispitivane kemikalije pomiješane s promijenjenim umjetnim tlom (8) koristeći se sadržajem organske tvari od 5 % (ili alternativno tlo). Scenarij ispitivanja može se podijeliti u dvije faze:
|
—
|
U slučaju da nema dovoljno informacija o toksičnosti, ispitivanje za određivanje raspona u kojem su smrtnost i reprodukcija osnovni konačni učinci koji se procjenjuju nakon dva tjedna za vrstu F. fimetaria i tri tjedna za vrstu F. candida.
|
|
—
|
Konačno ispitivanje reprodukcije u kojem se procjenjuje ukupan broj potomaka nastalih od roditeljskih životinja i opstanak roditeljskih životinja. Trajanje ovog konačnog ispitivanja jest tri tjedna za vrstu F. fimetaria ili četiri tjedna za vrstu F. candida.
|
Toksični učinak ispitivane kemikalije na smrtnost odraslih jedinki i reproduktivnu uspješnost izražava se kao LCx i ECx slaganjem podataka na odgovarajući model nelinearnom regresijom kako bi se procijenila koncentracija koja bi prouzročila x % smrtnost ili smanjenje reproduktivne uspješnosti ili alternativno kao vrijednost NOEC-a/LOEC-a (9).
|
INFORMACIJE O ISPITIVANOJ KEMIKALIJI
|
7.
|
Fizikalna svojstva, topljivost u vodi, log Kow, podjelni koeficijent vode u tlu i tlak pare ispitivane kemikalije po mogućnosti bi trebali biti poznati. Poželjne su dodatne informacije o sudbini ispitivane kemikalije u tlu, kao što su stope fotolize i hidrolize te biotičke razgradnje. Kemijsku identifikaciju ispitivane kemikalije prema IUPAC nomenklaturi, CAS broj, seriju, partiju, strukturnu formulu i čistoću potrebno je dokumentirati ako su dostupni.
|
|
8.
|
Ova ispitna metoda može se upotrebljavati za kemikalije topljive ili netopljive u vodi. Međutim, način primjene ispitivane kemikalije razlikovat će se sukladno tome. Ispitna metoda ne primjenjuje se na hlapljive kemikalije, tj. kemikalije za koje je konstanta Henryjeva zakona ili podjelni koeficijent zrak/voda veći od jedan ili na kemikalije u kojih je tlak pare veći od 0,0133 Pa na 25 °C.
|
VALJANOST ISPITIVANJA
|
9.
|
Sljedeće kriterije potrebno je ispuniti u neobrađenim kontrolnim serijama kako bi se rezultat ispitivanja smatrao valjanim:
|
—
|
Prosječna smrtnost odraslih životinja ne smije prelaziti 20 % na kraju ispitivanja;
|
|
—
|
Prosječan broj mladih jedinki po posudi trebao bi biti najmanje 100 na kraju ispitivanja;
|
|
—
|
Koeficijent varijacije izračunan za broj mladih jedinki trebao bi biti najmanje 30 % na kraju glavnog ispitivanja.
|
|
REFERENTNA KEMIKALIJA
|
10.
|
Referentnu kemikaliju potrebno je testirati na njezinoj EC50 koncentraciji za odabranu vrstu tla bilo u redovitim intervalima ili je eventualno uključiti u svaki ispitni niz kako bi se provjerilo da je reakcija ispitnih organizama u ispitnom sustavu unutar normalne razine. Prikladna referentna kemikalija jest borna kiselina, kojom bi se reprodukcija trebala smanjiti za 50 % (10) (11) na oko 100 mg/kg suhe mase tla za obje vrste.
|
OPIS ISPITIVANJA
Ispitne posude i oprema
|
11.
|
Spremnici koji mogu držati 30 g vlažnog tla jesu prikladne ispitne posude. Materijal bi trebao biti staklo ili inertna plastika (netoksično). Međutim, upotrebu plastičnih spremnika potrebno je izbjegavati ako je izlaganje ispitivanoj kemikaliji smanjeno zbog sorpcije. Ispitne posude trebale bi imati područje poprečnog presjeka koje omogućava da stvarna dubina tla u ispitnoj posudi bude 2 – 4 cm. Posude bi trebale imati poklopce (npr. staklo ili polietilen) koji su oblikovani kako bi se smanjilo isparavanje vode, čime se omogućava izmjena plinova između tla i atmosfere. Spremnik bi trebao biti barem djelomično proziran kako bi se omogućilo propuštanje svjetlosti.
|
|
12.
|
Potrebna je uobičajena laboratorijska oprema, a posebno sljedeće:
|
—
|
mjerač pH-vrijednosti i luksometar;
|
|
—
|
vage prikladne točnosti;
|
|
—
|
odgovarajuća oprema za regulaciju temperature;
|
|
—
|
odgovarajuća oprema za kontrolu vlažnosti zraka (nije bitno ako su izložene posude pokrivene poklopcima);
|
|
—
|
inkubator s kontroliranom temperaturom ili mala soba;
|
|
—
|
pincete-hvataljke ili uređaj za protok zraka sa slabim usisom.
|
|
Priprema tla za ispitivanje
|
13.
|
Upotrebljava se izmijenjeno umjetno tlo (8) sa sadržajem organske tvari od 5 %. Kao druga mogućnost može se upotrebljavati prirodno tlo s obzirom na to da umjetno tlo ne nalikuje prirodnim tlima. Preporučeni sastav umjetnog tla jest sljedeći (na temelju suhe mase, osušen na stalnu težinu na 105 °C):
|
—
|
5 % sphagnum treseta, sušenog na zraku i fino usitnjenog (prihvatljiva veličina čestica jest 2 ± 1 mm);
|
|
—
|
20 % kaolinitske gline (sadržaj kaolinita po mogućnosti iznad 30 %);
|
|
—
|
oko 74 % industrijskog pijeska sušenog na zraku (ovisno o potrebnoj količini CaCO3), pretežno sitni pijesak s više od 50 % čestica između 50 i 200 mikrona. Točna količina pijeska ovisi o količini CaCO3 (vidi u nastavku), zajedno bi trebali iznositi 75 %.
|
|
—
|
1,0 % kalcijeva karbonata (CaCO3, u prahu, analitički čist) kako bi se dobila pH-vrijednost od 6,0 ± 0,5; količina kalcijeva karbonata koja će se dodati može ovisiti ponajprije o kvaliteti/prirodi treseta (vidi napomenu 1.).
|
Napomena 1: Količina potrebnog CaCO3 ovisit će o komponentama supstrata tla i potrebno ju je odrediti mjerenjem pH-vrijednosti predinkubiranih poduzoraka vlažnog tla neposredno prije ispitivanja.
Napomena 2: Preporučuje se mjerenje pH-vrijednosti i proizvoljno omjera C/N, kapaciteta izmjene kationa (CEC) i sadržaja organske tvari u tlu kako bi se omogućila normalizacija u kasnijoj fazi i bolje tumačili rezultati.
Napomena 3: Ako je potrebno, npr. za određene svrhe ispitivanja, prirodna tla s neonečišćenih mjesta mogu poslužiti kao ispitni supstrat i/ili supstrat za uzgoj kultura. Međutim, ako se upotrebljava prirodno tlo, potrebno mu je zabilježiti najmanje podrijetlo (mjesto skupljanja), pH-vrijednost, teksturu (distribucija veličine čestica), CEC i sadržaj organske tvari te ne smije biti kontaminirano. Za prirodno tlo preporučljivo je dokazati njegovu prikladnost za ispitivanje i za postizanje validacijskih kriterija ispitivanja prije upotrebe tla u glavnom ispitivanju.
|
|
14.
|
Suhi sastojci tla temeljito se izmiješaju (npr. u velikoj laboratorijskoj miješalici). Maksimalni vodni kapacitet (WHC) umjetnog tla određuje se u skladu s postupkom opisanim u Dodatku 5. Sadržaj vlage ispitivanog tla potrebno je optimizirati kako bi se postigla mekana porozna struktura tla zahvaljujući kojoj će skokuni moći ući u pore. To je obično između 40 i 60 % maksimalnog WHC-a.
|
|
15.
|
Suho umjetno tlo prethodno se navlaži dodavanjem dovoljno deionizirane vode kako bi se dobila otprilike polovina konačnog sadržaja vode od dva do sedam dana prije početka ispitivanja kako bi se uravnotežila/stabilizirala kiselost. Za određivanje pH-vrijednosti upotrebljava se smjesa tla i otopina 1 M kalijeva klorida (KCl) i 0,01 M kalcijeva klorida (CaCl2) u omjeru 1: 5 (prema Dodatku 6.). Ako je tlo kiselije od potrebnog raspona, može se regulirati dodavanjem odgovarajuće količine CaCO3. Ako je tlo lužnatije, može se regulirati dodavanjem anorganske kiseline koja je bezopasna za skokune.
|
|
16.
|
Prethodno navlaženo tlo dijeli se u dijelove koji odgovaraju broju ispitnih koncentracija (i referentne kemikalije prema potrebi) i kontrolama koje se upotrebljavaju za ispitivanje. Dodaju se ispitivane kemikalije i regulira se sadržaj vode prema stavku 24.
|
Odabir i priprema pokusnih životinja
|
17.
|
Vrsta F. candida koja se bespolno razmnožava jest preporučena vrsta s obzirom na to da je u prstenastom testu ispitne metode (11) ova vrsta ispunila validacijske kriterije za preživljavanje češće nego vrsta F. fimetaria. Ako se upotrebljava alternativna vrsta, trebala bi ispuniti validacijske kriterije navedene u stavku 9. Na početku ispitivanja životinje bi trebale biti dobro uhranjene i u dobi između 23 i 26 dana za vrstu F. fimetaria i između 9 i 12 dana za vrstu F. candida. Za svako ponavljanje, broj vrste F. fimetaria trebao bi biti deset mužjaka i deset ženki, a za vrstu F. candida potrebno je upotrebljavati deset ženki (vidi Dodatak 2. i Dodatak 3.). Istodobne životinje biraju se nasumice iz posudica te se njihovo zdravlje i fizičko stanje provjeravaju za svaku seriju koja se dodaje za ponavljanje. Svaka skupina od 10/20 jedinki dodaje se u nasumice odabrani ispitni spremnik i odabiru se velike ženke vrste F. fimetaria kako bi se osigurala jasna razlika od mužjaka vrste F. fimetaria.
|
Priprema ispitnih koncentracija
|
18.
|
Mogu se upotrebljavati četiri načina primjene ispitivane kemikalije: 1) miješanje ispitivane kemikalije u tlo s vodom kao nosačem, 2) miješanje ispitivane kemikalije u tlo s organskim otapalom kao nosačem, 3) miješanje ispitivane kemikalije u tlo s pijeskom kao nosačem ili 4) primjena ispitivane kemikalije na površini tla. Izbor odgovarajuće metode ovisi o osobinama kemikalije i svrsi ispitivanja. Općenito, preporučuje se miješanje ispitivane kemikalije u tlo. Međutim, mogu se zahtijevati postupci primjene koji su u skladu s praktičnom upotrebom ispitivane kemikalije (npr. raspršivanje tekuće formulacije ili upotreba posebnih formulacija pesticida kao što su granule ili sredstva za tretiranje sjemenja). Tlo se tretira prije dodavanja skokuna, osim kada se ispitivana kemikalija dodaje na površini tla, skokunima je potrebno dopustiti da uđu u tlo.
|
Ispitivana kemikalija topljiva u vodi
|
19.
|
Otopina ispitivane kemikalije priprema se u deioniziranoj vodi u količini dovoljnoj za sva ponavljanja jedne ispitne koncentracije. Svaka otopina ispitivane kemikalije miješa se temeljito s jednom serijom prethodno navlaženog tla prije unosa u ispitnu posudu.
|
Ispitivana kemikalija netopljiva u vodi
|
20.
|
Za kemikalije netopljive u vodi, ali topljive u organskim otapalima, ispitivana kemikalija može se otopiti u najmanjoj mogućoj količini prikladnog otapala (npr. acetonu), pri čemu se i dalje osigurava pravilno miješanje kemikalije u tlu i njezino miješanje s dijelom potrebnog kremenog pijeska. Potrebno je upotrebljavati samo hlapljiva otapala. Kada se upotrebljava organsko otapalo, sve ispitne koncentracije i dodatna negativna kontrola za otapalo trebali bi sadržavati istu minimalnu količinu otapala. Spremnike za primjenu potrebno je ostaviti otvorene tijekom određenog razdoblja kako bi se omogućilo da otapalo povezano s primjenom ispitivane kemikalije ispari, osiguravajući nerasipanje toksične kemikalije u tom razdoblju.
|
Ispitivana kemikalija slabo topljiva u vodi i organskim otapalima
|
21.
|
Za kemikalije koje su slabo topljive u vodi i organskim otapalima, kremeni pijesak, koji bi trebao biti dio ukupnog pijeska dodanog u tlo, miješa se s količinom ispitivane kemikalije kako bi se dobila željena ispitna koncentracija. Ta se smjesa kremenog pijeska i ispitivane kemikalije dodaje prethodno navlaženom tlu i temeljito se izmiješa nakon dodavanja odgovarajuće količine deionizirane vode kako bi se dobio potrebni sadržaj vlage. Konačna se smjesa podijeli u ispitne posude. Taj se postupak ponavlja za svaku ispitnu koncentraciju, a priprema se i prikladna kontrola.
|
Primjena ispitivane kemikalije na površini tla
|
22.
|
Kada je ispitivana kemikalija pesticid, primjereno ga je nanijeti na površinu tla prskanjem. Tlo se tretira nakon dodavanja skokuna. Ispitni spremnici prvo se napune navlaženim supstratom tla, dodaju se životinje, a zatim se ispitni spremnici izvažu. Kako bi se izbjeglo svako izravno izlaganje životinja ispitivanoj kemikaliji izravnim kontaktom, ispitivana kemikalija nanosi se najmanje pola sata nakon uvođenja skokuna. Ispitivanu kemikaliju potrebno je nanijeti na površinu tla što ravnomjernije s pomoću prikladnog laboratorijskog uređaja za raspršivanje kako bi se simuliralo prskanje u polju. Nanošenje je potrebno obaviti na temperaturi unutar ± 2 °C varijacije, a za vodene otopine, emulzije ili disperzije primjenjuje se količina vode u skladu s preporukama za procjenu rizika. Količinu je potrebno provjeriti s pomoću odgovarajuće tehnike kalibracije. Posebne formulacije poput granula ili sredstva za tretiranje sjemenja mogli bi se primijeniti na način koji je u skladu s upotrebom u poljoprivredi. Hrana se dodaje nakon prskanja.
|
POSTUPAK
Uvjeti ispitivanja
|
23.
|
Srednja temperatura ispitivanja trebala bi biti 20 ± 1 °C s temperaturnim područjem od 20 ± 2 °C. Ispitivanje se provodi u kontroliranim ciklusima svjetla i mraka (po mogućnosti 12 sati svjetla i 12 sati mraka) uz osvjetljenje od 400 do 800 luksa u području ispitnih posuda.
|
|
24.
|
Kako bi provjerili vlažnost tla, posude se važu na početku, u sredini i na kraju ispitivanja. Gubitak težine > 2 % dopunjuje se dodavanjem deionizirane vode. Potrebno je naglasiti da se gubitak vode može smanjiti održavanjem visoke vlažnosti zraka (> 80 %) u ispitnom inkubatoru.
|
|
25.
|
pH-vrijednost potrebno je izmjeriti na početku i na kraju ispitivanja za određivanje raspona i za glavno ispitivanje. Mjerenja je potrebno provesti na jednom dodatnom kontrolnom uzorku i jednom dodatnom uzorku tretiranih (sve koncentracije) uzoraka tla koji su pripremljeni i održavani na isti način kao i ispitivane kulture, ali bez dodavanja skokuna.
|
Ispitni postupak i mjerenja
|
26.
|
Za svaku ispitnu koncentraciju količina tla za ispitivanje koja odgovara 30 g svježe mase stavlja se u ispitnu posudu. Pripremaju se i kontrole vode, bez ispitivane kemikalije. Ako se upotrebljava nosač za primjenu ispitivane kemikalije, uz ispitni niz potreban je jedan kontrolni niz koji sadržava samo nosač. Koncentracija otapala ili dispergenta trebala bi biti ista kao u posudama koje sadržavaju ispitivanu kemikaliju.
|
|
27.
|
Pojedinačni skokuni pažljivo se prenose u svaku ispitnu posudu (rasporede se nasumice u ispitne posude) i stavljaju na površinu tla. Za učinkovit prijenos životinja može se upotrebljavati uređaj za protok zraka sa slabim usisom. Broj ponavljanja za ispitne koncentracije i za kontrole ovisi o planu ispitivanja koji se upotrebljava. Ispitne posude postavljaju se nasumično u ispitni inkubator i takvi položaji ponovno se nasumično raspoređuju jednom tjedno.
|
|
28.
|
Za ispitivanje vrste F. fimetaria treba upotrebljavati 20 odraslih jedinki, deset mužjaka i deset ženki starih 23 – 26 dana po ispitnoj posudi. Dvadeset i prvog dana skokuni se ekstrahiraju iz tla i broje. Za vrstu F. fimetaria spol se razlikuje po veličini u seriji životinja iste dobi koja se upotrebljava za ispitivanje. Ženke su izrazito veće od mužjaka (vidi Dodatak 3.).
|
|
29.
|
Za ispitivanje vrste F. Candida potrebno je upotrebljavati deset mladih jedinki starosti 9 – 12 dana po ispitnoj posudi. Dvadeset i osmog dana skokuni se ekstrahiraju iz tla i broje.
|
|
30.
|
Kao prikladan izvor hrane dodaje se dovoljna količina suhog pekarskog kvasca u prahu, koji je dostupan u slobodnoj trgovini, npr. 2 – 10 mg u svakoj posudi na početku ispitivanja te nakon otprilike dva tjedna.
|
|
31.
|
Na kraju ispitivanja procjenjuju se smrtnost i reprodukcija. Nakon tri tjedna (F. fimetaria) ili četiri tjedna (F. candida) skokuni se ekstrahiraju iz tla za ispitivanje (vidi Dodatak 4.) i broje (12). Skokun se bilježi kao mrtav ako nije prisutan u ekstrakciji. Metode ekstrakcije i brojenja potrebno je validirati. Valjanost uključuje učinkovitost ekstrakcije mladih životinja veću od 95 %, npr. dodavanjem poznatog broja tlu.
|
|
32.
|
Praktičan sažetak i raspored ispitnog postupka navedeni su u Dodatku 2.
|
Plan ispitivanja
Ispitivanje za određivanje raspona
|
33.
|
Prema potrebi provodi se ispitivanje za određivanje raspona s npr. pet koncentracija ispitivane kemikalije od 0,1, 1,0, 10, 100 i 1 000 mg/kg suhe mase tla i dva ponavljanja za svaku obradu i kontrolu. Dodatne informacije, iz ispitivanja sa sličnim kemikalijama ili iz literature, o smrtnosti ili reprodukciji skokuna mogu biti korisne u odlučivanju o rasponu koncentracija koje se upotrebljavaju u ispitivanju za određivanje raspona.
|
|
34.
|
Trajanje ispitivanja za određivanje raspona jest dva tjedna za vrstu F. fimetaria i tri tjedna za vrstu F. candida kako bi se osigurala proizvodnja legla mladih životinja. Na kraju ispitivanja procjenjuju se smrtnost i reprodukcija skokuna. Potrebno je zabilježiti broj odraslih i pojavu mladih životinja.
|
Glavno ispitivanje
|
35.
|
Za određivanje ECx (npr. EC10, EC50) potrebno je ispitati dvanaest koncentracija. Preporučuju se najmanje dva ponavljanja za svaku obradu ispitne koncentracije i šest kontrolnih ponavljanja. Faktor razmaka može varirati ovisno o uzorku doze i reakcije.
|
|
36.
|
Za određivanje NOEC-a/LOEC-a potrebno je ispitati najmanje pet koncentracija u geometrijskom nizu. Preporučuju se četiri ponavljanja za svaku obradu koncentracije plus osam kontrola. Koncentracije je potrebno prorijediti faktorom koji ne prelazi 1,8.
|
|
37.
|
Kombinirani pristup omogućuje utvrđivanje i NOEC-a/LOEC-a i ECx-a. Za ovaj kombinirani pristup potrebno je upotrebljavati osam obrada koncentracije u geometrijskom nizu. Preporučuju se četiri ponavljanja za svaku obradu plus osam kontrola. Koncentracije je potrebno prorijediti faktorom koji ne prelazi 1,8.
|
|
38.
|
Ako nema vidljivih učinaka pri najvišoj koncentraciji u ispitivanju za određivanje raspona (tj. 1 000 mg/kg), ispitivanje reprodukcije može se provesti kao granično ispitivanje s pomoću ispitne koncentracije od 1 000 mg/kg i kontrole. Granično ispitivanje pružit će mogućnost dokaza da ne postoji statistički značajan učinak pri graničnoj koncentraciji. Potrebno je upotrebljavati osam ponavljanja i za obrađeno tlo i za kontrolu.
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
39.
|
Reproduktivna uspješnost jest osnovni krajnji učinak (npr. broj mladih životinja proizvedenih po ispitnoj posudi). Statistička analiza, npr. postupak ANOVA-e, uspoređuje obrade Studentovim t-testom, Dunnettovim testom ili Williamsovim testom. Intervali pouzdanosti od 95 % izračunavaju se za pojedinačne srednje vrijednosti obrada.
|
|
40.
|
Broj preživjelih odraslih životinja u neobrađenim kontrolnim serijama jest glavni validacijski kriterij i potrebno ga je dokumentirati. Kao u ispitivanju za određivanje raspona, sve ostale štetne znakove potrebno je prijaviti i u završnom izvješću.
|
LCx i ECx
|
41.
|
Vrijednosti ECx, uključujući s njima povezane donje i gornje granice pouzdanosti od 95 % za parametar, izračunavaju se primjenom odgovarajućih statističkih metoda (npr. logistička ili Weibullova funkcija, modificirana (potkraćena) Spearman-Karberova metoda ili jednostavna interpolacija). ECx se dobiva uvođenjem vrijednosti koja odgovara x % kontrolne srednje vrijednosti u nađenoj jednadžbi. Za izračun EC50 ili bilo koji drugi ECx cjelokupan skup podataka potrebno je podvrgnuti regresijskoj analizi. LC50 obično se procjenjuje analizom vjerojatnosti ili sličnom analizom koja uzima u obzir binomno distribuirane podatke o smrtnosti.
|
NOEC/LOEC
|
42.
|
Ako se statističkom analizom namjerava utvrditi NOEC/LOEC, potrebni su statistički podaci za svaku posudu (pojedinačne posude smatraju se ponavljanjima). Potrebno je upotrebljavati odgovarajuće statističke metode u skladu s OECD-ovom Smjernicom o sadašnjim pristupima statističke analize podataka o ekotoksičnosti: Smjernice za primjenu (9). Općenito, štetni učinci ispitivane kemikalije u usporedbi s kontrolom istražuju se primjenom jednosmjernog testiranja hipoteze na p ≤ 0,05.
|
|
43.
|
Normalna raspodjela i homogenost varijance može se ispitati primjenom odgovarajućeg statističkog testa, npr. Shapiro-Wilkova testa i Leveneova testa (p ≤ 0,05). Mogu se provesti jednosmjerna analiza varijance (ANOVA) i naknadni višestruki usporedni testovi. Višestruke usporedbe (npr. Dunnettov test) ili testovi trenda postupnog snižavanja (npr. Williamsov test) mogu se upotrebljavati kako bi se izračunalo postoje li značajne razlike (p ≤ 0,05) između kontrola i raznih koncentracija ispitivane kemikalije (izbor preporučenog testa prema OECD-ovoj Smjernici (9)). U protivnome, za određivanje NOEC-a i LOEC-a mogle bi se upotrijebiti neparametrijske metode (npr. Bonferronijev-U-test prema Holmovom ili Jonckheere-Terpstra testu trenda).
|
Granično ispitivanje
|
44.
|
Ako je granično ispitivanje (usporedba kontrole i samo jedne obrade) provedeno i uvjeti postupaka parametrijskih testova (normalnost, homogenost) ispunjeni, metrički odgovori mogu se ocijeniti Studentovim testom (t-test). Ako ti uvjeti nisu ispunjeni, mogu se upotrebljavati t-test nejednake varijance (Welchov t-test) ili neki neparametrijski test, kao što je Mann-Whitheyev-U test.
|
|
45.
|
Za određivanje značajnih razlika između kontrolnih skupina (kontrolnih skupina i kontrolnih skupina s otapalom) ponavljanja svake kontrole mogu se testirati kao što je opisano za granično ispitivanje. Ako se ovim testovima ne otkriju značajne razlike, sva ponavljanja kontrolnih skupina i kontrolnih skupina s otapalom mogu se ujediniti. U protivnome, sve obrade potrebno je usporediti s kontrolnom skupinom s otapalom.
|
Izvješće o ispitivanju
|
46.
|
Izvješće o ispitivanju trebalo bi sadržavati barem sljedeće podatke:
|
|
Ispitivana kemikalija
|
—
|
identitet ispitivane kemikalije, serija, partija, CAS broj, čistoća;
|
|
—
|
fizikalno-kemijska svojstva ispitivane kemikalije (npr. log Kow, topljivost u vodi, tlak pare, Henryjeva konstanta (H) i po mogućnosti informacije o sudbini ispitivane kemikalije u tlu, ako su raspoložive;
|
|
—
|
potrebno je navesti formulaciju ispitivane kemikalije i aditive ako se ispituje kemikalija koja nije čista;
|
|
|
|
Ispitni organizmi
|
—
|
identifikacija vrsta i dobavljača ispitnih organizama, opis uvjeta uzgoja i dobni raspon ispitnih organizama;
|
|
|
|
Uvjeti ispitivanja
|
—
|
opis plana i postupaka pokusa;
|
|
—
|
pojedinosti pripreme ispitnog tla; detaljna specifikacija ako se upotrebljava prirodno tlo (podrijetlo, povijest, distribucija veličine čestica, pH-vrijednost, sadržaj organske tvari);
|
|
—
|
maksimalni vodni kapacitet tla;
|
|
—
|
opis tehnike koja se upotrebljava za primjenu ispitivane kemikalije na tlo;
|
|
—
|
uvjeti ispitivanja; jačina svjetlosti, trajanje ciklusa svjetla i mraka, temperatura;
|
|
—
|
opis režima hranjenja, vrsta i količina hrane koja se upotrebljava u ispitivanju, datumi hranjenja;
|
|
—
|
pH-vrijednost i sadržaj vode u tlu na početku i kraju ispitivanja (kontrola i svaka obrada);
|
|
—
|
detaljan opis metode ekstrakcije i učinkovitosti ekstrakcije;
|
|
|
|
Rezultati ispitivanja
|
—
|
broj mladih životinja utvrđen u svakoj ispitnoj posudi na kraju ispitivanja;
|
|
—
|
broj starih životinja i njihova smrtnost ( %) u svakoj ispitnoj posudi na kraju ispitivanja;
|
|
—
|
opis očitih fizioloških i patoloških simptoma ili izrazitih promjena u ponašanju;
|
|
—
|
rezultati dobiveni s referentnom ispitivanom kemikalijom;
|
|
—
|
vrijednosti NOEC-a/LOEC-a, LCx za smrtnost i ECx za reprodukciju (uglavnom LC50, LC10, EC50 i EC10) zajedno s 95 %-im intervalima pouzdanosti. grafikon prilagođenog modela koji se upotrebljava za izračun, njegova funkcionalna jednadžba i njegovi parametri (vidi (9));
|
|
—
|
sve informacije i zapažanja korisna za tumačenje rezultata;
|
|
—
|
snaga stvarnog ispitivanja ako se vrši ispitivanje hipoteze (9);
|
|
—
|
odstupanja od postupaka opisanih u ovoj ispitnoj metodi i bilo koje neobične pojave tijekom ispitivanja;
|
|
—
|
za NOEC, prilikom procjene, minimalna uočljiva razlika.
|
|
|
LITERATURA
|
(1)
|
Wiles JA i Krogh PH (1998.) Testing with the collembolans I. viridis, F. candida and F. fimetaria. In Handbook of soil invertebrate toxicity tests (ed. H Løkke i CAM Van Gestel), str. 131. – 156. John Wiley & Sons, Ltd., Chichester
|
|
(2)
|
ISO (1999.) Soil Quality – Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. br. 11267. Međunarodna organizacija za normizaciju, Ženeva
|
|
(3)
|
Burges A i Raw F (Eds) (1967.) Soil Biology. Academic Press. London
|
|
(4)
|
Petersen H Luxton M (1982.) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287. – 388.
|
|
(5)
|
Petersen H (1994.) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195.: 111. – 118.
|
|
(6)
|
Hopkin SP (1997.). Biology of the Springtails (Insecta: Collembola). Oxford University Press. str. 330. (ISBN 0-19-854084-1)
|
|
(7)
|
Ulber B (1983.) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In New trends in soil Biology (Lebrun Ph, André HM, De Medts A, Grégoire-Wibo, Wauthy G (Eds), Proceedings of the VI. international colloquium on soil zoology, Louvain-la-neuve (Belgium), 30. kolovoza – 2. rujna 1982., I Dieu-Brichart, Ottignies-Louvain-la-Neuve, str. 261. – 268.
|
|
(8)
|
Poglavlje C.36 ovog Priloga, Ispitivanje reproduktivne toksičnosti u tlu za grabežljivu grinju (Hypoaspis (Geolaelaps) aculeifer).
|
|
(9)
|
OECD (2006.), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006.)18, OECD Paris
|
|
(10)
|
Scott-Fordsmand JJ i Krogh PH (2005.) Background report on prevalidation of an OECD springtail test guideline. Environmental Project br. 986. Miljøstyrelsen str. 61. Danish Ministry for the Environment.
|
|
(11)
|
Krogh, P.H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danish Environmental Protection Agency, Environmental Project br. 1256, str. 66.
|
|
(12)
|
Krogh PH, Johansen K and Holmstrup M (1998.) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201. – 205.
|
|
(13)
|
Fjellberg A (1980.) Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
(14)
|
Edwards C.A. (1955.) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan D.K. McE., Ed). Butterworths, London, str. 412. – 416.
|
|
(15)
|
Goto HE (1960.) Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96: 138.– 140.
|
Dodatak 1.
Definicije
Slijedeće definicije primjenjuju se na ovu ispitnu metodu (u ovom ispitivanju sve koncentracije s učinkom izražavaju se kao masa ispitivane kemikalije po suhoj masi ispitnog tla):
|
|
Kemikalija je tvar ili smjesa.
|
|
|
NOEC (najviša koncentracija bez vidljivog učinka) jest koncentracija ispitivane kemikalije u kojoj nije opažen učinak. U ovom ispitivanju koncentracija koja odgovara NEOC-u nema statistički značajan učinak (p < 0,05) unutar navedenog razdoblja izlaganja u usporedbi s kontrolom.
|
|
|
LOEC (najniža koncentracija s vidljivim učinkom) jest najniža koncentracija ispitivane kemikalije koja ima statistički značajan učinak (p < 0,05) unutar navedenog razdoblja izlaganja u usporedbi s kontrolom.
|
|
|
ECx (koncentracija s učinkom za x % učinka) jest koncentracija koja uzrokuje x % učinka na ispitne organizme unutar navedenog razdoblja izlaganja u usporedbi s kontrolom. Na primjer, EC50 jest koncentracija za koju se procjenjuje da prouzročuje učinak na krajnju točku ispitivanja u 50 % izložene populacije tijekom određenog razdoblja izlaganja.
|
|
|
Ispitivana kemikalija jest bilo koja tvar ili smjesa koja se ispituje ovom ispitnom metodom.
|
Dodatak 2.
Glavne aktivnosti i raspored za obavljanje ispitivanja na skokunima
Faze ispitivanja mogu se sažeti kako slijedi:
|
Vrijeme (dan)
|
Aktivnost
|
|
od – 23 do – 26
|
Priprema kulture za jedinke iste dobi vrste F. fimetaria
|
|
– 14
|
Pripremiti umjetno tlo (miješanje suhih sastojaka)
Provjeriti pH-vrijednost umjetnog tla i prilagoditi ga sukladno tome
Izmjeriti maksimalni WHC tla
|
|
– 9 do – 12
|
Priprema kulture za jedinke iste dobi vrste F. candida
|
|
– 2 do – 7
|
Prethodno navlažiti tlo
|
|
–1
|
Rasporediti mlade životinje u serije
Pripremiti radne otopine i primijeniti ispitivanu kemikaliju ako je potrebno otapalo
|
|
0
|
Pripremiti radne otopine i primijeniti ispitivanu kemikaliju ako je potrebna kruta kemikalija, topljiva u vodi ili površinska primjena
Izmjeriti pH-vrijednost tla i izvagati spremnike.
Dodati hranu. Uvesti skokune.
|
|
14
|
Ispitivanje za određivanje raspona vrste F. fimetaria: Prekinuti ispitivanje, izvaditi životinje, izmjeriti pH-vrijednost tla i gubitak vode (težina)
Glavna ispitivanja: Izmjeriti sadržaj vlage i napuniti vodom te dodati 2 – 10 mg kvasca
|
|
21
|
Glavno ispitivanje vrste F. fimetaria: Prekinuti ispitivanje, izvaditi životinje, izmjeriti pH-vrijednost tla i gubitak vode (težina)
Ispitivanje za određivanje raspona vrsteF. candida: Prekinuti ispitivanje, izvaditi životinje, izmjeriti pH-vrijednost tla i gubitak vode (težina)
|
|
28
|
Glavno ispitivanje vrste F. candida: Prekinuti ispitivanje, izvaditi životinje, izmjeriti pH-vrijednost tla i gubitak vode (težina)
|
Dodatak 3.
Smjernica o uzgoju i sinkronizaciji vrsta F. fimetria i F. candida
Vrijeme i trajanje navedeno u ovoj smjernici potrebno je provjeriti za svaki pojedini soj skokuna kako bi se osiguralo da će odabir trenutka omogućiti dovoljno mladih životinja iste dobi. Načelno, učestalost odlaganja jajašaca nakon što se odrasle životinje prenesu na svježi supstrat i jajašaca za nasad određuju odgovarajući dan za skupljanje jajašaca i skupljanje mladih životinja iste dobi.
Preporučuje se imati trajnu matičnu kulturu koji se sastoji od npr. 50 spremnika / Petrijevih zdjelica. Matičnu kulturu potrebno je držati u dobrim uvjetima hranjenja te ju tjedno hraniti, zalijevati vodom i uklanjati staru hranu i trupla. Premalo skokuna na supstratu može dovesti do inhibicije zbog većeg rasta gljivica. Ako se matična kultura upotrebljava prečesto za proizvodnju jajašaca, kultura se može umoriti. Znakovi umora jesu mrtve odrasle životinje i plijesan na supstratu. Preostala jajašca iz proizvodnje životinja iste dobi mogu se upotrebljavati za pomlađivanje kulture.
U sinkronoj kulturi vrste F. fimetaria mužjaci se razlikuju od ženki ponajprije po veličini. Mužjaci su očito manji od ženki, a brzina kretanja mužjaka veća je nego kod ženki. Pravilan odabir spola zahtijeva malo prakse i može se potvrditi mikroskopskim pregledom genitalnog područja (13).
1. Uzgoj
1.a. Priprema supstrata za uzgoj kulture
Supstrat za uzgoj kulture jest gips (kalcijev sulfat) s aktivnim ugljenom. Time se dobiva vlažan supstrat u kojem je funkcija ugljena apsorbirati otpadne plinove i izlučevine (14) (15). Različiti oblici ugljena mogu se upotrijebiti za olakšavanje promatranja skokuna. Na primjer, ugljen u prahu upotrebljava se za vrste F. candida i F. fimetaria (proizvodeći crno-sivi gips):
Sastojci supstrata:
|
—
|
200 ml destilirane vode
|
ili
|
—
|
50 g aktivnog ugljena u prahu
|
|
—
|
260 – 300 ml destilirane vode.
|
Prije upotrebe smjesu supstrata potrebno je pustiti da se staloži.
1.b. Uzgoj
Skokuni se drže u spremnicima kao što su Petrijeve zdjelice (90 mm × 13 mm) čije je dno pokriveno slojem supstrata gipsa/ugljena od 0,5 cm. Oni se uzgajaju na 20 ± 1 °C u ciklusu 12 sati svjetla i 12 sati mraka (400 – 800 luksa). Spremnici se stalno drže vlažnima i osiguravaju da relativna vlažnost zraka unutar spremnika bude 100 %. To se može zajamčiti prisustvom vode unutar poroznog gipsa, ali izbjegavanjem stvaranja filma vode na površini gipsa. Gubitak vode može se spriječiti dotokom vlažnog zraka iz okoline. Sve mrtve jedinke potrebno je ukloniti iz spremnika, kao i svu pljesnivu hranu. Za poticanje proizvodnje jajašaca potrebno je prenijeti odrasle životinje na Petrijeve zdjelice s novopripremljenim supstratom gipsa/ugljena.
1.c. Izvor hrane
Suhi pekarski kvasac u granulama upotrebljava se kao jedini izvor hrane i za vrste F. candida i F. fimetaria. Svježa hrana daje se jednom ili dva puta tjedno kako bi se izbjeglo pljesnivljenje. Stavlja se izravno na gips u maloj gomili. Masu dodanog pekarskog kvasca potrebno je prilagoditi veličini populacije skokuna, ali u pravilu dovoljno je 2 – 15 mg.
2. Sinkronizacija
Ispitivanje je potrebno provesti sa životinjama iste dobi kako bi se dobile homogene pokusne životinje istog stadija i veličine. Nadalje, sinkronizacijom se omogućuje razlikovanje mužjaka i ženki vrste F. fimetaria u dobi od tri tjedna i nadalje na temelju spolnog dimorfizma, tj. razlika u veličini. Postupak u nastavku jest prijedlog o tome kako dobiti životinje iste dobi (praktični koraci nisu obvezni).
2.a. Sinkronizacija.
|
—
|
Pripremiti spremnike sa slojem supstrata gipsa/ ugljena od 0,5 cm.
|
|
—
|
Za nesenje jajašaca prenijeti 150 – 200 odraslih životinja vrste F. fimetaria i 50 – 100 vrste F. candida iz najboljih 15 – 20 spremnika matične kulture sa supstratom starim od četiri do osam tjedana u spremnike i hraniti ih s 15 mg pekarskog kvasca. Izbjegavati dovođenje mladih životinja s odraslim životinjama s obzirom na to da prisutnost mladih životinja može usporiti proizvodnju jajašaca.
|
|
—
|
Držati kulturu na 20 ± 1 °C (srednja vrijednost trebala bi biti 20 °C) i u ciklusu 12 sati svjetla i 12 sati mraka (400 – 800 luksa). Omogućiti da je svježa hrana dostupna i zrak zasićen vodom. Nedostatak hrane može dovesti do toga da životinje vrše nuždu po jajašcima, što dovodi do rasta gljivica na jajašcima ili vrsta F. candida može pojesti vlastita jajašca. Nakon deset dana jajašca se pažljivo skupljaju iglom i lopaticom te se premještaju na ‚papir za jajašca’ (komadići filtarskog papira umočenog u suspenziju gipsa/ugljena) koji se stavlja u spremnik sa svježim supstratom gipsa/ugljena. Nekoliko zrna kvasca dodaje se supstratu kako bi privuklo mlade životinje i potaknulo ih da napuste papir za jajašca. Važno je da papir za jajašca i supstrat budu vlažni jer će u protivnome jajašca dehidrirati. Kao druga mogućnost odrasle životinje mogu se ukloniti iz kutije za sinkronizaciju kulture nakon proizvodnje jajašaca za dva ili tri dana.
|
|
—
|
Nakon tri dana većina jajašaca na papiru za jajašca izleći će se, a poneke mlade životinje mogu se naći ispod papira za jajašca.
|
|
—
|
Kako bi se dobile mlade životinje iste dobi, papir za jajašca s neizlegnutim jajašcima uklanja se pincetom iz Petrijeve zdjelice. Mlade životinje, sada stare od nula do tri dana, ostaju u posudi i hrane se pekarskim kvascem. Neizlegnuta jajašca bacaju se.
|
|
—
|
Jaja i izlegnute mlade životinje uzgajaju se na isti način kao i odrasle životinje. Posebno za vrstu F. fimetaria potrebno je poduzeti sljedeće mjere: osigurati dovoljno svježe hrane, ukloniti staru pljesnivu hranu, nakon tjedan dana mlade životinje podijele se u nove Petrijeve zdjelice pod uvjetom da je gustoća iznad 200.
|
2.b. Rukovanje skokunima na početku ispitivanja
|
—
|
Vrsta F. candida stara od devet do 12 dana ili od 23 do 26 dana stara vrsta F. fimetaria prikupljaju se npr. usisavanjem i puštaju u mali spremnik s vlažnim supstratom gipsa/ugljena, a njihovo fizičko stanje provjerava se dvogledom (ozlijeđene i oštećene životinje uklanjaju se). Sve faze potrebno je izvršiti čuvajući skokune u vlažnoj atmosferi kako bi se izbjegao stres zbog suše, npr. primjenom navlaženih površina itd.
|
|
—
|
Okrenuti spremnik naopako i kucati po njemu kako bi se skokuni premjestili na tlo. Statički elektricitet potrebno je neutralizirati, u protivnome životinje mogu samo poletjeti u zrak ili se priljubiti uz stranu ispitnog spremnika i isušiti. Ionizator ili vlažna krpa ispod spremnika može se upotrebljavati za neutralizaciju.
|
|
—
|
Hranu je potrebno raširiti po cijeloj površini tla, a ne samo na jednoj hrpi.
|
|
—
|
Tijekom prijevoza i tijekom razdoblja ispitivanja potrebno je izbjegavati kucanje ili drugi fizički poremećaj ispitnog spremnika s obzirom na to da se tako može povećati zbijanje tla i ugroziti interakcija između skokuna.
|
3. Alternativne vrste skokuna
Za ispitivanje u skladu s ovom ispitnom metodom mogu se izabrati druge vrste skokuna, kao što su Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi, Mesaphorura macrochaeta. Prije primjene alternativnih vrsta potrebno je ispuniti brojne preduvjete:
|
—
|
potrebno ih je nedvosmisleno identificirati;
|
|
—
|
potrebno je dati obrazloženje za odabir vrste;
|
|
—
|
potrebno je osigurati da se reproduktivna biologija uključi u fazu testiranja tako da će biti potencijalna meta tijekom izlaganja;
|
|
—
|
potrebno je poznavati životnu povijest: dob pri sazrijevanju, trajanje razvoja jajašaca i stadija koji su predmet izlaganja;
|
|
—
|
optimalne uvjete za rast i razmnožavanje potrebno je osigurati ispitnim supstratom i opskrbom hranom;
|
|
—
|
varijabilnost bi trebala biti dovoljno niska za precizno i točno određivanje toksičnosti.
|
Dodatak 4.
Uzimanje i brojenje životinja
1. Mogu se provesti dvije metode ekstrakcije:
|
1.a.
|
Prva metoda: može se upotrebljavati uređaj za ekstrakciju s kontroliranim temperaturnim gradijentom koji se temelji na načelima MacFadyena (1). Toplina dolazi od grijaćeg elementa na vrhu kutije za ekstrakciju (regulira se s pomoću termistora postavljenog na površini uzorka tla). Temperatura u ohlađenoj tekućini koja okružuje sabirnu posudu regulira se s pomoću termistora koji se nalazi na površini kutije za ekstrakciju (smještene ispod jezgre tla). Termistori su povezani s programabilnom kontrolnom jedinicom koja podiže temperaturu prema unaprijed programiranom rasporedu. Životinje se prikupljaju u ohlađenu kutiju za prikupljanje (2 °C) s donjim slojem gipsa/ugljena. Ekstrakcija započinje na 25 °C i temperatura se automatski povećava svakih 12 sati za 5 °C te ima ukupno trajanje od 48 sati. Nakon 12 sati na 40 °C ekstrakcija je završena.
|
|
1.b.
|
Druga metoda: Nakon eksperimentalnog razdoblja inkubacije broj prisutnih mladih skokuna procjenjuje se plutanjem. U tu svrhu ispitivanje se provodi u posudama volumena od otprilike 250 ml. Na kraju ispitivanja dodaje se otprilike 200 ml destilirane vode. Tlo se lagano miješa finim kistom kako bi se omogućilo skokunima da plutaju na površini vode. Mala količina, otprilike 0,5 ml crne Kentmereove boje za fotografiju može se dodati u vodu radi pomoći u brojenju povećanjem kontrasta između vode i bijelih skokuna. Boja nije toksična za skokune.
|
2. Brojenje:
Brojenje se može obaviti golim okom ili pod svjetlosnim mikroskopom upotrebom rešetke postavljene iznad posude za plutanje ili fotografiranjem površine svake posude i kasnije brojenjem skokuna na povećanim fotografijama ili projiciranim dijapozitivima. Brojenje se može obaviti i s pomoću tehnika za digitalnu obradu slike (12). Sve tehnike potrebno je provjeriti.
Dodatak 5.
Određivanje maksimalnog WHC-a tla
Utvrđeno je da je prikladna sljedeća metoda za određivanje maksimalnog vodnog kapaciteta (WHC) tla. Opisana je u Dodatku C ISO DIS 11268-2 (Kakvoća tla – Učinci onečišćujućih tvari na gujavice (Eisenia fetida). Dio 2.: Određivanje učinaka na reprodukciju).
Prikupiti određenu količinu (npr. 5 g) supstrata tla za ispitivanje s pomoću prikladnog uređaja za uzorkovanje (cijev s pužnim transporterom i sl.). Pokriti dno cijevi komadom vlažnog filtarskog papira i zatim ga staviti na stalak u vodenoj kupelji. Cijev je potrebno postupno uroniti dok razina vode ne bude iznad vrha tla. Zatim ju je potrebno ostaviti u vodi oko tri sata. Budući da se ne može zadržati sva voda koju apsorbiraju kapilare tla, uzorku tla potrebno je dati dva sata da se osuši postavljanjem cijevi na podlogu od vrlo vlažnog fino usitnjenog kremenog pijeska koji se nalazi u pokrivenoj posudi (kako bi se spriječilo isušivanje). Uzorak se zatim važe i suši do konstantne mase pri 105 °C. Vodni kapacitet (WHC) potrebno je izračunati na sljedeći način:

Gdje je:
|
S
|
=
|
supstrat zasićen vodom + masa cijevi + masa filtarskog papira
|
|
T
|
=
|
tara (masa cijevi + masa filtarskog papira)
|
|
D
|
=
|
suha masa supstrata
|
Dodatak 6.
Određivanje pH-vrijednosti tla
Sljedeća metoda za određivanje pH-vrijednosti tla temelji se na opisu navedenim u ISO DIS 10390: Kakvoća tla – određivanje pH-vrijednosti.
Utvrđena količina zemlje suši se na sobnoj temperaturi najmanje 12 sati. Zatim se izrađuje suspenzija tla (koja sadržava najmanje 5 g tla) u peterostruko većem volumenu 1 M otopine analitički čistog kalijeva klorida (KCl) ili 0,01 M otopine analitički čistog kalcijeva klorida (CaCl2). Suspenzija se zatim temeljito protresa pet minuta i zatim se ostavi da se sliježe najmanje dva sata, ali ne dulje od 24 sata. Potom se pH-vrijednost tekuće faze mjeri s pomoću mjerača pH-vrijednosti koji je kalibriran prije svakog mjerenja s pomoću odgovarajućeg niza puferskih otopina (npr. pH 4,0 i 7,0).
C.40. TOKSIKOLOŠKO ISPITIVANJE UNUTAR ŽIVOTNOG CIKLUSA TRZALACA (CHIRONOMIDAE) U VODI IZ SEDIMENTA S VODOM OBRAĐENOM SPIKINGOM ILI SA SEDIMENTOM OBRAĐENIM SPIKINGOM
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje (TG) br. 233 (2010.). Namijenjena je procjeni učinaka cjeloživotnog izlaganja kemikalijama slatkovodnih dvokrilaca trzalaca (Chironomus sp.) i u cijelosti obuhvaća prvu generaciju (roditeljsku generaciju) i rani dio druge generacije (filijalna generacija). Predstavlja proširenje postojećih ispitnih metoda C.28. (1) ili C. 27. (15) s pomoću scenarija izlaganja u vodi obrađenoj spikingom ili scenarija sedimenta obrađenog spikingom. Uzima u obzir postojeće protokole ispitivanja toksičnosti za Chironomus riparius i Chironomus dilutus (prethodnog naziva C. tentans (2)) koji su razvijeni u Europi i Sjevernoj Americi (3)(4)(5)(6)(7)(8)(9) i naknadno ispitani u prstenastom testu (1)(7)(11)(12). Mogu se upotrebljavati i druge vrste trzalaca o kojima postoji opsežna dokumentacija, npr. Chironomus yoshimatsui (13)(14). Ukupno trajanje izlaganja jest otprilike 44 dana za C. riparius i C. yoshimatsui, a otprilike 100 dana za C. dilutus.
|
|
2.
|
U ovoj su ispitnoj metodi opisani scenarij izlaganja u vodi i scenarij izlaganja u sedimentu. Odabir prikladnog scenarija izlaganja ovisi o namijenjenoj primjeni ispitivanja. Namjena scenarija izlaganja u vodi, obrađivanja vodenog stupca spikingom, jest simulirati rasap pesticida, a obuhvaća početnu vršnu koncentraciju u površinskim vodama. Obrađivanje vode spikingom korisno je i za druge vrste izlaganja (uključujući i izlijevanja kemikalija), no ne i za procese akumulacije unutar sedimenta koji traju dulje od razdoblja ispitivanja. U tom bi slučaju, kao i kad je otjecanje glavni način na koji pesticidi ulaze u vodu, prikladniji mogao biti plan koji uključuje sediment obrađen spikingom. Plan ispitivanja lako se može prilagoditi pokažu li se korisnima drugi scenariji izlaganja. Na primjer, ako raspodjela ispitivane kemikalije između vodene faze i sloja sedimenta nije od interesa i potrebno je smanjiti adsorpciju na sediment na najmanju moguću razinu, može se uzeti u obzir upotrebu surogatnog umjetnog sedimenta (npr. kremenog pijeska).
|
|
3.
|
Kemikalije u odnosu na koje je potrebno ispitivanje organizama koji žive u sedimentu mogu dugo opstati u sedimentu. Organizmi koji žive u sedimentu mogu se izlagati na razne načine. Relativna važnost svakog načina izlaganja i vrijeme potrebno kako bi svaki od tih načina pridonio cjelokupnom toksičnom učinku ovise o fizikalno-kemijskim svojstvima kemikalije. U slučaju jako adsorptivnih kemikalija ili kemikalija koje se vežu sa sedimentom kovalentnim vezama gutanje kontaminirane hrane može biti važan način izlaganja. Kako se ne bi podcijenila toksičnost izrazito lipofilnih kemikalija, u obzir se može uzeti upotreba hrane koja se dodaje sedimentu prije primjene ispitivane kemikalije (vidi stavak 31.). Stoga je moguće uključiti sve načine izlaganja i sve životne stadije.
|
|
4.
|
Izmjereni krajnji učinci ukupan su broj preobraženih odraslih životinja (za prvu i drugu generaciju), brzina razvoja (za prvu i drugu generaciju), omjer spolova živih odraslih životinja koje su se u cijelosti preobrazile (za prvu i drugu generaciju), broj skupina jajašaca po ženki (samo prva generacija) i stvarna plodnost jajašaca (samo prva generacija).
|
|
5.
|
Svakako se preporučuje formulirani sediment. Formulirani sediment ima nekoliko prednosti nad prirodnim sedimentima:
|
—
|
pokusna varijabilnost smanjena je jer stvara mjerno obnovljivu ‚standardiziranu matricu’ te se eliminira potreba za pronalaženjem nekontaminiranog i čistog sedimenta;
|
|
—
|
ispitivanja se mogu provoditi u bilo koje doba, a da se pritom ne suočava sa sezonskom varijabilnošću u ispitnom sedimentu, a nema ni potrebe za prethodnom obradom sedimenta radi uklanjanja urođene faune;
|
|
—
|
sniženi troškovi u usporedbi s terenskim prikupljanjem dovoljnih količina potrebnih za rutinsko ispitivanje;
|
|
—
|
formulirani sediment omogućuje usporedbe toksičnosti po studijama i razvrstavanje kemikalija u skladu s tim (3).
|
|
|
6.
|
Upotrijebljene definicije navedene su u Dodatku 1.
|
NAČELO ISPITIVANJA
|
7.
|
Ličinke trzalaca u prvom stadiju razvoja izlažu se rasponu koncentracija ispitivane kemikalije u sustavu sediment/voda. Ispitivanje počinje stavljanjem ličinaka trzalaca u prvom stadiju razvoja (prva generacija) u ispitne laboratorijske čaše u kojima se nalazi sediment obrađen spikingom ili se ispitivana kemikalija dodaje spikingom u vodu nakon dodavanja ličinaka. Procjenjuju se preobrazba trzalaca, vrijeme preobrazbe i omjer spolova živih mušica koje su se u cijelosti preobrazile. Preobražene odrasle životinje prenose se u kaveze za uzgoj kako bi se mogle rojiti, pariti i polagati jajašca. Procjenjuju se broj proizvedenih skupina jajašaca i njihova stvarna plodnost. Iz tih se skupina jajašaca dobivaju ličinke u prvom stadiju razvoja druge generacije. Te se ličinke stavljaju u svježe pripremljene ispitne laboratorijske čaše (postupak spikinga kao u slučaju prve generacije) kako bi se utvrdila održivost druge generacije procjenom njihove preobrazbe, vremena preobrazbe i omjera spolova živih mušica koje su se u cijelosti preobrazile (shematski prikaz ispitivanja životnog ciklusa nalazi se u Dodatku 5.). Svi se podaci analiziraju bilo modelom regresijske analize u cilju određivanja koncentracije koja bi izazvala X %-tno smanjenje relevantnog krajnjeg učinka bilo testiranjem hipoteze u cilju određivanja najviše koncentracije bez vidljivog učinka (NOEC). Za potonje je potrebna usporedba reakcija na tretman s odgovarajućim kontrolnim odgovorima s pomoću statističkih testova. Potrebno je napomenuti da bi u scenariju vode obrađene spikingom, u slučaju kemikalija koje se brzo razgrađuju, kasniji životni stadiji svake generacije (npr. faza kukuljice) mogli biti izloženi znatno nižoj razini koncentracije u vodi iznad sedimenta u odnosu na ličinke u prvom stadiju razvoja. Ako to predstavlja problem i ako je potrebna usporediva razina izlaganja za svaki životni stadij, mogu se uzeti u obzir sljedeće izmjene ispitne metode:
|
—
|
paralelna ispitivanja sa spikingom u različitim životnim stadijima ili
|
|
—
|
ponovljeno obrađivanje (ili obnova vode iznad sedimenta) ispitnog sustava spikingom za vrijeme obiju faza ispitivanja (prva i druga generacija), pri čemu je intervale obrade spikingom (obnove) potrebno prilagoditi svojstvima sudbine ispitivane kemikalije.
|
Takve su izmjene izvedive samo u slučaju vode obrađene spikingom, ne i u slučaju sedimenta obrađenog spikingom.
|
INFORMACIJE O ISPITIVANOJ KEMIKALIJI
|
8.
|
Trebali bi biti poznati topljivost ispitivane kemikalije u vodi, njezin tlak pare i log K
ow, izmjerena ili izračunana razdioba u sedimentu te stabilnost u vodi i sedimentu. Trebala bi biti dostupna pouzdana analitička metoda kvantifikacije ispitivane kemikalije u vodi iznad sedimenta, pornoj vodi i sedimentu, s poznatom i prijavljenom preciznošću i granicama detekcije. Korisne informacije uključuju strukturnu formulu i čistoću ispitivane kemikalije. Korisna je informacija i kemijska sudbina ispitivane kemikalije (npr. rasipanje, abiotička i biotička razgradnja itd.). Daljnje smjernice za ispitivanje kemikalija čija su fizikalno-kemijska svojstva takva da je zbog njih teško provoditi ispitivanja nalaze se u (16).
|
REFERENTNE KEMIKALIJE
|
9.
|
Referentne kemikalije mogu se ispitivati periodično kao način kojim se osigurava nepromjenjivost osjetljivosti laboratorijske populacije. Kao u slučaju dafnija, bit će dovoljno provesti 48-satno ispitivanje akutne toksičnosti (u skladu sa 17). Međutim, dok ne bude dostupna potvrđena smjernica za akutnu toksičnost, u obzir se može uzeti ispitivanje kronične toksičnosti u skladu s poglavljem C.28. ovog Priloga. Primjeri referentnih toksičnih tvari koje se uspješno upotrebljavaju u prstenastim testovima i validacijskim studijama jesu: lindan, trifluralin, pentaklorofenol, kadmijev klorid i kalijev klorid (1) (3) (6) (7) (18).
|
VALJANOST ISPITIVANJA
|
10.
|
Kako bi ispitivanje bilo valjano, primjenjuju se sljedeći uvjeti:
|
—
|
prosječna uspješnost preobrazbe u kontrolnoj skupini trebala bi iznositi najmanje 70 % na kraju razdoblja izlaganja za obje generacije (1)(7);
|
|
—
|
za C. riparius i C. yoshimatsui, 85 % ukupnih ličinaka iz kontrolne skupine stavljenih u posude u prvom stadiju razvoja trebalo bi se preobraziti u odrasle mušice nakon 12 do 23 dana; za C. dilutus prihvatljivo je razdoblje od 20 do 65 dana;
|
|
—
|
srednji omjer spolova živih odraslih životinja koje su se u cijelosti preobrazile (kao udio ženki ili mužjaka) u kontrolnoj skupini obiju generacija treba iznositi najmanje 0,4, a najviše 0,6;
|
|
—
|
za svaki kavez za uzgoj broj skupina jajašaca u kontrolnim posudama prve generacije trebao bi iznositi najmanje 0,6 po ženki dodanoj u kavez za uzgoj;
|
|
—
|
udio plodnih skupina jajašaca u svakom kavezu za uzgoj kontrolnih posuda prve generacije trebao bi iznositi najmanje 0,6;
|
|
—
|
na kraju razdoblja izlaganja za obje generacije treba u svakoj posudi izmjeriti pH-vrijednost i koncentraciju otopljenog kisika. Koncentracija kisika trebala bi iznositi najmanje 60 % vrijednosti zasićenosti kisikom (ASV (24)), a pH-vrijednost vode iznad sedimenta trebala bi biti u rasponu od 6 do 9 u svim ispitnim posudama;
|
|
—
|
temperatura vode ne bi se smjela razlikovati za više od ± 1,0 °C.
|
|
OPIS METODE
Ispitne posude i kavezi za uzgoj
|
11.
|
Ličinke su izložene u staklenim laboratorijskim čašama od 600 ml promjera otprilike 8,5 cm (vidi Dodatak 5.). Prikladne su i druge posude, ali mora se zajamčiti da je i u njima prikladna dubina sedimenta i vode iznad sedimenta. Površina sedimenta mora biti dovoljno velika da po svakoj ličinki bude od 2 do 3 cm2 površine. Omjer dubine sloja sedimenta i dubine vode iznad sedimenta treba biti otprilike 1: 4. Treba upotrebljavati kaveze za uzgoj (najmanje 30 cm za svaku od triju dimenzija) s gazom (veličina otvora gaze otprilike 1 mm) na gornjoj strani i najmanje jednoj bočnoj strani (vidi Dodatak 5.). U svakom se kavezu radi polaganja jajašaca postavlja 21 posuda za kristalizaciju koja sadržava ispitnu vodu i sediment. Što se tiče posude za kristalizaciju, omjer dubine sloja sedimenta i dubine vode iznad sedimenta trebao bi biti otprilike 1: 4. Nakon sakupljanja skupina jajašaca iz posude za kristalizaciju iste se stavljaju na mikrotitracijsku pločicu s 12 jažica (jedna skupina po jažici koja sadržava najmanje 2,5 ml vode iz posude za kristalizaciju obrađene spikingom) nakon čega se pločice pokrivaju poklopcem kako bi se spriječilo znatno isparavanje. Mogu se upotrebljavati i druge posude prikladne za čuvanje skupina jajašaca. Uz iznimku mikrotitracijskih pločica, sve ispitne posude i druga aparatura koja dolazi u dodir s ispitnim sustavom trebali bi biti izrađeni u cijelosti od stakla ili nekog drugog kemijski inertnog materijala (npr. politetrafluoretilena).
|
Odabir vrste
|
12.
|
Vrsta koju treba upotrebljavati u ovom ispitivanju po mogućnosti je Chironomus riparius. Može se upotrebljavati i vrsta C. yoshimatsui. Prikladna je i vrsta C. dilutus, ali njome je teže rukovati te je za nju potrebno dulje razdoblje ispitivanja. Pojedinosti o metodama uzgoja kultura nalaze se u Dodatku 2. za vrstu C. riparius. Podaci o uvjetima uzgoja kultura dostupni su i za vrste C. dilutus (5) i C. yoshimatsui (14). Mora se potvrditi identifikacija vrste prije ispitivanja, ali to nije potrebno prije svakog ispitivanja ako organizmi potječu iz kulture uzgojene u laboratoriju.
|
Sediment
|
13.
|
Po mogućnosti bi se trebao upotrebljavati formulirani sediment (zvan još i obrađeni, umjetni ili sintetički sediment). Međutim, ako se upotrebljava prirodni sediment, isti je potrebno karakterizirati (barem pH-vrijednost, sadržaj organskog ugljika, a preporučuje se i određivanje drugih parametara kao što su omjer C/N i granulometrija) te ne smije biti kontaminiran i u njemu ne smije biti nikakvih organizama koji bi se mogli natjecati s ličinkama trzalaca ili ih jesti. Preporučuje se, prije ispitivanja, i priprema sedimenata sedam dana u uvjetima ispitivanja. Preporučuje se sljedeći formulirani sediment (1)(20)(21), kako je opisano u (1):
|
a.
|
4 – 5 % (suhe mase) treseta: što je moguće bliže pH-vrijednosti od 5,5 do 6,0; važno je da se upotrebljava treset u obliku praha, fino usitnjen (veličine čestica ≤ 1 mm) i isključivo sušen na zraku;
|
|
b.
|
20 % (suhe mase) kaolinitske gline (sadržaj kaolinita po mogućnosti iznad 30 %);
|
|
c.
|
75 – 76 % (suhe mase) kremenog pijeska (fini bi pijesak trebao prevladavati s više od 50 posto čestica između 50 i 200 μm);
|
|
d.
|
Dodaje se deionizirana voda kako bi se dobila vlaga konačne smjese u rasponu 30 – 50 %;
|
|
e.
|
Dodaje se kalcijev karbonat kemijski čiste kakvoće (CaCO3) kako bi se pH-vrijednost konačne smjese sedimenta podesila na 7,0 ± 0,5;
|
|
f.
|
Sadržaj organskog ugljika konačne smjese trebao bi iznositi 2 % (± 0,5 %) i treba se prilagoditi upotrebom odgovarajućih količina treseta i pijeska prema (a) i (c).
|
|
|
14.
|
Izvor treseta, kaolinitske gline i pijeska trebao bi biti poznat. Potrebno je provjeriti jesu li komponente sedimenta kemijski kontaminirane (npr. teški metali, organoklorni spojevi, organofosforni spojevi itd.). Primjer pripreme formuliranog sedimenta opisan je u Dodatku 3. Prihvatljivo je i miješanje suhih sastojaka ako se pokaže da nakon dodavanja vode iznad sedimenta ne dolazi do razdvajanja sastojaka sedimenta (npr. plutanje čestica treseta) i da je treset ili sediment dovoljno prethodno pripremljen.
|
Voda
|
15.
|
Kao ispitna voda prikladna je svaka voda koja ima kemijska svojstva prihvatljive vode za razrjeđivanje koja su navedena u dodacima 2. i 4. Kao voda za uzgoj kultura i ispitna voda prikladna je svaka prikladna voda, prirodna voda (površinske ili podzemne vode), obrađena voda (vidi Dodatak 2.) ili voda iz slavine iz koje je uklonjen klor ako će trzalci u njoj preživjeti tijekom uzgoja kulture i ispitivanja, a da ne pokažu nikakve znakove stresa. Na početku ispitivanja pH-vrijednost ispitne vode trebala bi biti između 6 i 9, a ukupna tvrdoća ne viša od 400 mg/l kao CaCO3. Međutim, ako se sumnja u postojanje interakcije između iona tvrdoće i ispitivane kemikalije, potrebno je upotrebljavati vodu manje tvrdoće (u toj se situaciji stoga ne smije upotrebljavati medij Elendt M4). Tijekom cijele studije potrebno je upotrebljavati istu vrstu vode. Najmanje dvaput godišnje ili kada se sumnja da su se svojstva kakvoće vode navedena u Dodatku 4. znatno promijenila, potrebno je izmjeriti ta svojstva.
|
Radne otopine – voda obrađena spikingom
|
16. a.
|
Ispitne koncentracije izračunavaju se na temelju koncentracija u vodenom stupcu, odnosno u vodi iznad sedimenta. Ispitne otopine u odabranim koncentracijama obično se pripremaju razrjeđivanjem radne otopine. Radne otopine potrebno je, po mogućnosti, pripremiti otapanjem ispitivane kemikalije u ispitnoj vodi. Možda će u nekim slučajevima biti potrebno upotrijebiti otapala ili dispergente kako bi se dobila prikladno koncentrirana radna otopina. Primjeri prikladnih otapala jesu aceton, etilen glikol monoetil eter, etilen glikol dimetil eter, dimetilformamid i trietilen glikol. Dispergenti koji se mogu upotrebljavati jesu Cremophor RH40, Tween 80, metil-celuloza 0,01 % i HCO-40. Koncentracija otapajućeg sredstva u konačnom ispitnom mediju trebala bi biti minimalna (odnosno ≤ 0,1 ml/l) i trebala bi biti ista u svim grupama. Kada se upotrebljava otapajuće sredstvo, ono ne smije imati nikakve znatne učinke na preživljavanje prema podacima kontrolne skupine s otapalom u usporedbi s podacima negativne kontrolne skupine s vodom. Međutim, potrebno je uložiti sve napore da se izbjegne upotreba takvih tvari.
|
Radne otopine – sediment obrađen spikingom
|
16.b.
|
Sedimenti obrađeni spikingom odabrane koncentracije obično se pripremaju dodavanjem otopine ispitivane kemikalije izravno u sediment. Radna otopina ispitivane kemikalije otopljena u deioniziranoj vodi miješa se s formuliranim sedimentom valjkastim mlinom, miješalicom hrane ili ručnim miješanjem. Ako je ispitivana kemikalija slabo topljiva u vodi, može se otopiti u što je moguće manjem volumenu prikladnog organskog otapala (npr. heksan, aceton ili kloroform). Ta se otopina potom miješa s 10 g finog kremenog pijeska za svaku ispitnu posudu. Otapalo se pusti da ispari i mora se u cijelosti ukloniti iz pijeska; potom se pijesak miješa s prikladnom količinom sedimenta. Samo lako hlapljiva sredstva mogu se upotrebljavati za otapanje, dispergiranje ili emulgiranje ispitivane kemikalije. Potrebno je imati na umu da se pijesak koji nastane miješanjem ispitivane kemikalije i pijeska mora uzeti u obzir prilikom pripreme sedimenta (odnosno sediment je stoga potrebno pripremiti s manje pijeska). Ispitivanu kemikaliju koja se dodaje u sediment potrebno je temeljito i ravnomjerno raspršiti u sedimentu. Ako je potrebno, mogu se analizirati i poduzorci kako bi se odredio stupanj homogenosti.
|
PLAN ISPITIVANJA
|
17.
|
Plan ispitivanja odnosi se na odabir broja i raspored ispitnih koncentracija, na broj posuda za svaku koncentraciju, na broj ličinaka po posudi, na broj posuda za kristalizaciju i kaveza za uzgoj. Planovi za ECx, NOEC i granično ispitivanje opisani su u nastavku.
|
Plan za regresijsku analizu
|
18.
|
Ispitivanje mora obuhvaćati koncentraciju s učinkom (ECx,) i raspon koncentracija unutar kojega je učinak ispitivane kemikalije od interesa, tako da se krajnji učinak ne ekstrapolira izvan granica dobivenih podataka. Potrebno je izbjegavati ekstrapolaciju znatno ispod najniže ili iznad najviše koncentracije. Preliminarno ispitivanje za određivanje raspona prema ispitnim metodama iz C.27. ili C.28. može biti korisno za odabir prikladnog raspona ispitnih koncentracija.
|
|
19.
|
Za pristup ECx potrebno je najmanje pet koncentracija i osam ponavljanja za svaku koncentraciju. Za svaku koncentraciju potrebno je upotrebljavati dva kaveza za uzgoj (A i B). Osam ponavljanja podijeljeno je u dvije skupine od četiri ponavljanja za primjenu u svakom kavezu za uzgoj. To spajanje ponavljanja potrebno je zbog broja mušica potrebnih u kavezu radi pouzdanih procjena razmnožavanja. Međutim, druga generacija ponovno ima osam ponavljanja koja se pokreću iz izloženih populacija u kavezima za uzgoj. Faktor između koncentracija ne bi smio biti veći od dva (iznimka se može učiniti u slučajevima kada krivulja odgovora na dozu ima plitak nagib). Broj ponavljanja u svakoj grupi može se sniziti na šest (tri za svaki kavez za uzgoj) ako se poveća broj ispitnih koncentracija različitih odgovora. Povećanje broja ponavljanja ili smanjivanje trajanja intervala ispitnih koncentracija obično dovodi do užih intervala pouzdanosti oko ECx-a.
|
Plan za procjenu NOEC-a
|
20.
|
Za pristup NOEC potrebno je upotrebljavati pet ispitnih koncentracija s najmanje osam ponavljanja (četiri za svaki kavez za uzgoj, A i B), a faktor između koncentracija ne bi smio biti veći od dva. Broj ponavljanja trebao bi biti dovoljan da osigura adekvatnu statističku snagu kojom će se otkriti 20 % razlike od kontrolne posude pri razini značajnosti od 5 % (α = 0,05). Kod brzine razvoja i potencijalne i stvarne plodnosti obično je prikladna analiza varijance (ANOVA) nakon koje slijede Dunnettov test ili Williamsov test (22 – 25). Kod omjera preobrazbe i omjera spolova mogli bi biti prikladni Cochran-Armitageov test, Fisherov test (s Bonferronijevom korekcijom) ili Mantel-Haenszelov test.
|
Granično ispitivanje
|
21.
|
Može se provesti granično ispitivanje (jedna ispitna koncentracija i kontrolna posuda ili kontrolne posude) ako se u fakultativnom preliminarnom testu za određivanje raspona ne vide nikakvi učinci do najveće koncentracije. Cilj graničnog ispitivanja jest naznačiti da su svi učinci toksičnosti ispitivane kemikalije utvrđeni na razinama većima od ispitivane granične koncentracije. Za vodu se predlaže 100 mg/l, a za sediment 1 000 mg/kg (suhe mase). Obično je potrebno najmanje osam ponavljanja i za grupu i za kontrolnu posudu. Potrebno je pokazati adekvatnu statističku snagu kojom će se otkriti 20 % razlike od kontrolne posude pri razini značajnosti od 5 % (α = 0,05). Kod metričkog odgovora (npr. brzina razvoja) t-test prikladna je statistička metoda ako podaci zadovoljavaju zahtjeve tog ispitivanja (normalnost, homogene varijance). Ako ti zahtjevi nisu ispunjeni, mogu se upotrebljavati t-test nejednake varijance ili neparametrijsko ispitivanje, kao što je Wilcoxon-Mann-Whitheyev test. Kod omjera preobrazbe prikladan je Fisherov test.
|
POSTUPAK
Uvjeti izlaganja
Priprema sustava voda/sediment (obrađivanje vode spikingom)
|
22. a.
|
Formulirani sediment (vidi stavke 13. i 14. i Dodatak 3.) dodaje se u svaku ispitnu posudu i posudu za kristalizaciju kako bi se stvorio sloj od najmanje 1,5 cm (ili nešto manji u slučaju posude za kristalizaciju), ali najviše 3 cm. Voda (vidi stavak 15.) se dodaje tako da omjer dubine sloja sedimenta i dubine vode ne premašuje 1: 4. Nakon pripreme ispitnih posuda sustav voda/sediment potrebno je blago dozračivati otprilike sedam dana prije dodavanja ličinaka u prvom stadiju razvoja prve i druge generacije (vidi stavak 14. i Dodatak 3.). Sustav voda/sediment u posudama za kristalizaciju ne dozračuje se tijekom ispitivanja jer nije potrebno podržati preživljavanje ličinaka (skupine jajašaca sakupljaju se prije valjenja). Kako bi se izbjeglo razdvajanje sastojaka sedimenta i resuspendiranje finog materijala tijekom dodavanja ispitne vode u vodeni stupac, sediment se može prekriti plastičnim diskom dok se na njega lijeva voda. Disk se miče odmah nakon toga. Prikladni bi mogli biti i drugi predmeti.
|
Priprema sustava voda/sediment (sediment obrađen spikingom)
|
22.b.
|
Sedimenti obrađeni spikingom koji su pripremljeni u skladu sa stavkom 16.b. stavljaju se u posude i posudu za kristalizaciju pa se dodaje voda iznad sedimenta, i to u omjeru sedimenta i vode 1: 4. Dubina sloja sedimenta trebala bi se kretati u rasponu od 1,5 do 3 cm (može biti nešto manja u slučaju posude za kristalizaciju). Kako bi se izbjeglo razdvajanje sastojaka sedimenta i resuspendiranje finog materijala tijekom dodavanja ispitne vode u vodeni stupac, sediment se može prekriti plastičnim diskom dok se na njega lijeva voda, a disk se miče odmah nakon toga. Prikladni bi mogli biti i drugi predmeti. Kad se pripremi sediment postupkom spikinga s vodom iznad sedimenta, poželjno je dopustiti razdiobu ispitivane kemikalije iz sedimenta u tekuće stanje (4)(5)(7)(18). To je po mogućnosti potrebno učiniti u uvjetima temperature i dozračivanja koji se upotrebljavaju u ispitivanju. Prikladno vrijeme uravnoteženja specifično je za svaki sediment i kemikaliju, a može se kretati od nekoliko sati pa sve do nekoliko dana, a u rijetkim slučajevima i do pet tjedana. Budući da je time ostavljeno dovoljno vremena za razgradnju brojnih kemikalija, ne čeka se uravnoteženje, ali preporučuje se vrijeme uravnoteženja od 48 sati. Međutim, vrijeme uravnoteženja može se produljiti ako je poznato da je vrijeme polurazgradnje kemikalije dugo (vidi stavak 8.). Na kraju tog dodatnog vremena uravnoteženja potrebno je izmjeriti koncentraciju ispitivane kemikalije u vodi iznad sedimenta, pornoj vodi i u sedimentu, barem u najvišoj koncentraciji i u jednoj nižoj (vidi stavak 38.). Ta analitička određivanja ispitivane kemikalije omogućuju izračun bilance mase i izražavanje rezultata na temelju izmjerenih koncentracija.
|
|
23.
|
Ispitne posude trebale bi biti pokrivene (npr. staklenim pločicama). Ako je potrebno, tijekom studije u izvorni volumen vode nadolijeva se još vode kako bi se nadomjestilo isparavanje. Za to je potrebno upotrebljavati destiliranu ili deioniziranu vodu kako bi se spriječilo stvaranje soli. Posude za kristalizaciju u kavezima za uzgoj nisu pokrivene i može ih se, ali i ne treba prilagoditi kako bi se nadomjestio gubitak vode tijekom razdoblja ispitivanja s obzirom na to da su skupine jajašaca samo u dodiru s vodom otprilike jedan dan i posude se upotrebljavaju samo tijekom kratke faze ispitivanja.
|
Dodavanje ispitnih organizama
|
24.
|
Od četiri do pet dana prije dodavanja ličinaka u prvom stadiju razvoja prve generacije mase jajašaca potrebno je izvaditi iz kultura i staviti u male posude na hranjivu podlogu za uzgoj kulture. Može se upotrebljavati stara hranjiva podloga iz matične kulture ili svježe pripremljena hranjiva podloga za uzgoj kulture. U svakom slučaju, hranjivoj podlozi za uzgoj kulture potrebno je dodati manju količinu hrane, npr. nekoliko kapljica filtrata suspenzije fino mljevenih pahuljica riblje hrane (vidi Dodatak 2.). Potrebno je upotrebljavati samo svježe položene mase jajašaca. Valjenje ličinaka obično počinje nekoliko dana nakon polaganja jajašaca (od dva do tri dana za C. riparius na 20 °C i od jednog do četiri dana za C. dilutus na 23 °C i za C. yoshimatsui na 25 °C), a ličinke se razvijaju u četiri stadija razvoja, od kojih svaki traje od četiri do osam dana. U ispitivanju je potrebno upotrebljavati ličinke u prvom stadiju razvoja (najviše 48 sati poslije valjenja). Stadij razvoja ličinaka moguće je provjeriti s pomoću širine kapsule glave (7).
|
|
25.
|
Dvadeset ličinaka iz prvog stadija razvoja stavlja se nasumice u svaku ispitnu posudu koja sadržava sustav voda/sediment, i to s pomoću tupe pipete. Dozračivanje vode zaustavlja se tijekom dodavanja ličinaka u ispitne posude i potrebno je da tako ostane još 24 sata nakon dodavanja ličinaka (vidi stavak 32.). Prema upotrijebljenom planu ispitivanja (vidi stavke 19. i 20.) broj ličinaka po koncentraciji iznosi najmanje 120 (šest ponavljanja po koncentraciji) za pristup ECX i 160 za pristup NOEC (osam ponavljanja po koncentraciji). U planu sa sedimentom obrađenim spikingom izlaganje počinje nakon dodavanja ličinaka.
|
Obrađivanje vode iznad sedimenta spikingom
|
26.
|
Dvadeset i četiri sata nakon dodavanja ličinaka u prvom stadiju razvoja prve generacije ispitivana kemikalija dodaje se spikingom u vodeni stupac iznad sedimenta i ponovno se osigurava blago dozračivanje (za moguće izmjene plana ispitivanja vidi stavak 7.). Male količine radnih otopina ispitivane kemikalije stavljaju se ispod površine vode pipetom. Voda iznad sedimenta trebala bi se potom pažljivo promiješati kako se sediment ne bi umiješao. U planu s vodom obrađenom spikingom izlaganje počinje obrađivanjem vode spikingom (odnosno jedan dan nakon dodavanja ličinaka).
|
Sakupljanje preobraženih odraslih životinja
|
27.
|
Preobražene mušice prve generacije sakupljaju se barem jedanput, no po mogućnosti dvaput na dan (vidi točku 36.) iz ispitnih posuda s pomoću aspiratora, sisaljke ili sličnog uređaja (vidi Dodatak 5.). Potrebno je posebno paziti kako se ne bi ozlijedilo odrasle životinje. Sakupljene mušice iz četiri ispitne posude unutar jedne grupe otpuštaju se u kavez za uzgoj kojem su prethodno dodijeljene. Na dan prve preobrazbe (mužjaka) posude za kristalizaciju obrađuju se spikingom dodavanjem male količine radne otopine ispitivane kemikalije s pomoću pipete ispod površine vode (plan za vodu obrađenu spikingom). Voda iznad sedimenta trebala bi se potom pažljivo promiješati kako se sediment ne bi umiješao. Koncentracija ispitivane kemikalije u posudi za kristalizaciju nominalno je jednaka onoj u ispitnim posudama koje su dodijeljene tom specifičnom kavezu za uzgoj. U slučaju plana sa sedimentom obrađenim spikingom posude za kristalizaciju pripremaju se oko 11. dana nakon početka izlaganja (odnosno nakon dodavanja ličinaka prve generacije) kako bi se uravnotežile kroz otprilike 48 sati prije dobivanja prvih skupina jajašaca.
|
|
28.
|
Skupine jajašaca sakupljaju se iz posude za kristalizaciju u kavezu za uzgoj s pomoću pincete ili tupe pipete. Svaka se skupina jajašaca stavlja u posudu u kojoj se nalazi hranjiva podloga za uzgoj kulture iz posude za kristalizaciju iz koje je sakupljena (npr. jažica mikrotitracijske pločice s 12 jažica zajedno s najmanje 2,5 ml hranjive podloge). Posude sa skupinama jajašaca pokrivaju se poklopcem kako bi se spriječilo znatno isparavanje. Skupine jajašaca čuvaju se radi promatranja najmanje šest dana nakon što su proizvedene kako bi ih se moglo razvrstati u skupinu plodnih ili neplodnih jajašaca.
Za početak druge generacije iz svakog se kaveza za uzgoj odabiru najmanje tri, no po mogućnosti šest plodnih skupina jajašaca i s određenom hranom omogućuje se njihovo valjenje. Te skupine jajašaca trebale su biti proizvedene na vrhuncu njihova polaganja do kojeg obično dolazi oko 19. dana ispitivanja u kontrolnim posudama. U idealnim okolnostima druga generacija svih grupa pokreće se istog dana, no zbog učinaka kemikalije na razvoj ličinaka to možda neće uvijek biti moguće. U tom slučaju veće koncentracije mogu biti pokrenute kasnije nego grupe nižih koncentracija i kontrolne posude s otapalom.
|
|
29. a.
|
U planu s vodom obrađenom spikingom sustav voda/sediment za drugu generaciju priprema se dodavanjem spikingom ispitivane kemikalije u vodeni stupac iznad sedimenta otprilike jedan sat prije dodavanja ličinaka u prvom stadiju razvoja u ispitne posude. Male količine otopina ispitivane kemikalije stavljaju se ispod površine vode pipetom. Voda iznad sedimenta trebala bi se potom pažljivo promiješati kako se sediment ne bi umiješao. Nakon obrađivanja spikingom osigurava se blago dozračivanje.
|
|
29.b.
|
U planu sa sedimentom obrađenim spikingom posude za izlaganje koje sadržavaju sustav voda/sediment za drugu generaciju pripremaju se na isti način kao za prvu generaciju.
|
|
30.
|
Dvadeset ličinaka u prvom stadiju razvoja (najviše 48 sati nakon valjenja) druge generacije stavlja se nasumice u svaku ispitnu posudu koja sadržava sustav voda/sediment obrađen spikingom, i to s pomoću tupe pipete. Potrebno je zaustaviti dozračivanje vode tijekom dodavanja ličinaka u prvom stadiju razvoja u ispitne posude i tako treba ostati još 24 sata nakon dodavanja ličinaka. Prema upotrijebljenom planu ispitivanja (vidi stavke 19. i 20.) broj ličinaka po koncentraciji iznosi najmanje 120 (šest ponavljanja po koncentraciji) za pristup ECX i 160 za pristup NOEC (osam ponavljanja po koncentraciji).
|
Hrana
|
31.
|
Potrebno je hraniti ličinke u ispitnim posudama, po mogućnosti svakodnevno ili najmanje triput tjedno. Riblja hrana (suspenzija u vodi ili fino mljevena hrana, npr. Tetra-Min ili Tetra-Phyll; vidi pojedinosti u Dodatku 2.) u količini od 0,25 – 0,5 mg (0,35 – 0,5 mg za C. yoshimatui) dnevno po ličinki prikladna je količina hrane za mlade ličinke tijekom prvih deset dana njihova razvoja. Za starije će ličinke biti potrebno malo više hrane: Od 0,5 do 1 mg dnevno po ličinki trebalo bi biti dostatno za ostatak ispitivanja. Porcije hrane potrebno je smanjiti u svim grupama ako se primijeti rast gljivica ili ako se primijeti smrtnost u kontrolnim posudama. Ako se ne može zaustaviti rast gljivica, ispitivanje je potrebno ponoviti.
Toksikološka važnost izlaganja oralnim putem općenito je veća kod kemikalija visokog afiniteta prema organskom ugljiku ili kemikalija koje se vežu sa sedimentom kovalentnim vezama. Stoga kod ispitivanja kemikalija s takvim svojstvima količina hrane neophodna za osiguranje preživljavanja i prirodnog rasta ličinaka može se dodati formuliranom sedimentu prije razdoblja stabilizacije, ovisno o regulatornim zahtjevima. Kako bi se spriječilo pogoršanje kvalitete vode, umjesto riblje hrane potrebno je upotrebljavati biljni materijal, npr. može se dodati 0,5 % (suha masa) fino usitnjenog lišća npr. velike koprive (Urtica dioica), duda (Morus alba), bijele djeteline (Trifolium repens), špinata (Spinacia oleracea) ili nekog drugog biljnog materijala (Cerophyl ili alfa-celuloze). Dodavanje cjelovite porcije organskog izvora hrane u sediment prije njegova obrađivanja spikingom niti je beznačajno u odnosu na kvalitetu vode i biološki učinak (21) niti čini standardiziranu metodu, no najnovije studije upućuju na uspješnost ove metode (19)(26). Odrasle mušice u kavezu za uzgoj obično ne trebaju hranu, no potencijalna i stvarna plodnost povećavaju se kad se preobraženim odraslim životinjama (34) kao izvor hrane ponudi vuneni podložak namočen u zasićenu šećernu otopinu.
|
Uvjeti za inkubaciju
|
32.
|
Blago dozračivanje vode iznad sedimenta u ispitnim posudama osigurava se 24 sata poslije dodavanja ličinaka u prvom stadiju razvoja obje generacije i nastavlja se tijekom cijelog ispitivanja (potrebno je pobrinuti se da koncentracija otopljenog kisika ne padne ispod 60 % ASV-a). Dozračivanje se vrši putem staklene Pasteurove pipete čiji je ispusni dio pričvršćen 2 – 3 cm iznad sloja sedimenta puštajući nekoliko mjehurića u sekundi. Pri ispitivanju hlapljivih kemikalija potrebno je paziti da se ne dozračuje sustav sediment/voda, a istovremeno je potrebno ispuniti validacijski kriterij od najmanje 60 % ASV-a (stavak 10.). Ostale upute nalaze se u (16).
|
|
33.
|
Ispitivanje koje uključuje vrstu C. riparius provodi se na stalnoj temperaturi od 20 °C (± 2 °C). Za vrste C. dilutus i C. yoshimatsui preporučene temperature su 23 °C i 25 °C (± 2 °C). Upotrebljava se fotoperiod od 16 sati, a jačina svjetlosti trebala bi biti od 500 do 1 000 luksa. U slučaju kaveza za uzgoj može se uključiti joj jedan sat u fazi zore ili sumraka.
|
Trajanje izlaganja
|
34.
|
Plan s vodom obrađenom spikingom: Razdoblje izlaganja prve generacije počinje nakon što se ispitivana kemikalija doda spikingom u vodu iznad sedimenta u ispitnim posudama (a to je jedan dan nakon stavljanja ličinka – za moguće izmjene plana izlaganja vidi stavak 7.). Izlaganje druge generacije ličinaka počinje odmah jer ih se stavlja u sustav voda/sediment koji je već obrađen spikingom. Maksimalno trajanje izlaganja za prvu generaciju jest 27 dana, a za drugu generaciju 28 dana (prva generacija ličinaka provodi jedan dan u posudama bez izlaganja) za vrste C. riparius i C. yoshimatsui. Uzimajući u obzir preklapanje, ukupno trajanje ispitivanja jest otprilike 44 dana. Za vrstu C. dilutus maksimalno trajanje izlaganja jest 64 dana za prvu i 65 dana za drugu generaciju. Ukupno trajanje jest otprilike 100 dana.
Plan sa sedimentom obrađenim spikingom: izlaganje počinje nakon dodavanja ličinaka i traje maksimalno 28 dana za obje generacije za vrste C. riparius i C. yoshimatsui i maksimalno 65 dana za obje generacije za vrstu C. dilutus.
|
Opažanja
Preobrazba
|
35.
|
Određuju se vrijeme razvoja i ukupni broj živih muških i ženskih mušica koje su se u cijelosti preobrazile za obje generacije. Mužjaci se lako razaznaju po svojim dlakavim ticalima i tankom tijelu.
|
|
36.
|
Ispitne posude obiju generacija potrebno je promatrati najmanje triput tjedno kako bi se vizualno procijenilo svako neuobičajeno ponašanje ličinaka (npr. napuštanje sedimenta, neuobičajeno plivanje) u usporedbi s kontrolnim posudama. Tijekom razdoblja preobrazbe, koje počinje otprilike 12 dana nakon dodavanja ličinaka za vrste C. riparius i C. yoshimatsui (nakon 20 dana za vrstu C. dilutus), preobražene se mušice broje i utvrđuje im se spol barem jedanput, no po mogućnosti dvaput na dan (rano ujutro i kasno poslijepodne). Nakon utvrđivanja mušice prve generacije pažljivo se uklanjaju iz posuda i prenose u kavez za uzgoj. Mušice druge generacije uklanjaju se i usmrćuju nakon utvrđivanja. Sve skupine jajašaca stavljene u ispitne posude prve generacije potrebno je sakupiti pojedinačno i prenijeti s najmanje 2,5 ml vode iz koje su prikupljene na mikrotitracijske pločice s 12 jažica (ili druge prikladne posude) prekrivene poklopcem kako bi se spriječilo znatno isparavanje. Potrebno je bilježiti i broj mrtvih ličinaka i vidljivih kukuljica koje se nisu uspjele preobraziti. Primjeri kaveza za uzgoj, ispitne posude i sisaljke navedeni su u Dodatku 5.
|
Razmnožavanje
|
37.
|
Učinci na razmnožavanje procjenjuju se s pomoću broja skupina jajašaca koje su proizvele mušice prve generacije i stvarne plodnosti tih skupina jajašaca. Skupine jajašaca sakupljaju se jedanput na dan iz posude za kristalizaciju koja se stavlja u svaki spremnik za uzgoj. Skupine jajašaca potrebno je sakupljati i prenositi s najmanje 2,5 ml vode iz koje su prikupljene na mikrotitracijsku pločicu s 12 jažica (jedna skupina jajašaca u svaku jažicu) ili u druge prikladne posude pokrivene poklopcem kako bi se spriječilo znatno isparavanje. Sljedeća se svojstva dokumentiraju za svaku skupinu jajašaca: dan nastanka, veličina (uobičajena, odnosno 1,0 ± 0,3 cm ili mala; obično ≤ 0,5 cm) i struktura (uobičajena = oblik banane sa spiralnim nizom jajašaca i neuobičajena, npr. nespiralni niz jajašaca) te stvarna plodnost (plodna ili neplodna). Stvarna plodnost skupine jajašaca procjenjuje se u razdoblju od šest dana nakon što su proizvedena. Skupina jajašaca smatra se plodnom ako se izlegnu životinje iz najmanje jedne trećine jajašaca. Ukupan broj ženki stavljenih u kavez za uzgoj upotrebljava se za izračun broja skupina jajašaca po ženki i broja plodnih skupina jajašaca po ženki. Ako je potrebno, broj jajašaca u bilo kojoj skupini jajašaca može se procijeniti bez da ih se uništava s pomoću metode brojenja prstena (više pojedinosti u 32 i 33).
|
Analitička mjerenja
Koncentracija ispitivane kemikalije
|
38.
|
Kao minimum, na početku izlaganja (po mogućnosti sat vremena nakon dodavanja u slučaju obrađivanja vode spikingom) i na kraju ispitivanja potrebno je analizirati uzorke vode iznad sedimenta, porne vode i sedimenta, i to u najvišoj koncentraciji i u nekoj nižoj. To vrijedi za posude obiju generacija. Iz posuda za kristalizaciju u kavezu za uzgoj analizira se samo voda iznad sedimenta s obzirom na to da skupine jajašaca dolaze u dodir samo s njom (u slučaju plana sa sedimentom obrađenim spikingom može se uzeti u obzir analitička potvrda koncentracije sedimenta). Prema potrebi mogu se provesti dodatna mjerenja sedimenta, porne vode ili vode iznad sedimenta tijekom ispitivanja. Ta određivanja koncentracije ispitivane kemikalije daju informacije o ponašanju/razdiobi ispitivane kemikalije u sustavu voda/sediment. Uzorkovanje sedimenta i porne vode na početku i tijekom ispitivanja (vidi stavak 39.) zahtijeva dodatne ispitne posude za provođenje analitičkih određivanja. Mjerenja u sedimentu u planu s vodom obrađenom spikingom možda neće biti potrebna ako je razdioba ispitivane kemikalije između vode i sedimenta jasno određena u okviru studije vode/sedimenta u usporedivim uvjetima (npr. omjer sedimenta i vode, vrsta primjene, sadržaj organskog ugljika u sedimentu) ili ako su izmjerene koncentracije u vodi iznad sedimenta na razini između 80 i 120 % nominalnih ili izmjerenih početnih koncentracija.
|
|
39.
|
Kada se provode posredna mjerenja (npr. 7. dana i/ili 14. dana) te ako su za analizu potrebni veliki uzorci koji se ne mogu uzeti iz ispitnih posuda, a da to pritom ne utječe na ispitni sustav, analitička određivanja potrebno je provoditi na uzorcima iz dodatnih ispitnih posuda koje se tretiraju na isti način (uključujući i prisustvo ispitnih organizama), ali koje se ne upotrebljavaju za biološka opažanja.
|
|
40.
|
Preporučeni postupak za izoliranje međuprostorne (porne) vode jest centrifugiranje na npr. 10 000 g na 4 °C tijekom 30 min. Međutim, ako se utvrdi da se ispitivana kemikalija ne adsorbira na filtre, prihvatljivo je i filtriranje. U nekim slučajevima možda neće biti moguće analizirati koncentracije u pornoj vodi jer je uzorak premalen.
|
Fizikalno-kemijski parametri
|
41.
|
Na prikladan način potrebno je izmjeriti pH-vrijednost, otopljeni kisik u ispitnoj vodi i temperaturu vode u ispitnim posudama i posudama za kristalizaciju (vidi stavak 10.). Tvrdoću i amonijak potrebno je mjeriti u kontrolnim posudama i u jednoj ispitnoj posudi te posudi za kristalizaciju u najvišoj koncentraciji na početku i na kraju ispitivanja.
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
42.
|
Svrha ovog ispitivanja životnog ciklusa jest odrediti učinak ispitivane kemikalije na razmnožavanje i, za dvije generacije, na brzinu razvoja i ukupan broj živih mužjaka i ženki mušica koje su se u cijelosti preobrazile. Za potrebe omjera preobrazbe potrebno je ujediniti podatke o mužjacima i ženkama. Ako ne postoje statistički značajne razlike između osjetljivosti brzine razvoja suprotnih spolova, rezultati koji se odnose na mužjake i ženke mogu se ujediniti radi statističke analize.
|
|
43.
|
Koncentracije s učinkom izražene kao koncentracije u vodi iznad sedimenta (za vodu obrađenu spikingom) ili u sedimentu (za sediment obrađen spikingom) obično se izračunavaju na temelju izmjerenih koncentracija na početku izlaganja (vidi stavak 38.). Stoga se, za vodu obrađenu spikingom, za svaku grupu izračunava prosjek koncentracija obično izmjerenih na početku izlaganja u vodi iznad sedimenta u posudama za obje generacije i onih u posudama za kristalizaciju. Za sediment obrađen spikingom, za svaku grupu izračunava se prosjek koncentracija obično izmjerenih na početku izlaganja u posudama za obje generacije (i fakultativno onih u posudama za kristalizaciju).
|
|
44.
|
Za izračun procijenjene vrijednosti, odnosno ECx, statistički podaci za svaku posudu i za svaki kavez za uzgoj mogu se upotrijebiti kao stvarna ponavljanja. U izračunu intervala pouzdanosti za bilo koji ECx u obzir je potrebno uzeti varijabilnost među posudama ili je potrebno pokazati da je ta varijabilnost toliko neznatna da se može ignorirati. Kada se model prilagođava metodi najmanjih kvadrata, na statističke podatke za svaku posudu potrebno je primijeniti transformaciju kako bi se poboljšala homogenost varijance. Međutim, vrijednosti ECx trebale bi se izračunati tek nakon što se odgovor transformira natrag u izvornu vrijednost (31).
|
|
45.
|
Ako je cilj statističke analize odrediti NOEC testiranjem hipoteze, u obzir je potrebno uzeti varijabilnost među posudama koju jamči upotreba metoda ANOVA-e (npr. postupaka Williamsova i Dunnettova testa). Williamsov test bio bi prikladan ako se u teoriji očekuje odgovor na monotoničnu dozu, a Dunnettov test bio bi prikladan ako se odbaci hipoteza o monotoničnosti. Kao druga mogućnost, u situacijama kršenja uobičajenih pretpostavki ANOVA-e (31), mogu biti prikladna i robusnija ispitivanja (27).
|
Omjer preobrazbe
|
46.
|
Omjeri preobrazbe jesu kvantalni podaci i mogu se analizirati Cochran-Armitageovim testom koji se primjenjuje postupnim snižavanjem kada se očekuje odgovor na monotoničnu dozu i kad se ti podaci slažu s tim očekivanjem. Ako to nije slučaj, može se upotrebljavati Fisherov test ili Mantel-Haenszelov test s Bonferroni-Holmovim prilagođenim p-vrijednostima. Ako ima dokaza za još veću varijabilnost između ponavljanja u istoj koncentraciji nego što bi to naznačila binomna distribucija (često zvana i ‚ekstra-binomna’ varijacija), potrebno je primijeniti robusni Cochran-Armitageov ili Fisherov test kakvi su predloženi u (27).
Određuje se broj živih mušica (mužjaci i ženke) preobraženih po posudi, ne
, koji se onda dijeli brojem uvedenih ličinaka, na
:

pri čemu je:
|
ER
|
=
|
omjer preobrazbe
|
|
ne
|
=
|
broj živih mušica preobraženih po posudi
|
|
na
|
=
|
broj uvedenih ličinaka po posudi (obično 20)
|
Ako je ne
veći od na
(odnosno ako se nenamjerno uvede veći broj ličinaka od predviđenog), na
potrebno je izjednačiti s ne
.
|
|
47.
|
Najprikladniji alternativni pristup za velike uzorke, kada postoji ekstra-binomna varijanca, jest tretirati omjer preobrazbe kao kontinuirani odgovor te primijeniti postupke u skladu s tim ER podacima. Veliki uzorak ovdje se definira kao broj preobraženih mušica i broj nepreobraženih mušica veći od pet, i to po ponavljanju (posudi).
|
|
48.
|
Za primjenu metoda ANOVA-e vrijednosti ER-a moraju se prvo transformirati arkus sinus drugi korijen transformacijom ili Tukey-Freemanovom transformacijom kako bi se dobila približna normalna distribucija i ujednačile varijance. Kad se upotrebljavaju apsolutne frekvencije, može se primijeniti Cochran-Armitageov, Fisherov (Bonferronijev) ili Mantel-Haenszelov test. Arkus sinus drugi korijen transformacija primjenjuje se tako što se uzme inverzni sinus (sin– 1) drugog korijena ER-a.
|
|
49.
|
Za omjere preobrazbe vrijednosti ECx računaju se regresijskom analizom (npr. probit, logit ili Weibullov model (28)). Ako regresijska analiza ne uspije (npr. kad imamo manje od dva djelomična odgovora), mogu se upotrebljavati druge neparametrijske metode, kao što je pomični prosjek ili jednostavna interpolacija.
|
Brzina razvoja
|
50.
|
Srednje vrijeme razvoja predstavlja srednji raspon vremena između uvođenja ličinaka (nulti dan ispitivanja) i njihove preobrazbe u pokusnu skupinu mušica (za izračun stvarnog vremena razvoja potrebno je u obzir uzeti dob ličinaka u vrijeme njihova uvođenja). Brzina razvoja (jedinica: 1/dan) recipročna je vremenu razvoja i predstavlja dio razvoja ličinaka koji se odvija tijekom jednog dana. Brzina razvoja preferira se za procjenu ovih studija o toksičnosti sedimenta jer je njezina varijanca niža, a homogenija je i bliža normalnoj raspodjeli u usporedbi s vremenom razvoja. Stoga se mogu upotrebljavati moćni postupci parametrijskih ispitivanja s brzinom razvoja radije nego s vremenom razvoja. Za brzinu razvoja kao kontinuirani odgovor mogu se procijeniti vrijednosti ECx regresijskom analizom (npr. (29), (30)). NOEC za srednju brzinu razvoja može se odrediti metodama ANOVA-e, npr. Williamsovim ili Dunnettovim testom. Budući da se mužjaci preobraze ranije nego ženke, odnosno imaju veću brzinu razvoja, logično je izračunati brzinu razvoja za svaki spol zasebno uz izračun brzine razvoja za ukupni broj mušica.
|
|
51.
|
U svrhe statističkog ispitivanja pretpostavlja se da se broj mušica zamijećen na dan pregleda x preobrazio u srednjem vremenskom intervalu između dana x i dana x – l (l = trajanje intervala pregleda, obično jedan dan). Srednja brzina razvoja po posudi (

) računa se prema:

pri čemu je:
|

|
:
|
srednja brzina razvoja po posudi
|
|
i
|
:
|
indeks intervala pregleda
|
|
m
|
:
|
maksimalni broj intervala pregleda
|
|
fi
|
:
|
broj mušica preobraženih u intervalu pregleda i
|
|
ne
|
:
|
ukupni broj mušica preobraženih na kraju pokusa (Σfi)
|
|
xi
|
:
|
brzina razvoja mušica preobraženih u intervalu i
|

pri čemu je:
|
dani
|
:
|
dan pregleda (dana od uvođenja ličinaka)
|
|
li
|
:
|
trajanje intervala pregleda i (dani, obično 1 dan)
|
|
Omjer spolova
|
52.
|
Omjeri spolova kvantalni su podaci i stoga ih je potrebno procijeniti Fisherovim testom ili drugim prikladnim metodama. Prirodan omjer spolova vrste C. riparius jest jedan, odnosno jednak je broj mužjaka i ženki. Podacima o omjeru spolova potrebno je postupati jednako za obje generacije. Budući da je maksimalni broj mušica po posudi (odnosno 20) premalen za značajnu statističku analizu, ukupan broj živih mušica koje su se u cijelosti preobrazile za svaki spol dobiva se zbrajanjem svih posuda u jednoj grupi. Ti nepretvoreni podaci ispituju se u usporedbi s podacima kontrolne posude s otapalom ili svih kontrolnih posuda u tablici kontingencije 2 × 2.
|
Razmnožavanje
|
53.
|
Razmnožavanje, kao potencijalna plodnost, računa se kao broj skupina jajašaca po ženki. Točnije, ukupan broj skupina jajašaca dobivenih u kavezu za uzgoj dijeli se s ukupnim brojem živih i nepovrijeđenih ženki stavljenih u taj kavez. NOEC za potencijalnu plodnost može se odrediti metodama ANOVA-e, npr. Williamsovim ili Dunnettovim testom.
|
|
54.
|
Stvarna plodnost skupine jajašaca upotrebljava se za kvantificiranje broja plodnih skupina jajašaca po ženki. Ukupan broj plodnih skupina jajašaca proizvedenih u kavezu za uzgoj dijeli se s ukupnim brojem živih i nepovrijeđenih ženki stavljenih u taj kavez. NOEC za stvarnu plodnost može se odrediti metodama ANOVA-e, npr. Williamsovim ili Dunnettovim testom.
|
Izvješće o ispitivanju
|
55.
|
Izvješće o ispitivanju trebalo bi obuhvaćati sljedeće informacije:
|
|
Ispitivana kemikalija:
|
—
|
fizikalna priroda i fizikalno-kemijska svojstva (topljivost u vodi, tlak pare, log K
ow,podjelni koeficijent u tlu (ili u sedimentu ako postoji), stabilnost u vodi i sedimentu itd.);
|
|
—
|
podaci za identifikaciju kemikalije (opći naziv, kemijski naziv, strukturna formula, CAS broj itd.), uključujući čistoću i analitičku metodu kvantifikacije ispitivane kemikalije.
|
|
|
|
Ispitne vrste:
|
—
|
upotrijebljeni ispitni organizmi: vrsta, znanstveni naziv, izvor organizama i uvjeti uzgoja;
|
|
—
|
informacije o postupanju s masama jajašaca i ličinkama;
|
|
—
|
informacije o postupanju s preobraženim odraslim životinjama prve generacije s pomoću sisaljke itd. (vidi Dodatak 5.)
|
|
—
|
dob ispitnih organizama u vrijeme stavljanja u ispitne posude prve i druge generacije.
|
|
|
|
Uvjeti ispitivanja:
|
—
|
upotrijebljeni sediment, odnosno prirodni ili formulirani (umjetni) sediment;
|
|
—
|
prirodni sediment: lokacija i opis mjesta uzorkovanja sedimenta, uključujući, po mogućnosti, povijest onečišćenja, svojstva sedimenta: pH-vrijednost, sadržaj organskog ugljika, omjer C/N i granulometriju (ako je prikladno).
|
|
—
|
formulirani sediment: priprema, sastojci i svojstva (sadržaj organskog ugljika, pH-vrijednost, vlaga itd. izmjereni na početku ispitivanja);
|
|
—
|
priprema ispitne vode (ako se upotrebljava obrađena voda) i svojstva (koncentracija kisika, pH-vrijednost, tvrdoća itd. izmjereni na početku ispitivanja);
|
|
—
|
dubina sedimenta i vode iznad sedimenta za ispitne posude i posude za kristalizaciju;
|
|
—
|
volumen vode iznad sedimenta i porne vode, masa mokrog sedimenta s i bez porne vode za ispitne posude i posude za kristalizaciju;
|
|
—
|
ispitne posude (materijal i veličina);
|
|
—
|
posude za kristalizaciju (materijal i veličina);
|
|
—
|
kavezi za uzgoj (materijal i veličina)
|
|
—
|
metoda pripreme radnih otopina i ispitnih koncentracija za ispitne posude i posude za kristalizaciju;
|
|
—
|
dodavanje ispitivane kemikalije u ispitne posude i posude za kristalizaciju: ispitne koncentracije, broj ponavljanja i otapala ako je potrebno;
|
|
—
|
uvjeti za inkubaciju za ispitne posude: temperatura, ciklus i jačina svjetlosti, dozračivanje (mjehurića po sekundi);
|
|
—
|
uvjeti za inkubaciju za kaveze za uzgoj i posude za kristalizaciju: temperatura, ciklus i jačina svjetlosti;
|
|
—
|
uvjeti za inkubaciju za skupine jajašaca na mikrotitracijskim pločicama (ili u drugim posudama): temperatura, ciklus i jačina svjetlosti:
|
|
—
|
detaljne informacije o hranjenju, uključujući vrstu hrane, pripremu, količinu i režim hranjenja.
|
|
|
|
Rezultati:
|
—
|
nominalne ispitne koncentracije, izmjerene ispitne koncentracije i rezultati svih analiza za određivanje koncentracije ispitivane kemikalije u ispitnim posudama i posudama za kristalizaciju;
|
|
—
|
kakvoća vode u ispitnim posudama i posudama za kristalizaciju, odnosno pH-vrijednost, temperatura, otopljeni kisik, tvrdoća i amonijak;
|
|
—
|
zamjena isparene ispitne vode za ispitne posude, ako je bilo;
|
|
—
|
broj preobraženih mužjaka i ženki mušica po posudi i po danu za prvu i drugu generaciju;
|
|
—
|
omjer spolova živih mušica koje su se u cijelosti preobrazile po grupi za prvu i drugu generaciju
|
|
—
|
broj ličinaka koje se nisu preobrazile kao mušice po posudi za prvu i drugu generaciju;
|
|
—
|
postotak/udio preobrazbe po ponavljanju i ispitnoj koncentraciji (mužjaci i ženke mušica zajedno) za prvu i drugu generaciju;
|
|
—
|
srednja brzina razvoja živih mušica koje su se u cijelosti preobrazile po ponavljanju i brzini tretmana (mužjaci i ženke mušica odvojeno i zajedno) za prvu i drugu generaciju;
|
|
—
|
broj skupina jajašaca položenih u posude za kristalizaciju po kavezu za uzgoj i danu;
|
|
—
|
svojstva svake skupine jajašaca (veličina, oblik i stvarna plodnost);
|
|
—
|
potencijalna plodnost – ukupan broj skupina jajašaca po ukupnom broju ženki stavljenih u kavez za uzgoj;
|
|
—
|
stvarna plodnost – ukupan broj plodnih skupina jajašaca po ukupnom broju ženki stavljenih u kavez za uzgoj;
|
|
—
|
procjene toksičnih krajnjih učinaka, npr. ECx (i s time povezani intervali pouzdanosti), NOEC i statističke metode upotrijebljene za njihovo određivanje;
|
|
—
|
rasprava o rezultatima, uključujući i svaki utjecaj na rezultate ispitivanja nastao uslijed odstupanja od ove ispitne metode.
|
|
|
LITERATURA
|
(1)
|
Poglavlje C.27. ovog Priloga, Ispitivanje toksičnosti trzalaca (chironomidae) u vodi iz sedimenta sa sedimentom obrađenim spikingom.
|
|
(2)
|
Shobanov, N.A., Kiknadze, I.I. and M.G. Butler (1999.), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311. – 322.
|
|
(3)
|
Fleming, R. et al. (1994.), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. kolovoz 1994. WRc, UK.
|
|
(4)
|
SETAC (1993.), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, From the WOSTA Workshop held in the Netherlands.
|
|
(5)
|
ASTM International (2009.), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
(6)
|
Environment Canada (1997.), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, prosinac 1997.
|
|
(7)
|
US-EPA (2000.), Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, drugo izdanje, EPA 600/R-99/064, ožujak 2000., Izmjene prvog izdanja od lipnja 1994.
|
|
(8)
|
US-EPA/OPPTS 850.1735 (1996.), Whole Sediment Acute Toxicity Invertebrates.
|
|
(9)
|
US-EPA/OPPTS 850.1790 (1996.), Chironomid Sediment toxicity Test.
|
|
(10)
|
Milani, D., Day, K.E., McLeay, D.J. and R.S. Kirby (1996.), Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canada.
|
|
(11)
|
Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R. and C.D. Rowland (2006.), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662. – 2674.
|
|
(12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. and L. Weltje (2007.), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221. – 230.
|
|
(13)
|
Sugaya, Y. (1997.), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345. – 350.
|
|
(14)
|
Kawai, K. (1986.), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47. – 57.
|
|
(15)
|
Poglavlje C.27. ovog Priloga, Ispitivanje toksičnosti trzalaca (chironomidae) u vodi iz sedimenta sa sedimentom obrađenim spikingom.
|
|
(16)
|
OECD (2000.), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000.)6, OECD, Paris.
|
|
(17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. and M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
(18)
|
Environment Canada. (1995.), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, rujan 1995.
|
|
(19)
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. and J. Oehlmann (2005.), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: 353. – 361.
|
|
(20)
|
Suedel, B.C. and J.H. Rodgers (1994.), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163. – 1175.
|
|
(21)
|
Naylor, C. and C. Rodrigues (1995.), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291. – 3303.
|
|
(22)
|
Dunnett, C.W. (1964.), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096. – 1121.
|
|
(23)
|
Dunnett, C.W. (1964.), New tables for multiple comparisons with a control, Biometrics, 20: 482. – 491.
|
|
(24)
|
Williams, D.A. (1971.), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103. – 117.
|
|
(25)
|
Williams, D.A. (1972.), The comparison of several dose levels with a zero dose control. Biometrics, 28: 510. – 531.
|
|
(26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L. and H.M. Maes (2009.), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94. – 102.
|
|
(27)
|
Rao, J.N.K. and A.J. Scott (1992.), A simple method for the analysis of clustered binary data. Biometrics, 48: 577. – 585.
|
|
(28)
|
Christensen, E.R. (1984.), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213. – 221.
|
|
(29)
|
Bruce, R.D. and D.J. Versteeg (1992.), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485. – 1494.
|
|
(30)
|
Slob, W. (2002.), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298. – 312.
|
|
(31)
|
OECD (2006.), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No. 54, 146 pp., ENV/JM/MONO(2006)18, OECD, Paris.
|
|
(32)
|
Benoit, D.A., Sibley, P.K., Juenemann, J.L. and G.T. Ankley (1997.), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165. – 1176.
|
|
(33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. and J. Oehlmann (2007.), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) – baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: 1. – 9.
|
|
(34)
|
OECD (2010), Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OECD, Paris.
|
Dodatak 1
Definicije
Za potrebe ove ispitne metode upotrebljavaju se sljedeće definicije:
|
|
Kemikalija je tvar ili smjesa.
|
|
|
Formulirani sediment ili obrađeni, umjetni ili sintetički sediment jest smjesa materijala koja se upotrebljava za oponašanje fizikalnih svojstava prirodnog sedimenta.
|
|
|
Voda iznad sedimenta jest voda koja se u ispitnoj posudi nalazi iznad sedimenta.
|
|
|
Međuprostorna voda ili porna voda jest voda u prostoru između sedimenta i čestica tla.
|
|
|
Voda obrađena spikingom jest ispitna voda u koju je dodana ispitivana kemikalija.
|
|
|
Ispitivana kemikalija jesu sve tvari ili smjese koje se ispituju ovom ispitnom metodom.
|
Dodatak 2.
Preporuke za uzgoj kulture Chironomus riparius
|
1.
|
Ličinke vrste Chironomus mogu se uzgajati u posudama za kristalizaciju ili velikim spremnicima. Fini kremeni pijesak nanese se u tankom sloju dubine oko 5 do 10 mm po dnu spremnika. Pokazalo se i da je dijatomejska zemlja (npr. Merck, Art 8117) prikladan supstrat (dostatan je tanji sloj od svega nekoliko mm). Potom se dodaje prikladna voda u dubini od nekoliko centimetara. Vodu je potrebno nadolijevati po potrebi kako bi se zamijenila voda izgubljena isparavanjem i spriječilo isušivanje. Voda se po potrebi može zamijeniti. Potrebno je osigurati blago dozračivanje. Posude za uzgoj ličinaka potrebno je držati u prikladnom kavezu koji će spriječiti bijeg preobraženih odraslih životinja. Kavez bi trebao biti dovoljno velik da se preobražene odrasle životinje mogu rojiti; u suprotnome možda neće doći do kopulacije (minimalno oko 30 x 30 x 30 cm).
|
|
2.
|
Kaveze je potrebno držati na sobnoj temperaturi ili u prostoriji s konstantnim okolišem na 20 ± 2 °C s fotoperiodom od 16 sati svjetlosti (jačine oko 1 000 luksa), osam sati mraka. Izvješća ukazuju na to da vlažnost zraka ispod 60 % RV može spriječiti razmnožavanje.
|
Voda za razrjeđivanje
|
3.
|
Može se upotrebljavati bilo koja prikladna prirodna ili sintetička voda. Obično se upotrebljavaju izvorska voda, voda iz slavine iz koje je uklonjen klor i umjetni mediji (npr. mediji Elendt ‚M4’ ili ‚M7’; vidi u nastavku). Vodu je prije upotrebe potrebno dozračiti. Ako je to potrebno, voda za uzgoj kulture može se obnoviti pažljivim izlijevanjem upotrijebljene vode iz posuda za uzgoj kulture, izravno ili putem sifona, da se pritom ne unište cjevčice s ličinkama.
|
Hranjenje ličinaka
|
4.
|
Ličinke vrste Chironomus treba hraniti pahuljicama riblje hrane (Tetra Min®, Tetra Phyll® ili neka druga slična robna marka riblje hrane), i to otprilike 250 mg dnevno po posudi. Hrana se može dati kao suhi usitnjeni prah ili kao suspenzija u vodi: 1,0 g pahuljaste hrane doda se u 20 ml vode za razrjeđivanje i izmiješa u homogenu smjesu. Taj se pripravak može dodavati brzinom od oko 5 ml dnevno po posudi (protresti prije upotrebe). Starije ličinke mogu dobiti više hrane.
|
|
5.
|
Hranjenje se prilagođava kakvoći vode. Ako hranjiva podloga za uzgoj kultura postane ‚mutna’, potrebno je smanjiti hranjenje. Dodavanje hrane potrebno je pažljivo nadzirati. Premalo hrane dovest će do prebacivanja ličinaka prema vodenom stupcu, a previše hrane dovest će do povećane aktivnosti mikroba i sniženih koncentracija kisika. Oba ta uvjeta mogu dovesti do sniženih brzina rasta.
|
|
6.
|
Mogu se dodati i stanice nekih zelenih algi (npr. Scenedesmus subspicatus, Chlorella vulgaris) kada se postavljaju nove posude za uzgoj kultura.
|
Hranjenje preobraženih odraslih životinja
|
7.
|
Neki izvođači pokusa sugerirali su da bi vuneni podložak namočen u zasićenoj šećernoj otopini mogao poslužiti kao hrana za preobražene odrasle životinje.
|
Preobrazba
|
8.
|
Na 20 ± 2 °C ličinke iz posuda za uzgoj ličinaka počinju se preobražavati u odrasle životinje nakon otprilike 13 – 15 dana. Mužjaci se lako razaznaju po svojim dlakavim ticalima i tankom tijelu.
|
Mase jajašaca
|
9.
|
Kad se u kavezu za uzgoj pojave odrasle životinje, u svim posudama za uzgoj ličinaka triput tjedno potrebno je provjeravati ima li položenih želatinoznih masa jajašaca. Ako ima masa jajašaca, potrebno ih je pažljivo ukloniti. Potrebno ih je prenijeti u malu posudu u kojoj se nalazi uzorak vode za uzgoj. Te se mase jajašaca upotrebljavaju za postavljanje nove posude za uzgoj kulture (npr. od dvoje do četiri mase jajašaca/posudi) ili se upotrebljavaju za ispitivanja toksičnosti.
|
|
10.
|
Valjenje ličinaka u prvom stadiju razvoja trebalo bi se zbiti nakon dva do tri dana.
|
Postavljanje novih posuda za uzgoj kulture
|
11.
|
Kad se kulture razviju, trebalo bi biti moguće postaviti novu posudu za uzgoj kulture jedanput tjedno ili rjeđe, ovisno o potrebama ispitivanja, i ukloniti starije posude nakon što se ličinke preobraze u odrasle mušice. Na taj način, uz minimalno upravljanje, stvarat će se redovita zaliha odraslih životinja.
|
Priprema ispitnih otopina ‚M4’ i ‚M7’
|
12.
|
Elendt (1990.) opisao je medij ‚M4’. Medij ‚M7’ priprema se kao medij ‚M4’, osim za tvari iz tablice 1., za koje su koncentracije četiri puta niže u ‚M7’ od onih u ‚M4’. Ispitnu otopinu ne bi trebalo pripremati prema Elendtu i Biasu (1990.) jer koncentracije NaSiO3 · 5H2O, NaNO3, KH2PO4 i K2HPO4 navedene za pripremu radnih otopina nisu adekvatne.
|
Priprema medija ‚M7’
|
13.
|
Svaka se radna otopina (I) priprema zasebno, a kombinirana radna otopina (II) priprema se iz tih radnih otopina (I) (vidi tablicu 1.). Za pripremu medija ‚M7’ miješa se 50 ml kombinirane radne otopine (II) i količine svake radne otopine makronutrijenata navedene u tablici 2. do ukupno jedne litre deionizirane vode. Vitaminska radna otopina priprema se dodavanjem triju vitamina u deioniziranu vodu, kao što je naznačeno u tablici 3., a 0,1 ml kombinirane vitaminske radne otopine dodaje se konačnom mediju ‚M7’ netom prije upotrebe. Vitaminska radna otopina čuva se zamrznuta u malim alikvotima. Medij se dozrači i stabilizira.
|
Tablica 1.
Radne otopine elemenata u tragovima za medij M4 i M7
|
Radne otopine (I)
|
Količina (mg) od koje se umiješa do jedne litre deionizirane vode
|
Za pripremu kombinirane radne otopine (II): pomiješajte sljedeće količine (ml) radnih otopina (I) u do jedne litre deionizirane vode
|
Konačne koncentracije u ispitnim otopinama (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7H2O (25)
(26)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tablica 2.
Radne otopine makronutrijenata za medij M4 i M7
|
|
Količina od koje se umiješa do jedne litre deionizirane vode
(mg)
|
Količina radnih otopina makronutrijenata koja se dodaje za pripremu medija M4 i M7
(ml/l)
|
Konačne koncentracije u ispitnim otopinama M4 i M7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tablica 3.
Vitaminska radna otopina za medij M4 i M7
Sve tri vitaminske otopine kombiniraju se u jednu vitaminsku radnu otopinu.
|
|
Količina od koje se umiješa do jedne litre deionizirane vode
(mg)
|
Količina vitaminske radne otopine koja se dodaje za pripremu medija M4 i M7
(ml/l)
|
Konačne koncentracije u ispitnim otopinama M4 i M7
(mg/l)
|
|
Tiamin-hidroklorid
|
750
|
0,1
|
0,075
|
|
Cianokobalamin (B12)
|
10
|
0,1
|
0,0010
|
|
Biotin
|
7,5
|
0,1
|
0,00075
|
REFERENCE
BBA (1995.), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, Edited by M. Streloke and H. Köpp. Berlin.
Elendt, B.P. (1990.), Selenium deficiency in Crustacea, Protoplasma, 154: 25. – 33.
Elendt, B.P. and W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157. – 1167.
Dodatak 3.
Priprema formuliranog sedimenta
SASTAV SEDIMENTA
Formulirani sediment trebao bi imati sljedeći sastav:
|
Sastojak
|
Svojstva
|
% suhe mase sedimenta
|
|
Treset
|
Sphagnum moss treset, što bliže pH-vrijednosti 5,5 – 6,0, bez vidljivih ostataka biljaka, fino usitnjen (veličina čestica ≤ 1 mm) i sušen na zraku
|
4 – 5
|
|
Kremeni pijesak
|
Veličina zrna: > 50 % čestica trebalo bi biti u rasponu 50 – 200 μm
|
75 – 76
|
|
Kaolinitska glina
|
Sadržaj kaolinita ≥ 30 %
|
20
|
|
Organski ugljik
|
Prilagođava se dodavanjem treseta i pijeska
|
2 (± 0,5)
|
|
Kalcijev karbonat
|
CaCO3, u prahu, kemijski čist
|
0,05 – 0,1
|
|
Voda
|
Provodljivost ≤ 10 μS/cm
|
30 – 50
|
PRIPREMA
Treset se suši na zraku i usitnjava u fini prah. Priprema se suspenzija potrebne količine treseta u prahu u deioniziranoj vodi s pomoću uređaja za homogenizaciju visokog učinka. pH-vrijednost te suspenzije podešava se u području od 5,5 ± 0,5 s pomoću CaCO3. Suspenzija se priprema najmanje dva dana blagim miješanjem na 20 ± 2 °C, kako bi se stabilizirala pH-vrijednost i uspostavila stabilna mikrobna komponenta. pH-vrijednost ponovno se mjeri i trebala bi iznositi 6,0 ± 0,5. Potom se suspenzija treseta miješa s ostalim sastojcima (pijeskom i kaolinitskom glinom) i deioniziranom vodom kako bi se dobio homogeni sediment sa sadržajem vode u rasponu od 30–50 % suhe mase sedimenta. Još jednom mjeri se pH-vrijednost konačne smjese i podešava na od 6,5 do 7,5 s pomoću CaCO3 ako je potrebno. Uzimaju se uzorci sedimenta kako bi se odredili suha masa i sadržaj organskog ugljika. Potom se preporučuje da se formulirani sediment, prije upotrebe u ispitivanju toksičnosti trzalaca, priprema sedam dana u istim uvjetima koji prevladavaju i u naknadnom ispitivanju.
SKLADIŠTENJE
Suhi sastojci za pripremu umjetnog sedimenta mogu se skladištiti na suhom i hladnom mjestu na sobnoj temperaturi. Formulirani (mokri) sediment ne bi trebalo skladištiti prije upotrebe u ispitivanju. Njega je potrebno upotrijebiti odmah nakon razdoblja pripremanja od sedam dana koje završava pripremu.
REFERENCE
OECD (1984.), Earthworm, Acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OECD, Pariz.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. and B. Streit (1998.), Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10. – 20.
Dodatak 4.
Kemijska svojstva prihvatljive vode za razrjeđivanje
|
SASTOJAK
|
KONCENTRACIJE
|
|
Čestice
|
< 20 mg/l
|
|
Ukupni organski ugljik
|
< 2 mg/l
|
|
Neionizirani amonijak
|
< 1 μg/l
|
|
Tvrdoća kao CaCO3
|
< 400 mg/l (27)
|
|
Rezidualni klor
|
< 10 μg/l
|
|
Ukupni organofosforni pesticidi
|
< 50 ng/l
|
|
Ukupni organofosforni pesticidi plus poliklorirani bifenili
|
< 50 ng/l
|
|
Ukupni organski klor
|
< 25 ng/l
|
Dodatak 5.
Smjernice za provođenje ispitivanja
Primjer kaveza za uzgoj:
|
A
|
:
|
mreža na gornjoj strani i najmanje s jedne strane kaveza (veličina otvora gaze otprilike 1 mm)
|
|
B
|
:
|
otvor za stavljanje preobraženih odraslih životinja u kavez za uzgoj i uklanjanje položenih skupina jajašaca iz posuda za kristalizaciju (nije ovdje prikazano)
|
|
C
|
:
|
veličina kaveza za uzgoj najmanje duljine 30 cm, visine 30 cm i širine 30 cm
|
Primjer ispitne posude:

|
A
|
:
|
Pasteurova pipeta za dovod zraka u vodu iznad sedimenta
|
|
B
|
:
|
stakleni poklopac za sprečavanje bijega preobraženih mušica
|
|
C
|
:
|
površinski sloj vode
|
|
D
|
:
|
ispitna posuda (staklena laboratorijska čaša od 600 ml)
|
|
E
|
:
|
sloj sedimenta
|
Primjer sisaljke za hvatanje odraslih mušica (strelice ukazuju na smjer protoka zraka):

|
A
|
:
|
staklena cjevčica (unutarnji promjer otprilike 5 mm) spojena na samousisnu crpku
|
|
B
|
:
|
čep od vulkanizirane gume, probušen staklenom cjevčicom (A). S unutarnje strane otvor staklene cjevčice (A) prekriven je pamukom i gazom (veličina otvora mrežice otprilike 1 mm) kako bi se spriječila povreda mušica pri njihovu uvlačenju u sisaljku
|
|
C
|
:
|
proziran spremnik (plastičan ili staklen, duljine otprilike 15 cm) za ulovljene mušice
|
|
D
|
:
|
čep od vulkanizirane gume, probušen cjevčicom (E). Za puštanje mušica u kavez za uzgoj, čep D se miče iz spremnika C
|
|
E
|
:
|
cjevčica (plastična ili staklena, unutarnjeg promjera otprilike 8 mm) za sakupljanje odraslih mušica iz posude
|
Shematski prikaz ispitivanja životnog ciklusa:

|
A
|
:
|
prva generacija – ispitne posude koje sadržavaju sustav voda/sediment, osam ponavljanja, 20 ličinaka iz prvog stadija razvoja po posudi
|
|
B
|
:
|
četiri ispitne posude za svaki kavez za uzgoj, A i B
|
|
C
|
:
|
kavezi za uzgoj (A i B) za rojenje, parenje i polaganje jajašaca
|
|
D
|
:
|
posude za kristalizaciju za polaganje jajašaca
|
|
E
|
:
|
mikrotitracijske pločice, jedna jažica za svaku skupinu jajašaca
|
|
F
|
:
|
druga generacija – ispitne posude koje sadržavaju sustav voda/sediment, osam ponavljanja, 20 ličinaka iz prvog stadija razvoja po posudi
|
C.41. ISPITIVANJE SPOLNOG RAZVOJA RIBA
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 234 (2011.). Temelji se na odluci iz 1998. o razvoju novih ili ažuriranju postojećih ispitnih metoda za preventivno ispitivanje i ispitivanje potencijalnih endokrinih ometača. Ispitivanje spolnog razvoja riba (FSDT) bilo je utvrđeno kao obećavajuća ispitna metoda kojom je bio obuhvaćen osjetljivi životni stadij riba u kojem dolazi do reakcije na kemikalije slične estrogenu i androgenu. Od 2006. do 2010. provedena je međulaboratorijska validacija ispitne metode u okviru koje su validirani medaka (Oryzias latipes), zebrica (Danio rerio) i koljuška (Gasterosteus aculeatus) i djelomično debeloglava gavčica (Pimephales promelas) (41) (42) (43). Ovaj protokol uključuje medaku, koljušku i zebricu. Protokol je u načelu unapređenje Smjernice za ispitivanje OECD-a 210 Ispitivanje toksičnosti na ribama u ranim životnim stadijima (1), u kojem se izlaganje nastavlja sve do diferencijacije riba po spolu, odnosno približno 60 dana poslije valjenja (dph) za medaku, koljušku i zebricu (vrijeme izlaganja može biti kraće ili dulje za druge vrste koje će biti validirane u budućnosti), i dodavanja endokrinih konačnih učinaka. Ispitivanjem spolnog razvoja riba procjenjuju se učinci u ranim životnim stadijima i potencijalno štetne posljedice navodno endokrino disruptivnih kemikalija (npr. estrogena, androgena i inhibitora steroidogeneze) na spolni razvoj. Kombinacijom dvaju osnovnih endokrinih krajnjih učinaka, koncentracijom vitelogenina (VTG) i omjerom fenotipskih spolova omogućuje se da se u ispitivanju naznači način djelovanja ispitivane kemikalije. Zbog promjene omjera fenotipskih spolova koja je relevantna za populaciju, ispitivanje spolnog razvoja riba može se upotrebljavati za procjenu opasnosti i rizika. Međutim, ako se ispitivanje upotrebljava za procjenu opasnosti ili rizika, ne bi trebalo upotrebljavati koljušku jer raspoloživi podaci o validaciji do sada upućuju na to da za tu vrstu nisu uobičajene promjene omjera fenotipskih spolova pod djelovanjem ispitivanih kemikalija.
|
|
2.
|
Protokol se temelji na ribama koje su putem vode izložene kemikalijama tijekom razdoblja u kojem je spol nestabilan i u kojem se očekuje da su ribe najosjetljivije na učinke endokrino disruptivnih kemikalija koje utječu na spolni razvoj. Dva osnovna krajnja učinka mjere se kao pokazatelji razvojnih aberacija povezanih s endokrinim sustavom, koncentracije VTG-a i omjeri spolova (udjeli spolova) utvrđeni histološkom analizom spolnih žlijezda. Histopatološka analiza spolnih žlijezda (ocjenjivanje i određivanje stadija jajnih stanica i spermatogenih stanica) nije obvezna. Pored toga, genetski spol određuje se kada god je to moguće (npr. u medake i koljuške). Prisutnost markera genetskog spola predstavlja znatnu prednost jer se njime povećava snaga statističkih podataka o omjeru spolova i omogućuje utvrđivanje pojedinačne promjene fenotipskog spola. Ostali apikalni krajnji učinci koje je potrebno mjeriti uključuju stopu valjenja, preživljavanje, dužinu i tjelesnu masu. Ispitna metoda mogla bi se prilagoditi za druge vrste koje nisu prethodno navedene pod uvjetom da druge vrste budu podvrgnute validaciji koja je jednaka onoj provedenoj za medaku, koljušku i zebricu, da se kontrolne ribe razlikuju po spolu na kraju ispitivanja, da su razine VTG-a dovoljno visoke za utvrđivanje znatnih varijacija povezanih s kemikalijama i da je utvrđena osjetljivost sustava ispitivanja primjenom endokrino aktivnih referentnih kemikalija ((anti)estrogena, (anti)androgena, inhibitora aromataze itd.). Pored toga, OECD bi trebao pregledati svako izvješće / sva izvješća o validaciji u kojem se upućuje na podatke o ispitivanju spolnog razvoja riba u kojem su upotrijebljene druge vrste, a ishod validacije trebao bi se smatrati zadovoljavajućim.
|
Početna razmatranja i ograničenja
|
3.
|
VTG se uobičajeno proizvodi u jetri ženki oviparnih kralježnjaka kao reakcija na cirkulirajući endogeni estrogen (2). On je prethodnik proteina u žumanjku koji nakon proizvodnje u jetri putuje krvotokom do jajnika, gdje ga preuzimaju i modificiraju jajašca u razvoju. Sinteza VTG-a vrlo je ograničena, iako ju je moguće utvrditi u nezrelih riba i odraslih mužjaka riba jer nemaju dovoljno cirkulirajućeg estrogena. Međutim, jetra može sintetizirati i izlučivati VTG kao reakciju na stimulaciju egzogenim estrogenom (3) (4) (5).
|
|
4.
|
Mjerenjem VTG-a utvrđuju se kemikalije s estrogenim, antiestrogenim i androgenim načinima djelovanja i kemikalije koje utječu na steroidogenezu kao što su na primjer inhibitori aromataze. Postojanje estrogenih kemikalija može se utvrditi mjerenjem indukcije VTG-a u mužjacima riba, pri čemu je to utvrđivanje uvelike dokumentirano u znanstvenoj, stručno pregledanoj literaturi. Dokazana je i indukcija VTG-a nakon izlaganja androgenima koji mogu aromatizirati (6) (7). Smanjenjem razine cirkulirajućeg estrogena u ženkama, na primjer inhibicijom aromataze kojom se endogeni androgen pretvara u prirodni estrogen estradiol 17β, dolazi do smanjenja koncentracije VTG-a, koje služi za utvrđivanje kemikalija sa svojstvima inhibitora aromataze ili općenito inhibitora steroidogeneze (33). Biološka relevantnost reakcije VTG-a nakon estrogene inhibicije / inhibicije aromataze utvrđena je i uvelike dokumentirana (8) (9). Međutim, moguće je da na proizvodnju VTG-a u ženki utječu i opća toksičnost te neendokrini toksični načini djelovanja.
|
|
5.
|
Uspješno je razvijeno i standardizirano nekoliko metoda mjerenja za rutinsku primjenu pri određivanju količine VTG-a u uzorcima krvi, jetre, cijelog tijela ili homogenata glave/repa prikupljenih od pojedinačnih riba. Navedeno vrijedi za zebricu, koljušku i medaku te za djelomično validiranu vrstu debeloglava gavčica; dostupne su metode enzimskog imunosorbentnog testa (ELISA) specifičnoga za vrstu u okviru kojih se primjenjuje imunokemija za kvantifikaciju VTG-a (5) (10) (11) (12) (13) (14) (15) (16). U medake i zebrice postoji dobra korelacija između VTG-a izmjerenog iz uzoraka krvne plazme, jetre i homogenata, iako postoji tendencija da su vrijednosti dobivene iz homogenata nešto niže od onih dobivenih iz plazme (17) (18) (19). U Dodatku 5. predviđeni su preporučeni postupci za uzimanje uzoraka za analizu VTG-a.
|
|
6.
|
Promjena omjera fenotipskih spolova (udjela spolova) krajnji je učinak kojim se odražava promjena spola. U načelu, estrogeni, antiestrogeni, androgeni, antiandrogeni i kemikalije kojima se inhibira steroidogeneza mogu utjecati na omjer spolova riba u razvoju (20). Pokazalo se da je navedena promjena spola djelomično reverzibilna u zebrica (21) nakon izlaganja kemikalijama sličnima estrogenu, dok je promjena spola nakon izlaganja kemikalijama sličnima androgenu trajna (30). Spol je definiran kao ženski, muški, međuspol (jajne stanice i spermatogene stanice u jednoj spolnoj žlijezdi) ili nediferencirani, a u riba određuje se histološkom pretragom spolnih žlijezda. Smjernica je navedena u Dodatku 7. i Smjernici OECD-a za dijagnozu histopatološke analize spolnih žlijezda riba povezane s endokrinim sustavom (22).
|
|
7.
|
Genetski se spol ispituje genetskim markerima ako postoje za određenu vrstu ribe. U medake ženski gen XX ili muški gen XY mogu se odrediti lančanom reakcijom polimeraze (PCR) ili se može analizirati gen iz DM-domene povezan s kromosomom Y (DMY) (DMY negativan ili pozitivan) kako je opisano u (23) (24). Za koljušku postoji ekvivalentna metoda PCR-a za određivanje genetskog spola opisana u Dodatku 10. Mogućnošću da se genetski spol pojedinačno poveže s fenotipskim spolom poboljšava se snaga ispitivanja i stoga je genetski spol potrebno određivati za vrste s dokumentiranim markerima genetskog spola.
|
|
8.
|
Dvama osnovnim krajnjim učincima, VTG-om i omjerom spolova, može se u kombinaciji dokazati endokrini način djelovanja kemikalije (tablica 1.). Omjer je spolova biomarker relevantan za populaciju (25) (26), a za određene, dobro definirane načine djelovanja mogu se primjenjivati rezultati ispitivanja spolnog razvoja riba za procjenu opasnosti i rizika ako to regulatorna agencija smatra primjerenim. U ovom trenutku ti načini djelovanja uključuju estrogene, androgene i inhibitore steroidogeneze.
Tablica 1.
Reakcija endokrinih krajnjih učinaka na različite načine djelovanja kemikalija:
↑ = u porastu, ↓ = u padu, — = nije istraženo
|
Način djelovanja
|
VTG ♂
|
VTG ♀
|
Omjer spolova
|
Upućivanja
|
|
Slab agonist estrogena
|
↑
|
↑
|
↑♀ ili ↑nediferencirano
|
(27) (40)
|
|
Jak agonist estrogena
|
↑
|
↑
|
↑♀ ili ↑nediferencirano, bez ♂
|
(28) (40)
|
|
Antagonist estrogena
|
—
|
—
|
↓♀, ↑nediferencirano
|
(29)
|
|
Agonist androgena
|
↓ ili —
|
↓ ili —
|
↑ ♂, bez ♀
|
(28) (30)
|
|
Antagonist androgena
|
—
|
—
|
↑♀
↑Međuspol
|
(31)
|
|
Inhibitor aromataze
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
Ispitivanjem spolnog razvoja riba nije obuhvaćen reproduktivni životni stadij riba i stoga je kemikalije za koje se pretpostavlja da utječu na reprodukciju u nižim koncentracijama od onih za spolni razvoj potrebno proučiti u okviru ispitivanja kojim je obuhvaćena reprodukcija.
|
|
10.
|
Definicije u smislu ove ispitne metode navedene su u Dodatku 1.
|
|
11.
|
In vivo ispitivanje spolnog razvoja riba namijenjeno je utvrđivanju kemikalija s androgenim i estrogenim svojstvima kao i antiandrogenim i antiestrogenim svojstvima te svojstvima inhibicije steroidogeneze. Validacijskim fazama (prvom i drugom) ispitivanja spolnog razvoja riba bile su obuhvaćene estrogene i androgene kemikalije te kemikalije kojima se inhibira steroidogeneza. Učinci antagonista estrogena i androgena u ispitivanju spolnog razvoja riba navedeni su u tablici 1., ali ti su načini djelovanja u ovom trenutku slabije dokumentirani.
|
NAČELO ISPITIVANJA
|
12.
|
U okviru ispitivanja ribe, u stadijima od svježe oplođenih jajašaca do završetka spolne diferencijacije, izlažu se najmanje trima koncentracijama ispitivane kemikalije otopljene u vodi. Uvjeti ispitivanja trebali bi obuhvaćati protočni postupak, osim ako to nije moguće zbog dostupnosti ili naravi (npr. ograničena topljivost) ispitivane kemikalije. Ispitivanje počinje stavljanjem svježe oplođenih jajašaca (prije cijepanja blastodiska) u ispitne posude. U stavku 27. opisano je punjenje posuda za svaku vrstu. Za validirane vrste riba, odnosno za medaku, koljušku i zebricu utvrđeno je ispitivanje u trajanju od 60 dph. Nakon završetka ispitivanja sve se ribe humano usmrćuju. Biološki uzorak (krvna plazma, jetra ili homogenat glave/repa) za analizu VTG-a prikuplja se od svake ribe, a preostali dio fiksira se za histološku procjenu spolnih žlijezda radi određivanja fenotipskog spola; po izboru se može provesti histopatološka analiza (npr. određivanje stadija spolnih žlijezda, stupanj međuspola). Biološki uzorak (analna ili leđna peraja) za određivanje genetskog spola uzima se za vrste koje imaju odgovarajuće markere (Dodaci 9. i 10.).
|
|
13.
|
Pregled relevantnih uvjeta ispitivanja specifičnih za validirane vrste, a to su medaka, koljuška i zebrica, prikazan je u Dodatku 2.
|
INFORMACIJE O ISPITIVANOJ KEMIKALIJI
|
14.
|
Trebali bi biti dostupni rezultati testa akutne toksičnosti ili drugog testa kratkotrajne toksičnosti (npr. ispitna metoda C.14. (34) i Smjernica OECD-a TG 210 (1)), po mogućnosti provedenih na vrstama odabranima za ovo ispitivanje. To znači da su topljivost u vodi i tlak pare ispitivane kemikalije poznati te da je raspoloživa pouzdana analitička metoda za kvantifikaciju kemikalije u ispitnim posudama s poznatom i dokumentiranom točnošću i granicom detekcije.
|
|
15.
|
Osim toga, korisno je imati ostale informacije o strukturnoj formuli, čistoći kemikalije, stabilnosti u vodi i na svjetlosti, pKa, Pow i rezultatima ispitivanja na laku biorazgradivost (ispitna metoda C.4.) (35).
|
Kriteriji prihvatljivosti ispitivanja
|
16.
|
Da bi rezultati ispitivanja bili prihvatljivi, primjenjuju se sljedeći uvjeti:
|
—
|
tijekom čitavog ispitivanja koncentracija otopljenog kisika trebala bi biti najmanje 60 posto vrijednosti zasićenosti kisikom (ASV),
|
|
—
|
razlike u temperaturi vode između ispitnih posuda ni u jednom trenutku tijekom izlaganja ne bi trebale biti veće od ± 1,5 °C; temperaturu vode potrebno je održavati unutar utvrđenoga temperaturnog područja za ispitnu vrstu u pitanju (Dodatak 2.),
|
|
—
|
na raspolaganju bi trebala biti validacijska metoda za analizu kemikalije izlaganja s granicom detekcije nižom od najniže nazivne koncentracije i trebali bi biti prikupljeni dokazi o tome da su koncentracije ispitivane kemikalije u otopini na zadovoljavajući način održavane u granicama ± 20 % srednjih izmjerenih vrijednosti,
|
|
—
|
ukupno preživljavanje oplođenih jajašaca u kontrolnim skupinama i po potrebi kontrolnim skupinama s otapalom trebalo bi biti veće od ili jednako graničnim vrijednostima definiranima u Dodatku 2.,
|
|
—
|
kriteriji prihvatljivosti povezani s rastom i udjelima spolova na kraju ispitivanja temelje se na podacima iz kontrolnih skupina (kontrola otapala i vode zajedno, osim ako su bitno drukčiji, u tom slučaju samo kontrola otapala):
|
|
Medaka
|
Zebrica
|
Koljuška
|
|
Rast
|
Mokra masa ribe osušene upijajućim materijalom
|
> 150 mg
|
> 75 mg
|
> 120 mg
|
|
Dužina (standardna dužina)
|
> 20 mm
|
> 14 mm
|
> 20 mm
|
|
Omjer spolova (% mužjaka ili ženki)
|
30 – 70 %
|
30 – 70 %
|
30 – 70 %
|
|
|
—
|
Ako se upotrebljava otapalo, ono ne bi trebalo imati nikakvog statistički značajnog učinka na preživljavanje i ne bi trebalo izazivati nikakve endokrine disruptivne učinke ili druge štetne učinke na rane životne stadije, što se otkriva kontrolnom skupinom s otapalom.
|
Ako je opaženo odstupanje od kriterija prihvatljivosti ispitivanja, potrebno je razmotriti posljedice u odnosu na pouzdanost podataka o ispitivanju i ta razmatranja uključiti u izvješćivanje.
|
OPIS ISPITNE METODE
Ispitne posude
|
17.
|
Mogu se upotrebljavati bilo kakve staklene posude, posude od plemenitog čelika ili druge kemijski inertne posude. Posude bi trebale biti dovoljno velike da se omogući usklađenost s kriterijima količine punjenja navedenima u nastavku. Poželjno je da se ispitne posude nasumično smjeste unutar ispitnog prostora. Nasumičnom bloknom rasporedu gdje su sve koncentracije prisutne u svim blokovima potrebno je dati prednost u odnosu na potpuno nasumični raspored. Ispitne posude treba zaštititi od neželjenog uznemiravanja.
|
Odabir vrste
|
18.
|
Preporučene vrste riba navedene su u Dodatku 2. Postupci za uključivanje novih vrsta navedeni su u stavku 2.
|
Držanje roditeljskih riba
|
19.
|
Pojedinosti o držanju roditeljskih riba pod zadovoljavajućim uvjetima mogu se pronaći u Smjernici OECD-a TG 210 (1). Roditeljske ribe potrebno je hraniti odgovarajućom hranom jedanput ili dvaput dnevno.
|
Rukovanje embrijima i ličinkama
|
20.
|
Na početku izlaganja embriji i ličinke mogu se položiti u manje staklene posude ili posude od plemenitog čelika smještene unutar glavne posude opremljene mrežastim stranicama odnosno krajevima kojima se omogućuje protok ispitivane kemikalije kroz posudu. Neturbulentno strujanje kroz navedene male posude može se postići tako da se posude objese o polugu s pomoću koje se posuda njiše gore-dolje, ali tako da ispitni organizmi ostanu čitavo vrijeme uronjeni.
|
|
21.
|
Ako se za držanje jajašaca unutar glavne ispitne posude upotrebljavaju spremnici za jajašca, rešetke ili mreže, njih je potrebno ukloniti nakon što se ličinke izvale, osim mreža, koje je potrebno zadržati kako bi se onemogućio bijeg riba. Ako ličinke treba premjestiti, ne bi ih trebalo izložiti zraku; ribe iz spremnika za jajašca ne bi trebalo vaditi mrežicom. Vrijeme prijenosa različito je ovisno o vrsti, s time da prijenos nije uvijek ni potreban.
|
Voda
|
22.
|
Prikladna je ispitna voda svaka voda u kojoj je kontrolna vrijednost preživljavanja ispitne vrste barem na razini jednakoj onoj u vodi opisanoj u Dodacima 2. i 3. Ona bi trebala biti stalne kakvoće tijekom razdoblja ispitivanja. Kako voda za razrjeđivanje ne bi neprimjereno utjecala na rezultat ispitivanja (na primjer reagiranjem s ispitivanom kemikalijom) ili imala negativan utjecaj na uspješnost uzgojnog jata, potrebno je u određenim razmacima uzimati uzorke na analizu. Potrebno je mjeriti ukupni organski ugljik, provodljivost, pH-vrijednost i suspendirane krute tvari na primjer svaka tri mjeseca ako je poznato da je voda za razrjeđivanje relativno stalne kakvoće. Teške metale (npr. Cu, Pb, Zn, Hg, Cd, Ni), glavne anione i katione (npr. Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) i pesticide potrebno je mjeriti ako je kakvoća vode upitna. Pojedinosti o kemijskoj analizi i skupljanju vode navedene su u stavku 34.
|
Ispitne otopine
|
23.
|
Ako je to izvedivo u praksi, potrebno je primjenjivati protočni sustav. Kod protočnih ispitivanja za dopremanje niza koncentracija u ispitne posude potreban je sustav koji stalno odmjerava i razrjeđuje radnu otopinu ispitivane kemikalije (npr. dozirna crpka, proporcionalni razrjeđivač, zasićivač). Brzine protoka radnih otopina i vode za razrjeđivanje potrebno je provjeravati u određenim razmacima tijekom ispitivanja i one za vrijeme ukupnog trajanja ispitivanja ne smiju odstupati više od 10 %. Pokazalo se da je prikladna brzina protoka koja odgovara barem peterostrukom volumenu ispitne posude u 24 sata (1). Potrebno je paziti da se ne upotrebljavaju plastične cijevi ili drugi materijali, od kojih neki mogu sadržavati biološki aktivne kemikalije ili mogu adsorbirati ispitivanu kemikaliju.
|
|
24.
|
Radnu otopinu potrebno je po mogućnosti pripremiti bez primjene otapala jednostavnim miješanjem ili protresanjem ispitivane kemikalije u vodi za razrjeđivanje mehaničkim sredstvima (npr. mješačem ili ultrazvukom). Ako se ispitivana kemikalija teško otapa u vodi, potrebno je slijediti postupke opisane u Smjernici OECD-a za ispitivanje toksičnosti teških tvari i smjesa u vodi (36). Potrebno je izbjegavati upotrebu otapala, ali ona će u nekim slučajevima možda biti potrebna kako bi se dobila prikladno koncentrirana radna otopina. Primjeri prikladnih otapala navedeni su u (36).
|
|
25.
|
Potrebno je izbjegavati polustatične uvjete ispitivanja, osim ako su opravdani utemeljenim razlozima koji se odnose na ispitivanu kemikaliju (npr. stabilnost, ograničena dostupnost, visoki troškovi ili opasnost). Kod polustatičnog postupka mogu se primjenjivati dva različita postupka obnavljanja. Pripremaju se nove ispitne otopine u čistim posudama te se preživjela jajašca i ličinke nježno prenose u nove posude ili se ispitni organizmi zadržavaju u ispitnim posudama dok se dio ispitne vode (najmanje dvije trećine) mijenja svakog dana.
|
POSTUPAK
Uvjeti izlaganja
Prikupljanje jajašaca i trajanje
|
26.
|
Kako bi se izbjeglo utjecanje na odabir genetskog materijala, jajašca se skupljaju od najmanje triju uzgojnih parova ili skupine, miješaju i nasumično odabiru prije početka ispitivanja. Za koljušku vidi opis umjetne oplodnje u Dodatku 11. Ispitivanje je potrebno početi što je prije moguće nakon oplodnje jajašaca, pri čemu je embrije potrebno po mogućnosti uroniti u ispitne otopine prije ili što je prije moguće nakon početka cijepanja blastodiska, a najkasnije 12 sati nakon oplodnje. Ispitivanje je potrebno nastaviti do završetka spolne diferencijacije u kontrolnoj skupni (60 dph za medaku, koljušku i zebricu).
|
Punjenje
|
27.
|
Broj oplođenih jajašaca na početku ispitivanja trebao bi iznositi najmanje 120 po koncentraciji raspoređeno na najmanje četiri ponavljanja (za kontrolu je prihvaćena raspodjela po metodi drugog korijena). Jajašca je potrebno nasumično rasporediti (primjenom statističkih tablica za nasumičan odabir) između ispitnih posuda. Količina punjenja (definiciju vidi u Dodatku 1.) trebala bi biti dovoljno niska da se koncentracija otopljenog kisika može održati barem na razini 60 % ASV-a bez izravnog dozračivanja posuda. Preporučena količina punjenja kod protočnih ispitivanja iznosi najviše 0,5 g/l u 24 sata i najviše 5 g/l otopine u bilo kojem trenutku. Najkasnije 28 dana nakon oplodnje broj riba po ponavljanju potrebno je ponovno rasporediti tako da broj riba u svakom ponavljanju bude što je moguće sličniji. U slučaju pojavljivanja smrtnosti povezane s izlaganjem broj ponavljanja potrebno je na odgovarajući način smanjiti kako bi gustoća riba između razina obrade bila što je moguće sličnija.
|
Svjetlo i temperatura
|
28.
|
Razdoblje svjetla i tame i temperaturu vode potrebno je prilagoditi ispitnoj vrsti (vidi Dodatak 2. u vezi s uvjetima pokusa za ispitivanje spolnog razvoja riba).
|
Hranjenje
|
29.
|
Hrana i hranjenje kritični su i bitno je za svaki stadij osigurati pravilnu hranu u odgovarajućim vremenskim razmacima i na razinama dostatnima za normalan rast. Hranjenje bi trebalo biti ad libitum vodeći računa o tome da višak bude minimalan. Kako bi se postigla dostatna stopa rasta, ribe je potrebno hraniti najmanje dva puta dnevno (vikendom je prihvatljivo jedanput dnevno) uz razmak od najmanje tri sata između svakog hranjenja. Suvišnu hranu i izmet potrebno je po potrebi ukloniti kako bi se izbjeglo nakupljanje otpada. Na temelju stečenog iskustva hrana i režimi hranjenja neprestano se unapređuju u cilju optimizacije rasta i poboljšanja preživljavanja. Stoga je potrebno nastojati od priznatih stručnjaka dobiti potvrdu za predloženi režim. Hranjenje je potrebno prekinuti 24 sata prije završetka ispitivanja. Primjeri odgovarajuće hrane navedeni su u Dodatku 2. (vidi i Okvir za ispitivanje riba OECD-a) (39).
|
Ispitne koncentracije
|
30.
|
Ispitivane kemikalije potrebno je rasporediti kako je opisano u Dodatku 4. Potrebno je upotrijebiti minimalno tri ispitne koncentracije u najmanje četiri ponavljanja. Pri odabiru raspona ispitnih koncentracija potrebno je uzeti u obzir krivulju ovisnosti LC50 o vremenu izlaganja kod dostupnih istraživanja akutne toksičnosti. Ako se podaci upotrebljavaju za procjenu rizika, preporučuje se pet ispitnih koncentracija.
|
|
31.
|
Nije potrebno ispitivati koncentracije kemikalije iznad 10 % LC50 kod akutne toksičnosti za odrasle ribe ili 10 mg/l, ovisno o tome što je manje. Maksimalna ispitna koncentracija trebala bi biti 10 % LC50 po životnom stadiju ličinke / juvenilne ribe.
|
Kontrolne skupine
|
32.
|
Uz ispitne koncentracije potrebno je provesti jednu kontrolnu skupinu s vodom za razrjeđivanje (≥ 4 ponavljanja) i po potrebi jednu kontrolnu skupinu s otapalom. U ispitivanju potrebno je upotrebljavati samo otapala za koja je ispitivanjem utvrđeno da nemaju statistički značajan utjecaj na krajnje učinke ispitivanja.
|
|
33.
|
Ako se upotrebljava otapalo, njegova konačna koncentracija ne bi trebala biti veća od 0,1 ml/l (36) i koncentracija bi trebala biti jednaka u svim ispitnim posudama, osim u slučaju kontrole s vodom za razrjeđivanje. Međutim, potrebno je uložiti sve napore da se izbjegne upotreba takvih otapala ili bi koncentracije otapala trebale biti minimalne.
|
Učestalost analitičkih određivanja i mjerenja
|
34.
|
Kemijsku je analizu koncentracije ispitivane kemikalije potrebno provesti prije početka ispitivanja kako bi se provjerila usklađenost s kriterijima prihvatljivosti. Sva ponavljanja potrebno je analizirati pojedinačno na početku i kraju ispitivanja. Jedno ponavljanje po ispitnoj koncentraciji potrebno je analizirati najmanje jedanput tjedno tijekom ispitivanja uz sustavnu izmjenu ponavljanja (1, 2, 3, 4, 1, 2….). Ako se uzorci pohranjuju za kasniju analizu, metoda pohrane uzoraka trebala bi biti prethodno validirana. Uzorke je potrebno filtrirati (npr. primjenom veličine pora 0,45 μm) ili centrifugirati kako bi se osigurala određivanja kemikalije u pravoj otopini.
|
|
35.
|
Otopljeni kisik, pH-vrijednost, ukupnu tvrdoću, provodljivost, salinitet (po potrebi) i temperaturu potrebno je mjeriti u svim ispitnim posudama tijekom ispitivanja. Otopljeni kisik, salinitet (po potrebi) i temperaturu potrebno je mjeriti najmanje jedanput tjedno, a pH-vrijednost, provodljivost i tvrdoću na početku i na kraju ispitivanja. Temperaturu je po mogućnosti potrebno neprekidno pratiti u najmanje jednoj ispitnoj posudi.
|
|
36.
|
Rezultati bi se trebali temeljiti na izmjerenim koncentracijama. Međutim, ako se koncentracija ispitivane kemikalije u otopini tijekom čitavog ispitivanja na zadovoljavajući način održava u granicama ± 20 % nazivne koncentracije, rezultati se mogu temeljiti na nazivnim ili izmjerenim vrijednostima.
|
Opažanja i mjerenja
Stadij embrionalnog razvoja
|
37.
|
Izlaganje bi trebalo započeti što je prije moguće nakon oplodnje i prije početka cijepanja blastodiska, a najkasnije 12 sati nakon oplodnje kako bi se osiguralo izlaganje tijekom ranog embrionalnog razvoja.
|
Valjenje i preživljavanje
|
38.
|
Valjenje i preživljavanje potrebno je promatrati najmanje jedanput dnevno i relevantne brojke dokumentirati. Mrtve embrije, ličinke i juvenilne ribe potrebno je ukloniti čim ih se uoči jer se mogu brzo raspasti i druge ih ribe svojim aktivnostima mogu raskidati. Kod uklanjanja mrtvih jedinki nužan je krajnji oprez kako bi se izbjegli udarci ili fizičko ozljeđivanje susjednih jajašaca/ličinki, koji su izuzetno nježni i osjetljivi. Kriteriji za utvrđivanje smrti razlikuju se ovisno o životnom stadiju:
|
—
|
za jajašca: posebno u ranim stadijima, vidan gubitak prozirnosti i promjena boje zbog koagulacije i/ili taloženja proteina, što rezultira bjelkasto-mutnim izgledom,
|
|
—
|
za ličinke i juvenilne ribe: nepomičnost i/ili odsutnost pokreta disanja i/ili odsutnost bila i/ili bijela mutna boja središnjeg živčanog sustava i/ili izostanak reakcije na mehaničke podražaje.
|
|
Neuobičajeni izgled
|
39.
|
Potrebno je zabilježiti broj ličinki ili riba u kojih su vidljive nepravilnosti u obliku tijela i opisati izgled i vrstu nepravilnosti. Važno je napomenuti da je pojava abnormalnih embrija i ličinki prirodna i da ih u nekih vrsta u kontroli/kontrolama može biti i više postotaka. Abnormalne životinje potrebno je ukloniti iz ispitnih posuda tek nakon smrti. Međutim, u skladu s Direktivom 2010/63/EU Europskog parlamenta i Vijeća od 22. rujna 2010. o zaštiti životinja koje se koriste u znanstvene svrhe, ako nepravilnosti prouzroče bol, patnju, stres ili trajno oštećenje i ako se smrt može pouzdano predvidjeti, životinje je potrebno anestezirati i usmrtiti kako je opisano u stavku 44. i obraditi kao smrtnost u analizi podataka.
|
Neuobičajeno ponašanje
|
40.
|
Nepravilnosti, npr. hiperventilaciju, nekoordinirano plivanje, atipičnu mirnoću i atipično ponašanje pri hranjenju potrebno je bilježiti kada se pojave.
|
Masa
|
41.
|
Na kraju ispitivanja potrebno je usmrtiti (anestezirati ako je potrebno uzeti uzorke krvi) sve preživjele ribe i izmjeriti pojedinačnu mokru masu riba (osušenih upijajućim materijalom).
|
Dužina
|
42.
|
Na kraju ispitivanja potrebno je izmjeriti pojedinačne dužine (standardne dužine).
|
|
43.
|
Na temelju navedenih opažanja dobit će se svi ili neki od sljedećih podataka koji se upotrebljavaju u izvješćivanju:
|
—
|
broj zdravih riba na kraju ispitivanja,
|
|
—
|
vrijeme do početka valjenja i kraja valjenja,
|
|
—
|
dužina i masa preživjelih životinja,
|
|
—
|
broj deformiranih ličinki,
|
|
—
|
broj riba koje pokazuju neuobičajeno ponašanje.
|
|
Uzorkovanje riba
|
44.
|
Uzorkovanje riba provodi se nakon završetka ispitivanja. Uzorkovanu ribu potrebno je usmrtiti npr. primjenom MS-222 (100 – 500 mg po litri puferirano s 200 mg NaHCO3 po litri) ili FA-100 (4-alil-2-metoksifenol: eugenol) i pojedinačno izmjeriti i izvagati kao mokru masu ribe (osušene upijajućim materijalom) ili anestezirati ako je potrebno uzeti uzorak krvi (vidi stavak 49.).
|
Uzorkovanje za analizu VTG-a i određivanje spola histološkom procjenom
|
45.
|
Sve ribe potrebno je uzorkovati i pripremiti za analizu spola i VTG-a. Sve ribe potrebno je histološki analizirati kako bi im seodredio spol. Za mjerenje VTG-a prihvaća se poduzorkovanje najmanje 16 riba iz svakog ponavljanja. Potrebno je analizirati više riba za VTG ako se rezultati poduzorkovanja pokažu nejasnima.
|
|
46.
|
Postupak uzorkovanja za VTG i određivanje spola ovise o metodi analize VTG-a.
|
Metoda homogenata glave/repa za analizu VTG-a
|
47.
|
Ribe se usmrćuju. Glava i rep svake ribe skalpelom se odvajaju od tijela ribe rezovima neposredno iza prsnih peraja i neposredno iza leđne peraje (vidi sliku 1.). Glava i rep svake ribe ujedinjuju se, važu i pojedinačno označuju brojem, zamrzavaju tekućim dušikom i pohranjuju na – 70 ° ili manje za analizu VTG-a. Tijelo ribe označuje se brojem i fiksira u odgovarajućem fiksativu za histološku procjenu (22). Primjenom ove metode VTG i histopatološka analiza ocjenjuju se za svaku jedinku i stoga se svaka promjena razine VTG-a može povezati s fenotipskim spolom ribe ili genetskim spolom (medaka i koljuška) ribe. Za više informacija vidi smjernicu za homogenizaciju (Dodatak 5.) i smjernicu za kvantifikaciju VTG-a (Dodatak 6.).
|
Metoda homogenata jetre za analizu VTG-a
|
48.
|
Ribe se usmrćuju. Jetra se secira i pohranjuje na ili ispod – 70 °C. Preporučeni su postupci za eksciziju i prethodnu obradu jetre navedeni u Smjernici OECD-a TG 229 (37.) ili poglavlju C.37. ovog Priloga (38). Potom se jetra pojedinačno homogenizira kako je opisano u Smjernici OECD-a TG 229 ili poglavlju C.37. ovog Priloga. Prikupljeni supernatant upotrebljava se za mjerenje VTG-a homolognom ELISA tehnikom (vidi Dodatak 6. za primjer kvantifikacije u slučaju zebrica ili Smjernicu OECD-a TG 229 (37) za medaku). Primjenom tog pristupa moguće je dobiti i podatke o VTG-u i histološkoj analizi spolnih žlijezda za pojedinačne ribe.
|
Metoda krvne plazme za analizu VTG-a
|
49.
|
Krv se prikuplja iz riba pod anestezijom punkcijom srca, iz kaudalne vene ili rezanjem repa i centrifugira na 4 °C za prikupljanje plazme. Plazma se pohranjuje na ili ispod – 70 °C. Sve se ribe usmrćuju i fiksiraju za histološku analizu. Uzorci plazme i ribe pojedinačno se označuju brojevima kako bi se razine VTG-a povezale sa spolom riba.
Slika 1.
Kako rezati ribu za mjerenje VTG-a u homogenatu glave/repa i histološkoj procjeni srednjeg dijela.

|
Određivanje genetskog spola
|
50.
|
Biološki uzorak za određivanje genetskog spola uzima se iz pojedinačnih riba u vrsta koje imaju odgovarajuće markere. U slučaju medake uzima se analna ili leđna peraja. U Dodatku 9. naveden je detaljan opis uključujući uzorkovanje tkiva i određivanje spola metodom PCR-a. Isto tako, u Dodatku 10. opisano je uzorkovanje tkiva i određivanje spola metodom PCR-a za koljušku.
|
Mjerenje VTG-a
|
51.
|
Mjerenje VTG-a trebalo bi se temeljiti na kvantitativnoj i analitički provjerenoj metodi. Informacije bi trebale biti dostupne na temelju varijabilnosti metode upotrijebljene u odgovarajućem laboratoriju unutar testa i između testova. Izvor međulaboratorijske i unutarlaboratorijske varijabilnosti (najvjerojatnije) temelji se na različitim razvojnim stadijima populacije riba. Uzimajući u obzir varijabilnost mjerenja VTG-a, najviše koncentracije bez vidljivog učinka (NOEC) koje se temelje samo na tom krajnjem učinku potrebno je obraditi s velikom pažnjom. Dostupne su različite metode za procjenu proizvodnje VTG-a u ribljim vrstama koje se razmatraju u ovom ispitivanju. Mjerna je tehnika koja je relativno osjetljiva i specifična određivanje koncentracija proteina enzimskim imunosorbentnim testom (ELISA). Trebala bi se upotrebljavati homologna antitijela (na VTG iste vrste) i najvažniji homologni standardi.
|
Određivanje spola
|
52.
|
Ovisno o postupku uzorkovanja VTG-a, cijela se riba ili preostali srednji dio svake ribe stavlja u prethodno označenu kasetu za obradu i fiksira u odgovarajućem fiksativu za histološko određivanje spola (po izboru i za procjenu stadija razvoja spolnih žlijezda). Smjernica za fiksiranje i uklapanje navedena je u Dodatku 7. i Smjernici OECD-a za dijagnozu histopatološke analize spolnih žlijezda riba povezane s endokrinim sustavom (22). Nakon obrade ribe se uklapaju u parafinske blokove. Jedinke se polažu longitudinalno u parafinski blok. Od svake se jedinke uzima najmanje šest longitudinalnih sekcija (debljine 3 – 5 μm) u prednjoj ravnini uključujući tkivo obiju spolnih žlijezda. Razmak između navedenih sekcija trebao bi biti oko 50 μm za mužjake i 250 μm za ženke. Međutim, s obzirom na to da će svaki blok često sadržavati mužjake i ženke (ako je u svaki blok uklopljeno više jedinki), razmak između sekcija iz navedenih blokova trebao bi biti oko 50 μm dok se ne dobije najmanje šest sekcija spolnih žlijezda od svakog mužjaka. Nakon toga razmak između sekcija može se povećati na oko 250 μm za ženke. Sekcije se boje hematoksilinom i eozinom i ispituju svjetlosnom mikroskopijom s fokusom na spol (muški, ženski, međuspol, nediferenciran). Međuspol je definiran kao prisutnost više od jedne jajne stanice u testisu u šest analiziranih sekcija ili spermatogenih stanica (da/ne) u jajnicima. Histopatološka analiza i određivanje stadija jajnika i testisa nisu obvezni, ali ako se ispituju, rezultate je potrebno statistički analizirati i navesti u izvješću. Potrebno je navesti da određene riblje vrste prirodno nemaju potpuno razvijeni par spolnih žlijezda i da može biti prisutna samo jedna spolna žlijezda (to je npr. slučaj u medake i povremeno u zebrice). Sva takva opažanja potrebno je zabilježiti.
|
|
53.
|
Određivanje genetskog spola u pojedinačnih medaki temelji se na prisutnosti ili odsutnosti gena kojim se određuje muški spol medake, DMY, a smješten je na kromosomu Y. Genotipski spol medake može se odrediti sekvenciranjem gena DMY iz DNK-a ekstrahiranog iz, na primjer, komada analne peraje ili prsne peraje. Prisutnost gena DMY ukazuje na jedinku XY (mužjaka) bez obzira na fenotip, dok njegova odsutnost ukazuje na jedinku XX (ženku) bez obzira na fenotip (23). Smjernica za pripremu tkiva i metodu PCR-a navedena je u Dodatku 9. U pojedinačnih se koljuški spol isto tako određuje metodom PCR-a kako je opisano u Dodatku 10.
|
|
54.
|
Pojavu međuspola (definiciju vidi u Dodatku 1.) potrebno je navesti u izvješću.
|
Sekundarna spolna obilježja
|
55.
|
U vrsta kao što je medaka sekundarna spolna obilježja pod kontrolom su endokrinog sustava; stoga je opažanja povezana s fizičkim izgledom riba potrebno po mogućnosti provesti nakon završetka izlaganja. U ženki medake papilarna formacija na stražnjem dijelu analne peraje osjetljiva je na androgen. U poglavlju C.37. ovog Priloga (38) nalaze se relevantne fotografije sekundarnih spolnih obilježja mužjaka i androgeniziranih ženki.
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
56.
|
Važno je da se krajnji učinak odredi najjačim valjanim statističkim ispitivanjem. Ponavljanje je pokusna jedinica, ali u statističko ispitivanje potrebno je uključiti i varijabilnost unutar ponavljanja. Dodatak 8. sadržava dijagram toka odlučivanja kao pomoć pri odabiru najprikladnijeg statističkog ispitivanja na temelju svojstava podataka dobivenih ispitivanjem. Razina statističke značajnosti iznosi 0,05 za sve uključene krajnje učinke.
|
Udjeli spolova i genetski spol
|
57.
|
Udjele spolova trebalo bi analizirati u pogledu značajnog učinka (pristup NOEC/LOEC (najniža koncentracija s vidljivim učinkom)) izlaganja Jonckheere-Terpstrovim testom (testom trendova) ako postoji monotonična reakcija na dozu. Ako se utvrdi nepostojanje monotoničnosti, potrebno je primijeniti test parova. Dunnettov test upotrebljava se ako se mogu postići normalnost i homogena varijanca. Tamhane-Dunnettov test upotrebljava se ako je prisutna heterogena varijanca. U protivnom, upotrebljava se Mann-Whitneyev test s prilagodbom Bonferroni-Holm. Dijagram toka kojim su opisani statistički podaci o udjelima spolova prikazan je u Dodatku 8. Udjele spolova potrebno je u tablicama prikazati kao udjele koncentracija ± standardno odstupanje ženki, mužjaka, međuspolova i nediferenciranih. Potrebno je istaknuti statističku značajnost. Primjeri su prikazani u izvješću o validaciji druge faze ispitivanja spolnog razvoja riba (42). Genetski spol potrebno je navesti kao postotak promjene fenotipskog spola mužjaka, ženki, međuspolova i nediferenciranih.
|
Koncentracije VTG-a
|
58.
|
Koncentracije VTG-a potrebno je analizirati s obzirom na značajan učinak (pristup NOEC/LOEC) izlaganja. Prednost se daje Dunnettovom testu u odnosu na t-test s Bonferronijevom korekcijom. Ako se upotrebljava Bonferronijeva korekcija, prednost se daje Bonferroni-Holmovoj korekciji. Potrebno je predvidjeti logaritamsku transformaciju VTG-a za postizanje normalnosti i homogenosti varijance. Nadalje, ako je reakcija na koncentraciju u skladu s monotoničnošću, prednost se daje Jonckheere-Terpstrovu testu u odnosu na sve prethodno navedene. Ako se upotrebljavaju t-testovi ili Dunnettov test, nema potrebe za značajnim F-testom analize varijance (ANOVA) kako bi se nastavilo dalje. Pojedinosti su prikazane u dijagramu toka u Dodatku 8. Rezultati u tablicama navode se kao srednje vrijednosti koncentracija ± standardno odstupanje posebno za mužjake, ženke, međuspol i nediferencirane. Potrebno je istaknuti statističku značajnost za fenotipske ženke i fenotipske mužjake. Primjeri su prikazani u izvješću o validaciji druge faze ispitivanja spolnog razvoja riba (42).
|
Stvarne koncentracije ispitivane kemikalije
|
59.
|
Stvarne koncentracije ispitivane kemikalije u posudama potrebno je analizirati učestalošću opisanom u stavku 34. Rezultati u tablicama navode se kao srednje vrijednosti koncentracija ± standardno odstupanje na temelju ponavljanja te na temelju koncentracije, pri čemu se ističu informacije o broju uzoraka i netipične vrijednosti iz srednje koncentracije obrade ± 20 %. Primjeri se mogu pronaći u izvješću o validaciji druge faze ispitivanja spolnog razvoja riba (42).
|
Tumačenje rezultata
|
60.
|
Rezultate je potrebno tumačiti s oprezom ako se izmjerene koncentracije ispitivane kemikalije u ispitnim otopinama nalaze u blizini granice detekcije analitičke metode.
|
Izvješće o ispitivanju
|
61.
|
Izvješće o ispitivanju trebalo bi sadržavati sljedeće podatke:
|
|
ispitivanu kemikaliju
|
—
|
relevantna fizikalno-kemijska svojstva, podatke za identifikaciju kemikalije, uključujući podatke o čistoći i analitičkoj metodi za kvantifikaciju ispitivane kemikalije,
|
|
|
|
uvjete ispitivanja
|
—
|
primijenjeni postupak ispitivanja (npr. protočni polustatični / obnavljanje), plan ispitivanja uključujući ispitne koncentracije, način pripreme radnih otopina (u Prilogu), učestalost obnavljanja (ako se primjenjuju, potrebno je navesti otapajuće sredstvo i njegovu koncentraciju),
|
|
—
|
nazivne ispitne koncentracije, srednje izmjerene vrijednosti i njihova standardna odstupanja u ispitnim posudama i metodu kojom su dobivene (upotrijebljena analitička metoda trebala bi biti prikazana u Prilogu), dokaze da se mjerenja odnose na koncentracije ispitivane kemikalije u pravoj otopini,
|
|
—
|
kakvoću vode u ispitnim posudama: pH-vrijednost, tvrdoću, temperaturu i koncentraciju otopljenog kisika,
|
|
—
|
detaljne informacije o hranjenju (npr. vrstu (vrste) hrane, izvor, količinu dane hrane i učestalost hranjenja te po potrebi analize provedene radi utvrđivanja kontaminirajućih tvari (npr. polikloriranih bifenila (PCB), policikličkih aromatskih ugljikovodika (PAH) i organofosfornih pesticida),
|
|
|
|
rezultate
|
—
|
dokaze o usklađenosti kontrola s validacijskim kriterijima: podatke o stopi valjenja u tablicama potrebno je navesti kao postotak po ponavljanju i po koncentraciji. Potrebno je istaknuti netipične vrijednosti u odnosu na kriterije prihvatljivosti (u kontrolama). Preživljavanje je potrebno prikazati kao postotak po ponavljanju i po koncentraciji. Potrebno je istaknuti netipične vrijednosti u odnosu na validacijske kriterije (u kontrolama),
|
|
—
|
jasno navođenje rezultata dobivenih u vezi s različitim opaženim krajnjim učincima: preživljavanje embrija i uspješnost valjenja, vanjske nepravilnosti, dužinu i masu, mjerenja VTG-a (ng/g homogenata, ng/ml plazme ili ng/mg jetre), histološku analizu spolnih žlijezda, omjer spolova, podatke o genetičkom spolu, učestalost svih neuobičajenih reakcija u riba i sve vidljive učinke nastale kao posljedica ispitivane kemikalije.
|
|
|
|
62.
|
Rezultate je potrebno prikazati kao srednje vrijednosti ± standardno odstupanje ili standardna pogreška. Statistički podaci navode se najmanje kao NOEC i LOEC te intervali pouzdanosti. Potrebno je slijediti statistički dijagram toka (Dodatak 8.).
|
LITERATURA
|
(1)
|
OECD (1992.), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Pariz.
|
|
(2)
|
Jobling, S., D. Sheahan, J. A. Osborne, P. Matthiessen i J. P. Sumpter, 1996., ‚Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals’, Environmental Toxicology and Chemistry 15, str. 194. – 202.
|
|
(3)
|
Sumpter, J. P., i S. Jobling, 1995., ‚Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment’, Environmental Health Perspectives 103, str. 173. – 178.
|
|
(4)
|
Tyler, C. R., R. van Aerle, T. H. Hutchinson, S. Maddix i H. Trip (1999.), ‚An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin’, Environmental Toxicology and Chemistry 18, str. 337. – 347.
|
|
(5)
|
Holbech, H., L. Andersen, G. I. Petersen, B. Korsgaard, K. L. Pedersen i P. Bjerregaard (2001.a), ‚Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, str. 119. – 131.
|
|
(6)
|
Andersen, L., P. Bjerregaard i B. Korsgaard (2003.), ‚Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters’, Fish Physiology and Biochemistry 28, str. 319. – 321.
|
|
(7)
|
Orn, S., H. Holbech, T. H. Madsen, L. Norrgren i G. I. Petersen (2003.), ‚Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone’, Aquatic Toxicology 65, str. 397. – 411.
|
|
(8)
|
Panter, G. H., T. H. Hutchinson, R. Lange, C. M. Lye, J. P. Sumpter, M. Zerulla i C. R. Tyler (2002.), ‚Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances’, Environmental Toxicology and Chemistry 21, str. 319. – 326.
|
|
(9)
|
Sun, L. W., J. M. Zha, P. A. Spear i Z. J. Wang (2007.), ‚Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, str. 533. – 541.
|
|
(10)
|
Parks, L. G., A. O. Cheek, N. D. Denslow, S. A. Heppell, J. A. McLachlan, G. A. LeBlanc i C. V.Sullivan (1999.), ‚Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, str. 113. – 125.
|
|
(11)
|
Brion, F., B. M. Nilsen, J. K. Eidem, A. Goksoyr i J. M. Porcher (2002.), ‚Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)’, Environmental Toxicology and Chemistry 21, str. 1699. – 1708.
|
|
(12)
|
Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara i E. Tamiya (2002.), ‚Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, str. 161. – 169.
|
|
(13)
|
Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James i B. E. Bengtsson (2004.), ‚The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption – II – kidney hypertrophy, vitellogenin and spiggin induction’, Aquatic Toxicology 70, str. 311. – 326.
|
|
(14)
|
Tatarazako, N., M. Koshio, H. Hori, M. Morita i T. Iguchi (2004.), ‚Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka’, Journal of Health Science 50, str. 301. – 308.
|
|
(15)
|
Eidem, J. K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Panter, T. Hutchinson i A. Goksoyr (2006.), ‚Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology’, 78, str. 202. – 206.
|
|
(16)
|
Jensen, K. M., i G. T. Ankley (2006.), ‚Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)’, Ecotoxicology and Environmental Safety 64, str. 101. – 105.
|
|
(17)
|
Holbech, H., Petersen, G. I., Norman, A., Örn, S, Norrgren, L., i Bjerregaard, P., (2001.b), ‚Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)’, Nordic Council of Ministers, TemaNord 2001:597, str. 48. – 51.
|
|
(18)
|
Nilsen, B. M., K. Berg, J. K. Eidem, S. I. Kristiansen, F. Brion, J. M. Porcher i A. Goksoyr (2004.), ‚Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening’, Analytical and Bioanalytical Chemistry 378, str. 621. – 633.
|
|
(19)
|
Orn, S., S. Yamani i L. Norrgren (2006.), ‚Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone’, Archives of Environmental Contamination and Toxicology 51, str. 237. – 243.
|
|
(20)
|
Scholz, S., i N. Kluver (2009.), ‚Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish’, Sexual Development 3, str. 136. – 151.
|
|
(21)
|
Fenske, M., G. Maack, C. Schafers i H. Segner (2005.), ‚An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio’, Environmental Toxicology and Chemistry 24, str. 1088. – 1098.
|
|
(22)
|
OECD (2010.), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Pariz.
|
|
(23)
|
Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi, A. Suzuki, N. Saito, M. Nakamoto, N. Shibata i Y. Nagahama (2004.), ‚Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes’, Developmental Dynamics 231, str. 518. – 526.
|
|
(24)
|
Shinomiya, A., H. Otake, K. Togashi, S. Hamaguchi i M. Sakaizumi (2004.), ‚Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations’, Zoological Science 21, str. 613. – 619.
|
|
(25)
|
Kidd, K. A., P. J. Blanchfield, K. H. Mills, V. P. Palace, R. E. Evans, J. M. Lazorchak i R. W. Flick (2007.), ‚Collapse of a fish population after exposure to a synthetic estrogen’, Proceedings of the National Academy of Sciences of the United States of America 104, str. 8897. – 8901.
|
|
(26)
|
Palace, V. P., R. E. Evans, K. G. Wautier, K. H. Mills, P. J. Blanchfield, B. J. Park, C. L. Baron i K. A. Kidd (2009.), ‚Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake’, Canadian Journal of Fisheries and Aquatic Sciences 66, str. 1920. – 1935.
|
|
(27)
|
Panter, G. H., T. H. Hutchinson, K. S. Hurd, J. Bamforth, R. D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno i C. R. Tyler (2006.), ‚Development of chronic tests for endocrine active chemicals – Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)’, Aquatic Toxicology 77, str. 279. – 290.
|
|
(28)
|
Holbech, H., L. Andersen, G. I. Petersen, P. Jackson, K. Hylland, L. Norrgren i P. Bjerregaard (2006.), ‚Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, str. 57. – 66.
|
|
(29)
|
Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard i P. Bjerregaard (2004.), ‚Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)’, Fish Physiology and Biochemistry 30, str. 257. – 266.
|
|
(30)
|
Morthorst, J. E., H. Holbech i P. Bjerregaard (2010.), ‚Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations’, Aquatic Toxicology 98, str. 336. – 343.
|
|
(31)
|
Kiparissis, Y., T. L. Metcalfe, G. C. Balch i C. D. Metcalf (2003.), ‚Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)’, Aquatic Toxicology 63, str. 391. – 403.
|
|
(32)
|
Panter, G. H., T. H. Hutchinson, K. S. Hurd, A. Sherren, R. D. Stanley i C. R. Tyler (2004.), ‚Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development’, Aquatic Toxicology 70, str. 11. – 21.
|
|
(33)
|
Kinnberg, K., H. Holbech, G. I. Petersen i P. Bjerregaard (2007.), ‚Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)’, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, str. 165. – 170.
|
|
(34)
|
Poglavlje C.14. ovog Priloga, Test rasta juvenilnih riba.
|
|
(35)
|
Poglavlje C.4. ovog Priloga, Određivanje ‚lake’ biorazgradivosti.
|
|
(36)
|
OECD (2000.), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OECD, Pariz.
|
|
(37)
|
OECD (2009.), Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OECD, Pariz.
|
|
(38)
|
Poglavlje C.37. ovog Priloga, 21-dnevni test na ribama: Kratkoročni test probira na estrogensku i androgensku aktivnost i inhibiciju aromataze.
|
|
(39)
|
OECD (2012.), Fish Toxicity Testing Framework, Series on Testing and Assessment No. 171, OECD, Pariz.
|
|
(40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H., (2007.), ‚Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio’, Journal of Toxicology and Environmental Health-Part A, 70, 9-10, str. 768. – 779.
|
|
(41)
|
OECD (2011.), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Pariz.
|
|
(42)
|
OECD (2011.), Validation Report (Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Pariz.
|
|
(43)
|
OECD (2011.), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Pariz.
|
|
(44)
|
Direktiva 2010/63/EU Europskog parlamenta i Vijeća od 22. rujna 2010. o zaštiti životinja koje se koriste u znanstvene svrhe. SL L 276, 20.10.2010., str. 33.
|
Dodatak 1.
Pokrate i definicije
Apikalni krajnji učinak
: izaziva učinak na razini populacije.
ASV
: vrijednost zasićenosti kisikom.
Biomarker
: izaziva učinak na razini jedinke.
Kemikalija
: tvar ili smjesa.
Dph
: dana poslije valjenja.
DMY
: gen iz DM-domene specifičan za kromosom Y i potreban za razvoj mužjaka medake.
ELISA
: enzimski imunosorbentni test.
Masa ribe
: mokra masa ribe (osušene upijajućim materijalom).
FSDT
: ispitivanje spolnog razvoja riba.
Os HPG
: os hipotalamus-hipofiza-gonade.
Međuspolna riba
: riba s više od jedne jajne stanice u testisu u šest analiziranih sekcija ili sa spermatogenim stanicama u jajnicima (da/ne).
Masa riba u odnosu na prostor
: mokra masa riba u odnosu na određenu količinu vode.
MOA
: način djelovanja.
RT-PCR
: lančana reakcija polimeraze u reverznoj transkriptazi.
Ispitivana kemikalija
: Bilo koja tvar ili smjesa ispitivana primjenom ove ispitne metode.
Nediferencirana riba
: riba sa spolnim žlijezdama bez raspoznatljivih zametnih stanica.
VTG
: vitelogenin.
Dodatak 2.
Uvjeti pokusa za ispitivanje spolnog razvoja riba (slatkovodne vrste)
|
|
Medaka (Oryzias latipes)
|
Zebrica (Danio rerio)
|
Koljuška (Gasterostreus aculeatus)
|
|
|
Protočno ili polustatično
|
Protočno ili polustatično
|
Protočno ili polustatično
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
|
Fluorescentne žarulje (široki spektar)
|
Fluorescentne žarulje (široki spektar)
|
Fluorescentne žarulje (široki spektar)
|
|
|
10 – 20 μE/m2/s, 540 – 1 080 luksa ili 50 – 100 ft-c (razine u laboratorijskim uvjetima)
|
10 – 20 μE/m2/s, 540 – 1 080 luksa ili 50 – 100 ft-c (razine u laboratorijskim uvjetima)
|
10 – 20 μE/m2/s, 540 – 1 080 luksa ili 50 – 100 ft-c (razine u laboratorijskim uvjetima)
|
|
6.
|
Razdoblje svjetla i tame
|
|
12 – 16 h svjetlo, 8 – 12 h tama
|
12 – 16 h svjetlo, 8 – 12 h tama
|
16 h svjetlo, 8 h tama
|
|
7.
|
Minimalna veličina posude
|
|
Pojedinačne posude trebale bi sadržavati minimalno 7 l volumena vode
|
Pojedinačne posude trebale bi sadržavati minimalno 7 l volumena vode
|
Pojedinačne posude trebale bi sadržavati minimalno 7 l volumena vode
|
|
8.
|
Zamjene volumena ispitnih otopina
|
|
Minimalno pet dnevno
|
Minimalno pet dnevno
|
Minimalno pet dnevno
|
|
9.
|
Starost ispitnih organizama na početku izlaganja
|
|
Svježe oplođena jajašca (stadij rane blastule)
|
Svježe oplođena jajašca (stadij rane blastule)
|
Svježe oplođena jajašca
|
|
10.
|
Broj jajašaca po obradi
|
|
Minimalno 120
|
Minimalno 120
|
Minimalno 120
|
|
|
Minimalno tri (plus prikladne kontrole)
|
Minimalno tri (plus prikladne kontrole)
|
Minimalno tri (plus prikladne kontrole)
|
|
12.
|
Broj ponavljanja po obradi
|
|
Minimalno četiri (osim raspodjele po metodi drugog korijena za kontrole)
|
Minimalno četiri (osim raspodjele po metodi drugog korijena za kontrole)
|
Minimalno četiri (osim raspodjele po metodi drugog korijena za kontrole)
|
|
|
Živa Artemia, smrznuti odrasli slani škampi, pahuljasta hrana itd. Preporučuje se hranjenje dvaput dnevno.
|
Posebna suha hrana, živa Artemia, smrznuti odrasli slani škampi, pahuljasta hrana itd. Preporučuje se hranjenje dvaput dnevno.
|
Živa Artemia, smrznuti odrasli slani škampi, pahuljasta hrana itd. Preporučuje se hranjenje dvaput dnevno.
|
|
|
Bez dozračivanja, osim ako koncentracija otopljenog kisika padne na manje od 60 % zasićenosti
|
Bez dozračivanja, osim ako koncentracija otopljenog kisika padne na manje od 60 % zasićenosti
|
Bez dozračivanja, osim ako koncentracija otopljenog kisika padne na manje od 70 % zasićenosti
|
|
15.
|
Voda za razrjeđivanje
|
|
Čista površina, izvorska ili obrađena voda
|
Čista površina, izvorska ili obrađena voda
|
Čista površina, izvorska ili obrađena voda
|
|
16.
|
Trajanje izlaganja ispitivanoj kemikaliji
|
|
60 dph
|
60 dph
|
60 dph
|
|
17.
|
Biološki krajnji učinci
|
|
Uspješnost valjenja, preživljavanje, makromorfologija, VTG, histološka analiza spolnih žlijezda, genetski spol, omjer spolova
|
Uspješnost valjenja, preživljavanje, makromorfologija, VTG, histološka analiza spolnih žlijezda, omjer spolova
|
Uspješnost valjenja, preživljavanje, makromorfologija, VTG, histološka analiza spolnih žlijezda, omjer spolova
|
|
18.
|
Kriteriji prihvatljivosti ispitivanja za udružena ponavljanja kontrola
|
|
Uspješnost valjenja > 80 %
|
Uspješnost valjenja > 80 %
|
Uspješnost valjenja > 80 %
|
|
Preživljavanje nakon valjenja ≥ 70 %
|
Preživljavanje nakon valjenja ≥ 70 %
|
Preživljavanje nakon valjenja ≥ 70 %
|
|
Rast (mokra masa ribe osušene upijajućim materijalom) > 150 mg
|
Rast (mokra masa ribe osušene upijajućim materijalom) > 75 mg
|
Rast (mokra masa ribe osušene upijajućim materijalom) > 120 mg
|
|
Dužina (standardna dužina) > 20 mm
|
Dužina (standardna dužina) > 14 mm
|
Dužina (standardna dužina) > 20 mm
|
|
Omjer spolova (% mužjaka ili ženki)
30 % – 70 %
|
Omjer spolova (% mužjaka ili ženki) 30 % – 70 %
|
Omjer spolova (% mužjaka ili ženki) 30 % – 70 %
|
Dodatak 3.
Kemijska svojstva prihvatljive vode za razrjeđivanje
|
SASTOJAK
|
KONCENTRACIJA
|
|
Čestice
|
< 20 mg/l
|
|
Ukupni organski ugljik
|
< 2 mg/l
|
|
Neionizirani amonijak
|
< 1 μg/l
|
|
Rezidualni klor
|
< 10 μug/l
|
|
Ukupni organofosforni pesticidi
|
< 50 ng/l
|
|
Ukupni organofosforni pesticidi plus poliklorirani bifenili
|
< 50 ng/l
|
|
Ukupni organski klor
|
< 25 ng/l
|
Dodatak 4.
Iz ispitne metode c.14. / smjernica za ispitne koncentracije
|
Stupac (broj koncentracija između 100 i 10 ili između 10 i 1) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
Dodatak 5.
Smjernica za homogenizaciju glave i repa juvenilne zebrice, debeloglave gavčice, koljuške i medake
Cilj je ovog odjeljka opisati postupke koji prethode kvantifikaciji koncentracije VTG-a. Mogu se primjenjivati i drugi postupci čiji su rezultati usporedivi s kvantifikacijom VTG-a. Određivanje koncentracije VTG-a u krvnoj plazmi ili jetri umjesto u homogenatu glave/repa nije obvezno.
Postupak
|
1.
|
Ribe se anesteziraju i usmrćuju u skladu s opisom ispitivanja.
|
|
2.
|
Glava i rep ribe režu se u skladu s opisom ispitivanja. Važno: sve instrumente za seciranje i ploču za rezanje potrebno je pravilno isprati i očistiti (npr. 96 %-tnim etanolom) između postupanja sa svakom pojedinačnom ribom kako bi se spriječilo ‚onečišćenje VTG-a’ sa ženki ili induciranih mužjaka na neinducirane mužjake.
|
|
3.
|
Zajednička masa glave i repa svake ribe mjeri se s točnošću do miligrama.
|
|
4.
|
Nakon vaganja dijelovi se stavljaju u odgovarajuće cijevi (npr. u Eppendorfovu epruvetu od 1,5 ml) i zamrzavaju na – 80 °C do homogenizacije ili se izravno homogeniziraju na ledu s dvama plastičnim tučcima. (Mogu se primjenjivati i druge metode ako se provode na ledu i ako je rezultat homogena masa.) Važno: cijevi bi trebale biti pravilno označene brojevima tako da se glava i rep ribe mogu povezati s odgovarajućom sekcijom tijela upotrijebljenom za histološku analizu spolnih žlijezda.
|
|
5.
|
Nakon dobivanja homogene mase dodaje se ledeno hladni homogenizacijski pufer
(29) u količini koja odgovara 4 – 10 puta masi tkiva (razrjeđivanje se bilježi). Nastavlja se rad s tučcima dok smjesa ne postane homogena. Važna napomena:
za svaku se ribu upotrebljavaju novi tučci.
|
|
6.
|
Uzorci se stavljaju na led do centrifugiranja na 4 °C i na 50 000 g tijekom 30 minuta.
|
|
7.
|
Pipetom se odmjeravaju količine od 20 do 50 μl (količina se bilježi) supernatanta u najmanje dvije cijevi umakanjem vrha pipete ispod sloja masti na površini i pažljivim usisavanjem supernatanta bez dijelova masti ili peleta.
|
|
8.
|
Cijevi se do upotrebe pohranjuju na – 80 °C.
|
Napomena: homogenizacijski pufer potrebno je upotrijebiti na dan njegove izrade. Tijekom primjene stavlja se na led.
Dodatak 6.
Smjernica za kvantifikaciju vitelogenina iz homogenata glave i repa zebrice (Danio rerio) (izmijenjena u odnosu na Holbech et al., 2001.). Mogu se primjenjivati drugi postupci u kojima se primjenjuju homologna antitijela i drugi standardi
|
1.
|
Mikrotitracijske pločice (certificirani Maxisorp F96, Nunc, Roskilde, Danska), na koje se prethodno nanosi 5 μg/ml antitijela na lipovitelin-IgG zebrice, otapaju se i ispiru tri puta puferom za ispiranje (*).
|
|
2.
|
Standard pročišćenog vitelogenina zebrice (30) serijski se razrjeđuje na 0,2, 0,5, 1, 2, 5, 10 i 20 ng/ml u puferu za razrjeđivanje (**) te se uzorci razrjeđuju najmanje 200 puta (kako bi se spriječio učinak matrice) u puferu za razrjeđivanje i nanose na pločice. Kontrola testa provodi se dva puta. U svaku se jažicu stavlja 150 μl. Standardi se primjenjuju dva puta, a uzorci tri puta. Inkubira se tijekom noći na 4 °C na mućkalici.
|
|
3.
|
Pločice se ispiru pet puta puferom za ispiranje (*).
|
|
4.
|
Peroksidaza hrena (HRP) povezana s dekstranskim lancem (npr. AMDEX A/S, Danska) i konjugirana antitijela razrjeđuju se u puferu za ispiranje; stvarno se razrjeđivanje razlikuje po šarži i starosti. U svaku jažicu stavlja se 150 μl i pločice se inkubiraju sat vremena na sobnoj temperaturi na mućkalici.
|
|
5.
|
Pločice se ispiru pet puta puferom za ispiranje (*) i dno pločica pažljivo se čisti etanolom.
|
|
6.
|
U svaku jažicu stavlja se 150 μl tetrametil benzidina (TMB) plus (***). Pločica se zaštićuje od svjetla aluminijskom folijom i prati se razvoj boje u mućkalici.
|
|
7.
|
Nakon što je potpuno razvijena standardna krivulja, zaustavlja se djelovanje enzima dodavanjem 150 μl 0,2 M H2SO4 u svaku jažicu.
|
|
8.
|
Apsorbancija se mjeri na 450 nm (npr. na čitaču pločica Molecular Devices Thermomax). Podaci se analiziraju povezanim softverom (npr. Softmaxom).
|
|
(*)
|
Pufer za ispiranje:
|
PBS – izvorna otopina (****)
|
500,0
|
ml
|
|
goveđi serumski albumin (BSA)
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
podešavanje pH-vrijednosti na 7,3 i dodavanje millipore H2O do 5 l. Pohranjivanje na 4 °C.
|
|
|
(**)
|
Pufer za razrjeđivanje:
|
PBS – izvorna otopina (****)
|
100,0
|
ml
|
|
BSA
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
podešavanje pH-vrijednosti na 7,3 i dodavanje millipore H2O do 1 l. Pohranjivanje na 4 °C.
|
|
|
(***)
|
TMB plus jest supstrat spreman za upotrebu koji proizvodi KemEnTec (Danska). Osjetljiv je na svjetlo. Pohranjivanje na 4 °C.
|
|
(****)
|
PBS – izvorna otopina
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4
.2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
podešavanje pH-vrijednosti na 6,8 i dodavanje millipore H2O do 2 l. Pohranjivanje na sobnoj temperaturi.
|
|
Dodatak 7.
Smjernica za pripremu sekcija tkiva za određivanje spola i određivanje stadija spolnih žlijezda
Cilj je ovog odjeljka opisati postupke koji prethode histološkoj procjeni sekcija. Mogu se primjenjivati i drugi postupci čiji je rezultat slično određivanje spola i određivanje stadija spolnih žlijezda.
Uz nekoliko iznimaka, navedeni su postupci slični za medaku i zebricu.
Usmrćivanje, obdukcija i fiksiranje tkiva
Ciljevi:
|
1.
|
osigurati humano usmrćivanje riba;
|
|
2.
|
dobiti potrebne tjelesne mase i mjerenja;
|
|
3.
|
ocijeniti sekundarna spolna obilježja;
|
|
4.
|
secirati tkiva za analizu VTG-a;
|
|
5.
|
fiksirati spolne žlijezde.
|
Postupci:
|
1.
|
Ribe je potrebno usmrtiti neposredno prije obdukcije. Stoga, osim ako je na raspolaganju više osoba koje obavljaju seciranje, više riba ne bi trebalo usmrćivati istovremeno.
|
|
2.
|
Riba se mrežicom uklanja iz pokusne posude i u prijenosnom spremniku prenosi u područje za obdukciju.
|
|
3.
|
Riba se stavlja u otopinu za usmrćivanje. Riba se uklanja iz otopine nakon prestanka disanja i nakon prestanka reagiranja na vanjske podražaje.
|
|
4.
|
Određuje se mokra masa ribe.
|
|
5.
|
Za pripremu tkiva za analizu VTG-a riba se može staviti na ploču od prešanog pluta na stolu mikroskopa za seciranje.
|
a.
|
Zebrici se glava reže neposredno iza prsne peraje, a rep se reže neposredno iza leđne peraje.
|
|
b.
|
Medaki se otvara abdomen pažljivim rezom uz središnju trbušnu liniju od prsnog pojasa do točke kranijalno od anusa. Jetra se pažljivo uklanja malim hvataljkama i malim škarama.
|
|
|
6.
|
Uzorci za analizu VTG-a stavljaju se u Eppendorfove epruvete i odmah zamrzavaju tekućim dušikom.
|
|
7.
|
Trupla se sa spolnom žlijezdama stavljaju u prethodno označenu plastičnu kasetu za tkivo koja se prenosi na Davidsonov ili Bouinov fiksativ. Volumen fiksativa trebao bi biti najmanje deset puta približni volumen tkiva. Spremnik fiksativa nježno se protresa pet sekundi kako bi se uklonili mjehurići zraka iz kasete.
|
|
8.
|
|
a.
|
Sva tkiva ostaju u Davidsonovu fiksativu tijekom noći nakon čega se sljedećeg dana premještaju u pojedinačne spremnike s 10 %-tnim neutralnim puferiranim formalinom. Spremnici s kasetama nježno se protresaju pet sekundi kako bi se osiguralo odgovarajuće prodiranje formalina u kasete;
|
|
b.
|
Tkiva ostaju u Bouinovu fiksativu 24 sata nakon čega se premještaju u 70 %-tni etanol.
|
|
Obrada tkiva
Ciljevi:
|
1.
|
Dehidrirati tkivo radi odgovarajućeg prodiranja parafina.
|
|
2.
|
Impregnirati tkivo parafinom radi zadržavanja integriteta tkiva i stvaranja čvrste površine za mikrotomiju.
|
Postupci:
|
3.
|
Označene kasete s tkivima uklanjanju se iz formalina/etanola i stavljaju u košaru (košare) za obradu. Košara za obradu stavlja se u uređaj za obradu tkiva.
|
|
4.
|
Odabire se program obrade.
|
|
5.
|
Nakon što uređaj za obradu tkiva završi ciklus obrade, košaru/košare može se prenijeti u jedinicu za uklapanje.
|
Uklapanje
Cilj:
Pravilno usmjeriti uzorak u očvrsnutom parafinu za mikrotomiju.
Postupci:
|
1.
|
Košara (košare) kaseta uklanja (uklanjaju) se iz uređaja za obradu i uranja (uranjaju) u prednju, parafinom ispunjenu posudu termalne konzole uklopne jedinice ili se kasete prenose u odvojeni parafinski grijač.
|
|
2.
|
Prva kaseta koju treba uklopiti uklanja se iz prednje posude termalne konzole ili parafinskog grijača. Poklopac kasete uklanja se i baca, a oznaka kasete uspoređuje se s evidencijom o životinjama kako bi se prije uklapanja riješila potencijalna odstupanja.
|
|
3.
|
Odabire se kalup za uklapanje odgovarajuće veličine.
|
|
4.
|
Kalup se drži ispod otvora konzole za doziranje i puni otopljenim parafinom.
|
|
5.
|
Uzorak se uklanja iz kasete i stavlja u otopljeni parafin u kalupu. Postupak se ponavlja s četiri do osam uzoraka za svaki kalup s parafinom. Položaj pojedinačnih riba označava se stavljanjem ribe broj 1 pod kutom od 180 stupnjeva u odnosu na ribu broj 2 – 4/8.
|
|
6.
|
Dodatnim se parafinom prekriva uzorak.
|
|
7.
|
Kalup s postoljem kasete stavlja se na rashladnu ploču kriokonzole.
|
|
8.
|
Nakon stvrdnjavanja parafina blok (odnosno stvrdnuti parafin koji sadržava tkiva i postolje kasete) se uklanja iz kalupa.
|
Mikrotomija
Cilj:
Izrezati i postaviti histološke sekcije za bojenje.
Postupci:
|
1.
|
Početna faza mikrotomije nazvana ‚orijentacija’ provodi se kako slijedi:
|
a.
|
Parafinski blok stavlja se na držač mikrotoma.
|
|
b.
|
Držač se pomiče prema naprijed okretanjem kotača mikrotoma i režu se deblje sekcije s parafinske površine bloka dok nož ne dođe do uklopljenih tkiva.
|
|
c.
|
Debljina sekcije na mikrotomu postavljena je između tri i pet mikrona. Držač se pomiče prema naprijed i reže se više sekcija s bloka kako bi se uklonili svi artefakti nastali na izrezanoj površini tkiva tijekom grubog obrezivanja.
|
|
d.
|
Blok se može ukloniti s držača i položiti licem prema dolje na led radi namakanja tkiva.
|
|
|
2.
|
Sljedeća faza mikrotomije jest završno rezanje i postavljanje sekcija tkiva na objektna stakalca. Ti se postupci provode kako slijedi:
|
a.
|
Ako je blok stavljen na led, on se uklanja s leda i postavlja na držač mikrotoma.
|
|
b.
|
Debljina sekcija na mikrotomu postavlja se na tri do pet mikrona i držač se pomiče prema naprijed okretanjem kotača mikrotoma. Sekcije se izrezuju iz bloka sve dok ne nastane ‚traka’ koja sadržava najmanje jednu prihvatljivu sekciju uključujući i spolne žlijezde. (Tijekom rezanja blok se po potrebi može ukloniti iz držača, staviti na led radi namakanja tkiva i zatim ponovno postaviti na držač.)
|
|
c.
|
Sekcije plutaju na površini vode u vodenoj kupelji. Treba pokušati dobiti najmanje jednu sekciju bez nabora i bez zarobljenih mjehurića zraka.
|
|
d.
|
Mikroskopsko stakalce uranja se ispod najbolje sekcije, koja se vadi iz vode s pomoću stakalca. Taj se proces naziva postavljanje sekcije na objektno stakalce.
|
|
e.
|
Pripremaju se po tri sekcije za skup riba. Druga i treća sekcija vade se u razmacima od 50 mikrona nakon prve sekcije. Ako ribe nisu uklopljene sa svojim spolnim žlijezdama na istoj razini rezanja, treba napraviti više sekcija kako bi se osiguralo da se od svake ribe dobije najmanje šest sekcija sa spolnim žlijezdama.
|
|
f.
|
Na objektnom se stakalcu olovkom za označivanje objektnih stakalaca bilježi broj bloka iz kojeg je pripremljen preparat.
|
|
g.
|
Objektno stakalce postavlja se na okvir za bojenje.
|
|
h.
|
Blok se uklanja s držača i postavlja licem prema dolje za pohranu.
|
|
Bojenje, postavljanje pokrovnica i označivanje objektnih stakalaca
Ciljevi:
|
—
|
Obojiti sekcije za histopatološki pregled.
|
|
—
|
Trajno zabrtviti postavljena i obojena tkiva.
|
|
—
|
Trajno odrediti obojene sekcije tako da se omogući potpuna sljedivost.
|
Postupci:
|
1.
|
Bojenje
|
a.
|
Objektna se stakalca prije bojenja suše na zraku tijekom noći.
|
|
b.
|
Sekcije se boje hematoksilin-eozinom.
|
|
|
2.
|
Postavljanje pokrovnica
|
a.
|
Pokrovnice se postavljaju ručno ili automatski.
|
|
b.
|
Objektno stakalce umače se u ksilen ili TissueClear, višak ksilena/TissueCleara nježno se otrese s objektnog stakalca.
|
|
c.
|
Oko 0,1 ml sredstva za pripremu preparata nanosi se blizu kraja objektnog stakalca nasuprot zamrznutom kraju ili na pokrovnicu.
|
|
d.
|
Pokrovnica se naginje pod blagim kutom pri postavljanju na objektno stakalce.
|
|
|
3.
|
Označivanje
|
a.
|
Svaka oznaka na objektnom stakalcu trebala bi sadržavati sljedeće informacije:
|
iii.
|
broj uzorka / broj objektnog stakalca;
|
|
iv.
|
kemikaliju / skupinu obrade;
|
|
|
Dodatak 8.
Statistički dijagram toka za analizu vitelogenina

Statistički dijagram toka za analizu omjera spolova
Dodatak 9.
Smjernica za uzorkovanje tkiva za određivanje genetskog spola i za određivanje genetskog spola metodom PCR-a
Uzorkovanje, priprema i pohrana tkiva prije određivanja genetskog spola metodom PCR-a u medake (pripremio Laboratorij za vodene organizme Bayer CropScience AG-a)
|
1.
|
Finim se škarama reže analna ili leđna peraja svake pojedine ribe i stavlja u cijev napunjenu sa 100 μl pufera za ekstrakciju 1 (pojedinosti o pripremi pufera nalaze se u nastavku). Škare se nakon svake pojedine ribe čiste u laboratorijskoj čaši napunjenoj destiliranim H2O i suše papirnatim ručnikom.
|
|
2.
|
Nakon toga tkivo peraja homogenizira se teflonskim tučkom s mikrocjevčicom kako bi se razložile stanice. Za svaku se cijev upotrebljava novi tučak kako bi se izbjegla bilo kakva kontaminacija. Tučci se tijekom noći stavljaju u 0,5 M NaOH, ispiru pet minuta u destiliranom H2O i pohranjuju u etanolu ili sterilni nakon autoklava do upotrebe.
|
|
3.
|
Tkivo peraja može se pohraniti i bez pufera za ekstrakciju 1 na suhom ledu i zatim na – 80 °C u hladnjaku kako bi se spriječila bilo kakva degeneracija DNK-a. Međutim, ekstrakciju je bolje provesti uz istovremenu ekstrakciju DNK-a (prethodno vidi postupak; uzorci bi se trebali otapati na ledu nakon pohrane na – 80 °C prije dodavanja pufera u cijevi).
|
|
4.
|
Nakon homogenizacije sve se cijevi stavljaju u vodenu kupelj i kuhaju 15 minuta na 100 °C.
|
|
5.
|
Zatim se pipetom u svaku cijev dodaje 100 μl pufera za ekstrakciju 2 (pojedinosti o pripremi pufera nalaze se u nastavku). Uzorci se pohranjuju na sobnoj temperaturi 15 minuta uz povremeno nježno protresanje rukom.
|
|
6.
|
Nakon toga sve se cijevi ponovno stavljaju u vodenu kupelj i kuhaju dodatnih 15 minuta na 100 °C.
|
|
7.
|
Do daljnje se analize cijevi zamrzavaju na – 20 °C.
|
Priprema pufera
PCR-pufer 1:
|
|
500 mg N-lauroilsarkozina (npr. Merck KGaA, Darmstadt, Njemačka)
|
|
|
dodaje se 100 ml destiliranog H2O
|
PCR-pufer 2:
|
|
20 g Chelexa (npr. Biorad, München, Njemačka)
|
|
|
bubrenje u 100 ml destiliranog H2O
|
Određivanje genetskog spola (metodom PCR-a) u medake (pripremili Laboratorij za vodene organizme Bayer CropScience AG-a i Universität Würzburg Biozentrum)
Pripremljene i zamrznute cijevi (opisane u prethodnom odjeljku) otapaju se na ledu. Nakon toga centrifugiraju se primjenom centrifuge za Eppendorfove epruvetice (30 sekundi pri maksimalnoj brzini na sobnoj temperaturi). Za PCR upotrebljava se bistri supernatant odvojen od taloga. Apsolutno se mora izbjeći prijenos bilo kakvih tragova Chelexa (lokaliziranog u talogu) na reakciju PCR jer će to utjecati na djelovanje polimeraze Taq. Supernatant se upotrebljava izravno ili se može pohraniti zamrznut (na – 20 °C) i ponovno otopiti u nekoliko ciklusa bez negativnog učinka na DNK za kasnije analize.
1. Priprema ‚reakcijske smjese’ (25 μl po uzorku):
|
|
Volumen
|
Konačna koncentracija
|
|
Kalup DNK-a
|
0,5 μl – 2 μl
|
|
|
10 x PCR-pufer s MgCl2
|
2,5 μl
|
1 x
|
|
Nukleotidi (svaki dATP, dCTP, dGTP, dTTP)
|
4 μl (5 mM)
|
200 μM
|
|
Uzvodna početnica (10 μM) (vidi u nastavku 3 – 5)
|
0,5 μl
|
200 nM
|
|
Nizvodna početnica (10 μM) (vidi u nastavku 3 – 5)
|
0,5 μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Voda (stupanj čistoće za PCR)
|
do 25 μl
|
|
|
Polimeraza Taq E
|
0,3 μl
|
1,5 U
|
|
10 × PCR-pufer s MgCl2: 670 mM Tris/HCl (pH-vrijednost 8,8 na 25 °C), 160 mM (NH4)2SO4, 25 mM MgCl2, 0,1 Tween 20
|
Za svaki je PCR (vidi u nastavku 3 – 5) potrebna posebna početnica kao nova kombinacija ‚reakcijske smjese’ i odgovarajuće potrebne količine kalupa DNK-a za svaki uzorak (vidi prethodno). Odgovarajući se volumeni pipetama prenose u nove cijevi. Nakon toga sve se cijevi zatvaraju, miješaju (oko deset sekundi) i centrifugiraju (deset sekundi na sobnoj temperaturi). Sada se može pokrenuti odgovarajući program PCR-a. Pored toga, u svakom se programu PCR-a primjenjuju pozitivna kontrola (reprezentativni uzorak DNK-a s poznatim djelovanjem i jasnim rezultatima) i negativna kontrola (1 μl destiliranog H2O).
2. Priprema agaroznog gela (1 %) – tijekom provedbe programa PCR-a:
|
—
|
Otopiti 3 g agaroze u 300 ml 1 × tris-acetatni EDTA pufera (TAE) (1 %-tni agarozni gel).
|
|
—
|
Otopinu je potrebno kuhati u mikrovalnoj peći (oko dvije do tri minute).
|
|
—
|
Topla se otopina prenosi u posebnu kutiju za izradu odljevaka, koja je položena na led.
|
|
—
|
Nakon približno 20 minuta agarozni gel spreman je za upotrebu.
|
|
—
|
Agarozni gel pohranjuje se u pufer TAE do kraja programa PCR-a.
|
3. Program PCR-a za aktin
Cilj je navedene reakcije PCR dokazati da DNK iz uzorka nije oštećen.
|
—
|
Posebna početnica:
|
—
|
‚Mact1(gornji/uzvodni)’ → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
‚Mact2(donji/nizvodni)’ → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Program:
|
—
|
ciklus (35 puta)
|
denaturacija
|
→ 45 sekundi na 95 °C
|
|
prianjanje
|
→ 45 sekundi na 56 °C
|
|
produljenje
|
→ jedna minuta na 68 °C
|
|
|
4. Program PCR-a za gene X i Y
U okviru navedenog programa PCR-a upotrebljavaju se uzorci s netaknutim DNK-om za određivanje gena X i Y. Muški DNK trebao bi pokazivati jednu dvostruku vrpcu, a ženski jednu jednostruku vrpcu (nakon bojenja i gel-elektroforeze). U provedbu ovog programa potrebno je uključiti jednu pozitivnu kontrolu za mužjake (uzorak XY) i jednu za ženke (uzorak XX).
|
—
|
Posebna početnica:
|
—
|
‚PG 17,5’ (gornji/uzvodni) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
‚PG 17.6’ (donji/nizvodni) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Program:
|
—
|
ciklus (40 puta)
|
denaturacija
|
→ 45 sekundi na 95 °C
|
|
prianjanje
|
→ 45 sekundi na 55 °C
|
|
produljenje
|
→ jedna minuta 30 sekundi na 68 °C
|
|
|
5. Program PCR-a za gen Y kao ‚kontrola’ programa PCR-a za gene X i Y
Ovim se programom PCR-a potvrđuju rezultati ‚programa PCR-a za gene X i Y’. ‚Muški uzorci’ trebali bi pokazivati jednu vrpcu, dok ‚ženski uzorci’ ne bi trebali pokazivati ni jednu vrpcu (nakon bojenja i gel-elektroforeze).
|
—
|
Posebna početnica:
|
—
|
‚DMTYa (gornji/uzvodni)’ → GGC CGG GTC CCC GGG TG
|
|
—
|
‚DMTYd (donji/nizvodni)’ → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Program:
|
—
|
ciklus (40 puta)
|
denaturacija
|
→ 45 sekundi na 95 °C
|
|
prianjanje
|
→ 45 sekundi na 56 °C
|
|
produljenje
|
→ jedna minuta na 68 °C
|
|
|
6. Bojenje uzoraka za PCR:
otopina za bojenje:
|
|
1 % natrijeva dodecil sulfata (SDS)
|
U svaku se pojedinačnu cijev pipetom stavlja 1 μl otopine za bojenje.
7. Početak gel-elektroforeze:
|
—
|
Pripremljeni 1 %-tni agarozni gel prenosi se u posudu za gel-elektroforezu koja je napunjena 1 × puferom TAE.
|
|
—
|
Pipetom se prenosi 10 – 15 μl svakog obojenog uzorka za PCR u utor u agaroznom gelu.
|
|
—
|
U zasebni se utor pipetom dodaje i 5 – 15 μl ‚ljestvice’ od 1 kb (Invitrogen).
|
|
—
|
Početak elektroforeze na 200 V.
|
|
—
|
Prestanak nakon 30 – 45 minuta.
|
8. Određivanje vrpci:
|
—
|
Agarozni gel čisti se u destiliranom H2O.
|
|
—
|
Zatim se agarozni gel prenosi u etidijev bromid u trajanju 15 – 30 minuta.
|
|
—
|
Nakon toga potrebno je napraviti sliku agaroznog gela UV lampom.
|
|
—
|
Naposljetku se analiziraju uzorci u odnosu na vrpcu (ili vrpce) iz pozitivne kontrole i ljestvicu.
|
Dodatak 10.
Smjernica za uzorkovanje tkiva za određivanje genetskog spola metodom PCR-a u koljuške
Uzorkovanje tkiva i ekstrakcija DNK-a
DNK se može ekstrahirati primjenom različitih komercijalno dostupnih reagensa te ručnih i automatskih sustava za ekstrakciju. U nastavku je opisan protokol koji se upotrebljava u laboratoriju Cefas Weymouth i po potrebi dodani su alternativni pristupi.
|
1.
|
Sa svake se pojedinačne ribe finim škarama uklanja mali komad tkiva (10 – 20 mg) s dorzolateralnog područja (nakon uklanjanja glave i repa za analizu VTG-a). Tkivo se dodaje u cijev i zatim stavlja izravno u tekući dušik (za pohranu na – 80 °C) ili se cijev puni 70 %-tnim etanolom (za prijevoz i naknadnu pohranu na 4 °C). Nakon svake pojedinačne ribe škare se čiste u 70 %-tnom etanolu i zatim u destiliranoj vodi te suše papirnatim ručnikom.
|
|
2.
|
Etanol se (ako je prisutan) uklanja aspiracijom i tkivo se tijekom noći otapa proteinazom K u 400 μl pufera za razlaganje životinjskog tkiva (ATL) (Qiagen). Alikvot (200 μl) otopine prenosi se u S-blok s 96 jažica (Qiagen) i ekstrahira se DNK u formatu s 96 jažica primjenom pribora Qiagen Universal BioRobot i QIamp Investigator BioRobot. DNK se eluira u 50 μl vode bez DNase i RNase. Ako se za ekstrakciju DNK-a upotrebljavaju čvrsta tkiva (kao što su bodlje ili prsne peraje), može biti potrebno homogenizirati uzorak u puferu za razlaganje uz primjenu instrumenta za razlaganje tkiva FastPrep® ili istovjetnog sustava za razlaganje tkiva.
Kao druga mogućnost,
|
(a)
|
tkivo se otapa tijekom noći proteinazom K u 400 μl pufera za razlaganje G2 (Qiagen) i ekstrahira se DNK iz 200 μl otopine uz primjenu pribora za jednostavno dobivanje DNK-a iz tkiva EZ-1 i pribora EZ-1 biorobot ili minipribora za jednostavno dobivanje DNK-a iz tkiva. DNK se eluira u 50 μl volumena;
|
|
(b)
|
tkiva se obrađuju primjenom reagensa DNAzol. Ukratko, uzorci tkiva razlažu se u 1 ml DNAzola deset minuta u mikrocijevi za centrifugu od 1,5 ml i zatim centrifugiraju na 13 000 o/min pet minuta kako bi se uklonile sve čestice. Razloženi uzorak zatim se prenosi u novu mikrocijev za centrifugu od 1,5 ml koja sadržava 500 μl etanola 100 %-tne molekularne čistoće i potom centrifugira na 13 000 o/min deset minuta kako bi nastao talog DNK-a. Etanol se uklanja i zamjenjuje s 400 μl etanola 70 %-tne molekularne čistoće, provodi se centrifugiranje na 13 000 rpm pet minuta i otapa se pelet DNK-a u 50 μl vode bez DNase i RNase za molekularnu biologiju. Ponovno, ako se upotrebljavaju čvrsta tkiva (prsna peraja), može biti potrebno homogenizirati uzorak u puferu za razlaganje primjenom instrumenta za razlaganje tkiva FastPrep® ili istovjetnog sustava za razlaganje tkiva prije ekstrakcije DNK-a.
|
|
|
3.
|
DNK se pohranjuje na – 20 °C do upotrebe.
|
Važna napomena: obvezno je nošenje rukavica tijekom postupaka.
Analiza lančane reakcije polimerazom (PCR)
Provedene su amplifikacije primjenom 2,5 μl ekstrakta DNK-a u 50 μl reakcijskog volumena uz upotrebu prajmera lokusa Idh (kako je opisano u Peichel et al., 2004. Current Biology 1:1416. – 1424.):
|
uzvodna početnica
|
5' GGG ACG AGC AAG ATT TAT TGG 3'
|
|
nizvodna početnica
|
5' TAT AGT TAG CCA GGA GAT GG 3'
|
Mnogo je dobavljača odgovarajućih reagensa za PCR. Metoda opisana u nastavku trenutačno se primjenjuje u laboratoriju Cefas Weymouth.
1. Priprema ‚reakcijske smjese’ (50 μl po uzorku)
Glavna smjesa priprema se kako slijedi. Smjesu je moguće pripremiti unaprijed i pohraniti zamrznutu na – 20 °C do upotrebe. Treba pripremiti dovoljno glavne smjese za negativnu kontrolu (samo voda za molekularnu biologiju).
|
|
Volumen (koncentracija zaliha) / uzorak
|
Konačna koncentracija
|
|
5 x reakcijski pufer GoTaq®
|
10 μl
|
1 x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nukleotidi (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (25 mM svaki)
|
250 μM svaki
|
|
Uzvodna početnica
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Nizvodna početnica
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Voda za molekularnu biologiju
|
30,75 μl
|
|
|
Polimeraza GoTaq
|
0,25 μl
|
1,25 U
|
|
—
|
Ulijeva se 47,5 μl u označenu cijev za PCR tanke stijenke od 0,5 ml.
|
|
—
|
Dodaje se 2,5 μl pročišćenog DNK-a u prikladno označenu cijev. Postupak se ponavlja za sve uzorke i negativnu kontrolu.
|
|
—
|
Na vrh se nanose dvije kapi mineralnog ulja. Kao druga mogućnost može se upotrijebiti cirkularna termalna kupka sa zagrijanim poklopcem.
|
|
—
|
Uzorci su bili denaturirani u cirkularnoj termalnoj kupki Peltier PTC-225 na 94 ± 2 °C pet minuta nakon čega je slijedilo 39 ciklusa na 94 ± 2 °C jednu minutu, na 55 ± 2 °C jednu minutu, na 72 ± 2 °C jednu minutu i konačno produljenje na 72 ± 2 °C deset minuta.
|
2. Priprema agaroznog gela (2 %)
Tradicionalno se produkti PCR-a razlučuju na 20 % agaroznom gelu koji sadržava etidijev bromid.
Mogu se upotrebljavati i kapilarni sustavi za elektroforezu.
|
—
|
Važu se 2 g agaroze u 100 ml 1 × pufera TAE.
|
|
—
|
Zagrijava se u mikrovalnoj peći (oko 2 – 3 minute) kako bi se otopila agaroza.
|
|
—
|
Dodaju se dvije kapi etidijeva bromida konačne koncentracije od 0,5 μg/ml.
|
|
—
|
Topla otopina prenosi se u opremu za izradu odljevaka od gela.
|
|
—
|
Gel se ostavlja kako bi se stvrdnuo.
|
3. Gel-elektroforeza
|
—
|
Agarozni se gel prenosi u opremu za elektroforezu i uranja u 1 × pufer TAE.
|
|
—
|
Puni se 20 μl svakog uzorka u zasebnu jažicu uz dodavanje markera molekularne mase (DNK ljestvica 100 bp, Promega) u raspoloživu jažicu.
|
|
—
|
Elektroforeza se provodi na 120 V u trajanju 30 – 45 minuta.
|
4. Vizualizacija produkata amplifikacije
Ako je etidijev bromid bio inkorporiran u agarozni gel kako je prethodno opisano, produkti DNK-a vidljivi su pod izvorom UV svjetla. Kao druga mogućnost agarozni gel boji se prekrivanjem gela razrijeđenom otopinom etidijeva bromida (0,5 μg/ml u vodi) 30 minuta prije vizualizacije.
Dodatak 11.
Smjernica za postupak umjetne oplodnje za koljušku
Cilj je ovog odjeljka opisati postupke za dobivanje oplođenih jajašaca koljuške radi njihove upotrebe u ispitivanju spolnog razvoja riba.
Postupci
Dobivanje sperme od mužjaka
|
1.
|
Usmrćuje se mužjak dobre boje iz željene populacije.
|
|
2.
|
Ribi se sa svake strane seciraju testisi. Testisi su uobičajeno jako pigmentirane strukture u obliku štapa koje su jasno vidljive na bočnoj središnjoj liniji tijela. Primjenjuje se bilo koja od metoda navedenih u nastavku.
|
|
3.
|
Finim se škarama počinje od kloake i pravi se rez veličine 1 – 1,5 cm jednim potezom pod kutom od približno 45 stupnjeva.
|
|
4.
|
Skalpelom se pravi mali rez sa strane ribe malo iza zdjelice i odmah ventralno od bočnih pločica.
|
|
5.
|
Testisi se uklanjaju finim hvataljkama i stavljaju u Petrijevu zdjelicu.
|
|
6.
|
Svaki se testis prekriva sa 100 μl svježe pripremljene Hankove konačne otopine
(31).
|
|
7.
|
Testisi se britvicom ili skalpelom usitnjavaju. Time se oslobađa sperma te Hankova otopina poprima mliječni izgled.
|
|
8.
|
Tekućina koja sadržava spermu dodaje se u cijev uz istovremeno izbjegavanje dodavanja dijelova tkiva testisa prilikom prijenosa pipetom.
|
|
9.
|
800 μl Hankove konačne otopine dodaje se u cijev i dobro miješa.
|
|
10.
|
Po potrebi se mužjak može konzervirati fiksiranjem u 100 %-tnom etanolu ili drugom željenom fiksativu. To je osobito važno ako se u studiji određuje roditeljsko podrijetlo potomaka.
|
Važna napomena:
iako se većinu radnih otopina može pripremiti unaprijed,
radnu otopinu 5
i kasnije
konačnu otopinu
potrebno je pripremiti
svježe
na dan upotrebe.
|
Radna otopina 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Destilirana voda
|
100 ml
|
|
Radna otopina 2
|
|
Na2HPO4 (anhidridni)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
Destilirana voda
|
100 ml
|
|
Radna otopina 3
|
|
CaCl2
|
0,72 g
|
|
Destilirana voda
|
50 ml
|
|
Radna otopina 4
|
|
MgSO4 7H2O
|
1,23 g
|
|
Destilirana voda
|
50 ml
|
|
Radna otopina 5 (svježe pripremljena)
|
|
NaHCO3
|
0,35 g
|
|
Destilirana voda
|
10 ml
|
Napomena: ako su neke od prethodno navedenih soli već na raspolaganju, ali s različitim sadržajem vode (npr. 2H2O umjesto anhidridnog), mogu se upotrijebiti, ali prvo se prilagođava masa na temelju molekularne mase.
Za Hankovu se konačnu otopinu kombiniraju sastojci sljedećim redoslijedom:
|
radna otopina 1
|
1,0 ml
|
|
radna otopina 2
|
0,1 ml
|
|
radna otopina 3
|
0,1 ml
|
|
destilirana voda
|
8,6 ml
|
|
radna otopina 4
|
0,1 ml
|
|
radna otopina 5
|
0,1 ml.
|
Dobro se promiješa prije upotrebe.
Oplodnja
|
1.
|
U željenoj se populaciji identificiraju velike, gravidne ženke; ženke su spremne za istiskivanje tek kada su vidljiva jajašca isturena iz kloake. Spremne ženke imaju karakterističan položaj s ‚uzdignutom glavom’.
|
|
2.
|
Prstom ili palcem nježno se prelazi niz bočnu stranu ribe prema repu kako bi se potaknulo izbacivanje vrećice s jajašcima u Petrijevu zdjelicu. Postupak se ponavlja s druge strane i zatim se riba vraća u akvarij.
|
|
3.
|
Jajašca se mogu raširiti (tako da čine jedan sloj) finim kistom. Važno je pokušati što je moguće više jajašaca izložiti spermi tako da je korisno maksimalno povećati površinu jajašaca. Važna napomena: jajašca je potrebno održavati vlažnima tako da se oko njih položi vlažni papirnati ručnik (važno je da jajašca ne dodiruju vodu izravno jer to može dovesti do prijevremenog stvrdnjavanja koriona i sprečavanja oplodnje). Velika je razlika u broju jajašaca koje svaka ženka može proizvesti, ali u prosjeku od pojedinačne gravidne ženke trebalo bi se lako dobiti oko 150 jajašaca.
|
|
4.
|
Kistom se 25 μl sperme u Hankovoj smjesi ravnomjerno raspoređuje preko cijele površine jajašaca. Jajašca će se brzo stvrdnuti i promijeniti boju (u roku od jedne minute) nakon početka oplodnje. Ako je procijenjeni broj jajašaca veći od 150, postupak se ponavlja. Slično tome, ako se jajašca ne stvrdnu u roku od jedne minute, dodaje se još sperme. Važna napomena: dodavanjem sperme na poboljšava se nužno stopa oplodnje.
|
|
5.
|
Jajašca i otopina sa spermom ostavljaju se najmanje 15 minuta radi ‚interakcije’, a oplođena jajašca potrebno je staviti u akvarije za izlaganje u roku od 1,5 sati nakon oplodnje.
|
|
6.
|
Postupak se ponavlja s drugom ženkom dok se ne prikupi željeni broj jajašaca.
|
|
7.
|
Iz prethodne se šarže zadržava nekoliko jajašaca i fiksira u 10 %-tnoj octenoj kiselini.
|
Brojanje i raspoređivanje jajašaca u ispitnim akvarijima
|
1.
|
Jajašca se ravnomjerno raspoređuju između svake razine obrade kako bi se izbjeglo utjecanje na odabir genetskog materijala. Svaku je šaržu oplođenih jajašaca potrebno tupim instrumentom (npr. širokim entomološkim hvataljkama ili uporabom inokulacijske petlje) razdvojiti u skupine jednake veličine (čiji broj odgovara broju razina obrade). Ako je cilj četiri ponavljanja po obradi, za 20 jajašaca u svakom ponavljanju treba distribuirati 80 jajašaca po akvariju za izlaganje. Važna napomena: preporučuje se dodatnih 20 % (odnosno 96 jajašaca po razini obrade) dok nije sigurno da je postignuta 100 %-tna stopa oplodnje.
|
|
2.
|
Jajašca koljuške vrlo su sklona gljivičnim infekcijama izvan gnijezda koje čuva otac. U tom pogledu od kritične je važnosti sva jajašca tretirati metilenskim modrilom tijekom prvih pet dana ispitivanja. Radna se otopina metilenskog modrila priprema u koncentraciji 1 mg/ml i dodaje akvarijima za izlaganje kako bi se dobila maksimalna konačna koncentracija od 2,125 mg/l. Važna napomena: koljuške ne bi trebalo izlagati metilenskom modrilu nakon valjenja pa bi sustav do šestog dana trebao biti bez metilenskog modrila.
|
|
3.
|
Jajašca se pregledava svakodnevno i bilježe se sva mrtva ili neoplođena jajašca kao takva. Važna napomena: jajašca nikada ne bi smjela biti izvan vode do valjenja, čak ni u vrlo kratkim razdobljima.
|
C.42. BIORAZGRADIVOST U MORSKOJ VODI
OPĆI UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 306 (1992.). U vrijeme izrade izvornih ispitnih metoda nije bilo poznato u kojoj se mjeri rezultati testova pretraživanja na laku biorazgradivost u kojima su se primjenjivali slatka voda i izlazne otpadne vode ili aktivni mulj kao inokulum mogu primjenjivati na morski okoliš. U tom pogledu zabilježeni su različiti rezultati (npr. (1)).
|
|
2.
|
Brojne industrijske otpadne vode, koje sadržavaju različite kemikalije, dolaze u more izravnim ispuštanjem ili preko ušća i rijeka u kojima je vrijeme zadržavanja kratko u odnosu na razdoblje potrebno za potpunu biorazgradnju mnogih prisutnih kemikalija. Zbog sve veće svijesti o potrebi zaštite morskog okoliša od sve većeg opterećenja kemikalijama i potrebi da se procijeni vjerojatna koncentracija kemikalija u moru, razvijene su ispitne metode za biorazgradivost u morskoj vodi.
|
|
3.
|
U ovdje opisanim metodama upotrebljava se morska voda kao vodena faza i kao izvor mikroorganizama. U nastojanju da se postigne usklađenost s metodama za laku biorazgradivost u svježoj vodi, provedena su istraživanja ultrafiltrirane i centrifugirane morske vode te primjene morskih sedimenata kao inokuluma. Ta su istraživanja bila neuspješna. Stoga je ispitni medij prirodna morska voda koja je prethodno obrađena kako bi se uklonile grube čestice.
|
|
4.
|
Za ocjenu konačne biorazgradivosti metodom protresanja u tikvici moraju se upotrijebiti relativno visoke koncentracije ispitivane tvari zbog slabe osjetljivosti analitičke metode otopljenog organskog ugljika (DOC). Zbog toga je pak potrebno morskoj vodi dodati mineralne nutrijente (N i P) jer bi u protivnome njihovim niskim koncentracijama bilo ograničeno uklanjanje DOC-a. Nutrijente je potrebno dodati i u metodi zatvorenih boca zbog koncentracije dodane ispitivane tvari.
|
|
5.
|
Stoga metode nisu ispitivanja na laku biorazgradivost jer se mikroorganizmima koji su već prisutni u morskoj vodi ne dodaje inokulum. Ispitivanjima se isto tako ne simulira morski okoliš jer se dodaju nutrijenti i jer je koncentracija ispitivane tvari puno viša nego što bi bila u moru. Zbog navedenih su razloga metode predložene u okviru novog pododjeljka ‚Biorazgradivost u morskoj vodi’.
|
PRIMJENA
|
6.
|
Rezultatima ispitivanja, koji bi se primjenjivali jer se modelom upotrebe i odlaganja predmetne tvari ukazuje na put do mora, ostavlja se prvi dojam biorazgradivosti u morskoj vodi. Ako je rezultat pozitivan (> 70 % uklanjanja DOC-a, > 60 % teoretske potrošnje kisika (TPK)), može se zaključiti da postoji potencijal za biorazgradnju u morskom okolišu. Međutim, negativnim se rezultatom ne isključuje takav potencijal, već ukazuje na to da su potrebne daljnje studije, na primjer uz primjenu što je moguće niže koncentracije ispitivane tvari.
|
|
7.
|
U svakom slučaju, ako je za brzinu ili stupanj biorazgradnje u morskoj vodi na određenom mjestu potrebna točnija vrijednost, morat će se primijeniti druge, složenije i sofisticiranije, a time i skuplje metode. Na primjer, mogao bi se primijeniti simulacijski test u kojem se primjenjuje koncentracija ispitivane tvari bliža vjerojatnoj koncentraciji u okolišu. Nadalje, mogla bi se upotrijebiti morska voda koja nije ojačana i prethodno obrađena i koja je uzeta s lokacije od interesa te bi se specifičnom kemijskom analizom mogla pratiti primarna biorazgradnja. Za konačnu biorazgradivost bile bi potrebne tvari označene s pomoću14C kako bi se mogle izmjeriti brzine nestanka topljivog organskog14C i proizvodnje14CO2 u realnim koncentracijama u okolišu.
|
ODABIR METODA
|
8.
|
Odabir metode ovisi o brojnim čimbenicima, a sljedeća tablica služi kao pomoć pri odabiru. Iako se tvari čija je topljivost u vodi manja od ekvivalenta 5 mg C/l ne mogu ispitivati metodom protresanja u tikvici, slabo se topljive tvari u načelu mogu ispitivati barem metodom zatvorenih boca.
Tablica
prednosti i nedostaci testa protresanjem u tikvici i testa za zatvorenim bocama.
|
METODA
|
PREDNOSTI
|
NEDOSTACI
|
|
PROTRESANJE U TIKVICI
|
|
—
|
jednostavna aparatura, osim analizatora ugljika
|
|
—
|
trajanje od 60 dana nije problem
|
|
—
|
bez interferencije nitrifikacije
|
|
—
|
može se prilagoditi za hlapljive tvari
|
|
|
—
|
potreban je analizator ugljika
|
|
—
|
upotreba 5 – 40 mg DOC-a/1, može imati inhibitorni učinak
|
|
—
|
DOC se teško određuje na niskim koncentracijama u morskoj vodi (učinak klorida)
|
|
—
|
DOC je ponekad visok u morskoj vodi
|
|
|
ZATVORENE BOCE
|
|
—
|
jednostavno završno određivanje
|
|
—
|
primjenjuje se niska koncentracija ispitivane tvari (2 mg/l) te se time smanjuje mogućnost inhibicije
|
|
—
|
jednostavna prilagodba za hlapljive tvari
|
|
|
—
|
može biti teško održavati zrakonepropusnost boca
|
|
—
|
rast bakterija na stijenkama može dovesti do lažnih vrijednosti
|
|
—
|
vrijednosti potrošnje O2 u slijepim probama mogu biti visoke, osobito nakon 28 dana; može se nadvladati starenjem morske vode
|
|
—
|
moguća interferencija potrošnje O2 zbog nitrifikacije
|
|
|
METODA PROTRESANJEM U TIKVICI
UVOD
|
1.
|
Ova je metoda varijanta izmijenjenog testa pretraživanja OECD-a za morsku vodu opisanog u poglavlju C.4.B ovog Priloga (2). Dovršena je kao rezultat međulaboratorijskog ispitivanja koje je za Europsku komisiju (EK) organizirao Danski institut za kakvoću vode (3).
|
|
2.
|
Kao i kod prateće metode zatvorenih boca za morski okoliš, rezultate ispitivanja ne treba smatrati pokazateljima lake biorazgradivosti, već ih je potrebno primjenjivati isključivo za dobivanje informacija o biorazgradivosti tvari u morskim okolišima.
|
NAČELO METODE
|
3.
|
Unaprijed utvrđena količina ispitivane tvari otapa se u ispitnom mediju kako bi se dobila koncentracija od 5 – 40 mg otopljenog organskog ugljika (DOC)/l. Ako se poboljšaju granice osjetljivosti analiza organskog ugljika, primjena nižih koncentracija ispitivane tvari može biti korisna, osobito za tvari s inhibitornim učincima. Otopina ispitivane tvari u ispitnom mediju inkubira se uz protresanje u mraku ili pod difuznom rasvjetom u aerobnim uvjetima na fiksnoj temperaturi (koja se održava unutar ± 2 °C) koja je uobičajeno u rasponu od 15- do 20 °C. U slučajevima u kojima je cilj studije simulacija situacija u okolišu, ispitivanja se mogu provesti izvan uobičajenog temperaturnog područja. Preporučeno je maksimalno trajanje ispitivanja oko 60 dana. Nakon razgradnje slijede mjerenja DOC-a (konačna razgradnja), a u nekim slučajevima i specifična analiza (primarna razgradnja).
|
INFORMACIJE O ISPITIVANOJ TVARI
|
4.
|
Kako bi se utvrdilo može li se ispitivanje primijeniti na određenu tvar, moraju biti poznata neka od njezinih svojstava. Mora se utvrditi sadržaj organskog ugljika tvari, njezina hlapljivost mora biti takva da ne dolazi do znatnih gubitaka tijekom ispitivanja i njezina topljivost u vodi trebala bi biti veća od ekvivalenta 25 – 40 mg C/l. Isto tako, ispitivana tvar ne bi se trebala znatno adsorbirati na staklene površine. Za tumačenje dobivenih rezultata potrebne su informacije o čistoći ili relativnim udjelima glavnih sastojaka ispitivane tvari, osobito ako su vrijednosti blizu razine prolaznosti.
|
|
5.
|
Informacije o toksičnosti ispitivane tvari za bakterije, na primjer dobivene mjerenjima u kratkoročnim testovima stope disanja (4), mogu biti korisne za odabir odgovarajućih ispitnih koncentracija te mogu biti ključne za ispravno tumačenje niskih vrijednosti biorazgradnje. Međutim, takve informacije nisu uvijek dovoljne za tumačenje rezultata dobivenih ispitivanjem biorazgradnje te je postupak opisan u stavku 18. prikladniji.
|
REFERENTNE TVARI
|
6.
|
Moraju se primijeniti prikladne referentne tvari za provjeru djelovanja mikroba u uzorku morske vode. Natrijev benzoat, natrijev acetat i anilin primjeri su tvari koje se mogu primijeniti u tu svrhu. Referentne tvari moraju se razgraditi u razumno kratkom roku, a u protivnome preporučuje se ponavljanje ispitivanja uz upotrebu drugog uzorka morske vode.
|
|
7.
|
U međulaboratorijskom su ispitivanju za EK, u kojem su se uzorci morske vode uzimali na različitim lokacijama i u različito doba godine (3), eksponencijalna faza razvoja (tL) i vrijeme potrebno za postizanje 50 %-tne razgradnje (t50), isključujući eksponencijalnu fazu razvoja, iznosili od jednog do četiri dana, odnosno od jednog do sedam dana za natrijev benzoat. Za anilin je tL bio u rasponu od nula do deset dana, a t50 od jednog do deset dana.
|
MJERNA OBNOVLJIVOST I OSJETLJIVOST METODE
|
8.
|
Mjerna obnovljivost metode utvrđena je međulaboratorijskim ispitivanjem (3). Najniža koncentracija ispitivane tvari za koju se ova metoda može primijeniti s analizom DOC-a u velikoj je mjeri određena granicom detekcije analize organskog ugljika (trenutačno oko 0,5 mg C/l) i koncentracijom otopljenog organskog ugljika u upotrijebljenoj morskoj vodi (obično 3 – 5 mg/l za vodu s otvorenog mora). Pozadinska koncentracija DOC-a ne bi trebala prelaziti oko 20 % ukupne koncentracije DOC-a nakon dodavanja ispitivane tvari. Ako to nije izvedivo, pozadinsku koncentraciju DOC-a ponekad je moguće smanjiti starenjem morske vode prije ispitivanja. Ako se metoda primjenjuje samo sa specifičnom kemijskom analizom (kojom se mjeri primarna razgradnja), ispitivač mora navođenjem dodatnih informacija dokumentirati može li se očekivati konačna razgradivost. Navedene se dodatne informacije mogu sastojati od rezultata drugih ispitivanja na laku ili svojstvenu biorazgradivost.
|
OPIS METODE
Aparatura
|
9.
|
Uobičajena laboratorijska aparatura i:
|
a.
|
tresilica s automatskom regulacijom temperature ili smještena u prostoriji s konstantnom temperaturom od 15- do 20 °C koja se održava unutar ± 2 °C za Erlenmeyerove tikvice od 0,5 do 2 litre;
|
|
b.
|
Erlenmeyerove tikvice uskog vrata od 0,5 do 2 litre;
|
|
c.
|
aparatura za membransku filtraciju ili centrifuga;
|
|
d.
|
membranski filtri, 0,2–0,45 μm;
|
|
f.
|
oprema za specifičnu analizu (po izboru).
|
|
Morska voda
|
10.
|
Uzorak morske vode uzima se temeljito očišćenim spremnikom i prenosi u laboratorij, po mogućnosti u roku od jednog ili dva dana od skupljanja. Tijekom prijenosa temperatura uzorka ne smije znatno prijeći temperaturu koja će se primjenjivati tijekom ispitivanja. Lokacija uzorkovanja precizno se određuje i opisuje s obzirom na status u pogledu onečišćenja i nutrijenata. Posebno se za obalne vode u navedeni opis uključuje i broj heterotrofnih kolonija mikroba i određivanje koncentracija otopljenog nitrata, amonijaka i fosfata.
|
|
11.
|
O samom uzorku morske vode navode se sljedeće informacije:
|
—
|
izgled uzorka, zamućenost itd.,
|
|
—
|
temperatura u trenutku skupljanja,
|
|
—
|
vrijeme između skupljanja i upotrebe u ispitivanju.
|
|
|
12.
|
Ako se utvrdi da je sadržaj DOC-a u uzorku morske vode visok (stavak 8.), preporučuje se starenje morske vode u trajanju od približno tjedan dana prije upotrebe. Starenje vode provodi se u aerobnim uvjetima na sobnoj temperaturi u mraku ili pod difuznom rasvjetom. Aerobni uvjeti po potrebi se održavaju blagim dozračivanjem. Tijekom starenja smanjuje se sadržaj lako razgradivog organskog materijala. Međulaboratorijskim ispitivanjem (3) nije utvrđena nikakva razlika između potencijala razgradnje uzoraka starije i svježe skupljene morske vode. Prije upotrebe morska voda prethodno se obrađuje kako bi se uklonile grube čestice, npr. filtracijom kroz najlonski filtar ili grubi papirni filtar (ne kroz membranski filtar ili GF-C filtar) ili taloženjem i pretakanjem. Primijenjeni se postupak mora zabilježiti. Prethodna se obrada provodi nakon starenja ako je provedeno.
|
Radne otopine za mineralne nutrijente
|
13.
|
Pripremaju se sljedeće radne otopine s analitički čistim reagensima:
|
(a)
|
Kalijev dihidrogen fosfat, KH2PO4
|
8,50 g
|
|
Dikalijev hidrogen ortofosfat, K2HPO4
|
21,75 g
|
|
Dinatrijev hidrogen ortofosfat dihidrat, Na2HPO4 · 2H2O
|
33,30 g
|
|
Amonijev klorid, NH4Cl
|
0,50 g
|
|
Otapa se i miješa do jedne litre s destiliranom vodom.
|
|
|
(b)
|
Kalcijev klorid, CaCl2
|
27,50 g
|
|
Otapa se i miješa do jedne litre s destiliranom vodom.
|
|
|
(c)
|
Magnezijev sulfat heptahidrat, MgSO4 · 7H2O
|
22,50 g
|
|
Otapa se i miješa do jedne litre s destiliranom vodom.
|
|
|
(d)
|
Željezov (III) klorid heksahidrat, FeCl3 · 6H2O
|
0,25 g
|
|
Otapa se i miješa do jedne litre s destiliranom vodom.
|
|
Taloženje u otopini (d) može se spriječiti dodavanjem jedne kapi koncentriranog HCl ili 0,4 g etilendiamintetraoctene kiseline (EDTA-e, dinatrijeve soli) po litri. Ako se u radnoj otopini stvori talog, treba je zamijeniti svježe pripremljenom otopinom.
|
Priprema ispitnog medija
|
14.
|
Dodaje se 1 ml svake od prethodno navedenih radnih otopina po litri prethodno obrađene morske vode.
|
Inokulum
|
15.
|
Mikroorganizmima koji su već prisutni u morskoj vodi ne dodaje se specifični inokulum. Određuje se (po izboru) broj heterotrofa koji tvore kolonije u ispitnom mediju morske vode (po mogućnosti i u izvornim uzorcima morske vode), npr. određivanjem broja na pojedinačnim pločicama primjenom morskog agara. To je osobito poželjno kod uzoraka s obalnih ili onečišćenih mjesta. Provjerava se djelovanje heterotrofnih mikroba u morskoj vodi provedbom ispitivanja s referentnom tvari.
|
Priprema tikvica
|
16.
|
Treba osigurati da je sva staklena oprema temeljito očišćena, ali ne nužno sterilna (npr. da je očišćena alkoholnom klorovodičnom kiselinom) te da je isprana i osušena prije upotrebe kako bi se izbjegla kontaminacija ostacima iz prethodnih ispitivanja. Tikvice isto tako moraju biti očišćene prije prve upotrebe.
|
|
17.
|
Ispitivana tvar ocjenjuje se u dvjema paralelnim tikvicama istovremeno zajedno s jednom tikvicom za referentnu tvar. Za određivanje analitičkih slijepih proba dva se puta paralelno provodi slijepa proba bez ispitivane i referentne tvari. Ispitivana tvar otapa se u ispitnom mediju, koji se prikladno mogu dodati s pomoću koncentrirane radne otopine, kako bi se dobile željene početne koncentracije, uobičajeno 5 – 40 mg DOC/l. Referentna tvar uobičajeno se ispituje pri početnoj koncentraciji koja odgovara 20 mg DOC/l. Ako se upotrebljavaju radne otopine ispitivane i/ili referentne tvari, treba osigurati da ne dođe do velike promjene saliniteta morske vode.
|
|
18.
|
Ako se mogu očekivati ili se ne mogu isključiti toksični učinci, savjetuje se da se u plan ispitivanja uključi dvostruka paralelna provedba pokusa inhibicije. Ispitivana i referentna tvar dodaju se u istu posudu, pri čemu je koncentracija referentne tvari uobičajeno jednaka kao u kontrolnom ispitivanju (odnosno 20 mg DOC/l) kako bi se omogućila usporedba.
|
|
19.
|
U Erlenmeyerove tikvice odmjeravaju se odgovarajuće količine ispitnih otopina (praktična je količina do približno polovice volumena tikvice), nakon čega se svaka tikvica prekriva (npr. aluminijskom folijom) tako da se omogući izmjena plinova iz tikvice i okolnog zraka. (Čepovi od vate nisu prikladni ako se primjenjuje analiza DOC-a). Posude se stavljaju u mućkalicu i neprekidno protresaju blagom brzinom (npr. 100 o/min) tijekom čitavog ispitivanja. Temperatura se održava (15 – 20 °C i unutar ± 2 °C), a posude se zaštićuju od svjetla kako bi se spriječio rast algi. Treba osigurati da u zraku nema toksičnih materijala.
|
Fizikalno-kemijsko kontrolno ispitivanje (po izboru)
|
20.
|
Ako se sumnja u abiotičku razgradnju ili mehanizme gubitaka, kao što su hidroliza (problem samo sa specifičnom analizom), hlapljenje ili adsorpcija, savjetuje se provedba fizikalno-kemijskoga kontrolnog pokusa. On se može provesti dodavanjem živina (II) klorida (HgCl2) (32) (50–100 mg/l) posudama s ispitivanom tvari kako bi se prekinulo djelovanje mikroba. Znatnim smanjenjem koncentracije DOC-a ili specifične tvari u fizikalno-kemijskom kontrolnom ispitivanju ukazuje se na abiotičke mehanizme uklanjanja. (Ako se upotrebljava živin klorid, potrebno je obratiti pozornost na interferencije ili trovanje katalizatora u analizi DOC-a.)
|
Broj tikvica
|
21.
|
U tipičnom ispitivanju upotrebljavaju se sljedeće tikvice:
|
tikvice 1 i 2
|
sadržavaju ispitivanu tvar (ispitna suspenzija),
|
|
tikvice 3 i 4
|
sadržavaju samo morsku vodu (slijepa proba),
|
|
tikvica 5
|
sadržava referentnu tvar (kontrola postupka),
|
|
tikvica 6
|
sadržava ispitivanu i referentnu tvar (kontrola toksičnosti) – po izboru,
|
|
tikvica 7
|
sadržava ispitivanu tvar i sredstvo za sterilizaciju (abiotička sterilna kontrola) – po izboru.
|
|
Analiza DOC-a
|
22.
|
Tijekom ispitivanja uzorci se u prikladnim intervalima uzimaju za analizu DOC-a (Dodatak 1.). Uzorci se uvijek uzimaju na početku ispitivanja (0. dan) i zatim 60. dana. Za opis vremenskog tijeka razgradnje ukupno je potrebno minimalno pet uzoraka. Budući da brzina biorazgradnje varira, nije moguće navesti fiksan vremenski raspored uzorkovanja. DOC se određuje dva puta paralelno na svakom uzorku.
|
Uzorkovanje
|
23.
|
Potreban volumen uzoraka ovisi o analitičkoj metodi (specifična analiza), upotrijebljenom analizatoru ugljika i odabranom postupku (membranska filtracija ili centrifugiranje) za obradu uzorka prije određivanja ugljika (stavci 25. i 26.). Prije uzorkovanja potrebno je osigurati da je ispitni medij dobro promiješan i da je sav materijal koji se prilijepi na stijenke otopljen ili suspendiran.
|
|
24.
|
Membranska filtracija ili centrifugiranje provodi se odmah nakon uzorkovanja. Filtrirani ili centrifugirani uzorci po potrebi se pohranjuju na 2 – 4 °C do 48 sati ili ispod – 18 °C ako je riječ o duljim razdobljima (ako je poznato da to neće imati učinka na tvar, ona se acidifira na pH-vrijednost 2 prije pohranjivanja).
|
|
25.
|
Prikladni su membranski filtri (0,2 – 0,45 μm) koji ne otpuštaju ugljik i ne adsorbiraju tvar tijekom filtracije, npr. polikarbonatni membranski filtri. Neki su membranski filtri impregnirani surfaktantima radi hidrofilizacije i mogu otpuštati znatne količine otopljenog ugljika. Takvi se filtri pripremaju kuhanjem u deioniziranoj vodi tijekom triju uzastopnih jednosatnih razdoblja. Filtri se nakon kuhanja pohranjuju u deioniziranoj vodi. Prvih se 20 ml filtrata odbacuje.
|
|
26.
|
Kao alternativa membranskoj filtraciji može se odabrati centrifugiranje uzoraka. Uzorci se centrifugiraju na 40 000 m.s– 2 (~ 4000 g) 15 minuta, po mogućnosti u hladnoj centrifugi.
Napomena: čini se da diferencijacija ukupnog organskog ugljika (TOC) u odnosu na DOC (TOC/DOC) centrifugiranjem pri vrlo niskim koncentracijama ne djeluje jer se njome ne uklanjaju sve bakterije ili se ugljik ponovno otapa kao dio bakterijske plazme. Čini se da je pogreška centrifugiranja pri višim ispitnim koncentracijama (> 10 mg C po litri) usporedivo manja.
|
Učestalost uzorkovanja
|
27.
|
Ako se analize provode odmah nakon uzorkovanja, vrijeme sljedećeg uzorkovanja ocjenjuje se uzimajući u obzir rezultate analitičkog određivanja.
|
|
28.
|
Ako se uzorci čuvaju (stavak 24.) za kasniju analizu, treba uzeti više uzoraka od minimalno potrebnih pet. Prvo se analiziraju zadnji uzorci, a postupnim odabirom odgovarajućih uzoraka za analizu obrnutim redoslijedom moguće je dobiti dobar opis krivulje biorazgradnje s relativno malim brojem analitičkih određivanja. Ako do kraja ispitivanja nije došlo do razgradnje, nije potrebno analizirati daljnje uzorke i u toj se situaciji strategijom obrnutog redoslijeda mogu uštedjeti znatni troškovi analize.
|
|
29.
|
Ako je opaženo da je krivulja dosegnula plato prije 60. dana, ispitivanje se završava. Ako je očito da je razgradnja počela prije 60. dana, ali još nije dosegnula plato, pokus se produljuje za dodatno razdoblje.
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
30.
|
Analitički se rezultati bilježe u priloženi obrazac za dostavu podataka (Dodatak 2.) i izračunavaju se vrijednosti biorazgradnje za ispitivanu i referentnu tvar na temelju sljedeće jednadžbe:

pri čemu je:
|
Dt
|
=
|
razgradnja u postotku uklanjanja DOC-a ili specifične tvari u vremenu t,
|
|
Co
|
=
|
početna koncentracija DOC-a ili specifične tvari u ispitnom mediju,
|
|
Ct
|
=
|
koncentracija DOC-a ili specifične tvari u ispitnom mediju u vremenu t,
|
|
Cbl(0)
|
=
|
početna koncentracija DOC-a ili specifične tvari u slijepoj probi,
|
|
Cbl(t)
|
=
|
koncentracija DOC-a ili specifične tvari u slijepoj probi u vremenu t.
|
|
|
31.
|
Razgradnja se navodi kao postotak uklanjanja DOC-a (konačna razgradnja) ili uklanjanja specifične tvari (primarna razgradnja) u vremenu t. Koncentracije DOC-a izračunavaju se do najbližeg 0,1 mg po litri, a srednje vrijednosti Dt zaokružuju se na najbliži cijeli postotak.
|
|
32.
|
Tijek razgradnje grafički se prikazuje dijagramom kako je prikazano na slici u odjeljku ‚Valjanost i tumačenje rezultata’. Ako su na raspolaganju dostatni podaci, iz krivulje se izračunava eksponencijalna faza razvoja (tL) i vrijeme potrebno za postizanje 50 %-tnog uklanjanja od kraja eksponencijalne faze razvoja (t50).
|
Izvješće o ispitivanju
|
33.
|
Izvješće o ispitivanju mora sadržavati sljedeće informacije.
|
|
Ispitivana tvar:
|
—
|
fizikalno stanje i po potrebi fizikalno-kemijska svojstva,
|
|
—
|
podatke za identifikaciju.
|
|
|
|
Uvjeti ispitivanja:
|
—
|
lokaciju i opis mjesta uzorkovanja, stanje onečišćenja i nutrijenata (broj kolonija, nitrat, amonijak, fosfat po potrebi),
|
|
—
|
svojstva uzorka (datum uzorkovanja, dubinu, izgled, temperaturu, salinitet, DOC (po izboru), vrijeme od skupljanja do upotrebe u ispitivanju),
|
|
—
|
metodu (ako je primijenjena) za starenje morske vode,
|
|
—
|
metodu primijenjenu za prethodnu obradu (filtraciju/taloženje) morske vode,
|
|
—
|
metodu primijenjenu za određivanje DOC-a,
|
|
—
|
metodu primijenjenu za specifičnu analizu (po izboru),
|
|
—
|
metodu primijenjenu za određivanje broja heterotrofa u morskoj vodi (metodu određivanja broja na pojedinačnim pločicama ili alternativni postupak) (po izboru),
|
|
—
|
druge metode (po izboru) primijenjene za opis morske vode (mjerenja adenozin-trifosfata (ATP) itd.).
|
|
|
|
Rezultati:
|
—
|
analitičke podatke zabilježene u obrascu za dostavu podataka (Dodatak 2.),
|
|
—
|
tijek ispitivanja razgradnje predstavljen je grafičkim dijagramom kojim su prikazani eksponencijalna faza razvoja (tL), nagib i vrijeme (počevši od kraja eksponencijalne faze razvoja) potrebno za postizanje 50 %-tnog uklanjanja (t50). Eksponencijalna faza razvoja može se procijeniti grafički kako je prikazano na slici u odjeljku ‚Valjanost i tumačenje rezultata’ ili se prikladno može uzeti kao vrijeme potrebno za 10 %-tnu razgradnju,
|
|
—
|
postotak razgradnje izmjerene nakon 60 dana ili na kraju ispitivanja.
|
|
|
Valjanost i tumačenje rezultata
|
34.
|
Rezultati dobiveni na temelju referentnih tvari, npr. natrijeva benzoata, natrijeva acetata ili anilina, trebali bi biti usporedivi s rezultatima dobivenima međulaboratorijskim ispitivanjem (3) (vidi odjeljak ‚Referentne tvari’ stavak 7.). Ako su rezultati dobiveni na temelju referentnih tvari atipični, ispitivanje je potrebno ponoviti uz upotrebu drugog uzorka morske vode. Iako se rezultati testova inhibicije možda ne mogu uvijek izravno tumačiti zbog doprinosa ispitivane tvari DOC-u, znatno smanjenje brzine uklanjanja ukupnog DOC-a u odnosu na brzinu iz kontrole pozitivan je znak toksičnih učinaka.
|
|
35.
|
Zbog relativno visokih upotrijebljenih ispitnih koncentracija u odnosu na većinu prirodnih sustava (i stoga nepovoljan omjer koncentracija ispitivanih tvari i drugih izvora ugljika) metoda se smatra preliminarnim ispitivanjem koje se može primijeniti kako bi se pokazalo je li tvar lako biorazgradiva ili nije. Shodno tome, nizak rezultat ne znači nužno da ispitivana tvar nije biorazgradiva u morskim okolišima, već pokazuje da će za utvrđivanje navedenoga biti potrebno obaviti dodatan posao.
Primjer pokusa teoretske razgradnje kojim se ilustrira izvediv način procjene vrijednosti tL (duljine ‚eksponencijalne faze razvoja’) i t50 (vremenskog intervala počevši od tL) potrebnog za postizanje 50 %-tnog uklanjanja prikazan je na slici u nastavku.
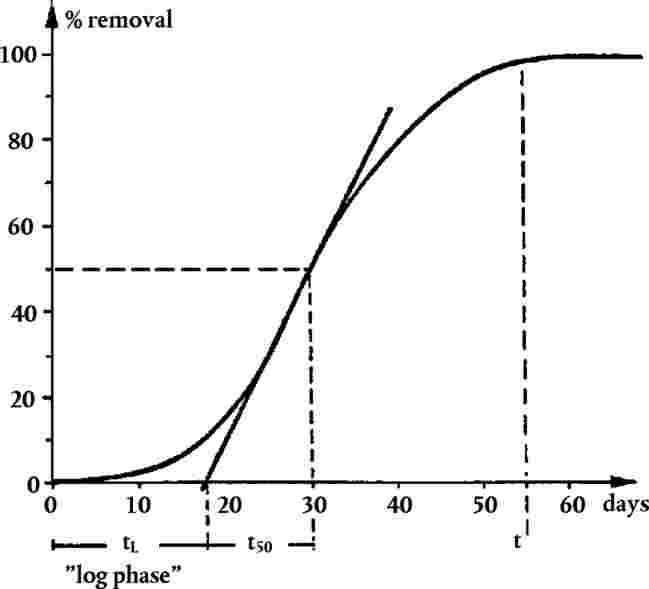
|
METODA ZATVORENIH BOCA
UVOD
|
1.
|
Ova je metoda varijanta testa sa zatvorenim bocama (5) i dovršena je kao rezultat međulaboratorijskog ispitivanja koje je za Europsku komisiju (EK) organizirao Danski institut za kakvoću vode (3).
|
|
2.
|
Kao i kod prateće metode protresanja u tikvici za morski okoliš, rezultate ispitivanja ne treba smatrati pokazateljima lake biorazgradivosti, već ih je potrebno primjenjivati isključivo za dobivanje informacija o biorazgradivosti tvari u morskim okolišima.
|
NAČELO METODE
|
3.
|
Unaprijed određena količina ispitivane tvari otapa se u ispitnom mediju pri uobičajenoj koncentraciji od 2 – 10 mg ispitivane tvari po litri (može se upotrijebiti jedna koncentracija ili više njih). Otopina se drži u napunjenoj i zatvorenoj boci u mraku u kupelji ili kućištu s konstantnom temperaturom koja se održava unutar ± 1 °C u rasponu od 15- do 20 °C. U slučajevima u kojima je cilj studije simulacija situacija u okolišu, ispitivanja se mogu provesti izvan uobičajenog temperaturnog područja pod uvjetom da su za održavanje temperature predviđene prikladne prilagodbe. Nakon razgradnje slijedi analiza kisika u razdoblju od 28 dana.
|
|
4.
|
Međulaboratorijskim se ispitivanjem pokazalo da ako je ispitivanje trajalo dulje od 28 dana, nisu bile prikupljene nikakve korisne informacije, u većini slučajeva zbog jakih interferencija. Vrijednosti biološke potrošnje kisika (BPK) u slijepim probama bile su pretjerano visoke vjerojatno zbog rasta na stijenkama prouzročenog izostankom miješanja i zbog nitrifikacije. Stoga se preporučuje trajanje od 28 dana, ali ako vrijednost BPK-a u slijepim probama ostane unutar granice od 30 posto (stavci 15. i 40.), ispitivanje se može produljiti.
|
INFORMACIJE O ISPITIVANOJ TVARI
|
5.
|
Kako bi se utvrdilo može li se ispitivanje primijeniti na određenu tvar, moraju biti poznata neka od njezinih svojstava. Za izračun teoretske potrošnje kisika (TPK) potrebna je empirijska formula (vidi Dodatak 3.); u protivnom se kao referentna vrijednost mora odrediti kemijska potrošnja kisika (KPK) tvari. Primjena je KPK-a manje zadovoljavajuća jer se neke tvari ne oksidiraju potpuno u ispitivanju KPK-a.
|
|
6.
|
Topljivost tvari trebala bi biti najmanje 2 mg/l, iako se u načelu mogu ispitivati i slabije topljive tvari (npr. primjenom ultrazvučne obrade) kao i hlapljive tvari. Za tumačenje dobivenih rezultata potrebne su informacije o čistoći ili relativnim udjelima glavnih sastojaka ispitivane tvari, osobito ako su vrijednosti blizu razine prolaznosti.
|
|
7.
|
Informacije o toksičnosti ispitivane tvari za bakterije, npr. dobivene mjerenjima u kratkoročnim testovima disanja (4), mogu biti vrlo korisne za odabir odgovarajućih ispitnih koncentracija te mogu biti ključne za ispravno tumačenje niskih vrijednosti biorazgradnje. Međutim, takve informacije nisu uvijek dovoljne za tumačenje rezultata dobivenih ispitivanjem biorazgradnje te je postupak opisan u stavku 27. prikladniji.
|
REFERENTNE TVARI
|
8.
|
Moraju se primijeniti prikladne referentne tvari za provjeru djelovanja mikroba u uzorku morske vode. U tu se svrhu mogu upotrebljavati (na primjer) anilin, natrijev acetat ili natrijev benzoat. Do razgradnje navedenih tvari od najmanje 60 posto (njihova TPK-a) mora doći u razumno kratkom roku, a u protivnom se preporučuje ponavljanje ispitivanja s drugim uzorkom morske vode.
|
|
9.
|
U međulaboratorijskom su ispitivanju za EK, u kojem su se uzorci morske vode uzimali na različitim lokacijama i u različito doba godine, eksponencijalna faza razvoja (tL) i vrijeme potrebno za postizanje 50 %-tne razgradnje (t50), isključujući eksponencijalnu fazu razvoja, iznosili od nula do dva dana odnosno od jednog do četiri dana za natrijev benzoat. Za anilin vrijednosti tL i t50 iznosile su od nula do sedam odnosno od dva do 12 dana.
|
MJERNA OBNOVLJIVOST
|
10.
|
Mjerna obnovljivost metoda utvrđena je međulaboratorijskim ispitivanjem za EK (3).
|
OPIS METODE
Aparatura
|
11.
|
Uobičajena laboratorijska oprema i:
|
(a)
|
mogu se upotrijebiti staklene boce BPK sa staklenim čepovima od 250 – 300 ml ili boce uskog vrata od 250 ml sa staklenim čepovima;
|
|
(b)
|
nekoliko boca od dvije, tri ili četiri litre s označenim litrama za pripremu pokusa i za punjenje boca BPK;
|
|
(c)
|
vodena kupelj ili prostorija s konstantnom temperaturom (± 1 °C) bez svjetla;
|
|
(d)
|
oprema za analizu otopljenog kisika;
|
|
(e)
|
membranski filtri, 0,2–0,45 μm;
|
|
(f)
|
oprema za specifičnu analizu (po izboru).
|
|
Morska voda
|
12.
|
Uzorak morske vode uzima se temeljito očišćenim spremnikom i prenosi u laboratorij, po mogućnosti u roku od jednog ili dva dana od skupljanja. Tijekom prijenosa temperatura uzorka ne smije znatno prijeći temperaturu koja će se primjenjivati tijekom ispitivanja.
|
|
13.
|
Lokacija uzorkovanja precizno se određuje i opisuje s obzirom na status u pogledu onečišćenja i nutrijenata. Posebno se za obalne ili onečišćene vode u navedeni opis uključuje i broj heterotrofnih kolonija mikroba i određivanje koncentracija otopljenog nitrata, amonijaka i fosfata.
|
|
14.
|
O samom uzorku morske vode navode se sljedeće informacije:
|
—
|
izgled uzorka, zamućenost itd.,
|
|
—
|
temperatura u trenutku skupljanja,
|
|
—
|
otopljeni organski ugljik (DOC),
|
|
—
|
vrijeme između skupljanja i upotrebe u ispitivanju.
|
|
|
15.
|
Ako se utvrdi da je sadržaj DOC-a u uzorku visok ili ako se smatra da bi BPK u slijepim probama nakon 28 dana bio viši od 30 posto od postotka referentne tvari, preporučuje se starenje morske vode u trajanju od približno tjedan dana prije upotrebe.
|
|
16.
|
Starenje uzorka provodi se u aerobnim uvjetima na sobnoj temperaturi u mraku ili pod difuznom rasvjetom. Aerobni se uvjeti po potrebi održavaju blagim dozračivanjem. Tijekom starenja smanjuje se sadržaj lako razgradivog organskog materijala. Međulaboratorijskim ispitivanjem (3) nije utvrđena nikakva razlika između potencijala razgradnje uzoraka starije i svježe skupljene morske vode.
|
|
17.
|
Prije upotrebe morska se voda prethodno obrađuje kako bi se uklonile grube čestice, npr. filtracijom kroz najlonski filtar ili grubi papirni filtar (ne kroz membranski filtar ili GF-C filtar) ili taloženjem i pretakanjem. Primijenjeni se postupak bilježi. Prethodna se obrada provodi nakon starenja ako je provedeno.
|
Radne otopine za mineralne nutrijente
|
18.
|
Pripremaju se sljedeće radne otopine s analitički čistim reagensima:
|
(a)
|
kalijev dihidrogen ortofosfat, KH2PO4
|
8,50 g
|
|
dikalijev hidrogen ortofosfat, K2HPO4
|
21,75 g
|
|
dinatrijev hidrogen ortofosfat dihidrat, Na2HPO4 · 2H2O
|
33,30 g
|
|
amonijev klorid, NH4Cl
|
0,50 g
|
|
Otapa se i miješa do jedne litre s destiliranom vodom.
|
|
|
(b)
|
kalcijev klorid, CaCl2
|
27,50 g
|
|
Otapa se i miješa do jedne litre s destiliranom vodom.
|
|
|
(c)
|
magnezijev sulfat heptahidrat, MgSO4 · 7H2O
|
22,50 g
|
|
Otapa se i miješa do jedne litre s destiliranom vodom.
|
|
|
(d)
|
željezov (III) klorid heksahidrat, FeCl3 · 6H2O
|
0,25 g
|
|
Otapa se i miješa do jedne litre s destiliranom vodom.
|
|
Taloženje u otopini (d) može se spriječiti dodavanjem jedne kapi koncentriranog HCl ili 0,4 g etilendiamintetraoctene kiseline (EDTA-e, dinatrijeve soli) po litri. Ako se u radnoj otopini stvori talog, treba je zamijeniti svježe pripremljenom otopinom.
|
Priprema ispitnog medija
|
19.
|
Po litri prethodno obrađene morske vode dodaje se 1 ml svake od prethodno navedenih radnih otopina. Ispitni medij zasićuje se zrakom na ispitnoj temperaturi dozračivanjem čistim komprimiranim zrakom oko 20 minuta. Određuje se koncentracija otopljenog kisika u svrhu kontrole. Zasićena koncentracija otopljenog kisika kao funkcija saliniteta i temperature može se očitati iz nomograma priloženog ovoj ispitnoj metodi (Dodatak 4.).
|
Inokulum
|
20.
|
Mikroorganizmima koji su već prisutni u morskoj vodi ne dodaje se specifični inokulum. Određuje se (po izboru) broj heterotrofa koji tvore kolonije u ispitnom mediju morske vode (po mogućnosti i u izvornom uzorku morske vode), npr. određivanjem broja na pojedinačnim pločicama primjenom morskog agara. To je osobito poželjno kod uzoraka s obalnih ili onečišćenih mjesta. Provjerava se djelovanje heterotrofnih mikroba u morskoj vodi provedbom ispitivanja s referentnom tvari.
|
Priprema ispitnih boca
|
21.
|
Provode se sve potrebne manipulacije uključujući starenje i prethodnu obradu morske vode na odabranoj ispitnoj temperaturi između 15 i 20 °C kako bi se osigurala čistoća, ali ne i sterilnost cjelokupne staklene opreme.
|
|
22.
|
Pripremaju se skupine boca BPK za određivanje BPK-a ispitivane i referentne tvari u simultanim pokusnim nizovima. Sve se analize provode u dvjema paralelnim bocama (slijepe probe, referentna i ispitivana tvar), odnosno pripremom dviju boca za svako određivanje. Analize se provode najmanje 0., 5., 15. i 28. dana (četiri određivanja). Pri analizi kisika za četiri je određivanja potrebno ukupno 3 × 2 × 4 = 24 boce (slijepe probe, referentna i ispitivana tvar) i oko osam litara ispitnog medija (za jednu koncentraciju ispitivane tvari).
|
|
23.
|
U velikim bocama dostatnog volumena zasebno se pripremaju otopine ispitivane i referentne tvari (stavak 11.) tako da se prvo doda ispitivana i referentna tvar izravno ili upotrebom koncentrirane radne otopine u djelomično napunjene velike boce. Dodaje se još ispitnog medija kako bi se dobila konačna željena koncentracija. Ako se upotrebljavaju radne otopine ispitivane i/ili referentne tvari, treba osigurati da ne dođe do znatne promjene saliniteta morske vode.
|
|
24.
|
Koncentracije ispitivane i referentne tvari odabiru se uzimajući u obzir:
|
(a)
|
topljivost otopljenog kisika u morskoj vodi pri prevladavajućoj ispitnoj temperaturi i salinitetu (vidi priloženi nomogram u Dodatku 4.);
|
|
(b)
|
BPK morske vode u slijepim probama i
|
|
(c)
|
očekivanu biorazgradivost ispitivane tvari.
|
|
|
25.
|
Na 15 °C i 20 °C te pri salinitetu od 32 promila (oceanska voda) topljivost je otopljenog kisika oko 8,1 odnosno 7,4 mg/l. Potrošnja kisika morske vode (disanje u slijepim probama) može biti 2 mg O2/l ili više ako morska voda nije bila podvrgnuta starenju. Stoga, kako bi se osiguralo da nakon oksidacije ispitivane tvari ostane znatna koncentracija kisika, primjenjuje se početna koncentracija ispitivane tvari od oko 2–3 mg/l (ovisno o TPK-u) za tvari za koje se očekuje da će se potpuno razgraditi u uvjetima ispitivanja (kao što su referentne tvari). Slabije razgradive tvari ispituju se pri višim koncentracijama, do oko 10 mg/l, pod uvjetom da nema toksičnih učinaka. Provedba paralelnih ispitivanja s niskom (oko 2 mg/l) i visokom (oko 10 mg/l) koncentracijom ispitivane tvari može biti korisna.
|
|
26.
|
Kisik u slijepoj probi mora se odrediti paralelno u bocama koje ne sadržavaju ispitivanu ili referentnu tvar.
|
|
27.
|
Ako se određuju inhibitorni učinci, priprema se sljedeći niz otopina u zasebnim velikim bocama (stavak 13.):
|
(a)
|
2 mg po litri lako razgradive tvari, npr. bilo koje od navedenih referentnih tvari;
|
|
(b)
|
x mg po litri ispitivane tvari (x je obično 2);
|
|
(c)
|
2 mg po litri lako razgradive tvari plus x mg po litri ispitivane tvari.
|
|
Fizikalno-kemijsko kontrolno ispitivanje (po izboru)
|
28.
|
Ako se upotrebljava opcija primjene specifične analize, može se provesti fizikalno-kemijski pokus kako bi se provjerilo je li ispitivana tvar uklonjena abiotičkim mehanizmima poput hidrolize ili adsorpcije. Fizikalno-kemijsko kontrolno ispitivanje može se provesti dodavanjem živina (II) klorida (HgCl2) (33) (50–100 mg/l) dvjema paralelnim tikvicama s ispitivanom tvari kako bi se prekinulo djelovanje mikroba. Znatnim smanjenjem koncentracije specifične tvari tijekom ispitivanja ukazuje se na abiotičke mehanizme uklanjanja.
|
Broj boca BPK u tipičnom ispitivanju
|
29.
|
U tipičnom ispitivanju upotrebljavaju se sljedeće boce:
|
—
|
najmanje osam boca koje sadržavaju ispitivanu tvar,
|
|
—
|
najmanje osam boca koje sadržavaju samo morsku vodu ojačanu nutrijentima,
|
|
—
|
najmanje osam boca koje sadržavaju referentnu tvar i po potrebi
|
|
—
|
šest boca koje sadržavaju ispitivanu i referentnu tvar (kontrola toksičnosti).
|
|
POSTUPAK
|
30.
|
Odmah nakon pripreme svaka se otopina ispušta iz donje četvrtine (ne s dna) odgovarajuće velike boce kako bi se napunila odgovarajuća skupina boca BPK. Nulte se kontrole (u nultom vremenu) odmah analiziraju u pogledu otopljenog kisika (stavak 33.) ili se čuvaju za kasniju kemijsku analizu taloženjem s MnCl2 (manganovim (II) kloridom) i NaOH (natrijevim hidroksidom).
|
|
31.
|
Preostale se paralelne boce BPK inkubiraju na ispitnoj temperaturi (15–20 °C), drže u mraku i uklanjaju iz prostora inkubacije u odgovarajućim vremenskim intervalima (npr. minimalno nakon 5., 15. i 28. dana) te analiziraju u pogledu otopljenog kisika (stavak 33.).
|
|
32.
|
Uzorci za specifičnu analizu filtriraju se kroz membranski filtar (0,2–0,45 μm) ili centrifugiraju 15 minuta (po izboru). Ako se ne analiziraju odmah, pohranjuju se do 48 sati na 2–4 °C ili dulje na – 18 °C (ako je poznato da to neće imati učinka na ispitivanu tvar, ona se acidifira na pH-vrijednost 2 prije pohranjivanja).
|
Određivanje otopljenog kisika
|
33.
|
Koncentracija otopljenog kisika određuje se kemijskom ili elektro-kemijskom metodom priznatom na nacionalnoj ili međunarodnoj razini.
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
34.
|
Analitički rezultati bilježe se u priložene obrasce za dostavu podataka (Dodatak 5.).
|
|
35.
|
BPK se izračunava kao razlika u potrošnji kisika između slijepe probe i otopine ispitivane tvari u uvjetima ispitivanja. Neto potrošnja kisika dijeli se s koncentracijom (w/v) tvari kako bi se BPK izrazio kao mg BPK/mg ispitivane tvari. Razgradnja je definirana kao omjer biokemijske potrošnje kisika i po mogućnosti teoretske potrošnje kisika (TPK) ili kemijske potrošnje kisika (KPK) i izražena kao postotak (vidi stavak 36.).
|
|
36.
|
Vrijednosti biorazgradnje izračunavaju se za svako vrijeme uzorkovanja za ispitivanu i referentnu tvar na temelju jedne od sljedećih dviju jednadžbi:

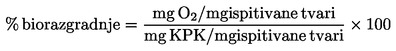
pri čemu je:
|
TPK
|
=
|
teoretska potrošnja kisika (za izračun vidi Dodatak 3.)
|
|
KPK
|
=
|
kemijska potrošnja kisika određena pokusima.
|
Napomena: Ponekad se dvama načinima izračuna (kao postotak TPK-a ili postotak KPK-a) ne dobivaju jednaki rezultati; prednost se daje primjeni TPK-a jer neke tvari ne oksidiraju potpuno u ispitivanju KPK-a.
|
|
37.
|
Tijek ispitivanja razgradnje grafički se prikazuje dijagramom (vidi primjer u odjeljku ‚Valjanost i tumačenje rezultata’). Ako su na raspolaganju dostatni podaci, iz krivulje biorazgradnje izračunavaju se eksponencijalna faza razvoja (tL) i vrijeme (t50) potrebno za postizanje 50 %-tnog uklanjanja od kraja eksponencijalne faze razvoja.
|
|
38.
|
Ako se primjenjuje specifična analiza (po izboru), navodi se postotak primarne razgradnje kao postotak uklanjanja specifične tvari u razdoblju ispitivanja (uz korekciju za analitičke slijepe probe).
|
Izvješće o ispitivanju
|
39.
|
Izvješće o ispitivanju mora sadržavati sljedeće informacije.
|
|
Ispitivana tvar:
|
—
|
fizikalno stanje i po potrebi fizikalno-kemijska svojstva,
|
|
—
|
podatke za identifikaciju.
|
|
|
|
Uvjeti ispitivanja:
|
—
|
lokaciju i opis mjesta uzorkovanja: stanje onečišćenja i nutrijenata (broj kolonija, nitrat, amonijak, fosfat po potrebi),
|
|
—
|
svojstva uzorka (datum uzorkovanja, dubinu, izgled, temperaturu, salinitet, DOC (po izboru), vrijeme od skupljanja do upotrebe u ispitivanju),
|
|
—
|
metodu (ako je primijenjena) za starenje morske vode,
|
|
—
|
metodu primijenjenu za prethodnu obradu (filtraciju/taloženje) morske vode,
|
|
—
|
metodu primijenjenu za određivanje KPK-a (ako je provedeno),
|
|
—
|
metodu primijenjenu za mjerenja kisika,
|
|
—
|
postupak dispergiranja za tvari koje su slabo topljive u uvjetima ispitivanja,
|
|
—
|
metodu primijenjenu za određivanje broja heterotrofa u morskoj vodi (metodu određivanja broja na pojedinačnim pločicama ili alternativni postupak),
|
|
—
|
metodu primijenjenu za određivanje DOC-a u morskoj vodi (po izboru),
|
|
—
|
metodu primijenjenu za specifičnu analizu (po izboru),
|
|
—
|
druge neobvezne metode primijenjene za opis morske vode (mjerenja ATP-a itd.).
|
|
|
|
Rezultati:
|
—
|
analitičke podatke zabilježene u obrascu za dostavu podataka (priložen u Dodatku 5.),
|
|
—
|
tijek ispitivanja razgradnje predstavljen grafički dijagramom kojim su prikazani eksponencijalna faza razvoja (tL), nagib i vrijeme (počevši od kraja eksponencijalne faze razvoja) potrebno za postizanje 50 %-tne konačne potrošnje kisika prouzročene oksidacijom ispitivane tvari (t50). Eksponencijalna faza razvoja može se procijeniti grafički kako je prikazano na priloženoj slici ili se prikladno može uzeti kao vrijeme potrebno za 10 %-tnu razgradnju,
|
|
—
|
postotak razgradnje izmjerene nakon 28 dana.
|
|
|
Valjanost i tumačenje rezultata
|
40.
|
Disanje u slijepoj probi ne bi trebalo prelaziti 30 posto kisika u ispitnoj boci. Ako se navedeni kriterij ne može ispuniti upotrebom svježe skupljene morske vode, mora se provesti starenje (stabilizacija) morske vode prije upotrebe.
|
|
41.
|
Potrebno je uzeti u obzir mogućnost da na rezultate mogu utjecati tvari koje sadržavaju dušik.
|
|
42.
|
Rezultati dobiveni na temelju referentnih tvari, odnosno natrijeva benzoata i anilina trebale bi biti usporedivi s rezultatima dobivenima međulaboratorijskim ispitivanjem (3) (stavak 9.). Ako su rezultati dobiveni na temelju referentnih tvari atipični, ispitivanje je potrebno ponoviti uz upotrebu drugog uzorka morske vode.
|
|
43.
|
Može se smatrati da ispitivana tvar ima inhibitorni učinak na bakterije (pri upotrijebljenoj koncentraciji) ako je BPK smjese referentne i ispitivane tvari manji od zbroja BPK-a zasebnih otopina dviju tvari.
|
|
44.
|
Zbog relativno visokih upotrijebljenih ispitnih koncentracija u odnosu na većinu prirodnih sustava i stoga nepovoljan omjer koncentracija ispitivane tvari i drugih izvora ugljika metoda se smatra preliminarnim ispitivanjem koje se može primijeniti kako bi se pokazalo je li tvar lako biorazgradiva ili nije. Shodno tome, nizak rezultat ne znači nužno da ispitivana tvar nije biorazgradiva u morskim okolišima, već ukazuje na to da će za utvrđivanje navedenoga biti potrebno provesti dodatne radnje.
Primjer pokusa teoretske razgradnje kojim se prikazuje izvediv način procjene vrijednosti tL (duljine ‚eksponencijalne faze razvoja’) i t50, odnosno vremenskog intervala (počevši od tL) potrebnog za postizanje 50 %-tne konačne potrošnje kisika prouzročene oksidacijom ispitivane tvari nalazi se u nastavku.

|
LITERATURA
|
(1)
|
de Kreuk, J .F., i Hanstveit, A. O. (1981.) Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6), 561. – 573.
|
|
(2)
|
Metoda C.4-B ovog Priloga: Određivanje ‚lake’ biorazgradivosti, dio III, Izmijenjeni test pretraživanja OECD.
|
|
(3)
|
Nyholm, N., i Kristensen, P. (1987.) Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984-1985, ožujak 1987., Komisija Europskih zajednica.
|
|
(4)
|
Poglavlje C.11. ovog Priloga: Aktivni mulj, test inhibicije disanja (oksidacija ugljika i amonijaka).
|
|
(5)
|
Metoda C.4.-E ovog Priloga: Određivanje ‚lake’ biorazgradivosti, dio VI., Test sa zatvorenim bocama.
|
Dodatak 1.
Određivanje organskog ugljika u morskoj vodi
METODA PROTRESANJEM U TIKVICI
Za određivanje organskog ugljika uzorka vode organski spojevi u uzorku oksidiraju u ugljikov dioksid primjenom jedne od triju sljedećih tehnika:
|
—
|
mokre oksidacije persulfatom / UV zračenjem,
|
|
—
|
mokre oksidacije persulfatom / povišenom temperaturom (116 – 130 °C),
|
Nastali CO2 kvantitativno se određuje infracrvenom spektrometrijom ili titrimetrijom. Druga mogućnost reduciranje je CO2 u metan, koji se kvantitativno određuje ionizacijskim detektorom plamena (FID).
Metoda oksidacije persulfatom / UV zračenjem uobičajeno se primjenjuje za analizu ‚čiste’ vode s niskim sadržajem čestica. Druge dvije metode mogu se primjenjivati na većinu vrsta uzoraka vode, pri čemu je oksidacija persulfatom / povišenom temperaturom najprikladnija za uzorke niske razine, dok se tehnika izgaranja primjenjuje za uzorke čiji je sadržaj nehlapljivog organskog ugljika (NVOC) veći od 1 mg C/l.
Interferencije
Sve tri metode ovise o eliminaciji ili kompenzaciji anorganskog ugljika (IC) prisutnog u uzorku. Uklanjanje CO2 iz acidificiranog uzorka najčešće je primijenjena metoda za eliminaciju IC-a, iako ono dovodi do gubitka hlapljivih organskih spojeva (1). Potpuna eliminacija ili kompenzacija IC-a moraju se osigurati za svaku matricu uzorka, a pored NVOC-a mora se odrediti i hlapljivi organski ugljik (VOC), ovisno o vrsti uzorka.
Visoke koncentracije klorida dovode do smanjenja učinkovitosti oksidacije u slučaju primjene metode oksidacije persulfatom / UV zračenjem (2). Međutim, ta se interferencija može ukloniti primjenom oksidacijskog reagensa modificiranog dodavanjem živina (II) nitrata. Preporučuje se upotreba maksimalnog prihvatljivog volumena uzorka za ocjenjivanje svih vrsta uzoraka koji sadržavaju klorid. Visoke koncentracije soli u analiziranom uzorku u metodi izgaranja mogu dovesti do prekrivanja katalizatora solima i prekomjerne korozije cijevi za izgaranje. Potrebno je poduzeti mjere opreza u skladu s priručnikom proizvođača.
Jako zamućeni uzorci kao i uzorci koji sadržavaju čestice možda neće potpuno oksidirati u slučaju primjene metode oksidacije persulfatom / UV zračenjem.
Primjer prikladne metode
Nehlapljivi organski ugljik određuje se oksidacijom persulfatom / UV zračenjem i naknadnim kvantitativnim određivanjem nastalog CO2 nedisperzivnom infracrvenom spektrometrijom.
Oksidacijski reagens modificira se u skladu s prijedlozima navedenima pod (2) kako je opisano u priručniku proizvođača:
|
(a)
|
8,2 g HgCl2 i 9,6 g Hg(NO3)2 · H2O otapaju se u nekoliko stotina mililitara vode s niskom koncentracijom ugljika kao reagensa;
|
|
(b)
|
20 g K2S2O8 otapa se u otopini živine soli;
|
|
(c)
|
smjesi se dodaje 5 ml HNO3 (konc.);
|
|
(d)
|
reagens se razrjeđuje do 1 000 ml.
|
Interferencija klorida uklanja se upotrebom 40 μl volumena uzorka za deset posto klorida i 200 μl volumena uzorka za 1,9 posto klorida. Uzorci s visokim koncentracijama klorida i/ili veliki volumeni uzoraka mogu se analizirati u skladu s navedenom metodom pod uvjetom da se spriječi stvaranje klorida u oksidacijskoj posudi. Nakon toga po potrebi se može odrediti hlapljivi organski ugljik za predmetnu vrstu uzorka može.
LITERATURA
|
(1)
|
ISO, Kvaliteta vode – utvrđivanje ukupnog organskog ugljika. Nacrt međunarodne norme ISO/DIS 8245, 16. siječnja 1986.
|
|
(2)
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16th edition, 1985.
Preporučuje se i (opisan je autoanalizator):
|
|
(3)
|
Schreurs, W. (1978.) An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137. – 142.
|
Dodatak 2.
Biorazgradnja u morskoj vodi
METODA PROTRESANJEM U TIKVICI
OBRAZAC ZA DOSTAVU PODATAKA
|
2.
|
DATUM POČETKA ISPITIVANJA:
|
|
3.
|
ISPITIVANA TVAR:
Naziv:
|
Koncentracija radne otopine:
|
mg/l kao tvar
|
|
Početna koncentracija u mediju, to:
|
mg/l kao tvar
|
|
:
|
mg DOC/l
|
|
|
4.
|
MORSKA VODA:
Izvor:
Datum skupljanja:
Dubina skupljanja:
Izgled u trenutku skupljanja (npr. zamućenost itd.):
|
Salinitet u trenutku skupljanja:
|
‰
|
|
Temperatura u trenutku skupljanja:
|
°C
|
|
DOC ‚x’ sati nakon skupljanja:
|
mg/l
|
Prethodna obrada prije ispitivanja (npr. filtracija, taloženje, starenje itd.):
|
Broj kolonija mikroba
|
|
kolonije/ml
|
|
|
|
—
|
na početku ispitivanja:
|
|
kolonije/ml
|
|
Druga svojstva:
|
|
|
|
|
5.
|
ODREĐIVANJA UGLJIKA:
Analizator ugljika:
|
|
Tikvica br.
|
|
DOC nakon n dana (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Ispitivanje: morska voda ojačana nutrijentima s ispitivanom tvari
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
srednja vrijednost, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
srednja vrijednost, Cb(t)
|
|
|
|
|
|
|
Slijepa proba: morska voda ojačana nutrijentima bez ispitivane tvari
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
srednja vrijednost, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
srednja vrijednost, Cd(t)
|
|
|
|
|
|
| srednja vrijednost,

|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
VREDNOVANJE SIROVIH PODATAKA:
|
Tikvica br.
|
Izračun rezultata
|
% razgradnje nakon n dana
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|

|
0
|
|
|
|
|
|
Srednja vrijednost (34)
|

|
0
|
|
|
|
|
|
Napomena:
|
Slični se obrasci mogu upotrijebiti kada nakon razgradnje slijedi specifična analiza i za referentnu tvar te kontrole toksičnosti.
|
|
|
7.
|
ABIOTIČKA RAZGRADNJA (po izboru)
|
|
Vrijeme (dani)
|
|
0
|
t
|
|
DOC (mg/l) u sterilnoj kontroli
|
Cs(o)
|
Cs(t)
|

|
Dodatak 3.
Izračun teoretske biokemijske potrošnje kisika
METODA ZATVORENIH BOCA
TPK tvari CcHhClclNnNanaOoPpSs molekularne mase MW izračunava se u skladu s:

Tim se izračunom pokazuje da se C mineralizira u CO2, H u H2O, P u P2O5 i Na u Na2O. Halogen se eliminira kao halogenovodik, a dušik kao amonijak.
Primjer:
glukoza C6H12O6, MW = 180

Molekularne mase soli koje nisu soli alkalijskih metala izračunavaju se pod pretpostavkom da su soli hidrolizirane.
Za sumpor se pretpostavlja da oksidira u stanje + 6.
Primjer:
natrijev n-dodecilbenzensulfonat C18H29SO3Na, MW = 348

U slučaju tvari koje sadržavaju dušik, dušik se može eliminirati kao amonijak, nitrit ili nitrat u skladu s različitim teoretskim biokemijskim potrošnjama kisika.


Pod pretpostavkom da je analizom opažena potpuna tvorba nitrata u slučaju sekundarnog amina:
(C12H25)2 NH, MW = 353

Dodatak 4.

Dodatak 5.
Biorazgradnja u morskoj vodi
METODA ZATVORENIH BOCA
OBRAZAC ZA DOSTAVU PODATAKA
|
2.
|
DATUM POČETKA ISPITIVANJA:
|
|
3.
|
ISPITIVANA TVAR:
Naziv:
|
Koncentracija radne otopine:
|
mg/l
|
|
Početna koncentracija u morskoj vodi:
|
mg/l
|
|
TPK ili KPK:
|
mg O2/mg ispitivane tvari
|
|
|
4.
|
MORSKA VODA:
Izvor:
Datum skupljanja:
Dubina skupljanja:
Izgled u trenutku skupljanja (npr. zamućenost itd.):
|
Salinitet u trenutku skupljanja:
|
‰
|
|
Temperatura u trenutku skupljanja:
|
°C
|
|
DOC ‚x’ sati nakon skupljanja:
|
mg/l
|
Prethodna obrada prije ispitivanja (npr. filtracija, taloženje, starenje itd.):
|
Broj kolonija mikroba
|
|
kolonije/ml
|
|
|
|
—
|
na početku ispitivanja:
|
|
kolonije/ml
|
|
Druga svojstva:
|
|
|
|
|
5.
|
ISPITNI MEDIJ:
|
Temperatura nakon dozračivanja:
|
°C
|
|
Koncentracija O2 nakon dozračivanja i stanje prije početka ispitivanja:
|
mg O2/l
|
|
|
6.
|
ODREĐIVANJE DO-A:
Metoda: Winkler/elektroda
|
|
Tikvica br.
|
|
mg O2/l nakon n dana
|
|
0
|
5
|
15
|
28
|
|
Ispitivanje: morska voda ojačana nutrijentima s ispitivanom tvari
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Srednja vrijednost u ispitivanju
|

|
|
|
|
|
|
Slijepa proba: morska voda ojačana nutrijentima, ali bez ispitivane tvari
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Srednja vrijednost u slijepoj probi
|

|
|
|
|
|
Napomena: sličan se obrazac može upotrijebiti za referentnu tvar i kontrole toksičnosti.
|
|
7.
|
POTROŠNJA DO-A: % RAZGRADNJE (% D):
|
|
Potrošnja DO-a nakon n dana
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|

|
|
|
|
|
C.43. ANAEROBNA BIORAZGRADIVOST ORGANSKIH TVARI U RAZGRAĐENOM MULJU: MJERENJEM PROIZVODNJE PLINA
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 311 (2006.). Postoje brojni testovi probira za procjenu aerobne biorazgradivosti organskih tvari (ispitne metode C.4., C.9., C.10. i C.11. (1) i Smjernica za ispitivanje OECD-a 302C (2)) i rezultati njihove primjene uspješno su upotrijebljeni za predviđanje sudbine tvari u aerobnom okolišu, osobito u aerobnim fazama pročišćavanja otpadnih voda. Različiti udjeli tvari topljivih u vodi, kao i onih koje adsorbiraju otpadne krute tvari, obrađuju se aerobno s obzirom na to da su one prisutne u istaloženim otpadnim vodama. Međutim, veće frakcije tih tvari povezane su s prvim istaloženim muljem, koji se odvaja od otpadne vode u primarnim taložnicama prije nego što se otpadne vode ili supernatant pročišćava aerobno. Mulj, koji sadržava neke topljive tvari u međuprostornoj tekućini, zatim se prenosi u grijane digestere za anaerobno pročišćavanje. Budući da još ne postoje ispitivanja iz ove serije kojima se procjenjuje anaerobna biorazgradivost u anaerobnim digesterima i da je svrha ovog ispitivanja popunjavanje te praznine, ono nije nužno primjenjivo na ostale anoksične dijelove okoliša.
|
|
2.
|
Respirometrijske metode kojima se mjere količine proizvedenog plina, uglavnom metana (CH4) i ugljikova dioksida (CO2), u anaerobnim su uvjetima uspješno primijenjene za procjenu anaerobne biorazgradivosti. Birch et al. (3) revidirali su te postupke te zaključili da je rad autora Sheltona i Tiedjea (4), koji se temelji na ranijim ispitivanjima (5)(6)(7), bio najopsežniji. Metodom (4), koju su ostali autori dodatno razvili (8) i koja je postala američki standard (9), (19), nisu riješene teškoće povezane s različitim topljivostima spojeva CO2 i CH4 u ispitnom mediju te s izračunom teoretske proizvodnje plina ispitivane tvari. U izvješću ECETOC (3) preporučuju se dodatna mjerenja sadržaja otopljenog anorganskog ugljika (DIC) tekućeg supernatanta, što je ovu metodu učinilo široko primjenjivom. Metoda ECETOC bila je podvrgnuta međunarodnom kalibracijskom testiranju (ili prstenastom testu) te je postala norma ISO 11734 (11).
|
|
3.
|
U ovoj ispitnoj metodi, koja se temelji na normi ISO 11734 (11), opisuje se metoda probira za ocjenjivanje potencijalne anaerobne biorazgradivosti organskih tvari u određenim uvjetima (tj. u anaerobnom digesteru u određenom trenutku i rasponu koncentracije mikroorganizama). Budući da se razrijeđeni mulj upotrebljava s relativno visokom koncentracijom ispitivane tvari te da je trajanje testa uobičajeno dulje od vremena zadržavanja u anaerobnim digesterima, uvjeti ispitivanja ne odgovaraju nužno uvjetima u anaerobnim digesterima i ono nije primjenjivo na procjenu anaerobne biorazgradivosti organskih tvari u različitim okolišnim uvjetima. Mulj se izlaže ispitivanoj tvari u trajanju do 60 dana, što je dulje od uobičajenog vremena zadržavanja mulja (od 25 do 30 dana) u anaerobnim digesterima, iako vrijeme zadržavanja na industrijskim lokacijama može biti mnogo dulje. Procjene dobivene iz rezultata ovog ispitivanja ne mogu se provesti jednako uvjerljivo kao u slučaju aerobne biorazgradivosti jer dokazi o ponašanju ispitivanih tvari u ‚spremnim’ aerobnim ispitivanjima i simulacijskim ispitivanjima i aerobnom okolišu dovoljni su da dokažu da postoji povezanost; za anaerobni okoliš postoji malo sličnih dokaza. Pretpostavlja se da do potpune anaerobne biorazgradivost može doći u slučaju 75 – 80 % teoretske proizvodnje plina. Visoki omjeri tvari u biomasi upotrijebljenoj u ovim ispitivanjima znače da tvar koja prođe ima veće šanse za razgradnju u anaerobnom digesteru. Osim toga, tvari koje se ne pretvore u plin tijekom ispitivanja možda se neće održati u okolišno realističnijim omjerima tvar: biomasa. Nadalje, događaju se ostale anaerobne reakcije u kojima se tvari mogu barem djelomično razgraditi, npr. uklanjanje klora, ali ovim ispitivanjem ne otkrivaju se takve reakcije. Međutim, primjenom specifičnih analitičkih metoda za određivanje ispitivane tvari može se pratiti njezino nestajanje (vidi odjeljke 6., 30., 44. i 53.).
|
NAČELO ISPITIVANJA
|
4.
|
Isprani razgrađeni mulj (36), koji sadržava niske (< 10 mg/l) koncentracije anorganskog ugljika (engl. inorganic carbon, IC), razrijeđuje se deseterostruko do ukupne koncentracije krute tvari od 1 g/l do 3 g/l i inkubira na 35 °C ± 2 °C u zabrtvljenim posudama s ispitivanom tvari na od 20 do 100 mg C/l na razdoblje do 60 dana. Dopušta se mjerenje aktivnosti mulja izvođenjem paralelnih slijepih proba s inokulumom mulja u mediju, ali bez ispitivane tvari.
|
|
5.
|
Mjeri se povećan tlak plinskog prostora u posudama koji je rezultat proizvodnje ugljikova dioksida i metana. Velika količina proizvedenog CO2 otopit će se u tekućoj fazi ili će se pretvoriti u karbonat ili hidrogenkarbonat u ispitnim uvjetima. Taj anorganski ugljik mjeri se na kraju ispitivanja.
|
|
6.
|
Količina ugljika (anorganski plus metan) koji nastaje biorazgradnjom ispitivane tvari izračunava se iz neto proizvodnje plina i neto stvaranja anorganskog ugljika u tekućem stanju u višku slijepih kontrolnih vrijednosti. Doseg biorazgradnje mjeri se na temelju ukupnog proizvedenog anorganskog ugljika i metana-C kao postotak izmjerene ili izračunane količine ugljika dodanog ispitivanoj tvari. Tijek biorazgradnje može se pratiti samo srednjim mjerenjima proizvodnje plina. Osim toga, primarna biorazgradnja može se odrediti specifičnim analizama na početku i na kraju ispitivanja.
|
INFORMACIJE O ISPITIVANOJ TVARI
|
7.
|
Trebali bi biti poznati čistoća, topljivost u vodi, hlapljivost i adsorpcijska svojstva ispitivane tvari kako bi se omogućilo ispravno tumačenje rezultata. Sadržaj organskog ugljika ( % w/w) ispitivane tvari mora biti poznat iz njezine kemijske strukture ili mjerenja. Za hlapljive ispitivane tvari izmjerena ili izračunana konstanta Henryjeva zakona pomaže pri odlučivanju je li ispitivanje primjenjivo. Informacije o toksičnosti ispitivane tvari za anaerobne bakterije korisne su pri odabiru odgovarajuće ispitne koncentracije te za tumačenje rezultata koji pokazuju slabu biorazgradivost. Preporučuje se uključiti kontrolu inhibicije, osim ako je poznato da ispitivana tvar ima inhibitorni učinak na anaerobne mikrobne aktivnosti (vidi stavak 21. i normu ISO 13641-1 (12)).
|
PRIMJENJIVOST ISPITNE METODE
|
8.
|
Ispitnu metodu moguće je primijeniti na tvari topljive u vodi; jednako tako, moguće ju je primijeniti na slabo topljive i netopljive tvari pod uvjetom da se upotrebljava metoda preciznog doziranja, npr. vidi normu ISO 10634 (13). Općenito govoreći, za hlapljive tvari potrebno je donijeti odluku za svaki slučaj zasebno. Možda je potrebno poduzeti posebne korake, primjerice ne ispuštati plin tijekom ispitivanja.
|
REFERENTNE TVARI
|
9.
|
Za provjeru postupka referentna tvar ispituje se paralelnim postavljanjem odgovarajućih posuda kao dijelom uobičajenih ispitnih nizova. Primjeri su fenol, natrijev benzonat i polietilen glikol 400 i očekuje se da bi se mogli razgraditi proizvodnjom plina većom od 60 % (tj. metan i anorganski ugljik) unutar 60 dana (3)(14).
|
MJERNA OBNOVLJIVOST REZULTATA ISPITIVANJA
|
10.
|
U međunarodnom prstenastom testu (14) postojalo je dobro ponovno ostvarivanje u mjerenjima tlaka plina između triju posuda. Relativna standardna devijacija (koeficijent varijacije, KV) uglavnom je bila ispod 20 %, iako se ova vrijednost često povećavala na > 20 % u prisutnosti toksičnih tvari ili prema kraju 60-dnevnog inkubacijskog razdoblja. Više devijacije pronađene su i u posudama zapremnine < 150 ml. Konačne pH-vrijednosti ispitnog medija bile su u rasponu 6,5 – 7,0.
|
|
11.
|
Sljedeći rezultati dobiveni su prstenastim ispitivanjem.
|
Ispitivana tvar
|
Ukupni podaci
n1
|
Srednja razgradnja
(ukupnih podataka)
(%)
|
Relativno standardno odstupanje
(ukupnih podataka)
(%)
|
Valjani podaci
n2
|
Srednja razgradnja
(valjanih podataka)
(%)
|
Relativno standardno odstupanje
(valjanih podataka)
(%)
|
Podaci > 60 % Razgradnje u valjanim ispitivanjima
n3
|
|
Palmitinska kiselina
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (37)
|
|
Polietilen Glikol 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Koeficijenti varijacije sredine svih vrijednosti dobivenih s palmitinskom kiselinom i polietilen glikolom 400 iznosili su 45 % (n = 36), odnosno 35 % (n = 38). Kada su izostavljene vrijednosti < 40 % i > 100 % (za prvo se pretpostavlja da je zbog niže od optimalnih uvjeta, a za potonje zbog nepoznatih razloga), KV-ovi su smanjeni na 26 %, odnosno na 23 %. Udjeli ‚valjanih’ vrijednosti koje su ostvarile barem 60 % razgradnje iznosile su 70 % za palmitinsku kiselinu i 83 % za polietilen glikol 400. Udjeli postotka biorazgradnje dobivene iz mjerenja otopljenog anorganskog ugljika bile su relativno niske, ali varijabilne. Za palmitinsku kiselinu raspon je bio 0 – 35 %, srednji 12 % s KV-om 92 % te za polietilen glikol 400 0 – 40 %, srednji 24 %, s KV-om od 54 %.
|
OPIS ISPITNE METODE
Aparatura
|
13.
|
Potrebna je uobičajena laboratorijska oprema te sljedeće:
|
a.
|
inkubator – otporan na iskre i kontroliran na 35 °C ± 2 °C;
|
|
b.
|
staklene posude otporne na tlak odgovarajuće nominalne veličine (38), od kojih je svaka opremljena plinonepropusnim septumom koji može podnijeti tlak oko 2 bar. Zapremnina plinskog prostora trebala bi iznositi oko 10 do 30 % ukupne zapremnine. Ako se bioplin redovno otpušta, prikladno je oko 10 % plinskog prostora, ali ako se plin otpušta samo na kraju, prikladno je 30 %. Prilikom otpuštanja tlaka i pri svakom mjerenju uzorkovanja preporučuju se staklene serum boce, nominalne vrijednosti 125 ml, ukupne zapremnine oko 160 ml, zabrtvljene serum septumima (39) i uvijenim aluminijskim prstenovima;
|
|
c.
|
uređaj za mjerenje tlaka (40) prilagođen za omogućivanje mjerenja i propuhivanja proizvedenog plina, primjerice ručni precizni mjerač tlaka spojen na odgovarajuću špricu s iglom; trostruki plinonepropusni ventil olakšava otpuštanje viška tlaka (Dodatak 1.). Interni volumen cijevi za mjerenje tlaka i ventila potrebno je održavati što nižim tako da pogreške koje nastale zanemarivanjem volumena opreme budu neznatne;
Napomena – Očitavanja tlaka upotrebljavaju se izravno za izračunavanje količine proizvedenog ugljika u plinskom prostoru (stavci od 42. do 44.). Druga je mogućnost da se očitavanja tlaka pretvore u volumene (na 35 °C, atmosferski tlak) proizvedenog plina s pomoću grafikona konverzije. Ovaj je grafikon sačinjen od podataka dobivenih injektiranjem poznatih volumena dušikova plina u niz ispitnih posuda (npr. serum boce) na temperaturi od 35 ° +/– 2 °C i bilježenjem rezultata stabiliziranih očitavanja tlaka (vidi Dodatak 2.). Izračun je prikazan u Napomeni u stavku 44.
Upozorenje – Pazite da se ne ozlijedite iglom tijekom upotreba mikrošprica.
|
|
d.
|
analizator ugljika, prikladan za izravno određivanje anorganskog ugljika u rasponu od 1 mg/l do 200 mg/l;
|
|
e.
|
šprice velike preciznosti za uzorke plina i tekućine;
|
|
f.
|
magnetske miješalice i uređaji za praćenje (fakultativno);
|
|
g.
|
komora za rukovanje s rukavicama (preporučuje se).
|
|
Reagensi
|
14.
|
Tijekom cijelog ispitivanja upotrebljavajte reagense analitičke čistoće.
|
Voda
|
15.
|
Destilirana ili deionizirana voda (deoksigenirana propuhivanjem s dušikovim plinom koji sadržava manje od 5 μl/l kisika) koja sadržava manje od 2 mg/l otopljenog organskog ugljika (DOC).
|
Ispitni medij
|
16.
|
Pripremite medij za razrjeđivanje da sadržava sljedeće sastojke u navedenim količinama;
|
Anhidridan kalijev dihidrogen fosfat (KH2PO4)
|
0,27 g
|
|
Dinatrijev monohidrogen ortofosfat dodekahidrat (Na2HPO4 · 12H2O))
|
1,12 g
|
|
Amonijakov klorid (NH4Cl)
|
0,53 g
|
|
Kalcijev klorid dihidrat (CaCl2 · 2H2O)
|
0,075g
|
|
Magnezijev klorid heksahidrat (MgCl2 · 6H2O)
|
0,10 g
|
|
Željezov (II) klorid tetrahidrat (FeCl2 · 4H2O)
|
0,02 g
|
|
Resazurin (indikator kisika)
|
0,001g
|
|
Natrijev sulfid nonahidrat (Na2S · 9H2O)
|
0,10 g
|
|
Radna otopina elemenata u tragovima (fakultativno, stavak 18.)
|
10 ml
|
|
Dodati deoksigeniranu vodu (stavak 15.)
|
jednoj litri
|
Napomena: Svježe isporučen natrijev sulfid trebao bi biti upotrijebljen ili ispran i osušen prije upotrebe kako bi se postigao redukcijski kapacitet. Ispitivanje se može provesti bez upotrebe komore za rukovanje s rukavicama (vidi stavak 26.). U tom slučaju konačna koncentracija natrijeva sulfida u mediju trebala bi se povećati do 0,20 g Na2S · 9H2O po litri. Natrijev sulfid moguće je dodati i iz odgovarajuće anaerobne radne otopine kroz septum zatvorenih ispitnih posuda jer će se tim postupkom smanjiti rizik od oksidacije. Natrijev sulfid moguće je zamijeniti titanovim (III) citratom, koji se dodaje kroz septum zatvorenih ispitnih posuda u konačnoj koncentraciji od 0,8 do 1,0 mmol/l. Titanov (III) citrat visoko je učinkovito redukcijsko sredstvo niske toksičnosti, koje se priprema na sljedeći način: Otopite 2,94 g trinatrijeva citrat dihidrata u 50 ml deoksigenirane vode (kako biste dobili otopinu od 200 mmol/l) i dodajte 5 ml 15 % (w/v) otopine titanova (III) klorida. Neutralizirajte do pH-vrijednosti 7 ± 0,2 s mineralnom lužinom i stavite u odgovarajuću posudu pod tok dušika. Koncentracija titanova (III) citrata u ovoj radnoj otopini iznosi 164 mmol/l.
|
|
17.
|
Pomiješajte sastojke ispitnog medija, osim redukcijskog sredstva (natrijev sulfid titanov citrat) i propuhujte otopinu s dušikovim plinom na otprilike 20 minuta netom prije upotrebe kako biste uklonili kisik. Zatim dodajte odgovarajući volumen svježe pripravljene otopine redukcijskog sredstva (pripremljenog u deoksigeniranoj vodi) netom prije upotrebe medija. Prema potrebi prilagodite pH-vrijednost medija s razrijeđenom mineralnom kiselinom ili lužinom na 7 ± 0,2.
|
Radna otopina elemenata u tragovima (fakultativno)
|
18.
|
Preporučuje se da ispitni medij sadržava sljedeće elemente u tragovima radi poboljšanja postupaka anaerobne razgradnje, osobito ako se upotrebljavaju niske koncentracije (npr. 1 g/l) inokuluma (11).
|
Manganov klorid tetrahidrat (MnCl2 · 4H2O)
|
50 mg
|
|
Borna kiselina (H3BO3)
|
5 mg
|
|
Cinkov klorid (ZnCl2)
|
5 mg
|
|
Bakar (II) klorid (CuCl2)
|
3 mg
|
|
Dinatrijev molibdat dihidrat (Na2MoO4 · 2H2O)
|
1 mg
|
|
Kobalt klorid tetrahidrat (CoCl2 · 6H2O)
|
100 mg
|
|
Nikal klorid heksahidrat (NiCl2 · 6H2O)
|
10 mg
|
|
Dinatrijev selenit (Na2SeO3)
|
5 mg
|
|
Dodati deoksigeniranu vodu (stavak 15.)
|
jednoj litri
|
|
Ispitivana tvar
|
19.
|
Dodajte ispitivanu tvar kao radnu otopinu, suspenziju, emulziju ili izravno kao krutu ili tekuću tvar, ili absorbiranu na filtar od staklenih vlakana za dobivanje koncentracije ne veće od 100 ml/l organskog ugljika. Ako se upotrebljavaju radne otopine, pripravite prikladnu otopinu s vodom (stavak 15.) (prethodno deoksiginirana propuhivanjem s dušikovim plinom) čija je snaga tolika da dodani volumen bude manji od 5 % ukupnog volumena reakcijske smjese. Prema potrebi prilagodite pH-vrijednost radne otopine na 7 ± 0,2. Za ispitivane tvari koje nisu dovoljno topljive u vodi konzultirajte normu ISO 10634 (13). Ako se upotrebljava otapalo, pripremite dodatnu kontrolu tako da otapalo dodate samo inokuliranog medija. Potrebno je izbjegavati organska otapala za koja se zna da inhibiraju proizvodnju metana, poput kloroforma i ugljikova tetraklorida.
Upozorenje – Oprezno rukujte toksičnim ispitivanim tvarima te tvarima s nepoznatim svojstvima.
|
Referentne tvari
|
20.
|
Referentne tvari kao što su natrijev benzonat, fenol i polietilen glikol 400 uspješno su upotrijebljeni za provjeru postupka jer su biorazgrađeni za više od 60 % unutar 60 dana. Pripravite radnu otopinu (u deoksigeniranoj vodi) odabrane referentne tvari na isti način kao što ste pripravili ispitivanu tvar i prema potrebi prilagodite na pH-vrijednost 7 ± 0,2.
|
Kontrola inhibicije (uvjetovana)
|
21.
|
Za dobivanje informacija o toksičnosti ispitivane tvari za anaerobne mikroorganizme u svrhu postizanja najprikladnije ispitne koncentracije, dodajte ispitivanu tvar i referentnu tvar posudi s ispitnim medijem (vidi stavak 16.), odnosno svaku u istoj koncentraciji kako je dodano (vidi stavke 19. i 20. i vidi normu ISO 13641-1 (12)).
|
Razgrađeni mulj
|
22.
|
Prikupite razgrađeni mulj iz digestera na postrojenju za pročišćavanje otpadnih voda na kojem se pretežno pročišćava komunalni otpad. Mulj je potrebno potpuno opisati te izvijestiti o pozadinskim informacijama (vidi stavak 15.). Ako se namjerava upotrijebiti prilagođeni inokulum, može se razmotriti upotreba razgrađenog mulja iz postrojenja za pročišćavanje industrijskih otpadnih voda. Za prikupljanje razgrađenog mulja upotrijebite boce širokoga grla izrađene od polietilena visoke gustoće ili sličnog materijala koji se može proširiti. Dodajte mulj do unutar oko 1 cm vrha boca i čvrsto zabrtvite, po mogućnosti sigurnosnim ventilom. Nakon prijevoza u laboratorij prikupljeni mulj moguće je upotrebljavati izravno ili ga staviti u laboratorijski digester. Otpustite višak bioplina opreznim otvaranjem boca s muljem. Druga je mogućnost da se anaerobni mulj uzgojen u laboratoriju može upotrebljavati kao izvor inokuluma, ali spektar njegovih aktivnosti mogao bi biti oslabljen.
Upozorenje – Razgrađeni mulj proizvodi zapaljive plinove koji predstavljaju rizik od požara i eksplozije: sadržava i potencijalno patogene organizme, stoga poduzmite odgovarajuće mjere opreza pri rukovanju muljem. Zbog sigurnosnih razloga tijekom prikupljanja mulja ne upotrebljavajte staklene posude.
|
|
23.
|
Kako bi se smanjila proizvodnja pozadinskog plina i kako bi se smanjio utjecaj slijepih proba, može se razmotriti mogućnost prethodne razgradnje mulja. Ako je potrebno napraviti prethodnu razgradnju, potrebno je omogućiti da se mulj razgradi bez dodavanja ikakvih nutrijenata ili supstrata na 35 °C ± 2 °C na razdoblje do sedam dana. Dokazano je da se prethodnom razgradnjom u trajanju od otprilike pet dana uobičajeno dobiva optimalno smanjenje proizvodnje plina u slijepoj probi bez neprihvatljivih povećanja razdoblja prilagodbe ili inkubacije tijekom ispitne faze ili gubitka aktivnosti prema malom broju ispitivanih tvari.
|
|
24.
|
Za slabo razgradive ispitivane tvari ili za one tvari za koje se očekuje da će biti slabo razgradive, razmotrite prethodno izlaganje mulja ispitivanoj tvari kako biste dobili bolje prilagođen inokulum. U tom slučaju dodajte ispitivanu tvar u koncentraciji organskog ugljika od 5 ml/l do 20 mg/l razgrađenom mulju i inkubiranom u razdoblju do dva tjedna. Pažljivo isperite prethodno izložen mulj prije upotrebe (vidi stavak 25.) i u izvješću o ispitivanju naznačite uvjete prethodnog izlaganja.
|
Inokulum
|
25.
|
Isperite mulj (vidi stavke od 22. do 24.) netom prije upotrebe kako biste smanjili koncentraciju anorganskog ugljika na ispod 10 mg/l u završnoj ispitnoj suspenziji. Centrifugirajte mulj u zabrtvljenim cijevima (npr. 3 000 g tijekom 5 min) i ispustite supernatant. Suspendirajte dobiveni talog u deoksigeniranom mediju (stavci 16. i 17.), ponovno centrifugirajte suspenziju i ispustite tekući supernatant. Ako se anorganski ugljik nije uspješno spustio, postupak ispiranja mulja moguće je ponoviti najviše dva puta. Čini se da to ne utječe štetno na mikroorganizme. Konačno, suspendirajte talog u potrebnoj količini ispitnog medija i odredite ukupnu koncentraciju krutih tvari [npr. ISO 11923 (15)]. Konačna ukupna koncentracija krutih tvari u posudama trebala bi biti u rasponu od 1 g/l do 3 g/l (ili oko 10 % toga u nerazrijeđenom razgrađenom mulju). Poduzmite sve prethodno navedene radnje tako da mulj bude u najmanjem doticaju s kisikom (npr. upotrijebite dušikovu atmosferu).
|
POSTUPAK ISPITIVANJA
|
26.
|
Provedite sljedeće početne postupke koristeći se tehnikama kojima će doticaj između razgrađenog mulja i kisika ostati što je niže izvedivo, na primjer, možda će biti potrebno raditi u komori za rukovanje s rukavicama u atmosferi dušika i/ili pročistiti boce s dušikom (4).
|
Priprema ispitnih i kontrolnih analiza
|
27.
|
Pripremite barem tri ispitne posude (vidi stavak 13.b) za ispitivanu tvar, slijepe probe, referentnu tvar, kontrole inhibicijom (uvjetovane) i posude za kontrolu tlaka (fakultativni postupak) (vidi stavke 7. i od 19. do 21.). Mogu biti pripremljene i dodatne posude za procjenu primarne biorazgradnje s pomoću specifičnih analiza ispitivane tvari. Isti skup slijepih proba može se upotrebljavati za nekoliko ispitivanih tvari u istom ispitivanju dokle god su volumeni plinskog prostora dosljedni.
|
|
28.
|
Pripremite razrijeđeni inokulum prije dodavanja posudama primjerice s pomoću pipete sa širokim otvorom. Dodajte alikvote dobro izmiješanog inokuluma (stavak 25.) tako da ukupna koncentracija krutih tvari bude jednaka u svim posudama (između 1 g/l i 3 g/l). Prema potrebi dodajte radne otopine ispitivanoj i referentnoj tvari nakon prilagodbe na pH-vrijednost 7 ± 0,2. Ispitivanu tvar i referentnu tvar potrebno je dodati najprikladnijim načinom primjene (stavak 19.).
|
|
29.
|
Ispitna koncentracija organskog ugljika trebala bi uobičajeno iznositi između 20 i 100 mg/l (stavak 4.). Ako je ispitivana tvar toksična, ispitna koncentracija trebala bi biti smanjena na 20 mg/l ili čak i manje ako će se mjeriti samo primarna biorazgradnja specifičnim analizama. Potrebno je napomenuti da se varijabilnost rezultata ispitivanja povećava na nižim ispitnim koncentracijama.
|
|
30.
|
Za posude sa slijepim probama dodajte istovjetnu količinu nosača koji se upotrebljava za doziranje ispitivane tvari umjesto radne otopine, suspenzije ili emulzije. Ako je ispitivana tvar bila dodana s pomoću filtara od staklenih vlakana ili organskih otapala, slijepim probama dodajte filtar ili istovjetnu količinu otapala koje je isparilo. Pripremite dodatno ponovljeno višestruko određivanje s ispitivanom tvari za mjerenje pH-vrijednosti. Prema potrebi prilagodite pH-vrijednost na 7 ± 0.2, s malim količinama razrijeđene mineralne kiseline ili lužine. Potrebno je dodati iste količine sredstava za neutralizaciju svim ispitnim posudama. Ta dodavanja nije bilo potrebno provesti jer je pH-vrijednost radnih otopina ispitivanih tvari i referentne tvari već bila prilagođena (vidi stavke 19. i 20.). Ako će se mjeriti primarna biorazgradnja, potrebno je uzeti odgovarajući uzorak iz posude za kontrolu pH-vrijednosti ili iz dodatne ispitne posude i koncentracija ispitivane tvari trebala bi se mjeriti s pomoću specifičnih analiza. Svim je posudama moguće dodati pokrivene magnete ako treba izmiješati reakcijsku smjesu (fakultativno).
|
|
31.
|
Pobrinite se da su ukupna količina tekućine V1 i volumen plinskog prostora Vh isti u svim posudama; zabilježite vrijednosti od V1 i Vh. Svaka posuda trebala bi biti zabrtvljena plinskim septumom i premještena iz komore za upravljanje s rukavicama (vidi stavak 26.) u inkubator (vidi stavak 13.a).
|
Netopljive ispitivane tvari
|
32.
|
Dodajte odvagane količine tvari koje su slabo topljive u vodi izravno u pripremljene posude. Kada je potrebna upotreba otapala (vidi stavak 19.), premjestite tekućinu ispitivane tvari u prazne posude. Kad je moguće, isparite otapalo puštanjem dušikova plina kroz posude i zatim dodajte ostale sastojke, odnosno razrijeđeni mulj (stavak 25.) i deoksigeniranu vodu prema potrebi. Potrebno je pripremiti i dodatnu kontrolnu skupinu s otapalom (vidi stavak 19.). Za ostale metode dodavanja netopljivih tvari može se konzultirati normu ISO 10634 (13). Tekuće ispitivane tvari mogu se dozirati s pomoću šprice u potpuno pripremljene zabrtvljene posude ako je očekivano da početna pH-vrijednost neće prijeći 7 ± 1, u tom slučaju dozirajte kako je prethodno opisano (vidi stavak 19.).
|
Inkubacija i mjerenja tlaka plina
|
33.
|
Inkubirajte pripremljene posude na 35 °C ± 2 °C na otprilike sat vremena kako biste omogućili izjednačavanje i otpuštanje viška plina u atmosferu, primjerice naizmjeničnim protresanjem svake posude, umetanjem igle mjerača tlaka (stavak 13-c) kroz čep i otvaranjem ventila dok mjerač tlaka ne očita nulu. Ako je u ovoj fazi ili pri srednjim mjerenjima tlak plinskog prostora niži od atmosferskoga, potrebno je uvesti dušikov plin za ponovnu uspostavu atmosferskog tlaka. Zatvorite ventil (vidi stavak 13-c) i nastavite s inkubacijom u mraku te se pobrinite da svi se dijelovi posuda održavaju na temperaturi razgradnje. Promatrajte posude nakon inkubacije od 24 do 48 sati. Odbacite one posude čiji sadržaj ima jasnu ružičastu boju u tekućem supernatantu, tj. ako je resazurin (vidi stavak 16.) promijenio boju, čime se naznačuje prisutnost kisika (vidi stavak 50.). Manje količine kisika u sustavu mogu se tolerirati, ali više koncentracije mogu ozbiljno inhibirati tijek anaerobne biorazgradnje. Odbacivanje pojedinačnih posuda iz skupine od triju posuda može biti prihvatljivo, ali u slučaju da ih veći broj ne valja, potrebno je provesti istragu eksperimentalnih postupaka te ponoviti ispitivanje.
|
|
34.
|
Pažljivo pomiješajte sadržaj svake posude miješanjem ili protresanjem nekoliko minuta barem dva do tri puta tjedno i netom prije svakog mjerenja tlaka. Mjerenjem se ponovno suspendira inokulum i osigurava se uravnoteženost plinova. Sva mjerenja tlaka potrebno je provoditi brzo s obzirom na to da bi posude mogle biti izložene snižavanju temperature, što može dovesti do lažnih očitavanja. Tijekom mjerenja tlaka cijelu je ispitnu posudu, uključujući plinski prostor, potrebno održavati na temperaturi razgradnje. Mjeri se tlak plina, primjerice umetanjem kroz septum šprice s iglom (stavak 13-c) povezanom s mjeračem tlaka. Potrebna je pažnja kako bi se spriječio ulazak vode u špricu s iglom; ako se to dogodi, potrebno je osušiti mokre dijelove i uvesti novu iglu. Tlak je potrebno mjeriti u milibarima (vidi stavak 42.). Tlak plina u posudama može se mjeriti s vremena na vrijeme, npr. tjedno i fakultativno, višak plina ispušta se u atmosferu. Druga je mogućnost da se tlak mjeri samo na kraju ispitivanja kako bi se odredila količina proizvedenog bioplina.
|
|
35.
|
Preporučuje se da se provedu srednja očitavanja tlaka plina jer povećanje tlaka služi kao smjernica kada bi ispitivanje moglo završiti i omogućuje praćenje kinetike (vidi stavak 6.).
|
|
36.
|
Uobičajeno ispitivanje završite nakon razdoblja inkubacije od 60 dana, osim ako je krivulja biorazgradnje koja je dobivena iz mjerenja tlaka prije toga dosegla fazu platoa; riječ je o fazi u kojoj je dosegnuta maksimalna razgradnja i krivulja razgradnje je izravnana. Ako je vrijednost platoa manja od 60 %, tumačenje postaje problematično jer se naznačuje da je mineraliziran samo dio molekule ili da je napravljena pogreška. Na kraju uobičajenog razdoblja inkubacije plin se proizvodi, ali faza platoa očito nije dosegnuta, tada je potrebno razmotriti produljivanje ispitivanja kako bi se provjerilo hoće li plato (> 60 %) biti dosegnut.
|
Mjerenje anorganskog ugljika
|
37.
|
Na kraju ispitivanja nakon posljednjeg mjerenja tlaka plina pustite mulj da se istaloži. Naizmjence otvorite svaku posudu i odmah uzmite uzorak za određivanje koncentracije (mg/l) anorganskog ugljika (IC) u suspenziji supernatanta. Nije potrebno primijeniti ni centrifugiranje ni filtriranje suspenzije supernatanta jer bi došlo do neprihvatljivog gubitka otopljenog ugljikova dioksida. Ako je suspenziju nemoguće analizirati ili uzorkovati, pohranite je u zabrtvljenu bočicu, bez plinskog prostora i ohlađenu na oko 4 °C na razdoblje do dva dana. Nakon mjerenja anorganskog ugljika izmjerite i zabilježite pH-vrijednost.
|
|
38.
|
Druga je mogućnost da anorganski ugljik u supernatantu bude određen neizravno otpuštanjem razrijeđenog anorganskog ugljika kao ugljikova dioksida koji se može izmjeriti u plinskom prostoru. Slijedeći posljednje mjerenje tlaka plina, prilagodite tlak u svakoj posudi atmosferskom tlaku. Acidificirajte sadržaj svake posude na otprilike pH-vrijednost 1 dodavanjem koncentriranih mineralnih kiselina (npr. H2SO4) kroz septum zabrtvljenih posuda. Inkubirajte protresene posude na 35 °C ± 2 °C na otprilike 24 sata i mjerite tlak plina koji je nastao iz razvijenog ugljikova dioksida s pomoću mjerača tlaka.
|
|
39.
|
Slično očitajte odgovarajuće slijepe probe, referentnu tvari i, ako su uključene, posude za kontrolu inhibicijom (vidi stavak 21.).
|
|
40.
|
U nekim slučajevima, posebno ako se iste kontrolne posude upotrebljavaju za nekoliko ispitivanih tvari, mjerenja srednje koncentracije anorganskog ugljika u ispitnim i kontrolnim posudama potrebno je razmotriti prema potrebi. U tom slučaju potrebno je pripremiti dovoljan broj posuda za sva srednja mjerenja. U ovom postupku prednost se daje uzimanju uzoraka samo iz jedne posude. Potonje se može učiniti samo ako potrebna količina otopljenog anorganskog ugljika za analizu nije procijenjena visokom. Mjerenje otopljenog anorganskog ugljika potrebno je provesti nakon mjerenja tlaka plina bez otpuštanja viška plina kako je opisano u nastavku:
|
—
|
uzmite što je moguće manju količinu uzoraka supernatanta špricom kroz septum bez otvaranja posuda i određen je otopljeni anorganski ugljik u uzorku;
|
|
—
|
nakon uzimanja uzorka višak plina otpušta se ili ne otpušta;
|
|
—
|
potrebno je uzeti u obzir činjenicu da čak i malo smanjenje u količini supernatanta (npr. oko 1 %) može dati znatno povećanje u volumenu plina plinskog prostora (Vh);
|
|
—
|
jednadžbe (vidi stavak 44.) su ispravljene povećanjem Vh u jednadžbi 3 prema potrebi.
|
|
Specifične analize
|
41.
|
Ako će se odrediti primarna anaerobna razgradnja (vidi stavak 30.), uzmite odgovarajuću količinu uzorka za specifične analize na početku i na kraju ispitivanja iz posuda koje sadržavaju ispitivanu tvar. Ako je to napravljeno, imajte na umu da će volumeni plinskog prostora (Vh) i tekućine(Vl) biti promijenjeni i uzmite to u obzir pri izračunavanju rezultata proizvodnje plina. Druga je mogućnost da se uzorci uzmu za specifične analize iz dodatnih mješavina prethodno napravljenih u ovu svrhu (stavak 30.).
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
42.
|
Zbog praktičnih razloga tlak plina mjeri se u milibarima (1 mbar = 1h Pa = 102 Pa; 1 Pa = 1 N/m2), volumen u litrama i temperatura u stupnjevima Celzijevima.
|
Ugljik u plinskom prostoru
|
43.
|
Budući da jedna molekula metana i jedna molekula ugljikova dioksida sadržavaju 12 g ugljika, masa ugljika u danom volumenu razvijenog plina može biti izražena kao:
|
m= 12 × 103×n
|
Jednadžba [1]
|
pri čemu je:
|
m
|
=
|
masa ugljika (mg) u danom volumenu razvijenog plina;
|
|
12
|
=
|
relativna atomska masa ugljika;
|
|
n
|
=
|
broj molekula plina u danom volumenu.
|
Ako je neki drugi plin osim metana ili ugljikova dioksida (npr. N2O) proizveden u znatnim količinama, formulu [1] potrebno je izmijeniti kako bi se opisala mogućnost učinaka proizvedenih plinova.
|
|
44.
|
Iz plinskih zakona n je moguće izraziti kao:
|
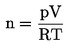
|
Jednadžba [2]
|
pri čemu je:
|
p
|
=
|
tlak plina (Pascali);
|
|
V
|
=
|
volumen plina (m3);
|
|
R
|
=
|
molarna plinska konstanta [8,314 J/(mol K)];
|
|
T
|
=
|
temperatura inkubacije (Kelvini).
|
Kombiniranjem jednadžbi [1] i [2] i racionaliziranjem kako bi se omogućila proizvodnja plina slijepih roba:
|

|
Jednadžba [3]
|
pri čemu je:
|
mh
|
=
|
masa neto ugljika proizvedenog kao plina u plinskom prostoru (mg);
|
|
Dp
|
=
|
sredina razlike između početnog i završnog tlaka u ispitnim posudama minus odgovarajuća sredina u slijepim probama (milibari);
|
|
Vh
|
=
|
volumen plinskog prostora u posudi (l);
|
|
0,1
|
=
|
pretvaranje njutna/m2 u milibare i m3 u litre.
|
Jednadžbu [4] potrebno je upotrebljavati za uobičajenu temperaturu inkubacije od 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
Jednadžba [4]
|
Napomena: Izračunavanje alternativnog volumena. Očitavanja mjerača tlaka pretvaraju se u ml plina proizvedenog s pomoću standardne krivulje dobivene grafičkim prikazom volumena (ml) injektiranog u naspram očitavanja mjerača (Dodatak 2.). Broj molekula (n) plina u plinskom prostoru svake posude izračunava se dijeljenjem sveukupne proizvodnje plina (ml) s 25 286 ml/molekuli, što je volumen koji zauzima jedna molekula plina na 35 °C i standardnom atmosferskom tlaku. Budući da svaka molekula CH4 i molekula CO2 sadržava 12 g ugljika, količina ugljika (mg) u plinskom prostoru (mh
) dobiva se jednadžbom [5]:
|
mh
= 12 × 103×n
|
Jednadžba [5]
|
Racionaliziranje kako bi se omogućila proizvodnja plina u slijepoj kontroli:
|

|
Jednadžba [6]
|
pri čemu je:
|
mh
|
=
|
masa neto ugljika proizvedenog u plinskom prostoru (mg);
|
|
DV
|
=
|
sredina razlike između volumena plina proizvedenog u plinskom prostoru u ispitnim posudama i posudama za kontrolnu slijepu probu;
|
|
25 286
|
=
|
volumen koji zauzima jedna molekula plina na 35 °C, jedna atmosfera.
|
|
|
45.
|
Tijek biorazgradnje može se slijediti grafičkim prikazom ukupnog povećanja tlaka Dp (milibari) u ovisnosti o vremenu, prema potrebi. Iz ove krivulje odredite i zabilježite fazu prilagodbe (u danima). Faza prilagodbe jest vrijeme od početka ispitivanja do početka znatne razgradnje (za primjer vidi Dodatak 3.). Ako su srednji uzorci supernatanta uzeti i analizirani (vidi stavke 40., 46. i 47.), tada ukupni proizvedeni C (u plinu plus onaj u tekućini) može biti grafički prikazan umjesto samo sveukupnog tlaka.
|
Ugljik u tekućini
|
46.
|
Količina metana u tekućini zanemaruje se jer je poznato da je njegova topljivost u vodi vrlo niska. Izračunajte masu anorganskog ugljika u tekućini ispitnih posuda s pomoću jednadžbe [7]:
|
ml
=Cnet
×Vl
|
Jednadžba [7]
|
pri čemu je:
|
ml
|
=
|
masa anorganskog ugljika u tekućini (mg);
|
|
Cnet
|
=
|
koncentracija anorganskog ugljika u ispitnim posudama minus koncentracija u kontrolnim posudama na kraju ispitivanja (mg/l);
|
|
Vh
|
=
|
volumen tekućine u posudi (l);
|
|
Ukupni isplinjeni ugljik
|
47.
|
Izračunajte ukupnu masu isplinjenog ugljika u posudi s pomoću jednadžbe [8]:
pri čemu je:
|
|
mt
= ukupna masa isplinjenog ugljika (mg);
|
|
|
mh
i ml
prethodno su definirani.
|
|
Ugljik ispitivane tvari
|
48.
|
Izračunajte masu ugljika u ispitivanoj tvari dobivenu iz dodane ispitivane tvari s pomoću jednadžbe [9]:
pri čemu je:
|
mv
|
=
|
masa ugljika ispitivane tvari (mg);
|
|
Cc
|
=
|
koncentracija ugljika ispitivane tvari u ispitnoj posudi (mg/l)
|
|
Vh
|
=
|
volumen tekućine u ispitnoj posudi (l).
|
|
Doseg biorazgradnje
|
49.
|
Izračunajte postotak biorazgradnje iz plina iz plinskog prostora s pomoću jednadžbe [10] i ukupan postotak biorazgradnje s pomoću jednadžbe [11]:
|
Dh
= (mh
/mv
) × 100
|
Jednadžba [10]
|
|
Dt
= (mt
/mv
) × 100
|
Jednadžba [11]
|
pri čemu je:
|
|
Dh
= biorazgradnja iz plina plinskog prostora ( %);
|
|
|
Dt
= ukupna biorazgradnja ( %);
|
|
|
mh
, mv
i mt
prethodno su definirani.
|
Stupanj primarne biorazgradnje izračunava se iz (fakultativnih) mjerenja koncentracije ispitivane tvari na početku i kraju inkubacije s pomoću jednadžbe [12]:
|
Dp
= (1 –Se
/Si
) × 100
|
Jednadžba [12]
|
pri čemu je:
|
Dp
|
=
|
primarna razgradnja ispitivane tvari ( %);
|
|
Si
|
=
|
početna koncentracija ispitivane tvari (mg/l);
|
|
Se
|
=
|
koncentracija ispitivane tvari na kraju (mg/l).
|
Ako se metodom analize naznačuju znatne koncentracije ispitivane tvari u neizmijenjenom inokulumu anaerobnog mulja, upotrijebite jednadžbu [13]:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
Jednadžba [13]
|
pri čemu je:
|
Dp
1
|
=
|
ispravljena primarna razgradnja ispitivane tvari ( %);
|
|
Sib
|
=
|
početna ‚očita’ koncentracija ispitivane tvari (mg/l);
|
|
Sib
|
=
|
‚očita’ koncentracija ispitivane tvari u kontroli slijepim probama (mg/l);
|
|
Valjanost rezultata
|
50.
|
Očitavanja tlaka potrebno je upotrebljavati samo iz posuda koje ne pokazuju ružičastu boju (vidi stavak 33.). Kontaminacija kisikom svodi se na najmanju mjeru upotrebom odgovarajućih anaerobnih tehnika rukovanja.
|
|
51.
|
Potrebno je uzeti u obzir činjenicu da je ispitivanje valjano ako referentna tvar dosegne plato koji predstavlja više od 60 % biorazgradnje (41).
|
|
52.
|
Ako je pH-vrijednost na kraju ispitivanja premašila raspon 7 ± 1 i dogodila se nedovoljna biorazgradnja, ponovite ispitivanje s povećanjem puferskog kapaciteta medija.
|
Inhibicija razgradnje
|
53.
|
Proizvodnja plina u posudama koje sadržavaju i ispitivanu tvar i referentnu tvar trebala bi biti barem jednaka plinu u posudama koje sadržavaju samo referentnu tvar; u suprotnome naznačuje se inhibicija proizvodnje plina. U nekim slučajevima proizvodnja plina u posudama koje sadržavaju ispitivanu tvar bez referentne tvari bit će niža od proizvodnje u slijepim probama, naznačujući da je ispitivana tvar inhibitorna.
|
Izvješće o ispitivanju
|
54.
|
Izvješće o ispitivanju mora obuhvaćati sljedeće informacije:
|
|
Ispitivana tvar:
|
—
|
uobičajeni naziv, kemijski naziv, CAS broj, strukturna formula i relevantna fizikalno-kemijska svojstva;
|
|
—
|
čistoća (nečistoće) ispitivane tvari.
|
|
|
|
Uvjeti ispitivanja:
|
—
|
količine razrijeđene suspenzije iz digestera (Vl
) i plinskog prostora (Vh
) u posudi;
|
|
—
|
opis ispitnih posuda, glavnih karakteristika mjerenja bioplina (npr. vrsta mjerača tlaka) i analizatora anorganskog ugljika;
|
|
—
|
primjena ispitivane tvari i referentne tvari na sustav ispitivanja: upotrijebljena ispitna koncentracija i svaka upotreba otapala;
|
|
—
|
detaljne informacije o upotrijebljenom inokulumu: naziv postrojenja za pročišćavanje otpadnih voda, opis izvora pročišćene vode (npr. radna temperatura, vrijeme zadržavanja mulja, pretežno komunalni itd.), koncentracija, sve informacije koje su potrebne kako bi se ovo potkrijepilo te svako prethodno čišćenje inokuluma (npr. prethodna razgradnja, prethodno izlaganje);
|
|
—
|
temperatura inkubacije;
|
|
|
|
Rezultati:
|
—
|
pH-vrijednost i vrijednosti anorganskog ugljika na kraju ispitivanja;
|
|
—
|
koncentracija ispitivane tvari na početku i kraju ispitivanja ako je izvedeno specifično mjerenje;
|
|
—
|
svi izmjereni podaci prikupljeni tijekom ispitivanja, slijepa proba, referentna tvar i posude za kontrolu inhibicijom, prema potrebi (npr. tlak u milibarima, koncentracija anorganskog ugljika (mg/l) u tabličnom obliku (o izmjerenim podacima za plinski prostor i tekućinu potrebno je odvojeno obavijestiti);
|
|
—
|
statistička obrada podataka, trajanje ispitivanja i dijagram biorazgradnje ispitivane tvari, referentne tvari i kontrola inhibicijom;
|
|
—
|
postotak biorazgradnje ispitivane tvari i referentne tvari;
|
|
—
|
obrazloženje odbijanja rezultata ispitivanja;
|
|
—
|
rasprava o rezultatima.
|
|
|
LITERATURA
|
(1)
|
Sljedeća poglavlja ovog Priloga:
|
|
C.4. Određivanje ‚lake’ biorazgradivosti;
|
|
|
C.9. Biorazgradnja – Zahn-Wellensov test;
|
|
|
C.10. Biorazgradnja – Simulacijski testovi s aktivnim muljem:
A: Jedinice s aktivnim muljem, B: Biofilmovi;
|
|
|
C.11. Aktivni mulj, test inhibicije disanja (oksidacija ugljika i amonijaka).
|
|
|
(2)
|
OECD (2009.) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OECD, Pariz
|
|
(3)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W.E., Pagga,U., Steber, J., Reust, H. and Bontinck, W.J. (1989.) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527. – 1550. (Objavljeno i kao dokument ECETOC Technical Report No. 28, lipanj 1988.).
|
|
(4)
|
Shelton D.R. and Tiedje, J.M. (1984.) General method for determining anaerobic biodegradation potential. Appl. Environ. Mircobiology, 47, 850. – 857.
|
|
(5)
|
Owen, W.F., Stuckey, DC., Healy J.B., Jr, Young L.Y. and McCarty, P.L. (1979.) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485. – 492.
|
|
(6)
|
Healy, J.B.Jr. and Young, L.Y. (1979.) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84. – 89.
|
|
(7)
|
Gledhill, W.E. (1979.) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Radni dokument. 2. nacrt br. 35.24. Američko društvo za ispitivanje materijala, Philadelphia.
|
|
(8)
|
Battersby, N.S. and Wilson, V. (1988.) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441. – 2460.
|
|
(9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
|
|
(10)
|
US-EPA (1998.) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
(11)
|
Međunarodna organizacija za normizaciju (1995.) ISO 11 734 Water Quality – Evaluation of the ultimate anaerobic biodegradation of organic compounds in digested sludge – Method by measurement of the biogas production.
|
|
(12)
|
Međunarodna organizacija za normizaciju (2003.) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1 General Test.
|
|
(13)
|
Međunarodna organizacija za normizaciju (1995.) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(14)
|
Pagga, U. and Beimborn, D.B., (1993.) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499. – 1509.
|
|
(15)
|
Međunarodna organizacija za normizaciju (1997.) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Dodatak 1.
Primjer uređaja za mjerenje proizvodnje bioplina tlakom plina

Legenda:
|
1
|
–
|
Mjerač tlaka
|
|
2
|
–
|
Trostruki plinonepropusni ventil
|
|
3
|
–
|
Šprica s iglom
|
|
4
|
–
|
Plinonepropusna brtva (uvijeni čep i septum)
|
|
5
|
–
|
Plinski prostor (Vh
)
|
|
6
|
–
|
Inokulum razgrađenog mulja (Vl
)
|
Ispitne posude u okolišu na 35 °C ± 2 °C
Dodatak 2.
Pretvaranje mjerača tlaka
Očitavanja mjerača tlaka mogu biti povezana s volumenima plina putem standardne krivulje koja nastaje injektiranjem poznatih količina zraka na 35 °C ± 2 °C u serum boce koje sadržavaju količinu vode jednaku količini reakcijske smjese, V
R:
|
—
|
Stavite V
R ml alikvota vode, čuvanih na 35 °C ± 2 °C u pet serum boca. Zabrtvite boce i stavite ih u vodenu kupku na 35 °C na jedan sat kako bi se izjednačile;
|
|
—
|
Uključite mjerač tlaka, pričekajte da se stabilizira i prilagodite na nulu;
|
|
—
|
Umetnite špricu s iglom kroz brtvu jedne od boca, otvorite ventil dok mjerač tlaka ne očita nulu te zatvorite ventil;
|
|
—
|
Ponovite postupak s preostalim bocama;
|
|
—
|
Injektirajte 1 ml zraka na 35 °C ± 2 °C u svaku bocu. Umetnite iglu (na mjeraču) kroz brtvu jedne od boca i pričekajte da se očitavanje tlaka stabilizira. Zabilježite tlak, otvorite ventil dok mjerač tlaka ne očita nulu i zatim zatvorite ventil;
|
|
—
|
Ponovite postupak s preostalim bocama;
|
|
—
|
Ponovite u potpunosti prethodni postupak s pomoću 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml i 50 ml zraka;
|
|
—
|
Grafički prikažite krivulju tlaka (Pa) naspram injektiranog volumena plina Vb (ml). Odgovor instrumenta jest linearan u rasponu od 0 Pa do 70 000 Pa i od 0 ml do 50 ml proizvodnje plina.
|
Dodatak 3.
Primjer krivulje razgradnje (sveukupno neto povećanje tlaka)

Dodatak 4.
Primjer obrasca za ispitivanje anaerobne biorazgradnje – Obrazac za ispitivanu tvar
|
Laboratorij: …
|
Ispitivana tvar: …
|
Ispitivanje br.: …
|
|
Temperatura ispitivanja:(°C): …
|
Volumen plinskog prostora (V
h): …(l)
|
Volumen tekućine (V
l ): …(l)
|
|
Ugljik u ispitivanoj tvari C
c,v: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Dan
|
p
1 (ispitivana tvar)
(mbar)
|
p
2 (ispitivana tvar)
(mbar)
|
p
3 (ispitivana tvar)
(mbar)
|
p (ispitivana tvar)
srednja vrijednost
(mbar)
|
p
4 (slijepa proba)
(mbar)
|
p
5 (slijepa proba)
(mbar)
|
p
6 (slijepa proba)
(mbar)
|
p (slijepa proba)
srednja vrijednost
(mbar)
|
p (neto)
ispitivana tvar – slijepa proba
srednja vrijednost (mbar)
|
Δ
p (neto)
Sveukupno
(mbar)
|
m
h
plinski prostor C
(43)
(mg)
|
D
h
Biorazgradnja (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
ispitivana tvar
(mg)
|
C
IC, 2
ispitivana tvar
(mg)
|
C
IC, 3
ispitivana tvar
(mg)
|
C
IC
srednja vrijednost ispitivane tvari
(mg)
|
C
IC, 4
slijepa proba
(mg)
|
C
IC, 5
slijepa proba
(mg)
|
C
IC, 6
slijepa proba
(mg)
|
C
IC
srednja vrijednost slijepe probe
(mg)
|
C
IC, net
ispitivana tvar – slijepa proba
srednja vrijednost
(mg)
|
m
l
tekućina C (45)
(mg)
|
m
t
ukupno C (46)
(mg)
|
D
t
Biorazgradnja (47)
(%)
|
|
Anorganski ugljik (kraj)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH-vrijednost (kraj)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laboratorij: …
|
Referentna tvar: …
|
Ispitivanje br.: …
|
|
Temperatura ispitivanja:(°C): …
|
Volumen plinskog prostora (V
h): …(l)
|
Volumen tekućine (V
l ) (u litrama): …
|
|
Ugljik u referentnoj tvari C
c,v (mg/l): …
|
mv
(48) (mg): …
|
|
|
Dan
|
p
1 (ref.)
(mbar)
|
p
2 (ref.)
(mbar)
|
p
3 (ref.)
(mbar)
|
p (ref.)
srednja vrijednost
(mbar)
|
p
4 (inhib.)
(mbar)
|
p
5 (inhib.)
(mbar)
|
p
6 (inhib.)
(mbar)
|
p (inhib.)
srednja vrijednost
(mbar)
|
p (ref.)
ref. – slijepa proba
(mbar)
|
Δ
p (ref.)
sveukupno
(mbar)
|
m
h
plinski prostor C
(49)
(mg)
|
D
h
Biorazgradnja (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
ref.
(mg)
|
C
IC, 2
ref.
(mg)
|
C
IC, 3
ref.
(mg)
|
C
IC
ref. srednja vrijednost
(mg)
|
C
IC, 4
inhib.
(mg)
|
C
IC, 5
inhib.
(mg)
|
C
IC, 6
inhib.
(mg)
|
C
IC
inhib. srednja vrijednost
(mg)
|
C
IC, net
ref. – inhib.
(mg)
|
m
l
tekućina C (51)
(mg)
|
m
t
ukupno C (52)
(mg)
|
D
t
Biorazgradnja (53)
(%)
|
|
Anorganski ugljik (kraj)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH-vrijednost (kraj)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. ISPIRANJE U STUPCIMA TLA
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 312 (2004.). Umjetne kemikalije mogu doći u doticaj s tlom izravno zahvaljujući namjernoj primjeni (primjerice agrokemikalije) ili neizravnim putevima (primjerice, otpadna voda → kanalizacijski mulj → tlo ili zrak → mokar/suh talog). Pri procjeni rizika tih kemikalija važno je procijeniti njihov potencijal za pretvorbu u tlu i za prodiranje (ispiranje) u dublje slojeve tla, a potom i u podzemne vode.
|
|
2.
|
Dostupno je nekoliko metoda za mjerenje potencijala za ispiranje kemikalija u tlu u kontroliranim laboratorijskim uvjetima, odnosno kromatografija tankog sloja tla, kromatografija debelog sloja tla, kromatografija stupca tla te mjerenja adsorpcije – desorpcije (1) (2). U slučaju neioniziranih kemikalija zahvaljujući podjelnom koeficijentu n–oktanol–voda (Pow) moguća je rana procjena njihove adsorpcije i potencijala za ispiranje (3)(4)(5).
|
|
3.
|
Ovdje opisana ispitna metoda temelji se na kromatografiji stupca tla u poremećenom tlu (za definiciju vidi Dodatak 1.). Provode se dvije vrate pokusa za utvrđivanje (i) potencijala za ispiranje ispitivane kemikalije te (ii) potencijala za ispiranje proizvoda pretvorbe (studija sa starim ostacima) u tlima u kontroliranim laboratorijskim uvjetima (54). Ispitna metoda temelji se na postojećim metodama (6)(7)(8)(9)(10)(11).
|
|
4.
|
Na radionici OECD-a o odabiru tala/sedimenata održanoj u talijanskom Belgiratu 1995. (12) dogovoreni su broj i vrste tla za upotrebu u ovoj ispitnoj metodi. Iznesene su i preporuke za prikupljanje i skladištenje uzoraka tla te rukovanje njima za pokuse ispiranja.
|
NAČELO ISPITNE METODE
|
5.
|
Stupci izrađeni od odgovarajuće inertnog materijala (primjerice stakla, nehrđajućeg čelika, aluminija, teflona, PVC-a itd.) pune se tlom i potom zasićuju i uravnotežuju otopinom ‚umjetne kiše’ (za definiciju vidi Dodatak 1) te ostavljaju da se ocijede. Potom se površina svakog stupca tla tretira ispitivanom kemikalijom i/ili starim ostacima ispitivane kemikalije. Nakon toga u stupce tla dodaje se umjetna kiša i prikuplja se eluat. Nakon postupka ispiranja tlo se vadi iz stupaca i dijeli u odgovarajući broj segmenata ovisno o informacijama za potrebe studije. Svi segmenti tla i eluat potom se analiziraju na ispitivanu kemikaliju i, po potrebi, na proizvode pretvorbe ili ostale ispitivane kemikalije.
|
PRIMJENJIVOST ISPITNE METODE
|
6.
|
Ispitna metoda može se primijeniti na ispitivane kemikalije (neobilježene i radioaktivno obilježene, primjerice14C) za koje postoji dovoljno točna i osjetljiva analitička metoda. Ispitnu metodu ne bi trebalo primjenjivati na kemikalije koje hlape iz tla i vode, odnosno ne ostaju u tlu i/ili eluatu u pokusnim uvjetima ove ispitne metode.
|
INFORMACIJE O ISPITIVANOJ KEMIKALIJI
|
7.
|
Neobilježene i radioaktivno obilježene ispitivane kemikalije mogu se upotrijebiti za mjerenje ispiranja u stupcima tla. Radioaktivno obilježeni materijal potreban je za ispitivanje ispiranja proizvoda pretvorbe (starih ostataka ispitivane kemikalije) i za određivanja bilance mase. Preporučuje se označavanje izotopom14C, ali korisni mogu biti i ostali izotopi, poput13C,15N,3H,32P. Oznaku je po mogućnosti potrebno staviti na najstabilniji dio odnosno dijelove molekule. Čistoća ispitivane kemikalije trebala bi biti najmanje 95 %.
|
|
8.
|
Većinu je kemikalija potrebno primijeniti kao jedinstvenu tvar. Međutim, u slučaju aktivnih tvari u sredstvima za zaštitu bilja za ispitivanje ispiranja polazne ispitivane tvari mogu se upotrebljavati formulirani proizvodi, ali je njihovo ispitivanje posebno nužno u slučaju vjerojatnosti da smjesa utječe na stopu ispuštanja (primjerice granulirani ili kontrolirani pripravci koji se otpuštaju). Kad je riječ o posebnim zahtjevima za plan ispitivanja, prije provedbe korisno je savjetovanje s regulatornim tijelom. U studijama ispiranja ostatka potrebno je upotrebljavati čistu polaznu ispitivanu tvar.
|
|
9.
|
Prije provedbe ispitivanja ispiranja u stupcima tla sljedeće bi informacije o ispitivanoj kemikaliji, trebale po mogućnosti biti raspoložive:
|
(1)
|
topljivost u vodi [ispitna metoda A.6.] (13);
|
|
(2)
|
topljivost u organskim otapalima;
|
|
(3)
|
tlak para [ispitna metoda A.4. ] (13) i konstanta Henryjevog zakona;
|
|
(4)
|
podjelni koeficijent n-oktanol/voda [ispitne metode A.8. i A.24.] (13);
|
|
(5)
|
koeficijent adsorpcije (Kd, Kf or KOC) [ispitne metode C.18. i/ili C.19.] (13);
|
|
(6)
|
hidroliza [ispitna metoda C.7.] (13);
|
|
(7)
|
konstanta disocijacije (pKa) [smjernica OECD-a TG 112] (25);
|
|
(8)
|
aerobna i anaerobna pretvorba u tlu [ispitna metoda C.23.] (13)
|
Napomena: U pripadajućim izvješćima o ispitivanju potrebno je navesti temperaturu na kojoj su provedena ta mjerenja.
|
|
10.
|
Količina ispitivane kemikalije primijenjene na stupce tla trebala bi biti dovoljna za otkrivanje najmanje 0,5 % primijenjene doze u svim pojedinačnim segmentima. U slučaju aktivnih kemikalija u sredstvima za zaštitu bilja količina primijenjene ispitivane kemikalije može odgovarati maksimalnoj preporučenoj stopi upotrebe (jedna primjena).
|
|
11.
|
Za kvantifikaciju ispitivane kemikalije i, po potrebi, njezinih proizvoda pretvorbe u tlu i eluatu mora biti raspoloživa odgovarajuća analitička metoda poznate točnosti, preciznosti i osjetljivosti. Trebala bi biti poznata i granica analitičke detekcije ispitivane kemikalije i njezinih važnih proizvoda pretvorbe (u pravilu najmanje svih proizvoda pretvorbe ≥ 10 % primijenjene doze uočene u studijama puta pretvorbe, ali, po mogućnosti, svih relevantnih ispitivanih proizvoda pretvorbe) (vidi stavak 17.).
|
REFERENTNE KEMIKALIJE
|
12.
|
Za procjenu relativne pokretljivosti ispitivane kemikalije u tlu potrebno je upotrebljavati referentne kemikalije poznatog ponašanja u smislu ispiranja, poput atrazina ili monurona čije se otpuštanje u području smatra umjerenim. Za potvrdu hidrodinamičkih svojstava stupca tla mogu biti korisne i nesorbirajuće i nerazgradive polarne referentne kemikalije (primjerice tritij, brom, fluorescein, eozin) za praćenje kretanja vode u stupcu.
|
|
13.
|
Mogu se upotrebljavati i analitičke standardne kemikalije za karakterizaciju i/ili identifikaciju proizvoda pretvorbe pronađenih u segmentima tla i u eluatima kromatografskim, spektroskopskim ili ostalim relevantnim metodama.
|
DEFINICIJE I JEDINICE
KRITERIJI KVALITETE
Iskorištenje
|
15.
|
Zbroj postotaka ispitivane kemikalije pronađenih u segmentima tla i eluata u stupcu nakon ispiranja predstavlja iskorištenje pokusa ispiranja. Iskorištenja bi se trebala kretati u rasponu od 90 % do 110 % kod radioaktivno obilježenih kemikalija (11) i od 70 % do 110 % kod neobilježenih kemikalija (8).
|
Ponovljivost i osjetljivost analitičke metode
|
16.
|
Ponovljivost analitičke metode za kvantifikaciju ispitivane kemikalije i proizvoda pretvorbe moguće je provjeriti dvostrukom analizom istog ekstrakta segmenta tla ili eluata (vidi stavak 11.).
|
|
17.
|
Granica detekcije (engl. limit of detection, LOD) analitičke metode za ispitivanu kemikaliju i proizvode pretvorbe trebala bi biti najmanje 0,01 mg · kg– 1 u svim segmentima tla ili eluatu (kao ispitivana kemikalija) ili 0,5 % primijenjene doze u pojedinačnim segmentima, ovisno o tome što je manje. Potrebno je navesti i granicu kvantifikacije (engl. limit of quantification, LOQ).
|
OPIS ISPITNE METODE
Sustav ispitivanja
|
18.
|
Za ispitivanje se upotrebljavaju podjeljivi i nepodjeljivi stupci za ispiranje izrađeni od odgovarajuće inertnog materijala (primjerice stakla, nehrđajućeg čelika, aluminija, teflona, PVC-a itd.) unutarnjeg promjera najmanje 4 cm i visine najmanje 35 cm. Materijale stupaca potrebno je ispitati s obzirom na moguće interakcije s ispitivanom kemikalijom i/ili njezinim proizvodima pretvorbe. Primjeri odgovarajućih podjeljivih i nepodjeljivih stupaca navedeni su u Dodatku 2.
|
|
19.
|
Za punjenje i sabijanje stupaca tla upotrebljavaju se spužva, brizgaljka i vibracijski uređaj.
|
|
20.
|
Za dodavanje umjetne kiše stupcima tla mogu se upotrijebiti klip ili peristaltičke crpke, glave za tuširanje, Mariotteove boce ili jednostavni lijevci za dokapavanje.
|
Laboratorijska oprema i kemikalije
|
21.
|
Potrebna je standardna laboratorijska oprema, a posebno:
|
(1)
|
analitički instrumenti, poput opreme za GLC, HPLC i TLC, uključujući odgovarajuće detekcijske sustave za analizu obilježenih ili neobilježenih kemikalija ili inverznu metodu razrjeđivanja izotopa,
|
|
(2)
|
instrumenti za identifikaciju (npr. MS, GC-MS, HPLC-MS, NMR itd.),
|
|
(3)
|
tekućinski scintilacijski brojač za radioaktivno označenu ispitivanu kemikaliju,
|
|
(4)
|
oksidator za izgaranje označenog materijala,
|
|
(5)
|
aparatura za ekstrakciju (npr. epruvete za centrifugiranje za hladnu ekstrakciju i aparatura po Soxhletu za kontinuiranu ekstrakciju pod refluksom),
|
|
(6)
|
instrumenti za koncentriranje otopina i ekstrakata (npr. rotacijski isparivač).
|
|
|
22.
|
Upotrijebljene kemikalije uključuju: analitički čista organska otapala poput acetona, metanola itd., scintilacijsku tekućinu, otopinu 0,01 M CaCl2 u destiliranoj ili deioniziranoj vodi (umjetna kiša).
|
Ispitivana kemikalija
|
23.
|
Ispitivana kemikalija trebala bi za primjenu u stupcu tla biti otopljena u vodi (deioniziranoj ili destiliranoj). Ako je ispitivana kemikalija slabo otopljena u vodi, moguće ju je primijeniti kao formulirani proizvod (po potrebi nakon suspenzije ili emulgacije u vodi) ili u bilo kojem organskom otapalu. U slučaju upotrebe organskog otapala ono bi trebalo biti svedeno na najmanju moguću mjeru i trebalo bi ispariti s površine stupca tla prije početka postupka ispiranja. Čvrste pripravke, poput granula, potrebno je primijeniti u čvrstom obliku, bez vode; radi bolje distribucije po površini stupca tla formulirani proizvod može se prije upotrebe pomiješati s malom količinom kvarcnog pijeska (primjerice 1 g).
|
|
24.
|
Količina ispitivane kemikalije primijenjene na stupce tla trebala bi biti dovoljna za otkrivanje najmanje 0,5 % primijenjene doze u svim pojedinačnim segmentima. U slučaju aktivnih kemikalija u sredstvima za zaštitu bilja ona se može temeljiti na maksimalnoj preporučenoj stopi upotrebe (stopa jedne primjene) te bi se u slučaju polaznog i starog ispiranja trebala odnositi na površinu upotrijebljenog stupca tla (55).
|
Referentna kemikalija
|
25.
|
U pokusima ispiranja potrebno je upotrebljavati referentnu kemikaliju (vidi stavak 12.). Tu je kemikaliju potrebno primijeniti na površinu stupca tla na sličan način kao ispitivanu kemikaliju te po odgovarajućoj stopi zahvaljujući kojoj je moguća adekvatna detekcija kao interni standard s ispitivanom kemikalijom na istom stupcu tla ili samostalno na zasebnom stupcu tla. Poželjno je obje kemikalije primijeniti na istom stupcu, osim ako su slično označene.
|
Tla
Odabir tla
|
26.
|
Za studije ispiranja polaznom ispitivanom kemikalijom potrebno je upotrebljavati tri do četiri tla različitih pH-vrijednosti, sadržaja organskog ugljika i teksture (12). Smjernice za odabir tala za pokuse ispiranja nalaze se u tablici 1. u nastavku. U slučaju ionizirajućih ispitivanih kemikalija odabrana tla trebala bi uključivati širok raspon pH-vrijednosti radi procjene pokretljivosti kemikalije u ionizirajućim i neionizirajućim oblicima; najmanje tri tla trebala bi imati pH-vrijednost pri kojoj je ispitivana kemikalija u pokretnom obliku.
Tablica 1.
Smjernice za odabir tala za studije ispiranja
|
Br. tla
|
pH-vrijednost
|
Organski ugljik
%
|
Sadržaj gline
%
|
Tekstura (56)
|
|
1
|
> 7,5
|
3,5 – 5,0
|
20 – 40
|
glinasta ilovača
|
|
2
|
5,5 – 7,0
|
1,5 – 3,0
|
15 – 25
|
praškasta ilovača
|
|
3
|
4,0 – 5,5
|
3,0 – 4,0
|
15 – 30
|
ilovača
|
|
4
|
< 4,0 – 6,0 (57)
|
< 0,5 – 1,5 (57)
(58)
|
< 10 – 15 (57)
|
ilovasti pijesak
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
ilovasti pijesak / pijesak
|
|
|
27.
|
Povremeno mogu biti potrebne ostale vrste tla koje predstavljaju hladnije, umjerene i tropske predjele. Stoga, ako se ipak upotrebljavaju ostale vrste tla, njih je potrebno opisati na temelju jednakih parametara te bi one trebale imati slične razlike u svojstvima kao i vrste opisane u smjernicama za odabir tala za studije ispiranja (vidi prethodnu tablicu 1.), čak i ako u potpunosti ne ispunjavaju kriterije.
|
|
28.
|
Za studije ispiranja ‚starim ostacima’ potrebno je upotrebljavati jedno tlo (12). Ono bi trebalo imati sadržaj pijeska > 70 % te sadržaj organskog ugljika od 0,5 do 1,5 % (primjerice tlo br. 4 u tablici 1.). Postoji mogućnost upotrebe više vrsta tala u slučaju važnosti podataka o proizvodima pretvorbe.
|
|
29.
|
Potrebno je opisati barem teksturu [ % pijeska, % praha, % gline prema sustavima klasifikacije FAO i USDA (14)], pH-vrijednost, kapacitet izmjene kationa, sadržaj organskog ugljika, nasipnu gustoću (za poremećeno tlo) i vodni kapacitet svih tala. Mjerenje mikrobne biomase potrebno je isključivo za tlo koje se upotrebljava tijekom razdoblja starenja/inkubacije prije starog pokusa ispiranja. Informacije o dodatnim svojstvima tla (primjerice klasifikacija tla, mineralogija gline, određenoj površini) mogu biti korisne pri tumačenju rezultata ove studije. Za određivanje svojstava tla mogu se upotrebljavati metode preporučene u referencama (15)(16)(17)(18)(19).
|
Prikupljanje i skladištenje tala
|
30.
|
Tla je potrebno uzimati iz gornjeg sloja (horizont A) do najdublje 20 cm. Ostatke vegetacije, krupnije faune i kamenja potrebno je ukloniti. Tla, osim onih koja se upotrebljavaju za starenje ispitivane kemikalije) suše se na zraku na sobnoj temperaturi (poželjno od 20 do 25 °C). Rahljenje je potrebno obaviti uz minimalnu primjenu sile kako bi se što bolje sačuvala izvorna tekstura tla. Tla se prosijavaju kroz sito ≤ 2 mm. Preporučuje se pažljiva homogenizacija jer to povećava obnovljivost rezultata. Prije upotrebe tla se mogu skladištiti na sobnoj temperaturi i sušiti na zraku (12). Ne postoji preporučeno ograničenje vremena skladištenja, ali tla koja se skladište duže od tri godine potrebno je prije upotrebe ponovno analizirati s obzirom na sadržaj organskog ugljika i pH-vrijednost.
|
|
31.
|
Detaljne informacije o povijesti lokacija polja gdje se uzimaju ispitivana tla trebale bi biti na raspolaganju. Podaci uključuju točnu lokaciju [točno definiranu UTM-om (univerzalna poprečna Mercatorova projekcija / europski horizontalni datum) ili geografskim koordinatama], vegetacijski pokrov, tretiranje sredstvima za zaštitu usjeva, tretiranje organskim i anorganskim gnojivima, dodatke biološkog materijala ili slučajna onečišćenja (12). Ako je u posljednje četiri godine tretirano ispitivanom kemikalijom ili njezinim strukturnim analozima, tlo se ne bi trebalo upotrebljavati za studije ispiranja.
|
Uvjeti ispitivanja
|
32.
|
Tijekom razdoblja ispitivanja stupce za ispiranje tla potrebno je čuvati na tamnom mjestu na sobnoj temperaturi sve dok se ona kreće u rasponu od ± 2 °C. Preporučene su temperature od 18 do 25 °C.
|
|
33.
|
Umjetnu je kišu (0,01 M CaCl2) potrebno stalno primjenjivati na površinu stupaca tla po stopi od 200 mm tijekom 48 sati (60); ta je stopa istovjetna primjeni 251 ml za stupac unutarnjeg promjera 4 cm. Za potrebe ispitivanja mogu se dodatno upotrebljavati i ostale stope umjetnih padalina i dulje trajanje.
|
Provedba ispitivanja
Ispiranje polaznom ispitivanom kemikalijom
|
34.
|
Najmanje dvostruki stupci za ispiranje pune se netretiranim, na zraku osušenim i prosijanim tlom (< 2 mm) do visine od približno 30 cm. Kako bi se osiguralo ujednačeno punjenje, tlo se žlicom stavlja u stupce u malim količinama i pritišće brizgaljkom te istovremeno nježno vibrira sve dok vrh stupca tla dalje ne potone. Ujednačeno punjenje potrebno je radi dobivanja ponovljivih rezultata za stupce za ispiranje. Za pojedinosti o tehnikama punjenja stupaca vidi reference (20) (21) i (22). Radi kontrole ponovljivosti postupka punjenja utvrđuje se ukupna masa tla kojima se stupci pune (61); mase dvostrukih stupaca trebale bi biti slične.
|
|
35.
|
Nakon punjenja stupci tla prethodno se vlaže umjetnom kišom (0,01 M CaCl2) od dna do vrha kako bi voda istisnula zrak u porama tla. Potom se stupci tla ostavljaju da se uravnoteže, a višak vode otječe zahvaljujući gravitaciji. Metode zasićenja stupaca navedene su u referenci (23).
|
|
36.
|
Potom se ispitivana kemikalija i/ili referentna kemikalija primjenjuje na stupce tla (vidi i stavke 23. do 25.). Za postizanje homogene distribucije otopine, suspenzije ili emulzije ispitivane i/ili referentne kemikalije potrebno je primijeniti ravnomjerno po površini stupaca tla. Ako je za primjenu ispitivane kemikalije preporučeno umiješati je u tlo, to je potrebno učiniti s malom količinom (primjerice 20 g) tla i staviti na površinu stupca tla.
|
|
37.
|
Na površinu stupaca tla potom se stavljaju stakleni sinterirani disk, staklene kuglice, filtri od staklenih vlakana ili okrugli filtarski papir radi ravnomjerne distribucije umjetne kiše po cijeloj površini i izbjegavanja narušavanja površine tla kapljicama kiše. Što je veći promjer stupca, to je više pažnje potrebno pri primjeni umjetne kiše na stupce tla radi ravnomjerne distribucije umjetne kiše po površini tla. Potom se umjetna kiša stavlja u stupce tla kap po kap klipom, peristaltičkom crpkom ili lijevkom za dokapavanje. Poželjno je eluate prikupiti u frakcijama i evidentirati njihove volumene (62).
|
|
38.
|
Nakon ispiranja i ostavljanja stupaca da se ocijede oni se dijele na odgovarajući broj segmenata ovisno o informacijama potrebnima za potrebe studije; segmenti se ekstrahiraju odgovarajućim otapalima ili mješavinama otapala te analiziraju za ispitivanu kemikaliju i, ovisno o slučaju, proizvode pretvorbe, za ukupnu radioaktivnosti i za referentnu kemikaliju. Eluati ili frakcije eluata analiziraju se izravno ili nakon ekstrakcije za iste proizvode. Pri upotrebi radioaktivno označene ispitivane kemikalije potrebno je identificirati sve frakcije koje sadržavaju ≥ 10 % primijenjene radioaktivnosti.
|
Ispiranje starim ostacima
|
39.
|
Svježe tlo (koje nije prethodno sušeno na zraku) tretira se po stopi koja odgovara površini stupaca tla (vidi stavak 24.) radioaktivno označenom ispitivanom kemikalijom te inkubira u aerobnim uvjetima u skladu s ispitnom metodom C.23. (13). Razdoblje inkubacije (starenja) trebalo bi biti dovoljno dugo za proizvodnju znatnih količina proizvoda pretvorbe; preporučuje se razdoblje starenja jednog poluvijeka ispitivane kemikalije (63), ali koje ne bi trebalo premašivati 120 dana. Staro se tlo prije ispiranja analizira za ispitivanu kemikaliju i njezine proizvode pretvorbe.
|
|
40.
|
Stupci za ispiranje pune se do visine od 28 cm istim tlom (ali sušenim na zraku) koje se upotrebljava u pokusu starenja opisanom u stavku 34., a utvrđuje se i ukupna masa napunjenih stupaca tla. Stupci tla potom se prethodno vlaže prema opisu iz stavka 35.
|
|
41.
|
Potom se ispitivana kemikalija i njezini proizvodi pretvorbe primjenjuju na površinu stupaca tla u obliku starih ostataka tla (vidi stavak 39.) kao segment tla visok 2 cm. Ukupna visina stupaca tla (netretirano tlo + staro tlo) ne bi trebala premašiti 30 cm (vidi stavak 34.).
|
|
42.
|
Ispiranje se obavlja kako je opisano u stavku 37.
|
|
43.
|
Nakon ispiranja segmenti tla i eluati analiziraju se kako je navedeno u stavku 38. za ispitivanu kemikaliju, njezine proizvode pretvorbe i neekstrahiranu radioaktivnost. Kako bi se utvrdila količina starog ostatka koji se nakon ispiranja zadržao u gornjem sloju od 2 cm, taj je segment potrebno zasebno analizirati.
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
44.
|
Količine ispitivane kemikalije, proizvoda pretvorbe, neekstraktivnih tvari te, ovisno o slučaju, referentne kemikalije potrebno je navesti u % primijenjene početne doze za svaki segment tla i frakciju eluata. Za svaki je stupac potrebno navesti grafički prikaz utvrđenih postotaka kao funkciju dubina tla.
|
|
45.
|
Kad se u studijama ispiranja stupaca upotrebljava referentna kemikalija, njezino ispiranje može se procijeniti na relativnoj skali s pomoću faktora relativne pokretljivosti (engl. relative mobility factors, RMF; za definiciju vidi Dodatak 3.) (1) (11) zahvaljujući kojima je moguća usporedba podataka o ispiranju različitih kemikalija dobivenih s pomoću različitih vrsta tala. Primjeri vrijednosti faktora relativne pokretljivosti za niz kemikalija za zaštitu usjeva navedeni su u Dodatku 3.
|
|
46.
|
Procjene vrijednosti Koc (koeficijent adsorpcije normiran na organski ugljik) i Kom (koeficijent razdiobe normiran na organsku tvar) mogu se dobiti i iz rezultata ispiranja stupaca s pomoću prosječne dubine ispiranja ili utvrđenih korelacija između faktora relativne pokretljivosti i koeficijenta Kom, odnosno Koc (4) ili primjenom jednostavne kromatografske teorije (24). Međutim, potonju je metodu potrebno oprezno primjenjivati, posebno kad se uzme u obzir činjenica da postupak ispiranja ne uključuje samo uvjete zasićenog protoka, već i nezasićene sustave.
|
Tumačenje rezultata
|
47.
|
Zahvaljujući studiji ispiranja stupaca opisanoj u ovoj metodi moguće je određivanje potencijala ispiranja ili pokretljivosti ispitivane kemikalije (u studijama ispiranja polazne kemikalije) i/ili njezinih proizvoda pretvorbe (u studijama ispiranja starog ostatka) u tlu. Ta ispitivanja nisu kvantitativno predviđanje ponašanja u smislu ispiranja u uvjetima na terenu, ali mogu se upotrijebiti za usporedbu mogućnosti ispiranja jedne kemikalije s ostalima čije je ponašanje u smislu ispiranja možda poznato (24). Slično tome, njima se ne mjeri kvantitativno postotak primijenjene kemikalije koji bi prodrijeti u podzemne vode (11). Međutim, rezultati studija ispiranja stupaca mogu biti pomoć pri odluci o potrebi provedbe dodatnih poluterenskih ili terenskih ispitivanja za kemikalije koje pokazuju velik potencijal pokretljivosti u laboratorijskim ispitivanjima.
|
Izvješće o ispitivanju
|
48.
|
Izvješće mora sadržavati:
|
|
Ispitivana kemikalija i referentna kemikalija (ovisno o slučaju):
|
—
|
uobičajeni naziv, kemijski naziv (IUPAC i CAS nomenklatura), CAS broj, kemijska struktura (uz naznaku mjesta oznake u slučaju upotrebe radioaktivno obilježenog materijala) i relevantna fizikalno-kemijska svojstva,
|
|
—
|
čistoće (nečistoće) ispitivane kemikalije,
|
|
—
|
radiokemijska čistoća obilježene kemikalije i specifična aktivnost (po potrebi).
|
|
|
|
Ispitivana tla:
|
—
|
podaci o mjestu prikupljanja,
|
|
—
|
svojstva tla, poput pH-vrijednosti, sadržaja organskog ugljika i gline, teksture i nasipne gustoće (u slučaju poremećenog tla),
|
|
—
|
djelovanje mikroba u tlu (isključivo u slučaju tla koje se upotrebljava za starenje ispitivane kemikalije),
|
|
—
|
trajanje skladištenja tla i uvjeti skladištenja.
|
|
|
|
Uvjeti ispitivanja:
|
—
|
datumi provedbe studija,
|
|
—
|
duljina i promjer stupaca za ispiranje,
|
|
—
|
ukupna masa tla u stupcima,
|
|
—
|
količina primijenjene ispitivane kemikalije i, ovisno o slučaju, referentne kemikalije,
|
|
—
|
količina, učestalost i trajanje primjene umjetne kiše,
|
|
—
|
temperatura pokusnih postavki,
|
|
—
|
broj ponavljanja (najmanje dva),
|
|
—
|
metode za analizu ispitivane kemikalije, proizvoda pretvorbe i, ovisno o slučaju, referentne kemikalije u različitim segmentima tla i eluatima,
|
|
—
|
metode za karakterizaciju i identifikaciju proizvoda pretvorbe u segmentima tla i eluatima.
|
|
|
|
Rezultati ispitivanja:
|
—
|
tablice rezultata izraženih kao koncentracije i kao postotak primijenjene doze za segmente tla i eluate,
|
|
—
|
bilanca mase, ovisno o slučaju,
|
|
—
|
dubina ispiranja i, ovisno o slučaju, faktori relativne pokretljivosti,
|
|
—
|
grafički prikaz postotka pronađenog u segmentima tla u odnosu na dubinu segmenta tla,
|
|
—
|
rasprava i tumačenje rezultata.
|
|
|
LITERATURA
|
(1)
|
Guth, J.A., Burkhard, N. and Eberle, D.O. (1976.). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
(2)
|
Russel, M.H. (1995.). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals – T.R. Roberts and P.C. Kearney, Eds.). J. Wiley & Sons.
|
|
(3)
|
Briggs, G.G. (1981.). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J.Agric. Food Chem. 29, 1050. – 1059.
|
|
(4)
|
Chiou, C.T., Porter, P.E. and Schmedding, D.W. (1983.). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227. – 231.
|
|
(5)
|
Guth, J.A. (1983.). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26. – 33.
|
|
(6)
|
US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(7)
|
Agriculture Canada (1987.). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
(8)
|
Prilog I. Direktivi Komisije 95/36/EZ od 14. srpnja 1995. o izmjeni Direktive Vijeća 91/414/EEZ o stavljanju sredstava za zaštitu bilja na tržište, SL L 172, 22.7.1995., str. 8.
|
|
(9)
|
Dutch Commission for Registration of Pesticides (1991.). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
BBA (1986.). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
(11)
|
SETAC (1995.). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
(12)
|
OECD (1995.). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italija, 18. – 20. siječnja 1995.
|
|
(13)
|
Sljedeća poglavlja ovog Priloga:
|
|
Poglavlje A.4., Tlak pare
|
|
|
Poglavlje A.6., Topljivost u vodi
|
|
|
Poglavlje A.8., Koeficijent razdjeljenja, metoda protresanjem u tikvici
|
|
|
Poglavlje A.24., Koeficijent razdjeljenja (n-oktanol/voda), metoda visokoučinkovite tekućinske kromatografije (HPLC)
|
|
|
Poglavlje C.7., Razgradnja – abiotička razgradnja: hidroliza kao funkcija pH
|
|
|
Poglavlje C.18., Šaržno ispitivanje adsorpcije/desorpcije u ravnoteži
|
|
|
Poglavlje C.23., Aerobna i anaerobna pretvorba u tlu
|
|
|
(14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985.) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962.).
|
|
(15)
|
Methods of Soil Analysis (1982.). Part 1, Physical and Mineralogical Methods (A. Klute, Ed.). Agronomy Series No. 9, 2nd Edition.
|
|
(16)
|
Methods of Soil Analysis (1986.). Part 2, Chemical and Microbiological Properties (A.L. Page, R.H. Miller and D.R. Kelney, Eds.). Agronomy Series No. 9, 2nd Edition.
|
|
(17)
|
ISO Standard Compendium Environment (1994.). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
|
|
(18)
|
Mückenhausen, E. (1975.). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
(19)
|
Scheffer, F. and Schachtschabel, P. (1998.). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(20)
|
Weber, J.B. and Peeper, T.F. (1977.). In Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, 73. – 78.
|
|
(21)
|
Weber, J.B., Swain, L.R., Strek, H.J. and Sartori, J.L. (1986.). In Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, 190. – 200.
|
|
(22)
|
Oliveira, et al. (1996.). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): 49. – 53.
|
|
(23)
|
Shackelford, C. D. (1991.). Laboratory diffusion testing for waste disposal. – A review. J. Contam. Hydrol. 7, 177. – 217.
|
|
(24)
|
(Hamaker, J.W. (1975.). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V.H. Freed, Eds), 115. – 133. Plenum Press, New York.
|
|
(25)
|
OECD (1981). Dissociation constants in water. Smjernica OECD-a za ispitivanje kemikalija, br. 4112, OECD, Pariz
|
Dodatak 1.
Definicije i jedinice
Stari ostatak tla
: ispitivana kemikalija i proizvodi pretvorbe prisutni u tlu nakon primjene i nakon dovoljno dugog razdoblja kako bi procesi transporta, adsorpcije, metabolizma i rasipanja mogli promijeniti distribuciju i kemijska svojstva nekih od primijenjenih kemikalija (1).
Umjetna kiša
: otopina 0,01 M CaCl2 u destiliranoj ili deioniziranoj vodi.
Prosječna dubina ispiranja
: dno odjeljka tla s kumulativnom rekuperiranom kemikalijom = 50 % ukupno rekuperirane ispitivane kemikalije [uobičajeni pokus ispiranja] ili (dno odjeljka tla s kumulativnom rekuperiranom kemikalijom = 50 % ukupno rekuperirane ispitivane kemikalije) – ((debljina sloja starog ostatka)/2) [studija ispiranja starog ostatka].
Kemikalija
: tvar ili smjesa.
Eluat
: vodena faza procijeđena kroz profil tla ili stupac tla (1).
Ispiranje
: postupak kojim kemikalija prodire u profil tla ili stupac tla (1).
Dubina ispiranja
: najdublji segment tla u kojem je nakon postupka ispiranja pronađeno ≥ 0,5 % primijenjene ispitivane kemikalije ili starog ostatka (ekvivalent dubini prodiranja).
Granica detekcije (engl. limit of Detection, LOD) i granica kvantifikacije (engl. limit of Quantification, LOQ): granica detekcije (LOD) koncentracija je kemikalije ispod koje se kemikalija više ne može razlikovati od analitičkih artefakata. Granica kvantifikacije (LOQ) koncentracija je kemikalije ispod koje se koncentracija ne može odrediti s prihvatljivom točnošću.
Faktor relativne pokretljivosti
: (dubina ispiranja ispitivane kemikalije (cm)) / (dubina ispiranja referentne kemikalije (cm))
Ispitivana kemikalija
: Bilo koja tvar ili smjesa ispitivana primjenom ove ispitne metode.
Proizvod pretvorbe
: sve kemikalije koje nastaju u biotičkim ili abiotičkim reakcijama pretvorbe ispitivane tvari, uključujući CO2 i proizvode u vezanim ostacima.
Tlo
: mješavina mineralnih sastojaka i organsko-kemijskih sastojaka koji sadržavaju spojeve velike molekulske mase s visokim sadržajem ugljika i dušika, nastanjena sitnim (uglavnom mikro) organizmima. Tlom se može rukovati u dvama stanjima:
|
—
|
neporemećenom: u obliku nastalom s vremenom, s karakterističnim slojevima različitih vrsta tla;
|
|
—
|
poremećenom: u obliku u kojem se obično nalazi na poljoprivrednim zemljištima, odnosno o tome u kojem je u ovoj metodi prisutno u uzorcima koji se uzimaju kopanjem (2).
|
|
(1)
|
Holland, P.T. (1996.). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, 1167. – 1193.
|
|
(2)
|
Smjernica OECD-a za ispitivanje 304 A: svojstvena biorazgradivost u tlu (donesena 12. svibnja 1981.).
|
Dodatak 2.
Slika 1.
Primjer staklenih nepodjeljivih stupaca za ispiranje
duljine 35 cm i unutarnjeg promjera 5 cm (1)

|
(1)
|
Drescher, N. (1985.). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden – 70 Jahre Agrarforschung der BASF AG, 225. – 236. Verlag Wissenschaft und Politik, Köln.
|
Slika 2.
Primjer podjeljivog metalnog stupca unutarnjeg promjera 4 cm (1)

|
(1)
|
Burkhard, N., Eberle D.O. and Guth, J.A. (1975.). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203. – 213.
|
Dodatak 3.
Primjeri faktora relativne pokretljivosti
(64)
za različite kemikalije za zaštitu usjeva (1)(2) i odgovarajuće klase pokretljivosti
(66)
|
Raspon faktora relativne pokretljivosti
|
Kemikalija (faktor relativne pokretljivosti)
|
Klasa pokretljivosti
|
|
≤ 0,15
|
Paration (< 0,15), flurodifen (0,15)
|
I
nepokretljivost
|
|
0,15 – 0,8
|
Profenofos (0,18), propikonazol (0,23), diazinon (0,28), diuron (0,38), terbutilazin (0,52), metidation (0,56), prometrin (0,59), propazin (0,64), alaklor (0,66), metolaklor (0,68)
|
II
blaga pokretljivost
|
|
0,8 – 1,3
|
monuron (65) (1,00), atrazin (1,03), simazin (1,04), fluometuron (1,18)
|
III
umjerena pokretljivost
|
|
1,3 – 2,5
|
Prometon (1,67), cianazin (1,85), bromacil (1,91), karbutilat (1,98)
|
IV
prilična pokretljivost
|
|
2,5 – 5,0
|
karbofuran (3,00), dioksakarb (4,33)
|
V
pokretljivost
|
|
> 5,0
|
Monokrotofos (> 5,0), dikrotofos (> 5,0)
|
VI
iznimna pokretljivost
|
|
(1)
|
Guth, J.A. (1985.). Adsorption/desorption. In Joint International Symposium ‚Physicochemical Properties and their Role in Environmental Hazard Assessment’. Canterbury, UK, 1. – 3. srpnja 1985.
|
|
(2)
|
Guth, J.A. and Hörmann, W.D. (1987.). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91. – 106.
|
|
(3)
|
Harris, C.I. (1967.). Movement of herbicides in soil. Weeds 15, 214. – 216.
|
|
(4)
|
Helling, C.S. (1971.). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, 743. – 748.
|
|
(5)
|
McCall, P.J., Laskowski, D.A., Swann, R.L. and Dishburger, H.J. (1981.). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
(6)
|
Hollis, J.M. (1991.). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, 165. – 174.
|
C.45. PROCJENA EMISIJA U OKOLIŠ IZ DRVA TRETIRANOG ZAŠTITNIM SREDSTVIMA: LABORATORIJSKA METODA ZA DRVENE PREDMETE U DOTICAJU SA SLATKOM ILI MORSKOM VODOM KOJI NISU U NJU URONJENI
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 313 (2007.). Emisije u okoliš iz drva tretiranog zaštitnim sredstvima treba kvantificirati radi procjene rizika tretiranog drva za okoliš. Ovom se ispitnom metodom opisuje laboratorijska metoda za procjenu emisija iz drva tretiranog zaštitnim sredstvima u slučaju dviju mogućnosti ulaska emisija u okoliš:
|
—
|
Emisije iz tretiranog drva u doticaju sa slatkom vodom. Mogućnost ulaska emisija iz površine tretiranog drva u vodu.
|
|
—
|
Emisije iz tretiranog drva u doticaju s morskom vodom. Mogućnost ulaska emisija iz površine tretiranog drva u morsku vodu.
|
|
|
2.
|
Svrha je ove ispitne metode ispitivanje emisija iz drva i drvenih predmeta u doticaju sa slatkom ili morskom vodom koji nisu u nju uronjeni. Klase upotrebe u međunarodnoj su upotrebi za kategorizaciju biološkog rizika kojem će tretirani predmet biti podvrgnut. Klasama upotrebe definira se i upotreba tretiranog predmeta te određuju područja okoliša (zrak, voda, tlo) kojima prijeti mogući rizik od drva tretiranog zaštitnim sredstvima.
|
|
3.
|
Ispitna je metoda laboratorijski postupak za prikupljanje uzoraka (emisata) iz vode u koju je uronjeno tretirano drvo tijekom sve duljih vremenskih intervala nakon izlaganja. Količina emisija u emisatu povezana je s površinom drva i trajanjem izloženosti radi procjene strujanja u mg/m2/dan. Na taj se način može procijeniti strujanje (stopa ispiranja) nakon duljih razdoblja izlaganja.
|
|
4.
|
Količina emisija može se upotrijebiti za procjenu rizika za okoliš tretiranog drva.
|
POČETNA RAZMATRANJA
|
5.
|
Ne pretpostavlja se da su karakter i težina mehanizma ispiranja površine drva slatkom vodom jednaki ispiranju površine drva morskom vodom. Stoga je za tretiranje drva zaštitnim proizvodima ili smjesama za upotrebu u morskoj vodi potrebna studija ispiranja drva za morsku vodu.
|
|
6.
|
Drvo tretirano zaštitnim sredstvima trebalo bi predstavljati drvo u komercijalnoj upotrebi. Drvo je potrebno tretirati u skladu s uputama proizvođača o zaštitnim sredstvima te s odgovarajućim standardima i specifikacijama. Prije početka ispitivanja potrebno je navesti parametre o kondicioniranju drva nakon tretiranja.
|
|
7.
|
Upotrijebljeni uzorci drva trebali bi predstavljati upotrijebljene predmete (primjerice u smislu vrste, gustoće i ostalih svojstava).
|
|
8.
|
Drvo ili tretirano drvo, čija se površina obvezno mora dodatno tretirati (primjerice bojom koja se nanosi zbog zahtjeva za komercijalnu upotrebu), može se ispitivati postupkom penetracije ili površinskog nanošenja.
|
|
9.
|
Sastav, količina, pH-vrijednost i fizički oblik vode važni su pri utvrđivanju kvalitete, sadržaja i prirode emisija iz drva.
|
NAČELO ISPITNE METODE
|
10.
|
Primjerci drva tretiranog zaštitnim sredstvima uranjaju se u vodu. Voda (emisat) prikuplja se i kemijski analizira više puta tijekom razdoblja izlaganja, što je dostatno za izradu statističkih izračuna. Stope emisije u mg/m2/dan izračunavaju se iz rezultata analize. Potrebno je evidentirati razdoblja uzorkovanja. Ispitivanja na netretiranim uzorcima mogu se prekinuti ako se u prvim trima podatkovnim točkama ne otkrije pozadina.
|
|
11.
|
Zahvaljujući uključivanju primjeraka netretiranog drva moguće je odrediti pozadinske razine emisata iz drva za koji nisu upotrijebljena zaštitna sredstva.
|
KRITERIJI KVALITETE
Točnost
|
12.
|
Točnost ispitne metode za procjenu emisija ovisi o ispitnim primjercima koji predstavljaju drvo tretirano komercijalnim sredstvima, mjeri u kojoj voda predstavlja stvarnu vodu i mjeri u kojoj režim izlaganja predstavlja prirodne uvjete.
|
|
13.
|
Točnost, preciznost i ponovljivost analitičke metode potrebno je odrediti prije provedbe ispitivanja.
|
Mjerna obnovljivost
|
14.
|
Tri se uzorka vode prikupljaju i analiziraju te se kao vrijednost emisije uzima srednja vrijednost. Mjerna obnovljivost rezultata unutar laboratorija i između različitih laboratorija ovisi o režimu uranjanja i drvima koja su upotrijebljena kao ispitni primjerci.
|
Prihvatljivi raspon rezultata
|
15.
|
Prihvatljiv je raspon rezultata ovog ispitivanja u kojem se gornje i donje vrijednosti razlikuju manje od jednog reda veličine.
|
UVJETI ISPITIVANJA
Voda
|
16.
|
Scenariji ispiranja slatkom vodom: preporučuje se upotreba deionizirane vode (primjerice ASTM D 1193 vrsta II.) za ispitivanje ispiranja radi ocjene drva izloženog slatkoj vodi. Temperatura vode iznosi 20 °C +/– 2 °C, a izmjerena pH-vrijednost i temperatura vode navedene su u izvješću o testiranju. Zahvaljujući analizi uzoraka vode uzetih prije uranjanja tretiranih primjeraka moguća je procjena analiziranih kemikalija u vodi. Riječ je o kontroli radi utvrđivanja pozadinskih razina kemikalija koje se potom kemijski analiziraju.
|
|
17.
|
Scenariji ispiranja morskom vodom: preporučuje se upotreba sintetičke morske vode (primjerice ASTM D 1141 zamjenska voda iz oceana, bez teških metala) za ispitivanje ispiranja radi ocjene drva izloženog morskoj vodi. Temperatura vode iznosi 20 °C +/– 2 °C, a izmjerena pH-vrijednost i temperatura vode navedene su u izvješću o testiranju. Zahvaljujući analizi uzoraka vode uzetih prije uranjanja tretiranih primjeraka moguća je procjena analiziranih kemikalija u vodi. Riječ je o kontroli za analizu pozadinskih razina važnih kemikalija.
|
Ispitni primjerci drva
|
18.
|
Primjerci drva trebali bi biti tipični primjerci drva koje se upotrebljava za ispitivanje učinkovitosti zaštitnih sredstava za drvo. Preporučene su vrste Pinus sylvestris L. (obični bor), Pinus resinosa Ait. (američki crveni bor) ili Pinus spp (bor). Dodatna je ispitivanja moguće provesti na drugim vrstama.
|
|
19.
|
Potrebno je upotrijebiti drvo ravnih godova i bez čvorova. Potrebno je izbjegavati materijal s izgledom smole. Drvo bi trebalo biti tipičan primjerak komercijalno dostupnog drva. Potrebno je evidentirati izvor, gustoću i broj godova na 10 mm.
|
|
20.
|
Preporučuje se da su ispitni primjerci drva u skladu s normom EN 113 kompleti od pet blokova veličine 25 mm × 50 mm × 15 mm s uzdužnim plohama paralelnima s godovima, iako se mogu upotrijebiti i ostale dimenzije poput 50 mm × 150 mm × 10 mm. Ispitni bi primjerak trebao u potpunosti biti uronjen u vodu. Ispitni primjerci sastoje se od 100 %-tne bjelike. Svaki se primjerak jedinstveno obilježava radi identifikacije tijekom ispitivanja.
|
|
21.
|
Ispitne primjerke potrebno je izblanjati ili zagladiti, a površine nije potrebno brusiti.
|
|
22.
|
Broj kompleta ispitnih primjeraka drva radi analize iznosi najmanje pet: tri kompleta primjeraka tretiraju se zaštitnim sredstvima, jedan se komplet ne tretira, dok jedan komplet služi za procjenu udjela vlage u pećnici sušenih ispitnih primjeraka prije tretiranja. Priprema se dovoljno ispitnih primjeraka radi odabira triju kompleta uzoraka koji su unutar 5 % srednje vrijednosti zadržavanja zaštitnih sredstava skupine ispitnih primjeraka.
|
|
23.
|
Svi ispitni primjerci završno se zabrtve kemikalijom koja sprečava penetraciju zaštitnog sredstva u krajnje godove primjeraka ili ispiranje s krajnjih godova primjeraka. Potrebno je razlikovati primjerke za postupke površinskog nanošenja i penetracije radi nanošenja završnog brtvila. Završno brtvilo treba nanijeti prije tretiranja samo u slučaju površinskog nanošenja.
|
|
24.
|
Krajnji god treba biti otvoren za tretiranje postupkom penetracije. Stoga primjerci moraju biti završno zabrtvljeni na kraju razdoblja kondicioniranja. Emisiju je potrebno procijeniti samo za uzdužnu površinu. Brtvila je potrebno provjeriti i ponovno nanijeti prije početka ispiranja te ih nakon toga nije potrebno ponovno nanositi.
|
Spremnik za uranjanje
|
25.
|
Spremnik je izrađen od inertnog materijala i dovoljno je velik za uranjanje pet primjeraka drva u skladu s normom EN113 u 500 ml vode zbog čega omjer površine i volumena vode iznosi 0,4 cm2/ml.
|
Stalak za ispitivanje primjeraka
|
26.
|
Ispitni primjerci nalaze se na stalku na kojem sve izložene površine primjerka mogu biti u doticaju s vodom.
|
POSTUPAK TRETIRANJA ZAŠTITNIM SREDSTVIMA
Priprema tretiranih ispitnih primjeraka
|
27.
|
Ispitni primjerak drva koji je potrebno tretirati ispitivanim zaštitnim sredstvom tretira se metodom navedenom za to zaštitno sredstvo koja može uključivati postupak penetracije ili površinskog nanošenja umakanjem, raspršivanjem ili kistom.
|
Zaštitna sredstva koja je potrebno nanijeti postupkom penetracije
|
28.
|
Potrebno je pripremiti otopinu zaštitnog sredstva kojom će se postići utvrđena apsorpcija ili zadržavanje u postupku penetracije. Ispitni primjerak drva važe se i mjeri. Postupak penetracije trebao bi biti u skladu s postupkom za nanošenje zaštitnog sredstva na drvo za upotrebu u klasi upotrebe 4 ili 5. Primjerak se ponovno važe nakon tretiranja, a zadržavanje zaštitnog sredstva (kg/m3) računa se formulom:

|
|
29.
|
Napomena: u ovom se ispitivanju može upotrijebiti drvo tretirano u industrijskim pogonima (primjerice vakuumskom impregnacijom). Primijenjene je postupke potrebno zabilježiti, a zadržavanje materijala tretiranog na ovaj način analizirati i zabilježiti.
|
Zaštitna sredstva koja je potrebno nanijeti postupcima površinskog nanošenja
|
30.
|
Postupak površinskog nanošenja uključuje umakanje, raspršivanje ili bojenje kistom ispitnih primjeraka drva. Postupak i količina nanošenja (primjerice litre/m2) trebali bi biti u skladu s postupkom i količinom nanošenja za površinsko nanošenje zaštitnog sredstva.
|
|
31.
|
I u ovom je slučaju napomena da se u ovom ispitivanju može upotrijebiti drvo tretirano u industrijskim pogonima. Primijenjene je postupke potrebno zabilježiti, a zadržavanje materijala tretiranog na ovaj način analizirati i zabilježiti.
|
Kondicioniranje ispitnih primjeraka nakon ispitivanja
|
32.
|
Tretirane ispitne primjerke potrebno je nakon tretiranja kondicionirati u skladu s preporukama dobavljača ispitivanog zaštitnog sredstva prema zahtjevima za pakiranje zaštitnog sredstva ili u skladu s komercijalnim praksama tretiranja ili normom EN 252.
|
Priprema i odabir ispitnih primjeraka
|
33.
|
Srednje zadržavanje skupine ispitnih primjeraka izračunava se poslije kondicioniranja nakon tretiranja te se za mjerenja ispiranja nasumično biraju tri reprezentativna kompleta primjeraka sa zadržavanjem unutar 5 % srednje vrijednosti skupine.
|
POSTUPAK MJERENJA EMISIJE ZAŠTITNIH SREDSTAVA
Metoda uranjanja
|
34.
|
Ispitni se primjerci važu i potom u potpunosti uranjaju u vodu uz bilježenje datuma i vremena. Spremnik je pokriven radi smanjivanja isparavanja.
|
|
35.
|
Voda se mijenja u sljedećim intervalima: nakon šest sati, jednog dana, dva dana, četiri dana, osam dana, 15 dana, 22 dana, 29 dana (napomena: riječ je o ukupnom trajanju, a ne o trajanju intervala). Potrebno je evidentirati vrijeme i datum izmjene vode te masu vode izvađenu iz spremnika.
|
|
36.
|
Nakon svake izmjene vode uzorak vode u koju je bio uronjen komplet ispitnih primjeraka zadržava se za naknadnu kemijsku analizu.
|
|
37.
|
Zahvaljujući postupku uzorkovanja moguć je izračun profila količine emisija tijekom vremena. Uzorke je potrebno pohraniti u uvjetima za očuvanje predmeta analize, primjerice na tamnom mjestu u frižideru kako bi se smanjio rast mikroba u uzorku prije analize.
|
MJERENJA EMISIJE
Tretirani uzorci
|
38.
|
Prikupljena se voda po potrebi kemijski analizira na aktivne tvari i/ili relevantne degradacijske/transformacijske proizvode.
|
Netretirani uzorci
|
39.
|
Zahvaljujući prikupljanju vode (emisata) u ovom sustavu i naknadnoj analizi kemikalija koje su isprane s netretiranih uzoraka drva moguća je procjena moguće stope emisije zaštitnog sredstva s netretiranog drva. Zahvaljujući prikupljanju i analizi emisata nakon duljih razdoblja izlaganja moguća je procjena stope promjene stope emisije tijekom vremena. Ta je analiza kontrolni postupak za utvrđivanje pozadinskih razina ispitivane kemikalije u netretiranom drvu kako bi se potvrdilo da drvo upotrijebljeno kao izvor uzoraka nije prethodno tretirano zaštitnim sredstvom.
|
PODACI I IZVJEŠĆIVANJE
Kemijske analize
|
40.
|
Prikupljena voda kemijski se analizira, a njezin se rezultat navodi u odgovarajućim jedinicama, primjerice u μg/l.
|
Dostava podataka
|
41.
|
Svi se rezultati evidentiraju. U dodatku je naveden primjer predloženog obrasca za evidenciju za jedan komplet tretiranih ispitnih primjeraka i tablica sa sažetkom za izračun srednjih vrijednosti emisije tijekom svakog intervala uzorkovanja.
|
|
42.
|
Dnevno strujanje emisije u mg/m2/dan izračunava se uzimanjem triju izmjerenih vrijednosti iz triju replika i dijeljenjem s brojem dana uranjanja.
|
Izvješće o ispitivanju
|
43.
|
U izvješću o ispitivanju navode se najmanje sljedeće informacije:
|
—
|
naziv dobavljača ispitivanog zaštitnog sredstva,
|
|
—
|
poseban ili jedinstven naziv ili oznaka ispitivanog zaštitnog sredstva,
|
|
—
|
komercijalan ili uobičajen naziv aktivnih sastojaka uz generički opis pomoćnih tvari (primjerice pomoćnog otapala, smole) i sastav sastojaka u % m/m,
|
|
—
|
relevantno zadržavanje ili opterećenje (u kg/m3, odnosno l/m2) za drvo koje se upotrebljava u doticaju s vodom,
|
|
—
|
vrste upotrijebljenog drva, uključujući njegovu gustoću i stopu rasta u godovima na 10 mm,
|
|
—
|
opterećenje ili zadržavanje ispitivanog zaštitnog sredstva i formula za izračun zadržavanja izraženog u l/m2 ili kg/m3,
|
|
—
|
metoda nanošenja zaštitnog sredstva uz navođenje rasporeda tretiranja u postupku penetracije te metoda nanošenja u slučaju površinskog tretiranja,
|
|
—
|
datum nanošenja zaštitnog sredstva i procjena udjela vlage ispitnih primjeraka izražena u postotku,
|
|
—
|
primijenjeni postupci kondicioniranja uz navođenje vrste, uvjeta i trajanja,
|
|
—
|
podaci o vrsti i broju nanošenja završnog brtvila,
|
|
—
|
podaci o svim naknadnim tretiranjima drva, primjerice podaci o dobavljaču, vrsti, svojstvima i količini boje,
|
|
—
|
vrijeme i datum svakog uranjanja, količina vode u koju su uronjeni svi ispitni primjerci pri svakom uranjanju te količina vode koju je drvo apsorbiralo tijekom uranjanja,
|
|
—
|
sva odstupanja od opisane metode i svi čimbenici koji su mogli utjecati na rezultate.
|
|
LITERATURA
|
(1)
|
Europska norma EN 84 – 1997. Sredstva za zaštitu drva. Ubrzano starenje tretiranog drva prije biološkog testiranja. Postupak ispiranja.
|
|
(2)
|
Europska norma EN 113 – 2004. Sredstva za zaštitu drva. Metoda ispitivanja za određivanje učinkovitosti zaštite protiv razarača drva iz odjeljka basidiomycetes. Određivanje toksičnih vrijednosti.
|
|
(3)
|
Europska norma EN 252 – 1989. Metoda ispitivanja na otvorenom za određivanje zaštitne učinkovitosti sredstva za zaštitu drva u dodiru sa zemljom.
|
|
(4)
|
Europska norma EN 335 – Dio 1: 2006. Trajnost drva i proizvoda na osnovi drva – Definicije upotreba razreda – Dio 1: Općenito.
|
|
(5)
|
American Society for Testing and Materials Standards, ASTM D 1141 – 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
(6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II – 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
Dodatak 1.
Obrazac za evidenciju za ispitnu metodu
Procjena emisija u okoliš iz drva tretiranog zaštitnim sredstvima: laboratorijska metoda za drvene predmete u doticaju sa slatkom ili morskom vodom koji nisu u nju uronjeni
|
Ispitna ustanova
|
|
|
Sredstvo za zaštitu drva
|
|
Dobavljač zaštitnog sredstva
|
|
|
Poseban ili jedinstven naziv ili oznaka zaštitnog sredstva
|
|
|
Komercijalan ili uobičajen naziv zaštitnog sredstva
|
|
|
Pomoćne tvari
|
|
|
Relevantno zadržavanje za drvo koje se upotrebljava u doticaju s vodom
|
|
|
Nanošenje
|
|
Metoda nanošenja
|
|
|
Datum nanošenja
|
|
|
Formula za izračun zadržavanja:
|
|
|
Postupak kondicioniranja
|
|
|
Trajanje kondicioniranja
|
|
|
Završno brtvilo / broj nanošenja
|
|
|
Naknadno tretiranje
|
po potrebi
|
|
Ispitni primjerci
|
|
Vrste drva
|
|
|
Gustoća drva
|
(najmanja … srednja vrijednost … najveća)
|
|
Stopa rasta (broj godova na 10 mm)
|
(najmanja … srednja vrijednost … najveća)
|
|
Udjel vlage
|
|
|
Stalci za ispitivanje
(67)
|
Zadržavanje (primjerice u kg/m3)
|
|
Tretirani ‚x’
|
Srednja vrijednost i standardno odstupanje ili raspon od pet primjeraka
|
|
Tretirani ‚y’
|
Srednja vrijednost i standardno odstupanje ili raspon od pet primjeraka
|
|
Tretirani ‚z’
|
Srednja vrijednost i standardno odstupanje ili raspon od pet primjeraka
|
|
Netretirani
|
|
|
Varijacija parametara ispitne metode
|
Primjerice kvaliteta vode, dimenzija ispitnih primjeraka itd.
|
|
Vrijeme
|
Izmjena vode
|
Masa primjerka
|
Apsorpcija vode
|
Uzorak vode
|
|
Tretirani (srednja vrijednost)
|
Netretirani
|
Tretirani (srednja vrijednost)
|
Netretirani
|
|
Ispitna voda
|
x
|
y
|
z
|
|
|
Datum
|
g
|
g
|
g
|
g
|
br.
|
pH-vrijednost
|
pH-vrijednost
|
pH-vrijednost
|
pH-vrijednost
|
|
početak
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
šest sati
|
|
|
|
|
|
1
|
|
|
|
|
|
24 sata
|
|
|
|
|
|
2
|
|
|
|
|
|
dva dana
|
|
|
|
|
|
3
|
|
|
|
|
|
četiri dana
|
|
|
|
|
|
4
|
|
|
|
|
|
osam dana
|
|
|
|
|
|
5
|
|
|
|
|
|
15 dana
|
|
|
|
|
|
6
|
|
|
|
|
|
22 dana
|
|
|
|
|
|
7
|
|
|
|
|
|
29 dana
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
Za svaki aktivni sastojak popunite zasebnu tablicu.
|
Vrijeme
|
Izmjena vode
|
Rezultati analize
|
|
Netretirani primjerci
|
Tretirani primjerci
|
|
Koncentracija aktivnog sastojka u vodi
mg/l
|
Emitirana količina
mg/m2
|
Stopa emisije
mg/m2/dan
|
Koncentracija aktivnog sastojka u vodi
|
Emitirana količina
|
Stopa emisije
|
|
x
|
y
|
z
|
Srednja vrijednost
|
x
|
y
|
z
|
Srednja vrijednost
|
x
|
y
|
z
|
Srednja vrijednost
|
|
|
Datum
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/dan
|
mg/m2/dan
|
mg/m2/dan
|
mg/m2/dan
|
|
šest sati
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 sata
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dva dana
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
četiri dana
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
osam dana
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 dana
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 dana
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 dana
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Napomena: S obzirom na mogućnost upotrebe rezultata netretiranih uzoraka za ispravak stopa emisije tretiranih uzoraka, prvo je potrebno navesti rezultate netretiranih uzoraka, a sve bi vrijednosti tretiranih uzoraka trebale biti ‚ispravljene vrijednosti’. Moguć je i ispravak za analizu početne vode.
Dodatak 2.
Definicije
Kemikalija
: tvar ili smjesa.
Ispitivana kemikalija
: Bilo koja tvar ili smjesa ispitivana primjenom ove ispitne metode.
C.46. BIOAKUMULACIJA U BENTIČKIM OLIGOHETIMA IZ SEDIMENTA
UVOD
|
1.
|
Ova ispitna metoda odgovara Smjernici za ispitivanje OECD-a (TG) 315 (2008.), Endobentičke životinje koje konzumiraju sediment mogu biti izložene tvarima povezanima sa sedimentom. Među tim konzumentima sedimenta vodeni oligoheti imaju važnu ulogu na dnima vodenih sustava. Žive u sedimentu i često predstavljaju najbrojniju vrstu, posebno u staništima u kojima su okolišni uvjeti štetni za ostale životinje. Bioturbacijom sedimenta te služenjem kao plijen ove životinje mogu snažno utjecati na bioraspoloživost takvih tvari ostalim organizmima, primjerice bentivornim ribama. Za razliku od epibentičkih organizama, endobentički vodeni oligoheti ruju u sedimentu te konzumiraju čestice sedimenta ispod površine sedimenta. Zbog toga ovi su organizmi izloženi tvarima brojnim ostalim načinima unošenja, uključujući izravni kontakt, konzumiranje kontaminiranih čestica sedimenta, pornu vodu i vodu iznad sedimenta. Neke vrste bentičkih oligoheta koje se trenutačno upotrebljavaju u ekotoksikološkim ispitivanjima opisane su u Dodatku 6.
|
|
2.
|
Parametri koji karakteriziraju bioakumulaciju tvari ponajprije obuhvaćaju faktor bioakumulacije (BAF), konstantu brzine apsorpcije sedimenta (ks) i konstantu brzine eliminacije (ke). Detaljne definicije tih parametara navedene su u Dodatku 1.
|
|
3.
|
Da bi se ocijenio bioakumulacijski potencijal tvari općenito te da bi se istražila bioakumulacija tvari koje se obično dijele u ili na sedimentima, potrebna je ispitna metoda specifična za ovaj odjeljak (1)(2)(3)(4).
|
|
4.
|
Ova je ispitna metoda namijenjena za procjenu bioakumulacije tvari povezanih sa sedimentom u endobentičkim oligohetnim crvima. Ispitivana se tvar postupkom spikinga dodaje u sediment. Sediment obrađen postupkom spikinga upotrebljava se u cilju simulacije kontaminiranog sedimenta.
|
|
5.
|
Ova se metoda temelji na postojećim metodama ispitivanja toksičnosti sedimenta i bioakumulacije (1)(4)(5)(6)(7)(8)(9). Ostali korisni dokumenti jesu: rasprave i rezultati međunarodne radionice (11) te ishod međunarodnog prstenastog testa (12).
|
|
6.
|
Ovaj se test primjenjuje na stabilne, neutralne organske tvari koje se obično vežu za sedimente. Ovom se metodom može mjeriti i bioakumulacija stabilnih metaloorganskih spojeva koji se vežu za sediment. Bez izmjene plana ispitivanja u pogledu volumena supstrata i vode te možda veličine tkiva uzorka metoda nije primjenjiva na metale i ostale elemente u tragovima (11).
|
PREDUVJETI I INFORMACIJE O ISPITIVANOJ TVARI
|
7.
|
Postoji samo nekoliko dobro poznatih kvantitativnih odnosa strukture i aktivnosti (QSAR-ova) o procesima bioakumulacije koji su trenutačno dostupni (14). Najčešće upotrebljavani odnos jest korelacija između bioakumulacije i biokoncentracije stabilnih organskih tvari i njihove lipofilnosti (izražena kao logaritam podjelnog koeficijenta oktanol/voda (log Kow); za definiciju vidi Dodatak 1.) koja je razvijena radi opisa razdiobe tvari između vode i riba. S pomoću ovog odnosa utvrđene su i korelacije za odjeljke sedimenta (15)(16)(17)(18). Korelacija log Kow-log BCF kao najvažniji QSAR može pomoći u prvoj preliminarnoj procjeni potencijala bioakumulacije tvari koje se vežu za sediment. Međutim, na BAF može utjecati sadržaj lipida ispitivanog organizma te sadržaj organskog ugljika sedimenta. Stoga se podjelni koeficijent organski ugljik-voda (Koc) može upotrebljavati i kao najvažniji determinant bioakumulacije organskih tvari koje se vežu za sediment.
|
|
8.
|
Ovo se ispitivanje primjenjuje na:
|
—
|
stabilne organske tvari čije su log Kow vrijednosti između 3,0 i 6,0 (5)(19) i na superlipofiličke tvari s vrijednostima log Kow većima od 6,0 (5);
|
|
—
|
tvari koje pripadaju razredu organskih tvari poznatih po svojem bioakumulacijskom potencijalu u živim organizmima, primjerice surfaktantima ili jako adsorptivnim tvarima (primjerice visok Koc).
|
|
|
9.
|
Prije početka istraživanja potrebno je prikupiti informacije o ispitivanoj tvari, poput mjera opreza, ispravnih uvjeta skladištenja i stabilnosti te analitičke metode. Smjernice za ispitivanje tvari čija fizikalno-kemijska svojstva otežavaju ispitivanje nalaze se u literaturi pod (20) i (21). Prije provedbe ispitivanja bioakumulacije s vodenim oligohetima trebale bi biti poznate sljedeće informacije o ispitivanoj tvari:
|
—
|
opći naziv, kemijski naziv (po mogućnosti IUPAC naziv), strukturna formula, CAS registarski broj, čistoća;
|
|
—
|
topljivost u vodi [ispitna metoda A.6. (22) ];
|
|
—
|
podjelni koeficijent oktanol-voda, Kow [ispitne metode A.8., A.24. (22)];
|
|
—
|
podjelni koeficijent sediment-voda, izražen kao Kd ili Koc [ispitna metoda C.19. (22)];
|
|
—
|
hidroliza [ispitna metoda C.7. (22)];
|
|
—
|
fototransformacija u vodi (23);
|
|
—
|
tlak pare [ispitna metoda A.4. (22)];
|
|
—
|
laka biorazgradivost [ispitne metode C.4. i C.29. (22)];
|
|
—
|
površinska napetost [ispitna metoda A.5. (22)];
|
|
—
|
kritična micelacijska koncentracija (24).
|
Osim toga, sljedeće bi informacije, ako su dostupne,– bile važne:
|
—
|
biorazgradnja u vodenom okolišu [ispitne metode C.24. i C.25. (22)];
|
|
—
|
konstanta Henryjeva zakona.
|
|
|
10.
|
Radioaktivno obilježene ispitivane tvari mogu olakšati analizu uzoraka vode, sedimenta i bioloških uzoraka te se mogu upotrijebiti u definiranju potrebe za identifikacijom i kvantifikacijom produkata razgradnje. Ovdje opisana metoda potvrđena je u međunarodnom prstenastom testu (12) za tvari obilježene s14C. Ako se mjere ukupni radioaktivni ostaci, faktor bioakumulacije (BAF) temelji se na polaznoj tvari, uključujući sve zadržane produkte razgradnje. Analizom i kvantifikacijom postotka polazne tvari i njezinih produkata razgradnje u uzorcima uzetima na kraju faze apsorpcije ili na vršnoj razini bioakumulacije mogu se kombinirati istraživanje metabolizma i istraživanje bioakumulacije. U svakom slučaju preporučuje se temeljiti izračun BAF-a na koncentraciji polazne tvari u organizmima, a ne samo na ukupnim radioaktivnim ostacima.
|
|
11.
|
Uz svojstva ispitivane tvari, ostale potrebne informacije jesu toksičnost za vrste oligoheta koje će biti upotrijebljene u ispitivanju, poput srednje smrtonosne koncentracije (LC50) za vrijeme potrebno za fazu apsorpcije, kako bi se osigurale koncentracije izlaganja koje su mnogo niže od toksičnih razina. Ako su dostupne, prednost je potrebno dati vrijednostima toksičnosti dobivenima u dugotrajnim studijama o subletalnim konačnim učincima (EC50). Ako takvi podaci nisu poznati, korisne se informacije mogu dobiti ispitivanjem akutne toksičnosti u uvjetima koji su identični uvjetima ispitivanja bioakumulacije ili iz podataka o toksičnosti ostalih surogatnih vrsta.
|
|
12.
|
Mora biti dostupna odgovarajuća analitička metoda poznate točnosti, preciznosti i osjetljivosti na kvantifikaciju tvari u ispitnim otopinama, u sedimentu i u biološkom materijalu, s pojedinostima o pripremi i skladištenju uzoraka kao i sigurnosno-tehničkim listovima za materijale. Potrebno je poznavati i analitičke granice detekcije ispitivane tvari u vodi, sedimentu i u tkivu crva. Ako se upotrebljava radioaktivno obilježena ispitivana tvar, moraju se znati i specifična radioaktivnost (primjerice Bq mol– 1), položaj radioaktivno obilježenih atoma i postotak radioaktivnosti povezan s nečistoćama. Specifična radioaktivnost ispitivane tvari trebala bi biti čim veća kako bi se utvrdile čim niže ispitivane koncentracije.
|
|
13.
|
Trebale bi biti dostupne informacije o svojstvima sedimenta koji će se upotrijebiti (primjerice podrijetlo sedimenta ili njegovih sastojaka, pH-vrijednost i koncentracija amonijaka porne vode (terenski sedimenti), sadržaj organskog ugljika (TOC), distribucija veličine čestica (postotak pijeska, praha i gline) i postotak suhe mase) (6).
|
NAČELO ISPITIVANJA
|
14.
|
Ispitivanje se sastoji od dviju faza: faze apsorpcije (faze izlaganja) i faze eliminacije (faze nakon izlaganja). Tijekom faze apsorpcije crvi su izloženi sedimentu u koji je postupkom spikinga dodana ispitivana tvar, prelivenom obrađenom vodom i uravnoteženom po potrebi (11). Skupine kontrolnih crva drže se u istim uvjetima, bez ispitivane tvari.
|
|
15.
|
Za fazu eliminacije crvi se prenose u sustav sediment-voda u kojem nema ispitivane tvari. Faza eliminacije nužna je kako bi se dobile informacije o brzini kojom ispitni organizmi izlučuju ispitivanu tvar (19)(25). Faza eliminacije uvijek je potrebna, osim ako je apsorpcija ispitivane tvari tijekom faze izlaganja bila neznatna (primjerice nema statističke razlike između koncentracije ispitivane tvari u ispitnih i kontrolnih crva). Ako se tijekom faze apsorpcije ne postigne stabilno stanje, rezultati faze eliminacije mogu se upotrijebiti za određivanje kinetičke – BAFk konstante te konstante brzine apsorpcije i eliminacije. Promjena koncentracije ispitivane tvari u/na crvima prati se tijekom obiju faza ispitivanja.
|
|
16.
|
Tijekom faze apsorpcije mjerenja se vrše dok BAF ne postigne plato ili stabilno stanje. Prema zadanim postavkama faza apsorpcije trebala bi trajati 28 dana. Praktična iskustva pokazala su da je faza apsorpcije u trajanju od 12 do 14 dana dovoljna da nekoliko stabilnih, neutralnih organskih tvari postigne stabilno stanje (6)(8)(9).
|
|
17.
|
Međutim, ako se unutar 28 dana ne postigne stabilno stanje, prijenosom izloženih oligoheta u posude koje sadržavaju isti medij bez ispitivane tvari pokreće se faza eliminacije. Faza eliminacije završava ili kada se postigne 10 % razine koncentracije izmjerene u crvima 28. dana faze apsorpcije ili nakon maksimalnog trajanja od deset dana. Kao dodatni krajnji učinak, odnosno kao neeliminirani ostaci (NER), navodi se razina ostataka u crvima na kraju faze eliminacije. Faktor bioakumulacije (BAFss) po mogućnosti se izračunava i kao omjer koncentracije u crvima (Ca) i u sedimentu (Cs) u očigledno stabilnom stanju te kao faktor kinetičke bioakumulacije, BAFK, kao omjer konstante brzine apsorpcije iz sedimenta (ks) i konstante brzine eliminacije (ke) pod pretpostavkom kinetike prvog reda. Ako se unutar 28 dana ne postigne stabilno stanje, izračunajte BAFK iz konstanti brzine apsorpcije i brzine eliminacije. Za izračun vidi Dodatak 2. Ako se ne može primijeniti kinetika prvog reda, potrebno je primijeniti složenije modele (Dodatak 2. i referenca (25.)).
|
|
18.
|
Ako se stabilno stanje ne postigne unutar 28 dana, faza apsorpcije može se fakultativno produžiti podvrgavanjem skupina izloženih crva. ako ih ima, daljnjim mjerenjima dok se ne postigne stabilno stanje. Istodobno, faza eliminacije trebala bi, neovisno o svemu, započeti 28. dana faze apsorpcije.
|
|
19.
|
Konstanta brzine apsorpcije, konstanta (ili konstante, kada su obuhvaćeni složeniji modeli) brzine eliminacije, faktor kinetičke bioakumulacije (BAFK) te, kad je to moguće, granice pouzdanosti svih tih parametara izračunavaju se iz jednadžbi kompjutoriziranog modela (za modele vidi Dodatak 2.). Ispravnost usklađenosti bilo kojeg modela može se odrediti iz koeficijenta korelacije ili koeficijenta određivanja (koeficijenti blizu jedinice znak su dobre usklađenosti).
|
|
20.
|
Da bi se smanjila varijabilnost rezultata ispitivanja za organske tvari visoke lipofilnosti, faktore bioakumulacije potrebno je dodatno izraziti u odnosu na sadržaj lipida ispitivanih organizama i na sadržaj organskog ugljika (TOC) u sedimentu (faktor akumulacije biota-sediment ili BSAF kg sedimenta TOC kg– 1 sadržaja lipida u crvima). Ovaj pristup temelji se na iskustvima i teoretskim korelacijama za vodeni odjeljak kada za neke kemijske razrede postoji jasna veza između potencijala tvari za bioakumulaciju i njezine lipofilnosti, koja je dobro poznata za ribe kao organizme modele (14)(25)(27). Postoji i veza između sadržaja lipida u ispitivanim ribama i opažene bioakumulacije takvih tvari. Slične su korelacije utvrđene i za bentičke organizme (15)(16)(17)(18). Ako je na raspolaganju dovoljno tkiva crva, sadržaj lipida pokusnih životinja može se odrediti na istom biološkom materijalu upotrijebljenom za određivanje koncentracije ispitivane tvari. Međutim, praktično je upotrebljavati aklimatizirane kontrolne životinje barem na početku ili po mogućnosti na kraju faze apsorpcije za mjerenje sadržaja lipida, što se potom može iskoristiti za normalizaciju vrijednosti BAF-a.
|
VALJANOST ISPITIVANJA
|
21.
|
Da bi ispitivanje bilo valjano, treba zadovoljiti sljedeće uvjete:
|
—
|
Kumulativna smrtnost crva (kontrolnih i ispitnih) do kraja ispitivanja ne bi trebala premašiti 20 % od početnog broja.
|
|
—
|
Dodatno, potrebno je dokazati da crvi ruju u sedimentu kako bi omogućili maksimalno izlaganje. Za detalje vidi stavak 28.
|
|
OPIS METODE
Ispitne vrste
|
22.
|
Nekoliko se vrsta vodenih oligoheta može upotrijebiti za ispitivanje. Najčešće upotrebljavane vrste popisane su u Dodatku 6.
|
|
23.
|
Testove toksičnosti (96 sati, samo u vodi) potrebno je provoditi u redovitim razmacima (primjerice svakog mjeseca) s referentnom toksičnom tvari, poput kalijeva klorida (KCl) ili bakrova sulfata (CuSO4) (1) radi dokazivanja zdravstvenih stanja pokusnih životinja (1) (69. Ako se referentni testovi toksičnosti ne provode u redovitim intervalima, potrebno je provjeriti šaržu organizama koja će se upotrebljavati u ispitivanju bioakumulacije sedimenta s pomoću referentne toksične tvari. I mjerenje sadržaja lipida može pružiti korisne informacije o stanju životinja.
|
Kultura ispitnih organizama
|
24.
|
Kako bi se osigurao dovoljan broj crva za provođenje ispitivanja bioakumulacije, crvi se mogu čuvati u trajnoj laboratorijskoj kulturi jedne vrste. Metode laboratorijske kulture za odabrane ispitne vrste sažete su u Dodatku 6. Za detalje vidi reference (8)(9)(10)(18)(28)(29)(30)(31)(32).
|
Aparatura
|
25.
|
Potrebno je pobrinuti se da se za sve dijelove opreme izbjegava upotreba materijala koji mogu otapati, apsorbirati ispitivane tvari ili propuštati ostale tvari te koji imaju negativan učinak na pokusne životinje. Standardne pravokutne ili cilindrične posude od kemijski inertnog materijala prikladne zapremine mogu se upotrebljavati u skladu s brzinom punjenja, odnosno brojem ispitnih crva. Potrebno je izbjegavati upotrebu mekanih plastičnih cijevi za davanje vode ili zraka. Za svu opremu koja dolazi u doticaj s ispitnim medijem potrebno je upotrebljavati politetrafluoroetilen, nehrđajući čelik /ili staklo. Za tvari s visokim koeficijentima apsorpcije, kao što su sintetički piretroidi, možda će biti potrebno silanizirano staklo. U tim situacijama oprema će se morati baciti nakon upotrebe (5). Kad je riječ o radioaktivno obilježenim ispitivanim tvarima i hlapljivim tvarima, potrebno je pobrinuti se da se izbjegne stripiranje i oslobađanje stripirane ispitivane tvari. Potrebno je upotrebljavati zamke (primjerice staklene posude za pranje plinova) koje sadržavaju odgovarajuće apsorbente kako bi se zadržali svi ostaci koji isparavaju iz ispitnih posuda (11).
|
Voda
|
26.
|
Kakvoća vode iznad sedimenta mora omogućavati preživljavanje ispitne vrste tijekom razdoblja aklimatizacije i ispitivanja bez pojave anomalija u izgledu i ponašanju riba. U skladu s ispitnom metodom C.1. (25) u ispitivanjima kao i u laboratorijskim kulturama crva preporučuje se upotreba obrađene vode kao vode iznad sedimenta. Dokazano je da nekoliko ispitnih vrsta u toj vodi (8) može preživjeti, rasti i razmnožavati se te je omogućena maksimalna standardizacija uvjeta ispitivanja i kulture. Potrebno je zabilježiti barem s obzirom na pH-vrijednost, provodljivost i tvrdoću vode. Analiza vode na onečišćujuće mikrotvari prije upotrebe mogla bi pružiti korisne informacije (Dodatak 4.).
|
|
27.
|
Tijekom razdoblja ispitivanja voda bi trebala biti stalne kakvoće. pH-vrijednost vode iznad sedimenta trebala bi biti između šest i devet. Ukupna tvrdoća na početku ispitivanja trebala bi biti između 90 i 400 mg CaCO3 po litri (7). Rasponi za pH-vrijednost i tvrdoću u spomenutoj obrađenoj vodi navedeni su u ispitnoj metodi C.1. (25). Ako se sumnja u postojanje interakcije između iona tvrdoće i ispitivane tvari, potrebno je upotrebljavati vodu manje tvrdoće. U Dodatku 4. sažeti su dodatni kriteriji prihvatljive vode za razrjeđivanje u skladu sa Smjernicom za ispitivanje OECD-a TG 210 (34).
|
Sediment
|
28.
|
Kakvoća sedimenta mora omogućiti preživljavanje i, po mogućnosti, razmnožavanje ispitnih organizama tijekom trajanja aklimatizacije i razdoblja ispitivanja, a da pritom oni ne pokazuju nikakav neuobičajen izgled ili ponašanje. Crvi bi trebali rovati u sedimentu. Ponašanje pri rovanju može utjecati na izlaganje i, posljedično, na BAF. Stoga je, gdje zamućenost vode iznad sedimenta dopušta takva promatranja, potrebno zabilježiti izbjegavanje sedimenta ili ponašanje pri rovanju ispitnih organizama. Crvi (kontrolni i ispitni) trebali bi rovariti u sedimentu unutar razdoblja od 24 sata nakon dodavanja u ispitne posude. Ako se opazi trajno nerovanje ili izbjegavanje sedimenta (primjerice više od 20 % tijekom više od polovice trajanja faze apsorpcije), to je znak da ili uvjeti ispitivanja nisu prikladni ili ispitni organizmi nisu zdravi, ili da koncentracija ispitivane tvari izaziva takvo ponašanje. U takvom slučaju ispitivanje bi bilo potrebno prekinuti i ponoviti pri poboljšanim uvjetima. Dodatne informacije o konzumiranju sedimenta mogu se dobiti primjenom metoda opisanih u (35) (36) u kojima se navodi konzumiranje sedimenta ili odabir čestica u ispitnim organizmima. Ako su vidljive, potrebno je zabilježiti barem prisutnost ili odsutnost fekalnih peleta na površini sedimenta koje ukazuju na to da crvi konzumiraju sediment te je navedeno potrebno razmotriti pri tumačenju rezultata ispitivanja u smislu putova izloženosti.
|
|
29.
|
Za upotrebu i u ispitivanim i u laboratorijskim kulturama crva preporučuje se umjetni sediment na temelju umjetnog tla opisanog u ispitnoj metodi C.8. (40) (Dodatak 5.) jer prirodni sedimenti odgovarajuće kvalitete možda neće biti dostupni tijekom cijele godine. Dodatno, na ispitivanje mogu utjecati prirodni organizmi kao i moguće prisustvo onečišćujućih mikrotvari u prirodnim sedimentima. Nekoliko ispitnih vrsta može preživjeti, rasti i razmnožavati se u umjetnom sedimentu (8).
|
|
30.
|
Za umjetni sediment potrebno je zabilježiti barem podrijetlo sastojaka, distribuciju veličine zrna (postotak pijeska, praha i gline), sadržaj organskog ugljika (TOC), sadržaj vode i pH-vrijednost. Mjerenje redoks potencijala fakultativno je. Međutim, prirodni sedimenti s neonečišćenih mjesta mogu poslužiti kao ispitni sediment i/ili sediment kulture (1). Za prirodne sedimente potrebno je zabilježiti barem podrijetlo (mjesto skupljanja), pH-vrijednost i amonijak porne vode, sadržaj organskog ugljika (TOC), distribuciju veličine čestica (postotak pijeska, praha i gline) te postotak sadržaja vode (6). Ako se očekuje stvaranje amonijaka, preporučuje se da se prirodni sediment prije dodavanja ispitivane tvari postupkom spikinga prethodno priprema sedam dana u istim uvjetima koji prevladavaju i u narednom ispitivanju. Na kraju tog razdoblja pripreme potrebno je ukloniti i baciti vodu iznad sedimenta. Analiza sedimenta ili njegovih sastojaka na onečišćujuće mikrotvari prije upotrebe mogla bi dati korisne informacije.
|
Priprema
|
31.
|
Rukovanje prirodnim sedimentima prije njihove upotrebe u laboratoriju opisano je u (1)(6)(44). Priprema umjetnog sedimenta opisana je u Dodatku 5.
|
Skladištenje
|
32.
|
Prirodni sedimenti u laboratoriju trebali bi se skladištiti čim kraće. Agencija za zaštitu okoliša SAD-a (6) preporučuje maksimalno razdoblje skladištenja od osam tjedana pri temperaturi od 4 ± 2 °C u mraku. Iznad sedimenta u spremnicima za skladištenje ne bi trebalo biti plinskog prostora. Preporuke za skladištenje umjetnog sedimenta navedene su u Dodatku 5.
|
Primjena ispitivane tvari
|
33.
|
U sediment je postupkom spikinga dodana ispitivana tvar. Postupak spikinga obuhvaća premazivanje jednog ili većeg broja sastojaka sedimenta ispitivanom tvari. Primjerice, kremeni pijesak ili njegov dio (primjerice 10 g kremenog pijeska po ispitnoj posudi) može se namočiti u otopini ispitivane tvari u prikladnom otapalu koji onda polako isparava dok ne ostane suhi pijesak. Premazani dio potom se može umiješati u mokri sediment. Pri pripremi sedimenta u obzir se mora uzeti količina pijeska koja nastane miješanjem ispitivane tvari i pijeska, odnosno sediment je stoga potrebno pripremiti s manje pijeska (6).
|
|
34.
|
S prirodnim sedimentom, ispitivana tvar može se dodati postupkom spikinga sušenog dijela sedimenta na prethodno opisani način za umjetni sediment ili miješanjem ispitivane tvari u vlažni sediment, uz naknadno isparavanje bilo kakva otapajućeg sredstva. Prikladna otapala za postupak spikinga jesu etanol, metanol, etilen-glikol-monometil eter, etilen-glikol-dimetil eter, dimetilformamid i trietilenglikol (5)(34). Glavni kriteriji za odabir odgovarajućeg otapajućeg sredstva trebali bi biti toksičnost i hlapljivost otapala te topljivost ispitivane tvari u odabranom otapalu. Dodatna smjernica o postupcima spikinga navedena je u dokumentu Environment Canada (1995)(41). Potrebno je pobrinuti se da se ispitivana tvar koja se dodaje u sediment temeljito i ravnomjerno rasprši u sedimentu. Potrebno je analizirati poduzorke višestrukog određivanja sedimenta obrađenog postupkom spikinga kako bi se provjerile koncentracije ispitivane tvari u sedimentu te utvrdio stupanj homogenosti raspodjele ispitivane tvari.
|
|
35.
|
Kad se pripremi sediment obrađen postupkom spikinga s vodom iznad sedimenta, poželjno je dopustiti razdiobu ispitivane tvari između sedimenta i tekućeg stanja. To je po mogućnosti potrebno učiniti u uvjetima temperature i dozračivanja koji se primjenjuju pri ispitivanju. Prikladno vrijeme uravnoteženja specifično je za svaki sediment i tvar, a može se kretati od nekoliko sati pa sve do nekoliko dana, pa čak u rijetkim slučajevima i do nekoliko tjedana (od četiri do pet tjedana) (28)(42). U ovom se ispitivanju ne čeka uravnoteženje, već se preporučuje vrijeme uravnoteženja od 48 sati do sedam dana. Ovisno o svrsi istraživanja, primjerice kada se oponašaju okolišni uvjeti, sediment obogaćen postupkom spikinga može biti uravnotežen ili ga se može ostaviti dulje vrijeme da stari (11).
|
PROVEDBA ISPITIVANJA
Preliminarno ispitivanje
|
36.
|
Preliminarni eksperiment može biti koristan za optimizaciju uvjeta ispitivanja za glavno ispitivanje, primjerice odabir koncentracije, odnosno koncentracija ispitivane tvari, trajanje faze apsorpcije i izlučivanja. Tijekom preliminarnog ispitivanja potrebno je promatrati i bilježiti ponašanje crva, primjerice izbjegavanje sedimenta, odnosno bijeg crva iz sedimenta, koje može biti prouzročeno ispitivanom tvari i/ili samim sedimentom. Izbjegavanje sedimenta u preliminarnom se ispitivanju može upotrijebiti kao subletalni parametar za procjenu koncentracije(a) ispitivane tvari koja će se upotrijebiti u ispitivanju bioakumulacije.
|
Uvjeti izloženosti
Trajanje faze apsorpcije
|
37.
|
Ispitni organizmi izlažu se ispitivanoj tvari tijekom faze apsorpcije. Prvi je uzorak potrebno uzeti između četiri i 24 sata nakon početka faze apsorpcije. Faza apsorpcije trebala bi trajati do 28 dana (1)(6)(11), osim ako se može dokazati da je ravnoteža uspostavljena prije toga. Stabilno stanje postiže se kada: (i) je graf faktora bioakumulacije u svakom razdoblju uzorkovanja u ovisnosti o vremenu paralelan s vremenskom osi; (ii) se tri uzastopne analize BAF-a provedene na uzorcima uzetima u razmacima od najmanje dva dana ne razlikuju više od ± 20 % i (iii) ne postoje velike razlike između triju razdoblja uzorkovanja (na temelju statističkih usporedbi, primjerice analize varijance, regresijske analize). Ako se do 28. dana ne postigne stabilno stanje, faza apsorpcije može se završiti pokretanjem faze eliminacije, a BAFK može se izračunati iz konstanta apsorpcije i brzine eliminacije (vidi i stavke od 16. do 18.).
|
Trajanje faze eliminacije
|
38.
|
Prvi je uzorak potrebno uzeti između četiri i 24 sata nakon početka faze eliminacije jer tijekom početnog razdoblja može doći do brzih promjena u ostacima u tkivu. Preporučuje se prekinuti fazu eliminacije ili kada je koncentracija ispitivane tvari niža od 10 % koncentracije stabilnog stanja ili nakon maksimalnog trajanja od deset dana. Razina ostataka u crvima na kraju faze eliminacije prijavljuje se kao sekundarni krajnji rezultat. Međutim, to razdoblje može biti uvjetovano razdobljem tijekom kojeg se koncentracija ispitivane tvari u crvima zadržava iznad analitičke granice detekcije.
|
Ispitni organizmi
Broj ispitnih crva
|
39.
|
Broj crva po uzorku mora pružiti masu tkiva crva tako da masa ispitivane tvari po uzorku na početku faze apsorpcije, odnosno na kraju faze eliminacije bude znatno viša od granice detekcije za ispitivanu tvar u biološkom materijalu. U navedenim je fazama apsorpcije i eliminacije koncentracija u pokusnim životinjama obično relativno niska (6)(8)(18). Budući da je pojedinačna masa brojnih vrsta vodenih oligoheta vrlo niska (od pet do deset miligrama mokre mase po jedinci za vrste Lumbriculus variegatus i Tubifex tubifex), mogu se pridružiti i crvi iz ispitnih posuda za višestruka određivanja za vaganje i analizu ispitivane kemikalije. Za ispitne vrste više pojedinačne mase (primjerice Branchiura sowerbyi) mogu se upotrebljavati višestruka određivanja koja sadržavaju jednu jedinku, no u tim je slučajevima potrebno povećati broj višestrukih određivanja na pet po mjestu uzorkovanja (11). Međutim, potrebno je napomenuti da vrsta B. sowerbyi nije bila uključena u prstenasti test (12) te da se stoga ne preporučuje kao preferirana vrsta u metodi.
|
|
40.
|
Potrebno je upotrebljavati crve slične veličine (za vrstu L. variegatus vidi Dodatak 6.). Trebali bi biti iz istog izvora te bi kao odrasle ili velike životinje trebali pripadati istom starosnom razredu (vidi Dodatak 6.). Budući da masa i starost životinje mogu znatno utjecati na vrijednosti BAF-a (primjerice zbog različitog sadržaja lipida i/ili prisutnosti jajašaca), te parametre potrebno je točno zabilježiti. Prije početka ispitivanja potrebno je izvagati poduzorak crva kako bi se izvagala srednja mokra i suha masa.
|
|
41.
|
Kad je riječ o vrstama Tubifex tubifex i Lumbriculus variegatus, očekuje se da će tijekom ispitnog razdoblja doći do razmnožavanja. Potrebno je zabilježiti izostanak razmnožavanja u ispitivanju bioakumulacije te to razmotriti pri tumačenju rezultata ispitivanja.
|
Punjenje
|
42.
|
Potrebno je upotrijebiti visoke omjere sediment-crv i voda-crv kako bi se minimiziralo smanjenje koncentracije ispitivane tvari u sedimentu tijekom faze apsorpcije te kako bi se izbjegla smanjenja u koncentraciji otopljenog kisika. Odabrana brzina punjenja trebala bi odgovarati prirodno nastalim gustoćama naseljenosti odabrane vrste (43). Primjerice, za vrstu Tubifex tubifex preporučuje se brzina punjenja od jednog do četiriju miligrama tkiva crva (mokra masa) po gramu mokrog sedimenta (8)(11). Za vrstu L. variegatus reference (1) i (6) preporučuju brzina punjenja od ≤ 1 g suhe mase tkiva crva po 50 g organskog ugljika sedimenta.
|
|
43.
|
Crvi koji će se upotrebljavati u ispitivanju uklanjaju se iz kulture prosijavanjem kulture sedimenta. Životinje (odrasli ili veliki crvi bez znakova nedavne fragmentacije) prenose se u staklene zdjelice (primjerice Petrijeve zdjelice) s čistom vodom. Ako se uvjeti ispitivanja razlikuju od uvjeta uzgoja kulture, trebala bi biti dovoljna faza aklimatizacije od 24 sata. Prije vaganja iz crva je potrebno odstraniti višak vode. To se može učiniti nježnim stavljanjem crva na prethodno navlažen papirnati ručnik. Za sušenje crva ne preporučuje se upotreba upijajućeg papira jer može prouzročiti stres crva ili ih oštetiti. Brunson et al. (1998.) preporučuju upotrebu crva iz kojih nije uklonjen višak tekućine koji predstavljaju približno 1,33 puta ciljane biomase. Tih dodatnih 33 % odgovara razlici između crva iz kojih je uklonjen višak tekućine i onih iz kojih to nije učinjeno (28).
|
|
44.
|
Na početku faze apsorpcije (0. dan ispitivanja) ispitni se organizmi uklanjaju iz aklimatizirane komore te se nasumično raspoređuju po posudama (primjerice Petrijevim zdjelicama) koje sadržavaju obrađenu vodu dodavanjem skupina od po dva crva u svaku posudu sve dok u svakoj posudi ne bude deset crva. Svaka od tih skupina crvi potom se nasumično prenosi u zasebne ispitne posude, primjerice s pomoću hvataljka od mekog željeza). Ispitne posude potom se inkubiraju u skladu s uvjetima ispitivanja.
|
Hranjenje
|
45.
|
S obzirom na nizak hranjivi sadržaj umjetnog sedimenta, sediment je potrebno obogatiti izvorom hrane. Kako se ne bi podcijenila izloženost ispitnih organizama, primjerice selektivnim hranjenjem nekontaminiranom hranom, hranu potrebnu za razmnožavanje i rast ispitnih organizama potrebno je dodati sedimentu jednom prije ili tijekom primjene ispitivane tvari (vidi Dodatak 5.).
|
Omjer sedimenta i vode
|
46.
|
Preporučeni je omjer sedimenta i vode 1: 4 (45). Ovaj se omjer smatra stabilnim za održavanje koncentracija kisika na primjerenim razinama te za izbjegavanje stvaranja amonijaka u vodi iznad sedimenta. Sadržaj kisika u vodi iznad sedimenta potrebno je održavati na razini od ≥ 40 % zasićenosti. Voda iznad sedimenta u ispitnim posudama trebala bi se lagano dozračivati (primjerice dva do četiri mjehurića po sekundi) Pasteurovom pipetom smještenom približno dva centimetra iznad površine sedimenta kako bi se minimiziralo uznemiravanje sedimenta.
|
Svjetlo i temperatura
|
47.
|
Fotoperiod u kulturi i ispitivanju jest 16 sati (1)(6). Intenzitet svjetla u ispitnom području potrebno je održavati na otprilike 500 – 1 000 lx. Temperatura bi trebala iznositi 20 ± 2 °C tijekom cijelog ispitivanja.
|
Ispitne koncentracije
|
48.
|
Za utvrđivanje kinetike apsorpcije upotrebljava se jedna ispitna koncentracija (što je moguće niža), no može se upotrijebiti druga (viša) koncentracija (primjerice (46)). Uzorci se u tom slučaju uzimaju i analiziraju u stabilnom stanju ili nakon 28 dana kako bi se potvrdio BAF izmjeren pri nižoj koncentraciji (11). Potrebno je izabrati višu koncentraciju kako bi se mogli isključiti štetni učinci (primjerice odabirom približno 1 % najniže poznate koncentracije s vidljivim kroničnim učinkom ECx dobivenim iz relevantnih studija kronične toksičnosti). Niža ispitna koncentracija trebala bi biti znatno viša od granice detekcije u sedimentu i biološkim uzorcima iz primijenjene analitičke metode. Ako je koncentracija s vidljivim učinkom ispitivane kemikalije blizu granice analitičke detekcije, preporučuje se upotreba radioaktivno obilježene ispitne kemikalije visoke specifične radioaktivnosti.
|
Ispitna i kontrolna višestruka određivanja
|
49.
|
Najmanji broj ispitnih višestrukih određivanja za kinetička mjerenja trebao bi biti tri po mjestu uzorkovanja (11) tijekom faze apsorpcije i eliminacije. Potrebno je upotrijebiti dodatna višestruka određivanja, primjerice za fakultativne dodatne datume uzorkovanja. Za fazu eliminacije pripremljen je odgovarajući broj višestrukih određivanja sa sedimentom koji nije obrađen postupkom spikinga i vodom iznad sedimenta kako bi se ispitni crvi na kraju faze apsorpcije mogli prebaciti iz određenih ispitnih posuda u neispitne posude. Ukupan broj ispitnih višestrukih određivanja trebao bi biti dovoljan i za fazu apsorpcije i za fazu eliminacije.
|
|
50.
|
Alternativno, crvi koji su tijekom faze eliminacije određeni za uzorkovanje mogu biti izloženi u jednom velikom spremniku sa sedimentom koji je podvrgnut postupku spikinga iste šarže koja je upotrijebljena za kinetiku apsorpcije. Potrebno je dokazati da su uvjeti ispitivanja (primjerice dubina sedimenta, omjer sedimenta i vode, dodavanje, temperatura, kvaliteta vode) usporedivi s višestrukim određivanjima određenima za fazu apsorpcije. Na kraju faze apsorpcije iz ovog je spremnika potrebno uzeti uzorke vode, sedimenta i tla za analizu. Potrebno je pozorno ukloniti dovoljan broj velikih crva koji ne pokazuju znakove nedavne fragmentacije te ih premjestiti u višestruka određivanja pripremljena za fazu eliminacije (primjerice deset organizama po posudi za višestruko određivanje).
|
|
51.
|
Ako se osim vode ne upotrebljava drugo otapalo, za biološku i pozadinsku analizu potrebno je osigurati najmanje devet višestrukih određivanja iz negativne kontrole (najmanje tri uzorkovana na početku, tri na kraju apsorpcije i tri na kraju eliminacije). Ako je za primjenu ispitivane tvari upotrijebljeno bilo kakvo otapajuće sredstvo, potrebno je oformiti kontrolnu skupinu s otapalom (najmanje tri višestruka određivanja trebala bi biti uzorkovana na početku, tri na kraju apsorpcije i tri na kraju eliminacije) U tom slučaju potrebno je pružiti najmanje četiri višestruka određivanja iz negativne kontrole (bez otapala) za uzorkovanje na kraju faze apsorpcije. Ta se višestruka određivanja mogu biološki usporediti s kontrolnim skupinama s otapalom da bi se dobile informacije o mogućem utjecaju otapala na ispitne organizme. Detalji su navedeni u Dodatku 3.
|
Učestalost mjerenja kakvoće vode
|
52.
|
Tijekom faze apsorpcije i eliminacije u vodi iznad sedimenta potrebno je mjeriti barem sljedeće parametre kakvoće vode:
|
temperatura
|
u jednoj posudi svake razine ispitivanja po datumu uzorkovanja i u jednoj kontrolnoj posudi jednom tjedno te na početku i na kraju razdoblja apsorpcije i eliminacije; može se i zabilježiti temperatura u mediju koji okružuje (vanjski zrak ili vodena kupelj) ili u jednoj reprezentativnoj ispitnoj posudi, primjerice kontinuirano ili u intervalima po satima;
|
|
sadržaj otopljenog kisika
|
u jednoj posudi svake razine ispitivanja i u jednoj kontrolnoj posudi po datumu uzorkovanja; izražen kao mg/l i % ASV-a (vrijednosti zasićenosti kisikom);
|
|
dovod zraka
|
kontrolira se najmanje jednom dnevno (za radnih dana) i prilagođava se po potrebi;
|
|
pH-vrijednost
|
u jednoj ispitnoj posudi svake razine ispitivanja po datumu uzorkovanja i u jednoj kontrolnoj posudi jednom tjedno te na početku i na kraju razdoblja apsorpcije i eliminacije;
|
|
ukupna tvrdoća vode
|
barem u jednoj ispitnoj posudi i jednoj kontrolnoj ispitnoj posudi na početku i kraju razdoblja apsorpcije i eliminacije, izraženo kao mg/l CaCO3;
|
|
ukupni sadržaj amonijaka
|
barem u jednoj ispitnoj posudi i jednoj kontrolnoj ispitnoj posudi na početku i kraju razdoblja apsorpcije i eliminacije, izraženo kao mg/l NH4
+ ili NH3 ili ukupni amonijak – N.
|
|
Uzorkovanje i analiza crva, sedimenta i vode
Raspored uzorkovanja
|
53.
|
Primjeri rasporeda uzorkovanja za fazu apsorpcije od 28 dana i fazu eliminacije od deset dana nalaze se u Dodatku 3.
|
|
54.
|
Uzorkujte vodu i sediment iz ispitnih posuda za određivanje koncentracije ispitivane tvari prije umetanja crva te tijekom faze apsorpcije i faze eliminacije. Tijekom ispitivanja utvrđuju se koncentracije ispitivane tvari u crvima, sedimentu i vodi kako bi se nadzirala distribucija ispitivane tvari u segmentima ispitnog sustava.
|
|
55.
|
Crve, sediment i vodu uzorkujte u najmanje šest prigoda tijekom faze apsorpcije kao i eliminacije.
|
|
56.
|
Nastavite s uzorkovanjem sve dok se ne postigne plato (stabilno stanje) (vidi Dodatak 1.) ili 28 dana. Ako se unutar 28 dana ne postigne plato, počnite s fazom eliminacije. Pri započinjanju faze eliminacije određene crve prenesite u posude za višestruko određivanje koje sadržavaju netretirani sediment i vodu (vidi i stavke 17. i 18.).
|
Uzorkovanje i priprema uzoraka
|
57.
|
Uzorke vode dobijte procjeđivanjem, ispuštanjem ili pipetiranjem volumena koji je dovoljan za mjerenje količine ispitne tvari u uzorku.
|
|
58.
|
Preostala voda iznad sedimenta pozorno se procjeđuje ili ispušta iz ispitne(ih) posude(a). Uzorke sedimenta potrebno je uzimati pozorno, uz minimalno ometanje crva.
|
|
59.
|
Uklonite sve crve iz ispitnih višestrukih određivanja u vrijeme uzorkovanja, primjerice suspendiranjem sedimenta s vodom iznad sedimenta i rasprostiranjem sadržaja svakog višestrukog određivanja u plitkoj posudi te vađenjem crva hvataljkom od mekog željeza. Brzo ih isperite vodom u plitkoj staklenoj ili čeličnoj plitici. Uklonite višak vode. Crve pozorno prenesite u prethodno izvaganu posudu i izvažite ih. Crve usmrtite zamrzavanjem (primjerice ≤ – 18 °C). Potrebno je zabilježiti prisutnost i broj kokona i/ili mladih.
|
|
60.
|
Općenito, crve je potrebno izvagati i usmrtiti odmah nakon uzorkovanja, bez faze pražnjenja crijeva, kako bi se dobio konzervativni BAF koji obuhvaća onečišćeni sadržaj crijeva te kako bi se izbjegli gubici tjelesnih ostataka tijekom razdoblja pražnjenja crijeva samo u vodi (8). Tijekom bilo kojeg razdoblja pražnjenja crijeva samo u vodi ne očekuje se znatna eliminacija tvari čiji je log Kow iznad pet, dok može doći do gubitka znatnih količina tvari čiji je log Kow niži od četiri (47).
|
|
61.
|
Tijekom faze eliminacije crvi prazne crijeva u čistom sedimentu. To znači da mjerenja odmah nakon faze eliminacije uključuju kontaminirani sediment crijeva, dok se pretpostavlja da se kontaminirani sadržaj crijeva nakon početnih četiri do 24 sata faze eliminacije zamjenjuje čistim sedimentom (11) (47). Koncentracija u crvima u ovom uzorku tada se može smatrati koncentracijom tkiva nakon pražnjenja crijeva. Kako bi se u obzir uzelo i razrjeđivanje koncentracije ispitivane tvari u nekontaminiranom sedimentu tijekom faze eliminacije, masa sadržaja crijeva može se procijeniti iz omjera mokre mase crva / mase praha crva ili iz suhe mase crva / mase praha crva.
|
|
62.
|
Ako je svrha specifičnog istraživanja izmjeriti bioraspoloživost i ostatke pravog tkiva u ispitnim organizmima, tada je barem poduzorak ispitnih životinja (primjerice iz triju dodatnih posuda za višestruko određivanje) koji je, po mogućnosti, uzorkovan tijekom stabilnog stanja, potrebno izvagati, pročišćivati u čistoj vodi šest sati (47) i ponovno izvagati prije analize. Tada se podaci o masi i tjelesnoj koncentraciji crva ovog poduzorka mogu usporediti s vrijednostima dobivenima od nepročišćenih crva. Crve određene za mjerenje eliminacije potrebno je pročistiti prije prijenosa u čisti sediment kako bi se za životinje minimizirao dodatni stres.
|
|
63.
|
Po mogućnosti, uzorke vode, sedimenta i crva analizirajte neposredno nakon njihova vađenja (odnosno u roku od jednog do dva dana) kako bi se spriječila razgradnja ili ostali gubici te kako bi se izračunale približne brzine apsorpcije i eliminacije tijekom nastavka ispitivanja. Osim toga, trenutačnom se analizom izbjegava kašnjenje u određivanju platoa.
|
|
64.
|
Ako se analiza ne obavi odmah, uzorke je potrebno uskladištiti pod prikladnim uvjetima. Prije početka istraživanja pribavite informacije o stabilnosti i ispravnim uvjetima skladištenja za određenu ispitivanu tvar (primjerice trajanje i temperatura skladištenja, postupci ekstrakcije itd.). Ako takve informacije nisu dostupne te ako se procijeni da su nužne, istodobno se mogu analizirati kontrolna tkiva podvrgnuta postupku spikinga kako bi se utvrdila stabilnost skladištenja.
|
Kakvoća analitičke metode
|
65.
|
Budući da čitav postupak uglavnom ovisi o točnosti, preciznosti i osjetljivosti analitičke metode koja se primjenjuje u odnosu na ispitivanu tvar, pokusima treba provjeriti jesu li preciznost i obnovljivost kemijske analize te izdvajanje ispitivane tvari iz uzoraka vode, sedimenta i crva zadovoljavajući za metodu u pitanju. Provjerite i može li se ispitivana tvar detektirati u kontrolnim posudama u koncentracijama višima od pozadinskih. Ako je to potrebno, ispravite vrijednosti Cw, Cs i Ca za oporavke i pozadinske vrijednosti kontrola. Tijekom ispitivanja svim uzorcima rukujte na način da minimizirate kontaminaciju i gubitak (primjerice nastali kao rezultat adsorpcije ispitivane tvari na uređaj za uzorkovanje).
|
|
66.
|
Potrebno je zabilježiti i u izvješće uključiti i ukupni oporavak te oporavak ispitivane tvari u crvima, sedimentu, vodi te, ako se upotrebljavaju, u zamkama koje sadržavaju apsorbente radi zadržavanja isparene ispitivane tvari.
|
|
67.
|
Budući da se preporučuje upotreba radioaktivno obilježenih tvari, moguće je analizirati cjelokupnu radioaktivnost (odnosno polazni i produkti razgradnje). Međutim, ako je to analitički izvedivo, korisne informacije može pružiti kvantifikacija polazne tvari i produkata razgradnje u stabilnom stanju ili na kraju faze apsorpcije. Ako je predviđeno provođenje takvih mjera, tada je uzorke potrebno podvrgnuti odgovarajućim postupcima ekstrakcije kako bi se polazna tvar mogla zasebno kvantitativno odrediti. Kada uočeni produkt razgradnje predstavlja znatan postotak (primjerice > 10 %) radioaktivnosti izmjerene u ispitnim organizmima u stabilnom stanju ili na kraju faze apsorpcije, preporučuje se identificirati takve produkte razgradnje (5).
|
|
68.
|
Zbog niske pojedinačne biomase često nije moguće utvrditi koncentraciju ispitivane tvari u svakom pojedinom crvu, osim ako se kao ispitivana vrsta ne upotrebljava Branchiura sowerbyi (40 – 50 mg mokre mase po crvu) (11). Stoga je udruživanje jedinki uzorkovanih iz dane ispitne posude prihvatljivo, ali ograničava statističke postupke koji se mogu primijeniti na podatke. Ako su određeni statistički postupak i snaga bitni, u ispitivanje je potrebno uključiti dovoljan broj pokusnih životinja i/ili broj posuda za višekratno određivanje kako bi se omogućilo željeno spajanje, postupak i snaga.
|
|
69.
|
Preporučuje se BAF izražavati i kao funkciju ukupne mokre mase i, kad je to potrebno (primjerice za jako lipofilne tvari), kao funkciju sadržaja lipida i TOC-a sedimenta. Za određivanje sadržaja lipida potrebno je upotrebljavati prikladne metode (48)(49). Ekstrakcijski postupak kloroform-metanol (50) može se preporučiti kao standardna metoda (48). Međutim, radi izbjegavanja upotrebe kloriranih otapala može se upotrebljavati metoda Bligha i Dyera izmijenjena u prstenastom testu (50) kako je opisano u (51). Budući da razne metode ne daju identične vrijednosti (48), vrlo je važno navesti pojedinosti primijenjene metode. Kad je to moguće, odnosno ako postoji dovoljno tkiva crva, sadržaj lipida mjeri se na istom uzorku ili ekstraktu kao i onaj proizveden za analizu ispitivane tvari jer se lipidi često moraju ukloniti iz ekstrakta prije nego što se on kromatografski analizira (5). Međutim, praktično je upotrebljavati aklimatizirane kontrolne životinje barem na početku ili po mogućnosti na kraju faze apsorpcije za mjerenje sadržaja lipida, odnosno u trima uzorcima.
|
PODACI I IZVJEŠĆIVANJE
Obrada rezultata
|
70.
|
Krivulja apsorpcije ispitivane tvari dobiva se grafičkim prikazom koncentracije u/na crvima tijekom faze apsorpcije u ovisnosti o vremenu na aritmetičkoj ljestvici. Ako je krivulja dosegnula plato, izračunajte BAFss u stabilnom stanju:

|
|
71.
|
Odredite faktor kinetičke bioakumulacije (BAFK) kao omjer ks/ke. Konstanta eliminacije (ke) obično se određuje iz krivulje eliminacije (odnosno grafičkog prikaza koncentracije ispitivane tvari u crvima tijekom faze eliminacije). Potom se izračunava konstanta brzine apsorpcije ks iz krivulje kinetike apsorpcije. Za dobivanje BAFK i konstanti brzine, ks, i ke prednost se daje metodama upotrebe procjene nelinearnih parametara na računalu (vidi Dodatak 2.). Ako eliminacija očito nije prvog reda, potrebno je primijeniti kompleksnije modele (25)(27)(52).
|
|
72.
|
Faktor akumulacije biota-sedimenta (BSAF) određuje se normaliziranjem BAFK-a za sadržaj lipida u crvima i za ukupni sadržaj organskog kisika u sedimentu.
|
Tumačenje rezultata
|
73.
|
Rezultate je potrebno tumačiti s oprezom ako se izmjerene koncentracije ispitnih koncentracija kreću u blizini granice detekcije upotrijebljene analitičke metode.
|
|
74.
|
Jasno definirane krivulje apsorpcije i eliminacije znak su dobre kakvoće podataka o bioakumulaciji. Granice pouzdanosti za vrijednosti BAF iz dobro osmišljenih studija općenito ne bi trebale premašivati 25 % (5).
|
Izvješće o ispitivanju
|
75.
|
Izvješće o ispitivanju mora obuhvaćati sljedeće informacije:
|
|
Ispitivana tvar
|
—
|
fizikalna narav i fizikalno-kemijska svojstva, primjerice log Kow, topljivost u vodi;
|
|
—
|
podaci za identifikaciju kemikalije, izvor ispitivane tvari, identitet i koncentracija upotrijebljenog otapala;
|
|
—
|
kod radioaktivno obilježenih tvari: točan položaj obilježenih atoma, specifična radioaktivnost i postotak radioaktivnosti povezan s nečistoćama.
|
|
|
|
Ispitivane vrste
|
—
|
znanstveni naziv, soj, izvor, sve vrste prethodne obrade, aklimatizacija, starost, red veličina itd.
|
|
|
|
Uvjeti ispitivanja
|
—
|
ispitni postupak (primjerice statički, polustatički ili protočni);
|
|
—
|
vrsta i svojstva korištene rasvjete i fotoperiod/fotoperiodi;
|
|
—
|
plan ispitivanja (primjerice broj, materijal i veličina ispitnih posuda, volumen vode, masa i volumen sedimenta, brzina izmjene volumena vode (za protočne ili polustatičke postupke), bilo kakvo dozračivanje upotrijebljeno prije ili tijekom ispitivanja, broj višestrukih određivanja, broj crva po višestrukom određivanju, broj ispitnih koncentracija, dužina faza apsorpcije i eliminacije, učestalost uzorkovanja);
|
|
—
|
metoda pripreme i primjene ispitivane tvari kao i obrazloženje odabira specifične metode;
|
|
—
|
nazivne ispitne koncentracije;
|
|
—
|
izvor sastojaka umjetne vode i sedimenta ili, ako se upotrebljavaju prirodni mediji, podrijetlo tla, opis svake prethodne obrade, rezultati svake demonstracije sposobnosti pokusnih životinja da žive i/ili se reproduciraju u upotrijebljenom mediju, značajke sedimenta (pH-vrijednost i amonijak porne vode (prirodni sedimenti), sadržaj organskog ugljika (OC), distribucija veličine čestica (postotak pijeska, praha i gline), postotak sadržaja vode i sva ostala mjerenja) te značajke vode (pH-vrijednost, tvrdoća, provodljivost, temperatura, koncentracija otopljenog kisika, rezidualni klor (ako se mjeri) i sva ostala mjerenja);
|
|
—
|
nominalna i izmjerena suha masa u % mokre mase (ili omjer suhe i mokre mase) umjetnog sedimenta; izmjerena suha masa u % mokre mase (ili omjer suhe i mokre mase) za terenske sedimente;
|
|
—
|
kakvoća vode unutar ispitnih posuda karakterizirana temperaturom, pH-vrijednošću, amonijakom, ukupnom tvrdoćom i koncentracijom otopljenog kisika;
|
|
—
|
detaljni podaci o tretiranju uzoraka vode, sedimenta i crva, uključujući i pojedinosti o pripremi, skladištenju, postupcima spikinga, ekstrakcijskim i analitičkim postupcima (i preciznosti) za ispitivanu tvar i sadržaj lipida te oporavak ispitivane tvari.
|
|
|
|
Rezultati
|
—
|
smrtnost kontrolnih crva i crva u svakoj ispitnoj posudi te svi opaženi subletalni učinci, uključujući neuobičajeno ponašanje (primjerice izbjegavanje sedimenta, prisutnost ili odsutnost fekalnih peleta, nedostatak razmnožavanja);
|
|
—
|
izmjerena suha masa u % mokre mase tla (ili omjer suhe i mokre mase) sedimenta i ispitivanih organizama (korisno za normalizaciju);
|
|
—
|
krivulje koje pokazuju kinetiku apsorpcije i eliminacije ispitivane tvari u crvima i vrijeme do stabilnog stanja;
|
|
—
|
Ca, Cs i Cw (sa standardnim odstupanjem i rasponom, prema potrebi) za sva vremena uzorkovanja (Ca izražen u g kg– 1 mokre i suhe mase čitavog tijela, Cs izražen u g kg– 1 mokre i suhe mase sedimenta te Cw u mg l– 1). Ako se traži i faktor akumulacije biota-sedimenta (BSAF; za definicije vidi Dodatak 1.) (primjerice radi usporedbe rezultata dvaju ili većeg broja ispitivanja provedenih sa životinjama različitog sadržaja lipida), Ca trebao bi se dodatno izraziti kao g kg– 1 sadržaja lipida u organizmu, a Cs trebao bi se izraziti kao g kg– 1 organskog ugljika (OC) u sedimentu;
|
|
—
|
BAF (izražen u kg mokrog sedimenta kg– 1 mokrog crva), konstanta brzine apsorpcije sedimenta ks (izražena u g mokrog sedimenta kg– 1 mokrog crva d– 1) i konstanta brzine eliminacije ke (izražena u d– 1); naknadno se može izvijestiti o BSAF-u (izražen u kg OC-a u sedimentu kg– 1 sadržaja lipida u crvu);
|
|
—
|
Neeliminirani ostaci (NER) na kraju faze eliminacije;
|
|
—
|
ako su mjereni: postoci polazne tvari, produkata razgradnje i vezanih ostataka (odnosno postotak ispitivane tvari koja se ne može ekstrahirati uobičajenim metodama ekstrakcije) detektirani u pokusnim životinjama;
|
|
—
|
metode upotrijebljene za statističke analize podataka.
|
|
|
|
Ocjena rezultata
|
—
|
sukladnost rezultata s validacijskim kriterijima navedenima u stavku 21.;
|
|
—
|
neočekivani ili neobični rezultati, primjerice nepotpuna eliminacija ispitivane tvari iz pokusnih životinja; u takvim slučajevima rezultati iz bilo kojeg preliminarnog istraživanja mogu pružiti korisne informacije.
|
|
|
Dodatak 1.
Definicije i jedinice
|
|
Umjetni sediment ili formulirani, obrađeni ili sintetički sediment jest smjesa tvari koja se upotrebljava za oponašanje fizikalnih sastojaka prirodnog sedimenta.
|
|
|
Bioakumulacija jest porast koncentracije ispitivane tvari u ili na organizmu u odnosu na koncentraciju ispitivane tvari u mediju koji je okružuje. Bioakumulacija nastaje i iz procesa biokoncentracije i iz procesa biomagnifikacije (vidi u nastavku teksta).
|
|
|
Faktor bioakumulacije (BAF) u bilo kojem trenutku tijekom faze apsorpcije ovog ispitivanja bioakumulacije jest koncentracija ispitivane kemikalije u/na ispitnom organizmu (Ca u g kg– 1 mokre ili suhe mase) podijeljena s koncentracijom te tvari u mediju koji je okružuje (Cs kao g kg– 1 mokre ili suhe mase sedimenta). Da bi se odnosio na jedinice Ca i Cs, BAF ima jedinice kg sedimenta kg– 1 crva (15).
|
|
|
Faktori bioakumulacije izračunani izravno iz omjera konstante brzine apsorpcije sedimenta i konstante brzine eliminacije (ks, odnosno ke – vidi u nastavku teksta) nazivaju se faktorom kinetičke bioakumulacije (BAFK).
|
|
|
Biokoncentracija jest porast koncentracije ispitivane tvari u ili na organizmu, koja nastaje uglavnom kao izravni rezultat apsorpcije preko površine tijela, u odnosu na koncentraciju ispitivane tvari u okruženju.
|
|
|
Biomagnifikacija jest porast koncentracije ispitivane tvari u ili na organizmu, koja nastaje uglavnom kao rezultat apsorpcije iz onečišćene hrane ili plijena, u odnosu na koncentraciju ispitivane tvari u hrani ili plijenu. Biomagnifikacija može dovesti do prijenosa akumulacije ispitivane tvari unutar mreža hrane.
|
|
|
Faktor akumulacije biota-sediment (BSAF) jest koncentracija ispitivane kemikalije u/na ispitnom organizmu u stabilnom stanju, normalizirana lipidima, podijeljena koncentracijom ispitivane tvari u sedimentu, normaliziranom organskim ugljikom u stabilnom stanju. Ca stoga je izražen kao g kg– 1 sadržaja lipida organizma, a Cs kao g kg– 1 organskog sadržaja sedimenta.
|
|
|
Razdoblje pripremanja služi za stabilizaciju mikrobne komponente sedimenta i za uklanjanje primjerice amonijaka koji nastaje u odjeljcima sedimenta. Odvija se prije dodavanja ispitivane tvari u sediment postupkom spikinga. Voda iznad sedimenta obično se baca nakon pripremanja.
|
|
|
Eliminacija ispitivane tvari jest gubitak te tvari iz tkiva ispitnog organizma aktivnim ili pasivnim procesima koji se odvijaju neovisno o prisustvu ili odsustvu ispitivane tvari u mediju koji je okružuje.
|
|
|
Faza eliminacije jest vrijeme, nakon prijenosa ispitnih organizama iz onečišćenog medija u medij bez ispitivane tvari, tijekom kojeg se proučava eliminacija (ili neto gubitak) tvari iz ispitnih organizama.
|
|
|
Konstanta brzine eliminacije (ke) jest brojčana vrijednost koja definira brzinu opadanja koncentracije ispitivane tvari u/na ispitnim organizmima nakon prijenosa ispitnih organizama iz medija koji sadržava ispitivanu tvar u medij bez te kemikalije; ke izražava se u d– 1.
|
|
|
Razdoblje uravnoteženja služi za omogućivanje raspodjele ispitivane tvari između krute faze, porne vode i vode iznad sedimenta. Odvija se nakon dodavanja ispitivane tvari u sediment postupkom spikinga i prije dodavanja ispitnih organizama.
|
|
|
Podjelni koeficijent oktanol-voda (Kow) jest omjer topljivosti tvari u n-oktanolu i vodi u ravnoteži, a ponekad se izražava i kao Pow. Logaritam Kow (log Kow) upotrebljava se kao pokazatelj potencijala tvari za bioakumulaciju vodenim organizmima.
|
|
|
Podjelni koeficijent organski ugljik-voda (Koc) jest omjer koncentracije tvari u/na dijelu sedimenta s organskim ugljikom i koncentracije tvari u vodi u ravnoteži.
|
|
|
Voda iznad sedimenta jest voda koja se u ispitnoj posudi nalazi iznad sedimenta.
|
|
|
Plato ili stabilno stanje definira se kao uravnoteženje između procesa apsorpcije i eliminacije koji se odvijaju istodobno tijekom faze izlaganja. Stabilno se stanje postiže na grafičkom prikazu BAF-a u svakom razdoblju uzorkovanja u ovisnosti o vremenu kada krivulja postane paralelna s vremenskom osi i kad se rezultati triju uzastopnih analiza BAF-a provedenih na uzorcima koji se uzimaju u razmacima od najmanje dva dana nalaze unutar 20 % te kad ne postoje statistički značajne razlike među trima razdobljima uzorkovanja. Za ispitivane tvari koje se sporo apsorbiraju prikladniji bi vremenski razmak bio sedam dana (5).
|
|
|
Porna voda ili međuprostorna voda jest voda u prostoru među česticama sedimenta ili tla.
|
|
|
Konstanta brzine apsorpcije sedimenta (ks) jest brojčana vrijednost koja definira brzinu porasta koncentracije ispitivane tvari u/na ispitnom organizmu, a koja nastaje kao rezultat apsorpcije iz faze sedimenta. ks izražava se kao g sedimenta kg-1 crva d– 1.
|
|
|
Sediment obrađen postupkom spikinga jest sediment u koji je dodana ispitivana tvar.
|
|
|
Faktor bioakumulacije stabilnog stanja (BAFss) jest BAF u stabilnom stanju i ne mijenja se znatno tijekom duljeg razdoblja, a koncentracija ispitivane tvari u mediju koji je okružuje (Cs kao g kg-1 mokre ili suhe mase sedimenta) konstantna je tijekom tog razdoblja.
|
|
|
Faza apsorpcije ili izlaganja jest vrijeme tijekom kojeg ispitni organizmi bivaju izloženi ispitivanoj tvari.
|
Dodatak 2.
Izračun parametara apsorpcije i eliminacije
Osnovni konačni učinak ispitivanja bioakumulacije jest faktor bioakumulacije, BAF. Izmjereni BAF može se izračunati dijeljenjem koncentracije u ispitnom organizmu, Ca, koncentracijom u sedimentu, Cs, u stabilnom stanju. Ako se stabilno stanje ne postigne tijekom faze apsorpcije, BAF se izračunava na isti način za 28. dan. Međutim, ipak je potrebno zabilježiti temelji li se BAF na koncentracijama u stabilnom stanju.
Preferirani način dobivanja faktora kinetičke bioakumulacije (BAFK), konstante brzine apsorpcije sedimenta (ks) i konstante brzine eliminacije (ke) jest upotreba metoda procjene nelinearnih parametara na računalu. Imajući na umu vremenske serije prosječnih faktora akumulacije (Ca, srednje vrijednosti datuma svakog uzorkovanja/Cs, srednje vrijednosti datuma svakog uzorkovanja = AF) faze apsorpcije na temelju mokre mase crva i sedimenta te modela jednadžbe:
|
AF(t) = BAF × (1 – eke × t)
|
[jednadžba 1]
|
pri čemu je AF(t) omjer koncentracije ispitivane tvari u crvima i njezina koncentracija u sedimentu u bilo kojoj danoj vremenskoj točki (t) faze apsorpcije, ti računalni programi izračunavaju vrijednosti za BAFK, ks i ke.
Kad se tijekom faze apsorpcije postigne stabilno stanje (odnosno t = ∞), jednadžba 1 može se reducirati na:
|

|
[jednadžba 2]
|
pri čemu je
|
ks
|
=
|
konstanta brzine apsorpcije u tkivu [g sedimenta kg– 1 crva d– 1]
|
|
ke
|
=
|
konstanta brzine eliminacije [d– 1]
|
Tada je ks/ke × Cs pristup koncentraciji ispitivane tvari u tkivu crva u stabilnom stanju (Ca,ss).
Faktor akumulacije biota-sediment (BSAF) potrebno je izračunati na sljedeći način:

pri čemu je foc frakcija organskog ugljika u sedimentu, dok je flip frakcija lipida crva, a temelji se ili na suhoj ili na mokroj masi.
Imajući na umu vremenske serije vrijednosti koncentracije, kinetika eliminacije može se oblikovati s pomoću sljedećih modela jednadžbi i metode procjene nelinearnog parametra temeljene na računalnom izračunu.
Kao zadana početna točka preporučuje se srednji mjereni tjelesni ostatak na kraju faze apsorpcije. Potrebno je upotrebljavati samo vrijednost koja je oblikovana/procijenjena u fazi apsorpcije, primjerice ako mjerena tvar znatno odstupa od oblikovana tjelesnog ostatka. U stavku 50. pročitajte i o alternativnom prethodnom izlaganju crva određenih za eliminaciju. U ovom se pristupu smatra da uzorci tih crva prethodno izloženih 0. dana faze eliminacije pružaju realističan ostatak tijela za započinjanje kinetike eliminacije.
Ako podaci na grafičkom prikazu u ovisnosti o vremenu naznačuju konstantni eksponencijalni pad koncentracije ispitivane tvari u životinjama, model s jednim odjeljkom (jednadžba 4) može se upotrijebiti za opis trajanja eliminacije.
|

|
[jednadžba 3]
|
Ponekad se čini da su procesi eliminacije dvofazni i da u njima dolazi do rapidnog pada Ca tijekom početnih faza, a to se pretvara u sporiji gubitak ispitivanih tvari u kasnijim fazama eliminacije (8)(19)(25)). Te se dvije faze mogu protumačiti pretpostavkom da u organizmu postoje dva odjela iz kojih se gubi ispitivana tvar, i to različitom brzinom. U tim je slučajevima potrebno proučiti specifičnu literaturu (15)(16)(17)(25).
Opisana je eliminacija iz dvaju odjeljaka, primjerice sljedećom jednadžbom (25):
|
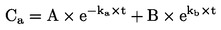
|
[jednadžba 4]
|
A i B predstavljaju veličinu odjeljaka (u postotku cjelokupnog ostatka tkiva), pri čemu je odjeljak A onaj s brzim gubitkom tvari, a odjeljak B onaj sa sporim gubitkom tvari. Zbroj A i B jednak je 100 % cijelog volumena odjeljka životinja u stabilnom stanju. ka i kb predstavljaju odgovarajuće konstante eliminacije [d– 1]. Ako se model s dvama odjeljcima prilagodi podacima izlučivanja, konstanta brzine apsorpcije ks može se odrediti kako slijedi (53)(54):
|

|
[jednadžba 5]
|
Unatoč tomu, ove modele jednadžbi potrebno je oprezno upotrebljavati, poglavito kada tijekom ispitivanja dođe do promjena bioraspoloživosti ispitivane tvari (42).
Kao druga mogućnost prethodno opisanom modelu jednadžbe, u istom se ispitivanju može izračunati i kinetika (ks i ke) primjenom kinetičkog modela prvog reda istodobno na sve podatke iz faze apsorpcije i iz faze eliminacije. Za opis metode koja bi omogućila takav kombinirani izračun konstanti brzine apsorpcije i eliminacije mogu se konzultirati reference (55), (56) i (57).
Neeliminirani ostaci (NER) trebali bi se izračunavati kao sekundarni krajnji rezultat množenjem omjera prosječne koncentracija u crvima (Ca) 10. dana faze eliminacije i prosječne koncentracija u crvima (Ca) u stabilnom stanju (28. dan faze apsorpcije) sa 100:

Dodatak 3
Primjer rasporeda uzorkovanja za ispitivanje bioakumulacije u trajanju od 28 dana
a) Faza apsorpcije (uključujući četverodnevnu fazu uravnoteženja)
|
Dan
|
Djelatnosti
|
|
– 6
|
Pripremanje suspenzije treseta za sediment; kondicioniranje suspenzije 48 sati;
|
|
– 4
|
Obrada sedimenta ili frakcije sedimenta postupkom spikinga; miješanje svih sastojaka sedimenta; uklanjanje uzoraka sedimenta iz tretiranih skupina i kontrolnih skupina s otapalom radi utvrđivanja koncentracije ispitivane tvari; dodavanje vode iznad sedimenta; inkubacija u uvjetima ispitivanja (faza ujednačavanja);
|
|
– 3/– 2
|
Vađenje ispitnih organizama iz uzgojene kulture radi aklimatizacije;
|
|
0
|
Mjerenje kakvoće vode (vidi stavak 52.); uklanjanje višestrukih određivanja radi uzimanja uzoraka vode i sedimenta za određivanje koncentracije ispitivane tvari; nasumično raspoređivanje crva u ispitne posude; zadržavanje dovoljnog broja poduzoraka crva za određivanje analitičkih pozadinskih vrijednosti; kontroliranje dovoda zraka ako se upotrebljava zatvoreni sustav ispitivanja;
|
|
1
|
Uklanjanje višestrukih određivanja radi uzorkovanja; kontroliranje dovoda zraka, ponašanje crva, kakvoća vode (vidi stavak 56.); uzimanje uzoraka vode, sedimenta i crva radi određivanja koncentracije ispitivane tvari.
|
|
2
|
Kontrola dovoda zraka, ponašanja crva i temperature;
|
|
3
|
Isto kao i 1. dan;
|
|
4 – 6
|
Isto kao i 2. dan;
|
|
7
|
Isto kao i 1. dan; nadomještanje isparene vode ako je to potrebno;
|
|
8 – 13
|
Isto kao i 2. dan;
|
|
14
|
Isto kao i 1. dan; nadomještanje isparene vode ako je to potrebno;
|
|
15 – 20
|
Isto kao i 2. dan;
|
|
21
|
Isto kao i 1. dan; nadomještanje isparene vode ako je to potrebno;
|
|
22 – 27
|
Isto kao i 2. dan;
|
|
28
|
Isto kao i 1. dan; mjerenje kakvoće vode (vidi stavak 52.); završetak faze apsorpcije, zadržavanje dovoljnog broja poduzoraka crva radi određivanja analitičkih pozadinskih vrijednosti, mokre i suhe mase te sadržaja lipida; prenošenje crva iz preostalih izloženih višestrukih određivanja u posude koje sadržavaju čisti sediment radi faze eliminacije (nema pražnjenja crijeva); uzorkovanje vode, sedimenta i crva iz kontrolnih skupina s otapalom; uzorkovanje otapala koja zarobljavaju, ako su postavljena.
|
|
|
Djelatnosti prethodnog izlaganja (faza uravnoteženja) potrebno je planirati uzimajući u obzir svojstva ispitivane tvari. Ako je to potrebno, kondicioniranje pripremljenog sedimenta pod vodom iznad sedimenta pri temperaturi od 20 ± 2 °C sedam dana; u ovom slučaju, ranija priprema sedimenta!
|
|
|
Djelatnosti opisane za drugi dan potrebno je provoditi svakodnevno (barem za radnih dana).
|
b) Faza eliminacije
|
Dan
|
Djelatnosti
|
|
– 6
|
Pripremanje suspenzije treseta za sediment; kondicioniranje suspenzije 48 sati;
|
|
– 4
|
Miješanje svih sastojaka sedimenta; uklanjanje uzoraka sedimenta iz tretiranih skupina i kontrolnih skupina s otapalom radi utvrđivanja koncentracije ispitivane tvari; dodavanje vode iznad sedimenta; inkubacija u uvjetima ispitivanja;
|
|
0 (28. dan faze apsorpcije)
|
Mjerenje kakvoće vode (vidi stavak 52.); prenošenje crva iz preostalih izloženih višestrukih određivanja u posude koje sadržavaju čisti sediment; uklanjanje višestrukih određivanja nakon četiri do šest sati radi uzimanja uzoraka vode, sedimenta i crva radi određivanja koncentracije ispitivane tvari; nasumično raspoređivanje crva u ispitne posude;
|
|
1
|
Uklanjanje višestrukih određivanja radi uzorkovanja; kontroliranje dovoda zraka, ponašanje crva, kakvoća vode (vidi stavak 52.); uzimanje uzoraka vode, sedimenta i crva radi određivanja koncentracije ispitivane tvari.
|
|
2
|
Kontrola dovoda zraka, ponašanja crva i temperature;
|
|
3
|
Isto kao i 1. dan;
|
|
4
|
Isto kao i 2. dan;
|
|
5
|
Isto kao i 1. dan;
|
|
6
|
Isto kao i 2. dan;
|
|
7
|
Isto kao i 1. dan; nadomještanje isparene vode ako je to potrebno;
|
|
8 – 9
|
Isto kao i 2. dan;
|
|
10
|
Isto kao i 1. dan; kraj faze eliminacije; mjerenje kakvoće vode (vidi stavak 52.); uzorkovanje vode, sedimenta i crva iz kontrolnih skupina s otapalom; uzorkovanje otapala koja zarobljavaju, ako su postavljena.
|
|
|
Pripremu sedimenta prije početka faze eliminacije potrebno je obaviti na isti način kao i prije faze apsorpcije.
|
|
|
Djelatnosti opisane za drugi dan potrebno je provoditi svakodnevno (barem za radnih dana).
|
Dodatak 4.
Neka fizičko-kemijska svojstva prihvatljive vode za razrjeđivanje
|
SASTOJAK
|
KONCENTRACIJE
|
|
Čestice
|
< 20 mg/l
|
|
Ukupni organski ugljik
|
< 2μg/l
|
|
Neionizirani amonijak
|
< 1 μg/l
|
|
Rezidualni klor
|
< 10 μg/l
|
|
Ukupni organofosforni pesticidi
|
< 50 ng/l
|
|
Ukupni organofosforni pesticidi plus poliklorirani bifenili
|
< 50 ng/l
|
|
Ukupni organski klor
|
< 25 ng/l
|
SASTAV PREPORUČENE OBRAĐENE VODE
|
(a)
|
Otopina kalcijeva klorida
Otopiti 11,76 g CaCl2 2 H2O u deioniziranoj vodi; nadopuniti deioniziranom vodom do 1 l
|
|
(b)
|
Otopina magnezijeva sulfata
Otopiti 4,93 g MgSO4 7 H2O u deioniziranoj vodi; nadopuniti deioniziranom vodom do 1 l
|
|
(c)
|
Otopina natrijeva bikarbonata
Otopiti 2,59 g NaHCO3 u deioniziranoj vodi; nadopuniti deioniziranom vodom do 1 l
|
|
(d)
|
Otopina kalijeva klorida
Otopiti 0,23 g KCl u deioniziranoj vodi; nadopuniti deioniziranom vodom do 1 l
|
Sve kemikalije moraju biti analitički čiste.
Provodljivost destilirane ili deioniziranoj vodi ne bi trebala premašivati10 μScm– 1.
Pomiješa se 25 ml svake otopine od (a) do (d) te se ukupni volumen nadopuni deioniziranom vodom do 1 l. Zbroj iona kalcija i magnezija u ovoj je otopini 2,5 mmol/l.
Omjer Ca: Mg iona jest 4: 1, dok je omjer Na: K iona 10: 1. Kapacitet kiseline KS4.3 ove otopine jest 0,8 mmol/l.
Dozračujte vodu za razrjeđivanje dok se ne postigne zasićenost kisikom, a potom je skladištite približno dva dana bez dodatnog dozračivanja prije uporabe.
pH-vrijednost prihvatljive vode za razrjeđivanje trebala bi biti u rasponu od šest do devet.
Dodatak 5.
Umjetni sediment – preporuke za pripremu i skladištenje
Za razliku od zahtjeva u ispitnoj metodi C.8. (40), preporučuje se da sadržaj treseta umjetnog sedimenta bude 2 % umjesto 10 % suhe mase kako bi odgovarao niskom do umjerenom organskom sadržaju prirodnih sedimenata (58).
Postotak suhih sastojaka umjetnog sedimenta:
|
Sastojak
|
Svojstva
|
% suhog sedimenta
|
|
Treset
|
Tresetnica, stupanj razgradnje: ‚srednji’, sušena na zraku, bez vidljivih ostataka biljke, fino usitnjen (veličina čestice ≤ 0,5 mm)
|
2 ± 0,5
|
|
Kremeni pijesak
|
Veličina zrna: ≤ 2 mm, ali > 50 % čestica trebalo bi biti u rasponu od 50 – 200 μm
|
76
|
|
Kaolinitska glina
|
Sadržaj kaolinita ≥ 30 %
|
22 ± 1
|
|
Izvor hrane
|
Vrsta Folia urticae, listovi u prahu vrste Urtica sp. (kopriva), fino usitnjeni (veličina čestice ≤ 0,5 mm) ili mješavina listova u prahu vrste Urtica sp. s alfa-celulozom (1: 1); u skladu s farmakološkim standardima, za ljudsku potrošnju; dodatak suhom sedimentu
|
0,4 – 0,5 %
|
|
Kalcijev karbonat
|
CaCO3, u prahu, kemijski čisti, dodatak suhom sedimentu
|
0,05 – 1
|
|
Deionizirana voda
|
Provodljivost ≤ 10 μS/cm, kao dodatak suhom sedimentu
|
30 – 50
|
Očekuju li se povišene koncentracije amonijaka, primjerice ako se za ispitivanu tvar zna da inhibira nitrifikaciju, može biti korisno zamijeniti 50 % koprive u prahu bogate dušikom celulozom (primjerice α-celulozom u prahu, kemijski čistom, veličina čestica ≤ 0,5 mm).
Priprema
Treset se suši na zraku te se usitnjava u fini prašak (veličina zrna ≤ 0,5 mm, bez vidljivih ostataka biljke). Suspenzija potrebne količine treseta u prahu priprema se s pomoću dijela deionizirane vode koja se dodaje suhom sedimentu (volumen vode od 11,5 x suha masa treseta koristan je za proizvodnju smjese treseta koja se može miješati (8)) s pomoću uređaja za homogenizaciju visoke djelotvornosti.
pH-vrijednost te suspenzije podešava se do 5,5 ± 0,5 s pomoću CaCO3. Suspenzija se kondicionira najmanje dva dana blagim miješanjem na 20 ± 2 °C kako bi se stabilizirala pH-vrijednost i uspostavila stabilna mikrobna komponenta. Ponovno se mjeri pH-vrijednost i trebala bi iznositi 6,0 ± 0,5. Potom se suspenzija miješa s ostalim suhim sastojcima uzimajući u obzir bilo koji udio upotrijebljen za postupak spikinga. Dodaje se ostatak deionizirane vode kako bi se dobio homogeni sediment. Prema potrebi, ponovno se mjeri pH-vrijednost te se s CaCO3 podešava od 6,5 do 7,5. Međutim, ako se očekuje stvaranje amonijaka, moglo bi biti korisno pH-vrijednost sedimenta držati ispod 7,0 (primjerice između 6,0 i 6,5). Uzimaju se uzorci sedimenta kako bi se odredili suha masa i sadržaj organskog ugljika. Ako se očekuje stvaranje amonijaka, umjetni se sediment može kondicionirati sedam dana pod istim uvjetima koji prevladavaju u narednom ispitivanju (primjerice omjer sedimenta i vode 1: 4, visina sloja sedimenta kao u ispitnim posudama) prije nego što mu se postupkom spikinga doda ispitivana tvar, odnosno potrebno ga je prekriti vodom koja bi trebala biti dozračena. Na kraju razdoblja kondicioniranja potrebno je ukloniti i baciti vodu iznad sedimenta. Uzimaju se uzorci sedimenta kako bi se odredili suha masa i ukupni sadržaj organskog ugljika (primjerice tri uzorka).
Stoga se kvarcni pijesak obrađen postupkom spikinga miješa sa sedimentom za svaku razinu obrade, sediment se razdjeljuje u ispitne posude za višestruka određivanja te se preljeva ispitnom vodom (primjerice omjer sedimenta i vode 1: 4, visina sloja sedimenta kao u ispitnim posudama). Posude se tada inkubiraju pod istim uvjetima koji prevladavaju u narednom ispitivanju. Tada počinje razdoblje ujednačavanja. Vodu iznad sedimenta potrebno je dozračiti.
Prije ili tijekom dodavanja ispitne tvari u sediment postupkom spikinga potrebno je dodati odabrani izvor hrane. U početku se može pomiješati sa suspenzijom treseta (vidi prethodno). Međutim, pretjerana degradacija izvora hrane prije dodavanja ispitivanih organizama, primjerice u slučaju dugog razdoblja ujednačavanja, može se izbjeći održavanjem razdoblja između dodavanja hrane i početka izlaganja čim kraćim. Kako bi se osigurao dovoljan kontakt s ispitivanom tvari, potrebno je izvor hrane pomiješati sa sedimentom najkasnije na dan kada se sedimentu postupkom spikinga dodaje ispitivana tvar. Iznimke se mogu učiniti kada dužina razdoblja ujednačavanja vodi do pretjerane mikrobne degradacije hrane prije dodavanja ispitivanih organizama. Uzimaju se uzorci sedimenta kako bi se odredili suha masa i ukupni organski ugljik (primjerice tri uzorka obrađenog postupkom spikinga ili kontrolnog sedimenta).
O suhoj masi komponenata (treset, pijesak, kaolin) potrebno je izvještavati u g i u postotku ukupne suhe mase.
O volumenu vode koji se dodaje suhim komponentama tijekom pripreme sedimenta potrebno je izvijestiti i u postocima ukupne suhe mase (primjerice 100 % suhe mase + 46 % vode znači da 1 000 g suhe mase ukupno primi 460 ml vode, što rezultira s 1 460 g mokrog sedimenta.
Skladištenje
Suhi sastojci umjetnog sedimenta mogu se skladištiti na suhom, hladnom mjestu na sobnoj temperaturi. Pripremljeni se mokri sediment može skladištiti (za daljnju upotrebu samo u kulturi) na temperaturi od 4 ± 2 °C u mraku na razdoblje od dva do četiri tjedna od dana pripremanja (8).
Sediment u koji je ispitivana tvar dodana postupkom spikinga potrebno je upotrijebiti odmah, osim ako postoje podaci koji naznačuju da bi se taj određeni sediment mogao skladištiti, a da to nema utjecaja na toksičnost i bioraspoloživost ispitivane tvari. Tada se uzorci sedimenta obrađenog postupkom spikinga mogu skladištiti do analize u uvjetima preporučenima za određenu ispitivanu tvar.
Dodatak 6.
Preporučene vrste oligoheta za ispitivanje bioakumulacije
Tubifex tubifex (MÜLLER),Tubificidae, Oligochaeta
Tubificidni oligohet (Tubificidae, Oligochaeta) Tubifex tubifex (Müller) živi u slatkovodnim sedimentima u cijevima obloženima sluzi. Crvi u tim cijevima obitavaju s glavom prema dolje, konzumirajući čestice sedimenta i koristeći se povezanim mikroorganizmima i organskim otpadom. Stražnji se dio obično talasa u vodi iznad sedimenta u respiracijske svrhe. Iako ova vrsta naseljava širok raspon vrsta sedimenta diljem čitave sjeverne polutke, Tubifex tubifex preferira relativno finu veličinu zrna (59). Prikladnost ove vrste za ekotoksikološko ispitivanje opisana je primjerice u (8)(29)(31)(39)(60)(62)(63).
Metode uzgoja
Kako bi se osigurao dovoljan broj vrste Tubifex tubifex za provođenje ispitivanja bioakumulacije, crvi se trebaju čuvati u trajnoj laboratorijskoj kulturi. Za kulturu T. tubifex (8) preporučuje se sustav koji se sastoji od umjetnog sedimenta na bazi umjetnog tla u skladu s ispitnom metodom C.8. (40) i obrađene vode u skladu s ispitnom metodom C.1.
Kao posude za uzgoj kulture mogu se upotrebljavati spremnici od stakla ili nehrđajućeg čelika visine od 12 do 20 cm. Svaka posuda za uzgoj kulture puni se slojem mokrog umjetnog sedimenta pripremljenog kako je opisano u Dodatku 5. Dubina sloja sedimenta trebala bi omogućiti prirodno rovanje crva (minimalna dubina od dva cm za T. tubifex). Sustavu se dodaje obrađena voda. Potrebno je paziti da se minimizira miješanje sedimenta. Vodena se cjelina blago dozračuje (primjerice dva do četiri mjehurića po sekundi s 0,45 μm filtriranog zraka) Pasteurovom pipetom smještenom približno dva centimetra iznad površine sedimenta. Preporučena temperatura kulture iznosi 20 ± 2 °C.
Crvi se dodaju sustavu kulture, a maksimalno doziranje iznosi 20 000 jedinaka/m2 površine sedimenta. Veće doziranje može prouzročiti smanjenje brzine rasta i razmnožavanja (43).
U kulturama umjetnog sedimenta crve je potrebno hraniti. Kao dodatak može se upotrebljavati prehrana koja se sastoji od fino usitnjene hrane za ribu, primjerice TetraMin® (8); Klerks 1994., osobna komunikacija. Količina hrane trebala bi omogućiti dovoljan rast i razmnožavanje te bi stvaranje amonijaka i rast gljivica u kulturi trebala svesti na minimum. Hrana se može davati dvaput tjedno (primjerice, 0,6 – 0,8 mg po cm2 površine sedimenta). Praktično iskustvo pokazalo je da upotreba hrane koja je suspendirana i homogenizirana u deioniziranoj vodi može olakšati raspodjelu homogenizirane hrane po površini sedimenta u spremnicima za uzgoj kulture.
Da bi se izbjeglo stvaranje amonijaka, vodu iznad sedimenta potrebno je mijenjati protočnim sustavom ili, barem jednom tjedno, ručno. Sediment je potrebno mijenjati svaka tri mjeseca u matičnim kulturama.
Ako su potrebni samo odrasle jedinke, crvi se iz kulture mogu uzorkovati prosijavanjem kulture sedimenta kroz sito od jednog milimetra. Za zadržavanje kokona prikladna je mrežica od 0,5 mm, a za mlade crve sito od 0,25 mm. Sita se mogu spustiti u obrađenu vodu nakon što sediment prođe. Crvi izlaze iz sita i tada se mogu vaditi iz vode hvataljkom od mekanog željeza ili pipetom s rubovima poliranima vatrom.
Za početak ispitivanja ili novih kultura upotrebljavaju se samo netaknute i jasno utvrđene jedinke vrste Tubifex tubifex (primjerice (64)). Bolesni i ozlijeđeni crvi kao i kokoni zaraženi hifama gljiva moraju se baciti.
Sinkronizirana kultura može omogućiti crve određene dobi u prikladnim intervalima po želji. Posude za uzgoj nove kulture postavljaju se u odabranim intervalima (primjerice svaka dva tjedna), počevši sa životinjama određene dobi (primjerice kokonima). U ovdje opisanim uvjetima kulture crvi su odrasli nakon osam do deset tjedana. Kulture se mogu skupiti kada crvi polože nove kokone, odnosno nakon deset tjedana. Uzorkovani odrasli primjerci mogu se upotrijebiti za ispitivanja, a nove se kulture mogu pokrenuti s kokonima.
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta
I vrsta Lumbriculus variegatus (Lumbriculidae, Oligochaeta) nastanjuje slatkovodne sedimente diljem svijeta te se često upotrebljavaju u ekotoksikološkim ispitivanjima. Informacije o biologiji, uvjetima kulture i osjetljivosti vrste mogu se dobiti iz (1)(6)(9)(36). U skladu s (8) i unutar određenih ograničenja, i kultura vrste Lumbriculus variegatus može se uzgajati u umjetnom sedimentu preporučenom za vrstu T. tubifex. Budući da vrsta L. variegatus u prirodi preferira grublje sedimente od vrste T. tubifex (59), laboratorijske kulture s umjetnim sedimentom koji se upotrebljava za vrstu T. tubifex mogu uginuti nakon četiri do šest mjeseci. Praktično iskustvo pokazalo je da se vrsta L. variegatus u pjeskovitom supstratu (primjerice kvarcni pijesak, fini šljunak) u protočnim sustavima u kojima se kao izvor prehrane upotrebljava riblja hrana može držati nekoliko godina, a da se ne obnavlja supstrat. Velika prednost vrste L. variegatus pred ostalim vrstama vodenih oligoheta jest njezino brzo razmnožavanje čiji je rezultat brzo povećanje biomase u laboratorijski uzgojenim populacijama (1)(6)(9)(10).
Metode uzgoja
Uvjeti kulture za vrstu Lumbriculus variegatus detaljno su navedeni u: Phipps et al. (1993) (10), Brunson et al. (1998) (28), ASTM (2000) (1), U.S. EPA (2000) (6). Kratak sažetak tih uvjeta naveden je u nastavku.
Crvi se mogu uzgajati u velikim akvarijima (57 – 80 l) pri temperaturi od 23 °C s fotoperiodom od 16L: 8D (100 – 1 000 luxa) s pomoću svakodnevno obnovljene prirodne vode (45 – 50 l po akvariju). Supstrat se priprema rezanjem nebijeljenih ručnika od smeđeg papira u trake koje se potom nekoliko sekundi mogu miješati s vodom kulture, što rezultira malim komadima papirnog supstrata. Ovaj se supstrat potom može izravno upotrebljavati u akvarijima kulture Lumbriculus tako da se pokrije dno akvarija ili da se smrznut uskladišti u deioniziranoj vodi za kasniju upotrebu. Novi supstrat u spremniku općenito će trajati otprilike dva mjeseca.
Svaka kultura crva pokreće se s 500 – 1 000 crvi koji se hrane sa suspenzijom od 10 ml koja sadržava šest grama prve hrane za pastrve triput tjedno u uvjetima obnavljanja ili protoka. Statičke ili polustatičke kulture trebale bi dobivati manje količine hrane kako bi se spriječio rast bakterija i gljivica. Potrebno je analizirati hranu i papirni supstrat za tvari koji će se upotrebljavati u ispitivanjima bioakumulacije.
Pod tim se uvjetima broj jedinaka u kulturi općenito udvostruči za otprilike deset do 14 dana.
Vrsta Lumbriculus variegatus može se ukloniti iz kultura, primjerice prenošenjem supstrata finom mrežicom ili organizama u zasebnu čašu s pomoću vatrom polirane staklene pipete širokog otvora (promjer od približno 5 mm). Ako se supstrat suprenosi u tu čašu, čaša koja sadržava crve i supstrat ostavlja se tijekom noći u uvjetima protoka u kojima će se iz čaše ukloniti supstrat, dok će crvi ostati na dnu posude. Može ih se dodati u novopripremljene spremnike za uzgoj kulture ili se dalje obrađivati za ispitivanje, kako je naznačeno u (1) i (6). Potrebno je spriječiti ozljede ili autotomiju crva, primjerice upotrebom pipeta čiji su rubovi polirani vatrom ili iglicama od nehrđajućeg čelika za rukovanje tim crvima.
Pri upotrebi vrste L. variegatus u ispitivanjima bioakumulacije u sedimentu kritički treba razmotriti problem njezina načina razmnožavanja (arhitomija nakon koje slijedi morfalaksa). Ovakvo aseksualno razmnožavanje rezultira dvama fragmentima koji se ne hrane tijekom određenog razdoblja dok se ne regenerira dio s glavom ili repom (primjerice (36)(37)). To znači da apsorpcija konzumiranjem sedimenta i tvari koja onečišćava u vrsti L. variegatus možda neće biti kontinuirana kao u tubificidima koji se ne razmnožavaju fragmentacijom.
Stoga bi se trebala provesti sinkronizacija radi minimaliziranja nekontroliranog razmnožavanja i regeneracije te naknadne visoke varijacije u rezultatima ispitivanja. Primjerice, do takve varijacije može doći kada su neke jedinke, koje su se fragmentirale i stoga se ne trebaju hraniti tijekom određenog razdoblja, manje izložene ispitivanoj tvari od ostalih jedinaka koje se tijekom ispitivanja ne fragmentiraju (38). Crve je potrebno umjetno fragmentirati (sinkronizacija) deset do 14 dana prije početka izlaganja (65). Trebali bi se upotrebljavati veliki crvi koji, po mogućnosti, ne pokazuju znakove nedavne fragmentacije. Ti se crvi mogu staviti na stakalce u kapi vode iz kulture te skalpelom izrezati u središnjem području tijela. Potrebno je pripaziti da stražnji dijelovi budu slične veličine. Stražnje je dijelove tada potrebno ostaviti da u posudi za uzgoj kulture koja sadržava isti supstrat koji je upotrijebljen u kulturi i obrađenu vodu regeneriraju nove glave do početka izlaganja. Regeneracija novih glava indicirana je kada sinkronizirani crvi ruju u supstratu (prisutnost regeneriranih glava može se potvrditi pregledom reprezentativnog poduzorka pod binokularnim mikroskopom). Stoga se od ispitnih organizama očekuje da budu u sličnom fiziološkom stanju. To znači da se, kad tijekom ispitivanja u sinkroniziranih crva dolazi do regeneracije morfalaksijom, očekuje da sve životinje budu jednako izložene sedimentu koji je obrađen postupkom spikinga. Sinkronizirane crve potrebno je nahraniti čim počnu rovati u supstratu ili sedam dana nakon seciranja. Režim hranjenja trebao bi biti usporediv s regularnim kulturama, no može se savjetovati hranjenje sinkroniziranih crva istim izvorom hrane koji će se upotrebljavati u ispitivanju. Crve je potrebno držati na ispitnoj temperaturi, pri 20 ± 2 °C. Nakon regeneracije za ispitivanje bi se trebali upotrebljavati netaknuti cijeli crvi slične veličine koji aktivno plivaju ili puze na nježan mehanički poticaj. Potrebno je spriječiti ozljede ili autonomiju crva, primjerice upotrebom pipeta čiji su rubovi polirani vatrom ili iglicama od nehrđajućeg čelika za rukovanje tim crvima.
Zbog specifičnog načina razmnožavanja ove vrste, kada se pri ispitivanju upotrebljava Lumbriculus variegatus, tijekom ispitivanja bi, ako su uvjeti prikladni, moglo doći do povećanja u broju crva (6). Potrebno je zabilježiti izostanak razmnožavanja u ispitivanju bioakumulacije s vrstom L. variegatus te to razmotriti pri tumačenju rezultata ispitivanja.
Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (nije potvrđeno u prstenastom testu)
Vrsta Branchiura sowerbyi nastanjuje različite vrste sedimenata ležišta, jezera, jezeraca i rijeka, izvorno u tropskim područjima. Može se pronaći i u tijelima tople vode sjeverne hemisfere. Međutim, više ih je u sedimentima mulja i gline s visokim udjelom organske tvari. Nadalje, crvi žive u sloju sedimenta. Čak je i stražnji dio crva obično ukopan. Ova se vrsta lako identificira po škržnim filamentima na njihovu stražnjem dijelu. Odrasle jedinke mogu dosegnuti duljinu od devet do 11 cm i mokru masu od 40 do 50 mg. Crvi imaju visoku stopu razmnožavanja, pokazuju vrijeme populacijskog udvostručivanja od najmanje dva tjedna u uvjetima temperature i hranjenja navedenima u nastavku (Aston et al., 1982, (65)). Vrsta B. sowerbyi upotrijebljena je i u ispitivanjima toksičnosti i bioakumulacije (Marchese & Brinkhurst 1996, (31), odnosno Roghair et al. 1996, (67)).
Metode uzgoja
Sažetak uvjeta kulture za vrstu Branchiura sowerbyi naveden je u nastavku (prema Mercedes R. Marchese, INALI, Argentina, i Carli J. Roghair, RIVM, Nizozemska).
Za uzgoj kulture ispitivanih organizama nije potrebna nikakva tehnika. Organizmi se mogu uzgajati s pomoću nekontaminiranog prirodnog segmenta (31). Praktično iskustvo pokazalo je da, u usporedbi s čistim prirodnim sedimentom, medij koji se sastoji od prirodnog sedimenta i pijeska poboljšava stanje crva (32) (67). Za uzgoj kulture mogu se upotrebljavati 3 L-čaše koje sadržavaju 1 500 ml medija sediment-voda koji se sastoji od 375 ml prirodnog nekontaminiranog sedimenta (približno 10 % ukupnog organskog ugljika; približno 17 % čestica ≤ 63 μm), 375 ml čistog pijeska (M32) i 750 ml obrađene vode ili vode iz slavine iz koje je uklonjen klor (31)(32)(67). I papirnati ručnici mogu se upotrebljavati kao supstrat za uzgoj kulture, no rast populacije niži je nego u prirodnom sedimentu. U polustatičkim sustavima sloj vode u čaši polako se dozračuje te je vodu nad sedimentom potrebno obnavljati na tjednoj bazi.
Svaka čaša na početku sadržava 25 mladih crva. Nakon dva mjeseca iz sedimenta se pincetom vade veliki crvi i stavljaju u novu čašu s novim medijem sedimenta-vode. I stara čaša sadržava kokone i mlade crve. Na ovaj se način po čaši može skupiti do 400 mladih crva. Odrasli se crvi za razmnožavanje mogu upotrebljavati barem jednu godinu.
Kulture je potrebno održavati na temperaturi od 21 do 25 °C. Varijaciju temperature potrebno je držati ispod ± 2 °C. Vrijeme potrebno za embrionalni razvoj od jajašca koje je sneseno dok mladi ne iziđu iz kokona približno iznosi tri tjedna pri 25 °C. Utvrđeno je da je raspon proizvodnje jajašaca dobivenih po crvu koji je preživio iz vrste B. sowerbyi od 6,36 (31) do 11,2 (30) u mulju pri 25 °C. Broj jajašaca po kokonu u rasponu je od 1,8 do 2,8 (66) (69) ili sve do osam (68).
Svakog tjedna potrebno je mjeriti otopljeni kisik, tvrdoću vode, temperaturu i pH-vrijednost. Riblja hrana (primjerice TetraMin®) može se dodavati kao suspenzija dvaput ili triput tjedno ad libitum. Crvi se mogu hraniti i odmrznutom salatom ad libitum.
Velika prednost ove vrste jest visoka pojedinačna biomasa (do 40 – 50 mg mokre mase po jedinki). Stoga se ova vrsta može upotrebljavati za ispitivanje bioakumulacije ispitnih tvari koje nisu radioaktivno obilježene. Ona se može se izložiti u sustavima koji se upotrebljavaju za T. tubifex ili L. variegatus sa samo jednom jedinkom po višestrukom određivanju (11). Međutim, replike je tada potrebno povećati, osim ako se upotrebljavaju veće ispitne posude (11). Jednako tako, uvjet valjanosti koji je povezan s rovanjem potrebno je prilagoditi za ovu vrstu.
LITERATURA
|
(1)
|
ASTM International (2000.). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688. – 00. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(2)
|
Europska komisija (EK) (2003.). Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I – IV. Office for Official Publications of the European Communities, Luxembourg.
|
|
(3)
|
OECD (1992.a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(4)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. i Winger, P.V. (1995.). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885. – 1894.
|
|
(5)
|
Poglavlje C.13. ovog Priloga, Biokoncentracija: test s ribama u protočnom postupku.
|
|
(6)
|
US EPA (2000.). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(7)
|
Poglavlje C.27. ovog Priloga, Test toksičnosti trzalaca (Chironomidae) u vodi iz sedimenta sa sedimentom obrađenim spikingom.
|
|
(8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997.). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835. – 852.
|
|
(9)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003.). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872. – 885.
|
|
(10)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993.). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269. – 279.
|
|
(11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999.). Workshop on ‚Bioaccumulation: Sediment test using benthic oligochaetes’, 26. – 27. 4. 1999., Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(12)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2006.). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
(13)
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. & Morton, R.D. (1990.). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301. – 310.
|
|
(14)
|
Nendza, M. (1991.). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. u: R. Nagel and R. Loskill (ur.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim
|
|
(15)
|
Landrum, P.F., Lee II, H., & Lydy, M.J. (1992.). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709. – 1725.
|
|
(16)
|
Markwell, R.D., Connell, D.W. & Gabric, A.J. (1989.). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Res. Res. 23, 1443 – 1450.
|
|
(17)
|
Gabric, A.J., Connell, D.W. & Bell, P.R.F. (1990.). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. Res. 24, 1225. – 1231.
|
|
(18)
|
Kukkonen, J. and Landrum, P.F. (1994.). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457. – 1468.
|
|
(19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. and Jöhncke, U. (1994.). The assessment of bioaccumulation. Chemosphere 29, 1501. – 1514.
|
|
(20)
|
OECD (2000.). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(21)
|
US EPA (1996.). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
(22)
|
Sljedeća poglavlja ovog Priloga:
|
|
Poglavlje A.4., Tlak pare
|
|
|
Poglavlje A.5., Površinska napetost
|
|
|
Poglavlje A.6., Topljivost u vodi
|
|
|
Poglavlje A.8., Koeficijent razdjeljenja, metoda protresanjem u tikvici
|
|
|
Poglavlje A.24., Koeficijent razdjeljenja (n-oktanol/voda), metoda visokoučinkovite tekućinske kromatografije (HPLC)
|
|
|
Poglavlje C.7., Razgradnja – abiotička razgradnja: hidroliza kao funkcija pH
|
|
|
Poglavlje C.4 A. – F. Određivanje lake biorazgradivosti
|
|
|
Poglavlje C.19., Procjena koeficijenta adsorpcije (Koc) na tlo i kanalizacijski mulj primjenom tekućinske kromatologije visoke djelotvornosti (HPLC)
|
|
|
Poglavlje C.29., Laka biorazgradivost CO2 u zabrtvljenim posudama
|
|
|
(23)
|
OECD (1996.). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OECD, Paris.
|
|
(24)
|
Antoine, M.D., Dewanathan, S. & Patonay, G. (1991.). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165. – 172.
|
|
(25)
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke & G. Studinger (2000.). The assessment of bioaccumulation. In Hutzinger, O. (urednik), The Handbook of Environmental Chemistry, Vol. 2 Part J (Urednik vol.: B. Beek): Bioaccumulation – New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235. – 276.
|
|
(26)
|
Spacie, A. & Hamelink, J.L. (1982.). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309. – 320.
|
|
(27)
|
Hawker, D.W. & Connell, D.W. (1988.). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. Res. 22, 701. – 707.
|
|
(28)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998.). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191. – 201.
|
|
(29)
|
Reynoldson, T.B., Thompson, S.P. and Bamsey, J.L. (1991.). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061. – 1072.
|
|
(30)
|
Aston, R.J. & Milner, A.G.P. (1981.). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155. – 160.
|
|
(31)
|
Marchese, M.R. & Brinkhurst, R.O. (1996.). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163. – 168.
|
|
(32)
|
Roghair, C.J. & Buijze, A. (1994.). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
(33)
|
Poglavlje C.1. ovog Priloga, Akutna toksičnost za ribe.
|
|
(34)
|
OECD (1992.c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(35)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984.). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181. – 184.
|
|
(36)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998. Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183. – 194.
|
|
(37)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998. Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196. – 2202.
|
|
(38)
|
Leppänen M.T. & Kukkonen J.V.K. (1998.). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503. – 1508.
|
|
(39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999.). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111. – 124.
|
|
(40)
|
Poglavlje C.8. ovog Priloga, Toksičnost za gujavice.
|
|
(41)
|
Environment Canada (1995.). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(42)
|
Landrum, P.F. (1989.). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588. – 595.
|
|
(43)
|
Poddubnaya, T.L. (1980.). Life cycles of mass species of Tubificidae (Oligochaeta). u: R.O. Brinkhurst and D.G. Cook (ur.): Aquatic Oligochaeta Biology, 175. – 184. Plenum Press, New York.
|
|
(44)
|
ASTM (1998.). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391. – 94.
|
|
(45)
|
Hooftman, R.N., van de Guchte, K. & Roghair, C.J. (1993.). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
(46)
|
Franke, C. (1996.). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, 1897. – 1905.
|
|
(47)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999.). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244. – 1249.
|
|
(48)
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991.). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431. – 1436.
|
|
(49)
|
Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985.). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099. – 1105.
|
|
(50)
|
Bligh, E.G. & Dyer, W.J. (1959.). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911. – 917.
|
|
(51)
|
De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999.). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
(52)
|
Kristensen, P. (1991.). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
(53)
|
Zok, S., Görge, G., Kalsch, W. & Nagel, R. (1991.). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411. – 421.
|
|
(54)
|
Nagel, R. (1988.). Umweltchemikalien und Fische – Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Germany.
|
|
(55)
|
Janssen, M.P.M., A Bruins, T.H. De Vries & Van Straalen, N.M. (1991.). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305. – 312.
|
|
(56)
|
Van Brummelen, T.C. & Van Straalen, N.M. (1996.). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277. – 285.
|
|
(57)
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003.). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167. – 1171.
|
|
(58)
|
Suedel, B.C. and Rodgers, J.H. (1993.). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163. – 1175.
|
|
(59)
|
Wachs, B. (1967.). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310. – 386.
|
|
(60)
|
Oliver, B. G. (1987.). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785. – 790.
|
|
(61)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982.a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47. – 67.
|
|
(62)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982.b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69. – 78.
|
|
(63)
|
Rodriguez, P. & Reynoldson, T.B. (1999.). Laboratory methods and criteria for sediment bioassessment. u: A. Mudroch, J.M. Azcue & P. Mudroch (ur.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(64)
|
Brinkhurst, R.O. (1971.). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(65)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005.). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(66)
|
Aston, R.J., Sadler, K. & Milner, A.G.P. (1982.). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137. – 145.
|
|
(67)
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. & Hermens, J.L.M. (1996.). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
(68)
|
Aston, R.J. (1984.). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89. – 94.
|
|
(69)
|
Bonacina, C., Pasteris, A., Bonomi, G. & Marzuoli, D. (1994.). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267. – 274
|
” |
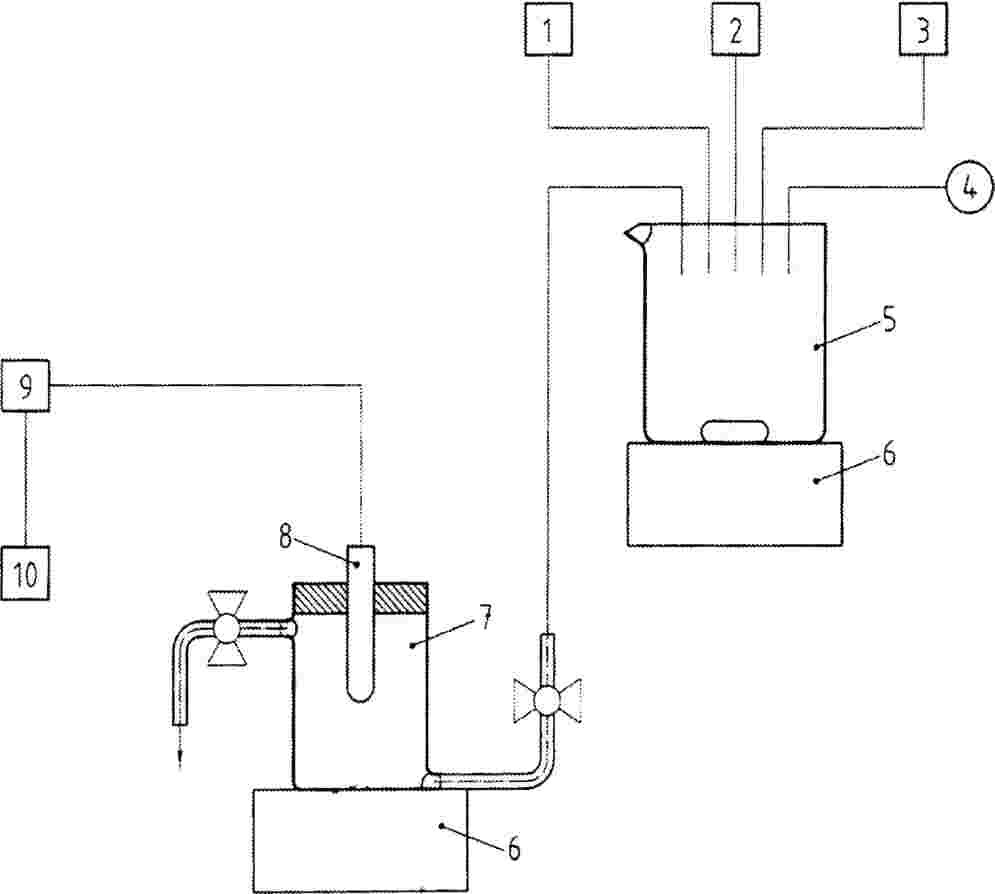







































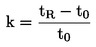
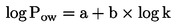
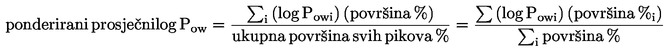




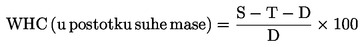 ,
, ,
,