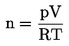|
(6)
|
Les chapitres C.31 à C.46 suivants sont ajoutés: «C.31. ESSAI SUR PLANTE TERRESTRE: ESSAI D'ÉMERGENCE DE PLANTULES ET DE CROISSANCE DE PLANTULES
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 208 (2006) pour les essais de produits chimiques de l'OCDE. Les méthodes d'essai sont régulièrement révisées pour tenir compte des progrès scientifiques et de l'adéquation à la pratique réglementaire. La présente méthode d'essai mise à jour a pour objet d'évaluer les effets potentiels de substances chimiques sur l'émergence et la croissance de plantules. Elle ne couvre pas pour autant tous les effets chroniques ni tous les effets sur la reproduction (c'est-à-dire la grenaison, la formation de fleurs, la maturation des fruits). Il est impératif de tenir compte des conditions d'exposition et des propriétés de la substance de l'essai pour garantir l'utilisation de procédés d'essai appropriés (par exemple, lors de l'essai de métaux et de composés métalliques, il convient de prendre en compte les effets de pH et des contre-ions associés) (1). La présente méthode d'essai ne concerne pas les plantes exposées à des vapeurs de substances chimiques. Elle s'applique aux essais de produits chimiques généraux, aux biocides et aux produits de protection des cultures (également désigné par produits phytosanitaires ou pesticides). Elle s'inspire de procédés existants (2) (3) (4) (5) (6) (7). D'autres références en lien avec les essais sur plantes ont également été consultées (8) (9) (10). L'Appendice 1 présente les définitions utilisées.
|
PRINCIPE DE L'ESSAI
|
2.
|
Le test évalue les effets d'une exposition à la substance chimique d'essai contenue dans le sol (ou une autre matrice de sol appropriée) sur l'émergence des plantules et le début de croissance des plantes supérieures. Les semences sont placées au contact d'un sol traité par la substance chimique d'essai, dont les effets sont évalués au bout d'environ 14 à 21 jours après émergence de 50 % des plantules dans le groupe témoin. Les points finals mesurés représentent l'évaluation visuelle de l'émergence des plantules, le poids sec des pousses (ou bien le poids frais des pousses) et dans certains cas la hauteur des pousses, ainsi que l'évaluation des effets nocifs visibles sur différentes parties de la plante. Ces mesures et observations sont comparées à celles réalisées sur des plantes témoins non traitées.
|
|
3.
|
Selon la voie d'exposition probable, la substance chimique d'essai est incorporée dans le sol (ou éventuellement dans une matrice de sol artificiel) ou bien appliquée sur la surface du sol, ce qui représente précisément la voie potentielle d'exposition au produit chimique. La substance est incorporée dans le sol par traitement du sol brut. Après l'application, le sol est transféré dans des pots, puis les graines de l'espèce de plante donnée sont plantées dans le sol. Dans les cas d'application en surface, le produit chimique est appliqué sur le sol en pots dans lequel les graines ont déjà été plantées. Les unités d'essai (témoins et sols traités plus graines) sont ensuite placées dans des conditions appropriées favorisant la germination et/ou la croissance des plantes.
|
|
4.
|
Selon l'objectif visé par l'étude, l'essai peut permettre de déterminer la courbe dose-réponse, ou il peut être mis en œuvre à une unique concentration ou un unique taux, et il s'agit alors d'un essai de seuil. Si les résultats de l'essai sur une seule concentration ou un seul taux excèdent un certain seuil de toxicité (par exemple, lorsque des effets supérieurs à x % sont observés), on procède à un essai de détermination de l'ordre de grandeur afin de définir les limites de toxicité supérieures et inférieures, puis à un essai employant plusieurs concentrations ou taux afin de tracer une courbe dose-réponse. Une analyse statistique appropriée permet de calculer une concentration efficace CEx ou un taux d'application efficace TEx (par exemple CE25, TE25, CE50, TE50), pour le paramètre ou les paramètres pertinents les plus sensibles. Cet essai peut également fournir les valeurs calculées de concentration sans effet observé (CSEO) et de concentration minimale avec effet observé (CMEO).
|
INFORMATION SUR LA SUBSTANCE CHIMIQUE D'ESSAI
|
5.
|
La détermination de la voie d'exposition probable de la substance chimique, et par conséquent la conception de l'essai pourront s'appuyer sur les informations suivantes: formule développée, pureté, solubilité dans l'eau, solubilité dans les solvants organiques, coefficient de partage n-octanol/eau, comportement de sorption par le sol, pression de vapeur, stabilité chimique vis-à-vis de l'eau et de la lumière et biodégradabilité.
|
VALIDITÉ DE L'ESSAI
|
6.
|
Pour valider l'essai, les critères de performance suivants devront être satisfaits par les témoins:
|
—
|
L'émergence des plantules atteint au moins 70 %;
|
|
—
|
les plantes ne présentent aucun effet phytotoxique visible (par exemple, chlorose, nécrose, flétrissement, déformation des feuilles et des tiges). Seules des variations normales de la croissance et de la morphologie de l'espèce particulière de plantes sont observées;
|
|
—
|
le taux de survie moyen des plantules témoins émergées est d'au moins 90 % pendant la durée de l'étude;
|
|
—
|
les conditions environnementales pour une espèce particulière sont identiques et les milieux de croissance contiennent la même quantité de matrice de sol, de milieu de support ou de substrat provenant de la même source.
|
|
SUBSTANCE CHIMIQUE DE RÉFÉRENCE
|
7.
|
L'essai d'une substance chimique de référence à intervalles réguliers permet de vérifier la régularité des performances de l'essai et de la réponse des plantes particulières de l'essai, ainsi que des conditions d'essai. Il est également possible d'utiliser des mesures historiques de biomasse ou de croissance de témoins pour évaluer les performances du système d'essai dans des laboratoires particuliers et ces mesures peuvent également servir de contrôle de qualité intra-laboratoire.
|
DESCRIPTION DE LA MÉTHODE
Sol naturel — Substrat artificiel
|
8.
|
On peut cultiver les plantes dans des pots contenant un limon sableux, un sable limoneux ou un limon d'argile sableuse dont la teneur en carbone organique peut atteindre 1,5 % (environ 3 % de matières organiques). Un terreau commercial ou un mélange de sol synthétique qui contient jusqu'à 1,5 % de carbone organique conviennent également. Les sols argileux doivent être exclus si la substance chimique de l'essai a une affinité élevée avérée pour les argiles. Les sols de champs doivent être tamisés pour homogénéiser la taille de particule en dessous de 2 mm et éliminer les particules grossières. Le type et la texture, la proportion de carbone organique, le pH et la teneur en sels mesurée par la conductivité électronique du sol préparé final doivent être enregistrés, et le sol classé conformément à un schéma de classification standard (11). Pour réduire les effets des pathogènes du sol, celui-ci pourra subir une pasteurisation ou un traitement thermique.
|
|
9.
|
L'emploi d'un sol naturel peut compliquer l'interprétation des résultats et augmenter la variabilité, du fait de la variation des propriétés physicochimiques et des populations microbiennes. Ces paramètres peuvent modifier la capacité de rétention d'humidité, la capacité de liaison chimique, l'aération et la teneur en nutriment et en oligoéléments. Les fluctuations de ces facteurs physiques s'ajoutent à des variations des propriétés chimiques telles que le pH et le potentiel redox, qui peuvent affecter la biodisponibilité de la substance d'essai (12) (13) (14).
|
|
10.
|
Il est inhabituel d'utiliser des substrats artificiels pour les essais de produits phytosanitaires, mais ils peuvent être employés pour les essais de produits chimiques généraux ou lorsqu'il est souhaitable de réduire la variabilité des sols naturels et d'améliorer la comparabilité des résultats de l'essai. Les substrats doivent être composés de matériaux inertes présentant des interactions minimales avec la substance chimique d'essai, le solvant véhicule ou les deux. Des matériaux inertes appropriés qui absorbent très peu la substance d'essai (15), assurant ainsi une disponibilité maximale de la substance pour les plantules par absorption racinaire, sont le sable de quartz lavé par un acide, la laine minérale et les billes de verre (par exemple, de 0,35 à 0,85 mm de diamètre). La vermiculite, la perlite ou d'autres matériaux très absorbants ne conviennent pas. L'apport de nutriments favorisant la croissance végétale évitera aux plantes les stress dus aux carences nutritives, qui seront évaluées, si possible, par des analyses chimiques ou un contrôle visuel des plantes témoins.
|
Critère de sélection de l'espèce de l'essai
|
11.
|
L'espèce sélectionnée devra être raisonnablement répandue, par exemple, en termes de diversité taxonomique dans le royaume végétal, de distribution, d'abondance, de caractéristiques du cycle vital spécifique de l'espèce et de régions d'occurrence naturelle, pour permettre le développement d'une série de réponses (8) (10) (16) (17) (18) (19) (20). Le choix devra tenir compte des caractéristiques suivantes des espèces d'essai envisagées:
|
—
|
Les semences de l'espèce sont uniformes, et largement disponibles auprès de sources de semences standard fiables, et produisent une germination régulière, fiable et uniforme, ainsi qu'une croissance uniforme des plantules;
|
|
—
|
La plante est adaptée à l'essai au laboratoire, et susceptible de donner des résultats fiables et reproductibles dans une même installation d'essai et entre des installations d'essai différentes;
|
|
—
|
La sensibilité de l'espèce d'essai doit correspondre aux réponses des plantes se trouvant dans l'environnement exposé à la substance;
|
|
—
|
L'espèce a déjà été utilisée dans des essais de toxicité antérieurs de quelque ampleur, et son comportement, par exemple dans des essais biologiques d'herbicides, le criblage de métaux lourds, des essais de stress salin ou minéral ou des études d'allélopathie indique une sensibilité à une large gamme d'agents stressants;
|
|
—
|
elle est compatible avec les conditions de croissance du procédé de l'essai;
|
|
—
|
elle se conforme aux critères de validité de l'essai.
|
Certaines des espèces les plus couramment utilisées dans le passé sont indiquées dans l'Appendice 2 et des espèces non cultivées potentielles dans l'Appendice 3.
|
|
12.
|
Le nombre d'espèces à inclure dans l'essai dépend des exigences réglementaires en vigueur et n'est par conséquent pas spécifié dans la présente méthode d'essai.
|
Application de la substance chimique d'essai
|
13.
|
La substance chimique doit être appliquée dans un support approprié (par exemple eau, acétone, éthanol, polyéthylène glycol et gomme arabique). Il est également possible de tester des mélanges (produits préparés ou préparations) contenant les ingrédients actifs et divers adjuvants.
|
Incorporation dans le sol ou dans le substrat artificiel
|
14.
|
Les substances chimiques hydrosolubles ou en suspension dans l'eau peuvent être ajoutées à de l'eau, et la solution est ensuite mélangée avec du sol à l'aide d'un dispositif de mélange approprié. Ce type d'essai peut convenir pour une exposition au produit chimique par le sol ou par l'eau de porosité et lorsqu'il y a un risque d'absorption racinaire. La quantité de la substance chimique d'essai ajoutée ne doit pas excéder la capacité de rétention d'eau du sol. Le volume d'eau ajouté doit être identique pour chaque concentration de l'essai, tout en restant limité afin d'éviter la formation d'amas de sol aggloméré.
|
|
15.
|
Les substances chimiques à faible solubilité dans l'eau doivent être dissoutes dans un solvant volatile approprié (par exemple acétone, éthanol) et mélangées à du sable. Il est possible de retirer ensuite le solvant du sable à l'aide d'un courant d'air sous agitation continue du sable. Le sable traité est ensuite mélangé avec le sol expérimental. Un second témoin constitué seulement de sable ou de solvant est préparé. Les traitements à différentes doses et le second témoin reçoivent des quantités égales de sable duquel le solvant a été mélangé puis ôté. Dans le cas de substances chimiques d'essai solides insolubles, le mélange de sol sec et de produit chimique est préparé dans un dispositif de mélange approprié. Ensuite, le sol est ajouté aux pots et les graines y sont immédiatement semées.
|
|
16.
|
Lorsqu'un substrat artificiel remplace le sol, les produits chimiques solubles dans l'eau peuvent être dissous dans la solution nutritive juste avant le début de l'essai. Les produits chimiques insolubles dans l'eau, mais qu'il est possible de mettre en suspension dans l'eau grâce à un support de solvant, sont ajoutés avec le support à la solution nutritive. Les produits chimiques insolubles dans l'eau pour lesquels il n'existe aucun support hydrosoluble non toxique doivent être dissous dans un solvant volatil approprié. La solution mélangée avec du sable ou des billes de verre est placée dans un appareil rotatif sous vide et évaporée, en formant un revêtement uniforme de produit chimique sur le sable ou les billes. Une portion tarée de billes est extraite par le même solvant organique et le produit chimique de l'essai dosé avant de remplir les pots.
|
Application en surface
|
17.
|
Dans le cas de produits phytosanitaires, l'application de la solution d'essai se fait souvent par pulvérisation sur la surface du sol d'une solution d'essai. Le modèle et la capacité de tous les équipements utilisés pour conduire l'essai, en particulier les appareils utilisés pour préparer et administrer la substance chimique d'essai, doivent permettre sa mise en œuvre précise, avec une couverture reproductible. Celle-ci doit être uniforme sur les surfaces de sol. On s'efforcera d'éviter d'éventuelles interactions par absorption ou réaction des produits chimiques avec le matériel (par exemple, tubes de plastique et produits chimiques, composants ou éléments en acier). La pulvérisation de la substance chimique d'essai sur la surface de sol simule des applications par pulvérisations usuelles. En général, les volumes pulvérisés se situent dans l'intervalle utilisé en pratique agronomique normale et ils doivent être notés (quantité d'eau etc.). Le type de buse choisi doit permettre de couvrir uniformément la surface de sol. Dans le cas d'applications de solvants ou de supports, un second groupe de plantes témoins est mis en place et ne reçoit que le solvant ou le support, sauf pour les produits phytosanitaires testés sous forme de formulations.
|
Vérification de la concentration ou du taux de substance chimique d'essai
|
18.
|
Les concentrations ou les taux d'application doivent être confirmés par une vérification analytique appropriée. L'analyse de la concentration la plus élevée de solutions d'essai, associée au relevé des dilutions consécutives et à l'utilisation d'applicateurs étalonnés (par exemple, verrerie analytique étalonnée, étalonnage du pulvérisateur) confirmera éventuellement la vérification des concentrations et les taux de l'essai pour substances chimiques solubles. Pour les substances chimiques insolubles, la vérification devra s'appuyer sur les poids de substance chimique d'essai ajoutés au sol. L'analyse du sol peut être nécessaire dans le cas où l'homogénéité de l'application doit être démontrée.
|
RÉALISATION DE L'ESSAI
Modèle de l'essai
|
19.
|
Des graines de la même espèce sont semées en pots. Le nombre de graines par pot dépend de l'espèce, de la taille du pot et de la durée de l'essai, et doit garantir des conditions de croissance adéquates et uniformes et éviter la surpopulation pendant la durée de l'essai. La densité maximale de graines est d'environ 3 à 10 graines par cm2, selon la taille des graines. Par exemple, des densités d'un ou deux plants de maïs, de soja, de tomate, de concombre ou de betterave à sucre par récipient de 15 cm, de trois plants de colza ou de pois par récipient de 15 cm et de 5 à 10 graines d'oignons, de blé ou d'autres petites graines par récipient de 15 cm sont recommandées. Le nombre de graines et de répliques de pots (une réplique correspond à un pot, et par conséquent les plantes dans un même pot ne peuvent faire fonction de répliques) doit satisfaire aux conditions d'une analyse statistique optimale (21). Il convient de noter que la variabilité augmente pour les espèces d'essai à grosses graines dont on n'utilise moins de graines par pot (réplique) par rapport à des espèces d'essai pour lesquelles il est possible d'utiliser des nombres plus élevés de petites graines par pot. En plantant un nombre égal de graines dans chaque pot, cette variabilité diminue.
|
|
20.
|
L'utilisation de groupes de contrôle permet de confirmer que les effets observés ne peuvent être associés ou attribués qu'à l'exposition à la substance chimique d'essai. Le groupe de contrôle approprié doit être identique sous tous rapports avec le groupe d'essai, à l'exception de l'exposition à la substance chimique d'essai. Dans un essai donné, toutes les plantes de l'essai, y compris les témoins devront provenir de la même source. Pour éliminer tout biais, une répartition aléatoire des pots d'essai et témoins est indispensable.
|
|
21.
|
Il convient d'éviter l'emploi de graines recouvertes d'un insecticide ou d'un fongicide (c'est à dire les graines enrobées). Toutefois, l'utilisation de certains fongicides de contact non systémiques (par exemple captan, thiram) est autorisée par certaines autorités réglementaires (22). Le problème éventuel des pathogènes disséminés par les semences peut être résolu par une brève immersion des semences dans une solution d'hypochloride à 5 %, suivie d'un rinçage abondant à l'eau courante et d'un séchage. Aucun autre traitement curatif par des produits phytosanitaires n'est autorisé.
|
Conditions de l'essai
|
22.
|
Les conditions de l'essai doivent être aussi proches que possible des conditions nécessaires à la croissance normale ou des conditions environnementales habituelles pour l'espèce et les variétés testées (voir par exemple Appendice 4). Les plantes émergentes doivent être entretenues par de bonnes pratiques horticoles dans des chambres à environnement contrôlé, des phytotrons ou des serres. Si l'on dispose des installations adéquates, ces pratiques comprennent habituellement le contrôle et l'enregistrement suffisamment fréquents (par exemple quotidien) de la tempérante, de l'humidité, de la concentration de dioxyde de carbone, des variables de luminosité (intensité, longueur d'onde, domaine de longueur d'onde autorisant la photosynthèse) et de la périodicité lumineuse, du fonctionnement des dispositifs d'arrosage, etc, permettant d'assurer une croissance satisfaisante de la plante estimée par l'observation des plantes témoins. Les températures de serre sont contrôlées par des systèmes de ventilation, de chauffage et/ou de refroidissement. Les conditions suivantes sont généralement recommandées pour les essais en serre:
|
—
|
température: 22 °C ± 10 °C;
|
|
—
|
photopériode: 16 heures de lumière au minimum;
|
|
—
|
intensité lumineuse: 350 ± 50 μE/m2/s. Un éclairage d'appoint peut être nécessaire si l'intensité descend en dessous de 200 μE/m2/s, longueur d'onde 400-700 nm, sauf pour certaines espèces dont les exigences en lumière sont moindres.
|
Les conditions environnementales doivent être contrôlées et notées pendant la durée de l'étude. Les plantes sont cultivées dans des pots en plastique non poreux ou émaillé posés sur une clayette ou une soucoupe. On peut les déplacer périodiquement pour diminuer la variabilité de croissance entre plantes (provoquées par des différences de conditions d'essai dans les installations de culture). La taille des pots doit être suffisante pour une croissance.
|
|
23.
|
Des suppléments peuvent compléter les nutriments du sol pour assurer une bonne vigueur végétale. Les besoins en nutriments et le calendrier de leur addition sont déterminés par l'observation des plantes témoins. Il est recommandé d'alimenter en eau par le fond des récipients d'essai (par exemple, en utilisant des mèches en fibres de verre). Toutefois, un arrosage initial par le haut peut stimuler la germination des graines et faciliter le déplacement du produit chimique dans le sol lors d'une application sur la surface du sol.
|
|
24.
|
Les conditions de croissance spécifiques doivent être adaptées à l'espèce d'essai et à la substance chimique d'essai à l'étude. Il faut maintenir les plantes témoins et traitées dans les mêmes conditions environnementales, et prendre par conséquent des dispositions pour empêcher une exposition croisée (par exemple par des substances volatiles) entre différents traitements, et une exposition des témoins à la substance chimique d'essai.
|
Essais à une seule concentration ou un seul taux
|
25.
|
Plusieurs facteurs prévalent lorsque l'on cherche à déterminer la concentration ou le taux approprié d'une substance dans le cadre d'un essai à une seule concentration ou un seul taux (stimulation/limite). Ils comprennent les propriétés physiques et chimiques de la substance, lorsqu'il s'agit de substances chimiques à usage général. Pour les produits phytosanitaires, il convient de tenir compte des propriétés physico-chimiques et du régime d'utilisation de la substance chimique d'essai, de sa concentration ou de son taux maximal, du nombre d'applications par saison et/ou de la persistance de la substance chimique d'essai. La détermination d'éventuelles propriétés phytotoxiques d'un produit chimique général peut demander la mise en œuvre de l'essai à une teneur maximale de 1 000 mg/kg de sol sec.
|
Essai de détermination de l'ordre de grandeur
|
26.
|
Le cas échéant, un essai de détermination de l'ordre de grandeur peut contribuer à fixer la concentration ou le taux d'application à expérimenter dans l'étude dose-réponse définitive. Dans un tel essai, les concentrations ou les taux à tester sont largement espacés (par exemple 0,1, 1,0, 10, 100 et 1 000 mg/kg de sol sec). Dans le cas de produits phytosanitaires, on peut calculer les concentrations ou les taux à partir de la concentration ou du taux d'application recommandé ou maximal, par exemple, 1/100, 1/10, ou 1 fois la concentration ou le taux d'application recommandé ou maximal.
|
Essais à plusieurs concentrations ou taux d'application
|
27.
|
L'objectif d'un essai à plusieurs concentrations ou taux d'application est l'établissement d'une relation dose-réponse et la détermination d'une valeur de CEx ou de TEx lié à l'émergence, à la biomasse et/ou à des effets visuels par rapport à des témoins non exposés, comme il est exigé par les autorités réglementaires.
|
|
28.
|
L'intervalle entre les concentrations ou les taux ainsi que leur nombre doivent être suffisants pour établir une relation dose-réponse et une équation de régression, et obtenir une estimation des CEx ou des TEx. Les intervalles de concentration ou de taux doivent englober les valeurs de CEx ou de TEx à déterminer. Par exemple, si l'on recherche une CE50, il est préférable de conduire l'essai à des taux produisant un effet de 20 à 80 %. Le nombre recommandé de concentrations ou de taux d'essai pour atteindre cet objectif est d'au moins 5 en série géométrique, plus un témoin non traité, espacés d'un facteur d'au plus trois. Pour chaque groupe de traitement et de contrôle, le nombre de répliques doit être au moins égal à quatre et le nombre total de graines au moins égal à 20. Pour certaines plantes à faible taux de germination ou aux caractéristiques de croissance variables, davantage de répliques peuvent être nécessaires pour augmenter la puissance statistique de l'essai. Lorsque l'on utilise un grand nombre de concentrations ou de taux d'essai, on peut réduire le nombre de répliques. Pour estimer le CSEO, il faut parfois davantage de répliques pour obtenir la puissance statistique adéquate (23).
|
Observations
|
29.
|
Pendant la période d'observation, c'est-à-dire 14 à 21 jours après l'émergence de 50 % des plantes témoins (et également des témoins de solvant, le cas échéant), les plantes sont examinées fréquemment (au moins une fois par semaine et si possible une fois par jour) pour enregistrer l'émergence, la phytoxicité visuelle et la mortalité. A la fin de l'essai, le pourcentage d'émergence et la biomasse des plantes survivantes sont mesurés, ainsi que les effets nocifs visibles sur différentes parties de la plante, en particulier des anomalies dans l'apparence des plantules émergées, une croissance avortée, une chlorose, une décoloration, une mortalité et des effets sur le développement végétal. La biomasse finale peut être mesurée par le poids sec moyen des pousses des plantes survivantes, après récolte des pousses à la surface du sol et séchage à masse constante à 60 °C, ou bien par le poids frais des pousses. La hauteur de la pousse peut constituer un autre effet mesuré, parfois exigé par les autorités réglementaires. Il convient d'utiliser une notation homogène des lésions visuelles pour évaluer les réponses toxiques détectables. Des exemples pratiques d'évaluations visuelles qualitatives et quantitatives sont proposés dans les références (23) (24).
|
RÉSULTATS ET RAPPORT
Analyse statistique
Essai à une seule concentration ou un seul taux
|
30.
|
Pour chaque espèce végétale, les données sont analysées en utilisant une méthode statistique appropriée (21). Il convient de noter la valeur d'un effet à la concentration ou au taux de l'essai, ou bien l'incapacité à obtenir un effet donné à la concentration ou au taux de l'essai (par exemple, < x % de l'effet observé à la concentration ou au taux y).
|
Essais à plusieurs concentrations ou taux d'application
|
31.
|
Une relation dose-réponse est établie par une équation de régression. Différents modèles sont applicables, par exemple, pour estimer une CEx ou un TEx (par exemple CE25, TE 25, CE50, TE50) et leurs limites de confiance pour l'émergence sous forme de résultats tout ou rien, d'unités logit, probit, Weibull, les méthodes de Spearman-Karber et Spearman-Karber abrégées peuvent convenir. Pour évaluer la croissance des plantules (poids et hauteur) en points finals continus, CEx ou TEx et leurs limites de confiance peuvent être estimés à l'aide d'une analyse de régression appropriée (par exemple analyse de régression non linéaire Bruce-Versteeg (25)). Autant que possible, la valeur de R2 sera supérieure ou égale à 0.7 pour les espèces les plus sensibles et les concentrations ou taux d'essai utilisés comprendront les effets à 20 % et à 80 %. Dans la mesure où il faut estimer le CSEO, il est préférable d'appliquer des tests statistiques puissants qui seront choisis en fonction de la distribution des données (21) (26).
|
Rapport d'essai
|
32.
|
Le rapport d'essai doit mentionner les résultats des études ainsi qu'une description détaillée des conditions d'essai, une discussion approfondie des résultats, une analyse des données et les conclusions tirées de l'analyse. Un résumé sous forme de tableaux et une synthèse des résultats sont proposés. Le rapport doit comporter les informations suivantes:
|
|
Substance chimique d'essai:
|
—
|
données d'identification de la substance chimique, propriétés pertinentes de la substance d'essai (par exemple log Pow, solubilité dans l'eau, pression de vapeur et informations sur le devenir et le comportement dans l'environnement lorsqu'elles sont disponibles);
|
|
—
|
détails sur la préparation de la solution d'essai et vérification des concentrations d'essai comme il est spécifié dans le paragraphe 18.
|
|
|
|
Espèces soumises à l'essai:
|
—
|
détails sur l'organisme expérimental: espèce/variété, familles de plantes, noms scientifiques et communs, source et histoire de la graine aussi détaillées que possible (à savoir, nom du fournisseur, pourcentage de germination, classe de taille de la semence, numéro du lot, année de la semence ou saison de croissance de la récolte, date de l'évaluation de la germination), viabilité, etc.;
|
|
—
|
nombre d'espèces monocotylédones et dicotylédones soumises à l'essai;
|
|
—
|
justification du choix de l'espèce;
|
|
—
|
description du stockage, du traitement et de la maintenance des semences.
|
|
|
|
Conditions d'essai:
|
—
|
installation utilisée dans l'essai (par exemple, chambre de croissance, phytotron, serre);
|
|
—
|
description du système d'essai (par exemple, dimension des pots, matière des pots et quantité de sol);
|
|
—
|
caractéristiques du sol (texture ou type de sol: par exemple distribution et classification des particules du sol, propriétés physiques et chimiques, en particulier pourcentage de matières organiques, pourcentage de carbone organique, pH);
|
|
—
|
préparation du sol ou du substrat (par exemple, sol artificiel, sable, et autres) avant l'essai;
|
|
—
|
description du milieu nutritif, le cas échéant;
|
|
—
|
application de la substance chimique d'essai: description de la méthode d'application, description du matériel, taux d'exposition et volume, en particulier vérification chimique, description de la méthode d'étalonnage, description des conditions environnementales pendant l'application;
|
|
—
|
conditions de croissance: intensité lumineuse (par exemple, domaine longueur d'onde autorisant la photosynthèse), photopériode, températures maximales et minimales, régime et procédé d'arrosage, fertilisation;
|
|
—
|
nombre de graines par pot, nombre de plantes par dose; nombre de répliques (pots) par taux d'exposition;
|
|
—
|
type et nombre de contrôles (témoins négatifs et/ou positifs, témoin de solvant le cas échéant);
|
|
|
|
Résultats:
|
—
|
tableau de tous les effets mesurés pour chaque réplique, taux ou concentration d'essai et espèce;
|
|
—
|
pourcentage d'inhibition pour chaque espèce par rapport aux témoins;
|
|
—
|
mesures de biomasse (poids sec ou poids frais des pousses) des plantes en pourcentages de témoins;
|
|
—
|
hauteur des pousses des plantes en pourcentages des témoins, lorsqu'elles ont été mesurées;
|
|
—
|
pourcentage de lésions visibles et description qualitative et quantitative des lésions visibles (chlorose, nécrose, flétrissement, déformation des feuilles et des tiges ainsi qu'une absence quelconque d'effet) provoquées par la substance chimique d'essai par rapport aux plantes témoins;
|
|
—
|
description de l'échelle d'évaluation utilisée pour estimer les lésions visibles, lorsqu'une évaluation visuelle est rapportée;
|
|
—
|
pour les études à un seul taux, le pourcentage de lésions doit être rapporté;
|
|
—
|
valeurs CEx ou TEx (par exemple CE50, TE50, CE25, TE25) et limites de confiance correspondantes. Pour chaque analyse de régression, l'écart type pour l'équation de régression et l'écart type pour l'estimation des paramètres individuels (par exemple pente, interception) seront fournis;
|
|
—
|
valeurs de CSEO (et de CMEO) dans le cas où elles ont été calculées;
|
|
—
|
description des protocoles statistiques et des hypothèses adoptées;
|
|
—
|
présentation graphique de ces données et relation dose-réponse de l'espèce soumise à l'essai.
|
|
Variantes des protocoles décrits dans la présente méthode d'essai et tous les événements inhabituels survenus pendant l'essai.
|
BIBLIOGRAPHIE
|
(1)
|
Schrader G., Metge K., and Bahadir M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189-193.
|
|
(2)
|
Organisation internationale de normalisation. (1993). ISO 11269-1. Qualité du sol -Détermination des effets des polluants sur la flore du sol -- Partie 1: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(3)
|
Organisation internationale de normalisation. (1995). ISO 11269-2. Qualité du sol -Détermination des effets des polluants sur la flore du sol -- Partie 2: Effets des substances chimiques sur l'émergence et la croissance des végétaux supérieurs.
|
|
(4)
|
American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
U.S. EPA. (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
|
|
(6)
|
US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850,4000: Background — Non-target Plant Testing;
|
|
—
|
850,4025: Target Area Phytotoxicity;
|
|
—
|
850,4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850,4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850,4225: Seedling Emergence, Tier II;
|
|
—
|
850,4230: Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/IS0 11269-1. (1993) Détermination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K.E. and Keddy, C.J. (1993). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No. 145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Canada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C., and Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms — A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. No 48.
|
|
(10)
|
Hale, B., Hall, J.C., Solomon, K., and Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario Canada.
|
|
(11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sc. Soc. Amer. Proc. 26:305 (1962).
|
|
(12)
|
Audus, L.J. (1964). Herbicide behaviour in the soil. In: Audus, L.J. ed. The Physiology and biochemistry of Herbicides, London, New York, Academic Press, NY, Chapter 5, pp. 163-206.
|
|
(13)
|
Beall, M.L., Jr. and Nash, R.G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571-575.
|
|
(14)
|
Beetsman, G.D., Kenney, D.R. and Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247-250.
|
|
(15)
|
U.S.Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 pp., FDA, Washington, DC.
|
|
(16)
|
McKelvey, R.A., Wright, J.P., Honegger, J.L. and Warren, L.W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161-1174.
|
|
(17)
|
Boutin, C.; Elmegaard, N. and Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349-369.
|
|
(18)
|
Boutin, C., and Rogers, C.A. (2000). Patterns of sensitivity of plant species to various herbicides — An analysis with two databases. Ecotoxicology vol.9(4):255-271.
|
|
(19)
|
Boutin, C. and Harper, J.L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155-271.
|
|
(20)
|
Boutin, C., Lee, H.-B., Peart, T.E., Batchelor, S.P. and Maguire, R.J... (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532-2541.
|
|
(21)
|
OCDE (2006). Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Série sur les essais et l'évaluation no 54, Organisation de coopération et de développement économiques, Paris.
|
|
(22)
|
Hatzios, K.K. and Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1-63.
|
|
(23)
|
Hamill, P.B., Marriage, P.B. and G. Friesen. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386-389.
|
|
(24)
|
Frans, R.E. and Talbert, R.E. (1992). Design of field experiments and the measurement and analysis of plant response. In: B. Truelove (Ed.) Research Methods in Weed Science, 2nd ed. Southern weed Science Society, Auburn, 15-23.
|
|
(25)
|
Bruce, R.D. and Versteeg, D. J.(1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485-1492.
|
|
(26)
|
Chapitre C.33 de la présente annexe: Essai de reproduction chez le lombric (Eisenia fetida/Eisenia andrei).
|
Appendice 1
Définitions
Ingrédient actif (i.a.) [ou substance active (s.a.)]
: matériau destiné à exercer un effet biologique spécifique (par exemple, lutte contre les insectes, contre les maladies végétales, contre les mauvaises herbes, dans la zone de traitement), également désigné par ingrédient actif ou substance active de qualité technique,
Substance chimique
: une substance ou un mélange.
Produits phytosanitaires ou pesticides
: matériaux dotés d'une activité biologique spécifique utilisés intentionnellement pour protéger les plantes cultivées contre les nuisibles (par exemple, maladies fongiques, insectes, plantes compétitrices).
CEx · concentration efficace à x % ou TEx. taux efficace à x %
: concentration ou taux qui provoque un changement ou une altération indésirable de x % de l'effet mesuré de l'essai par rapport au témoin (par exemple, une réduction de 25 % ou de 50 % de l'émergence des plantules, du poids des pousses, du nombre final de plantes présentes ou une augmentation de 25 % ou de 50 % d'une lésion visuelle constituent respectivement une CE25/TE25 ou une CE50/TE50).
Émergence
: apparition du coléoptile ou du cotylédon au-dessus de la surface du sol.
Formulation
: produit formulé commercial contenant la substance active (ingrédient actif), que l'on appelle également préparation finale (8) ou produit final typique.
CMEO (concentration minimale avec effet observé)
: concentration la plus faible de la substance chimique d'essai à laquelle a été observé l'effet. Dans cet essai, la concentration correspondant à la CMEO a un effet statistiquement significatif (p < 0,05) pendant une durée d'exposition donnée par rapport au témoin, et est supérieure à la valeur de CSEO.
Plantes non visées
: plantes situées hors de la zone contenant les plantes visées. Pour les produits phytosanitaires, ce terme se réfère généralement à des plantes situées hors de la surface de traitement.
CSEO (concentration sans effet observé)
: concentration la plus élevée de substances d'essai à laquelle aucun effet n'est observé. Dans cet essai, la concentration correspondant à la CSEO n'a pas d'effet statistiquement significatif (p < 0,05) pendant une durée d'exposition donnée lorsqu'on la compare au témoin.
Phytotoxicité
: anomalies préjudiciables (selon des mesures et des évaluations visuelles) par rapport à l'apparence et au modèle de croissance normaux des plantes, qui apparaissent en réponse à une substance chimique donnée.
Réplique
: unité expérimentale qui représente le groupe de contrôle et/ou le groupe de traitement. Dans ces études, la réplique est définie par un pot.
Évaluation visuelle
: appréciation des dommages visuels d'après l'observation du port de la plante, de sa vigueur, de malformations, d'une chlorose, d'une nécrose et de l'apparence globale par rapport à un témoin.
Substance chimique d'essai
: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
Appendice 2
Liste des espèces habituellement utilisées dans les essais sur plantes
|
Famille
|
Espèces
|
Noms vulgaires
|
|
DICOTYLEDONAE
|
|
Apiaceae (Umbelliferae)
|
Daucus carota
|
Carotte
|
|
Asteraceae (Compositae)
|
Helianthus annuus
|
Tournesol
|
|
Asteraceae (Compositae)
|
Lactuca sativa
|
Laitue
|
|
Brassicaceae (Cruciferae)
|
Sinapis alba
|
Moutarde blanche
|
|
Brassicaceae (Cruciferae)
|
Brassica campestris var. chinensis
|
Chou chinois
|
|
Brassicaceae (Cruciferae)
|
Brassica napus
|
Colza
|
|
Brassicaceae (Cruciferae)
|
Brassica oleracea var. capitata
|
Chou
|
|
Brassicaceae (Cruciferae)
|
Brassica rapa
|
Navet
|
|
Brassicaceae (Cruciferae)
|
Lepidium sativum
|
Cresson alénois
|
|
Brassicaceae (Cruciferae)
|
Raphanus sativus
|
Radis
|
|
Chenopodiaceae
|
Beta vulgaris
|
Betterave à sucre
|
|
Cucurbitaceae
|
Cucumis sativa
|
Concombre
|
|
Fabaceae (Leguminosae)
|
Glycine max (G. soja)
|
Soja
|
|
Fabaceae (Leguminosae)
|
Phaseolus aureus
|
Haricot mungo
|
|
Fabaceae (Leguminosae)
|
Phaseolus vulgaris
|
Haricot
|
|
Fabaceae (Leguminosae)
|
Pisum sativum
|
Pois
|
|
Fabaceae (Leguminosae)
|
Trigonella foenum-graecum
|
Fenugrec
|
|
Fabaceae (Leguminosae)
|
Lotus corniculatus
|
Lotier corniculé
|
|
Fabaceae (Leguminosae)
|
Trifolium pratense
|
Trèfle des prés
|
|
Fabaceae (Leguminosae)
|
Vicia sativa
|
Vesce cultivée
|
|
Linaceae
|
Linum usitatissimum
|
Lin
|
|
Polygonaceae
|
Fagopyrum esculentum
|
Sarasin
|
|
Solanaceae
|
Solanum lycopersicon
|
Tomate
|
|
MONOCOTYLEDONAE
|
|
Liliaceae (Amarylladaceae)
|
Allium cepa
|
Oignon
|
|
Poaceae (Gramineae)
|
Avena sativa
|
Avoine
|
|
Poaceae (Gramineae)
|
Hordeum vulgare
|
Orge
|
|
Poaceae (Gramineae)
|
Lolium perenne
|
Raygras pérenne
|
|
Poaceae (Gramineae)
|
Oryza sativa
|
Riz
|
|
Poaceae (Gramineae)
|
Secale cereale
|
Seigle
|
|
Poaceae (Gramineae)
|
Sorghum bicolor
|
Sorgho
|
|
Poaceae (Gramineae)
|
Triticum aestivum
|
Blé
|
|
Poaceae (Gramineae)
|
Zea mays
|
Maïs
|
Appendice 3
Liste des espèces non cultivées potentielles
Espèces potentielles selon l'OCDE pour les essais de toxicité sur plantes
Note: Le tableau suivant fournit des informations sur 52 espèces non cultivées (les références sont données entre parenthèses pour chaque entrée). Les taux d'émergence indiqués sont issus de la littérature publiée et ne sont fournis qu'à titre d'indication générale. L'expérience individuelle peut varier en fonction de la source de semence et d'autres facteurs.
|
FAMILLE Nom botanique de l'espèce
(Nom commun français)
|
Durée de vie (9) et habitat
|
Poids des graines
(mg)
|
Photopériode pour la germination ou la croissance (10)
|
Profondeur du semis
(mm) (11)
|
Durée de germination
(jours) (12)
|
Traitements spéciaux (13)
|
Essai de toxicité (14)
|
Distributeurs de semences (15)
|
Autres références (16)
|
|
APIACEAE
Torilis japónica
(Torillis du Japon)
|
A, В zones perturbées, haies, pâturages (16, 19)
|
1,7 – 1,9 (14, 19).
|
L = D (14)
|
0
(1, 19)
|
5 (50 %) (19).
|
stratification froide (7, 14, 18, 19) une maturation peut être nécessaire (19) germination inhibée par l'obscurité (1, 19) aucun traitement particulier (5)
|
POST (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(Pâquerette vivace)
|
Ρ
prairie, terres arables, gazon (16, 19)
|
0,09 – 0,17 (4, 19).
|
L = D (14)
|
0
4)
|
3 (50 %) (19).
11 (100 %) (18).
|
germination non affectée par une irradiation (18, 19) aucun traitement particulier (4, 14)
|
POST (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(Bleuet des champs)
|
A
champs, bords de routes, habitats ouverts (16)
|
4,1 – 4,9 (4, 14).
|
L = D (14)
|
0 — 3 (2, 4, 14).
|
14-21 (100 %) (14)
|
aucun traitement particulier (2,4)
|
POST (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(Centaurée noire)
|
Ρ
champs, bords de routes, habitats ouverts (16, 19)
|
2,4 – 2,6 (14, 19).
|
L = D (14)
|
0 (19)
|
3 (50 %) (19).
4 (97 %) (18).
|
une maturation peut être nécessaire (18, 19) germination inhibée par l'obscurité (19) aucun traitement particulier (5, 14, 26)
|
POST (5, 22, 26)
|
A
|
|
|
Inula helenium
(Inule aulnée)
|
Ρ
sites humides, perturbés
16)
|
1 – 1,3 (14, 14, 19).
|
|
0
(4, 29)
|
|
aucun traitement particulier (4)
|
POST (4)
|
A, F
|
|
|
Leontodon hispidus
(Liondent hérissé)
|
Ρ
champs, bords de routes, zones perturbées (16, 19)
|
0,85 – 1,2 (14, 19).
|
L = D (14)
|
0 (19)
|
4 (50 %) (19).
7 (80 %) (18).
|
germination inhibée par l'obscurité (17, 18, 19) aucun traitement particulier (5, 23)
|
POST (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(Rudbeckie hérissée)
|
Β, Ρ perturbé
(16)
|
0,3 (4, 14)
|
L = D (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
aucun traitement particulier
(4, 14, 33)
|
POST (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(Solidage du Canada)
|
Ρ
pâturages, zones ouvertes (16)
|
0,06 – 0,08 (4, 14).
|
L = D (11)
|
0
(4)
|
14-21
11)
|
mélanger avec une quantité égale de sable et tremper dans du GA 500 ppm pendant 24 h (11) aucun traitement particulier (4)
|
POST (4)
|
E, F
|
|
|
Xanthium pensylvanicum
|
A
champs, habitats ouverts (16)
|
25 – 61 (14, 29)
|
|
0(1)
5(29)
|
|
la germination peut être inhibée par l'obscurité (1) tremper dans l'eau tiède pendant 12 heures (29)
|
PRE & POST (31)
|
A
|
|
|
Xanthium spinosum
(Lampourde épineuse)
|
A
habitats ouverts (16)
|
200 (14)
|
L = D (14)
L > D (6)
|
10
(6)
|
|
scarification (14) aucun traitement particulier (6)
|
PRE & POST (6)
|
A
|
|
|
Xanthium strumarium
(Violette des champs)
|
A
champs, habitats ouverts (16)
|
67,4 (14)
|
L = D (14)
|
10 - 20 (6, 21)
|
|
aucun traitement particulier
(6, 14, 21)
|
PRE & POST (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Cardamine pratensis
(Cardamine des prés)
|
Ρ
champs, bords de routes, gazon (16, 19)
|
0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19).
15 (98 %) (18).
|
germination inhibée par l'obscurité (18, 19) aucun traitement particulier (5, 14, 22)
|
POST (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
(Lychnis fleur de coucou)
|
Ρ
(16)
|
0,21 (14)
|
L = D (14)
|
|
< 14 (100 %) (14, 25)
|
une maturation peut être nécessaire (18) aucun traitement particulier (5, 14, 15, 22-26)
|
POST (5, 15, 22-26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(Chénopode blanc)
|
A
bordures de champs, zones perturbées (16, 19)
|
0,7 – 1,5 (14, 19, 34).
|
L = D (14)
|
0
(1, 19)
|
2 (50 %) (19).
|
le traitement diffère en fonction de la couleur de la graine (19) dormance en stockage à sec (19) germination inhibée par l'obscurité (1, 18, 19) stratification froide (18) aucun traitement particulier (14, 34)
|
PRE & POST (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(Millepertuis perforé)
|
Ρ
champs, terres arables, habitats ouverts (16, 19)
|
0,1 – 0,23
(14, 19)
|
L= D
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18).
|
germination inhibée par l'obscurité (1, 18, 19)
aucun traitement particulier (5, 14, 15, 25, 27)
|
POST
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
(Etoile du matin)
|
A
bords de routes, habitats ouverts, champs de maïs (16)
|
28,2
(14)
|
L > D
(6, 10)
|
10-20
(6, 10, 21)
|
4 (100 %)
(10)
|
germination non affectée par une irradiation (1)
aucun traitement particulier (6, 21)
|
PRE & POST
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
(Souchet rond)
|
Ρ
terres arables, pâturages, bords de routes (16, 30)
|
0,2
(14)
|
L= D
(14)
|
0 (1)
10 - 20 (6, 10)
|
12 (91 %)
(10)
|
germination inhibée par l'obscurité (1)
aucun traitement particulier (6, 10, 14)
|
PRE & POST
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
(Lotie corniculé)
|
Ρ
zones herbeuses, bords de routes, habitats ouverts (16, 19)
|
1-1,67
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
scarification (14, 19)
germination non affectée par une irradiation (18, 19) aucun traitement particulier (23, 25)
|
POST
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(Casse fétide)
|
A
bois humide (16)
|
23-28
(9)
|
L = D (14)
L > D (9)
|
10-20
(6,9)
|
|
tremper les graines humides dans l'eau pendant 24 heures (9)
scarification (14) la viabilité des graines dépend de leur couleur (1) aucun traitement particulier (6)
|
POST
(6,9)
|
A
|
|
|
Sesbania exaltata
(Chanvre)
|
A
sol alluvial (16)
|
11 – 13
(9, 14)
|
L > D (9)
|
10-20
(9, 21)
|
|
tremper les graines humides dans l'eau pendant 24 heures (9)
germination non affectée par une irradiation (1) aucun traitement particulier (21)
|
PRE & POST
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(Trèfle des prés)
|
Ρ
champs, bords de routes, terres arables (16, 19)
|
1,4 – 1,7
(14, 19)
|
L= D (14)
|
|
1 (50 %)
(19)
|
scarification (14, 18)
peut requérir une maturation (19) germination non affectée par une irradiation (1, 19) aucun traitement particulier (5)
|
POST
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(Agripaume)
|
Ρ
zones ouvertes (16)
|
0,75 – 1,0
(4, 14)
|
L= D (14)
|
0
(4)
|
|
aucun traitement particulier
(4, 14)
|
POST
(4)
|
F
|
|
|
Mentha spicata
(Menthe verte)
|
Ρ
zones humides (16)
|
2,21
(4)
|
|
0
(4)
|
|
aucun traitement particulier
(4)
|
POST
(4)
|
F
|
|
|
Nepeta cataria
(Herbe à chats)
|
Ρ
zones perturbées (16)
|
0,54
(4, 14)
|
L= D (14)
|
0
(4)
|
|
aucun traitement particulier
(2, 4, 14)
|
POST
(2,4)
|
F
|
|
|
Prunella vulgaris
(Brunelle commune)
|
Ρ
terres arables, zones herbeuses, sites perturbés (16, 19)
|
0,58 – 1,2.
(4, 14, 19)
|
L= D (14)
|
0
(4, 19)
|
5 (50 %) (19).
7 (91 %) (18).
|
germination inhibée par l'obscurité (18, 19)
meilleure germination avec les grosses graines (1) aucun traitement particulier (4, 14, 22)
|
POST
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(Epiaire officinale)
|
Ρ
prairies, bordures de champs (19)
|
14-18
(14, 19)
|
L= D (14)
|
|
7 (50 %)
(19)
|
aucun traitement particulier
(5, 14, 22)
|
POST
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilón theophrasti
(Abutilón)
|
A
champs, habitats ouverts (16)
|
8,8
(14)
|
L= D (14)
|
10-20
(6, 10, 21)
|
4 (84 %)
(10)
|
scarification (14)
aucun traitement particulier (5, 10, 21)
|
PRE & POST
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(Sida épineux)
|
A
champs, bords de route (16)
|
3,8
(14)
|
L= D (14)
|
10-20
(6, 21)
|
|
scarification (14)
germination non affectée par une irradiation (1) aucun traitement particulier (6,21)
|
PRE & POST
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(Grand coquelicot)
|
A
champs, terres arables, sites perturbés (16, 19)
|
0,1 – 0,3
(4, 14, 19, 29)
|
L= D (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
stratification froide et scarification (1, 19, 32)
aucun traitement particulier (4, 14, 29)
|
POST
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis
(Agrostide vulgaire)
|
pelouses, pâturages (16)
|
0,07 (14)
|
L > D (Ю)
|
20 (10)
|
10 (62 %) (10).
|
germination inhibée par l'obscurité (1, 17-19) aucun traitement particulier (10)
|
POST (10)
|
A, E
|
|
|
Alopecurus myosuroides
(Vulpin agreste)
|
A
champs, habitats ouverts (16)
|
0,9-1,6
(29, 34)
|
L = D (14)
|
2
(29)
|
< 24 (30 %) (34)
|
scarification (14) traiter avec 101 mg/l de KNO3 (14) stratification chaude (1) germination inhibée par l'obscurité (1) aucun traitement particulier (34)
|
PRE & POST
(28, 34)
|
A
|
32
|
|
Avena fatua
(Avoine folle)
|
A
zones cultivées, habitats ouverts (16)
|
7 – 37,5 (14, 30)
|
L = D (14)
L > D (6)
|
10 — 20 (6, 10)
|
3 (70 %) (18).
|
scarification (7, 32) germination inhibée par l'obscurité (1)
stratification froide (1,18) aucun traitement particulier (6, 10, 14)
|
PRE & POST (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(Brome des toits)
|
A
champs, bords de routes, terres arables (16)
|
0,45 – 2,28 (14, 29)
|
L = D (14)
|
3 (29)
|
|
période de maturation (1, 7, 32) germination inhibée par la lumière (1) aucun traitement particulier (14)
|
PRE & POST (28, 31)
|
A
|
|
|
Cynosurus cristatus
(Crételle)
|
P
champs, bords de routes, habitats ouverts (16, 19)
|
0,5 – 0,7 (14, 19, 29).
|
L = D (14)
|
0 (29)
|
3 (50 %) (19).
|
germination non affectée par une irradiation (19) aucun traitement particulier (14, 29)
|
POST (5)
|
A
|
|
|
Digitaria sanguinalis
(Digitaire sanguine)
|
A
champs, gazon, habitats ouverts (16)
|
0,52 – 0,6 (14,30)
|
L = D (14)
|
10 - 20 (21)
|
7 (75 %)
14 (94 %) (7).
|
scarification, stratification froide & maturation (1, 7, 14, 32) traiter avec 101 mg/l de KNO3 (14) germination inhibée par l'obscurité (1) aucun traitement particulier (21 )
|
PRE & POST (18, 25, 31)
|
A
|
|
|
Echinochloa crusgalli
(panic pied-de-coq)
|
A
(16)
|
1,5 (14)
|
L = D (14)
L > D (3)
|
10 - 20 (7, 21)
|
|
scarification (7, 32) germination non affectée par une irradiation (1) aucun traitement particulier (3, 14, 21)
|
PRE & POST (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(Elyme du Canada)
|
P
riverain, sites perturbés (16)
|
4-5 (14, 30)
|
L = D (11)
|
1
(11)
|
14-28
(11)
|
aucun traitement particulier
(2, 11)
|
POST (2)
|
C, D, E
|
|
|
Festuca pratensis
(Fétuque des prés)
|
P
champs, zones humides (16, 19)
|
1,53-2,2 (16, 19)
|
L = D (14)
L > D (10)
|
20 (10)
|
9 (74 %) (10).
2 (50 %) (19).
|
aucun traitement particulier
(10, 19)
|
POST (10)
|
A
|
7
|
|
Hordeum pusillum
(Orge naine)
|
A
pâturages, bords de routes, habitats ouverts (16)
|
3,28 (14)
|
|
|
|
stratification chaude (1) germination non affectée par une irradiation (1)
|
PRE (31)
|
|
7
|
|
Phieum pratense
(Fléole des prés)
|
P
pâturages, terres arables, sites perturbés (16, 19)
|
0,45 (14, 19)
|
L > D (10, 14)
|
0-10 (10, 19)
|
2 (74 %) (10).
8 (50 %) (19).
|
germination inhibée par l'obscurité (19) germination non affectée par une irradiation (17) aucun traitement particulier (10, 14, 17, 19)
|
POST (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(Renouée faux-liseron)
|
A
habitats ouverts, bords de routes (16)
|
5 – 8 (4, 14, 29)
|
L = D (20)
|
0-2 (4, 29)
|
|
stratification froide pendant 4- 8 semaines (1, 2, 4, 20, 29) germination non affectée par une irradiation (1)
|
PRE & POST 1, 2, 20, 28, 31
|
A
|
32
|
|
Polygonum lapathifolium
(Renouée à feuille de patience)
|
A
sol humide (16)
|
1,8 – 2,5 (14)
|
L > D (6)
|
|
5 (94 %) (18).
|
germination non affectée par une irradiation (1) germination inhibée par l'obscurité (18) stratification froide (1) aucun traitement particulier (5)
|
PRE & POST (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
(Renouée de Pennsylvanie)
|
A
champs, habitats ouverts (16)
|
3,6 – 7 (14, 29)
|
|
2 (29)
|
|
stratification froide pendant 4 semaines à 0 - 5 °C (1, 29) germination inhibée par l'obscurité (1)
|
PRE (31)
|
A, E
|
|
|
Polygonum periscaria
(Renouée persicaire)
|
A
zones perturbées, terres arables (16, 19)
|
2,1 – 2,3 (14, 19)
|
L > D (13)
|
0 (19)
|
14 (13)
2 (50 %) (19).
|
scarification, stratification froide, traitement au GA (14) stratification froide, maturation (17 - 19) germination inhibée par l'obscurité (19) aucun traitement particulier (13)
|
POST (13)
|
A
|
32
|
|
Rumex crispus
(Patience crépue)
|
P
terres arables, bords de routes, zones ouvertes (16, 19)
|
1,3 – 1,5 (4, 14, 19)
|
L = D (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19).
6 (100 %) (33).
|
germination inhibée par une irradiation (18, 19) une maturation peut être requise (18) aucun traitement particulier (4, 14, 33)
|
POST (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
(Mourron rouge)
|
A
terres arables, zones ouvertes, sites perturbés (16, 19)
|
0,4 – 0,5 (4, 14, 19)
|
L = D (14)
|
|
1 (50 %) (19).
|
stratification froide, traitement au G A (1, 14, 18, 19, 32) lumière requise pour la germination (1) aucun traitement particulier (2, 4)
|
POST (2,4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(Renoncule acre)
|
Ρ
terres arables, bords de routes, zones ouvertes (16, 19)
|
1,5 – 2 (14, 19, 29)
|
L = D (14)
|
1
(29)
|
41 - 56 (19, 29)
|
aucun traitement particulier
(5, 14, 22, 24 - 26)
|
POST (5, 22, 24-26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(Benoîte commune)
|
Ρ
bordures de haies, zones humides
(16, 19)
|
0,8 – 1,5 (14, 19).
|
L = D (14)
|
0 (19)
|
5 (50 %) (19).
16 (79 %) (18).
|
germination inhibée par l'obscurité (18, 19) stratification à chaude (1) aucun traitement particulier (5, 14, 22, 25, 26)
|
POST (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(Gailiet gratteron)
|
A
terres arables, zones humides, sites perturbés (16, 19)
|
7-9 (14, 19)
|
L = D (14)
|
|
5 (50 %) (19).
6 (100 %) (18).
|
stratification froide (1, 18, 19) germination non affectée par une irradiation (18, 19) la lumière inhibe la germination (1) aucun traitement particulier (6, 14)
|
PRE & POST (6, 28)
|
A
|
32
|
|
Galium mollugo
(Caille-lait blanc)
|
Ρ
haies sur talus, zones ouvertes (8)
|
7
(29)
|
L = D (14)
|
2
(29)
|
|
aucun traitement particulier
(5, 14, 22, 24, 26, 29)
|
POST (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(Digitale pourpre)
|
B, P haies, zones ouvertes (16, 19)
|
0,1 – 0,6 (4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
6 (50 %) (19).
8 (99 %) (18).
|
germination inhibée par l'obscurité (1,17-19) aucun traitement particulier (4, 22-26)
|
POST (4, 22 - 26)
|
D, G, F
|
|
|
Veronica persica
(Véronique de Perse)
|
A
terres arables, zones ouvertes, sites perturbés (16, 19)
|
0,5-0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3(19)
5 (96 %) (18).
|
germination inhibée par l'obscurité (18, 19) stratification froide (18) aucun traitement particulier (14)
|
PRE & POST (28)
|
A
|
32
|
Distributeurs de semences cités
|
ID Fournisseur
|
Coordonnées Fournisseur
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ ENGLAND +44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 USA
|
|
(727) 344 - 4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla — Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 CANADA (519) 586 - 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 USA (303) 431 - 7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 USA
|
|
(800) 873 - 3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB ENGLAND
|
|
+44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 CANADA (800) 274 - 7333
|
|
www.thompson-morgan.com
|
|
RÉFÉRENCES CITÉES
|
(1)
|
Baskin, C.C. & Baskin, J.M. 1998. Seeds. Academic Press, Toronto
|
|
(2)
|
Blackburn, L.G. & Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271-285.
|
|
(3)
|
Boutin, C., Lee, H-B., Peart, T., Batchelor, P.S., & Maguire, R.J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
|
|
(4)
|
Boutin, C., Elmegaard, N., & Kjaer, C. 2004. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349-369.
|
|
(5)
|
Breeze, V., Thomas, G., & Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669-677.
|
|
(6)
|
Brown, R.A., & Farmer, D. 1991. Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. In: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J.W. Gorsuch, W.R. Lower, W.Wang, & M.A. Lewis, eds. American Society for Testing & Materials, Philadelphia. pp 197 — 208.
|
|
(7)
|
Buhler, D.D. & Hoffman, M.L. 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
(8)
|
Clapham, A.R., Tutin, T.G., & Warburg, E.F. 1981. Excursion flora of the British Isles, 3rd ed. Cambridge University Press, Cambridge
|
|
(9)
|
Clay, P.A. & Griffin, J.L. 2000. Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481-486.
|
|
(10)
|
Cole, J.F.H. & Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC — Weeds. pp. 151 — 156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds). 2004. Personal communication. (www.ernstseed.com)
|
|
(12)
|
Fletcher, J.S., Johnson, F.L., & McFarlane, J.C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769-776.
|
|
(13)
|
Fletcher, J.S., Pfleeger, T.G., Ratsch, H.C., & Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189-1196.
|
|
(14)
|
Flynn, S., Turner, R.M., and Dickie, J.B. 2004. Seed Information Database (release 6.0, Oct 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid)
|
|
(15)
|
Franzaring, J., Kempenaar, C., & van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21-28.
|
|
(16)
|
Gleason, H.A. & Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2nd ed. New York Botanical Garden, Bronx, NY
|
|
(17)
|
Grime, J.P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555-558.
|
|
(18)
|
Grime, J.P., Mason, G., Curtis, A.V., Rodman, J., Band, S.R., Mowforth, M.A.G., Neal, A.M., & Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017-1059.
|
|
(19)
|
Grime, J.P., Hodgson, J.G., & Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London
|
|
(20)
|
Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453-459.
|
|
(21)
|
Klingaman, T.E., King, C.A., & Oliver, L.R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227-232.
|
|
(22)
|
Marrs, R.H., Williams, C.T., Frost, A.J., & Plant, R.A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71-86.
|
|
(23)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223-235.
|
|
(24)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25-42.
|
|
(25)
|
Marrs, R.H., Frost, A.J., Plant, R.A., & Lunnis, P. 1993. Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283-293.
|
|
(26)
|
Marrs, R.H. & Frost, A.J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369-388.
|
|
(27)
|
Marshall, E.J.P. & Bernie, J.E. 1985. Herbicide effects on field margin flora. BCPC — Weeds. pp. 1021-1028.
|
|
(28)
|
McKelvey, R.A., Wright, J.P., & Honegger, J.L. 2002. A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161-1174.
|
|
(29)
|
Morton, S. (Herbiseed). 2004. Personal communication. (http://www.herbiseed.com)
|
|
(30)
|
USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA
|
|
(31)
|
USEPA. 1999. One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
(32)
|
Webster, R.H. 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L. & Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Personal communication.
|
|
(34)
|
Zwerger, P. & Pestemer, W. 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711-718.
|
Appendice 4
Exemple de conditions de croissance appropriées à certaines espèces cultivées
Les conditions suivantes se sont révélées satisfaisantes pour 10 espèces cultivées et on peut donc s'en inspirer pour les essais en chambre de culture avec certaines autres espèces:
|
|
Concentration de dioxyde de carbone: 350 ± 50 ppm;
|
|
|
Humidité relative: 70 ± 5 % pendant les périodes d'éclairement et 90 ± 5 % pendant les périodes d'obscurité;
|
|
|
Température: 25 ± 3 °C pendant la journée, 20 ± 3 °C pendant la nuit;
|
|
|
Photopériode: 16 heures de lumière/8 heures d'obscurité, en supposant une longueur d'onde moyenne de 400 à 700 nm;
|
|
|
Lumière: luminance de 350 ± 50 μE/m2/s, mesurée au-dessus du feuillage.
|
Les espèces végétales sont les suivantes:
|
—
|
tomate (Solanum lycopersicon),
|
|
—
|
concombre (Cucumis sativus),
|
|
—
|
laitue (Lactuca sativa),
|
|
—
|
chou (Brassica oleracea var. capitata),
|
|
—
|
carotte (Daucus carota),
|
|
—
|
raygras pérenne (Lolium perenne),
|
C.32. ESSAI DE REPRODUCTION CHEZ L'ENCHYTRÉE
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 220 (2004) de l'OCDE pour les essais de produits chimiques. Elle est destinée à évaluer les effets des substances chimiques sur la reproduction d'un ver enchytrée, Enchytraeus albidus, Henle 1873, dans le sol. Elle repose pour l'essentiel sur une méthode développée par l'Umweltbundesamt (Allemagne) (1) qui a été soumise à un essai tournant (2). D'autres méthodes d'évaluation de la toxicité des substances chimiques sur les enchytrées et les lombrics ont aussi été prises en considération (3)(4)(5)(6)(7)(8).
|
CONSIDÉRATIONS INITIALES
|
2.
|
Les annélides pédocoles du genre Enchytraeus sont des espèces écologiquement pertinentes pour les essais d'écotoxicité. Bien que fréquents dans les sols à lombrics, les enchytrées colonisent souvent en abondance de nombreux sols qui n'abritent pas de lombrics. Les enchytrées se prêtent à des essais en laboratoire, ainsi qu'à des essais sur le terrain et en partie sur le terrain. Sur le plan pratique, de nombreuses espèces ď Enchytraeus sont faciles à manipuler et à élever et leur génération est nettement plus courte que celle des lombrics. Aussi la durée d'un essai de reproduction chez l'enchytrée n'est-elle que de 4 à 6 semaines, contre 8 semaines chez les lombrics (Eisenia fetida).
|
|
3.
|
Des notions de base sur l'écologie et l'écotoxicologie des enchytrées en milieu terrestre sont fournies par les références (9)(10)(11)(12).
|
PRINCIPE DE L'ESSAI
|
4.
|
Les enchytrées adultes sont exposés à une gamme de concentrations de la substance chimique d'essai mélangée à un sol artificiel. Cet essai peut être divisé en deux étapes: a) un essai de détermination de l'ordre de grandeur des concentrations, si des informations manquent, où la mortalité constitue le principal résultat évalué après deux semaines d'exposition et b) l'essai de reproduction proprement dit dans lequel on évalue le nombre total de vers juvéniles produits par animal parent et la survie des animaux parents. L'essai proprement dit dure six semaines. À la fin des trois premières semaines, on enlève les vers adultes et on note leurs changements morphologiques. Au terme des trois semaines suivantes, le nombre de descendants éclos des cocons engendrés par les adultes est compté. On compare le taux de reproduction des animaux exposés à la substance chimique d'essai à celui du(des) témoin(s), afin de déterminer i) la concentration sans effet observé (CSEO) et/ou ii) la CEx (par exemple CE10, CE50), à l'aide d'un modèle de régression pour estimer la concentration qui entraînerait une réduction de x % du taux de reproduction. Les concentrations expérimentales doivent couvrir la CEx (par exemple CE10, CE50), de façon à ce que la CEx soit interpolée plutôt qu'extrapolée.
|
INFORMATIONS SUR LA SUBSTANCE CHIMIQUE D'ESSAI
|
5.
|
Il est préférable de connaître l'hydrosolubilité, le log Koe, le coefficient de partage entre l'eau et le sol (chapitre C.18 ou C.19 de la présente annexe, par exemple) et la pression de vapeur de la substance chimique d'essai. Des informations supplémentaires sur le devenir de la substance chimique d'essai dans le sol, notamment sa vitesse de photolyse et d'hydrolyse, seraient souhaitables.
|
|
6.
|
La présente méthode d'essai convient à l'essai de substances chimiques hydrosolubles ou insolubles; néanmoins, le mode d'application de la substance d'essai variera en conséquence. Cette méthode d'essai ne s'applique pas aux substances volatiles, à savoir les substances dont la constante de Henry ou le coefficient de partage air/eau sont supérieurs à un, ou les substances dont la pression de vapeur dépasse 0,0133 Pa à 25 °C.
|
VALIDITÉ DE L'ESSAI
|
7.
|
Pour que l'essai soit valide, les témoins doivent satisfaire aux critères suivants:
|
—
|
la mortalité des adultes n'excédera pas 20 % à la fin de l'essai de détermination de l'ordre de grandeur des concentrations et à la fin des trois premières semaines de l'essai de reproduction.
|
|
—
|
si dix adultes ont été déposés dans chaque récipient au début de l'essai, on doit retrouver en moyenne au moins 25 vers juvéniles par récipient à la fin de l'essai.
|
|
—
|
le coefficient de variation autour du nombre moyen de vers juvéniles ne doit pas dépasser 50 % à la fin de l'essai de reproduction.
|
Un essai qui ne remplirait pas les critères de validité susmentionnés doit être arrêté, à moins que la poursuite de l'essai puisse être justifiée. Cette justification doit figurer dans le rapport d'essai.
|
SUBSTANCE CHIMIQUE DE RÉFÉRENCE
|
8.
|
Afin de vérifier que la réaction des organismes d'expérience ne change pas de façon significative au cours du temps, une substance chimique de référence sera soit testée à intervalles réguliers, soit incluse dans chaque essai. La carbendazime, qui affecte la survie et la reproduction des enchytrées (13)(14), est une substance de référence appropriée, tout comme d'autres produits chimiques dont la toxicité est bien connue. Le Derosal™, fourni par AgrEvo (Francfort, Allemagne), est un produit renfermant de la carbendazime à raison de 360 g/l (32,18 %) d'ingrédient actif, qui a été utilisé dans un essai tournant (2). La CE50 pour la reproduction déterminée au cours de l'essai tournant s'élevait à 1,2 ± 0,8 mg d'ingrédient actif/kg de masse sèche (2). Si un étalon toxique positif est inclus dans la série d'essais, on n'applique qu'une seule concentration et un nombre d'expériences identiques égal à celui des témoins. En ce qui concerne la carbendazime, on recommande l'essai de 1,2 mg d'ingrédient actif/kg de poids sec (testé sous forme liquide).
|
DESCRIPTION DE L'ESSAI
Matériel
|
9.
|
Les récipients expérimentaux doivent être composés de verre ou d'un autre matériau chimiquement inerte. On utilisera des bocaux en verre (volume: 0,20 - 0,25 litre; diamètre ± 6 cm, par exemple) munis de couvercles transparents (en verre ou en polyéthylène, par exemple) afin de réduire l'évaporation de l'eau, tout en autorisant les échanges gazeux entre le sol et l'atmosphère. Les couvercles doivent être transparents pour laisser passer la lumière.
|
|
10.
|
Cet essai requiert du matériel de laboratoire courant et en particulier:
|
—
|
balances suffisamment précises;
|
|
—
|
instruments appropriés permettant de réguler la température;
|
|
—
|
instruments appropriés permettant de réguler l'humidité (pas essentiel si les récipients expérimentaux ont des couvercles);
|
|
—
|
incubateur ou petite chambre équipée d'un conditionnement de l'air;
|
|
—
|
pinces, crochets ou anses;
|
|
—
|
cuve de développement photographique
|
|
Préparation du sol artificiel
|
11.
|
Dans cet essai, on utilise un sol artificiel (5)(7) composé comme suit (en poids secs, séchés à 105 °C jusqu'à obtention d'un poids constant):
|
—
|
10 % de tourbe à sphaigne, séchée à l'air et finement broyée (une dimension des particules de 2±1 mm est acceptable); il est recommandé de vérifier qu'un sol préparé avec un lot frais de tourbe convient à la culture des vers, avant de l'utiliser dans un essai;
|
|
—
|
20 % d'argile kaolinique (taux de kaolinite de préférence supérieur à 30 %);
|
|
—
|
environ 0,3 à 1,0 % de carbonate de calcium (CaCO3 pulvérisé, de qualité pour analyse) pour obtenir un pH de 6,0 ± 0,5; la quantité de carbonate de calcium à ajouter peut dépendre principalement de la qualité/nature de la tourbe;
|
|
—
|
environ 70 % de sable quartzique (selon la quantité de CaCO3 nécessaire) séché à l'air, composé en majorité de sable fin (plus de 50 % des particules mesurant entre 50 et 200 μm).
|
Avant d'utiliser le sol artificiel dans l'essai proprement dit, il est conseillé de démontrer que ce sol convient à la culture des vers et qu'il permet de répondre aux critères de validité de l'essai. Cette précaution vise en particulier à vérifier que le bon fonctionnement de l'essai ne sera pas compromis si la teneur en carbone organique du sol artificiel est réduite, par exemple si le pourcentage de tourbe est ramené à 4-5 % et que le taux de sable est augmenté en conséquence. Cette réduction de la teneur en carbone organique est susceptible de diminuer les possibilités d'adsorption de la substance chimique d'essai sur le sol (carbone organique) et d'augmenter la disponibilité de la substance d'essai pour les vers. Il a été démontré qu'Enchytraeus albidus peut satisfaire aux critères de validité concernant la reproduction lorsqu'il est testé sur le terrain sur des sols dont la teneur en carbone organique est inférieure à celle mentionnée ci-dessus (2,7 %, par exemple) (15), et on a constaté (bien que l'expérience en la matière soit limitée) que ce ver peut aussi satisfaire aux critères de validité lorsqu'il est mis à l'essai sur un sol artificiel renfermant 5 % de tourbe.
Remarque: Lorsqu'on utilise un sol naturel dans un essai supplémentaire (réalisé à un niveau supérieur dans le cadre d'essais séquentiels, par exemple), l'adéquation du sol à la culture des vers et au respect des critères de validité doit aussi être démontrée.
|
|
12.
|
Les ingrédients secs du sol sont mélangés complètement (par exemple, dans un grand mélangeur de laboratoire), et ce au moins une semaine avant le début de l'essai. Le sol mélangé doit être entreposé durant deux jours pour que l'acidité s'équilibre/se stabilise. Pour déterminer le pH, on mélange le sol avec une solution 1 M de chlorure de potassium (KCl) ou 0,01 M de chlorure de calcium (CaCl2) dans des proportions de 1/5 [voir (16) et Appendice 3]. Si l'acidité du sol dépasse les valeurs incluses dans la gamme requise (voir paragraphe 11), elle peut être ajustée par l'addition d'une quantité appropriée de CaCO3. Si le sol est trop alcalin, il peut être rééquilibré par l'ajout d'un mélange comprenant les ingrédients cités au paragraphe 11, à l'exclusion du CaCO3.
|
|
13.
|
La capacité maximale de rétention d'eau du sol artificiel est déterminée conformément aux procédures décrites à l'Appendice 2. Un ou deux jours avant le début de l'essai, le sol artificiel sec est préhumidifié par l'ajout d'une quantité suffisante d'eau désionisée pour atteindre environ la moitié de sa teneur en eau finale, à savoir 40 à 60 % de la capacité maximale de rétention d'eau. Au début de l'essai, le sol préhumidifié est divisé en autant de portions que de concentrations expérimentales, témoins et substance chimique de référence utilisés dans l'essai. La teneur en humidité est ajustée à 40-60 % de la capacité maximale de rétention d'eau par l'addition de la solution contenant la substance d'essai et/ou d'eau distillée ou désionisée (voir paragraphes 19-21). La teneur en humidité est déterminée au début et à la fin de l'essai (par séchage à 105 °C jusqu'à obtention d'un poids constant) et doit se situer dans la gamme optimale pour la survie des vers. Il est possible d'estimer en gros le taux d'humidité du sol en pressant doucement une poignée de sol dans une main: si le taux d'humidité est correct, de petites gouttes d'eau apparaissent entre les doigts.
|
Sélection et préparation des animaux d'essai
|
14.
|
L'espèce recommandée dans cet essai est Enchytraeus albidus, Henle 1837 (ver blanc), de la famille des Enchytraeidae (ordre des Oligochaeta, phylum des annélides). E. albidus est l'un des plus grands représentants des enchytrées, des spécimens mesurant jusqu'à 35 mm de long ayant été recensés (17)(18). Espèce à répartition mondiale, E. albidus colonise des habitats marins, dulcicoles et terrestres, constitués la plupart du temps de matière organique en décomposition (algues, compost), et fréquente rarement les prairies (9). Le fait qu'il tolère une gamme étendue de conditions écologiques et certaines variations morphologiques indiquent qu'il pourrait exister différentes races.
|
|
15.
|
E. albidus est vendu dans le commerce, comme nourriture pour les poissons. Il y a lieu de vérifier si la culture est contaminée par d'autres espèces, généralement plus petites (1)(19). Dans l'affirmative, tous les vers doivent être lavés à l'eau dans une boîte de Petri. On sélectionne ensuite les grands spécimens adultes d'E. albidus (au moyen d'un stéréomicroscope), afin de lancer une nouvelle culture et on jette tous les autres vers. E. albidus s'élève facilement sur des matières organiques très diverses (voir Appendice 4). Le cycle de vie d'E. albidus est court: il met entre 33 jours (à 18 °C) et 74 jours (à 12 °C) à atteindre sa maturité (1). Seules les cultures qui auront pu être maintenues en laboratoire durant au moins cinq semaines (1 génération) sans poser de problème seront utilisées dans l'essai.
|
|
16.
|
D'autres espèces du genre Enchytraeus conviennent également, par exemple E. buchholzi, Vejdovsky 1879, ou E. crypticus Westheide & Graefe 1992 (voir Appendice 5). Si on utilise d'autres espèces ď Enchytraeus, il faut les identifier clairement et justifier ce choix dans le rapport.
|
|
17.
|
Les animaux utilisés dans les essais sont des vers adultes. Il doivent porter des oeufs (points blancs) dans la région du clitellum et mesurer à peu près la même taille (environ 1 cm de long). La synchronisation de la culture d'élevage n'est pas nécessaire.
|
|
18.
|
Si les enchytrées ne sont pas élevés sur un type de sol et dans des conditions (y compris alimentaires) identiques à celles de l'essai final, ils doivent passer par une période d'acclimatation comprise entre 24 heures et 3 jours. Il convient d'acclimater au départ un plus grand nombre d'adultes que ne le requiert l'essai, afin de pouvoir rejeter les individus blessés ou inutilisables pour une autre raison. Au terme de la période d'acclimatation, seuls les vers portant des oeufs et ne manifestant aucun comportement anormal (par exemple, essayant d'échapper du sol) sont sélectionnés pour l'essai. Les vers sont prélevés soigneusement à l'aide d'une pince de bijoutier, de crochets ou d'anses et placés dans une boîte de Petri contenant une petite quantité d'eau douce. À cet effet, il est préférable d'utiliser une eau douce reconstituée, telle que décrite au chapitre C.20 de la présente annexe (Daphnia magna, Essai de reproduction, l'eau désionisée, déminéralisée ou du robinet risquant d'être néfaste aux vers. Les vers sont examinés au stéréomicroscope et tous ceux qui ne portent pas d'oeufs sont éliminés. On veillera à éliminer toutes les mites ou les collemboles qui auraient pu infecter les cultures. Les vers sains qui ne serviront pas à l'essai sont remis dans la culture mère.
|
Préparation des concentrations expérimentales
Substance chimique d'essai hydrosoluble
|
19.
|
Une solution de la substance chimique d'essai dans de l'eau désionisée est préparée en quantité suffisante pour toutes les expériences identiques d'une concentration expérimentale. Il est recommandé d'utiliser la quantité d'eau nécessaire pour obtenir le taux d'humidité requis, à savoir 40 à 60 % de la capacité maximale de rétention d'eau (voir paragraphe 13). Chaque solution de la substance d'essai est mélangée complètement avec un lot du sol préhumidifié, avant d'être introduite dans le récipient expérimental.
|
Substance chimique d'essai non soluble dans l'eau
|
20.
|
Les substances chimiques non solubles dans l'eau mais solubles dans des solvants organiques peuvent être dissoutes dans le plus petit volume possible d'un véhicule approprié (par exemple de l'acétone). Seuls des solvants volatils peuvent être utilisés. Le véhicule est pulvérisé sur, ou mélangé à, une petite quantité, 2,5 g par exemple, de sable quartzique fin. Ensuite, le véhicule est éliminé par évaporation sous une hotte durant au moins une heure. Ce mélange de sable quartzique et de la substance chimique d'essai est ajouté au sol préhumidifié, auquel il sera mélangé complètement après l'ajout de la quantité nécessaire d'eau désionisée pour atteindre l'humidité requise. Le mélange final est introduit dans les récipients expérimentaux.
|
|
21.
|
Pour les substances chimiques peu solubles dans l'eau et les solvants organiques, on mélange l'équivalent de 2,5 g de sable quartzique finement broyé par récipient expérimental à la quantité nécessaire de la substance chimique d'essai pour obtenir la concentration expérimentale voulue. Ce mélange de sable quartzique et de la substance chimique d'essai est ajouté au sol préhumidifié, auquel il sera mélangé complètement après l'ajout de la quantité nécessaire d'eau désionisée pour atteindre l'humidité requise. Le mélange final est réparti entre les récipients expérimentaux. On répète la procédure pour chaque concentration expérimentale et on prépare un témoin approprié.
|
|
22.
|
En principe, les substances ne devraient pas être mises à l'essai à des concentrations supérieures à 1 000 mg/kg de masse sèche de sol. Cependant, certains objectifs expérimentaux particuliers pourront exiger des concentrations supérieures.
|
CONDUITE DES ESSAIS
Groupes traités et témoins
|
23.
|
Pour chaque concentration expérimentale, une quantité de sol d'essai correspondant à 20 g de poids sec est placée dans le récipient expérimental (voir paragraphes 19-21). On prépare également des récipients témoins sans substance chimique d'essai. La nourriture est introduite dans chaque récipient selon les procédures décrites au paragraphe 29. Dix vers choisis au hasard sont assignés à chaque récipient expérimental. Les vers sont soigneusement transférés dans les récipients et déposés à la surface du sol à l'aide de pinces, de crochets ou d'anses, par exemple. Le nombre d'expériences identiques pour les concentrations expérimentales et les témoins dépend de la conception de l'essai (voir paragraphe 34). Les récipients expérimentaux sont placés au hasard dans l'incubateur et leurs emplacements sont modifiés au hasard chaque semaine.
|
|
24.
|
Si la substance chimique d'essai est appliquée à l'aide d'un véhicule, une série de témoins contenant du sable quartzique sur lequel le solvant a été pulvérisé ou auquel le solvant a été mélangé devrait être mise à l'essai parallèlement à la série traitée avec la substance chimique d'essai. La concentration du solvant ou du dispersant devrait être identique à celle utilisée dans les récipients expérimentaux contenant la substance d'essai. Une série de témoins contenant un supplément de sable quartzique (2,5 g par récipient) devrait aussi être mise à l'essai pour les substances administrées conformément à la procédure décrite au paragraphe 21.
|
Conditions expérimentales
|
25.
|
La température expérimentale est de 20 ± 2 °C. Pour dissuader les vers de s'échapper du sol, l'essai est mené sous des cycles réglés de lumière et d'obscurité (de préférence 16 heures de lumière et 8 heures d'obscurité), avec un éclairement de 400 à 800 lux dans la zone des récipients expérimentaux.
|
|
26.
|
Pour vérifier l'humidité du sol, on pèse les récipients au début de l'essai, puis une fois par semaine. La perte de poids est compensée par l'ajout d'une quantité équivalente d'eau désionisée. Remarquons que la perte d'eau peut être réduite par le maintien d'un taux d'humidité de l'air élevé (> 80 %) dans l'incubateur.
|
|
27.
|
Le taux d'humidité et le pH sont à mesurer au début et à la fin de l'essai de détermination de l'ordre de grandeur des concentrations et de l'essai proprement dit. Les mesures doivent être effectuées sur des échantillons de sol traités (à toutes les concentrations) et témoins, préparés et entretenus de la même manière que les cultures expérimentales, mais ne contenant pas de vers. La nourriture ne sera ajoutée à ces échantillons de sol qu'au début de l'essai, afin de faciliter l'activité microbienne, et ce dans des quantités identiques à celles administrées aux cultures expérimentales. Il n'est pas nécessaire d'ajouter plus de nourriture dans ces récipients au cours de l'essai.
|
Alimentation
|
28.
|
On utilisera une nourriture à même de satisfaire aux besoins de la population d'enchytrées. Les flocons d'avoine, de préférence autoclavés avant l'emploi pour éviter une contamination microbienne (un traitement à la chaleur convient également) constituent une nourriture appropriée.
|
|
29.
|
La première fois, on administre la nourriture en mélangeant 50 mg de flocons d'avoine moulus au sol de chaque récipient, avant d'y introduire les vers. Par la suite, la nourriture est dispensée une fois par semaine jusqu'au 21ème jour. Aucune nourriture n'est fournie le 28ème jour, car à cette date les adultes auront été enlevés et les vers juvéniles ne demandent désormais qu'un supplément relativement minime de nourriture. Au cours de l'essai, on introduit 25 mg de flocons d'avoine moulus dans chaque récipient, en les déposant soigneusement à la surface du sol de façon à éviter de blesser les vers. Pour réduire la croissance fongique, on enfouit les flocons d'avoine dans le sol en les recouvrant de petites quantités de sol. Si des restes de nourriture subsistent, on diminue la ration.
|
Conception de l'essai de détermination de l'ordre de grandeur des concentrations
|
30.
|
Si nécessaire, un essai de détermination de l'ordre de grandeur sera mené avec, par exemple, cinq concentrations expérimentales: 0,1, 1,0, 10, 100 et 1 000 mg/kg (masse sèche de sol). Une expérience par concentration et par témoin suffit.
|
|
31.
|
L'essai de détermination de l'ordre de grandeur dure deux semaines. À la fin de l'essai, on évalue la mortalité des vers. Un ver est consigné comme mort s'il ne réagit pas à un stimulus mécanique appliqué à l'extrémité antérieure. Outre le taux de mortalité, il pourrait être utile de disposer d'autres informations pour sélectionner la gamme de concentrations à appliquer dans l'essai proprement dit. Des modifications du comportement des adultes (par exemple, s'ils deviennent incapables de creuser le sol, s'ils restent prostrés contre la paroi en verre du récipient) et de leur morphologie (par exemple, des blessures ouvertes) devraient, par conséquent, aussi être notées, de même que la présence de vers juvéniles. Cette dernière peut être déterminée par la méthode de coloration décrite à l'Appendice 6.
|
|
32.
|
La moyenne géométrique des données de la mortalité donne une idée approximative de la CL50. On établit la gamme de concentrations pour l'essai proprement dit, en supposant que les effets sur la reproduction sont inférieurs à ceux de la CL50 d'un facteur pouvant aller jusqu'à 10. Il ne s'agit toutefois que d'une relation empirique, susceptible de ne pas se vérifier dans des cas particuliers. Les observations supplémentaires effectuées au cours de l'essai de détermination de l'ordre de grandeur, telles que la présence de vers juvéniles, peuvent permettre d'ajuster plus finement la gamme de concentrations expérimentales à appliquer dans l'essai proprement dit.
|
|
33.
|
Pour déterminer la CL50 avec précision, on recommande de conduire l'essai en y incluant au moins quatre expériences identiques par concentration expérimentale et un nombre suffisant de concentrations pour obtenir au moins quatre résultats moyens différents et statistiquement significatifs à ces concentrations. Le cas échéant, un nombre identique de concentrations et d'expériences identiques sera mis à l'essai pour les témoins.
|
Conception de l'essai de reproduction proprement dit
|
34.
|
Trois conceptions, s'appuyant sur les recommandations émises à l'issue d'un essai tournant sont proposées (2):
|
—
|
Pour déterminer la CSEO, tester au moins cinq concentrations formant une série géométrique. Il est recommandé d'inclure quatre expériences identiques par concentration expérimentale et huit témoins. Les concentrations sont espacées d'un facteur n'excédant pas 1,8.
|
|
—
|
Pour déterminer la CEx (CE10, CE50, par exemple), tester au moins cinq concentrations couvrant la CEx, de façon à interpoler la CEx au lieu de l'extrapoler. Il est recommandé d'inclure au moins quatre expériences identiques par concentration expérimentale et quatre témoins identiques. Le facteur d'espacement peut varier: il est inférieur ou égal à 1,8 dans la gamme censée produire un effet et supérieur à 1,8 aux concentrations supérieures et inférieures.
|
|
—
|
Une approche combinée permet de déterminer à la fois la CSEO et la CEx. Pour ce faire, on utilise huit concentrations formant une série géométrique. Il est recommandé d'inclure quatre expériences identiques par concentration et huit témoins. Les concentrations sont espacées d'un facteur n'excédant pas 1,8.
|
|
|
35.
|
Chaque récipient expérimental contient dix vers adultes (voir paragraphe 23). La nourriture est déposée dans les récipients expérimentaux au début de l'essai, puis une fois par semaine (voir paragraphe 29) jusqu'au 21ème jour inclus. Le 21ème jour, on prélève soigneusement à la main les échantillons de sol, afin d'observer et de compter les vers adultes vivants et de recenser leurs éventuels changements de comportement (incapacité de creuser le sol, prostration contre la paroi en verre du récipient expérimental, par exemple) et de morphologie (blessures ouvertes, par exemple). Tous les vers adultes sont ensuite retirés des récipients expérimentaux et du sol d'essai. Le sol d'essai renfermant des cocons est incubé durant trois semaines supplémentaires dans les mêmes conditions expérimentales, à ceci près que la nourriture n'est administrée que le 35ème jour (25 mg de flocons d'avoine moulus par récipient).
|
|
36.
|
Après six semaines, les vers éclos sont comptés. On recommande d'appliquer la méthode de coloration au rouge de Bengale (voir Appendice 6), bien que d'autres techniques d'extraction et de flottation par voie humide (mais sans chauffage) (voir Appendice 6) aient également fait leurs preuves (4)(10)(11)(20). La coloration au rouge de Bengale est recommandée car l'extraction par voie humide à partir d'un sol peut être gênée par la turbidité causée par les particules d'argile en suspension.
|
Essai limite
|
37.
|
Si la concentration la plus élevée (1 000 mg/kg) de l'essai de détermination de l'ordre de grandeur n'engendre aucun effet, l'essai de reproduction peut être conduit comme un essai limite, à la dose de 1 000 mg/kg pour démontrer que la CSEO sur la reproduction est supérieure à cette valeur.
|
Résumé et calendrier de l'essai
|
38.
|
Les étapes de l'essai peuvent se résumer comme suit:
|
Calendrier
|
Essai de détermination de l'ordre de grandeur des concentrations
|
Essai proprement dit
|
|
Jour –7 ou précédents
|
|
—
|
Préparer le sol artificiel (mélanger les ingrédients secs)
|
|
|
—
|
Préparer le sol artificiel (mélanger les ingrédients secs)
|
|
|
Jour –5
|
|
—
|
Vérifier le pH du sol artificiel
|
|
—
|
Mesurer la capacité de rétention d'eau maximale du sol
|
|
|
—
|
Vérifier le pH du sol artificiel
|
|
—
|
Mesurer la capacité de rétention d'eau maximale du sol
|
|
|
Jour –5 à –3
|
|
—
|
Trier les vers en vue de leur acclimatation
|
|
|
—
|
Trier les vers en vue de leur acclimatation
|
|
|
Jour -3 à 0
|
|
—
|
Acclimater les vers durant au moins 24 heures
|
|
|
—
|
Acclimater les vers durant au moins 24 heures
|
|
|
Jour –1
|
|
—
|
Préhumidifier le sol artificiel et le diviser en lots
|
|
|
—
|
Préhumidifier le sol artificiel et le diviser en lots
|
|
|
Jour 0
|
|
—
|
Préparer les solutions mères
|
|
—
|
Appliquer la substance chimique d'essai
|
|
—
|
Peser le substrat expérimental dans les récipients expérimentaux
|
|
—
|
Y incorporer à la nourriture
|
|
—
|
Mesurer le pH et le taux d'humidité du sol
|
|
|
—
|
Préparer les solutions mères
|
|
—
|
Appliquer la substance chimique d'essai
|
|
—
|
Peser le substrat expérimental dans les récipients expérimentaux
|
|
—
|
Y incorporer la nourriture
|
|
—
|
Mesurer le pH et le taux d'humidité du sol
|
|
|
Jour 7
|
|
—
|
Vérifier le taux d'humidité du sol
|
|
|
—
|
Vérifier le taux d'humidité du sol
|
|
—
|
Administrer la nourriture
|
|
|
Jour 14
|
|
—
|
Déterminer la mortalité adulte
|
|
—
|
Estimer le nombre de vers juvéniles
|
|
—
|
Mesurer le pH et le taux d'humidité du sol
|
|
|
—
|
Vérifier le taux d'humidité du sol
|
|
—
|
Administrer la nourriture
|
|
|
Jour 21
|
|
|
—
|
Observer le comportement des adultes
|
|
—
|
Déterminer la mortalité adulte
|
|
—
|
Vérifier le taux d'humidité du sol
|
|
—
|
Administrer la nourriture
|
|
|
Jour 28
|
|
|
—
|
Vérifier le taux d'humidité du sol
|
|
—
|
Ne pas administrer de nourriture
|
|
|
Jour 35
|
|
|
—
|
Vérifier le taux d'humidité du sol
|
|
—
|
Administrer la nourriture
|
|
|
Jour 42
|
|
|
—
|
Compter les vers juvéniles
|
|
—
|
Mesurer le pH et le taux d'humidité du sol
|
|
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
39.
|
La présente méthode d'essai ne prescrit aucune démarche statistique stricte pour analyser les résultats de l'essai, bien que l'Appendice 7 en présente les grandes lignes.
|
|
40.
|
Dans l'essai de détermination de l'ordre de grandeur, le principal effet observé est la mortalité. Les changements comportementaux (par exemple, l'incapacité de creuser le sol; la prostration contre la paroi du récipient expérimental) ou morphologiques (par exemple des blessures ouvertes) chez les vers adultes doivent néanmoins aussi être enregistrés, de même que la présence de vers juvéniles. Il faut normalement appliquer l'analyse probit (21) ou la régression logistique pour déterminer la CL50. Toutefois, dans les cas où cette méthode d'analyse ne convient pas (par exemple si l'on obtient moins de trois concentrations engendrant une mortalité partielle), d'autres méthodes peuvent être utilisées, notamment les moyennes mobiles (22), la méthode de Spearman-Karber simplifiée (23) ou une simple interpolation (par exemple la moyenne géométrique de la CL0 et de la CL100, calculée en multipliant la racine carrée de la CL0 par la CL100).
|
|
41.
|
Dans l'essai proprement dit, l'effet observé est la fécondité (c'est-à-dire le nombre de vers juvéniles produits). Néanmoins, comme dans l'essai de détermination de l'ordre de grandeur, tous les autres signes de nocivité doivent être consignés dans le rapport final. Pour calculer les résultats de la reproduction, il faut connaître la moyenne arithmétique et l'écart-type par traitement et par témoin afin d'effectuer l'analyse statistique.
|
|
42.
|
Si on a pratiqué une analyse de la variance, l'écart-type, s, et les degrés de liberté, dl, peuvent être remplacés respectivement par l'estimation de la variance “fusionnée” obtenue par analyse de la variance (ANOVA) et par ses degrés de liberté, à condition que la variance ne dépende pas de la concentration. Dans ce cas, on utilisera les variances uniques des témoins et des échantillons traités. On calcule généralement ces valeurs à l'aide d'un logiciel statistique commercial, en utilisant les résultats par récipient comme des expériences identiques. Si la fusion des résultats relatifs aux témoins négatifs et au(x) témoin(s) contenant le solvant semble plus pertinente que de calculer les résultats de l'essai comparativement à l'un de ces deux témoins, il faudra vérifier à l'aide d'un test qu'ils ne présentent pas de différence significative (pour les tests appropriés, voir au paragraphe 45 et à l'Appendice 7).
|
|
43.
|
Si les résultats des expériences identiques présentent une distribution normale et des variances homogènes, d'autres tests statistiques et déductions pourront être effectués.
|
Estimation de la CSEO
|
44.
|
Il est préférable d'appliquer des tests puissants. Il faudrait savoir si les données ont une distribution à peu près normale, en se reportant, par exemple, aux expériences précédentes (essais tournants) ou à d'autres données antérieures. L'homogénéité de la variance est plus déterminante. On a constaté empiriquement que la variance s'accroît souvent lorsque la moyenne s'accroît. Dans ce cas, une transformation des données pourrait déboucher sur l'homogénéité de la variance. Néanmoins, cette transformation devrait s'appuyer sur des données antérieures plutôt que sur les données en cours d'étude. En présence de données homogènes, il faudrait recourir à des tests t de comparaison multiple, tels que le test de Williams (α= 0,05, unilatéral) (24)(25), ou, dans certains cas, le test de Dunnett (26)(27). Remarquons que, dans le cas d'une reproduction inégale, les valeurs de t en tableau doivent être corrigées, comme l'ont suggéré Dunnett et Williams. En présence d'une variation importante, il peut arriver que la croissance ou la décroissance des résultats ne soit pas régulière. Avec un tel écart à la monotonicité, le test de Dunnett est plus approprié. Si la variance n'est pas homogène, il peut être utile d'examiner de plus près les répercussions possibles sur la variance afin de déterminer si les tests t peuvent être appliqués sans perdre beaucoup en puissance (28). Sinon, un test U de comparaison multiple, par exemple un test U de Bonferroni selon Holm (29), ou, si ces données présentent une variance hétérogène, mais concordent par ailleurs avec une relation dose-effet sous-jacente monotone, un autre test non paramétrique [par exemple un test de Jonckheere-Terpstra (30)(31) ou de Shirley (32)(33)] peuvent être appliqués et sont généralement préférables aux tests t à variance inégale. (voir aussi le schéma exposé à l'Appendice 7).
|
|
45.
|
Si un essai limite a été conduit et que les conditions requises par les tests paramétriques (normalité, homogénéité) sont remplies, le test t de Student en paire peut être utilisé ou, sinon, le test U de Mann-Whitney (29).
|
Estimation de la CEx
|
46.
|
Pour calculer une quelconque valeur de CEx, on utilise la moyenne par traitement dans l'analyse de la régression (linéaire ou non linéaire), après avoir obtenu une fonction dose-effet appropriée. S'agissant de la croissance des vers considérée comme une réponse continue, les valeurs de la CEx peuvent être estimées à l'aide d'une analyse de la régression adéquate (35). Les fonctions appropriées aux résultats épousant une valeur de tout ou rien (mortalité/survie et nombre de descendants produits) sont les fonctions sigmoïdes normales, logistiques ou de Weibull, à deux ou quatre paramètres, dont certaines peuvent aussi modéliser des réponses hormétiques. Si la fonction dose-effet a été ajustée par une analyse de la régression linéaire, il faudrait trouver un r2 (coefficient de détermination) et/ou une pente significatifs avant d'estimer la CEx en insérant une valeur correspondant à x % de la moyenne du témoin dans l'équation obtenue par l'analyse de la régression. Des limites de confiance à 95 % sont calculées selon la méthode de Fieller (mentionnée par Finney (21)) ou par une autre méthode récente appropriée.
|
|
47.
|
Sinon, la réponse est modélisée comme un pourcentage ou une proportion du paramètre du modèle, paramètre qui est interprété comme le résultat moyen du témoin. Dans ce cas, la courbe sigmoïde normale (logistique, Weibull) peut souvent être facilement ajustée aux résultats à l'aide de la régression probit (21). Dans ce cas, la fonction de pondération doit être ajustée pour les résultats métriques selon Christensen (36). Cependant, si on observe une hormèse, l'analyse probit doit être remplacée par une fonction logistique ou de Weibull à quatre paramètres, ajustée par une régression non linéaire (36). S'il est impossible d'ajuster une fonction dose-effet appropriée aux données, d'autres méthodes peuvent être utilisées pour estimer la CEx et ses limites de confiance, telles que les moyennes mobiles d'après Thompson (22) et la méthode simplifiée de Spearman-Karber (23).
|
RAPPORT D'ESSAI
|
48.
|
Le rapport d'essai doit contenir les informations suivantes:
|
|
Substance chimique d'essai:
|
—
|
état physique et, s'il y a lieu, propriétés physico-chimiques (par exemple hydrosolubilité, pression de vapeur);
|
|
—
|
identification chimique de la substance chimique d'essai selon la nomenclature de l'IUPAC, numéro CAS, lot de fabrication, lot de conditionnement, formule structurale et pureté.
|
|
—
|
date d'expiration de l'échantillon.
|
|
|
|
Espèce d'expérience
|
—
|
animal d'expérience utilisé: espèce, nom scientifique, source et conditions d'élevage.
|
|
|
|
Conditions expérimentales:
|
—
|
ingrédients et préparation du sol artificiel;
|
|
—
|
méthode d'application de la substance chimique d'essai;
|
|
—
|
description des conditions expérimentales, notamment la température, le taux d'humidité, le pH, etc.;
|
|
—
|
description complète de la conception de l'essai et du mode opératoire.
|
|
|
|
Résultats de l'essai:
|
—
|
mortalité des vers adultes après deux semaines et nombre de vers juvéniles à la fin de l'essai de détermination de l'ordre de grandeur;
|
|
—
|
mortalité des vers adultes après trois semaines d'exposition et recensement complet des vers juvéniles à la fin de l'essai proprement dit;
|
|
—
|
tout symptôme physique ou pathologique et changement comportemental observé chez les organismes d'expérience;
|
|
—
|
CL50, CSEO et/ou CEx (par exemple CE50, CE10) pour la reproduction si certaines d'entre elles sont applicables avec des intervalles de confiance et représentation graphique du modèle ajusté utilisé pour leur calcul, toutes les informations et observations utiles à l'interprétation des résultats.
|
|
Écarts par rapport aux procédures décrites dans la présente méthode d'essai et faits inhabituels survenus au cours de l'essai.
|
BIBLIOGRAPHIE
|
(1)
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen — Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke, J. and Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 pp.
|
|
(3)
|
Westheide, W. and Bethge Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, In: Modern Ecology: Basic and Applied Aspects. Ed. by Esser, G. and Overdieck, D. pp 497-508. Elsevier, Amsterdam,
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(5)
|
Chapitre C.8 de la présente annexe, Toxicité pour les vers de terre.
|
|
(6)
|
ISO (Organisation internationale de normalisation) (1993). Qualité du sol — Effets des polluants vis-à-vis des vers de terre (Eisenia fetida) Partie 1: Détermination de la toxicité aiguë en utilisant des substrats de sol artificiel. No 11268-1. ISO, Genève.
|
|
(7)
|
ISO (Organisation internationale de normalisation) (1996). Qualité du sol — Effets des polluants vis-à-vis des vers de terre (Eisenia fetida) Partie 2: Détermination des effets sur la reproduction. No 11268-2. ISO, Genève.
|
|
(8)
|
Rundgren, S. and A.K. Augustsson (1998). Test on the enchytraeid Cognettia shagnetorum (Vejdovsky 1877). In: Løkke, H. and C.A.M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73-94.
|
|
(9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217-232.
|
|
(10)
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF — Z. Umweltchem. Ökotox. 7, 246-249.
|
|
(11)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
(12)
|
Didden, W.A.M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2-29.
|
|
(13)
|
Becker, H. (1991). Bodenorganismen — Prüfungskategorien der Forschung. UWSF — Z. Umweltchem. Ökotox. 3, 19-24.
|
|
(14)
|
Römbke, J. and Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79-96.
|
|
(15)
|
Römbke, J., Riepert, F. & Achazi R. (2000): Enchytraeen als Testorganismen. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(16)
|
ISO (Organisation internationale de normalisation) (1994). Qualité du sol — Détermination du pH. n0 10390. ISO, Genève.
|
|
(17)
|
Bell, A.W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1-13.
|
|
(18)
|
Nielsen, C.O. and Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1-160.
|
|
(19)
|
Bouguenec, V. and Giani, N. (1987). Deux nouvelles espèces d'Enchytraeus (Oligochaeta, Enchytraeidae) et redescription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9-22.
|
|
(20)
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(21)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(22)
|
Finney, D.J. (1978). Statistical method in Biological Assay. Charles Griffin & Company Ltd, London.
|
|
(23)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(24)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(25)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(26)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(27)
|
Dunnett, C.W., (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(28)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361.
|
|
(29)
|
Holm, S., (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(30)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(31)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(32)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(33)
|
Williams, D.A. (1986). A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(34)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(35)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(36)
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Appendice 1
Définitions
Les définitions suivantes s'appliquent aux fins de la présente méthode d'essai:
Substance chimique
: une substance ou un mélange.
CEx
(concentration efficace à x %): concentration qui engendre un effet de x % sur les organismes d'expérience durant une période d'exposition déterminée, en comparaison avec un témoin. Dans cet essai, les concentrations efficaces sont exprimées en masse de substance chimique d'essai par masse sèche de sol expérimental.
CL0
(concentration non létale): concentration d'une substance chimique d'essai qui ne tue aucun des organismes d'expérience exposés durant une période déterminée. Dans cet essai, la CL0 s'exprime en masse de substance chimique d'essai par masse sèche de sol expérimental.
CL50
(concentration létale moyenne): concentration d'une substance chimique d'essai qui entraîne la mort de 50 % des organismes d'expérience exposés durant une période déterminée. Dans cet essai, la CL50 s'exprime en masse de substance chimique d'essai par masse sèche de sol expérimental.
CL100
(concentration totalement létale): concentration d'une substance chimique d'essai qui entraîne la mort de 100 % des organismes d'expérience exposés durant une période déterminée. Dans cet essai, la CL100 s'exprime en masse de substance chimique d'essai par masse sèche de sol expérimental.
CMEO (concentration minimale avec effet observé): la plus faible concentration de la substance chimique d'essai qui exerce un effet statistiquement significatif (p < 0,05). Dans cet essai, la CMEO s'exprime en masse de substance chimique d'essai par masse sèche de sol expérimental. Toutes les concentrations expérimentales supérieures à la CMEO doivent normalement produire un effet statistiquement différent du résultat observé sur le témoin. Tous les écarts à ce qui précède dans la détermination de la CMEO doivent être justifiés dans le rapport d'essai.
CSEO (concentration sans effet observé): la plus haute concentration de la substance chimique d'essai directement inférieure à la CMEO et à laquelle aucun effet n'est observé. Dans cet essai, la concentration correspondant à la CSEO n'a pas d'effet statistiquement significatif (p < 0,05) durant une période d'exposition donnée, en comparaison avec le témoin.
Taux de reproduction
: rapport du nombre moyen de vers juvéniles produits par le nombre d'adultes durant la période de l'essai.
Substance chimique d'essai
: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
Appendice 2
Détermination de la capacité maximale de rétention d'eau
Détermination de la capacité de rétention d'eau du sol artificiel
La méthode suivante a fait ses preuves. Elle est décrite à l'annexe C de la norme ISO DIS 11268-2
Prélevez une quantité déterminée (5 g, par exemple) du sol expérimental servant de substrat à l'aide d'un instrument approprié (tarière, etc.). Couvrez le fond de la tarière avec un morceau de papier filtre et, après l'avoir remplie d'eau, placez-la sur un support dans un bain d'eau. La tarière doit être progressivement submergée jusqu'à ce que le niveau d'eau dépasse le sommet de la carotte de sol. Laissez la tarière dans l'eau durant environ trois heures. Comme l'eau absorbée par les capillaires du sol ne peut pas être retenue en totalité, laissez l'échantillon de sol dégorger durant deux heures en plaçant le tube sur un lit de sable quartzique fin très humide contenu dans un récipient fermé (pour empêcher le séchage). Pesez l'échantillon et séchez-le à 105 °C jusqu'à ce qu'il atteigne une masse constante. La capacité de rétention d'eau (CRE) se calcule comme suit:
où:
|
S
|
=
|
masse du substrat saturé en eau + masse de la tarière + masse du papier filtre
|
|
T
|
=
|
tare (masse de la tarière + masse du papier filtre)
|
|
D
|
=
|
masse sèche du substrat
|
RÉFÉRENCES:
ISO (Organisation internationale de normalisation) (1996). Qualité du sol — Effets des polluants vis-à-vis des vers de terre (Eisenia fetida) Partie 2: Détermination des effets sur la reproduction. No 11268-2. ISO, Genève.
Appendice 3
Détermination du pH du sol
La méthode de détermination du pH d'un échantillon de sol, décrite ci-dessous, s'appuie sur la norme ISO 10390 (Qualité du sol — Détermination du pH).
Laissez sécher une quantité définie de sol à température ambiante durant au moins 12 heures. Confectionnez une suspension du sol (contenant au moins 5 g de sol) dans cinq fois le volume du sol soit d'une solution de chlorure de potassium (KCl) 1 M de qualité pour analyse, soit d'une solution de chlorure de calcium (CaCl2) 0,01 M de qualité pour analyse. Agitez énergiquement la suspension durant cinq minutes. Laissez reposer la suspension durant au moins deux heures, mais pas plus de 24 heures. Mesurez le pH de la phase liquide à l'aide d'un pH-mètre, étalonné avant chaque mesure avec une série appropriée de solutions tampons (pH 4,0 et 7,0, par exemple).
RÉFÉRENCES:
ISO (Organisation internationale de normalisation) (1994). Qualité du sol — Détermination du pH. No 10390. ISO, Genève.
Appendice 4
Conditions de culture d'Enchytraeus sp.
Les enchytrées de l'espèce Enchytraeus albidus (ainsi que d'autres espèces ď Enchytraeus) peuvent être cultivés dans de grandes boîtes en plastique (30 × 60 × 10 cm, par exemple) garnies d'un mélange 1/1 de sol artificiel et de sol naturel de jardin non contaminé. L'emploi de compost, qui risque de contenir des substances chimiques toxiques, telles que des métaux lourds, est à éviter. La faune doit être éliminée du sol avant utilisation de ce dernier (par congélation, par exemple). Un substrat composé uniquement de sol artificiel peut être utilisé, mais le taux de reproduction risque d'être inférieur à celui obtenu avec un sol mixte. Le substrat destiné à la culture doit avoir un pH de 6,0 ± 0,5.
La culture est gardée à l'obscurité à une température de 15 à 20 °C ± 2 °C. La température ne devrait pas dépasser 23 °C. Le sol doit rester humide sans s'engorger. L'humidité du sol est correcte si, lorsqu'on presse doucement une poignée de sol dans une main, de petites gouttes d'eau perlent entre les doigts. On évitera de créer des conditions anoxiques en s'assurant que les couvercles des récipients de culture autorisent suffisamment d'échanges gazeux avec l'atmosphère. Il faudrait retourner soigneusement le sol chaque semaine pour favoriser l'aération.
Les vers peuvent être nourris avec des flocons d'avoine. Les flocons doivent être conservés dans des récipients hermétiquement fermés, et autoclavés ou chauffés avant l'emploi afin de prévenir une infestation par des mites de la farine (Glyzyphagus sp., Astigmata, Acarina, par exemple) ou des mites prédatrices [(Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina, par exemple)]. Après avoir été chauffés, les flocons doivent être moulus de façon à pouvoir être facilement parsemés à la surface du sol. De temps à autre, la ration de flocons d'avoine pourra être enrichie de vitamines, de lait et d'huile de foie de morue. D'autres aliments, tels que la levure de boulanger et la nourriture pour poissons “Tetramin”, conviennent également.
La ration alimentaire est administrée environ deux fois par semaine. Une quantité appropriée de flocons d'avoine est répandue à la surface du sol ou délicatement mélangée au substrat lorsqu'on remue le sol pour favoriser l'aération. La quantité absolue de nourriture fournie dépend du nombre de vers peuplant le substrat. À titre indicatif, la ration doit être augmentée si elle est entièrement consommée le jour où elle a été donnée. Par contre, si des restes de nourriture subsistent encore à la surface du sol lors de l'administration de la deuxième ration (une semaine plus tard), la ration doit être diminuée. La nourriture contaminée par des champignons doit être enlevée et remplacée. Après trois mois, les vers sont transférés dans un substrat fraîchement préparé.
Les conditions de culture sont jugées satisfaisantes si les vers: a) ne tentent pas de quitter le substrat, b) se déplacent rapidement dans le sol, c) présentent une surface extérieure brillante sur laquelle les particules de sol n'adhèrent pas, d) ont une couleur plus ou moins blanchâtre, e) présentent diverses tranches d'âge et f) se reproduisent continuellement.
Appendice 5
Conduite de l'essai avec d'autres espèces d'Enchytraeus
Sélection des espèces
Il est possible d'utiliser d'autres espèces qu'E. albidus, mais le mode opératoire et les critères de validité doivent être adaptés en conséquence. Comme de nombreuses espèces d'Enchytraeus sont faciles à se procurer et supportent bien les conditions de laboratoire, le critère le plus important pour sélectionner une espèce autre qu'E. albidus, est sa pertinence écologique et, d'autre part, sa sensibilité comparable. On est parfois obligé d'utiliser une autre espèce d'Enchytraeus; par exemple, dans les pays où E. albidus est absent et impossible à importer (en raison de restrictions imposées par une quarantaine, par exemple).
Exemples d'autres espèces appropriées
|
—
|
Enchytraeus crypticus (Westheide & Graefe, 1992): Ces dernières années, cette espèce a souvent été utilisée dans des études écotoxicologiques en raison de sa facilité d'élevage et de mise à l'essai. Néanmoins, elle est petite, ce qui la rend plus difficile à manipuler qu'E. albidus (en particulier aux stades précédant l'emploi de la méthode de coloration). L'existence d'E. crypticus dans la nature n'est pas certaine, cette espèce n'ayant été décrite que dans les cultures de lombrics. Aussi, ses besoins écologiques sont-ils inconnus.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky, 1879): Ce nom recouvre probablement un groupe d'espèces très proches, difficiles à distinguer sur le plan morphologique. Son usage à des fins expérimentales est déconseillé si les individus destinés à l'essai ne peuvent être identifiés jusqu'au niveau de l'espèce. E. buchholzi fréquente habituellement les prairies et des sites dérangés tels que les bords de routes.
|
|
—
|
Enchytraeus luxuriosus: Dénommée à l'origine E. minutus, cette espèce a été décrite récemment (1). Elle a été découverte pour la première fois par U. Graefe (Hambourg) dans une prairie proche de St. Peter-Ording (Schleswig-Holstein, Allemagne). E. luxuriosus atteint environ la moitié de la taille d'E. albidus, mais est plus grand que les autres espèces décrites ici, ce qui pourrait en faire un bon remplaçant d'E. albidus.
|
|
—
|
Enchytraeus bulbosus (Nielsen & Christensen, 1963): Jusqu'à présent, la présence de cette espèce a été signalée dans des sols minéraux allemands et espagnols, où elle est commune, mais généralement pas très abondante. En comparaison avec d'autres petites espèces de ce genre, elle est relativement facile à identifier. On ne sait rien de son comportement dans des essais de laboratoire, ni de sa sensibilité aux produits chimiques. Néanmoins, elle s'est avérée facile à cultiver (E. Belotti, communication personnelle).
|
Conditions d'élevage
Toutes les espèces d'Enchytraeus susmentionnées peuvent être cultivées sur les mêmes substrats qu'E. albidus. Comme elles sont plus petites, elles peuvent être cultivées dans des récipients plus petits et recevoir une ration alimentaire de la même composition, mais plus réduite. Ces espèces ayant un cycle de vie plus court qu'E. albidus, elles doivent être nourries plus fréquemment.
Conditions expérimentales
Les conditions expérimentales sont généralement identiques à celles qui s'appliquent à E. albidus, à ceci près que:
|
—
|
la dimension des récipients expérimentaux peut (mais ne doit pas) être inférieure;
|
|
—
|
la durée de l'essai de reproduction peut (mais ne doit pas) être plus courte, c'est-à-dire quatre au lieu de six semaines, mais la durée de l'essai de détermination de l'ordre de grandeur ne doit pas être modifiée;
|
|
—
|
compte tenu de la petitesse des vers juvéniles, l'utilisation de la méthode de coloration est fortement recommandée pour le comptage;
|
|
—
|
le critère de validité relatif au “nombre de vers juvéniles par récipient témoin” doit être porté à “50”.
|
RÉFÉRENCES
|
(1).
|
Schmelz, R.M. and Collado, R. (1999). Enchytraeus luxuriosus sp. nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93-100.
|
Appendice 6
Description détaillée des techniques d'extraction
Coloration au rouge de Bengale
Cette méthode, développée à l'origine en écologie limnique (1) a été proposée la première fois pour le dénombrement des enchytrées juvéniles dans un essai de reproduction des enchytrées par W. de Coen (Université de Gand, Belgique). Une version modifiée (rouge de Bengale mélangé avec du formaldéhyde au lieu de l'éthanol) a été mise au point indépendamment par le RIVM (Bilthoven, Pays-Bas) (2)(3).
À la fin de l'essai proprement dit (après six semaines), le sol des récipients expérimentaux est transféré dans un récipient peu profond. Un récipient Bellaplast ou une cuve de développement photographique munie d'un fond strié sont utiles à cet effet, et ce, dans le cas de la cuve, parce que les stries restreignent le mouvement des vers dans le champ d'observation. Les vers juvéniles sont fixés avec de l'éthanol (environ 5 ml par expérience identique). Ensuite, les récipients sont remplis d'eau sur une hauteur de 1 à 2 cm. On ajoute quelques gouttes (200 à 300μl) de rouge de Bengale (solution à 1 % dans de l'éthanol) ou d'une solution d'éosine à 0,5 % et les deux composés sont soigneusement mélangés. Après 12 heures, les vers devraient présenter une coloration rougeâtre et être faciles à compter car ils reposeront à la surface du substrat. Une autre possibilité consiste à tamiser le mélange substrat/alcool (dimension des mailles: 0,250 mm) avant le comptage des vers. De cette manière, la kaolinite, la tourbe et une partie du sable seront évacuées à travers le tamis et les vers colorés en rouge seront plus faciles à voir et à compter. L'utilisation de loupes éclairées (dimension des lentilles: au moins 100 × 75 mm, avec un facteur d'agrandissement de 2 à 3) facilitera également le comptage.
La technique de coloration réduit la durée du comptage à quelques minutes par récipient et, à titre indicatif, une seule personne devrait pouvoir évaluer tous les récipients d'un essai en deux jours maximum.
Extraction par voie humide
L'extraction par voie humide doit être pratiquée immédiatement après la fin de l'essai. Le sol de chaque récipient expérimental est versé dans des tamis en plastique dont les trous mesurent environ 1 mm. Les tamis sont ensuite suspendus dans des bols en plastique sans toucher le fond. On verse doucement de l'eau dans les bols jusqu'à ce que les échantillons contenus dans les tamis soient complètement submergés. Pour obtenir un taux de récupération de plus de 90 % des vers présents, la période d'extraction doit durer 3 jours à 20 ± 20C. À la fin de la période d'extraction, on enlève les tamis et on laisse l'eau décanter lentement (exception faite d'une petite quantité), en prenant soin de ne pas remuer le sédiment au fond des bols. Ensuite, on agite légèrement les bols en plastique pour suspendre le sédiment dans l'eau sus-jacente. L'eau est transférée dans une boîte de Petri et, après le dépôt des particules de sol, les enchytrées peuvent être identifiés, enlevés et comptés sous un stéréomicroscope, à l'aide de pinces souples en acier.
Flottation
Une méthode fondée sur la flottation a été décrite dans une note rédigée par R. Kuperman (4). Après avoir fixé le contenu du récipient expérimental avec de l'éthanol, on submerge le sol en versant du Ludox (silice colloïdale AM-30, suspension aqueuse à 30 % en poids) jusqu'à une hauteur de 10 à 15 mm au-dessus de la surface du sol. Après que le sol a été bien mélangé à l'agent de flottation durant 2 à 3 minutes, les vers juvéniles flottant à la surface se comptent aisément.
RÉFÉRENCES
|
(1)
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R.P.M. en Dirven-Van Breemen, E.M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108-121.
|
|
(4)
|
Phillips, C.T., Checkai, R.T. and Kuperman, R.G. (1998). An alternative to the OConnor Method for Extracting Enchytraeids from soil. SETAC 19th Annual Meeting, Charlotte, USA. Abstract Book No. PMP069, p. 157.
|
Appendice 7
Description schématique de l'évaluation statistique des résultats (détermination de la CSEO)

C.33. ESSAI DE REPRODUCTION CHEZ LE LOMBRIC (EISENIA FETIDA /EISENIA ANDREI)
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 222 (2004) de l'OCDE pour les essais de produits chimiques. Elle est destinée à évaluer les effets des substances chimiques dans le sol sur le taux de reproduction (et sur d'autres critères sub-létaux) de deux espèces de lombric: Eisenia fetida (Savigny 1826) ou Eisenia andrei (Andre 1963) (1)(2). Cet essai a fait l'objet d'un essai tournant (3). Une méthode d'essai existe pour les essais de toxicité aiguë sur le ver de terre (4). Plusieurs autres lignes directrices nationales et internationales pour les essais de toxicité aiguë et chronique sur le lombric ont été publiées (5)(6)(7)(8).
|
|
2.
|
Eisenia fetida et Eisenia andrei sont considérés comme des représentants de la pédofaune et des vers de terre en particulier. Il existe des informations de référence sur l'écologie des vers de terre et leur utilisation dans les essais d'écotoxicité (7)(9)(10)(11)(12).
|
PRINCIPE DE L'ESSAI
|
3.
|
Les vers adultes sont exposés à une série de concentrations de la substance chimique d'essai, soit mélangée au sol, soit, dans le cas des pesticides, appliquée dans ou sur le sol selon des procédures imitant le mode d'emploi de la substance. La méthode d'application dépend de la finalité de l'essai. La gamme de concentrations choisie doit couvrir les concentrations susceptibles de provoquer des effets à la fois sublétaux et létaux sur une période de huit semaines. La mortalité et les effets sur la croissance des vers adultes sont déterminés après quatre semaines d'exposition. Ensuite, les adultes sont extraits du sol et on évalue les effets sur la reproduction à l'issue des quatre semaines suivantes en comptant le nombre de descendants présents dans le sol. On compare le taux de reproduction des vers exposés à la substance chimique d'essai à celui du (des) témoin(s), afin de déterminer i) la concentration sans effet observé (CSEO) et/ou ii) la CEx (par exemple CE10, EC50), en utilisant un modèle de régression pour estimer la concentration qui entraînerait une réduction de x % du taux de reproduction. Les concentrations expérimentales doivent couvrir la CEx (CE10, CE50, par exemple) de façon à ce que la CEx soit interpolée plutôt qu'extrapolée (voir les définitions à l'Appendice 1).
|
INFORMATIONS SUR LA SUBSTANCE CHIMIQUE D'ESSAI
|
4.
|
Il faudrait connaître les informations suivantes sur la substance chimique d'essai pour pouvoir définir le mode opératoire approprié:
|
—
|
si possible, données sur le devenir et le comportement dans l'environnement (par exemple, vitesse de photolyse et d'hydrolyse si ces paramètres sont pertinents au regard du mode d'application de la substance d'essai).
|
|
|
5.
|
La présente méthode d'essai s'applique à toutes les substances chimiques, indépendamment de leur solubilité dans l'eau. La méthode ne convient pas aux substances volatiles, définies ici comme des substances dont la constante de Henry ou le coefficient de partage air/eau sont supérieurs à un, ni aux substances dont la pression de vapeur excède 0,0133 Pa à 25 °C.
|
|
6.
|
La présente méthode d'essai ne tient pas compte de l'éventuelle dégradation de la substance chimique d'essai au cours de l'essai. Par conséquent, il est impossible de garantir que les concentrations d'exposition conserveront leur valeur initiale tout au long de l'essai. Dans ce cas, il est recommandé d'effectuer une analyse chimique de la substance chimique d'essai au début et à la fin de l'essai.
|
SUBSTANCE CHIMIQUE DE RÉFÉRENCE
|
7.
|
Il faut déterminer la CSEO et/ou la CEx d'une substance chimique de référence pour s'assurer que les conditions expérimentales du laboratoire sont adéquates et vérifier que la réaction des organismes d'expérience ne change pas de façon statistiquement significative au fil du temps. Il est conseillé de tester une substance de référence au moins une fois par an, ou, lorsque les essais sont conduits moins fréquemment, parallèlement à la détermination de la toxicité d'une substance chimique d'essai. La carbendazime ou le bénomyl, qui affectent la reproduction, conviennent comme substances de référence (3). Des effets appréciables devraient apparaître entre a) 1 et 5 mg d'ingrédient actif/kg de masse sèche ou b) 250-500 g/ha ou 25-50 mg/m2. Si un étalon toxique positif est inclus dans la série d'essais, on n'applique qu'une seule concentration et un nombre d'expériences identiques égal à celui des témoins.
|
VALIDITÉ DE L'ESSAI
|
8.
|
Les témoins devraient satisfaire aux critères suivants pour que le résultat de l'essai soit considéré comme valide:
|
—
|
chaque expérience identique (sur 10 adultes) aura produit au moins 30 vers juvéniles à la fin de l'essai;
|
|
—
|
le coefficient de variation de la reproduction est ≤ 30 %;
|
|
—
|
la mortalité adulte durant les quatre premières semaines de l'essai est ≤ 10 %.
|
Un essai qui ne remplirait pas les critères de validité susmentionnés doit être abandonné, à moins que la poursuite de l'essai puisse être justifiée. Cette justification doit figurer dans le rapport d'essai.
|
DESCRIPTION DE L'ESSAI
Matériel
|
9.
|
Il convient d'utiliser des récipients expérimentaux en verre ou en un autre matériau chimiquement inerte d'une capacité d'un à deux litres. Les récipients doivent avoir une section horizontale d'environ 200 cm2, de sorte que l'ajout de 500 à 600 g de masse sèche de substrat donne un volume de substrat humide d'une profondeur de 5 à 6 cm. La forme du récipient doit permettre les échanges gazeux entre le substrat et l'atmosphère et laisser passer la lumière (couvercle transparent perforé, par exemple), tout en empêchant la fuite des vers. Si la quantité de substrat utilisée est nettement supérieure à 500 à 600 g par récipient expérimental, le nombre de vers doit être augmenté proportionnellement.
|
|
10.
|
Cet essai requiert du matériel de laboratoire courant, en particulier:
|
—
|
pH-mètre et photomètre;
|
|
—
|
balances suffisamment précises;
|
|
—
|
instruments appropriés permettant de réguler la température;
|
|
—
|
instruments appropriés permettant de réguler l'humidité (pas essentiel si les récipients expérimentaux ont des couvercles);
|
|
—
|
incubateur ou petite chambre équipée d'un conditionnement de l'air;
|
|
—
|
pinces, crochets ou anses;
|
|
Préparation du sol artificiel
|
11.
|
Dans cet essai, on utilise un sol artificiel (5)(7) composé comme suit (en poids secs, séchés à 105 °C jusqu'à obtention d'un poids constant):
|
—
|
10 % de tourbe à sphaigne (pH aussi proche que possible de 5,5-6,0, pas de résidus visibles de plantes, finement broyée, séchée jusqu'à atteindre un taux d'humidité donné, mesuré);
|
|
—
|
20 % d'argile kaolinique (taux de kaolinite de préférence supérieur à 30 %);
|
|
—
|
0,3 à 1,0 % de carbonate de calcium (CaCO3 pulvérisé, de qualité pour analyse) pour obtenir un pH initial de 6,0 ± 0,5;
|
|
—
|
70 % de sable quartzique (selon la quantité de CaCO3 nécessaire) séché à l'air, composé en majorité de sable fin (plus de 50 % des particules mesurent entre 50 et 200 μm).
|
Remarque 1: La quantité de CaCO3 requise dépendra des ingrédients du sol, y compris la nourriture, et devrait être déterminée par des mesures effectuées sur des sous-échantillons de sol immédiatement avant l'essai. Le pH est mesuré sur un échantillon de sol mélangé à une solution 1 M de chlorure de potassium (KCl) ou à une solution 0,01 M de chlorure de calcium (CaCl2)(13).
Remarque 2: Il est possible de réduire la teneur en carbone organique du sol artificiel, par exemple en ramenant le pourcentage de tourbe à 4-5 % et en augmentant le taux de sable en conséquence. Cette réduction de la teneur en carbone organique est susceptible de diminuer les possibilités d'adsorption de la substance chimique d'essai sur le sol (carbone organique) et d'augmenter la disponibilité de la substance chimique d'essai pour les vers. Il a été démontré qu'Eisenia feù'da peut satisfaire aux critères de validité concernant la reproduction lorsqu'il est testé sur le terrain sur des sols dont la teneur en carbone organique est inférieure (2,7 %, par exemple) (14), et on a constaté expérimentalement que ce ver peut aussi satisfaire aux critères de validité lorsqu'il est mis à l'essai sur un sol artificiel renfermant 5 % de tourbe. Par conséquent, avant d'utiliser ce type de sol dans l'essai proprement dit, il n'est pas nécessaire de démontrer que le sol artificiel permet de répondre aux critères de validité, à moins que le taux de tourbe soit inférieur aux valeurs indiquées ci-dessus.
Remarque 3: Lorsqu'on utilise un sol naturel dans un essai supplémentaire (réalisé à un niveau supérieur dans le cadre d'essais séquentiels, par exemple), l'adéquation du sol à la culture des vers et au respect des critères de validité doit aussi être démontrée.
|
|
12.
|
Les ingrédients secs du sol sont mélangés complètement (dans un grand mélangeur de laboratoire, par exemple) dans un endroit bien ventilé. Avant d'entamer l'essai, on humidifiera le sol artificiel sec avec suffisamment d'eau désionisée pour lui conférer environ la moitié de sa teneur finale en eau, à savoir 40 % à 60 % de la capacité maximale de rétention d'eau (équivalant à 50± 10 % d'humidité par masse sèche). De cette manière, on obtient un substrat qui ne rejette pas d'eau libre ou dormante lorsqu'on le presse dans la main. La capacité maximale de rétention d'eau du sol artificiel est déterminée conformément à la procédure décrite à l'Appendice 2, à la norme ISO 11274 (15) ou à la norme UE équivalente.
|
|
13.
|
Si la substance chimique d'essai est appliquée à la surface du sol ou mélangée au sol sans eau, la quantité finale d'eau peut être mélangée au sol artificiel durant la préparation du sol. Si la substance chimique d'essai est mélangée au sol avec une certaine quantité d'eau, l'eau supplémentaire peut être ajoutée en même temps que la substance chimique d'essai (voir paragraphe 19).
|
|
14.
|
Le taux d'humidité du sol est déterminé au début et à la fin de l'essai, conformément à la norme ISO 11465 (16), et le pH du sol, suivant les instructions données à l'Appendice 3, dans la norme ISO 10390 (13) ou dans la norme UE équivalente. Ces déterminations devraient être conduites sur un échantillon de sol témoin et sur un échantillon de sol de chaque concentration de la substance d'essai. Le pH du sol ne doit pas être ajusté lorsque des substances acides ou basiques sont mises à l'essai. Il faudrait vérifier le taux d'humidité tout au long de l'essai en pesant périodiquement les récipients (voir paragraphe 26 et 30).
|
Sélection et préparation des animaux d'essai
|
15.
|
L'espèce utilisée dans cet essai est Eisenia fetida ou Eisenia andrei (1)(2). Au début de l'essai, les vers sont adultes, âgés de deux mois à un an et pourvus d'un clitellum. Les vers devraient provenir d'une culture synchronisée offrant une structure d'âge relativement homogène (Appendice 4). L'âge des individus d'un même groupe d'essai ne devrait pas s'écarter de plus de 4 semaines.
|
|
16.
|
On acclimate les vers sélectionnés pendant au moins un jour dans le type de sol artificiel utilisé pendant l'essai. Durant cette période, les vers reçoivent la même nourriture qu'au cours de l'essai (voir paragraphes 31 à 33).
|
|
17.
|
Les vers sont pesés individuellement et répartis au hasard, par groupes de dix, dans les récipients expérimentaux au début de l'essai. Avant la pesée, on lave les vers avec de l'eau désionisée, puis on les dépose un instant sur un papier filtre pour éponger l'excès d'eau. La masse humide de chaque ver sera comprise entre 250 et 600 mg.
|
Préparation des concentrations expérimentales
|
18.
|
Deux méthodes d'application de la substance chimique d'essai peuvent être utilisées: mélanger la substance d'essai au sol (voir paragraphes 19 à 21) ou l'appliquer à la surface du sol (voir paragraphes 22 à 24). La sélection de la méthode appropriée dépend de la finalité de l'essai. On recommande, en général, de mélanger la substance d'essai au sol. Cependant, il convient parfois de simuler les pratiques agricoles normales (par exemple, la pulvérisation de préparations liquides ou l'utilisation de présentations spéciales de pesticides telles que les granulés ou des produits de traitement des semences). Les solvants choisis pour faciliter le traitement du sol par la substance chimique d'essai seront peu toxiques pour les vers de terre et l'essai inclura un témoin traité au solvant, le cas échéant (voir paragraphe 27).
|
Incorporer la substance chimique d'essai au sol
Substance chimique d'essai hydrosoluble
|
19.
|
Une solution de la substance chimique d'essai dans de l'eau désionisée est préparée juste avant le début de l'essai, en quantité suffisante pour toutes les expériences menées à la même concentration. Il est parfois nécessaire de faciliter la préparation de la solution expérimentale à l'aide d'un co-solvant. On prépare suffisamment de solution pour atteindre le taux d'humidité final (40 à 60 % de la capacité maximale de rétention d'eau). La solution est mélangée complètement au sol avant d'être introduite dans le récipient expérimental
|
Substance chimique d'essai insoluble dans l'eau
|
20.
|
La substance chimique d'essai est dissoute dans un petit volume d'un solvant organique approprié (par exemple de l'acétone), puis pulvérisée sur, ou mélangée à, une petite quantité de sable quartzique fin. Le solvant est ensuite éliminé par évaporation sous une hotte pendant au moins quelques minutes. Le sable traité est alors mélangé complètement au sol artificiel préhumidifié. On ajoute la quantité d'eau désionisée requise pour atteindre le taux d'humidité final, à savoir 40 à 60 % de la capacité maximale de rétention d'eau, en la mélangeant au sol. Après quoi, le sol est prêt à être déversé dans les récipients expérimentaux. On veillera à ce que le solvant ne soit pas toxique pour les vers de terre.
|
Substance chimique d'essai insoluble dans l'eau et dans les solvants organiques
|
21.
|
On prépare un mélange composé de 10 g de sable quartzique industriel finement broyé et de la quantité nécessaire de substance d'essai pour obtenir la concentration expérimentale voulue dans le sol. Ce mélange est ensuite mélangé complètement au sol artificiel préhumidifié. On ajoute la quantité d'eau désionisée requise pour atteindre le taux d'humidité final, à savoir 40 à 60 % de la capacité maximale de rétention d'eau, en la mélangeant au sol. Le sol est alors prêt à être déversé dans les récipients expérimentaux.
|
Application de la substance chimique d'essai à la surface du sol
|
22.
|
Le sol est traité après l'ajout des vers. On verse le sol humidifié dans les récipients expérimentaux avant de déposer les vers, préalablement pesés, à la surface du sol. Normalement, un ver sain s'enfouit immédiatement dans le substrat, si bien que tous les vers subsistant à la surface après 15 minutes seront considérés comme lésés et devront être remplacés. Le cas échéant, les remplaçants et les vers écartés devront être pesés, de telle sorte que le poids vif total du groupe de vers exposés et le poids total du récipient contenant les vers soient connus au départ.
|
|
23.
|
La substance chimique d'essai est appliquée. Elle ne doit pas être ajoutée au sol dans la demi-heure qui suit l'introduction des vers dans le récipient (ou si des vers sont présents à la surface du sol) de façon à éviter une exposition directe à la substance chimique d'essai par contact cutané. Si la substance d'essai est un pesticide, il peut être pertinent de l'appliquer à la surface du sol par pulvérisation. La substance d'essai devrait être répartie à la surface du sol de façon aussi régulière que possible, à l'aide d'un épandeur de laboratoire apte à simuler la pulvérisation sur un champ. Avant l'application, on enlève le couvercle des récipients expérimentaux et on le remplace par un revêtement interne protégeant les parois latérales du récipient des projections. Le revêtement peut être confectionné avec un récipient expérimental dont la base a été enlevée. L'application devrait avoir lieu à une température de 20 ± 2 °C et, s'agissant de solutions aqueuses, d'émulsions ou de dispersions, à un taux compris entre 600 et 800 μl/m2. Il convient de vérifier le taux à l'aide d'une technique d'étalonnage appropriée. L'application des présentations spéciales, telles que les granulés ou les produits de traitement des semences, doit reproduire leur mode d'emploi en agriculture.
|
|
24.
|
On laissera les récipients expérimentaux sans couvercle durant une heure pour permettre au solvant volatil associé à l'application de la substance chimique d'essai de s'évaporer, le cas échéant, en prenant garde qu'aucun ver ne s'échappe.
|
MODE OPÉRATOIRE
Groupes d'essai et témoins
|
25.
|
Il est recommandé de déposer 10 vers par 500 à 600 g de masse sèche de sol artificiel (soit 50 à 60 g de sol par ver). Si l'on utilise de plus grandes quantités de sol, comme cela pourrait être le cas pour des pesticides exigeant un mode d'application spécial, tels les produits de traitement des semences, la charge de 50 à 60 g de sol par ver doit être maintenue moyennant l'augmentation du nombre de vers. On prépare dix vers par récipient témoin et traité. Les vers sont lavés à l'eau et essuyés, puis déposés un instant sur un papier absorbant pour éponger l'excès d'eau.
|
|
26.
|
Afin d'éviter les erreurs systématiques dans la répartition des vers dans les récipients expérimentaux, on mesure l'homogénéité de la population expérimentale en pesant individuellement 20 vers prélevés au hasard dans la population qui fournira les vers d'expérience. Une fois l'homogénéité établie, des lots de vers sont sélectionnés, pesés et répartis dans les récipients expérimentaux selon un procédé de randomisation. Après l'introduction des vers d'expérience, il faut peser chaque récipient expérimental, de façon à obtenir un poids initial de référence pour la mesure du taux d'humidité du sol tout au long de l'essai, comme décrit au paragraphe 30. Les récipients expérimentaux sont ensuite couverts, comme décrit au paragraphe 9 et placés dans le local expérimental.
|
|
27.
|
On prépare des témoins appropriés à chacune des méthodes d'application de la substance chimique d'essai décrites aux paragraphes 18 à 24. Les témoins sont préparés de la même façon que les récipients traités, sauf qu'ils ne contiennent pas la substance d'essai. Aussi, le cas échéant, les témoins renfermeront un solvant organique, du sable quartzique ou d'autres véhicules à des concentrations/quantités comparables à celles employées dans les récipients traités. Si la substance chimique d'essai est incorporée à l'aide d'un solvant ou d'un autre véhicule, il convient de préparer un témoin supplémentaire ne contenant ni le véhicule ni la substance d'essai, afin de s'assurer que le véhicule n'influence pas les résultats.
|
Conditions expérimentales
|
28.
|
L'essai est conduit à 20 ± 2 °C, avec des cycles réglés de lumière et d'obscurité (de préférence 16 heures de lumière et 8 heures d'obscurité) et un éclairement de 400 à 800 lux dans la zone des récipients expérimentaux.
|
|
29.
|
Les récipients expérimentaux ne sont pas aérés durant l'essai, mais les couvercles de ces récipients doivent autoriser les échanges gazeux avec l'atmosphère tout en limitant l'évaporation de l'humidité (voir paragraphe 9).
|
|
30.
|
La teneur en eau du substrat des récipients expérimentaux est maintenue constante tout au long de l'essai. Pour ce faire, on pèse périodiquement les récipients sans leurs couvercles et on compense toute perte avec de l'eau désionisée. La teneur en eau ne doit pas varier de plus de 10 % par rapport à sa valeur au début de l'essai.
|
Alimentation
|
31.
|
Toute nourriture dont la composition permet au moins de maintenir le poids des vers durant l'essai est jugée acceptable. Les flocons d'avoine, le crottin de cheval ou la bouse de vache ont fait leurs preuves à cet égard. Il faudra s'assurer que les vaches ou les chevaux dont on recueille les déjections ne font pas l'objet d'un traitement vétérinaire avec des substances telles que des activateurs de croissance, des nématicides ou des produits analogues, susceptibles d'être nocives pour les vers durant l'essai. Il est recommandé de ramasser soi-même la bouse de vache, l'expérience ayant démontré que la bouse de vache vendue dans le commerce comme engrais de jardin risque de nuire aux vers. Les déjections doivent être séchées à l'air, finement broyées et pasteurisées avant emploi.
|
|
32.
|
Avant de l'utiliser dans l'essai, on administre chaque nouveau lot de nourriture à une culture de vers non expérimentale, afin de vérifier qu'il est d'une qualité appropriée. La croissance et la production des cocons ne devraient pas diminuer par rapport à celles de vers élevés dans un substrat ne contenant pas le nouveau lot de nourriture [conditions décrites dans la méthode d'essai C.8 (4)].
|
|
33.
|
La première fois, la nourriture est administrée un jour après l'introduction des vers et l'ajout de la substance chimique d'essai au sol. Environ 5 g de nourriture sont parsemés à la surface du sol de chaque récipient et humidifiés avec de l'eau désionisée (quelque 5 à 6 ml par récipient). Ensuite, la nourriture est dispensée une fois par semaine au cours des quatre semaines de l'essai. Si des restes de nourriture subsistent, il faudra diminuer la ration afin d'éviter une croissance fongique, ou des moisissures. Les adultes sont retirés du sol au 28ème jour de l'essai. Cinq grammes supplémentaires de nourriture sont fournis à chaque récipient expérimental. Aucune nourriture supplémentaire n'est administrée durant les quatre semaines restantes de l'essai.
|
Sélection des concentrations expérimentales
|
34.
|
Une connaissance préalable de la toxicité de la substance chimique d'essai, tirée, par exemple, d'un essai de toxicité aiguë (4) et/ou d'une étude de détermination de l'ordre de grandeur, devrait faciliter la sélection des concentrations expérimentales appropriées. Une étude de détermination de l'ordre de grandeur est menée, s'il y a lieu, avec, par exemple, cinq concentrations expérimentales: 0,1, 1,0, 10, 100 et 1 000 mg/kg (masse sèche de sol). Une expérience identique par traitement et témoin suffit. L'étude de détermination de l'ordre de grandeur dure deux semaines et l'on évalue la mortalité à la fin de l'essai.
|
Conception expérimentale
|
35.
|
Comme aucun traitement statistique défini ne peut être prescrit pour cet essai, la présente méthode d'essai fournit des instructions pour déterminer la CSEO et la CEx. La CSEO sera vraisemblablement demandée par les autorités réglementaires dans un avenir proche. L'usage de la CEx pourrait se généraliser à court terme, pour des raisons statistiques et écologiques. Aussi, la présente méthode d'essai propose-t-elle trois conceptions fondées sur des recommandations émises à l'issue de l'essai tournant d'une méthode d'essai de reproduction chez l'enchytrée (17):
|
|
36.
|
En sélectionnant la gamme de concentrations à appliquer, on tiendra compte des aspects suivants:
|
—
|
s'agissant de déterminer la CSEO, il faudrait tester au moins cinq/douze concentrations formant une série géométrique. Il est recommandé d'inclure quatre expériences identiques pour chaque concentration expérimentale et huit témoins. Les concentrations devraient être espacées d'un facteur n'excédant pas 2,0.
|
|
—
|
s'agissant de déterminer la CEx (CE10, CE50, par exemple), il est recommandé de prévoir suffisamment de concentrations différentes pour obtenir au moins quatre réponses moyennes statistiquement différentes à ces concentrations. Il conviendrait d'inclure au moins deux expériences identiques par concentration expérimentale et six témoins identiques. Le facteur d'espacement peut varier: il doit être inférieur ou égal à 1,8 dans la gamme censée produire un effet et supérieur à 1,8 aux concentrations supérieures et inférieures.
|
|
—
|
une démarche combinée permet de déterminer à la fois la CSEO et la CEx. On utilise huit concentrations formant une série géométrique. Il est recommandé d'inclure quatre expériences identiques par traitement et huit témoins. Les concentrations devraient être espacées d'un facteur n'excédant pas 1,8.
|
|
Durée de l'essai et mesures
|
37.
|
Le 28ème jour, les vers adultes vivants sont observés et comptés. Tout comportement inhabituel (incapacité de creuser le sol, prostration, par exemple) et changement morphologique (blessures ouvertes, par exemple) sont également notés. Tous les vers adultes sont ensuite retirés des récipients expérimentaux, comptés et pesés. Le transfert du sol renfermant les vers sur un plateau propre, avant l'évaluation, peut faciliter la recherche des adultes. Avant d'être pesés, les vers extraits du sol devraient être lavés avec de l'eau désionisée et déposés un instant sur un papier filtre qui absorbera l'eau excédentaire. Tous les vers non retrouvés à cette étape doivent être consignés comme morts, on suppose en effet que ces vers sont morts et ont été décomposés avant l'évaluation.
|
|
38.
|
Si le sol a été retiré des récipients, il faut l'y remettre (sans les vers adultes mais avec tous les cocons engendrés, le cas échéant). Le sol est ensuite incubé durant quatre semaines supplémentaires dans les mêmes conditions expérimentales, si ce n'est que la nourriture n'est administrée qu'une seule fois, au début de cette phase de l'essai (voir paragraphe 33).
|
|
39.
|
À la fin de la seconde période de quatre semaines, on dénombre les vers juvéniles éclos des cocons dans le sol expérimental et les cocons, en utilisant les procédures décrites à l'Appendice 5. Tous les signes de nocivité ou les lésions observés sur les vers doivent aussi être enregistrés tout au long de la durée de l'essai.
|
Essai limite
|
40.
|
Si aucun effet n'est observé à la plus haute concentration de l'essai de détermination de l'ordre de grandeur (1 000 mg/kg), l'essai de reproduction est à conduire comme un essai limite, avec une concentration expérimentale de 1 000 mg/kg. L'essai limite permettra de démontrer que la CSEO pour la reproduction est supérieure à la concentration limite et de réduire au minimum le nombre de vers utilisé dans l'essai. Cet essai comprend huit expériences identiques à la fois pour le sol traité et pour le témoin.
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
41.
|
La présente méthode d'essai ne prescrit aucune démarche statistique stricte pour analyser les résultats de l'essai, bien que l'Appendice 6 en présente les grandes lignes.
|
|
42.
|
L'un des effets observés est la mortalité. Les changements comportementaux (par exemple, l'incapacité de creuser le sol, la prostration contre la paroi en verre du récipient expérimental) ou morphologiques (par exemple des blessures ouvertes) chez les vers adultes doivent néanmoins aussi être enregistrés, de même que la présence de vers juvéniles. La CL50 se détermine normalement par analyse probit (18) ou régression logistique. Toutefois, dans les cas où cette méthode d'analyse ne convient pas (par exemple si l'on obtient moins de trois concentrations engendrant une mortalité partielle), d'autres méthodes peuvent être utilisées, notamment les moyennes mobiles (19), la méthode de Spearman-Karber simplifiée (20) ou une simple interpolation (par exemple la moyenne géométrique de la CL0 et de la CL100, calculée en multipliant la racine carrée de la CL0 par la CL100).
|
|
43.
|
L'autre effet observé est la fécondité (le nombre de vers juvéniles produits). Néanmoins, comme pour l'essai de détermination de l'ordre de grandeur, tous les autres signes de nocivité doivent être mentionnés dans le rapport final. Pour calculer les résultats de la reproduction, il faut connaître la moyenne arithmétique
et l'écart-type par traitement et par témoin afin d'effectuer l'analyse statistique. |
|
44.
|
Si l'on a pratiqué une analyse de la variance, l'écart-type, s, et les degrés de liberté, dl, peuvent être remplacés respectivement par l'estimation de la variance “fusionnée” obtenue par analyse de la variance (ANOVA) et par ses degrés de liberté, à condition que la variance ne dépende pas de la concentration. Dans ce cas, on utilisera les variances uniques des récipients témoins et traités. On calcule généralement ces valeurs à l'aide d'un logiciel statistique commercial, en utilisant les résultats par récipient comme des expériences identiques. Si la fusion des résultats relatifs aux témoins négatifs et au(x) témoin(s) contenant le solvant semble plus pertinente que de calculer les résultats de l'essai comparativement à l'un de ces deux témoins, il faudra vérifier à l'aide d'un test qu'ils ne présentent pas de différence significative (pour le test approprié, voir au paragraphe 47 et à l'Appendice 6).
|
|
45.
|
Si les résultats des expériences identiques présentent une distribution normale et des variances homogènes, d'autres tests statistiques et déductions pourront être effectués.
|
Estimation de la CSEO
|
46.
|
Il est préférable d'appliquer des tests puissants. Il faudrait savoir si les données ont une distribution à peu près normale, en se reportant, par exemple, aux expériences précédentes (essais tournants) ou à d'autres données antérieures. L'homogénéité de la variance est plus critique. On a constaté empiriquement que la variance s'accroît souvent lorsque la moyenne s'accroît. Dans ce cas, une transformation des données pourrait déboucher sur l'homogénéité de la variance. Néanmoins, cette transformation devrait s'appuyer sur des données antérieures plutôt que sur les données en cours d'étude. En présence de données homogènes, il faudrait recourir à des tests t de comparaison multiple, tels que le test de Williams (α = 0,05, unilatéral) (21)(22), ou, dans certains cas, le test de Dunnett (23)(24). Remarquons que, dans le cas d'une reproduction inégale, les valeurs de t en tableau doivent être corrigées, comme l'ont suggéré Dunnett et Williams. En présence d'une variation importante, il peut arriver que la croissance ou la décroissance des résultats ne soit pas régulière. Avec un tel écart à la monotonicité, le test de Dunnett est plus approprié. Si la variance n'est pas homogène, il peut être utile d'examiner de plus près les répercussions possibles sur la variance afin de déterminer si les tests t peuvent être appliqués sans perdre beaucoup en puissance (25). Sinon, un test U de comparaison multiple, par exemple un test U de Bonferroni selon Holm (26), ou, si ces données présentent une variance hétérogène, mais concordent par ailleurs avec une relation dose-effet sous-jacente monotone, un autre test non paramétrique (par exemple un test de Jonckheere-Terpstra (27)(28) ou de Shirley (29)(30)) peuvent être appliqués et sont généralement préférables aux tests de t à variance inégale. (voir aussi le schéma exposé à l'Appendice 6).
|
|
47.
|
Si un essai limite a été conduit et que les conditions requises pour les tests paramétriques (normalité, homogénéité) sont remplies, le test t de Student en paire peut être utilisé ou, sinon, le test U de Mann-Whitney (31).
|
Estimation de la CEx
|
48.
|
Pour calculer une quelconque valeur de CEx, on utilise la moyenne par traitement dans l'analyse de la régression (linéaire ou non linéaire), après avoir obtenu une fonction dose-effet appropriée. S'agissant de la croissance des vers considérée comme une réponse continue, les valeurs de la CEx peuvent être estimées à l'aide d'une analyse de la régression adéquate (32). Les fonctions appropriées aux résultats épousant une valeur de tout ou rien (mortalité/survie) et le nombre de descendants sont les fonctions sigmoïdes normales, logistiques ou de Weibull, à deux ou quatre paramètres, dont certaines peuvent aussi modéliser des réponses hormétiques. Si la fonction dose-effet a été ajustée par une analyse de la régression linéaire, il faudrait trouver un r2 (coefficient de détermination) et/ou une pente appréciables avant d'estimer la CEx en insérant une valeur correspondant à x % de la moyenne du témoin dans l'équation obtenue par l'analyse de la régression. Des limites de confiance à 95 % sont calculées selon la méthode de Fieller [mentionnée par Finney (18)] ou par une autre méthode récente appropriée.
|
|
49.
|
Sinon, la réponse est modélisée comme un pourcentage ou une proportion du paramètre du modèle, paramètre qui est interprété comme le résultat moyen du témoin. Dans ce cas, la courbe sigmoïde normale (logistique, Weibull) peut souvent être facilement ajustée aux résultats à l'aide de la régression probit (18). Dans ce cas, la fonction de pondération doit être ajustée selon Christensen (33) pour les résultats métriques. Cependant, si on observe une hormèse, l'analyse probit doit être remplacée par une fonction logistique ou de Weibull à quatre paramètres, ajustée par une régression non linéaire (34). S'il est impossible d'ajuster une fonction dose-effet appropriée aux données, d'autres méthodes peuvent être utilisées pour estimer la CEx et ses limites de confiance, telles que les moyennes mobiles d'après Thompson (19) et la méthode simplifiée de Spearman-Karber (20).
|
RAPPORT D'ESSAI
|
50.
|
Le rapport d'essai doit contenir les informations suivantes:
|
|
Substance chimique d'essai:
|
—
|
description bien fondée de la substance chimique d'essai, lot de fabrication, lot de conditionnement, numéro CAS, pureté;
|
|
—
|
propriétés de la substance chimique d'essai (par exemple, log Koe, hydrosolubilité, pression de vapeur, constante de Henry (H) et données concernant son devenir et son comportement).
|
|
|
|
Organisme d'essai:
|
—
|
animal d'expérience utilisé: espèce, nom scientifique, source et conditions d'élevage;
|
|
—
|
âge, gamme de dimension (masse) des organismes d'expérience.
|
|
|
|
Conditions expérimentales:
|
—
|
détails sur la préparation du sol d'essai;
|
|
—
|
capacité maximale de rétention d'eau du sol;
|
|
—
|
description de la méthode d'application de la substance chimique d'essai dans le sol;
|
|
—
|
détails relatifs aux substances auxiliaires utilisées pour administrer la substance chimique d'essai;
|
|
—
|
détails relatifs à l'étalonnage de l'appareil de pulvérisation, le cas échéant;
|
|
—
|
description de la conception expérimentale et du mode opératoire;
|
|
—
|
dimension des récipients expérimentaux et volume du sol d'essai;
|
|
—
|
conditions expérimentales: intensité lumineuse, durée des cycles de lumière et d'obscurité, température;
|
|
—
|
description du régime d'administration de la nourriture, nature et quantité de nourriture fournie au cours de l'essai, dates d'alimentation;
|
|
—
|
pH et teneur en eau du sol au début et à la fin de l'essai.
|
|
|
|
Résultats de l'essai:
|
—
|
mortalité adulte (%) dans chaque récipient expérimental, à la fin des quatre premières semaines de l'essai;
|
|
—
|
masse totale des adultes au début de l'essai, dans chaque récipient expérimental;
|
|
—
|
modification du poids corporel des adultes vivants (% du poids initial) dans chaque récipient expérimental, à l'issue des quatre premières semaines de l'essai;
|
|
—
|
nombre de vers juvéniles produits dans chaque récipient expérimental à la fin de l'essai;
|
|
—
|
description des effets évidents ou des symptômes pathologiques ou des changements nets de comportement;
|
|
—
|
résultats obtenus avec la substance chimique de référence;
|
|
—
|
CL50, CSEO et/ou CEx (par exemple CE50, CE10) pour la reproduction si certaines d'entre elles sont applicables avec des intervalles de confiance et représentation graphique du modèle ajusté utilisé pour leur calcul, toutes les informations et observations utiles à l'interprétation des résultats;
|
|
—
|
courbe de la relation dose-effet;
|
|
—
|
résultats obtenus avec chaque récipient.
|
|
Écarts par rapport aux procédures décrites dans la présente méthode d'essai et faits inhabituels survenus au cours de l'essai.
|
BIBLIOGRAPHIE
|
(1)
|
Jaenicke, J. (1982). “Eisenia foetida” is two biological species. Megadrilogica 4, 6-8.
|
|
(2)
|
Oien, N and J. Stenerson (1984). Esterases of earthworm — III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277 — 282.
|
|
(3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei — comparison of two ringtests. In: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, p. 50-82.
|
|
(4)
|
Chapitre C.8. de la présente annexe, Toxicité pour les vers de terre.
|
|
(5)
|
ISO (Organisation internationale de normalisation) (1996). Qualité du sol — Effets des polluants vis-à-vis des vers de terre (Eisenia fetida) Partie 2: Détermination des effets sur la reproduction, №11268-2. ISO, Genève.
|
|
(6)
|
ISO (Organisation internationale de normalisation) (1993). Qualité du sol — Effets des polluants vis-à-vis des vers de terre (Eisenia fetida) Partie 1: Détermination de la toxicité aiguë en utilisant des substrats de sol artificiel, №11268-1. ISO, Genève.
|
|
(7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S.C., Bembridge, J.D., Holmstrup, M. and Posthuma, L. (Eds). SETAC Press, 456 pages.
|
|
(8)
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, avril 1996.
|
|
(9)
|
Bouché, M.B. (1972). Lombriciens de France, Écologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C.A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714EN, Commission of European Communities.
|
|
(11)
|
Greig-Smith, P.W., H. Becker, P.J. Edwards and F. Heimbach (eds.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C.A. and Bohlen, J.P. (1996). Biology and ecology of Earthworms, 3rd Edition. Chapman and Hall, London.
|
|
(13)
|
ISO (Organisation internationale de normalisation) (1994). Qualité du sol — Détermination du pH. no 10390. ISO, Genève.
|
|
(14)
|
Hund-Rinke, K, Römbke, J., Riepert, F. & Achazi R. (2000): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(15)
|
ISO (Organisation internationale de normalisation) (1992). Qualité du sol — Détermination de la caractéristique de la rétention en eau — Méthodes de laboratoire, №11274. ISO, Genève.
|
|
(16)
|
ISO (Organisation internationale de normalisation) (1993). Qualité du sol — Détermination de la teneur pondérale en matière sèche et en eau — Méthode gravimétrique, №11465. ISO, Genève.
|
|
(17)
|
Römbke, J. and Moser, Th. (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150+223 pp.
|
|
(18)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(19)
|
Finney, D.J. (1978). Statistical method in Biological Assay. Charles Griffin & Company Ltd, London.
|
|
(20)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(21)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(22)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(23)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(24)
|
Dunnett, C.W., (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(25)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361.
|
|
(26)
|
Holm, S., (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(27)
|
Jonckheere, A.R. (1954). A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(28)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(29)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(30)
|
Williams, D.A. (1986). A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(31)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(32)
|
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11: 1485-1494.
|
|
(33)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(34)
|
Van Ewijk, P.H. and Hoekstra, J.A., (1993). (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Appendice 1
Définitions
Les définitions suivantes s'appliquent aux fins de la présente méthode d'essai:
Substance chimique
: une substance ou un mélange.
CEx
(concentration efficace à x %): concentration qui engendre un effet de x % sur les organismes d'expérience durant une période d'exposition déterminée, en comparaison avec un témoin. Par exemple, la CE50 est la concentration estimée causer un effet déterminé sur 50 % d'une population exposée durant une période définie. Dans cet essai, les concentrations efficaces sont exprimées en masse de substance chimique d'essai par masse sèche de sol expérimental ou en masse de substance chimique d'essai par unité de superficie du sol.
CL0
(concentration non létale): désigne la concentration d'une substance chimique d'essai qui ne tue aucun des organismes d'expérience exposés durant une période déterminée. Dans cet essai, la CL0 s'exprime en masse de substance chimique d'essai par masse sèche de sol expérimental.
CL50
(concentration létale moyenne): concentration d'une substance chimique d'essai qui entraîne la mort de 50 % des organismes d'expérience exposés durant une période déterminée. Dans cet essai, la CL50 s'exprime en masse de substance chimique d'essai par masse sèche de sol expérimental ou en masse de substance chimique d'essai par unité de superficie du sol.
CL100
(concentration totalement létale): concentration d'une substance chimique d'essai qui entraîne la mort de 100 % des organismes d'expérience exposés durant une période déterminée. Dans cet essai, la CL100 s'exprime en masse de substance chimique d'essai par masse sèche de sol expérimental.
CMEO (concentration minimale avec effet observé): désigne la plus faible concentration de la substance chimique d'essai qui exerce un effet statistiquement significatif (p < 0,05). Dans cet essai, la CMEO s'exprime en masse de substance chimique d'essai par masse sèche de sol expérimental ou en masse de substance chimique d'essai par unité de superficie du sol. Toutes les concentrations expérimentales supérieures à la CMEO doivent normalement produire un effet statistiquement différent du résultat observé sur le témoin. Tous les écarts à ce qui précède dans la détermination de la CMEO doivent être justifiés dans le rapport d'essai.
CSEO (concentration sans effet observé): désigne la plus haute concentration de la substance chimique d'essai directement inférieure à la CMEO et à laquelle aucun effet n'est observé. Dans cet essai, la CSEO n'a pas d'effet statistiquement significatif (p < 0,05) durant une période d'exposition donnée, en comparaison avec le témoin.
Taux de reproduction
: le taux de reproduction est le rapport du nombre moyen de vers juvéniles engendrés durant la période de l'essai par le nombre d'adultes.
Substance chimique d'essai
: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
Appendice 2
Détermination de la capacité maximale de rétention d'eau du sol
La méthode suivante pour déterminer la capacité maximale de rétention d'eau du sol a fait ses preuves. Elle est décrite à l'annexe C de la norme ISO DIS 11268-2 (1).
Prélevez une quantité déterminée (5 g, par exemple) du sol expérimental servant de substrat à l'aide d'un instrument approprié (tarière, etc.). Couvrez le fond de la tarière avec un morceau de papier filtre et, après l'avoir remplie d'eau, placez-la sur un support dans un bain d'eau. La tarière doit être progressivement submergée jusqu'à ce que le niveau d'eau dépasse le sommet de la carotte de sol. Laissez la tarière dans l'eau durant environ trois heures. Comme l'eau absorbée par les capillaires du sol ne peut pas être retenue en totalité, laissez l'échantillon de sol dégorger durant deux heures, en plaçant le tube sur un lit de sable quartzique fin très humide contenu dans un récipient fermé (pour empêcher le séchage). Pesez l'échantillon et séchez-le à 105 °C jusqu'à ce qu'il atteigne une masse constante. La capacité de rétention d'eau (CRE) se calcule comme suit:

où:
|
S
|
=
|
masse du substrat saturé en eau + masse de la tarière + masse du papier filtre
|
|
T
|
=
|
tare (masse de la tarière + masse du papier filtre)
|
|
D
|
=
|
masse sèche du substrat
|
RÉFÉRENCE:
|
1).
|
ISO (Organisation internationale de normalisation) (1996). Qualité du sol — Effets des polluants vis-à-vis des vers de terre (Eisenia fetida) Partie 2: Détermination des effets sur la reproduction, No11268-2. ISO, Genève.
|
Appendice 3
Détermination du pH du sol
La méthode de détermination du pH d'un échantillon de sol, décrite ci-dessous, s'appuie sur la norme ISO 10390 (Qualité du sol — Détermination du pH) (1).
Laissez sécher une quantité définie de sol à température ambiante durant au moins 12 heures. Confectionnez une suspension du sol (contenant au moins 5 g de sol) dans cinq fois son volume soit d'une solution de chlorure de potassium (KCl) 1 M de qualité pour analyse, soit d'une solution de chlorure de calcium (CaCl2) 0,01 M de qualité pour analyse. Agitez énergiquement la suspension durant cinq minutes. Laissez reposer la suspension durant au moins deux heures, mais pas plus de 24 heures. Mesurez le pH de la phase liquide à l'aide d'un pH-mètre, étalonné avant chaque mesure avec une série appropriée de solutions tampons (pH 4,0 et 7,0, par exemple).
RÉFÉRENCE:
|
1).
|
ISO (Organisation internationale de normalisation) (1994). Qualité du sol — Détermination du pH. no 10390. ISO, Genève.
|
Appendice 4
Élevage d'eisenia fetida/Eisenia andrei
Il est préférable d'élever ces espèces dans un local climatisé à 20 °C ± 2 °C. À cette température et à condition d'être suffisamment nourris, les vers atteignent leur maturité au bout de 2 à 3 mois.
Ces deux espèces peuvent être élevées dans des déchets animaux très divers. Le milieu de culture recommandé est un mélange 50/50 de crottin de cheval ou de bouse de vache et de tourbe. Il faudra s'assurer que les vaches ou les chevaux dont on recueille les déjections ne font pas l'objet d'un traitement vétérinaire avec des substances telles que des activateurs de croissance, des nématicides ou des produits analogues, susceptibles d'être nocives pour les vers durant l'essai. Il est recommandé de récolter soi-même les déjections dans un élevage de l'agriculture biologique, l'expérience ayant démontré que les déjections vendues dans le commerce comme engrais de jardin risquent d'être nocives pour les vers. Le milieu devrait avoir un pH d'environ 6 à 7 (ajusté avec du carbonate de calcium), une faible conductivité ionique (une concentration de sels inférieure à 0,5 % ou à 6 mg) et ne devrait pas être trop contaminé par de l'ammoniac ou des urines animales. Le substrat doit être humide, mais pas engorgé. Des boîtes d'élevage d'une capacité de 10 à 50 litres conviennent.
Pour obtenir une population de vers homogène quant à l'âge et à la taille (masse), il vaut mieux commencer la culture avec des cocons. Une fois que la culture a été lancée, on la poursuit en transférant les vers adultes dans une boîte d'élevage garnie d'un substrat neuf et en les y laissant durant 14 à 28 jours pour leur permettre d'engendrer de nouveaux cocons. Les adultes sont ensuite enlevés et les juvéniles issus des cocons utilisés comme population de départ pour la prochaine culture. Les vers sont nourris en continu avec des déchets animaux et transférés de temps en temps dans un substrat neuf. On a constaté que les flocons d'avoine, du crottin de cheval ou de la bouse de vache séchés à l'air et finement broyés constituent une alimentation appropriée. Il faudra vérifier que les vaches ou les chevaux dont proviennent les déjections ne sont pas traités par des médicaments vétérinaires tels que des activateurs de croissance, susceptibles d'être nocifs pour les vers durant la culture à long terme. Les vers éclos des cocons sont utilisés dans l'essai dès qu'ils sont âgés de 2 à 12 mois et considérés comme adultes.
Les vers peuvent être considérés comme sains s'ils se déplacent dans le substrat, ne tentent pas de s'en échapper et se reproduisent continuellement. L'épuisement du substrat est révélé par le fait que les vers se déplacent très lentement et présentent une extrémité postérieure jaune. Dans ce cas, il est recommandé de renouveler le substrat et/ou de diminuer la densité de peuplement des boîtes.
Appendice 5
Techniques de comptage des vers juvéniles éclos des cocons
Le tri manuel des vers présents dans le substrat exigeant un temps considérable, deux autres méthodes sont recommandées:
|
a)
|
Les récipients expérimentaux sont déposés dans un bain d'eau, dont la température initiale de 40 °C est portée à 60 °C. Après une vingtaine de minutes, les vers juvéniles devraient apparaître à la surface du sol, d'où il est facile de les enlever et de les compter.
|
|
b)
|
Le sol d'essai peut être rincé à travers un tamis selon la méthode mise au point par Van Gestel et al. (1), à condition que la tourbe et les déjections ou les flocons d'avoine ajoutés au sol aient été moulus en poudre fine. Deux tamis dont les mailles mesurent 0,5 mm (diamètre 30 cm) sont placés l'un au-dessus de l'autre. Le contenu du récipient expérimental est versé sur un tamis sous un puissant jet d'eau du robinet, de façon à retenir la majorité des jeunes vers et des cocons dans le tamis supérieur. Il importe de noter que toute la surface du tamis supérieur doit rester mouillée durant cette opération de façon que les vers juvéniles flottent sur un film d'eau, ce qui les empêche de se faufiler à travers les mailles du tamis. On obtient le meilleur résultat avec une pomme de douche.
|
Dès que la totalité du substrat est passée à travers le tamis, le tamis supérieur peut être rincé au-dessus d'un bol de façon à y recueillir les juvéniles et les cocons. On laisse reposer le contenu du bol jusqu'à ce que les cocons vides flottent à la surface et les cocons pleins ainsi que les juvéniles tombent au fond. Après quoi, l'eau du bol est vidée et les jeunes vers et les cocons sont transférés dans une boîte de Petri contenant un peu d'eau. On peut alors compter les vers en les enlevant à l'aide d'une aiguille ou d'une pince.
L'expérience a montré que la méthode a) convient mieux à l'extraction des vers juvéniles, susceptibles de passer à travers les mailles, même avec une ouverture de 0,5 mm.
L'efficacité de la méthode employée pour extraire les vers (et les cocons, le cas échéant) du sol devrait toujours être déterminée. Si les vers juvéniles sont enlevés par tri manuel, on conseille de répéter l'opération une fois sur tous les échantillons.
RÉFÉRENCE:
|
(1)
|
Van Gestel, C.A.M., van Dis, W.A., van Breemen, E.M., Sparenburg, P.M. (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32: 367-371.
|
Appendice 6
Description schématique de l'évaluation statistique des résultats (détermination de la CSEO)

C.34. DÉTERMINATION DE L'INHIBITION DE L'ACTIVITÉ DES BACTÉRIES ANAÉROBIES — RÉDUCTION DE LA PRODUCTION DE GAZ PAR UNE BOUE (D'EAUX USÉES) À DIGESTION ANAÉROBIE
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 224 (2007) de l'OCDE pour les essais de produits chimiques. Les produits chimiques rejetés dans l'environnement aquatique traversent des zones aérobies et des zones anaérobies, dans lesquelles ils peuvent être dégradés et/ou ils peuvent inhiber l'activité bactérienne; dans certains cas, ils peuvent demeurer dans des zones anaérobies pendant des décennies ou des durées plus longues sans perturbation aucune. Lors du traitement des eaux usées, la première étape, la décantation primaire, est aérobie dans le liquide surnageant et anaérobie dans les boues sous-nageantes. Ensuite, l'étape secondaire fait intervenir une zone aérobie dans le bassin d'aération à boues activées et une zone anaérobie dans la boue sous-nageante dans le bassin de décantation secondaire. Les boues issues de ces deux étapes sont généralement soumises à un traitement anaérobie, et produisent alors du méthane et du dioxyde de carbone habituellement utilisés en production d'électricité. Dans les milieux moins confinés, les produits chimiques qui rejoignent les sédiments dans les baies, les estuaires et la mer ont toutes les chances de rester dans ces zones anaérobies indéfiniment s'ils ne sont pas biodégradables. Certaines propriétés physiques telles qu'une médiocre solubilité dans l'eau, une capacité d'adsorption élevée sur les solides en suspension, ou une inaptitude à la biodégradation aérobie permettront à quelques produits chimiques d'atteindre ces zones en proportions plus importantes.
|
|
2.
|
Il est préférable que les produits chimiques rejetés dans l'environnement soient biodégradables en conditions anaérobies et aérobies, mais il est également essentiel qu'ils n'inhibent pas l'activité des microorganismes dans l'une ou l'autre zone. Au Royaume-Uni, quelques cas d'inhibition complète de la production de méthane due, par exemple, au pentacholorophénol présent dans les décharges industrielles, ont été signalés, qui ont engendré des frais considérables de transport des boues inhibées depuis les digesteurs vers des sites “sûrs” et d'importation de boue de digestion non contaminée en provenance d'installations proches. Il existe toutefois de nombreux cas d'interruption moins drastiques de la digestion par plusieurs autres produits chimiques, notamment des hydrocarbures aliphatiques halogénés (nettoyage à sec) et des détergents, qui nuisent gravement à l'efficacité des digesteurs.
|
|
3.
|
Seule la méthode d'essai C.11 (1) traite de l'inhibition de l'activité bactérienne (Respiration de boues activées), et évalue l'effet de substances chimiques d'essais sur la vitesse d'absorption de l'oxygène en présence de substrat. La méthode a été largement utilisée en guise d'alerte précoce d'effets potentiellement nocifs de produits chimiques sur le traitement aérobie des eaux usées, ainsi que pour déterminer les concentrations non inhibitrices des substances chimiques d'essai susceptibles d'être utilisées dans les divers essais de biodégradabilité. La méthode d'essai C.43 (2) permet de déterminer dans une certaine mesure la toxicité d'une substance chimique d'essai sur la production de gaz par une boue anaérobie, diluée dix fois par rapport à sa concentration normale de solides afin d'obtenir la précision requise dans l'évaluation du pourcentage de biodégradation. Les boues diluées étant parfois plus sensibles aux substances inhibitrices, le groupe ISO a décidé de mettre au point une méthode employant une boue non diluée. Trois textes au moins ont été examinés (issus du Danemark, de l'Allemagne et du Royaume- Uni), pour aboutir finalement à la mise au point de deux normes ISO, l'une employant une boue non diluée, ISO 13 641-1 (3) et l'autre une boue diluée cent fois, ISO 13 641-2 (4), dans l'objectif de représenter les vases et les sédiments à faibles populations bactériennes. Les deux méthodes ont été soumises à un essai tournant (5); la première a été reconnue comme une norme acceptable, mais la seconde n'a pu faire l'objet d'un accord. Le Royaume-Uni a considéré que la proportion importante de participants signalant une production de gaz très faible ou nulle, en partie parce que la proportion de l'espace gazeux était trop élevée (75 %) pour une sensibilité optimale, appelait à un nouvel examen de la méthode.
|
|
4.
|
Des travaux préalables menés au Royaume-Uni (6)(7) font état d'une méthode manométrique sur boue de digestion non diluée additionnée de boue d'eaux usées à titre de substrat, dans des récipients de 500 ml; l'appareil était encombrant et l'odeur de la boue brute nauséabonde. Par la suite, l'appareil plus compact et plus pratique de Shelton et Tiedje (8), amélioré par Battersby et Wilson (9) a été exploité avec succès par Wilson et al. (10). Kawahara et al (11) sont parvenus à préparer des boues plus homogènes au laboratoire, pour les utiliser dans des essais de biodégradabilité anaérobie et d'inhibition sur plusieurs produits chimiques. De surcroît, le substrat de boue brute a été remplacé afin de procéder à l'essai avec une boue anaérobie diluée cent fois ou avec des vases, des sédiments, etc., à faible activité bactérienne.
|
|
5.
|
Cette méthode permet d'obtenir des informations utiles pour prédire l'effet probable d'une substance chimique d'essai sur la production de gaz dans des digesteurs anaérobies. Toutefois, seuls des essais plus longs qui simulent plus rigoureusement le fonctionnement de digesteurs sont capables d'indiquer si les microorganismes peuvent s'adapter à la substance chimique d'essai ou si ces substances susceptibles d'être absorbées ou adsorbées sur les boues peuvent s'accumuler jusqu'à atteindre une concentration toxique, sur une période plus longue que celle testée dans cet essai.
|
PRINCIPE DE L'ESSAI
|
6.
|
Des fractions aliquotes d'un mélange de boue à digestion anaérobie (20 g/l à 40 g/l de matières solides totales) et d'une solution de substrat dégradable sont incubées seules et, en parallèle, avec la substance chimique d'essai en quantités comprises dans un intervalle de concentrations, dans des récipients scellés, pendant une durée pouvant atteindre trois jours. La quantité de gaz produits (méthane plus dioxyde de carbone) est mesurée par l'augmentation de la pression (Pa) dans les flacons. Les pourcentages d'inhibition de la production de gaz attribuables aux diverses concentrations de la substance chimique d'essai sont calculés à partir des quantités produites dans les flacons d'essai et témoins respectifs. La CE50 et d'autres concentrations efficaces sont calculées à partir des courbes du pourcentage d'inhibition en fonction de la concentration des substances chimiques d'essai, ou, le plus souvent, de son logarithme.
|
INFORMATIONS SUR LA SUBSTANCE CHIMIQUE D'ESSAI
|
7.
|
Les substances chimiques d'essai sont habituellement utilisées sous la forme la plus pure facilement accessible, car les impuretés contenues dans certaines substances chimiques, par exemple, les cholorophénols, sont parfois plus toxiques que la substance d'essai elle-même. Il peut toutefois se révéler utile de tester les substances chimiques sous la forme dans laquelle elles sont produites ou commercialisées. L'utilisation en routine de produits formulés est déconseillée, mais convient parfois pour les substances chimiques d'essais de solubilité médiocre. Il convient de connaître les propriétés suivantes de la substance chimique d'essai: solubilité dans l'eau et dans certains solvants organiques, pression de vapeur, coefficient d'adsorption, hydrolyse et biodégradabilité en conditions anaérobies.
|
CHAMP D'APPLICATION DE LA METHODE
|
8.
|
Cet essai s'applique à des substances solubles ou insolubles dans l'eau, y compris les substances volatiles. Toutefois, des précautions particulières sont indispensables avec les matériaux à faible solubilité dans l'eau [voir réf. (12)] et à volatilité élevée. Il est également possible d'utiliser des inoculums provenant d'autres sites anaérobies, par exemple, vases, sols saturés et sédiments. Les systèmes bactériens anaérobies préalablement exposés à des substances toxiques peuvent être adaptés de façon à ce que leur activité soit maintenue en présence de produits chimiques xénobiotiques. Les inoculums issus de systèmes bactériens adaptés font parfois preuve d'une tolérance plus élevée aux substances chimiques d'essais que des inoculums obtenus à partir de systèmes non adaptés.
|
SUBSTANCES CHIMIQUES DE RÉFÉRENCE
|
9.
|
Pour vérifier le mode opératoire, on teste une substance chimique de référence parallèlement à la substance d'essai dans des récipients appropriés en suivant le même protocole; le 3,5-dichlorophénol s'est révélé un inhibiteur type de la production de gaz anaérobie, ainsi que de la consommation d'oxygène par les boues activées et d'autres réactions biochimiques. Deux autres produits chimiques présentent une capacité d'inhibition plus élevée que celle du 3,5-dichlorophénol sur la production de méthane, le bis-thiocyanate de méthylène et le pentachlorophénol, mais les résultats les concernant n'ont pas encore été validés. Le pentachlorophénol n'est pas recommandé, car il est difficile à obtenir sous forme pure.
|
REPRODUCTIBILITÉ DES RÉSULTATS
|
10.
|
Dans un essai tournant international (5), une reproductibilité seulement moyenne a été relevée entre les valeurs de CE50 de 10 laboratoires participants pour le 3,5-dichlorophénol et d'acide 2-bromo- éthane-sulfonique (l'intervalle pour le premier allait de 32 mg/l à 502 mg/l et pour le second de 220-2 190 mg/l.)
|
Nombre de laboratoires
|
En mg/l
|
En mg/g de boue
|
|
moyenne
|
e.t.
|
cv(%)
|
moyenne
|
e.t.
|
cv(%)
|
|
|
3, 5-Dichlorophénol
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
Acide 2-bromo-éthane-sulfonique
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
Données CE50 de l'essai tournant — boue non diluée
|
11.
|
Les coefficients de variations élevés entre les laboratoires s'expliquent dans une large mesure par des différences de sensibilité des microorganismes des boues qui ont été ou non préalablement exposés à la substance chimique d'essai ou à d'autres substances de même nature chimique. La précision de la détermination de la valeur de CE50 en fonction de la concentration de boue était à peine meilleure que celle de la valeur “volumétrique” (mg/l). Dans les trois laboratoires ayant indiqué la précision de leur valeur de CE50 pour le 3,5-dichlorophénol, les coefficients de variation étaient nettement inférieurs (22, 9 et 18 % respectivement pour la CE50 en mg/g) que ceux des moyennes des dix laboratoires réunies. Les moyennes individuelles des trois laboratoires s'élevaient à 3,1; 3,2 et 2,8 mg/g, respectivement. Les coefficients de variation plus faibles et acceptables au sein d'un même laboratoire, comparés aux coefficients beaucoup plus élevés entre les valeurs des laboratoires, c'est-à-dire 9-22 % cf. 92 %, révèlent des différences significatives entre les propriétés des boues individuelles.
|
DESCRIPTION DE LA MÉTHODE
Appareillage
|
12.
|
L'utilisation de matériel courant de laboratoire et des équipement suivants est requise:
|
a)
|
Incubateur — anti-étincelles et thermostaté à 35 °C ± 2 °C;
|
|
b)
|
Récipients expérimentaux en verre résistant à la pression d'une capacité1 nominale appropriée (17), munis d'un septum étanche au gaz, capable de supporter une pression d'environ 2 bars ou 2 × 105 Pa (le revêtement utilisé sera, par exemple du PTFE = polytétrafluoréthylène). L'utilisation de flacons à sérum en verre d'un volume nominal de 125 ml, et d'un volume réel d'environ 160 ml, obturé par des septum (18) adaptés aux flacons à sérum et des capsules en aluminium serties est recommandée; il est également possible d'utiliser des flacons d'un volume total compris entre 0.1 et 1 litre;
|
|
c)
|
Manomètre de précision
(19)
et aiguilles fixées
La production totale de gaz (méthane plus dioxyde de carbone) est mesurée à l'aide d'un manomètre capable de mesurer et d'évacuer les gaz produits, par exemple, un manomètre de précision manuel relié à une aiguille de seringue; un robinet à trois voies étanche aux gaz permet la libération de la pression excédentaire (Appendice 1). Le volume interne des tuyaux et du robinet du transducteur de pression doit être aussi faible que possible, de telle sorte que les erreurs introduites en négligeant le volume de l'appareillage restent insignifiantes;
|
|
d)
|
Récipients isolés, pour le transport des boues de digestion;
|
|
e)
|
Robinets à pression trois voies;
|
|
f)
|
Tamis, avec une ouverture de maille de 1 mm;
|
|
g)
|
Réservoir, pour la boue de digestion, flacon en verre ou en polyéthylène haute densité, d'un volume d'environ 5 litres, muni d'un agitateur et d'un dispositif permettant le passage d'un courant d'azote gazeux (voir paragraphe 13) dans l'espace libre;
|
|
h)
|
filtres membranaires (0,2 μm) pour stériliser le substrat;
|
|
i)
|
micro-seringues, pour la connexion étanche au gaz du transducteur de pression [voir paragraphe 12(c)] à l'espace libre des bouteilles [voir paragraphe 12(b)]; elles servent également à ajouter les matériaux d'essai liquides dans les flacons;
|
|
j)
|
boîte à gants, en option, mais recommandée, avec une pression d'azote légèrement positive.
|
|
Réactifs
|
13.
|
Des réactifs de qualité analytique sont utilisés dans tout l'essai. Il faut toujours utiliser de l'azote gazeux très pur avec une concentration d'oxygène inférieure à 5 μM.
|
Eau
|
14.
|
Si une dilution s'avère nécessaire à quelque étape que ce soit, il convient d'utiliser de l'eau désionisée préalablement désaérée. Il n'est pas indispensable de contrôler analytiquement cette eau, mais plutôt de s'assurer que l'appareil de désionisation est régulièrement entretenu. Les solutions mères doivent également être préparées avec de l'eau désionisée. On s'assurera que toutes les solutions ou les dilutions du matériel d'essai sont exemptes d'oxygène avant d'y ajouter l'inoculum anaérobie. Cette absence peut se vérifier par soufflage d'azote gazeux dans l'eau de dilution (ou dans les dilutions) une heure avant l'addition de l'inoculum, ou bien en chauffant l'eau de dilution jusqu'à son point d'ébullition et en la refroidissant à température ambiante dans une atmosphère sans oxygène.
|
Boue digérée
|
15.
|
Les boues de digestion activées sont prélevées dans un digesteur de station d'épuration d'eaux usées, ou bien dans un digesteur de laboratoire, affecté au traitement de boues principalement dérivées d'eaux usées domestiques. Les informations pratiques concernant les boues de digesteurs de laboratoire sont disponibles dans d'autres références (11). S'il est prévu d'utiliser un inoculum adapté, il faudra peut- être envisager de prélever une boue de digestion dans une station d'épuration d'effluents industriels. Pour récolter ces boues, il est préférable d'utiliser des flacons à large ouverture en polyéthylène haute densité ou un matériau similaire, capables de se dilater. Remplir ces flacons de boue jusqu'à environ 1 cm de leur embouchure et les fermer hermétiquement, de préférence avec une soupape de sécurité [paragraphe 12 (e)], et les placer dans des réceptacles isolés [paragraphe 12 (d)] pour réduire au minium le choc thermique, jusqu'à leur transfert dans un incubateur maintenu à 35 °C ± 2 °C. A l'ouverture des flacons, prendre soin de relâcher la pression de gaz en excès en ouvrant avec précaution le bouchon, ou grâce au robinet de libération de la pression trois voies (paragraphe 12 (e)). Il est préférable d'utiliser la boue dans les quelques heures qui suivent sa récolte ou bien de la conserver à 35 °C ± 2 °C sous un espace libre rempli d'azote pendant une durée inférieure à 3 jours, dans le cas où la perte d'activité normale est faible.
Avertissement — Les boues de digestion présentent des risques d'incendie ou d'explosion à cause des gaz inflammables qu'elles dégagent: elles renferment également des organismes potentiellement pathogènes, de sorte que ces boues sont à manipuler avec prudence. Pour des raisons de sécurité, il n'est pas conseillé de recueillir les boues dans des récipients en verre.
|
Inoculum
|
16.
|
Immédiatement avant son utilisation, mélanger la boue par agitation douce et la faire passer sur un tamis à mailles de 1 mm2 [paragraphe 12(f)] avant de l'introduire dans un flacon approprié [paragraphe 12(g)] en la faisant traverser l'espace vide balayé par un courant d'azote. Prélever un échantillon pour la mesure de la concentration des matières solides sèches totales (voir, par exemple, la norme ISO 11 923 (13) ou la norme UE équivalente). En général, la boue est utilisée sans dilution. La concentration de solides est généralement comprise entre 2 % et 4 % (p/v). Contrôler la valeur du pH de la boue et l'ajuster, s'il y a lieu, à 7 ± 0.5.
|
Substrat d'essai
|
17.
|
Dissoudre 10 g de bouillon nutritif (par exemple Oxoid), 10 g d'extrait de levure et 10 g de D-glucose dans de l'eau désionisée et diluer à 100 ml. Stériliser par filtration sur un filtre membranaire de 0,2 μm [paragraphe 12 (h)] et utiliser immédiatement ou conserver à 4 °C pendant 1 jour au maximum.
|
Substance chimique d'essai
|
18.
|
Préparer une solution mère séparée de chaque substance chimique d'essai hydrosoluble de sorte qu'elle contienne, par exemple, 10 g/l de la substance dans de l'eau de dilution sans oxygène (paragraphe 14). Utiliser des volumes appropriés de ces solutions mères pour préparer des mélanges réactionnels de concentrations croissantes. Il est également possible de préparer des dilutions en série de chaque solution mère afin d'ajouter un volume identique dans chaque flacon d'essai pour chaque concentration finale requise. Le pH des solutions mères est ajusté à 7 ± 0.2, s'il y a lieu.
|
|
19.
|
Pour les substances chimiques d'essai insuffisamment solubles dans l'eau, se reporter à la norme ISO 10 634 (12) ou à la norme UE équivalente. Lorsqu'il faut utiliser un solvant organique, il convient d'éviter l'emploi de solvants tels que le chloroforme, et le tétrachlorure de carbone dont le puissant effet d'inhibition de la production de méthane est notoire. Préparer une solution de concentration appropriée de substance insoluble dans l'eau dans un solvant volatil adapté, par exemple, l'acétone ou l'éther diéthylique. Ajouter des volumes nécessaires de solution de solvant aux flacons d'essai vides (paragraphe 12(b)) et évaporer le solvant avant l'addition de la boue. Pour d'autres traitements, consulter la norme ISO 10 634 (12) ou la norme UE équivalente en gardant à l'esprit que tout tensioactif utilisé pour produire des émulsions peut inhiber la production de gaz anaérobie. Si l'on estime que la présence de solvants organiques et d'agents émulsifiants est susceptible d'engendrer des artefacts, la substance chimique d'essai peut être directement ajoutée au mélange d'essai sous forme d'une poudre ou d'un liquide. Il est possible d'injecter les substances volatiles et les substances chimiques d'essai liquides insolubles dans l'eau dans les flacons de sérum inoculé à l'aide de micro-seringues [paragraphe 12(i)].
|
|
20.
|
Ajouter les substances chimiques d'essai aux flacons afin d'obtenir une série géométrique de concentrations, par exemple, 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l, et 15,6 mg/l. Lorsque l'intervalle de toxicité n'est pas prévisible en se basant sur des substances similaires, il convient de réaliser tout d'abord un essai préliminaire de détermination de l'intervalle de toxicité approprié sur des concentrations de 1 000 mg/l, 100 mg/l et 10 mg/l.
|
Substance chimique de référence
|
21.
|
Préparer une solution aqueuse de 3,5-dichlorophénol (10 g/l) en ajoutant progressivement la quantité minimale de 5 mol/l de solution d'hydroxyde de sodium au solide, sous agitation, jusqu'à dissolution. Ajouter ensuite de l'eau de dilution désoxygénée (paragraphe 14) pour ajuster le volume requis; une sonication peut favoriser la dissolution. D'autres substances de référence peuvent être utilisées lorsque l'intervalle moyen de la CE50 a été obtenu dans au moins trois tests employant des inoculums différents (sources différentes ou dates de récolte différentes).
|
INTERFÉRENCE/ERREURS
|
22.
|
Il est vraisemblable que certains des constituants de la boue réagissent avec des inhibiteurs potentiels, ce qui annulera leurs effets sur les micro-organismes, avec pour résultat une inhibition plus faible, voir nulle. En outre, si la boue contient déjà une substance inhibitrice, l'essai avec la substance donnera des résultats erronés. Ces exemples, et de nombreux autres facteurs identifiés, peuvent produire de faux résultats. Ils sont indiqués dans l'Appendice 3, conjointement à des méthodes permettant d'éliminer ou au moins de réduire les erreurs.
|
MODE OPÉRATOIRE
|
23.
|
Le nombre de répétitions requis dépend du degré de précision exigé pour les indices d'inhibition. Si les bouchons des flacons sont suffisamment étanches aux gaz pendant la durée du test, ne préparer qu'un seul lot (au moins trois répétitions) de flacons d'essai à chaque concentration requise. En parallèle, préparer un lot de flacons avec la substance chimique de référence et un ensemble de témoins. Toutefois, lorsque la fiabilité des bouchons des flacons n'est assurée que pour une ou quelques percées, préparer un lot (par exemple trois répétitions) des flacons d'essai pour chaque intervalle de temps (t) auquel sont requis les résultats à toutes les concentrations d'une substance chimique chimique d'essai. Parallèlement, préparer des lots 't' de flacons équivalents pour la substance chimique de référence et les témoins.
|
|
24.
|
L'utilisation d'une boîte à gants [paragraphe 12 j)] est recommandée. Au moins 30 minutes avant le début de l'essai, faire passer un courant d'azote à travers la boîte à gants contenant tout l'équipement nécessaire. S'assurer que la température de la boîte est 35 °C ± 2 °C pendant la manipulation et la fermeture hermétique des flacons.
|
Essai préliminaire
|
25.
|
Lorsque l'activité de la boue est inconnue, il est recommandé de procéder à un essai préliminaire. Préparer des témoins dont les concentrations de matières solides s'élèvent à 10 g/l, 20 g/l et 40 g/l, par exemple, additionnés de substrat, mais sans substance d'essai. Utiliser également différents volumes de mélange réactionnel afin de disposer de trois ou quatre rapports entre volume d'espace libre et volume de liquide. On choisira parmi les résultats de volumes de gaz produits à divers intervalles de temps les conditions les mieux appropriées à l'obtention de deux mesures quotidiennes caractérisées par des volumes significatifs de gaz et une libération de pression par jour avec une sensibilité optimale (20) sans risque d'explosion.
|
Addition des substances chimiques d'essai
|
26.
|
Ajouter les substances chimiques d'essai hydrosolubles aux flacons d'essai vides [paragraphe 12(b)] sous forme de solutions aqueuses (paragraphe 18). Utiliser des lots de flacons comportant au moins trois répétitions pour chaque concentration de l'intervalle (paragraphe 20). Lorsque les substances chimiques d'essai sont insolubles ou médiocrement solubles, les injecter en solution dans des solvants organiques à l'aide d'une micro-seringue dans les flacons vides pour préparer des lots de répétition des cinq concentrations de substance d'essai. Evaporer le solvant par purge à l'aide d'un jet d'azote gazeux sur la surface des solutions dans les flacons d'essai. Il est également possible d'ajouter des quantités pesées des produits chimiques insolubles solides directement dans les flacons d'essai.
|
|
27.
|
Les substances chimiques d'essai liquides insolubles et médiocrement solubles dans l'eau ajoutées sans solvant sont introduites directement par une micro-seringue dans les flacons d'essai après addition de l'inoculum et du substrat d'essai (voir paragraphe 30). Cette technique peut également s'appliquer aux substances d'essai volatiles.
|
Addition d'inoculum et de substrat
|
28.
|
Agiter un volume approprié de boue de digestion tamisée (voir paragraphe 16) dans un flacon de 5 litres [paragraphe 12 (g)], en faisant passer un courant d'azote dans l'espace vide. Purger les flacons d'essai, qui contiennent les solutions aqueuses ou les solutions dans un solvant évaporé de substances d'essai, avec un courant d'azote, pendant environ 2 minutes pour éliminer l'air. Répartir des fractions aliquotes, par exemple de 100 ml, de boue bien mélangée dans les flacons d'essai à l'aide d'une pipette à grande pointe ou d'une éprouvette graduée. Il est essentiel de remplir la pipette en une seule fois jusqu'au volume exact de boue nécessaire, car les matières solides de la boue sédimentent facilement. Dans le cas d'un prélèvement trop important, vider la pipette et recommencer.
|
|
29.
|
Ajouter ensuite une quantité suffisante de solution de substrat (paragraphe 17) pour ajuster à 2 g /l la concentration dans le mélange de chacun des composants suivants: bouillon nutritif, extrait de levure et D-glucose, tout en poursuivant la purge à l'azote. Le tableau suivant présente un exemple de lots d'essai
|
Concentration finale en masse de la substance chimique d'essai dans les flacons d'essai
(mg/l)
|
Volume de substance chimique d'essai
(ml)
|
Réactifs et milieux
(ml)
|
|
Solution stock a)10 g/lpara. 18
|
Solution stock b)1 g/lpara. 18
|
Dilution dans l'eau
para. 14
|
Inoculum
para. 16
|
Substrat
para. 17
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Volume total du flacon = 160 ml. Volume de liquide = 103 ml
Volume de gaz = 57 ml, soit 35,6 % du volume total.
|
|
|
30.
|
Purger à l'azote de la même manière un nombre suffisant de flacons d'essai vides pour éliminer tout produit volatil et substance chimique d'essai liquide insoluble (voir paragraphe 27).
|
Témoins et substance chimique de référence
|
31.
|
Préparer des lots comportant au moins trois répétitions contenant seulement la boue et le substrat, en guise de témoins. Préparer également des flacons en deux exemplaires contenant de la boue et du substrat additionnés d'une quantité suffisante de solution mère de la substance chimique de référence, le 3,5- dichlorophénol (paragraphe 21) pour ajuster la concentration finale à 150 mg/l. Cette concentration devrait inhiber la production de gaz d'environ 50 %. Il est également possible de préparer la substance de référence à plusieurs concentrations couvrant un intervalle. Trois flacons supplémentaires serviront à la mesure du pH, et contiendront la boue, de l'eau désoxygénée et le substrat. Ajouter la substance chimique d'essai à deux flacons à la concentration la plus élevée de l'essai et ajouter de l'eau désoxygénée aux deux autres flacons.
|
|
32.
|
Il convient de s'assurer que toutes les flacons, d'essai, de substances de référence et témoins, contiennent le même volume (VR) de liquide; s'il y a lieu, ajouter de l'eau désionisée désoxygénée (paragraphe 14) pour ajuster le volume. L'espace libre doit représenter entre 10 % et 40 % du volume du flacon et sa valeur exacte est choisie en se fondant sur les données obtenues dans l'essai préliminaire. Après introduction de tous les constituants dans les flacons, retirer l'aiguille d'alimentation en gaz et fermer hermétiquement chaque flacon avec un bouchon de caoutchouc et une capsule d'aluminium (paragraphe 12 (b)) en humidifiant le bouchon avec une goutte d'eau désionisée pour faciliter son insertion. Mélanger le contenu de chaque flacon par agitation.
|
Incubation des flacons
|
33.
|
Transférer les flacons dans l'incubateur thermostaté, muni de préférence d'un dispositif d'agitation et maintenu à 35 °C ± 2 °C. Les flacons sont incubés à l'obscurité. Au bout d'environ 1 heure, équilibrer la pression dans les flacons avec la pression atmosphérique en insérant l'aiguille de seringue, reliée au manomètre (paragraphe 12(c)), à travers le bouchon de chaque flacon, ouvrir le robinet jusqu'à ce que le manomètre affiche zéro, puis fermer le robinet. Il convient d'insérer l'aiguille à un angle d'environ 45° pour éviter la fuite du gaz contenu dans les flacons. Si les flacons incubés sont dépourvus de dispositif d'agitation, les agiter manuellement deux fois par jour pendant toute la période d'incubation afin d'équilibrer le système. Incuber les flacons en position inversée pour éviter la perte de gaz à travers le septum. Toutefois, l'inversion est déconseillée dans le cas où des substances chimiques d'essai insolubles sont susceptibles d'adhérer au fond du flacon.
|
Mesures de pression
|
34.
|
Lorsque la température de tous les flacons a atteint 35 °C ± 2 °C, mesurer et noter le pH du contenu de deux des quatre flacons préparés à cette fin et en jeter le contenu. Poursuivre l'incubation des flacons restants à l'obscurité. Mesurer et noter la pression dans les flacons deux fois par jour pendant les 48 à 72 heures suivantes en insérant l'aiguille du manomètre à travers le bouchon de chaque flacon, tout à tour, et en séchant l'aiguille entre chaque mesure. Maintenir toutes les parties du flacon à la température d'incubation pendant la mesure, qui doit être réalisée aussi rapidement que possible. Noter la pression après stabilisation de la mesure. Ouvrir ensuite la soupape de ventilation et la refermer lorsque la valeur de la pression est revenue à zéro. L'essai dure habituellement 48 heures à partir de la première égalisation de la pression, désignée par “temps 0”. Dans le cas de substances chimiques volatiles, le nombre de mesures et de ventilations doit être réduit à un (à la fin de l'incubation) ou deux pour limiter au minimum la perte de substance d'essai (10).
|
|
35.
|
Si la mesure de pression donne un résultat négatif, il ne faut pas ouvrir la soupape. Il arrive que de l'humidité s'accumule dans l'aiguille et le tube de la seringue, ce qui se traduit par une valeur de pression faiblement négative. Dans ce cas, retirer la seringue, secouer le tube, le sécher avec un mouchoir en papier et monter une aiguille neuve.
|
Mesure du pH
|
36.
|
Mesurer et enregistrer le pH du contenu de chaque flacon après la mesure de pression finale.
|
RÉSULTATS ET RAPPORT
Expression des résultats
|
37.
|
La somme et la moyenne des pressions enregistrées sont calculées à chaque intervalle de temps pour chaque ensemble de flacons de répétition et la pression de gaz globale cumulée moyenne est calculée à chaque intervalle de temps pour chaque lot de répétitions. Tracer les courbes de production de gaz cumulée moyenne (Pa) en fonction du temps pour les flacons témoins, d'essai et de référence. Choisir un point temporel dans la partie linéaire de la courbe, généralement 48 heures, et calculer le pourcentage d'inhibition (1) pour chaque concentration par l'équation [1]:
|
I = (1 – Pt/PC) × 100
|
[1],
|
où
|
I
|
pourcentage d'inhibition;
|
|
Pt
|
pression gazeuse produite avec le matériau d'essai à un instant donné, en Pascal (Pa);
|
|
Pc
|
pression gazeuse produite dans le flacon témoin au même instant, en Pascal (Pa).
|
II est conseillé de tracer deux courbes, la courbe I en fonction de la concentration, et une autre courbe en fonction du logarithme de la concentration, de façon à choisir la courbe la plus proche de la linéarité. La valeur de CE50 (mg/l) est évaluée visuellement ou par analyse de régression à partir de la courbe la plus proche de la linéarité. A des fins de comparaison, il peut être utile d'exprimer la concentration de la substance en mg de substance/g de matières solides sèches totales. Pour obtenir cette concentration, il suffit de diviser la concentration volumique (mg/l) par la concentration volumique des matières solides de la boue sèche (g/l) (paragraphe 16).
|
|
38.
|
Calculer le pourcentage d'inhibition obtenu par l'unique concentration de la substance chimique de référence utilisée, ou bien la CE50 lorsqu'un nombre suffisant de concentrations a été analysé.
|
|
39.
|
Convertir la pression moyenne du gaz produit dans le flacon témoin Pc(Pa) en volume en se reportant à la courbe d'étalonnage du manomètre (Appendice 2) et de calculer ainsi le rendement en gaz, exprimé en volume produit en 48 heures par 100 ml de boue non diluée à une concentration de matières solides de 2 % (20 g/l) à 4 % (40 g/l).
|
Critères de validité
|
40.
|
Les résultats issus de l'essai ISO inter-laboratoires (5) montrent que la substance chimique de référence (3,5-dichlorophénol) provoque une inhibition de 50 % de la production de gaz dans un intervalle de concentrations allant de 32 mg/l à 510 mg/l, avec une moyenne de 153 mg/l (paragraphe 10). L'ampleur de cet intervalle ne permet pas d'établir des limites précises utilisables comme critères de validité, qui ne seront disponibles que lorsqu'auront été mises au point des techniques de production d'inoculums moins variables. Les volumes de gaz produits dans les flacons témoins en 48 heures étaient compris entre 21 ml/g de matières sèches de boue et 149 ml/g (moyenne 72 ml/g). Aucune relation évidente n'a pu être établie entre le volume de gaz produit et la valeur de CE50 correspondante. Le pH final variait entre 6,1 et 7,5.
|
|
41.
|
La validité de l'essai est reconnue si une inhibition supérieure à 20 % est obtenue dans le témoin de référence contenant 150 mg/l de 3,5-dichlorophénol, si plus de 50 ml de gaz par g de matières sèches sont produits dans le témoin à blanc et si la valeur du pH est comprise dans l'intervalle de 6,2 à 7,5 à la fin de l'essai.
|
Rapport d'essai
|
42.
|
Le rapport d'essai doit inclure les informations suivantes:
|
|
Substance chimique d'essai
|
—
|
nom courant, nom chimique, numéro CAS, formule structurale et propriétés physicochimiques pertinentes;
|
|
—
|
pureté (impuretés) de la substance chimique d'essai.
|
|
|
|
Conditions expérimentales:
|
—
|
volumes des contenus liquides et de l'espace vide dans les récipients d'essai;
|
|
—
|
description des récipients d'essai et de l'appareil de mesure des gaz (par exemple, type de manomètre);
|
|
—
|
ajout de la substance chimique d'essai et de la substance chimique de référence au système expérimental, concentrations expérimentales utilisées et recours à un solvant, le cas échéant;
|
|
—
|
détails sur l'inoculum utilisé: nom de la station d'épuration des eaux usées, description de la source des eaux usées traitées (par exemple, température de fonctionnement, temps de rétention de la boue, origine principalement domestique ou déchets industriels, etc.), concentration de matières solides, activité de production gazeuse du digesteur anaérobie, exposition préalable ou préadaptation éventuelle à des substances toxiques ou site de récolte de vase, de sédiments etc;
|
|
—
|
température d'incubation et intervalle;
|
|
|
|
Résultats:
|
—
|
valeurs de pH à la fin de l'essai;
|
|
—
|
toutes les valeurs mesurées dans les récipients d'essai, les témoins à blanc, les témoins contenant la substance chimique de référence, le cas échéant, (par exemple pression en Pa ou en millibars) sous forme de tableau;
|
|
—
|
pourcentage d'inhibition dans les flacons d'essai et de référence et courbes d'inhibition en fonction de la concentration;
|
|
—
|
calcul des valeurs de CE50, exprimées en mg/l et en mg/g;
|
|
—
|
production de gaz par gramme de boue en 48 heures;
|
|
—
|
motifs d'un rejet éventuel des résultats de l'essai;
|
|
—
|
discussion des résultats, en particulier mention de tous les écarts par rapport aux modes opératoires présentés dans cette méthode d'essai et discussion de tous les écarts observés dans les résultats d'essais dus à des interférences et à des erreurs par rapport aux résultats escomptés;
|
|
—
|
objectifs de l'essai: définir si l'essai était destiné à mesurer la toxicité de micro-organismes préalablement exposés ou non.
|
|
|
BIBLIOGRAPHIE
|
(1)
|
Chapitre C.11 de la présente annexe: Boues activées, essai d'inhibition de la respiration.
|
|
(2)
|
Chapitre C.43 de la présente annexe: Essai de biodégradabilité anaérobie des composés organiques dans une boue digérée: mesure du dégagement gazeux.
|
|
(3)
|
Organisation internationale de normalisation (2003) ISO 13 641-1 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 1: General Test.
|
|
(4)
|
Organisation internationale de normalisation (2003) ISO 13 641-2 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 2: Test for low biomass concentrations.
|
|
(5)
|
ISO (2000) Ring test of ISO 13 641-1 and ISO 13 641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
(6)
|
Swanwick JD, Foulkes M (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Pollut. Control, 70, 58-70.
|
|
(7)
|
HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, In: Methods for the Examination of Waters and Associated Materials UK.
|
|
(8)
|
Shelton DR, Tiedje JM (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47 850-857.
|
|
(9)
|
Battersby NS and Wilson V (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441-2460.
|
|
(10)
|
Wilson V, Painter HA and Battersby NS (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Germany (1990). Eds. Steinberg C and Kettrup A, pp117-132 (1992).
|
|
(11)
|
Kawahara K, Yakabe Y, Chida T, and Kida K (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007-2018.
|
|
(12)
|
Organisation internationale de normalisation (1995) ISO 10 634 Qualité de l'eau — Lignes directrices pour la préparation et le traitement de composés organiques peu solubles dans l'eau en vue de l'évaluation de leur biodégradabilité en milieu aqueux.
|
|
(13)
|
Organisation internationale de normalisation (1997) ISO 11 923 Qualité de l'eau — Dosage des matières en suspension par filtration sur filtre en fibres de verre.
|
Appendice 1
Exemple d'un appareil permettant de mesurer la production de biogaz d'après la pression gazeuse

Légende
|
1
|
—
|
Manomètre
|
|
2
|
—
|
Robinet 3 voies étanche aux gaz
|
|
3
|
—
|
Aiguille de seringue
|
|
4
|
—
|
Bouchon étanche aux gaz (septum et capsule sertis)
|
|
5
|
—
|
Espace libre
|
|
6
|
—
|
Inoculum de boue digérée
|
Récipient d'essai maintenu à 35 °C ± 2 °C
Appendice 2
Conversion des mesures manométriques
Les pressions relevées au manomètre peuvent être rapportées à des volumes gazeux à l'aide d'une courbe de référence à partir de laquelle le volume de gaz produit par gramme de boue sèche par 48 heures peut être calculé. Cet indice d'activité est l'un des critères d'évaluation de la validité des résultats de l'essai. La courbe de référence est obtenue en injectant des volumes de gaz connus à 35 °C ± 2 °C dans des flacons à sérum contenant un volume d'eau égal à celui du mélange réactionnel, VR;
|
—
|
Verser des fractions aliquotes de VR ml d'eau, maintenues à 35 °C ± 2 °C dans cinq flacons à sérum. Fermer hermétiquement les flacons et les plonger dans un bain d'eau à 35 °C ± 2 °C pendant 1 heure pour les laisser s'équilibrer;
|
|
—
|
Enclencher le manomètre, attendre qu'il se stabilise et le régler à zéro;
|
|
—
|
Insérer l'aiguille de la seringue à travers le bouchon de l'un des flacons, ouvrir le robinet jusqu'à ce que le manomètre indique zéro et fermer le robinet;
|
|
—
|
Répéter ce processus avec les autres flacons;
|
|
—
|
Injecter 1 ml d'air à 35 °C ± 2 °C dans chaque flacon. Insérer l'aiguille (montée sur le manomètre) à travers le bouchon de l'un des flacons et attendre que la valeur affichée se stabilise. Noter la pression, ouvrir le robinet jusqu'à ce que la pression retombe à zéro, puis fermer le robinet;
|
|
—
|
Répéter ce processus avec les autres flacons;
|
|
—
|
Répéter la totalité du processus en appliquant des volumes d'air de 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml et 50 ml;
|
|
—
|
Tracer une courbe de conversion de la pression (Pa) en fonction du volume de gaz injecté (ml). La réponse de l'instrument est linéaire sur l'intervalle compris entre 0 Pa et 70 000 Pa, et entre 0 ml et 50 ml de gaz produit.
|
Appendice 3
Identification des facteurs à l'origine de résultats erronés
a) Qualité des bouchons de flacons
Différents types de septums pour les flacons de sérums sont disponibles dans le commerce; nombre d'entre eux, en particulier le caoutchouc butyle, perdent leur étanchéité après avoir été percés d'une aiguille dans les conditions de cet essai. Il arrive que la pression chute très lentement une fois le septum percé par l'aiguille de seringue. L'utilisation de septums étanches aux gaz est recommandée pour éviter les fuites [paragraphe 12 b)].
b) Humidité dans l'aiguille de la seringue
L'humidité s'accumule parfois dans l'aiguille et le tube de la seringue, ce qui est signalé par une valeur de pression faiblement négative. Cet incident est corrigé en retirant l'aiguille et en secouant le tube, en le séchant avec un mouchoir en papier et en montant une aiguille neuve (paragraphes 12 c) et 35).
c) Contamination par l'oxygène
Les méthodes anaérobies sont sensibles aux erreurs engendrées par une contamination par l'oxygène qui peut réduire la production de gaz. L'utilisation de techniques strictement anaérobies, en particulier grâce à la boîte à gants, permet de restreindre au minimum ces problèmes.
d) Substrats bruts dans la boue
La production anaérobie de gaz et la sensibilité de la boue sont influencées par des substrats transférés avec l'inoculum dans les flacons d'essais. La boue digérée provenant de digesteurs anaérobies domestiques contient encore souvent des matières identifiables comme des poils et des résidus végétaux de cellulose, qui compliquent la tâche de prélèvement d'échantillons représentatifs. Les matières insolubles grossières peuvent être éliminées de la boue par tamisage, pour augmenter la représentativité de l'échantillonnage (paragraphe 16).
e) Substances chimiques d'essai volatiles
Les substances chimiques d'essai volatiles se dégagent dans l'espace vide des flacons d'essai. Elles sont donc susceptibles de s'échapper en partie du système pendant la ventilation qui suit les mesures de pression, ce qui se traduira par des valeurs de CE50 fictivement élevées. Ce type d'erreurs peut être réduit par le choix approprié d'un rapport volume vide à volume de liquide et par la suppression de la ventilation après les mesures de pression (10).
f) Non-linéarité de la production de gaz
Lorsque la courbe de production de gaz cumulée moyenne en fonction de la durée d'incubation ne tend pas vers la linéarité pendant la période de 48 h, la précision de l'essai peut diminuer. Il est conseillé, pour résoudre ce problème, d'utiliser une boue de digestion d'origine différente ou d'ajouter des concentrations plus élevées de substrat d'essai et de bouillon de nutriment, d'extrait de levure et de glucose (paragraphe 29).
Appendice 4
Application aux échantillons environnementaux à faible concentration de biomasse — vases anaérobies, sédiments, etc.
INTRODUCTION
A.1 En général, l'activité microbienne spécifique (volume de gaz produit par gramme de solides secs) des vases, des sédiments, et des sols anaérobies naturels est très inférieure à celle d'une boue anaérobie prélevée dans des eaux usées. C'est pourquoi il est nécessaire de modifier certaines conditions expérimentales pour mesurer les effets inhibiteurs de produits chimiques sur ces échantillons moins actifs. Dans ce cas, deux approches sont possibles:
|
a)
|
Procéder un essai préliminaire modifié (paragraphe 25) avec l'échantillon de vase, de sol, etc non dilué à 35 °C ± 2 °C ou à la température du site de prélèvement de l'échantillon, pour optimiser la simulation (comme c'est le cas dans la partie 1 de la norme ISO 13 641);
|
|
b)
|
ou bien mettre en œuvre l'essai avec une boue de digesteur diluée (100 fois) afin de simuler l'activité réduite escomptée de l'échantillon environnemental, tout en maintenant la température à 35 °C ± 2 °C (comme dans la partie 2 de la norme ISO 13 641).
|
A.2 L'option (a) peut être adoptée conformément à la méthode décrite ici (qui est équivalente à la partie 1 de la norme ISO 13 641), mais il est essentiel de déterminer les conditions optimales par un essai préliminaire (paragraphe 25), à moins qu'elles ne soient déjà connues grâce à des essais antérieurs. L'échantillon de vase ou de sédiment doit être parfaitement mélangé, par exemple dans un mélangeur, et, s'il y a lieu, dilué avec une proportion mineure d'eau de dilution désaérée (paragraphe 14) afin de lui conférer une fluidité suffisante pour son transfert par une pipette à large pointe ou une éprouvette graduée. Dans le cas où l'on estime que la quantité de nutriments pourrait être insuffisante, il est possible de centrifuger l'échantillon de vase (en conditions anaérobies) et de le remettre en suspension dans un milieu minéral contenant de l'extrait de levure (A.11).
A.3 Option (b). Cette approche reproduit convenablement l'activité réduite des échantillons environnementaux, à l'exception de la concentration élevée en matières solides en suspension présente dans ces échantillons. Le rôle qu'elles jouent dans l'inhibition est inconnu, mais une réaction éventuelle entre les substances chimiques d'essai et les constituants de la vase, ou bien l'adsorption des substances chimiques d'essai sur les solides, pourrait réduire la toxicité de la substance chimique d'essai.
A.4 La température est un autre facteur important: une simulation rigoureuse exige de procéder aux essais à la température du site d'échantillon, sachant que des groupes différents de consortium méthanogènes de bactéries sont fonctionnels dans des intervalles de températures différents, à savoir les groupes thermophiles (~ 30-35 °C), mésophiles (20-25 °C) et psychrophiles (< 20 °C), dont les modèles d'inhibition peuvent être différents.
A.5 Durée. Dans l'essai général, Partie 1, sur boue non diluée, la production de gaz en 2-4 jours suffit toujours largement, tandis que dans la partie 2 sur boue diluée 100 fois, la production de gaz, lorsqu'elle existe, s'est révélée insuffisante dans ce délai selon l'essai tournant. Madsen et al (1996), dans leur description de ce second type d'essai, proposent une période de 7 jours.
Essais avec une faible concentration de biomasse (option b)
Les modifications et amendements suivants doivent être apportés, et s'ajoutent à certains des paragraphes ou sous-paragraphes existants du texte principal ou les remplacent.
A.6 Ajout au paragraphe 6: Principe de l'essai;
“Cette technique peut être utilisée avec une boue anaérobie diluée 100 fois, pour simuler en partie la faible activité des vases et des sédiments. La température d'incubation peut être égale à 35 °C, ou à la température du site de prélèvement de l'échantillon. En raison d'une activité bactérienne très inférieure à celle d'une boue non diluée, la période d'incubation peut être prolongée jusqu'à au moins 7 jours.”
A.7 Ajout au paragraphe 12 (a):
“l'incubateur doit être capable de fonctionner à des températures de l'ordre de 15 °C.”
A.8 Ajout d'un réactif supplémentaire après le paragraphe 13:
“Acide phosphorique (H3PO4), 85 % en masse dans l'eau.”
A.9 Ajout à la fin du paragraphe 16:
“Utiliser une concentration finale de 0,20 ± 0,05 g/l de matières solides sèches totales dans l'essai.”
A.10 Paragraphe 17. Substrat d'essai
Ce substrat n'est pas utilisé, mais remplacé par de l'extrait de levure (voir paragraphes 17; A.11, A.12, A.13).
A.11 La boue anaérobie doit être diluée par un milieu minéral, contenant des oligo-éléments, et le substrat organique, l'extrait de levure, est ajouté pour des raisons pratiques à ce milieu.
Ajout après le paragraphe 17:
|
“(a)
|
Milieu minéral d'essai, contenant de l'extrait de levure.
|
Ce milieu est préparé à partir d'un milieu d'essai concentré 10 fois [paragraphe 17 (b); A.12] contenant une solution d'oligo-éléments [paragraphe 17 (c); A.13]. Utiliser du sulfure de sodium nonahydraté préparé extemporanément (paragraphe 17 (b); A.12) ou lavé et séché avant utilisation afin de s'assurer qu'il soit suffisamment réducteur. Dans le cas où l'essai est mis en œuvre sans boîte à gants [paragraphe 12 (j)], la concentration finale de sulfure de sodium dans la solution mère peut être portée à 2 g/l [au lieu de 1 g/l]. Le sulfure de sodium peut également être ajouté à partir d'une solution mère appropriée à travers le septum des flacons d'essai fermés, ce mode opératoire diminuant le risque d'oxydation, jusqu'à obtenir une concentration finale de 0,2 g/l. On peut également utiliser du citrate de titane (III) [paragraphe 17 (b)]. Celui-ci est ajouté à travers le septum des flacons d'essai fermés, pour ajuster la concentration entre 0,8 mmol/l et 1,0 mmol/l. Le citrate de titane (III) est un agent réducteur très efficace et peu toxique que l'on peut préparer de la manière suivante: dissoudre 2,94 g de citrate de sodium dihydraté dans 50 ml d'eau de dilution sans oxygène (paragraphe 14) (on obtient alors une solution à 200 mmol/l) et ajouter 5 ml d'une solution de chlorure de titane (II) (15 g/100 ml d'eau de dilution). Neutraliser à pH 7± 0,5 avec du carbonate de sodium et verser dans un flacon à sérum approprié sous un courant d'azote gazeux. La concentration du citrate de titane (III) dans cette solution mère est égale à 164 mmol/l. Utiliser le milieu d'essai immédiatement ou bien le conserver à 4 °C pendant une journée au maximum.
|
A.12
|
b)
|
Milieu d'essai concentré 10 fois, préparé à partir des composants suivants:
|
dihydrogénophosphate de potassium anhydre (KH2PO4)
|
2,7 g
|
|
hydrogénophosphate de sodium (Na2HPO4)
|
4,4 g
|
|
(ou 11,2 g de dodécahydrate)
chlorure d'ammonium (NH4Cl)
|
5,3 g
|
|
chlorure de calcium dihydraté (CaCl2 · 2H2O)
|
0,75 g
|
|
chlorure de magnésium hexahydraté (MgCl2 · 6H2O)
|
1,0 g
|
|
chlorure de fer (II) tétrahydraté (FeSO4 · 4H2O)
|
0,2 g
|
|
résazurine (indicateur d'oxygène)
|
0,01 g
|
|
sulfure de sodium nonahydraté (Na2S · 9H2O)
|
1,0 g
|
|
[ou citrate de titane (III) citrate] concentration finale
|
0,8 mmol/l à 1,0 mmol/l
|
|
solution d'oligo-élément [voir paragraphe 17 (c); A.13]
|
10,0 ml
|
|
extrait de levure
|
100 g
|
|
dissoudre dans de l'eau de dilution (paragraphe 14) et ajuster à:
|
1 000 ml
|
|
|
A.13
|
c)
|
Solution d'oligo-éléments, préparée à partir des composants suivants:
|
chlorure de manganèse (II) tétrahydraté (MnCl2 · 4H2O)
|
0,5 g
|
|
acide ortho-borique (H3BO3)
|
0,05 g
|
|
chlorure de zinc (ZnCl2)
|
0,05 g
|
|
chlorure de cuivre (II) (CuCl2)
|
0,03 g
|
|
molybdate de sodium dihydraté (Na2MoO4 · 2H2O)
|
0,01 g
|
|
chlorure de cobalt (II) hexahydraté (CoCl2 · 6H2O)
|
1,0 g
|
|
chlorure de nickel (II) hexahydraté (NiCl2 · 6H2O)
|
0,1 g
|
|
sélénite de sodium (Na2SeO3)
|
0,05 g
|
|
dissoudre dans de l'eau de dilution (paragraphe 14) et ajuster à:
|
1 000 ml”
|
|
A.14 Paragraphe 25: Essai préliminaire
Il est essentiel de procéder à un essai préliminaire comme il est décrit dans le paragraphe 24, mais en employant des concentrations de matières solides de boue égales à un centième de celles indiquées, c'est-à-dire 0,1 g/l, 0,2 g/l et 0,4 g/l. La durée d'incubation doit être d'au moins 7 jours.
Note: Dans l'essai tournant (5), le volume vide, qui représentait 75 % du volume total, était beaucoup trop élevé. Il devrait se situer dans l'intervalle recommandé de 10 %-40 %. Le critère décisif à satisfaire est l'obtention d'un volume de gaz produit mesurable avec une précision acceptable (par exemple ± 5 % à ± 10 %) pour une inhibition d'environ 80 %.
A.15 Paragraphes 26 à 30: Addition de substance chimique d'essai, d'inoculum et de substrat.
L'introduction de ces composants est identique à celle qui est décrite dans ces paragraphes, en remplaçant la solution de substrats (paragraphe 17) par le milieu d'essai additionné de substrat d'extrait de levure (A.11).
En outre, la concentration finale de matières solides de boue sèche est réduite de 2 g/l – 4 g/l à 0,2 ± 0,05 g/l (A.9). Le tableau A.1, qui remplace le tableau du paragraphe 29, présente deux exemples d'addition des composants au mélange d'essai.
A.16 Paragraphe 33: Incubation des flacons
La vitesse de production de gaz attendue étant plus faible, l'incubation dure au moins 7 jours.
A.17 Paragraphe 34: Mesures de pression
Le mode opératoire de mesure de la pression dans l'espace vide des flacons est identique à celui décrit au paragraphe 34 lorsqu'il est aussi nécessaire d'analyser les quantités dans la phase gazeuse. Lorsque l'on mesure les quantités totales de CO2 et de CH4, le pH de la phase liquide est abaissé à environ pH 2 par l'injection de H3PO4 dans chaque flacon concerné et la pression est mesurée au bout de 30 minutes d'agitation à la température de l'essai. Toutefois, la mesure de la pression dans chaque flacon avant et après acidification fournira davantage d'informations sur la qualité de l'inoculum. Par exemple, si le CO2 est produit beaucoup plus rapidement que le méthane, la sensibilité des bactéries fermentaires est peut-être modifiée, ou bien les bactéries méthanogènes sont préférentiellement affectées par la substance chimique d'essai.
A.18 Paragraphe 36: mesure du pH
S'il est nécessaire d'utiliser du H3PO4, il convient de préparer quelques flacons supplémentaires sans addition de H3PO4, en particulier pour la mesure du pH.
RÉFÉRENCE:
Madsen, T, Rasmussen, HB; and Nilsson, L (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No.336, Water Quality Institute, Danish Environment Protection Agency, Copenhagen.
Tableau A.1
Exemples d'organisation de l'essai pour des lots d'essai
|
Mélange réactionnel composants
|
Exemple 1
|
Exemple 2
|
Ordre normal d'addition
|
|
Concentration de l'inoculum préparé (g/l)
|
0,42
|
2,1
|
—
|
|
Volume d'inoculum ajouté (ml)
|
45
|
9
|
4
|
|
Concentration d'inoculum dans les flacons d'essai (g/l)
|
0,20
|
0,20
|
—
|
|
Volume de milieu d'essai ajouté (ml)
|
9
|
9
|
2
|
|
Volume d'eau de dilution ajouté (ml)
|
36
|
72
|
3
|
|
Concentration d'extrait de levure dans les flacons d'essai (g/l)
|
9,7
|
9,7
|
—
|
|
Volume de solution mère de substance chimique d'essai (ml)
|
3
|
3
|
1
|
|
Volume total de liquide (ml) i
|
93
|
93
|
—
|
Appendice 5
Définitions
Aux fins de la présente méthode d'essai, les définitions suivantes s'appliquent:
Substance chimique
: une substance ou un mélange.
Substance chimique d'essai
: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
C.35 ESSAI DE TOXICITÉ SUR LUMBRICULUS DANS UN SYSTÈME EAU-SÉDIMENT CHARGÉ
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 225 (2007) de l'OCDE pour les essais de produits chimiques. Les animaux endobenthiques qui ingèrent des sédiments sont soumis à un risque d'exposition substantielle aux substances liées aux sédiments, et soulèvent par conséquent un grand intérêt, par exemple (1), (2), (3). Parmi les organismes de ce type, les oligochetes aquatiques jouent un rôle important dans les sédiments des systèmes aquatiques. Leur implication dans la bioturbation du sédiment et leur fonction de proie pourraient leur conférer une influence considérable sur la biodisponibilité de ces substances pour d'autres organismes, par exemple les poissons benthivores. Au contraire des organismes épibenthiques, les oligochetes aquatiques endobenthiques, (par exemple, Lumbriculus variegatus) s'enfouissent dans le sédiment et ingèrent des particules en dessous de la surface sédimentaire. L'exposition des organismes expérimentaux aux substances chimiques d'essai par toutes les voies d'absorption possibles (par exemple contact, ingestion de particules de sédiment contaminé, mais également par l'intermédiaire de l'eau interstitielle, et de l'eau sus-jacente) est ainsi assurée.
|
|
2.
|
La présente méthode d'essai a pour objectif d'évaluer les effets d'une exposition prolongée de l'oligochete endobenthique Lumbriculus variegatus (Müller) aux substances chimiques associées au sédiment. Elle est fondée sur des protocoles existants d'essais de toxicité et de bioaccumulation dans les sédiments, par exemple (3), (4), (5), (6), (7), (8), (9), (10). La méthode est décrite dans des conditions d'essai statiques. Le mode d'exposition utilisé dans cette méthode d'essai consiste à charger le sédiment de la substance chimique d'essai, dans l'intention de l'utiliser pour simuler un sédiment contaminé par la substance chimique d'essai.
|
|
3.
|
Les substances qu'il faut tester sur des organismes vivant dans le sédiment présentent généralement une persistance de longue durée dans ce compartiment. Plusieurs voies d'exposition sont valides pour les organismes résidant dans ce milieu. L'importance relative de chaque voie et le délai nécessaire à leur contribution aux effets toxiques globaux dépendent des propriétés physico-chimiques du produit concerné et de sa destination finale dans l'animal. Dans le cas des substances dont l'absorption est très élevée (par exemple, avec log Koe > 5) ou de substances liées par covalence aux sédiments, l'ingestion d'aliments contaminés peut se révéler une voie d'exposition significative. Pour éviter toute sous-estimation de la toxicité de ces substances, les aliments nécessaires à la reproduction et à la croissance des organismes d'essai sont ajoutés au sédiment avant application de la substance chimique d'essai (11). La méthode décrite ici est suffisamment détaillée pour permettre la conduite de l'essai tout en admettant des adaptations du modèle expérimental aux conditions des laboratoires concernés et aux diverses caractéristiques des substances chimiques d'essais.
|
|
4.
|
La méthode expérimentale a pour objectif de déterminer les effets d'une substance chimique d'essai sur la reproduction et la biomasse des organismes d'essai. Les paramètres biologiques mesurés sont les suivants: nombre total de vers survivants et biomasse (poids sec) en fin d'exposition. Ces données sont analysées à l'aide d'un modèle de régression afin d'estimer la concentration responsable d'un effet de x % (par exemple CE50, CE25, et CE10), ou par vérification d'une hypothèse statistique visant à déterminer la concentration sans effet observé (CSEO) et la concentration minimale avec effet observé (CMEO).
|
|
5.
|
Le chapitre C.27 de la présente annexe “Essai de toxicité sur les chironomes dans un système eau-sédiment dopé” (6) fournit de nombreux détails essentiels et utiles à la mise en œuvre de la présente méthode d'essai de toxicité sur sédiment. Par conséquent, ce document a servi de base à laquelle ont été apportées les modifications nécessaires à la réalisation d'essais de toxicité sur sédiment avec Lumbriculus variegatus. On se référera également, par exemple, aux documents suivants: ASTM Standard Guide for Determination of the Bioaccumulation of Sediment-Associated Contaminants by Benthic Invertebrates (3), the U.S. EPA Methods for Measuring the Toxicity and Bioaccumulation of Sediment-Associated Contaminants with Freshwater Invertebrates (7), et ASTM Standard Guide for Collection, Storage, Characterization, and Manipulation of Sediments for Toxicological Testing and for selection of samplers used to collect benthic invertebrates (12). De surcroît, l'expérience pratique acquise pendant l'essai circulaire de la méthode [(13), rapport d'essai circulaire], et les précisions recueillies dans la littérature constituent des sources d'informations importantes pour la rédaction de ce document.
|
PRÉREQUIS ET RECOMMANDATIONS
|
6.
|
Il conviendra d'obtenir avant le début de l'étude des informations concernant la substance chimique d'essai, par exemple, en termes précautions à prendre pour assurer la sécurité, de conditions de stockage appropriées et de méthodes analytiques. Des conseils à propos des substances d'essai dont les propriétés physicochimiques compliquent la mise en œuvre de l'essai sont proposés dans (14).
|
|
7.
|
Avant la réalisation d'un essai, les informations suivantes sur la substance chimique d'essai doivent être disponibles:
|
—
|
nom courant, nom chimique (de préférence nom IUPAC), formule structurale, numéro d'enregistrement CAS, pureté;
|
|
|
8.
|
Les informations complémentaires suivantes sont estimées utiles avant le début de l'essai:
|
—
|
coefficient de partage octanol-eau, Koe;
|
|
—
|
coefficient de partage carbone organique-eau, exprimé par Kco;
|
|
—
|
phototransformation dans l'eau;
|
|
|
9.
|
Des informations sur certaines caractéristiques du sédiment utilisé doivent être connues avant de commencer l'essai (7). On se référera aux paragraphes 22 à 25 pour plus de détails à ce sujet.
|
PRINCIPE DE L'ESSAI
|
10.
|
Des vers dans un état physiologique similaire (synchronisés comme il est décrit dans l'Appendice 5) sont exposés à une substance toxique à une série de concentrations appliquées à la phase sédiment d'un système sédiment-eau. Il convient d'utiliser comme milieu un sédiment artificiel et de l'eau reconstituée. Des récipients expérimentaux sans adjonction de substance chimique d'essai servent de témoins. La substance chimique d'essai est introduite dans le sédiment dans un grand volume à chaque concentration afin de réduire au minimum la variabilité entre les expériences identiques et les organismes d'essai sont inoculés ensuite dans les récipients dans lesquels ont été équilibrées les concentrations de sédiments et d'eau (voir paragraphe 29). Les animaux d'essai sont exposés au système sédiment-eau pendant une durée de 28 jours. Le sédiment artificiel ne contenant que de petites quantités de nutriments, il faut l'enrichir par l'apport d'une source d'aliments (voir paragraphes 22 à 23, et Appendice 4) afin de garantir la croissance et la reproduction des vers dans des conditions contrôlées. On s'assure ainsi que l'exposition des animaux expérimentaux s'opère par l'intermédiaire de l'eau et du sédiment ainsi que par leur alimentation.
|
|
11.
|
L'effet préférentiellement analysé dans ce type d'étude est la CEx (par exemple CE50, CE25, et CE10; concentration avec un effet qui affecte x % des organismes expérimentaux) pour la reproduction et la biomasse, respectivement, relativement au témoin. Toutefois, il convient de noter qu'en raison de l'incertitude élevée qui marque les CEx aux basses valeurs (e.g. CE10, CE25), qui sont associées à des limites de confiance de 95 % extrêmement élevées (par exemple (15)) et de la puissance statistique calculée au cours de la vérification de l'hypothèse, la CE50 est considérée comme le résultat le plus fiable. En outre, on peut calculer la concentration sans effet observé (CSEO) et la concentration minimale avec effet observé (CMEO) pour la biomasse et la reproduction, sous réserve que le modèle d'essai et les résultats permettent ces calculs (voir paragraphes 34 à 38). L'objectif de l'étude, CEx ou calcul de la CSEO, déterminera le modèle de l'essai.
|
ESSAI DE RÉFÉRENCE
|
12.
|
La capacité d'un laboratoire à mener l'essai est d'ordinaire amplement démontré par les performances des organismes témoins, et, lorsque des données historiques sont disponibles, par la répétabilité de l'essai. Il est également possible de mener des essais de toxicité de référence à intervalles réguliers en employant un produit toxique de référence permettant d'évaluer la sensibilité des organismes d'essai. Des tests de toxicité de référence de 96 h dans l'eau devraient suffire à démontrer la sensibilité et la condition des animaux expérimentaux (4)(7). L'Appendice 6 présente des informations sur la toxicité du pentachlorophénol (PCP) dans des essais réalisés (exposition de 28 jours à du sédiment chargé), ainsi que le rapport sur l'essai circulaire de la méthode d'essai (13). La toxicité aiguë du PCP en présence d'eau seule est décrite dans, par exemple, (16). Ces informations peuvent permettre la comparaison de la sensibilité de l'organisme expérimental dans des essais de référence, le PCP faisant fonction de produit toxique de référence. Les produits toxiques de référence recommandés pour L. variegatus sont le chlorure de potassium (KCl) ou le sulfate de cuivre (CuSO4) (4)(7). Il est difficile à ce jour d'établir des critères de qualité fondés sur des données de toxicité du KCl, car les résultats de la littérature sur L. variegatus font défaut. Des informations sur la toxicité du cuivre sur L. variegatus sont fournies dans (17) à (21).
|
VALIDITÉ DE L'ESSAI
|
13.
|
Un essai est validé aux conditions suivantes:
|
—
|
Un essai circulaire (13) a montré que dans le cas de Lumbriculus variegatus, une augmentation d'un facteur d'au moins 1,8 du nombre moyen des vers vivants par expérience dans les témoins entre le début et la fin de l'exposition doit être atteinte.
|
|
—
|
Le pH de l'eau sus-jacente doit être compris entre 6 et 9 pendant toute la durée de l'essai.
|
|
—
|
La concentration d'oxygène dans l'eau sus-jacente ne doit pas descendre en dessous de 30 % de sa valeur dans l'air saturé (VAS) à la température appliquée pendant l'essai.
|
|
DESCRIPTION DE LA MÉTHODE D'ESSAI
Système expérimental
|
14.
|
Il est recommandé d'utiliser des systèmes statiques sans renouvellement de l'eau sus-jacente. Lorsque le rapport sédiment à eau (voir paragraphe 15) est adéquat, une légère aération suffira habituellement au maintien de la qualité de l'eau à des niveaux acceptables pour les organismes de l'essai (par exemple, avec obtention de niveaux maximaux d'oxygène dissous et accumulation minimale de produits d'excrétion). Il conviendra de réserver l'utilisation de systèmes semi-statiques ou à écoulement continu avec renouvellement intermittent ou continu de l'eau sus-jacente à des cas exceptionnels, car le renouvellement régulier de l'eau sus-jacente est susceptible d'affecter l'équilibre chimique (par exemple, déperditions de substance chimique d'essai par le système expérimental).
|
Récipients et appareils expérimentaux
|
15.
|
L'exposition doit être mise en œuvre dans des béchers en verre, par exemple, de 250 ml, et de 6 cm de diamètre. Il est possible d'utiliser d'autres récipients en verre appropriés, sous réserve qu'ils garantissent une profondeur convenable d'eau sus-jacente et de sédiment. Une couche d'environ 1,5-3 cm de sédiment formulé sera introduite dans chaque récipient. Le rapport de la profondeur de la couche de sédiment à la profondeur de la couche d'eau sus-jacente doit être égal à 1:4. Le volume des récipients doit être adapté au taux de charge, c'est-à-dire au nombre de vers de l'essai ajoutés par unité pondérale de sédiment (voir également paragraphe 39).
|
|
16.
|
Les récipients expérimentaux et les autres appareils susceptibles d'entrer en contact avec la substance chimique d'essai doivent être entièrement constitués de verre ou d'un autre matériau chimiquement inerte. Il conviendra d'éviter avec soin l'utilisation dans toutes les parties de l'équipement de matériaux capables de dissoudre ou d'absorber les substances chimiques d'essai ou de laisser s'échapper d'autres substances exerçant un effet indésirable sur les animaux de l'essai. Il faut utiliser du polytétrafluoréthylène (PTFE), de l'acier inoxydable et/ou du verre dans tous les équipements entrant en contact avec le milieu d'essai. En présence de substances organiques qui s'adsorbent sur le verre, il faudra éventuellement employer un verre silanisé. Dans ce cas, l'équipement sera jeté après utilisation.
|
Espèce expérimentale
|
17.
|
L'espèce expérimentale utilisée dans ce type d'études est l'oligochete d'eau douce Lumbriculus variegatus (Müller). Cette espèce tolère une large gamme de sédiments et est largement utilisée dans les essais de toxicité et de bioaccumulation dans les sédiments (par exemple, (3), (5), (7), (9), (13), (15), (16), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34), (35)). Il conviendra de définir l'origine des animaux de l'essai, de confirmer l'identité de l'espèce (par exemple (36)) et d'expliciter les conditions de culture. Il n'est pas nécessaire d'identifier l'espèce avant chaque essai lorsque les organismes proviennent d'une culture sur site.
|
Culture des organismes expérimentaux
|
18.
|
Afin de disposer d'un nombre suffisant de vers pour mener des essais de toxicité sur sédiment, il est utile de maintenir en permanence une culture de vers au laboratoire. Des directives pour les méthodes de culture en laboratoire de Lumbriculus variegatus, et des sources de culture de départ sont indiquées dans l'Annexe 5. Des détails sur la culture de cette espèce sont fournis dans les références (3), (7), (27).
|
|
19.
|
Il est fermement recommandé d'établir des cultures d'espèces individuelles pour garantir la mise en œuvre des essais sur des animaux de la même espèce. On s'assurera que les cultures, et en particulier les vers utilisés dans les essais, sont exemptes de maladies et d'anomalies visibles.
|
Eau
|
20.
|
L'utilisation dans les essais d'eau reconstituée conformément au chapitre C.1 de la présente annexe (37) comme eau sus-jacente est recommandée; on peut également l'utiliser pour les cultures des vers en laboratoire (voir Appendice 2 pour la préparation). Si nécessaire, de l'eau naturelle peut être utilisée. La qualité de l'eau choisie doit permettre la croissance et la reproduction de l'espèce expérimentale au cours des périodes d'acclimatation et d'essai, sans manifestation d'une apparence ou d'un comportement anormal quelconque. On a démontré que Lumbriculus variegatus survivait, se développait et se reproduisait dans ce type d'eau (30) et elle permet une standardisation maximale des conditions d'essai et de culture. Dans le cas de l'utilisation d'une eau reconstituée, il conviendra d'en indiquer la composition et de la caractériser avant son utilisation, au moins en termes de pH, de teneur en oxygène et de dureté (exprimée en mg de CaCO3/l). La détection d'éventuels micropolluants dans l'eau avant son utilisation devrait fournir des informations utiles (voir, par exemple, Appendice 3).
|
|
21.
|
Le pH de l'eau sus-jacente doit être compris dans l'intervalle de 6,0 à 9,0 (voir paragraphe 13). Si un dégagement d'ammoniac important est à prévoir, on considère qu'il est utile de maintenir le pH entre 6,0 et 8,0. Lors de l'analyse d'acides organiques faibles, par exemple, il est conseillé d'ajuster le pH en tamponnant l'eau utilisée dans l'essai, comme il est décrit, par exemple, dans (16). La dureté totale de l'eau utilisée dans l'essai doit être comprise entre 90 et 300 mg de CaCO3 par litre pour l'eau naturelle. L'Appendice 3 résume d'autres critères caractérisant une eau de dilution acceptable conformément à la Ligne directrice No 210 de l'OCDE (38).
|
Sédiment
|
22.
|
Les sédiments naturels non contaminés provenant d'une source particulière ne sont pas toujours disponibles tout au long de l'année, et des organismes indigènes ainsi que la présence de micropolluants peuvent influer sur l'essai, et par conséquent, il est préférable d'utiliser un sédiment formulé (également dénommé sédiment reconstitué, artificiel ou synthétique). L'utilisation d'un sédiment formulé limite la variabilité des conditions d'essais, ainsi que l'introduction d'une faune indigène. Le sédiment suivant a été formulé à partir du sédiment artificiel décrit dans (6), (39), et (40). Son utilisation est recommandée dans ce type d'essai [(6), (10), (30), (41), (42), (43)]:
|
a)
|
4-5 % (poids sec) de tourbe à sphaignes; il est important d'utiliser la tourbe sous forme pulvérisée avec un degré de décomposition “moyen”, finement broyée (dimension des particules ≤ 0,5 mm), et séchée uniquement à l'air.
|
|
b)
|
20 ± 1 % (poids sec) d'argile kaolinique (teneur en kaolinite de préférence supérieure à 30 %).
|
|
c)
|
75-76 % (poids sec) de sable quartzique (sable fin, dimension des grains: ≤ 2 mm, mais plus de 50 % des particules doivent mesurer de 50 à 200 μm).
|
|
d)
|
Eau désionisée, 30–50 % de poids sec du sédiment, en plus des composants du sédiment sec.
|
|
e)
|
Carbonate de calcium de qualité chimiquement pure (CaCO3), ajouté pour ajuster le pH du mélange final du sédiment.
|
|
f)
|
La teneur en carbone organique total (TCO) du mélange final doit être égale à 2 % (± 0,5 %) du poids sec de sédiment, ajustée à l'aide de quantité appropriée de tourbe et de sable, comme indiqué en (a) et (c).
|
|
g)
|
Des aliments, par exemple, feuilles pulvérisées d'ortie (Urtica sp., conformément aux normes pharmaceutiques, pour consommation humaine), ou un mélange de feuilles pulvérisées d'Urtica sp. avec de l'alpha-cellulose (1: 1), à 0,4 - 0,5 % de poids sec de sédiment, en plus des composants secs du sédiment; pour d'autres détails, on se référera à l'Appendice 4.
|
|
|
23.
|
Les sources de tourbe, d'argile kaolinique, d'aliments et de sable doivent être connues. Outre ceux du (g) ci-dessus, le chapitre C.27 de la présente annexe (6) énumère d'autres substances végétales susceptibles d'être utilisées comme sources d'aliments: feuilles déshydratées de mûrier (Morus alba), de trèfle blanc (Trifolium repens), d'épinard (Spinacia oleracea), ou céréales.
|
|
24.
|
La source d'aliments choisie doit être ajoutée avant ou pendant l'introduction de la substance chimique d'essai dans le sédiment. Elle doit permettre au moins une reproduction acceptable dans les échantillons témoins. L'analyse des micropolluants dans le sédiment artificiel ou ses constituants avant utilisation devrait fournir des informations utiles. Un exemple de préparation du sédiment formulé est décrit dans l'Appendice 4. Il est également possible de mélanger des constituants secs, sous réserve de démontrer qu'après l'addition de l'eau sus-jacente, il n'y a pas séparation des constituants du sédiment (par exemple particules de tourbe flottante) et que la tourbe ou le sédiment est suffisamment conditionné (voir également paragraphe 25 et Appendice 4). Il faut au moins caractériser le sédiment artificiel par l'origine de ses constituants, la distribution des tailles de grains (pourcentage de sable, limon et d'argile), sa teneur en carbone organique total (TCO), sa teneur en eau, et son pH. La mesure du potentiel redox est optionnelle.
|
|
25.
|
Le cas échéant, par exemple dans des objectifs d'analyse spécifique, il est possible d'utiliser des sédiments naturels provenant de sites non pollués comme sédiments d'essai et/ou de culture (3). Toutefois, dans ce cas, il conviendra de les caractériser au moins par leur origine (site de collecte), leur pH et la teneur en ammoniac de l'eau interstitielle, la teneur en carbone organique total (TCO) et la teneur en azote, la distribution de tailles de particules (pourcentage de sable, de limon et d'argile) et la proportion d'eau (7)), et ils devront être exempts de toute contamination et d'autres organismes susceptibles d'entrer en compétition avec les organismes de l'essai ou d'en faire des proies. La mesure du potentiel redox et de la capacité d'échange de cations est optionnelle. Il est également recommandé d'adapter le sédiment naturel pendant 7 jours aux paramètres appliqués dans l'essai consécutif avant d'introduire la substance chimique d'essai. A la fin de cette période de conditionnement, il faut retirer et jeter l'eau sus-jacente.
|
|
26.
|
La qualité du sédiment utilisé doit permettre la survie et la reproduction des organismes témoins tout au long de la période d'exposition, sans manifestation d'apparence ou de comportement anormal quelconque. Les vers témoins doivent s'enfouir dans le sédiment et l'ingérer. La reproduction dans les témoins doit au moins se conformer aux critères de validité présentés dans le paragraphe 13. La présence ou l'absence de granules fécaux sur la surface du sédiment, preuves de l'ingestion de sédiment par les vers, doit être notée et peut faciliter l'interprétation des résultats de l'essai relativement aux voies d'exposition. D'autres informations sur l'ingestion du sédiment peuvent être collectées par les méthodes décrites dans (24), (25), (44), et (45), qui caractérisent l'ingestion de sédiments ou la sélection de particules dans les organismes.
|
|
27.
|
Les protocoles de manipulation des sédiments naturels avant leur utilisation au laboratoire sont décrits dans (3), (7) et (12). La préparation et le stockage du sédiment artificiel dont l'utilisation est recommandée dans l'essai sur Lumbriculus sont décrits dans l'Appendice 4.
|
Application de la substance chimique d'essai
|
28.
|
La substance chimique d'essai doit être introduite dans le sédiment. La faible solubilité dans l'eau de la plupart des substances chimiques d'essai impose leur dissolution dans un solvant organique approprié (par exemple acétone, n-hexane, cyclohexane) dans un volume aussi faible que possible, lors de la préparation de la solution stock. La solution stock doit être diluée avec le même solvant pour préparer les solutions d'essai. Le choix d'un agent solubilisant approprié s'appuiera sur quelques critères majeurs, tels que la toxicité et la volatilité du solvant et la solubilité de la substance chimique d'essai dans le solvant choisi. Il convient d'employer à chaque concentration le même volume de solution correspondante. Le sédiment doit être chargé avec un grand volume à chaque concentration afin de modérer autant que possible la variabilité entre les expériences à concentrations identiques de substance chimique d'essai. Les solutions d'essai sont ensuite mélangées avec du sable quartzique comme il est décrit au paragraphe 22 (par exemple 10 g de sable quartzique par récipient expérimental). Un volume de 0,20 - 0,25 ml par g de sable s'est révélé suffisant pour immerger complètement le sable quartzique. Ensuite, le solvant doit être évaporé à sec. Pour limiter les déperditions de substance d'essai par co-évaporation (par exemple, liée à la pression de vapeur de la substance), le sable enrobé doit être utilisé immédiatement après séchage. Le sable sec est mélangé avec la quantité adéquate de sédiment formulé à la concentration correspondante. Lors de la préparation du sédiment, la quantité de sable introduite par le mélange de substance chimique d'essai et de sable doit être prise en compte (le sédiment doit donc être préparé avec la plus petite quantité de sable possible). Ce protocole a pour principal avantage de n'introduire que très peu de solvant dans le sédiment (7). Il est également possible, par exemple dans le cas d'un sédiment naturel, d'ajouter la substance chimique d'essai en incorporant une portion séchée et finement broyée du sédiment par le procédé décrit ci-dessus pour le sable quartzique ou en agitant la substance d'essai dans le sédiment humide, puis en évaporant la totalité de l'agent solubilisant utilisé. Il conviendra de s'assurer que la substance chimique d'essai ajoutée au sédiment est totalement et uniformément distribuée dans tout le sédiment. Le cas échéant, l'analyse de fractions d'échantillons permettra de confirmer les concentrations cibles dans le sédiment et de déterminer le degré d'homogénéité. L'analyse de fractions des solutions expérimentales peut également être utile pour confirmer les concentrations cibles dans le sédiment. Comme un solvant est utilisé pour déposer la substance chimique d'essai sur le sable quartzique, il faut employer un témoin de solvant préparé avec la quantité de solvant utilisée dans les sédiments de l'essai. La méthode adoptée pour la charge, et les raisons expliquant le choix d'un protocole de charge spécifique différent de celui décrit ci-dessus devront être indiquées. La méthode de charge doit être adaptée aux propriétés physico-chimiques de la substance d'essai, afin d'éviter, par exemple, les pertes dues à la volatilisation pendant la charge ou l'équilibrage. D'autres recommandations sur les protocoles de charge sont présentées dans Environnement Canada (1995) (46).
|
|
29.
|
Après la préparation du sédiment chargé, sa distribution dans des récipients d'essai en plusieurs exemplaires, et l'addition de l'eau d'essai, il est souhaitable de laisser la substance chimique d'essai se partager entre le sédiment et la phase aqueuse (par exemple (3)(7)(9)), de préférence, dans les conditions de températures et d'aération utilisées dans l'essai. La durée nécessaire pour atteindre l'équilibre dépend du sédiment et des produits chimiques et se situe entre quelques heures et quelques jours, dans de rares cas, atteint plusieurs semaines (4-5 semaines) (par exemple, (27)(47)). Dans cet essai, l'équilibre complet n'est pas requis, mais une période d'équilibrage de 48 heures à 7 jours est recommandée. La dégradation de la substance chimique d''essai est ainsi limitée dans le temps. Selon l'objectif de l'étude, par exemple, s'il faut reproduire les conditions environnementales, le sédiment chargé peut être équilibré ou vieilli pendant une durée plus longue.
|
|
30.
|
Au terme de cette période d'équilibrage, des échantillons sont prélevés au moins dans la couche d'eau sus-jacente et dans la masse du sédiment, au moins à la concentration la plus élevée et à une concentration plus basse, afin d'analyser la concentration de la substance chimique d'essai. Ces mesures analytiques de la substance chimique d'essai doivent permettre le calcul du bilan massique et une expression des résultats fondée sur les concentrations initiales déterminées. Généralement, le prélèvement d'échantillon perturbe ou détruit le système sédiment-eau, c'est pourquoi, il n'est guère possible d'utiliser les mêmes expériences pour le prélèvement de sédiment et de vers. Il faudra préparer d'autres récipients “analytiques” de dimensions appropriées, que l'on traitera de manière identique (y compris par la présence des organismes d'essai), mais qui ne seront pas utilisés pour les observations biologiques. Les dimensions des récipients choisis devront permettre de prélever des quantités d'échantillons exigées par la méthode analytique. La technique de prélèvement est détaillée dans le paragraphe 53.
|
CONDUITE DE L'ESSAI
Essai préliminaire
|
31.
|
Faute d'informations disponibles sur la toxicité de la substance chimique d'essai pour Lumbriculus variegatus, il est parfois utile de mener une expérience préliminaire afin de déterminer l'intervalle de concentrations qu'il convient de tester dans l'essai proprement dit, et d'optimiser les conditions de cet essai final. A cet effet, on utilise une série de concentrations largement espacées de la substance chimique d'essai. Les vers sont exposés à chaque concentration de la substance chimique d'essai pendant une durée (par exemple, 28 jours comme dans le test final) permettant d'estimer les concentrations expérimentales appropriées; on ne répète pas les expériences. On s'efforcera d'observer et d'enregistrer pendant le test préliminaire le comportement des vers, par exemple, leur tendance à éviter le sédiment, susceptible d'être induit par la substance chimique d'essai et/ou le sédiment. Les concentrations testées dans l'essai préliminaire ne dépasseront pas 1 000 mg/kg de poids sec de sédiment.
|
Essai final
|
32.
|
Au moins cinq concentrations doivent être utilisées et sélectionnées pour l'essai proprement dit, en se fondant, par exemple, sur l'essai préliminaire de détermination de l'ordre de grandeur (paragraphe 31), comme il est décrit dans les paragraphes 35, 36, 37 et 38.
|
|
33.
|
Un témoin (pour le nombre d'expériences identiques, voir les paragraphes 36, 37 et 38) contenant tous les constituants à l'exception de la substance chimique d'essai est traité parallèlement à la série de l'essai. Il conviendra de démontrer, à l'aide d'un témoin ne contenant que du solvant, que l'agent solubilisant, quel qu'il soit, utilisé pour l'application de la substance chimique d'essai, ne présente aucun effet significatif sur les organismes expérimentaux.
|
Modèle de l'essai
|
34.
|
Le modèle de l'essai définit le nombre des concentrations expérimentales et les intervalles qui les séparent, le nombre de récipients à chaque concentration et le nombre de vers ajoutés par récipient. La marche à suivre pour estimer une CEx, la CESO et procéder à un essai limite est décrite dans les paragraphes 35, 36, 37 et 38.
|
|
35.
|
La concentration avec effet (par exemple, CE50 CE25, CE10), et l'intervalle de concentrations dans lequel l'effet de la substance chimique d'essai a un impact, doivent être encadrés par les concentrations incluses dans l'essai. Il faut éviter les extrapolations à des valeurs très inférieures à la concentration la plus faible qui affecte les organismes de l'essai, ou à des valeurs supérieures à la concentration la plus élevée de l'analyse. Si néanmoins, à titre exceptionnel, ce type d'extrapolation est calculé, la raison devra en être détaillée dans le rapport.
|
|
36.
|
Pour estimer une CEx, au moins cinq concentrations et trois expériences identiques par concentration au minimum devront être analysées; on recommande six répétitions pour le témoin ou, le cas échéant, pour le témoin de solvant, afin d'affiner l'estimation de la variabilité entre témoins. En tout état de cause, il est judicieux de tester suffisamment de concentrations pour obtenir une bonne estimation du modèle. Le facteur séparant les concentrations ne doit pas excéder deux (sauf dans les cas où la pente de la courbe de réponse en fonction de la concentration est faible). Le nombre d'expériences identiques par traitement peut être réduit si le nombre de concentrations expérimentales dont les réponses sont comprises dans l'intervalle de 5– 95 % est élevé. L'augmentation du nombre d'expérience identiques ou la réduction de l'intervalle des concentrations expérimentales restreint généralement les intervalles de confiance de l'essai.
|
|
37.
|
Si l'estimation des valeurs de CMEO ou de CSEO est recherchée, au moins cinq concentrations expérimentales, chacune testée par au moins quatre expériences identiques (six sont recommandées pour le témoin, ou, le cas échéant, le témoin de solvant afin d'affiner l'estimation de la variabilité des témoins) doivent être analysées, et le facteur séparant les concentrations n'excédera pas deux. L'Appendice 6 fournit des informations sur la puissance statistique déterminée au cours de la vérification de l'hypothèse dans l'essai circulaire de la méthode.
|
|
38.
|
La conduite d'un essai limite peut être envisagée (sur une seule concentration et des témoins) dans le cas où aucun effet n'est à prévoir jusqu'à 1 000 mg/kg de poids sec de sédiment (par exemple, d'après un essai préliminaire de détermination de l'ordre de grandeur), ou dans le cas où l'analyse d'une concentration unique permet de confirmer une valeur de CSEO d'intérêt. Dans ce dernier cas, une justification détaillée du choix de la concentration seuil doit être intégrée au rapport d'essai. L'intérêt de l'essai limite est d'analyser une concentration suffisamment élevée pour légitimer la décision d'exclure tout éventuel effet toxique de la substance, et la limite est fixée à une concentration impossible à atteindre quelle que soit la situation. La limite recommandée est de 1 000 mg/kg (poids sec). Habituellement, il est nécessaire de répéter l'expérience six fois tant pour les échantillons traités que pour les témoins. L'Appendice 6 fournit des informations sur la puissance statistique déterminée au cours de la vérification de l'hypothèse dans l'essai circulaire de la méthode.
|
Conditions d'exposition
Organismes de l'essai
|
39.
|
L'essai est réalisé sur au moins 10 vers pour chaque expérience incluse dans la détermination des paramètres biologiques. Ce nombre correspond à environ 50-100 mg de biomasse fraîche. Avec une teneur en matières sèches estimée de 17,1 % (48) chaque récipient contiendra environ 9 à 17 mg de biomasse sèche. U.S. EPA (2000 (7)) recommande l'utilisation d'un taux de charge n'excédant pas 1: 50 (biomasse sèche: TCO). Dans le cas du sédiment formulé décrit au paragraphe 22, ce taux de charge correspond à environ 43 g de sédiment (poids sec) pour dix vers à une teneur en TCO de 2,0 % de sédiment sec. A plus de 10 vers par récipient, il convient d'ajuster la quantité de sédiment et d'eau sus-jacente en conséquence.
|
|
40.
|
Tous les vers utilisés dans un essai doivent provenir de la même source, et présenter un état physiologique similaire (voir Appendice 5). On choisira des vers de taille similaire (voir paragraphe 39). Il est préférable de peser une fraction du lot ou du stock de vers avant l'essai afin d'en estimer le poids moyen.
|
|
41.
|
Les vers utilisés dans un essai sont prélevés dans la culture (pour plus de précisions, se reporter à l'Appendice 5). De gros animaux (adultes), ne présentant aucun signe de fragmentation récente, sont transférés dans des boîtes en verre (par exemple, boîtes de Petri) contenant de l'eau pure. Ils sont ensuite synchronisés par le procédé décrit dans l'Appendice 5. Après régénération pendant une période allant de 10 à 14 jours, des vers intacts et complets de taille similaire, nageant ou rampant activement après un léger stimulus mécanique, sont choisis pour l'essai. Lorsque les conditions de l'essai diffèrent des conditions de culture (par exemple, en termes de température, d'éclairement et d'eau sus-jacente), une phase d'acclimatation, par exemple, de 24 h avec des paramètres de température, d'éclairement et d'eau sus-jacente identiques à ceux de l'essai devrait suffire à l'adaptation des vers aux conditions de l'essai. Les oligochetes adaptés sont ensuite répartis au hasard dans les récipients de l'essai.
|
Alimentation
|
42.
|
Les aliments sont ajoutés au sédiment avant (ou pendant) l'application de la substance chimique d'essai, et les vers ne sont donc plus nourris pendant l'essai.
|
Lumière et température
|
43.
|
La photopériode appliquée pendant la culture et au cours de l'essai est généralement de 16 heures (3), (7). Pour représenter fidèlement conditions naturelles à la surface du sédiment, l'intensité lumineuse est réglée à bas niveau (par exemple, 100-500 lx), et elle est mesurée au moins une fois pendant la période d'exposition. La température doit se situer à 20 °C ± 2 °C pendant tout l'essai. À chaque date de mesure, la température ne doit pas différer de plus de ± 1 °C entre les récipients de l'essai. Les récipients doivent être placés dans l'incubateur de l'essai ou la zone d'essai selon un modèle randomisé, afin de limiter le biais de reproduction dû à l'emplacement du récipient.
|
Aération
|
44.
|
L'eau sus-jacente des récipients expérimentaux est soumise à une aération légère (par exemple, 2 - 4 bulles par seconde) à l'aide d'une pipette Pasteur placée environ 2 cm au-dessus de la surface du sédiment, pour en limiter les perturbations. Il conviendra de s'assurer que la concentration d'oxygène dissous ne chute pas en dessous de 30 % de sa valeur dans l'air saturé (VAS). L'apport d'air doit être contrôlé, et, le cas échéant, ajusté au moins quotidiennement les jours ouvrés.
|
Mesures de la qualité de l'eau
|
45.
|
Les paramètres suivants caractérisant la qualité de l'eau doivent être mesurés dans l'eau sus-jacente:
|
Température:
|
au moins dans un récipient expérimental à chaque concentration et dans l'un des récipients des témoins une fois par semaine et au début et à la fin de la période d'exposition; si possible, la température dans le milieu environnant (air ambiant ou bain d'eau) est également enregistrée, par exemple, à intervalles d'une heure;
|
|
Teneur en oxygène dissous:
|
au moins dans un récipient expérimental à chaque concentration et dans l'un des récipients des témoins une fois par semaine et au début et à la fin de la période d'exposition; exprimée en mg/l et % de VAS (valeur dans l'air saturé);
|
|
Apport d'air:
|
il doit être contrôlé au moins une fois par jour les jours ouvrés, et, le cas échéant, ajusté;
|
|
pH:
|
au moins dans un récipient expérimental à chaque concentration et dans l'un des récipients des témoins une fois par semaine et au début et à la fin de la période d'exposition;
|
|
Dureté totale de l'eau:
|
au moins dans l'un des témoins et dans un récipient expérimental à la concentration la plus élevée au début et à la fin de la période d'exposition; exprimée en mg/l de CaCO3;
|
|
Teneur totale en ammoniac:
|
au moins dans l'un des récipients des témoins et dans un récipient expérimental à chaque concentration au début de la période d'exposition, et ensuite trois fois par semaine; exprimée en mg/l de NH4+ ou de NH3 ou en azote ammoniacal total.
|
Si la mesure des paramètres caractérisant la qualité de l'eau exige le prélèvement d'une quantité significative d'eau dans les récipients, il peut être préférable de préparer des récipients séparés pour les mesures de qualité de l'eau afin d'éviter de modifier le rapport volumique eau à sédiment.
|
Observations biologiques
|
46.
|
Pendant l'exposition, la comparaison des récipients expérimentaux aux témoins permettra d'évaluer visuellement toutes les différences comportementales manifestées par les vers (par exemple, évitement du sédiment, granules fécaux visibles sur la surface du sédiment). Ces observations seront notées.
|
|
47.
|
A la fin de l'essai, chaque récipient expérimental est examiné (les récipients supplémentaires destinés aux analyses chimiques peuvent être exclus de l'examen). Tous les vers du récipient expérimental sont récupérés par une méthode appropriée. On veillera à n'en endommager aucun. L'une des méthodes envisageable consiste à tamiser les vers dans le sédiment. A cet effet, on peut utiliser un tamis en acier inoxydable de taille de mailles appropriée. L'eau sus-jacente est décantée au maximum avec précaution, et le sédiment et l'eau résiduelle sont agités pour obtenir une suspension épaisse qui peut être tamisée. Sur des mailles de 500 μm, la majeure partie des particules de sédiment traverse le tamis très vite; le tamisage doit en effet être rapide afin d'éviter que les vers ne rampent dans le tamis, ni ne le traversent. Sur des mailles de 250 μm, les vers ne pourront pas s'échapper ainsi, mais il conviendra de s'assurer de retenir sur le tamis le moins possible de particules de sédiment. La suspension tamisée de chaque récipient peut être soumise à un second passage afin de garantir la récupération de la totalité des vers. Une autre méthode consiste à réchauffer le sédiment en plaçant les récipients expérimentaux dans un bain-marie à 50-60 °C; les vers sortent alors du sédiment et peuvent être recueillis à sa surface à l'aide d'une pipette à large ouverture polie au feu. Une autre méthode encore consiste à obtenir une suspension épaisse de sédiment et à la verser dans un bac peu profond de dimensions appropriées. Les vers sont ensuite prélevés dans la mince couche de suspension à l'aide d'une aiguille d'acier ou de pinces de bijoutier (il est préférable d'utiliser cet outil comme fourche plutôt que comme pinces pour éviter de blesser les vers) et les animaux sont transférés dans de l'eau pure. Après avoir été séparés de la suspension de sédiment, les vers sont rincés dans du milieu d'essai et comptés.
|
|
48.
|
Quelle que soit la méthode utilisée, le laboratoire doit démontrer que son personnel parvient à récupérer en moyenne au moins 90 % des organismes dans le sédiment entier, par exemple, en ajoutant un certain nombre d'organismes d'essai au sédiment témoin ou à des sédiments expérimentaux et en déterminant leur récupération au bout de 1 h (7).
|
|
49.
|
Le nombre total d'individus vivants et morts par expérience est noté et évalué. Les vers sont considérés morts s'ils appartiennent à l'un des groupes suivants:
|
a)
|
aucune réaction n'est obtenue après un stimulus mécanique léger
|
|
b)
|
des signes de décomposition sont observés (en combinaison avec “a”)
|
|
c)
|
il manque un certain nombre de vers
|
De surcroît, les vers vivants peuvent être affectés à l'une des trois catégories suivantes:
|
a)
|
gros vers complets (adultes) sans régions corporelles régénérées
|
|
b)
|
vers complets comportant des régions corporelles régénérées de couleur plus claire (par exemple, dotés d'une nouvelle partie postérieure, d'une nouvelle partie antérieure ou des deux)
|
|
c)
|
vers incomplets (c'est-à-dire vers récemment fragmentés dont certaines régions corporelles ne sont pas régénérées)
|
Ces observations complémentaires ne sont pas obligatoires, mais peuvent enrichir l'interprétation des résultats biologiques (par exemple, un nombre élevé de vers inclus dans la catégorie c peut indiquer un retard de reproduction ou de régénération induit par un traitement donné). De surcroît, si l'on observe entre les vers traités et témoins des différences d'apparence (par exemple lésion des phanères, sections du corps oedémateuses), il faut les noter.
|
|
50.
|
Immédiatement après le comptage et l'évaluation, les vers vivants retrouvés dans chaque récipient expérimental sont transférés dans des plateaux de balance séchés, tarés et marqués (un par répétition), puis ils sont tués à l'aide d'une goutte d'éthanol par plateau. Les plateaux sont placés dans une étuve à 100 ± 5 °C pour un séchage d'une nuit, puis ils sont pesés après refroidissement dans un dessiccateur, et le poids sec des vers est déterminé (de préférence en grammes, au moins 4 chiffres après la virgule).
|
|
51.
|
Outre le poids sec total, on peut déterminer le poids sec sans les cendres selon la description de (49) afin de prendre en compte les composants inorganiques issus du sédiment, ingérés et présents dans le tractus alimentaire des vers.
|
|
52.
|
La biomasse déterminée est la biomasse totale par expérience identique, incluant les vers adultes et jeunes. Les vers morts n'entrent pas en ligne de compte dans cette détermination.
|
Vérification des concentrations de substance chimique d'essai
Prélèvement des échantillons
|
53.
|
Il faut prélever des échantillons pour l'analyse chimique de la substance chimique d'essai au moins à la concentration la plus élevée et à une concentration inférieure, au moins à la fin de la phase d'équilibrage (avant l'addition des organismes de l'essai) et à la fin de l'essai. Il faut au moins analyser des échantillons prélevés dans la masse du sédiment et dans l'eau sus-jacente. Au moins deux échantillons doivent être prélevés par matrice et par traitement à chaque date de prélèvement. L'un des échantillons en double peut être stocké en réserve (puis analysé, par exemple, dans le cas où les résultats de l'analyse initiale sont en dehors de l'intervalle de ± 20 % de la concentration nominale). Si la substance chimique présente des propriétés spécifiques, par exemple, si sa dégradation rapide est à prévoir, le dispositif analytique doit être ajusté (par exemple, prélèvements plus fréquents, analyse d'un plus grand nombre de concentrations), en s'en remettant à l'avis d'un expert. Il est possible de prélever des échantillons à des dates intermédiaires (par exemple, sept jours après le début de l'exposition).
|
|
54.
|
Il faut prélever les échantillons d'eau sus-jacente en décantant ou en siphonnant avec précaution l'eau de façon à perturber au minimum le sédiment. Le volume des échantillons doit être consigné.
|
|
55.
|
Après retrait de l'eau sus-jacente, le sédiment doit être homogénéisé, puis transféré dans un récipient approprié. Le poids de l'échantillon de sédiment humide est noté.
|
|
56.
|
Dans les cas où il est nécessaire d'analyser en sus la substance chimique d'essai dans l'eau interstitielle, les échantillons de sédiments homogénéisés et pesés sont centrifugés pour séparer cette eau. On peut par exemple introduire environ 200 ml de sédiment humide dans des béchers à centrifugation de 250 ml. Les échantillons sont ensuite centrifugés sans filtration afin d'isoler l'eau interstitielle, par exemple à 10 000 ± 600 × g pendant 30 - 60 min à une température inférieure ou égale à la température utilisée dans l'essai. Après centrifugation, le surnageant est décanté ou prélevé à la pipette en prenant soin de n'introduire aucune particule de sédiment, et son volume est noté. Le poids du culot de sédiment résiduel est également enregistré. Cette mesure peut contribuer à l'estimation du bilan massique ou de la récupération de la substance chimique d'essai dans le système eau-sédiment lorsque le poids sec du sédiment est déterminé à chaque date de prélèvement. Dans certains cas, il est impossible d'analyser les concentrations dans l'eau interstitielle, car le volume de l'échantillon est trop faible.
|
|
57.
|
Si l'analyse n'est pas immédiate, il faut stocker tous les échantillons en suivant un protocole adéquat, par exemple dans des conditions de stockage recommandées pour une dégradation minimale de la substance chimique d'essai spécifique (par exemple, les échantillons prélevés dans l'environnement sont habituellement stockés à – 18 °C dans l'obscurité). Il convient d'obtenir des informations sur les conditions convenant à la substance chimique d'essai donnée — par exemple, durée et température de stockage, protocole d'extraction, etc. — avant le début de l'étude.
|
Méthode analytique
|
58.
|
L'ensemble du protocole reposant essentiellement sur l'exactitude, la précision et la sensibilité de la méthode analytique utilisée sur la substance chimique d'essai, il faut vérifier expérimentalement que la précision et la reproductibilité de l'analyse chimique, ainsi que la récupération de la substance d'essai à partir de l'eau et des échantillons de sédiment, conviennent à la méthode particulière, au moins aux concentrations la plus élevée et la plus basse de l'essai. On vérifiera également que la substance chimique d'essai est indétectable dans les récipients témoins à des concentrations supérieures à la limite de quantification. S'il y a lieu, les concentrations nominales seront corrigées pour tenir compte des charges récupérées dans les témoins de contrôle de qualité (par exemple, si la récupération est en dehors de l'intervalle 80 - 120 % de la quantité introduite). Pendant toute la durée de l'essai, tous les échantillons sont manipulés de façon à réduire au minimum la contamination et les déperditions (par exemple, du fait de l'adsorption de la substance chimique d'essai sur le dispositif de prélèvement).
|
|
59.
|
Il faut enregistrer et indiquer la récupération de la substance chimique d'essai, la limite de quantification et la limite de détection dans le sédiment et l'eau.
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
60.
|
Les principales variables de réponses de l'essai qu'il est impératif d'évaluer statistiquement sont la biomasse et le nombre total de vers par expérience. On peut également choisir d'évaluer la reproduction (augmentation des nombres de vers) et la croissance (augmentation de la biomasse sèche). Dans ce cas, il faut estimer le poids sec des vers au début de l'exposition, par exemple par mesure du poids sec d'une fraction d'échantillon représentative du lot des vers synchronisés utilisés dans l'essai.
|
|
61.
|
Même si la mortalité n'est pas l'un des résultats proprement dits de cet essai, il convient de l'évaluer dans la mesure du possible. À cet effet, sont considérés comme morts les vers qui ne réagissent pas à un stimulus mécanique léger ou qui présentent des signes de décomposition, ou les vers manquants. Les mortalités doivent être à tout le moins notées et prises en compte lors de l'interprétation des résultats de l'essai.
|
|
62.
|
Les concentrations avec effet doivent être exprimées en mg/kg de poids sec de sédiments. Si 80 à 120 % des concentrations nominales de la substance chimique d'essai sont récupérés dans le sédiment, ou dans le sédiment et l'eau sus-jacente au début de l'exposition, les concentrations avec effet (CEx, CSEO, CMEO) peuvent être rapportées aux concentrations nominales. Si le taux de récupération s'écarte des concentrations nominales de plus de ± 20 %, les concentrations avec effet (CEx, CSEO, CMEO) sont rapportées aux concentrations initialement mesurées au début de l'exposition, par exemple en tenant compte du bilan massique de la substance chimique d'essai dans le système expérimental (voir paragraphe 30). Dans ce cas, des informations supplémentaires peuvent être tirées de l'analyse des solutions stocks ou des solutions d'application afin de confirmer que les sédiments de l'essai ont été préparés correctement.
|
CEx
|
63.
|
Les valeurs CEx relatives aux paramètres décrits au paragraphe 60 sont calculées par des méthodes statistiques adéquates (par exemple analyse par la méthode des probits, fonction logistique ou de Weibull, méthode abrégée de Spearman-Karber, ou interpolation simple). Des informations sur l'évaluation statistique sont présentées dans (15) et (50). Une CEx est calculée en incorporant une valeur correspondant à x % de la valeur du témoin dans l'équation. Le calcul de la CE50 ou de toute autre CEx, implique la soumission des moyennes par traitement (
) à une analyse de régression. |
CSEO/CMEO
|
64.
|
Dans le cas d'une analyse statistique visant à déterminer la CSEO ou la CMEO, il est nécessaire d'appliquer une analyse statistique par récipient (les récipients individuels sont considérés comme des répétitions). Il convient d'utiliser des méthodes statistiques adéquates. En général, les effets indésirables de la substance d'essai, relativement au témoin, sont étudiés en utilisant une vérification de l'hypothèse unilatérale (plus faible) à p < 0,05. Des exemples sont présentés dans les paragraphes suivants. On trouvera des renseignements sur le choix des méthodes statistiques appropriées dans (15) et (50).
|
|
65.
|
La distribution normale des données peut être analysée, par exemple, par le test de validité de l'ajustement de Kolmogorov-Smirnov, le test du rapport intervalle à écart-type (test R/s) ou le test de Shapiro-Wilk (bilatéral, p ≤ 0,05). Le test de Cochran, le test de Levene ou le test de Bartlett (bilatéral, p ≤ 0,05) peuvent être utilisés pour analyser l'homogénéité de la variance. Lorsque les prérequis des protocoles de tests paramétriques (normalité, homogénéité de la variance) sont satisfaits, une analyse de la variance à un facteur (ANOVA), puis des tests multi-comparaisons peuvent être appliqués. Des comparaisons par paires (par exemple, test-t de Dunnett) ou des tests d'analyse de tendance descendante (par exemple test de William) peuvent permettre de calculer d'éventuelles différences significatives (p ≤ 0,05) entre les témoins et les diverses concentrations de substance d'essai. Dans le cas contraire, des méthodes non paramétriques (test U de Bonferroni selon Holm ou test de tendance de Jonckheere-Terpstra) permettront le calcul de la CSEO et de la CMEO.
|
Essai limite
|
66.
|
Lorsqu'un essai limite (comparaison du témoin et d'un seul traitement) a été effectué et que les prérequis des protocoles de test paramétrique (normalité, homogénéité) sont satisfaits, on peut évaluer les réponses métriques (nombre total de vers et biomasse en poids sec de vers) par le test de Student (test-t). Le test t avec variance inégale (test t de Welch) ou un test non paramétrique, tel que le test U de MannWhitney peut être utilisé lorsque ces conditions ne sont pas remplies. L'Appendice 6 fournit des informations sur la puissance statistique déterminée au cours de la vérification de l'hypothèse dans l'essai circulaire de la méthode.
|
|
67.
|
La détermination des différences significatives entre les témoins (témoin et témoin de solvant) peut faire appel à l'analyse de plusieurs expériences identiques pour chaque témoin comme il est décrit pour l'essai limite. S'il n'est détecté aucune différence significative, toutes les expériences identiques témoins et témoins de solvant peuvent être réunies. Si ce n'est pas le cas, tous les traitements doivent être comparés avec le témoin de solvant.
|
Interprétation des résultats
|
68.
|
Les résultats doivent être interprétés avec prudence lorsque l'essai s'écarte de la présente méthode d'essai, et lorsque les concentrations mesurées de l'essai approchent la limite de détection de la méthode analytique utilisée. Tout écart par rapport à cette méthode d'essai doit être noté.
|
Rapport d'essai
|
69.
|
Le rapport d'essai comprend au moins les informations suivantes:
|
—
|
Substance chimique d'essai:
|
—
|
données permettant l'identification chimique (nom courant, nom chimique, formule structurelle, numéro CAS, etc.), notamment pureté et méthode analytique de quantification de la substance chimique d'essai; source de la substance d'essai, identité et concentration de tous les solvants utilisés.
|
|
—
|
toutes les informations disponibles sur la nature physique et les propriétés physico-chimiques recueillies antérieurement au début de l'essai (par exemple, solubilité dans l'eau, pression de vapeur, coefficient de partage dans le sol (ou dans le sédiment si possible), log Koe, stabilité dans l'eau, etc.);
|
|
|
—
|
Espèce expérimentale:
|
—
|
nom scientifique, source, toutes les conditions de prétraitement, d'acclimatation, de culture, etc.
|
|
|
—
|
Conditions expérimentales:
|
—
|
protocole d'essai utilisé (par exemple, statique, semi-statique ou à écoulement continu);
|
|
—
|
modèle de l'essai (par exemple, nombre, matière et dimensions des récipients d'essai, volume d'eau par récipient, masse et volume de sédiment par récipient (pour les protocoles à écoulement continu ou semi-statique: vitesse de remplacement du volume d'eau), toute aération utilisée avant et pendant l'essai, nombre d'expériences identiques, nombre de vers par expérience au début de l'exposition, nombre de concentrations de l'essai, durée du conditionnement, périodes d'équilibrage et d'exposition, des prélèvements);
|
|
—
|
profondeur du sédiment et de l'eau sus-jacente;
|
|
—
|
méthode de prétraitement de la substance chimique d'essai et charge/application;
|
|
—
|
concentrations nominales de l'essai, précisions sur le prélèvement des échantillons destinés à l'analyse chimique, et sur les méthodes analytiques de détermination des concentrations de la substance chimique d'essai;
|
|
—
|
caractéristiques du sédiment, selon la description des paragraphes 24 - 25, et toute autre mesure; préparation du sédiment formulé;
|
|
—
|
préparation de l'eau de l'essai (dans le cas où l'on utilise de l'eau reconstituée) et ses caractéristiques (concentration d'oxygène, pH, conductivité, dureté, et toute autre mesure réalisée) avant le début de l'essai;
|
|
—
|
précisions sur l'alimentation, notamment le type d'aliments, leur préparation, leur quantité et le régime alimentaire;
|
|
—
|
intensité lumineuse et photopériodes;
|
|
—
|
méthodes utilisées pour la détermination de tous les paramètres biologiques (par exemple prélèvements d'échantillons, examen, pesée des organismes expérimentaux), et de tous les paramètres abiotiques (par exemple, paramètres de qualité de l'eau et du sédiment);
|
|
—
|
volumes et/ou poids de tous les échantillons destinés à l'analyse chimique;
|
|
—
|
information détaillée sur le traitement de tous les échantillons destinés à l'analyse chimique, notamment précisions sur la préparation, le stockage, les protocoles de charge, l'extraction et les protocoles analytiques (et leur précision) concernant la substance chimique d'essai, et récupérations de la substance chimique d'essai.
|
|
|
—
|
Résultats:
|
—
|
qualité de l'eau dans les récipients expérimentaux (pH, température, concentration d'oxygène dissous, dureté, concentration d'ammoniac et toute autre mesure réalisée);
|
|
—
|
teneur en carbone organique total (COT), rapport poids sec à poids frais, pH du sédiment et toute autre mesure réalisée;
|
|
—
|
nombre total, et s'il a été déterminé, nombre de vers complets et incomplets dans chaque récipient expérimental à la fin de l'essai;
|
|
—
|
poids sec des vers dans chaque récipient à la fin de l'essai, et, le cas échéant, poids sec d'une fraction des vers au début de l'essai;
|
|
—
|
tout comportement anormal observé par rapport aux témoins (par exemple, évitement du sédiment, présence ou absence de granules fécaux);
|
|
—
|
toute mortalité observée;
|
|
—
|
estimations des effets toxiques (par exemple, CEx, CSEO et/ou CMEO), et méthodes statistiques utilisées pour leur détermination;
|
|
—
|
concentrations nominales de l'essai, concentrations mesurées de l'essai et résultats de toutes les analyses effectuées pour déterminer la concentration de la substance chimique d'essai dans les récipients expérimentaux;
|
|
—
|
tout écart par rapport aux critères de la validité.
|
|
|
—
|
Evaluation des résultats:
|
—
|
conformité des résultats aux critères de validité indiqués dans le paragraphe 13;
|
|
—
|
discussion des résultats, notamment sur une influence éventuelle sur les résultats de l'essai de modifications apportées à la présente méthode d'essai.
|
|
|
BIBLIOGRAPHIE
|
(1)
|
EC (2003). Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I — IV. Office for Official Publications of the EC (European Commission), Luxembourg.
|
|
(2)
|
OCDE (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation de coopération et de développement économiques (OCDE), Paris.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment- Associated Contaminants with Freshwater Invertebrates, E1706-00. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. et Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(6)
|
Chapitre C.27 de la présente annexe, “Essai de toxicité sur les chironomes dans un système eau-sédiment dopé”.
|
|
(7)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment- associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(8)
|
Environnement Canada (1997). Essai de survie et de croissance des larves dulcicoles de chironomes (Chironomus tentans ou Chironomus riparius) dans les sédiments. Méthode d'essai biologique. Rapport SPE 1/RM/32. Decembre 1997.
|
|
(9)
|
Hill, I.R., Matthiessen, P., Heimbach, F. (eds), 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8-10 November 1993, Renesse (NL).
|
|
(10)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H.Köpp. Berlin 1995.
|
|
(11)
|
Riedhammer C. & B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105-110.
|
|
(12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(14)
|
OCDE (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(15)
|
Environnement Canada (2003). Document d'orientation sur les methodes statistiques applicables aux essais d'écotoxicité; première version, mars 2003; Rapport EPS 1/RM/
|
|
(16)
|
Nikkilä A., Halme A., Kukkonen J.V.K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35-46.
|
|
(17)
|
Baily H.C., & Liu D.H.W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. p. 205-215. In J.C. Eaton, P.R. Parrish, and A.C. Hendricks (eds). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
(18)
|
Chapman K. K., Benton M. J., Brinkhurst R. O. & Scheuerman P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271-278.
|
|
(19)
|
Meyer J.S., Boese C.J. & Collyard S.A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Part C 133:99-109.
|
|
(20)
|
Schubauer-Berigan M.K., Dierkes J.R., Monson P.D. & Ankley G.T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxciol. Chem. 12(7):1261-1266.
|
|
(21)
|
West, C.W., V.R. Mattson, E.N. Leonard, G.L. Phipps & G.T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57-63.
|
|
(22)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(23)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(24)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(25)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(26)
|
Landrum, P.F., Gedeon, M.L., Burton, G.A., Greenberg. M.S., & Rowland, C.D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42: 292-302.
|
|
(27)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(28)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(29)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph. Oehlmann, J., & Knacker, Th. (2005). Bioaccumulation of 14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271-280.
|
|
(31)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000-2007.
|
|
(32)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(33)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
(34)
|
Dermott R. & Munawar M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407-414.
|
|
(35)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(36)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(37)
|
Chapitre C.1 de la présente annexe, Toxicité aiguë vis-à-vis des poissons.
|
|
(38)
|
OCDE (1992c). Ligne directrice pour les essais de produits chimiques. No. 210: poisson, essai de toxicité aux premiers stades de la vie OCDE, Paris.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(40)
|
Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel and B. Streit. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10-20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on “Bioaccumulation: Sediment test using benthic oligochaetes”, 26.-27.04.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(42)
|
Suedel, B.C. et Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
(43)
|
Naylor, C. et C. Rodrigues. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
|
|
(44)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181184.
|
|
(45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(46)
|
Environnement Canada (1995). Document d'orientation sur la mesure de la précision des essais de toxicité sur sédiments de contrôle dopés avec un produit toxique de référence. Environmental Protection Series Rapport EPS 1/RM/30.
|
|
(47)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588-595.
|
|
(48)
|
Brooke, L.T., Ankley, G.T., Call, D.J. & Cook, P.M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223-228.
|
|
(49)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
(50)
|
OCDE 2006. Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment No. 54, OCDE, Paris, France.
|
|
(51)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten — Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Allemagne. pp. 107-119.
|
Références complémentaires sur les protocoles statistiques:
Dunnett, C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
Finney, D.J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction: Environ. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
Sokal, R.R. et F.J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
Miller, R.G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro S.S. & Wilk M.B (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591-611.
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519 531.
Appendice 1
Définitions
Aux fins de la présente méthode d'essai, les définitions suivantes sont utilisées:
Substance chimique
: une substance ou un mélange.
Période de conditionnement
: période employée pour stabiliser le composant microbien du sédiment et éliminer, par exemple, l'ammoniac issu des composants du sédiment; elle se déroule avant l'introduction dans le sédiment de la substance chimique d'essai. Habituellement, on élimine l'eau sus-jacente après conditionnement.
CEx
: concentration de substance chimique d'essai dans le sédiment qui provoque un effet de X % (par exemple 50 %) sur un paramètre biologique après une durée d'exposition donnée.
Période d'équilibrage
: période utilisée pour que la substance chimique d'essai se répartisse entre la phase solide, l'eau interstitielle et l'eau sus-jacente; elle se déroule après l'introduction dans le sédiment de la substance chimique d'essai et avant l'addition des organismes expérimentaux.
Phase d'exposition
: durée pendant laquelle les organismes expérimentaux sont exposés à la substance chimique d'essai.
Sédiment formulé ou sédiment reconstitué, artificiel ou synthétique: mélange de matériaux employés pour simuler les composants physiques d'un sédiment naturel.
Concentration minimale avec effet observé (CMEO)
: la concentration la plus faible analysée d'une substance chimique d'essai à laquelle on a observé un effet toxique significatif de la substance (à p ≤ 0,05) par rapport au témoin. Toutefois, toutes les concentrations de l'essai supérieures à la CMEO doivent présenter un effet égal ou supérieur à celui de la CMEO. Si ces deux conditions ne sont pas satisfaites, une explication exhaustive doit justifier le choix de la CMEO (et par conséquent de la CSEO).
Concentration sans effet observé (CSEO)
: la concentration de l'essai immédiatement inférieure à la CMEO qui, si on se réfère au témoin, ne présente aucun effet statistiquement significatif (p ≤ 0,05), après une exposition pendant une période donnée.
Coefficient de partage octanol-eau (Koe, parfois exprimé par Poe): rapport de la solubilité d'une substance dans le n-octanol et dans l'eau à l'équilibre; correspond à la lipophilie d'une substance (Chapitre A.24 de la présente annexe). Le Koe ou le logarithme de Koe (log Koe) sert d'indicateur de la bioaccumulation d'une substance par des organismes aquatiques.
Coefficient de partage carbone organique-eau (Kco): rapport de la concentration d'une substance chimique dans/sur la fraction de carbone organique d'un sédiment et de la concentration de substance dans l'eau à l'équilibre.
Eau sus-jacente
: l'eau qui recouvre le sédiment dans le récipient expérimental.
Eau intertitielle
: l'eau qui occupe les espaces entre les particules de sédiment ou de sol.
Sédiment chargé
: sédiment auquel a été ajoutée la substance chimique d'essai.
Substance chimique d'essai
: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
Appendice 2
Composition de l'eau reconstituée recommandée
[Adapté du chapitre C.1 de la présente annexe (1)]
|
a)
|
Solution de chlorure de calcium
Dissoudre 11,76 g de CaCl2 · 2 H2O dans de l'eau désionisée; ajuster à 1 l avec de l'eau désionisée
|
|
b)
|
Solution de sulfate de magnésium
Dissoudre 4,93 g de MgSO4 · 7 H2O dans de l'eau désionisée; ajuster à 1 l avec de l'eau désionisée
|
|
c)
|
Solution de bicarbonate de sodium
Dissoudre 2,59 g deNaHCO3 dans de l'eau désionisée; ajuster à 1 l avec de l'eau désionisée
|
|
d)
|
Solution de chlorure de potassium
Dissoudre 0,23 g de KCl dans de l'eau désionisée; ajuster à 1 l avec de l'eau désionisée
|
Tous les produits chimiques doivent être de qualité analytique.
La conductivité de l'eau distillée ou désionisée ne doit pas excéder 10 μScm– 1.
On mélange de 25 ml de chaque solution de (a) à (d) et on ajuste le volume total à 1 l avec de l'eau désionisée. La somme des concentrations d'ions calcium et magnésium dans ces solutions est égale à 2,5 mmol/l.
La proportion d'ions Ca:Mg est égale à 4:1 et celle des ions Na:K 10:1. La capacité acide KS4.3 de cette solution est égale à 0,8 mmol/l.
Aérer l'eau de dilution jusqu'à obtenir une saturation en oxygène, puis la stocker pendant environ 2 jours sans autre aération avant utilisation.
RÉFÉRENCE
|
1).
|
Chapitre C.1 de la présente annexe, Toxicité aiguë vis-à-vis des poissons.
|
Appendice 3
Caractéristiques physiques et chimiques d'une eau de dilution admissible
|
Constituant
|
Concentrations
|
|
Matières particulaires
|
< 20 mg/l
|
|
Carbone organique total
|
< 2 μg/l
|
|
Ammoniac non ionisé
|
< 1 μg/l
|
|
Chlore résiduel
|
< 10 μg/l
|
|
Pesticides organophosphorés totaux
|
< 50 ng/l
|
|
Pesticides organochlorés totaux plus biphényles polychlorés
|
< 50 ng/l
|
|
Chlore organique total
|
< 25 ng/l
|
|
[Adapté de OCDE 1992 (1)]
|
RÉFÉRENCE
|
(1)
|
OCDE (1992) Ligne directrice pour les essais de produits chimiques No 210: poisson, essai de toxicité aux premiers stades de la vie OCDE, Paris.
|
Appendice 4
Sédiment artificiel recommandé — prescriptions pour la préparation et le stockage
Constituants du sédiment
|
Constituant
|
Caractéristiques
|
% de poids sec de sédiment
|
|
Tourbe
|
Tourbe à sphaignes, degré de décomposition: “moyen”, séchée à l'air, aucun résidu végétal visible, finement broyée (taille de particule ≤ 0,5 mm)
|
5 ± 0,5
|
|
Sable quartzique
|
Dimension des particules: ≤ 2 mm, mais > 50 % des particules doivent mesurer entre 50 et 200 μm
|
75 - 76
|
|
Argile kaolinite
|
Taux de kaolinite ≥ 30 %
|
20 ± 1
|
|
Source d'aliment
|
par exemple, poudre d'Urtica (Folia urticae), feuilles d'Urtica dioica (ortie), finement broyées (taille des particules ≤ 0,5 mm); conformes aux normes pharmaceutiques pour la consommation humaine; additionnées au sédiment sec
|
0,4 - 0,5 %
|
|
Carbone organique
|
Ajusté par addition de tourbe et de sable
|
2 ± 0,5
|
|
Carbonate de calcium
|
CaCO3, pulvérisé, chimiquement pur, ajouté au sédiment sec
|
0,05 - 1
|
|
Eau désionisée
|
Conductivité ≤ 10 μS/cm, ajoutée au sédiment sec
|
30 - 50
|
Note: si des concentrations élevées d'ammoniac sont à prévoir, par exemple, s'il est notoire que la substance chimique d'essai inhibe la nitrification, il peut utile de remplacer 50 % de la poudre d'orties riche en azote par de la cellulose [par exemple poudre d'α-cellulose, chimiquement pure, taille de particules ≤ 0,5 mm; (1) (2)].
Préparation
La tourbe est séchée à l'air et broyée en une fine poudre. Une suspension de la quantité requise de poudre de tourbe dans de l'eau désionisée est préparée à l'aide d'un dispositif d'homogénéisation à haute performance. Le pH de cette suspension est ajusté à 5,5 ± 0,5 avec du CaCO3. La suspension est conditionnée pendant au moins deux jours sous agitation douce, à 20 ± 2 °C, afin de stabiliser le pH et d'établir une flore microbienne stable. Le pH est à nouveau mesuré et doit alors être égal à 6,0 ± 0,5. Ensuite, la suspension de tourbe est mélangée avec les autres constituants (sable et argile kaolinique) et de l'eau désionisée afin d'obtenir un sédiment homogène dont la teneur en eau est comprise dans l'intervalle de 30 à 50 % de poids sec du sédiment. Le pH du mélange final est à nouveau mesuré et ajusté entre 6,5 et 7,5 avec du CaCO3, s'il y a lieu. Néanmoins, si l'on prévoit un dégagement d'ammoniac, il peut être utile de maintenir le pH du sédiment en dessous de 7,0 (par exemple, entre 6,0 et 6,5). On prélève des échantillons de sédiment afin d'en déterminer le poids sec et la teneur en carbone organique. Si l'on prévoit un dégagement d'ammoniac, le sédiment formulé peut être conditionné pendant sept jours dans les conditions appliquées dans l'essai consécutif (par exemple, rapport sédiment-eau 1:4, profondeur de la couche de sédiment identique à celle introduite dans les récipients expérimentaux) avant d'y introduire la substance chimique d'essai, c'est-à-dire qu'il doit être recouvert d'eau impérativement aérée. À la fin de la période de conditionnement, l'eau sus-jacente doit être retirée et jetée. On mélange ensuite le sable quartzique chargé avec le sédiment pour chaque dose de traitement, on répartit le sédiment dans les récipients expérimentaux pour expériences identiques, et on les recouvre de l'eau de l'essai. Les récipients sont ensuite incubés dans les conditions appliquées dans l'essai consécutif. Cet événement marque le début de la période d'équilibrage. L'eau sus-jacente doit être aérée.
La source d'aliments choisie doit être ajoutée avant ou pendant l'introduction de la substance chimique d'essai dans le sédiment. On peut la mélanger préalablement avec la suspension de tourbe (voir ci-dessus). Toutefois, une dégradation trop importante de la source d'aliments avant l'addition des organismes expérimentaux — par exemple, dans le cas d'une longue durée d'équilibrage — peut être évitée en réduisant autant que possible la période qui s'écoule entre l'addition des aliments et le début de l'exposition. Pour garantir la charge des aliments par le composé d'essai, il convient de mélanger la source d'aliment avec le sédiment au plus tard le jour de l'introduction de la substance chimique d'essai dans le sédiment.
Stockage
Les constituants secs du sédiment artificiel peuvent être stockés dans un endroit sec et frais ou à température ambiante. Le sédiment préparé chargé de la substance chimique d'essai est de préférence utilisé immédiatement dans l'essai. Les échantillons de sédiment chargés peuvent être stockés dans les conditions recommandées pour la substance d'essai particulière jusqu'à analyse.
RÉFÉRENCES
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(2)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten — Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Allemagne. pp. 107-119.
|
Appendice 5
Méthodes de culture de lumbriculus variegatus
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochete vit dans les sédiments d'eau douce et est largement utilisé dans les essais écotoxicologiques. Il est facile à cultiver en conditions de laboratoire. Une description générale des méthodes de culture est donnée dans les paragraphes suivants.
Méthodes de culture
Les conditions de culture de Lumbriculus variegatus sont détaillées dans Phipps et al. (1993) (1), Brunson et al. (1998) (2), ASTM (2000) (3), U.S. EPA (2000) (4). Un bref résumé de ces conditions est présenté ci- dessous. Le principal avantage de L. variegatus est sa reproduction rapide, qui permet une augmentation rapide de la biomasse dans les populations cultivées au laboratoire [par exemple (1), (3), (4), (5)].
Les vers peuvent être cultivés dans de grands aquariums (57 — 80 l) à 23 °C avec une photopériode de 16 h de lumière (100 — 1 000 lx) et 8 h d'obscurité en renouvelant quotidiennement l'eau naturelle (45 - 50 l par aquarium). Le substrat est préparé en découpant en bandes des serviettes en papier gris non blanchi qui peuvent ensuite être mélangées avec l'eau de culture pendant quelques secondes pour donner des petits morceaux de substrat de papier. Ce substrat peut ensuite être directement utilisé pour recouvrir le fond du réservoir de l'aquarium de culture de Lumbriculus, ou il peut être stocké congelé dans de l'eau désionisée pour une utilisation ultérieure. Chaque nouvel apport de substrat dans le réservoir dure généralement environ deux mois.
On démarre chaque culture de vers avec 500 — 1 000 vers, que l'on nourrit par une suspension de 10 ml contenant 6 g d'aliment de culture de départ pour truites 3 fois par semaine dans des conditions de renouvellement ou d'écoulement de l'eau. Si les cultures sont statiques ou semi-statiques, il faut réduire les vitesses d'alimentation pour prévenir la croissance bactérienne et fongique.
Dans ces conditions, le nombre d'individus dans la culture double habituellement en environ 10 à 14 jours.
Il est également possible de cultiver Lumbriculus variegatus dans un système constitué d'une couche de sable quartzique employé pour le sédiment artificiel (1 - 2 cm de profondeur) additionnée d'eau reconstituée. On peut utiliser comme récipient de culture des conteneurs en verre ou en acier inoxydable de 12 à 20 cm de haut. L'eau doit être légèrement aérée (par exemple, 2 bulles par seconde) par l'intermédiaire d'une pipette Pasteur placée environ 2 cm au-dessus de la surface du sédiment. Afin d'éviter toute accumulation, d'ammoniac par exemple, il convient d'échanger l'eau sus-jacente à l'aide d'un système à écoulement continu, ou bien au moins une fois par semaine manuellement. Les oligochetes peuvent être cultivés à température ambiante avec une photopériode de 16 heures de lumière (intensité 100 – 1 000 lx) et 8 heures d'obscurité. Dans le cas d'une culture semi-statique (renouvellement de l'eau une fois par semaine), les vers sont nourris de TetraMine deux fois par semaine (par exemple, 0,6 - 0,8 mg par cm2 de surface de sédiment), aliment qui peut être fourni sous forme d'une suspension de 50 mg de TetraMine par ml d'eau désionisée.
Lumbriculus variegatus peut être prélevé dans des cultures, par exemple par transfert dans un nouveau bécher du substrat avec un filet à mailles fines ou transfert des organismes à l'aide d'une pipette en verre à large ouverture (environ 5 mm de diamètre) polie au feu. Lorsque du substrat est transféré en même temps dans ce bécher, le récipient contenant les vers et le substrat est placé une nuit dans des conditions d'écoulement continu, qui permettront l'élimination du substrat, tout en laissant les vers au fond du récipient. On peut ensuite les introduire dans des réservoirs de culture préparés extemporanément ou les traiter ensuite pour l'essai comme il est décrit dans (3) et (4) ou dans les paragraphes suivants.
Il convient de considérer avec attention le mode de reproduction de L. variegatus dans les essais sur sédiment lorsqu'on utilise cet animal (architomie ou morphallaxie, par exemple (6)). Ce mode de reproduction asexuée produit deux fragments, qui ne s'alimentent plus pendant un certain temps jusqu'à ce que les segments de tête et de queue se régénèrent (par exemple, (7) (8)). Par conséquent, l'exposition de L. variegatus par ingestion de sédiment contaminé n'est pas un processus continu.
Par conséquent, il convient de procéder à une synchronisation pour réduire au minimum la reproduction et la régénération incontrôlées, source de variation élevée dans les résultats de l'essai. Cette variation peut découler d'une moindre exposition à la substance chimique d'essai de certains individus qui se sont fragmentés et ne se sont par conséquent pas alimentés pendant une certaine période de temps, alors que d'autres individus ne se sont pas fragmentés pendant l'essai (9), (10), (11). Dix à 14 jours avant le début de l'exposition, les vers doivent être artificiellement fragmentés (synchronisation). Il faut choisir pour la synchronisation des gros vers (adultes), qui, de préférence, ne présentent aucun signe de morphallaxie récente. Ces vers sont placés sur une lame de verre dans une goutte d'eau de culture, et la région corporelle médiane est disséquée au scalpel. On s'assurera que les extrémités postérieures sont de tailles similaires. Les extrémités postérieures régénèrent ensuite de nouvelles têtes dans un récipient de culture contenant le substrat utilisé dans la culture et de l'eau reconstituée, jusqu'au début de l'exposition. La régénération de nouvelles têtes est signalée par l'enfouissement des vers synchronisés dans le substrat (la présence de têtes régénérées peut être confirmée par l'examen d'une fraction d'échantillon représentative au microscope binoculaire). On estime alors que les organismes expérimentaux sont tous dans un état physiologique similaire, c'est-à-dire que lorsqu'une reproduction par morphallaxie a lieu chez des vers synchronisés pendant l'essai, on estime que pratiquement tous les animaux sont également exposés au sédiment chargé. Les vers synchronisés doivent être alimentés une fois dès que les vers commencent à s'enfouir dans le substrat, ou 7 jours après la dissection. Le régime alimentaire doit être comparable à celui des cultures normales, mais il est préférable d'alimenter les vers synchronisés par la même source d'aliments que celle utilisée dans l'essai. Les vers doivent être maintenus à une température d'essai à 20 ± 2 °C. Après régénération, les vers complets intacts, qui nagent ou rampent activement après un léger stimulus mécanique, sont utilisés dans l'essai. Il convient de prévenir les lésions ou l'autotomie des vers, par exemple, en utilisant pour les manipuler des pipettes à bords polis au feu et ou des cure-dents en acier inoxydable.
Sources de cultures de départ de Lumbriculus variegatus [adresses aux États-Unis issues de (4)]
|
Europe
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Allemagne
|
|
|
Bayer Crop Science AG
|
|
Development — Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Allemagne
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Box 111
|
|
FIN-80101 Joensuu
|
|
Finlande
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Allemagne
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
U.S.A.
|
|
Agence de protection de l'environnement des États-Unis
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Université d'état du Michigan
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
Agence de protection de l'environnement des États-Unis
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Université d'état de Wright
|
|
Institute for Environmental Quality
|
|
Dayton, OH 4543
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
RÉFÉRENCES
|
(1)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. et Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(2)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field- collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment- associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(5)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(6)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(7)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(8)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(9)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000-2007.
|
|
(10)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG- AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(11)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
Appendice 6
Synthèse des résultats de l'essai circulaire
Essai de toxicité du sédiment avec “Lumbriculus variegatus”
Tableau 1
Résultats des cycles individuels de l'essai circulaire: nombres moyens de vers dans les témoins et les témoins de solvant à la fin de l'essai; EC = écart type; EC = écart type; CV = coefficient de variation.
|
|
nombre moyen de versdans les témoins
|
EC
|
CV (%)
|
n
|
nombre moyen de versdans les témoins de solvant
|
EC
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
Moyenne interlaboratoire
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
EC
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min
|
16,3
|
|
|
|
15,0
|
|
|
|
|
max
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Tableau 2
Résultats des cycles individuels de l'essai circulaire: poids sec moyen total des vers par expérience dans les témoins et les témoins de solvant à la fin de l'essai; EC = écart type; CV = coeff. de variation.
|
|
poids sec total des vers par expérience (témoins)
|
EC
|
CV (%)
|
n
|
poids sec total des vers par expérience (témoins de solvant)
|
EC
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
Moyenne interlaboratoire
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
EC
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min
|
12,9
|
|
|
|
10,5
|
|
|
|
|
max
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Tableau 3
Toxicité du PCP: résumé des effets dans l'essai circulaire: moyennes interlaboratoire pour la CE50, la CSEO et la CMEO; EC = écart type; CV = coefficient de variation. moyenne
|
paramètre biologique
|
|
Moyenne interlaboratoire (mg/kg)
|
min
|
max
|
Facteur interlaboratoire
|
EC
|
CV (%)
|
Moyenne géométr. (mg/kg)
|
|
nombre total de vers total
|
CE50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
CSEO
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
CMEO
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
DDM (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
poids sec total des vers
|
CE50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
CSEO
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
CMEO
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
DDM (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
mortalité/survie
|
CE50.
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
CSEO
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
CMEO
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
reproduction (augmentation du nombre de vers par expérience)
|
CE50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
CSEO
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
CMEO
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
DDM (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
croissance (augmentation de biomasse par expérience)
|
CE50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
CSEO
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
CMEO
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
DDM (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
DDM: différence détectable minimale par rapport aux valeurs des témoins lors de la vérification de l'hypothèse; utilisée comme mesure de la puissance statistique
|
RÉFÉRENCE
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
C.36 ESSAI DE REPRODUCTION D'UN ACARIEN PRÉDATEUR [HYPOASPIS (GEOLAELAPS) ACULEIFER] DANS LE SOL
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 226 (2008) de l'OCDE pour les essais de produits chimiques. Cette méthode d'essai est conçue pour évaluer les effets de substances chimiques contenues dans le sol sur le taux de reproduction d'une espèce d'acarien du sol Hypoaspis (Geolaelaps) aculeifer Canestrini (Acari: Laelapidae), et permet donc d'estimer l'inhibition de la vitesse de croissance spécifique d'une population (1,2). Le taux de reproduction désigne ici le nombre de juvéniles à la fin de la période d'essai. H. aculeifer ajoute un niveau trophique aux espèces déjà représentées dans des méthodes d'essai. Un essai de reproduction sans discrimination ni quantification des différentes étapes du cycle de la reproduction est jugé approprié aux desseins de cette méthode d'essai. Pour les substances chimiques dont le mode d'exposition n'implique pas le sol, d'autres approches devraient mieux convenir (3).
|
|
2.
|
Hypoaspis (Geolaelaps) aculeifer est considéré comme dûment représentatif de la faune du sol, et des acariens prédateurs en particulier. Il est répandu dans le monde entier (5) et sa récolte et son élevage au laboratoire sont aisés. L'Appendice 7 propose un résumé de la biologie de H. aculeifer. Des informations de référence sur l'écologie des espèces d'acariens et sur leur utilisation dans les essais d'écotoxicité apparaissent dans (4), (5), (6), (7), (8), (9), (10), (11), (12).
|
PRINCIPE DE L'ESSAI
|
3.
|
Des adultes femelles sont exposées à une série de concentrations de la substance chimique d'essai mélangée au sol. Au début de l'essai, 10 femelles adultes sont placées dans chaque récipient expérimental. Les mâles ne sont pas inclus dans l'essai, car l'expérience montre que les femelles s'accouplent dès l'éclosion du stade deutonymphe ou peu après dès lors que des mâles sont présents. De surcroît, l'inclusion de mâles exigerait une discrimination laborieuse des stades de développement, avec pour effet de prolonger l'essai. Par conséquent, l'accouplement lui-même reste hors de l'essai. Les femelles sont introduites dans l'essai 28 à 35 jours après le début de la période de ponte dans le processus de synchronisation (voir Appendice 4), car on peut alors considérer que les femelles se sont déjà accouplées et ont dépassé le stade de la préoviposition. À 20 °C, l'essai s'achève le 14e jour après l'introduction des femelles (jour 0), durée qui permet aux premiers descendants dans les témoins d'atteindre le stade de la deutonymphe (voir Appendice 4). Le nombre de juvéniles par récipient expérimental ainsi que le nombre de femelles survivantes sont déterminés pour calculer la principale variable mesurée. Le taux de reproduction des mites exposées à la substance chimique d'essai est comparé à celui des témoins, afin de déterminer la CEx (par exemple CE10, CE50) ou la concentration sans effet observé (CSEO) (voir Appendice 1 pour les définitions), selon le modèle expérimental choisi (voir paragraphe 29). Une description générale du calendrier de l'essai est proposée dans l'Appendice 8.
|
INFORMATIONS SUR LA SUBSTANCE CHIMIQUE D'ESSAI
|
4.
|
Il est préférable de connaître l'hydrosolubilité, le log Koe, le coefficient de partage entre l'eau et le sol et la pression de vapeur de la substance chimique d'essai. Des informations complémentaires sur le devenir de la substance d'essai dans le sol, notamment sa vitesse de dégradation biotique et abiotique, sont souhaitables.
|
|
5.
|
La présente méthode d'essai peut être utilisée pour des substances chimiques hydrosolubles ou insolubles dans l'eau; néanmoins, le mode d'application de la substance chimique d'essai variera en conséquence. Cette méthode d'essai ne s'applique pas aux substances volatiles, à savoir les substances dont la constante de Henry ou le coefficient de partage air/eau sont supérieurs à un, ou les substances dont la pression de vapeur dépasse 0,0133 Pa à 25 °C.
|
VALIDITÉ DE L'ESSAI
|
6.
|
Un résultat de l'essai sera considéré comme valide si les témoins non traités répondent aux critères suivants:
|
—
|
La mortalité moyenne des femelles adultes ne dépasse pas 20 % à la fin de l'essai;
|
|
—
|
Le nombre moyen de juvéniles par expérience (10 femelles adultes introduites) est égal à au moins 50 à la fin de l'essai;
|
|
—
|
Le coefficient de variation calculé pour le nombre d'acariens juvéniles par expérience n'excède pas 30 % à l'achèvement de l'essai final.
|
|
SUBSTANCE CHIMIQUE DE RÉFÉRENCE
|
7.
|
Le calcul de la CEx et/ou de la CSEO d'une substance chimique de référence garantit l'adéquation des conditions expérimentales du laboratoire et contrôle la régularité de la réaction des organismes d'expérience au cours du temps. Le diméthoate (CAS 60-51-5) est une substance chimique de référence reconnue dont l'effet sur la taille de la population est démontré (4). L'acide borique (CAS 10043-35-3) peut également servir de substance chimique de référence, mais il a été toutefois moins étudié. On peut choisir l'un des deux modèles expérimentaux suivants:
|
—
|
On peut parallèlement tester la substance chimique de référence et déterminer la toxicité de chaque substance chimique d'essai à une concentration préalablement identifiée dans une étude dose-réponse pour provoquer une réduction > 50 % de la descendance. Dans ce cas, le nombre d'expériences identiques sera le même que celui des témoins (voir paragraphe 29).
|
|
—
|
On peut aussi tester la substance chimique de référence 1 à 2 fois par an dans un essai dose-réponse. Selon le modèle choisi, les nombres de concentrations et d'expériences identiques et le facteur d'espacement diffèrent (voir paragraphe 29), mais il faut obtenir une réponse égale à 10 à 90 % de l'effet (facteur d'espacement de 1,8). La CE50 du diméthoate calculée d'après le nombre de juvéniles doit être comprise entre 3,0 et 7,0 s.e./kg de sol (ps). D'après les résultats obtenus à ce jour avec l'acide borique, la CE50 basée sur le nombre de juvéniles doit être comprise dans l'intervalle de 100 à 500 mg/kg de ps de sol.
|
|
DESCRIPTION DE L'ESSAI
Récipients expérimentaux et matériel
|
8.
|
Il convient d'utiliser des récipients expérimentaux en verre ou en un autre matériau chimiquement inerte de 3 à 5 cm de diamètre (hauteur de sol ≥1,5 cm) munis d'un couvercle étroitement ajusté. Il est préférable d'employer des bouchons à vis et dans ce cas, il faut aérer les récipients deux fois par semaine. Il est également possible d'utiliser des couvercles qui permettent un échange gazeux direct entre le substrat et l'atmosphère (par exemple, une gaze). Le taux d'humidité doit rester suffisamment élevé pendant l'essai, et il est donc essentiel de vérifier le poids de chaque récipient expérimental durant l'essai et de rajouter de l'eau si nécessaire. Ce contrôle présente une importance particulière lorsque l'on ne dispose pas de bouchons à vis. Si les récipients expérimentaux sont opaques, le matériau du couvercle doit permettre le passage de la lumière (par exemple un couvercle transparent perforé), et empêcher néanmoins les acariens de s'échapper. La taille et le type du récipient expérimental dépendent de la méthode d'extraction (voir Appendice 5 pour plus de détails). Lorsque l'on procède à une extraction à la chaleur directement sur le récipient expérimental, il convient alors d'ajouter au fond un treillis aux mailles de dimensions appropriées (qui restera scellé jusqu'à l'extraction), et d'utiliser une épaisseur de sol suffisante pour l'établissement d'un gradient de température et d'humidité.
|
|
9.
|
Cet essai requiert du matériel de laboratoire standard, en particulier les articles suivants:
|
—
|
récipients, de préférence en verre avec des bouchons à vis;
|
|
—
|
pinceaux pour le transfert des acariens;
|
|
—
|
balances suffisamment exactes;
|
|
—
|
instruments permettant de contrôler la température;
|
|
—
|
instruments permettant de contrôler l'humidité de l'air (facultatifs si les récipients expérimentaux sont fermés par des couvercles);
|
|
—
|
incubateur ou petite chambre à température contrôlée;
|
|
—
|
matériel pour l'extraction (voir Appendice 5) (13);
|
|
—
|
panneau lumineux suspendu avec réglage de la lumière;
|
|
—
|
bocaux de récolte pour les acariens extraits.
|
|
Préparation du sol artificiel
|
10.
|
Pour cet essai, on utilise un sol artificiel. Il comprend les composants suivants (toutes les valeurs sont proportionnelles à la masse sèche):
|
—
|
5 % de tourbe à sphaigne, séchée à l'air et finement broyée (une dimension des particules de 2 ± 1 mm est acceptable);
|
|
—
|
20 % d'argile kaolinique (teneur en kaolinite de préférence supérieure à 30 %);
|
|
—
|
environ 74 % de sable industriel séché à l'air (selon la quantité de CaCO3 nécessaire), essentiellement du sable fin contenant plus de 50 % de particules mesurant entre 50 et 200 microns. La quantité exacte de sable dépend de la quantité de CaCO3 (voir ci-dessous), la proportion combinée des deux composants devant atteindre 75 %.
|
|
—
|
< 1,0 % de carbonate de calcium (CaCO3, pulvérisé, qualité analytique) afin d'obtenir un pH de 6,0 ± 0,5; la quantité de carbonate de calcium à ajouter dépend principalement de la qualité et de la nature de la tourbe (voir Note 1).
|
Note 1: La quantité de CaCO3 requise dépendra des composants du substrat de sol et doit être déterminée par mesure du pH sur des échantillons prélevés dans le sol immédiatement avant l'essai (14)
Note 2: La proportion de tourbe dans le sol artificiel diffère de celle recommandée dans les autres méthodes d'essai sur les organismes du sol, dans lesquelles on utilise dans la plupart des cas 10 % de tourbe [par exemple (15)]. Toutefois, selon l'OEPP (16), un sol agricole type ne contient pas plus de 5 % de matières organiques et la réduction de la proportion de tourbe vise à représenter les capacités réduites de sorption par un sol naturel de la substance chimique d'essai sur le carbone organique.
Note 3: Si besoin est, par exemple à des fins d'essai spécifiques, des sols naturels provenant de sites non pollués peuvent également servir de substrat d'essai et/ou de culture. Toutefois, lorsque l'on utilise un sol naturel, il faut le caractériser au moins par son origine (site de récolte), son pH, sa texture (distribution de tailles de particules) et sa teneur en matières organiques. Le cas échéant, le type et le nom du sol seront mentionnés conformément à la classification des sols, et le sol doit être exempt de toute contamination. Dans le cas où la substance chimique d'essai est un métal ou un composé organométallique, il conviendra également de déterminer la capacité d'échange de cations (CEC) du sol naturel. On s'efforcera tout particulièrement de satisfaire les critères de validité, car les informations de référence sur les sols naturels sont habituellement rares.
|
|
11.
|
Les constituants secs du sol sont soigneusement mélangés (par exemple, dans un grand mélangeur de laboratoire). Le pH est déterminé avec un mélange de sol et d'une solution de chlorure de potassium (KCl) 1 M ou de chlorure de calcium (CaCl2) 0,01 M dans un rapport 1/5 [voir (14) et Appendice 3]. Si l'acidité du sol est supérieure à la limite requise (voir paragraphe 10), elle peut être ajustée par addition d'une quantité appropriée de CaCO3. Si le sol est trop alcalin, le pH peut être abaissé par l'addition d'un supplément du mélange comprenant les trois premiers composants décrits au paragraphe 10, à l'exclusion du CaCO3.
|
|
12.
|
La capacité de rétention d'eau (CRE) maximale du sol artificiel est déterminée conformément aux protocoles décrits dans l'Appendice 2. Deux à sept jours avant le début de l'essai, le sol artificiel sec est préhumidifié par addition d'une quantité suffisante d'eau distillée ou désionisée pour atteindre environ la moitié de la teneur en eau finale, c'est-à-dire 40 à 60 % de la CRE maximale. Le taux d'humidité est ajusté à 40-60 % de la capacité de rétention d'eau maximale par addition de la solution de substance chimique d'essai et/ou addition d'eau distillée ou désionisée (voir paragraphes 16-18). Il est possible d'estimer approximativement le taux d'humidité du sol en pressant doucement une poignée de sol dans la main: si le taux d'humidité est correct, de petites gouttes d'eau apparaissent entre les doigts.
|
|
13.
|
La teneur en humidité du sol est déterminée au début et à la fin de l'essai par séchage à 105 °C jusqu'à l'obtention d'un poids constant, conformément à la norme ISO 11465 (17) et à un pH du sol conforme à l'Appendice 3 ou à la norme ISO 10390 (14). Ces mesures doivent être réalisées dans des échantillons supplémentaires sans acarien, sur le sol témoin et sur des sols contenant chaque concentration d'essai. Il ne faut pas ajuster le pH du sol lorsque l'on teste des substances acides ou basiques. Il convient de vérifier la teneur en humidité pendant tout l'essai par pesée périodique des récipients (voir paragraphes 20 et 24).
|
Sélection et préparation des animaux expérimentaux
|
14.
|
L'espèce utilisée dans l'essai est Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). Des acariens adultes femelles, prélevés dans une cohorte synchronisée, sont nécessaires au début de l'essai. Les acariens sont introduits environ 7 à 14 jours après le passage au stade adulte, 28 à 35 jours après le début de la ponte dans le processus de synchronisation (voir paragraphe 3 et Appendice 4). La source des acariens ou leur fournisseur et le maintien de la culture au laboratoire doivent être enregistrés. Lorsqu'une culture est maintenue au laboratoire, il est recommandé de confirmer l'identité des espèces au moins une fois par an. L'Appendice 6 comprend une fiche d'identification.
|
Préparation des concentrations expérimentales
|
15.
|
La substance d'essai est mélangée dans le sol. Il convient de choisir les solvants organiques utilisés pour faciliter le traitement du sol par la substance d'essai sur des critères de faible toxicité pour les acariens, et un témoin de solvant approprié doit être inclus dans l'essai (voir paragraphe 29).
|
Substance d'essai hydrosoluble
|
16.
|
Une solution de la substance chimique d'essai dans de l'eau désionisée est préparée en une quantité suffisante pour toutes les expériences identiques d'une concentration expérimentale. Il est recommandé d'utiliser la quantité d'eau nécessaire pour obtenir le taux d'humidité requis, à savoir 40 à 60 % de la capacité maximale de rétention d'eau (voir paragraphe 12). Chaque solution de la substance d'essai est mélangée complètement avec un lot du sol préhumidifié, avant d'être introduite dans le récipient expérimental.
|
Substance chimique d'essai hydrosoluble
|
17.
|
Les substances chimiques non solubles dans l'eau mais solubles dans des solvants organiques peuvent être dissoutes dans le plus petit volume possible d'un véhicule approprié (par exemple de l'acétone). Seuls des solvants volatils peuvent être utilisés. Dans le cas où ces véhicules sont utilisés, toutes les concentrations expérimentales et les témoins contiennent la même quantité minimale du véhicule. Le véhicule est pulvérisé sur ou mélangé à une petite quantité, 10 g par exemple, de sable quartzique fin. Il convient de corriger la quantité de sable contenu dans le substrat pour tenir compte de cette quantité. Ensuite, le véhicule est éliminé par évaporation sous une hotte durant au moins une heure. Ce mélange de sable quartzique et de la substance d'essai est ajouté au sol préhumidifié, auquel il est soigneusement mélangé après l'ajout de la quantité nécessaire d'eau désionisée pour atteindre l'humidité requise. Le mélange final est introduit dans les récipients expérimentaux. Il convient de noter que certains solvants peuvent être toxiques pour les acariens. Par conséquent, il est recommandé d'utiliser un témoin d'eau supplémentaire sans véhicule lorsque cette toxicité est inconnue. La démonstration fiable d'absence d'effet du solvant (aux concentrations appliquées) permet d'omettre le témoin d'eau.
|
Substance chimique d'essai peu soluble dans l'eau et les solvants organiques
|
18.
|
Pour les substances chimiques peu solubles dans l'eau et les solvants organiques, on mélange l'équivalent de 2,5 g de sable quartzique finement broyé par récipient expérimental (par exemple, 10 g de sable quartzique fin pour quatre expériences identiques) à la quantité nécessaire de la substance d'essai pour obtenir la concentration expérimentale voulue. Il convient de corriger la quantité de sable contenu dans le substrat pour tenir compte de cette quantité. Ce mélange de sable quartzique et de la substance chimique d'essai est ajouté au sol préhumidifié, auquel il est soigneusement mélangé après l'ajout de la quantité nécessaire d'eau désionisée pour atteindre l'humidité requise. Le mélange final est réparti entre les récipients expérimentaux. On répète la procédure pour chaque concentration expérimentale et on prépare un témoin approprié.
|
MODE OPÉRATOIRE
Groupes traités et témoins
|
19.
|
Il est recommandé d'utiliser dix adultes femelles dans 20 g de masse sèche de sol artificiel dans chaque récipient témoin et traité. Les organismes expérimentaux doivent être ajoutés dans les deux heures qui suivent la préparation du substrat d'essai final (c'est-à-dire après l'application de la substance d'essai). Dans certains cas particuliers (par exemple, lorsque le vieillissement est considéré comme un facteur déterminant), la durée écoulée entre la préparation du substrat d'essai final et l'addition des acariens peut être prolongée (pour des détails sur ce vieillissement, voir (18)). Il convient toutefois de fournir une justification scientifique de cette décision.
|
|
20.
|
Une fois les acariens ajoutés au sol, ils sont nourris, et le poids initial de chaque récipient expérimental doit être mesuré pour servir de référence lors du contrôle du taux d'humidité du sol tout au long de l'essai, comme il est décrit au paragraphe 24. Les récipients expérimentaux sont ensuite couverts comme il est décrit au paragraphe 8 et placés dans la chambre expérimentale.
|
|
21.
|
Des témoins appropriés à la méthode d'application de la substance chimique d'essai, présentée dans l'un des paragraphes 15 à 18, sont préparés. La préparation des témoins se conforme aux protocoles décrits, sans addition de la substance chimique d'essai. Ainsi, le cas échéant, des solvants organiques, du sable quartzique ou d'autres véhicules sont utilisés dans les témoins en concentrations/quantités équivalentes à celles des traitements. Lorsqu'un solvant ou un autre véhicule est employé pour ajouter la substance chimique d'essai, il faut également préparer un témoin supplémentaire sans véhicule ni substance d'essai et le tester chaque fois que la toxicité du solvant est inconnue (voir paragraphe 17).
|
Conditions expérimentales
|
22.
|
La température expérimentale doit être de 20 ± 2 °C. Elle doit être enregistrée au moins quotidiennement et ajustée, s'il y a lieu. L'essai est mené dans des conditions de cycles de lumière et d'obscurité contrôlés (de préférence 16 heures de lumière et 8 heures d'obscurité) avec un éclairement de 400 à 800 lux dans la zone des récipients expérimentaux. À des fins de comparaisons, ces conditions sont identiques à celles appliquées dans d'autres essais écotoxicologiques dans le sol [par exemple, (15)].
|
|
23.
|
Les échanges gazeux doivent être assurés par aération des récipients expérimentaux au moins deux fois par semaine lorsque l'on utilise des bouchons à vis. Dans le cas d'une ouverture couverte de gaze, il convient de veiller particulièrement au maintien du taux d'humidité du sol (voir paragraphes 8 et 24).
|
|
24.
|
La teneur en eau du substrat de sol dans les récipients expérimentaux est maintenue pendant toute la durée de l'essai en pesant les récipients expérimentaux, et s'il y a lieu, en y rajoutant périodiquement de l'eau (par exemple une fois par semaine). Les pertes doivent être compensées selon les besoins par de l'eau désionisée. Le taux d'humidité pendant l'essai ne doit pas s'écarter de plus de 10 % de la valeur initiale.
|
Alimentation
|
25.
|
On a montré que les acariens du fromage [Tyrophagus putrescentiae (Schrank, 1781)] constituaient une source d'aliment appropriée. De petits collemboles (par exemple Folsomia candida juvénile Willem, 1902 ou Onychiurus fimatus (19, 20), des enchytrées (par exemple Enchytraeus crypticus Westheide & Graefe, 1992) ou des nématodes (par exemple Turbatrix silusiae de Man, 1913) peuvent également convenir (21). Il est recommandé de contrôler les aliments avant de les utiliser dans un essai. Le type et la quantité d'aliments doivent assurer l'obtention d'un nombre de juvéniles suffisant pour remplir les critères de validité (paragraphe 6). Lors du choix des proies, il convient de considérer le mode d'action de la substance d'essai (par exemple, un acaricide peut se révéler toxique aussi pour les acariens qui servent d'aliments, voir paragraphe 26).
|
|
26.
|
Les aliments doivent être fournis ad libitum [mais en petite quantité à chaque fois (pointe de spatule)]. A cette fin, on peut également utiliser un aspirateur à succion douce comme il est proposé dans l'essai sur les collemboles, ou un pinceau fin. Il suffira généralement de distribuer les aliments au début de l'essai et deux à trois fois par semaine. Si la substance d'essai se révèle toxique pour la proie, il faudra envisager d'augmenter la fréquence d'alimentation et/ou d'employer une autre source d'aliments.
|
Sélection des concentrations expérimentales
|
27.
|
Des informations préalables sur la toxicité de la substance chimique d'essai, issues par exemple d'études préliminaires de sélection des concentrations, devraient faciliter la sélection des concentrations expérimentales appropriées. Si besoin est, une étude préliminaire est menée, avec cinq concentrations de la substance chimique d'essai dans la gamme de 0,1 - 1 000 mg/kg de sol sec, avec au moins une expérience par traitement et un témoin. L'étude préliminaire dure 14 jours, à l'issue desquels la mortalité des acariens adultes et le nombre de juvéniles sont déterminés. Il est préférable de choisir dans l'essai final une gamme de concentrations qui inclut des concentrations affectant les nombres de juvéniles mais non la survie de la génération maternelle. Cette démarche est toutefois exclue pour les substances chimiques qui provoquent des effets létaux et sub-létaux à des concentrations pratiquement similaires. La concentration efficace (par exemple CE50, CE25, CE10) et la gamme de concentrations pour laquelle l'effet de la substance d'essai présente un intérêt doivent être contenues dans l'intervalle des concentrations de l'essai. L'extrapolation à des valeurs très inférieures à la concentration la plus basse qui affecte les organismes expérimentaux ou supérieures à la concentration la plus élevée de l'essai doit rester exceptionnelle, et justifiée en détail dans le rapport.
|
Modèle expérimental
Essais dose-réponse
|
28.
|
Trois modèles d'essai, fondés sur les recommandations issues d'un autre essai tournant (essai de reproduction chez l'enchytrée (22)) sont proposés. L'adéquation générale de ces trois modèles a été confirmée par les résultats de la validation sur H. aculeifer.
|
|
29.
|
Lors de l'établissement de la gamme de concentrations, il convient de tenir compte des points suivants:
|
—
|
Pour déterminer la CEx (par exemple CE10, CE50), il faut tester douze concentrations. Il est recommandé d'inclure au moins deux expériences identiques à chaque concentration d'essai et six témoins. Le facteur d'espacement peut varier, mais doit être inférieur ou égal à 1,8 dans la gamme efficace anticipée et supérieur à 1,8 aux concentrations plus élevées et plus faibles.
|
|
—
|
Pour déterminer la CSEO, il faut tester au moins cinq concentrations formant une série géométrique. Il est recommandé d'inclure quatre expériences identiques par concentration expérimentale et huit témoins. Les concentrations doivent être espacées d'un facteur d'au plus 2,0.
|
|
—
|
Une approche combinée permet de déterminer à la fois la CSEO et la CEx. Il faut alors utiliser huit concentrations expérimentales formant une série géométrique. Il est recommandé d'inclure quatre expériences identiques par traitement et huit témoins. Les concentrations doivent être espacées d'un facteur d'au plus 1,8.
|
|
Essai limite
|
30.
|
Si la concentration la plus élevée (par exemple 1 000 mg/kg) dans l'essai préliminaire de sélection des concentrations n'engendre aucun effet, l'essai de reproduction final peut être mené sous forme d'un essai limite, à la concentration expérimentale de 1 000 mg/kg ps de sol. Un essai limite permet de démontrer que la CSEO ou la CE10 pour la reproduction est supérieure à la concentration limite, en employant un nombre minimal d'acariens dans l'essai. Il faut alors utiliser huit expériences identiques pour le sol traité et pour le témoin.
|
Durée de l'essai et mesures
|
31.
|
Toutes les différences observées de comportement et de morphologie des acariens entre les récipients témoins et les récipients traités doivent être notées.
|
|
32.
|
Le 14e jour, les acariens survivants sont séparés du sol par extraction à la chaleur ou à la lumière ou par une autre méthode appropriée (voir Appendice 5). Les juvéniles (c'est-à-dire larves, protonymphes et deutonymphes) et les adultes sont comptés séparément. Tous les acariens adultes qui ne sont pas récupérés à ce stade doivent être comptabilisés comme morts, car on suppose qu'ils sont décédés et se sont décomposés avant l'évaluation. Il faut valider l'efficacité d'extraction une ou deux fois par an sur des témoins contenant des nombres connus d'adultes et de juvéniles. L'efficacité doit être supérieure à 90 % en moyenne combinée pour tous les stades de développement (voir Appendice 5). Les nombres des adultes et des juvéniles ne seront pas ajustés en fonction de l'efficacité.
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
33.
|
Les paragraphes 36 à 41 contiennent des informations sur les méthodes statistiques susceptibles d'être utilisées pour analyser les résultats de l'essai. Il faut également consulter le Document 54 de l'OCDE intitulé “Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application”.
|
|
34.
|
Le résultat principal de l'essai est le taux de reproduction, c'est-à-dire le nombre de juvéniles produits par récipient expérimental (dans lequel 10 femelles adultes ont été introduites). L'analyse statistique requiert le calcul de la moyenne arithmétique (X) et de la variance (s2) du taux de reproduction par traitement et par témoin. X et s2 sont employés dans des analyses de variance telles que le test t de Student, le test de Dunnett ou le test de William, et pour calculer des intervalles de confiance à 95 %.
Note: Ce résultat principal équivaut à la mesure de fécondité représentée par le nombre de juvéniles vivants produits pendant l'essai divisé par le nombre de parents femelles introduits au début de l'essai.
|
|
35.
|
Le nombre de femelles survivantes dans les témoins non traités est un critère de validité essentiel qui doit être détaillé. Comme dans l'essai préliminaire de sélection des concentrations, tous les autres signes de nocivité doivent également être consignés dans le rapport final.
|
CEx
|
36.
|
On calcule les valeurs de CEx et leurs limites de confiance à 95 % supérieures et inférieures correspondant au paramètre décrit dans le paragraphe 34 en utilisant des méthodes statistiques adéquates (par exemple, analyse probit, fonction logistique ou de Weibull, méthode simplifiée de Spearman-Karber, ou simple interpolation). Une CEx est obtenue en intégrant une valeur correspondant à x % de la moyenne du témoin dans l'équation retenue. Pour calculer la CE50 ou tout autre CEx, il faut soumettre les moyennes par traitement (X) à une analyse de régression.
|
CSEO/CMEO
|
37.
|
Lorsqu'une analyse statistique est appliquée pour déterminer la CSEO/CMEO, il faut disposer de statistiques par récipient (chaque récipient individuel est considéré comme une expérience). Il convient alors d'utiliser des méthodes statistiques adéquates (conformément au Document 54 de l'OCDE intitulé “Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application”). En général, les effets indésirables de la substance d'essai par rapport au témoin sont examinés en utilisant une hypothèse unilatérale (inférieure) avec une analyse à p ≤ 0,05. Les paragraphes suivants en comprennent des exemples.
|
|
38.
|
La distribution normale des données peut être analysée, par exemple, par le test d'ajustement de Kolmogorov-Smirnov, le test du rapport rang à écart-type (test R/s) ou le test de Shapiro-Wilk (bilatéral, p ≤ 0,05). On peut utiliser le test de Cochran, le test de Levene ou le test de Bartlett (bilatéral, p ≤ 0,05) pour tester l'homogénéité de la variance. Lorsque les pré-requis des procédures de tests paramétriques sont satisfaits (normalité, homogénéité de la variance), on peut appliquer une analyse de variance une voie, puis des tests multicomparatifs. Les tests de comparaison multiples (par exemple, tests t de Dunnett) ou les tests de tendance décroissante (par exemple, test de Williams dans le cas d'une relation réponse à la dose monotone) peuvent être utilisés pour calculer, le cas échéant, des différences significatives (p ≤ 0,05) entre les témoins et les diverses concentrations de la substance d'essai (on choisira le test recommandé conformément au Document 54 de l'OCDE intitulé “Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application”). On peut toutefois utiliser des méthodes non paramétriques (test U de Bonferroni conformément à Holm ou test de tendance de Jonckheere-Terpstra) pour déterminer la CSEO et la CMEO.
|
Essai limite
|
39.
|
Si un essai limite a été mis en œuvre (comparaison du témoin et d'un seul traitement) et que les conditions requises pour les procédures de tests paramétriques (normalité, homogénéité) sont remplies, on peut évaluer les réponses métriques par le test de Student (test t). Le test t de variance inégale (test t de Welch) ou bien un test t non paramétrique tel que le test U de Mann-Whitney peuvent être employés lorsque ces conditions ne sont pas satisfaites.
|
|
40.
|
Si l'on cherche à déterminer des différences significatives entre les témoins (témoin et témoin de solvant), les réplicas de chaque témoin peuvent être testés comme il est décrit pour l'essai limite. Lorsque les essais ne détectent aucune différence significative, il est possible de rassembler toutes les expériences identiques témoins et témoins de solvant. Dans le cas contraire, il faut comparer tous les traitements avec le témoin de solvant.
|
Rapport d'essai
|
41.
|
Le rapport d'essai doit comprendre au moins les informations suivantes:
|
—
|
Substance chimique d'essai
|
—
|
identité de la substance chimique d'essai, lot de fabrication, lot de conditionnement et numéros CAS, pureté;
|
|
—
|
propriétés physico-chimiques de la substance chimique d'essai (par exemple log Koe, hydrosolubilité, pression de vapeur, constante de Henry (H) et de préférence, information sur le devenir de la substance chimique d'essai dans le sol).
|
|
|
—
|
Organismes expérimentaux
|
—
|
identification et fournisseur des organismes expérimentaux, description des conditions d'élevage;
|
|
—
|
gamme d'âges des organismes expérimentaux.
|
|
|
—
|
Conditions expérimentales
|
—
|
description du modèle expérimental et du mode opératoire;
|
|
—
|
détails sur la préparation du sol d'essai; description détaillée lorsque l'on utilise un sol naturel (origine, histoire, distribution de tailles de particules, pH, teneur en matières organiques, et, le cas échéant, classification du sol);
|
|
—
|
capacité maximale de rétention d'eau du sol;
|
|
—
|
description de la méthode d'application de la substance chimique d'essai dans le sol;
|
|
—
|
conception expérimentale et mode opératoire;
|
|
—
|
dimension des récipients expérimentaux et masse sèche de sol d'essai par récipient;
|
|
—
|
Conditions expérimentales intensité lumineuse, durée des cycles de lumière et d'obscurité, température;
|
|
—
|
description du régime d'administration de la nourriture, nature et quantité de nourriture fournie au cours de l'essai, dates d'alimentation;
|
|
—
|
pH et teneur en eau du sol au début et pendant l'essai;
|
|
—
|
description détaillée de la méthode d'extraction et de l'efficacité d'extraction.
|
|
|
—
|
Résultats de l'essai
|
—
|
nombre de juvéniles déterminé dans chaque récipient expérimental à la fin de l'essai;
|
|
—
|
nombre de femelles adultes et mortalité des adultes (%) dans chaque récipient expérimental à la fin de l'essai;
|
|
—
|
description des symptômes évidents ou des changements nets de comportement;
|
|
—
|
résultats obtenus avec la substance chimique de référence de l'essai;
|
|
—
|
résumé des analyses statistiques (CEx et/ou CSEO) y compris les limites de confiance à 95 % et la description de la méthode de calcul;
|
|
—
|
courbe de la relation concentration-réponse;
|
|
—
|
écarts par rapport aux protocoles décrits dans la présente méthode d'essai et faits inhabituels, quels qu'ils soient, survenus au cours de l'essai
|
|
|
BIBLIOGRAPHIE
|
(1)
|
Casanueva, M.E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21-46.
|
|
(2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259-274.
|
|
(3)
|
Bakker, F.M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. and van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS — Journal of Soils and Sediments 3, 73-77.
|
|
(4)
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. 2nd edition In: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 pp.
|
|
(5)
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the population development of Hypoaspis aculeifer (Acari: Parasitiformes). In: F. Dusbabek & V. Bukva (eds.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487-492
|
|
(6)
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: p 241-249.
|
|
(7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: p 621-628.
|
|
(8)
|
Krogh, P.H. and Axelsen, J.A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. In: Lokke, H. and van Gestel, C.A.M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, p 239-251.
|
|
(9)
|
Løkke, H., Janssen, C.R., Lanno, R.P., Römbke, J., Rundgren, S. and Van Straalen, N.M. (2002). Soil Toxicity Tests — Invertebrates. In: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P.W., Van Straalen, N.M. and Tarazona, J.V. (eds.). SETAC Press, Pensacola, USA. 128 pp.
|
|
(10)
|
Schlosser, H.-J. and Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395-433.
|
|
(11)
|
Schlosser, H.-J. and Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413-433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K. and Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154-7157.
|
|
(13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95-122.
|
|
(14)
|
ISO (Organisation internationale de normalisation) (1994). Qualité du sol -- Détermination du pH, No. 10390. ISO, Genève.
|
|
(15)
|
Chapitre C.8 de la présente annexe — Toxicité pour les vers de terre.
|
|
(16)
|
EPPO (2003): EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195-209.
|
|
(17)
|
ISO (Organisation internationale de normalisation) (1993). Détermination de la teneur pondérale en matière sèche et en eau -- Méthode gravimétrique, No. 11465. ISO, Genève.
|
|
(18)
|
Fairbrother, A., Glazebrock, P.W., Van Straalen, N.M. and Tarazona, J.V. 2002. Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, USA.
|
|
(19)
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges.allg..angew. Ent. 3:122-125.
|
|
(20)
|
Schlosser, H.J., und Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool.Beitr. N.F. 34(3):395-433.
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. and Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130-135.
|
|
(22)
|
Chapitre C.32 de la présente annexe — Essai de reproduction chez l'enchytrée.
|
|
(23)
|
ISO (Organisation internationale de normalisation) (1994). Qualité du sol -- Effets des polluants vis-à-vis des vers de terre (Eisenia fetida). Partie 2: Détermination des effets sur la reproduction, No. 11268-2. ISO, Genève.
|
|
(24)
|
Southwood, T.R.E. (1991). Ecological methods. With particular reference to the study of insect populations. (2nd ed.). Chapman & Hall, London, 524 pp.
|
|
(25)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie (2nd ed.). G. Fischer, Jena, 539 pp.
|
|
(26)
|
Lesna, I. and Sabelis, M.W. (1999). Diet-dependent female choice for males with “good genes” in a soil predatory mite. Nature 401, 581-583.
|
|
(27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103-107.
|
|
(28)
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
(29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11-59.
|
|
(30)
|
Kevan, D.K. McE. and Sharma, G.D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647-658.
|
|
(31)
|
OCDE (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Publications Hygiène et Sécurité de l'environnement de l'OCDE — Série sur les essais et évaluations no54. ENV/JM/MONO(2006)18
|
Appendice 1
Définitions
Les définitions suivantes s'appliquent aux fins de la présente méthode d'essai (dans cet essai, toutes les concentrations efficaces sont exprimées en masse de la substance chimique d'essai rapportée à la masse sèche du sol d'essai):
Substance chimique
: une substance ou un mélange
CSEO (concentration sans effet observé): désigne la concentration de la substance chimique d'essai à laquelle aucun effet n'est observé. Dans cet essai, la concentration correspondant à la CSEO n'a pas d'effet statistiquement significatif (p < 0,05) durant une période d'exposition donnée, en comparaison avec le témoin.
CMEO (concentration minimale avec effet observé): la plus faible concentration de la substance chimique d'essai qui exerce un effet statistiquement significatif (p < 0,05) durant une période d'exposition donnée, en comparaison avec le témoin.
CEx
(concentration efficace à x %): concentration qui engendre un effet de x % sur les organismes d'expérience durant une période d'exposition déterminée, en comparaison avec un témoin. Par exemple, une CE50 est une concentration estimée produire un effet sur un paramètre évalué de l'essai dans 50 % d'une population exposée durant une période d'exposition déterminée.
Substance chimique d'essai
: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
Appendice 2
Détermination de la capacité maximale de rétention d'eau du sol
La méthode suivante de détermination de la capacité maximale de rétention d'eau du sol a fait ses preuves. Elle est décrite à l'annexe C de la norme ISO DIS 11268-2 (Qualité du sol -- Effets des polluants vis-à-vis des vers de terre (Eisenia fetida). Partie 2: Détermination des effets sur la reproduction (23).
Prélever une quantité déterminée (5 g, par exemple) du sol expérimental servant de substrat à l'aide d'un instrument approprié (tube de tarière, etc.). Couvrir le fond du tube d'un morceau de papier filtre imbibé d'eau, puis placer le tube sur un support dans un bain d'eau. Le tube doit être progressivement immergé jusqu'à ce que le niveau d'eau passe au-dessus du sol. Laisser le tube dans l'eau durant environ trois heures. Comme l'eau absorbée par les capillaires du sol ne peut pas être retenue en totalité, il faut la laisser s'évacuer de l'échantillon de sol durant deux heures en plaçant le tube sur un lit de sable quartzique finement broyé très humide contenu dans un récipient fermé (pour qu'il ne sèche pas). Il faut ensuite peser l'échantillon et le sécher à 105 °C jusqu'à ce qu'il atteigne une masse constante. La capacité de rétention d'eau (CRE) est ensuite calculée comme suit:

où:
S= masse du substrat saturé en eau + masse du tube + masse du papier filtre
T= tare (masse du tube + masse du papier filtre)
D= masse sèche du substrat
Appendice 3
Détermination du pH du sol
La méthode de détermination du pH d'un sol, décrite ci-dessous s'appuie sur la norme ISO 10390: Qualité du sol — Détermination du pH (16).
On laisse sécher une quantité définie de sol à température ambiante durant au moins 12 heures. On prépare une suspension du sol (contenant au moins 5 g de sol) dans cinq fois son volume d'une solution de chlorure de potassium (KCl) 1 M de qualité analytique ou d'une solution de chlorure de calcium (CaCl2) 0,01 M de qualité analytique. On agite vigoureusement la suspension durant cinq minutes et on la laisse sédimenter durant au moins deux heures, mais pas plus de 24 heures. On mesure ensuite le pH de la phase liquide à l'aide d'un pH-mètre, étalonné avant chaque mesure à l'aide d'une série appropriée de solutions tampons (pH 4,0 et 7,0, par exemple).
Appendice 4
Élevage de Hypoaspis (Geolaelaps) aculeifer, d'acariens des aliments et synchronisation des cultures
Élevage de Hypoaspis (Geolaelaps) aculeifer:
Les cultures peuvent être maintenues dans des récipients de plastique ou des flacons de verre remplis d'un mélange de plâtre de Paris et de poudre de charbon (9/1). Le plâtre doit rester humide grâce à l'addition, si besoin est, de quelques gouttes d'eau distillée ou désionisée. Les températures d'élevage optimales sont comprises dans l'intervalle de 20 ± 20 °C, le régime de lumière et d'obscurité n'est pas déterminant pour cette espèce. Les proies peuvent être des acariens Typrophagus putrescentiae ou Caloglyphus (les acariens des aliments doivent être manipulés avec précaution car ils peuvent provoquer des allergies chez l'homme), mais les nématodes, les enchytrées et les collemboles sont également des proies adéquates. Leur provenance doit être consignée. Il est possible d'initier le développement de la population à partir d'une seule femelle, car les mâles se développent dans les œufs non fécondés. Les générations se chevauchent dans une large mesure. Une femelle peut vivre au moins 100 jours et pondre environ 100 œufs au cours de sa vie. Le taux de ponte maximal est atteint entre 10 et 40 jours (à l'âge adulte) et il s'élève à 2,2 œufs femelle– 1 jour– 1. Le développement de l'œuf jusqu'au stade adulte de la femelle dure environ 20 jours à 20 °C. Il faut maintenir et traiter plusieurs cultures à l'avance.
Élevage de Typrophagus putrescentiae:
Les acariens sont élevés dans un récipient en verre rempli de poudre de levure de bière fine, et placé dans un seau en plastique rempli d'une solution de KNO3 qui empêche la fuite des animaux. Les acariens des aliments sont placés au dessus de cette poudre. Ensuite, ils sont soigneusement mélangés à la poudre (à remplacer deux fois par semaine) à l'aide d'une spatule.
Synchronisation de la culture:
Les spécimens utilisés dans l'essai doivent avoir à peu près le même âge (environ 7 jours après le passage au stade adulte). À la température d'élevage de 20 OQ la synchronisation est réalisée de la manière suivante:
Les femelles sont transférées dans un récipient d'élevage propre et reçoivent une quantité suffisante de nourriture
|
—
|
On les laisse pondre pendant deux ou trois jours, puis elles sont récoltées
|
|
—
|
Les femelles adultes sont prélevées pour l'essai entre le 28ème et le 35ème jour après le placement des femelles adultes dans des récipients d'élevage propres.
|
Il est facile de distinguer les femelles adultes des mâles et des animaux aux autres stades de développement par leur dimension plus grande, leur forme boursouflée et leur bouclier dorsal brun car les mâles sont plus minces et plats, et les stades immatures sont blancs à crèmes. Le développement des acariens est à peu près conforme au modèle décrit ci-dessous à 20 °C (Figure): oeuf 5 j, larve 2 j, protonymphe 5 j, deutonymphe 7 j, période de préoviposition de la femelle 2 j. Ensuite, les acariens sont adultes.
Figure
Développement de Hypoaspis (Geolaelaps) aculeifer à 20 °C. (prélèvement = femelles utilisées pour l'essai)
Les animaux adultes sont prélevés dans la culture synchronisée et introduits dans les récipients expérimentaux entre le 28e et le 35e jour après le début de la ponte des parents femelles (c'est-à-dire 7-14 jours après le passage à l'âge adulte). On s'assure ainsi que les animaux de l'essai sont au-delà de la période de préoviposition et se sont accouplés avec des mâles qui sont également présents dans le récipient de culture. Des observations réalisées sur des cultures de laboratoire suggèrent que, lorsque des mâles sont présents, les femelles s'accouplent dès le passage à l'âge adulte ou peu après (Ruf, Vaninnen, obs. pers.). La période de sept jours est retenue car elle s'intègre facilement à la routine du laboratoire et atténue la variabilité développementale individuelle entre les acariens. L'oviposition doit être initiée avec un nombre de femelles au moins égal à celui qui sera finalement nécessaire pour l'essai (par exemple, s'il faut 400 femelles dans l'essai, il faudra laisser pondre au moins 400 femelles pendant deux à trois jours. Le nombre d'œufs au point de départ de la population synchronisée doit être d'au moins 1 200 [proportion relative des sexes environ 0,5, mortalité environ 0,2)]. Afin d'éviter le cannibalisme, il est préférable que chaque récipient renferme au plus 20 à 30 femelles en période de ponte.
Appendice 5
Méthodes d'extraction
L'extraction à la chaleur est une méthode qui convient à la séparation de microarthropodes à partir d'un sol ou d'un substrat (voir figure ci-dessous). La méthode tire parti de l'activité des organismes, et ainsi, seuls les spécimens mobiles sont susceptibles d'être enregistrés. Le principe de l'extraction à la chaleur consiste à dégrader progressivement les conditions dans l'échantillon pour inciter les organismes à quitter le substrat et les faire tomber dans un liquide de fixation (par exemple éthanol). Les paramètres déterminants sont la durée de l'extraction et l'évolution des conditions appliquées, qui varient de bonnes à modérément bonnes puis deviennent mauvaises pour les organismes. Dans des essais écotoxicologiques, la durée de l'extraction doit être aussi brève que possible, car toute croissance de la population au cours de l'extraction falsifie les résultats. Par ailleurs, les conditions de températures et d'humidité dans l'échantillon doivent toujours garder des valeurs compatibles avec le déplacement des acariens. Le chauffage d'un échantillon de sol provoque la dessiccation du substrat. Si celle-ci est trop rapide, certains acariens se dessècheront en même temps et ne parviendront pas à s'enfuir.
Par conséquent, le protocole suivant est proposé (24) (25):
|
|
Appareil: Entonnoir de Tullgren ou équipement comparable, pour appliquer, par exemple la méthode de McFadyen (chauffage par-dessus, l'échantillon est placé sur un entonnoir)
|
|
|
Régime de chauffage: 25 °C pendant 12 h, 35 °C pendant 12 h, 45 °C pendant 24 heures (48 h au total). La température doit être mesurée dans le substrat.
|
|
|
Liquide de fixation: éthanol 70 %
|
|
|
Description détaillée: Utiliser le flacon de verre qui a servi pour l'essai. Retirer le couvercle et couvrir l'ouverture d'un morceau de treillis ou d'étoffe. L'étoffe doit avoir une dimension de maille de 1,0 à 1,5 mm. Fixer l'étoffe avec un élastique. Renverser soigneusement le flacon et le placer dans l'appareil d'extraction. L'étoffe empêche le substrat de couler dans le liquide de fixation, mais laisse les acariens sortir de l'échantillon. Démarrer le chauffage en appliquant le régime ci-dessus après avoir inséré tous les flacons. Terminer l'extraction au bout de 48 heures. Retirer les flacons de fixation et compter les acariens à l'aide d'un microscope à dissection.
|
Il faut démontrer l'efficacité d'extraction de la méthode choisie une ou deux fois par an en utilisant des récipients contenant un nombre connu d'acariens juvéniles et adultes élevés dans un substrat d'essai non traité. L'efficacité doit atteindre ≥ 90 % en moyenne combinée pour tous les stades de développement.
Dispositif d'extraction de type Tullgren
Comment préparer le flacon expérimental à la fin de l'essai et avant l'extraction

Appendice 6
Identification de Hypoaspis (Geolaelaps) aculeifer
|
Sous-classe/ordre/sous-ordre:
|
|
Famille:
|
|
Genre/sous-genre/espèce:
|
|
Acari/Parasitiformes/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Auteur et Date:
|
F. Faraji, Ph.D. (MITOX), 23 janvier 2007
|
|
Article utilisé:
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, 2e édition révisée: 1-523.
Hughes, A.M. (1976). The mites of stored food and houses. Ministry of Agriculture, Fisheries and Food, Technical Bulletin 9: 400pp.
Krantz, G.W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 pp.
|
|
Caractéristique s de détermination:
|
Tectum avec un bord denticulaire arrondi; sillons hypostomaux comprenant plus de 6 denticules; poils dorsaux caudaux Z4 assez courts; poils dorsaux sétiformes; bouclier génital normal peu développé et n'atteignant pas le bouclier anal; moitié postérieure du bouclier dorsal sans poils non appariés; pattes II et IV avec quelques macropoils épais; poil dorsal Z5 environ deux fois plus long que J5; doigt fixe de chélicère avec 12-14 dents et doigt mobile avec 2 dents; Idiosome 520-680 μm de longueur.
Hypoaspis miles est également utilisé comme témoin biologique et peut être confondu avec H. aculeifer. La principale différence est la suivante:
H. miles appartient au sous-genre Cosmolaelaps et ses poils dorsaux sont en forme de lame tandis que H. aculeifer appartient au sous-genre Geolaelaps avec des poils dorsaux sétiformes.
|

Appendice 7
Informations générales sur la biologie de Hypoaspis (Geolaelaps) aculeifer
Hypoaspis aculeifer appartient à la famille des Lealapidae, ordre des Acari (acariens), classe des Arachnida, tribu des Arthropoda. Ils vivent dans des sols de tous types et se nourrissent d'autres acariens, de nématodes, d'enchytrées et de collemboles (26). En cas de pénurie alimentaire, ils deviennent cannibales (27). Les acariens prédateurs sont segmentés en idiosome et gnathosome. La différenciation entre l'idiosome dans le prosome (tête) et l'opisthosome (abdomen) n'est pas nette. Le gnathosome (bouclier de la tête contient les pièces pour l'alimentation telles que les pattes et les chélicères. Les chélicères sont divisés en trois branches et munis de dents de différentes formes. Les mâles utilisent leurs chélicères pour l'ingestion, mais également pour transférer les spermatophores aux femelles. Un bouclier dorsal couvre presque complètement l'idiosome. Une grande partie de l'idiosome de la femelle est occupée par les organes reproducteurs, distincts en particulier peu avant la ponte des œufs. Sur la face ventrale, se trouvent deux boucliers, le bouclier sternal et le bouclier génital. Toutes les pattes sont pourvues de soie et d'épines. Les soies servent à l'ancrage lors du déplacement dans le sol ou sur le sol. La première paire de pattes fait essentiellement fonction d'antennes. La seconde paire de pattes sert non seulement au déplacement, mais également à l'immobilisation de la proie. Les épines de la quatrième paire de pattes servent de protection ainsi que de “moteurs de déplacement” (28). Les mâles mesurent de 0,55 à 0,65 mm de long et pèsent de 10 à 15 μg. Les femelles mesurent de 0,8 à 0,9 mm de long et pèsent de 50 à 60 μg (8) (28) (Fig 1).
Fig 1
Femelle, mâle, protonymphe et larve de H. aculeifer.

À 23 °C, les acariens atteignent la maturité sexuelle au bout de 16 jours (femelles) et de 18 jours (mâles), respectivement (6). Les spermatozoïdes sont transportés dans les femelles par le solénostome depuis lequel ils sont transférés dans l'ovaire. Dans l'ovaire, les spermatozoïdes subissent une maturation et sont stockés. La fécondation n'a lieu qu'après la maturation des spermatozoïdes dans l'ovaire. Les ovules fécondés ou non fécondés sont déposés par les femelles en amas ou séparément, de préférence dans des fissures ou des trous. Les femelles qui ont copulé peuvent porter des juvéniles des deux sexes, tandis qu'en l'absence de copulation, les œufs ne produisent que des juvéniles mâles. Au cours du développement jusqu'à l'âge adulte, les acariens traversent quatre phases (œuf-larve, larve-protonymphe, protonymphe-deutonymphe, deutonymphe-adulte).
L'œuf est blanc laiteux, hyalin, elliptique et mesure environ 0,37 mm de long. Il est doté d'un manteau solide. Selon (8), la taille des larves est comprise entre 0,42 et 0,45 mm. Elles n'ont que trois paires de pattes. Des palpes et des chélicères se développent dans la région de la tête. Les chélicères, munis de quelques petits denticules, sont utilisés pour l'éclosion. Après la première mue, un à deux jours après l'éclosion, les protonymphes se développent. Elles sont également blanches, d'une dimension de 0,45 à 0,62 mm (8) et elles possèdent quatre paires de pattes. Les chélicères sont entièrement pourvus de dents. C'est à partir de ce stade que les acariens commencent à rechercher leur nourriture. Dans ce but, la cuticule de la proie est percée par les chélicères et une sécrétion qui permet la digestion extra-intestinale est émise dans la proie. La pâte alimentaire peut ensuite être aspirée par l'acarien. Les chélicères peuvent être également utilisés pour fendre des boulettes d'aliments et en extraire des particules plus grosses (28). Les deutonymphes se développent après une nouvelle mue. Elles mesurent de 0,60 à 0,80 mm (8) et sont de couleur jaune à brun clair. À partir de ce stade, on peut séparer les femelles des mâles. Les acariens atteignent l'âge adulte après une nouvelle ecdysis, pendant laquelle les animaux restent inactifs et le bouclier brun se développe (après environ 14 jours) (28) (29) (30). Leur durée de vie se situe entre 48 et 100 jours à 25 °C (27).
Appendice 8
Résumé et calendrier des principales étapes de l'essai sur Hypoaspis
|
Temps (jours)
début de l'essai = jour 0
|
Activité/tâche
|
|
Jour – 35
à – 28:
|
Transfert des femelles de la culture mère dans des récipients propres pour initier la synchronisation
2 jours plus tard: prélèvement des femelles
Deux ou trois fois par semaine: apport d'aliments en quantité suffisante
|
|
Jour – 5 (+/ 2)
|
Préparation du sol artificiel
|
|
Jour – 4 (+/– 2)
|
Détermination de la capacité de rétention d'eau du sol artificiel
Séchage une nuit
Jour suivant: pesée des échantillons et calcul de la capacité de rétention d'eau
|
|
Jour – 4 (+/– 2)
|
Pré-humidification du sol artificiel pour obtenir une capacité de rétention d'eau de 20 à 30 %
|
|
Jour 0
|
Début de l'essai: addition de la substance chimique d'essai au sol artificiel
Introduction de 10 femelles dans chaque réplica
Pesée de chaque réplica
Préparation de témoins abiotiques pour la mesure du taux d'humidité et du pH, 2 expériences identiques par traitement
Séchage des témoins d'humidité une nuit
Jour suivant: pesée des témoins d'humidité
Jour suivant: mesure du pH des témoins abiotiques séchés
|
|
Jour 3, 6, 9, 12 (environ)
|
Apport d'une quantité suffisante de proies dans chaque expérience
Pesée de chaque expérience et rajout éventuel de la quantité d'eau évaporée
|
|
Jour 14
|
Fin de l'essai, extraction à partir de tous les réplicas et témoins d'efficacité de l'extraction
Séchage des témoins de teneur en eau une nuit
Jour suivant: pesée des témoins de teneur en eau
Jour suivant: mesure du pH des témoins séchés
|
|
Jour 16
|
Fin de l'extraction
|
|
Jour 16+
|
Comptage du nombre d'adultes et de juvéniles dans le matériau extrait
Report des résultats sur des tableaux matrices
Report du protocole d'essai dans le formulaire des protocoles d'essai
|
C.37. ESSAI DE 21 JOURS SUR LES POISSONS: ESSAI DE DÉPISTAGE À COURT TERME DE L'ACTIVITÉ ŒSTROGÉNIQUE ET ANDROGÉNIQUE, ET DE L'INHIBITION DE L'AROMATASE
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 230 (2009) de l'OCDE pour les essais de produits chimiques. Le développement et la validation d'un essai sur les poissons, capable de détecter des substances chimiques agissant sur le système endocrinien, sont devenus nécessaires du fait des inquiétudes suscitées par la présence dans l'environnement de produits chimiques à des concentrations susceptibles d'avoir des effets néfastes sur l'homme et la faune sauvage. En 1998, l'OCDE a lancé une activité à caractère hautement prioritaire visant à réviser les lignes directrices existantes et à élaborer de nouvelles lignes directrices concernant le dépistage et l'essai d'éventuels perturbateurs endocriniens. L'un des volets de cette activité consistait à élaborer une ligne directrice pour le dépistage des substances actives sur le système endocrinien des poissons. L'essai de 21 jours pour le dépistage des perturbateurs endocriniens des poissons a fait l'objet d'un programme de validation très complet comprenant des études inter-laboratoires portant sur une série de substances et visant à démontrer la pertinence et la fiabilité de l'essai pour la détection des agonistes/antagonistes des œstrogènes, des androgènes et de l'enzyme aromatase (1, 2, 3, 4, 5) chez trois espèces de poissons (le tête-de-boule (Pimephales promelas), le medaka japonais (Oryzias latipes) et le poisson-zèbre (Danio rerio)); la détection de l'activité androgénique est possible chez le tête-de-boule et le medaka, mais pas chez le poisson zèbre. La présente méthode d'essai ne permet pas la détection des antagonistes des androgènes. Les travaux de validation ont été revus par un comité composé d'experts désignés par les coordinateurs nationaux du programme sur les lignes directrices pour les essais (6). Cet essai n'est pas conçu pour identifier les mécanismes spécifiques du dérèglement hormonal dans la mesure où les animaux d'essai possèdent un axe hypothalamo-hypophyso-gonadique (HHG) sain et sont en mesure de réagir aux substances ayant des effets sur l'axe HHG à différents niveaux. L'essai à court terme de reproduction des poissons (ligne directrice 229 de l'OCDE) prend en compte la mesure de la fécondité, et le cas échéant l'histopathologie gonadique pour le tête-de-boule, ainsi que les observations mesurées dans la présente méthode d'essai. La ligne directrice 229 de l'OCDE permet un dépistage des substances chimiques qui affectent la reproduction par différents mécanismes, y compris des mécanismes endocriniens. Ces aspects doivent être pris en considération pour choisir ma méthode d'essai qui répond le mieux aux besoins.
|
|
2.
|
La présente méthode d'essai décrit un essai de dépistage in vivo sur des groupes de poissons (composés de mâles sexuellement matures et de femelles reproductrices) exposés à une substance pendant une durée limitée de leur cycle biologique (21 jours). A l'issue de cette période d'exposition de 21 jours, en fonction de l'espèce testée un ou deux biomarqueur(s) sont mesurés chez les mâles et les femelles pour servir d'indicateurs des effets de la substance chimique d'essai sur l'activité oestrogénique, androgénique ou sur l'inhibition de l'aromatase. Ces biomarqueurs sont la vitellogénine (VTG) et les caractères sexuels secondaires. La vitellogénine est dosée chez le tête-de-boule, le medaka japonais et le poisson-zèbre tandis que les caractères sexuels secondaires sont mesurés chez le tête-de-boule et le medaka japonais uniquement.
|
|
3.
|
Ce bio-essai sert d'essai de dépistage in vivo pour certains modes d'action liés au système endocrinien, et son application est envisagée dans le contexte du “Cadre conceptuel de l'OCDE pour les essais et l'évaluation de perturbateurs endocriniens”.
|
REMARQUES PRÉMIMINAIRES ET LIMITES
|
4.
|
La vitellogénine (VTG) est normalement produite par le foie des femelles vertébrées ovipares en réponse à la circulation d'œstrogènes endogènes. Il s'agit d'un précurseur des protéines du vitellus, produit par le foie puis acheminé par le sang vers les ovaires, où il est capté et modifié par les ovocytes en croissance. La vitellogénine est quasiment indétectable dans le plasma des poissons mâles et femelles immatures, et ce en raison d'une présence insuffisante d'œstrogènes circulants; néanmoins, le foie peut synthétiser et secréter la vitellogénine en réponse à une stimulation œstrogénique exogène.
|
|
5.
|
Le dosage de la vitellogénine sert à détecter les substances ayant une action (anti-)œstrogénique. Cette détection peut se faire par la mesure de l'induction de vitellogénine chez les poissons mâles; elle a fait l'objet de nombreuses publications scientifiques dans des revues à comité de lecture [(7), par exemple]. L'induction de vitellogénine a également été démontrée suite à une exposition à des androgènes aromatisables (8, 9). La diminution du taux d'œstrogènes circulants chez les femelles sous l'effet, par exemple, de l'inhibition de l'aromatase, l'enzyme permettant de convertir l'androgène endogène en œstrogène naturel (17β-œstradiol), engendre une diminution du niveau de vitellogénine utilisée pour détecter les inhibiteurs d'aromatase (10, 11). La pertinence biologique de la réponse donnée par la vitellogénine suite à l'inhibition des œstrogènes/de l'aromatase est établie et a été abondamment étudiée. Néanmoins la production de VTG chez les femelles peut également être affectée par une toxicité générale et des modes d'action toxiques non-endocriniens (hépatotoxicité, par exemple).
|
|
6.
|
Plusieurs méthodes de mesure ont été développées avec succès et normalisées en vue d'essais de routine. Ainsi, le test ELISA (Enzyme-Linked Immunosorbent Assay) est un principe de reconnaissance immunologique couplé à une réaction enzymatique permettant de doser la vitellogénine à partir de prélèvements sanguins ou hépatiques effectués sur des poissons (12, 13, 14, 15, 16, 17, 18). Les échantillons sont prélevés sur trois espèces: le tête-de-boule (sang), le poisson-zèbre (sang ou homogénat tête/queue) et le medaka (foie). Chez le medaka, il existe une bonne corrélation entre la concentration sanguine et la concentration hépatique de VTG (19). Les procédures recommandées pour les prélèvements effectués à des fins de dosage de la vitellogénine sont décrites à l'Appendice 6. Des kits de dosage de la vitellogénine sont largement disponibles; ils sont fondés sur une méthode ELISA validée et spécifique de l'espèce testée.
|
|
7.
|
Les caractères sexuels secondaires des poissons mâles de certaines espèces sont visibles à l'œil nu, quantifiables et réactifs aux taux d'androgènes endogènes circulants; c'est le cas pour le tête-de-boule et le medaka mais pas pour le poisson-zèbre, qui ne possède pas de caractères sexuels secondaires quantifiables. Les femelles conservent la capacité de développer des caractères sexuels secondaires masculins en cas d'exposition à des substances androgènes présentes dans l'eau. Un certain nombre d'études scientifiques traitent de ce type de réponse chez le tête-de-boule (20) et le medaka (21). La dégénérescence des caractères sexuels secondaires chez les mâles est interprétée avec prudence en raison de leur faible puissance statistique. Par ailleurs, toute interprétation en la matière est fondée sur un jugement expert et sur l'analyse du poids de la preuve. L'utilisation du poisson-zèbre pour cet essai a ses limites compte tenu de l'absence, chez cette espèce, de caractères sexuels secondaires quantifiables, réactifs aux substances chimiques agissant sur les androgènes.
|
|
8.
|
Chez le tête-de-boule, le nombre de tubercules nuptiaux situés sur le museau des femelles constitue le principal indicateur d'exposition à des androgènes exogènes. Chez le medaka femelle, le nombre de tubercules papillaires constitue le principal indicateur d'exposition à des substances androgènes exogènes. Les recommandations sur les procédures à suivre pour évaluer les caractères sexuels secondaires du tête-de-boule et du medaka figurent respectivement à l'Appendice 5A et à l'Appendice 5B.
|
|
9.
|
Les définitions utilisées dans la présente méthode d'essai figurent à l'Appendice 1.
|
PRINCIPE DE L'ESSAI
|
10.
|
Lors de l'essai, des poissons mâles et femelles en état de se reproduire sont placés ensemble dans des cuves où ils sont exposés à des substances chimiques. Leur état d'adultes reproducteurs permet une différenciation claire entre les deux sexes, et donc une analyse de chaque biomarqueur en fonction du sexe; il garantit également leur sensibilité aux substances exogènes. A la fin de l'essai, le sexe est confirmé par un examen macroscopique des gonades après incision de l'abdomen avec des ciseaux. Un tableau récapitulatif des conditions expérimentales pertinentes figure à l'Appendice 2. Pour cet essai on sélectionne normalement des poissons en état de frayer; les animaux sénescents sont écartés. La section relative à la sélection des poissons donne des indications sur l'âge des poissons et sur leur état reproducteur. Trois concentrations d'essai ainsi qu'une cuve témoin contenant de l'eau sont utilisées. Un autre témoin contenant un solvant peut être utilisé si nécessaire. Deux cuves ou répliquats par traitement sont utilisées (chaque cuve contenant 5 mâles et 5 femelles) pour le medaka et le poisson-zèbre; quatre cuves ou répliquats par traitement sont utilisées (chaque cuve comprenant 2 mâles et 4 femelles) pour le tête-de-boule. Ce principe permet de tenir compte du comportement territorial des têtes-de-boule mâles tout en maintenant la puissance de l'essai à un niveau suffisant. La durée d'exposition est de 21 jours; le prélèvement des poissons est effectué le 21e jour.
|
|
11.
|
Le 21e jour, tous les poissons sont euthanasiés. Les caractères sexuels secondaires du tête-de-boule et du medaka sont évalués (cf. Appendice 5A et Appendice 5B); des prélèvements sanguins sont effectués pour le dosage de la vitellogénine chez le poisson-zèbre et le tête-de-boule, mais un homogénat tête/queue peut aussi être utilisé pour le dosage de la vitellogénine chez le poisson-zèbre (Appendice 6); des prélèvements hépatiques sont effectués pour le dosage de la VTG chez le medaka (Appendice 6).
|
CRITÈRES DE VALIDITÉ DE L'ESSAI
|
12.
|
Pour que les résultats de l'essai soient acceptables, les conditions sont les suivantes:
|
—
|
La mortalité dans les cuves témoins (eau ou solvant) ne dépasse pas 10 % à la fin de la période d'exposition;
|
|
—
|
la concentration d'oxygène dissous est maintenue à 60 % au moins de la valeur de la saturation en air (VSA) durant toute la période d'exposition;
|
|
—
|
à aucun moment, durant toute la période d'exposition, la température de l'eau ne diffère de plus de ± 1,5 °C entre les cuves, et elle demeure à l'intérieur d'un intervalle de 2 °C compris dans la plage de température indiquée pour l'espèce étudiée (Appendice 2);
|
|
—
|
les données disponibles démontrent que la concentration de la substance chimique d'essai en solution a été correctement maintenue dans un intervalle de ± 20 % autour des valeurs moyennes mesurées.
|
|
DESCRIPTION DE LA MÉTHODE
Appareillage
|
13.
|
On utilise du matériel courant de laboratoire et en particulier:
|
a)
|
un pH-mètre et un appareil à mesurer l'oxygène;
|
|
b)
|
un instrument pour mesurer la dureté et l'alcalinité de l'eau;
|
|
c)
|
un dispositif adéquat de régulation de la température avec, de préférence, une surveillance en continu;
|
|
d)
|
des cuves en matériau chimiquement inerte et d'une capacité adaptée à la charge et à la densité de peuplement recommandées (Appendice 2);
|
|
e)
|
un substrat de frai pour les têtes-de-boule et les poissons-zèbres (voir Appendice 4);
|
|
f)
|
une balance suffisamment précise (précision de ± 0,5mg).
|
|
Eau
|
14.
|
On utilise une eau dans laquelle l'espèce testée présente des taux adéquats de croissance et de survie à long terme. Sa qualité demeure constante pendant la durée de l'essai. Le pH de l'eau est compris entre 6,5 et 8,5 sans varier de plus de ± 0,5 unité de pH au cours d'un même essai. Pour s'assurer que l'eau de dilution ne modifiera pas le résultat de l'essai (notamment par complexation de la substance chimique d'essai), on prélèvera des échantillons à différents intervalles pour analyse. Le dosage des métaux lourds (Cu, Pb, Zn, Hg, Cd, Ni, etc.), des principaux anions et cations (Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–, etc.), des pesticides (total des pesticides organophosphorés et organochlorés, etc.), du carbone organique total et des solides en suspension est effectué tous les trois mois, par exemple, pour une eau de dilution dont on sait que sa qualité est relativement constante. Si la qualité de l'eau s'est révélée constante durant au moins un an, on peut espacer les mesures (tous les six mois, par exemple). Certaines caractéristiques chimiques pour une eau de dilution acceptable sont énumérées à l'Appendice 3.
|
Solutions d'essai
|
15.
|
Des solutions d'essai sont ajustées à la concentration voulue par dilution d'une solution mère. La solution mère est, de préférence, préparée par simple mélange ou agitation de la substance chimique d'essai dans l'eau de dilution par des moyens mécaniques (secouement ou ultrasons, par exemple). Des colonnes de saturation (colonnes de solubilité) peuvent être utilisées pour réaliser une solution mère de concentration adéquate. L'emploi d'un véhicule solvant n'est pas recommandé mais peut s'avérer nécessaire. Dans ce cas, il faut tester en parallèle une cuve témoin contenant la même concentration de solvant que les cuves contenant la substance. Pour les substances difficiles à tester, un solvant peut être la meilleure solution technique et le Document d'orientation de l'OCDE sur les essais de toxicité aquatique des substances et mélanges “difficiles” devrait être consulté (22). Le choix du solvant est déterminé par les propriétés chimiques de la substance. Le Document d'orientation de l'OCDE recommande de ne pas dépasser une concentration maximale de 100 μl/l. Toutefois une étude récente (23) a montré que l'utilisation de solvants lors des essais de substances ayant des effets sur le système endocrinien pouvait poser d'autres problèmes. Si l'utilisation d'un solvant s'avère nécessaire, il est donc recommandé de réduire sa concentration à un minimum dans toute la mesure des possibilités techniques (qui dépendent des propriétés physicochimiques de la substance chimique d'essai).
|
|
16.
|
On utilise un système à écoulement continu On utilise un essai dynamique requérant un système qui délivre et dilue en continu une solution mère de la substance chimique d'essai (pompe doseuse, dilueur proportionnel, système de saturation, par exemple) pour appliquer une série de concentrations dans les enceintes d'essai. Le débit des solutions mères et de l'eau de dilution est vérifié périodiquement, de préférence tous les jours, pendant la durée de l'essai et ne varie pas de plus de 10 % durant l'essai. Il faut veiller à éviter l'utilisation de tubes en plastique de mauvaise qualité ou autres matériaux pouvant contenir des substances chimiques biologiquement actives. Pour la sélection du matériel pour l'essai dynamique, l'adsorption possible de la substance chimique d'essai sur le matériel est prise en compte.
|
Maintenance des poissons
|
17.
|
Les poissons d'essai sont sélectionnés parmi une population de laboratoire, issue de préférence d'une même lignée, qui a été acclimatée pendant au moins deux semaines avant l'essai dans des conditions de qualité de l'eau et d'éclairage similaires à celles de l'essai. Il importe que le taux de charge et la densité de peuplement (voir les définitions à l'Appendice 1) soient adaptés à l'espèce testée (voir Appendice 2).
|
|
18.
|
Après une période d'acclimatation de 48 heures, on note les mortalités et on applique les critères suivants:
|
—
|
mortalité supérieure à 10 % de la population en sept jours: le lot entier est rejeté;
|
|
—
|
mortalité comprise entre 5 et 10 % de la population: la période d'acclimatation est prolongée de sept jours; si la mortalité dépasse 5 % durant la deuxième période de 7 jours, le lot entier est rejeté;
|
|
—
|
mortalité inférieure à 5 % de la population en sept jours: le lot est accepté.
|
|
|
19.
|
Les poissons ne reçoivent pas de traitement pour maladie durant les périodes d'acclimatation, de pré-exposition et d'exposition.
|
Pré-exposition et sélection des poissons
|
20.
|
Pendant la période de pré-exposition (recommandée d'une semaine), les poissons sont placés dans des cuves similaires à celles de l'essai. Il est préférable de nourrir les poissons ad libitum durant toute la période d'acclimatation et d'exposition. La période d'exposition débute avec des adultes sexuellement dimorphes issus d'une population de laboratoire d'animaux sexuellement matures (présentant, par exemple, des caractères sexuels secondaires visibles à l'œil nu en ce qui concerne le tête-de-boule et le medaka), se reproduisant activement. À titre d'orientation générale (ne devant pas être prise en considération indépendamment de l'observation de l'état reproducteur du lot entier), le poisson tête-de- boule est âgé d'environ 20 (± 2) semaines, s'il a bénéficié d'une température de 25 ± 2 °C pendant son élevage; le medaka japonais est âgé d'environ 16 (± 2) semaines, s'il a bénéficié d'une température de 25 ± 2 °C pendant son élevage; et le poisson-zèbre est âgé d'environ 16 (± 2) semaines, s'il a bénéficié d'une température de 26 ± 2 °C pendant son élevage.
|
CONCEPTION DE L'ESSAI
|
21.
|
Trois concentrations de la substance chimique d'essai ainsi qu'une cuve témoin (contenant de l'eau) sont utilisées. Un autre témoin contenant un solvant peut être utilisé si nécessaire. Les données peuvent faire l'objet d'analyses statistiques permettant de déceler les différences significatives entre les réponses correspondant à chaque niveau de concentration et au témoin. Plutôt que de servir à l'évaluation des risques, ces analyses sont utiles pour déterminer si la substance chimique doit faire l'objet de tests afin d'évaluer ses éventuels effets néfastes à plus long terme (survie, développement, croissance et reproduction) (24).
|
|
22.
|
Pour les espèces medaka et poisson-zèbre, des échantillons sont prélevés le 21ème jour dans les groupes traités à chaque niveau de concentration (chacun des deux répliquats comprenant 5 mâles et 5 femelles) et dans chaque groupe témoin en vue du dosage de la vitellogénine et de l'évaluation des caractères sexuels secondaires, le cas échéant. Pour les têtes-de-boule, des échantillons sont prélevés le 21ème jour dans les groupes traités à chaque niveau de concentration (chacun des quatre répliquats comprenant 2 mâles et 4 femelles) et dans chaque groupe témoin en vue du dosage de la vitellogénine et de l'évaluation des caractères sexuels secondaires.
|
Sélection des concentrations d'essai
|
23.
|
Pour les besoins de l'essai, la concentration la plus forte est déterminée en fonction de la concentration maximale tolérée (CMT) obtenue à partir d'un essai préliminaire de détermination des concentrations d'essai ou à partir d'autres données de toxicité, est fixée à 10 mg/l, ou est déterminée en fonction de la solubilité maximale dans l'eau, selon la valeur qui est la plus basse. La CMT est définie comme la concentration d'essai maximale de la substance engendrant un taux de mortalité inférieur à 10 %. L'utilisation de cette approche suppose l'existence de données empiriques sur la toxicité aiguë ou d'autres données de toxicité à partir desquelles la CMT pourra être estimée. L'estimation de la CMT peut être inexacte et requiert généralement un jugement expert.
|
|
24.
|
Trois concentrations d'essai, espacées par un facteur constant ne dépassant pas 10, et une cuve témoin contenant l'eau de dilution (plus, si nécessaire, une cuve contenant un solvant) sont nécessaires. Les facteurs d'espacement sont situés entre 3,2 et 10.
|
MODE OPÉRATOIRE
Sélection et pesée des poissons d'essai
|
25.
|
Il importe de veiller à ce que le poids des poissons varie le moins possible au début de l'essai. L'Appendice 2 indique les gammes de poids qui conviennent aux différentes espèces recommandées pour cet essai. Si possible, au début de l'essai, la gamme des poids de l'ensemble des poissons mâles et femelles du lot utilisé ne sort pas d'un intervalle de ± 20 % autour de la moyenne arithmétique de chaque sexe. On recommande de peser un sous-échantillon de poissons avant l'essai afin d'estimer le poids moyen.
|
Conditions d'exposition
Durée
|
26.
|
La durée de l'essai est de 21 jours, après une période de pré-exposition. La durée de préexposition recommandée est d'une semaine.
|
Alimentation
|
27.
|
Les poissons reçoivent ad libitum une nourriture appropriée (Appendice 2) en quantité suffisante pour maintenir leur condition physique. Il faut veiller à prévenir la prolifération de micro-organismes et la turbidité de l'eau. A titre d'indication générale, la ration quotidienne peut être divisée en deux ou trois parts égales administrées à trois heures d'intervalle au moins. Une seule ration plus conséquente est acceptable, notamment le week-end. Les poissons sont privés de nourriture pendant les 12 heures qui précèdent les prélèvements/l'autopsie.
|
|
28.
|
Le dosage des contaminants [pesticides organochlorés, hydrocarbures aromatiques polycycliques (HAP), biphényles poly chlorés (PCB)] est effectué dans la nourriture. La nourriture présentant une forte concentration de phytœstrogènes qui compromettraient la réponse de l'essai à un agoniste œstrogénique connu (17β œstradiol, par exemple) est évitée.
|
|
29.
|
Les aliments non consommés et les matières fécales sont retirés des cuves au moins deux fois par semaine, par un nettoyage soigneux du fond de chaque cuve à l'aide d'un siphon, par exemple.
|
Lumière et température
|
30.
|
La photopériode et la température de l'eau sont adaptées à l'espèce testée (voir Appendice 2).
|
Fréquence des dosages analytiques et des mesures
|
31.
|
Avant le début de la période d'exposition, le bon fonctionnement du système de distribution de la substance est vérifié. Toutes les méthodes analytiques nécessaires sont établies, y compris des connaissances suffisantes sur la stabilité de la substance dans le système d'essai. Pendant l'essai, les concentrations de la substance chimique d'essai sont déterminées à intervalles réguliers, en vérifiant de préférence chaque jour, mais à défaut au moins deux fois par semaine, le débit du diluant et celui de la solution mère de substance toxique. Ces débits ne varient pas de plus de 10 % pendant toute la durée de l'essai. Il est recommandé de mesurer les concentrations de la substance d'essai dans chaque cuve au début de l'essai puis chaque semaine.
|
|
32.
|
Il est recommandé de fonder les résultats sur les concentrations mesurées. Toutefois, si la concentration de la substance chimique d'essai en solution a été correctement maintenue tout au long de l'essai dans un intervalle de ± 20 % autour de la concentration nominale, les résultats peuvent être calculés à partir des valeurs nominales ou mesurées.
|
|
33.
|
Les échantillons peuvent avoir besoin d'être filtrés (avec des pores de 0,45 μm, par exemple) ou centrifugés. Si elle est nécessaire, la centrifugation est la procédure recommandée. Cependant, si le matériel d'essai ne s'adsorbe pas sur le filtre, la filtration est également acceptable.
|
|
34.
|
Pendant l'essai, l'oxygène dissous, la température et le pH sont mesurés dans toutes les cuves au moins une fois par semaine. La dureté totale et l'alcalinité sont mesurées au moins une fois par semaine dans les cuves témoins et dans une cuve contenant la concentration la plus forte. Il est préférable de surveiller la température en continu dans au moins une cuve d'essai.
|
Observations
|
35.
|
Un certain nombre de réponses biologiques générales (survie, par exemple) et ciblées par l'essai (niveaux de vitellogénine, par exemple) sont évaluées au cours ou à la fin de l'essai. La mesure et l'évaluation de ces biomarqueurs ainsi que leur utilité sont décrits dans la suite de cette Ligne directrice.
|
Survie
|
36.
|
Il convient d'examiner les poissons quotidiennement durant l'essai. Les décès sont notés et les poissons morts retirés de la cuve dès que possible. Les poissons morts ne sont pas remplacés dans les cuves témoins ou les cuves contenant la substance. Le sexe des poissons morts durant l'essai est déterminé par observation macroscopique des gonades.
|
Comportement et apparence
|
37.
|
Tout comportement anormal (par rapport aux témoins) est noté, car il peut être un signe de toxicité générale (hyperventilation, nage non coordonnée, perte d'équilibre, immobilité ou alimentation atypiques). Il convient en outre de relever les éventuelles anomalies externes (hémorragie, décoloration, par exemple). La prudence s'impose lors de l'interprétation de ces signes de toxicité dans la mesure où ceux-ci peuvent révéler des concentrations auxquelles les biomarqueurs d'effets potentiels sur le système endocrinien ne sont pas fiables. Ces observations sur le comportement peuvent aussi fournir des informations qualitatives utiles pour les futures exigences potentielles en matière d'essais sur les poissons. On a ainsi pu observer une agressivité territoriale chez les têtes-de-boule mâles normaux ou chez les têtes-de-boule femelles masculinisées en cas d'exposition à des androgènes. Le comportement caractéristique d'accouplement et de reproduction du poisson-zèbre après les premières lueurs de l'aube est réduit ou entravé par l'exposition aux œstrogènes ou aux anti-androgènes.
|
|
38.
|
La manipulation des poissons pouvant engendrer une modification rapide de certaines caractéristiques physiques (notamment la couleur), il importe de procéder aux observations qualitatives avant le retrait des poissons du système expérimental. Les expériences menées jusqu'à présent sur le tête- de-boule donnent à penser que certains perturbateurs endocriniens peuvent d'emblée avoir des effets sur les caractéristiques physiques suivantes: couleur (claire ou sombre), motifs de coloration (présence de bandes verticales) et forme du corps (région de la tête et région pectorale). Les observations relatives aux caractéristiques physiques des poissons sont donc notées au cours et à la fin de l'essai.
|
Euthanasie des poissons
|
39.
|
Le 21e jour, c'est-à-dire à la fin de la période d'exposition, les poissons sont euthanasiés à l'aide de quantités de tricaïne appropriées [solution de 100-500 mg/1 de méthanesulfonate de tricaïne (MS 222) (CAS 886-86-2) tamponnée avec 300 mg/1 de NaHCO3 (bicarbonate de sodium, CAS 144-55-8)] destinées à réduire l'irritation de la muqueuse; des prélèvements de sang et de tissus sont ensuite effectués pour le dosage de la vitellogénine (voir la section sur la vitellogénine).
|
Observation des caractères sexuels secondaires
|
40.
|
Certains perturbateurs endocriniens peuvent avoir des effets sur des caractères sexuels secondaires spécialisés (nombre de tubercules nuptiaux chez le tête-de-boule mâle et de tubercules papillaires chez le medaka mâle). Certaines substances peuvent notamment engendrer l'apparition anormale de caractères sexuels secondaires chez les animaux du sexe opposé. Ainsi les agonistes des récepteurs d'androgènes tels que le trenbolone, la méthyltestostérone et la dihydrotestostérone peuvent provoquer l'apparition de tubercules nuptiaux proéminents chez le tête-de-boule femelle et celle de tubercules papillaires chez le medaka femelle (20, 11, 21). On a pu noter également que les agonistes des récepteurs d'œstrogènes peuvent réduire le nombre de tubercules nuptiaux et la taille de l'amas graisseux situé sur la tête des adultes mâles de tête-de-boule (25, 26). Ces observations morphologiques macroscopiques peuvent fournir des informations qualitatives et quantitatives utiles pour fonder d'éventuelles exigences futures en matière d'essais sur les poissons. Le nombre et la taille des tubercules nuptiaux chez le tête-de-boule ainsi que ceux des tubercules papillaires chez le medaka peuvent être quantifiés directement, ou de manière plus pratique sur des spécimens préservés. Les recommandations sur les procédures applicables pour l'évaluation des caractères sexuels secondaires du tête-de-boule et du medaka figurent respectivement à l'Appendice 5A et à l'Appendice 5B.
|
Vitellogénine (VTG)
|
41.
|
Un prélèvement sanguin est effectué dans l'artère / la veine caudale grâce à un tubule capillaire à microhématocrite héparinisé ou par ponction cardiaque avec une seringue. Selon la taille du poisson, les volumes sanguins prélevés sont généralement de 5 à 60 μ1 par individu pour les têtes-de-boule et de 5 à 15 μ1 par individu pour les poissons-zèbres. Le plasma est séparé du sang par centrifugation avant d'être stocké avec des inhibiteurs de protéase à – 80 °C jusqu'à son analyse pour le dosage de la vitellogénine. Chez le medaka, un prélèvement hépatique est utilisé; chez le poisson-zèbre, un homogénat tête/queue peut être utilisé comme échantillon tissulaire pour le dosage de la vitellogénine (Appendice 6). Le dosage de la VTG est effectué à l'aide d'une méthode ELISA homologue validée en utilisant des anticorps homologues et un standard de VTG homologue. Il est recommandé d'utiliser une méthode capable de détecter des concentrations de VTG de quelques ng/ml de plasma (ou ng/mg de tissus) seulement, correspondant à la concentration de fond chez les poissons mâles non exposés.
|
|
42.
|
Le contrôle qualité de l'analyse de la vitellogénine se fait par le biais de solutions-étalons, de blancs et, au minimum, d'analyses dédoublées. Pour chaque méthode ELISA, l'effet de matrice (effet de la dilution de l'échantillon) est testé afin de déterminer le facteur de dilution minimale de l'échantillon. Chaque plaque ELISA utilisée pour le dosage de la VTG comporte les échantillons de contrôle qualité suivants: au moins six solutions-étalons couvrant la plage des concentrations attendues de vitellogénine, et au moins un blanc d'essai de liaison non spécifique (en analyse dédoublée). L'absorbance de ces blancs est inférieure à 5 % de l'absorbance maximale des solutions-étalons. Au moins deux aliquotes (puits dédoublés) de chaque dilution de l'échantillon sont analysés. Les puits dédoublés qui diffèrent de plus de 20 % font l'objet d'une nouvelle analyse.
|
|
43.
|
Le coefficient de corrélation (R2) des courbes d'étalonnage est supérieur à 0,99. Toutefois une corrélation élevée ne suffit pas à garantir la prédiction adéquate de la concentration pour toutes les plages de concentration. En plus d'obtenir une corrélation suffisamment élevée pour la courbe d'étalonnage, la concentration de chaque solution-étalon, calculée à partir de la courbe d'étalonnage, est comprise entre 70 et 120 % de sa concentration nominale. Si les concentrations nominales ont tendance à s'éloigner de la droite de régression de l'étalonnage (à des concentrations plus faibles, par exemple), il peut s'avérer nécessaire de partager la courbe d'étalonnage en deux plages, l'une forte et l'autre faible, ou d'utiliser un modèle non linéaire pour ajuster correctement les données relatives à l'absorbance. Si la courbe est partagée, les deux segments de droite doivent avoir un coefficient de corrélation R2 > 0,99.
|
|
44.
|
La limite de détection (LDD) est définie comme la limite en deçà de laquelle la concentration est trop faible pour que la substance soit détectée, et la limite de quantification (LDQ) est définie comme la limite en deçà de laquelle la concentration est trop faible pour que la substance soit détectée, multipliée par le facteur de dilution le plus faible.
|
|
45.
|
Chaque jour où des essais portant sur la vitellogénine sont réalisés, un échantillon fortifié obtenu à partir d'un étalon de référence inter-essais sera analysé (Appendice 7). On notera alors systématiquement le rapport entre la concentration attendue et la concentration mesurée avec les résultats de chaque série d'essais effectués ce jour-là.
|
RÉSULTATS ET RAPPORT
Évaluation de la réponse des biomarqueurs par l'analyse de la variance (ANOVA)
|
46.
|
Pour identifier les effets potentiels d'une substance sur le système endocrinien, on compare les réponses des groupes traités et des groupes témoins en utilisant l'analyse de la variance (ANOVA). Si un témoin contenant un solvant est utilisé, une analyse statistique appropriée du témoin contenant l'eau de dilution et du témoin contenant le solvant est effectuée pour chaque effet observé. On trouvera dans OCDE (2006c) (27) des orientations sur le traitement des données relatives au témoin contenant l'eau de dilution et au témoin contenant le solvant lors de l'analyse statistique ultérieure. Les réponses biologiques obtenues sont analysées et notées séparément pour chaque sexe. Si les hypothèses requises concernant les méthodes paramétriques ne se vérifient pas — distribution non normale (par exemple test de Shapiro-Wilk) ou variance hétérogène (test de Bartlett ou de Levene) — il faudra envisager de transformer les données pour homogénéiser les variances avant de réaliser l'ANOVA ou de conduire une analyse pondérée de la variance. Le test de Dunnett (paramétrique) permettant de multiples comparaisons par paires ou le test de Mann-Whitney avec correction de Bonferroni (non paramétrique) peuvent être utilisés pour une relation dose-réponse non monotone. D'autres tests statistiques peuvent être utilisés (test de Jonckheere-Terpstra ou de Williams) si la relation dose-réponse est approximativement monotone. Un ordinogramme d'analyse statistique figure à l'Appendice 8. Cet outil d'aide à la décision permet de choisir le test statistique le plus approprié. Le document de l'OCDE sur les méthodes actuelles d'analyse statistique des données d'écotoxicité (27) fournit d'autres informations en la matière.
|
Communication des résultats des essais
|
47.
|
Le rapport d'essai contient les informations suivantes:
|
|
Installation d'essai:
|
—
|
Personnel chargé de l'étude et responsabilités de chacun;
|
|
—
|
Chaque laboratoire a démontré sa compétence sur une gamme de substances chimiques représentatives;
|
|
|
|
Substance chimique d'essai:
|
—
|
Caractérisation de la substance chimique d'essai
|
|
—
|
Nature physique et propriétés physico-chimiques pertinentes;
|
|
—
|
Méthode et fréquence de préparation des concentrations d'essai;
|
|
—
|
Informations sur la stabilité et la biodégradabilité;
|
|
|
|
Solvant:
|
—
|
Caractérisation du solvant (nature, concentration utilisée);
|
|
—
|
Justification du choix du solvant (si autre que l'eau);
|
|
|
|
Animaux d'expérience:
|
—
|
Fournisseur et équipements particuliers du fournisseur;
|
|
—
|
Âge des poissons au début de l'essai et état reproducteur;
|
|
—
|
Informations détaillées sur la procédure d'acclimatation des animaux;
|
|
—
|
Poids corporel des poissons au début de l'exposition (déterminé à partir d'un sous-échantillon issu de la population de poissons);
|
|
|
|
Conditions de l'essai:
|
—
|
Méthode utilisée (type d'essai, taux de charge, densité de peuplement, etc.);
|
|
—
|
Méthode de préparation des solutions mères et débit;
|
|
—
|
Concentrations d'essai nominales, dosage hebdomadaire de la concentration des solutions d'essai et méthode analytique utilisée, moyennes des valeurs mesurées avec leurs écarts-types dans les cuves d'essai et données montrant que les mesures se réfèrent aux concentrations de la substance chimique d'essai en solution vraie;
|
|
—
|
Caractéristiques de l'eau de dilution (pH, dureté, alcalinité, température, concentration d'oxygène dissous, teneurs résiduelles en chlore, carbone organique total, solides en suspension et toute autre mesure effectuée);
|
|
—
|
Qualité de l'eau dans les cuves d'essai: pH, dureté, température et concentration d'oxygène dissous;
|
|
—
|
Informations détaillées sur l'alimentation (par exemple type d'aliments, provenance, quantité donnée et fréquence) et analyse des contaminants pertinents (PCB, HAP et pesticides organochlorés, par exemple);
|
|
|
|
Résultats:
|
—
|
Données montrant que les témoins remplissent les critères de validité de l'essai;
|
|
—
|
Données sur la mortalité pour chaque concentration d'essai et chaque témoin;
|
|
—
|
Techniques d'analyse statistique appliquées, traitement des données et justification des méthodes utilisées;
|
|
—
|
Données sur les observations biologiques de morphologie macroscopique, y compris les caractères sexuels secondaires et la vitellogénine;
|
|
—
|
Résultats des analyses de données, de préférence sous forme de tableaux et de graphiques;
|
|
—
|
Fréquence des réactions inhabituelles des poissons et des effets visibles produits par la substance chimique d'essai.
|
|
|
ORIENTATIONS POUR L'INTERPRÉTATION ET L'ACCEPTATION DES RÉSULTATS DE L'ESSAI
|
48.
|
Cette partie traite des paramètres à prendre en compte pour l'interprétation des résultats de l'essai en ce qui concerne les différents effets mesurés. Les résultats sont interprétés avec prudence lorsque la substance chimique d'essai semble provoquer des signes de toxicité manifestes ou avoir des effets sur l'état général de l'animal d'expérience.
|
|
49.
|
Lors de l'essai préliminaire de détermination des concentrations d'essai, on veillera à ne pas dépasser la concentration maximale tolérée pour pouvoir interpréter les données de façon fiable. Il importe d'appliquer au moins un traitement qui ne provoque aucun signe d'effets toxiques. Les symptômes de maladie et les signes d'effets toxiques font l'objet d'une évaluation et d'un rapport détaillés. Il est possible, par exemple, que la production de VTG chez les femelles soit également affectée par une toxicité générale et des modes d'action toxiques non liés au système endocrinien (hépatotoxicité, par exemple). Toutefois l'interprétation des effets peut être renforcée par d'autres niveaux de traitement dont les effets ne sont pas perturbés par la toxicité systémique.
|
|
50.
|
Quelques paramètres sont pris en compte pour l'acceptation des résultats de l'essai. A titre indicatif, les niveaux de VTG sont distincts chez les mâles et les femelles témoins, et séparés d'au moins trois ordres de grandeur chez le tête-de-boule et le poisson-zèbre et d'un ordre de grandeur chez le medaka. Des exemples de la gamme des valeurs relevées dans les groupes témoins et les groupes traités sont disponibles dans les rapports de validation (1, 2, 3, 4). Des valeurs élevées de VTG chez les mâles des groupes témoins peuvent compromettre la performance de l'essai et sa capacité de détection des agonistes des œstrogènes de faible puissance. Des valeurs de VTG basses chez les femelles témoins peuvent compromettre la performance de l'essai et sa capacité de détection des inhibiteurs de l'aromatase et des antagonistes des œstrogènes. Les études de validation ont été utilisées pour la rédaction de ces orientations.
|
|
51.
|
Si un laboratoire n'a pas procédé à cet essai auparavant ou s'il a procédé à des modifications substantielles (changement de souche ou de fournisseur de poissons, par exemple), il est conseillé de faire un essai pour vérifier la compétence technique. Il est recommandé d'utiliser des substances représentant une gamme de modes d'action ou d'impacts sur certains des paramètres mesurés durant l'essai. En pratique, chaque laboratoire est encouragé à constituer ses propres données de contrôle historiques pour les mâles et les femelles, et à faire un essai avec un témoin positif de l'activité œstrogénique (par exemple, 17β-œstradiol à 100 ng/l/1, ou un agoniste faible connu) engendrant une augmentation de la VTG chez les mâles, un témoin positif de l'inhibition de l'aromatase (fadrozole ou prochloraz à 300 μg/l, par exemple) engendrant une diminution de la VTG chez les femelles, et un témoin positif de l'activité androgénique (17β-trenbolone à 5 μg/l, par exemple) engendrant l'induction de caractères sexuels secondaires chez les femelles tête-de-boule et medaka. Toutes ces données peuvent être comparées aux données disponibles issues des études de validation (1, 2, 3) pour garantir la compétence du laboratoire.
|
|
52.
|
En général, les mesures de la vitellogénine sont considérées comme positives en cas d'augmentation statistiquement significative de la VTG chez les mâles (p < 0,05) ou de baisse statistiquement significative chez les femelles (p < 0,05), et ce au moins à la concentration maximale soumise à l'essai par rapport au groupe témoin, et en l'absence de signes de toxicité générale. Un résultat positif est en outre confirmé par la démonstration d'une relation dose-réponse biologiquement plausible. Comme mentionné précédemment, la baisse de la vitellogénine peut ne pas être entièrement liée au système endocrinien; toutefois un résultat positif est en général interprété comme un élément de preuve d'une activité du système endocrinien in vivo, et motive normalement des actions visant à une clarification plus poussée
|
BIBLIOGRAPHIE
|
(1)
|
OCDE (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). Publications Hygiène et Sécurité de l'environnement de l'OCDE — Série sur les essais et l'évaluation, no 60, ENV/JM/M0N0(2006)27.
|
|
(2)
|
OCDE (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1 B). Publications Hygiène et Sécurité de l'environnement de l'OCDE — Série sur les essais et l'évaluation, no 61, ENV/JM/M0N0(2006)29.
|
|
(3)
|
OCDE (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. Publications Hygiène et Sécurité de l'environnement — Série sur les essais et l'évaluation, nO 78, ENV/JM/M0N0(2007)25.
|
|
(4)
|
0wens JW (2007). Phase 3 report of the validation of the 0ECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (accessed 18/09/08).
|
|
(5)
|
US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Rapport non publié daté du 15 décembre 2007. US Environmental Protection Agency, Washington, DC. 104 pp.
|
|
(6)
|
OCDE, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Publications Hygiène et Sécurité de l'environnement de l'OCDE — Série sur les essais et l'évaluation no 94, ENV/JM/M0N0(2008)21.
|
|
(7)
|
Sumpter et Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7:173-8 Review.
|
|
(8)
|
Pawlowski S, Sauer A, Shears JA, Tyler CR, Braunbeck T (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277-91.
|
|
(9)
|
Andersen L, Goto-Kazato R, Trant JM, Nash JP, Korsgaard B, Bjerregaard P (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4):343-52.
|
|
(10)
|
Ankley GT, Kahl MD, Jensen KM, Hornung MW, Korte JJ, Makynen EA, Leino RL (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephalespromelas). Toxicological Sciences;67(1): 121-30.
|
|
(11)
|
Panter GH, Hutchinson TH, Hurd KS, Sherren A, Stanley RD, Tyler CR (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11-21.
|
|
(12)
|
Parks LG, Cheek AO, Denslow ND, Heppell SA, McLachlan JA, LeBlanc GA, Sullivan CV (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2):113-25.
|
|
(13)
|
Panter GH, Tyler CR, Maddix S, Campbell PM, Hutchinson TH, Länge R, Lye C, Sumpter JP, 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Bruxelles, Belgique.
|
|
(14)
|
Fenske M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme- linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217-232.
|
|
(15)
|
Holbech H, Andersen L, Petersen GI, Korsgaard B, Pedersen KL, Bjerregaard P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119-131
|
|
(16)
|
Rose J, Holbech H, Lindholst C, Noerum U, Povlsen A, Korsgaard B, Bjerregaard P. 2002. Vitellogenin induction by 17β-estradiol and 17β-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131: 531-539.
|
|
(17)
|
Brion F, Nilsen BM, Eidem JK, Goksoyr A, Porcher JM, Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699-1708.
|
|
(18)
|
Yokota H, Morita H, Nakano N, Kang IJ, Tadokoro H, Oshima Y, Honjo T, Kobayashi K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87-98.
|
|
(19)
|
Tatarazako N, Koshio M, Hori H, Morita M and Iguchi T., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50:301308.
|
|
(20)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray LE (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350-60.
|
|
(21)
|
Seki M, Yokota H, Matsubara H, Maeda M, Tadokoro H, Kobayashi K (2004). Fish full life- cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3):774-81.
|
|
(22)
|
OCDE (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Publications Hygiène et sécurité de l'environnement de l'OCDE. — Série sur les essais et l'évaluation no 23 Paris
|
|
(23)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp.6992.
|
|
(24)
|
Hutchinson TH, Ankley GT, Segner H, Tyler CR, 2006b. Screening and testing for endocrine disruption in fish-biomarkers as “signposts”, not “traffic lights,” in risk assessment. Environmental Health Perspectives;114 Suppl 1:106-14.
|
|
(25)
|
Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure to 17β-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129-145.
|
|
(26)
|
Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve and G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478-488.
|
|
(27)
|
OCDE (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Publications Hygiène et Sécurité de l'environnement — Série sur les essais et l'évaluation no 54. ENV/JM/M0N0(2006)18.
|
|
(28)
|
OCDE (2012) Cadre conceptuel de l'OCDE pour les essais et l'évaluation de perturbateurs endocriniens (version révisée). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Série sur les essais et l'évaluation no 150 ENV/JM/M0N0(2012)22.
|
Appendice 1
Abréviations & définitions
Substance chimique
: une substance ou un mélange
CV
: coefficient de variation
ELISA
: (Enzyme-Linked Immunosorbent Assay): procédé immunochimique d'absorption enzymatique
Taux de charge
: poids frais de poissons par unité de volume d'eau
Densité de peuplement
: nombre de poissons par unité de volume d'eau
Vitellogénine (VTG)
: lipo-glyco-phospho-protéine précurseur des protéines du vitellus normalement produite par les femelles sexuellement actives de toutes les espèces ovipares
Axe HHG
: axe hypothalamo-hypophyso-gonadique
CMT
: concentration maximale tolérée représentant environ 10 % de la CL50
Substance chimique d'essai
: Toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
Appendice 2
Conditions expérimentales du protocole de dépistage des substances agissant sur le système endocrinien des poissons non reproducteurs
|
|
Tête-de-boule
(Pimephales promelas)
|
Medaka
(Oryzias latipes)
|
Poisson-zèbre
(Danio rerio)
|
|
|
dynamique
|
dynamique
|
dynamique
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
4.
|
Qualité de l'éclairage
|
|
Ampoules fluorescentes (à large spectre)
|
Ampoules fluorescentes (à large spectre)
|
Ampoules fluorescentes (à large spectre)
|
|
5.
|
Intensité de l'éclairage
|
|
10-20 μE/m2/s, 540-1 000 lux ou 50-100 fc (niveaux ambiants du laboratoire)
|
10-20 μE/m2/s, 540-1 000 lux ou 50-100 fc (niveaux ambiants du laboratoire)
|
10-20 μE/m2/s, 540-1 000 lux ou 50-100 fc (niveaux ambiants du laboratoire)
|
|
6.
|
Photopériode (transitions — aube et crépuscule — optionnelles, mais non considérées comme nécessaires)
|
|
16 h de lumière, 8 h d'obscurité
|
12-16 h de lumière, 12-8 h d'obscurité
|
12-16 h de lumière, 12-8 h d'obscurité
|
|
|
< 5 g/l
|
< 5 g/l
|
< 5 g/l
|
|
8.
|
Volume des enceintes d'essai
|
|
10 l (minimum)
|
2 l (minimum)
|
5 l (minimum)
|
|
9.
|
Volume de la solution d'essai
|
|
8 l (minimum)
|
1,5 l (minimum)
|
4 l (minimum)
|
|
10.
|
Remplacement volumique des solutions d'essai
|
|
Minimum 6 fois/jour
|
Minimum 5 fois/jour
|
Minimum 5 fois/jour
|
|
11.
|
Âge des organismes d'essai
|
|
voir paragraphe 20
|
voir paragraphe 20
|
voir paragraphe 20
|
|
12.
|
Poids frais approximatif des poissons adultes (g)
|
|
Femelles: 1,5 ± 20 %
Mâles: 2,5 ± 20 %
|
Femelles: 0,35 ± 20 %
Mâles: 0,35 ± 20 %
|
Femelles: 0,65 ± 20 %
Mâles: 0,4 ± 20 %
|
|
13.
|
Nombre de poissons par cuve
|
|
6 (2 mâles et 4 femelles)
|
10 (5 mâles et 5 femelles)
|
10 (5 mâles et 5 femelles)
|
|
14.
|
Nombre de traitements
|
|
= 3 (plus témoins appropriés)
|
= 3 (plus témoins appropriés)
|
= 3 (plus témoins appropriés)
|
|
15.
|
Nombre de cuves par traitement
|
|
4 minimum
|
2 minimum
|
2 minimum
|
|
16.
|
Nombre de poissons par concentration d'essai
|
|
16 adultes femelles et 8 mâles (4 femelles et 2 mâles dans chaque répliquat)
|
10 adultes femelles et 10 mâles (5 femelles et 5 mâles dans chaque répliquat)
|
10 adultes femelles et 10 mâles (5 femelles et 5 mâles dans chaque répliquat)
|
|
|
Artémies adultes ou nauplies d'artémies, vivantes ou congelées, deux ou trois fois par jour (ad libitum), nourriture disponible dans le commerce ou combinaison de ces éléments
|
Nauplies d'artémies, vivantes ou congelées, deux ou trois fois par jour (ad libitum), nourriture disponible dans le commerce ou combinaison de ces éléments
|
Nauplies d'artémies deux ou trois fois par jour (ad libitum), nourriture disponible dans le commerce ou combinaison de ces éléments
|
|
|
Pas d'aération sauf si la concentration d'oxygène dissous est inférieure à 60 % de la valeur de la saturation en air (VSA)
|
Pas d'aération sauf si la concentration d'oxygène dissous est inférieure à 60 % de la valeur de la saturation en air (VSA)
|
Pas d'aération sauf si la concentration d'oxygène dissous est inférieure à 60 % de la valeur de la saturation en air (VSA)
|
|
|
Eau de surface, de puits ou reconstituée, ou eau du robinet déchlorée
|
Eau de surface, de puits ou reconstituée, ou eau du robinet déchlorée
|
Eau de surface, de puits ou reconstituée, ou eau du robinet déchlorée
|
|
20.
|
Période de préexposition
|
|
7 jours (recommandé)
|
7 jours (recommandé)
|
7 jours (recommandé)
|
|
21.
|
Durée de l'exposition au produit chimique
|
|
21 jours
|
21 jours
|
21 jours
|
|
22.
|
Effets biologiques mesurés
|
|
survie
comportement
caract. sexuels secondaires
VTG
|
survie
comportement
caract. sexuels secondaires
VTG
|
survie
comportement
VTG
|
|
23.
|
Critères de validité de l'essai
|
|
Concentration d'oxygène dissous > 60 % de la VSA; température moyenne de 25 ± 2 °C; 90 % de survie dans les groupes témoins; concentration mesurée de la substance d'essai maintenue dans un intervalle de ± 20 % autour des valeurs moyennes mesurées pour chaque niveau de traitement
|
Concentration d'oxygène dissous > 60 % de la VSA; température moyenne de 24 ± 2 °C; 90 % de survie dans les groupes témoins; concentration mesurée de la substance d'essai maintenue dans un intervalle de ± 20 % autour des valeurs moyennes mesurées pour chaque niveau de traitement
|
Concentration d'oxygène dissous > 60 % de la VSA; température moyenne de 26 ± 2 °C; 90 % de survie dans les groupes témoins; concentration mesurée de la substance d'essai maintenue dans un intervalle de ± 20 % autour des valeurs moyennes mesurées pour chaque niveau de traitement
|
Appendice 3
Quelques caractéristiques chimiques d'une eau de dilution acceptable
|
Constituant
|
Concentrations
|
|
Matières particulaires
|
< 20 mg/l
|
|
Carbone organique total
|
< 2 mg/l
|
|
Ammoniac non ionisé
|
< 1 μg/l
|
|
Chlore résiduel
|
< 10 μg/l
|
|
Pesticides organophosphorés totaux
|
< 50 ng/l
|
|
Pesticides organochlorés totaux et biphényles polychlorés
|
< 50 ng/l
|
|
Chlore organique total
|
< 25 ng/l
|
Appendice 4 A
Substrat de frai pour les poissons-zèbres
Plateau de frai
: plat à instruments en verre, mesurant par exemple 22 × 15 × 5.5 cm (L × l × h), recouvert d'une grille amovible en acier inoxydable (mailles de 2 mm de largeur). La base de cette grille se trouve plus bas que le bord du plat à instruments.
Le substrat de frai est fixé sur la grille. Il forme une structure dans laquelle les poissons peuvent pénétrer. Des plantes d'aquarium artificielles en plastique vert, par exemple, peuvent convenir (NB: l'adsorption possible de la substance chimique d'essai sur la matière plastique est prise en compte). Le plastique est lessivé dans un volume suffisant d'eau chaude et pendant un temps suffisant pour qu'aucune substance ne risque de se retrouver dans la solution d'essai. Si des objets en verre sont utilisés, on veille à ce que les poissons ne soient ni blessés ni entravés lors de mouvements vigoureux.
La distance entre le plateau et les parois de la cuve est d'au moins 3 cm pour que le frai ne se fasse pas à l'extérieur du plateau. Les œufs déposés sur le plateau traversent la grille et peuvent être prélevés 45 à 60 minutes après le début de l'éclairage. Les œufs translucides n'adhèrent pas et peuvent facilement être comptés grâce une lumière transversale. Pour cinq femelles par cuve, le nombre d'œufs pondus peut être considéré comme faible s'il est inférieur ou égal à 20 par jour, moyen s'il est compris entre 20 et 100, et élevé s'il est supérieur à 100. Le plateau de frai est retiré, les œufs ramassés et le plateau de frai réintroduit dans la cuve d'essai, le plus tard possible dans la soirée ou bien très tôt le matin. La réintroduction du plateau se fait dans un délai maximum d'une heure car sinon le signal du substrat de frai peut induire un accouplement et un frai à un moment inhabituel. Si la situation nécessite une introduction ultérieure du plateau de frai, il faut attendre au moins neuf heures après le début de l'éclairage. A cette heure tardive de la journée, l'induction de frai ne se fait plus.
Appendice 4 B
Substrat de frai pour les têtes-de-boule
Deux ou trois plaques et plateaux de frai en plastique/céramique/verre ou en acier inoxydable combinés sont placés dans chaque enceinte d'essai (morceau de gouttière semi-circulaire grise de 80 mm de longueur posé sur un plateau à rebords de 130 mm de long, par exemple) (voir photo). Il est avéré que les plaques en PVC ou en céramique vieillies pouvaient convenablement servir de substrat de frai (Thorpe et al, 2007).
Il est recommandé d'utiliser des plaques abrasées pour améliorer l'adhérence. Le plateau est aussi muni d'un écran de protection empêchant les poissons d'accéder aux œufs tombés, à moins que l'efficacité de l'adhérence des œufs ait été démontrée pour le substrat de frai utilisé.

Le socle est conçu pour contenir tous les œufs qui n'adhèrent pas à la surface des plaques et tomberaient donc au fond de l'enceinte (ou les œufs déposés directement sur le socle en plastique plat). Tous les substrats de frai sont lessivés pendant au moins 12 heures dans l'eau de dilution avant leur utilisation.
RÉFÉRENCES
Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90-98.
Appendice 5 A
Évaluation des caractères sexuels secondaires du tête-de-boule pour la détection de certains perturbateurs endocriniens
Synthèse
Chez les têtes-de-boule adultes, les caractéristiques physiques pouvant avoir de l'importance dans les essais de perturbateurs endocriniens sont les suivantes: couleur (claire/sombre), motifs de coloration (présence ou absence de bandes verticales), forme du corps (région de la tête et région pectorale, distension de l'abdomen) et caractères sexuels secondaires spécifiques de l'espèce (nombre et taille des tubercules nuptiaux, taille du bourrelet dorsal et ovipositeur).
Les tubercules nuptiaux sont situés sur la tête (bourrelet dorsal) des têtes-de-boule adultes mâles reproducteurs, et sont généralement disposés bilatéralement et symétriquement (Jensen et al. 2001). Les femelles et les juvéniles mâles et femelles des cuves témoins ne développent pas de tubercule (Jensen et al. 2001). Il est possible de dénombrer jusqu'à huit tubercules individuels autour des yeux et entre les narines des mâles. Les tubercules les plus importants en nombre et en taille forment deux lignes parallèles situées juste en dessous des narines et au-dessus de la bouche. De nombreux poissons possèdent des groupes de tubercules sous la mâchoire inférieure; tout près de la bouche on en trouve généralement une seule paire alors que le ventre peut comprendre jusqu'à quatre tubercules. Le nombre de tubercules dépasse rarement 30 (fourchette, 18-28; Jensen et al. 2001). Les tubercules les plus nombreux forment une seule et même structure de forme plutôt arrondie, dont la hauteur est à peu près égale au rayon. Chez la plupart des mâles reproducteurs, certains tubercules sont si étendus et protubérants qu'il est impossible de les distinguer les uns des autres.
Certains types de perturbateurs endocriniens peuvent provoquer l'apparition anormale de caractères sexuels secondaires chez le sexe opposé; ainsi, les agonistes des récepteurs d'androgènes tels que la 17β-méthyltestostérone ou le 17ß-trenbolone peuvent provoquer l'apparition de tubercules nuptiaux chez le tête-de-boule femelle (Smith, 1974; Ankley et al., 2001, 2003), tandis que les agonistes des récepteurs d'œstrogènes peuvent réduire le nombre ou la taille des tubercules nuptiaux chez les mâles (Miles-Richardson et al, 1999; Harries et al., 2000).
On trouvera ci-après une description de la caractérisation des tubercules nuptiaux chez les têtes-de-boule, fondée sur le mode opératoire utilisé par le laboratoire de l'Agence pour la protection de l'environnement des États-Unis (USEPA) à Duluth, Minnesota. Les produits et/ou équipements spécifiques peuvent être remplacés par des matériaux comparables disponibles.
L'utilisation d'une loupe à éclairage ou d'un microscope binoculaire de dissection à éclairage (3X) permet une observation optimale. On observera le poisson en position dorsale, partie antérieure vers l'avant (tête vers l'observateur).
|
a)
|
Placer le poisson dans une petite boîte de Pétri (100 mm de diamètre, par exemple), sur le dos, partie antérieure vers l'avant. Régler le viseur pour pouvoir identifier les tubercules. Faire rouler doucement le poisson d'un côté puis de l'autre pour identifier les zones où se trouvent les tubercules. Compter et classer les tubercules.
|
|
b)
|
Renouveler l'observation sur la partie ventrale antérieure après avoir placé le poisson sur le dos, partie antérieure vers l'avant, dans la boîte de Pétri.
|
|
c)
|
Les observations ne prennent pas plus de 2 minutes par poisson.
|
Dénombrement et classement des tubercules
Six zones spécifiques ont été identifiées pour l'évaluation de la présence et du développement de tubercules chez les têtes-de-boule adultes. Une matrice a été créée pour cartographier la localisation des tubercules et la quantité de tubercules présents (voir fin du présent Appendice). Le nombre de tubercules est consigné, et les tubercules peuvent être classés comme suit en fonction de leur taille: 0-absence, 1-présent, 2-agrandi et 3-protubérant pour chaque organisme (Figure 1).
Classe 0-absence de tout tubercule. Classe 1-tubercule présent, identifié comme tout tubercule dont un seul point est de hauteur presque égale à son rayon (diamètre). Classe 2-tubercule agrandi, identifié par des tissus ressemblant à un astérisque, présentant généralement une large base radiale marquée de stries et de sillons partant du centre. La hauteur des tubercules est souvent plus irrégulière mais peut parfois être un peu arrondie. Classe 3-tubercule protubérant, de forme généralement plutôt large et arrondie et de structure moins bien définie. Ces tubercules s'agglomèrent parfois pour former une seule et même masse le long d'une zone ou de plusieurs zones (B, C et D, voir description ci-dessous). Leur couleur et leur forme sont similaires à celles de la classe 2, mais sont parfois assez indéterminées. Ce système de classement permet généralement d'obtenir un résultat global < 50 chez un mâle témoin normal possédant un nombre de tubercules compris entre 18 et 20 (Jensen et al. 2001).
Figure 1

Certains poissons peuvent présenter plus de tubercules que la matrice ne compte de cases (voir appendice A) pour une zone particulière. Dans ce cas, des chiffres supplémentaires peuvent être indiqués à l'intérieur, à droite ou à gauche de la case. La matrice n'a donc pas besoin d'afficher une symétrie. Une autre technique permettant de cartographier les tubercules allant par paires ou réunis verticalement le long du plan horizontal de la bouche pourrait consister à indiquer deux chiffres dans une seule case.
Zones cartographiées:
A— Tubercules situés autour des yeux. Localisés de dorsal à ventral autour du bord antérieur des yeux. Couramment multiples chez les mâles témoins mûrs, absents chez les femelles témoins, généralement par paires (un près de chaque œil) ou uniques chez les femelles exposées à des androgènes.
B— Tubercules situés entre les narines (pores-canaux sensoriels). Normalement par paires chez les mâles témoins à des niveaux de développement supérieurs (2-agrandi ou 3-protubérants). Absents chez les femelles témoins mais parfois présents chez les femelles exposées à des androgènes.
C— Tubercules situés immédiatement devant les narines, parallèlement à la bouche. Généralement agrandis ou protubérants chez les mâles témoins mûrs. Présents ou agrandis chez les mâles moins développés ou chez les femelles exposées à des androgènes.
D— Tubercules situés parallèlement à la bouche. Généralement classés “développés” chez les mâles témoins. Absents chez les femelles témoins mais présents chez les femelles exposées à des androgènes.
E— Tubercules situés sur la mâchoire inférieure, près de la bouche, généralement petits et par paires. Variables chez les mâles témoins ou traités et chez les femelles traitées.
F— Tubercules situés sous la zone E. Généralement petits et par paires. Présents chez les mâles témoins et chez les femelles exposées à des androgènes.
RÉFÉRENCES
|
(1)
|
Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276-1290.
|
|
(2)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray LE (2003). Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22:1350-1360.
|
|
(3)
|
Harries JE, Runnalls T, Hill E, Harris CA,Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003-3011.
|
|
(4)
|
Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephalespromelas). Comp Biochem Physiol C 128:127-141.
|
|
(5)
|
Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515-523.
|
|
(6)
|
Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17D-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephalespromelas). Aquat Toxicol 47:129-145.
|
|
(7)
|
Smith RJF. 1974. Effects of 17D-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52:1031-1038.
|
|
Matrice pour la cartographie des tubercules
|
Classification numérique
|
|
No ident.
|
1-présent
|
|
Date
|
2-agrandi
|
|
Score total
|
3-protubérant
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Appendice 5 B
Évaluation des caractères sexuels secondaires du medaka pour la détection de certains perturbateurs endocriniens
La mesure des tubercules papillaires (21), qui sont les caractères sexuels secondaires du medaka (Oryzias latipes) est décrite ci-après.
|
1)
|
Après excision du foie (Appendice 6), la carcasse est placée dans un tube conique contenant 10 ml environ de formol tamponné à 10 % (tête en haut, queue en bas). Si la gonade est fixée dans une autre solution que du formol tamponné à 10 %, pratiquer à l'aide d'un rasoir une incision transversale dans la carcasse entre la région antérieure de la nageoire anale et l'anus, en prenant soin de ne pas abîmer le gonopore et la gonade (fig. 3). Placer la partie tête du corps du poisson dans la solution de fixation pour préserver la gonade, et la partie queue dans du formol tamponné à 10 % tel que décrit ci-dessus.
|
|
2)
|
Après avoir placé le poisson dans du formol tamponné à 10 %, saisir la région antérieure de la nageoire anale avec des pincettes et la plier pendant une trentaine de secondes pour que la nageoire anale reste ouverte. En prenant la nageoire anale avec les pincettes, saisir quelques rayons de nageoire dans la région antérieure en prenant soin de ne pas abîmer les tubercules papillaires.
|
|
3)
|
Après avoir maintenu la nageoire anale ouverte pendant une trentaine de secondes, placer le poisson dans du formol tamponné à 10 % à température ambiante jusqu'à la mesure des tubercules papillaires (cette mesure est effectuée au bout de 24 heures minimum).
|
Mesure
|
1)
|
Après avoir fixé le poisson dans le formol tamponné à 10 % pendant au moins 24 heures, retirer la carcasse du tube conique et essuyer le formol avec du papier filtre (ou essuie-tout).
|
|
2)
|
Placer le poisson abdomen vers le haut. Découper ensuite soigneusement la nageoire anale avec de petits ciseaux à dissection (il est préférable de découper la nageoire anale avec un peu de rayon endosquelettique).
|
|
3)
|
Saisir la région antérieure de la nageoire anale excisée avec des pincettes et la poser sur une lame de verre avec quelques gouttes d'eau. Couvrir ensuite la nageoire anale avec une lamelle couvre-objet. Prendre soin de ne pas abîmer les tubercules papillaires en prenant la nageoire anale avec les pincettes.
|
|
4)
|
Noter le nombre de plaques conjointes présentant des tubercules papillaires à l'aide du compteur placé sous un microscope biologique (microscope droit ou microscope inversé). On reconnaît les tubercules papillaires à la petite formation de tubercules visible sur le côté postérieur des plaques conjointes. Inscrire sur la feuille de travail le nombre de plaques conjointes présentant des tubercules papillaires pour chaque rayon de nageoire (premier rayon: 0, deuxième rayon: 10, troisième rayon: 12, etc.) puis inscrire leur somme sur la feuille Excel pour chaque poisson. Si nécessaire, photographier la nageoire anale et noter le nombre de plaques conjointes présentant des tubercules papillaires sur la photo.
|
|
5)
|
Après la mesure, placer la nageoire anale dans le tube conique décrit au point 1) et le stocker.
|
Fig.1.
Schéma illustrant la différence de forme et de taille de la nageoire anale entre les sexes. A, mâle; B, femelle. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

Fig.2.
A, Tubercules papillaires situés sur les plaques conjointes de la nageoire anale. J.P., plaque conjointe; A.S., espace axial; P., tubercule B, Extrémité distale de la nageoire anale. Les actinotriches (Act.) sont situés à l'extrémité. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

Fig.3.
Photographie montrant le site de coupe lorsque la gonade est fixée dans une autre solution que du formol tamponné à 10 %. Dans ce cas, le corps restant sera coupé entre la région antérieure de la nageoire anale et l'anus à l'aide d'un rasoir (trait rouge). La tête sera placée dans la solution de fixation pour préserver la gonade, et la queue dans le formol tamponné à 10 %.

Appendice 6
Procédures recommandées pour les prélèvements effectués à des fins de dosage de la vitellogénine
On prendra soin d'éviter la contamination croisée entre les échantillons de VTG des mâles et des femelles.
Procédure 1A: tête-de-boule, prélèvement sanguin dans l'artère / la veine caudale
Après anesthésie, le pédoncule caudal est partiellement sectionné avec une lame de scalpel, et un prélèvement sanguin est effectué dans l'artère/la veine caudale grâce à un tubule capillaire à microhématocrite héparinisé. Après le prélèvement sanguin, le plasma est rapidement séparé par centrifugation à température ambiante pendant 3 minutes à 15 000g (ou bien à une température de 4 °C pendant 10 minutes à 15 000 g). Le pourcentage d'hématocrite peut éventuellement être déterminé à l'issue de la centrifugation. Le plasma est ensuite retiré du tube à microhématocrite puis stocké dans un tube de centrifugeuse avec 0,13 unité d'aprotinine (un inhibiteur de protéase) à – 80 °C jusqu'au dosage de la vitellogénine. Selon la taille du tête-de-boule (qui dépend du sexe), les volumes de plasma pouvant être prélevés sont généralement de 5 à 60 μl par individu (Jensen et al. 2001).
Procédure 1 B: tête-de-boule, prélèvement sanguin par ponction cardiaque
Il est également possible d'effectuer un prélèvement sanguin par ponction cardiaque effectuée à l'aide d'une seringue héparinisée (1 000 unités d'héparine par ml). Le sang est versé dans des tubes Eppendorf (maintenus dans de la glace) avant d'être centrifugé (5 minutes à 7 000 g à température ambiante). Le plasma est versé dans des tubes Eppendorf propres (dans des aliquotes si le volume de plasma le permet) puis rapidement congelé à – 80 °C jusqu'à l'analyse (Panter et al., 1998).
Procédure 2 A: Medaka japonais, excision du foie
Retrait des poissons d'essai de l'enceinte d'essai
|
(1)
|
Les poissons d'essai sont sortis de l'enceinte d'essai à l'aide d'une épuisette. Attention à ne pas laisser tomber les poissons dans une autre enceinte d'essai.
|
|
(2)
|
En principe, les poissons d'essai sont retirés dans l'ordre suivant: témoin, cuve témoin contenant le solvant (s'il y a lieu), concentration minimale, concentration moyenne, concentration maximale et témoin positif. De plus, tous les mâles sont retirés de l'enceinte d'essai avant les femelles.
|
|
(3)
|
Le sexe de chaque poisson d'essai est identifié à partir des caractères sexuels secondaires externes (forme de la nageoire anale, par exemple).
|
|
(4)
|
Placer les poissons dans un conteneur puis les transporter jusqu'au poste de travail pour l'excision du foie. Vérifier les étiquettes de l'enceinte d'essai et du conteneur de transport par souci de précision et pour confirmer que le nombre de poissons sortis de l'enceinte d'essai et le nombre de poissons restés dans l'enceinte d'essai sont compatibles avec les prévisions.
|
|
(5)
|
Si le sexe ne peut pas être identifié d'après l'apparence externe du poisson, sortir tous les poissons de l'enceinte d'essai. Dans ce cas, le sexe est identifié par observation de la gonade ou des caractères sexuels secondaires au stéréomicroscope.
|
Excision du foie
|
(1)
|
Transférer les poissons d'essai du conteneur de transport vers la solution anesthésique avec l'épuisette.
|
|
(2)
|
Après anesthésie, saisir les poissons d'essai avec des pincettes (de modèle courant) pour les déposer sur le papier filtre (ou essuie-tout). En saisissant les poissons, appliquer les pincettes sur les côtés de la tête pour éviter de casser la queue.
|
|
(3)
|
Essuyer l'eau de la surface des poissons d'essai avec le papier filtre (ou essuie-tout).
|
|
(4)
|
Placer les poissons sur le dos. Pratiquer ensuite une petite incision transversale entre la région ventre-nuque et le milieu de l'abdomen avec des ciseaux à dissection.
|
|
(5)
|
Introduire les ciseaux à dissection dans la petite incision, et inciser l'abdomen le long de sa ligne médiane, depuis un point caudal par rapport au manteau branchial jusqu'au côté cranien de l'anus. Attention à ne pas introduire les ciseaux à disséquer trop profondément pour ne pas abîmer le foie et la gonade.
|
|
(6)
|
Mener les opérations suivantes sous le stéréomicroscope.
|
|
(7)
|
Placer les poissons sur le dos sur l'essuie-tout (ou une boîte de Pétri en verre ou une lame de verre).
|
|
(8)
|
Écarter les parois de la cavité abdominale avec les pincettes de précision puis extérioriser les organes internes. Il est également possible d'extérioriser les organes internes en retirant l'une des parois de la cavité abdominale si nécessaire.
|
|
(9)
|
Étaler la partie qui relie le foie et la vésicule biliaire à l'aide d'une autre paire de pincettes de précision. Saisir ensuite le canal biliaire et couper la vésicule biliaire. Veiller à ne pas rompre la vésicule biliaire.
|
|
(10)
|
Saisir l'œsophage et exciser les intestins du foie selon la même méthode. Veiller à ce que le contenu du tube digestif ne s'échappe pas. Exciser l'intestin caudal de l'anus et retirer le tractus de la cavité abdominale.
|
|
(11)
|
Retirer la masse de tissus graisseux et autres situés à la périphérie du foie. Prendre soin de ne pas abîmer le foie.
|
|
(12)
|
Saisir la zone de la porte hépatique avec les pincettes de précision et retirer le foie de la cavité abdominale.
|
|
(13)
|
Placer le foie sur la lame de verre. A l'aide des pincettes de précision, retirer les autres tissus graisseux et étrangers (paroi abdominale interne, par exemple), s'il y a lieu, de la surface du foie.
|
|
(14)
|
Peser le foie au moyen d'une balance de précision électronique, en utilisant comme tare un microtube de 1,5 ml. Consigner la valeur sur la feuille de travail (précision à 0,1 mg près). Confirmer les informations d'identification sur l'étiquette du microtube.
|
|
(15)
|
Fermer le capuchon du microtube contenant le foie. Stocker le microtube dans un bac de refroidissement (ou un bac de glace).
|
|
(16)
|
Après chaque excision de foie, nettoyer les instruments de dissection ou les remplacer par des instruments propres.
|
|
(17)
|
Retirer le foie de tous les poissons se trouvant dans les conteneurs de transport comme indiqué ci-dessus.
|
|
(18)
|
Après excision du foie de tous les poissons se trouvant dans le conteneur de transport (c'est- à-dire de tous les mâles et de toutes les femelles d'une enceinte d'essai), placer tous les spécimens hépatiques sur un support pour tubes munis d'une étiquette d'identification puis les stocker dans un congélateur. Lorsque les foies sont fournis pour pré-traitement peu de temps après leur excision, les spécimens sont transportés jusqu'au poste de travail le plus proche dans un bac de refroidissement (ou un bac de glace).
|
Après excision du foie, la carcasse est prête pour l'histologie gonadique et la mesure des caractères sexuels secondaires.
Spécimens
Stocker les spécimens hépatiques prélevés sur les poissons d'essai à une température ≤ – 70 °C s'ils ne sont pas utilisés pour le pré-traitement juste après leur excision.
Fig-1
Une incision est pratiquée avec des ciseaux juste avant les nageoires pectorales.

Fig-2
La ligne médiane de l'abdomen est incisée avec des ciseaux jusqu'à un point situé environ 2 mm au-dessus de l'anus.
Fig-3
Les parois abdominales sont écartées avec des pincettes pour exposer le foie et les autres organes internes (elles peuvent aussi être épinglées latéralement).
Fig-4
Le foie est disséqué et excisé avec des pincettes.

Fig-5
Les intestins sont délicatement retirés avec des pincettes.
Fig-6
Les deux extrémités des intestins et les attaches du mésentère sont sectionnées avec des ciseaux.

Fig-7 (femelle)
La procédure est identique pour les femelles.

Fig-8
Procédure achevée.

Procédure 2 B: Medaka japonais (Oryzias latipes), pré-traitement du foie pour le dosage de la vitellogénine.
Retirer la bouteille contenant le tampon d'homogénat du kit ELISA et la refroidir avec de la glace pilée (température de la solution: ≤ 4 °C). Si un tampon d'homogénat provenant d'un kit ELISA EnBio est utilisé, laisser décongeler la solution à température ambiante, puis conserver la bouteille au frais avec de la glace pilée.
Calculer le volume de tampon d'homogénat pour le foie à partir du poids de ce dernier (utiliser 50 μl de tampon d'homogénat par mg de foie pour l' homogénat). Exemple: Si le foie pèse 4,5 mg, le volume de tampon d'homogénat pour le foie sera de 225 μl. Dresser une liste des volumes de tampon d'homogénat pour tous les foies.
Préparation du foie pour le pré-traitement
|
(1)
|
Retirer le microtube de 1,5 ml contenant le foie du congélateur juste avant le pré-traitement.
|
|
(2)
|
Le pré-traitement du foie des mâles est effectué avant celui des femelles pour éviter toute contamination de la vitellogénine. De plus, le pré-traitement des groupes d'essai est effectué dans l'ordre suivant: témoin, cuve témoin contenant le solvant (s'il y a lieu), concentration minimale, concentration moyenne, concentration maximale et témoin positif.
|
|
(3)
|
Le nombre de microtubes de 1,5 ml contenant les échantillons hépatiques sortis du congélateur à un moment donné ne dépasse pas le nombre de tubes pouvant être centrifugés à ce moment-là.
|
|
(4)
|
Placer les microtubes de 1,5 ml contenant les échantillons hépatiques dans le bac de glace selon l'ordre de numérotation des spécimens (la décongélation du foie n'est pas utile).
|
Déroulement du pré-traitement
1. Ajout du tampon d'homogénéisation
|
(1)
|
Vérifier sur la liste le volume de tampon d'homogénat à utiliser pour un échantillon hépatique particulier et ajuster la micropipette (gamme de volumes: 100-1 000 μl au volume approprié. Attacher un embout propre à la micropipette.
|
|
(2)
|
Retirer le tampon d'homogénat du flacon de réactif et ajouter le tampon dans le microtube de 1,5 ml contenant le foie.
|
|
(3)
|
Ajouter le tampon dans tous les microtubes de 1,5 ml contenant les échantillons hépatiques selon la procédure décrite ci-dessus. Il n'est pas nécessaire de remplacer l'embout de la micropipette par un embout neuf. Toutefois, si l'embout est contaminé ou suspect de contamination, il est changé.
|
2. Homogénéisation du foie
|
(1)
|
Attacher un nouveau pilon d'homogénéisation à l'homogénéisateur du microtube.
|
|
(2)
|
Introduire le pilon dans le microtube de 1,5 ml. Maintenir l'homogénéisateur pour presser le foie entre la surface du pilon et la paroi interne du microtube.
|
|
(3)
|
Faire fonctionner l'homogénéisateur pendant 10 à 20 secondes. Conserver le microtube au frais avec de la glace pilée pendant l'opération.
|
|
(4)
|
Retirer le pilon du microtube et laisser reposer pendant une dizaine de secondes. Procéder ensuite à une inspection visuelle de l'état de la suspension.
|
|
(5)
|
Si des morceaux de foie sont observés dans la suspension, répéter les opérations (3) et (4) pour obtenir un homogénat de foie satisfaisant.
|
|
(6)
|
Conserver l'homogénat hépatique en suspension dans le bac de glace jusqu'à sa centrifugation.
|
|
(7)
|
Utiliser un pilon neuf pour chaque homogénat.
|
|
(8)
|
Homogénéiser tous les foies avec un tampon d'homogénat selon la procédure décrite ci-dessus.
|
3. Centrifugation de l'homogénat hépatique en suspension
|
(1)
|
Confirmer que la température de la centrifugeuse réfrigérée est ≤ 5 °C.
|
|
(2)
|
Introduire les microtubes de 1,5 ml contenant l'homogénat hépatique en suspension dans la centrifugeuse réfrigérée (rééquilibrer s'il y a lieu).
|
|
(3)
|
Centrifuger l'homogénat hépatique en suspension pendant 10 minutes à 13 000g à une température ≤ 5 °C. Toutefois, si les surnageants sont correctement séparés, la force centrifuge et la durée de centrifugation peuvent être ajustées s'il y a lieu.
|
|
(4)
|
Après la centrifugation, vérifier que les surnageants sont correctement séparés (surface: lipides, intermédiaire: surnageant, culot: tissu hépatique). Si la séparation n'est pas concluante, renouveler la centrifugation de la suspension dans les mêmes conditions.
|
|
(5)
|
Retirer tous les échantillons de la centrifugeuse réfrigérée et les placer dans le bac de glace selon l'ordre de numérotation des spécimens. Prendre soin de ne pas remettre en suspension les couches séparées après centrifugation.
|
4. Collecte du surnageant
|
(1)
|
Placer quatre microtubes de 0,5 ml destinés au stockage du surnageant sur le support pour tubes.
|
|
(2)
|
Recueillir 30 μl de chaque surnageant (formant la couche intermédiaire après séparation) à l'aide de la micropipette et les verser dans un microtube de 0,5 ml. Prendre soin de ne pas recueillir de lipides de la surface ou de tissu hépatique du culot.
|
|
(3)
|
Recueillir le surnageant et le verser dans deux autres microtubes de 0,5 ml selon la procédure décrite ci-dessus.
|
|
(4)
|
Recueillir le reste du surnageant à l'aide de la micropipette (si possible: ≥ 100 μl). Verser ensuite le surnageant dans le microtube de 0,5 ml restant. Prendre soin de ne pas recueillir de lipides de la surface ou de tissu hépatique du culot.
|
|
(5)
|
Fermer le microtube de 0,5 ml avec le capuchon et inscrire le volume de surnageant sur l'étiquette. Placer immédiatement les microtubes dans le bac de glace.
|
|
(6)
|
Remplacer l'embout de la micropipette par un embout neuf pour chaque surnageant. Si une grande quantité de lipides adhère à l'embout, remplacer immédiatement ce dernier par un embout neuf pour éviter la contamination de l'extrait hépatique avec la graisse.
|
|
(7)
|
Verser tout le surnageant centrifugé dans quatre microtubes de 0,5 ml selon la procédure décrite ci-dessus.
|
|
(8)
|
Après avoir versé le surnageant dans les microtubes de 0,5 ml, placer tous ces derniers sur le support pour tubes avec leur étiquette d'identification, puis les mettre immédiatement au congélateur. Si les concentrations de VTG sont mesurées immédiatement après le pré-traitement, conserver au frais un microtube de 0,5 ml (contenant 30 μl de surnageant) dans le support pour tubes et le transférer jusqu'au poste de travail où l'essai ELISA est conduit. Dans ce cas, placer les microtubes restants dans les supports pour tubes et mettre le tout au congélateur.
|
|
(9)
|
Après la collecte du surnageant, jeter le résidu comme il se doit.
|
Stockage des spécimens
Stocker les microtubes de 0,5 ml contenant le surnageant de l'homogénat hépatique à une température ≤ – 70 °C jusqu'à la conduite de l'essai ELISA.
Procédure 3 A: Poisson-zèbre, prélèvement sanguin dans l'artère/la veine caudale
Immédiatement après anesthésie, le pédoncule caudal est sectionné transversalement, et un prélèvement sanguin est effectué dans l'artère/la veine caudale grâce à un tubule capillaire à microhématocrite héparinisé. Les volumes sanguins collectés varient entre 5 et 15 μl selon la taille du poisson. Un volume identique de tampon d'aprotinine [6 μg/ml de solution tampon phosphate (PBS)] est ajouté dans le tube microcapillaire, et le plasma est séparé du sang par centrifugation (5 minutes à 600 g). Le plasma est versé dans des tubes à essais puis stocké à une température de – 20 °C jusqu'au dosage de la vitellogénine ou d'autres protéines produisant des effets intéressants.
Procédure 3 B: Poisson-zèbre, prélèvement sanguin par ponction cardiaque
Pour éviter la coagulation du sang et la dégradation de la protéine, les échantillons sont collectés sur une solution tampon phosphate (PBS) contenant de l'héparine (1 000 unités/ml) et de l'aprotinine, un inhibiteur de protéase (2 TIU/ml). Pour constituer le tampon, il est recommandé d'utiliser de l'héparine (sel d'ammonium) et de l'aprotinine lyophilisée. Pour le prélèvement sanguin, une seringue (1 ml) munie d'une fine aiguille fixe (Braun Omnikan-F, par exemple) est recommandée. La seringue est pré-remplie avec le tampon (approximativement 100 μl) afin d'éluer complètement les faibles volumes sanguins de chaque poisson. Les prélèvements sanguins sont effectués par ponction cardiaque. Tout d'abord, le poisson est anesthésié avec du MS-222 (100 mg/l). Le bon plan d'anesthésie est celui qui permet à l'utilisateur de distinguer le battement du cœur du poisson-zèbre. Pendant la ponction cardiaque, maintenir le piston de la seringue sous faible tension. Les volumes sanguins pouvant être collectés varient entre 20 et 40 microlitres. Après la ponction cardiaque, le mélange sang/tampon est placé dans le tube à essais. Le plasma est séparé du sang par centrifugation (20 minutes à 5 000 g) et est stocké à une température de – 80 °C jusqu'à l'analyse.
Procédure 3C: POS: Poisson-zèbre, homogénéisation de la tête et de la queue
|
(1)
|
Les poissons sont anesthésiés puis euthanasiés conformément à la description de l'essai.
|
|
(2)
|
La tête et la queue du poisson sont coupées comme indiqué sur la figure 1.
|
Note importante: Tous les instruments de dissection ainsi que la planche à découper sont rincés et lavés correctement (avec de l'éthanol à 96 %, par exemple) entre chaque manipulation de poisson pour éviter que la vitellogénine des femelles ou des mâles induits ne “pollue” les mâles non-induits.
Figure 1

|
(3)
|
L'ensemble tête-queue de chaque poisson est pesé au mg près.
|
|
(4)
|
Après avoir été pesés, les morceaux sont placés dans des tubes appropriés (Eppendorf de 1,5 ml, par exemple) et stockés à une température de – 80 °C jusqu'à leur homogénéisation ou bien directement homogénéisées sur de la glace avec deux pilons en plastique. (D'autres méthodes peuvent être utilisées si elles impliquent de la glace et permettent d'obtenir une masse homogène). Note importante: Les tubes sont numérotés correctement de façon que la tête et la queue du poisson puissent être reliées à la partie du corps correspondante utilisée pour l'histologie gonadique.
|
|
(5)
|
Après obtention d'une masse homogène, on ajoute un tampon d'homogénéisation (22) glacé représentant 4 × la masse pondérale tissulaire. Continuer à pilonner jusqu'à ce que le mélange soit homogène. Note importante: De nouveaux pilons sont utilisés pour chaque poisson.
|
|
(6)
|
Les échantillons sont placés sur de la glace jusqu'à centrifugation à 50 000 g pendant 30 min. et à une température de 4 °C.
|
|
(7)
|
Utiliser une pipette pour répartir des portions de 20 μl de surnageant dans au moins deux tubes en plongeant l'embout de la pipette sous la couche lipidique située à la surface et en aspirant doucement le surnageant sans fraction lipidique ni culot.
|
|
(8)
|
Les tubes sont stockés à une température de – 80 °C jusqu'à leur utilisation.
|
Appendice 7
Échantillons fortifiés de vitellogénine utilisant un étalon de référence inter-essais
Chaque jour où des essais d'induction de la vitellogénine sont effectués, un échantillon fortifié préparé à l'aide d'un étalon de référence inter-essais sera analysé. La vitellogénine utilisée pour préparer l'étalon de référence inter-essais sera issue d'un lot différent de celui utilisé pour préparer les solutions-étalons pour l'essai en cours.
Pour préparer l'échantillon fortifié, on ajoutera une quantité connue d'étalon inter-essais à un échantillon de plasma de mâle témoin. L'échantillon sera fortifié jusqu'à atteindre une concentration de vitellogénine de 10 à 100 fois supérieure à la concentration de vitellogénine attendue chez les mâles témoins. L'échantillon de plasma ainsi fortifié peut provenir d'un seul poisson ou de plusieurs poissons.
Un sous-échantillon du plasma de mâle témoin non fortifié sera analysé dans au moins deux puits dupliqués. L'échantillon fortifié sera aussi analysé dans au moins deux puits dupliqués. La quantité moyenne de vitellogénine dans les deux échantillons non fortifiés de plasma de mâle témoin sera ajoutée à la quantité calculée de vitellogénine ajoutée pour fortifier les échantillons afin de déterminer la concentration attendue. On notera alors systématiquement le rapport entre cette concentration attendue et la concentration mesurée, ainsi que les résultats de chaque série d'essais effectués ce jour-là.
Appendice 8
Ordinogramme d'analyse statistique

C.38. ESSAI DE MÉTAMORPHOSE DES AMPHIBIENS
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 231(2009) de l'OCDE pour les essais de produits chimiques. Le développement et la validation d'un essai, capable de déceler les substances chimiques actives sur le système thyroïdien chez les vertébrés, sont devenus nécessaires du fait des inquiétudes relatives à la présence dans l'environnement de produits chimiques dans des teneurs susceptibles de provoquer des effets néfastes sur les humains et la faune. En 1998, l'OCDE a lancé une activité à caractère hautement prioritaire visant à réviser les lignes directrices existantes ou à établir de nouvelles lignes directrices pour le dépistage et les tests des substances susceptibles d'avoir des effets perturbateurs sur le système endocrinien. Un des axes de cette activité consistait à développer une ligne directrice pour le dépistage des substances chimiques actives sur le système thyroïdien chez les vertébrés. Une version étendue du document intitulé Toxicité orale à doses répétées pendant 28 jours sur les rongeurs (Chapitre B.7 de la présente annexe) et un essai de métamorphose des amphibiens (EMA) ont été proposés. La méthode d'essai B.7 ainsi amendée a été soumise à validation, avant d'être publiée dans une nouvelle mouture révisée. L'essai de métamorphose des amphibiens (EMA) a suivi un programme de validation complet, comprenant des études intralaboratoires et interlaboratoires visant à en démontrer la pertinence et la fiabilité (1, 2). La validation de l'essai a ensuite fait l'objet d'un examen par les pairs, constitués d'un jury d'experts indépendants (3). La présente méthode d'essai est donc le fruit de l'expérience acquise au cours des études de validation concernant la détection de substances chimiques actives sur la thyroïde, ainsi que des travaux menés par ailleurs au sein des pays membres de l'OCDE.
|
PRINCIPE DE L'ESSAI
|
2.
|
L'essai de métamorphose des amphibiens (EMA) est un essai de dépistage visant à identifier de manière empirique les substances chimiques susceptibles de perturber le fonctionnement normal de l'axe hypothalamo-hypophyso-thyroïdien (HHT). L'EMA constitue un modèle généralisé pour les vertébrés, dans la mesure où il se fonde sur des fonctions et des structures conservées de l'axe HHT. Cet essai est important, car la métamorphose des amphibiens est un processus bien étudié, dépendant de la thyroïde, et répondant aux substances chimiques actives sur l'axe HHT. De plus, il s'agit du seul essai existant capable de détecter l'activité sur la thyroïde chez un animal en cours de développement morphologique.
|
|
3.
|
Le schéma expérimental général comprend l'exposition de têtards de Xenopus laevis au stade 51 à un minimum de trois concentrations différentes d'une substance chimique d'essai ainsi qu'à un témoin d'eau pure pendant 21 jours. Chaque traitement d'essai est effectué avec quatre répliquats. La densité des larves au lancement de l'essai s'élève à 20 têtards par vivier ou répliquat pour l'ensemble des groupes traités. Les observations rapportées sont la longueur des pattes postérieures, la longueur museau-cloaque (LMC), le stade de développement, le poids humide, l'histologie de la thyroïde et la mortalité quotidienne. © OCDE, (2009). L'OCDE autorise l'utilisation de ce contenu pour usage personnel, dans un but non commercial sans autorisation préalable, sous réserve de mention de la source. Toute utilisation à but commercial doit faire l'objet d'une autorisation écrite préalable de l'OCDE.
|
DESCRIPTION DE LA MÉTHODE
Espèces utilisées dans l'essai
|
4.
|
Xenopus laevis est une espèce élevée couramment dans les laboratoires du monde entier, et aisément accessible auprès de fournisseurs commerciaux. Sa reproduction peut être induite facilement tout au long de l'année au moyen d'injections de gonadotropine chorionique humaine (hCG), les larves ainsi obtenues peuvent être élevées en grand nombre de manière systématique jusqu'aux stades de développement voulus, afin d'appliquer des protocoles d'essai spécifiques au stade de développement. Dans le cadre du présent essai, il est préférable d'utiliser des larves issues d'adultes élevés in situ. Bien qu'il ne s'agisse pas de la procédure privilégiée, il est également possible de transférer les œufs et les embryons à partir d'un autre laboratoire menant cet essai, et de leur permettre de s'acclimater. En revanche, l'expédition d'animaux au stade larvaire destinés à l'essai n'est pas acceptable.
|
Équipement et fournitures
|
5.
|
Le matériel suivant est nécessaire à la conduite de l'essai:
|
a)
|
système d'exposition (voir la description ci-dessous);
|
|
b)
|
aquariums en verre ou en acier inoxydable (voir la description ci-dessous);
|
|
c)
|
viviers de reproduction;
|
|
d)
|
appareil de contrôle de la température (p. ex., dispositifs de chauffage et de refroidissement réglables à 22 ± 1 °C);
|
|
f)
|
microscope binoculaire à dissection;
|
|
g)
|
caméra numérique dotée d'une résolution minimale de 4 mégapixels et d'une fonction micro;
|
|
h)
|
logiciel de numérisation des images;
|
|
i)
|
boîtes de Petri (p. ex. 100 × 15 mm) ou chambre de plastique transparent de taille comparable;
|
|
j)
|
balance analytique d'une précision de 3 décimales (mg);
|
|
k)
|
appareil de mesure de l'oxygène dissous;
|
|
m)
|
appareil de mesure de l'intensité lumineuse capable de fournir des résultats en lux;
|
|
n)
|
divers outils et éléments de verrerie de laboratoire;
|
|
o)
|
pipettes réglables (10 à 5 000 μl) ou série de pipettes de tailles équivalentes;
|
|
p)
|
quantités suffisantes de substance chimique d'essai pour mener l'étude, de préférence issues du même numéro de lot;
|
|
q)
|
instruments d'analyse adaptés à la substance d'essai, ou recours à des services d'analyse contractuels.
|
|
Testabilité des substances chimiques
|
6.
|
L'EMA est fondé sur un protocole d'exposition en milieu aquatique selon lequel la substance d'essai est introduite dans le récipient d'essai par le biais d'un système d'écoulement continu. Les méthodes par écoulement continu sont néanmoins soumises aux contraintes relatives au type de substances chimiques pouvant être soumises à l'essai, en fonction de leurs propriétés physico-chimiques. Par conséquent, avant la mise en œuvre de ce protocole, il convient de collecter les informations de référence sur la substance chimique en question pour déterminer sa testabilité, et de consulter la publication intitulée OECD Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures (4). Parmi les caractéristiques indiquant d'éventuelles difficultés pour un test en milieu aquatique figurent: des coefficients de partition eau/octanol (log Koe) élevés, une volatilité importante, une tendance à l'hydrolyse et à la photolyse dans les conditions d'éclairage ambiant d'un laboratoire. D'autres facteurs peuvent entrer en jeu dans la détermination de la testabilité, et font l'objet d'une évaluation au cas par cas. Si l'utilisation d'un système d'écoulement continu ne permet pas de tester la substance, il est possible de recourir à un dispositif de renouvellement statique. Dans le cas où aucune des solutions n'est adaptée à la substance d'essai, celle-ci ne peut donc pas être soumise au présent protocole.
|
Système d'exposition
|
7.
|
Un système de dilution par écoulement continu est préférable, si possible, à un dispositif de renouvellement statique. Si les propriétés physiques et/ou chimiques de l'une des substances chimiques d'essai ne permettent pas de recourir à un système de dilution par écoulement continu, un procédé d'exposition différent (p. ex. avec renouvellement statique) peut être employé. Les composants du système sont constitués d'un matériau adapté au contact avec l'eau, comme le verre, l'acier inoxydable ou le polytétrafluoroéthylène. Certaines matières plastiques appropriées peuvent toutefois être utilisées à condition qu'elles ne perturbent par l'étude. Les viviers d'exposition sont constitués d'aquariums de verre ou d'acier inoxydable, équipés de conduites verticales maintenant le volume d'eau entre 4,0 et 10,0 l et une profondeur minimum du milieu de 10 à 15 cm. Le système prend en charge l'ensemble des concentrations d'exposition ainsi que le témoin, avec quatre répliquats par traitement. La vitesse d'écoulement de chaque vivier est constante afin de garantir la stabilité des conditions biologiques et de l'exposition chimique (par exemple 25 ml/min). Les viviers sont disposés de manière aléatoire au sein du système d'exposition, pour amoindrir les effets éventuellement liés à la position, comprenant notamment de légères variations de température, d'intensité lumineuse, etc. Un éclairage fluorescent est apporté selon un cycle de 12 h de lumière/12 h d'obscurité, avec une intensité à la surface de l'eau comprise entre 600 et 2 000 lux (lumens/m2). Dans chaque vivier d'essai, les conditions sont maintenues aux valeurs suivantes: température de l'eau à 22 ± 1 °C, pH entre 6,5 et 8,5, et concentration d'oxygène dissous (OD) supérieure à 3,5 mg/l (> 40 % de la saturation de l'air). Ces valeurs sont contrôlées au minimum une fois par semaine, la température étant de préférence mesurée en permanence dans au moins un des récipients d'essai. L'Appendice 1 présente les conditions expérimentales nécessaires à l'exécution de ce protocole. Pour des informations complémentaires concernant la mise en place de systèmes d'exposition à écoulement continu et/ou renouvellement statique, veuillez vous reportez au guide de l'ASTM intitulé Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians (5) et aux essais de toxicologie aquatique généraux.
|
Qualité de l'eau
|
8.
|
Toute eau disponible localement ( par exemple: eau de source ou eau du robinet filtrée sur charbon) et permettant la croissance et le développement normaux des têtards de X. laevis peut être employée. Dans la mesure où la qualité de l'eau est susceptible de varier de façon importante d'une zone à l'autre, elle est évaluée, en particulier en l'absence de données historiques concernant l'usage de cette eau pour élever des xénopes. Il convient de vérifier avec soin que l'eau ne contient pas de cuivre, de chlore ou de chloramines, tous ces produits chimiques étant toxiques pour les grenouilles et les têtards. Il est également recommandé d'analyser les concentrations de fluorure, perchlorate et chlorate (produits secondaires issus de la désinfection de l'eau potable) dans le milieu aquatique, puisque tous ces anions sont des substrats des transporteurs d'iode de la glande thyroïde, et que des teneurs élevées de chacun de ces ions sont susceptibles de perturber les résultats de l'essai. L'analyse est réalisée avant le lancement des essais, et l'eau utilisée dans ce cadre ne contient donc normalement pas ces anions.
|
Concentration d'iode dans l'eau employée pour l'essai
|
9.
|
La synthèse d'hormones par la glande thyroïde repose sur des apports suffisants d'iode aux larves, assurés par une combinaison de sources aqueuses et alimentaires. Il n'existe aujourd'hui aucune recommendation d'origine empirique concernant les concentrations d'iode minimales. Cependant, la disponibilité de l'iode est susceptible d'affecter la capacité de réponse du système thyroïdien aux agents actifs sur la thyroïde, un facteur par ailleurs connu pour influencer l'activité basale de cette glande: ce point mérite d'être pris en compte lors de l'interprétation des résultats d'histopathologie de la thyroïde. C'est pourquoi les concentrations d'iode mesurées dans le milieu aquatique utilisé pour l'essai sont rapportées. D'après les données accessibles des études de validation, les concentrations de l'iodure (I–) dans l'eau de l'essai étaient situées entre 0,5 et 10 μg/l. Dans l'idéal, cette concentration ne devrait pas chuter en dessous de 0,5 μg/L. Lorsque l'essai est mené avec de l'eau désionisée, un supplément d'iode est nécessaire afin d'atteindre cette concentration minimum de 0,5 μg/l. Tout nouvel ajout d'iode ou d'autres sels à l'eau de l'essai est notifié dans le rapport.
|
Maintenance des animaux
Soin et reproduction des adultes
|
10.
|
Le soin et la reproduction des adultes sont réalisés conformément aux guides standard. Pour des informations plus détaillées, et le lecteur est invité à se reporter au guide des normes en matière d'essai de tératogénèse sur embryons de grenouille (FETAX) (6). Ces guides standard présentent un exemple des méthodes de soin et de reproduction adaptées, sans qu'il ne soit nécessaire de s'y conformer strictement. Pour provoquer la reproduction, des couples (3 à 5) d'adultes mâles et femelles reçoivent une injection de gonadotropine chorionique humaine (hCG). La dose injectée aux femelles et aux mâles s'élève respectivement à environ 800 UI - 1 000 UI et 600 UI — 800 UI de hCG dissoute dans une solution saline à 0,6 - 0,9 %. Les couples de reproducteurs sont placés dans de grands viviers, à l'abri des perturbations et dans des conditions statiques, en vue de stimuler l'amplexus. Chaque vivier de reproduction est équipé d'une grille en plastique ou en acier inoxydable en guise de faux plancher, permettant aux amas d'œufs de tomber dans un double fond. Si les grenouilles reçoivent une injection en fin d'après-midi, elles déposent habituellement la majorité de leurs œufs vers le milieu de la matinée suivante. Lorsqu'une quantité suffisante d'œufs ont été libérés et fertilisés, il convient de retirer les adultes des viviers de reproduction.
|
Soin et sélection des larves
|
11.
|
Une fois que les adultes ont quitté les viviers de reproduction, les œufs sont collectés et évalués en termes de viabilité en se fondant sur un sous-échantillon d'embryons représentatifs issus de tous ces viviers. Le ou les meilleurs frais produits par un individu (2 à 3 sont recommandés pour évaluer la qualité des frais) sont retenus, d'après des critères liés à la viabilité et à la quantité des embryons (s'élevant à 1 500 minimum). Tous les organismes employés dans l'étude sont issus d'un même frai, ce qui implique que les frais ne soient pas mélangés les uns aux autres. Les embryons sont transférés dans une boîte ou un récipient plat, et tous les œufs manifestement morts ou anormaux [voir la définition en (5)] sont retirés à l'aide d'une pipette. Les embryons sains de chacun des trois frais sont alors placés dans trois viviers différents d'éclosion. Quatre jours après ce transfert, le meilleur frai est sélectionné, sur des critères de viabilité et de succès de l'éclosion, et les larves sont réparties dans un nombre approprié de viviers d'élevage à 22 ± 1 °C. En outre, d'autres larves sont hébergées dans des viviers supplémentaires pour servir de doublure dans l'hypothèse où une mortalité serait observée dans les viviers d'élevage pendant la première semaine. Cette procédure maintient une densité d'individus cohérente, ce qui limite les divergences de développement au sein d'une cohorte issue d'un même frai. L'ensemble des viviers d'élevage sont vidés quotidiennement. Par précaution, les gants vinyle ou nitrile sont préférés aux gants en latex. Les individus décédés sont retirés tous les jours et remplacés par les larves prévues à cet effet afin de maintenir une densité d'organismes constante pendant la première semaine. Les larves sont alimentées au moins deux fois pas jour.
|
|
12.
|
Pendant la phase de pré-exposition, les têtards sont acclimatés aux conditions correspondant à la phase d'exposition réelle, y compris le type de nourriture, la température, le cycle lumière/obscurité et le milieu d'élevage. Il est donc recommandé d'employer la même eau pour la dilution/l'élevage au cours des phases de pré-exposition puis d'exposition. Lorsqu'un système d'élevage statique est utilisé lors de la préexposition des têtards, le milieu est intégralement renouvelé au moins deux fois par semaine. Il convient d'éviter le surpeuplement, dû à des densités de larves importantes pendant la période de pré-exposition, car ces conditions sont susceptibles de fortement perturber le développement des têtards lors de la phase d'essai consécutive. Aussi la densité ne doit-elle pas dépasser environ quatre têtards par litre de milieu d'élevage (dans le cas d'un système d'exposition statique) ou dix têtards par litre de milieu d'élevage (avec p. ex. une vitesse d'écoulement de 50 ml/min dans le système d'élevage ou de pré-exposition). Dans ces conditions, les têtards se développent pour passer du stade 45/46 au stade 51 en douze jours. Le stade de développement des têtards représentatifs de la population de cette lignée est évalué quotidiennement afin de déterminer le bon moment pour entamer la phase d'exposition. Il convient d'être attentif à stresser et perturber les têtards le moins possible, en particulier pendant les déplacements, le nettoyage des aquariums et la manipulation des larves. De même, toute activité ou condition stressante est évitée, notamment les bruits forts et/ou constants, les vibrations et coups au niveau des aquariums, l'activité excessive en laboratoire et les changements brusques de l'environnement (exposition lumineuse, température, pH, OD, vitesse d'écoulement, etc.). Si les têtards ne se développent pas jusqu'au stade 51 dans les 17 jours qui suivent la fertilisation, l'excès de stress est considéré comme une des causes éventuelles de ce retard.
|
Alimentation et élevage des larves
|
13.
|
Les têtards sont nourris avec, par exemple, l'aliment pour tétards du commerce qui est utilisé dans les études de validation (voir également l'Appendice 1) pendant la période de pré-exposition [après le stade Nieuwkoop Faber (NF) 45/46 (8)] et durant toute la phase d'essai de 21 jours, ou tout autre régime alimentaire ayant fait preuve des mêmes performances dans le cadre d'un essai de métamorphose des amphibiens. Pendant la période de préexposition, le régime alimentaire est soigneusement ajusté aux demandes des têtards en développement. En pratique, de petites portions de nourriture sont apportées aux larves nouvellement écloses plusieurs fois par jour (au moins deux fois). Néanmoins, l'excès de nourriture est à éviter i) pour maintenir la qualité de l'eau et ii) pour prévenir l'encrassement des filtres des branchies avec des particules alimentaires et des détritus. En cas d'emploi de l'aliment pour tétards utilisé dans les études de validation, les rations quotidiennes sont augmentées au cours de la croissance des têtards jusqu'à atteindre environ 30 mg/animal/jour, peu avant le début de l'essai. Cet aliment pour têtards disponible dans le commerce, dont les études de validation ont révélé l'aptitude à permettre une croissance et un développement corrects des larves de X. laevis se compose de fines particules qui restent en suspension dans la colonne d'eau pendant une longue période, et peuvent être entraînées par l'écoulement. La dose quotidienne de nourriture est donc répartie en portions réduites, apportées au moins deux fois par jour. Dans le cas de cet aliment, le régime alimentaire est présenté dans le Tableau 1. Le rythme d'alimentation est enregistré. L'aliment peut être administré sous forme sèche ou mis en réserve en solution dans l'eau de dilution. Une telle solution de réserve est préparée de nouveau un jour sur deux, et conservée à 4 °C quand elle n'est pas utilisée.
Tableau 1.
Régime alimentaire des têtards de X. laevis pendant la phase de l'EMA où les animaux sont en vie, en condition d'écoulement continu
|
Jour d'étude
|
Ration alimentaire (mg d'aliment/animal/jour)
|
|
0 - 4
|
30
|
|
5 - 7
|
40
|
|
8 - 10
|
50
|
|
11 - 14
|
70
|
|
15 - 21
|
80
|
|
Analyse chimique
|
14.
|
Avant de lancer l'étude, il convient d'évaluer la stabilité de la substance chimique d'essai en se penchant sur les informations disponibles en termes de solubilité, de dégradabilité et de volatilité. Des échantillons des solutions d'essai de chaque vivier répliqué pour chacune des concentrations sont soumis à des analyses chimiques au début de l'essai (jour 0), et une fois par semaine pendant son déroulement pour un minimum de quatre échantillons. Il est également conseillé d'analyser chaque concentration d'essai lors de la préparation du système afin d'en vérifier les performances, avant de lancer l'essai. L'analyse des solutions de réserve est en outre recommandée à chaque fois qu'elles sont renouvelées, en particulier si leur volume ne correspond pas aux quantités de produits chimiques suffisantes pour couvrir l'ensemble de la période d'échantillonnage de routine. Si les substances chimiques se révèlent indétectables à certaines, voire toutes les concentrations prévues pour l'essai, les solutions de réserve sont analysées et les vitesses d'écoulement du système sont enregistrées en vue de calculer les concentrations nominales.
|
Introduction des substances chimiques
|
15.
|
La méthode employée pour introduire la substance chimique d'essai dans le système est variable en fonction des propriétés physico-chimiques de la substance chimique. Les substances hydrosolubles peuvent être mises en solution en aliquotes dans l'eau utilisée pour l'essai à des concentrations aboutissant à la teneur voulue dans le cadre d'une introduction au moyen d'un système d'écoulement continu. Les substances chimiques liquides à température ambiante mais peu solubles dans l'eau peuvent être introduites avec les méthodes de saturation liquide-liquide. Les substances chimiques solides à température ambiante et faiblement hydrosolubles peuvent être introduites par saturation avec colonne de laine de verre (7). Les systèmes dépourvus de véhicules sont préférables, cependant les différentes substances d'essai possèdent des propriétés physico-chimiques variables, qui réclament des approches diverses pour la préparation des solutions aqueuses visant à l'exposition chimique. La priorité demeure néanmoins de chercher à éviter les solvants et autres véhicules, car: i) certains solvants sont par eux-mêmes susceptibles de se révéler toxiques et/ou d'induire des réponses endocriniennes indésirables ou inattendues, ii) l'essai de substances chimiques à une concentration supérieure à leur solubilité dans l'eau (ce qui arrive fréquemment si des solvants sont utilisés) peut fausser la détermination des concentrations efficaces, et iii) le recours aux solvants dans les essais à long terme peut se traduire par la formation importante de biofilms associés à l'activité microbienne. En présence de substances d'essai difficiles à tester, le solvant n'est utilisé qu'en dernier ressort, et le document intitulé OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures (4) est consulté afin de déterminer la meilleure méthode à employer. Le choix du solvant est guidé par les propriétés chimiques de la substance concernée. Parmi les solvants qui se sont révélés efficaces pour les essais de toxicité aquatique figurent l'acétone, l'éthanol, le méthanol, le diméthylformamide et le triéthylène glycol. Si un solvant est employé comme véhicule, ses concentrations demeurent en dessous de la concentration sans effet observé chronique; le document d'orientation de l'OCDE préconise un maximum de 100 μl/l, cependant un rapport récent ramène cette recommandation à une concentration de solvant dans l'eau de dilution limitée à 20 μl/l seulement (12). De plus, en cas de recours à un solvant comme véhicule, des témoins appropriés pour le solvant sont analysés en plus des témoins sans solvant (eau pure). Lorsque l'introduction du produit chimique se révèle impossible via l'eau, que ce soit en raison de ses caractéristiques physico-chimiques (faible solubilité) ou de sa disponibilité limitée, l'administration par le biais de l'alimentation peut être envisagée. Quelques travaux préliminaires ont été menés pour ce qui relève de l'exposition par la nourriture, cependant cette méthode demeure marginale. Le choix du procédé s'appuie sur une documentation solide et fait l'objet de vérification par l'analyse.
|
Sélection des concentrations d'essai
Établissement de la concentration d'essai maximale
|
16.
|
Dans le cadre de l'essai, la concentration maximale correspond: soit à la limite de solubilité de la substance en question: soit à la concentration maximale tolérée (CMT) pour les substances chimiques présentant une toxicité aiguë, soit à 100 mg/l, la concentration résultante la plus basse étant retenue.
|
|
17.
|
La CMT est définie comme la concentration de la substance d'essai la plus élevée entraînant moins de 10 % de mortalité aiguë. Pour recourir à cette approche, des données empiriques relatives à la mortalité aiguë permettant d'estimer la valeur de la CMT sont nécessaires. La détermination de la CMT peut s'avérer inexacte, et requiert donc généralement un avis professionnel. Si les modèles de régression constituent les outils les plus solides techniquement pour estimer la CMT, il est néanmoins possible d'en obtenir une approximation utile en divisant par trois les données existantes de toxicité aiguë exprimée par la CL50. Les données de toxicité aiguë peuvent cependant manquer pour les espèces employées dans l'essai. Si ces valeurs ne sont pas disponibles pour ces espèces, un essai de CL50 peut être effectué sur 96 h avec des têtards représentatifs (c'est-à-dire au même stade de développement) de la population soumise à l'EMA. Il est également possible, lorsque des données sur d'autres espèces aquatiques sont disponibles (par exemple des études de CL50 chez les poissons ou chez d'autres amphibiens), de faire appel à l'avis d'un professionnel qui fournira une estimation de la CMT probable, au moyen d'une extrapolation interespèces.
|
|
18.
|
Si la substance chimique ne présente pas de toxicité aiguë et demeure soluble à plus de 100 mg/l, une autre solution consiste à choisir cette valeur comme concentration d'essai maximale (CEM), puisque cette dernière est habituellement considérée comme “pratiquement non toxique”.
|
|
19.
|
Par ailleurs, et bien qu'il ne s'agisse pas de la procédure recommandée, des méthodes de renouvellement statique peuvent être mises en œuvre quand les méthodes par écoulement continu ne permettent pas d'atteindre la CMT. Si ces méthodes de renouvellement statiques sont employées, la stabilité de la concentration de la substance chimique d'essai est alors consignée, et reste dans les limites des critères de performances de l'essai. Des périodes de renouvellement de 24 h sont conseillées. En revanche, les périodes de renouvellement dépassant les 72 h ne sont pas acceptables. Les autres paramètres caractérisant la qualité de l'eau (notamment OD, température, pH, etc.) sont en outre mesurés à l'issue de chaque période, juste avant le renouvellement.
|
Fourchette de concentrations de l'essai
|
20.
|
Le minimum requis comprend trois concentrations d'essai et un témoin d'eau pure (plus un véhicule témoin, le cas échéant). Le différentiel entre la plus élevée et la plus basse des concentrations d'essai minimale observées est d'environ une unité d'ordre de grandeur. La distance entre deux doses correspond au maximum à un facteur de 0,1 et au minimum de 0,33.
|
PROCÉDURE
Lancement et conduite de l'essai
Jour 0
|
21.
|
L'exposition débute lorsqu'un nombre suffisant de têtards de la population d'élevage en préexposition ont atteint le stade de développement 51, d'après Nieuwkoop et Faber (8), et que leur âge postfertilisation est inférieur ou égal à 17 jours. Pour sélectionner les individus destinés à l'essai, les têtards d'aspect sain et normal sont isolés du reste de la lignée et placés dans un même récipient contenant un volume adapté d'eau de dilution. La détermination du stade de développement est effectuée en retirant un à un les têtards du vivier commun à l'aide d'un petit filet ou d'une passoire pour les transférer dans une chambre de mesure transparente (p. ex. une boîte de Petri de 100 mm) remplie d'eau de dilution. S'il est préférable de ne pas recourir à l'anesthésie pendant la détermination du stade de développement, on peut toutefois anesthésier les têtards individuellement avant manipulation avec 100 mg/l de méthanesulfonate de tricaïne (p. ex. MS-222), convenablement tamponné au bicarbonate de sodium (pH 7,0). Si le choix de l'anesthésie est retenu, il convient de recueillir la méthodologie appropriée pour utiliser le MS-222, par exemple, auprès de laboratoires expérimentés, et de la rapporter avec les résultats de l'essai. Les animaux sont traités avec soin durant le transfert afin de minimiser le stress dû à la manipulation et d'éviter toute blessure.
|
|
22.
|
Le stade de développement des individus est évalué au moyen d'un microscope binoculaire à dissection. Pour réduire la variabilité maximale du stade de développement, il est important de mener cet examen le plus précisément possible. D'après Nieuwkoop et Faber (8), le premier repère de développement permettant de sélectionner les larves ayant atteint le stade 51 est constitué par la morphologie des pattes postérieures. Les caractéristiques morphologiques des membres postérieurs sont donc à examiner au microscope. Le guide complet de Nieuwkoop et Faber (8) est consulté pour collecter les informations complètes sur la détermination du stade de développement des têtards, néanmoins, il est aussi possible de caractériser ce stade de manière fiable au moyen de critères morphologiques apparents. Le tableau suivant est un outil permettant de simplifier et rationaliser le procédé de détermination du stade de développement tout au long de l'étude, en identifiant les critères morphologiques apparents associés aux différents stades dans l'hypothèse d'un développement normal.
Tableau 2.
Critères morphologiques apparents pour la détermination du stade de développement d'après les recommandations de Nieukoop et Faber
|
Critères morphologiques apparents
|
Stade de développement
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Pattes postérieures
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Pattes antérieures
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Structure crâniofaciale
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Morphologie du nerf olfactif
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Longueur de la queue
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
L'essai n'est lancé que lorsque tous les têtards ont atteint le stade 51. Le principal critère morphologique apparent pour la détermination du stade de développement est la morphologie des pattes postérieures, comme cela est démontré dans la Figure 1.
Figure 1.
Morphologie des pattes postérieures d'un têtard de X. laevis au stade 51.

|
|
24.
|
En plus de la sélection en fonction du stade de développement, il est également possible d'effectuer une sélection des animaux destinés à l'expérimentation en fonction de leur taille. À cette fin, la longueur totale du corps (différente de la longueur museau-cloaque — LMC) est relevée au jour 0 chez un sous-échantillon d'environ 20 têtards au stade NF 51. Une fois que la moyenne de la longueur totale du corps a été calculée pour ce groupe d'individus, les valeurs limites minimum et maximum de cette longueur pour les individus admis dans l'essai sont fixées respectivement en soustrayant et en ajoutant 3 mm à la moyenne établie précédemment (les valeurs moyennes de la longueur totale du corps sont comprises entre 24,0 et 28,1 mm chez les têtards de stade 51). La détermination du stade de développement demeure néanmoins le principal paramètre pour évaluer si un animal est prêt pour l'essai ou non. Les têtards présentant des malformations manifestes ou des blessures sont exclus de l'essai.
|
|
25.
|
Les individus répondant aux critères liés au stade décrits précédemment sont mis de côté dans un vivier rempli avec l'eau d'élevage pure, jusqu'à la fin du processus de détermination du stade de développement. Une fois que cette étape est terminée, les larves sont reparties aléatoirement dans les viviers destinés au traitement d'exposition, jusqu'à ce que chacun d'eux compte 20 animaux. Chacun de ces viviers fait alors l'objet d'une inspection afin de détecter les individus d'apparence anormale, présentant notamment des blessures, une nage inhabituelle, etc. Quand leur aspect n'est absolument pas sain, les têtards sont retirés des viviers de traitement et remplacés par les larves nouvellement sélectionnées dans le vivier commun.
|
Observations
|
26.
|
Des informations plus approfondies sur les procédures de clôture de l'essai et le traitemeny des tétards sont disponibles dans le document d'orientation de l'OCDE intitulé Guidance Document on Amphibian Thyroid Histology (9).
|
Mesures au jour 7
|
27.
|
Au jour 7, cinq têtards par répliquat sont prélevés au hasard dans chaque vivier d'essai. La procédure aléatoire employée garantie une même probabilité d'être sélectionné à tous les individus. Pour cela, toute méthode de choix aléatoire est valable, mais tous les têtards sont capturés dans un filet. Les larves non retenues sont rendues à leur vivier d'origine, et les individus sélectionnés sont euthanasiés humainement en les plaçant dans 150 à 200 mg/l de MS-222, par exemple, convenablement tamponné à pH 7,0 avec du bicarbonate de sodium. Les têtards euthanasiés sont rincés à l'eau, séchés, puis pesés au milligramme près. La longueur des pattes postérieures, la longueur museau-cloaque et le stade de développement (évalués à l'aide d'un microscope binoculaire à dissection) sont déterminés pour chaque larve.
|
Mesures au jour 21 (clôture de l'essai)
|
28.
|
À la fin de l'essai (jour 21), les têtards restants sont euthanasiés humainement en les plaçant dans 150 à 200 mg/l de MS-222, par exemple, convenablement tamponné avec du bicarbonate de sodium, comme précédemment. Ils sont alors rincés à l'eau, séchés, puis pesés au milligramme près. Le stade de développement, la LMC et la longueur des pattes postérieures sont déterminés pour chaque têtard.
|
|
29.
|
Les larves sont ensuite toutes placées dans le fixateur de Davidson durant 48 à 72 h, soit comme échantillon de corps entier, soit en ne conservant que les tissus de la tête, y compris la mandibule, pour les évaluations histologiques. Pour l'histopathologie, l'échantillonnage exige un total de cinq têtards par vivier répliqué. La hauteur des cellules folliculaires dépendant du stade de développement (10), l'approche la mieux adaptée pour l'échantillonnage consiste à sélectionner les individus ayant atteint le même stade, autant que possible. Pour choisir des têtards de même stade de développement, il faut que ce stade soit connu chez tous les animaux avant la sélection et le traitement des données collectées et conservées. Il est nécessaire d'achever cette détermination des stades de développement car des différences de développement normales se traduisent par des différentiels dans la distribution des divers stades au sein de chaque vivier répliqué.
|
|
30.
|
Les animaux sélectionnés pour l'histopathologie (n = 5 pour chaque répliquat) correspondent au stade médian observé chez les témoins (répliquats regroupés), autant que possible. S'il se trouve des viviers répliqués comptant plus de cinq larves au stade approprié, cinq individus sont alors sélectionnés au hasard.
|
|
31.
|
À l'inverse, si certains viviers répliqués contiennent moins de cinq animaux au stade approprié, des individus sont choisis de manière aléatoire au sein de la population de stade immédiatement inférieur ou supérieur pour rejoindre le groupe échantillon, jusqu'à ce que cet ensemble compte cinq larves par répliquat. Idéalement, le choix de prélever des larves au sein de la population de stade immédiatement inférieur ou supérieur pour compléter l'échantillon est étayé par l'évaluation globale de la distribution des stades de développement dans les populations témoins et soumises aux traitements chimiques. Ainsi, si l'exposition chimique entraîne un retard de développement, les larves complémentaires sont alors prélevées dans la population présentant le stade immédiatement inférieur. Inversement, si l'exposition chimique entraîne une accélération du développement, les larves complémentaires sont prélevées dans la population présentant le stade immédiatement supérieur.
|
|
32.
|
En cas de perturbation sévère du développement des têtards en raison du traitement avec la substance chimique d'essai, la distribution des stades observés dans la population exposée chimiquement est susceptible de ne pas correspondre à la médiane des stades de développement calculée pour les témoins. Dans ces cas uniquement, le processus de sélection est modifié et se fonde sur un stade différent de la médiane des stades de développement observés pour les témoins, afin d'obtenir un échantillon de larves destinées à l'histologie de la thyroïde cohérent en termes de stade. En outre, si les stades demeurent indéterminés (dans les cas d'asynchronie), il convient de choisir au hasard cinq têtards dans chaque répliquat, pour les analyses histologiques. Les raisons motivant l'intégration dans l'échantillon de toute larve présentant un stade de développement différent de la valeur médiane chez les témoins sont rapportées.
|
Détermination des observations et effets biologiques
|
33.
|
Pendant la phase d'exposition de 21 jours, le relevé des principales observations rapportées a lieu aux jours 7 et 21, néanmoins une observation quotidienne de la population étudiée est nécessaire. Le Tableau 3 présente un aperçu de l'ensemble des observations rapportées et le moment où elles sont relevées. Des informations plus détaillées concernant les techniques relatives au relevé des observations biologiques et aux évaluations histologiques sont disponibles dans le document d'orientation de l'OCDE (9)
Tableau 3.
Date et fréquence des observations rapportées au cours de l'EMA.
|
Observations rapportées
|
Quotidiennement
|
Jour 7
|
Jour 21
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Longueur des pattes postérieures
|
|
|
ߦ
|
ߦ
|
|
—
|
Longueur museau-cloaque (LMC)
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Histologie de la glande thyroïde
|
|
|
|
ߦ
|
|
Observations rapportées
|
34.
|
Le stade de développement, la longueur des pattes postérieures, la LMC et le poids humide constituent les observations morphologiques de l'EMA; chacune de ces observations fait l'objet d'une discussion ci-après. Des informations techniques complémentaires sur la collecte de ces données, sont disponibles dans le document d'orientation de l'OCDE cité en référence, qui comprend entre autres les procédures d'analyse assistée par ordinateur recommandées.
|
Stade de développement
|
35.
|
Le stade de développement des têtards de X. laevis est déterminé à l'aide des critères d'évaluation établis par Nieuwkoop et Faber (8). Les données relatives au stade de développement permettent de déceler si celui-ci est accéléré, asynchrone, retardé ou non affecté. Une accélération ou un retard de développement sont détectés en comparant les stades médians atteints chez les témoins et les groupes traités, respectivement. Une asynchronie est rapportée quand les tissus observés ne présentent aucune anomalie ou malformation, mais que le rythme de la morphogenèse ou le développement des différents tissus sont en décalage chez un même individu.
|
Longueur des pattes postérieures
|
36.
|
La différenciation et la croissance des pattes postérieures sont contrôlées par les hormones thyroïdiennes et constituent des critères de développement majeurs, déjà employés pour la détermination du stade. Le développement des pattes postérieures est employé comme donnée qualitative pour déterminer le stade de développement, cependant, dans le cas présent, il s'agit d'un paramètre d'évaluation quantitatif. Par voie de conséquence, la longueur des pattes postérieures est mesurée pour détecter des effets sur l'axe thyroïdien (graphique 2). Par souci de cohérence, cette longueur est mesurée sur la patte postérieure gauche. La longueur des pattes postérieures est relevée aux jours 7 et 21 de l'essai. Au jour 7, cette valeur est mesurée directement, comme l'illustre le graphique 2. En revanche, le relevé de la longueur des pattes postérieures au jour 21 est compliqué par les courbures du membre. Aussi les mesures au jour 21 doivent- elles être prises à partir de la paroi corporelle puis suivre la ligne médiane de la patte, en se pliant à toutes les déviations angulaires. Des changements de longueur des pattes postérieures observés dès le jour 7, même s'ils ne sont pas évidents au jour 21, sont considérés comme des signes potentiels d'une activité sur la thyroïde. Les longueurs sont mesurées sur des photos numériques, au moyen de logiciels d'analyse d'image, procédé décrit dans le document d'orientation de l'OCDE intitulé Guidance Document on Amphibian Thyroid Histology (9).
|
Longueur et poids humide du corps
|
37.
|
Le protocole d'essai comprend la caractérisation de la longueur museau-cloaque (LMC) (Figure 2) et du poids humide, en vue d'évaluer les effets potentiels des substances chimiques d'essai sur la vitesse de croissance des têtards, par comparaison avec un groupe témoin. Par ailleurs, ces valeurs sont utiles pour détecter la toxicité générale de la substance chimique d'essai. Dans la mesure où l'élimination du film d'eau avant la pesée est susceptible de stresser les têtards et de leur infliger des blessures cutanées, de tels relevés sont limités à un sous-échantillon au jour 7, avant d'être effectués sur l'ensemble des animaux à la fin de l'essai (jour 21). À des fins de cohérence, il convient de considérer l'aspect crânien du cloaque comme la limite de la queue, pour la mesure.
|
|
38.
|
La longueur museau-cloaque (LMC) sert à évaluer la croissance des têtards, comme l'illustre la Figure 2.
Figure 2.
(A) Types de mesures de la longueur du corps et (B) de la longueur des pattes postérieures chez les têtards de X. laevis (1).

|
Histologie de la glande thyroïde
|
39.
|
Les observations du stade de développement et de la longueur des pattes postérieures sont importantes pour évaluer les changements du développement métamorphique liés à l'exposition, cependant, un retard de développement ne saurait être considéré en soi comme le signe d'une activité antithyroïdienne. Certaines modifications ne sont observables qu'au cours d'analyses histopathologiques de routine. Les critères de diagnostic comprennent l'hypertrophie/atrophie de la glande thyroïde, l'hypertrophie des cellules folliculaires, l'hyperplasie des cellules folliculaires, et, en tant que critères qualitatifs complémentaires: la superficie de la lumière folliculaire, la qualité des colloïdes ainsi que la taille/forme des cellules folliculaires. Le grade de sévérité attribué (sur 4 grades) est consigné. Des informations complémentaires sur l'obtention et le traitement des échantillons destinés à l'analyse histologique, et sur la mise en œuvre de telles analyses sur les échantillons tissulaires sont disponibles dans les documents intitulés “Amphibian Metamorphosis Assay: Part 1 — Technical guidance for morphologic sampling and histological preparation” et “Amphibian Metamorphosis Assay: Part 2 — Approach to reading studies, diagnostic criteria, severity grading and atlas” (9). Les laboratoires menant cet essai pour la ou les premières fois sont invités à recueillir les conseils de pathologistes expérimentés pour se former, avant de s'engager dans l'analyse histologique et l'évaluation de la glande thyroïde. Les changements aussi importants que manifestes observés sur les paramètres morphologiques indiquant une accélération du développement ou une asynchronie peuvent dispenser du besoin d'effectuer des analyses histologiques sur les glandes thyroïdes. L'absence de modifications morphologiques évidentes ou de retard de développement attesté justifie toutefois le recours aux analyses histologiques.
|
Mortalité
|
40.
|
L'ensemble des viviers est suivi quotidiennement pour détecter les têtards morts et contrôler le nombre de larves correspondant à chaque vivier. Il convient de consigner la date, la concentration et le numéro du vivier pour tout cas de mortalité. Les animaux morts sont retirés du vivier d'essai dès qu'ils sont identifiés. Les taux de mortalité supérieurs à 10 % sont des indicateurs potentiels de conditions d'essai mal adaptées, ou d'effets toxiques de la substance chimique d'essai.
|
Observations complémentaires
|
41.
|
L'observation d'un comportement anormal, de malformations très visibles et de lésions est consignée. Il convient de noter la date, la concentration et le numéro du vivier pour tout cas de comportement anormal, de malformations évidentes et de lésions. Un comportement normal se caractérise par la suspension des têtards dans la colonne d'eau, la queue élevée au-dessus de la tête, un battement léger de la queue sur un rythme régulier, des remontées à la surface, un opercule mobile, et la réponse au stimulus. Inversement, un comportement anormal implique notamment des animaux flottant à la surface, immobiles au fond du vivier, une nage inversée ou irrégulière, un manque d'activité à la surface, et l'absence de réponse au stimulus. En outre, les différences de consommation de nourriture entre les groupes de traitement sont consignées lorsqu'elles sont importantes. Les malformations apparentes et les lésions se manifestent éventuellement par des anomalies morphologiques (par exemple difformité des membres), des lésions hémorragiques et des infections bactériennes ou fongiques, entre autres. Ces déterminations sont d'ordre qualitatif, et sont considérées comme analogues aux signes cliniques de maladies/stress, et toujours en comparaison avec les animaux témoins. Une occurrence ou un taux d'occurrence supérieur dans les viviers exposés par rapport au groupe témoin constitue la preuve d'une toxicité manifeste.
|
DONNÉES ET RAPPORTS
Collecte des données
|
42.
|
Toutes les données sont collectées à l'aide de systèmes électroniques ou manuels conformes aux bonnes pratiques de laboratoire (BPL). Les données de l'étude comprennent:
|
|
Substance chimique d'essai:
|
—
|
Caractérisation de la substance chimique d'essai: propriétés physico-chimiques; informations sur la stabilité et la biodégradabilité.
|
|
—
|
Informations et données chimiques: méthode et fréquence de préparation des dilutions. Les informations sur les substances chimiques d'essai détaillent leurs concentrations réelle et nominale, et, dans certains cas, celles de produits chimiques qui ne sont pas la substance d'essai initiale, le cas échéant. Les mesures sur la substance d'essai peuvent aussi bien concerner les solutions de réserve que les solutions d'essai.
|
|
—
|
Solvant (s'il ne s'agit pas de l'eau pure): justification du choix et caractérisation de ce solvant (nature, concentration employée).
|
|
|
|
Conditions de l'essai:
|
—
|
Registres opérationnels: ils compilent les observations relatives au fonctionnement du système d'essai ainsi qu'à l'environnement et aux infrastructures qui y participent. Habituellement, les registres comprennent: la température ambiante, la température d'essai, la période d'exposition lumineuse, l'état des éléments cruciaux du système d'exposition (notamment les pompes, les compteurs de cycles, les pressions), les débits, les niveaux d'eau, les renouvellements des bouteilles de réserve, et les rapports sur l'alimentation. Les paramètres généraux sur la qualité de l'eau incluent: le pH, l'oxygène dissous, la conductivité, l'iode total, l'alcalinité et la dureté.
|
|
—
|
Déviations par rapport à la méthode d'essai: compile toutes les informations ou descriptions narratives des déviations consenties par rapport à la méthode d'essai.
|
|
|
|
Résultats:
|
—
|
Observations et données biologiques: elles comprennent les observations quotidiennes sur la mortalité, la consommation de nourriture, les nages anormales, la léthargie, la perte d'équilibre, les malformations, les lésions etc. Les observations et données collectées à intervalle prédéterminé incluent: le stade de développement, la longueur des pattes postérieures, la longueur museau-cloaque et le poids humide.
|
|
—
|
Techniques d'analyse statistique utilisées et justification de leur emploi; la présentation des résultats de cette analyse statistique sera de préférence sous forme de tableau.
|
|
—
|
Données histologiques: elles incluent les descriptions narratives ainsi que le degré de sévérité et le taux d'incidence des observations spécifiques, conformément au document d'orientation sur l'histopathologie.
|
|
—
|
Observations ad hoc: ces observations concernent toute description narrative de l'étude ne correspondant pas aux catégories décrites précédemment.
|
|
|
Rapports de données
|
43.
|
L'Appendice 2 propose des feuilles de calcul relatives au relevé quotidien des données, qui constituent une aide utile pour entrer les valeurs et calculer les statistiques globales. De plus, des tableaux de rapport sont fournis, ce qui facilite la communication des récapitulatifs des données concernant les effets mesurés. Les tableaux de rapport pour l'évaluation histologique sont disponibles dans l'Appendice 2.
|
Critères de performance et acceptabilité/validité de l'essai
|
44.
|
En général, des déviations importantes par rapport à de la méthode d'essai se traduisent par des données qui ne sont pas acceptables pour être interprétées et faire l'objet de rapports. Aussi les critères suivants, détaillés dans le tableau 4, ont-ils été développés en vue d'orienter la détermination de la qualité de l'essai effectué et la performance générale des individus témoins.
Tableau 4.
Critères de performance pour l'EMA.
|
Critères
|
Limites acceptables
|
|
Concentrations d'essai
|
Maintenues ≤ 20 % CV (variabilité de la concentration d'essai mesurée) sur les 21 jours de l'essai
|
|
Mortalité chez les témoins
|
≤ 10 % — la mortalité dans chaque répliquat des témoins ne dépasse pas 2 têtards
|
|
Stade de développement médian chez les témoins à la fin de l'essai
|
57
|
|
Répartition du stade de développement dans le groupe témoin
|
Les individus correspondant respectivement à 10 % et à 90 % de la distribution du stade de développement ne présentent pas une différence de plus de 4 stades.
|
|
Oxygène dissous
|
≥ 40 % de la saturation de l'air (23)
|
|
pH
|
Le pH demeure entre 6,5 et 8,5. Les différentiels interrépliquat et intertraitement n'excèdent pas 0,5.
|
|
Température de l'eau
|
22 ± 1 °C — Les différentiels interrépliquat et intertraitement n'excèdent pas 0,5 °C.
|
|
Concentrations d'essai hors toxicité manifeste
|
≥ 2
|
|
Performance des répliquats
|
≤ 2 répliquats sur l'ensemble de l'essai peuvent être compromis
|
|
Conditions particulières pour l'utilisation d'un solvant
|
Si un solvant est utilisé comme véhicule, il convient de mettre en place un témoin pour le solvant et pour l'eau, et les résultats correspondants sont consignés.
|
|
Les différences statistiquement significatives entre les groupes témoins pour le solvant et pour l'eau sont traitées de manière particulière. Voir ci-dessous pour plus d'informations
|
|
Conditions particulières pour le recours à un système de renouvellement statique
|
Les analyses chimiques représentatives effectuées avant et après le renouvellement sont rapportées.
|
|
La teneur en ammoniaque est calculée juste avant le renouvellement.
|
|
Tous les paramètres liés à la qualité de l'eau récapitulés dans le Tableau 1 de l'Appendice 1 sont évalués juste avant le renouvellement.
|
|
La période entre deux renouvellements ne dépasse pas 72 h.
|
|
Un calendrier d'alimentation adapté (50 % de la ration quotidienne de l'aliment pour tétards du commerce).
|
|
Validité de l'essai
|
45.
|
Pour être jugé acceptable/valide, un essai satisfait les exigences suivantes:
|
|
Validité d'une expérience menée dans le cadre de l'essai, pour conclure à une substance négative en termes d'activité sur la thyroïde:
|
(1)
|
Pour tous les traitements considérés (y compris les témoins), la mortalité n'excède pas 10 %. Pour un répliquat donné, la mortalité ne dépasse pas trois têtards; dans le cas contraire, le répliquat est jugé compromis.
|
|
(2)
|
Au moins deux niveaux de traitement dont les quatre répliquats demeurent non compromis sont nécessaires pour effectuer les analyses.
|
|
(3)
|
Au moins deux niveaux de traitement exempts de toxicité manifeste sont nécessaires pour effectuer les analyses.
|
|
|
|
Validité d'une expérience menée dans le cadre de l'essai, pour conclure à une substance positive en termes d'activité sur la thyroïde:
|
(1)
|
La mortalité observée est limitée à deux têtards par répliquat dans le groupe témoin, au maximum.
|
|
|
Diagramme de décision dans la conduite de l'EMA
|
46.
|
Un diagramme de décision a été créé pour l'EMA afin d'offrir une assistance logique dans la conduite et l'interprétation des résultats du bioessai (voir le diagramme de décision dans le Graphique 3). Ce diagramme de décision accorde, par essence, une forte pondération aux observations relevées que sont le développement accéléré, asynchrone, ou l'histopathologie thyroïdienne, tandis que les autres observations susceptibles d'être également affectées par la toxicité générale, comme le retard de développement, la longueur museau-cloaque et le poids du corps humide sont caractérisés par une pondération moindre.
Figure 3.
Diagramme de décision dans la conduite de l'EMA

|
Développement accéléré (évalué avec le stade de développement, la LMC et la longueur des pattes postérieures)
|
47.
|
On sait que le développement accéléré est dû uniquement aux effets liés aux hormones thyroïdiennes. Parmi ces effets figurent ceux qui affectent les tissus périphériques, notamment dus à l'interaction directe avec les récepteurs des hormones thyroïdiennes (par exemple T4), ou ceux qui entraînent une altération des concentrations d'hormones thyroïdiennes en circulation. Chacun de ces cas est jugé suffisant pour conclure à une activité de la substance sur la thyroïde. Le développement accéléré est évalué de l'une ou l'autre manière suivante: soit le stade de développement général est déterminé en se basant sur l'approche standard détaillée par Nieuwkoop et Faber (8), soit les caractères morphologiques spécifiques peuvent être quantifiés, par exemple la longueur des pattes postérieures, aux jours 7 et 21, car ce critère réagit positivement aux activités agonistes sur les récepteurs des hormones thyroïdiennes. Si les statistiques dégagent une accélération significative du développement ou de la croissance des pattes postérieures, l'essai indique que la substance présente une activité sur la thyroïde.
|
|
48.
|
L'évaluation d'un éventuel développement accéléré chez les animaux de l'essai par rapport à la population témoin se fonde sur les résultats des analyses statistiques menées sur les quatre relevés d'observations suivants:
|
—
|
longueur des pattes postérieures (normalisée par la LMC) au jour 7 de l'étude
|
|
—
|
longueur des pattes postérieures (normalisée par la LMC) au jour 21 de l'étude
|
|
—
|
stade de développement au jour 7 de l'étude
|
|
—
|
stade de développement au jour 21 de l'étude
|
|
|
49.
|
Les analyses statistiques portant sur la longueur des pattes postérieures exploitent les données relevées pour le membre postérieur gauche. La normalisation de la longueur des pattes postérieures se fait en calculant le rapport entre cette longueur et la longueur museau-cloaque pour chaque individu. Les moyennes des valeurs normalisées sont alors comparées. L'accélération du développement est alors signalée par une forte hausse de la moyenne des longueurs des pattes postérieures (normalisées) mesurées dans le groupe traité chimiquement, par rapport à celle du groupe témoin, au jour 7 et/ou 21 de l'étude (voir Appendice 3).
|
|
50.
|
Les analyses statistiques du stade de développement sont effectuées avec les stades évalués conformément aux critères morphologiques décrits par Nieuwkoop et Faber (8). L'accélération du développement est caractérisée quand les analyses multi-quantiques détectent une forte hausse des valeurs du stade de développement dans le groupe traité chimiquement, par rapport à celles du groupe témoin, au jour 7 et/ou 21 de l'étude.
|
|
51.
|
Dans la méthode de l'essai de métamorphose des amphibiens, un effet significatif observé sur l'un quelconque des quatre relevés d'observations mentionnés ci-dessus est considéré comme suffisant pour conclure à un développement accéléré. Ainsi, des effets significatifs sur la longueur des pattes postérieures relevés à un moment donné n'ont pas besoin d'être confirmés: ils n'impliquent pas nécessairement que la même tendance soit attestée lors de l'observation suivante, ni que le stade de développement soit affecté de la même manière, au même moment. De la même manière, les effets significatifs sur le stade de développement relevés à un moment donné n'ont pas besoin d'être confirmés: ils n'impliquent pas nécessairement que la même tendance soit attestée lors de l'autre observation, ni que la longueur des pattes postérieures soit affectée de la même manière, au même moment. Néanmoins, si des effets significatifs touchent plusieurs des observations rapportées, ils renforcent les preuves en faveur d'un développement accéléré.
|
Développement asynchrone (évalué avec le stade de développement)
|
52.
|
Un développement asynchrone se caractérise par un décalage dans le rythme de morphogenèse ou de développement des différents tissus chez un même têtard. L'impossibilité d'établir clairement le stade de développement d'un individu en se basant sur la série d'observations morphologiques considérées comme typiques d'un stade donné indique que les tissus se développent de manière asynchrone, à travers la métamorphose. Un développement asynchrone est un signe d'activité sur la thyroïde. Les seuls modes d'action connus entraînant une telle asynchronie sont fondés sur les effets de produits chimiques sur l'action périphérique et/ou le métabolisme associés aux hormones thyroïdiennes dans les tissus en développement, comme on l'observe avec les inhibiteurs de la déiodinase.
|
|
53.
|
L'évaluation du développement asynchrone chez les animaux inclus dans l'essai par rapport au groupe témoin s'appuie sur les examens morphologiques d'ensemble effectués sur les larves aux jours 7 et 21.
|
|
54.
|
La description du développement normal des xénopes par Nieuwkoop et Faber (8) constitue le cadre permettant d'identifier l'ordre séquentiel du remodelage des tissus attendu. Le terme “développement asynchrone” se rapporte spécifiquement aux déviations dans le développement morphologique général des têtards empêchant la détermination du stade de développement conformément aux références de Nieuwkoop et Faber (8), parce que les relevés morphologiques clés indiquent des stades différents.
|
|
55.
|
Comme le suppose le terme “développement asynchrone”, seuls les cas présentant des déviations de la progression du remodelage de tissus spécifiques par rapport au remodelage d'autres tissus sont pris en considération. Parmi les phénotypes classiques figurent le retard ou l'absence d'apparition des pattes antérieures, tandis que les tissus des pattes postérieures et de la queue se développent normalement ou de manière avancée, ou la résorption précoce des branchies par rapport au stade de morphogenèse des membres postérieurs et à la résorption de la queue. Un animal sera enregistré comme présentant un développement asynchrone s'il n'est pas possible de lui attribuer un stade dans la mesure où il ne répond pas à la majorité des critères de Niewkoop et Faber correspondants (8), ou si une ou plusieurs caractéristiques clés se montrent très retardées ou accélérées (par exemple queue complètement résorbée alors que les pattes antérieures ne sont pas apparues). Cette évaluation est d'ordre qualitatif, et intègre l'intégralité des caractéristiques répertoriées par Nieuwkoop et Faber (8). Il n'est toutefois pas nécessaire de consigner l'état de développement de chacun de ces critères caractéristiques chez les animaux observés. Les individus chez lesquels un développement asynchrone est diagnostiqué ne se voient pas attribuer de stade de développement au sens de Nieuwkoop et Faber (8).
|
|
56.
|
Ainsi, un des critères principaux pour désigner les anomalies du développement morphologique comme “développement asynchrone” réside dans le décalage entre le rythme relatif au remodelage et à la morphogenèse des tissus, tandis que la morphologie des tissus affectés ne présente pas d'anomalies évidentes. À titre d'exemple de cette interprétation des anomalies morphologiques importantes, un retard dans la morphogenèse des pattes postérieures par rapport au développement des autres tissus suffira à conclure à un “développement asynchrone”, contrairement aux cas d'absence de ces membres postérieurs, d'anomalies digitales (par exemple ectrodactylie, polydactylie) ou autres malformations des pattes évidentes.
|
|
57.
|
Dans ce contexte, les principaux critères morphologiques à évaluer en termes d'avancée coordonnée de la métamorphose comprennent la morphogenèse des pattes postérieures et antérieures, l'apparition des pattes antérieures, le stade de résorption de la queue (en particulier la résorption de la nageoire caudale) et la morphologie de la tête (par exemple la taille des branchies et le stade où elles se résorbent, la morphologie de la mandibule, ou la protrusion du cartilage de Meckel).
|
|
58.
|
Selon le mécanisme d'action de la substance chimique, différents phénotypes morphologiques importants sont susceptibles d'apparaître. Parmi les phénotypes classiques, on compte le retard ou l'absence d'apparition des pattes antérieures, malgré un développement normal voire accéléré des membres postérieurs et des tissus de la queue, ainsi que la résorption précoce des branchies par rapport aux pattes postérieures et au remodelage de la queue.
|
Histopathologie
|
59.
|
Si le produit chimique ne présente pas de toxicité manifeste et n'entraîne pas d'accélération ou d'asynchronie du développement, l'histopathologie de la glande thyroïde est alors étudiée, à l'aide du document d'orientation approprié (9). En l'absence de toxicité, le retard de développement est un indicateur fort d'activité anti-thyroïdienne. Cependant, l'étude du stade de développement est moins sensible et permet moins d'établir un diagnostic que les analyses histopathologiques de la glande thyroïde. Dans ce cas, ces analyses sont donc requises. Des effets sur l'histologie des glandes thyroïdes ont été démontrés, même lorsque le développement demeure normal. Si des changements sur l'histopathologie de la thyroïde sont observés, la substance chimique est alors considérée comme présentant une activité sur la thyroïde. Inversement, si les glandes thyroïdes ne souffrent d'aucune lésion histologique et qu'il n'y a pas de retard de développement, le produit chimique est considéré comme inactif sur la thyroïde. La raison de cette distinction repose sur le fait que la thyroïde est sous l'influence de la HST (hormone de stimulation thyroïdienne), si bien que toute substance chimique altérant suffisamment la circulation des hormones thyroïdiennes pour affecter la sécrétion de HST entraîne alors des modifications histopathologiques dans les glandes thyroïdes. Divers mécanismes et modes d'action sont susceptibles de réduire la circulation des hormones thyroïdiennes. Ainsi, même si la concentration des hormones thyroïdiennes représente une indication de l'effet sur la thyroïde, cet élément ne suffit pas à préciser le mécanisme ou le mode d'action associé à la réponse.
|
|
60.
|
Ces effets mesurés sur la glande thyroïde ne se prêtant pas aux approches statistiques de base, la détermination d'un effet consécutif à une exposition chimique s'appuie sur l'expertise d'un pathologiste.
|
Retard de développement (évalué avec le stade de développement, la longueur des pattes postérieures, le poids corporel et la LMC)
|
61.
|
Des retards de développement peuvent apparaître du fait de mécanismes anti-thyroïdiens ou d'une toxicité indirecte. De légers retards de développement associés à des signes importants de toxicité indiquent probablement un effet toxique non spécifique. L'évaluation de la toxicité non liée à la thyroïde constitue un élément primordial de l'essai, afin de diminuer la probabilité d'apparition de faux positifs. Une mortalité excessive est un signe évident que d'autres mécanismes toxiques entrent en jeu. De la même manière, de légers retards de croissance, évalués au moyen du poids humide et/ou de la LMC, suggèrent également une toxicité non liée à la thyroïde. Une augmentation apparente de la croissance est souvent observée avec les substances chimiques qui perturbent le développement normal. La présence d'animaux plus développés n'indique donc pas nécessairement une toxicité non thyroïdienne. En revanche, la croissance n'est pas le seul élément étayant la détermination de la toxicité sur la thyroïde. Elle est plutôt associée au stade de développement et à l'histopathologie de la thyroïde afin de juger de l'activité sur la thyroïde. D'autres observations sont prises en compte pour déterminer la toxicité manifeste, y compris les œdèmes, les lésions hémorragiques, la léthargie, une baisse de la consommation de nourriture, une nage erratique/altérée, etc. Si une toxicité manifeste se déclare pour toutes les concentrations testées, il convient de réévaluer la substance d'essai dans une fourchette de concentrations plus basse avant de conclure à une éventuelle activité sur la thyroïde.
|
|
62.
|
En l'absence de signes de toxicité manifeste, les retards de développement statistiquement significatifs indiquent que le produit chimique est actif sur la thyroïde (par un mécanisme antagoniste). En outre, s'il n'existe pas de réponse statistiquement marquée, cette observation peut être complétée par les résultats de l'histopathologie de la thyroïde.
|
Analyses statistiques
|
63.
|
Il est préférable d'effectuer ces analyses statistiques en suivant les procédures décrites dans le document intitulé Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application (11). En ce qui concerne l'ensemble des paramètres d'évaluation quantitatifs et continus (longueur des pattes postérieures, LMC, poids humide) correspondant à une fonction dose-réponse monotone, il convient d'appliquer le test de Jonckheere — Terpstra par méthode descendante afin de dégager un effet significatif du traitement.
|
|
64.
|
Pour les paramètres d'évaluation continus ne correspondant pas à une fonction dose-réponse monotone, les données sont examinées en termes de normalité (de préférence avec les tests de Shapiro — Wilk ou d'Anderson — Darling) et d'homogénéité de la variance (en priorité avec le test de Levene). Les deux tests utilisent les données résiduelles d'une ANOVA. S'il est possible de substituer les jugements d'un expert à ces tests formels de normalité et d'homogénéité de la variance, ces derniers demeurent toutefois préférables. En cas de non-normalité ou d'hétérogénéité de la variance, une transformation visant à normaliser les données et stabiliser la variance est recherchée. Si les valeurs (éventuellement après transformation) présentent une distribution normale avec une variance homogène, le test de Dunnett permet de dégager les effets significatifs du traitement. Si les valeurs (éventuellement après transformation) présentent une distribution normale avec une variance hétérogène, les effets significatifs du traitement sont déterminés grâce au test de Tamhane — Dunnett, ou au test T3, ou encore avec le test U de Mann — Whitney — Wilcoxon. Dans le cas où aucune transformation visant à normaliser les données n'a été trouvée, les effets significatifs du traitement sont déterminés avec le test U de Mann — Whitney — Wilcoxon après corrections des p-valeurs selon la méthode Bonferroni — Holm. Le test de Dunnett s'applique indépendamment du test F de l'ANOVA, et le test Mann — Whitney est indépendant de tout test de Kruskall — Wallis global.
|
|
65.
|
Aucune mortalité significative n'est attendue, néanmoins il convient de l'évaluer par méthode descendante avec le test de Cochran — Armitage lorsque les données se traduisent par une fonction dose- réponse monotone; dans les autres cas, c'est le test exact de Fisher avec correction de Bonferroni — Holm qui est appliqué.
|
|
66.
|
Un éventuel effet significatif du traitement sur le stade de développement est évalué par méthode descendante au moyen du test de Jonckheere — Terpstra sur les médianes des répliquats. Une autre technique pour dégager un tel effet consiste à recourir à des analyses multi-quantiques avec le test de Jonckheere en se basant sur les résultats compris entre les 20e et 80e percentiles; comme cette méthode prend en compte des changements dans le profil de distribution, elle est préférable aux autres.
|
|
67.
|
L'unité d'analyse correcte est le répliquat: ainsi, le test de Jonckheere — Terpstra ou le test U de Mann — Whitney exploitent les médianes des répliquats, tandis que le test de Dunnett analyse les moyennes des répliquats. Il est possible d'évaluer visuellement le caractère monotone de la fonction dose-réponse en examinant les moyennes ou médianes des répliquats et des traitements, ou bien par le biais de tests formels tels que ceux décrits précédemment (11). Si le nombre de répliquats par traitement ou pour les témoins est inférieur à cinq, il convient d'employer une approche fondée sur des permutations exactes, des tests de Jonckheere — Terpstra et Mann — Whitney, dans la mesure du possible. Pour tous les tests cités, on conclut à la significativité statistique au-dessus de 0,05.
|
|
68.
|
La Figure 4 présente la structure logique d'exécution des tests statistiques sur les données continues.
Figure 4.
Structure logique de l'approche statistique pour le traitement des données de réponse continues.

|
Considérations particulières pour l'analyse des données
Utilisation des traitements compromis
|
69.
|
Plusieurs facteurs entrent en jeu pour déterminer si un répliquat ou l'intégralité d'un traitement présentent une toxicité manifeste et s'il convient alors de les exclure de l'analyse. Une toxicité manifeste se caractérise par une mortalité supérieure à deux individus dans un répliquat, mortalité qui ne saurait être imputable à une erreur technique, et s'explique donc par la toxicité. Parmi les signes supplémentaires de toxicité manifeste figurent l'hémorragie, les comportements anormaux, les nages anormales, l'anorexie ainsi que tout autre signe clinique de maladie. Des évaluations qualitatives s'avèrent parfois nécessaires pour les signes de toxicité sous-létale, toujours par rapport au groupe témoin dans l'eau pure.
|
Témoins associés au solvant
|
70.
|
Un solvant n'est employé qu'en dernier ressort, après avoir considéré toutes les autres solutions de transport du produit chimique. Si l'option du solvant est néanmoins retenue, il est impératif de mettre en place conjointement un témoin constitué d'eau pure. À la clôture de l'essai, les effets potentiels du solvant font l'objet d'une évaluation. Pour cela, les résultats correspondant au groupe témoin du solvant sont comparés à ceux du groupe témoin de l'eau pure. Les relevés d'observation les plus pertinents dans ce cadre sont le stade de développement, la LMC et le poids humide, puisque ces relevés sont sensibles aux toxicités non thyroïdiennes. Si des différences statistiquement significatives entre les groupes témoins solvant et eau pure se dégagent sur ces relevés, il convient de déterminer les effets correspondants aux relevés d'observation en se fondant sur les observations relevées chez les témoins dans l'eau pure. Si, à l'inverse, il n'existe pas de différence statistiquement significative entre les deux groupes pour l'ensemble des observations relevées, les effets se fondent sur les observations relevées à la fois chez les témoins correspondant à l'eau de dilution et au solvant.
|
Groupes de traitement atteignant un stade de développement supérieur ou égal à 60
|
71.
|
Au-delà du stade 60, le poids et la taille des têtards diminuent du fait de la résorption des tissus et de la baisse de leur masse d'eau en valeur absolue. Aussi les mesures du poids humide et de la LMC ne sont-elles plus appropriées aux analyses statistiques des différences de vitesse de croissance. Les valeurs du poids humide et de la longueur des animaux à un stade NF supérieur à 60 sont donc censurées et exclues des analyses des moyennes et des médianes des répliquats. Deux approches différentes sont envisageables pour analyser les paramètres de croissance.
|
|
72.
|
L'une d'elle consiste à ne prendre en compte que les têtards à un stade de développement inférieur ou égal à 60 pour les analyses statistiques du poids humide et/ou de la LMC. Cette approche est supposée apporter des informations suffisamment solides sur la sévérité des éventuels effets sur la croissance, à condition que la proportion d'animaux exclus de l'analyse demeure limitée 20 %). Si un nombre plus important de têtards se caractérisent par un stade de développement dépassant 60 (≥ 20 %) dans une ou plusieurs concentrations nominales, il convient d'effectuer une ANOVA à deux facteurs intégrant une structure de variance sous-jacente pour évaluer les effets sur la croissance dus aux traitements chimiques sur l'ensemble des individus, tout en prenant en compte l'effet du stade de développement avancé sur la croissance. L'annexe 3 propose des orientations concernant l'ANOVA à deux facteurs (poids et longueur)..
|
BIBLIOGRAPHIE
|
(1)
|
OCDE (2007) Final report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 — Optimisation of the Test Protocol. Publications Hygiène et Sécurité de l'environnement. Série sur les essais et évaluations. No 76, Paris.
|
|
(2)
|
OCDE (2007) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 — Multi-chemical Interlaboratory Study. Publications Hygiène et Sécurité de l'environnement. Série sur les essais et évaluations. No 76. Paris
|
|
(3)
|
OCDE (2008) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Publications Hygiène et Sécurité de l'environnement. Série sur les essais et évaluations. No 92. Paris
|
|
(4)
|
OCDE (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Publications Hygiène et Sécurité de l'environnement. Série sur les essais et évaluations. No 23. Paris
|
|
(5)
|
ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729- 96(2002), Philadelpie, PA
|
|
(6)
|
ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay — Xenopus (FETAX). E 1439-98
|
|
(7)
|
Kahl,M.D., Russom,C.L., DeFoe,D.L. & Hammermeister,D.E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, pp. 539-551
|
|
(8)
|
Nieuwkoop,P.D. & Faber,J. (1994) Normal Table of Xenopus laevis. Garland Publishing, New York
|
|
(9)
|
OCDE (2007) Guidance Document on Amphibian Thyroid Histology. Publications Hygiène et Sécurité de l'environnement. Série sur les essais et évaluations. No 82. Paris
|
|
(10)
|
Dodd,M.H.I. & Dodd,J.M. (1976) Physiology of Amphibia. Lofts,B. (ed.), Academic Press, New York, pp. 467-599
|
|
(11)
|
OCDE (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Publications Hygiène et Sécurité de l'environnement. Série sur les essais et évaluations. No 54. Paris
|
|
(12)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Rapport. Aquatic Toxicology, 76; pp. 69-92.
|
Appendice 1
Tableau 1
Conditions expérimentales de l'essai de métamorphose des amphibiens sur 21 jours.
|
Animaux d'essai
|
Larves de Xenopus laevis
|
|
Stade larvaire initial
|
Stade 51 selon Nieuwkoop et Faber
|
|
Durée d'exposition
|
21 jours
|
|
Critères de sélection des larves
|
stade de développement et longueur totale (optionnelle)
|
|
Concentrations d'essai
|
Minimum de 3 concentrations s'étendant sur environ une unité de l'ordre de grandeur
|
|
Régime d'exposition
|
Avec écoulement continu (de préférence) et/ou renouvellement statique
|
|
Vitesse d'écoulement dans le système d'essai
|
25 ml/min (renouvellement complet du volume environ toutes les 2,7 h)
|
|
Principales observations rapportées — Calendrier des relevés
|
Mortalité
|
Quotidiennement
|
|
Stade de développement
|
J7 et 21
|
|
Longueur des pattes postérieures
|
J7 et 21
|
|
Longueur museau-cloaque
|
J7 et 21
|
|
Poids du corps humide
|
J7 et 21
|
|
Histologie de la thyroïde
|
J21
|
|
Eau de dilution — Témoin du laboratoire
|
Eau du robinet déchlorée (filtrée sur charbon) ou source équivalente issue du laboratoire
|
|
Densité de larves
|
20 larves/récipient d'essai (5/l)
|
|
Solution d'essai/Récipient d'essai
|
4 - 10 l (10 - 15 cm d'eau minimum)/récipient d'essai en verre ou en acier inoxydable (p. ex. 22,5 cm × 14 cm × 16,5 cm)
|
|
Réplication
|
4 récipients d'essai répliqués par concentration d'essai et témoin
|
|
Taux de mortalité admis chez les témoins
|
≤ 10 % par récipient d'essai répliqué
|
|
Fixation thyroïdienne
|
Nombre d'individus concernés
|
Tous les têtards (5/répliquat évalués initialement)
|
|
Région
|
Tête ou corps entier
|
|
Fluide de fixation
|
Fixateur de Davidson
|
|
Alimentation
|
Nourriture
|
Sera Micron® ou équivalent
|
|
Quantité — Fréquence
|
Consulter le tableau 1 présentant le régime alimentaire adapté à l'emploi de Sera Micron®
|
|
Éclairage
|
Période d'exposition lumineuse
|
12 h de lumière pour 12 h d'obscurité
|
|
Intensité
|
600 à 2 000 lux (mesurée à la surface de l'eau)
|
|
Température de l'eau
|
22 ± 1 °C
|
|
pH
|
6,5 – 8,5
|
|
Concentration d'oxygène dissous (OD)
|
> 3,5 mg/l (> 40 % de la saturation de l'air)
|
|
Calendrier d'échantillonnage pour les analyses chimiques
|
Une fois par semaine (4 échantillonnages/essai)
|
Appendice 2
Tableau pour le rapport des données brutes et résumées
Tableau 1
Informations générales sur la substance chimique d'essai
|
Informations sur la substance chimique chimique
|
|
|
Entrer la substance chimique, les unités de concentration et les traitements
|
|
|
Substance chimique d'essai:
|
|
|
|
|
Unités de concentration
|
|
|
|
|
Traitement 1
|
|
|
|
|
Traitement 2
|
|
|
|
|
Traitement 3
|
|
|
|
|
Traitement 4
|
|
|
|
|
|
|
|
|
|
Date (jour 0):
|
|
Entrer la date (jj/mm/aa)
|
|
|
Date (jour 7):
|
|
Entrer la date (jj/mm/aa)
|
|
|
Date (jour 21):
|
|
Entrer la date (jj/mm/aa)
|
Tableau 2
Feuille de collecte des données brutes pour les jours 7 et 21.
|
JOUR X
DATE 00/00/00
|
|
|
Concentration
|
Numéro du traitement
|
Numéro du répliquat
|
Numéro de l'individu
|
Identifiant de l'individu
|
Stade de développement
|
Longueur LMC (mm)
|
Longueur des pattes postérieures (mm)
|
Poids du corps humide (mg)
|
|
ROW
|
TRT
|
TRT
|
REP
|
IND
|
ID#
|
STAGE
|
BL
|
HLL
|
WEIGHT
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Tableau 3
Valeurs résumées calculées pour les observations des jours 7 et 21
|
|
|
Stade de développement
|
LMC (mm)
|
Longueur des pattes postérieures (mm)
|
Poids (mg)
|
|
TRT
|
REP
|
MIN
|
MEDIANE
|
MAX
|
MOYENNE
|
ECART TYPE
|
MOYENNE
|
ECART TYPE
|
MOYENNE
|
ECART TYPE
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Note: les calculs effectués sont normalement associés avec les données entrées dans le tableau 2.
|
Tableau 4
Données de mortalité quotidienne
|
Jour
|
Date
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Somme répliquat
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Somme traitement
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Note: les calculs effectués sont normalement associés avec les données entrées dans le tableau 1.
|
Tableau 5
Critères de qualité de l'eau
Système d'exposition (flux continu/renouvellement statique):
Température:
Intensité lumineuse:
Cycle jour-nuit:
Nourriture:
Fréquence de l'alimentaiton:
pH de l'eau:
Concentration d'iode dans la solution d'essai:
Tableau 6
Résumé des données de chimie.
|
Nom de la substance chimique
|
|
# CAS:
|
|
Jour
|
Date
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Note: les calculs effectués sont normalement associés avec les données entrées dans le tableau 1.
|
Tableau 7
Tableau de rapport des critères essentiels utilisés en histopathologie
|
Date:
|
Substance chimique:
|
|
|
Pathologiste:
|
|
|
Hypertrophie de la glande thyroïde
|
Atrophie de la glande thyroïde
|
Hypertrophie des cellules folliculaires
|
Hyperplasie des cellules folliculaires
|
|
Hypertrophie de la glande thyroïde
|
Atrophie de la glande thyroïde
|
Hypertrophie des cellules folliculaires
|
Hyperplasie des cellules folliculaires
|
|
ID Animal témoin — répliquat 1
|
|
|
|
|
|
Dose Animal ID — répliquat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID Animal témoin — répliquat 2
|
|
|
|
|
|
Dose Animal ID — répliquat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
|
|
Total:
|
|
|
|
|
|
|
Hypertrophie de la glande thyroïde
|
Atrophie de la glande thyroïde
|
Hypertrophie des cellules folliculaires
|
Hyperplasie des cellules folliculaires
|
|
|
Hypertrophie de la glande thyroïde
|
Atrophie de la glande thyroïde
|
Hypertrophie des cellules folliculaires
|
Hyperplasie des cellules folliculaires
|
|
Dose Animal ID — répliquat 1
|
|
|
|
|
|
Dose Animal ID — répliquat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dose Animal ID — répliquat 2
|
|
|
|
|
|
Dose Animal ID — répliquat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
|
|
Total:
|
|
|
|
|
Tableau 8
Critères supplémentaires utilisés en histopathologie
|
Date:
|
Substance chimique:
|
|
|
Pathologiste:
|
|
|
|
|
|
|
|
|
Augmentation de la surface de la lumière folliculaire
|
Diminution de la surface de la lumière folliculaire
|
Augmentation de la surface de la lumière folliculaire
|
Diminution de la surface de la lumière folliculaire
|
|
Animal témoin ID — repliquat 1
|
|
|
|
Dose Animal ID — répliquat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Animal témoin ID — répliquat 2
|
|
|
|
Dose Animal ID — répliquat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
Total:
|
|
|
|
|
Augmentation de la surface de la lumière folliculaire
|
Diminution de la surface de la lumière folliculaire
|
|
|
Augmentation de la surface de la lumière folliculaire
|
Diminution de la surface de la lumière folliculaire
|
|
Dose Animal ID — répliquat 1
|
|
|
|
Dose Animal ID — répliquat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dose Animal ID — répliquat 2
|
|
|
|
Dose Animal ID — répliquat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
Total:
|
|
|
Tableau 9
Description narrative des observations histopathologiques
|
Date:
|
|
Substance chimique:
|
|
Pathologiste:
|
|
|
Description narrative
|
|
Animal témoin ID — répliquat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Animal témoin ID — répliquat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dose Animal ID — répliquat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dose Animal ID — répliquat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dose Animal ID — répliquat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dose Animal ID — répliquat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dose Animal ID — répliquat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dose Animal ID — répliquat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tableau 10
Tableau de rapport des données résumées pour le jour J (7 ou 21) de l'EMA
|
|
|
Témoin
|
Traitement 1
|
Traitement 2
|
Traitement 3
|
|
Observation
|
Répliquat
|
Moyenne
|
Ec. Type
|
CV
|
N
|
Moyenne
|
Ec. Type
|
CV
|
N
|
p-value
|
Moyenne
|
Ec. Type
|
CV
|
N
|
p-value
|
Moyenne
|
Ec. Type
|
CV
|
N
|
p-value
|
|
Longueur des pattes postérieures
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Moyenne:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
LMC
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Moyenne:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Poids humide
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Moyenne:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tableau 11
Tableau de rapport des données de stade de développement résumées pour le jour J (7 ou 21) de l'EMA.
|
|
|
Témoin
|
Traitement 1
|
Traitement 2
|
Traitement 3
|
|
|
Répliquat
|
Médiane
|
Min
|
Max
|
N
|
Médiane
|
Min
|
Max
|
N
|
p-value
|
Médiane
|
Min
|
Max
|
N
|
p-value
|
Médiane
|
Min
|
Max
|
Médiane
|
p-value
|
|
Stade de développement
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Moyenne:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Appendice 3
Autres méthodes d'analyse du poids et de la longueur dans le cas où un stade de développement avancé concerne plus de 20 % des têtards dans une ou plusieurs concentrations
Si un nombre plus important de têtards se caractérisent par un stade de développement dépassant 60 (≥ 20 %) dans une ou plusieurs concentrations nominales, il convient d'effectuer une ANOVA à deux facteurs intégrant une structure de variance sous-jacente pour évaluer les effets sur la croissance dus aux traitements chimiques sur l'ensemble des individus, tout en prenant en compte l'effet du stade de développement avancé sur la croissance.
Il s'agit là d'exploiter l'intégralité des données, mais de prendre en compte l'effet du stade de développement avancé. À cette fin, il est possible de recourir à une ANOVA à deux facteurs intégrant une structure de variance sous-jacente. Ainsi, le critère Stade avancé = OUI concerne tout animal présentant un stade de développement supérieur ou égal à 61. Dans le cas contraire, le critère est défini par Stade avancé = NON. L'ANOVA à deux facteurs concernant les interactions entre la concentration et le Stage avancé est ainsi rendue possible, avec rep(Conc) comme facteur aléatoire et Têtard(rep) comme effet aléatoire. Cette méthode traite toujours le répliquat comme unité d'analyse, et fournit essentiellement les mêmes résultats qu'une analyse des moyennes rep*Stade avancé, pondérée par le nombre d'animaux par moyenne. Si les données ne répondent pas à l'exigence de normalité et d'homogénéité de la variance posée par une ANOVA, une transformation par rang normalisée peut être effectuée pour résoudre le problème.
En plus du test F classique de l'ANOVA sur les effets des Conc, Stade avancé et leurs interactions, le test F d'interaction peut être scindé en deux tests F d'ANOVA, l'un d'entre eux traitant les réponses moyennes obtenues sur l'ensemble des concentrations avec le critère Stade avancé = NON, tandis que le second se fonde sur les réponses moyennes relevées pour toutes les concentrations correspondant à Stade avancé = OUI. De plus amples comparaisons entre les moyennes des divers traitements par rapport au témoin sont menées au sein de chaque groupe défini par le critère Stade avancé. Une analyse tendancielle peut être effectuée en employant les contrastes appropriés ou une simple comparaison par paires, si la fonction dose-réponse se révèle non monotone chez un des groupes caractérisés par le critère Stade avancé. Une correction des p-valeurs selon Bonferroni — Holm n'est requise que lorsque la partie du test F correspondante n'est pas significative. Ces opérations sont prises en charge par SAS, et probablement d'autres logiciels statistiques. Des complications peuvent survenir si certaines concentrations ne comptent aucun animal présentant un stade de développement avancé, cependant ces situations peuvent être résolues simplement.
Appendice 4
Définitions
Substance chimique
: une substance ou un mélange.
Substance chimique d'essai
: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
C.39. ESSAI DE REPRODUCTION DE COLLEMBOLES DANS LE SOL
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 232 (2009) de l'OCDE pour les essais de produits chimiques. La présente méthode d'essai est destinée à évaluer les effets des substances chimiques sur la reproduction des collemboles dans le sol. Elle est fondée sur les procédures existantes (1) (2). Folsomia candida, qui se reproduit par parthénogénèse, et Folsomia fimetaria, dont la reproduction est sexuée, sont deux des espèces de collemboles les plus répandues, qu'il est possible d'élever et qui sont disponibles dans le commerce. Lorsque des habitats spécifiques où ni l'une ni l'autre de ces espèces ne sont présentes sont évalués, la procédure peut également être étendue à d'autres espèces de collemboles dès lors qu'elles peuvent satisfaire aux critères de validité de l'essai.
|
|
2.
|
Les collemboles, qui peuplent les sols, sont des espèces écologiquement pertinentes pour les essais d'écotoxicité. Les collemboles sont des hexapodes possédant un exosquelette extrêmement perméable à l'air et à l'eau, et constituent des espèces d'arthropodes caractérisées par une autre voie et un autre taux d'exposition que les vers de terre et les enchytréides.
|
|
3.
|
Les densités des populations de collemboles atteignent communément 105 m– 2 dans le sol et la litière feuillue dans beaucoup d'écosystèmes terrestres (3) (4). Les adultes mesurent généralement de 0,5 à 5 mm et leur contribution à la biomasse animale totale présente dans le sol et à la respiration totale du sol se situe d'après les estimations dans une fourchette de 1 % à 5 % (5). Ils pourraient donc jouer principalement le rôle de régulateurs potentiels des processus écologiques en s'alimentant de microorganismes comme au travers de la prédation de la microfaune. Les collemboles sont les prédateurs d'un vaste éventail d'invertébrés endogés et épigés, tels que les acariens, les millepattes, les araignées, les coléoptères carabidés et les staphylins. Les collemboles contribuent aux processus de décomposition dans les sols acides où ils peuvent être, avec les enchytréides, les principaux invertébrés présents dans le sol, puisque les vers de terre et les diplopodes en sont généralement absents.
|
|
4.
|
F. fimetaria a une répartition mondiale et est commun dans plusieurs types de sols, depuis les sols sableux jusqu'aux sols limoneux et depuis les mulls jusqu'aux mors. C'est un collembole dépourvu d'yeux et de pigmentation. Il a été observé dans les sols agricoles de toute l'Europe (6). Il a un régime alimentaire omnivore composé de filaments de mycélium, de bactéries, de protozoaires et de détritus. Il interagit au travers du broutage avec les infections imputables aux champignons pathogènes des végétaux (7) et pourrait exercer une influence sur les mycorhizes, à l'instar de F. candida, dont on sait que tel est le cas. Comme la plupart des espèces de collemboles, il se reproduit sexuellement, aussi la présence permanente de mâles est-elle indispensable pour la fécondation des œufs.
|
|
5.
|
F. candida a également une répartition mondiale. Bien qu'il soit commun dans la plupart des sols naturels, on le rencontre souvent en de très nombreux endroits riches en humus. C'est un collembole dépourvu d'yeux et de pigmentation. Doté d'une furca (organe de saut) bien développée, il court vivement et s'empresse de bondir s'il est dérangé. Le rôle écologique de F. candida est similaire à celui de F. fimetaria, mais ses habitats sont constitués de sols organiques plus riches. Il se reproduit par parthénogénèse. La proportion de mâles peut être inférieure à 1 pour mille.
|
PRINCIPE DE L'ESSAI
|
6.
|
Des collemboles synchrones, adultes (F. fimetaria) ou juvéniles (F. candida), sont exposés à une gamme de concentrations de la substance chimique d'essai mélangée à un sol artificiel modifié (8) comportant une teneur en matières organiques de 5 % (ou à un sol de remplacement). On peut distinguer deux étapes dans la procédure d'essai:
|
—
|
un essai préliminaire de détermination des concentrations, si des informations sur la toxicité manquent, dans lequel la mortalité et la reproduction sont les principaux paramètres évalués après 2 semaines pour F. fimetaria et 3 semaines pour F. candida
|
|
—
|
l'essai de reproduction proprement dit dans lequel on évalue le nombre total de juvéniles produits par animal parent et la survie des animaux parents. La durée de l'essai proprement dit est de 3 semaines pour F. fimetaria ou de 4 semaines pour F. candida.
|
L'effet toxique de la substance chimique d'essai sur la mortalité et le taux de reproduction des adultes est mesuré par les valeurs CLx et CEx, les données étant ajustées à un modèle approprié au moyen d'une régression non linéaire en vue d'estimer la concentration qui entraînerait x % de mortalité ou de réduction du taux de reproduction, respectivement, ou encore par celle de la CSEO/CMEO (9).
|
INFORMATION SUR LA SUBSTANCE CHIMIQUE D'ESSAI
|
7.
|
Il est préférable de connaître les propriétés physiques, l'hydrosolubilité, le log Koe, le coefficient de partage entre l'eau et le sol et la pression de vapeur de la substance chimique d'essai. Des informations supplémentaires sur le devenir de la substance d'essai dans le sol, notamment sa vitesse de photolyse, d'hydrolyse et de dégradation biotique, seraient souhaitables. L'identification chimique de la substance d'essai selon la nomenclature de l'IUPAC, le numéro CAS, le lot de fabrication, le lot de conditionnement, la formule structurale et le degré de pureté devraient également être consignés si ces informations sont disponibles.
|
|
8.
|
La présente méthode d'essai convient à l'essai de substances chimiques hydrosolubles ou insolubles; néanmoins, le mode d'application de la substance d'essai variera en conséquence. Cette méthode d'essai n'est pas applicable aux substances volatiles, c'est-à-dire aux substances chimiques pour lesquelles la constante de Henry ou le coefficient de partage air/eau est supérieur à un, ou celles pour lesquelles la pression de vapeur dépasse 0,0133 Pa à 25 °C.
|
VALIDITÉ DE L'ESSAI
|
9.
|
Les témoins non traités devraient satisfaire aux critères suivants pour que le résultat de l'essai soit considéré comme valide:
|
—
|
la mortalité moyenne des adultes n'excède pas 20 % à la fin de l'essai;
|
|
—
|
le nombre moyen de juvéniles par récipient est au moins égal à 100 à la fin de l'essai;
|
|
—
|
le coefficient de variation calculé pour le nombre de juvéniles est inférieur à 30 % à la fin de l'essai proprement dit.
|
|
SUBSTANCE CHIMIQUE DE RÉFÉRENCE
|
10.
|
Une substance chimique de référence est testée à sa concentration efficace à 50 % (CE50) pour le type de sol d'essai choisi, soit à intervalles réguliers, soit dans tous les essais, afin de vérifier que la réponse des organismes d'essai dans le système expérimental demeure de niveau normal. L'acide borique, qui devrait réduire de 50 % la reproduction de l'une et l'autre espèces (10) (11) à environ 100 mg/kg de sol en poids sec, est une substance de référence appropriée.
|
DESCRIPTION DE L'ESSAI
Récipients expérimentaux et matériel
|
11.
|
Les récipients expérimentaux peuvent contenir 30 g de sol humide. Le matériau est constitué de verre ou de plastique inerte (non toxique). Cependant, l'utilisation de récipients en plastique est évitée si l'exposition à la substance chimique d'essai est diminuée du fait de la sorption. Les récipients expérimentaux ont une surface horizontale telle qu'ils puissent contenir des échantillons de sol d'une profondeur effective de 2 à 4 cm. Les récipients sont munis de couvercles (en verre ou en polyéthylène, par exemple) afin de réduire l'évaporation de l'eau, tout en autorisant les échanges gazeux entre le sol et l'atmosphère. Les récipients sont au moins partiellement transparents afin de permettre le passage de la lumière.
|
|
12.
|
Cet essai requiert du matériel de laboratoire courant, en particulier:
|
—
|
balances suffisamment précises;
|
|
—
|
instruments appropriés permettant de réguler la température;
|
|
—
|
instruments permettant de contrôler l'humidité de l'air (facultatifs si les récipients expérimentaux sont fermés par des couvercles);
|
|
—
|
incubateur ou petite chambre à température contrôlée;
|
|
—
|
pinces ou appareil d'aspiration de faible puissance.
|
|
Préparation du sol d'essai
|
13.
|
Un sol artificiel modifié (8) contenant 5 % de matière organique est utilisé pour l'essai. Un sol naturel peut également être utilisé, étant donné que le sol artificiel ne ressemble pas aux sols naturels. La composition recommandée du sol artificiel est la suivante (en poids secs, séchés à 105 °C jusqu'à obtention d'un poids constant):
|
—
|
5 % de tourbe à sphaigne, séchée à l'air et finement broyée (une dimension des particules de 2 +/– 1 mm est acceptable);
|
|
—
|
20 % d'argile kaolinique (taux de kaolinite de préférence supérieur à 30 %);
|
|
—
|
environ 74 % de sable industriel séché à l'air (selon la quantité de CaCO3 nécessaire), essentiellement du sable fin contenant plus de 50 % de particules mesurant entre 50 et 200 microns. La quantité exacte de sable dépend de la quantité de CaCO3 (voir ci-dessous), la part conjointe de ces deux éléments devant atteindre 75 %;
|
|
—
|
1,0 % de carbonate de calcium (CaCO3, pulvérisé, qualité analytique) afin d'obtenir un pH de 6,0 ± 0,5; la quantité de carbonate de calcium à ajouter dépend principalement de la qualité et de la nature de la tourbe (voir note 1).
|
Note 1: La quantité de CaCO3 requise dépend des composants du substrat de sol et est déterminée par mesure du pH des sous-échantillons de sol humide préincubé immédiatement avant l'essai.
Note 2: Il est recommandé de mesurer le pH et de manière facultative le rapport C/N, la capacité d'échange de cations (CEC) et la teneur en matières organiques du sol en vue de permettre une normalisation ultérieure et une meilleure interprétation des résultats.
Note 3: Si besoin est, par exemple à des fins d'essai spécifiques, des sols naturels provenant de sites non pollués peuvent également servir de substrat d'essai et/ou de culture. Toutefois, lorsque l'on utilise un sol naturel, il faut le caractériser au moins par son origine (site de récolte), son pH, sa texture (distribution de tailles de particules) sa CEC et sa teneur en matières organiques, et il doit être exempt de toute contamination. Pour ce qui est des sols naturels, il convient de démontrer qu'ils sont adaptés à la réalisation d'un essai et qu'ils permettent de répondre aux critères de validité de l'essai.
|
|
14.
|
Les constituants secs du sol sont soigneusement mélangés (par exemple, dans un grand mélangeur de laboratoire). La capacité de rétention d'eau (CRE) maximale du sol artificiel est déterminée conformément aux protocoles décrits dans l'Appendice 5. La teneur en humidité du sol d'essai est optimisée de sorte à lui donner une structure meuble et poreuse qui permette aux collemboles de pénétrer dans les pores. Tel est généralement le cas entre 40 et 60 % de la capacité maximale de rétention d'eau.
|
|
15.
|
Le sol artificiel sec est préhumidifié par l'ajout d'une quantité suffisante d'eau désionisée pour atteindre environ la moitié de sa teneur en eau finale 2 à 7 jours avant le début de l'essai, pour que l'acidité s'équilibre/se stabilise. Le pH est déterminé avec un mélange de sol et d'une solution de chlorure de potassium (KCl) 1 M ou de chlorure de calcium (CaCb) 0,01 M dans un rapport 1/5 (voir Appendice 6). Si l'acidité du sol est supérieure à la limite requise, elle peut être ajustée par addition d'une quantité appropriée de CaCO3. Si le sol est trop alcalin, il peut être rééquilibré par l'ajout d'un acide inorganique sans danger pour les collemboles.
|
|
16.
|
Le sol préhumidifié est divisé en autant de portions que de concentrations expérimentales, de témoins et de substances chimiques de référence utilisés dans l'essai. Les substances chimiques d'essai sont ajoutées et la teneur en eau est régulée comme indiqué au paragraphe 24.
|
Sélection et préparation des animaux d'essai
|
17.
|
F. candida, qui est parthénogénétique, est l'espèce recommandée parce que dans l'essai circulaire de la méthode d'essai (11), le critère de validité relatif à la survie a été rempli plus souvent avec cette espèce qu'avec F. fimetaria. Si une espèce alternative est utilisée, il faut qu'elle remplisse les critères de validité mentionnés au paragraphe 9. Au début de l'essai les animaux sont bien nourris et âgés de 23 à 26 jours dans le cas de F. fimetaria et de 9 à 12 jours dans celui de F. candida. Pour chaque expérience identique, le nombre de F. fimetaria est de 10 mâles et 10 femelles, et pour ce qui est de F. candida 10 femelles sont utilisées (voir Appendices 2 et 3). Pour chacun des lots ajoutés à une expérience identique, les animaux synchrones sont tirés au hasard des récipients et leur état de santé et leur condition physique sont contrôlés. Chaque groupe de 10/20 individus est ajouté à un récipient d'essai choisi au hasard et de grosses femelles de F. fimetaria sont sélectionnées de sorte qu'elles puissent être aisément distinguées des F. fimetaria mâles.
|
Préparation des concentrations expérimentales
|
18.
|
Quatre méthodes d'application de la substance chimique d'essai peuvent être utilisées: 1) mélanger la substance d'essai au sol en utilisant de l'eau en guise de support, 2) mélanger la substance d'essai au sol en utilisant un solvant organique en guise de support, 3) mélanger la substance d'essai au sol en utilisant du sable en guise de support, ou 4) appliquer la substance d'essai à la surface du sol. Le choix de la méthode appropriée dépend des caractéristiques de la substance d'essai et de la finalité de l'essai. On recommande, en général, de mélanger la substance chimique d'essai au sol. Des modes d'application conformes à l'utilisation concrète de la substance d'essai pourraient cependant s'imposer (par exemple, la pulvérisation de préparations liquides ou l'utilisation de présentations spéciales de pesticides telles que les granulés ou les produits de traitement des semences). Le sol est traité avant l'ajout des collemboles, qu'il convient de laisser s'enfoncer dans le sol, sauf si la substance d'essai est appliquée à la surface de celui-ci.
|
Substance chimique d'essai hydrosoluble
|
19.
|
Une solution de la substance chimique d'essai dans de l'eau désionisée est préparée en une quantité suffisante pour toutes les expériences identiques d'une concentration expérimentale. Chaque solution de la substance d'essai est soigneusement mélangée à un lot du sol préhumidifié, avant d'être introduite dans le récipient expérimental.
|
Substance chimique d'essai insoluble dans l'eau
|
20.
|
Les substances chimiques non solubles dans l'eau mais solubles dans des solvants organiques peuvent être dissoutes dans le plus petit volume possible d'un solvant approprié (par exemple de l'acétone) permettant néanmoins un bon mélange de la substance chimique dans le sol ainsi que son mélange avec une partie du sable quartzique requis. Seuls des solvants volatils peuvent être utilisés. Lorsqu'un solvant organique est utilisé, toutes les concentrations expérimentales et un témoin négatif de solvant supplémentaire contiennent la même quantité minimale de solvant. Les récipients où est effectuée l'application sont laissés sans couvercle pendant un certain temps afin de permettre au solvant associé à l'application de la substance d'essai de s'évaporer, en veillant à ce qu'aucune dissipation de la substance toxique ne se produise pendant ce temps.
|
Substance chimique d'essai peu soluble dans l'eau et les solvants organiques
|
21.
|
Pour les substances chimiques peu solubles dans l'eau et les solvants organiques, on mélange du sable quartzique, qui doit faire partie du volume total de sable ajouté au sol, à la quantité de substance d'essai nécessaire pour obtenir la concentration expérimentale voulue. Ce mélange de sable quartzique et de la substance d'essai est ajouté au sol préhumidifié, auquel il est soigneusement mélangé après l'ajout de la quantité d'eau désionisée nécessaire pour atteindre l'humidité requise. Le mélange final est réparti entre les récipients expérimentaux. On répète la procédure pour chaque concentration expérimentale et on prépare un témoin approprié.
|
Application de la substance chimique d'essai à la surface du sol
|
22.
|
Si la substance d'essai est un pesticide, il peut être pertinent de l'appliquer à la surface du sol par pulvérisation. Le sol est traité après l'ajout des collemboles. Les récipients expérimentaux sont d'abord remplis avec le substrat de sol humidifié, puis les animaux sont ajoutés et les récipients expérimentaux sont ensuite pesés. Afin d'éviter toute exposition directe des animaux par contact direct avec la substance d'essai, celle-ci est appliquée au moins une demi-heure après l'introduction des collemboles. La substance chimique d'essai devrait être répartie à la surface du sol de façon aussi régulière que possible, à l'aide d'un épandeur de laboratoire apte à simuler la pulvérisation sur un champ. L'application devrait avoir lieu à une température de ± 2 °C et, s'agissant de solutions aqueuses, d'émulsions ou de dispersions à une densité conforme aux recommandations d'évaluation des risques. Il convient de vérifier le taux à l'aide d'une technique d'étalonnage appropriée. L'application des présentations spéciales, telles que les granulés ou les produits de traitement des semences, pourrait reproduire leur mode d'emploi en agriculture. La nourriture est ajoutée après la pulvérisation.
|
MODE OPÉRATOIRE
Conditions expérimentales
|
23.
|
L'essai est conduit à une température moyenne de 20 ± 1 °C, dans une fourchette de températures de 20 ± 2 °C. L'essai est mené sous des cycles réglés de lumière et d'obscurité (de préférence 12 heures de lumière et 12 heures d'obscurité), avec un éclairement de 400 à 800 lux dans la zone des récipients expérimentaux.
|
|
24.
|
Pour vérifier l'humidité du sol, on pèse les récipients au début, au milieu et à la fin de l'essai. Toute perte de poids > 2 % est compensée par l'ajout d'eau désionisée. Remarquons que la perte d'eau peut être réduite par le maintien d'un taux d'humidité de l'air élevé (> 80 %) dans l'incubateur.
|
|
25.
|
Le pH est mesuré au début et à la fin de l'essai préliminaire de détermination des concentrations et de l'essai proprement dit. Des mesures devraient être effectuées sur un échantillon supplémentaire témoin et un échantillon supplémentaire de sol traité (à toutes les concentrations), préparés et entretenus de la même manière que les cultures expérimentales, mais sans ajout des collemboles.
|
Procédure d'essai et mesures
|
26.
|
Pour chaque concentration expérimentale, une quantité de sol d'essai correspondant à 30 g de poids frais est placée à l'intérieur du récipient expérimental. On prépare également des témoins d'eau sans substance d'essai. Si la substance d'essai est appliquée à l'aide d'un véhicule, une série de témoins contenant uniquement le véhicule devrait être mis à l'essai parallèlement à la série traitée avec la substance d'essai. La concentration du solvant ou du dispersant devrait être identique à celle utilisée dans les récipients expérimentaux contenant la substance d'essai.
|
|
27.
|
Les collemboles sont transférés avec soin dans les différents récipients expérimentaux (entre lesquels ils sont répartis aléatoirement) et placés à la surface du sol. Pour assurer un transfert efficace des animaux, un appareil d'aspiration de faible puissance peut être utilisé. Le nombre d'expériences identiques pour les concentrations expérimentales et les témoins dépend de la conception de l'essai. Les récipients expérimentaux sont placés au hasard dans l'incubateur et leurs emplacements sont modifiés au hasard chaque semaine.
|
|
28.
|
Pour l'essai avec F. fimetaria, 20 adultes, 10 mâles et 10 femelles, âgés de 23 à 26 jours sont utilisés par récipient expérimental. Au 21ème jour, les collemboles sont extraits du sol et comptés. Dans le cas de F. fimetaria, le sexe des animaux synchronisés composant le lot utilisé pour l'essai est déterminé en fonction de leur taille. Les femelles sont en effet nettement plus grosses que les mâles (Voir Appendice 3).
|
|
29.
|
Pour l'essai avec F. candida, 10 juvéniles de 9 à 12 jours par récipient expérimental sont utilisés. Au 28ème jour, les collemboles sont extraits du sol et comptés.
|
|
30.
|
Une source de nourriture appropriée constituée d'une quantité suffisante, de 2 à 10 mg par exemple, de levure de boulanger sèche en granulés, disponible dans le commerce pour un usage ménager, est ajoutée à chaque récipient au début de l'essai puis après 2 semaines environ.
|
|
31.
|
À la fin de l'essai, la mortalité et la reproduction sont évaluées. Après 3 semaines (F. fimetaria) ou 4 semaines (F. candida), les collemboles sont extraits du sol d'essai (voir Appendice 4) et comptés (12). Un collembole est consigné comme mort s'il n'est pas présent lors de l'extraction. La méthode d'extraction et de comptage est validée. Sa validité implique une efficacité d'extraction des juvéniles supérieures à 95 %, et peut par exemple être vérifiée par l'ajout d'un nombre connu d'individus au sol.
|
|
32.
|
Le déroulement concret de la procédure d'essai et son calendrier sont décrits dans l'Appendice 2.
|
Plan de l'essai
Essai préliminaire de détermination des concentrations
|
33.
|
Si nécessaire, un essai préliminaire de détermination des concentrations est mené avec, par exemple, cinq concentrations expérimentales: 0,1, 1,0, 10, 100 et 1 000 mg/kg de masse sèche de sol. Deux expériences identiques par concentration et par témoin sont par ailleurs effectuées. Des informations supplémentaires, provenant d'essais avec des substances chimiques similaires ou tirées d'études déjà publiées, sur la mortalité ou la reproduction des collemboles peuvent également être utiles pour décider de la gamme de concentrations à utiliser dans l'essai préliminaire de détermination des concentrations.
|
|
34.
|
La durée de l'essai préliminaire de détermination des concentrations est de deux semaines pour F. fimetaria et de 3 semaines pour F. candida afin de garantir que des juvéniles auront été produits. À la fin de l'essai, la mortalité et la reproduction des collemboles sont évaluées. Le nombre d'adultes et celui de juvéniles sont consignés.
|
Essai proprement dit
|
35.
|
Pour déterminer la CEx (par exemple CE10, CE50), il faut tester douze concentrations. Au minimum deux expériences identiques par concentration d'essai plus six témoins identiques sont recommandés. Le facteur d'espacement peut varier en fonction de la relation dose-réponse.
|
|
36.
|
Pour déterminer la CSEO/CMEO, il faut tester au moins cinq concentrations formant une série géométrique. Quatre expériences identiques par concentration d'essai plus huit témoins sont recommandées. Les concentrations sont espacées d'un facteur d'au plus 1,8.
|
|
37.
|
Une démarche combinée permet de déterminer à la fois la CSEO/CMEO et la CEx. On utilise à cet effet huit concentrations formant une série géométrique. Quatre expériences identiques par concentration d'essai plus huit témoins sont recommandées. Les concentrations sont espacées d'un facteur d'au plus 1,8.
|
|
38.
|
Si aucun effet n'est observé à la plus forte concentration lors de l'essai préliminaire de détermination des concentrations (1 000 mg/kg), l'essai de reproduction peut devoir être conduit comme un essai limite, avec une concentration expérimentale de 1 000 mg/kg plus le témoin. Un essai limite permettra de démontrer l'absence d'effet statistiquement significatif à la concentration limite. Il faut alors utiliser huit expériences identiques pour le sol traité et pour le témoin.
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
39.
|
Le taux de reproduction est le principal paramètre à évaluer (par exemple le nombre de juvéniles produits par récipient expérimental). L'analyse statistique, à l'aide par exemple des procédures d'analyse de la variance (ANOVA), compare les différentes concentrations au moyen du test t de Student, du test de Dunnett, ou du test de Williams. Les intervalles de confiance à 95 % sont calculés pour les moyennes établies aux différentes concentrations.
|
|
40.
|
Le nombre d'adultes survivants dans les témoins non traités est un critère de validité essentiel qui est détaillé. Comme dans l'essai préliminaire de détermination des concentrations, tous les autres signes de nocivité sont également consignés dans le rapport final.
|
CLx et CEx
|
41.
|
On calcule les valeurs de CEx et leurs limites de confiance à 95 % supérieures et inférieures correspondant au paramètre, en utilisant des méthodes statistiques adéquates (fonction logistique ou de Weibull, méthode abrégée de Spearman-Karber, ou interpolation simple, par exemple). Une CEx est obtenue en intégrant une valeur correspondant à x % de la moyenne du témoin dans l'équation retenue. Pour calculer la CE50 ou toute autre CEx, la série de données complète est soumise à une analyse de régression. La CL50 est généralement estimée par analyse des probits ou par des méthodes d'analyse similaires prenant en compte les données sur la mortalité, qui suivent une distribution binomiale.
|
CSEO/CMEO
|
42.
|
Lorsqu'une analyse statistique est appliquée pour déterminer la CSEO ou la CMEO, il faut disposer de statistiques par récipient (chaque récipient individuel étant considéré comme une expérience distincte). Il convient alors d'utiliser des méthodes statistiques adéquates conformément au Document 54 de l'OCDE intitulé Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application (9). En général, les effets indésirables de la substance chimique d'essai par rapport au témoin sont étudiés en procédant à une vérification de l'hypothèse unilatérale (plus faible) pour p ≤ 0,05.
|
|
43.
|
La distribution normale et l'homogénéité de la variance peuvent être vérifiées à l'aide d'un test statistique approprié, tel que le test de Shapiro-Wilk et le test de Levene, respectivement (p ≤ 0,05). Une analyse de la variance à un facteur (ANOVA), puis des tests multi-comparaisons peuvent être effectués. Des tests de comparaisons multiples (test de Dunnett, par exemple) ou des tests d'analyse de tendance descendante (tel que le test de William) peuvent permettre de calculer d'éventuelles différences significatives (p≤ 0,05) entre les témoins et les diverses concentrations de substance chimique d'essai [on choisira le test recommandé conformément au Document 54 de l'OCDE (9)]. On peut toutefois utiliser des méthodes non paramétriques (tels que le test U de Bonferroni conformément à Holm ou le test de tendance de Jonckheere-Terpstra) pour déterminer la CSEO et la CMEO.
|
Essai limite
|
44.
|
Si un essai limite a été mis en œuvre (comparaison du témoin et d'un seul traitement) et que les conditions requises pour les procédures de tests paramétriques (normalité, homogénéité) sont remplies, on peut évaluer les réponses métriques par le test de Student (test t). Le test t de variance inégale (test t de Welch) ou bien un test non paramétrique tel que le test U de Mann-Whitney peuvent être employés lorsque ces conditions ne sont pas satisfaites.
|
|
45.
|
Si l'on cherche à déterminer des différences significatives entre les témoins (témoin et témoin de solvant), les répliques de chaque témoin peuvent être testées comme décrit pour l'essai limite. Lorsque les essais ne détectent aucune différence significative, il est possible de rassembler toutes les expériences identiques témoins et témoins de solvant. Dans le cas contraire, il faut comparer tous les traitements avec le témoin de solvant.
|
Rapport d'essai
|
46.
|
Le rapport d'essai comprend au moins les informations suivantes:
|
|
Substance chimique d'essai
|
—
|
identité de la substance d'essai, lot de fabrication, lot de conditionnement et numéros CAS, degré de pureté;
|
|
—
|
propriétés physico-chimiques de la substance d'essai (par exemple log Koe, hydrosolubilité, pression de vapeur, constante de Henry (H) et, de préférence, information sur le devenir de la substance d'essai dans le sol) si elles sont connues;
|
|
—
|
formulation de la substance d'essai et nature des additifs si ce n'est pas le produit chimique pur qui est testé;
|
|
|
|
Organisme d'essai
|
—
|
identification des espèces et fournisseur des organismes d'essai, description des conditions d'élevage et fourchettes d'âges des organismes d'essai;
|
|
|
|
Conditions expérimentales
|
—
|
description du plan de l'étude et du mode opératoire;
|
|
—
|
détails sur la préparation du sol d'essai; description détaillée lorsque l'on utilise un sol naturel (origine, histoire, distribution de tailles de particules, pH, teneur en matières organiques);
|
|
—
|
capacité de rétention d'eau du sol;
|
|
—
|
description de la méthode d'application de la substance chimique d'essai dans le sol;
|
|
—
|
conditions expérimentales intensité lumineuse, durée des cycles de lumière et d'obscurité, température;
|
|
—
|
description du régime d'administration de la nourriture, nature et quantité de nourriture fournie au cours de l'essai, dates d'alimentation;
|
|
—
|
pH et teneur en eau du sol au début et à la fin de l'essai (pour le témoin et chacune des concentrations);
|
|
—
|
description détaillée de la méthode d'extraction et de l'efficacité d'extraction;
|
|
|
|
Résultats de l'essai
|
—
|
nombre de juvéniles déterminés dans chaque récipient expérimental à la fin de l'essai;
|
|
—
|
nombre et mortalité des adultes (%) dans chaque récipient expérimental à la fin de l'essai;
|
|
—
|
description des effets physiologiques évidents ou des symptômes pathologiques ou des changements nets de comportement;
|
|
—
|
résultats obtenus avec la substance chimique d'essai de référence;
|
|
—
|
valeurs de la CSEO/CMEO, des CLx pour la mortalité et des CEx pour la reproduction (principalement les CL50, CL10, CE50 et CE10) et intervalles de confiance à 95 % Graphique du modèle ajusté utilisé pour effectuer le calcul, équation de la fonction correspondante, ainsi que ses paramètres (9);
|
|
—
|
toutes les informations et observations utiles à l'interprétation des résultats;
|
|
—
|
puissance du test effectivement réalisé s'il est procédé à une vérification de l'hypothèse formulée (9);
|
|
—
|
écarts par rapport aux procédures décrites dans la présente méthode d'essai et faits inhabituels survenus au cours de l'essai;
|
|
—
|
en cas d'estimation de la CSEO, différence minimale détectable.
|
|
|
BIBLIOGRAPHIE
|
(1)
|
Wiles JA and Krogh PH (1998) Testing with the collembolans I. viridis, F. candida and F. fimetaria. In Handbook of soil invertebrate toxicity tests (dir. de pub. H Løkke et CAM Van Gestel), pp. 131-156. John Wiley & Sons, Ltd., Chichester.
|
|
(2)
|
ISO (1999) Soil Quality — Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. No 11267. Organisation internationale de normalisation, Genève.
|
|
(3)
|
Burges A et Raw F (Eds) (1967) Soil Biology. Academic Press. Londres.
|
|
(4)
|
Petersen H et Luxton M (1982) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287-388.
|
|
(5)
|
Petersen H (1994) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111-118.
|
|
(6)
|
Hopkin SP (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330pp (ISBN 0-19-854084-1)
|
|
(7)
|
Ulber B (1983) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In New trends in soil Biology (Lebrun Ph, André HM, De Medts A, Grégoire-Wibo, Wauthy G (dir. de pub.), Actes du VIème colloque international sur la zoologie du sol, Louvain-la-neuve (Belgique), 30 août — 2 septembre 1982, I Dieu-Brichart, Ottignies-Louvain-la-Neuve, pp. 261-268.
|
|
(8)
|
Chapitre C.36 de la présente annexe, Essai de reproduction d'un acarien prédateur [Hypoaspis (Geolaelaps) aculeifer] dans le sol
|
|
(9)
|
OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. A guidance to application, Série de l'OCDE sur les essais et évaluations, Numéro 54, ENV/JM/MONO(2006) 18, OCDE, Paris
|
|
(10)
|
Scott-Fordsmand JJ et Krogh PH (2005) Background report on prevalidation of an OECD springtail test guideline. Environmental Project Nr. 986. Miljøstyrelsen 61 pp. Ministère danois de l'environnement.
|
|
(11)
|
Krogh, P.H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Agence danoise pour la protection de l'environnement, Environmental Project No. 1256, pp. 66.
|
|
(12)
|
Krogh PH, Johansen K and Holmstrup M (1998) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201-205.
|
|
(13)
|
Fjellberg A (1980) Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
(14)
|
Edwards C.A. (1955) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan D.K. McE., Ed). Butterworths, Londres, pp. 412416.
|
|
(15)
|
Goto HE (1960) Simple techniques for the rearing of Collembola and a note on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96:138-140.
|
Appendice 1
Définitions
Les définitions suivantes s'appliquent aux fins de la présente méthode d'essai (dans cet essai, toutes les concentrations efficaces sont exprimées en masse de la substance chimique d'essai rapportée à la masse sèche du sol d'essai):
Substance chimique
: une substance ou un mélange
CSEO (concentration sans effet observé)
: la concentration de la substance chimique d'essai à laquelle aucun effet n'est observé. Dans cet essai, la concentration correspondant à la CSEO n'a pas d'effet statistiquement significatif (p < 0,05) durant une période d'exposition donnée, en comparaison avec le témoin.
CMEO (concentration minimale avec effet observé)
: la plus faible concentration de la substance chimique d'essai qui exerce un effet statistiquement significatif (p < 0,05) durant une période d'exposition donnée, en comparaison avec le témoin.
CEx (concentration efficace à x %)
: concentration qui engendre un effet de x % sur les organismes d'expérience durant une période d'exposition déterminée, en comparaison avec un témoin. Par exemple, une CE50 est une concentration estimée produire un effet sur un paramètre évalué de l'essai dans 50 % d'une population exposée durant une période d'exposition déterminée.
Substance chimique d'essai
: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
Appendice 2
Principales actions et calendrier de réalisation d'un essai sur les collemboles
Les étapes de l'essai peuvent se résumer comme suit:
|
Date (jour)
|
Action
|
|
– 23 à – 26.
|
Préparation d'une culture synchrone de F. fimetaria
|
|
– 14
|
Préparer le sol artificiel (mélanger les ingrédients secs)
Vérifier le pH du sol artificiel et l'ajuster en conséquence
Mesurer la capacité de rétention d'eau maximale du sol
|
|
– 9 à – 12.
|
Préparation d'une culture synchrone de F. candida
|
|
– 2 à – 7
|
Sol préhumidifié
|
|
– 1
|
Répartir les juvéniles en lots
Préparer les solutions mères et appliquer la substance chimique d'essai si un solvant est requis
|
|
0
|
Préparer les solutions mères et appliquer la substance chimique d'essai si l'application d'une substance chimique solide ou hydrosoluble est requise, ou qu'elle est effectuée en surface.
Mesurer le pH du sol et peser les récipients.
Ajouter la nourriture. Introduire les collemboles.
|
|
14
|
Essai préliminaire de détermination des concentrations pour F. fimetaria: mettre un terme à l'essai, extraire les animaux, mesurer le pH du sol et la perte d'eau (poids)
Essais proprement dits: mesurer la teneur en humidité et compenser les pertes d'eau, et ajouter de 2 à 10 mg de levure
|
|
21
|
Essai proprement dit pour F. fimetaria: mettre un terme à l'essai, extraire les animaux, mesurer le pH du sol et la perte d'eau (poids)
Essai préliminaire de détermination des concentrations pour F. candida: mettre un terme à l'essai, extraire les animaux, mesurer le pH du sol et la perte d'eau (poids)
|
|
28
|
Essai proprement dit pour F. candida: mettre un terme à l'essai, extraire les animaux, mesurer le pH du sol et la perte d'eau (poids)
|
Appendice 3
Recommandations en matière d'élevage et de synchronisation de F. fimetaria et F. candida
Les indications de dates et de durées données dans les présentes recommandations sont vérifiées pour chaque variété particulière de collemboles afin de s'assurer que le calendrier prévu permettra de disposer d'une quantité suffisante de juvéniles synchronisés. Pour l'essentiel, ce sont la survenue de la ponte après le transfert des adultes à un substrat frais et l'éclosion des œufs qui déterminent le jour approprié pour la collecte des œufs et pour celle des juvéniles synchrones.
Il convient de disposer en permanence d'une culture mère composée par exemple de 50 récipients/boîtes de Petri. Cette culture mère devrait être maintenue dans de bonnes conditions d'alimentation en lui fournissant de la nourriture et de l'eau toutes les semaines, et en en retirant la nourriture ancienne et les cadavres. Si le nombre de collemboles présents sur le substrat est trop faible, il peut s'ensuivre une inhibition en raison d'une plus grande formation de moisissures. Si la culture mère est utilisée trop souvent pour la production d'œufs, elle risque de s'épuiser. Les signes d'épuisement prennent la forme de la présence d'adultes morts et de moisissures sur le substrat. Les œufs restant après la production d'animaux synchrones peuvent être utilisés pour rajeunir la culture.
Dans une culture synchrone de F. fimetaria, les mâles se distinguent principalement des femelles par la taille. Les mâles sont en effet nettement plus petits que les femelles, et ils se caractérisent par une plus grande vitesse de déplacement qu'elles. La bonne détermination des sexes n'exige guère d'expérience et elle peut être confirmée par inspection de la zone génitale au microscope (13).
1. Élevage
1.a. Préparation du substrat de culture
Le substrat de culture est constitué de plâtre de Paris (sulfate de calcium) et de charbon de bois actif. On obtient ainsi un substrat humide, la fonction du charbon étant d'absorber les effluents gazeux et les excrétions (14) (15). Différentes formes de charbon peuvent être utilisées pour faciliter l'observation des collemboles. Du charbon de bois en poudre est ainsi utilisé pour F. candida et F. fimetaria (donnant une coloration gris-noir au plâtre de Paris):
Composition du substrat:
|
—
|
20 ml de charbon de bois actif
|
|
—
|
200 ml de plâtre de Paris
|
ou
|
—
|
50 g de charbon de bois actif réduit en poudre
|
|
—
|
260-300 ml d'eau distillée
|
|
—
|
400 g de plâtre de Paris.
|
On laisse reposer le mélange du substrat avant son utilisation.
1.b. Reproduction
Les collemboles sont maintenus dans des récipients tels que des boîtes de Petri (90 mm × 13 mm), dont le fond est couvert d'une couche de 0,5 cm de substrat formé de plâtre et de charbon de bois. Ils sont cultivés à une température de 20 ± 1 °C et sous des cycles de 12 heures de lumière et de 12 heures d'obscurité (avec un éclairement de 400 à 800 lux). Les récipients sont maintenus humides en permanence de sorte que l'humidité relative de l'air y atteigne 100 %. Cela peut être obtenu en assurant la présence d'eau libre dans le plâtre poreux mais en évitant qu'une pellicule d'eau se forme à la surface du plâtre. La perte d'eau peut être évitée en maintenant l'humidité de l'air ambiant. Tous les individus morts devraient être retirés des récipients, de même que toute nourriture moisie. Pour stimuler la production d'œufs, les animaux adultes sont transférés dans des boîtes de Petri contenant un substrat de plâtre de Paris et de charbon de bois fraîchement préparé.
1.c. Source de nourriture
Pour F. candida comme pour F. fimetaria, la seule source de nourriture utilisée est constituée de levure de boulanger sèche en granulés. De la nourriture fraîche leur est fournie une ou deux fois par semaine, afin d'éviter la moisissure. Elle est directement placée en un petit tas sur le plâtre de Paris. La quantité de levure de boulanger ajoutée devrait être ajustée à la taille de la population de collemboles, mais un apport de 2 à 15 mg sera généralement suffisant.
2. Synchronisation
L'essai est mené avec des animaux synchronisés afin de disposer d'animaux d'essai homogènes, au même stade de développement et de même taille. Qui plus est, la synchronisation permet de distinguer les F. fimetaria mâles des femelles à partir de l'âge de 3 semaines sur la base de leur dimorphisme sexuel, c'est-à-dire de leurs différences de tailles. La procédure ci-dessous constitue une suggestion quant à la manière d'obtenir des animaux synchronisés (les étapes concrètes sont facultatives).
2.a. Synchronisation.
|
—
|
Préparer des récipients contenant une couche de 0,5 cm de substrat constitué de plâtre de Paris et de charbon de bois.
|
|
—
|
Pour la ponte, transférer dans les récipients de 150 à 200 F. fimetaria adultes et de 50 à 100 F. candida tirés des 15 à 20 meilleurs récipients de la culture mère avec un substrat vieux de 4 à 8 semaines et les nourrir avec 15 mg de levure de boulanger. Éviter de mêler des juvéniles aux adultes car la présence de juvéniles risquerait d'inhiber la production d'œufs.
|
|
—
|
Maintenir la culture à 20 ± 1 °C (la moyenne devrait être de 20 °C) et sous des cycles de 12 heures de lumière et de 12 heures d'obscurité (avec un éclairement de 400 à 800 lux). Veiller à ce que de la nourriture fraîche soit disponible et à ce que l'air soit saturé d'eau. Le manque de nourriture peut amener les animaux à déféquer sur les œufs, aboutissant à la formation de moisissures sur ceux-ci, ou encore F. candida pourrait cannibaliser ses propres œufs. Après 10 jours les œufs sont soigneusement collectés avec une épingle et une spatule et déposés sur du “papier à œufs” (petits morceaux de papier filtre plongés dans une barbotine de plâtre de Paris et de charbon de bois) qui est placé dans un récipient contenant un substrat frais constitué de plâtre et de charbon de bois. Quelques grains de levure sont ajoutés au substrat pour attirer les juvéniles et leur faire quitter ledit papier. Il importe que ce papier tout comme le substrat soient humides, car sinon les œufs souffriront de déshydratation. Une autre solution consiste à retirer les animaux adultes des boîtes de culture synchronisée après qu'ils ont produit des œufs pendant 2 ou 3 jours.
|
|
—
|
Après trois jours, la plupart des œufs déposés sur le papier auront éclos, et quelques juvéniles pourront être trouvés sous celui-ci.
|
|
—
|
Pour obtenir des juvéniles d'âge homogène, le papier et les œufs non éclos présents sur celui- ci sont retirés de la boîte de Petri à l'aide de pinces. Désormais âgés de 0 à 3 jours, les juvéniles demeurent dans le récipient et sont nourris avec de la levure de boulanger. Les œufs non éclos sont jetés.
|
|
—
|
Les œufs et les juvéniles éclos sont cultivés de la même manière que les adultes. Pour F. fimetaria en particulier, il conviendrait de prendre les dispositions suivantes: fournir suffisamment de nourriture fraîche et retirer la vieille nourriture qui commence à moisir, puis après 1 semaine répartir les juvéniles dans de nouvelles boîtes de Petri sous réserve que leur densité demeure supérieure à 200.
|
2.b. Gestion des collemboles au début de l'essai
|
—
|
Les F. candida âgés de 9 à 12 jours ou les F. fimetaria âgés de 23 à 26 jours sont collectés, par exemple par aspiration, puis relâchés dans un petit récipient contenant un substrat humide constitué de plâtre et de charbon de bois, leur condition physique étant contrôlée sous le stéréomicroscope (les animaux blessés ou ayant subi des dommages sont éliminés). Il convient de suivre les différentes étapes en maintenant les collemboles dans une atmosphère humide afin d'éviter tout stress dû à la sécheresse, en utilisant par exemple des surfaces humidifiées, etc.
|
|
—
|
Retourner le récipient et en tapoter le fond afin de transférer les collemboles sur le sol. Il convient de neutraliser l'électricité statique, au risque que les animaux se retrouvent sinon tout simplement en suspension dans l'air, ou adhèrent aux parois du récipient expérimental et s'y dessèchent. Un ioniseur ou un morceau de tissu humide placé sous le récipient peuvent être utilisés à cet effet.
|
|
—
|
La nourriture devrait être répartie sur toute la surface du sol et non disposée en un seul bloc.
|
|
—
|
Lors du transport et durant la période d'essai, il convient d'éviter de heurter ou de déranger physiquement de quelque autre manière les récipients d'essai, car cela risque d'accroître le tassement du sol et de compromettre l'interaction entre les collemboles.
|
3. Autres espèces de collemboles
D'autres espèces de collemboles peuvent être choisies pour procéder à des essais conformes à la présente méthode d'essai, comme par exemple Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi, ou encore Mesaphorura macrochaeta. Un certain nombre de conditions préalables sont toutefois réunies avant d'utiliser ces autres espèces:
|
—
|
Elles sont clairement identifiées;
|
|
—
|
Les raisons du choix de l'espèce retenue sont fournies;
|
|
—
|
Il faut veiller à ce que la biologie de la reproduction soit incluse dans la phase d'essai, de sorte qu'elle sera potentiellement ciblée durant l'exposition;
|
|
—
|
Leur cycle de vie est connu: âge de maturation, durée de développement des œufs, et stades de développement susceptibles d'être soumis à l'exposition;
|
|
—
|
Le substrat d'essai et la quantité de nourriture disponible garantissent des conditions optimales de croissance et de reproduction;
|
|
—
|
La variabilité est suffisamment faible pour permettre une estimation précise et exacte de la toxicité.
|
Appendice 4
Extraction et comptage des animaux
1. Deux méthodes d'extraction peuvent être appliquées.
|
1.a.
|
Première méthode: Un extracteur à gradient de température contrôlé reposant sur les principes énoncés par MacFadyen peut être utilisé (1). La chaleur émanant d'un dispositif de chauffage situé sur la partie supérieure de la boîte d'extraction est régulée par un thermistor placé à la surface de l'échantillon de sol. La température du liquide réfrigéré entourant le récipient de collecte est régulée par un thermistor situé à la surface de la boîte de collecte (placée sous l'échantillon de sol). Les thermistors sont reliés à une unité de contrôle programmable qui élève la température selon un schéma préétabli. Les animaux sont collectés dans la boîte de collecte réfrigérée (2 °C) dont le fond contient une couche constituée de plâtre de Paris et de charbon de bois. L'extraction débute à 25 °C et la température est ensuite automatiquement augmentée de 5 °C toutes les 12 h sur une durée totale de 48 heures. Après 12 h à 40 °C l'extraction est achevée.
|
|
1.b.
|
Seconde méthode: Au terme de la période d'incubation expérimentale le nombre de collemboles juvéniles présents est évalué par flottation. À cet effet, l'essai est réalisé dans des récipients d'un volume d'environ 250 ml. Environ 200 ml d'eau distillée sont ajoutés à la fin de l'essai. Le sol est remué doucement à l'aide d'un pinceau fin en vue de permettre aux collemboles de remonter à la surface de l'eau. Une petite quantité, environ 0,5 ml, de teinture photographique noire Kentmere peut être ajoutée à l'eau pour faciliter le comptage en augmentant leappend contraste entre l'eau et les collemboles blancs. Cette teinture n'est pas toxique pour les collemboles.
|
2. Comptage:
le comptage des animaux peut être effectué à l'œil nu ou à l'aide d'un microscope optique après avoir placé une grille sur le récipient de flottation, ou encore en photographiant la surface de chaque récipient puis en comptant ultérieurement les collemboles sur des agrandissements ou sur des projections de diapositives. Le comptage peut également être réalisé à l'aide de techniques de traitement numérique de l'image (12). Toutes ces techniques sont validées.
Appendice 5
Détermination de la capacité maximale de rétention d'eau du sol
La méthode suivante de détermination de la capacité maximale de rétention d'eau du sol a fait ses preuves. Elle est décrite à l'annexe C de la norme ISO DIS 11268-2 (Qualité du sol — Effets des polluants vis-à-vis des vers de terre (Eisenia fetida). Partie 2: Détermination des effets sur la reproduction).
Prélevez une quantité déterminée (5 g, par exemple) du sol expérimental servant de substrat à l'aide d'un instrument approprié (tarière, etc.). Couvrez le fond de la tarière avec un morceau de papier filtre humide et placez-la sur un support dans un bain d'eau. La tarière est progressivement submergée jusqu'à ce que le niveau d'eau dépasse le sommet de la carotte de sol. Laissez la tarière dans l'eau durant environ trois heures. Comme l'eau absorbée par les capillaires du sol ne peut pas être retenue en totalité, laissez l'échantillon de sol dégorger durant deux heures, en plaçant le tube sur un lit de sable quartzique fin très humide contenu dans un récipient fermé (pour empêcher le séchage). Pesez l'échantillon et séchez-le à 105 °C jusqu'à ce qu'il atteigne une masse constante. La capacité de rétention d'eau (CRE) est calculée comme suit:
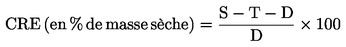
où:
|
S
|
=
|
masse du substrat saturé en eau + masse de la tarière + masse du papier filtre
|
|
T
|
=
|
tare (masse de la tarière + masse du papier filtre)
|
|
D
|
=
|
masse sèche du substrat
|
Appendice 6
Détermination du pH du sol
La méthode de détermination du pH d'un sol, décrite ci-dessous s'appuie sur la norme ISO 10390: Qualité du sol — Détermination du pH.
On laisse sécher une quantité définie de sol à température ambiante durant au moins 12 heures. On prépare une suspension du sol (contenant au moins 5 g de sol) dans cinq fois son volume d'une solution de chlorure de potassium (KCl) 1 M de qualité analytique ou d'une solution de chlorure de calcium (CaCl2) 0,01 M de qualité analytique. On agite vigoureusement la suspension durant cinq minutes et on la laisse sédimenter durant au moins deux heures, mais pas plus de 24 heures. On mesure ensuite le pH de la phase liquide à l'aide d'un pH-mètre, étalonné avant chaque mesure à l'aide d'une série appropriée de solutions tampons (pH 4,0 et 7,0, par exemple).
C.40. ESSAI DE TOXICITÉ SUR LE CYCLE DE VIE DES CHIRONOMES DANS UN SYSTÈME EAU-SÉDIMENT CHARGÉ OU EAU CHARGÉE-SÉDIMENT
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 233 (2010) de l'OCDE pour les essais de produits chimiques. Elle est conçue pour évaluer les effets d'une exposition vie entière à des substances chimiques chez Chironomus sp., un diptère d'eau douce, en couvrant toute la durée de vie de la première génération (génération P) et la première partie de la vie de la deuxième génération (génération F1). Elle prolonge les méthodes d'essai C.28 (1) ou C.27 (15) existantes, dans lesquelles l'exposition s'effectue respectivement à l'aide d'un système eau chargée-sédiment ou d'un système eau-sédiment chargé. Cette méthode d'essai s'appuie sur des protocoles d'essais de toxicité sur Chironomus riparius et Chironomus dilutus [anciennement dénommé C. tentans (2)], mis au point en Europe et en Amérique du Nord (3) (4) (5) (6) (7) (8) (9) puis soumis à des essais interlaboratoires (1) (7) (10) (11) (12). Il est également possible d'utiliser d'autres espèces de chironomes pour lesquelles il existe une littérature conséquente, telles que Chironomus yoshimatsui (13) (14). La durée totale d'exposition est d'environ 44 jours pour C. riparius et C. yoshimatsui, et d'environ 100 jours pour C. dilutus.
|
|
2.
|
La présente méthode d'essai décrit des scénarios d'exposition dans l'eau et le sédiment respectivement. Le choix du mode d'exposition dépend de la finalité de l'essai. Le mode d'exposition qui consiste à charger la colonne d'eau vise à simuler des pertes par dispersion lors de l'épandage de pesticides et couvre le pic de concentration initial dans les eaux de surface. Le chargement de la colonne d'eau s'applique également à d'autres types d'exposition (notamment déversements de substances chimiques), mais non aux processus d'accumulation dans le sédiment d'une durée supérieure à celle de l'essai. Dans ce dernier cas, mais aussi lorsque le ruissellement est la principale voie d'entrée des pesticides dans les masses d'eau, il peut être préférable de charger le sédiment. Si d'autres modes d'exposition sont envisagés, le protocole d'essai peut facilement être adapté. Par exemple, si la répartition de la substance chimique d'essai entre la phase aqueuse et la couche de sédiment ne présente pas d'intérêt, et qu'il est nécessaire de limiter au maximum l'adsorption sur le sédiment, on peut envisager d'avoir recours à un sédiment de substitution artificiel (tel que du sable quartzique).
|
|
3.
|
En général, les substances chimiques à tester sur des organismes vivant dans les sédiments subsistent longtemps dans le sédiment. Ces organismes peuvent être exposés par diverses voies. L'importance relative de chaque voie d'exposition et le temps pris par chacune d'entre elles pour contribuer à l'effet toxique global dépendent des propriétés physico-chimiques de la substance. Dans le cas de substances chimiques fortement adsorbantes ou de substances liées par covalence au sédiment, l'ingestion d'aliments contaminés peut se révéler une voie d'exposition significative. Afin de ne pas sous-estimer la toxicité des substances chimiques fortement lipophiles, on envisagera d'ajouter de la nourriture au sédiment avant l'application de la substance d'essai (voir paragraphe 31). Il est donc possible d'inclure toutes les voies d'exposition et tous les stades du cycle de vie.
|
|
4.
|
Les effets mesurés sont le nombre total d'adultes émergés (pour la 1ère et la 2ème génération), la vitesse de développement (pour la 1ère et la 2ème génération), le sex-ratio des adultes totalement émergés et vivants (pour la 1ère et la 2ème génération), le nombre d'amas cylindriques d'œufs par femelle (1ère génération uniquement) et le taux de fertilité des amas d'œufs (1ère génération uniquement).
|
|
5.
|
L'utilisation d'un sédiment reconstitué est vivement recommandée en raison de ses avantages par rapport aux sédiments naturels:
|
—
|
la variabilité expérimentale est réduite car le sédiment reconstitué forme une “matrice normalisée” reproductible; en outre, il n'est plus nécessaire de trouver des sources de sédiments non contaminés et non pollués;
|
|
—
|
les essais peuvent être effectués à n'importe quel moment de l'année, la variabilité saisonnière n'intervenant plus, et il n'est pas nécessaire de traiter préalablement le sédiment pour éliminer la faune indigène;
|
|
—
|
le coût est réduit par rapport à la collecte sur le terrain d'une quantité suffisante de sédiments pour les essais en routine;
|
|
—
|
les sédiments reconstitués permettent de comparer la toxicité des substances chimiques entre les différentes études (3).
|
|
|
6.
|
Les définitions utilisées figurent à l'Appendice 1.
|
PRINCIPE DE L'ESSAI
|
7.
|
Des chironomes au premier stade larvaire sont exposés à une gamme de concentrations de la substance chimique d'essai dans un système sédiment-eau. L'essai débute par l'introduction de larves du premier stade (1ère génération) dans des béchers expérimentaux contenant du sédiment chargé. Il est également possible d'injecter la substance chimique d'essai dans l'eau après l'introduction des larves. L'émergence des chironomes, le délai d'émergence et le sex-ratio des moucherons complètement émergés et vivants sont évalués. Les adultes émergés sont transférés dans des cages d'élevage pour faciliter l'essaimage, l'accouplement et la ponte. Le nombre d'amas d'œufs et leur fertilité sont évalués. Ces amas d'œufs produisent les larves du premier stade de la 2ème génération. Ces larves sont placées dans des béchers expérimentaux fraîchement préparés (les récipients sont chargés de la même façon que pour la 1ère génération) afin de déterminer la viabilité de la 2ème génération via l'évaluation de l'émergence des chironomes, du délai d'émergence et du sex-ratio des moucherons complètement émergés et vivants (on trouvera à l'Appendice 5 une présentation schématique de l'essai sur le cycle de vie). Toutes les données sont analysées, soit en utilisant un modèle de régression pour estimer la concentration qui entraînerait une réduction de x % de l'effet mesuré, soit en ayant recours à un test d'hypothèse pour déterminer une concentration sans effet observé (CSEO). Cette dernière méthode nécessite une comparaison des réponses au traitement avec les réponses témoins adéquates à l'aide de tests statistiques. Il convient de noter que dans le système eau chargée, en cas d'utilisation de substances chimiques se dégradant rapidement, les dernières phases du cycle de vie de chaque génération (par exemple la phase pupale) peuvent être exposées à un niveau de concentration bien plus faible dans l'eau sus-jacente que les larves du premier stade. Si cela pose problème et qu'un niveau d'exposition similaire est nécessaire pour chaque phase du cycle de vie, on peut alors envisager de modifier la méthode d'essai comme suit:
|
—
|
expériences parallèles avec chargement du système à différentes phases du cycle de vie, ou
|
|
—
|
chargement répété (ou renouvellement de l'eau sus-jacente) du système expérimental au cours des deux phases de l'essai (1ère et 2ème génération), les intervalles de chargement (renouvellement) devant être ajustés en fonction des caractéristiques du devenir de la substance chimique d'essai.
|
De telles modifications sont envisageables uniquement dans le système eau chargée, et non dans le système sédiment chargé.
|
INFORMATIONS SUR LA SUBSTANCE D'ESSAI
|
8.
|
Il est nécessaire de connaître l'hydrosolubilité de la substance chimique d'essai, sa pression de vapeur et son log Koe
, son coefficient de partage mesuré ou calculé dans le sédiment, et sa stabilité dans l'eau et le sédiment. Il convient de disposer, pour quantifier la substance d'essai dans l'eau sus-jacente, l'eau interstitielle et le sédiment, d'une méthode d'analyse fiable dont la précision et le seuil de détection sont connus. Il est également utile de connaître la formule structurale et la pureté de la substance chimique d'essai ainsi que son devenir chimique (par exemple dissipation, dégradation abiotique et biotique, etc.). Des conseils pour tester les substances chimiques se prêtant difficilement à l'essai en raison de leurs propriétés physico-chimiques sont fournis à la référence (16).
|
SUBSTANCES DE RÉFÉRENCE
|
9.
|
Il est possible de tester régulièrement des substances chimiques de référence afin de s'assurer que la sensibilité de la population du laboratoire n'a pas évolué. Comme pour les daphnies, il est suffisant d'effectuer un test de toxicité aiguë de 48 heures (tel que celui décrit dans la référence (17)). Toutefois, dans l'attente qu'une ligne directrice validée soit disponible pour la toxicité aigüe, il peut être envisagé de réaliser un essai de toxicité chronique selon la méthode C.28 de la présente annexe. Parmi les toxiques de référence ayant fait leurs preuves dans des essais interlaboratoires et des études de validation, citons le lindane, la trifluraline, le pentachlorophénol, le chlorure de cadmium et le chlorure de potassium. (1) (3) (6) (7) (18).
|
VALIDITÉ DE L'ESSAI
|
10.
|
Pour que l'essai soit valable, les conditions suivantes doivent être remplies:
|
—
|
l'émergence moyenne dans le système témoin est d'au moins 70 % à la fin de la période d'exposition pour les deux générations (1) (7);
|
|
—
|
pour C. riparius et C. yoshimatsui, 85 % du total des moucherons adultes émergés du système témoin pour les deux générations doivent apparaître entre 12 et 23 jours après l'introduction des larves de premier stade dans les récipients; pour C. dilutus, une période de 20 à 65 jours est acceptable;
|
|
—
|
le sex-ratio moyen des adultes totalement émergés et vivants (proportion de femelles ou de mâles) dans le système témoin pour les deux générations est d'au moins 0,4, mais ne dépasse pas 0,6;
|
|
—
|
pour chaque cage d'élevage, le nombre d'amas d'œufs dans les cultures témoin de la 1ère génération est d'au moins 0,6 par femelle introduite dans la cage d'élevage;
|
|
—
|
la fraction des amas d'œufs fertiles dans chaque cage d'élevage des témoins de la 1ère génération est d'au moins 0,6;
|
|
—
|
à l'issue de la période d'exposition pour les deux générations, le pH et la concentration d'oxygène dissous sont mesurés dans chaque récipient. La concentration d'oxygène doit atteindre au moins 60 % de la valeur de saturation en air (VSA (24)), et le pH de l'eau sus-jacente doit être compris entre 6 et 9 dans tous les récipients expérimentaux;
|
|
—
|
la température de l'eau ne varie pas de plus de ± 1,0 °C.
|
|
DESCRIPTION DE LA MÉTHODE
Récipients expérimentaux et cages d'élevage
|
11.
|
Les larves sont exposées dans des béchers en verre de 600 ml, mesurant environ 8,5 cm de diamètre (voir Appendice 5). D'autres récipients peuvent être utilisés à condition que la profondeur de l'eau sus-jacente et celle du sédiment puissent être suffisantes. Le sédiment doit offrir une superficie de 2 à 3 cm2 par larve. Le rapport de l'épaisseur de la couche de sédiment à celle de la couche d'eau sus-jacente doit être à peu près égal à 1/4. Il convient d'utiliser des cages d'élevage (de 30 cm minimum pour chacune des trois dimensions) dont le dessus et au moins un côté sont recouverts d'une gaze (maillage d'environ 1 mm) (voir Appendice 5). Dans caque cage, on dispose pour la ponte un cristallisoir de 2 l contenant un système expérimental eau-sédiment. Pour le cristallisoir également, le rapport de l'épaisseur de la couche de sédiment à celle de l'eau sus-jacente doit être à peu près égal à 1/4. Après avoir collecté les amas d'œufs dans le cristallisoir, on les transfère sur une plaque de microtitration à 12 puits (un amas par puits contenant au moins 2,5 ml d'eau prélevée dans le cristallisoir chargé), sur laquelle on place ensuite un couvercle afin d'éviter une trop forte évaporation. D'autres récipients peuvent également convenir pour recevoir les amas d'œufs. À l'exception des plaques de microtitration, tous les récipients et les autres appareils qui entreront en contact avec le système d'essai doivent être composés uniquement de verre ou d'un autre matériau chimiquement inerte (polytétrafluoroéthylène, par exemple).
|
Sélection des espèces
|
12.
|
Chironomus riparius est l'espèce qui convient le mieux. C. yoshimatsui convient également. C. dilutus peut aussi être utilisé, mais il est plus difficile à manipuler et nécessite une période d'essai plus longue. La méthode de culture de C. riparius est détaillée à l'Appendice 2. On dispose également d'informations sur les conditions de culture de C. dilutus (5) et C. yoshimatsui (14). L'identification des espèces est à confirmer avant l'essai, mais n'est pas requise avant chaque essai si les organismes ont été cultivés sur place.
|
Sédiment
|
13.
|
Il est préférable d'employer un sédiment reconstitué (également dénommé sédiment artificiel ou synthétique). Néanmoins, si l'on opte pour un sédiment naturel, il convient de le caractériser, au moins quant au pH et à la teneur en carbone organique (la détermination d'autres paramètres, tels que le rapport C/N et la granulométrie est aussi recommandée), et de s'assurer qu'il n'est pas contaminé et n'abrite pas d'autres organismes qui pourraient entrer en compétition avec les larves de chironomes ou les consommer. Avant d'utiliser un sédiment naturel dans un essai, il est également recommandé de le maintenir durant sept jours dans des conditions identiques à celles de l'essai. II est recommandé d'utiliser le sédiment reconstitué suivant, tel que décrit en (1) (20) (21):
|
a.
|
4-5 % (poids sec) de tourbe, avec un pH aussi proche que possible de 5,5 à 6,0; il importe d'utiliser une tourbe en poudre, finement broyée (dimension des particules≤ 1 mm) et séchée uniquement à l'air;
|
|
b.
|
20 % (poids sec) d'argile kaolinique (teneur en kaolinite de préférence supérieure à 30 %);
|
|
c.
|
75-76 % (poids sec) de sable quartzique (composé en majorité de sable fin, plus de 50 % des particules mesurant entre 50 et 200 μm);
|
|
d.
|
Ajouter de l'eau désionisée jusqu'à ce que la teneur en humidité du mélange final soit comprise entre 30 et 50 %;
|
|
e.
|
Ajouter du carbonate de calcium de qualité chimiquement pure (CaCO3) afin d'ajuster le pH du mélange final de sédiments à 7,0 ± 0,5;
|
|
f.
|
Il convient d'obtenir 2 % (± 0,5 %) de carbone organique dans le mélange final en y ajoutant les quantités appropriées de tourbe et de sable, comme indiqué en (a) et en (c).
|
|
|
14.
|
Les sources de tourbe, d'argile kaolinique et de sable doivent être connues. On vérifiera que les composants du sédiment ne sont pas contaminés par des substances chimiques (métaux lourds, composés organochlorés, composés organophosphorés, etc.). Un exemple de préparation de sédiment reconstitué est décrit à l'Appendice 3. Les composants du sédiment peuvent aussi être mélangés à l'état sec, à condition de démontrer qu'ils ne se séparent pas après l'ajout de l'eau sus-jacente (flottement de particules de tourbe, par exemple) et que la tourbe ou le sédiment sont suffisamment conditionnés.
|
Eau
|
15.
|
Toute eau conforme aux caractéristiques chimiques d'une eau de dilution acceptable selon les critères spécifiés aux annexes 2 et 4 convient à l'essai. Toute eau appropriée, naturelle (eau superficielle ou souterraine), reconstituée (voir Appendice 2) ou eau du robinet déchlorée, est acceptable comme eau de culture et d'essai, si les chironomes y survivent sur toute la durée de la culture et de l'essai sans manifester de signes de stress. Au début de l'essai, le pH de l'eau d'essai se situera entre 6 et 9 et sa dureté totale ne dépassera pas 400 mg/l en CaCO3. Néanmoins, si l'on suspecte une interaction entre les ions de dureté et la substance chimique d'essai, il faut utiliser une eau moins dure (auquel cas le milieu Elendt M4 ne pourra pas être utilisé). Le même type d'eau doit être utilisé tout au long de l'étude. Les caractéristiques de qualité de l'eau énumérées à l'Appendice 4 sont à mesurer au moins deux fois par an ou chaque fois qu'elles sont susceptibles d'avoir été significativement modifiées.
|
Solutions-mères — eau chargée
|
16. a.
|
Les concentrations expérimentales sont calculées en fonction des concentrations dans la colonne d'eau surmontant le sédiment. Les solutions d'essai sont généralement préparées aux concentrations choisies par dilution d'une solution-mère. Il est préférable de préparer les solutions-mères en dissolvant la substance chimique d'essai dans l'eau d'essai. Dans certains cas, il sera nécessaire d'utiliser des solvants ou des dispersants pour obtenir une solution-mère à la concentration voulue. Parmi les solvants appropriés, on peut citer l'acétone, l'éther monométhylique d'éthylène-glycol, l'éther diméthylique d'éthylène-glycol, le diméthylformamide et le triéthylène-glycol. Parmi les dispersants appropriés, citons le Cremophor RH40, le Tween 80, la méthylcellulose à 0,01 % et le HC0-40. La concentration de l'agent solubilisant dans le milieu d'essai final doit être minimale (≤ 0,1 ml/l) et identique dans tous les traitements. En cas d'utilisation d'un agent solubilisant, celui-ci ne doit avoir aucun effet significatif sur la survie des chironomes, ce qui pourra être démontré par la comparaison d'un témoin solvant avec un témoin négatif (eau). Il faut cependant s'efforcer, dans toute la mesure du possible, d'éviter d'utiliser ces produits.
|
Solutions-mères — sédiment chargé
|
16. b.
|
On prépare généralement les sédiments chargés à la concentration souhaitée en ajoutant directement une solution de la substance chimique d'essai au sédiment. Une solution-mère de la substance d'essai dissoute dans de l'eau désionisée est mélangée au sédiment reconstitué à l'aide d'un laminoir, d'un mélangeur d'aliments ou mélangée à la main. Si la substance chimique d'essai est peu soluble dans l'eau, elle peut être dissoute dans un volume aussi faible que possible d'un solvant organique adéquat (hexane, acétone ou chloroforme, par exemple). Cette solution est ensuite mélangée à 10 g de sable quartzique fin par récipient expérimental. Il faut attendre que le solvant s'évapore jusqu'à être totalement éliminé du sable; le sable est ensuite mélangé avec la quantité appropriée de sédiment. Seuls des agents très volatils peuvent être utilisés pour solubiliser, disperser ou émulsifier la substance chimique d'essai. On n'oubliera pas de tenir compte de la quantité de sable apportée avec le mélange de substance d'essai et de sable lors de la préparation du sédiment (ce dernier sera préparé avec moins de sable). Il faudra veiller à mélanger complètement la substance d'essai au sédiment et à l'y répartir uniformément. Si nécessaire, on analysera des sous- échantillons afin de déterminer le degré d'homogénéité.
|
PROTOCOLE D'ESSAI
|
17.
|
Le protocole d'essai définit le nombre et l'espacement des concentrations expérimentales, le nombre de récipients par concentration, le nombre de larves par récipient, et le nombre de cristallisoirs et de cages d'élevage. La marche à suivre pour établir la CEx et la CSEO et pour réaliser un essai limite est décrite ci-dessous.
|
Conduite d'une analyse de régression
|
18.
|
L'essai doit couvrir la concentration efficace (CEx,) et la gamme de concentrations auxquelles la substance chimique d'essai produit un effet intéressant, de façon à ce que l'effet observé ne soit pas extrapolé hors des limites des données générées. On évitera d'extrapoler des résultats très en dessous de la concentration la plus faible ou au-dessus de la concentration la plus forte. Il pourra être utile de réaliser un essai préliminaire de détermination des concentrations d'essai, conformément à la méthode d'essai C.27 ou C.28, de façon à définir la gamme des concentrations à utiliser.
|
|
19.
|
Pour estimer la CEx, un minimum de cinq concentrations et huit réplicats par concentration sont nécessaires. Pour chaque concentration, deux cages d'élevage seront utilisées (A et B). Les huit réplicats sont scindés en deux groupes de quatre réplicats (un groupe par cage). Ce regroupement des réplicats est nécessaire en raison du nombre de moucherons à atteindre dans les cages pour obtenir des évaluations fiables de leur reproduction. La 2ème génération compte aussi huit réplicats, obtenus à partir des populations exposées dans les cages d'élevage. Le facteur séparant les concentrations ne doit pas excéder deux (une exception peut être faite si la courbe dose-effet présente une pente faible). Le nombre de réplicats par traitement peut être ramené à six (trois pour chaque cage d'élevage) si le nombre de concentrations expérimentales entraînant différents effets est augmenté. L'augmentation du nombre d'expériences identiques ou la diminution des écarts entre les concentrations expérimentales tend à réduire les intervalles de confiance autour de la CEx.
|
Procédure d'estimation d'une CSEO
|
20.
|
Pour estimer la CSEO, cinq concentrations expérimentales et au moins huit réplicats par concentration (quatre pour chaque cage d'élevage, A et B) seront nécessaires, le facteur séparant les concentrations n'excédant pas deux. Le nombre de réplicats doit être suffisant pour fournir une puissance statistique permettant de détecter une différence de 20 % avec le témoin, au seuil de signification statistique de 5 % (α = 0,05). Pour la vitesse de développement, la fécondité et la fertilité, il est généralement utile d'effectuer une analyse de variance (ANOVA), suivie d'un test de Dunnett ou d'un test de Williams (22-25). S'agissant du taux d'émergence et du sex-ratio, le test de Cochran-Armitage, le test exact de Fisher (avec correction selon Bonferroni) ou le test de Mantel-Haentzal peuvent être appropriés.
|
Essai limite
|
21.
|
La conduite d'un essai limite peut être envisagée (sur une concentration expérimentale et un ou plusieurs témoins) si l'essai préliminaire facultatif de détermination des concentrations d'essai n'a permis d'observer aucun effet à une concentration maximale. L'essai limite a pour objet d'indiquer si des effets toxiques de la substance chimique d'essai sont décelés à des niveaux supérieurs aux concentrations limites étudiées. Les quantités recommandées sont 100 mg/l pour l'eau et 1 000 mg/kg (poids sec) pour le sédiment. Huit réplicats au moins sont généralement nécessaires pour le traitement et le témoin. Une puissance statistique suffisante pour détecter une différence de 20 % avec le témoin au seuil de signification statistique de 5 % (α = 0,05) devrait être démontrée. Pour les mesures métriques (par exemple, la vitesse de développement), le test t constitue une méthode statistique appropriée si les données répondent aux critères de ce test (normalité, variances homogènes). Un test t de variance inégale ou bien un test non paramétrique tel que le test de Wilcoxon-Mann-Whitney peuvent être employés lorsque ces conditions ne sont pas satisfaites. S'agissant du taux d'émergence, le test exact de Fisher est approprié.
|
PROCÉDURE
Conditions d'exposition
Préparation du système eau-sédiment (eau chargée)
|
22.a.
|
Un sédiment reconstitué (voir paragraphes 13-14 et Appendice 3) est introduit dans chaque récipient expérimental et dans le cristallisoir de façon à former une couche d'au moins 1,5 cm (qui peut être un peu moins épaisse dans le cristallisoir) et d'au plus 3 cm. L'eau (voir paragraphe 15) est ensuite versée de manière à ce que le rapport de l'épaisseur de la couche de sédiment à celle de la couche d'eau ne dépasse pas 1/4. Une fois la préparation des récipients expérimentaux achevée, le système sédiment-eau doit être soumis à une légère aération pendant environ sept jours avant l'introduction des chironomes au premier stade larvaire de la 1ère ou de la 2ème génération (voir paragraphe 14 et Appendice 3). Le système sédiment-eau des cristallisoirs n'est pas aéré au cours de l'essai, car il n'a pas à assurer la survie des larves (avant l'éclosion, les amas d'œufs sont déjà collectés). Afin d'éviter la séparation des ingrédients du sédiment et la remise en suspension des particules fines lors du remplissage de la colonne d'eau, on peut recouvrir le sédiment d'un disque en plastique durant cette opération et retirer le disque juste après. D'autres dispositifs peuvent aussi convenir.
|
Préparation du système eau-sédiment (sédiment chargé)
|
22.b.
|
On dépose les sédiments chargés, préparés comme indiqué au paragraphe 16b, au fond des récipients et du cristallisoir avant d'y verser l'eau sus-jacente, de façon à obtenir un rapport volumique sédiment-eau de 1/4. La profondeur de la couche de sédiment doit être comprise entre 1,5 et 3 cm (elle peut être légèrement inférieure dans le cristallisoir). Afin d'éviter la séparation des ingrédients du sédiment et la remise en suspension des particules fines lors du remplissage de la colonne d'eau, on peut recouvrir le sédiment d'un disque en plastique durant cette opération et retirer le disque juste après. D'autres dispositifs peuvent aussi convenir. Une fois préparé le sédiment chargé surmonté d'une couche d'eau, il est souhaitable de laisser la substance d'essai se répartir entre la phase aqueuse et le sédiment (4) (5) (7) (18), de préférence dans les mêmes conditions de température et d'aération que durant l'essai. La durée d'équilibrage appropriée dépend du sédiment et de la substance chimique; elle peut être de l'ordre de quelques heures à quelques jours, et dans de rares cas atteindre cinq semaines. Il ne faut pas attendre que l'équilibre soit atteint car de nombreuses substances auraient le temps de se dégrader, mais une période d'équilibrage de 48 heures est recommandée. Toutefois, s'il est connu que la demi-vie de la substance chimique dans le sédiment est longue (voir paragraphe 8), la durée d'équilibrage peut être allongée. Au terme de cette période d'équilibrage, on mesure la concentration de la substance d'essai dans l'eau sus-jacente, l'eau interstitielle et le sédiment, au moins pour la concentration la plus élevée et une concentration plus faible (voir paragraphe 38). Ces déterminations analytiques de la substance chimique d'essai permettent de calculer le bilan massique et d'exprimer les résultats en fonction des concentrations mesurées.
|
|
23.
|
Les récipients expérimentaux sont couverts (par des plaques de verre, par exemple). Si nécessaire, on remplace les volumes d'eau évaporée durant l'étude avec de l'eau distillée ou désionisée afin d'empêcher l'accumulation de sels. Les cristallisoirs placés dans les cages d'élevage ne sont pas couverts. Il est possible, mais pas indispensable, de remplacer l'eau perdue au cours de la durée de l'essai, puisque les amas d'œufs n'y sont en contact avec l'eau que pendant un jour environ, et que les cristallisoirs ne sont utilisés que pendant une courte phase de l'essai.
|
Introduction des organismes expérimentaux
|
24.
|
Quatre à cinq jours avant l'introduction des larves du premier stade de la 1ère génération, les amas d'œufs sont prélevés dans la culture et placés dans de petits récipients contenant du milieu de culture. Il est possible d'utiliser un milieu plus ancien issu de la culture-mère ou un milieu fraîchement préparé. Dans les deux cas, on ajoutera au milieu de culture une petite quantité de nourriture, par exemple quelques gouttelettes de filtrat d'une suspension de paillettes pour poissons finement broyées (voir Appendice 2). Seuls des amas d'œufs fraîchement pondus peuvent être utilisés. Normalement, les larves commencent à éclore quelques jours après la ponte (2 à 3 jours pour C. riparius à 20 °C, et 1 à 4 jours pour C. dilutus à 23 °C et C. yoshimatsui à 25 °C) et le développement des larves se déroule en quatre stades, chacun d'une durée de 4 à 8 jours. L'essai doit être réalisé avec des chironomes au premier stade larvaire (maximum 48 h après éclosion). Il est possible de vérifier le stade de développement des larves d'après la largeur de la capsule céphalique (7).
|
|
25.
|
Vingt larves du premier stade de la première génération, choisies au hasard, sont déposées à l'aide d'une pipette émoussée dans chaque récipient contenant le système sédiment-eau. L'aération de l'eau est interrompue pendant 24 heures à compter de l'introduction des larves de premier stade dans les récipients expérimentaux (voir paragraphe 32). Selon le protocole expérimental suivi (voir paragraphes 19 et 20), le nombre de larves utilisées par concentration sera d'au moins 120 (6 réplicats par concentration) pour la détermination de la CEX et 160 pour la CSEO (8 réplicats par concentration). Dans le protocole d'essai avec sédiment chargé, l'exposition débute lors de l'introduction des larves.
|
Chargement de l'eau sus-jacente
|
26.
|
Vingt-quatre heures après l'introduction des chironomes au premier stade larvaire de la 1ère génération dans les récipients expérimentaux, la substance d'essai est ajoutée à la colonne d'eau sus-jacente qui est de nouveau soumise à une légère aération (pour les modifications possibles du protocole d'essai, voir paragraphe 7). De faibles volumes des solutions-mères de la substance chimique d'essai sont injectés à l'aide d'une pipette sous la surface de l'eau. Ensuite, on mélange doucement l'eau sus-jacente en prenant soin de ne pas remuer le sédiment. Dans le protocole d'essai avec eau chargée, l'exposition débute avec l'ajout de la substance dans l'eau (c'est à dire un jour après l'introduction des larves).
|
Collecte des adultes émergés
|
27.
|
Les moucherons émergés de la 1ère génération sont collectés au moins une fois, mais de préférence deux fois, par jour (voir paragraphe 36) dans les récipients expérimentaux à l'aide d'un aspirateur, d'un extracteur ou d'un autre dispositif similaire (voir Appendice 5). Il convient de prendre toutes les précautions nécessaires pour ne pas endommager les adultes. Les moucherons prélevés dans les quatre récipients expérimentaux ayant reçu le même traitement sont transférés dans la cage d'élevage qui leur a été attribuée préalablement. Le jour où apparaissent les premiers moucherons (mâles), on charge les cristallisoirs en injectant à l'aide d'une pipette un faible volume de la solution-mère de substance d'essai sous la surface de l'eau (protocole avec eau chargée). Ensuite, on mélange doucement l'eau sus-jacente en prenant soin de ne pas remuer le sédiment. La valeur nominale de la concentration de substance chimique d'essai est la même dans le cristallisoir que dans les récipients de traitement associés à cette cage d'élevage précise. Dans le protocole avec sédiment chargé, les cristallisoirs sont préparés vers le 11ème jour après le début de l'exposition (c'est-à-dire à compter de l'introduction de la 1ère génération de larves), de façon à ce que l'équilibrage soit achevé environ 48 heures avant la ponte des premiers amas d'œufs.
|
|
28.
|
Les amas d'œufs sont collectés dans les cristallisoirs de la cage d'élevage à l'aide de pinces ou d'une pipette émoussée. Chaque amas est placé dans un récipient contenant un milieu de culture provenant du cristallisoir d'origine de l'amas (par exemple l'un des 12 puits d'une plaque de microtitration avec au moins 2,5 ml de milieu). Les récipients contenant les amas sont fermés par un couvercle afin d'éviter une évaporation importante. Les amas sont gardés en observation pendant 6 jours au minimum après la ponte, afin que l'on puisse les classer comme fertiles ou stériles.
Pour démarrer la 2ème génération, on choisit dans chaque cage d'élevage trois amas d'œufs fertiles au minimum, mais de préférence six, que l'on laisse éclore en présence d'un peu de nourriture. Ces amas devront avoir été produits lors du pic de ponte, qui intervient normalement autour du 19ème jour d'essai dans les récipients témoins. Dans l'idéal, tous les traitements sur la 2ème génération démarrent le même jour, mais en raison des effets liés aux substances chimiques d'essai sur le développement des larves, cela n'est pas toujours possible. Dans ce cas, mieux vaut lancer les traitements aux concentrations plus élevées après les traitements plus faibles et le témoin (solvant).
|
|
29.a.
|
Dans le protocole avec eau chargée, le système sédiment-eau destiné à la 2ème génération se prépare en ajoutant la substance chimique d'essai dans la colonne d'eau sus-jacente environ 1 heure avant d'introduire les larves de premier stade dans les récipients expérimentaux. De faibles volumes des solutions contenant la substance d'essai sont injectés sous la surface de la colonne d'eau à l'aide d'une pipette. Ensuite, on mélange doucement l'eau sus-jacente en prenant soin de ne pas remuer le sédiment. Une fois la substance ajoutée, on procède à une légère aération.
|
|
29.b.
|
Dans le protocole avec sédiment chargé, les récipients d'exposition contenant le système sédiment-eau pour la 2ème génération sont préparés de la même façon que ceux de la 1ère génération.
|
|
30.
|
Vingt larves de premier stade (48 heures maximum après éclosion) de la 2ème génération, choisies au hasard, sont déposées à l'aide d'une pipette émoussée dans chaque récipient expérimental contenant le système eau-sédiment chargé. L'aération de l'eau doit être interrompue pendant au moins 24 heures à compter de l'introduction des larves de premier stade dans les récipients expérimentaux. Selon le protocole expérimental suivi (voir paragraphes 19 et 20), le nombre de larves utilisées par concentration sera d'au moins 120 (6 réplicats par concentration) pour la détermination de la CEX et 160 pour la CSEO (8 réplicats par concentration).
|
Nourriture
|
31.
|
Les larves ont besoin d'être nourries dans les récipients expérimentaux, de préférence quotidiennement ou au moins trois fois par semaine. Durant les dix premiers jours, chaque jeune larve reçoit quotidiennement 0,25 à 0,5 mg (0,35-0,5 mg pour C. yoshimatsui) de nourriture pour poissons (en suspension dans l'eau ou finement broyée, par exemple Tetra-Min ou Tetra-phyll; voir les détails à l'Appendice 2). Il peut être nécessaire d'augmenter légèrement cette quantité pour les larves plus âgées: 0,5 — 1,0 mg par larve et par jour devrait suffire pour le reste de l'essai. On diminue la ration alimentaire de tous les organismes traités et témoins si l'on constate le développement de champignons ou en cas de mortalité parmi les organismes témoins. Si la croissance fongique ne peut être enrayée, l'essai est à recommencer.
La pertinence toxicologique de l'exposition par ingestion est généralement plus grande pour les substances chimiques possédant une forte affinité pour le carbone organique ou les substances formant des liaisons de covalence avec le sédiment. Ainsi, lors d'essais sur des substances présentant de telles propriétés, la quantité de nourriture nécessaire à la survie et à la croissance naturelle des larves peut être incorporée au sédiment reconstitué avant la période de stabilisation, en fonction de la règlementation imposée. Afin d'éviter de détériorer la qualité de l'eau, la nourriture pour poissons est remplacée par une ration végétale, par exemple 0,5 % (poids sec) de feuilles finement broyées d'ortie (Urtica dioeca), de mûrier (Morus alba), de trèfle blanc (Trifolium repens), d'épinard (Spinacia oleracea) ou d'un autre matériel végétal (Cerophyl ou α-cellulose). Incorporer toute la ration alimentaire d'origine organique au sédiment avant d'ajouter la substance d'essai n'est pas sans conséquence sur la qualité et les performances biologiques de l'eau (21), et ne constitue pas non plus une méthode normalisée; toutefois de récentes études indiquent que cette méthode fonctionne (19) (26). Les moucherons adultes de la cage d'élevage n'ont en principe pas besoin d'être nourris, mais la fécondité et la fertilité augmentent si l'on propose aux adultes émergés un tampon d'ouate imbibé d'une solution de sucrose saturée (34).
|
Conditions d'incubation
|
32.
|
L'eau sus-jacente des récipients expérimentaux est soumise à une légère aération, mise en route 24 heures après l'introduction des larves du premier stade des deux générations, et maintenue jusqu'à la fin de l'essai (il faut veiller à ce que la concentration d'oxygène dissous ne tombe pas en dessous de 60 % de la VSA). L'air est insufflé à l'aide d'une pipette Pasteur en verre dont l'extrémité est fixée 2 à 3 cm au-dessus de la couche de sédiment et délivre quelques bulles par seconde. Si la substance chimique d'essai est volatile, on pourra éventuellement supprimer l'aération du système sédiment-eau, à condition de respecter le critère de validité de 60 % de la VSA (voir paragraphe 10). D'autres indications sont données à la référence (16).
|
|
33.
|
L'essai sur C. riparius est mené à une température constante de 20 °C (± 2 °C). Pour C. dilutus et C. yoshimatsui, les températures recommandées sont respectivement de 23 °C et 25 °C (± 2 °C). La photopériode est de 16 heures et l'intensité lumineuse comprise entre 500 et 1 000 lux. Une phase supplémentaire d'une heure récréant l'aube et le crépuscule peut être prévue pour les cages d'élevage.
|
Temps d'exposition
|
34.
|
Protocole avec eau chargée: la période d'exposition de la 1ère génération commence lorsque la substance d'essai est injectée dans l'eau sus-jacente des récipients expérimentaux (c'est-à-dire un jour après l'introduction des larves; voir au paragraphe 7 les modifications possibles du protocole d'exposition). L'exposition de la 2ème génération de larves débute immédiatement, car elles sont introduites dans un système sédiment-eau déjà chargé. Pour C. riparius et C. yoshimatsui, le temps d'exposition maximal est de 27 jours pour la 1ère génération, et de 28 jours pour la 2ème génération (les larves de la 1ère génération passent une journée dans les récipients sans exposition). Compte tenu du chevauchement des deux expositions, la durée totale de l'essai est d'environ 44 jours. Pour C. dilutus, les durées maximales d'exposition sont de 64 et 65 jours respectivement pour la 1ère et la 2ème génération. Au total, l'essai dure environ 100 jours.
Protocole avec sédiment chargé: l'exposition débute avec l'introduction des larves et dure au maximum 28 jours pour les deux générations de C. riparius et C. yoshimatsui, et 65 jours au maximum pour les deux générations de C. dilutus.
|
Observations
Émergence
|
35.
|
La durée du développement et le nombre total de moucherons mâles et femelles adultes totalement émergés et vivants sont à déterminer pour les deux générations. Les mâles sont faciles à identifier grâce à leurs antennes plumeuses et leur corps fin.
|
|
36.
|
Au moins trois fois par semaine, on vérifie que les larves des récipients expérimentaux des deux générations ne manifestent aucun comportement anormal (sortie du sédiment, nage inhabituelle, par exemple) par rapport aux témoins. Au cours de la période d'émergence, qui débute environ 12 jours après l'introduction des larves pour C. riparius et C. yoshimatsui (20 jours après pour C. dilutus), les moucherons émergés sont dénombrés et leur sexe est identifié au moins une fois, mais de préférence deux fois par jour (tôt le matin et en fin d'après-midi). Une fois identifiés, les moucherons de la 1èregénération sont retirés avec soin des récipients et transférés dans une cage d'élevage. Les moucherons de la 2ème génération sont retirés et tués après identification. Les amas d'œufs déposés dans les récipients expérimentaux de la 1ère génération doivent être collectés individuellement et transférés avec au moins 2,5 ml d'eau de formation dans des plaques de microtitration à 12 puits (ou tout autre récipient adapté) fermées par un couvercle afin d'éviter une évaporation importante. Le nombre de larves mortes et de pupes visibles n'ayant pas émergé doit également être consigné. L'Appendice 5 présente des exemples de cage d'élevage, de récipient expérimental et d'extracteur.
|
Reproduction
|
37.
|
On évalue les effets sur la reproduction en déterminant le nombre d'amas d'œufs produits par la 1ère génération de moucherons et la fertilité de ces amas. Une fois par jour, les amas d'œufs sont collectés dans le cristallisoir de chaque cage d'élevage, et transférés avec au moins 2,5 ml d'eau de formation dans des plaques de microtitration à 12 puits (un amas par puits) ou d'autres récipients adaptés, fermés d'un couvercle afin d'éviter une évaporation importante. Les caractéristiques suivantes doivent être consignées par écrit pour chaque amas d'œufs: jour de ponte, taille (normale, soit 1,0 ± 0,3 cm, ou petite, généralement ≤ 0,5 cm), structure (normale = en forme de croissant avec cordon d'œufs spiralé, ou anormale, par exemple avec cordon non spiralé) et fertilité (fertile ou stérile). Sur une période de six jours après sa ponte, la fertilité de chaque amas d'œufs est évaluée. Un amas est considéré comme fertile lorsqu'au moins un tiers des œufs éclot. Le nombre total de femelles transférées dans la cage d'élevage sert à calculer le nombre d'amas d'œufs par femelle, et le nombre d'amas fertiles par femelle. Si nécessaire, le nombre d'œufs par amas peut être estimé de manière non destructive par la méthode des anneaux (expliquée dans les références 32 et 33).
|
Mesures analytiques
Concentration de la substance chimique d'essai
|
38.
|
Il est recommandé d'analyser, au minimum, des échantillons de l'eau sus-jacente, de l'eau interstitielle et du sédiment au début de l'exposition (en cas d'eau chargée, de préférence une heure après l'application) et à la fin de l'essai, et ce pour la concentration la plus élevée et pour une concentration plus faible. Cette recommandation s'applique aux récipients des deux générations. Dans les cristallisoirs de la cage d'élevage, seule l'eau sus-jacente est analysée, car c'est avec elle que les amas d'œufs entrent en contact (pour le protocole avec sédiment chargé, une confirmation analytique de la concentration sédimentaire peut être envisagée). Si cela est jugé nécessaire, d'autres mesures concernant le sédiment, l'eau interstitielle et l'eau sus-jacente peuvent être effectuées au cours de l'essai. La concentration de la substance d'essai nous renseigne sur le comportement et la répartition de la substance d'essai dans le système eau-sédiment. Des échantillons de sédiment et d'eau interstitielle devant être prélevés au début et au cours de l'essai (voir paragraphe 39), on prévoira des récipients expérimentaux supplémentaires afin de réaliser les déterminations analytiques. Il n'est pas forcément nécessaire d'analyser le sédiment dans le protocole avec eau chargée si la répartition de la substance chimique d'essai entre l'eau et le sédiment a été clairement déterminée par une étude eau/sédiment menée dans des conditions comparables (par exemple, rapport sédiment/eau, type d'application, teneur en carbone organique du sédiment), ou si les concentrations mesurées dans l'eau sus-jacente restent comprises entre 80 et 120 % des valeurs nominales ou mesurées initialement.
|
|
39.
|
Lorsqu'on effectue des mesures intermédiaires (par exemple au 7ème et/ou 14ème jour) et si l'analyse requiert des échantillons volumineux qui ne peuvent être prélevés des récipients sans influencer le système expérimental, les analyses seront pratiquées sur des échantillons provenant de récipients expérimentaux supplémentaires traités de la même façon (y compris par la présence des organismes d'expérience), mais non utilisés pour les observations biologiques.
|
|
40.
|
Pour isoler l'eau interstitielle, il est recommandé de centrifuger les échantillons à 10 000 g et à 4 °C durant 30 minutes. Cependant, s'il est démontré que la substance chimique d'essai n'adsorbe pas sur les filtres, la filtration est également acceptable. Avec des échantillons trop petits, il arrive que les concentrations dans l'eau interstitielle soient impossibles à analyser.
|
Paramètres physico-chimiques
|
41.
|
Le pH, l'oxygène dissous dans l'eau d'essai et la température de l'eau dans les récipients expérimentaux et les cristallisoirs sont mesurés de façon appropriée (voir paragraphe 10). La dureté de l'eau et sa teneur en ammoniac sont mesurées dans les récipients témoins ainsi que dans un récipient d'essai et un cristallisoir à la concentration la plus élevée, au début et à la fin de l'essai.
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
42.
|
Cet essai sur le cycle de vie a pour objet de déterminer l'effet de la substance chimique d'essai sur la reproduction et, pour deux générations, sur la vitesse de développement et le nombre total de moucherons mâles et femelles vivants complètement émergés. Pour déterminer le taux d'émergence, il faut rassembler les données concernant les mâles et les femelles. S'il n'existe pas de différence de sensibilité statistiquement significative entre les deux sexes en matière de vitesse de développement, les résultats mâles et femelles pourront être mis en commun à des fins d'analyse statistique.
|
|
43.
|
Il est d'usage de calculer les concentrations efficaces, exprimées en concentrations dans l'eau sus- jacente (pour l'eau chargée) ou dans le sédiment (pour le sédiment chargé), en fonction des concentrations mesurées au début de l'exposition (voir paragraphe 38). Ainsi, en ce qui concerne l'eau chargée, on effectue habituellement pour chaque traitement une moyenne des concentrations initialement mesurées dans l'eau sus-jacente des récipients des deux générations et de celles des cristallisoirs. En ce qui concerne les sédiments chargés, on effectue habituellement pour chaque traitement une moyenne des concentrations initialement mesurées dans les sédiments des récipients des deux générations (et éventuellement de celles des cristallisoirs).
|
|
44.
|
Pour calculer une estimation ponctuelle, c'est-à-dire une CEx, les statistiques par récipient et par cage d'élevage peuvent être utilisées comme réplicats vrais. Pour calculer un intervalle de confiance pour une CEx quelconque, il faut tenir compte de la variabilité entre les récipients, ou démontrer que celle-ci est négligeable. Si le modèle est ajusté par la méthode des moindres carrés, il convient de transformer les statistiques par récipient afin d'accroître l'homogénéité de la variance. Toutefois, les valeurs de la CEx sont à calculer après que les résultats ont été transformés à nouveau de façon à recouvrer la valeur d'origine
|
|
45.
|
Si l'analyse statistique vise à déterminer la CSEO par un test d'hypothèse, il est nécessaire de prendre en compte la variabilité entre les récipients, ce que garantissent les méthodes d'analyse de la variance (procédures de Williams et Dunnett par exemple). Le test de Williams est approprié lorsque la relation dose-effet est supposée être monotone en théorie, tandis que le test de Dunnett convient si l'hypothèse de la monotonie ne tient pas. En revanche, des tests plus robustes (27) peuvent être utilisés au cas où les hypothèses habituelles de l'analyse de variance (ANOVA) ne se vérifient pas (31).
|
Taux d'émergence
|
46.
|
Les données relatives au taux d'émergence sont des données quantales, qui peuvent être analysées par le test de Cochran-Armitage appliqué de façon régressive si la relation dose-effet est supposée être monotone et si les taux d'émergence corroborent cette hypothèse. Dans le cas contraire, un test exact de Fisher ou un test de Mantel-Haentzal avec des valeurs de p corrigées selon Bonferroni-Holm peuvent être employés. S'il s'avère que la variabilité entre réplicats à la même concentration est supérieure à ce qu'une distribution binomiale indiquerait (variation souvent qualifiée d'“extra-binomiale”), on appliquera un test plus robuste (Cochran-Armitage ou test exact de Fisher) comme proposé à la référence (27).
La somme des moucherons (mâles et femelles) vivants émergés par récipient, ne
, est déterminée et divisée par le nombre de larves introduites, na
:

Où:
|
TE
|
=
|
Taux d'émergence
|
|
ne
|
=
|
nombre de moucherons vivants émergés par récipient
|
|
na
|
=
|
nombre de larves introduites par récipient (normalement 20)
|
Lorsque ne
est supérieur à na
(c'est-à-dire lorsqu'involontairement, un nombre de larves plus important que prévu a été introduit), na
doit être augmenté pour être égal à ne
.
|
|
47.
|
Une autre approche plus appropriée aux échantillons de grande taille, lorsque la variance est extra-binomiale, consiste à traiter le taux d'émergence comme une réponse continue et à appliquer une méthode cohérente avec ces données du TE. On considère ici qu'un échantillon est de grande taille lorsque le nombre de moucherons émergés et le nombre de chironomes non émergés sont tous deux supérieurs à cinq par (récipient de) réplicat.
|
|
48.
|
Avant d'appliquer l'analyse de variance (ANOVA), il faut d'abord transformer les valeurs du TE par arcsinus-racine carrée ou selon Tukey-Freeman, afin d'obtenir une distribution proche de la normale et d'égaliser les variances. Le test de Cochran-Armitage, le test exact de Fisher (avec correction selon Bonferroni) ou le test de Mantel-Haentzal peuvent être employés lorsqu'on utilise les fréquences absolues. La transformation arcsinus-racine carrée consiste à calculer le sinus inverse (sinus– 1) de la racine carrée du TE.
|
|
49.
|
Pour les taux d'émergence, les valeurs de la CEx sont calculées au moyen d'une analyse de régression [modèles probit, logit ou Weibull (28), par exemple]. Si l'analyse de régression échoue (par exemple, lorsqu'il y a moins de deux réponses partielles), on fait appel à d'autres méthodes non paramétriques telles que la moyenne mobile ou l'interpolation simple.
|
Vitesse de développement
|
50.
|
La période moyenne de développement correspond au temps moyen écoulé entre l'introduction des larves (jour 0 de l'essai) et l'émergence de la cohorte expérimentale de moucherons (pour calculer la période réelle de développement, il faut tenir compte de l'âge des larves au moment de l'introduction). La vitesse de développement est l'inverse de la période de développement (unité: 1/jour) et correspond à la portion de développement larvaire qui s'effectue par jour. Pour évaluer la toxicité dans les sédiments, il est préférable de choisir la vitesse de développement car sa variance est plus faible et ses valeurs sont plus homogènes et plus proches d'une distribution normale, en comparaison avec la période de développement. C'est pourquoi des tests paramétriques plus puissants conviennent mieux à la vitesse de développement qu'à la période de développement. Si la vitesse de développement est traitée comme une réponse continue, les valeurs de la CEx peuvent être estimées par une analyse de régression [voir (29) (30)]. Les méthodes d'analyse de la variance (ANOVA), telles que les essais de Williams ou Dunnett, permettent de déterminer une CSEO pour la vitesse moyenne de développement. Les moucherons mâles émergeant plus tôt que les femelles, et présentant donc une vitesse de développement plus rapide, il est pertinent de calculer la vitesse de développement de chacun des sexes, en plus de celle de l'ensemble des moucherons.
|
|
51.
|
Pour les tests statistiques, les moucherons observés le jour x sont considérés comme ayant émergé au milieu de l'intervalle de temps compris entre le jour x et le jour x – 1 (1 = longueur de l'intervalle d'observation, habituellement 1 jour). La vitesse de développement moyenne par récipient (

) est calculée comme suit:

Où:
|

|
:
|
vitesse de développement moyenne par récipient
|
|
i
|
:
|
indice de l'intervalle d'observation
|
|
m
|
:
|
nombre maximal d'intervalles d'observation
|
|
fi
|
:
|
nombre de moucherons émergés durant l'intervalle d'observation i
|
|
ne
|
:
|
nombre total de moucherons émergés à la fin de l'expérience (Σfi
)
|
|
xi
|
:
|
vitesse de développement des moucherons émergés durant l'intervalle i
|

Où:
|
jouri
|
:
|
jour d'observation (nombre de jours depuis l'introduction des larves)
|
|
li
|
:
|
longueur de l'intervalle d'observation i (exprimée en jours, habituellement 1 jour)
|
|
Sex ratio
|
52.
|
Les données relatives au sex-ratio sont des données quantales qui doivent donc être évaluées au moyen d'un test exact de Fisher ou d'autres méthodes appropriées. Le sex-ratio naturel de C. riparius est de un, c'est-à-dire que le nombre de mâles est égal au nombre de femelles. Le sex-ratio doit être calculé de la même manière pour les deux générations. Le nombre maximum de moucherons par récipient (soit 20) étant trop faible pour permettre des analyses statistiques significatives, on additionnera le nombre total de moucherons complètement émergés et vivants de chaque sexe dans tous les récipients d'un même traitement. Ces données brutes sont comparées au témoin (solvant) ou aux résultats des témoins groupés dans un tableau à double entrée (2 × 2).
|
Reproduction
|
53.
|
La reproduction, tout comme la fécondité, est calculée comme le nombre d'amas d'œufs par femelle. Plus précisément, le nombre total d'amas d'œufs produits dans une cage d'élevage est divisé par le nombre total de femelles vivantes et en bonne santé introduites dans cette cage. Il est possible de déterminer une CSEO pour la fécondité en utilisant des méthodes d'analyse de variance (ANOVA) telles que le test de Williams ou de Dunnett.
|
|
54.
|
La fertilité des amas d'œufs sert à quantifier le nombre d'amas fertiles par femelle. Le nombre total d'amas fertiles produits dans une cage d'élevage est divisé par le nombre total de femelles vivantes et en bonne santé introduites dans cette cage. Il est possible de déterminer une CSEO pour la fertilité en utilisant des méthodes d'analyse de variance (ANOVA) telles que le test de Williams ou de Dunnett.
|
Rapport d'essai
|
55.
|
Le rapport d'essai doit fournir les informations suivantes:
|
|
Substance d'essai
|
—
|
état physique et propriétés physico-chimiques [par exemple, hydrosolubilité, pression de vapeur, log Koe
, coefficient de partage dans le sol (ou dans le sédiment s'il est connu), stabilité dans l'eau et dans le sédiment, etc.];
|
|
—
|
identification chimique (nom courant, nom chimique, formule structurale, numéro CAS, etc.), pureté et méthode analytique de dosage de la substance d'essai.
|
|
|
|
Espèces d'essai:
|
—
|
organismes utilisés pour l'essai: espèce, nom scientifique, source et conditions d'élevage;
|
|
—
|
informations sur la manipulation des amas d'œufs et des larves;
|
|
—
|
informations sur la manipulation des adultes émergés de la 1ère génération à l'aide d'un extracteur ou autre appareil (voir Appendice 5);
|
|
—
|
âge des organismes d'essai au moment de leur introduction dans les récipients expérimentaux de la 1ère et de la 2ème générations.
|
|
|
|
Conditions de l'essai:
|
—
|
sédiment utilisé, c'est-à-dire naturel ou reconstitué (artificiel);
|
|
—
|
pour les sédiments naturels: localisation et description du site de prélèvement avec, si possible, son historique de contamination; caractéristiques du sédiment: pH, teneur en carbone organique, rapport C/N et granulométrie (s'il y a lieu);
|
|
—
|
pour les sédiments reconstitués: préparation, ingrédients et caractéristiques (teneur en carbone organique, pH, humidité, etc. mesurés au début de l'essai);
|
|
—
|
préparation de l'eau d'essai (si l'eau est reconstituée) et caractéristiques (concentration d'oxygène, pH, dureté, etc. mesurés au début de l'essai);
|
|
—
|
profondeur du sédiment et de l'eau sus-jacente dans les récipients expérimentaux et les cristallisoirs;
|
|
—
|
volume d'eau sus-jacente et d'eau interstitielle; poids du sédiment humide avec et sans eau interstitielle dans les récipients expérimentaux et les cristallisoirs;
|
|
—
|
récipients expérimentaux (matériau et dimension);
|
|
—
|
cristallisoirs (matériau et dimension);
|
|
—
|
cages d'élevage (matériau et dimension);
|
|
—
|
méthode de préparation des solutions-mères et concentrations d'essai pour les récipients expérimentaux et les cristallisoirs;
|
|
—
|
application de la substance d'essai dans les récipients d'essai et les cristallisoirs: concentrations d'essai, nombre de réplicats et solvants, si nécessaire;
|
|
—
|
conditions d'incubation des récipients d'essai: température, cycle et intensité de lumière, aération (nombre de bulles par seconde);
|
|
—
|
conditions d'incubation pour les cages d'élevage et les cristallisoirs: température, cycle et intensité de lumière;
|
|
—
|
conditions d'incubation pour les amas d'œufs dans les plaques de microtitration (ou autres récipients): température, cycle et intensité de lumière;
|
|
—
|
informations détaillées sur la nourriture, notamment: type, préparation, quantité et régime d'administration.
|
|
|
|
Résultats:
|
—
|
concentrations d'essai nominales, concentrations d'essai mesurées et résultats de toutes les analyses conduites pour déterminer la concentration de la substance d'essai dans les récipients expérimentaux et les cristallisoirs;
|
|
—
|
qualité de l'eau dans les récipients expérimentaux et les cristallisoirs: pH, température, oxygène dissous, dureté et teneur en ammoniac;
|
|
—
|
remplacement de l'eau d'essai évaporée dans les récipients expérimentaux, le cas échéant;
|
|
—
|
nombre de moucherons mâles et femelles émergés par récipient et par jour pour la 1ère et la 2ème générations;
|
|
—
|
sex-ratio des moucherons entièrement émergés et vivants par traitement pour la 1ère et la 2ème générations;
|
|
—
|
nombre de larves non émergées sous la forme de moucherons par récipient pour la 1ère et la 2ème génération;
|
|
—
|
pourcentage/fraction d'émergence par réplicat et concentration d'essai (regroupement des résultats pour les moucherons mâles et femelles) pour la 1ère et la 2ème génération;
|
|
—
|
vitesse moyenne de développement des moucherons entièrement émergés et vivants par réplicat et par concentration d'essai (résultats séparés pour les moucherons mâles et femelles, ainsi que résultats regroupés) pour la 1ère et la 2ème génération;
|
|
—
|
nombre d'amas d'œufs déposés dans les cristallisoirs par cage d'élevage et par jour;
|
|
—
|
caractéristiques de chaque amas d'œufs (taille, forme et fertilité);
|
|
—
|
fécondité — nombre total d'amas d'œufs sur nombre total de femelles introduites dans la cage d'élevage;
|
|
—
|
fertilité — nombre total d'amas fertiles sur nombre total de femelles introduites dans la cage d'élevage;
|
|
—
|
estimation des effets toxiques observés, par exemple CEx (et intervalles de confiance associés), CSEO et méthodes statistiques employées pour la déterminer;
|
|
—
|
discussion des résultats, notamment influence éventuelle sur les résultats de l'essai d'écarts par rapport à cette Ligne directrice.
|
|
|
BIBLIOGRAPHIE
|
(1)
|
Chapitre C.28 de la présente annexe, Essi de toxicité sur les chironomes dans un système eau chargée-sédiment.
|
|
(2)
|
Shobanov, N.A., Kiknadze, I.I. and M.G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311-322.
|
|
(3)
|
Fleming, R. et al. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. August 1994. WRc, UK.
|
|
(4)
|
SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, Document de l'atelier sur l'évaluation de la toxicité des sédiments (WOSTA) tenu aux Pays-Bas.
|
|
(5)
|
ASTM International (2009), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards. Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
(6)
|
Environnement Canada (1997), Essai de survie et de croissance des larves dulcicoles de chironomes (Chironomus tentans ou Chironomus riparius) dans les sédiments, Méthode d'essai biologique, Rapport SPE 1/RM/32, Décembre 1997.
|
|
(7)
|
US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sediment- associated Contaminants with Freshwater Invertebrates. Deuxième édition, EPA 600/R-99/064. Mars 2000, Révision de la première édition (datant de juin 1994).
|
|
(8)
|
US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates.
|
|
(9)
|
US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment toxicity Test.
|
|
(10)
|
Milani, D., Day, K.E., McLeay, D.J. et R.S. Kirby (1996), Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canada.
|
|
(11)
|
Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R. and C.D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662-2674.
|
|
(12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. and L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221-230.
|
|
(13)
|
Sugaya, Y. (1997), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345-350.
|
|
(14)
|
Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47-57.
|
|
(15)
|
Chapitre C.27 de la présente annexe, Essai de toxicité sur les chironomes dans un système eau-sédiment chargé.
|
|
(16)
|
OCDE (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Publications de l'OCDE sur l'environnement, la santé et la sécurité, Série de l'OCDE sur les essais et l'évaluations no 23, ENV/JM/MONO(2000)6, OCDE, Paris.
|
|
(17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. and M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
(18)
|
Environnement Canada. (1995), Document d'orientation sur la mesure de la précision des essais de toxicité au moyen de sédiments de contrôle dopés avec un produit toxique de référence. Rapport SPE 1/RM/30, Septembre 1995.
|
|
(19)
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. et J. Oehlmann (2005), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: 353-361.
|
|
(20)
|
Suedel, B.C. et J.H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163-1175.
|
|
(21)
|
Naylor, C. and C. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291-3303.
|
|
(22)
|
Dunnett, C.W. (1964), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096-1121.
|
|
(23)
|
Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: 482-491.
|
|
(24)
|
Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117.
|
|
(25)
|
Williams, D.A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28: 510-531.
|
|
(26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L. and H.M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94-102.
|
|
(27)
|
Rao, J.N.K. et A.J. Scott (1992), A simple method for the analysis of clustered binary data. Biometrics, 48: 577-585.
|
|
(28)
|
Christensen, E.R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res, 18: 213-221.
|
|
(29)
|
Bruce, R.D. and D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485-1494.
|
|
(30)
|
Slob, W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298-312.
|
|
(31)
|
OCDE (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application, Publications Hygiène et Sécurité de l'environnement, Série sur les essais et l'évaluation, Document d'orientation de l'OCDE no 54, 146 pp., ENV/JM/MONO(2006)18, OCDE, Paris.
|
|
(32)
|
Benoit, D.A., Sibley, P.K., Juenemann, J.L. et G.T. Ankley (1997), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165-1176.
|
|
(33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. and J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) — baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: 1-9.
|
|
(34)
|
OCDE (2010), Validation report of the Chironomid full life-cycle toxicity test, Publication prochaîne dans la série sur les essais et l'évaluation, OCDE, Paris.
|
Appendice 1
Définitions
Les définitions suivantes s'appliquent aux fins de la présente méthode d'essai:
|
|
Substance chimique: une substance ou un mélange.
|
|
|
Sédiment reconstitué, artificiel ou synthétique: mélange de matériaux utilisés pour reproduire au mieux les composants physiques d'un sédiment naturel.
|
|
|
Eau sus-jacente: eau surmontant le sédiment dans le récipient expérimental.
|
|
|
Eau interstitielle, ou eau des pores: eau qui occupe l'espace entre le sédiment et les particules de sol.
|
|
|
Eau chargée: eau d'essai à laquelle a été ajoutée la substance d'essai.
|
|
|
Substance chimique d'essai: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
|
Appendice 2
Recommandations pour la culture de Chironomus riparius
|
1.
|
Les larves de Chironomus peuvent être élevées dans des cristallisoirs ou de grands récipients. Du sable quartzique fin est déposé en couche mince (environ 5 à 10 mm d'épaisseur) au fond du récipient. Le Kieselguhr (par exemple l'art. 8117 de Merck) convient aussi comme substrat (une couche encore plus mince de quelques millimètres à peine suffit). Une eau de qualité appropriée, profonde de plusieurs centimètres, vient ensuite recouvrir le substrat. En cas d'évaporation, le niveau d'eau doit toujours être ramené à sa hauteur initiale, afin de prévenir toute dessiccation. L'eau peut être remplacée si nécessaire. Une légère aération est fournie. Les récipients d'élevage des larves doivent être placés dans des cages appropriées, afin d'empêcher la fuite des adultes émergeant. La cage sera suffisamment grande pour permettre aux adultes émergés d'essaimer, sans quoi la copulation risque de ne pas avoir lieu (dimensions minimales: 30 × 30 × 30 cm).
|
|
2.
|
Les cages sont gardées à température ambiante, ou à 20 ± 2 °C si elles sont placées dans une chambre à ambiance constante, avec une photopériode de 16 heures de lumière (intensité: environ 1 000 lux) et 8 heures d'obscurité. Une humidité relative de l'air inférieure à 60 % serait susceptible d'empêcher la reproduction.
|
Eau de dilution
|
3.
|
Toute eau naturelle ou reconstituée appropriée peut être utilisée. De l'eau de puits, de l'eau du robinet déchlorée et un milieu artificiel (Elendt “M4” ou “M7”, voir ci-après) sont souvent utilisés. L'eau est aérée avant l'emploi. Si nécessaire, on peut renouveler l'eau de culture en versant ou en siphonnant soigneusement l'eau usée des récipients expérimentaux, sans détruire les tubes larvaires.
|
Alimentation des larves
|
4.
|
Les larves de Chironomus reçoivent des paillettes pour poissons (Tetra Min®, Tetra Phyll® ou une autre marque déposée équivalente), à raison d'environ 250 mg par récipient et par jour. Cette nourriture peut être administrée sous la forme d'une poudre moulue à sec ou d'une suspension dans l'eau: 1,0 g de paillettes ajoutées à 20 ml d'eau de dilution et agitées de façon à obtenir un mélange homogène. Cette préparation peut être administrée à raison d'environ 5 ml par récipient et par jour (agiter avant emploi). Les larves plus âgées peuvent en recevoir plus.
|
|
5.
|
La nourriture est ajustée en fonction de la qualité de l'eau. Si le milieu de culture devient trouble, il convient de réduire la ration. Les quantités de nourriture données sont soigneusement notées. Une insuffisance de nourriture fera émigrer les larves vers la colonne d'eau, tandis qu'un excès de nourriture intensifiera l'activité microbienne et abaissera la concentration d'oxygène. Ces deux conditions sont susceptibles de ralentir la croissance des organismes.
|
|
6.
|
Certaines cellules d'algues vertes (Scenedesmus subspicatus, Chlorella vulgaris, par exemple) peuvent aussi être ajoutées lors de la préparation de nouveaux récipients de culture.
|
Alimentation des adultes émergents
|
7.
|
Certains expérimentateurs ont suggéré de nourrir les adultes émergés au moyen d'un tampon d'ouate imbibé d'une solution de sucrose saturée.
|
Émergence
|
8.
|
À 20 ± 2 °C, les adultes commencent à émerger des récipients d'élevage des larves après environ 13 à 15 jours. Les mâles sont faciles à identifier grâce à leurs antennes plumeuses et leur corps fin.
|
Amas d'œufs
|
9.
|
Dès que des adultes sont présents dans la cage d'élevage, il faut vérifier trois fois par semaine, dans tous les récipients d'élevage de larves, si des amas d'œufs gélatineux ont été déposés. Si tel est le cas, les amas d'œufs doivent être soigneusement enlevés et transférés dans un petit récipient contenant un échantillon de l'eau d'élevage. Les amas d'œufs servent à préparer un nouveau récipient de culture (2 à 4 amas d'œufs par récipient, par exemple) ou à pratiquer des essais de toxicité.
|
|
10.
|
Les larves du premier stade devraient éclore après 2-3 jours.
|
Préparation de nouveaux récipients de culture
|
11.
|
Une fois que les cultures ont été lancées, il devrait être possible de préparer un nouveau récipient de culture de larves, une fois par semaine ou moins souvent, suivant les besoins de l'essai, et de retirer les récipients plus anciens après l'émergence des moucherons adultes. Ce système permet d'obtenir régulièrement un contingent d'adultes, avec une organisation minimale.
|
Préparation des solutions d'essai “M4” et “M7”
|
12.
|
Elendt (1990) a décrit le milieu “M4”. Le milieu “M7” est préparé comme le milieu “M4”, sauf pour les substances indiquées au tableau 1, dont les concentrations sont quatre fois plus faibles dans le milieu “M7” que dans le milieu “M4”. La solution d'essai ne doit pas être préparée selon les instructions d'Elendt et Bias (1990), car les concentrations de NaSiO3 · 5H2O, NaNO3, KH2PO4 et K2HPO4 indiquées pour la préparation des solutions-mères ne conviennent pas.
|
Préparation du milieu “M7”
|
13.
|
Chaque solution-mère (I) est préparée séparément et une solution-mère combinée (II) est préparée à partir de ces solutions-mères (I) (voir tableau 1). Cinquante millilitres de la solution-mère combinée (II), additionnés de la quantité de chaque solution-mère de macronutriments indiquée au tableau 2, sont amenés à 1 litre avec de l'eau désionisée pour composer le milieu “M7”. On prépare une solution-mère de vitamines en ajoutant trois vitamines à de l'eau désionisée, comme indiqué au tableau 3, et l'on verse 0,1 ml de la solution-mère combinée de vitamines au milieu “M7” final, peu avant l'emploi (la solution-mère de vitamines est stockée congelée par petites aliquotes). Le milieu est aéré et stabilisé.
|
Tableau 1
Solutions-mères d'éléments en traces pour les milieux M4 et M7
|
Solutions-mères (I)
|
Quantité (mg) pour former une solution de 1 litre avec de l'eau désionisée
|
Pour préparer la solution-mère (II): mélanger les quantités suivantes (ml) de solutions-mères (I) et compléter à un litre avec de l'eau désionisée
|
Concentrations finales dans les solutions expérimentales (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7H2O (25)
(26)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tableau 2
Solutions-mères de macronutriments pour les milieux M4 et M7
|
|
Quantité pour former une solution de 1 litre avec de l'eau désionisée
(mg)
|
Quantités de solutions-mères de macronutriments ajoutées pour préparer les milieux M4 et M7
(ml/l)
|
Concentrations finales dans les solutions expérimentales M4 et M7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tableau 3
Solution-mère de vitamines pour les milieux M4 et M7
Les trois solutions de vitamines sont mélangées de façon à former une solution-mère de vitamines.
|
|
Quantité pour former une solution de 1 litre avec de l'eau désionisée
(mg)
|
Quantités de solutions-mères de macronutriments ajoutées pour préparer les milieux M4 et M7
(ml/l)
|
Concentrations finales dans les solutions expérimentales M4 et M7
(mg/l)
|
|
Hydrochlorure de thiamine
|
750
|
0,1
|
0,075
|
|
Cyanocobalamine (B12)
|
10
|
0,1
|
0,0010
|
|
Biotine
|
7,5
|
0,1
|
0,00075
|
RÉFÉRENCES
BBA (1995), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, Édité par M. Streloke et H. Köpp. Berlin.
Elendt, B.P. (1990), Selenium deficiency in Crustacea, Protoplasma, 154: 25-33.
Elendt, B.P. and W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157-1167.
Appendice 3
Préparation du sédiment reconstitué
COMPOSITION DU SÉDIMENT
Le sédiment est reconstitué comme suit:
|
Ingrédient
|
Caractéristiques
|
% du sédiment poids sec
|
|
Tourbe
|
Tourbe à sphaigne, pH aussi proche que possible de 5,5-6,0, pas de résidus de plantes visibles, finement broyée (particules ≤ 1 mm) et séchée à l'air
|
4 - 5
|
|
Sable quartzique
|
Granulométrie: plus de 50 % des particules mesurent entre 50 et 200 μm
|
75 - 76
|
|
Argile kaolinique
|
Taux de kaolinite ≥ 30 %
|
20
|
|
Carbone organique
|
Ajusté par l'addition de tourbe et de sable
|
2 (± 0,5)
|
|
Carbonate de calcium
|
CaCO3, pulvérisé, chimiquement pur
|
0,05 - 0,1
|
|
Eau
|
Conductivité ≤ 10 μS/cm
|
30 - 50
|
PRÉPARATION
La tourbe est séchée à l'air et broyée en poudre fine. Une suspension de la quantité requise de poudre de tourbe dans de l'eau désionisée est préparée à l'aide d'un homogénéisateur à haute performance. Le pH de cette suspension est ajusté à 5,5 ± 0,5 avec du CaCO3. On conditionne la suspension durant au moins deux jours en l'agitant doucement à 20 ± 2 °C, afin de stabiliser le pH et d'établir une flore microbienne stable. On vérifie à nouveau le pH, qui doit atteindre 6,0 ± 0,5. Puis la suspension de tourbe est mélangée avec les autres ingrédients (sable et argile kaolinique) et de l'eau désionisée pour former un sédiment homogène dont la teneur en eau est comprise entre 30 et 50 % du poids sec du sédiment. Le pH du mélange final est à nouveau mesuré et ajusté à 6,5-7,5 avec du CaCO3, si nécessaire. On prélève des échantillons de sédiment afin de déterminer le poids sec et la teneur en carbone organique. Il est ensuite recommandé, avant d'utiliser le sédiment reconstitué dans l'essai de toxicité sur les chironomes, de le conditionner durant sept jours dans des conditions identiques à celles qui régneront durant l'essai subséquent.
STOCKAGE
Les ingrédients secs destinés à la préparation du sédiment artificiel peuvent être entreposés dans un endroit sec et frais, à température ambiante. Le sédiment reconstitué (humide) n'est pas stocké avant son utilisation dans l'essai. Il est utilisé immédiatement après la période de conditionnement de sept jours qui achève sa préparation.
RÉFÉRENCES
OCDE (1984), Ver de terre, essais de toxicité aiguë, Ligne directrice No 207, Lignes directrices pour les essais de produits chimiques, OCDE, Paris.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. et B. Streit (1998), Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10-20.
Appendice 4
Caractéristiques chimiques d'une eau de dilution acceptable
|
CONSTITUANT
|
CONCENTRATIONS
|
|
Particules
|
< 20 mg/l
|
|
Carbone organique total
|
< 2 mg/l
|
|
Ammoniac non ionisé
|
< 1 μg/l
|
|
Dureté en CaCO3
|
< 400 mg/l (27)
|
|
Chlore résiduel
|
< 10 μg/l
|
|
Pesticides organophosphorés totaux
|
< 50 ng/l
|
|
Pesticides organochlorés totaux plus biphényles polychlorés
|
< 50 ng/l
|
|
Chlore organique total
|
< 25 ng/l
|
Appendice 5
Conseils pour la réalisation de l'essai
Exemple de cage d'élevage:
|
A
|
:
|
gaze sur le dessus et au moins un côté de la cage (maillage environ 1 mm)
|
|
B
|
:
|
ouverture permettant d'introduire les adultes émergés à l'intérieur de la cage et de retirer les amas d'œufs des cristallisoirs (non représentés sur ce schéma)
|
|
C
|
:
|
taille minimale de la cage d'élevage: 30 cm de longueur, 30 cm de hauteur et 30 cm de profondeur
|
Exemple de récipient expérimental:

|
A
|
:
|
pipette Pasteur permettant d'aérer l'eau sus-jacente
|
|
B
|
:
|
couvercle en verre empêchant les moucherons de s'échapper
|
|
C
|
:
|
surface de la couche d'eau
|
|
D
|
:
|
récipient expérimental (bécher en verre d'une contenance minimum de 600 ml)
|
|
E
|
:
|
couche de sédiment
|
Exemple d'extracteur pour la capture des moucherons adultes (les flèches indiquent la direction du flux d'air):
|
A
|
:
|
tube de verre (diamètre interne environ 5 mm) relié à une pompe à amorçage automatique
|
|
B
|
:
|
bouchon en caoutchouc vulcanisé, transpercé d'un tube de verre (A). Face intérieure, l'ouverture du tube de verre (A) est recouverte de coton et d'une gaze (maillage environ 1 mm2) pour empêcher d'endommager les moucherons lorsqu'ils sont aspirés dans l'extracteur
|
|
C
|
:
|
conteneur transparent (en plastique ou verre, longueur 15 cm environ) pour les moucherons capturés
|
|
D
|
:
|
bouchon en caoutchouc vulcanisé, transpercé d'un tube (E). Pour libérer les moucherons dans la cage d'élevage, retirer le bouchon D du conteneur C
|
|
E
|
:
|
tube (de plastique ou de verre, diamètre intérieur environ 8 mm) pour collecter les moucherons dans le récipient expérimental
|
Présentation schématique d'un essai sur le cycle de vie:

|
A
|
:
|
1ère génération — récipients expérimentaux contenant un système sédiment-eau, huit réplicats, 20 larves de premier stade par récipient
|
|
B
|
:
|
quatre récipients expérimentaux pour chaque cage d'élevage, A et B
|
|
C
|
:
|
cages d'élevage (A et B) pour l'essaimage, l'accouplement et la ponte
|
|
D
|
:
|
cristallisoirs pour le dépôt des amas d'œufs
|
|
E
|
:
|
plaques de microtitration, un puits par amas d'œufs
|
|
F
|
:
|
2ème génération — récipients expérimentaux contenant un système sédiment-eau, huit réplicats, 20 larves de premier stade par récipient
|
C.41. ESSAI DE DÉVELOPPEMENT SEXUEL DES POISSONS
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 234 (2011) de l'OCDE pour les essais de produits chimiques. Elle découle d'une décision de 1998 visant à réviser les méthodes d'essai existantes ou à en élaborer de nouvelles concernant les essais de dépistage et les essais plus poussés de perturbateurs endocriniens potentiels. L'essai de développement sexuel des poissons (EDSP) a été identifié comme une méthode d'essai prometteuse couvrant un stade de la vie sensible chez les poissons et réceptif à la fois aux œstrogènes et aux androgènes. De 2006 à 2010, cette méthode d'essai a fait l'objet d'un programme de validation inter-laboratoires qui a permis la validation du medaka japonais (Oryzias latipes), du poisson-zèbre (Danio rerio) et de l'épinoche à trois épines (Gasterosteus aculeatus) et la validation partielle du tête-de-boule (Pimephales promelas) (41) (42) (43). Ce protocole inclut le medaka japonais, le poisson-zèbre et l'épinoche. Il vient, en principe, enrichir la ligne directrice 210 de l'OCDE: Poisson, Essai de Toxicité aux Premiers Stades de la Vie (1), avec une exposition maintenue jusqu'à la différenciation sexuelle des poissons, soit pendant les quelque 60 jours qui suivent l'éclosion pour le medaka japonais, l'épinoche et le poisson-zèbre (la période d'exposition peut être plus courte ou plus longue pour d'autres espèces validées ultérieurement), et avec l'ajout des effets observés sur le système endocrinien. L'EDSP évalue les effets aux premiers stades de la vie et les effets néfastes possibles de perturbateurs endocriniens potentiels (œstrogènes, androgènes et inhibiteurs de la stéroïdogenèse, par exemple) sur le développement sexuel. La combinaison des deux principaux effets observés sur le système endocrinien, la concentration de vitellogénine (VTG) et le ratio mâles/femelles phénotypique, permet à l'essai d'indiquer le mode d'action de la substance chimique d'essai. Étant donné que les évolutions du ratio mâles/femelles sont caractéristiques d'une population donnée, l'EDSP peut être utilisé pour l'évaluation des dangers et des risques. Cependant, si le test est utilisé à des fins d'évaluation des dangers et des risques, l'épinoche ne devrait pas être utilisée car les données de validation disponibles à ce jour ont montré que chez cette espèce les altérations du ratio mâles/femelles phénotypiques sont atypiques.
|
|
2.
|
Ce protocole s'appuie sur l'exposition de poissons exposés via de l'eau à des substances chimiques durant la période sexuelle labile, au cours de laquelle les poissons peuvent être extrêmement sensibles aux effets des perturbateurs endocriniens qui interfèrent dans le développement sexuel. Deux effets principaux sont mesurés pour indiquer les aberrations du développement liées au système endocrinien, les concentrations de VTG et les ratios mâles/femelles déterminés via l'histologie gonadique. L'histopathologie gonadique (évaluation et classement par stade des ovocytes et des cellules spermatogénétiques) est optionnelle. De plus, le sexe génétique est déterminé si possible (chez le medaka japonais et l'épinoche, par exemple). La présence d'un marqueur du sexe génétique présente un avantage considérable car elle permet d'améliorer la puissance statistique des effets mesurés sur le ratio mâles/femelles et permet la détection du changement de sexe phénotypique chez chaque individu. Les autres effets apicaux à mesurer sont le taux d'éclosion, la survie, la longueur et le poids corporel. On pourrait envisager d'adapter cette méthode d'essai à d'autres espèces que celles mentionnées précédemment à condition que ces autres espèces fassent l'objet d'une validation équivalente à celle effectuée pour le medaka japonais, l'épinoche et le poisson-zèbre, que les poissons témoins soient sexuellement différenciés à la fin de l'essai, que les niveaux de VTG soient suffisamment élevés pour que l'on puisse détecter des variations significatives dues à la substance, et que la sensibilité du système expérimental soit établie par le biais de perturbateurs endocriniens de référence [(anti)-œstrogènes, (anti)-androgènes, inhibiteurs de l'aromatase, etc.]. De plus, il convient que tout rapport de validation faisant référence à des données de l'EDSP utilisant d'autres espèces soit examiné par l'OCDE, et que le résultat de la validation soit considéré comme satisfaisant.
|
Remarques prémiminaires et limites de l'essai
|
3.
|
La VTG est normalement produite par le foie des femelles vertébrées ovipares en réponse à la circulation d'œstrogènes endogènes (2). Il s'agit d'un précurseur des protéines du vitellus, produit par le foie puis acheminé par le sang vers les ovaires, où il est capté et modifié par les ovocytes en croissance. La synthèse de la VTG est très limitée, quoique détectable, chez les poissons immatures et les poissons mâles adultes car la circulation des œstrogènes n'y est pas suffisante. Néanmoins, le foie peut synthétiser et secréter la VTG en réponse à une stimulation œstrogénique exogène (3) (4) (5).
|
|
4.
|
La mesure de la VTG sert à détecter les substances chimiques ayant des modes d'action œstrogéniques, anti-œstrogéniques, et androgéniques, ainsi que les substances qui interfèrent dans la stéroïdogenèse, telles que les inhibiteurs de l'aromatase. Cette détection peut se faire par la mesure de l'induction de VTG chez les poissons mâles; elle a fait l'objet de nombreuses publications scientifiques dans des revues à comité de lecture. L'induction de VTG a également été démontrée suite à une exposition à des androgènes aromatisables (6) (7). La diminution du taux d'œstrogènes circulants chez les femelles sous l'effet, par exemple, de l'inhibition de l'aromatase, l'enzyme permettant de convertir l'androgène endogène en œstrogène naturel (17β-œstradiol), engendre une diminution du niveau de VTG utilisée pour détecter les substances dont les propriétés inhibent l'aromatase ou, plus largement, les inhibiteurs de la stéroïdogenèse (33). La pertinence biologique de la réponse donnée par la VTG suite à l'inhibition des œstrogènes/de l'aromatase est établie et a été abondamment étudiée (8) (9). Néanmoins la production de VTG chez les femelles peut également être affectée par une toxicité générale et des modes d'action toxiques non- endocriniens.
|
|
5.
|
Plusieurs méthodes de mesure ont été développées avec succès et normalisées en vue d'essais de routine pour quantifier la VTG dans le sang, le foie, des échantillons d'homogénats de l'ensemble du corps ou de tête-queue prélevés individuellement sur des poissons. C'est le cas du poisson-zèbre, de l'épinoche, du medaka japonais, du tête-de-boule, une espèce partiellement validée, pour lesquels les méthodes ELISA (procédé immunochimique d'absorption enzymatique) utilisant l'immunochimie pour la quantification de la VTG sont disponibles (5) (10) (11) (12) (13) (14) (15) (16). Chez le medaka japonais et le poisson-zèbre, il existe une bonne corrélation entre les concentrations de VTG mesurées dans le plasma sanguin, le foie et les échantillons d'homogénats bien que les homogénats aient tendance à donner des valeurs légèrement inférieures au plasma (17) (18) (19). Les procédures recommandées pour les prélèvements effectués en vue du dosage de la VTG sont décrites dans l'Appendice 5.
|
|
6.
|
L'évolution du ratio mâles/femelles constitue un indicateur de changement de sexe. En principe, les œstrogènes, les anti-œstrogènes, les androgènes, les anti-androgènes et les inhibiteurs de la stéroïdogenèse peuvent affecter le ratio mâles/femelles des poissons en développement (20). On a pu constater que ce changement de sexe était partiellement réversible chez le poisson-zèbre (21) suite à l'exposition à des substances de type œstrogénique, tandis qu'un changement de sexe suite à l'exposition à des substances chimiques de type androgénique est permanente (30). Le sexe est défini comme féminin, masculin, hermaphrodite (ovocytes et cellules spermatogénétiques dans une seule et même gonade) ou indifférencié chez chaque poisson via l'examen histologique des gonades. Des recommendations sont fournies dans l'Appendice 7 et dans le document d'orientation de l'OCDE Diagnosis of Endocrine-Related Histopathology of Fish Gonads (22).
|
|
7.
|
Le sexe génétique est examiné via des marqueurs génétiques lorsqu'ils existent dans une espèce de poissons donnée. Chez le medaka japonais, les gènes féminins XX ou masculins XY peuvent être détectés par réaction en chaîne par polymérase (PCR), ou le gène lié à Y du domaine DM (DMY) peut être analysé (DMY négatif ou positif) tel que décrit dans les documents de référence (23) (24). Pour l'épinoche, il existe une méthode de PCR équivalente pour la détermination du sexe génétique, décrite dans l'Appendice 10. Lorsque le sexe génétique peut être individuellement mis en relation avec le sexe phénotypique, l'essai est renforcé et le sexe génétique est donc être déterminé dans des espèces ayant des marqueurs du sexe génétique abondamment étudiés.
|
|
8.
|
Les deux principaux effets mesurés sur le système endocrinien, la VTG et le ratio mâles/femelles, peuvent, s'ils sont combinés, démontrer le mode d'action de la substance chimique sur le système endocrinien (tableau 1). Le ratio mâles/femelles est un biomarqueur pertinent en terme de population (25) (26), et pour des modes d'action bien définis, les résultats de l'EDSP peuvent être utilisés pour évaluer les dangers et les risques si cela est jugé opportun par l'agence réglementaire. Ces modes d'action sont actuellement ceux des œstrogènes, androgènes et inhibiteurs de la stéroïdogenèse.
Tableau 1
réaction des effets mesurés sur le système endocrinien à différents modes d'action de substances chimiques:
↑ = augmentation,↓ = diminution, — = non recherché
|
Modes d'action
|
VTG ♂
|
VTG ♀
|
ratio mâles/femelles
|
Références
|
|
Agoniste faible des œstrogènes
|
↑
|
↑
|
↑♀ ou ↑indifférenciés
|
(27) (40)
|
|
Agoniste fort des œstrogènes
|
↑
|
↑
|
↑♀ ou ↑indifférenciés, néant ♂
|
(28) (40)
|
|
Antagoniste des œstrogènes
|
—
|
—
|
↑♀ ou ↑indifférenciés
|
(29)
|
|
Agoniste des androgènes
|
↓ ou -
|
↓ ou –
|
↑ ♂, néant ♀
|
(28) (30)
|
|
Antagoniste des androgènes
|
—
|
—
|
↑♀
↑hermaphrodites
|
(31)
|
|
Inhibiteur de l'aromatase
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
L'EDSP ne couvrant pas le stade de la reproduction des poissons, il convient d'évaluer les substances chimiques susceptibles d'affecter la reproduction à des concentrations plus faibles que le développement sexuel dans un essai qui couvre la reproduction.
|
|
10.
|
Certains termes techniques utilisés dans la présente méthode d'essai sont définis dans l'Appendice 1.
|
|
11.
|
L'essai in vivo de développement sexuel des poissons vise à détecter les substances chimiques ayant des propriétés androgéniques et œstrogéniques ainsi que des propriétés anti-androgéniques, anti-œstrogéniques et inhibitrices de la stéroïdogenèse. Les phases de validation (1 et 2) de l'EDSP couvraient les œstrogènes, les androgènes et les inhibiteurs de la stéroïdogenèse. Les effets des antagonistes des œstrogènes et des androgènes dans le cadre de l'EDSP sont illustrés dans le tableau 1, mais ces modes d'action font actuellement l'objet d'une littérature moins abondante
|
PRINCIPE DE L'ESSAI
|
12.
|
Dans cet essai, les poissons sont exposés, de l'œuf nouvellement fécondé à l'achèvement de la différenciation sexuelle, à au moins trois concentrations de la substance chimique d'essai dissoute dans de l'eau. L'essai se déroule dans des conditions dynamiques à moins que la substance chimique d'essai ne le permette pas pour des raisons de disponibilité ou de nature (solubilité limitée, par exemple). Au début de l'essai, les œufs nouvellement fécondés (avant division du blastodisque) sont placés dans les enceintes d'essai. Le taux de charge des enceintes est décrit pour chaque espèce au paragraphe 27. Pour les espèces validées, à savoir le medaka japonais, l'épinoche et le poisson-zèbre, l'essai est terminé 60 jours après l'éclosion. À la fin de l'essai, tous les poissons sont euthanasiés sans cruauté. Un prélèvement biologique (plasma sanguin, foie ou homogénat tête-queue) est effectué sur chaque poisson pour l'analyse de la VTG, et la partie restante est fixée pour l'évaluation histologique des gonades visant à déterminer le sexe phénotypique; l'histopathologie (classement par stade des gonades, gravité de l'hermaphrodisme, par exemple) est optionnelle. Un prélèvement biologique (nageoire anale ou dorsale) pour la détermination du sexe génétique est effectué sur les espèces possédant les biomarqueurs adéquats (Appendices 9 et 10).
|
|
13.
|
L'Appendice 2 donne une vue d'ensemble des conditions d'essai pertinentes spécifiques aux espèces validées: le medaka japonais, l'épinoche et le poisson-zèbre.
|
INFORMATIONS SUR LA SUBSTANCE CHIMIQUE D'ESSAI
|
14.
|
Il convient que les résultats d'un essai de toxicité aiguë ou d'un autre essai de toxicité à court terme [méthode d'essai C.14 (34) et ligne directrice 210 de l'OCDE (1), par exemple], mené de préférence avec l'espèce sélectionnée pour l'essai en question, soient disponibles. Cela suppose que l'hydrosolubilité et la pression de vapeur de la substance d'essai soient connues et qu'une méthode analytique fiable de quantification de la substance chimique dans les enceintes d'essai, avec une précision et une limite de détection connues et consignées par écrit, soit disponible.
|
|
15.
|
D'autres informations sont utiles, telles que la formule développée, la pureté de la substance chimique, la stabilité dans l'eau et à la lumière, le pKa, le Poe et les résultats d'un essai de biodégradabilité facile (méthode d'essai C.4) (35).
|
Critères de validité de l'essai
|
16.
|
Pour que les résultats de l'essai soient acceptables, les conditions sont les suivantes:
|
—
|
La concentration d'oxygène dissous est maintenue à 60 pour cent au moins de la valeur de la saturation en air (VSA) pendant toute la durée de l'essai.
|
|
—
|
À aucun moment, durant toute la période d'exposition, la température de l'eau ne différe de plus de ± 1,5 °C entre les enceintes, et elle demeure dans la plage de température indiquée pour l'espèce étudiée (Appendice 2).
|
|
—
|
Une méthode validée d'analyse de la substance d'exposition avec une limite de détection bien en-deçà de la plus faible concentration nominale est disponible et les données disponibles démontrent que les concentrations de substance chimique d'essai en solution ont été correctement maintenues dans un intervalle de ± 20 % autour des valeurs moyennes mesurées.
|
|
—
|
Le taux global de survie des œufs fécondés dans les témoins et, le cas échéant, dans les témoins contenant le solvant, est supérieur ou égal aux limites définies à l'Appendice 2.
|
|
—
|
Les critères de validité relatifs à la croissance et aux proportions de chaque sexe à la fin de l'essai sont basés sur les données issues des groupes témoins (témoin contenant à la fois le solvant et l'eau, à moins qu'ils présentent des différences significatives, puis uniquement le solvant):
|
|
Medaka japonais
|
Poisson-zèbre
|
Épinoche
|
|
Croissance
|
Poids frais de poissons à sec
|
> 150 mg
|
> 75 mg
|
> 120 mg
|
|
Longueur (longueur standard)
|
> 20 mm
|
> 14 mm
|
> 20 mm
|
|
Ratio mâles/femelles
|
30-70 %
|
30-70 %
|
30-70 %
|
|
|
—
|
L'utilisation d'un solvant ne devrait pas avoir d'effet statistique significatif sur la survie, d'effets perturbateurs sur le système endocrinien ni d'autres effets néfastes sur les premiers stades de la vie comme le révèle un témoin solvant.
|
Si l'on observe une déviation par rapport aux critères de validité de l'essai, les conséquences sont analysées en fonction de la fiabilité des données d'essai, et ces analyses sont consignées dans le rapport d'essai.
|
DESCRIPTION DE LA MÉTHODE D'ESSAI
Enceintes d'essai
|
17.
|
On peut utiliser tout récipient en verre, en acier inoxydable ou en matériau chimiquement inerte. Il convient que les enceintes soient suffisamment grandes pour être en conformité avec les critères de charge donnés ci-dessous. Il est souhaitable de disposer les enceintes expérimentales selon un schéma aléatoire par bloc, chaque traitement étant présent dans chaque bloc, plutôt que de les disposer de façon aléatoire. On protège les enceintes de toute perturbation non voulue.
|
Choix des espèces de poisson
|
18.
|
L'Appendice 2 regroupe les espèces de poissons recommandées pour cet essai. Les procédures d'inclusion de nouvelles espèces sont décrites dans le paragraphe 2.
|
Soins des poissons géniteurs
|
19.
|
Les moyens de maintenir les poissons géniteurs dans des conditions satisfaisantes sont détaillés dans la ligne directrice 210 de l'OCDE (1). Les poissons géniteurs sont nourris une ou deux fois par jour avec des aliments appropriés.
|
Manipulation des embryons et des larves
|
20.
|
Au départ, les embryons et les larves peuvent être exposés à l'intérieur de la cuve principale dans des récipients plus petits en verre ou en acier inoxydable avec des côtés ou des extrémités en treillis permettant à la solution d'essai de traverser le récipient. On peut créer un écoulement non turbulent à travers ces petits récipients en les suspendant à un bras disposé de façon à déplacer le récipient verticalement mais en gardant toujours les organismes submergés.
|
|
21.
|
Quand on utilise des récipients, des grillages ou des treillis pour maintenir les œufs à l'intérieur de la cuve principale, ces dispositifs sont enlevés après l'éclosion des larves, sauf si ces treillis ont pour objectif d'éviter aux poissons de s'enfuir. Si l'on doit transférer les larves, on ne les expose pas à l'air et il ne faut pas utiliser un filet pour enlever les poissons des récipients contenant les œufs. Le moment de ce transfert varie selon les espèces et il se peut que le transfert ne soit pas nécessaire.
|
Eau
|
22.
|
Pour les essais, on peut utiliser toute eau dans laquelle les espèces étudiées (témoins) ont un taux de survie au moins aussi bon que dans l'eau décrite dans l'Appendice 3. Il convient que sa qualité demeure constante pendant la durée de l'essai. On prélève et analyse régulièrement des échantillons afin de s'assurer que l'eau de dilution n'influencera pas indûment le résultat des essais (par exemple par réaction avec la substance d'essai) ou n'influencera pas négativement la performance des géniteurs. Le carbone organique total, la conductivité, le pH et les matières en suspension sont dosés par exemple tous les trois mois dans le cas d'une eau de dilution de qualité relativement constante. Les métaux lourds (Cu, Pb, Zn, Hg, Cd, Ni, par exemple), les anions et cations principaux (Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–, par exemple) et les pesticides sont dosés si la qualité de l'eau est discutable. L'analyse chimique et la collecte d'eau sont détaillées dans le paragraphe 34.
|
Solutions d'essai
|
23.
|
Il convient d'utiliser un système dynamique si cela est possible d'un point de vue pratique. Les essais en dynamique nécessitent un système qui délivre et dilue de façon continue une solution-mère de la substance chimique d'essai (par exemple une pompe doseuse, un dilueur proportionnel, un système de saturation) afin de distribuer une série de concentrations vers les enceintes d'essai. Pendant l'essai, on vérifie à intervalles réguliers les débits des solutions-mères et de l'eau de dilution; ceux-ci ne doivent pas varier de plus de 10 % pendant toute la durée de l'essai. Un débit équivalent à au moins cinq fois le volume de l'enceinte d'essai par 24 heures s'est révélé adéquat (1). Il faut veiller à éviter l'utilisation de tubes en plastique ou d'autres types de matériel pouvant contenir des substances biologiquement actives ou adsorber la substance chimique d'essai.
|
|
24.
|
La solution-mère est préparée, de préférence, sans l'utilisation de solvants par simple mélange ou agitation de la substance chimique d'essai dans l'eau de dilution par des moyens mécaniques (secouement ou ultrasons, par exemple). Si la substance chimique d'essai est difficile à dissoudre dans l'eau, les procédures décrites dans le document d'orientation de l'OCDE intitulé Guidance Document on aquatic toxicity testing of difficult substances and mixtures (36) sont suivies. L'utilisation de solvants est à éviter mais peut, dans certains cas, s'avérer nécessaire afin d'obtenir la concentration de solution-mère souhaitée. Le document (36) donne des exemples de solvants appropriés.
|
|
25.
|
Les conditions d'essai semi-statiques sont à éviter à moins qu'elles soient justifiées par des arguments irréfutables associés à la substance chimique d'essai (stabilité, disponibilité en quantité limitée, coût ou danger élevé, par exemple). Pour la technique semi-statique, on peut utiliser deux méthodes différentes de renouvellement du milieu. Soit on prépare de nouvelles solutions d'essai dans des récipients propres et on transfère avec précaution les œufs et les larves survivants dans les nouveaux récipients, soit on maintient les organismes d'essai dans les enceintes d'essai tout en changeant quotidiennement une partie (au moins les deux tiers) du milieu d'essai.
|
DÉROULEMENT DE L'ESSAI
Conditions d'exposition
Collecte des œufs et durée
|
26.
|
Pour éviter les biais génétiques, les œufs sont collectés au sein de trois couples ou groupes reproducteurs minimum, mélangés et sélectionnés au hasard pour démarrer l'essai. Pour l'épinoche, une description de la procédure de fertilisation artificielle est fournie dans l'Appendice 11. L'essai démarre aussitôt que possible après que les œufs aient été fécondés, les embryons étant de préférence immergés dans les solutions d'essai avant que la division du blastodisque ne commence ou aussi près que possible après ce stade et pas plus de 12 h après la fécondation. L'essai continue jusqu'à ce que la différenciation sexuelle dans le groupe témoin soit achevée (60 jours après l'éclosion pour le medaka japonais, l'épinoche et le poisson-zèbre).
|
Charge
|
27.
|
Au début de l'essai, on utilise au moins 120 œufs fécondés par concentration, répartis dans au moins quatre réplicats (la répartition par racine carrée dans le témoin est acceptée). Les œufs sont répartis au hasard (selon les tableaux statistiques de randomisation) dans les différents traitements. Il convient que le taux de charge (voir Appendice 1 pour la définition) soit suffisamment faible pour que la concentration en oxygène dissous puisse être maintenue sans aération directe à au moins 60 % de la valeur de saturation en air. Pour les essais dynamiques, il est recommandé que le taux de charge ne dépasse pas 0,5 g/l sur 24 heures et 5 g/l à un moment quelconque. Au plus tard 28 jours après la fécondation, le nombre de poissons par réplicat est redistribué de telle sorte que chaque réplicat contienne un nombre égal de poissons dans la mesure du possible. En cas de mortalité due à l'exposition, le nombre de réplicats est dûment réduit de sorte que la densité de poissons entre les niveaux de traitement soit maintenue aussi égale que possible.
|
Lumière et température
|
28.
|
La photopériode et la température de l'eau sont adaptées à l'espèce testée (voir les conditions expérimentales dans l'Appendice 2).
|
Alimentation
|
29.
|
La nourriture et l'alimentation sont des points critiques, et pour chaque stade de développement, il est primordial de fournir la nourriture appropriée à des intervalles de temps déterminés et dans des quantités suffisantes pour que la croissance soit normale. La nourriture est donnée ad libitum tout en minimisant le surplus. Pour que le taux de croissance soit suffisant, les poissons sont nourris au moins deux fois par jour (éventuellement une fois par jour le week-end), à raison d'un intervalle d'au moins trois heures entre chaque repas. La nourriture et les excréments sont retirés quand cela s'avère nécessaire afin d'éviter l'accumulation de déchets. Au fur et à mesure que l'on acquiert de l'expérience, on améliore continuellement la nourriture et les régimes alimentaires afin d'augmenter le taux de survie et d'optimiser la croissance. On s'efforce donc de faire confirmer le régime proposé par des experts reconnus. Les poissons ne sont plus être nourris durant les 24 heures qui précèdent la fin de l'essai. L'Appendice 2 donne des exemples de régimes alimentaires adaptés (voir également le document Fish Toxicity Testing Framework de l'OCDE (39).
|
Concentrations de la substance chimique d'essai
|
30.
|
Les concentrations de la substance chimique d'essai sont espacées tel que décrit à l'Appendice 4. Au moins trois concentrations de la substance d'essai placées dans au moins quatre réplicats sont utilisées. Pour choisir la gamme des concentrations d'essai, on s'inspire de la courbe qui donne la CL50 en fonction de la période d'exposition dans les études de toxicité aiguë. Cinq concentrations de la substance d'essai sont recommandées s'il est prévu d'utiliser les données pour l'évaluation des risques.
|
|
31.
|
Il n'est pas nécessaire de tester les concentrations supérieures à 10 % de la CL50 aiguë chez les adultes ou à 10 mg/l, quelle que soit la plus faible. Il convient que la concentration maximale représente 10 % de la CL50 chez les larves/juvéniles.
|
Témoins
|
32.
|
Un témoin contenant l'eau de dilution (≥ 4 réplicats) et, si nécessaire, un témoin contenant le solvant (≥ 4 réplicats) sont inclus dans l'essai en plus des concentrations de la substance d'essai. Seuls les solvants pour lesquels on a vérifié qu'ils n'avaient pas d'influence statistique significative sur les effets mesurés durant l'essai sont utilisés dans cet essai.
|
|
33.
|
Si un solvant est utilisé, sa concentration finale ne dépasse pas 0,1 ml/l (36) et la concentration est identique dans toutes les enceintes d'essai, sauf le témoin avec l'eau de dilution. Néanmoins, on évitera autant que possible d'utiliser un solvant, sinon on veillera à maintenir les concentrations de solvant à un minimum.
|
Fréquence des dosages analytiques et des mesures
|
34.
|
L'analyse chimique de la concentration de la substance chimique d'essai est effectuée avant le démarrage de l'essai afin de vérifier la conformité aux critères de validité. Tous les réplicats sont dosés séparément au début et à la fin de l'essai. Un réplicat par concentration de la substance d'essai est dosé au moins une fois par semaine au cours de l'essai, avec une rotation systématique des réplicats (1, 2, 3, 4, 1, 2 …). Si les échantillons sont stockés en vue d'un dosage ultérieur, il convient que la méthode de stockage des échantillons ait été validée en amont. Les échantillons sont filtrés (avec par exemple une dimension de pore de 0,45 μm) ou centrifugés afin de s'assurer que seule la substance chimique en solution est dosée analytiquement.
|
|
35.
|
Au cours de l'essai, on mesurer l'oxygène dissous, le pH, la dureté totale, la conductivité, la salinité (s'il y a lieu) et la température dans toutes les enceintes d'essai. L'oxygène dissous, la salinité (s'il y a lieu) et la température sont mesurés au moins une fois par semaine; le pH, la conductivité et la dureté sont mesurés au minimum au début et à la fin de l'essai. Il est préférable de surveiller la température en continu dans au moins une enceinte.
|
|
36.
|
Les résultats sont exprimés à partir des concentrations mesurées. Toutefois, si la concentration de la substance chimique d'essai en solution a été correctement maintenue tout au long de l'essai dans un intervalle de ± 20 % autour de la concentration nominale, les résultats peuvent être calculés à partir des valeurs nominales ou mesurées.
|
Observations et mesures
Stade du développement embryonnaire
|
37.
|
L'exposition démarre aussitôt que possible après la fécondation et avant le début de la division du blastodisque et pas plus de 12 h après la fécondation pour garantir l'exposition dès le début du développement embryonnaire.
|
Éclosion et survie
|
38.
|
Il faut observer et dénombrer les éclosions et les survivants au moins une fois par jour. Les embryons, larves et juvéniles morts sont enlevés dès qu'ils sont repérés, du fait qu'ils peuvent se décomposer rapidement et être mis en morceaux par les autres poissons. On fait très attention quand on retire les individus morts afin de ne pas heurter ou léser physiquement les œufs et larves proches qui sont extrêmement délicats et sensibles. Les critères indiquant la mort varient selon le stade de développement:
|
—
|
pour les œufs: en particulier au début de leur cycle, diminution marquée de la transparence et/ou modification de la coloration, provoquées par la coagulation et/ou la précipitation des protéines et conduisant à un aspect blanc opaque;
|
|
—
|
pour les larves et les juvéniles: immobilité et/ou absence de mouvement respiratoire et/ou absence de battement du cœur et/ou coloration blanche opaque du système nerveux central et/ou absence de réaction à un stimulus mécanique.
|
|
Apparence anormale
|
39.
|
On note le nombre de larves ou de poissons présentant une anomalie corporelle et on décrit l'aspect et la nature de l'anomalie. Il faut savoir que des embryons et larves anormaux surviennent de façon naturelle et que, chez le(s) témoin(s) de certaines espèces, leur proportion peut atteindre plusieurs pour cent. Les animaux anormaux ne sont retirés des récipients d'essai qu'à leur mort. Toutefois, conformément à la directive 2010/63/UE du Parlement européen et du Conseil du 22 septembre 2010 relative à la protection des animaux utilisés à des fins scientifiques, en cas d'observation de souffrance considérable (effets très graves et mort prévisible de façon fiable), les animaux sont anesthésiés et euthanasiés selon le mode opératoire décrit au paragraphe 44 et comptabilisés en tant de décès pour l'analyse des données.
|
Comportement anormal
|
40.
|
Des anomalies telles qu'une hyperventilation, une nage non coordonnée, une immobilité anormale et un comportement alimentaire atypique sont notées lorsqu'elles apparaissent.
|
Poids
|
41.
|
À la fin de l'essai, tous les poissons survivants sont euthanasiés (anesthésiés si des prélèvements sanguins doivent être effectués) et pesés individuellement à sec.
|
Longueur
|
42.
|
A la fin de l'essai, il est recommandé de mesurer la longueur de chaque individu (longueur standard).
|
|
43.
|
Ces observations permettront de disposer pour le rapport d'essai de tout ou une partie des données suivantes:
|
—
|
nombre de poissons sains à la fin de l'essai;
|
|
—
|
moment du commencement de l'éclosion et de la fin de celle-ci;
|
|
—
|
longueur et poids des animaux survivants;
|
|
—
|
nombre de larves déformées;
|
|
—
|
nombre de poissons présentant un comportement anormal.
|
|
Prélèvement sur les poissons
|
44.
|
Le prélèvement sur les poissons est effectué à la fin de l'essai. Les poissons échantillonnés sont euthanasiés avec, par exemple, du MS-222 (100-500 mg/l tamponnés avec 200 mg/l de NaHCO3) ou du FA-100 (4-allyl-2-méthoxyphénol: eugénol), et la longueur et le poids frais à sec de chaque individu sont mesurés, ou bien les poissons sont anesthésiés si un prélèvement sanguin doit être effectué (voir paragraphe 49).
|
Prélèvement pour l'analyse de la VTG et la détermination du sexe via l'évaluation histologique
|
45.
|
Des prélèvements sont effectués sur tous les poissons, qui sont préparés en vue de l'analyse du sexe et de la VTG. Tous les poissons font l'objet d'une analyse histologique visant à déterminer leur sexe. Pour les dosages de la VTG, un sous-échantillon issu d'au moins 16 poissons de chaque réplicat est accepté. L'analyse de la VTG est effectuée sur un plus grand nombre de poissons si les résultats du sous- échantillon se révèlent imprécis.
|
|
46.
|
La procédure de prélèvement pour la détermination de la VTG et du sexe dépend de la méthode d'analyse de la VTG:
|
Méthode d'analyse de la VTG utilisant un homogénat tête-queue
|
47.
|
Le poisson est euthanasié. La tête et la queue de chaque poisson sont séparées du reste du corps par incision au scalpel au niveau de la partie antérieure des nageoires pectorales et de la nageoire dorsale (voir Figure 1). La tête et la queue de chaque poisson forment un ensemble qui est pesé, et chaque ensemble tête-queue est numéroté puis congelé dans de l'azote liquide et stocké à une température inférieure ou égale à – 70 °C pour l'analyse de la VTG. Le reste du corps est numéroté et fixé dans une solution de fixation appropriée pour l'évaluation histologique (22). Cette méthode permet d'évaluer la VTG et l'histopathologie sur chaque individu, et une évolution éventuelle du niveau de VTG peut ainsi être corrélée au sexe phénotypique du poisson ou au sexe génétique (medaka japonais et épinoche) du poisson [pour de plus amples informations, voir le guide d'homogénéisation (Appendice 5) et le guide de quantification de la VTG (Appendice 6)].
|
Méthode d'analyse de la VTG utilisant un homogénat hépatique
|
48.
|
Le poisson est euthanasié. Le foie est extrait par dissection puis stocké à une température inférieure ou égale à – 70 °C. Les procédures recommandées pour l'excision du foie et le prétraitement figurent dans ligne directrice 229 de l'OCDE (37) ou dans le chapitre C.37 de la présente annexe (38). Les foies sont ensuite homogénéisés séparément tel que décrit dans la ligne directrice 229 de l'OCDE ou le chapitre C.37 de la présente annexe. Le surnageant collecté sert à doser la VTG par le biais d'une technique ELISA homologue [voir exemple de quantification chez le poisson-zèbre à l'Appendice 6 ou dans la ligne directrice 229 de l'OCDE (37) pour le medaka japonais]. En suivant cette démarche, il est également possible d'obtenir des données sur la VTG et l'histologie gonadique de chaque poisson.
|
Méthode d'analyse de la VTG utilisant le plasma sanguin
|
49.
|
Les prélèvements sanguins sur les poissons anesthésiés sont effectués par ponction cardiaque, dans la veine caudale ou par sectionnement de la queue, puis centrifugés à une température de 4 °C pour la collecte du plasma. Le plasma est stocké à une température inférieure ou égale à – 70 °C jusqu'à son utilisation. Le poisson est entièrement euthanasié et fixé pour l'histologie. Les échantillons de plasma et les poissons sont numérotés séparément pour corréler les niveaux de VTG au sexe des poissons.
Figure 1
Comment couper un poisson pour le dosage de la VTG dans un homogénat tête-queue et l'évaluation histologique de la section médiane.
|
Détermination du sexe génétique
|
50.
|
Un prélèvement biologique pour la détermination du sexe génétique est effectué sur chaque poisson appartenant à l'une des espèces possédant les biomarqueurs adéquats. Pour le medaka japonais, la nageoire anale ou la nageoire dorsale est collectée. Le prélèvement tissulaire et la détermination du sexe par réaction en chaîne par polymérase (PCR) sont détaillés dans l'Appendice 9. De la même façon, pour l'épinoche, une description de la procédure d'échantillonnage ainsi que de la méthode PCR pour la détermination du sexe génétique est fournie dans l'Appendice 10.
|
Dosage de la VTG
|
51.
|
Le dosage de la VTG est effectué à l'aide d'une méthode analytique quantitative validée. Il convient de disposer d'informations sur la variabilité intra-essai et inter-essais de la méthode utilisée dans un laboratoire donné. La source de variabilité inter-laboratoires et intra-laboratoire dépend (très probablement) des différents stades de développement de la population de poissons. Étant donnée la variabilité du dosage de la VTG, les CSEO basées exclusivement sur cet effet mesuré sont considérées avec une grande prudence. Différentes méthodes permettent d'évaluer la production de VTG dans les espèces de poissons prises en compte dans cet essai. La méthode ELISA (procédé immunochimique d'absorption enzymatique) constitue une méthode de dosage de la VTG à la fois relativement sensible et spécifique. Des anticorps homologues (de la VTG de la même espèce) et surtout des standards homologues sont utilisés.
|
Détermination du sexe
|
52.
|
Selon la procédure de prélèvement de la VTG, le corps entier ou la partie centrale restante de chaque poisson est placé(e) sur une cassette de traitement pré-étiquetée et fixé(e) dans une solution de fixation appropriée pour la détermination histologique du sexe (également pour le classement par stade des gonades, optionnel). L'Appendice 7 et le document d'orientation de l'OCDE intitulé Diagnosis of Endocrine-Related Histopathology of Fish Gonads (22) donnent des orientations sur la fixation et l'inclusion. À l'issue du traitement, les poissons sont placés dans un bloc de paraffine. Les individus sont placés dans ce bloc selon l'axe longitudinal. Au moins six coupes longitudinales (3-5 μm d'épaisseur) dans un plan frontal comprenant le tissu gonadal des deux gonades sont faites sur chaque individu. L'intervalle entre ces coupes est de 50 μm environ pour les mâles et de 250 μm environ pour les femelles. Toutefois, étant donné que chaque bloc contient souvent des mâles et des femelles (si plus d'un individu est inclus dans chaque bloc), l'intervalle entre les coupes effectuées dans ces blocs est de 50 μm environ jusqu'à ce que l'on obtienne au moins six coupes des gonades de chaque mâle. Par la suite, l'intervalle entre les coupes peut être augmenté jusqu'à 250 μm environ pour les femelles. Les coupes sont colorées à l'hématoxyline et à l'éosine puis examinées au microscope optique, l'observation étant axée sur le sexe (masculin, féminin, hermaphrodite ou indifférencié). L'hermaphrodisme est défini comme la présence de plus d'un ovocyte dans les testicules par lot de six coupes analysées ou de cellules spermatogéniques dans les ovaires (oui/non). L'histopathologie et le classement par stade des ovaires et des testicules sont optionnels, mais s'ils sont pratiqués, les résultats font l'objet d'une analyse statistique et d'un rapport. Il est intéressant de noter que certaines espèces de poissons ne possèdent pas, à l'état naturel, de paire de gonades entièrement développée et qu'une seule gonade peut être présente (medaka japonais et parfois poisson-zèbre, par exemple). Toutes ces observations sont consignées par écrit.
|
|
53.
|
Chez le medaka japonais, le sexe génétique est déterminé en fonction de la présence ou de l'absence du gène qui détermine le sexe masculin chez le medaka, le DMY, qui est situé sur le chromosome Y. Le sexe génotypique du medaka peut être identifié par séquençage du DMY à partir de l'ADN extrait d'un morceau de nageoire anale ou de nageoire dorsale, par exemple. La présence du DMY indique qu'il s'agit d'un individu de sexe masculin (XY) quel que soit le phénotype, tandis que l'absence de DMY indique qu'il s'agit d'un individu de sexe féminin (XX) quel que soit le phénotype (23). L'Appendice 9 donne des recommandations sur la préparation des tissus et la PCR. La détermination du sexe génétique individuellement chez chaque épinoche est également déterminée par analyse PCR, comme décrit dans l'Appendice 10.
|
|
54.
|
La présence d'hermaphrodites (consulter la définition dans l'Appendice 1) est notée.
|
Caractères sexuels secondaires
|
55.
|
Les caractères sexuels secondaires sont contrôlés par le système endocrinien chez des espèces telles que le medaka japonais; les observations relatives aux caractéristiques physiques des poissons sont donc notées si possible à la fin de l'exposition. Chez le medaka japonais, la formation de tubercules papillaires sur la partie postérieure de la nageoire anale des femelles est sensible aux androgènes. Le chapitre C.37 de la présente annexe (38) fournit des photos pertinentes des caractères sexuels secondaires de mâles et de femelles androgénisées.
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
56.
|
Il importe d'utiliser l'analyse statistique la plus valide pour déterminer l'effet mesuré. Le réplicat est l'unité expérimentale, mais la variabilité entre les réplicats est prise en compte lors de l'analyse statistique. Le diagramme de décision de l'Appendice 8 aide à choisir l'analyse statistique la plus adéquate en fonction des caractéristiques des résultats de l'essai. Le niveau de signification statistique est de 0,05 pour tous les effets mesurés pris en compte.
|
Proportions de sexe et de sexe génétique
|
57.
|
Les proportions de sexe sont analysées pour évaluer l'effet significatif (DSEO/CMEO) de l'exposition via le test de Jonckheere-Terpstra (test des tendances) si la relation dose-réponse est monotone. Si la relation est non monotone, des comparaisons par paires sont effectuées: on utilisera le test de Dunnett si l'on peut obtenir la normalité et une variance homogène. On utilisera le test de Tamhane-Dunnett en cas de variance hétérogène. Sinon, on appliquera fidèlement le test de Mann-Whitney avec correction de Bonferroni-Holm. Un diagramme de décision statistique des proportions de sexe figure à l'Appendice 8. Les proportions de sexe sont présentées sous forme de tableaux reprenant les proportions de concentration ± l'écart-type de mâles, de femelles, d'hermaphrodites et d'individus indifférenciés. Il convient de souligner la signification statistique. Des exemples sont présentés dans le rapport de validation de la phase 2 de l'essai de développement sexuel des poissons (42). Le sexe génétique est noté sous forme de pourcentage de changement de sexe phénotypique chez les mâles, les femelles, les hermaphrodites et les individus indifférenciés.
|
Concentrations de VTG
|
58.
|
Les concentrations de VTG sont analysées pour évaluer l'effet significatif (DSEO/CMEO) de l'exposition. Le test de Dunnett est préférable au test t avec correction de Bonferroni. Si l'on applique une correction de Bonferroni, la correction de Bonferroni-Holm est préférable. Il convient d'accepter une transformation logarithmique de la VTG pour atteindre la normalité et une variance homogène. Ensuite, si la relation dose-réponse est cohérente avec la monotonie, le test de Jonckheere-Terpstra est préférable à n'importe lequel des tests précités. Si l'on utilise le test t, ou le test de Dunnett, il n'est pas nécessaire d'utiliser l'ANOVA, qui utilise le mécanisme du test de Fisher, pour poursuivre. On pourra se reporter au diagramme de décision de l'Appendice 8 pour de plus amples informations. Les proportions de sexe sont présentées sous forme de tableaux reprenant les concentrations moyennes ± l'écart-type de mâles, de femelles, d'hermaphrodites et d'individus indifférenciés séparément. Il convient de souligner la signification statistique des femelles phénotypiques et des mâles phénotypiques. Des exemples sont présentés dans le rapport de validation de la phase 2 de l'essai de développement sexuel des poissons (42).
|
Concentrations réelles de la substance chimique d'essai
|
59.
|
Les concentrations réelles de la substance chimique d'essai dans les enceintes sont analysées selon les fréquences décrites au paragraphe 34. Les résultats sont notés dans des tableaux sous forme de concentration moyenne ± l'écart-type sur la base des réplicats ainsi que de la concentration, l'accent étant mis sur les informations sur le nombre d'échantillons et sur les valeurs de concentration aberrantes par rapport à la concentration moyenne des traitements ± 20 %. Des exemples figurent dans le rapport de validation de la phase 2 de l'essai de développement sexuel des poissons (42).
|
Interprétation des résultats
|
60.
|
Les résultats sont interprétés avec prudence lorsque les concentrations de la substance chimique d'essai mesurées en solutions d'essai atteignent des niveaux proches de la limite de détection de la méthode d'analyse.
|
Rapport
|
61.
|
Le rapport de l'essai comprend les informations suivantes:
|
|
Substance chimique d'essai
|
—
|
propriétés physico-chimiques pertinentes; données relatives à l'identification chimique, dont la pureté et la méthode analytique de dosage de la substance chimique d'essai.
|
|
|
|
Conditions d'essai:
|
—
|
mode opératoire utilisé (dynamique ou semi-statique); conception de l'essai comprenant les concentrations de la substance d'essai, la méthode de préparation des solutions-mères (dans une annexe), la fréquence de renouvellement (le solvant et sa concentration sont indiqués si ledit solvant est utilisé);
|
|
—
|
concentrations nominales de la substance d'essai, valeurs moyennes mesurées, déviations standard de ces moyennes dans les enceintes d'essai et méthode ayant permis de les obtenir (la méthode analytique utilisée est présentée dans une annexe). Données disponibles devant démontrer que les dosages correspondent aux concentrations de la substance chimique d'essai en solution vraie;
|
|
—
|
qualité de l'eau dans les enceintes d'essai: pH, dureté, température et concentration d'oxygène dissous.
|
|
—
|
Informations détaillées sur l'alimentation (par exemple type d'aliments, provenance, quantité donnée et fréquence) et analyse des contaminants pertinents (PCB, HAP et pesticides organochlorés, par exemple).
|
|
|
|
Résultats
|
—
|
données disponibles démontrant que les témoins ont rempli les critères de validité: les données sur le taux d'éclosion sont présentées sous forme de tableaux indiquant le pourcentage par réplicat et par concentration. Les résultats aberrants par rapport aux critères de validité (dans les témoins) sont soulignés. La survie est présentée sous forme de pourcentage par réplicat et par concentration. Les résultats aberrants par rapport aux critères de validité (dans les témoins) sont soulignés.
|
|
—
|
Indication claire des résultats obtenus par rapport aux différents effets observés: survie des embryons et réussite de l'éclosion; anomalies externes; longueur et poids; dosages de la VTG (ng/g d'homogénat, ng/ml de plasma ou ng/mg de foie); données sur l'histologie gonadique, le ratio mâles/femelles et le sexe génétique; fréquence des réactions inhabituelles des poissons et des effets visibles produits par la substance chimique d'essai.
|
|
|
|
62.
|
Les résultats sont présentés sous forme de valeurs moyennes ± l'écart-type ou l'erreur-type. Les résultats statistiques sont notés au minimum sous forme de DSEO et de CMEO et d'intervalles de confiance. Le diagramme de décision (Appendice 8) est suivi.
|
BIBLIOGRAPHIE
|
(1)
|
OCDE (1992), Poisson, Essai de Toxicité aux Premiers Stades de la Vie, Ligne directrice no 210 pour les essais de produits chimiques, OCDE, Paris.
|
|
(2)
|
Jobling,S., D.Sheahan, J.A.Osborne, P.Matthiessen, and J.P.Sumpter, 1996, “Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals”, Environmental Toxicology and Chemistry 15, pp. 194-202.
|
|
(3)
|
Sumpter,J.P. and S.Jobling, 1995, “Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment”, Environmental Health Perspectives 103, pp. 173-178.
|
|
(4)
|
Tyler,C.R., R.van Aerle, T.H.Hutchinson, S.Maddix, and H.Trip (1999), “An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin”, Environmental Toxicology and Chemistry 18, pp. 337-347.
|
|
(5)
|
Holbech,H., L.Andersen, G.I.Petersen, B.Korsgaard, K.L.Pedersen, and P.Bjerregaard (2001a), “Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, pp. 119-131.
|
|
(6)
|
Andersen,L., P.Bjerregaard, and B.Korsgaard ( 2003), “Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters”, Fish Physiology and Biochemistry 28, pp. 319-321.
|
|
(7)
|
Orn,S., H.Holbech, T.H.Madsen, L.Norrgren, and G.I.Petersen (2003), “Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone”, Aquatic Toxicology 65, pp. 397-411.
|
|
(8)
|
Panter,G.H., T.H.Hutchinson, R.Lange, C.M.Lye, J.P.Sumpter, M.Zerulla, and C.R.Tyler (2002), “Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances”, Environmental Toxicology and Chemistry 21, pp. 319-326.
|
|
(9)
|
Sun,L.W., J.M.Zha, P.A.Spear, and Z.J.Wang (2007), “Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 533-541.
|
|
(10)
|
Parks,L.G., A.O.Cheek, N.D.Denslow, S.A.Heppell, J.A.McLachlan, G.A.LeBlanc, and C.V.Sullivan (1999), “Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, pp. 113-125.
|
|
(11)
|
Brion,F., B.M.Nilsen, J.K.Eidem, A.Goksoyr, and J.M.Porcher (2002), “Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)”, Environmental Toxicology and Chemistry 21, pp. 1699-1708.
|
|
(12)
|
Nishi,K., M.Chikae, Y.Hatano, H.Mizukami, M.Yamashita, R.Sakakibara, and E.Tamiya (2002), “Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin”, Comparative Biochemistry and Physiology C- Toxicology & Pharmacology 132, pp. 161-169.
|
|
(13)
|
Hahlbeck,E., I.Katsiadaki, I.Mayer, M.Adolfsson-Erici, J.James, and B.E.Bengtsson (2004), “The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption — II — kidney hypertrophy, vitellogenin and spiggin induction”, Aquatic Toxicology 70, pp. 311-326.
|
|
(14)
|
Tatarazako,N., M.Koshio, H.Hori, M.Morita, and T.Iguchi (2004), “Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka”, Journal of Health Science 50, pp. 301-308.
|
|
(15)
|
Eidem,J.K., H.Kleivdal, K.Kroll, N.Denslow, R.van Aerle, C.Tyler, G.Panter, T.Hutchinson, and A.Goksoyr (2006), “Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology”, 78, pp. 202-206.
|
|
(16)
|
Jensen,K.M. and G.T.Ankley (2006), “Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)”, Ecotoxicology and Environmental Safety 64, pp. -105.
|
|
(17)
|
Holbech, H., Petersen, G. I., Norman, A.,Örn, S, Norrgren, L., and Bjerregaard, P (2001b), “Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)”, Nordic Council of Ministers, TemaNord 2001:597, pp. 48-51.
|
|
(18)
|
Nilsen,B.M., K.Berg, J.K.Eidem, S.I.Kristiansen, F.Brion, J.M.Porcher, and A.Goksoyr (2004), “Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening”, Analytical and Bioanalytical Chemistry 378, pp. 621-633.
|
|
(19)
|
Orn,S., S.Yamani, and L.Norrgren (2006), “Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha- ethinylestradiol and 17 beta-trenbolone”, Archives of Environmental Contamination and Toxicology 51, pp. 237-243.
|
|
(20)
|
Scholz,S. and N.Kluver (2009), “Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish”, Sexual Development 3, pp. 136-151.
|
|
(21)
|
Fenske,M., G.Maack, C.Schafers, and H.Segner (2005), “An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio”, Environmental Toxicology and Chemistry 24, pp. 1088-1098.
|
|
(22)
|
OCDE (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Série sur les essais et l'évaluation No 123, ENV/JM/M0N0(2010)14, OCDE, Paris.
|
|
(23)
|
Kobayashi,T., M.Matsuda, H.Kajiura-Kobayashi, A.Suzuki, N.Saito, M.Nakamoto, N.Shibata, and Y.Nagahama (2004), “Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes”, Developmental Dynamics 231, pp. 518-526.
|
|
(24)
|
Shinomiya,A., H.Otake, K.Togashi, S.Hamaguchi, and M.Sakaizumi (2004), “Field survey of sex- reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations”, Zoological Science 21, pp. 613-619.
|
|
(25)
|
Kidd,K.A., P.J.Blanchfield, K.H.Mills, V.P.Palace, R.E.Evans, J.M.Lazorchak, and R.W.Flick (2007), “Collapse of a fish population after exposure to a synthetic estrogen”, Proceedings of the National Academy of Sciences of the United States of America 104, pp. 8897-8901.
|
|
(26)
|
Palace,V.P., R.E.Evans, K.G.Wautier, K.H.Mills, P.J.Blanchfield, B.J.Park, C.L.Baron, and K.A.Kidd (2009), “Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake”, Canadian Journal of Fisheries and Aquatic Sciences 66, pp. 1920-1935.
|
|
(27)
|
Panter,G.H., T.H.Hutchinson, K.S.Hurd, J.Bamforth, R.D.Stanley, S.Duffell, A.Hargreaves, S.Gimeno, and C.R.Tyler (2006), “Development of chronic tests for endocrine active chemicals — Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)”, Aquatic Toxicology 77, pp. 279-290.
|
|
(28)
|
Holbech,H., K.Kinnberg, G.I.Petersen, P.Jackson, K.Hylland, L.Norrgren, and P.Bjerregaard (2006), “Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (EDSP)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, pp. 57-66.
|
|
(29)
|
Andersen,L., K.Kinnberg, H.Holbech, B.Korsgaard, and P.Bjerregaard (2004), “Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)”, Fish Physiology and Biochemistry 30, pp. 257-266.
|
|
(30)
|
Morthorst,J.E., H.Holbech, and P.Bjerregaard (2010), “Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations”, Aquatic Toxicology 98, pp. 336-343.
|
|
(31)
|
Kiparissis,Y., T.L.Metcalfe, G.C.Balch, and C.D.Metcalf (2003), “Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)”, Aquatic Toxicology 63, pp. 391-403.
|
|
(32)
|
Panter,G.H., T.H.Hutchinson, K.S.Hurd, A.Sherren, R.D.Stanley, and C.R.Tyler (2004), “Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development”, Aquatic Toxicology 70, pp. 11-21.
|
|
(33)
|
Kinnberg,K., H.Holbech, G.I.Petersen, and P.Bjerregaard (2007), “Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 165-170.
|
|
(34)
|
Chapitre C.14 de la présente annexe: Poisson, essai sur la croissance des juvéniles.
|
|
(35)
|
Chapitre C.4 de la présente annexe: Détermination de la biodégradabilité “facile”.
|
|
(36)
|
OCDE (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Série sur les essais et l'évaluation No 23, ENV/JM/MONO(2000)6, OCDE, Paris.
|
|
(37)
|
OCDE (2009), Essai à court terme de reproduction des poissons, Ligne directrice No 229 pour les essais de produits chimiques, OCDE, Paris.
|
|
(38)
|
Chapitre C.37 de la présente annexe: Essai de 21 jours sur les poissons: essai de dépistage à court terme de l'activité oestrogénique et androgénique, et de l'inhibition de l'aromatase.
|
|
(39)
|
OCDE (2012), Fish Toxicity Testing Framework, Série sur les essais et l'évaluation No 171, OCDE, Paris.
|
|
(40)
|
Schäfers, C., Teigeler,M., Wenzel,A., Maack,G., Fenske,M., Segner,H (2007), “Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio” Journal of Toxicology and Environmental Health-Part A, 70, 9-10 pp 768-779.
|
|
(41)
|
OCDE (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Série sur les essais et l'évaluation No 141, ENV/JM/MONO(2011)22, OCDE, Paris.
|
|
(42)
|
OCDE (2011), Validation Report (Phase 2) for the Fish Sexual Development Test, Série sur les essais et l'évaluation No 142, ENV/JM/MONO(2011)23, OCDE, Paris.
|
|
(43)
|
OCDE (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Série sur les essais et l'évaluation No 143, ENV/JM/MONO(2011)24, OCDE, Paris.
|
|
(44)
|
Directive 2010/63/UE du Parlement européen et du Conseil du 22 septembre 2010 relative à la protection des animaux utilisés à des fins scientifiques. JO L 276 du 20.10.2010, p. 33.
|
Appendice 1
Abréviations et définitions
Effet apical
: ayant des effets au niveau de la population
VSA
: valeur de la saturation en air
Biomarqueur
: ayant des effets au niveau individuel
Substance chimique
: une substance ou un mélange
DMY
: gène lié à Y du domaine DM indispensable au développement des caractères masculins chez le medaka japonais
ELISA (Enzyme-Linked Immunosorbent Assay): essai d'immuno-absorption enzymatique
Poids de poissons
: poids frais de poissons (à sec)
EDSP
: eessai de développement sexuel des poissons
Axe HHG
: axe hypothalamo-hypophyso-gonadique
Hermaphrodite
: poisson ayant plus d'un ovocyte dans les testicules par lot de six coupes analysées ou des cellules spermatogéniques dans les ovaires (oui/non)
Taux de charge
: poids frais de poissons par unité de volume d'eau
RT-PCR
: transcription inverse suivie d'une réaction en chaîne par polymérase
Substance chimique d'essai
: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
Poisson indifférencié
: poisson dont les gonades sont dénuées de cellules germinales visibles
VTG
: vitellogénine
Appendice 2
Conditions expérimentales de l'EDSP (espèces d'eau douce)
|
|
Medaka japonais (Oryzias latipes)
|
Poisson-zèbre(Danio rerio)
|
Épinoche à trois épines (Gasterostreus aculeatus)
|
|
|
dynamique ou semi-statique
|
dynamique ou semi-statique
|
dynamique ou semi-statique
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
4.
|
Qualité de l'éclairage
|
|
Ampoules fluorescentes (à large spectre)
|
Ampoules fluorescentes (à large spectre)
|
Ampoules fluorescentes (à large spectre)
|
|
5.
|
Intensité de l'éclairage
|
|
10-20 μΕ/m2/s, 540-1 080 lux ou 50-100 fc (niveaux ambiants du laboratoire)
|
10-20 μΕ/m2/s, 540-1 080 lux ou 50-100 fc (niveaux ambiants du laboratoire)
|
10-20 μΕ/m2/s, 540-1 080 lux ou 50-100 fc (niveaux ambiants du laboratoire)
|
|
|
12-16 h de lumière, 8-12 h d'obscurité
|
12-16 h de lumière, 8-12 h d'obscurité
|
16 h de lumière, 8 d'obscurité
|
|
7.
|
Volume minimum des enceintes
|
|
Chaque enceinte peut contenir au moins 7 l d'eau
|
Chaque enceinte peut contenir au moins 7 l d'eau
|
Chaque enceinte peut contenir au moins 7 l d'eau
|
|
8.
|
Remplacement volumique des solutions d'essai
|
|
Minimum 5 fois/jour
|
Minimum 5 fois/jour
|
Minimum 5 fois/jour
|
|
9.
|
Âge des organismes d'essai au début de l'exposition
|
|
Œufs nouvellement fécondés (au stade du blastodisque)
|
Œufs nouvellement fécondés (au stade du blastodisque)
|
Œufs nouvellement fécondés
|
|
10.
|
Nombre d'œufs par traitement
|
|
Minimum 120
|
Minimum 120
|
Minimum 120
|
|
11.
|
Nombre de traitements
|
|
Minimum 3 (plus témoins appropriés)
|
Minimum 3 (plus témoins appropriés)
|
Minimum 3 (plus témoins appropriés)
|
|
12.
|
Nombre de réplicats par traitement
|
|
Minimum 4 (sauf répartition par racine carrée dans les témoins)
|
Minimum 4 (sauf répartition par racine carrée dans les témoins)
|
Minimum 4 (sauf répartition par racine carrée dans les témoins)
|
|
|
Artémies vivantes, nauplies d'artémies adultes congelées, flocons, etc. Il est recommandé de nourrir les poissons deux fois par jour.
|
Friture spéciale, artémies vivantes, nauplies d'artémies adultes congelées, flocons, etc. Il est recommandé de nourrir les poissons deux fois par jour.
|
Artémies vivantes, nauplies d'artémies adultes congelées, flocons, etc. Il est recommandé de nourrir les poissons deux fois par jour.
|
|
|
Pas d'aération sauf si la concentration d'oxygène dissous est inférieure à 60 % de la valeur de la saturation en air
|
Pas d'aération sauf si la concentration d'oxygène dissous est inférieure à 60 % de la valeur de la saturation en air
|
Pas d'aération sauf si la concentration d'oxygène dissous est inférieure à 70 % de la valeur de la saturation en air
|
|
|
Eau de surface, de puits ou reconstituée
|
Eau de surface, de puits ou reconstituée
|
Eau de surface, de puits ou reconstituée
|
|
16.
|
Durée de l'exposition à la substance chimique d'essai
|
|
60 jours après l'éclosion
|
60 jours après l'éclosion
|
60 jours après l'éclosion
|
|
17.
|
Effets biologiques mesurés
|
|
Éclosion réussie, survie, morphologie brute, VTG, histologie gonadique, sexe génétique, ratio mâles/femelles
|
Éclosion réussie, survie, morphologie brute, VTG, histologie gonadique, ratio mâles/femelles
|
Éclosion réussie, survie, morphologie brute, VTG, histologie gonadique, ratio mâles/femelles
|
|
18.
|
Critères de validité de l'essai pour les lots de réplicats des témoins
|
|
Éclosion réussie > 80
|
Éclosion réussie > 80
|
Éclosion réussie > 80
|
|
Survie après éclosion ≥ 70 %
|
Survie après éclosion ≥ 70 %
|
Survie après éclosion ≥ 70 %
|
|
Croissance (poids frais de poissons à sec) >150 mg
|
Croissance (poids frais de poissons à sec) > 75 mg
|
Croissance (poids frais de poissons à sec) > 120 mg
|
|
Longueur (longueur standard) > 20 mm
|
Longueur (longueur standard) > 14 mm
|
Longueur (longueur standard) > 20 mm
|
|
Ratio mâles/femelles
30 %-70 %
|
Ratio mâles/femelles 30 %-70 %
|
Ratio mâles/femelles 30 %-70 %
|
Appendice 3
Caractéristiques chimiques d'une eau de dilution acceptable
|
CONSTITUANT
|
CONCENTRATIONS
|
|
Particules
|
< 20 mg/l
|
|
Carbone organique total
|
< 2 mg/l
|
|
Ammoniac non ionisé
|
< 1 μg/l
|
|
Chlore résiduel
|
< 10 μg/l
|
|
Pesticides organophosphorés totaux
|
< 50 ng/l
|
|
Pesticides organochlorés totaux et biphényles polychlorés
|
< 50 ng/l
|
|
Chlore organique total
|
< 25 ng/l
|
Appendice 4
Extrait de la méthode d'essai C.14/orientations sur les concentrations de substance d'essai
|
Colonne (Nombre de concentrations entre 100 et 10 ou entre 10 et 1) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
Appendice 5
Guide d'homogénéisation de la tête et de la queue des juvéniles des espèces poisson- zèbre, tête-de-boule, épinoche à trois épines et medaka japonais
Cette partie a pour objet de décrire les procédures qui précèdent la quantification de la concentration de VTG. D'autres procédures permettant un dosage similaire de la VTG peuvent être utilisées. La concentration de VTG peut, de manière optionnelle, être déterminée dans le plasma sanguin ou le foie au lieu d'un homogénat tête-queue.
Procédure
|
1.
|
Les poissons sont anesthésiés puis euthanasiés conformément à la description de l'essai.
|
|
2.
|
La tête et la queue des poissons sont coupées conformément à la description de l'essai. Note importante: tous les instruments de dissection ainsi que la planche à découper sont rincés et lavés correctement (avec de l'éthanol à 96 %, par exemple) entre chaque manipulation de poisson pour éviter que la vitellogénine des femelles ou des mâles induits ne “pollue” les mâles non-induits.
|
|
3.
|
L'ensemble tête-queue de chaque poisson est pesé au mg prêt.
|
|
4.
|
Après avoir été pesés, les morceaux sont placés dans des tubes appropriés (Eppendorf de 1,5 ml, par exemple) et stockés à une température de – 80 °C jusqu'à leur homogénéisation ou bien directement homogénéisés sur de la glace avec deux pilons en plastique (d'autres méthodes peuvent être utilisées si elles impliquent de la glace et permettent d'obtenir une masse homogène). Note importante: les tubes sont numérotés correctement de façon que la tête et la queue du poisson puissent être reliées à la partie du corps correspondante utilisée pour l'histologie gonadique.
|
|
5.
|
Après obtention d'une masse homogène, on ajoute un tampon d'homogénéisation
(29) glacé représentant 4-10 x la masse pondérale tissulaire (noter la dilution). Continuer à pilonner jusqu'à ce que le mélange soit homogène. Note importante: de nouveaux pilons sont utilisés pour chaque poisson.
|
|
6.
|
Les échantillons sont posés sur de la glace jusqu'à centrifugation à 50 000 g pendant 30 min. et à une température de 4 °C.
|
|
7.
|
Utiliser une pipette pour répartir des portions de 20 à 50 μl (noter la quantité) de surnageant dans au moins deux tubes en plongeant l'embout de la pipette sous la couche lipidique située à la surface et en aspirant doucement le surnageant sans fraction lipidique ni culot.
|
|
8.
|
Les tubes sont stockés à une température de – 80 °C jusqu'à leur utilisation.
|
Note: Le tampon d'homogénéisation est utilisé le jour de sa fabrication. Placer sur de la glace pendant son utilisation
Appendice 6
Guide de quantification de la vitellogénine dans des homogénats tête-queue de poisson-zèbre (Danio Rerio) (modifié à partir de Holbech et al., 2001). d'autres procédures utilisant des anticorps et des standards homlogues peuvent être utilisées.
|
1.
|
Décongeler les plaques de microtitration (certifiées Maxisorp F96, Nunc, Roskilde, Danemark) recouvertes au préalable de 5 mg/ml d'anti-IgG de lipovitelline de poisson-zèbre puis les laver 3 fois avec un tampon de lavage (*).
|
|
2.
|
Diluer en série le standard de vitellogénine de poisson-zèbre (30) purifié à raison de 0,2; 0,5; 1; 2; 5; 10 et 20 ng/ml dans un tampon de dilution (**) et diluer les échantillons au moins 200 fois (pour éviter l'effet de matrice) dans le tampon de dilution puis les poser sur les plaques. Dupliquer un contrôle d'essai. Verser 150 μl dans chaque puits. Dupliquer les standards et tripliquer les échantillons. Faire incuber pendant une nuit à 4 °C sur un agitateur.
|
|
3.
|
Laver 5 fois les plaques avec le tampon de lavage (*).
|
|
4.
|
Diluer HPR associé à une chaîne de dextrane (AMDEX A/S, Danemark, par exemple) et les anticorps conjugués dans le tampon de lavage; la dilution réelle diffère selon le lot et l'âge. Verser 150 μl dans chaque puits et mettre les plaques en incubation pendant 1 heure à température ambiante sur un shaker.
|
|
5.
|
Laver 5 fois les plaques avec le tampon de lavage (*), et nettoyer soigneusement le fond des plaques avec de l'éthanol.
|
|
6.
|
Verser 150 μl de TMB plus (***) dans chaque puits. Protéger les plaques de la lumière avec du papier aluminium puis observer le changement de couleur sur un shaker.
|
|
7.
|
Une fois la courbe d'étalonnage obtenue, stopper l'activité enzymatique en versant 150 μl 0,2 M de H2SO4 dans chaque puits.
|
|
8.
|
Mesurer l'absorbance à hauteur de 450 nm (sur un lecteur de plaque de dispositifs moléculaires Thermomax). Analyser les données sur le logiciel associé (Softmax, par exemple).
|
|
(*)
|
Tampon de lavage:
|
Stock de PBS (****)
|
500,0
|
ml
|
|
Sérum d'albumine bovine
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
Rééquilibrer le pH à 7,3 et verser dans 5 l d'eau filtrée sur membrane millipore. Stocker à 4 °C.
|
|
|
(**)
|
Tampon de dilution:
|
Stock de PBS (****)
|
100,0
|
ml
|
|
Sérum d'albumine bovine
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
Rééquilibrer le pH à 7,3 et verser dans 1 l d'eau filtrée sur membrane millipore. Stocker à 4 °C.
|
|
|
(***)
|
Le TMB plus est un substrat “prêt à l'emploi” produit par KemEnTec (Danemark). Il est photosensible. Stocker à 4 °C.
|
|
(****)
|
Stock de PBS
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4 2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
Rééquilibrer le pH à 6,8 et verser dans 2 l d'eau filtrée sur membrane millipore. Stocker à température ambiante
|
|
Appendice 7
Guide de préparation des coupes tissulaires pour la détermination du sexe et le classement par stade des gonades
Cette partie a pour objet de décrire les procédures qui précèdent l'évaluation des coupes histologiques. D'autres procédures similaires de détermination du sexe et de classement par stade des gonades peuvent être utilisées.
À quelques exceptions près, ces procédures sont similaires pour le medaka japonais et le poisson-zèbre.
Euthanasie, autopsie et fixation des tissus
Objectifs:
|
1.
|
Euthanasier les poissons sans les faire souffrir.
|
|
2.
|
Obtenir les poids corporels et les mesures nécessaires.
|
|
3.
|
Évaluer les caractères sexuels secondaires.
|
|
4.
|
Disséquer les tissus pour l'analyse de la VTG.
|
Procédures:
|
1.
|
Les poissons sont euthanasiés immédiatement avant l'autopsie. Par conséquent, à moins que les prosecteurs soient nombreux, les poissons ne sont pas sacrifiés en nombre simultanément.
|
|
2.
|
Transférer un poisson de l'enceinte d'essai vers la zone d'autopsie du conteneur de transport avec l'épuisette.
|
|
3.
|
Placer le poisson dans la solution euthanasique. Retirer le poisson de la solution lorsqu'il ne respire plus et qu'il ne répond plus aux stimuli extérieurs.
|
|
4.
|
Mesurer le poids frais du poisson.
|
|
5.
|
Pour la préparation des tissus à l'analyse de la VTG, le poisson peut être placé sur un carreau de liège sur la plate-forme élevée d'un microscope à dissection.
|
a.
|
Chez le poisson-zèbre, couper la tête juste derrière la nageoire pectorale et la queue juste derrière la nageoire dorsale.
|
|
b.
|
Chez le medaka japonais, ouvrir l'abdomen en pratiquant soigneusement une incision le long de la ligne médiane allant de l'attache pectorale à un point situé juste au-dessus de l'anus. Exciser délicatement le foie à l'aide de pincettes et de ciseaux.
|
|
|
6.
|
Placer les spécimens pour l'analyse de la VTG dans des tubes Eppendorf et les congeler immédiatement dans de l'azote liquide.
|
|
7.
|
Placer la carcasse avec les gonades dans une cassette à tissus en plastique pré-étiquetée qui sera transférée dans un liquide fixateur de Davidson ou de Bouin. Le volume de fixateur est supérieur ou égal à 10 fois le volume approximatif des tissus. Agiter doucement le conteneur avec le fixateur pendant cinq secondes pour évacuer les bulles d'air de la cassette.
|
|
8.
|
|
a.
|
Laisser les tissus dans le fixateur de Davidson pendant une nuit puis les transférer dans des conteneurs individuels de formol tamponné à 10 % le lendemain. Agiter doucement les conteneurs avec les cassettes pendant 5 secondes pour que le formol pénètre bien dans les cassettes.
|
|
b.
|
Laisser les tissus dans le fixateur de Bouin pendant 24 h puis les transférer dans de l'éthanol à 70 %.
|
|
Traitement des tissus
Objectifs:
|
1.
|
Déshydrater les tissus pour une bonne pénétration de la paraffine.
|
|
2.
|
Imprégner les tissus de paraffine pour maintenir l'intégrité des tissus et créer une surface ferme pour la microtomie.
|
Procédures:
|
3.
|
Retirer les cassettes étiquetées contenant les tissus du formol/de l'éthanol puis placer les cassettes dans le(s) panier(s) de traitement. Charger le panier dans l'appareil de traitement.
|
|
4.
|
Sélectionner le programme de traitement.
|
|
5.
|
À la fin du cycle de traitement, le(s) panier(s) peut/peuvent être transféré(s) vers la station d'inclusion.
|
Inclusion
Objectif:
Placer correctement le spécimen dans la paraffine solidifiée pour la microtomie.
Procédures:
|
1.
|
Retirer le(s) panier(s) des cassettes de l'appareil puis immerger le(s) panier(s) dans l'enceinte- avant, remplie de paraffine, de la console thermique de la station d'inclusion, ou déplacer les cassettes vers un réchauffeur de paraffine séparé.
|
|
2.
|
Retirer la première cassette à inclure de l'enceinte-avant de la console thermique ou du réchauffeur de paraffine. Retirer et mettre au rebut le couvercle de la cassette puis vérifier l'étiquette de la cassette par rapport aux données enregistrées sur les animaux afin de corriger les écarts éventuels avant inclusion.
|
|
3.
|
Sélectionner un moule d'inclusion aux dimensions adéquates.
|
|
4.
|
Placer le moule sous le bec verseur de la console de distribution et le remplir de paraffine fondue.
|
|
5.
|
Retirer le spécimen de la cassette et le placer dans le moule rempli de paraffine fondue. Répéter cette opération avec 4-8 spécimens pour chaque moule de paraffine. Marquer la position de chaque poisson en plaçant le poisson no 1 à 180 degrés des poissons 2-4/8.
|
|
6.
|
Recouvrir le spécimen d'une couche de paraffine supplémentaire.
|
|
7.
|
Placer le moule et le fond de la cassette sur la plaque froide de la console cryogénique.
|
|
8.
|
Une fois la paraffine solidifiée, démouler le bloc (à savoir la paraffine durcie contenant les tissus et le fond de la cassette).
|
Microtomie
Objectif:
Réalisation et montage de coupes histologiques en vue de leur coloration.
Procédures:
|
1.
|
La première phase de la microtomie, appelée “facing” se déroule ainsi:
|
a.
|
Placer le bloc de paraffine dans le porte-bloc du microtome.
|
|
b.
|
Avancer le porte-bloc en faisant tourner la roue du microtome et effectuer des coupes épaisses à la surface du bloc de paraffine jusqu'à ce que la lame atteigne les tissus inclus.
|
|
c.
|
Régler l'épaisseur de coupe du microtome sur 3-5 microns. Avancer le porte- bloc et réaliser de nombreuses coupes dans le bloc pour supprimer les éventuels phénomènes parasites provoqués à la surface de coupe du tissu lors de la préparation.
|
|
d.
|
Retirer le bloc du porte-bloc et le placer à l'envers sur de la glace pour détremper le tissu.
|
|
|
2.
|
La phase suivante de la microtomie correspond à la réalisation des coupes finales et à la confection des lames. La procédure est la suivante:
|
a.
|
Si le bloc a été placé sur de la glace, retirer le bloc de la glace puis le replacer dans le porte-bloc du microtome.
|
|
b.
|
L'épaisseur de coupe étant réglée sur 3-5 microns, avancer le porte-bloc en faisant tourner la roue du microtome. Confectionner un “ruban” de coupes comptant au moins une coupe acceptable comprenant les gonades. (Si nécessaire, pendant la réalisation des coupes, retirer le bloc du porte-bloc, le placer sur de la glace pour détremper le tissu puis le replacer dans le porte- bloc).
|
|
c.
|
Déplisser les coupes par flottaison à la surface du bain-marie. Essayer d'obtenir au moins une coupe sans plis et sans bulles d'air emprisonnées en dessous.
|
|
d.
|
Immerger une lame sous la meilleure coupe puis sortir celle-ci de l'eau à l'aide de la lame. Ce procédé est appelé “montage” de la coupe sur la lame ou “confection des lames”.
|
|
e.
|
Préparer trois coupes pour un ensemble de poissons. Effectuer la deuxième et la troisième coupe à 50 microns d'intervalle de la première. Si les poissons ne sont pas inclus avec leurs gonades dans le même niveau de coupe, effectuer plus de coupes pour s'assurer qu'au moins six coupes comprenant les gonades sont obtenues de chaque poisson.
|
|
f.
|
Noter sur la lame, à l'aide d'un marqueur spécial, le numéro du bloc à partir duquel la lame a été confectionnée.
|
|
g.
|
Placer la lame sur un support pour coloration de lames.
|
|
h.
|
Retirer le bloc du porte-bloc puis le placer à l'envers pour stockage.
|
|
Coloration, application des lamelles et étiquetage des lames
Objectifs:
|
—
|
Coloration des coupes en vue de l'analyse histopathologique
|
|
—
|
Coloration et montage étanche permanents des tissus
|
|
—
|
Identification permanente des coupes colorées de manière à assurer une traçabilité parfaite.
|
Procédures:
|
1.
|
Coloration
|
a.
|
Laisser sécher les lames à l'air libre toute une nuit avant leur coloration.
|
|
b.
|
Colorer les coupes à l'hématoxyline-éosine.
|
|
|
2.
|
Application des lamelles
|
a.
|
Les lamelles peuvent être appliquées manuellement ou automatiquement.
|
|
b.
|
Tremper une lame dans du xylène ou du TissueClear®, puis retirer délicatement l'excès de xylène/TissueClear® de la lame.
|
|
c.
|
Appliquer 0,1 ml environ de medium de montage près du bord de la lame à l'opposé du bord dépoli ou sur la lamelle.
|
|
d.
|
Appliquer la lamelle sur la lame en l'inclinant légèrement.
|
|
|
3.
|
Étiquetage des lames
|
e.
|
Chaque étiquette contient les informations suivantes:
|
iv.
|
Groupe de traitement chimique
|
|
|
Appendice 8
Diagramme de décision statistique pour l'analyse de la vitellogénine

Diagramme de décision statistique pour l'analyse du ratio mâles/femelles
Appendice 9
Recommandation pour le prélèvement tissulaire pour la détermination du sexe génétique par réaction en chaîne par polymérase (PCR)
Prélèvement, préparation et stockage des tissus avant détermination du sexe génétique par réaction en chaîne par polymérase (PCR) chez le medaka (préparé par le laboratoire pour les organismes aquatiques de Bayer CropScience AG)
|
1.
|
Couper la nageoire anale ou dorsale de chaque poisson à l'aide de ciseaux à fine lame et la placer dans un tube rempli de 100 μl de tampon d'extraction 1 (la préparation du tampon est détaillée ci-dessous). Nettoyer les ciseaux après chaque poisson dans un bécher rempli d'eau distillée puis les sécher avec du papier absorbant.
|
|
2.
|
Homogénéiser les nageoires avec un pilon de micro-tube en teflon pour lyser les cellules. Pour chaque tube, utiliser un pilon neuf pour éviter toute contamination. Placer les pilons une nuit dans 0,5 M de NaOH, les rincer 5 minutes dans de l'eau distillée puis les conserver dans de l'éthanol ou en milieu stérile après passage en autoclave jusqu'à utilisation.
|
|
3.
|
Il est également possible de stocker les nageoires sans tampon d'extraction 1 sur de la glace carbonique puis dans un réfrigérateur à une température de – 80 °C pour éviter toute dégénérescence de l'ADN. Néanmoins, l'extraction se fait mieux si l'on extrait l'ADN simultanément (pour la manipulation, voir ci- dessus; décongeler les échantillons sur de la glace après conservation à une température de – 80 °C avant de remplir les tubes de tampon).
|
|
4.
|
Après avoir homogénéisé tous les tubes, les mettre au bain-marie puis les porter à ébullition pendant 15 minutes à une température de 100 °C.
|
|
5.
|
Remplir chaque tube de 100 μl de tampon d'extraction 2 (la préparation du tampon est détaillée ci-dessous) à l'aide d'une pipette. Conserver les échantillons à température ambiante pendant 15 minutes et, pendant ce temps, les remuer délicatement de temps en temps avec la main.
|
|
6.
|
Remettre ensuite tous les tubes au bain-marie puis les porter de nouveau à ébullition pendant 15 minutes à une température de 100 °C.
|
|
7.
|
En attendant l'analyse plus approfondie, congeler les tubes à – 20 °C.
|
Préparation des tampons:
Tampon 1 utilisé pour la réaction PCR:
|
|
500 mg de N-Lauroylsarcosine (Merck KGaA, Darmstadt, GE, par exemple)
|
|
|
ajouter 100 ml d'eau distillée
|
Tampon 2 utilisé pour la réaction PCR:
|
|
20 g de Chelex (Biorad, Munich, GE, par exemple)
|
|
|
Gonfler dans 100 ml d'eau distillée
|
Détermination du sexe génétique (par PCR) chez le medaka (préparé par le laboratoire pour les organismes aquatiques de Bayer CropScience AG et Biozentrum de l'université de Würzburg)
Décongeler les tubes préparés et congelés (tel que décrit dans la partie précédente) sur de la glace. Ensuite, centrifuger les tubes avec une centrifugeuse Eppendorf (30 sec à vitesse maximale, à température ambiante). Pour la PCR, utiliser le surnageant clair séparé du précipité. Veiller absolument à ce qu'aucune trace de Chelex (situé dans le précipité) ne soit transférée vers la réaction PCR, car cela provoquerait des interférences avec l'activité de la Taq polymérase. Utiliser directement le surnageant ou le congeler (à – 20 °C) puis le faire de nouveau décongeler suivant plusieurs cycles sans effet négatif sur l'ADN pour les analyses ultérieures.
1. Préparation du “mélange réactif” (25 μl par échantillon):
|
|
Volume
|
Concentration finale
|
|
Modèle d'ADN
|
0,5μl-2μl
|
|
|
tampon 10x pour PCR avec MgCl2
|
2,5μl
|
1x
|
|
Nucléotides (dATP, dCTP, dGTP, dTTP)
|
4μl (5mM)
|
200μM
|
|
Amorce sens (10 μM) (voir ci-dessous 3-5)
|
0,5μl
|
200nM
|
|
Amorce anti-sens (10 μM) (voir ci-dessous 3-5)
|
0,5μl
|
200nM
|
|
DMSO
|
1,25μl
|
5 %
|
|
Eau (classe PCR)
|
jusqu'à 25 μl
|
|
|
Taq E- Polymérase
|
0,3μl
|
1,5U
|
|
Tampon 10x pour PCR avec MgCl2: 670 mM de Tris/HCl (pH 8,8 à 25 °C), 160 mM de (NH4)2SO4, 25 mM de MgCl2, 0,1 % de Tween 20
|
Pour chaque PCR (voir ci-dessous 3-5), on a besoin de l'amorce spéciale comme nouvelle combinaison de “mélange réactif” et du volume adéquat nécessaire de modèle d'ADN pour chaque échantillon (voir ci- dessus). Les volumes respectifs seront transférés dans de nouveaux tubes à l'aide de pipettes. Les tubes seront ensuite fermés, agités (10 s environ) et centrifugés (10 s à température ambiante). À ce moment, les programmes de PCR respectifs pourront être initiés. De plus, un témoin positif (échantillon d'ADN servant d'exemple, dont l'activité est connue et les résultats sont clairs) et un témoin négatif (1 μl d'eau distillée) seront utilisés dans chaque programme de PCR.
2. Préparation du gel d'agarose (1 %) — Pendant le fonctionnement des programmes de PCR:
|
—
|
Dissoudre 3 g d'agarose dans 300 ml de solution tampon TAE 1 × (gel d'agarose 1 %)
|
|
—
|
Porter cette solution à ébullition aux micro-ondes (2-3 min environ)
|
|
—
|
Transférer la solution chaude dans un moule spécial posé sur de la glace
|
|
—
|
Au bout de 20 minutes environ, le gel d'agarose est prêt à l'emploi
|
|
—
|
Stocker le gel d'agarose dans la solution tampon TAE 1 × jusqu'à la fin des programmes de PCR
|
3. Programme de PCR pour actines:
Cette réaction PCR vise à démontrer que l'ADN présent dans l'échantillon n'est pas détérioré.
|
—
|
Amorce spécifique:
|
—
|
“M act 1(upper/forward)” → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
“M act 2(lower/reverse)” → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Programme:
|
—
|
Cycle (35 fois):
|
Dénaturation
|
→ 45 sec à 95 °C
|
|
Hybridation
|
→ 45 sec à 56 °C
|
|
Élongation
|
→ 1 min à 68 °C
|
|
|
4. Programme de PCR pour gènes X et Y:
Les échantillons dont l'ADN est intact seront utilisés dans ce programme de PCR pour détecter les gènes X et Y. L'ADN des mâles comporte une double bande et l'ADN des femelles une seule bande (après coloration et électrophorèse sur gel d'agarose). Si l'on utilise ce programme, on intégrera un témoin positif pour les mâles (échantillon XY) et un pour les femelles (échantillon XX).
|
—
|
Amorce spécifique:
|
—
|
“PG 17.5” (upper/forward) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
“PG 17.6” (lower/reverse) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Programme:
|
—
|
Cycle (40 fois):
|
Dénaturation
|
→ 45 sec à 95 °C
|
|
Hybridation
|
→ 45 sec à 55 °C
|
|
Élongation
|
→ 1 min 30 sec à 68 °C
|
|
|
5. Programme de PCR pour gènes Y servant de “témoin” pour le programme de PCR pour gènes X et Y:
Ce programme permet de vérifier les résultats du “programme de PCR pour gènes X et Y”. Les “échantillons mâles” doivent comporter une bande et les “échantillons femelles” ne doivent en comporter aucune (après coloration et électrophorèse sur gel d'agarose).
|
—
|
Amorce spécifique:
|
—
|
“DMTYa (upper/forward)” → GGC CGG GTC CCC GGG TG
|
|
—
|
“DMTYd (lower/reverse)” → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Programme:
|
—
|
Cycle (40 fois):
|
Dénaturation
|
→ 45 sec à 95 °C
|
|
Hybridation
|
→ 45 sec à 56 °C
|
|
Élongation
|
→ 1 min à 68 °C
|
|
|
6. Coloration des échantillons de PCR:
Solution de coloration:
|
|
0,25 % de bleu de bromophénol
|
Verser 1 μl de cette solution dans chaque tube à l'aide d'une pipette.
7. Début de l'électrophorèse sur gel d'agarose:
|
—
|
Transférer la préparation de gel d'agarose 1 % dans une enceinte d'électrophorèse sur gel remplie de tampon TAE 1x
|
|
—
|
Verser 10-15 μl de chaque échantillon de PCR coloré dans une fente de gel d'agarose à l'aide d'une pipette
|
|
—
|
Verser 5-15 μl de 1kb-“Ladder” (Invitrogène) dans une fente séparée à l'aide d'une pipette
|
|
—
|
Commencer l'électrophorèse avec 200 V
|
|
—
|
Arrêter au bout de 30-45 min
|
8. Détermination des bandes:
|
—
|
Nettoyer le gel d'agarose avec de l'eau distillée.
|
|
—
|
Transférer le gel d'agarose dans du bromure d'éthidium pendant 15-30 min —
|
|
—
|
Photographier le gel d'agarose exposé à des rayonnements ultra-violets
|
|
—
|
Analyser les échantillons en les comparant à la bande/aux bandes témoin(s) positive(s) et à l'échelle
|
Appendice 10
Guide de prélèvement tissulaire pour la détermination du sexe génétique par réaction en chaîne par polymérase chez l'épinoche
Prélèvement tissulaire et extraction de l'ADN
L'ADN peut être extrait au moyen d'une variété de réactifs disponibles dans le commerce, et en utilisant des procédés d'extraction manuelle ou automatique. Le protocole utilisé au laboratoire CEFAS de Weymouth est décrit ci-dessous, et des méthodes alternatives ont été ajoutées dans certains cas.
|
1.
|
Au moyen de ciseaux fins, un petit morceau tissulaire (10-20 mg) de la partie dorso-latérale (après prélèvement de la tête et de la queue pour la mesure de la vitellogénine) est prélevé de chaque poisson individuellement. Le tissu est placé dans un tube et soit directement placé dans l'azote liquide (conservation à – 80 °C), soit rempli par de l'éthanol à 70 % (pour un transport et une conservation à 4 °C). Les ciseaux sont nettoyés après chaque dissection de poisson individuellement dans de l'éthanol à 70 %, puis trempés dans de l'eau distillée avant d'être séchés sur du papier absorbant.
|
|
2.
|
L'éthanol (en cas de présence) est ôté par aspiration et le tissu est digéré du jour au lendemain avec de la protéinase K dans 400 μl de tampon ATL (Qiagen). Un aliquot (200 μl du produit de cette digestion est transféré dans un S-Block (Qiagen) de 96 puits, et l'ADN extrait dans un format de 96 puits utilisant le BioRobot Universel Qiagen et le kit Qlamp Investigator BioRobot. L'ADN est élué dans 50 μl d'une une eau exempte de DNAse et de RNAse. Dans le cas ou il est fait usage de prélèvements tissulaires durs pour extraire l'ADN (tel que le rachis ou la nageoire pectorale) il peut s'avérer nécessaire d'homogénéiser l'échantillon dans le tampon de lyse au moyen d'un lyseur de tissu FastPrep® ou un système équivalent de rupture des tissus.
Alternativement,
|
a.
|
L'échantillon tissulaire est digéré du jour au lendemain avec la protéinase K dans 400 μl de tampon de lyse G2 (Qiagen) et l'ADN est extrait de 200 μl du produit de digestion en utilisant soit le kit EZ-1 DNA easy tissue et le Biorobot EZ-1, ou alors le mini kit DNA easy tissue. L'ADN est élué dans un volume de 50 μl.
|
|
b.
|
Les prélèvements tissulaires sont soumis au réactif DNAzol. Les prélèvements sont rapidement lysés dans 1 ml de DNAzol pendant 10 min dans un tube de 1,5 ml à l'intérieur d'une centrifugeuse, suivi d'une centrifugation à 13 000 rpm pendant 5 min afin d'enlever toutes les particules. L'échantillon lysé est ensuite transféré dans un nouveau tube de centrifugation de 1,5 ml contenant 500 μl d'éthanol à 100 %, puis centrifugé à 13 000 rpm pendant 10 min pour précipiter l'ADN. L'éthanol est enlevé et remplacé par 400 μl d'éthanol à 70 %, puis centrifugé à 13 000 rpm pendant 5 min et le culot d'ADN est dissous dans 50 μl d'eau exempte d'ADNase et de RNAse. A nouveau, dans le cas ou il est fait usage de prélèvements tissulaires durs pour extraire l'ADN (tel que le rachis ou la nageoire pectorale) il peut s'avérer nécessaire d'homogénéiser l'échantillon dans le tampon de lyse au moyen d'un lyseur de tissu FastPrep® ou un système équivalent de rupture des tissus, préalablement à l'extraction d'ADN.
|
|
|
3.
|
L'ADN est stocké à – 20 °C jusqu'à utilisation.
|
Note importante: des gants sont portés lors des manipulations
Analyse par réaction en chaîne de la polymérase (PCR)
Les amplifications ont été réalisées au moyen de 2,5 μl d'extrait d'ADN dans un volume réactionnel de 50 μl et en utilisant le Idh locus primers (comme décrit par Peichel et al, 2004. Current biology 1:1416- 1424):
|
Amorce sens:
|
5' GGG ACG AGC AAG ATT TAT TGG 3'
|
|
Amorce antisens:
|
5' TAT AGT TAG CCA GGA GAT GG 3'
|
Il existe un grand nombre de fournisseurs de réactifs appropriés pour l'analyse PCR. La méthode décrite ci-dessous est celle actuellement utilisée au laboratoire CEFAS de Weymouth.
1. Préparation du “mélange réactif” (50 μl par échantillon):
Un mastermix est préparé comme suit. Celui-ci peut être préparé à l'avance et conservé à – 20 °C jusqu'à utilisation. Préparer une quantité de mastermix suffisante pour un contrôle négatif (eau de qualité biologie moléculaire uniquement).
|
|
Volume (concentration du stock)/échantillon
|
Concentration finale
|
|
5xGoTaq® Tampon de réaction
|
10μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nucléotides (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (25 mM chaque)
|
250 μM chaque
|
|
Amorce sens
|
0,5μl (0,1 nmol/μl)
|
2,0 μM
|
|
Amorce anti-sens
|
0,5μl (0,1 nmol/μl)
|
2,0μM
|
|
Eau (qualité biologie moléculaire)
|
30,75 μl
|
|
|
GoTaq Polymérase
|
0,25 μl
|
1,25U
|
|
—
|
Déverser 47,5 μl dans un tube à paroi fine de PCR étiqueté 0,5 ml
|
|
—
|
Ajouter 2,5 μl d'ADN purifié dans le tube étiqueté approprié Répéter l'opération pour tous les échantillons et le contrôle négatif;
|
|
—
|
Ajouter par-dessus 2 gouttes d'huile minérale Alternativement, utiliser un cycleur thermal à couvercle chauffant
|
|
—
|
Les échantillons ont été dénaturés dans un cycleur thermal Peltier PTC-225 à 94 +/– 2 °C pendant 5 minutes, suivi de 39 cycles de 94 +/– 2 °C pendant 1 minute, 55 +/– 2 °C pendant 1 minute, 72 +/– 2 °C pendant 1 minute, et une extension finale à 72 +/– 2 °C pendant 10 minutes.
|
2. Préparation du gel d'agarose (2 %):
Traditionnellement les produits de la PCR sont résolus sur gel d'agarose à 20 % contenant du bromure d'éthidium.
Des systèmes d'électrophorèse capillaires peuvent également être utilisés.
|
—
|
Peser 2g d'agarose dans 100 ml de tampon TAE 1×
|
|
—
|
Chauffer dans un four à micro-onde (environ 2-3 minutes) pour dissoudre l'agarose
|
|
—
|
Ajouter 2 gouttes de bromure d'éthidium pour atteindre la concentration finale de 0,5 μg/ml
|
|
—
|
Transférer la solution encore chaude dans l'équipement de prise du gel
|
|
—
|
Attendre que le gel durcisse.
|
3. Electrophorèse sur gel:
|
—
|
Transférer le gel d'agarose dans l'appareil d'éléctrophorèse et immerger dans le tampon de TAE 1×
|
|
—
|
Charger 20 μl de chaque échantillon dans un puits séparé, en ajoutant un marqueur de poids moléculaire (échelle d'ADN de 100pb, Promega) dans un puits à part
|
|
—
|
Effectuer l'électrophorèse à 120 V pendant 30-45 minutes.
|
4. Visualisation des produits d'amplification
Si le bromure d'éthidium a été incorporé dans le gel d'agarose comme décrit ci-dessus, les produits d'ADN sont visualisés sous une source d'UV. Alternativement, le gel d'agarose est coloré en couvrant le gel par une solution diluée de bromure d'éthidium (0,5 μg/ml dans de l'eau) pendant 30 minutes avant de pouvoir visualiser
Appendice 11
Guide pour la procédure de fertilisation artificielle chez l'épinoche
Le but de cette section est de décrire la procédure pour obtenir des œufs d'épinoche fertilisés pour leur utilisation dans l'essai de développement sexuel.
Procédures
Recueil de sperme chez les mâles
|
1.
|
Un mâle bien coloré de la population est euthanasié.
|
|
2.
|
Les testicules sont disséqués de chaque côté du poisson. Les testicules sont généralement très pigmentés, de forme allongée facilement visibles depuis la ligne médiane latérale du corps. Utiliser l'une des méthodes suivantes:
|
|
3.
|
Utiliser une paire de ciseaux fins, commencer à ouvrir depuis le cloaque et faire une incision de 1- 1,5 cm avec une petite entaille à 45°.
|
|
4.
|
Utiliser le scalpel pour faire une petite incision sur le côté du poisson légèrement postérieure au pelvis et ventralement par rapport aux plaques latérales.
|
|
5.
|
Les testicules sont enlevés au moyen de forceps fins et placés dans une boîte de pétri.
|
|
6.
|
Chaque testicule est recouvert de 100 μl de solution de Hank
(31) fraîchement préparée.
|
|
7.
|
Les testicules sont finement coupés en dés au moyen d'un scalpel ou d'une lame de rasoir. Ceci permet la libération de sperme et donne à la solution de Hank un aspect laiteux.
|
|
8.
|
Le fluide contenant le sperme est placé dans un tube; il faut veiller à ne pas introduire de tissu testiculaire lors du pipetage.
|
|
9.
|
800 μl de solution de Hank sont ajoutés dans le tube et bien mélangés.
|
|
10.
|
Si nécessaire, le mâle peut être préservé par fixation dans de l'éthanol à 100 % ou un autre produit de fixation. Cela est particulièrement important si l'étude vise à assigner une origine parentale à la descendance.
|
Note importante: Bien que la totalité de la solution-mère requise puisse être préparée à l'avance, le
stock No 5
et consécutivement la
solution finale
sont
fraîchement
préparés le jour même.
|
Stock No 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Eau distillée
|
100 ml
|
|
Stock No 2
|
|
Na2HPO4 (anhydre)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
Eau distillée
|
100 ml
|
|
Stock No 3
|
|
CaCl2
|
0,72 g
|
|
Eau distillée
|
50 ml
|
|
Stock No 4
|
|
MgSO4 · 7H2O
|
1,23 g
|
|
Eau distillée
|
50 ml
|
|
Stock No 5 (fraîchement préparé)
|
|
NaHCO3
|
0,35 g
|
|
Eau distillée
|
10 ml
|
Note: Si vous avez déjà certains de ces sels mais avec un contenu aqueux différent (p.e. 2 H2O au lieu de la forme anhydre), vous pouvez faire usage de ceux-ci mais il faut au préalable ajuster le poids en fonction du poids moléculaire.
Pour la solution finale de Hank, combiner les stocks de la façon suivante:
|
Stock 1
|
1,0 ml
|
|
Stock 2
|
0,1 ml
|
|
Stock 3
|
0,1 ml
|
|
Eau distillée
|
8,6 ml
|
|
Stock 4
|
0,1 ml
|
|
Stock 5
|
0,1 ml
|
Bien mélanger avant utilisation.
Fertilisation
|
1.
|
Les femelles gravides, grosses, sont identifiées dans la population choisie; les femelles sont prêtes à être pressées seulement quand les œufs sont visiblement protubérants à partir du cloaque. Les femelles prêtes prennent une posture caractéristique avec la tête haute.
|
|
2.
|
Passer doucement un doigt le long du poisson vers la queue pour faciliter l'expulsion d'un paquet d'œufs dans une boîte de Pétri propre. Répéter l'opération de l'autre côté et replacer le poisson dans l'aquarium.
|
|
3.
|
Les œufs peuvent être étalés en couche à l'aide d'un pinceau fin. Il est important d'essayer d'exposer un grand nombre d'œufs au sperme, et donc il faut maximiser la surface de l'œuf en contact avec le sperme. Note importante: Garder les œufs humides en posant un tissu imbibé sur eux (il est important que les œufs ne soient pas au contact direct de l'eau car ceci pourrait durcir le chorion prématurément et ainsi empêcher la fertilisation). Il y a des variations importantes du nombre d'œufs qu'une femelle peut produire, mais en moyenne, environ 150 œufs peuvent être obtenus à partir d'une seule femelle gravide.
|
|
4.
|
25 μl de sperme dans le mélange de Hank sont répandus de manière uniforme sur la totalité des œufs à l'aide du pinceau. Les œufs vont rapidement durcir et changer de couleur (en l'espace d'une minute) une fois que la fertilisation a commencé. Si le nombre estimé d'œufs est supérieur à 150, répéter la procédure. Aussi, si les œufs ne durcissent pas après une minute, ajouter un peu plus de sperme. Note importante: l'ajout de sperme n'améliore pas forcément le taux de fertilisation.
|
|
5.
|
Les œufs et la solution spermatique sont laissés en contact pour “interagir” pendant au moins 15 minutes et les œufs fertilisés peuvent être placés dans l'aquarium ou a lieu l'exposition à la substance chimique d'essai dans les 90 minutes qui suivent la fertilisation.
|
|
6.
|
La procédure est répétée avec une autre femelle jusqu'à ce que le nombre d'œufs collectés soit suffisant.
|
|
7.
|
Préserver quelques œufs du dernier lot et fixer ces œufs dans de l'acide acétique à 10 %.
|
Dénombrement et répartition des œufs dans les aquariums d'essai
|
1.
|
Les œufs sont répartis également entre chaque groupe de traitement pour éviter tout biais génétique. Chaque lot d'œufs fertilisés est séparé en groupes de taille égale (autant que de groupes de traitement) en utilisant un instrument pointu (i.e. un forceps d'entomologie à large lame ou une boucle d'inoculation). Pour 4 réplicats par traitement, contenant chacun 20 œufs, 80 œufs sont répartis par aquarium d'exposition. Note importante: il est conseillé d'ajouter 20 % d'œufs en plus (i.e. 96 œufs par groupe de traitement) jusqu 'à ce que l'on soit sûr d'obtenir des pourcentages de fertilisation de 100 %.
|
|
2.
|
Les œufs d'épinoche sont enclins aux infections fongiques en dehors du nid gardé par le père. A cet égard, le traitement de tous les œufs avec du bleu de méthylène pendant les 5 premiers jours de l'essai est extrêmement important. Une solution mère de bleu de méthylène à 1 mg/ml est ajoutée aux aquariums d'exposition pour donner une concentration finale maximum de 2,125 mg/l. Note importante: les épinoches ne sont pas exposées au bleu de méthylène après éclosion et le système est sans méthylène à partir du 6ème jour.
|
|
3.
|
Les œufs sont inspectés chaque jour et tout œuf mort ou non fertilisé est enregistré come tel. Note importante: Les œufs ne sont jamais hors de l'eau jusqu'à l'éclosion, même pendant un temps très court.
|
C.42 BIODÉGRADABILITÉ DANS L'EAU DE MER
INTRODUCTION GÉNÉRALE
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 306 (1992) de l'OCDE pour les essais de produits chimiques. Quand les premières méthodes d'essai ont été mises au point, on ignorait dans quelle mesure on pouvait appliquer à l'environnement marin les résultats des essais de screening pour la biodégradabilité facile utilisant de l'eau douce et des inocula constitués d'effluents secondaires de station d'épuration ou de boue activée. Il existe dans ce domaine des résultats variables [entre autres (1)].
|
|
2.
|
De nombreuses eaux de rejet industriel contenant divers produits chimiques atteignent la mer, soit par déversement direct, soit par le chemin d'estuaires et de rivières dans lesquels les temps de séjour sont faibles comparés à la durée nécessaire à la biodégradation complète d'un grand nombre des produits chimiques présents. C'est à cause de la prise de conscience grandissante de la nécessité de protéger le milieu marin contre des charges croissantes de produits chimiques et de la nécessité d'évaluer la concentration probable des produits chimiques dans la mer, que des méthodes d'essai ont été élaborées afin d'évaluer la biodégradabilité dans l'eau de mer.
|
|
3.
|
Les méthodes décrites ici utilisent l'eau de mer naturelle à la fois comme phase aqueuse et comme source de microorganismes. Afin de se conformer aux méthodes de biodégradabilité facile en eau douce, on a étudié l'utilisation d'eau de mer ultrafiltrée et centrifugée, ainsi que l'utilisation de sédiments marins comme inocula. Ces recherches n'ont donné aucun résultat. Le milieu d'essai est donc constitué par de l'eau de mer naturelle prétraitée afin d'en éliminer les grosses particules.
|
|
4.
|
Afin de déterminer la biodégradabilité ultime par la méthode du flacon agité, on doit utiliser des concentrations relativement élevées de substance d'essai à cause de la faible sensibilité de la méthode d'analyse du carbone organique dissous (COD). Ceci en retour nécessite d'ajouter à l'eau de mer des substances nutritives minérales (N et P), sinon leur faible concentration limiterait la disparition du COD. Il est également nécessaire d'ajouter des substances nutritives dans la méthode de la fiole fermée à cause de la concentration de la substance d'essai ajoutée.
|
|
5.
|
Ces méthodes ne sont donc pas des essais de biodégradabilité facile puisqu'on ne rajoute pas d'inoculum en plus des microorganismes déjà présents dans l'eau de mer. Ces essais ne simulent pas non plus l'environnement marin, puisqu'on y ajoute des substances nutritives et que la concentration de la substance d'essai est beaucoup plus élevée que celle qu'on trouve dans la mer. C'est pourquoi on propose de classer ces méthodes dans une nouvelle section qui s'intitule “Biodégradabilité dans l'eau de mer”.
|
APPLICATION
|
6.
|
Les résultats des essais qui sont effectués parce que les conditions d'utilisation et de rejet de la substance en question indiquent un cheminement vers la mer, donnent une première indication de sa biodégradabilité dans l'eau de mer. Si le résultat est positif (disparition du COD > 70 %; demande théorique en oxygène DThO > 60 %), on peut conclure qu'il existe une potentialité pour que le produit subisse une biodégradation dans l'environnement marin. Cependant, un résultat négatif ne permet pas d'exclure une telle éventualité, mais indique que des études supplémentaires sont nécessaires, par exemple, en utilisant une concentration de substance d'essai aussi faible que possible.
|
|
7.
|
Dans les deux cas, si on désire une valeur plus précise du taux ou du degré de biodégradation dans l'eau de mer, à un endroit particulier, on devra appliquer d'autres méthodes plus complexes et plus sophistiquées, et de là plus couteuses. On pourrait par exemple effectuer un essai de simulation en utilisant une concentration de la substance d'essai plus proche de la concentration probable dans l'environnement. On pourrait également utiliser une eau de mer non fortifiée, non prétraitée, prélevée sur les lieux à étudier, et la dégradation primaire pourrait être suivie par une analyse chimique spécifique. Pour la biodégradabilité ultime, il serait nécessaire d'utiliser des substances marquées au 14C afin de pouvoir mesurer les taux de disparition du 14C organique soluble et de formation de 14CO2 à des concentrations proches de celles qui règnent dans l'environnement.
|
CHOIX DES MÉTHODES
|
8.
|
Le choix de la méthode à utiliser dépend d'un certain nombre de facteurs; le tableau suivant aide à faire ce choix. Alors que les substances chimiques dont la solubililité est inférieure à une valeur équivalente à environ 5 mg/l de C ne peuvent pas être testées par la méthode du flacon agité, au moins en principe, ces substances peu solubles peuvent être testées par la méthode de la fiole fermée.
Tableau
Avantages et inconvénients de la méthode du flacon agité et de la méthode de la fiole fermée
|
MÉTHODE
|
AVANTAGES
|
INCONVÉNIENTS
|
|
FLACON AGITÉ
|
|
—
|
matériel simple sauf pour l'analyseur de C
|
|
—
|
une durée de 60 jours n'est pas un problème
|
|
—
|
pas d'interférence avec la nitrification
|
|
—
|
peut être adaptée pour les substances volatiles
|
|
|
—
|
nécessite un analyseur de C
|
|
—
|
les utilisations de 5-40 mg/l de COD peuvent être inhibitrices
|
|
—
|
la détermination du COD est difficile pour de faibles concentrations dans l'eau de mer (effet chlorure)
|
|
—
|
le COD est parfois élevé dans l'eau de mer
|
|
|
FIOLE FERMÉE
|
|
—
|
détermination finale simple
|
|
—
|
utilise de faibles concentrations de la substance d'essai (2 mg/l), ce qui réduit les chances d'inhibition
|
|
—
|
facilement adaptée pour les substances volatiles
|
|
|
—
|
il pourrait être difficile de maintenir l'étanchéité à l'air des flacons
|
|
—
|
la croissance des bactéries sur les parois peut conduire à des valeurs fausses
|
|
—
|
les valeurs de la consommation d'O2 dans le témoin peuvent être élevées, en particulier après 28 j.; pourrait être supprimée en faisant vieillir l'eau de mer
|
|
—
|
interférence possible avec la consommation d'O2 par la nitrification
|
|
|
MÉTHODE DU FLACON AGITÉ
INTRODUCTION
|
1.
|
Cette méthode est une variante pour l'eau de mer de l'essai de screening modifié décrit au chapitre C.4B de la présente annexe (2). Elle a été mise au point à la suite d'un essai circulaire organisé pour la Commission européene (CE), par l'Institut Danois de la Qualité de l'Eau (3).
|
|
2.
|
De la même façon que pour la méthode de la fiole fermée en milieu marin, qui l'accompagne, les résultats de cet essai ne doivent pas être considérés comme des indicateurs de la biodégradabilité facile, mais ils doivent être utilisés de façon spécifique pour obtenir des informations sur la biodégradabilité des substances en milieu marin.
|
PRINCIPE DE LA MÉTHODE
|
3.
|
Une quantité prédéterminée de substance d'essai est dissoute dans le milieu d'essai de façon à obtenir une concentration en carbone organique dissous (COD) comprise entre 5 et 40 mg/l. Si on améliore les limites de sensibilité de l'analyse du carbone organique, il peut être avantageux d'utiliser des concentrations plus faibles de substance d'essai, en particulier dans le cas des substances inhibitrices La solution de la substance à étudier dans le milieu d'essai est incubée sous agitation dans l'obscurité ou en lumière diffuse, dans des conditions aérobies, à une température donnée (contrôlée à ± 2 °C près) normalement comprise entre 15 et 20 °C. Dans les cas où l'objectif de l'étude est de simuler des situations réelles de l'environnement, les essais peuvent être effectués en dehors de cet intervalle normal de température. La durée d'essai maximale recommandée est d'environ 60 jours. La dégradation est suivie par des mesures du COD (dégradation ultime) et, dans certains cas, par des analyses spécifiques (dégradation primaire).
|
INFORMATION SUR LA SUBSTANCE D'ESSAI
|
4.
|
Afin de savoir si on peut appliquer cet essai à une substance particulière, on doit connaître certaines de ses propriétés. La teneur en carbone organique de la substance doit être connue, sa volatilité doit être telle qu'il ne se produise pas de pertes importantes au cours de l'essai, enfin, sa solubilité dans l'eau doit être supérieure à une valeur équivalente à une concentration de 25 à 40 mg/l de C. La substance d'essai ne doit pas non plus s'adsorber de façon importante sur les surfaces de verre. Il est nécessaire de disposer d'informations sur la pureté ou les proportions relatives des principaux constituants de la substance étudiée afin de pouvoir interpréter les résultats obtenus, en particulier quand ceux-ci se situent près du niveau “seuil”.
|
|
5.
|
Des informations sur la toxicité de la substance d'essai vis à vis des bactéries recueillies, par exemple dans des essais à court terme sur le taux de respiration (4), peuvent s'avérer utiles pour choisir les concentrations d'essai appropriées et elles peuvent être essentielles pour interpréter correctement de faibles valeurs de biodégradation. Cependant, de telles informations ne sont pas toujours suffisantes pour interpréter les résultats obtenus dans l'essai de biodégradation, et la méthode décrite dans le paragraphe 18 est plus adaptée.
|
SUBSTANCES DE RÉFÉRENCE
|
6.
|
On doit utiliser des substances de référence adéquates pour contrôler l'activité microbienne de l'échantillon d'eau de mer. Le benzoate de sodium, l'acétate de sodium et l'aniline peuvent par exemple être utilisés. Les substances de référence doivent se dégrader dans un laps de temps relativement court, sinon il est recommandé de recommencer l'essai en utilisant un autre échantillon d'eau de mer.
|
|
7.
|
Dans l'essai circulaire de la CE où les échantillons d'eau de mer étaient prélevés à différents endroits et à différentes périodes de l'année (3), la phase de latence (tL) et le temps nécessaire après la phase de latence pour atteindre 50 % de dégradation (t50), étaient pour le benzoate de sodium respectivement de 1 à 4 jours et de 1 à 7 jours. Pour l'aniline, les valeurs étaient comprises entre 0 et 10 jours pour la tL et entre 1 et 10 jours pour la t50.
|
REPRODUCTIBILITÉ ET SENSIBILITÉ DE LA MÉTHODE
|
8.
|
La reproductibilité de la méthode a été établie dans l'essai circulaire (3). La concentration la plus faible de la substance d'essai pour laquelle cette méthode peut être utilisée est déterminée dans une large mesure, par la limite de détection de l'analyse du carbone organique (à l'heure actuelle, environ 0,5 mg/l de C) et par la concentration du carbone organique dissous dans l'eau de mer utilisée (habituellement de l'ordre de 3 à 5 mg/l pour l'eau du large). La concentration de base en COD ne doit pas dépasser environ 20 % de la concentration totale en COD après addition de la substance d'essai. Si ceci n'est pas possible, la concentration de base en COD peut parfois être réduite en faisant vieillir l'eau de mer avant l'essai. Si la méthode est utilisée seulement avec une analyse chimique spécifique (qui mesure la dégradation primaire) l'investigateur doit rechercher à l'aide d'informations supplémentaires, si la dégradabilité ultime peut être atteinte. Ces informations additionnelles peuvent être apportées par les résultats d'autres essais de biodégradabilité facile ou intrinsèque.
|
DESCRIPTION DE LA MÉTHODE
Appareillage
|
9.
|
Matériel courant de laboratoire et:
|
a.
|
Dispositif d'agitation pouvant recevoir des erlenmeyers de 0,5 à 2 litres, soit équipé d'un dispositif de contrôle de la température, soit fonctionnant dans une pièce thermostatée entre 15 et 20 °C à ± 2 °C près;
|
|
b.
|
Des erlenmeyers de 0,5 à 2 litres à col étroit;
|
|
c.
|
Un appareil de filtration sur membrane ou une centrifugeuse;
|
|
d.
|
Des membranes filtrantes d'une porosité de 0,2 à 0,45 μm;
|
|
e.
|
Un analyseur de carbone;
|
|
f.
|
Un équipement pour des analyses spécifiques (facultatif).
|
|
Eau de mer
|
10.
|
Prélever un échantillon d'eau de mer dans un récipient soigneusement nettoyé et le transporter au laboratoire, de préférence dans un intervalle de un à deux jours après le prélèvement. Au cours du transport, ne pas laisser la température de l'échantillon dépasser de façon importante la température qui sera utilisée dans l'essai. Identifier précisément l'endroit du prélèvement, décrire son état de pollution et indiquer les substances nutritives qu'on y trouve. En particulier pour les eaux côtières, inclure dans cette caractérisation un comptage des colonies bactériennes hétérotrophes et la détermination des concentrations en nitrate, ammonium et phosphate dissous.
|
|
11.
|
Pour l'échantillon d'eau de mer, fournir les informations suivantes:
|
—
|
profondeur du prélèvement;
|
|
—
|
aspect de l'échantillon — trouble, etc.;
|
|
—
|
température au moment du prélèvement;
|
|
—
|
délai entre le prélèvement et l'utilisation dans l'essai.
|
|
|
12.
|
Si l'on trouve que le taux de COD de l'échantillon d'eau de mer est élevé (paragraphe 8), il est recommandé de faire vieillir cet échantillon pendant environ une semaine avant son utilisation. Le vieillissement se fait en conservant l'échantillon dans des conditions aérobies à la température de l'essai, dans l'obscurité ou en lumière diffuse. Si nécessaire, les conditions aérobies sont maintenues par une légère agitation. Au cours du vieillissement, la teneur en matière organique facilement dégradable diminue. Dans l'essai circulaire (3), on a trouvé aucune différence entre le potentiel de dégradation d'échantillons d'eau de mer vieillis ou fraîchement recueillis. Avant son utilisation, prétraiter l'eau de mer afin d'en éliminer les grosses particules, par exemple par filtration sur un filtre de nylon ou sur du gros papier filtre (pas de membranes filtrantes ou de filtres GF-C), ou par sédimentation et décantation. On doit mentionner le procédé utilisé. Si l'échantillon est vieilli, effectuer le prétraitement après vieillissement.
|
Solutions mères des substances nutritives minérales
|
13.
|
Préparer les solutions-mères suivantes en utilisant des réactifs de qualité pour analyse.
|
a)
|
Dihydrogénophosphate monopotassique, KH2PO4
|
8,50 g
|
|
Hydrogénophosphate dipotassique, K2HPO4
|
21,75 g
|
|
Hydrogénophosphate disodique dihydraté, Na2HPO4 · 2H2O
|
33,30 g
|
|
Chlorure d'ammonium, NH4Cl
|
0,50 g
|
|
Dissoudre et compléter le volume à 1 litre avec de l'eau distillée.
|
|
|
b)
|
Chlorure de calcium anhydre, CaCl2
|
27,50 g
|
|
Dissoudre et compléter le volume à 1 litre avec de l'eau distillée.
|
|
|
c)
|
Sulfate de magnésium heptahydraté, MgSO4 · 7H2O
|
22,50 g
|
|
Dissoudre et compléter le volume à 1 litre avec de l'eau distillée.
|
|
|
d)
|
Chlorure de fer (III) hexahydraté, FeCl3 · 6H2O
|
0,25 g
|
|
Dissoudre et compléter le volume à 1 litre avec de l'eau distillée.
|
|
On peut éviter la précipitation de la solution (d) en ajoutant une goutte d'HCl concentré ou 0,4 g d'acide éthylènediamine-tétraacétique (sel disodique de l'EDTA). S'il se forme un précipité dans une solution-mère, la remplacer par une solution fraîchement préparée.
|
Préparation du milieu d'essai
|
14.
|
Ajouter 1 ml de chacune des solutions-mères ci-dessus par litre d'eau de mer prétraitée.
|
Inoculum
|
15.
|
Ne pas ajouter d'inoculum spécifique, en plus des micro-organismes déjà présents dans l'eau de mer. Déterminer (facultativement) le nombre d'hétérotrophes formant colonies présents dans le milieu d'essai contenant l'eau de mer (et de préférence également dans les échantillons d'eau de mer du départ) par exemple par comptage sur boîte, en utilisant de l'agar marin. Ceci est particulièrement souhaitable pour les échantillons provenant de zones côtières ou polluées. Contrôler l'activité microbienne hétérotrophe dans l'eau de mer en effectuant un essai avec une substance de référence.
|
Préparation des flacons
|
16.
|
S'assurer que toute la verrerie est parfaitement nettoyée, mais pas nécessairement stérile, (par exemple en utilisant de l'acide chlorhydrique alcoolique), qu'elle est rincée et séchée avant utilisation afin d'éviter toute contamination par des résidus d'expériences précédentes. Les flacons doivent également être nettoyés avant un premier usage.
|
|
17.
|
Travailler simultanément avec les substances d'essai dans des flacons en double et avec la substance de référence dans un seul récipient. Effectuer un essai témoin en double, sans substance d'essai ni composé de référence, afin de déterminer les blancs analytiques. Dissoudre les substances d'essai dans le milieu d'essai — il est commode de les ajouter à partir de solution mère concentrée — de façon à obtenir des concentrations de départ qui se situent normalement entre 5 et 40 mg/l de COD. La substance de référence est normalement testée à une concentration de départ correspondant à 20 mg/l de COD. Si on utilise des solutions mères de substances d'essai et/ou de référence, s'assurer que la salinité du milieu contenant l'eau de mer n'a pas été modifiée de façon importante.
|
|
18.
|
Si des effets toxiques sont attendus ou si l'on ne peut pas les exclure, il peut s'avérer judicieux d'inclure en double, dans la conception de l'essai, une expérience sur l'inhibition. Ajouter les substances d'essai et de référence dans le même récipient, la concentration de la substance de référence étant normalement celle utilisée dans l'essai témoin qui contrôle la procédure (c'est-à-dire 20 mg/l de COD) afin de pouvoir faire des comparaisons.
|
|
19.
|
Verser des quantités adéquates de solutions d'essai dans les erlenmeyers (une quantité acceptable va jusqu'à environ la moitié du volume des récipients), puis recouvrir chaque récipient non hermétiquement (par exemple avec une feuille d'aluminium) de façon à permettre les échanges gazeux entre le flacon et l'air environnant. (Des tampons de coton ne sont pas indiqués si on utilise l'analyse du COD). Placer les récipients sur le dispositif d'agitation et agiter de façon continue à vitesse faible (par exemple 100 t/min) tout au long de l'essai. Maintenir la température constante (entre 15 et 20 °C à ± 2 °C près), et protéger les récipients de la lumière afin d'éviter la croissance d'algues. S'assurer que l'air est exempt de matières toxiques.
|
Témoin physicochimique (facultatif)
|
20.
|
Si on s'attend à une dégradation abiotique ou à des mécanismes de perte, tels qu'une hydrolyse (problème qui se pose uniquement en cas d'analyse spécifique), une volatilisation ou une adsorption, il est judicieux de réaliser une expérience témoin physicochimique. Celle-ci peut être effectuée en ajoutant dans les récipients contenant la substance d'essai du chlorure de mercure (II) (HgCl2) (32) (entre 50 et 100 mg/l) afin de stopper l'activité microbienne. Une diminution importante du COD ou de la concentration d'une substance spécifique dans l'essai témoin physicochimique, indiquent la présence de mécanismes de disparition abiotiques. (Si on utilise du chlorure de mercure, on doit faire attention aux interférences ou à un empoisonnement catalytique dans l'analyse du COD).
|
Nombre de flacons
|
21.
|
Dans un essai type, on utilise les récipients suivants:
|
Flacons 1 et 2
|
—
|
contiennent la substance d'essai (suspension d'essai);
|
|
Flacons 3 et 4
|
—
|
contiennent seulement l'eau de mer (témoin inoculum);
|
|
Flacon 5
|
—
|
contient la substance de référence (contrôle de la procédure);
|
|
Flacon 6
|
—
|
contient les substances d'essai et de référence (témoin de toxicité) — facultatif;
|
|
Flacon 7
|
—
|
contient la substance d'essai et l'agent stérilisant (témoin stérile abiotique) — facultatif.
|
|
Analyse du COD
|
22.
|
Tout au long de l'essai, à des intervalles de temps appropriés, prélever des échantillons pour l'analyse du COD (Appendice 1). Prélever systématiquement des échantillons au début (jour 0) et à la fin (jour 60) de l'essai. Afin de tracer la courbe de la dégradation en fonction du temps, il est nécessaire de disposer au total, d'au moins cinq échantillons. On ne peut pas établir de calendrier précis pour l'échantillonnage étant donné que le taux de biodégradation varie. Effectuer des déterminations du COD en double pour chaque échantillon.
|
Prélèvement
|
23.
|
Le volume requis pour les échantillons dépend de la méthode analytique (analyse spécifique), de l'analyseur de carbone utilisé et de la procédure choisie (filtration sur membrane ou centrifugation) pour le traitement de l'échantillon avant la détermination du carbone (paragraphes 25 et 26). Avant de prélever, s'assurer que le milieu d'essai est bien mélangé et que toute matière adhérant à la paroi du récipient est dissoute ou remise en suspension.
|
|
24.
|
Immédiatement après le prélèvement, filtrer sur membrane ou centrifuger. Si nécessaire, conserver les échantillons filtrés ou centrifugés entre 2 et 4 °C pendant au maximum 48 heures ou en dessous de -18 °C sur de plus longues périodes (si on sait que cela n'affectera pas la substance, acidifier à pH 2 avant le stockage).
|
|
25.
|
Des membranes filtrantes (0,2 à 0,45 μm), telles que les membranes en polycarbonate, qui ne libèrent pas de carbone ou n'adsorbent pas la substance au cours de la filtration conviennent. Certaines membranes filtrantes sont imprégnées de tensio-actifs pour l'hydrophilisation et elles peuvent libérer des quantités considérables de carbone dissous. Préparer de tels filtres en les faisant bouillir dans de l'eau désionisée pendant trois périodes consécutives d'une heure. Après cette opération, conserver les filtres dans de l'eau désionisée. Jeter les premiers 20 ml de filtrat.
|
|
26.
|
Au lieu d'une filtration sur membrane, on peut choisir de centrifuger les échantillons. Centrifuger à 40 000 m.s– 2 (~ 4 000 g) pendant 15 minutes, de préférence dans une centrifugeuse réfrigérée.
Remarque: La différentiation par centrifugation entre le COT et le COD pour de très faibles concentrations semble inopérante, soit parce que toutes les bactéries ne sont pas enlevées, soit parce que du carbone faisant partie du plasma bactérien est redissous. Pour des concentrations d'essai plus élevées (>10 mg/l de C), l'erreur due à la centrifugation semble relativement petite.
|
Fréquence de prélèvement
|
27.
|
Si les analyses sont effectuées immédiatement après le prélèvement, déterminer le moment du prélèvement suivant au vu des résultats de la détermination analytique.
|
|
28.
|
Si les échantillons sont conservés pour des analyses ultérieures (paragraphe 24) on doit en prélever davantage que cinq. En analysant d'abord les derniers échantillons, puis des échantillons convenablement choisis en revenant par étape “à reculons” vers le début, on peut obtenir une description correcte de la courbe de biodégradation avec un nombre de dosages relativement faible. Si à la fin de l'essai il n'y a eu aucune dégradation, il n'est pas nécessaire d'analyser d'autres échantillons, et dans ce cas, la méthode “à reculons” permet d'économiser une partie considérable des coûts d'analyse.
|
|
29.
|
Si sur la courbe de dégradation, on observe un plateau avant le 60ème jour, arrêter l'essai. Si la dégradation a démarré de façon certaine au 60ème jour mais n'a pas atteint de plateau, prolonger l'expérience.
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
30.
|
Reporter les résultats analytiques sur la feuille de résultats jointe (Appendice 2), et calculer les valeurs de biodégradation pour les substances d'essai et de référence à partir de l'équation:
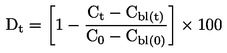
avec:
|
Dt
|
=
|
dégradation en pourcentage de COD ou disparition d'une substance spécifique au temps t,
|
|
Co
|
=
|
concentration initiale de COD ou d'une substance spécifique dans le milieu d'essai,
|
|
Ct
|
=
|
concentration de COD ou d'une substance spécifique dans le milieu d'essai au temps t,
|
|
Cbl(o)
|
=
|
concentration initiale de COD ou d'une substance spécifique dans le témoin,
|
|
Cbl(t)
|
=
|
concentration de COD ou d'une substance spécifique dans le témoin au temps t.
|
|
|
31.
|
Exprimer la dégradation comme le pourcentage de disparition du COD (dégradation ultime) ou d'une substance spécifique (dégradation primaire) au temps t. Calculer les concentrations en COD à 0,1 mg/l près et arrondir les moyennes des valeurs de Dt à l'entier le plus proche.
|
|
32.
|
Tracer sur un diagramme la courbe de dégradation en fonction du temps comme sur la figure du paragraphe “Validité et interprétation des résultats”. S'il existe suffisamment de données, à partir de cette courbe calculer la phase de latence (tL) et le temps nécessaire pour atteindre 50 % d'élimination après la fin de la phase de latence (t50).
|
Rapport d'essai
|
33.
|
Le rapport d'essai doit contenir les informations suivantes:
|
|
Substance d'essai:
|
—
|
état physique et s'il y a lieu, propriétés physicochimiques;
|
|
—
|
données relatives à l'identification.
|
|
|
|
Conditions d'essai:
|
—
|
lieu du prélèvement et description du site; état de la pollution et nature des substances nutritives (comptage des colonies, nitrate, ammonium, phosphate, s'il y a lieu);
|
|
—
|
caractéristiques de l'échantillon (date et profondeur de prélèvement, aspect, température, salinité, COD (facultatif), délai entre le prélèvement et l'utilisation dans l'essai;
|
|
—
|
méthode utilisée, s'il y a lieu, pour faire vieillir l'eau de mer;
|
|
—
|
méthode utilisée pour le prétraitement (filtration/sédimentation) de l'eau de mer;
|
|
—
|
méthode utilisée pour la détermination du COD;
|
|
—
|
méthode utilisée pour l'analyse spécifique (facultatif);
|
|
—
|
méthode utilisée pour déterminer le nombre de bactéries hétérotrophes dans l'eau de mer (méthode de comptage sur boîte ou autre méthode) (facultatif);
|
|
—
|
autres méthodes (facultatif) utilisées pour caractériser l'eau de mer (mesures d'ATP, etc.);
|
|
|
|
Résultats:
|
—
|
données analytiques reportées sur une feuille de résultats (Appendice 2);
|
|
—
|
on trace la courbe de dégradation en fonction du temps sur un diagramme qui indique la phase de latence (tL), la pente, et le temps nécessaire (à partir de la fin de la période de latence) pour atteindre 50 % d'élimination (t50). La phase de latence peut être évaluée graphiquement comme sur la figure du paragraphe “Critères de validité et interprétation des résultats” ou plus commodément elle peut être déterminée comme le temps nécessaire pour atteindre 10 % de dégradation;
|
|
—
|
le pourcentage de dégradation mesuré après 60 jours ou à la fin de l'essai.
|
|
|
|
Discussion des résultats.
|
|
Critères de validité et interprétation des résultats
|
34.
|
Les résultats obtenus avec les substances de référence par exemple le benzoate de sodium, l'acétate de sodium ou l'aniline, doivent être comparables à ceux de l'essai circulaire (3) (se reporter au paragraphe 7 sur les “Substances de référence”). Si les résultats obtenus avec les substances de référence sont atypiques, l'essai doit être recommencé avec un autre échantillon d'eau de mer. Bien qu'on ne puisse pas toujours interpréter sans ambiguïté les résultats des essais d'inhibition à cause du COD apporté par la substance d'essai, une réduction importante dans le taux de disparition du COD total par rapport à celui du témoin, contrôlant la procédure, constitue une indication de la présence d'effets toxiques.
|
|
35.
|
Du fait de l'utilisation de concentrations d'essai relativement élevées par rapport à celles de la plupart des systèmes naturels (et par conséquent d'un rapport défavorable entre les concentrations des substances d'essai et des autres sources de carbone), on doit considérer cette méthode comme un essai préliminaire qui peut être utilisé pour savoir si une substance est facilement biodégradable ou non. C'est pourquoi un résultat faible ne signifie pas nécessairement que la substance d'essai n'est pas biodégradable en milieu marin, mais il indique que davantage de travaux seront nécessaires pour conclure.
Un exemple d'une expérience de dégradation théorique illustrant une façon d'obtenir les valeurs de tL (durée de la “phase de latence”) et de t50 (intervalle de temps, démarrant après tL, nécessaire pour atteindre 50 % de disparition), est donné ci-après
|
MÉTHODE DU FLACON FERMÉ
INTRODUCTION
|
1.
|
Cette méthode est une variante pour l'eau de mer de l'essai en fiole fermée (5) et elle a été mise au point à la suite d'un essai circulaire organisé pour la Commission européenne (CE) par l'Institut Danois de la Qualité de l'Eau (3).
|
|
2.
|
De la même façon que pour la méthode du flacon agité en milieu marin, qui l'accompagne, les résultats de cet essai ne doivent pas être considérés comme des indicateurs de la biodégradabilité facile, mais ils doivent être utilisés de façon spécifique pour obtenir des informations sur la biodégradabilité des substances chimiques en milieu marin.
|
PRINCIPE DE LA MÉTHODE
|
3.
|
Une quantité prédéterminée de substance d'essai est dissoute dans le milieu d'essai de façon à obtenir une concentration comprise habituellement entre 2 et 10 mg/l de substance (on peut utiliser une ou plusieurs concentrations). La solution est conservée dans un flacon rempli fermé, dans l'obscurité, au bain-marie ou dans une enceinte thermostatisée entre 15 et 20 °C à ± 1 °C près. Dans les cas, où l'objectif de l'étude est de simuler des situations réelles de l'environnement, les essais peuvent être effectués en dehors de cet intervalle normal de température, pourvu qu'on dispose de moyens appropriés pour contrôler la température. La dégradation est suivie en analysant l'oxygène sur une période de 28 jours.
|
|
4.
|
L'essai circulaire a montré que si on prolonge l'essai au-delà de 28 jours, on obtient, dans la plupart des cas, aucune information utile, à cause de graves interférences. Les valeurs du témoin pour la demande biologique en oxygène (DBO) se sont révélées extrêmement élevées, probablement à cause d'une croissance sur les parois due à un manque d'agitation et à cause de la nitrification. La durée d'essai recommandée est donc de 28 jours, mais si la valeur du témoin pour la DBO reste en dessous d'une limite de 30 % (paragraphes 15 et 40) l'essai peut être prolongé.
|
INFORMATION SUR LA SUBSTANCE D'ESSAI
|
5.
|
Afin de savoir si on peut appliquer cet essai à une substance particulière, on doit connaître certaines de ses propriétés. Afin de calculer la demande théorique en oxygène (DThO), on doit connaître la formule générale (voir Appendice 3); sinon on doit déterminer la demande chimique en oxygène (DCO) de la substance afin de l'utiliser comme valeur de référence. L'utilisation de la DCO est moins satisfaisante car certaines substances ne sont pas totalement oxydées lors de cet essai.
|
|
6.
|
La solubilité de la substance doit être supérieure ou égale à 2 mg/l, bien qu'en principe, on puisse tester des substances moins solubles (par exemple en utilisant les ultra-sons) ainsi que des substances volatiles. Il est nécessaire de disposer d'informations sur la pureté ou les proportions relatives des principaux constituants de la substance d'essai afin de pouvoir interpréter les résultats obtenus, en particulier quand ceux-ci se situent près du niveau “seuil”.
|
|
7.
|
Des informations sur la toxicité de la substance d'essai vis à vis des bactéries [recueillies, par exemple dans des essais à court terme sur le taux de respiration (4)], peuvent s'avérer utiles pour choisir les concentrations d'essai appropriées et elles peuvent être essentielles pour interpréter correctement de faibles valeurs de biodégradation. Cependant, de telles informations ne sont pas toujours suffisantes pour interpréter les résultats obtenus dans l'essai de biodégradation, et la méthode décrite dans le paragraphe 27 est plus adaptée.
|
SUBSTANCES DE RÉFÉRENCE
|
8.
|
On doit utiliser des substances de référence adéquates pour contrôler l'activité microbienne de l'échantillon d'eau de mer. L'aniline, l'acétate de sodium ou le benzoate de sodium peuvent (par exemple) être utilisés. On doit observer pour ces composés une dégradation d'au moins 60 % (de leur DThO) dans un laps de temps relativement court, sinon il est recommandé de recommencer l'essai en utilisant un autre échantillon d'eau de mer.
|
|
9.
|
Dans l'essai circulaire de la CE où les échantillons d'eau de mer étaient prélevés à différents endroits et à différentes périodes de l'année, la phase de latence (tL) et le temps nécessaire, après la phase de latence, pour atteindre 50 % de dégradation (t50), étaient pour le benzoate de sodium respectivement de 0 à 2 jours et de 1 à 4 jours. Pour l'aniline, les valeurs étaient comprises entre de 0 et 7 jours pour la tL et entre 2 et 12 jours pour la t50.
|
REPRODUCTIBILITÉ
|
10.
|
La reproductibilité de ces méthodes a été établie dans l'essai circulaire de la CE (3).
|
DESCRIPTION DE LA MÉTHODE
Appareillage
|
11.
|
Matériel courant de laboratoire et:
|
a)
|
On peut utiliser des flacons pour l'analyse de la DBO d'une contenance de 250 à 300 ml, ou des fioles de 250 ml à col étroit, fermés dans les deux cas par des bouchons de verre;
|
|
b)
|
Plusieurs récipients de 2, 3 et 4 litres graduées en litres, pour la préparation de l'expérience et pour le remplissage des flacons à DBO;
|
|
c)
|
Un bain-marie ou une pièce thermostatée pour maintenir les récipients à température constante (± 1 °C) et à l'abri de la lumière;
|
|
d)
|
Un équipement pour l'analyse de l'oxygène dissous;
|
|
e)
|
Des membranes filtrantes d'une porosité de 0,2 à 0,45 μm (facultatif);
|
|
f)
|
Un équipement pour des analyses spécifiques (facultatif).
|
|
Eau de mer
|
12.
|
Prélever un échantillon d'eau de mer dans un récipient soigneusement nettoyé et le transporter au laboratoire, de préférence dans un intervalle de un à deux jours après le prélèvement. Au cours du transport, ne pas laisser la température de l'échantillon dépasser de façon importante la température qui sera utilisée dans l'essai.
|
|
13.
|
Identifier précisément l'endroit du prélèvement, décrire son état de pollution et indiquer les substances nutritives qu'on y trouve. En particulier pour les eaux côtières ou les eaux polluées, inclure dans cette caractérisation un comptage des colonies bactériennes hétérotrophes et la détermination des concentrations en nitrate, ammonium et phosphate dissous.
|
|
14.
|
Pour l'échantillon d'eau de mer, fournir les informations suivantes:
|
—
|
profondeur du prélèvement;
|
|
—
|
aspect de l'échantillon — trouble, etc.;
|
|
—
|
température au moment du prélèvement;
|
|
—
|
carbone organique dissous (COD);
|
|
—
|
délai entre le prélèvement et l'utilisation dans l'essai.
|
|
|
15.
|
Si l'on trouve que la teneur en COD de l'échantillon est élevée, ou si l'on pense qu'au bout de 28 jours la DBO du témoin représentera plus de 30 % de celle des substances de référence, il est recommandé de faire vieillir l'échantillon pendant environ une semaine avant son utilisation.
|
|
16.
|
Le vieillissement se fait en conservant l'échantillon dans des conditions aérobies à la température de l'essai, dans l'obscurité ou en lumière diffuse. Si nécessaire, les conditions aérobies sont maintenues par une légère agitation. Au cours du vieillissement, la teneur en matière organique facilement dégradable diminue. Dans l'essai circulaire (3), on a trouvé aucune différence entre le potentiel de dégradation d'échantillons d'eau de mer vieillis ou fraîchement recueillis.
|
|
17.
|
Avant son utilisation, prétraiter l'eau de mer afin d'en éliminer les grosses particules, par exemple par filtration sur un filtre de nylon ou sur du gros papier filtre (pas de membranes filtrantes ou de filtres GF-C), par sédimentation et décantation. On doit mentionner le procédé utilisé. Si l'échantillon est vieilli, effectuer le prétraitement après vieillissement.
|
Solutions mères des substances nutritives minérales
|
18.
|
Préparer les solutions-mères suivantes en utilisant des réactifs de qualité pour analyse:
|
a)
|
Dihydrogénophosphate monopotassique, KH2PO4
|
8,50 g
|
|
Hydrogénophosphate dipotassique, K2HPO4
|
21,75 g
|
|
Hydrogénophosphate disodique dihydraté, Na2HPO4 · 2H2O
|
33,30 g
|
|
Chlorure d'ammonium, NH4Cl
|
0,50 g
|
|
Dissoudre et compléter le volume à 1 litre avec de l'eau distillée.
|
|
|
b)
|
Chlorure de calcium anhydre, CaCl2
|
27,50 g
|
|
Dissoudre et compléter le volume à 1 litre avec de l'eau distillée.
|
|
|
c)
|
Sulfate de magnésium heptahydraté, MgSO4 · 7H2O
|
22,50 g
|
|
Dissoudre et compléter le volume à 1 litre avec de l'eau distillée.
|
|
|
d)
|
Chlorure de fer (III) hexahydraté, FeCl3 · 6H2O
|
0,25 g
|
|
Dissoudre et compléter le volume à 1 litre avec de l'eau distillée.
|
|
On peut éviter la précipitation de la solution (d) en ajoutant une goutte d'HCl concentré ou 0,4 g d'acide éthylènediamine-tétraacétique (sel disodique de l'EDTA). S'il se forme un précipité dans une solution-mère, la remplacer par une solution fraîchement préparée.
|
Préparation du milieu d'essai
|
19.
|
Ajouter 1 ml de chacune des solutions mères ci-dessus par litre d'eau de mer prétraitée. Saturer le milieu avec de l'air à la température de l'essai, en y faisant barboter de l'air comprimé propre pendant environ 20 minutes. Déterminer la concentration en oxygène dissous à des fins de contrôle. On peut lire sur l'abaque inclus dans cette méthode d'essai (Appendice 4) la concentration de saturation en oxygène dissous en fonction de la salinité et de la température.
|
Inoculum
|
20.
|
Ne pas ajouter d'inoculum spécifique, en plus des micro-organismes déjà présents dans l'eau de mer. Déterminer (facultativement) le nombre d'hétérotrophes formant colonies présents dans le milieu d'essai contenant l'eau de mer (et de préférence également dans les échantillons d'eau de mer du départ) par exemple par comptage sur boîte, en utilisant de l'agar marin. Ceci est particulièrement souhaitable pour les échantillons provenant de zones côtières ou polluées. Contrôler l'activité microbienne hétérotrophe dans l'eau de mer en effectuant un essai avec une substance de référence.
|
Préparation des flacons
|
21.
|
Toutes les manipulations nécessaires y compris le vieillissement et le prétraitement de l'eau de mer sont réalisées à la température d'essai choisie, comprise entre 15 et 20 °C; toute la verrerie doit être propre mais non stérile.
|
|
22.
|
Pour la détermination de la DBO des substances d'essai et de référence préparer des groupes de flacons à DBO dans des séries expérimentales simultanées. Réaliser toutes les analyses dans des récipients en double (témoins, substances de référence et d'essai), c'est-à-dire préparer deux récipients pour chaque détermination. Effectuer au moins quatre analyses aux jours 0, 5, 15 et 28. Pour les analyses d'oxygène, quatre déterminations exigent un total de 3 × 2 × 4 = 24 flacons (témoin, substance d'essai et de référence) et ainsi environ 8 litres de milieu d'essai (pour une seule concentration de la substance d'essai).
|
|
23.
|
Préparer les solutions séparées des substances d'essai et de référence dans de grands récipients d'un volume suffisant (paragraphe 11) en ajoutant d'abord les substances d'essai et de référence soit directement, soit à partir d'une solution mère concentrée, dans les récipients partiellement remplis. Ajouter du milieu d'essai supplémentaire jusqu'à obtenir les concentrations finales désirées. Si on utilise des solutions mères de substances d'essai et/ou de référence, s'assurer que la salinité du milieu contenant l'eau de mer n'a pas été modifiée de façon importante.
|
|
24.
|
Choisir les concentrations des substances d'essai et de référence en tenant compte de:
|
a)
|
la solubilité de l'oxygène dissous dans l'eau de mer pour la température et la salinité choisies pour l'essai (voir l'abaque ci-jointe de l'Appendice 4);
|
|
b)
|
la valeur de la DBO de l'eau de mer dans le témoin; et
|
|
c)
|
la valeur attendue pour la biodégradabilité de la substance d'essai.
|
|
|
25.
|
Pour une salinité de 32 pour mille (eau de l'océan), la solubilité de l'oxygène dissous est d'environ 8,1 mg/l à 15 °C et 7,4 mg/l à 20 °C. La consommation en oxygène de l'eau de mer elle-même. (respiration témoin) peut aller jusqu'à 2 mg O2/l ou plus, si l'eau de mer n'a pas été vieillie. C'est pourquoi, pour être sûr qu'après l'oxydation de la substance d'essai, il reste une concentration significative en oxygène, on utilise au départ une concentration d'environ 2 à 3 mg/l (selon la DThO) pour les substances qui sont susceptibles d'être complètement dégradées dans les conditions de l'essai (comme les substances de référence). Les substances moins dégradables sont testées à des concentrations supérieures, jusqu'à environ 10 mg/l, dans la mesure où cela n'entraîne pas d'effets toxiques. Il peut s'avérer intéressant d'effectuer en parallèle des essais avec une concentration faible (environ 2 mg/l) et une concentration élevée (environ 10 mg/l) de la substance d'essai.
|
|
26.
|
On doit déterminer en parallèle les valeurs témoins pour l'oxygène, dans des récipients qui ne contiennent ni substance d'essai ni substance de référence.
|
|
27.
|
Si l'on veut évaluer des effets inhibiteurs, préparer dans différents grands récipients, les séries de solutions suivantes (paragraphe 13):
|
a)
|
2 mg/l d'une substance facilement dégradable, par exemple une des substances de référence proposées;
|
|
b)
|
x mg/l de substance d'essai (x est habituellement égal à 2);
|
|
c)
|
2 mg/l de la substance facilement dégradable plus x mg/l de substance d'essai.
|
|
Témoin physicochimique (facultatif)
|
28.
|
Si on choisit de faire des analyses spécifiques, on peut effectuer une expérience physico-chimique afin de vérifier si la substance d'essai est éliminée par des mécanismes abiotiques tels qu'une hydrolyse ou une adsorption. Un témoin physico-chimique peut être réalisé en ajoutant du chlorure de mercure (II) (HgCl2) (33) (à raison de 50 à 100 mg/l) dans des récipients en double contenant la substance d'essai, afin de stopper l'activité microbienne. Une diminution importante de la concentration d'une substance spécifique au cours de l'essai indique l'existence de mécanismes d'élimination abiotiques.
|
Nombre de flacons à DBO dans un essai type
|
29.
|
Dans un essai type on utilise les flacons suivants:
|
—
|
au moins 8 flacons contenant la substance d'essai;
|
|
—
|
au moins 8 flacons contenant uniquement l'eau de mer fortifiée par des substances nutritives;
|
|
—
|
au moins 8 flacons contenant la substance de référence, et si nécessaire
|
|
—
|
6 flacons contenant les substances d'essai et de référence (témoin de toxicité).
|
|
EXÉCUTION DE LA MÉTHODE
|
30.
|
Après préparation, siphonner immédiatement chaque solution à partir du quart inférieur (pas à partir du fond) du grand récipient approprié afin de remplir les séries respectives de flacons à DBO. Mesurer immédiatement l'oxygène dissous à l'instant zéro (paragraphe 33) ou conserver par précipitation avec MnCl2 [chlorure de manganèse (II)] et NaOH (hydroxyde de sodium) les témoins du temps zéro en vue d'une analyse chimique ultérieure.
|
|
31.
|
Les flacons à DBO restants menés en parallèle sont incubés à la température de l'essai (15 à 20 °C), dans l'obscurité et retirés de la zone d'incubation à intervalles réguliers (par exemple au minimum après 5, 15 et 28 jours) et on mesure leur concentration en oxygène dissous (paragraphe 33).
|
|
32.
|
Les échantillons destinés à des analyses spécifiques (facultatives) sont filtrés sur membrane (0,2 à 0,45 μm) ou centrifugés pendant 15 minutes. Si on ne les analyse pas immédiatement, les conserver entre 2 et 4 °C pendant au maximum 48 heures ou à – 18 °C sur de plus longues périodes (si l'on sait que cela n'affectera pas la substance d'essai, acidifier à pH 2 avant stockage).
|
Détermination de l'oxygène dissous
|
33.
|
Déterminer la concentration en oxygène dissous en utilisant une méthode chimique ou électrochimique reconnue au niveau national ou international.
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
34.
|
Reporter les résultats analytiques sur les feuilles de résultats jointes (Appendice 5).
|
|
35.
|
Calculer la DBO en faisant la différence entre la perte en oxygène d'une solution témoin et d'une solution contenant la substance d'essai dans les conditions de l'essai. Diviser cette perte nette en oxygène par la concentration de la substance (en poids/volume) afin d'exprimer la DBO en mg de DBO/mg de substance. La dégradation est calculée en divisant la demande biochimique en oxygène soit, de préférence, par la demande théorique en oxygène (DThO) soit par la demande chimique en oxygène (DCO) et elle est exprimée sous forme de pourcentage (voir le paragraphe 36).
|
|
36.
|
Pour chaque temps de prélèvement, calculer les valeurs de la biodégradation à la fois pour les substances d'essai et de référence en utilisant l'une ou l'autre des équations suivantes:


avec:
|
DThO
|
=
|
demande théorique en oxygène (calculs en Appendice 3)
|
|
DCO
|
=
|
demande chimique en oxygène, déterminée expérimentalement.
|
Remarque: Il arrive que les deux modes de calcul (pourcentage de la DThO ou pourcentage de la DCO) ne donnent pas les mêmes résultats; il est préférable d'utiliser la DThO, car dans l'essai de la DCO certaines substances ne sont pas complètement oxydées.
|
|
37.
|
Tracer sur un diagramme la courbe de dégradation en fonction du temps (voir l'exemple du paragraphe “Validité et interprétation des résultats”). S'il existe suffisamment de données, à partir de cette courbe calculer la phase de latence (tL) et le temps nécessaire pour atteindre 50 % d'élimination après la fin de la phase de latence (t50)
|
|
38.
|
Si on réalise une analyse spécifique (facultatif), le pourcentage de dégradation primaire correspond au pourcentage de disparition de la substance spécifique au cours de la période d'essai (corrigé de la valeur obtenue dans les témoins).
|
Rapport d'essai
|
39.
|
Le rapport d'essai doit contenir les informations suivantes:
|
|
Substance d'essai:
|
—
|
état physique et s'il y a lieu, propriétés physicochimiques;
|
|
—
|
données relatives à l'identification.
|
|
|
|
Conditions d'essai:
|
—
|
lieu du prélèvement et description du site: état de la pollution et nature des substances nutritives (comptage des colonies, nitrate, ammonium, phosphate, s'il y a lieu);
|
|
—
|
caractéristiques de l'échantillon [date et profondeur de prélèvement, aspect, température, salinité, COD (facultatif), délai entre le prélèvement et l'utilisation dans l'essai];
|
|
—
|
méthode utilisée, s'il y a lieu, pour faire vieillir l'eau de mer;
|
|
—
|
méthode utilisée pour le prétraitement (filtration/sédimentation) de l'eau de mer;
|
|
—
|
méthode utilisée pour la détermination de la DCO (si elle est effectuée);
|
|
—
|
méthode utilisée pour mesurer l'oxygène;
|
|
—
|
procédé de dispersion des substances peu solubles dans les conditions de l'essai;
|
|
—
|
méthode utilisée pour déterminer le nombre de bactéries hétérotrophes dans l'eau de mer (méthode de comptage sur boîte ou autre méthode);
|
|
—
|
méthode utilisée pour déterminer le COD dans l'eau de mer (facultatif);
|
|
—
|
méthode utilisée pour l'analyse spécifique (facultatif);
|
|
—
|
autres méthodes facultatives utilisées pour caractériser l'eau de mer (mesures d'ATP, etc.);
|
|
|
|
Résultats
|
—
|
données analytiques reportées sur une feuille de résultats (comme celle jointe en Appendice 5);
|
|
—
|
la courbe de dégradation en fonction du temps représentée sur un diagramme qui indique la phase de latence (tL), la pente, et le temps nécessaire (à partir de la fin de la période de latence) pour atteindre 50 % de la consommation finale en oxygène due à l'oxydation de la substance d'essai (t50). La phase de latence peut être évaluée graphiquement comme sur la figure jointe, ou plus commodément déterminée comme le temps nécessaire pour atteindre 10 % de dégradation;
|
|
—
|
le pourcentage de dégradation mesuré après 28 jours.
|
|
|
|
Discussion des résultats.
|
|
Critères de validité et interprétation des résultats
|
40.
|
La respiration du témoin ne doit pas dépasser 30 % de l'oxygène consommé dans le récipient d'essai. S'il n'est pas possible de se conformer à ce critère en utilisant de l'eau de mer fraîchement prélevée, celle-ci doit être vieillie (stabilisée) avant utilisation
|
|
41.
|
On doit tenir compte du fait que les substances azotées peuvent modifier les résultats.
|
|
42.
|
Les résultats obtenus avec les substances de référence, par exemple le benzoate de sodium et l'aniline, doivent être comparables à ceux de l'essai circulaire (3) (paragraphe 9). Si les résultats obtenus avec les substances de référence sont atypiques, l'essai doit être recommencé avec un autre échantillon d'eau de mer.
|
|
43.
|
On peut considérer que la substance d'essai inhibe les bactéries (à la concentration utilisée) si la DBO du mélange des substances d'essai et de référence est inférieure à la somme des DBO des solutions séparées des deux substances.
|
|
44.
|
Du fait de l'utilisation de concentrations d'essai relativement élevées par rapport à celles de la plupart des systèmes naturels et par conséquent d'un rapport défavorable entre les concentrations de la substance d'essai et des autres sources de carbone, on doit considérer cette méthode comme un essai préliminaire qui peut être utilisé pour savoir si une substance est facilement biodégradable ou non. C'est pourquoi un résultat faible ne signifie pas nécessairement que la substance d'essai n'est pas biodégradable en milieu marin, mais il indique que davantage de travaux seront nécessaires pour conclure.
Un exemple d'une expérience de dégradation théorique illustrant une façon d'évaluer les valeurs de tL (durée de la “phase de latence”) et de t50, intervalle de temps (démarrant après tL), nécessaire pour atteindre 50 % de la consommation finale en oxygène due à l'oxydation de la substance d'essai, est donné ci-après.
|
BIBLIOGRAPHIE
|
(1)
|
de Kreuk J.F. and Hanstveit A.O. (1981). Determination of the biodegradability of organic fraction of chemical wastes. Chemosphere 10 (6); 561-573.
|
|
(2)
|
Chapitre C.4-B de la présente annexe: Détermination de la biodégradabilité “facile”, Partie III: Essai de screening modifié de l'OCDE.
|
|
(3)
|
N. Nyholm & P. Kristensen. Screening test methods for assessment of biodegradability of chemical substances in seawater. Final Report of the ring test programme 1984-1985, mars 1987, Commission des Communautés européennes (1985).
|
|
(4)
|
Chapitre C.11 de la présente annexe: Biodégradation — Boues activées: essai d'inhibition de la respiration.
|
|
(5)
|
Chapitre C.4-E de la présente annexe: Détermination de la biodégradabilité “facile”, Partie VI — Essai en fioles fermées.
|
Appendice 1
Détermination du carbone organique dans l'eau de mer
MÉTHODE DU FLACON AGITÉ
Pour déterminer le carbone organique d'un échantillon aqueux on oxyde les composés organiques de cet échantillon en dioxyde de carbone en utilisant généralement l'une des trois techniques suivantes:
|
—
|
oxydation-voie humide par persulfate/irradiation-UV;
|
|
—
|
oxydation-voie humide par persulfate/température élevée (116-130 °C);
|
La quantité de CO2 dégagée est mesurée par spectrométrie infrarouge ou par titrimétrie, ou bien le CO2 est réduit en méthane qui est dosé par un détecteur à ionisation de flamme (DIF).
La méthode persulfate/UV est communément utilisée pour analyser de l'eau “propre” avec une faible teneur en matière particulaire. Les deux autres méthodes peuvent être appliquées à la plupart des types d'échantillons d'eau, l'oxydation par le persulfate à température élevée se révélant plus adaptée pour les échantillons de faible teneur en carbone organique, tandis que la technique de la combustion s'applique aux échantillons dont la teneur en carbone organique non volatil (CONV) se situe bien au dessus de 1 mg/l de C.
Interférences
Ces trois méthodes dépendent de l'élimination ou de la compensation du carbone inorganique (CI) présent dans l'échantillon. Afin d'éliminer le CI, la méthode la plus fréquemment utilisée consiste à purger l'échantillon acidifié de son CO2, bien que cette manipulation entraîne également une perte des composés organiques volatils (1). L'élimination complète ou la compensation du CI doit être effectuée pour chaque type d'échantillon, et, selon les échantillons, le carbone organique volatil doit être déterminé, en plus du CONV.
Des concentrations élevées en chlorure entraînent une diminution de l'efficacité de l'oxydation quand on emploie la méthode persulfate/UV (2). Cette interférence peut cependant être éliminée en utilisant un oxydant modifié par l'addition de nitrate de mercure (II). Lors de l'étude d'échantillons contenant des chlorures, il est recommandé d'utiliser un volume d'échantillon le plus grand possible. Avec la méthode par combustion, des concentrations élevées en sel dans les échantillons analysés peuvent entraîner un dépôt de sel sur le catalyseur et une corrosion excessive du tube de combustion. On doit prendre les précautions indiquées dans le manuel du fabricant.
Quand on utilise la méthode persulfate/UV, il peut arriver que les échantillons très troubles ainsi que ceux qui contiennent des particules soient incomplètement oxydés.
Exemple d'une méthode appropriée
Le carbone organique non volatil est déterminé par oxydation au moyen de persulfate/irradiation UV et le CO2 qui se dégage alors est dosé par spectrométrie infrarouge non dispersive.
Le réactif pour l'oxydation est modifié selon les suggestions données dans (2) et comme décrit dans le manuel du fabricant:
|
a)
|
8,2 g de HgCl2 et 9,6 g de Hg(NO3)2 H2O sont dissous dans quelques centaines de millilitres d'eau de dilution contenant une faible concentration en carbone;
|
|
b)
|
20 g de K2S2O8 sont dissous dans la solution de sel mercurique;
|
|
c)
|
5 ml de HNO3 (concentré) sont ajoutés au mélange;
|
|
d)
|
le réactif est dilué jusqu'à un volume final de 1 000 ml.
|
On supprime l'interférence due au chlorure en utilisant un volume d'échantillon de 40 μl pour 10 % de chlorure et un volume d'échantillon de 200 μl pour 1,9 % de chlorure. Avec cette méthode on peut analyser des échantillons de forte teneur en chlorure et/ou des volumes d'échantillon plus importants dans la mesure où on empêche le chlorure de se former dans le récipient d'oxydation. On peut ensuite, si nécessaire, déterminer le carbone organique volatil dans le type d'échantillon étudié.
BIBLIOGRAPHIE
|
(1)
|
ISO, Qualité de l'eau — détermination du carbone organique total. Projet de norme internationale ISO/DIS 8245, 16 janvier 1986.
|
|
(2)
|
American Public Health Association, Standard methods for the estimation of water and wastewater. American Water Works Association & Water Pollution Control Federation, 16ème édition (1985).
Également intéressant (donne une description d'un système d'autoanalyse):
|
|
(3)
|
W. Schreurs (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137-142.
|
Appendice 2
Biodégradation dans l'eau de mer
MÉTHODE DU FLACON AGITÉ
FEUILLE DE RÉSULTATS
|
2.
|
DATE DU DÉBUT DE L'ESSAI:
|
|
3.
|
SUBSTANCE D'ESSAI:
Nom:
|
Concentration de la solution mère:
|
mg/l de substance
|
|
Concentration initiale dans le milieu, t0:
|
mg/l de substance
|
|
:
|
mg COD/l
|
|
|
4.
|
EAU DE MER:
Origine:
Date du prélèvement:
Profondeur du prélèvement:
Aspect au moment du prélèvement (par exemple trouble, etc.):
|
Salinité au moment du prélèvement:
|
‰
|
|
Température au moment du prélèvement:
|
°C
|
|
COD “x” heures après le prélèvement:
|
mg /l
|
Prétraitement avant l'essai (par exemple filtration, sédimentation, vieillissement, etc.):
|
Comptage des colonies microbiennes:
|
|
colonies/ml
|
|
|
|
colonies/ml
|
|
Autres caractéristiques:
|
|
|
|
|
5.
|
DOSAGES DU CARBONE:
Analyseur de carbone:
|
|
Flacon no
|
|
COD après n jours (mg/ml)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Essai: eau de mer fortifiée par des substances nutritives contenant la substance d'essai
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
moyenne, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
moyenne, Cb(t)
|
|
|
|
|
|
|
Témoin: eau de mer fortifiée par des substances nutritives ne contenant pas la substance d'essai
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
moyenne, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
moyenne, Cd(t)
|
|
|
|
|
|
| Moyenne,

|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
ÉVALUATION DES DONNÉES BRUTES:
|
Flacon no
|
Calcul des résultats
|
% de dégradation après n jours
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|

|
0
|
|
|
|
|
|
Moyenne (34)
|

|
0
|
|
|
|
|
|
Remarque:
|
des tableaux similaires peuvent être utilisés quand on suit la dégradation par une analyse spécifique et également pour la substance de référence et les témoins de toxicité.
|
|
|
7.
|
DÉGRADATION ABIOTIQUE (facultatif)
|
|
Temps (en jours)
|
|
0
|
t
|
|
Concentration en COD (en mg/l) dans le témoin stérile
|
Cs(o)
|
Cs(t)
|

|
Appendice 3
Calcul de la demande théorique biochimique en oxygène
MÉTHODE DU FLACON FERMÉ
La DThO de la substance CcHhClclNnNanaOoPpSs de poids moléculaire PM est calculée d'après la formule:

Ce calcul implique que C est minéralisé en CO2 et que H est transformé en H2O, P en P2O5 et Na en Na2O. Les halogènes sont éliminés sous forme d'halogénures d'hydrogène et l'azote sous forme d'ammoniac.
Exemple:
le glucose C6H12O6, de PM = 180

Les poids moléculaires des sels autres que ceux des métaux alcalins sont calculés en supposant qu'ils ont été hydrolysés.
On considère que le soufre est oxydé à l'état + 6.
Exemple:
le n-dodécylbenzènesulfonate de sodium C18H29SO3Na, de PM = 348

Dans le cas des substances azotées, l'azote peut être éliminé sous forme d'ammoniac, de nitrite ou de nitrate correspondant à différentes demandes théoriques en oxygène.


Par exemple, si dans le cas d'une amine secondaire, l'analyse a montré que l'azote était entièrement sous forme de nitrate:
(C12H25)2NH, de PM = 353
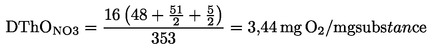
Appendice 4

Appendice 5
Biodégradation dans l'eau de mer
MÉTHODE DU FLACON FERMÉ
FEUILLE DE RÉSULTATS
|
2.
|
DATE DU DÉBUT DE L'ESSAI:
|
|
3.
|
SUBSTANCE D'ESSAI:
Nom:
|
Concentration de la solution mère:
|
mg /l
|
|
Concentration initiale dans le milieu contenant l'eau de mer:
|
mg /l
|
|
DThO ou DCO:
|
mg O2/mg de substance testée
|
|
|
4.
|
EAU DE MER:
Origine:
Date du prélèvement:
Profondeur du prélèvement:
Aspect au moment du prélèvement (par exemple trouble, etc.):
|
Salinité au moment du prélèvement:
|
‰
|
|
Température au moment du prélèvement:
|
°C
|
|
COD “x” heures après le prélèvement:
|
mg /l
|
Prétraitement avant l'essai (par exemple filtration, sédimentation, vieillissement, etc.):
|
Comptage des colonies microbiennes:
|
|
colonies/ml
|
|
|
|
colonies/ml
|
|
Autres caractéristiques:
|
|
|
|
|
5.
|
MILIEU D'ESSAI:
|
Température après aération:
|
°C
|
|
Concentration en O2 après aération et avant le début de l'essai:
|
mg O2/l
|
|
|
6.
|
DOSAGE DE L'OXYGÈNE DISSOUS:
Méthode: Winkler/électrode
|
|
Flacon no
|
|
mg O2/l après n jours
|
|
0
|
5
|
15
|
28
|
|
Essai: eau de mer, fortifiée par des substances nutritives, contenant la substance d'essai
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Moyenne essai
|
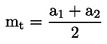
|
|
|
|
|
|
Témoin: eau de mer, fortifiée par des substances nutritives, ne contenant pas la substance d'essai
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Moyenne essai
|

|
|
|
|
|
Remarque: Des tableaux similaires peuvent être utilisés pour la substance de référence et pour les témoins de toxicité.
|
|
7.
|
DIMINUTION DE L'OXYGÈNE DISSOUS: % DE DÉGRADATION (% D):
|
|
Diminution de l'oxygène dissous après n jours
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|

|
|
|
|
|
C.43. ESSAI DE BIODÉGRADABILITÉ ANAÉROBIE DES SUBSTANCES ORGANIQUES DANS UNE BOUE DIGÉRÉE: MESURE DU DÉGAGEMENT GAZEUX
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 311 (2006) de l'OCDE pour les essais de produits chimiques. Il existe plusieurs essais de dépistage permettant de classer les substances organiques en fonction de leur biodégradabilité aérobie [méthodes d'essai C.4, C.9, C.10 et C.11 (1) et ligne directrice 302 C de l'OCDE (2)] et les résultats de ces essais ont permis de prédire de manière très satisfaisante le devenir de substances chimiques en milieu aérobie, en particulier aux stades aérobies du traitement des eaux usées. Des proportions diverses de substances insolubles dans l'eau et de substances s'adsorbant sur les particules solides des eaux usées sont également soumises à un traitement aérobie, puisqu'elles sont présentes dans les eaux usées décantées. Néanmoins, la majeure partie de ces substances est associée aux boues de décantation primaire, qui sont séparées des eaux usées non traitées dans des cuves de décantation avant que la partie surnageante des eaux usées subisse un traitement aérobie. La boue, qui renferme une partie des substances solubles dans le liquide interstitiel, est ensuite déversée dans un digesteur chauffé où elle subit un traitement anaérobie. À ce jour, il n'existe aucun essai dans cette série destiné à évaluer la biodégradabilité anaérobie dans les digesteurs anaérobies, d'où cette proposition de nouvelle Ligne directrice. Cet essai n'est pas nécessairement applicable à d'autres milieux anoxiques de l'environnement.
|
|
2.
|
Des techniques respirométriques permettant de mesurer les quantités de gaz produites en anaérobiose, essentiellement du méthane (CH4) et du dioxyde de carbone (CO2), ont été utilisées avec succès pour évaluer la biodégradabilité anaérobie. Birch et al. (3) ont passé ces procédés en revue et conclu que les travaux de Shelton et Tiedje (4), fondés sur des études antérieures (5)(6)(7), étaient les plus complets. Cette méthode (4), qui a été mise au point par d'autres (8) et est devenue des normes américaines (9)(10), ne résout pas les problèmes liés à la différence de solubilité entre le CO2 et le CH4 dans le milieu expérimental et au calcul de la production gazeuse théorique d'une substance d'essai. En recommandant de mesurer également la teneur en carbone inorganique dissous du liquide surnageant, le rapport de l'ECETOC (3) a étendu le champ d'application de la technique. La méthode de l'ECETOC, qui a fait l'objet d'un étalonnage international (ou essai circulaire), est devenue la norme ISO 11734 (11).
|
|
3.
|
La présente méthode d'essai, basée sur la norme ISO 11734 (11), décrit une méthode d'essai préliminaire destinée à évaluer la biodégradabilité anaérobie potentielle des substances organiques dans des conditions spécifiques (dans un digesteur anaérobie, sur une période définie et avec une gamme de concentrations de micro-organismes déterminée). Étant donné qu'on utilise une boue diluée et une concentration relativement élevée de substance d'essai et que la durée de l'essai est supérieure au temps de rétention appliqué dans les digesteurs anaérobies, les conditions de cet essai ne correspondent pas nécessairement aux conditions régnant dans les digesteurs anaérobies et ne s'appliquent pas forcément à l'évaluation de la biodégradabilité anaérobie de substances organiques dans d'autres conditions environnementales. La boue est exposée à la substance d'essai durant une période allant jusqu'à 60 jours, donc supérieure au temps de rétention normal des boues (25 à 30 jours) dans les digesteurs anaérobies, bien que ce temps de rétention puisse être bien plus long sur des sites industriels. Les résultats de cet essai ne permettent pas de formuler des prédictions aussi convaincantes que pour les essais de biodégradation aérobie. En effet, grâce aux essais de biodégradabilité aérobie facile et aux essais de simulation ainsi qu'en aérobiose, on a accumulé suffisamment de données sur le comportement des substances d'essai pour démontrer qu'il existe une connexion. Tandis que les données dont on dispose en ce qui concerne les milieux anaérobies sont beaucoup plus fragmentaires. On peut supposer que la biodégradation est complète si on atteint 75 à 80 % de la production gazeuse théorique. Les quotients élevés de quantité de substance chimique par biomasse appliqués dans cet essai impliquent que si une substance s'avère biodégradable à l'issue de cet essai, elle a encore plus de chances d'être dégradée dans un digesteur anaérobie. De plus, une substance qui ne se transforme pas en gaz au cours de cet essai ne sera pas nécessairement persistante dans des conditions où le quotient quantité de substance par biomasse est plus proche de celui qui règne dans la nature. Interviennent également d'autres réactions anaérobies susceptibles de dégrader, au moins partiellement, les substances, par exemple la déchloration, mais cet essai ne détecte pas ces réactions. Toutefois, certaines méthodes analytiques spécifiques permettent de suivre la disparition de la substance d'essai (voir les paragraphes 6, 30, 44 et 53).
|
PRINCIPE DE L'ESSAI
|
4.
|
Une boue digérée et lavée (36), à faible concentration (< 10 mg/l) de carbone inorganique (CI), est diluée environ dix fois, de telle sorte que la concentration des solides totaux atteigne 1 à 3 g/l, et est incubée à 35 °C ± 2 °C dans des récipients hermétiquement fermés, en présence de la substance d'essai à raison de 20 à 100 mg de C/l, durant une période allant jusqu'à 60 jours. L'activité de la boue est mesurée dans des récipients témoins à blanc contenant l'inoculum boueux mais pas la substance d'essai et incubés parallèlement aux récipients expérimentaux.
|
|
5.
|
L'augmentation de la pression dans l'espace libre (situé au dessus du liquide dans les récipients) provoquée par la production de dioxyde de carbone et de méthane est mesurée. Dans les conditions de l'essai, une proportion appréciable du CO2 produit est dissoute dans la phase liquide ou transformée en carbonate ou en carbonate d'hydrogène. Ce carbone inorganique est mesuré à la fin de l'essai.
|
|
6.
|
La quantité de carbone (inorganique et méthane) dégagée par la biodégradation de la substance d'essai est calculée d'après la production nette de gaz et la formation nette de carbone inorganique dans la phase liquide excédant celles relevées dans les récipients témoins. L'ampleur de la biodégradation est calculée d'après la production de carbone inorganique total et de carbone méthanique et exprimée en pourcentage de la quantité mesurée ou calculée de carbone ajouté par la substance d'essai. Le déroulement de la biodégradation peut être suivi par des mesures intermédiaires de la seule production gazeuse. De plus, la biodégradation primaire peut être déterminée par des analyses spécifiques au début et à la fin de l'essai.
|
INFORMATIONS SUR LA SUBSTANCE D'ESSAI
|
7.
|
Afin de pouvoir interpréter correctement les résultats, il est nécessaire de connaître la pureté, la solubilité dans l'eau, la volatilité et les caractéristiques d'adsorption de la substance d'essai. La teneur en carbone organique de la substance d'essai ( % poids/poids) doit être établie d'après sa structure chimique ou par une mesure. Pour des substances d'essai volatiles, il est utile de disposer d'une constante de Henry mesurée ou calculée pour savoir si cet essai est applicable à ces substances. Les informations sur la toxicité de la substance d'essai à l'égard des bactéries anaérobies permettent de sélectionner une concentration expérimentale appropriée et facilitent l'interprétation des résultats lorsque la biodégradabilité est faible. Il est recommandé d'inclure un témoin destiné à vérifier le pouvoir d'inhibition de la substance, sauf s'il est établi que la substance d'essai n'inhibe pas l'activité des micro-organismes anaérobies (voir le paragraphe 21 et la norme ISO 13641-1 (12)).
|
CHAMP D'APPLICATION DU PROCÉDÉ EXPÉRIMENTAL
|
8.
|
La présente méthode d'essai s'applique à des substances solubles dans l'eau, et peut aussi être réalisée sur des substances peu solubles ou insolubles, à condition d'utiliser une méthode de dosage exacte [voir, par exemple, ISO 10634 (13)]. Il faut généralement prendre une décision au cas par cas pour les substances volatiles. Des précautions particulières s'imposent, par exemple empêcher tout dégagement gazeux durant l'essai.
|
SUBSTANCES DE RÉFÉRENCE
|
9.
|
Pour vérifier le mode opératoire, on teste une substance de référence parallèlement à la substance d'essai dans des récipients appropriés. Le phénol, le benzoate de sodium et le polyéthylèneglycol 400 sont des exemples de substances de référence dont la dégradation devrait dépasser 60 % de la production gazeuse théorique (c'est-à-dire méthane et carbone inorganique) en l'espace de 60 jours (3)(14).
|
REPRODUCTIBILITÉ DES RÉSULTATS
|
10.
|
Dans un essai tournant international (14), une bonne reproductibilité a été relevée entre les mesures de la production gazeuse effectuées dans des récipients représentés en trois exemplaires. L'écart-type relatif (coefficient de variation) était presque toujours inférieur à 20 %, bien qu'il dépassait souvent les 20 % en présence de substances toxiques ou vers la fin de la période d'incubation de 60 jours. Des écarts plus importants ont également été observés dans des récipients ayant un volume inférieur à 150 ml. Les valeurs finales du pH dans le milieu d'essai étaient comprises entre 6,5 et 7,0.
|
|
11.
|
Les résultats suivants ont été obtenus dans l'essai tournant:
|
Substance d'essai
|
Nombre total de résultats
n1
|
Dégradation moyenne
(sur l'ensemble des résultats)
(%)
|
Écart-type relatif
(sur l'ensemble des résultats)
(%)
|
Résultats valables
n2
|
Dégradation moyenne
(sur les résultats valables)
(%)
|
Écart-type relatif
(sur les résultats valables)
(%)
|
Résultats affichant >60 % dégradation dans les essais valables
n3
|
|
Acide palmitique
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (37)
|
|
Polyéthylè-ne glycol 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Les coefficients de variation autour de la moyenne de tous les résultats obtenus avec l'acide palmitique et le polyéthylèneglycol 400 ont atteint respectivement 45 % (n = 36) et 35 % (n = 38). En écartant les valeurs < 40 % et > 100 % (attribuées à des conditions sous-optimales dans le premier cas et à des causes inconnues dans le second), on ramène leurs coefficients de variation respectifs à 26 % et 23 %. Les proportions de valeurs “valables” atteignant au moins 60 % de dégradation étaient de 70 % pour l'acide palmitique et de 83 % pour le polyéthylèneglycol 400. Les proportions du pourcentage de biodégradation calculées à partir des mesures du carbone inorganique dissous étaient relativement faibles, mais variables. Ces proportions s'échelonnent entre 0 et 35 % (moyenne de 12 % et coefficient de variation de 92 %), s'agissant de l'acide palmitique, et entre 0 et 40 % (moyenne de 24 % et coefficient de variation de 54 %), dans le cas du polyéthylèneglycol 400.
|
DESCRIPTION DU PROCÉDÉ EXPÉRIMENTAL
Appareillage
|
13.
|
Matériel courant de laboratoire et:
|
a.
|
incubateur anti-étincelles et thermostaté à 35 °C ± 2 °C;
|
|
b.
|
récipients expérimentaux en verre résistant à la pression et d'une capacité nominale appropriée (38), munis d'un septum étanche aux gaz, capable de supporter une pression d'environ 2 bars. Le volume de l'espace libre occupe environ 10 à 30 % du volume total. Si le dégagement de biogaz est régulier, un volume de 10 % convient, mais si le dégagement gazeux ne se produit qu'à la fin de l'essai, ce volume doit s'élever à 30 %. On recommande d'utiliser des flacons à sérum en verre d'un volume nominal de 125 ml et d'un volume total d'environ 160 ml, obturés par des septums (39) adaptés aux flacons à sérum et fixés par des surcapsules en aluminium, lorsqu'il y a un dégagement de pression à chaque prélèvement;
|
|
c.
|
manomètre capable de mesurer (40) et de laisser s'échapper le gaz produit, par exemple un manomètre manuel de précision connecté à une aiguille de seringue appropriée; un robinet à trois voies étanche aux gaz facilite la libération de la pression excédentaire (Appendice 1). Le volume interne des tuyaux et du robinet du transducteur de pression doit être aussi petit que possible, de telle sorte que les erreurs introduites du fait de négliger le volume de l'appareillage ne soient pas significatives.
Note: les pressions relevées sont utilisées directement pour calculer la quantité de carbone produite dans l'espace libre (paragraphes 42 à 44). Sinon, les pressions relevées peuvent également être converties en volumes (à 35 °C, à la pression atmosphérique) de gaz produit au moyen d'un graphique de conversion. Ce graphique est dressé à partir des données obtenues en injectant des volumes connus d'azote gazeux dans une série de récipients d'essai (par exemple des flacons à sérum) à 35 °C ± 2 °C et en notant les valeurs résultantes de la pression stabilisée (voir Appendice 2). Le calcul est exposé dans la note du paragraphe 44.
Avertissement: prendre garde de ne pas se blesser avec les aiguilles des microseringues;
|
|
d.
|
analyseur de carbone, capable de déterminer directement le carbone inorganique dans la gamme comprise entre 1 mg/l et 200 mg/l;
|
|
e.
|
seringues à haute précision pour les échantillons gazeux et liquides;
|
|
f.
|
agitateurs magnétiques (facultatif);
|
|
g.
|
boîte à gants (recommandé).
|
|
Réactifs
|
14.
|
Utiliser des réactifs de qualité pour analyse tout au long de l'essai.
|
Eau
|
15.
|
Eau distillée ou désionisée (désoxygénée par barbotage avec de l'azote gazeux renfermant moins de 5 μ1/l d'oxygène), contenant moins de 2 mg/l de carbone organique dissous.
|
Milieu d'essai
|
16.
|
Préparer un milieu de dilution contenant les ingrédients suivants dans les quantités spécifiées:
|
Dihydrogénophosphate de potassium anhydre (KH2PO4)
|
0,27 g
|
|
Hydrogénophosphate de sodium dodécahydraté (Na2HPO4 · 12H2O))
|
1,12 g
|
|
Chlorure d'ammonium (NH4Cl)
|
0,53 g
|
|
Chlorure de calcium dihydraté (CaCl2 · 2H2O)
|
0,075 g
|
|
Chlorure de magnésium hexahydraté (MgCl2 · 6H2O)
|
0,10 g
|
|
Chlorure de fer (II) tétrahydraté (FeCl2 · 4H2O)
|
0,02 g
|
|
Résazurine (indicateur d'oxygène)
|
0,001 g
|
|
Sulfure de sodium nonahydraté (Na2S · 9H2O)
|
0,10 g
|
|
Solution mère d'oligo-éléments (facultatif, paragraphe 18)
|
10 ml
|
|
Ajouter de l'eau désoxygénée (paragraphe 15) pour porter le volume à
|
1 litre-
|
Note: s'il est impossible d'utiliser du sulfure de sodium fraîchement préparé, il faut le laver et le sécher avant l'emploi, afin qu'il soit suffisamment réducteur. Cet essai peut être conduit sans boîte à gants (voir paragraphe 26). Dans ce cas, la concentration finale de sulfure de sodium dans le milieu peut être portée à 0,20 g de Na2S · 9H2O par litre. Le sulfure de sodium peut aussi être ajouté à partir d'une solution mère anaérobie appropriée à travers le septum des récipients d'essai fermés, ce mode opératoire diminuant le risque d'oxydation. Le sulfure de sodium peut être remplacé par du citrate de titane (III). Ce dernier est introduit à travers le septum des récipients d'essai fermés de telle sorte que sa concentration finale y atteigne 0,8 à 1,0 mmol/l/l. Le citrate de titane (III) est un agent réducteur très efficace et peu toxique que l'on prépare comme suit: dissoudre 2,94 g de citrate de sodium dihydraté dans 50 ml d'eau désoxygénée (afin d'obtenir une solution à 200 mmol/l) et ajouter 5 ml d'une solution de chlorure de titane (III) à 15 % (poids/volume). Neutraliser à pH 7 ± 0,2 avec une base minérale et verser dans un récipient approprié sous un jet d'azote. La concentration de citrate de titane (III) dans cette solution mère est de 164 mmol/l.
|
|
17.
|
Mélanger les ingrédients du milieu expérimental à l'exception de l'agent réducteur (sulfure de sodium, citrate de titane) et faire barboter de l'azote gazeux dans la solution durant environ 20 minutes, juste avant son utilisation, pour enlever l'oxygène. Ajouter ensuite le volume qui convient de la solution fraîchement préparée (dans de l'eau désoxygénée) de l'agent réducteur, juste avant d'utiliser le milieu. Ajuster le pH du milieu, si nécessaire, avec un acide ou une base minéraux dilués à 7 ± 0,2.
|
Solution mère d'oligo-éléments (facultatif)
|
18.
|
Il est recommandé d'utiliser un milieu d'essai contenant les oligo-éléments suivants, afin d'améliorer les processus de dégradation anaérobie, surtout si les concentrations d'inoculum sont faibles (par exemple 1 g/l) (11).
|
Chlorure de manganèse tétrahydraté (MnCl2 · 4H2O)
|
50 mg
|
|
Acide borique (H3BO3)
|
5 mg
|
|
Chlorure de zinc (ZnCl2)
|
5 mg
|
|
Chlorure de cuivre (II) (CuCl2)
|
3 mg
|
|
Molybdate de sodium dihydraté (Na2MoO4 · 2H2O)
|
1 mg
|
|
Chlorure de cobalt hexahydraté (CoCl2 · 6H2O)
|
100 mg
|
|
Chlorure de nickel hexahydrat (NiCl2 · 6H2O)
|
10 mg
|
|
Sélénite de sodium (Na2SeO3)
|
5 mg
|
|
Ajouter de l'eau désoxygénée (paragraphe 15) pour porter le volume à
|
1 litre
|
|
Substance d'essai
|
19.
|
Ajouter la substance d'essai véhiculée dans une solution, suspension ou émulsion mère ou directement, à l'état solide ou liquide, ou adsorbée sur un filtre en fibres de verre, de façon à obtenir une concentration ne dépassant pas 100 mg/l de carbone organique. Si l'on emploie une solution mère, préparer une solution appropriée avec de l'eau (paragraphe 15) préalablement désoxygénée par barbotage avec de l'azote gazeux, d'une concentration telle que le volume ajouté soit inférieur à 5 % du volume total du mélange réactionnel. Ajuster le pH de la solution mère à 7 ± 0,2, si nécessaire. Pour les substances d'essai insuffisamment solubles dans l'eau, se reporter à la norme ISO 10634 (13). Si l'on utilise un solvant, préparer un témoin supplémentaire dans lequel seul le solvant est ajouté au milieu inoculé. Les solvants organiques dont on sait qu'ils inhibent la production de méthane, tels que le chloroforme et le tétrachlorure de carbone, sont à éviter.
Avertissement — Les substances d'essai toxiques et celles dont les propriétés sont inconnues sont à manipuler avec précaution.
|
Substances de référence
|
20.
|
Des substances de référence, telles que le benzoate de sodium, le phénol et le polyéthylèneglycol 400, ont déjà permis de vérifier correctement le mode opératoire, puisqu'elles sont biodégradées à plus de 60 % en l'espace de 60 jours. Préparer une solution mère (dans de l'eau désoxygénée) de la substance de référence choisie, de la même manière que la solution de substance d'essai, et ajuster le pH à 7 ± 0,2, si nécessaire.
|
Témoin de l'inhibition (facultatif)
|
21.
|
Pour obtenir des informations sur la toxicité de la substance d'essai à l'égard des micro-organismes anaérobies, afin de trouver la concentration expérimentale la plus appropriée, ajouter la substance d'essai et la substance de référence dans un récipient contenant le milieu expérimental (voir paragraphe 16), chacune à la même concentration que celle à laquelle elles ont été ajoutées dans le milieu d'essai lors de l'essai (voir les paragraphes 19 et 20, ainsi que la norme ISO 13641-1 (12)).
|
Boue digérée
|
22.
|
Prélever de la boue digérée dans le digesteur d'une station d'épuration qui traite principalement des eaux usées domestiques. Cette boue doit être caractérisée de façon exhaustive et les informations de référence doivent être incluses dans le rapport (voir paragraphe 54). Si l'on projette d'employer un inoculum adapté, on pourra peut-être recueillir la boue digérée dans une station d'épuration d'effluents industriels. Utiliser des bouteilles à large ouverture en polyéthylène à haute densité ou d'une matière semblable, capables de se dilater, pour collecter la boue digérée. Remplir ces bouteilles de boue jusqu'à environ 1 cm de leur embouchure et les fermer hermétiquement, de préférence avec une soupape de sécurité. Après son arrivée au laboratoire, la boue récoltée peut être utilisée directement ou placée dans un digesteur à l'échelle du laboratoire. Libérer l'excès de biogaz en ouvrant les bouteilles de boue avec précaution. Sinon, une boue anaérobie cultivée en laboratoire peut également être utilisée comme source d'inoculum, mais son spectre d'activité risque d'avoir été altéré.
Avertissement — Les boues digérées comportent des risques d'incendie et d'explosion à cause des gaz inflammables qu'elles dégagent, elles renferment également des organismes potentiellement pathogènes, de sorte que ces boues sont à manipuler avec prudence. Pour des raisons de sécurité, il ne faut pas recueillir les boues dans des récipients en verre.
|
|
23.
|
Pour réduire la production gazeuse de fond et diminuer l'influence des témoins à blanc, on peut envisager de prédigérer la boue. Si une prédigestion s'avère nécessaire, on laisse la boue subir une digestion sans l'additionner d'éléments nutritifs ou de substrats à 35 °C ± 2 °C pendant sept jours au maximum. On a constaté, pour quelques substances testées, qu'une prédigestion d'environ 5 jours entraîne habituellement une diminution optimale de la production gazeuse dans le témoin à blanc, qui ne s'accompagne pas d'une prolongation inacceptable de la phase de latence ou des périodes d'incubation durant la phase d'essai, ni d'une perte d'activité.
|
|
24.
|
Pour les substances d'essai qui sont, ou risquent d'être, peu biodégradables, on envisagera de préexposer la boue à la substance d'essai, afin d'obtenir un inoculum mieux adapté. Dans ce cas, ajouter la substance d'essai à raison de 5 mg/l à 20 mg/l de carbone organique à la boue digérée et incuber ce mélange durant deux semaines au maximum. Laver soigneusement la boue préexposée avant de l'utiliser (voir paragraphe 25) et stipuler les conditions de la préexposition dans le rapport d'essai.
|
Inoculum
|
25.
|
Laver la boue juste avant son emploi (paragraphes 22 à 24), afin d'abaisser la concentration de carbone inorganique à moins de 10 mg/l dans la suspension expérimentale finale. Centrifuger la boue dans des tubes hermétiquement clos (par exemple pendant 5 minutes à 3 000 g) et jeter le surnageant. Suspendre le culot dans un milieu désoxygéné (paragraphes 16 et 17), centrifuger à nouveau la suspension et éliminer le liquide surnageant. Si la teneur en carbone inorganique n'a pas été suffisamment réduite, le lavage de la boue peut encore être répété deux fois au maximum. Ce traitement ne semble pas nuire aux micro-organismes. Enfin, suspendre le culot dans le volume requis de milieu expérimental et déterminer la concentration des solides totaux [voir, par exemple, ISO 11923 (15)]. La concentration finale des solides totaux dans les récipients d'essai doit être comprise entre 1 g/let 3 g/l (ou environ 10 % de la concentration dans la boue digérée non diluée). Mener les opérations ci-dessus en s'efforçant de préserver autant que possible la boue de tout contact avec l'oxygène (par exemple dans une atmosphère azotée).
|
MODE OPÉRATOIRE
|
26.
|
Conduire les étapes initiales suivantes en appliquant des techniques permettant de limiter au maximum le contact entre la boue digérée et l'oxygène; il peut par exemple être nécessaire de travailler dans une boîte à gants sous atmosphère azotée et/ou de purger les flacons avec de l'azote (4).
|
Préparation des récipients d'essai et des récipients témoins
|
27.
|
Préparer des récipients en au moins trois exemplaires (voir paragraphe 13-b) pour la substance d'essai, les témoins à blanc, la substance de référence, les témoins d'inhibition (le cas échéant) ainsi que des enceintes manostatées (option facultative) (voir paragraphes 7 et 19 à 21). On peut également préparer des récipients supplémentaires pour évaluer la biodégradation primaire par des procédés analytiques spécifiques de la substance d'essai. Le même ensemble de récipients témoins à blanc peut être utilisé pour plusieurs substances soumises au même essai, à condition que les volumes de l'espace libre soient homogènes.
|
|
28.
|
Préparer l'inoculum dilué avant de l'ajouter aux récipients, par exemple au moyen d'une pipette à large embouchure. Ajouter des aliquotes de l'inoculum bien mélangé (paragraphe 25), de telle sorte que la concentration des solides totaux soit identique dans tous les récipients (entre 1 g/l et 3 g/l). Ajouter les solutions mères de la substance d'essai et de la substance de référence, après avoir ajusté le pH à 7 ± 0,2, si nécessaire. Il convient d'ajouter les substances d'essai et de référence dans le véhicule le plus approprié (voir paragraphe 19).
|
|
29.
|
La concentration expérimentale en carbone organique doit normalement se situer entre 20 et 100 mg/l (paragraphe 4). Si la substance d'essai est toxique, la concentration expérimentale doit être réduite à 20 mg de C/l, ou même moins si seule la biodégradation primaire est à mesurer (par des analyses spécifiques). Il est à noter que la variabilité des résultats de l'essai augmente aux basses concentrations expérimentales.
|
|
30.
|
Dans les récipients témoins à blanc, ajouter une quantité équivalente du véhicule utilisé pour ajouter la substance d'essai, à la place de la solution, suspension ou émulsion mère. Si la substance d'essai a été introduite sur un support en fibres de verre (filtre) ou à l'aide de solvants organiques, ajouter un filtre dans les témoins à blanc ou un volume de solvant équivalent à celui qui a été évaporé. Inclure un récipient d'essai supplémentaire contenant la substance d'essai pour y mesurer le pH. Ajuster le pH à 7 ± 0,2, si nécessaire, avec de petites quantités de base ou d'acide minéraux dilués. On ajoute la même quantité d'agent neutralisant à tous les récipients d'essai. Ces ajouts ne devraient pas être nécessaires étant donné que le pH des solutions mères de la substance d'essai et de la substance de référence a déjà été ajusté (voir paragraphes 19 et 20). S'il faut mesurer la biodégradation primaire, on prélève un échantillon approprié dans le récipient destiné à l'analyse du pH ou dans un récipient d'essai supplémentaire et on mesure la concentration de la substance d'essai par une analyse spécifique. Si le mélange réactionnel requiert une agitation, des aimants enrobés peuvent être déposés dans tous les récipients (facultatif).
|
|
31.
|
S'assurer que le volume total du liquide V1 et le volume de l'espace libre Vh sont identiques dans tous les récipients; relever et consigner les valeurs de V1 et Vh. Chaque récipient doit être fermé hermétiquement au moyen d'un septum étanche aux gaz et transféré de la boîte à gants (paragraphe 26) dans l'incubateur (voir paragraphe 13-a))
|
Substances d'essai insolubles
|
32.
|
Les quantités pesées de substances peu solubles dans l'eau sont versées directement dans les récipients préparés. Si le recours à un solvant s'avère nécessaire (voir paragraphe 19), transférer la solution ou la suspension de substance d'essai dans les récipients vides. Si possible, évaporer le solvant en faisant circuler de l'azote gazeux dans les récipients, avant d'ajouter les autres ingrédients, à savoir la boue diluée (paragraphe 25) et l'eau désoxygénée, comme indiqué. Un témoin supplémentaire au solvant doit également être préparé (paragraphe 19). La norme ISO 10634 (13) présente d'autres méthodes d'ajout de substances insolubles. Les substances d'essai liquides peuvent être introduites avec une seringue dans les récipients complètement préparés et hermétiquement fermés, si l'on s'attend à ce que le pH initial ne dépasse pas 7 ± 1, sinon ajouter la substance d'essai comme indiqué plus haut (paragraphe 19).
|
Incubation et mesures de la pression gazeuse
|
33.
|
Incuber les récipients préparés à 35 °C ± 2 °C durant environ une heure, afin que leur contenu s'équilibre, et évacuer l'excès de gaz dans l'atmosphère, par exemple en secouant chaque récipient, l'un après l'autre, et en y insérant l'aiguille du manomètre (paragraphe 13-c) à travers le septum, puis en ouvrant le robinet jusqu'à ce que le manomètre indique zéro. Si à ce stade, ou lorsqu'on pratique des mesures intermédiaires, la pression de l'espace libre est inférieure à la pression atmosphérique, il faut rajouter de l'azote gazeux afin de rétablir la pression atmosphérique. Fermer le robinet (voir paragraphe 13-c) et incuber les récipients à l'obscurité, en s'assurant que toutes les parties des récipients sont maintenues à la température de la digestion. Observer les récipients après 24 à 48 heures d'incubation. Écarter les récipients dont le liquide surnageant présente une coloration rose bien nette, autrement dit, où la résazurine (voir paragraphe 16) a viré, révélant la présence d'oxygène (voir paragraphe 50). Bien que le système puisse tolérer de petites quantités d'oxygène, des concentrations plus importantes risquent d'inhiber fortement la biodégradation anaérobie. Le rejet occasionnel d'un seul récipient sur un ensemble de trois récipients identiques est acceptable, mais des rejets plus fréquents doivent amener l'expérimentateur à vérifier le mode opératoire et à recommencer l'essai.
|
|
34.
|
Mélanger soigneusement le contenu de chaque récipient en le remuant ou en agitant le récipient pendant quelques minutes, au moins 2 ou 3 fois par semaine et peu avant chaque mesure de la pression. L'agitation resuspend l'inoculum et permet d'équilibrer les gaz. Toutes les pressions sont à mesurer rapidement, les récipients d'essai pouvant subir une baisse de température induisant un affichage de valeurs erronées. Lorsqu'on mesure la pression, la totalité du récipient d'essai, y compris l'espace libre, doit être maintenue à la température de la digestion. Mesurer la pression gazeuse, par exemple en insérant l'aiguille à seringue connectée au manomètre à travers le septum (paragraphe 13-c). Veiller à ne pas laisser entrer d'eau dans l'aiguille; si cela se produit, sécher les parties humides et placer une nouvelle aiguille. La pression est à mesurer en millibars (voir paragraphe 42). La pression gazeuse régnant dans les récipients peut être mesurée périodiquement, par exemple une fois par semaine, et éventuellement l'excès de gaz peut être évacué dans l'atmosphère. Sinon, on peut aussi ne mesurer la pression qu'à la fin de l'essai, afin de déterminer la quantité de biogaz produite.
|
|
35.
|
On préconise de relever les pressions gazeuses intermédiaires, parce que l'augmentation de la pression indique à quel moment l'essai peut être achevé et permet de suivre la cinétique (voir paragraphe 6).
|
|
36.
|
Normalement, l'essai prend fin après une période d'incubation de 60 jours, à moins que la courbe de biodégradation obtenue à partir des mesures de la pression ait atteint un plateau avant; cette phase de plateau, où la courbe marque un pallier, correspond à la biodégradation maximale. Si le plateau atteint moins de 60 %, l'interprétation est délicate parce que cela signifie qu'une partie seulement de la molécule a été minéralisée ou qu'une erreur a été commise. Si, à l'issue de la période d'incubation normale, du gaz se dégage alors que la phase plateau n'a manifestement pas été atteinte, on envisagera de prolonger l'essai pour vérifier si la courbe parvient finalement au plateau (> 60 %).
|
Mesure du carbone inorganique
|
37.
|
À la fin de l'essai, après la dernière mesure de la pression gazeuse, laisser la boue au repos. Ouvrir chaque récipient, l'un après l'autre, et prélever immédiatement un échantillon en vue de déterminer la concentration (mg/l) du carbone inorganique dans le liquide surnageant. Le liquide surnageant ne peut être ni centrifugé ni filtré, car ces traitements entraîneraient une perte inacceptable de dioxyde de carbone dissous. Si le surnageant ne peut être analysé juste après avoir été prélevé, stocker ce dernier dans une fiole hermétiquement fermée, sans espace libre, et refroidie à environ 4 °C, pendant deux jours au maximum. Après avoir mesuré le carbone inorganique, mesurer et enregistrer la valeur du pH.
|
|
38.
|
Sinon, le carbone inorganique présent dans le surnageant peut être déterminé indirectement, d'après le rejet de carbone inorganique dissous sous la forme de dioxyde de carbone mesurable dans l'espace libre. Après la dernière mesure de pression gazeuse, ramener la pression régnant dans chaque récipient d'essai à la pression atmosphérique. Acidifier le contenu de chaque récipient d'essai à environ pH 1 en ajoutant un acide minéral concentré (par exemple H2SO4), à travers le septum des récipients hermétiquement fermés. Incuber les récipients secoués à 35 °C ± 2 °C durant environ 24 heures et mesurer au manomètre la pression gazeuse résultant du dioxyde de carbone dégagé.
|
|
39.
|
Effectuer les mêmes relevés pour le témoin à blanc, le témoin contenant la substance de référence et, le cas échéant, les témoins d'inhibition (voir paragraphe 21).
|
|
40.
|
Dans certains cas, en particulier si les mêmes récipients témoins sont utilisés pour plusieurs substances d'essai, on envisagera de mesurer, si nécessaire, les concentrations intermédiaires de carbone inorganique dans les récipients d'essai et les récipients témoins. Dans ce cas, il faut prévoir un nombre suffisant de récipients pour toutes les mesures intermédiaires. Il est préférable de procéder de cette manière plutôt que de prélever tous les échantillons dans le même récipient. Cette dernière option ne peut être retenue que si le volume nécessaire à l'analyse du carbone inorganique dissous ne semble pas trop important. Le carbone inorganique dissous est mesuré après la mesure de la pression gazeuse, mais sans que le gaz excédentaire ait été évacué, comme décrit ci-dessous:
|
—
|
prélever des échantillons de surnageant d'un volume aussi petit que possible, en introduisant une seringue à travers le septum, sans ouvrir les récipients, et déterminer la teneur en carbone inorganique de l'échantillon;
|
|
—
|
après avoir prélevé l'échantillon, évacuer éventuellement le gaz excédentaire;
|
|
—
|
il faut tenir compte du fait qu'une diminution, même minime, du volume du surnageant (par exemple de 1 %) peut entraîner une augmentation sensible du volume du gaz occupant l'espace libre (Vh);
|
|
—
|
si nécessaire, les équations (voir paragraphe 44) sont corrigées par une augmentation de la valeur de Vh dans l'équation 3.
|
|
Analyses spécifiques
|
41.
|
S'il y a lieu de déterminer la dégradation anaérobie primaire (voir paragraphe 30), prélever un échantillon d'un volume suffisant pour les analyses spécifiques, au début et à la fin de l'essai, dans les récipients contenant la substance d'essai. Il est à noter que, si ce prélèvement est effectué, les volumes de l'espace libre (Vh) et du liquide (Vl) sont modifiés et il faut en tenir compte dans le calcul de la production gazeuse. Sinon, il est également possible de prélever des échantillons destinés aux analyses spécifiques dans des mélanges supplémentaires, prévus à cette fin (paragraphe 30).
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
42.
|
Pour des raisons pratiques, la pression du gaz est mesurée en millibars (1 mbar = 1 hPa = 102 Pa; 1 Pa = 1 N/m2), le volume en litres et la température en degrés Celsius.
|
Carbone dans l'espace libre
|
43.
|
Sachant qu'une mole de méthane et une mole de dioxyde de carbone contiennent chacune 12 g de carbone, la masse de carbone dans un volume donné de gaz dégagé peut être exprimée par l'équation suivante:
|
m= 12 × 103×n
|
Équation [1]
|
où:
|
m
|
=
|
masse de carbone (mg) dans un volume donné de gaz dégagé;
|
|
12
|
=
|
masse atomique relative du carbone;
|
|
n
|
=
|
nombre de moles de gaz dans le volume donné.
|
Si un gaz autre que le méthane ou le dioxyde de carbone (par exemple du N2O) se dégage en quantité considérable, il convient de modifier la formule [1], de façon à décrire la possibilité d'effets engendrés par les gaz dégagés.
|
|
44.
|
D'après les lois sur les gaz, n peut s'exprimer par:
|
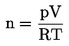
|
Équation [2]
|
où:
|
p
|
=
|
pression du gaz (Pascals);
|
|
V
|
=
|
volume du gaz (m3);
|
|
R
|
=
|
constante molaire des gaz [8,314 J/(mol K)];
|
|
T
|
=
|
température d'incubation (Kelvins).
|
En combinant les équations [1] et [2] et en adaptant la formule pour tenir compte de la production de gaz dans le témoin à blanc,
|

|
Équation [3]
|
où:
|
mh
|
=
|
masse de carbone net produite sous forme de gaz dans l'espace libre (mg);
|
|
Δp
|
=
|
moyenne de la différence entre les pressions initiale et finale dans les récipients d'essai moins la moyenne correspondante dans les récipients témoins à blanc (millibars);
|
|
Vh
|
=
|
volume de l'espace libre dans le récipient (litres).
|
|
0,1
|
=
|
facteur permettant de convertir à la fois les newtons/m2 en millibars et les m3 en litres.
|
L'équation [4] devrait être utilisée pour la température normale d'incubation, à savoir 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
Équation [4]
|
Note: Autre mode de calcul du volume: les pressions lues sur le manomètre sont converties en ml de gaz produit à l'aide de la courbe de référence tracée en portant le volume injecté (ml) en fonction des valeurs relevées sur le manomètre (Appendice 2). On calcule le nombre de moles (n) de gaz dans l'espace libre de chaque récipient en divisant la production de gaz cumulée (ml) par 25 286 ml/mole, valeur qui correspond au volume occupé par une mole de gaz à 35 °C à pression atmosphérique normale. Étant donné qu'une mole de CH4 et une mole de CO2 contiennent chacune 12 g de carbone, la quantité de carbone (mg) dans l'espace libre (mh
) est donnée par l'équation [5]:
|
mh
= 12 × 103×n
|
Équation [5]
|
En adaptant la formule pour tenir compte de la production de gaz dans le témoin à blanc,
|

|
Équation [6]
|
où:
|
mh
|
=
|
masse de carbone net produite sous forme de gaz dans l'espace libre (mg);
|
|
ΔV
|
=
|
moyenne de la différence entre le volume de gaz produit dans l'espace libre des récipients d'essai et le volume de gaz produit dans l'espace libre des récipients témoins à blanc
|
|
25 286
|
=
|
volume occupé par une mole de gaz à 35 °C et sous 1 atmosphère.
|
|
|
45.
|
Il est possible de suivre le déroulement de la biodégradation en portant sur un graphique l'accroissement de pression cumulé Δρ (millibars) en fonction du temps, s'il y a lieu. À partir de cette courbe, mettre en évidence et noter la phase de latence (jours). La phase de latence correspond au temps écoulé entre le début de l'essai et le moment où la dégradation commence à être sensible (l'Appendice 3 en donne un exemple). Si des échantillons intermédiaires de surnageant sont prélevés et analysés (paragraphes 40, 46 et 47), alors le carbone total produit (dans le gaz et dans le liquide) peut être porté sur le graphique à la place de la seule pression cumulée.
|
Carbone dans le liquide
|
46.
|
On néglige la quantité de méthane dans le liquide, sachant que sa solubilité dans l'eau est très faible. Calculer la masse de carbone inorganique dans le liquide des récipients d'essai à l'aide de l'équation [7]:
|
ml
=Cnet
×Vl
|
Équation [7]
|
où:
|
m1
|
=
|
masse de carbone inorganique dans le liquide (mg);
|
|
Cent
|
=
|
concentration de carbone inorganique dans les récipients d'essai moins cette même concentration dans les récipients témoins à la fin de l'essai (mg/l);
|
|
Vl
|
=
|
volume de liquide dans le récipient (litres).
|
|
Carbone gazéifié total
|
47.
|
Calculer la masse totale de carbone gazéifié dans le récipient au moyen de l'équation [8]:
où:
|
|
mt
= masse totale de carbone gazéifié (mg);
|
|
|
mh
+ ml
sont comme définis plus haut.
|
|
Carbone de la substance d'essai
|
48.
|
Calculer la masse de carbone (provenant de la substance d'essai ajoutée) dans les récipients d'essai à l'aide de l'équation [9]:
où:
|
mv
|
=
|
masse de carbone de la substance d'essai (mg);
|
|
Cc
|
=
|
concentration du carbone de la substance d'essai dans le récipient d'essai (mg/l);
|
|
Vl
|
=
|
volume de liquide dans le récipient d'essai (litres).
|
|
Ampleur de la biodégradation
|
49.
|
Calculer le pourcentage de biodégradation d'après le gaz présent dans l'espace libre à l'aide de l'équation [10] et le pourcentage total de biodégradation avec l'équation [11]:
|
Dh
= (mh
/mv
) × 100
|
Équation [10]
|
|
Dt
= (mt
/mv
) × 100
|
Équation [11]
|
où:
|
|
Dh
= biodégradation d'après le gaz présent dans l'espace libre (%);
|
|
|
Dt
= biodégradation totale (%);
|
|
|
mh
, mv
et mt
sont définis comme plus haut.
|
Le degré de biodégradation primaire est calculé d'après les mesures (facultatives) de la concentration de la substance d'essai au début et à la fin de l'incubation, à l'aide de l'équation [12]:
|
Dp
= (1 –Se
/Si
) × 100
|
Équation [12]
|
où:
|
Dp
|
=
|
dégradation primaire de la substance d'essai (%);
|
|
Si
|
=
|
concentration initiale de la substance d'essai (mg/l);
|
|
Se
|
=
|
concentration finale de la substance d'essai (mg/l).
|
Si la méthode d'analyse fait apparaître des concentrations significatives de substance d'essai dans l'inoculum de boue anaérobie non traité, utiliser l'équation [13]:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
Équation [13]
|
où:
|
Dp
1
|
=
|
dégradation primaire corrigée de la substance d'essai (%);
|
|
Sib
|
=
|
concentration initiale “apparente” de la substance d'essai dans les témoins à blanc (mg/l);
|
|
Seb
|
=
|
concentration finale “apparente” de la substance d'essai dans les témoins à blanc (mg/l).
|
|
Validité des résultats
|
50.
|
Seules les pressions relevées dans les récipients ne présentant pas de coloration rose (voir paragraphe 33) peuvent être utilisées. La contamination par l'oxygène est réduite au minimum par des techniques adéquates de manipulation en anaérobiose.
|
|
51.
|
Il faut considérer que l'essai est valable si la substance de référence atteint un plateau qui représente plus de 60 % de biodégradation (41).
|
|
52.
|
Si, à la fin de l'essai, le pH sort de l'intervalle 7 ± 1 et que la biodégradation est insuffisante, recommencer l'essai en augmentant le pouvoir tampon du milieu.
|
Inhibition de la dégradation
|
53.
|
La production de gaz dans les récipients contenant à la fois la substance d'essai et la substance de référence doit être au moins égale à celle enregistrée dans les récipients ne contenant que la substance de référence; sinon cela révèle une inhibition de la production de gaz. Dans certains cas, la production gazeuse dans les récipients renfermant la substance d'essai, mais pas la substance de référence est inférieure à celle régnant dans les récipients témoins à blanc: cela indique que la substance d'essai est inhibante.
|
Rapport d'essai
|
54.
|
Le rapport d'essai doit inclure les informations suivantes:
|
|
Substance d'essai:
|
—
|
nom courant, nom chimique, numéro CAS, formule structurale et propriétés physico-chimiques pertinentes;
|
|
—
|
pureté (impuretés) de la substance d'essai.
|
|
|
|
Conditions expérimentales:
|
—
|
volumes du liquide dilué du digesteur (Vl
) et de l'espace libre (Vh) dans le récipient;
|
|
—
|
description des récipients d'essai, des principales caractéristiques de la mesure du biogaz (par exemple, type de manomètre) et de l'analyseur de carbone inorganique;
|
|
—
|
ajout des substances d'essai et de référence au système expérimental: concentration expérimentale employée et recours à un solvant, le cas échéant;
|
|
—
|
détails sur l'inoculum utilisé: nom de la station d'épuration des eaux usées, description de la source des eaux usées traitées (par exemple, température des opérations, temps de rétention de la boue, origine principalement domestique, etc.), concentration, toutes les informations permettant d'étayer ce qui précède et renseignements sur le prétraitement éventuel de l'inoculum (par exemple prédigestion, préexposition);
|
|
—
|
température d'incubation;
|
|
—
|
nombre de récipients traités de manière identique.
|
|
|
|
Résultats:
|
—
|
valeurs du pH et du carbone inorganique à la fin de l'essai;
|
|
—
|
concentration de la substance d'essai au début et à la fin de l'essai, si une mesure spécifique a été effectuée;
|
|
—
|
toutes les valeurs mesurées dans les récipients d'essai, les témoins à blanc, les témoins contenant la substance de référence et les témoins d'inhibition, comme il convient [par exemple la pression en millibars, la concentration du carbone inorganique (mg/l)] sont présentées sous forme de tableau (les valeurs mesurées dans l'espace libre et le liquide doivent être rapportées séparément);
|
|
—
|
traitement statistique des données, durée de l'essai et diagramme de la biodégradation de la substance d'essai, de la substance de référence et du témoin d'inhibition;
|
|
—
|
pourcentage de biodégradation de la substance d'essai et de la substance de référence;
|
|
—
|
motifs du rejet éventuel des résultats;
|
|
|
BIBLIOGRAPHIE
|
(1)
|
Chapitres suivant de la présente annexe:
|
|
C.4. Détermination de la biodégradabilité facile;
|
|
|
C.9. Biodégradation — Essai de Zahn et Wellens;
|
|
|
C.10. Essai de simulation — Traitement aérobie des eaux usées:
A: Unités de traitement par boues activées; B: Biofilms
|
|
|
C.11. Biodégradation — Boues activées: essai d'inhibition de la respiration
|
|
|
(2)
|
OCDE (2009) Biodégradabilité dite intrinsèque: Essai MITI modifié (II), Ligne directrice de l'OCDE pour les essais de produits chimique no 302 C, OCDE, Paris
|
|
(3)
|
Birch, R.R., Biver, C., Campagna, R., Gledhill, W.E., Pagga,U., Steber, J., Reust, H. and Bontinck, W.J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550. (Also published as ECETOC Technical Report No. 28, June 1988).
|
|
(4)
|
Shelton D.R. and Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. Appl. Environ. Mircobiology, 47, 850-857.
|
|
(5)
|
Owen, W.F., Stuckey, DC., Healy J.B., Jr, Young L.Y. and McCarty, P.L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485-492.
|
|
(6)
|
Healy, J.B.Jr. and Young, L.Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84-89.
|
|
(7)
|
Gledhill, W.E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Philadelphia.
|
|
(8)
|
Battersby, N.S. and Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441-2460.
|
|
(9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
|
|
(10)
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
(11)
|
Organisation internationale de normalisation (1995) ISO 11 734 Qualité de l'eau — Évaluation de la biodégradabilité anaérobie “ultime” des composés organiques dans les boues de digesteurs — Méthode par mesurage de la production de biogaz.
|
|
(12)
|
Organisation internationale de normalisation (2003) ISO 13 641-1 Qualité de l'eau — Détermination de l'inhibition de la production de gaz des bactéries anaérobies — Partie 1 Essai général.
|
|
(13)
|
Organisation internationale de normalisation (1995) ISO 10 634 Qualité de l'eau — Lignes directrices pour la préparation et le traitement des composés organiques peu solubles dans l'eau en vue de l'évaluation de leur biodégradabilité en milieu aqueux.
|
|
(14)
|
Pagga, U. and Beimborn, D.B., (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499-1509.
|
|
(15)
|
Organisation internationale de normalisation (1997) ISO 11 923 Qualité de l'eau — Dosage des matières en suspension par filtration sur filtre en fibres de verre.
|
Appendice 1
Exemple d'appareil permettant de mesurer la production de biogaz d'après la pression gazeuse

Légende:
|
1
|
—
|
Manomètre
|
|
2
|
—
|
Robinet à trois voies étanche aux gaz
|
|
3
|
—
|
Aiguille de seringue
|
|
4
|
—
|
Bouchon étanche aux gaz (septum serré sur le col du flacon par une surcapsule)
|
|
5
|
—
|
Espace libre (Vh
)
|
|
6
|
—
|
Inoculum de boue digérée (Vl
)
|
Récipients d'essai maintenus à 35 °C ± 2 °C
Appendice 2
Conversion des mesures manométriques
Les pressions relevées peuvent être rapportées à des volumes gazeux à l'aide d'une courbe de référence obtenue en injectant des volumes d'air connus à 35 °C ± 2 °C dans des flacons à sérum contenant un volume d'eau égal à celui du mélange réactionnel, VR
:
|
—
|
Verser des aliquotes de VR
ml d'eau, maintenues à 35 °C ± 2 °C dans cinq flacons à sérum. Fermer les flacons hermétiquement et les plonger dans un bain d'eau à 35 °C durant 1 heure pour les laisser s'équilibrer.
|
|
—
|
Enclencher le manomètre, attendre qu'il se stabilise et le mettre à zéro.
|
|
—
|
Insérer l'aiguille de la seringue à travers le bouchon de l'un des flacons, ouvrir le robinet jusqu'à ce que le manomètre indique zéro et fermer le robinet.
|
|
—
|
Répéter ce processus avec les autres flacons.
|
|
—
|
Injecter 1 ml d'air à 35 °C ± 2 °C dans chaque flacon. Insérer l'aiguille (montée sur le manomètre) à travers le bouchon de l'un des flacons et attendre que la valeur affichée sur le manomètre se stabilise. Noter la pression, ouvrir le robinet jusqu'à ce que la pression retombe à zéro puis fermer le robinet.
|
|
—
|
Répéter ce processus avec les autres flacons.
|
|
—
|
Répéter la totalité du processus en appliquant des volumes d'air de 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml et 50 ml.
|
|
—
|
Tracer une courbe de conversion de la pression (Pa) en fonction du volume de gaz injecté Vb (ml). La réponse de l'instrument est linéaire sur la gamme comprise entre 0 Pa et 70 000 Pa et entre 0 ml et 50 ml de gaz produit.
|
Appendice 3
Exemple d'une courbe de dégradation (accroissement net cumulé de la pression en fonction de la durée exprimée en jours)

Appendice 4
Exemple de tableau de résultats pour l'essai de biodégradation anaérobie — Tableau pour la substance d'essai
|
Laboratoire: …
|
Substance d'essai: …
|
Essai no: …
|
|
Température de l'essai (°C): …
|
Volume de l'espace libre (V
h): …(l)
|
Volume du liquide (V
l): …(litres)
|
|
Carbone dans la substance d'essai Cc,v
: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Jour
|
p
1 (essai)
(mbar)
|
p
2 (essai)
(mbar)
|
p
3 (essai)
(mbar)
|
p (essai)
moyenne
(mbar)
|
p
4 (blanc)
(mbar)
|
p
5 (blanc)
(mbar)
|
p
6 (blanc)
(mbar)
|
p (blanc)
moyenne
(mbar)
|
p (nette)
essai — blanc
moyenne (mbar)
|
Δp (nette)
cumulée
(mbar)
|
m
h
espace libre C
(43)
(mg)
|
D
h
Biodégradation (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
essai
(mg)
|
C
IC, 2
essai
(mg)
|
C
IC, 3
essai
(mg)
|
C
IC
essai moyenne
(mg)
|
C
IC, 4
blanc
(mg)
|
C
IC, 5
blanc
(mg)
|
C
IC, 6
blanc
(mg)
|
C
IC
blanc moyenne
(mg)
|
C
IC, net
essai — blanc
moyenne
(mg)
|
m
l
liquide C (45)
(mg)
|
m
t
total C (46)
(mg)
|
D
t
Biodégradation (47)
(%)
|
|
CI (fin)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (fin)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laboratoire: …
|
Substance de référence: …
|
Essai no: …
|
|
Température de l'essai (°C): …
|
Volume de l'espace libre (V
h): …(l)
|
Volume du liquide (V
l): …(litres):
|
|
Carbone dans la substance de référence C
c,v (mg/l): …
|
mv
(48) (mg): …
|
|
|
Jour
|
p
1 (réf.)
(mbar)
|
p
2 (réf.)
(mbar)
|
p
3 (réf.)
(mbar)
|
p (réf.)
moyenne
(mbar)
|
p
4 (inhib.)
(mbar)
|
p
5 (inhib.)
(mbar)
|
p
6 (inhib.)
(mbar)
|
p (inhib.)
moyenne
(mbar)
|
p (réf.)
réf. — blanc
(mbar)
|
Δ
p(réf.)
cumulée
(mbar)
|
m
h
espace libre C
(49)
(mg)
|
D
h
Biodégradation (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
réf.
(mg)
|
C
IC, 2
réf.
(mg)
|
C
IC, 3
réf.
(mg)
|
C
IC
réf. moyenne
(mg)
|
C
IC, 4
inhib.
(mg)
|
C
IC, 5
inhib.
(mg)
|
C
IC, 6
inhib.
(mg)
|
C
IC
inhib. moyenne
(mg)
|
C
IC, net
réf. — inhib.
(mg)
|
m
l
liquide C (51)
(mg)
|
m
t
total C (52)
(mg)
|
D
t
Biodégradation (53)
(%)
|
|
CI (fin)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (fin)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. LIXIVIATION SUR DES COLONNES DE SOL
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 312(2004) de l'OCDE pour les essais de produits chimiques. Les produits chimiques de synthèse peuvent atteindre le sol directement, à la suite d'une application intentionnelle (produits agrochimiques, par exemple) ou indirectement (par exemple: véhiculés par les eaux usées → boues d'épuration → sol ou air → dépôts secs/humides). Pour évaluer les risques associés à ces substances, il est important d'estimer leur potentiel de transformation dans le sol et de migration (lixiviation) vers les couches plus profondes du sol jusqu'aux eaux souterraines.
|
|
2.
|
Il existe plusieurs méthodes pour mesurer le potentiel de lixiviation des produits chimiques dans le sol dans des conditions contrôlées en laboratoire: la chromatographie en couche mince de sol, la chromatographie en couche épaisse de sol, la chromatographie sur colonne de sol et les mesures d'adsorption-désorption (1)(2). S'agissant des substances chimiques non ionisées, le coefficient de partage n-octanol/eau (Poe) fournit une première évaluation de leurs potentiels d'adsorption et de lixiviation (3)(4)(5).
|
|
3.
|
La méthode décrite dans la présente méthode d'essai fait appel à la chromatographie sur colonne de sol avec un sol dérangé (voir la définition à l'Appendice 1). Deux types d'expériences sont conduits pour déterminer i) le potentiel de lixiviation de la substance chimique d'essai et ii) le potentiel de lixiviation des produits de transformation (étude avec des résidus de sol incubé, aussi appelés résidus “âgés”), sur sols, dans des conditions contrôlées en laboratoire (54). La méthode d'essai s'appuie sur des méthodes existantes (6)(7)(8)(9)(10)(11).
|
|
4.
|
Un atelier de l'OCDE sur la sélection des sols et des sédiments, tenu à Belgirate (Italie) en 1995 (12) a défini le nombre et les types de sols à utiliser dans cet essai. Il a également émis des recommandations concernant le prélèvement, la manipulation et le stockage des échantillons de sol destinés aux essais de lixiviation.
|
PRINCIPE DE LA MÉTHODE D'ESSAI
|
5.
|
Des colonnes composées d'un matériau suffisamment inerte (par exemple: verre, acier inoxydable, aluminium, Téflon, PVC, etc.) sont remplies de sol, puis saturées et équilibrées avec une solution de “pluie artificielle” (voir la définition à l'Appendice 1), et on les laisse s'égoutter. Ensuite, la surface de chaque colonne de sol est traitée avec la substance d'essai et/ou des résidus “âgés” de la substance chimique d'essai. Après quoi, on arrose les colonnes de sol avec la pluie artificielle et on recueille le lixiviat. Après la lixiviation, le sol est extrait des colonnes et sectionné en un nombre de segments déterminé en fonction des informations à tirer de l'étude. La substance d'essai présente dans chaque segment de sol et dans le lixiviat est analysée, de même que les produits de transformation ou d'autres substances intéressantes, le cas échéant.
|
APPLICABILITÉ DE LA MÉTHODE D'ESSAI
|
6.
|
La méthode s'applique aux substances chimiques d'essai (non marquées ou radiomarquées, par exemple au 14C), pour lesquelles il existe une méthode d'analyse suffisamment précise et sensible. L'essai ne convient pas aux substances volatiles dans le sol et l'eau, qui ne resteraient donc pas dans le sol et/ou le lixiviat dans les conditions expérimentales de cet essai.
|
INFORMATIONS SUR LA SUBSTANCE CHIMIQUE D'ESSAI
|
7.
|
Des substances chimiques non marquées ou radiomarquées peuvent être utilisées pour mesurer le comportement de lixiviation dans des colonnes de sol. L'étude de la lixiviation des produits de transformation (résidus “âgés” de la substance chimique d'essai) et les déterminations du bilan massique exigent des substances radiomarquées. Le marquage au 14C est recommandé, mais d'autres isotopes, tels que 13C, 15N, 3H, 32P, peuvent également être utiles. Dans toute la mesure du possible, le marqueur devra être porté par le ou les fragments les plus stables de la molécule. La pureté de la substance chimique d'essai atteindra au moins 95 %.
|
|
8.
|
La plupart des substances chimiques sont à appliquer sous forme isolée. Cependant, les substances actives des produits phytosanitaires peuvent être testées sous forme de préparation pour l'étude de la lixiviation de la substance parente, mais leur mise à l'essai sous forme isolée est fortement conseillée si le mélange risque d'affecter la vitesse de libération dans l'environnement (par exemple, préparations granulaires ou à libération régulée). Pour ce qui est d'adapter la conception de l'essai aux mélanges, il peut être utile de consulter les autorités réglementaires avant de conduire l'essai. Les études de lixiviation sur des résidus de sol incubé doivent être menées avec le composé parent à l'état pur.
|
|
9.
|
Il est préférable de connaître les informations suivantes avant de procéder aux essais de lixiviation sur des colonnes de sol:
|
(1)
|
solubilité dans l'eau [méthode d'essai A.6] (13);
|
|
(2)
|
solubilité dans les solvants organiques;
|
|
(3)
|
pression de vapeur [méthode d'essai A.4] (13) et constante de Henry;
|
|
(4)
|
coefficient de partage n-octanol/eau [méthodes d'essai A.8 et A.24] (13);
|
|
(5)
|
coefficient d'adsorption (Kd, Kf ou Kco) [méthodes d'essai C.18 et/ou C.19] (13);
|
|
(6)
|
hydrolyse[méthode d'essai C.7] (13);
|
|
(7)
|
constante de dissociation (pKa) [Ligne directrice 112 de l'OCDE] (25);
|
|
(8)
|
transformation aérobie et anaérobie dans le sol [méthode d'essai C.23] (13);
|
Remarque: la température à laquelle ces mesures ont été effectuées doit être mentionnée dans les rapports d'essai respectifs.
|
|
10.
|
Il convient d'appliquer suffisamment de substance chimique d'essai sur les colonnes de sol pour pouvoir détecter au moins 0,5 % de la dose appliquée dans n'importe quel segment. S'agissant des substances chimiques actives des produits phytosanitaires, la quantité de substance d'essai appliquée doit correspondre à la dose maximale recommandée (application unique).
|
|
11.
|
Il faut disposer d'une méthode analytique dont l'exactitude, la précision et la sensibilité sont connues pour quantifier la substance chimique d'essai et, le cas échéant, ses produits de transformation dans le sol et le lixiviat. Il faut également connaître le seuil de détection de la méthode d'analyse pour la substance d'essai et ses produits de transformation importants (normalement au moins tous les produits de transformation dont la concentration est ≥ 10 % de la dose appliquée, observés dans les études du chemin réactionnel, mais de préférence tous les produits de transformation présentant un intérêt) (voir paragraphe 17).
|
SUBSTANCES CHIMIQUES DE RÉFÉRENCE
|
12.
|
Il y a lieu d'employer des substances chimiques de référence dont le comportement de lixiviation est connu, tels que l'atrazine ou le monuron, qui peuvent être considérées comme des substances modérément sujettes à la lixiviation sur le terrain, pour évaluer la mobilité relative de la substance chimique d'essai dans le sol (1)(8)(11). Il pourrait également être utile d'utiliser une substance de référence polaire, non dégradable et non sorbante (tritium, bromure, fluorescéine, éosine, par exemple), pour suivre le mouvement de l'eau dans la colonne, afin de confirmer les propriétés hydrodynamiques de la colonne de sol.
|
|
13.
|
Des substances analytiques étalon pourraient aussi être utiles pour caractériser et/ou identifier les produits de transformation mis en évidence dans les segments de sol et dans les lixiviats, par chromatographie, spectroscopie ou par d'autres méthodes adéquates.
|
DÉFINITIONS ET UNITÉS
CRITÈRES DE QUALITÉ
Récupération
|
15.
|
La récupération à l'issue d'un essai de lixiviation équivaut à la somme des pourcentages de la substance chimique d'essai relevés après lixiviation dans les segments de sol et dans le lixiviat de la colonne. Le taux de récupération devrait varier entre 90 % et 110 % pour les substances chimiques radiomarquées (11) et entre 70 % et 110 % pour les substances chimiques non marquées (8).
|
Répétabilité et sensibilité de la méthode analytique
|
16.
|
La répétabilité de la méthode d'analyse pour ce qui est de quantifier la substance chimique d'essai et les produits de transformation peut être vérifiée par une double analyse du même extrait d'un segment de sol ou du lixiviat (voir paragraphe 11).
|
|
17.
|
Le seuil de détection de la méthode d'analyse pour la substance chimique d'essai et les produits de transformation devrait atteindre au moins 0,01 mg · kg– 1 dans chaque segment de sol ou dans le lixiviat (en substance chimique d'essai) ou 0,5 % de la dose appliquée dans n'importe quel segment, selon celui des deux seuils qui est le plus bas. Le seuil de quantification doit aussi être spécifié.
|
DESCRIPTION DE LA MÉTHODE EXPÉRIMENTALE
Système expérimental
|
18.
|
Pour l'essai, les colonnes de lixiviation (sectionnables ou non) se composent d'un matériau suffisamment inerte (verre, acier inoxydable, aluminium, Téflon, PVC, etc.,), présentent un diamètre interne d'au moins 4 cm et mesurent au moins 35 cm de haut. On s'assurera que la substance chimique d'essai et/ou ses produits de transformation n'interagissent pas avec les matériaux de la colonne. L'Appendice 2 donne des exemples de colonnes sectionnables et non sectionnables appropriées.
|
|
19.
|
Le remplissage et le tassement du sol dans les colonnes requièrent une cuillère, un piston et un appareil à vibrations.
|
|
20.
|
L'arrosage des colonnes de sol par la pluie artificielle peut s'effectuer à l'aide d'un piston, d'une pompe péristaltique, de pommes de douche, de flacons de Mariotte ou d'un simple entonnoir stilligoutte.
|
Matériel de laboratoire et produits
|
21.
|
Cet essai nécessite du matériel courant de laboratoire, et en particulier:
|
(1)
|
instruments d'analyse, tels que ceux permettant d'effectuer une chromatographie gaz-liquide, une chromatographie en phase liquide à haute performance (HPLC) ou une chromatographie en couche mince, couplés à des systèmes de détection appropriés pour analyser les substances chimiques marquées ou non, ou une méthode de dilution isotopique inverse;
|
|
(2)
|
instruments d'identification (par exemple par spectrométrie de masse, spectrométrie de masse couplée à la chromatographie en phase gazeuse, spectrométrie de masse couplée à la chromatographie en phase liquide à haute performance, résonance magnétique nucléaire, etc.);
|
|
(3)
|
compteur à scintillation liquide pour la substance chimique d'essai radiomarquée;
|
|
(4)
|
dispositif d'oxydation pour la combustion des substances chimiques marquées;
|
|
(5)
|
appareil d'extraction (par exemple: tubes à centrifuger pour l'extraction à froid et appareil à reflux de Soxhlet pour l'extraction continue);
|
|
(6)
|
appareils pour concentrer les solutions et les extraits (par exemple, évaporateur rotatif).
|
|
|
22.
|
Les substances chimiques utilisées incluent des solvants organiques de qualité pour analyse, tels que l'acétone, le méthanol, etc.; compteur à scintillation liquide; une solution 0,01 M de CaCl2 dans de l'eau distillée ou désionisée (= pluie artificielle).
|
Substance chimique d'essai
|
23.
|
Pour appliquer la substance chimique d'essai sur la colonne de sol, il faut la dissoudre dans de l'eau (désionisée ou distillée). Si la substance d'essai est peu soluble dans l'eau, elle peut être appliquée sous forme de préparation (si nécessaire, après suspension ou émulsion dans l'eau) ou dans un solvant organique quelconque. Le cas échéant, le volume du solvant organique sera réduit au minimum et devra être évaporé de la surface de la colonne de sol avant le début de la lixiviation. Les préparations solides, telles que les granulés, sont à appliquer à l'état solide sans eau; pour que la substance se répartisse mieux à la surface de la colonne de sol, la préparation peut être mélangée à une petite quantité de sable quartzique (1 g, par exemple), avant d'être appliquée.
|
|
24.
|
Il convient d'appliquer suffisamment de substance chimique d'essai sur les colonnes de sol pour pouvoir détecter au moins 0,5 % de la dose appliquée dans n'importe quel segment. Dans le cas des substances actives des produits phytosanitaires, la quantité de substance d'essai peut correspondre à la dose maximale recommandée (application unique) et, qu'il s'agisse du composé parent ou des résidus “âgés”, elle doit être proportionnelle à la superficie de la colonne de sol utilisée (55).
|
Substance chimique de référence
|
25.
|
Les essais de lixiviation devraient comporter une substance chimique de référence (voir paragraphe 12). Elle devrait être appliquée sur la colonne de sol de la même manière que la substance d'essai et à une dose permettant de la détecter correctement, soit comme étalon interne appliqué avec la substance d'essai dans la même colonne, soit isolément dans une colonne de sol séparée. Il est préférable d'appliquer les deux substances chimiques sur la même colonne, sauf si les deux substances sont marquées de la même façon.
|
Sols
Sélection des sols
|
26.
|
Pour les études de lixiviation conduites sur le composé parent, il convient d'utiliser 3 à 4 sols différant par le pH, la teneur en carbone organique et la texture (12). Le tableau 1 ci-dessous fournit des orientations quant à la sélection des sols destinés aux essais de lixiviation. Si la substance chimique d'essai est ionisable, on sélectionne des sols couvrant une vaste gamme de pH, de façon à pouvoir évaluer la mobilité de la substance sous ses formes ionisée et non ionisée; au moins 3 sols doivent avoir un pH auquel la substance d'essai se trouve à l'état mobile.
Tableau 1
Orientations pour la sélection des sols destinés aux études de lixiviation
|
Sol no
|
pH
|
Carbone organique
%
|
Teneur en argile
%
|
Texture (56)
|
|
1
|
> 7,5
|
3,5 - 5,0
|
20 - 40
|
Terre franche argileuse
|
|
2
|
5,5 - 7,0
|
1,5 - 3,0
|
15 - 25
|
Terre franche limoneuse
|
|
3
|
4,0 - 5,5
|
3,0 - 4,0
|
15 - 30
|
Terre franche
|
|
4
|
< 4,0 - 6,0 (57)
|
< 0,5 - 1,5 (57)
(58)
|
< 10 - 15 (57)
|
Sable gras
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
Sable gras/sable
|
|
|
27.
|
Il peut parfois s'avérer nécessaire d'utiliser d'autres types de sol pour représenter les régions plus froides, tempérées et tropicales. Aussi, si l'on opte pour d'autres types de sols, ceux-ci devront être caractérisés par les mêmes paramètres et la même variation de propriétés que les sols décrits dans les orientations pour la sélection des sols destinés aux études de lixiviation (voir Tableau 1 ci-dessus), même s'ils ne satisfont pas exactement aux critères.
|
|
28.
|
Les études de lixiviation sur des résidus de sol incubé sont menées sur un seul sol (12). Ce dernier doit avoir une proportion de sable >70 % et une teneur en carbone organique comprise entre 0,5 % et 1,5 % (par exemple le sol no 4 du Tableau 1). L'utilisation de davantage de types de sols peut être nécessaire si les données sur les produits de transformation sont importantes.
|
|
29.
|
Tous les sols doivent être caractérisés, au moins quant à la texture [% de sable, % de limon, % d'argile, selon les systèmes de classification de la FAO et du Département de l'agriculture des États-Unis ],au pH, à la capacité d'échange cationique, à la teneur en carbone organique, à la densité en vrac (pour les sols dérangés) et à la capacité de rétention d'eau. La mesure de la biomasse microbienne n'est requise que pour le sol utilisé durant la période d'incubation/vieillissement précédant l'essai sur des résidus de sol incubé. Des informations supplémentaires sur les propriétés du sol (classification du sol, minéralogie de l'argile, superficie spécifique, par exemple) peuvent être utiles à l'interprétation des résultats de cette étude. S'agissant de déterminer les caractéristiques du sol, les méthodes recommandées dans les références peuvent être appliquées.
|
Collecte et stockage des sols
|
30.
|
Les sols doivent être prélevés dans la couche superficielle (horizon A) jusqu'à une profondeur maximale de 20 cm et nettoyés de tous leurs résidus de végétation, de macrofaune et de pierres. Les sols (à l'exception des sols utilisés pour incuber la substance chimique d'essai) sont séchés à l'air, à température ambiante (de préférence entre 20 °C et 25 °C). La désagrégation s'effectue avec une force minime, de façon à dénaturer le moins possible la texture originale du sol. Les sols sont passés au travers d'un tamis pourvu de mailles ≤ 2 mm. Il est recommandé de les homogénéiser soigneusement, afin d'accroître la reproductibilité des résultats. Avant leur utilisation, les sols peuvent être entreposés à température ambiante et conservés séchés (à l'air) (12). Aucune durée limite de stockage n'est recommandée, mais il faudrait vérifier à nouveau la teneur en carbone organique et le pH des sols entreposés depuis plus de trois ans, avant de les utiliser.
|
|
31.
|
L'historique des sites extérieurs où les sols d'essai ont été collectés devrait être connu en détail. Ces détails incluent la localisation exacte [définie exactement par la projection MTU (Mercator Transverse Universel/Données Horizontales Européennes) ou par ses coordonnées géographiques], le couvert végétal, les traitements par des produits phytosanitaires, les traitements avec des engrais minéraux et organiques, les ajouts de matières biologiques ou toute contamination accidentelle (12). Les sols traités avec la substance chimique d'essai ou ses analogues de structure au cours des quatre dernières années ne peuvent servir aux études de lixiviation.
|
Conditions expérimentales
|
32.
|
Durant l'essai, les colonnes de sol destinées à la lixiviation doivent être gardées à l'obscurité et à température ambiante, à condition qu'il soit possible de limiter la variation de cette température à ± 2 °C. Les températures recommandées se situent entre 18 °C et 25 °C.
|
|
33.
|
La pluie artificielle (CaCl2 0,01 M) est appliquée en continu à la surface des colonnes de sol, à raison de 200 mm par période de 48 heures (60); cette valeur s'obtient par l'application de 251 ml sur une colonne dont le diamètre intérieur mesure 4 cm. Si la finalité de l'essai l'exige, d'autres volumes de pluie artificielle déversés sur des périodes plus longues pourront être appliqués en plus.
|
Réalisation de l'essai
Lixiviation de la substance chimique d'essai parente
|
34.
|
Au moins deux colonnes de lixiviation sont remplies avec un sol non traité, séché à l'air et tamisé (< 2 mm), jusqu'à une hauteur d'environ 30 cm. Pour que le sol soit homogène dans les colonnes, il y est introduit par petites quantités à la cuillère, puis pressé par un piston tout en soumettant simultanément la colonne à de petites vibrations, jusqu'à ce que le sommet de la colonne du sol ne s'enfonce plus. La reproductibilité des résultats obtenus avec les colonnes de lixiviation est subordonnée à la répartition uniforme du sol dans les colonnes. Les références (20)(21) et (22) fournissent des détails sur les techniques de remplissage des colonnes. Afin de contrôler la reproductibilité du procédé de remplissage, on détermine le poids total du sol tassé dans les colonnes (61): les poids des colonnes destinées à une expérience identique doivent être similaires.
|
|
35.
|
Une fois remplies, les colonnes de sol sont préalablement mouillées avec la pluie artificielle (CaCl2 à 0,01 M), de bas en haut, de façon que l'eau chasse l'air retenu dans les pores du sol. Après quoi, on laisse les colonnes s'équilibrer et l'excès d'eau s'égoutter par gravité. La référence (23) présente diverses méthodes de saturation des colonnes.
|
|
36.
|
Ensuite, la substance chimique d'essai et/ou la substance chimique de référence sont appliquées sur les colonnes de sol (voir aussi les paragraphes 23-25). Pour obtenir une répartition homogène, les solutions, suspensions ou émulsions de la substance chimique d'essai et/ou de référence sont appliquées uniformément à la surface des colonnes de sol. Si le mode d'application recommandé pour la substance chimique d'essai est l'incorporation dans le sol, la substance doit être mélangée à un petit volume de sol (20 g, par exemple) et ajoutée à la surface de la colonne de sol.
|
|
37.
|
On couvre ensuite les surfaces des colonnes de sol avec un disque en verre fritté, des perles de verre, un filtre en fibre de verre ou un papier filtre rond, afin que la pluie artificielle se répartisse uniformément sur toute la surface et d'éviter que les gouttes de pluie ne dérangent la surface du sol. L'arrosage des colonnes de sol par la pluie artificielle sera effectué avec d'autant plus de soin que le diamètre de ces colonnes est grand, de manière à ce que la pluie artificielle se répartisse uniformément à la surface du sol. Après quoi, la pluie artificielle est déversée goutte à goutte sur les colonnes de sol, à l'aide d'un piston ou d'une pompe péristaltique ou d'un entonnoir stilligoutte. Il est préférable de recueillir les lixiviats par fractions et de noter leurs volumes respectifs (62).
|
|
38.
|
À la fin de la lixiviation, on laisse les colonnes de sol s'égoutter avant de les sectionner en un nombre approprié de segments, selon les renseignements à tirer de l'étude. La substance d'essai est extraite à l'aide d'un solvant approprié ou d'un mélange de solvants, puis analysée, de même que, le cas échéant, les produits de transformation, la radioactivité totale et la substance de référence. Les mêmes produits sont analysés directement,ou après extraction, dans les lixiviats ou les fractions de lixiviats. Si la substance chimique d'essai est radiomarquée, toutes les fractions renfermant au moins 10 % de la radioactivité appliquée doivent être identifiées.
|
Lixiviation des résidus de sol incubé
|
39.
|
Un sol frais (non séché préalablement à l'air) est traité avec la substance chimique d'essai radiomarquée à une dose proportionnelle à la superficie des colonnes de sol (voir paragraphe 24) et incubé en aérobiose conformément à la méthode d'essai C.23 (13). La période d'incubation (vieillissement) doit être suffisamment longue pour autoriser la formation d'une quantité appréciable de produits de transformation; on recommande une période d'incubation équivalente à la demi-vie de la substance chimique d'essai (63), mais cette période ne doit pas dépasser 120 jours. Avant la lixiviation, la substance chimique d'essai et ses produits de transformation présents dans le sol incubé sont analysés.
|
|
40.
|
Les colonnes de lixiviation sont remplies jusqu'à une hauteur de 28 cm avec le même sol (mais séché à l'air) que celui utilisé pour l'incubation du sol, conformément aux instructions du paragraphe 34 et le poids total des colonnes de sol remplies est également déterminé. Les colonnes de sol sont ensuite mouillées préalablement, comme décrit au paragraphe 35.
|
|
41.
|
Puis, la substance chimique d'essai et ses produits de transformation sont appliqués à la surface des colonnes de sol sous la forme de résidus du sol incubé (voir paragraphe 39) en un segment de sol de 2 cm de haut. Il est préférable que la hauteur totale des colonnes de sol (sol non traité + sol incubé) n'excède pas 30 cm (voir paragraphe 34).
|
|
42.
|
La lixiviation est conduite selon les instructions données au paragraphe 37.
|
|
43.
|
Après la lixiviation, la substance chimique d'essai, ses produits de transformation et la radioactivité non extraite sont analysés dans les segments de sol et les lixiviats, comme indiqué au paragraphe 38. Afin de déterminer la proportion de résidus de sol incubé restant dans la couche supérieure de 2 cm après lixiviation, on doit analyser ce segment séparément.
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
44.
|
Les quantités de substance chimique d'essai, de produits de transformation, de fractions non extractibles et, le cas échéant, de la substance chimique de référence, doivent être établies en pourcentage de la dose initiale appliquée, pour chaque segment de sol et fraction de lixiviat. Pour chaque colonne, on tracera une représentation graphique des pourcentages en fonction des profondeurs de sol.
|
|
45.
|
Lorsque ces études de lixiviation sur colonne incluent une substance chimique de référence, la lixiviation d'une substance chimique peut être évaluée sur une échelle relative, à l'aide des facteurs de mobilité relative (FMR; voir la définition à l'Appendice 3) (1)(11), ce qui permet de comparer les résultats de la lixiviation de différentes substances chimiques dans différents types de sols. L'Appendice 3 fournit des exemples de valeurs de FMR pour différents produits phytosanitaires.
|
|
46.
|
Les estimations du Kco (coefficient d'adsorption normalisé du carbone organique) et du Kmo (coefficient de répartition normalisé de la matière organique) peuvent aussi être déduites des résultats de la lixiviation sur colonne, d'après la distance moyenne de lixiviation ou les corrélations établies entre le FMR et Kmo ou Kco respectivement (4), ou par l'application d'une théorie chromatographique simple (24). Toutefois, la dernière méthode doit être utilisée avec prudence, surtout si l'on considère que le processus de lixiviation n'obéit pas entièrement à un régime d'écoulement saturé, mais plutôt à un régime non saturé.
|
Interprétation des résultats
|
47.
|
Les études de lixiviation sur colonne décrites dans la présente méthode permettent de déterminer le potentiel de lixiviation ou de mobilité de la substance chimique d'essai dans le sol (dans l'étude de lixiviation sur le composé parent) et/ou de ses produits de transformation (dans l'étude de lixiviation sur les résidus de sol incubé). Ces essais ne permettent pas de quantifier la lixiviation des substances chimiques d'essai sur le terrain, mais peuvent être utilisés pour comparer la lixiviabilité d'une substance chimique avec d'autres dont le comportement de lixiviation est connu (24). De la même manière, ces essais ne mesurent pas quantitativement le pourcentage de substance chimique appliquée susceptible d'atteindre les eaux souterraines (11). Néanmoins, les résultats des études de lixiviation sur colonne peuvent orienter la décision de conduire ou non des essais supplémentaires sur le terrain ou en partie sur le terrain pour les substances qui présentent un potentiel de mobilité élevé lors des essais en laboratoire.
|
Rapport d'essai
|
48.
|
Le rapport d'essai doit inclure les informations suivantes:
|
|
Substance chimique d'essai et substance chimique de référence (le cas échéant):
|
—
|
nom courant, nom chimique (nomenclature IUPAC et CAS), numéro CAS, structure chimique (indiquant la position du marqueur si une substance radiomarquée est utilisée) et propriétés physico-chimiques pertinentes;
|
|
—
|
pureté (impuretés) de la substance chimique d'essai;
|
|
—
|
pureté radiochimique de la substance chimique marquée et activité spécifique, le cas échéant.
|
|
|
|
Sols d'essai:
|
—
|
détails relatifs au site de prélèvement;
|
|
—
|
propriétés des sols, telles que le pH, la teneur en carbone organique et en argile, la texture et la densité en vrac (pour les sols dérangés);
|
|
—
|
activité microbienne du sol (seulement pour le sol utilisé pour incuber/vieillir la substance chimique d'essai);
|
|
—
|
durée et conditions du stockage du sol.
|
|
|
|
Conditions expérimentales:
|
—
|
dates de la réalisation des études;
|
|
—
|
longueur et diamètre des colonnes de lixiviation;
|
|
—
|
poids total du sol contenu dans les colonnes de sol;
|
|
—
|
quantité de substance chimique d'essai et, s'il y a lieu, de substance chimique de référence appliquée;
|
|
—
|
volume, fréquence et durée de l'application de la pluie artificielle;
|
|
—
|
température du dispositif expérimental;
|
|
—
|
nombre d'expériences identiques (au moins deux);
|
|
—
|
méthodes d'analyse de la substance chimique d'essai, des produits de transformation et, le cas échéant, de la substance chimique de référence dans les différents segments de sol et les lixiviats;
|
|
—
|
méthodes de caractérisation et d'identification des produits de transformation dans les segments de sol et les lixiviats.
|
|
|
|
Résultats de l'essai:
|
—
|
tableaux de résultats exprimés en concentrations et en % de la dose appliquée pour les segments de sol et les lixiviats;
|
|
—
|
bilan massique, s'il y a lieu;
|
|
—
|
distances de lixiviation et, s'il y a lieu, facteurs de mobilité relative;
|
|
—
|
tracé du % détecté dans les segments de sol en fonction de la profondeur des segments de sol;
|
|
—
|
analyse et interprétation des résultats.
|
|
|
BIBLIOGRAPHIE
|
(1)
|
Guth, J.A., Burkhard, N. and Eberle, D.O. (1976). Experimental models for studying the persistence of pesticides in soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
(2)
|
Russel, M.H. (1995). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals — T.R. Roberts and P.C. Kearney, Eds.). J. Wiley & Sons.
|
|
(3)
|
Briggs, G.G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem. 29, 1050-1059.
|
|
(4)
|
Chiou, C.T., Porter, P.E. and Schmedding, D.W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227-231.
|
|
(5)
|
Guth, J.A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26-33.
|
|
(6)
|
US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(7)
|
Agriculture Canada (1987). Guide d'homologation des pesticides au Canada: chimie et devenir dans l'environnement.
|
|
(8)
|
Annexe I de la directive 95/36/CE de la Commission, du 14 juillet 1995, modifiant la directive 91/414/CEE du Conseil concernant la mise sur le marché des produits phytopharmaceutiques, JO L 172 du 22.7.1995, p.8.
|
|
(9)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
(11)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
(12)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy 18-20 January 1995.
|
|
(13)
|
Chapitres suivants de la présente annexe:
|
|
Chapitre A.4, pression de vapeur
|
|
|
Chapitre A.6, solubilité dans l'eau
|
|
|
Chapitre A.8, coefficient de partage, méthode par agitation en flacon
|
|
|
Chapitre A.24, coefficient de partage, méthode HPLC
|
|
|
Chapitre C.7, dégradation — dégradation abiotique: hydrolyse en fonction du pH
|
|
|
Chapitre C.18, détermination de l'adsorption/désorption au moyen de la méthode par agitation
|
|
|
Chapitre C.23, transformation aérobie et anaérobie dans le sol
|
|
|
(14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
|
|
(15)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods (A. Klute, Ed.). Agronomy Series No. 9, 2nd Edition.
|
|
(16)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A.L. Page, R.H. Miller and D.R. Kelney, Eds.). Agronomy Series No. 9, 2nd Edition.
|
|
(17)
|
Compendium de normes ISO Environnement (1994). Qualité du sol — Aspects généraux; méthodes d'analyse chimiques et physiques; méthodes d'analyse biologiques. Première édition.
|
|
(18)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen un petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
(19)
|
Scheffer, F. and Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(20)
|
Weber, J.B. and Peeper, T.F. (1977). In Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, 73-78.
|
|
(21)
|
Weber, J.B., Swain, L.R., Strek, H.J. and Sartori, J.L. (1986). In Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, 190-200.
|
|
(22)
|
Oliveira et al. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. Proc. 26, 60 (1). 49-53.
|
|
(23)
|
Shackelford, C.D. (1991). Laboratory diffusion testing for waste disposal. — A review. J. Contam. Hydrol. 7, 177-217.
|
|
(24)
|
Hamaker, J.W. (1975). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V.H. Freed, Eds.), 115-133. Plenum Press, New York
|
|
(25)
|
OCDE (1981). Constantes de dissociation dans l'eau. Ligne directrice no 112 de l'OCDE pour les essais de produits chimiques, OCDE, Paris
|
Appendice 1
Définitions et unités
Résidus de sol incubé (ou résidus “âgés”)
: substance chimique d'essai et produits de transformation présents dans le sol au terme d'une période suffisamment longue après l'application pour permettre aux processus de transport, d'adsorption, métaboliques et dissipatifs de modifier la répartition et la nature chimique d'une partie de la substance chimique appliquée (1).
Pluie artificielle
: solution de CaCl2 à 0,01 M dans de l'eau distillée ou désionisée.
Distance moyenne de lixiviation
: fond d'une section de sol où les différentes fractions de substance chimique récupérées jusque-là totalisent 50 % de la substance chimique d'essai récupérée totale [essai de lixiviation normal], ou (fond d'une section de sol où les différentes fractions de substance chimique récupérées jusque-là totalisent 50 % de la substance chimique d'essai récupérée totale) — [(épaisseur de la couche de sol incubé)/2] [essai de lixiviation des résidus de sol incubé].
Substance chimique
: une substance ou un mélange.
Lixiviat
: phase aqueuse ayant percolé à travers un profil de sol ou une colonne de sol (1).
Lixiviation
: processus par lequel une substance chimique migre vers le bas à travers un profil de sol ou une colonne de sol (1).
Distance de lixiviation
: distance du segment de sol le plus profond dans lequel on retrouve au moins 0,5 % de la substance chimique d'essai appliquée ou du résidu de sol incubé, après la lixiviation (équivaut à la profondeur de pénétration).
Seuil de détection et seuil de quantification
: le seuil de détection est la concentration d'une substance chimique en dessous de laquelle il n'est plus possible de distinguer l'identité de la substance des artéfacts de la technique d'analyse. Le seuil de quantification est la concentration d'une substance en dessous de laquelle la concentration ne peut être déterminée avec une précision acceptable.
Facteur de mobilité relative (FMR)
: [distance de lixiviation de la substance d'essai (cm)]/[distance de lixiviation de la substance de référence (cm)].
Substance chimique d'essai
: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
Produit de transformation
: toutes les substances engendrées par des réactions de transformation biotiques ou abiotiques de la substance d'essai, y compris le CO2 et les produits liés aux résidus.
Sol
: mélange de composants chimiques minéraux et organiques, ces derniers contenant des composés fortement carbonacés et azotés et de poids moléculaire élevé, peuplés de petits organismes (surtout des microorganismes). Le sol peut être mis à l'essai sous deux états:
|
—
|
non dérangé, tel qu'il s'est constitué au fil du temps, avec des couches caractéristiques de divers types de sols;
|
|
—
|
dérangé, comme on le trouve généralement dans les champs cultivés ou du fait que des échantillons y ont été prélevés par creusement et utilisés dans la présente méthode d'essai.
|
|
(1)
|
Holland, P.T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Weeds 68, 1167-1193.
|
|
(2)
|
Ligne directrice de l'OCDE no 304A: Biodégradabilité intrinsèque dans le sol (adoptée le 12 mai 1981).
|
Appendice 2
Figure 1
Exemple de colonnes de lixiviation en verre non sectionnables, de 35 cm de longueur et d'un diamètre interne de 5 cm (1)
(1)

|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden — 70 Jahre Agrarforschung der BASF AG, 225-236. Verlag Wissenschaft und Politik, Köln.
|
Figure 2
|
Exemple de colonne sectionnable en métal de 4 cm de diamètre intérieur (1)
(1)

|
Burkhard, N., Eberle, D.O. and Guth, J.A. (1975). Model systems for studying the environmental behaviour of pesticides.
|
Environmental Quality and Safety, Suppl. Vol. III, 203-213.
|
Appendice 3
Exemples de facteurs de mobilité relative
(64)
(FMR) de différents produits phytosanitaires (1)(2) et classes de mobilité correspondantes
(66)
|
Gamme de FMR
|
Substance chimique (FMR)
|
Classe de mobilité
|
|
≤ 0,15
|
Parathion (< 0,15), Flurodifen (0,15)
|
I
immobile
|
|
0,15 - 0,8
|
Profenophos (0,18), Propiconazole (0,23), Diazinon (0,28), Diuron (0,38), Terbutylazine (0,52), Methidathion (0,56), Prometryn (0,59), Propazine (0,64), Alachlor (0,66), Metolachlor (0,68)
|
II
légèrement mobile
|
|
0,8 - 1,3
|
Monuron (65) (1,00), Atrazine (1,03), Simazine (1,04), Fluometuron (1,18)
|
III
modérément mobile
|
|
1,3 - 2,5
|
Prometon (1,67), Cyanazine (1,85), Bromacil (1,91), Karbutilate (1,98)
|
IV
assez mobile
|
|
2,5 - 5,0
|
Carbofuran (3,00), Dioxacarb (4,33)
|
V
mobile
|
|
> 5,0
|
Monocrotophos (> 5,0), Dicrotophos (> 5,0)
|
VI
très mobile
|
|
(1)
|
Guth, J.A. (1985). Adsorption/desorption In Joint International Symposium “Physicochemical Properties and their role in Environmental Hazard Assessment”. Canterbury, UK, 1-3 July 1985.
|
|
(2)
|
Guth, J.A. and Hörmann, W.D. (1987). Problematik und Relevanz von Pflanzenschutzmittel Spuren im Grund (Trink-) Wasser. Schr. Reihe Verein WaBoLu, 68, 91-106.
|
|
(3)
|
Harris, C.I. (1967). Movement of herbicides in soil. Weeds 15, 214-216.
|
|
(4)
|
Helling, C.S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, 743-748.
|
|
(5)
|
McCall, P.J., Laskowski, D.A., Swann, R.L. and Dishburger, H.J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
(6)
|
Hollis, J.M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, 165-174.
|
C.45. ESTIMATION DES ÉMISSIONS ISSUES DE BOIS TRAITÉ PAR UN PRODUIT DE PRÉSERVATION DANS L'ENVIRONNEMENT: MÉTHODE DE LABORATOIRE APPLICABLE AUX ARTICLES EN BOIS SANS REVÊTEMENT QUI SONT EN CONTACT AVEC DE L'EAU DOUCE OU DE L'EAU DE MER.
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 313 (2007) de l'OCDE pour les essais de produits chimiques. Les émissions dans l'environnement issues de bois traité par un produit de préservation doivent être quantifiées pour permettre une évaluation des risques pour l'environnement engendrés par le bois traité. La présente méthode d'essai décrit une méthode de laboratoire permettant d'estimer les émissions issues de bois traité par des produits de préservation dans deux cas possible d'émission dans l'environnement:
|
—
|
Les émissions issues de bois traité en contact avec de l'eau douce. Les émissions provenant de la surface du bois traité pourraient pénétrer dans l'eau.
|
|
—
|
Les émissions issues de bois traité en contact avec de l'eau de mer. Les émissions provenant de la surface du bois traité pourraient pénétrer dans l'eau de mer.
|
|
|
2.
|
La présente méthode d'essai a pour objet l'analyse des émissions issues du bois et des articles en bois sans revêtement qui sont en contact avec de l'eau douce ou de l'eau de mer. Les classes d'emploi, utilisées au niveau international, déterminent les catégories de dangers biologiques auxquels sont exposés les articles traités. Les classes d'emploi définissent également les cas dans lesquels l'article traité est utilisé et délimitent les compartiments environnementaux (air, eau, sol) exposés à un risque du fait du bois traité par un produit de préservation.
|
|
3.
|
La méthode d'essai est un protocole de laboratoire permettant d'obtenir des échantillons (milieu d'émission) dans l'eau utilisée pour immerger un bois traité, après des délais croissants d'exposition. La quantité d'émissions dans le milieu d'émission est corrélée à la surface spécifique du bois et à la durée de l'exposition, afin d'estimer un flux en mg/m2/jour. Le flux (taux de délavage) après des périodes d'exposition de plus en plus longues peut ainsi être estimé.
|
|
4.
|
La quantité d'émissions peut être utilisée dans une évaluation des risques environnementaux engendrés par le bois traité.
|
REMARQUES PRÉLIMINAIRES
|
5.
|
Il est vraisemblable que le mécanisme de délavage de la surface du bois par l'eau douce n'est pas de nature ni d'intensité identiques au délavage d'une surface de bois par de l'eau de mer. Par conséquent, il est nécessaire d'entreprendre une étude du délavage du bois par l'eau de mer applicable aux produits ou aux mélanges de préservation utilisés pour traiter le bois employé dans un environnement d'eau salée.
|
|
6.
|
Dans une étude de traitement par un produit de préservation du bois, le bois doit être représentatif des matériaux utilisés dans le commerce. Il doit être traité conformément aux instructions du fabricant du produit de préservation et dans l'observation des normes et spécifications appropriées. Les paramètres du conditionnement postérieur au traitement du bois et préalables à l'essai doivent être spécifiés.
|
|
7.
|
Les échantillons de bois employés doivent correspondre aux produits utilisés (par exemple en termes d'espèce, de densité et d'autres caractéristiques).
|
|
8.
|
L'essai peut être appliqué au bois par un procédé de pénétration ou par application superficielle ou à un bois traité soumis ensuite à un traitement de surface imposé complémentaire (par exemple une peinture dont l'application est exigée pour un usage commercial).
|
|
9.
|
La composition, la quantité, le pH et l'état physique de l'eau sont des facteurs qui conditionnent la détermination de la quantité, de la teneur et de la nature des émissions issues du bois.
|
PRINCIPE DE LA MÉTHODE D'ESSAI
|
10.
|
Les échantillons expérimentaux de bois traités par un produit de préservation sont immergés dans de l'eau. L'eau (milieu d'émission) est recueillie et soumise à une analyse chimique répétée à plusieurs reprises au cours de la période d'exposition, de façon à permettre l'analyse statistique. Les taux d'émission en mg/m2/jour sont calculés à partir des résultats analytiques. Les périodes de prélèvement des échantillons doivent être notées. Il est possible d'interrompre les essais sur échantillons non traités si aucune valeur de base n'a été détectée sur les trois premiers points de résultats.
|
|
11.
|
L'inclusion dans l'étude d'échantillons de bois non traités permet la détermination des niveaux de base des produits émis par le bois autres que le produit de préservation utilisé.
|
CRITÈRES DE QUALITÉ
Exactitude
|
12.
|
L'exactitude de la méthode d'estimation des émissions dépend de la représentativité des échantillons expérimentaux par rapport au bois traité du commerce, de la représentativité de l'eau par rapport à de l'eau réelle et de la représentativité du régime d'exposition par rapport aux conditions naturelles.
|
|
13.
|
L'exactitude, la précision et la répétabilité de la méthode analytique doivent être déterminées avant la mise en œuvre de l'essai.
|
Reproductibilité
|
14.
|
La valeur moyenne est calculée à partir de trois échantillons d'eau prélevés et analysés et elle est considérée comme valeur d'émission. La reproductibilité des résultats au sein d'un laboratoire et entre différents laboratoires dépend du dispositif d'immersion et du bois utilisé pour les échantillons expérimentaux.
|
Intervalle de résultats acceptable
|
15.
|
L'intervalle de résultats de cet essai est acceptable dès lors que les valeurs supérieures et inférieures diffèrent de moins d'un ordre de grandeur.
|
CONDITIONS EXPÉRIMENTALES
Eau
|
16.
|
Modes de délavage dans l'eau douce: il est recommandé d'utiliser de l'eau désionisée (par exemple, ASTM D 1193 Type II) dans l'essai de délavage lorsque l'on cherche à évaluer un bois exposé à de l'eau douce. La température de l'eau doit se situer à 20 °C +/– 2 °C et les mesures de pH et de température de l'eau doivent être intégrées dans le rapport d'essai. L'analyse d'échantillons de l'eau employée prélevés avant immersion des échantillons traités permet d'estimer les substances chimiques étudiées dans l'eau. Il s'agit d'un témoin permettant de déterminer les valeurs de base des substances qui seront ensuite chimiquement analysées.
|
|
17.
|
Mode de délavage dans de l'eau de mer: Il est recommandé d'utiliser une eau de mer synthétique (par exemple, ASTM D 1141 Eau océanique substitut, sans métaux lourds) dans l'essai de délavage lorsqu'on cherche à évaluer un bois exposé à de l'eau de mer. La température de l'eau doit se situer à 20 °C +/– 2 °C et les mesures de pH et de température de l'eau doivent être intégrées dans le rapport d'essai. L'analyse d'échantillons de l'eau employée prélevés avant immersion des échantillons traités permet d'estimer les substances chimiques étudiées dans l'eau. Il s'agit là d'un témoin permettant de déterminer les valeurs de base des substances chimiques importantes.
|
Échantillons expérimentaux de bois
|
18.
|
Pour la pleine efficacité de l'essai des produits de préservation du bois, l'espèce de bois doit être représentative des espèces habituellement utilisées. Les espèces recommandées sont Pinus sylvestris L. (pin sylvestre), Pinus resinosa Ait. (pin rouge d'Amérique), ou Pinus spp (pin du sud). Des tests complémentaires peuvent être effectués sur d'autres espèces.
|
|
19.
|
Il convient d'utiliser un bois à fil droit sans nœud et d'éviter les matériaux d'apparence résineuse. Le bois doit être représentatif d'un bois disponible dans le commerce. Le bois doit être représentatif d'un bois disponible dans le commerce. La source, la densité et le nombre des cernes annuels pour 10 mm doivent être notés.
|
|
20.
|
Il est recommandé d'utiliser les échantillons expérimentaux de bois par groupes de cinq conformément aux blocs de taille de la norme EN 113 (dimensions 25 mm × 50 mm × 15 mm) avec des faces longitudinales parallèles au fil du bois, mais on peut cependant utiliser d'autres dimensions, par exemple 50 mm sur 150 mm sur 10 mm. L'échantillon doit être complètement immergé dans l'eau. Les échantillons doivent être constitués à 100 % d'aubier. Chaque échantillon est individuellement marqué de façon à pouvoir être identifié sur toute la durée de l'essai.
|
|
21.
|
Tous les échantillons doivent être rabotés ou sciés, sans ponçage des surfaces.
|
|
22.
|
Les groupes d'échantillons expérimentaux de bois utilisés pour l'analyse sont au nombre d'au moins cinq: trois groupes de spécimens sont traités par le produit de préservation, un groupe n'est pas traité et un groupe est réservé à l'estimation de la teneur en humidité après séchage à l'étuve des échantillons expérimentaux avant le traitement. Le nombre d'échantillons préparés doit permettre la sélection d'au moins trois groupes d'échantillons dont la rétention du produit de préservation a une valeur égale à la moyenne, à 5 % près, de l'ensemble des échantillons expérimentaux.
|
|
23.
|
Tous les échantillons expérimentaux sont colmatés à l'extrémité par une substance chimique qui empêche la pénétration du produit de préservation dans le fil d'extrémité ou empêche le délavage des échantillons par l'intermédiaire du fil d'extrémité. Lors de l'application de l'agent colmatant l'extrémité, il faut distinguer les échantillons recevant une application superficielle de ceux soumis à des procédés de pénétration. Cet agent ne doit être appliqué avant le traitement que dans le cas d'une application superficielle.
|
|
24.
|
Le fil d'extrémité doit rester ouvert lors des traitements par des procédés de pénétration. Par conséquent les échantillons seront colmatés à l'extrémité après la période de conditionnement. L'émission n'est estimée que pour la surface spécifique longitudinale. Il convient d'examiner les agents colmatants et de procéder à une nouvelle application, s'il y a lieu, avant le début du délavage, mais jamais après.
|
Récipient d'immersion
|
25.
|
Le récipient est constitué d'un matériau inerte et ses dimensions permettent de contenir 5 échantillons de bois conformes à EN 113 dans 500 ml d'eau, le rapport surface spécifique au volume d'eau étant égal à 0,4 cm2/ml.
|
Assemblage des échantillons dans l'essai
|
26.
|
L'assemblage qui soutient les échantillons expérimentaux permet le contact de toutes les surfaces exposées de l'échantillon avec l'eau.
|
PROTOCOLE DU TRAITEMENT DE PRÉSERVATION
Préparation des échantillons expérimentaux traités
|
27.
|
La méthode de traitement de l'échantillon expérimental de bois par le produit de préservation conformément à l'essai est celle spécifiée pour ce produit, c'est-à-dire un procédé de traitement de pénétration ou un procédé d'application superficielle, par exemple un trempage, une pulvérisation ou un badigeonnage.
|
Produits de préservation appliqués par un procédé de traitement par pénétration
|
28.
|
On prépare une solution du produit de préservation qui permet l'absorption ou la rétention spécifiée lorsqu'on l'applique à l'aide du procédé du traitement par pénétration. L'échantillon expérimental de bois est pesé et ses dimensions sont mesurées. Le procédé de traitement de pénétration doit être un procédé spécifié pour l'application du produit de préservation au bois dans l'objectif d'une utilisation dans la classe d'emploi 4 ou 5. L'échantillon est à nouveau pesé après traitement et la rétention du produit de préservation (kg/m3) est calculée par l'équation:

|
|
29.
|
Il convient de noter qu'il est possible d'utiliser dans cet essai un bois d'œuvre traité dans une usine de traitement industriel (par exemple, par imprégnation sous vide). Les protocoles employés doivent être consignés et la rétention du matériau ainsi traité doit être analysée et enregistrée.
|
Produit de préservation appliqué par des procédés d'application superficielle
|
30.
|
Les procédés d'application superficielle comprennent le trempage, la pulvérisation ou le badigeonnage des échantillons expérimentaux de bois. Le procédé et le taux d'application (par exemple litres/m2) sont ceux spécifiés pour l'application superficielle du produit de préservation.
|
|
31.
|
Il convient de noter que dans ce cas également du bois d'œuvre traité dans une usine de traitement industriel peut être utilisé dans l'essai. Les protocoles employés doivent être consignés et la rétention du matériau ainsi traité doit être analysée et enregistrée.
|
Conditionnement des échantillons expérimentaux après traitement
|
32.
|
Après traitement, il faut conditionner les échantillons expérimentaux traités conformément aux recommandations dispensées par le fournisseur du produit de préservation de l'essai, et en respectant les conditions portées sur l'étiquette du produit ou en respectant les pratiques de traitement habituelles dans l'industrie ou selon la norme EN 252.
|
Préparation et sélection des échantillons expérimentaux
|
33.
|
Après le conditionnement qui suit le traitement, la rétention moyenne du groupe d'échantillons expérimentaux est calculée et trois groupes d'échantillons représentatifs dont la rétention est égale à la moyenne à 5 % près du groupe sont sélectionnés au hasard pour procéder à des mesures de délavage.
|
PROTOCOLE DES MESURES D'ÉMISSION DU PRODUIT DE PRÉSERVATION
Méthode par immersion
|
34.
|
Les échantillons expérimentaux sont pesés et ensuite totalement immergés dans l'eau tandis que la date et l'heure sont enregistrées. Le récipient est couvert afin de réduire l'évaporation.
|
|
35.
|
L'eau est remplacée aux intervalles suivants: 6 heures, 1 jour, 2 jours, 4 jours, 8 jours, 15 jours, 22 jours, 29 jours (note: il s'agit là de durées totales et non des intervalles entre les prélèvements). L'heure et la date du changement de l'eau et la masse d'eau recueillie dans le récipient sont consignées.
|
|
36.
|
Chaque fois que l'eau est remplacée, un échantillon de l'eau dans laquelle a été immergé le groupe des échantillons expérimentaux est conservé à des fins d'analyses chimiques.
|
|
37.
|
Le protocole d'échantillonnage permet le calcul d'une courbe de quantité d'émissions en fonction du temps. Il faut conserver les échantillons dans des conditions permettant de préserver l'analyte, par exemple dans un réfrigérateur à l'obscurité, afin de limiter la croissance microbienne dans l'échantillon avant son analyse.
|
MESURE DES ÉMISSIONS
Échantillons traités
|
38.
|
La substance active et/ou ses produits de dégradation ou de transformation appropriés, s'il y a lieu, sont chimiquement analysés dans l'eau collectée.
|
Échantillons non traités
|
39.
|
La collecte de l'eau (milieu d'émission) dans ce système et l'analyse consécutive des substances lessivées à partir d'échantillons de bois non traité permet d'estimer le taux d'émission éventuel du produit de préservation par le bois non traité. La vitesse de changement du taux d'émission en fonction du temps peut être estimée par la collecte et l'analyse du milieu d'émission après des délais croissants d'exposition. Cette analyse constitue un moyen de contrôle permettant de déterminer les niveaux de base de la substance chimique d'essai dans le bois non traité pour confirmer l'absence de traitement préalable du bois source d'échantillons par le produit de préservation.
|
RÉSULTAT ET RAPPORT
Analyses chimiques
|
40.
|
L'eau collectée est chimiquement analysée et les résultats de l'analyse sont exprimés en unités appropriées, par exemple, μg/l.
|
Rapport des résultats
|
41.
|
Tous les résultats sont enregistrés. L'appendice présente un exemple de formulaire de relevé conseillé pour un groupe d'échantillons expérimentaux traités, et le tableau de synthèse permettant le calcul des valeurs moyennes d'émissions à chaque intervalle de prélèvement.
|
|
42.
|
Le calcul du flux d'émissions quotidiennes en mg/m2/jour consiste à diviser la moyenne des trois mesures de trois expériences identiques par le nombre de jours d'immersion.
|
Rapport de l'essai
|
43.
|
Le rapport de l'essai doit contenir au moins les informations suivantes:
|
—
|
Le nom du fournisseur du produit de préservation soumis à l'essai;
|
|
—
|
Le nom ou le code spécifique et individuel du produit de préservation testé;
|
|
—
|
Le nom commercial ou courant du ou des ingrédients actifs, assorti d'une description générique des co-formulants (par exemple, co-solvant, résine) et la composition en % m/m des ingrédients;
|
|
—
|
La valeur pertinente de rétention ou de charge (en kg/m3 ou l/m2, respectivement) spécifiée pour le bois employé au contact de l'eau;
|
|
—
|
L'espèce de bois utilisée, caractérisée par sa densité et sa vitesse de croissance en cernes pour 10 mm;
|
|
—
|
La charge ou la rétention du produit de préservation testé et la formule utilisée pour calculer la rétention, exprimée en l/m2 ou kg/m3;
|
|
—
|
La méthode d'application du produit de préservation, précisant le mode de traitement utilisé pour un procédé par pénétration, et la méthode d'application dans le cas d'un traitement superficiel;
|
|
—
|
La date d'application du produit de préservation ainsi qu'une estimation de la teneur en humidité des échantillons expérimentaux, exprimée en pourcentage;
|
|
—
|
Les protocoles de conditionnement employés, détaillant le type, les conditions et la durée;
|
|
—
|
L'indication de l'agent de colmatage d'extrémité employé et le nombre d'applications;
|
|
—
|
La notification de tout traitement consécutif du bois, par exemple, indication du fournisseur, du type, des caractéristiques et de la charge d'une peinture;
|
|
—
|
L'heure et la date de chaque événement d'immersion, la quantité d'eau utilisée pour l'immersion des échantillons expérimentaux lors de chacun de ces événements, et la quantité d'eau absorbée par le bois pendant l'immersion;
|
|
—
|
Toutes les variations modifiant la méthode décrite et tous les facteurs susceptibles d'influencer les résultats.
|
|
BIBLIOGRAPHIE
|
(1)
|
Norme Européenne, EN 84 — 1997. Produits de préservation du bois Epreuve de vieillissement accéléré des bois traités avant essais biologiques. Epreuve de délavage.
|
|
(2)
|
Norme Européenne, EN 113/A1 — 2004. Produits de préservation du bois. Produits de préservation du bois — Méthode d'essai pour déterminer l'efficacité protectrice vis-à-vis des champignons basidiomycètes lignivores — Détermination du seuil d'efficacité.
|
|
(3)
|
Norme Européenne, EN 252 — 1989. Essai de champ pour déterminer l'efficacité protectrice relative d'un produit de préservation du bois en contact avec le sol.
|
|
(4)
|
Norme Européenne, EN 335 — Partie 1: 2006. Durabilité du bois et des matériaux dérivés du bois — Définition des classes d'emploi — Partie 1: Généralités.
|
|
(5)
|
American Society for Testing and Materials Standards, ASTM D 1141 — 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
(6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II — 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
Appendice 1
Formulaire de relevé pour la méthode d'essai
Estimation des émissions issues de bois traité par un produit de préservation dans l'environnement: méthode de laboratoire applicable aux articles en bois sans revêtement qui sont en contact avec de l'eau douce ou de l'eau de mer.
|
Site de l'essai
|
|
|
Produit de préservation du bois
|
|
Fournisseur du produit de préservation
|
|
|
Nom ou code spécifique et individuel du produit de préservation
|
|
|
Nom commercial ou courant du produit de préservation
|
|
|
Co-formulants
|
|
|
Rétention correspondant au bois utilisé au contact de l'eau
|
|
|
Application
|
|
Méthode d'application
|
|
|
Date d'application
|
|
|
Formule utilisée pour calculer la rétention:
|
|
|
Protocole de conditionnement
|
|
|
Durée du conditionnement
|
|
|
Agent colmatant l'extrémité / nombre d'applications
|
|
|
Traitement consécutif
|
s'il y a lieu
|
|
Échantillons expérimentaux
|
|
Espèce de bois
|
|
|
Densité du bois
|
(minimum … valeur moyenne … maximum)
|
|
Vitesse de croissance (cernes pour 10 mm)
|
(minimum … valeur moyenne … maximum)
|
|
Teneur en humidité
|
|
|
Assemblages de l'essai
(67)
|
Rétention (par exemple kg/m3)
|
|
Traité “x”
|
Valeur moyenne et écart type ou intervalle pour 5 échantillons
|
|
Traité “y”
|
Valeur moyenne et écart type ou intervalle pour 5 échantillons
|
|
Traité “z”
|
Valeur moyenne et écart type ou intervalle pour 5 échantillons
|
|
Non traité
|
|
|
Variation par rapport aux paramètres de la méthode d'essai
|
Par exemple, qualité de l'eau, dimensions des échantillons expérimentaux etc.
|
|
Durée
|
Echange d'eau
|
Masse de l'échantillon
|
Absorption d'eau
|
Echantillon d'eau
|
|
Traité (moyenne)
|
Non traité
|
Traité (moyenne)
|
Non traité
|
|
Eau de l'essai
|
x
|
y
|
z
|
|
|
Date
|
g
|
g
|
g
|
g
|
no
|
pH
|
pH
|
pH
|
pH
|
|
début
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 h
|
|
|
|
|
|
1
|
|
|
|
|
|
24 h
|
|
|
|
|
|
2
|
|
|
|
|
|
2 j
|
|
|
|
|
|
3
|
|
|
|
|
|
4 j
|
|
|
|
|
|
4
|
|
|
|
|
|
8 j
|
|
|
|
|
|
5
|
|
|
|
|
|
15 j
|
|
|
|
|
|
6
|
|
|
|
|
|
22 j
|
|
|
|
|
|
7
|
|
|
|
|
|
29 j
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
Préparer des tableaux séparés pour chaque ingrédient actif
|
Durée
|
Échange d'eau
|
Résultats analytiques
|
|
Échantillons non traités
|
Échantillons traités
|
|
Concentration d'i.a. dans l'eau
mg/l
|
Quantité émise
mg/m2
|
Taux d'émission
mg/m2/j
|
Concentration d'i.a. dans l'eau
|
Quantité émise
|
Taux d'émission
|
|
x
|
y
|
z
|
Moyenne
|
x
|
y
|
z
|
Moyenne
|
x
|
y
|
z
|
Moyenne
|
|
|
Date
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/j
|
mg/m2/j
|
mg/m2/j
|
mg/m2/j
|
|
6 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 j
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 j
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 j
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 j
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 j
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 j
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Note: Les résultats concernant le bois non traité peuvent être utilisés pour corriger les taux d'émission des échantillons traités, et ils doivent par conséquent apparaître en premier et toutes les valeurs des échantillons traités sont des “valeurs corrigées”. L'analyse initiale de l'eau peut également donner lieu à une correction.
Appendice 2
Définitions
Substance chimique
: une substance ou un mélange.
Substance chimique d'essai
: toute substance ou tout mélange soumis à un essai réalisé suivant la présente méthode d'essai.
C.46. BIOACCUMULATION CHEZ LES OLIGOCHÈTES BENTHIQUES FOUISSEURS
INTRODUCTION
|
1.
|
La présente méthode d'essai est équivalente à la ligne directrice 315 (2008) de l'OCDE pour les essais de produits chimiques. Les animaux endobenthiques ingérant des sédiments peuvent être exposés aux substances liées aux sédiments (1). Parmi ces espèces ingérant des sédiments, les oligochètes aquatiques jouent un rôle important à la base des systèmes aquatiques. Ils vivent dans les sédiments et représentent souvent les espèces les plus abondantes, en particulier dans des habitats dont les conditions environnementales sont hostiles aux autres animaux. Par la bioturbation de ces sédiments et en servant de proie, ces animaux peuvent avoir une forte influence sur la biodisponibilité de ces substances pour d'autres organismes comme les poissons benthivores. Par opposition aux organismes épibenthiques, les oligochètes aquatiques endobenthiques s'enfouissent dans les sédiments et ingèrent des particules de sédiment sous la surface des sédiments. De ce fait, ces organismes sont exposés aux substances chimiques qui peuvent pénétrer dans leur corps de diverses manières comme par contact direct, ingestion de particules sédimentaires contaminées, via l'eau interstitielle et l'eau surjacente. Certaines espèces d'oligochètes benthiques actuellement utilisées dans des essais écotoxicologiques sont décrites à l'Appendice 6.
|
|
2.
|
Les paramètres qui caractérisent la bioaccumulation d'une substance se composent essentiellement du facteur de bioaccumulation (FBA), de la constante de vitesse d'absorption sédimentaire (ks) et de la constante de vitesse d'élimination (ke). L'Appendice 1 donne des définitions détaillées de ces paramètres.
|
|
3.
|
Afin d'évaluer le potentiel de bioaccumulation de substances chimiques de manière générale et d'étudier la bioaccumulation de substances ayant tendance à se répartir dans ou sur les sédiments, une méthode d'essai comportant des compartiments spécifiques est nécessaire (1) (2) (3) (4).
|
|
4.
|
La présente méthode d'essai doit permettre d'évaluer la bioaccumulation de substances chimiques associées à des sédiments dans des vers oligochètes endobenthiques. La substance d'essai est dispersée dans le sédiment. L'utilisation d'un sédiment enrichi a pour but de simuler un sédiment contaminé.
|
|
5.
|
La méthode se fonde sur les méthodes d'essai existantes pour la toxicité sédimentaire et la bioaccumulation (1) (4) (5) (6) (7) (8) (9). On trouvera des informations utiles dans les discussions et résultats d'un groupe de travail international (11) et les résultats d'un essai comparatif interlaboratoires international (12).
|
|
6.
|
Cet essai s'applique aux substances chimiques organiques neutres, stables, qui ont tendance à s'associer aux sédiments. Cette méthode permet également de mesurer la bioaccumulation de composés organométalliques stables, associés à des sédiments (12). Elle ne s'applique pas aux métaux et autres éléments présents à l'état de traces (11), sans modification de la conception de l'essai en ce qui concerne les volumes de substrat et d'eau, et probablement la dimension des échantillons de tissu.
|
PRÉREQUIS ET INFORMATIONS SUR LA SUBSTANCE D'ESSAI
|
7.
|
Il existe quelques relations structure-activité quantitatives (RSAQ) bien établies, disponibles, concernant les processus de bioaccumulation (14). La relation la plus largement utilisée est la corrélation entre la bioaccumulation et la bioconcentration de substances organiques stables et leur lipophilie respective (exprimée comme le logarithme du coefficient de partage octanol-eau (log Koe); voir la définition en Appendice 1), qui a été développée pour la description d'une substance se répartissant entre l'eau et les poissons. Cette relation a également permis d'établir des corrélations pour le compartiment sédimentaire (15)(16)(17)(18). La corrélation log Koe-log FBC, principale RSAQ, peut être utile pour une estimation préliminaire du potentiel de bioaccumulation de substances chimiques associées à un sédiment. Toutefois, le FBA peut être influencé par la teneur en lipide de l'organisme d'essai et la teneur en carbone organique du sédiment. Par conséquent, il est également possible d'utiliser le coefficient de partage carbone organique/eau (Kco) comme déterminant principal de la bioaccumulation de composés organiques associés à un sédiment.
|
|
8.
|
Cet essai s'applique:
|
—
|
aux substances organiques, stables, dont les valeurs de log Koe sont comprises entre 3,0 et 6,0 (5) (19) et aux substances superlipophiles dont le log Koe est supérieur à 6,0 (5);
|
|
—
|
aux substances appartenant à la classe des substances organiques connues pour leur potentiel de bioaccumulation dans les organismes vivants, p. ex. les agents tensioactifs ou les substances fortement adsorbantes (p. ex. de Kco élevée).
|
|
|
9.
|
Avant de débuter toute étude, il convient de se procurer certaines informations sur la substance d'essai, comme les mesures de sécurité, les conditions de stockage convenables, la stabilité et les méthodes analytiques. Des conseils pour la réalisation d'essais rendus difficiles par les propriétés physico-chimiques des substances d'essai sont donnés dans (20) et (21). Avant de conduire un essai de bioaccumulation sur des oligochètes aquatiques, il est nécessaire de réunir les informations suivantes à propos de la substance d'essai:
|
—
|
le nom courant, le nom chimique (de préférence le nom IUPAC), la formule structurale, le noCAS, la pureté;
|
|
—
|
la solubilité dans l'eau [méthode d'essai A.6 (22)];
|
|
—
|
le coefficient de partage octanol-eau (Koe) [méthodes d'essai A.8, A.24 (22)];
|
|
—
|
le coefficient de partage sédiment-eau, exprimé par Kdou Kco [méthode d'essai C.19 (22)];
|
|
—
|
les propriétés vis-à-vis de l'hydrolyse [méthode d'essai C.7 (22)];
|
|
—
|
la phototransformation dans l'eau (23);
|
|
—
|
la pression de vapeur [méthode d'essai A.4 (22)];
|
|
—
|
la biodégradabilité immédiate [méthodes d'essai C.4 et C.29 (22)];
|
|
—
|
la tension de surface [méthode d'essai A.5 (22)];
|
|
—
|
la concentration micellaire critique (24).
|
Par ailleurs, les informations suivantes, lorsqu'elles sont disponibles, sont pertinentes:
|
—
|
la biodégradation en environnement aquatique [méthodes d'essai C.24 et C.25 (22)];
|
|
—
|
la constante de la loi de Henry.
|
|
|
10.
|
Des substances d'essai radiomarquées peuvent faciliter l'analyse de l'eau, du sédiment et des échantillons biologiques et peuvent être employées afin de déterminer si l'identification et la quantification des produits de dégradation doivent être conduites. La méthode décrite ici a été validée par un essai comparatif interlaboratoires international (12), pour des substances marquées au 14C. Si l'ensemble des résidus marqués est mesuré, le facteur de bioaccumulation (FBA) est basé sur la substance parente incluant les éventuels produits de dégradation retenus. Il est également possible de combiner une étude du métabolisme et une étude de bioaccumulation par l'analyse et la quantification du pourcentage de la substance parente et de ses produits de dégradation dans des échantillons prélevés à la fin de la phase d'absorption ou au niveau du pic de bioaccumulation. Dans tous les cas, il est recommandé que le calcul du FBA se base sur la concentration de la substance parente dans les organismes et pas uniquement sur le total des résidus radioactifs.
|
|
11.
|
En plus des propriétés de la substance d'essai, une autre information nécessaire est la toxicité envers les espèces oligochètes devant être utilisées dans l'essai, comme la concentration létale médiane (CL50) pour la durée nécessaire à la phase d'absorption, afin de s'assurer que les concentrations d'exposition retenues son bien inférieures aux niveaux toxiques. Si elles sont disponibles, la préférence devrait être donnée aux valeurs de toxicité issues d'études sur le long terme sur des critères d'évaluation sublétaux (CE50). En cas d'indisponibilité de ces données, un test de toxicité aiguë dans des conditions identiques à celles de l'essai de bioaccumulation, ou des données toxicologiques concernant d'autres espèces substitutives peuvent fournir des informations utiles.
|
|
12.
|
Une méthode analytique appropriée, d'incertitude, de précision et de sensibilité connues pour la quantification de la substance dans les solutions, le sédiment et le matériau biologique d'essai doit être disponible, ainsi que les détails de la préparation et du stockage des échantillons et les fiches de données de sécurités des substances. Les limites de détection analytiques de la substance d'essai dans l'eau, le sédiment et les tissus du ver devraient également être connues. Si une substance d'essai radiomarquée est utilisée, la radioactivité spécifique (c.-à-d. en Bq.mol– 1), la position de l'atome marqué et le pourcentage de radioactivité associé aux impuretés doivent également être connus. La radioactivité spécifique de la substance d'essai devrait être aussi élevée que possible afin de permettre la détection de concentrations aussi faibles que possible (11).
|
|
13.
|
Des informations sur les caractéristiques du sédiment utilisé (p. ex. l'origine du sédiment ou de ses constituants, son pH et la concentration en ammoniaque de l'eau interstitielle (sédiments naturels) la teneur en carbone organique (COT), la distribution de taille des particules (le pourcentage de sable, de limon et d'argile) et le pourcentage de masse sèche) devraient être accessibles (6).
|
PRINCIPE DE L'ESSAI
|
14.
|
L'essai consiste en deux phases, la phase d'absorption (exposition) et la phase d'élimination (post-exposition). Durant la phase d'absorption, des vers sont exposés au sédiment enrichi avec la substance d'essai, recouverts d'eau reconstituée et convenablement équilibrée (11). Des groupes de vers témoins sont conservés dans des conditions identiques, sans la substance d'essai.
|
|
15.
|
Pour la phase d'élimination les vers sont transférés dans un système sédiment-eau ne contenant pas la substance d'essai. Une phase d'élimination est nécessaire afin de recueillir des informations sur la vitesse à laquelle la substance d'essai est excrétée par l'organisme d'essai (19)(25). Une phase d'élimination est toujours nécessaire sauf si l'absorption de la substance d'essai au cours de la phase d'exposition s'avère être non significative (p. ex. aucune différence statistique entre la concentration de la substance d'essai dans les vers d'essai et dans les vers témoins). Si un état quasi stationnaire n'a pas été atteint durant la phase d'absorption, il est possible de réaliser une détermination de la cinétique — constantes de vitesse d'absorption et d'élimination, FBAk, en utilisant les résultats de la phase d'élimination. Une évolution de la concentration de la substance d'essai dans/sur les vers est suivie sur l'ensemble des deux phases de l'essai.
|
|
16.
|
Durant la phase d'absorption, on conduit des mesures jusqu'à ce que le FBA atteigne un plateau ou un état quasi stationnaire. Par défaut, la durée de la phase d'absorption devrait être de 28 jours. La pratique a montré qu'une phase d'absorption de 12 à 14 jours suffit, pour plusieurs substances organiques neutres stables, à atteindre un état quasi stationnaire (6) (8) (9).
|
|
17.
|
Toutefois, si l'état quasi stationnaire n'est pas atteint dans les 28 jours, la phase d'élimination est démarrée en transférant les oligochètes exposés dans des récipients contenant le même milieu sans la substance d'essai. La phase d'élimination est achevée soit lorsqu'on atteint un niveau de 10 % de la concentration mesurée dans les vers au 28e jour de la phase d'absorption, soit après une durée de 10 jours au maximum. Le niveau résiduel dans les vers à la fin de la phase d'élimination est relevé comme un critère d'évaluation supplémentaire, p. ex. comme résidus non éliminés (RNE). Le facteur de bioaccumulation (FBAss) est calculé de préférence à la fois comme le rapport de la concentration dans les vers (Ca) à celle dans le sédiment (Cs) à un état quasi stationnaire apparent, et comme un facteur de bioaccumulation cinétique, FBAk comme le rapport de la constante de vitesse d'absorption à partir du sédiment (ks) à la constante de vitesse d'élimination (ke) en supposant une cinétique du premier ordre. Si aucun état quasi stationnaire n'est atteint dans les 28 jours, calculer FBAk à partir des constantes de vitesse d'absorption et d'élimination. Pour les calculs, voir l'Apendice 2. Si une cinétique du premier ordre ne s'applique pas, des modèles plus complexes devront être utilisés [Appendice 2 et référence (25)].
|
|
18.
|
Si aucun état quasi stationnaire n'est atteint dans les 28 jours, de manière facultative, la phase d'absorption peut être prolongée en soumettant les groupes de vers exposés — s'ils sont disponibles — à des mesures supplémentaires jusqu'à atteindre un état quasi stationnaire. En parallèle, la phase d'élimination devrait néanmoins débuter au 28e jour de la phase d'absorption.
|
|
19.
|
La constante de vitesse d'absorption, la constante de vitesse d'élimination (ou les constantes, dans le cas de modèles plus complexes), le facteur de bioaccumulation cinétique (FBAK), et lorsque cela est possible, les limites de confiance de chacun de ces paramètres sont calculés à partir des équations du modèle numérique (voir les modèles en Appendice 2). La pertinence d'un modèle peut être déterminée à partir du coefficient de corrélation ou du coefficient de détermination (des coefficients proches de 1 indiquent un bon accord).
|
|
20.
|
Pour réduire la dispersion des résultats pour des substances organiques de lipophilie élevée, les facteurs de bioaccumulation devraient être exprimés en plus en relation avec la teneur en liquide des organismes d'essai et avec la teneur en carbone organique (COT) du sédiment (facteur d'accumulation biote-sédiment ou BSAF en kg de sédiment COT.kg– 1 de teneur en lipide des vers). Cette approche se base sur des corrélations expérimentales et théoriques pour le compartiment aquatique, où — pour certaines classes chimiques — il existe une relation claire entre le potentiel d'une substance à être bioaccumulée et sa lipophilie, laquelle a été clairement établie pour des organismes modèles comme le poisson (14) (26) (27). Il existe également une relation entre la teneur en lipide du poisson d'essai et la bioaccumulation observée de ces substances. Pour les organismes benthiques, des corrélations similaires ont été trouvées (15) (16) (17) (18). Si on dispose de suffisamment de tissu de vers, il est possible de déterminer la teneur en lipide des animaux d'essai sur le même matériau biologique que celui utilisé pour déterminer la concentration de la substance d'essai. Toutefois, il est plus pratique d'utiliser des animaux témoins acclimatés au moins pour démarrer ou — de préférence — à la fin de la phase d'absorption pour mesurer la teneur en lipide, laquelle peut ensuite être utilisée pour normaliser les valeurs de FBA.
|
VALIDITÉ DE L'ESSAI
|
21.
|
Pour qu'un essai soit valable, les conditions suivantes doivent être satisfaites:
|
—
|
La mortalité cumulée des vers (témoins et traités) jusqu'à la fin de l'essai, ne devrait pas dépasser 20 % du nombre initial.
|
|
—
|
De plus, il devrait être prouvé que les vers s'enfouissent dans le sédiment pour prendre en compte une exposition maximum. Voir le paragraphe 28 pour les détails.
|
|
DESCRIPTION DE LA MÉTHODE
Espèces d'essai
|
22.
|
Différentes espèces d'oligochètes aquatiques se prêtent à l'essai. Les espèces les plus couramment employées sont listées en Annexe 6.
|
|
23.
|
Les essais de toxicité (96 h, dans l'eau seule) devraient être conduits à intervalles réguliers (p.ex. chaque mois) par rapport à un composé toxique de référence tel que le chlorure de potassium (KCl) ou le sulfate de cuivre (CuSO4) (1) afin de démontrer l'état de santé des animaux d'essai (1) (6). Si aucun essai de toxicité de référence n'est conduit à intervalles réguliers, le lot d'organismes devant être utilisés dans un essai de bioaccumulation sédimentaire doit être vérifié à l'aide d'un composé toxique de référence. La mesure de la teneur en lipide pourrait également fournir des informations utiles sur l'état des animaux.
|
Culture des organismes d'essai
|
24.
|
Afin de disposer d'un nombre suffisant de vers pour conduire les essais de bioaccumulation, il pourra être nécessaire de conserver les vers dans une culture de laboratoire mono-espèce permanente. Les méthodes de culture en laboratoire pour les espèces d'essai retenues sont résumées en Appendice 6. Pour les détails, voir les références (8) (9) (10) (18) (28) (29) (30) (31) (32).
|
Appareillage
|
25.
|
On doit veiller à tout moment à ne pas utiliser pour l'appareillage des matériaux susceptibles de dissoudre ou absorber les substances d'essai ou pouvant libérer des substances ayant un effet délétère sur les animaux d'essai. Des chambres rectangulaires ou cylindriques standard, faites d'un matériau chimiquement inerte et présentant une capacité adaptée au taux de charge, c.-à-d. au nombre de vers d'essai, peuvent être utilisées. Il convient d'éviter l'utilisation de tubes en plastique souples pour l'administration d'eau ou d'air. Du polytétrafluoroéthylène, de l'acier inoxydable et/ou du verre devront être utilisés pour tout équipement entrant en contact avec le milieu faisant l'objet de l'essai. Du verre silanisé peut s'avérer nécessaire pour des substances de coefficient d'adsorption élevé comme les pyréthroïdes synthétiques. Dans de telles circonstances, l'équipement devra être jeté après usage (5). Pour des substances d'essai radiomarquées et pour des substances chimiques volatiles, on doit prendre soin d'éviter l'évaporation et la perte des substances d'essai. Il convient d'utiliser des pièges (p. ex. des flacons de lavage des gaz) contenant un absorbant permettant de capter d'éventuels résidus s'évaporant des chambres d'essai (11).
|
Eau
|
26.
|
L'eau surjacente doit être d'une qualité permettant la survie des espèces d'essai durant les périodes d'acclimatation et d'essai, sans qu'elle ne présente un aspect ou un comportement anormal. Pour l'eau surjacente, tant pour les essais que pour les cultures de laboratoire, il est recommandé d'utiliser une eau reconstituée selon la méthode d'essai C.1 (25). Il a été démontré que plusieurs espèces d'essai peuvent survivre, croître et se reproduire dans cette eau (8); une normalisation maximum des conditions d'essai et de culture est proposée. L'eau devrait être caractérisée au moins par son pH, sa conductivité et sa dureté. La recherche de micropolluants dans l'eau, préalablement à son utilisation pourrait fournir des informations utiles (Appendice 4).
|
|
27.
|
L'eau devrait être de qualité constante sur toute la durée de l'essai. Le pH de l'eau surjacente devrait être compris entre 6 et 9. La dureté totale devrait être comprise entre 90 et 400 mg de CaCO3 par litre au début de l'essai (7). Les plages de pH et de dureté dans l'eau reconstituée mentionnée sont données dans la méthode d'essaire C.1 (25). Si une interaction est suspectée entre la dureté de certains ions et la substance d'essai, une eau moins dure devrait être utilisée. L'Appendice 4 résume des critères supplémentaires pour une eau de dilution acceptable selon la ligne directrice 210 de l'OCDE (34).
|
Sédiment
|
28.
|
Le sédiment doit être d'une qualité permettant la survie et de préférence la reproduction des organismes d'essai durant les périodes d'acclimatation et d'essai, sans qu'ils ne présentent un aspect ou un comportement anormal. Les vers devront s'enfouir dans le sédiment. Le comportement d'enfouissement peut avoir une influence sur l'exposition et donc sur le FBA. Par conséquent, la tendance à éviter le sédiment ou comportement fouisseur des organismes d'essai devra être observée, lorsque la turbidité de l'eau surjacente le permet. Les vers (témoins et traités) devront s'enfouir dans le sédiment dans les 24 h à compter de leur addition au récipient d'essai. Si on observe de manière permanente un défaut d'enfouissement ou un évitement du sédiment (p. ex. plus de 20 % sur plus de la moitié de la phase d'absorption), ceci indique soit que les conditions de l'essai ne sont pas appropriées, soit que les organismes d'essai ne sont pas en bonne santé, soit encore que la concentration de la substance chimique d'essai provoque ce comportement. Dans ce cas, l'essai devra être arrêté et répété en améliorant les conditions. Il est possible d'obtenir des informations supplémentaires sur l'ingestion du sédiment en utilisant les méthodes décrites dans (35) et (36), qui précisent l'ingestion de sédiments ou la sélection de particules par les organismes d'essai. Si elles sont observables, au moins la présence ou l'absence de coprolithes à la surface du sédiment, qui indiquent l'ingestion du sédiment par les vers, devraient être relevées et prises en compte dans l'interprétation des résultats de l'essai du point de vue du trajet d'exposition.
|
|
29.
|
On recommande l'utilisation d'un sédiment artificiel basé sur le sol artificiel décrit dans la méthode d'essai C.8 (40) à la fois pour l'essai et pour les cultures des vers en laboratoire (Appendice 5), puisque des sédiments naturels de qualité appropriée ne sont pas disponibles tout au long de l'année. De plus, l'essai pourrait être influencé par la présence éventuelle d'organismes indigènes ainsi que de micropolluants dans des sédiments naturels. Le sédiment artificiel permet à différentes espèces d'essai de survivre, croître et se reproduire (8).
|
|
30.
|
Le sédiment artificiel devrait être caractérisé au moins par l'origine de ses constituants, la distribution de taille de particule, (le pourcentage de sable, de limon et d'argile), la teneur en carbone organique (COT), la teneur en eau et le pH. La mesure du potentiel redox est facultative. Toutefois, il est possible d'utiliser des sédiments naturels, provenant de sites non pollués, comme sédiment d'essai et/ou de culture (1). Les sédiments naturels devraient être caractérisés au moins par leur origine (le site de prélèvement), le pH et la teneur en ammoniaque de l'eau interstitielle, la teneur en carbone organique (COT), la distribution de taille de particule, (le pourcentage de sable, de limon et d'argile), et la teneur en eau (6). Si un dégagement d'ammoniaque est attendu, on recommande de conditionner le sédiment naturel durant sept jours dans les conditions du test à venir, avant de l'enrichir avec la substance d'essai. À la fin de cette période de conditionnement, l'eau surjacente devra être enlevée et éliminée. La recherche de micropolluants dans le sédiment ou ses constituants, préalablement à son utilisation pourrait fournir des informations utiles.
|
Préparation
|
31.
|
La manipulation des sédiments naturels préalablement à leur utilisation en laboratoire est décrite dans (1) (6) (44). La préparation du sédiment artificiel est décrite en Appendice 5.
|
Stockage
|
32.
|
Le stockage de sédiments naturels au laboratoire devrait être aussi court que possible. L'Agence de Protection de l'Environnement américaine (6) recommande une durée maximum de stockage de 8 semaines à 4 °C ± 2 °C à l'abri de la lumière. Aucun espace libre ne doit être présent au-dessus du sédiment dans le récipient de stockage. L'Appendice 5 donne des recommandations concernant le stockage de sédiments artificiels.
|
Application de la substance d'essai
|
33.
|
La substance d'essai est dispersée sur le sédiment. La procédure de dispersion implique le revêtement d'un ou plusieurs des constituants du sédiment avec la substance d'essai. Par exemple, le sable de quartz, ou une portion de celui-ci (p. ex. 10 g de sable de quartz par récipient d'essai), peut être trempé dans une solution de la substance d'essai dans un solvant adapté, lequel est ensuite lentement évaporé à sec. La fraction revêtue peut ensuite être mélangée avec le sédiment mouillé. La quantité de sable apportée avec la substance d'essai et le mélange de sable doivent être pris en compte lors de la préparation du sédiment, c.-à-d. que le sédiment doit alors être préparé avec moins de sable (6).
|
|
34.
|
Pour un sédiment naturel, la substance d'essai peut être ajoutée par dispersion sur une portion séchée du sédiment ainsi que cela est décrit plus haut pour le sédiment artificiel, ou par mélange avec le sédiment mouillé, puis évaporation de l'agent de solubilisation éventuellement utilisé. Des solvants adaptés à la dispersion sur sédiment mouillé sont l'éthanol, le méthanol, l'éthylène glycol monométhyl éther, l'éthylène glycol diméthyl éther, le diméthylformamide et le triéthylène glycol (5) (34). La toxicité et la volatilité du solvant et la solubilité de la substance d'essai dans le solvant choisi doivent être les principaux critères de sélection d'un agent de solubilisation adapté. Des conseils supplémentaires sur les procédures de dispersion sont donnés dans Environment Canada (1995) (41). On doit prendre des précautions pour s'assurer que la substance chimique d'essai ajoutée au sédiment est distribuée régulièrement et dans l'ensemble du sédiment. Des sous-échantillons du sédiment enrichi, d'expériences identiques, devraient être analysés afin de vérifier les concentrations en substance d'essai dans le sédiment et afin de déterminer le degré d'homogénéité de la distribution de la substance d'essai.
|
|
35.
|
Une fois le sédiment enrichi préparé, avec une couche d'eau surjacente, il est souhaitable de laisser la substance d'essai se partager entre le sédiment et la phase aqueuse. Ceci devrait de préférence être réalisé dans les conditions de température et d'aération de l'essai. La durée d'équilibration appropriée dépend du sédiment et de la substance chimique et peut être de l'ordre de quelques heures à quelques jours, et dans quelques rares cas jusqu'à plusieurs semaines (4 à 5 semaines) (28) (42). Dans cet essai, on n'attend pas l'équilibre mais une période d'équilibration de 48 h à 7 jours est recommandée. Selon l'objectif de l'étude, p. ex. lorsqu'il s'agit de simuler des conditions environnementales, il peut être nécessaire d'équilibrer ou de vieillir le sédiment enrichi plus longtemps (11).
|
RÉALISATION DE L'ESSAI
Essai préliminaire
|
36.
|
Il peut être utile de conduire une expérience préliminaire afin d'optimiser les conditions de l'essai définitif, p. ex. choix des concentrations des substances testées et durées des phases phase d'absorption et d'élimination. Le comportement des vers, par exemple évitement du sédiment, c.-à-d. que les vers quittent le sédiment, ce qui peut être dû à la substance d'essai et/ou au sédiment lui-même, devrait être observé et noté durant un essai préliminaire. L'évitement du sédiment peut également être utilisé comme paramètre sublétal dans un essai préliminaire pour l'estimation des concentrations des substances d'essai à utiliser dans un essai de bioaccumulation.
|
Conditions d'exposition
Durée de la phase d'absorption
|
37.
|
Les organismes d'essai sont exposés à la substance d'essai durant la phase d'absorption. Le premier échantillon devrait être prélevé entre 4 et 24 h après le début de la phase d'absorption. La phase d'absorption devrait être conduite durant 28 jours au plus (1) (6) (11), sauf s'il peut être démontré qu'un équilibre a été atteint plus rapidement. On identifie un état quasi stationnaire par: (i) un tracé des facteurs de bioaccumulation pour chaque période d'échantillonnage en fonction du temps, parallèle à l'axe du temps, (ii) trois analyses successives de FBA réalisées sur des échantillons prélevés à des intervalles d'au moins deux jours, ne différant pas de plus de ± 20 % l'une par rapport à l'autre, et (iii) une absence de différence significative entre les trois périodes d'échantillonnage (sur la base de comparaisons statistiques, p. ex. l'analyse de la variance et une analyse par régression). Si l'état quasi stationnaire n'a pas été atteint après 28 jours, il est possible de clore la phase d'absorption en démarrant la phase d'élimination et il est possible de calculer le FBAK à partir des constantes de vitesse d'absorption et d'élimination (voir également les paragraphes 16 à 18).
|
Durée de la phase d'élimination
|
38.
|
Le premier échantillon devrait être prélevé entre 4 et 24 h après le début de la phase d'élimination car des modifications peuvent survenir dans les résidus de tissu durant de la période initiale. Il est recommandé de clore la phase d'élimination soit lorsque la concentration de substance d'essai est inférieure à 10 % de la concentration de l'état quasi stationnaire, soit après une durée de 10 jours. Le niveau résiduel dans les vers à la fin de la phase d'élimination est relevé comme un critère d'évaluation secondaire. La période peut toutefois être définie par la durée pendant laquelle la concentration de la substance d'essai dans les vers est supérieure à la limite de détection analytique.
|
Organismes d'essai
Nombre de vers d'essai
|
39.
|
Le nombre de vers par échantillon doit fournir une masse de tissu de vers telle que la masse de la substance d'essai par échantillon au début de la phase d'absorption et à la fin de la phase d'élimination soient, significativement supérieures à la limite de détection de la substance d'essai dans le matériau biologique. Dans les phases mentionnées d'absorption et d'élimination la concentration dans les animaux d'essai est généralement relativement faible (6) (8) (18). Comme le poids individuel de nombreuses espèces d'oligochètes aquatiques est très faible (5 à 10 mg de poids humide par individu pour Lumbriculus variegatus et Tubifex tubifex), il est possible de réunir les vers de chambres d'essai d'expériences identiques données pour la pesée et l'analyse de la substance chimique d'essai. Pour les espèces d'essai de poids individuel supérieur (p. ex. Branchiura sowerbyi), il est possible d'utiliser des expériences identiques contenant un unique individu, mais dans ce cas le nombre d'expériences identiques doit être augmenté à cinq par point d'échantillonnage (11). On doit toutefois avoir à l'esprit que B. sowerbyi ne faisait pas partie de l'essai comparatif interlaboratoires (12) et il ne fait par conséquent pas partie des espèces préférables de la ligne directrice préliminaire.
|
|
40.
|
Des vers de taille similaire devraient être utilisés (pour L. variegatus voir l'Appendice 6). Ils devraient provenir de la même source et devraient être des animaux adultes ou de gros animaux de la même classe d'âge (voir l'Appendice 6). Le poids et l'âge d'un animal peuvent avoir un effet significatif sur les valeurs de FBA (p. ex. du fait d'une teneur en lipide différente et/ou de la présence d'œufs); ces paramètres devraient être relevés avec précision. Afin de mesurer le poids moyen et le poids sec, un sous échantillon de vers devrait être pesé avant de débuter l'essai.
|
|
41.
|
Avec Tubifex tubifex et Lumbriculus variegatus, on peut s'attendre à observer une reproduction sur la durée de l'essai. Une absence de reproduction lors d'un essai de bioaccumulation devrait être relevée et prise en compte lors de l'interprétation des résultats.
|
Charge
|
42.
|
Il est recommandé d'utiliser des rapports sédiment/vers et eau/vers élevés afin de minimiser la réduction de la concentration de la substance d'essai dans le sédiment durant la phase d'absorption et d'éviter une réduction de la concentration en oxygène dissous. Les taux de charge choisis devraient également correspondre à des densités de population observées dans la nature pour l'espèce choisie (43). Par exemple, pour Tubifex tubifex, on recommande un taux de charge de 1 à 4 mg de tissu de ver (poids humide) par gramme de sédiment humide (8) (11). Les références (1) et (6) recommandent un taux de charge ≤ 1 g de poids sec de tissu de ver pour 50 g de carbone organique sédimentaire, pour L. variegatus.
|
|
43.
|
Les vers utilisés lors d'un essai sont extraits de la culture par tamisage du sédiment de culture. Les animaux (adultes ou gros vers sans signes de fragmentation récente) sont transférés dans des récipients en verre (p. ex. des boîtes de Petri) contenant une eau propre. Si les conditions de l'essai diffèrent des conditions de culture, une phase d'acclimatation de 24 h devrait suffire. Avant la pesée, l'excès d'eau doit être séparé des vers. Ceci peut être fait en plaçant les vers avec précaution sur un mouchoir en papier préhumidifié. Il est déconseillé d'utiliser un papier absorbant pour sécher les vers car celui-ci peut provoquer un stress ou abîmer les vers. Brunson et al. (1998) recommandent l'utilisation de vers non épongés d'environ 1,33 fois la biomasse cible. Ces 33 % supplémentaires correspondent à la différence entre des vers épongés et non épongés (28).
|
|
44.
|
Au début de la phase d'absorption (jour 0 de l'essai), les organismes d'essai sont transférés depuis la chambre d'acclimatation et distribués aléatoirement dans des récipients (p. ex. des boîtes de Petri) contenant de l'eau reconstituée, en ajoutant les vers par deux dans chaque récipient, jusqu'à ce que chaque récipient en contienne dix. Chacun de ces groupes de vers est ensuite aléatoirement transféré dans des récipients d'essai séparés, p. ex. en utilisant une pince en acier souple. Les récipients d'essai sont ensuite incubés dans les conditions de l'essai.
|
Alimentation
|
45.
|
Compte tenu de la faible teneur en nutriment du sédiment artificiel, le sédiment devra être complété d'une source alimentaire. Afin de ne pas sous-estimer l'exposition des organismes d'essai, p. ex. en apportant sélectivement une alimentation non contaminée, la nourriture nécessaire à la reproduction et à la croissance des organismes d'essai devrait être ajoutée au sédiment en une fois, avant ou durant l'application de la substance d'essai (voir l'Appendice 5).
|
Rapport sédiment/eau
|
46.
|
Le rapport sédiment/eau recommandé est de 1:4 (45). On considère que ce rapport permet de conserver les concentrations en oxygène à des niveaux convenables et d'éviter l'accumulation d'ammoniaque dans l'eau surnageante. La teneur en oxygène dans l'eau surjacente devrait être conservée à une valeur ≥ 40 % de la saturation. L'eau surjacente des récipients d'essai devrait être doucement aérée (p. ex. 2 à 4 bulles par seconde) via une pipette pasteur située environ 2 cm au-dessus de la surface du sédiment de sorte à minimiser la perturbation du sédiment.
|
Éclairement et température
|
47.
|
La photopériode de la culture et de l'essai est de 16 heures (1) (6). L'intensité lumineuse dans la zone de l'essai devrait être maintenue à environ 500 à 1 000 lux. La température devrait être de 20 ± 2 °C sur toute la durée de l'essai.
|
Concentrations d'essai
|
48.
|
L'une des concentrations d'essai (aussi faible que possible) est utilisée pour la détermination de la cinétique d'absorption, mais il est possible d'utiliser une seconde concentration (supérieure) [p. ex. (46)]. Dans ce cas, des échantillons sont prélevés et analysés à l'état quasi stationnaire ou après 28 jours afin de confirmer le FBA mesuré à la concentration la plus basse (11). La concentration supérieure devrait être choisie de sorte à ne pas provoquer d'effets délétères (p. ex; en se plaçant à environ 1 % en dessous de la concentration de toxicité chronique la plus basse connue ECx provenant d'études de toxicité chronique pertinentes). La concentration d'essai la plus basse devrait être significativement supérieure à la limite de détection dans le sédiment et dans les échantillons biologiques selon la méthode analytique employée. Si la concentration d'effet de la substance d'essai est voisine de la limite de détection analytique, on recommande l'utilisation d'une substance d'essai radiomarquée, de radioactivité spécifique élevée.
|
Expériences identiques traitées et témoins
|
49.
|
Le nombre minimum d'expériences identiques traitées pour les mesures de cinétique devrait être de trois par point d'échantillonnage (11), pour l'ensemble des phases d'absorption et d'élimination. Des expériences identiques supplémentaires devraient être utilisées p. ex. pour des dates d'échantillonnage supplémentaires facultatives. Pour la phase d'élimination, un nombre correspondant d'expériences identiques est préparé avec un sédiment et une eau surjacente non enrichis, de sorte que les vers traités puissent être transférés depuis des récipients traités donnés vers des récipients non traités à la fin de la phase d'absorption. Le nombre total d'expériences identiques traitées devrait être suffisant à la fois pour la phase d'absorption et pour la phase d'élimination.
|
|
50.
|
En variante, il est possible d'exposer les vers destinés à être échantillonnés durant la phase d'élimination dans un grand container contenant un sédiment enrichi, du même lot que celui utilisé pour la cinétique d'absorption. Il doit être prouvé que les conditions de l'essai (p. ex. la profondeur du sédiment, le rapport sédiment/eau, la charge, la température, la qualité de l'eau) sont comparables aux expériences identiques destinées à la phase d'absorption. Une fois la phase d'absorption terminée, l'eau, le sédiment et les échantillons de vers devraient être prélevés de ce container pour analyse et un nombre suffisant de grands vers, ne présentant pas de signes de fragmentation récents, devraient être soigneusement extraits et transférés vers les expériences identiques préparées pour la phase d'élimination (p. ex. dix organismes par récipient d'expérience identique).
|
|
51.
|
Si aucun solvant autre que l'eau n'a été utilisé, au moins 9 expériences identiques d'un contrôle négatif (au moins 3 échantillons au démarrage, 3 à la fin de la phase d'absorption et 3 à la fin de la phase d'élimination) devraient être fournies pour analyse biologique et du bruit de fond. Si un agent de solubilisation est utilisé pour l'application de la substance d'essai, il convient de contrôler le solvant (au moins 3 échantillons d'expériences identiques devraient être échantillonnés au démarrage, 3 à la fin de la phase d'absorption et 3 à la fin de la phase d'élimination). Dans ce cas, au moins 4 expériences identiques d'un contrôle négatif (sans solvant) devraient être fournies pour échantillonnage à la fin de la phase d'absorption. Ces expériences identiques peuvent être comparées biologiquement au contrôle du solvant afin d'obtenir des informations sur une éventuelle influence du solvant sur les organismes d'essai. L'Appendice 3 donne plus de détails.
|
Fréquence des mesures de la qualité de l'eau
|
52.
|
Durant les phases d'absorption et d'élimination, l'eau surjacente devrait faire l'objet de mesures de qualité, au minimum selon les paramètres suivants:
|
Température
|
dans un récipient de chaque niveau de traitement par date d'échantillonnage, et dans un récipient témoin, une fois par semaine et au départ et à la fin des phases d'absorption et d'élimination; la température peut également être enregistrée, p. ex. en continu ou à intervalles d'une heure, dans l'environnement (air ambiant ou bain d'eau) ou dans un récipient d'essai représentatif;
|
|
Teneur en oxygène dissous
|
dans un récipient de chaque niveau de traitement et dans un récipient témoin, par date d'échantillonnage, exprimée en mg/l et en % de la saturation à l'air;
|
|
Alimentation en air
|
contrôlée au moins une fois par jour (travaillé) et au besoin ajustée;
|
|
pH
|
dans un récipient traité de chaque niveau de traitement par date d'échantillonnage et dans un récipient témoin une fois par semaine et au début et à la fin des phases d'absorption et d'élimination;
|
|
Dureté totale de l'eau
|
au moins dans un récipient traité et dans un récipient témoin au début et à la fin des phases d'absorption et d'élimination, exprimée en mg de CaCO3/l;
|
|
Teneur totale en ammoniaque
|
au moins dans un récipient traité et dans un récipient témoin au début et à la fin des phases d'absorption et d'élimination, exprimée en mg de NH4+ ou de NH3 ou d'azote ammoniacal total par litre.
|
|
Échantillonnage et analyse des vers, du sédiment et de l'eau
Programme d'échantillonnage
|
53.
|
L'Appendice 3 donne des exemples de programme d'échantillonnage pour une phase d'absorption de 28 jours et une phase d'élimination de 10 jours.
|
|
54.
|
Échantillonner l'eau et le sédiment des chambres d'essai pour la détermination de la concentration de la substance d'essai avant addition des vers et durant les phases d'absorption et d'élimination. Durant l'essai, les concentrations de la substance d'essai sont déterminées dans les vers, le sédiment et l'eau, afin de suivre la distribution de la substance d'essai dans le compartiment du système d'essai.
|
|
55.
|
Échantillonner les vers, le sédiment et l'eau à au moins six reprises durant la phase d'absorption, comme dans la phase d'élimination.
|
|
56.
|
Poursuivre l'échantillonnage en continu jusqu'à atteindre un plateau (état quasi stationnaire) (voir l'Appendice 1) ou durant 28 jours. Si le plateau n'a pas été atteint dans les 28 jours, débuter la phase d'élimination. Au démarrage de la phase d'élimination, transférer les vers voulus vers des chambres des expériences identiques contenant un sédiment non traité et de l'eau (voir également les paragraphes 17 et 18).
|
Échantillonnage et préparation des échantillons
|
57.
|
Les échantillons d'eau sont obtenus par décantation, siphonnage ou pipetage d'un volume suffisant pour la mesure de la quantité de la substance d'essai dans l'échantillon.
|
|
58.
|
L'eau surjacente restante est soigneusement décantée ou siphonnée de la ou des chambres d'essai. Les échantillons de sédiment doivent être prélevés avec le plus grand soin, en dérangeant les vers au minimum.
|
|
59.
|
Enlever tous les vers des expériences d'essai identiques au moment de l'échantillonnage, p. ex. en mettant en suspension le sédiment avec l'eau surjacente et en étalant le contenu de chaque expérience identique sur un plateau peu profond et en prélevant les vers à l'aide d'une pince en acier souple. Les rincer rapidement à l'eau dans un récipient peu profond en verre ou en acier. Enlever l'eau en excès. Transférer délicatement les vers dans un récipient préalablement taré, et les peser. Sacrifier les vers par congélation (p. ex. ≤ – 18 °C). La présence et le nombre de cocons et/ou de jeunes devraient être relevés.
|
|
60.
|
De manière générale, les vers devraient être pesés et sacrifiés immédiatement après l'échantillonnage, sans phase de purge de l'intestin, afin d'obtenir un FBA classique incluant le contenu de l'intestin contaminé et afin d'éviter des pertes de résidus corporels durant une éventuelle phase de purge de l'intestin dans de l'eau seule (8). Les composés de log Koe supérieur à 5 ne sont pas censés être significativement éliminés durant une phase de purge des intestins dans l'eau seule, alors que les substances chimiques de log Koe inférieur à 4 peuvent être perdues en quantités significatives (47).
|
|
61.
|
Durant la phase d'élimination, les vers purgent leur intestin dans le sédiment propre. Ceci signifie que les mesures réalisées immédiatement avant la phase d'élimination incluent le sédiment avec l'intestin contaminé, alors qu'après les 4 à 24 h initiales de la phase d'élimination, l'essentiel du contenu de l'intestin contaminé est supposé avoir été remplacé par du sédiment propre (11) (47). La concentration dans les vers de cet échantillon peut alors être considérée comme la concentration dans les tissus après la purge de l'intestin. Pour tenir compte de la dilution de la substance d'essai par du sédiment non contaminé durant la phase d'élimination, il est possible d'estimer le poids du contenu de l'intestin à partir des rapports poids des vers humides/poids des cendres de vers ou poids des vers secs/poids des cendres de vers.
|
|
62.
|
Si l'objectif de l'étude est la mesure de la biodisponibilité et des résidus réels dans les tissus des organismes d'essai, alors au moins un sous-échantillon des animaux traités (provenant p. ex. de trois récipients d'expériences identiques supplémentaires), de préférence échantillonné durant l'état quasi stationnaire, devrait être pesé, purgé dans de l'eau propre durant 6 heures (47), et pesé de nouveau avant analyse. Les données de poids des vers et de concentrations corporelles de ces sous-échantillons peuvent ensuite être comparées aux valeurs obtenues à partir de vers purgés. Les vers destinés à une mesure d'élimination ne devraient pas être purgés avant le transfert vers le sédiment propre afin de minimiser le stress subi par les animaux.
|
|
63.
|
Analyser de préférence l'eau, le sédiment et les échantillons de vers immédiatement (c.-à-d. dans les 1 à 2 jours) après extraction afin d'éviter une dégradation ou autres pertes et de calculer les vitesses d'absorption et d'élimination approximatives pendant le déroulement de l'essai. Une analyse immédiate permet également de déterminer sans retard l'atteinte du plateau.
|
|
64.
|
Si les analyses ne sont pas réalisées immédiatement, les échantillons devront être stockés dans des conditions appropriées. Il convient d'obtenir les informations sur la stabilité et les conditions de stockage appropriées (p. ex. la durée et la température de stockage, les procédures d'extraction, etc.) pour la substance d'essai donnée, avant de débuter l'étude. Si ces informations ne sont pas disponibles et qu'elles sont jugées nécessaires, des tissus témoins contaminés peuvent être étudiés en parallèle afin de déterminer la stabilité au stockage.
|
Qualité de la méthode analytique
|
65.
|
Comme l'ensemble de la procédure est essentiellement gouverné par l'incertitude, la précision et la sensibilité de la méthode analytique employée pour la substance d'essai, il convient de vérifier expérimentalement que la précision et la reproductibilité de l'analyse chimique, ainsi que la récupération de la substance d'essai à partir de l'eau, du sédiment ou des échantillons de vers sont satisfaisantes pour la méthode donnée. Vérifier également que la substance d'essai n'est pas détectable dans les chambres témoins, en concentrations supérieures au bruit de fond. Si nécessaire, corriger les valeurs de Cw, Cs et Ca pour les valeurs des récupérations et du bruit de fond du témoin. Pour l'ensemble de l'essai, manipuler tous les échantillons de manière à minimiser les contaminations et les pertes (résultant p. ex. d'une adsorption de la substance d'essai sur le dispositif d'échantillonnage).
|
|
66.
|
La récupération globale et la récupération de la substance d'essai dans les vers, le sédiment, l'eau et le cas échéant, dans les pièges contenant des absorbants permettant de retenir la substance d'essai évaporée, devraient être enregistrées et consignées.
|
|
67.
|
Puisque l'utilisation de substances radiomarquées est recommandée, il est possible d'analyser la radioactivité totale (c.-à-d. celle du produit parent et des produits de dégradation). Toutefois, si ceci est faisable du point de vue analytique, une quantification de la substance parente et des produits de dégradation à l'état quasi stationnaire ou à la fin de la phase d'absorption peuvent fournir des informations importantes. Si on envisage de réaliser de telles mesures, les échantillons devraient alors être soumis à des procédures d'extraction appropriées de sorte que la substance parente puisse être quantifiée séparément. Lorsqu'un produit de dégradation détecté représente un pourcentage significatif (p. ex. > 10 %) de la radioactivité mesurée dans les organismes d'essai à l'état quasi stationnaire ou à la fin de la phase d'absorption, on recommande l'identification de ces produits de dégradation (5).
|
|
68.
|
Du fait de la faible biomasse individuelle, il est souvent impossible de déterminer la concentration de la substance d'essai dans chacun des vers, sauf à utiliser l'espèce d'essai Branchiura sowerbyi (poids humide: 40 à 50 mg par ver) (11). Par conséquent, le regroupement d'individus échantillonnés à partir d'un récipient d'essai donné est acceptable, mais ceci restreint les procédures statistiques pouvant s'appliquer aux données. Si une procédure et une puissance statistiques spécifiques sont des considérations importantes, alors l'essai devrait comprendre un nombre adéquat de chambres d'essai, d'animaux d'essais et/ou d'expériences identiques adaptés aux quantités, à la procédure et à la puissance voulues.
|
|
69.
|
On recommande d'exprimer le FBA à la fois comme une fonction du poids total humide, du poids total sec et si nécessaire (p. ex. pour des substances fortement lipophiles), comme une fonction de la teneur en lipide et du COT du sédiment. La teneur en lipide doit être déterminée par des méthodes adaptées (48) (49). On peut recommander la technique d'extraction au chloroforme/méthanol (50) comme une méthode standard (48). Toutefois, afin d'éviter l'utilisation de solvants chlorés, il est possible d'utiliser une modification, qui a fait l'objet d'un essai comparatif interlaboratoires, de la méthode de Bligh & Dyer (50); celle-ci est décrite dans (51). Comme les diverses méthodes ne conduisent pas à des valeurs identiques (48), il est important de détailler la méthode employée. Lorsque cela est possible, c.-à-d. si on dispose de suffisamment de tissu de vers, la teneur en lipide est mesurée dans le même échantillon ou extrait que celui produit pour l'analyse de la substance d'essai, puisqu'il est souvent nécessaire d'éliminer les lipides de l'extrait avant de pourvoir le chromatographier (5). Toutefois, il est plus pratique d'utiliser des animaux témoins acclimatés au moins pour démarrer ou — de préférence — à la fin de la phase d'absorption pour mesurer la teneur en lipide, p. ex. dans trois échantillons.
|
RÉSULTATS ET RAPPORT
Traitement des résultats
|
70.
|
On obtient la courbe d'absorption de la substance d'essai en portant, en échelle linéaire, la concentration de la substance d'essai dans/sur les vers durant la phase d'absorption en fonction du temps. Si la courbe a atteint un plateau, calculer le FBAss à l'état quasi stationnaire:

|
|
71.
|
Déterminer le facteur de bioaccumulation cinétique (FBAK) comme le rapport de ks/ke. La constante d'élimination (ke) est généralement déterminée à partir de la courbe d'élimination (c.-à-d. d'un tracé de la concentration de la substance d'essai dans les vers durant la phase d'élimination). La constante de vitesse d'absorption ks est ensuite calculée à partir de la cinétique de la courbe d'absorption. La méthode préférée pour l'obtention du FBAK et des constantes de vitesse, ks, et ke, consiste à utiliser des méthodes d'estimation des paramètres non linéaires à l'aide d'un ordinateur (voir l'Appendice 2). Si l'élimination n'est à l'évidence pas du premier ordre, alors des modèles plus complexes devraient être utilisés (26) (27) (52).
|
|
72.
|
Le facteur d'accumulation biote-sédiment (BSAF) est déterminé en normalisant le FBAK par rapport à la teneur en lipide des vers et à la teneur en carbone organique total du sédiment.
|
Interprétation des résultats
|
73.
|
Les résultats devraient être interprétés avec précaution lorsque les concentrations mesurées lors des essais sont à des niveaux proches de la limite de détection de la méthode analytique employée.
|
|
74.
|
Des courbes d'absorption et d'élimination clairement définies sont une indication de données de bioaccumulation de bonne qualité. En général, pour des études bien conçues, les limites de confiance des valeurs de FBA ne devraient pas dépasser 25 % (5).
|
Rapport d'essai
|
75.
|
Le rapport d'essai doit comporter les informations suivantes.
|
|
Substance d'essai
|
—
|
nature physique et propriétés physico-chimiques, p. ex. log Koe, solubilité dans l'eau;
|
|
—
|
données sur l'identification de la substance chimique; provenance de la substance d'essai, identités et concentrations des solvants éventuellement utilisés;
|
|
—
|
dans le cas de radiomarquage, la position précise des atomes marqués, la radioactivité spécifique et le pourcentage de radioactivité associé aux impuretés.
|
|
|
|
Espèces d'essai
|
—
|
nom scientifique, souche, origine, pré-traitement éventuel, acclimatation, âge, plage de taille, etc.
|
|
|
|
Conditions de l'essai
|
—
|
procédure utilisée pour l'essai (p. ex. statique, semi-statique, ou dynamique);
|
|
—
|
type et caractéristiques de l'éclairement utilisé et photopériode(s);
|
|
—
|
conception de l'essai (p. ex. nombre, matériau et dimension des chambres d'essai, volume d'eau, masse et volume de sédiment, vitesse de remplacement de l'eau (pour les procédures dynamiques ou semi- statiques), éventuelle aération utilisée avant et durant l'essai, nombre d'expériences identiques, nombre de vers par expérience identique, nombre de concentrations d'essai, durée des phases d'absorption et d'élimination, fréquence d'échantillonnage);
|
|
—
|
méthode de préparation de la substance d'essai et d'application ainsi que les raisons du choix d'une méthode donnée;
|
|
—
|
concentrations testées nominales;
|
|
—
|
source des constituants de l'eau et du sédiment artificiels ou — si un milieu naturel est utilisé — origine de l'eau et du sédiment, description d'un éventuel prétraitement, résultats d'une éventuelle démonstration de l'aptitude des animaux d'essai à vivre et/ou à se reproduire dans le milieu utilisé, caractéristiques du sédiment (pH et teneur en ammoniac de l'eau interstitielle (pour les sédiments naturels), teneur en carbone organique (COT), distribution de taille de particule (pourcentage de sable, de limon et d'argile), teneur en eau en pourcentage et toutes autres mesures réalisées) et caractéristiques de l'eau (pH, dureté, conductivité, température, concentration en oxygène dissous, niveaux de chlore résiduels (s'il est mesuré) et toutes autres mesures réalisées);
|
|
—
|
poids sec mesuré et nominal en % du poids humide (ou rapport poids sec/poids humide) du sédiment artificiel, poids sec mesuré en % du poids humide (ou rapport poids sec/poids humide) pour les sédiments naturels;
|
|
—
|
qualité de l'eau dans les chambres d'essai, caractérisée par sa température, son pH, sa teneur en ammoniaque, sa dureté totale et sa concentration en oxygène dissous;
|
|
—
|
informations détaillées sur le traitement des échantillons d'eau, de sédiment et de vers, y compris les détails concernant la préparation, le stockage, les procédures d'enrichissement en substance d'essai, l'extraction et les procédures analytiques (et leur précision) pour la substance d'essai et la teneur en lipide, et les méthodes de récupération de la substance d'essai.
|
|
|
|
Résultats
|
—
|
mortalité des vers témoins et des vers dans chaque chambre d'essai et éventuels effets sous-létaux observés, y compris un comportement anormal (p. ex. évitement du sédiment, présence ou absence de coprolithes, absence de reproduction);
|
|
—
|
mesure du poids sec en % du poids humide (ou rapport poids sec/poids humide) du sédiment et des organismes d'essai (utiles pour la normalisation);
|
|
—
|
teneur en lipide des vers;
|
|
—
|
courbe montrant les cinétiques d'absorption et d'élimination de la substance d'essai chez les vers, et la durée pour atteindre l'état quasi stationnaire;
|
|
—
|
Ca, Cs et Cw (avec écart type et étendue, si nécessaire) pour toutes les dates d'échantillonnage (Ca exprimé en g.kg– 1 de poids humide et sec de l'ensemble du corps, Cs exprimé en g.kg– 1 de poids humide et sec de sédiment, et Cw en mg.l– 1). Si un facteur d'accumulation biote-sédiment (BSAF, voir la définition en Appendice 1) est nécessaire (p. ex. pour une comparaison des résultats entre deux essais ou plus réalisés avec des animaux de teneur en lipide différente), Ca devrait en plus être exprimé en g.kg– 1 de teneur en lipide de l'organisme et Cs devrait être exprimé en g.kg– 1 de carbone organique (CO) du sédiment;
|
|
—
|
on peut également rapporter en plus les données suivantes: FBA (exprimé en kg de sédiment humide.kg– 1 de ver humide), constante de vitesse d'absorption sédimentaire ks (exprimée en g de sédiment humide.kg– 1 de vers humides.j– 1), et la constante de vitesse d'élimination ke (exprimée en j– 1); BSAF (exprimé en kg de CO du sédiment.kg– 1 de teneur en lipide des vers);
|
|
—
|
résidus non éliminés (RNE) à la fin de la phase d'élimination;
|
|
—
|
le cas échéant: les pourcentages de substance parente, les produits de dégradation et les résidus liés (c.- à-d. le pourcentage de substance d'essai ne pouvant être extraite par les méthodes d'extraction courantes) détectés dans les animaux d'essai;
|
|
—
|
méthodes utilisées pour les analyses statistiques des données.
|
|
|
|
Évaluation des résultats
|
—
|
conformité des résultats avec les critères de validité tels qu'ils sont listés au paragraphe 21;
|
|
—
|
résultats inattendus ou inhabituels, p. ex. élimination incomplète de la substance d'essai des animaux d'essai; dans ce cas, les résultats d'une éventuelle étude préliminaire peuvent fournir des informations utiles
|
|
|
Appendice 1
Définitions et unités
|
|
Sédiment artificiel, ou sédiment formulé, reconstitué ou synthétique: mélange de matériaux utilisé pour simuler les composants physiques d'un sédiment naturel.
|
|
|
Bioaccumulation: augmentation de concentration de la substance d'essai dans ou sur un organisme, par rapport à la concentration de la substance d'essai dans le milieu environnant. La bioaccumulation est le résultat combiné des processus de bioconcentration et de bioamplification (voir ci-dessous).
|
|
|
Facteur de bioaccumulation (FBA): concentration de la substance d'essai dans/sur l'organisme d'essai (Ca en g.kg– 1 de poids humide ou sec) divisée par la concentration de la substance dans le milieu environnant (Cs en g.kg– 1 de poids de sédiment humide ou sec) à tout instant durant la phase d'absorption d'un essai de bioaccumulation. Afin de conserver le lien avec Ca et Cs, le FBA est exprimé en kg de sédiment.kg– 1 de ver (15).
|
|
|
Les facteurs de bioaccumulation calculés directement à partir du rapport de la constante de vitesse d'absorption sédimentaire divisée par la constante de vitesse d'élimination (ks et ke, respectivement — voir ci-dessous) sont dénommés facteurs de bioaccumulation cinétique (FBAk).
|
|
|
Bioconcentration: augmentation de concentration de la substance d'essai dans ou sur un organisme, résultant exclusivement de l'absorption via la surface du corps, par rapport à la concentration de la substance d'essai dans le milieu environnant.
|
|
|
Bioamplification: augmentation de concentration de la substance d'essai dans ou sur un organisme, résultant principalement de l'absorption d'aliments ou de proies contaminés, par rapport à la concentration de la substance d'essai dans l'alimentation ou la proie. La bioamplification peut conduire à un transfert ou à une accumulation de la substance d'essai dans les réseaux trophiques.
|
|
|
Facteur d'accumulation biote-sédiment (BSAF): concentration de la substance d'essai à l'état quasi stationnaire normalisée par rapport aux lipides dans/sur l'organisme d'essai divisée par la concentration de la substance normalisée par rapport au carbone organique, dans le sédiment à l'état quasi stationnaire. Ca est alors exprimée en g kg– 1 de teneur en lipides de l'organisme, et Cs en g kg– 1 de teneur en carbone organique du sédiment.
|
|
|
Période de conditionnement: sert à stabiliser le composant microbien du sédiment et à enlever p. ex. l'ammoniaque provenant des composants du sédiment; elle a lieu avant l'enrichissement du sédiment avec la substance d'essai. Généralement, une fois le conditionnement terminé, l'eau surjacente est éliminée.
|
|
|
Élimination d'une substance d'essai: perte de cette substance par les tissus de l'organisme d'essai selon des processus actifs ou passifs survenant indépendamment de la présence ou de l'absence de la substance d'essai dans le milieu environnant.
|
|
|
Phase d'élimination: durée, suite au transfert des organismes d'essai depuis un milieu contaminé dans un milieu ne contenant pas la substance d'essai, durant laquelle est étudiée l'élimination (ou la perte nette) de la substance par les organismes.
|
|
|
Constante de vitesse d'élimination (ke): valeur numérique définissant la vitesse de réduction de la concentration de la substance d'essai dans/sur l'organisme d'essai, suite au transfert des organismes d'essai depuis un milieu contenant la substance d'essai vers un milieu ne contenant pas la substance; ke est exprimé en j– 1.
|
|
|
Période d'équilibration: utilisée afin de tenir compte de la distribution de la substance d'essai entre la phase solide, l'eau interstitielle et l'eau surjacente; elle a lieu après l'enrichissement du sédiment avec la substance d'essai et avant l'addition des organismes d'essai.
|
|
|
Coefficient de partage octanol-eau (Koe): rapport des solubilités de la substance dans le n-octanol et dans l'eau à l'équilibre; il est parfois exprimé par Poe. Le logarithme de Koe (log Koe) est utilisé comme indicateur du potentiel de bioaccumulation de la substance par les organismes aquatiques.
|
|
|
Coefficient de partage carbone organique-eau (Kco): rapport de la concentration d'une substance dans/sur la fraction carbone organique d'un sédiment à la concentration de la substance dans l'eau à l'équilibre.
|
|
|
Eau surjacente: eau se trouvant au-dessus du sédiment dans le récipient d'essai.
|
|
|
Plateau ou état quasi stationnaire: définit l'équilibre entre les processus d'absorption et d'élimination survenant simultanément durant la phase d'exposition. L'état quasi stationnaire est atteint, dans le tracé du FBA pour chaque période d'échantillonnage en fonction du temps, lorsque la courbe devient parallèle à l'axe des temps et que trois analyses successives de FBA réalisées sur des échantillons pris à intervalles d'au moins deux jours se tiennent dans 20 % et qu'il n'y a pas de différence statistique significative entre les trois périodes d'échantillonnage. Pour les substances d'essai absorbées lentement, des intervalles plus appropriés seraient de sept jours (5).
|
|
|
Eau interstitielle, ou eau des pores: eau occupant l'espace entre les particules du sédiment ou du sol.
|
|
|
Constante de vitesse d'absorption sédimentaire (ks): valeur numérique définissant la vitesse d'augmentation de la concentration de la substance d'essai dans/sur l'organisme d'essai résultant de l'absorption de la phase sédimentaire. ks est exprimé en g de sédiment.kg– 1 de ver.j– 1.
|
|
|
Sédiment enrichi: sédiment auquel une substance d'essai a été ajoutée.
|
|
|
Facteur de bioaccumulation à l'état quasi stationnaire (FBAss): FBA à l'état quasi stationnaire et n'évolue pas significativement dans le temps, la concentration de la substance d'essai dans le milieu environnant (Cs en g.kg– 1 de poids de sédiment humide ou sec) étant constante sur cette durée.
|
|
|
Phase d'absorption ou d'exposition: durée pendant laquelle les organismes d'essai sont exposés à la substance d'essai.
|
Appendice 2
Calcul des paramètres d'absorption et d'élimination
Le critère d'évaluation principal d'un essai de bioaccumulation est le facteur de bioaccumulation, FBA. Il est possible de calculer le FBA en divisant la concentration de la substance d'essai dans l'organisme d'essai, Ca, par la concentration de la substance d'essai dans le sédiment, Cs, à l'état quasi stationnaire. Si l'état quasi stationnaire n'est pas atteint durant la phase d'absorption, le FBA est calculé de la même manière pour le jour 28. Toutefois, on doit indiquer si le FBA est basé, ou non, sur des concentrations à l'état quasi stationnaire.
Les méthodes préférées pour l'obtention du facteur de bioaccumulation cinétique (FBAK), de la constante de vitesse d'absorption sédimentaire (ks) et de la constance de vitesse d'élimination (ke) consistent à utiliser des méthodes d'estimation des paramètres non linéaires de manière informatique. Pour une série temporelle de facteurs d'accumulation (FA) moyens donnée (Ca, valeurs moyennes pour chaque date d'échantillonnage/Cs, valeurs moyennes pour chaque d'échantillonnage = FA) de la phase d'absorption basée sur le poids humide de ver et de sédiment, et l'équation modèle
|
FA(t) = FBA × (1 – eke × t)
|
[équation 1]
|
où FA(t) est le rapport de la concentration de la substance d'essai dans les vers et de sa concentration dans le sédiment à un instant (t) quelconque de la phase d'absorption, ces programmes informatiques calculent les valeurs de FBAK, ks et ke.
Lorsqu'on a atteint un état quasi stationnaire durant la phase d'absorption (c.-à-d. t = ∞), il est possible de réduire l'équation 1 à:
|

|
[équation 2]
|
où
|
ks
|
=
|
constante de vitesse d'absorption [en g de sédiment.kg– 1 de ver.j– 1]
|
|
ke
|
=
|
constante de vitesse d'élimination [j– 1]
|
Ensuite ks/ke×Cs donne une valeur approchée de la concentration de la substance d'essai dans le tissu du ver à l'état quasi stationnaire (Ca,ss).
Le facteur d'accumulation biote-sédiment (BSAF) doit être calculé comme suit:
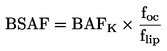
où foc est la fraction de carbone organique dans le sédiment, et flip est la fraction de lipide dans le ver, toutes deux basées soit sur le poids sec, soit sur le poids humide.
Pour une série temporelle donnée de valeurs de concentrations, il est possible de modéliser les cinétiques d'élimination en utilisant les équations du modèle suivantes et un calcul informatique fondé sur une méthode d'estimation des paramètres non linéaire.
On recommande d'utiliser le résidu corporel moyen mesuré à la fin de la phase d'absorption comme point de départ par défaut. L'utilisation de la valeur modélisée/estimée à partir de la phase d'absorption ne devrait être utilisée que, p. ex. si la valeur mesurée s'écarte significativement du résidu corporel modélisé. Voir également le paragraphe 50 pour une variante de pré-exposition des vers destinés à l'élimination; avec cette approche, des échantillons de ces vers pré-exposés au jour 0 de la phase d'élimination sont supposés fournir une valeur du résidu corporel réaliste, avec laquelle il est possible de démarrer la cinétique d'élimination.
Si le tracé des données en fonction du temps indique une décroissance exponentielle constante de la concentration de la substance d'essai dans les animaux, l'évolution temporelle de l'élimination peut être décrite par un modèle à un compartiment (équation 4).
|

|
[équation 3]
|
Les processus d'élimination semblent parfois évoluer en deux étapes, en montrant une décroissance rapide de Ca au cours des premières étapes, qui évolue vers une perte plus lente des substances d'essai dans les étapes ultérieures de l'élimination (8) (19) (26)). Les deux étapes peuvent être interprétées en faisant l'hypothèse de l'existence de deux compartiments dans l'organisme; compartiments à partir desquels la substance d'essai est éliminée à différentes vitesses. Dans ces cas particuliers, il convient d'étudier attentivement la littérature (15) (16) (17) (25).
L'équation ci dessous, par exemple, décrit une élimination à deux compartiments (25):
|
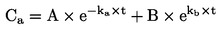
|
[équation 4]
|
A et B représentent les dimensions des compartiments (en pourcentage du résidu de tissu total), où A est le compartiment éliminant rapidement la substance et B est le compartiment ou l'élimination de la substance d'essai est la plus lente. La somme de A et de B fait 100 % de l'ensemble du volume du compartiment animal à l'état quasi stationnaire. ka et kb représentent les constantes d'élimination correspondantes [j– 1]. Si le modèle à deux compartiments correspond aux données de dépuration, il est possible de calculer la constante de vitesse d'absorption ks comme suit (53) (54):
|

|
[équation 5]
|
Quoi qu'il en soit, ces équations modèles doivent être utilisées avec précaution, en particulier lorsque des modifications de la biodisponibilité de la substance d'essai surviennent durant l'essai (42).
En variante aux équations modélisées décrites ci-dessus, il est également possible de calculer les cinétiques (ks et ke) en un essai, en appliquant un modèle de cinétique du premier ordre à toutes les données des phases d'absorption et d'élimination ensemble. Pour une description d'une méthode pouvant permettre un tel calcul combiné des constantes de vitesse d'absorption et d'élimination, consulter les références (55), (56) et (57).
Les résidus non éliminés (RNE) devraient être calculés comme un critère d'évaluation secondaire en multipliant le rapport de la concentration moyenne dans les vers (Ca) au dixième jour de la phase d'élimination à la concentration moyenne dans les vers (Ca) à l'état quasi stationnaire (28e jour de la phase d'absorption) par 100:

Appendice 3
Exemple de planning d'échantillonnage pour un essai de bioaccumulation sur 28 jours
a) Phase d'absorption (incluant une phase d'équilibration de 4 jours)
|
Jour
|
Activités
|
|
– 6
|
Préparation d'une suspension de tourbe pour le sédiment, conditionnement de la suspension durant 48 h;
|
|
– 4
|
Enrichissement du sédiment ou d'une fraction du sédiment; mélange de tous les constituants du sédiment; prélèvement d'échantillons de sédiment des sédiments témoins traité et solvant pour détermination de la concentration en élément d'essai; ajout d'eau surjacente; incubation dans les conditions de l'essai (phase d'équilibration);
|
|
– 3/– 2
|
Séparation des organismes d'essai de la culture pour acclimatation;
|
|
0
|
Mesure de la qualité de l'eau (voir le paragraphe 52); retrait d'expériences identiques pour la prise d'échantillons d'eau et de sédiment pour la détermination de la concentration de substance d'essai; répartition aléatoire des vers dans les chambres d'essai conservation de suffisamment de sous-échantillons de vers pour la détermination des valeurs de bruit de fond analytique; contrôle de l'alimentation en air, dans le cas d'un système fermé;
|
|
1
|
Retrait d'expériences identiques pour échantillonnage; contrôle de l'alimentation en air, du comportement des vers, de la qualité de l'eau (voir le paragraphe 56); prélèvement d'échantillons d'eau, de sédiment et de vers pour la détermination de la concentration de la substance d'essai;
|
|
2
|
Contrôle de l'alimentation en air, du comportement des vers et de la température;
|
|
3
|
Comme au 1er jour;
|
|
4 - 6
|
Comme au 2e jour;
|
|
7
|
Comme au 1er jour; si nécessaire, compenser l'évaporation de l'eau;
|
|
8 - 13
|
Comme au 2e jour;
|
|
14
|
Comme au 1er jour; si nécessaire, compenser l'évaporation de l'eau;
|
|
15 - 20
|
Comme au 2e jour;
|
|
21
|
Comme au 1er jour; si nécessaire, compenser l'évaporation de l'eau
|
|
22 - 27
|
Comme au 2e jour;
|
|
28
|
Comme au 1er jour; mesure de la qualité de l'eau (voir le paragraphe 52); fin de la phase d'absorption; conservation de suffisamment de sous-échantillons de vers pour la détermination des valeurs de bruit de fond analytique, du poids sec et humide et de la teneur en lipide; transfère des vers depuis les expériences identiques exposées restantes vers des récipients contenant du sédiment propre pour la phase d'élimination (sans purge de l'intestin); échantillonnage de l'eau, du sédiment et des vers des témoins solvants; échantillonnage des solutions pièges, le cas échéant.
|
|
|
Les activités de pré-exposition (phase d'équilibration) devraient être programmées en tenant compte des propriétés de la substance d'essai. Si nécessaire, conditionnement du sédiment préparé sous de l'eau surjacente à 20 ± 2 °C durant 7 jours; dans ce cas, préparation préalable du sédiment!
|
|
|
Les activités décrites pour le 2e jour devraient être réalisées quotidiennement (au moins les jours travaillés).
|
b) Phase d'élimination
|
Jour
|
Activités
|
|
– 6
|
Préparation d'une suspension de tourbe pour le sédiment, conditionnement de la suspension durant 48 h;
|
|
– 4
|
Mélange de tous les constituants du sédiment; prélèvement d'échantillons de sédiment des sédiments témoins traité et solvant pour détermination de la concentration en élément d'essai; ajout d'eau surjacente; incubation dans les conditions de l'essai;
|
|
0 (28e jour d'absorption)
|
Mesure de la qualité de l'eau (voir le paragraphe 52); transfert des vers depuis les de la phase expériences identiques exposées restantes vers les récipients contenant du sédiment propre; après 4 à 6 h, retrait d'expériences identiques pour la prise d'échantillons d'eau, de sédiment et de vers pour la détermination de la concentration en substance d'essai; répartition aléatoire des vers dans les chambres d'essai;
|
|
1
|
Retrait d'expériences identiques pour échantillonnage; contrôle de l'alimentation en air, du comportement des vers, de la qualité de l'eau (voir le paragraphe 52); prélèvement d'échantillons d'eau, de sédiment et de vers pour la détermination de la concentration de la substance d'essai;
|
|
2
|
Contrôle de l'alimentation en air, du comportement des vers et de la température;
|
|
3
|
Comme au 1er jour;
|
|
4
|
Comme au 2e jour;
|
|
5
|
Comme au 1er jour;
|
|
6
|
Comme au 2e jour;
|
|
7
|
Comme au 1er jour; si nécessaire, compenser l'évaporation de l'eau;
|
|
8 - 9
|
Comme au 2e jour;
|
|
10
|
Comme au 1er jour; fin de la phase d'élimination; mesure de la qualité de l'eau (voir le paragraphe 52); échantillonnage de l'eau, du sédiment et des vers des témoins solvants; échantillonnage des solutions pièges, le cas échéant.
|
|
|
La préparation du sédiment avant de débuter la phase d'élimination doit être conduite de la même manière que préalablement à la phase d'absorption.
|
|
|
Les activités décrites pour le 2e jour devraient être réalisées quotidiennement (au moins les jours travaillés).
|
Appendice 4
Quelques caractéristiques physico-chimiques d'une eau de dilution acceptable
|
CONSTITUANT
|
CONCENTRATIONS
|
|
Matière particulaire
|
< 20 mg/l
|
|
Carbone organique total
|
< 2 μg/l
|
|
Ammoniaque non ionisée
|
< 1 μg/l
|
|
Chlore résiduel
|
< 10 μg/l
|
|
Pesticides organophosphorés totaux
|
< 50 ng/l
|
|
Pesticides organochlorés totaux plus biphényles polychlorés
|
< 50 ng/l
|
|
Chlore organique total
|
< 25 ng/l
|
COMPOSITION DE L'EAU RECONSTITUÉE RECOMMANDÉE
|
a)
|
Solution de chlorure de calcium
Dissoudre 11,76 g de CaCl2 2 H2O dans de l'eau déionisée; ajuster à 1 l avec de l'eau déionisée
|
|
b)
|
Solution de sulfate de magnésium
Dissoudre 4,93 g de MgSO4 7 H2O dans de l'eau déionisée; ajuster à 1 l avec de l'eau déionisée
|
|
c)
|
Solution de bicarbonate de sodium
Dissoudre 2,59 g de NaHCO3 dans de l'eau déionisée; ajuster à 1 l avec de l'eau déionisée
|
|
d)
|
Solution de chlorure de potassium
Dissoudre 0,23 g de KCl dans de l'eau déionisée; ajuster à 1 l avec de l'eau déionisée
|
Tous les produits chimiques doivent être de qualité analytique.
La conductivité de l'eau distillée ou déionisée ne doit pas dépasser 10 μS.cm– 1.
25 ml de chacune des solutions a) à d) sont mélangés et le volume total est ajusté à 1 l avec de l'eau déionisée. La somme des concentrations en ions calcium et magnésium dans cette solution est de 2,5 mmol/l.
Le rapport ionique Ca:Mg est de 4:1 et Na:K est de 10:1. La capacité acide KS4,3 de cette solution est de 0,8 mmol/l.
Aérer l'eau de dilution jusqu'à atteindre la saturation en oxygène, puis la stocker durant approximativement deux jours sans aération supplémentaire avant utilisation.
Le pH d'une eau de dilution acceptable doit être dans la plage de 6 à 9.
Appendice 5
Sédiment artificiel — recommandations pour la préparation et le stockage
Contrairement aux exigences de la méthode d'essai C.8 (40), on recommande une teneur en tourbe de 2 % pour le sédiment artificiel plutôt que de 10 %, du poids sec, afin de correspondre à une teneur organique faible à modérée des sédiments naturels (58).
Pourcentage des constituants secs du sédiment artificiel:
|
Constituant
|
Caractéristiques
|
% du sédiment sec
|
|
Tourbe
|
Tourbe de sphaigne, degré de décomposition: “moyen”, séchée à l'air, pas de résidus végétaux visibles, finement broyée (taille de particules ≤ 0,5 mm)
|
2 ± 0,5
|
|
Sable de quartz
|
Taille de grains: ≤ 2 mm, mais > 50 % des particules doivent être dans la plage de 50 à 200 μm
|
76
|
|
Argile kaolinique
|
Teneur en kaolinite ≥ 30 %
|
22 ± 1
|
|
Aliments
|
Folia urticae, poudre de feuilles ď Urtica sp. (ortie brûlante), finement broyées (taille de particules ≤ 0,5 mm), ou un mélange de feuille en poudre d'Urtica sp. avec de la cellulose alpha (1:1); conformément aux normes de pharmacie, pour la consommation humaine; en plus du sédiment sec
|
0,4 - 0,5 %
|
|
Carbonate de calcium
|
CaCO3, pulvérisé, chimiquement pur, en plus du sédiment sec
|
0,05 - 1
|
|
Eau déionisée
|
Conductivité ≤ 10 μS/cm, en plus du sédiment sec
|
30 - 50
|
Si on s'attend à une concentration élevée en ammoniaque, p. ex. si la substance d'essai est connue pour inhiber la nitrification, il peut être utile de remplacer 50 % de la poudre d'ortie riche en azote par de la cellulose (p. ex.,de la poudre de cellulose α, chimiquement pure, taille de particule ≤ 0,5 mm).
Préparation
La tourbe est séchée à l'air et broyée en une poudre fine (taille de grain ≤ 0,5 mm, pas de résidus végétaux visibles). Une suspension de la quantité de tourbe voulue est préparée en utilisant une partie de l'eau déionisée devant être ajoutée au sédiment sec [un volume d'eau de 11,5 × le poids sec de tourbe a donné une suspension de tourbe qui a pu être agitée (8)] en utilisant un dispositif d'homogénéisation haute performance.
Le pH de cette suspension est ajusté à 5,5 ± 0,5 avec CaCO3. La suspension est conditionnée durant au moins deux jours sous agitation douce à 20 ± 2 °C, afin de stabiliser le pH et d'établir une composante microbienne stable. Le pH est de nouveau mesuré et ajusté à 6,0 ± 0,5 avec CaCO3 si nécessaire. Ensuite l'ensemble de la suspension est mélangé aux autres constituants secs, en prenant en compte l'éventuelle part utilisée pour l'enrichissement. L'eau déionisée restante est ajoutée afin d'obtenir un sédiment homogène. Le pH est de nouveau mesuré et ajusté à 6,5 à 7,5 avec CaCO3 si nécessaire. Toutefois, si on s'attend à un dégagement d'ammoniac, il peut être utile de conserver le pH du sédiment inférieur à 7,0 (p. ex. entre 6,0 et 6,5). Des échantillons du sédiment sont prélevés afin d'en déterminer le poids sec et la teneur en carbone organique. Si on s'attend à un dégagement d'ammoniac, le sédiment artificiel peut être conditionné durant sept jours dans les conditions des essais à venir (p. ex. rapport sédiment:eau de 1:4, hauteur de la couche de sédiment comme dans les récipients d'essai) avant enrichissement avec la substance d'essai, c.-à-d. il doit être recouvert d'eau, laquelle doit être aérée. À la fin de la période de conditionnement, l'eau surjacente devra être enlevée et éliminée. Des échantillons du sédiment sont prélevés afin de déterminer le poids sec et la teneur en carbone organique total (p. ex. 3 échantillons).
Après quoi, le sable de quartz enrichi est mélangé au sédiment pour chaque niveau de traitement, le sédiment est réparti dans les récipients d'essai d'expériences identiques et recouvert avec l'eau d'essai (p. ex. avec un rapport sédiment:eau de 1:4, une hauteur de la couche de sédiment comme dans les récipients d'essai). Les récipients sont ensuite incubés dans les conditions de l'essai à venir. Ceci définit le point de départ de la période d'équilibration. L'eau surjacente doit être aérée.
La source de nourriture choisie doit être ajoutée avant ou durant l'enrichissement du sédiment avec la substance d'essai. Elle peut être mélangée dès le départ à la suspension de tourbe (voir plus haut). Toutefois, il est possible d'éviter une dégradation excessive de la source de nourriture avant addition des organismes d'essai — p. ex. en cas de période d'équilibration longue — en réduisant autant que possible la durée entre l'addition des aliments et le début de l'exposition. Afin d'assurer que la nourriture est en contact suffisant avec le composé d'essai, la source de nourriture ne doit pas être mélangée avec le sédiment plus d'une journée après l'enrichissement du sédiment avec la substance d'essai. On peut faire une exception lorsque la durée de la période d'équilibration conduit à une dégradation microbienne excessive des aliments avant ajout des organismes d'essai. Des échantillons du sédiment sont prélevés afin de déterminer le poids sec et la teneur en carbone organique total (p. ex. 3 échantillons de sédiment enrichis ou témoins).
Le poids sec des composants (tourbe, sable, kaolin) devrait être rapporté en g et en pourcentage du poids sec total.
Le volume d'eau devant être ajouté aux composants secs durant la préparation du sédiment devrait également être rapporté en pourcentage du poids total (p. ex. 100 % de poids sec + 46 % d'eau signifie qu'un poids sec de 1 000 g reçoit un total de 460 ml d'eau, ce qui conduit à 1 460 g de sédiment humide).
Stockage
Les constituants secs du sédiment artificiel peuvent être stockés dans un endroit frais, sec à température ambiante. Le sédiment humide préparé peut être stocké (uniquement pour un usage en culture) à 4 ± 2 °C à l'abri de la lumière durant 2 à 4 semaines à compter du jour de la préparation (8).
Un sédiment enrichi avec la substance d'essai devrait être utilisé immédiatement, sauf si des informations spécifient qu'il est possible de stocker ce sédiment sans affecter la toxicité et la biodisponibilité de la substance d'essai. Des échantillons de sédiment enrichi peuvent être stockés dans les conditions recommandées pour la substance d'essai donnée jusqu'à analyse.
Appendice 6
Espèces oligochètes recommandées pour les essais de bioaccumulation
Tubifex tubifex (MÜLLER),Tubificidae, oligochaeta
L'oligochète tubificidé (Tubificidae, Oligochaeta) Tubifex tubifex (Müller) vie dans les sédiments d'eau douce dans des tubes enduits de mucus. Les vers vivent dans ces tubes, la tête en bas, ingérant les particules de sédiment en utilisant les micro-organismes et les débris organiques associés. La portion postérieure ondule généralement dans l'eau surjacente pour permettre au ver de respirer. Bien que cette espèce se rencontre dans une grande variété de sédiments sur tout l'hémisphère nord, Tubifex tubifex affectionne particulièrement les grains fins (59). Les raisons de l'adéquation de cette espèce pour des essais écotoxicologiques sont décrites, par exemple, dans (8) (29) (31) (39) (60) (62) (63).
Méthodes de culture
Afin de disposer d'un nombre suffisant de Tubifex tubifex pour conduire les essais de bioaccumulation, les vers devront être conservés dans une culture de laboratoire permanente. Un système consistant en un sédiment artificiel basé sur le sol artificiel de la méthode d'essai C.8 (40) et une eau reconstituée conformément à la méthode d'essai C.1 est recommandé pour la culture de T. tubifex (8).
Des récipients en verre ou en acier inoxydable d'une hauteur de 12 à 20 cm peuvent être utilisés comme récipients de culture. Chaque récipient de culture est chargé d'une couche de sédiment artificiel humide préparé selon la description de l'Appendice 5. L'épaisseur de la couche de sédiment doit permettre aux vers d'adopter un comportement d'enfouissement naturel (au minimum 2 cm de profondeur pour T. tubifex). Une eau reconstituée est ajoutée au système. Opérer soigneusement afin de ne pas perturber le sédiment. Le volume d'eau est doucement aéré (p. ex. 2 bulles par seconde avec un air filtré à 0,45 μm) via une pipette pasteur placée 2 cm au-dessus de la surface du sédiment. La température de culture recommandée est de 20 ± 2 °C.
Les vers sont ajoutés au système de culture avec une charge maximum de 20 000 individus/m2 de surface de sédiment. Une charge supérieure peut provoquer une réduction des vitesses de croissance et de reproduction (43).
Dans des cultures en sédiment artificiel, les vers doivent être nourris. Un régime alimentaire consistant en du poisson finement broyé, p. ex. du TetraMin®, peut servir de nutriment supplémentaire (8); Klerks 1994, communication personnelle. La fréquence de l'alimentation doit permettre une croissance et une reproduction suffisantes et doit maintenir au minimum l'accumulation d'ammoniaque et la croissance de champignons dans la culture. La nourriture peut être administrée deux fois par semaine (p. ex. à raison de 0,6 à 0,8 mg par cm2 de surface sédimentaire). L'expérience a montré que l'utilisation de nourriture mise en suspension et homogénéisée dans de l'eau déionisée peut faciliter une distribution homogène de la nourriture sur la surface du sédiment, dans les récipients de culture.
Afin d'éviter l'accumulation d'ammoniaque, l'eau surjacente devrait être renouvelée en utilisant un système dynamique ou, manuellement, au moins une fois par semaine. Dans les cultures de réserve, le sédiment devrait être remplacé tous les trois mois.
Si seuls des vers adultes sont nécessaires, il est possible de réaliser l'échantillonnage des vers à partir de la culture en tamisant le sédiment de culture au travers d'un tamis de 1 mm. Pour conserver des cocons, il convient d'utiliser un tamis de 0,5 mm et pour les jeunes, un tamis de 0,25 mm. Une fois que le sédiment est passé au travers, les tamis peuvent être placés dans de l'eau reconstituée. Les vers quittent le tamis et peuvent ensuite être prélevés dans l'eau en utilisant une pince en acier souple ou une pipette dont l'extrémité a été adoucie à la flamme.
Seuls des spécimens intacts et clairement identifiés de Tubifex tubifex [p. ex. (64)] sont utilisés pour démarrer l'essai ou de nouvelles cultures. Les vers malades ou blessés ainsi que les cocons infestés par une mycose doivent être éliminés.
Une culture synchronisée peut fournir des vers d'un âge spécifique à intervalles adaptés à la demande. De nouveaux récipients de culture sont mis en place aux intervalles voulus (p. ex. toutes les deux semaines), en démarrant avec des animaux d'âge connu (p. ex. des cocons). Dans les conditions de culture décrites ici, les vers sont adultes après 8 à 10 semaines. Les cultures peuvent être “récoltées” lorsque les vers ont formé de nouveaux cocons, p. ex. après dix semaines. Les adultes échantillonnés peuvent être utilisés pour les essais, et de nouvelles cultures peuvent être démarrées avec les cocons.
Lumbriculus variegatus (MÜLLER), Lumbriculidae, oligochaeta
Lumbriculus variegatus (Lumbriculidae, Oligochaeta) est également un habitant des sédiments d'eau douce présent partout sur terre et il est largement utilisé dans des essais écotoxicologiques. On peut trouver des informations sur la biologie, les conditions de culture et la sensibilité de l'espèce dans (1) (6) (9) (36). Il est également possible de cultiver Lumbriculus variegatus dans le sédiment artificiel recommandé pour T. tubifex conformément à (8) avec certaines limitations. Comme, dans la nature, L. variegatus préfère des sédiments plus grossiers que T. tubifex (59), les cultures de laboratoire avec le sédiment artificiel utilisé pour T. tubifex peuvent s'éteindre après 4 à 6 mois. L'expérience a montré que L. variegatus peut être conservé dans un substrat sableux (p. ex. du quartz, des graviers fins) dans un système dynamique, en utilisant une alimentation à base de poissons, durant plusieurs années sans renouvellement du substrat. Un avantage majeur de L. variegatus par rapport à d'autres espèces d'oligochètes est sa rapidité de reproduction, qui conduit à une augmentation rapide de la biomasse des populations cultivées en laboratoire (1) (6) (9) (10).
Méthodes de culture
Les conditions de culture pour Lumbriculus variegatus sont détaillées par Phipps et al. (1993) (10), Brunson et al. (1998) (28), ASTM (2000) (1), U.S. EPA (2000) (6). Un bref résumé de ces conditions est donné ci-dessous.
Les vers peuvent être cultivés dans de grands aquariums (57 à 80 l) à 23 °C avec une photopériode de 16L:8D (100 à 1 000 lux) en utilisant une eau naturelle renouvelée quotidiennement (45 à 50 l par aquarium). Le substrat est préparé en découpant des serviettes en papier brun non blanchi en rubans, lesquels peuvent ensuite être mélangés à l'eau de culture durant quelques secondes pour donner de petits morceaux de substrat de papier. Ce substrat peut ensuite être utilisé directement dans les aquariums de culture de Lumbriculus en couvrant le fond du récipient, ou être stocké congelé dans de l'eau déionisée pour une utilisation ultérieure. Un substrat neuf dans le réservoir durera généralement environ deux mois.
Chaque culture de vers démarre avec 500 à 1 000 vers et est alimentée par 10 ml d'une suspension contenant 6 g d'un starter à base de truite, 3 fois par semaine, en conditions dynamiques. Les cultures statiques ou semi-statiques devraient être alimentées moins fréquemment afin d'éviter le développement de bactéries et de champignons. Le substrat de nourriture et de papier devrait être analysé en y recherchant les substances chimiques utilisées dans les essais de bioaccumulation.
Dans ces conditions, le nombre d'individus de la culture double généralement en environ 10 à 14 jours.
Lumbriculus variegatus peut être sorti des cultures p. ex. en transférant soit le substrat avec un filet à mailles fines, soit les organismes en utilisant une pipette de verre à grande ouverture (environ 5 mm de diamètre) dont l'extrémité a été adoucie à la flamme, vers un bécher indépendant. Si du substrat est transféré dans ce bécher, le bécher contenant des vers et du substrat est laissé une nuit dans des conditions dynamiques, ce qui permet d'évacuer le substrat du bécher, alors que les vers restent dans le fond du récipient. Ils peuvent ensuite être introduits dans des récipients de culture fraîchement préparés, ou traités pour l'essai comme cela est indiqué dans (1) et (6). Il conviendra d'éviter les blessures ou l'autotomie des vers, p. ex. en utilisant des pipettes dont les bords ont été adoucis à la flamme, ou des pinces en acier inoxydable pour la manipulation de ces vers.
Un problème critique lors de l'utilisation de L. variegatus dans des essais de bioaccumulation concerne son mode de reproduction (architomie suivie de morphallaxie). Cette reproduction asexuée conduit à deux fragments qui, pendant un certain temps, ne s'alimentent pas jusqu'à ce que la partie tête ou queue soit régénérée (p. ex. (36) (37)). Ceci signifie que l'absorption de sédiment et de contaminant par ingestion ne peut avoir lieu en continu chez L. variegatus comme chez les tubificidés, qui ne se reproduisent pas par fragmentation.
Par conséquent, une synchronisation doit être réalisée afin de minimiser une reproduction et une régénération non contrôlée, qui s'ensuivraient d'une variation importante des résultats des essais. Une telle variation peut survenir, lorsque certains individus, qui se sont fragmentés et par conséquent ne s'alimentent pas durant un certain temps, sont moins exposés à la substance d'essai que les autres individus, qui ne se sont pas fragmentés durant l'essai, p. ex. (38). 10 à 14 jours avant le début de l'exposition, les vers devraient être fragmentés artificiellement (synchronisation) (65). Il est préférable d'utiliser des grands vers, ne montrant, de préférence, pas de signes de fragmentation récente. Ces vers peuvent être placés sur une lame de verre dans une goutte d'eau de culture, et disséqués dans la région médiane du corps avec un scalpel. Il convient de veiller à ce que les extrémités postérieures soient de taille similaire. On doit ensuite laisser les extrémités postérieures régénérer de nouvelles têtes dans un récipient de culture contenant un substrat identique à celui utilisé dans la culture et de l'eau reconstituée, jusqu'au début de l'exposition. La régénération de nouvelles têtes est indiquée par l'enfouissement des vers synchronisés, dans le substrat (la présence des têtes régénérées peut être confirmée par inspection d'un sous échantillon représentatif au microscope binoculaire). Les organismes d'essai sont par la suite supposés être dans un état physiologique similaire. Ceci signifie que, lorsque de la régénération par morphollaxie survient chez des vers synchronisés en cours d'essai, virtuellement tous les animaux sont supposés être également exposés au sédiment enrichi. L'alimentation des vers synchronisés devrait être réalisée dès que les vers commencent à s'enfouir dans le substrat, ou 7 jours après dissection. Le régime alimentaire devra être comparable à celui des cultures classiques, mais il est recommandé d'alimenter les vers synchronisés avec la même source de nourriture que celle utilisée durant l'essai. Les vers devraient être conservés à la température de l'essai, soit 20 ± 2 °C. Après régénération, des vers complets, intacts, de taille similaire, nageant ou rampant activement lors d'une stimulation douce, devraient être utilisés pour l'essai. Il conviendra d'éviter les blessures ou l'autotomie des vers, p. ex. en utilisant des pipettes dont les bords ont été adoucis à la flamme, ou des pinces en acier inoxydable pour la manipulation de ces vers.
Lorsque Lumbriculus variegatus est utilisé pour les essais, du fait du mode de reproduction particulier de cette espèce, le nombre de vers devrait augmenter durant l'essai, si les conditions le permettent (6). Une absence de reproduction lors d'un essai de bioaccumulation avec L. variegatus devrait être relevée et prise en compte lors de l'interprétation des résultats.
Branchiura sowerbyi (BEDDARD), Tubificidae, oligochaeta (non validé par des essais comparatifs interlaboratoires)
On trouve Branchiura sowerbyi dans une variété de type de sédiment de réservoirs, de lacs, d'étangs et de rivières, initialement dans les régions tropicales. On peut également les trouver dans des zones d'eau chaude de l'hémisphère nord. Toutefois, ils sont plus abondants dans les sédiments de boue argileuse à forte teneur en matière organique. En outre, les vers vivent dans la couche de sédiment. Même l'extrémité postérieure des vers est généralement enfouie. Cette espèce est facilement identifiée par les filaments branchiaux sur la partie postérieure. Les adultes peuvent atteindre une longueur de 9 à 11 cm et un poids humide de 40 à 50 mg. Les vers ont un taux de reproduction élevé, avec un temps de doublement de la population inférieur à 2 semaines, dans les conditions de température et d'alimentation décrites ci-dessous [Aston et al., 1982, (65)]. B. sowerbyi a été utilisé à la fois dans des études de toxicité et de bioaccumulation (Marchese & Brinkhurst 1996, (31), Roghair et al. 1996, (67) respectivement).
Méthodes de culture
Un résumé des conditions de culture est donné ci-dessous pour Branchiura sowerbyi (fourni par Mercedes R. Marchese, INALI, Argentine, et Carla J. Roghair, RIVM, Pays-Bas).
Il n'existe pas une technique unique pour la culture des organismes d'essai. Il est possible de cultiver les organismes en utilisant un sédiment naturel non contaminé (31). L'expérience a montré qu'un milieu consistant en un sédiment naturel et du sable améliore l'état des vers par rapport au sédiment naturel pur (32) (67). Des béchers de 3 l contenant 1 500 ml de milieu sédiment/eau, consistant en 375 ml de sédiment naturel non contaminé (environ 10 % de carbone organique total; environ 17 % de particules fines ≤ 63 μm), 375 ml de sable propre (M32), et 750 ml d'eau reconstituée ou d'eau du robinet déchlorée peuvent être utilisés pour la culture (31) (32) (67). Il est également possible d'utiliser des serviettes en papier comme substrat de culture, mais la croissance de population est plus lente que dans un sédiment naturel. Dans des systèmes semi-statiques, la couche d'eau, dans le bécher, est lentement aérée, et l'eau surjacente doit être renouvelée chaque semaine.
Pour démarrer, chaque bécher contient 25 jeunes vers. Après deux mois, les grands vers sont prélevés dans le sédiment avec une pince et sont placés dans un nouveau bécher avec un milieu sédiment/eau fraîchement préparé. L'ancien bécher contient également des cocons et des jeunes vers. De cette manière, il est possible de récolter jusqu'à 400 jeunes vers par bécher. Des vers adultes peuvent être utilisés pour la reproduction durant au moins un an.
Les cultures devraient être maintenues à une température de 21 à 25 °C. Les variations de température devraient être maintenues entre ± 2 °C. Le temps nécessaire au développement embryonnaire à partir de la ponte d'un œuf jusqu'à ce que le jeune quitte le cocon est d'environ trois semaines à 25 °C. La production d'œufs obtenue par un vers survivant de B. sowerbyi s'est avérée être dans la plage de 6,36 (31) à 11,2 (30) dans la boue à 25 °C. Le nombre d'œufs par cocon va de 1,8 à 2,8 (66) (69) ou jusqu'à 8 (68).
L'oxygène dissous, la dureté de l'eau, la température et le pH devraient être mesurés chaque semaine. Une alimentation à base de poisson (p. ex. TetraMin®) peut être ajoutée en suspension deux ou trois fois par semaine ad libitum. Les vers peuvent également être nourris avec de la salade décongelée ad libitum.
Un avantage majeur de cette espèce est la biomasse individuelle élevée (jusqu'à 40 à 50 mg de poids humide par individu). Par conséquent, cette espèce peut être utilisée pour des essais de bioaccumulation de substances d'essai non radiomarquées. Elle peut être exposée dans les systèmes utilisés pour T. tubifex ou L. variegatus avec un unique individu par expérience (11). Le nombre d'expériences identiques devra toutefois être augmenté, à moins d'utiliser des chambres d'essai plus grandes (11). Par ailleurs, le critère de validité concernant le comportement fouisseur doit être ajusté pour cette espèce.
BIBLIOGRAPHIE
|
(1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment- associated contaminants by benthic invertebrates, E 1688-00a. Dans ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(2)
|
Commission européenne (CE) (2003) Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I — IV. Office des publications officielles des Communautés européennes (Commission européenne), Luxembourg.
|
|
(3)
|
OCDE (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OCDE Monographie No. 60. Organisation de coopération et de développement économiques (OCDE), Paris.
|
|
(4)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. et Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(5)
|
Chapitre C.13 de la présente annexe — Bioconcentration: essai avec renouvellement continu sur les poissons.
|
|
(6)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(7)
|
Chapitre C.27 de la présente annexe — Essai de toxicité sur les chironomes dans un système eau-sédiment dopé.
|
|
(8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(9)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. et Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(10)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment- associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on “Bioaccumulation: Sediment test using benthic oligochaetes”, 26.-27.04.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(12)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
(13)
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. & Morton, R.D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301-310.
|
|
(14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim
|
|
(15)
|
Landrum, P.F., Lee II, H., & Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709-1725.
|
|
(16)
|
Markwell, R.D., Connell, D.W. & Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443-1450.
|
|
(17)
|
Gabric, A.J., Connell, D.W. & Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24, 1225-1231.
|
|
(18)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. et Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501-1514.
|
|
(20)
|
OCDE (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Publications de l'OCDE sur l'environnement, la santé et la sécurité, Série sur les essais et l'évaluation No 23.
|
|
(21)
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
(22)
|
Chapitres suivants de la présente annexe:
|
|
Chapitre A.4 — Pression de vapeur
|
|
|
Chapitre A.5 — Tension superficielle
|
|
|
Chapitre A.6 — Solubilité dans l'eau
|
|
|
Chapitre A.8 — Coefficient de partage, méthode par agitation en flacon
|
|
|
Chapitre A.24 — Coefficient de partage, méthode HPLC
|
|
|
Chapitre C.7 — Dégradation — dégradation abiotique: hydrolyse en fonction du pH
|
|
|
Chapitre C.4 A-F — Détermination de la biodégradabilité “facile”
|
|
|
Chapitre C.19 — Estimation du coefficient d'adsorption (Koc) sur le sol et les boues d'épuration par chromatographie liquide haute performance (HPLC)
|
|
|
Chapitre C.29 — Biodégradabilité facile — dégagement de CO2 dans des flacons hermétiquement clos
|
|
|
(23)
|
OCDE (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OCDE, Paris.
|
|
(24)
|
Antoine, M.D., Dewanathan, S. & Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165-172.
|
|
(25)
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke & G. Studinger (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation — New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235-276.
|
|
(26)
|
Spacie, A. & Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309-320.
|
|
(27)
|
Hawker, D.W. & Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22, 701-707.
|
|
(28)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(29)
|
Reynoldson, T.B., Thompson, S.P. and Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061-1072.
|
|
(30)
|
Aston, R.J. & Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155-160.
|
|
(31)
|
Marchese, M.R. & Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163-168.
|
|
(32)
|
Roghair, C.J. & Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
(33)
|
Chapitre C.1 de la présente annexe: Toxicité aiguë vis-à-vis des poissons.
|
|
(34)
|
OCDE (1992c). Lignes directrices pour les essais de produits chimiques n0 210. Poisson, essai de toxicité aux premiers stades de la vie. OCDE, Paris.
|
|
(35)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hofmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(36)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(37)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 2196-2202.
|
|
(38)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
(39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(40)
|
Chapitre C.8 de la présente annexe: Toxicité pour les vers de terre.
|
|
(41)
|
Environnement Canada (1995). Document d'orientation sur la mesure de la précision des essais de toxicité sur sédiments de contrôle dopé avec un produit toxique de référence. Série de la protection de l'environnement. Rapport SPE 1/RM/30.
|
|
(42)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588-595.
|
|
(43)
|
Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). In: R.O. Brinkhurst and D.G. Cook (eds.): Aquatic Oligochaeta Biology, 175-184. Plenum Press, New York.
|
|
(44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
|
|
(45)
|
Hooftman, R.N., van de Guchte, K. & Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
(46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, 1897-1905.
|
|
(47)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
(48)
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431-1436.
|
|
(49)
|
Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985) Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099-1105.
|
|
(50)
|
Bligh, E.G. & Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911-917.
|
|
(51)
|
De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
(52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
(53)
|
Zok, S., Görge, G., Kalsch, W. & Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411-421
|
|
(54)
|
Nagel, R. (1988). Umweltchemikalien und Fische — Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Germany.
|
|
(55)
|
Janssen, M.P.M., A Bruins, T.H. De Vries & Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305-312.
|
|
(56)
|
Van Brummelen, T.C. & Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277-285.
|
|
(57)
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167-1171.
|
|
(58)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
(59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310-386.
|
|
(60)
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785-790.
|
|
(61)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47-67.
|
|
(62)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69-78.
|
|
(63)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(64)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(65)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(66)
|
Aston, R.J., Sadler, K. & Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137-145.
|
|
(67)
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. & Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
(68)
|
Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89-94.
|
|
(69)
|
Bonacina, C., Pasteris, A., Bonomi, G. & Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267-274.
|
» |