|
21.7.2007
|
FR
|
Journal officiel de l’Union européenne
|
L 191/1
|
RÈGLEMENT (CE) N
o 829/2007 DE LA COMMISSION
du 28 juin 2007
modifiant les annexes I, II, VII, VIII, X et XI du règlement (CE) no 1774/2002 du Parlement européen et du Conseil en ce qui concerne la mise sur le marché de certains sous-produits animaux
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION DES COMMUNAUTÉS EUROPÉENNES,
vu le traité instituant la Communauté européenne,
vu le règlement (CE) no 1774/2002 du Parlement européen et du Conseil du 3 octobre 2002 établissant des règles sanitaires applicables aux sous-produits animaux non destinés à la consommation humaine (1), et notamment son article 28, deuxième alinéa, son article 29, paragraphe 3, premier alinéa, et son article 32, paragraphe 1,
considérant ce qui suit:
|
(1)
|
Le règlement (CE) no 1774/2002 établit les règles sanitaires et de police sanitaire applicables à l'importation dans la Communauté et au transit par celle-ci de certains sous-produits animaux et de produits qui en sont dérivés. Ce règlement énonce les exigences générales en matière d'hygiène applicables à la transformation des matières des catégories 1, 2 et 3 et il établit les conditions de mise sur le marché de ces sous-produits animaux et produits qui en sont dérivés ainsi que les modèles des certificats sanitaires qui doivent les accompagner lors de leur importation dans la Communauté.
|
|
(2)
|
En raison du risque d'introduction du petit coléoptère des ruches dans la Communauté, qui est actuellement préservée de ce parasite, il est nécessaire de fixer les conditions d'importation de la cire d'abeille destinée à des utilisations techniques et de modifier la définition des produits apicoles figurant à l'annexe I du règlement (CE) no 1774/2002. Il convient dès lors de modifier en conséquence la définition en question à l'annexe I dudit règlement, les conditions d'importation fixées au chapitre IX de l'annexe VIII et le modèle de certificat sanitaire figurant au chapitre 13 de l'annexe X dudit règlement.
|
|
(3)
|
Le chapitre X de l'annexe II du règlement (CE) no 1774/2002 établit le document commercial type qui doit accompagner les sous-produits animaux et les produits transformés qui en sont dérivés pendant le transport. L'amélioration de la traçabilité des peaux durant le transport implique la modification de ce document type. Il convient donc de modifier l'annexe II dudit règlement en conséquence.
|
|
(4)
|
Le règlement (CE) no 999/2001 du Parlement européen et du Conseil du 22 mai 2001 fixant les règles pour la prévention, le contrôle et l'éradication de certaines encéphalopathies spongiformes transmissibles (2) s'applique à la production et à la mise sur le marché des animaux vivants et des produits d'origine animale. Il interdit l'utilisation de protéines animales transformées dans l'alimentation des animaux d'élevage détenus, engraissés ou élevés pour la production de denrées alimentaires.
|
|
(5)
|
Sans préjudice de cette interdiction prévue par le règlement (CE) no 999/2001, il convient que des conditions de transformation moins strictes que l'actuelle méthode de transformation no 1, telles que prévues au chapitre II de l'annexe VII du règlement (CE) no 1774/2002, s'appliquent aux protéines animales transformées dérivées du sang de porcins, car le risque de transmission d'EST par les porcs n'est confirmé par aucune donnée scientifique. Il est toutefois nécessaire, pour des motifs de santé publique et animale, d'instaurer une exigence de température minimale en ce qui concerne la transformation du sang de porcins. Le chapitre II de l'annexe VII du règlement (CE) no 1774/2002 doit donc être modifié en conséquence.
|
|
(6)
|
L'annexe VIII, chapitre II, point A 1), du règlement (CE) no 1774/2002 autorise l'utilisation des parties d'animaux abattus qui sont propres à la consommation humaine, mais ne sont pas destinées à la consommation humaine pour des raisons commerciales, dans la production d'aliments crus pour animaux familiers. Il est avéré que les parties d'animaux abattus qui ont été déclarées impropres à la consommation humaine, mais sont exemptes de tout signe de maladie transmissible aux êtres humains ou aux animaux, peuvent également être utilisées sans risque dans les aliments pour animaux familiers. Le chapitre II, point A 1), et le chapitre XI de l'annexe VIII dudit règlement doivent donc être modifiés en conséquence.
|
|
(7)
|
Il est nécessaire de modifier les modèles existants des certificats sanitaires relatifs à l'importation de peaux dans la Communauté de manière à y apporter certains changements de nature technique. Il convient donc, dans un souci de clarté, de modifier en conséquence les exigences spécifiquement applicables à ces produits énoncées au chapitre VI de l'annexe VIII ainsi que les modèles de certificats sanitaires figurant aux chapitres 5 A, 5 B et 5 C de l'annexe X du règlement (CE) no 1774/2002.
|
|
(8)
|
Dans l'avis scientifique sur les effets de l'influenza aviaire sur la santé et le bien-être des animaux qu'elle a adopté les 13 et 14 septembre 2005, l'Autorité européenne de sécurité des aliments (EFSA) a précisé en guise de conclusion que les plumes devaient être traitées avant d'être commercialisées afin que soit réduit le risque de propagation de l'influenza aviaire. Le chapitre VIII de l'annexe VIII du règlement (CE) no 1774/2002 établit les exigences communautaires permanentes concernant la mise sur le marché et l'importation de plumes. Eu égard à l'avis précité et à la situation mondiale actuelle en matière d'épizootie d'influenza aviaire, il convient de modifier les exigences communautaires applicables à l'importation des plumes et au traitement qu'elles doivent subir avant leur importation. Il y a donc lieu de modifier l'annexe VIII dudit règlement en conséquence.
|
|
(9)
|
Il convient que le certificat sanitaire relatif aux importations dans la Communauté de protéines animales transformées non destinées à la consommation humaine et de produits autres que les aliments pour animaux familiers contenant ces protéines, figurant au chapitre 1 de l'annexe X du règlement (CE) no 1774/2002, soit modifié de manière à prévoir des possibilités de transformation équivalentes pour les pays tiers et la Communauté. Le chapitre 1 de l'annexe X du règlement (CE) no 1774/2002 doit donc être modifié en conséquence.
|
|
(10)
|
Le chapitre 3 B de l'annexe X du règlement (CE) no 1774/2002 contient le modèle de certificat sanitaire relatif aux importations dans la Communauté d'aliments transformés pour animaux familiers autres qu'en conserve. Les aliments transformés pour animaux familiers sont de plus en plus produits dans des pays tiers où ils résultent du mélange d'ingrédients déjà transformés qui ont été traités individuellement, conformément aux dispositions dudit règlement. Le traitement thermique de ces ingrédients pourrait altérer leurs qualités nutritionnelles. Il convient donc que l'importation dans la Communauté d'aliments transformés pour animaux familiers constitués de ces ingrédients sûrs soit autorisée et que le modèle de certificat sanitaire figurant au chapitre 3 B de l'annexe X du règlement (CE) no 1774/2002 soit modifié en conséquence.
|
|
(11)
|
Le règlement (CE) no 1774/2002 autorise l'importation dans la Communauté de certains sous-produits animaux destinés à la fabrication d'aliments pour animaux familiers bien qu'ils contiennent des matières qui proviennent d'animaux traités avec certaines substances interdites. Toutefois, l'importation dans la Communauté d'aliments transformés pour animaux familiers, d'articles à mastiquer et de viscères aromatiques contenant de telles matières est actuellement interdite. Étant donné que l'importation de ces matières premières en vue de la production d'aliments pour animaux familiers dans la Communauté ne présente pas de risque sanitaire plus important que l'importation de ces matières premières sous forme d'ingrédients d'aliments transformés pour animaux familiers, d'articles à mastiquer et de viscères aromatiques importés, il convient d’autoriser également l'importation dans la Communauté de ces produits transformés contenant les matières premières en question. Il y a donc lieu de modifier en conséquence les modèles de certificats sanitaires figurant aux chapitres 3 A, 3 B, 3 C et 3 E de l'annexe X du règlement (CE) no 1774/2002.
|
|
(12)
|
Le chapitre 3 B de l'annexe X du règlement (CE) no 1774/2002 prévoit que le certificat sanitaire pour les aliments transformés pour animaux familiers autres qu'en conserve doit comporter une attestation précisant que les aliments pour animaux familiers ont été conditionnés dans des emballages neufs munis d'étiquettes portant la mention «impropre à la consommation humaine». La directive 79/373/CEE du Conseil du 2 avril 1979 concernant la commercialisation des aliments composés pour animaux (3) contient déjà des dispositions équivalentes en matière de marquage qui visent à prévenir une utilisation accidentelle ou par négligence de ces produits pour la consommation humaine. Il convient que le modèle de certificat sanitaire figurant au chapitre 3 B de l'annexe X du règlement (CE) no 1774/2002 intègre les dispositions de cette législation et donc qu'il soit modifié en conséquence.
|
|
(13)
|
L'annexe VIII du règlement (CE) no 1774/2002 établit les exigences applicables à la mise sur le marché et à l'importation dans la Communauté d'aliments pour animaux familiers, d'articles à mastiquer et de produits techniques. Le chapitre II, point B 4, de cette annexe prévoit que les articles à mastiquer doivent être soumis, en cours de transformation, à un traitement thermique suffisant pour détruire les organismes pathogènes. Plusieurs États membres ont demandé que d'autres traitements offrant des garanties de sécurité équivalentes soient autorisés au cours de la transformation des articles à mastiquer. Le point B 4 du chapitre II de l'annexe VIII du règlement (CE) no 1774/2002 doit donc être modifié en conséquence.
|
|
(14)
|
Le chapitre 3 C de l'annexe X du règlement (CE) no 1774/2002 contient le modèle de certificat sanitaire relatif aux importations dans la Communauté d'articles à mastiquer. Étant donné que des traitements autres que le traitement thermique doivent être autorisés pour la transformation d'articles à mastiquer dans la Communauté, ces autres traitements doivent également être autorisés pour les articles à mastiquer importés. Certains articles à mastiquer sont produits selon des méthodes traditionnelles à partir de poisson. La protection de la santé des animaux ne requiert pas qu'un traitement thermique soit appliqué en pareil cas. Il convient donc que le modèle de certificat sanitaire figurant au chapitre 3 C de l'annexe X dudit règlement soit modifié en conséquence.
|
|
(15)
|
L'annexe VIII, chapitre II, point B 6, du règlement (CE) no 1774/2002 établit les normes microbiologiques applicables aux aliments crus pour animaux familiers produits dans la Communauté. Ces normes doivent également être appliquées aux aliments crus pour animaux familiers importés dans la Communauté en vue de leur vente directe et aux sous-produits animaux servant à l'alimentation des animaux d'élevage à fourrure, destinés à être expédiés vers la Communauté. Il convient donc que le chapitre 3 D de l'annexe X dudit règlement soit modifié en conséquence.
|
|
(16)
|
L'annexe XI du règlement (CE) no 1774/2002 présente les listes des pays tiers en provenance desquels les États membres peuvent autoriser les importations de sous-produits animaux non destinés à la consommation humaine. La partie XIII de cette annexe contient une liste des pays tiers en provenance desquels les États membres peuvent autoriser les importations de sérum d'équidés. Conformément à cette partie XIII, cette liste comprend les pays tiers énumérés à l'annexe I de la décision 2004/211/CE de la Commission du 6 janvier 2004 établissant la liste des pays tiers et des parties de territoires de ces pays en provenance desquels les États membres autorisent les importations d'équidés vivants et de sperme, d'ovules et d'embryons de l'espèce équine, et modifiant les décisions 93/195/CEE et 94/63/CE (4), en provenance desquels les importations d'équidés destinés à l'abattage sont autorisées.
|
|
(17)
|
Le sérum d'équidés peut toutefois être prélevé sur des animaux vivants. C'est pourquoi le statut zoosanitaire permettant à un pays tiers de figurer sur la liste des pays tiers en provenance desquels les importations d'équidés d'élevage et de rente sont autorisées devrait suffire pour déterminer si du sérum d'équidés peut être importé du pays tiers en question. Cela permettrait, en particulier, d'autoriser l'importation de sérum d'équidés du Mexique. La partie XIII de l'annexe XI du règlement (CE) no 1774/2002 doit donc être modifiée en conséquence.
|
|
(18)
|
Les certificats vétérinaires doivent être établis dans le format prévu par la décision 2007/240/CE (5) concernant l'adoption de nouveaux modèles harmonisés de certificats vétérinaires relatifs à l’importation dans la Communauté européenne d'animaux vivants et de produits d’origine animale. Le modèle de document commercial établi à l'annexe II, chapitre X, du règlement (CE) no 1774/2002 et les modèles de certificats sanitaires établis à l'annexe X du même règlement doivent être modifiés en conséquence.
|
|
(19)
|
Il convient de prévoir qu'une période transitoire courra à partir de la date d'entrée en vigueur du présent règlement, de manière à permettre la poursuite des importations dans la Communauté des sous-produits animaux et produits qui en sont dérivés régis par le règlement (CE) no 1774/2002 et accompagnés des certificats sanitaires conformes à ce règlement.
|
|
(20)
|
Les mesures prévues au présent règlement sont conformes à l'avis du comité permanent de la chaîne alimentaire et de la santé animale,
|
A ARRÊTÉ LE PRÉSENT RÈGLEMENT:
Article premier
Les annexes I, II, VII, VIII, X et XI du règlement (CE) no 1774/2002 sont modifiées conformément à l'annexe du présent règlement.
Article 2
Pendant une période transitoire de six mois à compter de la date d'entrée en vigueur du présent règlement, le document commercial prévu à l'annexe II du règlement (CE) no 1774/2002 et les certificats sanitaires types prévus à l'annexe X de ce règlement, qui ont été complétés conformément aux dispositions applicables avant la date d'entrée en vigueur du présent règlement, peuvent continuer d'accompagner les produits auxquels ils se rapportent.
Article 3
Le présent règlement entre en vigueur et est applicable le troisième jour suivant celui de sa publication au Journal officiel de l'Union européenne
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 28 juin 2007.
Par la Commission
Markos KYPRIANOU
Membre de la Commission
(1) JO L 273 du 10.10.2002, p. 1. Règlement modifié en dernier lieu par le règlement (CE) no 2007/2006 de la Commission (JO L 379 du 28.12.2006, p. 98).
(2) JO L 147 du 31.5.2001, p. 1. Règlement modifié en dernier lieu par le règlement (CE) no 1923/2006 de la Commission (JO L 404 du 30.12.2006, p. 1).
(3) JO L 86 du 6.4.1979, p. 30. Directive modifiée en dernier lieu par le règlement (CE) no 807/2003 (JO L 122 du 16.5.2003, p. 36).
(4) JO L 73 du 11.3.2004, p. 1. Décision modifiée par le règlement (CE) no 1792/2006 (JO L 362 du 20.12.2006, p. 1).
(5) JO L 104 du 21.4.2007, p. 37.
ANNEXE
Les annexes du règlement (CE) no 1774/2002 sont modifiées comme suit:
|
1)
|
L'annexe I est modifiée comme suit:
|
a)
|
Le point 1 est remplacé par le texte suivant:
|
«1.
|
“sous-produits apicoles” le miel, la cire, la gelée royale, la propolis ou le pollen qui ne sont pas destinés à la consommation humaine;»
|
|
|
b)
|
Le point 42 est remplacé par le texte suivant:
|
«42.
|
“protéines animales transformées” les protéines animales issues entièrement de matières de catégorie 3 traitées conformément à l'annexe VII, chapitre II, de manière à pouvoir être utilisées directement en tant que matières premières pour aliments des animaux ou à toute autre fin dans les aliments des animaux, y compris les aliments pour animaux familiers, ou à pouvoir être utilisées dans des engrais organiques ou amendements; toutefois, elles ne comprennent pas les produits sanguins, le lait, les produits à base de lait, le colostrum, la gélatine, les protéines hydrolysées et le phosphate dicalcique, les œufs et les ovoproduits, le phosphate tricalcique et le collagène;»
|
|
|
|
2)
|
À l'annexe II, le chapitre X est remplacé par le texte suivant:
«CHAPITRE X
Document commercial
|
1.
|
Le document commercial ci-après accompagne les sous-produits animaux et les produits transformés pendant le transport. Les États membres peuvent toutefois opter pour un document commercial différent, sur support papier ou électronique, pour les sous-produits animaux et les produits transformés transportés à l'intérieur d'un État membre, à condition que ce document commercial remplisse les conditions prévues au chapitre III, point 2.
|
|
2.
|
Lorsque plusieurs transporteurs sont concernés, chaque transporteur complète une déclaration telle que celle prévue au point 7 du document commercial, cette déclaration faisant partie du document.
|
MODÈLE DE DOCUMENT COMMERCIAL POUR LE TRANSPORT DE SOUS-PRODUITS ANIMAUX ET DE PRODUITS TRANSFORMÉS À L'INTÉRIEUR DE LA COMMUNAUTÉ EUROPÉENNE
Notes
|
a)
|
Le document commercial respecte la présentation du modèle figurant dans la présente annexe. Il contient, dans l'ordre de numérotation du modèle, les attestations requises pour le transport de sous-produits animaux et de produits transformés qui en sont dérivés.
|
|
b)
|
Il est rédigé dans l'une des langues officielles de l'État membre d'origine ou de l'État membre de destination, selon le cas. Il peut cependant être rédigé dans d'autres langues officielles de la Communauté s'il est accompagné d'une traduction officielle ou s'il a été approuvé au préalable par l'autorité compétente de l'État membre de destination.
|
|
c)
|
Le document commercial doit être fourni au moins en triple exemplaire (un original et deux copies). L'original doit accompagner l'envoi jusqu'à sa destination finale. Le destinataire doit le conserver. Le producteur et le transporteur doivent en garder une copie.
|
|
d)
|
L'original de chaque document commercial se compose d'une seule feuille, recto et verso, ou, si cela ne suffit pas, il est présenté de façon à ce que les différentes pages fassent partie d'un tout intégré et indivisible.
|
|
e)
|
Si, pour des raisons d'identification des composants de l'envoi, des pages supplémentaires sont jointes au document commercial, ces pages sont également considérées comme faisant partie de l'original si la signature du responsable de l'envoi est apposée sur chaque page.
|
|
f)
|
Lorsque le document commercial, y compris les pages supplémentaires visées au point e), comporte plusieurs pages, chaque page est numérotée en bas — (no de page) de (nombre total de pages) — et porte le numéro de code du document attribué par le responsable dans la partie supérieure.
|
|
g)
|
L'original du document commercial doit être complété et signé par la personne responsable. La personne responsable s'assure que les principes de documentation énoncés à l'annexe II, chapitre III, du règlement (CE) no 1774/2002 sont respectés. Le document commercial doit préciser:
|
i)
|
la date d'enlèvement des produits;
|
|
ii)
|
la description des produits, notamment l'identification des produits, l'espèce animale pour ce qui est des matières de catégorie 3 et des produits transformés qui en sont dérivés et sont destinés à être utilisés comme matières premières pour aliments des animaux et, s'il y en a un, le numéro de la marque auriculaire de l'animal;
|
|
iii)
|
la quantité de produit;
|
|
iv)
|
le lieu d'origine des produits;
|
|
v)
|
les nom et adresse du transporteur des produits;
|
|
vi)
|
les nom et adresse du destinataire et, s'il en a un, son numéro d'agrément; et
|
|
vii)
|
le cas échéant, le numéro d'agrément de l'usine ou établissement d'origine ainsi que la nature et les méthodes de traitement.
|
|
|
h)
|
La signature du responsable doit être d'une couleur différente de celle du texte imprimé.
|
|
i)
|
Le document commercial doit être conservé pendant au moins deux ans en vue de sa présentation à l'autorité compétente pour la vérification des relevés mentionnés à l'article 9 du règlement (CE) no 1774/2002.
|
|
j)
|
Si les États membres décident d'utiliser un document commercial électronique, les obligations énoncées aux points a) à i) sont respectées de manière adaptée au format électronique du document.
|



|
|
3)
|
À l'annexe VII, chapitre II, point A 1, le premier alinéa est remplacé par le texte suivant:
«Les protéines transformées issues de mammifères doivent avoir été traitées selon la méthode de transformation no 1. Toutefois, le sang de porcins peut avoir été traité selon n'importe laquelle des méthodes de transformation numérotées de 1 à 5, ou selon la méthode de transformation no 7 si, en cas d'application de cette dernière, un traitement thermique à cœur à une température d'au moins 80 °C a été pratiqué.»
|
|
4)
|
L'annexe VIII est modifiée comme suit:
|
a)
|
Le chapitre II est modifié comme suit:
|
i)
|
Le point A 1 est remplacé par le texte suivant:
|
«1.
|
Seuls les sous-produits animaux visés à l'article 6, paragraphe 1, points a) à j), peuvent être utilisés dans la production d'aliments pour animaux familiers et d'articles à mastiquer. Les aliments crus pour animaux familiers ne peuvent toutefois être préparés qu'à partir des sous-produits animaux énumérés à l'article 6, paragraphe 1, point a) ou à l'article 6, paragraphe 1, point b).»
|
|
|
ii)
|
Le point B 4 est remplacé par le texte suivant:
|
«4.
|
Les articles à mastiquer doivent être soumis, en cours de transformation, à un traitement suffisant pour détruire les organismes pathogènes, y compris les salmonelles.
Après ce traitement, toutes les précautions doivent être prises pour que ces articles à mastiquer ne soient pas exposés à une source de contamination. Les articles à mastiquer doivent être conditionnés dans des emballages neufs.»
|
|
|
|
b)
|
Le chapitre III est modifié comme suit:
|
i)
|
Le point I A 3 est remplacé par le texte suivant:
|
«3.
|
Le lisier non transformé issu d'équidés qui est commercialisé ne peut provenir d'une exploitation soumise à des restrictions de police sanitaire concernant la morve, la stomatite vésiculeuse, le charbon bactéridien ou la rage, conformément à l'article 4, paragraphe 5, de la directive 90/426/CEE.»
|
|
|
ii)
|
Le point I B 4 est remplacé par le texte suivant:
|
«4.
|
L'importation de lisier non transformé est interdite.»
|
|
|
iii)
|
Le point II B 6 d) est remplacé par le texte suivant:
|
«d)
|
sont accompagnés d'un certificat sanitaire conforme au modèle établi à l'annexe X, chapitre 17.»
|
|
|
|
c)
|
Le chapitre VI est modifié comme suit:
|
i)
|
Le point A 1 a) est remplacé par le texte suivant:
|
«a)
|
aux peaux d'ongulés satisfaisant aux dispositions du règlement (CE) no 853/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant des règles spécifiques d'hygiène applicables aux denrées alimentaires d'origine animale (1),
|
|
|
ii)
|
Le point B 3 est remplacé par le texte suivant:
|
«3.
|
Les échanges de peaux fraîches ou réfrigérées sont soumis à des conditions sanitaires identiques à celles qui sont applicables aux viandes fraîches en vertu de la directive 2002/99/CE du Conseil du 16 décembre 2002 fixant les règles de police sanitaire régissant la production, la transformation, la distribution et l'introduction des produits d'origine animale destinés à la consommation humaine (2).
|
|
|
iii)
|
Au point C 5 b), la phrase liminaire est remplacée par le texte suivant:
|
«b)
|
proviennent d'un pays tiers ou, en cas de régionalisation officielle au sens de la législation communautaire, d'une région d'un pays tiers figurant sur la liste visée à l'annexe XI, partie XIV, point A, et qui, selon l'espèce concernée:»
|
|
|
iv)
|
Au point C 6, les points b) à e) sont remplacés par le texte suivant:
|
«b)
|
proviennent:
|
i)
|
d'un pays tiers ou, en cas de régionalisation officielle au sens de la législation communautaire, d'une région d'un pays tiers figurant sur la liste visée à l'annexe XI, partie XIV, point B, en provenance desquels les importations de viandes fraîches des espèces correspondantes sont autorisées et ont été traitées conformément aux points A 2 a), A 2 b) et A 2 c); ou
|
|
ii)
|
d'un pays tiers qui figure sur la liste visée à l'annexe XI, partie XIV, point B et ont été traitées conformément aux points A 2 c) ou A 2 d); ou
|
|
iii)
|
d'équidés ou de ruminants provenant d'un pays tiers qui figure sur la liste établie à l'annexe XI, partie XIV, point C, ont été traitées conformément aux points A 2 a), A 2 b) et A 2 c) et ont été isolées pendant les vingt et un jours suivant le traitement;
|
|
|
c)
|
dans le cas de peaux salées transportées par navire, ont été traitées conformément aux points A 2 b) ou A 2 c) et ont été isolées durant le transport pendant au moins quatorze jours après l'application du traitement prévu au point A 2 b) et pendant au moins sept jours après l'application du traitement prévu au point A 2 c) avant leur importation; le certificat sanitaire accompagnant l'envoi mentionne le traitement appliqué et la durée du transport; et
|
|
d)
|
sont accompagnées d'un certificat sanitaire conforme au modèle de certificat sanitaire figurant à l'annexe X, chapitre 5 B ou, dans le cas des peaux visées au point C 6 b) iii) de la présente annexe, d'une déclaration officielle conforme au modèle figurant à l'annexe X, chapitre 5 C.»
|
|
|
|
d)
|
Le chapitre VIII est modifié comme suit:
|
i)
|
Au point B 4, le membre de phrase introductif est remplacé par le texte suivant:
«Les États membres doivent autoriser l'importation de la laine et des poils non transformés s'ils:»
|
|
ii)
|
Au point B, le point 5 suivant est ajouté:
|
«5.
|
L'importation des plumes et des parties de plumes non transformées est interdite.
Les États membres doivent autoriser l'importation des plumes et des parties de plumes transformées:
|
a)
|
s'il s'agit de plumes d’ornement traitées, de plumes traitées transportées par des voyageurs pour un usage privé ou d'envois de plumes traitées expédiés à des particuliers pour un usage non industriel; ou
|
|
b)
|
si elles sont accompagnées d'un document commercial attestant que les plumes ou parties de plumes ont été traitées par jet de vapeur ou toute autre méthode garantissant l'inactivation des agents pathogènes et sont conditionnées à l'état sec dans des emballages hermétiques.»
|
|
|
|
|
e)
|
Le chapitre IX est modifié comme suit:
|
i)
|
Au point A 1, le membre de phrase introductif est remplacé par le texte suivant:
|
«1.
|
Les sous-produits apicoles destinés à être utilisés exclusivement en apiculture:»
|
|
|
ii)
|
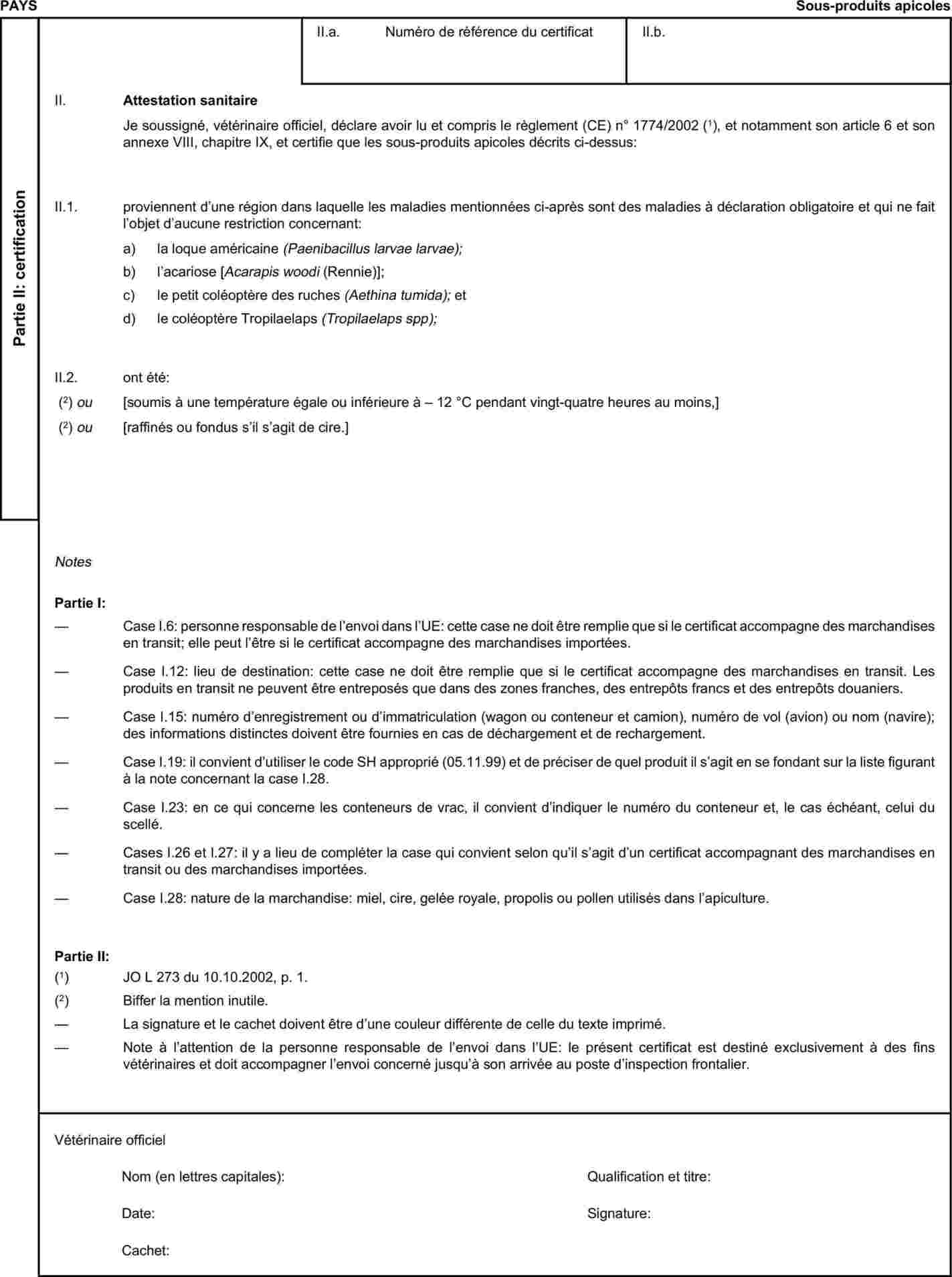
Le point B 3 est remplacé par le texte suivant:
|
«3.
|
Les États membres doivent autoriser l'importation de sous-produits apicoles, autres que la cire sous forme de rayons de miel, destinés à être utilisés en apiculture si ces produits:
|
a)
|
proviennent de pays tiers figurant sur la liste visée à l'annexe XI, partie XII;
|
|
b)
|
ou bien
|
i)
|
ont été soumis à une température égale ou inférieure à –12 °C pendant vingt-quatre heures au moins; ou bien
|
|
ii)
|
ont, s'il s'agit de cire, été raffinés ou fondus avant leur importation; et
|
|
|
c)
|
sont accompagnés d'un certificat sanitaire conforme au modèle établi à l'annexe X, chapitre 13.»
|
|
|
|
iii)
|
À la lettre B, les points 4 et 5 suivants sont ajoutés:
|
«4.
|
Les États membres doivent autoriser l'importation de cire d'abeille destinée à des utilisations techniques, autre que la cire d'abeille sous forme de rayons de miel, si la cire:
|
a)
|
a été raffinée ou fondue avant son importation; et
|
|
b)
|
est accompagnée d'un document commercial attestant qu'elle a été raffinée ou fondue.
|
|
|
5.
|
L'importation de cire d'abeille sous forme de rayons de miel est interdite.»
|
|
|
|
f)
|
Le chapitre XI est modifié comme suit:
|
i)
|
Au point 2, le deuxième alinéa est remplacé par le texte suivant:
«Toutefois, les sous-produits animaux destinés à l'alimentation des animaux d'élevage à fourrure ou destinés à être utilisés dans des aliments crus pour animaux familiers doivent consister exclusivement en sous-produits visés à l'article 6, paragraphe 1, points a) et b);»
|
|
ii)
|
Le point 6 est remplacé par le texte suivant:
|
«6.
|
sont accompagnés d'un certificat conforme au modèle établi à l'annexe X, chapitre 3 D, chapitre 3 F ou chapitre 8;»
|
|
|
|
|
5)
|
L'annexe X est remplacée par le texte suivant:
«ANNEXE X
MODÈLES DE CERTIFICATS SANITAIRES POUR CERTAINS SOUS-PRODUITS ANIMAUX ET PRODUITS DÉRIVÉS DE CEUX-CI, IMPORTÉS DE PAYS TIERS OU TRANSITANT PAR LA COMMUNAUTÉ EUROPÉENNE
Notes
|
a)
|
Les certificats vétérinaires sont établis par le pays exportateur sur la base des modèles figurant dans la présente annexe X, conformément au modèle correspondant aux sous-produits animaux concernés. Ils contiennent, numérotées dans l'ordre indiqué sur le modèle, les attestations exigées pour tout pays tiers et, le cas échéant, les garanties supplémentaires requises pour le pays exportateur ou pour une partie de ce dernier.
|
|
b)
|
L'original de chaque certificat se compose d'une seule feuille, recto et verso, ou, si cela ne suffit pas, il se présente sous une forme telle que toutes les feuilles nécessaires font partie d'un tout intégré et indivisible.
|
|
c)
|
Il est établi dans au moins une des langues officielles de l'État membre dans lequel est réalisée l'inspection au poste frontalier et de l'État membre de destination. Toutefois, ces États membres peuvent admettre que le certificat soit établi dans d’autres langues et accompagné, si nécessaire, d’une traduction officielle.
|
|
d)
|
Si des feuilles supplémentaires sont jointes au certificat pour des raisons d'identification des différents éléments de l'envoi, ces feuilles sont également considérées comme faisant partie du certificat original, la signature et le cachet du vétérinaire officiel chargé de la certification devant figurer sur chacune d'entre elles.
|
|
e)
|
Lorsque le certificat, y compris les tableaux supplémentaires visés au point d), comporte plus d'une page, chaque page doit être numérotée au bas de la page — (numéro de la page) de (nombre total de pages) —, et le numéro de code du certificat attribué par l'autorité compétente doit figurer en haut de la page.
|
|
f)
|
Le certificat original doit être rempli et signé par un vétérinaire officiel. Les autorités compétentes du pays exportateur garantissent ainsi l'application de principes de certification équivalents à ceux fixés dans la directive 96/93/CE du Conseil.
|
|
g)
|
La couleur de la signature doit être différente de celle du texte imprimé. Cette règle s'applique également aux cachets, à l'exclusion des reliefs et des filigranes.
|
|
h)
|
Le certificat original doit accompagner l'envoi jusqu'au poste d'inspection frontalier communautaire.
|
|
i)
|
Si le certificat sanitaire accompagne un envoi en transit, la case I.5. (“destinataire”) du certificat sanitaire en question doit contenir le nom et l'adresse du poste d'inspection frontalier par lequel l'envoi doit quitter la Communauté européenne.
|



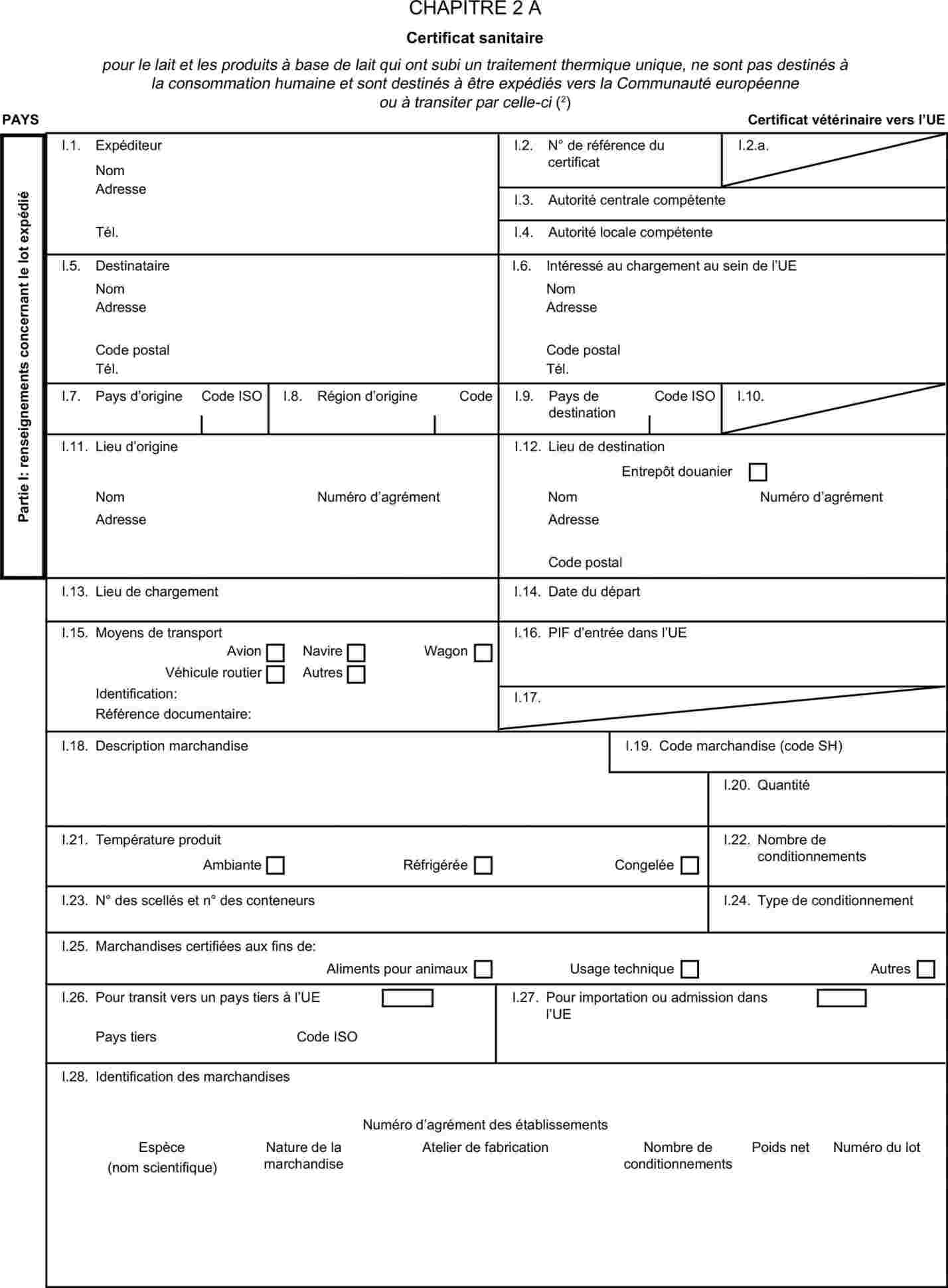

















































































|
|
6)
|
L'annexe XI est modifiée comme suit:
|
a)
|
Le titre de la partie VI est remplacé par le texte suivant:
«PARTIE VI
Liste des pays tiers en provenance desquels les États membres peuvent autoriser les importations de sous-produits animaux et de produits sanguins d’origine animale (à l’exception des produits sanguins provenant d'équidés) destinés à des fins techniques, y compris pharmaceutiques (certificats sanitaires des chapitres 4 C et 8)»
|
|
b)
|
Dans la partie VII A, le titre et le point A sont remplacés par le texte suivant:
«PARTIE VII A
Liste des pays tiers en provenance desquels les États membres peuvent autoriser les importations de sous-produits animaux destinés à la fabrication d'aliments transformés pour animaux familiers (certificats sanitaires des chapitres 3 B et 3 F)
|
A.
|
Sous-produits animaux issus d'animaux des espèces bovine, ovine, caprine, porcine et équine, comprenant les animaux sauvages et d'élevage
Pays tiers ou régions de pays tiers figurant sur la liste de l'annexe II, partie 1, de la décision 79/542/CEE du Conseil, en provenance desquels les importations de cette catégorie de viandes fraîches des espèces correspondantes sont autorisées, ainsi que les pays suivants, pour les sous-produits indiqués:
pays d'Amérique du Sud et d'Afrique australe, ou régions de ces pays, dans lesquels les viandes matures et désossées des espèces correspondantes sont autorisées, en ce qui concerne les viandes matures et désossées (y compris le diaphragme) et/ou les abats préparés de bovins, de caprins, d'ovins et de gibier (sauvage ou d'élevage).»
|
|
|
c)
|
La partie IX est remplacée par le texte suivant:
«PARTIE IX
Liste des pays tiers en provenance desquels les États membres peuvent autoriser les importations de lisier transformé et de produits transformés à base de lisier destinés au traitement des sols (certificat sanitaire du chapitre 17)
En ce qui concerne le lisier transformé et les produits transformés à base de lisier, les pays tiers figurant sur la liste de:
|
a)
|
l'annexe II, partie 1, de la décision 79/542/CEE;
|
|
b)
|
l'annexe I de la décision 2004/211/CE de la Commission; ou
|
|
|
d)
|
La partie XIII est remplacée par le texte suivant:
«PARTIE XIII
Liste des pays tiers en provenance desquels les États membres peuvent autoriser les importations de sérum d'équidés (certificat sanitaire du chapitre 4 A)
Pays tiers ou régions de pays tiers figurant à l'annexe I de la décision 2004/211/CE de la Commission (8), en provenance desquels les importations d'équidés d'élevage et de rente sont autorisées.»
|
|
(1) JO L 139 du 30.4.2004, p. 55, rectifié au JO L 226 du 25.6.2004, p. 22.»
(2) JO L 18 du 23.1.2003, p. 11.»
























































































