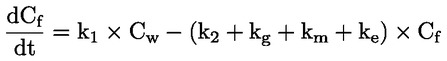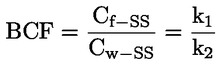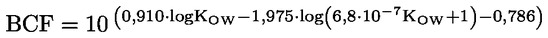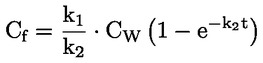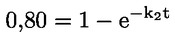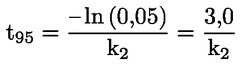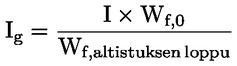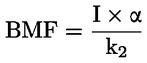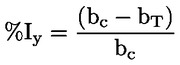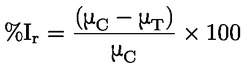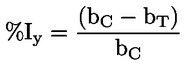LIITE
Muutetaan asetuksen (EY) N:o 440/2008 liite seuraavasti:
|
1) |
Lisätään A osaan luku seuraavasti: ”A.25 DISSOSIAATIOVAKIOT VEDESSÄ (TITRAUSMENETELMÄ – SPEKTROFOTOMETRINEN MENETELMÄ – KONDUKTOMETRINEN MENETELMÄ) JOHDANTO Tämä testimenetelmä vastaa OECD:n testiohjetta 112 (1981) Edellytykset
Ohjeet
Testimenetelmää koskevat lausumat
Vakioasiakirjat Tämä testimenetelmä perustuu menetelmiin, jotka annetaan osassa ”Lähdekirjallisuus” mainituissa lähteissä ja asiakirjassa Preliminary Draft Guidance for Premanufacture Notification EPA, 18. elokuuta 1978. MENETELMÄ – JOHDANTO, TARKOITUS, SOVELTAMISALA, SOVELTAMINEN JA TESTIN KÄYTTÖ JA RAJAT Aineen dissosiaatiolla vedessä on sen ympäristövaikutuksen arvioinnin kannalta merkitystä. Se ohjaa aineen muotoa, joka puolestaan määrittää sen toiminnan ja kulkeutumisen. Se voi vaikuttaa kemikaalin adsorptioon maaperään ja sedimentteihin sekä absorptioon biologisiin soluihin. Määritelmät ja yksiköt Dissosiaatio on reversiibeli jakautuminen kahteen tai useampaan kemialliseen aineeseen, jotka voivat olla ionisia. Tämä prosessi esitetään yleisesti seuraavasti RX ⇌ R ++ X – ja reaktiota koskeva tasapainopitoisuuden vakio on
Esimerkiksi erityistapauksessa, jossa R on vety (aine on happo), vakio on
tai
Vertailuaineet Seuraavia vertailuaineita ei tarvitse käyttää kaikissa tapauksissa uutta ainetta tutkittaessa. Ne mainitaan ensisijaisesti siksi, jotta menetelmän kalibrointi voidaan suorittaa ajoittain ja jotta tarjotaan mahdollisuus vertailla tuloksia toista menetelmää sovellettaessa.
On hyödyllistä käyttää ainetta, jolla on useita pK-arvoja, kuten esitetään jäljempänä kappaleessa ’Testimenetelmän periaate’. Tällainen aine voi olla
Testimenetelmän periaate Kuvattu kemiallinen prosessi on ainoastaan jonkin verran lämpötilariippuvainen ympäristön kannalta merkityksellisellä lämpötila-alueella. Dissosiaatiovakion määrittäminen edellyttää kemiallisen aineen liukenevien ja liukenemattomien muotojen pitoisuuksien mittaamista. Edellä kappaleessa ’Määritelmät ja yksiköt’ ilmoitetun dissosiaatioreaktion stoikiometrian tietämyksen perusteella voidaan määrittää asiaankuuluva vakio. Tässä testimenetelmässä kuvatussa erityistapauksessa aine käyttäytyy hapon tai emäksen tavoin, ja määritys tehdään helpoiten määrittämällä aineen ionisoitujen ja ei-ionisoitujen muotojen suhteelliset pitoisuudet ja liuoksen pH-arvo. Näiden termien välinen suhde annetaan edellä kappaleessa ’Määritelmät ja yksiköt’ esitetyssä pKa -yhtälössä. Joillain aineilla on enemmän kuin yksi dissosiaatiovakio, ja vastaavia yhtälöitä voidaan laatia. Jotkut tässä kuvatuista menetelmistä ovat myös sopivia ei-happamille/emäksisille dissosiaatioille. Laatuperusteet Toistettavuus Dissosiaatiovakio on toistettava (vähintään kolme määritystä) ± 0,1 log-yksikön puitteisiin. TESTIMENETELMIEN KUVAUS Arvon pKa määrittämiseen voidaan käyttää kahta lähestymistapaa. Ensimmäisessä tunnettua määrää ainetta titrataan tarvittaessa hapolla tai emäksellä; toisessa määritetään ionisoitujen ja ionisoitumattomien muotojen suhteellinen pitoisuus ja sen pH-riippuvuus. Valmisteet Näihin periaatteisiin perustuvat menetelmät voidaan luokitella titraus-, spektrofotometrisiksi ja konduktometrisiksi menetelmiksi. Testiliuokset Kemiallista ainetta tulee liuottaa tislattuun veteen titrausmenetelmässä ja konduktometrisessä menetelmässä. Spektrofotometrisessä ja muissa menetelmissä käytetään puskuriliuoksia. Testiaineen pitoisuus ei saisi olla yli 0,01 M tai yli puolet kyllästymispitoisuudesta, ja liuoksen valmistamisessa on käytettävä aineen puhtainta saatavilla olevaa muotoa. Jos aine on ainoastaan huonosti liukenevaa, sitä voidaan liuottaa pieneen määrään veteen sekoittuvaa liuotinta ennen kuin edellä mainittuja pitoisuuksia lisätään. Tyndallin sirontaa käytetään tarkistamaan emulsioiden esiintyminen liuoksissa, erityisesti jos liukoisuuden parantamiseksi on käytetty tukiliuotinta. Jos käytetään puskuriliuoksia, puskurin pitoisuus ei saisi ylittää arvoa 0,05 M. Testiolosuhteet Lämpötila Lämpötila on säädettävä ainakin ± 1 °C:n tarkkuudella. Määritys tulisi mieluiten suorittaa lämpötilassa 20 °C. Jos epäillään merkittävää lämpötilariippuvuutta, määritys on tehtävä ainakin kahdessa muussa lämpötilassa. Lämpötilavälien on oltava tässä tapauksessa 10 °C ja lämpötilan säädön ± 0,1 °C. Analyysit Menetelmä määräytyy testattavan aineen luonteen mukaan. Sen on oltava tarpeeksi herkkä, jotta eri lajit voidaan määrittää kussakin testiliuoksen pitoisuudessa. Testin suorittaminen Titrausmenetelmä Testiliuos määritetään titraamalla emäs- tai happoliuoksella ja pH-arvo mitataan jokaisen titrantin lisäyksen jälkeen. Ennen ekvivalenttipistettä on tehtävä ainakin 10 täydentävää lisäystä. Jos ekvivalenssi saavutetaan tarpeeksi nopeasti, voidaan käyttää piirturilla varustettua potentiometriä. Tässä menettelyssä aineen kokonaismäärä ja sen pitoisuus on oltava tarkasti tiedossa. On ryhdyttävä varotoimiin hiilidioksidin poissulkemiseksi. Yksityiskohtia menettelystä, varotoimista ja laskennasta annetaan vakiotesteissä, esim. viitteet (1), (2), (3) ja (4). Spektrofotometrinen menetelmä Löydetään aallonpituus, jossa aineen ionisoiduilla ja ionisoitumattomilla muodoilla on huomattavasti erilaiset ekstinktiokertoimet. UV-valon ja näkyvän valon absorptiospektri saadaan liuoksista, joissa on vakiopitoisuus, pH-olosuhteissa, joissa aine on olennaisesti ionisoitumaton ja täysin ionisoitu ja useissa pH-arvojen väliarvoissa. Tämä voidaan tehdä joko lisäämällä väkevää happoa (emästä) suhteellisen suureen määrään testiaineliuosta monikomponenttisessa puskuriliuoksessa aluksi korkealla (matalalla) pH-arvolla (viite 5), tai lisäämällä yhtä suuret tilavuudet aineen kantaliuosta esim. veteen, metanoliin, erilaisten puskuriliuosten, jotka kattavat halutun pH-välin, vakiotilavuuteen. Valitun aallonpituuden pH- ja absorbanssiarvoista lasketaan riittävä määrä arvoja pKa:lle käyttäen tietoja ainakin viidestä pH-arvosta, joissa aine on vähintään 10- ja korkeintaan 90-prosenttisesti ionisoitu. Lisätietoja kokeellisista yksityiskohdista ja laskentamenetelmästä annetaan viitteessä 1. Konduktometrinen menetelmä Käyttämällä pienen tunnetun kennovakion mittakennoa mitataan aineen noin 0,1 M liuoksen johtokykyä vedessä. Myös tämän liuoksen useiden tarkasti valmistettujen laimennuksien johtavuutta mitataan. Konsentraatiota puolitetaan kullakin kerralla ja sarjan tulisi kattaa ainakin konsentraatioiden suuruusjärjestys. Rajoittava johtuvuus äärettömässä laimennuksessa löydetään suorittamalla samanlainen koe Na-suolan kanssa ja ekstrapoloimalla. Dissosiaatioaste voidaan sen jälkeen laskea kunkin liuoksen johtavuudesta käyttämällä Onsagerin yhtälöä, ja näin ollen, Ostwaldin laimennuslakia soveltaen, dissosiaatiovakio voidaan laskea K = α2C/(1 – α), jossa C on konsentraatio mooleina litraa kohti ja α dissosioitunut osa. On ryhdyttävä varotoimiin hiilidioksidin poissulkemiseksi. Lisätietoja kokeellisista yksityiskohdista ja laskentamenetelmästä annetaan vakioasiakirjoissa ja viitteessä (1), (6) ja (7). TIEDOT JA RAPORTOINTI Tulosten käsittely Titrausmenetelmä Kymmenelle mitatulle pisteelle titrauskäyrällä lasketaan pKa-arvo. Tällaisten pKa-arvojen keskiarvo ja keskihajonta lasketaan. Luonnos pH-arvoista vakioemäksen tai -hapon tilavuuden osalta samoin kuin taulukkomuotoinen esitys pitäisi sisällyttää tähän. Spektrofotometriset menetelmät Absorbanssi ja pH esitetään taulukkoina jokaisesta spektristä. Ainakin viisi pKa -arvoa lasketaan spektrin datapisteistä, ja lisäksi lasketaan näiden tulosten keskiarvo ja standardipoikkeama. Konduktometrinen menetelmä Ekvivalenttijohtokyky Λ lasketaan kullekin hapon konsentraatiolle ja kullekin sellaisen seoksen konsentraatiolle, jossa on vastaava määrä happoa, plus 0,98 vastaava määrä karbonaatitonta natriumhydroksidia. Hapon määrä on korkeampi, jotta estetään hydrolyysista johtuva liika OH–. 1/Λ esitetään Ö_C ja suolan Λo voidaan löytää ekstrapoloimalla nollaväkevyyteen. Hapon Λo voidaan laskea käyttämällä H+:n ja Na+:n kirjallisuusarvoja, ja pKa-arvo voidaan laskea α = Λi /Λo ja Ka = α2C/(1 – α) kullekin konsentraatiolle. Paremmat arvot Ka:lle voidaan saada tekemällä korjauksia liikkuvuuden ja aktiivisuuden osalta. On laskettava pKa-arvojen keskiarvot ja keskihajonta. Testiraportti Kaikki raakadata ja pKa-arvot on toimitettava yhdessä laskentamenetelmän (mieluiten taulukkomuodossa, kuten ehdotetaan viitteessä 1, samoin kuin edellä mainittujen tilastollisten parametrien kanssa. Titrausmenetelmien osalta on esitettävä yksityiskohdat titranttien standardoinnista. Spektrofotometrisen menetelmän osalta on esitettävä kaikki spektrit. Konduktometrisen menetelmän osalta on esitettävä yksityiskohdat kennovakion määrityksestä. Tiedot käytetystä tekniikasta, analyyttisistä menetelmistä ja kaikkien puskuriaineiden erityispiirteistä on annettava. Testilämpötilat on ilmoitettava. LÄHDEKIRJALLISUUS
|
|
2) |
Korvataan B osassa oleva B.5 luku seuraavasti: ”B.5 AKUUTTI SILMÄN ÄRSYTTÄVYYS/SYÖVYTTÄVYYS JOHDANTO Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 405 (2012). OECD:n testiohjeita kemikaalien testaamiseksi on tarkistettava säännöllisesti, jotta ne heijastavat parhaita käytettävissä olevia tieteellisiä menetelmiä. Tämän testimenetelmän aikaisemmissa päivityksissä kiinnitettiin erityistä huomiota mahdollisiin parannuksiin arvioimalla kaikkia testikemikaalista aiemmin saatuja tietoja, jotta vältettäisiin tarpeettomat eläinkokeet ja siten vastattaisiin eläinten hyvinvointia koskeviin näkökohtiin. Testiohjeeseen 405 (joka hyväksyttiin vuonna 1981 ja jota päivitettiin vuosina 1987, 2002 ja 2012) sisältyy suositus, jonka mukaan ennen tässä kuvatun, aineen ärsyttävyyttä/syövyttävyyttä tutkivan in vivo -testin toteuttamista on arvioitava aiempien relevanttien tutkimustulosten painoarvo (1). Jos saatavissa olevat tiedot ovat puutteellisia, niitä voidaan täydentää vaiheittaisen menettelyn avulla (2) (3). Suositeltavaan testausstrategiaan, joka on selostettu tämän menetelmän täydennysosassa, sisältyy validoitujen ja hyväksyttyjen in vitro -testien suorittaminen. Kemikaalien rekisteröinnistä, arvioinnista, lupamenettelyistä ja rajoituksista (REACH) annetun asetuksen (EY) N:o 1907/2006 (2) mukaisesti integroitu testimenettely sisältyy myös asiaankuuluviin Euroopan kemikaaliviraston ohjeisiin (21). Eläinkokeita tulisi tehdä ainoastaan, jos niitä pidetään välttämättöminä sen jälkeen, kun on tarkasteltu käytettävissä olevia vaihtoehtoisia menetelmiä ja kun niiden käyttöä pidetään asianmukaisena. Tämän päivitetyn testimenetelmän valmistelun aikana on tullut esiin tapauksia, jolloin tämän testimenetelmän soveltamista pidetään edelleen tarpeellisena tai sitä edellytetään joidenkin sääntelyjärjestelmien perusteella. Viimeisimmässä päivityksessä keskityttiin pääasiassa kipulääkkeiden ja anestesia-aineiden käyttöön muuttamatta testiohjeen perusajatusta ja rakennetta. ICCVAM (3) ja riippumaton kansainvälinen tieteellinen vertaisarviointiryhmä arvioivat pintapuudutteiden rutiinikäytön käyttökelpoisuutta, systeemisiä kipulääkkeitä ja inhimillisiä päätepisteitä silmänärsytyksen in vivo -testauksen aikana (12). Arvioinnissa päädyttiin siihen, että pintapuudutteiden ja systeemisten kipulääkkeiden käytöllä voitaisiin välttää kokonaan tai suurin osa kivusta ja kärsimyksestä testin tulokseen vaikuttamatta, ja suositeltiin, että näitä aineita käytettäisiin aina. Tämä arviointi otetaan huomioon tässä testimenetelmässä. Pintapuudutteita ja systeemisiä kipulääkkeitä on käytettävä ja inhimillisiä päätepisteitä sovellettava akuuttia silmän ärsytystä ja syövyttävyyttä tutkivassa in vivo-testauksessa. Poikkeukset niiden käyttöön on perusteltava. Tässä menetelmässä kuvatuilla tarkennuksilla vähennetään merkittävästi tai vältetään eläinten kipu ja kärsimys useimmissa testaustilanteissa, joissa in vivo-silmätestaus on edelleen tarpeen. Tasapainoiseen ennaltaehkäisevään kivunhoitoon tulisi sisältyä (i) rutiininomainen esikäsittely pintapuudutteella (esim. proparakaiini ja tetrakaiini) ja systeemisellä kipulääkkeellä (kuten buprenorfiini); (ii) rutiininomainen jälkikäsittely systeemisellä kivunlievityksellä (kuten buprenorfiini ja meloksikaami); (iii) eläinten kivun ja/tai kärsimyksen kliinisten merkkien suunniteltu havainnointi, seuranta ja rekisteröinti; ja (iv) kaikkien silmävammojen luonteen, vakavuuden ja etenemisen suunniteltu havainnointi, seuranta ja rekisteröinti. Tarkempia tietoja annetaan jäljempänä kuvatuissa päivitetyissä menettelyissä. Testikemikaalin annostelun jälkeen mitään muita pintapuudutteita tai kipulääkkeitä ei tulisi käyttää, jotta tutkimukseen ei vaikuteta. Kipulääkkeitä, joilla on anti-inflammatorinen vaikutus (esim. meloksikaami), ei pitäisi käyttää paikallisesti, ja systeemisesti käytettyjen annoksien ei pitäisi häiritä silmävaikutuksia. Määritelmät annetaan tämän testimenetelmän lisäyksessä. ALUSTAVAT HUOMIOT Sekä järkevien tieteellisten menettelytapojen että eläinten hyvinvoinnin vuoksi in vivo -testiä ei pidä suorittaa ennen kuin kaikkien saatavissa olevien kemikaalin mahdolliseen silmä-ärsyttävyyteen/syövyttävyyteen liittyvien tietojen painoarvo on arvioitu. Tällaisia tietoja ovat todisteet aiemmista ihmisille ja/tai koe-eläimille tehdyistä tutkimuksista, todisteet yhden tai usean rakenteellisesti samankaltaisen aineen tai ainetta sisältävän seoksen silmä-ärsyttävyydestä/syövyttävyydestä, kemikaalin voimakasta happamuutta tai emäksisyyttä osoittavat tulokset (4) (5) sekä validoidut ja hyväksytyt in vitro- tai ex vivo -ihoärsyttävyys-/-syövyttävyystestit (6) (13) (14) (15) (16) (17). Tutkimukset voivat olla painoarvoanalyysia aiemmin tehtyjä tai sen tuloksena syntyneitä. Joidenkin kemikaalien kohdalla painoarvoanalyysi voi osoittaa, että in vivo -testi on tarpeen kemikaalin mahdollisen silmä-ärsyttävyyden/-syövyttävyyden selvittämiseksi. Kaikissa näissä tapauksissa, ennen kuin tarkastellaan in vivo -silmätestin käyttöä, olisi mieluiten tehtävä tutkimus in vitro ja/tai in vivo -testeissä siitä, mitä ihon syöpymisen vaikutuksia kemikaali aiheuttaa, ja tätä olisi arvioitava testimenetelmän B.4 vaiheittaisen testimenettelyn (7) tai kemikaaliviraston toimintaohjeissa kuvatun integroidun testimenettelyn (21) mukaisesti. Vaiheittainen testimenetelmä, johon sisältyvät validoidut silmän ärsyttävyyden/syövyttävyyden in vivo tai ex vivo -testit, sisällytetään liitteenä tähän testimenetelmään ja REACH-asetuksen nojalla Euroopan kemikaaliviraston ohjeisiin (21). Tällaisen testimenetelmän käyttöä suositellaan ennen in vivo -testin suorittamista. Uusia kemikaaleja testattaessa on suositeltavaa soveltaa vaiheittaista testimenettelyä, jonka avulla voidaan saada tieteellisesti päteviä tuloksia kemikaalin ärsyttävyydestä/syövyttävyydestä. Sellaisten kemikaalien tapauksessa, joiden iho- ja silmä-ärsyttävyydestä/-syövyttävyydestä ei ole riittävästi tietoja, menettelytapaa voidaan käyttää puuttuvien tietojen hankkimiseen. Päätös käyttää jotain muuta menettelytapaa tai olla käyttämättä vaiheittaista menettelytapaa on perusteltava. IN VIVO -TESTIN PERIAATE Systeemisellä kipulääkkeellä ja asianmukaisella pintapuudutteella annettavan esikäsittelyn jälkeen testiaine annostellaan yhtenä annoksena koe-eläimen toiseen silmään. Käsittelemätön silmä toimii kontrollina. Silmän ärtymisen/syöpymisen aste arvioidaan pisteyttämällä sidekalvon, sarveiskalvon ja värikalvon vammat tietyin väliajoin. Muut silmään kohdistuvat vaikutukset ja koko elimistöön kohdistuvat haittavaikutukset kuvataan myös, jotta vaikutuksia voidaan arvioida kokonaisuudessaan. Testin on kestettävä niin pitkään, että havaittujen vaikutusten korjautuvuus tai korjautumattomuus voidaan arvioida. Eläimet, joissa havaitaan merkkejä jatkuvasta vakavasta stressistä ja/tai tuskista missä tahansa testin vaiheessa tai vammoja, jotka ovat yhdenmukaisia tässä testimenetelmässä kuvattujen inhimillisten päätepisteiden kanssa (ks. 26 kohta), on lopetettava inhimillisellä tavalla, ja tämä on otettava huomioon kemikaalin arvioinnissa. Kuolevien ja kärsivien eläinten lopettamiskriteereihin sovelletaan OECD:n ohjeasiakirjaa (8). IN VIVO -TESTIN VALMISTELU Lajin valinta Suositeltava koe-eläinlaji on albiinokaniini. Kokeessa käytetään nuoria ja terveitä täysikasvuisia yksilöitä. Muiden lajien käyttö on perusteltava. Eläinten valmistelu Kunkin alustavasti testiin valitun koe-eläimen molemmat silmät tutkitaan testin alkua edeltävän 24 tunnin aikana. Eläimiä, joilla esiintyy silmien ärtyneisyyttä, silmävikoja tai aiempia sarveiskalvon vaurioita, ei voi käyttää testissä. Koe-eläintilat ja ruokinta Jokaisella eläimellä on oltava oma häkki. Koe-eläinhuoneen lämpötilan on oltava kaniineilla 20 °C (± 3 °C). Vaikka suhteellisen kosteuden pitäisi olla vähintään 30 % eikä mielellään yli 70 % muulloin kuin huoneen puhdistuksen aikana, pitäisi kuitenkin pyrkiä 50–60 %:n suhteelliseen kosteuteen. Huoneessa tulee käyttää keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa ja 12 tuntia pimeää). Liian voimakasta valoa on vältettävä. Eläinten ruokinnassa voidaan käyttää normaalia laboratorioruokavaliota, eikä juomaveden määrää saa rajoittaa. TESTIMENETTELY Pintapuudutteiden ja systeemisten kipulääkkeiden käyttö Seuraavia menetelmiä suositellaan, jotta kipua ja kärsimystä vältetään tai se minimoidaan silmätestausta koskevissa menettelyissä. Vaihtoehtoisia menettelyjä, joiden on todettu välttävän tai lievittävän kipua tai kärsimystä yhtä hyvin tai paremmin, voidaan käyttää niiden sijasta.
Testikemikaalin annostelu Eläimen alaluomea vedetään varovasti silmämunasta poispäin ja testikemikaali annostellaan eläimen toisen silmän sidekalvopussiin. Sen jälkeen luomia pidetään varovasti yhdessä sekunnin ajan, jotta aine ei valuisi ulos silmästä. Toinen silmä, jota ei käsitellä, toimii kontrollina. Kosteutus Koe-eläinten silmiä ei saa pestä vähintään 24 tuntiin testikemikaalin annostelun jälkeen, paitsi jos kyseessä on kiinteä aine (ks. 18 kohta) tai välitön ärsyttävä tai syövyttävä vaikutus. Silmät voidaan pestä 24 tunnin kuluttua, jos se katsotaan tarpeelliseksi. Pesemisen vaikutuksen selvittämiseksi ei suositella kontrolliryhmää, paitsi jos sille on tieteellisiä perusteita. Jos kontrolliryhmä tarvitaan, käytetään kahta kaniinia. Pesuolosuhteet on dokumentoitava tarkasti, esimerkiksi pesuaika, pesuliuoksen koostumus ja lämpötila, pesun kesto, nesteen tilavuus ja virtausnopeus. Annostaso (1) Nesteiden testaus Testattaessa nesteitä testiannos on 0,1 ml. Kemikaalia ei saa annostella suoraan suihkepumpusta silmään. Nestesuihke on ensin kerättävä astiaan ennen 0,1 ml:n annostelua silmään. (2) Kiinteiden kemikaalien testaus Testattaessa kiinteitä kemikaaleja, tahnoja ja hiukkasmaisia aineita annoksen tilavuuden on oltava 0,1 ml tai painon enintään 100 mg. Testikemikaali jauhetaan hienoksi pölyksi. Kiinteän aineen tilavuus mitataan, kun aine on ensin kevyesti tiivistetty esimerkiksi naputtamalla mitta-astiaa. Jos kiinteä testikemikaali ei ole poistunut koe-eläimen silmästä fysiologisten mekanismien seurauksena ensimmäiseen havainnointiaikaan mennessä eli tunnin kuluttua käsittelystä, silmä voidaan huuhdella fysiologisella suolaliuoksella tai tislatulla vedellä. (3) Aerosolien testaus On suositeltavaa kerätä kaikki pumpattavat suihkeet ja aerosolit ennen niiden annostelua silmään. Ainoa poikkeus ovat paineistetuissa aerosolisäiliöissä olevat kemikaalit, joita ei voida kerätä höyrystymisen takia. Sellaisessa tapauksessa silmää pidellään auki ja testikemikaali annostellaan silmään yhtenä sekunnin kestävänä purskauksena 10 cm:n etäisyydeltä suoraan silmän edestä. Välimatka voi vaihdella suihkesäiliön paineen ja sisällön mukaan. On varottava, ettei suihkesäiliön paine vahingoita silmää. Joissakin tapauksissa voi olla syytä arvioida suihkeen voimakkuuden silmälle mahdollisesti aiheuttamat ”mekaaniset” vauriot. Aerosoliannoksen suuruus voidaan arvioida simuloimalla testiä seuraavalla tavalla. Testikemikaali suihkutetaan punnituspaperille suoraan paperin edessä olevasta kaniinin silmän kokoisesta aukosta. Paperin painon lisäyksen avulla arvioidaan silmään suihkutettu määrä. Haihtuvien kemikaalien tapauksessa annoksen suuruus voidaan arvioida punnitsemalla keräysastia testikemikaalin poistamista ennen ja sen jälkeen. Alkutesti (in vivo -silmä-ärsyttävyys/syövyttävyystesti yhdelle eläimelle) On erittäin suositeltavaa suorittaa aluksi yhdelle eläimelle in vivo -testi (ks. tämän testimenetelmän täydennysosa: silmä-ärsyttävyyden ja -syövyttävyyden vaiheittainen testaus). Havainnoilla on voitava määrittää vakavuus ja korjautuvuus ennen kuin tehdään varmistustesti toisella eläimellä. Jos testitulos osoittaa, että kemikaali on silmää syövyttävä tai vakavasti ärsyttävä kuvattua menettelyä käytettäessä, silmän ärtymistä ei pidä enää testata. Vahvistustesti (in vivo -silmä-ärsyttävyystesti useille eläimille) Jos alkutestissä ei havaita syöpymisoireita tai vakavia ärsytysoireita, ärsyttävyys tai negatiivinen vaste on vahvistettava testaamalla vielä enintään kaksi eläintä. Jos alkutestissä todetaan voimakas ärsyttävä vaikutus, on suositeltavampaa tehdä vahvistustesti vaiheittaisen menettelyn mukaan yhdelle eläimelle kerrallaan kuin altistaa kaksi eläintä samalla kertaa. Jos toisella eläimellä esiintyy syöpymisoireita tai vakavia ärsytysoireita, testiä ei jatketa. Jos toisesta eläimestä saadaan tarpeeksi tuloksia vaaraluokituspäätöksen tekemiseksi, muita testejä ei pitäisi enää tehdä. Havainnointijakso Tarkkailujakson on oltava riittävän pitkä, jotta havaittujen vaikutusten voimakkuus ja korjautuvuus arvioidaan täydellisesti. Testi on kuitenkin lopetettava heti, jos eläin osoittaa merkkejä kovista tuskista tai stressistä (8). Vaikutusten korjautuvuuden määrittämiseksi eläimiä on tarkkailtava tavallisesti 21 päivän ajan testikemikaalin antamisen jälkeen. Jos korjautuvuus todetaan ennen kuin 21 päivää on kulunut, testi on lopetettava silloin. Kliiniset havainnot ja silmäreaktioiden pisteytys Silmiä on arvioitava kattavasti silmävaurioiden esiintymisen tai puuttumisen osalta tunnin kuluttua testikemikaalin antamisesta ja tämän jälkeen ainakin kerran päivässä. Eläimiä on arvioitava useita kertoja päivässä ensimmäisen kolmen päivän aikana, jotta varmistetaan, että lopettamispäätökset tehdään ajoissa. Koe-eläimiä on rutiininomaisesti arvioitava koko tutkimuksen keston ajan kivun ja/tai kärsimyksen kliinisten merkkien varalta (esim. silmien toistuva raapiminen tai hankaaminen, ylenmääräinen silmien räpyttely tai vuotaminen) (9) (10) (11) vähintään kaksi kertaa päivittäin, vähintään 6 tuntia havainnointien välillä, tai tarvittaessa useammin. Tämä on tarpeen, jotta (i) eläimiä arvioidaan asianmukaisesti kivun ja kärsimyksen merkkien varalta, jotta tehdään perusteltuja päätöksiä tarpeesta lisätä kipulääkkeiden annostusta ja (ii) eläimiä arvioidaan vakiintuneiden inhimillisten päätepisteiden osalta, jotta tehdään perusteltuja päätöksiä siitä, onko tarkoituksenmukaista lopettaa eläin humaanisti ja varmistaa, että tällaiset päätökset tehdään ajoissa. Fluoreseiinivärjäystä on käytettävä rutiininomaisesti ja rakolamppu- biomikroskopiaa käytetään tarpeen vaatiessa (esimerkiksi arvioitaessa sarveiskalvon haavauman yhteydessä vamman vakavuutta) havainnointivälineenä okulaarivaurion mittaamisessa ja arvioitaessa, onko humaanin lopettamisen osalta vahvistetut päätepistettä koskevat perusteet täytetty. Digitaalivalokuvia havaituista vaurioista voidaan kerätä viitteeksi ja tarjoamaan pysyvä aineisto okulaarivaurion laajuudesta. Eläintä ei saa pitää testattavana sen jälkeen kun lopulliset tiedot on saatu. Eläimet, jotka osoittavat stressin tai vakavien tuskien merkkejä, on viipymättä lopetettava inhimillisellä tavalla, ja tämä on otettava huomioon testikemikaalin vaikutusten arvioinnissa. Inhimillisellä tavalla on lopetettava eläimet, joilla esiintyy testiaineen annostelun jälkeen seuraavia silmävammoja (ks. taulukko 1 vaurioiden asteista): sarveiskalvon puhkeaminen tai huomattava sarveiskalvon haavauma mukaan luettuna pullistuma, verta silmän etukammiossa, asteen 4 sarveiskalvosamentuma, valorefleksin puuttuminen (värikalvon vaste 2), joka jatkuu 72 tuntia, sidekalvon haavauma, sidekalvon tai vilkkukalvon kuolio tai arpeutuminen. Näin menetellään siksi, että kyseiset vauriot ovat yleensä korjautumattomia. Lisäksi suositellaan, että seuraavia silmävammoja käytetään inhimillisinä päätepisteinä tutkimusten lopettamiseksi ennen suunniteltua 21 päivän tarkkailujaksoa. Näiden vaurioiden katsotaan osoittavan, että vamma aiheutuu vakavasti ärsyttävistä tai syövyttävistä kemikaaleista johtuvista vaurioista, joiden ei odoteta täysin poistuvan 21 päivän tarkkailujakson loppuun mennessä: vamman ulottuminen vakavaan syvyyteen (esim. sarveiskalvon haavauma, joka ulottuu strooman pintakerroksiin), sarveiskalvon rajan tuhoutuminen > 50 % (jota osoittaa sidekalvokudoksen vaalentuminen), ja vakava silmätulehdus (märkivä, rähmäinen silmä). Seuraavaa yhdistelmää voidaan pitää potentiaalisesti hyödyllisinä kriteereinä, jotka vaikuttavat kliiniseen päätökseen tutkimuksen ennenaikaisesta päättämisestä: sarveiskalvon pinnan verisuonittuminen (eli pannus); fluoreseiinivärjätty alue, jonka ala ei pienene ajan mittaan päivittäisen arvioinnin perusteella; ja re-epitelisaation puuttuminen viiden päivän kuluttua testikemikaalin antamisesta. Nämä havainnot eivät kuitenkaan riitä yksittäin perusteiksi tutkimuksen ennenaikaiselle päättämiselle. Kun vakavia silmävaikutuksia on havaittu, tarkkailijana olevaa/pätevää laboratorion eläinlääkäriä tai henkilöstöä, joka on koulutettu havaitsemaan kliiniset vammat, on kuultava kliinisessä tutkimuksessa, jossa määritetään, antaako näiden vaikutusten yhdistelmä aiheen päättää tutkimus varhaisessa vaiheessa. Silmänreaktioiden pisteytys (sidekalvo, sarveiskalvo ja värikalvo) on otettava ja kirjattava 1, 24, 48 ja 72 tunnin kuluttua testikemikaalin annostuksesta (taulukko 1). Eläimet, joille ei kehity silmävammoja, voidaan lopettaa aikaisintaan kolme päivää testikemikaalin annostelun jälkeen. Eläimiä, joilla esiintyy muita kuin vakavia vaurioita, on tarkkailtava, kunnes vauriot häviävät, tai 21 päivää, jolloin koe päätetään. Havainnot on tehtävä ja kirjattava vähintään 1 tunnin, 24 tunnin, 48 tunnin, 72 tunnin, 7 päivän, 14 päivän ja 21 päivän kuluttua, jotta voidaan määrittää vaurioiden tila ja niiden korjautuvuus tai korjautumattomuus. Havaintoja on tehtävä tarvittaessa tiheämmin, jotta määritetään, pitääkö koe-eläin lopettaa inhimillisistä syistä tai poistaa tutkimuksesta negatiivisten tulosten vuoksi. Silmävaurioiden pisteytys (taulukko 1) on kirjattava kussakin tarkastelussa. Kaikki muut silmävauriot (esimerkiksi sarveiskalvoverho, värjäytyminen, etukammion muutokset) tai koko elimistöön kohdistuvat haittavaikutukset on myös raportoitava. Reaktioiden tutkimista helpottaa luuppilasien, lampun, biomikroskoopin tai muiden sopivien laitteiden käyttö. Kun havainnot on kirjattu 24 tunnin jälkeen, silmiä voidaan edelleen tutkia fluoreskeiinin avulla. Silmävasteiden pisteytys on väistämättä subjektiivista. Silmävasteiden pisteytyksen yhdenmukaistamiseksi sekä testilaboratorion ja havaintoja tekevien ja tulkitsevien henkilöiden työn helpottamiseksi havaintoja tekevän henkilöstön on oltava riittävän perehtynyttä pisteytysjärjestelmään. TIEDOT JA RAPORTOINTI Tulosten arviointi Silmä-ärsytyspisteet on arvioitava yhdessä vammojen luonteen ja vakavuuden sekä niiden korjautuvuuden tai korjautumattomuuden kanssa. Yksittäiset pisteet eivät edusta kemikaalin ärsyttävyysominaisuuksien absoluuttista tasoa, koska testikemikaalin muutkin vaikutukset ovat arvioinnissa mukana. Sen sijaan yksittäisiä pisteitä pitäisi tarkastella viitearvoina, jotka ovat merkitseviä vain, kun kaikki muut havainnot ja niiden arviointi tukevat pisteiden antamaa tietoa. Testiraportti Testiraporttiin on sisällytettävä seuraavat tiedot:
Tulosten tulkinta Koe-eläimille tehtyjen silmä-ärsytystestien tulosten ekstrapolointi ihmisiä koskeviksi on vain rajoitetusti pätevää. Monissa tapauksissa albiinokaniini on ihmistä herkempi silmää ärsyttäville tai syövyttäville aineille. Tulosten tulkinnassa on huolellisesti erotettava sekundäärisestä tulehduksesta johtuva ärsytys. LÄHDEKIRJALLISUUS
Taulukko 1 Silmävaurioiden pisteytys
Lisäys MÄÄRITELMÄT Ei-ärsyttävä : Aineita, joita ei ole luokiteltu EPA-järjestelmän kategoriaan I, II tai III silmää ärsyttäviksi aineiksi; tai GHS:n kategoriaan 1, 2, 2A tai 2B; tai EU-kategoriaan 1 tai 2 (17) (18) (19). Happo-/emäsreservi : Kun kyse on happamista valmisteista, tämä on määrä (grammaa) natriumhydroksidia/100 g valmistetta, jota tarvitaan tietyn pH-arvon tuottamiseen. Kun kyse on emäksisistä valmisteista, tämä on määrä (grammaa) natriumhydroksidia, joka vastaa (grammaa) rikkihappoa/100 g valmistetta, jota tarvitaan tietyn pH-arvon tuottamiseen (Young et al. 1988). Kemikaali : Aine tai aineiden seos. Porrastettu menettely : Vaiheittainen testausstrategia, jossa kaikkia testikemikaalia koskevia olemassa olevia tietoja tarkastellaan tietyssä järjestyksessä käyttäen todistusnäyttöprosessia kussakin vaiheessa sen määrittämiseksi, onko käytettävissä riittävästi tietoja vaaraluokituspäätöstä varten, ennen kuin siirrytään seuraavaan vaiheeseen. Lisätestausta ei tarvita, jos testikemikaalin ärsytyskyky voidaan määrittää olemassa olevien tietojen perusteella. Jos testikemikaalin ärsytyskykyä ei voida määrittää olemassa olevien tietojen perusteella, toteutetaan vaiheittainen testaus eläimillä, kunnes luokitus voidaan määritellä aukottomasti. Silmää syövyttävä aine : a) Kemikaali, joka aiheuttaa silmään palautumatonta kudosvauriota; b) kemikaalit, jotka on luokiteltu GHS:n kategoriaan 1, EPA-järjestelmän kategoriaan I silmää ärsyttäviksi aineiksi tai EU:n kategoriaan 1 (17) (18) (19). Silmää vakavasti ärsyttävä aine : a) Kemikaali, joka aiheuttaa silmälle kudosvauriota, joka ei korjaudu 21 päivän kuluessa annostelusta tai joka aiheuttaa näkökyvyn vakavaa fyysistä rappiota; b) kemikaalit, jotka on luokiteltu GHS:n kategoriaan 1 silmää ärsyttäviksi aineiksi tai EPAn kategoriaan I silmää ärsyttäviksi aineiksi tai EU:n kategoriaan 1 (17) (18) (19). Silmää ärsyttävä aine : a) Kemikaali, joka aiheuttaa silmään palautuvan muutoksen; b) kemikaalit, jotka on luokiteltu EPA-järjestelmän kategoriaan II tai III silmää ärsyttäviksi aineiksi; tai GHS:n kategoriaan 2, 2A tai 2B silmää ärsyttäviksi aineiksi; tai EU:n kategoriaan 2 (17) (18) (19). Testikemikaali : Aine tai seos, jota testataan tällä testimenetelmällä. Todistusnäyttö (todistusnäyttöprosessi) : Tiedon kokoamisen vahvuuksia ja heikkouksia käytetään perustana päättelylle, joka ei välttämättä käy ilmi yksittäisistä tiedoista. TESTIMENETELMÄN B.5 TÄYDENNYS (4) SILMÄ-ÄRSYTTÄVYYDEN JA -SYÖVYTTÄVYYDEN VAIHEITTAINEN TESTAUS Yleisiä huomautuksia Sekä järkevien tieteellisten menettelytapojen että eläinten hyvinvoinnin vuoksi on tärkeää välttää tarpeettomia eläinkokeita ja tehdä mahdollisimman vähän sellaisia testejä, jotka todennäköisesti aiheuttavat elämissä vakavia vasteita. Ennen in vivo -testin suunnittelemista on arvioitava kaikki tiedot testikemikaalin mahdollisesta silmä-ärsyttävyydestä/-syövyttävyydestä. Riittävät todisteet testikemikaalin silmä-ärsyttävyyden/-syövyttävyyden luokittelemiseksi voivat jo olla olemassa, jolloin koe-eläintestejä ei tarvita. Painoarvoanalyysin ja vaiheittaisen menettelyn käyttö vähentää in vivo -testien tarvetta, erityisesti jos on todennäköistä, että testikemikaali aiheuttaa vakavia reaktioita. On suositeltavaa arvioida aineiden silmä-ärsyttävyydestä/-syövyttävyydestä saatavissa olevien tietojen painoarvo, jotta voidaan päättää, tarvitaanko kemikaalin silmä-ärsyttävyyspotentiaalin määrittämiseksi muita testejä kuin in vivo -silmätesti. Jos muita testejä tarvitaan, on suositeltavaa käyttää vaiheittaista menettelyä relevanttien koetulosten hankkimiseksi. Jos ainetta ei ole testattu aikaisemmin, vaiheittaisen menettelyn avulla voidaan hankkia silmä-ärsyttävyyden/-syövyttävyyden arviointiin tarvittavat tulokset. Tässä täydennyksessä kuvattu alkuperäinen testimenetelmä kehitettiin OECD:n työryhmässä (1). Se on vahvistettu ja laajennettu myöhemmin järjestelmässä Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, sellaisena kuin se vahvistettiin kemikaalikomitean ja kemikaalityöryhmän 28. yhteisessä kokouksessa marraskuussa 1998 (2) ja kuten OECD:n asiantuntijatyöryhmä päivitti sitä vuonna 2011. Vaikka tämä vaiheittainen testausstrategia ei ole olennainen osa testimenetelmää B.5, siinä kuvataan suositeltavaa lähestymistapaa aineen silmä-ärsyttävyys-/-syövyttävyysominaisuuksien määrittämiseen. Tämä lähestymistapa edustaa sekä parhaita käytäntöjä että eettistä vertailukohdetta silmä-ärsyttävyyden/-syövyttävyyden in vivo -testauksessa. Siinä annetaan ohjeita in vivo -testin suorittamiseen ja esitetään yhteenveto tekijöistä, jotka on käsiteltävä ennen testin aloittamista. Strategia tarjoaa lähestymistavan aiemmin saatujen tulosten arviointiin testiaineen silmä-ärsyttävyys-/-syövyttävyysominaisuuksien selvittämiseksi, ja sen avulla voidaan vaihe vaiheelta tuottaa merkitseviä tuloksia kemikaaleista, joista tarvitaan lisätietoja tai joita ei ole aikaisemmin tutkittu. Strategiassa suositellaan myös käyttämään ensin validoituja ja hyväksyttyjä in vitro- tai ex vivo -testejä ja sen jälkeen tietyissä tapauksissa testimenetelmän B.4 tutkimuksia (3) (4). Vaiheittaisen testausstrategian kuvaus Ennen vaiheittaiseen menettelyyn sisältyvien testien suorittamista (kaavio) on analysoitava kaikki saatavissa olevat tiedot, jotta in vivo -silmätestauksen tarve voidaan määrittää. Vaikka yksittäisistä parametreista (esimerkiksi äärimmäiset pH-arvot) voidaan saada merkitseviä tietoja, on syytä ottaa huomioon tulokset kokonaisuudessaan. Kaikkien kyseessä olevan kemikaalin tai sitä rakenteeltaan vastaavan kemikaalin vaikutustietojen painoarvo on arvioitava testauspäätöksen yhteydessä, ja päätökselle on esitettävä perustelut. Ensisijaisesti on painotettava sekä ihmis- että eläintesteillä kemikaalista aiemmin saatuja tuloksia ja seuraavaksi in vitro- tai ex vivo -testien tuloksia. Syövyttävien kemikaalien in vivo -testejä on vältettävä aina kun se on mahdollista. Testimenettelyssä on otettava huomioon seuraavat asiat:
SILMÄ-ÄRSYTTÄVYYDEN/-SYÖVYTTÄVYYDEN TESTAUS- JA ARVIOINTIMENETTELY
LÄHDEKIRJALLISUUS
|
|
3) |
Korvataan B osassa oleva B.10 luku seuraavasti: ”B.10 In vitro-kromosomipoikkeavuustesti nisäkässoluilla JOHDANTO Tämä testimenetelmä vastaa OECD:n testiohjetta 473 (2016). Se on osa geneettisen toksikologian testimenetelmiä. On laadittu OECD:n asiakirja, jossa ytimekkäitä tietoja geneettistä toksikologiaa koskevista testeistä sekä katsaus näihin testimenetelmiin tehtyihin viimeaikaisiin muutoksiin (1). In vitro -kromosomipoikkeavuustestin tarkoituksena on tunnistaa kemikaalit, jotka aiheuttavat rakenteellisia kromosomipoikkeavuuksia viljellyissä nisäkässoluissa (2) (3) (4). Rakenteelliset poikkeavuudet jakautuvat kahteen tyyppiin, kromosomi- ja kromatidipoikkeavuuksiin. Polyploidiaa (mukaan lukien endoreduplikaatio) voi aiheutua kromosomipoikkeavuutta koskevissa määritysmenetelmissä in vitro. Aneugeenit voivat aiheuttaa polyploidiaa; polyploidia ei yksinään osoita aneugeenistä mahdollisuutta, se voi yksinkertaisesti osoittaa solysyklin häiriön tai sytotoksisuuden (5). Tätä testiä ei ole suunniteltu mittaamaan aneuploidiaa, vaan aneuploidian havaitsemiseen on suositeltavaa käyttää in vitro -mikrotumatestiä (6). In vitro -kromosomipoikkeavuustestissä voidaan käyttää ihmisen tai jyrsijän pysyvien solulinjojen tai solukantojen viljelmiä. Käytettävät solut on valittava sen mukaan, mikä on solujen kasvukyky viljelmässä, karyotyypin pysyvyys, (mukaan lukien kromosomiluku) ja kromosomipoikkeavuuksien spontaanifrekvenssi (7). Tällä hetkellä käytettävissä olevien tietojen perusteella ei voida esittää vankkoja suosituksia, vaan todeta, että kemiallisten vaarojen arvioinnissa on tärkeää ottaa huomioon p53-status, geneettinen (karyotyypin) pysyvyys, DNA:n korjaantumiskapasiteetti ja testaukseen valittujen solujen alkuperä (jyrsijä tai ihminen). Tämän testimenetelmän käyttäjiä kehotetaan siten harkitsemaan näiden ja muiden solujen ominaisuuksien vaikutusta solulinjan kykyyn havaita kromosomipoikkeavuuksien induktio, kun tietoa saadaan lisää tällä alalla. Sovellettavat määritelmät esitetään lisäyksessä 1. ALUSTAVAT NÄKÖKOHDAT JA RAJOITUKSET In vitro -testit edellyttävät yleensä eksogeenista metabolista aktivaatiojärjestelmää, ellei solujen metabolia sovellu kyseisiin testikemikaaleihin. Eksogeeninen metabolinen aktivaatiojärjestelmä ei täysin jäljittele in vivo -olosuhteita. On huolehdittava, että vältetään olosuhteet, jotka voisivat johtaa vääriin positiivisiin tuloksiin, toisin sanoen kromosomivaurioihin, jotka eivät johdu testikemikaalien ja kromosomien suorasta vuorovaikutuksesta; tällaisiin olosuhteisiin sisältyvät pH:n tai osmolaalisuuden muutokset (8) (9) (10), yhdysvaikutus väliaineen komponenttien kanssa (11) (12) tai liian korkeat sytotoksisuustasot (13) (14) (15) (16). Tätä testiä käytetään havaitsemaan klastogeenisistä tapahtumista mahdollisesti johtuvat kromosomipoikkeavuudet. Kromosomipoikkeavuuden induktion analyysi on tehtävä metafaasissa olevia soluja käyttämällä. Siksi on tärkeää, että solujen pitäisi edetä mitoosiin sekä käsitellyissä että käsittelemättömissä viljelmissä. Valmistettujen nanomateriaalien osalta tähän testimenetelmään voidaan joutua tekemään erityisiä mukautuksia, mutta niitä ei ole kuvattu tässä testimenetelmässä. Ennen kuin testimenetelmää käytetään seoksen testaamiseen tietojen tuottamiseksi aiottuun sääntelytarkoitukseen, on harkittava, antaako se asianmukaiset tulokset tämän tavoitteen kannalta, ja jos antaa, miksi. Tällaista harkintaa ei tarvita, jos seoksen testaamista edellytetään sääntelyvaatimuksissa. TESTIN PERIAATE Ihmis- tai muut nisäkäsperäiset soluviljelmät altistetaan testikemikaalille sekä eksogeenisen metabolisen aktivaatiojärjestelmän kanssa että ilman sitä, paitsi jos testissä käytetään soluja, joiden metabolointikyky on riittävä (ks. 13 kohta). Sen jälkeen kun soluviljelmien altistus testikemikaalille aloitetaan, ne käsitellään sopivin etukäteen määrätyin välein metafaasin pysäyttävällä kemikaalilla (esim. colcemidilla tai kolkisiinilla), solut kerätään ja värjätään, ja metafaasissa olevat solut analysoidaan mikroskooppisesti kromatidityyppisten ja kromosomityyppisten poikkeavuuksien havaitsemiseksi. MENETELMÄN KUVAUS Valmisteet Solut Testissä voidaan käyttää erilaisia solulinjoja (esim. kiinanhamsterin munasarjat (CHO), kiinanhamsterin keuhkot V79, kiinanhamsterin keuhkot (CHL)/IU, TK6) tai primaarisia soluviljelmiä, myös ihmisen tai muun nisäkkään perifeerisen veren lymfosyyttejä (7). Käytettyjen solulinjojen valintaa on perusteltava tieteellisesti. Kun primaarisoluja käytetään, on käytettävä mahdollisuuksien mukaan ihmisestä peräisin olevia primaarisoluja, ja näytteet on otettava humaanien eettisten periaatteiden ja sääntöjen mukaisesti. Ihmisen perifeerisen veren lymfosyytit on saatava nuorilta (noin 18–35-vuotiailta), terveiltä ja tupakoimattomilta henkilöiltä, joiden ei tiedetä altistuneen äskettäin genotoksisille aineille (esim. kemikaaleille tai ionisoivalle säteilylle) sellaisilla tasoilla, jotka lisäisivät kromosomaalisten poikkeavuuksien taustaesiintyvyyttä. Tällä varmistetaan, että kromosomaalisten poikkeavuuksien taustaesiintyvyys on matala ja johdonmukainen. Kromosomaalisten poikkeavuuksien esiintyminen perustasolla lisääntyy iän myötä, ja tämä suuntaus on naisilla selvempi kuin miehillä (17) (18). Jos soluja kerätään useammalta kuin yhdeltä luovuttajalta, luovuttajien lukumäärä on ilmoitettava. On osoitettava, että solut ovat jakaantuneet testikemikaalilla käsittelyn aloittamisen ja solujen keräämisen välillä. Soluviljelmät pidetään eksponentiaalisessa kasvuvaiheessa (solulinjat) tai niitä stimuloidaan jakaantumaan (lymfosyyttien primaariset viljelmät), jotta solut altistetaan solusyklin eri vaiheissa, koska soluasteiden herkkyys testikemikaaleille ei ole ehkä tiedossa. Primaarisolut, joita on stimuloitava jakaantumaan mitogeenisilla aineilla, eivät yleensä ole enää synkronoituja testikemikaalille altistamisen aikana (esim. ihmisen lymfosyytit 48 tuntia kestävän mitogeenisen stimulaation jälkeen). Synkronoitujen solujen käyttöä käsittelyn aikana ei suositella, mutta se voidaan perustelluissa tapauksissa hyväksyä. Kasvatusväliaineet ja viljelyolosuhteet Soluviljelmiä on viljeltävä soveltuvassa kasvatusväliaineessa ja inkubaatio-olosuhteissa (kasvatusastiat, tarvittaessa kosteutettu ilma, jonka CO2-pitoisuus on 5 prosenttia, 37 °C:n inkubointilämpötila). Solulinjoista on tarkistettava ajoittain modaalisen kromosomimäärän pysyvyys ja varmistettava, ettei mykoplasmakontaminaatiota esiinny (7) (19); soluja ei pidä käyttää, jos ne ovat kontaminoituneet tai jos modaalinen kromosomimäärä on muuttunut. Normaali solusyklin kesto testauslaboratoriossa käytetyissä solulinjoissa tai primaarisissa soluviljelmissä on määritettävä ja sen on oltava solujen julkaistujen ominaisuuksien mukainen (20). Soluviljelmien valmistelu Solulinjat: solut kasvatetaan kantaviljelmistä ja kylvetään kasvatusväliaineeseen sellaiseen tiheyteen, että suspensiossa tai yksikerrosviljelmässä olevat solut kasvavat eksponentiaalisesti keräämisajankohtaan asti (esimerkiksi konfluenssia on vältettävä yksikerrosviljelmissä kasvavien solujen osalta). Lymfosyytit: antikoagulantilla (esimerkiksi hepariinilla) käsiteltyä kokoverta tai erotettuja lymfosyyttejä viljellään (esim. 48 tunnin ajan ihmisen lymfosyyttien osalta) mitogeenin [esim. fytohemagglutiniini (PHA), kun kyse on ihmisen lymfosyyteistä] kanssa, solunjakautumisen aikaansaamiseksi ennen testikemikaalille altistamista. Metabolinen aktivaatio Jos solujen endogeeninen metabolointikyky ei ole riittävä, on käytettävä eksogeenisia metabolisia järjestelmiä Yleisimmin käytetty aktivaatiojärjestelmä, jota suositellaan oletusarvoisesti, ellei toisin toimiminen ole perusteltua, on entsyymejä indusoivilla aineilla, kuten Aroclor 1254:llä (21) (22) (23) tai fenobarbitaalin ja ß-naftoflavonin (24) (25) (26) (27) (28) (29) yhdistelmällä käsiteltyjen jyrsijöiden (yleensä rottien) maksasta eristetty postmitokondriaalinen jae (S9), johon on lisätty kofaktoria. Jälkimmäisenä mainittu yhdistelmä ei ole ristiriidassa pysyviä orgaanisia yhdisteitä koskevan Tukholman yleissopimuksen kanssa (30), ja sen on osoitettu indusoivan sekaoksidaasia yhtä tehokkaasti kuin Aroclor 1254 (24) (25) (26) (28). S9-jakeen yleisesti käytetty pitoisuusalue on 1–2 tilavuusprosenttia, mutta sen pitoisuutta voidaan nostaa 10 tilavuusprosenttiin lopullisessa testiväliaineessa. Mitoosi-indeksiä vähentäviä tuotteita, erityisesti kalsiumiakomplekseja aiheuttavia tuotteita (31) on vältettävä käsittelyn aikana. Testattavien kemikaalien luokka saattaa vaikuttaa siihen, mitä eksogeenisen metabolisen aktivaatiojärjestelmän tai metabolisen indusoijan tyyppiä ja pitoisuutta päätetään käyttää. Testikemikaalin valmistus Kiinteät testikemikaalit on valmistettava sopivissa liuottimissa ja tarvittaessa laimennettava ennen solujen käsittelyä (ks. 23 kohta). Nestemäiset kemikaalit voidaan lisätä suoraan koejärjestelmiin ja/tai laimentaa ennen testijärjestelmän käsittelyä. Kaasujen tai haituvien kemikaalien testauksessa standardimenettelyihin on tehtävä asianmukaisia mukautuksia. Kyseiset kaasut tai kemikaalit on esimerkiksi käsiteltävä suljetuissa astioissa (32) (33) (34). Testikemikaali on valmisteltava juuri ennen käsittelyä, paitsi jos sen säilyvyys on osoitettu stabiliteettitesteillä. Testiolosuhteet Liuottimet Liuotin on valittava siten, että testikemikaalien liukoisuus on mahdollisimman hyvä eikä se haittaa testin suorittamista esimerkiksi muuttamalla solukasvua, vaikuttamalla testikemikaalin eheyteen, reagoimalla viljelyastioiden kanssa tai haittaamalla metabolista aktivaatiojärjestelmää. Vesipitoisen liuottimen (tai viljelynesteen) käyttöä on harkittava ensisijaisesti aina, kun se on mahdollista. Vakiintuneita liuottimia ovat esimerkiksi vesi tai dimetyylisulfoksidi. Yleensä orgaanisten liuottimien osuus ei saa ylittää yhtä ja vesipitoisten liuottimien (suolaliuos tai vesi) kymmentä tilavuusprosenttia lopullisessa kasvatusväliaineessa. Jos käytetään muita kuin vakiintuneita liuottimia (esim. etanolia tai asetonia), niiden käyttö on perusteltava tiedoilla, joilla osoitetaan, että ne ja testikemikaali sekä testijärjestelmä sopivat yhteen ja etteivät ne ole genotoksisia käytettyinä pitoisuuksina. Tällaisten perustelevien tietojen puuttuessa on tärkeää käyttää käsittelemättömiä kontrolleja (ks. lisäys 1), jotka osoittavat, ettei valittu liuotin aiheuta mitään haitallisia tai klastogeenisiä vaikutuksia. Solujen proliferaation ja sytotoksisuuden mittaaminen ja käsittelypitoisuuksien valitseminen Päätettäessä suurimmasta testikemikaalin pitoisuudesta on vältettävä pitoisuuksia, jotka voivat aiheuttaa vääriä positiivisia vasteita, kuten liian voimakasta sytotoksisuutta (ks. 22 kohta), saostumista väliaineeseen (ks. 23 kohta) tai pH-arvon tai osmolaliteetin merkittävää muuttumista (ks. 5 kohta). Jos testikemikaali aiheuttaa sitä lisättäessä väliaineen pH-arvon merkittävän muutoksen, pH-arvoa voidaan mukauttaa puskuroimalla lopullinen käsittelyväliaine väärien myönteisten tulosten välttämiseksi ja asianmukaisten viljelyolosuhteiden säilyttämiseksi. Solujen proliferaation mittauksella varmistetaan, että riittävässä määrässä käsiteltyjä soluja on tapahtunut mitoosi testin aikana ja että käsittelyissä on käytetty asianmukaisia sytotoksisuustasoja (ks. 18 ja 22 kohta). Sytotoksisuus on määritettävä pääasiallisessa kokeessa sekä metabolisen aktivaatiojärjestelmän läsnä ollessa että ilman sitä käyttäen asianmukaisia solukuoleman ja solukasvun indikaattoreita. Vaikka sytotoksisuuden arviointi alustavassa testissä saattaa olla hyödyllinen, jotta voidaan määrittää pääasiallisessa kokeessa käytettävät pitoisuudet, alustava testi ei ole pakollinen. Jos se tehdään, se ei saa korvata sytotoksisuuden mittausta pääasiallisessa kokeessa. Populaation suhteellinen kaksinkertaistuminen (PSK) tai solumäärän suhteellinen lisääntyminen (SMSL) ovat sopivia menetelmiä sytotoksisuuden arviointiin sytogeneettisissä testeissä (13) (15) (35) (36) (55) (ks. kaavojen osalta lisäys 2). Mikäli kyse on pitkäaikaisesta käsittelystä ja näytteenottoajoista sen jälkeen kun on aloitettu käsittely, joka on pidempi kuin 1,5 normaalin solusyklin kesto (ts. yhteensä yli 3 solusykliä), PSK:ssa voidaan aliarvioida sytotoksisuus (37). Tällaisissa olosuhteissa SLSM saattaa olla parempi mittari, tai sytotoksisuuden arviointi 1,5 normaalia solusyklia vastaavan ajan jälkeen on hyödyllinen arvio PSK:ta käyttäen. Kun kyse on lymfosyyteistä primaariviljelmissä, vaikka mitoosi-indeksi (MI) on sytotoksisten/sytostaattisten vaikutusten mitta, siihen vaikuttavat käsittelyn jälkeinen mittausaika, käytetty mitogeeni ja mahdolliset solusyklin häiriöt. MI on kuitenkin hyväksyttävä, koska muut sytotoksisuuden mitat saattavat olla hankalia ja epäkäytännöllisiä ja niitä ei mahdollisesti voida soveltaa PHA-stimulaation vaikutuksesta kasvavien lymfosyyttien kohdepopulaatioon. Vaikka SMSL ja PSK solulinjojen tapauksessa ja MI primaarisissa lymfosyyttiviljelmissä ovat suositeltuja sytotoksisuuden parametrejä, muillakin indikaattoreilla (esim. solujen eheys, apoptoosi, nekroosi, solusykli) voidaan antaa hyödyllistä lisätietoa. Vähintään kolmea hyväksyttävyysperusteet (asianmukainen sytotoksisuus, solumäärä jne.) täyttävää testipitoisuutta (pois lukien liuotinkontrolli ja positiiviset kontrollit) on arvioitava. Solujen tyypistä riippumatta (solulinjat tai primaariset lymfosyyttiviljelmät) kullekin testattavalle pitoisuudelle voidaan altistaa kaksi rinnakkaista viljelmää tai vain yksi viljelmä. Vaikka rinnakkaisten viljelmien käyttö on suositeltavaa, vain yhden viljelmän käyttö on myös hyväksyttävää edellyttäen, että yksittäisestä viljelmästä tai rinnakkaisviljelmistä lasketaan sama kokonaismäärä soluja. Yhden viljelmän käyttö on erityisen merkityksellistä, kun arvioidaan useampaa kuin kolmea pitoisuutta (ks. 31 kohta). Riippumattomista rinnakkaisviljelmistä tietyllä pitoisuudella saadut tulokset voidaan yhdistää analyysia varten (38). Sellaisten testikemikaalien kohdalla, jotka osoittavat vähän tai eivät lainkaan sytotoksisuutta, sopiva pitoisuuksien välinen kerroin on yleensä 2–3. Jos sytotoksisuutta esiintyy, valittujen testipitoisuuksien on katettava vaihteluväli 22 kohdassa kuvatusta sytotoksisuudesta vähäiseen sytotoksisuuteen tai tasoon, jolla sytotoksisuutta ei esiinny lainkaan. Monien testikemikaalien pitoisuus-vastekäyrä on jyrkkä, ja tietojen saamiseksi vähäisestä ja keskitason sytotoksisuustasosta tai annosvastesuhteen tutkimiseksi tarkasti on käytettävä pitoisuuksia, jotka ovat lähempänä toisiaan, ja/tai useampaa kuin kolmea pitoisuutta (yksittäisiä viljelmiä tai rinnakkaisviljelmiä) erityisesti tilanteissa, joissa tarvitaan toistettuja kokeita (ks. 47 kohta). Jos enimmäispitoisuus perustuu sytotoksisuuteen, suurimmassa pitoisuudessa sytotoksisuuden on oltava 55 ± 5 % käyttäen suositeltuja sytotoksisuuden parametrejä (solulinjojen SMSL:n ja PSK:n pieneneminen ja MI:n pieneneminen lymfosyyttien primaariviljelmissä 45 ± 5 %:iin rinnakkaisesta negatiivisesta kontrollista). On tulkittava varovaisesti positiivisia tuloksia, jotka on havaittu ainoastaan tämän sytotoksisuuden 55 ± 5 %:n vaihteluvälin yläpäässä (13). Sellaisten huonosti liukenevien testikemikaalien kohdalla, jotka eivät ole sytotoksisia pienintä liukenematonta pitoisuutta pienemmissä pitoisuuksissa, suurimmassa analysoitavassa pitoisuudessa on esiinnyttävä testikemikaalilla käsittelyn päättyessä silmin tai käänteismikroskoopilla nähtävää sameutta tai saostumista. Vaikka sytotoksisuutta esiintyy pienintä liukenematonta pitoisuutta pienemmissä pitoisuuksissa, on suositeltavaa testata ainoastaan yksi sameutta tai näkyvää saostumista tuottava pitoisuus, koska saostuminen saattaa aiheuttaa vääriä vasteita. Saostumista aiheuttavissa pitoisuuksissa on huolehdittava siitä, ettei saostuminen vaikuta testin suorittamiseen (esim. värjäykseen tai pisteytykseen). Ennen koetta saattaa olla hyödyllistä määrittää liukoisuus soluviljelmän elatusaineeseen. Jos ei havaita saostumista tai rajoittavaa sytotoksisuutta, suurimman testipitoisuuden on vastattava tasoa 10 mM, 2 mg/ml tai 2 μl/ml sen mukaan, mikä pitoisuuksista on pienin (39) (40) (41). Jos testikemikaalin koostumusta ei ole määritelty eli se on esimerkiksi koostumukseltaan tuntematon tai vaihteleva aine, kompleksien reaktiotuote tai biologinen materiaali (UVCB) (42) taikka ympäristöstä otettu näyte, suurimman pitoisuuden on riittävän sytotoksisuuden puuttuessa ehkä oltava suurempi (esim 5 mg/ml) kunkin osan pitoisuuden lisäämiseksi. On kuitenkin huomattava, että nämä vaatimukset voivat vaihdella ihmisille tarkoitettujen lääkkeiden osalta (43). Kontrollit Jokaisena solujen keräämisajankohtana on otettava rinnakkaiset negatiiviset kontrollit (ks. 15 kohta), jotka koostuvat pelkästään tutkittavaa ainetta sisältävässä kasvatusväliaineessa olevasta liuottimesta ja joita on käsitelty samalla tavoin kuin altistettuja viljelmiä. Samanaikaisia positiivisia kontrolleja tarvitaan osoittamaan laboratorion kyky tunnistaa klastogeenejä käytetyn testisuunnitelman olosuhteissa sekä eksogeenisen metabolisen aktivaatiojärjestelmän tehokkuus, kun tämä on tarpeen. Esimerkkejä positiivisista kontrolleista esitetään alla olevassa taulukossa 1. Vaihtoehtoisia positiivisia kontrollikemikaaleja voidaan käyttää perustelluissa tapauksissa. Koska nisäkässoluilla tehtävät in vitro -geenimutaatiotestit ovat riittävän standardoidut, positiivisten kontrollien käyttö voi rajoittua klastogeeniin, joka vaatii metabolista aktivaatiota. Jos tämä tehdään samanaikaisesti ei-aktivoidun testin kanssa samaa annostelukestoa soveltaen, tämä yksittäinen positiivinen kontrollivaste osoittaa sekä metabolisen aktivaatiojärjestelmän aktiivisuuden että testausjärjestelmän herkkyyden. Pitkäaikaisessa käsittelyssä (ilman S9-jaetta) on kuitenkin oltava oma positiivinen kontrollinsa, koska käsittelyn kesto poikkeaa testistä, jossa käytetään metabolista aktivointia. Kutakin positiivista kontrollikemikaalia on käytettävä yhtenä tai useampana pitoisuutena, joiden voidaan odottaa aiheuttavan toistettavissa ja havaittavissa oleva lisääntyminen taustaan verrattuna. Näin voidaan osoittaa testausjärjestelmän herkkyys (vaikutukset ovat selvät mutta eivät paljasta heti lukijalle koodattujen objektilasien identiteettiä), ja tässä testimenetelmässä määritetyt raja-arvot ylittävä sytotoksisuustaso ei saa vaarantaa vasteen luotettavuutta. Taulukko 1 Vertailukemikaalit, joita suositellaan laboratorion pätevyyden arvioimiseksi ja positiivisten kontrollien valintaan
MENETTELY Käsittely testikemikaalilla Lisääntyvät solut altistetaan testikemikaalille metabolisen aktivaatiojärjestelmän läsnäollessa ja ilman sitä. Näytteiden keräämisajankohdat Negatiivisen tuloksen vahvistamiseksi tarvittavaa perusteellista arviointia varten testi on kuitenkin suoritettava kaikissa seuraavissa kolmessa testiolosuhteissa käyttäen lyhytaikaista käsittelyä metabolisen aktivointijärjestelmän kanssa ja ilman sitä sekä pitkäaikaista käsittelyä ilman metabolista aktivointia (ks. 43, 44 ja 45 kohta):
Jos jokin edellä mainituista testiolosuhteista johtaa positiiviseen vasteeseen, muita altistusohjelmia ei ole välttämättä tarpeen tutkia. Kromosomipreparaattien valmistus Soluviljelmiä käsitellään colcemidilla tai kolkisiinilla yleensä 1–3 tunnin ajan ennen näytteiden keräämistä. Jokaisen viljelmän näytteet kerätään ja käsitellään erikseen kromosomipreparaattien valmistusta varten. Kromosomipreparaattien valmistukseen kuuluu solujen hypotoninen käsittely, fiksointi ja värjäys. Yhden solun vahvuisissa kerroksissa voi esiintyä mitoosissa olevia soluja (pyöreitä, irtoavat pinnasta) 3–6 tuntia kestävän käsittelyn päättyessä. Koska mitoosissa olevat solut irtoavat helposti, ne voivat hävitä testikemikaalia sisältävän väliaineen mukana, kun se kaadetaan pois. Jos mitoosissa olevien solujen määrän havaitaan lisääntyvän huomattavasti kontrolleihin verrattuna, mikä viittaa todennäköisesti mitoosin pysähtymiseen, solut on kerättävä sentrifugoimalla ja palautettava viljelmiin, jotta mitoosivaiheessa olevia soluja, joissa kromosomipoikkeavuuksia voi muodostua, ei menetetä keruuvaiheessa. Analyysi Kaikki objektilasit, myös positiiviset ja negatiiviset kontrollit, on koodattava toisistaan riippumattomasti ennen mikroskooppitutkimusta kromosomipoikkeavuuksista. Koska fiksaatio johtaa usein joidenkin metafaasissa olevien solujen kromosomien menettämiseen, lasketuissa soluissa tulisi olla sentromeerejä modaalista lukumäärää vastaava määrä ± 2. Kustakin pitoisuudesta ja kontrollista on laskettava vähintään 300 hyvin levinnyttä metafaasia sen päättelemiseksi, että testikemikaali on selvästi negatiivinen (ks. 45 kohta). Nämä 300 solua jaetaan tasan rinnakkaisnäytteisiin, jos käytetään rinnakkaisviljelmiä. Jos käytetään yhtä viljelmää pitoisuutta kohti (ks. 21 kohta), viljelmästä on laskettava vähintään 300 hyvin levinnyttä metafaasia. Tämän 300 solun laskennan ansiosta testin tilastollista voimaa lisätään ja lisäksi nolla-arvoja havaitaan harvoin (niitä oletetaan olevan vain viisi prosenttia) (44). Laskettujen metafaasien määrää voidaan vähentää, kun havaitaan korkea määrä soluja, joissa on kromosomipoikkeavuuksia ja testikemikaalia pidetään selkeästi positiivisena. Solut, joissa on rakenteellisia kromosomipoikkeavuuksia mukaan lukien ja ilman aukkoja (gaps), lasketaan. Katkeamiset (breaks) ja aukot määritellään liitteessä 1 lähteiden (45) ja (46) perusteella. Kromatidityyppiset ja kromosomityyppiset poikkeavuudet on kirjattava erikseen ja luokiteltava alatyypin mukaan (katkeamiset, vaihdokset). Laboratoriossa käytettävillä menettelyillä varmistetaan, että kromosomipoikkeavuuden analyysin tekevät hyvin koulutetut laskijat ja niitä vertaisarvioidaan tarvittaessa. Vaikka testillä pyritään ensisijaisesti toteamaan rakenteelliset kromosomipoikkeavuudet, on tärkeää rekisteröidä myös polyploidian ja endoreduplikaation esiintymistaajuudet, mikäli näitä esiintyy. (Ks. 2 kohta). Laboratorion pätevyys Jotta voidaan vahvistaa riittävä kokemus testin suorittamisesta ennen kuin sitä käytetään rutiinitestaukseen, laboratoriossa on teetettävä sarja kokeita positiivisilla vertailukemikaaleilla, jotka toimivat eri mekanismien kautta, ja erilaisia negatiivisia kontrolleja (käyttäen erilaisia liuottimia/kantaja-aineita). Näiden positiivisten ja negatiivisten kontrollien vasteiden on oltava lähdekirjallisuuden mukaisia. Tätä ei sovelleta laboratorioihin, joilla on kokemusta, eli joista on 37 kohdassa määritelty laboratoriokohtainen tietokanta. Tiettyjä positiivisia kontrollikemikaaleja (ks. 26 kohdassa oleva taulukko 1) on tutkittava lyhyillä ja pitkillä käsittelyillä ilman metabolista aktivaatiota, ja myös lyhyellä käsittelyllä metabolisen aktivaatiojärjestelmän läsnäollessa, jotta pätevyys havaita klastogeenisia kemikaaleja osoitetaan ja metabolisen aktivaatiojärjestelmän tehokkuus määritetään. Valittujen kemikaalien eri pitoisuudet valitaan siten, että ne aiheuttavat toistettavissa olevia ja pitoisuuteen liittyviä lisääntymisiä taustaan verrattuna, koejärjestelmän herkkyyden ja dynaamisen alueen osoittamiseksi. Aiemmat kontrollitiedot Laboratorion on määritettävä:
Kun ensimmäisen kerran saadaan tietoja aiemman negatiivisen kontrollin jakaumasta, rinnakkaisten negatiivisten kontrollien pitäisi olla julkaistujen kontrollitietojen mukaisia, jos sellaisia on olemassa. Kun kontrollin jakaumaan lisätään enemmän kokeellista tietoa, rinnakkaisten negatiivisten kontrollien tulisi mieluiten sijoittua kyseisen jakauman 95 %:n kontrollirajojen sisälle (44) (47). Laboratorion aikaisempien negatiivisten kontrollien tietokanta on aluksi luotava vähintään 10 kokeelle, mutta sen olisi mieluiten koostuttava vähintään 20 kokeesta, jotka on suoritettu vastaavissa koeolosuhteissa. Laboratorioiden on käytettävä laadunvalvontamenetelmiä, kuten valvontakortteja (esim. C-kortteja tai X-bar-kortteja (48)), positiivisten ja negatiivisten kontrollitietojensa vaihtelevuuden määrittämiseksi ja osoittaakseeen, että laboratorio ”hallitsee” menetelmän (44). Lisäsuosituksia aikaisempien tietojen muodostamisesta ja käytöstä (esimerkiksi perusteet tietojen sisällyttämiseksi aikaisempiin tietoihin tai jättämiseksi pois niistä sekä kokeiden hyväksyttävyysperusteet) annetaan lähdekirjallisuudessa (47). Mahdollisissa koejärjestelyn muutoksissa on otettava huomioon järjestelyn yhdenmukaisuus laboratorion olemassa olevien aikaisempia kontrolleja koskevan tietokannan kanssa. Jos havaitaan merkittäviä epäjohdonmukaisuuksia, on luotava uusi aikaisempien kontrollien tietokanta. Negatiivisten kontrollitietojen tulisi koostua kromosomipoikkeavuuksia sisältävien solujen esiintymistaajuudesta yhdessä viljelmässä tai rinnakkaisten viljelmien summasta, kuten 21 kohdassa kuvataan. Rinnakkaisten negatiivisten kontrollien olisi mieluiten sijoituttava laboratorion aikaisempien negatiivisten kontrollien tietokannan 95 %:n kontrollirajojen sisälle (44) (47). Jos rinnakkaisia negatiivisia kontrolleja koskevat tiedot jäävät 95 %:n kontrollirajojen ulkopuolelle, ne voidaan hyväksyä aikaisemman kontrollien jakaumaan edellyttäen, etteivät ne ole äärimmäisiä harha-arvoja ja on näyttöä siitä, että testijärjestelmä on ”hallinnassa” (ks. 37 kohta), sekä siitä, ettei kyse ole teknisestä tai inhimillisestä virheestä. TIEDOT JA RAPORTOINTI Tulosten esittäminen On arvioitava niiden solujen prosenttiosuus, joissa on kromosomipoikkeavuuksia. Kromatidityyppiset ja kromosomityyppiset poikkeavuudet (katkeamiset, vaihdokset) on lueteltava erikseen ja niiden lukumäärät ja esiintymistaajuudet altistetuissa viljelmissä ja kontrolliviljelmissä on mainittava. Aukot (gaps) rekisteröidään erikseen ja raportoidaan, mutta niitä ei lasketa mukaan kromosomipoikkeavuuksien kokonaistaajuuteen. Polyploidian ja/tai endoreduplikoituneita kromosomeja sisältävien solujen prosenttiosuus raportoidaan, kun tämä havaitaan. Lisäksi pääasiallisissa kromosomipoikkeavuustesteissä on rekisteröitävä kaikissa testiviljelmissä sekä negatiivisissa ja positiivisissa kontrolliviljelmissä tehdyt samanaikaiset sytotoksisuusmittaukset. Kustakin viljelmästä on esitettävä tiedot erikseen. Kaikista tiedoista on lisäksi esitettävä yhteenveto taulukkomuodossa. Hyväksyttävyysperusteet Testi hyväksytään seuraavilla perusteilla:
Tulosten arviointi ja tulkinta Mikäli kaikki hyväksyttävyysperusteet täyttyvät, testikemikaali katsotaan selvästi positiiviseksi, jos jossakin tarkastelluista koeolosuhteista (ks. 28 kohta):
Kun kaikki nämä perusteet täyttyvät, testikemikaalin katsotaan voivan indusoida kromosomipoikkeavuuksia viljellyissä nisäkässoluissa tässä testijärjestelmässä. Lähdekirjallisuudessa on suosituksia sopivimmille tilastomenetelmille (49) (50) (51). Mikäli kaikki hyväksyttävyysperusteet täyttyvät, testikemikaali katsotaan selvästi negatiiviseksi, jos kaikissa tarkastelluissa koeolosuhteissa (ks. 28 kohta):
Tällöin katsotaan, ettei testikemikaali voi indusoida kromosomipoikkeavuuksia viljellyissä nisäkässoluissa tässä testijärjestelmässä. Selvästi positiivista tai negatiivista vastetta ei tarvitse vahvistaa. Jos vaste ei ole selvästi negatiivinen eikä selvästi positiivinen yllä kuvatulla tavalla tai tuloksen biologisen merkityksellisyyden vahvistaminen kaipaa tukea, tietoja tulee arvioida asiantuntija-arviossa ja /tai lisätutkimuksissa. Lisäsolujen laskeminen (tarvittaessa) tai kokeen toistaminen käyttäen mahdollisesti modifioituja koeolosuhteita (esimerkiksi pitoisuusvälit, muut metaboliset aktivaatiojärjestelmät [kuten S9-jakeen pitoisuus tai alkuperä]) saattaa olla hyödyllistä. Saatujen tietojen pohjalta ei harvinaisissa tapauksissa lisätutkimustenkaan jälkeen voida saada positiivisia tai negatiivisia tuloksia, ja sen vuoksi testikemikaalin vaste jää epäselväksi. Polyploidisten solujen määrän suureneminen saattaa osoittaa, että testikemikaaleilla pystytään estämään mitoottisia prosesseja ja aiheuttamaan numeerisia kromosomipoikkeavuuksia (52). Endoreduplikoituneita kromosomeja sisältävien solujen määrän suureneminen saattaa osoittaa, että testikemikaalit kykenevät estämään solusyklin etenemisen (53) (54) (ks. 2 kohta). Siksi polyploidiset solut ja endoreduplikoituneita kromosomeja sisältävät solut on rekisteröitävä erikseen. Testiraportti Testiraportissa on esitettävä seuraavat tiedot:
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT Aneuploidia : yksittäisen tai useamman kuin yhden kromosomin mutta ei kuitenkaan koko kromosomiston (polyploidia) poikkeaminen kromosomien tavallisesta diploidisesta (tai haploidisesta) määrästä. Apoptoosi : ohjelmoitunut solukuolema, jossa tietyt vaiheet johtavat solujen hajoamiseen solukalvon ympäröimiksi rakkuloiksi, jotka myöhemmin häviävät fagosytoosin tai puhkeamisen seurauksena. Endoreduplikaatio : tapahtumasarja, jossa DNA:n kahdentumisen S-vaiheen jälkeen tuma ei etene mitoosiin vaan aloittaa uuden S-vaiheen. Tämän seurauksena syntyy kromosomeja, joissa on 4, 8, 16, … kromatidia. Genotoksinen : yleisnimitys kaikentyyppisille DNA- tai kromosomivaurioille, muun muassa katkeamiselle, deleetioille, addukteille, nukleotidien muutoksille ja sidoksille, uudelleenjärjestäytymiselle, geenimutaatioille, kromosomipoikkeavuuksille ja aneuploidialle. Kaikki genotoksiset vaikutukset eivät johda mutaatioihin tai pysyviin kromosomivaurioihin. Kemikaali : aine tai aineiden seos. Klastogeeni : kemikaali, joka aiheuttaa rakenteellisia kromosomipoikkeavuuksia solupopulaatioissa tai eukaryoottisten organismien populaatioissa. Kromatidien aukko (chromatid gap) : yhden kromatidin ei-värjätty alue (akromaattinen leesio), johon liittyy minimaalinen kromatidin siirtymä. Kromatidien katkeaminen (chromatid break) : yhden kromatidin katko, jossa on yhden kromatidin selvä siirtymä. Kromatidipoikkeavuus : rakenteellinen kromosomivaurio, joka ilmenee yksittäisten kromatidien katkeamisena tai kromatidien katkeamisena ja uudelleenyhtymisenä. Kromosomipoikkeavuus : rakenteellinen kromosomivaurio, joka ilmenee molempien kromatidien katkeamisena tai katkeamisena ja uudelleenyhtymisenä samassa kohdassa. Käsittelemättömät kontrollit : viljelmät, joita ei altisteta aineelle (eli niihin ei käytetä testikemikaalia eikä liuotinta) vaan ne käsitellään samanaikaisesti samalla tavalla kuin testikemikaalia saavat viljelmät. Liuotinkontrolli : yleinen nimitys kontrolliviljelmille, joihin lisätään vain testikemikaalin liuottamiseen käytettyä liuotinta. Maksasta eristetty S9-jae : maksahomogenaatin supernatantti 9 000 g sentrifugoinnin jälkeen, ts. käsittelemätön maksanäyte. Mitoosi : solutuman jakautuminen, joka jaotellaan yleensä profaasiin, prometafaasiin, metafaasiin, anafaasiin ja telofaasiin. Mitoosi-indeksi (MI) : suhdeluku, joka saadaan jakamalla metafaasissa olevien solujen määrä solupopulaatiossa todettujen solujen kokonaismäärällä; ilmoittaa solujen proliferaatioasteen kyseisessä solupopulaatiossa. Mutageeninen : aiheuttaa periytyvän muutoksen geenien DNA:n emäsparirakenteessa tai kromosomirakenteessa (kromosomipoikkeavuudet). Numeerinen poikkeavuus : käytetyille soluille tyypillisestä normaalista kromosomimäärästä poikkeava kromosomien lukumäärä. p53-status : p53-proteiini osallistuu solukierron säätelyyn, apoptoosiin ja DNA:n korjaukseen. Solut, joista puuttuu toimiva p53-proteiini tai jotka eivät pysty pysäyttämään solusykliä tai hävittämään vahingoittuneita soluja apoptoosilla tai muilla p53-proteiinin toimintoihin liittyvillä mekanismeilla (esimerkiksi indusoimalla DNA:n korjautumisen, ovat teoriassa alttiimpia geenimutaatioille tai kromosomipoikkeavuuksille. Pitoisuudet : viittaa testikemikaalin lopullisiin pitoisuuksiin viljelynesteessä. Polyploidia : solujen tai organismien kromosomien lukumäärää koskeva poikkeavuus, joka koskee yksittäisen kromosomin tai tiettyjen kromosomien (aneuploidia) sijaan koko kromosomistoa. Populaation suhteellinen kaksinkertaistuminen (PSK) : populaation kaksinkertaistumismäärän lisääntyminen kemikaalille altistetuissa viljelmissä verrattuna lisääntymiseen muissa kuin käsitellyissä viljelmissä; suhde ilmaistaan prosentteina. Rakenteellinen poikkeavuus : kromosomirakenteen muutos, joka voidaan havaita solunjakautumisen metafaasivaiheen mikroskooppitutkimuksella ja joka ilmenee deleetioina ja fragmentteina, kromosomien sisäisinä tai kromosomien välisinä tekijänvaihdoksina. S9-seos : S9-jakeen ja metabolisen entsyymitoiminnan kannalta välttämättömien kofaktorien seos. Solujen proliferaatio : solujen määrän kasvaminen solujen mitoottisen jakautumisen seurauksena. Solumäärän suhteellinen lisääntyminen (SMSL) : solujen määrän lisääntyminen kemikaalille altistetuissa viljelmissä verrattuna lisääntymiseen muissa kuin käsitellyissä viljelmissä; suhde ilmaistaan prosentteina. Sytotoksisuus : tämän testimenetelmän kattamissa analyyseissä solulinjoja käytettäessä sytotoksisuus määritetään aineelle altistettujen solujen populaation suhteellisen kaksinkertaistumisen vähentymisenä tai solumäärän suhteellisena lisääntymisenä verrattuna negatiiviseen kontrolliin (ks. 17 kohta ja lisäys 2). Tämän testimenetelmän kattamissa analyyseissä primaarisia lymfosyyttiviljelmiä käytettäessä sytotoksisuus määritetään aineelle altistettujen solujen mitoosi-indeksin pienentymisenä verrattuna negatiiviseen kontrolliin (ks. 18 kohta ja lisäys 2). Testikemikaali : aine tai seos, jota testataan tällä testimenetelmällä. Lisäys 2 KAAVAT SYTOTOKSISUUDEN MÄÄRITYSTÄ VARTEN Mitoosi-indeksi (MI):
Solumäärän suhteellista lisääntymistä (SMSL) tai populaation suhteellista kaksinkertaistumista (PSK) suositellaan, koska molemmissa otetaan huomioon jakaantuneen solupopulaation osuus.
Jossa populaation kaksinkertaistuminen = [log (solumäärä käsittelyn jälkeen ÷ alkuperäinen solumäärä)] ÷ log 2 Esimerkiksi jos SMSL tai PSK on 53 %, sytotoksisuus/sytostaasi on 47 % ja mitoosi-indeksillä (MI) mitattu 55 prosentin sytotoksisuus/sytostaasi tarkoittaa, että todellinen MI on 45 prosenttia kontrollista. Joka tapauksessa solujen määrä ennen käsittelyä on laskettava ja sen on oltava sama käsitellyissä ja negatiivisissa kontrolliviljelmissä. Vaikka suhteellisia solumääriä (eli solumääriä altistetuissa viljelmissä/solumääriä kontrolliviljelmissä) on käytetty aikaisemmin sytotoksisuuden parametrina, sitä ei enää suositella, koska se voi johtaa sytotoksisuuden aliarviointiin. Negatiivisissa kontrolliviljelmissä populaation kaksinkertaistumisen on oltava yhteensopiva sen vaatimuksen kanssa, että soluista otetaan näyte ajalla, joka vastaa suunnilleen 1,5 solusykliä, ja mitoosi-indeksin pitäisi olla niin korkea, että saadaan riittävä määrä mitoosissa olevia soluja, jotta voidaan luotettavasti laskea 50 prosentin vähennys. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4) |
Korvataan B osassa oleva B.11 luku seuraavasti: ”B.11 Nisäkkäiden luuytimen kromosomipoikkeavuustesti JOHDANTO Tämä testimenetelmä vastaa OECD:n testiohjetta 475 (2016). Se on osa geneettisen toksikologian testimenetelmiä. On laadittu OECD:n asiakirja, jossa ytimekkäitä tietoja geneettistä toksikologiaa koskevista testeistä sekä katsaus näihin testimenetelmiin tehtyihin viimeaikaisiin muutoksiin (1). Nisäkkäillä in vivo tehtävä luuytimen kromosomipoikkeavuustesti on erityisen relevantti genotoksisuuden arvioinnissa, koska vaikka lajien välillä voi olla vaihtelua, in vivo -metaboliaan, farmakokinetiikkaan ja DNA:n korjautumisprosesseihin liittyvät tekijät ovat aktiivisia ja voivat edistää vasteiden saantia. In vivo -analyysi on hyödyllinen myös in vitro -koejärjestelmässä havaitun genotoksisuuden jatkotutkimuksena. Nisäkkäillä in vivo tehtävää kromosomipoikkeavuustestiä käytetään testikemikaalien aiheuttamien rakenteellisten kromosomipoikkeavuuksien osoittamiseen nisäkkäiden, yleensä jyrsijöiden, luuydinsoluissa (2) (3) (4) (5). Rakenteelliset kromosomipoikkeavuudet jakautuvat kahteen tyyppiin, kromosomi- ja kromatidipoikkeavuuksiin. Vaikka genotoksisten kemiallisten mutageenien aiheuttamat poikkeavuudet ovat useimmiten kromatidityyppisiä, myös kromosomityyppisiä poikkeavuuksia esiintyy. Kromosomivauriot ja niihin liittyvät tapahtumat ovat syynä moniin ihmisen geneettisiin sairauksiin, ja on saatu vakuuttavia todisteita siitä, että kun nämä vauriot ja niihin liittyvä tapahtumat aiheuttavat muutoksia somaattisten solujen onkogeeneissä ja kasvunrajoitegeeneissä, ne ovat osallisina syövän synnyssä ihmisillä ja koejärjestelmissä. Polyploidiaa (mukaan lukien endoreduplikaatio) voi aiheutua kromosomipoikkeavuutta koskevissa määritysmenetelmissä in vivo. Polyploidian lisääntyminen ei yksinään osoita aneugeenista mahdollisuutta, vaan se voi yksinkertaisesti osoittaa solysyklin häiriön tai sytotoksisuuden. Tätä testiä ei ole suunniteltu mittaamaan aneuploidiaa. Mikrotumatesti nisäkkään punasoluissa in vivo (tässä liitteessä oleva B.12 luku) tai in vitro -mikrotumatesti nisäkässoluilla (tässä liitteessä oleva B.49 luku) ovat in vivo- ja in vitro -testejä, joita suositellaan aneuploidian havainnointiin. Käytettyjen termien määritelmät on esitetty lisäyksessä 1. ALUSTAVAT HUOMIOT Tässä testissä käytetään yleensä jyrsijöitä, mutta muut lajit voivat olla joissain tapauksissa sopivia, jos tämä on tieteellisesti perusteltua. Luuydin on tämän testin kohdekudos, sillä sen verisuonitus on hyvin runsasta ja se sisältää solupopulaation, jonka solusykli on nopea ja joka on helppo eristää ja prosessoida. Raportissa on esitettävä tieteelliset perustelut muiden lajien kuin rottien ja hiirten käytöstä. Jos käytetään muita lajeja kuin jyrsijöitä, on suositeltavaa, että luuytimen kromosomipoikkeavuuden mittaus sisällytetään toiseen sopivaan toksisuustestiin. Jos on saatu viitteitä siitä, etteivät testikemikaalit tai niiden metaboliitit pääse kohdekudokseen, tätä testiä ei pidä käyttää. Ennen kuin testimenetelmää käytetään seoksen testaamiseen tietojen tuottamiseksi aiottuun sääntelytarkoitukseen, on harkittava, antaako se asianmukaiset tulokset tämän tavoitteen kannalta, ja jos antaa, miksi. Tällaista harkintaa ei tarvita, jos seoksen testaamista edellytetään sääntelyvaatimuksissa. TESTIMENETELMÄN PERIAATE Eläimet altistetaan testikemikaalille soveltuvaa altistusreittiä käyttäen ja ne lopetetaan humaanisti sopivan ajan kuluttua altistuksesta. Ennen lopettamista eläimille annetaan ainetta, joka pysäyttää solunjakautumisen metafaasiin (esim. kolkisiinia tai colcemidia). Tämän jälkeen luuydinsoluista tehdään kromosomipreparaatit ja ne värjätään, ja metafaasissa olevien solujen kromosomipoikkeavuudet analysoidaan. LABORATORIOIDEN PÄTEVYYDEN VARMISTAMINEN Pätevyyttä koskevat tutkimukset Jotta voidaan vahvistaa riittävä kokemus analyysin suorittamisesta ennen kuin sitä käytetään tavanomaiseen testaukseen, laboratorion on osoitettava, että se voi tuottaa odotettavissa olevat tulokset julkaistuista tiedoista (esim. (6)) kromosomipoikkeavuuden taajuuden mittaamiseen vähintään kahdella positiivisella kontrollikemikaalilla (mukaan lukien heikot vasteet, joita indusoivat pienet määrät positiivista kontrollikemikaalia), kuten ne, jotka luetellaan taulukossa 1 ja yhdessä yhteensopivien kantaja-aine-/liuotinkontrollien kanssa (ks. 22 kappale). Näissä kokeissa pitää käyttää annoksia, joista aiheutuu toistettavissa olevaa ja annoksesta riippuvaa lukumäärän suurenemista, ja niiden on osoitettava testausjärjestelmän herkkyys sekä dynaaminen vaihteluväli kohdekudoksessa (luuydin) ja käyttää laskentamenetelmää, jota voidaan soveltaa laboratoriossa. Tätä vaatimusta ei sovelleta laboratorioihin, joilla on kokemusta, eli joilla on 10–14 kohdassa tarkoitettu aiemmin kerätty tietokanta. Aiemmat kontrollitiedot Pätevyyttä koskevissa tutkimuksissa laboratorion on määriteltävä:
Hankittaessa ensin tietoja aiempien negatiivisten kontrollien jakaumaa varten, rinnakkaisten negatiivisten kontrollien on oltava yhdenmukaisia julkaistujen kontrollitietojen kanssa, jos sellaisia on olemassa. Kun aikaisempien kontrollien jakaumaan lisätään enemmän kokeellisia tietoja, rinnakkaisten negatiivisten kontrollien olisi mieluiten sijoituttava kyseisen jakauman 95 %:n kontrollirajojen sisälle. Laboratorion aikaisempia negatiivisia kontrolleja koskevan tietokannan pitäisi olla tilastollisesti vankka, jotta varmistetaan laboratorion kyky arvioida negatiivisten kontrollitietojensa jakaumaa. Lähdekirjallisuuden mukaan voidaan tarvita vähintään 10 koetta, mutta mieluiten olisi tehtävä ainakin 20 koetta vastaavissa koeolosuhteissa. Laboratorioiden on käytettävä laadunvalvontamenetelmiä, kuten valvontakortteja (esim. C-kortteja tai X-bar-kortteja (7)), tunnistamaan kuinka vaihtelevat niiden tiedot ovat, ja osoittaakseen, että laboratorio ”hallitsee” menetelmän. Lisäsuosituksia aikaisempien tietojen muodostamisesta ja käytöstä (esimerkiksi perusteet tietojen sisällyttämiseksi aikaisempiin tietoihin tai jättämiseksi pois niistä sekä kokeiden hyväksyttävyysperusteet) annetaan lähdekirjallisuudessa (8). Jos laboratorio ei suorita loppuun riittävää määrää kokeita tilastollisesti vankan negatiivisen kontrollin jakauman osoittamiseksi (ks. 11 kohta) pätevyyttä koskevissa tutkimuksissa (kuvataan 9 kohdassa), on hyväksyttävää, että jakauma voidaan luoda ensimmäisten rutiinitutkimuksien aikana. Tässä lähestymistavassa pitäisi noudattaa lähdekirjallisuudessa (8) esitettyjä suosituksia ja negatiivisen kontrollin tuloksia, ja näissä kokeissa saatujen negatiivisten kontrollien tulosten on oltava julkaistujen negatiivisten kontrollien tuloksien mukaisia. Mahdollisissa koejärjestelyn muutoksissa on otettava huomioon, miten ne vaikuttavat tuloksena olevien tietojen yhdenmukaisuuteen laboratorion olemassa olevan aiempia kontrolleja koskevan tietokannan kanssa. Vain suurien epäjohdonmukaisuuksien vuoksi on luotava uusi aiempien kontrollien tietokanta, jos asiantuntija-arviossa määritetään, että se eroaa edellisestä jakaumasta (ks. 11 kohta). Sen uudelleenluonnin aikana täysimittaista negatiivisten kontrollien tietokantaa ei ehkä tarvita varsinaisen testin suorittamiseen, jos laboratorio voi osoittaa, että sen rinnakkaisen negatiivisen kontrollin arvot ovat yhdenmukaisia aiemman tietokannan tai vastaavien julkistettujen tietojen kanssa. Negatiivisen kontrollin tietojen tulisi koostua kunkin eläimen rakenteellisten kromosomipoikkeavuuksien (lukuun ottamatta aukkoja [gap]) esiintyvyydestä. Samanaikaisten negatiivisten kontrollien olisi mieluiten sijoituttava laboratorion aikaisempien negatiivisten kontrollien tietokannan 95 %:n kontrollirajojen sisälle. Jos rinnakkaisia negatiivisia kontrolleja koskevat tiedot jäävät 95 %:n kontrollirajojen ulkopuolelle, ne voidaan hyväksyä aikaisemman kontrollien jakaumaan edellyttäen, etteivät ne ole äärimmäisiä harha-arvoja ja että on näyttöä siitä, että testijärjestelmä on ”hallinnassa” (ks. 11 kohta), ja ettei ole kyse teknisestä tai inhimillisestä virheestä. MENETELMÄN KUVAUS Valmisteet Eläinlajin valinta Koe-eläinten on oltava yleisesti käytettyä laboratoriokantaa olevia nuoria terveitä täysikasvuisia eläimiä. Yleisesti käytetään rottia, ja hiirten käyttö voi olla asianmukaista. Kaikkia muita sopivia nisäkäslajeja voidaan käyttää, jos raportissa esitetään tieteellinen perustelu. Koe-eläintilat ja eläinten ruokinta Jyrsijöiden tapauksessa koe-eläinhuoneen lämpötilan tulee olla 22 °C (± 3 °C). Vaikka suhteellisen kosteuden olisi mieluiten oltava 50–60 prosenttia, sen olisi oltava ainakin 40 prosenttia eikä mielellään yli 70 prosenttia muulloin kuin tilan puhdistuksen aikana. Tilassa tulee käyttää keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa / 12 tuntia pimeää). Eläinten ruokinnassa voidaan käyttää normaalia laboratorioruokavaliota, eikä juomaveden määrää saa rajoittaa. Ravinnon valintaan voi vaikuttaa tarve varmistaa sopiva sekoitus testikemikaalia, kun sitä annetaan tätä reittiä. Jyrsijät on sijoitettava samaa sukupuolta ja käsittelyryhmää edustaviin pienryhmiin (enintään viisi häkkiä kohti), jos mitään aggressiivista käytöstä ei odoteta, mieluiten kiinteisiin lattiahäkkeihin, joissa on asianmukainen virikkeellinen ympäristö. Eläimet voivat olla häkissä yksittäin ainoastaan, jos tämä on tieteellisesti perusteltua. Eläinten valmistelu Yleensä käytetään nuoria terveitä täysikasvuisia eläimiä (jyrsijät ovat mieluiten 6–10 viikon ikäisiä käsittelyn alussa, joskin hieman vanhemmat eläimet hyväksytään) ja ne jaetaan satunnaistetusti testi- ja kontrolliryhmiin. Eläimet tunnistetaan yksilöllisesti inhimillisellä minimaalisen invasiivisella toimenpiteellä (esim. rengastamalla, merkitsemällä, mikrosirulla tai biometrisellä tunnuksella, mutta ei korvia tai varpaita leikkaamalla) ja sopeuttamalla laboratorio-olosuhteisiin vähintään viiden päivän ajan. Häkit on sijoitettava siten, että häkin sijainnista johtuvat vaikutukset ovat mahdollisimman vähäisiä. Ristikontaminaatiota positiivisella kontrollilla ja testikemikaalilla tulisi välttää. Tutkimuksen alkaessa eläinten painonvaihtelun on oltava vähäistä, ja se saa vaihdella korkeintaan ± 20 % kunkin sukupuolen tavanomaisesta keskiarvosta. Annosten valmistelu Kiinteät testattavat kemikaalit liuotetaan tai sekoitetaan asianmukaisiin liuottimiin tai kantaja-aineisiin taikka lisätään ravintoon tai juomaveteen, ennen kuin ne annetaan koe-eläimille. Nestemäiset testattavat kemikaalit voidaan antaa suoraan tai laimentaa ennen antamista. Testikemikaaleja voidaan antaa hengitystien kautta tapahtuvan altistamisen osalta kaasuna, höyrynä tai kiinteänä/nestemäisenä aerosolina niiden fysikokemiallisista ominaisuuksista riippuen. Testikemikaali on valmisteltava juuri ennen annostelua, paitsi jos sen säilyvyys on osoitettu stabiliteettitesteillä ja asianmukaiset säilytysolosuhteet on määritetty. Liuotin/kantaja-aine Liuottimella/kantaja-aineella ei saa olla myrkkyvaikutuksia käytetyillä annostasoilla, eikä sen käyttöön saa liittyä epäilyjä mahdollisista kemiallisista reaktioista testikemikaalien kanssa. Jos käytetään muita kuin hyvin tunnettuja liuottimia/kantaja-aineita, niiden käyttö on perusteltava yhteensopivuuden osoittavilla tutkimustuloksilla. Vesipitoisen liuottimen/kantaja-aineen käyttöä on harkittava ensisijaisesti aina, kun se on mahdollista. Esimerkkejä yleisesti käytetyistä yhteensopivista liuottimista/kantaja-aineista ovat vesi, fysiologinen suolaliuos, metyyliselluloosaliuos, natriumkarboksimetyyliselluloosan suolaliuos, oliiviöljy ja maissiöljy. Jos ei ole aikaisempia tai julkaistuja kontrollitietoja siitä, ettei valittu epätyypillinen liuotin/kantaja-aine aiheuta rakenteellisia poikkeavuuksia tai muita haitallisia vaikutuksia, on tehtävä alustava tutkimus, jolla voidaan määrittää liuotin-/kantajakontrollin hyväksyttävyys. Kontrollit Positiiviset kontrollit Kuhunkin testiin pitäisi normaalisti sisällyttää ryhmä eläimiä, joita käsitellään positiivisella kontrollikemikaalilla. Tästä voidaan poiketa, jos testilaboratorio on osoittanut olevansa pätevä tekemään testin ja se on vahvistanut aikaisemman positiivisen kontrollin vaihteluvälin. Kun rinnakkaista positiivisen kontrollin ryhmää ei ole, kuhunkin kokeeseen on sisällytettävä pisteytyskontrollit (kiinteät ja värjätyt objektilasit). Nämä voidaan saada sisällyttämällä tutkimuksen pisteytykseen asianmukaiset vertailunäytteet, jotka on saatu ja joita säilytetään erillisestä määräajoin (esim. 6–18 kuukauden välein) tehtävästä positiivisen kontrollin kokeesta laboratoriossa, jossa koe tehdään; esimerkiksi pätevyyden testaamisen aikana ja säännöllisesti tämän jälkeen, jos tätä tarvitaan. Positiivisten kontrollikemikaalien pitäisi luotettavasti tuottaa havaittavaa lisääntymistä rakenteellisia kromosomipoikkeavuuksia sisältävien solujen esiintymistaajuudessa spontaanitasoon verrattuna. Positiivisten kontrolliaineiden annokset on valittava siten, että vaikutukset ovat selvät mutta eivät paljasta heti laskijoille koodattujen näytteiden identiteettiä. On hyväksyttävää, että positiivinen kontrolliaine annetaan eri reittiä kuin testikemikaali käyttäen eri käsittelyaikataulua, ja näytteet voidaan ottaa vain kerran. Lisäksi positiivisina kontrolleina tulisi käyttää tarvittaessa samaan kemiallisten aineiden ryhmään kuuluvia aineita. Taulukkoon 1 sisältyy esimerkkejä positiivisista kontrollikemikaaleista. Taulukko 1 Esimerkkejä positiivisista kontrollikemikaaleista
Negatiiviset kontrollit Negatiivisen kontrolliryhmän eläimet on sisällytettävä jokaiseen näytteenottokertaan ja niitä tulisi käsitellä aivan samalla tavalla kuin tutkimusryhmiä, paitsi ettei niitä altisteta testikemikaalille. Jos testikemikaalin annostelussa käytetään liuotinta/kantaja-ainetta, kontrolliryhmän pitää saada tätä liuotinta/kantaja-ainetta. Kuitenkin, jos aikaisemmista negatiivisen kontrollin tiedoista kullakin näytteenottokerralla testilaboratoriossa käy ilmi johdonmukaisia eläinten välisiä eroja ja rakenteellisia poikkeavuuksia sisältävien solujen esiintymistaajuutta, negatiivista kontrollia varten voidaan tarvita vain yksi näytteenotto. Kun negatiiviseen kontrolliin käytetään yhtä näytteenottoa, kyse pitäisi olla tutkimuksessa käytetystä ensimmäisestä näytteenottokerrasta. MENETTELY Eläinten lukumäärä ja sukupuoli Mikrotuman vaste on yleensä samanlainen uros- ja naaraspuolisilla eläimillä (9) ja on odotettavissa, että tämä pätee myös rakenteellisiin kromosomipoikkeavuuksiin; tästä syystä useimmat tutkimukset voidaan suorittaa kumpaakin sukupuolta käyttäen. Tiedot, jotka osoittavat merkittäviä eroja urosten ja naaraiden välillä (esim. systeemisen toksisuuden, aineenvaihdunnan, biologisen saatavuuden, luuytimeen liittyvän toksisuuden erot, mukaan lukien esimerkiksi raja-annostutkimus) voisivat kannustaa käyttämään molempia sukupuolia. Tässä tapauksessa voi olla tarkoituksenmukaista tehdä tutkimus molemmilla sukupuolilla esim. osana toistuvan annostelun toksisuustutkimusta. Molempia sukupuolia käytettäessä saattaa olla tarkoituksenmukaista tehdä yhdistelykoe. Tarkempia tietoja siitä, miten tietoja yhdistelykokeessa analysoidaan, annetaan lisäyksessä 2. Ryhmäkoot varmistetaan tutkimuksen alussa, jotta tarjotaan vähintään viisi tutkimukseen soveltuvaa yhtä sukupuolta edustavaa eläintä, tai kustakin sukupuolesta (jos kumpiakin käytetään) ryhmää kohti. Jos ihmisen altistuminen tutkittavalle kemikaalille voi olla sukupuolesta riippuvaa, kuten joidenkin lääkeaineiden kohdalla, testi on tehtävä asianomaista sukupuolta olevilla eläimillä. Ohjeelliseksi maksimimääräksi eläimiä koskevien vaatimusten osalta annetaan, että luuydintutkimus tehdään kahdella näytteenottokerralla, kolmella annosryhmällä ja rinnakkaisella negatiivisella kontrolliryhmällä (kussakin ryhmässä on viisi samaa sukupuolta edustavaa eläintä), ts. tarvitaan 45 eläintä. Annostasot Jos tehdään alustava annoksenmääritystutkimus, koska sopivia tietoja ei ole vielä käytettävissä annoksen valinnan opastukseen, se on tehtävä samassa laboratoriossa käyttäen samaa lajia, samaa kantaa, samaa sukupuolta olevia eläimiä ja samaa altistusohjelmaa kuin päätutkimuksessa (10). Tutkimuksessa on pyrittävä tunnistamaan suurin siedetty annos, joka määritellään korkeimmaksi annokseksi, jota siedetään ilman näyttöä tutkimusta rajoittavasta toksisuudesta suhteessa tutkimuksen kestoon (esim. se aiheuttaa ruumiinpainon laskua tai vertavuotavan kudoksen sytotoksisuutta), mutta joka ei aiheuta kuolemaa eikä kipua, tuskaa tai kärsimystä, jonka vuoksi eläin on lopetettava inhimillisesti (11). Suurin annos voidaan määritellä myös annokseksi, joka aiheuttaa joitakin toksisuuteen viittaavia muutoksia luuytimessä. Kemikaalit, jotka osoittavat toksikokineettisten ominaisuuksien saturaation tai aiheuttavat detoksikaatioprosesseja, jotka voivat johtaa altistuksen vähenemiseen pitkäaikaisen käsittelyn jälkeen, voivat muodostaa poikkeuksen annoksenmäärityskriteereihin, ja niitä on arvioitava tapauskohtaisesti. Jotta saadaan annosvastetiedot, täydelliseen tutkimukseen on sisällyttävä negatiivisen kontrollin ryhmä ja vähintään kolme annostelutasoa, jotka yleensä erotetaan kertoimella 2, mutta enintään kertoimella 4. Jos testikemikaali ei aiheuta toksisuusvaikutusta annoksenmääritystutkimuksessa tai olemassa olevien tietojen perusteella, suurin annos kerta-annostelulle pitäisi olla 2 000 mg/painokilo. Jos testikemikaali aiheuttaa toksisuusvaikutuksen, suurimman siedetyn annoksen pitäisi olla korkein annettava annos, ja käytettävien annostasojen olisi mieluiten katettava vaihteluväli maksimista annokseen, jonka toksisuusvaikutus on vähäinen tai jolla ei ole toksisuusvaikutusta. Kun kohdekudoksen (luuytimen) toksisuusvaikutus havaitaan kaikilla testatuilla annostasoilla, on suositeltavaa tehdä täydentävä tutkimus ei-toksisilla annoksilla. Tutkimukset, joiden tarkoituksena on kuvata täydellisesti määrällisiä annos-vastetietoja, voivat vaatia täydentäviä annosryhmiä. Nämä rajat voivat vaihdella tietyntyyppisten testikemikaalien osalta (esim. ihmisten lääkkeet), jotka kuuluvat erityisten vaatimusten piiriin. Raja-annostesti Jos pitoisuusalueenmäärittelykokeet tai olemassa olevat tiedot vastaavista eläinkannoista osoittavat, että vähintään raja-annokseen (kuvattu jäljempänä) perustuva altistusohjelma ei tuota havaittavia toksisuusvaikutuksia (ei esim. luuytimeen liittyvän proliferaation vähentymistä tai muita todisteita kohdekudoksen sytotoksisuudesta), ja jos genotoksisuuden ei oleteta perustuvan in vitro -genotoksisuustutkimuksiin tai tietoihin rakenteellisesti samankaltaisista kemikaaleista, täydellistä tutkimusta kolmella annostasolla ei ehkä pidetä tarpeellisena, mikäli on osoitettu, että testikemikaalit saavuttavat kohdekudoksen (luuytimen). Tällaisissa tapauksissa yksi annostaso raja-annoksena saattaa riittää. Kun annostelu kestää yli 14 päivää, annos on 1 000 mg/painokiloa/päivä. Kun annostelu kestää korkeintaan 14 päivää, annos on 2 000 mg/painokiloa/päivä. Antotapa Testin suunnittelussa on otettava huomioon oletettu ihmisen altistusreitti. Siksi perustelluksi altistusreitiksi voidaan valita esim. ravinto tai juomavesi, ihonalainen, suonensisäinen, oraalinen (letkuruokinnalla), altistus hengitysteitse, henkitorven tai implantaation kautta kulkeva reitti. Joka tapauksessa reitti on valittava, jotta varmistetaan kohdekudosten riittävä altistus. Intraperitoneaalista injektiota ei yleensä suositella, koska se ei ole tarkoitettu ihmisen altistumisreitiksi, ja sitä tulisi käyttää vain erityisten tieteellisten perustelujen nojalla. Jos testikemikaali sekoitetaan ravintoon tai juomaveteen, varsinkin jos kyse on yhdestä annoksesta, vaikutuksien havaitsemiseksi on huolehdittava siitä, että viive ravinnon ja veden kulutuksen ja näytteenoton välillä on riittävä (ks. 33–34 kohta). Suurin letkuruokinnan tai injektion avulla kerralla annettava nestemäärä määräytyy koe-eläimen koon mukaan. Määrä ei saa normaalisti ylittää 1 ml/100 g painoa. Poikkeuksen muodostavat vesiliuokset, joita käytettäessä enimmäistilavuus voi olla 2 ml/100 g painoa. Tätä suurempien määrien käyttö on perusteltava. Lukuun ottamatta ärsyttäviä tai syövyttäviä testikemikaaleja, joiden vaikutukset yleensä pahenevat korkeammilla pitoisuuksilla, testikemikaalimäärän vaihtelu on minimoitava säätämällä pitoisuutta, jotta annostelun vakiotilavuus suhteessa ruumiinpainoon taataan kaikilla annostasoilla. Altistusohjelma Testikemikaalit annetaan yleensä yhtenä annoksena, mutta ne voidaan myös jakaa eri annoksiin (ts. kaksi tai useampaa altistuskertaa samana päivänä korkeintaan 2–3 tunnin välein), mikä helpottaa suurten määrien antamista. Näissä olosuhteissa, tai testikemikaalia hengitysteitse annettaessa, näytteenottoaika tulee ajoittaa edellisen annostelun tai altistuksen päättymisajan perusteella. On vain vähän tietoa toistuvan annostelun menetelmän soveltuvuudesta tähän testiin. Olosuhteissa, joissa tämä testi halutaan sisällyttää toistuvan annostelun toksisuustutkimukseen, on pyrittävä välttämään kromosomivaurioisten mitoosissa olevien solujen menettäminen, mikä voi sattua toksisia annoksia käytettäessä. Sisällyttäminen on hyväksyttävää, kun korkein annos on suurempi tai yhtä suuri kuin raja-annos (ks. 29 kohta) ja annosryhmälle annetaan raja-annos koko altistusajan. Mikrotumatestiä (testimenetelmä B.12) on pidettävä soveltuvimpana kromosomipoikkeavuuksien in vivo -testinä, kun tällainen halutaan sisällyttää muihin tutkimuksiin. Luuydinnäytteet on otettava kahtena eri ajankohtana eri altistuskertojen jälkeen. Jyrsijöillä ensimmäisen näytteenottovälin keston pitäisi olla 1,5 normaaliin solusykliin kuluva aika (solusykli on normaalisti 12–18 tuntia altistuksen jälkeen). Koska testikemikaalien soluunottoon ja metaboloitumiseen kuluva aika ja sen vaikutus solusyklin kinetiikkaan voi muuttaa kromosomipoikkeavuuksien optimaalista havaitsemisajankohtaa, myöhempi näyte tulisi kerätä 24 tunnin kuluttua ensimmäisestä näytteestä. Ensimmäisellä näytteenottokerralla kaikkia annosryhmiä on altistettava ja näytteitä on kerättävä analyysiin; myöhemmillä näytteenottokerroilla tarvitsee ainoastaan antaa korkein annos. Jos tutkittavaa ainetta annetaan tieteellisen perusteen nojalla pidempään kuin yhden päivän ajan, yleensä on otettava yksi näyte korkeintaan noin 1,5 normaalin solusyklin kuluttua viimeisestä altistusajankohdasta. Käsittelyn jälkeen ja ennen näytteenottoa eläimille annetaan injektiona vatsaonteloon sopiva annos ainetta, joka pysäyttää solut metafaasivaiheeseen (esim. colcemidia tai kolkisiinia), ja näytteet kerätään sen jälkeen sopivin välein. Hiirillä väli on noin 3–5 tuntia ennen keräämistä ja rotilla 2–5 tuntia. Solut kerätään luuytimestä, saatetaan turpoamaan, fiksoidaan, värjätään ja analysoidaan kromosomipoikkeavuuksien toteamiseksi (12). Havainnot Koe-eläimiä koskevia yleisiä kliinisiä havaintoja tulee tehdä ja kliinisiä oireita tulee kirjata ainakin kerran päivässä, mieluiten samaan aikaan joka päivä ottaen huomioon se, milloin annoksen antamisen jälkeen odotetut vaikutukset ovat suurimmillaan. Kaikkien eläinten sairastuvuutta ja kuolleisuutta on havainnoitava ainakin kahdesti vuorokaudessa annostelun aikana. Eläimet on punnittava tutkimuksen alussa ja vähintään kerran viikossa toistuvan annoksen tutkimuksissa ja lopetettaessa. Vähintään viikon kestävissä tutkimuksissa ravinnonkulutuksen mittaus on tehtävä vähintään viikoittain. Mikäli testikemikaalia annostellaan juomaveteen, veden kulutusta on mitattava, kun vesi vaihdetaan tai ainakin kerran viikossa. Eläimet, joilla ilmenee ei-letaaleja merkkejä liiallisesta myrkytysvaikutuksesta, on lopetettava inhimillisesti ennen tutkimusajan päättymistä (11). Kohdekudoksen altistaminen Verinäyte on otettava sopivana ajankohtana, jotta voidaan tutkia testikemikaalien plasmatasot luuytimen altistumisen osoittamiseksi, jos tämä on perusteltua ja jos muita altistustietoja ei ole (ks. 44 kohta). Luuydin- ja kromosomipreparaatit Heti inhimillisen lopettamisen jälkeen luuytimen solut otetaan eläinten reisi- tai sääriluista, pannaan hypotoniseen liuokseen ja fiksoidaan. Tämän jälkeen metafaasissa olevat solut levitetään objektilaseille ja värjätään vakiintuneilla menetelmillä (ks. (3) (12)). Analyysi Kaikki objektilasit, myös ne, joilla on positiiviset ja negatiiviset kontrollit, on koodattava toisistaan riippumattomasti ennen tutkimusta ja jaettava satunnaisotannalla siten, että laskija ei tiedä altistusolosuhteista. Mitoosi-indeksi on määritettävä sytotoksisuuden mittana vähintään 1 000 solusta eläintä kohti kaikista tutkittavalle aineelle altistetuista eläimistä (myös positiivisista kontrolleista), käsittelemättömistä tai kantaja-aineen/liuottimen negatiivisen kontrollin eläimistä. Jokaista eläintä kohti tulisi analysoida vähintään 200 metafaasia rakenteellisista kromosomipoikkeavuuksista mukaan lukien ja ilman aukkoja (gaps) (6). Jos aikaisempien negatiivisten kontrollien tietokanta kuitenkin osoittaa, että keskimääräisen kromosomipoikkeavuuksien taustaesiintyvyys on < 1 % testilaboratoriossa, on harkittava ylimääräisten solujen pisteytystä. Kromatidityyppiset ja kromosomityyppiset poikkeavuudet on kirjattava erikseen ja luokiteltava alatyypin mukaan (katkeamiset, vaihdokset). Laboratoriossa käytettävillä menettelyillä varmistetaan, että kromosomipoikkeavuuden analyysin tekevät hyvin koulutetut laskijat ja niitä vertaisarvioidaan tarvittaessa. Koska objektilasien valmistelu johtaa usein joidenkin metafaasissa olevien solujen rikkoutumiseen ja siten kromosomien menettämiseen, sentromeerien lukumäärän lasketuissa soluissa on vastattava lukua 2n ± 2, jossa haploidinen kromosomiluku on n kyseisen lajin osalta. TIEDOT JA RAPORTOINTI Tulosten käsittely Yksittäisiä eläimiä koskevat tiedot on esitettävä taulukossa. Jokaisen eläimen osalta on arvioitava mitoosi-indeksi, laskettujen metafaasissa olevien solujen lukumäärä, poikkeavuuksien lukumäärä solua kohti ja niiden solujen prosentuaalinen osuus, joissa on yksi tai useampia rakenteellisia kromosomipoikkeavuuksia. Erityyppiset rakenteelliset kromosomipoikkeavuudet on lueteltava, ja niiden lukumäärä ja esiintymistaajuus koe- ja kontrolliryhmien osalta on ilmoitettava. Aukot (gaps) sekä polyploidiset solut ja endoreduplikoituneita kromosomeja sisältävät solut on rekisteröitävä erikseen. Aukkojen esiintymistaajuus ilmoitetaan, mutta sitä ei yleensä sisällytetä rakenteellisten poikkeavuuksien kokonaistaajuuden analyysiin. Ellei viitteitä sukupuolten välisistä vaste-eroista ole havaittavissa, tiedot voidaan yhdistää tilastollista analyysiä tehtäessä. Eläinten toksisuustiedot ja kliiniset oireet on myös raportoitava. Hyväksyttävyysperusteet Testin hyväksyttävyys määritetään seuraavilla kriteereillä:
Tulosten arviointi ja tulkinta Jos kaikki hyväksymisperusteet täyttyvät, testikemikaalin katsotaan olevan selvästi positiivinen, mikäli:
Jos vain suurinta annosta tutkitaan tietyllä näytteenottokerralla, testikemikaalia pidetään selvästi positiivisena, mikäli esiintyy tilastollisesti merkittävää kasvua rinnakkaiseen negatiiviseen kontrolliin verrattuna ja tulokset ovat aikaisempien negatiivisen kontrollin tietojen jakauman ulkopuolella (esim. Poissonin jakaumaan perustuvat 95 %:n kontrollirajat). Lähdekirjallisuudessa on suosituksia sopiville tilastomenetelmille (13). Kun tehdään annos–vaste-analyysi, on analysoitava ainakin kolmea altistettua annosryhmää. Tilastollisissa testeissä kokeellisena yksikkönä on käytettävä eläintä. Kromosomipoikkeavuustestissä saadut positiiviset tulokset osoittavat, että testikemikaali aiheuttaa rakenteellisia kromosomipoikkeavuuksia testatun lajin luuytimessä. Jos kaikki hyväksymisperusteet täyttyvät, testikemikaalin katsotaan olevan selvästi negatiivinen, jos kaikissa tutkituissa koeolosuhteissa:
Lähdekirjallisuudessa on suosituksia soveltuvimmista tilastollisista menetelmistä (13). Näyttöön luuytimen altistumisesta testikemikaalille voi sisältyä mitoosi-indeksin alentuminen tai testikemikaalien plasman tai veritasojen mittaus. Laskimonsisäisen annostelun tapauksessa näyttöä altistumisesta ei tarvita. Vaihtoehtoisesti luuytimen altistumisen osoittamiseen voidaan käyttää samalla altistustavalla ja samalla eläinlajilla tehdyn riippumattoman tutkimuksen tietoja. Negatiiviset tulokset osoittavat, ettei tutkittava kemikaali aiheuta koeolosuhteissa rakenteellisia kromosomipoikkeavuuksia testatun lajin luuytimessä. Selvästi positiivista tai negatiivista vastetta ei tarvitse vahvistaa. Jos vaste ei ole selvästi negatiivinen eikä selvästi positiivinen tai tuloksen biologisen merkityksellisyyden vahvistaminen kaipaa tukea (esim. heikko tai rajatapaukseksi luokiteltava lisäys), tietoja tulee arvioida asiantuntija-arvioinnissa ja/tai loppuun saatettuihin kokeisiin liittyvissä lisätutkimuksissa. Useampien solujen analysointi tai toistokokeen suorittaminen mahdollisesti käyttämällä mukautettuja koeolosuhteita voi olla joissakin tapauksissa hyödyllistä. Harvoissa tapauksissa edes lisätutkimusten pohjalta ei voida päätellä, että testikemikaali tuottaa positiivisia tai negatiivisia tuloksia, ja sen vuoksi tutkimusta pidetään epäselvänä. Polyploidisten ja/tai endoreduplikoituneiden solujen metafaasien esiintymistaajudet metafaasissa olevien solujen kokonaismäärässä on rekisteröitävä erikseen. Polyploidisten/endoreduplikoituneiden solujen määrän suureneminen saattaa osoittaa, että testikemikaaleilla pystytään estämään mitoottisia prosesseja tai solysyklin etenemistä (ks. 3 kohta). Testiraportti Testiraporttiin on sisällytettävä seuraavat tiedot: Yhteenveto
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT Aneuploidia : kaikki yksittäisen tai useamman kuin yhden kromosomin mutta ei kuitenkaan koko kromosomiston (polyploidia) poikkeaminen kromosomien tavallisesta diploidisesta (tai haploidisesta) määrästä. Endoreduplikaatio : tapahtumasarja, jossa DNA:n kahdentumisen S-vaiheen jälkeen tuma ei etene mitoosiin vaan aloittaa uuden S-vaiheen. Tämän seurauksena syntyy kromosomeja, joissa on 4, 8, 16, … kromatidia. Gap : gap, akromaattinen leesio, joka on pienempi kuin yhden kromatidin leveys, ja johon liittyy minimaalinen kromatidien siirtymä. Kemikaali : aine tai seos. Kromatidipoikkeavuus : rakenteellinen kromosomivaurio, joka ilmenee yksittäisten kromatidien katkeamisena tai kromatidien katkeamisena ja uudelleenyhtymisenä. Kromosomipoikkeavuus : rakenteellinen kromosomivaurio, joka ilmenee molempien kromatidien katkeamisena tai katkeamisena ja uudelleenyhtymisenä samassa kohdassa. Mitoosi-indeksi : suhdeluku, joka saadaan jakamalla mitoosissa olevien solujen luku solupopulaation solujen kokonaismäärällä, joka on kyseisen solupopulaation proliferaatioasteen mitta. Numeerinen poikkeavuus : testissä käytetyille eläimille tyypillisestä normaalista kromosomimäärästä poikkeava kromosomien lukumäärä (aneuploidia). Polyploidia : numeerinen kromosomipoikkeavuus, joka liittyy muutokseen koko kromosomiston määrässä, toisin kuin numeerinen muutos osassa kromosomistoa (ks. aneuploidia). Rakenteellinen kromosomipoikkeavuus : kromosomirakenteen muutos, joka voidaan havaita solunjakautumisen metafaasivaiheen mikroskooppitutkimuksella ja joka ilmenee deleetioina ja fragmentteina, kromosomien sisäisinä tai kromosomien välisinä tekijänvaihdoksina. Sentromeeri : kromosomin alue (alueita), joihin sukkularihmat ovat kiinnittyneet solunjakautumisen aikana. Tähän perustuu tytärkromosomien järjestäytynyt siirtyminen tytärsolujen napoihin. Testikemikaali : aine tai seos, jota testataan tällä testimenetelmällä. Lisäys 2 YHDISTELYKOE SUKUPUOLTEN EROJEN TUNNISTAMISEKSI IN VIVO -KROMOSOMIPOIKKEAVUUSTESTISSÄ Yhdistelykoe ja sen analysointi Tässä kokeessa vähintään 5 urosta ja 5 naarasta testataan kullakin pitoisuustasolla, mikä johtaa koemalliin, jossa käytetään vähintään 40 eläintä (20 urosta ja 20 naarasta sekä asiaankuuluvat positiiviset kontrollit). Tämä koe, joka on yksi yksinkertaisimmista yhdistelykokeista, vastaa kaksisuuntaista varianssianalyysia, jossa sukupuoli ja pitoisuustaso ovat tärkeimmät vaikutukset. Tietoja voidaan analysoida käyttäen monia vakiintuneita tilastollisia ohjelmistopaketteja, kuten SPSS, SAS, STATA, Genstat ja R. Tietoihin liittyvä vaihtelu ositetaan analyysissa sukupuolten ja pitoisuuksien väliseksi sekä sukupuolten ja pitoisuuksien väliseen vuorovaikutukseen liittyväksi vaihteluksi. Kutakin perustetta testataan rinnakkaisten eläinten välisen vaihtelevuuden arvion perusteella samaa sukupuolta edustavissa eläinryhmissä, joille annetaan sama pitoisuus. Täydelliset tiedot menetelmästä annetaan useissa vakiintuneissa tilastollisissa oppikirjoissa (ks. viitteet) ja tilastopakettien tukitoiminnoissa. Analyysissä tutkitaan sen jälkeen sukupuolen x pitoisuuteen liittyvä yhdysvaikutustermi ANOVA-taulukossa (5). Merkitsevän yhdysvaikutustermin puuttuessa sukupuolten tai pitoisuustasojen yhdistetyt arvot ovat tasojen välisiä valideja tilastollisia testejä ANOVA-taulukon ryhmän sisäisen yhdistetyn vaihtelutekijän pohjalta. Analyysi jatkuu siten, että arvio pitoisuuksien välisestä vaihtelusta jaetaan kontrasteihin, joista saadaan testi vasteiden lineaarisille ja kvadraattisille kontrasteille eri pitoisuustasoilla.. Kun sukupuolen x pitoisuuteen liittyvä yhdysvaikutus on merkittävä, tämä termi voidaan myös osittaa sukupuoleen x liittyviksi lineaarisiksi ja sukupuoleen x liittyviksi kvadraattisiksi interaktiokontrasteiksi. Näiden tekijöiden perusteella voidaan testata, onko sukupuolten pitoisuusvaste rinnakkainen vai onko sukupuolten välillä vaste-eroa. Arviota ryhmän sisäisestä yhdistetystä vaihtelusta voidaan käyttää keskiarvojen erotuksen parittaiseen testaukseen. Näitä vertailuja voitaisiin tehdä kummankin sukupuolen keskiarvojen välillä sekä eri pitoisuustasojen keskiarvojen välillä, kuten negatiivisten kontrollitasojen kanssa. Kun yhdysvaikutus on merkitsevä, vertailuja voitaisiin tehdä eri pitoisuuksia saaneen yhden sukupuolen keskiarvojen välillä tai samaa pitoisuutta saaneiden molempien sukupuolten keskiarvojen välillä. Viitteet Asiasta on laadittu monia tilastollisia oppikirjoja, joissa käsitellään yhdistelmäkokeiden – jotka vaihtelevat yksinkertaisimmista kaksifaktorianalyyseistä kokeiden suunnittelumetodologiassa käytettyihin monimutkaisimpiin analyyseihin – teoriaa, suunnittelua, metodologiaa, analyysia ja tulkintaa. Seuraava luettelo ei ole tyhjentävä.. Joissain annetaan esimerkkejä vertailukelpoisista malleista ja joissakin tapauksissa annetaan koodit analyysien tekemiseen erilaisia ohjelmistoja hyödyntämällä.
|
|
5) |
Korvataan B osassa oleva B.12 luku seuraavasti: ”B.12 Nisäkkäiden erytrosyyttimikrotumatesti JOHDANTO Tämä testimenetelmä vastaa OECD:n testiohjetta 474 (2016). Se on osa geneettisen toksikologian testimenetelmiä. On laadittu OECD:n asiakirja, jossa ytimekkäitä tietoja geneettistä toksikologiaa koskevista testeistä sekä katsaus näihin testimenetelmiin tehtyihin viimeaikaisiin muutoksiin (1). Nisäkkäillä in vivo -mikrotumatesti on erityisen relevantti genotoksisuuden arvioinnissa, koska vaikka lajien välillä voi olla vaihtelua, in vivo -metaboliaan, farmakokinetiikkaan ja DNA:n korjautumisprosesseihin liittyvät tekijät ovat aktiivisia ja voivat vaikuttaa vasteisiin. In vivo -analyysi on hyödyllinen myös in vitro -koejärjestelmässä havaitun genotoksisuuden jatkotutkimuksena. Nisäkkäiden in vivo -mikrotumatestiä käytetään tutkittavan aineen aiheuttamien kromosomivaurioiden tai mitoosilaitteen vaurioiden toteamiseen erytroblasteissa. Testissä arvioidaan mikrotumien muodostumista erytroblasteissa analysoimalla eläinten, yleensä jyrsijöiden, luuytimen soluja tai perifeerisiä verisoluja. Mikrotumatestin tarkoituksena on tunnistaa sellaisia sytogeneettisiä vaurioita aiheuttavat kemikaalit, jotka johtavat hitaasti liikkuvia (lagging) kromosomifragmentteja tai kokonaisia kromosomeja sisältävien mikrotumien muodostumiseen. Kun luuytimen erytroblasti kehittyy punasolun esiasteeksi (johon viitataan joskus polykromaattisena punasoluna tai retikulosyyttinä), päätuma irtoaa solusta, ja mahdollinen muodostunut mikrotuma saattaa jäädä muutoin tumattomaan solulimaan. Päätuman puuttuminen helpottaa mikrotumien havaitsemista näissä soluissa. Mikrotumaisten punasolujen esiasteiden suurentunut esiintymistaajuus altistetuilla eläimillä osoittaa tutkittavan aineen aiheuttaman rakenteellisen tai numeerisen kromosomipoikkeavuuden. Vasta muodostuneet punasolut tunnistetaan ja kvantifioidaan värjäämällä, mitä seuraa joko visuaalinen pisteytys mikroskooppia käyttäen, tai automaattinen analyysi. Täysikasvuisten eläinten perifeerisessä veressä tai luuytimessä olevien punasolujen esiasteiden riittävän määrän laskentaa helpottaa automaattinen laskentajärjestelmä. Tällaiset järjestelmät ovat hyväksyttäviä vaihtoehtoja manuaaliselle arvioinnille (2). Vertailevat tutkimukset ovat osoittaneet, että tällaisilla menettelyillä, asianmukaisia kalibrointistandardeja käyttämällä, voidaan tarjota parempi toistettavuus ja herkkyys samassa laboratoriossa ja eri laboratorioissa manuaaliseen mikroskooppipisteytykseen verrattuna (3) (4). Automaattiset järjestelmät, joilla voidaan mitata mikrotumaisten punasolujen taajuudet ovat (mutta eivät pelkästään) virtaussytometrit (5), kuva-analyysijärjestelmät (6) (7), ja laserskannaukseen perustuvat sytometrit (8). Kromosomifragmentit voidaan erottaa kokonaisista kromosomeista useiden perusteiden perusteella, vaikka tätä ei normaalisti tehdä osana testiä. Näitä ovat kinetokorin tai sentromeerisen DNA:n (jotka ovat tyypillisiä ehjille kromosomeille) esiintymisen tai puuttumisen osoittaminen. Kinetokorin tai sentromeerisen DNA:n puuttuminen osoittaa, että mikrotuma sisältää ainoastaan kromosomifragmentteja, ja sen olemassaolo osoittaa kromosomin häviämisen. Käytettyjen termien määritelmät on esitetty lisäyksessä 1. ALUSTAVAT HUOMIOT Nuorten täysikasvuisten jyrsijöiden luuydin on kohdekudos geneettisille vaurioille tässä testissä, koska tässä kudoksessa muodostuvat punasolut. Punasolujen esiasteiden mikrotumien mittaus perifeerisessä veressä on hyväksyttävää muissa nisäkäslajeissa, joiden osalta on osoitettu, että ne ovat riittävän herkkiä havaitsemaan kemikaalit, jotka aiheuttavat rakenteellisia tai numeerisia kromosomipoikkeavuuksia näissä soluissa (indusoimalla mikrotumia punasolujen esiasteissa), ja joiden tapauksessa annetaan tieteelliset perusteet. Mikrotumaisten epäkypsien punasolujen esiintymistaajuus on pääasiallinen päätepiste. Sellaisten kypsien punasolujen taajuus, jotka sisältävät mikrotumia perifeerisessä veressä, voidaan myös käyttää päätepisteenä lajeissa, joilla ei ole vahvaa pernassa tapahtuvaa valintaa mikrotumaisilla soluilla, ja kun eläimet altistetaan yhtäjaksoisesti käytettyjen lajien punasolujen eliniän ylittävän ajan (esim. 4 viikkoa tai enemmän hiirillä). Jos on saatu viitteitä siitä, etteivät testikemikaalit tai niiden metaboliitit pääse kohdekudokseen, tätä testiä ei pidä käyttää. Ennen kuin testimenetelmää käytetään seoksen testaamiseen tietojen tuottamiseksi aiottuun sääntelytarkoitukseen, on harkittava, tarjoaako se asianmukaiset tulokset tämän tavoitteen kannalta, ja jos tarjoaa, miksi. Tällaista harkintaa ei tarvita, jos seoksen testaamista edellytetään sääntelyvaatimuksissa. TESTIMENETELMÄN PERIAATE Eläimet altistetaan testikemikaalille sopivaa antotapaa käyttäen. Jos käytetään luuydintä, eläimet lopetetaan inhimillisesti sopivan ajan kuluttua altistuksesta, luuytimestä otetaan näyte, ja preparaatit valmistetaan ja värjätään (9) (10) (11) (12) (13) (14) (15). Käytettäessä perifeeristä verta verinäytteet otetaan sopivina ajankohtina altistuksen jälkeen, tehdään valmistelut ja värjätään (12) (16) (17) (18). Kun annos annetaan akuutisti, on tärkeää valita luuytimen tai veren näytteenotto aikoina, jolloin mikrotumaisten punasolujen esiasteiden käsittelyyn liittyvä induktio voidaan havaita. Kun kyse on perifeerisen veren näytteenotosta, näiden tapahtumien välillä on myös oltava kulunut tarpeeksi aikaa, jotta ne voidaan havaita kiertävässä veressä. Mikrotumien esiintyminen analysoidaan valmisteista joko havainnoimalla mikroskooppia, kuva-analyysijärjestelmää, virtaussytomeriä käyttäen tai laskerskannaukseen perustuvaa sytometria käyttäen. LABORATORIOIDEN PÄTEVYYDEN VARMISTAMINEN Pätevyyttä koskevat tutkimukset Jotta laboratoriolla voidaan todeta olevan riittävä kokemus testistä ennen sen käyttöä rutiinitestauksessa, laboratorion on osoitettava, että se voi tuottaa odotettavissa olevat tulokset julkaistuista tiedoista (17) (19) (20) (21) (22) mikrotumien taajuuden mittaamiseen vähintään kahdella positiivisella kontrollikemikaalilla (mukaan lukien heikot vasteet, joita indusoivat pienet määrät positiivista kontrollikemikaalia), kuten ne, jotka luetellaan taulukossa 1 ja yhdessä yhteensopivien kantaja-aine-/liuotinkontrollien kanssa (ks. 26 kappale). Näissä kokeissa pitää käyttää annoksia, joista aiheutuu toistettavissa olevia ja annokseen liittyviä lisääntymisiä, ja niiden on osoitettava testausjärjestelmän herkkyys ja dynaaminen vaihteluväli kohdekudoksessa (luuydin tai perifeerinen veri) ja käyttää laskentamenetelmää, jota voidaan soveltaa laboratoriossa. Tätä vaatimusta ei sovelleta laboratorioihin, joilla on kokemusta, eli joilla on 14–18 kohdassa määritelty laboratoriokohtainen tietokanta. Aiemmat kontrollitiedot Pätevyyttä koskevissa tutkimuksissa laboratorion on määriteltävä:
Hankittaessa ensin tietoja aiempien negatiivisten kontrollien jakaumaa varten, rinnakkaisten negatiivisten kontrollien on oltava yhdenmukaisia julkaistujen kontrollitietojen kanssa, jos sellaisia on olemassa. Kun aikaisempien kontrollien jakaumaan lisätään enemmän kokeellisia tietoja, rinnakkaisten negatiivisten kontrollien olisi mieluiten sijoituttava kyseisen jakauman 95 %:n kontrollirajojen sisälle. Laboratorion aikaisempia negatiivisia kontrolleja koskevan tietokannan pitäisi olla tilastollisesti vankka, jotta varmistetaan laboratorion kyky arvioida negatiivisten kontrollitietojensa jakaumaa. Lähdekirjallisuuden mukaan voidaan tarvita vähintään 10 koetta, mutta mieluiten olisi tehtävä ainakin 20 koetta vastaavanlaisissa koeolosuhteissa. Laboratorioiden on käytettävä laadunvalvontamenetelmiä, kuten valvontakortteja (esim. C-kortteja tai X-bar-kortteja (23)), kontrollitietojensa vaihtelevuuden määrittämiseksi ja osoittaakseen, että laboratorio ”hallitsee” menetelmän. Lisäsuosituksia aikaisempien tietojen muodostamisesta ja käytöstä (esimerkiksi perusteet tietojen sisällyttämiseksi aikaisempiin tietoihin tai jättämiseksi pois niistä sekä kokeiden hyväksyttävyysperusteet) annetaan lähdekirjallisuudessa (24). Jos laboratorio ei suorita loppuun riittävää määrää kokeita tilastollisesti vankan negatiivisen kontrollin jakauman osoittamiseksi (ks. 15 kohta) pätevyyttä koskevissa tutkimuksissa (kuvataan 13 kohdassa), on hyväksyttävää, että jakauma voidaan luoda ensimmäisten rutiinitutkimuksien aikana. Tässä lähestymistavassa pitäisi noudattaa lähdekirjallisuudessa (24) esitettyjä suosituksia ja negatiivisen kontrollin tuloksia, ja näissä kokeissa saatujen negatiivisten kontrollien tulosten on oltava julkaistujen negatiivisten kontrollien tuloksien mukaisia. Mahdollisissa koejärjestelyn muutoksissa on otettava huomioon, miten ne vaikuttavat tuloksena olevien tietojen yhdenmukaisuuteen laboratorion olemassa olevan aiempia kontrolleja koskevan tietokannan kanssa. Vain merkittävien epäjohdonmukaisuuksien perusteella on luotava uusi aiempien kontrollien tietokanta, jos asiantuntija-arviossa määritetään, että se eroaa edellisestä jakaumasta (ks. 15 kohta). Sen uudelleenluonnin aikana täysimittaista negatiivisten kontrollien tietokantaa ei ehkä tarvita varsinaisen testin suorittamiseen, jos laboratorio voi osoittaa, että sen rinnakkaisen negatiivisen kontrollin arvot ovat yhdenmukaisia aiemman tietokannan tai vastaavien julkistettujen tietojen kanssa. Negatiivisen kontrollin tietojen tulisi koostua kunkin eläimen mikrotumaisten epäkypsien punasolujen esiintyvyydestä. Samanaikaisten negatiivisten kontrollien olisi mieluiten sijoituttava laboratorion aikaisempien negatiivisten kontrollien tietokannan 95 %:n kontrollirajojen sisälle. Jos rinnakkaisia negatiivisia kontrolleja koskevat tiedot jäävät 95 %:n kontrollirajojen ulkopuolelle, ne voidaan hyväksyä aikaisemman kontrollien jakaumaan edellyttäen, etteivät ne ole äärimmäisiä harha-arvoja ja että on näyttöä siitä, että testijärjestelmä on ”hallinnassa” (ks. 15 kohta), ja ettei ole kyse teknisestä tai inhimillisestä virheestä. MENETELMÄN KUVAUS Valmisteet Eläinlajin valinta Koe-eläinten on oltava yleisesti käytettyä laboratoriokantaa olevia nuoria terveitä täysikasvuisia eläimiä. Hiiriä, rottia tai muita soveltuvia nisäkäslajeja voidaan käyttää. Kun käytetään perifeeristä verta, on osoitettava, että mikrotumaisten solujen poistuminen verenkierrosta pernassa ei vaaranna aiheutettujen mikrotumien havaitsemista valitussa lajissa. Tämä on selkeästi osoitettu hiiren ja rotan perifeerisessä veressä (2). Raportissa on esitettävä tieteelliset perustelut muiden lajien kuin rottien ja hiirten käytöstä. Jos käytetään muita lajeja kuin jyrsijöitä, on suositeltavaa, että indusoitujen mikrotumien mittaus sisällytetään toiseen sopivaan toksisuustestiin. Koe-eläintilat ja eläinten ruokinta Jyrsijöiden tapauksessa koe-eläinhuoneen lämpötilan tulee olla 22 °C (± 3 °C). Vaikka suhteellisen kosteuden olisi mieluiten oltava 50–60 prosenttia, sen olisi oltava ainakin 40 prosenttia eikä mielellään yli 70 prosenttia muulloin kuin tilan puhdistuksen aikana. Tilassa tulee käyttää keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa / 12 tuntia pimeää). Eläinten ruokinnassa voidaan käyttää normaalia laboratorioruokavaliota, eikä juomaveden määrää saa rajoittaa. Ravinnon valintaan voi vaikuttaa tarve varmistaa sopiva sekoitus testikemikaalia, kun sitä annetaan tätä reittiä. Jyrsijät on sijoitettava samaa sukupuolta ja käsittelyryhmää edustaviin pienryhmiin (enintään viisi häkkiä kohti), jos mitään aggressiivista käytöstä ei odoteta, mieluiten kiinteisiin lattiahäkkeihin, joissa on asianmukainen virikkeellinen ympäristö. Eläimet voivat olla häkissä yksittäin ainoastaan, jos tämä on tieteellisesti perusteltua. Eläinten valmistelu Yleensä käytetään nuoria terveitä täysikasvuisia eläimiä (jyrsijät ovat mieluiten 6–10 viikon ikäisiä käsittelyn alussa, joskin hieman vanhemmat eläimet hyväksytään) ja ne jaetaan satunnaistetusti testi- ja kontrolliryhmiin. Eläimet tunnistetaan yksilöllisesti inhimillisellä minimaalisen invasiivisella toimenpiteellä (esim. rengastamalla, merkitsemällä, mikrosirulla tai biometrisellä tunnuksella, mutta ei korvia tai varpaita leikkaamalla) ja sopeuttamalla laboratorio-olosuhteisiin vähintään viiden päivän ajan. Häkit on sijoitettava siten, että häkin sijainnista johtuvat vaikutukset ovat mahdollisimman vähäisiä. Ristikontaminaatiota positiivisella kontrollilla ja testikemikaalilla tulisi välttää. Tutkimuksen alkaessa eläinten painonvaihtelun on oltava vähäistä, ja se saa vaihdella korkeintaan ± 20 % kunkin sukupuolen tavanomaisesta keskiarvosta. Annosten valmistelu Kiinteät testikemikaalit liuotetaan tai sekoitetaan asianmukaisiin liuottimiin tai kantaja-aineisiin taikka lisätään ravintoon tai juomaveteen, ennen kuin ne annetaan koe-eläimille. Nestemäiset testikemikaalit voidaan antaa suoraan tai laimentaa ennen antamista. Testikemikaaleja voidaan antaa hengitystien kautta tapahtuvan altistamisen osalta kaasuna, höyrynä tai kiinteänä/nestemäisenä aerosolina niiden fysikokemiallisista ominaisuuksista riippuen. Testikemikaali on valmisteltava juuri ennen annostelua, paitsi jos sen säilyvyys on osoitettu stabiliteettitesteillä ja asianmukaiset säilytysolosuhteet on määritetty. Testiolosuhteet Liuotin/kantaja-aine Liuottimella/kantaja-aineella ei saa olla myrkkyvaikutuksia käytetyillä annostasoilla, eikä sen käyttö saa aiheuttaa mahdollisia kemiallisia reaktioita testikemikaalien kanssa. Jos käytetään muita kuin hyvin tunnettuja liuottimia/kantaja-aineita, niiden käyttö on perusteltava yhteensopivuuden osoittavilla tutkimustuloksilla. Vesipitoisen liuottimen/kantaja-aineen käyttöä on harkittava ensisijaisesti aina, kun se on mahdollista. Esimerkkejä yleisesti käytetyistä yhteensopivista liuottimista/kantaja-aineista ovat vesi, fysiologinen suolaliuos, metyyliselluloosaliuos, natriumkarboksimetyyliselluloosan suolaliuos, oliiviöljy ja maissiöljy. Jos ei ole aikaisempia tai julkaistuja kontrollitietoja siitä, ettei valittu epätyypillinen liuotin/kantaja-aine aiheuta mitään mikrotumia tai muita haitallisia vaikutuksia, on tehtävä alustava tutkimus, jolla voidaan määrittää liuotin-/kantajakontrollin hyväksyttävyys. Kontrollit Positiiviset kontrollit Kuhunkin testiin pitäisi normaalisti sisällyttää ryhmä eläimiä, joita käsitellään positiivisella kontrollikemikaalilla. Tästä voidaan poiketa, jos testilaboratorio on osoittanut olevansa pätevä tekemään testin ja se on vahvistanut aikaisemman positiivisen kontrollin vaihteluvälin. Kun rinnakkaista positiivisen kontrollin ryhmää ei ole, kuhunkin kokeeseen on sisällytettävä pisteytyskontrollit (kiinteät ja värjätyt objektilasit tai solususpensionäytteet, pisteytysmenetelmän mukaisesti). Nämä voidaan saada sisällyttämällä tutkimuksen pisteytykseen asianmukaiset vertailunäytteet, jotka on saatu ja joita säilytetään erillisestä määräajoin (esim. 6–18 kuukauden välein) tehtävästä positiivisen kontrollin kokeesta; esimerkiksi pätevyyden testaamisen aikana ja säännöllisesti tämän jälkeen, jos tätä tarvitaan. Positiivisten kontrollikemikaalien pitäisi luotettavasti tuottaa havaittavaa lisääntymistä mikrotumien esiintymistaajuudessa spontaanitasoa enemmän. Kun käytetään manuaalista pisteytystä mikroskoopilla, positiivisten kontrolliaineiden annokset on valittava siten, että vaikutukset ovat selvät mutta eivät paljasta heti laskijoille koodattujen näytteiden identiteettiä. On hyväksyttävää, että positiivinen kontrolliaine annetaan eri reittiä kuin testikemikaali käyttäen eri käsittelyaikataulua, ja näytteet voidaan ottaa vain kerran. Lisäksi positiivisina kontrolleina tulisi käyttää tarvittaessa samaan kemiallisten aineiden ryhmään kuuluvia aineita. Taulukkoon 1 sisältyy esimerkkejä positiivisista kontrollikemikaaleista. Taulukko 1 Esimerkkejä positiivisista kontrollikemikaaleista: Kemikaalit ja CAS-rekisterinumero Etyylimetaanisulfonaatti [CAS-numero 62-50-0] Metyylimetaanisulfonaatti [CAS-numero 66-27-3] Etyylinitrosourea [CAS-numero 759-73-9] Mitomysiini C [CAS-numero 50-07-7] Syklofosfamidi (monohydraatti) [CAS-numero 50-18-0 (CAS-numero 6055-19-2)] Trietyleenimelamiini [CAS-numero 51-18-3] Kolkisiini [CAS-numero 64-86-8] tai vinblastiini [CAS-numero 865-21-4] – aneugeeneinä Negatiiviset kontrollit Negatiivisen kontrolliryhmän eläimet on sisällytettävä jokaiseen näytteenottokertaan ja niitä tulisi käsitellä aivan samalla tavalla kuin tutkimusryhmiä, paitsi ettei niitä altisteta testikemikaalille. Jos testikemikaalin annostelussa käytetään liuotinta/kantaja-ainetta, kontrolliryhmän pitää saada tätä liuotinta/kantaja-ainetta. Kuitenkin, jos aikaisemmista negatiivisen kontrollin tiedoista kullakin näytteenottokerralla testilaboratoriossa käy ilmi johdonmukaisia eläinten välisiä eroja ja mikrotumia sisältävien solujen esiintymistaajuutta, negatiivista kontrollia varten voidaan tarvita vain yksi näytteenotto. Kun negatiiviseen kontrolliin käytetään yhtä näytteenottoa, kyse pitäisi olla tutkimuksessa käytetystä ensimmäisestä näytteenottokerrasta. Jos käytetään perifeeristä verta, käsittelyä edeltävä näyte on hyväksyttävä rinnakkaisen negatiivisen kontrollin sijaan lyhyen aikavälin tutkimuksissa, mikäli saadut tulokset ovat testauslaboratorion aikaisempien kontrollien tietokannan mukaisia. Rotilla on osoitettu, että pienten määrien käsittelyä edeltävällä näytteenotolla (esim. alle 100 μl/päivä) on minimaalinen vaikutus mikrotuman taustataajuuteen (25). MENETTELY Eläinten lukumäärä ja sukupuoli Mikrotuman vaste on yleensä samanlainen uros- ja naaraspuolisilla eläimillä ja tästä syystä useimmat tutkimukset voidaan suorittaa jompaakumpaa sukupuolta käyttäen (26). Tiedot, jotka osoittavat merkittäviä urosten ja naaraiden välisiä eroja (esim. systeemisen toksisuuden, aineenvaihdunnan, biologisen saatavuuden, luuytimeen liittyvän toksisuuden erot, mukaan lukien esimerkiksi raja-annostutkimus) voisivat kannustaa käyttämään molempia sukupuolia. Tällaisessa tapauksessa voi olla tarkoituksenmukaista tehdä tutkimus molemmilla sukupuolilla esim. osana toistuvan annostelun toksisuustutkimusta. Molempia sukupuolia käytettäessä saattaa olla tarkoituksenmukaista tehdä yhdistelykoe.. Tarkempia tietoja siitä, miten tietoja yhdistelykokeessa analysoidaan, annetaan lisäyksessä 2. Ryhmäkoot varmistetaan tutkimuksen alussa, jotta tarjotaan vähintään viisi tutkimukseen soveltuvaa yhtä sukupuolta edustavaa eläintä, tai kustakin sukupuolesta (jos kumpiakin käytetään) ryhmää kohti. Jos ihmisen altistuminen tutkittavalle kemikaalille voi olla sukupuolesta riippuvaa, kuten joidenkin lääkeaineiden kohdalla, testi on tehtävä asianomaista sukupuolta olevilla eläimillä. Ohjeelliseksi maksimimääräksi eläimiä koskevien vaatimusten osalta annetaan, että luuydintutkimus tehdään 37 kohdassa vahvistettujen parametrien mukaan kolmella annosryhmällä ja rinnakkaisella negatiivisella ja positiivisella kontrolliryhmällä (kuhunkin ryhmään kuuluu viisi samaa sukupuolta olevaa eläintä), eli tarvitaan 25–35 eläintä. Annostasot Jos tehdään alustava annoksenmääritystutkimus, koska soveltuvia tietoja ei ole vielä käytettävissä annoksen valinnan opastukseen, se on tehtävä samassa laboratoriossa käyttäen samaa lajia, samaa kantaa, samaa sukupuolta olevia eläimiä ja samaa altistusohjelmaa kuin päätutkimuksessa on tarkoitus käyttää (27). Tutkimuksessa on pyrittävä tunnistamaan suurin siedetty annos, joka määritellään korkeimmaksi annokseksi, jota siedetään ilman näyttöä tutkimusta rajoittavasta toksisuudesta suhteessa tutkimuksen kestoon (esim. se aiheuttaa ruumiinpainon laskua tai vertavuotavan kudoksen sytotoksisuutta, mutta joka ei aiheuta kuolemaa eikä kipua, tuskaa tai kärsimystä, jonka vuoksi eläin on lopetettava inhimillisesti (28)). Suurin annos voidaan määritellä myös annokseksi, joka aiheuttaa toksisuutta luuytimessä (esim. punasolujen esiasteiden osuuden pieneneminen punasolujen kokonaismäärästä luuytimessä tai perifeerisessä veressä yli 50 prosenttia, mutta vähintään 20 prosenttia vertailuarvosta). Kuitenkin, kun CD71-positiivisia soluja analysoidaan ääreisverenkierrossa (esim. virtaussytometrillä), tämä erittäin varhainen punasolujen esiasteiden fraktio vastaa toksisuuteen nopeammin kuin punasolujen esiasteiden suurempi RNA-positiivinen kohortti. Tästä syystä suurempi näennäinen toksisuus voi olla ilmeinen akuutin altistumisen malleissa, joissa tutkitaan CD71-positiivista punasolun esiasteen fraktiota verrattuna niihin, joissa punasolujen esiasteisiin liittyvä tunnistus perustuu RNA-sisältöön. Tästä syystä, kun kokeissa käytetään enintään viisi altistuspäivää, toksisuutta aiheuttavien testikemikaalien korkeimmaksi annostasoksi voidaan määritellä annos, joka aiheuttaa CD71-positiivisten punasolujen esiasteiden osuuden tilastollisesti merkittävän vähenemisen punasolujen kokonaismäärässä, mutta ei vähemmän kuin viisi prosenttia kontrollin arvosta (29). Kemikaalit, jotka osoittavat toksikokineettisten ominaisuuksien saturaation tai aiheuttavat detoksikaatioprosesseja, jotka voivat johtaa altistuksen vähenemiseen pitkäaikaisen annostelun jälkeen, voivat muodostaa poikkeuksen annoksenmäärityskriteereihin, ja niitä on arvioitava tapauskohtaisesti. Jotta saadaan annosvastetiedot, täydelliseen tutkimukseen on sisällyttävä negatiivisen kontrollin ryhmä ja vähintään kolme annostelutasoa, jotka yleensä erotetaan kertoimella 2, mutta enintään kertoimella 4. Jos testikemikaali ei aiheuta toksisuusvaikutusta annoksenmääritystutkimuksessa tai olemassa olevien tietojen perusteella, suurimman annoksen vähintään 14 päivän annostelun aikana pitäisi olla 1 000 mg/painokilo/päivä tai alle 14 päivän annostelun aikana 2 000 mg/painokilo/päivä. Jos testikemikaali aiheuttaa toksisuusvaikutuksen, suurimman siedetyn annoksen pitäisi olla korkein annettava annos, ja käytettävien annostasojen olisi mieluiten katettava vaihteluväli maksimista annokseen, jonka toksisuusvaikutus on vähäinen tai jolla ei ole toksisuusvaikutusta. Kun kohdekudoksen (luuytimen) toksisuusvaikutus havaitaan kaikilla testatuilla annostasoilla, on suositeltavaa tehdä täydentävä tutkimus ei-toksisilla annoksilla. Tutkimukset, joiden tarkoituksena on kuvata täydellisesti määrällisiä annos-vastetietoja, voivat vaatia täydentäviä annosryhmiä. Nämä rajat voivat vaihdella tietyntyyppisten testikemikaalien osalta (esim. ihmisten lääkkeet), jotka kuuluvat erityisvaatimusten piiriin. Raja-annostesti Jos pitoisuusalueenmäärittelykokeet tai olemassa olevat tiedot vastaavista eläinkannoista osoittavat, että vähintään raja-annokseen (kuvattu jäljempänä) perustuva altistusohjelma ei tuota havaittavia toksisuusvaikutuksia (ei esim. luuytimeen liittyvän proliferaation vähentymistä tai muita todisteita kohdekudoksen sytotoksisuudesta), ja jos genotoksisuuden ei oleteta perustuvan in vitro -genotoksisuustutkimuksiin tai tietoihin rakenteellisesti samankaltaisista kemikaaleista, täydellistä tutkimusta kolmella annostasolla ei ehkä pidetä tarpeellisena, mikäli on osoitettu, että testikemikaalit saavuttavat kohdekudoksen (luuytimen). Tällaisissa tapauksissa yksi annostaso raja-annoksena saattaa riittää. Kun annostelu kestää vähintään 14 päivää, annos on 1 000 mg/painokiloa/päivä. Kun annostelu kestää alle 14 päivää, annos on 2 000 mg/painokiloa/päivä. Antotapa Testin suunnittelussa on otettava huomioon oletettu ihmisen altistusreitti. Siksi perustelluksi altistusreitiksi voidaan valita esim. ravinto tai juomavesi, ihonalainen, suonensisäinen, oraalinen (letkuruokinnalla), altistus hengitysteitse, henkitorven tai implantaation kautta kulkeva reitti. Joka tapauksessa reitti on valittava, jotta varmistetaan kohdekudosten riittävä altistus. Intraperitoneaalista injektiota ei yleensä suositella, koska se ei ole tarkoitettu ihmisen altistumisreitiksi, ja sitä tulisi käyttää vain erityisten tieteellisien perusteiden nojalla. Jos testikemikaali sekoitetaan ravintoon tai juomaveteen, varsinkin jos kyse on yhdestä annoksesta, on huolehdittava siitä, että viive ravinnon ja veden kulutuksen ja näytteenoton välillä on riittävä, jotta vaikutukset voidaan havaita (ks. 37 kohta). Suurin letkuruokinnan tai injektion avulla kerralla annettava nestemäärä määräytyy koe-eläimen koon mukaan. Määrä ei saa normaalisti ylittää 1 ml/100 g painoa. Poikkeuksen muodostavat vesiliuokset, joita käytettäessä enimmäistilavuus voi olla 2 ml/100 g painoa. Tätä suurempien määrien käyttö on perusteltava. Lukuun ottamatta ärsyttäviä tai syövyttäviä testikemikaaleja, joiden vaikutukset yleensä pahenevat korkeammilla pitoisuuksilla, testikemikaalimäärän vaihtelu on minimoitava säätämällä pitoisuutta, jotta annostelun vakiotilavuus suhteessa ruumiinpainoon taataan kaikilla annostasoilla. Altistusohjelma Mieluiten tehdään ainakin kaksi käsittelyä, jolloin annos annetaan 24 tunnin välein erityisesti, kun tämä testi sisällytetään muihin toksisuustutkimuksiin. Vaihtoehtoisesti voidaan antaa yksittäisiä annoksia, jos tämä on tieteellisesti perusteltua (esim. testikemikaalien tiedetään estävän solusyklin). Testikemikaalit voidaan antaa myös eri annoksina, eli kaksi tai useampaa altistuskertaa samana päivänä korkeintaan 2–3 tunnin välein, mikä helpottaa suurten määrien antamista. Näissä olosuhteissa, tai testikemikaalia hengitysteitse annettaessa, näytteenottoaika tulee ajoittaa edellisen annostuksen tai altistuksen päättymisajan perusteella. Testi voidaan tehdä hiirillä tai rotilla kolmella eri tavalla:
Muita annostelu- tai näytteenotto-ohjelmia voidaan käyttää tarvittaessa ja tieteellisten perustelujen nojalla ja kun helpotetaan tietojen sisällyttämistä muihin toksisuustutkimuksiin. Havainnot Koe-eläimiä koskevia yleisiä kliinisiä havaintoja tulee tehdä ja kliinisiä oireita kirjata ainakin kerran päivässä, mieluiten samaan aikaan joka päivä ottaen huomioon se, milloin annoksen antamisen jälkeen odotetut vaikutukset ovat suurimmillaan. Kaikkien eläinten sairastuvuutta ja kuolleisuutta on havainnoitava ainakin kahdesti vuorokaudessa annostelun aikana. Eläimet on punnittava tutkimuksen alussa ja vähintään kerran viikossa toistuvan annoksen tutkimuksissa ja lopetettaessa. Vähintään viikon kestävissä tutkimuksissa ravinnonkulutuksen mittaus on tehtävä vähintään viikoittain. Mikäli testikemikaalia annostellaan juomaveteen, veden kulutusta on mitattava, kun vesi vaihdetaan tai ainakin kerran viikossa. Eläimet, joilla ilmenee ei-letaaleja merkkejä liiallisesta myrkytysvaikutuksesta, on lopetettava inhimillisesti ennen tutkimusajan päättymistä (28). Tietyissä olosuhteissa eläimen kehon lämpötilaa voidaan tarkkailla, koska käsittelyn aiheuttama hyper- ja hypotermia ovat tuottaneet vääriä tuloksia (32) (33) (34). Kohdekudoksen altistaminen Verinäyte on otettava sopivana ajankohtana, jotta voidaan tutkia testikemikaalien plasmatasot luuytimen altistumisen osoittamiseksi, jos tämä on perusteltua ja jos muita altistustietoja ei ole (ks. 48 kohta). Luuydin-/veripreparaatit Luuydinsolut otetaan yleensä eläinten reisiluista tai sääriluista heti koe-eläinten inhimillisen lopettamisen jälkeen. Solut poistetaan, niistä tehdään preparaatit ja ne värjätään vakiintuneilla värjäysmenetelmillä. Pieniä määriä perifeerista verta voidaan ottaa asiaankuuluvien eläinten hyvinvointia koskevien vaatimusten perusteella joko käyttämällä menetelmää, joka sallii koe-eläimen selviytymisen, kuten veri häntälaskimosta tai muusta sopivasta verisuonesta, tai sydänpunktio taikka näytteenotto suurikokoisesta suonesta lopettamisen yhteydessä. Kun kyse on luuytimestä tai perifeerisestä verestä peräisin olevista punasoluista, solut voidaan analyysimenetelmästä riippuen värjätä välittömästi supravitaaliväreillä (16) (17) (18) tai niistä tehdään ensin sivelyvalmisteet ja ne värjätään sen jälkeen mikroskooppitutkimukseen tai ne fiksoidaan ja värjätään asianmukaisesti virtaussytometrista tutkimusta varten. DNA-spesifisen väriaineen (esimerkiksi akridiinioranssin (35) tai Hoechst 33258:n plus pyroniini-Y:n (36)) käytöllä voidaan eliminoida joitakin ei-DNA-spesifisen väriaineen käyttöön liittyviä artefakteja. Tämä etu ei sulje pois tavanomaisten väriaineiden (esim. Giemsa mikroskooppitutkimuksessa) käyttöä. Myös muita järjestelmiä [esim. selluloosapylväitä tumallisten solujen poistamiseksi (37) (38)] voidaan käyttää, mikäli nämä menetelmät on laboratoriossa osoitettu yhteensopivaksi näytteen valmistuksen kanssa. Jos nämä menetelmät ovat sovellettavissa, antikinetokorivasta-aineita (39), fluoresenssi- in situ -hybridisaatiota pansentromeerisillä DNA-koettimilla (40), tai suoraa in situ -merkintää, johon liittyy pansentromeerispesifisiä alukkeita yhdessä sopivan DNA:n vastavärjäyksen (41) kanssa, voidaan käyttää tunnistamaan mikrotumien (kromosomin/kromosomifragmentin) luonne, jotta voidaan määrittää, johtuuko mikrotuman indusoitumismekanismi klastogeenisesta ja/tai aneugeenisesta vaikutuksesta. Muita klastogeenien ja aneugeenien erottelumenetelmiä voidaan käyttää, jos menetelmät on osoitettu tehokkaiksi. Analyysi (manuaalinen ja automaattinen) Kaikki objektilasit tai näytteet, myös ne, joilla on positiiviset ja negatiiviset kontrollit, on koodattava toisistaan riippumattomasti ennen minkäänlaista tutkimusta ja jaettava satunnaisotannalla siten, että laskija ei tiedä altistusolosuhteista; tällainen koodaus ei ole tarpeen käytettäessä automaattisia pisteytysjärjestelmiä, jotka eivät ole riippuvaisia silmämääräisestä tarkastuksesta ja joihin eivät vaikuta toimijan ennakkokäsitykset. Punasolujen esiasteiden osuus koko punasolumäärästä (esiasteet + kypsät punasolut) määritetään jokaisen eläimen osalta erikseen laskemalla yhteensä vähintään 500 punasolua luuytimestä ja 2 000 punasolua perifeerisestä verestä (42). Mikrotumaisten punasolujen esiasteiden esiintymistaajuuden määrittämistä varten on laskettava vähintään 4 000 punasolun esiastetta eläintä kohti (43). Jos aikaisempien negatiivisten kontrollien tietokanta osoittaa, että mikrotumaisten punasolujen esiasteiden taustaesiintyvyys on <0,1 % testilaboratoriossa, on harkittava ylimääräisten solujen laskentaa. Näytteitä analysoitaessa punasolujen esiasteiden osuus testikemikaalia saaneiden eläinten punasolujen kokonaismäärästä pitäisi olla vähintään 20 prosenttia kantaja-aine-/liuotinkontrollin osuudesta, kun laskenta tehdään mikroskoopilla, ja vähintään noin 5 prosenttia kantaja-aine-/liuotinkontrollin osuudesta, kun, CD71+ -punasolujen esiasteita lasketaan sytometrisillä menetelmillä (ks. 31 kohta) (29). Esim. mikroskoopilla laskettavassa luuydinkokeessa, jos punasolujen esiasteen kontrolliosuus luuytimessä on 50 prosenttia, toksisuuden yläraja käsittää 10 prosenttia punasolujen esiasteita. Koska rotan perna eristää ja tuhoaa mikrotumaisia punasoluja, on suositeltavaa rajoittaa mikrotumaisten punasolujen esiasteiden analyysi varhaisimpaan fraktioon. Siten pidetään yllä määritysmenetelmän korkeaa herkkyyttä rotan perifeerista verta analysoitaessa. Kun käytetään automaattisia analyysijärjestelmiä, punasolujen varhaisimmat esiasteet voidaan määrittää niiden korkean RNA-pitoisuuden tai niiden pinnalla olevan transferiinireseptoreiden (CD71+) korkean tason (31) perustella. Kuitenkin suora vertailu eri värjäysmenetelmien välillä on osoittanut, että tyydyttäviä tuloksia voidaan saada erilaisilla menetelmillä, myös perinteisellä akridiinioranssivärjäyksellä (3) (4). TIEDOT JA RAPORTOINTI Tulosten käsittely Yksittäisiä eläimiä koskevat tiedot on esitettävä taulukossa. Punasolujen esiasteiden laskettu määrä, mikrotumaisten punasolujen esiasteiden lukumäärä ja punasolujen esiasteiden osuus koko punasolumäärästä on lueteltava kunkin analysoidun eläimen osalta erikseen. Kun hiiriä käsitellään jatkuvasti vähintään neljän viikon ajan, tiedot mikrotumaisten kypsien punasolujen määrästä ja osuudesta on myös annettava, jos tämä kerätään. Eläinten toksisuustiedot ja kliiniset oireet on myös raportoitava. Hyväksyttävyysperusteet Testin hyväksyttävyys määritetään seuraavilla kriteereillä:
Tulosten arviointi ja tulkinta Jos kaikki hyväksymisperusteet täyttyvät, testikemikaalin katsotaan olevan selvästi positiivinen, mikäli:
Jos vain suurinta annosta tutkitaan tietyllä näytteenottokerralla, testikemikaalia pidetään selvästi positiivisena, mikäli esiintyy tilastollisesti merkittävää kasvua rinnakkaiseen negatiiviseen kontrolliin verrattuna ja tulokset ovat aikaisempien negatiivisen kontrollin tietojen jakauman ulkopuolella (esim. Poissonin jakaumaan perustuvat 95 %:n kontrollirajat). Lähdekirjallisuudessa on suosituksia soveltuvimmista tilastollisista menetelmistä (44) (45) (46) (47). Kun tehdään annos–vaste-analyysi, on analysoitava ainakin kolmea altistettua annosryhmää. Tilastollisissa testeissä kokeellisena yksikkönä olisi käytettävä eläintä. Mikrotumatestissä saadut positiiviset tulokset osoittavat, että testikemikaali aiheuttaa mikrotumia, jotka ovat seurausta kromosomivauriosta tai mitoosilaitteen vauriosta testatun lajin erytroblasteissa. Tapauksessa, jossa testi tehtiin sentromeerien havaitsemiseen mikrotumissa, testikemikaali, joka tuottaa sentromeeria sisältäviä mikrotumia (sentromeerinen DNA tai kinetokori, joka indusoi koko kromosomin häviämisen) on osoitus siitä, että testikemikaali on aneugeeni. Jos kaikki hyväksymisperusteet täyttyvät, testikemikaalin katsotaan olevan selvästi negatiivinen, jos kaikissa tutkituissa koeolosuhteissa:
Lähdekirjallisuudessa on suosituksia soveltuvimmista tilastollisista menetelmistä (44) (45) (46) (47). Näyttöön luuytimen altistumisesta testikemikaalille voi sisältyä punasolujen esiasteiden ja kypsien punasolujen suhteen alentuminen tai testikemikaalien plasman tai veritasojen mittaaminen. Laskimonsisäisen annostelun tapauksessa näyttöä altistumisesta ei tarvita. Vaihtoehtoisesti luuytimen altistumisen osoittamiseen voidaan käyttää samalla altistustavalla ja samalla eläinlajilla tehdyn riippumattoman tutkimuksen tietoja. Negatiiviset tulokset osoittavat, ettei tutkittava kemikaali aiheuta koeolosuhteissa mikrotumia testattujen lajien punasolujen esiasteissa. Selvästi positiivista tai negatiivista vastetta ei tarvitse vahvistaa. Tapauksissa, joissa vaste ei ole selvästi negatiivinen tai positiivinen tai tuloksen biologisen merkityksellisyyden vahvistaminen kaipaa tukea (esim. heikko tai rajatapaukseksi luokiteltava lisäys), tietoja tulee arvioida asiantuntija-arvioinnissa ja/tai loppuun saatettuihin kokeisiin liittyvissä lisätutkimuksissa. Joissakin tapauksissa useampien solujen analysointi tai toistokokeen suorittaminen mahdollisesti käyttämällä mukautettuja koeolosuhteita voi olla hyödyllistä. Harvoissa tapauksissa edes lisätutkimusten pohjalta ei voida päätellä, että testikemikaali tuottaa positiivisia tai negatiivisia tuloksia, ja sen vuoksi tutkimusta pidetään epäselvänä. Testiraportti Testiraporttiin on sisällytettävä seuraavat tiedot:
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT Erytroblasti : varhainen vaihe punasolun kehityksessä, joka edeltää välittömästi punasolun esiastetta, jossa soluun sisältyy yhä tuma. Kemikaali : aine tai seos. Kinetokori : proteiinirakenne, joka muodostuu eukaryoottisolujen sentometrin päälle ja joka yhdistää kromosomin tumasukkulan mikrotubuluksen sukkularihmoihin mitoosin ja meioosin aikana ja toimii solunjakautumisen aikana ohjaten sisarkromatidit irti toisistaan. Mikrotumat : pieniä solun päätumasta erillisiä ja niiden rinnalla esiintyviä tumia, jotka muodostuvat mitoosin (meioosin) telofaasin aikana hitaasti liikkuvista (lagging) kromosomikappaleista tai kokonaisista kromosomeista. Normokromaattinen tai kypsä punasolu : täysin kypsä punasolu, joka on menettänyt enukleaation jälkeen jäljellä olevan RNA:n ja/tai on menettänyt muut lyhytaikaiset solumarkkerit, jotka tyypillisesti häviävät enukleaation jälkeen viimeisen erytroblastin jakautumisen jälkeen. Polykromaattinen punasolu tai punasolun esiaste : äskettäin muodostunut punasolu kehityksen välivaiheessa, joka värjää siniset ja punaiset komponentit klassisessa veren värjäyksessä (kuten Wrightin-Giemsan värjäys), koska vasta muodostuneeseen soluun sisältyy RNA:ta. Tällaiset äskettäin muodostuneet solut ovat likimain samanlaisia kuin retikulosyytit, joita visualisoidaan käyttämällä vitaalivärjäystä aiheuttaen jäännöksenä olevan solun RNA:n kasautumisen retikulumiksi. Muita menetelmiä, kuten RNA:n yksiväristä värjäystä fluoresoivilla väreillä tai lyhytikäisten pintamarkkereiden, kuten CD71:n merkitsemistä fluoresoivilla vasta-aineilla käytetään tällä hetkellä usein tunnistamaan vasta muodostuneet punasolut. Polykromaattiset punasolut, retikulosyytit ja CD71-positiiviset punasolut ovat punasolujen esiasteita, vaikka jokaisella on hieman erilainen elinaikajakauma. Retikulosyytti : vasta muodostunut punasolu, joka on värjätty vitaalivärjäyksellä aiheuttaen jäännöksenä olevan solun RNA:n kasautumisen retikulumiksi. Retikulosyyteillä ja polykromaattisilla punasoluilla on samanlainen solun ikäjakauma. Sentromeeri : kromosomin alue (alueita), joihin sukkularihmat ovat kiinnittyneet solunjakautumisen aikana. Tähän perustuu tytärkromosomien järjestäytynyt siirtyminen tytärsolujen napoihin. Testikemikaali : Aine tai seos, jota testataan tällä testimenetelmällä. Lisäys 2 YHDISTELYKOE SUKUPUOLTEN EROJEN TUNNISTAMISEKSI IN VIVO -MIKROTUMATESTISSÄ Yhdistelykoe ja sen analysointi Tässä kokeessa vähintään viisi urosta ja viisi naarasta testataan kullakin pitoisuustasolla. Tämä johtaa koemalliin, jossa on vähintään 40 eläintä (20 urosta ja 20 naarasta sekä asiaankuuluvat positiiviset kontrollit). Tämä koe, joka on yksi yksinkertaisimmista yhdistelykokeista, vastaa kaksisuuntaista varianssianalyysia, jossa sukupuoli ja pitoisuustaso ovat tärkeimmät vaikutukset. Tietoja voidaan analysoida käyttäen monia vakiintuneita tilastollisia ohjelmistopaketteja, kuten SPSS, SAS, STATA, Genstat ja R. Tietoihin liittyvä vaihtelu ositetaan analyysissa sukupuolten ja pitoisuuksien väliseksi sekä sukupuolten ja pitoisuuksien väliseen yhdysvaikutukseen liittyväksi vaihteluksi. Kutakin perustetta testataan rinnakkaisten eläinten välisen vaihtelevuuden arvion perusteella samaa sukupuolta edustavissa eläinryhmissä, joille annetaan sama pitoisuus. Täydelliset tiedot menetelmästä annetaan useissa vakiintuneissa tilastollisissa oppikirjoissa (ks. viitteet) ja tilastopakettien tukitoiminnoissa. Analyysissä tutkitaan sen jälkeen sukupuolen x pitoisuuteen liittyvä yhdysvaikutusyhdysvaikutustermi ANOVA-taulukossa (6). Merkitsevän yhdysvaikutustermin puuttuessa sukupuolten tai pitoisuustasojen yhdistetyt arvot ovat tasojen välisiä valideja tilastollisia testejä ANOVA-taulukon ryhmän sisäisen yhdistetyn vaihtelutekijän pohjalta. Analyysi jatkuu siten, että arvio pitoisuuksien välisestä vaihtelusta jaetaan kontrasteihin, joista saadaan testi vasteiden lineaarisille ja kvadraattisille kontrasteille eri pitoisuustasoilla. Kun sukupuolen x pitoisuuteen liittyvä yhdysvaikutus on merkittävä, tämä termi voidaan myös osittaa sukupuoleen x liittyviksi lineaarisiksi ja sukupuoleen x liittyviksi kvadraattisiksi interaktiokontrasteiksi. Näiden tekijöiden perusteella voidaan testata, onko sukupuolten pitoisuusvaste rinnakkainen vai onko sukupuolten välillä vaste-eroa. Arviota ryhmän sisäisestä yhdistetystä vaihtelusta voidaan käyttää keskiarvojen erotuksen parittaiseen testaukseen. Näitä vertailuja voitaisiin tehdä kummankin sukupuolen keskiarvojen välillä sekä eri pitoisuustasojen keskiarvojen välillä, kuten negatiiviisten kontrollitasojen kanssa. Kun yhdysvaikutus on merkitsevä, vertailuja voitaisiin tehdä eri pitoisuuksia saaneen yhden sukupuolen keskiarvojen välillä tai samaa pitoisuutta saaneiden molempien sukupuolten keskiarvojen välillä. Viitteet Asiasta on monia tilastollisia oppikirjoja, joissa käsitellään yhdistelmäkokeiden – jotka vaihtelevat yksinkertaisimmista kaksifaktorianalyyseistä kokeiden suunnittelumetodologiassa käytettyihin monimutkaisimpiin analyyseihin – teoriaa, suunnittelua, metodologiaa, analyysia ja tulkintaa. Seuraava luettelo ei ole tyhjentävä. Joissain kirjoissa annetaan esimerkkejä vertailukelpoisista malleista ja joissakin tapauksissa annetaan koodit analyysien tekemiseen erilaisia ohjelmistoja hyödyntämällä.
|
|
6) |
Poistetaan B osassa oleva B.15 luku. |
|
7) |
Poistetaan B osassa oleva B.16 luku. |
|
8) |
Poistetaan B osassa oleva B.18 luku. |
|
9) |
Poistetaan B osassa oleva B.19 luku. |
|
10) |
Poistetaan B osassa oleva B.20 luku. |
|
11) |
Poistetaan B osassa oleva B.24 luku. |
|
12) |
Korvataan B osassa oleva B.47 luku seuraavasti: ”B.47 Naudan sarveiskalvon sameuden ja läpäisevyyden testimenetelmä, jolla voidaan määrittää i) vakavia silmävaurioita aiheuttavat kemikaalit ja ii) kemikaalit, jotka eivät vaadi luokitusta silmä-ärsytyksen tai vakavan silmävaurion osalta JOHDANTO Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 437 (2013). Naudan sarveiskalvon sameuden ja läpäisevyyden testimenetelmä (BCOP) on arvioitu vaihtoehtoisten menetelmien validoinnin virastojenvälisen koordinointikomitean (ICCVAM, Interagency Coordinating Committee on the Validation of Alternative Methods) toimesta. Tutkimukseen ovat osallistuneet vaihtoehtoisten menetelmien eurooppalainen validointikeskus (ECVAM) ja Japanin vastaava keskus (JaCVAM) vuosina 2006 ja 2010 (1) (2). Ensimmäisellä kerralla arvioitiin BCOP-testimenetelmän käytettävyyttä vakavan silmävaurion aiheuttavien kemikaalien (aineiden ja seosten) tunnistamisessa (1). Toisella kerralla arvioitiin BCOP-testimenetelmän käytettävyyttä sellaisten kemikaalien (aineiden ja seosten) tunnistamisessa, joita ei luokitella silmä-ärsytyksen tai vakavan silmävaurion osalta (2). BCOP-validointitietokanta sisälsi yhteensä 113 ainetta ja 100 seosta (2) (3). Arviointien ja niiden vertaisarvioiden perusteella katsottiin, että testimenetelmällä voidaan tunnistaa oikein sekä vakavia silmävaurioita aiheuttavat kemikaalit (aineet ja seokset) (luokka 1) että sellaiset, jotka eivät vaadi luokitusta silmä-ärsytyksen tai vakavien silmävaurioiden osalta siten, kun se on määritetty Yhdistyneiden kansakuntien (YK) kemikaalien maailmanlaajuisesti yhdenmukaistetussa luokitus- ja merkintäjärjestelmässä (GHS-järjestelmässä) (4) ja aineiden ja seosten luokituksesta, merkinnöistä ja pakkaamisesta annetussa asetuksessa (EY) N:o 1272/2008 (CLP-asetuksessa) (7), ja menetelmä on siten vahvistettu tieteellisesti päteväksi molempiin tarkoituksiin. Vakava silmävaurio on silmän kudosvaurio tai vakava fyysinen näön rappeutuminen, joka syntyy, kun testiainetta on annosteltu silmän pinnalle, eikä se palaudu täysin 21 päivän kuluessa annostelusta. Vakavan silmävaurion aiheuttavat testikemikaalit on luokiteltu YK:n GHS-luokkaan 1. Kemikaalit, joita ei ole luokiteltu silmä-ärsytyksen tai vakavan silmävaurion osalta, on määritelty kemikaaleiksi, joita ei voida luokitella YK:n GHS-järjestelmän luokan 1 tai 2 (2A tai 2B) kemikaaleiksi, joten niitä kutsutaan kemikaaleiksi, joilla ei ole YK:n GHS-luokitusta. Tähän testimenetelmään kuuluvat BCOP-testimenetelmän suositeltu käyttö ja rajoitukset, jotka perustuvat BCOP:n arviointeihin. OECD:n testiohjeiden alkuperäisen vuoden 2009 version ja vuoden 2013 päivitetyn version tärkeimmät, mutta eivät ainoat, erot ovat: BCOP-testimenetelmän käyttö sellaisten kemikaalien tunnistamisessa, jotka eivät vaadi YK:n GHS-järjestelmän luokitusta (2 ja 7 kohdat); tarkennukset BCOP-testimenetelmän soveltuvuuteen alkoholien, ketonien ja kiintoaineiden (6 ja 7 kohdat) sekä aineiden ja seosten (8 kohta) testaamisessa; tarkennukset pinta-aktiivisten aineiden ja pinta-aktiivisia aineita sisältävien seosten suositeltavaan testaustapaan (28 kohta); positiivisia kontrolleja koskevat päivitykset ja tarkennukset (39 ja 40 kohdat); BCOP-testimenetelmän päätösperusteiden päivitys (47 kohta); tutkimuksen hyväksymisperusteiden päivitys (48 kohta); testiraportin osien päivitys (49 kohta); lisäyksen 1 määritelmien päivitys; lisäykseen 2 lisätty maininta BCOP-testimenetelmän ennustamiskyvystä eri luokitusjärjestelmissä; lisäyksessä 3 olevan pätevyyden osoittamiseen tarkoitettujen kemikaalien luettelon päivitys sekä lisäyksen 4 päivitys BCOP-testissä käytetyn sarveiskalvotelineen (1 kohta) ja opasitometrin (2 ja 3 kohdat) osalta. Nykyään on yleisesti hyväksyttyä, että Draizen in vivo -silmätestiä ei lähitulevaisuudessa voida korvata millään yksittäisellä in vitro -silmä-ärsytystestillä, kun halutaan ennakoida kaikki eri kemikaaliluokkien aiheuttamien aiheuttamat ärsytykset. Draizen silmätesti voidaan mahdollisesti kuitenkin korvata käyttämällä monen vaihtoehtoisen testimenetelmän (porrastettua) testausstrategiaa (5). Ylhäältä alaspäin suuntautuva lähestymistapa (5) on tarkoitettu käytettäväksi silloin, kun olemassa olevien tietojen perusteella voidaan olettaa, että kemikaalin ärsytyskyky on korkea. Alhaalta ylöspäin suuntautuva lähestymistapa (5) on taasen tarkoitettu käytettäväksi silloin, kun olemassa olevien tietojen perusteella voidaan olettaa, että kemikaali ei aiheuta niin suurta silmä-ärsytystä, että se olisi luokiteltava. BCOP-testimenetelmä on in vitro -testimenetelmä, jota voidaan käyttää tietyissä olosuhteissa ja tietyin rajoituksin kemikaalien silmävaarallisuuden luokitukseen ja merkintään. Vaikka BCOP-testimenetelmää ei pidetäkään yksinään luotettavana in vivo -kaninsilmätestin korvaavana testinä, sitä suositellaan Scott et al.:n ehdotuksen kaltaisen ylhäältä alaspäin suuntautuvan testausstrategian ensimmäiseksi vaiheeksi (5) käytettäväksi vakavan silmävaurion aiheuttavien kemikaalien eli YK:n GHS-luokkaan 1 luokiteltujen kemikaalien tunnistamisessa ilman lisätestejä (4). BCOP-testimenetelmää suositellaan myös sellaisten kemikaalien tunnistamiseen, jotka eivät vaadi luokitusta silmä-ärsytyksen tai vakavan silmävaurion osalta sellaisena, kuin ne on määritetty YK:n GHS-järjestelmässä (ei YK:n GHS-luokitusta) (4) osana ylhäältä alaspäin suuntautuvan lähestymistavan kaltaista testausstrategiaa (5). Lopullisen luokituksen vahvistamiseksi kemikaali, jonka ei ennusteta aiheuttavan vakavaa silmävaurioita tai jota ei ole luokitettu BCOP-testimenetelmällä silmä-ärsytyksen tai vakavan silmävaurion osalta, on kuitenkin testattava (in vitro ja/tai in vivo) lisätesteillä. Tässä testimenetelmässä kuvataan menettelyt, joilla arvioidaan testikemikaalin mahdollinen vaarallisuus silmälle mittaamalla kykyä aiheuttaa sameutta ja läpäisevyyden lisääntymistä eristetyssä naudan sarveiskalvossa. Myrkylliset vaikutukset sarveiskalvoon mitataan seuraavilla menetelmillä: i) valo läpikulun (transmission) vähentyminen (sameus) ja ii) natriumfluoreseiini-väriaineen lisääntynyt siirtyminen silmään (läpäisevyys). Testikemikaalille altistuksen jälkeen tehtyjä sarveiskalvon sameus- ja läpäisevyysarviointeja tarkastellaan yhdessä siten, että voidaan johtaa in vitro -ärsyttävyysarvo (In vitro Irritancy Score, IVIS), jonka avulla luokitellaan testikemikaalin ärsyttävyystaso. Määritelmät ovat lisäyksessä 1. ALUSTAVAT NÄKÖKOHDAT JA RAJOITUKSET Tämä testimenetelmä perustuu ICCVAMin ICE-testimenetelmäprotokollaan (6) (7), joka kehitettiin alun perin In vitro -tieteiden instituutin (IIVS) protokollasta ja INVITTOX-protokollasta 124 saatujen tietojen pohjalta (8). Viimeksi mainittua käytettiin Euroopan yhteisöjen rahoittamassa validointia edeltävässä tutkimuksessa vuosina 1997–1998. Molemmat protokollat perustuivat BCOP-testimenetelmään, jonka raportoivat ensimmäisenä Gautheron et al. (9) BCOP-testimenetelmää voidaan YK:n GHS-järjestelmän mukaan vakavan silmävaurion aiheuttavaksi kemikaaliksi määritettyjen kemikaalien eli YK:n GHS-luokkaan 1 luokiteltujen kemikaalien tunnistamiseen (4). Tähän käyttötarkoitukseen käytettynä BCOP-testimenetelmän yleinen tarkkuus on 79 % (150/191), väärien positiivisten tulosten osuus 25 % (32/126) ja väärien negatiivisten tulosten osuus 14 % (9/65) verrattuna kanin silmällä tehdyllä in vivo -testimenetelmällä saatuihin tietoihin luokiteltuna YK:n GHS-luokitusjärjestelmän mukaisesti (3) (ks. lisäys 2, taulukko 1). Kun tiettyihin kemiallisiin luokkiin (kuten alkoholit, ketonit) tai fysikaalisiin luokkiin (kuten kiintoaineet) kuuluvat testikemikaalit poistetaan tietokannasta, BCOP-testimenetelmän yleinen tarkkuus on 85 % (111/131), väärien positiivisten tulosten osuus 20 % (16/81) ja väärien negatiivisten tulosten osuus 8 % (4/50) luokiteltuna YK:n GHS-luokitusjärjestelmän mukaisesti (3). BCOP-testimenetelmän mahdolliset puutteet vakavan silmävaurion aiheuttavien kemikaalien tunnistamisessa (YK:n GHS-luokka 1) johtuvat validointitietokannassa havaittujen alkoholien ja ketonien korkeasta väärien positiivisten tulosten määrästä ja kiintoaineiden korkean väärien negatiivisten tulosten määrästä (1) (2) (3). Koska kaikkia alkoholeja ja ketoneja ei kuitenkaan yliennusteta BCOP-testimenetelmässä, ja jotkin tunnistetaan oikein YK:n GHS-luokkaan 1 kuuluviksi, näiden orgaanisten funktionaalisten ryhmien ei katsota olevan testimenetelmän soveltamisalan ulkopuolella. Testimenetelmän käyttäjä voi päättää, onko alkoholien tai ketonien mahdollinen yliedustus hyväksyttävissä vai onko todistusnäytön perusteella tehtävä lisätestejä. Kiintoaineiden väärien negatiivisten tulosten osalta on huomattava, että kiintoaineet voivat aiheuttaa Draizen in vivo -silmä-ärsytystestissä erilaisia vaihtuvia ja äärimmäisiä altistumisolosuhteita, mistä voi aiheutua epäolennaisia johtopäätöksiä niiden todellisesta ärsyttävyydestä (10). On myös syytä huomata, että mikään ICCVAMin validointitietokannassa havaituista vakavan silmävaurion aiheuttavia kemikaaleja (YK:n GHS-luokkaa 1) koskevista vääristä negatiivisista tuloksista (2) (3) ei ollut sellainen, jossa IVIS-arvo olisi ollut ≤ 3, mikä on vaatimus sille, että testikemikaalin luokaksi voidaan määrittää ”ei YK:n GHS-luokitusta”. BCOP-testin väärät negatiiviset tulokset eivät tässä haittaa senkään vuoksi, koska kaikki testikemikaalit, joiden testituloksena on 3 < IVIS ≤ 55 testattaisiin myöhemmin muilla asianmukaisesti validoiduilla in vitro -testeillä tai viimeisenä vaihtoehtona kaneilla sääntömääräisistä vaatimuksista riippuen käyttäen vaiheittaista testausstrategiaa ja todistusnäytön arviointia. Koska jotkin kiinteät kemikaalit tunnistetaan BCOP-testimenetelmässä oikein YK:n GHS-luokkaan 1 kuuluviksi, tämän fysikaalisen olomuodon ei katsota olevan testimenetelmän soveltamisalan ulkopuolella. Tutkijat voisivat kuitenkin harkita tätä testimenetelmää kaikentyyppisille kemikaaleille, jolloin IVIS-arvon > 55 katsottaisiin viittaavan vakavaan silmävaurioon, jolloin kemikaali olisi luokiteltava ilman lisätestausta YK:n GHS-luokkaan 1. Alkoholeilla ja ketoneilla saatuihin positiivisiin tuloksiin olisi kuten sanottu kuitenkin suhtauduttava varovaisesti mahdollisesti yliennustuksen vaaran takia. BCOP-testimenetelmää voi käyttää myös sellaisten kemikaalien tunnistamiseen, jotka eivät vaadi luokitusta silmä-ärsytyksen tai vakavan silmävaurion osalta sellaisena, kuin ne on määritetty YK:n GHS-järjestelmässä (4). Tähän käyttötarkoitukseen käytettynä BCOP-testimenetelmän yleinen tarkkuus on 69 % (135/196), väärien positiivisten tulosten osuus 69 % (61/89) ja väärien negatiivisten tulosten osuus 0 % (0/107) verrattuna kanin silmällä tehdyllä in vivo -testimenetelmällä saatuihin tietoihin luokiteltuna YK:n GHS-luokitusjärjestelmän mukaisesti (3) (ks. lisäys 2, taulukko 2). Väärien negatiivisten tulosten määrä (in vivo -testin kemikaalit, joilla ei YK:n GHS-luokitusta ja joiden IVIS-arvo on >3, ks. 47 kohta) on huomattavan suuri, mutta se ei haittaa tässä, koska kaikki testikemikaalit, joiden testituloksena on 3 < IVIS ≤ 55 testattaisiin myöhemmin muilla asianmukaisesti validoiduilla in vitro -testeillä tai viimeisenä vaihtoehtona kaneilla sääntömääräisistä vaatimuksista riippuen käyttäen vaiheittaista testausstrategiaa ja todistusnäytön arviointia. BCOP-testimenetelmässä ei ole havaittu erityisiä puutteita alkoholien, ketonien ja kiintoaineiden testauksessa, kun tarkoituksena on tunnistaa kemikaalit, jotka eivät vaadi luokitusta silmä-ärsytyksen tai vakavan silmävaurion osalta sellaisena, kuin ne on määritetty YK:n GHS-järjestelmässä (3). Tutkijat voisivat kuitenkin harkita tätä testimenetelmää kaikentyyppisille kemikaaleille, jolloin negatiivisen tuloksen (IVIS ≤ 3) katsottaisiin viittaavan siihen, että kemikaali ei vaadi luokitusta (”ei YK:n GHS-luokitusta”). Koska BCOP-testimenetelmällä voidaan tunnistaa oikein vain 31 % sellaisista kemikaaleista, jotka eivät vaadi luokitusta silmä-ärsytyksen tai vakavan silmävaurion osalta, tämän testimenetelmän ei pitäisi olla ensisijainen menetelmä alhaalta ylös suuntautuvan lähestymistavan ensimmäisenä testinä (5), jos käytettävissä on muita validoituja ja hyväksyttyjä in vitro -menetelmiä, joiden herkkyys on yhtä korkea ja erittelykyky korkeampi. BCOP-validointitietokanta sisälsi yhteensä 113 ainetta ja 100 seosta (2) (3). BCOP-testausmenetelmää pidetään siten sopivana sekä aineiden että seosten testaukseen. BCOP-testimenetelmää ei suositella sellaisten testikemikaalien tunnistamiseen, jotka olisi luokiteltava silmiä ärsyttäväksi (YK:n GHS-luokka 2 tai luokka 2A) tai sellaisten testikemikaalien, jotka olisi luokiteltava lievästi silmiä ärsyttäväksi (YK:n GHS-luokka 2B), koska huomattava määrä YK:n GHS-luokan 1 kemikaaleja luokitellaan liian alhaiseen GHS-luokkaan 2, 2A tai 2B, ja kemikaalit, joille ei ole YK:n GHS-luokitusta, luokitellaan liian korkeaan GHS-luokkaan 2, 2A tai 2B (2),( 3). Tätä varten saattaa olla tarpeen tehdä lisää testejä muilla soveltuvilla menetelmillä. Kaikissa naudan silmiä ja sarveiskalvoja käyttävissä menettelyissä olisi noudatettava testauslaitoksen määräämiä eläinperäisten materiaalien (muun muassa muttei ainoastaan kudosten ja kudosnesteiden) käsittelyä koskevia sääntöjä. Suositellaan yleismaailmallisia laboratorioissa noudatettavia ennaltavarautumiskäytänteitä (11). Vaikka BCOP-testimenetelmässä ei tarkastellakaan sidekalvon ja värikalvon vaurioita, siinä tutkitaan vaikutuksia sarveiskalvoon, jotka ovat YK:n GHS-luokituksen kannalta merkittävin in vivo -tekijä. BCOP-testimenetelmässä ei sinänsä voida arvioida sarveiskalvovaurioiden palautuvuutta. Kaninsilmätutkimusten perusteella on myös ehdotettu, että sarveiskalvovaurion alkusyvyyden avulla voidaan tunnistaa jotkin palautumattomat vaikutukset (12). Tarvitaan kuitenkin lisää tieteellistä tietoa siitä, miten syntyvät ne palautumattomat vaikutukset, jotka eivät liity suureen alkuvaurioon. BCOP-testimenetelmällä ei voida myöskään arvioida sitä, missä määrin silmäaltistukseen voi liittyä systeemistä toksisuutta. Tätä testimenetelmää päivitetään aika ajoin sitä mukaa, kun saadaan uusia tietoja. Esimerkiksi histopatologiset tutkimukset voivat olla hyödyllisiä, jos sarveiskalvon vauriota on luonnehdittava tarkemmin. Kuten OECD:n ohjeasiakirjassa nro 160 (13) esitetään, käyttäjiä kehotetaan säilyttämään sarveiskalvot ja valmistelemaan histopatologisia näytteitä, joiden perusteella voidaan laatia tietokanta ja päätösperusteet, joiden avulla voidaan parantaa tämän testimenetelmän tarkkuutta. Kun laboratorio alkaa käyttää tätä testimenetelmää, sen olisi käytettävä lisäyksessä 3 mainittuja pätevyyden osoittamiseen tarkoitettuja kemikaaleja. Laboratorio voi käyttää näitä kemikaaleja osoittaakseen teknisen pätevyytensä BCOP-testin suorituksessa ennen kuin se toimittaa BCOP-testimenetelmästä saatuja tietoja sääntömääräistä vaaraluokitusta varten. TESTIN PERIAATE BCOP-testimenetelmä on elinmalli, joka mahdollistaa naudan sarveiskalvon tavanomaisten fysiologisten ja biokemiallisten toimintojen lyhytaikaisen ylläpitämisen in vitro -oloissa. Testikemikaalin aiheuttamaa vauriota arvioidaan tässä menetelmässä mittaamalla muutokset sarveiskalvon sameudessa ns. opasitometrillä ja muutokset läpäisevyydessä näkyvää valoa mittaavalla spektrofotometrillä. Molempia mittauksia käytetään IVIS-arvon laskemiseen. IVIS-arvon avulla osoitetaan aineelle in vitro -ärsyttävyyteen perustuva vaaraluokituskategoria, jotta voidaan ennustaa testiaineen in vivo -silmä-ärsytyskyky (ks. päätösperusteet, 48 kohta). BCOP-testimenetelmässä käytetään vasta teurastetuista naudoista saaduista silmistä eristettyjä sarveiskalvoja. Sarveiskalvon sameus mitataan sinä valomääränä, joka kulkee sarveiskalvon läpi. Läpäisevyys mitataan sinä määränä natriumfluoreseiini-väriainetta, joka imeytyy koko sarveiskalvon läpi ja joka mitataan takakammiossa olevassa mediumissa (väliaineessa). Testikemikaalit annostellaan sarveiskalvon epiteelipinnalle lisäämällä sitä sarveiskalvotelineen etukammioon. Lisäyksessä 4 on kuvaus ja kaavio BCOP-testimenetelmässä käytetystä sarveiskalvotelineestä. Sarveiskalvotelineitä saa kaupallisesti eri lähteistä, tai ne voi rakentaa itse. Naudan silmien lähde ja eläinten ikä sekä eläinlajin valinta Teurastamoihin tuodut nautaeläimet teurastetaan useimmiten käytettäväksi ihmisravinnoksi tai muihin kaupallisiin tarkoituksiin. BCOP-testimenetelmään voidaan käyttää vain sarveiskalvoja, jotka on saatu terveistä, ihmisravinnoksi kelpaavista eläimistä. Koska nautaeläinten paino vaihtelee paljon riippuen rodusta, iästä ja sukupuolesta, ei anneta mitään suositusta siitä, minkä painoisia eläinten olisi oltava teurastushetkellä. Sarveiskalvojen mitat voivat vaihdella käytettäessä eri ikäisistä eläimistä saatuja silmiä. Yli kahdeksan vuoden ikäisistä eläimistä saatujen sarveiskalvojen halkaisija vaakasuunnassa on yleensä >30,5 mm ja sarveiskalvon keskiosan paksuus (CCT) ≥ 1100 μm, kun taas alle viiden vuoden ikäisten sarveiskalvon halkaisija on 28,5 mm ja CCT < 900 μm (14). Tästä syystä ei yleensä käytetä silmiä, jotka on saatu yli 60 kuukauden ikäisistä eläimistä. Perinteisesti ei ole käytetty alle 12 kuukauden ikäisten nautojen silmiä, koska silmien kehitys on vielä kesken ja sarveiskalvo on huomattavasti ohuempi ja sen halkaisija pienempi kuin täysikasvuisten eläinten sarveiskalvon. Nuorista eläimistä (eli 6–12 kuukautta vanhoista) saatuja sarveiskalvoja voidaan käyttää, koska siihen liittyy joitakin etuja. Niitä saa helpommin, ikävaihtelu on pienempi, ja vaara työntekijöiden altistumisesta naudan spongiformiselle enkefalopatialle on pienempi (15). Koska olisi hyödyllistä arvioida lisää sarveiskalvon koon tai paksuuden vaikutusta sarveiskalvon reagoimiseen syövyttäviin ja ärsyttäviin kemikaaleihin, käyttäjiä kehotetaan raportoimaan niiden eläinten arvioitu ikä ja/tai paino, joista tutkimuksessa käytetyt sarveiskalvot on saatu. Silmien kerääminen ja niiden kuljetus laboratorioon Teurastamon henkilökunta kerää silmät. Silmien mekaanisten ja muiden vaurioiden ehkäisemiseksi silmät olisi poistettava silmästä mahdollisimman pian kuoleman jälkeen, ja ne olisi pantava jäähdytykseen heti silmämunasta poistamisen jälkeen ja kuljetuksen ajaksi. Jotta silmät eivät altistuisi mahdollisesti ärsyttäville kemikaaleille, teurastamon työntekijät eivät saisi käyttää detergenttejä huuhtoessaan eläimen päätä. Silmät olisi upotettava kokonaan jäähdytettyyn Hanksin suolaliuokseen (Hanks' Balanced Salt Solution, HBSS) sopivankokoisessa astiassa ja kuljetettava laboratorioon sellaisella tavalla, että bakteerikontaminaatio tai muut vauriot ovat mahdollisimman pieniä. Koska silmät kerätään teurastuksen yhteydessä, niihin saattaa roiskua verta ja muita biologisia aineita, kuten bakteereja ja muita pieneliöitä. Siksi on tärkeää varmistaa, että kontaminaatioriski on mahdollisimman pieni. Esimerkiksi astia, jossa silmät ovat, on pidettävä jäähauteessa, ja kuljetusta varten käytettävään HBSS:ään on lisättävä antibiootteja (esim. penisilliiniä 100 IU/ml ja streptomysiiniä 100 μg/mL]). Silmien keräämisen ja BCOP-testin tekemisen välisen ajan pitäisi olla mahdollisimman lyhyt (keräys ja käyttö mieluiten samana päivänä), ja pitäisi osoittaa, etteivät määritystulokset ole sen takia epäluotettavia. Nämä tulokset perustuvat silmien valintaperusteisiin sekä positiivisten ja negatiivisten kontrollinäytteiden vasteisiin. Kaikkien määrityksessä käytettyjen silmien olisi oltava peräisin samasta tiettynä päivänä kerätystä silmäryhmästä. BCOP-testissä käytettävien silmien valintaperusteet Heti kun silmät saapuvat laboratorioon, tutkitaan huolellisesti, onko niissä vikoja, kuten lisääntynyttä sameutta, naarmuja ja verisuonittumista. Testissä saa käyttää vain sellaisista silmistä saatuja sarveiskalvoja, joissa ei ole tällaisia vikoja. Kaikkien sarveiskalvojen laatua arvioidaan myös määrityksen myöhemmissä vaiheissa. Sarveiskalvot, joiden sameus on tunnin tasapainottumisajan jälkeen yli seitsemän sameusyksikköä tai opasitometrin ja sarveiskalvotelineen vastaavaa yksikköä, on hylättävä (HUOMAUTUS: opasitometri olisi kalibroitava sameusyksikköjen määrittelemiseen käytettävien sameusstandardien mukaisesti, ks. lisäys 4). Kussakin käsittelyryhmässä (testikemikaali, samaan aikaan tehtävät negatiiviset ja positiiviset kontrollit) on oltava vähintään kolme silmää. BCOP-testauksessa pitäisi negatiiviseen kontrolliin käyttää kolme sarveiskalvoa. Koska kaikki sarveiskalvot leikataan kokonaisesta silmämunasta ja asetetaan sarveiskalvokammioihin, voi käsittelystä aiheutua vahinkoa, joka vaikuttaa yksittäisen sarveiskalvon sameuteen ja läpäisevyyteen (myös negatiivisessa kontrollissa). Negatiivisista kontrollisarveiskalvoista saatuja sameus- ja läpäisevyysarvoja käytetään lisäksi IVIS-laskelmissa korjaamaan testikemikaalilla käsiteltyjen ja positiivisella kontrollilla käsiteltyjen sarveiskalvojen sameus- ja läpäisevyysarvoja. MENETTELY Silmien valmistelu Virheettömät sarveiskalvot leikataan siten, että niihin jää 2–3 mm:n reuna kovakalvoa, mikä helpottaa myöhempää käsittelyä. Varotaan vahingoittamasta sarveiskalvon epiteeliä ja endoteeliä. Eristetyt sarveiskalvot asetetaan erikoistelineisiin, joissa on etu- ja takaosasto. Nämä ovat kosketuksissa sarveiskalvon epiteelipuoleen (etukammio) ja endoteelipuoleen (takakammio). Molemmat kammiot täytetään ylimäärin esilämmitetyllä Eaglen Minimum Essential Medium (EMEM) -viljelynesteellä (mediumilla), jossa ei ole fenolipunaa (takakammio ensin) ja varmistetaan, ettei muodostu kuplia. Laitteen annetaan tasapainottua 32 ± 1 celsiusasteessa vähintään tunnin, jotta sarveiskalvot tasapainottuvat mediumin kanssa ja niiden metabolinen toiminta palautuu normaaliksi (mikäli mahdollista). Sarveiskalvon pinnan lämpötila in vivo on noin 32 °C. Tasapainottumisjakson jälkeen molempiin kammioihin lisätään tuoretta esilämmitettyä EMEM:iä, jossa ei ole fenolipunaa, ja kustakin sarveiskalvosta otetaan sameuden perustasolukema. Sarveiskalvot, joissa ilmenee makroskooppista kudosvauriota (kuten naarmuja, pigmentaatiota tai verisuonittumista) tai joiden sameus on yli seitsemän sameusyksikköä tai opasitometrin ja sarveiskalvotelineen vastaavaa yksikköä, on hylättävä. Negatiiviseksi kontrolliryhmäksi (tai liuotinkontrolliryhmäksi) valitaan vähintään kolme sarveiskalvoa. Muut sarveiskalvot jaetaan käsittelyryhmään ja positiivisen kontrollin ryhmään. Koska veden lämpökapasiteetti on suurempi kuin ilman, vedellä saadaan tasaisempi inkubaatiolämpötila. Siksi suositellaan vesihauteen käyttöä sarveiskalvotelineen ja sen sisällön pitämiseksi 32 ± 1 celsiusasteessa. Kuitenkin myös ilmainkubaattoreita voidaan käyttää, kunhan huolehditaan siihen, että lämpötila pysyy vakaana (esimerkiksi esilämmittämällä telineet ja mediumit). Testikemikaalin annostelu Käsittelyä varten on kaksi eri protokollaa, toinen nesteille ja pinta-aktiivisille aineille (kiinteät tai nestemäiset) ja toinen kiinteille aineille, jotka eivät ole pinta-aktiivisia. Nesteet testataan laimentamattomina. Puoliksi kiinteät aineet, voiteet ja vahat testataan tavallisesti kuten nesteet. Pinta-aktiiviset aineet testataan 10-prosenttisena liuoksena (w/v) 0,9-prosenttisessa natriumkloridiliuoksessa, tislatussa vedessä tai muussa liuottimessa, josta on osoitettu, ettei se häiritse testijärjestelmää. Jos laimennuksia muutetaan, on ne perusteltava. Pinta-aktiivisia aineita sisältävät teokset voidaan testata laimentamattomina tai sopivaksi pitoisuudeksi laimennettuna riippuen kysymykseen tulevasta in vivo -altistusskenaariosta. Jos pitoisuuksia muutetaan, on ne perusteltava. Sarveiskalvot altistetaan nesteille ja pinta-aktiivisille aineille 10 minuutin ajan. Jos altistusaikaa muutetaan, olisi se perusteltava tieteellisesti. Lisäyksessä 1 on pinta-aktiivisen aineen ja pinta-aktiivista ainetta sisältävän seoksen määritelmät. Kiinteät aineet, jotka eivät ole pinta-aktiivisia, testataan tavallisesti 20-prosenttisena liuoksena (w/v) tai suspensiona 0,9-prosenttisessa natriumkloridiliuoksessa, tislatussa vedessä tai muussa liuottimessa, josta on osoitettu, ettei se häiritse testijärjestelmää. Joissakin olosuhteissa ja asianmukaisesti tieteellisesti perusteltuna kiinteitä aineita voidaan testata myös sellaisenaan annostelemalla niitä suoraan sarveiskalvon pinnalle avoimen kammion menetelmässä (ks. 32 kohta). Sarveiskalvot altistetaan kiinteille aineille neljän tunnin ajan. Kuten nesteiden ja pinta-aktiivisten aineiden tapauksessa, altistusajan muuttaminen on perusteltava tieteellisesti. Käsittely voi olla erilaista riippuen testattavan aineen fysikaalisista ja kemiallisista ominaisuuksista, esimerkiksi siitä, onko kyseessä kiinteä aine, neste, viskoosi tai ei-viskoosi neste. Tärkeintä on varmistaa, että testikemikaali peittää riittävästi epiteelin pinnan ja että se voidaan huuhtelemalla poistaa riittävästi. Suljetun kammion menetelmää käytetään tavallisesti testattaville nestemäisille kemikaaleille, jotka vaihtelevat ei-viskoosista lievästi viskoosiin, kun taas avoimen kammion menetelmää käytetään tavallisesti puoliksi viskooseille ja viskooseille nestemäisille testikemikaaleille ja kiinteille aineille. Suljetun kammion menetelmässä annostellaan etukammioon niin paljon testikemikaalia (750 μl), että se peittää sarveiskalvon epiteelipuolen. Annostelu tapahtuu kammion yläosassa olevien aukkojen kautta. Aukot suljetaan sitten tulpilla altistuksen ajaksi. On tärkeää varmistaa, että kukin sarveiskalvo altistetaan testiaineelle niin pitkäksi aikaa kuin on asianmukaista. Avoimen kammion menetelmässä ikkunan lukitusrengas ja etukammion lasi-ikkuna poistetaan ennen käsittelyä. Kontrollia tai testikemikaalia (750 μl tai niin paljon, että testikemikaali peittää sarveiskalvon kokonaan) annostellaan suoraan sarveiskalvon epiteelipinnalle mikropipetillä. Jos testikemikaalia on vaikea annostella pipetillä, annostelua voidaan helpottaa siirtämällä testikemikaali positive displacement -pipettiin paineen avulla. Positive displacement -pipetin kärki työnnetään ruiskun annostelukärkeen niin, että aine voidaan siirtää displacement-pipetin kärkeen paineen avulla. Ruiskun mäntää painetaan samalla kun pipetin mäntää vedetään ylöspäin. Jos pipetin kärkeen ilmestyy ilmakuplia, testiaine puhalletaan ulos ja prosessi toistetaan, kunnes kärki saadaan täytettyä ilman ilmakuplia. Jos on tarpeen, voidaan käyttää tavallista ruiskua (ilman neulaa), koska sillä voidaan mitata tarkka tilavuus testikemikaalia, ja annostelu sarveiskalvon epiteelipinnalle on helpompaa. Annostelun jälkeen lasi-ikkuna pannaan paikalleen etukammion päälle, jotta järjestelmä on jälleen suljettu. Inkubointi altistuksen jälkeen Altistusajan jälkeen testikemikaali, negatiivinen kontrollikemikaali tai positiivinen kontrollikemikaali poistetaan etukammiosta ja epiteeli pestään vähintään kolmesti (tai kunnes testikemikaalia ei näy) EMEM:illä (jossa on fenolipunaa). Huuhteluun käytetään fenolipunaa sisältävää mediumia, koska fenolipunan värin vaihtumista voidaan seurata, kun halutaan määrittää happamien tai emäksisten testikemikaalien huuhtelun tehokkuus. Sarveiskalvoja pestään enemmän kuin kolme kertaa, jos fenolipuna on edelleen vääränvärinen (keltainen tai purppuranvärinen) tai jos testikemikaalia on vielä näkyvillä. Kun mediumissa ei ole enää testikemikaalia, sarveiskalvot pestään vielä kerran EMEM:illä (jossa ei ole fenolipunaa). EMEM-huuhtelua (ilman fenolipunaa) käytetään viimeiseksi sen varmistamiseksi, että fenolipuna on poistunut etukammiosta ennen sameusmittausta. Etukammio täytetään sitten uudelleen tuoreella EMEM:illä (ilman fenolipunaa). Kun testikemikaali on neste tai pinta-aktiivinen aine, sarveiskalvoja inkuboidaan huuhtelun jälkeen vielä kaksi tuntia 32 ± 1 celsiusasteessa. Tietyissä olosuhteissa voi pitempi aika altistuksen jälkeen olla hyödyksi. Sitä voidaan harkita tapauskohtaisesti. Kiinteillä aineilla käsitellyt sarveiskalvot huuhdellaan perusteellisesti neljän tunnin altistuksen päätteeksi, mutta niitä ei tarvitse enää inkuboida enempää. Kunkin sarveiskalvon sameus ja läpäisevyys kirjataan nesteille ja pinta-aktiivisille aineille altistuksen jälkeisen inkubaation jälkeen ja kiinteille aineille, jotka eivät ole pinta-aktiivisia aineita, neljän tunnin altistuksen jälkeen. Kutakin sarveiskalvoa tarkastellaan myös silmämääräisesti ja kirjataan merkitykselliset havainnot (esimerkiksi kudoksen kuoriutuminen, testikemikaalin jäämät, epätasainen sameusjakauma). Tällaiset havainnot voivat olla tärkeitä, sillä ne voivat näkyä opasitometrin lukemien vaihteluna. Kontrollikemikaalit Kussakin kokeessa on mukana samanaikaisesti määritettävät negatiiviset eli liuotin/kantaja-ainekontrollit ja positiiviset kontrollit. Kun testataan 100-prosenttista nestemäistä ainetta, otetaan BCOP-määritykseen samanaikaisesti määritettävä negatiivinen kontrolli (esimerkiksi 0,9-prosenttinen natriumkloridiliuos tai tislattu vesi) sitä varten, että epäspesifiset muutokset testijärjestelmässä voidaan havaita ja määrityksen päätepisteille saadaan perustaso. Näin varmistetaan myös, etteivät määritysolosuhteet aiheuta ärsytysvastetta tahattomasti. Kun testataan laimennettua nestettä, pinta-aktiivista ainetta tai kiinteää ainetta, otetaan BCOP-määritykseen samanaikaisesti määritettävä liuotin/kantaja-ainekontrolliryhmä sitä varten, että epäspesifiset muutokset testijärjestelmässä voidaan havaita ja määrityksen päätepisteille saadaan perustaso. Liuotinta/kantaja-ainetta saa käyttää vain, jos on osoitettu, ettei se häiritse testijärjestelmää. Kuhunkin kokeeseen otetaan mukaan positiivisena kontrollina kemikaali, jonka tiedetään aiheuttavan positiivisen vasteen, jotta voidaan varmistaa testijärjestelmän vahingoittumattomuus ja sen moitteeton toiminta. Ärsytysvaste ei kuitenkaan saisi olla liian voimakas, jotta positiivisen kontrollivasteen vaihtelu ajan funktiona voidaan määrittää. Esimerkkejä nestemäisten testikemikaalien positiivisista kontrolleista ovat 100-prosenttinen etanoli tai 100-prosenttinen dimetyyliformamidi. Esimerkki kiinteiden testikemikaalien positiivisesta kontrollista on 20-prosenttisena liuoksena (w/v) oleva imitsadoli 0,9-prosenttisessa natriumkloridiliuoksessa. Vertailukemikaalit ovat hyödyllisiä, kun arvioidaan tiettyyn kemikaali- tai tuoteryhmään kuuluvien tuntemattomien kemikaalien silmä-ärsytyskykyä tai silmää ärsyttävän aineen suhteellista ärsytyskykyä tietyllä ärsytysvastealueella. Mitatut päätepisteet Sarveiskalvon sameus mitataan sinä valomääränä, joka kulkee sarveiskalvon läpi. Sarveiskalvon sameus mitataan kvantitatiivisesti opasitometrillä, jolla saadaan jatkuvalla asteikolla mitattuja sameusarvoja. Läpäisevyys mitataan sinä määränä natriumfluoreseiini-väriainetta, joka imeytyy kaikkien sarveiskalvon solukerrosten (ts. sarveiskalvon ulkopinnan epiteelin ja sisäpinnan endoteelin) läpi. 1 ml natriumfluoreseiiniliuosta (4 mg/ml testattaessa nesteitä tai pinta-aktiivisia aineita tai 5 mg/ml testattaessa kiinteitä aineita, jotka eivät ole pinta-aktiivisia) lisätään sarveiskalvotelineen etukammioon, joka on kosketuksissa sarveiskalvon epiteelipuolen kanssa. Takakammiossa, joka on kosketuksissa sarveiskalvon endoteelipuolen kanssa, on tuoretta EMEM:iä. Telinettä inkuboidaan vaakasuorassa 90 ± 5 min 32 ± 1 celsiusasteessa. Takakammioon siirtyvän natriumfluoreseiinin määrä mitataan UV/VIS-spektrofotometrillä. 490 nanometrin aallonpituudella mitatut spektrofotometrin lukemat kirjataan optisena tiheytenä (OD490) tai absorbanssiarvoina, jotka mitataan jatkuvalla asteikolla. Fluoreseiiniläpäisevyysarvot määritetään käyttäen OD490-arvoja, jotka on mitattu spektrofotometrillä tavanomaisella 1 senttimetrin valotiellä. Vaihtoehtoisesti voidaan käyttää 96 kuopan kuoppalevyjen lukulaitetta, jos i) laitteen fluoreseiinin OD490 -arvojen mittausalue on lineaarinen; ja ii) 96 kuopan levyissä käytetään sellaista fluoreseiininäytteiden tilavuutta, jolla saadaan 1 cm:n valotiellä saatuja arvoja vastaavat OD490 -arvot (tämä saattaa edellyttää, että kuoppa täytetään kokonaan [tavallisesti 360 μl). TIEDOT JA RAPORTOINTI Tietojen arviointi Kun sameusarvot ja keskimääräiset läpäisevyysarvot (OD490) on korjattu taustan sameuden ja negatiivisen kontrollin läpäisevyyden OD490-arvojen suhteen, yhdistetään kunkin käsittelyryhmän sameuden keskiarvot ja läpäisevyyden keskimääräiset OD490-arvot kokemusperäiseen kaavaan, josta lasketaan kullekin käsittelyryhmälle in vitro -ärsytysaste (IVIS) seuraavasti: IVIS = sameuden keskiarvo + (15 × keskimääräinen läpäisevyyden OD490-arvo) Sina et al. (16) ovat raportoineet, että tämä kaava on johdettu heidän laboratoriossaan ja laboratorioidenvälisissä tutkimuksissa. Monilaboratoriotutkimuksessa 36 yhdisteen sarjalle saaduille tuloksille tehtiin monimuuttuja-analyysi, jossa määritettiin paras yhtälö in vivo ja in vitro saatujen tuloksien välille. Kahden eri yhtiön tutkijat toistivat analyysin ja saivat lähes samat yhtälöt. Sameus- ja läpäisevyysarvoja olisi arvioitava myös erikseen, jotta nähdään, aiheuttaako testikemikaali syövytystä tai vakavaa ärsytystä vain yhden päätepisteen määrityksessä (ks. päätösperusteet). Päätösperusteet Seuraavassa on esitetty IVIS-raja-arvot, joiden avulla voidaan tunnistaa sellaiset kemikaalit, jotka aiheuttavat vakavia silmävaurioita (YK:n GHS-luokka 1), sekä kemikaalit, jotka eivät vaadi luokitusta silmä-ärsytyksen tai vakavan silmävaurion osalta (kemikaalit, joilla ei ole YK:n GHS-luokitusta):
Tutkimuksen hyväksymisperusteet Testiä pidetään hyväksyttävänä, jos positiivisella kontrollilla saadaan IVIS-arvo, joka on kahden standardipoikkeaman sisällä senhetkisestä pitkän aikavälin keskiarvosta, joka on päivitettävä vähintään kolmen kuukauden välein tai joka kerta kun sellaisissa laboratorioissa, joissa testejä tehdään vain harvoin (eli vähemmän kuin kerran kuussa) saadaan hyväksytty testi. Negatiivisista tai liuotin/kantaja-ainevasteista saatujen sameus- ja läpäisevyysarvojen pitäisi olla pienemmät kuin vahvistetut sameuden ja läpäisevyyden taustaraja-arvot naudan sarveiskalvolle, jota on käsitelty negatiivisilla tai liuotin/kantaja-ainekontrolleilla. Kun testikemikaalin luokittelu on yksiselitteinen, se voidaan testata yhdessä vähintään kolme sarveiskalvoa käsittävässä testiajossa. Jos ensimmäisen testiajon tulokset ovat moniselitteisiä, on harkittava toista testiajoa (se ei kuitenkaan ole välttämätöntä) ja kolmatta, jos ensimmäisen ja toisen testiajon keskimääräiset IVIS-tulokset ovat ristiriitaisia. Ensimmäisen testiajon tuloksia pidetään moniselitteisinä, jos kolmen sarveiskalvon ennusteet ovat ristiriitaisia, kuten
Testiraportti Testiraportissa olisi annettava seuraavat tiedot, jos ne ovat merkityksellisiä tutkimuksen suorittamiselle:
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT Aine : Alkuaineet ja niiden yhdisteet sellaisina kuin ne esiintyvät luonnossa tai tuotantomenetelmin valmistettuina, jotka sisältävät kaikki pysyvyyden säilyttämiseksi tarvittavat lisäaineet ja tuotantotoiminnassa muodostuvat epäpuhtaudet lukuun ottamatta liuottimia, jotka voidaan erottaa vaikuttamatta aineen pysyvyyteen tai muuttamatta sen koostumusta (4). Ei luokiteltu : Kemikaalit, joita ei ole luokiteltu silmä-ärsytyksen (YK:n GHS-luokka 2, 2A tai 2B) tai vakavan silmävaurion (YK:n GHS-luokka 1) osalta. Sama kuin ”Ei YK:n GHS-luokitusta”. Ei YK:n GHS-luokitusta : Kemikaalit, joita ei voida luokitella YK:n GHS-järjestelmän luokan 1 tai 2 (2A tai 2B) kemikaaleiksi. Sama kuin ”Ei luokiteltu”. In vitro ärsytysarvo (In vitro Irritancy Score, IVIS) : BCOP-testimenetelmässä käytetty empiirisesti johdettu kaava, jossa kunkin käsittelyryhmän sameuden keskiarvot ja läpäisevyyden keskiarvot yhdistetään yhteen in vitro -arvoon. IVIS = sameuden keskiarvo + (15 × keskimääräinen läpäisevyysarvo) Jäsentävä lähestymistapa : Vaiheittainen lähestymistapa, jota käytetään oletettaessa, että kemikaali aiheuttaa vakavia silmävaurioita. Se aloitetaan määrittämällä vakavia silmävaurioita aiheuttavat kemikaalit (positiivinen tulos) ja muut kemikaalit (negatiivinen tulos). Kemikaali : Aine tai aineiden seos. Kokoava lähestymistapa : Vaiheittainen lähestymistapa, jota käytetään oletettaessa, että kemikaalia ei tarvitse luokitella silmä-ärsytyksen tai vakavien silmävaurioiden osalta. Se aloitetaan määrittämällä kemikaalit, joita ei tarvitse luokitella (negatiivinen tulos) ja muut kemikaalit (positiivinen tulos). Korjautuvat vaikutukset silmiin : Ks. ”Silmä-ärsytys”. Liuotin/kantaja-ainekontrolli : Käsittelemätön näyte, jossa on kaikki testijärjestelmän osat, mukaan luettuina liuotin tai kantaja-aine, ja joka prosessoidaan testikemikaalilla käsiteltyjen ja muiden kontrollinäytteiden kanssa perusvastetason määrittämiseksi näytteille, joissa testikemikaali on liuotettu samaan liuottimeen tai kantaja-aineeseen. Kun tällainen näyte testataan samanaikaisesti negatiivisen kontrollin kanssa, se osoittaa myös, reagoiko liuotin tai kantaja-aine testijärjestelmän kanssa. Luotettavuus : Laajuus, jolla testimenetelmä on toistettavissa samassa laboratoriossa tai eri laboratorioissa pidemmällä aikavälillä käytettäessä samaa menettelyä. Arvo määritetään laskemalla laboratorionsisäinen ja laboratorioidenvälinen uusittavuus ja laboratorionsisäinen toistettavuus. Negatiivinen kontrolli : Käsittelemätön näyte, jossa on kaikki testijärjestelmän osat. Negatiivinen kontrolli prosessoidaan testikemikaalilla käsiteltyjen näytteiden ja muiden kontrollinäytteiden kanssa, jotta voidaan määrittää, reagoiko liuotin testijärjestelmän kanssa. Opasitometri : Laite, jolla mitataan sarveiskalvon sameutta arvioimalla kvantitatiivisesti valon kulkeminen sarveiskalvon läpi. Opasitometrissä on tyypillisesti kaksi osastoa, joista kussakin on oma valonlähde ja valokenno. Toista osastoa käytetään käsitellylle sarveiskalvolle ja toista laitteen kalibrointiin ja nollaamiseen. Halogeenilampun valoa lähetetään kontrolliosaston läpi (tyhjä kammio, jossa ei ole ikkunaa eikä nestettä) valokennoon ja verrataan valoon, joka on lähetetty näytteelle käytetyn osaston (jossa on sarveiskalvon sisältävä kammio) läpi valokennoon. Valokennoista saadun valon transmissioita verrataan, ja numeronäytöllä näytetään numeerinen sameuden arvo. Pinta-aktiivinen aine : Aine, esimerkiksi detergentti, joka voi vähentää nesteen pintajännitettä ja saada sen siten vaahtoamaan tai läpäisemään kiinteitä aineita; tunnetaan myös vettymistä edistävänä aineena. Pinta-aktiivista ainetta sisältävä seos : Tämän testimenetelmän yhteydessä seos, joka sisältää yhden tai useamman pinta-aktiivisen aineen, jonka lopullinen pitoisuus on > 5 %. Positiivinen kontrolli : Näyte, jossa on kaikki testijärjestelmän osat ja joka on käsitelty kemikaalilla, jonka tiedetään aiheuttavan positiivisen vasteen. Positiivinen vaste ei kuitenkaan saisi olla liian voimakas, jotta positiivisen kontrollivasteen vaihtelu ajan funktiona voidaan arvioida. Pysyvät vaikutukset silmiin : Ks. ”Vakava silmävaurio”. Sarveiskalvo : Silmämunan etuosan läpinäkyvä osa, joka peittää värikalvon ja silmäterän ja päästää valoa sisäosiin. Sarveiskalvon läpäisevyys : Sarveiskalvon epiteelin vaurion mitta, jota varten määritetään kaikkien sarveiskalvon solukerrosten läpi menneen fluoreseiini-väriaineen määrä. Sarveiskalvon sameus : Sarveiskalvon sameuden mitta, kun sarveiskalvo on altistettu testikemikaalille. Sarveiskalvon sameuden lisääntyminen merkitsee sarveiskalvon vauriota. Sameus voidaan arvioida subjektiivisesti Draizen kaninsilmätestillä tai objektiivisesti jollain laitteella, kuten ”opasitometrillä”. Seos : Seos tai liuos, joka koostuu kahdesta tai useammasta aineesta, jotka eivät reagoi keskenään (4). Silmä-ärsytys : Silmän muutokset, jotka syntyvät, kun testikemikaalia on annosteltu silmän etupinnalle, ja korjautuvat täysin 21 päivän kuluessa annostelusta. Sama kuin ”Korjautuvat vaikutukset silmiin” ja ”YK:n GHS-luokka 2” (4). Tarkkuus : Testimenetelmän tulosten ja hyväksyttyjen vertailuarvojen välinen ero. Se on testimenetelmän suorituskyvyn mitta ja yksi merkityksellisyyden osa-alueista. Tarkkuutta ja vastaavuutta käytetään usein toisiaan korvaavasti tarkoittamaan testimenetelmällä saatujen oikeiden tulosten osuutta. Testikemikaali : Aine tai seos, jota testataan tällä testimenetelmällä. Todistusnäyttö : Prosessi, jossa tarkastellaan erilaisten tietojen vahvuuksia ja heikkouksia, kun niiden avulla on tarkoitus päättää testikemikaalin vaarallisuutta koskevasta päätelmästä tai kun tietojen on määrä tukea kyseistä päätelmää. Vaara : Vaikuttavan tekijän (’agentin’) tai tilanteen sisäinen ominaisuus, jolla on kyky aiheuttaa haitallisia vaikutuksia, kun organismi, järjestelmä tai (ala)populaatio altistuu kyseiselle aineelle. Vaiheittainen testausstrategia : Vaiheittainen testausstrategia, jossa kaikkia testikemikaalia koskevia olemassa olevia tietoja tarkastellaan tietyssä järjestyksessä käyttäen todistusnäyttöprosessia kussakin vaiheessa sen määrittämiseksi, onko käytettävissä riittävästi tietoja vaaraluokituspäätöstä varten, ennen kuin siirrytään seuraavaan vaiheeseen. Jos testikemikaalin ärsytyskyky voidaan määrittää olemassa olevien tietojen perusteella, ei lisätestausta tarvita. Jos testikemikaalin ärsytyskykyä ei voida määrittää olemassa olevien tietojen perusteella, toteutetaan vaiheittainen testaus eläimillä, kunnes luokitus voidaan määritellä aukottomasti. Vakava silmävaurio : Silmän kudosvaurio tai vakava fyysinen näön rappeutuminen, joka on seurausta testikemikaalin annostelusta silmän etupinnalle eikä korjaudu täysin 21 päivän kuluessa annostelusta. Sama kuin ”Pysyvät vaikutukset silmiin” ja ”YK:n GHS-luokka 1” (4). Validoitu testimenetelmä : Testimenetelmä, jolle on tehty validointitutkimukset sen merkityksellisyyden (myös tarkkuuden) ja luotettavuuden määrittämiseksi tiettyä tarkoitusta varten. On tärkeää huomata, että validoitu testi ei ehkä ole riittävän tarkka ja luotettava, jotta se voitaisiin hyväksyä ehdotettuun tarkoitukseen. Vertailukemikaali : Kemikaali, johon testikemikaalia verrataan. Vertailuaineella olisi oltava seuraavat ominaisuudet: i) se saadaan vakaana pysyvästä ja luotettavasta lähteestä; ii) sen rakenne ja toiminta ovat samankaltaisia testattavan aineryhmän kanssa; iii) sen fysikaalis-kemialliset ominaisuudet tunnetaan; iv) se tukee tunnetuista vaikutuksista saatuja tietoja, ja v) sen vaikutuskyky halutun vasteen vaihtelualueella tunnetaan. Väärien negatiivisten tulosten osuus : Niiden positiivisten kemikaalien osuus, jotka testimenetelmä yksilöi virheellisesti negatiivisiksi. Väärien negatiivisten tulosten osuus on eräs testimenetelmän suorituskyvyn indikaattori. Väärien positiivisten tulosten osuus : Kaikkien negatiivisten kemikaalien osuus, jotka testimenetelmä yksilöi virheellisesti positiivisiksi. Väärien positiivisten tulosten osuus on eräs testimenetelmän suorituskyvyn indikaattori. YK:n GHS-luokka 1 : Ks. ”Vakava silmävaurio”. YK:n GHS-luokka 2 : Ks. ”Silmä-ärsytys”. YK:n kemikaalien maailmanlaajuisesti yhdenmukaistettu luokitus- ja merkintäjärjestelmä (United Nations Globally Harmonized System of Classification and Labelling of Chemicals, UN GHS) : Tässä järjestelmässä kemikaalit (aineet ja seokset) luokitellaan vakioitujen fysikaalisten sekä terveys- ja ympäristövaarojen tyyppien ja -tasojen mukaisesti, ja niille osoitetaan vaaraviestinnän tunnukset, kuten kuvamerkit, huomiosanat, vaaralausekkeet, turvalausekkeet ja turvatiedotteet, jotta voidaan välittää tietoa kemikaalien haittavaikutuksista ihmisten ja ympäristön suojelemiseksi (esimerkiksi työnantajille, työntekijöille, kuljetushenkilökunnalle, kuluttajille ja pelastushenkilöstölle) (4). Lisäys 2 BCOP-TESTIMENETELMÄN ENNUSTAMISKYKY Taulukko 1 BCOP-menetelmän ennustamiskyky vakavan silmävaurion aiheuttavien kemikaalien tunnistamisessa [YK:n GHS-luokka / EU:n CLP-asetuksen luokka 1 vs Ei-luokiteltu 1 (luokka 2 + ei luokiteltu); US EPA -luokka I vs Ei-luokiteltu I (luokka II + luokka III + luokka IV)]
Taulukko 2 BCOP-menetelmän ennustamiskyky sellaisten kemikaalien tunnistamisessa, jotka eivät vaadi luokitusta silmä-ärsytyksen tai vakavan silmävaurion osalta (”ei-ärsyttävät”) [YK:n GHS-luokka / EU:n CLP-asetuksen luokka Ei-luokiteltu vs Ei ei-luokiteltu (luokka 1 + luokka 2); US EPA -luokka IV vs Ei luokiteltu IV (luokka I + luokka II + luokka III)]
Lisäys 3 PÄTEVYYDEN OSOITTAMISEEN TARKOITETUT KEMIKAALIT BCOP-TESTIMENETELMÄLLE Ennen kuin laboratorio alkaa käyttää tähän testimenetelmään perustuvaa menetelmää rutiininomaisesti, sen olisi osoitettava teknisen pätevyytensä määrittämällä oikein taulukossa 1 suositeltujen 13 kemikaalin silmävaarallisuusluokitus. Kemikaalit valittiin sen mukaan, että ne edustavat erilaisia vasteita silmävaaroihin perustuen tuloksiin, jotka on saatu kanin silmällä tehdyllä in vivo -testillä (TG 405) (17) ja YK:n GHS-luokitusjärjestelmää (eli luokkia 1, 2A, 2B tai ei luokiteltu) (4). Muita valintaperusteita olivat kemikaalien kaupallinen saatavuus, korkealaatuisten in vivo -tutkimustulosten saatavuus ja BCOP-testimenetelmällä saatujen korkealaatuisten in vitro -tulosten saatavuus. Tutkimustulokset ovat nähtävissä asiakirjoista Streamlined Summary Document (3) ja in the ICCVAM Background Review Document for the BCOP test method (2) (18). Taulukko 1 Teknisen pätevyyden osoittamiseen tarkoitetut suositellut kemikaalit BCOP-testimenetelmälle
Lisäys 4 BCOP-TESTISSÄ KÄYTETTY SARVEISKALVOTELINE BCOP-testissä käytetyt sarveiskalvotelineet valmistetaan reagoimattomasta aineesta (esimerkiksi polypropyleenistä). Telineissä on kaksi puolta (etu- ja takakammio) ja kaksi samanlaista lieriönmuotoista sisäkammiota. Kukin kammio on suunniteltu sellaiseksi, että siihen mahtuu noin 5 ml; kammion päässä on lasi-ikkuna, josta sameusmittaukset kirjataan. Kunkin sisäkammion halkaisija on 1,7 cm ja syvyys 2,2 cm (11). Takakammiossa on tiivisterengas vuotojen estämiseksi. Sarveiskalvo asetetaan endoteelipuoli alaspäin takakammion tiivisterenkaan päälle, ja etukammio asetetaan sarveiskalvon epiteelipuolen päälle. Kammiot kiinnitetään paikoilleen kolmella ruostumattomasta teräksestä valmistetulla ruuvilla, jotka sijaitsevat kammion ulkoreunoilla. Kunkin kammion päässä on lasi-ikkuna, joka voidaan poistaa, että sarveiskalvoon päästään helposti käsiksi. Lasi-ikkunan ja kammion välissä on tiivisterengas vuotojen estämiseksi. Medium ja testikemikaalit lisätään kammioon (ja poistetaan siitä) niiden yläosassa olevien kahden aukon kautta. Aukot suljetaan kumitulpilla käsittelyn ja inkubaation ajaksi. Sarveiskalvotelineen läpi kulkevan valon määrä saattaa muuttua, koska sisäkammioon reikiin tai lasi-ikkunoihin kerääntyvien tai niistä poistuvien kemiallisten jäämien voi vaikuttaa valon sirontaan ja heijastumiseen. Seurauksena voi olla sarveiskalvotelineen läpi kulkevan valon määrän perustason (ja vastaavasti sameuden perustasolukeman) kasvaminen ja väheneminen, mikä voi ilmetä odotettavien sarveiskalvon sameuden perustason alkumittausten huomattavina muutoksina (eli alussa mitattavat yksittäisissä sarveiskalvotelineissä olevan sarveiskalvojen sameusarvot voivat säännöllisesti poiketa yli kaksi tai kolme sameusyksikköä odotettavista perustasoarvoista). Kunkin laboratorion olisi harkittava tarkastusohjelman laatimista sarveiskalvotelineen läpi kulkevan valon muutosten arvioimiseksi testattavien kemikaalien luonteen ja kammioiden käyttötiheyden mukaan. Perustasoarvojen määrittämiseksi sarveiskalvotelineet voidaan ennen rutiinikäytön aloittamista tarkastaa mittaamalla sameuden perustasoarvot kammioista, jotka on täytetty mediumilla ja joissa ei ole sarveiskalvoja. Sarveiskalvotelineen läpi kulkevan valon määrä tarkastetaan säännöllisesti käyttöjaksojen aikana. Laboratorio voi määrittää testattavien kemikaalien, käyttötiheyden ja sarveiskalvon sameusarvojen perustasossa tapahtuvien muutosten perusteella itse, miten usein sarveiskalvoteline tarkastetaan. Jos sarveiskalvotelineen läpikulkevan valon määrässä ilmenee huomattavia muutoksia, sarveiskalvotelineen sisäpinta on aiheellista puhdistaa ja/tai kiillottaa tai vaihtaa uuteen. Sarveiskalvoteline: räjäytyskuva 
Lisäys 5 OPASITOMETRI Opasitometri on laite, jolla mitataan valon läpikulkua. Esimerkiksi BCOP-testimenetelmän validoinnissa käytettävän Electro Designin (Riom, Ranska) OP-KIT-laitteen halogeenilampusta lähetetään valoa kontrolliosaston läpi (tyhjä kammio, jossa ei ole ikkunaa eikä nestettä) valokennoon ja verrataan valoon, joka on lähetetty näytteelle käytetyn osaston (jossa on sarveiskalvon sisältävä kammio) läpi valokennoon. Valokennoista saadun valon transmissioita verrataan, ja numeronäytöllä näytetään numeerinen sameuden arvo. Sameusyksiköt määritetään. Muun tyyppisiä ja rakenteisia opasitometrejä (esimerkiksi sellaisia, joissa ei tarvitse mitata samanaikaisesti kontrolliosastoa ja näytteelle käytettyä osastoa) voidaan käyttää, jos ne antavat validoiduille laitteille todistetusti samanlaisia tuloksia. Opasitometrillä pitäisi saada lineaarinen vaste sellaisella sameuslukema-alueella, joka kattaa ennustemallissa kuvatuille eri luokituksille käytetyt raja-arvot (ts. siihen arvoon saakka, joka määrittää syövyttävyyden ja/tai vakavan ärsyttävyyden). Jotta voidaan varmistaa, että lukemat ovat lineaarisia ja tarkkoja 75–80 sameusyksikköön saakka, on opasitometri kalibroitava sarjalla kalibraattoreita. Kalibraattorit asetetaan kalibrointikammioon (sarveiskalvokammion, joka on tarkoitettu kalibraattoreiden pitämiseen), ja ne luetaan opasitometrillä. Kalibrointikammio on suunniteltu sellaiseksi, että kalibraattorit ovat siinä suunnilleen samalla etäisyydellä valosta ja valokennosta kuin mihin sarveiskalvot asetettaisiin sameusmittausten ajaksi. Vertailuarvot ja alkuvaiheen asetuspisteet riippuvat käytettävästä laitteesta. Sameusmittausten lineaarisuus olisi vahvistettava soveltuvin (välinekohtaisin) menettelyin. Esimerkiksi Electro Designin (Riom, Ranska) OP-KIT-laitteessa opasitometri kalibroidaan ensin arvoon 0 sameusyksikköä käyttämällä kalibrointikammiota ilman kalibraattoria. Kalibrointikammioon asetetaan sitten peräkkäin kolme erilaista kalibraattoria ja mitataan sameudet. Kalibraattoreilla 1, 2 ja 3 pitäisi saada 5 prosentin tarkkuudella samat sameuslukemat kuin asetetut arvot 75, 150 ja 225 sameusyksikköä. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
13) |
Korvataan B osassa oleva B.48 luku seuraavasti: ”B.48 Eristetyn kanan silmän käyttöön perustuva testimenetelmä, jolla tunnistetaan i) vakavia silmävaurioita aiheuttavat kemikaalit ja ii) kemikaalit, joita ei tarvitse luokitella silmä-ärsytyksen tai vakavien silmävaurioiden osalta JOHDANTO Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 438 (2013). Eristetyn kanan silmän käyttöön perustuva testimenetelmä (Isolated Chicken Eye, ICE) arvioitiin ICCVAMissa (Interagency Coordinating Committee on the Validation of Alternative Methods, vaihtoehtoisten menetelmien validoinnin virastojenvälinen koordinointikomitea) yhdessä Euroopan vaihtoehtoisten tutkimusmenetelmien keskuksen (ECVAM) ja Japanin vastaavan keskuksen (JaCVAM) kanssa vuosina 2006 ja 2010 (1) (2) (3). Ensimmäisessä arvioinnissa ICE-menetelmä vahvistettiin tieteellisesti päteväksi testimenetelmäksi, jota voidaan käyttää seulontatestinä sellaisten kemikaalien (aineiden ja seosten) tunnistamiseksi, jotka aiheuttavat vakavia silmävaurioita (luokka 1), kuten Yhdistyneiden kansakuntien (YK) kemikaalien maailmanlaajuisesti yhdenmukaistetussa luokitus- ja merkintäjärjestelmässä (GHS) (1) (2) (4) sekä aineiden ja seosten luokituksesta, merkinnöistä ja pakkaamisesta annetussa asetuksessa (EY) N:o 1272/2008 (CLP-asetus) on määritelty (12). Toisessa arvioinnissa käsiteltiin ICE-menetelmän käyttöä seulontatestinä sellaisten kemikaalien tunnistamiseksi, joita ei ole YK:n GHS-järjestelmän (3) (4) nojalla luokiteltu silmä-ärsytystä tai vakavia silmävaurioita aiheuttaviksi. Validointitutkimuksen tulosten ja vertaisarviointilautakunnan suositusten perusteella pitäydyttiin alkuperäisessä suosituksessa, jonka mukaan ICE-menetelmää käytetään vakavia silmävaurioita aiheuttavien kemikaalien luokittelemiseen (YK:n GHS-järjestelmän luokka 1), koska käytettävissä olevaa tietokantaa ei ole muutettu ICCVAMin alkuperäisen validoinnin jälkeen. Siinä vaiheessa ei annettu muita suosituksia ICE-menetelmän soveltamisalan laajentamiseksi myös muihin kategorioihin. Validointitutkimuksessa käytettyjen in vitro- ja in vivo -tulosjoukkojen uudelleenarvioinnissa keskityttiin arvioimaan ICE-menetelmän käytettävyyttä sellaisten kemikaalien tunnistamiseen, joita ei tarvitse luokitella silmä-ärsytyksen tai vakavan silmävaurion osalta (5). Uudelleenarvioinnin tuloksena oli, että ICE-menetelmää voidaan käyttää myös sellaisten kemikaalien tunnistamiseen, joita ei tarvitse luokitella YK:n GHS-järjestelmässä määritettyjen silmä-ärsytyksen ja vakavan silmävaurion osalta (4) (5). Testimenetelmä sisältää ICE-menetelmän käyttösuositukset ja -rajoitukset, jotka perustuvat näihin arviointeihin. OECD:n testiohjeen alkuperäisen vuoden 2009 version ja päivitetyn vuoden 2013 version väliset suurimmat erot ovat muun muassa ICE-menetelmän käyttö sellaisten kemikaalien tunnistamiseen, joita ei tarvitse luokitella YK:n GHS-järjestelmän mukaisesti, testiselosteen osien päivitys, lisäyksen 1 määritelmien päivitys ja lisäyksen 2 pätevyyden osoittamiseen tarkoitettujen kemikaalien päivitys. On yleisesti tunnustettu, että lähitulevaisuudessa millään yksittäisellä silmä-ärsytystä mittaavalla in vitro -testillä tuskin voidaan korvata Draizen in vivo -silmätestiä, jolla pystytään ennustamaan kaikenlainen ärsytys, jota eri luokkiin kuuluvat kemikaalit voivat aiheuttaa. Draizen silmätesti saatetaan kuitenkin voida korvata yhdistelemällä strategisesti useita vaihtoehtoisia testimenetelmiä niin, että niistä muodostuu (vaiheittainen) testausstrategia (6). Jäsentävää lähestymistapaa (7) on tarkoitus käyttää silloin, kun kemikaalin odotetaan käytettävissä olevien tietojen perusteella olevan erittäin ärsyttävä, kun taas kokoavaa lähestymistapaa (7) käytetään silloin, kun kemikaalin odotetaan käytettävissä olevien tietojen perusteella aiheuttavan niin vähän silmä-ärsytystä, että sitä ei tarvitse luokitella. ICE-menetelmä on in vitro -testi, jota voidaan käyttää 8–10 kohdan mukaisesti tietyissä olosuhteissa ja tietyin rajoituksin kemikaalien luokittelemiseksi ja merkitsemiseksi silmiin kohdistuvien vaarojen osalta. Vaikka ICE-menetelmän ei katsota sellaisenaan korvaavan in vivo -kaninsilmätestiä, sitä suositellaan käytettävän ensimmäisenä testinä Scottin ja muiden (7) suositteleman jäsentävän lähestymistavan kaltaisissa testausstrategioissa tunnistamaan vakavia silmävaurioita aiheuttavia kemikaaleja. Nämä kemikaalit luokitellaan ilman lisätestausta YK:n GHS-järjestelmän luokkaan 1 (4). ICE-menetelmää suositellaan käytettävän myös sellaisten kemikaalien tunnistamiseen, joita ei tarvitse luokitella silmä-ärsytyksen tai vakavien silmävaurioiden osalta YK:n GHS-järjestelmässä (ei luokitusta) (4), ja siksi sitä voidaan käyttää ensimmäisenä testinä kokoavaa lähestymistapaa soveltavassa testausstrategiassa (7). Lopullisen luokituksen määrittämiseksi sellaisille kemikaaleille, joiden ei ennusteta aiheuttavan vakavia silmävaurioita tai joita ei ole luokiteltu silmä-ärsytyksen / vakavien silmävaurioiden osalta, on kuitenkin suoritettava lisätestejä (in vitro ja/tai in vivo). Lisäksi toimivaltaisilta sääntelyviranomaisilta tulisi pyytää ohjeita, ennen kuin ICE-menetelmää käytetään kokoavan lähestymistavan testausstrategiassa jonkin muun luokitusjärjestelmän kuin YK:n GHS-järjestelmän puitteissa. Tässä testimenetelmässä kuvataan menettelyt, joilla arvioidaan testattavan kemikaalin vaarallisuus silmälle mittaamalla sen kykyä aiheuttaa toksisuutta irrotetussa kanan silmässä. Sarveiskalvoon kohdistuneet toksisuusvaikutukset mitataan i) määrittämällä sameus kvalitatiivisesti, ii) määrittämällä epiteelivaurio kvalitatiivisesti, kun silmään annostellaan fluoreseiiniä (fluoreseiinin retentio), iii) mittaamalla paksuuntuminen (turpoaminen) kvantitatiivisesti ja iv) arvioimalla pinnan makroskooppiset morfologiset vauriot kvalitatiivisesti. Sarveiskalvon sameus, turpoaminen ja vauriot arvioidaan testattavalle kemikaalille altistuksen jälkeen erikseen, minkä jälkeen ne yhdistetään, jotta niistä voidaan johtaa silmä-ärsytysluokitus. Määritelmät ovat lisäyksessä 1. ALUSTAVAT NÄKÖKOHDAT JA RAJOITUKSET Tämä testimenetelmä perustuu OECD:n ohjeasiakirjassa 160 (8) ehdotettuun protokollaan, joka kehitettiin ICCVAMin kansainvälisen validointitutkimuksen perusteella (1) (3) (9). Tutkimukseen ovat osallistuneet vaihtoehtoisten menetelmien eurooppalainen validointikeskus ECVAM, Japanin vastaava keskus ja Alankomaiden sovelletun luonnontieteen tutkimuslaitoksen (TNO) toksikologian ja sovelletun farmakologian elämän laatu -osasto. Protokolla perustuu julkaistuista protokollista ja TNO:n nykyisin käyttämästä protokollasta saatuihin tietoihin (10) (11) (12) (13) (14). Tämän menetelmän validoinnin yhteydessä on testattu useita erilaisia kemikaaleja. Validointitutkimuksen empiirisessä tietokannassa on 152 kemikaalia, joista 72 on aineita ja 80 seoksia (5). Testimenetelmää voidaan soveltaa kiinteisiin aineisiin, nesteisiin, emulsioihin ja geeleihin. Nesteet voivat olla vesiliuoksia tai orgaanisia liuoksia; kiinteät aineet voivat olla joko veteen liukenevia tai veteen liukenemattomia. Kaasuja ja aerosoleja ei ole vielä arvioitu validointitutkimuksessa. ICE-menetelmää voidaan käyttää vakavia silmävaurioita aiheuttavien kemikaalien tunnistamisessa. Niitä ovat YK:n GHS-järjestelmän luokkaan 1 luokiteltavat kemikaalit (4). Kyseisessä käytössä on havaittu, että ICE-menetelmän haittana ovat alkoholien testauksessa saadut useat väärät positiiviset tulokset sekä kiinteiden aineiden ja pinta-aktiivisten aineiden testauksessa saadut useat väärät negatiiviset tulokset (1) (3) (9). Tässä yhteydessä vääristä negatiivisista tuloksista (eli YK:n GHS-järjestelmän luokkaa 1 ei tunnisteta YK:n GHS-järjestelmän luokaksi 1) ei kuitenkaan ole haittaa, koska kaikki negatiivisen tuloksen saaneet testikemikaalit testataan tämän jälkeen vähintään yhdellä muulla yhtä pätevällä in vitro -testillä tai viimeisenä vaihtoehtona sääntelyvaatimuksista riippuen kaneilla käyttäen vaiheittaista testausstrategiaa, jossa sovelletaan todistusnäyttöön perustuvaa lähestymistapaa. On syytä panna merkille, että kiinteät aineet voivat johtaa Draizen in vivo -silmä-ärsyttävyystestissä vaihteleviin ja äärimmäisiin altistusolosuhteisiin, minkä vuoksi niiden todellisesta ärsyttävyydestä voidaan saada käyttökelvoton ennuste (15). Tutkijat voisivat harkita tämän testimenetelmän käyttöä kaiken tyyppisiin kemikaaleihin, ja positiivisen tuloksen tulisi tällöin katsoa viittaavan vakavaan silmävaurioon, mikä tarkoittaisi YK:n GHS-järjestelmän luokkaa 1 ilman lisätestausta. Alkoholeilla saatuihin positiivisiin tuloksiin olisi kuitenkin suhtauduttava varovaisesti yliennustuksen vaaran takia. Vakavia silmävaurioita aiheuttavien kemikaalien (YK:n GHS-järjestelmän luokka 1) tunnistamiseen käytettäessä ICE-menetelmän yleinen tarkkuus on 86 prosenttia (120/140), väärien positiivisten tulosten osuus on 6 prosenttia (7/113) ja väärien negatiivisten tulosten osuus 48 prosenttia (13/27) verrattuna YK:n GHS-järjestelmän mukaan luokiteltuihin in vivo -kaninsilmätestistä saatuihin tietoihin (4) (5). ICE-menetelmää voidaan käyttää myös sellaisten kemikaalien tunnistamiseen, joita ei tarvitse luokitella YK:n GHS-järjestelmän mukaisesti silmä-ärsytyksen ja vakavien silmävaurioiden osalta (4). Toimivaltaisilta sääntelyviranomaisilta tulisi pyytää ohjeita, ennen kuin ICE-menetelmää käytetään kokoavan lähestymistavan testausstrategiassa jonkin muun luokitusjärjestelmän puitteissa. Tällä menetelmällä voidaan testata kaiken tyyppisiä kemikaaleja. Negatiivisen tuloksen perusteella kemikaali voitaisiin jättää luokittelematta silmä-ärsytyksen ja vakavien silmävaurioiden osalta. Validointitietokannan yhden tuloksen perusteella orgaanisia liuottimia sisältävien eliönestomaalien vaikutus saatetaan kuitenkin aliennustaa (5). Kun ICE-menetelmää käytetään sellaisten kemikaalien tunnistamiseen, joita ei tarvitse luokitella silmä-ärsytyksen ja vakavien silmävaurioiden osalta, sen yleinen tarkkuus on 82 prosenttia (125/152), väärien positiivisten tulosten osuus on 33 prosenttia (26/79) ja väärien negatiivisten tulosten osuus 1 prosentti (1/73) verrattuna YK:n GHS-järjestelmän mukaan luokiteltuihin in vivo -kaninsilmätestistä saatuihin tietoihin (4) (5). Kun tietokannan ulkopuolelle jätetään tiettyihin luokkiin kuuluvat testikemikaalit (eli orgaanisia liuottimia sisältävät eliönestomaalit), ICE-menetelmän tarkkuus on 83 prosenttia (123/149), väärien positiivisten tulosten osuus on 33 prosenttia (26/78) ja väärien negatiivisten tulosten osuus 0 prosenttia (0/71) YK:n GHS-järjestelmässä (4) (5). ICE-menetelmää ei suositella käytettävän sellaisten testikemikaalien tunnistamiseen, jotka tulisi luokitella silmiä ärsyttäviksi (eli YK:n GHS-järjestelmän luokkaan 2 tai 2A), tai testikemikaaleja, jotka tulisi luokitella lievästi silmiä ärsyttäviksi (YK:n GHS-järjestelmän luokka 2B), koska suuri määrä YK:n GHS-järjestelmän luokan 1 mukaisia kemikaaleja on luokiteltu liian alhaisiin YK:n GHS-järjestelmän luokkiin 2, 2A tai 2B ja YK:n GHS-järjestelmän mukaisia ”ei luokitusta” -kemikaaleja on luokiteltu liian korkeisiin YK:n GHS-järjestelmän luokkiin 2, 2A tai 2B. Tätä varten saattaa olla tarpeen tehdä lisää testejä muilla soveltuvilla menetelmillä. Kaikissa kanan silmiä käyttävissä menettelyissä olisi noudatettava testauslaitoksen määräämiä ihmis- tai eläinperäisten materiaalien (muun muassa kudosten ja kudosnesteiden) käsittelyä koskevia sääntöjä ja menettelyjä. Suositeltavia ovat yleiset laboratorioissa noudatettavat ennaltavarautumiskäytänteet (16). Vaikka ICE-menetelmässä ei oteta huomioon kaninsilmätestissä arvioituja sidekalvon ja värikalvon vaurioita, siinä käsitellään vaikutuksia sarveiskalvoon, jotka ovat in vivo -testeissä suurin luokittelun peruste YK:n GHS-järjestelmästä puhuttaessa. Kaninsilmätutkimusten perusteella on ehdotettu, että vaikka ICE-testissä ei sinänsä voida arvioida sarveiskalvovaurioiden palautuvuutta, sarveiskalvovaurion alkusyvyyden perusteella voidaan kuitenkin tunnistaa tietyt palautumattomat vaikutukset (17). Erityisesti tarvitaan enemmän tieteellistä tietoa sen ymmärtämiseksi, miten ensimmäisenä syntyviin suuriin vaurioihin liittymättömät palautumattomat vaikutukset syntyvät. ICE-menetelmällä ei voida myöskään arvioida sitä, missä määrin silmäaltistukseen voi liittyä systeemistä toksisuutta. Tätä testimenetelmää päivitetään aika ajoin sitä mukaa, kun saadaan uusia tietoja. Esimerkiksi histopatologiasta saattaa olla hyötyä, jos sarveiskalvon vauriota on tarpeen luonnehtia tarkemmin. Tämän mahdollisuuden arvioimiseksi käyttäjiä kehotetaan säilyttämään silmät ja ottamaan histopatologisia näytteitä, joita voidaan käyttää tietokannan luomiseen ja päätösperusteiden laatimiseen, jotta menetelmän tarkkuutta voidaan parantaa. OECD on kehittänyt ohjeasiakirjan silmätoksisuuden in vitro -testimenetelmien käytöstä. Ohjeessa kuvataan yksityiskohtaisesti histopatologisten näytteiden ottaminen ja annetaan tiedot siitä, mihin näytteet ja/tai histopatologiset tiedot tulee toimittaa (8). Kun laboratorio alkaa käyttää tätä määritysmenetelmää, sen olisi käytettävä lisäyksessä 2 mainittuja pätevyyden osoittamiseen tarkoitettuja kemikaaleja. Laboratorio voi käyttää näitä kemikaaleja osoittaakseen teknisen pätevyytensä ICE-menetelmän käytössä ennen kuin se toimittaa ICE-määritystuloksia sääntömääräistä vaaraluokitusta varten. TESTIN PERIAATE ICE-menetelmä on elinmalli, joka mahdollistaa kanan silmän lyhytaikaisen ylläpitämisen in vitro. Tässä testimenetelmässä testikemikaalin aiheuttama vaurio arvioidaan määrittämällä sarveiskalvon turpoaminen, sameus ja fluoreseiinin retentio. Kaksi jälkimmäistä muuttujaa arvioidaan kvalitatiivisesti, kun taas sarveiskalvon turpoaminen määritetään kvantitatiivisesti. Kukin mittaus joko muunnetaan kvantitatiiviseksi arvoksi, josta lasketaan yleinen ärsyttävyysindeksi, tai sille osoitetaan kvalitatiivinen luokka, jonka perusteella määritetään in vitro silmän vaaraluokitus, joko YK:n GHS-järjestelmän luokka 1 tai YK:n GHS-järjestelmän ”Ei luokitusta”. Kummankin tuloksen avulla voidaan ennustaa, kuinka todennäköisesti testikemikaali aiheuttaa vakavia silmävaurioita in vivo tai voidaanko se jättää luokittelematta silmän vaaraluokituksessa (ks. päätösperusteet). Sellaisia kemikaaleja ei voida luokitella lainkaan, joiden mahdollisuutta aiheuttaa vakavia silmävaurioita ei ole ennustettu tai joita ei ole luokiteltu ICE-menetelmässä (ks. 11 kohta). Kanansilmien alkuperä ja kanojen ikä Tässä määrityksessä on tavanomaisesti käytetty teurastamossa elintarviketuotantoa varten teurastetuista kanoista saatuja silmiä, jolloin ei ole tarvittu laboratorioeläimiä. Testiin voidaan käyttää vain silmiä, jotka on saatu terveistä, ihmisravinnoksi kelpaavista eläimistä. Parasta kanan ikää ei ole arvioitu kontrolloidussa tutkimuksessa. Testimenetelmässä on yleensä käytetty sen ikäisiä ja painoisia kanoja kuin siipikarjateurastamossa tavanomaisesti teurastetut kevätkananpojat ovat (eli noin seitsemän viikon ikäisiä, paino 1,5–2,5 kg). Silmien kerääminen ja niiden kuljetus laboratorioon Päät tulisi irrottaa heti sen jälkeen, kun kanat on tainnutettu, mikä tehdään tavallisesti sähkösokilla, ja kaula on viilletty verenlaskua varten. Laboratorion läheisyydestä tulisi etsiä paikallinen kanojen teurastamo, jotta kanojen päät voidaan kuljettaa teurastamosta laboratorioon riittävän nopeasti. Näin pilaantuminen ja/tai bakteerikontaminaatio voidaan pitää mahdollisimman vähäisinä. Kananpäiden keräämisestä ja silmien poistamisesta silmien tiputuslaitteen (superfuusiolaitteen) kammioon asettamiseen kuluvan ajan tulisi olla mahdollisimman lyhyt (yleensä enintään kaksi tuntia), jotta näytteiden määrittämisen hyväksymisperusteet täyttyvät. Kaikkien määrityksessä käytettyjen silmien olisi oltava peräisin samasta, tiettynä päivänä kerätystä silmäryhmästä. Koska silmät dissekoidaan laboratoriossa, koskemattomat päät kuljetetaan teurastamosta ympäristön lämpötilassa (yleensä 18–25 °C) muovilaatikoissa kosteutettuina isotonisella fysiologisella keittosuolaliuoksella kostutetuilla liinoilla. ICE-testissä käytettävien silmien valintaperusteet ja määrä Hylätyksi tulevat sellaiset silmät, jotka värjäytyvät voimakkaasti fluoreseiinillä (> 0,5) tai joiden sarveiskalvon sameusarvo on suuri (> 0,5) silmämunan poistamisen jälkeen. Kussakin käsitellyssä ryhmässä ja samanaikaisesti määritettävässä positiivisessa kontrollissa on oltava vähintään kolme silmää. Negatiivisessa kontrolliryhmässä tai liuotinkontrollissa (jos käytetään muuta liuotinta kuin fysiologista keittosuolaliuosta) on oltava vähintään yksi silmä. Jos kiinteitä aineita testattaessa tulokseksi tulee YK:n GHS-järjestelmän ”Ei luokitusta”, suositellaan testin uusimista vielä kolmella silmällä, jotta tulokselle saadaan vahvistus tai se voidaan hylätä. MENETTELY Silmien valmistelu Silmäluomet leikataan huolellisesti pois varoen vahingoittamasta sarveiskalvoa. Sarveiskalvon eheys arvioidaan nopeasti lisäämällä tippa 2-prosenttista (w/v) natriumfluoreseiiniä sarveiskalvon pinnalle muutamaksi sekunniksi, minkä jälkeen pinta huuhdotaan fysiologisella keittosuolaliuoksella. Fluoreseiinillä käsiteltyjä silmiä tarkastellaan rakovalomikroskoopilla, jotta voidaan varmistaa, ettei sarveiskalvo ole vahingoittunut (eli fluoreseiinin retentio ja sarveiskalvon sameusarvo ovat enintään 0,5). Jos silmä on vahingoittumaton, se dissekoidaan kallosta varoen vahingoittamasta sarveiskalvoa. Silmämuna vedetään irti silmäkuopasta pitäen tiukasti vilkkukalvosta kiinni kirurgisilla pihdeillä, ja silmän lihakset leikataan käyrillä, tylppäkärkisillä saksilla. On tärkeää, ettei sarveiskalvoa vahingoiteta liialla paineella (kompressioartefakta). Kun silmää poistetaan silmäkuopasta, pitäisi osa näköhermoa jättää kiinni ja näkyville. Kun silmä on poistettu silmäkuopasta, se asetetaan imupaperialustalle, ja vilkkukalvo ja muu sidekudos leikataan pois. Poistettu silmä kiinnitetään ruostumattomasta teräksestä valmistettuun pitimeen siten, että sarveiskalvo on pystysuorassa. Pidin siirretään tiputuslaitteen kammioon (18). Pidin asetetaan tiputuslaitteeseen niin, että tiputettava fysiologinen keittosuolaliuos kastelee koko sarveiskalvon (3–4 tippaa minuutissa tai 0,1–0,15 ml/min). Tiputuslaitteen kammioiden lämpötila on pidettävä arvossa 32 ± 1,5 °C. Lisäyksessä 3 esitetään kaavio tyypillisestä tiputuslaitteesta ja silmänpitimistä. Niitä voi ostaa tai ne voi rakentaa itse. Laite voidaan mukauttaa yksittäisen laboratorion tarpeisiin (esimerkiksi eri silmämäärille). Kun silmät on asetettu tiputuslaitteeseen, niitä tarkastellaan jälleen rakovalomikroskoopilla, jotta voidaan varmistaa, etteivät ne ole vahingoittuneet dissektiossa. Sarveiskalvon huippukohdan paksuus olisi myös mitattava rakovalomikroskooppiin kuuluvalla syvyydenmittauslaitteella. Jos i) fluoreseiinin retentioarvo on yli 0,5, ii) sarveiskalvon sameus on yli 0,5 tai iii) silmissä on muita vahingoittumisen merkkejä, silmät on vaihdettava toisiin. Niistä silmistä, joita ei ole hylätty edellä mainittujen perusteiden perusteella, hylätään sellaiset, joiden sarveiskalvon paksuus poikkeaa yli 10 prosenttia kaikkien silmien keskiarvosta. Käyttäjien on syytä panna merkille, että rakovalomikroskoopeilla voi saada erilaisia arvoja sarveiskalvon paksuudelle, jos raon leveyden asetus on eri. Raon leveys olisi asetettava arvoon 0,095 mm. Kun kaikki silmät on tutkittu ja hyväksytty, silmiä inkuboidaan noin 45–60 min, jotta ne tasapainottuvat testijärjestelmässä ennen annostelua. Tasapainottumisjakson jälkeen sarveiskalvon paksuudelle ja sameudelle otetaan lukema perusarvoa varten (nolla-arvo ajanhetkellä 0). Dissektion yhteydessä määritettyä fluoreseiiniarvoa käytetään fluoreseiinin retention perusarvona. Testikemikaalin annostelu Välittömästi nolla-arvojen mittausten jälkeen silmä (telineineen) poistetaan tiputuslaitteesta, asetetaan vaakasuoraan, ja testikemikaali annostellaan sarveiskalvolle. Nestemäiset testikemikaalit testataan tavallisesti laimentamattomina, mutta ne voidaan laimentaa tarvittaessa (esimerkiksi jos se kuuluu tutkimussuunnitelmaan). Testikemikaalit laimennetaan mieluiten fysiologisella keittosuolaliuoksella. Muitakin liuottimia voidaan käyttää valvotuissa olosuhteissa, mutta muiden liuottimien kuin fysiologisen keittosuolaliuoksen käyttökelpoisuus olisi osoitettava. Nestemäiset testikemikaalit annostellaan sarveiskalvolle siten, että testiaine peittää kokonaan ja tasaisesti sarveiskalvon pinnan; tavanomainen tilavuus on 0,03 ml. Kiinteät aineet olisi mahdollisuuksien mukaan jauhettava mahdollisimman hienoksi morttelissa survimella tai vastaavassa jauhamislaitteessa. Jauhe annostellaan sarveiskalvolle siten, että testiaine peittää pinnan tasaisesti; tavanomainen määrä on 0,03 g. Testiaineen (nesteen tai kiinteän aineen) annetaan vaikuttaa 10 sekunnin ajan, minkä jälkeen se huuhdellaan silmästä fysiologisella keittosuolaliuoksella (noin 20 ml) huoneenlämpötilassa. Telineessä oleva silmä asetetaan uudelleen tiputuslaitteeseen pystysuoraan. Tarvittaessa silmää voidaan huuhdella lisää 10 sekunnin vaikutusajan jälkeen sekä myös myöhemmin (esimerkiksi silloin, kun sarveiskalvolla havaitaan testikemikaalin jäänteitä). Yleensä lisähuuhtelussa käytettävän keittosuolaliuoksen määrällä ei ole merkitystä, mutta kemikaalin tarttumista sarveiskalvolle on ehdottomasti tarkkailtava. Kontrollikemikaalit Kussakin kokeessa on oltava mukana negatiiviset eli liuotin-/kantaja-ainekontrollit ja positiiviset kontrollit. Testattaessa 100-prosenttisia nesteitä tai kiinteitä aineita käytetään ICE-testissä negatiivisena kontrollina fysiologista keittosuolaliuosta, jotta voidaan havaita epäspesifiset muutokset testijärjestelmässä ja varmistaa, etteivät määritysolosuhteet aiheuta tahattomasti ärsytysvastetta. Testattaessa laimennettuja nesteitä testissä käytetään samanaikaisesti liuotin-/kantaja-ainekontrolliryhmää, jotta voidaan havaita epäspesifiset muutokset testijärjestelmässä ja varmistaa, etteivät määritysolosuhteet aiheuta tahattomasti ärsytysvastetta. Kuten kohdassa 31 mainitaan, liuotinta/kantaja-ainetta saa käyttää vain, jos on osoitettu, ettei se häiritse testijärjestelmää. Kuhunkin kokeeseen otetaan mukaan tunnettu silmiä ärsyttävä kemikaali positiivisena kontrollina, jotta voidaan varmistaa, että saadaan asianmukainen vaste. Koska ICE-määritystä käytetään tässä testimenetelmässä syövyttävien tai vakavasti ärsyttävien kemikaalien tunnistamiseksi, positiivisen kontrollin olisi mielellään oltava vertailukemikaali, joka aiheuttaa tässä testimenetelmässä vakavan vasteen. Vakava ärsytysvaste ei kuitenkaan saisi olla liian voimakas, jotta positiivisen kontrollivasteen vaihtelu ajan funktiona voidaan arvioida. Positiivisesta kontrollista olisi hankittava riittävästi in vitro -tuloksia, jotta positiiviselle kontrollille voidaan laskea tilastollisesti määritelty hyväksyttävä alue. Jos tietylle positiiviselle kontrollille ei ole saatavilla riittävästi aiempia ICE-testimenetelmällä saatuja tuloksia, on tietojen saamiseksi mahdollisesti tehtävä lisätutkimuksia. Nestemäisten testikemikaalien positiivisina kontrolleina voidaan käyttää esimerkiksi 10-prosenttista etikkahappoa tai 5-prosenttista bentsalkoniumkloridia, ja kiinteiden testikemikaalien positiivisina kontrolleina voidaan käyttää esimerkiksi natriumhydroksidia tai imidatsolia. Vertailukemikaalit ovat hyödyllisiä, kun arvioidaan tiettyyn kemikaali- tai tuoteryhmään kuuluvien tuntemattomien kemikaalien silmä-ärsytyskykyä tai silmää ärsyttävän aineen suhteellista ärsytyskykyä tietyllä ärsytysvastealueella. Mitatut päätepisteet Käsitellyt sarveiskalvot arvioidaan ennen käsittelyä ja 30, 75, 120, 180 ja 240 minuuttia (± 5 minuuttia) käsittelyn jälkeen tehdyn huuhtelun jälkeen. Näillä ajanhetkillä saadaan riittävä määrä mittauksia neljän tunnin käsittelyn aikana, ja mittauksien välillä on riittävästi aikaa tehdä kaikista silmistä tarvittavat havainnot. Arvioidut päätepisteet ovat sarveiskalvon sameus, turpoaminen, fluoreseiinin retentio ja morfologiset vaikutukset (esimerkiksi epiteelin pistemäinen syöpyminen tai irtoaminen). Kaikki määritykset (lukuun ottamatta fluoreseiinin retentiota, joka määritetään vain ennen käsittelyä ja 30 minuutin kuluttua testikemikaalin annostelusta) tehdään kullakin mainitulla ajanhetkellä. On suositeltavaa ottaa valokuvia osoitukseksi sarveiskalvon sameudesta, fluoreseiinin retentiosta, morfologisista muutoksista ja histopatologiasta (jos sellaisia tutkimuksia on tehty). Kun viimeinen tutkimus on tehty neljän tunnin kohdalla, silmät suositellaan säilytettävän sopivassa kiinnitysaineessa (esimerkiksi neutraalissa puskuroidussa formaliinissa) mahdollisia histopatologisia tutkimuksia varten (lisätietoja on kohdassa 14 ja lähteessä 8). Sarveiskalvon turpoaminen arvioidaan sarveiskalvon paksuuden mittauksista, jotka tehdään rakovalomikroskooppiin kuuluvalla optisella paksuudenmittauslaitteella. Turpoaminen ilmoitetaan prosenttilukuna, ja se lasketaan sarveiskalvon paksuuden mittauksista seuraavalla kaavalla:
Kaikkien testattujen silmien sarveiskalvon turpoamisen prosenttikeskiarvo lasketaan kaikille havaintoajanhetkille. Kullekin testikemikaalille annetaan yleinen luokkaa koskeva arvo sarveiskalvon turpoamiselle saadun korkeimman (millä tahansa ajanhetkellä havaitun) keskimääräisen arvon perusteella (ks. 51 kohta). Sarveiskalvon sameus lasketaan käyttäen sitä sarveiskalvon kohtaa, joka antaa suurimman sameusarvon (ks. taulukko 1). Kaikkien testattujen silmien sarveiskalvon keskimääräinen sameusarvo lasketaan kaikille havaintoajanhetkille. Kullekin testikemikaalille annetaan yleinen luokkaa koskeva arvo sarveiskalvon sameudelle saadun korkeimman (minä tahansa ajanhetkenä havaitun) keskimääräisen arvon perusteella (ks. 51 kohta). Taulukko 1 Sarveiskalvon sameusarvot
Fluoreseiinin retentio arvioidaan ainoastaan 30 minuutin ajanhetkelle (ks. taulukko 2). Kaikkien testattujen silmien fluoreseiinin retention keskiarvo lasketaan tämän jälkeen 30 minuutin ajanhetkelle. Sitä käytetään kullekin testikemikaalille annettavaan yleiseen luokka-arvoon (ks. 51 kohta). Taulukko 2 Fluoreseiinin retention arvot
Morfologisia vaikutuksia ovat esimerkiksi sarveiskalvon epiteelisolujen ”pistemäinen syöpyminen”, epiteelin ”irtoaminen”, sarveiskalvon pinnan ”karhentuminen” ja testikemikaalin ”takertuminen” sarveiskalvoon. Näiden löydösten vakavuus voi vaihdella, ja ne voivat esiintyä samanaikaisesti. Näiden löydösten luokittelu riippuu tutkijan tulkinnasta. TIEDOT JA RAPORTOINTI Tietojen arviointi Sarveiskalvon sameutta, turpoamista ja fluoreseiinin retentiota koskevat tulokset olisi arvioitava erikseen, jotta kullekin päätepisteelle voidaan muodostaa ICE-luokka. Tämän jälkeen kutakin päätepistettä koskevat ICE-luokat yhdistetään ärsytysluokituksen muodostamiseksi kullekin testikemikaalille. Päätösperusteet Kun kukin päätepiste on arvioitu, voidaan ICE-luokat osoittaa ennalta määrätyn vaihteluvälin perusteella. Sarveiskalvon turpoaminen (taulukko 3), sameus (taulukko 4) ja fluoreseiinin retentio (taulukko 5) käyttäen neljää ICE-luokkaa tulkitaan alla olevien asteikkojen mukaisesti. On syytä panna merkille, että taulukossa 3 esitettyjä sarveiskalvon turpoamisarvoja voi soveltaa vain, jos paksuus on mitattu rakovalomikroskoopilla (esim. Haag-Streit BP900), jossa on syvyydenmittauslaite nro 1 ja jonka raon leveys on 9 Taulukko 3 ICE-luokitusperusteet sarveiskalvon turpoamiselle
Taulukko 4 ICE-luokitusperusteet sameudelle
Taulukko 5 ICE-luokitusperusteet keskimääräiselle fluoreseiinin retentiolle
Testikemikaalin in vitro -luokitus arvioidaan lukemalla GHS-luokitus, joka vastaa sarveiskalvon turpoamiselle, sarveiskalvon sameudelle ja fluoreseiinin retentiolle saatujen kategorioiden yhdistelmää taulukossa 6 esitetyllä tavalla. Taulukko 6 Yhdistetyt in vitro -luokitukset
Tutkimuksen hyväksymisperusteet Testi katsotaan hyväksyttäväksi, jos samanaikaisesti tehtyjen negatiivisten tai liuotin-/kantaja-ainekontrollien antama GHS-luokitus on ”ei luokitusta” ja samanaikaisesti tehtyjen positiivisten kontrollien antama GHS-luokitus on luokkaluokka 1. Testiseloste Testiselosteessa olisi annettava seuraavat tiedot, jos niillä on merkitystä tutkimuksen suorittamisen kannalta:
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT Aine : Alkuaineet ja niiden yhdisteet, sellaisina kuin ne esiintyvät luonnossa tai tuotantomenetelmin valmistettuina, joihin sisältyy kaikki tuotteen pysyvyyden säilyttämiseksi tarvittavat lisäaineet ja kaikki menetelmästä peräisin olevat epäpuhtaudet lukuun ottamatta liuottimia, jotka voidaan erottaa vaikuttamatta aineen pysyvyyteen tai koostumukseen (4). Ei luokiteltu : Aineet, joita ei ole luokiteltu silmä-ärsytyksen (YK:n GHS-järjestelmän luokka 2) tai vakavien silmävaurioiden (YK:n GHS-järjestelmän luokka 1) osalta. Sama kuin ”Ei YK:n GHS-luokitusta”. Fluoreseiinin retentio : ICE-testissä tehty subjektiivinen mittaus fluoreseiininatriumin määrästä, jonka epiteelisolut pidättävät sarveiskalvossa, kun se on altistettu testiaineelle. Fluoreseiinin retentioaste viittaa sarveiskalvon epiteelin vaurioon. Jäsentävä lähestymistapa : Vaiheittainen lähestymistapa, jota käytetään oletettaessa, että kemikaali aiheuttaa vakavia silmävaurioita. Se aloitetaan määrittämällä vakavia silmävaurioita aiheuttavat kemikaalit (positiivinen tulos) ja muut kemikaalit (negatiivinen tulos). Kemikaali : Aine tai aineiden seos. Kokoava lähestymistapa : Vaiheittainen lähestymistapa, jota käytetään oletettaessa, että kemikaalia ei tarvitse luokitella silmä-ärsytyksen tai vakavien silmävaurioiden osalta. Se aloitetaan määrittämällä kemikaalit, joita ei tarvitse luokitella (negatiivinen tulos) ja muut kemikaalit (positiivinen tulos). Liuotin-/kantaja-ainekontrolli : Käsittelemätön näyte, jossa on kaikki testijärjestelmän osat, mukaan luettuina liuotin tai kantaja-aine, ja joka prosessoidaan testikemikaalilla käsiteltyjen ja muiden kontrollinäytteiden kanssa perusvastetason määrittämiseksi näytteille, joissa testikemikaali on liuotettu samaan liuottimeen tai kantaja-aineeseen. Kun tällainen näyte testataan samanaikaisesti negatiivisen kontrollin kanssa, se osoittaa myös, reagoiko liuotin tai kantaja-aine testijärjestelmän kanssa. Luotettavuus : Laajuus, jolla testimenetelmä on toistettavissa samassa laboratoriossa tai eri laboratorioissa pidemmällä aikavälillä käytettäessä samaa menettelyä. Arvo määritetään laskemalla laboratorionsisäinen ja laboratorioidenvälinen uusittavuus ja laboratorionsisäinen toistettavuus. Negatiivinen kontrolli : Käsittelemätön näyte, jossa on kaikki testijärjestelmän osat. Negatiivinen kontrolli prosessoidaan testikemikaalilla käsiteltyjen näytteiden ja muiden kontrollinäytteiden kanssa, jotta voidaan määrittää, reagoiko liuotin testijärjestelmän kanssa. Pinta-aktiivinen aine : Aine, esimerkiksi detergentti, joka voi vähentää nesteen pintajännitettä ja saada sen siten vaahtoamaan tai läpäisemään kiinteitä aineita; tunnetaan myös vettymistä edistävänä aineena. Positiivinen kontrolli : Näyte, jossa on kaikki testijärjestelmän osat ja joka on käsitelty kemikaalilla, jonka tiedetään aiheuttavan positiivisen vasteen. Vakava vaste ei kuitenkaan saisi olla liian voimakas, jotta positiivisen kontrollivasteen vaihtelu ajan funktiona voidaan arvioida. Rakovalomikroskooppi : Laite, jolla tarkastellaan silmää suoraan kaksiokulaarisen mikroskoopin suurennoksella luomalla stereoskooppinen, pysty kuva. Laitetta käytetään ICE-testissä kanan silmän etukammion tarkasteluun ja sarveiskalvon paksuuden objektiiviseen mittaukseen mikroskooppiin liitetyn syvyyttä mittaavan laitteen avulla. Sarveiskalvo : Silmämunan etuosan läpinäkyvä osa, joka peittää värikalvon ja silmäterän ja päästää valoa sisäosiin. Sarveiskalvon sameus : Sarveiskalvon sameuden mitta, kun sarveiskalvo on altistettu testikemikaalille. Sarveiskalvon sameuden lisääntyminen merkitsee sarveiskalvon vauriota. Sarveiskalvon turpoaminen : ICE-testissä objektiivisesti mitattu sarveiskalvon pullistumisen voimakkuus, kun sarveiskalvo on altistettu testikemikaalille. Turpoaminen ilmaistaan prosenttilukuna ja lasketaan sarveiskalvon paksuuden perustasomittauksista (ennen annostelua) ja paksuuksista, jotka on mitattu säännöllisin väliajoin sen jälkeen, kun sarveiskalvo on altistettu testikemikaalille ICE-testissä. Sarveiskalvon turpoamisaste viittaa sarveiskalvon vaurioon. Seos : Kahdesta tai useammasta aineesta koostuva seos tai liuos, jossa aineet eivät reagoi (4). Silmälle aiheutuvat palautumattomat vaikutukset : ks. ”Vakava silmävaurio” ja ”YK:n GHS-järjestelmän luokka 1”. Silmälle aiheutuvat palautuvat vaikutukset : ks. ”Silmä-ärsytys” ja ”YK:n GHS-järjestelmän luokka 2”. Silmä-ärsytys : Silmän muutokset, jotka syntyvät, kun testikemikaalia on annosteltu silmän etupinnalle, ja korjautuvat täysin 21 päivän kuluessa annostelusta. Vaihdettavissa ”Silmälle aiheutuvien palautuvien vaikutusten” ja ”YK:n GHS-järjestelmän luokan 2” kanssa (4). Tarkkuus : Testimenetelmän tulosten ja hyväksyttyjen vertailuarvojen välinen ero. Tarkkuus on testimenetelmän suorituskyvyn mitta ja yksi merkityksellisyyden osatekijöistä. Tarkkuutta ja vastaavuutta käytetään usein toisiaan korvaavasti tarkoittamaan testimenetelmällä saatujen oikeiden tulosten osuutta. Testikemikaali : Aine tai seos, jota testataan tällä testimenetelmällä. Todistusnäyttö : Prosessi, jossa tarkastellaan erilaisten tietojen vahvuuksia ja heikkouksia, kun niiden avulla on tarkoitus päättää kemikaalin vaarallisuutta koskevasta päätelmästä tai kun tietojen on määrä tukea kyseistä päätelmää. Vaara : Vaikuttavan tekijän (”agentin”) tai tilanteen sisäinen ominaisuus, jolla on kyky aiheuttaa haitallisia vaikutuksia, kun organismi, järjestelmä tai (ala)populaatio altistuu kyseiselle aineelle. Vaiheittainen testausstrategia : Monivaiheinen testausstrategia, jossa kaikkia testikemikaalia koskevia olemassa olevia tietoja tarkastellaan tietyssä järjestyksessä käyttäen todistusnäyttöprosessia kussakin vaiheessa sen määrittämiseksi, onko käytettävissä riittävästi tietoja vaaraluokituspäätöstä varten, ennen kuin siirrytään seuraavaan vaiheeseen. Jos testikemikaalin ärsytyskyky voidaan määrittää olemassa olevien tietojen perusteella, ei lisätestausta tarvita. Jos testikemikaalin ärsytyskykyä ei voida määrittää olemassa olevien tietojen perusteella, toteutetaan vaiheittainen testaus eläimillä, kunnes luokitus voidaan määritellä aukottomasti. Vakava silmävaurio : Silmän kudosvaurio tai vakava fyysinen näön rappeutuminen, joka on seurausta testikemikaalin annostelusta silmän etupinnalle eikä korjaudu täysin 21 päivän kuluessa annostelusta. Vaihdettavissa ”Silmälle aiheutuvien palautumattomien vaikutusten” ja ”YK:n GHS-järjestelmän luokan 1” kanssa (4). Validoitu testimenetelmä : Testimenetelmä, jolle on tehty validointitutkimukset sen merkityksellisyyden (myös tarkkuuden) ja luotettavuuden määrittämiseksi tiettyä tarkoitusta varten. On tärkeää huomata, että validoitu testi ei ehkä ole riittävän tarkka ja luotettava, jotta se voitaisiin hyväksyä ehdotettuun tarkoitukseen. Vertailukemikaali : Kemikaali, johon testikemikaalia verrataan. Vertailukemikaalilla on oltava seuraavat ominaisuudet: i) luotettava ja muuttumaton alkuperä, ii) samanlainen rakenne ja toiminta kuin testikemikaaliryhmällä, iii) tunnetut fysikaaliskemialliset ominaisuudet, iv) todisteet tunnetuista vaikutuksista ja v) tunnettu voimakkuus tavoitellulla vasteen vaihteluvälillä. Väärien negatiivisten tulosten osuus : Niiden positiivisten kemikaalien osuus, jotka testimenetelmä yksilöi virheellisesti negatiivisiksi. Se on eräs testimenetelmän suorituskyvyn indikaattoreista. Väärien positiivisten tulosten osuus : Kaikkien negatiivisten kemikaalien osuus, jotka testimenetelmä yksilöi virheellisesti positiivisiksi. Se on eräs testimenetelmän suorituskyvyn indikaattoreista. YK:n GHS-järjestelmän ”Ei luokitusta” : Aineet, jotka eivät täytä YK:n GHS-järjestelmän luokan 1 tai 2 (2A tai 2B) vaatimuksia. Vaihdettavissa määrityksen ”Ei luokiteltu” kanssa. YK:n GHS-järjestelmän luokka 1 : ks. ”Vakava silmävaurio” ja/tai ”Silmälle aiheutuvat palautumattomat vaikutukset”. YK:n GHS-järjestelmän luokka 2 : ks. ”Silmä-ärsytys” ja/tai ”Silmälle aiheutuvat palautuvat vaikutukset”. YK:n kemikaalien maailmanlaajuisesti yhdenmukaistettu luokitus- ja merkintäjärjestelmä (United Nations Globally Harmonized System of Classification and Labelling of Chemicals, UN GHS) : Tässä järjestelmässä kemikaalit (aineet ja seokset) luokitellaan vakioitujen fysikaalisten sekä terveys- ja ympäristövaarojen tyyppien ja tasojen mukaisesti, ja niille osoitetaan vaaraviestinnän tunnukset, kuten kuvamerkit, huomiosanat, vaaralausekkeet, turvalausekkeet ja turvatiedotteet, jotta voidaan välittää tietoa kemikaalien haittavaikutuksista ihmisten ja ympäristön suojelemiseksi (esimerkiksi työnantajille, työntekijöille, kuljetushenkilökunnalle, kuluttajille ja pelastushenkilöstölle) (4). Lisäys 2 PÄTEVYYDEN OSOITTAMISEEN TARKOITETUT KEMIKAALIT ICE-TESTIMENETELMÄÄ VARTEN Ennen kuin laboratorio alkaa käyttää tähän testimenetelmään perustuvaa menetelmää rutiininomaisesti, sen tulisi osoittaa tekninen pätevyytensä määrittämällä oikein taulukossa 1 suositeltujen 13 kemikaalin silmän vaaraluokitus. Kemikaalit valittiin edustamaan silmään kohdistuvia vaaroja koskevia erilaisia vasteita, jotka perustuvat in vivo -kaninsilmätestiin (TG 405) ja YK:n GHS-järjestelmään (eli YK:n GHS-järjestelmän kategorioihin 1, 2A, 2B tai ”Ei luokitusta”) (4) (6). Muita valintaperusteita olivat kemikaalien kaupallinen saatavuus, korkealaatuisten in vivo -vertailutietojen saatavuus ja korkealaatuiset ICE-menetelmän in vitro -tutkimustulokset. Vertailutiedot ovat nähtävissä OECD:n (5) ja ICCVAMin (9) ICE-menetelmää koskevissa tausta-asiakirjoissa. Taulukko 1 Suositellut kemikaalit ICE-menetelmän teknisen pätevyyden osoittamiseksi
Lisäys 3 ICE-TESTISSÄ KÄYTETYN TIPUTUSLAITTEEN JA SILMÄNPITIMIEN KAAVIOT (ks. Burton et al. (18), jossa esitetään yleinen kuvaus tiputuslaitteesta ja silmänpitimestä) 
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
14) |
Korvataan B osassa oleva B.49 luku seuraavasti: ”B.49 In vitro -mikrotumatesti nisäkässoluilla JOHDANTO Tämä testimenetelmä vastaa OECD:n testiohjetta 487 (2016).Se on osa genotoksisuutta koskevien testimenetelmien sarjaa. On laadittu OECD:n asiakirja, jossa ytimekkäitä tietoja geneettistä toksikologiaa koskevista testeistä sekä katsaus näihin testimenetelmiin tehtyihin viimeaikaisiin muutoksiin (1).. In vitro -mikrotumatesti (MNvit) on genotoksisuustesti, jolla määritetään interfaasisolujen sytoplasman mikrotumat. Mikrotumat voivat olla peräisin asentrisista kromosomin osista (joista puuttuu sentromeeri) tai kokonaisista kromosomeista, jotka eivät pysty vetäytymään kohti napoja solunjakautumisen anafaasivaiheessa. Näin ollen MNvit-testi on in vitro -menetelmä, jolla voidaan kattavasti tutkia in vitro kromosomivaurioiden mahdollisuutta, koska sillä voidaan havaita sekä aneugeenit että klastogeenit (2) (3) soluissa, joissa on tapahtunut solun jakautuminen testikemikaalille altistumisen aikana tai sen jälkeen (ks. lähemmin 13 kohta). Mikrotumat edustavat vauriota, jotka ovat välittyneet tytärsoluihin. Sen sijaan metafaasivaiheen soluissa esiintyvät kromosomipoikkeavuudet eivät ehkä välity seuraaviin vaiheisiin. Kummassakin tapauksessa muutokset saattavat vaikuttaa solujen elinkykyyn. Testi voidaan suorittaa niin, että aktiinin polymerisaation inhibiittoria sytokalasiini B:tä (sytoB) käytetään tai ei käytetä. SytoB:n lisääminen ennen tavoiteltua mitoosia johtaa kaksitumaisiin soluihin ja mahdollistaa siten mikrotumien määrittämisen ja analysoinnin ainoastaan niissä soluissa, joissa on tapahtunut yksi mitoosi (4) (5). Tässä testimenetelmässä testisuunnitelmia voidaan soveltaa myös ilman sytokineesin inhibitointia edellyttäen, että analysoitavassa solupopulaatiossa on todistetusti tapahtunut mitoosi. Mikrotumien muodostumista aiheuttavien kemikaalien tunnistamiseksi toteutettavan MNvit-testin lisäksi kromosomivaurioiden ja mikrotuman muodostumisen mekanismeista voidaan saada tietoa myös käyttämällä kinetokorien immunokemiallista merkkausta tai sentromeeri-/telomeerikoettimilla suoritettavaa hybridisaatiota (fluoresenssi- in situ -hybridisaatio (FISH)) (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17). Näitä merkkaus- ja hybridisaatiomenetelmiä voidaan käyttää, kun mikrotumien muodostuminen on kiihtynyt ja tutkija haluaa määrittää, johtuuko kiihtyminen klastogeenisista ja/tai aneugeenisista tapahtumista. Koska interfaasisolujen mikrotumat voidaan havaita suhteellisen objektiivisesti, laboratorion henkilökunnan on vain määritettävä kaksitumaisten solujen määrä sytoB:tä käytettäessä ja mikrotumaisten solujen määrä kaikissa tapauksissa. Näin ollen objektilasit voidaan laskea suhteellisen nopeasti ja analysointi voidaan automatisoida. Tämän takia kussakin käsittelyssä voidaan laskea satojen solujen sijaan tuhansia soluja, mikä lisää testin tehokkuutta. Koska mikrotumia voi syntyä hitaasti liikkuvista (”lagging”) kromosomeista, menetelmällä voidaan havaita aneuploidisia tekijöitä, joita on vaikea tutkia perinteisillä kromosomipoikkeavuustesteillä, kuten OECD:n testiohjeella 473 (tässä liitteessä oleva B.10 luku) (18). MNvit-testillä ei kuitenkaan voida eritellä kromosomimäärän ja/tai ploidian muutoksia aiheuttavia kemikaaleja ja klastogeenisia kemikaaleja ilman erityistekniikoita, kuten 4 kohdassa tarkoitettua FISH-tekniikkaa. MNvit-testi on luotettava ja siinä voidaan käyttää useita eri solutyyppejä joko sytoB:n kanssa tai ilman sitä. Erilaisten solutyyppien (solulinjojen viljelmien sekä primääristen soluviljelmien) käytön soveltuvuudesta MNvit-testiin on saatu kattavia todisteita (19) (20) (21) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35) (36). Näitä ovat etenkin Société Française de Toxicologie Génétique -järjestön (SFTG) koordinoimat kansainväliset validointitutkimukset (19) (20) (21) (22) (23) sekä genotoksisuuden testausta käsittelevän kansainvälisen työryhmän (International Workshop on Genotoxicity Testing) selvitykset (5) (17). Saatavilla olevat tiedot on myös arvioitu uudelleen Euroopan komission alaisen Euroopan vaihtoehtoisten menetelmien validointikeskuksen (ECVAM) tekemässä todistusnäytön jälkivalidointitutkimuksessa, ja ECVAM:in tieteellinen neuvoa-antava komitea (ESAC) on vahvistanut testimenetelmän tieteellisesti päteväksi (37) (38) (39). Nisäkässoluilla tehtävässä MNvit-testissä voidaan käyttää ihmisistä tai jyrsijöistä saatujen solulinjojen viljelmiä tai primäärisiä soluviljelmiä. Koska mikrotumien esiintymistaajuus vaikuttaa taustana testin herkkyyteen, testissä olisi käytettävä solutyyppejä, joissa mikrotumien muodostumisen taustataajuus on tasainen ja selvästi erottuva. Käytettävien solujen valintakriteerejä ovat solujen hyvä kasvukyky viljelmässä, niiden karyotyypin pysyvyys (kromosomiluku mukaan luettuna) ja mikrotumien spontaanifrekvenssi (40). Tällä hetkellä käytettävissä olevat tiedot eivät mahdollista vankkoja suosituksia, mutta viittaavat siihen, että kemiallisia vaaroja arvioitaessa on tärkeää ottaa huomioon p53-status, geneettinen (karyotyypin) pysyvyys, DNA:n korjautumiskyky sekä testattavaksi valittujen solujen alkuperä (jyrsijät vai ihmiset). Näin ollen tämän testimenetelmän käyttäjiä kehotetaan ottamaan huomioon näiden sekä muiden solujen ominaisuuksien vaikutus solulinjan tehokkuuteen mikrotumien muodostumisen havaitsemisessa tietämyksen lisääntyessä tällä alalla. Sovellettavat määritelmät esitetään lisäyksessä 1. ALUSTAVAT NÄKÖKOHDAT JA RAJOITUKSET In vitro -testit edellyttävät yleensä eksogeenista metabolista aktivaatiojärjestelmää, ellei solujen metabolia sovellu kyseisiin testikemikaaleihin. Eksogeeninen metabolinen aktivaatiojärjestelmä ei täysin jäljittele in vivo -olosuhteita. On pyrittävä välttämään erityisesti sellaisia olosuhteita, joissa saatavat väärät positiiviset tulokset eivät heijasta testikemikaalien genotoksisuutta. Tällaisia olosuhteita ovat muun muassa pH-arvon (41) (42) (43) tai osmolaliteetin muutokset, vuorovaikutus soluviljelmän elatusaineen kanssa (44) (45) tai sytotoksisuuden korkea taso (ks. 29 kohta). Mikrotumien muodostumisen analysoimiseksi on tärkeää, että sekä käsitellyissä että käsittelemättömissä viljelmissä on tapahtunut mitoosi. Eniten tietoja mikrotumien laskemiseksi saadaan soluista, joissa on tapahtunut yksi mitoosi testikemikaalilla käsittelyn aikana tai sen jälkeen. Valmistettuja nanomateriaaleja varten tätä testimenetelmää on mukautettava, mutta mukauttamisia ei kuvailla tästä testimenetelmässä. Ennen kuin testimenetelmää käytetään seoksen testaamiseen tietojen tuottamiseksi aiottuun sääntelytarkoitukseen, on harkittava, antaako se asianmukaiset tulokset tämän tavoitteen kannalta, ja jos antaa, miksi. Tällaista harkintaa ei tarvita, jos seoksen testaamista edellytetään sääntelyvaatimuksissa. TESTIN PERIAATE Ihmisistä tai muista nisäkkäistä peräisin olevat soluviljelmät altistetaan testikemikaalille sekä eksogeenisen metabolisen aktivaatiojärjestelmän kanssa että ilman sitä, paitsi jos testissä käytetään soluja, joiden metabolointikyky on riittävä (ks. 19 kohta). Testikemikaalille altistamisen aikana tai sen jälkeen soluja kasvatetaan riittävän kauan, jotta kromosomivauriot tai muut vaikutukset solusykliin/solunjakautumiseen voivat johtaa mikrotuman muodostumiseen inferfaasisoluissa. Jotta aneuploidia muodostuisi, testikemikaalin olisi yleensä oltava läsnä mitoosin aikana. Kerätyt ja värjätyt interfaasisolut analysoidaan mikrotumien havaitsemiseksi. Mikrotumat on laskettava pääasiassa vain niissä soluissa, joissa mitoosi on päättynyt testikemikaalille altistamisen aikana tai käsittelyn jälkeisessä vaiheessa, jos testissä käytetään sitä. Sytokineesin inhibiittorilla käsitellyistä viljelmistä tämä tehdään yksinkertaisesti laskemalla vain kaksitumaiset solut. Jos sytokineesin inhibiittoria ei ole käytetty, on tärkeä osoittaa solupopulaation lisääntymisen perusteella, että analysoiduissa soluissa on todennäköisesti tapahtunut solunjakautuminen testikemikaalille altistumisen aikana tai sen jälkeen. Kaikissa menetelmissä on tärkeä osoittaa, että solut ovat lisääntyneet sekä kontrolliviljelmässä että käsitellyissä viljelmissä, ja testikemikaalin aiheuttamaa sytotoksisuutta tai sytostaasia on arvioitava kaikissa niissä viljelmissä, joiden mikrotumat lasketaan. MENETELMÄN KUVAUS Solut Testeissä voidaan käyttää viljeltyjä ihmisen tai muiden nisäkkäiden perifeerisen veren lymfosyyttejä (7) (20) (46) (47) ja erilaisten jyrsijäsolulinjojen (esimerkiksi CHO, V79, CHL/IU ja L5178Y) tai ihmisen solulinjojen (esimerkiksi TK6) soluja (19) (20) (21) (22) (23) (26) (27) (28) (29) (31) (33) (34) (35) (36) (ks. 6 kohta). Muiden solulinjojen (esimerkiksi HT29 (48), Caco-2 (49), HepaRG (50) (51), HepG2) soluja (52) (53), A549-soluja ja syyrianhamsterialkion primaarisoluja (54) on käytetty mikrotumatestauksessa, mutta toistaiseksi niitä ei ole validoitu laajasti. Tästä syytä näiden solulinjojen ja -tyyppien käyttö on perusteltava esittäen tiedot niiden todistetusta suorituskyvystä testissä Hyväksyttävyysperusteet -kohdan mukaisesti. SytoB:n on raportoitu vaikuttavan mahdollisesti L5178Y-solulinjan solujen kasvuun, ja tästä syystä sitä ei suositella käytettäväksi tämän solulinjan kanssa (23). Primaarisoluja käytettäessä olisi eläinten hyvinvoinnin vuoksi harkittava ihmisestä peräisin olevien solujen käyttöä, kun tämä on mahdollista, edellyttäen, että solut on kerätty ihmisiä koskevien eettisten periaatteiden ja sääntöjen mukaisesti. Ihmisen perifeerisen veren lymfosyytit on kerättävä nuorilta (noin 18–35-vuotiaat), terveiltä, tupakoimattomilta henkilöiltä, joiden ei tiedetä altistuneen äskettäin genotoksisille aineille (esimerkiksi kemikaaleille tai ionisoivalle säteilylle) sellaisilla tasoilla, jotka lisäisivät mikrotumaisten solujen taustaesiintyvyyttä. Näin varmistetaan, että mikrotumaisten solujen taustaesiintyvyys on matala ja tasainen. Mikrotumaisten solujen taustaesiintyvyys kasvaa iän myötä, ja ilmiö on yleisempi naisilla kuin miehillä (55). Jos soluja kerätään useammalta kuin yhdeltä luovuttajalta, luovuttajien määrä on ilmoitettava. On osoitettava, että solut ovat jakautuneet testikemikaalilla käsittelyn aloittamisen ja solujen keräämisen välillä. Soluviljelmiä pidetään eksponentiaalisessa kasvuvaiheessa (solulinjat) tai niitä stimuloidaan jakautumaan (primaariset viljelmät tai lymfosyytit), jotta solut altistetaan solusyklin eri vaiheissa, koska soluasteiden herkkyys testikemikaaleille ei ehkä ole tiedossa. Primaarisolut, joita on niiden jakautumiseksi stimuloitava mitogeenisilla aineilla, eivät yleensä ole enää synkronoituja testikemikaalille altistamisen aikana (esimerkiksi ihmisen lymfosyytit 48 tuntia kestävän mitogeenisen stimulaation jälkeen). Synkronoitujen solujen käyttöä testikemikaalilla käsittelyn aikana ei suositella, mutta se voidaan perustelluissa tapauksissa hyväksyä. Elatusaineet ja viljelyolosuhteet Soluviljelmiä on viljeltävä sopivissa kasvatusväliaineissa ja inkubaatio-olosuhteissa (kasvatusastiat, kosteutettu ilmakehä, jonka CO2-pitoisuus on 5 %, 37 °C:n lämpötila). Solulinjoista on tarkistettava ajoittain modaalisen kromosomimäärän pysyvyys ja varmistettava, ettei ole mykoplasmakontaminaatiota. Soluja ei pidä käyttää, jos ne ovat kontaminoituneet tai jos modaalinen kromosomimäärä on muuttunut. Normaali solusyklin kesto testauslaboratoriossa käytetyissä solulinjoissa tai primaarisissa soluviljelmissä on määritettävä ja sen on oltava solujen julkaistujen ominaisuuksien mukainen. Soluviljelmien valmistelu Solulinjat: solut kasvatetaan kantaviljelmistä ja kylvetään elatusaineeseen sellaiseen tiheyteen, että suspensioissa tai yksikerrosviljelmissä olevat solut kasvavat eksponentiaalisesti keräämisajankohtaan asti (esimerkiksi konfluenttisuutta olisi vältettävä yksikerrosviljelmissä kasvavien solujen osalta). Lymfosyytit: antikoagulantilla (esimerkiksi hepariinilla) käsiteltyä kokoverta tai erotettuja lymfosyyttejä viljellään (esimerkiksi 48 tunnin ajan ihmisen lymfosyyttien osalta) mitogeenin (esimerkiksi fytohemagglutiniini, PHA) kanssa solunjakautumisen indusoimiseksi ennen testikemikaalille ja sytoB:lle altistamista. Metabolinen aktivaatio Jos solujen endogeeninen metabolointikyky ei ole riittävä, on käytettävä eksogeenisia metabolisia järjestelmiä. Yleisimmin käytetty aktivaatiojärjestelmä, jota suositellaan oletusarvoisesti, ellei jokin muu järjestelmä ole perusteltu, on entsyymejä indusoivilla aineilla, kuten Aroclor 1254:llä (56) (57) tai fenobarbitonin ja b-naftoflavonin (58) (59) (60) yhdistelmällä, käsiteltyjen jyrsijöiden (yleensä rottien) maksasta eristetty postmitokondriaalinen jae (S9), johon on lisätty kofaktoria. Jälkimmäisenä mainittu yhdistelmä ei ole ristiriidassa pysyviä orgaanisia yhdisteitä koskevan Tukholman yleissopimuksen (61) kanssa, ja sen on osoitettu indusoivan sekaoksidaasia yhtä tehokkaasti kuin Aroclor 1254:n (58) (59) (60). S9-jakeen yleisesti käytetty pitoisuusalue on 1–2 tilavuusprosenttia, mutta sen pitoisuutta voidaan nostaa 10 tilavuusprosenttiin lopullisessa testiväliaineessa. Mitoosi-indeksiä vähentäviä tuotteita, varsinkin kalsiumkomplekseja aiheuttavia tuotteita (62), olisi vältettävä käsittelyn aikana. Testattavien kemikaalien luokka saattaa vaikuttaa siihen, mitä eksogeenisen metabolisen aktivaatiojärjestelmän tai metabolisen indusoijan tyyppiä ja pitoisuutta päätetään käyttää. Testikemikaalin valmistus Kiinteät testikemikaalit on valmistettava sopivissa liuottimissa ja tarvittaessa laimennettava ennen solujen käsittelyä. Nestemäiset testikemikaalit voidaan lisätä suoraan koejärjestelmiin ja/tai laimentaa ennen testijärjestelmän käsittelyä. Kaasujen tai haituvien kemikaalien testauksessa standardimenettelyihin on tehtävä asianmukaisia mukautuksia. Kyseiset kaasut tai kemikaalit on esimerkiksi käsiteltävä suljetuissa astioissa (63) (64) (65). Testikemikaali on valmistettava juuri ennen käsittelyä, paitsi jos sen säilyvyys on osoitettu stabiliteettitesteillä. Testiolosuhteet Liuottimet Liuotin on valittava siten, että testikemikaalien liukoisuus on mahdollisimman hyvä eikä tämä haittaa testin suorittamista esimerkiksi muuttamalla solukasvua, vaikuttamalla testikemikaalin eheyteen, reagoimalla viljelyastioiden kanssa tai haittaamalla metabolista aktivaatiojärjestelmää. Vesipitoisen liuottimen (tai soluviljelmän elatusaineen) käyttöä on harkittava ensisijaisesti aina, kun se on mahdollista. Hyvin tunnettuja liuottimia ovat vesi ja dimetyylisulfoksidi (DMSO). Yleisesti ottaen orgaanisten liuottimien pitoisuus saa olla enintään 1 tilavuusprosentti. Jos sytoB:tä liuotetaan DMSO:hon, sekä testikemikaalia että sytoB:tä varten käytettävän orgaanisen liuottimen kokonaismäärä saa olla enintään 1 tilavuusprosentti; muussa tapauksessa on käytettävä käsittelemättömiä kontrolleja sen varmistamiseksi, että orgaanisen liuottimen pitoisuudella ei ole haitallisia vaikutuksia. Vesipitoisten liuottimien (suolaliuoksen tai veden) pitoisuus lopullisessa kasvatusväliaineessa saa olla enintään 10 tilavuusprosenttia. Jos testissä käytetään muita kuin hyvin tunnettuja liuottimia (esimerkiksi etanolia tai asetonia), niiden käyttö on perusteltava tiedoilla, joilla osoitetaan, että ne ja testikemikaali sopivat yhteen ja että ne eivät ole genotoksisia käytettyinä pitoisuuksina. Tällaisten perustelevien tietojen puuttuessa on tärkeää käyttää käsittelemättömiä kontrolleja (ks. lisäys 1) sekä liuotinkontrolleja, jotka osoittavat, ettei valitulla liuottimella ole haitallisia eikä kromosomeihin kohdistuvia vaikutuksia (esimerkiksi aneuploidia tai klastogeenisyys). SytoB:n käyttö sytokineesin inhibiittorina Yhtenä MNvit-testin tärkeimpänä näkökohtana on varmistaa, että lasketuissa soluissa on tapahtunut mitoosi käsittelyn aikana tai käsittelyä seuraavalla inkubaatiojaksolla, jos sitä on käytetty. Tästä syystä mikrotumien laskeminen on rajoitettava soluihin, joissa on tapahtunut mitoosi käsittelyn aikana tai sen jälkeen. Sytokineesin inhibiittorina käytetään yleisimmin sytoB:tä, koska se estää aktiinin muodostumisen ja näin ollen estää tytärsolujen erkaantumisen mitoosin jälkeen, mikä johtaa kaksitumaisten solujen muodostumiseen (6) (66) (67). Testikemikaalin vaikutus solujen proliferaation kinetiikkaan voidaan mitata samanaikaisesti sytoB:tä käytettäessä. Ihmisen lymfosyyttejä käytettäessä sytokineesin inhibiittorina on käytettävä sytoB:tä, koska solusyklin kesto vaihtelee eri luovuttajien välillä ja koska kaikki lymfosyytit eivät reagoi PHA-stimulaatioon. SytoB:n käyttö ei ole pakollista muita solutyyppejä käytettäessä, jos voidaan osoittaa 27 kohdassa kuvatulla tavalla, että ne ovat jakautuneet. Lisäksi sytoB:tä ei yleensä käytetä, kun näytteitä arvioidaan mikrotumien havaitsemiseksi virtaussytometrisillä menetelmillä. Laboratorion on määritettävä sopiva sytoB:n pitoisuus erikseen kullekin solutyypille, jotta liuottimella käsiteltyjen kontrolliviljelmien kaksitumaisten solujen määrä voidaan optimoida, ja pitoisuuden on osoitettava tuottavan hyvän kaksitumaisten solujen saannon laskemista varten. Yleensä SytoB:n sopiva pitoisuus on 3–6 μg/ml (19). Solujen proliferaation ja sytotoksisuuden mittaaminen ja käsittelypitoisuuksien valitseminen Päätettäessä testikemikaalin suurimmasta pitoisuudesta on vältettävä pitoisuuksia, jotka voivat aiheuttaa vääriä positiivisia vasteita, kuten liian voimakasta sytotoksisuutta (ks. 29 kohta), saostumista väliaineeseen (ks. 30 kohta) tai pH-arvon tai osmolaliteetin merkittävää muuttumista (ks. 9 kohta). Jos testikemikaali aiheuttaa sitä lisättäessä väliaineen pH-arvon merkittävän muuttumisen, pH-arvoa voidaan mukauttaa puskuroimalla lopullinen käsittelyväliaine väärien myönteisten tulosten välttämiseksi ja asianmukaisten viljelyolosuhteiden säilyttämiseksi. Solujen proliferaation mittauksella varmistetaan, että riittävän monissa käsitellyissä soluissa on tapahtunut mitoosi testin aikana ja että käsittelyissä on käytetty asianmukaisia sytotoksisuustasoja (ks. 29 kohta). Sytotoksisuus on määritettävä pääasiallisessa kokeessa sekä metabolisen aktivaatiojärjestelmän läsnäollessa että ilman sitä käyttäen asianmukaisia solukuoleman ja solukasvun indikaattoreita (ks. 26 ja 27 kohta). Vaikka sytotoksisuuden arviointi alustavassa testissä voi olla hyödyksi, jotta voidaan määrittää pääasiallisessa kokeessa käytettävät pitoisuudet, alustava testi ei ole pakollinen. Jos se suoritetaan, se ei saa korvata sytotoksisuuden mittausta pääasiallisessa kokeessa. Kun viljelmät käsitellään sytoB:llä ja viljelmän yksitumaisten, kaksitumaisten ja monitumaisten solujen suhteellinen osuus määritetään, käsittelyn täsmällinen vaikutus solujen proliferaatioon ja solun sytotoksiseen tai sytostaattiseen toimintaan voidaan määrittää kvantitatiivisesti (6). Lisäksi varmistetaan, että mikroskoopilla tehtävässä laskennassa huomioon otetaan vain solut, jotka ovat jakautuneet käsittelyn aikana tai sen jälkeen. Sytokineesin eston proliferaatioindeksiä (6) (27) (68) tai replikaatioindeksiä (RI), joka on määritetty vähintään 500 solulle viljelmää kohti, suositellaan käsittelyn sytotoksisen ja sytostaattisen toiminnan arvioimiseksi vertailemalla käsiteltyjen viljelmien ja kontrolliviljelmien arvoja. Myös muiden sytotoksisuuden merkkien (esimerkiksi solujen eheyden, apoptoosin, nekroosin, metafaasien määrän ja solusyklin) arvioinnilla voidaan saada hyödyllistä tietoa, mutta sitä ei saa käyttää sytokineesin eston proliferaatioindeksin tai RI:n sijasta. Ilman sytoB:tä tehtävissä tutkimuksissa on osoitettava, että viljelmän solut ovat jakautuneet siten, että merkittävä osuus lasketuista soluista on jakautunut testikemikaalilla käsittelyn aikana tai sen jälkeen. Muussa tapauksessa tutkimuksesta voidaan saada vääriä negatiivisia tuloksia. Populaation suhteellisen kaksinkertaistumisen (PSK) tai solumäärän suhteellisen lisääntymisen (SMSL) määrittämistä suositellaan käsittelyn sytotoksisen ja sytostaattisen toiminnan arvioimiseksi (17) (68) (69) (70) (71) (ks. kaavat lisäyksessä 2). Kun näytteenottoajat ovat pitkiä (esimerkiksi käsittely 1,5–2 normaalia solusykliä vastaavan ajan ja kerääminen 1,5–2 normaalia solusykliä vastaavan ajan tämän jälkeen, jolloin näytteenottoajat ovat yhteensä 3–4 normaalia solusykliä, kuten 38 ja 39 kohdassa kuvataan), PSK saattaa johtaa sytotoksisuuden aliarviointiin (71). Tällaisissa olosuhteissa SLSM saattaa olla parempi mittari, tai sytotoksisuuden arviointi 1,5–2 normaalia solusykliä vastaavan ajan jälkeen antaisi hyödyllisen arvion. Myös muiden sytotoksisuuden tai sytostaattisuuden merkkien (esimerkiksi solujen eheyden, apoptoosin, nekroosin, metafaasien määrän, profileraatioindeksin (PI), solusyklin, tumasiltojen tai mikrotumien) arvioinnilla voidaan saada hyödyllistä tietoa, mutta sitä ei saa käyttää PSK:n tai SMSL:n sijasta. Vähintään kolmea hyväksyttävyysperusteet (asianmukainen sytotoksisuus, solumäärä jne.) täyttävää testipitoisuutta (pois lukien liuotinkontrolli ja positiiviset kontrollit) on arvioitava. Solujen tyypistä riippumatta (solulinjat tai primaariset lymfosyyttiviljelmät) kullekin testattavalle pitoisuudelle voidaan altistaa kaksi rinnakkaista viljelmää tai vain yksi viljelmä. Vaikka rinnakkaisten viljelmien käyttö on suositeltavaa, vain yhden viljelmän käyttö on myös hyväksyttävää edellyttäen, että yksittäisestä viljelmästä tai rinnakkaisviljelmistä lasketaan sama kokonaismäärä soluja. Yhden viljelmän käyttö on erityisen merkityksellistä, kun arvioidaan useampaa kuin kolmea pitoisuutta (ks. 44–45 kohta). Riippumattomista rinnakkaisviljelmistä tietyllä pitoisuudella saadut tulokset voidaan yhdistää analyysia varten. Sellaisten testikemikaalien kohdalla, jotka osoittavat vähän tai eivät lainkaan sytotoksisuutta. sopiva pitoisuuksien välinen kerroin on yleensä 2–3. Jos sytotoksisuutta esiintyy, valittujen testipitoisuuksien on katettava vaihteluväli 29 kohdassa kuvatusta sytotoksisuudesta vähäiseen sytotoksisuuteen tai tasoon, jolla sytotoksisuutta ei esiinny lainkaan. Monien testikemikaalien pitoisuus-vastekäyrä on jyrkkä, ja tietojen saamiseksi vähäisestä ja keskitason sytotoksisuustasosta tai annosvastesuhteen tutkimiseksi tarkasti on käytettävä pitoisuuksia, jotka ovat lähempänä toisiaan, ja/tai useampaa kuin kolmea pitoisuutta (yksittäisiä viljelmiä tai rinnakkaisviljelmiä) erityisesti tilanteissa, joissa tarvitaan toistettuja kokeita (ks. 60 kohta). Jos enimmäispitoisuus perustuu sytotoksisuuteen, suurimmassa pitoisuudessa sytotoksisuuden olisi oltava 55 ± 5 prosenttia suositeltuja sytotoksisuusparametreja käyttäen (solulinjojen SMSL:n ja PSK:n väheneminen, kun sytoB:tä ei käytetä, ja sytokineesin eston proliferaatioindeksin tai RI:n pieneneminen 45 ± 5 prosentin tasoon samanaikaisesta negatiivisesta kontrollista, kun sytoB:tä käytetään (72). Tulkittaessa vain tämän sytotoksisuuden 55 ± 5 prosentin vaihteluvälin yläpäässä havaittuja positiivisia tuloksia on oltava varovainen (71). Sellaisten huonosti liukenevien testikemikaalien kohdalla, jotka eivät ole sytotoksisia pienintä liukenematonta pitoisuutta pienemmissä pitoisuuksissa, suurimmassa analysoitavassa pitoisuudessa on esiinnyttävä testikemikaalilla käsittelyn päättyessä silmin tai käänteismikroskoopilla havaittavaa sameutta tai saostumista.Vaikka sytotoksisuutta esiintyisi pienintä liukenematonta pitoisuutta pienemmissä pitoisuuksissa, on suosit eltavaa testata vain yhdessä sameutta tai näkyvää saostumista aiheuttavassa pitoisuudessa, koska saostuminen saattaa aiheuttaa vääriä vasteita. Saostumista aiheuttavissa pitoisuuksissa on huolehdittava siitä, että saostuminen ei vaikuta testin suorittamiseen (esimerkiksi värjäykseen tai laskemiseen). Ennen koetta saattaa olla hyödyllistä määrittää liukoisuus soluviljelmän elatusaineeseen. Jos saostumista tai rajoittavaa sytotoksisuutta ei esiinny, suurimman testipitoisuuden on vastattava tasoa 10 mM, 2 mg/ml tai 2 μl/ml sen mukaan, mikä pitoisuuksista on pienin (73) (74) (75). Jos testikemikaalin koostumusta ei ole määritelty eli se on esimerkiksi koostumukseltaan tuntematon tai vaihteleva aine, kompleksien reaktiotuote tai biologinen materiaali (UCVB) (76) tai ympäristöstä otettu näyte, suurimman pitoisuuden on riittävän sytotoksisuuden puuttuessa ehkä oltava suurempi (esimerkiksi 5 mg/ml) kunkin osan pitoisuuden lisäämiseksi. On kuitenkin huomattava, että nämä vaatimukset voivat vaihdella ihmisille tarkoitettujen lääkkeiden osalta (93). Kontrollit Jokaisena solujen keräämisajankohtana on otettava samanaikaisesti näytteet myös negatiivisista kontrolleista (ks. 21 kohta), jotka koostuvat pelkästä tutkittavaa ainetta sisältävässä kasvatusväliaineessa olevasta liuottimesta ja joita on käsitelty samalla tavoin kuin altistettuja viljelmiä. Samanaikaisia positiivisia kontrolleja tarvitaan, jotta voidaan osoittaa laboratorion kyky tunnistaa klastogeenejä ja aneugeenejä käytetyn testisuunnitelman olosuhteissa sekä eksogeenisen metabolisen aktivaatiojärjestelmän tehokkuus (tarvittaessa). Esimerkkejä positiivisista kontrolleista esitetään jäljempänä taulukossa 1. Vaihtoehtoisia positiivisia kontrollikemikaaleja voidaan käyttää perustelluissa tapauksissa. Tähän mennessä ei ole havaittu, että yhdenkään aneugeenin genotoksinen toiminta edellyttäisi metabolista aktivaatiota (17). Koska nisäkässoluilla tehtävät in vitro -geenitoksisuustestit on standardoitu riittävästi samanaikaisesti metabolisen aktivaation kanssa ja ilman sitä tehtäviä ja lyhyitä kestoltaan samoja käsittelyjä varten, positiivisten kontrollien käyttö voidaan rajoittaa metabolista aktivaatiota edellyttävään klastogeeniin. Tässä tapauksessa yksikin klastogeeninen positiivinen kontrollisvaste osoittaa sekä metaboolisen aktivaatiojärjestelmän toiminnan että testijärjestelmän herkkyyden. Pidennetyllä käsittelyllä (ilman S9-jaetta) on kuitenkin oltava oma positiivinen kontrollinsa, koska käsittelyn kesto poikkeaa testistä, jossa käytetään metabolista aktivaatiota. Jos lyhyen metabolisen aktivaation kanssa ja ilman sitä suoritettavan käsittelyn ainoaksi positiiviseksi kontrolliksi valitaan klastogeeni, pidennetyn ilman metabolista aktivaatiota suoritettavan käsittelyn kontrolliksi on valittava aneugeeni. Sekä klastogeenisuuden että aneugeenisuuden positiivisia kontrollikemikaaleja on käytettävä metabolialtaan soveltuvissa soluissa, joissa ei tarvita S9-jaetta Kutakin positiivista kontrollikemikaalia on käytettävä yhtenä tai useampana pitoisuutena, joiden voidaan odottaa aiheuttavan toistettavissa ja havaittavissa olevan lisääntymisen taustaan verrattuna, mikä osoittaa koejärjestelmän herkkyyden (vaikutukset ovat selvät mutta eivät paljasta heti lukijalle koodattujen objektilasien identiteettiä), eikä tässä testimenetelmässä määritetyt raja-arvot ylittävä sytotoksisuustaso saa vaarantaa vasteen luotettavuutta. Taulukko 1 Laboratorion pätevyyden arviointia ja positiivisten kontrollien valintaa varten suositellut vertailukemikaalit
MENETTELY Altistusohjelma Jotta aneugeenin tai klastogeenin toiminta tietyssä solusyklin vaiheessa voidaan mahdollisimman todennäköisesti osoittaa, on tärkeää, että testikemikaalilla käsitellään riittävä määrä soluja niiden kaikissa solusyklin vaiheissa. Kaikki käsittelyt on käynnistettävä ja saatava päätökseen, kun solut kasvavat eksponentiaalisesti, ja solujen on jatkettava kasvuaan näytteenottoajankohtaan asti. Solulinjojen ja primääristen soluviljelmien käsittelyaikataulu voi näin ollen poiketa jonkin verran lymfosyyttien käsittelyaikataulusta, sillä niiden solusyklin käynnistyminen edellyttää mitogeenista stimulaatiota (17). Tehokkain menetelmä lymfosyyteille on aloittaa testikemikaalille altistaminen 44–48 tunnin kuluttua PHA-stimulaatiosta, kun solut jakautuvat asynkronisesti (6). Julkaistujen tietojen perusteella (19) useimmat aneugeenit ja klastogeenit voidaan osoittaa S9-jakeen kanssa ja ilman S9-jaetta toteutettavalla 3–6 tuntia kestävällä lyhyellä käsittelyjaksolla, jonka jälkeen testikemikaali poistetaan ja solut kerätään noin 1,5–2,0 normaalin solusyklin kuluttua käsittelyn aloittamisen jälkeen (7). Negatiivisen tuloksen vahvistamiseksi tarvittavaa perusteellista arviointia varten testi on kuitenkin suoritettava kaikissa seuraavissa kolmessa testiolosuhteissa, joissa käytetään lyhytkestoista käsittelyä metabolisen aktivaatiojärjestelmän läsnäollessa sekä ilman metabolista aktivaatiota (ks. 56, 57 ja 58 kohta)
Jos joissakin edellä esitetyistä testiolosuhteista saadaan positiivinen vaste, muita altistusohjelmia ei ole välttämättä tarpeen tutkia. Jos tiedetään tai oletetaan, että testikemikaali vaikuttaa solusyklin kestoon (esimerkiksi kun testataan nukleosidianalogeja) erityisesti testattaessa p53-proteiinia vastaanottamaan kompetentteja soluja (35) (36) (77), näytteenotto- tai palautumisaikoja voidaan pidentää vielä 1,5–2,0 normaalia solusykliä vastaavalla ajalla (eli yhteensä 3,0–4,0 solusyklin mittaisiksi lyhyt- ja pitkäkestoisen käsittelyn aloittamisesta). Näin voidaan ottaa huomioon testikemikaalin ja sytoB:n mahdollinen vuorovaikutus. Kun käytetään pidennettyjä näytteenottoaikoja (yhteensä 3,0–4,0 solusyklin mittaisia viljelyaikoja), on huolehdittava siitä, että solut jakautuvat yhä aktiivisesti. Esimerkiksi lymfosyyttien eksponentiaalinen kasvu voi hidastua 96 tunnin kuluttua stimulaatiosta, ja yksikerrosviljemistä voi tulla konfluentteja. Solujen ehdotetut käsittelyaikataulut esitetään taulukossa 2. Näitä yleisiä käsittelyaikatauluja voidaan mukauttaa (tämä on perusteltava) testikemikaalin stabiiliuden tai reaktiivisuuden tai käytettävien solujen erityisten kasvuominaisuuksien mukaisesti. Taulukko 2 Solujen käsittely- ja keräämisajankohdat MNvit-testissä
Yksikerrosviljelmissä voi esiintyä mitoosissa olevia soluja (pyöreitä, irtoavat pinnasta) 3–6 tuntia kestävän käsittelyn päättyessä. Koska mitoosissa olevat solut irtoavat helposti, ne voivat hävitä testikemikaalia sisältävän väliaineen mukana, kun se kaadetaan pois. Jos mitoosissa olevien solujen määrän havaitaan lisääntyvän huomattavasti kontrolleihin verrattuna, mikä viittaa todennäköisesti mitoosin pysähtymiseen, solut on kerättävä sentrifugoimalla ja palautettava viljelmään, jotta mitoosivaiheessa olevia soluja, joissa mikrotumia/kromosomipoikkeavuuksia voi muodostua, ei menetetä keruuvaiheessa. Solujen kerääminen ja objektilasien preparointi Jokainen viljelmä kerätään ja käsitellään erikseen. Solujen preparointiin voidaan käyttää hypotonista käsittelyä, mutta tämä vaihe ei ole tarpeen, jos solut levittäytyvät lasille riittävästi. Objektilasien preparoinnissa voidaan käyttää erilaisia tekniikoita edellyttäen, että pisteytystä varten saadaan korkealaatuisia solupreparaatteja. Solut, joiden solukalvo ja solulima ovat vahingoittumattomia, on säilytettävä mikrotumien osoittamista ja (sytokineesin estämiseen perustuvassa menetelmässä) kaksitumaisten solujen luotettavaa tunnistamista varten. Objektilasit voidaan värjätä erilaisilla menetelmillä, kuten Giemsa-menetelmällä tai fluorisoivilla DNA-spesifisillä väriaineilla. Asianmukaisten fluorisoivien väriaineiden (esimerkiksi akridiinioranssin (78) tai Hoechst 33258:n plus pyroniini-Y:n (79)) käytöllä voidaan eliminoida joitakin ei-DNA-spesifisen väriaineen käyttöön liittyviä artefakteja. Mikrotumien sisällön selvittämisessä (kokonaiset kromosomit värjäytyvät, mutta asentriset kromosomifragmentit eivät) voidaan käyttää anti-kinetokorivasta-aineita, FISH-tekniikkaa yhdessä pansentromeeri-DNA-koettimien kanssa tai in situ -merkkausta pansentromeerispesifisillä alukkeilla yhdessä sopivan DNA:n vastavärjäyksen kanssa, jos mikrotumien muodostumisesta halutaan saada mekanistista tietoa (16) (17). Muita klastogeenien ja aneugeenien erottelumenetelmiä voidaan käyttää, jos menetelmät on osoitettu tehokkaiksi ja validoitu. Esimerkiksi tietyissä solulinjoissa sellaisten tumien määrittäminen, joiden kromosomimäärä on alle 2N, hypodiploidisina tapahtumina kuva-analyysin, laserpyyhkäisysytometrian tai virtaussytometrian kaltaisten menetelmien avulla voi myös antaa hyödyllistä tietoa (80) (81) (82). Myös morfologiset havainnot tumista voivat antaa viitteitä mahdollisesta aneuploidiasta. Lisäksi metafaasissa olevien solujen kromosomipoikkeavuustesti, joka suoritetaan mieluiten samalla solutyypillä ja herkkyydeltään vastaavalla testisuunnitelmalla, saattaa myös olla hyödyllinen tapa määrittää, johtuvatko mikrotumat kromosomien katkeamisesta (kun tiedetään, että kromosomien häviämää ei havaittaisi kromosomipoikkeavuustestissä). Analyysi Kaikki objektilasit, myös negatiivisia ja käsittelemättömiä kontrolleja (jos niitä käytetään) ja positiivisia kontrolleja sisältävät, on koodattava toisistaan riippumattomasti ennen mikrotumien esiintymistaajuuden mikroskooppitutkimusta. Käytettäessä automatisoitua pisteytysjärjestelmää, kuten virtaussytometriaa, laserpyyhkäisysytometriaa tai kuva-analyysia, on käytettävä tarvittavia menetelmiä mahdollisten virheiden tai muutosten valvomiseksi. Riippumatta siitä, käytetäänkö mikrotumien laskentaan automaattista järjestelmää, olisi arvioitava samanaikaisesti sytokineesin eston proliferaatioindeksi, RI, PSK tai SMSL. SytoB-käsiteltyjen viljelmien mikrotumien määrä on analysoitava vähintään 2 000 kaksitumaisessa solussa kutakin pitoisuutta ja kontrollia kohti (83). Solujen on jakauduttava tasaisesti rinnakkaisviljelmien kesken, mikäli niitä käytetään. Jos käytetään yhtä erillistä viljelmää (ks. 28 kohta), viljelmästä on laskettava vähintään 2 000 kaksitumaista solua viljelmää kohti (83). Jos kussakin pitoisuudessa laskettavissa on huomattavasti vähemmän kuin 1 000 kaksitumaista solua (jos käytetään rinnakkaisviljelmiä) tai 2 000 solua (jos käytetään yhtä viljelmää) viljelmää kohti ja jos mikrotumien määrä ei havaintojen mukaan ole kasvanut merkittävästi, testi on toistettava useammilla soluilla tai vähemmän sytotoksisilla pitoisuuksilla sen mukaisesti, kumpi vaihtoehto soveltuu tarkoitukseen paremmin. On varmistettava, että muodoltaan epäsäännöllisiä kaksitumaisia soluja tai soluja, joiden kaksi tumaa poikkeavat kooltaan huomattavasti toisistaan, ei lasketa. Kaksitumaisia soluja ei myöskään saa sekoittaa huonosti levittyneisiin monitumaisiin soluihin. Useampia kuin kaksi päätumaa sisältävistä soluista ei pitäisi analysoida mikrotumia, koska mikrotumien määrä voi olla tällaisissa soluissa suurempi (84). Yksitumaisten solujen laskeminen hyväksytään, jos testikemikaalin on osoitettu häiritsevän sytoB:n aktiivisuutta. Testin toistaminen ilman sytoB:tä saattaa olla tällaisissa tapauksissa hyödyllistä. Yksitumaisten solujen laskeminen kaksitumaisten solujen lisäksi saattaa antaa hyödyllistä tietoa (85) (86), mutta se ei ole pakollista. Solulinjoissa, jotka testataan ilman sytoB-käsittelyä, mikrotumat olisi pisteytettävä vähintään 2 000 solussa testattavaa pitoisuutta ja kontrollia kohti (83). Solujen on jakauduttava tasaisesti rinnakkaisviljelmien kesken, mikäli niitä käytetään. Jos käytetään yhtä erillistä viljelmää pitoisuutta kohti (ks. 28 kohta), viljelmästä on laskettava vähintään 2 000 kaksitumaista solua viljelmää kohti. Jos kussakin pitoisuudessa laskettavissa on huomattavasti vähemmän kuin 1 000 solua (jos käytetään rinnakkaisviljelmiä) tai 2 000 solua (jos käytetään yhtä viljelmää) viljelmää kohti ja jos mikrotumien määrä ei havaintojen mukaan ole kasvanut merkittävästi, testi on toistettava useammilla soluilla tai vähemmän sytotoksisilla pitoisuuksilla sen mukaisesti, kumpi vaihtoehto soveltuu tarkoitukseen paremmin. Kun sytoB:tä käytetään, sytokineesin eston proliferaatioindeksi tai RI on määritettävä solujen proliferaation arvioimiseksi (ks. lisäys 2) käyttämällä vähintään 500:aa solua viljelmää kohti. Kun käsittely tehdään ilman sytoB:tä, on tärkeää esittää todisteet siitä, että laskettavat solut ovat jakautuneet (ks. 24–28 kohta). Laboratorion pätevyys Jotta laboratoriolla voidaan todeta olevan riittävä kokemus testistä ennen sen käyttöä rutiinitestauksessa, laboratorion täytyy olla suorittanut useita kokeita positiivisilla vertailukemikaaleilla, jotka vaikuttavat eri mekanismien välityksellä (ainakin yksi metabolisen aktivaatiojärjestelmän läsnäollessa ja yksi ilman sitä sekä yksi aneugeenisen mekanismin välityksellä vaikuttava kemikaali, jotka valitaan taulukossa 1 luetelluista kemikaaleista), sekä useita negatiivisia kontrolleja (joihin sisältyy käsittelemättömiä viljelmiä ja erilaisia liuottimia/kantaja-aineita). Näiden positiivisten ja negatiivisten kontrollien vasteiden olisi oltava yhdenmukaisia lähdekirjallisuuden kanssa. Tätä ei sovelleta laboratorioihin, joilla on kokemusta eli joista on käytettävissä 49–52 kohdassa määritelty laboratoriokohtainen tietokanta. Tiettyjä positiivisia kontrollikemikaaleja (ks. taulukko 1) on tutkittava lyhyillä ja pidennetyillä käsittelyillä ilman metabolista aktivaatiota ja myös lyhyellä käsittelyllä metabolisen aktivaatiojärjestelmän läsnäollessa, jotta osoitetaan pätevyys havaita klastogeenisia ja aneugeenisia kemikaalisia, määrittää metabolisen aktivaatiojärjestelmän tehokkuus ja osoittaa laskentamenetelmien (mikroskooppianalyysi, virtaussytometria, laserpyyhkäisysytometria tai kuva-analyysi) soveltuvuus. Valittujen kemikaalien eri pitoisuudet on valittava siten, että ne aiheuttavat toistettavissa olevia ja pitoisuuteen liittyviä lisääntymisiä taustaan verrattuna, koejärjestelmän herkkyyden ja dynaamisen alueen osoittamiseksi. Aiemmat kontrollitiedot Laboratorion on määritettävä:
Hankittaessa aluksi tietoja aiempien negatiivisten kontrollien jakaumaa varten samanaikaisten negatiivisten kontrollien on oltava yhdenmukaisia julkaistujen negatiivisten kontrollitietojen kanssa, jos sellaisia on olemassa. Kun kontrollien jakaumaan lisätään kokeellisia tietoja, samanaikaisten negatiivisten kontrollien olisi mieluiten sijoituttava kyseisen jakauman 95 prosentin kontrollirajojen sisälle (87) (88). Laboratorion aiempien negatiivisten kontrollien tietokanta on aluksi luotava vähintään 10 kokeella, mutta sen olisi mieluiten koostuttava vähintään 20 kokeesta, jotka on suoritettu vastaavissa testiolosuhteissa. Laboratorioiden on käytettävä laadunvalvontamenetelmiä, kuten laadunvalvontakortteja (esimerkiksi C-kortteja tai X-bar-kortteja (88)), positiivisten ja negatiivisten kontrollitietojensa vaihtelevuuden määrittämiseksi ja osoittaakseeen, että laboratorio ”hallitsee” menetelmän (83). Lisäsuosituksia aiempien tietojen muodostamisesta ja käytöstä (esimerkiksi perusteet tietojen sisällyttämiseksi aiempiin tietoihin tai jättämiseksi pois niistä sekä kokeiden hyväksyttävyysperusteet) annetaan lähdekirjallisuudessa (87). Mahdollisissa koejärjestelyn muutoksissa olisi otettava huomioon tietojen yhdenmukaisuus laboratorion olemassa olevien aiempia kontrolleja koskevien tietokantojen kanssa. Jos havaitaan merkittäviä epäjohdonmukaisuuksia, on luotava uusi aiempien kontrollien tietokanta. Negatiivisten kontrollitietojen on koostuttava mikrotumaisten solujen esiintymistiheydestä yhdessä viljelmässä tai niiden yhteismäärästä rinnakkaisviljelmissä 28 kohdan mukaisesti. Samanaikaisten negatiivisten kontrollien olisi mieluiten sijoituttava laboratorion aiempien negatiivisten kontrollien tietokannan 95 prosentin kontrollirajojen sisälle (87) (88). Jos samanaikaisia negatiivisia kontrolleja koskevat tiedot jäävät 95 prosentin kontrollirajojen ulkopuolelle, ne voidaan hyväksyä aiempien kontrollien jakaumaan edellyttäen, että ne eivät ole äärimmäisiä harha-arvoja ja on näyttöä siitä, että testijärjestelmä on ”hallinnassa” (ks. 50 kohta), sekä siitä, että kyse ei ole teknisestä tai inhimillisestä virheestä. TIEDOT JA RAPORTOINTI Tulosten esittäminen Jos käytetään sytokineesin inhibiittoritekniikkaa, mikrotumien indusoitumisen arvioinnissa käytetään vain sellaisia kaksitumaisia soluja, joissa esiintyy mikrotumia (riippumatta mikrotumien määrästä solua kohti). Yksi, kaksi tai monta mikrotumaa omaavien solujen määrä voidaan ilmoittaa erikseen, ja sen laskemisella voidaan saada hyödyllistä tietoa, mutta se ei ole pakollista. Kaikille käsitellyille, negatiivisille ja positiivisille kontrolliviljelmille olisi tehtävä samanaikaisesti sytotoksisuus- ja/tai sytostaasimääritykset (16). Sytokineesin eston proliferaatioindeksi tai RI on laskettava kaikille käsitellyille viljelmille ja kontrolliviljelmille määrittämällä solusyklin viivästyminen, kun käytetään sytokineesin estomenetelmää. Jos sytoB:tä ei käytetä, on määritettävä populaation suhteellinen kaksinkertaistuminen tai solumäärän suhteellisen lisääntyminen (ks. lisäys 2). Kustakin viljelmästä on esitettävä tiedot erikseen. Kaikista tiedoista on lisäksi esitettävä yhteenveto taulukkomuodossa. Hyväksyttävyysperusteet Testin hyväksyttävyysperusteet ovat seuraavat:
Tulosten arviointi ja tulkinta Edellyttäen, että kaikki hyväksyttävyysperusteet täyttyvät, testikemikaali katsotaan selvästi positiiviseksi, jos jossakin tarkastelluista testiolosuhteista (ks. 36–39 kohta)
Kun kaikki nämä perusteet täyttyvät, testikemikaalin katsotaan voivan indusoida kromosomien katkeamista ja/tai liittymää tai häviämää tässä testijärjestelmässä. Lähdekirjallisuudessa on myös suosituksia soveltuvimmista tilastollisista menetelmistä (90) (91) (92). Edellyttäen, että kaikki hyväksyttävyysperusteet täyttyvät, testikemikaali katsotaan selvästi negatiiviseksi, jos jossakin tarkastelluista testiolosuhteista (ks. 36–39 kohta):
Tällöin katsotaan, että testikemikaali ei voi indusoida kromosomien katkeamista ja/tai liittymää tai häviämää tässä testijärjestelmässä. Lähdekirjallisuudessa on myös suosituksia soveltuvimmista tilastollisista menetelmistä (90) (91) (92). Selvästi positiivista tai negatiivista vastetta ei tarvitse vahvistaa. Jos vaste ei ole selvästi negatiivinen eikä selvästi positiivinen edellä kuvatun mukaisesti ja/tai tuloksen biologisen merkityksellisyyden vahvistaminen kaipaa tukea, tietoja on arvioitava asiantuntija-arvion ja/tai lisätutkimusten avulla. Lisäsolujen laskeminen (tarvittaessa) tai kokeen toistaminen käyttäen mahdollisesti modifioituja testiolosuhteita (esimerkiksi pitoisuusvälit, muut metaboliset aktivaatiojärjestelmät [kuten S9-jakeen pitoisuus tai alkuperä]) saattaa olla hyödyllistä. Joissakin harvinaisissa tapauksissa saatujen tietojen pohjalta ei lisätutkimusten jälkeenkään voida tehdä varmoja päätelmiä positiivisuudesta tai negatiivisuudesta, ja tulokset jäävät näin ollen epäselviksi. MNvit-testissä testikemikaalit voivat aiheuttaa mikrotumien muodostumista indusoimalla kromosomien katkeamista, niiden häviämistä tai molempia. Antikinetokorivasta-aineilla, sentromeerispesifisillä in situ -koettimilla tai muilla menetelmillä voidaan yrittää määrittää, johtuuko mikrotumien indusoitumismekanismi klastogeenisesta ja/tai aneugeenisesta vaikutuksesta. Testiraportti Testiraportissa on esitettävä seuraavat tiedot:
LÄHDELUETTELO
Lisäys 1 MÄÄRITELMÄT Aneugeeni : aine tai prosessi, joka on vuorovaikutuksessa solun mitoottisen ja meioottisen jakautumissyklin vaiheiden kanssa johtaa solujen tai organismien aneuploidiaan. Aneuploidia : yksittäisen tai useamman kuin yhden kromosomin mutta ei kuitenkaan koko kromosomiston (polyploidia) poikkeaminen kromosomien tavallisesta diploidisesta (tai haploidisesta) määrästä. Apoptoosi : ohjelmoitunut solukuolema, jossa tietyt vaiheet johtavat solujen hajoamiseen solukalvon ympäröimiksi rakkuloiksi, jotka myöhemmin häviävät fagosytoosin tai puhkeamisen seurauksena. Genotoksinen : yleinen nimitys kaikentyyppisille DNA- tai kromosomivaurioille, muun muassa katkeamiselle, deleetioille, addukteille, nukleotidien muutoksille ja sidoksille, uudelleenjärjestäytymiselle, geenimutaatioille, kromosomipoikkeavuuksille ja aneuploidialle. Kaikki genotoksiset vaikutukset eivät johda mutaatioihin tai pysyviin kromosomivaurioihin. Interfaasisolut : solut, jotka eivät ole mitoosivaiheessa. Kemikaali : aine tai aineiden seos. Kinetokori : proteiinia sisältävä rakenne, joka rakentuu kromosomin sentromeerin kohdalle, johon tumasukkulat kiinnittyvät solun jakautumisen aikana ja jonka ansiosta tytärkromosomit voivat liikkua kohti tytärsolujen napoja. Klastogeeni : aine tai prosessi, joka aiheuttaa rakenteellisia kromosomipoikkeavuuksia solu- tai organismipopulaatioissa. Käsittelemätön kontrolli : soluviljelmät, joita ei altisteta (eli joihin ei lisätä testikemikaalia eikä liuotinta), mutta jotka käsitellään samanaikaisesti samalla tavoin kuin testikemikaalia saavat soluviljelmät. Liuotinkontrolli : yleinen nimitys kontrolliviljelmille, joihin lisätään vain testikemikaalin liuottamiseen käytettyä liuotinta. Maksan S9-jae : maksan homogenaatin supernatantti 9 000 g:n sentrifugoinnin jälkeen, ts. käsittelemättömästä maksasta eristetty osa. Mikrotumat : pienet tumat, jotka eivät ole solujen varsinaisia tumia vaan esiintyvät niiden lisäksi ja jotka muodostuvat hitaasti liikkuvista kromosomifragmenteista tai kokonaisista kromosomeista mitoosin tai meioosin telofaasin aikana. Mitoosi : solutuman jakautuminen, joka jaotellaan yleensä profaasiin, prometafaasiin, metafaasiin, anafaasiin ja telofaasiin. Mitoosi-indeksi : suhdeluku, joka saadaan jakamalla metafaasissa olevien solujen määrä solupopulaatiossa todettujen solujen kokonaismäärällä; ilmoittaa solujen proliferaatioasteen kyseisessä solupopulaatiossa. Mutageeninen : aiheuttaa periytyvän muutoksen geenien DNA:n emäsparirakenteessa tai kromosomirakenteessa (kromosomipoikkeavuudet). Nondisjunktio : häiriö, jossa kromatidiparit eivät erkaannu toisistaan ja jakaudu oikein kehittyviin tytärsoluihin, minkä takia tytärsolujen kromosomimäärä poikkeaa tavallisesta. p53-status : p53-proteiini osallistuu solusyklin säätelyyn, apoptoosiin ja DNA:n korjautumiseen. Solut, joista puuttuu toimiva p53-proteiini tai jotka eivät pysty pysäyttämään solusykliä tai hävittämään vahingoittuneita soluja apoptoosilla tai muilla p53-proteiinin toimintoihin liittyvillä mekanismeilla (esimerkiksi indusoimalla DNA:n korjautumisen, ovat teoriassa alttiimpia geenimutaatioille tai kromosomipoikkeavuuksille. Pitoisuudet : testikemikaalin lopulliset pitoisuudet kasvatusväliaineessa. Polyploidia : solujen tai organismien kromosomien lukumäärää koskeva poikkeavuus, joka koskee yksittäisen kromosomin tai kromosomien (aneuploidia) sijaan koko kromosomistoa. Populaation suhteellinen kaksinkertaistuminen (PSK) : sytotoksisuuden mittausmenetelmä, kun sytoB:tä ei käytetä (ks. kaava lisäyksessä 2). Proliferaatioindeksi (PI) : sytotoksisuuden mittausmenetelmä, kun sytoB:tä ei käytetä (ks. kaava lisäyksessä 2). Replikaatioindeksi (RI) : altistus- ja palautumisjakson aikana päättyneiden solunjakautumissyklien osuus käsitellyssä viljelmässä verrattuna käsittelemättömään kontrolliviljelmään (ks. kaava lisäyksessä 2). S9-seos : S9-jakeen ja metabolisen entsyymitoiminnan kannalta välttämättömien kofaktorien seos. Sentromeeri : kromosomin DNA:n alue, jossa kromatidit liittyvät yhteen ja johon molemmat kinetokorit kiinnittyvät rinnakkain. Solujen proliferaatio : solujen määrän kasvaminen solujen mitoottisen jakautumisen seurauksena. Solumäärän suhteellinen lisääntyminen (SMSL) : sytotoksisuuden mittausmenetelmä, kun sytoB:tä ei käytetä (ks. kaava lisäyksessä 2). Sytokineesi : solun jakautuminen välittömästi mitoosin jälkeen, jolloin muodostuu kaksi yksitumaista tytärsolua. Sytokineesin eston proliferaatioindeksi (SEPI) : toisen jakautumisvaiheen solujen osuus käsitellyssä populaatiossa käsittelemättömään kontrollipopulaatioon verrattuna (ks. kaava lisäyksessä 2). Sytostaasi : solujen kasvun estäminen (ks. kaava lisäyksessä 2). Sytotoksisuus : Tämän testimenetelmän kattamien, sytokalasiini B:n läsnäollessa suoritettujen testien osalta sytotoksisuus määritellään käsiteltyjen solujen sytokineesin eston proliferaatioindeksin (SEPI) tai replikaatioindeksin (RI) pienenemiseksi negatiiviseen kontrolliin verrattuna (ks. 26 kohta ja lisäys 2). Tämän testimenetelmän kattamien, ilman sytokalasiini B:tä suoritettujen testien osalta sytotoksisuus määritellään käsiteltyjen solujen populaation suhteellisen kaksinkertaistumisen (PSK) tai solumäärän suhteellisen lisääntymisen (SMSL) vähentymiseksi negatiiviseen kontrolliin verrattuna (ks. 27 kohta ja lisäys 2). Testikemikaali : aine tai seos, jota testataan tällä testimenetelmällä. Lisäys 2 KAAVAT SYTOTOKSISUUDEN MÄÄRITYSTÄ VARTEN Kun sytoB:tä käytetään , sytotoksisuuden arvioinnin on perustuttava sytokineesin eston proliferaatioindeksiin (SEPI) tai replikaatioindeksiin (RI) (17) (69). Sytokineesin eston proliferaatioindeksi ilmaisee tumien keskimääräistä määrää solua kohti, ja sitä voidaan käyttää solujen proliferaation laskemiseen. RI ilmaisee solusyklien suhteellista määrää solua kohti käsitellyissä viljelmissä sytoB:lle altistamisen aikana verrattuna kontrolliviljelmiin, ja sitä voidaan käyttää sytostaasiasteen (sytostaasi- %) laskemiseen seuraavasti: sytostaasi- % = 100 – 100{(SEPIT – 1) ÷ (SEPIC – 1)} ja:
jossa
Näin ollen, jos SEPI = 1 (kaikki solut ovat yksitumaisia), sytostaasi on 100 %. Sytostaasi = 100 – RI
Näin ollen, jos RI = 53 %, kontrolliviljelmässä kaksitumaisiksi ja monitumaisiksi soluiksi jakaantuneiden solujen määrään verrattuna vain 53 % soluista jakaantui käsitellyssä viljelmässä, eli sytostaasi on 47 %. Kun sytoB:tä ei käytetä , sytotoksisuus on arvioitava solumäärän suhteellisen lisääntymisen (SMSL) tai populaation suhteellisen kaksinkertaistumisen (PSK) perusteella (69), koska molemmissa otetaan huomioon jakaantuneen solupopulaation osuus.
jossa populaation kaksinkertaistuminen = [log (solumäärä käsittelyn jälkeen ÷ alkuperäinen solumäärä)] ÷ log 2 Näin ollen, jos SMSL tai PSK = 53 %, sytotoksisuus/sytostaasi = 47 %. Sytotoksisuutta voidaan arvioida proliferaatioindeksin (PI) avulla laskemalla 1 solusta (kl1), 2 solusta (kl2), 3 tai 4 solusta (kl4) ja 5–8 solusta (kl8) muodostuneiden kloonien määrä seuraavasti
Proliferaatioindeksiä on käytetty sytotoksisuuden tärkeänä ja luotettavana parametrina myös ilman sytoB:tä in vitro viljellyille solulinjoille (35) (36) (37) (38), ja sitä voidaan pitää hyödyllisenä lisäparametrina. Joka tapauksessa solujen määrän ennen käsittelyä olisi oltava sama käsitellyissä ja negatiivisissa kontrolliviljelmissä. Vaikka solumäärän suhteellista lisääntymistä (solujen lukumäärä käsitellyissä viljelmissä / solujen lukumäärä kontrolliviljelmissä) on aiemmin käytetty sytotoksisuuden parametrina, sitä ei enää suositella, koska se voi johtaa sytotoksisuuden aliarviointiin. Käytettäessä automaattisia laskentajärjestelmiä, kuten virtaussytometriaa, laserpyyhkäisysytometriaa tai kuva-analyysia, kaavassa käytetty solumäärä voidaan korvata tumien määrällä. Negatiivisissa kontrolliviljelmissä populaation kaksinkertaistumisen tai replikaatioindeksin määrittämisessä on noudatettava vaatimusta ottaa soluista näyte noin 1,5–2,0 normaalia solusykliä vastaavan ajan kuluttua käsittelyn jälkeen. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
15) |
Lisätään B osaan luvut seuraavasti: ”B.59 In chemico -ihoherkistys: DPRA (Direct Peptide Reactivity Assay) JOHDANTO Tämä testimenetelmä (TM) vastaa OECD:n testiohjetta (TG) nro 442C (2015). Ihoa herkistävällä aineella tarkoitetaan Yhdistyneiden kansakuntien (YK) GHS-järjestelmän (Globally Harmonized System of Classification and Labelling of Chemicals; kemikaalien maailmanlaajuisesti yhdenmukaistettu luokitus- ja merkintäjärjestelmä) (1) sekä aineiden ja seosten luokituksesta, merkinnöistä ja pakkaamisesta annetun asetuksen (EY) N:o 1272/2008 (CLP-asetus) määritelmän mukaisesti ainetta, joka aiheuttaa ihokosketuksen seurauksena allergisen reaktion. (18) Tämä testimenetelmä on in chemico -menetelmä (Direct Peptide Reactivity Assay, DPRA), joka auttaa erottamaan ihoa herkistävät aineet herkistystä aiheuttamattomista aineista YK:n GHS-järjestelmän sekä CLP-asetuksen mukaisesti. Ihon herkistymisen taustalla vaikuttavista keskeisistä biologisista tapahtumista vallitsee yleinen yhteisymmärrys. Olemassa olevat tiedot ihon herkistymiseen liittyvistä kemiallisista ja biologisista mekanismeista on esitetty tiivistetysti haittavaikutusreitin (Adverse Outcome Pathway, AOP) (2) muodossa herkistymisen käynnistävästä molekyylitason tapahtumasta välivaiheiden kautta aina haittavaikutukseen eli ihmisen allergiseen kosketusihottumaan tai jyrsijän kosketusallergiaan. Ihon herkistymisen haittavaikutusreitissä herkistymisen käynnistävä molekyylitason tapahtuma on se, että elektrofiiliset aineet muodostavat kovalenttisidoksen ihon proteiinien nukleofiilisiin keskuksiin. Ihon herkistymisen arvioinnissa on käytetty yleensä koe-eläimiä. Marsujen käyttöön perustuvilla klassisilla menetelmillä – Magnusson–Kligmanin GMPT-testillä (Guinea Pig Maximisation Test) ja Buehlerin testillä (TM B.6 (3)) – tutkitaan ihon herkistymisen induktio- ja haastevaihetta. Myös hiirillä tehty LLNA-koe (Local Lymph Node Assay, TM B.42 (4)) ja sen kaksi ei-radioaktiivista muunnosta (LLNA: DA (TM B.50 (5)) ja LLNA: BrdU-ELISA (TM B.51 (6)), joilla kaikilla arvioidaan vain induktiovastetta, ovat saaneet hyväksyntää, sillä marsukokeisiin verrattuna niillä on eläinten hyvinvointiin liittyviä hyötyjä ja niillä mitataan objektiivisesti ihon herkistymisen induktiovaihetta. Viime aikoina mekanistispohjaiset in chemico- ja in vitro -testimenetelmät on katsottu tieteellisesti päteviksi menetelmiksi kemikaalien ihoherkistysvaaran arviointiin. Jotta käytössä olevat eläinkokeet voidaan korvata täysin, testausta ja arviointia koskeviin yhdennettyihin lähestymistapoihin (Integrated Approaches to Testing and Assessment, IATA) tarvitaan kuitenkin eläinkokeettomien menetelmien (in silico, in chemico, in vitro) yhdistelmiä, sillä kullakin nykyisin käytettävissä olevalla eläinkokeettomalla testimenetelmällä voidaan kattaa haittavaikutusreitti mekanistisesti vain rajallisesti (2) (7). DPRA-menetelmällä on tarkoitus tutkia ihon herkistymisen haittavaikutusreitissä herkistymisen käynnistävää molekyylitason tapahtumaa eli proteiinin reaktiivisuutta kvantifioimalla testikemikaalien reaktiivisuutta suhteessa mallin synteettisiin peptideihin, jotka sisältävät joko lysiiniä tai kysteiiniä (8). Tämän jälkeen kysteiiniä ja lysiiniä sisältävien peptidien depleetioarvojen avulla aine luokitellaan yhteen neljästä reaktiivisuusluokasta, mikä auttaa erottelemaan ihoa herkistävät aineet herkistystä aiheuttamattomista aineista (9). DPRA-menetelmää on arvioitu Euroopan unionin vaihtoehtoisten tutkimusmenetelmien vertailulaboratorion (EURL ECVAM) johtamassa validointitutkimuksessa, minkä jälkeen sen tieteellinen neuvoa-antava komitea (ESAC) teki riippumattoman vertaisarvioinnin. Menetelmän katsottiin olevan tieteellisesti pätevä (10) käytettäväksi osana testausta ja arviointia koskevaa yhdennettyä lähestymistapaa (IATA) ihoa herkistävien aineiden erottamiseen herkistystä aiheuttamattomista aineista vaaran luokittelua varten ja merkintätarkoituksiin. Kirjallisuudessa annetaan esimerkkejä siitä, miten DPRA-menetelmällä saatuja tietoja on käytetty muihin tietoihin yhdistettyinä (11) (12) (13) (14). Määritelmät ovat lisäyksessä 1. ALUSTAVAT NÄKÖKOHDAT, KÄYTETTÄVYYS JA RAJOITUKSET Proteiinin reaktiivisuuden on vahvistettu korreloivan ihon herkistämispotentiaalin kanssa (15) (16) (17). Koska proteiinin sitoutuminen on kuitenkin haittavaikutusreitissä vain yksi keskeinen tapahtuma, joskin ihon herkistymisen käynnistävä molekyylitason tapahtuma, testaamiseen perustuvilla ja muilla menetelmillä hankittu tieto proteiinin reaktiivisuudesta ei välttämättä riitä itsessään osoittamaan, etteivät kemikaalit voi herkistää ihoa. Siksi tällä testimenetelmällä tuotettuja tietoja pitäisi tarkastella yhdennettyjen lähestymistapojen (esimerkiksi IATA) valossa yhdistämällä ne muihin, täydentäviin tietoihin, kuten tietoihin, jotka on saatu in vitro -kokeilla, joissa tutkitaan ihon herkistymisen haittavaikutusreitin muita keskeisiä tapahtumia, sekä testittömillä menetelmillä, joihin kuuluu muun muassa interpolointi (read-across) samankaltaisista kemikaaleista. Tätä testimenetelmää voidaan käyttää yhdessä muiden täydentävien tietojen kanssa ihoa herkistävien aineiden (YK:n GHS-järjestelmän / CLP-asetuksen luokka 1) erottamiseen herkistystä aiheuttamattomista aineista IATA:n valossa. Tätä testimenetelmää ei voida käyttää yksinään ihoa herkistävien aineiden luokittelemiseen YK:n GHS-järjestelmän / CLP-asetuksen alaluokkiin 1A ja 1B eikä niiden vaikutuksen ennustamiseen turvallisuuden arviointiin liittyvää päätöksentekoa varten. Sääntelykehyksestä riippuen DPRA-menetelmällä saatua positiivista tulosta voidaan kuitenkin sellaisenaan käyttää kemikaalin luokitteluun YK:n GHS-järjestelmän / CLP-asetuksen luokkaan 1. DPRA-testimenetelmän on osoitettu olevan siirrettävissä laboratorioihin, joilla on kokemusta korkean suorituskyvyn nestekromatografisista (HPLC) analyyseista. Testimenetelmällä odotettavasti saatavien ennusteiden toistettavuus on 85 prosentin luokkaa laboratorioissa ja 80 prosentin luokkaa laboratorioiden välillä (10). Validointitutkimuksen (18) ja kaikkiaan julkaistujen tutkimusten (19) tulokset viittaavat siihen, että DPRA:n tarkkuus ihoa herkistävien aineiden erottelussa (YK:n GHS-järjestelmän / CLP-asetuksen luokka 1) herkistystä aiheuttamattomista aineista on 80 prosenttia (N = 157), herkkyys 80 prosenttia (88/109) ja spesifisyys 77 prosenttia (37/48) LLNA-kokeen tuloksiin verrattuna. DPRA:lla saadaan todennäköisemmin aliarvioiva ennuste siitä, että kemikaalien ihoherkistyspotentiaali on lievästä kohtalainen (YK:n GHS-järjestelmän / CLP-asetuksen alaluokka 1B) kuin että niiden ihoherkistyspotentiaali olisi suuri (YK:n GHS-järjestelmän / CLP-asetuksen alaluokka 1A) (18) (19). Tässä esitetyt tarkkuusarvot, jotka koskevat DPRA-menetelmän käyttöä ainoana testinä, ovat kuitenkin vain suuntaa-antavia, sillä testimenetelmää pitäisi käyttää yhdessä muiden tietolähteiden kanssa IATA:n valossa ja edellä olevan kohdan 9 mukaisesti. Lisäksi arvioitaessa ihon herkistymiseen liittyviä eläinkokeettomia menetelmiä tulisi pitää mielessä, että LLNA-koe samoin kuin muut eläinkokeet eivät välttämättä täysin kerro tilanteesta kiinnostuksen kohteena olevan lajin eli ihmisen tapauksessa. Saatavana olevat kokonaistiedot osoittavat, että DPRA-menetelmällä voidaan testata kemikaaleja, jotka kuuluvat moniin orgaanisiin toiminnallisiin ryhmiin, joilla on monenlaisia reaktiomekanismeja, joiden ihoherkistyspotentiaaleissa on suuria eroja (in vivo -tutkimusten mukaan) ja joilla on monenlaisia psykokemiallisia ominaisuuksia (8) (9) (10) (19). Yhdessä nämä tiedot viittaavat siihen, että DPRA-menetelmää voidaan käyttää apuna ihon herkistymisvaaran tunnistamisessa. Tässä testimenetelmässä käytetyllä termillä ”testikemikaali” tarkoitetaan sitä, mitä testataan, eikä termi liity siihen, voidaanko DPRA-menetelmää käyttää aineiden ja/tai seosten testaamiseen. Tätä testimenetelmää ei voida käyttää metalliyhdisteiden testaamiseen, sillä niiden tiedetään reagoivan proteiinien kanssa muilla tavoin kuin muodostamalla kovalenttisidoksia. Testikemikaalin pitäisi liueta sopivaan liuottimeen, niin että lopullisen liuoksen pitoisuus on 100 mM (ks. 18 kohta). Ellei testikemikaali liukene niin, että tällainen pitoisuus olisi saavutettavissa, sitä voidaan kuitenkin testata alhaisemmalla pitoisuudella. Tällöin positiivisen tuloksen perusteella testikemikaali voidaan edelleen määrittää ihoa herkistäväksi aineeksi, mutta negatiivisen tuloksen perusteella ei voida tehdä varmoja päätelmiä reaktiivisuuden puuttumisesta. Siitä, voidaanko DPRA-menetelmää käyttää seoksiin, joiden koostumus on tiedossa, on tällä hetkellä saatavana vain rajallisesti tietoa (18) (19). DPRA-menetelmän katsotaan kuitenkin olevan teknisesti käytettävissä monesta aineosasta muodostuvien aineiden testaamiseen sekä sellaisten seosten testaamiseen, joiden koostumus on tiedossa (ks. 18 kohta). Ennen kuin tällä testimenetelmällä testataan seosta, jotta testillä voidaan tuottaa tuloksia haluttua, sääntelyyn perustuvaa tarkoitusta varten, olisi pohdittava sitä, saadaanko testillä riittävät tulokset kyseiseen tarkoitukseen, ja jos saadaan, niin miksi. Tällaisia pohdintoja ei tarvita, kun sääntely edellyttää kyseisen seoksen testaamista. Nykyistä ennustemallia ei voida käyttää monimutkaisiin seoksiin, joiden koostumus ei ole tiedossa, tai aineisiin, joiden koostumus ei ole tiedossa tai se vaihtelee, monimutkaisiin reaktiotuotteisiin tai biologisiin aineisiin (eli UVCB-aineisiin) testikemikaalin ja peptidin tarkan moolisuhteen vuoksi. Tähän tarkoitukseen on kehitettävä uusi ennustemalli, joka perustuu gravimetriseen menetelmään. Testimenetelmällä ei pidä testata tiettyjä muita kemikaaliluokkia, joiden testaamiseen se ei todistetusti sovellu. Tämä testimenetelmä on in chemico -menetelmä, jota ei tehdä metabolisessa järjestelmässä. Testimenetelmä ei tunnista kemikaaleja, joiden kohdalla ihon herkistyminen edellyttää entsymaattista bioaktivointia (eli pro-hapteeneja). Testimenetelmän on todettu havaitsevan toisinaan oikein kemikaalit, joista tulee herkistäviä abioottisen transformaation jälkeen (pre-hapteenit) (18). Edellä esitetyn valossa testimenetelmällä saatuja negatiivisia tuloksia pitäisi tulkita ottaen huomioon esitetyt rajoitukset sekä yhdessä muiden tietolähteiden kanssa IATA:n valossa. Testikemikaalit, jotka eivät muodosta kovalenttisidosta peptidiin vaan edistävät sen hapettumista (kysteiinidimerisaatio), voivat aiheuttaa peptididepleetion yliarvioinnin, mikä saattaa mahdollisesti johtaa virheelliseen positiiviseen ennusteeseen ja/tai siihen, että kemikaali luokitellaan ylempään reaktiivisuusluokkaan (ks. 29 ja 30 kohta). Kuten edellä on kuvattu, DPRA auttaa erottamaan ihoa herkistävät aineet herkistystä aiheuttamattomista aineista. Siitä voi kuitenkin myös olla apua herkistyspotentiaalin (11) arvioinnissa, kun sitä käytetään osana yhtenäisiä lähestymistapoja, kuten IATA:ta. Työtä on kuitenkin jatkettava, mieluiten ihmisistä saatujen tietojen pohjalta, jotta voidaan määrittää, miten DPRA-menetelmän tuloksia voidaan käyttää herkistyspotentiaalin arvioinnissa. TESTIN PERIAATE DPRA on in chemico -menetelmä, jolla kvantifioidaan kysteiinia tai lysiinia sisältävän peptidin jäännöspitoisuus, kun sitä on inkuboitu 24 tuntia testikemikaalin kanssa 25 ± 2,5 °C:ssa. Synteettiset peptidit sisältävät fenyylialaniinia, joka auttaa havaitsemisessa. Suhteellinen peptidipitoisuus mitataan korkean suorituskyvyn nestekromatografialla (HPLC) käyttäen gradienttieluutiota ja UV-detektiota (220 nm). Tämän jälkeen lasketaan kysteiini- ja lysiinipeptidin prosentuaaliset depleetioarvot, joita käytetään ennustemallissa (ks. 29 kohta); sen avulla testikemikaali luokitellaan yhteen neljästä reaktiivisuusluokasta, joiden avulla ihoa herkistävät kemikaalit erotetaan muista kemikaaleista. Ennen kuin laboratoriot ryhtyvät käyttämään rutiininomaisesti tämän testimenetelmän mukaista menetelmää, niiden on osoitettava tekninen pätevyytensä lisäyksessä 2 lueteltujen kymmenen pätevyyden osoittamiseen tarkoitetun aineen avulla. MENETTELY Testimenetelmä perustuu DPRA DB-ALM -testiprotokollaan nro 154 (20), joka on EURL:n ECVAMin koordinoimassa validointitutkimuksessa käytettävä protokolla. Suosituksena on käyttää tätä protokollaa, kun menetelmä otetaan käyttöön ja sitä käytetään laboratoriossa. Seuraavassa kuvataan DPRA:n päävaiheet ja menettelyt. Vaihtoehtoista HPLC-mittausta käytettäessä on osoitettava sen vastaavan DB-ALM-protokollassa kuvattua validoitua mittausta (esimerkiksi tekemällä testi lisäyksessä 2 luetelluilla pätevyyden osoittamiseen tarkoitetuilla aineilla). Kysteiinia tai lysiinia sisältävien peptidien valmistelu Kysteiinia (Ac-RFAACAA-COOH) ja lysiiniä (Ac-RFAAKAA-COOH) sisältäviä synteettisiä peptidejä sisältävät kantaliuokset pitäisi valmistaa juuri ennen niiden inkubointia testikemikaalin kanssa, ja niiden puhtausasteen on oltava yli 85 prosenttia ja mieluiten 90–95 prosenttia. Kysteiinipeptidin lopullisen pitoisuuden pitäisi olla 0,667 mM fosfaattipuskurissa, jonka pH-arvo on 7,5, kun taas lysiinipeptidin lopullisen pitoisuuden pitäisi olla 0,667 mM ammoniumasetaattipuskurissa, jonka pH-arvo on 10,2. HPLC-ajosekvenssi pitäisi suunnitella siten, että HPLC-analyysi kestää alle 30 tuntia. Validointitutkimuksessa käytettävässä ja tässä testimenetelmässä kuvatussa HPLC-mittauksessa yksi HPLC-ajo voi käsittää jopa 26 analyysinäytettä (jotka käsittävät testikemikaalin, positiivisen kontrollin ja sopivan määrän liuotinkontrolleja testissä käytettyjen yksittäisten liuottimien määrän mukaan, ja näistä kukin testataan kolmesti). Kaikissa samassa ajossa analysoiduissa rinnakkaisnäytteissä pitäisi käyttää täysin samaa kysteiini- ja lysiinipeptidikantaliuosta. Yksittäisten peptidierien liukoisuuden asianmukaisuus on suositeltavaa osoittaa ennen niiden käyttöä. Testikemikaalin valmistelu Testikemikaalin liukoisuutta sopivaan liuottimeen pitäisi arvioida ennen testin tekemistä DPRA DB-ALM -protokollassa kuvatun liukoisuusmenettelyn mukaisesti (20). Sopivaan liuottimeen testikemikaali liukenee täysin. Koska DPRA:ssa testikemikaalia, jota inkuboidaan joko kysteiini- tai lysiinipeptidien kanssa, on huomattavasti tarvittavaa suurempi määrä, silmämääräistä tarkastusta, jossa todetaan kirkkaan liuoksen muodostuminen, pidetään riittävänä keinona varmistaa testikemikaalin (ja kaikkien sen aineosien, jos testattava kemikaali on monesta aineosasta muodostuva aine tai seos) liukeneminen. Sopivia liuottimia ovat asetonitriili, vesi, asetonitriilin, isopropanolin tai asetonin ja veden seos, jonka sekoitussuhde on 1:1, taikka asetonin ja asetonitriilin seos, jonka sekoitussuhde on 1:1. Muita liuottimia voidaan käyttää, kunhan ne eivät vaikuta peptidin stabiilisuuteen, jota seurataan C-vertailukontrollien avulla (tällä tarkoitetaan näytteitä, joissa sopivaan liuottimeen on liuotettu pelkkää peptidiä; ks. lisäys 3). Ellei testikemikaali liukene mihinkään näistä liuottimista, viimeisenä vaihtoehtona on yritettävä liuottaa se 300 μL:aan dimetyylisulfoksidia (DMSO) ja liuottaa näin syntyvä liuos 2 700 μL:aan asetonitriiliä, ja ellei testikemikaali liukene tähänkään seokseen, on yritettävä liuottaa sama määrä testikemikaalia 1 500 μL:aan dimetyylisulfoksidia ja liuottaa näin syntyvä liuos 1 500 μL:aan asetonitriiliä. Testikemikaali on punnittava ja annosteltava etukäteen lasipulloihin ja liuotettava välittömästi ennen testaamista sopivaan liuottimeen 100 mM:n liuokseksi. Kun kyseessä on seos tai monesta aineosasta koostuva aine, jonka koostumus on tiedossa, on määritettävä sen yleinen puhtausaste laskemalla yhteen aineosien suhteet (lukuun ottamatta vettä) sekä määritettävä yleinen näennäinen molekyylimassa ottamalla huomioon seoksen kunkin aineosan molekyylimassat (lukuun ottamatta vettä) ja niiden suhteet. Näin lasketun puhtausasteen ja näennäisen molekyylimassan perusteella pitäisi sitten laskea 100 mM:n liuoksen valmistamiseen tarvittavan testikemikaalin massa. Kun kyseessä on polymeeri, jonka vallitsevaa molekyylimassaa ei voida määrittää, 100 mM:n liuoksen valmistuksessa voidaan ottaa huomioon monomeerin molekyylimassa (tai polymeerin sisältämien eri monomeerien näennäinen molekyylimassa). Testattaessa seoksia, monesta aineosasta koostuvia aineita tai polymeereja, joiden koostumus on tiedossa, on kuitenkin harkittava myös laimentamattoman kemikaalin testaamista. Kun kyseessä on neste, laimentamatonta kemikaalia pitäisi testata sellaisenaan ilman etukäteisliuotusta inkuboimalla sitä kysteiini- ja lysiinipeptidien kanssa, niin että moolisuhde on 1:10 kysteiinipeptidien ja 1:50 lysiinipeptidien tapauksessa. Kun kyseessä on kiinteä aine, testikemikaalia on liuotettava suurin liukeneva määrä samaan liuottimeen, jota käytetään näennäisesti 100 mM:n liuoksen valmistamiseen. Tämän jälkeen sitä pitäisi testata sellaisenaan tekemättä muita liuotuksia inkuboimalla sitä kysteiini- ja lysiinipeptidien kanssa, niin että moolisuhde on 1:10 kysteiinipeptidien ja 1:50 lysiinipeptidien tapauksessa. Tuloksesta voidaan tehdä pysyvä päätelmä, jos näennäisesti 100 mM:n liuoksella ja liuottamattomalla kemikaalilla saadut tulokset ovat yhtäpitävät (reaktiivinen/ei-reaktiivinen). Positiivisen kontrollin, vertailukontrollien ja koeluointikontrollien valmistelu Positiivisena kontrollina (PC) pitäisi käyttää kanelialdehydia (CAS 104-55-2; ≥95 % puhtaudeltaan elintarvikelaatuista), joka on liuotettu asetonitriiliin, niin että pitoisuus on 100 mM. On myös mahdollista käyttää muita sopivia positiivisia kontrolleja, joilla mieluiten saadaan keskitasoa edustavat depleetioarvot, jos saatavilla on aiempia tietoja, joista saadaan vertailukelpoiset ajon hyväksyttävyysperusteet. Lisäksi HPCL-testijaksoon pitäisi kuulua myös vertailukontrolleja (eli näytteitä, jotka sisältävät vain sopivaan liuottimeen liuotettua peptidiä), joiden avulla varmistetaan HPLC-järjestelmän sopivuus ennen analyysia (A-vertailukontrollit) ja vertailukontrollien stabiilisuus ajan mittaan (B-vertailukontrollit) ja se, että testikemikaalin liuottamiseen käytetty liuotin ei vaikuta peptidin depleetioasteeseen (C-vertailukontrollit) (ks. lisäys 3). Kullekin kemikaalille sopivan vertailukontrollin avulla lasketaan peptidin depleetioaste kyseisen kemikaalin osalta (ks. 26 kohta). Lisäksi ajosekvenssiin pitäisi kuulua kunkin analysoitavan testikemikaalin osalta pelkästä testikemikaalista muodostuva koeluutiokontrolli, jotta voidaan havaita testikemikaalin mahdollinen koeluutio joko lysiini- tai kysteiinipeptidin kanssa. Testikemikaalin inkubointi kysteiini- ja lysiinipeptidiliuosten kanssa Kysteiini- ja lysiinipeptidiliuoksia on inkuboitava automaattisen näytteensyöttölaitteen lasipulloissa testikemikaalin kanssa niin, että kysteiiniliuoksen sekoitussuhde on 1:10 ja lysiiniliuoksen 1:50. Jos välittömästi sen jälkeen, kun testikemikaaliliuosta on lisätty peptidiliuokseen, havaitaan saostumista, joka johtuu testikemikaalin heikosta liukenevuudesta veteen, on epävarmaa, miten paljon testikemikaalia liuokseen jää reagoimaan peptidin kanssa. Siksi positiivinen tulos on tällöin edelleen käyttökelpoinen, mutta negatiivinen tulos on epävarma ja sitä on tulkittava asianmukaisella varovaisuudella (ks. myös kohdan 11 vaatimukset sellaisten kemikaalien testaamisesta, jotka eivät liukene 100 mM:n pitoisuutena). Reaktioliuosta pidetään pimeässä 25 ± 2,5 °C:ssa 24 ± 2 tuntia ennen HPLC-analyysin tekemistä. Kukin testikemikaali on analysoitava kolmesti kummankin peptidin osalta. Ennen HPLC-analyysia näytteet on tarkastettava silmämääräisesti. Jos näytteissä havaitaan sakkaa tai faasiutumista, ne voidaan sentrifugoida alhaisella nopeudella (100–400 xg), niin että sakka laskeutuu pullon pohjaan; tämä on varotoimenpide, sillä suuri sakkamäärä voi tukkia HPLC-laitteen putket tai kolonnit. Inkubointivaiheen aikana havaittu saostuminen tai faasiutuminen on merkki siitä, että peptididepleetio saatetaan aliarvioida, eikä negatiivisen tuloksen pohjalta voida tehdä riittävällä varmuudella päätelmää reaktiivisuuden puuttumisesta. HPCL-standardikalibrointikäyrän laatiminen Kysteiini- ja lysiinipeptideille on laadittava standardikalibrointikäyrät. Niiden laadinnassa on käytettävä liuosta, jossa asetonitriili suhde puskuriin on 20 tai 25 prosenttia, niin että kysteiinipeptidin tapauksessa käytetään fosfaattipuskuria (pH 7,5) ja lysiinipeptidin tapauksessa käytetään ammoniumasetaattipuskuria (pH 10,2). Peptidikantaliuoksesta (0,667mM) valmistetaan laimentamalla kuuden kalibrointiliuoksen sarja, joka kattaa pitoisuusalueen 0,534–0,0167 mM. Standardikalibrointikäyrään pitäisi sisältyä myös nollanäyte, joka sisältää pelkkää laimennuspuskuria. Sopivassa kalibrointikäyrässä r2 > 0,99. HPLC-analyysin valmistelu ja suorittaminen Ennen analyysin tekemistä on varmistettava HPCL-järjestelmän sopivuus. Peptididepleetiota seurataan HPLC-järjestelmällä, joka on liitetty UV-detektoriin (valodiodirividetektori tai kiinteän aallonpituuden absorptiodetektori; signaali 220 nm). HPLC-järjestelmään asennetaan sopiva kolonni. Validoidussa protokollassa kuvatussa HPLC-laitteistossa käytettävä kolonni on ensisijaisesti Zorbax SB-C-18 2,1 mm x 100 mm × 3.5 μ. Tätä HPLC-käänteisfaasikolonnia käytettäessä koko järjestelmä pitäisi tasapainottaa 30 °C:ssa, niin että 50 prosenttia on faasia A (0,1 tilavuusprosenttia trifluoroetikkahappoa vedessä) ja 50 prosenttia on faasia B (0,085 tilavuusprosenttia trifluoroetikkahappoa asetonitriilissä) vähintään kaksi tuntia ennen analyysin suorittamista. HPLC-analyysissa käytettävä virtausnopeus on 0,35 ml/min, ja lineaarisen gradientin avulla asetonitriili nostetaan 10 prosentista 25 prosenttiin 10 minuutissa, minkä jälkeen asetonitriili nostetaan nopeasti 90 prosenttiin muiden aineiden poistamiseksi. Standardia, näytettä ja kontrollia pitäisi ruiskuttaa yhtä suuret määrät. Ruiskutusten välillä kolonnia on tasapainotettava uudelleen alkuperäisissä olosuhteissa seitsemän minuutin ajan. Erilaista HPLC-käänteisfaasikolonnia käytettäessä edellä kuvattuja järjestelmän muuttujia saattaa olla tarpeen säätää kysteiini- ja lysiinipeptidien sopivan eluution ja integraation varmistamiseksi; tämä koskee myös ruiskutusmäärää, joka voi vaihdella käytettävän järjestelmän mukaan (yleensä 3–10 μl). Vaihtoehtoista HPLC-järjestelmää käytettäessä on tärkeää osoittaa, että se vastaa edellä kuvattua validoitua järjestelmää (esimerkiksi testaamalla lisäyksen 2 mukaiset pätevyyden osoittamiseen tarkoitetut aineet). Absorbanssia seurataan 220 nm:ssa. Valodiodirividetektoria käytettäessä pitäisi kirjata myös absorbanssi 258 nm:ssa. On huomattava, että jotkin asetonitriilin lähteet voivat vaikuttaa kielteisesti peptidin stabiilisuuteen, ja tätä on arvioitava uutta asetonitriilierää käytettäessä. 220 nm:ssa kirjatun piikin pinta-alan ja 258 nm:ssa kirjatun piikin pinta-alan suhdetta voidaan käyttää koeluution indikaattorina. Kunkin näytteen tapauksessa suhteen sijoittuminen alueelle 90 % < kontrollinäytteiden suhteen keskiarvoalue (19) <100 % olisi hyvä merkki siitä, että koeluutiota ei ole tapahtunut. Jotkin testikemikaalit saattavat edistää kysteiinipeptidin hapettumista. Dimerisoituneen kysteiinipeptidin piikkiä voidaan seurata silmämääräisesti. Jos dimerisaatiota näyttää tapahtuneen, tämä on otettava huomioon, sillä peptidin depleetioaste saatetaan yliarvioida, mikä johtaa vääriin positiivisiin ennusteisiin ja/tai siihen, että kemikaali luokitellaan korkeampaan reaktiivisuusluokkaan (ks. 29 ja 30 kohta). Kysteiini- ja lysiinipeptidien HPLC-analyysi voidaan tehdä samanaikaisesti (jos käytettävissä on kaksi HPLC-järjestelmää) tai eri päivinä. Jos analyysit tehdään eri päivinä, testejä varten on kumpanakin päivänä valmistettava tuoreet testikemikaaliliuokset. Analyysi pitäisi ajoittaa niin, että ensimmäisen näytteen ruiskutus alkaa 22–26 tuntia sen jälkeen, kun testikemikaali on sekoitettu peptidiliuokseen. HPLC-ajosekvenssi pitäisi suunnitella siten, että HPLC-analyysi kestää alle 30 tuntia. Validointitutkimuksessa käytetty ja tässä testimenetelmässä kuvattu HPLC-järjestelmä mahdollistaa jopa 26 analyysinäytteen käsittelyn yhdessä HPLC-ajossa (ks. myös 17 kohta). HPLC-analyysisekvenssistä annetaan esimerkki lisäyksessä 3. TIEDOT JA RAPORTOINTI Tietojen arviointi Kysteiini- tai lysiinipeptidin pitoisuus kussakin näytteessä määritetään fotometrisesti 220 nm:ssa mittaamalla piikin pinta-ala (käyrän alapuolinen alue, AUC) asianmukaisista piikeistä ja laskemalla peptidipitoisuus käyttämällä standardeista saatua lineaarista kalibrointikäyrää. Peptidin depleetioaste ( %) määritetään kustakin näytteestä mittaamalla piikin pinta-ala ja jakamalla se relevanttien C-vertailukontrollien (ks. lisäys 3) keskimääräisellä piikin pinta-alalla jäljempänä kuvatun kaavan mukaisesti.
Hyväksyntäperusteet Jotta ajoa voidaan pitää luotettavana, seuraavien perusteiden on täytyttävä:
Jos yksi tai useampi näistä ehdoista ei täyty, ajo on toistettava. Jotta testikemikaalin tuloksia voidaan pitää luotettavina, seuraavien perusteiden on täytyttävä:
Ennustemalli Kunkin testikemikaalin osalta lasketaan kysteiinin ja lysiinin keskimääräinen prosentuaalinen depleetioaste. Keskiarvoa laskettaessa negatiivinen depleetio katsotaan nollaksi (0). Taulukon 1 mukaista kysteiini 1:10 / lysiini 1:50 -ennustemallia käyttämällä ihoa herkistävien aineiden ja herkistystä aiheuttamattomien aineiden erottelussa yhdennetyn lähestymistavan (IATA) mukaisesti pitäisi käyttää apuna peptidin keskimääräisen depleetioasteen 6,38 prosentin raja-arvoa. Ennustemallin käyttö testikemikaalin reaktiivisuusluokittelussa (esimerkiksi vähäinen, kohtalainen, suuri reaktiivisuus) saattaa osoittautua hyödylliseksi keinoksi hankkia tietoja potentiaalin arviointiin IATA:n puitteissa. Taulukko 1 Kysteiini 1:10 / lysiini 1:50 -ennustemalli (20)
Joissakin tapauksissa testikemikaali (aine, useammasta aineosasta koostuvan aineen yksi tai useampi aineosa tai seos) saattaa absorboida merkittävästi 220 nm:ssa ja sillä on sama peptidin retentioaika (koeluutio). Koeluutio saattaa ratketa siten, että HPLC-mittausta säädetään hieman niin, että testikemikaalin ja peptidin eluutioaika erotetaan toisistaan. Jos koeluutio yritetään ratkaista käyttämällä vaihtoehtoista HPLC-mittausta, on osoitettava, että se vastaa validoitua mittausta (esimerkiksi tekemällä testi liitteen 2 mukaisilla pätevyyden osoittamiseen tarkoitetuilla aineilla). Koeluution tapahtuessa peptidin piikkiä ei voida integroida eikä peptidin prosentuaalista depleetioastetta voida laskea. Jos näiden testikemikaalien koeluutiota tapahtuu sekä kysteiini- että lysiinipeptidin kanssa, on todettava, ettei analyysin pohjalta voida tehdä varmoja päätelmiä. Jos koeluutiota tapahtuu vain lysiinipeptidin kanssa, voidaan käyttää taulukon 2 mukaista kysteiini 1:10 -ennustemallia. Taulukko 2 Kysteiini 1:10 -ennustemalli (22)
Joissakin tapauksissa on mahdollista, että testikemikaalin ja jommankumman peptidin retentioajan päällekkäisyys jää vaillinaiseksi. Tällaisissa tapauksissa peptidin prosentuaaliset depleetioarvot voidaan arvioida ja niitä voidaan käyttää kysteiini 1:10 / lysiini 1:50 -ennustemallissa, mutta testikemikaalin tarkka reaktiivisuusluokittelu ei ole mahdollista. Yhden HPLC-analyysin pitäisi riittää niin kysteiini- kuin lysiinipeptidinkin osalta yhtä testikemikaalia kohden, kun tulos on yksiselitteinen. Lisätestit saattavat kuitenkin olla tarpeen silloin, kun tulokset sijoittuvat lähelle positiivisten ja negatiivisten tulosten erotteluun käytettävää raja-arvoa. Tilanteissa, joissa keskimääräinen depleetioaste on 3–10 prosenttia kysteiini 1:10 / lysiini 1:50 -ennustemallissa tai kysteiinin prosentuaalinen depleetioaste on 9–17 prosenttia kysteiini 1:10 -ennustemallissa, on harkittava toista ajoa; lisäksi on harkittava kolmatta ajoa siinä tapauksessa, että kahden ensimmäisen ajon tulokset ovat keskenään ristiriidassa. Testiraportti Testiraporttiin on sisällytettävä seuraavat tiedot:
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT Aine : Alkuaineet ja niiden yhdisteet sellaisina kuin ne esiintyvät luonnossa tai tuotantomenetelmin valmistettuina, mukaan lukien tuotteen pysyvyyden säilyttämiseksi tarvittavat lisäaineet ja käytetyssä menetelmässä muodostuvat epäpuhtaudet, ei kuitenkaan liuottimet, jotka voidaan erottaa vaikuttamatta aineen pysyvyyteen tai muuttamatta sen koostumusta (1). Haittavaikutusreitti (Adverse Outcome Pathway, AOP) : Tarkastelun kohteena olevan kemikaalin tai samankaltaisten kemikaalien ryhmän kemiallisesta rakenteesta johtuva tapahtumasarja molekyylitasolla tapahtuvasta käynnistävästä tapahtumasta kiinnostuksen kohteena olevaan lopputulokseen in vivo (2). Herkkyys : Testimenetelmällä oikein luokiteltujen positiivisten/aktiivisten testikemikaalien osuus. Herkkyys on tärkeää ottaa huomioon arvioitaessa testimenetelmän merkityksellisyyttä (21). Järjestelmän soveltuvuus : Välineen suorituskyvyn (esimerkiksi herkkyyden) määrittäminen referenssinormaalin analysoinnilla ennen analyysierän ajamista (22). Kalibrointikäyrä : Kokeellisen vastearvon ja tunnetun aineen analyyttisen pitoisuuden välinen suhde (josta käytetään myös nimitystä vakiokäyrä). Kemikaali : Aine tai aineiden seos. Koostumukseltaan tuntematon tai vaihteleva aine (UVCB) : Koostumukseltaan tuntemattomat tai vaihtelevat aineet, kompleksit reaktiotuotteet tai biologiset materiaalit. Käynnistävä molekyylitason tapahtuma : Kemikaalin aiheuttama, molekyylitasolla tapahtuva biologisen järjestelmän häiriö, joka on määritetty haittavaikutusreitin käynnistäväksi tapahtumaksi. Luotettavuus : Laajuus, jolla testimenetelmä on toistettavissa samassa laboratoriossa tai eri laboratorioissa pidemmällä aikavälillä käytettäessä samaa menettelyä. Arvo määritetään laskemalla laboratorionsisäinen ja laboratorioidenvälinen uusittavuus ja laboratorionsisäinen toistettavuus (21). Merkityksellisyys : Kuvaus testin ja toivotun vaikutuksen välisestä suhteesta ja siitä, onko testi tarkoituksenmukainen ja hyödyllinen tiettyä tarkoitusta varten. Merkityksellisyydellä tarkoitetaan sitä, missä määrin testillä voidaan tarkasti mitata tai ennustaa haluttua biologista vaikutusta. Merkityksellisyyden yhteydessä on huomioitava myös testimenetelmän tarkkuus (vastaavuus) (21). Positiivinen kontrolli : Näyte, jossa on kaikki testijärjestelmän osat ja joka on käsitelty aineella, jonka tiedetään aiheuttavan positiivisen vasteen. Vaste ei kuitenkaan saisi olla liian voimakas, jotta positiivisen kontrollivasteen vaihtelu ajan funktiona voidaan arvioida. Seos : Seos tai liuos, joka muodostuu kahdesta tai useammasta aineesta ja jossa nämä aineet eivät reagoi (1). Spesifisyys : Testimenetelmällä oikein luokiteltujen negatiivisten/inaktiivisten testikemikaalien osuus. Spesifisyys on tärkeää ottaa huomioon testimenetelmän merkityksellisyyttä arvioitaessa (21). Tarkkuus : Testimenetelmän tulosten ja hyväksyttyjen vertailuarvojen välinen ero. Se on testimenetelmän suorituskyvyn mitta ja yksi merkityksellisyyden osa-alueista. Tarkkuutta ja vastaavuutta käytetään usein toisiaan korvaavasti tarkoittamaan testimenetelmällä saatujen oikeiden tulosten osuutta (21). Testikemikaali : Termillä ”testikemikaali” viitataan siihen, mitä testataan. Useasta aineosasta koostuva aine : Aine, jossa sen kvantitatiivisen koostumuksen perusteella on useampaa kuin yhtä pääaineosaa ja jonka aineosien pitoisuudet ovat vähintään 10 painoprosenttia ja alle 80 painoprosenttia. Useasta aineosasta koostuva aine syntyy valmistusprosessin tuloksena. Seoksen ja useasta aineosasta koostuvan aineen välinen ero on se, että seos saadaan aikaan sekoittamalla kahta tai useampaa ainetta ilman kemiallista reaktiota. Useasta aineosasta muodostuva aine syntyy kemiallisen reaktion tuloksena. Uusittavuus : Samalla kemikaalilla ja saman testiprotokollan mukaisesti tehdyillä testeillä saatujen tulosten keskinäinen vastaavuus (ks. luotettavuus) (21). Vaara : Vaikuttavan tekijän (”agentin”) tai tilanteen sisäinen ominaisuus, jolla on kyky aiheuttaa haitallisia vaikutuksia, kun organismi, järjestelmä tai (ala)populaatio altistuu kyseiselle aineelle. Validoitu testimenetelmä : Testimenetelmä, jonka katsotaan olevan riittävän relevantti ja luotettava tiettyyn tarkoitukseen ja joka perustuu tieteellisesti vakaisiin periaatteisiin. Mitään testimenetelmää ei voida koskaan pitää absoluuttisesti validoituna vaan ainoastaan validoituna suhteessa määritettyyn tarkoitukseen (21). Variaatiokerroin : Variaation mittayksikkö, joka lasketaan toistoista saatujen tietojen pohjalta jakamalla normaalijakauma keskiarvolla. Variaatiokerroin voidaan ilmaista prosenttilukuna kertomalla se 100:lla. Vertailukontrolli : Käsittelemätön näyte, jossa on kaikki testijärjestelmän osat, mukaan luettuina liuotin tai kantaja-aine, ja joka prosessoidaan testikemikaalilla käsiteltyjen ja muiden kontrollinäytteiden kanssa perusvastetason määrittämiseksi näytteille, joissa testikemikaali on liuotettu samaan liuottimeen tai kantaja-aineeseen. Kun tällainen näyte testataan samanaikaisesti negatiivisen kontrollin kanssa, se osoittaa myös, reagoiko liuotin tai kantaja-aine testijärjestelmän kanssa. Yhdennetty lähestymistapa testaamiseen ja arviointiin (Integrated Approach to Testing and Assessment, IATA) : Jäsennelty lähestymistapa, jota käytetään kemikaalin tai kemikaaliryhmän aiheuttaman vaaran tunnistamiseen (potentiaali), vaaran luonnehtimiseen (potenssi) ja/tai turvallisuuden arviointiin (potentiaali/potenssi ja altistus), kokoamalla ja punnitsemalla kaikki strategisesti keskeiset tiedot, jotta voidaan tarjota tietoa sääntelyyn perustuvaan päätöksentekoon potentiaalisesta vaarasta ja/tai riskistä ja/tai tarpeesta tehdä lisää kohdennettua ja siksi mahdollisimman vähäistä testausta. Yhdestä aineosasta koostuva aine : Aine, jossa sen kvantitatiivisen koostumuksen perusteella on vähintään 80 painoprosenttia yhtä pääaineosaa. YK:n kemikaalien maailmanlaajuisesti yhdenmukaistettu luokitus- ja merkintäjärjestelmä (United Nations Globally Harmonized System of Classification and Labelling of Chemicals, UN GHS) : Järjestelmä, jossa kemikaalit (aineet ja seokset) luokitellaan vakioitujen fysikaalisten sekä terveys- ja ympäristövaarojen tyyppien ja -tasojen mukaisesti ja niille osoitetaan vaaraviestinnän tunnukset, kuten kuvamerkit, huomiosanat, vaaralausekkeet, turvalausekkeet ja turvatiedotteet, jotta voidaan välittää tietoa kemikaalien haittavaikutuksista ihmisten ja ympäristön suojelemiseksi (esimerkiksi työnantajille, työntekijöille, kuljetushenkilökunnalle, kuluttajille ja pelastushenkilöstölle) (1). Lisäys 2 PÄTEVYYDEN OSOITTAMISEEN TARKOITETUT AINEET In chemico -ihoherkistys: DPRA (Direct Peptide Reactivity Assay) Ennen kuin laboratoriot ottavat tämän testimenetelmän rutiininomaiseen käyttöön, niiden on osoitettava tekninen pätevyytensä saamalla oikea, odotettava DPRA-ennuste 10:lle pätevyyden osoittamiseen tarkoitetulle aineelle, joita suositellaan taulukossa 1, ja saamalla kysteiinin ja lysiinin depeetioarvot, jotka osuvat niille määritettyihin viiteväleihin, kahdeksalla aineella kymmenestä kunkin peptidin osalta. Nämä pätevyyden osoittamiseen tarkoitetut aineet on valittu niin, että ne edustavat erilaisia vasteita ihon herkistymisvaaraan.. Valintakriteereihin kuului myös se, että niitä on kaupallisesti saatavana, että saatavana on laadukkaita in vivo -vertailutietoja ja laadukkaita DPRA:lla tuotettuja in vitro -tietoja ja että niitä käytettiin EURL ECVAMin koordinoimassa validointitutkimuksessa sen osoittamiseen, että testimenetelmän käyttöönotto onnistui tutkimukseen osallistuneissa laboratorioissa. Taulukko 1 Suositellut pätevyyden osoittamiseen tarkoitetut aineet DPRA-kokeeseen liittyvän teknisen pätevyyden osoittamiseksi
Lisäys 3 ESIMERKKEJÄ ANALYYSISEKVENSSISTÄ
B.60 In vitro -ihoherkistys: ARE-Nrf2-lusiferaasi-testimenetelmä JOHDANTO Tämä testimenetelmä (TM) vastaa OECD:n testiohjetta (TG) nro 442D (2015). Ihoa herkistävällä aiheella tarkoitetaan Yhdistyneiden kansakuntien (YK) GHS-järjestelmän (Globally Harmonized System of Classification and Labelling of Chemicals; kemikaalien maailmanlaajuisesti yhdenmukaistettu luokitus- ja merkintäjärjestelmä) (1) sekä aineiden ja seosten luokituksesta, merkinnöistä ja pakkaamisesta annetun asetuksen (EY) N:o 1272/2008 (CLP-asetus) määritelmän mukaisesti ainetta, joka aiheuttaa ihokosketuksen seurauksena allergisen reaktion. (27) Tämä testimenetelmä on in vitro -menetelmä (ARE-Nrf2-lusiferaasikoe), joka auttaa erottamaan ihoa herkistävät aineet herkistystä aiheuttamattomista aineista YK:n GHS-järjestelmän (1) sekä CLP-asetuksen mukaisesti. Ihon herkistymisen taustalla vaikuttavista keskeisistä biologisista tapahtumista vallitsee yleinen yhteisymmärrys. Olemassa olevat tiedot ihon herkistymiseen liittyvistä kemiallisista ja biologisista mekanismeista on esitetty tiivistetysti haittavaikutusreitin (Adverse Outcome Pathway, AOP) (2) muodossa herkistymisen käynnistävästä molekyylitason tapahtumasta välivaiheiden kautta aina haittavaikutukseen eli ihmisen allergiseen kosketusihottumaan tai jyrsijän kosketusallergiaan (2) (3). Herkistymisen käynnistävä molekyylitason tapahtuma on se, että elektrofiiliset aineet muodostavat kovalenttisidoksen ihon proteiinien nukleofiilisiin keskuksiin. Toinen keskeinen tapahtuma tässä ihon herkistymisen haittavaikutusreitissä tapahtuu keratinosyyteissä; se käsittää tulehdusvasteita ja geeniekspression, joka liittyy tiettyihin solujen viestinvälitysreitteihin, kuten antioksidatiivisista/elektrofiilisista vaste-elementeistä (ARE) riippuviin reitteihin. Kolmas keskeinen tapahtuma on dendriittisolujen aktivoituminen, jota arvioidaan yleensä tiettyjen solujen pintamarkkerien, kemokiinien ja sytokiininen, ilmenemisen perusteella. Neljäs keskeinen tapahtuma on T-solujen proliferaatio, jota arvioidaan välillisesti hiirille tehdyllä LLNA-kokeella (Local Lymph Node Assay) (4). Ihon herkistymisen arvioinnissa on käytetty yleensä koe-eläimiä. Marsujen käyttöön perustuvilla klassisilla menetelmillä – Magnusson–Kligmanin GMPT-testillä (Guinea Pig Maximisation Test) ja Buehlerin testillä (TM B.6 (5)) – tutkitaan ihon herkistymisen induktio- ja haastevaihetta. Myös hiirillä tehty LLNA-koe (Local Lymph Node Assay) (TM B.42 (4)) ja sen kaksi ei-radioaktiivista muunnosta (LLNA: DA (TM B.50 (6)) ja LLNA: BrdU-ELISA (TM B.51 (7)), joilla kaikilla arvioidaan vain induktiovastetta, ovat saaneet hyväksyntää, sillä marsukokeisiin verrattuna niillä on eläinten hyvinvointiin liittyviä hyötyjä ja niillä mitataan objektiivisesti ihon herkistymisen induktiovaihetta. Viime aikoina mekanistispohjaiset in chemico- ja in vitro -testausmenetelmät on katsottu tieteellisesti valideiksi menetelmiksi kemikaalien ihoherkistysvaaran arviointiin. Jotta käytössä olevat eläinkokeet voidaan korvata täysin, testausta ja arviointia koskeviin yhdennettyihin lähestymistapoihin (Integrated Approaches to Testing and Assessment, IATA) tarvitaan kuitenkin eläinkokeettomien menetelmien (in silico, in chemico, in vitro) yhdistelmiä, sillä kullakin nykyisin käytettävissä olevalla eläinkokeettomalla testimenetelmällä voidaan kattaa haittavaikutusreitti mekanistisesti vain rajallisesti (2) (3). Tällä testimenetelmällä (ARE-Nrf2-lusiferaasikokeella) on tarkoitus tutkia toista keskeistä tapahtumaa, joka kuvataan kohdassa 2. Ihoa herkistävien aineiden on raportoitu indusoivan geenejä, joita antioksidatiiviset vaste-elementit (ARE) säätelevät (8) (9). Pienikokoiset elektrofiiliset aineet, kuten ihoa herkistävät aineet, voivat vaikuttaa Keap1-sensoriproteiiniin (Kelch-like ECH-associated protein 1), esimerkiksi kysteiinijäämän kovalenttimuutoksen kautta, minkä seurauksena se irtautuu transkriptiotekijästä Nrf2 (nuclear factor-erythroid 2-related factor 2). Irtautunut Nrf2 voi sitten aktivoida ARE-riippuvaisia geenejä, kuten vaiheen II detoksifioivia entsyymejä koodaavia geenejä (8) (10) (11). Tällä hetkellä ainoa tämän testimenetelmän kattama in vitro -ARE-Nrf2-lusiferaasikoe on KeratinoSens™-koe, josta on tehty validointitutkimukset (9) (12) (13), minkä jälkeen Euroopan unionin vaihtoehtoisten tutkimusmenetelmien vertailulaboratorio (EURL ECVAM) on tehnyt riippumattoman vertaisarvioinnin (14). KeratinoSens™-kokeen katsottiin olevan tieteellisesti kelvollinen käytettäväksi osana testausta ja arviointia koskevaa yhtenäistä lähestymistapaa ihoa herkistävien aineiden erottamiseen herkistystä aiheuttamattomista aineista vaaran luokittelua varten ja merkintätarkoituksiin (14). Laboratoriot, jotka haluavat ottaa testimenetelmän käyttöön, voivat saada KeratinoSens™-kokeessa käytetyn rekombinanttisolulinjan tekemällä lisenssisopimuksen testimenetelmän kehittäjän kanssa (15). Määritelmät esitetään lisäyksessä 1. ALUSTAVAT NÄKÖKOHDAT, KÄYTETTÄVYYS JA RAJOITUKSET Koska Keap1-Nrf2-ARE-reitin aktivoituminen liittyy ainoastaan ihon herkistymisen haittavaikutusreitin toiseen keskeiseen tapahtumaan, tällä testimenetelmällä saadut tiedot, jotka perustuvat tämän reitin aktivoitumiseen, eivät todennäköisesti itsessään riitä kemikaalien ihoherkistyspotentiaalia koskevien päätelmien tekemiseen. Siksi tällä testimenetelmällä tuotettuja tietoja pitäisi tarkastella osana kokonaisvaltaista lähestymistapaa (esimerkiksi IATA) yhdistämällä ne muihin, täydentäviin tietoihin, kuten tietoihin, jotka on saatu in vitro -kokeilla, joissa tutkitaan ihon herkistymisen haittavaikutusreitin muita keskeisiä tapahtumia, sekä testittömillä menetelmillä, joihin kuuluu muun muassa interpolointi (read-across) samankaltaisista kemikaaleista. Esimerkkejä siitä, miten ARE-Nrf2-lusiferaasi-testimenetelmää voidaan käyttää yhdessä muiden tietojen kanssa, annetaan alan kirjallisuudessa (13) (16) (17) (18) (19). Tätä testimenetelmää voidaan käyttää apuna ihoa herkistävien aineiden (YK:n GHS-järjestelmän / CLP-asetuksen luokka 1) erottamiseen herkistystä aiheuttamattomista aineista osana IATA:ta. Tätä testimenetelmää ei voida käyttää yksinään ihoa herkistävien aineiden luokittelemiseen YK:n GHS-järjestelmän / CLP-asetuksen mukaisiin alaluokkiin 1A ja 1B eikä niiden vaikutuksen ennustamiseen turvallisuuden arviointiin liittyvää päätöksentekoa varten. Sääntelykehyksestä riippuen positiivista tulosta voidaan kuitenkin sellaisenaan käyttää kemikaalin luokitteluun YK:n GHS-järjestelmän / CLP-asetuksen luokkaan 1. Validointitutkimuksesta ja omista testeistä (in-house testing) saatujen, testimenetelmän riippumattomaan vertaisarviointiin käytettyjen tietojen perusteella KeratinoSens-kokeen on osoitettu olevan siirrettävissä laboratorioihin, joilla on kokemusta soluviljelystä. Testimenetelmällä odotettavien ennusteiden toistettavuus on 85 prosentin luokkaa laboratorioissa ja niiden välillä (14). KeratinoSens™-kokeen tarkkuus (77 prosenttia – 155/201), herkkyys (78 prosenttia – 71/91) ja spesifisyys (76 prosenttia – 84/110) ihoa herkistävien aineiden (eli YK:n GHS-järjestelmän / CLP-asetuksen luokan 1) erottamisessa herkistämättömistä aineista LLNA-tuloksiin verrattuna laskettiin ottamalla huomioon kaikki EURL ECVAMille tämän testimenetelmän arviointia ja vertaisarviointia varten toimitetut tiedot (14). Nämä luvut ovat samankaltaisia kuin hiljattain julkaistut luvut, jotka perustuvat noin 145 aineen in-house-testaukseen (tarkkuus 77 prosenttia, sensitiivisyys 79 prosenttia ja spesifisyys 72 prosenttia) (13). KeratinoSens™-koe todennäköisesti aliennustaa sitä, että kemikaaleilla on matalasta kohtalainen ihoherkistyspotentiaali (YK:n GHS-järjestelmän / CLP-asetuksen alaluokka 1B) kuin että kemikaaleilla olisi suuri ihoherkistyspotentiaali (YK:n GHS-järjestelmän / CLP-asetuksen alaluokka 1A) (13) (14). Yhdessä nämä tiedot viittaavat siihen, että KeratinoSens™-koe auttaa hyödyllisellä tavalla tunnistamaan ihon herkistämisvaaran. Tässä esitetyt tarkkuusarvot, jotka koskevat KeratinoSens™-kokeen käyttöä ainoana testinä, ovat kuitenkin vain suuntaa-antavia, sillä testimenetelmää pitäisi käyttää yhdessä muiden tietolähteiden kanssa IATA:n valossa ja edellä olevan kohdan 9 mukaisesti. Lisäksi arvioitaessa ihon herkistymiseen liittyviä eläinkokeettomia menetelmiä tulisi pitää mielessä, että LLNA-koe ja muut eläinkokeet eivät välttämättä täysin kerro tilanteesta kiinnostuksen kohteena olevan lajin eli ihmisen tapauksessa. Tässä testimenetelmässä käytetään termiä ”testikemikaali”, jolla tarkoitetaan sitä, mitä testataan, eikä termi liity siihen, voidaanko ARE-Nrf2-lusiferaasitestimenetelmää käyttää aineiden ja/tai seosten testaamiseen. Nykyisten saatavilla olevien tietojen perusteella on osoitettu, että testikemikaalit, joihin KeratinoSens™-koetta voidaan käyttää, kattavat monenlaisia orgaanisia funktionaalisia ryhmiä ja reaktiomekanismeja ja vaihtelevat ihon herkistämispotentiaalin (siten kuin se määritetään in vivo -tutkimuksissa) ja fysikaalis-kemiallisten ominaisuuksiensa osalta (9) (12) (13) (14). Testatut aineet olivat pääasiassa yhdestä aineosasta muodostuvia aineita, vaikka olemassa onkin myös rajallinen määrä tietoa seosten testaamisesta (20). Testimenetelmää voidaan kuitenkin käyttää teknisesti monesta aineosasta muodostuvien aineiden ja seosten testaamiseen. Ennen kuin tätä testimenetelmää käytetään seokseen tulosten tuottamiseksi haluttua sääntelyyn perustuvaa tarkoitusta varten, olisi kuitenkin pohdittava sitä, antaako se riittävät tulokset kyseiseen tarkoitukseen, ja jos antaa, niin miksi. Tällaisia pohdintoja ei tarvita, kun sääntely edellyttää kyseisen seoksen testaamista. Lisäksi monesta aineosasta muodostuvia aineita tai seoksia testattaessa pitäisi ottaa huomioon sytotoksisten aineosien mahdollinen häiritsevä vaikutus havaittuihin vasteisiin. Testimenetelmää voidaan soveltaa testikemikaaleihin, jotka liukenevat tai muodostavat stabiilin dispersion (eli kolloidin tai suspension, jossa testikemikaali ei sakkaudu tai erotu faaseiksi liuottimesta) joko vedessä tai dimetyylisulfoksidissa (mukaan lukien testikemikaalin kaikki aineosat testattaessa monesta aineosasta muodostuvaa ainetta tai seosta). Jos testikemikaalit eivät täytä näitä ehtoja suurimpana vaadittuna lopullisena pitoisuutena, joka on 2 000 μM (ks. 22 kohta), niitä voidaan silti testata alhaisempina pitoisuuksina. Tällöin kohdassa 39 positiiviselle tulokselle asetetut perusteet täyttävien tulosten perusteella testikemikaali voidaan edelleen määrittää ihoa herkistäväksi aineeksi, kun taas alle 1 000 μM:n pitoisuudella saadusta negatiivisesta tuloksesta ei voida tehdä varmoja päätelmiä (ks. ennustemalli kohdasta 39). Yleisesti aineita, joiden LogP on enintään 5, on testattu onnistuneesti, kun taas testimenetelmää ei tiettävästi voida käyttää sellaisten äärimmäisten hydrofobisten aineiden kanssa, joiden LogP on yli 7 (14). Aineista, joiden LogP on 5–7, on saatavana tietoa vain rajallisesti. Negatiivisia tuloksia pitäisi tulkita varoen, sillä testimenetelmä voi antaa negatiivisen tuloksen aineista, jotka reagoivat ainoastaan lysiinijäämiin. Lisäksi käytetyn solulinjan rajallisen metabolointikyvyn (21) ja koeolosuhteiden vuoksi myös prohapteenit (eli kemikaalit, jotka vaativat entsymaattista aktivointia esimerkiksi P450-entsyymien kautta) ja prehapteenit (eli kemikaalit, jotka itsehapetus aktivoi) voivat antaa negatiivisia tuloksia varsinkin hapettumisvauhdin ollessa hidas. Toisaalta testikemikaalit, jotka eivät aiheuta herkistystä mutta ovat kuitenkin kemikaalisia stressitekijöitä, voivat aiheuttaa virheellisiä positiivisia tuloksia (14). Lisäksi erittäin sytotoksisia testikemikaaleja ei voida aina arvioida luotettavasti. Myös lusiferaasientsyymiin häiritsevästi vaikuttavat testikemikaalit voivat sekoittaa lusiferaasin toimintaa solupohjaisissa kokeissa ja aiheuttaa joko ilmeistä inhibitiota tai lisätä luminesenssia (22). Esimerkiksi fytoestrogeenipitoisuuksien, jotka ovat suurempia kuin 1 μM, on raportoitu vaikuttavan häiritsevästi luminesenssisignaaleihin muissa lusiferaasipohjaisissa reportterigeenikokeissa, mikä johtuu lusiferaasireportterigeenin yliaktivoitumisesta (23). Tämän seurauksena lusiferaasiekspressiota, joka on saatu suurilla pitoisuuksilla fytoestrogeeneja tai vastaavia kemikaaleja, joiden epäillään aiheuttavan fytoestrogeenin tavoin lusiferaasireportterigeenin yliaktivoitumista, on tutkittava huolella (23). Jos voidaan osoittaa, ettei testimenetelmä sovi käytettäväksi tiettyjen muiden testikemikaaliluokkien kanssa, testimenetelmää ei pidä käyttää niihin. Sen lisäksi, että KeratinoSens™-koe auttaa erottamaan ihoa herkistävät aineet herkistystä aiheuttamattomista aineista, se antaa myös pitoisuus-vastetietoja, jotka voivat mahdollisesti auttaa arvioimaan herkistyspotentiaalia, kun menetelmää käytetään osana kokonaisvaltaisia lähestymistapoja, kuten IATA:ta (19). Sen määrittäminen, miten KeratinoSens™-kokeen tulokset voivat auttaa arvioimaan herkistyspotentiaalia (24) ja luokittelemaan herkistäviä aineita YK:n GHS-järjestelmän / CLP-asetuksen mukaisesti, edellyttää kuitenkin lisää työtä, jonka pitäisi mieluiten perustua luotettaviin ihmisistä saatuihin tietoihin. TESTIN PERIAATE ARE-Nrf2-lusiferaasitestimenetelmässä käytetään immortalisoitua adherenttia solulinjaa, joka on saatu ihmisen HaCaT-keratinosyyteistä, jotka on stabiilisti transfektoitu selektoitavalla plasmidilla. Solulinja sisältää lusiferaasigeenin, joka on kosketuksen kautta herkistävien aineiden säätelemäksi tiedetystä geenistä peräisin olevaan ARE-elementtiin yhdistetyn konstitutiivisen promoottorin transkriptionaalisessa kontrollissa (25) (26). Lusiferaasisignaali heijastaa endogeenisten Nrf2-riippuvaisten geenien aktivoitumista herkistävien aineiden vaikutuksesta, ja lusiferaasisignaalin on osoitettu riippuvan Nrf2:sta rekombinatissa solulinjassa (27). Tämä tarjoaa mahdollisuuden mitata lusiferaasigeenin induktiota kvantitatiivisesti (havaitsemalla luminesenssi) käyttämällä vakiintuneita valoa tuottavia lusiferaasisubstraatteja merkkinä Nrf2-transkriptiotekijän aktiivisuudesta soluissa sen jälkeen, kun ne on altistettu elektrofiilisille aineille. KeratinoSens™-kokeessa testikemikaalit katsotaan positiivisiksi, jos ne indusoivat tilastollisesti merkitsevän, tietyn rajan ylittävän lusiferaasiaktiivisuuden (yli 1,5-kertainen eli 50 prosentin kasvu) tietyn rajan alittavalla pitoisuutella, joka ei merkitsevästi vaikuta solujen elinkykyyn (alle 1 000 μM ja pitoisuus, jolla solujen elinkyky on yli 70 prosenttia (9) (12)). Tätä varten lusiferaasiaktiivisuuden induktiolle määritetään enimmäiskerroin suhteessa (negatiiviseen) liuotinkontrolliin (Imax). Lisäksi koska solut altistetaan joukolle testikemikaaleja eri pitoisuuksina, vaste-annoskäyrästä pitäisi interpoloida pitoisuus, joka tarvitaan tilastollisesti merkitsevään rajan ylittävään lusiferaasiaktiivisuuden induktioon (EC1,5-arvo) (ks. ohjeet laskelmiin kohdasta 32). Lopuksi pitäisi tehdä rinnakkaisia sytotoksisuusmittauksia, jotta voidaan arvioida, ilmeneekö lusiferaasiaktiivisuuden indusoivia tasoja sytotoksisuutta pienemmillä pitoisuuksilla. Ennen kuin laboratoriot ryhtyvät käyttämään tähän testimenetelmään liittyvää ARE-Nrf2-lusiferaasikoetta rutiininomaisesti, niiden pitäisi osoittaa tekninen pätevyytensä lisäyksessä 2 lueteltujen kymmenen aineen avulla. Saatavana on suoritusarvostandardeja (PS) (28), jotka helpottavat KeratinoSens™-kokeen kaltaisten uusien tai muunnettujen in vitro -ARE-Nrf2-lusiferaasitestimenetelmien validointia ja mahdollistavat tämän menetelmän oikea-aikaisen muokkaamisen niin, että ne voidaan sisällyttää siihen. OECD:n sopimuksen mukainen tietojen vastavuoroinen hyväksyntä (Mutual Acceptance of Data, MAD) taataan ainoastaan PS:n mukaisesti validoitujen testimenetelmien osalta, jos OECD on tarkistanut ja sisällyttänyt ne vastaavaan testausohjeeseen. MENETTELY Tällä hetkellä ainoa menetelmä, jonka tämä testimenetelmä kattaa, on tieteellisesti validoitu KeratinoSens™-koe (9) (12) (13) (14). KeratinoSens™-kokeen vakiomenettely (Standard Operating Procedures, SOP) on saatavana, ja sitä pitäisi käyttää, kun laboratorio ottaa testimenetelmän käyttöön ja käyttää sitä (15). Laboratoriot, jotka haluavat ottaa testimenetelmän käyttöön, voivat saada KeratinoSens™-kokeessa käytetyn rekombinanttisolulinjan tekemällä lisenssisopimuksen testimenetelmän kehittäjän kanssa. Seuraavissa kappaleissa kuvaillaan ARE-Nrf2-lusiferaasitestimenetelmän tärkeimmät osat ja menettelyt. Keratinosyyttiviljelmien valmistelu Viljelmien valmistelussa pitäisi käyttää transgeenistä solulinjaa, johon on insertoitu vakaasti ARE-elementin säätelemä lusiferaasireportterigeeni (esimerkiksi KeratinoSens™-solulinjaa). Vastaanoton jälkeen soluja propagoidaan (esimerkiksi 2–4 jatkoviljelyä) ja säilytetään pakastettuina homogeenisena kantana. Tästä alkuperäisestä kannasta peräisin olevia soluja voidaan propagoida jatkoviljelyjen enimmäismäärään saakka (joka on KeratinoSensin™ tapauksessa 25), ja niitä käytetään rutiininomaiseen testaamiseen käyttämällä asianmukaista elatusainetta (KeratinoSensin™ tapauksessa kyseeseen tulevat DMEM:ää sisältävä seerumi ja Geneticin). Testissä käytettävien solujen pitäisi olla 80–90-prosenttisen konfluentteja, ja on varmistettava, ettei solujen anneta koskaan kasvaa täysin konfluenteiksi. Päivä ennen testaamista solut kerätään ja jaetaan 96 kuopan levyihin (KeratinoSensin™ tapauksessa 10 000 solua/kuoppa). Jotta solut jakautuisivat kuoppalevylle määrältään tasaisesti, on pyrittävä välttämään solujen sedimentaatiota siirrostuksen aikana. Ellei näin tehdä, erot kuoppien välillä voivat olla suuret. Kussakin toistossa käytetään kolmea rinnakkaisnäytettä lusiferaasiaktiviteetin mittaamiseen ja yhtä rinnakkaista rinnakkaisnäytettä solujen elinkyvyn testaamiseen. Testikemikaalien ja kontrolliaineiden valmistelu Testikemikaali ja kontrolliaineet valmistetaan testipäivänä. KeratinoSens™-kokeessa käytettävät testikemikaalit liuotetaan dimetyylisulfoksidiin (DMSO) halutun lopullisen pitoisuuden saavuttamiseksi (esimerkiksi 200 mM). Dimetyylisulfoksidiliuoksia voidaan pitää itsesteriloivina, joten steriilisuodatusta ei tarvita. Testikemikaali, joka ei liukene dimetyylisulfoksidiin, liuotetaan steriliin veteen tai viljelyalustaan ja liuokset steriloidaan esimerkiksi suodattamalla. Ellei testikemikaalille ole määritetty molekyylimassaa (MW), KeratinoSens™-kokeessa valmistetaan oletuspitoisuuden mukainen kantaliuos (40 mg/mL eli 4 painoprosenttia tilavuudesta). Muiden liuottimien kuin dimetyylisulfoksidin, veden tai viljelyalustan käytölle on esitettävä riittävät tieteelliset perustelut. Dimetyylisulfoksidiin liuotetusta testikemikaalista valmistettujen kantaliuosten pohjalta valmistetaan sarja laimennoksia käyttämällä dimetyylisulfoksidia, niin että testattavasta kemikaalista saadaan 12 master-pitoisuutta (jotka ovat KeratinoSens™-kokeessa 0,098–200 mM). Ellei testikemikaali liukene dimetyylisulfoksidiin, master-pitoisuuksien saamiseksi tehtäviin laimennoksiin käytetään steriiliä vettä tai steriiliä viljelyalustaa. Käytetystä liuottimesta riippumatta master-pitoisuudet laimennetaan sitten edelleen 25-kertaisesti seerumia sisältävällä viljelyalustalla, ja lopuksi niitä laimennetaan edelleen 4-kertaisesti, jolloin testatun kemikaalin lopulliset pitoisuudet ovat 0,98–2000 μ–M KeratinoSens™-kokeessa. Muita pitoisuuksia voidaan käyttää, jos se on perusteltua (esimerkiksi sytotoksisuuden tai heikon liukenevuuden vuoksi). KeratinoSens™-kokeessa käytettävä negatiivinen kontrolli (liuotinkontrolli) on dimetyylisulfoksidi (CAS-nro 67-68-5, puhtaus ≥ 99 prosenttia), jota käytetään kuudessa kuopassa kullakin kuoppalevyllä. Sille tehdään kohdassa 22 kuvattu sama laimennus kuin master-pitoisuuksille, minkä seurauksena negatiivisen kontrollin (liuotinkontrollin) lopullinen pitoisuus on 1 prosentti; tämä pitoisuus ei vaikuta solujen elinkykyyn, ja se vastaa testatun kemikaalin ja positiivisen kontrollin dimetyylisulfoksidipitoisuutta. Ellei testikemikaali liukene dimetyylisulfoksidiin, vaan laimennuksessa on käytettävä vettä, lopullisen testiliuoksen dimetyylisulfoksidipitoisuutta on kaikissa kuopissa säädettävä 1 prosenttiin, niin kuin myös muiden testikemikaalien ja kontrolliaineiden kanssa tehdään. KeratinoSens™-kokeessa käytettävä positiivinen kontrolli on kanelialdehydi (CAS-nro 14371-10-9, puhtaus ≥ 98 prosenttia), josta valmistetaan dimetyylisulfoksidiin (6,4 mM:n kantaliuos) viiden master-pitoisuuden sarja, joiden pitoisuudet ovat 0,4–6,4 mM ja jotka kohdassa 22 kuvataan master-pitoisuuksien osalta kuvatulla tavalla, niin että positiivisen kontrollin lopullinen pitoisuus on 4–64 μM. Myös muita sopivia positiivisia kontrolleja, joiden tuottamat EC1,5-arvot ovat mieluiten keskitasoa, voidaan käyttää, jos saatavana on historiallisia tietoja, joista voidaan johtaa vastaavat ajon hyväksyntäperusteet. Testikemikaalin ja kontrolliaineiden annostelu Kutakin testikemikaalia ja positiivista kontrolliainetta kohden tarvitaan (positiivisen tai negatiivisen) ennusteen saamiseksi yksi koe; se muodostuu vähintään kahdesta riippumattomasta toistosta, joista kukin käsittää kolme rinnakkaisnäytettä (eli n = 6). Jos kahden riippumattoman toiston tulokset ovat keskenään ristiriidassa, on tehtävä kolmas toisto, joka käsittää kolme rinnakkaisnäytettä (eli n = 9). Kukin riippumaton toisto tehdään eri päivinä käyttämällä testikemikaalien tuoretta kantaliuosta ja erikseen kerättyjä soluja. Solut voivat kuitenkin olla peräisin samasta jatkoviljelystä. Kohdassa 20 kuvatun siirrostuksen jälkeen soluja viljellään 24 tuntia 96-kuoppaisissa kuoppalevyissä. Tämän jälkeen viljelyaine poistetaan ja korvataan tuoreella viljelyaineella (KeratinoSensin™ tapauksessa 150 μl:n viljelyaine, joka sisältää seerumia, mutta ei Geneticinia), johon lisätään 50 μl 25-kertaisesti laimennettua testikemikaalia ja kontrolliaineita. Jokaisesta levystä pitäisi jättää tyhjäksi ainakin yksi kuoppa (ei soluja eikä käsittelyä) tausta-arvojen arviointia varten. Käsiteltyjä levyjä inkuboidaan sitten noin 48 tuntia 37 ± 1 °C:ssa, niin että CO2 -pitoisuus on 5 prosenttia, KeratinoSens™-kokeessa. Haihtuvien testikemikaalien höyrystymistä ja testikemikaalien aiheuttamaa kuoppien välistä ristikontaminaatiota on vältettävä esimerkiksi peittämällä levyt kelmulla ennen inkubointia testikemikaalien kanssa. Lusiferaasiaktiivisuuden mittaukset Asianmukaisten luminesenssilukemien saamiseen vaikuttavat keskeisesti kolme asiaa:
Ennen testaamista on varmistettava näiden kolmen kohdan täyttyminen tekemällä lisäyksessä 3 kuvatut kontrollikoejärjestelyt. Kun soluja on altistettu KeratinoSens™-kokeessa 48 tuntia testikemikaalille ja kontrolliaineille, ne pestään fosfaattipuskuroidulla suolaliuoksella, ja kuhunkin kuoppaan lisätään luminesenssilukemia varten asianmukaista lyysispuskuria 20 minuutiksi huoneenlämpötilassa. Tämän jälkeen levyt, joissa on solulysaattia, asetetaan luminometriin KeratinoSens™-koetta varten ohjelmoitujen lukemien ottamista varten: (i) kuhunkin kuoppaan lisätään lusiferaasisubstraattia (eli 50 μl), (ii) odotetaan yksi sekunti ja (iii) mitataan lusiferaasiaktiivisuutta kahden sekunnin ajan. Jos esimerkiksi käytetyn luminometrin mallin vuoksi käytetään muita asetuksia, ne on perusteltava. Lisäksi voidaan käyttää hohtosubstraattia, jos lisäyksen 3 mukainen laadunvalvontakoe on tehty onnistuneesti. Sytotoksisuuden arviointi Solujen elinkykyisyyttä testaavaa KeratinoSens™ -koetta varten viljelyaine korvataan 48 tunnin altistusajan jälkeen tuoreella viljelyaineella, joka sisältää MTT:tä (3-(4,5-dimetyylitiatsol-2-yyli)-2,5-difenyylitetrasoliumbromidi; tiatsolyylisininen tetrasoliumbromidi; CAS-nro 298-93-1) ja soluja inkuboidaan 4 tuntia 37 °C:ssa, niin että ympäristön CO2-pitoisuus on 5 prosenttia. Sitten MTT:tä sisältävä viljelyaine poistetaan ja solujen annetaan lysoitua yön yli (esimerkiksi lisäämällä 10-prosenttista SDS-liuosta kuhunkin kuoppaan). Ravistuksen jälkeen mitataan absorptio 600 nm:ssa fotometrilla. TIEDOT JA RAPORTOINTI Tietojen arviointi KeratinoSens™-kokeessa lasketaan seuraavat parametrit:
Yhtälö 1:
jossa
EC1,5 lasketaan yhtälöllä 2 käyttämällä lineaarista interpolointia, ja yleinen EC1,5 on yksittäisten toistojen geometrinen keskiarvo. Yhtälö 2:
jossa
Elinkyky lasketaan yhtälöllä 3: Yhtälö 3:
jossa
IC50 ja IC30 lasketaan yhtälöllä 4 käyttämällä lineaarista interpolointia, ja yleiset IC50 ja IC30 ovat yksittäisten toistojen geometrisiä keskiarvoja. Yhtälö 4:
jossa
Jokaisen pitoisuuden osalta, jolla lusiferaasiaktiivisuuden induktio on yli 1,5-kertainen, lasketaan tilastollinen merkitsevyys (esimerkiksi kaksisuuntaisella Studentin t-testillä), vertaamalla kolmen rinnakkaisnäytteen luminesenssiarvoja liuotinkontrollia (negatiivinen kontrolli) sisältävien kuoppien luminesenssiarvoihin, jotta voidaan määrittää, onko luminesenssiaktiivisuuden induktio tilastollisesti merkitsevä (p < 0,05). Pienin pitoisuus, jolla lusiferaasiaktiivisuuden induktiokerroin on vähintään 1,5, ratkaisee EC1,5-arvon. Kussakin tapauksessa tarkastetaan, onko tämä arvo pienempi kuin IC30-arvo, mikä viittaa siihen, että solujen elinkyky on vähentynyt alle 30 prosenttia EC1,5-arvon määrittävällä pitoisuudella. Suosituksena on, että tiedot tarkastetaan visuaalisesti graafien avulla. Jos selvää annos-vastekäyrää ei havaita tai jos saatu annos-vastekäyrä on bifaasinen (eli 1,5:n raja ylittyy kahdesti), koe pitäisi toistaa, jotta voidaan varmistaa, johtuuko tämä testikemikaalista vai kokeeseen liittyvästä artefaktista. Jos bifaasinen vaste kyetään toistamaan riippumattomassa kokeessa, on ilmoitettava alhaisempi EC1,5-arvo (pitoisuus, jolla 1,5:n raja ylittyy ensimmäistä kertaa). Niissä harvinaisissa tapauksissa, joissa havaitaan tilastollisesti ei-merkitsevä yli 1,5-kertainen induktio, minkä jälkeen suurempi pitoisuus aiheuttaa tilastollisesti merkitsevän induktion, tämän toiston tuloksia pidetään yhtä valideina ja positiivisina kuin jos 1,5:n rajan ylittävä tilastollisesti merkitsevä induktio olisi saatu ei-sytotoksisella pitoisuudella. Kun testikemikaalilla saadaan aikaan 1,5-kertainen tai suurempi induktio jo alhaisimmalla testipitoisuudella (0,98 μM), EC1,5-arvoksi määritetään alle 0,98 annos-vastekäyrän visuaalisen tarkastuksen perusteella. Hyväksyntäperusteet Seuraavien hyväksyntäperusteiden pitäisi täyttyä KeratinoSens™-koetta käytettäessä. Ensinnäkin positiivisella kontrollilla, kanelialdehydillä, saadun lusiferaasiaktiivisuuden induktion pitäisi olla tilastollisesti merkitsevä 1,5:n rajan yläpuolella (esimerkiksi T-testiä käytettäessä) ainakin yhdellä testatulla pitoisuudella (4–64 μM). Toiseksi EC1,5-arvon pitäisi olla testauslaitoksen säännöllisesti päivitettävän historiallisen keskiarvon kahden keskihajonnan välissä (esimerkiksi 7–30 μM validointitietojen perusteella). Lisäksi kanelialdehydin osalta kolmen rinnakkaisnäytteen keskimääräisen induktion pitäisi olla 64 μM:ssä 2–8. Ellei jälkimmäinen peruste täyty, kanelialdehydin annos-vastesuhde pitäisi tarkistaa huolella ja testit voidaan hyväksyä vain, jos on annos-vastesuhde on selvä, niin että lusiferaasiaktiivisuuden induktio kasvaa positiivisen kontrollin pitoisuuksien kasvaessa. Lisäksi negatiivisen kontrollin (liuotinkontrollin) eli dimetyylisulfoksidin luminesenssilukeman keskimääräisen variaatiokertoimen pitäisi olla alle 20 prosenttia jokaisessa toistossa, joka käsittää kuusi kuoppaa, joista kukin testataan kolmesti. Jos vaihtelevuus on suurempi, tulokset on hylättävä. Tulosten tulkinta ja ennustettavuusmalli KeratinoSens™-ennuste katsotaan positiiviseksi, jos kaikki neljä seuraavaa ehtoa täyttyvät kahdessa toistossa kahdesta tai samoissa kahdessa toistossa kolmesta; muutoin KeratinoSens™-ennuste katsotaan negatiiviseksi (kuva 1):
Jos tietyssä toistossa kaikki kolme ensimmäistä edellytystä täyttyvät, mutta lusiferaasi-induktion selvää annos-vastesuhdetta ei havaita, kyseisen toiston tulos pitäisi katsoa epävarmaksi ja testejä on mahdollisesti tehtävä lisää (kuva 1). Lisäksi negatiivinen tulos, joka on saatu pitoisuuksilla, jotka ovat alle 1 000 μM (tai alle 200 μg/ml, kun testikemikaalin molekyylimassaa ei ole määritetty), pitäisi myös katsoa epävarmaksi (ks. 11 kohta). Kuva 1 KeratinoSens™-kokeessa käytetty ennustemalli. KeratinoSens™-ennustetta pitäisi tarkastella IATA:n valossa ja kohtien 9 ja 11 mukaisesti.
Harvoissa tapauksissa testikemikaalit, joiden indusoima lusiferaasiaktiivisuus on hyvin lähellä sytotoksisia tasoja, voivat olla positiivisia joissakin toistoissa ei-sytotoksisila tasoilla (eli EC1,5-arvon ratkaiseva pitoisuus on pienempi kuin (<) IC30), ja toisissa toistoissa vain sytotoksisilla tasoilla (eli EC1,5-arvon ratkaiseva pitoisuus on suurempi kuin (>) IC30). Tällaiset kemikaalit on testattava uudelleen käyttämällä kapeampaa annos-vasteanalyysia ja pienempää laimennuskerrointa (eli 1,33- tai Ö2 (= 1,41) -kertainen laimennus kuoppien välillä), jotta voidaan määrittää, onko induktio tapahtunut sytotoksisilla tasoilla vai ei (9). Testiraportti Testiraporttiin on sisällytettävä seuraavat tiedot:
LÄHDENKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT Aine : Alkuaineet ja niiden yhdisteet sellaisina kuin ne esiintyvät luonnossa tai tuotantomenetelmin valmistettuina, mukaan lukien tuotteen pysyvyyden säilyttämiseksi tarvittavat lisäaineet ja käytetyssä menetelmässä muodostuvat epäpuhtaudet, ei kuitenkaan liuottimet, jotka voidaan erottaa vaikuttamatta aineen pysyvyyteen tai muuttamatta sen koostumusta (1). ARE : Antioksidatiivinen vaste-elementti (josta käytetään myös nimitystä elektrofiilinen vaste-elementti, EpRE) on vaste-elementti, joka löytyy monien sytoprotektiivisten ja vaiheen II geenien ylävirrassa sijaitsevalta promoottorialueelta. Kun Nfr2 aktivoi sen, se välittää näiden geenien transkriptionaalisen induktion. EC1,5 : 1,5-kertaiselle lusiferaasi-induktiolle interpoloitu pitoisuus. Haittavaikutusreitti (Adverse Outcome Pathway, AOP) : Tarkastelun kohteena olevan kemikaalin tai samankaltaisten kemikaalien ryhmän kemiallisesta rakenteesta johtuva tapahtumasarja molekyylitasolla tapahtuvasta käynnistävästä tapahtumasta kiinnostuksen kohteena olevaan lopputulokseen in vivo (2). Herkkyys : Niiden positiivisten/aktiivisten testikemikaalien osuus, jotka on luokiteltu testissä oikein. Herkkyydellä mitataan luokittavia tuloksia tuottavan testimenetelmän tarkkuutta, ja se on tärkeää ottaa huomioon arvioitaessa testimenetelmän merkityksellisyyttä (29). IC30 : Pitoisuus, joka vähentää solujen elinkykyä 30 prosenttia. IC50 : Pitoisuus, joka vähentää solujen elinkykyä 50 prosenttia. Imax : Suurin lusiferaasiaktiivisuuden induktiokerroin verrattuna liuoskontrolliin (negatiiviseen kontrolliin) mitattuna millä tahansa testikemikaalipitoisuudella. Keap1 : Lyhenne sanoista Kelch-like ECH-associated protein 1. Sensoriproteiini, joka voi säädellä Nrf2-aktiivisuutta. Indusoimattomissa olosuhteissa Keap 1-sensoriproteiini vaikuttaa Nrf2-transkriptiofaktoriin ja saa aikaan ubikitinaation ja protelyyttisen degradaation proteasomissa. Keap 1:n reaktiivisten kysteiinijäämien kovalenttimuunnos pienten molekyylien vaikutuksesta voi johtaa Nrf2:n irtoamiseen Keap1:stä (8) (10) (11). Kemikaali : Aine tai aineiden seos. Koostumukseltaan tuntematon tai vaihteleva aine (UVCB) : Koostumukseltaan tuntemattomat tai vaihtelevat aineet, kompleksit reaktiotuotteet tai biologiset materiaalit. Liuotin-/kantajakontrolli : Rinnakkaisnäyte, joka sisältää kaikki testijärjestelmän komponentit lukuun ottamatta testikemikaalia ja mukaan lukien käytetyn liuottimen. Sen avulla määritetään perusvaste sellaisten näytteiden osalta, joita käsitellään samaan liuottimeen liuotetulla testikemikaalilla. Luotettavuus : Laajuus, jolla testimenetelmä on toistettavissa samassa laboratoriossa tai eri laboratorioissa pidemmällä aikavälillä käytettäessä samaa menettelyä. Arvo määritetään laskemalla laboratorionsisäinen ja laboratorioidenvälinen uusittavuus ja laboratorionsisäinen toistettavuus (29). Merkityksellisyys : Kuvaus testin ja toivotun vaikutuksen välisestä suhteesta ja siitä, onko testi tarkoituksenmukainen ja hyödyllinen tiettyä tarkoitusta varten. Merkityksellisyydellä tarkoitetaan sitä, missä määrin testillä voidaan tarkasti mitata tai ennustaa haluttua biologista vaikutusta. Merkityksellisyyden yhteydessä on huomioitava myös testimenetelmän tarkkuus (vastaavuus) (29). Nrf2 : Lyhenne sanoista Nuclear factor (erythroid-derived 2)-like 2. Transkriptiofaktori, joka on osa antioksidatiivista vastereittiä. Kun Nrf2 ei ubikinoidu, se kertyy sytoplasmaan ja siirtyy tumaan, missä se yhdistyy ARE:hen monien sytoprotektiivisten geenien ylävirrassa sijaitsevalla promoottorialueella ja käynnistää niiden transkription (8) (10) (11). Positiivinen kontrolli : Näyte, jossa on kaikki testijärjestelmän osat ja joka on käsitelty aineella, jonka tiedetään aiheuttavan positiivisen vasteen. Vaste ei kuitenkaan saisi olla liian voimakas, jotta positiivisen kontrollivasteen vaihtelu ajan funktiona voidaan arvioida. Seos : Seos tai liuos, joka muodostuu kahdesta tai useammasta aineesta ja jossa nämä aineet eivät reagoi (1). Spesifisyys : Niiden negatiivisten/inaktiivisten kemikaalien osuus, jotka on luokiteltu testissä oikein. Sillä mitataan luokittavia tuloksia tuottavan testimenetelmän tarkkuutta. Spesifisyys on tärkeää ottaa huomioon arvioitaessa testimenetelmän merkityksellisyyttä (29). Tarkkuus : Testimenetelmän tulosten ja hyväksyttyjen vertailuarvojen välinen ero. Se on testimenetelmän suorituskyvyn mitta ja yksi merkityksellisyyden osa-alueista. Tarkkuutta ja vastaavuutta käytetään usein toisiaan korvaavasti tarkoittamaan testimenetelmällä saatujen oikeiden tulosten osuutta (29). Testikemikaali : Termillä ”testikemikaali” viitataan siihen, mitä testataan. Useasta aineosasta koostuva aine : Aine, jossa sen kvantitatiivisen koostumuksen perusteella on useampaa kuin yhtä pääaineosaa ja jonka aineosien pitoisuudet ovat vähintään 10 painoprosenttia ja alle 80 painoprosenttia. Useasta aineosasta koostuva aine syntyy valmistusprosessin tuloksena. Seoksen ja useasta aineosasta koostuvan aineen välinen ero on se, että seos saadaan aikaan sekoittamalla kahta tai useampaa ainetta ilman kemiallista reaktiota. Useasta aineosasta muodostuva aine syntyy kemiallisen reaktion tuloksena. Uusittavuus : Samalla kemikaalilla ja saman testiprotokollan mukaisesti tehdyillä testeillä saatujen tulosten keskinäinen vastaavuus (ks. luotettavuus) (29). Vaara : Vaikuttavan tekijän (”agentin”) tai tilanteen sisäinen ominaisuus, jolla on kyky aiheuttaa haitallisia vaikutuksia, kun organismi, järjestelmä tai (ala)populaatio altistuu kyseiselle aineelle. Validoitu testimenetelmä : Testimenetelmä, jonka katsotaan olevan riittävän relevantti ja luotettava tiettyyn tarkoitukseen ja joka perustuu tieteellisesti vakaisiin periaatteisiin. Mitään testimenetelmää ei voida koskaan pitää absoluuttisesti validoituna vaan ainoastaan validoituna suhteessa määritettyyn tarkoitukseen (29). Variaatiokerroin : Variaation mittayksikkö, joka lasketaan toistoista saatujen tietojen pohjalta jakamalla normaalijakauma keskiarvolla. Variaatiokerroin voidaan ilmaista prosenttilukuna kertomalla se 100:lla. Yhdennetty lähestymistapa testaamiseen ja arviointiin (Integrated Approach to Testing and Assessment, IATA) : Jäsennelty lähestymistapa, jota käytetään kemikaalin tai kemikaaliryhmän aiheuttaman vaaran tunnistamiseen (potentiaali), vaaran luonnehtimiseen (potenssi) ja/tai turvallisuuden arviointiin (potentiaali/potenssi ja altistus), kokoamalla ja punnitsemalla kaikki strategisesti keskeiset tiedot, jotta voidaan tarjota tietoa sääntelyyn perustuvaan päätöksentekoon potentiaalisesta vaarasta ja/tai riskistä ja/tai tarpeesta tehdä lisää kohdennettua ja siksi mahdollisimman vähäistä testausta. Yhdestä aineosasta koostuva aine : Aine, jossa sen kvantitatiivisen koostumuksen perusteella on vähintään 80 painoprosenttia yhtä pääaineosaa. YK:n GHS (United Nations Globally Harmonized System of Classification and Labelling of Chemicals, Yhdistyneiden kansakuntien kemikaalien maailmanlaajuisesti yhdenmukaistettu luokitus- ja merkintäjärjestelmä) : Järjestelmä, jossa kemikaalit (aineet ja seokset) luokitellaan vakioitujen fysikaalisten sekä terveys- ja ympäristövaarojen tyyppien ja -tasojen mukaisesti ja niille osoitetaan vaaraviestinnän tunnukset, kuten kuvamerkit, huomiosanat, vaaralausekkeet, turvalausekkeet ja turvatiedotteet, jotta voidaan välittää tietoa kemikaalien haittavaikutuksista ihmisten ja ympäristön suojelemiseksi (esimerkiksi työnantajille, työntekijöille, kuljetushenkilökunnalle, kuluttajille ja pelastushenkilöstölle) (1). Lisäys 2 PÄTEVYYDEN OSOITTAMISEEN TARKOITETUT AINEET In vitro -ihoherkistys: ARE-Nrf2-lusiferaasitestimenetelmä Ennen kuin laboratorio alkaa käyttää tätä testimenetelmää rutiininomaisesti, sen pitää osoittaa tekninen pätevyytensä saamalla KeratinoSens™-kokeella oikea, odotettu ennuste kymmenelle taulukossa 1 suositellulle pätevyyden osoittamiseen tarkoitetulle aineelle ja saamalla EC1,5- ja IC50-arvot, jotka ovat vastaavilla viitealueilla, ainakin kahdeksalle kymmenestä pätevyyden osoittamiseen tarkoitetusta aineesta. Nämä pätevyyden osoittamiseen tarkoitetut aineet on valittu edustamaan erilaisia vasteita ihon herkistymisvaaraan. Muita valintakriteerejä olivat kaupallinen saatavuus, laadukkaan in vivo -referenssin saatavuus sekä laadukkaiden in vitro -tietojen saatavuus KeratinoSensTM-kokeesta. Taulukko 1 Suositellut aineet KeratinoSens™-kokeen teknisen pätevyyden osoittamiseksi
Lisäys 3 LUMINESENSSIMITTAUSTEN LAADUNVALVONTA Peruskoe, jolla varmistetaan optimaaliset luminesenssimittaukset KeratinoSensTM-kokeessa Seuraavat kolme parametria ovat ratkaisevan tärkeitä varmistettaessa luminometrin tulosten luotettavuus:
Ennen testiä on suositeltavaa varmistaa luminesenssimittausten asianmukaisuus tekemällä testi seuraavassa kuvatulla kontrollilevykokoonpanolla (kolminkertainen analyysi). Ensimmäisen harjoituskokeen levykokoonpano
EGDMA= Etyleeniglykolidimetakrylaatti (CAS-nro 97-90-5), voimakkaasti indusoiva kemikaali CA= Kanelialdehydi, positiivinen vertailuaine (CAS-nro 104-55-2) Laadunvalvonta-analyysin pitäisi osoittaa seuraavaa:
B.61 Fluoreseiinivuototestimenetelmä silmää syövyttävien ja silmää vakavasti ärsyttävien aineiden tunnistamiseksi JOHDANTO Tämä testimenetelmä (TM) vastaa OECD:n testiohjetta (TG) nro 460 (2012). Fluoreseiinivuototestimenetelmä (FL) on in vitro -testimenetelmä, jota voidaan käyttää tietyissä olosuhteissa ja tietyin rajoituksin kemikaalien (aineiden ja seosten) luokitteluun silmää syövyttäviksi ja silmää vakavasti ärsyttäviksi aineiksi Yhdistyneiden kansakuntien (YK) GHS-järjestelmän (Globally Harmonized System of Classification and Labelling of Chemicals) (luokka 1), aineiden ja seosten luokituksesta, merkinnöistä ja pakkaamisesta annetun asetuksen (EY) N:o 1272/2008 (CLP-asetus) (31) (luokka 1) ja Yhdysvaltojen ympäristönsuojeluviraston (Environmental Protection Agency, EPA) (luokka I) (1) (2) määritelmien mukaisesti. Tässä testimenetelmässä silmää vakavasti ärsyttävillä aineilla tarkoitetaan testikemikaaleja, joiden annostelu silmään aiheuttaa kudosvaurioita, jotka eivät palaudu 21 päivässä, tai jotka aiheuttavat vakavaa fyysistä näön rappeutumista, ja silmää syövyttävillä aineilla tarkoitetaan kemikaaleja, jotka aiheuttavat silmään palautumatonta kudosvauriota. Nämä kemikaalit kuuluvat YK:n GHS-järjestelmän luokkaan 1, EU:n CLP-asetuksen luokkaan 1 ja EPA:n luokkaan I. Vaikka fluoreseiinivuototestimenetelmää ei pidetäkään sopivana menetelmänä korvaamaan kokonaan kanin silmällä tehdyn in vivo -testin, sitä suositellaan käytettäväksi osana vaiheittaista testausstrategiaa sääntömääräistä luokittelua ja merkitsemistä varten. Siten fluoreseiinivuototestimenetelmää suositellaan ensimmäisen vaiheen menetelmäksi ylhäältä alaspäin etenevässä lähestymistavassa silmää syövyttävien tai vakavasti ärsyttävien aineiden tunnistamiseksi, erityisesti tietynlaisten, tarkkaan rajattujen kemikaalien osalta (vesiliuokset aineet ja seokset). (3) (4). Nykyään tunnustetaan yleisesti se, ettei yksikään in vitro -silmä-ärsytystesti voi korvata lähitulevaisuudessa in vivo -silmätestiä (TM B.5 5 (5)) keinona saada ennusteita koko ärsytysskaalasta eri kemikaaliluokkien osalta. In vivo -silmätesti saattaa kuitenkin olla mahdollista korvata useiden eri testimenetelmien strategisilla yhdistelmillä (vaiheittaisessa) testausstrategiassa (4). Ylhäältä alaspäin etenevä lähestymistapa (4) on suunniteltu käytettäväksi silloin, kun olemassa olevien tietojen perusteella kemikaalin ärsytyspotentiaalin oletetaan olevan suuri. Kohdassa 35 esitetyn tarkan ennustemallin mukaisesti fluoreseiinitestimenetelmällä voidaan määrittää kemikaaleja rajalliselta sovellettavuusalueelta silmää syövyttäviksi aineiksi / silmää vakavasti ärsyttäviksi aineiksi (YK:n GHS-järjestelmän luokka 1; EU:n CLP-asetuksen luokka 1; EPA:n luokka I) ilman jatkotestausta. Saman oletetaan koskevan seoksia, joskaan seoksia ei käytetty validoinnissa. Siksi fluoreseiinitestimenetelmää voidaan käyttää määrittämään kemikaalien ärsyttävyys/syövyttävyys silmässä testimenetelmän B.5 (5) vaiheittaisen testausstrategian mukaisesti. Kemikaali, jonka ei ole ennustettu syövyttävän tai ärsyttävän vakavasti silmää fluoreseiinitestimenetelmällä, on kuitenkin testattava yhdellä tai useammalla lisätestimenetelmällä (in vitro- ja/tai in vivo -menetelmällä), jolla voidaan tunnistaa täsmällisesti i) kemikaalit, jotka ovat in vitro vääriä negatiivisia silmää syövyttäviä / vakavasti ärsyttäviä aineita FL-menetelmässä (YK:n GHS-järjestelmän luokka 1; EU:n CLP-asetuksen luokka 1; EPA:n luokka I); ii) kemikaalit, joita ei ole luokiteltu silmää syövyttäviksi/ärsyttäviksi (ei luokitusta YK:n GHS-järjestelmässä; ei luokitusta EU:n CLP-asetuksessa; EPA:n luokka IV); ja/tai iii) kemikaalit, joilla on kohtalainen/lievä silmää ärsyttävä vaikutus (YK:n GHS-järjestelmän luokat 2A ja 2B; EU:n CLP-asetuksen luokka 2; EPA:n luokat II ja III). Tässä testimenetelmässä kuvataan menettelyt, joilla arvioidaan testikemikaalin mahdollinen kyky syövyttää tai ärsyttää vakavasti silmää mittaamalla sen kykyä aiheuttaa vahinkoa läpäisemättömässä konfluentissa yksikerroksisessa epiteelisolukudoksessa. Epiteelikerroksen, kuten sidekalvon ja sarveiskalvon epiteelikerroksen, tärkeänä tehtävänä on valvoa epiteelin läpäisevyyttä. Epiteelin läpäisevyyttä hallitsevat monet tiiviit liitokset. Sarveiskalvon epiteelin läpäisevyyden kasvun in vivo on osoitettu korreloivan havaitun tulehduksen ja pintavaurion voimakkuuden kanssa silmän ärsytyksen kehittyessä. Fluoreseiinitestimenetelmässä mitataan toksisia vaikutuksia lyhytaikaisen testikemikaalialtistuksen jälkeen sen pohjalta, miten natriumfluoreseiinin kyky päästä läpäisevien inserttien päällä viljellyistä Madin-Darby Canine Kidney (MDCK) -soluista muodostuvan yhden solun vahvuisen epiteelikerroksen läpi kasvaa. Fluoreseiinivuodon määrä riippuu vauriosta, jonka kemikaali on aiheuttanut tiiviille liitoksille, desmosomiliitoksille ja solukalvoille, ja sen avulla voidaan arvioida testikemikaalin potentiaalista toksisuutta silmälle. Lisäyksessä 1 on kaavio fluoreseiinivuototestimenetelmää varten inserttikalvolla viljellyistä MDCK-soluista. Määritelmät esitetään lisäyksessä 2. ALUSTAVAT NÄKÖKOHDAT JA RAJOITUKSET Tämä testimenetelmä perustuu INVITTOX-testimenetelmäprotokollaan nro 71 (6), jota Euroopan vaihtoehtoisten menetelmien validointikeskus (ECVAM) on arvioinut yhteistyössä Yhdysvaltojen vaihtoehtoisten menetelmien validoinnin virastojen välisen koordinointikomitean (Interagency Coordinating Committee on the Validation of Alternative Methods, ICCVAM) ja Japanin vastaavan keskuksen (JaCVAM) kanssa. Fluoreseiinivuototestimenetelmää ei suositella sellaisten kemikaalien tunnistamiseen, jotka pitäisi luokitella lievää tai kohtalaista ärsytystä aiheuttaviksi tai joita ei pitäisi luokitella silmä-ärsytyksen osalta (aineet ja seokset) (eli YK:n GHS-järjestelmän luokka 2A/2B, ei luokitusta; EU:n CLP-asetuksen luokka 2, ei luokitusta; EPA:n luokka II/III/IV), kuten validointitutkimuksessa on osoitettu (3) (7). Testimenetelmä soveltuu vain vesiliukoisille kemikaaleille (aineille ja seoksille). Fluoreseiinivuototestimenetelmä ennustaa yleensä oikein kemikaalien vakavan silmä-ärsytyspotentiaalin, jos kemikaalit ovat vesiliukoisia ja/tai laimennuksella ei ole vaikutusta niiden toksiseen vaikutukseen (7). Jotta kemikaali voidaan luokitella vesiliukoiseksi, sen pitäisi koeolosuhteissa liueta steriiliin kalsiumpitoiseen (pitoisuus 1,0–1,8 mM), fenolipunaa sisältämättömään Hanksin suolaliuokseen (HBSS), niin että sen pitoisuus on vähintään 250 mg/ml (yksi annos yli rajan 100 mg/ml). Jos testikemikaali kuitenkin liukenee alle 100 mg:n/ml pitoisuutena mutta saa jo kyseisellä pitoisuudella aikaan 20 prosentin fluoreseiinivuodon (eli FL20 < 100 mg/ml), se voidaan silti luokitella YK:n GHS-järjestelmän luokkaan 1 tai EPA:n luokkaan I. Tämän testimenetelmän rajoituksena on se, ettei sitä voida käyttää vahvoihin happoihin ja emäksiin, solufiksatiiveihin ja erittäin haihtuviin kemikaaleihin. Näihin kemikaaleihin liittyy mekanismeja, joita fluoreseiinivuototestimenetelmä ei mittaa, esimerkiksi mittava koagulaatio, saippuoituminen tai erityisiä kemiallisia reaktioita. Muut menetelmän tunnetut rajoitteet perustuvat tuloksiin, jotka liittyvät menetelmän kykyyn antaa ennusteita värillisten ja viskoosisten testikemikaalien osalta (7). On esitetty, että kummankin tyyppisiä kemikaaleja on vaikeaa saada pois yhden solun vahvuisesta kerroksesta lyhyen altistusajan jälkeen ja että useamman pesuvaiheen käyttö parantaisi testimenetelmän ennustuskykyä. Nesteeseen liuotetuilla kiinteillä kemikaaleilla on taipumusta saostua, ja solujen altistuksessa käytettyä lopullista pitoisuutta on vaikeaa määrittää. Kun tietokannasta poistetaan näihin kemiallisiin ja fysikaalisiin luokkiin kuuluvat kemikaalit, fluoreseiinivuototestimenetelmän tarkkuus EU:n, EPA:n ja GHS:n luokitusjärjestelmissä paranee huomattavasti (7). Tämän testimenetelmän tarkoituksen valossa (eli vain silmää syövyttävien / vakavasti ärsyttävien aineiden tunnistamiseksi) väärät negatiiviset tulokset (ks. 13 kohta) eivät ole ratkaisevia, sillä tällaiset kemikaalit testattaisiin tämän jälkeen muilla asianmukaisesti validoiduilla in vitro -testeillä tai kaneilla sen mukaan, mitä sääntömääräiset vaatimukset edellyttävät, käyttäen vaiheittaista testistrategiaa todistusnäyttölähestymistavan mukaisesti (5) (ks. myös 3 ja 4 kohta). Muut fluoreseiinivuototestimenetelmän tunnetut rajoitukset liittyvät vääriin negatiivisiin ja vääriin positiivisiin tuloksiin. Kun menetelmää käytetään ensimmäisenä vaiheena ylhäältä alaspäin etenevässä lähestymistavassa vesiliukoisten silmää syövyttävien / vakavasti ärsyttävien aineiden ja seosten tunnistamiseksi (YK:n GHS-järjestelmän luokka 1; EU:n CLP-asetuksen luokka 1; EPA:n luokka I), FL-testimenetelmän väärien positiivisten tulosten osuus vaihteli 7 prosentista (7/103; YK:n GHS ja EU:n CLP) 9 prosenttiin (9/99; Yhdysvaltojen EPA) ja väärien negatiivisten tulosten osuus vaihteli 54 prosentista (15/28; Yhdysvaltojen EPA) 56 prosenttiin (27/48; YK:n GHS ja EU:n CLP) verrattuna in vivo -tuloksiin. Kemikaaliryhmiä, jotka tuottivat vääriä positiivisia ja/tai vääriä negatiivisia tuloksia FL-testimenetelmässä, ei määritetä tässä. MDCK-soluviljelmään liittyy tiettyjä teknisiä rajoitteita. Tiiviit liitokset, jotka estävät natriumfluoreseiiniväriaineen kulkeutumisen yhden solun vahvuisen kerroksen läpi, heikentyvät lukuisten jatkoviljelyjen myötä. Puutteet tiiviiden liitosten muodostumisessa johtavat siihen, että fluoreseiinivuoto lisääntyy käsittelemättömässä kontrollissa. Siksi on tärkeää määrittää suurin sallittu vuoto käsittelemättömissä kontrolleissa (ks. 38 kohta: vuoto 0 prosenttia). Koska solut voivat alkaa muuttua ajan mittaan, aivan kuten kaikkien in vitro -kokeidenkin tapauksessa, on tärkeää ilmoittaa, kuinka monetta jatkoviljelyä kokeissa käytetään. Käyttöaluetta voidaan laajentaa nykyisestä joissakin tapauksissa, mutta vasta kun kattavampia tietoja tutkituista testikemikaaleista on analysoitu, ja nämä tiedot on mieluiten hankittava testaamalla (3). Tätä testimenetelmää päivitetään sen mukaisesti uusien tietojen tarkastelun myötä. Kun laboratorio alkaa käyttää tätä määritysmenetelmää, sen olisi käytettävä lisäyksessä 3 mainittuja pätevyyden osoittamiseen tarkoitettuja kemikaaleja. Laboratoriot voivat käyttää näitä kemikaaleja osoittaakseen teknisen pätevyytensä FL-testin suorituksessa ennen kuin ne toimittavat FL-määritystuloksia sääntömääräistä vaaraluokitusta varten. TESTIN PERIAATE Fluoreseiinivuototestimenetelmä on sytotoksisuuteen ja solujen toimintaan perustuva in vitro -koe, jossa käytetään yhden solun vahvuista MDCK CB997 -lieriöepiteelisolujen konfluenttia viljelmää, joka on kasvatettu puoliläpäisevälle insertille ja joka mallintaa sarveiskalvon epiteelin proliferoitumatonta tilaa in vivo. MDCK-solulinja on vakiintunut käyttöön, ja solut muodostavat samanlaisia tiiviitä liitoksia ja desmosomiliitoksia kuin sidekalvon ja sarveiskalvon epiteelin apikaalisella puolella. Tiiviit liitokset ja desmosomiliitokset estävät in vivo liuenneita aineita ja vierasaineksia tunkeutumasta sarveiskalvon epiteelin läpi. Epiteelikudoksen muodostaman esteen menetys tiiviiden liitosten ja desmosomiliitosten vaurioitumisen vuoksi on yksi kemikaalin aiheuttamaan silmä-ärsytykseen johtavista varhaisista tapahtumista. Testikemikaalia annostellaan insertin apikaalipuolelle kasvatetulle konfluentille solukerrokselle. Testissä käytetään rutiininomaisesti lyhyttä, yhden minuutin pituista altistusta, joka vastaa normaalia puhdistusvauhtia tilanteissa, joissa ihminen altistuu kemikaalille. Lyhyen altistusajan etuna on se, että vesipohjaisia aineita ja seoksia voidaan testata laimentamattomina, jos ne voidaan poistaa helposti altistuksen jälkeen. Tämän seurauksena tulokset ovat suoremmin verrattavissa kemikaalin vaikutuksiin ihmisissä. Tämän jälkeen testikemikaali poistetaan ja yhden solun vahvuiselle kerrokselle annostellaan myrkytöntä, erittäin fluoresenttia natriumfluoreseiiniväriainetta 30 minuutiksi. Vahinko, jonka testikemikaali aiheuttaa tiiviille liitoksille, määritetään sen perusteella, minkä verran fluoreseiinia vuotaa solukerroksen läpi tietyn ajan kuluessa. Natriumfluoreseiiniväriaineen määrä, joka vuotaa yhden solun vahvuisen kerroksen ja inserttikalvon läpi kuopassa olevaan tiettyyn liuosmäärään (johon natriumfluoreseiiniväriaine päätyy), määritetään mittaamalla kuopan fluoreseiinipitoisuus spektrofluorometrialla. Fluoreseiinivuodon (FL) määrä lasketaan vertaamalla fluoresenssin intensiteetistä (FI) kertovia lukemia, jotka on saatu kahdesta kontrollista: nollakontrollista ja maksimaalista vuotoa kuvaavasta kontrollista. Vuotoprosentti ja siten tiiviiden liitosten vaurioitumisen aste ilmaistaan suhteessa näihin kontrolleihin kunkin määritetyn testikemikaalipitoisuuden osalta. Sitten lasketaan FL20 (eli pitoisuus, joka aiheuttaa 20 prosentin fluoreseiinivuodon suhteessa käsittelemättömän, konfluentin, yhden solun vahvuisen kerroksen ja soluttomien inserttien osalta kirjattuun arvoon). FL20-arvoa (mg/ml) käytetään ennustemallissa silmää syövyttävien ja vakavasti ärsyttävien aineiden tunnistamiseen (ks. 35 kohta). Palautuminen on tärkeä osa testikemikaalin toksisuusprofiilia, ja myös sitä arvioidaan in vivo -silmä-ärsytystestillä. Alustavien analyysien mukaan palautumistiedot (aina 72 tunnin jälkeen kemikaalialtistuksesta) voivat mahdollisesti lisätä INVITTOX-protokollan nro 71 ennusteentekoedellytyksiä, mutta lisäarvioita tarvitaan ja niissä olisi hyötyä lisätiedoista, jotka on mieluiten hankittu lisätesteillä (6). Tätä testimenetelmää päivitetään sen mukaisesti uusien tietojen tarkastelun myötä. MENETTELY Yhden solun vahvuisen kerroksen valmistelu Yhden solun vahvuinen MDCK CB997 -solukerros valmistellaan käyttämällä ei-konfluentteja soluja, jotka kasvavat soluviljelypulloissa DMEM:ssä / Nutrient Mix F12 -seoksessa (1 x L-glutamiinipitoista konsentraattia, 15 mM HEPES-puskuria, kalsiumia (pitoisuus 1,0–1,8 mM) ja 10 prosenttia lämmöllä inaktivoitua FCS:ää/FBS:ää). On tärkeää, että kaikki aineet/liuokset, joita käytetään koko FL-kokeen ajan, sisältävät kalsiumia (jonka pitoisuus on 1,8 mM:n (200 mg/l) ja 1,0 mM:n (111 mg/l) välillä), mikä takaa kestävien tiiviiden liitosten muodostumisen. Tasaisten ja toistettavien tiiviiden liitosten muodostumisen varmistamiseksi on valvottava sitä, kuinka monennesta jatkoviljelystä peräisin olevia soluja käytetään (jatkoviljelyluku). Solujen jatkoviljelyluvun pitäisi mieluiten olla 3–30 sulatuksesta, sillä näistä jatkoviljelyeristä saadut solut toimivat samankaltaisesti, mikä myötävaikuttaa koetulosten toistettavuuteen. Ennen fluoreseiinivuototestiä solut irrotetaan pullosta trypsinisaatiolla ja sentrifugoidaan ja sopiva määrä soluja siirrostetaan insertteihin, jotka on pantu 24-kuoppaisiin levyihin (ks. lisäys 1). Solujen siirrostamiseen pitäisi käyttää inserttejä, joiden halkaisija on 12 mm ja joissa on selluloosaesteriseoksesta muodostuva kalvo, jonka paksuus on 80–150 μm ja huokoskoko 0,45 mm. Validointitutkimuksessa käytettiin 12 mm:n Millicell-HA-inserttejä. Insertin ja kalvotyypin ominaisuudet ovat tärkeitä, sillä ne voivat vaikuttaa solujen kasvuun ja kemikaalin sitoutumiseen. Tietyntyyppiset kemikaalit voivat sitoutua Millicell-HA-inserttikalvoon, mikä voi vaikuttaa tulosten tulkintaan. Muita kalvoja käytettäessä niiden vastaavuus on osoitettava käyttämällä pätevyyden osoittamiseen tarkoitettuja kemikaaleja (ks. lisäys 3). Kemikaalien sitoutuminen inserttikalvoon on tavallisempaa, kun kyseessä on kationinen kemikaali, kuten bentsalkoniumkloridi, joka jota varautunut kalvo vetää puoleensa (7). Kemikaalin sitoutuminen inserttikalvoon saattaa pidentää altistumisaikaa kemikaalille, mikä johtaa kemikaalin toksisen potentiaalin yliarviointiin, mutta voi myös fyysisesti vähentää fluoreseiinin vuotoa insertin läpi sitomalla väriainetta inserttikalvoon sitoutuneeseen kationiseen kemikaaliin, mikä johtaa kemikaalin toksisen potentiaalin aliarviointiin. Tätä on helppo seurata altistamalla pelkkä kalvo testattavan kemikaalin huippupitoisuudelle ja lisäämällä sitten natriumfluoreseiiniväriainetta normaali pitoisuus vakioajaksi (ei solukontrollia). Jos natriumfluoreseiiniväriainetta sitoutuu inserttikalvoon, se näyttää keltaiselta, kun testiaine on pesty pois. Siksi on olennaista tuntea testikemikaalin sitoutumisominaisuudet, jotta kemikaalin vaikutusta soluihin voidaan tulkita. Insertteihin siirrostettujen solujen pitäisi muodostaa konfluentti yhden solun vahvuinen kerros, kun solut altistetaan kemikaalille. Kuhunkin inserttiin pitäisi lisätä 1,6 × 105 solua (400 μl solususpensiota, jossa on 4 × 105 solua millilitrassa). Näissä olosuhteissa konfluentti yhden solun vahvuinen kerros syntyy yleensä 96 tunnin viljelyn jälkeen. Insertit pitäisi tutkia silmämääräisesti ennen siirrostusta, jotta varmistetaan, että kohdan 30 mukaisessa silmämääräisessä tarkastuksessa mahdollisesti kirjatut vauriot johtuvat käsittelystä. MDCK-soluviljelmiä pitäisi pitää inkubaattoreissa kosteutetussa ympäristössä, jossa on 5 ± 1 prosentti CO2:ta, ja 37 ± 1 °C:n lämpötilassa. Soluissa ei saa olla kontaminaatiota (bakteerit, virukset, mykoplasmat tai sieni-itiöt). Testi- ja kontrollikemikaalien annostelu Kutakin koeajoa varten on valmistettava tuore testikemikaalin kantaliuos, ja se on käytettävä 30 minuutin kuluessa valmistuksesta. Seerumin proteiinien sitoutumisen välttämiseksi testikemikaalien valmistelussa on käytettävä kalsiumpitoista (pitoisuus 1,0–1,8 mM) fenolipunatonta HBSS:ää. Ennen testaamista on arvioitava, miten 250 mg kemikaalia liukenee millilitraan HBSS:ää. Jos kemikaali pysyy tällä pitoisuudella vakaana suspensiona tai emulsiona (eli jos se säilyy tasaisena eikä saostu tai jakaudu useampaan faasiin) 30 minuutin jälkeen, HBSS:ää voidaan käyttää edelleen liuottimena. Jos kuitenkin havaitaan, ettei kemikaali liukene tällaisena pitoisuutena HBSS:ään, on harkittava muiden testimenetelmien käyttämistä fluoreseiinivuotomenetelmän sijaan. Tilanteissa, joissa kemikaali ei liukene HBSS:ään, kevyen mineraaliöljyn käyttöä liuottimena pitäisi harkita varoen, sillä saatavana ei ole riittävästi tietoja, joiden pohjalta voitaisiin tehdä päätelmiä fluoreseiinivuotokokeen suorituskyvystä tällaisissa olosuhteissa. Kaikkien testattavien kemikaalien valmistelussa käytetään steriiliä kalsiumpitoista (pitoisuus 1,0–1,8 mM) fenolipunatonta HBSS:ää, ja kantaliuoksesta valmistetaan viisi pitoisuutta liuottamalla tietty massa tiettyyn tilavuuteen – 1, 25, 100 ja 250 milligrammaa yhteen millilitraan sekä yksi raaka tai tyydyttynyt liuos. Kiinteää kemikaalia testattaessa mukana pitäisi olla yksi liuos, jossa pitoisuus on erittäin suuri, 750 mg/ml. Tämän kemikaalipitoisuuden annostelussa soluille on mahdollisesti käytettävä positive displacement -pipettiä. Jos toksisen pitoisuuden havaitaan olevan 25–100 mg/ml, on testattava kahdesti seuraavat ylimääräiset pitoisuudet: 1, 25, 50, 75, 100 mg/ml. FL20-arvo pitäisi johtaa näistä pitoisuuksista sillä edellytyksellä, että hyväksyttävyysperusteet täyttyvät. Testikemikaaleja annostellaan konfluentille yhden solun vahvuiselle kerrokselle soluviljelynesteen poistamisen jälkeen ja pestään steriilillä, lämpimällä (37 °C), kalsiumpitoisella (pitoisuus 1,0–1,8 mM) fenolipunattomalla HBSS:llä. Tätä ennen tarkastetaan silmämääräisesti, ettei suodattimissa ole ennalta vaurioita, jotka voisivat virheellisesti aiheuttaa mahdollisia yhteensopimattomuuksia testikemikaalien kanssa. Kussakin ajossa kutakin testikemikaalipitoisuutta ja kontrollia kohden pitäisi käyttää ainakin kolmea rinnakkaisnäytettä. Kun altistus huoneenlämmössä on kestänyt yhden minuutin, testikemikaali imetään huolellisesti pois, yhden solun vahvuinen kerros pestään steriilillä, lämpimällä (37 °C), kalsiumpitoisella (pitoisuus 1,0–1,8 mM) fenolipunattomalla HBSS:llä ja fluoreseiinivuoto mitataan välittömästi. Kussakin ajossa olisi käytettävä rinnakkaisia negatiivisia kontrolleja (NC) ja positiivisia kontrolleja (PC) osoittamaan, että yhden solun vahvuisen kerroksen eheys (negatiivinen kontrolli) ja solujen herkkyys (positiivinen kontrolli) ovat määritellyn aikaisemman hyväksyttävyysvälin sisällä. Positiivisen kontrollin kemikaaliksi ehdotetaan Brij 35:tä (CAS-nro 9002-92-0), niin että pitoisuus on 100 mg/ml. Tämän pitoisuuden pitäisi saada aikaan noin 30 prosentin fluoreseiinivuoto (hyväksyttävyysväli on 20–40 prosentin fluoreseiinivuoto eli vaurio solukerroksessa). Negatiivisen kontrollin kemikaaliksi ehdotetaan kalsiumpitoista (pitoisuus 1,0–1,8 mM), fenolipunatonta HBSS:ää (käsittelemätön nollakontrolli). Kunkin ajon pitäisi sisältää myös enimmäisvuotokontrolli, jotta FL20-arvot voidaan laskea. Enimmäisvuoto määritetään käyttämällä kontrolli-inserttiä ilman soluja. Fluoreseiinin läpäisevyyden määrittäminen Heti kun testi- ja kontrollikemikaalit on poistettu, insertteihin lisätään 400 μl natriumfluoreseiiniliuosta, jonka pitoisuus on 0,1 mg/ml (0,01 painoprosenttia tilavuudesta kalsiumpitoisessa [pitoisuus 1,0–1,8 mM] fenolipunattomassa HBSS:ssä) (esimerkiksi Millicell-HA). Viljelmiä pidetään 30 minuuttia huoneenlämmössä. Kun inkubaatio fluoreseiinin kanssa päättyy, insertit poistetaan huolellisesti kustakin kuopasta. Kukin suodatin tarkistetaan silmämääräisesti, ja käsittelyn aikana mahdollisesti syntyneet vauriot kirjataan. Yhden solun vahvuisen kerroksen ja insertin läpi vuotaneen fluoreseiinin määrä kvantifioidaan liuoksesta, joka jää kuoppiin inserttien poistamisen jälkeen. Mittaukset tehdään spektrofluorometerillä, niin että eksitaatioaallonpituus on 485 nm ja emissioaallonpituus 530 nm. Spektrofluorometrin herkkyys pitäisi asettaa sellaiseksi, että suurimman fluoreseiinivuodon (insertti ilman soluja) ja pienimmän fluoreseiinivuodon (insertti, jossa on negatiivisella kontrollilla käsitelty konfluentti yhden solun vahvuinen kerros) välinen numeerinen ero on mahdollisimman suuri. Käytettyjen spektrofluorometrien erojen vuoksi ehdotetaan käytettäväksi herkkyyttä, jolla fluoresenssin intensiteetti on yli 4 000 suurimman fluoreseiinivuotokontrollin osalta. Suurin fluoreseiinivuotoarvo ei saa olla yli 9 999. Fluoreseiinivuodon suurimman intensiteetin pitäisi olla käytetyn spektrofluorometrin lineaarisella vaihtelualueella. Tulosten tulkinta ja ennustettavuusmalli Fluoreseiinivuodon määrä riippuu siitä, minkä verran kemikaali on vahingoittanut tiiviitä liitoksia. Kunkin testatun kemikaalipitoisuuden aiheuttaman fluoreseiinivuodon prosentuaalinen aste lasketaan kyseisen testikemikaalin fluoreseiinivuotoarvoista vertaamalla niitä negatiivisen kontrollin fluoreseiinivuotoarvoihin (negatiivisella kontrollilla käsitellystä konfluentista yhden solun vahvuisesta kerroksesta saatu lukema) ja enimmäisvuorokontrollin fluoreseiinivuotoarvoihin (soluttoman insertin läpi vuotaneen fluoreseiinin määrästä kertova lukema). Enimmäisvuodon fluoresenssin keskimääräinen intensiteetti = x 0 prosentin vuodon fluoresenssin keskimääräinen intensiteetti (NC) = y 100 prosentin vuodon keskiarvo saadaan vähentämällä keskimääräinen 0 prosentin vuoto keskimääräisestä enimmäisvuodosta eli kaavalla x – y = z. Kunkin tietyn annoksen vuotoprosentti lasketaan vähentämällä 0 prosentin vuoto kolmen rinnakkaisnäytteen fluoresenssin keskimääräisestä intensiteetistä (m) ja jakamalla tämä arvo 100 prosentin vuodolla, toisin sanoen kaavalla % FL = [(m–y) / z] × 100 %, jossa
Kemikaalipitoisuus, joka aiheuttaa 20 prosentin fluoreseiinivuodon, on laskettava seuraavalla kaavalla: FLD = [(A – B) / (C – B)] × (MC – MB) + MB jossa
FL20:n raja-arvo sen ennustamiselle, ovatko kemikaalit silmää syövyttäviä / vakavasti ärsyttäviä, esitetään seuraavassa:
Fluoreseiinitestimenetelmää suositellaan vain vesiliukoisten silmää syövyttävien ja vakavasti ärsyttävien aineiden tunnistamiseen (YK:n GHS-järjestelmän luokka 1, EU:n CLP-asetuksen luokka 1, Yhdysvaltojen EPA:n luokka I) (ks. 1 ja 10 kohta). Jotta vesiliukoisten kemikaalien (aineiden ja seosten) (3) (6) (7) voidaan katsoa aiheuttavan ”vakavaa vahinkoa silmälle” (YK:n GHS-järjestelmän / EU:n CLP-asetuksen luokka 1) tai olevan ”silmää syövyttävä tai vakavasti ärsyttävä” (Yhdysvaltojen EPA:n luokka I), testikemikaalin pitäisi tuottaa FL20-arvo enintään 100 mg:n/ml pitoisuudella. Tulosten hyväksyminen Suurimman keskimääräisen fluoreseiinivuotoarvon (x) pitäisi olla yli 4 000 (ks. 31 kohta), 0 prosentin vuodon keskiarvon (y) pitäisi olla enintään 300, ja 100 prosentin vuodon keskiarvon (z) pitäisi olla 3 700–6 000. Testiä pidetään hyväksyttävänä, jos positiivinen kontrolli on aiheuttanut 20–40 prosentin vaurion solukerrokselle (mitattuna prosentuaalisena fluoreseiinivuotona). TIEDOT JA RAPORTOINTI Tiedot Yksittäisten rinnakkaisnäytekuoppien tiedot pitäisi esittää kunkin ajon osalta taulukkomuodossa (esimerkiksi fluoresensin intensiteetin arvot ja lasketun prosentuaalisen fluoreseiinivuodon tiedot kunkin testikemikaalin osalta, luokitus mukaan luettuna). Lisäksi on raportoitava kunkin ajon yksittäisten rinnakkaisnäytemittausten keskiarvot ± keskihajonta. Testiraportti Testiraporttiin on sisällytettävä seuraavat tiedot:
LÄHDEKIRJALLISUUS
Lisäys 1 KAAVIO INSERTTIKALVOLLA FLUORESEIINIVUOTOTESTIMENETELMÄÄ VARTEN KASVATETUISTA MDCK-SOLUISTA Insertin puoliläpäisevälle kalvolle kasvatetaan konfluentti MDCK-solukerros. Insertit asetetaan 24-kuoppaisten levyjen kuoppiin. 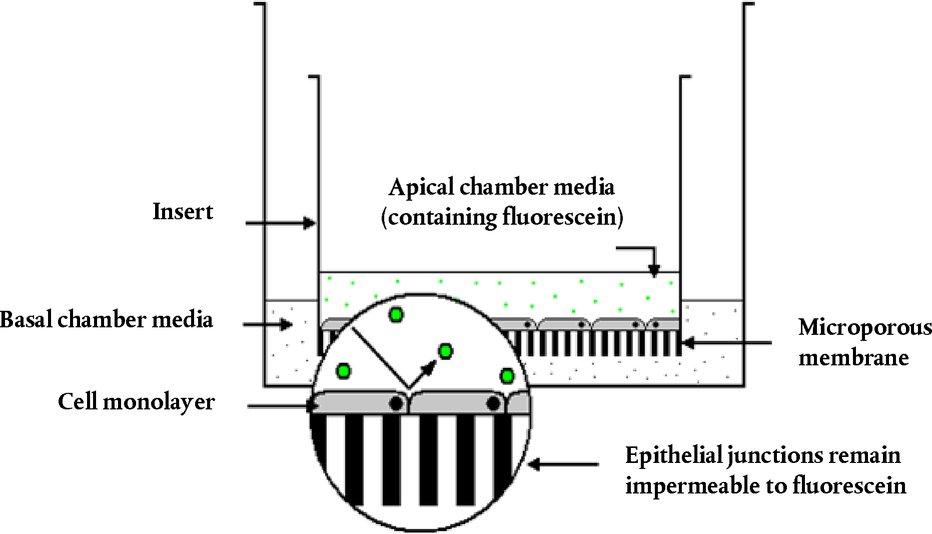
Kuvan lähde: Wilkinson, P.J. (2006), Development of an in vitro model to investigate repeat ocular exposure, Ph.D. Thesis, University of Nottingham, UK. Lisäys 2 MÄÄRITELMÄT Aine : Tarkoittaa YK:n GHS-järjestelmässä alkuaineita ja niiden yhdisteitä sellaisina kuin ne esiintyvät luonnossa tai tuotantomenetelmin valmistettuina, jotka sisältävät kaikki pysyvyyden säilyttämiseksi tarvittavat lisäaineet ja tuotantotoiminnassa muodostuvat epäpuhtaudet lukuun ottamatta liuottimia, jotka voidaan erottaa vaikuttamatta aineen pysyvyyteen tai muuttamatta sen koostumusta. EPA:n luokka 1 : Syövyttävä (palautumaton silmäkudoksen tuhoutuminen) tai yli 21 vuorokautta kestävä sarveiskalvoon kohdistuva vaikutus tai ärsytys (2). EU:n CLP-asetu : (asetus (EY) N:o 1272/2008 aineiden ja seosten luokituksesta, merkinnöistä ja pakkaamisesta): Asetus, jolla kemikaalien (aineiden ja seosten) luokittelua ja merkintöjä koskeva YK:n GHS-järjestelmä saatetaan osaksi Euroopan unionin (EU) lainsäädäntöä. FL20 : Arvioitavissa määrittämällä pitoisuus, jolla testattu kemikaali aiheuttaa 20-prosenttisen fluoreseiinivuodon solukerroksen läpi. Fluoreseiinivuoto : Spektrofluorometrilla mitattu solukerroksen läpi kulkeneen fluoreseiinin määrä. GHS (Yhdistyneiden kansakuntien (YK) kemikaalien maailmanlaajuisesti yhdenmukaistettu luokitus- ja merkintäjärjestelmä) : Järjestelmä, jossa ehdotetaan kemikaalien (aineet ja seokset) luokitusta fysikaalisten, terveyteen ja ympäristöön liittyvien vaarojen standardityyppien ja -tasojen mukaisesti ja osoitetaan niille vaaraviestinnän tunnukset, kuten kuvamerkit, huomiosanat, vaaralausekkeet, turvalausekkeet ja turvatiedotteet, jotta voidaan välittää tietoa kemikaalien kielteisistä vaikutuksista ihmisten (mukaan luettuina työnantajat, työntekijät, kuljettajat, kuluttajat ja pelastushenkilöstö) ja ympäristön suojelemiseksi. GHS:n luokka 1 : Silmän kudosvauriot tai vakava fyysinen näön rappeutuminen, joka syntyy, kun testiainetta on annosteltu silmän etupinnalle, eikä se korjaudu täysin 21 päivän kuluessa annostelusta. Herkkyys : Niiden positiivisten/aktiivisten testikemikaalien osuus, jotka on luokiteltu testissä oikein. Sillä mitataan luokittavia tuloksia tuottavan testimenetelmän tarkkuutta. Herkkyys on tärkeää ottaa huomioon arvioitaessa testimenetelmän merkityksellisyyttä (8). Kemikaali : Aine tai aineiden seos. Korvaava testi : Testi, jolla voidaan korvata testi, joka on säännöllisesti käytössä ja joka on hyväksytty vaarallisuuden määrittämiseen ja/tai riskien arviointiin, ja jonka on osoitettu antavan ihmisten tai eläinten terveyden tai tarvittaessa ympäristön kannalta vastaavan tai korkeamman suojelutason hyväksyttyyn testiin verrattuna kaikissa mahdollisissa testaustilanteissa ja kaikkien kemikaalien yhteydessä. Liuotin-/kantajakontrolli : Käsittelemätön näyte, jossa on kaikki testijärjestelmän osat, mukaan luettuina liuotin tai kantaja-aine, ja joka prosessoidaan testikemikaalilla käsiteltyjen ja muiden kontrollinäytteiden kanssa perusvastetason määrittämiseksi näytteille, joissa testikemikaali on liuotettu samaan liuottimeen tai kantaja-aineeseen. Kun tällainen näyte testataan samanaikaisesti negatiivisen kontrollin kanssa, se osoittaa myös, reagoiko liuotin tai kantaja-aine testijärjestelmän kanssa. Luokittelematon : Kemikaali, jota ei ole luokiteltu YK:n GHS-järjestelmän luokkaan 1, 2A tai 2B, EU:n CLP-asetuksen luokkaan 1 tai 2 tai Yhdysvaltojen EPA:n luokkaan I, II, tai III kuuluvaksi silmää ärsyttäväksi aineeksi. Luotettavuus : Laajuus, jolla testimenetelmä on toistettavissa samassa laboratoriossa tai eri laboratorioissa pidemmällä aikavälillä käytettäessä samaa menettelyä. Arvo määritetään laskemalla laboratorionsisäinen ja laboratorioidenvälinen uusittavuus ja laboratorionsisäinen toistettavuus. Merkityksellisyys : Kuvaus testin ja toivotun vaikutuksen välisestä suhteesta ja siitä, onko testi tarkoituksenmukainen ja hyödyllinen tiettyä tarkoitusta varten. Merkityksellisyydellä tarkoitetaan sitä, missä määrin testillä voidaan tarkasti mitata tai ennustaa haluttua biologista vaikutusta. Merkityksellisyyden yhteydessä on huomioitava myös testimenetelmän tarkkuus (vastaavuus) (8). Negatiivinen kontrolli : Käsittelemätön näyte, jossa on kaikki testijärjestelmän osat. Negatiivinen kontrolli prosessoidaan testikemikaalilla käsiteltyjen näytteiden ja muiden kontrollinäytteiden kanssa, jotta voidaan määrittää, reagoiko liuotin testijärjestelmän kanssa. Positiivinen kontrolli : Näyte, jossa on kaikki testijärjestelmän osat ja joka on käsitelty kemikaalilla, jonka tiedetään aiheuttavan positiivisen vasteen. Positiivinen vaste ei saisi olla äärimmäinen, jotta positiivisen kontrollivasteen vaihtelua ajan funktiona voidaan arvioida. Pätevyyden osoittamiseen tarkoitetut kemikaalit : Vertailukemikaalien listalla oleva alaryhmä, jonka avulla kokematon laboratorio voi osoittaa pätevyytensä validoidun vertailutestimenetelmän käyttöön. Seos : YK:n GHS-järjestelmän yhteydessä tarkoitettu seos tai liuos, joka muodostuu kahdesta tai useammasta keskenään reagoimattomasta aineesta. Silmää syövyttävä aine : (a) Aine, joka aiheuttaa silmään palautumatonta kudosvauriota. (b) Kemikaali, joka on luokiteltu YK:n GHS-järjestelmän luokkaan 1, EU:n CLP-asetuksen luokkaan 1 tai Yhdysvaltojen EPA:n luokkaan I kuuluvaksi silmää ärsyttäväksi aineeksi. Silmää vakavasti ärsyttävä aine : (a) Kemikaali, joka aiheuttaa silmän etupinnalle annosteltuna kudosvauriota, joka ei korjaudu 21 päivän kuluessa annostelusta tai joka aiheuttaa näkökyvyn vakavaa fyysistä rappiota. (b) Kemikaali, joka on luokiteltu YK:n GHS-järjestelmän luokkaan 1, EU:n CLP-asetuksen luokkaan 1 tai Yhdysvaltojen EPA:n luokkaan I kuuluvaksi silmää ärsyttäväksi aineeksi. Silmää ärsyttävä aine : (a) Kemikaali, joka aiheuttaa silmään palautuvan muutoksen, kun sitä on annosteltu silmän etupinnalle; (b) Kemikaali, joka on luokiteltu YK:n GHS-järjestelmän luokkaan 2A tai 2B, EU:n CLP-asetuksen luokkaan 2 tai Yhdysvaltojen EPA:n luokkaan II tai III kuuluvaksi silmää ärsyttäväksi aineeksi. Spesifisyys : Niiden negatiivisten/inaktiivisten testikemikaalien osuus, jotka on luokiteltu testissä oikein. Sillä mitataan luokittavia tuloksia tuottavan testimenetelmän tarkkuutta, ja se on tärkeää ottaa huomioon arvioitaessa testimenetelmän merkityksellisyyttä. Tarkkuus : Testimenetelmän tulosten ja hyväksyttyjen vertailuarvojen välinen ero. Se on testimenetelmän suorituskyvyn mitta ja yksi merkityksellisyyden osa-alueista. Tarkkuutta ja vastaavuutta käytetään usein toisiaan korvaavasti tarkoittamaan testimenetelmällä saatujen oikeiden tulosten osuutta. Testikemikaali : Tällä testimenetelmällä testattu aine tai seos. Todistusnäyttö : Prosessi, jossa tarkastellaan erilaisten tietojen vahvuuksia ja heikkouksia, kun niiden avulla on tarkoitus päättää kemikaalin vaarallisuutta koskevasta päätelmästä tai kun tietojen on määrä tukea kyseistä päätelmää. Vaara : Vaikuttavan tekijän (”agentin”) tai tilanteen sisäinen ominaisuus, jolla on kyky aiheuttaa haitallisia vaikutuksia, kun organismi, järjestelmä tai (ala)populaatio altistuu kyseiselle aineelle. Vaiheittainen testausstrategia : Vaiheittainen testausstrategia, jossa kaikkia testikemikaalia koskevia olemassa olevia tietoja tarkastellaan tietyssä järjestyksessä käyttäen todistusnäyttöprosessia kussakin vaiheessa sen määrittämiseksi, onko käytettävissä riittävästi tietoja vaaraluokituspäätöstä varten, ennen kuin siirrytään seuraavaan vaiheeseen. Jos testikemikaalin ärsytyskyky voidaan määrittää olemassa olevien tietojen perusteella, ei lisätestausta tarvita. Jos testikemikaali ärsytyskykyä ei voida määrittää olemassa olevien tietojen perusteella, toteutetaan vaiheittainen testaus eläimillä, kunnes luokitus voidaan määritellä aukottomasti. Vakava silmävaurio : Silmän kudosvaurio tai vakava fyysinen näön rappeutuminen, joka on seurausta testikemikaalin annostelusta silmän etupinnalle eikä korjaudu täysin 21 päivän kuluessa annostelusta. Validoitu testimenetelmä : Testimenetelmä, jolle on tehty validointitutkimukset sen merkityksellisyyden (myös tarkkuuden) ja luotettavuuden määrittämiseksi tiettyä tarkoitusta varten. On syytä pitää mielessä, että validoidun testimenetelmän suorituskyky tarkkuuden ja luotettavuuden osalta ei välttämättä ole riittävä, jotta se voitaisiin hyväksyä ehdotettuun tarkoitukseen (8). Väärien negatiivisten tulosten osuus : Niiden positiivisten aineiden osuus, jotka testimenetelmä yksilöi virheellisesti negatiivisiksi. Se on eräs testimenetelmän suorituskyvyn indikaattoreista. Väärien positiivisten tulosten osuus : Niiden negatiivisten aineiden osuus, jotka testimenetelmä yksilöi virheellisesti positiivisiksi. Se on eräs testimenetelmän suorituskyvyn indikaattoreista. Lisäys 3 PÄTEVYYDEN OSOITTAMISEEN TARKOITETUT KEMIKAALIT FLUORESEIINIVUOTOTESTIMENETELMÄSSÄ Ennen kuin laboratorio alkaa käyttää tähän testimenetelmään perustuvaa menetelmää rutiininomaisesti, sen pitäisi osoittaa tekninen pätevyytensä määrittämällä oikein taulukossa 1 suositeltujen kahdeksan aineen silmäsyövyttävyysluokitus. Nämä kemikaalit on valittu siten, että ne edustavat kattavasti erilaisia vasteita silmän paikalliselle ärsytykselle/syövytykselle, ja nämä puolestaan perustuvat kanin silmällä tehtyyn in vivo -testiin (TG 405, TM B.5(5)) (eli luokat 1, 2A, 2B tai ei luokitusta YK:n GSH-järjestelmässä). Fluoreseiinivuotokokeen validoidun käyttökelpoisuuden kannalta (eli vain silmää syövyttävien / vakavasti ärsyttävien aineiden tunnistaminen) pätevyyden osoittamiseksi tarkoitettuun luokitukseen sopivia testituloksia on vain kaksi (syövyttävä / vakavasti ärsyttävä tai ei-syövyttävä / ei vakavasti ärsyttävä). Muita valintakriteerejä olivat se, että kemikaaleja on kaupallisesti saatavana, se, että saatavana on laadukkaita in vivo -vertailutietoja, ja se, että fluoreseiinitestimenetelmästä on laadukasta tietoa. Tästä syystä pätevyyden osoittamiseen tarkoitetut kemikaalit valittiin asiakirjasta ”Fluorescein Leakage Assay Background Review Document as an Alternative Method for Eye Irritation Testing” (8), jota käytettiin fluoreseiinivuototestimenetelmän takautuvaan validointiin. Taulukko 1 Suositellut kemikaalit FL-menetelmän teknisen pätevyyden osoittamiseksi
B.62 Nisäkkäiden emäksinen in vivo -komeettakoe JOHDANTO Tämä testimenetelmä (TM) vastaa OECD:n testiohjetta (TG) nro 489 (2016). Emäksistä in vivo -komeettakoetta (’Comet-koe’, jäljempänä ’komeettakoe’, eli yhden solun geelielektroforeesi) käytetään DNA-säikeen katkeamien havaitsemiseen soluissa tai tumissa, jotka on eristetty potentiaalisesti genotoksiselle materiaalille / genotoksisille materiaaleille altistettujen eläinten, useimmiten jyrsijöiden, erilaisista kudoksista. Monet asiantuntijaryhmät ovat arvioineet komeettakoetta ja julkaisseet suosituksia (1) (2) (3) (4) (5) (6) (7) (8) (9) (10). Tämä testimenetelmä kuuluu geneettisen toksikologian testimenetelmiin. On laadittu OECD:n asiakirja, jossa ytimekkäitä tietoja geneettistä toksikologiaa koskevista testeistä sekä katsaus näihin testimenetelmiin tehtyihin viimeaikaisiin muutoksiin (1). Komeettakokeen tarkoituksena on tunnistaa DNA-vaurioita aiheuttavia kemikaaleja. Komeettakokeella voidaan havaita emäksisissä olosuhteissa (pH > 13) yhden ja kahden säikeen katkeamia, jotka johtuvat esimerkiksi suorasta vuorovaikutuksesta DNA:n kanssa, emäksen labiileista kohdista tai DNA:n korjauksesta johtuvista väliaikaisista DNA-säikeen katkeamista. Nämä säikeiden katkeamat voivat korjaantua ilman pysyviä vaikutuksia, ne voivat johtaa solun kuolemaan tai ne voivat korjaantua mutaatiossa, joka johtaa pysyvään elinkykyiseen muutokseen. Ne voivat myös johtaa kromosomimuutokseen, joka yhteydessä myös moniin ihmisen sairauksiin, kuten syöpään. Jyrsijöiden in vivo -komeettakokeen muodollinen validointikoe tehtiin 2006–2012, ja sitä koordinoi JaCVAM (Japanin vaihtoehtoisten menetelmien validointikeskus) yhdessä ECVAM:n (vaihtoehtoisten menetelmien eurooppalaisen validointikeskuksen), ICCVAM:n (vaihtoehtoisten menetelmien validoinnin virastojenvälisen koordinointikomitean) ja NICEATM:n (NTP Interagency Center for the Evaluation of Alternative Toxicological Methods) kanssa (12). Testimenetelmän kuvaus sisältää komeettakokeen käyttöä koskevat suositukset ja rajoitukset ja perustuu validointikokeessa käytettyyn lopulliseen protokollaan (12) sekä muihin olennaisiin julkaistuihin ja julkaisemattomiin (laboratorioiden tekijänoikeuksien alaisiin) tietoihin. Keskeisten termien määritelmät esitetään lisäyksessä 1. Todettakoon, että tässä kokeessa voidaan käyttää monenlaisia alustoja (mikroskoopin näytelaseja, geelipisaroita, 96-kuoppaisia levyjä jne.) Käytännöllisyyden vuoksi koko tekstissä käytetään jäljempänä ilmaisua ”näytelasi”, mutta sillä tarkoitetaan myös kaikkia muita alustoja. ALUSTAVAT NÄKÖKOHDAT JA RAJOITUKSET Komeettakoe on menetelmä, jolla mitataan DNA-säikeen katkeamia eukaryoottisoluissa. Agaroosiin upotetuille yksittäisille soluille/tumille tehdään lyysis, jossa käytetään puhdistusainetta ja jossa suolapitoisuus on korkea. Lyysisvaiheessa solun ja tuman kalvot sulavat, mikä mahdollistaa kierteisten DNA-ketjujen vapautumisen; näitä kutsutaan yleisesti nukleoideiksi ja DNA-fragmenteiksi. Kun elektroforeesi tehdään korkeassa pH:ssa, syntyy komeettaa muistuttavia rakenteita, jotka voidaan havaita voidaan havaita fluoresenssimikroskoopilla, käyttämällä sopivia fluoresoivia väriaineita; DNA-fragmentit siirtyvät niiden koosta riippuen komeetan ”ytimestä” sen ”pyrstöön”, ja se, kuinka suuri komeetan pyrstö on suhteessa koko komeetan kokoon (ydin ja pyrstö), kertoo DNA:n hajoamisen asteesta (13) (14) (15). Emäksinen in vivo -komeettakoe soveltuu erityisen hyvin genotoksisen vaaran arviointiin, sillä kokeessa vasteet riippuvat ADME-prosessista in vivo (absorption, distribution, metabolism and excretion eli absorptio, leviäminen, metabolismi ja eritys) ja myös DNA:n korjaantumisprosesseista. Nämä voivat vaihdella lajien, kudosten ja DNA-vaurion tyypin mukaan. Eläinten hyvinvointia ja erityisesti eläinten käytön vähentämistä koskevien vaatimusten täyttämiseksi (noudattaen 3R-periaatetta – replacement, reduction, refinement eli korvaaminen, vähentäminen ja parantaminen) tämä koe voidaan yhdistää myös muihin toksikologisiin tutkimuksiin, esimerkiksi toistuvan annoksen toksisuutta koskeviin tutkimuksiin (10) (16) (17), tai päätetapahtuma voidaan yhdistää muihin genotoksisuuden päätetapahtumiin, esimerkkinä nisäkkäiden erytrosyyttimikrotumatesti in vivo (18) (19) (20). Komeettakokeessa käytetään useimmiten jyrsijöitä, joskin siihen on käytetty myös muita eläinlajeja, nisäkkäitä ja muita kuin nisäkkäitä. Muiden lajien kuin jyrsijöiden käyttö on perusteltava tieteellisesti ja eettisesti tapauskohtaisesti, ja vahvana suosituksena on, että komeettakokeessa käytetään muita lajeja kuin jyrsijöitä vain, jos koetta ei tehdä ainoana kokeena vaan se tehdään osana toista toksisuuskoetta. Altistamisreittiä ja tutkittavaa altistettavaa kudosta / tutkittavia altistettavia kudoksia valittaessa päätöksenteon tulisi perustua kaikkeen saatavana/olemassa olevaan tietoon testikemikaaleista; tällaisia tietoja ovat esimerkiksi ihmisen suunniteltu/odotettava altistumisreitti, metabolismi ja leviäminen, potentiaaliset vaikutukset kosketuspaikassa, hälyttävät rakenteelliset seikat, muut genotoksisuus- tai toksisuustiedot sekä tutkimuksen tarkoitus. Siispä testikemikaalien genotoksisuuspotentiaalia voidaan arvioida soveltuvin osin kohdekudoksessa/-kudoksissa ilmenevien karsinogeenisten ja/tai muiden toksisten vaikutusten perusteella. Koetta pidetään hyödyllisenä myös in vitro -koejärjestelmässä havaitun mutageenisen vaikutuksen jatkotutkimuksena. Tutkimuksen kohteena olevalle kudokselle on sopivaa tehdä in vivo -komeettakoe, kun voidaan kohtuudella odottaa, että tutkimuksen kohteena oleva kudos on asianmukaisen altistuksen kohteena. Kattavin validointi kokeelle on tehty käyttämällä urosrottien somaattisia kudoksia yhteistyötutkimuksissa, esimerkiksi JaCVAM (12) ja Rothfuss et al., 2010 (10). JaCVAMin kansainvälisessä validointitutkimuksessa käytetiin maksaa ja mahalaukkua. Maksaa käytettiin siksi, että se on aktiivisin elin kemikaalien metabolismissa ja usein myös karsinogeenisten vaikutusten kohteena. Mahalaukkua käytettiin siksi, että se on yleensä ensimmäinen elin, jonka kanssa kemikaalit päätyvät kosketuksiin suun kautta tapahtuvan altistuksen jälkeen, joskin ruoansulatuskanavan muut alueet, kuten pohjukaissuoli (duodenum) ja tyhjäsuoli (jejunum), pitäisi myös lukea kemikaalin kanssa kosketuksiin joutuviksi kudoksiksi ja niillä voi olla ihmisten kohdalla olennaisempi merkitys kuin jyrsijän rauhasmahalla. On pidettävä huolta siitä, etteivät nämä kudokset altistu liian suurille testikemikaalipitoisuuksille (21). Menetelmää voidaan periaatteessa soveltaa mihin tahansa kudokseen, josta saadaan analysoitavia yhden solun/tuman suspensioita. Monien laboratorioiden tekijänoikeuksien alaiset tiedot osoittavat, että menetelmää voidaan soveltaa onnistuneesti moniin eri kudoksiin, ja monet julkaisut osoittavat, että menetelmää voidaan soveltaa muihin elimiin tai kudoksiin kuin maksaan ja mahalaukkuun, kuten tyhjäsuoleen (22), munuaiseen (23) (24), ihoon (25) (26) tai virtsarakkoon (27) (28), keuhkoihin ja bronkoalveolaarisiin lavaatiosoluihin (olennaista tutkimuksissa, joissa tutkitaan sisäänhengitettyjä kemikaaleja) (29) (30), ja lisäksi on tehty testejä, joissa on käytetty monia elimiä (31) (32). Vaikka sukusoluihin kohdistuvat genotoksiset vaikutukset saattavatkin olla kiinnostavia, on huomattava, ettei tässä testimenetelmässä kuvattua vakiomuotoista emäksistä komeettakoetta pidetä sopivana keinona mitata DNA-säikeiden katkeamista kypsissä sukusoluissa. Koska kirjallisuuskatsauksessa komeettakokeen käytöstä sukusoluihin kohdistuvan genotoksisuuden tutkimiseen todettiin DNA-vaurioiden olevan lähtötilanteessa korkeita ja vaihtelevia (33), on välttämätöntä tehdä muutoksia protokollaan ja parantaa standardointia ja validointitutkimuksia, ennen kuin testimenetelmään voidaan sisällyttää kypsille sukusoluille (kuten siittiöille) tehtävä komeettakoe. Myöskään tämän testimenetelmän mukainen suositeltu altistusohjelma ei ole optimaalinen, ja mielekkään analyysin tekeminen DNA-säikeiden katkeamista kypsissä siittiöissä edellyttäisi pidempiä altistuksia ja näytteenottoaikoja. Komeettakokeella mitattuja genotoksisia vaikutuksia kiveksen soluissa erilaistumisen eri vaiheissa on kuvattu kirjallisuudessa (34) (35). On kuitenkin huomattava, että gonadeissa on seos somaattisia soluja ja sukusoluja. Tästä syystä positiiviset tulokset koko gonadissa (kiveksessä) eivät välttämättä kerro sukusoluille aiheutuneista vaurioista, mutta ne kertovat kuitenkin sen, että testikemikaali(t) ja/tai sen/niiden metaboliitit ovat päätyneet gonadiin asti. Komeettakokeen vakiokoeolosuhteissa ei voida havaita luotettavasti ristisidoksia. Tietyissä muutetuissa koeolosuhteissa voidaan mahdollisesti havaita DNA–DNA- ja DNA–proteiini-ristisidoksia sekä muita emäsmuutoksia, kuten emäksen hapettumista (23) (36) (37) (38) (39). Tarvittavien protokollamuutosten asianmukainen luonnehtiminen edellyttäisi kuitenkin lisätyötä. Siksi ristisidoksia muodostavien aineiden havaitseminen ei ole tässä kuvatun kokeen päätarkoitus. Koe ei sovellu edes muutettuna aneugeenien havaitsemiseen. Tämänhetkisen tietotason vuoksi in vivo -komeettakokeeseen liittyy useita lisärajoituksia (ks. lisäys 3). Odotuksena on, että testimenetelmää arvioidaan tulevaisuudessa ja tarkistetaan tarvittaessa saatujen kokemusten valossa. Ennen kuin testimenetelmää käytetään seoksen testaamiseen tietojen tuottamiseksi aiottuun sääntelytarkoitukseen, on harkittava, antaako se asianmukaiset tulokset tämän tavoitteen kannalta, ja jos antaa, miksi. Tällaista harkintaa ei tarvita, jos seoksen testaamista edellytetään sääntelyvaatimuksissa. MENETELMÄN PERIAATE Eläimet altistetaan testikemikaalille sopivaa antotapaa käyttäen. Annostelu ja näytteenotto kuvataan yksityiskohtaisesti kohdissa 36–40. Valitulla näytteenottohetkellä / valituilla näytteenottohetkillä tutkimuksen kohteena olevat kudokset leikataan, yhden solun/tuman suspensiot valmistetaan ja ne upotetaan näytelasille pehmeään agariin. Solun ja/tai tuman kalvo poistetaan käsittelemällä soluja/tumia lyysispuskurilla ja ne altistetaan vahvalle emäkselle (esimerkiksi pH ≥ 13), jotta DNA purkautuu ja irronneet DNA-ketjut ja -fragmentit vapautuvat. Tämän jälkeen agarissa olevalle tuman DNA:lle tehdään elektroforeesi. Normaalit fragmentoitumattomat DNA-molekyylit jäävät paikoilleen sinne, missä tuman DNA on agarissa, kun taas fragmentoitunut DNA ja irtonaiset DNA-ketjut liikkuvat kohti anodia. Elektroforeesin jälkeen DNA:ta tarkastellaan käyttämällä sopivaa fluoresoivaa väriainetta. Valmisteet analysoidaan käyttämällä mikroskooppia sekä täysin automatisoitua tai puoliautomaattista kuvananalysointijärjestelmää. Se, kuinka paljon ja kuinka kauas DNA:ta on liikkunut elektroforeesin aikana, kertoo DNA-fragmenttien määrästä ja koosta. Komeettakokeessa on useita päätetapahtumia. Suosituksena on, että DNA-vaurioita arvioidaan pyrstön DNA-pitoisuuden perusteella (pyrstön DNA- % eli %:a pyrstön koosta) (12) (40) (41) (42). Kun tumia on analysoitu riittävä määrä, tiedot analysoidaan sopivilla menetelmillä koetulosten arviointia varten. On huomattava, että menetelmän eri näkökohtien muuttamista – kuten näytteen valmistelun, elektroforeesin olosuhteiden ja silmämääräisen analyysin muuttujien /(esimerkiksi väriaineen voimakkuuden, mikroskoopin valon voimakkuuden, mikroskoopin suotimien käytön ja kameran dynamiikan) muuttamista – on tutkittu ja niiden on todettu voivan vaikuttaa DNA:n kulkeutumiseen (43) (44) (45) (46). LABORATORIOIDEN PÄTEVYYDEN VARMISTAMINEN Kunkin laboratorion pitäisi osoittaa koemenetelmän käyttöä koskeva pätevyytensä osoittamalla kykynsä tuottaa riittävän laadukkaita yhden solun tai tuman suspensioita kunkin tutkitun lajin tutkimuksen kohteena olevasta kudoksesta / olevista kudoksista. Valmisteiden laatua arvioidaan ennen kaikkea sen perusteella, onko kantaja-aineella käsitellyistä eläimistä saadun pyrstön DNA-pitoisuus ( %) toistettavissa olevalla alhaisella vaihteluvälillä. Nykyisten tietojen perusteella rotan maksasta saatu keskimääräinen ryhmän pyrstön DNA-pitoisuus ( %) (joka perustuu mediaanien keskiarvoon – ks. asiaa koskevat tarkemmat tiedot kohdasta 57) ei saa mielellään olla yli 6 prosenttia, mikä olisi linjassa JaCVAMin validointitutkimuksen (12) arvojen sekä muiden julkaistujen tietojen ja tekijänoikeuksien alaisten tietojen kanssa. Tällä hetkellä tietoja ei ole tarpeeksi, jotta muiden kudosten osalta voitaisiin antaa suosituksia optimaalisista tai hyväksyttävistä vaihteluväleistä. Tämä ei silti estä käyttämästä muita kudoksia, jos se on perusteltua. Testiraportissa pitäisi esittää asianmukainen arvio komeettakokeen suorituskyvystä näiden kudosten osalta suhteessa julkaistuun kirjallisuuteen tai tekijänoikeuksien alaisiin tietoihin. Ensinnäkin on suotavaa, että kontrolleissa pyrstön DNA-pitoisuuden ( %) vaihteluväli on alhainen, jotta vaihteluväli on riittävän dynaaminen positiivisen vaikutuksen havaitsemiseksi. Toiseksi kunkin laboratorion pitäisi kyetä toistamaan odotetut vasteet suorien mutageenien ja pro-mutageenien osalta eri toimintatavoilla taulukon 1 mukaisesti (kohta 29). Positiivisia aineita voidaan valita tarvittaessa esimerkiksi JaCVAMin validointikokeesta (12) tai muista julkaistuista tiedoista (ks. 9 kohta) esittäen perustelut ja osoittamalla selvät positiiviset vasteet kiinnostuksen kohteena olevissa kudoksissa. Lisäksi pitäisi osoittaa kyky havaita tunnettujen mutageenien, kuten EMS:n, heikkoja vaikutuksia pienillä annoksilla, esimerkiksi vahvistamalla annos-vastesuhde sopivalla määrällä annoksia ja sopivilla annosväleillä. Ensitoimissa pitäisi keskittyä pätevyyden osoittamiseen yleisimmin käytettyjen kudosten, kuten jyrsijän maksan osalta, sillä vertaaminen olemassa oleviin tietoihin ja odotettavissa oleviin tuloksiin on mahdollista (12). Muista kudoksista, kuten vatsalaukusta, pohjukaissuolesta, tyhjäsuolesta, verestä jne., voidaan kerätä tiedot samaan aikaan. Laboratorion on osoitettava pätevyytensä kunkin tutkittavan lajin kunkin yksittäisen tutkittavan kudoksen osalta sekä se, että kyseisissä kudoksissa voidaan saada aikaan tunnetulla mutageenilla (kuten EMS:llä) hyväksyttävä positiivinen vaste. Kantaja-aineen / negatiivisen kontrollin tiedot pitäisi kerätä, jotta voidaan osoittaa negatiivisten datavasteiden toistettavuus, varmistaa kokeen teknisten näkökohtien asianmukainen valvonta ja tuoda esiin tarve määrittää aikaisemmat kontrollien vaihteluvälit uudelleen (ks. 22 kohta). On huomattava, että vaikka ruumiinavauksessa voidaan kerätä useita kudoksia ja prosessoida niitä komeettakoetta varten, laboratorion on oltava pätevä keräämään useita kudoksia samalta eläimeltä, jotta voidaan varmistaa, ettei mahdollista DNA-vaurioita menetetä eikä komeettakoe vaarannu. Ajalla, joka kuluu lopettamisesta prosessoitavien kudosten poistamiseen, saattaa olla ratkaiseva merkitys (ks. 44 kohta ). Hankittaessa pätevyyttä tämän testin käyttöön on otettava huomioon eläinten hyvinvointi, ja siksi muissa testeissä käytettyjä eläinperäisiä kudoksia voidaan käyttää tämän testin eri näkökohtiin liittyvän osaamisen kartuttamiseen. Lisäksi laboratorion ottaessa käyttöön uutta testimenetelmää prosessin eri vaiheissa ei välttämättä ole tarpeen tehdä kattavaa tutkimusta, ja tarvittavia taitoja hankittaessa voidaan käyttää pienempää määrää eläimiä tai testipitoisuuksia. Aiemmat kontrollitiedot Pätevyystutkimusten aikana laboratorion pitäisi luoda aiempia tietoja sisältävä tietokanta määrittääkseen positiivisten ja negatiivisten kontrollien vaihteluvälit ja jakaumat tiettyjen kudosten ja lajien osalta. Suosituksia tällaisen tietokannan luomisesta ja käytöstä (eli perusteet, joiden perusteella tietoja valitaan mukaan aiempiin tietoihin tai ei valita, sekä hyväksyttävyysperusteet tietyn kokeen osalta) annetaan kirjallisuudessa (47). Erilaiset kudokset ja eri lajit sekä eri kantajat ja annostelureitit voivat johtaa erilaisiin negatiivisiin vertailuarvoihin pyrstön DNA-pitoisuuden ( %) osalta. Siksi negatiivisen kontrollin vaihteluvälit on tärkeää määrittää kunkin kudoksen ja lajin osalta. Laboratorioiden pitäisi määrittää käyttämällä laadunvalvontamenetelmiä, kuten kontrollikaavioita (esimerkiksi C-kaavioita tai X-pylväskaavioita (48)), minkä verran niiden tiedoissa on vaihtelua, sekä osoittaa valvovansa menetelmää. Lisäksi heikkojen vaikutusten havaitsemiseksi (ks. 17 kohta) saattaa olla tarpeen optimoida sopivien positiivisten kontrolliaineiden, annosten vaihteluvälien ja koeolosuhteiden (esimerkiksi elektroforeesiolosuhteet) valintaa. Mahdollisissa koejärjestelyn muutoksissa on otettava huomioon järjestelyn yhdenmukaisuus laboratorion olemassa olevien aikaisempia kontrolleja koskevan tietokannan kanssa.. Jos havaitaan merkittäviä epäjohdonmukaisuuksia, on luotava uusi aikaisempien kontrollien tietokanta. MENETELMÄN KUVAUS Valmistelut Eläinlajin valinta Kokeessa käytetään normaalisti yleisesti käytettyä laboratoriokantaa olevia terveitä nuoria täysikasvuisia jyrsijöitä (jotka ovat käsittelyn alussa 6–10 viikon ikäisiä, joskin hieman vanhemmatkin eläimet voidaan hyväksyä). Jyrsijälajia valittaessa päätöksen pitäisi perustua (i) lajeihin, joita on käytetty muissa toksisuustutkimuksissa (tietojen korreloinnin ja integroitujen tutkimusten mahdollistamiseksi), (ii) lajeihin, joille on kehittynyt kasvaimia jossakin karsinogeenisyystutkimuksessa (tutkittaessa karsinogeneesin mekanismia), tai (iii) lajeihin, joiden metabolismi on ihmisten kannalta merkityksellisin, jos se tunnetaan. Testissä käytetään yleensä rottia. Muiden lajien käyttö on kuitenkin myös mahdollista, jos se on eettisesti ja tieteellisesti perusteltua. Koe-eläintilat ja eläinten ruokinta Koe-eläintilan ihanteellinen lämpötila on jyrsijöille 22 °C (± 3 °C). Suhteellisen kosteuden pitäisi olla ihanteellisesti 50–60 prosenttia, vähintään kuitenkin 30 prosenttia ja mieluiten enintään 70 prosenttia muulloin kuin tilan siivouksen yhteydessä. Huoneessa tulee käyttää keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa / 12 tuntia pimeää). Eläinten ruokinnassa voidaan käyttää normaalia laboratorioruokavaliota, eikä juomaveden määrää saa rajoittaa. Ravinnon valintaan voi vaikuttaa tarve varmistaa sopiva sekoitus testikemikaalia, kun sitä annetaan tätä reittiä. Samaa sukupuolta olevat jyrsijät olisi pidettävä häkeissä pienissä ryhmissä (yleensä enintään viisi), jos minkäänlaista aggressiivista käytöstä ei ole odotettavissa. Eläimet voivat olla häkissä yksittäin vain, jos tämä on tieteellisesti perusteltua. Lattian pitäisi olla tasainen, jos se vain on mahdollista, sillä verkkolattia voi aiheuttaa vakavia vammoja (49). Eläimille on järjestettävä sopivia virikkeitä. Eläinten valmistelu Eläimet jaetaan verrokki- ja testiryhmään satunnaistetusti. Eläimiä sopeutetaan laboratorio-olosuhteisiin vähintään viiden päivän ajan ennen käsittelyn aloittamista. Eläinten yksilöllisessä merkinnässä on käytettävä vähiten kajoavaa menetelmää. Sopivia menetelmiä ovat muun muassa rengastaminen, merkin kiinnittäminen, mikrosirun asettaminen ja biometrinen tunnistaminen. Varpaiden tai korvien leikkaaminen ei ole tieteellisesti perusteltua näissä testeissä. Häkit tulee järjestää siten, että niiden sijoittamisesta mahdollisesti aiheutuvat vaikutukset minimoituvat. Tutkimuksen alussa eläinten painon vaihtelun pitäisi olla mahdollisimman vähäistä, alle ± 20 prosenttia. Annosten valmistelu Kiinteät testattavat kemikaalit liuotetaan tai sekoitetaan asianmukaisiin kantajiin tai lisätään ravintoon tai juomaveteen, ennen kuin ne annetaan koe-eläimille. Nestemäiset testattavat kemikaalit voidaan antaa suoraan tai laimentaa ennen antamista. Testikemikaaleja voidaan antaa hengitystien kautta tapahtuvan altistamisen osalta kaasuna, höyrynä tai kiinteänä/nestemäisenä aerosolina niiden fysikaalis-kemiallisista ominaisuuksista riippuen (50) (51). Testikemikaali on valmisteltava juuri ennen annostelua, paitsi jos sen säilyvyys on osoitettu stabiliteettitesteillä ja asianmukaiset säilytysolosuhteet on määritetty. Testiolosuhteet Kantaja Liuottimella/kantaja-aineella ei saa olla toksisia vaikutuksia käytetyillä annostasoilla, eikä sen käyttöön saa liittyä epäilyjä mahdollisista kemiallisista reaktioista testikemikaalin kanssa. Jos käytetään muita kuin hyvin tunnettuja kantaja-aineita, niiden käyttö on perusteltava tutkimustuloksilla, jotka osoittavat niiden yhteensopivuuden testieläinten, annostelutavan ja päätetapahtuman kanssa. Vesipitoisen liuottimen/kantaja-aineen käyttöä on harkittava ensisijaisesti aina, kun se on mahdollista. On huomattava, että jotkin kantajat (erityisesti viskoosiset kantaja-aineet) voivat aiheuttaa tulehdusta ja lisätä DNA-säikeiden katkoksien taustatasoa kosketuskohdassa, erityisesti jos annostelukertoja on useita. Kontrollit Positiiviset kontrollit Tässä yhteydessä kussakin testissä pitäisi normaalisti olla mukana positiivisella kontrolliaineella käsitelty ryhmä, joka muodostuu vähintään kolmesta analysoitavasta eläimestä, jotka edustavat samaa sukupuolta tai kumpaakin sukupuolta, jos kumpaakin sukupuolta käytetään (ks. 32 kohta). Tulevaisuudessa positiivisten kontrollien tarvetta voidaan mahdollisesti vähentää osoittamalla riittävä pätevyys. Jos näytteenottoajankohtia on useita (esimerkiksi testiprotokollassa, jossa annostelukertoja on yksi), positiiviset kontrollit otetaan mukaan vain yhteen näytteenottoajankohtaan, mutta tasapaino kokeen suunnittelussa on turvattava (ks. 48 kohta). Samanaikaisia positiivisia kontrolliaineita ei tarvitse antaa samaa reittiä kuin testikemikaalia, vaikka onkin tärkeää, että samaa reittiä käytetään mitattaessa vaikutuksia kosketuskohdassa. Positiivisten kontrolliaineiden pitäisi osoittaa katkovan DNA-säikeitä kaikissa testikemikaalin kannalta kiinnostavissa kudoksissa, ja EMS sopii todennäköisesti positiiviseksi kontrolliksi, sillä se on katkonut DNA-säikeitä kaikissa tutkituissa kudoksissa. Positiivisten kontrolliaineiden annokset on valittava niin, että niillä saadaan aikaan kohtalaiset vaikutukset, joiden perusteella voidaan arvioida kriittisesti kokeen suorituskykyä ja herkkyyttä, ja ne voivat perustua annos-vastekäyriin, jotka laboratorio on määrittänyt pätevyyden osoittamisen aikana. Samanaikaisesti positiivisella kontrollilla käsitellyistä eläimistä saadun pyrstön DNA-pitoisuuden ( %) pitäisi vastata vaihteluväliä, jonka laboratorio on vahvistanut ennalta kyseisen lajin kunkin yksittäisen kudoksen ja näytteenottoajankohdan osalta (ks. 16 kohta). Taulukko 1 sisältää esimerkkejä positiivisista kontrolliaineista ja muutamista niiden kohdekudoksista (jyrsijöillä). Muita kuin taulukossa 1 mainittuja aineita voidaan valita, jos se on tieteellisesti perusteltua. Taulukko 1 Esimerkkejä positiivisista kontrollikemikaaleista ja muutamista niiden kohdekudoksista Aineet ja CAS RN -nro Etyylimetaanisulfonaatti (CAS RN 62-50-0), mikä tahansa kudos Ethyylinitrosourea (CAS RN 759-73-9), maksa ja mahalaukku, pohjukaissuoli tai tyhjäsuoli Metyylimetaanisulfonaatti (CAS RN 66-27-3), maksa, mahalaukku, pohjukaissuoli tai tyhjäsuoli, keuhko ja bronkoalveolaariset lavaatiosolut (BAL), munuainen, virtsarakko, keuhko, kives ja luuydin/veri N-metyyli-N′-nitro-N-nitrosoguanidiini (CAS RN 70-25-7), mahalaukku, pohjukaissuoli tai tyhjäsuoli 1,2-dimetyylihydratsiini 2HCl (CAS RN 306-37-6), maksa ja suolisto N-metyyli-N-nitrosourea (CAS RN 684-93-5), maksa, luuydin, veri, munuainen, mahalaukku, tyhjäsuoli ja aivot Negatiiviset kontrollit Kussakin testissä pitäisi olla kunakin näytteenottoajankohtana ja kunkin kudoksen osalta mukana negatiivisten kontrollieläinten ryhmä, joka käsitellään pelkällä kantaja-aineella mutta jota muutoin käsitellään samalla tavalla kuin muita tutkittavia ryhmiä. Negatiivisista kontrollieläimistä saadun pyrstön DNA-pitoisuuden ( %) pitäisi vastata taustapitoisuuden vaihteluväliä, jonka laboratorio on vahvistanut ennalta kyseisen lajin kunkin yksittäisen kudoksen ja näytteenottoajankohdan osalta (ks. 16 kohta). Ellei olemassa ole aiempia tai julkaistuja kontrollitietoja, jotka osoittaisivat, että valittu kantaja-aine, annosten määrä tai annostelureitti ei aiheuta deleetetioita tai genotoksisia vaikutuksia, ennen koko tutkimuksen tekemistä pitäisi tehdä alustavia tutkimuksia, joilla määritetään kantajakontrollin hyväksyttävyys. MENETTELY Eläinten lukumäärä ja sukupuoli Vaikka saatavana onkin varsin vähän naaraisiin liittyviä tietoja, joiden perusteella voitaisiin tehdä komeettakokeeseen liittyviä sukupuolten välisiä vertailuja, muut in vivo -genotoksisuusvasteet ovat yleensä naarailla ja uroksilla samankaltaisia, minkä vuoksi useimmat tutkimukset voitaisiin tehdä kummalle sukupuolelle tahansa. Tiedot, jotka osoittavat naaraiden ja urosten välillä olevan olennaisia eroja (esimerkiksi eroja, jotka liittyvät systeemiseen toksisuuteen, metabolismiin, biologiseen hyötyosuuteen jne., mukaan lukien esimerkiksi raja-annostutkimus) kannustavat molempien sukupuolten käyttöön. Tässä tapauksessa saattaa olla sopivaa tehdä tutkimus molemmilla sukupuolilla esimerkiksi osana toistuvan annostelun toksisuustutkimusta. Molempia sukupuolia käytettäessä saattaa olla sopivaa tehdä yhdistelykoe. Tarkempia tietoja siitä, miten tietoja yhdistelykokeessa analysoidaan, annetaan lisäyksessä 2. Tutkimuksen alussa (ja pätevyyden osoittamisen aikana) ryhmien koot pitäisi valita niin, että yhdessä ryhmässä on vähintään viisi yhtä sukupuolta edustavaa eläintä – tai molempia sukupuolia käytettäessä vähintään viisi kumpaakin sukupuolta edustavaa eläintä (ja samanaikaisessa positiivisessa kontrolliryhmässä vähemmän; ks. 29 kohta). Jos ihmisen altistuminen tutkittavalle kemikaalille voi olla sukupuolesta riippuvaa, kuten joidenkin lääkeaineiden kohdalla, testi on tehtävä asianomaista sukupuolta käyttäen. Eläinten tyypillistä enimmäismäärää koskeviin vaatimuksiin liittyvänä ohjeena todettakoon, että kohdan 33 mukaisesti tehtävä tutkimus, jossa käytetään kolmea annosryhmää ja samanaikaisesti negatiivista ja positiivista kontrollia (kussakin ryhmässä viisi samaa sukupuolta edustavaa eläintä), vaatisi 25–35 eläintä. ALTISTUSOHJELMA Eläimiä pitäisi käsitellä päivittäin vähintään kahden päivän ajan (eli vähintään kahdesti noin 24 tunnin välein), ja näytteet pitäisi kerätä kerran 2–6 tunnin kuluttua (eli hetkellä Tmax) viimeisestä käsittelystä (12). Pitempien altistusohjelmien aikana (esimerkiksi 28 päivän altistus) kerätyt näytteet ovat hyväksyttäviä. Komeettakokeen ja erytrosyyttimikrotumatestin yhdistämisen on osoitettu onnistuneen (10) (19). Komeettakokeen kudosnäytteiden ottamiseen liittyvää logistiikkaa sekä muunlaisten toksikologisten arvioiden näytteenottovaatimuksia on kuitenkin punnittava huolellisesti. Yleiselle toksisuustutkimukselle tyypillinen keruu 24 tunnin kuluttua viimeisestä annoksesta ei sovellu useimpiin tapauksiin (ks. 40 kohta näytteenottoajasta). Muiden käsittely- ja näytteenottoaikataulujen käyttö on perusteltava (ks. lisäys 3). Esimerkiksi kerta-annostelun ja usean näytteenoton käyttö on mahdollista, mutta kerta-annostutkimukseen tarvitaan enemmän eläimiä, koska näytteenottoajankohtia on oltava useita; toisinaan tämä voi kuitenkin olla suotava vaihtoehto, esimerkiksi silloin, kun testikemikaalin toistuva annostelu aiheuttaa liiallista toksisuutta. Testi on hyväksyttävä testitavasta riippumatta, kunhan testikemikaali antaa positiivisen vasteen tai – jos kyse on negatiivisesta tutkimuksesta – kunhan saadaan suoraa tai välillistä näyttöä, joka tukee kiinnostuksen kohteena olevan kudoksen (olevien kudosten) altistumista taikka toksisuutta kudokselle (kudoksille) tai jos raja-annos saavutetaan (ks. 36 kohta). Testikemikaalit voidaan antaa myös jaettuina annoksina, jolloin käsittelyjä on kaksi samana päivänä enintään 2–3 tunnin välein, mikä helpottaa suurten ainemäärien antamista. Tällöin näytteenotto pitäisi ajoittaa viimeisen annoksen antamisajankohdan perusteella (ks. 40 kohta). Annostasot Jos tehdään alustava annoksenmääritystutkimus, koska muista olennaisista tutkimuksista ei ole saatavilla soveltuvia tietoja, jotka auttaisivat annoksen valinnassa, se on tehtävä samassa laboratoriossa käyttäen samaa lajia, samaa kantaa ja samaa sukupuolta olevia eläimiä sekä samaa altistusohjelmaa kuin päätutkimuksessa on tarkoitus käyttää, annoksenmääritystutkimusta koskevien nykyisten lähestymistapojen mukaisesti. Tutkimuksessa pitäisi pyrkiä määrittämään suurin siedetty annos (MTD-arvo) eli annos, joka aiheuttaa lievästi toksisen vaikutuksen suhteessa tutkimusjakson kestoon (esimerkiksi selviä kliinisiä merkkejä, kuten epänormaalia käytöstä tai reagointia, vähäistä painonlaskua tai kohdekudoksen sytotoksisuutta), mutta ei kuolemaa tai merkkejä kivusta, kärsimyksestä tai stressistä, joka edellyttäisi eläimen lopettamista. Kun kyseessä on myrkytön testikemikaali, jonka annosteluaika on vähintään 14 päivää, enimmäisannos (raja-annos) on 1 000 mg/painokilo/päivä. Kun annosteluaika on alle 14 päivää, enimmäisannos (raja-annos) on 2 000 mg/painokilo/päivä. Nämä rajat voivat vaihdella tietyn tyyppisten testikemikaalien kohdalla (esimerkiksi ihmisten lääkkeet), joihin sovelletaan erityisiä sääntöjä. Annoksenmääritysperusteista voidaan poiketa sellaisten kemikaalien kohdalla, jotka ilmentävät toksikokineettisten ominaisuuksien tyydyttymistä tai aiheuttavat detoksifikaatioprosesseja, jotka voivat puolestaan johtaa altistuksen vähenemiseen pitkäaikaisen annostelun jälkeen. Näitä perusteita pitäisikin arvioida tapauskohtaisesti. Komeettakokeen akuuteissa ja subakuuteissa versioissa enimmäisannoksen (suurin siedetty annos, suurin käyttökelpoinen annos, enimmäisaltistus tai raja-annos) lisäksi kullekin näytteenottoajalle on valittava ainakin kahdesta ylimääräisestä, sopivin välein annettavasta annoksesta muodostuva alenevan annostason sarja (annosten väli on mieluiten alle 10) annoksesta riippuvan vasteen osoittamiseksi. On suotavaa, että nämä annostasot kattavat vaihteluvälin enimmäisannoksesta annokseen, jolla on vähäinen myrkkyvaikutus tai ei myrkkyvaikutusta lainkaan. Kun kohdekudoksen toksisuus havaitaan kaikilla testatuilla annostasoilla, on suositeltavaa tehdä lisätutkimuksia ei-toksisilla annoksilla (ks. 54–55 kohta). Tutkimukset, joiden tarkoituksena on tutkia kattavammin annos-vastekäyrän muotoa, saattavat edellyttää ylimääräisiä annosryhmiä. Antotapa Testin suunnittelussa on otettava huomioon oletettu ihmisen altistusreitti. Siksi altistumisreitti – kuten ruoan, juomaveden tai ihoaltistuksen kautta, ihonalaisesti, suonensisäisesti, suun kautta (letkulla), hengittämällä, intratrakeaalisesti tai implantaation kautta tapahtuva altistuminen – voidaan valita sen mukaan, mikä on perusteltua. Joka tapauksessa reitti pitää valita tavalla, jolla varmistetaan tutkimuksen kohteena olevan kudoksen (olevien kudosten) asianmukainen altistuminen. Intraperitoneaalista injektiota ei yleensä suositella, sillä se ei ole ihmiselle tyypillinen ja merkittävä altistumisreitti, ja sitä pitäisikin käyttää vain, jos sille on erityisiä perusteita (esimerkiksi jotkin positiiviset kontrolliaineet tutkimustarkoituksiin tai jotkin lääkkeet, joita annetaan intraperitoneaalisesti). Suurin letkuruokinnan tai injektion avulla kerralla annettava nestemäärä määräytyy koe-eläimen koon mukaan. Määrä ei saa olla yli 1 ml/100 g painoa. Poikkeuksen muodostavat vesiliuokset, joita käytettäessä tilavuus voi olla 2 ml/100 g painoa. Tätä suurempien määrien käyttö (jos eläinsuojelulainsäädäntö sen sallii) on perusteltava. Aina kun mahdollista, eri annostasot pitäisi saavuttaa säätämällä valmisteannoksen pitoisuutta niin, että määrä pysyy tasaisena suhteessa kehonpainoon kaikilla annostasoilla. Näytteenottoaika Näytteenottoaika on kriittinen muuttuja, sillä se riippuu siitä, missä ajassa kohdekudoksessa saavutetaan testikemikaalin enimmäispitoisuus ja DNA-säikeet katkeavat, mutta nämä katkeamat eivät poistu, korjaannu tai johda solun kuolemaan. Tietyt vauriot, jotka aiheuttavat komeettakokeella havaittavia DNA-säikeiden katkeamia, saattavat olla hyvin lyhytkestoisia ainakin joidenkin in vitro -testattujen kemikaalien osalta (52) (53). Siksi tällaisia väliaikaisia DNA-vaurioita epäiltäessä on ryhdyttävä toimenpiteisiin, joilla estetään niiden menettäminen, varmistamalla, että kudosnäytteet kerätään riittävän aikaisin, mahdollisesti jo ennen jäljempänä esitettyjä oletusajankohtia. Optimaalinen näytteenottoaika saattaa (optimaaliset näytteenottoajat saattavat) riippua kemikaalista ja antoreitistä ja johtaa esimerkiksi kudoksen nopeaan altistumiseen, jos annostelu tapahtuu suonensisäisesti tai altistus tapahtuu hengittämällä. Siksi näytteenottoajat pitäisi määrittää kineettisten tietojen pohjalta (esimerkiksi aika (Tmax), jossa saavutetaan plasman tai kudoksen huippupitoisuus (Cmax) tai monen annoksen tapauksessa vakaa tila), jos sellaisia on saatavana. Ellei kineettisiä tietoja ole saatavana, sopiva kompromissiratkaisu genotoksisuuden mittaamisen kannalta on kerätä näytteet, kun viimeisestä käsittelystä on kulunut 2–6 tuntia (kahden tai useamman käsittelyn tapauksessa) tai kun kerta-annoksen antamisesta on kulunut 2–6 tuntia ja 16–26 tuntia, joskin on huolehdittava, että kaikkien eläinten ruumiinavaus tehdään samana ajankohtana viimeisen (tai ainoan) annoksen jälkeen. Sopivien näytteenottoaikojen valinnassa on käytettävä myös tietoja toksisten vaikutusten ilmenemisestä kohde-elimessä (jos niitä on saatavana). Havainnot Yleisiä kliinisiä havaintoja eläinten terveydentilasta tulee tehdä ja kirjata ainakin kerran päivässä, mieluiten samaan aikaan (samoihin aikoihin) joka päivä ottaen huomioon se, milloin annoksen antamisen jälkeen odotetut vaikutukset ovat suurimmillaan (54). Kaikkien eläinten sairastuvuutta ja kuolleisuutta on havainnoitava ainakin kahdesti vuorokaudessa. Kestoltaan pidemmissä tutkimuksissa kaikki eläimet on punnittava vähintään kerran viikossa ja testijakson päättyessä. Ruoan kulutusta on mitattava, kun ruoka vaihdetaan, ja ainakin kerran viikossa. Jos testikemikaalia annostellaan juomaveteen, veden kulutusta on mitattava, kun vesi vaihdetaan, tai ainakin kerran viikossa. Eläimet, joilla ilmenee ei-letaaleja merkkejä liiallisesta myrkytysvaikutuksesta, on lopetettava ennen tutkimusjakson päättymistä, eikä niitä yleensä käytetä komeetta-analyysiin. Kudosnäytteiden kerääminen Koska DNA-säikeiden katkeamia (komeettoja) voidaan mahdollista tutkia melkeinpä mistä tahansa kudoksista, kudoksen/kudosten valintaperusteet pitäisi määrittää selvästi ja niiden pitäisi perustua syyhyn, jonka vuoksi tutkimus tehdään, sekä olemassa oleviin, tutkittavia testikemikaaleja koskeviin ADME-, genotoksisuus- tai karsinogeenisyystietoihin tai muuta toksisuutta koskeviin tietoihin. Tärkeitä huomioon otettavia seikkoja ovat muun muassa annostelureitti (joka riippuu ihmisen todennäköisestä altistumisreitistä / todennäköisistä altistumisreiteistä), ennakoitu leviäminen ja absorptio kudoksessa, metabolismin rooli sekä testikemikaalien mahdollinen toimintamekanismi. Useimmin tutkittu kudos on maksa, ja siitä on myös saatavana eniten tietoa. Siksi tilanteessa, jossa taustatietoja ei ole eikä erityistä mielenkiinnon kohteena olevaa kudosta ole määritetty, on perusteltua ottaa näyte maksasta, sillä se on ksenobioottisen metabolismin ensisijainen paikka ja se altistuu usein voimakkaasti sekä emoaineelle/-aineille että metaboliitille/metaboliiteille. Joissakin tapauksissa saattaa olla mielekkäintä tutkia suoralle kontaktille altistuvaa kohtaa (esimerkiksi suun kautta annosteltujen kemikaalien tapauksessa rauhasmahaa tai pohjukaissuolta/tyhjäsuolta tai hengitettyjen kemikaalien tapauksessa keuhkoja). Jos ylimääräisiä tai vaihtoehtoisia kudoksia valitaan, valinnan pitäisi perustua syihin, joiden vuoksi testi tehdään, mutta samojen eläinten useiden kudosten tarkastelusta saattaa olla hyötyä, jos laboratorio on osoittanut pätevyytensä kyseisten kudosten osalta ja pystyvänsä käsittelemään useita kudoksia samaan aikaan. Näytteiden valmistelu Seuraavissa kohdissa (44–49) kuvatuissa prosesseissa on tärkeää, että kaikki liuokset tai vakaat suspensiot käytetään ennen niiden käyttöajan päättymistä tai tarvittaessa heti niiden valmistuksen jälkeen. Lisäksi seuraavissa kappaleissa (i) kunkin kudoksen poistamiseen ruumiinavauksen jälkeen, (ii) kunkin kudoksen prosessointiin ja solu-/tumasuspensioiden valmistamiseen sekä (iii) suspension prosessointiin ja näytelasien valmisteluun kuluvat ajat ovat kaikki kriittisiä muuttujia (ks. määritelmät lisäyksestä 1), ja kussakin vaiheessa hyväksyttävät ajat on pitänyt määrittää menetelmän käyttöönoton ja pätevyyden osoittamisen yhteydessä. Eläimet lopetetaan voimassa olevan eläinsuojelulainsäädännön ja 3R-periaatteiden mukaisesti sopivana ajankohtana / sopivina ajankohtina viimeisen testikemikaalilla tehdyn käsittelyn jälkeen. Valittu kudos / valitut kudokset poistetaan ja leikataan ja osa otetaan talteen komeettakoetta varten, ja samalla kudoksen samasta osasta otetaan leike, joka pannaan formaldehydiliuokseen tai sopivaan fiksatiiviin mahdollista histopatologista analyysia varten (ks. 55 kohta) vakiomenetelmien mukaisesti (12). Komeettakoetta varten otettu kudos pannaan hienonnuspuskuriin, verijäämät poistetaan huuhtelemalla sitä riittävästi kylmällä hienonnuspuskurilla ja kudosta säilytetään jääkylmässä hienonnuspuskurissa, kunnes se prosessoidaan. Esimerkiksi maksalle tai munuaiselle voidaan tehdä myös perfuusio in situ. Solun/tuman eristämiseen on olemassa monia julkaistuja menetelmiä. Niihin kuuluvat muun muassa kudosten, kuten maksan ja munuaisen, hienontaminen, limakalvopintojen raaputus ruoansulatuskanavan tapauksessa, homogenointi ja sulatus entsyymillä. JaCVAM-validointikokeessa tutkittiin vain eristettyjä soluja, ja siksi eristetyt solut ovat parempia siltä osin kuin kyse on menetelmän käyttöönotosta ja edellytyksistä viitata JaCVAM testitietoihin pätevyyden osoittamiseksi. On kuitenkin osoitettu, ettei tuloksissa ollut olennaista eroa sen perusteella, käytettiinkö kokeessa eristettyjä soluja vai tumia (8). Myös solujen/tumien eristämiseen käytetyt eri menetelmät (esimerkiksi homogenointi, hienontaminen, sulatus entsyymillä ja verkkosuodatus) antoivat vertailukelpoisia tuloksia (55). Siten kokeessa voidaan käyttää joko eristettyjä soluja tai eristettyjä tumia. Laboratorion pitäisi arvioida perusteellisesti ja validoida kudoskohtaiset menetelmät yksittäisen solun/tuman eristämiseen. Kuten kohdassa 40 on todettu, jotkin vauriot, jotka aiheuttavat komeettakokeella havaittavia DNA-säikeiden katkeamia, saattavat olla hyvin lyhytkestoisia (52) (53). Siksi riippumatta siitä, mitä menetelmää yhden solun/tuman suspensioiden valmistamiseen käytetään, on tärkeää, että kudokset prosessoidaan mahdollisimman pian eläinten lopettamisen jälkeen ja saatetaan olosuhteisiin, jotka ehkäisevät vaurioiden häviämistä (esimerkiksi kudoksen säilyttäminen alhaisessa lämpötilassa). Solususpensiot on pidettävä jääkylminä, kunnes ne ollaan valmiita käyttämään, jotta näytteiden välinen variaatio on mahdollisimman vähäistä ja jotta voidaan osoittaa sopivat positiiviset ja negatiiviset kontrollivasteet. NÄYTELASIEN VALMISTELU Näytelasit pitäisi valmistella mahdollisimman pian (ihanteellisesti tunnin sisällä) yhden solun/tuman valmistelusta, mutta lämpötilaa sekä eläimen kuoleman ja näytelasin valmistelun välistä aikaa on valvottava tarkkaan ja ne on validoitava laboratorion olosuhteissa. Näytelasien valmisteluun käytettävään alhaisen sulamispisteen agaroosiin lisättävän solususpension määrä (yleensä 0,5–1,0 prosenttia) ei saa laskea alhaisen sulamispisteen agaroosin osuutta alle 0,45 prosenttiin. Optimaalinen solutiheys määritetään komeettojen arviointiin käytettävällä kuva-analyysijärjestelmällä. Lyysis Myös lyysisolosuhteet ovat kriittinen muuttuja ja saattavat vaikuttaa säikeiden katkeamiseen, joka johtuu eri tyyppisistä DNA-muutoksista (tietyistä DNA-alkylaatioista ja emäsaddukteista). Siksi suositellaan, että lyysisolosuhteet pidetään mahdollisimman tasaisina kaikkien kokeessa käytettävien näytelasien osalta. Kun näytelasit on valmisteltu, ne upotetaan jäähdytettyyn (noin 2–8 °C) lyysisliuokseen ainakin yhdeksi tunniksi (tai yön yli) ja niitä pidetään heikoissa valaistusolosuhteissa (esimerkiksi keltaisessa valossa tai valoa läpäisemättömässä paikassa), jotta vältetään niiden altistuminen valkoiselle valolle, joka saattaa sisältää UV-komponentteja. Tämän inkubaatiovaiheen jälkeen näytelaseista huuhdellaan pois puhdistusainejäämät ja suolot ennen emäksen purkamisvaihetta. Tähän voidaan käyttää puhdistettua vettä, neutralointipuskuria tai fosfaattipuskuria. Myös elektroforeesipuskurin käyttäminen on mahdollista. Tämä pitää olosuhteet emäksisinä elektroforeesikammiossa. Purkaminen ja elektroforeesi Näytelasit asetetaan upotettavaa tyyppiä olevan elektroforeesiyksikön tasolle satunnaisesti; elektroforeesiliuosta on oltava riittävästi, jotta näytelasien pinnat peittyvät täysin (peittymissyvyys pitäisi pitää samana joka ajossa). Komeettakokeessa käytetyissä toisenlaisissa elektroforeesiyksiköissä, joissa on aktiivinen jäähdytys, kierto ja tehokas virtalähde – näytelasien upottaminen syvemmälle liuokseen johtaa suurempaan sähkövirtaan jännitteen pysyessä ennallaan. Näytelasit pitäisi asettaa elektroforeesisäiliöön tasapainoisella tavalla, jotta säiliössä ei ilmene erityisiä suuntauksia tai reunavaikutuksia ja jotta erien välinen vaihtelu saadaan pidettyä mahdollisimman vähäisenä; toisin sanoen kussakin elektroforeesiajossa pitäisi olla sama määrä näytelaseja kustakin tutkimuksessa käytetystä eläimestä sekä näytteitä eri annosryhmistä, negatiivisista ja positiivisista kontrolleista. Näytelasit pitäisi jättää liuokseen ainakin 20 minuutiksi DNA:han purkautumista varten, minkä jälkeen elektroforeesi pitäisi tehdä hallituissa oloissa, joilla maksimoidaan kokeen herkkyys ja dynamiikka-alue (eli jotka johtavat pyrstön DNA-pitoisuutta koskeviin hyväksyttäviin tasoihin herkkyyden maksimoivien negatiivisten ja positiivisten kontrollien osalta). DNA:n kulkeutumisen aste riippuu lineaarisesti elektroforeesin kestosta sekä jännitteestä (V/cm). JaCVAMin kokeen perusteella se voisi olla 0,7 V/cm vähintään 20 minuutin ajan. Elektroforeesin kestoa pidetään kriittisenä muuttujana, ja elektroforeesiaika pitäisi valita siten, että dynamiikka-alue optimoidaan. Pidemmät elektroforeesiajat (esimerkiksi 30 tai 40 minuuttia herkkyyden maksimoimiseksi) johtavat yleensä vahvempiin positiivisiin vasteisiin tunnettujen mutageenien kanssa. Pidemmät elektroforeesiajat voivat kuitenkin myös aiheuttaa liiallista kulkeutumista kontrollinäytteissä. Kussakin kokeessa jännite pitäisi pitää vakiona, ja muiden muuttujien vaihtelun pitäisi pysyä tietyllä kapealla vaihteluvälillä; esimerkkinä mainittakoon JaCVAM-kokeessa 300 mA:n käynnistymisvirralla saatu 0,7 V/cm. Puskurin syvyyttä pitäisi säätää niin, että vaaditut olosuhteet saavutetaan ja ne säilyvät koko kokeen ajan. Virta elektroforeesijakson alussa ja lopussa on kirjattava. Siksi optimaaliset olosuhteet pitäisi määrittää pätevyyden osoittamisen alkuvaiheessa kyseisessä laboratoriossa kullakin tutkitulla kudoksella. Purkamisen ja elektroforeesin aikana elektroforeesiliuoksen lämpötila pitäisi pitää alhaisena, yleensä 2–10 °C:ssä (10). Elektroforeesiliuoksen lämpötila purkamisen alussa, elektroforeesin alussa ja elektroforeesin lopussa on kirjattava. Elektroforeesin päättyessä näytelasit on upotettava neutralointipuskuriin tai niitä on huuhdeltava neutralointipuskurilla vähintään viiden minuutin ajan. Geelit voidaan värjätä ja arvioida ”tuoreina” (esimerkiksi 1–2 päivän sisällä) tai ne voidaan kuivattaa myöhempää arviointia varten (esimerkiksi 1–2 viikon kuluttua värjäämisestä) (56). Olosuhteet pitäisi kuitenkin validoida pätevyyden osoittamisen aikana, ja kustakin tällaisesta olosuhteesta pitäisi hankkia ja säilyttää aiempia tietoja. Jälkimmäisessä vaihtoehdossa näytelasit pitäisi kuivattaa upottamalla ne puhtaaseen etanoliin vähintään viideksi minuutiksi ja antamalla niiden kuivua ilmassa, minkä jälkeen niitä säilytetään joko huoneenlämmössä tai säiliössä jääkaapissa, kunnes ne arvioidaan. Mittausmenetelmät Komeettoja pitäisi arvioida kvantitatiivisesti käyttämällä automaattista tai puoliautomaattista kuva-analyysijärjestelmää. Näytelasit värjätään käyttämällä sopivaa fluoresoivaa väriainetta, esimerkiksi SYBR Gold -väriainetta, Green I -väriainetta, propidiumjodidia tai etidiumbromidia, ja mitataan sopivaa suurennusta (esimerkiksi 200 ×) käyttäen mikroskoopilla, jossa on epifluoresenssivarustus ja sopivat detektorit tai digitaalinen kamera (esimerkiksi CCD-kamera). Solut voidaan jakaa kolmeen komeettoja esittelevässä kuvastossa (57) esitettyyn luokkaan: nimittäin arviointikelpoisiin, arviointikelvottomiin ja niin sanottuihin ”siileihin” (ks. lisätietoja 56 kohdasta). Artefaktien välttämiseksi pyrstön DNA-pitoisuutta pitäisi arvioida vain arviointikelpoisista soluista (joiden ydin ja pyrstö erottuvat selvästi, ilman että viereiset solut aiheuttavat sekaannusta). Arviointikelvottomien solujen tiheyttä ei ole tarpeen raportoida. Ns. siilien tiheys pitäisi määrittää silmämääräisen laskennan perusteella (sillä kuva-analyysi ei havaitse selvästi soluja, joista puuttuu selväpiirteinen ydin), jos näytteessä on niitä ainakin 150 (ks. lisätietoja 56 kohdasta), ja ne pitäisi dokumentoida erikseen. Kaikki analysoitavat näytelasit, mukaan lukien positiiviset ja negatiiviset kontrollit, pitäisi merkitä erikseen tunnisteella ja niitä pitäisi arvioida ”sokkona”, jotta arvioitsija ei tiedä, mistä käsittelystä on kyse. Kustakin näytteestä (yksi näyte kudosta kohti, yksi kudos eläintä kohti) pitäisi analysoida vähintään 150 solua (lukuun ottamatta ns. siilejä, ks. 56 kohta). 150 solun arviointi eläintä kohti, niin että eläimiä on ainakin viisi yhtä annosta kohti (vähemmän samanaikaisessa positiivisessa kontrollissa, ks. 29 kohta) antaa Smithin et al., 2008 analyysin mukaan (5) riittävän tilastollisen voiman. Kun eläimiä on yhdessä ryhmässä viisi, tämä voisi näytelaseja käytettäessä tarkoittaa 2:ta–3:a näytelasia yhtä näytettä kohti. Näytelasista pitäisi arvioida useita alueita, joiden sijainti valitaan siten, että pyrstöjen päällekkäisyyden mahdollisuus suljetaan pois. Näytelasien reunojen arviointia pitäisi välttää. Komeettakokeessa DNA-säikeiden katkeamia voidaan arvoida käyttämällä riippumattomia päätetapahtumia, kuten pyrstön DNA-pitoisuutta (%), pyrstön pituutta ja pyrstön momenttia. Kaikki kolme mittausta voidaan tehdä käyttämällä sopivaa kuvien analysointiohjelmaa. Tulosten arviointiin ja tulkintaan suositellaan käytettävän pyrstön DNA-pitoisuutta (%) (johon viitataan myös ilmaisulla ”%:a pyrstön koosta”) (12) (40) (41) (42), ja sen ratkaisee DNA-fragmenttien määrä pyrstössä ilmaistuna prosentteina solun kokonaiskoosta (13). Kudosvaurio ja sytotoksisuus Positiiviset havainnot komeettakokeessa eivät välttämättä johdu yksin genotoksisuudesta, vaan myös kohdekudoksen toksisuus voi lisätä DNA:n siirtymistä (12) (41). Sitä vastoin tunnettujen genotoksiinien yhteydessä nähdään usein alhaista tai kohtalaista sytotoksisuutta (12), mikä osoittaa, että genotoksisuuden aiheuttamaa DNA:n siirtymistä ei ole mahdollista erottaa sytotoksisuuden aiheuttamasta siirtymisestä yksin komeettakokeessa. Kun DNA:n kulkeutumisen havaitaan lisääntyneen, on kuitenkin suositeltavaa tutkia yksi tai useampi sytotoksisuusindikaattori, sillä tämä voi auttaa tulkitsemaan havaintoja. Kun sytotoksisuudesta on selvää näyttöä, DNA:n liikkumisen lisääntymistä on tulkittava varovasti. Useita erityyppisiä sytotoksisuusmittauksia on ehdotettu. Histopatologisia muutoksia pidetään asiaankuuluvana tapana mitata kudoksen toksisuutta. DNA:n siirtymisen lisääntymiseen on liitetty tulehduksen, solujen infiltraation, apoptoottisten tai nekroottisten muutosten kaltaisia löydöksiä, mutta kuten JaCVAMin validointikoe (12) osoitti, saatavana ei ole ehdotonta luetteloa histopatologisista muutoksista, jotka liittyisivät aina DNA:n siirtymisen lisääntymiseen. Muutokset kliinisissä kemiallisissa mittauksissa (esimerkiksi AST, ALT) voivat myös tarjota hyödyllistä tietoa kudosvauriosta, ja ylimääräisiä indikaattoreita, kuten kaspaasiaktivaatiota, TUNEL-värjäystä, Annexin V -värjäystä jne., voidaan myös tarkastella. Saatavilla on kuitenkin vain rajallinen määrä julkaistuja tietoja, joiden mukaan jälkimmäistä olisi käytetty in vivo -tutkimuksissa Osa näistä tiedoista ei välttämättä ole erityisen luotettavia. Siilit (eli pilvet tai haamusolut) ovat soluja, joilla on mikroskooppikuvassa pieni tai olematon ydin ja suuri hajanainen pyrstö; niitä pidetään pahasti vaurioituneina soluina, vaikka niiden etiologiasta ei olekaan varmuutta (ks. lisäys 3). Niiden ulkonäön vuoksi pyrstön DNA-pitoisuuden ( %) mittaaminen kuva-analyysilla on epäluotettavaa, ja siksi siilejä pitäisi arvioida erikseen. Siilien esiintyminen on pantava merkille ja raportoitava, ja niiden määrän merkittävää kasvua, jonka ajatellaan johtuvan testikemikaalista, on tutkittava ja tulkittava varoen. Tieto testikemikaalien potentiaalisesta vaikutustavasta saattaa auttaa tällaisissa pohdinnoissa. TIEDOT JA RAPORTOINTI Tulosten käsittely Eläin on koeyksikkö, ja siksi sekä yksittäisen eläimen tiedot että tulosyhteenveto olisi esitettävä taulukkomuodossa. Tietojen hierarkkisen luonteen vuoksi suositellaan, että kunkin näytelasin osalta määritetään pyrstön DNA-pitoisuuden ( %) mediaani ja että kunkin eläimen osalta lasketaan mediaanien keskiarvo (12). Sitten lasketaan yksittäisen eläimen keskiarvojen keskiarvo, jonka pohjalta saadaan ryhmän keskiarvo. Kaikki nämä arvot on kirjattava raporttiin. Vaihtoehtoisia lähestymistapoja (ks. 53 kohta) voidaan käyttää, jos se on tieteellisesti ja tilastollisesti perusteltua. Tilastoanalyysiin voidaan käyttää useita eri lähestymistapoja (58) (59) (60) (61). Käytettäviä tilastollisia menetelmiä valittaessa huomioon pitäisi ottaa tarve muuntaa tietoja (esimerkiksi log tai neliöjuuri) ja/tai lisätä pieni luku (esimerkiksi 0,001) kaikkiin arvoihin (jopa muihin kuin nolla-arvoihin) solujen nolla-arvojen vaikutusten minimoimiseksi, kuten edellä mainituissa kirjallisuusviitteissä on todettu. Yksityiskohtaiset tiedot käsittelyn ja sukupuolen keskinäisen vaikutuksen analysoinnista (molempia sukupuolia käytettäessä) sekä sen jälkeisestä tietojen analysoinnista (kun eroja havaitaan tai niitä ei havaita) esitetään liitteessä 2. Tiedot toksisuudesta ja kliinisistä merkeistä pitäisi myös raportoida. Hyväksyttävyysperusteet Testin hyväksyttävyysperusteet ovat seuraavat:
Tulosten arviointi ja tulkinta Jos kaikki hyväksyttävyysperusteet täyttyvät, testikemikaalia pidetään selvästi positiivisena, jos
Kun kaikki nämä perusteet täyttyvät, testikemikaalin katsotaan voivan aiheuttaa DNA:n säikeiden katkeamista testijärjestelmässä tutkituissa kudoksissa. Jos kriteereistä täyttyy vain yksi tai kaksi, ks. 62 kohta. Jos kaikki hyväksyttävyysperusteet täyttyvät, testikemikaalia pidetään selvästi negatiivisena, jos
Tällöin katsotaan, että testikemikaali ei kykene aiheuttamaan DNA-säikeiden katkeamista tässä testijärjestelmässä tutkituissa kudoksissa. Selvästi positiivista tai negatiivista vastetta ei tarvitse vahvistaa. Jos vaste ei ole selvästi negatiivinen eikä selvästi positiivinen (eli jos kaikki 59 tai 60 kohdassa luetellut perusteet eivät täyty), tuloksen biologisen merkityksellisyyden määrittämiseksi asiantuntijan pitäisi arvioida tietoja ja/tai pitäisi tehdä lisätutkimuksia, jos se on tieteellisesti perusteltua. Ylimääräisten solujen arvioinnista (tarvittaessa) tai kokeen toistamisesta mahdollisesti optimoiduissa olosuhteissa (esimerkiksi annosväli, muut annostelureitit, muut näytteenottoajat tai muut kudokset) voisi olla hyötyä. Päätelmää positiivisuudesta tai negatiivisuudesta ei joissain erittäin harvoissa tapauksissa voida tehdä tietojen pohjalta edes lisätutkimusten jälkeen. Niitä pidetään tästä syystä epäselvinä tapauksina. Positiivisen tai epäselvän tuloksen biologisen merkityksellisyyden arviointi vaatii tietoa sytotoksisuudesta kohdekudoksessa (ks. 54–55 kohta). Kun sytotoksisuudesta on selvää näyttöä ja havainnot ovat positiivisia tai epäselviä, tutkimus on katsottava genotoksisuuden osalta epäselväksi, ellei saatavana ole riittävästi tietoa, joka tukee lopullisen johtopäätöksen tekemistä. Jos tutkimuksen tulos on negatiivinen ja toksisuudesta on merkkejä kaikilla testatuilla annoksilla, lisätutkimusten tekeminen ei-toksisilla annoksilla saattaa olla suositeltavaa. Testiraportti Testiraporttiin on sisällytettävä seuraavat tiedot:
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT Emäksinen yhden solun geelielektroforeesi : Herkkä tekniikka, jolla havaitaan primaarinen DNA-vaurio yksittäisessä solussa/tumassa. Kemikaali : Aine tai seos. Komeetta : Komeettaa muistuttava muoto, jonka nukleoidit saavat sen jälkeen, kun ne on altistettu yhdelle elektroforeesikentälle: tuma muodostaa ytimen, ja pyrstö muodostuu DNA:sta, joka kulkeutuu ulos tumasta sähkökentässä. Koostumukseltaan tuntematon tai vaihteleva aine (UVCB) : Koostumukseltaan tuntemattomat tai vaihtelevat aineet, kompleksit reaktiotuotteet tai biologiset materiaalit. Kriittinen muuttuja/parametri : Protokollan muuttuja, jossa tapahtuvalla pienellä muutoksella voi olla suuri vaikutus kokeen lopputulokseen. Kriittiset muuttujat voivat olla kudoskohtaisia. Kriittisiä muuttujia ei pidä muuttaa varsinkaan kokeessa ottamatta huomioon sitä, miten muutos muuttaa kokeessa saatavaa vastetta, niin kuin esimerkiksi positiivisten ja negatiivisten kontrollien suuruusluokka ja vaihtelu osoittavat. Testiraportissa pitäisi luetella kokeen aikana tehdyt kriittisten muuttujien muutokset tai muutoksia pitäisi verrata laboratorion standardiprotokollaan ja kullekin muutokselle pitäisi esittää perustelut. Pyrstön koko tai pyrstön DNA-pitoisuus (%) : Suhteutuu komeetan pyrstön kokoon, joka puolestaan suhteutuu kokonaiskokoon (ydin ja pyrstö). Kertoo DNA:n hajoamisasteesta ja ilmoitetaan prosentteina. Testikemikaali : Tällä testimenetelmällä testattu aine tai seos. Lisäys 2 YHDISTELYKOE SUKUPUOLIEROJEN MÄÄRITTÄMISEKSI IN VIVO -KOMEETTAKOKEESSA: Yhdistelykoe ja sen analysointi Tässä koemallissa testataan vähintään viisi urosta ja viisi naarasta kullakin pitoisuudella, minkä vuoksi mallissa käytetään vähintään 40:tä eläintä (20:tä urosta ja 20:tä naarasta, joihin lisätään asiaankuuluvat positiiviset kontrollit.) Tämä koe, joka on yksi yksinkertaisemmista yhdistelykokeista, vastaa kaksisuuntaista varianssianalyysia, jossa sukupuoli ja pitoisuus ovat päävaikutukset. Tietoja voidaan analysoida käyttäen monia vakiintuneita tilastollisia ohjelmistopaketteja, kuten SPSS, SAS, STATA, Genstat ja R. Analyysissa jaotellaan tietojen vaihtelu sukupuolten väliseksi vaihteluksi, pitoisuuksien väliseksi vaihteluksi sekä vaihteluksi, joka liittyy sukupuolten ja pitoisuuksien yhdysvaikutukseen. Kutakin perustetta testataan rinnakkaisten eläinten välisen vaihtelevuuden arvion perusteella samaa sukupuolta edustavissa eläinryhmissä, joille annetaan sama pitoisuus. Täydelliset tiedot menetelmästä annetaan useissa vakiintuneissa tilastollisissa oppikirjoissa (ks. viitteet) ja tilastopakettien tukitoiminnoissa. Analyysissä tutkitaan sen jälkeen sukupuolen x pitoisuuteen liittyvä yhdysvaikutustermi ANOVA-taulukossa (35). Merkitsevän yhdysvaikutustermin puuttuessa sukupuolten tai pitoisuustasojen yhdistetyt arvot ovat tasojen välisiä valideja tilastollisia testejä ANOVA-taulukon ryhmän sisäisen yhdistetyn vaihtelutekijän pohjalta. Analyysi jatkuu siten, että arvio pitoisuuksien välisestä vaihtelusta jaetaan kontrasteihin, joista saadaan testi vasteiden lineaarisille ja kvadraattisille kontrasteille eri pitoisuustasoilla. Kun sukupuolen x pitoisuuteen liittyvä yhdysvaikutus on merkittävä, tämä termi voidaan myös osittaa sukupuoleen x liittyviksi lineaarisiksi ja sukupuoleen x liittyviksi kvadraattisiksi interaktiokontrasteiksi. Näiden tekijöiden perusteella voidaan testata, onko sukupuolten pitoisuusvaste rinnakkainen vai onko sukupuolten välillä vaste-eroa. Arviota ryhmän sisäisestä yhdistetystä vaihtelusta voidaan käyttää keskiarvojen erotuksen parittaiseen testaukseen. Näitä vertailuja voitaisiin tehdä kummankin sukupuolen keskiarvojen välillä sekä eri pitoisuustasojen keskiarvojen välillä, kuten negatiivisten kontrollitasojen kanssa. Kun yhdysvaikutus on merkitsevä, vertailuja voitaisiin tehdä eri pitoisuuksia saaneen yhden sukupuolen keskiarvojen välillä tai samaa pitoisuutta saaneiden molempien sukupuolten keskiarvojen välillä. Viitteet Asiasta on laadittu monia tilastollisia oppikirjoja, joissa käsitellään yhdistelmäkokeiden – jotka vaihtelevat yksinkertaisimmista kaksifaktorianalyyseistä kokeiden suunnittelumetodologiassa käytettyihin monimutkaisimpiin analyyseihin – teoriaa, suunnittelua, metodologiaa, analyysia ja tulkintaa. Seuraava luettelo ei ole tyhjentävä. Joissain annetaan esimerkkejä vertailukelpoisista malleista ja joissakin tapauksissa annetaan koodit analyysien tekemiseen erilaisia ohjelmistoja hyödyntämällä.
Lisäys 3 KOKEEN NYKYISET RAJOITUKSET Tämänhetkisen tietotason vuoksi in vivo -komeettakokeeseen liittyy useita rajoituksia. Nämä rajoitukset odotettavasti vähenevät tai supistuvat, kun kokeen käytöstä saadaan lisää kokemusta ja sääntelyllä voidaan vastata turvallisuuskysymyksiin.
Viitteet
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
16) |
Korvataan C osassa oleva C.13 luku seuraavasti: ”C.13 Bioakkumulaatio kaloissa: Altistaminen veden ja ravinnon välityksellä JOHDANTO Tämä testimenetelmä (TM) vastaa OECD:n testiohjetta (TG) nro 305 (2012). Testimenetelmän tarkistamisella on kaksi päätavoitetta. Ensinnäkin tavoitteena on yhdistää ravinnon välityksellä tapahtuvaa bioakkumulaatiota (36) koskeva testi hyvin niukkaliukoisten aineiden mahdollisen bioakkumulaation määrittämiseen. Toiseksi tavoitteena on luoda testimenetelmä, jossa käytetään mahdollisuuksien mukaan vähemmän kaloja, mikä parantaa eläinten hyvinvointia ja on myös kustannustehokkaampaa. Konsolidoidun testimenetelmän C.13 (1) käyttöönoton jälkeen on testattu lukuisia aineita, joten sekä laboratorioilla että sääntelyviranomaisilla on nykyään huomattavasti enemmän kokemusta asiasta. Tämä on vakuuttanut eri tahot siitä, että testejä voidaan yksinkertaistaa tiettyjen perusteiden täyttyessä (ks. 88 kohta) ja että vaiheittainen lähestymistapa on mahdollinen. Kokemus on myös osoittanut, että erilaiset biologiset tekijät, kuten kasvu ja kalan rasvapitoisuus, voivat vaikuttaa merkittävästi testituloksiin, joten ne pitää tarvittaessa ottaa huomioon. Lisäksi on todettu, ettei hyvin niukkaliukoisten aineiden testaus ole välttämättä teknisesti mahdollista. Vesiympäristössä esiintyville hyvin niukkaliukoisille aineille altistuminen veden välityksellä ei myöskään välttämättä ole niin merkittävää kuin ravinnon välityksellä tapahtuva altistuminen. Näiden seikkojen perusteella on kehitetty testimenetelmä, jossa kalat altistetaan ravinnon välityksellä (ks. 7–14 kohta ja 97 kohdasta eteenpäin). Ravinnon välityksellä tehtävä altistustesti validoitiin (yhteistutkimuksessa) vuonna 2010 (51). Tärkeimpiä muutoksia ovat seuraavat:
Ennen bioakkumulaatiotestin tekemistä testiaineesta on tiedettävä seuraavat asiat:
Riippumatta valitusta altistusmenetelmästä tai otanta-aikataulusta tämä testimenetelmä kuvaa prosessia, jonka avulla voidaan määrittää eri aineiden bioakkumulaatiopotentiaali kaloissa. Vaikka läpivirtausolosuhteissa suoritettu testaus on paras, puolistaattiset olosuhteet ovat hyväksyttäviä tiettyjen validiteettiperusteiden täyttyessä (ks. 24 ja 113 kohta). Ravinnon välityksellä tehtävä altistus ei edellytä läpivirtausjärjestelmää, jotta testiaineen pitoisuus vedessä pysyisi samana, mutta sen avulla voidaan ylläpitää liuenneen hapen pitoisuus sopivalla tasolla sekä varmistaa veden puhtaus ja mitätöidä esimerkiksi erilaisten eritteiden vaikutukset. Tässä kuvatussa testimenetelmässä annetaan riittävän tarkat ohjeet testin suorittamiseksi valitusta testimenetelmästä riippumatta, mutta koejärjestelyjä on mahdollista mukauttaa yksittäisten laboratorioiden erityisolosuhteiden ja testiaineiden vaihtelevien ominaisuuksien huomioimiseksi. Vesialtistustesti soveltuu parhaiten sellaisille stabiileille orgaanisille aineille, joiden log K OW -arvo on 1,5–6,0 (13), mutta sitä voidaan käyttää myös erittäin hydrofobisten aineiden (joiden log K OW on yli 6,0) testaamisessa, jos on mahdollista osoittaa, että testiaine on kokonaan liuennut ja sen pitoisuus vedessä on vakaa. Jos testiaineen vakaata pitoisuutta vedessä ei voida osoittaa, vesitutkimus ei ole hyvä menetelmä. Tällöin ainetta on testattava kaloissa ravinnon välityksellä (vaikkakin ravintoaltistustestin tulosten tulkinta ja käyttö saattavat riippua sovellettavasta säädöskehyksestä). Orgaanisilla aineilla, joiden log K OW on noin 9,0, biokertyvyystekijä (BCF, josta käytetään joskus myös tunnusta K B), biokertyvyystekijää voidaan arvioida alustavasti Bintein et al. -yhtälön avulla (14). Erittäin hydrofobisilla aineilla biokertyvyystekijän alustavassa arviossa saatu arvo voi olla korkeampi kuin laboratorio-olosuhteissa odotettu tasapainotilan biokertyvyystekijä (BCFSS). Näin on erityisesti silloin, kun alustavassa arviossa käytetään yksinkertaista lineaarista mallia. Bioakkumulaatiopotentiaalia kuvaavia muuttujia ovat muun muassa kertymävakio (k 1), poistumavakiot (kuten k 2), tasapainotilan biokertyvyystekijä (BCFSS), kineettinen biokertyvyystekijä (BCFK) ja ravinnon biomagnifikaatiokerroin (BMF) (38). Radioaktiivisten merkkiaineiden käyttö saattaa helpottaa vesi-, ravinto- ja kalanäytteiden analysointia, ja niitä voi käyttää sen arvioimiseksi, onko metaboliittien tunnistaminen ja kvantifiointi tarpeen. Jos mitataan vain radioaktiivisten jäämien kokonaismäärä (esim. polttamalla tai kudoksiin liuottamalla), BCF tai BMF perustuu perusaineen kokonaismäärään, mahdollisesti jäljellä oleviin metaboliitteihin sekä assimiloituneeseen hiileen. Radioaktiivisten jäämien kokonaismäärään perustuva BCF- tai BMF-arvo ei siis ole välttämättä suoraan verrattavissa siihen BCF:ään tai BMF:ään, joka on johdettu pelkästään perusaineen spesifisestä kemiallisesta analyysistä. Erilaisia erotusmenetelmiä, kuten TLC, HPLC GC (39), voidaan käyttää ennen analyysia radioaktiivisia merkkiaineita soveltavissa tutkimuksissa perusaineeseen perustuvan BCF:n tai BMF:n määrittämiseksi. Erotustekniikoita käytettäessä on tunnistettava ja kvantifioitava perusaine ja merkitykselliset metaboliitit (40) (ks. 65 kohta), jos BCF tai BMF on tarkoitus määrittää kalojen perusainepitoisuuden perusteella radioaktiivisten jäämien kokonaismäärän sijasta. Kalojen aineenvaihduntaa koskeva tutkimus tai in vivo -distribuutiotesti on myös mahdollista liittää bioakkumulaatiotutkimukseen analysoimalla ja tunnistamalla kudoksissa esiintyvät jäämät. Mahdollista metaboloitumista voidaan ennustaa tarkoitukseen soveltuvilla työkaluilla (kuten OECD:n QSAR-työkalupakki (15) sekä alkuperäisvalmisteita koskevat QSAR-ohjelmat). Siitä, tehdäänkö altistustesti veden vai ravinnon välityksellä, pitäisi päättää 3 kohdassa kuvattujen tekijöiden sekä sovellettavan säädöskehyksen perusteella. Esimerkiksi aineilla, joiden log K OW -arvo on korkea mutta joiden vesiliukoisuus on kuitenkin arvioitavissa käytettävissä olevien analyysitekniikoiden herkkyyden ansiosta, pitäisi ensisijaisesti valita vesialtistustesti. On kuitenkin mahdollista, etteivät vesiliukoisuutta koskevat tiedot ole hydrofobisilla aineilla lopullisia. Näin ollen ennen testimenetelmän valitsemista pitäisi selvittää, onko mahdollista valmistaa vakaita ja mitattavissa olevia liuenneita vesipitoisuuksia (stabiilit emulsiot eivät ole sallittuja), joita voidaan käyttää veden välityksellä tehtävässä altistustutkimuksessa (16). Käytettävästä menetelmästä ei ole mahdollista antaa tarkkoja ohjeita vesiliukoisuuden ja oktanoli-vesi-jakaantumiskertoimen raja-arvojen perusteella, koska muut tekijät (kuten analyysitekniikat, hajoaminen ja imeytyminen) voivat vaikuttaa merkittävästi menetelmän soveltuvuuteen edellä esitetyistä syistä. Log K OW -arvon ollessa yli 5 ja vesiliukoisuuden alle ~0,01–0,1 mg/l aineen testaus vesialtistuksella voi olla hankalampaa. Testimenetelmän valintaan mahdollisesti vaikuttavat muut tekijät on myös otettava huomioon. Niitä ovat esimerkiksi aineen mahdollinen imeytyminen testiastioihin ja -laitteisiin ja aineen stabiilius vesiliuoksessa verrattuna sen stabiiliuteen kalan ravinnossa (17) (18). Tietoa vastaavista käytännön seikoista saattaa löytyä aiemmin tehdyistä vesitutkimuksista. Lisätietoa bioakkumulaatiotutkimusten tehokkuuden arvioinnista löytyy aihetta käsittelevästä kirjallisuudesta (esim. (19)). Tätä menetelmää suositaan testiaineen bioakkumulaatiopotentiaalin määrittämisessä aineilla, joilla liukoisuus tai vesipitoisuuden ylläpitäminen ja pitoisuuksien analysointi ei hankaloita vesialtistusmenetelmän toteutusta. Joka tapauksessa olisi varmistettava, että vesialtistuksessa käytettävät pitoisuudet vastaavat väliaineen vesiliukoisuusaluetta. Liuenneiden testiaineiden pitoisuuksien ylläpitämiseksi stabiileina voidaan käyttää eri menetelmiä, kuten kantaliuosten tai passiivisten annostelujärjestelmien käyttöä (esimerkiksi kolonnieluutiomenetelmä), kunhan voidaan osoittaa, että pitoisuudet voidaan pitää stabiileina eivätkä testiaineet muutu kohdassa 27 annettuihin suosituksiin nähden. Erittäin hydrofobisilla aineilla (log K OW > 5 ja liukoisuus alle ~ 0,01–0,1 mg/l) testaaminen vesialtistuksessa voi olla hankalampaa. Ongelmia saattaa seurata siitä, ettei vesipitoisuutta voida ylläpitää riittävän vakiona (esimerkiksi siksi, että aine imeytyy altistussäiliöiden lasiin tai kertyy kaloihin nopeasti) tai käytettävien vesipitoisuuksien taso on yhtä alhainen tai alhaisempi kuin kvantifioinnin analysointiraja (41). Tällaisilla erittäin hydrofobisilla aineilla on suositeltavaa käyttää ravinnon välityksellä tehtävää testiä edellyttäen, että testissä noudatetaan sovellettavaa säädöskehystä ja huomioidaan riskinarviointiin liittyvät tarpeet. Pinta-aktiivisilla aineilla on arvioitava, voidaanko biokertyvyys testata vedessä ottaen huomioon aineen ominaisuudet. Jos se ei ole mahdollista, ravinnon välityksellä tehtävä tutkimus on todennäköisemmin parempi vaihtoehto Pinta-aktiiviset aineet ovat aineita, jotka alentavat kahden nesteen välistä rajapintajännitystä. Ne ovat luonteeltaan amfifiilisia (eli niissä on sekä hydrofiilinen että hydrofobinen osa), minkä takia ne kertyvät erilaisiin rajapintoihin, kuten veden ja ilman väliseen rajapintaan, veden ja ravinnon väliseen rajapintaan sekä lasiseinämiin. Tästä johtuen niiden vesipitoisuutta ei voida määrittää. Ravinnon välityksellä tehtävässä testissä voidaan kiertää osa altistukseen liittyvistä näkökohdista, kun on kyse monimutkaisista seoksista, joiden ainesosat liukenevat veteen eri tavoin. Tällöin vertailtavissa oleva altistuminen kaikille seoksen ainesosille on todennäköisempää kuin veden välityksellä tehtävässä menetelmässä (ks. (20)). On huomattava, että ravinnon välityksellä tehtävässä testissä saadaan ennemminkin ravinnon biomagnifikaatiokerroin (BMF) kuin biokertyvyystekijä (BCF) (42). Kineettinen biokertyvyystekijä (BCFK) voidaan arvioida erilaisin menetelmin ravinnon välityksellä tehtävässä tutkimuksessa saatujen tietojen perusteella (kuten esitetään liitteessä 8), mutta niitä on käytettävä varovaisesti. Yleensä kyseisillä menetelmillä voidaan selvittää ensimmäisen asteen kinetiikka ja ne soveltuvat vain tietyille ainesosaryhmille. On epätodennäköistä, että niitä voitaisiin soveltaa pinta-aktiivisiin aineisiin (ks. 12 kohta). Minimoitua vesialtistustestiä, jossa eläinten ja/tai resurssien määrä pidetään pienempänä vähentämällä näytteenottopisteiden määrää (ks. 83 kohta ja siitä eteenpäin), pitäisi käyttää vain sellaisilla aineilla, joilla on syytä olettaa, että kertymä ja poistuma noudattavat suurin piirtein ensimmäisen asteen kinetiikkaa (eli kyse on yleensä ionisoitumattomista orgaanisista aineista, ks. 88 kohta). C.13 – I: Biokertyvyyden testaaminen kaloilla vesialtistuksessa TESTIN PERIAATE Testissä on kaksi vaihetta: altistusvaihe (kertymävaihe) ja altistuksen jälkeinen vaihe (poistumavaihe). Kertymävaiheen aikana ryhmä tietyn kalalajin yksilöitä altistetaan testiaineelle yhdessä tai useammassa valitussa pitoisuudessa testiaineen ominaisuuksista riippuen (ks. 49 kohta). Kalat siirretään tämän jälkeen poistumavaihetta varten väliaineeseen, jossa ei ole testiainetta. Kokeessa on aina oltava poistumavaihe, paitsi jos aineen kertyminen kertymisvaiheen aikana on mitättömän pieni. Testiaineen pitoisuutta kalassa tai kalan pinnalla (tai sen tietyssä kudoksessa) seurataan testin molempien vaiheiden aikana. Altistusryhmän lisäksi kalojen vertailuryhmää pidetään samanlaisissa olosuhteissa (mutta ilman testiainetta), jotta biokertyvyyskokeessa mahdollisesti havaittavia haitallisia vaikutuksia voidaan verrata vertailukelpoiseen vertailuryhmään ja saadaan testiaineen taustapitoisuudet (43). Vesialtistuksessa kertymävaihe kestää tavallisesti 28 vuorokautta. Kertymävaiheen kestoa voidaan tarvittaessa pidentää (ks. 18 kohta) tai sitä voidaan lyhentää, jos ilmenee, että tasapainotila on saavutettu nopeammin (ks. lisäys 1, määritelmät ja yksiköt). Kertymävaiheen kestoa ja tasapainotilan saavuttamiseen tarvittavaa aikaa voidaan ennustaa liitteessä 5 esitettyjen yhtälöiden avulla. Poistumavaihe alkaa, kun kaloja ei enää altisteta testiaineelle ja ne siirretään puhtaaseen astiaan samaan väliaineeseen, jossa ei kuitenkaan ole testiainetta. Biokertyvyystekijä lasketaan mahdollisuuksien mukaan sekä kalassa olevan pitoisuuden (C f) ja vedessä olevan pitoisuuden suhteena (C w) tasapainotilassa (BCFSS; ks. lisäys 1, määritelmä) että kineettisenä biokertyvyystekijänä (BCFK; ks. lisäys 1, määritelmät ja yksiköt), joka arvioidaan kertymävakion (k1) ja poistuma-vakion (k2) suhteena, kun oletetaan, että reaktio noudattaa ensimmäisen asteen kinetiikkaa (44). Jos tasapainotilaa ei saavuteta 28 vuorokauden kuluessa, voidaan joko laskea BCF käyttämällä kineettistä lähestymistapaa (ks. 38 kohta) tai pidentää kertymävaihetta. Jos tasapainotilan saavuttaminen edellyttää kohtuuttoman pitkää kertymävaihetta (ks. 37 ja 38 kohta, liite 5), on suositeltavampaa käyttää kineettistä lähestymistapaa. Erittäin hydrofobisilla aineilla pitäisi vaihtoehtoisesti harkita ravintoaltistustestin toteuttamista (45) edellyttäen, että sovellettava säädöskehys sallii tämän. Kertymävakio, poistumavakio (tai vakiot, jos käytetään monimutkaisempia malleja), biokertyvyystekijä (tasapainotilan ja/tai kineettinen) ja mahdollisuuksien mukaan näiden muuttujien luottamusvälit lasketaan mallista, joka parhaiten kuvaa testiaineen mitattuja pitoisuuksia kaloissa ja vedessä (ks. liite 5). Koska kalan massa kasvaa testin aikana, testiaineen pitoisuus kasvavassa kalassa laskee (niin kutsuttu kasvun aiheuttama liukeneminen). Näin ollen kineettinen BCF arvioidaan liian alhaiseksi, jollei sitä korjata kasvun mukaisesti (ks. 72 ja 73 kohta). BCF perustuu aineen kokonaispitoisuuteen kalassa (tässä huomioidaan kalan kokonaistuorepaino). Erityisistä syistä voidaan kuitenkin käyttää tiettyjä kudoksia tai elimiä (esim. lihas ja maksa), jos kala on riittävän suurikokoinen tai se voidaan jakaa syötävään (filee) ja syömäkelvottomaan (sisälmykset) osaan. Koska monien orgaanisten aineiden biokertyvyyspotentiaalin ja hydrofobisuuden välillä on selvä suhde, myös testattavan kalan rasvapitoisuuden ja kyseisten aineiden havaitun biokertyvyyden välillä on vastaava suhde. Jotta tämän muuttujan merkitystä testituloksissa voitaisiin pienentää aineilla, joiden lipofiilisyys on korkea (joiden log K OW > 3), biokertyvyys pitäisi ilmaista normalisoituna viiden prosentin rasvapitoisuuden mukaisesti (kalan kokonaistuorepainoon verrattuna) suoraan tutkimuksesta johdetun biokertyvyyden ohella. Tämä on tarpeen, jotta eri aineita ja/tai testilajeja koskevia tuloksia voidaan verrata keskenään. Viiden prosentin rasvapitoisuutta on käytetty laajalti, koska se edustaa tässä testimenetelmässä yleisesti käytettävien kalojen keskimääräistä rasvapitoisuutta (21). TESTIAINEEN TIEDOT Johdannossa (3 kohta) mainittujen testiaineen ominaisuuksien lisäksi muita tarvittavia tietoja ovat aineen toksisuus testissä käytettävälle kalalajille, mieluiten asymptoottinen (ajasta riippumaton) LC50, ja/tai pitkäkestoisten kalakokeiden perusteella arvioitu toksisuus (esim. TM C.47 (22), TM C.15 (23) ja TM C.14 (24)). Testiliuoksissa ja biologisessa aineksessa olevan aineen kvantifioimiseksi pitäisi olla käytettävissä sopiva määritysmenetelmä, jonka tarkkuus, täsmällisyys ja herkkyys tunnetaan, sekä näytteen valmistusta ja säilyttämistä koskevat yksityiskohtaiset tiedot. Testiaineen kvantifiointiraja sekä vedessä että kalan kudoksissa pitäisi myös olla tiedossa. Jos testissä käytetään radioaktiivista merkkiainetta, sen pitäisi olla mahdollisimman puhdasta (mieluiten > 98 %). Lisäksi on tunnettava epäpuhtauksiin liittyvän radioaktiivisuuden prosenttiosuus. TESTIN VALIDITEETTI Testi on luotettava, jos seuraavat edellytykset täyttyvät:
VERTAILUAINEET Testimenettelyn tarkistamisessa (esimerkiksi silloin, kun laboratoriolla ei ole aiempaa kokemusta kyseisestä testistä tai testausolosuhteet ovat muuttuneet) on hyödyllistä käyttää vertailuaineita, joiden biokertyvyyspotentiaali tunnetaan ja joiden metaboloituminen tiedetään vähäiseksi. MENETELMÄN KUVAUS Laitteisto Laitteistossa – tai missään sen osissa – ei saisi käyttää materiaaleja, jotka voivat liueta, sorboitua tai uuttua ja vaikuttaa kaloihin haitallisesti. Testeissä voidaan käyttää tavallisia laatikon- tai lieriönmuotoisia säiliöitä, jotka on tehty kemiallisesti inertistä aineesta ja jotka ovat täyttönopeuden perusteella kooltaan sopivia (ks. 43 kohta). Pehmeää muoviletkua pitäisi käyttää mahdollisimman vähän. Ennemminkin pitäisi käyttää politetrafluorieteenistä, ruostumattomasta teräksestä ja/tai lasista valmistettua putkea/letkua. Kokemus on osoittanut, että testiaineilla, joilla on korkea imeytymiskerroin, kuten synteettisillä pyretroideilla, voi olla tarpeen käyttää silanoitua lasia. Tällöin välineet pitäisi hävittää käytön jälkeen. On suositeltavaa altistaa testijärjestelmät tutkimuksessa käytettävälle testiainepitoisuudelle niin kauan kuin on tarpeen sen osoittamiseksi, että altistuspitoisuus pysyy stabiilina, ennen kuin testiorganismit syötetään niihin. Vesi Testissä käytetään yleensä luonnon vettä, jonka on oltava pilaantumatonta ja laadultaan tasaista. Synteettinen vesi (eli demineralisoitu vesi, johon on lisätty tunnettu määrä tiettyjä ravinteita) voi kuitenkin varmistaa tasalaatuisuuden paremmin ajan kuluessa. Laimennusvesi, joka sekoitetaan testiaineen kanssa ennen sen syöttämistä testiastiaan (ks. 30 kohta), pitäisi olla niin hyvälaatuista, että valitut kalalajit elävät siinä totuttamisvaiheen ja testin ajan ilman, että niiden ulkonäössä tai käyttäytymisessä ilmenee mitään poikkeavaa. Olisi ihanteellista pystyä osoittamaan, että koelaji elää, kasvaa ja lisääntyy laimennusvedessä (esim. laboratoriokasvatuksessa tai koko sukupolven kierron käsittävässä toksisuustestissä). Laimennusvedestä on tiedettävä ainakin sen pH, kovuus, kiinteiden aineiden kokonaispitoisuus, orgaanisissa yhdisteissä olevan hiilen kokonaismäärä (TOC (47)) ja mieluiten myös ammonium-ioni- ja nitriittipitoisuus sekä emäksisyys ja merieliöiden osalta suolapitoisuus. Kalojen hyvinvoinnille tärkeitä tekijöitä ei tunneta täysin, mutta lisäyksessä 2 annetaan suositeltavat enimmäispitoisuudet useille makean ja meriveden testivesien muuttujille. Laimennusveden laadun on pysyttävä tasaisena testin ajan. Sen pH-arvo voi olla testin alkaessa 6,0–8,5, mutta vaihteluväli ei saa olla tietyn testin ajan suurempi kuin ± 0,5 pH-yksikköä. Sen varmistamiseksi, ettei laimennusvesi vaikuta liikaa testituloksiin (esimerkiksi kompleksoimalla testiainetta) tai vaikuta haitallisesti kalakannan vointiin, näytteitä olisi otettava analysointia varten säännöllisin väliajoin ja vähintään testin alussa ja lopussa. Raskasmetallit (esim. Cu, Pb, Zn, Hg, Cd ja Ni), tärkeimmät anionit ja kationit (esim. Ca2+, Mg2+, Na+, K+, Cl–, ja SO4 2–), torjunta-aineet (esim. orgaanista fosforia ja orgaanista klooria sisältävien torjunta-aineiden kokonaispitoisuudet), orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaispitoisuus ja suspendoituneet kiinteät aineet olisi määritettävä esimerkiksi kolmen kuukauden välein, jos laimennusveden laatu tiedetään suhteellisen vakioksi. Jos laimennusveden laadun on osoitettu pysyvän vakiona ainakin vuoden ajan, määrityksiä voidaan tehdä harvemmin (esimerkiksi kuuden kuukauden välein). Luonnosta peräisin olevien hiukkasten samoin kuin orgaanisen hiilen kokonaismäärän laimennusvedessä olisi oltava mahdollisimman alhainen, jotta testiaine ei absorboituisi orgaaniseen aineeseen, mikä saattaisi vähentää sen biologista hyötyosuutta ja johtaa samalla siihen, että BCF arvioitaisiin liian pieneksi. Suurin hyväksyttävä arvo on 5 mg/l hiukkasille (kuiva-aine, joka ei läpäise 0,45 μm:n suodatinta) ja 2 mg/l orgaanisen hiilen kokonaismäärälle (ks. lisäys 2). Laimennusvesi on tarvittaessa suodatettava ennen käyttöä. Testattavista kaloista (ulosteista) ja ruoanjätteistä peräisin olevan orgaanisen hiilen määrän pitäisi olla testivedessä mahdollisimman alhainen (ks. 46 kohta). Testiliuokset Testiaineesta tehdään kantaliuos, jonka pitoisuus on sopiva. Kantaliuos valmistetaan mieluiten joko sekoittamalla tai ravistelemalla testiaine laimennusveteen. Joissakin tapauksissa voi olla parempi käyttää kiinteän faasin desorptioannostelujärjestelmää. Liuottimien ja dispergointiaineiden (liuotusapuaineiden) käyttöä ei yleensä suositella (ks. (25)). Kyseisten aineiden käyttö voi kuitenkin joskus olla hyväksyttävää riittävän väkevän kantaliuoksen valmistamiseksi, mutta niiden käyttö pitää kaikin tavoin pyrkiä pitämään mahdollisimman vähäisenä eikä niiden kriittistä misellipitoisuutta pitäisi ylittää (tarvittavilta osin). Hyväksyttäviä liuottimia ovat asetoni, etanoli, metanoli, dimetyyliformamidi ja trietyleeniglykoli. Dispergointiaineista käytössä ovat olleet Tween 80, 0,01-prosenttinen metyyliselluloosa ja HCO-40. Lopullisen testiaineen liuotinpitoisuuden pitäisi olla sama kaikissa käsittelyissä (riippumatta testiaineen pitoisuudesta), eikä sen pitäisi ylittää kyseiselle liuottimille määritettyä toksisuuden kynnysarvoa testiolosuhteissa. Suurin sallittu pitoisuus on 100 mg/l (tai 0,1 ml/l). On epätodennäköistä, että liuottimen pitoisuus muuttaisi testiaineen liuennutta maksimipitoisuutta väliaineessa, kun se on 100 mg/l (25). Liuottimen (samoin kuin testiaineen) osuus orgaanisen hiilen kokonaismäärästä testivedessä on tunnettava. Orgaanisen hiilen pitoisuus testiastioissa ei saa missään testivaiheessa ylittää testiaineesta ja mahdollisesti käytetystä liuotusaineesta tai liuotinapuaineesta (48) peräisin olevaa pitoisuutta yli 10 milligrammalla litraa kohti (± 20 prosenttia). Orgaanisen aineksen pitoisuus voi vaikuttaa merkittävästi siihen, minkä verran testiainetta liukenee vapaasti kaloilla tehtävän läpivirtaustestin aikana. Tämä koskee etenkin erittäin lipofiilisia aineita. Kiinteäfaasiuuton (ks. 60 kohta) avulla voidaan saada tärkeää tietoa sitoutuneiden ja vapaasti liuenneiden yhdisteiden suhteesta. Viimeksi mainitun katsotaan osoittavan aineen biologisen hyötyosuuden. Testiaineen pitoisuuden pitäisi olla väliaineessa testiaineen liukoisuuden raja-arvoa alhaisempi riippumatta siitä, käytetäänkö testissä liuotinta tai liuotusapuainetta. Nopeasti biohajoavia liuottimia käytettäessä on oltava varovainen, koska ne voivat aiheuttaa läpivirtaustesteissä ongelmia bakteerikasvuston takia. Jos kantaliuosta ei voida valmistaa ilman liuotusapuainetta, on mietittävä, onko vesialtistustutkimus todella parempi vaihtoehto kuin ravinnon välityksellä tehtävää altistus. Läpivirtaustestissä on käytettävä järjestelmää (esim. annostelupumppua, laimenninta, kyllästävää järjestelmää), joka annostelee ja laimentaa jatkuvasti testiaineen kantaliuosta, tai kiinteän faasin desorptioannostelujärjestelmää testipitoisuuksien annostelemiseksi testikammioihin. Testikammioiden veden pitäisi vaihtua mielellään ainakin viisi kertaa vuorokaudessa. Läpivirtausmalli on paras, mutta jos sitä ei voida käyttää (jos se esimerkiksi vaikuttaa haitallisesti testiorganismeihin), voidaan käyttää puolistaattista järjestelmää, mikäli validiteettiperusteet täyttyvät (ks. 24 kohta). Kantaliuosten ja laimennusveden virtausnopeudet on tarkistettava sekä 48 tuntia ennen testiä että vähintään kerran päivässä testin aikana. Tämän tarkistuksen yhteydessä mitataan myös läpivirtausnopeus kaikissa testikammioissa ja varmistetaan, ettei se vaihtele yli 20:tä prosenttia yhdessä kammiossa tai kammioiden välillä. Lajin valinta Tärkeitä perusteita lajin valinnassa ovat se, että lajia on helposti saatavilla, se, että lajia voi saada sopivan kokoisina yksilöinä, sekä se, että lajia voidaan helposti ylläpitää laboratoriossa. Muita perusteita kalalajin valitsemiselle voivat olla virkistyskäyttö, kaupallinen tai ekologinen merkitys sekä vertailukelpoinen herkkyys, onnistunut käyttö aikaisemmin ym. Suositeltavat testilajit luetellaan lisäyksessä 3. Muita lajeja voidaan käyttää, mutta testiprosessia on mahdollisesti mukautettava sopivien testiolosuhteiden varmistamiseksi. Tällaisessa tapauksessa olisi selostettava syyt lajin ja koemenetelmän valitsemiseen. Kun käytetään pienempiä kalalajeja, tasapainotila saavutetaan yleensä nopeammin. Tällöin saatetaan kuitenkin tarvita enemmän kaloja (suurempi otanta), jotta rasvapitoisuus ja testiaineen pitoisuus kaloissa voitaisiin määrittää asianmukaisesti. On myös mahdollista, että erot nuorten ja vanhojen kalojen soluhengitystasossa ja aineenvaihdunnassa estävät eri testeissä ja eri lajeilla saatujen tulosten vertaamisen. On huomattava, että kalalajien testaaminen nopean kasvun vaiheessa (nuorena) voi vaikeuttaa testitulosten tulkintaa. Kalojen hoito (veden ja ravinnon välityksellä tehtävissä altistuksissa) Kalojen kantapopulaatiota pitäisi totuttaa veteen vähintään kahden viikon ajan (ks. 28 kohta) testauslämpötilassa ja kaloja ruokkia riittävästi (ks. 45 kohta). Sekä veden että ravinnon pitäisi olla samantyyppistä kuin varsinaisessa testissä. Kuolleiden kalojen määrä kirjataan 48 tunnin alkutotuttelun jälkeen, jonka jälkeen noudatetaan seuraavia periaatteita:
Testeissä käytettävissä kaloissa ei saa olla havaittavia tauteja tai poikkeavuuksia. Kuolleet kalat on hävitettävä. Kaloille ei saisi antaa mitään hoitoa sairauden takia testiä edeltävien kahden viikon aikana eikä testin aikana. TESTIN SUORITTAMINEN Alustava testi Voi olla hyvä tehdä esikoe lopullisen testin olosuhteiden optimoimiseksi. Näin voidaan esimerkiksi valita testiaineen pitoisuus (pitoisuudet), määrittää kertymä- ja poistumavaiheen kesto tai arvioida, miten kattava testin pitäisi olla. Alustava testi on suunniteltava siten, että se antaa tarvittavat tiedot. Näin voidaan arvioida, riittääkö minimitesti BCF:n määrittämiseksi vai tarvitaanko kattava tutkimus (ks. 83–95 kohta, joissa käsitellään minimoitua testiä). Altistusolosuhteet Kertymävaiheen kesto Kertymävaiheen kesto voidaan ennustaa käytännön kokemuksen perusteella (esim. rakenteeltaan samankaltaisia aineita koskevien aiempien tutkimusten tai akkumulaatiotutkimusten perusteella) tai tietyistä kokemusperäisistä suhteista hyödyntämällä joko testiaineen vesiliukoisuutta tai oktanoli-vesi-jakaantumiskerrointa koskevia tietoja (edellyttäen, että kertymä noudattaa ensimmäisen asteen kinetiikkaa, ks. liite 5). Kertymävaiheen on kestettävä 28 vuorokautta, paitsi jos voidaan osoittaa, että tasapainotila on saavutettu aikaisemmin (ks. lisäys 1, määritelmät ja yksiköt). Tasapainotila saavutetaan kalassa esiintyvän testiaineen määrää (C t) ajan funktiona esittävässä käyrässä silloin, kun käyrä on aika-akselin suuntainen, kolme peräkkäistä vähintään kahden vuorokauden välein otetuista näytteistä tehtyä C t-määritystä ovat ± 20 prosenttia toisiinsa verrattuna eikä C t ole kasvanut merkittävästi ensimmäisen ja viimeisen perättäisen määrityksen välisenä aikana. Yhdistettyjä näytteitä määritettäessä vaaditaan vähintään neljä perättäistä määritystä. Kun testataan aineita, joiden kertyminen kudoksiin tapahtuu hitaasti, välit voivat olla pikemminkin seitsemän vuorokautta. Jos tasapainotilaa ei ole saavutettu 28 vuorokauden kuluessa, voidaan joko laskea BCF soveltamalla kineettistä lähestymistapaa, joka ei edellytä tasapainotilan saavuttamista, tai jatkaa kertymäaikaa ja tehdä mittauksia niin kauan, että tasapainotila saavutetaan, tai kun on kulunut 60 vuorokautta riippuen siitä, kumpi tapahtuu aiemmin. Testiaineen pitoisuuden on myös oltava kalassa riittävän korkea kertymävaiheen lopussa, jotta k 2-arvo voidaan arvioida luotettavasti poistumavaiheessa. Jos kertymä ei ole 28 vuorokauden jälkeen merkittävä, testi voidaan lopettaa. Poistumavaiheen kesto Ensimmäisen asteen kinetiikkaa noudattavilla aineilla puolet kertymävaiheesta riittää tavallisesti siihen, että kalaan kertynyt aine vähenee riittävästi (esim. 95 prosenttia) (ks. liite 5, arviointia koskeva selitys). Jos 95 prosentin vähenemiseen pääseminen kestää erittäin kauan, esimerkiksi yli kaksi kertaa kertymävaiheen normaalin kestoajan (eli yli 56 vuorokautta), voidaan hyväksyä lyhyempi aika (esim. kunnes testiaineen pitoisuus on alle 10 prosenttia tasapainotilasta). Jos aineen kertymä ja poistuma ovat monimutkaisempia kuin yhden osaston mallissa, jota voidaan kuvata ensimmäisen asteen kinetiikalla, poistumavaiheen on kuitenkin mahdollisesti oltava pidempi. Jos aineen kinetiikan havaitaan ja/tai ennakoidaan olevan monimutkaisempi, on suositeltavaa pyytää neuvoa biostatistiikan ja/tai farmakokinetiikan asiantuntijalta testiolosuhteiden soveltuvuuden varmistamiseksi. Koska poistumavaihe pitenee, näytteenotossa käytettävien kalojen määrä voi aiheuttaa rajoituksia ja kalojen väliset kasvuerot saattavat vaikuttaa tuloksiin. Vaiheen kestoon vaikuttaa myös se, kuinka kauan testiaineen pitoisuus kalassa pysyy kvantifioinnin analyysirajan yläpuolella. Testikalojen määrä Kalojen lukumäärä jokaista testipitoisuutta kohti valitaan siten, että käytettävissä on vähintään neljä kalaa näytteenottopistettä kohti. Kalanäytteet voidaan yhdistää, jos yksittäisten kalojen analysointi ei ole mahdollista. Jos käyrän sovitus (ja siitä johdetut muuttujat) on tarkoitus tehdä erittäin tarkasti tai edellytetään metabolismitutkimusten tekemistä (esimerkiksi metaboliittien ja perusaineen erottelemiseksi radioaktiivisia merkkiaineita käytettäessä), kaloja on oltava enemmän kutakin näytteenottopistettä kohti. Rasvapitoisuus olisi määritettävä samasta biologisesta aineksesta, jota käytetään testiaineen pitoisuuden määrittämisessä. Jos tämä ei ole mahdollista, kaloja tarvitaan mahdollisesti enemmän (ks. 56 ja 57 kohta). Jos käytetään täysikasvuisia (sukukypsiä) kaloja, kalojen ei pitäisi olla ennen testiä tai sen aikana kutuvaiheessa tai hiljattain kutenut. Lisäksi on ilmoitettava, käytetäänkö testissä koiraita, naaraita vai molempia. Jos käytetään molempia, sukupuolten väliset erot kasvussa rasvapitoisuudessa on kirjattava ei-merkitseviksi ennen altistuksen aloittamista, etenkin jos etukäteen arvioidaan, että koiras- ja naaraskalojen näytteet on yhdistettävä sen varmistamiseksi, että aineen pitoisuudet ja/tai rasvapitoisuus voidaan havaita. Jokaiseen testiin on valittava samanpainoisia kaloja, jolloin pienimpien on painettava vähintään kaksi kolmasosaa suurimpien painosta. Kaikkien pitäisi olla samaa vuosiluokkaa ja peräisin samasta lähteestä. Koska paino ja ikä saattavat joskus vaikuttaa merkittävästi BCF-arvoihin (12), ne on kirjattava tarkasti. Osa näytekaloista on suositeltavaa punnita juuri ennen testin aloittamista keskipainon arvioimiseksi (ks. 61 kohta). Täyttö Vesimäärän pitäisi olla suuri suhteessa kalojen määrään, jotta testattavan yhdisteen pitoisuus vedessä laskee mahdollisimman vähän, kun kalat lisätään kammioon testin alussa, eikä liuenneen hapen pitoisuus ei laske. On tärkeää, ettei kaloja lisätä kammioon liian nopeasti. Joka tapauksessa kalojen täyttönopeudeksi suositellaan normaalisti 0,1-1,0 g kalaa (tuorepaino) litraa vettä kohti vuorokaudessa. Kalat voidaan lisätä veteen nopeammin, jos osoitetaan, että testiaineen pitoisuus voidaan pitää ± 20 prosentin rajoissa eikä liuenneen hapen pitoisuus laske alemmaksi kuin 60 prosenttia kyllästyneisyysarvosta (ks. 24 kohta). Sopivaa täyttötapaa valittaessa on otettava huomioon kalalajin luonnollinen elinympäristö. Esimerkiksi pohjakalat voivat vaatia samaa vesitilavuutta kohti suuremman pohjapinta-alan kuin pelagiset kalalajit. Ruokinta Totuttamisvaiheessa ja testin aikana kalojen ravinnossa noudatetaan ruokavaliota, jonka rasvapitoisuus ja valkuaisaineiden kokonaispitoisuus tunnetaan. Ravintoa annetaan riittävästi niin, että kalat pysyvät terveinä ja niiden paino ei pysy samana (pieni kasvu sallitaan). Totuttamisvaiheessa ja testin aikana kaloille päivittäin annettavan ravinnon määrä riippuu valitusta lajista, koeoloista ja ravinnon kaloripitoisuudesta (esimerkiksi kirjolohella päivittäinen määrä on noin 1–2 prosenttia kalan painosta). Ruokkimistaajuus määritetään sellaiseksi, etteivät kalat kasva nopeasti eikä niiden rasvapitoisuus kohoa merkittävästi. Jotta ruokkimistaajuus pysyisi samana, ravinnon määrä pitäisi laskea tarvittaessa uudelleen esimerkiksi kerran viikossa. Tässä laskutoimituksessa kussakin testikammiossa olevien kalojen paino voidaan arvioida viimeksi kyseisestä kammiosta näytteeksi otetun kalan painosta. Kammiossa olevia kaloja ei punnita. Syömättä jäänyt ruoka ja ulosteet olisi poistettava testikammioista päivittäin hieman (0,5–1 tuntia) ruokinnan jälkeen. Kammiot olisi pidettävä mahdollisimman puhtaina koko testin ajan, jotta orgaanisen aineksen pitoisuus pysyy mahdollisimman alhaisena (ks. 29 kohta), koska orgaaninen hiili saattaa vaikuttaa haitallisesti testiaineen biologiseen hyötyosuuteen (12). Koska monet rehut on valmistettu kalajauhoista, on varmistettava, ettei rehu vaikuta testituloksiin tai aiheuta haittavaikutuksia esimerkiksi sen takia, että se sisältää torjunta-aineita, raskasmetalleja ja/tai testiainetta (tai niiden jäämiä). Valo ja lämpötila Suositeltava valoisa aika on 12–16 tuntia. Lämpötilan pitäisi olla kalalajille sopiva (vaihtelu enintään ± 2 °C) (ks. lisäys 3). Valaistuksen tyyppi ja ominaisuudet on tunnettava. Testiaineen mahdollinen muuntuminen tutkimuksen säteilyolosuhteissa on otettava huomioon. Valaistusolosuhteiden olisi oltava asianmukaiset, ja kalojen altistumista epäluonnolliselle valolle on vältettävä. Joskus voi olla tarpeen suodattaa pois alle 290 nm:n UV-säteily. Testipitoisuudet Testi on alun perin suunniteltu polaarittomille orgaanisille aineille. Kyseisillä aineilla kalojen altistus yhdelle pitoisuudelle arvioidaan riittäväksi, koska pitoisuusvaikutuksia ei ole odotettavissa. Sovellettavassa säädöskehyksessä saatetaan kuitenkin edellyttää kahta pitoisuutta. Jos testataan kyseiseen tyyppiin kuulumattomia aineita tai tiedossa on viitteitä mahdollisesta pitoisuusriippuvuudesta, testi on suoritettava kahdella tai useammalla pitoisuudella. Jos testataan vain yhtä pitoisuutta, yhden pitoisuuden käyttö on perusteltava (ks. 79 kohta). Testatun pitoisuuden pitäisi myös olla niin alhainen kuin käytännön tai tekniikan puolesta on mahdollista (eli sen ei pidä olla lähellä liukoisuuden raja-arvoa). Joissakin tapauksissa voidaan ennakoida, että aineen biokertyvyys on riippuvainen vesipitoisuudesta (esimerkiksi metalleilla, joiden kertymistä kaloihin voidaan säännellä ainakin osittain). Tällaisissa tapauksissa on tarpeen testata vähintään kaksi, mutta mieluiten useampi sellainen pitoisuus (ks. 49 kohta), jotka ovat ympäristön kannalta merkityksellisiä. Myös aineilla, joilla testatun pitoisuuden on oltava käytännön syistä lähellä liukoisuuden raja-arvoa, suositellaan vähintään kahden pitoisuuden testaamista, koska siten voidaan saada käsitys altistuspitoisuuksien luotettavuudesta. Testipitoisuudet pitäisi valita siten, että testeihin sisällytetään sekä ympäristön kannalta realistinen pitoisuus että tehtävän arvioinnin kannalta merkityksellinen pitoisuus. Testiaineen pitoisuus pitäisi valita siten, että se on alhaisempi kuin krooninen vaikutustaso tai yhden prosentin aineen akuutista asymptoottisesta LC50-arvosta. Pitoisuuden on myös oltava ympäristön kannalta merkityksellinen ja suuruusluokaltaan vähintään yhden asteen korkeampi kuin aineen kvantifiointiraja vedessä kyseistä analyysimenetelmää käytettäessä. Korkein sallittu testipitoisuus voidaan myös määrittää jakamalla akuutti 96 tunnin LC50-arvo asianmukaisella akuutti/krooninen-suhteella (tarkoituksenmukaiset suhteet joillekin aineille ovat noin 3, mutta muutamassa tapauksessa yli 100). Jos käytetään toista pitoisuutta, sen eron edelliseen pitoisuuteen on oltava kymmenkertainen. Jos tämä ei ole mahdollista toksisuuskriteereiden takia (kyseiset perusteet rajoittavat korkeamman testipitoisuuden käyttöä) tai määritysrajan takia (kyseinen raja estää alhaisemman testipitoisuuden käytön), voidaan käyttää pienempää kerrointa kuin kymmenen. Tällöin pitäisi myös harkita radioaktiivisen testiaineen käyttöä (sen on oltava mahdollisimman puhdasta, mieluiten yli 98 prosenttista). On varmistettava, ettei yksikään käytetty pitoisuus alita testiaineen liukoisuusrajaa väliaineessa. Kontrollit Laimennusvesi tarkastetaan kerran ja tarvittaessa (ks. 30 ja 31 kohta) testisarjan lisäksi tehdään yksi liuotinkontrolli. Veden laatua koskevien mittausten taajuus Testin aikana on mitattava liuennut happi, TOC (orgaanisen hiilen kokonaismäärä), pH ja lämpötila kaikista testi- ja kontrolliastioista. Veden kokonaiskovuus ja suolapitoisuus (jos sillä on merkitystä) mitataan kontrolleista ja yhdestä astiasta. Jos testattavia pitoisuuksia on kaksi tai useampi, kyseiset muuttujat mitataan suuremmasta (tai suurimmasta) pitoisuudesta. Liuennut happi ja suolapitoisuus on mitattava (mikäli aiheellista) vähintään kolme kertaa kertymävaiheessa – sen alussa, keski- ja loppuvaiheessa – sekä kerran viikossa poistumavaiheen aikana. TOC on mitattava testin alussa (24 ja 48 tuntia ennen kertymävaiheen alkua), ennen kalojen lisäämistä astiaan ja vähintään kerran viikossa sekä kertymä- että poistumisvaiheen aikana. Lämpötila on mitattava ja kirjattava ylös joka päivä, pH kunkin vaiheen alussa ja lopussa sekä kovuus kerran testin aikana. Lämpötilaa olisi seurattava jatkuvasti vähintään yhdessä astiassa. Näytteenotto ja mittaukset kaloista ja vedestä Näytteenottoaikataulu Testiaineen pitoisuuden määrittämiseen käytetyistä testikammioista olisi otettava vesinäyte ennen kalojen lisäystä sekä kertymä- ja poistumisvaiheen aikana. Vesinäyte pitäisi ottaa ennen ruokintaa kalanäytteiden oton yhteydessä. Tiheämpi näytteenotto voi olla hyödyllistä sen varmistamiseksi, että pitoisuudet pysyvät stabiileina kalojen lisäämisen jälkeen. Kertymävaiheen aikana pitäisi määrittää testiaineen pitoisuudet sen tarkistamiseksi, että hyväksyttävyysperusteet täyttyvät (24 kohta). Jos poistumavaiheen alussa tehtävät vesinäyteanalyysit osoittavat, ettei testiainetta havaita, tätä voidaan käyttää perusteena sille, ettei testiaineen jäämiä mitata testi- ja kontrollivedestä poistumavaiheen loppuaikana. Kaloista pitäisi ottaa näyte ainakin viidesti kertymävaiheen aikana ja vähintään neljästi poistumavaiheen aikana testiaineen mittaamiseksi. Koska joskus voi olla vaikea laskea riittävän tarkkaa arviota BCF-arvosta tämän näytemäärän perusteella (erityisesti jos näyttää siltä, että kertymä ja poistuma noudattavat muuta kuin yksinkertaista ensimmäisen asteen kinetiikkaa), tiheämpi näytteenotto voi olla suositeltavaa molemmissa vaiheissa (ks. lisäys 4). Rasvapitoisuus pitäisi määrittää siitä biologisesta aineksesta, jota käytetään testiaineen pitoisuuden määrittämiseen, ainakin kertymävaiheen alussa ja lopussa sekä poistumavaiheen lopussa. Jos tämä ei ole mahdollista, pitäisi ottaa näyte vähintään kolmesta kalayksilöstä rasvapitoisuuden määrittämiseksi jokaisena kolmena ajankohtana. Kalojen määrä kussakin säiliössä kokeen alkaessa pitäisi määrittää tämän mukaisesti (49). Jos vertailukaloissa (eli kantapopulaation kaloissa) ei havaita merkittävää määrää testiainetta, vertailukaloista voidaan vaihtoehtoisesti määrittää ainoastaan rasvapitoisuus ja testiaineen pitoisuus (sekä siihen liittyvä kertymävakio ja BCF-arvot) voidaan korjata vertailuryhmän testin aikaisen rasvapitoisuuden mukaisesti (50). Kuolleista tai sairastuneista kaloista ei pitäisi määrittää testiaineen pitoisuutta eikä rasvapitoisuutta. Hyväksyttävästä näytteenottoaikataulusta on esimerkki lisäyksessä 4. Muunlaiset aikataulut voidaan laskea helposti käyttäen muita oletettuja K OW-arvoja 95 prosentin kertymään tarvittavan altistusajan laskemiseksi (ks. laskentaperusteet lisäyksessä 5). Näytteenottoa pitäisi jatkaa kertymävaiheessa tasapainotilan saavuttamiseen asti (ks. lisäys 1, määritelmät ja yksiköt) tai kun kertymävaihe päättyy (28 tai 60 vuorokauden kuluttua, ks. 37 ja 38 kohta). Ennen poistumavaiheen aloittamista kalat pitäisi siirtää puhtaisiin astioihin. Näytteenotto ja näytteiden valmistelu Vesinäytteet otetaan määritystä varten esimerkiksi lapolla inertin putken/letkun kautta testikammion keskivaiheilla olevasta kohdasta. Suodattamalla tai sentrifugoimalla ei aina pystytä erottamaan testiaineen biologisesti hyödyntämiskelvotonta osaa biologisesti hyödynnettävästä osasta. Jos käytetään erotustekniikkaa, valittu tekniikka on aina perusteltava tai validoitava testiraportissa biologiseen hyötyosuuteen liittyvien hankaluuksien takia (25). Erittäin hydrofobisilla aineilla (eli aineilla, joiden log K OW on > 5) (12) (26), jotka saattavat adsorboitua suodatusmatriisiin tai sentrifugointisäiliöihin, näytteitä ei pitäisi käsitellä edellä mainituilla tavoilla. Sen sijaan on huolehdittava siitä, että säiliöt pidetään mahdollisimman puhtaina (ks. 46 kohta), ja orgaanisen hiilen kokonaismäärää on seurattava sekä kertymä- että poistumavaiheessa (ks. 53 kohta). Biologisen hyötyosuuden pienenemiseen liittyvien mahdollisten ongelmien välttämiseksi heikosti liukenevien ja erittäin hydrofobisten aineiden näytteenotossa voidaan käyttää kiinteäfaasimikrouuttoa. Näytteenotossa käytetyt kalat pitäisi lopettaa välittömästi sopivinta ja inhimillisintä menetelmää käyttäen (kokonaisilla kaloilla tehtävissä kokeissa kalat pitäisi näytteenoton jälkeen vain huuhdella vedellä (ks. 28 kohta) ja kuivata taputtamalla). Kalat punnitaan ja niiltä mitataan kokonaispituus (51). Jokaisella näytteeksi otetulla kalalla mitattu paino ja pituus pitäisi liittää niissä määritettyyn ainepitoisuuteen (ja tarvittaessa myös rasvapitoisuuteen) esimerkiksi käyttämällä kustakin kalasta yksilöllistä tunnistetta. On suositeltavaa tehdä määritykset kaloista ja vedestä heti näytteenoton jälkeen, jotta ei tapahtuisi hajoamista tai muuta ainehävikkiä ja jotta voidaan laskea likimääräiset kertymä- ja poistumavakiot testin edetessä. Kun näytteet määritetään heti, voidaan myös nähdä nopeasti, milloin tasapainotila on saavutettu. Jos näytteitä ei voi määrittää heti, ne pitäisi säilyttää asianmukaisella tavalla. Ennen testin aloittamista on hankittava tietoja testiaineen oikeasta säilytystavasta, joka voi olla esimerkiksi pakastaminen, säilyttäminen 4 °C:ssa, uuttaminen jne. Säilytysaika pitää valita siten, ettei aineen laatu heikkene varastoinnin aikana. Analyysimenetelmän laatu Koska koko menetelmä riippuu olennaisesti testiaineen määritykseen käytettävän menetelmän tarkkuudesta, täsmällisyydestä ja herkkyydestä, on todettava kokeellisesti, että kyseisessä menetelmässä aineen määrityksen tarkkuus, täsmällisyys ja toistettavuus samoin kuin testiaineen saanto sekä vedestä että kaloista ovat tyydyttäviä. Tämä pitäisi tehdä alustavien testien yhteydessä. On myös tarkastettava, ettei testiainetta ole laimennukseen käytetyssä vedessä mitattavia määriä. Testissä määritetyt testiaineen pitoisuusarvot vedessä ja kaloissa on tarvittaessa korjattava saantoja ja kontrollien tausta-arvoja varten. Kala- ja vesinäytteitä pitäisi käsitellä koko ajan siten, että kontaminoituminen ja hävikki (joka voi johtua esimerkiksi adsorboitumisesta näytteenottolaitteistoon) ovat mahdollisimman pienet. Kalanäytteiden analysointi Jos testissä käytetään radioaktiivisia merkkiaineita, on mahdollista määrittää kokonaisradioaktiivisuus (ts. perusaine ja siitä syntyneet metaboliitit) tai näytteet voidaan puhdistaa siten, että perusaine on mahdollista määrittää erikseen. Jos BCF-arvo määritetään perusaineen perusteella, merkittävien metaboliittien ominaisuudet pitäisi määritellä ainakin kertymävaiheen lopussa (ks. 6 kohta). Merkittäviä metaboliitteja ovat ne, joiden osuus on ≥ 10 prosenttia kalan kudoksissa havaittavista kokonaisjäämistä, joiden osuus on ≥ 5 prosenttia kahdessa perättäisessä näytteenottopisteessä, joiden osuus kasvaa koko kertymävaiheen ajan tai jotka tiedetään myrkyllisiksi. Jos koko kalan BCF-arvo radioaktiivisten jäämien kokonaismääränä ilmaistuna on ≥ 500, voi olla suositeltavaa – ja tiettyihin luokkiin kuuluvien aineiden, kuten torjunta-aineiden tapauksessa erittäin suositeltavaa – tunnistaa ja kvantifioida merkitykselliset metaboliitit. Jotkut sääntelyviranomaiset myös edellyttävät kyseisten metaboliittien kvantifioimista. Jos kalan kudoksista tunnistettujen ja kvantifioitujen hajoamistuotteiden osuus on ≥ 10 prosenttia radioaktiivisten jäämien kokonaismäärästä, on suositeltavaa tunnistaa ja kvantifioida hajoamistuotteet myös testivedestä. Jos tämä ei ole mahdollista, syyt on selvitettävä testiraportissa. Testiaineen pitoisuus on tavallisesti määritettävä kustakin yksittäisestä punnitusta kalasta. Jos tämä ei ole mahdollista, näytteet voidaan yhdistää kullakin näytteenottokerralla, mutta näytteiden yhdistäminen rajoittaa kyseisiin tietoihin sovellettavia tilastomenettelyjä. Näin ollen testissä pitäisi varmistaa, että kalojen määrä vastaa haluttua yhdistämistä, tilastomenettelyä ja voimaa. Viitteitä (27) ja (28) voi käyttää johdantona olennaisiin yhdistämismenettelyihin. BCF pitäisi ilmoittaa normalisoituna viiden prosentin rasvapitoisuuden mukaisesti (kalan tuorepainoon verrattuna) suoraan tutkimuksesta johdettavan arvon lisäksi (ks. 21 kohta), paitsi jos voidaan esittää, ettei testiaine keräänny ensisijaisesti rasvoihin. Jos mahdollista, kalan rasvapitoisuus olisi määritettävä jokaisella näytteenottokerralla ja mieluiten samasta uutteesta, josta testiaine määritetään, koska rasvat täytyy usein poistaa uutteesta ennen kuin sitä voi käyttää kromatografisessa analyysissa. Testiaineiden analysointi edellyttää kuitenkin usein erityisiä uuttomenetelmiä, jotka saattavat olla ristiriidassa rasvapitoisuuden määrittämiseen käytettävien testimenetelmien kanssa. Tässä tapauksessa (niin kauan kuin käytettävissä ei ole sopivia non-destruktiivisia menetelmiä) kalojen rasvapitoisuuden määrittämisessä on suositeltavaa soveltaa erilaista strategiaa (ks. 56 kohta). Sopivia menetelmiä pitäisi käyttää rasvapitoisuuden määrittämiseksi (20). Kloroformi-metanoliuuttoa (29) voidaan suositella standardimenetelmänä (30), mutta vaihtoehtoisena menetelmänä suositellaan Smedesin menetelmää (31). Jälkimmäinen on uuttomenetelmänä yhtä tehokas, ja se on myös erittäin tarkka, siinä käytetään vähemmän myrkyllisiä orgaanisia liuottimia ja se on myös helppo toteuttaa. Muitakin tarkkuudeltaan suositeltuihin menetelmiin verrattavia menetelmiä voi käyttää, jos käyttö perustellaan asianmukaisesti. Käytetystä menetelmästä on tärkeää toimittaa yksityiskohtaiset tiedot. Kalojen kasvun mittaaminen Testin alussa on punnittava erikseen 5–10 kantapopulaation kalaa ja mitattava niiden kokonaispituus. Samoja kaloja voidaan käyttää rasvapitoisuuden määrittämiseen (ks. 56 kohta). Kunkin näytteenottokerran yhteydessä näytteiksi otetuilta testi- ja vertailuryhmien kaloilta on mitattava paino ja pituus ennen kemikaali- ja rasvapitoisuuden määrittämistä. Näytteiksi otettujen kalojen mittoja voidaan käyttää testi- ja kontrollisäiliöihin jäävien kalojen painon ja pituuden arvioinnissa (ks. 45 kohta). TIEDOT JA RAPORTOINTI Tulosten käsittely Testiaineen kertymäkäyrä saadaan esittämällä kalassa tai kalan pinnalla (tai määritellyissä kudoksissa) kertymävaiheen aikana olevan aineen pitoisuus ajan funktiona aritmeettisella asteikolla. Jos käyrä osoittaa tasapainotilaa (eli käyrä on suunnilleen asymptoottinen aika-akselin kanssa), tasapainotilan BCF (BCFSS) lasketaan seuraavan kaavan mukaisesti:
Kalan kasvu voi vaikuttaa C f-arvon kehitykseen (ks. 72 ja 73 kohta). Ajan kuluessa tapahtuva vaihtelu vaikuttaa altistuspitoisuuden keskiarvoon (Cw ). On odotettavissa, että aikapainotettu keskipitoisuus on bioakkumulaatiotutkimuksissa merkityksellisempi ja täsmällisempi siinäkin tapauksessa, että vaihtelu pysyy asianmukaisella hyväksyttävyysalueella (ks. 24 kohta). Aikapainotettu keskimääräinen pitoisuus vedessä (TWA) voidaan laskea siten kuin esitetään lisäyksen 5 kohdassa 1. Kineettinen biokertyvyystekijä (BCFK) pitäisi määrittää kahden ensimmäisen asteen kineettisen vakion suhteena (k 1/k 2). Vakiot k 1 ja k 2 sekä BCFK voidaan määrittää sovittamalla kertymä- ja poistumavaihe samanaikaisesti. Vakiot k 1 ja k 2 voidaan vaihtoehtoisesti määrittää erikseen (ks. kyseisten menetelmien kuvaukset ja vertailu lisäyksessä 5). Poistumavakio (k 2) voidaan joutua korjaamaan kasvun aiheuttaman liukenemisen huomioon ottamiseksi (ks. 72 ja 73 kohta). Jos kertymä- ja/tai poistumakäyrä ei selvästikään noudata ensimmäisen asteen kinetiikkaa, pitäisi käyttää monimutkaisempia malleja (ks. lisäyksessä 5 olevat viitteet ja pyydä neuvoa biostatistiikan ja/tai farmakokinetiikan asiantuntijoilta). Tiedot kalojen painosta ja pituudesta Yksittäisten kalojen tuorepainot ja kokonaispituudet kaikilla näytteenottoväleillä taulukoidaan erikseen sekä testi- että vertailuryhmässä kertymävaiheessa (koskee myös kantapopulaatiota kertymävaiheen alkaessa) sekä poistumavaiheessa. Kultakin näytteeksi otetulta kalalta mitattu paino ja pituus pitäisi liittää niissä määritettyyn kemikaalipitoisuuteen esimerkiksi käyttämällä kustakin kalasta yksilöllistä tunnistetta. Paino on paras kasvumittari kineettisten BCF-arvojen korjaamiseksi kasvun aiheuttaman liukenemisen mukaan (ks. 73 kohta ja lisäyksessä 5 esitetty menetelmä tietojen korjaamiseksi kasvun aiheuttaman liukenemisen mukaan). Kasvun aiheuttaman liukenemisen mukaan tehtävät korjaukset ja rasvapitoisuuden normalisointi Poistumavaiheessa tapahtuva kasvu voi alentaa kaloissa mitattua kemikaalipitoisuutta, minkä johdosta yleinen poistumavakio (k 2) on suurempi kuin pelkistä poistoprosesseista (esim. hengitys, metabolismi ja ulostaminen) johtuva poistumavakio. Kineettiset biokertyvyystekijät pitäisi korjata kasvun aiheuttaman liukenemisen mukaan. Kasvu vaikuttaa myös BCFSS-arvoon, mutta sen korjaamiseksi kasvun mukaan ei ole määritetty yleisesti hyväksyttyä menettelyä. Jos kasvu on merkittävää, pitäisi johtaa myös BCFK, joka korjataan kasvun mukaan (BCFKg), koska se voi olla biokertyvyystekijän mittana merkittävämpi. Testikalojen rasvapitoisuus (joka liitetään vahvasti hydrofobisten aineiden bioakkumulaatioon) voi käytännössä vaihdella sen verran, että se on normalisoitava kalan vakiorasvapitoisuuden (5 prosenttia tuorepainosta) mukaisesti, jotta sekä kineettinen että tasapainotilan biokertyvyystekijä voidaan esittää tarkoituksenmukaisesti, paitsi jos voidaan olettaa, ettei testiaine keräänny ensisijaisesti rasvaan (esimerkiksi jotkut perfluoratut aineet saattavat sitoutua proteiineihin). Näitä laskutoimituksia koskevia yhtälöitä ja esimerkkejä esitellään lisäyksessä 5. Kineettisen BCF:n korjaamiseksi kasvun aiheuttaman liukenemisen mukaan myös poistumavakiota pitäisi korjata kasvun mukaisesti. Kasvukorjattu poistumavakio (k 2g) lasketaan vähentämällä kasvuvakio (k g, joka on saatu punnitustiedoista) yleisestä poistumavakiosta (k 2). Tämän jälkeen lasketaan kasvukorjattu kineettinen biokertyvyystekijä jakamalla kertymävakio (k 1) kasvukorjatulla poistumavakiolla (k 2g) (ks. liite 5). Joissakin tapauksissa tämä lähestymistapa aiheuttaa hankaluuksia. Esimerkiksi silloin, kun testataan hyvin hitaasti poistuvia aineita nopeasti kasvavissa kaloissa, johdettu k 2g voi olla hyvin pieni, joten kyseisissä kahdessa johtamisessa käytetyssä vakiossa piilevä virhe muuttuu kriittiseksi. Joissakin tapauksissa arvioitu kg voi olla suurempi kuin k 2. On olemassa vaihtoehtoinen lähestymistapa, joka ei edellytä korjaamista kasvun aiheuttaman liukenemisen mukaan. Siinä käytetään testiaineen massaa koskevia poistumatietoja kalakohtaisesti (kokonainen kala perusteena) sen sijaan, että testiaineen massaa koskevat tiedot suhteutettaisiin kalan massayksikköä (pitoisuutta) koskeviin tietoihin. Tämä voidaan tehdä helposti, koska kyseisessä testimenetelmässä kudoksissa havaitut pitoisuudet pitäisi liittää yksittäisten kalojen painoon. Tätä koskevaa yksinkertaista menettelyä kuvataan lisäyksessä 5. On huomattava, että k 2 pitää ilmoittaa myös vaihtoehtoista lähestymistapaa sovellettaessa. Lisäksi pitäisi ilmoittaa kineettinen ja tasapainotilan biokertyvyystekijä kalojen viiden prosentin vakiorasvapitoisuuden (suhteessa tuorepainoon) mukaisesti, paitsi jos voidaan esittää, ettei testiaine keräänny ensisijaisesti rasvaan. Kaloissa mitattuja pitoisuuksia koskevat tiedot tai BCF normalisoidaan viiden prosentin rasvapitoisuuden ja todellisen (yksittäisen kalan) keskimääräisen rasvapitoisuuden (prosenttiosuus tuorepainosta) suhteen mukaisesti (ks. liite 5). Jos samasta kalasta on määritetty kemikaali- ja rasvapitoisuus, yksittäisen kalan normalisoitua rasvapitoisuutta pitäisi käyttää rasvapitoisuuden mukaan normalisoidun BCF:n laskemisessa. Jos vertailu- ja altistusryhmien kalojen kasvu on samanlaista, rasvapitoisuuden korjaamisessa voidaan vaihtoehtoisesti käyttää ainoastaan vertailukalojen rasvapitoisuutta (ks. 56 kohta). Rasvapitoisuuden mukaan normalisoidun BCF:n laskentamenetelmä kuvataan lisäyksessä 5. Tulosten tulkinta Tulosten tulkinnassa on oltava varovainen, jos testiliuoksista mitatut tulokset ovat lähellä analyysimenetelmän havaitsemisrajaa. Testi- ja vertailuryhmien kalojen keskimääräinen kasvu ei saisi periaatteessa erota merkittävästi, jotta voidaan sulkea pois toksisuus. Kummankin ryhmän kasvuvakioita tai kasvukäyriä pitäisi verrata tarkoitukseen sopivalla menetelmällä (52)). Jos kertymä- ja poistumakäyrät ovat selkeitä, biokertyvyystietoja voidaan pitää hyvälaatuisina. Eri vakioiden osalta χ2-sopivuustestin tulosten pitäisi osoittaa, että bioakkumulaatiomallin sopivuus on hyvä (eli mittavirheiden osuus on pieni (32)), jotta vakioita voitaisiin pitää luotettavina (ks. liite 5). Jos testissä käytetään useampaa kuin yhtä pitoisuutta, testipitoisuuksien välinen kertymä- ja poistumisvakioiden vaihtelu saa olla enintään 20 prosenttia (53). Jos näin ei ole, voidaan osoittaa pitoisuusriippuvuus. Jos kertymä-/poistumavakioissa havaitaan merkittäviä eroja käytettyjen testipitoisuuksien välillä, ne on kirjattava ja mahdollisuuksien mukaan myös selitettävä. BCF-arvojen 95 prosentin luotettavuustaso hyvin suunnitelluissa kokeissa on yleensä lähellä ± 20:tä prosenttia johdetusta BCF:stä. Jos testissä käytetään kahta tai useampaa pitoisuutta, molempien tai kaikkien pitoisuuksien tuloksia käytetään sen määrittämiseksi, ovatko tulokset johdonmukaisia ja riippuvatko ne pitoisuudesta. Jos testataan vain yksi pitoisuus eläinten ja/tai resurssien käytön vähentämiseksi, se on perusteltava. Saatu BCFSS on epäilyttävä, jos BCFK on huomattavasti sitä suurempi, koska tämä voi olla viite siitä, ettei tasapainotilaa ole saavutettu tai kasvun aiheuttamaa liukenemista ja poistumaprosesseja otettu huomioon. Jos BCFSS on hyvin paljon suurempi kuin BCFK, johdetut kertymä- ja poistumavakiot olisi tarkistettava mahdollisten virheiden varalta ja arvioitava uudelleen. Erilainen sovitusmenetelmä saattaisi helpottaa BCFK:n arvioimista (ks. liite 5). Testiraportti Kohdassa 3 tarkoitettujen testiaineen tietojen lisäksi testiraportti sisältää seuraavat tiedot:
C.13 – II: Minimoitu vesialtistustesti kaloilla JOHDANTO Sekä laboratoriot että sääntelyviranomaiset ovat saaneet koko ajan enemmän kokemusta kattavan testin tekemisestä ja tulkinnasta. Se on osoittanut, että – joitakin poikkeuksia lukuun ottamatta – kertymä- ja poistumavakioiden arvioimisessa voidaan soveltaa ensimmäisen asteen kinetiikkaa. Kertymä- ja poistumavakiot voidaan siis arvioida pitämällä näytteenottopisteiden määrä pienempänä ja kineettinen BCF on myös mahdollista johtaa. Vaihtoehtoisia tapoja järjestää BFC-tutkimukset alettiin tutkia alun perin sen takia, että voitaisiin kehittää kevyempi välivaiheen testi K OW-arvoon ja QSAReihin perustuvien arvioiden hylkäämiseksi tai vahvistamiseksi. Tällöin ei tarvitsisi tehdä kattavaa testiä useilla aineilla, mikä alentaisi kustannuksia ja testieläinten käyttöä, koska näytteenottotarve ja testisekvenssien määrä olisivat pienemmät. Aiempaa testimenetelmää noudatettiin pääpiirteittäin, jotta testitulokset voitaisiin yhdistää aiempien BCF-tietojen kanssa ja testin suorittaminen ja tietojen tulkinta olisi helpompaa. Tavoitteena oli kuitenkin mahdollistaa BCF:n arviointi riittävän tarkasti ja täsmällisesti riskinarviointia koskevien päätösten tekemiseksi. Monia kattavan testin näkökohtia voidaan soveltaa myös minimoidussa testissä. Sellaisia ovat esimerkiksi hyväksyttävyysperusteet (ks. 24 kohta) sekä testin keskeyttäminen, jos kertymävaiheen lopussa havaittava kertymä on mitättömän pieni (ks. 16 ja 38 kohta). Minimoituun testiin kelpaavia aineita ovat siihen yleiseen ryhmään kuuluvat aineet, jota varten tämä testimenetelmä on kehitetty, eli polaarittomat orgaaniset aineet (ks. 49 kohta). Jos on viitteitä siitä, että testattavaksi aiottu aine saattaisi käyttäytyä eri tavalla (eli poikkeaisi selvästi ensimmäisen asteen kinetiikasta), sääntelyä varten pitäisi tehdä kattava testi. Minimoidun testin kesto ei tavallisesti ole standardin BCF-testin kestoa lyhyempi, mutta kaloista otetaan vähemmän näytteitä (ks. perustelut lisäyksestä 6). Nopeasti poistuvien aineiden osalta poistumavaihetta voidaan kuitenkin lyhentää, millä vältetään se, että niiden pitoisuudet kaloissa laskevat havaitsemis- tai kvantifiointirajan alapuolelle ennen testin päättymistä. Minimoitu altistustesti, jossa kaloissa testataan vain yhtä pitoisuutta, voidaan käyttää kattavaa testiä koskevan tarpeen arvioimisessa. Jos sen tuloksena saatavat tiedot, joiden perusteella lasketaan nopeusvakiot ja BCF, ovat riittävän luotettavia (ks. 93 kohta), kattavaa testiä ei tarvitse tehdä, koska saatu BCF on kaukana lainsäädännössä asetetuista huolta aiheuttavista arvoista. Joissakin tapauksissa voi olla hyödyllistä tehdä minimoitu testi esikokeena useammalla kuin yhdellä pitoisuudella sen määrittämiseksi, riippuvatko jotakin ainetta koskevat BCF-arviot pitoisuudesta. Jos minimoidun testin perusteella arvioidut BCF-arvot osoittavat niiden riippuvan pitoisuudesta, on tehtävä kattava testi. Jos minimoidun testin perusteella arvioinut BCF-arvot eivät riipu pitoisuudesta mutta tuloksia ei pidetä lopullisina, sitä mahdollisesti seuraava kattava testi voidaan tehdä vain yhdellä pitoisuudella, jolloin testieläimiä tarvitaan vähemmän kuin kahdessa (tai useammassa) kattavassa testissä. Minimoituun testiin mahdollisesti kelpaavien aineiden pitäisi täyttää seuraavat edellytykset:
NÄYTTEENOTTOAIKATAULU MINIMOIDUSSA TUTKIMUSJÄRJESTELYSSÄ Kalanäytteiden otto Kalanäytteitä otetaan vain neljästä näytteenottopisteestä:
Vesinäytteiden otto Minimoidussa testissä vesinäytteet otetaan samalla tavalla kuin kattavassa tutkimuksessa (ks. 54 kohta) tai vähintään viisi kertaa säännöllisin väliajoin kertymävaiheessa ja viikoittain poistumavaiheessa. Testijärjestelyä koskevat muutokset Testiaineen ominaisuudet, pätevät QSAR-ennusteet ja tutkimuksen tarkoituksen huomioon ottaen tutkimusjärjestelyihin voidaan tehdä joitakin muutoksia:
Laskutoimitukset Tämän lähestymistavan perusteena on, että kattavassa testissä biokertyvyystekijä voidaan määrittää joko tasapainotilan biokertyvyystekijänä (BCFSS) vertaamalla toisiinsa testiaineen pitoisuutta kaloissa ja vedessä tai kineettisenä biokertyvyystekijänä (BCFK) laskemalla kertymävakion k 1 ja poistumavakion k 2 välinen suhde. BCFK on pätevä siinäkin tapauksessa, ettei aineen pitoisuudessa saavuteta kertymävaiheen aikana tasapainotilaa, mikäli kertymä ja poistuma noudattavat likimäärin ensimmäisen asteen kineettisiä prosesseja. Kertymä- ja poistumavakioiden arviointi edellyttää aina vähintään kahta datapistettä, joista toinen on kertymävaiheen päättymisajankohta (ja samalla poistumavaiheen alkamisajankohta) ja toinen poistumavaiheen päättymisajankohta (tai ajankohta, jona poistumavaihe on edennyt huomattavan pitkälle). Välinäytteiden ottaminen on suositeltavaa kertymä- ja poistumavaiheen kinetiikan tarkistamiseksi (57). Katso laskentamenetelmät liitteistä 5 ja 6. Tulosten tulkinta Testin hyväksyttävyyden ja saatujen tietojen arvon arviointi edellyttää, että poistumavaihe on pidempi kuin puoliintumisaika. Lisäksi BCFKm-arvoa (minimoidun testin perusteella johdettu kineettinen BCF) pitäisi verrata minimoituun BCFSS-arvoon. (Viimeksi mainittu on kertymävaiheen lopuksi laskettu BCFSS, mikäli oletuksena on, että tasapainotila on saavutettu. Tämä on vain oletus, koska näytteenottopisteiden määrä ei riitä vahvistamaan tietoa.) Jos BCFKm < minimoitu BCFSS, käytetään mieluummin minimoitua BCFSS-arvoa. Jos BCFKm on pienempi kuin 70 prosenttia minimoidusta BCFSS-arvosta, tulokset eivät ole päteviä ja on tehtävä kattava testi. Jos minimoidussa testissä määritetty BCFKm vastaa sääntelyn näkökulmasta huolestuttavaa arvoa, on tehtävä kattava testi. Jos tulos on kaukana lainsäädännössä annetuista huolestuttavista arvoista (selvästi niiden ylä- tai alapuolella), kattavaa testiä ei välttämättä tarvita tai kattavassa testissä voidaan käyttää vain yhtä pitoisuutta, jos sovellettavassa sääntelykehyksessä edellytetään kattavaa testiä. Jos kattava testi katsotaan tarpeelliseksi yhdellä pitoisuudella tehdyn minimoidun testin perusteella, se voidaan tehdä toisella pitoisuudella. Jos tulokset ovat johdonmukaisia, kattavaa testiä ei ole välttämätöntä tehdä erilaisella pitoisuudella, koska kyseisen aineen biokertyvyyden ei odoteta riippuvan pitoisuudesta. Jos minimoidussa testissä on käytetty kahta pitoisuutta eikä kertyvyys ole tulosten perusteella riippuvainen pitoisuudesta, kattavassa testissä voidaan testata vain yksi pitoisuus (ks. 87 kohta). Testiraportti Minimoitua testiä koskevan testiraportin pitäisi sisältää kaikki samat tiedot kuin kattavan testin seloste (ks. 81 kohta) lukuun ottamatta tietoja, joita ei ole mahdollista antaa (kuten käyrä, joka osoittaa tasapainotilan saavuttamiseen kuluneen ajan ja tasapainotilan biokertyvyystekijän; viimeksi mainitusta pitäisikin ilmoittaa minimoitu BCFss). Testiraportin pitäisi lisäksi sisältää perustelut minimoidun testin toteuttamiselle sekä sen perusteella saatu BCFKm-arvo. C.13 – III: Bioakkumulaation testaaminen kaloilla ravintoaltistuksessa JOHDANTO Tässä osiossa kuvattua menetelmää olisi käytettävä aineilla, joiden testauksessa ei voida soveltaa vesialtistusta (esimerkiksi siksi, ettei vesipitoisuutta voida pitää stabiilina ja mitattavana tai ettei kertymä ole riittävä 60 vuorokauden altistuksessa; katso edeltävät osiot, joissa käsitellään vesialtistusmenetelmää). On kuitenkin ymmärrettävä, että tämän testin lopputuloksena saadaan ennemminkin ravintoon liittyvä biomagnifikaatiokerroin (BMF) kuin biokertyvyystekijä (BCF) (58). Toukokuussa 2001 Madridissa pidetyssä SETAC Europen konferenssissa esiteltiin uusi menetelmä heikosti veteen liukenevien orgaanisten aineiden bioakkumulaation testaamiseksi (36). Menetelmä perustuu lukuisiin kirjallisuudessa käsiteltyihin bioakkumulaatiotutkimuksiin, joissa on käytetty testiainetta sisältävän rehun annostelumenetelmää (esim. (37)). Vuoden 2004 alkupuolella EU:n hitaasti hajoavia, biokertyviä ja myrkyllisiä aineita käsittelevälle työryhmälle esiteltiin pöytäkirjaluonnos (38), jossa käsiteltiin sellaisten vesiliukoisten orgaanisten aineiden bioakkumulaatiopotentiaalin määrittämistä, joiden biokertyvyyttä ei voitu selvittää standardilla vesialtistusmenetelmällä, sekä kyseisen pöytäkirjaluonnoksen valmisteluasiakirjat (39). Kyseisen menetelmän käyttöä perusteltiin lisäksi sillä, että altistuminen tällaisille niukkaliukoisille aineille (joiden log K OW >5) saattaa tapahtua ympäristössä pääosin ravinnon välityksellä (ks. (40) (41) (42) (43) (44)). Näin ollen joissakin julkaistuissa kemikaaliasetuksissa viitataan ravinnon välityksellä tehtäviin altistustesteihin (59). Pitäisi kuitenkin huomata, että tässä osiossa kuvatussa menetelmässä vesialtistusvaihe pyritään nimenomaan välttämään, minkä takia tämän testimenetelmän tuloksena saatavaa BMF-arvoa ei voida verrata suoraan kenttätutkimuksessa saatavaan BMF-arvoon (koska niissä voidaan yhdistää sekä veden että ravinnon välityksellä tapahtuva altistus). Tässä osiossa käsiteltävä testimenetelmä perustuu mainittuun pöytäkirjaan (38). Kyse on uudesta menetelmästä, joka ei ollut mukana testimenetelmän C.13 edellisessä versiossa. Tässä vaihtoehtoisessa testissä ravinnon välityksellä tapahtuvaa altistumista voidaan tutkia suoraan valvotuissa laboratorio-oloissa. Tutkijoiden pitäisi lukea tämän testimenetelmän kohdat 1–14, joissa annetaan tietoa siitä, milloin ravinnon välityksellä tehtävä altistus voi olla suositeltavampi kuin vesialtistus. Lisäksi annetaan tietoa erilaisista aineisiin liittyvistä näkökohdista, jotka pitäisi ottaa huomioon ennen testin aloittamista. Radioaktiivisten merkkiaineiden käyttöä voidaan harkita samoin perustein kuin vesialtistusmenetelmässä (ks. 6 ja 65 kohta). Ravinnon välityksellä tehtävässä altistuksessa voidaan testata kerralla useampaa kuin yhtä ainetta, jos tietyt edellytykset täyttyvät. Näitä edellytyksiä käsitellään tarkemmin 112 kohdassa. Yksinkertaisuuden nimissä tässä kuvataan kyseistä menetelmää vain yhtä ainetta testattaessa. Ravinnon välityksellä tehtävä altistus on monessa suhteessa samanlainen kuin vesialtistus, mutta altistumisreitti on luonnollisesti eri. Näin ollen tässä kuvattuun menetelmään pätevät monet samat huomiot kuin edellisessä osiossa kuvattuun vesialtistusmenetelmään. Edellisen osion olennaisiin kohtiin on pyritty viittaamaan niin paljon kuin mahdollista, mutta luettavuuden ja ymmärrettävyyden varmistamiseksi kaikkia päällekkäisyyksiä ei ole voitu välttää. TESTIN PERIAATE Testissä voidaan käyttää läpivirtausta tai puolistaattista menetelmää (ks. 4 kohta). Läpivirtausmenetelmää suositellaan, jotta vältettäisiin mahdollinen altistuminen veden välityksellä, joka johtuu testiainetta sisältävän rehun lisäämisestä tai ulosteista. Testi on kaksivaiheinen: kertymävaihe (kaloille annetaan testiainetta sisältävää rehua) ja poistumavaihe (annettava rehu on puhdasta ja käsittelemätöntä) (ks. 16 kohta). Kertymävaiheessa testiryhmän kaloja ruokitaan päivittäin tietyllä kaupallisesti saatavalla kalanruoalla, jonka koostumus tunnetaan ja johon on lisätty testiainetta. Ideaalitilanteessa kalat syövät kaiken annetun ruoan (ks. 141 kohta). Poistumavaiheessa kaloja ruokitaan puhtaalla ja käsittelemättömällä kaupallisesti saatavalla kalanruoalla. Kuten vesialtistuksessa, tarvittaessa voidaan käyttää useampaa kuin yhtä testiryhmää, joille annettava ruoka sisältää eri pitoisuuksia testiainetta, mutta erittäin hydrofobisia orgaanisia aineita testattaessa yksi testiryhmä on yleensä riittävä (ks. 49 ja 107 kohta). Jos käytetään puolistaattista menetelmää, kalat pitäisi siirtää uuteen liuokseen ja/tai uuteen testikammioon kertymävaiheen päätyttyä (siltä varalta, että väliaine ja/tai laitteisto on kontaminoitunut testiaineen uuttumisen seurauksena). Testiaineen pitoisuus kaloissa mitataan testin molempien vaiheiden aikana. Testiainetta sisältävää ruokaa saavan kalaryhmän (testiryhmä) lisäksi pidetään vertailuryhmää, jonka kalat elävät täysin samanlaisissa olosuhteissa ja saavat muuten samaa kaupallisesti saatavaa kalanruokaa, paitsi että vertailuryhmän ruokaan ei ole lisätty testiainetta. Vertailuryhmän ansiosta voidaan kvantifioida testiaineen taustapitoisuudet altistamattomilla kaloilla ja testiryhmässä (tai -ryhmissä) mahdollisesti havaittuja käsittelyyn liittyviä haittavaikutuksia voidaan verrata siihen (60). Lisäksi sen avulla voidaan verrata ryhmien kasvuvakioita sen tarkistamiseksi, että kalat ovat syöneet saman verran tarjottua ruokaa (mahdolliset erot ravinnon maittavuudessa pitäisi myös huomioida selitettäessä kasvuvakioiden välisiä eroja; ks. 138 kohta). On tärkeää, että testi- ja vertailuryhmiä ruokitaan sekä kertymä- että poistumavaiheessa ravintoarvoltaan samanlaisella ruoalla. Testimenetelmän kehittäjien saamien kokemusten perusteella kertymävaiheen riittävä kesto on yleensä 7–14 vuorokautta (38) (39). Tämän pituisena kertymävaiheen pitäisi pitää testin toteuttamiskustannukset mahdollisimman pieninä mutta varmistaa kuitenkin useimmilla aineilla riittävä altistuminen. Joissakin tapauksissa kertymävaihetta voidaan kuitenkin jatkaa (ks. 127 kohta). Kertymävaiheessa aineen pitoisuus kaloissa ei ehkä saavuta tasapainotilaa, joten tietojen käsittely ja tällä menetelmällä saatavat tulokset perustuvat tavallisesti kudosjäämien kineettisen analyysin tuloksiin. (Huom. tasapainotilan saavuttamiseen kuluvan ajan arvioinnissa voidaan soveltaa samoja yhtälöitä kuin vesialtistuksessa, ks. liite 5.) Poistumavaihe alkaa, kun kaloille aletaan antaa ruokaa, johon ei ole lisätty testiainetta. Se kestää yleensä enimmillään 28 vuorokautta tai niin kauan, ettei testiainetta enää voida kvantifioida kokonaisesta kalasta, riippuen siitä, kumpi tapahtuu aiemmin. Poistumavaihetta voidaan lyhentää tai jatkaa kauemmin kuin 28 vuorokautta eri vaiheissa mitattua kemikaalipitoisuutta koskevan muutoksen tai kalojen koon perusteella. Tässä menetelmässä on mahdollista määrittää testiaineelle ainekohtainen puoliintumisaika (t 1/2, poistumavakiosta k 2), assimilaatioteho (absorboituminen suolistossa; a), ravintoon liittyvä kineettinen biomagnifikaatiokerroin (BMFK), kasvukorjattu ravintoon liittyvä biomagnifikaatiokerroin (BMFKg) sekä rasvapitoisuuden mukaan korjattu (61) kineettinen biomagnifikaatiokerroin (BMFKL) (ja/tai kasvun ja rasvapitoisuuden mukaan korjattu kineettinen biomagnifikaatiokerroin, BMFKgL) kaloissa. Kuten vesialtistusmenetelmässä, kalan massan kasvaessa testin aikana testiaineen pitoisuus laskee kasvavassa kalassa. Näin ollen (kineettinen) BCF määritetään liian alhaiseksi, jollei sitä korjata kasvun mukaisesti (ks. 162 ja 163 kohta). Jos arvioidaan, että tasapainotila on saavutettu kertymävaiheessa, voidaan lisäksi laskea suuntaa-antava tasapainotilan BMF. Käytettävissä on menetelmiä, joiden avulla voidaan arvioida kineettinen biokertyvyystekijä (BCFK) ravintotutkimuksessa saatujen tietojen perusteella (esim. (44) (45) (46) (47) (48). Näiden menetelmien hyviä ja huonoja puolia käsitellään lisäyksessä 8. Testi suunniteltiin alun perin niukkaliukoisille polaarittomille orgaanisille aineille, jotka noudattavat likimääräisesti ensimmäisen asteen kertymä- ja poistumakinetiikkaa kaloissa. Jos testataan ainetta, joka ei noudata ensimmäisen asteen kertymä- ja poistumakinetiikkaa, pitäisi käyttää monimutkaisempia malleja (ks. lisäyksessä 5 olevat viitteet) ja pyytää neuvoa biostatistiikan ja/tai farmakokinetiikan asiantuntijoilta. BMF määritetään tavallisesti analysoimalla testiaine kokonaisesta kalasta (perusteena tuorepaino). Näytteitä voidaan ottaa myös yksittäisistä kudoksista (kuten lihaksista tai maksasta), jos se on tutkimuksen tavoitteiden kannalta olennaista ja kala on jaettu syötävään ja syömäkelvottomaan osaan (ks. 21 kohta). Lisäksi voidaan irrottaa ja analysoida erikseen ruoansulatuskanava, jotta voitaisiin määrittää näytteenottopisteissä mitattujen pitoisuuksien merkitys kokonaisessa kalassa kertymävaiheen lopussa ja juuri ennen poistumavaiheen alkua. Tämä voidaan tehdä myös osana massatasemenetelmää. Näytteeksi otettujen kokonaisten kalojen rasvapitoisuus pitäisi määrittää siten, että pitoisuudet voidaan korjata rasvapitoisuuden mukaisesti ja ottaen huomioon sekä ravinnon että kalan rasvapitoisuus (ks. 56 ja 57 kohta sekä liite 7). Näytteeksi otetut kalat pitäisi punnita ja saadut painot kirjata ja liittää kussakin yksilössä mitattuun kemikaalipitoisuuteen (testiraportissa voidaan esimerkiksi käyttää jokaisesta kalasta yksilöllistä tunnistetta). Tämä mahdollistaa testin aikana mahdollisesti tapahtuvan kasvun laskemisen. Kalan kokonaispituus pitäisi mitata aina kuin mahdollista (62). Painoa tarvitaan myös arvioitaessa BCF:ää ravintoaltistustestissä saatujen poistumatietojen perusteella. TESTIAINEEN TIEDOT Testiaineesta pitäisi olla saatavilla kohdissa 3 ja 22 luetellut tiedot. Analyyttista menetelmää testiaineen pitoisuuden mittaamiseksi vedessä ei yleensä tarvita. Sen sijaan pitoisuudet kalanruoassa ja kalojen kudoksissa on määritettävä riittävän herkillä menetelmillä. Tässä menetelmässä voidaan testata yhdellä kertaa useampia kuin yksi aine. Testiaineiden pitäisi kuitenkin olla yhteensopivia niin, etteivät ne vaikuta toisiinsa tai muuta toistensa kemiallista koostumusta, kun niitä lisätään kalanruokaan. Tavoitteena on varmistaa, etteivät yhdessä testattujen aineiden mittaustulokset eroaisi merkittävästi tuloksista, jotka saataisiin, jos aineet testattaisiin erikseen. Alustavassa analyysissa pitäisi osoittaa, että kukin aine voidaan erottaa useita testiaineita sisältävästä ravinnosta ja kaloista otetuista kudosnäytteistä siten, että i) saannot ovat suuria (esimerkiksi > 85 prosenttia nimellisarvosta) ja ii) ne ovat riittävän herkkiä testattavaksi. Yhdessä testattavien aineiden kokonaisannostuksen pitäisi olla pienempi kuin se yhdistetty pitoisuus, joka voisi olla myrkyllinen (ks. 51 kohta). Lisäksi testijärjestelyissä pitäisi huomioida mahdolliset haittavaikutukset kaloille ja aineiden mahdolliset yhteisvaikutukset (esimerkiksi metaboliset vaikutukset), jotka liitetään useiden aineiden samanaikaiseen testaamiseen. Ionisoituvien aineiden samanaikaista testaamista pitäisi välttää. Altistumisen näkökulmasta tätä menetelmää voidaan käyttää myös monimutkaisten seosten testaamisessa (ks. 13 kohta), vaikka sitä koskevat samat rajoitukset kuin muissa menetelmissä. TESTIN VALIDITEETTI Testi on luotettava, jos seuraavat edellytykset täyttyvät (ks. 24 kohta):
VERTAILUAINEET Jos laboratorio ei ole tehnyt määritystä aikaisemmin tai jos on tehty huomattavia muutoksia (esimerkiksi kalakannan tai toimittajan vaihto, kalalajin vaihtaminen tai merkittävä muutos kalojen koossa, kalojen ruoassa tai testiaineen lisäysmenetelmässä), on syytä tehdä tekninen pätevyystutkimus vertailuainetta käyttäen. Vertailuainetta käytetään pääasiassa sen määrittämiseksi, onko valittu menetelmä testiaineen lisäämiseksi ruokaan sellainen, että sillä voidaan varmistaa mahdollisimman hyvin testiaineiden homogeenisuus ja biologinen hyötyosuus. Polaarittomilla hydrofobisilla aineilla on käytetty esimerkiksi heksaklooribentseenia (HCB), mutta HCB:n vaarallisuuden takia pitäisi harkita muiden sellaisten aineiden käyttöä, joiden kertymisestä ja biomagnifikaatiosta on luotettavaa tietoa (63). Jos käytetään vertailuainetta, siitä pitäisi ilmoittaa testiraportissa samat perustiedot kuin testiaineista, eli aineen nimi, puhtaus, CAS-numero, rakenne ja myrkyllisyystiedot (jos saatavilla) (ks. 3 ja 22 kohta). MENETELMÄN KUVAUS Laitteisto Materiaaleja ja laitteistoa pitäisi käyttää samalla tavalla kuin veden välityksellä tehtävässä altistuksessa (ks. 26 kohta). Testissä pitäisi käyttää läpivirtausmenetelmää tai staattista ajoittaisvaihtoista järjestelmää, jolla varmistetaan laimennusveden riittävä määrä testisäiliöissä. Virtausnopeudet on kirjattava muistiin. Vesi Testivettä pitäisi käyttää samalla tavalla kuin vesialtistuksessa (ks. 27–29 kohta). Väliaineen on oltava ominaisuuksiltaan kuvatun kaltaista ja sen pitäisi pysyä laadultaan samana koko testin ajan. Luonnosta peräisin olevien hiukkasten pitoisuuden ja orgaanisen hiilen kokonaismäärän pitäisi olla ennen testin alkamista mahdollisimman alhainen (hiukkasia ≤ 5 mg/l ja orgaanisen hiilen kokonaismäärä ≤ 2 mg/l). Orgaanisen hiilen kokonaismäärä (TOC) mitataan vain ennen testin alkua testiveden ominaisuuksia määritettäessä (ks. 53 kohta). Ruokavalio Suositeltavaa on antaa kaupallisesti saatavaa kalanruokaa (kelluvat ja/tai hitaasti uppoavat hiutaleet), joka sisältää vähintään valkuaisaineita ja rasvaa. Ruokahiutaleiden pitäisi olla kooltaan yhdenmukaisia ravinnon välityksellä tapahtuvan altistuksen tehokkuuden voimistamiseksi, jotta kalat söisivät enemmän sen sijaan, että syövät vain suuremmat hiutaleet ja jättävät pienemmät syömättä. Hiutaleiden pitäisi olla testin alussa sopivan kokoisia kalojen kokoon nähden (esimerkiksi jos kalojen kokonaispituus on 3–7 cm, hiutaleiden halkaisija voi olla noin 0,6–0,85 mm, ja jos kalojen kokonaispituus on 6–12 cm, hiutaleiden halkaisija voi olla noin 0,85–1,2 mm). Hiutaleiden kokoa voidaan muuttaa kalojen kasvun mukaan poistumavaiheen alkaessa. Sopivasta kaupallisesti saatavasta ruoasta annetaan esimerkki lisäyksessä 7. Tätä menetelmää kehitettäessä käytetyn ruokavalion kokonaisrasvapitoisuus oli 15–20 prosenttia (tuorepaino). Joillakin alueilla ei välttämättä ole saatavilla kalanruokaa, jonka rasvapitoisuus on näin suuri. Tällöin tutkimuksessa käytetään ruokaa, jonka rasvapitoisuus on pienempi, ja tarvittaessa ruokkimistaajuutta muutetaan sen mukaan kalojen terveyden ylläpitämiseksi (alustavan testin perusteella). Testi- ja vertailuryhmien kalojen kokonaisrasvapitoisuus on määritettävä ja kirjattava muistiin ennen testin alkua sekä kertymävaiheen lopussa. Kaupallisen rehun valmistajan ilmoittamat tiedot ruoan sisältämistä ravintoaineista, kosteuspitoisuudesta, kuiduista ja tuhkasta ja mahdollisuuksien mukaan myös kivennäisaineista ja torjunta-ainejäämistä on esitettävä testiraportissa. Testiainetta on lisättävä ruokaan siten, että ruoka olisi mahdollisimman homogeenista koko testin ajan. Testiryhmälle annettavan ruoan sisältämän testiainepitoisuuden määrittämisessä on huomioitava analyysitekniikan herkkyys, testiaineen myrkyllisyys (NOEC-arvo, jos se on tiedossa) sekä olennaiset fysikaalis-kemialliset tiedot. Jos käytetään vertailuainetta, se pitäisi lisätä testiaineen pitoisuuden ollessa noin 10 prosenttia (tai joka tapauksessa niin pieni kuin on käytännössä mahdollista) riippuen analyysin herkkyydestä (esim. heksaklooribentseenin hyväksyttäväksi pitoisuudeksi ruoassa on todettu 1–100 μg/g; lisätietoa HCB:n assimilaatiotehosta on 47 kohdassa). Testiaine voidaan lisätä kalanruokaan eri tavoin riippuen sen fyysisistä ominaisuuksista ja liukoisuudesta (ks. lisätietoa lisäämismenetelmistä lisäyksestä 7).
Joissakin tapauksissa, esimerkiksi testattaessa vähemmän hydrofobisia aineita, joita desorboituu ruoasta helpommin, voi olla tarpeen valella valmiit ruokahiutaleet pienellä määrällä maissi- tai kalaöljyä (ks. 142 kohta). Tällöin vertailuruoka on käsiteltävä samalla tavalla ja rasvapitoisuus määritettävä valmiin testirehun avulla. Jos käytetään vertailuainetta, sitä koskevien tulosten on oltava verrattavissa samanlaisissa olosuhteissa toteutettuja ja samaa ruokkimistaajuutta soveltavia tutkimuksia koskeviin tietoihin (ks. 45 kohta). Tiettyä vertailuainetta koskevien muuttujien pitäisi myös täyttää olennaiset perusteet, jotka mainitaan 113 kohdassa (alakohdat 3, 4 ja 5). Jos testiaineen lisäämisessä käytetään kantaja-aineena öljyä tai liuotinainetta, samaa kantaja-ainetta olisi sekoitettava sama määrä (ilman testiainetta) vertailuryhmän ruokavalioon, jotta se vastaisi testiainetta sisältävää ruokavaliota. On tärkeää, että testi- ja vertailuryhmiä ruokitaan sekä kertymä- että poistumavaiheessa ravintoarvoltaan samanlaisella ruoalla. Testiainetta sisältävä ruoka olisi varastoitava siten (esim. kylmässä), että testiaineen pitoisuus pysyy rehuseoksessa vakaana. Varastointiolosuhteet on ilmoitettava testiraportissa. Kalalajin valinta Käytettävät kalalajit voivat olla samoja kuin vesialtistuksessa (ks. 32 kohta ja lisäys 3). Ruokavalion välityksellä tehtävissä bioakkumulaatiotutkimuksissa yleisesti käytetyt kalalajit ennen tämän testimenetelmän julkaisua ovat olleet kirjolohi (Oncorhynchus mykiss), karppi (Cyprinus carpio) ja paksupäämutu (Pimephales promelas). Testattavien lajien ruokailutottumusten olisi oltava sellaiset, että kalat syövät nopeasti saamansa ruoka-annoksen, jotta testiaineen pitoisuuteen ruoassa mahdollisesti vaikuttavat tekijät (kuten uuttuminen veteen ja mahdollinen altistuminen veden välityksellä) voitaisiin pitää mahdollisimman vähäisinä. Testissä olisi käytettävä kaloja, joiden koko ja paino ovat suositusten mukaiset (ks. lisäys 3). Kalojen olisi oltava niin suuria, että yksittäisten kalojen analysointi onnistuu helposti. Kalalajien testaaminen nopean kasvun vaiheessa voi hankaloittaa tietojen tulkintaa, ja nopea kasvu voi vaikuttaa assimilaatiotehon laskemiseen (64). Kalojen hoito Totuttamista, kuolleisuutta ja sairauksia koskevat hyväksyntäperusteet, joita sovelletaan ennen testin suorittamista, ovat samat kuin vesialtistuksessa (ks. 33–35 kohta). TESTIN SUORITTAMINEN Tutkimuksen valmistelu ja alueenmääritystesti Ennen varsinaista tutkimusta on tehtävä analyyseja, joilla osoitetaan testiaineen saannot testiainetta sisältävästä ruoasta / testiainetta sisältävää ruokaa saaneiden kalojen kudoksista. Aina ei ole välttämätöntä tehdä alueenmääritystestiä sen määrittämiseksi, mikä on aineen sopiva pitoisuus ruoassa. Alustavien ruokintakokeiden avulla voidaan osoittaa, ettei haittavaikutuksia ole havaittavissa, arvioida testiainetta sisältävän ruokavalion maittavuutta ja kalojen kudosten ja ravinnon analysoinnissa käytetyn menetelmän herkkyyttä sekä valita sopiva ruokkimistaajuus ja näytteenottovälit poistumavaiheessa. Niiden toteuttaminen ei kuitenkaan ole pakollista. Esitutkimuksesta voi olla hyötyä sen arvioimisessa, minkä verran kaloja näytteenotossa tarvitaan poistumavaiheen aikana. Käytettyjen kalojen määrää voidaan näin vähentää huomattavasti etenkin sellaisten testiaineiden osalta, jotka ovat erityisen alttiita metaboloitumaan. Altistusolosuhteet Kertymävaiheen kesto Kertymävaiheen riittävä kesto on tavallisesti 7–14 vuorokautta, joiden ajan yhdelle kalaryhmälle annetaan päivittäin vertailuruokaa ja toiselle testiruokaa ennalta määrätty annos, jonka suuruus riippuu testattavasta lajista ja kokeen olosuhteista. Esimerkiksi kirjolohella annos on 1–2 prosenttia ruumiinpainosta (tuorepaino). Ruokkimistaajuus määritetään sellaiseksi, etteivät kalat kasva nopeasti eikä niiden rasvapitoisuus kohoa merkittävästi. Kertymävaihetta voidaan tarvittaessa pidentää aiemmista tutkimuksista saatujen kokemusten tai testiaineen (tai sitä vastaavan aineen) kertymistä/poistumista kalassa koskevien tietojen perusteella. Testin katsotaan alkavan, kun kaloille annetaan ensimmäisen kerran testiainetta sisältävää ruokaa. Yksi testivuorokausi alkaa ruokintahetkestä ja päättyy vähän (esimerkiksi tuntia) ennen seuraavaa ruokintaa. Ensimmäinen testivuorokausi alkaa siis siitä, kun kaloille annetaan ensimmäisen kerran testiainetta sisältävää ruokaa, ja päättyy juuri ennen hetkeä, jolloin kaloille annetaan toisen kerran testiainetta sisältävää ruokaa. Käytännössä kertymävaihe päättyy vähän (esimerkiksi tuntia) ennen sitä, kun kaloille annetaan ensimmäisen kerran testiainetta sisältämätöntä ruokaa, koska testiainetta sisältävää ruokaa on kalojen ruoansulatusjärjestelmässä ja se absorboituu kaloihin noin 24 tunnin ajan. On tärkeää varmistaa, että testiaineen (ei-myrkyllinen) kertymä kaloissa on riittävän suuri analyysimenetelmään nähden, jotta poistumavaiheessa voidaan mitata vähintään yhden suuruusluokan aleneminen. Erityistapauksissa voidaan soveltaa pidempää kertymävaihetta (enintään 28 vuorokautta), jolloin myös otetaan lisänäytteitä kertymäkinetiikan arvioimiseksi. Pitoisuus kalassa ei välttämättä saavuta tasapainotilaa kertymävaiheen aikana. Tasapainotilan ja samalla hyväksyttävän pitoisuuden saavuttamiseen kuluvan ajan arvioimisessa voidaan käyttää samoja yhtälöitä kuin vesialtistustestissä (ks. liite 5). Joissakin tapauksissa tiedetään jo etukäteen, ettei ainetta kerry ravinnon välityksellä tarpeeksi 7–14 vuorokaudessa valitulla pitoisuudella riittävän suuren pitoisuuden saavuttamiseksi kaloissa, jotta voitaisiin analysoida vähintään yhden suuruusluokan aleneminen poistumavaiheessa. Tämä voi johtua siitä, ettei analyysitekniikka ole kovin herkkä, tai siitä, että assimilaatioteho on alhainen. Tällöin voi olla järkevää jatkaa ensimmäistä ruokintavaihetta kauemmin kuin 14 vuorokautta tai vaihtoehtoisesti pitäisi harkita, etenkin helposti metaboloituvilla aineilla, pitoisuuden nostamista ravinnossa. On kuitenkin huolehdittava siitä, ettei kalojen kudoksiin kertyneen aineen määrä ylitä kertymävaiheessa sitä (arvioitua) rajaa, jota alempi pitoisuus ei aiheuta havaittavaa kroonista vaikutusta (NOEC) (ks. 138 kohta). Poistumavaiheen kesto Poistumavaihe kestää yleensä korkeintaan 28 vuorokautta. Se alkaa, kun testiryhmän kaloille aletaan antaa kertymävaiheen jälkeen käsittelemätöntä ruokaa. Poistumavaihe alkaa, kun kaloille annetaan ensimmäistä kertaa testiainetta sisältämätöntä ruokaa, ei siis heti sen jälkeen, kun kaloille on annettu viimeisen kerran testiainetta sisältävää ruokaa. Tämä johtuu siitä, että testiainetta sisältävää ruokaa on kalojen ruoansulatusjärjestelmässä ja se absorboituu kaloihin noin 24 tunnin ajan, kuten todetaan 126 kohdassa. Poistumavaiheen ensimmäinen näyte otetaan vähän ennen toista kertaa, kun kaloille annetaan testiainetta sisältämätöntä ruokaa. Edellä mainittu poistumavaiheen kesto on määritelty siten, että voidaan havaita aineet, joiden puoliintumisaika on enintään 14 vuorokautta, kuten biokertyvillä aineilla (65). Näin ollen 28 vuorokautta käsittää kyseisillä aineilla kaksi puoliintumisaikaa. Erittäin herkästi bioakkumuloituvilla aineilla voi olla hyödyllistä pidentää poistumavaihetta (jos alustava testi antaa viitteitä tästä). Vaikka aine poistuu hyvin hitaasti eikä puoliintumisaikaa siten voida määrittää tarkasti poistumavaiheessa, tietoa voi olla riittävästi sitä varten, että bioakkumulaation arvioidaan olevan merkittävää. Jos taas aine poistuu niin nopeasti, ettei nollapitoisuuden (pitoisuus kertymävaiheen lopussa / poistumavaiheen alussa, C 0,d) ajankohtaa ja k 2-arvoa voida johtaa luotettavasti, k 2 voidaan arvioida suuntaa-antavasti (ks. liite 7). Jos aikaisemmassa vaiheessa (esim. seitsemän tai 14 vuorokauden kuluttua) kaloista tehdyt analyysit osoittavat, ettei aineen poistuma vastaa kvantifiointirajaa ennen 28 vuorokauden täyttä ajanjaksoa, näytteenotto voidaan keskeyttää ja testi päättää. Joissakin tapauksissa testiainetta ei ehkä ole kertynyt kertymävaiheen lopussa (tai poistumavaiheen toisena näytteenottoajankohtana) mitattavissa olevaa määrää. Jos voidaan osoittaa, että i) kohdassa 113 annetut hyväksyttävyysperusteet täyttyvät eikä ii) kertymän olemattomuus johdu testin toteuttamiseen liittyvistä puutteista (esim. kertymävaihe ei ole riittävän pitkä, testiainetta on lisätty ruokaan puutteellisella tekniikalla, minkä takia biologinen hyötyosuus on huono, analyysimenetelmä ei ole riittävän herkkä, kalat eivät syö ravintoa ja niin edelleen), tutkimus voidaan lopettaa eikä sitä tarvitse tehdä uudelleen soveltaen pidempää kertymävaihetta. Jos alustavat testit osoittavat, että näin saattaisi käydä, voidaan harkita mahdollisuuksien mukaan sulamatta jääneen testiaineen analysoimista ulosteista osana massatasemenetelmää. Testikalojen määrä Samoin kuin vesialtistustestissä valittujen kalojen on oltava keskenään suunnilleen samanpainoisia ja -pituisia, eli pienimmän kalan painon on oltava vähintään kaksi kolmasosaa suurimman kalan painosta (ks. 40–42 kohta). Tutkimuksessa käytettävien kalojen kokonaismäärä on valittava näytteenottoaikataulun mukaan (vähintään yksi näyte kertymävaiheen lopussa ja neljästä kuuteen näytettä poistumavaiheen aikana). Lisäksi on otettava huomioon analyysitekniikan herkkyys, kertymävaiheen lopussa todennäköisesti saavutettava pitoisuus (aiempien tietojen perusteella) sekä poistumavaiheen kesto (jos se voidaan arvioida aiempien tietojen perusteella). Kullakin näytteenottokerralla pitäisi analysoida viidestä kymmeneen kalaa, joiden kasvu (paino ja kokonaispituus) mitataan ennen kemikaali- tai rasvapitoisuuden määrittämistä. Kalojen koko, kasvuvauhti ja fysiologia vaihtelevat luonnostaan ja kalat syövät saamaansa ravintoa todennäköisesti eri määriä. Näin ollen näytteet pitäisi ottaa kullakin kerralla vähintään viidestä testiryhmän kalasta ja viidestä vertailuryhmän kalasta, jotta keskimääräinen pitoisuus ja sen vaihtelu voitaisiin määrittää asianmukaisesti. Käytettyjen kalojen keskuudessa esiintyvä vaihtelu vaikuttaa todennäköisesti enemmän yleiseen vaihteluun, jota ei voida testissä hallita, kuin käytettyjen analyysimenetelmien välinen luontainen vaihtelu, mikä puoltaa joissakin tapauksissa jopa kymmenen kalan käyttöä yhtä näytteenottopistettä kohti. Jos testiaineen taustapitoisuuksia ei voida mitata poistumavaiheen alussa, kemiallisen analyysin tekeminen viimeisenä näytteenottoajankohtana kahdesta tai kolmesta vertailuryhmän kalasta saattaa riittää, kunhan lopuilta vertailuryhmän kaloilta mitataan paino ja kokonaispituus kaikissa näytteenottopisteissä (siten, että kasvu mitataan yhtä suurelta määrältä testi- ja vertailuryhmän kaloja). Kalat pitäisi varastoida ja punnita yksitellen (vaikka näytteenoton tulokset olisi myöhemmin yhdistettävä), ja niiltä pitäisi mitata kokonaispituus. Standarditestissä, jossa poistumavaihe kestää 28 vuorokautta ja poistumavaiheen aikana otetaan viisi näytettä, tämä esimerkiksi tarkoittaa, että näyte otetaan kaikkiaan 59–120:stä testiryhmän kalasta ja 50–110:stä vertailuryhmien kalasta olettaen, että kyseisen aineen analyysitekniikka mahdollistaa rasvapitoisuuden analysoinnin samoista kaloista. Jos rasvapitoisuutta ja kemikaalipitoisuutta ei voida analysoida samoista kaloista eikä vertailuryhmien kalojen käyttö pelkästään rasvapitoisuuden analysoimiseksi ole mahdollista (ks. 56 kohta), näytteenottoon saatetaan tarvita 15 kalaa enemmän (kolme kalaa kantapopulaatiosta testin alussa, kolme kalaa sekä testi- että vertailuryhmästä poistumavaiheen alussa ja kolme kalaa sekä testi- että vertailuryhmästä kokeen lopussa). Esimerkki näytteenottoaikataulusta ja kalojen määrästä esitetään lisäyksessä 4. Täyttö Vesimäärän suhteessa kalojen määrään pitäisi olla sama kuin vesialtistuksessa (ks. 43 ja 44 kohta). Vaikka nopeus, jolla kaloja lisätään veteen, ei vaikuta altistuspitoisuuteen tässä testissä, kalaa on suositeltavaa lisätä 0,1–1,0 g (tuorepaino) vesilitraa kohti päivässä, jotta liuenneen hapen pitoisuus pysyy sopivana ja testiorganismiin kohdistuva stressi on mahdollisimman pieni. Testiruokavalio ja ruokinta Totuttamisvaiheessa kaloille annetaan sopivaa ravintoa edellä kuvatulla tavalla (117 kohta). Jos testi tehdään läpivirtausmenetelmällä, virtaus on keskeytettävä kalojen ruokinnan ajaksi. Testin aikana testiryhmälle annettavassa ruokavaliossa on noudatettava edellä kuvattuja periaatteita (116–121 kohta). Ainekohtaisten tekijöiden, analyysin herkkyyden, luonnonympäristössä odotetun ruokavalioon kertymisen sekä kroonisen myrkyllisyyden/kertymisen lisäksi ruoan sisältämän testiaineen pitoisuuden valinnassa on huomioitava ruoan maittavuus (jotta kalat eivät jätä ruokaa syömättä). Testiraportissa on ilmoitettava testiaineen nimellispitoisuus ruoassa. Kokemuksen perusteella käytännön työn kannalta sopiva testiainepitoisuus ruoassa on 1–1 000 μg/g aineilla, joilla ei ole havaittavissa erityistä toksista mekanismia. Aineilla, joiden vaikutus ei perustu erityiseen mekanismiin, kudosjäämät eivät saa olla yli 5 μmol/g rasvaa, koska tätä suuremmat jäämät saattavat aiheuttaa kroonisia vaikutuksia (19) (48) (50) (66). Muiden aineiden osalta on huolehdittava siitä, ettei kumulatiivinen altistus aiheuta haittavaikutuksia (ks. 127 kohta). Tämä pätee erityisesti silloin, kun samanaikaisesti testataan useampaa kuin yhtä ainetta (ks. 112 kohta). Sopiva määrä testiainetta voidaan lisätä kalanruokaan yhdellä kolmesta tavasta, jotka kuvataan 119 kohdassa ja lisäyksessä 7. Testiraportissa on ilmoitettava menetelmät ja menettelyt, joita on käytetty testiaineen lisäämiseksi rehuun. Vertailuryhmän kaloille annetaan käsittelemätöntä ruokaa, joka sisältää saman verran kantaja-aineena toimivaa öljyä (ilman testiainetta) kuin testiainetta sisältävä rehu, jos sitä on käytetty kertymävaiheessa, tai ruokaa, joka on käsitelty ”puhtaalla” liuotinaineella, jos testiryhmän kaloille annetun ruoan valmistuksessa on käytetty kantaja-aineena liuotinta. Käsitelty ja käsittelemätön ruoka pitäisi analysoida sen sisältämän testiainepitoisuuden määrittämiseksi vähintään kolmeen otteeseen ennen kertymävaiheen alkamista ja sen päättyessä. Kun kalat on altistettu käsitellylle ruoalle (kertymävaihe), niille (kummankin ryhmän kaloille) annetaan käsittelemätöntä ruokaa (poistumavaihe). Kaloille annetaan ruokaa tietty annos (jonka suuruus riippuu lajista; esimerkiksi kirjolohen päivittäinen ruoka-annos on noin 1–2 prosenttia kalan tuorepainosta). Ruokkimistaajuus määritetään sellaiseksi, etteivät kalat kasva nopeasti eikä niiden rasvapitoisuus kohoa merkittävästi. Kokeen aikainen ruokkimistaajuus on kirjattava täsmällisesti ylös. Alkuvaiheen ruokinnassa pitäisi huomioida kantapopulaation suunniteltu punnitus, joka tehdään juuri ennen testin alkamista. Annettavan rehun määrää pitäisi mukauttaa kullakin näytteenottokerralla punnittujen kalojen tuorepainon mukaisesti, jotta voidaan huomioida kalojen kasvu kokeen aikana. Testi- ja vertailusäiliöissä olevien kalojen painot ja pituudet voidaan arvioida kulloinkin näytteeksi otettujen kalojen painojen ja kokonaispituuksien perusteella. Testi- ja vertailusäiliöihin jääviä kaloja ei punnita tai mitata. On tärkeää, että ruokkimistaajuus pidetään koko testin ajan samana. Ruokintaa pitäisi tarkkailla sen varmistamiseksi, että kalat syövät silmämääräisesti kaiken niille annetun ruoan. Näin voidaan taata, että laskennassa käytetään oikeita syöntimääriä. Ruokkimistaajuus pitäisi määrittää alustavien ruokintakokeiden tai aiemman kokemuksen perusteella, jotta kalat söisivät varmasti päivittäisen ruoka-annoksensa kokonaan. Jos kalat jättävät toistuvasti ruoan syömättä, ruoka kannattaa jakaa useampaan annokseen jokaisena testipäivänä (esimerkiksi puolittamalla päivittäinen annos ja antamalla se kahdesti päivässä yhden sijasta). Jos tämä katsotaan tarpeelliseksi, toinen ruokkimiskerta on järjestettävä aina samaan aikaan ja se on ajoitettava siten, että ennen näytteiden ottamista kuluu mahdollisimman pitkä aika (toinen ruokkimiskerta järjestetään esimerkiksi testivuorokauden ensimmäisen puoliskon aikana). Vaikka kalat syövät ruoan yleensä nopeasti, on tärkeää varmistaa, että aine säilyy absorboituneena ruokaan. Testiaineen hajoaminen veteen pitäisi estää, jotta kalat eivät altistuisi testiainepitoisuudelle sekä veden että ruokavalion välityksellä. Tämä voidaan varmistaa siten, että syömättä jäänyt ruoka (ja ulosteet) poistetaan testi- ja vertailusäiliöistä viimeistään tunnin, mutta mieluiten puolen tunnin kuluessa ruokinnasta. Lisäksi voidaan käyttää aktiivihiilisuodatukseen perustuvaa järjestelmää, joka puhdistaa veden jatkuvasti absorboimalla veteen mahdollisesti liuenneet epäpuhtaudet. Läpivirtausjärjestelmien avulla ruokahiukkaset ja liuenneet aineet voidaan poistaa vedestä nopeasti (67). Joissakin tapauksissa tätä ongelmaa voidaan lievittää muuttamalla hieman testiainetta sisältävän ruoan valmistustekniikkaa (ks. 119 kohta). Valo ja lämpötila Samoin kuin vesialtistuksessa (ks. 48 kohta) valojakson pitäisi suositusten mukaan olla 12–16 tuntia ja lämpötila asetetaan testatuille lajeille sopivaksi (± 2 °C) (ks. lisäys 3). Valaistuksen tyyppi ja ominaisuudet on tunnettava ja kirjattava ylös. Kontrollit Kontrollia varten pitäisi olla yksi vertailuryhmä, jonka kaloille annetaan samaa rehua kuin testiryhmälle, mutta ilman testiainetta. Jos testiaine on lisätty testiryhmälle annettavaan rehuun käyttämällä kantaja-aineena öljyä tai liuotinta, vertailuryhmälle annettava ruoka on käsiteltävä muuten täysin samalla tavalla, mutta siihen ei lisätä testiainetta. Näin varmistetaan, että testi- ja vertailuryhmien ruokavaliot vastaavat toisiaan (ks. 121 ja 139 kohta). Veden laatua koskevien mittausten taajuus Tässäkin olosuhteet ovat samat kuin vesialtistuksessa lukuun ottamatta sitä, että TOC-arvo mitataan vain ennen testiä testiveden ominaisuuksia määritettäessä (ks. 53 kohta). Näytteenotto ja kalojen ja ruoan analysointi Ruokanäytteiden analysointi Testi- ja vertailuryhmille annettavan ruoan testiaine- ja rasvapitoisuudet pitäisi analysoida vähintään kolmeen otteeseen ennen kertymävaiheen alkua ja sen päättyessä. Testiraportissa on ilmoitettava analyysimenetelmät sekä menettelyt, joilla on varmistettu ruoan homogeenisuus. Testiainepitoisuuden määrittämiseksi otetut näytteet pitäisi analysoida vakiintunutta ja validoitua menetelmää käyttäen. Tutkimusta edeltävä alustava testi on tarpeen kvantifiointirajan, prosenttimääräisen saannon, häiriötekijöiden sekä analyysia koskevan vaihtelun määrittämiseksi suunnitellusta näytematriisista. Radioaktiivista merkkiainetta testattaessa on otettava huomioon samat asiat kuin vesialtistuksessa, mutta veden sijasta analysoidaan rehu (ks. 65 kohta). Kalanäytteiden analysointi Kunakin näytteenottoajankohtana näytteeksi otetaan 5–10 kalaa altistus- ja vertailuryhmästä (joissakin tapauksissa pienempi määrä riittää; ks. 134 kohta). Näytteet pitäisi ottaa kaikkina testipäivinä samaan aikaan (ruokkimisajankohdan mukaan), ja näytteenotto pitäisi myös ajoittaa siten, että todennäköisyys, että kalojen suolistossa on kertymävaiheessa ja poistumavaiheen alussa ruokaa, on mahdollisimman pieni. Tarkoituksena on välttää vääristymät testiaineen kokonaispitoisuudessa. (Näytteeksi otetut kalat on siten poistettava kunkin testivuorokauden päätteeksi ottaen huomioon, että testivuorokausi alkaa ruokintahetkestä ja päättyy seuraavaan ruokintaan, eli noin 24 tuntia myöhemmin. Poistumavaihe alkaa, kun kaloille annetaan ensimmäisen kerran testiainetta sisältämätöntä ruokaa; ks. 128 kohta). Poistumavaiheen ensimmäinen näyte (joka otetaan vähän ennen kuin kaloille annetaan toisen kerran testiainetta sisältämätöntä ruokaa) on tärkeä, koska tätä mittausta käytetään edellisen päivän tuloksen ekstrapoloinnissa nolla-ajankohdan pitoisuuden arvioimiseksi (C 0,d, eli pitoisuus kalassa kertymävaiheen lopussa / poistumavaiheen alussa). Vaihtoehtoisesti voidaan irrottaa kalan ruoansulatuskanava ja analysoida se erikseen kertymävaiheen alussa sekä poistumavaiheen ensimmäisenä ja kolmantena päivänä. Kunakin näytteenottoajankohtana otetaan kaloja kummastakin testiastiasta, ja ne käsitellään samalla tavalla kuin vesialtistuksessa (ks. 61–63 kohta). Testiainepitoisuus koko kalassa (tuorepainoon verrattuna) määritetään vähintään kertymävaiheen lopussa ja poistumavaiheen aikana sekä vertailu- että testiryhmän kaloista. Poistumavaiheessa on suositeltavaa käyttää neljästä kuuteen näytteenottopistettä (esim. päivät 1, 3, 7, 14 ja 28). On myös mahdollista lisätä yksi näytteenottopiste kertymävaiheen kestettyä 1–3 vuorokautta, jotta voidaan arvioida assimilaatioteho kaloissa kertymävaiheen lineaarisessa osassa, kun altistusvaihe on vasta alussa. Aikataulusta voidaan poiketa pääasiassa kahdessa tapauksessa: i) jos kertymävaihetta pidennetään kertymäkinetiikan tutkimista varten, kertymävaiheessa otetaan yksi lisänäyte, jolloin on myös lisättävä näytteeksi otettavien kalojen määrää (ks. 126), tai ii) jos tutkimus on lopetettava kertymävaiheen jälkeen, koska kertymä on liian vähäinen mitattavaksi (ks. 131 kohta). Näytteeksi otetut kalat on punnittava yksitellen (ja niiden kokonaispituus mitattava), jotta voidaan määrittää kasvuvakio. Testiaineen pitoisuus tietyissä kalan kudoksissa (syötäväksi kelpaavissa ja kelpaamattomissa osissa) voidaan määrittää myös kertymävaiheen lopussa ja vapaavalintaisina ajankohtina poistumavaiheessa. Radioaktiivista merkkiainetta testattaessa on otettava huomioon samat asiat kuin vesialtistuksessa, mutta veden sijasta analysoidaan rehu (ks. 65 kohta). Jos vertailuainetta käytetään jaksoittain (ks. 25 kohta), pitoisuudet on suositeltavaa mitata testiryhmästä (kokonaisista kaloista) kertymävaiheen lopussa sekä kaikkina kyseiselle testiaineelle määritettyinä ajankohtina poistumavaiheessa. Vertailuryhmässä pitoisuus analysoidaan (kokonaisista kaloista) vain kertymävaiheen lopussa. Tietyissä tilanteissa (jos esimerkiksi testiaineeseen ja vertailuaineeseen sovellettavat analyysitekniikat ovat keskenään epäsopivia, jolloin näytteenottoaikataulun noudattaminen edellyttäisi suurempaa määrää kaloja) voidaan soveltaa jotain muuta lähestymistapaa, jolla voidaan pitää tarvittavien lisäkalojen määrä mahdollisimman pienenä. Vertailuaineen pitoisuus mitataan poistumavaiheessa ainoastaan päivinä 1 ja 3 sekä kahdessa muussa näytteenottopisteessä, jotka valitaan siten, että niiden perusteella voidaan arvioida luotettavasti vertailuaineen pitoisuus nolla-ajankohtana (C 0,d) sekä k 2-arvo. Yksittäisten kalojen rasvapitoisuus pitäisi määrittää mahdollisuuksien mukaan kaikkina näytteenottoajankohtina tai vähintään kertymävaiheen alussa ja lopussa sekä poistumavaiheen lopussa (ks. 56 ja 67 kohta). Analyysimenetelmästä riippuen (ks. 67 kohta ja lisäys 4) samaa kalaa voidaan mahdollisesti käyttää sekä rasvapitoisuuden että testiainepitoisuuden määrittämisessä. Tämä on suositeltavaa, jotta tarvittavien kalojen määrä pysyisi mahdollisimman pienenä. Jos tämä ei kuitenkaan ole mahdollista, voidaan soveltaa samaa lähestymistapaa kuin vesialtistuksessa (ks. rasvapitoisuuden määrittämiseen sopivat vaihtoehtoiset keinot 56 kohdassa). Rasvapitoisuuden laskennassa käytetty menetelmä on ilmoitettava testiraportissa. Analyysimenetelmän laatu Kokeelliset tarkastukset ovat tarpeen, jotta voidaan varmistaa ainekohtaisen analyysitekniikan tarkkuus, oikeellisuus, täsmällisyys ja toistettavuus sekä taata testiaineen saanto ruoasta ja kaloista. Kalojen kasvun mittaaminen Testin alussa on punnittava osa kantapopulaation kaloista (ja mitattava niiden kokonaispituus). Kyseiset kalanäytteet pitäisi ottaa vähän (esim. tuntia) ennen kuin kaloille aletaan antaa testiainetta sisältävää ruokaa. Kyseessä on testipäivä 0. Tähän näytteeseen pitäisi ottaa saman verran kaloja kuin testin aikana otettaviin näytteisiin. Osa kaloista voi olla samoja kuin ne, joita käytetään rasvapitoisuuden analysoinnissa ennen kertymävaiheen alkua (ks. 153 kohta). Kullakin näytteenottokerralla kalat punnitaan ja niiden pituus mitataan ensin. Jokaisella näytteeksi otetulla kalalla mitattu paino ja pituus pitäisi liittää niissä määritettyyn kemikaalipitoisuuteen (ja tarvittaessa myös rasvapitoisuuteen) esimerkiksi käyttämällä kustakin kalasta yksilöllistä tunnistetta. Näytteiksi otettujen kalojen mittoja voidaan käyttää testi- ja kontrollisäiliöihin jäävien kalojen painon ja pituuden arvioinnissa. Kokeellinen arviointi Kuolleisuutta pitäisi tarkkailla ja se pitäisi kirjata muistiin päivittäin. Lisäksi pitäisi määrittää ja kirjata haittavaikutukset, kuten epätavallinen käytös tai pigmenttimuutokset. Kala katsotaan kuolleeksi, jos se ei hengitä eikä reagoi vähäiseen mekaaniseen ärsykkeeseen. Kuolleet tai selvästi kuolemaisillaan olevat kalat on poistettava. TIEDOT JA RAPORTOINTI Tulosten käsittely Tuloksia käytetään poistumavakion (k 2) määrittämisessä kalojen kokonaistuorepainon funktiona. Kasvuvakio (k g) lasketaan kalojen painon keskimääräisen nousun perusteella, ja sitä käytetään tarvittaessa kasvukorjatun poistumavakion (k 2g) määrittämisessä. Lisäksi pitäisi ilmoittaa assimilaatioteho (a; absorboituminen suolistosta), kineettinen biomagnifikaatiokerroin (BMFK) (tarvittaessa annetaan kasvukorjattu arvo, eli BMFKg), rasvapitoisuuden mukaan korjattu BMF-arvo (BMFKL tai BMFKgL, jos arvo on korjattu kasvun aiheuttaman liukenemisen mukaan) sekä ruokkimistaajuus. Jos kertymävaiheessa tasapainotilan saavuttamiseen kuluva aika voidaan arvioida (esim. 95 prosenttia tasapainotilasta tai t 95 = 3,0/k 2), voidaan ilmoittaa myös tasapainotilan arvioitu BMF (BMFSS) (ks. 105 ja 106 kohta sekä lisäys 5) edellyttäen, että tasapainotila on t 95-arvon perusteella mahdollisesti saavutettu. BMFSS-arvo korjataan rasvapitoisuuden mukaan käyttäen samaa menetelmää kuin kineettisesti johdetulla BMF:llä (BMFK), jotta siitä voidaan ilmoittaa rasvapitoisuuden mukaan korjattu arvo BMFSSL (huomaa, ettei tasapainotilan BMF:n korjaamiseksi kasvun aiheuttaman liukenemisen mukaan ole yleisesti hyväksyttyä menettelyä). Kaavoja ja laskentaesimerkkejä esitellään liitteessä 7. Käytettävissä on menetelmiä, joiden avulla voidaan arvioida kineettinen biokertyvyystekijä (BCFK) ravintotutkimuksessa saatujen tietojen perusteella. Asiaa käsitellään liitteessä 8. Tiedot kalojen painosta ja pituudesta Eri ajankohtina saadut yksittäisten kalojen tuorepainot ja pituudet taulukoidaan erikseen testi- ja vertailuryhmittäin kertymävaiheen kaikilta näytteenottopäiviltä (kantapopulaation kaloista taulukoidaan kertymävaiheen alussa otetut mitat; vertailu- ja testiryhmien kaloista kertymävaiheen lopussa ja tarvittaessa kertymävaiheen alussa, esimerkiksi kertymävaiheen päivinä 1–3, sekä poistumavaiheessa esimerkiksi päivinä 1, 2, 4, 7, 14 ja 28, otetut mitat). Kasvua seurataan mieluiten painon perusteella kasvun aiheuttaman liukenemisen huomioon ottamiseksi. Tietojen korjaamisessa kasvun aiheuttaman liukenemisen mukaan sovellettava(t) menetelmä(t) esitellään jäljempänä (162 ja 163 kohta) sekä liitteessä 5. Tiedot testiaineen pitoisuudesta kaloissa Tiedot sekä testi- että vertailuryhmien yksittäisistä kaloista mitatuista testiaineen jäämistä (tai jos jäämiä ei voida mitata yksittäisistä kaloista, kalanäytteiden yhdistetyt tiedot) ilmoitetaan pitoisuutena suhteessa tuorepainoon ja taulukoidaan kultakin näytteenottoajankohdalta. Jos rasvapitoisuus on määritetty erikseen jokaisesta näytekalasta, voidaan johtaa ja taulukoida yksilökohtaiset rasvapitoisuuden mukaan korjatut pitoisuudet (rasvapitoisuus suhteessa tuorepainoon).
Poistumavakio ja biomagnifikaatiokerroin Biomagnifikaatiokertoimen laskeminen saatujen tietojen perusteella edellyttää, että ensin määritetään assimilaatioteho (testiaineen absorboituminen suolistossa, α). Tässä pitäisi soveltaa liitteessä 7 esitettyä yhtälöä A7.1, jota varten tiedossa on oltava johdettu pitoisuus kalassa poistumavaiheen nolla-ajankohtana (C 0,d), (yleinen) poistumavakio (k 2), pitoisuus ruoassa (C ruoka), ruoan imeytymisvakio (I) ja kertymävaiheen kesto (t). Ln(konsentraation) ja poistuma-ajan välisen lineaarisen suhteen kulmakerroin ja leikkauspiste ilmoitetaan yleisenä poistumavakiona (k 2 = kulmakerroin) ja nolla-ajankohdan pitoisuutena (C 0,d = eintercept), kuten edellä esitetään. Johdettujen arvojen biologinen paikkansapitävyys pitäisi tarkistaa (assimilaatiotehon osuus ei esimerkiksi voi olla suurempi kuin 1). (I) lasketaan jakamalla ruoan massa päivittäin ruokittujen kalojen massalla (jos ruoan määrä on 2 prosenttia ruumiinpainosta, I on 0,02). Laskennassa sovellettavaa ruokkimistaajuutta saatetaan kuitenkin joutua muuttamaan kalojen kasvun mukaisesti (mikä voidaan tehdä käyttämällä tiedossa olevaa kasvuvakiota kalojen painon arvioimiseksi kunakin kertymävaiheen ajankohtana; ks. lisäys 7). Jos k 2- ja C 0,d-arvoja ei voida johtaa esimerkiksi sen takia, että pitoisuudet laskevat alle havaitsemisrajan poistumavaiheen toiseen näytteenottokertaan mennessä, k 2-arvo ja BMFk-arvon yläraja voidaan arvioida suuntaa-antavasti (ks. lisäys 7). Kun assimilaatioteho (α) on saavutettu, biomagnifikaatiokerroin voidaan laskea kertomalla α ruoan imeytymisvakiolla (I) ja jakamalla tulo (yleisellä) poistumavakiolla (k 2). Kasvukorjattu biomagnifikaatiokerroin lasketaan muuten samalla tavalla, mutta laskennassa käytetään kasvukorjattua poistumavakiota (k 2g; ks. 162 ja 163 kohta). Assimilaatioteholle voidaan myös johtaa vaihtoehtoinen arvio, jos kertymävaiheen alkupuolella lineaarisessa vaiheessa näytteeksi otetuille kaloille on tehty kudosanalyysi (ks. 151 kohta ja lisäys 7). Kyseessä on riippumaton arvio assimilaatiotehosta pääasiassa altistamattomissa organismeissa (eli kalat ovat juuri aloittamassa kertymävaiheen). Poistumatietojen perusteella arvioitua assimilaatiotehoa käytetään tavallisesti BMF:n johtamisessa. Korjaaminen rasvapitoisuuden ja kasvun aiheuttaman liukenemisen mukaan Poistumavaiheessa tapahtuva kasvu voi alentaa kaloissa mitattua kemikaalipitoisuutta, minkä johdosta yleinen poistumavakio k2 on suurempi kuin pelkkien poistoprosessien (esim. metabolismi ja ulostaminen) seurauksena syntyvä vakio (ks. 72 kohta). Testikalojen rasvapitoisuus (joka on selvästi sidoksissa hydrofobisten aineiden bioakkumulaatioon) sekä ruoan rasvapitoisuus voivat käytännössä vaihdella sen verran, että niitä on korjattava, jotta biomagnifikaatiokertoimet voidaan esittää tarkoituksenmukaisesti. Biomagnifikaatiokerroin pitäisi korjata kasvun aiheuttaman liukenemisen mukaan (kuten kineettinen BCF vesialtistuksessa) sekä ruoan rasvapitoisuuden mukaan suhteessa kalan rasvapitoisuuteen (rasvapitoisuuden korjauskerroin). Näitä laskutoimituksia koskevia yhtälöitä esitellään liitteessä 5 ja esimerkkejä liitteessä 7. Kasvun aiheuttaman liukenemisen mukaan tehtävää korjausta varten on laskettava kasvukorjattu poistumavakio k 2g (ks. yhtälöt liitteessä 5). Kasvukorjattua poistumavakiota (k 2g) käytetään kasvukorjatun biomagnifikaatiokertoimen laskennassa, kuten esitetään 73 kohdassa. Joissakin tapauksissa tämä lähestymistapa ei ole mahdollinen. On olemassa vaihtoehtoinen lähestymistapa, joka ei edellytä korjaamista kasvun aiheuttaman liukenemisen mukaan. Siinä käytetään testiaineen massaa koskevia poistumatietoja kalakohtaisesti (kokonainen kala perusteena) sen sijaan, että testiaineen massaa koskevat tiedot suhteutettaisiin kalan massayksikköä (pitoisuutta) koskeviin tietoihin. Tämä voidaan tehdä helposti, koska kyseisessä testimenetelmässä kudoksissa havaitut pitoisuudet pitää liittää yksittäisten kalojen painoon. Tätä koskevaa yksinkertaista menettelyä kuvataan liitteessä 5. On huomattava, että k 2 pitää arvioida ja raportoida myös vaihtoehtoista lähestymistapaa sovellettaessa. Jos kaikista näytteeksi otetuista kaloista ei ole analysoitu rasvapitoisuutta, ruoan ja kalan rasvapitoisuuden mukainen korjaaminen edellyttää, että sekä kaloille että ruoalle johdetaan keskimääräiset rasvaosuudet (tuorepainoon verrattuna) (68). Rasvapitoisuuden korjauskerroin (Lc ) lasketaan tämän jälkeen jakamalla kalan keskimääräinen rasvaosuus ruoan keskimääräisellä rasvaosuudella. Biomagnifikaatiokerroin, tarvittaessa kasvukorjattuna, jaetaan rasvapitoisuuden korjauskertoimella rasvapitoisuuden mukaan korjatun biomagnifikaation laskemiseksi. Jos kemikaali- ja rasvapitoisuudet on analysoitu kaikissa näytteenottopisteissä samoista kaloista, yksittäisten kalojen kudoksista saatuja ja rasvapitoisuuden mukaan korjattuja tietoja voidaan käyttää suoraan rasvapitoisuuden mukaan korjatun BMF:n laskennassa (ks. 37 kohta). Rasvapitoisuuden mukaan korjatun pitoisuuskäyrän tiedot osoittavat rasvapitoisuuteen perustuvan C 0,d-arvon sekä k 2-arvon. Tämän jälkeen voidaan tehdä matemaattinen analyysi käyttäen liitteessä 7 esitettyjä yhtälöitä, mutta assimilaatioteho (a) lasketaan käyttäen rasvapitoisuuden mukaan normalisoitua ruoan imeytymisvakiota (I rasva) ja rasvapitoisuuteen perustuvaa pitoisuutta ruokavaliossa (C ruoka-rasva). Rasvapitoisuuden mukaan korjattuja muuttujia käytetään samalla tavalla BMF:n laskemisessa (huomaa, että rasvaosuuteen pitäisi myös soveltaa mieluummin korjattua kasvuvakiota kuin kalan tuorepainoa rasvapitoisuuden ja kasvun mukaan korjatun BMFKgL-arvon laskemiseksi). Tulosten tulkinta Testi- ja vertailuryhmien kalojen keskimääräinen kasvu ei saisi periaatteessa erota merkittävästi, jotta voidaan sulkea pois toksisuus. Kummankin ryhmän kasvuvakioita tai kasvukäyriä pitäisi verrata tarkoitukseen sopivalla menetelmällä (69)). Testiraportti Tutkimuksen päätyttyä laaditaan loppuseloste, joka sisältää tiedot testiaineesta, testatuista lajeista sekä testiolosuhteista, kuten mainitaan 81 kohdassa (samat tiedot kuin vesialtistuksessa). Lisäksi on ilmoitettava seuraavat tiedot:
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT JA YKSIKÖT
LÄHDEKIRJALLISUUS
Lisäys 2 JOITAKIN HYVÄKSYTTÄVÄN LAIMENNUSVEDEN KEMIALLISIA OMINAISUUKSIA
Lisäys 3 KALALAJIT, JOITA SUOSITELLAAN KÄYTETTÄVÄKSI TESTISSÄ
Erilaisia suisto- ja merikalalajeja on käytetty vähemmän. Esimerkkejä:
Edellä olevassa taulukossa lueteltuja makean veden kaloja on helppo kasvattaa ja/tai niitä on helposti saatavissa läpi vuoden, kun taas meri- tai suistokalalajeja on lähinnä saatavissa tiettyjä meriä ja suistoja ympäröivissä maissa. Niitä voidaan kasvattaa joko kalanviljelylaitoksissa tai laboratorioissa, joissa voidaan torjua tauteja ja loisia niin, että saadaan terveitä koe-eläimiä, joiden alku/sukuperä tunnetaan. Näitä kaloja on saatavissa eri puolilla maailmaa. LÄHDEKIRJALLISUUS
Lisäys 4 NÄYTTEENOTTOAIKATAULUT VEDEN JA RAVINNON VÄLITYKSELLÄ TEHTÄVISSÄ ALTISTUSTESTEISSÄ 1. Teoreettinen esimerkki näytteenottoaikataulusta kattavassa vesialtistukseen perustuvassa biokertyvyystestissä aineilla, joiden log KOW = 4.
2. Teoreettinen esimerkki näytteenottoaikataulusta testattaessa aineen bioakkumulaatiota ravinnon välityksellä, kun kertymävaihe kestää 10 vuorokautta ja poistumavaihe 42 vuorokautta.
Huomioita eri vaiheita ja näytteenottoa koskevista aikatauluista: Kertymävaihe alkaa, kun kaloille annetaan ensimmäisen kerran testiainetta sisältävää ruokaa. Testivuorokausi alkaa ruokinnasta ja päättyy juuri ennen seuraavaa ruokintaa 24 tuntia myöhemmin. Ensimmäinen näyte (nro 1 taulukossa) pitäisi ottaa juuri ennen (esimerkiksi tuntia ennen) ensimmäistä ruokintaa. Tutkimuksen aikana näyte otetaan mieluiten juuri ennen seuraavan päivän ruokintaa (eli noin 23 tuntia edellisen näytepäivän ruokinnan jälkeen). Kertymävaihe päättyy juuri ennen hetkeä, jona kaloille annetaan ensimmäistä kertaa ruokaa, joka ei sisällä testiainetta, ja jolloin poistumavaihe alkaa (testiainetta saattaa olla testiryhmän kalojen ruoansulatusjärjestelmässä 24 tunnin ajan sen jälkeen, kun niille on annettu viimeisen kerran testiainetta sisältävää ruokaa). Näin ollen kertymävaiheen viimeinen näyte pitäisi ottaa juuri ennen kuin kaloille annetaan ruokaa, joka ei sisällä testiainetta, ja poistumavaiheen ensimmäinen näyte noin 23 tuntia tämän jälkeen. Lisäys 5 YLEISET LASKUTOIMITUKSET
1. JOHDANTO Veden välityksellä tapahtuvan biokertyvyyden yleinen malli voidaan kuvata kaloilla kertymä- ja poistumaprosesseina ruoan kautta tapahtuvasta kertymästä välittämättä. Kaloissa olevien pitoisuuksien (mg·kg– 1·vrk– 1) muutosvakiota koskeva erotuskaavio (dC f/dt) saadaan seuraavasti (1):
Tässä yhtälössä:
Biokertyvillä aineilla on odotettavissa, että aikapainotettu keskiarvo osoittaa parhaiten hyväksyttävän vaihteluvälin rajoissa olevan altistuspitoisuuden vedessä (Cw ) (ks. 24 kohta). Pitoisuuksien aikapainotettu keskiarvo (TWA) vedessä on suositeltavaa laskea testimenetelmän C.20 liitteessä 6 esitettyä menettelyä noudattaen (2). On huomattava, että vesipitoisuuden lineaarinen muutos on sopiva, kun uusiutumiskausien välissä on odotettavissa eksponentiaalista hajoamista, kuten puolistaattisessa testijärjestelmässä. Läpivirtausjärjestelmässä altistuspitoisuuksien lineaarinen muutos ei välttämättä ole tarpeellinen. Jos aikapainotetut keskiarvot vedessä on johdettu, ne on ilmoitettava ja niitä on käytettävä myöhemmissä laskelmissa. Standardissa kaloilla tehtävässä BCF-testissä kertymä ja poistuma voidaan kuvata kahden ensimmäisen asteen kineettisen prosessin mukaisesti.
Tasapainotilassa kasvun ja metaboloitumisen arvioinnilla ei ole merkitystä (k g- ja k m-arvoja ei voida erottaa nollasta) ja kertymävakio vastaa poistumavakiota, joten yhtälöt A5.2 ja A5.3 osoittavat yhdistettyinä seuraavan suhteen:
Tässä:
k 1:n ja k 2:n suhde on kineettinen BCF (BCFK), jonka pitäisi vastata tasapainotilan BCF-arvoa (BCFSS), joka saadaan vertaamalla tasapainotilan pitoisuutta kaloissa vastaavaan pitoisuuteen vedessä. Poikkeamia voi kuitenkin esiintyä, jos tasapainotilan saavuttaminen ei ole varmaa tai kineettistä BCF:ää on korjattu kasvun mukaan. BCFK-arvon johtaminen ei kuitenkaan edellytä tasapainotilan saavuttamista, koska k 1ja k 2 ovat vakioita. Tässä lisäyksessä esitetään kyseisiin ensimmäisen asteen yhtälöihin perustuvat yleiset laskelmat, joita tarvitaan sekä veden että ravinnon välityksellä tehtävissä altistuksissa biokertyvyyden määrittämiseksi. Osat 5, 6 ja 8 koskevat vain veden välityksellä tehtävää altistusta, mutta ne ovat tässä mukana ”yleisinä” tekniikoina. Vaiheittaisilla menetelmillä (osat 4 ja 5) ja samanaikaismenetelmillä (osa 6) voidaan laskea kertymä- ja poistumavakiot, joita käytetään kineettisten BCF-arvojen laskennassa. Vaiheittainen menetelmä k 2:n määrittämiseksi (osa 4) on tärkeä ravintoaltistusmenetelmässä, koska sitä tarvitaan sekä assimilaatiotehon että BMF:n laskemisessa. Ravintoaltistusta soveltavassa menetelmässä tarvittavat erityislaskelmat esitetään yksityiskohtaisesti lisäyksessä 7. 2. KERTYMÄVAIHEEN KESTON ARVIOIMINEN Ennen testin suorittamista voidaan arvioida k 2 ja määrittää jokin prosenttimäärä tasapainotilan saavuttamiseksi tarvittavasta ajasta k 2:n ja n-oktanoli-vesi -jakautumiskertoimen (K OW) tai k 1:n ja BCF:n välisten empiiristen suhteiden perusteella. On kuitenkin pidettävä mielessä, että tässä osassa esitellyt yhtälöt soveltuvat vain silloin, kun kertymä ja poistuma noudattavat ensimmäisen asteen kinetiikkaa. Jos näin ei selvästikään ole ja kertymävaiheesta halutaan antaa ennusteita, kannattaa pyytää neuvoa biostatistiikan ja/tai farmakokinetiikan asiantuntijoilta. Arvo k2 (vrk– 1) voidaan arvioida monella eri menetelmällä. Ensisijaisesti voidaan käyttää esimerkiksi seuraavaa empiiristä suhdetta (87):
tai
W = käsiteltyjen kalojen keskipaino (grammaa tuorepainona) kertymävaiheen lopussa / poistumavaiheen alussa (88) Muista olennaisista suhteista ks. (6). K2:n arvioinnissa voi olla hyödyllistä käyttää monimutkaisempia malleja, jos esimerkiksi merkittävä metaboloituminen on todennäköistä (7) (8). Mitä monimutkaisempaa mallia käytetään, sitä huolellisempi on oltava ennusteiden tulkinnassa. Esimerkiksi nitroryhmien esiintyminen voi olla merkki nopeasta metaboloitumisesta, mutta aina näin ei ole. Käyttäjän pitäisikin arvioida ennustemenetelmällä saatuja tuloksia kemiallisen rakenteen ja muiden olennaisten tietojen (kuten alustavien tutkimusten tulosten) perusteella tutkimuksen aikataulua suunnitellessaan. Aika, joka tarvitaan tietyn prosenttiasteisen tasapainotilan saavuttamiseksi, voidaan laskea arvioidun k 2:n perusteella yleisestä kertymä- ja poistumavaihetta kuvaavasta yhtälöstä (ensimmäisen asteen kinetiikka) olettaen, että kasvu ja metaboloituminen ovat vähäisiä. Jos kalat kasvavat merkittävästi tutkimuksen aikana, alla kuvatut arviot eivät ole luotettavia. Tällaisissa tapauksissa on parempi soveltaa kasvukorjattua arvoa k 2g, kuten esitetään jäljempänä (ks. tämän liitteen osa 7):
tai jos C w on vakio:
Kun lähestytään tasapainotilaa (t → ∞), yhtälö A5.10 voidaan muuttaa (ks. (9) (10)) seuraavasti:
tai
Tällöin BCF × C w on lähellä pitoisuutta kalassa tasapainotilassa (C f-SS). Huomautus: Samaa lähestymistapaa voidaan soveltaa arvioitaessa tasapainotilan BMF:ää ravinnon välityksellä tehtävässä testissä. Tällöin edellä esitetyissä yhtälöissä korvataan BCF BMF:llä ja C w ruoassa mitatulla pitoisuudella C ruoka. Yhtälö A5.10 voidaan kirjoittaa seuraavasti:
tai
Soveltamalla yhtälöä A5.14 voidaan arvioida aika, joka vaaditaan jonkin prosenttiasteen tasapainotilan saavuttamiseksi, kun k 2 on arvioitu ensin soveltamalla yhtälöä A5.5 tai A5.6. Tilastollisesti paras kertymävaiheen kesto tilastollisesti hyväksyttävien tulosten saamiseksi (BCFK) on aika, joka tarvitaan, jotta kalassa olevan testiainepitoisuuden logaritmia lineaarisen ajan funktiona kuvaava käyrä osoittaa vähintään 50-prosenttisen tasapainotilan (eli 0,69/k 2), mutta ei saavuta enempää kuin 95 prosenttia tasapainotilasta (eli 3,0/k 2) (11). Jos akkumulaatio saavuttaa yli 95 prosenttisesti tasapainotilan, voidaan laskea BCFSS. Aika, joka tarvitaan 80-prosenttisen tasapainotilan saavuttamiseen on (yhtälö A5.14):
tai
Samaten aika, joka tarvitaan 95-prosenttisen tasapainotilan saavuttamiseen, on:
Esimerkiksi kertymävaiheen kesto (eli aika, joka tarvitaan tietyn prosenttiosuuden saavuttamiseksi tasapainotilasta, esim. t 80 tai t 95) aineella, jonka log K OW = 4, olisi seuraava (kun käytetään yhtälöitä A5.5, A5.16 ja A5.17): logk 2 = 1,47 – 0,414 · 4 k 2 = 0,652 vrk– 1
tai kun käytetään vaihtoehtoisesti seuraavaa yhtälöä:
tosiasiallisen tasapainotilan saavuttamiseksi tarvittavan ajan (t eSS) laskemiseen (12). Aineella, jonka log K OW = 4, tulos on seuraavanlainen: teSS = 6,54 · 10 – 3 · 104 + 55,31 = 121 tuntia 3. POISTUMAVAIHEEN KESTON ARVIOIMINEN Ennakkoarvio ajasta, joka tarvitaan kertymän laskemiseksi tiettyyn prosenttimäärään alkupitoisuudesta, voidaan myös saada kertymä- ja poistumavaihetta kuvaavasta yleisestä yhtälöstä (kun oletuksena on ensimmäisen asteen kinetiikka, ks. yhtälö A5.9) (1) (13). Poistumavaiheen C w-arvoksi (tai C ruoka-arvoksi, jos on kyse ravintoaltistustestistä) oletetaan nolla. Yhtälö voidaan tällöin esittää seuraavasti:
tai
jossa C f,0 on pitoisuus poistumavaiheen alussa. Siten saavutetaan 50 prosentin poistuma ajankohtana (t 50):
tai
Samaten 95 prosentin poistuma saavutetaan seuraavana ajankohtana:
Jos 80 prosentin kertymää käytetään ensimmäisessä vaiheessa (1,6/k 2) ja 95 prosentin poistumaa poistumavaiheessa (3,0/k 2), niin poistumavaihe on suunnilleen kaksi kertaa niin pitkä kuin kertymävaihe. On huomattava, että arviot perustuvat oletukseen, että kertymä- ja poistumavaihe noudattavat ensimmäisen asteen kinetiikkaa. Jos ne eivät selvästikään noudata ensimmäisen asteen kinetiikkaa, nämä arviot eivät päde. 4. VAIHEITTAINEN MENETELMÄ: POISTUMAVAKION K 2 MÄÄRITTÄMINEN Biokertyvyystietojen on yleensä oletettu noudattavan ”kohtuullisesti” yksinkertaista kahden osaston ja kahden muuttujan mallia. Sen osoittaa suora kuvaaja, joka vastaa kalassa poistumavaiheessa havaittuja pitoisuuksia (lineaarisella asteikolla).
On huomattava, että poikkeamat suorasta viivasta voivat viitata siihen, että poistuma noudattaa ensimmäisen asteen kinetiikkaa monimutkaisempaa mallia. Graafista menetelmää voidaan käyttää sellaisten poistumatyyppien selvittämiseen, jotka poikkeavat ensimmäisen asteen kinetiikasta. Jos halutaan laskea k 2 eri (näytteenotto-)ajankohtina, tehdään lineaarinen regressio, jossa verrataan ln(konsentraatiota) aikaan. Regressiosuoran kulmakerroin osoittaa arvioidun poistumavakion k 2 (89). Keskimääräinen pitoisuus kaloissa poistumavaiheen alussa (C 0,d, joka vastaa keskimääräistä pitoisuutta kaloissa kertymävaiheen lopussa) voidaan laskea helposti leikkauspisteestä (myös virhemarginaali huomioitu) (89):
Jos näytteenottoajankohtia on vain kaksi (kuten minimoidussa testissä), k 2 lasketaan korvaamalla kaksi keskimääräistä pitoisuutta seuraavassa yhtälössä:
jossa ln(C f1) on pitoisuuden luonnollinen logaritmi ajankohtana t 1 ja ln(C f2) ajankohtana t 2 ja jossa t 2 ja t 1 osoittavat, minä ajankohtina kaksi poistumavaiheen alussa otettua näytettä on otettu (90). 5. VAIHEITTAINEN MENETELMÄ: KERTYMÄVAKION K 1 MÄÄRITTÄMINEN (VAIN VEDEN VÄLITYKSELLÄ TEHTÄVÄSSÄ ALTISTUKSESSA) K1:n arvon määrittämiseksi kertymävaiheen tiettyinä ajankohtina mitattuja pitoisuuksia koskevien tietojen perusteella käytetään tietokoneohjelmaa seuraavan mallin sovittamiseksi:
Jos k 2 on saatu aiemmassa laskutoimituksessa, C f(t) osoittaa pitoisuuden kaloissa ja C w(t) vedessä ajankohtana t. Jos näytteenottopisteitä on vain kaksi (kuten minimoidussa testissä), k 1:n laskemisessa sovelletaan seuraavaa kaavaa:
jossa k 2 saadaan aiemmasta laskutoimituksesta, C f on pitoisuus kalassa poistumavaiheen alkaessa ja C w on keskimääräinen pitoisuus vedessä kertymävaiheen aikana (91). Sovituksen oikeellisuutta voidaan arvioida vertaamalla silmämääräisesti k 1:n ja k2 :n kulmakertoimia näytteenottopisteestä saatuihin mittaustietoihin. Jos käy ilmi, että vaiheittaisen menetelmän mukaan tehty arvio k 1:stä on heikko, k 1 ja k 2 pitäisi laskea samanaikaismenetelmällä (ks. seuraava osa 6). Tässäkin on verrattava saatuja kulmakertoimia mitattuihin tietoihin, jotta sovituksen oikeellisuus voidaan tarkastaa silmämääräisesti. Jos sovituksen oikeellisuus on edelleen heikko, se voi olla merkki siitä, ettei ensimmäisen asteen kinetiikka päde, jolloin pitäisi soveltaa monimutkaisempia malleja. 6. KERTYMÄ- JA POISTUMAVAKIOIDEN LASKENNASSA SOVELLETTAVA SAMANAIKAISMENETELMÄ (VAIN VEDEN VÄLITYKSELLÄ TEHTÄVÄ ALTISTUS) Tietokoneohjelmien avulla voidaan määrittää k 1 ja k 2-arvot peräkkäisiä ajankohtia koskevia pitoisuustietoja ja seuraavaa mallia soveltaen:
joissa
Tässä lähestymistavassa k 1- ja k 2-arvioiden keskivirhetaso voidaan määrittää suoraan. Jos k 1/k 2 korvataan BCF:llä (ks. yhtälö A5.4) yhtälöissä A5.25 ja A5.26, voidaan arvioida myös BCF:n keskivirhetaso ja 95 prosentin luottamusväli. Tästä on erityistä hyötyä verrattaessa arvioita, jotka eroavat toisistaan tietojen muuntamisen takia. Riippuva muuttuja (pitoisuus kaloissa) voidaan sovittaa lineaarisen muutoksen kanssa tai ilman sitä, ja tuloksena saatava BCF:n epävarmuus voidaan arvioida. Koska muuttujien k 1 ja k 2 välillä on voimakas korrelaatio, jos ne on arvioitu samanaikaisesti, voi olla kannattavaa laskea ensin k 2 pelkästään poistumatietojen perusteella (ks. edellä). Useimmissa tapauksissa k 2 voidaan arvioida poistumakäyrästä suhteellisen tarkasti. Tämän jälkeen voidaan laskea k 1 kertymätietojen perusteella käyttämällä ei-lineaarista regressiota (92). Tiedot on suositeltavaa muuntaa samalla tavalla vaiheittaisessa sovittamisessa. Sovituksen oikeellisuutta voidaan arvioida vertaamalla silmämääräisesti laskettuja kulmakertoimia näytteenottopisteestä saatuihin mittaustietoihin. Jos käy ilmi, että tämän menetelmän mukaan tehty arvio k1 :stä on heikko, k 1 ja k 2 voidaan laskea samanaikaismenetelmällä. Tässäkin tapauksessa sovitetun mallin sopivuus pitäisi tarkistaa silmämääräisesti vertaamalla sitä mittaustietoihin. Lisäksi pitäisi vertailla keskenään eri sovitustyypeille arvioituja k 1- ja k 2-muuttujia ja saatua BCF:ää sekä niiden keskivirhetasoa ja luottamusväliä. Sovituksen heikkous saattaa tarkoittaa, ettei ensimmäisen asteen kinetiikka päde, jolloin on käytettävä monimutkaisempia malleja. Yksi yleisimmistä ongelmista on kalojen kasvu testin aikana. 7. KINEETTISEN BCF:N JA BMF:N KORJAAMINEN KASVUN MUKAAN Tässä osassa esitellään standardi menetelmä arvojen korjaamiseksi kalojen kasvun mukaan (niin kutsuttu kasvun aiheuttama liukeneminen). Sitä voidaan soveltaa vain silloin, kun ensimmäisen asteen kinetiikka pätee. Jos vaikuttaa siltä, ettei ensimmäisen asteen kinetiikka päde, on suositeltavaa pyytää neuvoa biostatistiikan asiantuntijalta, jotta kasvun aiheuttama liukeneminen voidaan huomioida oikein korjaamisessa tai jotta voidaan käyttää massaperusteista lähestymistapaa, joka esitellään jäljempänä. Joissakin tapauksissa tämä kasvun aiheuttamaan liukenemiseen perustuva korjausmenetelmä on epätarkka tai se ei toimi. (Näin on esimerkiksi silloin, kun testiaine poistuu hyvin hitaasti mutta kalojen kasvu on nopeaa, jolloin kasvun aiheuttaman liukenemisen perusteella korjattu johdettu poistumavakio k 2g saattaa olla hyvin pieni ja virhe sen johtamisessa käytetyissä vakioissa on kriittinen. Joissakin tapauksissa arvioitu k g saattaa olla suurempi kuin k 2.) Tällöin voidaan soveltaa vaihtoehtoista (eli massaperusteista) lähestymistapaa, joka toimii myös silloin, kun ensimmäisen asteen kinetiikka ei päde. Tällöin ei tarvitse tehdä korjauksia. Tätä lähestymistapaa käsitellään osan lopussa. Kasvuvakion vähennysmenetelmä korjaamiseksi kasvun mukaan Standardimenetelmässä yksittäisten kalojen painot ja pituudet muunnetaan luonnollisiksi logaritmeiksi ja sekä käsittely- että vertailuryhmien ln(paino)- tai ln(l/paino)-arvoja verrataan erikseen aikaan (vrk). Kertymä- ja poistumavaiheen tiedot käsitellään samalla tavalla erikseen. Kasvun aiheuttaman liukenemisen mukaan tehtävässä korjauksessa on tavallisesti parempi käyttää koko tutkimuksen ajalta saatuja painotietoja poistumavakion (k g) johtamiseksi. Jos kertymä- ja poistumavaiheita varten johdetuissa kasvuvakioissa on tilastollisesti suuria eroja, voi olla tarpeen käyttää poistumavakiota. Vesitutkimuksissa saatuja testi- ja vertailuryhmien yleisiä kasvuvakioita voidaan käyttää käsittelyn mahdollisten vaikutusten tarkistamiseksi. Lineaarinen pienin neliösumma lasketaan, jotta saadaan lineaarinen eli ln(kalojen paino) vuorokautta kohti (tai ln(1/paino) vuorokautta kohti) kussakin ryhmässä (testi- ja vertailuryhmissä ja yksilökohtaisten tietojen perusteella, ei päivittäisten keskiarvojen mukaan) koko testiajalta. Kertymä- ja poistumavaiheiden osalta käytetään standardeja tilastomenetelmiä. Suorien leikkauspisteiden varianssit lasketaan, ja niitä käytetään leikkauspisteiden välisten erojen (kasvuvakiot) tilastollisen merkityksen arvioimiseksi (p = 0,05) Studentin t-testillä (tai ANOVA-testillä, jos testataan useampia pitoisuuksia). Kasvun mukaan tehtävässä korjaamisessa suositaan yleisesti painotietoja. Pituustiedot käsitellään samalla tavalla, ja niitä voidaan hyödyntää vertailtaessa käsittelystä johtuvia vaikutuksia vertailu- ja testiryhmissä. Jos painotiedoissa ei analyysin mukaan ole tilastollisesti merkittävää eroa, testi- ja vertailuryhmien tiedot voidaan yhdistää ja koko tutkimusta varten laskea kalojen yleinen kasvuvakio (k g) lineaarisen korrelaation yleisestä kaltevuudesta. Jos havaitaan tilastollisesti merkittäviä eroja, kunkin kalaryhmän ja/tai tutkimusvaiheen kasvuvakiot ilmoitetaan erikseen. Kunkin käsitellyn ryhmän kasvuvakioita käytetään kyseisen ryhmän osalta kasvun aiheuttaman liukenemisen mukaan tehtävässä korjaamisessa. Jos kertymä- ja poistumavakioissa havaitaan tilastollisesti merkittäviä eroja, käytetään poistumavaiheen johdettuja kasvuvakioita. Laskettu kasvuvakio (k g ilmaistuna vrk-1) voidaan vähentää yleisestä poistumavakiosta (k 2), jolloin saadaan poistumavakio k 2g.
Kertymävakio jaetaan kasvukorjatulla poistumavakiolla, jolloin saadaan kasvukorjattu kineettinen BCF, eli BCFKg (tai BMFKg).
Ravinnon välityksellä tehtävää tutkimusta varten johdettua kasvuvakiota käytetään myös yhtälössä A7.5 kasvukorjatun BMFKg:n määrittämiseksi (ks. lisäys 7). Massaperusteinen menetelmä kasvun mukaan korjaamisessa Seuraavassa kuvattua menetelmää voidaan käyttää edellä kuvatun ”kasvuvakion vähennysmenetelmän” sijasta, jolloin arvoja ei tarvitse korjata kasvun takia. Periaatteena on, että poistumatietoja käytettäessä huomioidaan kokonaisten kalojen massa pitoisuuden sijasta. Poistumavaiheessa kudoksista mitatut pitoisuudet (testiaineen massa / kalojen massayksikkö) muunnetaan testiaineen massaksi suhteessa kaloihin. Sitten pitoisuudet ja yksittäisten kalojen painot yhdistetään taulukkoon (esimerkiksi tietokonepohjaista laskentataulukkoa käyttäen) ja jokainen pitoisuus kerrotaan kyseisellä mittauskerralla saadulla kalojen yhteispainolla, jolloin saadaan testiaineen massa suhteessa kaloihin kaikissa poistumavaiheen näytteissä. Tuloksena saatua testiaineen massatietojen luonnollista logaritmia verrataan kokeen ajankohtaan (poistumavaihe), kuten yleensäkin. Vesialtistusmenetelmässä kertymävakio johdetaan rutiininomaisesti (ks. osat 4 ja 6). On huomattava, että ”normaalia”k 2-arvoa pitäisi käyttää käyrien sovitusyhtälöissä k 1-arvon osalta ja johtaa poistumavakio edellä mainituista tiedoista. Poistumavakioksi saatava arvo ei ole riippuvainen kasvusta, koska se on johdettu massaperusteisesti kokonaisten kalojen painon perusteella. Näin ollen sen tunnuksena on k 2g,ei k 2. 8. RASVAPITOISUUDEN NORMALISOINTI VIIDEN PROSENTIN RASVAPITOISUUDEN MUKAISESTI (KOSKEE AINOASTAAN VESIALTISTUSMENETELMÄÄ) Vesialtistustesteissä saadut (kineettiset ja tasapainotilan) BCF-tulokset pitäisi myös ilmoittaa suhteessa kalojen viiden prosentin vakiorasvapitoisuuteen (tuorepainosta), paitsi jos voidaan esittää, ettei testiaine keräänny ensisijaisesti rasvaan (esimerkiksi jotkut perfluoratut aineet saattavat sitoutua proteiineihin). Pitoisuus kaloissa, tai BCF, on muunnettava vastaamaan viiden prosentin rasvapitoisuutta tuorepainoon nähden. Jos testiaineen pitoisuus ja rasvapitoisuus on mitattu samoista kaloista kaikissa näytteenottopisteissä, jokainen yksittäiseltä kalalta mitattu pitoisuus on korjattava kyseisen kalan rasvapitoisuuden mukaan.
jossa
Jos rasvapitoisuutta ei ole analysoitu kaikista näytteeksi otetuista kaloista, BCF normalisoidaan keskimääräisen rasvapitoisuuden perusteella. Tasapainotilan BCF määritetään kertymävaiheen lopussa käsittelyryhmän kaloille kirjatun keskiarvon perusteella. Kineettisen BCF:n normalisoinnissa saatetaan joissakin tapauksissa tarvita toisenlaista lähestymistapaa. Näin on esimerkiksi silloin, kun rasvapitoisuus on muuttunut huomattavasti joko kertymä- tai poistumavaiheen aikana. Ruokkimistaajuuden pitäisi kuitenkin aina olla sellainen, ettei rasvapitoisuudessa juuri tapahdu dramaattisia muutoksia.
jossa
LÄHDEKIRJALLISUUS
Lisäys 6 YHTÄLÖT VESIALTISTUSTESTISSÄ: MINIMOITU TESTIJÄRJESTELY Tämän lähestymistavan perusteena on, että kattavassa testissä biokertyvyystekijä voidaan määrittää joko tasapainotilan biokertyvyystekijänä (BCFSS) vertaamalla toisiinsa testiaineen pitoisuutta kaloissa ja vedessä tai kineettisenä biokertyvyystekijänä (BCFK) laskemalla kertymävakion k 1 ja poistumavakion k 2 välinen suhde. BCFK on pätevä siinäkin tapauksessa, ettei aineen pitoisuudessa saavuteta kertymävaiheen aikana tasapainotilaa, mikäli kertymä ja poistuma noudattavat likimäärin ensimmäisen asteen kineettisiä prosesseja. Jos testiaineen pitoisuus kudoksissa (C f1) mitataan altistuksen päättyessä (t 1) ja sama pitoisuus mitataan uudelleen (C f2) tietyn ajan kuluttua (t 2), poistumavakio (k 2) voidaan arvioida soveltamalla lisäyksessä 5 kuvattua yhtälöä A5.22. Tämän jälkeen kertymävakio k 1 voidaan määrittää matemaattisesti soveltamalla liitteessä 5 esitettyä yhtälöä A5.23 (jossa C f on sama kuin C f1 ja t sama kuin t 1) (1). Minimoidussa testijärjestelyssä kineettinen biokertyvyystekijä (jota kuvataan tunnuksella BCFKm sen erottamiseksi muilla menetelmillä määritetyistä kineettisistä biokertyvyystekijöistä) on seuraavanlainen:
Pitoisuudet tai tulokset on korjattava kasvun aiheuttaman liukenemisen mukaan ja normalisoitava kalojen viiden prosentin rasvapitoisuuden perusteella, kuten todetaan liitteessä 5. Minimoidussa testijärjestelyssä BCFSS vastaa kertymävaiheen lopussa mitattua BCF:ää kun oletuksena on, että tasapainotila on saavutettu. Tämä on vain oletus, koska näytteenottopisteiden määrä ei riitä vahvistamaan tietoa.
jossa C f-minSS = pitoisuus kaloissa oletetussa tasapainotilassa kertymävaiheen lopussa (mg kg– 1 tuorepaino). C w-minSS = pitoisuus vedessä oletetussa tasapainotilassa kertymävaiheen lopussa (mg l– 1). LÄHDEKIRJALLISUUS
Lisäys 7 YHTÄLÖT RAVINTOALTISTUSTESTISSÄ
1. ESIMERKKI SOPIVAN KAUPALLISESTI SAATAVAN KALANRUOAN ERI AINESOSIEN MÄÄRISTÄ
2. ESIMERKKEJÄ TEKNIIKOISTA TESTIAINEEN LISÄÄMISEKSI RUOKAAN Yleistä Vertailuryhmälle annettava ruoka pitäisi valmistaa muuten täysin samalla tavalla kuin testiainetta sisältävä ruoka, mutta siihen ei lisätä testiainetta. Käsitellyn ruoan pitoisuuden tarkistamiseksi ruoka-annoksesta otetaan kolme näytettä soveltuvalla talteenottomenetelmällä ja niistä mitataan testiaineen pitoisuus tai radioaktiivisuus. On osoitettava suuri saanto analyysia varten (> 85 %) siten, että näytteiden välinen vaihtelu on pientä (testiaineen pitoisuus kolmessa ennen testin alkua otetussa näytteessä ei saisi poiketa enemmän kuin ± 15 prosenttia keskiarvosta). Ravintoaltistustestissä pitäisi kerätä analysoitavaksi kolme näytettä päivänä 0 sekä kertymävaiheen lopussa, jotta voidaan määrittää testiaineen pitoisuus ruoassa. Kalanruoan valmistaminen testimateriaalin ollessa nestemäistä (puhdasta) Käsitellylle kalanruoalle määritetään nimellinen tavoitearvo testiaineen pitoisuutta varten. Se voi olla esimerkiksi 500 μg testiainetta grammassa ruokaa. Sopiva määrä (moolimassana tai tietyn radioaktiivisuuden perusteella) puhdasta testiainetta lisätään tiettyyn määrään kalanruokaa lasipurkissa tai pyöröhaihdutuspullossa. Kalanruoan massan pitäisi olla sellainen, että se riittää poistumavaiheen ajaksi (ottaen huomioon, että annosmäärää pitää kasvattaa jokaisella ruokintakerralla kalojen kasvun mukaisesti). Kalanrehun ja testiaineen pitäisi antaa sekoittua keskenään yön yli hitaasti pyörivässä sekoittimessa (esimerkiksi pyörivän sekoittimen tai rotaatiomenetelmän avulla, jos käytössä on pyöröhaihdutuspullo). Testiainetta sisältävä ruoka pitäisi varastoida ennen käyttöä siten (esim. kylmässä), että testiaineen pitoisuus pysyy rehuseoksessa vakaana käyttöön asti. Kalanruoan valmistaminen, kun kantaja-aineena käytetään maissi- tai kalaöljyä Kiinteät testiaineet jauhetaan morkkelissa hienoksi jauheeksi. Nestemäiset testiaineet voidaan lisätä suoraan maissi- tai kalaöljyyn. Testiaine liuotetaan tiettyyn määrään maissi- tai kalaöljyä (esim. 5–15 ml). Öljyannos siirretään kvantitatiivisesti sopivan kokoiseen pyöröhaihdutuspulloon. Öljyannoksen valmistelussa käytetty pullo pitäisi huuhdella kahdella pienellä öljyalikvootilla, jotka lisätään pulloon sen varmistamiseksi, että liuennut testiaine saadaan siirrettyä kokonaisuudessaan. Jotta aine liukenisi tai hajoaisi varmasti öljyyn (tai jos testataan useampaa kuin yhtä ainetta), käytetään lisäksi mikrosekoitinta, pullo suljetaan ja seosta sekoitetaan nopealla tahdilla yön yli. Testin kannalta sopiva määrä kalanruokaa (yleensä pelletteinä) lisätään pulloon ja pullon sisältö sekoitetaan tasalaatuiseksi pyörittämällä pulloa yhtäjaksoisesti vähintään 30 minuutin ajan, kuitenkin mieluiten yön yli. Tämän jälkeen testiainetta sisältävä ruoka varastoidaan asianmukaisesti (esim. kylmässä) sen varmistamiseksi, että testiaineen laatu pysyy ruoassa vakaana käyttöön asti. Kalanruoan valmistaminen, kun käytetään orgaanista liuotinta Riittävä määrä testiainetta (moolimassan tai erityisen radioaktiivisuuden mukaan) tavoitellun annoksen saamiseksi liuotetaan sopivaan orgaaniseen liuottimeen (esim. sykloheksaanilla tai asetonilla määrä on 10–40 ml; tarvittava määrä voi olla suurempi riippuen siitä, mihin määrään ruokaa testiainetta on tarkoitus lisätä). Liuoksen alikvootti tai liuos kokonaisuudessaan (riippuen lisätystä annoksesta) sekoitetaan sellaiseen massaan kalanruokaa, joka riittää testissä vaaditun nimellisen annoskoon saamiseksi. Ruoka ja testiaine voidaan sekoittaa keskenään ruostumattomassa sekoitusmaljassa ja tuoreena annosteltu kalanruoka voidaan jättää laboratoriokaappiin kahdeksi vuorokaudeksi (välillä sekoittaen) ylimääräisen liuottimen haihduttamiseksi, tai ne voidaan sekoittaa pyöröhaihdutuspullossa jatkuvalla rotaatiolla. Ylimääräinen liuotin voidaan tarvittaessa ”puhaltaa” pois ilmavirran tai typpikaasun avulla. Tällöin on varmistettava, ettei testiaine kiteydy liuottimen haihtuessa. Testiainetta sisältävä ruoka pitäisi varastoida siten (esim. kylmässä), että testiaineen pitoisuus pysyy rehuseoksessa vakaana käyttöön asti. 3. ASSIMILAATIOTEHON JA BIOMAGNIFIKAATIOKERTOIMEN LASKEMINEN Assimilaatiotehon laskemista varten on ensin arvioitava yleinen poistumavakio liitteen 5 osassa 4 kuvatulla tavalla (vaiheittaista menetelmää eli standardia lineaarista regressiota soveltaen) ja käyttäen poistumavaiheessa otettujen näytteiden keskipitoisuutta. Ruokkimistaajuusvakio I ja kertymävaiheen kesto t ovat tiedossa olevat tutkimusparametrit. C ruoka, eli testiaineen keskimääräinen pitoisuus ruoassa on muuttuja, jota tutkimuksessa mitataan. C 0,d, eli testiaineen pitoisuus kaloissa kertymävaiheen lopussa, johdetaan tavallisesti ln(konsentraation) ja poistumavaiheen kyseisen päivän leikkauspisteestä. Aineen assimilaatioteho (a, testiaineen absorboituminen suolistossa) lasketaan seuraavasti:
jossa C 0,d = johdettu pitoisuus kaloissa poistumavaiheen nolla-ajankohtana (mg kg– 1) k 2 = yleinen (ei kasvukorjattu) poistumavakio (vrk– 1), joka on laskettu liitteen 5 osassa 3 esitettyjen yhtälöiden mukaisesti I = ruoan imeytymisvakio (g ruokaa g– 1 kalaa vrk– 1) C ruoka = pitoisuus ruoassa (mg kg– 1 ruokaa) t= ruokintajakson kesto (vrk) Laskennassa käytettyä ruokkimistaajuutta I voidaan kuitenkin joutua korjaamaan kalan kasvun mukaan tarkan assimilaatiotehon a määrittämiseksi. Jos kalat kasvavat merkittävästi testin kertymävaiheen aikana (eikä annettuja rehumääriä korjata valitun ruokkimistaajuuden ylläpitämiseksi), todellinen ruokkimistaajuus pienenee kertymäajan edetessä asetettuun määrään nähden, jolloin ”todellinen” assimilaatioteho on suurempi. (Huomaa, ettei tällä ole merkitystä BMF:n yleisessä laskennassa, koska I kumoaa tosiasiassa yhtälöiden A7.1 ja A7.4 keskinäisen vaikutuksen.) Kasvun aiheuttaman liukenemisen mukaan korjattu keskimääräinen ruokkimistaajuus I g voidaan johtaa useilla eri tavoilla, mutta yksinkertaisin ja perusteellisin tapa on käyttää tiedossa olevaa kasvuvakiota (k g) testikalojen painon arvioimiseksi kertymävaiheen eri ajankohtina:
jossa W f(t)= kalojen keskipaino kertymävaiheen päivänä t W f,0 = kalojen keskipaino kokeen alkaessa. Näin voidaan arvioida (vähintään) kalojen keskipaino altistuksen viimeisenä päivänä (W f,altistuksen loppu). Koska ruokkimistaajuuden määritysperusteena on ollut W f,0, todellinen ruokkimistaajuus kunakin kertymävaiheen päivänä voidaan laskea kyseisten kahden painon arvon perusteella. Kasvukorjattu ruokkimistaajuus I g (g ruokaa g– 1 kalaa vrk-1), jota on käytettävä I:n sijasta, jos kalat kasvavat nopeasti kertymävaiheessa, voidaankin laskea seuraavasti:
Kun assimilaatioteho on määritetty, BMF voidaan laskea kertomalla se ruokkimistaajuusvakiolla I (tai I g, jos se on α:n laskentaperusteena) ja jakamalla tulo yleisellä poistumavakiolla k 2:
Kasvukorjattu biomagnifikaatiokerroin pitäisi laskea samalla tavalla käyttäen kasvukorjattua poistumavakiota (joka on johdettu liitteen 5 osassa 7 kuvatulla tavalla). Jos α:n laskentaperusteena on ollut I g, sitä pitäisi tässäkin käyttää I:n sijasta:
jossa α = assimilaatioteho (testiaineen absorboituminen suolistossa) k 2 = yleinen (ei kasvukorjattu) poistumavakio (vrk-1), joka on laskettu liitteen 5 osassa 3 esitettyjen yhtälöiden mukaisesti k 2g = kasvukorjattu poistumavakio (vrk– 1) I = ruoan imeytymisvakio (g ruokaa g– 1 kalaa vrk– 1) Kasvukorjattu puoliintumisaika (t 1/2) lasketaan seuraavasti:
Testiaineen assimilaatioteho ruoassa voidaan myös arvioida, jos kudoksissa todetaan jäämiä kertymävaiheen lineaarisessa vaiheessa (vuorokausien 1 ja 3 välisenä aikana). Tällöin assimilaatioteho (α) voidaan määrittää seuraavasti:
jossa C kala (t) = testiaineen pitoisuus kaloissa ajankohtana t (mg kg– 1 tuorepainosta). 4. KORJAAMINEN RASVAPITOISUUDEN MUKAAN Jos rasvapitoisuus on kaikilla näytteenottoväleillä mitattu samoista kaloista, joille on tehty myös kemiallinen analyysi, yksittäiset pitoisuudet korjataan rasvapitoisuuden mukaan ja (rasvapitoisuuden mukaan korjattua) lineaarista konsentraatiota verrataan poistuma-ajankohtaan (vrk), jolloin voidaan määrittää C 0,d ja k 2. Tämän jälkeen assimilaatioteho (yhtälö A7.1) voidaan laskea rasvapitoisuuden perusteella käyttämällä rasvapitoisuuteen perustuvaa arvoa C ruoka (eli C ruoka kerrotaan ruoan sisältämän rasvan keskiarvolla). Tämän jälkeen laskennassa käytettävät yhtälöt A7.4 ja A7.5 antavat suoraan tulokseksi rasvapitoisuuden (ja kasvun aiheuttaman liukenemisen) mukaan korjatun BMF:n. Muutoin rasvan keskimääräinen osuus (tuorepainosta) kaloissa ja ruoassa johdetaan sekä käsittely- että vertailuryhmissä (ruoan ja vertailuryhmän kalojen osalta tavallisesti mittaustiedoista, jotka on saatu altistuksen alkaessa ja päättyessä; käsittelyryhmän kaloilla tavallisesti vain mittaustiedoista, jotka on saatu altistuksen päättyessä). Joissakin tutkimuksissa kalojen rasvapitoisuus voi nousta selvästi. Tällöin on parempi käyttää kalojen keskimääräistä rasvapitoisuutta, joka on laskettu altistusvaiheen ja poistumavaiheen lopussa mitatuista arvoista. Molempien rasvaosuuksien johtamisessa käytetään tavallisesti vain käsittelyryhmästä saatuja tietoja. Rasvapitoisuuden korjauskerroin (Lc ) lasketaan seuraavasti:
jossa L kala on keskimääräinen rasvaosuus kaloissa ja L ruoka on keskimääräinen rasvaosuus ruoassa. Rasvapitoisuuden korjauskerrointa käytetään rasvakorjatun biomagnifikaatiokertoimen (BMFL) laskennassa:
5. NOLLA-AJANKOHDAN MITATUN PITOISUUDEN (C 0,M) JA NOLLA-AJANKOHDAN JOHDETUN PITOISUUDEN (C 0,D) VÄLISTEN EROJEN ARVIOINTI Nolla-ajankohdan mitattua pitoisuutta (C 0,m) ja nolla-ajankohdan johdettua pitoisuutta (C 0,d) pitäisi verrata toisiinsa. Jos ne ovat keskenään hyvin samanlaiset, poistumakauden muuttujat kannattaa johtaa käyttäen ensimmäisen asteen mallia. Joissakin tutkimuksissa nolla-ajankohdan johdettu arvo C 0,d saattaa poiketa selvästi nolla-ajankohdan mitatusta keskipitoisuudesta C 0,m (ks. tätä testimenetelmää käsittelevän 159 kohdan viimeinen luetelmakohta). Jos C 0,d on paljon pienempi kuin C 0,m (C 0,d << C 0,m), se voi olla merkki siitä, ettei testiainetta sisältävä ruoka ole vielä kokonaan sulanut suolistossa. Tämä voidaan myös tarkistaa kokeellisesti irrottamalla suolisto ja analysoimalla se erikseen, jos kertymävaiheen päättyessä on otettu näytteeksi ylimääräisiä (kokonaisia) kaloja ja ne varastoitu. Jos poistumavaiheen lineaariseen regressioon sovellettu tilastollisesti pätevä poikkeamatesti osoittaa, että poistumavaiheen ensimmäisen näytteenottopisteen tulos on liian korkea, voi olla suositeltavaa soveltaa lineaarista regressiota k 2:n johtamisessa mutta jättää ensimmäinen poistumavaiheessa mitattu pitoisuus huomioimatta. Jos lineaariseen regressioon liittyvä epävarmuus vähenee huomattavasti ja on selvää, että poistumavaihe noudattaa ensimmäisen asteen kinetiikkaa, assimilaatiotehon laskennassa voi olla hyvä käyttää tuloksena saatuja arvoja C 0,d ja k 2. Tämä on perusteltava kattavasti testiraportissa. On myös mahdollista, että poistumavaihe noudattaa muuta kuin ensimmäisen asteen kinetiikkaa. Jos tämä on todennäköistä (eli luonnolliseksi logaritmiksi muunnetut tiedot näyttävät noudattavan käyrää verrattuna vaakasuoraan lineaariseen regressioon), k 2- ja C 0,d-arvojen laskutoimitukset eivät todennäköisesti päde ja olisi pyydettävä neuvoa biostatistiikan asiantuntijalta. Jos C 0,d on hyvin paljon suurempi kuin mitattu arvo (C 0,d >> C 0,m), se voi olla merkki jostakin seuraavista: aine on poistunut hyvin nopeasti (eli näytteenottopisteet ovat lähellä sovelletun analyysimenetelmän kvantifiointirajaa jo hyvin varhain poistumavaiheessa, ks. osa 6 jäljempänä), poistuma poikkeaa ensimmäisen asteen kinetiikasta, k 2:n ja C 0,d:n johtamisessa käytetty lineaarinen regressio on virheellinen tai mitatuissa pitoisuuksissa on ollut ongelmia joinakin näytteenottoajankohtina. Tällöin lineaarinen regressiokäyrä on tarkistettava osoittamalla näytteet, jotka ovat kvantifiointirajalla tai lähellä sitä, poikkeamat sekä käyrän selvä kaarevuus (jolloin voidaan olettaa, ettei ensimmäisen asteen kinetiikka päde). Nämä asiat on myös mainittava testiraportissa. Jos lineaarinen regressio arvioidaan uudelleen arvoja koskevien arvioiden parantamiseksi, tämä toimenpide on kuvattava ja perusteltava. Jos havaitaan, että poikkeama ensimmäisen asteen kinetiikasta on merkittävä, lasketut k 2 ja C 0,d eivät todennäköisesti päde ja on pyydettävä neuvoa biostatistiikan asiantuntijalta. 6. OHJEITA TESTIAINEILLE, JOILLA POISTUMA ON HYVIN NOPEAA Kuten tämän testimenetelmän 129 kohdassa todetaan, jotkut aineet poistuvat niin nopeasti, ettei nolla-ajankohdan pitoisuutta C 0,d ja k 2-arvoa voida johtaa luotettavasti, koska testiainetta ei enää havaita (pitoisuudet ovat kvantifiointirajalla) poistumavaiheen varhaisessa vaiheessa otetuissa näytteissä (eli toisesta poistumavaiheen näytteestä alkaen). Tämän testimenetelmän tueksi tehdyssä yhteistutkimuksessa havaittiin, että bentso[a]pyreenilla tilanne oli tällainen. Tämä esitetään myös menetelmän validointiselosteessa. Tällöin lineaarista regressiota ei voida tehdä luotettavasti, koska se antaa todennäköisesti epärealistisen korkean arvion C 0,d-arvosta, jolloin assimilaatioteho näyttää olevan paljon suurempi kuin 1. Tällaisissa tapauksissa on mahdollista laskea k 2 ja BMF:n yläarvo suuntaa-antavasti. Käyttämällä niitä poistumavaiheen datapisteitä, joissa pitoisuus mitattiin – mukaan lukien ensimmäinen piste, jossa pitoisuus oli ”ei-havaittava” (eli kvantifiointirajalla) –k 2 voidaan arvioida lineaarisen regression perusteella (käyttämällä luonnolliseksi logaritmiksi muunnettua pitoisuustietoa suhteutettuna aikaan). Tällaisissa tapauksissa kyseeseen tulee todennäköisesti vain kaksi datapistettä (esim. poistumavaiheen näytteenottopäivät 1 ja 2) ja k 2 voidaan sitten arvioida soveltamalla liitteessä 5 kuvattua yhtälöä A5.22. Arvioitua k2-arvoa voidaan käyttää assimilaatiotehon arvioimiseksi yhtälön A7.1 mukaan korvaamalla C0,d-arvo yhtälössä mitatulla nolla-ajankohdan pitoisuudella (C0,m) tapauksissa, joissa C0,d on selvästi arvioitu suuremmaksi kuin mitä testissä olisi ollut mahdollista saavuttaa. Jos C0,m-arvoa ei voitu mitata, pitäisi käyttää kalojen kudoksiin sovellettavaa havaitsemisrajaa. Jos joissakin tapauksissa saadaan tällöin tulokseksi α > 1, assimilaatiotehon oletetaan ”pahimmassa tapauksessa” olevan 1. Sitten voidaan arvioida suurin mahdollinen BMFK käyttämällä yhtälöä A7.4, ja se pitäisi ilmoittaa ”paljon pienempi kuin” -arvona (<<). Jos tutkimuksen ruokkimistaajuus on 3 prosenttia, poistumavaiheen puoliintumisaika on vähemmän kuin kolme vuorokautta ja α on ”pahimmassa tapauksessa” 1, BMFK on todennäköisesti alle 0,13. Kun otetaan huomioon tämän arvioinnin tarkoitus sekä se, että arvot ovat luonteeltaan suuntaa-antavia, niitä ei ole tarpeen korjata kasvun aiheuttaman liukenemisen tai kalan ja ruoan rasvapitoisuuden mukaan. Lisäys 8 LÄHESTYMISTAVAT ALUSTAVIEN BCF-ARVOJEN ARVIOIMISEKSI RAVINTOALTISTUSTESTISSÄ KERÄTTYJEN TIETOJEN PERUSTEELLA Ravintoaltistusta käytetään osana tätä testimenetelmää sellaisten aineiden bioakkumulaation määrittämiseksi, joita ei voida käytännössä testata vesialtistusmenetelmällä. Vesialtistusmenetelmän avulla saadaan biokertyvyystekijä, kun taas ravintoaltistusmenetelmässä saadaan suoraan tietoa ravintoon liittyvästä biomagnifikaatiopotentiaalista. Monissa kemikaaliturvallisuutta koskevissa järjestelmissä edellytetään tietoa biokertyvyydestä vedessä (kuten riskiarvioinnissa ja kemikaalien maailmanlaajuisesti yhdenmukaistetussa luokitus- ja merkintäjärjestelmässä). Näin ollen ravintotutkimuksessa saatuja tietoja tarvitaan biokertyvyystekijän arvioimiseksi siten, että sitä voidaan verrata vesialtistusmenetelmän mukaan tehtyihin testeihin (94). Tässä osassa käsitellään lähestymistapoja, jotka mahdollistavat edellä mainitun mutta tunnustavat arviointiin luontaisesti liittyvät puutteet. Ravintotutkimuksessa mitataan poistuma poistumavakion k 2 määrittämiseksi. Jos kertymävakio voidaan arvioida saatavilla olevien tietojen perusteella silloin, kun kalat on altistettu testiaineelle veden välityksellä, voidaan arvioida myös kineettinen BCF. Vesialtistuksessa testiaineen kertymävakiota koskeva arvio perustuu monilta osin olettamuksiin, jotka kaikki lisäävät arvion epävarmuustekijöitä. Kun tätä lähestymistapaa käytetään BCF:n arvioinnissa, oletuksena on, ettei yleinen poistumavakio (mukaan lukien siihen vaikuttavat tekijät, kuten leviäminen kehossa ja yksittäiset poistumisprosessit) ole riippuvainen altistustekniikasta, jota on käytetty testiaineen kertymän osoittamisessa. Arvioihin perustuvan lähestymistavan pääolettamat voidaan tiivistää seuraavassa esitetyllä tavalla. Ravintoaltistuksen kertymävaihetta seuraava poistuma noudattaa tietyllä aineella samaa kaavaa kuin vesialtistuksessa. Vedestä saatava kertymä noudattaa mahdollisesti ensimmäisen asteen kinetiikkaa. Kertymän arvioinnissa sovelletusta menetelmästä riippuen
kertymän arviointimenetelmän kehittämisessä käytetty tietokanta (”harjoitussarja”) antaa edustavan kuvan tutkimuksen kohteena olevasta aineesta. Useissa kaikille avoimesta kirjallisuudesta löytyvissä julkaisuissa esitellään johdettuja yhtälöitä, joissa liitetään veden välityksellä tapahtuva kertymä kalan kiduksissa aineen oktanoli-vesi-jakaantumiskertoimeen, kalojen painoon (1) (2) (3) (4), määrään ja/tai rasvapitoisuuteen, limakalvojen läpäisevyyteen/diffuusioon niiden kautta (5) (6), kalojen ilmanvaihtovolyymiin (7) fugasiteettiin tai massaan perustuvassa lähestymistavassa (8) (9) (10). Kyseisten menetelmien käyttöä tässä yhteydessä arvioidaan yksityiskohtaisesti Crookesin & Brooken teoksessa (11). Barberin julkaisu (12), jossa käsitellään bioakkumulaation mallintamista ravinnon välityksellä tapahtuvassa kertymässä, on myös hyödyllinen tässä yhteydessä, koska siinä esitellään kudosten kautta tapahtuvaa kertymää koskevia malleja. Vuonna 2014 julkaistun ravintoprotokollan (13) tausta-asiakirjassa yksi osa oli myös varattu kokonaan tämän näkökulman käsittelyyn. Useimmat näistä malleista on ilmeisesti johdettu käyttäen apuna rajallisia tietokantoja. Sellaisten mallien osalta, joiden muodostamisessa käytettyjen tietokantojen tarkat tiedot ovat saatavilla, näyttää siltä, että käytettyjen ainetyyppien rakenne ja luokitus ovat usein samankaltaisia (esim. toimivuuden kannalta, kuten orgaanisilla klooreilla). Tämä lisää epävarmuutta silloin, kun käytetään jotakin mallia tyypiltään erilaisen aineen kertymävakion ennustamisessa testikohtaisten piirteiden, kuten muun muassa lajien ja lämpötilan, ohella. Käytössä olevien tekniikoiden tarkastuksen yhteydessä (11) kävi ilmi, ettei mikään menetelmä ole muita ”oikeampi”. Näin ollen valittu malli on perusteltava selkeästi. Jos tarjolla on useita menetelmiä, joiden käyttö on perusteltavissa, kannattaa mahdollisesti esittää useita arvioita k 1-arvosta (ja BCF:stä) tai k 1-arvojen (ja BCF:n) vaihteluväli useiden kertymään sovellettavien arviointimenetelmien mukaisesti. Koska mallien tyypit ja niissä käytetyt tietosarjat eroavat toisistaan, eri tavalla johdettujen arvioiden keskiarvoa ei ole tarkoituksenmukaista käyttää. Jotkut tutkijat ovat esittäneet, että tämän kaltaiset BCF-arviot on korjattava biologisen hyötyosuuden perusteella, jotta voidaan ottaa huomioon aineen absorboituminen liuenneeseen orgaaniseen hiileen (DOC) vesialtistuksessa. Näin arvio voidaan mukauttaa vesialtistustutkimusten tuloksiin (esim. (13) (14)). Tämä korjaus ei kuitenkaan aina ole tarkoituksenmukaista, koska vesialtistustutkimuksessa tarvittavan orgaanisen hiilen taso ”pahimmassa tapauksessa” -arviota varten on niin alhainen (biologisesti hyödynnettävän aineen osuus suhteessa liuoksessa mitattuun aineeseen). Erittäin hydrofobisilla aineilla kudosten pinnan lähellä tapahtuvan passiivisen diffuusion taso saattaa rajoittaa kudosten kautta tapahtuvaa kertymää. Tällöin on mahdollista, että korjaus on oleellisempaa tämän vaikutuksen kannalta kuin sen vaikutuksen kannalta, jota varten se on alun perin suunniteltu. On suositeltavaa keskittyä menetelmiin, jotka edellyttävät syötteitä, joille on jo saatavissa tietoa tässä kuvatun ravintotutkimuksen mukaisesti testattavista aineista (kuten log K OW, kalojen paino). Monimutkaisempia syötteitä edellyttäviä menetelmiä voidaan myös soveltaa, mutta niissä on mahdollisesti tehtävä testin aikana suurempi määrä mittauksia tai niissä tarvitaan sellaista yksityiskohtaista tietoa testiaineesta tai kalalajista, joka ei ole vielä yleisesti saatavilla. Lisäksi mallin valinnassa saattavat vaikuttaa sen validointitaso ja soveltamisala (ks. (11) eri menetelmien tarkistamisesta ja vertailusta). On pidettävä mielessä, että saatava k 1-arvio sekä arvioitu BCF ovat epävarmoja ja ne on arvioitava todistusnäyttöön perustuvan lähestymistavan sekä johdetun BMF:n ja aineen muuttujien (kuten molekyylikoko) perusteella, jotta saataisiin kokonaiskuva kyseisen aineen bioakkumulaatiopotentiaalista. Näiden muuttujien tulkinta ja käyttö saattavat riippua sovellettavasta säädöskehyksestä. LÄHDEKIRJALLISUUS
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
17) |
Korvataan C osassa oleva C.20 luku seuraavasti: ”C.20 Lisääntymistesti vesikirpulla (Daphnia magna) JOHDANTO Tämä testimenetelmä vastaa OECD:n testiohjetta (TG) nro 211 (2012). OECD:n testiohjeita tarkistetaan säännöllisesti tieteen kehityksen perusteella. Lisääntymistestin yleisohje 211 on peräisin testiohjeen 202 II osasta, Daphnia-lajin vesikirppujen lisääntymistesti (Daphnia sp. reproduction test) (1984) On yleisesti tunnustettu, että tiedot testeistä, jotka tehtiin testiohjeen 202 perusteella, voivat olla vaihtelevia. Siksi pyrittiin panostamaan huomattavasti tämän vaihtelun syiden tunnistamiseen. Tavoitteena oli saada aikaan parempi testimenetelmä. Testiohje 211 perustuu näiden tutkimusten, yhteistutkimusten ja vuonna 1992 (1), 1994 (2) ja 2008 (3) tehtyjen validointitutkimusten tuloksiin. Lisääntymistestin ohjeen alkuperäisen version (testiohje 202, 1984) ja toisen version (testiohje 211, 1988) väliset pääasialliset erot ovat seuraavat:
Käytetyt määritelmät on esitetty lisäyksessä 1. TESTIN PERIAATE Testin pääasiallinen tarkoitus on määrittää kemikaalien vaikutus Daphnia magna-vesikirpun lisääntymistuotokseen. Tästä syystä nuoria naarasvesikirppuja (emot), joiden ikä on alle 24 tuntia testin alussa, altistetaan testikemikaalille, jota on lisätty veteen useissa pitoisuuksissa. Testin kesto on 21 vuorokautta. Testin lopussa arvioidaan elävien jälkeläisten kokonaismäärä. Emojen lisääntymistuotos voidaan ilmaista muillakin tavoin (esim. elävien jälkeläisten määrä eläintä kohti päivässä siitä päivästä lähtien, jolloin jälkeläiset havaittiin ensimmäisen kerran), mutta tämä pitäisi ilmoittaa testin lopussa tuotettujen elävien jälkeläisten kokonaismäärän lisäksi. Koska puolistaattisella testillä on erityinen rakenne muihin selkärangattomien lisääntymistä koskeviin testimenetelmiin verrattuna, on myös mahdollista laskea kunkin yksittäisen emon elävien jälkeläisten määrä. Tämä mahdollistaa, toisin kuin muissa selkärangattomien lisääntymistä koskevissa testimenetelmissä, että jos emoeläin kuolee vahingossa ja/tai epähuomiossa testijakson aikana, sen jälkeläisten tuotanto voidaan jättää pois tietojen arvioinnista. Jos emojen kuolleisuus ilmenee altistetuissa rinnakkaisnäytteissä, olisi harkittava, seuraako kuolleisuus pitoisuusvastesuhdetta, eli onko vasteen regressio huomattava verrattuna testikemikaalin pitoisuuteen, joka on ylöspäin nouseva (tähän voidaan käyttää tilastollista testiä, kuten Cochran-Armitagen trenditestiä). Jos kuolleisuus ei seuraa pitoisuusvastesuhdetta, rinnakkaisnäytteet, joissa emo on kuollut, pitäisi jättää testin tuloksen arvioinnin ulkopuolelle. Jos kuolleisuus seuraa pitoisuusvastesuhdetta, emojen kuolleisuus pitäisi määrittää testikemikaalin vaikutukseksi, ja rinnakkaisnäytteitä ei pitäisi jättää arvioinnin ulkopuolelle. Jos emo kuolee testin aikana, joko vahingossa epäasianmukaisen käsittelyn tai tapaturman vuoksi tai epähuomiossa selittämättömän tapauksen vuoksi, joka ei liity testikemikaalin vaikutukseen, tai jos kyseessä on koiras, rinnakkainen eläin jätetään arvioinnin ulkopuolelle (lisätietoja on 51 kohdassa). Testikemikaalin toksinen vaikutus lisääntymistuotokseen ilmaistaan EXc-arvolla sovittamalla tiedot sopivaan malliin epälineaarisella regressiomenetelmällä, jolla arvioidaan pitoisuus, joka aiheuttaisi x prosentin vähennyksen lisääntymistuotoksiin, tai vaihtoehtoisesti NOEC/LOEC-arvolla (4). Testipitoisuudeksi olisi valittava alhaisin käytetyistä vaikuttavista pitoisuuksista (esim. EC10), mikä merkitsee, että tämä arvo lasketaan ekstrapoloinnin sijaan interpoloimalla. Myös emojen eloonjääminen ja ensimmäisten sikiöiden tuottamisen ajankohta on ilmoitettava. Muut kemikaaliin liittyvät vaikutukset muuttujiin, kuten kasvu (esim. pituus), ja mahdollisesti populaation kasvun ominaisnopeus voidaan myös tutkia (ks. 44 kohta). TESTIKEMIKAALIA KOSKEVIA TIETOJA Akuuttia toksisuutta koskevan tutkimuksen tulokset (ks. tässä liitteessä oleva C.2 luku: Daphnia sp. akuutin immobilisaation testi), joka tehdään Daphnia magna -vesikirpuille voi olla hyödyllinen valittaessa lisääntymistestien sopivat testipitoisuusalueet. Testikemikaalin vesiliukoisuus ja höyrynpaine on oltava tiedossa, ja kemikaalin kvantifioimiseksi testiliuoksissa on oltava käytettävissä luotettava analyysimenetelmä, jonka saantoteho on raportoitu, ja määritysraja pitäisi olla saatavissa. Testikemikaalia koskevia tietoja, joista on hyötyä testiolosuhteiden määrittelemiseksi, ovat mm. rakennekaava, kemikaalin puhtaus, valostabiilisuus, stabiilisuus testiolosuhteissa, pKa, Pow ja helpon biohajoavuuden testin tulokset (ks. tässä liitteessä oleva C.4 luku [biohajoavuuden määritys] ja C.29 luku [helpon biohajoavuuden testi – hiilidioksidi suljetuissa astioissa]). TESTIN VALIDITEETTI Jotta testi olisi luotettava, kontrollien pitäisi täyttää seuraavat perusteet:
Huomautus: samaa hyväksyttävyysperustetta (20 prosenttia) voidaan soveltaa emon vahingossa ja/tai epähuomiossa tapahtuvaan kuolemaan kontrolleissa sekä kutakin testipitoisuutta kohti. MENETELMÄN KUVAUS Laitteisto Astioiden ja muiden laitteiden, jotka joutuvat kosketuksiin testiliuosten kanssa, on oltava kokonaan lasia tai muuta kemiallisesti inerttiä materiaalia. Testiastiat ovat tavallisesti lasisia dekantterilaseja. Lisäksi tarvitaan seuraavia välineitä (kaikkia tai joitakin niistä):
Koe-eliö Testissä olisi käytettävä Daphnia magna Straus -eliötä (95). Klooni olisi mieluiten tunnistettava genotyypin määrityksellä. Tutkimuksissa (1) on osoitettu, että kloonin A (joka on peräisin IRCHA:sta Ranskasta) (5) lisääntymistuottavuus täyttää jatkuvasti vaatimuksen, jonka mukaan tässä testimenetelmässä kuvatuissa olosuhteissa tuotto on keskimäärin ≥ 60 jälkeläistä kutakin elävää emoa kohti. Muutkin kloonit ovat kuitenkin hyväksyttäviä, jos vesikirppuviljelmän osoitetaan täyttävän testiä koskevan validiteettiperusteen. Testin alussa eläinten on oltava alle 24 tunnin ikäisiä, eivätkä ne saa olla ensimmäistä sikiösarjaa. Niiden olisi oltava peräisin terveestä varastokannasta (ts. niissä ei saa näkyä merkkejä stressistä, kuten korkeaa kuolleisuutta, koiraita ja lepomunia, viivästymistä ensimmäisten sikiöiden tuottamisessa, värihäiriöisiä eläimiä jne.). Varastokannan eläimiä on pidettävä samanlaisissa viljelyoloissa (valo, lämpötila, viljelyneste, ravinto ja eläinten määrä tilavuusyksikköä kohti) kuin testissä käytettäviä. Jos testissä käytettävä viljelyneste eroaa vesikirpun viljelyssä normaalisti käytetystä viljelynesteestä, on hyvä noudattaa käytäntöä, että eläimet totutetaan viljelyoloihin ennen testiä noin kolmen viikon ajan (ts. yhden sukupolven ajan), jotta emojen stressaantuminen vältettäisiin. Testiviljelyaine Testiin suositellaan täysin määriteltyä viljelynestettä. Siten voidaan välttää sellaisten lisäaineiden (esim. levät, maaperäuute) käyttö, joiden ominaisuuksia ei voida hallita täydellisesti, ja parannetaan siten mahdollisuuksia laboratorioiden väliseen vakiointiin. Elendtin M4- (6) ja M7-viljelynesteet (ks. lisäys 2) on todettu sopiviksi tähän tarkoitukseen. Muitakin viljelynesteitä (esim. (7) (8)) voidaan käyttää, jos vesikirppuviljelmän osoitetaan täyttävän testiä koskevan validiteettiperusteen. Jos käytetään viljelynesteitä, joissa on kemiallisesti määrittelemättömiä lisäaineita, lisäaineet on spesifioitava selvästi ja testiselosteessa on annettava tietoa niiden koostumuksesta, erityisesti hiilipitoisuudesta, koska se voi vaikuttaa annettavaan ravintoon. Suositellaan, että orgaanisen lisäaineen varastovalmisteen orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaispitoisuus (TOC) ja/tai kemiallinen hapenkulutus (COD) määritetään ja valmisteen vaikutus testissä käytettävän viljelynesteen TOC- ja/tai COD-arvoihin arvioidaan. Viljelynesteen TOC-tason olisi oltava (ennen levien lisäämistä) alle 2 mg/l (9). Kun testataan metalleja sisältäviä kemikaaleja, on tärkeää ottaa huomioon, että testissä käytettävän viljelynesteen ominaisuudet (esim. kovuus, kelaatiokyky) voivat vaikuttaa testikemikaalien toksisuuteen. Tästä syystä on toivottavaa käyttää kemiallisesti määriteltyä viljelynestettä. Tällä hetkellä kuitenkin ainoat kemiallisesti määritellyt viljelynesteet, joiden tiedetään sopivan Daphnia magnan pitkäaikaiseen viljelyyn, ovat Elendtin M4 ja M7. Molemmissa viljelynesteissä on kelatoivaa ainetta EDTA:ta. On osoitettu (2), että kadmiumin ”näennäinen toksisuus” on yleensä pienempi, kun testi tehdään M4- ja M7-viljelynestcessä kuin nesteessä, joka ei sisällä EDTA:ta. M4- ja M7-viljelynesteitä ei siksi suositella metalleja sisältävien kemikaalien testaukseen, ja myös muita viljelynesteitä, joissa on tunnettuja kelatoivia aineita, olisi vältettävä. Metalleja sisältäville kemikaaleille voi olla suositeltavaa käyttää jotain muuta viljelynestettä, esimerkiksi ASTM:n rekonstituoitua kovaa makeaa vettä (9), joka ei sisällä EDTA:ta. Tämä ASTM:n kovan makean veden ja leväuutteen yhdistelmä (10) sopii myös Daphnia magna -vesikirpun pitkäaikaiseen viljelyyn (2). Testin alussa ja sen aikana liuenneen hapen pitoisuuden olisi oltava yli 3 mg/l, ja pH:n olisi oltava välillä 6–9, eikä se saisi yleensä vaihdella enemmän kuin 1,5 yksikköä testin aikana. Kovuudeksi suositellaan yli 140 mg/l (ilmaistuna CaCO3:na). Tällä ja suuremmalla pitoisuudella tehdyissä testeissä on osoitettu validiteettiperusteiden mukaista lisääntymistuottavuutta (11) (12). Testiliuokset Halutun pitoiset testiliuokset valmistetaan tavallisesti kantaliuoksista laimentamalla. Kantaliuokset valmistetaan mieluiten ilman liuottimia tai dispergointiaineita sekoittamalla testikemikaali laimennusveteen mekaanisia menetelmiä (kuten sekoittaminen tai ultraääni) tai muita asianmukaisia menetelmiä käyttäen. On suositeltavaa, että testijärjestelmiä altistetaan tutkimukseen käytettävän testikemikaalin pitoisuudelle niin kauan kuin se on tarpeen, jotta vakaiden altistuspitoisuuksien ylläpitäminen osoitetaan ennen testiorganismien käyttöönottoa. Jos testikemikaalia on vaikea liuottaa veteen, olisi noudatettava menettelyitä, joita kuvataan OECD:n ohjeissa vaikeasti testattavista aineista (13). Liuottimien tai dispergointiaineiden käyttöä pitäisi välttää, mutta tämä voi olla tarpeen joissakin tapauksissa riittävän väkevän kantaliuoksen valmistamiseksi annostelua varten. Testisarjojen lisäksi on tehtävä laimennusvesikontrolli, johon liittyvät riittävät rinnakkaisnäytteet, ja jos on välttämätöntä, liuotinkontrolliviljelmä, johon liittyvät riittävät rinnakkaisnäytteet. Testissä on käytettävä ainoastaan liuottimia tai dispergointiaineita, joilla ei ole tutkimusten perusteella merkittävää vaikutusta vastemuuttujaan tai joilla on ainoastaan vähäinen vaikutus. Esimerkkejä sopivista liuottimista (esim. asetoni, etanoli, metanoli, dimetyyliformamidi ja trietyleeniglykoli) ja dispergointiaineista (esim. Cremophor RH40, 0,01-prosenttinen metyyliselluloosa ja HCO-40) annetaan viitteessä (13). Jos käytetään liuotinta tai dispergointiainetta, sen pitoisuus ei saisi olla suurempi kuin 0,1 ml/l (13) ja pitoisuuden on oltava sama kaikissa testiastioissa paitsi laimennusvesikontrollissa. On kuitenkin kaikin keinoin pidettävä liuottimen pitoisuutta minimissä. MENETTELY Altistusolosuhteet Kesto Testin kesto on 21 vuorokautta. Täyttö Emoja pidetään testiastiassa yksi eläin astiaa kohti, astiaan pannaan yleensä 50–100 ml viljelynestettä (kun kyseessä on Daphnia magna, pienemmille vesikirpuille, esim. Ceriodaphnia dubia -lajille voidaan mahdollisesti käyttää pienempiä vesimääriä), ellei testiin tarvita läpivirtaustestiä. Suurempi tilavuus voi olla joskus tarpeen testikemikaalin pitoisuuden määritykseen käytettävän analyyttisen menetelmän vaatimusten vuoksi, vaikka rinnakkaisnäytteet voidaan myös yhdistää kemiallista analyysiä varten. Jos tilavuus on yli 100 ml, vesikirpulle annettavaa annosta on ehkä suurennettava, jotta varmistetaan ravinnon riittävyys ja validiteettiperusteiden noudattaminen. Koe-eläimet Puolistaattisissa oloissa tehtävässä testissä on oltava vähintään 10 yksittäin kasvatettua vesikirppua kutakin testipitoisuutta kohti ja vähintään 10 yksittäin pidettyä vesikirppua kontrollisarjassa. Läpivirtaustesteissä 40 vesikirppua neljään 10 vesikirpun ryhmään jaettuna on osoittautunut sopivaksi (1). Pienempääkin määrää eläimiä voi käyttää. Suositellaan vähintään 20:tä vesikirppua pitoisuutta kohti jaettuna kahdeksi tai useammaksi yhtä monta vesikirppua käsittäväksi rinnakkaisnäytteeksi (esim. neljä rinnakkaista, joista kussakin viisi vesikirppua). On pantava merkille, että testeissä, joissa eläimiä pidetään ryhmissä, mitään jälkeläistä ei voida jättää tilastollisen analyysin ulkopuolelle, jos emo kuolee epähuomiossa/vahingossa lisääntymisen alettua, ja siksi näissä tapauksissa lisääntymistuotos olisi ilmaistava elävien jälkeläisten kokonaismääränä testin alussa mukana olevia emoja kohti. Testiaineet jaetaan testiastioihin, joita on tämän jälkeen käsiteltävä satunnaistetusti. Jollei satunnaisteta, tästä saattaa aiheutua systemaattinen virhe, joka voidaan tulkita pitoisuudesta aiheutuvaksi vaikutukseksi. Erityisesti jos koeastioita käsitellään annostelu- tai pitoisuusjärjestyksessä, jokin aikaan liittyvä tekijä, kuten työntekijän väsymys tai muu virhe, saattaa aiheuttaa voimakkaampia vaikutuksia suuremmilla pitoisuuksilla. Jos lisäksi olosuhteet testin alussa tai ympäristöolosuhteet, kuten sijoituspaikka laboratoriossa, saattavat vaikuttaa testituloksiin, olisi harkittava testin eristämistä. Ruokinta Puolistaattisissa oloissa tehtävässä testissä vesikirppuja olisi ruokittava mieluiten joka päivä mutta ainakin kolmesti viikossa (ts. silloin kun viljelyneste vaihdetaan). Altistuspitoisuuksien mahdollinen laimentaminen ravinnon lisäämisellä on otettava huomioon ja sitä on vältettävä mahdollisimman paljon konsentroidussa leväsuspensioissa. Jos tästä poiketaan (esim. läpivirtaustestissä), siitä olisi ilmoitettava. Testin aikana emojen ruokavalion pitäisi koostua mieluiten seuraavien lajien (yhden tai useamman) elävistä levistä: Chlorella sp., Pseudokirchneriella subcapitata (aikaisemmin Selenastrum capricornutum) ja Desmodesmus subspicatus (aikaisemmin Scenedesmus subspicatus). Ruokavalion pitäisi perustua siihen orgaanisen hiilen (C) määrään, joka on annettava kullekin emolle. Tutkimuksissa (14) on osoitettu, että annokset 0,1–0,2 mg C/vesikirppu/vrk riittävät vesikirpulla siihen, että eläviä jälkeläisiä saadaan riittävä määrä, jotta testin validiteettiperusteet täyttyvät. Ravintoannos voidaan annostella joko vakionopeudella koko testin ajan tai haluttaessa voidaan alussa käyttää alhaisempaa nopeutta, jota lisätään testin aikana emojen kasvun huomioon ottamiseksi. Tällöinkin annoksen on pysyttävä samana suositellulla alueella 0,1–0,2 mg C/vesikirppu/vuorokausi koko testin ajan. Jos käytetään muita menetelmiä (kuten leväsolujen määrä tai valon absorptio) vaaditun ravintoannoksen määrittämiseksi esimerkiksi siksi, että hiilipitoisuuden määritys on aikaa vievää, laboratorioiden on laadittava omat nomogramminsa, joista saadaan leväviljelmän hiilipitoisuus (ks. lisäys 3, ohjeet nomogrammien laatimiseksi). Nomogrammit olisi tarkistettava vähintään kerran vuodessa ja useamminkin, jos levien viljelyolosuhteet muuttuvat. On havaittu että valon absorptio on parempi menetelmä hiilipitoisuuden määrittämiseksi kuin solumäärä (15). Vesikirpulle olisi annettava ravinnoksi konsentroitua leväsuspensiota, jotta testiastioihin lisätyn levänviljelynesteen tilavuus olisi mahdollisimman pieni. Konsentroitu levä saadaan aikaan sentrifugoimalla, jota seuraa suspendointi uudelleen vesikirppuviljelmän viljelynesteessä. Valo 16 tuntia valoa, jonka intensiteetti on enintään 15–20 μE · m– 2 · s– 1 mitattuna astian veden pinnasta. (Jos valonmittauslaitteet on kalibroitu lux-yksikköä varten, suositeltu valonvoimakkuus 15–20 μE·m–2·s–1 vastaa suunnilleen kylmänvalkoisen valon voimakkuusaluetta 1 000–1 500 lux.) Lämpötila Testissä käytettävän viljelynesteen lämpötilan on oltava 18–22 °C. Lämpötila ei saisi kuitenkaan, jos mahdollista, vaihdella missään testissä enempää kuin 2 °C kyseisissä rajoissa (esim. 18–20, 19–21 tai 20–22 °C) vuorokauden vaihteluvälinä. Lämpötilan seuraamista varten voi olla tarpeen lisätä yksi testiastia. Ilmastus Testiastioita ei saa ilmastaa testin aikana. Testijärjestely Raja-annostesti Tarvittaessa pitoisuusalueen määritystesti toteutetaan esimerkiksi siten, että siinä on viisi testikemikaalipitoisuutta ja kaksi rinnakkaisnäytettä kutakin altistusta ja kontrollia kohti. Lisätiedot testeistä, joissa käytetään samankaltaisia kemikaaleja tai kirjallisuus välittömästä toksisuudesta vesikirpuille ja/tai muille vesieliöille, voivat olla hyödyllisiä päätettäessä pitoisuusalueen määritystestissä käytettävästä konsentraatioalueesta. Pitoisuusalueen määritystestin kesto on 21 päivää tai riittävä kesto vaikutustasojen luotettavaan ennustamiseen. Testin lopussa arvioidaan vesikirppujen lisääntyneisyys. Vanhempien määrä ja jälkeläisten esiintyminen olisi kirjattava. Varsinainen testi Normaalisti pitäisi olla vähintään viisi testipitoisuutta, joissa haarukoidaan vaikuttava pitoisuus (esim. ECx) ja jotka on järjestetty geometriseen sarjaan, jonka suhdeluvun ei tulisi olla suurempi kuin 3,2. Kutakin testipitoisuutta kohden olisi tehtävä asianmukainen määrä rinnakkaisnäytteitä (ks. 24–25 kohta). Vähemmän kuin viiden pitoisuuden käyttö on perusteltava. Kemikaaleja ei saisi testata niiden liukoisuusrajaa suuremmassa pitoisuudessa. Ennen kokeen tekemistä on suositeltavaa harkita testimallin tilastollista voimaa ja käyttää asianmukaisia tilastollisia menetelmiä (4). Pitoisuusalueen valinnassa on otettava huomioon seuraavat seikat:
Jos mitään vaikutuksia ei havaita suurimmassa pitoisuudessa pitoisuusalueen määritystestissä (esim. 10 mg/l) tai jos testikemikaalilla on erittäin todennäköinen alhainen toksisuusvaikutus/ei ole toksisuusvaikutusta perustuen siihen, ettei muille eliöille aiheuteta toksisuusvaikutusta, ja/tai alhainen ottotaso tai ei ollenkaan ottotasoa, lisääntymistesti voidaan tehdä raja-annostestinä käyttäen testipitoisuutena esim. 10 mg/l ja kontrollia. Altistus- ja kontrolliryhmien osalta olisi tehtävä kymmenen rinnakkaisnäytettä. Jos raja-annostesti tehdään läpivirtausjärjestelmässä, vähempi määrä rinnakkaisnäytteitä riittää. Raja-annostesti antaa mahdollisuuden osoittaa, ettei rajapitoisuudessa ole tilastollisesti merkittävää vaikutusta, mutta jos vaikutukset kirjataan, tavanomaisesti vaaditaan koko testin tekemistä. Kontrollit Testisarjan lisäksi on määritettävä yksi viljelynestettä sisältävä kontrollisarja ja tapauksen mukaan yksi liuotinta tai dispergointiainetta sisältävä kontrollisarja. Mahdollisen liuottimen tai dispergointiaineen pitoisuuden olisi oltava sama kuin testikemikaalia sisältävissä testiastioissa. Riittävä määrä rinnakkaisnäytteitä olisi määritettävä (ks. 23–24 kohta). Yleensä hyvin suoritetussa testissä kontrollinäytteissä emojen tuottamien elävien jälkeläisten määrän keskiarvon vaihtelukerroin saisi olla ≤ 25 %, ja tämä olisi ilmoitettava testimalleista, joissa käytetään yksittäin kasvatettuja eläimiä. Testissä käytettävän viljelynesteen vaihto Viljelynesteen vaihtoväli riippuu testikemikaalin stabiiliuudesta ja se pitäisi vaihtaa vähintään kolme kertaa viikossa. Jos testikemikaalin pitoisuus alustavien testien perusteella (ks. 7 kohta) ei ole stabiili (ts. ei ole välillä 80–120 prosenttia nimellispitoisuudesta tai laskee alle 80 prosentin mitatusta alkupitoisuudesta) pisimmän hyväksytyn vaihtovälin aikana (ts. 3 vrk), olisi harkittava viljelynesteen vaihtamista useammin tai siirtymistä läpivirtaustestiin. Kun viljelyneste vaihdetaan puolistaattisessa testissä, valmistetaan toinen sarja testiastioita ja emovesikirput siirretään niihin esim. sopivan kokoisella lasipipetillä. Vesikirpun kanssa siirrettävän viljelynesteen tilavuuden pitäisi olla mahdollisimman pieni. Havainnot Testin aikana tehtyjen havaintojen tulokset olisi kirjattava testilomakkeille (ks. lisäyksen 4 ja 5 esimerkit). Jos on tehtävä muita mittauksia (ks. 44 kohta), on ehkä tehtävä lisähavaintoja. Jälkeläiset Kunkin emon tuottamat jälkeläiset olisi mieluiten otettava astiasta ja laskettava päivittäin ensimmäisistä jälkeläisistä lähtien, jotta ne eivät söisi emoille tarkoitettua ravintoa. Tässä testimenetelmässä tarvitsee laskea vain elävät jälkeläiset, mutta kuolleiden munien tai poikasten esiintyminen olisi kirjattava. Kuolleisuus Emojen kuolleisuus olisi kirjattava mieluiten päivittäin tai ainakin yhtä usein, kun poikaset lasketaan. Muut parametrit Vaikka tämän testimenetelmän pääasiallisena tarkoituksena on lisääntymistuotosten arviointi, on mahdollista, että muitakin vaikutuksia esiintyy siinä määrin, että ne voidaan analysoida tilastollisesti. Lisääntymistuotos elossa olevaa eläintä kohti eli testin aikana tuotettujen elävien jälkeläisten lukumäärä elossa olevaa emoa kohti, voidaan kirjata. Tätä voidaan verrata tärkeimpään vastemuuttujaan (lisääntymistuotos emoa kohti testin alkaessa, joka ei kuole epähuomiossa tai vahingossa testin aikana). Jos emojen kuolleisuus ilmenee altistetuissa rinnakkaisnäytteissä, olisi harkittava, seuraako kuolleisuus pitoisuusvastesuhdetta, eli onko vasteen regressio huomattava verrattuna testikemikaalin pitoisuuteen, joka on ylöspäin nouseva (tähän voidaan käyttää tilastollista testiä, kuten Cochran-Armitagen trenditestiä). Jos kuolleisuus ei seuraa pitoisuusvastesuhdetta, rinnakkaisnäytteet, joissa emo on kuollut, pitäisi jättää testin tuloksen arvioinnin ulkopuolelle. Jos kuolleisuus seuraa pitoisuusvastesuhdetta, emojen kuolleisuus pitäisi määrittää testikemikaalin vaikutukseksi, ja rinnakkaisnäytteitä ei pitäisi jättää testituloksen arvioinnin ulkopuolelle. Kasvumittaukset ovat hyvin toivottavia, koska niistä saa mahdollisia subletaaleja vaikutuksia koskevia tietoja, jotka voivat olla hyödyllisiä lisääntymisen määrittämisen lisäksi. Emojen pituuden (ts. pituus ilman pyrstörankaa) mittausta testin lopussa suositellaan. Muita muuttujia, jotka voidaan mitata tai laskea, ovat aika ensimmäisten sikiöiden (ja myöhempien sikiöiden) tuottamiseksi, sikiöiden määrä ja koko eläintä kohti, abortoitujen sikiöiden määrä, vastasyntyneiden koiraiden esiintyvyys (OECD, 2008) tai lepomunat ja mahdollisesti populaation kasvun ominaisnopeus (määritelmistä on tietoja liitteessä 1 ja vastasyntyneiden sukupuolen tunnistamisesta liitteessä 7). Analyyttisten määritysten ja mittausten taajuus Happipitoisuus, lämpötila, veden kovuus ja pH-arvot olisi mitattava vähintään kerran viikossa sekä tuoreesta että vanhasta viljelynesteestä, kontrolleista ja testistä, jossa on suurin testikemikaalin pitoisuus. Testin aikana testikemikaalin pitoisuus määritetään säännöllisin väliajoin. Suositellaan, että puolistaattisissa testeissä, joissa testikemikaalin pitoisuuden odotetaan pysyvän ± 20 prosentissa (ts. välillä 80–120 prosenttia) nimellispitoisuudesta (ks. 6, 7 ja 39 kohta), suurimmat ja pienimmät testissä käytetyt pitoisuudet määritetään tuoreista testiliuoksista ja viljelynestettä vaihdettaessa kerran ensimmäisen testiviikon aikana (ts. määritys olisi tehtävä samasta liuoksesta, kun se on tuore ja kun se vaihdetaan). Nämä määritykset olisi tehtävä tämän jälkeen uudelleen vähintään viikon välein. Testeissä, joissa testikemikaalin pitoisuuden ei odoteta pysyvän ± 20 prosentissa nimellispitoisuudesta, on välttämätöntä määrittää testipitoisuudet sekä tuoreesta liuoksesta että liuosta vaihdettaessa. Kuitenkin jos mitattu testikemikaalin alkupitoisuus ei ole ± 20 prosentin rajoissa nimellispitoisuudesta, mutta jos on riittävästi näyttöä siitä, että alkupitoisuudet ovat toistettavissa ja stabiileja (toisin sanoen 80–120 prosenttia alkupitoisuudesta), kemialliset määritykset voidaan tehdä viikolla 2 ja 3 ainoastaan suurimmista ja pienimmistä testipitoisuuksista. Joka tapauksessa testiaineen pitoisuus tarvitsee määrittää liuosta vaihdettaessa vain yhdestä rinnakkaisnäytteestä kullekin pitoisuudelle. Jos kyseessä on läpivirtaustesti, samanlainen näytteenotto-ohjelma on sopiva kuin puolistaattisissa testeissä (vaikka ”vanhasta” liuoksesta ei tehdä määritystä). Voi kuitenkin olla suositeltavaa lisätä näytteenottoajankohtia ensimmäisen viikon aikana (esim. kolme määrityssarjaa) sen varmistamiseksi, että testipitoisuudet ovat pysyneet muuttumattomina. Tällaisissa testeissä laimentimen ja testikemikaalin virtausnopeus on tarkistettava päivittäin. Jos on näyttöä siitä, että testattavan kemikaalin pitoisuus on pysynyt tyydyttävällä tavalla ± 20 prosentissa nimellispitoisuudesta tai alkupitoisuudesta koko testin ajan, tulokset voivat perustua nimellispitoisuuksiin tai alkupitoisuuksiin. Jos poikkeama nimellispitoisuudesta tai alkupitoisuudesta on suurempi kuin ± 20 prosenttia, tulokset olisi ilmaistava aikapainotettuna keskiarvona (ohjeet laskentaan ks. lisäys 6). TIEDOT JA RAPORTOINTI Tulosten käsittely Testin tarkoituksena on määrittää testikemikaalin vaikutukset lisääntymistuotoksiin. Elävien jälkeläisten kokonaismäärä emojen määrää kohti olisi laskettava jokaiselle testiastialle (ts. rinnakkaisnäytteille). Lisäksi lisääntyminen voidaan laskea elossa olevan emon tuottamien elävien jälkeläisten tuotannon perusteella. Kuitenkin ekologisesti merkittävin vastemuuttuja on elävien jälkeläisten kokonaismäärä emoa kohti, joka ei kuole vahingossa (96) tai epähuomiossa (97) testin aikana. Jos jossakin rinnakkaisnäytteessä emo kuolee vahingossa tai epähuomiossa testin aikana tai osoittautuu koiraaksi, kyseinen rinnakkaisnäyte jätetään testin ulkopuolelle. Analyysi perustuu silloin pienempään määrään rinnakkaisnäytteitä. Jos emojen kuolleisuus ilmenee altistetuissa rinnakkaisnäytteissä, olisi harkittava, seuraako kuolleisuus pitoisuusvastesuhdetta, eli onko vasteen regressio huomattava verrattuna testikemikaalin pitoisuuteen, joka on ylöspäin nouseva (tähän voidaan käyttää tilastollista testiä, kuten Cochran-Armitagen trenditestiä). Jos kuolleisuus ei seuraa pitoisuusvastesuhdetta, rinnakkaisnäytteet, joissa emo on kuollut, pitäisi jättää testin tuloksen arvioinnin ulkopuolelle. Jos kuolleisuus seuraa pitoisuusvastesuhdetta, emojen kuolleisuus pitäisi määrittää testikemikaalin vaikutukseksi, ja rinnakkaisia eläimiä ei pitäisi jättää testituloksen arvioinnin ulkopuolelle. Yhteenvetona, kun LOEC/NOEC-arvoa tai ECx-arvoa käytetään ilmaisemaan vaikutuksia, on suositeltavaa laskea lisääntymisen vaikutus käyttämällä kumpaakin edellä mainittua vastemuuttujaa, eli
ja sen jälkeen käyttää lopullisena tuloksena alhaisinta LOEC/NOEC-arvoa tai ECx-arvoa, joka lasketaan käyttämällä jompaakumpaa näistä kahdesta vastemuuttujasta. Ennen tilastollisen analyysin käyttöä, esim. ANOVA-menettelyt, käsittelyiden vertaaminen kontrolliin Student t-testillä, Dunnettin testillä, tai alaspäin askeltavalla Jonskheere-Terpstran testillä, on suositeltavaa tarkastella tietojen muutosta tarvittaessa, jotta tietyn tilastollisen testin vaatimukset täytetään. Ei-parametrisena vaihtoehtona voidaan harkita Sunnin tai Mann-Whitneyn testejä. Yksittäisille käsittelyille lasketaan 95 prosentin luottamusväli. Elossa olevien emojen määrä käsittelemättömissä kontrolleissa on hyväksyttävyysperuste, joten sitä on dokumentoitava ja se on ilmoitettava. Myös kaikki muut haitalliset vaikutukset, esim. epänormaali käytös ja toksikologisesti merkittävät havainnot olisi ilmoitettava loppuraportissa. ECx ECx-arvot, mukaan lukien niitä koskevat alhaisemmat ja ylimmät luottamusvälit, lasketaan sopivien tilastollisten menetelmien avulla (esimerkiksi logistinen funktio tai Weibullin funktio, viritetty Spearmanin ja Kärberin menetelmä tai yksinkertainen interpolointi). Jos halutaan laskea EC10, EC50 tai jokin muu ECx-arvo, kaikista tiedoista on tehtävä regressioanalyysi. NOEC/LOEC Jos tilastollisella analyysilla on tarkoitus määrittää NOEC/LOEC-arvo, asianmukaisia tilastomenetelmiä tulee käyttää ekotoksisuustietojen tilastollisessa analyysissa sovellettavia nykyisiä lähestymistapoja koskevan OECD:n asiakirjan nro 54 mukaan (Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application) (4). Yleensä testikemikaalin haitallisia vaikutuksia verrattuna kontrolliin tutkitaan käyttämällä yksisuuntaista hypoteesitestausta, jossa p ≤ 0,05. Normaalijakauman ja varianssin homogeenisuutta voidaan testata käyttämällä sopivaa tilastollista testiä, esim. Shapiron-Wilkin testiä ja Levenen testiä, vastaavasti (p ≤ 0,05). Yksisuuntainen ANOVA sekä tämän jälkeisiä monivertailutestejä voidaan tehdä. Monivertailuja (esimerkiksi Dunnettin testiä) tai alaspäin askeltavia trenditestejä (esimerkiksi Williamsin testiä tai Jonckheere-Terpsrtan testiä) voidaan käyttää sen laskemiseen, onko kontrollien ja testikemikaalin eri pitoisuuksien välillä merkitseviä eroja (p ≤ 0,05) (suositellun testin valinta OECD:n ohjeasiakirjan nro 54 mukaan (4)). Muutoin NOEC- ja LOEC-arvojen määrittämisessä voidaan käyttää parametrittomia menetelmiä (esimerkiksi Bonferroni-U-testiä Holmin mukaan tai Jonckheere-Terpstran trenditestiä). Raja-annostesti Jos raja-annostesti (kontrollin ja vain yhden käsittelyn vertailu) on tehty ja jos parametristen testimenetelmien vaatimukset (normaalius, homogeenisuus) täyttyvät, metrisiä vasteita voidaan arvioida Studentin testillä (t-testillä). Jos vaatimukset eivät täyty, voidaan käyttää t-testiä, jossa varianssit ovat heterogeenisia (kuten Welchin testi) tai parametritonta testiä, kuten Mann-Whitney-U-testiä. Kontrollien välisten (kontrolli ja liuotinkontrolli sekä dispergointiaineen kontrolli) merkitsevien erojen määrittämiseksi jokaisen kontrollin rinnakkaisnäytteet voidaan testata raja-annoksen yhteydessä kuvatulla tavalla. Jos näissä testeissä ei havaita merkitseviä eroja, kaikki kontrollin ja liuotinkontrollin rinnakkaisnäytteet voidaan yhdistää. Muussa tapauksessa kaikkia käsittelyjä tulee vertailla liuotinkontrolliin. Testiraportti Testiraportissa on esitettävä seuraavat tiedot:
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT Tässä testimenetelmässä käytetään seuraavia määritelmiä: Ecx : Veteen liuotetun testikemikaalin pitoisuus, joka aiheuttaa x prosentin laskun vesikirpun lisääntymisessä tietyllä altistusajanjaksolla. Emoeläimet : Naarasvesikirput, jotka ovat mukana testin alussa ja joiden lisääntymistuotos määritetään. Epähuomiossa tapahtunut kuolema : Muu kuin kemikaaliin liittyvä kuolema, jolla ei ole tunnettua syytä. Havaitsemisraja : Pienin pitoisuus, joka voidaan osoittaa, mutta ei mitata kvantitatiivisesti. Jälkeläiset : Nuoret vesikirput, joita emoeläimet tuottavat testin aikana. Kemikaali : Aine tai seos. Kuolleisuus : Eläin katsotaan kuolleeksi, kun se ei liiku, ts. ei pysty uimaan tai sen raajoissa tai takaruumiissa ei havaita mitään liikettä sen jälkeen kun testiastiaa on ravisteltu varovasti 15 sekuntia. (Jos käytetään muuta määritelmää, se on ilmoitettava testiselosteessa ja sille on annettava lähdeviite.) Lisääntymistuotos : Emoeläinten elävien jälkeläisten kokonaismäärä testin ajankohdalla. LOEC (Lowest Observed Effect Concentration) : Pienin testipitoisuus, jolla kemikaalin havaitaan aiheuttavan tilastollisesti merkittävän vaikutuksen (todennäköisyystasolla p < 0,05) lisääntymiseen ja emokuolleisuuteen kontrolliin verrattuna tietyllä altistusajanjaksolla. Ehtona on myös, että kaikilla LOEC-pitoisuutta suuremmilla testipitoisuuksilla on oltava vähintään yhtä suuri haitallinen vaikutus kuin LOEC-pitoisuudella. Jos nämä kaksi ehtoa eivät täyty, on annettava tyhjentävä selitys siitä, miten LOEC-pitoisuus (ja myös NOEC-pitoisuus) on valittu. Määritysraja : Pienin pitoisuus, joka voidaan mitata kvantitatiivisesti. NOEC (No Observed Effect Concentration) : LOEC:tä pienempi testipitoisuus, jolla ei ole kontrolliin verrattuna tietyllä altistusajanjaksolla tilastollisesti merkittävää vaikutusta (todennäköisyystasolla p < 0,05). Populaation ominaiskasvunopeus : Populaation kasvu, jossa yhdentyvät lisääntyminen ja ikäspesifinen kuolleisuus (1) (2) (3). Dynaamisessa tasapainossa olevassa populaatiossa ominaiskasvu on nolla. Suurenevissa populaatioissa se on positiivinen ja pienenevissä negatiivinen. Negatiivinen arvo johtaa luonnollisesti lopulta populaation häviämiseen. Testikemikaali : Aine tai seos, jota testataan tällä testimenetelmällä. Vahingossa tapahtuva kuolema : Muu kuin kemikaaliin liittyvä kuolema, jonka on aiheuttanut vahinko (tunnettu syy). Lähdekirjallisuus
Lisäys 2 KEMIALLISESTI MÄÄRITELTYJEN ELENDT M7- JA M4-VILJELYNESTEIDEN VALMISTUS Totuttaminen Elendt M7- ja M4-viljelynesteeseen Joissakin laboratorioissa on ollut vaikeuksia, kun ne ovat siirtäneet vesikirput suoraan M4- (1) tai M7-viljelynesteeseen. Siirto onnistuu paremmin totuttamalla vesikirput asteittain uuteen viljelynesteeseen: ensin siirretään entisestä viljelynesteestä 30-prosenttiseen, sitten 60-prosenttiseen ja lopulta 100-prosenttiseen Elendt-viljelynesteeseen. Totuttamisvaiheen pitää mahdollisesti olla jopa kuukauden pituinen. Valmistaminen Mineraalit Ensin valmistetaan erilliset varastoliuokset (I) yksittäisistä mineraaleista sopivan puhtaaseen (esim. deionisoituun, tislattuun tai käänteisosmoosilla puhdistettuun) veteen. Näistä eri varastoliuoksista (I) valmistetaan yksi ainoa varastoliuos (II), jossa on kaikkia hivenaineita (yhdistetty liuos), ts.:
M4- ja M7-viljelyneste M4- ja M7-viljelynesteet valmistetaan käyttäen kantaliuosta II, makroravinteita ja vitamiineja seuraavasti:
Yhdistetty vitamiinien kantaliuos säilytetään jäädytettynä pienissä erissä. Vitamiinit lisätään viljelynesteeseen vähän ennen käyttöä.
Lisäys 3 ORGAANISIIN YHDISTEISIIN SITOUTUNEEN HIILEN KOKONAISMÄÄRÄN (TOC) MÄÄRITYS JA NOMOGRAMMIN LAATIMINEN LEVÄREHUN TOC-PITOISUUDELLE Levärehun hiilipitoisuutta ei tunnetusti mitata suoraan, vaan se määritetään korvaavilla menetelmillä kuten levysolujen määrän tai valon absorption perusteella laadittujen nomogrammien avulla. TOC olisi mitattava mieluummin korkeassa lämpötilassa tapahtuvan oksidaation avulla kuin UV- tai persulfaattimenetelmällä. (Ks. ohjeeksi: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB). Nomogrammin laatimista varten levät olisi erotettava viljelynesteestä sentrifugoimalla, jonka jälkeen ne suspendoidaan uudelleen tislattuun veteen. Korvaava muuttuja ja TOC-pitoisuus määritetään kustakin näytteestä (kolme rinnakkaista). Tislattuun veteen perustuvat nollanäytteet määritetään ja niiden TOC-pitoisuus vähennetään levänäytteen TOC-pitoisuudesta. Nomogrammien olisi oltava lineaarisia tarvittavalla hiilipitoisuusalueella. Jäljempänä annetaan esimerkkejä:

Chlorella vulgaris var. viridis (CCAP 211/12). Regressiokuvaaja, mg/l kuivapaino vs. mg C/l. Mittaustiedot tislattuun veteen uudelleen suspendoitujen puolijatkuvasti erissä viljeltyjen solujen konsentroiduista suspensioista. x-akseli: mg C/l konsentroitua levärehua y-akseli: mg/l konsentroidun levärehun kuivapainoa Korjauskerroin -0,980 
Chlorella vulgaris var. viridis (CCAP 211/12). Regressiokuvaaja, solumäärä vs. mg C/l. Mittaustiedot tislattuun veteen uudelleen suspendoitujen puolijatkuvasti erissä viljeltyjen solujen konsentroiduista suspensioista. x-akseli: mg C/l konsentroitua levärehua y-akseli: solujen lukumäärä/1 konsentroitua levärehua Korjauskerroin -0,926 
Chlorella vulgaris var. viridis (CCAP 211/12). Valon absorption regressio mg C/1 (1 senttimetrin valotiellä). Mittaustiedot tislattuun veteen uudelleen suspendoitujen puolijatkuvasti erissä viljeltyjen solujen konsentroiduista suspensioista. x-akseli: mg C/l konsentroitua levärehua y-akseli: konsentroidun levärehun 1/10-laimennoksen absorbanssi aallonpituudella 440 nm Korjauskerroin – 0,998 Lisäys 4 ESIMERKKI LOMAKKEESTA, JOHON KIRJATAAN VILJELYNESTEEN VAIHDOT, FYSIKAALISET JA/TAI KEMIALLISET SEURANTATIEDOT, RUOKKIMINEN, VESIKIRPUN LISÄÄNTYMINEN JA EMOKUOLLEISUUS
Lisäys 5 ESIMERKKI LOMAKKEESTA, JOHON KIRJATAAN KEMIALLISTEN MÄÄRITYSTEN TULOKSET (a) Mitatut pitoisuudet
(b) Mitatut pitoisuudet prosentteina nimellisarvoista
Lisäys 6 AIKAPAINOTETUN KESKIARVON LASKEMINEN Aikapainotettu keskiarvo Koska testikemikaalin pitoisuus voi laskea viljelynesteen vaihtojen välillä, on harkittava, mikä pitoisuus olisi valittava edustamaan sitä pitoisuusaluetta, jossa emovesikirppu on elänyt. Valinnan pitäisi perustua sekä biologisiin että tilastollisiin näkökohtiin. Jos esimerkiksi oletetaan, että lisääntymiseen vaikuttaa lähinnä huippupitoisuus, olisi käytettävä suurinta pitoisuutta. Jos taas oletetaan, että myrkyllisen kemikaalin kerääntynyt tai pitkän aikavälin vaikutus on tärkeämpi, keskipitoisuus sopii paremmin. Silloin käytettäväksi sopiva asianmukainen keskiarvo on aikapainotettu keskipitoisuus, koska siinä otetaan huomioon hetkellisten pitoisuuksien vaihtelu ajan funktiona. Kuva 1 Esimerkki aikapainotetusta keskiarvosta 
Kuvassa 1 on (yksinkertaistettu) esimerkki testistä, joka kestää seitsemän päivää ja jossa viljelyneste vaihdetaan päivinä 0, 2 ja 4.
Aikapainotettu keskiarvo lasketaan siten, että aikapainotetun keskiarvon kuvaajan alle jäävä pinta-ala on yhtä suuri kuin pitoisuuskäyrän alle jäävä pinta-ala. Edellä olevaa esimerkkiä varten tehty laskutoimitus kuvataan taulukossa 1. Taulukko 1 Aikapainotetun keskiarvon laskeminen
”Pinta-ala” on kutakin vaihtoperiodia vastaavan eksponentiaalisen käyrän alle jäävä pinta-ala Se lasketaan seuraavasti:
Aikapainotettu keskiarvo (TW Mean) on kokonaispinta-ala (Total Area) jaettuna päivien kokonaismäärällä (Total Days). Vesikirpun lisääntymistestiä varten taulukon on tietysti katettava 21 päivää. On selvää, että kun havaintoja tehdään vain kunkin vaihtoperiodin alussa ja lopussa, ei voida olla varmoja siitä, että hajoaminen on todella eksponentiaalista. Erilaisesta käyrästä olisi seurauksena erilainen pinta-ala. Eksponentiaalinen hajoamisprosessi ei kuitenkaan ole epätodennäköinen, ja sitä kuvaava käyrä on todennäköisesti paras, jota voidaan käyttää, kun muuta tietoa ei ole. On kuitenkin esitettävä varoitus siltä varalta, että kemiallisessa määrityksessä ei havaita kyseistä kemikaalia lainkaan vaihtoperiodin lopussa. Ellei voida arvioida, kuinka nopeasti kemikaali on hävinnyt liuoksesta, on mahdotonta saada todenmukaista pinta-alaa käyrän alle ja myös mahdotonta määrittää järkevää aikapainotettua keskiarvoa. Lisäys 7 OHJEET VASTASYNTYNEEN SUKUPUOLEN TUNNISTAMISEKSI Vastasyntyneiden koiraiden tuotantoa voi esiintyä muuttuvissa ympäristöolosuhteissa, kuten lyhennetty valoisa aika, lämpötila, ravinnon pitoisuuden vähentäminen ja populaatiotiheyden lisääminen (Hobaek and Larson, 1990; Kleiven et al., 1992) Koiraiden tuotanto on myös tunnettu vaste tietyille hyönteisten kasvunsääteille (Oda et al., 2005). Olosuhteissa, joissa kemialliset stressitekijät aiheuttavat partenogeeneettisten naaraiden lisääntymiskykyisten jälkeläisten vähentymistä, koiraiden määrän odotetaan lisääntyvän (OECD, 2008). Käytettävissä olevien tietojen perusteella ei ole mahdollista ennustaa, mikä sukupuolten suhde tai lisääntymisen päätepiste on herkempi; on kuitenkin viitteitä siitä (viite ”validaatioraportti”, osa 1), että tämä koirasten määrän kasvu voi olla vähemmän herkkä kuin jälkeläisten vähentyminen. Koska tämän testimenetelmän pääasiallinen tarkoitus on arvioida tuotettujen jälkeläisten määrä, koirasten ilmaantuminen on valinnainen havainto. Jos tätä valinnaista päätepistettä arvioidaan tutkimuksessa, olisi sovellettavaa täydentävää testin validiteettiperustetta, jonka mukaan kontrollissa olisi käytettävä enintään 5 prosenttia koiraita. Käytännöllisin ja helpoin tapa erottaa vesikirpun sukupuoli on käyttää fenotyyppisiä ominaisuuksia, koska koiraat ja naaraat ovat geneettisesti identtisiä ja niiden sukupuolen määrää ympäristö. Koiraat ja naaraat ovat eri pituisia ja niiden ensimmäisillä tuntosarvilla on eri morfologia, koiraiden ovat pidemmät kuin naaraiden (kuva 1). Tämä ero on tunnistettavissa heti syntymän jälkeen, vaikka muut toissijaiset sukupuoliominaisuudet kehittyvät iän myötä (ks. esim. kuva 2, Olmstead and LeBlanc, 2000). Morfologisen sukupuolen havainnointia varten kunkin koe-eläimen tuottamat vastasyntyneet olisi siirrettävä pipetillä ja asetettava petrimaljaan viljelynesteen kanssa. Viljelyneste pidetään minimissä eläinten liikkumisen hillitsemiseksi. Ensimmäisiä tuntosarvia koskevat havainnoinnit voidaan tehdä stereomikroskoopilla (× 10–60). Kuva 1 24 tuntia vanha vesikirppukoiras (vasemmalla) ja vesikirppunaaras (oikealla). Koiraat voidaan erottaa naaraista pituuden ja niiden ensimmäisten tuntosarvien morfologian perusteella, kuten esitetään ympyröissä (Tatarazako et al., 2004). 
VIITTEET Hobaek A and Larson P. 1990. Sex determination in Daphnia magna. Ecology 71: 2255–2268. Kleiven O.T., Larsson P., Hobaek A. 1992. Sexual reproduction in Daphnia magna requires three stimuli. Oikos 65, 197–206. Oda S., Tatarazako N, Watanabe H., Morita M., and Iguchi T. 2005. Production of male neonates in Daphnia magna (Cladocera, Crustacea) exposed to juvenile hormones and their analogs. Chemosphere 61:1168–1174. OECD, 2008. Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. OECD Series on Testing and Assessment, Number 88. Organisation for Economic Co-operation and Development, Paris. Olmstead, A.W., LeBlanc, G.A., 2000. Effects of endocrine-active chemicals on the development characteristics of Daphnia magna. Environmental Toxicology and Chemistry 19: 2107–2113. Tatarazako, N., Oda, S., Abe, R., Morita M. and Iguchi T., 2004. Development of a screening method for endocrine disruptors in crustaceans using Daphnia magna (Cladocera, Crustacea). Environmental Science 17, 439–449. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
18) |
Korvataan C osassa olevan C.29 luvun 66 kohta seuraavasti:
|
|
19) |
Lisätään C osaan luvut seuraavasti: ”C.47 Toksisuustesti kaloilla niiden varhaiskehitysvaiheissa JOHDANTO
TESTIN PERIAATE
TESTIKEMIKAALIA KOSKEVIA TIETOJA
TESTIN VALIDITEETTI
MENETELMÄN KUVAUS Testiastiat
Lajin valinta
Siitoskalojen kasvatus
Hedelmöityneiden mätimunien, alkioiden ja toukkien käsittely
Vesi
Testiliuokset
MENETTELY Altistumisolosuhteet Kesto
Täyttö
Valo ja lämpötila
Ruokinta
Testipitoisuudet
Kontrollit
Analyyttisten määritysten ja mittausten taajuus
Havainnot 26. Alkiokehitysvaihe : Testikemikaalille altistuksen alussa alkiokehitysvaihe on varmistettava mahdollisimman tarkasti. Siinä voidaan käyttää sopivasti säilytettyä ja puhdistettua edustavaa näytettä mätimunista. 27. Kuoriutuminen ja eloonjääminen : Kuoriutumisesta ja eloonjäämisestä on tehtävä havaintoja vähintään kerran päivässä, ja yksilöiden lukumäärät on kirjattava. Jos mätimunissa havaitaan sieniä alkiokehityksen varhaisvaiheessa (eli testin ensimmäisenä tai toisena päivänä), sellaiset mätimunat on laskettava ja poistettava. Kuolleet alkiot, toukat ja juveniilit on poistettava heti, kun ne havaitaan, koska ne voivat hajota nopeasti ja muut kalat saattavat rikkoa ne. Kuolleita yksilöitä poistettaessa on oltava erittäin varovainen, ettei vieressä olevia mätimunia tai toukkia vahingoiteta fyysisesti. Kuolemantapaukset todetaan eri kehitysvaiheissa ja eri lajeilla eri tavoin. Esimerkiksi
28. Epänormaali ulkonäkö : Sellaisten toukkien tai juveniilien lukumäärä, joiden ruumiinmuodossa havaitaan epänormaaliutta, on kirjattava määräajoin testin kestosta ja kuvatun epänormaaliuden laadun mukaan. On huomattava, että epänormaaleja toukkia ja juveniileja esiintyy luonnollisesti, ja niiden määrä voi joillakin lajeilla olla useita prosentteja kontroll(e)issa. Jos epämuodostumia ja niihin liittyvää epänormaalia käytöstä pidetään niin vakavana, että eliö kärsii huomattavasti ja se on saavuttanut pisteen, jossa toipuminen ei ole mahdollista, eliö voidaan poistaa testistä. Tällaiset eläimet on lopetettava ja lisättävä kuolleisuuslukuihin myöhemmin tehtävässä analyysissa. Useimmilla lajeilla, joita on suositeltu käytettäväksi tässä testimenetelmässä, on rekisteröity normaalia alkiokehitystä (9) (10) (11) (12). 29. Epänormaali käyttäytyminen : Epänormaali käyttäytyminen, esimerkiksi hyperventilaatio, koordinoimaton uinti, epätyypillinen liikkumattomuus ja epätyypillinen syömiskäyttäytyminen, on kirjattava sopivin väliajoin testin aikana (esim. kerran päivässä lämpimän veden lajeilla). Vaikka tällaisia vaikutuksia on vaikea kvantifioida, niiden havainnoiminen voi auttaa kuolleisuusdatan tulkinnassa. 30. Paino : Kaikki eloonjääneet kalat punnitaan testin lopuksi vähintään rinnakkaisastiakohtaisesti (ilmoitetaan astiassa olevien eläinten lukumäärä ja keskipaino eläintä kohden). Tuorepainoa (eläimet kuivataan pinnalta) pidetään parempana, mutta myös kuivapainotiedot saa ilmoittaa (13). 31. Pituus : Testin lopussa mitataan yksilöiden pituus. Kokonaispituus on suositeltava, mutta jos pyrstöevä tai muut evät ovat syöpyneet, voidaan käyttää vakiopituutta. Kussakin testissä on käytettävä samaa menetelmää kaikkiin kaloihin. Yksilön pituus voidaan mitata käyttämällä esimerkiksi työntömittaa, digitaalista kameraa tai kalibroitua okulaarimikrometriä. Tyypilliset vähimmäispituudet on määritelty lisäyksessä 2. TIEDOT JA RAPORTOINTI Tulosten käsittely
Testiraportti
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT
Lisäys 2 TESTIOLOSUHTEET, TESTIN KESTO JA ELOONJÄÄMISKRITEERIT SUOSITELLUILLE LAJEILLE
Lisäys 3 SUOSITUSLAJIEN SIITOS- JA TESTIELÄINTEN RUOKINTA- JA KÄSITTELYOHJEET
Lisäys 4 JOITAKIN HYVÄKSYTTÄVÄN LAIMENNUSVEDEN KEMIALLISIA OMINAISUUKSIA
Lisäys 5 TILASTOLLISIA OHJEITA NOEC-MÄÄRITYKSEEN Yleistä Analyysiyksikkö on rinnakkaistankki. Siten jatkuvissa mittauksissa, kuten koon mittauksessa, on laskettava rinnakkaisnäytteen keskiarvo tai mediaani, ja analyysissa käytetään näitä rinnakkaisarvoja. Testien voima on osoitettava mielellään jokaisen laboratorion aiempia riittäviä tuloksia koskevan tietokannan avulla. Käytettävässä tilastollisessa testissä on jokaista tutkittavaa ominaisuutta varten annettava vaikutuksen suuruus, joka voidaan havaita 75–80 prosentin voimalla. Tämän testausmenetelmän kehittämisajankohtana käytettävissä olevissa tietokannoissa ilmoitetaan mahdollinen voima suositeltavissa tilastomenetelmissä. Yksittäisen laboratorion on osoitettava kykynsä täyttää voimaa koskeva vaatimus joko tekemällä oma voima-analyysi tai osoittamalla, että kunkin vasteen variaatiokerroin ei ylitä testiohjeen laadinnassa käytettyjen variaatiokertoimien 90. prosenttipistettä. Kyseiset variaatiokertoimet esitetään taulukossa 1. Jos käytettävissä ovat ainoastaan rinnakkaisnäytteiden keskiarvot tai mediaanit, rinnakkaisnäytteiden sisäiset variaatiokertoimet voidaan jättää huomiotta. Taulukko 1 Valikoitujen makean veden lajien 90. prosenttipisteen variaatiokertoimet
Lähes kaikissa laboratorioiden toksisuustutkimusten arvioinnissa käytettävissä tilastollisissa testeissä kiinnostuksen kohteena on vertailla käsittelyryhmiä kontrolleihin. Tästä syystä ei ole asianmukaista vaatia merkitsevää ANOVA-F-testiä, ennen kuin käytetään Dunnettin tai Williamsin testiä, taikka merkitsevää Kruskal-Wallisin testiä, ennen kuin käytetään Jonckheere-Terpstran, Mann-Whitneyn tai Dunnin testiä (Hochberg ja Tamhane 1987, Hsu 1996, Dunnett 1955, 1964, Williams 1971, 1972, 1975, 1977, Robertson ja muut 1988, Jonckheere 1954, Dunn 1964). Dunnettin testiin on etukäteen määritetty kerrannaisuuskorjaus, jolloin sen väärien positiivisten ja väärien negatiivisten tulosten osuuksiin vaikuttaa haitallisesti F-testin käyttäminen portinvartijana. Vastaavasti Williamsin ja Jonckheere-Terpstran vertailutesteissä, joissa käytetään 0,05:n merkitsevyystasoa jokaisessa vaiheessa, väärien positiivisten tulosten kokonaisosuus pysyy 5 prosentissa, mihin, samoin kuin testien voimaan, vaikuttaa haitallisesti F-testin tai Kruskal-Wallisin testin käyttäminen portinvartijana. Mann-Whitneyn ja Dunnin testejä on korjattava kerrannaisuuden osalta, ja siihen suositellaan Bonferroni-Holmin korjausta. OECD:n julkaisussa (2006) käsitellään hypoteesitestausta ja testien perustana olevien olettamusten todentamista koskevia suosituksia yksityiskohtaisesti, ja siinä on myös laaja kirjallisuusluettelo. Kontrollien käsittely liuottimen yhteydessä Jos käytetään liuotinta, testiin on otettava sekä laimennusvesikontrolli että liuotinkontrolli. Näitä kahta kontrollia on verrattava jokaisen vasteen osalta, ja tulokset on yhdistettävä tilastollista analyysia varten, ellei kontrollien välillä ole merkitsevää eroa. Muutoin NOEC:n määritykseen tai ECx:n estimointiin on käytettävä liuotinkontrollia, eikä vesikontrollia käytetä. Ks. rajoitus validiteettikriteereissä (7 kohta). T-testiä tai Mann-Whitneyn testiä on käytettävä vertaamaan laimennusvesikontrollia ja liuotinkontrollia pituuden, painon, kuoriutuneisuuden, toukkakuolleisuuden tai epänormaalien toukkien osuuden sekä kuoriutumisen ensimmäisen ja viimeisen päivän tai uimaan lähdön osalta 0,05:n merkitsevyystasolla ottamatta käsittelyryhmiä huomioon. Näiden testien tulokset on raportoitava. Kokomittaukset (pituus ja paino) Yksittäisten kalojen pituus- ja painoarvot voivat olla normaali- tai log-normaalijakaumalla. Kummassakin tapauksessa rinnakkaisnäytteiden keskiarvot ovat yleensä normaalijakaumalla keskeisen raja-arvolauseen nojalla, mikä on vahvistettu runsaasti yli 100 ELS-tutkimuksessa kolmella makean veden lajilla. Vaihtoehtoisesti, jos tiedot tai aiemmat tietokannat viittaavat yksittäisten kalojen kokoarvojen log-normaalijakaumaan, voidaan laskea yksittäisten kalojen arvojen rinnakkaisnäytteiden logaritminen keskiarvo, minkä jälkeen analyysitietoja voidaan käyttää rinnakkaisnäytteiden logaritmisen keskiarvon anti-logina. Tietojen yhdenmukaisuus normaalijakauman ja varianssien homogeenisuuden kanssa on arvioitava. Tätä varten on käytettävä ANOVA-mallin jäännöksiä siten, että pitoisuudet ovat ainoa selittävä luokkamuuttuja. Visuaalista määritystä hajontakaavioiden ja pylväsdiagrammien tai lehti-ruoti-kuvioiden avulla voidaan käyttää. Vaihtoehtoisesti voidaan käyttää virallista testiä, kuten Shapiro-Wilkin tai Anderson-Darlingin testiä. Yhdenmukaisuus varianssien homogeenisuuden kanssa voidaan arvioida samasta hajontakaaviosta visuaalisesti tai virallisesti Levenen testillä. Vain parametritesteissä (kuten Williams, Dunnett) on arvioitava normaalius tai varianssien homogeenisuus. Mahdollisiin poikkeaviin havaintoarvoihin ja niiden vaikutukseen analyysissa on kiinnitettävä huomiota. Tukeyn poikkeavien havaintoarvojen testiä ja samojen edellä kuvattujen jäännöskaavioiden visuaalista tarkastelua voidaan käyttää. On muistettava, että havainnot koskevat kokonaisia rinnakkaisnäytteitä, joten poikkeavan havaintoarvon pois jättäminen analyysistä on tehtävä vasta huolellisen harkinnan jälkeen. Tilastolliset testit, joissa hyödynnetään testijärjestelyn ominaispiirteitä ja biologisia odotuksia, ovat alaspäin askeltavia trenditestejä, kuten Williams ja Jonckheere-Terpstra. Testeissä on oletuksena monotoninen pitoisuus-vaste, ja on arvioitava, ovatko tiedot yhdenmukaisia tämän olettaman kanssa. Se voidaan tehdä visuaalisesti rinnakkaisnäytteiden keskiarvojen hajontakaaviosta verrattuna testipitoisuuteen. On avuksi asettaa hajontakaavion päälle paloittain lineaarinen kaavio, jossa yhdistetään rinnakkaisnäytteen näytekoolla painotetut pitoisuuden keskiarvot. Jos paloittainen lineaarinen kaavio poikkeaa suuresti monotonisuudesta, on ehkä tarpeen käyttää muita kuin trenditestejä. Vaihtoehtoisesti voidaan käyttää virallisia testejä. Yksinkertainen virallinen testi on laskea pitoisuuskeskiarvojen lineaariset ja kvadraattiset kontrastit. Jos kvadraattinen kontrasti on merkitsevä ja lineaarinen kontrasti ei, se on merkki mahdollisesta monotonisuusongelmasta, jota on arvioitava kaavioista tarkemmin. Jos normaalius tai varianssien homogeenisuus voi olla ongelma, kontrastit voidaan konstruoida sijatunnusmuunnetuista tiedoista. Vaihtoehtoisia menettelyjä, kuten Bartholomewin monotonisuustestiä, voidaan käyttää, mutta ne lisäävät kompleksisuutta. Kuva 2 NOEC-vuokaavio koon mittauksista (pituus ja paino). 
Paitsi jos tiedot eivät ole yhdenmukaisia näitä testejä koskevien vaatimusten kanssa, NOEC määritetään soveltamalla alaspäin askeltavia Williamsin tai Jonckheere-Terpstran testejä. OECD:n julkaisussa (2006) annetaan näistä menettelyistä yksityiskohtaiset tiedot. Jos tiedot eivät ole yhdenmukaisia alaspäin askeltavien testien vaatimusten kanssa, voidaan käyttää Dunnettin testiä tai Tamhane-Dunnettin testiä (T3), joissa kummassakin on etukäteen määritetyt kerrannaisuuskorjaukset. Näissä testeissä oletuksena on normaalius ja Dunnettin tapauksessa varianssien homogeenisuus. Jos kyseiset edellytykset eivät täyty, voidaan käyttää Dunnin parametritonta testiä. OECD:n julkaisussa (2006) on yksityiskohtaiset tiedot kaikista näistä testeistä. Kuvassa 2 on yleiskatsaus testin valintaan. Mätimunien kuoriutuminen ja toukkien eloonjääminen Tiedot koskevat kuoriutuvien mätimunien tai eloonjäävien toukkien osuuksia yksittäisissä rinnakkaisnäytteissä. Osuuksista on arvioitava ylihajonta, joka on tavallista muttei vallitsevaa tällaisissa mittauksissa. Kuvan 3 vuokaaviossa on ohjeita testin valintaan; yksityiskohtaiset kuvaukset on annettu tekstissä. Kahta testiä käytetään yleisesti. Ne ovat Taronen C(α)-testi (Tarone 1979) ja Khin neliö -testi, joita kumpaakin sovelletaan erikseen jokaiseen testipitoisuuteen. Jos ylihajontaa löydetään yhdessäkin testipitoisuudessa, on käytettävä menetelmiä, joissa se voidaan ottaa huomioon. Kaava 1 Taronen C(α)-testi (Tarone 1979)
jossa ̂ on tietyn pitoisuuden keskimääräinen osuus, m on rinnakkaistankkien lukumäärä, nj on kohteiden lukumäärä rinnakkaisnäytteessä j, ja xj on kyseisessä rinnakkaisnäytteessä vasteen antavien eli esim. kuoriutumattomien tai kuolleiden kohteiden lukumäärä. Testiä sovelletaan kuhunkin pitoisuuteen erikseen. Testiä voidaan pitää Khin neliö -testin sovelluksena, mutta rajoitetulla voimalla Taronella tehdyt simulaatiot ovat osoittaneet, että se on tehokkaampi kuin Khin neliö -testi. Kuva 3 NOEC-vuokaavio. Mätimunien kuoriutuminen ja toukkakuolleisuus. 
Jos ylihajonnasta ei ole merkitsevää näyttöä, voidaan käyttää Cochran-Armitagen vertailutestiä. Tässä testissä rinnakkaisnäytteitä ei oteta huomioon, joten jos ylihajonnasta on näyttöä, suositellaan Cochran-Armitagen testin Rao-Scott-korjausta (RSCA), jossa rinnakkaisnäytteet, rinnakkaisnäytekoot ja ylihajonta otetaan huomioon. Vaihtoehtoisia testejä ovat muun muassa Williamsin ja Jonckheere-Terpstran vertailutestit ja Dunnettin testi, kuten edellä on kuvattu koon mittauksissa. Näitä testejä sovelletaan ylihajonnasta riippumatta, mutta niiden voima on hieman alhaisempi (Agresti 2002, Morgan 1992, Rao ja Scott 1992, 1999, Fung ja muut 1994, 1996). Ensimmäinen tai viimeinen kuoriutumispäivä tai uimaan lähtö Vaste on kokonaisluku, joka ilmoittaa testipäivän, jona mainitut havainnot on tehty tietyssä rinnakkaistankissa. Arvojen vaihteluväli on yleensä hyvin rajoitettu, ja toisiinsa sidottujen arvojen osuus on usein hyvin suuri. Esimerkiksi sama ensimmäinen kuoriutumispäivä havaitaan kaikissa rinnakkaiskontrolleissa ja ehkä yhdessä tai kahdessa alhaisen testipitoisuuden näytteessä. Parametritestitestit, kuten Williams ja Dunnett, eivät sovellu tällaisten tietojen käsittelyyn. Jonckheere-Terpstran vertailutestillä havaitaan erittäin tehokkaasti testikemikaalin vaikutukset, ellei ole näyttöä vakavasta monotonisuuden puutteesta. Muussa tapauksessa voidaan käyttää Dunnin testiä. Toukkien epämuodostumat Vaste on jollain lailla epänormaaleiksi todettujen toukkien lukumäärä. Vaste on usein hyvin alhainen, ja siihen liittyy joitakin samoja ongelmia kuin ensimmäiseen kuoriutumispäivään, ja toisinaan pitoisuusvaste on epäsäännöllinen. Jos tiedot ainakin pääpiirteittäin noudattavat monotonista pitoisuusmuotoa, testikemikaalin vaikutukset havaitaan erittäin tehokkaasti Jonckheere-Terpstran vertailutestillä. Muussa tapauksessa voidaan käyttää Dunnin testiä. VIITTEET Agresti, A. (2002), Categorical Data Analysis, 2. laitos, Wiley, Hoboken. Dunnett, C. W. (1955), A multiple comparisons procedure for comparing several treatments with a control, Journal of American Statistical Association, 50, 1096–1121. Dunn, O. J. (1964), Multiple Comparisons Using Rank Sums, Technometrics 6, 241–252. Dunnett, C. W. (1964), New tables for multiple comparisons with a control, Biometrics 20, 482–491. Fung, K. Y., Krewski, D., Rao, J. N. K., Scott, A. J. (1994), Tests for Trend in Developmental Toxicity Experiments with Correlated Binary Data, Risk Analysis 14, 639–648. Fung, K. Y, Krewski, D., Smythe, R. T. (1996), A comparison of tests for trend with historical controls in carcinogen bioassay, Canadian Journal of Statistics 24, 431–454. Hochberg, Y. ja Tamhane, A. C. (1987), Multiple Comparison Procedures, Wiley, New York. Hsu, J. C. (1996), Multiple Comparisons: Theory and Methods; Chapman and Hall/CRC Press, Boca Raton. Jonckheere, A. R. (1954), A distribution-free k-sample test against ordered alternatives, Biometrika 41, 133. Morgan, B. J. T. (1992), Analysis of Quantal Response Data, Chapman and Hall, Lontoo. OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series on Testing and Assessment, No. 54. Organisation for Economic Co-operation and Development, OECD, Pariisi. Rao, J. N. K. ja Scott, A. J. (1992), A simple method for the analysis of clustered binary data, Biometrics 48, 577–585. Rao, J. N. K. ja Scott, A. J. (1999), A simple method for analyzing overdispersion in clustered Poisson data, Statistics in Medicine 18, 1373–1385. Robertson, T., Wright, F. T. ja Dykstra, R. L. (1988), Order restricted statistical inference, Wiley. Tarone, R. E. (1979), Testing the goodness of fit of the Binomial distribution, Biometrika 66, 585–590. Williams, D. A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics 27, 103–117. Williams, D. A. (1972), The comparison of several dose levels with a zero dose control, Biometrics 28, 519–531. Williams, D. A. (1975), The Analysis of Binary Responses from Toxicological Experiments Involving Reproduction and Teratotlogy, Biometrics 31, 949–952. Williams, D. A. (1977), Some inference procedures for monotonically ordered normal means, Biometrika 64, 9–14. Lisäys 6 REGRESSIOESTIMAATTEJA KOSKEVIA TILASTOLLISIA OHJEITA Yleistä Mallin sovittamiseen käytettäviä havaintoja ovat rinnakkaisnäytteiden keskiarvot (pituus ja paino) tai rinnakkaisnäytteiden suhteelliset osuudet (mätimunien kuoriutuminen ja toukkakuolleisuus) (OECD 2006). Yleisesti suositellaan painotettua regressiota, jossa painona käytetään rinnakkaisnäytteen näytekokoa. Muut painotusjärjestelmät ovat mahdollisia, kuten painotus ennakoidulla keskivasteella tai sen ja rinnakkaisnäytteen näytekoon yhdistelmällä. Painotusta saman pitoisuuden sisäisen näytteen varianssin käänteisluvulla ei suositella (Bunke ja muut 1999, Seber ja Wild 2003, Motulsky ja Christopoulos 2004, Huet ja muut 2003). Jos vasteita muunnetaan ennen analyysia, on säilytettävä havaintojen riippumattomuus, ja ECx ja sen luottamusrajat on ilmaistava alkuperäisinä mittayksiköinä eikä muunnettuina yksiköinä. Esimerkiksi 20 prosentin muutos pituuden logaritmissa ei vastaa 20 prosentin muutosta pituudessa (Lyles ja muut 2008, Draper ja Smith 1999). Kuvan 4 kaaviossa esitetään yleiskatsaus ECx-estimaatteihin. Yksityiskohdat esitetään jäljempänä. Kuva 4 Vuokaavio – rinnakkaisnäytteiden keskipituuden tai -painon taikka mätimunien kuoriutumisosuuden tai toukkakuolleisuuden ECx-estimointi, ks. tarkemmin jäljempänä. 
Mätimunien kuoriutumista ja toukkakuolleisuutta koskevia näkökohtia Mätimunien kuoriutumiseen ja toukkakuolleisuuteen on yleensä paras sovittaa alenevaa mallia, ellei soviteta jäljempänä kuvattua probittimallia. On toisin sanoen mallinnettava kuoriutumatta jääneiden mätimunien tai kuolevien toukkien osuutta. Tämä johtuu siitä, että ECx viittaa pitoisuuteen, jossa muutos on x prosenttia kontrollin keskivasteesta. Jos kontrollimunista 5 prosenttia jää kuoriutumatta ja mallinnetaan kuoriutumatta jäämistä, EC20 viittaa pitoisuuteen, jossa muutos on 20 prosenttia kontrollien 5 prosentin kuoriutumatta jäämisestä, jolloin muutos on 0,2 × 0,05 = 0,01. Toisin sanoen kuoriutumatta jääneitä on 1 prosenttiyksikköä eli 6 prosenttia. Näin pientä muutosta ei voida mielekkäästi estimoida käytettävissä olevista tiedoista eikä se ole biologisesti merkitsevä. Jos sen sijaan mallinnetaan niiden mätimunien osuutta, jotka kuoriutuvat, kontrolliosuus on tässä esimerkissä 95 prosenttia, ja 20 prosentin vähennys kontrollin keskiarvosta vastaa muutosta 0,95 × 0,2 = 0,18, joten 95 prosentin kuoriutumismenestys muuttuu 77 prosentiksi (= 95 – 18). Tällöin pitoisuuden vaikutus voidaan estimoida, joten menetelmällä on oletettavasti enemmän arvoa. Kokomittauksissa tämä ei ole ongelma, vaikka haitalliset vaikutukset kokoon tarkoittavat yleensä koon pienenemistä. Kokoa (pituutta tai painoa) ja mätimunien kuoriutumismenestystä tai toukkien eloonjääntiä koskevat mallit Kaikki mallit on kuvattu ja niitä suositellaan OECD:n julkaisussa (2006), Brain-Cousensin hormeettista mallia lukuun ottamatta. Niin sanottuja OECD 2–5 -malleja käsitellään ekotoksisuustestien yhteydessä myös Slobin teoksessa (2002). Mahdollisesti hyödyllisiä malleja on luonnollisesti muitakin. Teoksessa Bunke ja muut (1999) luetellaan useita malleja, joita ei käsitellä tässä, ja muita malleja koskevia viitteitä on runsaasti. Jäljempänä ehdotettuja malleja pidetään erityisen hyvin sopivina ekotoksisuustesteihin, ja niitä käytetään laajalti. 5 testipitoisuutta ja kontrolli
Vähintään 6 testipitoisuutta ja kontrolli
Jos hormeesista on visuaalista näyttöä (epätodennäköistä mätimunien onnistuneen kuoriutumisen tai toukkien eloonjäännin yhteydessä, mutta kokohavainnoissa sitä havaitaan toisinaan)
Mätimunien kuoriutumisen epäonnistumista ja toukkakuolleisuutta koskevia vaihtoehtoisia malleja
Yhden ainoan mallin sopivuus
Mallien vertailu
ECx-estimaatin laatu ECx:n luottamusväli ei saa olla liian suuri. Tilastollista harkintaa tarvitaan sen ratkaisemiseen, kuinka suuri luottamusväli voi olla, jotta ECx on edelleen hyödyllinen. Mätimunien kuoriutumis- ja kokotietoihin sovitetuilla regressiomalleilla tehdyt simulaatiot osoittavat, että ECx:n (x = 10, 20 tai 30) 75 prosentin luottamusväli ulottuu enintään kahteen testipitoisuuteen. Näin saadaan yleisohje siitä, mikä on hyväksyttävää, ja käytännön ohje siitä, mikä on saavutettavissa. Lukuisat kirjoittajat vahvistavat tarpeen ilmoittaa kaikkien parametrien luottamusvälit ja sen, että malliparametrien suuret luottamusvälit ovat merkki malleista, joita ei voida hyväksyä (Ott ja Longnecker 2008, Alvord ja Rossio 1993, Motulsky ja Christopoulos 2004, Lyles ja muut 2008, Seber ja Wild 2003, Bunke ja muut 1999, Environment Canada 2005). ECx:n (tai minkään muun malliparametrin) luottamusväli ei saa sisältää nollaa (Motulsky ja Christopoulos (2004). Tämä on pienintä merkitsevää eroa vastaava regressio, joka mainitaan usein hypoteesitestausmenetelmissä (esim. Wang ja muut 2000). Se vastaa myös keskiarvovasteita LOEC-arvossa, joka ei sisällä kontrollikeskiarvoa. Parametriestimaattien tieteellistä uskottavuutta on pohdittava. Jos esim. y0:n luottamusväli on ± 20 prosenttia, mikään EC10-estimaatti ei ole uskottava. Jos mallissa ennakoidaan 20 prosentin vaikutus pitoisuudella C ja C:n ja sitä pienemmillä pitoisuuksilla havaittu maksimivaikutus on 10 prosenttia, EC20 ei ole uskottava (Motulsky ja Christopoulos 2004, Wang ja muut 2000, Environment Canada 2005). ECx:n määrittäminen ei saa edellyttää ekstrapolointia positiivisten pitoisuuksien vaihteluvälin ulkopuolella (Draper ja Smith 1999, OECD 2006). Yleisohjeena voidaan esimerkiksi pitää, että ECx on enintään 25 prosenttia pienimmän testatun pitoisuuden alapuolella tai suurimman testatun pitoisuuden yläpuolella. VIITTEET Alvord, W. G., Rossio, J. L. (1993), Determining confidence limits for drug potency in immunoassay, Journal of Immunological Methods 157, 155–163. Brain, P. ja Cousens, R. (1989), An equation to describe dose responses where there is stimulation of growth at low doses. Weed res. 29: 93–96. Bunke, O., Droge, B. ja Polzehl, J. (1999), Model selection, transformations and variance estimation in nonlinear regression. Statistics 33, 197–240. Collett, D. (2002), Modelling Binary Data, 2. laitos, Chapman and Hall, Lontoo. Collett, D. (2003), Modelling Survival Data in Medical Research, 2. laitos, Chapman and Hall, Lontoo. Draper, N. R. ja Smith, H. (1999), Applied Regression Analysis, 3. laitos. New York: John Wiley & Sons. Environment Canada (2005), Guidance Document on Statistical Methods for Environmental Toxicity Tests, Report EPS 1/RM/46. Huet, S., Bouvier, A., Poursat, M.-A., Jolivet, E. (2003), Statistical Tools for Nonlinear Regression: A Practical Guide with S-PLUS and R Examples, Springer Series in Statistics, New York. Lyles, R. H., Poindexter, C., Evans, A., Brown, M. ja Cooper, C. R. (2008), Nonlinear Model-Based Estimates of IC50 for Studies Involving Continuous Therapeutic Dose-Response Data, Contemp Clin Trials, marraskuu 2008, 29(6): 878–886. Morgan, B. J. T. (1992), Analysis of Quantal Response Data, Chapman and Hall, Lontoo. Motulsky, H., Christopoulos, A. (2004), Fitting Models to Biological Data Using Linear and Nonlinear Regression: A Practical Guide to Curve Fitting, Oxford University Press, USA. O'Hara Hines, R. J. ja Lawless, J. F. (1993), Modelling Overdispersion in Toxicological Mortality Data Grouped over Time, Biometrics nide 49, s. 107–121. OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series Testing and Assessment, No. 54, Organisation for Economic Co-operation and Development, OECD, Pariisi. Ott, R. L., Longnecker, M. T. (2008), An Introduction to Statistical Methods and Data Analysis, 6. laitos, Brooks-Cole, Belmont, CA. Ratkowsky, D. A. (1993), Principles of nonlinear regression, Journal of Industrial Microbiology 12, 195–199. Seber, G. A. F., Wild, C. J. (2003), Nonlinear Regression, Wiley. Slob W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66, 298–312. Wang, Q., Denton, D. L. ja Shukla, R. (2000), Applications and Statistical Properties Of Minimum Significant Difference-Based Criterion Testing In a Toxicity Testing Program, Environmental Toxicology and Chemistry, nide 19, s. 113–117, 2000. C.48 Kalojen lyhytaikainen lisääntymistutkimus JOHDANTO
ALUSTAVAT NÄKÖKOHDAT JA RAJOITUKSET
TESTIN PERIAATE
TESTIN HYVÄKSYTTÄVYYSKRITEERIT
MENETELMÄN KUVAUS Laitteisto
Vesi
Testiliuokset
Kalojen hoito
Esialtistus ja kalojen valinta
TESTISUUNNITELMA
Testipitoisuuksien valinta
MENETTELY Kalojen valinta ja punnitus
Altistumisolosuhteet Kesto
Ruokinta
Valo ja lämpötila
Analyyttisten määritysten ja mittausten taajuus
Havainnot
Eloonjääneisyys
Käyttäytyminen ja ulkonäkö
Hedelmällisyys
Kalojen humaani lopettaminen
Sekundaaristen sukupuoliominaisuuksien havainnointi
Vitellogeniini (VTG)
Sukurauhasten histopatologinen arviointi
TIEDOT JA RAPORTOINTI Biomarkkerivasteiden arviointi varianssianalyysilla (ANOVA)
Testitulosten raportointi
TESTITULOSTEN TULKINTAA JA HYVÄKSYMISTÄ KOSKEVAT OHJEET
LÄHDEKIRJALLISUUS
Lisäys 1 LYHENTEET JA MÄÄRITELMÄT CV (coefficient of variation) : Variaatiokerroin. ELISA (Enzyme-Linked Immunosorbent Assay) : Entsyymivälitteinen immunosorbenttimääritys. HPG-akseli : Hypotalamus-aivolisäke-sukurauhasakseli. Kalamäärä : Kalojen tuorepaino suhteessa vesimäärään. Kalatiheys : Kalojen lukumäärä suhteessa vesimäärään. Kemikaali : Aine tai seos. MTC (Maximum Tolerated Concentration) : Suurin siedetty pitoisuus, noin 10 prosenttia LC50-arvosta. Testikemikaali : Aine tai seos, jota testataan tällä testimenetelmällä. VTG : Vitellogeniini – fosfolipoglykoproteiini, munankeltuaisen esiaste, jota tavataan yleensä kaikilla munimalla lisääntyvien lajien sukukypsillä naarailla. Lisäys 2 KALOJEN HORMONIJÄRJESTELMÄÄN KOHDISTUVAN SEULONTATUTKIMUKSEN KOEOLOSUHTEET
Lisäys 3 JOITAKIN HYVÄKSYTTÄVÄN LAIMENNUSVEDEN KEMIALLISIA OMINAISUUKSIA
Lisäys 4A SEEPRAKALAN KUTUALUSTA Kututarjotin : Lasinen instrumenttitarjotin (koko esimerkiksi 22 × 15 × 5,5 cm (p × l × s)), jonka päällä irrotettava ruostumaton teräsristikko (silmäkoko 2 mm). Ristikonon peitettävä instrumenttitarjotin hieman reunojen alapuolelta. 
Kutualusta on kiinnitettävä ristikkoon. Kutualustaan on muodostettava rakenne, jolle kalat voivat siirtyä. Sopivia rakenteita ovat esimerkiksi vihreästä muovimateriaalista valmistetut keinotekoiset akvaariokasvit (huom. testikemikaalin adsorptio muovimateriaaliin on muistettava ottaa huomioon). Muovimateriaalia on huuhdeltava runsaassa lämpimässä vedessä riittävän kauan, jotta varmistetaan, ettei testiveteen joudu kemikaaleja. Lasimateriaaleja käytettäessä on varmistettava, etteivät kalat vahingoitu ja että niillä on riittävästi tilaa rajuihinkin liikkeisiin. Tarjottimen ja lasilevyjen välisen etäisyyden on oltava vähintään kolme senttimetriä sen varmistamiseksi, ettei kuteminen tapahdu tarjottimen ulkopuolella. Tarjottimelle lasketut mätimunat putoavat ristikon läpi, ja ne voidaan kerätä näytteenottoa varten 45–60 minuutin kuluttua valojen sytyttämisestä. Läpinäkyvät mätimunat eivät ole tahmeita, ja ne on helppo laskea poikittaisvalossa. Kun astiassa on viisi naarasta, 20:tä mätimunaa päivässä voidaan pitää pienenä määränä, 100:aa mätimunaa kohtalaisena määränä ja yli 100:aa mätimunaa suurena määränä. Kutualusta on poistettava astiasta ja mätimunat on kerättävä joko mahdollisimman myöhään illalla tai erittäin varhain aamulla, ja alusta on laitettava sen jälkeen takaisin testiastiaan. Alusta on laitettava takaisin astiaan tunnin kuluessa sen poisottamisesta, sillä muutoin kutualusta saattaa houkutella kalat parittelemaan tai kutemaan yksilöllisesti epätavallisiin aikoihin. Jos tilanne vaatii kutualustan laittamista takaisin myöhemmin, se on tehtävä vähintään yhdeksän tunnin kuluttua valojen sytyttämisestä. Niin myöhäiseen vuorokaudenaikaan se ei aiheuta enää kutemista. Lisäys 4B RASVAPÄÄMUDUN KUTUALUSTA Jokaiseen testiastiaan asetetaan kaksi tai kolme muovista/keramiikasta/lasista tai ruostumattomasta teräksestä valmistettua kutulaattaa ja -levyä (esimerkiksi 80 mm pitkä harmaa puoliympyrän muotoinen katos 130 mm pitkän huulletun levyn päälle) (ks. kuva). Asianmukaisesti katetut PVC- tai keramiikkalaatat ovat osoittautuneet sopiviksi kutualustoiksi (Thorpe ja muut 2007). Laattoja kannattaa karhentaa hieman, jotta mätimunat kiinnittyvät niihin paremmin. Tarjotin on suojattava siten, etteivät kalat pääse laskettujen mätimunien luokse, ellei ole osoitettu, että munat kiinnittyvät käytettyyn alustaan pitävästi. 
Alusta on suunniteltava siten, että kaikki mätimunat, jotka eivät kiinnity laatan pintaan ja putoaisivat muutoin astian pohjalle, jäävät sille (samoin kuin munat, jotka lasketaan suoraan sileälle muovialustalle). Kaikkia kutualustoja on huuhdeltava vähintään 12 tuntia laimennusvedessä ennen käyttöä. Thorpe K. L., Benstead R., Hutchinson T. H., Tyler C. R. (2007), An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98. Lisäys 5A RASVAPÄÄMUDUN SEKUNDAARISTEN SUKUPUOLIOMINAISUUKSIEN ARVIOINTI TIETTYJEN HORMONIJÄRJESTELMÄÄN VAIKUTTAVIEN KEMIKAALIEN HAVAITSEMISEKSI Yleiskatsaus Hormonitoimintaa häiritsevien aineiden testauksessa mahdollisesti tärkeitä fyysiseen ulkonäköön liittyviä piirteitä täysikasvuisilla rasvapäämuduilla ovat väri (vaalea/tumma), värityskuviot (onko esimerkiksi pystysuoria raitoja vai ei), kalan muoto (pään ja rinnan alueen muoto, vatsan pullistuneisuus) sekä erikoistuneet sekundaariset sukupuoliominaisuudet (kutukyhmyjen lukumäärä ja koko, niskakyhmyn koko, munanasetin). Kutukyhmyt sijaitsevat sukukypsien rasvapäämutukoiraiden päässä (niskakyhmyssä), ja ne ovat useimmiten järjestäytyneet molemmin puolin symmetriseksi kuvioksi (Jensen ja muut 2001). Kontrollinaarailla sekä nuorilla koirailla ja naarailla kyhmyt eivät ole kehittyneet (Jensen ja muut 2001). Koiraiden silmien ympärillä ja sierainten välissä voi olla jopa kahdeksan yksittäistä kyhmyä. Eniten kyhmyjä on kahdella samansuuntaisella viivalla heti sierainten alapuolella ja suun yläpuolella, ja ne ovat myös suurimpia kyhmyjä. Monilla kaloilla kyhmyryhmiä on alaleuan alapuolella. Suuta lähimpänä sijaitsee yleensä yksittäinen kyhmypari, kun taas lähempänä vatsapuolta voi olla jopa neljästä kyhmystä muodostuva sarja. Kyhmyjen todellinen määrä on harvoin yli 30 (vaihteluväli 18–28; Jensen ja muut, 2001). Useimmat kyhmyt (määrän kannalta) ovat yksittäisiä, pyöreähköjä rakenteita, joiden korkeus vastaa suurin piirtein niiden sädettä. Useimmilla sukukypsillä koirailla on ainakin joitakin kyhmyjä, jotka ovat siinä määrin laajentuneita ja korostuneita, ettei niistä voi erottaa yksittäisiä rakenteita. Tietyntyyppiset hormonitoimintaa häiritsevät kemikaalit voivat aiheuttaa sen, että tiettyjä sekundaarisia sukupuoliominaisuuksia alkaa esiintyä vastakkaisella sukupuolella. Esimerkiksi androgeenireseptorin agonistit, kuten 17α-metyylitestosteroni tai 17β-trenboloni, voivat aiheuttaa kutukyhmyjen kehittymisen rasvapäämutunaaraille (Smith 1974; Ankley ja muut 2001; 2003), kun taas estrogeenireseptorin agonistit saattavat vähentää koiraiden kutukyhmyjen määrää tai pienentää niiden kokoa (Miles-Richardson ja muut 1999; Harries ja muut 2000). Jäljempänä on kuvaus rasvapäämutujen kutukyhmyjen luonnehdinnasta, joka perustuu Yhdysvaltain ympäristönsuojeluviraston laboratoriossa (Duluth, MN) käytettyihin menettelyihin. Tietyt tuotteet ja/tai laitteet voidaan korvata saatavilla olevilla samantyyppisillä materiaaleilla. Kalojen tutkimisessa on parhainta käyttää valollista suurennuslasia tai valollista dissektiomikroskooppia (3X). Tutki kalaa selkäpuolelta ja siten, että sen etupää on eteenpäin (pää tutkijaa kohti).
Kyhmyjen laskeminen ja arviointi Täysikasvuisilta rasvapäämuduilta on tunnistettu kuusi aluetta, joilla kyhmyjen esiintymistä ja kehittymistä voidaan arvioida. On laadittu myös malli, johon kyhmyjen sijainti ja lukumäärä voidaan merkitä (ks. tämän lisäyksen loppu). Kyhmyjen lukumäärä merkitään muistiin, ja niiden kokoa voidaan arvioida määrällisesti seuraavasti: 0 – ei kyhmyjä, 1 – kyhmyjä, 2 – laajentuneita kyhmyjä ja 3 – korostuneita kyhmyjä kunkin organismin osalta (kuva 1). Luokka 0 – kyhmyjä ei ole. Luokka 1 – kyhmyjä: tähän luokkaan kuuluvat kaikki kyhmyt, joissa on yksi piste, jonka korkeus on miltei sama kuin sen säde. Luokka 2 – laajentuneita kyhmyjä: Tähän luokkaan kuuluu sellainen kudos, jonka ulkonäkö muistuttaa asteriskia. Tällaisessa kyhmyssä on yleensä laaja säteittäinen pohja, jossa on keskeltä reunoille päin suuntautuvia uria tai vakoja. Kyhmyn huippu on usein muita epätasaisempi, mutta joskus se voi olla myös hieman pyöristynyt. Luokka 3 – korostunut: Tähän luokkaan kuuluvat kyhmyt ovat tavallisesti varsin suuria ja pyöreitä, ja niiden rakenne on muita epäselvempi. Toisinaan tällaiset kyhmyt yhtyvät muodostaen yhtenäisen massan yhdelle alueelle tai useammalle alueelle (B, C ja D, kuvattu jäljempänä). Kyhmyjen väri ja muoto vastaavat luokkaa 2, mutta joskus ne ovat melko epämääräisiä. Tätä arviointimenetelmää käyttämällä kyhmyjen kokonaispistemäärä on yleensä < 50 normaalilla kontrollikoiraalla, jolla on 18–20 kutukyhmyä (Jensen ja muut 2001). Kuva 1 
Joidenkin kalojen kutukyhmyjen todellinen määrä voi olla suurempi kuin mallin ruuduissa tietyllä pisteytysalueella. Jos näin on, pisteytysnumeroita voi lisätä laatikon oikealle tai vasemmalle puolelle. Mallin ei siis tarvitse näyttää symmetriseltä. Toinen tapa merkitä muistiin parilliset kyhmyt tai sellaiset kyhmyt, jotka ovat yhtyneet pystysuunnassa yhteen suun vaakasuuntaista tasoa pitkin, on merkitä yhteen ruutuun kahdet arviointipisteet. Merkitsemisalueet:
VIITTEET
Lisäys 5B MEDAKAN SEKUNDAARISTEN SUKUPUOLIOMINAISUUKSIEN ARVIOINTI TIETTYJEN HORMONIJÄRJESTELMÄÄN VAIKUTTAVIEN KEMIKAALIEN HAVAITSEMISEKSI Jäljempänä on kuvaus sukuelinpapilleista (*10), jotka ovat sekundaarisia sukupuoliominaisuuksia medakalla (Oryzias latipes).
Mittaus
Kuva 1. Piirros, josta näkee peräevän muotoon ja kokoon liittyvät sukupuolierot. A, uros; B, naaras. Oka, T. B. (1931), On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209–218. 
Kuva 2. A: Peräevän eväpoimun liitoslevyissä olevia sukuelinpapilleja. J.P. = liitoslevy; A.S. = aksiaalinen väli; P. = papilli. B: Eväpoimun distaalinen pää. Actinotrichium-säikeet (Act.) ovat kärjessä. Oka, T. B. (1931), On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209–218. 
Kuva 3. Kuva kalan ruumiista, jossa näkyy leikkauskohta, kun sukurauhanen on kiinnitetty muulla kuin 10-prosenttisella neutraalilla puskuroidulla formaliinilla. Tässä tapauksessa jäljellä oleva ruumis leikataan kahtia peräevän etuosan ja peräaukon välistä partaterällä (punainen viiva). Kalan ruumiin päänpuoleinen osa laitetaan sukurauhasen kiinnitysliuokseen ja pyrstöosa 10-prosenttiseen neutraaliin puskuroituun formaliiniin. 
Lisäys 6 SUOSITELLUT NÄYTTEENOTTOMENETELMÄT VITELLOGENIINIANALYYSIA VARTEN Näytteenotossa on oltava huolellinen koiraiden ja naaraiden vitellogeniininäytteiden välisen ristikontaminaation välttämiseksi. Menetelmä 1A: Rasvapäämutu, verinäytteen otto pyrstösuonesta Nukutuksen jälkeen pyrstö leikataan osittain auki skalpellilla ja verinäyte otetaan pyrstösuonesta heparinisoituun mikrohematokriittikapillaariputkeen. Kun verinäyte on otettu, plasma eristetään nopeasti sentrifugoimalla näytettä kolme minuuttia g-arvolla 15 000 (tai 4 °C:n lämpötilassa 10 minuuttia g-arvolla 15 000). Haluttaessa hematokriittien prosenttiosuus voidaan määrittää sentrifugoinnin jälkeen. Sen jälkeen plasma poistetaan mikrohematokriittiputkesta ja sitä säilytetään – 80 °C:n lämpötilassa sentrifugiputkessa, jossa on 0,13 yksikköä aprotiniinia (proteaasin estäjää), siihen saakka, kunnes vitellogeniinimääritys voidaan tehdä. Rasvapäämudun (sukupuolen mukaan määräytyvän) koon mukaan kerättävä plasmamäärä on yleensä 5–60 mikrolitraa kalaa kohti (Jensen ja muut 2001). Menetelmä 1B: Rasvapäämutu, verinäytteen otto sydämestä Verinäyte voidaan ottaa vaihtoehtoisesti myös sydänpunktiolla, jossa käytetään heparinisoitua ruiskua (1 000 yksikköä hepariinia millilitrassa). Veri siirretään Eppendorf-putkiin (jotka pidetään jäällä) ja sentrifugoidaan (5 minuuttia, g-arvo 7 000, huonelämpötila). Plasma on siirrettävä puhtaisiin Eppendorf-putkiin (alikvooteissa, jos se on plasman tilavuuden perusteella mahdollista) ja jäädytettävä nopeasti – 80 °C:seen, jossa sitä säilytetään analysointiin saakka (Panter ja muut 1998). Menetelmä 2A: Medaka, maksan poisto Kalan ottaminen pois testiastiasta
Maksan poistaminen
Maksan irrottamisen jälkeen kalan ruumiista voi tutkia sukurauhasten histopatologian ja mitata sekundaariset sukupuoliominaisuudet. Näyte Säilytä kaloilta otetut maksanäytteet – 70 °C:n lämpötilassa, jos niitä ei käytetä esikäsittelyyn pian irrottamisen jälkeen. Kuva 1 Viilto tehdään saksilla aivan rintaevien edestä. 
Kuva 2 Vatsan keskiviiva leikataan saksilla auki pisteeseen, joka sijaitsee noin kaksi millimetriä kallosta peräaukkoon päin. 
Kuva 3 Vatsaontelon seinämät levitetään pihdeillä, jotta maksa ja muut sisäelimet saadaan esiin. (Vaihtoehtoisesti seinämät voidaan kiinnittää sivuille.) Nuoli osoittaa maksaa. 
Kuva 4 Maksa leikataan irti suoraan ja otetaan pois pihdeillä. 
Kuva 5 Sisäelimet irrotetaan varovasti pihdeillä. 
Kuva 6 Sisäelinten molemmat päät ja mahdolliset suoliliepeen kiinnikkeet leikataan irti saksilla. 
Kuva 7 (naaras) Menettely on naaraiden osalta samanlainen. 
Kuva 8 Toimenpide on valmis. 
Menetelmä 2 B: Medaka (Oryzias latipes), maksan esikäsittely vitellogeniinialyysia varten Ota homogenaattipuskuria sisältävä pullo ELISA-pakkauksesta ja jäähdytä se jäämurskalla (liuoksen lämpötila: ≤ 4 °C). Jos käytetään EnBio ELISA -järjestelmän homogenaattipuskuria, sulata liuos huoneenlämmössä ja jäähdytä pullo sen jälkeen jäämurskalla. Laske tarvittavan homogenaattipuskurin määrä maksan painon perusteella (lisää 50 μl homogenaattipuskuria maksan painomilligrammaa kohti). Esimerkki: jos maksa painaa 4,5 mg, tarvittavan homogenaattipuskurin määrä on 225 μl. Tee luettelo kutakin maksaa varten tarvittavan homogenaattipuskurin määrästä. Maksan valmistelu esikäsittelyä varten
Esikäsittely 1) Homogenaattipuskurin lisääminen Tarkista luettelosta, kuinka paljon homogenaattipuskuria kutakin maksanäytettä kohti on käytettävä ja säädä mikropipetti (vaihteluväli: 100–1 000 μl) tarvittavan määrän mukaisesti. Kiinnitä mikropipettiin puhdas kärki. Ota homogenaattipuskuri reagenssipullosta ja lisää puskuri maksanäytteen sisältävään 1,5 ml:n mikroputkeen. Lisää edellä kuvatun menettelyn mukaisesti homogenaattipuskuri kaikkiin 1,5 ml:n mikroputkiin, jotka sisältävät maksanäytteen. Mikropipettiin ei tarvitse vaihtaa välillä uutta kärkeä, paitsi jos kärki kontaminoituu tai jos epäilet sen kontaminoituneen. 2) Maksan homogenisointi
3) Suspendoidun maksahomogenaatin sentrifugointi
4) Supernatantin kerääminen
Näytteiden säilytys Säilytä maksahomogenaatin supernatanttia sisältävät 0,5 ml:n mikroputket – 70 °C:ssa siihen saakka, kun niitä käytetään ELISA-määrityksessä. Menetelmä 3A: Seeprakala, verinäytteen otto pyrstösuonesta Pyrstöön tehdään välittömästi nukutuksen jälkeen poikittainen viilto, ja verinäyte otetaan pyrstösuonesta heparinisoituun mikrohematokriittikapillaariputkeen. Verimäärä vaihtelee 5–15 mikrolitraan kalan koon mukaan. Mikrokapillaariputkeen lisätään sama määrä aprotiniinipuskuria (6 mikrogrammaa/ml fosfaattipuskuroidussa suolaliuoksessa), ja plasma erotellaan verestä sentrifugoimalla (5 minuuttia g-arvolla 600). Plasma kerätään koeputkiin ja varastoidaan – 20 °C:ssä siihen saakka, kunnes siitä analysoidaan vitellogeniini tai muut tutkittavat proteiinit. Menetelmä 3B: Seeprakala, verinäytteen otto sydänpunktiolla Veren koaguloitumisen ja proteiinin hajoamisen välttämiseksi näytteet otetaan fosfaattipuskuroituun suolaliuokseen, joka sisältää hepariinia (1 000 yksikköä/ml) ja proteaasin estäjää, aprotiniinia (2 TIU/ml). Hepariini-ammoniumsuola ja kylmäkuivattu aprotiniini ovat puskurin suositeltavia ainesosia. Näytteenotossa suositellaan käytettäväksi ruiskua (1 ml) ja kiinteää ohutneulaa (esimerkiksi Braun Omnikan-F). Ruisku on esitäytettävä puskurilla (noin 100 mikrolitraa), jotta jokaisen kalan pieni verimäärä voidaan eluoida kunnolla. Verinäytteet otetaan sydänpunktiolla. Ensin kala on nukutettava MS-222:lla (100 mg/l). Kun anestesian taso on asianmukainen, näytteenottaja voi erottaa seeprakalan sydämensykkeen. Pidä ruiskun mäntä pienen paineen alaisena, kun punktoit sydäntä. Kerättävän veren määrä on 20–40 mikrolitraa. Sydänpunktion jälkeen veri-puskuriseos on laitettava koeputkeen. Plasma erotellaan verestä sentrifugoimalla (20 minuuttia; g-arvo 5 000), ja sitä on säilytettävä – 80 °C:ssa analysointiin saakka. Menetelmä 3C: Menettelytapaohje – seeprakala, pään ja pyrstön homogenisointi
Lisäys 7 VITELLOGENIININ RIKASTUSNÄYTTEET JA MÄÄRITYSTEN VÄLINEN VERTAILUAINE Niinä päivinä, kun tehdään vitellogeniinimäärityksiä, analysoidaan myös rikastusnäyte käyttämällä määritysten välistä vertailuainetta. Määritysten välisen vertailuaineen valmistamisessa käytettävä vitellogeniini on peräisin eri erästä kuin se, jota käytettiin tehtävän määrityksen kalibrointistandardien tekemiseen. Rikastusnäyte tehdään lisäämällä tunnettu määrä määritysten välistä vertailuainetta kontrollikoiraan plasmanäytteeseen. Näytettä rikastetaan, jotta saadaan sellainen vitellogeniinipitoisuus, joka on 10–100 kertaa suurempi kuin kontrollikoiraan odotettu vitellogeniinipitoisuus. Rikastettava kontrollikoiraan plasmanäyte voi olla peräisin yksittäiseltä kalalta, tai se voidaan yhdistää useilta kaloilta. Rikastamattomasta kontrollikoiraan plasmasta otettu alanäyte analysoidaan vähintään kahdessa rinnakkaisessa kuopassa. Myös rikastettu näyte analysoidaan vähintään kahdessa rinnakkaisessa kuopassa. Vitellogeniinin keskimääräinen määrä kahdessa rikastamattomassa kontrollikoiraan plasmanäytteessä lisätään siihen vitellogeniinin laskettuun määrään, joka on lisätty näytteiden rikastamiseen, odotetun pitoisuuden määrittämiseksi. Tämä odotetun pitoisuuden ja mitatun pitoisuuden välinen suhde ilmoitetaan kyseisenä päivänä tehtyjen määritysten tulosten mukana. Lisäys 8 VUOKAAVIO TILASTOLLISTA ANALYYSIA KOSKEVAN PÄÄTÖKSENTEON TUEKSI 
C.49 Kalojen alkioilla tehtävä akuuttia toksisuutta koskeva testi (FET-testi) JOHDANTO
TESTIN PERIAATE
ALUSTAVAT HUOMIOT
TESTIN VALIDITEETTI
MENETELMÄN KUVAUS
Laitteisto
Testiastiat
Vesi ja koeolosuhteet
Testiliuokset
Emokalojen ylläpito
Pätevyyden testaaminen
Mätimunien tuotanto
Mätimunien erottelu
MENETTELY Altistumisolosuhteet
Testipitoisuudet
Kontrollit
Altistuksen aloittaminen ja testin kesto
Mätimunien jakaminen 24-kuoppalevyihin
Havainnot
Mittaukset
RAJA-ANNOSTESTI
TIEDOT JA RAPORTOINTI Tulosten käsittely
Testiraportti
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT Apikaalinen päätepiste : aiheuttaa vaikutuksen populaation tasolla. Blastula : Alkion animaalisen navan ympärillä oleva solumuodostuma, joka peittää ruskuaisen tietyn osan. Epibolia : pääasiassa epidermaalisten solujen voimakas lisääntyminen alkion gastrulaatiovaiheessa ja niiden liikkuminen dorsaalipuolelta ventraalipuolelle, jolloin entodermaaliset solukerrokset internalisoituvat invaginaatiota muistuttavassa prosessissa ja ruskuainen siirtyy osaksi alkiota. IUPAC : Kansainvälinen puhtaan ja sovelletun kemian liitto (International Union of Pure and Applied Chemistry) Kemikaali : aine tai seos. Levyn sisäinen kontrolli : Sisäinen kontrolli, joka muodostuu neljästä laimennusvedellä täytetystä kuopasta kutakin 24-kuoppalevyä kohti ja jolla havaitaan valmistajan tai tutkijan menettelyn aikana mahdollisesti aiheuttama levyjen kontaminaatio ja testin tulokseen mahdollisesti vaikuttavat levyjen vaikutukset (esimerkiksi lämpötilagradientti). Läpivirtauskoe : Koe, jossa testiliuokset virtaavat jatkuvasti testijärjestelmän läpi altistuksen aikana. Mediaani tappava pitoisuus (LC50) : Testikemikaalin pitoisuus, jonka arvioidaan aiheuttavan 50 prosentin kuolleisuuden altistuneissa testiorganismeissa testin aikana. Semistaattinen ajoittaisvaihtotesti : Testi, jossa testiliuokset vaihdetaan säännöllisesti määritellyin välein (esimerkiksi 24 tunnin välein). SMILES : SMILES-järjestelmä (Simplified Molecular Input Line Entry Specification). Somiitti : Somiitit ovat kehittyvissä selkärankaisten alkioissa hermostoputken molemmin puolin olevia mesodermirykelmiä, joista kehittyy verinahka (dermatomi), luustolihakset (myotoomi) ja selkäranka (sklerotomi). Staattinen testi : Testi, jossa testiliuokset pysyvät muuttumattomina testin ajan. Testikemikaali : aine tai seos, jota testataan tällä testimenetelmällä. UVCB-aineet : koostumukseltaan tuntemattomat tai vaihtelevat aineet, kompleksit reaktiotuotteet tai biologiset materiaalit (Chemical Substances of Unknown or Variable Composition, Complex Reaction Products and Biological Materials) Ylläpitovesi : Vesi, jossa täysikasvuisia kaloja pidetään. Lisäys 2 YLLÄPITO, KASVATUS JA TYYPILLISET OLOSUHTEET SEEPRAKALAN ALKIOILLA TEHTÄVÄÄ AKUUTTIA TOKSISUUSTESTIÄ VARTEN
Lisäys 3 SEEPRAKALAN NORMAALI KEHITYS 26 °C:N LÄMPÖTILASSA 

Lisäys 4 Kuva 1 24-kuoppalevyjen täyttö 
Kuva 2 Kaavio seeprakalan alkioilla tehtävän akuuttia toksisuutta koskeva testimenettely (vasemmalta oikealle): munien tuotanto, munien kerääminen, esialtistus välittömästi hedelmöitymisen jälkeen lasiastioissa, hedelmöityneiden munien valinta käänteismikroskoopilla tai kaksiokulaarisella mikroskoopilla ja niiden jakaminen 24-kuoppalevyihin, joissa on kutakin testipitoisuutta/kontrolliliuosta, n = testipitoisuutta/kontrolliliuosta kohti tarvittavien munien määrä (tässä 20), thj = tuntia hedelmöitymisen jälkeen. 
Lisäys 5 KUVASTO SEEPRAKALAN ALKIOILLA TEHTÄVÄN AKUUTIN TOKSISUUSTESTIN LETAALEISTA PÄÄTEPISTEISTÄ Seuraavat apikaaliset päätepisteet ovat osoitus akuutista toksisuudesta ja siten alkioiden kuolemasta: alkion koaguloituminen, hännän irtoamattomuus, somiittien muodostumattomuus ja sydämenlyöntien puute. Seuraavat mikroskooppikuvat on valittu havainnollistamaan näitä päätepisteitä. Kuva 1 Alkion koaguloituminen: 
Helotaustavalaistuksessa koaguloituneissa seeprakalan alkioissa näkyy erilaisia läpinäkymättömiä osia. Kuva 2 Somiittien muodostumattomuus: 
Vaikka 24 tuntia vanhan seeprakalan alkion kehitys on myöhässä noin 10 tuntia, siinä näkyy kuvassa (a) hyvin kehittyneitä somiitteja (→), kun taas kuvan (b) alkiossa ei näy mitään merkkejä somiittien muodostumisesta (→). Vaikka kuvan (c) 48 tuntia vanha seeprakalan alkiolla on selvä ruskuaispussin ödeema, siinä näkyy selvää somiittien muodostumista (→), kun taas kuvassa (d) 96 tuntia vanhassa seeprakalan alkiossa ei näy mitään merkkejä somiittien muodostumisesta (→). Huomaa myös kuvassa (d) olevan alkion selkärangan kieroutuma (skolioosi) sekä perikardiaalinen ödeema (*). Kuva 3 Häntäsilmun irtoamattomuus sivulta nähtynä 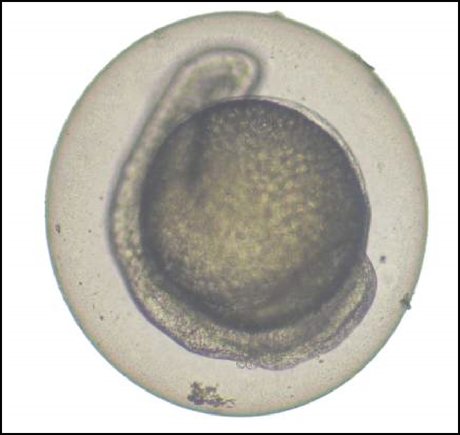
Kuva 4 Sydämenlyöntien puutetta 
Sydämenlyöntien puutetta on luonnollisesti vaikea kuvata mikroskooppikuvassa. Sydämenlyöntien puutetta osoittaa se, että sydän ei supistu (kaksoisnuoli). Verisolujen liikkumattomuus esimerkiksi vatsa-aortassa (→ pienemmässä kuvassa) ei ole osoitus sydämenlyöntien puutteesta. Huomaa myös somiittien muodostumattomuus tässä alkiossa (*, lihaskudosten homogeeninen eikä segmentaalinen ulkonäkö). Sydämenlyöntien puutteen kirjaamiseksi vaadittava havainnointiaika on vähintään yksi minuutti vähintään 80-kertaisella suurennuksella. C.50 Sedimentitön Myriophyllum spicatum -lajilla tehtävä toksisuustesti JOHDANTO
TESTIN PERIAATE
TESTIKEMIKAALIA KOSKEVIA TIETOJA
TESTIN VALIDITEETTI
VERTAILUKEMIKAALI
MENETELMÄN KUVAUS Laitteisto
Koe-eliö
Viljely
Testiviljelyaine
Testiliuokset
Testi- ja kontrolliryhmät
Altistus
Testiolosuhteet
Kesto
Mittaukset ja analyyttiset määritykset
Mittausten ja analyyttisten määritysten tiheys
Raja-annostesti
TIEDOT JA RAPORTOINTI Vastemuuttujat
Keskimääräinen spesifinen kasvunopeus
Tuotos
Kaksinkertaistumisaika
Pitoisuus-vastekäyrien piirtäminen
ECx-pitoisuuden arviointi
Tilastomenetelmät
Raportointi
LÄHDEKIRJALLISUUS
Lisäys 1 MÄÄRITELMÄT
Lisäys 2 MUUTETTU ANDREWSIN KASVUALUSTA KANTAVILJELMÄÄ JA ESIVILJELMÄÄ VARTEN Kantaviljelmää ja esiviljelmää varten tarvittava muutettu Andrewsin kasvualusta valmistetaan viidestä erikseen valmistetusta kantaliuoksesta ja siihen lisätään 3 prosenttia sakkaroosia. Taulukko 1 Andrewsin ravinneliuoksen koostumus: (ASTM Designation E 1913-04)
Kantaliuoksia voidaan säilyttää jääkaapissa 6 kuukautta (5–10 °C lämpötilassa) Vain kantaliuoksella nro 5 on lyhyempi säilyvyysaika (kaksi kuukautta). Taulukko 2 Kantaliuoksen nro 3.1 valmistus kantaliuoksen nro 3 valmistusta varten
Kantaliuoksen nro 3.1 valmistamisen jälkeen (taulukko 2) tämä liuos pakastetaan noin 11 ml:n määräosissa (vähintään – 18 °C:n lämpötilassa). Pakastettujen annosten säilyvyysaika on viisi vuotta. Kantaliuoksen nro 3 valmistamiseksi sulatetaan kantaliuos nro 3.1, kaadetaan 10 ml sitä 1 litran vetoiseen mittapulloon ja lisätään ultrapuhdasta vettä pullon mittamerkkiin asti. Muutetun Andrewsin kasvualustan valmistamiseksi 5 litran mittapulloon kaadetaan noin 2 500 ml ultrapuhdasta vettä. Kun siihen on lisätty 50 ml kutakin kantaliuosta, mittapullo täytetään 90 prosenttiin asti ultrapuhtaalla vedellä ja pH-arvoksi säädetään 5,8. Tämän jälkeen lisätään 150 g liuotettua sakkaroosia (3 prosenttia 5 litraa kohti) ja täytetään mittapullo ultrapuhtaalla vedellä mittamerkkiin asti. Lopuksi ravinneliuos kaadetaan 1 litran Schott-pulloihin ja autoklavoidaan 121 °C:n lämpötilassa 20 minuutin ajan. Näin saatu ravinneliuos voidaan säilyttää steriilinä jääkaapissa (5–10 °C:n lämpötilassa) kolme kuukautta. Muutettu Andrewsin kasvualusta sedimentitöntä toksisuustestiä varten Taulukoissa 1 ja 2 mainituista viidestä kantaravinneliuoksesta valmistetaan testiliuosten valmistamiseen tarvittava kymmenkertaisesti tiivistetty muutettu Andrewsin viljelyneste, johon lisätään 30 prosenttia sakkaroosia. Tätä varten kaadetaan noin 100 ml ultrapuhdasta vettä 1 litran mittapulloon. Siihen lisätään 100 ml kutakin kantaliuosta ja pH-arvoksi säädetään 5,8. Tämän jälkeen lisätään 30 prosenttia liuotettua sakkaroosia (300 g / 1 000 ml) ja mittapullo täytetään ultrapuhtaalla vedellä mittamerkkiin asti. Lopuksi ravinneliuos kaadetaan 0,5 litran Schott-pulloihin ja autoklavoidaan 121 °C:n lämpötilassa 20 minuutin ajan. Näin saatu kymmenkertaisesti tiivistetty muutettu ravinneliuos voidaan säilyttää steriilinä jääkaapissa (5–10 °C:n lämpötilassa) kolme kuukautta. Lisäys 3 KANTAVILJELMÄN YLLÄPITO Tässä lisäyksessä kuvaillaan ärviöiden sukuun kuuluvan kaksisirkkaisen Myriophyllum spicatum L -uposkasvilajin (103) kantaviljelmää. Kasvin vaaleanpunertavat huomaamattomat kukat työntyvät kesäkuusta elokuuhun vedenpinnan yläpuolelle. Kasvit juurtuvat pohjaan lujilla juurakoilla, ja niitä tavataan koko pohjoisella pallonpuoliskolla rehevöityneissä, mutta pilaantumattomissa ja kalkkipitoisissa rauhallisissa mutapohjaisissa vesissä. Myriophyllum spicatum viihtyy parhaiten makeassa vedessä, mutta sitä tavataan myös murtovesissä. Laboratorio-olosuhteissa viljeltävää sedimentitöntä kantaviljelmää varten tarvitaan steriilejä kasveja. Steriilejä kasveja on saatavissa Saksan liittovaltion ympäristöviraston (Umweltbundesamt) ekotoksikologian laboratoriosta. Vaihtoehtoisesti koe-eliöt voidaan valmistaa epästeriileistä kasveista standardin ASTM E 1913-04 mukaisesti. Seuraavassa esitetään – ASTM-standardioppaasta lainattu – menettely luonnosta kerättyjen Myriophyllum sibiricum -kasvien viljelemiseksi: ”Jos viljely aloitetaan luonnosta kerätyillä epästeriileillä kasveilla, Myriophyllum sibiricum -kasvien talvehtimissilmut kerätään syksyllä. Talvehtimissilmut asetetaan 20 litran vetoiseen akvaarioon, jossa on 5 cm silikahiekalla tai esimerkiksi Turface®-soralla peitettyä steriiliä sedimenttiä, sekä 18 l reagenssivettä. Akvaario ilmastetaan ja sen lämpötilana pidetään 15 °C ja kokonaisvuon tiheytenä 200–300 μmol m– 2 s– 1 16 tunnin ajan päivässä. Akvaariossa kasvatettavaa kasviviljelmää voidaan ylläpitää kasvien varalähteenä siltä varalta, että steriilit kasviviljelmät tuhoutuvat kasvatuskaapin mekaanisen toimintahäiriön, kontaminaation tai muun syyn vuoksi. Akvaariossa kasvatetut kasvit eivät ole steriilejä, eikä steriilejä viljelmiä voida ylläpitää panosviljelyjärjestelmässä. Viljelmän steriloimiseksi kasvit poistetaan akvaarioista ja niitä huuhdellaan virtaavassa deionisoidussa vedessä noin 0,5 tuntia. Kasvin desinfioidaan aseptisissa olosuhteissa laminaarivirtauskaapissa alle 20 minuutin ajan (kunnes suurin osa kasvikudoksesta on valkaistunut ja vain kasvukärki on edelleen vihreä) 3 tilavuusprosentin natriumhypokloriittiliuoksessa, jossa on 0,01 prosenttia sopivaa pinta-aktiivista ainetta. Desinfiointiainetta ja kasvimateriaalia ravistellaan. Useita niveliä sisältävät segmentit siirretään steriileihin viljelyputkiin, joissa on 45 ml steriloitua muutettua Andrewsin kasvualustaa, ja putket suljetaan sileillä viljelyputkien tulpilla. Kuhunkin testiastiaan laitetaan vain yksi kasvisegmentti. Viljelyastian sulkeminen varmistetaan laboratoriokäyttöön tarkoitetulla tiivistyskalvolla. Kun steriili viljelmä on perustettu, useita niveliä sisältävät kasvisegmentit on siirrettävä 10–12 päivän välein uusiin testiastioihin, jotka sisältävät tuoretta ravinneliuosta. Kuten agar-maljoissa suoritetut viljelyt ovat osoittaneet, kasvien on oltava steriilejä ja pysyttävä steriileinä kahdeksan viikon ajan, ennen kuin testaus voidaan aloittaa.” Koska muunnettu Andrewsin kasvualusta sisältää sakkaroosia (joka stimuloi sienten ja bakteerien kasvua), kaikkia materiaaleja, liuoksia ja viljelmiä on käsiteltävä steriileissä olosuhteissa. Kaikki nesteet sekä laitteet on steriloitava ennen käyttöä. Sterilointi tehdään 4 tuntia kestävällä kuumailmakäsittelyllä (210 °C) tai autoklavoimalla 20 minuutin ajan lämpötilassa 121 °C. Lisäksi kaikki pullot, maljat, kulhot ja muut tarvikkeet liekitetään steriilillä työpöydällä välittömästi ennen käyttöä. Kantaviljelmiä voidaan säilyttää heikommassa valaistuksessa ja alhaisemmassa lämpötilassa (50 μE m– 2 s– 1, 20 ± 2 °C) suhteellisen pitkiä aikoja käynnistämättä niitä uudelleen. Myriophyllum-kasvien viljelyaine voi olla sama kuin testauksessa käytetty viljelyaine, mutta kantaviljelmissä voidaan käyttää myös muita ravinteikkaita viljelyaineita. Kasvisegmentit jaetaan akseenisesti useisiin 500 ml:n Erlenmeyer-pulloihin tai/ja 2 000 ml:n Fernbach-pulloihin, joista kuhunkin kaadetaan 450 ml (Erlenmeyer-pullot) tai 1 000 ml (Fernbach-pullot) muutettua Andrewsin kasvualustaa. Tämän jälkeen pullot suljetaan akseenisesti selluloosatulpilla. Lisäksi tarvikkeet on ehdottomasti liekitettävä steriilillä työpöydällä välittömästi ennen käyttöä. Määrästä ja koosta riippuen kasvit on siirrettävä tuoreeseen ravinneliuokseen noin kolmen viikon välein. Tähän uuteen viljelmään voidaan käyttää kärkiä sekä varren keskiosan segmenttejä. Siirrettävien kasvien (tai kasvisegmenttien) määrä ja koko riippuvat tarvittavien kasvien määrästä. Esimerkiksi voidaan siirtää viisi versosegmenttiä yhteen Fernbach-puolloon ja kolme versosegmenttiä yhten Erlenmeyer-pulloon. Kaikkien segmenttien pituus on 5 cm. Kaikki juuria kasvattaneet, kukkivat, kuolleet tai muutoin silmiinpistävät osat heitetään pois. Kuva 1 Kasvien leikkaaminen kanta- ja esiviljelmää varten 3 viikkoa kestäneen viljelyn jälkeen 
Kasvit viljellään 500 ml:n Erlenmeyer-pulloissa ja 2 000 ml:n Fernbach-pulloissa jäähdyttävässä inkubaattorissa 20 ± 2 °C:n lämpötilassa jatkuvassa valaistuksessa, jonka voimakkuus on noin 100–150 μE m– 2 s– 1 tai 6 000–9000 luksia (viljelykaapin sisäinen valaistus, värilämpötila ”lämpimänvalkoinen”. Kuva 2 Kasvien viljely jäähdyttävässä inkubaattorissa, jossa on sisäinen valaistus. 
Kasveja viljeltäessä on käytettävä kemiallisesti puhtaita (happopestyjä) ja steriilejä lasisia kasvatusastioita sekä aseptisia käsittelytekniikoita. Jos esimerkiksi levät, sienet ja/tai bakteerit kontaminoivat kantaviljelmän, on valmistettava uusi viljelmä tai käytettävä toisesta laboratoriosta saatavaa kantaviljelmää kyseisen viljelmän uudistamiseen. Lisäys 4 ESIVILJELMÄN YLLÄPITO JA KOE-ELIÖN VALMISTELU TESTAUSTA VARTEN Esiviljelmän valmistamiseksi kantaviljelmästä peräisin olevat versot leikataan segmenteiksi, joissa on kaksi kiehkuraa kussakin. Segmentit laitetaan muutetulla Andrewsin kasvualustalla(jossa on 3 prosenttia sakkaroosia) täytettyihin Fernbach-pulloihin. Kussakin pullossa voi olla enintään 50 versosegmenttiä. On kuitenkin huolehdittava siitä, että segmentit ovat elinkykyisiä eikä niissä ole juuria tai sivuhaaroja tai niiden silmuja (ks. lisäyksessä 3 oleva kuva 1). Esiviljelmän eliöitä viljellään 14–21 päivää steriileissä olosuhteissa ilmastoidussa kaapissa valaistuksessa, jossa 16 tunnin valoisat ja 8 tunnin pimeät jaksot vuorottelevat. Valon voimakkuuden on oltava 100–150 μE m– 2 s– 1. Lämpötilan on oltava koeastioissa 23 ± 2 °C. Koska muunnettu Andrewsin elatusaine sisältää sakkaroosia (joka stimuloi sienten ja bakteerien kasvua), testikemikaalin liuokset on valmistettava ja viljely suoritettava steriileissä olosuhteissa. Kaikki nesteet sekä laitteet on steriloitava ennen käyttöä. Sterilointi tehdään 4 tuntia kestävällä kuumailmakäsittelyllä (210 °C) tai autoklavoimalla 20 minuutin ajan lämpötilassa 121 °C. Lisäksi kaikki pullot, maljat, kulhot ja muut tarvikkeet liekitetään steriilillä työpöydällä välittömästi ennen käyttöä. Versot poistetaan akseenisesti esiviljelypulloista, ja tässä yhteydessä valitaan mahdollisimman homogeenista materiaalia. Kuhunkin testiin tarvitaan vähintään 60 koe-eliötä (testaus kahdeksalla testikemikaalin pitoisuudella). Testausta varten esiviljelmistä otetaan tuoreita sivuhaaroja, jotka lyhennetään 2,5 cm:n pituuteen tyvestä (mittaviivaimella mitattuna) ja siirretään steriiliä muutettua Andrewsin kasvualustaa sisältävään dekantterilasiin. Näitä tuoreita sivuhaaroja voidaan käyttää sedimentittömään Myriophyllum spicatum -lajilla tehtävään toksisuustestiin. Kuva 2 Esiviljelmästä peräisin olevien kasvien leikkaaminen sedimentittömään Myriophyllum spicatum -lajilla tehtävään toksisuustestiin. 
C.51 Myriophyllum spicatum -lajilla tehtävä toksisuustesti vesisedimenttijärjestelmässä JOHDANTO
TESTIN PERIAATE
TESTIKEMIKAALIA KOSKEVIA TIETOJA
TESTIN VALIDITEETTI
VERTAILUKEMIKAALI
MENETELMÄN KUVAUS Testauslaitteet
Koe-eliö
Koe-eliön viljely
Sedimentti
Testiviljelyaine
Testijärjestely
Testikemikaalin pitoisuudet ja kontrolliryhmät
Raja-annostesti
Testiliuokset
TESTIMENETTELY
Perustamisvaihe
Yhtenäisen kasvimateriaalin valinta
Altistaminen vesifaasin kautta
Altistus sedimentin kautta
Vedenpinnan tason ylläpito testin aikana
Testiolosuhteet
Testin kesto
Mittaukset ja analyyttiset määritykset
Mittausten ja analyyttisten määritysten tiheys
Testikemikaalin analyyttiset mittaukset
TIETOJEN ARVIOINTI
Vastemuuttujat
Keskimääräinen spesifinen kasvunopeus
Tuotos
Pitoisuus-vastekäyrien piirtäminen
ECx-pitoisuuden arviointi
Tilastomenetelmät
RAPORTOINTI
LÄHDEKIRJALLISUUS
Lisäys 1 SMARTIN JA BARKON KASVUALUSTAN KOOSTUMUS
Lisäys 2 MÄÄRITELMÄT
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(1) Mitään arvoa ei ole käytettävissä 20 celsiusasteelle, mutta voidaan olettaa, että mittaustulosten vaihtelu on korkeampi kuin oletettava lämpötilariippuvuus.
(2) Euroopan parlamentin ja neuvoston asetus (EY) N:o 1907/2006, annettu 18 päivänä joulukuuta 2006, kemikaalien rekisteröinnistä, arvioinnista, lupamenettelyistä ja rajoituksista (REACH), Euroopan kemikaaliviraston perustamisesta, direktiivin 1999/45/EY muuttamisesta sekä neuvoston asetuksen (ETY) N:o 793/93, komission asetuksen (EY) N:o 1488/94, neuvoston direktiivin 76/769/ETY ja komission direktiivien 91/155/ETY, 93/67/ETY, 93/105/EY ja 2000/21/EY kumoamisesta, EUVL L 304, 22.11.2007, s. 1.
(3) Interagency Coordinating Committee on the Validation of Alternative Methods (vaihtoehtoisten menetelmien validoinnin virastojenvälinen koordinointikomitea), Yhdysvallat.
(*1) Sarveiskalvosamentuman alue on mainittava.
(4) Käytettäessä REACH-asetuksen mukaista silmän ärsytyksen integroitua testimenetelmää, ks. myös ECHA:n ohjeet tietovaatimuksista ja kemikaaliturvallisuusarvioinnista, R.7a luku: Päätepisteitä koskevat erityisohjeet (Endpoint specific guidance) http://echa.europa.eu/documents/10162/13632/information_requirements_r7a_en.pdf
(5) Tilastotieteilijät, jotka käyttävät mallintamiseen perustuvaa lähestymistapaa, kuten yleistettyjä lineaarisia malleja, voivat tarkastella analyysia erilaisella, mutta vertailukelpoisella tavalla, mutta eivät välttämättä tee päätelmiä perinteisestä ANOVA-taulukosta, jonka juuret juontuvat ennen tietokoneita kehitettyihin tilastotieteen laskennan algoritmisiin lähestymistapoihin.
(6) Tilastotieteilijät, jotka käyttävät mallintamiseen perustuvaa lähestymistapaa, kuten yleistettyjä lineaarisia malleja, voivat tarkastella analyysia erilaisella, mutta vertailukelpoisella tavalla, mutta eivät välttämättä tee päätelmiä perinteisestä ANOVA-taulukosta, jonka juuret juontuvat ennen tietokoneita kehitettyihin tilastotieteen laskennan algoritmisiin lähestymistapoihin.
(7) Euroopan parlamentin ja neuvoston asetus (EY) N:o 1272/2008, annettu 16 päivänä joulukuuta 2008, aineiden ja seosten luokituksesta, merkinnöistä ja pakkaamisesta sekä direktiivien 67/548/ETY ja 1999/45/EY muuttamisesta ja kumoamisesta ja asetuksen (EY) N:o 1907/2006 muuttamisesta (EUVL L 353, 31.12.2008, s. 1).
(8) Kunkin testikemikaalin kemiallinen luokka määritettiin National Library of Medicine Medical Subject Headings (MeSH) -luokitusjärjestelmään (saatavilla osoitteessa http//www.nlm.nih.gov/mesh) perustuvan tavanomaisen luokitusjärjestelmän perusteella.
(9) Perustuu tuloksiin, jotka on saatu kanin silmällä tehdyllä in vivo -testillä (OECD TG 405) (17) käyttäen YK:n GHS-järjestelmää (4).
(10) Se, luokitellaanko kemikaali luokkaan 2A vai 2B, riippuu siitää, miten YK:n GHS-järjestelmässä tulkitaan erotettavan nämä kaksi luokkaa, eli onko eläimiä, joilla on seitsemäntenä päivänä vaikutuksia, oltava yksi kolmesta vai kaksi kolmesta, jotta kemikaali voidaan luokitella luokkaan 2A. In vivo -tutkimukseen sisältyi kolme eläintä. Yhdellä eläimellä esiintynyttä sidekalvon punaisuutta lukuun ottamatta kaikki päätepisteet palautuivat nolla-arvoon viimeistään päivään 7 mennessä. Päivään 7 mennessä toipumattoman eläimen sidekalvon punaisuusarvo oli 1 (päivänä 7). Täydellinen toipuminen tapahtui päivänä 10.
(11) Mitat ovat sarveiskalvotelineelle, jota käytetään 12–60 kuukauden ikäisille lehmille. Jos käytetään 6–12 kuukauden ikäisiä eläimiä, olisi teline suunniteltava niin, että kunkin kammion tilavuus on 4 ml ja kunkin sisäkammion halkaisija 1,5 cm ja syvyys 2,2 cm. Jos tehdään uusi, erilainen sarveiskalvoteline, on tärkeää huolehtia siitä, että altistetun sarveiskalvon pinta-alan suhde takakammion tilavuuteen on sama kuin käytettäessä tavanomaista sarveiskalvotelinettä. Tämä on välttämätöntä, jotta läpäisevyysarvot voidaan määrittää oikein IVIS-arvon laskemiseksi ehdotetulla kaavalla.
(12) Euroopan parlamentin ja neuvoston asetus (EY) N:o 1272/2008, annettu 16 päivänä joulukuuta 2008, aineiden ja seosten luokituksesta, merkinnöistä ja pakkaamisesta sekä direktiivien 67/548/ETY ja 1999/45/EY muuttamisesta ja kumoamisesta ja asetuksen (EY) N:o 1907/2006 muuttamisesta (EUVL L 353, 31.12.2008, s. 1).
(*2) Korkein keskiarvo minä tahansa ajankohtana
(*3) Keskimääräinen suurin arvo minä tahansa ajankohtana (perustuu taulukon 1 sameusarvoihin).
(*4) Perustuu taulukon 2 arvoihin.
(*5) Harvinaisemmat yhdistelmät.
(13) Kunkin testikemikaalin kemiallinen luokka määritettiin National Library of Medicine Medical Subject Headings (MeSH) -luokitusjärjestelmään (saatavilla osoitteessa http://www.nlm.nih.gov/mesh) perustuvan tavanomaisen luokitusjärjestelmän perusteella.
(14) Perustuu tuloksiin, jotka on saatu in vivo -kaninsilmätestillä (OECD TG 405) käyttäen YK:n GHS-järjestelmää (4) (6).
(15) Perustuu ICE-testin tuloksiin (ks. taulukko 6).
(16) Muiden kuin taulukossa 6 kuvattujen ICE-testitulosten yhdistelmä, josta käy ilmi kuuluvuus YK:n GHS-järjestelmän luokkaan ”Ei luokitusta” tai YK:n GHS-järjestelmän luokkaan 1 (ks. taulukko 6).
(17) Luokittelu luokkaan 2A tai 2B riippuu siitä, miten tulkitaan YK:n GHS-järjestelmän kriteerejä, jotka erottavat nämä luokat toisistaan, eli siitä, onko päivänä 7 vaikutuksia osoittavia eläimiä oltava yksi vai kaksi kolmesta, jotta kemikaali voidaan luokitellaan luokkaan 2A. In vivo -tutkimuksessa oli kolme eläintä. Yhdellä eläimellä esiintynyttä sidekalvon punaisuutta lukuun ottamatta kaikki päätepisteet palautuivat nolla-arvoon viimeistään päivään 7 mennessä. Päivään 7 mennessä toipumattoman eläimen sidekalvon punaisuusarvo oli 1 (päivänä 7). Täydellinen toipuminen tapahtui päivänä 10.
(18) Euroopan parlamentin ja neuvoston asetus (EY) N:o 1272/2008, annettu 16 päivänä joulukuuta 2008, aineiden ja seosten luokituksesta, merkinnöistä ja pakkaamisesta sekä direktiivien 67/548/ETY ja 1999/45/EY muuttamisesta ja kumoamisesta ja asetuksen (EY) N:o 1907/2006 muuttamisesta (EUVL L 353, 31.12.2008, s. 1).
(19) Keskiarvolla tarkoitetaan koko asiakirjassa aritmeettista keskiarvoa.
(20) Luvut viittaavat tilastollisiin raja-arvoihin eivätkä liity mittauksen tarkkuuteen.
(21) DPRA-ennustetta pitäisi tarkastella IATA:n sekä kohtien 9 ja 12 vaatimusten valossa.
(22) Luvut viittaavat tilastollisiin raja-arvoihin eivätkä liity mittauksen tarkkuuteen.
(23) DPRA-ennustetta pitäisi tarkastella IATA:n sekä kohtien 9 ja 12 vaatimusten valossa.
(24) In vivo -riski ja (vaikutuskykyä koskevat) ennusteet perustuvat LLNA-tietoihin (19). In vivo -vaikutuskyvyn määrityksessä on käytetty ECETOCin esittämiä kriteereitä (23).
(25) DPRA-ennustetta pitäisi tarkastella IATA:n ja kohtien 9 ja 11 määräysten valossa.
(26) Vaihteluvälit on määritetty vähintään 10 depleetioarvon pohjalta; arvot ovat kuuden riippumattoman laboratorion tuottamia.
(27) Euroopan parlamentin ja neuvoston asetus (EY) N:o 1272/2008, annettu 16 päivänä joulukuuta 2008, aineiden ja seosten luokituksesta, merkinnöistä ja pakkaamisesta sekä direktiivien 67/548/ETY ja 1999/45/EY muuttamisesta ja kumoamisesta ja asetuksen (EY) N:o 1907/2006 muuttamisesta (EUVL L 353, 31.12.2008, s. 1).
(28) Vaaraa (ja potenssia) koskevat ennusteet in vivo perustuvat LLNA-tietoihin (13). In vivo -potenssi on saatu käyttämällä ECETOC:n esittämiä kriteerejä (24).
(29) KeratinoSens™-ennustetta pitäisi tarkastella IATA:n ja tämän testimenetelmän kohtien 9 ja 11 määräysten valossa.
(30) Perustuu aiemmin havaittuihin arvoihin (12).
(31) Euroopan parlamentin ja neuvoston asetus (EY) N:o 1272/2008, annettu 16 päivänä joulukuuta 2008, aineiden ja seosten luokituksesta, merkinnöistä ja pakkaamisesta sekä direktiivien 67/548/ETY ja 1999/45/EY muuttamisesta ja kumoamisesta ja asetuksen (EY) N:o 1907/2006 muuttamisesta (EUVL L 353, 31.12.2008, s. 1).
(32) Kunkin testikemikaalin kemiallinen luokka määritettiin National Library of Medicine Medical Subject Headings (MeSH) -luokitusjärjestelmään (saatavilla osoitteessa http//www.nlm.nih.gov/mesh) perustuvan tavanomaisen luokitusjärjestelmän perusteella.
(33) Perustuu tuloksiin, jotka on saatu kanin silmällä tehdyllä in vivo -testillä (OECD TG 405, TM B.5) käyttäen YK:n GHS-järjestelmää ja EU:n CLP-asetusta.
(34) Perustuu fluoreseiinivuotomenetelmällä saatuihin tuloksiin (INVITTOX-protokolla nro 71(6)).
(35) Tilastotieteilijät, jotka valitsevat mallinnuslähestymistavan ja esimerkiksi käyttävät yleisiä lineaarisia malleja (General Linear Models, GLM), saattavat lähestyä analyysia erilaisella mutta vastaavalla tavalla mutta eivät välttämättä luo perinteistä ANOVA-taulukkoa, joka on perua tietokoneita edeltävänä aikana kehitetyistä algoritmeihin perustuvista tilastolaskennan lähestymistavoista.
(36) Ks. liitteessä 1 annetut määritelmät ja yksiköt.
(37) Joskus käytetään myös lyhennettä P OW; määritetään ravistuspullomenetelmällä TM A.8:ssa (3), HPLC-menetelmällä (nestekromatografia) TM A.24:ssä (4) ja hidassekoitusmenetelmällä TM A.23:ssa (5). Log KOW -kertoimen määrittämisessä käytetään joskus myös kehitinkolonnimenetelmää. Tätä menetelmää on käytetty tutkimuksissa vähän. Tutkimusten kohteina ovat tällöin olleet etupäässä klooratut bifenyylit ja dibentsodioksiinit (esimerkiksi Li ja Doucette, 1993) (3). Mahdollisesti ionisoituvilla aineilla log K OW -kertoimen pitäisi viitata ionisoitumattomaan muotoon.
(38) Ks. määritelmät ja yksiköt liitteessä 1.
(39) TLC: ohutkerroskromatografia; HPLC: nestekromatografia; GC: kaasukromatografia.
(40) Joidenkin säädöskehysten mukaan metaboliittien analysointi voi olla pakollista, jos tietyt edellytykset täyttyvät (ks. 65 kohta).
(41) Kertymävaiheen aikana vedestä mitattujen pitoisuuksien pitäisi yleensä olla vähintään yhden suuruusluokan korkeampia kuin kvantifiointiraja, jotta kaloihin kertyneestä aineesta saadaan tutkimuksen poistumavaiheessa määritettyä useampi kuin yksi puoliintumisaika.
(42) Ks. määritelmät ja yksiköt liitteessä 1.
(43) Useimmilla testiaineilla niitä ei pitäisi ideaalitilanteessa löytyä kontrollivedestä. Taustapitoisuuksilla pitäisi olla merkitystä vain luonnossa esiintyvien materiaalien (kuten joidenkin metallien) ja kaikkialla ympäristössä olevien aineiden kannalta.
(44) Jos reaktio ei selvästikään noudata ensimmäisen asteen kinetiikkaa, pitäisi käyttää monimutkaisempia malleja (ks. liitteessä 5 annetut viitteet) ja pyytää neuvoa biostatistiikan asiantuntijoilta.
(45) Alhainen altistuspitoisuus voi rajoittaa kertymää, koska biokertyvyystestissä vesiliukoisuus on heikko, kun taas ravintotestissä voidaan saavuttaa korkeampi altistuspitoisuus.
(46) Useammasta ainesosasta koostuvien aineiden, koostumukseltaan tuntemattomien tai vaihtelevien aineiden, kompleksin reaktiotuotteen tai biologisen materiaalin (UCVB) sekä seosten testauksessa sopiva altistuspitoisuus on määritettävä kunkin olennaisen ainesosan vesiliukoisuuden perusteella.
(47) TOC käsittää sekä hiukkasten muodostaman orgaanisen hiilen että liuenneen orgaanisen hiilen, eli TOC = POC + DOC.
(48) Liuottimen tai liuotusapuaineen käyttöä ei yleensä suositella,. Jos niitä kuitenkin käytetään, niistä peräisin oleva orgaaninen hiili on laskettava yhteen testiaineesta peräisin olevan orgaanisen hiilen kanssa, jotta voidaan arvioida orgaanisen hiilen pitoisuus testiastioissa.
(49) Jos rasvapitoisuutta ja testiainetta ei määritetä samoista kaloista, analysoitavien kalojen pitäisi ainakin olla saman painoisia ja samaa sukupuolta (jos sukupuolella on merkitystä).
(50) Tätä vaihtoehtoa voidaan soveltaa vain siinä tapauksessa, että kalojen määrä on kaikissa testiryhmässä sama, kaloja poistetaan samoin perustein ja niitä ruokitaan samalla tavalla. Näin voidaan varmistaa, että kalojen kasvu on samanlaista kaikissa testiryhmissä, jos testattu pitoisuus jää toksisuusalueen alle. Jos kasvu on samanlaista, myös rasvapitoisuuden odotetaan olevan sama. Erilainen kasvu vertailuryhmässä on viite aineen vaikutuksesta eikä tutkimus olisi validi.
(51) Painon lisäksi pitäisi kirjata kokonaispituus, koska testin aikaisen pituuskasvun nopeutta vertaamalla saadaan hyödyllistä tietoa siitä, onko aineella ollut haittavaikutuksia.
(52) Kasvuvakioita koskeva t-testi voidaan tehdä sen määrittämiseksi, onko vertailu- ja testiryhmien kalojen kasvussa eroja. Vaihtelu voidaan analysoida F-testillä. F-testiä tai uskottavuusosamäärätestiä voidaan tarvittaessa käyttää apuna sopivan kasvumallin valinnassa (OECD monograph 54, (32).
(53) Kyseiset prosenttiluvut osoittavat, että analyysimenetelmät ovat luotettavia ja puoliintumisaika on < 14 vuorokautta. Jos analyysimenetelmät eivät ole näin luotettavia tai puoliintumisaika on (huomattavasti) pidempi, luvut ovat suurempia.
CI, Confidence interval: luottamusväli (kun mahdollista arvioida).
SD, Standard deviation: standardi poikkeama (kun mahdollista arvioida).
(56) Minimoitua testiä voidaan käyttää nopean metaboloitumisen osoittamiseksi, jos sen tiedetään olevan todennäköistä.
(57) Jos testissä käytetään vain kahta datapistettä, BCFKm-arvo voidaan arvioida bootstrap-menetelmien avulla. Jos näytteitä otetaan myös välidatapisteistä, BCFKm:n luottamusvälit voidaan laskea samalla tavalla kuin kattavassa testissä.
(58) Ks. määritelmät ja yksiköt liitteessä 1.
(59) Kemikaalien rekisteröinnistä, arvioinnista, lupamenettelyistä ja rajoituksista (REACH) annetun asetuksen (EY) N:o 1907/2006 (EUVL L 396, 30.12.2006, s. 1) täytäntöönpanoa varten tätä kysymystä käsitellään tietovaatimuksia ja kemikaaliturvallisuusarviointia koskevissa ohjeissa (Guidance on Information Requirements and Chemical Safety Assessment), luvuissa R.7 c, R.7.10.3.1, s. 13; R.7.10.4.1, s. 31–32 ja kuvassa R7.10-2, s. 50.
(60) Useimmilla testiaineilla niitä ei pitäisi ideaalitilanteessa löytyä kontrollivedestä. Taustapitoisuuksilla pitäisi olla merkitystä vain luonnossa esiintyvien materiaalien (kuten joidenkin metallien) ja kaikkialla ympäristössä olevien aineiden kannalta.
(61) Koska BMF määritetään jonkin aineen pitoisuutena organismissa suhteessa saman aineen pitoisuuteen organismin ravinnossa tasapainotilassa, rasvaisuus otetaan huomioon korjaamalla organismin ja ravinnon rasvapitoisuus. Näin ollen se on parempi ilmoittaa ”korjattuna”. Tämä lähestymistapa eroaa ”normalisoinnista” kyseisen organismin normaalin rasvapitoisuuden mukaisesti, mitä käytetään veden välityksellä tehtävässä biokertyvyystestissä.
(62) Kokonaispituus pitäisi myös kirjata testin aikana, koska se on hyvä keino selvittää mahdolliset haittavaikutukset.
(63) HCB mainitaan Tukholman yleissopimuksen liitteissä A ja C sekä pysyvistä orgaanisista yhdisteistä annetun asetuksen (EY) N:o 850/2004 (EUVL L 158, 30.4.2004, s. 7) liitteissä I ja III olevissa luetteloissa.
(64) Kertymävaiheessa tapahtuvan nopean kasvun takia todellinen ruokkimistaajuus laskee altistuksen alussa määritettyä pienemmäksi.
(65) Veden välityksellä tehtävässä altistustutkimuksessa 14 vuorokauden puoliintumisaika vastaisi BCF-arvoa, joka on noin 10 000 L/kg, kun käytetään noin gramman painoisia kaloja, joiden kertymävakio on noin 500 L/kg/pv (Sijm et al:n yhtälön mukaisesti(46)).
(66) Koska todellinen sisäinen pitoisuus voidaan määrittää vasta testin tekemisen jälkeen, on arvioitava odotettu sisäinen pitoisuus (esim. odotetun BMF-arvon ja ruoan sisältämän pitoisuuden perusteella; ks. liitteessä 5 esitetty yhtälö A5.8).
(67) Testiainetta saattaa päästä väliaineeseen kalojen ulosteista tai sen uuttuessa ruoasta, mitä ei voida välttämättä täysin estää. Yksi vaihtoehto onkin mitata testiaineen pitoisuus vedessä kertymävaiheen lopussa, etenkin jos käytetään puolistaattista järjestelmää. Näin voidaan tarkistaa, ovatko kalat mahdollisesti altistuneet sille myös veden välityksellä.
(68) Tämä lähestymistapa koskee vain ravinnon välityksellä tehtävää tutkimusta, joten menettely on erilainen kuin vesialtistuksessa. Sekaannusten välttämiseksi käytetään siksi ”normalisoinnin” sijasta mieluummin käsitettä ”korjaaminen”. Ks. myös alaviite kappaleessa 106.
(69) Kasvuvakioita koskeva t-testi voidaan tehdä sen määrittämiseksi, onko vertailu- ja testiryhmien kalojen kasvussa eroja. Vaihtelu voidaan analysoida F-testillä. F-testiä tai uskottavuusosamäärätestiä voidaan tarvittaessa käyttää apuna sopivan kasvumallin valinnassa (OECD monograph 54, (32).
(70) Elintarvikkeiden sisältämän proteiinin, rasvan, raakakuidun ja tuhkan analyysitekniikka. Tämän tiedon saa tavallisesti rehun toimittajalta.
CI, Confidence interval: luottamusväli (kun mahdollista arvioida).
SD, Standard deviation: standardipoikkeama (kun mahdollista arvioida).
(73) Meyer et al. (1)
(74) Olisi otettava huomion, että itse testissä pidetään painoa parempana yksikkönä koon mittaamisessa ja kasvuvakion johtamisessa. Yleisesti kuitenkin tunnustetaan, että pituus on käytännöllisempi mittari, jos kalat on valittava kokeen alussa silmämääräisesti (kantapopulaatiosta).
(75) Tämä pituuden vaihteluväli määritetään Japanin kemikaalivalvontalakiin perustuvissa uusia kemikaaleja jne. koskevissa testimenetelmissä.
(76) Suluissa olevat luvut osoittavat mahdollisten lisänäytteiden (vesi/kala) määrän.
(77) Ennen testiä tehty arvio k 2-arvosta, kun log K OW 4,0 on 0,652 vrk– 1. Koko kokeen kesto on 3 × t SS = 3 × 4,6 vrk, eli 14 vuorokautta. TSS-arvon arviointia varten katso lisäys 5.
(78) Vedestä otetaan näyte, kun kammioon on lisätty vähintään 3 kammion tilavuutta vettä.
(79) Nämä kalat valitaan näytettä varten kantapopulaatiosta.
(80) Jos testin on oltava tarkempi tai on tutkittava metaboloituminen, jolloin tarvitaan enemmän kaloja, näytekalat on valittava kertymävaiheen ja poistumavaiheen lopussa (ks. 40 kohta).
(81) Rasvapitoisuuden analysointiin saatetaan tarvitaan vähintään kolme kalaa enemmän, jos samoja kaloja ei voida käyttää ainepitoisuuden määrittämiseen testin alussa, kertymävaiheen lopussa ja poistumavaiheen lopussa. Huomaa, että monissa tapauksissa kolme vertailuryhmän kalaa saattaa riittää (ks. 56 kohta).
(82) Vertailu- ja testiryhmässä otetaan kummassakin kolme rehunäytettä, joista analysoidaan testiaine- ja rasvapitoisuudet.
(83) Näytteeksi otettava kalat valitaan kantapopulaatiosta mahdollisimman lähellä testin alkamista. Kantapopulaatiosta valitaan vähintään kolme kalaa, joista mitataan rasvapitoisuus.
(84) Kertymävaiheen alussa voidaan (valinnaisesti) ottaa näyte, josta lasketaan testiaineen assimiloituminen ravinnon kautta, ja näitä tuloksia verrataan poistumavaiheen tietojen perusteella laskettuun assimilaatiotehoon.
(85) Kudoskohtaista analyysia varten voidaan ottaa näytteeksi viisi ylimääräistä kalaa.
(86) Rasvapitoisuuden analysointiin saatetaan tarvitaan vähintään kolme kalaa enemmän, jos samoja kaloja ei voida käyttää ainepitoisuuden määrittämiseen testin alussa, kertymävaiheen lopussa ja poistumavaiheen lopussa. Huomaa, että monissa tapauksissa kolme vertailuryhmän kalaa saattaa riittää (ks. 56 ja 153 kohta).
(87) Kuten kaikissa empiirisissä suhteissa, tässäkin on varmistettava, että testiaineeseen voidaan soveltaa kyseistä suhdetta.
(88) Kalojen paino kertymävaiheen lopussa voidaan arvioida aiempien tutkimustulosten perusteella tai sen mukaan, miten testattavan lajin tiedetään kasvavan tavanomaisen kertymävaiheen (jonka kesto on esimerkiksi 28 vuorokautta) aikana verrattuna normaalipainoon testin alussa.
(89) Useimmissa lineaarisen regression mahdollistavissa ohjelmissa saadaan myös keskivirhetaso ja luottamusväli. Tämä onnistuu esimerkiksi Microsoft Excelissä käyttämällä data-analysoinnin työkalupakettia.
(90) Sen sijaan lineaarisessa regressiomenetelmässä tämän kaavan avulla ei voida määrittää k2:n keskivirhetasoa.
(91) Sen sijaan lineaarisessa sovitusmenetelmässä k1:n arvioitua arvoa koskevaa keskivirhetasoa tai luottamusväliä ei yleensä voida määrittää tällä tavalla.
(92) On huomattava, että k2-arvioon liittyvää epävarmuutta ei hyödynnetä kunnolla biokertyvyysmallissa, jos se luokitellaan pääasiassa vakioksi sovitettaessa k1:tä vaiheittaisen sovituksen malliin. Näin ollen BCF:lle saatu epävarmuus on erilainen riippuen siitä, sovelletaanko samanaikaista vai vaiheittaista sovitusmenetelmää.
(93) Joillain alueilla saatavilla on mahdollisesti vain kalanruokaa, jonka rasvapitoisuus on kaukana tästä ylärajasta. Tällöin tutkimuksessa käytetään ruokaa, jonka rasvapitoisuus on pienempi, ja ruokkimistaajuutta muutetaan asianmukaisesti kalojen terveyden ylläpitämiseksi. Ruokavalion rasvapitoisuutta ei kasvateta keinotekoisesti öljyä lisäämällä.
(94) Luonnossa suurin mahdollinen altistus vesiympäristössä tapahtuu todennäköisesti imeytymisen kautta hyvin hydrofobisilla aineilla. Näin ollen arvioitu BCF ei kuvaa täysin tarkasti tällaisen aineen biokertyvyyspotentiaalia.
(95) Muita vesikirppuja saa käyttää, jos ne täyttävät asianmukaiset vaatimukset (kontrollien lisääntymistuottavuutta koskevan perustet pitäisi olla kaikille lajeille merkityksellinen). Jos muita vesikirppuja käytetään, ne olisi selkeästi tunnistettava ja niiden käyttö olisi perusteltava.
(96) Vahingossa tapahtuva kuolema: muu kuin kemikaaliin liittyvä kuolema, jonka on aiheuttanut vahinko (tunnettu syy).
(97) Epähuomiossa tapahtunut kuolema: muu kuin kemikaaliin liittyvä kuolema, jolla ei ole tunnettua syytä.
(*6) Ilmoitettava, mitä astiaa käytettiin kokeeseen
(*7) Abortoidut sikiöt kirjataan merkinnällä ’AB’ asianomaiseen ruutuun
(*8) Kuolleet aikuiset kirjataan merkinnällä ’M’ asianomaiseen ruutuun
(98) Tyypillinen kokonaispituuden vähimmäiskeskiarvo ei ole validiteettikriteeri, mutta ilmoitetun arvon alapuolella olevat poikkeamat on huolellisesti tutkittava testin herkkyyden kannalta. Kokonaispituuden vähimmäiskeskiarvo on johdettu nykyhetkellä käytettävissä olevien tietojen valikoimasta.
(99) Testattava kirjolohikanta saattaa edellyttää muiden lämpötilojen käyttöä. Siitoskanta on pidettävä samassa lämpötilassa kuin mätimunat. Lyhyt totutus testilämpötilaan on välttämätön sen jälkeen, kun mätimunat on saatu kaupalliselta kasvattajalta (esim. 1–2 t).
(100) Toukat on pidettävä pimeässä yhden viikon ajan kuoriutumisen jälkeen lukuun ottamatta aikoja, jolloin niitä tarkastellaan. Sen jälkeen käytetään koko testin ajan heikkoa valaistusta (valoisa aika 12–16 tuntia) (4).
(101) Valaistusolojen on oltava kaikissa testausolosuhteissa vakaita.
(102) Kaikissa testeissä ± 2 0/00.
(*9) Ravintoa on annettava niin paljon, että eläimet ovat kylläisiä. Jätteen kertymisen välttämiseksi ylimääräinen rehu ja ulosteet on tarvittaessa poistettava.
|
FBS |
pakastetut suolalehtijalkaiset; aikuiset Artemia sp |
|
BSN |
suolalehtijalkaisten naplius-toukat; vasta kuoriutuneet |
|
BSN48 |
suolalehtijalkaisten nauplius-toukat; 48 tunnin ikäiset |
(1) Ruskuaispussivaiheen toukat eivät tarvitse ravintoa.
(2) Suodatettu sekaviljelmästä.
(3) Rakeita käymisprosessista.
(*10) Sukuelinpapilleja on yleensä vain täysikasvuisilla koirailla, ja ne sijaitsevat toisen ja seitsemännen tai kahdeksannen eväpoimun välissä peräevän takapäästä laskettuna (kuvat 1 ja 2). Papilleja on kuitenkin harvoin peräevän takapäästä katsottuna ensimmäisessä eväpoimussa. Tämä menettelytapaohje kattaa ensimmäisessä eväpoimussa olevien papillien mittauksen (tässä ohjeessa eväpoimun numero tarkoittaa poimujen järjestystä peräevän takapäästä katsottuna).
(*11) Homogenisointipuskuri:
|
— |
(50 mM Tris-HCl pH 7,4; 1-prosenttinen proteaasinestäjäsekoitus (Sigma)): 12 ml Tris-HCl pH 7,4 + 120 μl proteaasinestäjäsekoitusta |
|
— |
TRIS: TRIS-ULTRA PURE (ICN), valmistaja esimerkiksi Bie & Berntsen, Tanska |
|
— |
proteaasinestäjäsekoitus: Sigman (nisäkkäiden kudoksille tarkoitettu) tuote nro P 8340 |
Huomaa: Homogenisointipuskuri on käytettävä samana päivänä kuin se valmistetaan. Pidä puskuri jäällä käytön aikana.
(103) Carl von Linné (* 23. toukokuuta 1707, Råshult /Älmhult; † 10. tammikuuta 1778, Uppsala).
(*12) Demineralisoitua (eli tislattua tai deionisoitua) vettä.


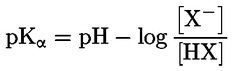




 , mikä vastaa 0,095 mm:iä. Käyttäjien on muistettava, että rakovalomikroskoopeilla voi saada erilaisia arvoja sarveiskalvon paksuudelle, jos raon leveyden asetus on eri.
, mikä vastaa 0,095 mm:iä. Käyttäjien on muistettava, että rakovalomikroskoopeilla voi saada erilaisia arvoja sarveiskalvon paksuudelle, jos raon leveyden asetus on eri.