|
21.7.2007
|
FI
|
Euroopan unionin virallinen lehti
|
L 191/1
|
KOMISSION ASETUS (EY) N:o 829/2007,
annettu 28 päivänä kesäkuuta 2007,
Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 1774/2002 liitteiden I, II, VII, VIII, X ja XI muuttamisesta tiettyjen eläimistä saatavien sivutuotteiden markkinoille saattamisen osalta
(ETA:n kannalta merkityksellinen teksti)
EUROOPAN YHTEISÖJEN KOMISSIO, joka
ottaa huomioon Euroopan yhteisön perustamissopimuksen,
ottaa huomioon muiden kuin ihmisravinnoksi tarkoitettujen eläimistä saatavien sivutuotteiden terveyssäännöistä 3 päivänä lokakuuta 2002 annetun Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 1774/2002 (1) ja erityisesti sen 28 artiklan toisen kohdan, 29 artiklan 3 kohdan ensimmäisen alakohdan sekä 32 artiklan 1 kohdan,
sekä katsoo seuraavaa:
|
(1)
|
Asetuksessa (EY) N:o 1774/2002 vahvistetaan eläinten terveyttä ja kansanterveyttä koskevat vaatimukset tiettyjen eläimistä saatavien sivutuotteiden ja niistä johdettujen tuotteiden maahantuonnille ja kauttakuljetukselle yhteisön kautta. Kyseisessä asetuksessa säädetään yleiset hygieniavaatimukset luokkaan 1, 2 ja 3 kuuluvan aineksen käsittelylle ja vahvistetaan lisäksi vaatimukset kyseisten eläimistä saatavien sivutuotteiden ja niistä johdettujen tuotteiden saattamiseksi markkinoille, mukaan luettuna terveystodistusten mallit niiden tuomiseksi yhteisöön.
|
|
(2)
|
Yhteisössä ei tätä nykyä esiinny pientä pesäkuoriaista, mutta koska on olemassa uhka tämän loisen kulkeutumisesta yhteisöön, on välttämätöntä vahvistaa vaatimukset teknisiin tarkoituksiin aiotun mehiläisvahan maahantuonnille ja muuttaa lisäksi asetuksen (EY) N:o 1774/2002 liitteessä I annettua mehiläistuotteiden määritelmää. Sen vuoksi kyseisen asetuksen liitteessä I esitettyä määritelmää, liitteessä VIII olevassa IX luvussa vahvistettuja tuontivaatimuksia sekä liitteessä X olevassa 13 luvussa esitettyä terveystodistuksen mallia olisi muutettava.
|
|
(3)
|
Asetuksen (EY) N:o 1774/2002 liitteessä II olevassa X luvussa vahvistetaan sellaisen kaupallisen asiakirjan malli, jonka on oltava eläimistä saatavien sivutuotteiden ja käsiteltyjen tuotteiden mukana kuljetuksen ajan. Jotta parannettaisiin vuotien ja nahkojen jäljitettävyyttä kuljetuksen aikana, tätä asiakirjamallia on välttämätöntä muuttaa. Sen vuoksi kyseisen asetuksen liitettä II olisi muutettava.
|
|
(4)
|
Tiettyjen tarttuvien spongiformisten enkefalopatioiden ehkäisyä, valvontaa ja hävittämistä koskevista säännöistä 22 päivänä toukokuuta 2001 annettua Euroopan parlamentin ja neuvoston asetusta (EY) N:o 999/2001 (2) sovelletaan elävien eläinten ja eläinperäisten tuotteiden tuotantoon ja markkinoille saattamiseen. Siinä kielletään käsitellyn eläinvalkuaisen syöttäminen tuotantoeläimille, joita pidetään, lihotetaan tai kasvatetaan elintarvikkeiden tuotantoa varten.
|
|
(5)
|
Kyseinen asetuksessa (EY) N:o 999/2001 asetettu kielto on edelleen voimassa, mutta sian verestä saatuun käsiteltyyn eläinvalkuaiseen olisi – kuten asetuksen (EY) N:o 1774/2002 liitteessä VII olevassa II luvussa vahvistetaan – sovellettava vähemmän tiukkoja käsittelyvaatimuksia kuin nykyisin käytössä olevaa ensimmäistä käsittelymenetelmää, sillä ei ole olemassa mitään tieteellistä osoitusta siitä, että tarttuvat spongiformiset enkefalopatiat tarttuisivat sikojen välityksellä. Kansanterveyteen ja eläinten terveyteen liittyvistä syistä on kuitenkin välttämätöntä ottaa käyttöön vähimmäislämpötilavaatimus sian veren käsittelyä varten. Sen vuoksi asetuksen (EY) N:o 1774/2002 liitteessä VII olevaa II lukua olisi muutettava.
|
|
(6)
|
Asetuksen (EY) N:o 1774/2002 liitteessä VIII olevan II luvun A kohdan 1 alakohdan mukaisesti raa'an lemmikkieläinten ruoan valmistukseen voidaan yhteisössä käyttää sellaisia teuraseläinten osia, jotka on todettu ihmisravinnoksi kelpaaviksi mutta joita ei ole kaupallisista syistä tarkoitettu ihmisravinnoksi. Näyttää siltä, että tällaisten eläinten osia, jotka on todettu ihmisravinnoksi kelpaamattomiksi mutta joissa ei ole merkkejä ihmisiin tai eläimiin tarttuvasta taudista, voidaan käyttää turvallisesti myös lemmikkieläinten ruoassa. Sen vuoksi olisi muutettava kyseisen asetuksen liitteessä VIII olevan II luvun A kohdan 1 alakohtaa ja XI lukua, jossa annetaan säännökset tuonnista yhteisöön.
|
|
(7)
|
On välttämätöntä muuttaa nykyisiä vuotien ja nahkojen tuontia yhteisöön koskevia terveystodistusten malleja joidenkin teknisten mukautusten sisällyttämiseksi niihin. Selkeyden vuoksi olisi muutettava liitteessä VIII olevassa VI luvussa esitettyjä tuotteita koskevia erityisvaatimuksia ja asetuksen (EY) N:o 1774/2002 liitteessä X olevassa 5A, 5B ja 5C luvussa esitettyjä terveystodistusten malleja.
|
|
(8)
|
Euroopan elintarviketurvallisuusviranomainen tuli 13 ja 14 päivänä syyskuuta 2005 antamassaan tieteellisessä lausunnossa, joka käsitteli lintuinfluenssaan liittyviä eläinten terveyttä ja hyvinvointia koskevia näkökohtia, siihen tulokseen, että sulat ja höyhenet olisi käsiteltävä ennen kuin niitä pidetään kaupan, jotta pienennetään lintuinfluenssan leviämisriskiä. Asetuksen (EY) N:o 1774/2002 liitteessä VIII olevassa VIII luvussa vahvistetaan sulkien ja höyhenien markkinoille saattamista ja tuontia koskevat pysyvät yhteisön toimenpiteet. Kyseinen lausunto ja lintuinfluenssan nykyinen maailmanlaajuinen epidemiologinen tilanne huomioon ottaen on aiheellista muuttaa niitä yhteisön toimenpiteitä, joita sovelletaan sulkien ja höyhenten tuontiin ja niiden käsittelyyn ennen tuontia. Sen vuoksi kyseisen asetuksen liitettä VIII olisi muutettava.
|
|
(9)
|
Olisi muutettava asetuksen (EY) N:o 1774/2002 liitteessä X olevassa 1 luvussa esitettyä terveystodistusta, joka koskee muun kuin ihmisravinnoksi tarkoitetun käsitellyn eläinvalkuaisen ja muiden tällaista valkuaista sisältävien tuotteiden kuin lemmikkieläinten ruoan tuontia yhteisöön, jotta kolmansille maille tarjotaan yhtäläiset käsittelymahdollisuudet kuin yhteisölle. Sen vuoksi asetuksen (EY) N:o 1774/2002 liitteessä X olevaa I lukua olisi muutettava.
|
|
(10)
|
Asetuksen (EY) N:o 1774/2002 liitteessä X olevassa 3B luvussa esitetään terveystodistuksen malli yhteisöön tuotavalle käsitellylle, muulle kuin purkitetulle lemmikkieläinten ruoalle. Näyttää siltä, että käsiteltyä lemmikkieläinten ruokaa valmistetaan kolmansissa maissa yhä useammin sekoittamalla toisiinsa sellaisia jo käsiteltyjä ainesosia, joista kutakin on käsitelty kyseisen asetuksen vaatimusten mukaisesti. Tällaisten ainesosien lämpökäsittely saattaisi heikentää niiden ravitsemuksellisia ominaisuuksia. Tämän vuoksi olisi sallittava tällaisista turvallisista ainesosista koostuvan käsitellyn lemmikkieläinten ruoan tuonti yhteisöön, ja asetuksen (EY) N:o 1774/2002 liitteessä X olevassa 3B luvussa esitettyä terveystodistuksen mallia olisi muutettava.
|
|
(11)
|
Asetuksessa (EY) N:o 1774/2002 säädetään, että yhteisöön saa tuoda tiettyjä eläimistä saatavia sivutuotteita lemmikkieläinten ruoan valmistusta varten, vaikka ne sisältävät sellaisista eläimistä saatua ainesta, joille on annettu tiettyjä kiellettyjä aineita. Yhteisöön ei kuitenkaan tätä nykyä saa tuoda tällaista ainesta sisältäviä käsiteltyjä lemmikkieläinten ruokia, puruluita eikä arominvahventeita. Koska näyttää siltä, että tällaisen aineksen tuontiin lemmikkieläinten ruoan valmistamiseksi yhteisössä liittyvä terveysriski ei ole suurempi kuin riski, joka liittyy tällaiseen ainekseen silloin kun se esiintyy yhteisöön tuotujen käsiteltyjen lemmikkieläinten ruokien, puruluiden ja arominvahventeiden ainesosana, olisi sallittava myös tällaista ainesta sisältävien käsiteltyjen tuotteiden tuonti yhteisöön. Sen vuoksi olisi muutettava asetuksen (EY) N:o 1774/2002 liitteessä X olevassa 3A, 3B, 3C ja 3E luvussa esitettyjä terveystodistusten malleja.
|
|
(12)
|
Asetuksen (EY) N:o 1774/2002 liitteessä X olevassa 3B luvussa säädetään, että käsitellyn, muun kuin purkitetun lemmikkieläinten ruoan terveystodistuksen on sisällettävä todistus, jossa todetaan, että lemmikkieläinten ruoka oli pakattu uuteen pakkaukseen, jossa on merkintä ”ei ole tarkoitettu ihmisravinnoksi”. Rehuseosten pitämisestä kaupan 2 päivänä huhtikuuta 1979 annetussa neuvoston direktiivissä 79/373/ETY (3) on jo säädetty vastaavista merkintävaatimuksista, joilla estetään tällaisten tuotteiden tahaton tai huolimattomuudesta johtuva väärinkäyttö ihmisravintona. Asetuksen (EY) N:o 1774/2002 liitteessä X olevassa 3B luvussa esitettyyn terveystodistuksen malliin sovellettavissa vaatimuksissa olisi otettava huomioon kyseinen lainsäädäntö ja niitä olisi sen vuoksi muutettava.
|
|
(13)
|
Asetuksen (EY) N:o 1774/2002 liitteessä VIII vahvistetaan lemmikkieläinten ruoan, puruluiden ja teknisten tuotteiden markkinoille saattamista ja yhteisöön tuontia koskevat vaatimukset. Kyseisen liitteen II luvun B kohdan 4 alakohdassa säädetään, että puruluille on käsittelyn aikana täytynyt tehdä lämpökäsittely siten, että taudinaiheuttajat tuhoutuvat. Useat jäsenvaltiot ovat vaatineet, että puruluiden käsittelyssä sallittaisiin muita käsittelyitä, jotka antavat vastaavat turvatakeet. Sen vuoksi asetuksen (EY) N:o 1774/2002 liitteessä VIII olevaa II luvun B kohdan 4 alakohtaa olisi muutettava.
|
|
(14)
|
Asetuksen (EY) N:o 1774/2002 liitteessä X olevassa 3C luvussa esitetään terveystodistuksen malli yhteisöön tuotaville puruluille. Koska yhteisössä tapahtuvassa puruluiden käsittelyssä tullaan sallimaan muitakin käsittelyjä kuin lämpökäsittely, nämä muut käsittelyt olisi sallittava myös yhteisöön tuoduille puruluille. Jotkin puruluut valmistetaan perinteisten menetelmien mukaisesti kalasta. Lämpökäsittely ei tällaisessa tapauksessa ole eläinten terveyden kannalta tarpeellinen. Sen vuoksi kyseisen asetuksen liitteessä X olevassa 3C luvussa esitettyä terveystodistuksen mallia olisi muutettava.
|
|
(15)
|
Asetuksen (EY) N:o 1774/2002 liitteessä VIII olevan II luvun B kohdan 6 alakohdassa vahvistetaan yhteisössä tuotettuun raakaan lemmikkieläinten ruokaan sovellettavat mikrobiologiset standardit. Näitä standardeja olisi sovellettava myös tuotaessa yhteisöön suoraan myytäväksi tarkoitettua raakaa lemmikkieläinten ruokaa ja eläimistä saatavia sivutuotteita, jotka syötetään yhteisöön lähetettäviksi tarkoitetuille tarhatuille turkiseläimille. Sen vuoksi kyseisen asetuksen liitteessä X olevaa 3D lukua olisi muutettava.
|
|
(16)
|
Asetuksen (EY) N:o 1774/2002 liitteessä XI vahvistetaan luettelot kolmansista maista, joista jäsenvaltiot voivat sallia muuksi kuin ihmisravinnoksi tarkoitettujen eläimistä saatavien sivutuotteiden tuonnin. Kyseisen liitteen XIII osassa esitetään luettelo kolmansista maista, joista jäsenvaltiot voivat sallia hevoseläinten seerumin tuonnin. Kyseisen XIII osan mukaisesti tämä luettelo sisältää ne kolmannet maat, joita tarkoitetaan niiden kolmansien maiden ja kolmansien maiden alueiden osien alueiden luettelosta, joista jäsenvaltiot sallivat elävien hevoseläinten ja hevoseläinten siemennesteen, munasolujen ja alkioiden tuonnin, sekä päätösten 93/195/ETY ja 94/63/EY muuttamisesta 6 päivänä tammikuuta 2004 tehdyn komission päätöksen 2004/211/EY (4) liitteessä I, ja joista on sallittua tuoda hevoseläimiä teurastukseen.
|
|
(17)
|
Hevoseläinten seerumia voidaan kuitenkin ottaa talteen elävistä eläimistä. Jos kolmas maa voidaan eläinten terveystilanteensa perusteella sisällyttää niiden kolmansien maiden luetteloon, joista hevoseläinten tuonti jalostukseen ja tuotantoon on sallittua, olisi hevoseläinten seerumin tuonti kyseisestä kolmannesta maasta oltava sallittua. Tällöin voitaisiin erityisesti sallia hevoseläinten seerumin tuonti Meksikosta. Sen vuoksi asetuksen (EY) N:o 1774/2002 liitteessä XI olevaa XIII osaa olisi muutettava.
|
|
(18)
|
Eläinlääkärintodistukset on annettava senmuotoisina kuin yhdenmukaistettujen eläinlääkärintodistusten mallien hyväksymistä tuotaessa eläviä eläimiä ja eläinperäisiä tuotteita Euroopan yhteisöön koskevassa komission päätöksessä 2007/240/EY (5) vahvistetaan. Sen vuoksi asetuksen (EY) N:o 1774/2002 liitteessä II olevassa X luvussa vahvistettua kaupallista asiakirjaa ja kyseisen asetuksen liitteessä X vahvistettuja terveystodistusten malleja olisi muutettava.
|
|
(19)
|
Tämän asetuksen voimaantulopäivän jälkeen olisi sallittava siirtymäkausi, jotta yhteisöön voitaisiin edelleen tuoda eläimistä saatavia sivutuotteita ja niistä johdettuja tuotteita, jotka kuuluvat asetuksen (EY) N:o 1774/2002 soveltamisalaan ja joiden mukana ovat kyseisen asetuksen mukaiset terveystodistukset.
|
|
(20)
|
Tässä asetuksessa säädetyt toimenpiteet ovat elintarvikeketjua ja eläinten terveyttä käsittelevän pysyvän komitean lausunnon mukaiset,
|
ON ANTANUT TÄMÄN ASETUKSEN:
1 artikla
Muutetaan asetuksen (EY) N:o 1774/2002 liitteet I, II, VII, VIII, X ja XI tämän asetuksen liitteen mukaisesti.
2 artikla
Tämän asetuksen voimaantulopäivää seuraavan kuuden kuukauden siirtymäkauden ajan asetuksen (EY) N:o 1774/2002 liitteessä II vahvistettu kaupallinen asiakirja ja kyseisen asetuksen liitteessä X esitetyt terveystodistukset, jotka on täytetty niiden säännösten mukaisesti, joita sovellettiin ennen tämän asetuksen voimaantulopäivää, voidaan edelleen toimittaa näiden asiakirjojen tai todistusten piiriin kuuluvien tuotteiden mukana.
3 artikla
Tämä asetus tulee voimaan kolmantena päivänä sen jälkeen, kun se on julkaistu Euroopan unionin virallisessa lehdessä.
Tämä asetus on kaikilta osiltaan velvoittava, ja sitä sovelletaan sellaisenaan kaikissa jäsenvaltioissa.
Tehty Brysselissä 28 päivänä kesäkuuta 2007.
Komission puolesta
Markos KYPRIANOU
Komission jäsen
(1) EYVL L 273, 10.10.2002, s. 1, asetus sellaisena kuin se on viimeksi muutettuna komission asetuksella (EY) N:o 2007/2006 (EUVL L 379, 28.12.2006, s. 98).
(2) EYVL L 147, 31.5.2001, s. 1, asetus sellaisena kuin se on viimeksi muutettuna komission asetuksella (EY) N:o 1923/2006 (EUVL L 404, 30.12.2006, s. 1).
(3) EYVL L 86, 6.4.1979, s. 30, direktiivi sellaisena kuin se on viimeksi muutettuna asetuksella (EY) N:o 807/2003 (EUVL L 122, 16.5.2003, s. 36).
(4) EUVL L 73, 11.3.2004, s. 1, direktiivi sellaisena kuin se on muutettuna asetuksella (EY) N:o 1792/2006 (EUVL L 362, 20.12.2006, s. 1).
(5) EUVL L 104, 21.4.2007, s. 37.
LIITE
Muutetaan asetuksen (EY) N:o 1774/2002 liitteet seuraavasti:
|
1)
|
Muutetaan liite I seuraavasti:
|
a)
|
Korvataan 1 kohta seuraavasti:
|
”1.
|
’mehiläistuotteet’ muuksi kuin ihmisravinnoksi tarkoitettu hunaja, mehiläisvaha, emoaine, kittivaha ja siitepöly,”.
|
|
|
b)
|
Korvataan 42 kohta seuraavasti:
|
”42.
|
’käsitelty eläinvalkuainen’ eläinvalkuainen, joka on saatu yksinomaan luokkaan 3 kuuluvasta aineksesta ja joka on käsitelty liitteessä VII olevan II luvun mukaisesti niin, että se soveltuu käytettäväksi suoraan rehuaineena tai muuten käytettäväksi rehuissa, myös lemmikkieläinten ruoassa, taikka käytettäväksi eloperäisissä lannoitteissa tai maanparannusaineissa; siihen eivät kuitenkaan kuulu verituotteet, maito, maitopohjaiset tuotteet, ternimaito, gelatiini, hydroloidut proteiinit ja dikalsiumfosfaatti, munat ja munatuotteet, trikalsiumfosfaatti ja kollageeni,”.
|
|
|
|
2)
|
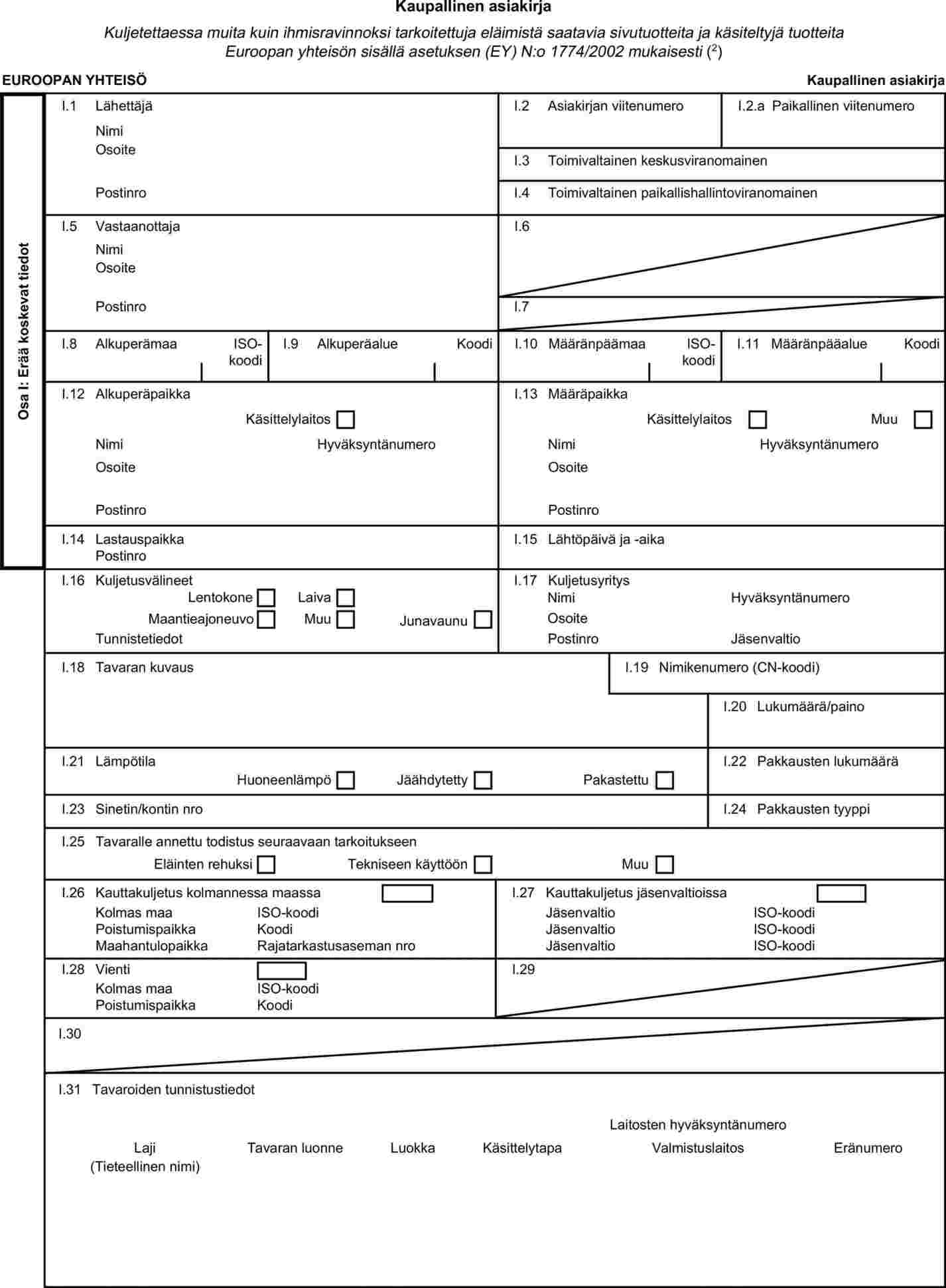
Korvataan liitteessä II oleva X luku seuraavasti:
"X LUKU
Kaupallinen asiakirja
|
1.
|
Eläimistä saatavien sivutuotteiden ja käsiteltyjen tuotteiden mukana on kuljetuksen ajan oltava seuraava kaupallinen asiakirja. Jäsenvaltiot voivat kuitenkin päättää käyttää erilaista kaupallista asiakirjaa paperimuodossa tai sähköisessä muodossa, kun on kyse eläimistä saatavista sivutuotteista ja käsitellyistä tuotteista, joita kuljetetaan saman jäsenvaltion sisällä, edellyttäen että kyseinen kaupallinen asiakirja täyttää III luvun 2 kohdassa vahvistetut vaatimukset.
|
|
2.
|
Jos kuljettajia on enemmän kuin yksi, kukin kuljettaja täyttää kaupallisen asiakirjan 7 kohdassa tarkoitetun ilmoituksen, joka on osa asiakirjaa.
|
KAUPALLISEN ASIAKIRJAN MALLI: ELÄIMISTÄ SAATAVIEN SIVUTUOTTEIDEN JA KÄSITELTYJEN TUOTTEIDEN KULJETUKSET EUROOPAN YHTEISÖN SISÄLLÄ
Huomautuksia
|
a)
|
Kaupalliset asiakirjat on laadittava tässä liitteessä olevan mallin ulkoasun mukaan. Kaupallisen asiakirjan on sisällettävä mallissa esitetyssä numerojärjestyksessä ne todistukset, jotka vaaditaan eläimistä saatavien sivutuotteiden ja niistä johdettujen käsiteltyjen tuotteiden kuljettamiseen.
|
|
b)
|
Se laaditaan tilanteen mukaan yhdellä joko alkuperäjäsenvaltion tai määräjäsenvaltion virallisista kielistä. Se voidaan laatia myös muilla virallisilla yhteisön kielillä, jos sen mukana on virallinen käännös tai jos määräjäsenvaltion toimivaltainen viranomainen on antanut siihen etukäteen suostumuksen.
|
|
c)
|
Kaupallinen asiakirja on laadittava vähintään kolmena kappaleena (alkuperäiskappale ja kaksi jäljennöstä). Alkuperäiskappaleen on oltava lähetyksen mukana lopulliseen määräpaikkaan asti. Vastaanottajan on säilytettävä se itsellään. Tuottajan ja kuljetuksesta vastaavan on kummankin säilytettävä itsellään yksi jäljennös.
|
|
d)
|
Kunkin kaupallisen asiakirjan alkuperäiskappaleen on koostuttava yhdestä kaksipuolisesta paperiarkista, tai jos tarvitaan enemmän tilaa, todistuksen on oltava sellainen, että kaikista sivuista muodostuu yhtenäinen kokonaisuus, jonka sivuja ei voi erottaa toisistaan.
|
|
e)
|
Jos kaupalliseen asiakirjaan liitetään lisäsivuja lähetyksen sisällön tunnistamista varten, tällaiset sivut katsotaan myös asiakirjan alkuperäiskappaleen osaksi, ja lähetyksestä vastaavan henkilön on allekirjoitettava jokainen sivu.
|
|
f)
|
Jos kaupallinen asiakirja e kohdassa tarkoitettuine lisäsivuineen käsittää enemmän kuin yhden sivun, kunkin sivun alareunassa on oltava sivunumero – (sivunumero)/(sivujen kokonaismäärä) – ja kunkin sivun yläreunassa on oltava vastuuhenkilön antama asiakirjan koodinumero.
|
|
g)
|
Vastuuhenkilön on täytettävä ja allekirjoitettava kaupallisen asiakirjan alkuperäiskappale. Näin tehdessään vastuuhenkilö takaa, että asetuksen (EY) N:o 1774/2002 liitteessä II olevassa III luvussa säädettyjä dokumentoinnin periaatteita noudatetaan. Kaupallisessa asiakirjassa on täsmennettävä
|
i)
|
päivämäärä, jona aines vietiin pois tiloista;
|
|
ii)
|
aineksen kuvaus, mukaan luettuna aineksen tunnistetiedot, eläinlajit luokkaan 3 kuuluvan aineksen osalta sekä siitä johdetut käsitellyt tuotteet, jotka on tarkoitettu käytettäviksi rehuaineena, sekä tapauksen mukaan eläimen korvamerkissä oleva tunniste;
|
|
iv)
|
aineksen alkuperäpaikka;
|
|
v)
|
aineksen kuljettajan nimi ja osoite;
|
|
vi)
|
vastaanottajan nimi ja osoite sekä tarvittaessa tämän hyväksyntänumero; ja
|
|
vii)
|
tarpeen mukaan alkuperälaitoksen hyväksyntänumero sekä käsittelyn luonne ja käsittelytavat.
|
|
|
h)
|
Vastuuhenkilön allekirjoituksen on oltava erivärinen kuin painoväri.
|
|
i)
|
Kaupallinen asiakirja on säilytettävä vähintään kahden vuoden ajan, jotta se voidaan esittää toimivaltaiselle viranomaiselle asetuksen (EY) N:o 1774/2002 9 artiklassa tarkoitetun kirjanpidon tarkastamisen yhteydessä.
|
|
j)
|
Jos jäsenvaltiot päättävät käyttää sähköisessä muodossa olevaa kaupallista asiakirjaa, a–i alakohdassa lueteltuja vaatimuksia on sovellettava sähköisen muodon kannalta soveltuvin osin.
|


|
|
3)
|
Korvataan liitteessä VII olevan II luvun A kohdan 1 alakohdan ensimmäinen alakohta seuraavasti:
”Nisäkkäistä saatavan käsitellyn eläinvalkuaisen on oltava ensimmäisellä käsittelymenetelmällä käsiteltyä. Sian veri on kuitenkin voitu käsitellä 1.—5. käsittelymenetelmällä tai 7 käsittelymenetelmällä edellyttäen, että 7. käsittelymenetelmän yhteydessä on tehty lämpökäsittely kuumentamalla se läpikotaisin vähintään 80 °C:seen.”
|
|
4)
|
Muutetaan liite VIII seuraavasti:
|
a)
|
Muutetaan II luku seuraavasti:
|
i)
|
Korvataan A kohdan 1 alakohta seuraavasti:
|
”1.
|
Lemmikkieläinten ruokien ja puruluiden valmistukseen voidaan käyttää ainoastaan 6 artiklan 1 kohdan a–j alakohdassa tarkoitettuja eläinten sivutuotteita. Raa'an lemmikkieläinten ruoan valmistukseen voidaan kuitenkin käyttää ainoastaan 6 artiklan 1 kohdan a tai b alakohdassa tarkoitettuja eläinten sivutuotteita.”
|
|
|
ii)
|
Korvataan B kohdan 4 alakohta seuraavasti:
|
”4.
|
Puruluut on käsittelyn aikana käsiteltävä siten, että taudinaiheuttajat, salmonella mukaan luettuna, tuhoutuvat.
Kyseisen käsittelyn jälkeen on toteutettava kaikki varotoimenpiteet, joilla varmistetaan, etteivät puruluut saastu. Puruluut on pakattava uuteen pakkaukseen.”
|
|
|
|
b)
|
Muutetaan III luku seuraavasti:
|
i)
|
Korvataan I osan A kohdan 3 alakohta seuraavasti:
|
”3.
|
Sellainen hevoseläinten käsittelemätön lanta, jolla käydään kauppaa, ei saa olla peräisin tilalta, johon kohdistuu direktiivin 90/426/ETY 4 artiklan 5 kohdan mukaisesti räkätautiin, vesicular stomatitis -tautiin, pernaruttoon tai raivotautiin liittyviä eläinten terveyttä koskevia rajoituksia.”
|
|
|
ii)
|
Korvataan I osan B kohdan 4 alakohta seuraavasti:
|
”4.
|
Käsittelemättömän lannan tuonti on kiellettyä.”
|
|
|
iii)
|
Korvataan II osan B kohdan 6 alakohdan d alakohta seuraavasti:
|
”d)
|
niiden mukana on liitteessä X olevassa 17 luvussa vahvistetun mallin mukainen terveystodistus.”
|
|
|
|
c)
|
Muutetaan VI luku seuraavasti:
|
i)
|
Korvataan A kohdan 1 alakohdan a alakohta seuraavasti:
|
”a)
|
eläinperäisiä elintarvikkeita koskevista erityisistä hygieniasäännöistä 29 päivänä huhtikuuta 2004 annetun Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 853/2004 (1) vaatimukset täyttäviin sorkka- ja kavioeläinten vuotiin ja nahkoihin;
|
|
|
ii)
|
Korvataan B kohdan 3 alakohta seuraavasti:
|
”3.
|
Tuoreiden tai jäähdytettyjen vuotien ja nahkojen kauppaa koskevat samat terveysvaatimukset, joita sovelletaan ihmisravinnoksi tarkoitettujen eläinperäisten tuotteiden tuotantoon, jalostukseen, jakeluun ja yhteisön alueelle tuomiseen liittyvistä eläinten terveyttä koskevista säännöistä 16 päivänä joulukuuta 2002 annetun neuvoston direktiivin 2002/99/EY (2) mukaisesti tuoreeseen lihaan.
|
|
|
iii)
|
Korvataan C kohdan 5 alakohdan b alakohdan johdantolause seuraavasti:
|
”b)
|
ne ovat peräisin sellaisesta kolmannesta maasta tai – jos kyseessä on yhteisön lainsäädännön mukainen aluejako – kolmannen maan osasta, joka on mainittu liitteessä XI olevan XIV osan A kohdassa vahvistetussa luettelossa ja joka – kyseisen lajin mukaisesti –”.
|
|
|
iv)
|
Korvataan C kohdan 6 alakohdan b–e alakohta seuraavasti:
|
”b)
|
ne ovat peräisin joko
|
i)
|
sellaisesta kolmannesta maasta tai – jos kyseessä on yhteisön lainsäädännön mukainen aluejako – kolmannen maan osasta, joka on mainittu liitteessä XI olevan XIV osan B kohdassa vahvistetussa luettelossa ja josta vastaavien lajien tuoreen lihan tuonti on sallittua, ja ne on käsitelty A kohdan 2 alakohdan a, b tai c alakohdan mukaisesti; tai
|
|
ii)
|
sellaisesta kolmannesta maasta, joka on mainittu liitteessä XI olevan XIV osan B kohdassa vahvistetussa luettelossa, ja ne on käsitelty A kohdan 2 alakohdan c tai d alakohdan mukaisesti; tai
|
|
iii)
|
sellaisesta kolmannesta maasta, joka on mainittu liitteessä XI olevan XIV osan C kohdassa vahvistetussa luettelossa, peräisin olevista hevoseläimistä tai märehtijöistä, ja ne on käsitelty A kohdan 2 alakohdan a, b tai c alakohdan mukaisesti ja pidetty käsittelyn jälkeen erillään vähintään 21 päivän ajan;
|
|
|
c)
|
laivattavien suolattujen vuotien ja nahkojen ollessa kyseessä, ne on käsitelty A kohdan 2 alakohdan b tai c alakohdan mukaisesti ja pidetty erillään käsittelyn jälkeen kuljetuksen ajan vähintään 14 päivän ajan b alakohdan tapauksessa tai seitsemän päivän ajan c alakohdan tapauksessa ennen yhteisöön tuontia, ja lähetyksen mukana olevassa terveystodistuksessa todistetaan tällainen käsittely ja kuljetuksen kesto; ja
|
|
d)
|
niiden mukana on liitteessä X olevassa 5B luvussa vahvistetun terveystodistuksen mallin mukainen terveystodistus tai, kun on kyse tämän liitteen C kohdan 6 alakohdan b alakohdan iii alakohdassa tarkoitetuista vuodista ja nahoista, liitteessä X olevassa 5C luvussa vahvistetun mallin mukainen virallinen ilmoitus.”
|
|
|
|
d)
|
Muutetaan VIII luku seuraavasti:
|
i)
|
Korvataan B kohdan 4 alakohdan johdantolause seuraavasti:
”Jäsenvaltioiden pitää sallia käsittelemättömän villan ja karvan tuonti, jos”.
|
|
ii)
|
Lisätään B kohtaan 5 alakohta seuraavasti:
|
”5.
|
Käsittelemättömien sulkien ja höyhenten sekä sulkien ja höyhenten osien tuonti on kiellettyä.
Jäsenvaltioiden pitää sallia käsiteltyjen sulkien ja höyhenten sekä sulkien ja höyhenten osien tuonti, jos
|
a)
|
ne ovat koristesulkia ja koristehöyheniä, matkustajien mukanaan tuomia, yksityiskäyttöön tarkoitettuja käsiteltyjä sulkia ja höyheniä tai käsiteltyjä sulkia ja höyheniä sisältäviä tavaraeriä, jotka on lähetetty yksityishenkilöille muuhun kuin teolliseen tarkoitukseen; tai
|
|
b)
|
niiden mukana on kaupallinen asiakirja, jossa todetaan, että sulat ja höyhenet tai sulkien ja höyhenten osat on käsitelty höyryllä tai jollakin muulla menetelmällä taudinaiheuttajien inaktivoinnin varmistamiseksi, ne on suljettu turvallisesti pakkauksiin ja ne ovat kuivia.”
|
|
|
|
|
e)
|
Muutetaan IX luku seuraavasti:
|
i)
|
Korvataan A kohdan 1 alakohdan johdantolause seuraavasti:
|
”1.
|
Ainoastaan mehiläishoidossa käytettäväksi tarkoitetut mehiläishoidon sivutuotteet:”
|
|
|
ii)
|
Korvataan B kohdan 3 alakohta seuraavasti:
|
”3.
|
Jäsenvaltioiden pitää kennomaista mehiläisvahaa lukuun ottamatta sallia mehiläishoidossa käytettäväksi tarkoitettujen mehiläishoidon sivutuotteiden tuonti, jos
|
a)
|
tuotteet tulevat liitteessä XI olevassa XII osassa olevassa luettelossa mainitusta kolmannesta maasta;
|
|
b)
|
joko
|
i)
|
tuotteita on pidetty enintään –12 °C:n lämpötilassa vähintään 24 tunnin ajan, tai
|
|
ii)
|
kun on kyse vahasta, aines on puhdistettu tai renderoitu ennen vientiä, ja
|
|
|
c)
|
tuotteiden mukana on liitteessä X olevassa 13 luvussa vahvistetun mallin mukainen terveystodistus.”
|
|
|
|
iii)
|
Lisätään B kohtaan 4 ja 5 alakohta seuraavasti:
|
”4.
|
Jäsenvaltioiden pitää kennomaista mehiläisvahaa lukuun ottamatta sallia teknisiin tarkoituksiin tarkoitetun mehiläisvahan tuonti, jos
|
a)
|
se on puhdistettu tai renderoitu ennen maasta vientiä; ja
|
|
b)
|
sen mukana on kaupallinen asiakirja, jossa todistetaan tämä puhdistaminen tai renderointi.
|
|
|
5.
|
Kennomaisen mehiläisvahan maahantuonti on kiellettyä.”
|
|
|
|
f)
|
Muutetaan XI luku seuraavasti:
|
i)
|
Korvataan 2 kohdan toinen alakohta seuraavasti:
”tarhattujen turkiseläinten rehuna ja raa'assa lemmikkieläinten ruoassa käytettävien eläimistä saatavien sivutuotteiden on koostuttava ainoastaan 6 artiklan 1 kohdan a ja b alakohdassa tarkoitetuista eläimistä saatavista sivutuotteista;”
|
|
ii)
|
Korvataan 6 kohta seuraavasti:
|
”6.
|
niiden mukana on liitteessä X olevassa 3D, 3F tai 8 luvussa vahvistetun mallin mukainen todistus.”
|
|
|
|
|
5)
|
Korvataan liite X seuraavasti:
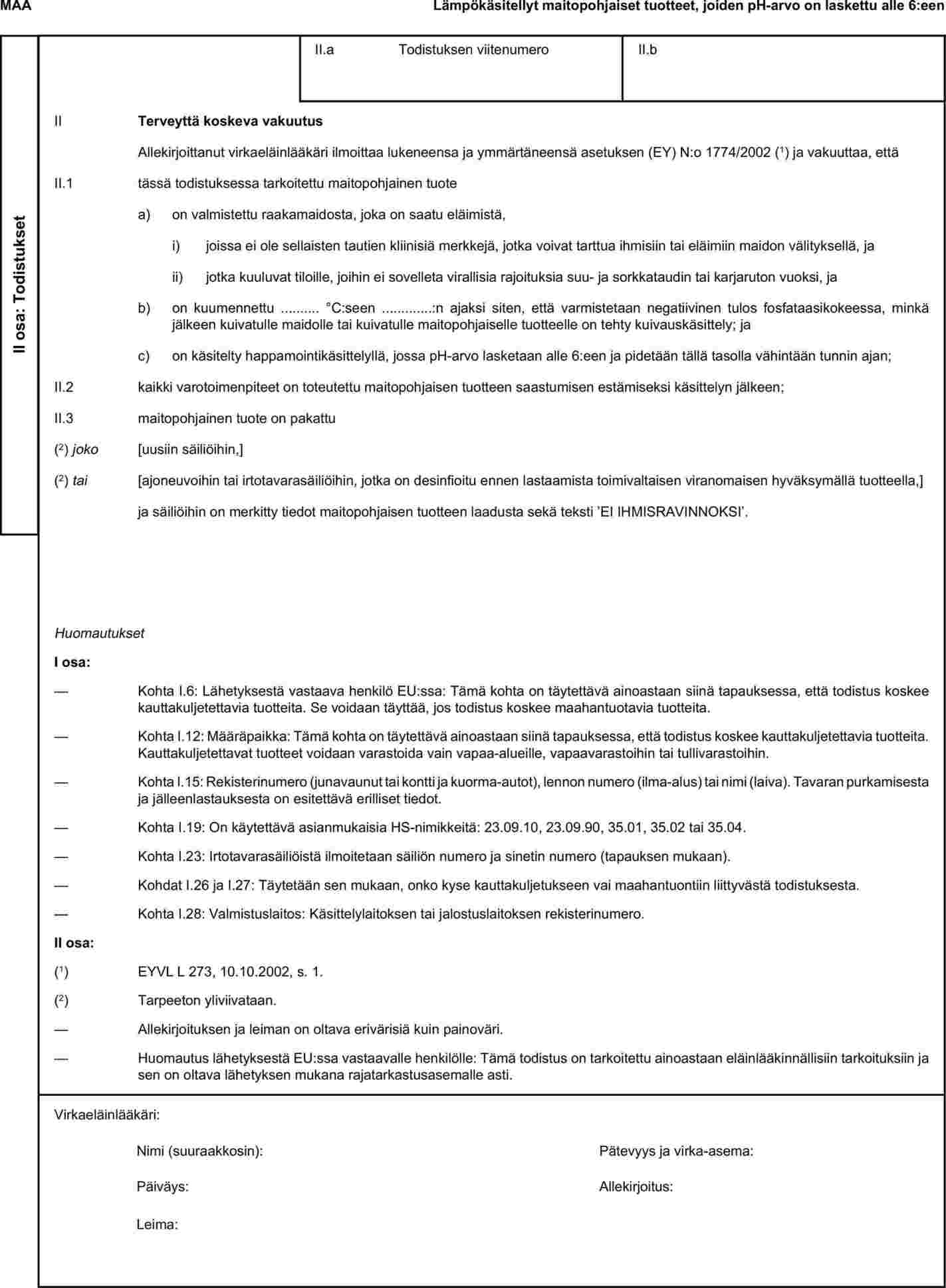
”LIITE X
TERVEYSTODISTUSTEN MALLIT TIETTYJEN ELÄINTEN SIVUTUOTTEIDEN JA NIISTÄ JOHDETTUJEN TUOTTEIDEN KOLMANSISTA MAISTA TUONTIA JA EUROOPAN YHTEISÖN KAUTTA TAPAHTUVAA KAUTTAKULJETUSTA VARTEN
Huomautuksia
|
a)
|
Viejämaan on laadittava eläinlääkärintodistukset liitteessä X olevien, asianomaisia eläimistä saatavia sivutuotteita vastaavien mallien mukaisesti. Niissä on oltava mallin mukaisessa numerojärjestyksessä kolmannen maan osalta vaaditut vakuutukset ja tapauksen mukaan viejänä toimivalta kolmannelta maalta tai sen osalta vaaditut lisätakeet.
|
|
b)
|
Kunkin todistuksen alkuperäiskappaleen on koostuttava yhdestä kaksipuolisesta paperiarkista, tai jos tarvitaan enemmän tilaa, todistuksen on oltava sellainen, että kaikista sivuista muodostuu yhtenäinen kokonaisuus, jonka sivuja ei voi erottaa toisistaan.
|
|
c)
|
Todistus on laadittava vähintään yhdellä sen EU-jäsenvaltion virallisista kielistä, jonka rajatarkastusasemalla tarkastus tehdään, sekä vähintään yhdellä määräpaikkana olevan EU-jäsenvaltion virallisista kielistä. Kyseiset jäsenvaltiot voivat kuitenkin tarvittaessa sallia muiden kielien käytön, jos mukaan liitetään virallinen käännös.
|
|
d)
|
Jos todistukseen liitetään lisäsivuja lähetyksen osien tunnistamiseksi, kyseisten sivujen katsotaan olevan osa todistuksen alkuperäiskappaletta, ja todistuksen antavan virkaeläinlääkärin on allekirjoitettava ja leimattava leimalla jokainen sivu.
|
|
e)
|
Jos todistuksessa, d kohdassa tarkoitetut lisäsivut mukaan luettuina, on enemmän kuin yksi sivu, kunkin sivun alaosaan on merkittävä sivunumero – (sivunumero) / (sivujen kokonaismäärä) – ja yläosaan on merkittävä toimivaltaisen viranomaisen osoittama todistuksen koodinumero.
|
|
f)
|
Virkaeläinlääkärin on täytettävä ja allekirjoitettava alkuperäinen todistus. Näin tehdessään viejämaan toimivaltaisen viranomaisen on varmistettava, että noudatetaan neuvoston direktiivissä 96/93/EY vahvistettuja periaatteita vastaavia todistuksen myöntämistä koskevia periaatteita.
|
|
g)
|
Allekirjoituksen värin on oltava eri kuin painoväri. Samat säännöt koskevat muita leimoja kuin kohopainettuja leimoja ja vesileimoja.
|
|
h)
|
Todistuksen alkuperäiskappaleen on oltava lähetyksen mukana EU:n rajatarkastusasemalle asti.
|
|
i)
|
Jos terveystodistus liitetään kauttakulussa oleviin eriin, kyseisen terveystodistuksen kohtaan I.5 (’vastaanottaja’) täytetään sen rajatarkastusaseman nimi ja osoite, jonka kautta lähetyksen on tarkoitus lähteä Euroopan yhteisöstä.
|




















































































|
|
6)
|
Muutetaan liite XI seuraavasti:
|
a)
|
Korvataan VI osan otsake seuraavasti:
”VI OSA
Luettelo kolmansista maista, joista jäsenvaltiot voivat sallia teknisiin tarkoituksiin, farmaseuttiset tuotteet mukaan luettuina, käytettävien eläimistä saatavien sivutuotteiden ja verituotteiden tuonnin, hevoseläimistä saatavia verituotteita lukuun ottamatta (4C ja 8 luvun terveystodistukset)”
|
|
b)
|
Korvataan VII A osan otsake ja A kohta seuraavasti:
”VII A OSA
Luettelo kolmansista maista, joista jäsenvaltiot voivat sallia käsitellyn lemmikkieläinten ruoan valmistukseen käytettävien eläimistä saatavien sivutuotteiden tuonnin (3B ja 3F luvun terveystodistukset)
|
A.
|
Nautaeläimistä, lampaista, vuohista, sioista ja hevoseläimistä, tarhatut ja luonnonvaraiset eläimet mukaan luettuina, peräisin olevat eläimistä saatavat sivutuotteet:
Neuvoston päätöksen 79/542/ETY liitteessä II olevassa 1 osassa luetellut kolmannet maat tai kolmansien maiden osat, joista vastaavien lajien kyseiseen luokkaan kuuluvan tuoreen lihan tuonti on sallittua, sekä seuraavat maat niiden kohdalla mainittujen eläimistä saatavien sivutuotteiden osalta:
Etelä-Amerikan ja eteläisen Afrikan maat tai niiden osat, joista sallitaan vastaavista lajeista saadun raakakypsytetyn ja luuttomaksi leikatun lihan tuonti, raakakypsytetyn ja luuttomaksi leikatun lihan (puremalihakset mukaan luettuina) ja/tai nautaeläimistä, vuohista, lampaista ja (luonnonvaraisesta tai tarhatusta) riistasta saatujen raakakypsytettyjen viimeisteltyjen muiden eläimenosien osalta.”
|
|
|
c)
|
Korvataan IX osa seuraavasti:
”IX OSA
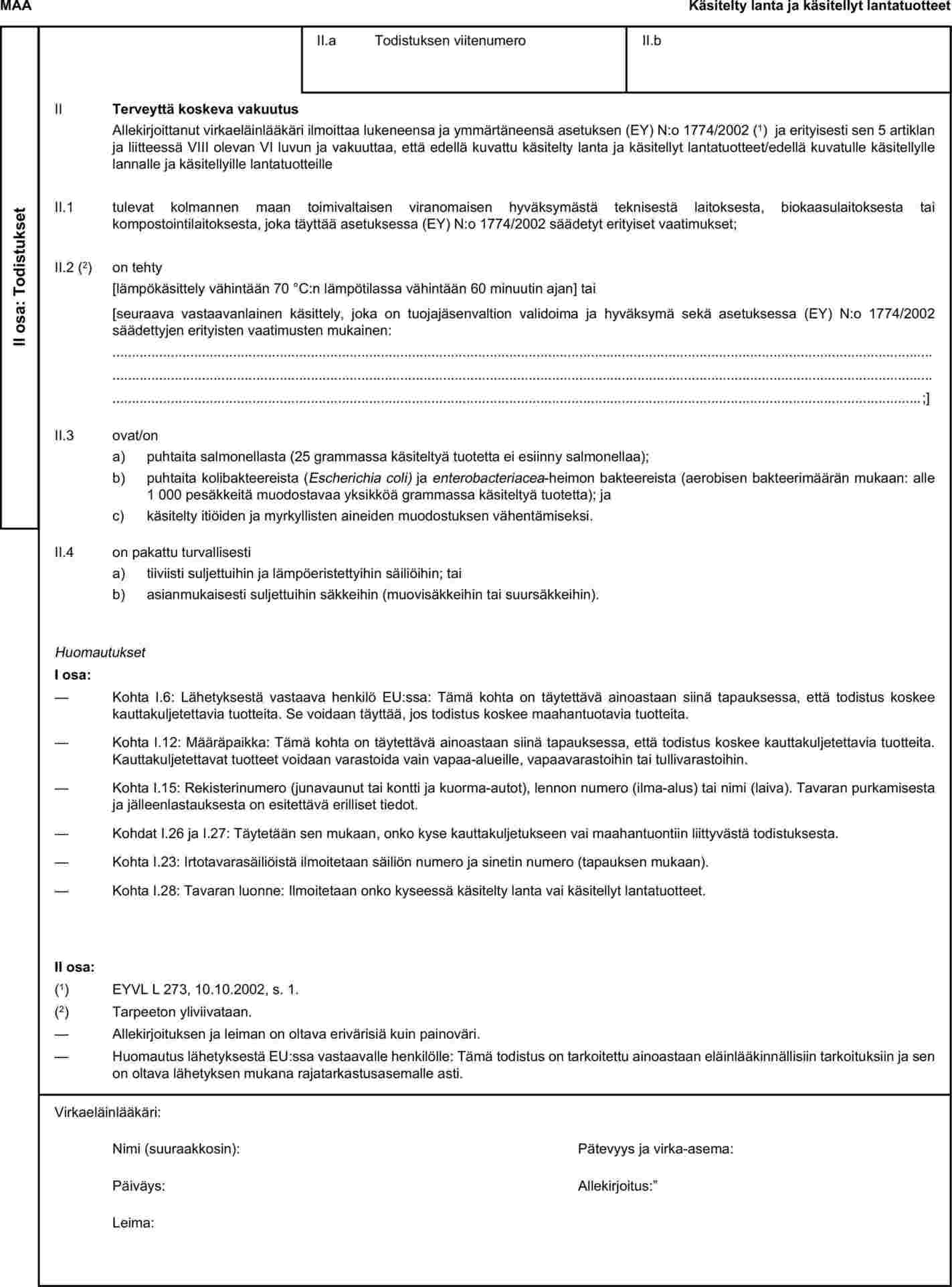
Luettelo kolmansista maista, joista jäsenvaltiot voivat sallia maanparannukseen käytettävän käsitellyn lannan ja käsiteltyjen lantatuotteiden tuonnin (17 luvun terveystodistus)
Käsitellyn lannan ja käsiteltyjen lantatuotteiden osalta kolmannet maat, jotka on lueteltu
|
a)
|
päätöksen 79/542/ETY liitteessä II olevassa 1 osassa;
|
|
b)
|
komission päätöksen 2004/211/EY liitteessä I; tai
|
|
|
d)
|
Korvataan XIII osa seuraavasti:
”XIII OSA
Luettelo kolmansista maista, joista jäsenvaltiot voivat sallia hevoseläinten seerumin tuonnin (4A luvun terveystodistus)
Komission päätöksen 2004/211/EY (8) liitteessä I luetellut kolmannet maat tai kolmansien maiden osat, joista hevoseläinten tuonti jalostukseen ja tuotantoon on sallittua.”
|
|
(1) EUVL L 139, 30.4.2004, s. 55, oikaisu EUVL L 226, 25.6.2004, s. 22.”
(2) EUVL L 18, 23.1.2003, s. 11.”
























































































