EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32008R0440
Council Regulation (EC) No 440/2008 of 30 May 2008 laying down test methods pursuant to Regulation (EC) No 1907/2006 of the European Parliament and of the Council on the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) (Text with EEA relevance)
Komission asetus (EY) N:o 440/2008, annettu 30 päivänä toukokuuta 2008 , testimenetelmien vahvistamisesta kemikaalien rekisteröinnistä, arvioinnista, lupamenettelyistä ja rajoituksista (REACH) annetun asetuksen (EY) N:o 1907/2006 nojalla (ETA:n kannalta merkityksellinen teksti)
Komission asetus (EY) N:o 440/2008, annettu 30 päivänä toukokuuta 2008 , testimenetelmien vahvistamisesta kemikaalien rekisteröinnistä, arvioinnista, lupamenettelyistä ja rajoituksista (REACH) annetun asetuksen (EY) N:o 1907/2006 nojalla (ETA:n kannalta merkityksellinen teksti)
OJ L 142, 31.5.2008, p. 1–739
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
Special edition in Croatian: Chapter 13 Volume 033 P. 3 - 741
 In force: This act has been changed. Current consolidated version: 26/03/2023
In force: This act has been changed. Current consolidated version: 26/03/2023
|
31.5.2008 |
FI |
Euroopan unionin virallinen lehti |
L 142/1 |
KOMISSION ASETUS (EY) N:o 440/2008,
annettu 30 päivänä toukokuuta 2008,
testimenetelmien vahvistamisesta kemikaalien rekisteröinnistä, arvioinnista, lupamenettelyistä ja rajoituksista (REACH) annetun asetuksen (EY) N:o 1907/2006 nojalla
(ETA:n kannalta merkityksellinen teksti)
EUROOPAN YHTEISÖJEN KOMISSIO, joka
ottaa huomioon Euroopan yhteisön perustamissopimuksen,
ottaa huomioon kemikaalien rekisteröinnistä, arvioinnista, lupamenettelyistä ja rajoituksista (REACH), Euroopan kemikaaliviraston perustamisesta, direktiivin 1999/45/EY muuttamisesta sekä neuvoston asetuksen (ETY) N:o 793/93, komission asetuksen (EY) N:o 1488/94, neuvoston direktiivin 76/769/ETY ja komission direktiivien 91/155/ETY, 93/67/ETY, 93/105/EY ja 2000/21/EY kumoamisesta 18 päivänä joulukuuta 2006 annetun Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 1907/2006 (1) ja erityisesti sen 13 artiklan 3 kohdan,
sekä katsoo seuraavaa:
|
(1) |
Aineiden sisäisten ominaisuuksien selvittämiseksi käytettävät testimenetelmät on asetuksen (EY) N:o 1907/2006 mukaisesti hyväksyttävä yhteisön tasolla. |
|
(2) |
Vaarallisten aineiden luokitusta, pakkaamista ja merkintöjä koskevien lakien, asetusten ja hallinnollisten määräysten lähentämisestä 27 päivänä kesäkuuta 1967 annetun neuvoston direktiivin 67/548/ETY (2) liitteessä V säädetään aineiden ja valmisteiden fysikaalis-kemiallisten ominaisuuksien, myrkyllisyyden ja ekomyrkyllisyyden määritysmenetelmistä. Direktiivin 67/548/ETY liite V on kumottu Euroopan parlamentin ja neuvoston direktiivillä 2006/121/EY 1 päivästä kesäkuuta 2008 alkaen. |
|
(3) |
Direktiivin 67/548/ETY liitteessä V olevat testimenetelmät olisi sisällytettävä tähän asetukseen. |
|
(4) |
Tämä asetus ei rajoita muiden testimenetelmien käyttämistä, jos niitä käytetään asetuksen (EY) N:o 1907/2006 13 artiklan 3 kohdan mukaisesti. |
|
(5) |
Testimenetelmien suunnittelussa olisi otettava täysimääräisesti huomioon eläinkokeiden korvaamista, vähentämistä sekä niihin liittyvien menetelmien parantamista koskevat periaatteet, erityisesti jos saataville tulee asianmukaisia validoituja menetelmiä, joilla voidaan korvata eläinkokeita, vähentää niiden käyttöä tai parantaa menetelmiä. |
|
(6) |
Tässä asetuksessa säädetyt toimenpiteet ovat asetuksen (EY) N:o 1907/2006 133 artiklalla perustetun komitean lausunnon mukaiset, |
ON ANTANUT TÄMÄN ASETUKSEN:
1 artikla
Asetuksen (EY) N:o 1907/2006/EY soveltamiseksi käytettävät testimenetelmät vahvistetaan tämän asetuksen liitteessä.
2 artikla
Komissio tarkastelee tarvittaessa uudelleen tässä asetuksessa mainittuja testimenetelmiä, jos niitä on tarpeen muuttaa selkärankaisilla eläimillä tehtävien kokeiden korvaamiseksi, vähentämiseksi ja menetelmien parantamiseksi.
3 artikla
Viittauksia direktiivin 67/548/ETY liitteeseen V pidetään viittauksina tähän asetukseen.
4 artikla
Tämä asetus tulee voimaan seuraavana päivänä sen jälkeen, kun se on julkaistu Euroopan unionin virallisessa lehdessä.
Sitä sovelletaan 1 päivästä kesäkuuta 2008.
Tehty Brysselissä 30 päivänä toukokuuta 2008.
Komission puolesta
Stavros DIMAS
Komission jäsen
(1) EUVL L 396, 30.12.2006, s. 1, oikaisu EUVL L 136, 29.5.2007, s. 3.
(2) EYVL 196, 16.8.1967, s. 1, direktiivi sellaisena kuin se on viimeksi muutettuna Euroopan parlamentin ja neuvoston direktiivillä 2006/121/EY (EUVL L 396, 30.12.2006, s. 850, oikaisu EUVL L 136, 29.5.2007, s. 281) — täydennetään asianmukaisella viitteellä, kun 30. ATP on julkaistu.
LIITE
OSA A: FYSIKAALIS-KEMIALLISTEN OMINAISUUKSIEN MÄÄRITYSMENETELMÄT
SISÄLLYSLUETTELO
|
A.1 |
SULAMIS-/JÄÄTYMISLÄMPÖTILA |
|
A.2 |
KIEHUMISLÄMPÖTILA |
|
A.3 |
SUHTEELLINEN TIHEYS |
|
A.4 |
HÖYRYNPAINE |
|
A.5 |
PINTAJÄNNITYS |
|
A.6 |
VESILIUKOISUUS |
|
A.8 |
JAKAANTUMISKERROIN |
|
A.9 |
LEIMAHDUSPISTE |
|
A.10 |
SYTTYVYYS (KIINTEÄT AINEET) |
|
A.11 |
SYTTYVYYS (KAASUT) |
|
A.12 |
SYTTYVYYS (KOSKETUS VEDEN KANSSA) |
|
A.13 |
KIINTEIDEN AINEIDEN JA NESTEIDEN ITSESYTTYVYYS |
|
A.14 |
RÄJÄHTÄVYYS |
|
A.15 |
ITSESYTTYMISLÄMPÖTILA (NESTEET JA KAASUT) |
|
A.16 |
KIINTEIDEN AINEIDEN SUHTEELLINEN ITSESYTTYMISLÄMPÖTILA |
|
A.17 |
HAPETTAVAT OMINAISUUDET (KIINTEÄT AINEET) |
|
A.18 |
POLYMEERIEN LUKUKESKIMÄÄRÄINEN MOLEKYYLIPAINO JA MOLEKYYLIPAINOJAKAUMA |
|
A.19 |
PIENIMOLEKYYLISTEN AINEIDEN PITOISUUS POLYMEERISSÄ |
|
A.20 |
VESILIUOKSESSA OLEVIEN POLYMEERIEN LIUKENEMIS/UUTTUMISOMINAISUUDET |
|
A.21 |
HAPETTAVAT OMINAISUUDET (NESTEET) |
A.1 SULAMIS-/JÄÄTYMISLÄMPÖTILA
1. MENETELMÄ
Tässä kuvattavat menetelmät perustuvat pääosin OECD:n testiohjeisiin (1). Perusperiaatteet kuvataan viitteissä (2) ja (3).
1.1 JOHDANTO
Kuvattuja menetelmiä ja laitteita voidaan soveltaa aineiden sulamislämpötilan määritykseen ilman rajoituksia aineiden puhtausasteen suhteen.
Sopiva menetelmä valitaan testattavan aineen luonteen mukaan. Aineet voivat olla helposti, vaikeasti tai ei lainkaan jauhettavissa.
Joidenkin aineiden kohdalla on käytännöllisempää määrittää jäätymis- tai jähmettymislämpötila, ja tästä syystä menetelmään on myös otettu mukaan tällaisten määritysten standardit.
Jos aineen ominaisuudet ovat sellaiset, että mikään edellä mainituista parametreista ei ole mitattavissa, voidaan joissakin tapauksissa käyttää jähmettymispistettä.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Määritelmän mukaan sulamislämpötila on se lämpötila, jossa tapahtuu faasimuutos kiinteästä olomuodosta nestemäiseen olomuotoon ilmakehän paineessa. Ihannetapauksissa sulamislämpötila on sama kuin jäätymislämpötila.
Koska faasimuutos kattaa usein määrätyn lämpötila-alueen, voidaan käyttää myös käsitettä sulamisalue.
Yksiköiden muuntaminen (K > oC)
t = T - 273,15
|
t |
: |
Celsius-lämpötila, Celsius-astetta ( oC) |
|
T |
: |
termodynaaminen lämpötila, kelviniä (K) |
1.3 VERTAILUAINEET
Uutta ainetta tutkittaessa ei aina tarvitse käyttää vertailuaineita. Vertailuaineita käytetään lähinnä menetelmän toimivuuden ajoittaiseen tarkistamiseen ja verrattaessa tuloksia muiden menetelmien avulla saatuihin tuloksiin.
Viitteessä (4) kuvataan joitakin kalibrointiaineita.
1.4 TESTIMENETELMÄN PERIAATTEET
Määritetään lämpötila (lämpötila-alue), jossa tapahtuu faasimuutos kiinteästä olomuodosta nestemäiseen olomuotoon tai päinvastoin. Käytännössä määritetään sulamisen tai jäätymisen alku- ja loppulämpötila kuumennettaessa tai jäähdytettäessä näytettä ilmakehän paineessa. Jäljempänä kuvataan viisi menetelmätyyppiä: kapillaarimenetelmä, kuuma-alustamenetelmät, jäätymislämpötilan määritykset, terminen analyysi ja jähmettymispisteen määritys (kehitetty paloöljyjä varten).
Joissakin tapauksissa voi olla käytännöllisempää määrittää sulamislämpötilan sijasta jäätymislämpötila.
1.4.1 Kapillaarimenetelmä
1.4.1.1 Nestehauteella varustetut sulamislämpötilalaitteet
Pieni määrä hienoksi jauhettua näytettä pakataan tiiviisti kapillaariputkeen. Putkea kuumennetaan yhdessä lämpömittarin kanssa siten, että lämpötilan nousu on alle 1 K minuutissa varsinaisen sulamisen aikana. Määritetään sulamisen alku- ja loppulämpötila.
1.4.1.2 Metallikappaleeseen perustuvat sulamislämpötilalaitteet
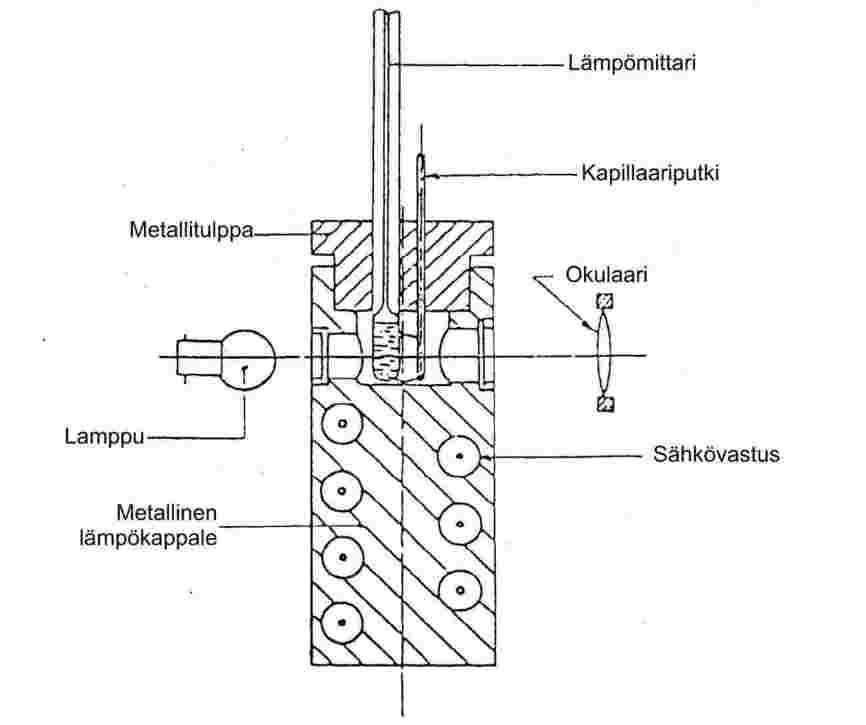
Periaate on muutoin sama kuin kohdassa 1.4.1.1, mutta kapillaariputki ja lämpömittari asetetaan kuumennettavaan metallikappaleeseen, jossa on reiät niiden tarkastelua varten.
1.4.1.3 Valokennoilmaisin
Kapillaariputkessa olevaa näytettä kuumennetaan metallisylinterissä automaattisesti. Aineen läpi johdetaan valonsäde sylinterin reiän kautta tarkasti kalibroituun valokennoon. Digitaalisesta osoittimesta nähdään kuumennuskammiossa sijaitsevan platinavastuslämpömittarin mittaama lämpötila. Useimpien aineiden optiset ominaisuudet muuttuvat sulamisen myötä valoaläpäisemättömäksi läpinäkyvään, jolloin valokennoon tulevan valonsäteen intensiteetti kasvaa ja digitaalinen osoitin saa pysäytyssignaalin. Menetelmä ei sovellu voimakkaanväristen aineiden mittauksiin.
1.4.2 Kuuma-alustamenetelmät
1.4.2.1 Koflerin kuumasauva
Koflerin kuumasauvassa on kaksi metalliosaa, joilla on eri lämmönjohtavuus. Sähkölämmitteinen sauva on suunniteltu siten, että lämpötilagradientti on lähes lineaarinen sauvan pituussuunnassa. Sauvan mitattava lämpötila-alue on 283–573 K, ja mittaus tehdään sauvatyyppikohtaisella erikoislaitteella, jossa on osoitinkisko. Aineen sulamislämpötilan määritystä varten näytettä levitetään ohuelti suoraan kuuman sauvan pinnalle. Muutamassa sekunnissa muodostuu selvä raja nestemäisen ja kiinteän faasin välille. Rajan lämpötila luetaan siirtämällä osoitin rajan kohdalle.
1.4.2.2 Sulamismikroskooppi
Sulamismikroskoopin avulla sulamislämpötila voidaan määrittää hyvin pienestä näytemäärästä. Sulamismikroskooppcja on monia eri tyyppejä. Useimmissa malleissa lämpötila mitataan herkän termoparin avulla, mutta myös elohopeamittaria käytetään. Tyypillisessä sulamismikroskoopissa on kuumennuskammio ja tämän sisällä metallilevy, jolle näytettä sisältävä objektilasi asetetaan. Tarvittava valo saadaan kammioon mikroskoopin valaisupeilistä metallilevyn keskiön reiän kautta. Kammion sulkeva lasilevy estää ilman pääsyn näytealueelle mittauksen aikana.
Näytteen kuumentamista säätää reostaatti. Hyvin tarkoissa optisesti anisotrooppisten aineiden mittauksissa voidaan käyttää polarisoitua valoa.
1.4.2.3 Meniskimenetelmä
Tätä menetelmää käytetään erityisesti polyamidien ominaisuuksien mittauksissa.
Määritetään visuaalisesti lämpötila, jossa polyamidinäytteellä lepäävä kuumennusalustan ja lasilevyn välinen silikoniöljymeniski liikkuu.
1.4.3 Jäätymislämpötilan määritysmenetelmä
Näyte pannaan erityiseen koeputkeen, joka asetetaan jäätymislämpötilan määrityslaitteeseen. Näytettä hämmennetään kevyesti koko jäähdyttämisen ajan. Mitataan lämpötila sopivin välein. Kun lämpötila on pysynyt samana muutaman mittauksen ajan, tämä lämpötila (lämpömittarin virheellä korjattuna) katsotaan jäätymislämpötilaksi.
Alijäähtymistä on vältettävä pitämällä yllä kiinteän ja nestemäisen faasin välistä tasapainoa.
1.4.4 Terminen analyysi
1.4.4.1 Differentiaaliterminen analyysi (DTA)
Tämän tekniikan avulla voidaan rekisteröidä näytteen ja vertailuaineen lämpötilaero lämpötilan funktiona, kun näytettä ja vertailuainetta käsitellään saman valvotun lämpötilaohjelman mukaan. Kun näytteessä tapahtuu entalpiamuutoksen sisältävä olomuodon muutos, muutos näkyy endotermisenä (sulaminen) tai eksotermisenä (jäätyminen) poikkeamana lämpötilakäyrän perusviivasta.
1.4.4.2 Differentiaalinen pyyhkäisykalorimetria (DSC)
Tämän tekniikan avulla voidaan rekisteröidä näytteen ja vertailuaineen energianottoero lämpötilan funktiona, kun näytettä ja vertailuainetta käsitellään saman valvotun lämpötilaohjelman mukaan. Tämä energiaero on energiamäärä, joka tarvitaan pienentämään näytteen ja vertailuaineen lämpötilaero nollaan. Kun näytteessä tapahtuu entalpiamuutoksen sisältävä muodonmuutos, muutos näkyy endotermisenä (sulaminen) tai eksotermisena (jäätyminen) poikkeamana lämpövirran perusviivasta.
1.4.5 Jähmettymispiste
Tätä paloöljyjä varten kehitettyä menetelmää voidaan käyttää alhaisen sulamispisteen omaavien öljymäisten aineiden tutkimiseen.
Alustavan kuumennuksen jälkeen näytettä jäähdytetään määrätyllä nopeudella. Jäähtymisen aikana näytteen virtausominaisuuksia tarkastellaan 3 K:n välein. Alin lämpötila, jossa vielä esiinny liikettä, on aineen jähmettymispiste.
1.5 LAATUKRITEERIT
Sulamislämpötilan tai sulamisalueen määritykseen tarkoitettujen menetelmien soveltuvuus ja tarkkuus kuvataan seuraavassa taulukossa:
TAULUKKO: MENETELMIEN SOVELTUVUUS
A. Kapillaarimenetelmät
|
Mittausmenetelmä |
Jauhettavat aineet |
Vaikeasti jauhettavat aineet |
Lämpötila-alue |
Arvioitu tarkkuus (1) |
Nykyinen standardi |
|
Nestehauteella varustetut sulamislämpötilalaitteet |
kyllä |
vain harvat |
273–573 K |
±0,3K |
JIS K 0064 |
|
Metallikappaleeseen perustuvat sulamislämpötilalaitteet |
kyllä |
vain harvat |
293... > 573 K |
±0,5K |
ISO 1218(E) |
|
Valokennoilmaisin |
kyllä |
useat (erikoislaitteiden avulla) |
253–573 K |
±0,5 K |
|
B. Kuuma-alusta- ja jäätymismenetelmät
|
Mittausmenetelmä |
Jauhettavat aineet |
Vaikeasti jauhettavat aineet |
Lämpötila-alue |
Arvioitu tarkkuus (2) |
Nykyinen standardi |
|
Koflerin kuumasauva |
kyllä |
ei |
283... > 573 K |
±1,0 K |
ANSI/ASTM D 3451-76 |
|
Sulamismikroskooppi |
kyllä |
vain harvat |
273... > 573 K |
±0,5K |
DIN 53736 |
|
Meniskimenetelmä |
ei |
erityisesti polyamidit |
293... > 573 K |
±0,5 K |
ISO 1218 (E) |
|
Jäätymislämpötilamenetelmät |
kyllä |
kyllä |
223–573 K |
±0,5 K |
esim. BS 4695 |
C. Terminen analyysi
|
Mittausmenetelma |
Jauhettavat aineet |
Vaikeasti jauhettavat aineet |
Lämpötila-alue |
Arvioitu tarkkuus (3) |
Nykyinen standardi |
|
Differentiaaliterminen analyysi |
kyllä |
kyllä |
173–1 273 K |
enintään 600 K ±0,5 K enintään 1 273 K ±2,0 K |
ASTM E 537-76 |
|
Differentiaalinen pyyhkäisykalorimetria |
kyllä |
kyllä |
173–1 273 K |
enintään 600 K ±0,5 K enintään 1 273 K ±2,0 K |
ASTM E 537-76 |
D. Jähmettymispiste
|
Mittausmenetelmä |
Jauhettavat aineet |
Vaikeasti jauhettavat aineet |
Lämpötila-alue |
Arvioitu tarkkuus (4) |
Nykyinen standardi |
|
Jähmettymispiste |
paloöljyt ja öljymäiset aineet |
paloöljyt ja öljymäiset aineet |
223–323 K |
±3,0 K |
ASTM D 97-66 |
1.6 MENETELMÄKUVAUKSET
Testimenetelmien työjärjestys on pääosin kuvattu kansainvälisissä ja kansallisissa standardeissa (katso liitettä 1)
1.6.1 Kapillaariputkimenetelmät
Kun hienoksi jauhettua ainetta kuumennetaan hitaasti, siinä on yleensä havaittavissa kuvassa 1 esitettävät sulamisvaiheet.
Kuva 1

Sulamislämpötila määritetään rekisteröimällä sulamisen alku- ja loppulämpötila.
1.6.1.1 Nestehauteella varustetut sulamislämpötilalaitteet
Kuvassa 2 on lasista valmistettu standardoitu sulamislämpötilalaite (JIS K 0064). Kaikki mitat ovat millimetreinä.
Kuva 2

Haudeneste:
Haudeneste valitaan määritettävän sulamislämpötilan mukaan. Jos esimerkiksi sulamislämpötila on enintään 473 K, käytetään paloöljyä, ja jos sulamislämpötila on enintään 573 K, käytetään silikoniöljyä.
Jos sulamislämpötila on suurempi kuin 523 K, voidaan käyttää seosta, jossa on kolme paino-osaa rikkihappoa ja kaksi paino-osaa kaliumsulfaattia. Tätä seosta käytettäessä on noudatettava tarpeellisia varotoimenpiteitä.
Lämpömittari
Käytettävän lämpömittarin tulee täyttää seuraavat tai niitä vastaavat standardit:
ASTM E 1-71, DIN 12770, JIS K 8001.
Työjärjestys:
Kuiva näyte hienonnetaan huhmareessa ja siirretään kapillaariputkeen, jonka toinen pää on suljettu. Näytettä pannaan putkeen sellainen määrä, että sen korkeus tiiviiksi pakattuna on noin 3 mm. Yhtenäisen pakkaustiiviyden saavuttamiseksi kapillaariputki pudotetaan noin 700 mm:n korkeudelta kohtisuoraan lasiputken läpi kellonlasille.
Täytetty kapillaariputki asetetaan hauteeseen siten, että lämpömittarin elohopeanuppi koskettaa kapillaariputkea näytteen kohdalta. Kun kapillaariputki asetetaan hauteeseen, sen lämpötila on yleensä noin 10 K alle sulamislämpötilan.
Hauteen nestettä kuumennetaan siten, että lämpötilan nousu on noin 3 K/min. Nestettä on hämmennettävä. Kun lämpötila on noin 10 K alle sulamislämpötilan, kuumenemista säädetään, niin että lämpötilan nousu on enintään 1 K/min.
Tuloksen laskenta:
Sulamislämpötila lasketaan seuraavan suureyhtälön mukaan:
T = TD + 0,00016(TD - TE)n
jossa:
|
T |
= |
korjattu sulamislämpötila kelvineinä |
|
TD |
= |
D-lämpömittarin lukema kelvineinä |
|
TE |
= |
E-lämpömittarin lukema kelvineinä |
|
n |
= |
D-lämpömittarin nesteen yläpuolella olevan varren elohopeapylvään astejakojen määrä |
1.6.1.2 Metallikappaleeseen perustuvat sulamislämpötilalaitteet
Laitteisto:
Laitteiston osat ovat seuraavat:
|
— |
sylinterinmuotoinen metallikappale, jonka yläosa on ontto ja muodostaa kammion (katso kuvaa 3), |
|
— |
metallitulppa, jossa on vähintään kaksi reikää, joiden kautta metallikappaleeseen voidaan työntää putkia, |
|
— |
metallikappaleen kuumennusjärjestelmä, esimerkiksi kappaleen sisällä oleva sähkövastus, |
|
— |
reostaatti tehonsäätöä varten (jos käytössä on sähkölämmitys), |
|
— |
kammion sivuseinissä neljä lämmönkestävää lasi-ikkunaa, jotka ovat vastakkain ja toisiinsa nähden suorassa kulmassa; yhden ikkunan edessä on okulaari kapillaariputken tarkastelua varten, muiden ikkunoiden läpi johdetaan lampuista valoa kammion sisäosaan, |
|
— |
lämmönkestävästä lasista valmistettu kapillaariputki, jonka toinen pää on suljettu (katso kohtaa 1.6.1.1). |
Lämpömittari:
Katso kohdassa 1.6.1.1 mainittavia standardeja. Myös riittävän tarkkoja lämpösähköisiä mittauslaitteita voidaan käyttää.
Kuva 3
1.6.1.3 Valokennoilmaisin
Laitteisto ja työjärjestys:
Laitteisto on automaattisella kuumennusjärjestelmällä varustettu metallikammio. Kolme kapillaariputkea täytetään kohdan 1.6.1.1 ohjeiden mukaan ja asetetaan uuniin.
Laitteiston kalibroinnin avulla saadaan useita lineaarisia lämpötilan nousukäyriä. Kuumennus säädetään sähköisesti valitun vakion ja lineaarisen nousukäyrän mukaan. Uunin lämpötila ja kapillaariputkessa olevien näytteiden lämpötila ilmenevät rekisteröintilaitteesta.
1.6.2 Kuuma-alustat
1.6.2.1 Koflerin kuumasauva
Katso liitettä.
1.6.2.2 Sulamismikroskooppi
Katso liitettä.
1.6.2.3 Meniskimenetelmä (polyamidit)
Katso liitettä.
Sulamislämpötilan alueella lämpötilan nousun on oltava alle 1 K/min.
1.6.3 Jäätymislämpötilan määritysmenetelmät
Katso liitettä.
1.6.4 Terminen analyysi
1.6.4.1 Differentiaaliterminen analyysi
Katso liitettä.
1.6.4.2 Differentiaalinen pyyhkäisykalorimetria
Katso liitettä.
1.6.5 Jähmettymispisteen määritys
Katso liitettä.
2. TIEDOT
Joissakin tapauksissa lämpömittarin korjaus on tarpeen.
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
käytetty menetelmä, |
|
— |
aineen tarkka spesifikaatio (tunnistustiedot, epäpuhtaudet) ja mahdolliset esipuhdistukset, |
|
— |
arvio tarkkuudesta. |
Sulamislämpötilana raportoidaan vähintään kahden arvioidulla tarkkuusalueella (katso taulukoita) olevan mittauksen keskiarvo.
Jos sulamisen alku- ja loppulämpötilan ero on menetelmän tarkkuusrajojen sisällä, sulamislämpötilana raportoidaan sulamisen loppuvaiheen lämpötila. Muussa tapauksessa molemmat lämpötilat raportoidaan.
Jos aine hajoaa tai höyrystyy ennen sulamislämpötilaa, raportoidaan lämpötila, jossa hajoaminen tai höyrystyminen on tapahtunut.
Raporttiin tulee sisällyttää myös kaikki tiedot ja huomautukset, joilla on merkitystä tulosten tulkinnan kannalta, erityisesti epäpuhtauksien ja aineen fysikaalisen olomuodon osalta.
4. VIITTEET
|
(1) |
OECD, Paris, 1981, Test Guideline 102, Decision of the Council C(81) 30 Final. |
|
(2) |
UIPAC, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London, 1975, vol. II, 803-834. |
|
(3) |
R. Weissberger ed.: Technique of organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed, Interscience Publ., New York, 1959, vol. I, Part I, Chapter VII. |
|
(4) |
UICPA, Physiochemical measurements: Catalogue of reference materials from national laboratories, Pure and applied chemistry, 1976, vol. 48, 505–515. |
Liite
Lisää teknisiä tietoja on seuraavissa standardeissa.
1. Kapillaarimenetelmät
1.1 Nestehauteella varustetut sulamislämpötilalaitteet
|
ASTM E 324-69 |
Standard test method for relative initial and final melting points and the melting range of organic chemicals |
|
BS 4634 |
Method for the determination of melting point and/or melting range |
|
DIN 53181 |
Bestimmung des Schmelzintervalles von Harzen nach Kapillarverfahren |
|
JIS K 00-64 |
Testing methods for melting point of chemical products. |
1.2 Metallikappaleeseen perustuvat sulamislämpötilalaitteet
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
|
ISO 1218 (E) |
Plastics — polyamides — determination of ’melting point’ |
2. Kuuma-alustat
2.1 Koflerin kuumasauva
|
ANSI/ASTM D 3451-76 |
Standard recommended practices for testing polymeric powder coatings |
2.2 Sulamismikroskooppi
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
2.3 Meniskimenetelmä (polyamidit)
|
ISO 1218 (E) |
Plastics — polyamides — determination of ’melting point’ |
|
ANSI/ASTM D 2133-66 |
Standard specification for acetal resin injection moulding and extrusion materials |
|
NF T 51-050 |
Résines de polyamides. Détermination du ’point de fusion’. méthode du ménisque. |
3. Jäätymislämpötilan määritysmenetelmät
|
BS 4633 |
Method for the determination of crystallizing point |
|
BS 4695 |
Method for Determination of Melting Point of petroleum wax (Cooling Curve) |
|
DIN 51421 |
Bestimmung des Gefrierpunktes von Flugkraftstoffen, Ottokraftstoffen und Motorenbenzolen |
|
ISO 2207 |
Cires de pétrole: détermination de la température de figeage |
|
DIN 53175 |
Bestimmung des Erstarrungspunktes von Fettsäuren |
|
NF T 60-114 |
Point de fusion des paraffines |
|
NF T 20-051 |
Méthode de détermination du point de cristallsation (point de congélation) |
|
ISO 1392 |
Method for the determination of the freezing point |
4. Terminen analyysi
4.1 Terminen differentiaalianalyysi
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
4.2 Differentiaalinen pyyhkäisykalorimetria
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
5. Jähmettymispisteen määritys
|
NBN 52014 |
Echantillonnage et analyse des produits du pétrole: point de trouble et point d'ecoulement limite — Monsterneming en ontleding van aardolieproducten: Troebelingspunt en vloeipunt |
|
ASTM D 97-66 |
Standard test method for pour point of petroleum oils |
|
ISO 3016 |
Petroleum oils — Determination of pour point. |
A.2 KIEHUMISLÄMPÖTILA
1. MENETELMÄ
Tässä kuvattavat menetelmät perustuvat pääosin OECD:n testiohjeisiin (1). Perusperiaatteet kuvataan viitteissä (2) ja (3).
1.1 JOHDANTO
Tässä kuvattuja menetelmiä ja laitteita voidaan soveltaa nesteiden ja matalissa lämpötiloissa sulavien aineiden kiehumispisteen määritykseen, edellyttäen että aineissa ei tapahdu kemiallisia reaktioita ennen kiehumista (esimerkiksi itsehapettumista, rakennemuutoksia, hajoamista tms.). Menetelmät soveltuvat sekä puhtaisiin että epäpuhtaisiin nestemäisiin aineisiin.
Päähuomion kohteena ovat valokennoilmaisimiin ja termiseen analyysiin perustuvat menetelmät, koska näiden menetelmien avulla voidaan määrittää sekä sulamis- että kiehumislämpötila. Lisäksi mittaukset voidaan suorittaa automaattisesti.
Ns. dynaamisen menetelmän etu on se, että menetelmää voidaan käyttää höyrynpaineen määritykseen. Tällöin kiehumislämpötilaa ei tarvitse korjata normaaliin paineeseen (101,325 kPa), koska normaalipainetta voidaan mittauksen aikana säätää painekytkimen avulla.
Huomautuksia:
Epäpuhtauksien vaikutus kiehumislämpötilan määritykseen vaihtelee huomattavasti niiden luonteen mukaan. Jos näyte sisältää haihtuvia epäpuhtauksia, jotka voivat vaikuttaa tulokseen, aine voidaan puhdistaa.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Määritelmän mukaan normaali kiehumislämpötila on lämpötila, jossa nesteen höyrynpaine on 101,325 kPa.
Jos kiehumislämpötilaa ei mitata normaalissa ilmakehän paineessa, lämpötilan riippuvuus höyrynpaineesta voidaan esittää Clausius-Clapeyronin yhtälön avulla:

jossa:
|
p |
= |
aineen höyrynpaine (Pa) |
|
Δ Hv |
= |
höyrystymislämpö (J mol-1) |
|
R |
= |
yleinen molaarinen kaasuvakio (8,314 J mol-1 K-1) |
|
T |
= |
termodynaaminen lämpötila (K) |
Kiehumislämpötilan rekisteröinnissä otetaan huomioon mittauksen aikana vallitseva ympäristön paine.
Muunnokset:
Paine (yksikkö: kPa)
|
100 kPa |
= |
0,1 bar = 0,1 MPa (yksikköä bar (baari) saa edelleen käyttää, mutta sitä ei suositella) |
|
133 Pa |
= |
1 mmHg = 1 Torr (yksiköitä mmHg ja Torr ei saa käyttää) |
|
1 atm |
= |
normaali-ilmakehä = 101 325 Pa (yksikköä atm ei saa käyttää) |
Lämpötila (yksikkö: K)
t = T - 273,15
|
t |
: |
Celsius-lämpötila, Celsius-asteina ( oC) |
|
T |
: |
termodynaaminen lämpötila, kelvineinä (K) |
1.3 VERTAILUAINEET
Uutta ainetta tutkittaessa ei aina tarvitse käyttää vertailuaineita. Vertailuaineita käytetään lähinnä menetelmän toimivuuden ajoittaiseen tarkistamiseen ja verrattaessa tuloksia muiden menetelmien avulla saatuihin tuloksiin.
Liitteessä kuvattavissa menetelmissä mainitaan joitakin kalibrointiaineita.
1.4 TESTIMENETELMÄN PERIAATTEET
Kiehumislämpötilan (kiehumisalueen) määritysmenetelmistä viisi perustuu kiehumislämpötilan mittaamiseen ja kaksi termiseen analyysiin.
1.4.1 Ebulliometrimenetelmä
Ebulliometrit kehitettiin alun perin molekyylipainon määritykseen kiehumispisteen kohoamisen avulla, mutta niitä voidaan myös käyttää tarkan kiehumislämpötilan määritykseen. Standardissa ASTM D 1120-72 (katso liitettä) kuvataan yksinkertainen laitteisto, jolla neste kuumennetaan tasapaino-olosuhteissa kiehumispisteeseen.
1.4.2 Dynaaminen menetelmä
Mitataan höyryn jälleenlauhtumislämpötila pitämällä tarkoitukseen soveltuvaa lämpömittaria höyryn palautusvirrassa nesteen kiehuessa. Tämä menetelmä sallii paineen vaihtelun.
1.4.3 Tislausmenetelmä
Neste tislataan ja höyryn jälleenlauhtumislämpötila sekä tisleen määrä mitataan.
1.4.4 Siwoloboffin menetelmä
Näyte kuumennetaan putkiottimessa, joka upotetaan kuumahauteen nesteeseen. Putkiottimeen pannaan suljettu kapillaari, jonka alaosassa on ilmakupla.
1.4.5 Valokennomenetelmä
Tehdään automaattisia valosähköisiä mittauksia nousevien ilmakuplien avulla Siwoloboffin menetelmän mukaan.
1.4.6 Differentiaaliterminen analyysi
Tämän tekniikan avulla voidaan rekisteröidä näytteen ja vertailuaineen lämpötilaero lämpötilan funktiona, kun näytettä ja vertailuainetta käsitellään saman valvotun lämpötilaohjelman mukaan. Kun näytteessä tapahtuu entalpiamuutoksen sisältävä olomuodon muutos, muutos näkyy endotermisenä (kiehuminen) poikkeamana lämpötilakäyrän perusviivasta.
1.4.7 Differentiaalinen pyyhkäisykalorimetria
Tämän tekniikan avulla voidaan rekisteröidä näytteen ja vertailuaineen energianottoero lämpötilan funktiona, kun näytettä ja vertailuainetta käsitellään saman valvotun lämpötilaohjelman mukaan. Tämä energiaero on energiamäärä, joka tarvitaan pienentämään näytteen ja vertailuaineen lämpötilaero nollaan. Kun näytteessä tapahtuu entalpiamuutoksen sisältävä olomuodon muutos, muutos näkyy endotermisenä (sulaminen) poikkeamana lämpövirran perusviivasta.
1.5 LAATUKRITEERIT
Kiehumislämpötilan ja kiehumisalueen määritykseen tarkoitettujen menetelmien soveltuvuus ja tarkkuus kuvataan taulukossa 1.
Taulukko 1
Menetelmien vertailu
|
Mittausmenetelmä |
Arvioitu tarkkuus |
Nykyinen standardi |
|
Ebullioometri |
ASTMD 1120-720 (5) |
|
|
Dynaaminen menetelmä |
±0,5 K (enintään 600 K) (6) |
|
|
Tislausprosessi (kiehumisalue) |
±0,5 K (enintään 600 K) |
ISO/R 918, DIN 53171, BS 4591/71 |
|
Siwoloboffin menetelmä |
± 2 K (enintään 600 K) (6) |
|
|
Valokennomenetelmä |
±0,3 K (enintään 373 K) (6) |
|
|
Differentiaaliterminen analyysi |
±0,5 K (enintään 600 K) ±2,0 K (enintään 1 273 K) |
ASTM E 537-76 |
|
Differentiaalinen pyyhkäisykalorimetria |
±0,5 K (enintään 600 K) ±2,0 K (enintään 1 273 K) |
ASTM E 537-76 |
1.6 MENETELMÄKUVAUKSET
Joidenkin testimenetelmien työjärjestys on kuvattu kansainvälisissä ja kansallisissa standardeissa (katso liitettä).
1.6.1 Ebulliometrimenetelmä
Katso liitettä.
1.6.2 Dynaaminen menetelmä
Katso testimenetelmää A4, höyrynpaineen määritys.
Rekisteröidään havaittu kiehumislämpötila 101,325 kPa:n paineessa.
1.6.3 Tislausmenetelmä
Katso liitettä.
1.6.4 Siwoloboffin menetelmä
Näyte pannaan putkiottimeen, jonka halkaisija on noin 5 mm (kuva 1). Putkiotinta kuumennetaan sulamislaitteella.
Kuvassa 1 on lasista valmistettu standardisoitu sulamis- ja kiehumislämpötilalaite (JIS K 0064). Kaikki mitat ovat millimetreinä.
Kuva 1

Kapillaariputki (kiehumiskapillaari), joka on suljettu noin 1 cm alareunan yläpuolelta, asetetaan putkiottimeen. Näytettä lisätään niin paljon, että kapillaariputken suljettu osa on nestepinnan alapuolella. Kiehumiskapillaarin sisältävä putkiotin kiinnitetään lämpömittariin kuminauhan avulla tai tuetaan sivulta muulla tavoin (katso kuva 2).
|
Kuva 2 Siwoloboffin periaate |
Kuva 3 Muunneltu periaate |
|
|
|
Haudeneste valitaan mitattavan kiehumislämpötilan mukaan. Mitattaessa alle 573 K:n lämpötiloja voidaan käyttää silikoniöljyä. Parafiiniöljyä voidaan käyttää vain 473 K:iin asti. Alussa haudenestettä kuumennetaan siten, että lämpötila nousee 3 K/min. Kuumentamisen aikana nestettä on hämmennettävä. Kun lämpötila on noin 10 K odotetun kiehumispisteen alapuolella, kuumennusta hidastetaan, niin että lämpötila nousee alle 1 K/min. Kun lämpötila on saavuttanut kiehumispisteen, kiehumiskapillaarista alkaa nopeasti nousta kuplia.
Kiehumislämpötila on lämpötila, jossa kuplien nousu lakkaa ja neste alkaa nousta nopeasti kapillaariputkessa hetkellisen jäähdyttämisen seurauksena. Lämpömittarin lukema osoittaa tällöin näytteen kiehumislämpötilaa.
Muunnetun periaatteen mukaan (kuva 3) kiehumispiste määritetään sulamislämpötilakapillaarin avulla. Kapillaariputkeen imetään näytettä, kunnes näytepatsaan korkeus kapillaarissa on noin 2 cm (a). Kapillaariputken kapea pää suljetaan sulattamalla ja pieni ilmakupla jätetään ääripäähän. Kun putkea kuumennetaan sulamislämpötilalaitteessa (b), ilmakupla laajenee. Kiehumislämpötila on se lämpötila, jossa näytteen muodostama tulppa saavuttaa haudenesteen pinnan (c).
1.6.5 Valokennomenetelmä
Tässä menetelmässä kuumennettava näyte on metallikappaleeseen asetetussa kapillaariputkessa.
Metallikappaleen reikien kautta johdetaan valonsäde näytteen läpi tarkasti kalibroituun valokennoon.
Kun näytteen lämpötila nousee, kiehumiskapillaarista nousee yksittäisiä kuplia. Kun kiehumislämpötila saavutetaan, kuplien määrä lisääntyy huomattavasti. Tämä aiheuttaa muutoksen valokennon rekisteröimässä valon intensiteetissä. Valokennosta lähtee pysäytyssignaali osoitinlaitteeseen, joka lukee metallikappaleessa sijaitsevan platinavastuslämpömittarin lukeman.
Tämä menetelmä on erityisen käytännöllinen, koska sillä voidaan tehdä määrityksiä kylmissä lämpötiloissa — jopa 253,15 K:ssa (–20 oC:ssa) asti — ilman laitteeseen tehtäviä muutoksia. Riittää, kun laite asetetaan jäähdytyshauteeseen.
1.6.6 Terminen analyysi
1.6.6.1 Differentiaaliterminen analyysi
Katso liitettä.
1.6.6.2 Differentiaalinen pyyhkäisykalorimetria
Katso liitettä.
2. TIEDOT
Kun poikkeamat normaalipaineesta ovat pieniä (enintään ± 5 kPa), kiehumislämpötilat normalisoidaan Tn:ään Sidney Youngin yhtälön avulla:
Tn = T + (fTxΔp)
jossa:
|
Δp |
= |
(101,325 - p) [huomaa etumerkki] |
|
p |
= |
paine (kPa) |
|
fT |
= |
kiehumislämpötilan muutos paineen funktiona (K/kPa) |
|
T |
= |
mitattu kiehumislämpötila (K) |
|
Tn |
= |
normaalipaineeseen korjattu kiehumislämpötila (K). |
Lämpötilan korjausvakiot (fT) ja yhtälöt näiden vakioiden likiarvojen laskemista varten sisältyvät monien aineiden kohdalla edellä mainittuihin kansainvälisiin ja kansallisiin standardeihin.
Esimerkiksi DIN 53171 -menetelmä mainitsee seuraavat karkeat korjaukset maaleissa käytettävien liuottimien osalta:
Taulukko 2
Lämpötilat ja vastaavat korjauskertoimet fT
|
Lämpötila T (K) |
Korjauskerroin fT (K/kPa) |
|
323,15 |
0,26 |
|
348,15 |
0,28 |
|
373,15 |
0,31 |
|
398,15 |
0,33 |
|
423,15 |
0,35 |
|
448,15 |
0,37 |
|
473,15 |
0,39 |
|
498,15 |
0,41 |
|
523,15 |
0,44 |
|
548,15 |
0,45 |
|
573,15 |
0,47 |
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
käytetty menetelmä, |
|
— |
aineen tarkka spesifikaatio (tunnistustiedot, epäpuhtaudet) ja mahdolliset esipuhdistukset, |
|
— |
arvio tarkkuudesta. |
Kiehumislämpötilana raportoidaan vähintään kahden, arvioidun tarkkuusalueen (katso taulukoita) sisällä olevan mittauksen keskiarvo.
Ilmoitetaan mitatut kiehumislämpötilat ja näiden keskiarvo. Mittaushetkellä vallinnut paine ilmoitetaan kilopascaleina (kPa). Paineen tulisi olla lähellä normaalia ilmakehän painetta.
Raporttiin tulee sisällyttää myös kaikki tiedot ja huomautukset, joilla on merkitystä tulosten tulkinnan kannalta, erityisesti epäpuhtauksien ja aineen fysikaalisen olomuodon osalta.
4. VIITTEET
|
(1) |
OECD, Paris, 1981, Test Guideline 103, Decision of the Council C(81) 30 Final. |
|
(2) |
UICPA, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London, 1975, vol. II. |
|
(3) |
R. Weissberger ed.: Technique of organic chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, vol. I, Part I, Chapter VIII. |
Liite
Lisää teknisiä tietoja on seuraavissa standardeissa.
1. Ebulliometri
|
ASTM D 1120-72 |
Standard test method for boiling point of engine anti-freezes |
2. Tislausprosessi (kiehumisalue)
|
ISO/R 918 |
Test Method for Distillation (Distillation Yield and Distillation Range) |
|
BS 4349/68 |
Method for determination of distillation of petroleum products |
|
BS 4591/71 |
Method for the determination of distillation characteristics |
|
DIN 53171 |
Lösungsmittel für Anstrichstoffe, Bestimmung des Siedeverlaufes |
|
NF T 20-608 |
Distillation: détermination du rendement et de l'intervalle de distillation |
3. Differentiaaliterminen analyysi ja differentiaalinen pyyhkäisykalorimetria
|
ASTM F 537 76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definition of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse: Begriffe |
A.3 SUHTEELLINEN TIHEYS
1. MENETELMÄ
Tässä kuvattavat menetelmät perustuvat pääosin OECD:n testiohjeisiin (1). Perusperiaatteet kuvataan viitteessä (2).
1.1 JOHDANTO
Tässä kuvattavia suhteellisen tiheyden määritysmenetelmiä voidaan soveltaa kiinteisiin ja nestemäisiin aineisiin, ilman rajoituksia aineiden puhtauden suhteen. Luettelo menetelmistä on taulukossa 1.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Kiinteiden ja nestemäisten aineiden suhteellinen tiheys (D4 20) ilmaisee tutkittavan aineen (t = 20 oC) tilavuuden massan ja saman vesimäärän (t = 4 oC) massan suhteen. Suhteellisella tiheydellä ei ole yksikköä.
Aineen tiheys ρ on sen massan (m) ja tilavuuden (v) suhde.
Tiheys ρ ilmaistaan SI-yksikköinä kg/m3.
1.3 VERTAILUAINEET
Uutta ainetta tutkittaessa ei aina tarvitse käyttää vertailuaineita. Vertailuaineita käytetään lähinnä menetelmän toimivuuden ajoittaiseen tarkistamiseen ja verrattaessa tuloksia muiden menetelmien avulla saatuihin tuloksiin.
1.4 TESTIMENETELMIEN PERIAATTEET
Käytössä on neljä menetelmäluokkaa.
1.4.1 Nesteeseen perustuvat menetelmät
1.4.1.1 Hydrometri (nestemäiset aineet)
Nesteen tiheys voidaan määrittää nopeasti ja tyydyttävän tarkasti kelluvan hydrometrin avulla, jonka asteikosta voidaan lukea uppoamissyvyyteen perustuva tiheyslukema.
1.4.1.2 Hydrostaattinen vaaka (nestemäiset ja kiinteät aineet)
Aineen tiheys voidaan määrittää punnitsemalla näyte ensin ilmassa ja sen jälkeen sopivassa nesteessä (esimerkiksi vedessä).
Kiinteiden aineiden kohdalla mitattu tiheys on edustava vain kyseisen näytteen osalta. Nesteiden tiheys määritetään siten, että tunnettu tilavuus (v) punnitaan ensin ilmassa ja sen jälkeen nesteessä.
1.4.1.3 Uppokappalemenetelmä (nestemäiset aineet) (4)
Tässä menetelmässä nesteen tiheys määritetään kahden punnitustuloksen eron perusteella. Kun näyte on ensin punnittu, siihen upotetaan kappale, jonka tilavuus on tunnettu, ja punnitus toistetaan.
1.4.2 Pyknometrimenetelmät
Erimuotoisia pyknometrejä, joiden tilavuus on tunnettu, voidaan käyttää kiinteiden ja nestemäisten aineiden tiheyksien määritykseen. Tiheys lasketaan täyden ja tyhjän pyknometrin painoeron ja sen tunnetun tilavuuden perusteella.
1.4.3 Kaasuvertailupyknometri (kiinteät aineet)
Kaasuvertailupyknometrin avulla voidaan mitata minkä tahansa aineen tiheys huoneenlämpötilassa, olipa aineen muoto mikä tahansa. Aineen tilavuus mitataan ilmassa tai inerttikaasussa sylinterissä, jonka tilavuus on muutettavissa ja kalibroitu. Tiheyden laskemista varten mitataan tilavuusmittauksen jälkeen aineen massa.
1.4.4 Oskilloiva densitometri (5) (6) (7)
Tämän laitteen avulla voidaan mitata nesteen tiheys. U-putken muotoinen mekaaninen oskillaattori asetetaan värähtelemään oskillaattorin resonanssitaajuudella, joka määräytyy oskillaattorin massan mukaan. Kun oskillaattoriin pannaan näyte, resonanssitaajuus muuttuu. Laitteen kalibroinnissa käytetään kahta nestemäistä ainetta, joiden tiheys tunnetaan. Kalibrointiaineet valitaan siten, että niiden tiheydet kattavat mitattavan alueen.
1.5 LAATUKRITEERIT
Jäljempänä olevassa taulukossa esitetään suhteellisen tiheyden määritysmenetelmien soveltuvuus eri tarkoituksiin.
1.6 MENETELMÄKUVAUKSET
Lisätietoja teknisistä yksityiskohdista on mm. liitteessä mainituissa standardeissa.
Testit tulee suorittaa lämpötilassa 20 oC. Vähintään kaksi mittausta vaaditaan.
2. TIEDOT
Katso standardeja.
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
käytetty menetelmä, |
|
— |
aineen tarkka spesifikaatio (tunnistustiedot, epäpuhtaudet) ja mahdolliset esipuhdistukset. |
Suhteellinen tiheys ( ) raportoidaan kohdan 1.2 määrityksen mukaan. Lisäksi on mainittava mitattavan aineen fysikaalinen olomuoto.
) raportoidaan kohdan 1.2 määrityksen mukaan. Lisäksi on mainittava mitattavan aineen fysikaalinen olomuoto.
Raporttiin tulee sisällyttää myös kaikki tiedot ja huomautukset, joilla on merkitystä tulosten tulkinnan kannalta, erityisesti epäpuhtauksien ja aineen fysikaalisen olomuodon osalta.
Taulukko
menetelmien soveltuvuus
|
Mittausmenetelmä |
Tiheys |
Suurin mahdollinen dynaaminen viskositeetti |
Nykyiset standardit |
|||
|
kiinteä aine |
neste |
|||||
|
|
kyllä |
5 Pa s |
ISO 387, ISO 649-2, NF T 20-050 |
||
|
|
|
|
|
||
|
kyllä |
|
|
ISO 1183 (A) |
||
|
|
kyllä |
5 Pa s |
ISO 901 ja 758 |
||
|
|
kyllä |
20 Pa s |
DIN 53217 |
||
|
|
|
|
ISO 3507 |
||
|
kyllä |
|
|
ISO 1183 (B), NF T 20-053 |
||
|
|
kyllä |
500 Pa s |
ISO 758 |
||
|
kyllä |
|
|
DIN 55990 Teil 3, DIN 53243 |
||
|
|
kyllä |
5 Pa s |
|
||
4. VIITTEET
|
(1) |
OECD, Paris, 1981, Test Guideline 109, Decision of the Council C(81) 30 Final. |
|
(2) |
R. Weissberger ed., Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed, Chapter IV, Interscience Publ., New York, 1959, vol. I, Part 1. |
|
(3) |
IUPAC, Recommended reference materials for realisation of physico-chemical properties, Pure and applied chemistry, 1976, vol. 48, 508. |
|
(4) |
Wagenbreth, H., Die Tauchkugel zur Bestimmung der Dichte von Fliissigkeiten, Technisches Messen tm, 1979, vol. 11, 427–430. |
|
(5) |
Leopold, H., Die digitale Messung von Flüssigkeiten, Elektronik, 1970, vol. 19, 297–302. |
|
(6) |
Baumgarten, D., Füllmengenkontrolle bei vorgepackten Erzeugnissen — Verfahren zur Dichteb estimmung bei flüssigen Produkten und ihre praktische Anwendung — Die Pharmazeutische Industrie, 1975, vol. 37, 717–726. |
|
(7) |
Riemann, J., Der Einsatz der digitalen Dichtemessung im Brauereilaboratorium, Brauwissenschaft, 1976, vol. 9, 253–255. |
Liite
Lisää teknisiä tietoja on seuraavissa standardeissa:
1. Nesteeseen perustuvat menetelmät
1.1 Hydrometri
|
DIN 12790, IS0 387 |
Hydrormeter; general instructions |
|
DIN 12791 |
Part I: Density hydrometers; construction, adjustment and use Part II: Density hydrometers; standardized sizes, designation Part III: Use and test |
|
ISO 649-2 |
Laboratory glassware: Density hydrometers for general purpose |
|
NF T 20-050 |
Chemical products for industrial use — Determination of density of liquids — Areometric method |
|
DIN 12793 |
Laboratory glassware: range find hydrometers |
1.2 Hydrostaattinen vaaka
Kiinteät aineet
|
ISO 1183 |
Method A: Methods for determining the density and relative density of plastics excluding cellular plastics |
|
NF T 20-049 |
Chemical products for industrial use — Determination of density and relative density of solids other than powders and cellular products — Hydrostatic balance method |
|
ASTM-D-792 |
Specific gravity and density of plastics by displacement |
|
DIN 53479 |
Testing of plastics and elastomers; determination of density |
Nestemäiset aineet
|
ISO 901 |
ISO 758 |
|
DIN 51757 |
Testing of mineral oils and related materials; determination of density |
|
ASTM D 941-55, ASTM D 1296-67 ja ASTM D 1481-62 |
|
|
ASTM D 1298 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
|
BS 4714 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
1.3 Uppokappalemenetelmät
|
DIN 53217 |
Testing of paints, varnishes and similar coating materials; determination of density; immersed body method |
2. Pyknometriset menetelmät
2.1 Nestemäiset aineet
|
ISO 3507 |
Pycnometers |
|
ISO 758 |
Liquid chemical products; determination of density at 20 oC |
|
DIN 12797 |
Gay-Lussac pycnometer (for non-volatile liquids which are not too viscous) |
|
DIN 12798 |
Lipkin pycnometer (for liquids with a kinematic viscosity of less than 100 × 10-6 m2 s-1 at 15 oC) |
|
DIN 12800 |
Sprengel pycnometer (for liquids as DIN 12798) |
|
DIN 12801 |
Reischauer pycnometer (for liquids with a kinematic viscosity of less than 100 × 10-6 m2 s-1 at 20 oC, applicable in particular also to hydrocarbons and aqueous solutions as well as to liquids with higher vapour pressure, approximately 1 bar at 90 oC) |
|
DIN 12806 |
Hubbard pycnometer (for viscous liquids of all types which do not have a too high vapour pressure, in particular also for paints, varnishes and bitumen) |
|
DIN 12807 |
Bingham pycnometer (for liquids, as in DIN 12801) |
|
DIN 12808 |
Jaulmes pycnometer (in particular for ethanol-water mixture) |
|
DIN 12809 |
Pycnometer with ground-in thermometer and capillary side rube (for liquids which are not too viscous) |
|
DIN 53217 |
Testing of paints, varnishes and similar products; determination of density by pycnometer |
|
DIN 51757 |
Point 7: testing of mineral oils and related materials; determination of density |
|
ASTM D 297 |
Section 15: Rubber products — chemical analysis |
|
ASTM D 2111 |
Method C: Halogenated organic compounds |
|
BS 4699 |
Method for determination of specific gravity and density of petroleum products (graduated bicapillary pycnometer method) |
|
BS 5903 |
Method for determination of relative density and density of petroleum products by the capillary — stoppered pycnometer method |
|
NF T 20-053 |
Chemical products for industrial use — Determination of density of solids in powder and liquids — Pycnometric method |
2.2 Kiinteät aineet
|
ISO 1183 |
Method B: Methods for determining the density and relative density of plastics excluding cellular plastics |
|
NF T 20-053 |
Chemical products for industrial use — Determination of density of solids in powder and liquids — Pycnometric method |
|
DIN 19683 |
Determination of the density of soils |
3. Kaasuvertailupyknometri
|
DIN 55990 |
Part 3: Prüfung von Anstrichstoffen und ähnlichen Beschichtungsstoffen; Pulverlack; Bestimmung der Dichte |
|
DIN 53243 |
Anstrichstoffe; Chlorhaltige Polymere; Prüfung |
A.4 HÖYRYNPAINE
1. MENETELMÄ
Tässä kuvatut menetelmät perustuvat pääosin OECD:n testiohjeisiin (1). Perusperiaatteet kuvataan viitteissä (2) ja (3).
1.1 JOHDANTO
On suositeltavaa ensin selvittää tutkittavan aineen rakenne, sulamislämpötila ja kiehumislämpötila.
Koska koko höyrynpainealuetta kattavaa yksittäistä mittausmenetelmää ei ole, seuraavassa suositellaan useita eri menetelmiä, joita voidaan käyttää höyrynpainealueella < 10-4 – 105 Pa.
Epäpuhtaudet vaikuttavat yleensä höyrynpaineeseen, Vaikutuksen voimakkuus vaihtelee epäpuhtauden laadun mukaan.
Jos näyte sisältää haihtuvia epäpuhtauksia, jotka voivat vaikuttaa tulokseen, aine voidaan puhdistaa. Joissakin tapauksissa on suositeltavaa ilmoittaa teknisen aineen höyrynpaine.
Joissakin kuvatuissa menetelmissä käytetään metalliosia sisältäviä laitteita, mikä on otettava huomioon syövyttävien aineiden testauksissa.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Määritelmän mukaan aineen höyrynpaine on kiinteään tai nestemäiseen aineeseen ylhäältä kohdistuva kyllästyspaine. Termodynaamisen tasapainon vallitessa puhtaan aineen höyrynpaine vaihtelee ainoastaan lämpötilan funktiona.
Höyrynpaineen SI-yksikkö, jota tulee käyttää, on pascal (Pa).
Aiemmin käytetyt yksiköt ja niiden muunnostekijät ovat seuraavat:
|
1 Torr |
= 1,333 x 102 Pa |
|
1 ilmakehä |
= 1,013 x 105 Pa |
|
1 baari (bar) |
= 105 Pa |
Lämpötilan SI-yksikkö on kelvin (K).
Yleinen molaarinen kaasuvakio R on 8,314 J mol-1 K-1.
Lämpötilan ja höyrynpaineen välinen riippuvuus voidaan laskea Clausiuksen ja Clapeyronin yhtälön avulla:

jossa:
|
p |
= |
aineen höyrynpaine (Pa) |
|
ΔHv |
= |
aineen höyrystymislämpö (J mol-1) |
|
R |
= |
yleinen molaarinen kaasuvakio (J mol-1 K-1) |
|
T |
= |
termodynaaminen lämpötila (K) |
1.3 VERTAILUAINEET
Uutta ainetta tutkittaessa ei aina tarvitse käyttää vertailuaineita. Vertailuaineita käytetään lähinnä menetelmän toimivuuden ajoittaiseen tarkistamiseen ja verrattaessa tuloksia muiden menetelmien avulla saatuihin tuloksiin.
1.4 TESTIMENETELMIEN PERIAATTEET
Seuraavassa ehdotetaan höyrynpaineen määritystä varten seitsemää menetelmää, joita voidaan soveltaa höyrynpaineen eri alueilla. Jokainen menetelmä sisältää höyrynpaineen mittaamisen eri lämpötiloissa. Rajoitetulla lämpötila-alueella puhtaan aineen höyrynpaineen logaritmi on suoraan verrannollinen lämpötilan käänteisarvoon.
1.4.1 Dynaaminen menetelmä
Dynaamisessa menetelmässä mitataan tiettyä painetta vastaava kiehumislämpötila.
Suositeltava alue:
103–105 Pa.
Menetelmää on myös suositeltu normaalin kiehumislämpötilan määritykseen. Tällöin yläraja on 600 K.
1.4.2 Staattinen menetelmä
Staattisessa menetelmässä mitataan tiettyä lämpötilaa vastaavaa höyrynpaine suljetussa järjestelmässä, jossa vallitsee termodynaaminen tasapaino. Menetelmä soveltuu kiinteiden ja nestemäisten yksi- tai monikomponenttiaineiden tutkimiseen.
Suositeltava alue:
10–105 Pa.
Menetelmää voidaan huolellisuutta noudattaen käyttää myös alueella 1–10 Pa.
1.4.3 Isoteniskooppi
Tämä standardoitu menetelmä on myös staattinen menetelmä, mutta se ei yleensä sovellu monikomponent-tijärjestelmien tutkimiseen. Lisätietoja on menetelmäkuvauksessa ASTM D-2879-86.
Suositeltava alue:
100–105 Pa.
1.4.4 Effuusiomenetelmä: Höyrynpainevaaka
Ainemäärä, joka aikayksikköä kohti virtaa kennosta tunnetun aukon läpi, määritetään tyhjössä olosuhteissa, joissa aineen paluuvirta on häviävän pieni (esimerkiksi mittaamalla höyrysuihkeen aiheuttaman pulssin vaikutus herkkään vaakaan tai mittaamalla painohäviö).
Suositeltava alue:
10-3–1 Pa.
1.4.5 Effuusiomenetelmä: Painohäviön laskenta tai höyryn talteenkeräys
Menetelmässä mitataan Knudsen-kennosta (4) aikayksikköä kohti virtaavan, höyrymäisen näytteen massa. Virtaus tapahtuu mikroaukon läpi äärityhjössä. Ulos virtaavan höyryn massa saadaan joko määrittämällä kennon painohäviö tai tiivistämällä höyry alhaisessa lämpötilassa, minkä jälkeen höyrystyneen aineen määrä voidaan määrittää kromatografia-analyysilla. Höyrynpaine lasketaan Hertz-Knudsenin yhtälön avulla.
Suositeltava alue:
10-3–1 Pa.
1.4.6 Kaasunkyllästysmenetelmä
Näytteen yli johdetaan inerttiä kantokaasua siten, että näytteen höyry kyllästää kantokaasun. Tunnetun kantokaasun kuljettama ainemäärä voidaan mitata talteenkeräämällä tai suora-analyysitekniikalla. Mittaustuloksen avulla voidaan laskea aineen höyrynpaine määrätyssä lämpötilassa.
Suositeltava alue:
10-4–1 Pa.
Menetelmää voidaan huolellisuutta noudattaen käyttää myös alueella 1–10 Pa.
1.4.7 Pyörivä roottori -menetelmä
Tässä mittarissa varsinainen mittauselementti on pieni teräspallo, joka magneettikentän vaikutuksesta pyörii suurella nopeudella. Kaasun paine voidaan päätellä määrittämällä teräspallon nopeuden pieneneminen paineen vaikutuksesta.
Suositeltava alue:
10-4–0,5 Pa.
1.5 LAATUKRITEERIT
Seuraavassa taulukossa on höyrynpaineen eri määritysmenetelmien vertailu soveltuvuuden, toistettavuuden, uusittavuuden, mittausalueen ja nykyisen standardin suhteen.
Laatukriteerit
|
Mittausmenetelmä |
Aineet |
Arvioitu toistettavuus (7) |
Arvioitu uusittavuus (7) |
Suositettu alue |
Nykyinen standardi |
|||
|
kiinteät aineet |
nestemäiset aineet |
|||||||
|
Alhainen sulamispiste |
kyllä |
enintään 25 % |
enintään 25 % |
103 Pa – 2 × 103 Pa |
— |
||
|
|
|
|
1–5 % |
1–5 % |
2 × 103 Pa – 105 Pa |
— |
||
|
kyllä |
kyllä |
5–10 % |
5–10 % |
10Pa – 105 Pa (8) |
NFT 20-048 (5) |
||
|
kyllä |
kyllä |
5–10 % |
5–10 % |
102 Pa – 105 Pa |
ASTM-D 2879-86 |
||
|
kyllä |
kyllä |
5–20 % |
enintään 50 % |
10-3 Pa – 1 Pa |
NFT 20-047 (6) |
||
|
kyliä |
kyllä |
10–30 % |
— |
10-3 Pa – 1 Pa |
— |
||
|
kyllä |
kyllä |
10–30 % |
enintään 50 % |
10-4 Pa – 1 Pa (8) |
— |
||
|
kyllä |
kyllä |
10– 20 % |
— |
10-4 Pa – 0,5 Pa |
— |
||
1.6 MENETELMÄKUVAUKSET
1.6.1 Dynaaminen mittaus
1.6.1.1 Laite
Tyypillisessä mittauslaitteessa on keittokattila, johon on liitetty lasinen tai metallinen jäähdytin (kuva 1), lämpötilan mittausosa sekä paineensäädin ja painemittari. Piirroksen mukainen tyypillinen mittauslaitteisto on valmistettu lämmönkestävästä lasista, ja siinä on seuraavat osat:
Suuri, osittain kaksoisseinällä varustettu putki, jossa on lasihios, jäähdytin, jäähdytysastia ja sisääntulo.
Putken kiehuntaosassa sijaitsevan, Cottrell-pumpulla varustetun lasisylinterin pinta on murskattua lasia, mikä ehkäisee nesteen ”poukkoilua” kiehunnan aikana.
Lämpötilan mittaukseen käytetään sopivaa lämpötilanilmaisinta (esimerkiksi vastuslämpömittaria, vaippatermoparia), joka upotetaan mittauspisteeseen (kuva 1, osa 5) sopivan sisääntulon (esimerkiksi urospuolisen maadoitusliitoksen) kautta.
Paineensäätimeen ja painemittariin tehdään tarvittavat liitännät.
Pallomainen laajennus, joka toimii tilavuuspuskurina, on liitetty mittalaitteeseen kapillaariputkella.
Keittoastian kuumentamiseen käytetään kuumennuselementtiä (esimerkiksi kasettilämmitintä), joka asetetaan lasilaitteistoon alakautta. Kuumennustehoa säädetään termoparin avulla.
Tarvittava tyhjö (102–105 Pa) saadaan aikaan tyhjöpumpulla.
Paineensäätöä varten tarvittava ilman tai typen mittaus (painealue noin 102–105) ja ilmanvaihto tapahtuvat venttiilin kautta.
Paine mitataan manometrilla.
1.6.1.2 Työjärjestys
Höyrynpaine määritetään mittaamalla näytteen kiehumislämpötila useassa eri paineessa alueella 102–105 Pa. Kun lämpötila pysyy vakiona määrätyssä vakiopaineessa, näytteen katsotaan saavuttaneen kiehumispisteen. Menetelmä ei sovellu vaahtoavien aineiden mittaukseen.
Näyte pannaan puhtaaseen, kuivaan näyteastiaan. Jos näyte ei ole jauheena, mahdolliset ongelmat voidaan yrittää ratkaista kuumentamalla jäähdytysvaippaa. Näyteastian täytön jälkeen laite suljetaan laipan kohdalta ja tehdään kaasunpoisto. Sitten asetetaan alin haluttu paine ja aloitetaan kuumennus. Lämpötilanilmaisin kytketään rekisteröintilaitteeseen.
Järjestelmässä vallitsee tasapaino, kun vakiopaineessa mitattu kiehumislämpötila pysyy vakiona. Kiehumisen aikana on erityisesti vältettävä näytteen ”poukkoilua”. Lisäksi jäähdyttimellä tulee tapahtua täydellinen tiivistyminen. Jos näytteen sulamispiste on alhainen, on varottava lauhduttimen tukkeutumista.
Tasapainopisteen kirjaamisen jälkeen asetetaan uusi, suurempi paine. Mittauksia jatketaan 105 Pa:n paineeseen asti (yhteensä 5–10 mittausta). Tulokset tarkistetaan toistamalla mittaukset laskevassa painejärjestyksessä.
1.6.2 Staattinen mittaus
1.6.2.1 Laite
Laitteessa on näyteastia, näytteen lämpötilaa säätävä kuumennus- ja jäähdytysjärjestelmä sekä paineen asetin ja painemittari. Laitteen periaatepiirrokset ovat kuvissa 2a ja 2b.
Näytekammion (kuva 2a) toiselle puolelle on liitetty tyhjöventtiili ja toiselle puolelle on liitetty painemittarinestettä sisältävä U-putki. U-putken toinen pää on liitetty linjaan, jossa on tyhjöpumppu, typpisylinteri tai ilmaventtiili ja manometri.
U-putken sijasta voidaan käyttää osoitinlaitteella varustettua painemittaria (kuva 2b).
Näytteen lämpötilaa säädetään pitämällä näyteastiaa venttiileineen ja U-putkineen tai painemittareineen hauteessa, jonka lämpötila pidetään vakiona (±0,2 K). Lämpötila mitataan näyteastian ulkopuolelta tai astian sisältä.
Laite evakuoidaan tyhjöpumpulla, jonka tulopuolella on kylmäloukku.
Menetelmässä 2a näytteen höyrynpaine mitataan epäsuorasti nollaosoitinlaitteella. Menetelmä perustuu siihen, että U-putkessa olevan nesteen tiheys muuttuu, jos lämpötilassa tapahtuu suuria muutoksia.
U-putken nollaosoittimia varten voidaan painealueen ja näytteen kemiallisen käyttäytymisen mukaan käyttää silikoninesteitä tai ftalaatteja. Näyte ei saa mainittavassa määrin liueta U-putken nesteeseen tai reagoida sen kanssa.
Manometrissa voidaan käyttää elohopeaa normaalista ilmanpaineesta 102 Pa:iin asti ja silikoninesteitä sekä ftalaatteja painealueella 102–10 Pa. Kuumakalvomanometreja voidaan käyttää jopa alle 10-1 Pa:n paineessa. Käytössä on myös muuntyyppisiä painemittareita alle 102 Pa:n mittauksia varten.
1.6.2.2 Työjärjestys
Ennen mittauksia laitteen kaikki osat (katso kuvaa 2) on puhdistettava ja kuivattava huolella.
Menetelmässä 2a U-putki täytetään valitulla nesteellä, jolle on tehtävä kaasunpoisto korkeassa lämpötilassa ennen mittauksia.
Näytettä pannaan laitteeseen, joka suljetaan. Lämpötilaa lasketaan kaasunpoistoa varten niin paljon, että ilma saadaan ulos. Lämpötilaa ei saa laskea niin paljon, että näytteen koostumus muuttuu (monikomponenttijärjestelmät). Tarvittaessa näytettä voidaan hämmentää, jotta tasapaino saavutettaisiin nopeammin.
Näyte alijäähdytetään käyttäen nestemäistä typpeä (jolloin on varottava ilmankosteuden tai pumppunesteen lauhtumista) tai etanolin ja hiilihappojään seosta. Alhaisen lämpötilan mittauksissa käytetään lämpötilasäädettyä haudetta, johon on kytketty ultrakryometri.
Näyteastian venttiili avataan ja ilma poistetaan ylläpitämällä imua usean minuutin ajan. Venttiili suljetaan ja näytteen lämpötila säädetään alimmalle mitattavalle tasolle. Tarvittaessa ilmanpoisto toistetaan useita kertoja.
Kun näytettä kuumennetaan, höyrynpaine suurenee, mikä vaikuttaa U-putken nestepatsaan tasapainoon. Tämä kompensoidaan päästämällä typpeä tai ilmaa venttiilin kautta laitteeseen, kunnes paineosoittimen nestepatsas palaa nollaan. Tähän vaadittavan paineen lukema voidaan katsoa tarkkuuspainemittarista huoneenlämmössä. Paine vastaa näytteen höyrynpainetta kyseisessä mittauslämpötilassa.
Menetelmä 2b on muuten samanlainen, mutta höyrynpaineen lukema saadaan suoraan,
Höyrynpaineen lämpötilariippuvuus määritetään sopivin välein (yhteensä 5-10 mittauspistettä) haluttuun maksimilämpötilaan asti. Alhaisen lämpötilan mittaukset on toistettava tarkistuksen vuoksi.
Jos toistomittauksista saadut tulokset eivät ole yhteneviä lämpötilan noston aikana saatujen tulosten kanssa, syy voi olla jokin seuraavista:
|
1. |
Näyte sisältää edelleen ilmaa (esimerkiksi aineet, joiden viskositeetti on suuri) tai alhaisessa lämpötilassa kiehuvaa ainetta, joka vapautuu kuumentamisen aikana ja joka voidaan poistaa imemällä alijäähtymisen yhteydessä. |
|
2. |
Jäähdytyslämpötila ei ole tarpeeksi alhainen. Tällöin jäähdytysaineena käytetään nestemäistä typpeä. Jos syy on jokin edellisistä, mittaukset on toistettava. |
|
3. |
Näytteessä tapahtuu kemiallinen reaktio (esimerkiksi hajoaminen tai polymerisoituminen) mitattavalla lämpötila-alueella. |
1.6.3 Isoteniskooppi
Menetelmän kattava kuvaus on viitteessä 7. Mittauslaitteen periaatepiirros on kuvassa 3. Isoteniskooppi soveltuu kohdassa 1.6.2 kuvatun staattisen menetelmän tavoin kiinteiden ja nestemäisten aineiden tutkimiseen.
Nestemäiset näytteet toimivat samalla apumanometrin nesteenä. Isoteniskooppiin lisätään nestettä niin paljon, että manometrin laajennus ja manometrin lyhyempi jalka täyttyvät. Isoteniskooppi liitetään tyhjöjärjestelmään ja siitä poistetaan ilma, minkä jälkeen se täytetään typellä. Tämä toistetaan kaksi kertaa hapenjäännösten poistamiseksi. Täytetty isoteniskooppi asetetaan vaaka-asentoon siten, että näyte leviää ohueksi kerrokseksi laajennuksessa ja manometriosassa (U-osassa). Järjestelmän paine lasketaan arvoon 133 Pa ja näytettä kuumennetaan varovasti, kunnes se alkaa kiehua (näytteeseen liuenneiden kaasujen poisto). Isoteniskoopin asentoa muutetaan niin, että näyte palaa manometrin laajennukseen ja lyhyeen jalkaan täyttäen molemmat. Painetta pidetään yllä kuten kaasunpoistossa: laajennuksen nokkaa kuumennetaan pienen liekin avulla, kunnes näytteestä vapautuu niin paljon höyryä, että näytettä työntyy laajennuksen yläosasta ja manometrin varresta isoteniskoopin manometriosaan, jolloin muodostuu höyrytäytteinen tila, jossa ei ole typpeä.
Tämän jälkeen isoteniskooppi asetetaan hauteeseen, jonka lämpötila on vakio, ja typen painetta säädetään, kunnes se on sama kuin näytteen paine. Paineiden tasapaino voidaan nähdä isoteniskoopin manometriosasta. Tässä tilanteessa typen ja näytteen höyrynpaine on sama.
Kiinteiden aineiden tutkimiseen käytetään jotakin kohdassa 1.6.2.1 mainituista manometrinesteistä mitattavan paine- ja lämpötila-alueen mukaan. Manometrineste, josta on poistettu kaasut, pannaan isoteniskoopin pidemmän varren pullistumaan. Näyte pannaan laajennukseen, ja sille tehdään kaasunpoisto korkeassa lämpötilassa, minkä jälkeen isoteniskooppia kallistetaan, kunnes manometrineste virtaa U-putkeen. Höyrynpaine mitataan lämpötilan funktiona kohdan 1.6.2 mukaan.
1.6.4 Effuusiomenetelmä: Höyrynpainevaaka
1.6.4.1 Laite
Kirjallisuudessa on usean laiteversion kuvaukset (1). Tässä käsiteltävä laite kuvaa menetelmän yleisperiaatetta (kuva 4). Kuvassa 4 ovat laitteen pääosat: ruostumattomasta teräksestä tai lasista valmistettu tyhjöastia, tyhjön tuottamiseen ja mittaamiseen tarkoitetut laitteet sekä sisäänrakennetut osat höyrynpaineen mittaamiseksi vaa'alla. Laite sisältää seuraavat osat:
|
— |
Laipalla ja pyörivällä sisääntulolla varustettu haihdutinuuni, joka on valmistettu sylinterin muotoon esimerkiksi kuparista tai kemikaaleja kestävästä seoksesta, jonka lämmönjohtavuus on hyvä. Kupariseinällä varustettua lasiastiaa voidaan myös käyttää. Uunin läpimitta on 3–5 cm ja korkeus 2–5 cm. Höyryvirtaa varten on 1-3 erikokoista aukkoa. Kuumennus tehdään uunin alla sijaitsevalla kuumennuslevyllä tai uunia ympäröivällä kuumennuskierukalla. Lämmön johtuminen aluslevyyn on estetty liittämällä kuumennin aluslevyyn metallilla, jonka lämmönjohtavuus on heikko (nikkelihopealla tai krominikkeliteräksellä), esimerkiksi nikkelihopeaputkella, joka on liitetty pyörivään tuloliitäntään (tämä edellyttää sitä, että käytetään moniaukkoista uunia. Tällaisen järjestelyn etuna on mahdollisuus panna uuniin kuparitanko, jolla voidaan hoitaa jäähdytys ulkopuolelta jäähdytyshauteiden avulla. |
|
— |
Sijoittamalla kupariuunin kanteen kolme erikokoista aukkoa 90 asteen kulmaan toisiinsa nähden saadaan mahdollisuus mitata erilaisia höyrynpaineita mitta-alueen sisällä (aukkojen halkaisija noin 0,30-4,50 mm). Suuret aukot ovat alhaisia höyrynpaineita ja pienet aukot suuria höyrynpaineita varten. Uunia pyörittämällä höyryvirtaan voidaan asettaa haluttu aukko tai väliasento (uunin aukko — suoja — vaakakuppi), ja näin molekyylivirta joko pääsee uunin aukon läpi vaakakupille tai molekyylivirran pääsy vaakakupille on estetty. Näytteen lämpötila mitataan sopivaan pisteeseen asetetulla termoparilla tai vastuslämpömittarilla. |
|
— |
Suojan yläpuolella on erittäin herkkään mikrovaakaan kuuluva vaakakuppi (lisätietoja on jäljempänä), jonka läpimitta on noin 30 mm. Vaakakupin aineeksi suositellaan kultapäällysteistä alumiinia. |
|
— |
Vaakakuppia ympäröi sylinterinmuotoinen messingistä tai kuparista tehty jäähdytyslaatikko. Vaakatyypin mukaan siinä on aukot vaa'an palkkia varten ja suojan aukko molekyylivirtaa varten. Jäähdytyslaatikon tulisi taata höyryn täydellinen tiivistyminen vaakakupille. Lämmön johtuminen ulkopuolelle tapahtuu esimerkiksi jäähdytyslaatikkoon liitetyn kuparitangon kautta. Tanko kulkee aluslevyn kautta, ja se on eristetty siitä termisesti esimerkiksi krominikkeliteräsputken avulla. Tanko pannaan Dewar-astiaan, jonka aluslevyn alla on nestemäistä typpeä (vaihtoehtoisesti nestemäistä typpeä kierrätetään tangon läpi). Täten jäähdytyslaatikon lämpötila pysyy - 120 oC:een tuntumassa. Vaakakupin jäähdytys tapahtuu vain säteilyn avulla, ja vaakakuppi on sopiva paineiden mittaukseen tutkittavalla alueella (jäähdytys aloitetaan noin tunti ennen mittauksia). |
|
— |
Vaaka sijaitsee jäähdytyslaatikon yläpuolella. Sopivia vaakoja ovat esimerkiksi kaksivartinen elektroninen mikrovaaka (8) tai erittäin herkkä kiertokäämimittauslaite (katso OECD:n testiohjetta 104, 12.5.81). |
|
— |
Aluslevyssä on myös sähköiset liitännät termopareja tai vastuslämpömittareita ja kuumennuskäämiä varten. |
|
— |
Astiaan imetään tyhjö alipaine- tai tyhjöpumpulla (tarvittava tyhjö on noin 1-2 × 10-3 Pa, mikä vaatii kahden tunnin pumppauksen). Painetta säädetään sopivan ionisaatiomanometrin avulla. |
1.6.4.2 Työjärjestys
Astia täytetään näytteellä ja kansi suljetaan. Suoja ja jäähdytyslaatikko työnnetään uunin läpi. Laite suljetaan ja tyhjöpumput käynnistetään. Mittaukset voidaan aloittaa, kun paine on laskenut noin 10-4 Pa:n tasolle. Jäähdytyslaatikon jäähdytysmekanismi käynnistyy, kun paine on 10-2 Pa.
Kun laitteessa on vaadittava tyhjö, käynnistetään kalibrointisarjat alimmassa vaaditussa lämpötilassa. Kun kannen vastaava aukko avataan, höyryvirta kulkee suojan läpi suoraan aukon yläpuolella ja osuu jäähdytettyyn vaakakuppiin. Vaakakupin on oltava niin suuri, että suojan kautta ohjattu virta osuu siihen kokonaisuudessaan. Höyryvirran momentti toimii voimana vaakakuppia kohti, ja molekyylit tiivistyvät kupin kylmälle pinnalle.
Momentista ja samanaikaisesti tapahtuvasta tiivistymisestä syntyy rekisteröintilaitteeseen signaali. Signaaleja analysoimalla saadaan kahdenlaista tietoa:
|
1 |
Tässä kuvatussa laitteessa höyrynpaine määritetään suoraan vaakakuppiin kohdistuvasta momentista (tätä varten ei tarvita tietoja molekyylipainosta (2)). Geometriset tekijät, kuten uunin aukko ja molekyylivirran kulma, on otettava huomioon lukemien arvioinnissa. |
|
2 |
Samalla voidaan mitata tiivistyneen höyryn massa ja sen perusteella voidaan edelleen laskea haihtumisnopeus. Höyrynpaine voidaan laskea myös haihtumisnopeudesta ja molekyylipainosta Hertzin yhtälön (2) avulla. |
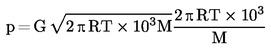
jossa
|
G |
= |
haihtumisnopeus (kg s-1 m-2) |
|
M |
= |
moolimassa (g mol-1) |
|
T |
= |
lämpötila (K) |
|
R |
= |
yleinen molaarinen kaasuvakio (J mol-1 K-1) |
|
p |
= |
höyrynpaine (Pa) |
Kun tyhjö on saavuttanut halutun arvon, mittaukset aloitetaan alimmasta mittauslämpötilasta.
Mittauksia jatketaan nostamalla lämpötilaa vähitellen korkeimpaan haluttuun mittauslämpötilaan asti. Tämän jälkeen näyte jäähdytetään ja mittaukset toistetaan. Jos toinen sarja ei vahvista ensimmäisen sarjan mittaustuloksia, syynä saattaa olla näytteen hajoaminen mitattavalla lämpötila-alueella.
1.6.5 Effuusiomenetelmä: Painohäviön laskenta
1.6.5.1 Laite
Effuusiolaitteen perusosat ovat seuraavat:
|
— |
effuusiokennoja sisältävä säiliö, jonka lämpötila on säädettävissä ja johon saadaan tyhjö, |
|
— |
tyhjömittarilla varustettu tyhjöpumppu (esimerkiksi diffuusiopumppu tai molekyyliahtopumppu), |
|
— |
nestemäiseen typpeen tai hiilihappojäähän perustuva loukku. |
Kuvassa 5 on esimerkkinä sähkölämmitteinen, alumiinirakenteinen tyhjösäiliö, jossa on neljä ruostumattomasta teräksestä valmistettua effuusiokennoa. Teräskalvon paksuus on noin 0,3 mm ja sen effuusioaukon läpimitta on 0,2–1,0 mm. Teräskalvo on kiinnitetty effuusiokennoon kierrekannella.
1.6.5.2 Työjärjestys
Toinen kenno täytetään vertailuaineella ja toinen näytteellä. Aukolla varustettu metallikalvo kiinnitetään kierrekannella ja kumpikin kenno punnitaan 0,1 mg:n tarkkuudella. Kenno pannaan termostaatilla varustettuun säiliöön, joka evakuoidaan yhden kymmenyksen alle odotetun paineen. Määrätyin (5-30 tunnin) välein laitteeseen päästetään ilmaa ja effuusiokennon painohäviö määritetään punnitsemalla.
Kenno on punnittava uudelleen määrätyin välein, jotta voitaisiin todeta, että haihtumisnopeus pysyy vakiona vähintäin kahden aikajakson ajan. Näin varmistetaan, että näytteeseen mahdollisesti sisältyvät haihtuvat epäpuhtaudet eivät vaikuta tulokseen.
Effuusiokennon höyrynpaine lasketaan seuraavan suureyhtälön avulla:
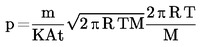
jossa
|
p |
= |
höyrynpaine (Pa) |
|
m |
= |
massa, joka aikajakson t kuluessa poistuu kennosta (kg) |
|
t |
= |
aika (s) |
|
A |
= |
aukon pinta-ala (m2) |
|
K |
= |
korjauskerroin |
|
R |
= |
yleinen molaarinen kaasuvakio (J mol-1 K-1) |
|
T |
= |
lämpötila (K) |
|
M |
= |
molekyylimassa (kg mol-1) |
Korjauskerroin vaihtelee sylinterinmuotoisen aukon pituuden ja säteen keskinäisen suhteen mukaan seuraavasti:
|
Suhde |
0,1 |
0,2 |
0,6 |
1,0 |
2,0 |
|
K |
0,952 |
0,909 |
0,771 |
0,672 |
0,514 |
Yhtälö voidaan kirjoittaa seuraavaan muotoon:
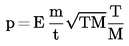
jossa  muodostaen effuusiokennovakion.
muodostaen effuusiokennovakion.
Effuusiokennovakio E voidaan määrittää käyttämällä vertailuaineita (2,9) ja seuraavaa yhtälöä:

jossa
|
p(r) |
= |
vertailuaineen höyrynpaine (Pa) |
|
M(r) |
= |
vertailuaineen molekyylimassa (kg x mol-1) |
1.6.6 Kaasunkyllästysmenetelmä
1.6.6.1 Laite
Kuvassa 6a on tyypillisen laitteen osat (1):
Inertti kaasu
Kantokaasu ei saa reagoida kemiallisesti näytteen kanssa. Yleensä voidaan käyttää typpeä, mutta eräissä tapauksissa on käytettävä muuta kaasua (19). Kaasun on oltava kuivaa (kuva 6a, 4: suhteellisen kosteuden ilmaisin).
Virtausohjaus
Kaasunohjausjärjestelmä valvoo, että virtaus kyllästymiskolonnin läpi pysyy vakiona ja halutussa arvossa.
Höyryloukut
Loukut vaihtelevat näytteen ominaisuuksien ja valitun analyysimenetelmän mukaan. Kaikki höyry on kerättävä talteen myöhemmin tehtävää analyysiä varten. Joillekin näytteille sopii nestettä (esimerkiksi heksaania tai etyleeniglykoolia) sisältävä loukku, toisten kohdalla voi olla parempi käyttää kiinteitä absorbentteja.
Höyryn keräämisen ja tätä seuraavan analyysin vaihtoehtona tunnetun kaasumäärän kuljettama ainemäärä voidaan määrittää myös suora-analyysin (esimerkiksi kromatografian) avulla.
Lämmönvaihdin
Kun mittauksia tehdään eri lämpötiloissa, laitteeseen voidaan lisätä lämmönvaihdin.
Kyllästymiskolonni
Näytettä kaadetaan nesteestä sopivalle inertille alustalle. Päällystetty alusta pakataan kyllästymiskolonniin, jonka mitat ja virtausnopeus valitaan siten, että kantokaasu kyllästyy) täysin. Kyllästymiskolonnissa on oltava lämpötilan säätömekanismi. Kun tehdään mittauksia huoneenlämpötilaa korkeammassa lämpötilassa, näytteen lauhtuminen on estettävä lämmittämällä kyllästymiskolonnin ja loukkujen välistä aluetta.
Diffuusion kautta tapahtuvaa massankuljetusta voidaan vähentää asentamalla kyllästymiskolonnin perään kapillaariputki (kuva 6b).
1.6.6.2 Työjärjestys
Kyllästymiskolonnin valmistelu:
Näytettä ja voimakkaasti haihtuvaa liuotinta sisältävä liuos kaadetaan sopivalle alustalle. Näytettä lisätään sellainen määrä, että sillä varmistetaan kyllästyminen koko testin ajaksi. Liuotin haihdutetaan täysin ilmassa tai pyörivässä haihduttimessa, ja huolella sekoitettu aine lisätään kyllästinkolonniin. Näytteen lämpötila säädetään toivotulle tasolle ja kuivaa typpeä johdetaan laitteen läpi.
Mittaus
Kytketään loukut tai suora-analyysi-ilmaisin kolonnin poistolinjaan ja mitataan aika. Virtausnopeus tarkistetaan testin alussa ja sen jälkeen säännöllisin välein testin aikana kuplavirtausmittarilla (tai jatkuvasti massavirtausmittarilla).
Kyllästimen ulostulon paine mitataan jollakin seuraavista menetelmistä:
|
(a) |
Kyllästimen ja loukkujen väliin lisätään painemittari. (Tämä menetelmä voi olla epätyydyttävä, koska se lisää kuollutta tilaa ja suurentaa adsorptiopintaa.) |
|
(b) |
Tehdään erillinen mittaus, jossa määritetään käytettävän loukkujärjestelmän aiheuttamat paineen laskut virtausnopeuden funktiona. (Tämä menetelmä voi olla nesteloukkujen osalta epätyydyttävä.) |
Näytteen kvantitatiiviseen keräämiseen tarvittava aika eri analyysimenetelmissä määritetään alustavien ajojen tai arvioiden perusteella. Vaihtoehtona näytteen keräämiselle myöhemmin tehtävää analyysiä varten ainemäärä voidaan määrittää myös suora-analyysin (esimerkiksi kromatografian) avulla. Ennen höyrynpaineen määritystä annetussa lämpötilassa on alustavien ajojen avulla löydettävä suurin virtausnopeus, jolla näytehöyry vielä kyllästää kantokaasun täysin. Virtausnopeus on tarpeeksi pieni, kun sen pienentäminen ei enää suurenna höyrynpaineen laskettua arvoa.
Jos käytetään analyyttisiä menetelmiä, menetelmä (esimerkiksi kaasukromatografia tai painoanalyysi) valitaan testattavan aineen luonteen mukaan.
Määritetään tunnetun kantokaasumäärän kuljettama ainemäärä.
1.6.6.3 Höyrynpaineen laskeminen
Höyrynpaine lasketaan höyryn tiheyden (W/V) perusteella seuraavan suureyhtälön mukaan:

jossa:
|
p |
= |
höyrynpaine (Pa) |
|
W |
= |
haihdutetun näytteen massa (g) |
|
V |
= |
kyllästetyn kaasun tilavuus (m3) |
|
R |
= |
yleinen molaarinen kaasuvakio J mol-1 K-1) |
|
T |
= |
lämpötila (K) |
|
M |
= |
näytteen moolimassa (g mol-1) |
Mitatut tilavuudet on korjattava virtausmittarin ja lämpötilasäädetyn kyllästimen välisten paine- ja lämpötilaerojen suhteen. Jos virtausmittari sijaitsee höyryloukusta alavirtaan, voi olla tarpeen ottaa huomioon myös loukun sisältämät höyrystyneet aineet (1).
1.6.7 Pyörivä roottori (8, 11, 13)
1.6.7.1 Laite
Pyörivän roottorin tekniikkaa voidaan soveltaa käyttämällä pyörivään roottoriin perustuvaa viskositeettimittaria (kuva 8). Laitteen periaatepiirros on kuvassa 7.
Tyypillisessä laitteessa on pyörivään roottoriin perustuva mittapää, joka on suljettu lämpötilasäädettyyn tilaan (säätötarkkuus 0,1 oC). Näytesäiliö asetetaan lämpötilasäädettyyn koteloon (säätötarkkuus 0,01 oC), ja järjestelmän kaikkia muita osia pidetään lämmitettyinä tiivistymisen estämiseksi. Järjestelmään on liitetty tyhjöpumppu tyhjöventtiilien avulla.
Mittapäässä on putkeen asetettu teräspallo (halkaisija 4–5 mm). Pallo leijuu stabiloituna magneettikentässä, joka luodaan kestomagneettien ja ohjauskäämien yhdistelmällä.
Pallo pyörii käämien tuottamien pyörivien kenttien vaikutuksesta. Pallon pyörimisnopeus saadaan pallon jatkuvaa heikkoa sivuttaista magnetisointia mittaavien vastaanottokäämien avulla.
1.6.7.2 Työjärjestys
Kun pallo on saavuttanut annetun pyörimisnopeuden v(o) (yleensä noin 400 kierrosta sekunnissa), magnetointi lopetetaan, jolloin pyöriminen hidastuu kaasukitkan vaikutuksesta.
Pyörimisnopeuden pienenemiset mitataan ajan funktiona. Koska magneettisen leijunnan aiheuttama kitka on häviävän pieni kaasukitkaan verrattuna, kaasun paine saadaan seuraavasti:
![]()
jossa
|
|
= |
kaasumolekyylien keskinopeus |
|
r |
= |
pallon säde |
|
p |
= |
pallon massatiheys |
|
σ |
= |
tangentiaalisen momentinsiirron vakio (e = 1, kun pallon pinnan pyöreys on ihanteellinen) |
|
t |
= |
aika |
|
v(t) |
= |
pyörimisnopeus ajan t jälkeen |
|
v(o) |
= |
pyörimisnopeuden alkuarvo |
Yhtälö voidaan myös kirjoittaa seuraavaan muotoon:

jossa tn, tn-1 ilmaisevat annettuun kierrosmäärään N kuluvan ajan. Aikavälit tn ja tn-1 seuraavat toisiaan, ja tn > tn-1.
Kaasumolekyylin keskinopeus c saadaan seuraavan ![]() suureyhtälön mukaan:
suureyhtälön mukaan:

jossa
|
T |
= |
lämpötila |
|
R |
= |
yleinen molaarinen kaasuvakio |
|
M |
= |
moolimassa |
2. TIEDOT
Kaikissa edellä kuvatuissa menetelmissä höyrynpaine määritetään vähintään kahdessa lämpötilassa. Lämpötila-alueella 0–50 oC suositellaan vähintään kolmea mittausta, jotta höyrynpainekäyrän lineaarisuus voitaisiin tarkistaa.
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
käytetty rnenetelmä, |
|
— |
aineen tarkka spesifikaatio (tunnistustiedot, epäpuhtaudet) ja mahdolliset esipuhdistukset, |
|
— |
vähintään kaksi höyrynpaine- ja lämpötila-arvoa, mieluiten alueelta 0–50 oC, |
|
— |
kaikki lähtöarvot, |
|
— |
käyrä, joka kuvaa log p:n muuttumista 1/T:n funktiona, |
|
— |
arvio höyrynpaineesta 20 tai 25 oC:n lämpötilassa. |
Jos aineessa tapahtuu muutoksia (olomuodon muutos, hajoaminen), on lisäksi ilmoitettava:
|
— |
muutoksen luonne, |
|
— |
lämpötila, jossa muutos tapahtui ilmakehän paineessa, |
|
— |
höyrynpaine 10 oC ja 20 oC muutoslämpötilan alapuolella sekä 10 oC ja 20 oC tämän lämpötilan yläpuolella (ellei kyseessä ole muutos kiinteästä olomuodosta kaasuksi). |
Raporttiin tulee sisällyttää myös kaikki tiedot ja huomautukset, joilla on merkitystä tulosten tulkinnan kannalta, erityisesti epäpuhtauksien ja aineen fysikaalisen olomuodon osalta.
4. VIITTEET
|
(1) |
OECD, Paris, 1981, Test Guideline 104, Decision of the Council C(81) 30 final. |
|
(2) |
Ambrose, D. in B. Le Neindre; B. Vodar, (Eds.): Experimental Thermodynamics, Buttenvorths, London, 1975, Vol. II. |
|
(3) |
R. Weissberger ed.: Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed, Chapter IX, Interscience Publ. New York, 1959, Vol. I, Part I. |
|
(4) |
Knudsen, M. Ann Phys. Lpz., 1909, vol. 29, 1979; 1911, vol. 34, 593. |
|
(5) |
NF T 20-048 AFNOR (septembre 1985). Produits chimiques à usage industriel — Détermination de la pression de vapeur des solides et des liquides dans le domaine 10-1 à 105 Pa. Méthode statique. |
|
(6) |
NF T 20-047 AFNOR (septembre 1985). Produits chimiques à usage industriel — Détermination de la pression de vapeur des solides et des liquides dans le domaine 10-3 à 1 Pa. Méthode de la balance de pression de vapeur. |
|
(7) |
ASTM D 2879-86, Standard test method for vapour pressure-temperature relationship and initial decomposition temperature of liquids by isoteniscope. |
|
(8) |
G. Messer, P. Röhl, G. Grosse and W. Jitschin. J. Vac. Sci. Technol.(A), 1987, vol. 5 (4), 2440. |
|
(9) |
Ambrose, D.; Lawrenson, I. J.; Sprake, C. H. S. J. Chem. Thermodynamics 1975, vol. 7, 1173. |
|
(10) |
B. F. Rordorf. Thermochimica Acta, 1985, vol. 85, 435. |
|
(11) |
G. Comsa, J. K. Fremerey anb B. Lindenau. J. Vac. Sci. Technol., 1980, vol. 17 (2), 642. |
|
(12) |
G. Reich. J. Vac. Sci. Technol., 1982, vol. 20 (4), 1148. |
|
(13) |
J. K. Fremerey. J. Vac Sci. Technol.(A), 1985, vol. 3 (3), 1715. |
Liite 1
Arviointimenetelmä
JOHDANTO
Höyrynpaineen laskettuja arvoja voidaan käyttää, kun halutaan
|
— |
päättää, mikä kokeellisista menetelmistä on sopiva, |
|
— |
saada arvio tai raja-arvo tapauksissa, joissa kokeellista menetelmää ei voida käyttää teknisistä syistä (esimerkiksi jos höyrynpaine on hyvin alhainen), |
|
— |
apua sellaisten tapausten tunnistamisessa, joissa kokeellisia mittauksia ei tarvita, koska höyrynpaine huoneenlämmössä on todennäköisesti pienempi kuin 10-5. |
ARVIOINTIMENETELMÄ
Nesteiden ja kiinteiden aineiden höyrynpaine voidaan arvioida muunnetun Watson-korrelaation (a) avulla. Ainoa tarvittava kokeellinen tieto on normaali kiehumispiste. Menetelmää voidaan käyttää painealueella 105–10-5 Pa.
Tarkemmat tiedot menetelmästä on kirjassa Handbook of Chemical Property Estimation Methods (b).
LASKENTA
Höyrynpaine voidaan kirjallisuusviitteen (b) mukaan laskea seuraavan suureyhtälön mukaan:

jossa
|
T |
= lämpötila |
|
Tb |
= normaali kiehumispiste |
|
Pvp |
= höyrynpaine lämpötilassa T |
|
ΔHvb |
= höyrystymislämpö |
|
ΔZb |
= puristuvuustekijä (arvioitu arvo = 0,97) |
|
m |
= empiirinen kerroin, joka vaihtelee fysikaalisen olomuodon mukaan kyseisessä lämpötilassa. |
Lisäksi
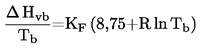
jossa KF on empiirinen vakio, jolla otetaan huomioon aineen polaarisuus. Viitteessä (b) on lueteltu KF-vakiot useille sekoitetyypeille.
Usein on saatavana tietoja kiehumispisteestä alennetussa paineessa. Tällöin höyrynpaine voidaan viitteen (b) mukaan laskea seuraavasti:
jossa T1 on kiehumispiste alennetussa paineessa P1.
RAPORTTI
Kun käytetään laskentamenetelmää, raporttiin tulee sisällyttää yksityiskohtaiset selvitykset laskennasta.
KIRJALLISUUS
|
(a) |
K. M. Watson, Ind. Eng. Chem., 1943, vol. 35, 398. |
|
(b) |
W. J. Lyman, W. F. Reehl, D. H. Rosenblatt. Handbook of Chemical Property Estimation Methods, Mc Graw-Hill, 1982. |
Liite 2
Kuva 1
Laite dynaamisen menetelmän mukaan tehtävää höyrynpainekäyrän määritystä varten.

Kuva 2a
Laite staattisen menetelmän mukaan U-putkimanometrin avulla tehtävää höyrynpainekäyrän määritystä varten.
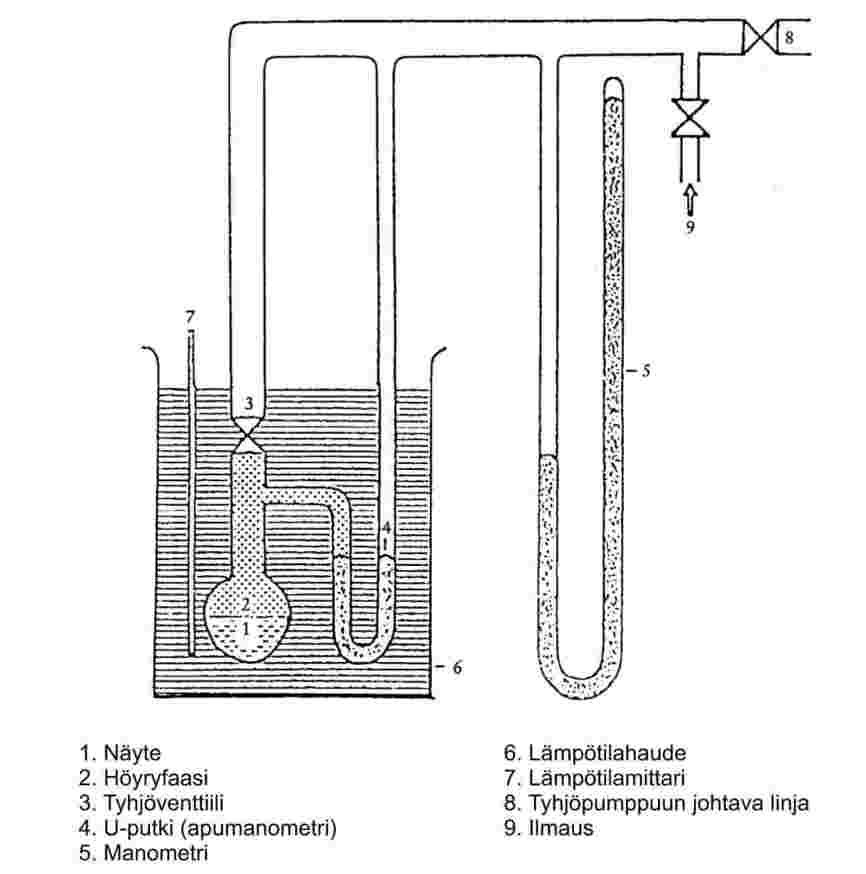
Kuva 2b
Laite staattisen menetelmän mukaan paineenosoittimen avulla tehtävää höyrynpainekäyrän määritystä varten

Kuva 3
Isoteniskooppi (katso viitettä 7)

Kuva 4
Laite höyrynpainevaakaan perustuvan menetelmän mukaan tehtävää höyrynpainekäyrän määritystä varten

Kuva 5
Esimerkki alhaisen paineen effuusiomenetelmän mukaan toimivasta haihdutuslaitteesta, jonka effuusiokennon tilavuus on 8 cm3

Kuva 6a
Esimerkki virtausjärjestelmästä, jolla määritetään höyrynpaine kaasunkyllästysmenetelmän mukaan

Kuva 6b
Esimerkki järjestelmästä, jolla määritetään höyrynpaine kaasunkyllästymismenetelmällä ja jossa on kapillaariputki kyllästyskammion jälkeen

Kuva7
Esimerkki kokeellisesta järjestelystä pyörivän roottorin menetelmää varten
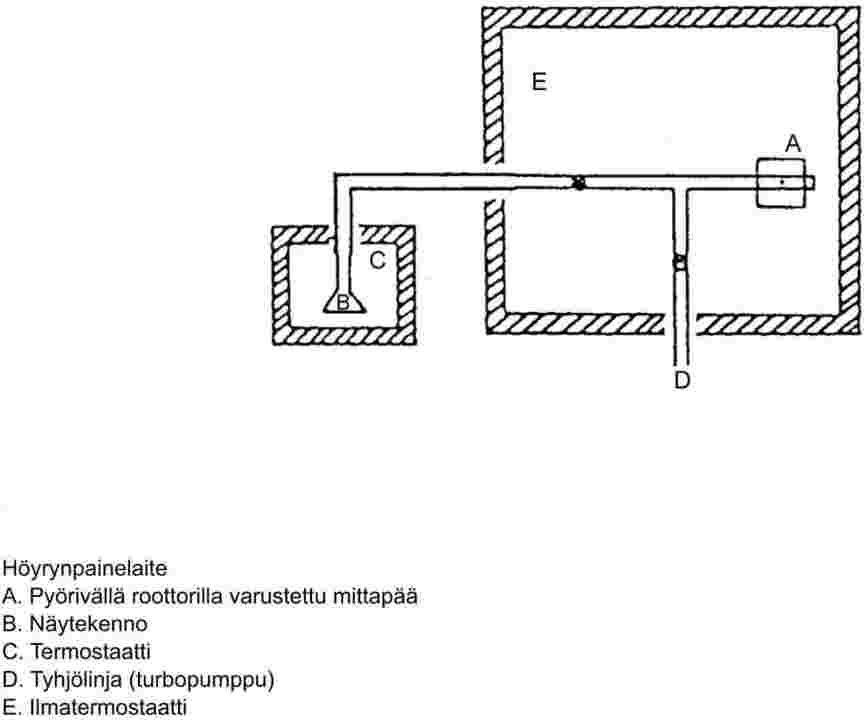
Kuva 8
Esimerkki pyörivällä roottorilla varustetusta mittapäästä
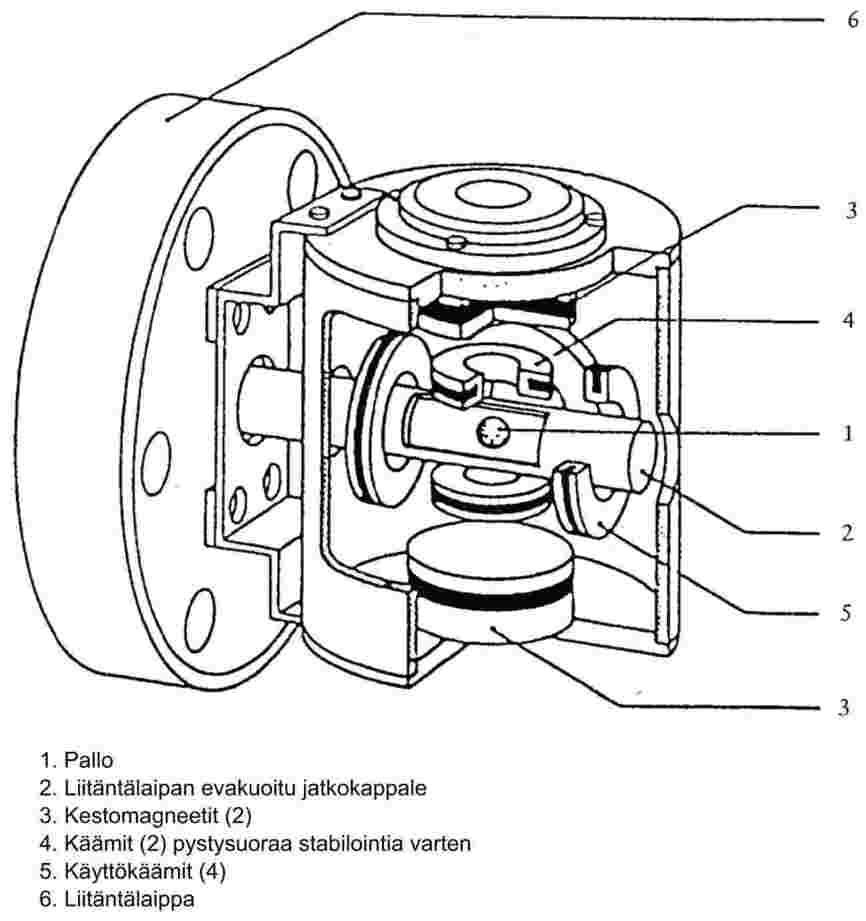
A.5 PINTAJÄNNITYS
1. MENETELMÄ
Tässä kuvatut menetelmät perustuvat OECD:n testiohjeisiin (1). Perusperiaatteet kuvataan viitteessä (2).
1.1 JOHDANTO
Kuvattuja menetelmiä voidaan soveltaa vesiliuosten pintajännityksen mittaamiseen.
On suositeltavaa selvittää ensin tutkittavan aineen vesiliukoisuus, rakenne, hydrolysoitumisominaisuudet ja misellimuodostuksen kriittinen pitoisuus.
Kuvattuja menetelmiä voidaan käyttää lähes kaikkiin kemiallisiin aineisiin ilman rajoituksia aineiden puhtausasteen suhteen.
Pintajännityksen mittaaminen rengastensiometrillä on rajoitettu vesiliuoksiin, joiden dynaaminen viskositeetti on alle 200 mPa s.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Vapaan pinnan entalpiaa pintayksikköä kohti kutsutaan pintajännitykseksi.
Pintajännityksen yksiköt ovat seuraavat:
N/m (SI-yksikkö) tai
mN/m (SI-alayksikkö)
1 N/m = 103 dyniä/cm
1 mN/m = 1 dyni käytöstä poistuneessa cgs-järjestelmässä
1.3 VERTAILUAINEET
Uutta ainetta tutkittaessa ei aina tarvitse käyttää vertailuaineita. Vertailuaineita käytetään lähinnä menetelmän toimivuuden ajoittaiseen tarkistamiseen ja verrattaessa tuloksia muiden menetelmien avulla saatuihin tuloksiin.
Viitteissä (1) ja (3) esitetään vertailuaineita, jotka kattavat laajan pintajännitysalueen.
1.4 TESTIMENETELMIEN PERIAATTEET
Menetelmä perustuu sen pystysuoran vetovoiman mittaamiseen, joka tarvitaan erottamaan sanka tai rengas mitta-astiassa olevan tutkittavan nesteen pinnasta vetämällä kohtisuoraan ylöspäin. Voidaan myös panna neste lautaselle ja mitata voima, joka tarvitaan kappaleen reunan ja nestepinnan välisen kalvon irrottamiseen.
Aineet, joiden vesiliukoisuus on vähintään 1 mg/l, tutkitaan vesiliuoksessa yhtenä ainoana pitoisuutena.
1.5 LAATUKRITEERIT
Menetelmillä on mahdollista saavuttaa tarkkuus, joka on todennäköisesti suurempi kuin mitä ympäristöllisiä arviointeja varten tarvitaan.
1.6 MENETELMÄKUVAUKSET
Ainetta liuotetaan tislattuun veteen. Liuoksen pitoisuuden tulee olla 90 % aineen kyllästymispitoisuudesta veteen liuotettaessa. Jos kyllästymispitoisuus ylittää arvon 1 g/l, testiin käytetään pitoisuutta 1 g/l. Aineita, joiden vesiliukoisuus on alle 1 mg/l, ei tarvitse testata.
1.6.1 Lautasmenetelmä
Katso standardeja ISO 304 ia NF T 73-060 (Surface active agents — determination of surface tension by drawing up liquid films)
1.6.2 Sinkilämenetelmä
Katso standardeja ISO 304 ja NF T 73-060 {Surface active agents — determination of surface tension by drawing up liquid films)
1.6.3 Rengasmenetelmä
Katso standardeja ISO 304 ja NF T 73-060 (Surface active agents — determination of surface tension by drawing up liquid films)
1.6.4 OECD-maiden yhtenäistetty rengasmenetelmä
1.6.4.1 Laite
Tähän mittaukseen voidaan käyttää kaupallisesti saatavia tensiometrejä. Tensiometrin osat ovat seuraavat:
|
— |
liikkuva näytepöytä, |
|
— |
mittauskappale (rengas), |
|
— |
voimanmittausjärjestelmä, |
|
— |
mittausastia. |
1.6.4.1.1
Liikkuva näytepöytä toimii näytettä paikallaanpitävän, termostaatilla varustetun mittausastian tukena. Näytepöytä ja voimanmittausjärjestelmä on kiinnitetty telineeseen.
1.6.4.1.2
Voimanmittausjärjestelmä (katso kuvaa) sijaitsee näytepöydän yläpuolella. Voimanmittauksen virhe ei saa ylittää arvoa ± 10-6 N, mikä vastaa virherajaa ±0,1 mg massamittauksissa. Useimmissa tapauksissa kaupallisten tensiometrien mitta-asteikko on mN/m-yksikköinä, jolloin pintajännityslukema saadaan suoraan mN/m-yksikköinä 0,1 mN/m:n tarkkuudella.
1.6.4.1.3
Rengas on yleensä tehty noin 0,4 mm:n paksuisesta platina-iridiumlangasta. Keskiympärysmitta on 60 mm. Rengas riippuu vaakasuorassa metallitapista ja lankatelineestä ja on tätä kautta yhteydessä voimanmittausjärjestelmään (katso kuvaa).
Kuva
Mittauskappale
(Kaikki mitat ovat millimetreinä.)

1.6.4.1.4
Näyteliuosta sisältävän mittausastian on oltava termostaatilla varustettu ja lasista valmistettu. Astian tulee olla siten muotoiltu, että näyteliuoksen ja sen yläpuolella olevan kaasufaasin lämpötila pysyy mittauksen aikana vakiona eikä näytettä pääse haihtumaan. Hyväksyttävän sylinterinmuotoisen mittausastian sisähalkaisijan on oltava vähintään 45 mm.
1.6.4.2 Valmistelutoimet
1.6.4.2.1
Lasiastiat on puhdistettava huolella. Tarvittaessa ne on pestävä kuumalla kromi-rikkihapolla ja sen jälkeen väkevällä fosforihapolla (83–98 painoprosenttia H3PO4:ää), ja sen jälkeen huuhdeltava huolellisesti vesijohtovedellä. Lopuksi astiat on pestävä kaksoistislatulla vedellä, niin että saadaan neutraali reaktio, ja kuivattava, tai huuhdeltava pienellä määrällä näyteliuosta.
Rengas huuhdellaan ensin huolellisesti vedellä kaikkien vesiliukoisten aineiden poistamiseksi. Tämän jälkeen se upotetaan hetkeksi kromi-rikkihappoon, ja sitten se pestään kaksoistislatulla vedellä, niin että saadaan neutraali reaktio. Lopuksi rengasta kuumennetaan vähän aikaa metanoliliekin yllä.
Huomautus:
Epäpuhtaudet, jotka eivät liukene tai tuhoudu kromi-rikkihapon tai fosforihapon vaikutuksesta, poistetaan sopivalla orgaanisella liuottimella.
1.6.4.2.2
Laite kalibroidaan vahvistamalla nollapiste ja säätämällä se siten, että instrumentin lukema sallii luotettavan mN/m-lukeman määrityksen.
Asennus:
Laite tasapainotetaan esimerkiksi tensiometrin jalustalla olevan vesiva'an avulla. Jalustan tasapainotusruuveja säädetään tarpeen mukaan.
Nollapisteen säätö:
Kun rengas on kiinnitetty laitteeseen, tensiometrin lukema on ennen mittauksia säädettävä nollaan ja renkaan yhdensuuntaisuus nesteen pinnan suhteen on tarkistettava. Nesteen pintaa voidaan käyttää peilinä.
Kalibrointi:
Varsinainen kalibrointi voidaan tehdä jollakin seuraavista menetelmistä:
|
a) |
Massamenetelmä: Renkaalle asetetaan kappaleita, joiden massa on tunnettu (0,1–1,0 g). Kalibrointikerroin (Фa), jolla instrumentin kaikki lukemat on kerrottava, määritetään yhtälön (1) mukaisesti:
jossa
|
|
b) |
Vesimenetelmä: Käytetään vettä, jonka pintajännitys esimerkiksi 23 oC:ssa on 72,3 mN/m. Menetelmä on nopeampi kuin painokalibrointi, mutta siihen liittyy vaara veden pintajännitysarvon vääristymisestä pinta-aktiivisten epäpuhtauksien vaikutuksesta. Kalibrointikerroin (Фb), jolla instrumentin kaikki lukemat on kerrottava, määritetään yhtälön (2) mukaisesti:
jossa
|
1.6.4.3 Näytteiden valmistelu
Näytteistä valmistetaan vaadittavan pitoiset vesiliuokset, jotka eivät saa sisältää liukenemattomia aineita.
Liuosten lämpötila on pidettävä vakiona (±0,5 oC). Koska mittausastiassa olevan liuoksen pintajännitys muuttuu ajan kuluessa, on tehtävä useita mittauksia eri ajankohtina ja tuloksista on piirrettävä käyrä, joka ilmaisee pintajännityksen muuttumisen ajan funktiona. Kun muutoksia ei enää tapahdu, järjestelmä on saavuttanut tasapainon.
Pölyt ja muiden aineiden kaasumaiset epäpuhtaudet häiritsevät mittauksia. Siksi mittaukset on suoritettava suojan alla.
1.6.5 Testiolosuhteet
Mittaukset tehdään noin 20 oC:ssa. Lämpötila on säädettävä ±0,5 oC:n tarkkuudella.
1.6.6 Työjärjestys
Näyteliuokset kaadetaan huolella puhdistettuun mittausastiaan välttäen tarkoin vaahdon muodostumista. Mittausastia asetetaan laitteen pöydälle. Pöytää mittausastioineen nostetaan, kunnes rengas on kokonaan näyteliuoksen pinnan alla. Tämän jälkeen pöytää lasketaan hitaasti ja tasaisesti (noin 0,5 cm minuutissa), niin että saavutetaan maksimivoima renkaan noustessa pintaan irtoamatta siitä ja pintaa yhdistävästä vesikerroksesta. Mittauksen jälkeen rengas lasketaan uudelleen pinnan alle ja mittauksia toistetaan, kunnes pintajännitysarvo ei enää muutu. Jokaisen mittauksen yhteydessä rekisteröidään aika, joka on kulunut näyteliuoksen kaatamisesta mittausastiaan. Mittaustulokseksi valitaan maksimivoima, joka tarvitaan nostamaan rengas nesteen pinnan yläpuolelle.
2. TIEDOT
Yksikkönä mN/m saadut mittaustulokset kerrotaan ensin kalibrointikertoimella Φa tai Φb (käytetyn kalibrointimenetelmän mukaan). Näin saadaan kuitenkin vain likiarvo, jota on vielä korjattava.
Harkins ja Jordan (4) ovat määritelleet empiirisesti korjauskertoimia rengasmenetelmällä mitatuille arvoille renkaan mittojen, nesteen tiheyden ja pintajännityksen mukaan.
Koska korjauskertoimen määritys Harkinsin ja Jordanin taulukosta jokaista yksittäistä mittausta varten on työlästä, voidaan vesiliuosten pintajännityksen laskemista varten käyttää yksinkertaistettua menetelmää, jossa korjatut pintajännitysarvot luetaan suoraan taulukosta. (Väliarvoja varten käytetään interpolointia.)
Taulukko
Mitatun pintajännityksen korjaaminen
Vain vesiliuoksille, joiden tiheys on noin 1 g/cm3
|
R |
= 9,55 mm (renkaan säteen keskiarvo) |
|
r |
= 0,185 mm (renkaan langan säde) |
|
Kokeellinen arvo (mN/m) |
Korjattu arvo (mN/m) |
|
|
Painokalibroint (katso 1.6.4.2.2 i (a)) |
Vesikalibrointi (katso 1.6.4.2.2 (b)) |
|
|
20 |
16,9 |
18,1 |
|
22 |
18,7 |
20,1 |
|
24 |
20,6 |
22,1 |
|
26 |
22,4 |
24,1 |
|
28 |
24,3 |
26,1 |
|
30 |
26,2 |
28,1 |
|
32 |
28,1 |
30,1 |
|
34 |
29,9 |
32,1 |
|
36 |
31,8 |
34,1 |
|
38 |
33,7 |
36,1 |
|
40 |
35,6 |
38,2 |
|
42 |
37,6 |
40,3 |
|
44 |
39,5 |
42,3 |
|
46 |
41,4 |
44,4 |
|
48 |
43,4 |
46,5 |
|
50 |
45,3 |
48,6 |
|
52 |
47,3 |
50,7 |
|
54 |
49,3 |
52,8 |
|
56 |
51,2 |
54,9 |
|
58 |
53,2 |
57,0 |
|
60 |
55,2 |
59,1 |
|
62 |
57,2 |
61,3 |
|
64 |
59,2 |
63,4 |
|
66 |
61,2 |
65,5 |
|
68 |
63,2 |
67,7 |
|
70 |
65,2 |
69,9 |
|
72 |
67,2 |
72,0 |
|
74 |
69,2 |
— |
|
76 |
71,2 |
— |
|
78 |
73,2 |
— |
Taulukko perustuu Harkinsin-Jordanin korjaukseen. Taulukko vastaa vettä ja vesiliuoksia käsittelevän DIN-standardin (DIN 53914) taulukkoa (tiheys = 1 g/cm3). Se on tarkoitettu mittauksiin, joissa käytetään kaupallista rengasta, jonka mitat ovat R = 9,55 mm (renkaan säteen keskiarvo) ja r = 0,185 mm (renkaan langan säde). Taulukossa on pintajännitysmittauksien korjatut arvot, jotka tehdään paino- tai vesikalibroinnin jälkeen.
Vaihtoehtoisesti pintajännitys, joka on mitattu ilman ensin tehtyä kalibrointia, voidaan laskea seuraavan suureyhtälön mukaan:
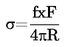
jossa
|
F |
= |
dynamometrin mittaama voima kalvon murtuessa |
|
R |
= |
renkaan säde |
|
f |
= |
korjauskerroin (1) |
3. RAPORTOINTI
3.1 TESTIRAPORTTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
käytetty menetelmä, |
|
— |
käytetyn veden tai liuoksen tyyppi, |
|
— |
aineen tarkka spesifikaatio (tunnistustiedot, epäpuhtaudet), |
|
— |
mittaustulokset: pintajännitys (lukema); ilmoitetaan sekä yksilölliset lukemat aritmeettisine keskiarvoineen että korjattu keskiarvo (laitekerroin ja korjaustaulukko huomioon ottaen), |
|
— |
liuoksen pitoisuus, |
|
— |
testilämpötila, |
|
— |
liuoksen ikä; erityisesti aika liuoksen valmistelusta mittaushetkeen, |
|
— |
selvitys liuoksen pintajännityksen verrannollisuudesta aikaan siitä hetkestä lähtien, jolloin liuos on siirretty mittausastiaan, |
|
— |
kaikki tiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta, erityisesti epäpuhtauksien ja aineen fysikaalisen olomuodon osalta. |
3.2 TULOSTEN TULKINTA
Koska tislatun veden pintajännitys on 20 oC:ssa 72,75 mN/m, aineet, joiden pintajännitys on alle 60 mN/m kuvatun menetelmän kaltaisissa olosuhteissa, on katsottava pinta-aktiivisiksi aineiksi.
4. VIITTEET
|
(1) |
OECD, Paris, 1981, Test Guideline 115, Decision of the Council C(81) 30 final. |
|
(2) |
R. Weissberger ed., Technique of organic chemistry, Chapter XIV, Physical Methods of Organic Chemistry, 3rd ed, Interscience Publ. New York, 1959, Vol. I, Part I, Chapter XIV. |
|
(3) |
Pure Appl. Chem., 1976, vol. 48, 511. |
|
(4) |
Harkins, W. D., Jordan, H. E, J. Amer. Chem. Soe, 1930, vol. 52, 1751. |
A.6 VESILIUKOISUUS
1. MENETELMÄ
Tässä kuvatut menetelmät perustuvat OECD:n testiohjeeseen (1).
1.1 JOHDANTO
On suositeltavaa selvittää ensin tutkittavan aineen rakennekaava, dissosiaatiovakio ja hydrolysoituminen (pH:n funktiona).
Yksittäistä, koko vesiliukoisuusalueen kattavaa menetelmää ei ole.
Seuraavat kaksi testimenetelmää kattavat yhdessä koko liukoisuusalueen, mutta niitä ei voi soveltaa haihtuviin aineisiin:
|
— |
Ensimmäistä menetelmää voidaan soveltaa huomattavan puhtaisiin aineisiin, joiden liukoisuus on alhainen (< 10-2 grammaa litraa kohti) ja jotka ovat stabiileja vedessä. Menetelmää kutsutaan jäljempänä kolonnieluutiomenetelmäksi. |
|
— |
Toista menetelmää voidaan soveltaa huomattavan puhtaisiin aineisiin, joiden liukoisuus on suuri (> 10-2 grammaa litraa kohti) ja jotka ovat stabiileja vedessä. Menetelmää kutsutaan jäljempänä pullomenetelmäksi. |
1.2 MÄÄRITELMÄT JA YKSIKÖT
Määritelmän mukaan aineen vesiliukoisuus on sen kyllästyspitoisuus vedessä määrätyssä lämpötilassa. Vesiliukoisuus ilmoitetaan massayksikkönä liuostilavuutta kohti. SI-yksikkö on kg/m3 (myös yksikköä g/l voidaan käyttää).
1.3 VERTAILUAINEET
Uutta ainetta tutkittaessa ei aina tarvitse käyttää vertailuaineita. Vertailuaineita käytetään lähinnä menetelmän toimivuuden ajoittaiseen tarkistamiseen ja verrattaessa tuloksia muiden menetelmien avulla saatuihin tuloksiin.
1.4 TESTIMENETELMIEN PERIAATTEET
Yksinkertaisen alustavan testin avulla selvitetään näytteen likimääräinen määrä ja kyllästyspitoisuuden saavuttamiseksi tarvittava aika.
1.4.1 Kolonnieluutiomenetelmä
Menetelmä perustuu veden avulla suoritettavaan näytteen eluutioon mikrokolonnista, jossa on inerttiä, runsaalla määrällä näytettä päällystettyä kantaja-ainetta, esimerkiksi lasihelmiä tai hiekkaa. Vesiliukoisuus voidaan määrittää, kun eluaatin massapitoisuus on vakio (vakiotila näkyy pitoisuus-aika-käyrässä tasanteena).
1.4.2 Pullomenetelmä
Näyte (kiinteät aineet on jauhettava) liuotetaan veteen lämpötilassa, joka on hieman testilämpötilan yläpuolella. Kun kyllästyminen saavutetaan, seos jäähdytetään, ja sitä pidetään sen jälkeen testilämpötilassa. Seosta ravistellaan tässä lämpötilassa, kunnes nestejärjestelmä saavuttaa tasapainon. Vaihtoehtoisesti mittaus voidaan suorittaa suoraan testilämpötilassa, edellyttäen, että kyllästymistasapaino varmistetaan soveltuvalla näytteenotolla. Tämän jälkeen määritetään aineen massapitoisuus sopivalla analyyttisellä menetelmällä. Määritys tehdään vesiliuoksessa, joka ei saa sisältää liukenemattomia hiukkasia.
1.5 LAATUKRITEERIT
1.5.1 Toistettavuus
Kolonnieluutiomenetelmällä voidaan saavuttaa arvo < 30 %. Pullomenetelmällä tulisi saavuttaa arvo < 15 %.
1.5.2 Herkkyys
Herkkyys vaihtelee analyysimenetelmän mukaan, mutta massapitoisuuksia voidaan määrittää arvoon 10-6 g/l asti.
1.6 MENETELMIEN KUVAUKSET
1.6.1 Testiolosuhteet
Testi on mieluiten tehtävä lämpötilassa 20 ±0,5 oC. Jos epäillään, että vesiliukoisuus vaihtelee lämpötilan mukaan, (> 3 % astetta kohti), on käytettävä kahta ylimääräistä lämpötilaa vähintään 10 oC ensin valitun lämpötilan ylä- ja alapuolella. Tässä tapauksessa lämpötilansäädön on toimittava ±0,1 oC:n tarkkuudella. Valittua lämpötilaa on pidettävä yllä laitteen kaikissa tärkeissä osissa.
1.6.2 Alustava testi
Noin 0,1 g näytettä (kiinteät aineet on ensin jauhettava) pannaan lasilla suljettuun, 10 ml:n asteikolla varustettuun sylinteriin. Sylinteriin lisätään huoneenlämpöistä tislattua vettä seuraavan taulukon mukaan:
|
0,1 g liukenee ’x’ ml:aan vettä |
0,1 |
0,5 |
1 |
2 |
10 |
100 |
> 100 |
|
Likimääräinen liukoisuus (g/l) |
> 1 000 |
1 000–2 000 |
200–100 |
100–50 |
50–10 |
10–1 |
< 1 |
Jokaisen taulukon mukaisen vedenlisäyksen jälkeen seosta ravistetaan voimakkaasti 10 minuuttia ja tarkistetaan silmämääräisesti, ettei liuokseen ole jäänyt liukenemattomia hiukkasia. Jos näyte tai sen osa jää liukenematta 10 ml:n vedenlisäyksen jälkeen, koe on toistettava 100 ml:n sylinterissä aiempaa suuremmalla vesimäärällä. Huonosti liukenevien aineiden kohdalla liukenemisaika voi olla huomattavasti pitempi (on käytettävä vähintään 24 tuntia). Likimääräinen liukoisuus ilmenee taulukosta sen vesimäärän alta, jonka lisäyksen jälkeen näyte on täysin liuennut. Jos näyte edelleen vaikuttaa liukenemattomalta, odotetaan enemmän kuin 24 tuntia (enintään 96 tuntia), tai liuosta laimennetaan edelleen, jotta voitaisiin päättää, käytetäänkö kolonnieluutio- vai pullomenetelmää.
1.6.3 Kolonnieluutiomenetelmä
1.6.3.1 Kantaja-aine, liuotin ja eluentti
Kolonnieluutiota varten on valittava inertti kantaja-aine, esimerkiksi lasihelmet tai hiekka. Näyte kaadetaan kantaja-aineelle sopivaan, analyyttisen puhtaaseen haihtuvaan liuottimeen liuotettuna. Eluenttina käytetään lasi- tai kvartsilaitteessa kahdesti tislattua vettä.
Huomautus:
Suoraan orgaanisesta ioninvaihtimesta otettua vettä ei pidä käyttää.
1.6.3.2 Kantaja-aineen lisääminen
Noin 600 mg kantaja-ainetta punnitaan ja siirretään 50 ml:n pyörökolviin.
Sopiva, punnittu määrä näytettä liuotetaan valittuun liuottimeen. Kantaja-aine täytetään sopivalla määrällä tätä liuosta. Liuottimen on haihduttava täysin, esimerkiksi pyörivässä haihduttimessa, muutoin kantaja-aine ei kyllästy vedellä kantaja-aineen pinnalla tapahtuvien jakaantumisilmiöiden takia.
Kantaja-aineen täyttö saattaa aiheuttaa ongelmia (vääriä tuloksia), jos näyte lisätään öljynä tai erilaisena kristallifaasina. Ongelmaa on tutkittava kokeellisesti ja yksityiskohdat on raportoitava.
Täytön jälkeen kantaja-ainetta pidetään noin 5 ml:ssa vettä kahden tunnin ajan, minkä jälkeen suspensio kaadetaan mikrokolonniin. Vaihtoehtoisesti voidaan kaataa kuivaa, täytettyä kantaja-ainetta vedellä täytettyyn mikrokolonniin ja jättää se tasapainottumaan kahden tunnin ajaksi.
Testi:
Näytteen eluointi kantaja-aineesta voidaan tehdä kahdella eri tavalla:
|
— |
kiertopumpun avulla (kuva 1), |
|
— |
tasausastian avulla (kuva 4). |
1.6.3.3 Kolonnieluutiomenetelmä ja kiertopumppu
Laite
Kuvassa 1 esitetään tyypillisen järjestelmän periaatteellinen järjestely. Kuvassa 2 on sopiva mikrokolonni, mutta koko voidaan valita vapaasti, edellyttäen, että laite täyttää toistettavuus- ja herkkyysvaatimukset. Kolonnin ylätilaan on mahduttava vähintään viisi tilavuutta vettä, ja kolonniin on mahduttava vähintään viisi näytettä. Vaihtoehtoisesti kokoa voidaan pienentää, jos liuotinta lisäämällä voidaan korvata ensimmäiset viisi epäpuhtauksien poistoon tarkoitettua tilavuutta.
Kolonni kytketään kiertopumppuun, joka pystyy säätämään virtauksia, joiden nopeus on noin 25 ml tunnissa. Pumppuliitännät ovat polytetrafluorietyleeniä (PTFE:tä) tai lasia. Asennetussa kolonni-pumppujärjestelmässä pitää olla mahdollisuus näytteenottoon ulos virtaavasta nesteestä ja mahdollisuus ylätilan paineen tasaamiseen ilmanpaineen suhteen. Kolonniainetta tukee pieni (5 mm:n) lasivillatulppa, joka samalla suodattaa pois hiukkasia. Kiertopumppu voi olla esimerkiksi peristaltiikkapumppu tai kalvopumppu (on huolehdittava siitä, ettei putken materiaali aiheuta saastumista tai adsorptiota).
Mittauksen tekeminen
Käynnistetään virtaus kolonnin läpi. Suositeltava virtausnopeus on noin 25 ml tunnissa (vastaa 10 tilavuutta tunnissa kuvatun kolonnin kohdalla). Vesiliukoiset epäpuhtaudet poistetaan hylkäämällä vähintään ensimmäiset viisi tilavuutta. Tämän jälkeen kiertopumppu saa käydä, kunnes tasapaino on saavutettu. Tasapainotila voidaan todeta saavutetuksi, kun viiden peräkkäin otetun näytteen pitoisuudet vaihtelevat enintään ± 30 % satunnaisella tavalla. Näytteenottovälin on vastattava vähintään eluentin kymmenen tilavuuden läpivirtausta.
1.6.3.4 Kolonnieluutiomenetelmä ja tasausastia
Laite (katso kuvia 4 ja 3)
Tasausastia: Liitokset tasausastiaan toteutetaan lasihioksella, joka on yhdistetty PTFE-putkeen. Suositeltava virtausnopeus on 25 ml tunnissa. Peräkkäiset eluaattifraktiot kerätään ja analysoidaan valitun menetelmän mukaan.
Mittauksen tekeminen
Vesiliukoisuuden määritykseen käytetään vähintään viisi peräkkäin otettua fraktiota eluaatin keskialueelta, jossa pitoisuudet pysyvät vakiona (± 30 %).
Molemmissa tapauksissa (kiertopumppu- tai tasausastiajärjestelmä) on tehtävä toinen ajo, jossa virtausnopeus on puolet ensimmäisen ajon virtausnopeudesta. Jos molempien ajojen tulokset ovat yhtenevät, testin katsotaan olevan tyydyttävä. Jos alempi virtausnopeus antaa suuremman liukoisuuden, virtausnopeuden puolittamista on jatkettava, kunnes saadaan kaksi peräkkäistä, saman liukoisuuden antavaa ajoa.
Molemmissa tapauksissa (kiertopumppu- tai tasausastiajärjestelmä) fraktioista on etsittävä kolloideja Tyndall-ilmiön (valon sironta) avulla. Kolloidien esiintyminen mitätöi tulokset, ja tällöin testi on toistettava kolonnin suodatustehon parantumisen jälkeen.
Jokaisen näytteen pH on kirjattava, Toinen ajo on tehtävä samassa lämpötilassa.
1.6.4 Pullomenetelmä
1.6.4.1 Laite
Pullomenetelmää varten tarvitaan seuraavat osat:
|
— |
laboratoriolaseja ja –instrumentteja, |
|
— |
laite, jolla liuoksia voidaan ravistaa säädetyissä vakiolämpötiloissa, |
|
— |
sentrifugi (mieluiten termostaatilla varustettu), jos sellainen tarvitaan emulsion käsittelyyn, |
|
— |
laitteet analyyttisia määrityksiä varten. |
1.6.4.2 Mittausten tekeminen
Alustavan testin avulla saadaan tieto halutun vesimäärän kyllästämiseen tarvittavasta ainemäärästä. Tarvittava vesimäärä vaihtelee analyyttisen menetelmän ja liukoisuusalueen mukaan. Noin viisinkertainen määrä ainetta punnitaan kolmeen eri lasitulpalla varustettuun lasiastiaan (esimerkiksi sentrifugiputkiin tai pulloihin). Valittu vesimäärä lisätään astioihin, jotka suljetaan tiiviisti. Suljettuja astioita ravistetaan 30 oC:ssa. (Tarkoitukseen käytetään ravistus- tai sekoitustapaa, jossa voidaan pitää yllä vakiolämpötilaa, esimerkiksi magneettisekoitusta termostaatilla varustetussa vesihauteessa.) Vuorokauden kuluttua yksi astioista poistetaan, ja astian sisältö tasapainotetaan uudelleen 24 tunnin aikana testilämpötilassa astiaa ajoittain ravistamalla. Astian sisältö lingotaan testilämpötilassa ja näytteen pitoisuus määritetään kirkkaasta vesifaasista sopivan analyyttisen menetelmän mukaisesti. Toista jäljellä olevaa astiaa käsitellään ensimmäisen 30 oC:ssä tapahtuneen tasapainotuksen jälkeen samalla tavoin kaksi vuorokautta ja toista astiaa kolme vuorokautta. Jos pitoisuustulokset vähintään kahdesta viimeisestä astiasta täyttävät toistettavuusvaatimukset, testi hyväksytään. Jos astioista 1, 2 ja 3 saadut tulokset osoittavat nousevaa suuntausta, koko testi on toistettava pidempiä tasapainotusaikoja käyttäen.
Mittaus voidaan myös toteuttaa ilman 30 oC:ssa tapahtuvaa esi-inkubaatiota. Kyllästystasapainon saavuttamisnopeutta voidaan arvioida jatkamalla näytteidenottoa, kunnes sekoitusaika ei enää vaikuta liuoksen pitoisuuteen.
Jokaisen näytteen pH on kirjattava.
1.6.5 Analyysi
Näitä määrityksiä varten suositellaan ainekohtaista analyyttista menetelmää, koska pienet määrät liukoisia epäpuhtauksia voivat aiheuttaa suuria virheitä mitatussa liukoisuudessa. Esimerkkejä tällaisista menetelmistä ovat kaasu- tai nestekromatografia, titrausmenetelmät, fotometriset menetelmät ja kulometriset menetelmät.
2. TIEDOT
2.1 KOLONNIELUUTIOMENETELMÄ
Jokaista ajoa kohti on laskettava vähintään viiden peräkkäisen kyllästysalueelta otetun näytteen keskiarvo ja näytteiden keskihajonta. Tulokset ilmoitetaan massayksikköinä liuostilavuutta kohti.
Verrataan keskenään kahden eri virtauksilla tehdyn testin keskiarvoja. Toistettavuuden on oltava pienempi kuin 30 %.
2.2 PULLOMENETELMÄ
Jokaisen yksittäisen pullon yksittäinen tulos ilmoitetaan, ja vakiona pidettävistä tuloksista (toistettavuus alle 15 %) lasketaan keskiarvo. Näin saatu tulos ilmoitetaan massayksikköinä liuostilavuutta kohti. Tämä saattaa edellyttää massayksiköiden muuntamista tilavuusyksiköiksi. Tällöin käytetään tiheyttä, jossa liukoisuus on hyvin suuri (> 100 g/l).
3. RAPORTOINTI
3.1 KOLONNIELUUTIOMENETELMÄ
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
alustavan testin tulokset, |
|
— |
aineen tarkka spesifikaatio (tunnistustiedot, epäpuhtaudet), |
|
— |
jokaisen näytteen pitoisuus, virtausnopeus ja pH, |
|
— |
jokaisen ajon vähintään viiden kyllästysalueelta otetun näytteen keskiarvot ja keskihajonnat, |
|
— |
kahden peräkkäisen hyväksyttävän ajon keskiarvo, |
|
— |
veden lämpötila kyllästysprosessin aikana, |
|
— |
käytetty analyysimenetelmä, |
|
— |
käytetyn kantaja-aineen luonne, |
|
— |
kantaja-aineen täyttö, |
|
— |
käytetty liuotin, |
|
— |
näytteet aineen mahdollisesta kemiallisesta epästabiliteetista testin ja menetelmän suorittamisen aikana, |
|
— |
kaikki tiedot ja huomautukset, joilla on merkitystä tulosten tulkinnan kannalta, erityisesti epäpuhtauksien ja aineen fysikaalisen olomuodon osalta. |
3.2 PULLOMENETELMÄ
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
alustavan testin tulokset, |
|
— |
aineen tarkka spesifikaatio (tunnistustiedot, epäpuhtaudet), |
|
— |
yksittäiset analyyttiset määritykset sekä keskiarvo, jos jokaista pulloa kohti on määritetty useampia arvoja, |
|
— |
jokaisen näytteen pH, |
|
— |
keskiarvo niistä eri astioista, joiden tulokset olivat yhteneviä, |
|
— |
testilämpötila, |
|
— |
käytetty analyyttinen menetelmä, |
|
— |
todisteet aineen mahdollisesta kemiallisesta epästabiliteetista testin ja menetelmän suorittamisen aikana, |
|
— |
kaikki tiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta, erityisesti epäpuhtauksien ja aineen fysikaalisen olomuodon osalta. |
4. VIITTEET
|
(1) |
OECD, Paris, 1981, Test Guideline 105, Decision of the Council C(81) 30 final. |
|
(2) |
NFT 20-045 (AFNOR) (Sept. 1985). Chemical products for industrial use — Determination of water solubility of solids and liquids with low solubility — Column elution method |
|
(3) |
NF T 20-046 (AFNOR) (Sept. 1985). Chemical products for industrial use — Determination of water solubility of solids and liquids with high solubility — Flask method |
Liite
Kuva 1
Kolonnieluutiomenetelmä ja kiertopumppu

Kuva 2
Tyypillinen mikrokolonni
(Kaikki mitat ovat millimetreinä.)
Kuva 3
Tyypillinen mikrokolonni
(Kaikki mitat ovat millimetreinä.)

Kuva 4
Kolonnieluutiomenetelmä ja tasausastia

A.8 JAKAANTUMISKERROIN
1. MENETELMÄ
Tässä kuvattu ravistuspullomenetelmä perustuu OECD:n testiohjeeseen (1).
1.1 JOHDANTO
On suositeltavaa selvittää ensin tutkittavan aineen rakennekaava, dissosiaatiovakio, vesiliukoisuus, hydrolysoituminen, n-oktanoliliukoisuus ja pintajännitys.
Mitattaessa ionisoituvia aineita on aina käytettävä aineiden ionisoitumatonta muotoa (vapaata happoa tai vapaata emästä), joka on saatu sellaisen sopivan puskurin avulla, jonka pH on vähintään yhden pH-yksikön pK-arvoa pienempi (vapaa happo) tai suurempi (vapaa emäs).
Testi voidaan tehdä kahdella eri menetelmällä: ravistuspullomenetelmällä tai HPLC-nestekromatografialla. Ensimmäistä menetelmää voidaan soveltaa, kun Pow-arvo (katso jäljempänä olevaa määritelmää) on - 2...4, ja toista menetelmää arvon ollessa 0...6. Alustavan kokeen avulla saadaan arvio näytteen jakaantumiskertoimesta, minkä jälkeen valitaan sopiva menetelmä.
Ravistuspullomenetelmää voidaan soveltaa vain huomattavan puhtaiden, vesi- ja n-oktanoliliukoisten aineiden testaukseen. Menetelmää ei voida soveltaa pinta-aktiivisten aineiden testaukseen (näiden kohdalla on esitettävä laskettu arvo tai arvio, joka perustuu yksittäisiin vesi- ja n-oktanoliliukoisuuksiin).
HPLC-menetelmää ei voida soveltaa vahvojen happojen ja emästen, metallikompleksien, pinta-aktiivisten aineiden tai eluentin kanssa reagoivien aineiden testaukseen. Näiden aineiden kohdalla on esitettävä laskettu arvo tai arvio, joka perustuu yksittäisiin vesi- ja n-oktanoliliukoisuuksiin.
HPLC-menetelmä ei ole yhtä herkkä näytteessä oleville epäpuhtauksille kuin ravistuspullomenetelmä. Kuitenkin epäpuhtaudet voivat joissakin tapauksissa vaikeuttaa tulosten tulkintaa, koska kärkien kohdentaminen on tällöin epävarmaa. Jos seoksen testauksessa saadaan määrittämätön kaista, on ilmoitettava log P:n ylä- ja alaraja.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Määritelmän mukaan jakaantumiskerroin (P) on liuotetun aineen tasapainopitoisuuksien (ci) välinen suhde kaksifaasijärjestelmässä, jossa on kaksi toisiinsa heikosti sekoittuvaa liuotinta:

Jakaantumiskerroin (P) on siis kahden pitoisuuden välinen suhde, ja se ilmoitetaan normaalisti kymmenkantaisena logaritmina (log P).
1.3 VERTAILUAINEET
Ravistuspullomenetelmä
Uutta ainetta tutkittaessa ei aina tarvitse käyttää vertailuaineita. Vertailuaineita käytetään lähinnä menetelmän toimivuuden ajoittaiseen tarkistamiseen ja verrattaessa tuloksia muiden menetelmien avulla saatuihin tuloksiin.
HPLC-menetelmä
Aineen HPLC-mittaustulosten ja yhdisteen P-arvon välinen vastaavuus saadaan kalibrointikäyrästä, jossa log P esitetään kromatografisten tietojen funktiona. Kalibrointikäyrän kromatografisten tietojen on katettava vähintään 6 vertailupistettä. Käyttäjä valitsee sopivat vertailuaineet. Mahdollisuuksien mukaan on valittava vähintään yksi vertailuaine, jonka Pow-arvo on pienempi kuin näytteen Pow-arvo, ja yksi vertailuaine, jonka Pow-arvo on suurempi. Kun log P -arvo on pienempi kuin 4, kalibrointi voi perustua ravistuspullomenetelmällä saatuihin tuloksiin. Kun log P -arvo on suurempi kuin 4, kalibrointi voi perustua validoituihin, lähdekirjallisuudesta saatuihin arvoihin, jotka ovat yhteneviä laskettujen arvojen kanssa. Tarkkuutta voidaan parantaa käyttämällä vertailuaineita, joiden rakenne muistuttaa näytteen rakennetta.
Lähdekirjallisuudessa on laajat luettelot monen kemikaaliryhmän log Pow -arvoista (2), (3). Jos näytteen kanssa samankaltaisen rakenteen omaavien yhdisteiden tietoja ei ole käytettävissä, voidaan käyttää yleisempää kalibrointia, joka perustuu muihin vertailuaineisiin.
Liitteessä 2 on luettelo suositeltavista vertailuaineista ja niiden Pow-arvoista.
1.4 MENETELMIEN PERIAATTEET
1.4.1 Ravistuspullomenetelmä
Jakaantumiskertoimen määritystä varten järjestelmän kaikkien keskinäisessä vuorovaikutuksessa olevien osien on saavutettava tasapaino, minkä jälkeen määritetään järjestelmän kahteen faasiin liuotetun aineen pitoisuudet. Lähdekirjallisuudessa esitetään useita tekniikoita, joiden avulla molemmat faasit voidaan sekoittaa huolella ja joiden avulla niistä voidaan määrittää näytteen tasapainopitoisuudet kummassakin faasissa faasien erotuksen jälkeen.
1.4.2 HPLC-menetelmä
HPLC tapahtuu analyyttisessa kolonnissa, joka on täytetty kaupallisesti saatavana olevalla, pitkiä hiilivetyketjuja (esimerkiksi C8, C18) sisältävällä kiinteällä faasilla, joka on kemiallisesti sidottu piidioksidiin. Kolonniin ruiskutetut kemikaalit liikkuvat eri nopeuksilla sen mukaan, mikä on niiden jakaantumiskerroin liikkuvan faasin ja kiinteän hiilivetyfaasin välillä. Kemikaaliseokset eluoituvat hydrofobisuuden perusteella siten, että vesiliukoiset kemikaalit eluoituvat ensin ja öljyliukoiset viimeisenä suhteessa niiden hiilivety-vesi-jakaantumiskertoimeen. Näin voidaan määrittää vastafaasikolonnin retention ja n-oktanoli-vesi-jakaantumiskertoimen välinen suhde. Jakaantumiskerroin voidaan laskea käyttökertoimen k perusteella seuraavasti:
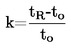
jossa tR = näytteen retentio ja t0 = liuotinmolekyylin keskimääräinen läpäisyaika (viive).
Kvantitatiivisia analyyttisia menetelmiä ei tarvita. Eluointiaikojen määritys riittää.
1.5 LAATUKRITEERIT
1.5.1 Toistettavuus
Ravistuspullomenetelmä
Jakaantumiskertoimen tarkkuus varmistetaan tekemällä kolme määritystä eri testiolosuhteissa, joissa näytteen määrä ja liuotintilavuuksien suhde voivat vaihdella. Saadut jakaantumiskertoimen arvot saavat vaihdella enintään ±0,3 logaritmiyksikköä kymmenkantaisina logaritmeina ilmaistuna.
HPLC-menetelmä
Mittaustulokset varmistetaan tekemällä kaksi määritystä. Yksittäisten mittausten perusteella saadut log P -arvot saavat vaihdella enintään ±0,1 logaritmiyksikköä.
1.5.2 Herkkyys
Ravistuspullomenetelmä
Menetelmän mittausalue määräytyy analyyttisen menetelmän havaintorajojen mukaan. Yleensä log Pow -arvoja voidaan määrittää alueella - 2...4 (määrätyissä olosuhteissa jopa arvoon log Pow = 5 asti), kun liuenneen aineen pitoisuus kummassakin faasissa on enintään 0,01 moolia litrassa.
HPLC-menetelmä
HPCL-menetelmällä voidaan laskea jakaantumiskerroin Pow-alueella 0–6.
Yleensä yhdisteen jakaantumiskertoimeksi voidaan arvioida ± 1 logaritmista yksikköä ravistuspullomenetelmän arvosta. Tyypillisiä korrelaatioita löytyy lähdekirjallisuudesta (4), (5), (6), (7), (8). Yleensä on mahdollista saada tarkempia tuloksia, kun korrelaatiopisteet on saatu rakenteellisesti samankaltaisten vertailuyhdisteiden tiedoista (9).
1.5.3 Spesifisyys
Ravistuspullomenetelmä
Nernstin jakaantumislakia voidaan laimennettujen liuosten kohdalla soveltaa vain vakiolämpötilassa, vakiopaineessa ja vakio-pH:ssa. Suoraan sovellettuna laki koskee vain puhtaita aineita, jotka jakautuvat kahden puhtaan liuottimen välillä. Jos toisessa tai molemmissa faaseissa on samanaikaisesti useita erilaisia liuoksia, tämä saattaa vaikuttaa tuloksiin.
Liuotettujen molekyylien assosiaatiosta tai dissosiaatiosta seuraa poikkeamia Nernstin jakaantumislaista. Tällaiset poikkeamat voidaan osoittaa sillä, että jakaantumiskerroin vaihtelee liuoksen pitoisuuden mukaan.
Koska tasapainoja on useita, testimenetelmää ei pidä soveltaa ionisoituviin yhdisteisiin ilman korjausta. Tällaisten yhdisteiden kohdalla on harkittava veden korvaamista puskuriliuoksilla, ja puskurin pH:n tulisi poiketa vähintään yhden pH-yksikön verran aineen pKa-arvosta. Lisäksi on otettava huomioon valitun pH:n sovellettavuus kyseiseen ympäristöön.
1.6 MENETELMÄKUVAUS
1.6.1 Jakaantumiskertoimen alustava arviointi
Alustavaan arviointiin tulisi mieluiten käyttää laskentamenetelmää (katso liitettä 1). Määrätyissä tapauksissa arviointiin voidaan käyttää myös näytteen liukoisuutta puhtaisiin liuottimiin (10).
1.6.2 Ravistuspullomenetelmä
1.6.2.1 Valmistelutoimet
n-oktanoli: Jakaantumiskertoimen määritykseen käytetään analyyttisen puhdasta reagenssia.
Vesi: Tarkoitukseen käytetään lasi- tai kvartsilaitteessa tislattua tai kaksoistislattua vettä. Ionisoituvien aineiden kohdalla on tarpeen mukaan käytettävä puskuriliuoksia veden sijasta.
Huomautus:
Suoraan ioninvaihtimesta otettua vettä ei pidä käyttää.
1.6.2.1.1
Ennen jakaantumiskertoimen määritystä molemmat liuotinjärjestelmän faasit kyllästetään ravistamalla testilämpötilassa. Käytännöllinen toteutustapa on käyttää kahta suurta, analyyttisen puhtaalla n-oktanolilla tai vedellä täytettyä varastopulloa, joissa on tarpeellinen määrä toista liuotinta, pitää pulloja vuorokauden ajan mekaanisessa ravistimessa ja antaa tämän jälkeen pullojen levätä, kunnes faasit erottuvat ja kyllästyspiste saavutetaan.
1.6.2.1.2
Kaksifaasijärjestelmän on täytettävä testausastia lähes kokonaan. Näin voidaan pienentää haihtumisesta aiheutuvaa ainehukkaa. Aineen tilavuussuhde ja määrät määräytyvät seuraavien tekijöiden mukaan:
|
— |
jakaantumiskertoimen alustava määritys (katso edellä), |
|
— |
pienin määrä näytettä, joka tarvitaan analyyttistä menetelmää varten, |
|
— |
rajoitus, jonka mukaan pitoisuus ei saa ylittää 0,01 moolia litrassa kummassakaan faasissa. |
Tehdään kolme testiä. Ensimmäisessä käytetään laskettua n-oktanolin ja veden tilavuussuhdetta, toisessa suhde puolitetaan ja kolmannessa se kerrotaan kahdella (esimerkiksi 1:1, 1:2, 2:1).
1.6.2.1.3
Valmistetaan varastoliuos esikyllästämällä n-oktanolia vedellä. Varastoliuoksen pitoisuus määritetään tarkasti juuri ennen liuoksen käyttöä jakaantumiskertoimen määritykseen. Liuosta on pidettävä olosuhteissa, joissa sen stabiliteetti voidaan taata.
1.6.2.2 Testiolosuhteet
Lämpötila on pidettävä vakiona (± 1 oC) alueella 20–25 oC.
1.6.2.3 Mittauksen suorittaminen
1.6.2.3.1
Jokaista testiolosuhdetta varten valmistetaan kaksi testausastiaa, joissa on tarkasti mitatut määrät kumpaakin liuotinta ja tarpeellinen määrä varastoliuosta.
Mitataan n-oktanolifaasit tilavuuden mukaan. Testausastiat pannaan sopivaan ravistuslaitteeseen tai niitä ravistetaan käsin. Jos käytössä on sentrifugiputki, suositellaan sen kääntämistä nopeasti poikittaisakselillaan 180 astetta, jolloin mahdollisesti loukkuun jäänyt ilma nousee molempien faasien läpi. Käytäntö on osoittanut, että 50 tällaisella käännöllä voidaan saavuttaa jakaantumistasapaino. Varmuuden vuoksi suositellaan kuitenkin 100:aa kääntöä viidessä minuutissa.
1.6.2.3.2
Tarvittaessa faasien erotukseen on käytettävä sentrifugointia. Tämä tehdään laboratoriosentrifugissa huoneenlämmössä. Jos sentrifugissa ei ole termostaattia, sentrifugiputket on pidettävä testilämpötilassa vähintään yhden tunnin ajan ennen analyysia.
1.6.2.4 Analyysi
Jakaantumiskertoimen määritystä varten on määritettävä näytteen pitoisuus kummassakin faasissa. Tämä voidaan toteuttaa ottamalla alikvootti kumpaakin faasia kummastakin putkesta testiolosuhdetta kohti ja analysoimalla otokset valitulla menetelmällä. Aineen kokonaismäärä kummassakin faasissa lasketaan ja arvoja verrataan alun perin lisättyyn määrään.
Näytteenotto vesifaasista on tehtävä menetelmällä, joka minimoi n-oktanolin mukaanpääsyn riskin. Poistettavalla neulalla varustettu lasiruisku on hyvä vaihtoehto. Näytteenottoa varten ruisku täytetään osittain ilmalla, joka työnnetään varovasti ulos vietäessä ruisku n-oktanolikerroksen läpi. Tämän jälkeen ruiskuun vedetään sopiva määrä vesifaasia. Ruisku poistetaan nopeasti liuoksesta ja neula irrotetaan. Ruiskun sisältöä voidaan tämän jälkeen käyttää vesinäytteenä. Aineen pitoisuus kummassakin erotetussa faasissa määritetään mieluiten ainekohtaisella menetelmällä. Sopivia analyyttisiä menetelmiä ovat esimerkiksi
|
— |
fotometriset menetelmät, |
|
— |
kaasukromatografia, |
|
— |
nestekromatografia (HPLC). |
1.6.3 HPLC-menetelmä
1.6.3.1 Valmistelutoimet
Laite
Menetelmää varten tarvitaan sykkimättömällä pumpulla ja sopivalla ilmaisulaitteella varustettu nestekromatografi, jossa tulisi olla suihkusilmukoilla varustettu suihkuventtiili. Kiinteässä faasissa olevat polaariset ryhmät saattavat vakavasti häiritä HPCL-kolonnin tehokkuutta, minkä vuoksi polaaristen ryhmien määrä kiinteissä faaseissa (1) on minimoitava. Menetelmässä voidaan käyttää kaupallisesti saatavana olevia mikrohiukkas-vastafaasipakkauksia tai valmiiksi pakattuja kolonneja. Ruiskutusjärjestelmän ja analyyttisen kolonnin välissä voidaan pitää suojakolonnia.
Liikkuva faasi
Eluutioliuotin valmistetaan HPLC-laatuisesta metanolista ja HPLC-laatuisesta vedestä. Liuottimelle tehdään kaasunpoisto ennen käyttöä. On käytettävä isokraattista eluutiota. Metanoli-vesiseoksessa on oltava vähintään 25 % vettä. Yleensä seos, jossa on metanolia ja vettä tilavuussuhteessa 3:1, on tyydyttävä log P 6 -yhdisteiden eluoimiseksi yhdessä tunnissa, kun virtausnopeus on 1 ml/min. Jos yhdisteiden log P -arvo on suuri, saattaa olla tarpeen lyhentää eluointiaikaa (myös vertailuaineiden kohdalla) vähentämällä liikkuvan faasin polaarisuutta tai kolonnin pituutta.
Aineilla, jotka liukenevat n-oktanoliin hyvin heikosti, on yleensä poikkeavan alhainen HPLC-menetelmällä saatu log Pow -arvo. Joskus tällaisten yhdisteiden tuottamat kärjet eivät ylitä liuottimen tasoa. Syynä on todennäköisesti se, että jakaantumisprosessi on liian hidas, eikä tasapaino ehdi asettua HPLC-erotteluun normaalisti käytetyssä ajassa. Tulosten luotettavuutta voidaan yleensä parantaa pienentämällä virtausnopeutta tai metanolin ja veden välistä suhdetta.
Näytteiden ja vertailuaineiden liukoisuuden liikkuvaan faasiin on oltava tarpeeksi suuri niiden havaitsemista varten. Vain poikkeustapauksissa voidaan käyttää lisäaineita metanoli-vesiseoksen yhteydessä, koska lisäaineet muuttavat kolonnin ominaisuuksia. Jos käytetään lisäaineita kromatogrammin tuottamiseen, on ehdottomasti käytettävä erillistä, samantyyppistä kolonnia. Jos metanoli-vesiseos ei sovellu tarkoitukseen, voidaan käyttää muita orgaanisen liuottimen ja veden seoksia, esimerkiksi etanoli-vesi- tai asetonitriili-vesiseosta.
Ionisoivien yhdisteiden osalta eluentin pH on kriittinen. Sen on oltava kolonnin pH-alueella, yleensä 2-8. Puskurointia suositellaan. On varottava suolan saostumista ja kolonnin huononemista, mitä voi tapahtua eräiden orgaanisten faasi-puskuriseosten yhteydessä. HPLC-mittauksia, joissa piidioksidipohjaisen kiinteän faasin pH on yli 8, ei suositella, koska emäksinen liikkuva faasi voi aiheuttaa kolonnin suorituskyvyn nopeaa huononemista.
Liuokset
Vertailuaineiden on oltava mahdollisimman puhtaita. Testi- ja kalibrointitarkoituksiin käytettävät yhdisteet liuotetaan liikkuvaan faasiin mahdollisuuksien mukaan.
Testiolosuhteet
Mittausten aikana lämpötila saa vaihdella enintään ± 2 K.
1.6.3.2 Mittaukset
Viiveen to laskeminen
Viive to voidaan määrittää käyttämällä homologista sarjaa (esimerkiksi n-alkyylimetyyliketoneja) tai kolonnin läpi pidättymättä kulkevia orgaanisia yhdisteitä (esimerkiksi tiokarbamidia tai formamidia). Ensimmäistä vaihtoehtoa käytettäessä kolonniin ruiskutetaan vähintään seitsenosainen homologinen sarja ja vastaavat retentiot määritetään. Suoraan saadut retentiot tr(nc+1) piirretään ajan tr(nc) funktiona, ja regressioyhtälön
tr(nc+1)= a + b t r(nc)
poikkeama ja kaltevuus b määritetään (nc = hiiliatomien määrä). Viive to saadaan tämän jälkeen seuraavasta yhtälöstä:
to=a/(l - b)
Kalibrointikäyrä
Seuraavaksi laaditaan korrelaatiokäyrä, joka esittää soveltuvien vertailuaineiden log k -arvot log P -arvojen funktiona. Tätä varten ruiskutetaan samanaikaisesti sarja, jossa on 5–10 vakiovertailuainetta, joiden log P kattaa odotetun alueen. Retentiot on suositeltavaa määrittää ilmaisinjärjestelmään kytketyllä tallentavalla integraattorilla. Käyttökertoimen k vastaavat logaritmit lasketaan ja merkitään käyrään ravistuspullomenetelmällä saatujen log P -arvojen funktiona. Kalibrointi tehdään määrätyin välein, vähintään kerran päivässä, jotta kolonnin suorituskyvyn mahdolliset muutokset voidaan havaita.
Näytteen käyttökertoimen määritys
Näytettä ruiskutetaan mahdollisimman pieneen määrään liikkuvaa faasia. Retentio määritetään kaksi kertaa. Tuloksen perusteella voidaan laskea käyttökerroin k. Näytteen jakaantumiskerroin voidaan interpoloida vertailuaineiden korrelaatiokäyrästä. Jos jakaantumiskerroin on hyvin pieni tai hyvin suuri, on käytettävä ekstrapolointia. Tällöin on erityisesti otettava huomioon regressiosuoran luottamusrajat.
2. TIEDOT
Ravistuspullomenetelmä
Määritettyjen log P -arvojen luotettavuus voidaan tarkistaa vertaamalla kaksoismääritysten keskiarvoa kokonaiskeskiarvoon.
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
aineen tarkka spesifikaatio (tunnistustiedot, epäpuhtaudet), |
|
— |
jos menetelmiä ei voida soveltaa (esimerkiksi aineen pinta-aktiivisuuden vuoksi), laskettu arvo tai arvio, joka perustuu yksittäisiin n-oktanoli- tai vesiliukoisuuksiin, |
|
— |
kaikki tiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta, erityisesti epäpuhtauksien ja aineen fysikaalisen olomuodon osalta. |
Ravistuspullomenetelmän osalta:
|
— |
alustavan arvioinnin tulos (jos sellainen on tehty), |
|
— |
määrityslämpötila, |
|
— |
tiedot pitoisuuden määritykseen käytetyistä analyyttisista menetelmistä, |
|
— |
sentrifugointiaika ja -nopeus (jos sentrifugointia on käytetty), |
|
— |
kummastakin faasista mitatut pitoisuudet (eli raportoidaan yhteensä 12 pitoisuutta) jokaista määritystä kohti, |
|
— |
näytteen paino, yksittäisten testausastioiden faasien tilavuudet ja näytteen laskettu kokonaismäärä jokaisessa faasissa tasapainon saavuttamisen jälkeen, |
|
— |
jakaantumiskertoimen (P) lasketut arvot, keskiarvo ja kaikkien määritysten keskiarvo jokaista testiolosuhdetta kohti. Jos on havaittu merkkejä jakaantumiskertoimen vaihtelusta pitoisuuden mukaan, tästä on oltava maininta raportissa, |
|
— |
yksittäisten P-arvojen keskihajonta keskiarvon suhteen, |
|
— |
kaikkien määritysten P-keskiarvo ilmoitetaan kymmenkantaisena logaritmilukuna, |
|
— |
laskettu teoreettinen Pow kun tällainen on määritetty tai kun mittausten perusteella saatu arvo on > 104, |
|
— |
käytetyn veden ja vesifaasin pH, |
|
— |
jos on käytetty puskureita veden sijasta, on ilmoitettava syy, puskureiden kokoonpano, pitoisuus ja pH sekä vesifaasin pH ennen testiä ja sen jälkeen. |
HPLC-menetelmän osalta:
|
— |
alustavan arvioinnin tulos (jos sellainen on tehty), |
|
— |
näytteet ja vertailuaineet sekä niiden puhtausaste, |
|
— |
määritysten lämpötila-alue, |
|
— |
pH, jossa määritykset on tehty, |
|
— |
analyyttisen kolonnin, suojakolonnin, liikkuvan faasin ja ilmaisumenetelmän tiedot, |
|
— |
retentiotiedot ja lähdekirjallisuudesta saadut, kalibroinnissa käytettyjen vertailuaineiden log P -arvot, |
|
— |
regressiosuoran tiedot (log k:n riippuvuus log P:stä), |
|
— |
retentiotietojen keskiarvo ja näytteen interpoloitu log P -arvo, |
|
— |
laitteen ja käyttöolosuhteiden kuvaus, |
|
— |
eluointiprofillit, |
|
— |
kolonniin pantujen näytteiden ja vertailuaineiden määrät, |
|
— |
viiveet ja niiden mittaustavat. |
4. VIITTEET
|
(1) |
OECD, Paris, 1981, Test Guideline 107, Decision of the Council C(81) 30 final. |
|
(2) |
C. Hansch and A. J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979. |
|
(3) |
Log P and Parameter Database, A tool for the quantitative prediction of bioactivity (C. Hansch, chairman, A. J. Leo, dir.) — Available from Pomona College Medical Chemistry Project 1982, Pomona College, Claremont, California 91711. |
|
(4) |
L. Renberg, G. Sundström and K. Dundh-Nygärd, Chemosphere, 1980, vol. 80, 683. |
|
(5) |
H. Ellgehausen, C. D'Hondt and R. Fuerer, Pestic. Sei., 1981, vol. 12, 219 (1981). |
|
(6) |
B. McDuffie, Chemosphere, 1981, vol. 10, 73. |
|
(7) |
W. E. Hammers et al, J. Chromatogr., 1982, vol. 247, 1. |
|
(8) |
J. E. Haky and A. M. Young, J. Liq. Chromat., 1984, vol. 7, 675. |
|
(9) |
S. Fujisawa and E. Masuhara, J. Biomed Mat. Res., 1981, vol. 15, 787. |
|
(10) |
O. Jubermann, Verteilen und Extrahieren, in Methoden der Organischen Chemie (Houben Weyl), Allgemeine Laboratoriumpraxis (edited by E. Muller), Georg Thieme Verlag, Stuttgart, 1958, Band I/1, 223-339. |
|
(11) |
R. F. Rekker and H. M. de Kort, Euro. J. Med. Chem., 1979, vol. 14, 479. |
|
(12) |
A. Leo, C. Hansch and D. Elkins, Partition coefficients and their uses, Chem. Rev., 1971, vol. 71, 525. |
|
(13) |
R. F. Rekker, The Hydrophobic Fragmental Constant, Elsevier, Amsterdam, 1977. |
|
(14) |
NF T 20-043 AFNOR (1985). Chemical products for Industrial use — Determination of partition coefficient — Flask shaking method. |
|
(15) |
C. V. Eadsforth and P. Moser, Chemosphere, 1983, vol. 12, 1459. |
|
(16) |
A. Leo, C. Hansch and D. Elkins, Chem. Rev, 1971, vol. 71, 525. |
|
(17) |
C. Hansch, A. Leo, S. H. Unger, K. H. Kim, D. Nikaitani and E. J. Lien, J. Med. Chem., 1973, vol. 16, 1207. |
|
(18) |
W. B. Neely, D. R. Branson and G. E. Blau, Environ. Sci. Technol., 1974, vol. 8, 1113. |
|
(19) |
D. S. Brown and E. W. Flagg, J. Environ. Qual., 1981, vol. 10, 382. |
|
(20) |
J. K. Seydel and K. J. Schaper, Chemische Struktur und biologische Aktivität von Wirkstoffen, Verlag Chemie, Weinheim, New York, 1979. |
|
(21) |
R. Franke, Theoretical Drug Design Methods, Elsevier, Amsterdam, 1984. |
|
(22) |
Y. C. Martin, Quantitative Drug Design, Marcel Dekker, New York, Basel, 1978. |
|
(23) |
N. S. Nirrlees, S. J. Noulton, C. T. Murphy, P. J. Taylor; J. Med. Chem., 1976, vol. 19, 615. |
Liite 1
Laskenta- ja arviointimenetelmät
JOHDANTO
Julkaisussa Handbook of Chemical Property Estimation Methods (a) on yleinen johdatus aiheeseen (laskentamenetelmiä, tietoja ja esimerkkejä).
Laskettuja Pow-arvoja voidaan käyttää seuraviin tarkoituksiin:
|
— |
päättäminen soveltuvasta kokeellisesta menetelmästä (ravistuspullomenetelmän alue: log Pow: - 2...4, HPLC-menetelmän alue: log Pow: 0...6), |
|
— |
sopivien testiolosuhteiden (esimerkiksi HPLC-menetelmän vertailuaineiden ja ravistuspullomenetelmän n-oktanoli-vesisuhteen) valinta, |
|
— |
laboratorion sisäiset tarkistukset menetelmävirheiden löytämiseksi, |
|
— |
Pow-arvion antaminen tapauksissa, joissa kokeellisia menetelmiä ei voida soveltaa teknisistä syistä. |
ARVIOINTIMENETELMÄ
Jakaantumiskertoimen alustava arviointi
Jakaantumiskertoimen arvo voidaan arvioida näytteen liukoisuudesta puhtaisiin liuottimiin, joka voidaan laskea seuraavan suureyhtälön avulla:
![]()
LASKENTAMENETELMÄT
Laskentamenetelmien periaate
Kaikki laskentamenetelmät perustuvat molekyylin muodolliseen fragmentointiin sopiviin alarakenteisiin, joille on tiedossa luotettavat log Pow -differentiaalit. Koko molekyylin log Pow -arvo voidaan tämän jälkeen laskea fragmenttiarvojensa summana lisättynä korjaustermeillä, jotka perustuvat molekyylin sisäisiin vuorovaikutuksiin.
Luettelot fragmenttivakioista ja korjaustermeistä ovat saatavana lähteistä (b), (c), (d) ja (e). Joitakin niistä päivitetään säännöllisesti.
Laatukriteerit
Yleisesti ottaen laskentamenetelmien luotettavuus heikkenee tutkittavan yhdisteen monimutkaisuuden kasvaessa. Kun tutkitaan yksinkertaisia molekyyleja, joilla on alhainen molekyylipaino ja yksi tai kaksi funktionaalista ryhmää, voidaan odottaa, että poikkeama fragmentaatiomenetelmien ja mitatun arvon välillä on 0,1-0,3 log Pow -yksikköä. Kun käsitellään monimutkaisempia molekyyleja, virhemarginaali voi olla tätä suurempi. Tämä vaihtelee fragmenttivakioiden luotettavuuden ja saatavuuden mukaan sekä sen mukaan, miten hyvin molekyylin sisäiset vuorovaikutukset (esimerkiksi vetysidokset) ovat tunnistettavissa ja miten hyvin korjaustermejä osataan käyttää (ongelma pienenee käytettäessä tietokoneohjelmaa CLOGP-3) (b). Kun käsitellään ionisoivia yhdisteitä, on tärkeää, että lataus tai ionisointiaste otetaan huomioon oikealla tavalla.
Laskentamenetelmät
Hanschin π-menetelmä
Alkuperäinen hydrofobinen substituenttivakio, π, jonka ovat esittäneet Fujita et al. (f), määritetään seuraavasti:
πx = log Pow (PhX) - log Pow (PhH)
jossa Pow (PhX) on aromaattisen johdannaisen jakaantumiskerroin ja Pow (PhH) on emoyhdisteen jakaantumiskerroin. Esimerkki:
(πCl = log Pow (C6H5Cl) - log Pow (C6H6) = 2,84-2,13 = 0,71.
Tämän määritelmän mukaan p-menetelmä soveltuu lähinnä aromaattiseen substituutioon, p-arvot suurelle määrälle substituentteja on yhdistetty taulukkomuotoon (b), (c), (d). Arvoja käytetään aromaattisten molekyylien tai alarakenteiden log Pow -arvojen laskentaan.
Rekker-menetelmä
Rekkerin mukaan (g) log Pow -arvo lasketaan seuraavasti:
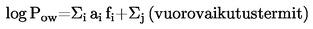
jossa f1 edustaa eri molekyylifragmenttivakioita ja a1 niiden esiintymistaajuutta tutkittavassa molekyylissa. Korjaustermit voidaan esittää yhden ainoan vakion Cm integraalikerrannaisina (niin sanottuna maagisena vakiona). Fragmenttivakiot f1 ja Cm on määritetty 1 054 kokeellista Pow-arvoa (825 yhdistettä) sisältävän luettelon perusteella moninkertaista regressioanalyysiä (c), (h) käyttäen. Vuorovaikutustermin määritys tehdään lähdekirjallisuudessa kuvatun säännöstön mukaan (e), (h), (i).
Hansch-Leon menetelmä
Hanschin ja Leon mukaan (c) log Pow lasketaan seuraavan suureyhtälön mukaan:

jossa f1 edustaa eri molekyylifragmenttivakioita, Fj korjaustermejä ja ai, bj vastaavia esiintymistaajuuksia. Yrityksen ja erehdyksen kautta on koottu kokeellisista Pow-arvoista johdettujen atomien ja ryhmien fragmenttiarvojen luettelo sekä korjaustermien Fj (niin sanottujen kertoimien) luettelo. Korjaustermit on jaettu useaan eri luokkaan (a), (c). Kaikkien näiden sääntöjen ja korjaustermien huomioonottaminen on melko monimutkaista ja hidasta. Tehtävää helpottavat markkinoilla myytävät erikoisohjelmat (b).
Yhdistetty menetelmä
Monimutkaisten molekyylien Pow-laskentaa voidaan helpottaa huomattavasti jakamalla molekyylit suurehkoihin alarakenteisiin, joille on saatavana luotettavia Pow-arvoja joko taulukoista (b), (c) tai omista mittauksista. Tällaiset fragmentit (esimerkiksi heterosykliset renkaat, antrakinoni ja atsobentseeni) voidaan sen jälkeen yhdistää Hanschin π-arvoihin tai Rekkerin tai Leon fragmenttivakioihin.
Huomautuksia
|
i) |
Laskentamenetelmiä voidaan soveltaa vain osittain tai kokonaan ionisoituihin yhdistelmiin, edellyttäen, että tarpeelliset korjauskertoimet voidaan ottaa huomioon. |
|
ii) |
Jos voidaan olettaa, että molekyylin sisällä on vetysidoksia, on lisättävä vastaavat korjaustermit (noin +0,6...+ 0,1 log Pow -yksikköä). Indikaatiot vetysidosten olemassaolosta saadaan stereomalleista tai molekyylin spektroskooppisista tiedoista. |
|
iii) |
Jos useat tautomeeriset muodot ovat mahdollisia, todennäköisintä muotoa käytetään laskennan perustana. |
|
iv) |
Fragmenttivakioluetteloiden päivityksiä on seurattava huolella. |
Raportti
Kun käytetään laskenta- tai arviointimenetelmiä, testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
aineen kuvaus (seos, epäpuhtaudet jne.), |
|
— |
indikaatiot mahdollisten vetysidosten olemassaolosta, dissosiaatiosta, latauksesta tai muista epätavallisista ilmiöistä (esimerkiksi tautomeria), |
|
— |
laskentamenetelmän kuvaus, |
|
— |
tietokannan nimi tai lähde, |
|
— |
fragmenttivalinnan erikoispiirteitä, |
|
— |
yksityiskohtainen selvitys laskennasta. |
LÄHDEKIRJALLISUUS
|
(a) |
W. J. Lyman, W. F. Reehl and D. H. Rosenblatt (ed.), Handbook of Chemical Property Estimation Methods, McGraw-Hill, New York, 1983. |
|
(b) |
Pomona College, Medicinal Chemistry Project, Claremont, California 91711, USA, Log P Database and Med. Chem. Software (Program CLOGP-3). |
|
(c) |
C. Hansch, A. J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979. |
|
(d) |
A. Leo, C. Hansch, D. Elkins, Chem. Rev., 1971, vol. 71, 525. |
|
(e) |
R. F. Rekker, H. M. de Kort, Eur. J. Med. Chem.- Chim Ther, 1979, vol. 14, 479. |
|
(f) |
T. Fujita, J. lwasa and C. Hansch, J. Amer. Chem. Soc., 1964, vol. 86, 5175. |
|
(g) |
R. F. Rekker, The Hydrophobic Fragmental Constant, Pharmacochemistry Library, Elsevier, New York, 1977, vol. 1. |
|
(h) |
C. V. Eadsforth, P. Moser, Chemosphere, 1983, vol. 12, 1459. |
|
(i) |
R. A. Scherrer, ACS — American Chemical Society, Washington, D. C. 1984, Symposium Series 255, p. 225. |
Liite 2
Suositeltavia vertailuaineita HPLC-menetelmää varten
|
Nro |
Vertailuaine |
log Pow |
pKa |
|
1 |
2-butanoni |
0,3 |
|
|
2 |
4-asetyylipyridini |
0,5 |
|
|
3 |
Aniliini |
0,9 |
|
|
4 |
Asetanilidi |
1,0 |
|
|
5 |
Bentsyylialkoholi |
1,1 |
|
|
6 |
p-metoksifenoli |
1,3 |
pKa = 10,26 |
|
7 |
Fenoksietikkahappo |
1,4 |
pKa = 3,12 |
|
8 |
Fenoli |
1,5 |
pKa = 9,92 |
|
9 |
2,4-dinitrofenoli |
1,5 |
pKa = 3,96 |
|
10 |
Bentsonitriili |
1,6 |
|
|
11 |
Fenyyliasetonitriili |
1,6 |
|
|
12 |
4-metyylibentsyylialkoholi |
1,6 |
|
|
13 |
Asetofenoni |
1,7 |
|
|
14 |
2-nitrofenoli |
1,8 |
pKa = 7,17 |
|
15 |
3-nitrobentsoehappo |
1,8 |
pKa = 3,47 |
|
16 |
4-kloorianiliini |
1,8 |
pKa = 4,15 |
|
17 |
Nitrobentseeni |
1,9 |
|
|
18 |
Kanelihappo |
1,9 |
|
|
19 |
Bentsoehappo |
1,9 |
pKa = 4,19 |
|
20 |
p-kresoli |
1,9 |
pKa = 10,17 |
|
21 |
Kanelihappo |
2,1 |
pKa = 3,89 cis 4,44 trans |
|
22 |
Anisoli |
2,1 |
|
|
23 |
Metyylibentsoaatti |
2,1 |
|
|
24 |
Bentseeni |
2,1 |
|
|
25 |
3-metyylibentsoehappo |
2,4 |
pKa = 4,27 |
|
26 |
4-klorofenoli |
2,4 |
pKa = 9,1 |
|
27 |
Trikloroetyleeni |
2,4 |
|
|
28 |
Atrasiini |
2,6 |
|
|
29 |
Etyylibentsoaatti |
2,6 |
|
|
30 |
2,6-diklorobentsonitriili |
2,6 |
|
|
31 |
3-klorobentsoehappo |
2,7 |
pKa = 3,82 |
|
32 |
Tolueeni |
2,7 |
|
|
33 |
1-naftoli |
2,7 |
pKa = 9,34 |
|
34 |
2,3-dikloroanilini |
2,8 |
|
|
35 |
Klorobentseeni |
2,8 |
|
|
36 |
Allyylifenyylieetteri |
2,9 |
|
|
37 |
Bromobentseeni |
3,0 |
|
|
38 |
Etyylibentseeni |
3,2 |
|
|
39 |
Bentsofenoni |
3,2 |
|
|
40 |
4-fenyylifenoli |
3,2 |
pKa = 9,54 |
|
41 |
Tymoli |
3,3 |
|
|
42 |
1,4-diklorobentseeni |
3,4 |
|
|
43 |
Difenyyliamiini |
3,4 |
pKa = 0,79 |
|
44 |
Naftaleeni |
3,6 |
|
|
45 |
Fenyylibentsoaatti |
3,6 |
|
|
46 |
Isopropyylibentseeni |
3,7 |
|
|
47 |
2,4,6-trikloorifenoli |
3,7 |
pKa = 6 |
|
48 |
Bifenyyli |
4,0 |
|
|
49 |
Bentsyylibentsoaatti |
4,0 |
|
|
50 |
2,4-dinitro-6 sek. butyylifenoli |
4,1 |
|
|
51 |
1,2,4-triklooribentseeni |
4,2 |
|
|
52 |
Dodekaanihappo |
4,2 |
|
|
53 |
Difenyylieetteri |
4,2 |
|
|
54 |
n-butyylibentseeni |
4,5 |
|
|
55 |
Fenantreeni |
4,5 |
|
|
56 |
Fluoranteeni |
4,7 |
|
|
57 |
Dibentsyyli |
4,8 |
|
|
58 |
2,6-difenyylipyridiini |
4,9 |
|
|
59 |
Trifenyyliamiini |
5,7 |
|
|
60 |
DDT |
6,2 |
|
|
Muita vertailuaineita, joilla on pieni log Pow -arvo |
|||
|
1 |
Nikotiinihappo |
-0,07 |
|
A.9 LEIMAHDUSPISTE
1. MENETELMÄ
1.1 JOHDANTO
On suositeltavaa selvittää tutkittavan aineen syttyvyys ennen testauksen aloittamista. Testimenetelmää voidaan soveltaa nestemäisiin aineisiin, joiden höyryt ovat sytytettävissä sytytyslähteen avulla. Tässä luetellut testimenetelmät ovat luotettavia vain menetelmien yhteydessä mainituilla leimahduspistealueilla.
Menetelmän valinnassa on otettava huomioon mahdolliset kemialliset reaktiot tutkittavan aineen ja näytteenpitimen välillä.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Leimahduspiste on alin lämpötila, korjattuna 101,325 kPa:n paineeseen, jossa neste testimenetelmässä kuvatuissa olosuhteissa muodostaa niin paljon höyryä, että testausastiassa muodostuu syttyvä höyryn ja ilman seos.
Yksiköt: oC
t = T - 273,15
(t annetaan Celsius-asteina ja T kelvineinä)
1.3 VERTAILUAINEET
Uutta ainetta tutkittaessa ei aina tarvitse käyttää vertailuaineita. Vertailuaineita käytetään lähinnä menetelmän toimivuuden ajoittaiseen tarkistamiseen ja verrattaessa tuloksia muiden menetelmien avulla saatuihin tuloksiin.
1.4 TESTIMENETELMÄN PERIAATE
Näyte pannaan testausastiaan ja se kuumennetaan tai jäähdytetään testilämpötilaan testimenetelmän ohjeiden mukaan. Tämän jälkeen selvitetään syttymiskokeiden avulla, leimahtaako näyte testilämpötilassa vai ei.
1.5 LAATUKRITEERIT
1.5.1 Toistettavuus
Toistettavuus vaihtelee leimahduspistealueen ja testimenetelmän mukaan. Maksimiarvo on 2 oC.
1.5.2 Herkkyys
Herkkyys vaihtelee testimenetelmän mukaan.
1.5.3 Spesifisyys
Joidenkin testimenetelmien spesifisyys rajoittuu määrättyyn leimahduspistealueeseen ja vaihtelee aineen ominaisuuksien (esimerkiksi viskositeetin) mukaan.
1.6 MENETELMÄKUVAUS
1.6.1 Valmistelutoimet
Näyte asetetaan laitteeseen kohdan 1.6.3.1 tai 1.6.3.2. mukaan.
Turvallisuussyistä suositellaan, että voimakkaasti reagoivien tai myrkyllisten aineiden kohdalla valitaan menetelmä, jossa näyte on pieni, noin 2 cm3.
1.6.2 Testiolosuhteet
Turvallisuusmääräysten mukaan laite on pidettävä paikassa, jossa ei ole vetoa.
1.6.3 Työjärjestys
1.6.3.1 Tasapainomenetelmä
Katso seuraavia standardeja: ISO 1516, ISO 3680, ISO 1523, ISO 3679.
1.6.3.2 Tasapainottomuusmenetelmä
Abelin laite:
Katso seuraavia standardeja: BS 2000 osa 170, NF M07.011, NF T66-009.
Abel-Penskyn laite:
Katso seuraavia standardeja: EN 57, DIN 51755 osa 1 (lämpötila-alue 5-65 oC), DIN 51755 osa 2 (lämpötilat alle 5 oC), NF M07-036.
Tagin laite:
Katso standardia ASTM D 56.
Pensky- Martensin laite:
Katso seuraavia standardeja: ISO 2719, EN 11, DIN 51758, ASTM D 93, BS 2000-34, NF M07-019.
Huomautuksia:
Jos kohdan 1.6.3.2 mukaisen tasapainottomuusmenetelmän tuloksena saadaan leimahduspiste, joka on 0 ± 2 oC, 21 ± 2 oC tai 55 ± 2 oC, tulos on vahvistettava tasapainomenetelmän avulla samaa laitetta käyttäen.
Ilmoituskelpoisia ovat vain sellaiset menetelmät, joilla saadaan leimahduspisteen lämpötila.
Nesteiden, jotka sisältävät liuotinta ja joiden viskositeetti on suuri (esimerkiksi maalien ja kumien) leimahduspisteen määritykseen saa käyttää ainoastaan laitteita ja testimenetelmiä, jotka soveltuvat suuren viskositeetin omaavien nesteiden leimahduspisteen määritykseen.
Katso seuraavia standardeja: ISO 3679, ISO 3680, ISO 1523, DIN 53213 osa 1.
|
2. |
TIEDOT |
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
aineen tarkka spesifikaatio (tunnistustiedot ja epäpuhtaudet), |
|
— |
käytetty menetelmä ja mahdolliset poikkeamat, |
|
— |
kaikki tiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta. |
4. VIITTEET
Viitteitä ei ole.
A.10 SYTITVYYS (KIINTEÄT AINEET)
1. MENETELMÄ
1.1 JOHDANTO
On suositeltavaa selvittää tutkittavan aineen mahdolliset räjähtävät ominaisuudet ennen testiä.
Testimenetelmää tulee soveltaa vain jauhemaisiin, rakeisiin tai pastamaisiin aineisiin.
Koska ei ole käytännöllistä testata kaikkia syttyviä aineita, vaan vain sellaisia, jotka palavat nopeasti tai joiden palamisominaisuudet ovat joltakin osalta erityisen vaaralliset, herkästi syttyväksi aineeksi luokitellaan vain sellaiset, joiden palamisnopeus ylittää määrätyn raja-arvon.
Hehku, joka etenee metallijauheessa, voi olla erityisen vaarallinen palon sammutusvaikeuksien vuoksi. Metallijauheita on pidettävä herkästi syttyvinä, jos hehku etenee niissä massan läpi määrätyssä ajassa.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Palamisaika sekunteina.
1.3 VERTAILUAINEET
Vertailuaineita ei ole määritetty.
1.4 MENETELMÄN PERIAATE
Aine muotoillaan yhteneväksi nauhaksi tai jauhelinjaksi, jonka pituus on noin 250 mm. Alustavan seulontatestin avulla määritetään, eteneekö kyteminen tai liekki, kun aine sytytetään kaasuliekillä. Jos liekki tai kyteminen etenee yli 200 mm annetun ajan kuluessa, aineen palamisnopeus määritetään kattavan testiohjelman avulla.
1.5 LAATUKRITEERIT
Laatukriteerejä ei ole määritetty.
1.6 MENETELMÄKUVAUS
1.6.1 Alustava seulontatesti
Aine muotoillaan yhteneväksi nauhaksi tai jauhelinjaksi, jonka pituus on noin 250 mm, leveys 20 mm ja korkeus 10 mm, palamattomalle, ei-huokoiselle ja heikosti lämpöä johtavalle alustalle.
Kaasupolttimen kuumaa liekkiä (vähimmäishalkaisija 5 mm) pidetään jauhelinjan toisessa päässä, kunnes jauhe syttyy tai enintään 2 minuuttia (5 minuuttia metallien ja metalliseosten kohdalla). Seurataan, eteneekö palaminen 200 mm linjaa pitkin 4 minuutin testijakson aikana (40 minuuttia metallijauheiden kohdalla). Jos aine ei syty eikä liekki tai kyteminen etene 200 mm:ä 4 minuutin testijakson aikana (40 minuuttia metallijauheiden kohdalla), ainetta ei pidetä herkästi syttyvänä, eikä lisätestausta tarvita. Jos aineen palaminen etenee jauhelinjaa pitkin 200 mm alle 4 minuutissa (tai alle 40 minuutissa metallijauheiden kohdalla), testausta on jatkettava jäljempänä kuvatun menetelmän mukaan (jatka kohdasta 1.6.2).
1.6.2 Palamisnopeuden testaus
1.6.2.1 Valmistelutoimet
Jauhemaista tai rakeista ainetta pannaan kevyelti 250 mm pitkään muottiin, jonka kolmionmuotoisen läpileikkauksen sisäkorkeus on 10 mm ja leveys 20 mm. Muotin pituussuunnassa on molemmille sivuille kiinnitetty kaksi metallilevyä siten, että levyjen yläreuna on 2 mm muotin reunan yläpuolella (katso kuvaa). Muotti pudotetaan kolme kertaa 2 cm:n korkeudelta kiinteälle pinnalle. Tarvittaessa ainetta lisätään muottiin. Tämän jälkeen sivulevyt poistetaan ja ylimääräinen aines kaavitaan pois. Muotille asetetaan palamaton, ei-huokoisesta ja heikosti lämpöä johtavasta aineesta valmistettu aluslevy, laite käännetään ja muotti poistetaan.
Pastamaiset aineet levitetään nauhana, jonka pituus on 250 mm ja läpileikkaus noin 1 cm2, palamattomalle, ei-huokoiselle ja lämpöä heikosti johtavalle alustalle.
1.6.2.2 Testiolosuhteet
Jos aine on herkkä kosteudelle, testi on tehtävä mahdollisimman pian aineen säilöstä ottamisen jälkeen.
1.6.2.3 Työjärjestys
Aseta näyte vetokaappiin.
Veto on säädettävä sellaiseksi, ettei laboratoriotiloihin pääse savua. Vedon voimakkuus ei saa vaihdella testin aikana. Laitteen ympärille pystytetään suojaseinä vetoa vastaan.
Näytenauha sytytetään toisesta päästä kaasupolttimen kuumalla liekillä, jonka halkaisija on vähintään 5 mm. Kun palaminen on edennyt 80 mm:n verran, mitataan palamisnopeus seuraavalla 100 mm:n osuudella. Testi tehdään kuusi kertaa käyttäen aina puhdasta ja kylmää alustaa, ellei positiivista tulosta saavuteta aiemmin.
2. TIEDOT
Arvioinnissa käytetään alustavasta seulontatestistä saatua palamisaikaa (1.6.1) ja enintään kuudesta testistä saatua lyhyintä palamisaikaa (1.6.2.3).
3. RAPORTOINTI
3.1 TESTIRAPORTTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
aineen tarkka spesifikaatio (tunnistustiedot, epäpuhtaudet), |
|
— |
testattavan aineen kuvaus, sen fysikaalinen olomuoto ja kosteuspitoisuus, |
|
— |
tulokset alustavasta seulonta- ja palamisnopeustestistä, jos tällaiset on tehty, |
|
— |
kaikki tiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta. |
3.2 TULOSTEN TULKINTA
Jauhemaisia, rakeisia tai pastamaisia aineita pidetään herkästi syttyvinä, jos niiden palamisaika minkä tahansa kohdassa 1.6.2 kuvatun testin tuloksena on lyhyempi kuin 45 sekuntia. Metalli- tai metalliseosjauheita pidetään herkästi syttyvinä, jos ne voidaan sytyttää ja liekin tai reaktioalueen leviäminen koko näytteeseen kestää enintään kymmenen minuuttia.
4. VIITTEET
|
(1) |
NF T 20-042 (SEPT 85). Chemical products for industrial use. Determination of the flammability of solids. |
Liite
Kuva
Muotti ja tarvikkeet näytteen valmistelua varten
(Kaikki mitat ovat millimetreinä)

A.11 SYTTYVYYS (KAASUT)
1. MENETELMÄ
1.1 JOHDANTO
Tällä menetelmällä voidaan määrittää pitoisuusalueet, joilla ilma-kaasuseos syttyy huoneenlämpötilassa (noin 20 oC:ssa) ja normaalissa ilmanpaineessa. Tutkittavan kaasun ja ilman seoksia altistetaan kaasupitoisuuksia suurentaen sähkökipinälle ja tarkkaillaan, syttyykö seos vai ei.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Syttyvyysalue on alimman ja ylimmän räjähdysrajan välinen pitoisuusalue. Alin ja ylin räjähdysraja ovat ne syttyvän kaasun ja ilman seoksen pitoisuudet, joissa ei synny leimahdusta.
1.3 VERTAILUAINEET
Vertailuaineita ei ole määritetty.
1.4 MENETELMÄN PERIAATE
Ilman kaasupitoisuutta suurennetaan asteittain ja jokaisen vaiheen pitoisuuden seos altistetaan sähkökipinälle.
1.5 LAATUKRITEERIT
Laatukriteerejä ei ole määritetty.
1.6 MENETELMÄKUVAUS
1.6.1 Laite
Testausastia on pystysuora lasisylinteri, jonka sisähalkaisija on vähintään 50 mm ja korkeus vähintään 300 mm. Sytytyselektrodit sijaitsevat 3–5 mm:n etäisyydellä toisistaan ja 60 mm:n korkeudella sylinterin pohjasta. Sylinterissä on paineentasausaukko. Laitteen ympärillä on oltava suoja mahdollisten räjähdysvahinkojen estämiseksi.
Kipinälähteenä käytetään 0,5 sekunnin induktiokipinää, joka saadaan korkeajännitemuuntajasta, jonka lähtöjännite on 10-15 kV (tehontarve enintään 300 W). Esimerkki soveltuvasta laitteesta on viitteessä (2).
1.6.2 Testiolosuhteet
Testi tehdään huoneenlämpötilassa (noin 20 oC:ssa).
1.6.3 Työjärjestys
Lasisylinteriin pumpataan annostuspumpulla kaasu-ilmaseosta, jonka pitoisuus tunnetaan. Seoksen läpi johdetaan kipinä ja liekin mahdollista irtaantumista kipinälähteestä sekä sen itsenäistä etenemistä tarkkaillaan. Kaasupitoisuutta muutetaan yhden tilavuusprosentin askelin, kunnes syttyminen tapahtuu edellä kuvatulla tavalla.
Jos kaasun kemiallisen rakenteen perusteella voidaan olettaa, että kaasu ei ole syttyvää, ja kaasun ja ilman seoksen stökiometrimen koostumus voidaan testata 1 %:n askelin, tarvitsee testata vain seokset, joiden pitoisuus on enintään 10 % suurempi tai pienempi kuin tämä koostumus.
2. TIEDOT
Määrityksen ainoa merkitsevä tieto on liekin eteneminen.
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
aineen tarkka spesifikaatio (tunnistustiedot ja epäpuhtaudet), |
|
— |
käytetyn laitteen kuvaus mittatietoineen, |
|
— |
testilämpötila, |
|
— |
testatut pitoisuudet ja saadut tulokset, |
|
— |
testin tulos: syttyvä kaasu tai herkästi syttyvä kaasu, |
|
— |
jos kaasu todetaan syttymättömäksi, on ilmoitettava, millä pitoisuusalueella kaasua on testattu 1 %:n askelin, |
|
— |
kaikki tiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta. |
4. VIITTEET
|
(1) |
NF T 20-041 (SEPT 85). Chemical products for industrial use. Determination of the flammability of gases. |
|
(2) |
W. Berthold, D. Conrad, T, Grewer, H. Grosse-Wortmann, T. Redeker und H. Schacke. ”Entwicklung einer Standard-Apparatur zur Messung von Explosionsgrenzen”. Chem.-Ing.-Tech., 1984, vol. 56, 2, 126–127. |
A.12 SYTTYVYYS (KOSKETUS VEDEN KANSSA)
1. MENETELMÄ
1.1 JOHDANTO
Tällä testimenetelmällä voidaan määrittää, kehittääkö testattava aine veden tai kostean ilman kanssa kosketuksiin joutuessaan vaarallisia määriä kaasua tai kaasuja, jotka voivat olla herkästi syttyviä.
Testimenetelmää voidaan soveltaa sekä kiinteisiin että nestemäisiin aineisiin. Menetelmää ei voi soveltaa aineisiin, jotka syttyvät itsestään joutuessaan kosketuksiin ilman kanssa.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Herkästi syttyviä ovat aineet, jotka veden tai kostean ilman kanssa kosketuksiin joutuessaan muodostavat vaarallisia määriä herkästi syttyviä kaasuja miniminopeudella 1 l/kg/h.
1.3 MENETELMÄN PERIAATE
Ainetta testataan jäljempänä kuvatun vaiheittaisen sarjan mukaan. Jos syttymistä esiintyy, sarjaa ei tarvitse jatkaa. Jos tiedetään, että aine ei reagoi voimakkaasti veden kanssa, voidaan edetä vaiheeseen 4 (1.3.4).
1.3.1 Vaihe 1
Näyte pannaan kaukaloon, jossa on 20-celsiusasteista tislattua vettä. Todetaan, syttyykö muodostunut kaasu vai ei.
1.3.2 Vaihe 2
Näyte pannaan suodatinpaperille, joka kelluu 20-celsiusasteisen tislatun veden pinnalla sopivassa astiassa. Todetaan, syttyykö muodostunut kaasu vai ei. Suodatinpaperia tarvitaan vain pitämään näyte koossa mahdollisen syttymisen helpottamiseksi.
1.3.3 Vaihe 3
Näyte muotoillaan keoksi, jonka korkeus on noin 2 cm ja läpimitta noin 3 cm. Keolle kaadetaan muutama tippa vettä, ja todetaan, syttyykö muodostunut kaasu vai ei.
1.3.4 Vaihe 4
Näytettä sekoitetaan 20-celsiusasteiseen tislattuun veteen ja kaasun muodostumisnopeus mitataan tunnin välein seitsemän tunnin ajan. Jos muodostumisnopeus on epäsäännöllinen tai kasvava seitsemän tunnin jälkeen, mittausaika voidaan pidentää enintään viideksi päiväksi. Testi voidaan keskeyttää, jos nopeus missä tahansa vaiheessa ylittää arvon 1 l/kg/h.
1.4 VERTAILUAINEET
Vertailuaineita ei ole määritetty.
1.5 LAATUKRITEERIT
Laatukriteerejä ei ole määritetty.
1.6 MENETELMÄKUVAUKSET
1.6.1 Vaihe 1
1.6.1.1 Testiolosuhteet
Testi tehdään huoneenlämmössä (noin 20 oC:ssa).
1.6.1.2 Työjärjestys
Pieni määrä näytettä, jonka läpimitta on noin 2 mm, pannaan tislattua vettä sisältävään kaukaloon. Todetaan, (i) muodostuuko kaasua ja (ii) syttyykö kaasu. Jos kaasu syttyy, testiä ei tarvitse jatkaa, koska aine luokitellaan tällöin vaaralliseksi.
1.6.2 Vaihe 2
1.6.2.1 Laite
Sopivassa astiassa, esimerkiksi 100 ml:n haihdutusastiassa, pidetään 20-celsiusasteista tislattua vettä. Veden pinnalla kelluu suodatinpaperi.
1.6.2.2 Testiolosuhteet
Testi tehdään huoneenlämmössä (noin 20 oC:ssa).
1.6.2.3 Työjärjestys
Pieni määrä näytettä (läpimitta noin 2 mm) asetetaan suodatinpaperin keskelle. Todetaan, (i) muodostuuko kaasua ja (ii) syttyykö kaasu. Jos kaasu syttyy, testausta ei tarvitse jatkaa, koska aine luokitellaan tällöin vaaralliseksi.
1.6.3 Vaihe 3
1.6.3.1 Testiolosuhteet
Testi tehdään huoneenlämmössä (noin 20 oC:ssa).
1.6.3.2 Työjärjestys
Näyte muotoillaan keoksi, jonka korkeus on noin 2 cm ja läpimitta noin 3 cm. Keon huipulle tehdään kuoppa, johon kaadetaan muutama tippa vettä. Todetaan, (i) muodostuuko kaasua ja (ii) syttyykö kaasu. Jos kaasu syttyy, testausta ei tarvitse jatkaa, koska aine luokitellaan tällöin vaaralliseksi.
1.6.4 Vaihe 4
1.6.4.1 Laite
Laite rakennetaan kuvan mukaisesti.
1.6.4.2 Testiolosuhteet
Katsotaan, onko näytesäiliössä jauhetta (hiukkaskoko < 500 μm). Jos tällaisen jauheen paino-osuus ylittää 1 % tai jos näyte on murenevaa, koko näyte on jauhettava ennen testausta, jotta hiukkaskoko olisi pienempi varastoinnin ja käsittelyn aikana. Muuten näytettä testataan vastaanotetussa muodossa. Testi tehdään huoneenlämmössä (noin 20 °C:ssa) ja yhden ilmakehän paineessa.
1.6.4.3 Työjärjestys
Laitteen tiputussuppiloon kaadetaan 10–20 ml vettä ja erlenmeyerpulloon pannaan 10 g näytettä. Muodostuneen kaasun tilavuus voidaan mitata millä tahansa sopivalla menetelmällä. Tiputussuppilon hana avataan ja samalla käynnistetään sekuntikello. Kaasunmuodostus mitataan kerran tunnissa seitsemän tunnin ajan. Jos muodostumisnopeus on epäsäännöllinen tai kasvava seitsemän tunnin jälkeen, mittausaikaa voidaan pidentää enintään viideksi päiväksi. Testi voidaan keskeyttää, jos nopeus ylittää arvon 1 l/kg/h missä tahansa vaiheessa. Testi tehdään kolme kertaa.
Jos kaasun kemiallista koostumusta ei tunneta, kaasu on analysoitava. Jos kaasu sisältää herkästi syttyviä osia eikä tiedetä, onko koko seos herkästi syttyvä, on valmistettava koostumukseltaan samanlainen seos, joka testataan menetelmän A. 11 mukaisesti.
2. TIEDOT
Aine katsotaan vaaralliseksi, jos:
|
— |
se syttyy itsestään testin jossakin vaiheessa, tai |
|
— |
jos syttyvää kaasua muodostuu nopeudella, joka ylittää arvon 1 l/kg/h. |
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
aineen tarkka spesifikaatio (tunnistustiedot, epäpuhtaudet), |
|
— |
selvitys mahdollisista aineen valmistelutoimista, |
|
— |
testitulokset (vaiheet 1, 2, 3 ja 4), |
|
— |
muodostuneen kaasun kemiallinen koostumus, |
|
— |
kaasun muodostumisnopeus, jos vaihe 4 suoritetaan (1.6.4), |
|
— |
kaikki tiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta. |
4. VIITTEET
|
(1) |
Recommendations on the transport of dangerous goods, test and criteria, 1990, United Nations, New York. |
|
(2) |
NF T 20-040 (SEPT 85). Chemical products for industrial use. Determination of the flammability of gases formed by the hydrolysis of solid and liquid products. |
Liite
Kuva
Laite

A.13 KIINTEIDEN AINEIDEN JA NESTEIDEN ITSESYTTYVYYS
1. MENETELMÄ
1.1 JOHDANTO
Testimenetelmää voidaan soveltaa kiinteisiin ja nestemäisiin aineisiin, jotka pieninä määrinä syttyvät itsestään nopeasti jouduttuaan kosketuksiin huoneenlämpöisen (20 oC) ilman kanssa.
Testimenetelmä ei kata aineita, jotka syttyvät vain siinä tapauksessa, että niitä pidetään huoneenlämpöisessä ilmassa useita tunteja tai päiviä tai jos lämpötilaa korotetaan.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Aine luokitellaan itsestään syttyväksi, jos se syttyy tai aiheuttaa hiiltymistä kohdassa 1.6 kuvatuissa olosuhteissa.
Nesteiden itsesyttyvyyden testauksessa voidaan myös tarvita menetelmää A.15 Itsesyttymislämpötila (nesteet ja kaasut).
1.3 VERTAILUAINEET
Vertailuaineita ei ole määritetty.
1.4 MENETELMÄN PERIAATE
Näyte (kiinteä tai nestemäinen) pannaan inertille alustalle ja saatetaan kosketuksiin huoneenlämpöisen ilman kanssa viideksi minuutiksi. Jos neste ei syty tässä ajassa, se imeytetään suodatinpaperiin ja pannaan huoneenlämpöiseen (20 oC) ilmaan viideksi minuutiksi. Jos kiinteä aine tai neste syttyy tai jos neste sytyttää suodatinpaperin tai aiheuttaa sen hiiltymisen, aine luokitellaan itsestään syttyväksi.
1.5 LAATUKRITEERIT
Toistettavuus: koska itsesyttyvyysominaisuus on tärkeä turvallisuustekijä, yksi positiivinen tulos riittää aineen luokittelemiseksi itsestään syttyväksi.
1.6 MENETELMÄKUVAUKSET
1.6.1 Laite
Posliinikuppiin, jonka läpimitta on noin 10 cm, pannaan noin 5 mm:n kerros huoneenlämpöistä (noin 20 oC) piimaata.
Huomautus:
Piimaa tai muu vastaava inertti, yleisesti saatavilla oleva aine katsotaan esimerkiksi aineesta, johon testattavaa ainetta voi kaataa vahingon sattuessa.
Kuivaa suodatinpaperia tarvitaan sellaisten nesteiden testaukseen, jotka inertillä alustalla pidettyinä eivät syty joutuessaan ilman kanssa kosketuksiin.
1.6.2 Testin suorittaminen
a) Jauhemaiset kiinteät aineet
1–2 cm3 testattavaa jauhetta kaadetaan noin 1 m:n korkeudelta palamattomalle alustalle. Samalla tarkkaillaan, syttyykö aine palamaan pudotessaan tai viiden minuutin kuluessa alustalle asettumisesta.
Ellei syttymistä tapahdu, koe tehdään kuusi kertaa.
b) Nesteet
Noin 5 cm3 testattavaa nestettä kaadetaan preparoituun posliinikuppiin. Samalla tarkkaillaan, syttyykö neste viiden minuutin kuluessa.
Ellei neste syty kuuden kokeen aikana, jatketaan seuraavilla kokeilla:
0,5 ml näytenestettä annostellaan ruiskusta suodatinpaperille. Samalla tarkkaillaan, syttyykö suodatinpaperi palamaan tai hiiltyykö se viiden minuutin kuluessa nesteen lisäyksen jälkeen. Ellei syttymistä tai hiiltymistä tapahdu, testi tehdään kolme kertaa.
2. TIEDOT
2.1 TULOSTEN KÄSITTELY
Testi voidaan keskeyttää heti kun mistä tahansa testin osasta saadaan myönteinen tulos.
2.2 ARVIOINTI
Jos aine syttyy viiden minuutin kuluessa siitä, kun sitä on pantu inertille alustalle ja saatettu kosketuksiin ilman kanssa, tai jos neste sytyttää suodatinpaperin tai aiheuttaa sen hiiltymisen viiden minuutin kuluessa, aine luokitellaan itsestään syttyväksi.
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
aineen tarkka spesifikaatio (tunnistustiedot ja epäpuhtaudet), |
|
— |
testitulokset, |
|
— |
kaikki tiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta. |
4. VIITTEET
|
(1) |
NF T 20-039 (SEPT 85). Chemical products for industrial use. Determination of the spontaneous flammability of solids and liquids. |
|
(2) |
Recommendations on the Transport of Dangereous Goods, Test and Criteria, 1990, United Nations, New York. |
A.14 RÄJÄHTÄVYYS
1. MENETELMÄ
1.1 JOHDANTO
Menetelmä koostuu testiohjelmasta, jonka avulla voidaan määrittää, onko kiinteä tai pastamainen aine räjähdysaltis, kun se altistetaan liekille (lämpöherkkyys) tai iskulle tai kitkalle (mekaaninen herkkyys) ja onko neste räjähdysaltis, kun se altistetaan liekille tai iskulle.
Menetelmä on kolmiosainen:
|
a) |
lämpöherkkyyden testaus (1); |
|
b) |
iskuherkkyyden testaus (1); |
|
c) |
kitkaherkkyyden testaus (1). |
Menetelmän avulla voidaan selvittää todennäköisyys sille, että aine räjähtää, kun se altistetaan määrätyille tavallisille ärsykkeille. Menetelmää ei ole tarkoitettu käytettäväksi sen selvittämiseen, voiko aine yleensä räjähtää.
Menetelmällä voidaan määrittää, liittyykö aineeseen lämpöherkkyydestä ja mekaanisesta herkkyydestä aiheutuvaa räjähdysvaaraa direktiivin kuvaamissa erikoisolosuhteissa. Menetelmä perustuu joukkoon laitetyyppejä, joita käytetään yleisesti monissa maissa (1) ja joilla yleensä saadaan selkeitä tuloksia. Todettakoon, että menetelmä ei ole lopullinen. Myös muita laitteita voidaan käyttää, edellyttäen, että ne ovat kansainvälisesti tunnustettuja ja että tulokset ovat riittävän hyvin korreloitavissa.
Testiä ei tarvitse suorittaa, jos käytettävissä olevien termodynaamisten tietojen (esimerkiksi muodostumis- tai hajoamislämmön) tai määrättyjen reaktiivisten ryhmien (2) rakennekaavasta puuttumisen perusteella avulla voidaan täysin varmasti osoittaa, että aine ei voi hajota nopeasti muodostaen kaasuja tai lämpöä, eikä siihen näin ollen liity minkäänlaista räjähdysvaaraa. Nesteiden kohdalla ei vaadita kitkaherkkyyden testausta.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Räjähtävä:
Aineet, jotka voivat räjähtää liekin vaikutuksesta tai jotka ovat herkkiä iskulle tai kitkalle spesifioidussa laitteessa (tai ovat mekaanisesti herkempiä kuin 1,3-dinitrobentseeni vaihtoehtoisessa laitteessa).
1.3 VERTAILUAINEET
1,3-dinitrobentseeni, tekninen kiteinen tuote, joka on läpäissyt 0,5 mm:n seulan, käytetään kitka- ja iskumenetelmissä.
Perhydro-l,3,5-trinitro-l,3,5-triatsiini (RDX, heksogeeni, sykloniini — CAS 121-82-4); uudelleenkiteytetty vesipitoisesta sykloheksanonista, märkäseulottu 250 mm:n tarkkuudella ja pidätetty 150 μm:n seulaan sekä kuivattu 130 ± 2 °C:ssa (4 tuntia) toista kitka- ja iskutestisarjaa varten.
1.4 MENETELMÄN PERIAATE
On tarpeen tehdä alustavat testit, joiden avulla voidaan määrittää turvalliset olosuhteet kolmelle herkkyystestille.
1.4.1 Käsittelyturvallisuustestit (3)
Ennen varsinaisen testin aloittamista on turvallisuussyistä altistettava hyvin pieniä näytemääriä (noin 10 mg) kuumentamiselle avoimessa kaasuliekissä tai vasaran ja alasimen tai sopivan kitkakoneen avulla aikaansaatavalle kitkalle. Tarkoituksena on selvittää, onko aineen herkkyys ja räjähtävyys sellaista luokkaa, että kuvatut herkkyystestit, etenkin lämpöherkkyyden kohdalla, on henkilövahinkojen välttämiseksi suoritettava erityistä varovaisuutta noudattaen.
1.4.2 Lämpöherkkyys
Näytettä kuumennetaan teräsputkessa, joka on suljettu sopivalla reiällä varustetulla mittauslaipalla. Testin avulla selvitetään, onko aine räjähdysherkkä hyvin kuumissa olosuhteissa ja ahtaassa tilassa.
1.4.3 Mekaaninen herkkyys (isku)
Näyte altistetaan iskulle pudottamalla sen päälle määrätty massa määrätyltä korkeudelta.
1.4.4 Mekaaninen herkkyys (kitka)
Kiinteä tai pastamainen näyte altistetaan kitkalle vakiopintojen välillä käyttäen annettua kuormaa ja suhteellista liikettä.
1.5 LAATUKRITEERIT
Laatukriteerejä ei ole määritelty.
1.6 MENETELMÄKUVAUS
1.6.1 Lämpöherkkyys (liekin vaikutus)
1.6.1.1 Laite
Laitteessa on kuumennus- ja suojaosaan asennettu kertakäyttöinen teräsputki, jossa on uudelleen käytettävä suljinosa (kuva 1). Syvävedetystä teräslevystä (katso liitettä) valmistettujen putkien sisähalkaisija on 24 mm, pituus on 75 mm ja seinän paksuus 0,5 mm. Putken avoimessa päässä on laippaliitos mittauslaippaa varten. Paineenkestävä mittauslaippa kiinnitetään putkeen kaksiosaisella ruuviliitännällä (mutterilla ja kierrelaipalla). Mutteri ja kierrelaippa on valmistettu kromi-mangaaniteräksestä (katso liitettä), joka on kipinöimätöntä 800 oC:een asti. Lämmönkestävästä teräksestä valmistettujen, useilla eri reiänhalkaisijoilla varustettujen mittauslaippojen paksuus on 6 mm.
1.6.1.2 Testiolosuhteet
Yleensä aine testataan sellaisenaan. Joissakin tapauksissa (esimerkiksi jos aine on puristetussa, valetussa tai muulla tavoin tiivistetyssä muodossa) aine on murskattava ennen testiä.
Kiinteiden aineiden kussakin testauksessa käytettävä massa määritetään kaksivaiheisen kuiva-ajon avulla. Taarattuun putkeen pannaan 9 cm3 ainetta, joka sullotaan putkeen tämän koko poikkileikkauspinta-alaan kohdistuvalla 80 N:n voimalla. Turvallisuussyistä ja tapauksissa, joissa näytteen fyysinen muoto voi muuttua puristuksen vaikutuksesta, voidaan käyttää muuntyyppistä täyttömenetelmää (sullomista ei voi käyttää esimerkiksi hyvin kitkaherkkien aineiden kohdalla). Jos aine kestää puristamista, täyttöä ja sullomista jatketaan, kunnes aineen yläpinnan etäisyys putken reunasta on 55 mm. Määritetään kokonaismassa, joka on käytetty putken täyttämiseen 55 mm:iin asti, minkä jälkeen tehdään vielä kaksi lisäystä, kumpikin 80 N:n voimalla sulloen. Tämän jälkeen ainetta joko lisätään sulloen tai poistetaan niin paljon, että aineen yläpinta on 15 mm:n etäisyydellä putken reunasta. Tehdään toinen kuiva-ajo, joka aloitetaan sullotulla massalla, joka on kolmasosa ensimmäisen ajon kokonaismassasta. Kaksi tällaista määrää lisätään sulloen 80 N:n voimalla, ja aineen yläpinta säädetään ainetta lisäämällä tai poistamalla 15 mm:n tasolle putken yläpinnasta. Kussakin kokeessa käytetään toisessa ajossa määritettyä massaa; täyttö tehdään kolmella yhtä suurella määrällä, joista jokainen puristetaan 9 cm3:iin tarpeellista voimaa käyttäen (apuna voidaan käyttää välirenkaita).
Nesteet ja geelit täytetään putkeen 60 mm:n korkeuteen. Täytössä on erityisesti varottava tyhjien kohtien muodostumista. Kierrelaippa ohjataan putkeen yläkautta, valittu mittauslaippa asetetaan paikoilleen, hieman molybdeeni-disulfidipohjaista voiteluainetta lisätään ja mutteri kiristetään. On tärkeää tarkistaa, että mitään aineista ei ole jäänyt laipan ja levyn väliin tai kierteisiin.
Kuumennus tehdään propaanilla, joka otetaan kaasupullosta. Sylinterissä on oltava paineensäädin (60–70 mbar). Kaasun on kuljettava mittarin ja jakotukin kautta tasaisesti (virtauksen tasaisuus voidaan todeta pohtimien liekeistä) neljään polttimeen, Pohtimien sijoitus testauskammion ympärille ilmenee kuvasta 1. Polttimet kuluttavat yhteensä noin 3,2 litraa propaania minuutissa. Myös muita polttokaasuja tai muita polttimia voidaan käyttää, mutta kuumennusnopeuden on tällöin oltava sama kuin kuvassa 3. Kaikkien laitteiden kuumennusnopeus on tarkistettava säännöllisesti kuvasta 3 ilmenevällä tavalla dibutyyliftalaatilla täytettyjen putkien avulla.
1.6.1.3 Testin suorittaminen
Jokaista testiä jatketaan, kunnes putki hajoaa tai kunnes sitä on kuumennettu viiden minuutin ajan. Jos testin tuloksena on putken hajoaminen vähintään kolmeen osaan, jotka joissakin tapauksissa voivat olla vielä kiinni toisissaan kapeilla metallikaistaleilla (katso kuvaa 2), aineen katsotaan räjähtäneen. Jos hajoamisosien määrä on pienempi tai jos hajoamista ei tapahdu, katsotaan, että räjähdystä ei ole tapahtunut.
Ensin tehdään kolmen testin sarja, jossa mittauslaipan aukon halkaisija on 6,0 mm. Ellei räjähdystä tapahdu, tehdään toinen kolmen testin sarja, jossa mittauslaipan aukon halkaisija on 2,0 mm. Jos jommankumman sarjan tuloksena on räjähdys, testejä ei tarvitse jatkaa.
1.6.1.4 Arviointi
Testitulos katsotaan positiiviseksi, jos jommankumman edellä kuvatun testisarjan aikana tapahtuu räjähdys.
1.6.2 Mekaaninen herkkyys (isku)
1.6.2.1 Laite (kuva 4)
Tyypillisen vasaralaitteen tärkeimmät osat ovat teräsvalukappale alustoineen, alasin, pylväs, ohjaimet, pudotuspainot, irrotuslaite ja näytteenpidin. Teräsalasin (halkaisija 100 mm ja korkeus 70 mm) on kiinnitetty ruuveilla teräskappaleeseen (pituus 230 mm, leveys 250 mm ja korkeus 200 mm). Teräskappale on teräsvalualustalla (pituus 450 mm, leveys 450 mm ja korkeus 60 mm). Pylväs on tehty saumattomasta teräksestä vedetystä putkesta, ja se sijaitsee pitimessä, joka on kiinnitetty ruuveilla teräskappaleen taakse. Laite on ankkuroitu massiiviseen sementtikappaleeseen (60 x 60 x 60 cm) ruuveilla siten, että ohjainkiskot ovat ehdottomasti pystysuorassa ja pudotuspaino pääsee putoamaan vapaasti. Painot (5 kg ja 10 kg) on valmistettu umpiteräksestä. Kummankin painon pää on karkaistua terästä (HRC 60-63), iskuhalkaisijaltaan vähintään 25 mm.
Näyte suljetaan iskulaitteeseen, jossa on kaksi päällekkäistä, konsentrista, umpiteräksistä sylinteriä, jotka sijaitsevat ontossa, sylinterinmuotoisessa teräsrenkaassa. Umpiterässylintereiden on oltava halkaisijaltaan 10 (-0,003, -0,005) mm ja korkeudeltaan 10 mm ja niissä on oltava kiillotettu pinta sekä pyöristetyt reunat (kaarevuussäde 0,5 mm). Sylintereiden kovuusarvon on oltava HRC 58-65. Onton sylinterin ulkohalkaisijan on oltava 16 mm, sisähalkaisijan 10 (+0,005, +0,10) mm (kiillotettu sisäpinta) ja korkeuden 13 mm. Iskulaite on asennettu teräksiseen välialasimeen (halkaisija 26 mm ja korkeus 26 mm), joka on keskitetty renkaan avulla. Renkaassa on reiät savunpoistoa varten.
1.6.2.2 Testiolosuhteet
Näytettä käytetään 40 mm3 tai muu, vaihtoehtoiselle laitteelle sopiva määrä. Kiinteät aineet testataan kuivina ja valmistellaan seuraavasti;
|
a) |
Jauhetut aineet seulotaan (seulakoko 0,5 mm). Kaikki seulan läpäissyt aines käytetään. |
|
b) |
Puristetut tai muulla tavoin tiivistetyt aineet murskataan ja seulotaan. Testissä käytetään seulontafraktiota 0,5–1 mm, jonka on edustettava alkuperäistä ainetta. |
Aineet, jotka toimitetaan yleensä pastamuodossa, on mahdollisuuksien mukaan testattava kuivina tai vasta mahdollisimman täydellisen laimennusaineen poiston jälkeen. Nestemäisten aineiden testauksessa ylemmän ja alemman teräs sylinterin väliin on jätettävä 1 mm:n aukko.
1.6.2.3 Testin suorittaminen
Tehdään kuuden testin sarja pudottamalla 10 kg:n massa 0,40 m:n korkeudelta (40 J). Jos näiden testien aikana syntyy räjähdys, tehdään toinen kuuden testin sarja pudottamalla 5 kg:n massa 0,15 m:n korkeudelta (7,5 J). Jos käytetään muuntyyppistä laitetta, näytettä verrataan valittuun vertailuaineeseen käyttämällä hyväksyttyä menetelmää (esimerkiksi ylös-alas-tekniikkaa).
1.6.2.4 Arviointi
Testitulos katsotaan positiiviseksi, jos räjähdys (liekkeihin leimahtaminen tai muu raportti katsotaan räjähdykseksi) tapahtuu vähintään kerran määritetyllä iskulaitteella suoritetussa testissä tai jos näyte on vaihtoehtoisessa iskutestissä herkempi kuin 1,3-dinitrobentseeni tai RDX.
1.6.3 Mekaaninen herkkyys (kitka)
1.6.3.1 Laite (kuva 5)
Kitkalaitteen muodostavat valettu teräslaatta ja sille asennettu kitkayksikkö. Kitkayksikkö koostuu kiinteästä posliinitapista ja liikkuvasta posliinilaatasta, joka on kiinnitetty kahdessa ohjaimessa liikkuvaan vaunuun. Vaunu on kytketty sähkömoottoriin kytkentäsauvan, epäkeskoakselin ja sopivan vaihteiston kautta siten, että posliinilaatta liikkuu kerran edestakaisin 10 mm:n matkan posliinitapin alla. Posliinitappia voidaan kuormittaa esimerkiksi 120 tai 360 Newtonin voimalla.
Litteät posliinilaatat on valmistettu valkoisesta teknisestä posliinista (karheus 9–32 μm). Laattojen mitat ovat 25 mm (pituus) x 25 mm (leveys) x 5 mm (korkeus). Myös sylinterinmuotoinen posliinitappi on valkoista teknistä posliinia, pituudeltaan 15 mm ja halkaisijaltaan 10 mm. Tapin pää on pyöreä ja karhennettu (kaarevuussäde 10 mm).
1.6.3.2 Testiolosuhteet
Näytettä käytetään 10 mm3 tai jokin muu vaihtoehtoiseen laitteeseen sopiva määrä.
Kiinteät aineet testataan kuivina ja valmistellaan seuraavasti:
|
a) |
Jauhetut aineet seulotaan (seulakoko 0,5 mm). Kaikki seulan läpäissyt aines käytetään. |
|
b) |
Puristetut tai muulla tavalla tiivistetyt aineet murskataan ja seulotaan, Testissä käytetään alle 0,5 mm:n seulontafraktiota. |
Aineet, jotka yleensä toimitetaan pastamuodossa, on mahdollisuuksien mukaan testattava kuivina. Jos ainetta ei voi valmistella kuivassa muodossaan, pasta (jolle tehdään ensin mahdollisimman täydellinen laimennusaineen poisto) muotoillaan kalvoksi, jonka paksuus on 0,5 mm, leveys 2 mm ja pituus 10 mm.
1.6.3.3 Testin suorittaminen
Posliinitappi asetetaan testattavan näytteen päälle ja kuormitus aktivoidaan. Testin aikana posiinilaatan karhennuksien on oltava poikittain liikkeen suuntaan nähden. On varmistettava, että tappi lepää näytteellä, että tarpeellinen määrä näyteainetta on tapin alla ja että laatta liikkuu oikealla tavoin tapin alla. Pastamaista ainetta pannaan laatalle käyttäen 2 × 10 mm:n uralla varustettua mittalevyä, jonka paksuus on 0,5 mm. Posliinilaatan on liikuttava posliinitapin alla 10 mm:n matka eteen ja taakse 0,44 sekunnissa. Laatan ja tapin pinnan osia saa käyttää vain kerran; kummankin tapin molempia päitä voidaan käyttää kahdessa testissä ja laatan kummankin pinnan pitää kestää kolme testiä.
Tehdään kuuden testin sarja 360 N:n kuormalla. Jos näiden testien aikana saadaan positiivinen tulos, tehdään toinen kuuden testin sarja 120 N:n kuormalla. Jos käytetään muuntyyppistä laitetta, näytettä verrataan valittuun vertailuaineeseen hyväksyttyä menetelmää (esimerkiksi ylös-alas-tekniikkaa) käyttäen.
1.6.3.4 Arviointi
Testin tulos katsotaan positiiviseksi, jos räjähdys (kuuluva rätinä, muu raportti tai leimahdus katsotaan räjähdykseksi) tapahtuu vähintään kerran määritetyllä kitkalaitteella suoritetuissa testeissä tai täyttää tätä vastaavan kriteerin vaihtoehtoisessa kitkatestissä.
2. TIEDOT
Periaatteessa aine katsotaan räjähdysvaaralliseksi direktiivin tarkoittamassa mielessä, jos lämpöherkkyys-, iskuherkkyys- tai kitkaherkkyystestistä saadaan positiivinen tulos.
3. RAPORTOINTI
3.1 TESTIRAPORTTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot;
|
— |
näyteaineen tunnistustiedot, koostumus, puhtaus, kosteuspitoisuus jne., |
|
— |
aineen fyysinen muoto ja tiedot siitä, onko ainetta murskattu, rikottu tai seulottu, |
|
— |
havainnot lämpöherkkyystesteistä (esimerkiksi näytteen massa ja sirpaleiden määrä), |
|
— |
havainnot mekaanisista herkkyystesteistä (esimerkiksi huomattavan savumäärän muodostuminen tai raportoimaton täydellinen hajoaminen, liekit, kipinät, muu raportti ja rätinä), |
|
— |
jokaisen testityypin tulokset, |
|
— |
jos vaihtoehtoisia laitteita on käytetty, on esitettävä tieteellinen perustelu ja todisteet korrelaatiosta määritetyllä laitteella saatujen ja tätä vastaavalla laitteella saatujen tulosten välillä, |
|
— |
kaikki käyttökelpoiset kommentit, kuten tulosten tulkinnan kannalta varten tärkeät viitteet vastaavien tuotteiden testauksiin, |
|
— |
kaikki tiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta. |
3.2 TULOSTEN TULKINTA JA ARVIOINTI
Testiraportissa on mainittava kaikki tulokset, joita pidetään virheellisinä, epänormaaleina tai ei-edustavina. Jos jokin tulos hylätään, on annettava selitys ja esitettävä tulos vaihtoehtoisesta tai täydentävästä testistä. Ellei epänormaalia tulosta voida selittää, se on hyväksyttävä sellaisenaan ja sitä on käytettävä aineen luokitukseen tuloksen mukaan.
4. VIITTEET
|
(1) |
Recommendations on the Transport of Dangerous Goods, Test and Criteria, 1990, United Nations, New York. |
|
(2) |
Bretherick, L,. Handbook of Reactive Chemical Hazards, 4th edition, Buttervorths, London, ISBN 0-750-60103-5, 1990. |
|
(3) |
Koenen, H., Ide, K. H. and Swart, K. H., Explosivstoffe, 1961, vol. 3, 6-13 and 30-42. |
|
(4) |
NF T 20-038 (Sept. 85). Chemical products for industrial use — Determination of explosion risk. |
Liite
Esimerkki ainespesifikaatiosta lämpöherkkyystestiä varten (katso standardia DIN 1623)
|
(1) |
Putki: ainespesifikaatio nro 1.0336.505 g |
|
(2) |
Mittauslaippa: ainespesifikaatio nro 1.4873 |
|
(3) |
Kierrelaippa ja mutteri: ainespesifikaatio nro 1.3817 |
Kuva 1
Lämpöherkkyyden mittauslaite
(kaikki mitat ovat millimetreinä)

Kuva 1a Teräsputki varusteineen
Kuva 2
Lämpöherkkyystesti Esimerkkejä sirpaleenmuodostuksesta

Kuva 3
Kuumennusnopeuden kalibrointi lämpöherkkyystestiä varten

Lämpötila-aikakäyrä, joka on saatu kuumentamalla dibutyyliftalaattia (27 cm3) suljetussa (1,5 mm:n mittauslaipalla varustetussa) putkessa käyttäen propaania ja virtausnopeutta 3,2 litraa minuutissa. Lämpötilan mittaukseen käytetään taipuisaa, ruostumattomasta teräksestä valmistettua kromi/alumiini-termoparia, jonka halkaisija on 1 mm ja joka on asetettu keskelle putkea 43 mmm etäisyydelle sen suusta. Alueella 135–285 oC kuumennusnopeuden on oltava välillä 185–215 K/min.
Kuva 4
Iskutestilaite
(kaikki mitat ovat millimetreinä)
Kuva 4
(Jatkuu)

Kuva 5
Kitkaherkkyyslaite

A.15 ITSESYTTYMISLÄMPÖTILA (NESTEET JA KAASUT)
1. MENETELMÄ
1.1 JOHDANTO
Tätä testiä ei pidä käyttää räjähdysaineiden ja itsestään ilmassa tai huoneenlämmössä syttyvien aineiden kohdalla. Testiä voidaan soveltaa kaasuihin, nesteisiin tai höyryihin, jotka kosketuksissa ilmaan voivat syttyä kuuman pinnan vaikutuksesta.
Itsesyttymislämpötila laskee huomattavasti katalyyttisten epäpuhtauksien, pinta-aineen tai testausastian suuremman tilavuuden vaikutuksesta.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Itsesyttyvyysaste ilmaistaan itsesyttymislämpötilana. Itsesyttymislämpötila on alhaisin lämpötila, jossa näyte syttyy, kun se sekoitetaan ilmaan testimenetelmän määrittelemissä olosuhteissa.
1.3 VERTAILUAINEET
Vertailuaineet mainitaan standardeissa (katso kohtaa 1.6.3). Vertailuaineita käytetään lähinnä menetelmän toimivuuden ajoittaiseen tarkistamiseen ja verrattaessa tuloksia muiden menetelmien avulla saatuihin tuloksiin.
1.4 MENETELMÄN PERIAATE
Menetelmällä määritetään suljetun astian sisäseinän alhaisin lämpötila, jossa astiaan ruiskutettu kaasu, höyry tai neste syttyy palamaan.
1.5 LAATUKRITEERIT
Toistettavuus vaihtelee itsesyttymislämpötila-alueiden ja käytetyn testimenetelmän mukaan.
Herkkyys ja spesifisyys vaihtelevat käytetyn testimenetelmän mukaan.
1.6 MENETELMÄKUVAUS
1.6.1 Laite
Laite kuvataan kohdassa 1.6.3 mainituissa menetelmäkuvauksissa.
1.6.2 Testiolosuhteet
Näyte aineesta testataan kohdassa 1.6.3 mainitun menetelmäkuvauksen mukaan.
1.6.3 Testin suorittaminen
Katso standardeja IEC 79-4, DIN 51794, ASTM-E 659-78, BS 4056, NF T 20-037.
2. TIEDOT
Pidetään kirjaa testilämpötilasta, ilmanpaineesta, käytetystä näytemäärästä ja syttymiseen kuluvasta ajasta.
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
näyteaineen tarkat tiedot (tunnistustiedot ja epäpuhtaudet), |
|
— |
käytetty näytemäärä, |
|
— |
ilmanpaine, |
|
— |
käytetty laite, |
|
— |
testitulokset (testilämpötilat, syttymistulokset ja viiveet), |
|
— |
kaikki lisätiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta. |
4. VIITTEET
Viitteitä ei ole.
A.16 KIINTEIDEN AINEIDEN SUHTEELLINEN ITSESYTTYMISLÄMPÖTILA
1. MENETELMÄ
1.1 JOHDANTO
Tätä testiä ei pidä käyttää räjähtävien aineiden ja itsestään ilmassa tai huoneenlämmössä syttyvien aineiden kohdalla. Testin avulla saadaan alustavaa tietoa kiinteiden aineiden itsesyttyvyydestä korkeissa lämpötiloissa.
Jos lämmön vapautuminen ympäristöön aineen reagoidessa hapen kanssa tai sen hajotessa eksotermisesti ei tapahdu tarpeeksi nopeasti, aineen kuumentaminen johtaa itsesyttymiseen. Näin ollen itsesyttyminen tapahtuu, kun lämmöntuotanto on nopeampaa kuin lämpöhäviö.
Testimenetelmä on käytännöllinen tapa saada alustavaa tietoa kiinteistä aineista. Koska kiinteiden aineiden syttyminen ja palaminen on monimutkainen tapahtuma, tällä menetelmällä määritettyjä itsesyttymislämpötiloja tulee käyttää vain vertailutarkoituksiin.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Tällä menetelmällä saatu itsesyttymislämpötila on alhaisin ympäristön lämpötila ( oC), jossa tunnettu tilavuus näyteainetta syttyy tunnetuissa olosuhteissa.
1.3 VERTAILUAINEET
Vertailuaineita ei ole.
1.4 MENETELMÄN PERIAATE
Tunnettu määrä näyteainetta pannaan huoneenlämpöiseen uuniin. Uunin lämpötila nostetaan 0,5 oC:n minuuttinopeudella arvoon 400 oC (tai sulamispisteeseen, jos tämä on alhaisempi), ja näytteen keskustan lämpötila kirjataan ajan funktiona. Tämän testin itsesyttymislämpötilaksi katsotaan se uunin lämpötila, jossa näytteen lämpötila on itsestään kuumenemisen seurauksena saavuttanut arvon 400 oC.
1.5 LAATUKRITEERIT
Laatukriteerejä ei ole.
1.6 MENETELMÄKUVAUS
1.6.1 Laite
1.6.1.1 Uuni
Uuni on termostaatilla varustettu laboratoriouuni (tilavuus noin 2 litraa), jossa on luonnollinen ilmanvaihto ja räjähdysventtiili. Räjähdysvaaran välttämiseksi hajoamiskaasuja ei saa päästää kosketuksiin sähkölämmityselementtien kanssa.
1.6.1.2 Lankaverkkokuutio
Ruostumattomasta teräslangasta valmistetusta verkosta (0,045 mm aukko) leikataan kuvan 1 mukainen kuvio. Verkko taivutetaan ylhäältä avoimeksi kuutioksi ja kiinnitetään teräslangalla.
1.6.1.3 Termoparit
Käytetään sopivia termopareja.
1.6.1.4 Rekisteröintilaite
Mikä tahansa kaksikanavainen rekisteröintilaite, joka on kalibroitu 0–600 oC:lle tai vastaavalle jännitteelle.
1.6.2 Testiolosuhteet
Aineet testataan vastaanotetussa muodossa.
1.6.3 Testin suorittaminen
Verkkokuutioon pannaan näyteainetta, naputetaan kevyesti, ja lisätään ainetta, kunnes kuutio täyttyy. Tämän jälkeen kuutio ripustetaan huoneenlämpöisen uunin keskelle. Toinen termopari pannaan kuution keskustaan ja toinen kuution ja uunin seinän väliin mittaamaan uunin lämpötilaa.
Uunin lämpötila nostetaan 400 oC:seen (tai sulamispisteeseen, jos tämä on alhaisempi) 0,5 oC:n minuuttinopeudella. Uunin ja näytteen lämpötilaa rekisteröidään koko kuumennuksen ajan.
Kun aine syttyy, näytteessä olevan termoparin lämpötila nousee erittäin jyrkästi yli uunin lämpötilan.
2. TIEDOT
Arviointia varten käytetään sitä uunin lämpötilaa, jossa näytteen lämpötila on noussut 400 oC:seen itsesyttymisen vaikutuksesta (katso kuvaa 2).
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
näyteaineen tiedot, |
|
— |
mittaustulokset lämpötila-aikakäyrineen, |
|
— |
kaikki lisätiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta. |
4. VIITTEET
|
(1) |
NF T 20-036 (September 85), Chemical products for industrial use. Determination of the relative temperature of the spontaneous flammability of solids. |
Kuva 1
20 mm:n näytekuution kaava

Kuva 2
Tyypillinen lämpötila-aikakäyrä

A.17 HAPETTAVAT OMINAISUUDET (KIINTEÄT AINEET)
1. MENETELMÄ
1.1 JOHDANTO
Ennen testiä on suositeltavaa hankkia alustavia tietoja aineen mahdollisista räjähdysominaisuuksista.
Menetelmää ei voi käyttää nesteiden, kaasujen, räjähdysalttiiden tai herkästi syttyvien aineiden tai orgaanisten peroksidien testaukseen.
Testiä ei tarvitse suorittaa, jos aineen rakennekaavasta voidaan täysin varmasti päätellä, että aine ei voi reagoida eksotermisesti syttyvien aineiden kanssa.
Alustavan testin avulla selvitetään, onko varsinaisessa testissä noudatettava erityistä varovaisuutta.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Palamisaika sekunteina on se aika, jossa reaktiovyöhyke kulkee keon läpi, kun käytetään kohdassa 1.6 kuvattua menetelmää.
Palamisnopeus ilmaistaan millimetreinä sekunnissa.
Suurin palamisnopeus on se palamisnopeuden suurin arvo, joka saadaan kun ainetta sekoitetaan hapettimeen eri pitoisuuksina (10–90 painoprosenttia hapetinta).
1.3 VERTAILUAINEET
Analyyttisen puhdasta bariumnitraattia voidaan käyttää testin ja alustavan testin vertailuaineena.
Vertailuseoksena käytetään sitä kohdan 1.6 mukaan valmistettua bariumnitraatin ja jauhetun selluloosan seosta, jolla on suurin palamisnopeus (yleensä seos. jossa on 60 painoprosettia bariumnitraattia).
1.4 MENETELMÄN PERIAATE
Turvallisuussyistä tehdään alustava testi. Jos alustavasta testistä selvästi ilmenee, että aineella on hapettavia ominaisuuksia, testiä ei tarvitse jatkaa. Muussa tapauksessa aine testataan kattavan testiohjelman mukaan.
Kattavassa testissä testattavaa ainetta ja määritettyä syttyvää ainetta sekoitetaan eri suhteissa. Jokaisesta seoksesta valmistetaan pitkänomainen keko, joka sytytetään toisesta päästä. Suurinta palamisnopeutta verrataan vertailuseoksen suurimpaan palamisnopeuteen.
1.5 LAATUKRITEERIT
Tarvittaessa voidaan käyttää mitä tahansa jauhamis- ja sekoitusmenetelmää, edellyttäen, että kuudesta erillisestä testistä saadut suurimmat palamisnopeudet poikkeavat aritmeettisesta keskiarvosta enintään 10 %.
1.6 MENETELMÄKUVAUS
1.6.1 Valmistelutoimet
1.6.1.1 Näyte
Näytteen hiukkaskoko pienennetään alle 0,125 mm:iin seuraavasti: näyte seulotaan, jäännös jauhetaan ja seulonta toistetaan. Tätä jatketaan, kunnes koko näytemäärä on läpäissyt seulan.
Jauhamiseen ja seulontaan voidaan käyttää mitä tahansa laatukriteerit täyttävää menetelmää.
Ennen seoksen valmistelua näytettä kuivataan 105 oC:ssa, kunnes paino vakiintuu. Jos testattavan aineen hajoamislämpötila on alle 105 oC, kuivaus on tehtävä sopivassa, alhaisemmassa lämpötilassa.
1.6.1.2 Syttyvä aine
Syttyvänä aineena käytetään jauhettua selluloosaa. Selluloosan on oltava ohutkerroskromatografiaan tai pylväskromatografiaan tarkoitettua tyyppiä. Selluloosatyyppi, jossa yli 85 % kuiduista on pituudeltaan 0,020–0,075 mm, on osoittautunut sopivaksi. Selluloosajauhe seulotaan 0,125 mm:n silmäkoon läpi. Testiin on käytettävä saman erän selluloosaa.
Jauhettua selluloosaa kuivataan ennen seoksen valmistelua 105 oC:ssa, kunnes paino vakiintuu.
Jos alustavaan testiin käytetään puujauhoa, vaimistetaan havupuujauhe keräämällä talteen 1,6 mm:n seulan läpäissyt osa. Jauhe sekoitetaan huolellisesti ja sitä kuivataan 105 oC:ssa neljä tuntia enintään 25 mm:n paksuisena kerroksena. Kuivauksen jälkeen puujauhe jäähdytetään ja pannaan ilmatiiviiseen säiliöön, joka pakataan mahdollisimman täyteen. Jauhe tulisi käyttää 24 tunnin kuluessa kuivauksesta.
1.6.1.3 Sytytyslähde
Sytytyslähteenä käytetään kaasupolttimen kuumaa liekkiä (minimihalkaisija 5 mm). Jos käytetään toista sytytyslähdettä (esimerkiksi kun testi tapahtuu inertissä ilmakehässä), on annettava tilanteen kuvaus ja perustelu.
1.6.2 Testin suorittaminen
Huomaulus:
Hapettimien ja selluloosan tai puujauheen seoksia on pidettävä räjähdysvaarallisina ja niitä on käsiteltävä varoen.
1.6.2.1 Alustava testi
Kuivattua näytettä ja kuivattua selluloosaa tai puujauhetta sekoitetaan huolella suhteessa 2 paino-osaa näytettä ja 1 paino-osa selluloosaa tai puujauhetta. Seos muotoillaan pieneksi kartionmuotoiseksi keoksi, jonka pohjan halkaisija on 3,5 cm ja korkeus 2,5 cm. Keko tehdään täyttämällä (ilman tiivistämistä) kartionmuotoinen muotti (esimerkiksi lasisuppilo, jonka varsi on suljettu).
Keko asetetaan kylmälle, palamattomalle ja ei-huokoiselle aluslevylle, jonka lämmönjohtavuus on heikko. Testi on suoritettava vetokaapissa (katso 1.6.2.2).
Kartiota kosketetaan sytytystähteellä. Sytytystä seuraavan reaktion voimakkuutta ja kestoa tarkkaillaan ja tulos kirjataan.
Jos reaktio on voimakas, ainetta pidetään hapettavana.
Jos tuloksen suhteen on epäilyjä, on tarpeen tehdä jäljempänä kuvattu kattava testi.
1.6.2.2 Sarjatesti
Valmistetaan hapettimen ja selluloosan seoksia, joissa hapettimen painoprosentti on 10–90 ja vaihteluväli 10 %. Rajatapauksissa on valmistettava seoksia, joilla on pienemmät vaihteluvälit, jotta suurin palamisnopeus voitaisiin määrittää mahdollisimman tarkasti.
Keko muotoillaan muotin avulla. Metallista valmistetun muotin pituus on 250 mm. Muotin kolmionmuotoisen läpileikkauksen sisäkorkeus on 10 mm ja leveys 20 mm. Muotin pituussuunnassa on molemmille sivuille kiinnitetty kaksi metallilevyä siten, että levyjen yläreuna on 2 mm muotin reunan yläpuolella (katso kuvaa). Lisätään seosta kevyelti hiukan muotin reunojen yli. Muotti pudotetaan kerran 2 cm korkeudelta kiinteälle pinnalle. Ylimääräinen aines kaavitaan pois, sivulevyt poistetaan ja muottiin jäävä aines tasoitetaan rullalla. Muotille asetetaan palamaton, ei-huokoisesta ja lämpöä heikosti johtavasta aineesta valmistettu aluslevy, laite käännetään ja muotti poistetaan.
Aseta näyte vetokaappiin.
Veto on säädettävä sellaiseksi, ettei savua pääse laboratoriotiloihin. Vedon voimakkuus ei saa vaihdella testin aikana. Laitteen ympärille pystytetään suojaseinä vetoa vastaan.
Koska selluloosa ja eräät testattavat aineet ovat hygroskooppisia, testi on suoritettava mahdollisimman nopeasti.
Keon toinen pää sytytetään koskettamalla sitä liekillä.
Kun reaktiovyöhyke on edennyt 30 mm, mitataan aika, joka kuluu seuraavan 200 mm:n etenemiseen.
Testi tehdään vertailuaineella ja vähintään kerran näyte-selluloosaseossarjan jokaisella osalla.
Jos todetaan, että näyteseoksen palamisnopeus on huomattavasti suurempi kuin vertailuseoksen palamisnopeus, testi voidaan keskeyttää. Muussa tapauksessa testi toistetaan viisi kertaa kolmelle nopeimmin palavalle seokselle.
Jos epäillään, että positiivinen tulos on virheellinen, testi toistetaan käyttäen selluloosan sijasta inerttiä ainetta, jolla on sama hiukkaskoko (esimerkiksi piimaata). Vaihtoehtoisesti nopeimmin palava näyte-selluloosaseos voidaan testata uudelleen inertissä ilmakehässä (< 2 tilavuusprosenttia happea).
2. TIEDOT
Turvallisuussyistä suurinta palamisnopeutta — ei keskiarvoa — pidetään näyteaineen tunnusomaisena hapettavana ominaisuutena.
Arviointia varten käytetään kuuden kokeen sarjan suurinta palamisnopeutta.
Laaditaan käyrä, johon jokaista seosta kohden merkitään suurin palamisnopeus hapettimen pitoisuuden funktiona. Tältä käyrältä luetaan suurin palamisnopeus.
Testattaessa suurimman palamisnopeuden omaava seos, testisarjan kuusi palamisnopeuden arvoa saavat poiketa aritmeettisesta keskiarvosta enintään 10 %. Muussa tapauksessa jauhamis- ja sekoitusmenetelmiä on parannettava.
Suurinta saatua palamisnopeutta verrataan vertailuseoksen palamisnopeuteen (katso 1.3).
Jos testit tehdään inertissä ilmakehässä, suurinta saatua reaktionopeutta verrataan inertissä ilmakehässä testatun vertailuaineen tulokseen.
3. RAPORTOINTI
3.1 TESTIRAPORTTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
näyteaineen tunnistetiedot, koostumus, puhtausaste, kosteuspitoisuus jne., |
|
— |
näyteaineen mahdolliset käsittelyt (esimerkiksi jauhaminen ja kuivaus), |
|
— |
testeissä käytetty sytytyslähde, |
|
— |
mittaustulokset, |
|
— |
havaitun reaktion luonne (esimerkiksi liekki näytteen pinnalla, palaminen koko massan läpi, tiedot palamistuotteista,...), |
|
— |
kaikki lisätiedot ja huomautukset, joilla on merkitystä tulkinnan kannalta mukaan lukien kuvaus reaktion voimakkuudesta (liekit, kipinät, savunmuodostus, kyteminen, jne.) ja likimääräinen kesto alustavan testin yhteydessä sekä näytteen että vertailuaineen osalta, |
|
— |
tulokset inertin aineen testauksesta, jos tuloksia on käytettävissä, |
|
— |
inertissä ilmakehässä tehtyjen testien tulokset, jos tuloksia on käytettävissä. |
3.2 TULOSTEN TULKINTA
Aineen katsotaan olevan hapettava seuraavissa tapauksissa:
|
a) |
jos alustavassa testissä tapahtuu voimakas reaktio; |
|
b) |
jos seosten palamisnopeus kattavassa testissä on vähintään yhtä suuri kuin selluloosasta ja bariumnitraatista valmistetun vertailuseoksen suurin palamisnopeus. |
Väärän positiivisen tuloksen välttämiseksi tulosten tulkinnassa on otettava huomioon myös tulokset, jotka on saatu testattaessa näytteen ja inertin aineen seosta tai suoritettaessa testiä inertissä ilmakehässä.
4. VIITTEET
|
(1) |
NF T 20-035 (SEPT 85), Chemical products for industrial use. Determination of the oxidizing properties of solids. |
Liite
Kuva
Muotti ja tarvikkeet näytteen valmistelua varten
(Kaikki mitat ovat millimetreinä)
A.18. POLYMEERIEN LUKUKESKIMÄÄRÄINEN MOLEKYYLIPAINO JA MOLEKYYLIPAINOJAKAUMA
1. MENETELMÄ
Tämä geelipermeaatiokromatografiamenetelmä (GPC) on toisinto OECD:n testausohjeesta N:o 118 (1996). Menetelmän periaatteet ja teknisiä lisätietoja on viitteessä 1.
1.1 JOHDANTO
Koska polymeerien ominaisuudet ovat hyvin vaihtelevia, on mahdotonta antaa yhtä ainoaa menetelmää ja täsmällisiä erotus- ja arviointiohjeita, jotka sopisivat kaikkiin polymeerien erotuksessa mahdollisesti esiintyviin tapauksiin. Erityisesti monimutkaisia polymeeriseoksia voi olla mahdoton erottaa geelipermeaatiomenetelmällä. Jos GPO:tä ei voi käyttää, voidaan molekyylipaino määrittää muilla tavoilla (katso liite). Tällaisissa tapauksissa on käytetystä menetelmästä annettava yksityiskohtaiset tiedot ja perustelut on esitettävä.
Jäljempänä esitettävä menetelmä perustuu DIN-standardiin 55672 (1). Yksityiskohtaiset ohjeet kokeiden suorittamiseksi ja tulosten arvioimiseksi annetaan kyseisessä DIN-standardissa. Jos koeolosuhteita täytyy muuttaa, on muutokset perusteltava. Muita standardeja saa käyttää, jos niistä annetaan täydelliset viitteet. Tässä menetelmässä käytetään kalibrointiin polystyreeninäytteitä, johon sisältyvien polymeerien koot tunnetaan, ja menetelmää voi joutua muuttamaan, jotta sitä voitaisiin käyttää tietyille polymeereille, esim. vesiliukoisille ja pitkäketjuisille haaraantuville polymeereille.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Lukukeskimääräinen molekyylipaino M ja painokeskimääräinen molekyylipaino Mw määritetään seuraavilla yhtälöillä:
|
|
|
joissa
Hi on detektorisignaalin korkeus perustasosta retentiotilavuudelle Vi,
Mi on retentiotilavuutta Vi vastaava polymeerifraktion molekyylipaino ja
n on mittauspisteiden lukumäärä.
Molekyylipainojakauman leveys, joka kuvastaa seoksen dispersiivisyyttä, saadaan suhteesta Mw/Mn.
1.3 VERTAILUAINEET
Koska GPC on suhteellinen menetelmä, on tehtävä kalibrointi. Tähän käytetään tavallisesti kokojakaumaltaan kapeita lineaarisia polystyreenistandardeja, joiden keskimääräiset molekyylipainot Mn ja Mw sekä molekyylipainojakauma tunnetaan. Kalibrointikäyrää voidaan käyttää tuntemattoman näytteen molekyylipainon määritykseen vain, jos näytteen ja standardin erotusolosuhteet on valittu samalla tavalla.
Molekyylipainon ja eluutiotilavuuden suhde on validi ainoastaan tietyn kokeen tietyissä koeolosuhteissa. Tärkeitä tekijöitä ovat ennen kaikkea lämpötila, liuotin (tai liuotinseos), kromatografiajärjestely sekä erotuspylväs tai pylväsjärjestelmä.
Tällä tavoin määritetyt näytteen molekyylipainot ovat suhteellisia arvoja ja niistä käytetään nimitystä ”polystyreeniekvivalenttimolekyylipaino”. Tämä tarkoittaa sitä, että riippuen näytteen ja standardien rakenne-eroista ja kemiallisista eroista molekyylipainot voivat poiketa absoluuttisista arvoista enemmän tai vähemmän. Jos käytetään muita standardeja, esim. polyetyleeniglykolia, polyetyleemoksidia, polymetyylimetakrylaattia tai polyakryylihappoa, on syy ilmoitettava.
1.4 TESTIMENETELMÄN PERIAATE
Sekä näytteen molekyylipainojakauma että keskimääräiset molekyylipainot Mn ja Mw voidaan määrittää GPC:llä. GPC on erityinen nestekromatografian laji, jossa näytteen erottaminen perustuu seoksen yksittäisten aineiden hydrodynaamisiin tilavuuksiin (2).
Erottuminen tapahtuu, kun näyte kulkee huokoisella aineella, tyypillisesti orgaanisella geelillä täytetyn pylvään läpi. Pienet molekyylit tunkeutuvat huokosiin, kun taas suuret molekyylit jäävät huokosten ulkopuolelle. Isojen molekyylien kulkema tie on siten lyhyempi, ja ne tulevat ensimmäisenä ulos pylväästä. Keskikokoiset molekyylit tunkeutuvat joihinkin huokosiin ja eluoituvat myöhemmin. Pienimmät molekyylit, joiden keskimääräinen hydrodynaaminen säde on pienempi kuin geelin huokoset, voivat tunkeutua kaikkiin huokosiin. Ne eluoituvat viimeisinä.
Ihanteellisessa tilanteessa erottumiseen vaikuttaa ainoastaan molekyylilajin koko, mutta käytännössä on vaikea välttää ainakin jonkin verran adsorptiosta aiheutuvaa haittaa. Epätasaisesti pakattu pylväs ja kuolleet tilavuudet voivat pahentaa tilannetta (2).
Detektorina käytetään esim. taitekerroin- tai UV-detektoria, ja tuloksena saadaan yksinkertainen jakaumakäyrä. Jotta käyrästä voidaan lukea oikeita molekyylipainoja, on pylväs kalibroitava molekyylipainoltaan tunnetuilla polymeereillä, joilla on mieluiten suunnilleen samanlainen rakenne, esim. erilaiset polystyreenistandardit. Tuloksena on tyypillisesti Gaussin käyrä, joka on joskus vääristynyt siten, että pienen molekyylipainon puolella on ”häntä”; pystysuoralla akselilla on eluoitujen molekyylilajien määrät painomitoissa ja vaaka-akselilla molekyylipainon logaritmi.
1.5 LAATUKRITEERIT
Eluutiotilavuuden toistettavuuden (keskihajonnan keskivirhe: RSD) olisi oltava parempi kuin 0,3 %. Määrityksen vaadittu toistettavuus on varmistettava sisäistä standardia käyttämällä, jos kromatogrammin arviointi on aikariippuvainen eikä täytä edellä mainittuja kriteerejä (1). Polydispersiivisyys riippuu standardien molekyylipainoista. Polystyreenistandardien osalta tyypillisiä arvoja ovat:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 < Mp < 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw/Mn < 1,20 |
(Mp on standardin molekyylipaino piikin maksimissa)
1.6 TESTIMENETELMÄN KUVAUS
1.6.1 Polystyreenistandardiliuosten valmistus
Polystyreenistandardit liuotetaan sekoittamalla huolellisesti haluttuun eluointiliuokseen. Valmistajan ohjeet on otettava huomioon liuosten valmistuksessa.
Valittujen standardien pitoisuudet riippuvat eri tekijöistä, esim. injektiotilavuudesta, liuoksen viskositeetistä ja detektorin herkkyydestä. Suurin injektiotilavuus on sovitettava pylvään pituuden mukaan, ettei pylvästä kuormiteta liikaa. Tyypilliset injektiotilavuudet käytettäessä GPC:tä analyyttisiin erotuksiin pylväässä, jonka koko on 30 cm x 7,8 mm, ovat tavallisesti 40–100 μl. Suuremmat tilavuudet ovat mahdollisia, mutta eivät saisi olla enemmän kuin 250 μl. Injektiotilavuuden ja aineen pitoisuuden paras suhde on määritettävä ennen pylvään varsinaista kalibrointia.
1.6.2 Näyteliuoksen valmistus
Periaatteessa samat vaatimukset koskevat näyteliuosten valmistamista. Näyte liuotetaan sopivaan liuottimeen (esim tetrahydrofuraaniin (THF)) ravistamalla huolellisesti. Sitä ei saa missään tapauksessa liuottaa ultraäänihauteessa. Tarpeen vaatiessa näyte puhdistetaan suodattamalla kalvolla, jonka huokoskoko on 0,2–2 μm.
Jos näytteessä on liukenemattomia hiukkasia, on tämä kirjattava loppuraporttiin, koska se saattaa johtua suurikokoisista molekyyleistä. Liukenemattomien hiukkasten painoprosenttiosuus on määritettävä jollakin sopivalla menetelmällä. Liuokset on käytettävä vuorokauden sisällä.
1.6.3 Laitteisto
|
— |
liuotinsäiliö |
|
— |
kaasunpoistolaite (tarvittaessa) |
|
— |
pumppu |
|
— |
pulssinvaimennin (tarvittaessa) |
|
— |
injektiojärjestelmä |
|
— |
kromatografiapylväät |
|
— |
ilmaisin (detektori) |
|
— |
virtausmittari (tarvittaessa) |
|
— |
tulosten tallennus/prosessointilaite |
|
— |
jäteastia |
On varmistettava, että GPC-laitteisto ei reagoi käytettävien liuottimien kanssa (esim. THF:n kanssa on käytettävä teräskapillaareja).
1.6.4 Injektiojärjestelmä ja liuottimen annostelujärjestelmä
Määrätty näytetilavuus syötetään pylvääseen joko automaattisella näytteensyöttölaitteella tai käsin tarkasti määriteltyyn vyöhykkeeseen, jos ruiskun mäntää vedetään tai työnnetään liian nopeasti, se voi aiheuttaa muutoksia havaitussa molekyylipainojakaumassa. Liuotinta pumppaavien pumppujen olisi oltava mahdollisimman tasaisia ja niissä saisi mieluiten olla pulssinvaimennin. Virtausnopeuden pitäisi olla noin 1 ml/min.
1.6.5 Pylväs
Näytteestä riippuen polymeerin ominaisuudet määritetään käyttäen joko yhtä pylvästä tai useita peräkkäin kytkettyjä pylväitä. Kaupallisesti on saatavilla lukuisia pylväsmateriaaleja, joiden ominaisuudet on määritelty (esim. huokoskoko, ekskluusiorajat). Erotusgeelin ja pylvään pituuden valinta riippuu sekä näytteen ominaisuuksista (hydrodynaamiset tilavuudet, molekyylipainojakauma) että erotuksen erityisvaatimuksista kuten liuottimesta, lämpötilasta ja virtausnopeudesta (1) (2) (3).
1.6.6 Teoreettiset levyt
Käytettävästä pylväästä tai pylväsyhdistelmästä on tiedettävä teoreettisten levyjen lukumäärä. Tätä varten syötetään pituudeltaan tunnettuun pylvääsen — jos THF on eluutioliuotin — etyylibentseeniIiuosta tai muuta sopivaa ei-polaarista liuotinta. Teoreettisten levyjen lukumäärä saadaan seuraavasta yhtälöstä:
|
|
tai |
|
jossa
|
N |
on teoreettisten levyjen lukumäärä |
|
Ve |
on eluutiotilavuus piikin maksimin kohdalla |
|
W |
on piikin leveys perusviivalla |
|
W1/2 |
on piikin leveys piikin korkeuden puolivälissä. |
1.6.7 Erotusteho
Teoreettisten levyjen lukumäärän lisäksi, joka on vyöhykkeen leveyden määräävä suure, myös erotusteholla on osansa. Erotustehon määrää kalibraatiokäyrän jyrkkyys. Pylvään erotusteho saadaan seuraavasta yhtälöstä:

jossa
|
Ve, Mx |
= |
on sellaisen polystyreenin, jonka molekyylipaino on Mx, eluutiotilavuus |
|
Ve,(10Mx) |
= |
on molekyylipainoltaan kymmenen kertaa suuremman polystyreenin eluutiotilavuus. |
Järjestelmän erotuskyky määritellään yleensä seuraavasti:

jossa
|
Vel, Ve2 |
= |
ovat kahden polystyreenistandardin eluutiotilavuudet piikin maksimissa |
|
W1, W2 |
= |
ovat piikin leveydet perusviivalla |
|
Ml, M2 |
= |
ovat molekyylipainot piikin maksimissa (niiden ero pitäisi olla vähintään 10-kertainen). |
Pylvään R-arvon olisi oltava suurempi kuin 1,7 (4).
1.6.8 Liuottimet
Kaikkien liuottimien on oltava korkeaa puhtauslaatua (THF:n puhtaus 99,5 %). Liuotinastian (tarvittaessa inertissä kaasussa) on oltava riittävän iso pylvään kalibroimiseen ja useiden näytteiden määrittämiseen. Liuottimesta on poistettava kaasut ennen kuin sitä pumpataan pylvääseen.
1.6.9 Lämpötilansäätö
Tärkeiden laitteiston sisäisten osien (injektiosilmukka, pylväät, detektori ja letkut/putket) lämpötilan olisi oltava vakaa ja valitulle liuottimelle sopiva.
1.6.10 Detektori
Detektorin tarkoitus on mitata pylväästä tulevan näytteen pitoisuus. Jotta piikit eivät leviäisi tarpeettomasti, on detektorin mittauskyvetin tilavuuden oltava mahdollisimman pieni. Se ei saisi olla suurempi kuin 10 μl paitsi valon sirontaa tai viskositeettia mittaavilla detektoreilla. Detektorina käytetään tavallisesti differentiaalirefraktometriä. Muitakin detektoreja, esim. UV/VIS-, IR- ja viskositeettidetektoreja voidaan käyttää, mikäli näytteen tai eluutioliuottimen erityiset ominaisuudet edellyttävät sitä.
2. MÄÄRITYSTULOKSET JA TULOSTEN ILMOITTAMINEN
2.1 MÄÄRITYSTULOKSET
Yksityiskohtaisten arviointiperusteiden samoin kuin määritystulosten keräämisen ja käsittelyn osalta on noudatettava DIN-standardin (1) määrityksiä.
Kustakin näytteestä tehdään kaksi erillistä koetta, jotka on analysoitava erikseen.
Mn, Mw, Mw/Mn ja Mp on ilmoitettava jokaisesta mittauksesta. On ilmoitettava selvästi, että mitatut arvot ovat suhteellisia arvoja, jotka ovat suhteessa käytettyjen standardien molekyylipainoihin.
Kun retentiotilavuudet tai retentioajat (mahdollisesti korjattuina sisäisten standardien suhteen) on määritetty, esitetään log M -arvot (M on kalibrointistandardin piikin korkein kohta) jonkin edellä mainitun suureen funktiona. Kutakin molekyylipainon kymmentä potenssia kohti tarvitaan vähintään kaksi kalibrointipistettä ja koko käyrällä on oltava vähintään viisi mittauspistettä, joiden pitäisi kattaa näytteen arvioitu molekyylipainoalue. Kalibrointikäyrän loppupiste pienen molekyylipainon päässä määritetään n-heksyylibentseenin tai jonkin muun sopivan ei-polaarisen liuottimen avulla Mn ja Mw määritetään tavallisesti tietokoneella osastossa 1.2 esitettyjen kaavojen perusteella. Jos käytetään manuaalista digitointia, voidaan ohjeeksi katsoa menetelmää ASTM D 3536-91 (3).
Jakaumakäyrä on esitettävä taulukon tai kuvan muodossa (differentiaalinen taajuus tai summaprosenttiosuudet log M:n funktiona). Graafisessa esityksessä yksi molekyylipainon kymmenen potenssi pitäisi olla tavallisesti noin 4 cm leveä ja piikin maksimin pitäisi olla noin 8 cm korkea. Koko jakaumakäyrän osalta y-akselin korkeuden 0 ja 100 %:n välillä olisi oltava noin 10 cm.
2.2 TESTIRAPORTTI
Testiraportissa on esitettävä seuraavat asiat:
2.2.1 Testattava aine
|
— |
saatavissa olevat tiedot testattavasta aineesta (tunnistetiedot, lisäaineet, epäpuhtaudet); |
|
— |
näytteen käsittelyn kuvaus, mahdolliset huomiot ja ongelmat. |
2.2.2 Laitteisto
|
— |
eluenttisäiliö, inertti kaasu, kaasun poisto eluentista, eluentin koostumus, epäpuhtaudet, |
|
— |
pumppu, pulssinvaimennin, injektiojärjestelmä, |
|
— |
erotuspylväät (valmistaja, kaikki tiedot pylväiden ominaisuuksista kuten huokoskoko, erotusmateriaalin tyyppi jne., käytettävien pylväiden lukumäärä, pituus ja järjestys), |
|
— |
pylvään (tai pylväsyhdistelmän) teoreettisten levyjen lukumäärä, erotusteho (järjestelmän erotuskyky), |
|
— |
piikkien symmetriaa koskevat tiedot, |
|
— |
pylvään lämpötila, lämpötilan säätötapa, |
|
— |
detektori (mittausperiaate, tyyppi, kyvetin tilavuus), |
|
— |
mahdollinen virtausmittari (valmistaja, mittausperiaate), |
|
— |
mittaustulosten tallennus- ja käsittelyjärjestelmä (laitteet ja ohjelmat). |
2.2.3 Järjestelmän kalibrointi
|
— |
kalibrointikäyrän määrittämiseksi käytetyn menetelmän tarkka kuvaus |
|
— |
tiedot menetelmän laatukriteereistä (esim. korrelaatiokerroin, jäännösneliösumma jne.) |
|
— |
tiedot kaikista kokeen aikana sekä tulosten arvioinnissa ja käsittelyssä suoritetuista ekstrapolaatioista, oletuksista ja aproksimaatioista, |
|
— |
kaikki kalibrointikäyrän määrittämiseksi käytetyt mittaukset on esitettävä taulukossa, jossa esitetään myös seuraavat tiedot kustakin kalibrointipisteestä:
|
2.2.4 Arviointi
|
— |
aikaperusteinen arviointi: toistettavuuden varmistamiseen käytetyt menetelmät (korjausmenetelmä, sisäinen standardi jne.), |
|
— |
suoritetaanko arviointi eluutiotilavuuden vai retentioajan perusteella, |
|
— |
tiedot arvion rajoituksista, jos piikkiä ei analysoida täydellisesti, |
|
— |
mahdollisten tasoitusmenetelmien kuvaus, |
|
— |
näytteen valmistus ja esikäsittely, |
|
— |
mahdolliset liukenemattomat hiukkaset, |
|
— |
injektiotilavuus (μl) ja injektoitavan näytteen pitoisuus (mg/ml), |
|
— |
huomiot seikoista, joista aiheutuu poikkeamista ihanteellisesta GPC-käyttäytymisestä, |
|
— |
tarkka kuvaus kaikista testausmeneteimien muutoksista, |
|
— |
virherajoja koskevat yksityiskohtaiset tiedot, |
|
— |
kaikki tulosten tulkintaan vaikuttavat tiedot ja huomiot. |
3. KIRJALLISUUSVIITTEET
|
(1) |
DIN 55672 (1995). Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1. |
|
(2) |
Yau, W.W., Kirkland, J.J., and Bly, D.D. eds, (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons. |
|
(3) |
ASTM D 3536-91, (1991). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
ASTM D 5296-92, (1992). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
Liite
Esimerkkejä muista menetelmistä polymeerien lukukeskimääräisen molekyylipainon (Mn) määrittämiseksi
Geelipermeaatiokromatografia (GPC) on paras menetelmä Mn:n määrittämiseksi, erityisesti, jos on käytettävissä sarja standardeja, joiden rakenne vastaa polymeerin rakennetta. Jos kuitenkin GPC:n käytössä on käytännön hankaluuksia tai on odotettavissa, että aine ei täytä säädettyä M-kriteeriä (joka on varmistettava), voidaan käyttää muita menetelmiä, kuten
1. Kolligatiivisten ominaisuuksien käyttö
|
1.1 |
Ebullioskopia/kryoskopia Tässä mitataan kiehumispisteen ylenemä (ebullioskopia) tai jäätymispisteen alenema (kryoskopia), kun liuokseen lisätään tutkittavaa polymeeriä. Menetelmä perustuu siihen, että liuenneen polymeerin vaikutus nesteen kiehumis/jäätymispisteeseen riippuu polymeerin molekyylipainosta (1) (2). Soveltamisala: Mn < 20 000. |
|
1.2 |
Höyrynpaineen aleneminen Tässä mitataan valitun vertailuaineen höyrynpaine ennen ja jälkeen, kun on lisätty tunnettu määrä polymeeriä (1) (2). Soveltamisala: Mri < 20 000 (teoreettisesti; käytännössä tästä menetelmästä on vähän hyötyä). |
|
1.3 |
Kalvo-osmometria Tämä menetelmä perustuu osmoosiin, ts. liuotinmolekyylien luonnolliseen taipumukseen diffundoitua puoliläpäisevän kalvon läpi laimeasta väkevään liuokseen päin tasapainon saavuttamiseksi. Testin laimeassa liuoksessa ei ole lainkaan polymeeriä, ja väkevä liuos sisältää polymeeriä. Kun liuos menee kalvon läpi, muodostuu paine-ero, joka riippuu polymeerin konsentraatiosta ja molekyylipainosta (1) (3) (4). Solveltamisala: Mn < 20 000–200 000. |
|
1.4 |
Höyryfaasiosmometria Tässä menetelmässä verrataan puhtaan liuotinaerosolin haihtumisnopeutta vähintään kolmeen aerosoliin, joissa polymeerin pitoisuus vaihtelee (1) (5) (6). Soveltamisala: Mn < 20 000. |
2. Pääteryhmäanalyysi
Jotta tätä menetelmää voitaisiin käyttää, on tunnettava sekä polymeerin koko rakenne että ketjujen päissä olevien ryhmien laatu (joka pitää voida olla erotettavissa päärakenteesta esim. NMR:llä tai titraamalla/derivatisoimalla). Kun määritetään polymeerissä olevien pääteryhmien molekulaarinen konsentraatio, voidaan johtaa arvo molekyylipainolle (7) (8) (9).
Soveltamisala: Mn korkeintaan 50 000 (luotettavuus vähenee molekyylipainon noustessa).
Kirjallisuusviitteet
|
(1) |
Billmeyer, F.W. Jr, (1984). Textbook of Polymer Science, 3rd Edn, John Wiley, New York. |
|
(2) |
Glover, C.A., (1975). Absolute Colligative Property Methods. Chapter 4. In: Polymer Molecular Weights, Part I P.E. Slade, Jr. ed, Marcel Dekker, New York. |
|
(3) |
ASTM D 3750-79, (1979). Standard Practice for Determination of Number-Average Molecular Weight of Polymers by Membrane Osmometry. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
Coll, H. (1989). Membrane Osmometry. In: Determination of Molecular Weight, A.R. Cooper ed., J. Wiley and Sons, pp. 25–52. |
|
(5) |
ASTM 3592-77, (1977). Standard Recommended Practice for Determination of Molecular Weight by Vapour Pressure, American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(6) |
Morris, C.E.M., (1989). Vapour Pressure osmometry. In: Determination of Molecular Weight, A.R. Cooper ed., John Wiley and Sons. |
|
(7) |
Schröder, E, Müller, G., and Arndt, K-F., (1989). Polymer Characterisation, Carl Hanser Verlag, Munich. |
|
(8) |
Garmon, R.G., (1975). End-Group Determinations, Chapter 3 In: Polymer Molecular Weights, Part I, P.E. Slade, jr. ed. Marcel Dekker, New York. |
|
(9) |
Amiya, S., et al. (1990). Pure and Applied Chemistry, 62, 2139–2146. |
A.19. PIENIMOLEKYYLISTEN AINEIDEN PITOISUUS POLYMEERISSÄ
1. MENETELMÄ
Tämä geelipermeaatiokromatografiamenetelmä on toisinto OECD:n testausohjeesta N:o 119 (1996). Perusperiaatteet ja teknisiä lisätietoja saa kirjallisuusviitteistä.
1.1 JOHDANTO
Koska polymeerien ominaisuudet vaihtelevat suuresti, on mahdotonta kuvata yhtä ainoaa menetelmää, jossa selitettäisiin täsmällisesti kaikki polymeerien erotuksessa mahdollisesti esiintyvät erityiset seikat kattavat erotus- ja analysointiedellytykset. Erityisesti kompleksiset polymeerijärjestelmät eivät useinkaan sovi geelipermeaatiokromatografiaan. Kun GPC:tä ei voida käyttää, molekyylipaino voidaan määrittää muilla menetelmillä (katso Liite). Tällöin on esitettävä käytettyä menetelmää koskevat yksityiskohdat ja perustelut.
Seuraavassa kuvattava menetelmä perustuu DIN-standardiin 55672 (1). Tässä standardissa esitetään yksityiskohtaisesti, miten kokeet suoritetaan ja tulokset arvioidaan. Jos koeolosuhteita täytyy muuttaa, on muutokset perusteltava. Muita standardeja voi käyttää, jos niistä annetaan täydelliset viitteet. Tässä kuvattavassa menetelmässä käytetään tunnetun polydispersiivisyyden omaavia polystyreeninäytteitä kalibrointiin, ja menetelmää on mahdollisesti muutettava tiettyjä polymeerejä varten, esim. vesiliukoisia ja pitkäketjuisia haaraisia polymeerejä varten.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Matalaksi molekyylipainoksi määritellään pienempi kuin 1 000 (daltonia).
Mn (lukukeskimääräinen molekyylipaino) ja Mw (painokeskimääräinen molekyylipaino) määritellään seuraavilla yhtälöillä:
|
|
|
joissa
|
H1 |
= |
on detektorisignaalin korkeus perustasosta retentiotilavuudelle Vi, |
|
Mj |
= |
on polymeerifraktion molekyylipaino retentiotilavuudessa Vi, ja n on mittauspisteiden lukumäärä. |
Molekyylipainojakauman leveys, joka on suhteessa järjestelmän dispersiivisyyteen, saadaan suhteesta Mw/Mn
1.3 VERTAILUAINEET
Koska GPC on suhteellinen menetelmä, on tehtävä kalibrointi. Tähän käytetään tavallisesti kokojakaumaltaan kapeita lineaarisia polystyreenistandardeja, joiden keskimääräiset molekyylipainot Mn ja Mw sekä molekyylipainojakauma tunnetaan. Kalibrointikäyrää voidaan käyttää tuntemattoman näytteen molekyylipainon määritykseen vain, jos näytteen ja standardin erotusolosuhteet on valittu samalla tavalla.
Molekyylipainon ja eluutiotilavuuden suhde on validi ainoastaan tietyn kokeen tietyissä koeolosuhteissa. Tärkeitä tekijöitä ovat ennen kaikkea lämpötila, liuotin (tai liuotinseos), kromatografiajärjestely sekä erotus pylväs tai pylväsjärjestelmä.
Tällä tavoin määritetyt näytteen molekyylipainot ovat suhteellisia arvoja ja niistä käytetään nimitystä ”polystyreeniekvivalenttimolekyylipaino”. Tämä tarkoittaa sitä, että riippuen näytteen ja standardien rakenne-eroista ja kemiallisista eroista molekyylipainot voivat poiketa absoluuttisista arvoista enemmän tai vähemmän. Jos käytetään muita standardeja, esim. polyetyleeniglykolia, polyetyleenioksidia, poly-metyylimetakrylaattia tai polyakryylihappoa, on syy ilmoitettava.
1.4 TESTIMENETELMÄN PERIAATE
Sekä näytteen molekyylipainojakauma että keskimääräiset molekyylipainot Mn ja Mw voidaan määrittää GPC:llä. GPC on erityinen nestekromatografian laji, jossa näytteen erottaminen perustuu seoksen yksittäisten aineiden hydrodynaamisiin tilavuuksiin (2).
Erottuminen tapahtuu, kun näyte kulkee huokoisella aineella, tyypillisesti orgaanisella geelillä täytetyn pylvään läpi. Pienet molekyylit tunkeutuvat huokosiin, kun taas suuret molekyylit jäävät huokosten ulkopuolelle. Isojen molekyylien kulkema tie on siten lyhyempi, ja ne tulevat ensimmäisenä ulos pylväästä. Keskikokoiset molekyylit tunkeutuvat joihinkin huokosiin ja eluoituvat myöhemmin. Pienimmät molekyylit, joiden keskimääräinen hydrodynaaminen säde on pienempi kuin geelin huokoset, voivat tunkeutua kaikkiin huokosiin. Ne eluoituvat viimeisinä.
Ihanteellisessa tilanteessa erottumiseen vaikuttaa ainoastaan molekyylilajin koko, mutta käytännössä on vaikea välttää ainakin jonkin verran adsorptiosta aiheutuvaa haittaa. Epätasaisesti pakattu pylväs ja kuolleet tilavuudet voivat pahentaa tilannetta (2).
Detektorina käytetään esim. taitekerroin- tai UV-detektoria, ja tuloksena saadaan yksinkertainen jakaumakäyrä. Jotta käyrästä voidaan lukea oikeita molekyylipainoja, on pylväs kalibroitava molekyylipainoltaan tunnetuilla polymeereillä, joilla on mieluiten suunnilleen samanlainen rakenne, esim. erilaiset polystyreenistandardit. Tuloksena on tyypillisesti Gaussin käyrä, joka on joskus vääristynyt siten, että pienen molekyylipainon puolella on ”häntä”; pystysuoralla akselilla on eluoitujen molekyylilajien määrät painomitoissa ja vaaka-akselilla molekyylipainon logaritmi.
1.5 LAATUKRITEERIT
Eluutiotilavuuden toistettavuuden (keskihajonnan keskivirhe: RSD) olisi oltava parempi kuin 0,3 %, Määritvksen vaadittu toistettavuus on varmistettava sisäistä standardia käyttämällä, jos kromato-grammin arviointi on aikariippuvainen eikä täytä edellä mainittuja kriteerejä (1). Polydispersiivisyys riippuu standardien molekyylipainoista. Polystyreenistandardien osalta tyypillisiä arvoja ovat:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw /Mn < 1,20 |
(Mp on standardin molekyylipaino piikin maksimissa).
1.6 TESTIMENETELMÄN KUVAUS
1.6.1 Polystyreenistandardiliuosten valmistus
Polystyreenistandardit liuotetaan sekoittamalla huolellisesti haluttuun eluointiliuokseen. Valmistajan ohjeet on otettava huomioon liuosten valmistuksessa.
Valittujen standardien pitoisuudet riippuvat eri tekijöistä, esim. injektiotilavuudesta, liuoksen viskositeetistä ja detektorin herkkyydestä, Suurin injektiotilavuus on sovitettava pylvään pituuden mukaan, ettei pylvästä kuormiteta liikaa. Tyypilliset injektiotilavuudet käytettäessä GPC:tä analyyttisiin erotuksiin pylväässä, jonka koko on 30 cm x 7,8 mm, ovat tavallisesti 40–100 μl. Suuremmat tilavuudet ovat mahdollisia, mutta eivät saisi olla enemmän kuin 250 μl. Injektiotilavuuden ja aineen pitoisuuden paras suhde on määritettävä ennen pylvään varsinaista kalibrointia.
1.6.2 Näyteliuoksen valmistus
Periaatteessa samat vaatimukset koskevat näyteliuosten valmistamista. Näyte liuotetaan sopivaan liuottimeen (esim. tetrahydrofuraaniin (THF) ravistamalla huolellisesti. Sitä ei saa missään tapauksessa liuottaa ultraäänihauteessa. Tarpeen vaatiessa näyte puhdistetaan suodattamalla kalvolla, jonka huokoskoko on 0,2–2 μm.
Jos näytteessä on liukenemattomia hiukkasia, on tämä kirjattava loppuraporttiin, koska se saattaa johtua suurikokoisista molekyyleistä. Liukenemattomien hiukkasten painoprosenttiosuus on määritettävä jollakin sopivalla menetelmällä. Liuokset on käytettävä vuorokauden sisällä.
1.6.3 Epäpuhtauksista ja lisäaineista johtuvat korjaukset
Molekyylipainoltaan alle 1 000 olevien molekyylien suhteen on yleensä tehtävä korjaus, joka aiheutuu ei-polymeerisistä komponenteista (esim. epäpuhtaudet ja/tai lisäaineet), ellei pitoisuus jo ole pienempi kuin 1 %. Tämä tehdään analysoimalla suoraan polymeeriliuos tai GPC-eluaatti.
Jos eluaatti on pylväästä tultuaan liian laimea analysoitavaksi edelleen, se on konsentroitava. Voi olla tarpeen haihduttaa se kuiviin ja liuottaa uudelleen. Konsentroiminen on tehtävä siten, ettei eluaatissa tapahdu muutoksia. Eluaatin käsittely GPC-vaiheen jälkeen riippuu kvantitatiiviseen määritykseen käytettävästä analyyttisestä menetelmästä.
1.6.4 Laitteisto
GPC-laitteistoon kuuluu seuraavat osat:
|
— |
liuotinsäiliö |
|
— |
kaasunpoistolaite (tarvittaessa) |
|
— |
pumppu |
|
— |
pulssinvaimennin (tarvittaessa) |
|
— |
injektiojärjestelmä |
|
— |
kromatografiapylväät |
|
— |
ilmaisin (detektori) |
|
— |
virtausmittari (tarvittaessa) |
|
— |
tulosten tallennus/prosessointilaite |
|
— |
jäteastia. |
On varmistettava, että GPC-laitteisto ei reagoi käytettävien liuottimien kanssa (esim. THF:n kanssa on käytettävä teräskapillaareja).
1.6.5 Injektiojärjestelmä ja liuottimen annostelujärjestelmä
Määrätty näytetilavuus syötetään pylvääseen joko automaattisella näytteensyöttölaitteella tai käsin tarkasti määriteltyyn vyöhykkeeseen. Jos ruiskun mäntää vedetään tai työnnetään liian nopeasti, se voi aiheuttaa muutoksia havaitussa molekyylipainojakaumassa. Liuotinta pumppaavien pumppujen olisi oltava mahdollisimman tasaisia ja niissä saisi mieluiten olla pulssinvaimennin. Virtausnopeuden pitäisi olla noin 1 ml/min.
1.6.6 Pylväs
Näytteestä riippuen polymeerin ominaisuudet määritetään käyttäen joko yhtä pylvästä tai useita peräkkäin kytkettyjä pylväitä. Kaupallisesti on saatavilla lukuisia pylväsmateriaaleja, joiden ominaisuudet on määritelty (esim. huokoskoko, ekskluusiorajat). Erotusgeelin ja pylvään pituuden valinta riippuu sekä näytteen ominaisuuksista (hydrodynaamiset tilavuudet, molekyylipainojakauma) että erotuksen erityisvaatimuksista kuten liuottimesta, lämpötilasta ja virtausnopeudesta (1) (2) (3).
1.6.7 Teoreettiset levyt
Käytettävästä pylväästä tai pylväsyhdistelmästä on tiedettävä teoreettisten levyjen lukumäärä. Tätä varten syötetään pituudeltaan tunnettuun pylvääseen — jos THF on eluutioliuotin — etyylibentseeniliuosta tai muuta sopivaa ei-polaarista liuotinta. Teoreettisten levyjen lukumäärä saadaan seuraavasta yhtälöstä:
|
|
tai |
|
jossa
|
N |
on teoreettisten levyjen lukumäärä |
|
Ve |
on eluutiotilavuus piikin maksimin kohdalla |
|
W |
on piikin leveys perusviivalla |
|
W172 |
on piikin leveys piikin korkeuden puolivälissä. |
1.6.8 Erotusteho
Teoreettisten levyjen lukumäärän lisäksi, joka on vyöhykkeen leveyden määräävä suure, myös erotusteholla on osansa. Erotustehon määrää kalibraatiokäyrän jyrkkyys. Pylvään erotusteho saadaan seuraavasta yhtälöstä:

jossa
|
Ve, Mx |
on sellaisen polystyreenin, jonka molekyylipaino on Mx, eluutiotilavuus |
|
Ve,(10Mx) |
on molekyylipainoltaan kymmenen kertaa suuremman polystyreenin eluutiotilavuus. |
Järjestelmän erotuskyky määritellään yleensä seuraavasti:
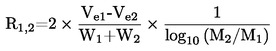
jossa
|
Ve1, Ve2 |
ovat kahden polystyreenistandardin eluutiotilavuudet piikin maksimissa |
|
W1, W2 |
ovat piikin leveydet perusviivalla |
|
M1, M2, |
ovat molekyylipainot piikin maksimissa (niiden ero pitäisi olla vähintään 10-kertainen) |
Pylvään R-arvon olisi oltava suurempi kuin 1,7 (4).
1.6.9 Liuottimet
Kaikkien liuottimien on oltava korkeaa puhtauslaatua (THF:n puhtaus 99,5 %). Liuotinastian (tarvittaessa inertissä kaasussa) on oltava riittävän iso pylvään kalibroimiseen ja useiden näytteiden määrittämiseen. Liuottimesta on poistettava kaasut ennen kuin sitä pumpataan pylvääseen.
1.6.10 Lämpötilansäätö
Tärkeiden laitteiston sisäisten osien (injektiosilmukka, pylväät, detektori ja letkut/putket) lämpötilan olisi oltava vakaa ja valitulle liuottimelle sopiva.
1.6.11 Detektori
Detektorin tarkoitus on mitata pylväästä tulevan näytteen pitoisuus. Jotta piikit eivät leviäisi tarpeettomasti, on detektorin mittauskyvetin tilavuuden oltava mahdollisimman pieni. Se ei saisi olla suurempi kuin 10 μl paitsi valon sirontaa tai viskositeettia mittaavilla detektoreilla. Detektorina käytetään tavallisesti differentiaalirefraktometriä. Muitakin detektoreja, esim. UV/VIS-, IR- ja viskositeettidetekto-reja voidaan käyttää, mikäli näytteen tai eluutioliuottimen erityiset ominaisuudet edellyttävät sitä.
2. MÄÄRITYSTULOKSET JA TULOSTEN ILMOITTAMINEN
2.1 MÄÄRITYSTULOKSET
Yksityiskohtaisten arviointiperusteiden samoin kuin määritystulosten keräämisen ja käsittelyn osalta on noudatettava DIN-standardin (1) määrävksiä.
Kustakin näytteestä tehdään kaksi erillistä koetta, jotka on analysoitava erikseen.
Mn, Mw, Mw /Mn ja M on ilmoitettava jokaisesta mittauksesta. On ilmoitettava selvästi, että mitatut arvot ovat suhteellisia arvoja, jotka ovat suhteessa käytettyjen standardien molekyylipainoihin.
Kun retentiotilavuudet tai retentioajat (mahdollisesti korjattuina sisäisten standardien suhteen} on määritetty, esitetään log M -arvot (Mp on kalibrointistandardin piikin korkein kohta) jonkin edellä mainitun suureen funktiona. Kutakin molekyylipainon kymmenen potenssia kohti tarvitaan vähintään kaksi kalibrointipistettä ja koko käyrällä on oltava vähintään viisi mittauspistettä, joiden pitäisi kattaa näytteen arvioitu molekyylipainoalue. Kalibrointikäyrän loppupiste pienen molekyylipainon päässä määritetään n-heksyylibentseenin tai jonkin muun sopivan ei-polaarisen liuottimen avulla. Mn ja Mw määritetään tavallisesti tietokoneella osastossa 1.2 esitettyjen kaavojen perusteella. Jos käytetään manuaalista digitointia, voidaan ohjeeksi katsoa menetelmää ASTM D 3536-91 (3).
Jakaumakäyrä on esitettävä taulukon tai kuvan muodossa (differentiaalinen taajuus tai summaprosenttiosuudet log M:n funktiona). Graafisessa esityksessä yksi molekyylipainon kymmenen potenssi pitäisi olla tavallisesti noin 4 cm leveä ja piikin maksimin pitäisi olla noin 8 cm korkea. Koko jakaumakäyrän osalta y-akselin korkeuden 0 ja 100 %:n välillä olisi oltava noin 10 cm.
2.2 TESTIRAPORTTI
Testiraportissa on esitettävä seuraavat asiat:
2.2.1 Testattava aine
|
— |
saatavissa olevat tiedot testattavasta aineesta (tunnistetiedot, lisäaineet, epäpuhtaudet), |
|
— |
näytteen käsittelyn kuvaus, mahdolliset huomiot ja ongelmat. |
2.2.2 Laitteisto
|
— |
eluenttisailiö, inertti kaasu, kaasun poisto eluentista, eluentin koostumus, epäpuhtaudet |
|
— |
pumppu, pulssinvaimennin, injektiojärjestelmä |
|
— |
erotuspylväät (valmistaja, kaikki tiedot pylväiden ominaisuuksista kuten huokoskoko, erotusmateriaalin tyyppi jne, käytettävien pylväiden lukumäärä, pituus ja järjestys), |
|
— |
pylvään (tai pylväsyhdistelmän) teoreettisten levyjen lukumäärä, erotusteho (järjestelmän erotuskyky), |
|
— |
piikkien symmetriaa koskevat tiedot, |
|
— |
pylvään lämpötila, lämpötilan säätötapa, |
|
— |
detektori (mittausperiaate, tyyppi, kyvetin tilavuus), |
|
— |
mahdollinen virtausmittari (valmistaja, mittausperiaate), |
|
— |
mittaustulosten tallennus- ja käsittelyjärjestelmä (laitteet ja ohjelmat). |
2.2.3 Järjestelmän kalibrointi
|
— |
kalibrointikäyrän määrittämiseksi käytetyn menetelmän tarkka kuvaus, |
|
— |
tiedot menetelmän laatukriteereistä (esim. korrelaatiokerroin, jäännösneliösumma jne.), |
|
— |
tiedot kaikista kokeen aikana sekä tulosten arvioinnissa ja käsittelyssä suoritetuista ekstrapolaatioista, oletuksista ja aproksimaatioista, |
|
— |
kaikki kalibrointikäyrän määrittämiseksi käytetyt mittaukset on esitettävä taulukossa, jossa esitetään myös seuraavat tiedot kustakin kalibrointipisteestä:
|
2.2.4 Tiedot pienimolekyylipainoisen polymeerin pitoisuudesta
|
— |
käytettyjen analyysimenetelmien kuvaus ja kokeiden suoritustapa, |
|
— |
tiedot pienimolekyylipainoisen aineen pitoisuusprosentista (w/w) suhteessa koko näytteeseen, |
|
— |
tiedot epäpuhtauksista, lisäaineista ja muista ei-polymeerisistä aineista painoprosentteina kokonäytteestä. |
2.2.5 Arviointi
|
— |
aikaperusteinen arviointi: toistettavuuden varmistamiseen käytetyt menetelmät (korjausmenetelmä, sisäinen standardi jne.), |
|
— |
suoritetaanko arviointi eluutiotilavuuden vai retentioajan perusteella, |
|
— |
tiedot arvion rajoituksista, jos piikkiä ei analysoida täydellisesti, |
|
— |
mahdollisten tasoitusmenetelmien kuvaus, |
|
— |
näytteen valmistus ja esikäsittely, |
|
— |
mahdolliset liukenemattomat hiukkaset, |
|
— |
injektiotilavuus (μl) ja injektoitavan näytteen pitoisuus (mg/ml), |
|
— |
huomiot seikoista, joista aiheutuu poikkeamista ihanteellisesta GPC-käyttäytymisestä, |
|
— |
tarkka kuvaus kaikista testausmenetelmien muutoksista, |
|
— |
virherajoja koskevat yksityiskohtaiset tiedot, |
|
— |
kaikki tulosten tulkintaan vaikuttavat tiedot ja huomiot. |
3. KIRJALLISUUSVIITTEET
|
(1) |
DIN 55672 (1995) Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1. |
|
(2) |
Yau, W.W., Kirkland, J.J, and Bly, D.D. eds (1979). Modern Size Exclusion Liquid Chromatography, J.Wiley and Sons. |
|
(3) |
ASTM D 3536-91, (1991). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
ASTM D 5296-92, (1992). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
Liite
Ohjeet pienimolekyylipainoisten aineiden pitoisuuden korjaamiseksi, jos näytteessä on liukenematonta polymeeriä
Jos näytteessä on liukenematonta polymeeriä, aiheuttaa se massakatoa GPC-analyysissä. Liukenematon polymeeri tarttuu pylvääseen tai näytesuodattimeen, kun taas näytteen liukoinen osa menee pylvään läpi. Jos polymeerin taitekerroindifferentiaali (inkrementti) (dn/dc) voidaan arvioida tai mitata, voidaan arvioida pylvääseen hävinnyt näytemassa. Tällöin tehdään korjaus ulkoisella kalibroinnilla käyttäen standardiaineita, joiden konsentraatio ja dn/dc tunnetaan, refraktometrin vasteen kalibroimiseksi. Seuraavassa esimerkissä käytetään poly(metyylimetakrylaatti) (pMMA) -stardardia.
Akryylipolymeerianalyysin ulkoisessa kalibroinnissa analysoidaan tetrahydrofuraanissa oleva, tietyn konsentraatin omaava pMMA-standardi GPC:llä, ja tuloksien avulla määritetään refraktometrivakio seuraavalla yhtälöllä:
K = R/ (C x V x dn/dc),
jossa
|
K |
on refraktometrivakio (mikrovolttiasekunti/ml), |
|
R |
on pMMA-standardin vaste (mikrovolttiasekunti), |
|
C |
on pMMA-standardin konsentraatio (mg/ml), |
|
V |
on injektiovolyymi (ml) ja |
|
dn/dc |
on tetrahydrofuraanissa olevan pMMA-standardin taitekerroindifferentiaali (ml/mg). |
Seuraavat tiedot ovat tyypillisiä pMMA-standardille:
|
R |
= |
2 937 891 |
|
C |
= |
1,07 mg/ml |
|
V |
= |
0,1 ml |
|
dn/dc |
= |
9 × 10-5 ml/mg. |
Tulokseksi saatua K-arvoa (3,05 × 1011) käytetään sitten teoreettisen detektorivasteen laskemiseksi, kun oletetaan, että injisoitu polymeeri eluoituu detektorist 100-prosenttisesti.
A.20. VESILIUOKSESSA OLEVIEN POLYMEERIEN LIUKENEMIS/UUTTUMISOMINAISUUDET
1. MENETELMÄ
Seuraava menetelmä on toisinto OECD:n ohjeen N:o 120 (1997) muutetusta versiosta. Teknisiä lisätietoja on viitteessä (1).
1.1 JOHDANTO
Tietyille polymeereille, kuten emulsiopolymeerit, on tehtävä esikäsittelyjä ennen kuin seuraavassa selostettua menetelmää voi käyttää. Menetelmä ei sovellu nestemäisiin polymeereihin eikä veden kanssa testausolosuhteissa reagoiviin polymeereihin.
Jos menetelmä ei ole kohtuullisesti tai lainkaan mahdollinen, liukenemis/uuttumisominaisuuksia voi tutkia muilla menetelmillä. Tällöin on esitettävä käytetyn menetelmän yksityiskohdat ja perustelut.
1.2. VERTAILUAINEET
Ei vertailuaineita.
1.3. TESTAUSMENETELMÄN PERIAATE
Vesiliuoksessa olevien polymeerien liukenemis/uuttumisominaisuudet määritetään pullomenetelmällä (katso A.6. Vesiliukoisuus, pullomenetelmä) seuraavin muutoksin.
1.4 LAATUKRITEERIT
Ei laatukriteerejä.
1.5 TESTAUSMENETELMÄN KUVAUS
1.5.1 Laitteisto
Menetelmässä tarvitaan seuraavat laitteet:
|
— |
murskauslaite, esim. jauhin, tietyn koon omaavien hiukkasten valmistamiseksi, |
|
— |
ravistelulaite, jossa on lämpötilansäätö, |
|
— |
kalvosuodatusjärjestelmä |
|
— |
sopiva analyysilaitteisto |
|
— |
standardisoidut seulat. |
1.5.2 Näytteen valmistus
Edustava näyte on ensin saatettava hiukkaskokoon 0,125–0,25 mm sopivilla seuloilla. Näytteen stabiilisuuden varmistamiseksi tai jauhamisen aikana voidaan tarvita jäähdytystä. Kumimaisia aineita voi murskata neste typpilämpötilassa (1).
Jos vaadittua hiukkaskokoa ei voida saavuttaa, olisi pyrittävä saamaan hiukkaskoko mahdollisimman pieneksi, ja ilmoitettava tulos. Raportissa on selostettava, miten murskattua näytettä säilytettiin ennen testausta.
1.5.3 Menetelmä
Kolme 10 gramman näytettä testattavaa ainetta punnitaan kolmeen pulloon, joissa on lasitulpat, ja 1 000 ml vettä lisätään kuhunkin pulloon. Jos on hankala käsitellä 10:tä grammaa polymeeriä, käytetään suurempaa määrää ja lisätyn veden tilavuutta muutetaan vastaavasti.
Pullot suljetaan tiiviisti ja niitä ravistetaan 20 oC:ssa. Olisi käytettävä ravistelu- tai sekoituslaitetta, jonka lämpötila pysyy käytettäessä vakiona. Kunkin pullon sisältö sentrifugoidaan tai suodatetaan 24 tunnin kuluttua ja polymeerin pitoisuus kirkkaassa vesifaasissa määritetään sopivalla määritysmenetelmällä. Jos vesifaasille ei ole olemassa sopivaa määritysmenetelmää, kokonaisliukoisuus/uuttuvuus voidaan arvioida suodatusjäännöksen tai sentrifugoidun sakan kuivapainosta.
Tavallisesti on tehtävä kvantitatiivinen ero epäpuhtauksien ja lisäaineiden ja toisaalta pienimolekyylipainoisten aineiden välillä. Gravimetrisiä määrityksiä tehtäessä on tärkeää tehdä myös nollakoe ilman testattavaa ainetta, jotta voidaan määrittää koemenetelmästä johtuvat jäämät.
Polymeerien liukenemis/uuttumisominaisuuksia vedessä 37 oC:ssa pH:ssa 2 ja 9 voidaan määrittää samalla tavalla kuin 20 oC:n kokeessa. pH-arvot voidaan säätää lisäämällä joko sopivia puskureita tai sopivia happoja tai emäksiä kuten suolahappoa, etikkahappoa, pro analyysi -laatuista natrium- tai kaliumhydroksidia tai NH3:a.
Määritysmenetelmästä riippuen on tehtävä yksi tai kaksi testiä. Jos on olemassa riittävän spesifinen menetelmä polymeerikomponentin määrittämiseksi suoraan vesiliuoksesta, pitäisi yhden edellä kuvatun kaltaisen testin riittää. Jos tällaista menetelmää ei kuitenkaan ole käytettävissä ja jos polymeerin liukenemis/uuttumisominaisuuksien määritys rajoittuu epäsuoraan analyysiin eli ainoastaan orgaanisen hiilen kokonaismäärän (TOC) määrittämiseen vesiuutteesta, pitäisi tehdä lisätesti. Tämä lisätesti pitäisi myös tehdä kolmoismäärityksenä käyttäen kymmenen kertaa pienempiä polymeerinäytteitä ja samaa määrää vettä kuin ensimmäisessä testissä.
1.5.4 Määritys
1.5.4.1 Testi, jossa on yksi näytekoko
Menetelmiä vesifaasissa olevan polymeerikomponentin suoraa määrittämistä varten voi olla olemassa. Vaihtoehtoisesti voidaan harkita myös liuenneiden/uuttuneiden polymeerikomponenttien epäsuoraa analyysiä, jolloin määritetään liukoisten osien kokonaispitoisuus ja korjataan ei-polymeerispesifisten komponenttien suhteen.
Kokonaispolymeeri voidaan määrittää vesiliuoksesta:
joko riittävän herkällä menetelmällä, esim.
|
— |
TOC käyttämällä persulfaatti- tai dikromaattidigestiota, jolloin muodostuva CO2 määritetään IR:llä tai kemiallisesti; |
|
— |
atomiabsorptiospektrometrialla (AAS) tai ICP (inductively coupled plasma) -emissiomenetelmällä, jos polymeeri sisältää piitä tai metallia; |
|
— |
UV-absorptio- tai spektrofluorometrialla, jos on kyseessä aryylipolymeeri; |
|
— |
LC-MS:llä, jos on kyseessä pienimolekyylipainoiset näytteet; |
tai haihduttamalla vesiuute tyhjiössä kuiviin ja tekemällä jäännöksestä spektroskooppinen (IR, UV jne.) tai AAS/ICP-analyysi.
Jos vesifaasia ei voida sellaisenaan analysoida, pitäisi vesiuute uuttaa veteen sekoittuvalla orgaanisella liuottimella, esim. klooratulla hiilivedyllä. Liuotin haihdutetaan ja jäännöksestä määritetään ilmoitetun polymeerin pitoisuus kuten edellä on selostettu. Jos tässä jäännöksessä tunnistetaan epäpuhtauksia tai lisäaineita, on niiden osuus vähennettävä itse polymeerin liukenemis/uuttumisasteen määrittämiseksi.
Jos näytteessä on suhteellisen paljon tällaisia aineita, voi olla tarpeen tehdä jäännökselle esim. HPLC-tai GC-analyysi epäpuhtauksien erottamiseksi monomeeristä ja monomeeristä peräisin olevasta aineesta, jotta monomeerin todellinen pitoisuus voidaan määrittää.
Joskus voi riittää, että orgaaninen liuotin haihdutetaan kuiviin ja kuiva jäännös punnitaan.
1.5.4.2 Testi, jossa on kaksi eri näytekokoa
Kaikista vesiuutteista määritetään TOC.
Näytteen liukenemattomalle osalle (joka ei uuttunut) tehdään gravimetrinen analyysi. Jos kunkin pullon sisällön sentrifugoinnin tai suodattamisen jälkeen polymeerijäännöksiä on tarttunut pullon seinämiin, pitäisi pullo huuhtoa suodoksella, kunnes siinä ei enää näy mitään jäännöstä. Sen jälkeen suodos sentrifugoidaan tai suodatetaan uudelleen. Suodattimeen tai sentrifuugiputkeen jäänyt jäännös kuivataan 40 oC:ssa tyhjiössä ja punnitaan. Kuivaamista jatketaan, kunnes saavutetaan vakiopaino.
2. MÄÄRITYSTULOKSET
2.1 TESTI, JOSSA ON YKSI NÄYTEKOKO
Ilmoitetaan erilliset tulokset kutakin kolmea pulloa kohti ja keskiarvot ilmaistuna massayksiköllä liuostilavuutta kohti (tyypillisesti mg/l) tai massayksiköllä polymeerinäytteen massaa kohti (tyypillisesti mg/g). Lisäksi pitäisi ilmoittaa näytteen painohävikki (liuenneen aineen paino jaettuna alkuperäisen näytteen painolla) Suhteelliset keskihajonnat (RSD) pitäisi laskea. Tulokset pitää antaa koko ainemäärää kohti (polymeeri + olennaiset lisäaineet jne.) ja pelkkää polymeeriä kohti (ts. sen jälkeen, kun on vähennetty tällaisten lisäaineiden vaikutus).
2.2 TESTI, JOSSA ON KAKSI NÄYTEKOKOA
Ilmoitetaan erilliset TOC-arvot kahden kolmenkertaisilla näytteillä tehdyn kokeen vesiliuosuutteille ja kunkin kokeen keskiarvo ilmaistuna massayksiköllä liuostilavuutta kohti (tyypillisesti mgC/l) sekä massayksikköinä alkuperäisen näytteen painoa kohti (tyypillisesti mgC/g).
Jos tuloksissa ei ole eroa, kun näytteen suhde vesimäärään on suuri tai pieni, tämä voi merkitä sitä, että kaikki uuttuvat komponentit ovat todella uuttuneet. Tällöin ei suora määritys ole yleensä tarpeen.
Kunkin jäännöksen painot olisi ilmoitettava erikseen ja ilmaistava prosentteina näytteiden alkuperäispainoista. Keskiarvot lasketaan koetta kohti. Erotus sadan prosentin ja havaittujen prosenttimäärien välillä on alkuperäisen näytteen liukoisen ja uuttuvan aineksen prosenttimäärä.
3. TULOSTEN ILMOITTAMINEN
3.1 TESTIRAPORTTI
Testiraportissa on esitettävä seuraavat tiedot:
3.1.1 Testattava aine:
|
— |
saatavissa olevat tiedot testattavasta aineesta (tunnistetiedot, lisäaineet, epäpuhtaudet, pienimolekyylipainoisen aineen pitoisuus) |
3.1.2 Koeolosuhteet
|
— |
kuvaus käytetyistä menetelmistä ja koeolosuhteista; |
|
— |
kuvaus analyyttisistä ja detektiomenetelmistä. |
3.1.3 Tulokset:
|
— |
liukoisuus/uuttuvuustulokset mg/l; yksittäiset arvot ja keskiarvot uuttumiskokeista eri liuoksissa, eritellen polymeeripitoisuus ja epäpuhtaudet, lisäaineet ym., |
|
— |
liukoisuus/uuttuvuustulokset mg/g polymeeriä, |
|
— |
vesiliuosuutteiden TOC-arvot, liuenneen aineen paino ja lasketut prosenttiosuudet, jos ne on mitattu, |
|
— |
kunkin näytteen pH, |
|
— |
tiedot nollanäytteistä, |
|
— |
tarvittaessa kirjallisuudesta saatavat tiedot testattavan aineen kemiallisesta epästabiilisuudesta sekä testausprosessin aikana että analyysin aikana, |
|
— |
muut tiedot, jotka ovat tärkeitä tulosten tulkitsemisen kannalta. |
4. KIRJALLISUUSVIITTEET
|
(1) |
DIN 53733 (1976) Zerkleinerung von Kunststofferzeugnissen für Prüfzwecke. |
A.21. HAPETTAVAT OMINAISUUDET (NESTEET)
1. MENETELMÄ
1.1 JOHDANTO
Tämän testimenetelmän tarkoituksena on mitata nestemäisen aineen kyky suurentaa palavan aineen palamisnopeutta tai -intensiteettiä tai sen kykyä muodostaa palavan aineen kanssa sellainen seos, joka voi syttyä itsestään, kun aineet sekoitetaan täydellisesti. Menetelmä perustuu YK:n testiin hapettaville nesteille (1) ja vastaa sitä täysin. Koska menetelmä A.21 on kuitenkin tarkoitettu pääasiassa täyttämään asetuksen 1907/2006 vaatimukset, testattavaa ainetta on tarpeen verrata vain yhteen vertailuaineeseen. Testaaminen ja aineen vertaaminen muihin vertailuaineisiin voi olla tarpeen, jos on odotettavissa, että testien tuloksia käytetään muihin tarkoituksiin (9).
Tätä testiä ei tarvitse tehdä, jos rakennekaavaa tarkastelemalla voidaan päätellä kohtuullisella varmuudella, että aine ei voi reagoida eksotermisesti palavan aineen kanssa.
On hyvä, jos aineen mahdollisista räjähdysominaisuuksista on saatavilla alustavaa tietoa ennen testin tekemistä.
Tätä testi ei sovellu kiinteille aineille, kaasuille, räjähtäville tai erittäin helposti syttyville aineille eikä orgaanisille peroksideille.
Tätä testiä ei mahdollisesti tarvitse tehdä, jos ainetta koskevia tuloksia on jo olemassa YK:n hapettavia nesteitä koskevasta testistä (1).
1.2 MÄÄRITELMÄT JA MITTAYKSIKÖT
Keskimääräinen paineennousuaika on niiden aikojen keskiarvo, jotka on mitattu, kun testattavan seoksen paine on nostettu 690 kPa:sta 2 070 kPa:an ilmanpaineen yläpuolella.
1.3 VERTAILUAINE
Vertailuaineeksi tarvitaan 65-painoprosenttista typpihappoa (vesiliuos; analyyttinen laatu) (10).
Jos kokeen tekijä kuitenkin arvelee, että testin tuloksia saatetaan käyttää muihin tarkoituksiin (9), muidenkin vertailuaineiden testaaminen voi olla aiheellista (11).
1.4 TESTIMENETELMÄN PERIAATE
Testattava neste sekoitetaan massasuhteessa 1:1 kuituselluloosan kanssa ja siirretään paineastiaan. Jos aineet syttyvät itsestään sekoitettaessa tai astiaa täytettäessä, ei testiä tarvitse jatkaa.
Jos testattava seos ei syty itsestään, tehdään koko testi. Seosta kuumennetaan paineastiassa ja määritetään keskimääräinen aika, joka tarvitaan, että paine nousee 690 kPa:sta 2 070 kPa:an ilmanpaineen yläpuolella. Tätä verrataan siihen keskimääräiseen aikaan, joka tarvitaan, että vertailuaine(id)en ja selluloosan 1:1-seos paine nousee saman verran.
1.5 LAATUKRITEERIT
Viiden kokeen sarjassa yhdellä aineella mikään tulos ei saa erota enempää kuin 30 % aritmeettisesta keskiarvosta. Tulokset, jotka eroavat yli 30 % keskiarvosta, on hylättävä, sekoitus- ja täyttömenetelmää on parannettava ja testi uusittava.
1.6 MENETELMÄN KUVAUS
1.6.1 Valmistelu
1.6.1.1 Palava aine
Palavana aineena käytetään kuivattua kuituselluloosaa, jonka kuidun pituus 50–250 μm ja keskihalkaisuja 25 μm (12). Selluloosa kuivataan vakiopainoon kerroksena, joka on enintään 25 mm paksu, 105 oC:ssa 4 tuntia, ja sitä pidetään eksikkaattorissa kuivatusaineen kanssa, kunnes se on jäähtynyt ja kunnes sitä tarvitaan. Kuivatun selluloosan vesipitoisuuden pitäisi olla alle 0,5 % kuivasta massasta (13). Tarvittaessa kuivatusaikaa on pidennettävä, jotta tähän päästään (14). Koko testin aikana on käytettävä samaa selluloosaerää.
1.6.1.2 Laitteet
1.6.1.2.1
Testiin tarvitaan lieriönmuotoinen teräksinen paineastia, jonka pituus on 89 mm ja ulkohalkaisija 60 mm (ks. kuva 1). Vastakkaisille sivuille työstetään kaksi tasaista pintaa (jolloin astian poikkileikkaus pienenee 50 mm:iin) kiinnipitämisen helpottamiseksi, kun sytytystulppaa ja ilmaustulppaa pannaan paikoilleen. Astian sisäläpimitta on 20 mm ja kummankin pään sisäpuoli on kyntetty 19 mm:n syvyydeltä ja siinä on kierteet, joihin sopii 1" British Standard Pipe (BSP) tai vastaava metrijärjestelmän mukainen osa. Paineastian pyöreään pintaan 35 mm:n päähän astian toisesta päästä ja 90 asteen kulmassa työstettyihin pintoihin on ruuvattu sivuhaara, jonka kautta paine voidaan päästää ulos. Sivuhaaraputken istukka porataan 12 mm:n syvyyteen siten, että siihen sopii 1/2":n BSP (tai metrijärjestelmän vastaava) kierre sivuhaaran päässä. Tarvittaessa lisätään inertti tiiviste, jotta liitos on kaasutiivis. Sivuhaara ulottuu 55 mm:n päähän paineastian ulkopuolelle, ja sen sisäläpimitta on 6 mm. Sivuhaaran pää on kyntetty ja sen kierteet ovat sellaiset, että niihin sopii kalvotyyppinen paineenmuunnin. Mitä tahansa paineenmittauslaitetta voidaan käyttää edellyttäen, etteivät kuumat kaasut tai hajoamisessa syntyvät yhdisteet vaikuta siihen ja että se pystyy mittaamaan paineennousunopeuksia 690–2 070 kPa:n välillä alle 5 ms:ssa.
Kauempana sivuhaarasta oleva paineastian pää suljetaan sytytystulpalla, jossa on kaksi elektrodia. Toinen niistä on eristetty tulpan pääosasta ja toinen on maadoitettu siihen. Paineastian toisessa päässä on varokalvo (murtumispaine noin 2 200 kPa), jota pitää paikallaan sisäläpimitaltaan 20 mm:n tulppa. Tarvittaessa sytytystulpan kanssa käytetään inerttiä tiivistettä, jotta liitos on kaasutiivis. Tukiteline (kuva 2) pitää kokoonpanon oikeassa asennossa käytön aikana. Siihen kuuluu tavallisesti pehmeää terästä oleva pohjalaatta, jonka mitat ovat 235 mm x 184 mm x 6 mm, ja 185 mm:n pituinen poikkileikkaukseltaan neliönmuotoinen onttotanko, jonka mitat ovat 70 mm x 70 mm x 4 mm.
Neliöonttotangon toisessa päässä siitä leikataan pala vastakkaisilta puolilta siten, että saadaan rakenne, jossa on kaksi litteäreunaista jalkaa, joiden yläpuolella on 86 mm koskematonta neliöonttotankoa. Jalat leikataan siten, että ne muodostavat 60o:n kulman vaakatason kanssa, kun tanko on hitsattu pohjalaattaan. Pohjarakenteen yläosan yhdelle laidalle työstetään lovi, jonka leveys on 22 mm ja syvyys 46 mm, siten, että kun paineastiakokoonpano lasketaan onttotankotelineeseen sytytystulppa edellä, sivuhaara sopii loveen. Onttotangon alempaan sisäpintaan hitsataan 30 mm leveä ja 6 mm paksu teräspala, joka toimii välikkeenä. Kaksi vastakkaisilla pinnoilla olevaa 7 mm:n siipiruuvia pitää paineastian tukevasti paikallaan. Kaksi 12 mm leveää 6 mm:n paksuisesta teräksestä tehtyä nauhaa, jotka on hitsattu onttotangon pohjaosaan kiinnittyviin sivuosiin, tukee paineastiaa alhaalta päin.
1.6.1.2.2
Sytytysjärjestelmä koostuu 25 cm pitkästä Ni/Cr-langasta, jonka halkaisija on 0,6 mm ja vastus 3,85 ohm/m. Lanka on kierretty halkaisijaltaan 5 mm:n tangon avulla kelaksi ja kiinnitetty sytytystulpan elektrodeihin. Kelan muodon pitäisi olla sellainen kuin kuvassa 3 esitetään. Astian pohjan ja sytytyskelan alapään välisen etäisyyden pitäisi olla 20 mm. Ellei elektrodeja voi säätää, pitäisi kelan ja astian pohjan välillä olevan sytytyslangan päät eristää keraamivaipalla. Lankaa kuumennetaan tasavirtatehonlähteellä, joka pystyy tuottamaan vähintään 10 A:n voimakkuista virtaa.
1.6.2 Testin suoritusarvot (15)
Laitetta, joka on koottu täydellisesti ja jossa on paineenmuunnin ja kuumennusjärjestelmä, mutta johon ei ole asennettu varokalvoa, tuetaan sytytystulppapuoli alaspäin. 2,5 g testattavaa nestettä ja 2,5 g kuivattua selluloosaa sekoitetaan lasidekanterissa käyttäen lasista sekoitussauvaa (16). Turvallisuussyistä työntekijän ja seoksen välillä on oltava suojalevy sekoituksen aikana. Jos seos syttyy sekoituksen tai täytön aikana, ei testiä tarvitse jatkaa. Seos siirretään paineastiaan pieni määrä kerrallaan taputtaen, jotta seos pakkautuisi sytytyskelan ympärille ja olisi hyvin kosketuksissa sen kanssa. On tärkeää, ettei kela vääristy seoksen pakkaamisen aikana, koska se voisi aiheuttaa vääriä tuloksia (17). Varokalvo asetetaan paikalleen ja kiinnitystulppa kierretään tiukasti paikalleen. Täytetty astia asetetaan tukitelineeseen siten, että varokalvo on ylöspäin. Teline olisi sijoitettava sopivaan vahvistettuun vetokaappiin tai sytytyskammioon. Tehonlähde yhdistetään sytytystulpan ulompiin päihin ja annetaan 10 A:n virtaa. Aika, joka kuluu sekoituksen aloittamisesta tehon kytkemiseen, ei saisi olla pitempi kuin 10 min.
Paineenmuuntimen aikaansaama signaali rekisteröidään sopivalla järjestelmällä, joka mahdollistaa sekä arvioinnin että saadun aika-painekäyrän pysyvän rekisteröinnin (esim. transienttitallennin, joka on kytketty piirturiin). Seosta kuumennetaan, kunnes varokalvo murtuu tai ainakin 60 s. Jos varokalvo ei murru, seoksen on annettava jäähtyä ennen kuin laite puretaan varovasti ja varoen erityisesti mahdollista paineen vapautumista. Testattavalla aineella ja vertailuaineella (-aineilla) tehdään viisi koetta. Kirjataan aika, joka kuluu siihen, että paine nousee 690 kPa:sta 2 070 kPa:iin ilmanpaineen yläpuolella. Lasketaan paineennousuun kuluvien aikojen keskiarvo.
Joissakin tapauksissa aineet saattavat aiheuttaa paineen nousun (liian suuren tai liian pienen), joka aiheutuu sellaisista kemiallisista reaktioista, jotka eivät liity aineen hapettaviin ominaisuuksiin. Tällöin voi olla tarpeen toistaa testi inertillä aineella, esim. piimaalla (kieselguhr), selluloosan sijasta reaktion laadun selvittämiseksi.
2. MITTAUSTULOKSET
Paineen nousuun kuluneet ajat sekä testiaineelle että vertailuaineelle (-aineille). Paineen nousuun kuluneet ajat mahdollisille inertin aineen kanssa tehdyille testeille.
2.1 TULOSTEN KÄSITTEY
Lasketaan paineen nousuun kuluneiden aikojen keskiarvot sekä testiaineelle että vertailuaineelle (-aineille).
Lasketaan paineen nousuun kuluneiden aikojen keskiarvot mahdollisille inertin aineen kanssa tehdyille testeille.
Taulukossa 1 esitetään joitakin esimerkkejä tuloksista.
Taulukko 1
Esimerkkejä tuloksista (18)
|
Aine (19) |
Keskimääräinen paineen nousuun kulunut aika 1:1 -selluloosaseokselle (ms) |
|
Ammoniumdikromaatti, kyllästetty vesiliuos |
20 800 |
|
Kalsiumnitraatti, kyllästetty vesiliuos |
6 700 |
|
Ferrinitraatti, kyllästetty vesiliuos |
4 133 |
|
Litiumperkloraatti, kyllästetty vesiliuos |
1 686 |
|
Magnesiumperkloraatti, kyllästetty vesiliuos |
777 |
|
Nikkelinitraatti, kyllästetty vesiliuos |
6 250 |
|
Typpihappo, 65 % |
4 767 (20) |
|
Perkloorihappo, 50 % |
121 (20) |
|
Perkloorihappo, 55 % |
59 |
|
Kaliumnitraatti, 30 % vesiliuos |
26 690 |
|
Hopeanitraatti, kyllästetty vesiliuos |
— (21) |
|
Natriumkloraatti, 40 % vesiliuos |
2 555 (20) |
|
Natriumnitraatti, 45 % vesiliuos |
4 133 |
|
Inertti aine |
|
|
Vesi: selluloosa |
— (21) |
3. TESTISELOSTE
3.1 TESTISELOSTE
Testiselosteessa on ilmoitettava seuraavat tiedot:
|
— |
testattavan aineen tunnistetiedot, koostumus, puhtausaste jne. |
|
— |
testiaineen pitoisuus, |
|
— |
selluloosan kuivausmenetelmä, |
|
— |
käytetyn selluloosan vesipitoisuus, |
|
— |
mittaustulokset, |
|
— |
inertin aineen kanssa mahdollisesti tehtyjen testien tulokset, |
|
— |
paineen nousuun kuluvista ajoista lasketut keskiarvot, |
|
— |
mahdolliset poikkeamat tästä menetelmästä ja syyt niihin, |
|
— |
kaikki lisätiedot ja huomautukset, jotka voivat vaikuttaa tulosten tulkintaan. |
3.2 TULOSTEN TULKINTA (22)
Testitulosten arvioinnissa
|
a) |
todetaan, syttyykö testiaineen ja selluloosan seos itsestään ja |
|
b) |
verrataan paineen nousuun (690 kPa – 2 070 kPa) kuluneiden aikojen keskiarvoja vertailuaine(id)en vastaaviin arvioihin. |
Nestemäisen aineen katsotaan olevan hapettava, kun
|
a) |
testattavan aineen ja selluloosan 1:1-seos (massana) syttyy itsestään tai |
|
b) |
testattavan aineen ja selluloosan 1:1-seoksella (massana) on pienempi tai yhtä suuri keskimääräinen paineen nousuun kuuluva aika kuin 65-painoprosenttisen typpihapon ja selluloosan 1:1-seoksella (massana). |
Väärien positiivisten tulosten välttämiseksi on tuloksia tulkittaessa tarkasteltava tarvittaessa myös tuloksia, jotka on saatu testattaessa ainetta inertin materiaalin kanssa.
4. KIRJALLISUUS
|
(1) |
Recommendations on the Transport of Dangerous Goods, Manual of Tests and Criteria. 3. tarkistettu painos. YK:n julkaisu nro ST/SG/AC.10/11/Rev. 3, 1999, sivu 342. Test O.2: Test for oxidizing liquids. |
Kuva1
Paineastia
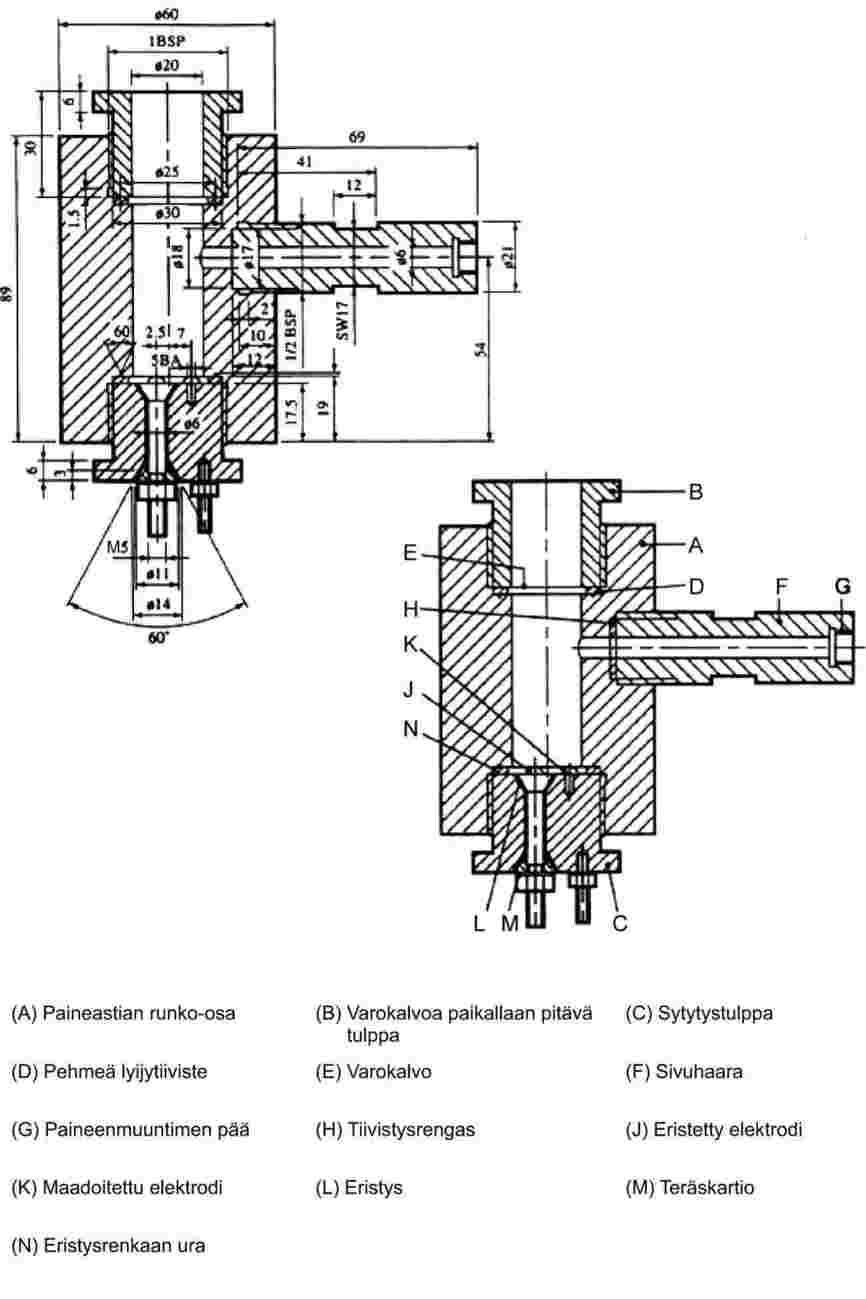
Kuva 2
Tukiteline
Kuva 3
Sytytysjärjestelmä

Huom: kokoonpanosta voidaan käyttää kumpaa hyvänsä.
(1) Vaihtelee laitteen tyypin ja aineen puhtausasteen mukaan.
(2) Vaihtelee laitteen tyypin ja aineen puhtausasteen mukaan.
(3) Vaihtelee laitteen tyypin ja aineen puhtausasteen mukaan.
(4) Vaihtelee laitteen tyypin ja aineen puhtausasteen mukaan.
(5) Koskee vain esimerkiksi ASTM D 1120-72:ssa kuvattujen yksinkertaisten laitteiden avulla tehtäviä määrityksiä. Tarkkuutta voidaan parantaa käyttämällä kehittyneempiä laitteita.
(6) Koskee vain puhtaita aineita. Menetelmän käyttö muissa olosuhteissa on perusteltava.
(7) Vaihtelee puhtausasteen mukaan.
(8) Menetelmiä voidaan huolellisuutta noudattaen käyttää myös alueella 1–10 Pa.
(9) Esimerkiksi YK:n kuljetussäännösten yhteydessä.
(10) Happo on titrattava ennen testausta sen konsentraation varmistamiseksi.
(11) Esimerkiksi 50-painoprosenttista perkloorihappoa ja 40-painoprosenttista natriumkloraattia on käytetty viitteessä 1.
(12) Esimerkiksi Whatman Column Chromatographic Cellulose Powder CF 11, luettelon nro 4021 050.
(13) Varmistetaan (esim.) Karl-Fisherin titrauksella.
(14) Vesipitoisuus voidaan määrittää myös (esim.) kuumentamalla 105 oC:ssa tyhjiössä 24 h.
(15) Hapettimien ja selluloosan seoksia on pidettävä mahdollisesti räjähtävinä ja käsiteltävä asianmukaisella huolella.
(16) Käytännössä tämä voidaan tehdä valmistamalla testattavasta nesteestä ja selluloosasta 1:1-seosta suurempi määrä kuin kokeeseen tarvitaan ja siirtämällä 5 ±0,1 g seosta paineastiaan. Seos on valmistettava tuoreeltaan joka koetta varten.
(17) Erityisesti on estettävä kelan vierekkäisten kierteiden välinen kosketus.
(18) Ks. viite (1), YK:n kuljetusjärjestelmän mukainen luokitus.
(19) Kyllästetyt liuokset on valmistettava 20 oC:ssa.
(20) Laboratorioidenvälisten vertailevien tutkimusten keskiarvo.
(21) Maksimipainetta 2 070 kPa ei saavutettu.
(22) Ks. viite 1, tulosten tulkinta YK:n kuljetusmäärysten mukaan käytettäessä useita vertailuaineita.
OSA B: TOKSISUUDEN JA MUIDEN TERVEYSVAIKUTUSTENMÄÄRITYS
SISÄLLYSLUETTELO
YLEISJOHDANTO
|
B.1 a. |
AKUUTTI ORAALINEN TOKSISUUS — VAKIOANNOSMENETELMÄ |
|
B.1 b. |
AKUUTTI ORAALINEN TOKSISUUS — AKUUTIN TOKSISUUSLUOKAN MENETELMÄ |
|
B.2. |
AKUUTTI MYRKYLLISYYS (HENGITETTYNÄ) |
|
B.3. |
AKUUTTI MYRKYLLISYYS (IHON KAUTTA) |
|
B.4. |
AKUUTTI TOKSISUUS: IHOÄRSYTTÄVYYS/-SYÖVYTTÄVYYS |
|
B.5. |
AKUUTTI TOKSISUUS: SILMÄN ÄRSYTTÄVYYS/SYÖVYTTÄVYYS |
|
B.6. |
IHON HERKISTYMINEN |
|
B.7. |
ORAALINEN TOISTUVAN ANNOSTELUN TOKSISUUSTUTKIMUS (28 VRK) |
|
B.8. |
TOISTETUN ANNOKSEN (28 PÄIVÄÄ) MYRKYLLISYYS (HENGITETTYNÄ) |
|
B.9. |
TOISTETUN ANNOKSEN (28 PÄIVÄÄ) MYRKYLLISYYS (IHON KAUTTA NAUTITTAVAT AINEET) |
|
B.10. |
MUTAGEENISUUS — KROMOSOMIPOIKKEAVUUSTESTI NISÄKÄSSOLUILLA IN VITRO |
|
B.11. |
MUTAGEENISUUS — KROMOSOMIPOIKKEAVUUSTESTI NISÄKKÄIDEN LUUYTIMESSÄ IN VIVO |
|
B.12. |
MUTAGEENISUUS — MIKROTUMATESTI NISÄKKÄÄN PUNASOLUISSA IN VIVO |
|
B.13/14. |
MUTAGEENISUUS — TAKAISINMUTAATIOTESTI BAKTEEREILLA |
|
B.15. |
MUTAGEENISUUSTESTAUS JA KARSINOGEENISTEN AINEIDEN SEULONTA GEENIMUTAATIOT — SACCHAROMYCES CEREVISIAE |
|
B.16. |
MITOOTTINEN REKOMBINAATIO — SACCHAROMYCES CEREVISIAE. |
|
B.17. |
MUTAGEENISUUS — GEENIMUTAATIOTESTI NISÄKÄSSOLUILLA IN VITRO |
|
B.18. |
DNA-VAURIO JA SEN KORJAANTUMINEN — UDS-TESTI NISÄKÄSSOLUVILJELMÄLLÄ |
|
B.19. |
SISARKROMATIDIVAIHDOSTESTI |
|
B.20. |
RESESSIIVI LETAALI -TESTI BANAANIKÄRPÄSELLÄ (DROSOPHILIA MELANOGASTER) |
|
B.21. |
SOLUTRANSFORMAATIOTESTIT NISÄKÄSSOLUVILJELMILLÄ |
|
B.22. |
DOMINOIVA LETAALITESTI JYRSIJÖILLÄ |
|
B.23. |
NISÄKKÄIDEN SPERMATOGONIOIDEN KROMOSOMIPOIKKEAVUUSTESTI |
|
B.24. |
HIIREN SPOT-TESTI |
|
B.25. |
HIIREN PERIYTYVÄ TRANSLOKAATIO |
|
B.26. |
SUBKROONINEN ORAALINEN MYRKYLLISYYSTESTI TOISTETUILLA ANNOKSILLA TEHTÄVÄ 90 VUOROKAUDEN ORAALINEN MYRKYLLISYYSTUTKIMUS JYRSIJÖILLÄ |
|
B.27. |
SUBKROONINEN ORAALINEN MYRKYLLISYYSTESTI TOISTETUILLA ANNOKSILLA TEHTÄVÄ 90 VUOROKAUDEN ORAALINEN MYRKYLLISYYSTUTKIMUS MUILLA KUIN JYRSIJÖILLÄ |
|
B.28. |
SUBKROONINEN MYRKYLLISYYSTESTI (IHON KAUTTA) TOISTUVA ANNOSTELU IHON KAUTTA, 90 VUOROKAUTTA, JYRSIJÄT |
|
B.29. |
SUBKROONINEN MYRKYLLISYYSTESTI (HENGITYSTEIDEN KAUTTA) TOISTUVA ANNOSTELU HENGITYSTEIDEN KAUTTA, 90 VUOROKAUTTA, JYRSIJÄT |
|
B.30. |
KROONINEN MYRKYLLISYYSTESTI |
|
B.31. |
PRENATAALISEN KEHITYKSEN AIKAISTEN MYRKYLLISYYSVAIKUTUSTEN TUTKIMUS |
|
B.32. |
KARSINOGEENISUUSTESTI |
|
B.33. |
YHDISTETTY KROONINEN MYRKYLLISYYS/KARSINOGEENISUUSTESTI |
|
B.34. |
MYRKKYJEN VAIKUTUS LISÄÄNTYMISKYKYYN (YHDEN SUKUPOLVEN TESTI) |
|
B.35. |
KAKSI SUKUPOLVEA KÄSITTÄVÄ LISÄÄNTYMISKYKYYN KOHDISTUVIEN MYRKYLLISYYSVAIKUTUSTEN TUTKIMUS |
|
B.36. |
MYRKKYKINETIIKKA |
|
B.37. |
ORGANOFOSFAATTIEN AIHEUTTAMA VIIVÄSTYNYT NEUROTOKSISUUS AKUUTIN ALTISTUKSEN JÄLKEEN |
|
B.38. |
ORGANOFOSFAATTIEN AIHEUTTAMA VIIVÄSTYNYT NEUROTOKSISUUS 28 PÄIVÄN TOISTUVAN ANNOSTELUN TUTKIMUKSESSA |
|
B.39. |
UDS-TESTI NISÄKKÄIDEN MAKSASOLUILLA IN VIVO |
|
B.40. |
IN VITRO IHOSYÖVYTTÄVYYS: IHON SÄHKÖVASTUSMÄÄRITYSTESTI (TER) |
|
B.40 a. |
IN VITRO IHOSYÖVYTTÄVYYS: IHMISIHOMALLITESTI |
|
B.41. |
IN VITRO 3T3 NRU — VALOMYRKYLLISYYSTESTI |
|
B.42. |
IHOHERKISTYS: PAIKALLINEN IMUSOLMUKEMÄÄRITYSMENETELMÄ |
|
B.43. |
NEUROTOKSISUUSTUTKIMUS JYRSIJÖILLÄ |
|
B.44. |
IHON KAUTTA IMEYTYMINEN: IN VIVO -MENETELMÄ |
|
B.45. |
IHON KAUTTA IMEYTYMINEN: IN VITRO -MENETELMÄ |
YLEISJOHDANTO
A. TESTIAINEEN KARAKTERISAATIO
Testiaineen koostumus, mukaan lukien tärkeimmät epäpuhtaudet, ja sen olennaiset fysikaalis-kemialliset ominaisuudet, mukaan lukien stabiliteetti, on oltava tiedossa ennen toksisuustutkimusten aloittamista.
Testiaineen fysikaalis-kemialliset ominaisuudet antavat tärkeää tietoa antotavan, tutkimusasetelman ja testiaineen käsittely- ja säilyttämistavan valintaa varten.
Annosteluaineessa ja biologisessa materiaalissa olevan testiaineen (ja mahdollisuuksien mukaan myös tärkeimpien epäpuhtauksien) määrittämiseen käytettävä määrällinen ja laadullinen analyysimenetelmä tulee kehittää ennen tutkimuksen aloittamista.
Kaikki testiaineen tunnistamiseen, fysikaalis-kemiallisiin ominaisuuksiin, puhtauteen ja käyttäytymiseen liittyvät tiedot tulee sisällyttää tutkimusraporttiin.
B. ELÄINTEN HOITO
Ympäristöolosuhteiden ja eläinten oikeiden hoitomenetelmien tiukka seuranta on oleellista toksisuustutkimuksissa.
i) Elinolosuhteet
Koe-eläintilojen ja häkkien ympäristöolosuhteiden on oltava testattavalle lajille tarkoituksenmukaiset. Rotalle, hiirelle ja marsulle sopiva huoneenlämpötila on 22 ± 3 oC ja suhteellinen ilmankosteus 30-70 %. Kaniineille sopiva huoneenlämpötila on 20 ± 3 oC ja suhteellinen ilmankosteus 30–70 %.
Jotkut tutkimusmenetelmät ovat erityisen herkkiä lämpötilavaikutuksille. Näissä tapauksissa asianmukaiset olosuhteet on selostettu yksityiskohtaisesti tutkimusmenetelmän kuvauksen yhteydessä. Kaikissa toksisuustutkimuksissa on valvottava huoneenlämpötilaa ja ilmankosteutta, rekisteröitävä tiedot ja kirjattava ne tutkimuksen loppuraporttiin.
Valaistuksen tulee olla keinovaloa. Eläimen tulee saada olla 12 tuntia valossa ja 12 tuntia pimeässä. Valaistusmallin yksityiskohdat on rekisteröitävä ja kirjattava tutkimuksen loppuraporttiin.
Jollei menetelmässä erikseen muuta mainita, eläimiä voidaan säilyttää yksin tai pienryhmänä häkeissä, joissa on samaa sukupuolta. Yhdessä ryhmähäkissä saa olla enintään viisi eläintä.
Koe-eläintutkimusraporteissa on tärkeää ilmoittaa käytetty häkkityyppi ja eläinten määrä häkkiä kohti sekä kemiallisen altistuksen että sitä seuranneiden havainnointijaksojen aikana.
ii) Ruokintaolosuhteet
Ravinnon tulee tyydyttää testattavan eläinlajin kaikki ravitsemukselliset tarpeet. Jos testiainetta annetaan eläimille ravinnossa, ravinnon ravintoarvo voi heiketä testiaineen ja ruoka-aineen interaktion vuoksi. Tällaisen reaktion mahdollisuus on otettava huomioon tutkimustuloksia tulkittaessa. Eläimille voidaan antaa tavanomaista koe-eläinravintoa ja juomavettä on oltava kaiken aikaa tarjolla. Ravinnon valintaan voi vaikuttaa tarve varmistaa testiaineelle sopiva sekoitus, kun se annostellaan ravinnon mukana.
Ravintoa saastuttavia aineita, joiden tiedetään vaikuttavan toksisuuteen, ei saa olla läsnä häiritsevinä pitoisuuksina.
C. VAIHTOEHTOISET TUTKIMUKSET
Euroopan unioni on sitoutunut edistämään sellaisten vaihtoehtomenetelmien kehittämistä ja validointia, joista saadaan samantasoista tietoa kuin nykyisistä eläinkokeista, mutta joihin tarvitaan vähemmän eläimiä ja jotka aiheuttavat vähemmän kärsimystä tai joissa eläimiä ei tarvita lainkaan.
Sitä mukaa kuin tällaisia menetelmiä tulee saataville, on niitä mahdollisuuksien mukaan käytettävä vaaran luonnehdinnassa ja siihen perustuvassa ominaisvaarojen luokittelussa ja merkitsemisessä.
D. ARVIONTI JA TULKINTA
Testien arvioinnissa ja tulkinnassa on otettava huomioon ekstrapolaatiorajoitukset eläinkokeiden ja in vitro -tutkimusten tulosten soveltamisessa suoraan ihmiseen, ja siksi mahdollisesti saatavia todisteita haittavaikutuksista ihmisellä voidaan käyttää tutkimustulosten vahvistamiseen.
E. LÄHDELUETTELO
Useimmat näistä menetelmistä on kehitetty OECD:n ”Testing Guidelines” -ohjelman puitteissa ja niitä tulisi käyttää yhtenevästi GLP (Good Laboratory Practice) -periaatteiden kanssa mahdollisimman laajan ”keskinäisen tietojen hyväksymisen” varmistamiseksi.
Lisätietoa löytyy OECD-ohjeiston kirjallisuusluettelossa mainituista lähteistä ja muusta asiaankuuluvasta kirjallisuudesta.
B.1 a. AKUUTTI ORAALINEN TOKSISUUS — VAKIOANNOSMENETELMÄ
1. MENETELMÄ
Tämä menetelmä vastaa OECD:n testiohjetta nro TG 420 (2001)
1.1 JOHDANTO
Perinteisissä menetelmissä akuutin toksisuuden arvioimiseksi käytetään päätepisteenä eläinten kuolemaa. Vuonna 1984 British Toxicology Society ehdotti akuutin toksisuuden testaamiseksi uutta käytäntöä, joka perustuu aineen annosteluun vakioannostasojen sarjana (1). Menetelmässä vältettiin käyttämästä eläinten kuolemaa päätepisteenä ja tarkkailtiin sen sijaan selviä toksisuusoireita yhdellä annossarjasta valitulla vakioannostasolla. Menetelmä on hyväksytty tutkimusmenetelmäksi vuonna 1992 Yhdistyneen kuningaskunnan (2) ja kansainvälisten (3) in vivo -validointitutkimusten perusteella. Tämän jälkeen vakioannosmenetelmän tilastollisia ominaisuuksia on arvioitu matemaattisten mallien avulla useissa tutkimuksissa (4) (5) (6). In vivo- ja mallintamistutkimukset ovat osoittaneet, että menetelmä on toistettava, että siinä käytetään vähemmän eläimiä ja että se aiheuttaa vähemmän kärsimystä kuin perinteiset menetelmät. Menetelmällä voidaan luokitella aineita vaarallisuuden mukaan samalla tavoin kuin muilla akuutin toksisuuden tutkimusmenetelmillä.
Ohjeita tiettyyn tarkoitukseen sopivimman tutkimusmenetelmän valinnasta on annettu akuutin oraalisen toksisuuden testausta koskevassa ohjeasiakirjassa (Guidance Document on Acute Oral Toxicity Testing (7)). Ohjeasiakirjassa on myös lisätietoa tutkimusmenetelmä B.l a:n käyttämisestä ja tulkinnasta.
Menetelmän periaatteena on, että päätutkimuksessa käytetään ainoastaan lievästi toksisia annoksia ja että todennäköisesti tappavien annosten antamista vältetään. Annoksia, joiden tiedetään aiheuttavan voimakasta kipua ja kärsimystä syövyttävien tai vaikea-asteisten ärsytysvaikutusten vuoksi, ei myöskään tarvitse annostella. Kuolemaisillaan olevat, selvästi kärsivät tai voimakkaasta ja jatkuvasta kivusta merkkejä osoittavat eläimet on lopetettava humaanilla tavalla, ja koetulosten tulkinnassa ne on otettava huomioon samalla tavalla kuin kokeessa kuolleet eläimet. Erillisessä ohjeasiakirjassa (8) on esitetty kriteerit, joiden perusteella tehdään päätös kuolemaisillaan olevan tai voimakkaasti kärsivän eläimen lopettamisesta. Lisäksi siinä on annettu ohjeita ennustettavan tai uhkaavan kuoleman tunnistamiseksi.
Menetelmällä saadaan tietoa vaarallisista ominaisuuksista ja aineet voidaan sen perusteella sijoittaa ja luokitella akuuttia toksisuutta aiheuttavien kemikaalien kansainvälisesti yhdenmukaistetun luokitusjärjestelmän mukaisesti (Globally Harmonised System (GHS) for the classification of chemicals which cause acute toxicity (9)).
Koelaboratorion on otettava huomioon kaikki testiaineesta saatavilla olevat tiedot ennen tutkimuksen suorittamista. Näissä tiedoissa on esitettävä aineen tunnistetiedot ja kemiallinen rakenne, sen fysikaalis-kemialliset ominaisuudet, kaikkien muiden aineella in vivo tai in vitro suoritettujen toksisuuskokeiden tulokset, rakenteellisesti samanlaisten aineiden toksikologiset tiedot ja aineen odotettu käyttö. Nämä tiedot ovat välttämättömiä kaikkien asianosaisten vakuuttamiseksi siitä, että kokeella on merkitystä ihmisten terveyden suojelun kannattaja että sen avulla voidaan valita sopiva alkuannos.
1.2 MÄÄRITELMÄT
Akuutti oraalinen toksisuus: haittavaikutukset, joita esiintyy, kun ainetta on annosteltu suun kautta kerta-annoksena tai useampana annoksena 24 tunnin aikana.
Viivästynyt kuolema: eläin ei kuole tai vaikuta kuolevalta 48 tunnin kuluessa, mutta kuolee myöhemmin 14 päivän havainnointijakson aikana.
Annos: annostellun testiaineen määrä. Annos ilmaistaan testiaineen painona koe-eläimen painoyksikköä kohti (esimerkiksi mg/kg).
Ilmeinen toksisuus: yleistermi, jolla tarkoitetaan testiaineen antamisen jälkeen ilmeneviä selviä toksisuuden oireita (katso esimerkiksi (3)). Näiden oireiden perusteella vakioannoksen suurentaminen seuraavaan annokseen aiheuttaisi todennäköisesti voimakasta kipua ja jatkuvia merkkejä kovasta kärsimyksestä tai sen, että eläin on kuolemaisillaan (perusteet on esitetty eläinkokeen humaaneja lopettamiskriteereitä koskevassa ohjeasiakirjassa Humane Endpoints Guidance Document (8)) tai todennäköisesti useimpien eläinten kuoleman.
GHS: Globally Harmonised Classification System for Chemical Substances and Mixtures (Kemiallisten aineiden ja seosten kansainvälisesti yhdenmukaistettu luokitusjärjestelmä). Yhteinen toimi, johon osallistuvat OECD (ihmisten terveys ja ympäristö), YK:n vaarallisten aineiden kuljettamista käsittelevä asiantuntijakomitea (fysikaalis-kemialliset ominaisuudet) ja ILO (vaarojen ilmoittaminen) ja jota koordinoidaan kemikaalien järkevää hallinnointia koskevalla organisaatioiden välisellä ohjelmalla (IOMC).
Uhkaava kuolema: eläin on vakavasti sairas tai kuolee todennäköisesti ennen seuraavaa suunniteltua havainnointiajankohtaa. Jyrsijöillä tällaista tilaa osoittavia merkkejä voivat olla kouristukset, kyljellään makaaminen, velttous ja vapina. (Katso tarkempia tietoja eläinkokeen humaaneja lopettamiskriteereitä koskevasta ohjeasiakirjasta (8)).
LD 50 (median lethal dose, keskimääräinen tappava annos): on tilastollinen kerta-annos, jonka voidaan suun kautta annosteltuna odottaa tappavan puolet annoksen saaneista eläimistä. LD50-arvo ilmoitetaan testiaineen painona koe-eläimen painoyksikköä kohti (mg/kg).
Raja-annos: kokeen yläraja-annos (2 000 tai 5 000 mg/kg).
Kuolemaisillaan oleva: eläin, joka on kuolemaisillaan tai ei kykene säilymään hengissä hoidosta huolimatta. (Katso tarkempia lisätietoja eläinkokeen humaaneja lopettamiskriteereitä koskevasta ohjeasiakirjasta (8)).
Ennustettava kuolema: sellaisten kliinisten oireiden esiintyminen, jotka viittaavat siihen, että eläin tulee kuolemaan tietyn ajan kuluttua ennen kokeen suunniteltua päättymistä. Näitä oireita ovat esimerkiksi kykenemättömyys käyttää vettä tai ruokaa. (Katso tarkempia lisätietoja eläinkokeen humaaneja lopettamiskriteereitä koskevasta ohjeasiakirjasta (8)).
1.3 KOEMENETELMÄN PERIAATE
Samaa sukupuolta olevien eläinten ryhmille annostellaan testiainetta vaiheittain käyttämällä 5, 50, 300 ja 2 000 mg:n/kg vakioannoksia (poikkeuksellisesti voidaan käyttää 5 000 mg:n/kg lisävakioannosta, katso kappale 1.6.2). Alkuannostaso valitaan esikokeen perusteella annokseksi, jonka odotetaan aiheuttavan joitakin toksisuusoireita, mutta ei kuitenkaan vakavia toksisia vaikutuksia tai kuolleisuutta. Kipuun, kärsimykseen ja uhkaavaan kuolemaan liittyviä kliinisiä oireita ja tiloja on kuvailtu yksityiskohtaisesti OECD:n ohjeasiakirjassa (8). Muille eläinryhmille voidaan antaa korkeampia tai matalampia vakioannoksia sen mukaan, esiintyykö merkkejä toksisuudesta tai kuolleisuudesta. Menettelyä jatketaan, kunnes ilmeistä toksisuutta tai korkeintaan yhden kuoleman aiheuttava annos pystytään määrittämään, tai kun korkeimmasta annoksesta ei ole havaittavissa vaikutuksia tai alhaisin annos aiheuttaa kuolemia.
1.4 KOEMENETELMÄN KUVAUS
1.4.1 Eläinlajin valinta
Suositeltavin jyrsijälaji on rotta, tosin muitakin jyrsijöitä voidaan käyttää. Yleensä käytetään naaraita (7). Syynä tähän on, että tavanomaisia LD50-kokeita koskevien kirjallisuustutkimusten perusteella sukupuolten herkkyydessä on yleensä vähän eroja, mutta silloin kun eroja on havaittu, naaraat ovat yleensä hieman herkempiä (10). Mikäli rakenteellisesti samanlaisten kemikaalien toksikologisia ja toksikokineettisiä ominaisuuksia koskevat tiedot osoittavat urosten olevan herkempiä, on käytettävä uroksia. Kokeen tekeminen uroksilla edellyttää riittäviä perusteita.
Kokeeseen on käytettävä terveitä, nuoria ja täysikasvuisia yleisesti käytettyjä koe-eläinkantoja. Naaraat eivät saa olla synnyttäneitä eivätkä kantavia. Kunkin eläimen on annostuksensa alussa oltava 8-12 viikon ikäinen, ja sen paino saa poiketa korkeintaan ± 20 % aikaisemmin annoksen saaneiden eläinten keskipainosta.
1.4.2 Koe-eläintilat ja eläinten ruokinta
Koe-eläinhuoneen lämpötilan tulee olla 22 oC (± 3 oC). Vaikka riittävät vaatimukset suhteellisen kosteuden suhteen ovat vähintään 30 % eikä mielellään yli 70 % muulloin kuin huoneen puhdistuksen aikana, pitäisi kuitenkin pyrkiä 50–60 %:n suhteelliseen kosteuteen. Huoneessa tulee käyttää keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa, 12 tuntia pimeää). Eläinten ruokinnassa voidaan käyttää normaalia laboratorioruokavaliota, eikä juomaveden määrää saa rajoittaa. Eläimet voidaan erotella eri häkkeihin annoksen mukaan, mutta eläinten lukumäärä häkkiä kohti ei saa häiritä kunkin eläimen selkeää havainnointia.
1.4.3 Eläinten valmistelu
Eläimet valitaan satunnaisesti ja merkitään yksilötunnistusta varten. Eläimiä pidetään häkeissään vähintään viiden päivän ajan ennen annostelun aloittamista, jotta ne tottuvat laboratorio-oloihin.
1.4.4 Annosten valmistelu
Yleensä testiaineen testattavat annokset annostellaan vakiotilavuudessa niin, että annosteltavan valmisteen pitoisuus vaihtelee. Testattaessa nestemäistä lopputuotetta tai sekoitusta testiaineen käyttö laimentamattomana eli vakiopitoisena saattaa kuitenkin olla oleellista kyseisen aineen myöhemmän riskinarvioinnin kannalta, ja jotkut sääntelyviranomaiset edellyttävätkin tällaista menettelyä. Kummassakaan tapauksessa annoksen enimmäistilavuutta ei saa ylittää. Kerralla annettavan nesteen enimmäismäärä riippuu koe-eläimen koosta. Jyrsijöillä määrä ei yleensä saa olla yli 1 ml sataa painogrammaa kohti. Vesiliuoksia voidaan kuitenkin antaa 2 ml sataa painogrammaa kohti. Annostellun valmisteen koostumukseksi suositellaan vesipitoista liuosta/suspensiota/emulsiota aina, kun se on mahdollista. Muussa tapauksessa on mieluiten käytettävä öljypohjaista (esimerkiksi maissiöljy) liuosta/suspensiota/emulsiota tässä järjestyksessä ja sen jälkeen muihin kantaja-aineisiin pohjautuvia liuoksia. Jos kantaja-aine on muu kuin vesi, sen toksiset ominaisuudet on tunnettava. Annokset on valmistettava vähän ennen annostelua paitsi, jos valmisteen tiedetään säilyttävän stabiliteettinsa käytön ajan ja sen on osoitettu olevan hyväksyttävä.
1.5 TESTIN SUORITUS
1.5.1 Annostelu
Testiaine annetaan kerta-annoksena mahaletkun tai sopivan intubaatiokanyylin kautta. Mikäli kerta-annostelu ei poikkeuksellisesti ole mahdollinen, annos voidaan antaa pienempinä osina enintään 24 tunnin kuluessa.
Eläimiä ei saa ruokkia ennen annostelua (esimerkiksi rottaa on pidettävä ruoatta yli yön ja hiirtä 3–4 tuntia, mutta vettä tulee olla tarjolla). Paaston jälkeen eläimet punnitaan ja niille annetaan testiaine. Aineen annostelun jälkeen ruokintaa voidaan siirtää rotilla vielä 3–4 tuntia ja hiirillä 1–2 tuntia. Mikäli annos annetaan osina tietyn ajan kuluessa, eläimille saatetaan joutua antamaan ruokaa ja vettä jakson pituudesta riippuen.
1.5.2 Esikoe
Esikokeen tarkoituksena on sopivan alkuannoksen valinta päätutkimusta varten. Testiaine annostellaan yksittäisille eläimille vaiheittain liitteessä 1 esitetyn toimenpidekaavion mukaisesti. Esikoe on valmis, kun päätös päätutkimuksessa käytettävästä alkuannoksesta voidaan tehdä (tai jos kuolleisuutta ilmenee alhaisimman vakioannoksen yhteydessä).
Esikokeen alkuannos valitaan vakioannostasoista 5, 50, 300 ja 2 000 mg/kg. Valitun alkuannoksen odotetaan aiheuttavan ilmeistä toksisuutta ja sen on mahdollisuuksien mukaan perustuttava samalla kemikaalilla tai rakenteellisesti samanlaisilla kemikaaleilla suoritettujen in vivo- tai in vitro -testien tietoihin. Jos tällaisia tietoja ei ole käytettävissä, alkuannos on 300 mg/kg.
Annokset annetaan eläimille vähintään 24 tunnin välein. Kaikkia eläimiä on havainnoitava vähintään 14 päivää.
Korkeinta 5 000 mg:n/kg vakioannostasoa voidaan käyttää poikkeuksellisesti ja vain silloin, kun se on perusteltua erityisten sääntelyyn liittyvien vaatimusten vuoksi (katso liite 3). Eläinten hyvinvoinnin takia eläinkokeiden tekeminen GHS-luokassa 5 annoksella 2 000–5 000 mg/kg ei ole suositeltavaa, ja sitä tulee käyttää vain, kun on erittäin todennäköistä, että tällaisen kokeen tuloksilla on välitöntä merkitystä eläinten tai ihmisten terveyden tai ympäristön suojelemiselle.
Kun esikokeessa alhaisimmalla vakioannostasolla (5mg/kg) testattu eläin kuolee, tavanomainen menettely on päättää tutkimus ja luokitella aine GHS-luokkaan 1 (kuten liitteessä 1 on esitetty). Mikäli luokitus on kuitenkin vielä varmennettava, voidaan suorittaa seuraavanlainen vaihtoehtoinen lisätoimenpide: Toiselle eläimelle annetaan 5 mg:n/kg annos. Mikäli eläin kuolee, vahvistetaan luokitukseksi GHS-luokka 1 ja tutkimus päätetään välittömästi. Mikäli eläin jää henkiin, annetaan korkeintaan kolmelle muulle eläimelle 5 mg:n/kg annos. Koska kuolleisuusriski on suuri, annostelun tulee tapahtua vaiheittain eläinten hyvinvoinnin turvaamiseksi. Annokset on annettava eläimille riittävin aikavälein, jotta voidaan osoittaa edellisen eläimen todennäköisesti jäävän henkiin. Mikäli toinen eläin kuolee, annostelu keskeytetään välittömästi eikä enempää eläimiä testata. Koska toisen eläimen kuolema (riippumatta testattujen eläinten määrästä päättymishetkellä) kuuluu tulosluokkaan A (kaksi tai useampia eläimiä kuolee), noudatetaan 5 mg:n/kg vakioannokselle liitteessä 2 esitettyä luokitussääntöä (luokka 1 mikäli kaksi tai useampia eläimiä kuolee tai luokka 2 mikäli vain yksi eläin kuolee). Lisäksi liitteessä 4 annetaan ohjeita EU:n järjestelmän mukaisesta luokituksesta ennen uuden GHS-järjestelmän käyttöönottoa.
1.5.3 Päätutkimus
1.5.3.1 Eläinten määrä ja annostasot
Alkuannostasolla tapahtuneen testauksen jälkeen suoritettavat toimet on esitetty toimenpidekaavioissa liitteessä 2. Valittavana on kolme toimintavaihtoehtoa: testauksen keskeyttäminen ja sopivan vaarallisuusluokan määrittäminen, korkeamman vakioannoksen testaaminen tai matalamman vakioannoksen testaaminen. Eläinten suojelemiseksi päätutkimuksessa ei kuitenkaan käytetä uudestaan esikokeessa kuolemaan johtanutta annostasoa (katso liite 2). Kokemusten mukaan todennäköisin tulos alkuannostasolla on, että aine voidaan luokitella eikä uutta testausta tarvita.
Yleensä kullakin tutkitulla annostasolla käytetään yhteensä viittä samaa sukupuolta olevaa eläintä. Näihin viiteen eläimeen kuuluu yksi esikokeessa valitulla annostasolla testattu eläin sekä neljä muuta eläintä (paitsi jos päätutkimuksessa käytetty annostaso ei poikkeuksellisesti sisältynyt katsaustutkimukseen).
Annostelun aikaväli kullakin tasolla määritellään toksisten oireiden alkamishetken, keston ja vaikeusasteen mukaan. Seuraavan annoksen antamista tulee siirtää, kunnes jo annosteltujen eläinten eloonjäämisestä on saatu varmuus. Tarvittaessa annosteluväliksi suositellaan jokaisella annostasolla 3–4 päivää viivästyneen toksisuuden havainnoimiseksi. Aikaväliä voidaan muuttaa sopivaksi esimerkiksi, jos vasteesta ei vielä ole täyttä varmuutta.
Käytettäessä korkeinta 5 000 mg:n/kg vakioannosta on noudatettava liitteessä 3 esitettyä menettelytapaa (katso myös kappale 1.6.2).
1.5.3.2 Raja-annostesti
Raja-annostestiä käytetään pääasiassa silloin, kun tutkimuksen tekijällä on tietoa, jonka mukaan testiaine on todennäköisesti ei-toksinen, toisin sanoen se on toksista ainoastaan ylittäessään säädösten mukaiset raja-annokset. Tietoa testiaineen toksisuudesta saadaan samanlaisia testattuja yhdisteitä tai seoksia koskevista tiedoista, kun otetaan huomioon toksikologisesti merkittävien ainesosien tunnistetiedot ja prosenttiosuus. Päätutkimus on suoritettava, kun testiaineen toksisuudesta on vain vähän tai ei lainkaan tietoa tai kun se todennäköisesti on toksinen.
Näiden ohjeiden mukaisena raja-annostestinä voidaan tavanomaista menettelytapaa käytettäessä käyttää katsaustutkimusta, jossa alkuannos on 2 000 mg/kg (tai poikkeuksellisesti 5 000 mg/kg), ja jossa sen jälkeen annetaan neljälle muulle eläimelle sama annos.
1.6 HAVAINNOINTI
Eläimiä havainnoidaan yksittäin annostelun jälkeen vähintään yhden kerran ensimmäisten 30 minuutin aikana ja säännöllisin väliajoin ensimmäisten 24 tunnin aikana. Havainnoinnin on oltava erityisen tarkkaa ensimmäisten neljän tunnin aikana. Sen jälkeen havainnointi tapahtuu päivittäin 14 päivän ajan paitsi, jos eläin on poistettava tutkimuksesta ja lopetettava humaanilla tavalla eläinten hyvinvointia koskevien periaatteiden vuoksi tai se löydetään kuolleena. Havainnoinnin kestoa ei pitäisi kuitenkaan määritellä tiukasti. Se tulee määrittää toksisten reaktioiden, niiden alkamishetken ja toipumisen keston perusteella ja sitä tulisi voida pidentää tarvittaessa. Toksisuusoireiden ilmaantumis- ja häviämisajankohdat ovat tärkeitä etenkin, jos toksisilla oireilla on taipumus viivästyä (11). Kaikki havainnot kirjataan järjestelmällisesti eläinkohtaisesti.
Lisähavainnointi on tarpeen jos eläinten toksisuusoireet jatkuvat. Havaintoihin tulee sisältyä ihon, karvapeitteen, silmien, limakalvojen, hengitys- ja verenkiertojärjestelmän, autonomisen hermoston ja keskushermoston, somatomotorisen toiminnan ja käyttäytymisen muutokset. Huomiota tulee kiinnittää vapinaan, kouristuksiin, syljeneritykseen, ripuliin, letargiaan, uneen ja koomaan. Eläinkokeiden humaaneja lopettamiskriteereitä koskevassa ohjeasiakirjassa esitetyt periaatteet ja perustelut on otettava huomioon (8). Kuolevat eläimet ja eläimet, jotka osoittavat merkkejä voimakkaasta kivusta ja jatkuvasta kovasta kärsimyksestä, tulee lopettaa humaanilla tavalla. Humaaneista syistä lopetettujen tai kuolleena löydettyjen eläinten kuolinajankohta tulee kirjata muistiin mahdollisimman tarkasti.
1.6.1 Ruumiinpaino
Kunkin eläimen paino on määritettävä hieman ennen testiaineen annostelua ja vähintään viikoittain sen jälkeen. Painon muutokset on laskettava ja kirjattava. Kokeen päätyttyä henkiin jääneet eläimet punnitaan ja lopetetaan sen jälkeen humaanilla tavalla.
1.6.2 Patologia
Kaikki koe-eläimet (myös kokeen aikana kuolleet tai eläinten hyvinvointia koskevien periaatteiden vuoksi tutkimuksesta poistetut) avataan. Kunkin eläimen kaikki makroskooppiset muutokset tulee kirjata. Ensimmäisen annostelun jälkeen vähintään 24 tuntia hengissä säilyneiden eläinten makroskooppisia muutoksia sisältävät elimet voidaan myös tutkia mikroskooppisesti siitä mahdollisesti saatavan hyödyllisen tiedon vuoksi.
2. TULOKSET
Tuloksina on esitettävä yksittäisiä eläimiä koskevat tulokset. Kaikki tulokset tulee esittää myös yhteenvetona taulukossa, josta käy ilmi kussakin koeryhmässä käytettyjen eläinten lukumäärä, toksisuusoireita osoittaneiden eläinten lukumäärä, kokeen aikana kuolleena löydettyjen tai humaaneista syistä lopetettujen eläinten lukumäärä, yksittäisten eläinten kuolinajankohta, toksisten vaikutusten ja palautuvuuden kuvaus ja niiden ajallinen esiintyminen sekä ruumiinavauslöydökset.
3. TULOSTEN ILMOITTAMINEN
3.1 LOPPURAPORTTI
Loppuraportin tulee tarpeen mukaan sisältää seuraavat tiedot:
|
|
Testiaine:
|
|
|
Kantaja-aine (tarvittaessa):
|
|
|
Koe-eläimet:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten tarkastelu ja tulkinta. |
|
|
Johtopäätökset |
4. VIITTEET
|
(1) |
British Toxicology Society Working Party on Toxicity (1984). Special report: a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol., 3, 85–92. |
|
(2) |
Van den Heuvel, M.J., Dayan, A.D. and Shillaker, R.O. (1987). Evaluation of the BTS approach to the testing of substances and preparations for their acute toxicity. Human Toxicol., 6, 279-291. |
|
(3) |
Van den Heuvel, M.J., Clark, D.G., Fielder, R.J., Koundakjian, P.P., Oliver, G.J.A., Pelling, D., Tomlinson, N.J. and Walker, A.P. (1990). The international validation of a fixed-dose procedure as an alternative to the classical LD50 test. Fd. Chem. Toxicol. 28, 469-482. |
|
(4) |
Whitehead, A. and Cumow, R.N. (1992). Statistical evaluation of the fixed-dose procedure. Fd. Chem. Toxicol., 30, 313-324. |
|
(5) |
Stallard, N. and Whitehead, A. (1995). Reducing numbers in the fixed-dose procedure. Human Exptl. Toxicol. 14, 315-323. Human Exptl. Toxicol. |
|
(6) |
Stallard, N., Whitehead, A. and Ridgeway, P. (2002). Statistical evaluation of the revised fixed dose procedure.-Hum. Exp. Toxicol., 21, 183-196. |
|
(7) |
OECD (2001). Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris |
|
(8) |
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N. 19. |
|
(9) |
OECD (1998). Harmonised Integrated Hazard Classification for Human Health and Environmental Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p.11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html]. |
|
(10) |
Lipnick, R.L., Cotruvo, J.A., Hill, R.N., Bruce, R.D., Stitzel, K.A., Walker, A.P., Chu, I., Goddard, M., Segal, L., Springer, J.A. and Myers, R.C. (1995). Comparison of the Up-and-Down, Conventional LD50, and Fixed-Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33, 223-231. |
|
(11) |
Chan P.K and A.W. Hayes (1994) Chapter 16 Acute Toxicity and Eye Irritation. In: Principles and Methods of Toxicology . 3rd Edition. A.W. Hayes, Editor. Raven Press, Ltd. New York, USA. |
LIITE 1:
ESIKOKEEN TOIMENPIDEKAAVIO
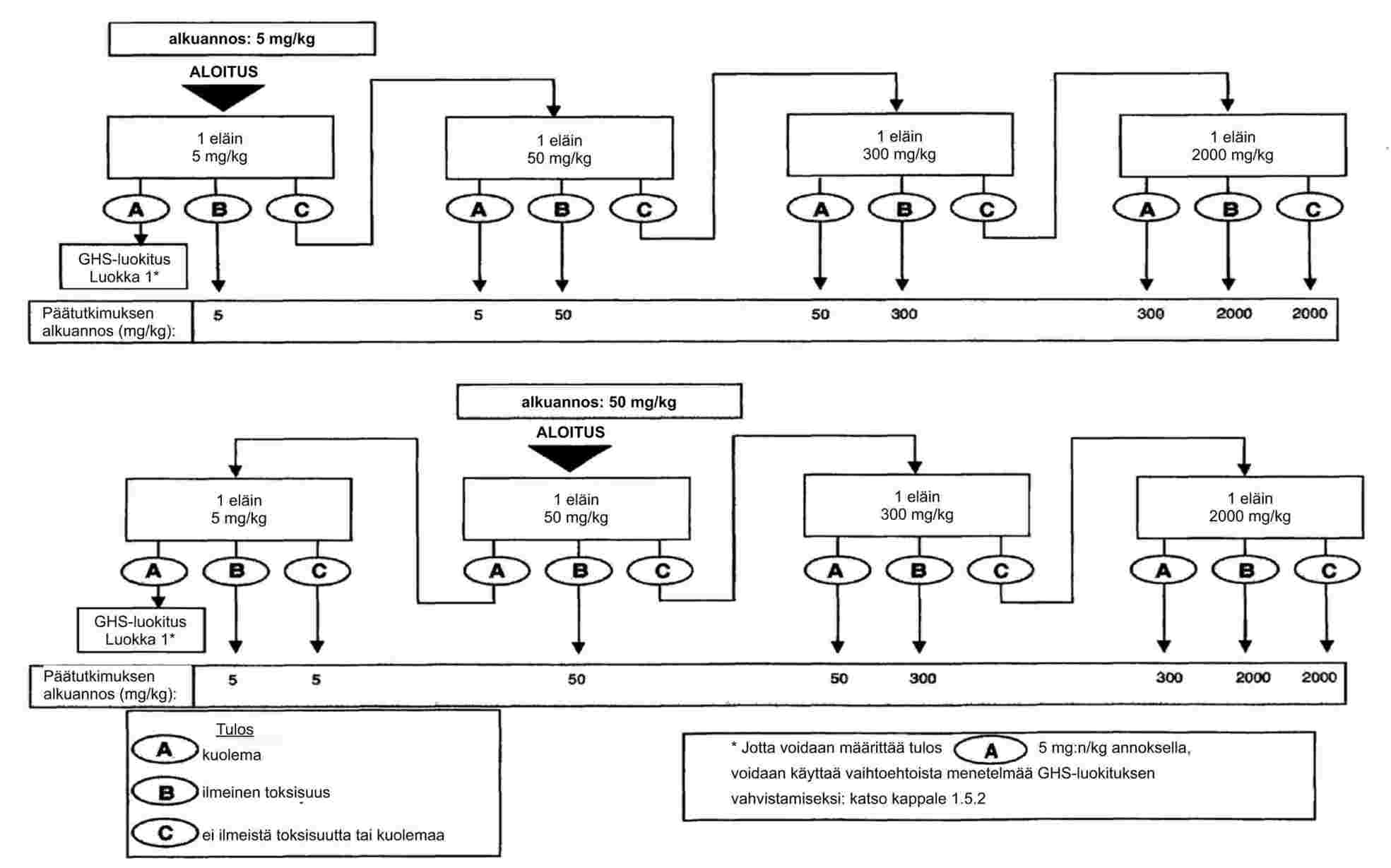
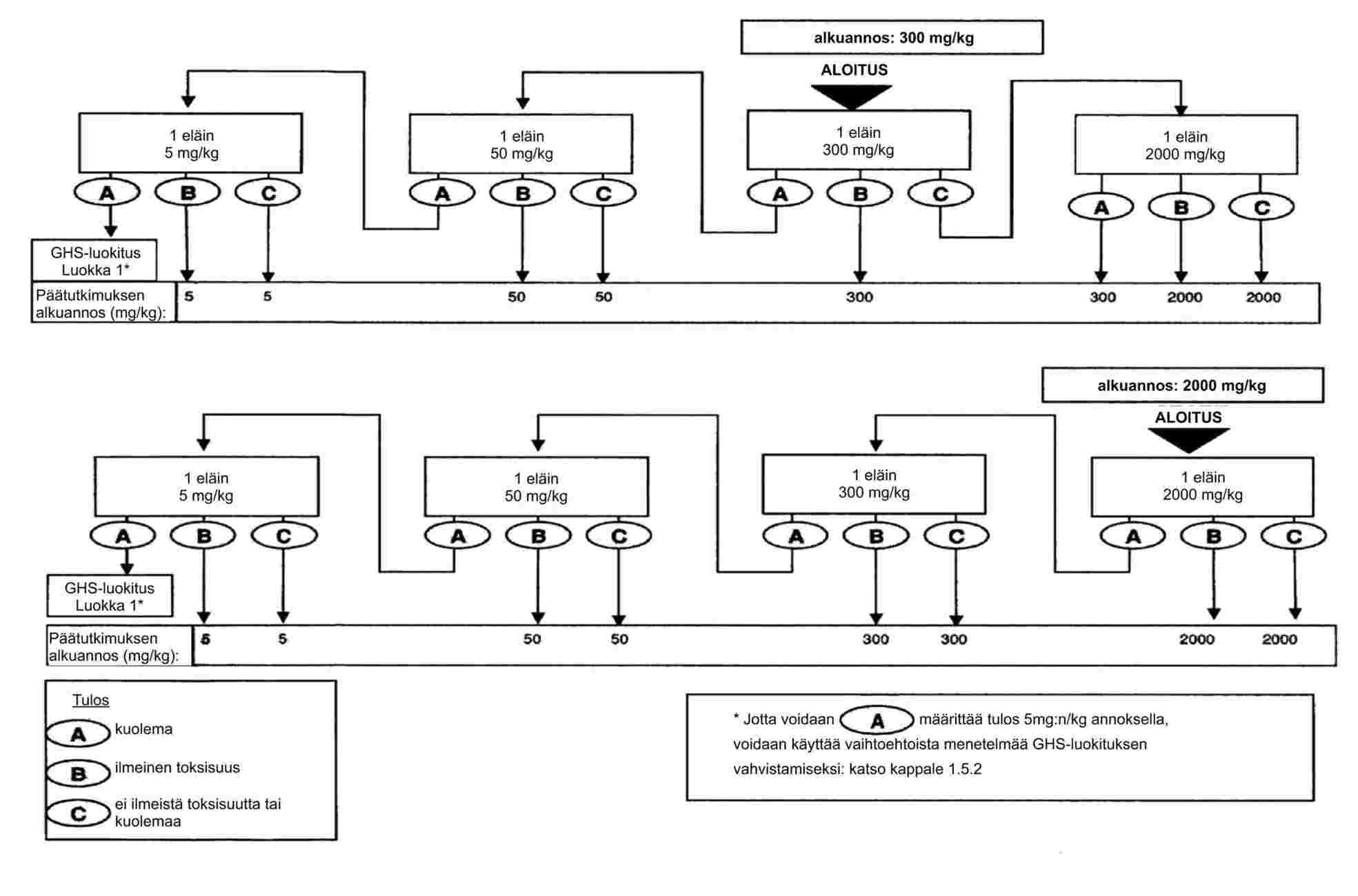
LIITE 2:
PÄÄTUTKIMUKSEN TOIMENPIDEKAAVIO
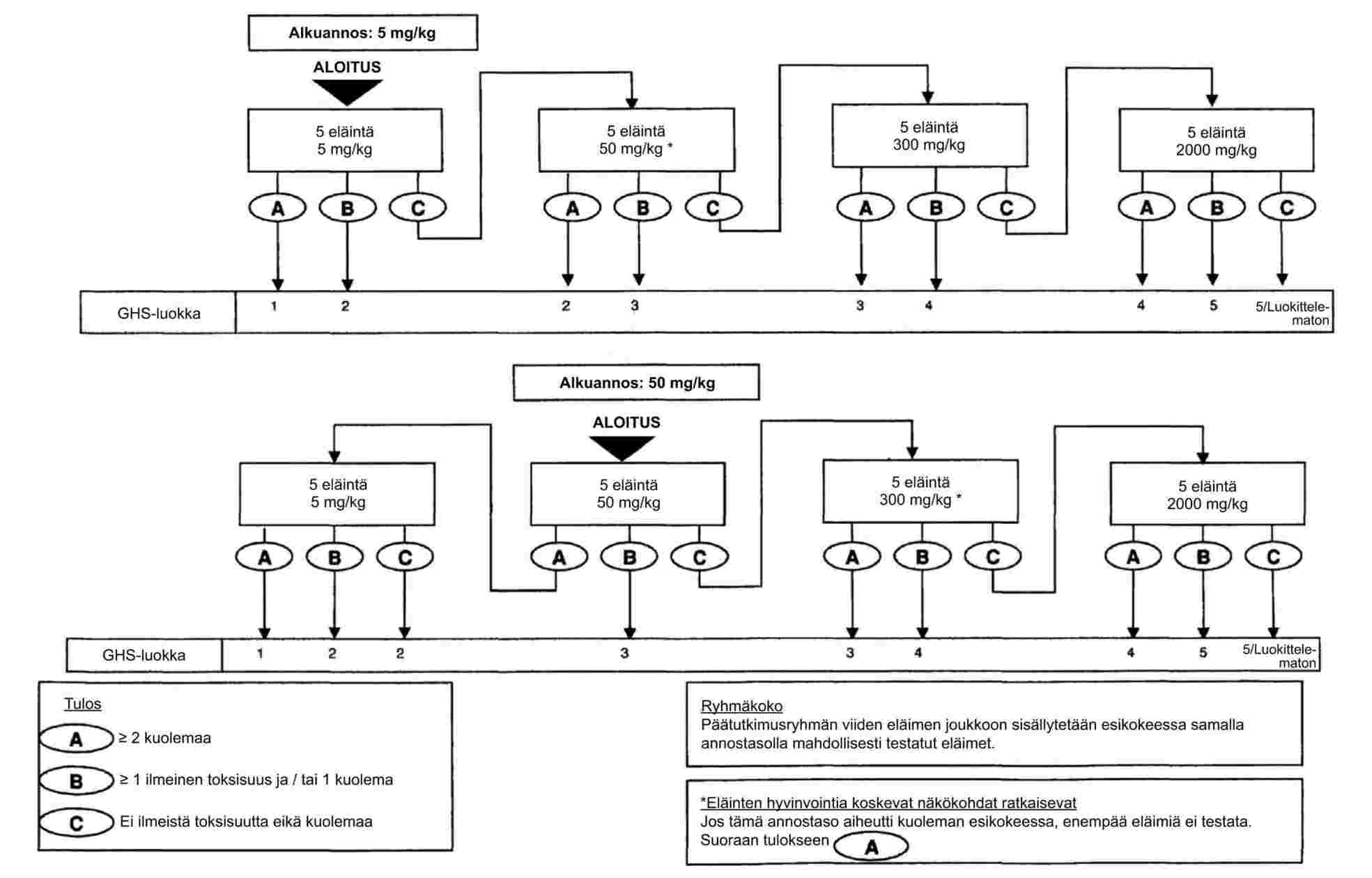

LIITE 3
PERUSTEET SELLAISTEN TESTIAINEIDEN LUOKITTELULLE, JOIDEN ODOTETTAVISSA OLEVA LD50-ARVO YLITTÄÄ 2 000 MG/KG JA JOITA EI TARVITSE TESTATA
Vaarallisuusluokkaa 5 koskevien kriteereiden avulla on tarkoitus tunnistaa sellaiset testiaineet, joiden akuutti toksisuusvaara on suhteellisen alhainen, mutta jotka tietyissä olosuhteissa voivat olla vaaraksi heikommille populaatioille. Näiden aineiden LD50-arvon odotetaan vaihtelevan välillä 2 000–5 000 mg/kg ihon tai suun kautta annosteltuna tai vastaavina annoksina muuta kautta annettuna. Testiaineet voidaan luokitella vaarallisuusluokkaan, jonka rajat ovat 2 000 mg/kg < LD50 < 5 000 mg/kg (luokka 5 GHS-järjestelmässä) seuraavissa tapauksissa:
|
a) |
mikäli aine määritellään missä tahansa liitteessä 2 esitetyistä koejärjestelyistä tähän luokkaan kuuluvaksi kuolleisuuden esiintymisen perusteella; |
|
b) |
mikäli on jo käytettävissä luotettavia todisteita, joiden mukaan LD50 on luokkaan 5 kuuluvien arvojen vaihteluvälin rajoissa tai mikäli muut eläinkokeet tai toksiset vaikutukset ihmisillä osoittavat, että asialla on välitöntä merkitystä ihmisten terveydelle; |
|
c) |
tietoja ekstrapoloimalla, arvioimalla tai mittaamalla, jos määritteleminen korkeampaan vaarallisuusluokkaan ei ole aiheellista; ja kun
|
TESTAAMINEN 2 000 MG/KG YLITTÄVILLÄ ANNOKSILLA
Korkeinta 5 000 mg:n/kg vakioannostasoa voidaan käyttää poikkeuksellisesti ja vain silloin, kun se on perusteltua erityisten sääntelyyn liittyvien vaatimusten vuoksi. Koska eläinten hyvinvointia on suojeltava, kokeiden tekeminen 5 000 mg:n/kg annoksella ei ole suositeltavaa, ja sitä tulee käyttää vain kun on erittäin todennäköistä, että tällaisen kokeen tuloksilla on välitöntä merkitystä eläinten tai ihmisten terveyden tai ympäristön suojelemiselle (9).
Esikoe
Liitteessä 1 esitettyä vaiheittaista menettelyä koskevia päätöksentekosääntöjä laajennetaan siten, että niihin sisältyy 5 000 mg:n/kg annostaso. Käytettäessä esikokeen alkuannoksena 5 000 mg:aa/kg tulos A (kuolema) edellyttää kokeen tekemistä toisella eläimellä 2 000 mg:n/kg annoksella. Jos saadaan tulos B tai C (ilmeinen toksisuus tai ei toksisuutta), voidaan päätutkimuksen alkuannokseksi valita 5 000 mg/kg. Vastaavasti käytettäessä muuta alkuannosta kuin 5 000 mg:aa/kg koetta jatketaan 5 000 mg:aan/kg asti siinä tapauksessa, että kokeen tulos on B tai C 2 000 mg:n/kg annoksella. Mikäli 5 000 mg:n/kg annoksella saadaan myöhemmin tulokseksi A, on päätutkimuksen alkuannos 2 000 mg/kg. Mikäli tulokseksi saadaan B ja C, on päätutkimuksen alkuannos 5 000 mg/kg.
Päätutkimus
Liitteessä 2 esitettyä vaiheittaista menettelyä koskevia päätöksentekosääntöjä laajennetaan siten, että niihin sisältyy 5 000 mg:n/kg annostaso. Käytettäessä päätutkimuksen alkuannoksena 5 000 mg:aa/kg tulos A (>2 kuolemaa) edellyttää kokeen tekemistä toisella ryhmällä 2 000 mg:n/kg annoksella. Mikäli tulos on B (ilmeinen toksisuus ja/tai < 1 kuolemaa) tai C (ei toksisuutta), ainetta ei GHS-järjestelmän mukaan luokitella. Vastaavasti käytettäessä muuta alkuannosta kuin 5 000 mg:aa/kg koetta jatketaan 5 000 mg:aan/kg asti siinä tapauksessa että kokeen tulos on C 2 000 mg:n/kg annoksella. Mikäli myöhemmin saadaan 5 000 mg:n/kg annoksella tulos A, aine luokitellaan kuuluvaksi GHS-järjestelmän luokkaan 5. Mikäli tulos on B tai C, ainetta ei luokitella.
LIITE 4
KOEMENETELMÄ B. 1 a
EU:n järjestelmän mukaiset luokitteluohjeet, joita käytetään siirtymäkaudella ennen kansainvälisesti yhdenmukaistetun järjestelmän (GHS) (viitteessä (8)) täysimääräistä täytäntöönpanoa

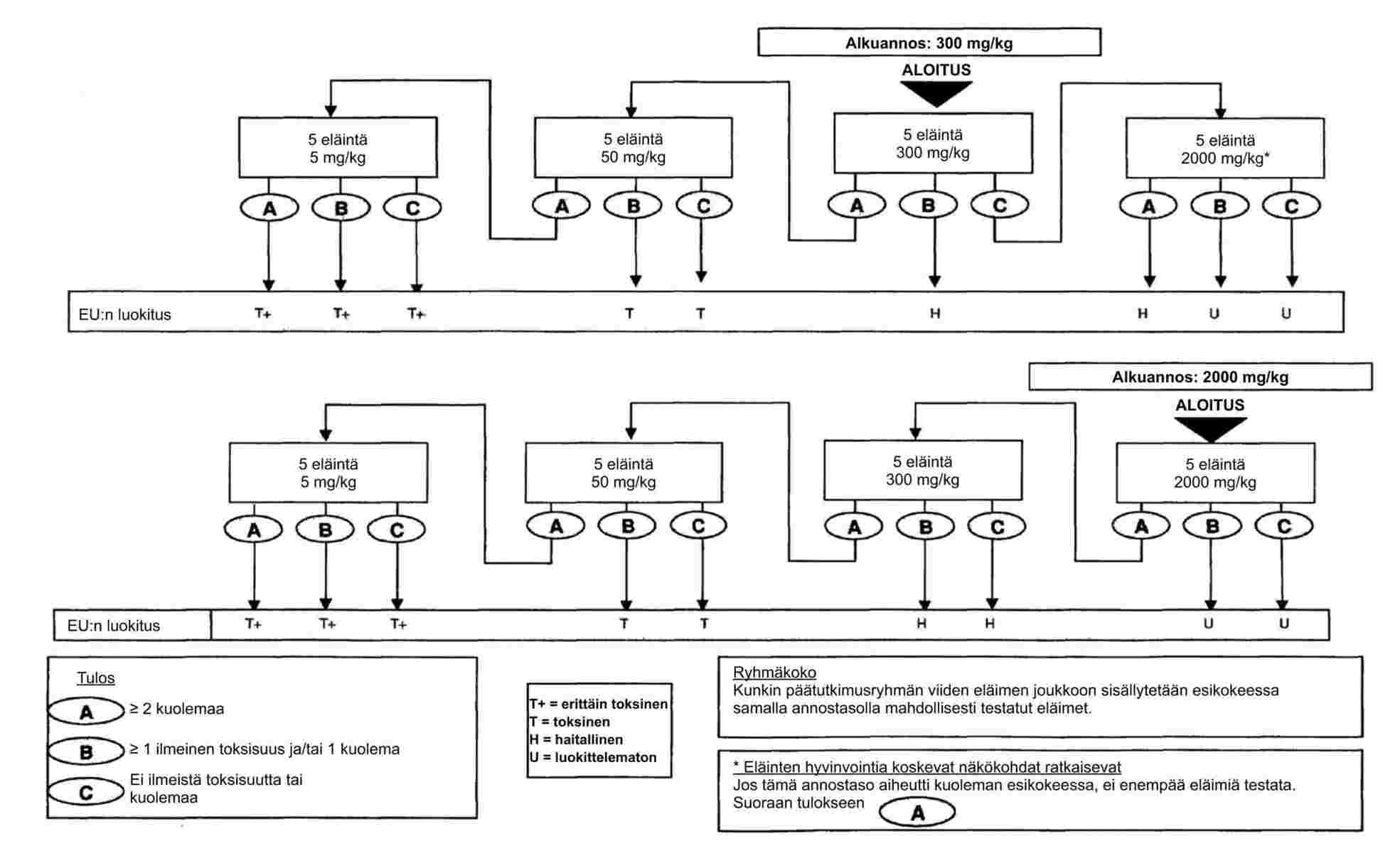
B.1 b. AKUUTTI ORAALINEN TOKSISUUS — AKUUTIN TOKSISUUSLUOKAN MENETELMÄ
1. MENETELMÄ
Tämä menetelmä vastaa OECD:n testiohjetta nro TG 423 (2001)
1.1 JOHDANTO
Tässä esitetään vaiheittainen akuutin toksisuusluokan menetelmä (1), jonka kussakin vaiheessa käytetään kolmea samaa sukupuolta olevaa eläintä. Testiaineen akuutin toksisuuden arvioimiseksi saatetaan tarvita keskimäärin kahdesta neljään vaihetta riippuen eläinten kuolleisuudesta ja/tai siitä, ovatko ne kuolemaisillaan. Menetelmä on toistettava ja siinä käytetään erittäin vähän eläimiä. Sillä voidaan luokitella aineita vaarallisuuden mukaan samalla tavoin kuin muilla akuutin toksisuuden tutkimusmenetelmillä. Akuutin toksisuusluokan menetelmä perustuu biometrisiin arviointeihin (2) (3) (4) (5) vakioannoksilla, jotka eroavat toisistaan riittävästi aineen luokittelemiseksi vaarallisuuden mukaan ja riskin arvioimiseksi. Menetelmä hyväksyttiin vuonna 1996, ja se on validoitu laajasti sekä kansallisella tasolla (6) että kansainvälisellä tasolla (7) in vivo vertaamalla tuloksia kirjallisuudesta saatuihin LD50-arvoja koskeviin tietoihin.
Ohjeita tiettyyn tarkoitukseen sopivimman tutkimusmenetelmän valinnasta on annettu akuutin oraalisen toksisuuden testausta käsittelevässä ohjeasiakirjassa (Guidance Document on Acute Oral Toxicity Testing (S)). Ohjeasiakirjassa on myös lisätietoa tutkimusmenetelmä B.1 b:n käyttämisestä ja tulkinnasta.
Testiaineita ei tarvitse annostella annoksina, joiden tiedetään aiheuttavan voimakasta kipua ja kärsimystä syövyttävien tai vaikea-asteisten ärsytysvaikutusten vuoksi. Kuolemaisillaan olevat, selvästi kärsivät tai voimakkaasta ja jatkuvasta kivusta merkkejä osoittavat eläimet on lopetettava humaanilla tavalla, ja koetulosten tulkinnassa ne on otettava huomioon samalla tavalla kuin kokeessa kuolleet eläimet. Erillisessä ohjeasiakirjassa (9) on esitetty kriteerit, joiden perusteella tehdään päätös kuolemaisillaan olevan tai voimakkaasti kärsivän eläimen lopettamisesta. Lisäksi siinä on annettu ohjeita ennustettavan tai uhkaavan kuoleman tunnistamiseksi.
Menetelmässä käytetään etukäteen määriteltyjä annoksia, ja tulosten avulla voidaan määritellä aineen vaarallisuusaste ja luokitella se akuuttia toksisuutta aiheuttavien kemikaalien kansainvälisesti yhdenmukaistetun luokitusjärjestelmän mukaisesti (Globally Harmonised System for the classification of chemicals which cause acute toxicity (10)).
Periaatteessa menetelmän avulla ei ole tarkoitus laskea tarkkaa LD50-annosta, vaan sillä voidaan määrittää tietty altistusalue, jolla kuolleisuutta on odotettavissa, sillä kokeen tärkein päätepiste on edelleenkin se, että osa eläimistä kuolee. Menetelmän avulla voidaan määrittää LD50-arvo vain silloin, kun vähintään kaksi annosta aiheuttaa kuolleisuuden, joka on korkeampi kuin 0 % ja alhaisempi kuin 100 %. Menetelmässä käytetään testiaineesta riippumatta tiettyjä etukäteen määriteltyjä annoksia, ja luokitus tehdään selkeästi eri tilassa olevien eläinten määrästä tehtyjen havaintojen perusteella. Tämän ansiosta eri laboratorioiden raportit ovat yhdenmukaisempia ja toistettavampia.
Koelaboratorion on otettava huomioon kaikki testiaineesta saatavilla olevat tiedot ennen tutkimuksen suorittamista. Näitä tietoja ovat mm. aineen tunnistetiedot ja kemiallinen rakenne, sen fysikaalis-kemialliset ominaisuudet, kaikkien muiden aineella in vitro tai in vivo suoritettujen toksisuuskokeiden tulokset, rakenteellisesti samanlaisten aineiden toksikologiset tiedot ja aineen odotettu käyttö. Nämä tiedot ovat välttämättömiä kaikkien asianosaisten vakuuttamiseksi siitä, että kokeella on merkitystä ihmisten terveyden suojelun kannalta ja että sen avulla voidaan valita sopiva alkuannos.
1.2 MÄÄRITELMÄT
Akuutti oraalinen toksisuus: haittavaikutukset, joita esiintyy, kun ainetta on annosteltu suun kautta kerta-annoksena tai useina annoksina 24 tunnin aikana.
Viivästynyt kuolema: eläin ei kuole tai vaikuta kuolevalta 48 tunnin kuluessa, mutta kuolee myöhemmin 14 päivän havainnointijakson aikana.
Annos: annostellun testiaineen määrä. Annos ilmaistaan testiaineen painona koe-eläimen painoyksikköä kohti (esimerkiksi mg/kg).
GHS: Globally Harmonised Classification System for Chemical Substances and Mixtures (Kemiallisten aineiden ja seosten kansainvälisesti yhdenmukaistettu luokitusjärjestelmä). Yhteinen toimi, johon osallistuvat OECD (ihmisten terveys ja ympäristö), YK:n vaarallisten aineiden kuljettamista käsittelevä asiantuntijakomitea (fysikaalis-kemialliset ominaisuudet) ja ILO (vaarojen ilmoittaminen) ja jota koordinoi kemikaalien järkevää hallinnointia koskeva organisaatioiden välinen ohjelma (IOMC).
Uhkaava kuolema: eläin on vakavasti sairas tai kuolee todennäköisesti ennen seuraavaa suunniteltua havainnointiajankohtaa. Jyrsijöillä tällaista tilaa osoittavia merkkejä voivat olla kouristukset, kyljellään makaaminen, velttous ja vapina. (Katso tarkempia tietoja eläinkokeen humaaneja lopettamiskriteereitä koskevasta ohjeasiakirjasta (9)).
LD 50 (median lethal oral dose, keskimääräinen tappava annos suun kautta annettuna): on tilastollinen kerta-annos, jonka voidaan suun kautta annosteltuna odottaa tappavan puolet annoksen saaneista eläimistä. LD50-arvo ilmoitetaan testiaineen painona koe-eläimen painoyksikköä kohti (mg/kg).
Raja-annos: kokeen yläraja-annos (2 000 tai 5 000 mg/kg).
Kuolemaisillaan oleva: eläin, joka on kuolemaisillaan tai ei kykene säilymään hengissä hoidosta huolimatta. (Katso tarkempia lisätietoja eläinkokeen humaaneja lopettamiskriteereitä koskevasta ohjeasiakirjasta (9)).
Ennustettava kuolema: sellaisten kliinisten oireiden esiintyminen, jotka viittaavat siihen, että eläin tulee kuolemaan tietyn ajan kuluttua ennen kokeen suunniteltua päättymistä. Näitä oireita ovat esimerkiksi kykenemättömyys käyttää vettä tai ruokaa. (Katso tarkempia lisätietoja eläinkokeen humaaneja lopettamiskriteereitä koskevasta ohjeasiakirjasta (9)).
1.3 TESTIN PERIAATE
Testin periaate on, että vaiheittaisella menetelmällä ja käyttämällä mahdollisimman vähän eläimiä kussakin vaiheessa saadaan riittävästi tietoa testiaineen akuutista toksisuudesta sen luokittelemiseksi. Ainetta annetaan koe-eläinryhmälle suun kautta yhdellä määritellyistä annostasoista. Ainetta testataan vaiheittain siten, että kussakin vaiheessa käytetään kolmea samaa sukupuolta olevaa eläintä (yleensä naaraita). Kyseisestä yhdisteestä johtuva kuolleisuus kussakin testin vaiheessa määrää kokeen seuraavan vaiheen, eli
|
— |
lisäkokeita ei tarvita, |
|
— |
ainetta annetaan kolmelle muulle eläimelle samalla annostasolla, |
|
— |
ainetta annetaan kolmelle muulle eläimelle astetta korkeammalla tai astetta matalammalla annostasolla. |
Testin suoritus on kuvattu yksityiskohtaisesti liitteessä 1. Menetelmän avulla testiaine voidaan luokitella johonkin niistä toksisuusluokista, jotka on määritelty kiinteiden LD50-raja-arvojen perusteella.
1.4 MENETELMÄN KUVAUS
1.4.1 Eläinlajin valinta
Suositeltavin jyrsijälaji on rotta, tosin muitakin jyrsijöitä voidaan käyttää. Yleensä käytetään naaraita (9). Syynä tähän on, että tavanomaisia LD50-kokeita koskevien kirjallisuustutkimusten perusteella sukupuolten herkkyydessä on vähäisiä eroja, mutta silloin kun eroja on havaittu, naaraat ovat yleensä hieman herkempiä (11). Mikäli rakenteellisesti samanlaisten kemikaalien toksikologisia ja toksikokineettisiä ominaisuuksia koskevat tiedot osoittavat urosten olevan herkempiä, on käytettävä uroksia. Kokeen tekeminen uroksilla edellyttää riittäviä perusteita.
Kokeeseen on käytettävä terveitä, nuoria ja täysikasvuisia yleisesti käytettyjä koe-eläinkantoja. Naaraat eivät saa olla synnyttäneitä eivätkä kantavia. Kunkin eläimen on annostuksensa alussa oltava 8–12 viikon ikäinen, ja sen paino saa poiketa korkeintaan ± 20 % aikaisemmin annoksen saaneiden eläinten keskipainosta.
1.4.2 Koe-eläintilat ja eläinten ruokinta
Koe-eläinhuoneen lämpötilan tulee olla 22 oC (± 3 oC). Vaikka riittävät vaatimukset suhteellisen kosteuden suhteen ovat vähintään 30 % eikä mielellään yli 70 % muulloin kuin huoneen puhdistuksen aikana, pitäisi kuitenkin pyrkiä 50–60 %:n suhteelliseen kosteuteen. Huoneessa tulee käyttää keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa, 12 tuntia pimeää). Eläinten ruokinnassa voidaan käyttää normaalia laboratorioruokavaliota, eikä juomaveden määrää saa rajoittaa. Eläimet voidaan sijoittaa eri häkkeihin ryhmissä annoksen mukaan, mutta eläinten lukumäärä häkkiä kohti ei saa häiritä kunkin eläimen selkeää havainnointia.
1.4.3 Eläinten valmistelu
Eläimet valitaan satunnaisesti ja merkitään yksilötunnistusta varten. Eläimiä pidetään häkeissään vähintään viiden päivän ajan ennen annostelun aloittamista, jotta ne tottuvat laboratorio-oloihin.
1.4.4 Annosten valmistelu
Yleensä testiaineen testattavat annokset annostellaan vakiotilavuudessa niin, että annosteltavan valmisteen pitoisuus vaihtelee. Testattaessa nestemäistä lopputuotetta tai seosta testiaineen käyttö laimentamattomana eli vakiopitoisena saattaa kuitenkin olla oleellista kyseisen aineen myöhemmän riskinarvioinnin kannalta, ja jotkut sääntelyviranomaiset edellyttävätkin tällaista menettelyä. Kummassakaan tapauksessa annoksen enimmäistilavuutta ei saa ylittää. Kerralla annettava nesteen enimmäismäärä riippuu koe-eläimen koosta. Jyrsijöillä määrä ei yleensä saa olla yli 1 ml sataa painogrammaa kohti. Vesiliuoksia voidaan kuitenkin antaa 2 ml sataa painogrammaa kohti. Annostellun valmisteen koostumukseksi suositellaan vesipohjaista liuosta/suspensiota/emulsiota aina kun se on mahdollista. Muussa tapauksessa on mieluiten käytettävä öljypohjaista (esimerkiksi maissiöljy) liuosta/suspensiota/emulsiota tässä järjestyksessä ja sen jälkeen muihin kantaja-aineisiin pohjautuvia liuoksia. Jos kantaja-aine on muu kuin vesi, sen toksiset ominaisuudet on tunnettava. Annokset on valmistettava vähän ennen annostelua paitsi, jos valmisteen tiedetään säilyttävän stabiliteettinsa käytön ajan ja sen on osoitettu olevan hyväksyttävä.
1.5 TESTIN SUORITUS
1.5.1 Annostelu
Testiaine annetaan kerta-annoksena mahaletkun tai sopivan intubaatiokanyylin kautta. Mikäli kerta-annostelu ei poikkeuksellisesti ole mahdollinen, annos voidaan antaa pienempinä osina enintään 24 tunnin kuluessa.
Eläimiä ei saa ruokkia ennen annostelua (esimerkiksi rottaa on pidettävä ruoatta yli yön ja hiirtä 3–4 tuntia, mutta vettä tulee olla tarjolla). Paaston jälkeen eläimet punnitaan ja niille annetaan testiaine. Aineen annostelun jälkeen ruokintaa voidaan siirtää rotilla vielä 3–4 tuntia ja hiirillä 1–2 tuntia. Mikäli annos annetaan osina tietyn ajan kuluessa, eläimille saatetaan joutua antamaan ruokaa ja vettä jakson pituudesta riippuen.
1.5.2 Eläinten määrä ja annostasot
Kussakin vaiheessa käytetään kolmea eläintä. Alkuannostasoksi valitaan yksi neljästä vakiotasosta, jotka ovat 5, 50, 300 ja 2 000 mg/kg. Alkuannostason tulee olla sellainen, että se todennäköisesti tappaa muutaman annoksen saaneista eläimistä. Liitteessä 1 esitetyissä toimenpidekaavioissa kuvataan kunkin alkuannoksen yhteydessä noudatettava menettely. Lisäksi liitteessä 4 annetaan ohjeita EU:n järjestelmän mukaisesta luokituksesta ennen uuden GHS-järjestelmän käyttöönottoa.
Kun saatavissa olevat tiedot viittaavat siihen, ettei korkein alkuannostaso (2 000 mg/kg) todennäköisesti aiheuta eläinten kuolemaa, on tehtävä raja-annostesti. Kun testiaineesta ei ole tietoja, alkuannokseksi suositellaan eläinten hyvinvointia koskevien periaatteiden vuoksi 300 mg/kg.
Testiryhmien testaamisen aikavälit määritellään toksisten oireiden alkamishetken, keston ja vaikeusasteen mukaan. Seuraavan annoksen antamista tulee siirtää, kunnes jo annosteltujen eläinten eloonjäämisestä on saatu varmuus.
Korkeinta 5 000 mg:n/kg annostasoa voidaan käyttää poikkeuksellisesti ja vain silloin, kun se on perusteltua erityisten sääntelyyn liittyvien vaatimusten vuoksi (katso liite 2). Eläinten hyvinvointia koskevien periaatteiden vuoksi eläinkokeiden tekeminen GHS-luokan 5 annoksilla (2 000–5 000 mg/kg) ei ole suositeltavaa, ja niitä tulee käyttää vain, kun on erittäin todennäköistä, että tällaisen kokeen tuloksilla on välitöntä merkitystä ihmisten tai eläinten terveyden tai ympäristön suojelemiselle.
1.5.3 Raja-annostesti
Raja-annostestiä käytetään pääasiassa silloin, kun tutkimuksen tekijällä on tietoa, jonka mukaan testiaine on todennäköisesti ei-toksinen, toisin sanoen se on toksista ainoastaan ylittäessään säädösten mukaiset raja-annokset. Tietoa testiaineen toksisuudesta saadaan samanlaisia testattuja yhdisteitä tai seoksia koskevista tiedoista, kun otetaan huomioon, mitä toksikologisesti merkittävät ainesosat ovat ja mikä on niiden prosenttiosuus. Päätutkimus on suoritettava, kun testiaineen toksisuudesta on vain vähän tai ei lainkaan tietoa tai kun se todennäköisesti on toksinen.
Raja-annostesti voidaan tehdä yhdellä annostasolla 2 000 mg/kg käyttäen kuutta eläintä (kolme eläintä vaihetta kohden). Poikkeuksellisesti voidaan tehdä raja-annostesti yhdellä annostasolla 5 000 mg/kg käyttäen kolmea eläintä (katso liite 2). Mikäli testiaineeseen liittyvää kuolleisuutta esiintyy, voidaan tarvita lisäkokeita seuraavaksi alemmalla annostasolla.
1.6 HAVAINNOINTI
Eläimiä havainnoidaan yksittäin annostelun jälkeen vähintään yhden kerran ensimmäisten 30 minuutin aikana ja säännöllisin väliajoin ensimmäisten 24 tunnin aikana. Havainnoinnin on oltava erityisen tarkkaa ensimmäisten neljän tunnin aikana. Sen jälkeen havainnointi tapahtuu päivittäin 14 päivän ajan paitsi, jos eläin on poistettava tutkimuksesta ja lopetettava humaanilla tavalla eläinten hyvinvointia koskevien periaatteiden vuoksi tai se löydetään kuolleena. Havainnoinnin kestoa ei pitäisi kuitenkaan määritellä tiukasti. Se tulee määrittää toksisten reaktioiden, niiden alkamishetken ja toipumisen keston perusteella ja sitä tulisi voida pidentää tarvittaessa. Toksisuusoireiden ilmaantumis- ja häviämisajankohdat ovat tärkeitä etenkin, jos toksisilla oireilla on taipumus viivästyä (12). Kaikki havainnot kirjataan järjestelmällisesti eläinkohtaisesti.
Lisähavainnointi on tarpeen jos eläinten toksisuusoireet jatkuvat. Havaintoihin tulee sisältyä ihon, karvapeitteen, silmien, limakalvojen, hengitys- ja verenkiertojärjestelmän, autonomisen hermoston ja keskushermoston, somatomotorisen toiminnan ja käyttäytymisen muutokset. Huomiota tulee kiinnittää vapinaan, kouristuksiin, syljeneritykseen, ripuliin, letargiaan, uneen ja koomaan. Eläinkokeiden humaaneja lopettamiskriteereitä koskevassa ohjeasiakirjassa (9) esitetyt periaatteet ja perustelut on otettava huomioon. Kuolevat eläimet ja eläimet, jotka osoittavat merkkejä voimakkaasta kivusta ja jatkuvasta kovasta kärsimyksestä, tulee lopettaa humaanilla tavalla. Humaaneista syistä lopetettujen tai kuolleena löydettyjen eläinten kuolinajankohta tulee kirjata mahdollisimman tarkasti.
1.6.1 Ruumiinpaino
Kunkin eläimen paino on määritettävä hieman ennen testiaineen annostelua ja vähintään viikoittain sen jälkeen. Painon muutokset on laskettava ja kirjattava. Kokeen päätyttyä henkiin jääneet eläimet punnitaan ja lopetetaan humaanilla tavalla.
1.6.2 Patologia
Kaikki koe-eläimet (myös kokeen aikana kuolleet tai eläinten hyvinvointia koskevien periaatteiden vuoksi tutkimuksesta poistetut) on avattava. Kunkin eläimen kaikki makroskooppiset muutokset tulee kirjata. Vähintään 24 tuntia hengissä säilyneiden eläinten makroskooppisia muutoksia sisältävät elimet voidaan myös tutkia mikroskooppisesti siitä mahdollisesti saatavan hyödyllisen tiedon vuoksi.
2. TULOKSET
Tuloksina on esitettävä yksittäisiä eläimiä koskevat tulokset. Kaikki tulokset tulee esittää myös yhteenvetona taulukossa, josta käy ilmi kussakin koeryhmässä käytettyjen eläinten lukumäärä, toksisuusoireita osoittaneiden eläinten lukumäärä, kokeen aikana kuolleena löydettyjen tai humaaneista syistä lopetettujen eläinten lukumäärä, yksittäisten eläinten kuolinajankohta, toksisten vaikutusten ja palautuvuuden kuvaus ja niiden ajallinen esiintyminen sekä ruumiinavauslöydökset.
3. TULOSTEN ILMOITTAMINEN
3.1 Loppuraportti
Loppuraportin tulee tarpeen mukaan sisältää seuraavat tiedot:
|
|
Testiaine:
|
|
|
Kantaja-aine (tarvittaessa):
|
|
|
Koe-eläimet:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten tarkastelu ja tulkinta. |
|
|
Johtopäätökset. |
4. VIITTEET
|
(1) |
Roll R., Höfer-Bosse Th. and Kayser D. (1986). New Perspectives in Acute Toxicity Testing of Chemicals. Toxicol. Lett., Suppl. 31, 86. |
|
(2) |
Roll R., Riebschläger M., Mischke U. and Kayser D. (1989). Neue Wege zur Bestimmung der akuten Toxizität von Chemikalien. Bundesgesundheitsblatt 32, 336–341. |
|
(3) |
Diener W., Sichha L., Mischke U., Kayser D. and Schlede E. (1994). The Biometric Evaluation of the Acute- Toxic-Class Method (Oral). Arch. Toxicol. 68, 559–610. |
|
(4) |
Diener W., Mischke U., Kayser D. and Schlede E. (1995). The Biometric Evaluation of the OECD Modified Version of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 729–734. |
|
(5) |
Diener W., and Schlede E. (1999) Acute Toxicity Class Methods: Alterations to LD/LC50 Tests. ALTEX 16, 129–134. |
|
(6) |
Schlede E., Mischke U., Roll R. and Kayser D. (1992). A National Validation Study of the Acute-Toxic-Class Method — An Altemative to the LD50 Test. Arch. Toxicol. 66, 455–470. |
|
(7) |
Schlede E., Mischke U., Diener W. and Kayser D. (1994). The International Validation Study of the Acute- Toxic-Class Method (Oral). Arch. Toxicol. 69, 659–670. |
|
(8) |
OECD (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris. |
|
(9) |
OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N 19. |
|
(10) |
OECD (1998) Harmonized Integrated Hazard Classification System For Human Health And Environmental Effects Of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnetl.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html]. |
|
(11) |
Lipnick R. L, Cotruvo, J. A., Hill R. N., Bruce R. D., Stitzel K. A., Walker A. P., Chu I.; Goddard M., Segal L., Springer J. A. and Myers R. C. (1995) Comparison of the Up-and Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol 33, 223–231. |
|
(12) |
Chan P.K. and A.W. Hayes. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A.W. Hayes, Editor. Raven Press, Ltd., New York, USA. |
LIITE 1
TESTIN SUORITUS ERI ALKUANNOKSILLA
YLEISIÄ HUOMAUTUKSIA
Tässä liitteessä selostetaan testin suoritus kullekin alkuannokselle.
|
— |
Liite 1 a: alkuannos 5 mg/kg |
|
— |
Liite 1 b: alkuannos 50 mg/kg |
|
— |
Liite 1 c: alkuannos 300 mg/kg |
|
— |
Liite 1 d: alkuannos 2 000 mg/kg |
Humaanilla tavalla lopetettujen tai kuolleiden eläinten lukumäärästä riippuen koe etenee nuolten osoittamalla tavalla.
Liite 1 A
TESTIN SUORITUS ALKUANNOKSELLA 5 MG/KG
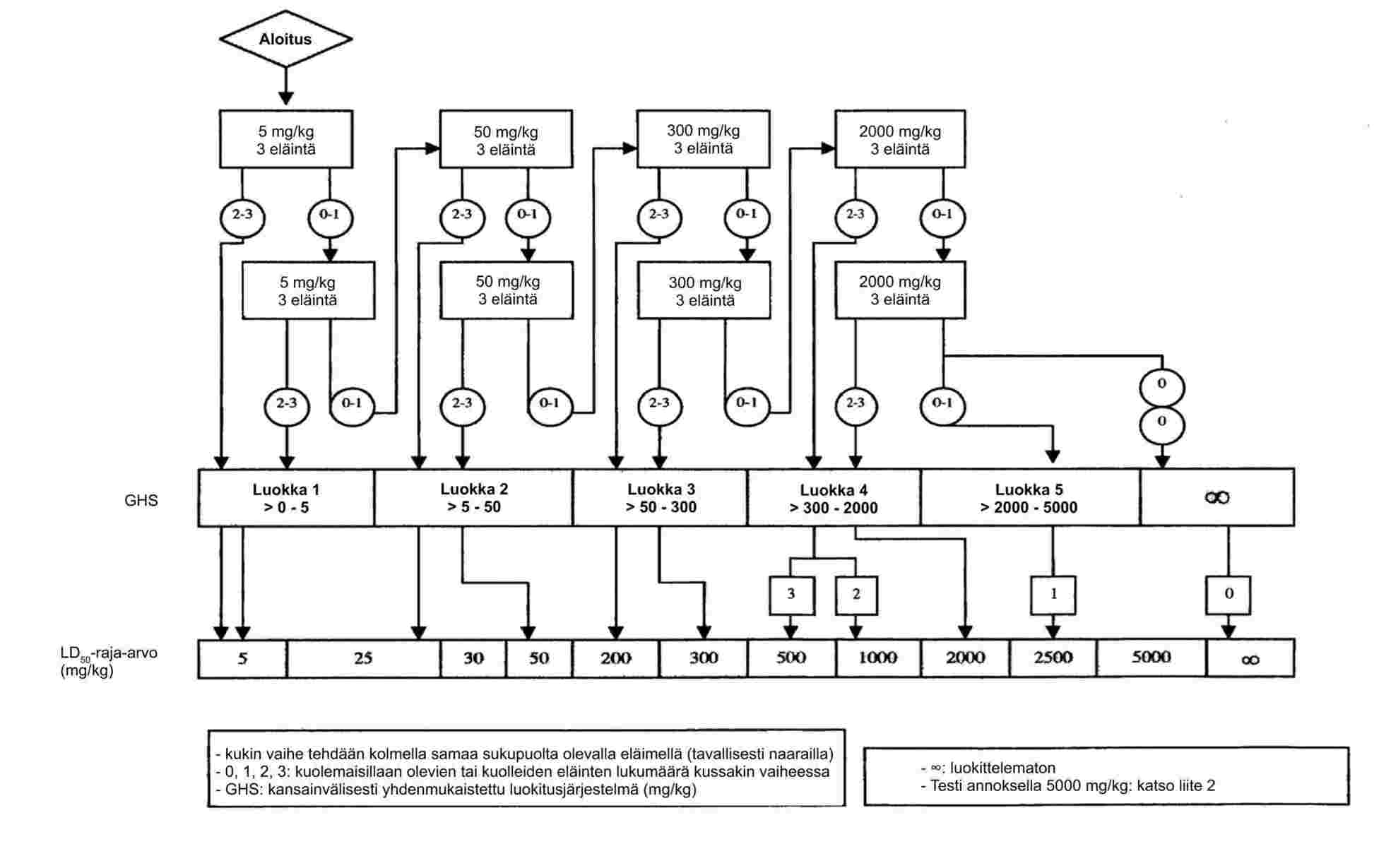
Liite 1 B
TESTIN SUORITUS ALKUANNOKSELLA 50 MG/KG

Liite 1 C
TESTIN SUORITUS ALKUANNOKSELLA 300 MG/KG

Liite 1 D
TESTIN SUORITUS ALKUANNOKSELLA 2 000 MG/KG

LIITE 2
PERUSTEET SELLAISTEN TESTIAINEIDEN LUOKITTELULLE, JOIDEN ODOTETTAVISSA OLEVA LD50-ARVO YLITTÄÄ 2 000 MG/KG JA JOITA EI TARVITSE TESTATA
Vaarallisuusluokkaa 5 koskevien kriteereiden avulla on tarkoitus tunnistaa sellaiset testiaineet, joiden akuutti toksisuusvaara on suhteellisen alhainen, mutta jotka tietyissä olosuhteissa voivat olla vaaraksi herkimmille populaatioille. Näiden aineiden LD50-arvon odotetaan vaihtelevan välillä 2 000–5 000 mg/kg ihon tai suun kautta annosteltuna tai vastaavina annoksina muuta kautta annettuna. Testiaineet on luokiteltava vaarallisuusluokkaan, jonka rajat ovat 2 000 mg/kg < LD50 < 5 000 mg/kg (luokka 5 GHS-järjestelmässä) seuraavissa tapauksissa:
|
a) |
mikäli aine määritellään missä tahansa liitteissä 1a-1d esitetyistä koejärjestelyistä tähän luokkaan kuuluvaksi kuolleisuuden esiintymisen perusteella; |
|
b) |
mikäli on jo käytettävissä luotettavaa näyttöä, jonka mukaan LD50 on luokkaan 5 kuuluvien arvojen vaihteluvälin rajoissa tai mikäli muut eläinkokeet tai toksiset vaikutukset ihmisillä osoittavat, että aineella on välitöntä merkitystä ihmisten terveydelle; |
|
c) |
tietoja ekstrapoloimalla, arvioimalla tai mittaamalla, jos määritteleminen korkeampaan vaarallisuusluokkaan ei ole aiheellista ja kun
|
TESTAAMINEN 2 000 MG/KG YLITTÄVILLÄ ANNOKSILLA
Koska eläinten hyvinvointia on suojeltava, testaaminen eläimillä luokan 5 (5 000 mg/kg) rajoissa ei ole suositeltavaa, ja sitä tulee käyttää vain kun on erittäin todennäköistä, että tällaisen kokeen tuloksilla on välitöntä merkitystä eläinten tai ihmisten terveyden suojelemiselle (10). Lisäkokeita korkeammilla annostasoilla ei pidä tehdä.
Kun kokeen tekeminen 5 000 mg:n/kg annoksella on välttämätöntä, tarvitaan vain yksi vaihe (eli kolme eläintä). Jos ensimmäinen annoksen saanut eläin kuolee, annostelua jatketaan 2 000 mg:n/kg annoksella liitteessä 1 esitettyjen toimenpidekaavioiden mukaisesti. Jos ensimmäinen eläin jää henkiin, kahdelle muulle eläimelle annetaan annos testiainetta. Jos vain yksi kolmesta eläimestä kuolee, LD50-arvo ylittää todennäköisesti 5 000 mg/kg. Jos molemmat eläimet kuolevat, annostelua jatketaan 2 000 mg:lla/kg.
LIITE 3
KOEMENETELMÄ B.1 b: EU:n järjestelmän mukaiset luokitteluohjeet, joita käytetään siirtymäkaudella ennen kemikaalien kansainvälisesti yhdenmukaistetun järjestelmän (GHS) (viitteessä (8)) täysimääräistä täytäntöönpanoa

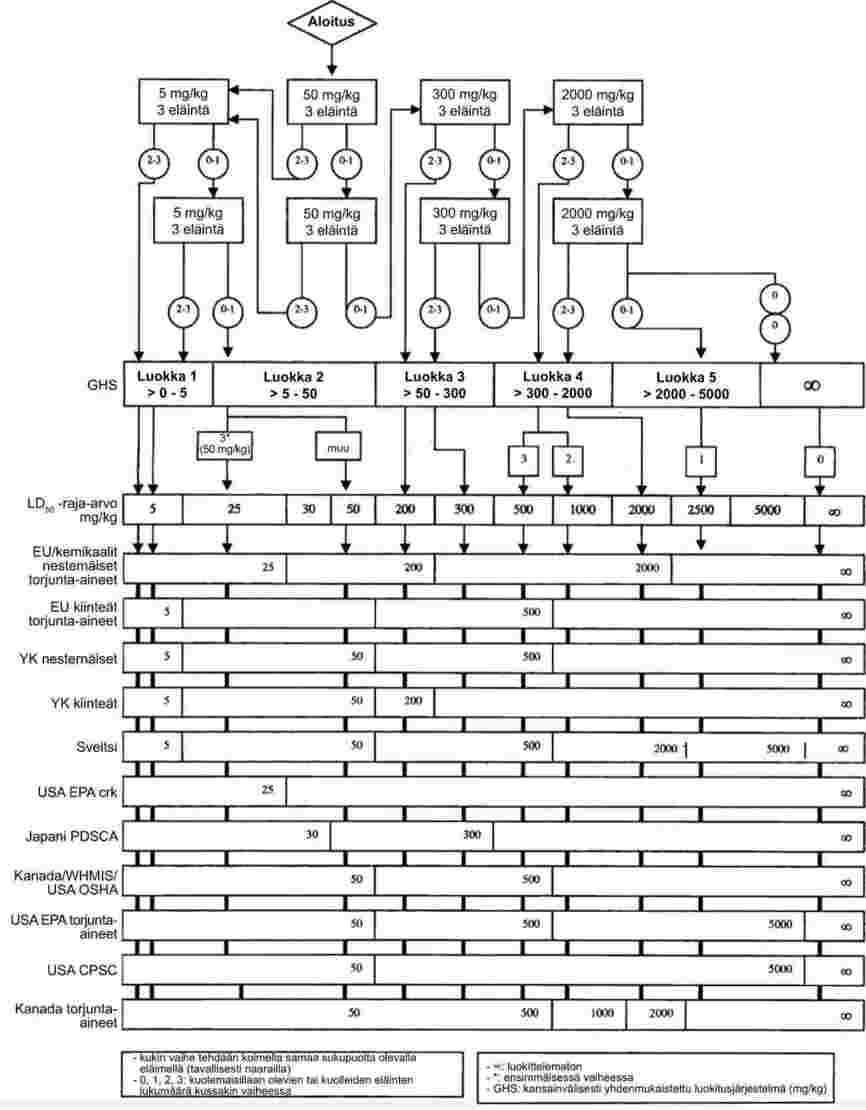
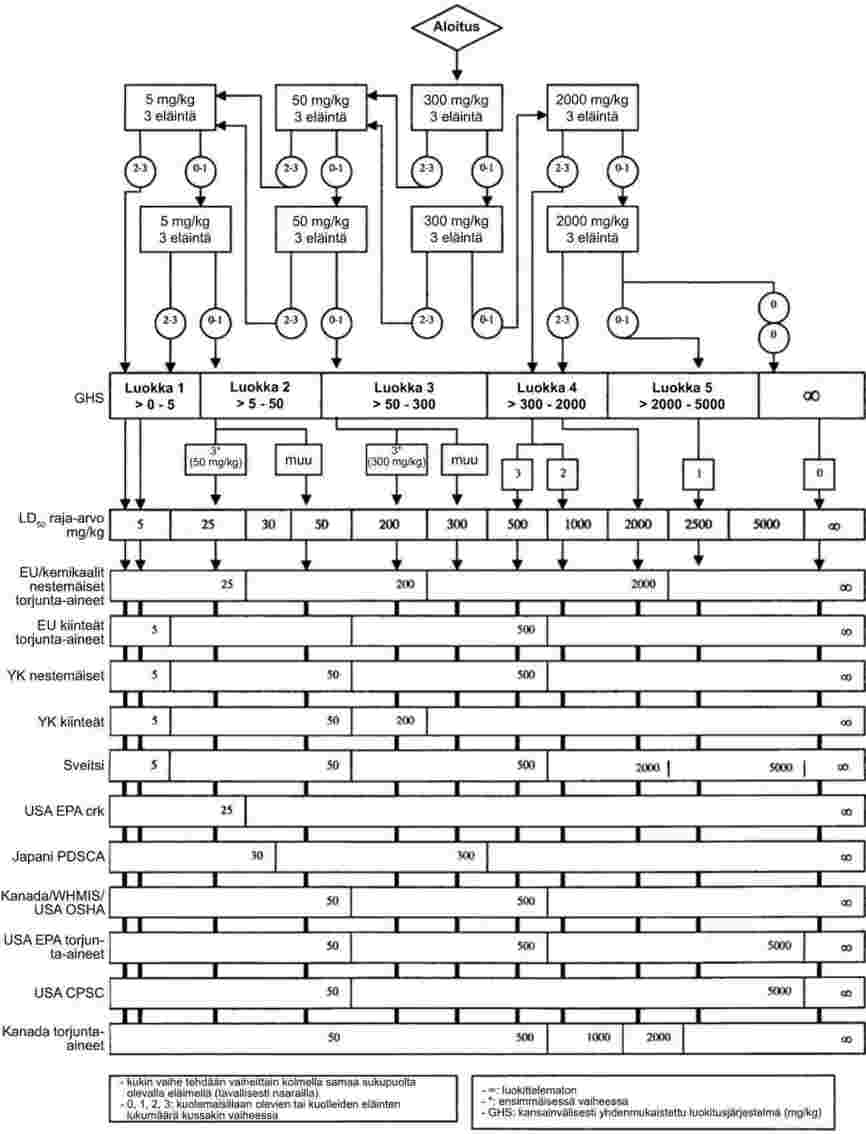
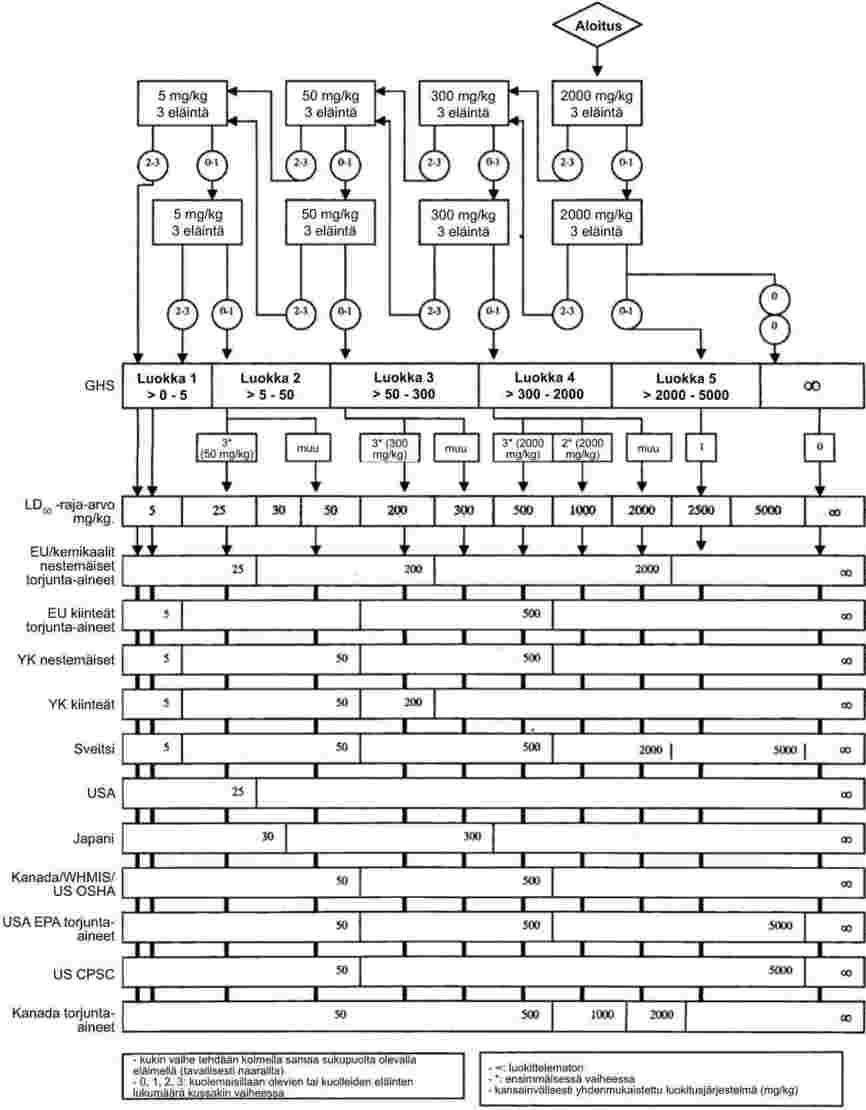
B.2. AKUUTTI MYRKYLLISYYS (HENGITETTYNÄ)
1. MENETELMÄ
1.1 JOHDANTO
On suositeltavaa selvittää aineen hiukkaskokojakauma, höyrynpaine, sulamispiste, kiehumispiste, leimahduspiste ja mahdollinen räjähtävyys ennalta.
Katso myös yleistä johdantoa, osa B (A).
1.2 MÄÄRITELMÄT
Katso yleistä johdantoa, osa B (B).
1.3 VERTAILUAINEET
Vertailuaineita ei ole.
1.4 TESTIMENETELMÄN PERIAATE
Koe-eläimet jaetaan useaan ryhmään, jotka altistetaan testattavalle aineelle määrätyn ajan porrastettuja pitoisuuksia käyttäen (yksi pitoisuus ryhmää kohti). Tämän jälkeen eläimiä tarkkaillaan oireiden ja kuolemien suhteen. Ruumiinavaus tehdään kokeen aikana kuolleille eläimille ja kokeen päätyttyä myös henkiin jääneille eläimille, kun ne on ensin lopetettu.
Eläimet, joilla on vakavia ja pitkittyneitä ahdistuneisuuden ja kivun oireita, voidaan tarvittaessa lopettaa. Testattavia aineita ei tarvitse antaa tavalla, jonka tiedetään aiheuttavan selvää kipua ja ahdistusta syövyttävien tai ärsyttävien ominaisuuksien vuoksi.
1.5 LAATUKRITEERIT
Laatukriteerejä ei ole.
1.6 MENETELMÄKUVAUS
1.6.1 Valmistelut
Ennen testiä eläinten elinolosuhteet pidetään tietyntyyppisinä vähintään viiden päivän ajan testin suorittamista silmälläpitäen. Terveiden aikuisten eläinten joukosta otetaan satunnaisotos, joka jaetaan haluttuun määrään ryhmiä. Eläimille ei tarvitse antaa simuloitua altistusta, ellei käytettävän altistuslaitteen tyyppi tätä vaadi.
Jos testattava aine on kiinteässä muodossa, se on tarpeen mukaan mikronoitava sopivan hiukkaskoon saavuttamiseksi.
Tarvittaessa voidaan käyttää sopivaa liuotinta, jonka avulla saadaan helpommin ilmakehään sopiva pitoisuus ainetta. Tällöin on käytettävä liuotinkontrolliryhmää. Jos annostelua varten käytetään liuotinta tai muita lisäaineita, on varmistettava, että ne eivät aiheuta myrkytysoireita. Soveltuvissa tapauksissa voidaan käyttää aikaisempia tietoja.
1.6.2 Testiolosuhteet
1.6.2.1 Koe-eläimet
Ellei kontraindikaatioita ole, rotan käyttöä suositellaan. Testiin käytetään yleisiä laboratoriokantoja. Testin alussa kumpaakaan sukupuolta edustavien eläinten painonvaihtelut eivät saa olla enempää kuin ± 20 % sukupuolen keskiarvosta.
1.6.2.2 Lukumäärä ja sukupuoli
Jokaista annostasoa kohti tarvitaan vähintään kymmenen jyrsijää (viisi naarasta ja viisi urosta). Naaraat eivät saa olla synnyttäneitä eivätkä tiineitä.
Huomautus: Käytettäessä rottaa kehittyneempiä eläimiä akuutin myrkyllisyyden testaukseen on harkittava pienempää eläinmäärää kuin rottien kohdalla. Annokset valitaan huolella, ja kohtuullisen myrkyllisten annosten ylittämistä on vältettävä kaikin keinoin. Tällaisissa kokeissa on vältettävä tappavien annosten antamista.
1.6.2.3 Altistuspitoisuudet
Pitoisuuksia on oltava tarpeellinen määrä, kuitenkin vähintään kolme. Ne jaetaan siten, että saadaan jakauma myrkytysoireiden ja kuolleisuuden suhteen. Tietojen perusteella tulisi voida piirtää pitoisuus/kuolleisuus-käyrä, ja LC50-arvo tulisi määrittää aina kun se vain on mahdollista.
”1.6.2.4 Raja-annostesti
Jos viiden uroksen ja viiden naaraan altistuminen pitoisuudelle 20 milligrammaa litrassa kaasua tai 5 milligrammaa litrassa aerosolia tai hiukkasille neljän tunnin ajan tai, jos tämä ei kemiallisten tai fysikaalisten tai räjähtävien ominaisuuksien vuoksi ole mahdollista, koeaineelle, altistuminen suurimmalle mahdolliselle pitoisuudelle ei aiheuta yhdenkään eläimen kuolemaa 14 vuorokaudessa, kokeilun jatkamista voidaan pitää hyödyttömänä.”
1.6.2.5 Altistusaika
Altistusaika on neljä tuntia.
1.6.2.6 Laitteet
Eläimiä testataan hengityslaitteella, jonka dynaaminen ilmanvirtaus takaa, että koko ilmamäärä vaihtuu vähintään 12 kertaa tunnissa. Näin varmistetaan riittävä happipitoisuus ja altistusilmakehän tasainen jakaantuminen. Jos käytetään kammiota, sen rakenteen on oltava sellainen, että eläinten elintilan ja altistumistehokkuuden suhde on optimaalinen. Yleinen sääntö kammion ilmakehän stabiiliuden varmistamiseksi on, että eläinten kokonaistilavuus saa olla enintään 5 % kammion tilavuudesta. Eläinkohtaisissa kammioissa voidaan käyttää oronasaalista, vain päähän kohdistuvaa tai koko kehoon kohdistuvaa altistamista. Kahden ensimmäisen tavan avulla aineen imeytyminen muuta kautta voidaan minimoida.
1.6.2.7 Tarkkailujakso
Tarkkailujakson minimipituus on 14 päivää. Jakson pituus ei ole ehdottoman kiinteä, vaan sitä voidaan tarvittaessa säätää myrkytysoireiden, oireiden alkamisnopeuden ja toipumisjakson mukaan. Myrkytysoireiden ilmestymis- ja häviämisajankohta sekä kuoleman ajankohta ovat tärkeät, etenkin jos kuolemilla on taipumus ”viivästyä”.
1.6.3 Testin suorittaminen
Eläimet punnitaan ja pannaan valittuun laitteeseen, jossa niitä altistetaan halutulle pitoisuudelle neljän tunnin ajan pitoisuustasapainon saavuttamisen jälkeen. Tasapainon saavuttamiseen kuluvan ajan tulee olla lyhyt. Testilämpötilana käytetään arvoa 22 ± 3 oC. Suhteellisen kosteuden tulisi olla 30–70 %, mutta joissakin tapauksissa (eräiden aerosolien testauksissa) tämä ei ehkä ole mahdollista. Pitämällä kammiossa alipainetta (≤ 5 mm H2O) voidaan estää aineen vuotaminen ympäristöön. Altistuksen aikana eläimille ei anneta ruokaa eikä vettä. Testi-ilmakehän tuottamiseen ja ylläpitämiseen on käytettävä soveltuvia järjestelmiä, joiden avulla voidaan varmistaa se, että stabiilit altistusolosuhteet saavutetaan mahdollisimman nopeasti. Kammion suunnittelussa ja sen käytössä on pyrittävä siihen, että testi-ilmakehä jakautuu kammioon mahdollisimman tasaisesti.
Seuraavia suureita on mitattava tai valvottava:
|
a) |
ilmanvirtaus (jatkuvasti). |
|
b) |
testattavan aineen todellinen pitoisuus hengitysilmassa, vähintään kolme kertaa altistuksen aikana (eräät ilmakehät, esimerkiksi aerosolit, voivat suurina pitoisuuksina vaatia edellyttää tiheämpää valvontaa). Päivittäisen altistuksen aikana pitoisuusvaihtelut eivät saa olla enempää kuin ± 15 % keskiarvosta. Eräiden aerosolien kohdalla tällaista säätötasoa ei ehkä voida saavuttaa, jolloin on hyväksyttävä laajempi alue. Aerosoleille on tehtävä hiukkaskokoanalyysi riittävän usein (vähintään kerran koeryhmää kohti). |
|
c) |
lämpötila ja kosteus (jatkuvasti, jos mahdollista). |
Altistuksen aikana ja sen jälkeen eläimiä tarkkaillaan systemaattisesti ja tulokset kirjataan. Jokaisesta yksittäisestä eläimestä tulee olla oma kirjanpitonsa. Ensimmäisen päivän aikana havaintoja on tehtävä usein. Vähintään kerran työpäivässä on tehtävä huolellinen kliininen tutkimus. Muut havainnot tehdään päivittäin ja eläinhukka minimoidaan soveltuvin toimenpitein (kuolleet eläimet jäädytetään tai niille tehdään ruumiinavaus ja heikot tai kuolevat eläimet eristetään tai lopetetaan).
Tarkkaillaan ihon, turkin, silmien, limakalvojen, hengitysteiden, verenkierron, autonomisen hermoston, keskushermoston, somatomotorisen aktiviteetin ja käyttäytymismallin muutoksia. Erityisesti on tarkkailtava vapinaa, kouristuksia, syljeneritystä, ripulia, letargiaa, unta ja koomaa. Kuoleman ajankohta on kirjattava niin tarkoin kuin mahdollista. Eläimet on punnittava yksitellen viikoittain altistuksen jälkeen sekä kuoleman jälkeen.
Ruumiinavaus tehdään kokeen aikana kuolleille eläimille ja kokeen päätyttyä myös henkiin jääneille eläimille, kun ne on ensin lopetettu. Ruumiinavauksessa kiinnitetään erityistä huomiota ylä- ja alahengitysteiden muutoksiin. Kaikki huomattavan suuret patologiset muutokset on kirjattava. Histopatologista tutkimusta varten otetaan kudosnäytteet voimassa olevan ohjeen mukaan.
2. TIEDOT
Yhteenveto tiedoista esitetään taulukkona, jossa jokaisen ryhmän kohdalla on eläinten määrä kokeen alussa, yksittäisten eläinten kuolinajankohdat, niiden eläinten määrä, joilla on muita myrkyllisyydestä johtuvia oireita, myrkytysoireiden kuvaus ja ruumiinavauslöydökset. Yksittäisten eläinten painot on kirjattava välittömästi ennen aineen annostelua, sen jälkeen viikoittain ja kuoleman jälkeen. Painonmuutokset on laskettava ja kirjattava, kun eläin pysyy hengissä kauemmin kuin yhden vuorokauden. Eläimet, jotka on lopetettu aineen aiheuttaman ahdistuksen ja kipujen takia, luokitellaan aineen vaikutuksesta kuolleiksi. LD50 voidaan määrittää yleisesti tunnetun menetelmän mukaan. Tietojen arviointiin tulee sisältyä mahdolliset yhteydet eläimen aineelle altistamisen ja kaikkien poikkeavuuksien esiintymisen ja vakavuuden välillä. Tällaisia poikkeavuuksia ovat esimerkiksi käyttäytymismuutokset, kliiniset muutokset, painonmuutokset, kuolleisuus ja muut myrkytysoireet.
3. RAPORTOINTI
3.1 TESTIRAPORTTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
laji, kanta, toimittaja, ympäristöolosuhteet, ruokavalio jne., |
|
— |
testiolosuhteet, altistuslaitteen kuvaus (rakenne, tyyppi, mitat, ilmalähde, aerosolin tuottamiseen käytetty järjestelmä, ilmastointijärjestelmä, mahdollisen testauskammion olosuhteet ja lämpötilan, kosteuden, aerosolin pitoisuuden sekä aerosolin hiukkaskokojakauman mittauslaitteiden tiedot). |
Altistustiedot
Altistustiedot kootaan taulukkoon, josta ilmenevät myös keskiarvot ja vaihtelut (esimerkiksi keskihajonta). Mahdollisuuksien mukaan esitetään seuraavat tiedot:
|
a) |
ilmanvirtaus hengityslaitteen kautta; |
|
b) |
ilman lämpötila ja kosteus; |
|
c) |
nimelliset pitoisuudet (hengityslaitteeseen syötetty kokonaismäärä ainetta jaettuna ilman tilavuudella); |
|
d) |
liuottimen laatu, jos liuotinta on käytetty; |
|
e) |
todelliset pitoisuudet hengitysilmassa; |
|
f) |
massan aerodynaamisen halkaisijan mediaani (MMAD) ja geometrinen keskihajonta (GDS); |
|
g) |
aika, joka kului tasapainon saavuttamiseen; |
|
h) |
altistusaika.
|
3.2 ARVIOINTI JA TULKINTA
Katso yleistä johdantoa, osa B (D).
4. VIITTEET
Katso yleistä johdantoa, osa B (E).
B.3. AKUUTTI MYRKYLLISYYS (IHON KAUTTA)
1. MENETELMÄ
1.1 JOHDANTO
Katso yleistä johdantoa, osa B (A).
1.2 MÄÄRITELMÄT
Katso yleistä johdantoa, osa B (B).
1.3 VERTAILUAINEET
Vertailuaineita ei ole.
1.4 TESTIMENETELMÄN PERIAATE
Ainetta levitetään useaan ryhmään jaettujen eläinten iholle porrastettuina annoksina (yksi annos ryhmää kohti). Tämän jälkeen eläimiä tarkkaillaan oireiden ja kuolemien suhteen. Ruumiinavaus tehdään kokeen aikana kuolleille eläimille ja kokeen päätyttyä myös henkiin jääneille eläimille, kun ne on ensin lopetettu.
Eläimet, joilla on vakavia ja pitkittyneitä ahdistuneisuuden ja kivun oireita, voidaan tarvittaessa lopettaa. Testattavia aineita ei tarvitse antaa tavalla, jonka tiedetään aiheuttavan selvää kipua ja ahdistusta syövyttävien tai ärsyttävien ominaisuuksien vuoksi.
1.5 LAATUKRITEERIT
Laatukriteerejä ei ole.
1.6 MENETELMÄKUVAUS
1.6.1 Valmistelut
Ennen testiä eläinten elinolosuhteet pidetään tietyntyyppisinä vähintään viiden päivän ajan testin suorittamista silmälläpitäen. Terveiden aikuisten eläinten joukosta otetaan satunnaisotos, joka jaetaan käsittelyryhmiin. Noin 24 tuntia ennen testiä turkki leikataan tai ajetaan eläinten selkäalueelta varoen naarmuttamasta ihoa, koska naarmut saattaisivat muuttaa ihon läpäisevyyttä. Vähintään 10 % ihoa peittävästä karvasta on ajeltava tai leikattava. Kiinteät aineet voidaan tarvittaessa jauhaa, ja ne on kosteutettava riittävällä vesimäärällä tai tarvittaessa muulla liuottimella hyvän ihokontaktin varmistamiseksi. Jos käytetään liuotinta, on otettava huomioon liuottimen vaikutus aineen imeytymiseen iholta. Nestemäisiä aineita käytetään yleensä laimentamattomina.
1.6.2 Testiolosuhteet
1.6.2.1 Koe-eläimet
Koe-eläiminä voidaan käyttää aikuisia rottia tai kaneja. Muiden lajien käyttö on perusteltava. Testiin käytetään yleisiä laboratoriokantoja. Testin alussa kumpaakaan sukupuolta edustavien eläinten painonvaihtelut eivät saa olla enempää kuin ± 20 % sukupuolen keskiarvosta.
1.6.2.2 Lukumäärä ja sukupuoli
Jokaista annostasoa kohti tarvitaan vähintään viisi eläintä, joiden on oltava samaa sukupuolta. Jos käytetään naaraita, ne eivät saa olla synnyttäneitä eivätkä tiineitä. Jos on käytettävissä tietoja, joiden mukaan jompikumpi sukupuoli on selvästi toista herkempi, kokeessa on käytettävä tätä sukupuolta.
Huomautus: Käytettäessä rottaa kehittyneempiä eläimiä akuutin myrkyllisyyden testauksia varten on harkittava pienempää eläinmäärää kuin rottien kohdalla. Annokset valitaan huolella, ja kohtuullisen myrkyllisten annosten ylittämistä on vältettävä kaikin keinoin. Tällaisissa kokeissa on vältettävä tappavien annosten antamista.
1.6.2.3 Annostasot
Annostasoja on oltava tarpeellinen määrä, kuitenkin vähintään kolme. Annostasot jaetaan siten, että saadaan jakauma myrkytysoireiden ja kuolleisuuden suhteen. Annostasojen valinnassa on otettava huomioon mahdolliset ärsyttävät tai syövyttävät ominaisuudet. Tietojen perusteella tulisi voida piirtää pitoisuus/kuolleisuus-käyrä, ja LC50-arvo tulisi määrittää aina kun se vain on mahdollista.
1.6.2.4 Rajatesti
Voidaan tehdä yhden annostason rajatesti (vähintään 2 000 mg/kg) viiden koiraan ja viiden naaraan ryhmälle edellä kuvattujen menetelmien mukaisesti. Jos aineeseen liittyvää kuolleisuutta esiintyy, on harkittava kattavaa testiä.
1.6.2.5 Tarkkailujakso
Tarkkailujakson minimipituus on 14 päivää. Jakson pituus ei ole ehdottoman kiinteä, vaan sitä voidaan tarvittaessa säätää myrkytysoireiden, oireiden alkamisnopeuden ja toipumisjakson mukaan. Myrkytysoireiden ilmestymis- ja häviämisajankohta sekä kuoleman ajankohta ovat tärkeät, etenkin jos kuolemilla on taipumus ”viivästyä”.
1.6.3 Testin suorittaminen
Eläimiä pidetään yksin häkeissä. Testattavaa ainetta levitetään tasaisesti alueelle, joka on noin 10 % kehon kokonaispinta-alasta. Erittäin myrkyllisten aineiden kohdalla voidaan käyttää pienempää pinta-alaa, mutta ainetta on levitettävä mahdollisimman ohuelti ja tasaisesti niin suurelle alueelle kuin mahdollista.
Testattava ihoalue peitetään harsositeellä ja ärsyttämättömällä laastarilla koko 24 tunnin altistusjakson ajaksi. Tämän lisäksi alue on peitettävä siten, että harsoside ja aine pysyvät paikallaan eikä eläin pääse syömään ainetta. Eläin voidaan sitoa osittain siten, että se ei pysty syömään ainetta. Täyttä liikkumattomuutta ei kuitenkaan suositella.
Altistusjakson jälkeen aineen jäännökset poistetaan vedellä tai muulla sopivalla ihonpuhdistusmenetelmällä.
Havainnot tehdään ja kirjataan systemaattisesti. Jokaisesta eläimestä tulee olla oma kirjanpitonsa. Ensimmäisen päivän aikana havaintoja on tehtävä usein. Vähintään kerran työpäivässä on tehtävä huolellinen kliininen tutkimus. Muut havainnot tehdään päivittäin ja eläinhukka minimoidaan soveltuvin toimenpitein (kuolleet eläimet jäädytetään tai niille tehdään ruumiinavaus ja heikot tai kuolevat eläimet eristetään tai lopetetaan).
Tarkkaillaan turkin, käsitellyn ihon, silmien, limakalvojen, hengitysteiden, verenkierron, autonomisen hermoston, keskushermoston, somatomotorisen aktiviteetin ja käyttäytymismallin muutoksia. Erityisesti on tarkkailtava vapinaa, kouristuksia, syljeneritystä, ripulia, letargiaa, unta ja koomaa. Kuoleman ajankohta on kirjattava niin tarkoin kuin mahdollista. Ruumiinavaus tehdään kokeen aikana kuolleille eläimille ja kokeen päätyttyä myös henkiin jääneille eläimille, kun ne on ensin lopetettu. Kaikki huomattavan suuret patologiset muutokset on kirjattava. Histopatologista tutkimusta varten otetaan kudosnäytteet voimassa olevan ohjeen mukaan.
Arviointi myrkyllisyydestä toisen sukupuolen kohdalla
Kun toiselle sukupuolelle tehty koe on saatu päätökseen, ainetta annostellaan vähintään viiden toista sukupuolta olevan eläimen ryhmälle, jotta voitaisiin todeta, ovatko tämän sukupuolen eläimet aineelle huomattavasti herkempiä. Pienemmänkin eläinmäärän käyttöä voidaan perustella yksittäisissä tapauksissa. Jos on käytettävissä tietoja, joiden mukaan testatun sukupuolen eläimet ovat huomattavasti herkempiä, toista sukupuolta ei tarvitse testata.
2. TIEDOT
Yhteenveto tiedoista esitetään taulukkona, jossa jokaisen ryhmän kohdalla on eläinten määrä kokeen alussa, yksittäisten eläinten kuolinajankohdat, niiden eläinten määrä, joilla on muita myrkyllisyydestä johtuvia oireita, myrkytysoireiden kuvaus ja ruumiinavauslöydökset. Yksittäisten eläinten painot on kirjattava välittömästi ennen aineen annostelua, sen jälkeen viikoittain ja lopuksi kuoleman jälkeen. Painonmuutokset on laskettava ja kirjattava, kun eläin pysyy hengissä kauemmin kuin yhden vuorokauden. Eläimet, jotka on lopetettu aineen aiheuttaman ahdistuksen ja kipujen takia, luokitellaan aineen vaikutuksesta kuolleiksi. LD50 voidaan määrittää yleisesti tunnetun menetelmän mukaan.
Tietojen arviointiin tulee sisältyä mahdolliset yhteydet eläimen aineelle altistamisen ja kaikkien poikkeavuuksien esiintymisen ja vakavuuden välillä. Tällaisia poikkeavuuksia ovat esimerkiksi käyttäytymismuutokset, kliiniset muutokset, painonmuutokset, kuolleisuus ja muut toksikologiset vaikutukset.
3. RAPORTOINTI
3.1 TESTIRAPORTTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
laji, kanta, toimittaja, ympäristöolosuhteet, ruokavalio jne., |
|
— |
testiolosuhteet (mukaan lukien ihonpuhdistusmenetelmä ja siteen tyyppi: okklusiivinen tai ei-okklusiivinen), |
|
— |
annostasot (annoksen suuruus apuaine mukaan lukien sekä mahdollinen testattavan aineen pitoisuus), |
|
— |
altistettujen eläinten sukupuoli, |
|
— |
vastetietojen luokittelu sukupuolen ja annostason mukaan (kokeen aikana kuolleiden tai lopetettujen eläinten määrä, niiden eläinten määrä, joilla on myrkyllisyydestä johtuvia oireita, altistettujen eläinten määrä), |
|
— |
annostelun jälkeisten kuolemien ajankohta, syyt ja kriteerit eläinten lopettamiseen, |
|
— |
kaikki havainnot, |
|
— |
LD50-arvo sukupuolelle, jolle on tehty 14 päivän pituinen kattava koe (määritysmenetelmä on ilmoitettava), |
|
— |
LD50-arvon 95 prosentin luottamusväli (mahdollisuuksien mukaan), |
|
— |
annos-kuolleisuuskäyrä ja sen kaltevuus (määritysmenetelmän sallimissa rajoissa), |
|
— |
ruumiinavauslöydökset, |
|
— |
muut histopatologiset löydökset, |
|
— |
toisen sukupuolen testauksen tulokset (jos on tehty), |
|
— |
tulosten pohdinta (erityistä huomiota on kiinnitettävä kokeen aikana tehtyjen koe-eläinten lopettamisien LD50-arvoon kohdistamaan vaikutukseen), |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Katso yleistä johdantoa, osa B (D).
4. VIITTEET
Katso yleistä johdantoa, osa B (E).
B.4. AKUUTTI TOKSISUUS: IHOÄRSYTTÄVYYS/-SYÖVYTTÄVYYS
1. TESTIMENETELMÄ
Tämä menetelmä on toisinto OECD:n testiohjeesta nro 404 (2002).
1.1 JOHDANTO
Tämän päivitetyn testimenetelmän valmistelun yhteydessä on erityisesti pyritty ottamaan huomioon eläinten hyvinvointiin liittyvät näkökohdat sekä kaikkien testiaineesta aiemmin saatujen tietojen arviointi, jotta voidaan välttää tarpeettomia eläinkokeita. Tässä menetelmässä esitetään suositus, että ennen tässä kuvatun, aineen ärsyttävyyttä/syövyttävyyttä tutkivan in vivo -testin toteuttamista on arvioitava aiempien relevanttien tutkimustulosten painoarvo. Jos saatavissa olevat tiedot ovat puutteellisia, niitä voidaan täydentää vaiheittaisen menettelyn avulla (1). Suositeltava testausstrategia, joka on selostettu tämän menetelmän liitteessä, sisältää validoitujen ja hyväksyttyjen in vitro -testien suorittamisen. Lisäksi suositellaan tilanteen mukaan, että in vivo -alkutestissä eläimelle asetetaan kolme testilappua peräkkäin eikä samanaikaisesti.
Sekä järkevien tieteellisten menettelytapojen että eläinten hyvinvoinnin vuoksi in viro -testiä ei pidä suorittaa ennen kuin kaikkien saatavissa olevien testiaineen mahdolliseen ihoärsyttävyyteen/-syövyttävyyteen liittyvien tietojen painoarvo on arvioitu. Tällaisia tietoja ovat todisteet aiemmista ihmisille ja/tai koe-eläimille tehdyistä tutkimuksista, todisteet yhden tai usean rakenteellisesti samankaltaisen aineen tai ainetta sisältävän seoksen ärsyttävyydestä/syövyttävyydestä, aineen voimakasta happamuutta tai emäksisyyttä osoittavat tulokset (2) (3) sekä validoidut ja hyväksytyt in vitro- tai ex vivo -testit (4) (5) (5a). Tällainen analyysi vähentää in vivo -testien tarvetta sellaisten aineiden kohdalla, joiden ihoärsyttävyydestä/-syövyttävyydestä aiempi tutkimus on jo tuottanut riittävästi todisteita.
Suositeltava tapa toteuttaa vaiheittainen menettely, johon sisältyy validoituja ja hyväksyttyjä in vitro- tai ex vivo -testejä ärsyttävyyden/syövyttävyyden selvittämiseksi, selostetaan tämän menetelmän liitteessä. Tämä menettelytapa kehitettiin OECD:n seminaarissa (6), jonka osanottajat suosittelevat sitä yksimielisesti, ja se hyväksyttiin suositeltavaksi testimenettelyksi Globally Harmonised System for the Classification of Chemical Substances (GHS) -kokouksessa (7). Vaikka tämä menettely ei olekaan olennainen osa testimenetelmää B.4, sen käyttöä suositellaan ennen in vivo -testin suorittamista. Uusia aineita testattaessa se on suositeltava vaiheittainen menettelytapa tieteellisesti pätevien tulosten tuottamiseksi aineen ärsyttävyydestä/syövyttävyydestä. Sellaisten aineiden kohdalla, joiden ihoärsyttävyydestä/-syövyttävyydestä ei ole riittävästi tietoja, menettelytapaa voidaan käyttää puuttuvien tietojen hankkimiseen. Jos päätetään käyttää jotain muuta menettelytapaa tai olla käyttämättä vaiheittaista menettelytapaa, päätös on perusteltava.
Jos aineen ärsyttävyyttä tai syövyttävyyttä ei voida määrittää vaiheittaisen menettelyn mukaisesti aiempien tulosten painoarvoanalyysin avulla, on syytä harkita in vivo -testiä (katso liite).
1.2 MÄÄRITELMÄT
Ihoärsytys: korjautuvan ihovaurion syntyminen enintään neljä tuntia kestäneen testiaineen annostelun jälkeen.
Ihon syöpyminen: korjautumattoman ihovaurion eli näkyvän orvasketeen ja verinahkaan ulottuvan kuolion ilmaantuminen enintään neljä tuntia kestäneen aineen annostelun jälkeen. Tyypillisiä syöpymisreaktioita ovat haavaumat, verenvuoto, veriset ruvet, 14 päivän tarkkailujakson lopussa ihon vaalenemisen aiheuttama värinmuutos, kokonaan kaljuuntuneet alueet ja arvet. Epäselvien vaurioiden tapauksessa olisi harkittava histopatologista tutkimusta.
1.3 TESTIMENETELMÄN PERIAATE
Testiaine annostellaan yhtenä annoksena koe-eläimen iholle; eläimen ihon käsittelemättömät alueet toimivat kontrollina. Ärsytyksen/syöpymisen aste todetaan ja pisteytetään määrävälein, ja vauriota kuvaillaan vaikutusten arvioinnin täydentämiseksi. Testin on kestettävä niin pitkään, että havaittujen vaikutusten korjautuvuus tai korjautumattomuus voidaan arvioida.
Eläimet, joissa havaitaan merkkejä jatkuvasta vakavasta stressistä ja/tai tuskista missä tahansa testin vaiheessa, on lopetettava inhimillisellä tavalla, ja tämä on otettava huomioon testiaineen arvioinnissa. Kuolevien ja kärsivien eläinten lopettamiskriteerit ovat lähteessä (8).
1.4 TESTIMENETELMÄN KUVAUS
1.4.1 In vivo -testin valmistelu
1.4.1.1 Eläinlajin valinta
Suositeltava koe-eläinlaji on albiinokaniini. Kokeessa käytetään nuoria ja terveitä täysikasvuisia yksilöitä. Muiden lajien käyttö on perusteltava.
1.4.1.2 Eläinten valmistelu
Noin 24 tuntia ennen testiä eläinten selkäpuolen karva ajetaan lyhyeksi. Ihoa on varottava hankaamasta. Testissä voidaan käyttää vain eläimiä, joiden iho on terve ja vahingoittumaton.
Joillakin kaniinikannoilla esiintyy tiheitä karvalaikkuja, jotka ovat tavallista voimakkaampia tiettyinä vuodenaikoina. Tällaisia tiheäkarvaisia alueita ei pidä käyttää testikohtina.
1.4.1.3 Eläinten häkit ja ruokinta
Jokaisella eläimellä on oltava oma häkki. Koe-eläinhuoneen lämpötilan on oltava kaniineilla 20 oC (± 3 oC). Vaikka riittää, että suhteellinen kosteus on vähintään 30 % eikä mielellään ylitä 70 %:a muulloin kuin huoneen puhdistuksen aikana, pitäisi kuitenkin pyrkiä 50–60 %:n suhteelliseen kosteuteen. Huoneessa täytyy käyttää keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa, 12 tuntia pimeää). Eläinten ruokinnassa voidaan käyttää normaalia laboratorioruokavaliota, eikä juomaveden määrää saa rajoittaa.
1.4.2 Testin suoritus
1.4.2.1 Testiaineen annostelu
Testiaine annostellaan pienelle ihoalueelle (noin 6 cm2) ja peitetään sideharsolapulla, joka kiinnitetään ihoa ärsyttämättömällä teipillä. Jos suora annostelu ei ole mahdollinen (esimerkiksi nesteiden tai joidenkin tahnojen tapauksessa), testiaine annostellaan ensin sideharsolapulle, joka sitten asetetaan iholle. Lappu on pidettävä kevyessä kosketuksessa ihoon sopivan, puolitiiviin siteen avulla koko altistusjakson ajan. Jos testiaine annostellaan lappuun, se on kiinnitettävä ihoon siten, että aine on hyvässä kosketuksessa ihoon ja leviää tasaisesti. Eläimen yltäminen lappuun ja testiaineen nieleminen tai sisäänhengittäminen on estettävä.
Nestemäisiä testiaineita käytetään yleensä laimentamattomina. Testattaessa kiinteitä aineita (jotka voidaan tarvittaessa jauhaa) testiaine on kostutettava mahdollisimman pienellä määrällä vettä (tai tarvittaessa jollain muulla sopivalla kantaja-aineella), jotta saadaan hyvä ihokosketus. Jos käytetään muuta kantaja-ainetta kuin vettä, kantaja-aineen mahdollisen vaikutuksen testiaineen aiheuttamaan ihoärsytykseen pitäisi olla olematon tai mahdollisimman vähäinen.
Tavallisesti neljän tunnin mittaisen altistusjakson lopussa ylimääräinen testiaine on poistettava, jos se on käytännössä mahdollista, vedellä tai sopivalla liuottimella muuttamatta orvaskeden senhetkistä vastetta tai eheyttä.
1.4.2.2 Annostaso
Testikohtaan annostellaan 0,5 ml nestettä tai 0,5 g kiinteää ainetta tai tahnaa.
1.4.2.3 Alkutesti (ihoärsyttävyyden/-syövyttävyyden in vivo -testi yhdelle eläimelle)
On erittäin suositeltavaa suorittaa in vivo -testi aluksi yhdelle eläimelle, erityisesti jos testiaineella arvellaan mahdollisesti olevan syövyttävä vaikutus. Tämä on vaiheittaisen menettelyn mukaista (katso liite 1).
Kun aine on todettu syövyttäväksi aiempien tietojen painoarvoanalyysin perusteella, eläinkokeita ei enää tarvita. Useimmille syövyttäviksi epäillyille aineille in vivo -jatkotesti ei yleensä ole tarpeen. Tapauksissa, joissa lisätietoja katsotaan tarvittavan puutteellisten todisteiden takia, rajoitettuja eläinkokeita voidaan kuitenkin tehdä seuraavasti: Enintään kolme testilappua asetetaan yksi toisensa jälkeen eläimen iholle. Ensimmäinen niistä poistetaan kolmen minuutin kuluttua. Jos vakavaa ihoreaktiota ei havaita, toinen lappu asetetaan iholle ja poistetaan tunnin kuluttua. Jos havainnot tässä vaiheessa osoittavat, että altistusta voidaan inhimillisesti jatkaa neljään tuntiin asti, kolmas lappu asetetaan paikoilleen ja poistetaan neljän tunnin kuluttua. Vaste pisteytetään.
Jos syövyttävä vaikutus havaitaan minkä tahansa kolmen peräkkäisen altistuksen aikana, testi lopetetaan heti. Jos syövyttävää vaikutusta ei havaita viimeisen lapun poistamisen jälkeen, eläintä tarkkaillaan 14 päivän ajan, mikäli syöpymistä ei kehity sitä ennen.
Jos testiaineen ei odoteta aiheuttavan syöpymistä vaan ärsytystä, eläimelle asetetaan yksi lappu neljän tunnin ajaksi.
1.4.2.4 Vahvistustesti (ihoärsyttävyyden in vivo -testi useille eläimille)
Jos alkutestissä ei havaita syövyttävää vaikutusta, ärsyttävyys tai negatiivinen vaste on vahvistettava testaamalla vielä kaksi eläintä. Kummallekin asetetaan lappu neljän tunnin altistusjakson ajaksi. Jos ärsyttävä vaikutus havaitaan alkutestissä, vahvistustesti voidaan tehdä peräkkäistestinä tai altistamalla kaksi lisäeläintä yhtäaikaisesti. Siinä poikkeustapauksessa, että alkutestiä ei tehdä, kahdelle tai kolmelle eläimelle voidaan asettaa yksi lappu, joka poistetaan neljän tunnin kuluttua. Kun käytetään kahta eläintä, lisätestiä ei tarvita, jos molemmilla esiintyy sama vaste. Muussa tapauksessa testataan myös kolmas eläin. Epäselvät vasteet täytyy mahdollisesti arvioida testaamalla lisää eläimiä.
1.4.2.5 Tarkkailujakso
Tarkkailujakson on oltava riittävän pitkä havaittujen vaikutusten korjautuvuuden arvioimiseksi täydellisesti. Testi on kuitenkin lopetettava heti, jos eläin osoittaa jatkuvia kovien tuskien tai stressin merkkejä. Vaikutusten korjautuvuuden määrittämiseksi eläimiä on tarkkailtava enintään 14 päivän ajan lappujen poistamisen jälkeen. Jos korjautuvuus todetaan ennen kuin 14 päivää on kulunut, testi on lopetettava silloin.
1.4.2.6 Kliiniset havainnot ja ihoreaktioiden pisteytys
Kaikista eläimistä tutkitaan eryteeman ja ödeeman merkit ja vasteet pisteytetään ensiksi 60 minuutin jälkeen ja sitten 24, 48 ja 72 tunnin kuluttua lapun poistamisesta. Yhdelle eläimelle tehtävän alkutestin jälkeen testikohta tutkitaan myös heti lapun poistamisen jälkeen. Ihoreaktiot pisteytetään ja kirjataan jäljempänä esitetyn taulukon asteikon mukaan. Jos iholla esiintyy vaurioita, joita ei voida tunnistaa ärsytykseksi tai syöpymiseksi 72 tunnin kuluttua, voi olla tarpeen jatkaa havainnointia päivään 14 asti, jotta vaikutusten korjautuvuus voidaan todeta. Ärsytyksen lisäksi kaikki paikalliset toksiset vaikutukset, kuten ihon rasvan liukeneminen ja mitkä tahansa koko elimistöön kohdistuvat vaikutukset (esimerkiksi vaikutukset kliinisiin toksisuuden merkkeihin ja ruumiinpainoon), on kuvattava ja kirjattava täydellisesti. Epäselvien vaurioiden tapauksessa olisi harkittava histopatologista tutkimusta.
Ihovasteiden pisteytys on väistämättä subjektiivista. Ihovasteiden pisteytyksen yhdenmukaistamiseksi sekä testilaboratorion ja havaintoja tekevien ja tulkitsevien henkilöiden työn helpottamiseksi havaintoja tekevän henkilöstön on oltava riittävän perehtynyttä pisteytysjärjestelmään (katso jäljempänä olevaa taulukkoa). Kuvitettu opas ihoärsytyksen ja muiden vaurioiden asteista voi olla hyödyllinen (9). Ihovasteiden pisteytys on arvioitava sokkona.
2. MÄÄRITYSTULOKSET
2.1 TULOSTEN ESITYSTAPA
Tutkimuksen tulokset on esitettävä taulukkomuodossa lopullisessa testiselosteessa, ja niiden on sisällettävä kaikki kohdassa 3.1 luetellut asiat.
2.2 TULOSTEN ARVIOINTI
Ihoärsytyspisteet on arvioitava yhdessä vaurioiden luonteen ja vakavuuden sekä niiden korjautuvuuden tai korjautumattomuuden kanssa. Yksittäiset pisteet eivät edusta aineen ärsyttävyysominaisuuksien absoluuttista tasoa, koska testiaineen muutkin vaikutukset ovat arvioinnissa mukana. Sen sijaan yksittäisiä pisteitä voidaan tarkastella viitearvoina, jotka on arvioitava kaikkien muiden tutkimuksessa tehtyjen havaintojen yhteydessä.
Ihovaurioiden korjautuvuus on otettava huomioon ärsytysvastetta arvioitaessa. Jos vasteet kuten kaljuuntuminen (suppealla alueella), liikasarveistuminen, liikakasvu ja hilseily jatkuvat 14 päivän tarkkailujakson loppuun asti, testiainetta voidaan pitää ihoa ärsyttävänä.
3. TULOSTEN ILMOITTAMINEN
3.1 LOPPURAPORTTI
Loppuraportissa on oltava seuraavat tiedot:
|
|
Perustelut in vivo -testin tekemiselle: aiemmista tutkimuksista saatujen testitulosten painoarvoanalyysi, mukaan luettuina vaiheittaisen menettelyn tulokset:
|
|
|
Testiaine:
|
|
|
Kantaja-aine:
|
|
|
Koe-eläin:
|
|
|
Testiolosuhteet:
|
|
|
Tulokset:
|
|
|
tulosten pohdinta. |
4. LÄHDELUETTELO
|
(1) |
Barratt, M. D., Castell, J. V., Chamberlain, M., Combes, R. D., Dearden, J. C, Fentem, J. H., Gerner, I., Giuliani, A., Gray, T. J. B., Livingston, D. J., Provan, W. M., Rutten, F. A. J. J. L., Verhaar, H. J. M., Zbinden, P. (1995). The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410–429. |
|
(2) |
Young, J. R., How, M. J., Walker, A. P., Worth W. M. H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19–26. |
|
(3) |
Worth, A. P., Fentem, J. H., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Esdaile, D. J., Liebsch, M. (1998). Evaluation of the proposed OECD Testing Strategy for skin corrosion. ATLA 26, 709–720. |
|
(4) |
ECETOC (1990) Monograph No. 15, ”Skin Irritation”, European Chemical Industry, Ecology and Toxicology Centre, Bryssel. |
|
(5) |
Fentem, J.H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Esdaile, D. J., Holzhutter, H. G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, 483–524. |
|
(5a) |
Testimenetelmä B.40 Skin Corrosion. |
|
(6) |
OECD (1996). OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Pidetty Solnassa, Ruotsissa 22.–.24. tammikuuta 1996 (http://wwwl.oecd.org/ehs/test/background.htm). |
|
(7) |
OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, marraskuu 1998 (http://wwwl.oecd.org/ehs/Class/HCL6.htm). |
|
(8) |
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://wwwl.oecd.org/ehs/test/monos.htm). |
|
(9) |
EPA (1990). Atlas of Dermal Lesions, (20T-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, elokuu 1990. (Saatavana OECD:n sihteeristöltä pyydettäessä.) |
Taulukko I
IHOREAKTIOIDEN PISTEYTYS
Eryteeman ja karstan muodostus
|
Ei eryteemaa … |
0 |
|
Hyvin lievä eryteema (tuskin havaittava) … |
1 |
|
Selkeästi erottuva eryteema … |
2 |
|
Keskivakava — vakava eryteema … |
3 |
|
Vakava eryteema (voimakas punoitus) — karsta, joka estää eryteeman pisteytyksen … |
4 |
Suurin mahdollinen pistemäärä: 4
Ödeeman (turvotuksen) muodostus
|
Ei ödeemaa … |
0 |
|
Hyvin lievä ödeema (tuskin havaittava) … |
1 |
|
Lievä ödeema (selvärajainen alue, jonka reunat ovat koholla) … |
2 |
|
Keskivakava ödeema (noin 1 mm koholla) … |
3 |
|
Vakava ödeema (enemmän kuin 1 mm koholla ja levinnyt altistuskohtaa laajemmalle) … |
4 |
Suurin mahdollinen pistemäärä: 4
Epäselvien vaurioiden tapauksessa voidaan tehdä histopatologinen tutkimus.
LIITE
Ihoärsyttävyyden ja -syövyttävyyden vaiheittainen testaus
YLEISIÄ NÄKÖKOHTIA
Sekä järkevien tieteellisten menettelytapojen että eläinten hyvinvoinnin vuoksi on tärkeää välttää tarpeettomia eläinkokeita ja tehdä mahdollisimman vähän sellaisia testejä, jotka todennäköisesti aiheuttavat eläimissä vakavia vasteita. Ennen in vivo -testin suunnittelemista on arvioitava kaikki tiedot testiaineen mahdollisesta ihoärsyttävyydestä/-syövyttävyydestä. Riittävät todisteet testiaineen ihoärsyttävyyden/-syövyttävyyden luokittelemiseksi voivat jo olla olemassa, jolloin koe-eläintestejä ei tarvita. Painoarvoanalyysin ja vaiheittaisen menettelyn käyttö vähentää in vivo -testien tarvetta, erityisesti jos on todennäköistä, että testiaine aiheuttaa vakavia reaktioita.
On suositeltavaa arvioida aineiden ihoärsyttävyydestä ja -syövyttävyydestä saatavissa olevien tietojen painoarvo, jotta voidaan päättää, tarvitaanko aineen ihoärsytyspotentiaalin määrittämiseksi muita testejä kuin in vivo -ihotesti. Jos muita testejä tarvitaan, on suositeltavaa käyttää vaiheittaista menettelyä relevanttien koetulosten hankkimiseksi. Jos ainetta ei ole aikaisemmin testattu, vaiheittaisen menettelyn avulla voidaan hankkia ihoärsyttävyyden/-syövyttävyyden arviointiin tarvittavat tulokset. Tässä liitteessä kuvattu testimenettely on kehitetty OECD:n seminaarissa (1), ja se on vahvistettu ja laajennettu myöhemmin järjestelmässä Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, sellaisena kuin se vahvistettiin kemikaalikomitean ja kemikaalityöryhmän 28. yhteisessä kokouksessa marraskuussa 1998 (2).
Vaikka tämä vaiheittainen testausstrategia ei ole olennainen osa testimenetelmää B.4, siinä kuvataan suositeltavaa lähestymistapaa aineen ihoärsyttävyys-/-syövyttävyysominaisuuksien määrittämiseen. Tämä lähestymistapa edustaa sekä parhaita käytäntöjä että eettistä vertailukohdetta ihoärsyttävyyden/-syövyttävyyden in vivo -testauksessa. Siinä annetaan ohjeita in vivo -testin suorittamiseen ja esitetään yhteenveto tekijöistä, jotka on käsiteltävä ennen testin aloittamista. Strategia tarjoaa lähestymistavan aiemmin saatujen tulosten arviointiin testiaineen ihoärsyttävyys-/-syövyttävyysominaisuuksien selvittämiseksi, ja sen avulla voidaan vaihe vaiheelta tuottaa merkitseviä tuloksia aineista, joista tarvitaan lisätietoja tai joita ei ole aikaisemmin tutkittu. Strategiassa suositellaan myös tietyissä tapauksissa käyttämään validoituja ja hyväksyttyjä in vitro-tai ex vivo -testejä ihoärsyttävyyden/-syövyttävyyden toteamiseksi.
ARVIOINTI- JA TESTAUSSTRATEGIAN KUVAUS
Ennen vaiheittaiseen menettelyyn sisältyvien testien suorittamista (kaavio) on analysoitava kaikki saatavissa olevat tiedot, jotta in vivo -ihotestauksen tarve voidaan määrittää. Vaikka yksittäisistä parametreista (esimerkiksi äärimmäiset pH-arvot) voidaan saada merkitseviä tietoja, on syytä ottaa huomioon tulokset kokonaisuudessaan. Kaikkien kyseessä olevan aineen tai sen kaltaisten aineiden vaikutusta koskevien tietojen painoarvo on arvioitava testauspäätöksen yhteydessä, ja päätökselle on esitettävä perustelut. Ensisijaisesti on painotettava sekä ihmisillä että eläimillä aiemmin saatuja tuloksia ja seuraavaksi in vitro- tai ex vivo -testien tuloksia. Syövyttävien aineiden in vivo -testejä on vältettävä aina kun se on mahdollista. Testimenettelyssä on otettava huomioon seuraavat asiat:
Ihmisillä ja eläimillä aiemmin saatujen tulosten arviointi (vaihe 1). Aiemmat ihmisillä saadut tulokset, esimerkiksi kliiniset tai työperäiseen altistukseen liittyvät tutkimustulokset ja tapausselostukset ja/tai eläinkokeiden tulokset, esimerkiksi yksittäisten tai toistettujen ihoaltistustestien tulokset, on otettava ensiksi huomioon, koska niistä saadaan suoraan aineen ihovaikutuksiin liittyviä tietoja. In vivo -testejä ei tarvitse tehdä aineille, joiden ärsyttävyys tai syövyttävyys tiedetään, eikä aineille, joista on selvästi todistettu, että ne eivät ole ärsyttäviä tai syövyttäviä.
Rakenne—aktiivisuusanalyysi (SAR) (vaihe 2). Jos saatavilla on rakenteellisesti samankaltaisten aineiden testituloksia, ne on otettava huomioon. Kun rakenteellisesti samankaltaisista aineista tai niitä sisältävistä seoksista on saatavilla riittävästi ihmisillä tehtyjen testien ja eläinkokeiden tuloksia, jotka osoittavat niiden ihoärsyttävyys-/-syövyttävyyspotentiaalin, voidaan olettaa, että arvioitava testiaine tuottaa samanlaiset vasteet. Tällaisessa tapauksessa ainetta ei kenties tarvitse testata. Negatiiviset tulokset rakenteellisesti samankaltaisten aineiden tai sellaisista aineista koostuvien seosten tutkimuksista eivät vaiheittaisessa menettelyssä ole riittävä todiste siitä, että aine ei ole ihoa ärsyttävä tai syövyttävä. Ihoärsyttävyys ja -syövyttävyys on selvitettävä validoitujen ja hyväksyttyjen SAR-menetelmien avulla.
Fysikokemialliset ominaisuudet ja kemiallinen reaktiivisuus (vaihe 3). Aineella, jolla esiintyy äärimmäisiä pH-arvoja, kuten ≤ 2,0 ja ≥ 11,5, voi olla voimakkaita paikallisvaikutuksia. Jos aine määritetään ihoa syövyttäväksi äärimmäisen pH-arvon perusteella, sen happo-/emäsreservi (eli puskurointikyky) voidaan myös ottaa huomioon (3) (4). Jos puskurointikyky viittaa siihen, että aine ei ole ihoa syövyttävä, tämän vahvistamiseksi on tehtävä jatkotesti, jonka on ensisijaisesti oltava validoitu ja hyväksytty in vitro- tai ex vivo -testi (katso vaiheet 5 ja 6).
Toksisuus iholla (vaihe 4). Jos aine on todettu erittäin toksiseksi ihon kautta annosteltuna, ihoärsyttävyyden/-syövyttävyyden testaaminen in vivo -testillä ei kenties ole järkevää, koska tavallisesti käytetty testiainemäärä voi ylittää erittäin toksisen annoksen ja siten johtaa eläinten kuolemaan tai vakaviin kärsimyksiin. Jos lisäksi toksisuuden ihotestejä albiinokaniineilla on jo tehty raja-annosarvoon 2 000 mg/ruumiinpainokilo tai sitä suurempaan arvoon eikä ihoärsytystä tai -syöpymistä ole havaittu, ihoärsyttävyyden/-syövyttävyyden lisätestaus ei kenties ole tarpeen. Joitakin seikkoja on syytä pitää mielessä arvioitaessa aiempien tutkimusten tuloksia akuutista toksisuudesta iholla. Esimerkiksi ihovaurioista raportoidut tiedot voivat olla puutteellisia. Testeissä ja havainnoinnissa on saatettu käyttää muuta eläinlajia kuin kaniinia, ja eri eläinlajien vasteherkkyys poikkeaa toisistaan suuresti. Niin ikään eläimille annosteltu testiaine ei välttämättä ole ollut sopivassa muodossa ihoärsyttävyyden/-syöpymisen arvioimiseksi (esimerkiksi aineiden laimentaminen toksisuuden testaamiseksi iholla (5)). Tapauksissa, joissa hyvin suunnitellut ja toteutetut ihotoksisuutta tutkivat testit on tehty kaniineille, negatiiviset löydökset voidaan kuitenkin katsoa riittäviksi todisteiksi siitä, että aine ei ole syövyttävä eikä ärsyttävä.
In vitro- tai ex vivo -testien tulokset (vaiheet 5 ja 6). Aineita, joilla on todettu olevan syövyttäviä tai vakavasti ärsyttäviä ominaisuuksia validoiduissa ja hyväksytyissä, nimenomaan näiden ominaisuuksien mittaamista varten kehitetyissä in vitro- tai ex vivo -testeissä (6) (7), ei tarvitse testata eläimillä. Voidaan olettaa, että tällaiset aineet aiheuttavat samoja vaikutuksia in vivo -testeissä.
In vivo -testi kaniineilla (vaiheet 7 ja 8). Jos painoarvoanalyysin jälkeen päätetään toteuttaa in vivo -testi, se on aloitettava testaamalla ensin yksi eläin. Jos tämän testin tulokset osoittavat, että aine on ihoa syövyttävä, jatkotestiä ei pidä tehdä. Jos alkutestissä ei todeta syövyttävää vaikutusta, ärsyttävyys tai negatiivinen vaste on vahvistettava testaamalla vielä enintään kaksi eläintä neljän tunnin altistusjakson ajan. Jos alkutestissä todetaan ihoa ärsyttävä vaikutus, vahvistustesti voidaan toteuttaa peräkkäistestinä tai altistamalla mainitut kaksi eläintä samanaikaisesti.
LÄHDELUETTELO
|
1) |
OECD (1996). Test Guidelines Programme: Final Report on the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Pidetty Solnassa, Ruotsissa, 22.–24. tammikuuta 1996 (http://wwwl.oecd.org/ehs/test/background.htm). |
|
2) |
OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, marraskuu 1998 (http://wwwl.oecd.org/ehs/Class/HCL6.htm). |
|
3) |
Worth, A. P., Fentem J. H., Balls M., Botham P. A., Curren R. D., Earl L. K., Esdaile D. J., Liebsch M. (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, 709–720. |
|
4) |
Young, J. R., How, M. J., Walker, A. P., Worth, W. M. H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing on Animals. Toxic In Vitro, 2 (1) s. 1926. |
|
5) |
Patil, S. M., Patrick, E., Maibach, H. I. (1996). Animal, Human, and In Vitro Test Methods for Predicting Skin Irritation teoksessa Francis N. Marzulli and Howard I. Maibach (toim.): Dermatotoxicology. Viides painos. ISBN 1-56032-356-6, luku 31, 411–436. |
|
6) |
Testimenetelmä B.40. |
|
7) |
Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Esdaile, D. J., Holzhutter, H. G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, s. 483–524. |
Kaavio
IHOÄRSYTTÄVYYDEN/SYÖVYTTÄVYYDEN TESTAUS- JA ARVIOINTIMENETTELY

B.5. AKUUTTI TOKSISUUS: SILMÄN ÄRSYTTÄVYYS/SYÖVYTTÄVYYS
1. MENETELMÄ
Tämä menetelmä on toisinto OECD:n testiohjeesta nro 405 (2002).
1.1 JOHDANTO
Tämän päivitetyn testimenetelmän valmistelun yhteydessä on erityisesti pyritty ottamaan huomioon kaikkien testiaineesta aiemmin saatujen tietojen arviointi ja eläinten hyvinvointiin liittyvät näkökohdat, jotta voidaan välttää tarpeettomia eläinkokeita. Tässä menetelmässä esitetään suositus, että ennen tässä kuvatun, akuuttia silmä-ärsyttävyyttä/syövyttävyyttä tutkivan in vivo -testin toteuttamista on arvioitava aiempien relevanttien tutkimustulosten painoarvo (1). Jos saatavissa olevat tiedot ovat puutteellisia, niitä voidaan täydentää vaiheittaisen menettelyn avulla (2) (3). Suositeltava testausstrategia, joka on selostettu tämän menetelmän liitteessä, sisältää validoitujen ja hyväksyttyjen in vitro -testien suorittamisen. Lisäksi suositellaan, että ennen in vivo -silmätestin tekemistä tehdään in vivo -ihoärsyttävyys-/-syövyttävyystesti silmäsyövytyksen ennustamiseksi.
Sekä järkevien tieteellisten menettelytapojen että eläinten hyvinvoinnin vuoksi in vivo -testiä ei pidä suorittaa ennen kuin kaikkien saatavissa olevien testiaineen mahdolliseen silmä-ärsyttävyyteen/syövyttävyyteen liittyvien tietojen painoarvo on arvioitu. Tällaisia tietoja ovat todisteet aiemmista ihmisille ja/tai koe-eläimille tehdyistä tutkimuksista, todisteet yhden tai usean rakenteellisesti samankaltaisen aineen tai ainetta sisältävän seoksen ärsyttävyydestä/syövyttävyydestä, aineen voimakasta happamuutta tai emäksisyyttä osoittavat tulokset (4) (5) sekä validoidut ja hyväksytyt in vitro- tai ex vivo -ihoärsyttävyys-/-syövyttävyystestit (6) (6a). Tutkimukset voivat olla painoarvoanalyysia aiemmin tehtyjä tai sen tuloksena syntyneitä.
Joidenkin aineiden kohdalla painoarvoanalyysi voi osoittaa, että in vivo -testi on tarpeen aineen mahdollisen silmä-ärsyttävyyden/-syövyttävyyden selvittämiseksi. Kaikissa sellaisissa tapauksissa on ennen in vivo -silmätestin harkitsemista suositeltavaa tehdä ensin in vivo -ihotesti ihovaikutusten selvittämiseksi ja arvioida se testimenetelmän B.4 mukaan (7). Painoarvoanalyysi ja vaiheittainen menettely vähentävät tarvetta in vivo -testeihin silmä-ärsyttävyyden/-syövyttävyyden selvittämiseksi aineilla, joiden ominaisuuksista muut tutkimukset ovat jo tuottaneet riittävästi todisteita. Jos aineen silmä-ärsyttävyyttä/-syövyttävyyttä ei voida määrittää vaiheittaisen menettelyn avulla eikä edes in vivo -ihotestin jälkeen, in vivo -silmätesti voidaan tehdä.
Suositeltava tapa toteuttaa vaiheittainen menettely, johon sisältyy validoituja ja hyväksyttyjä in vitro- tai ex vivo -testejä ärsyttävyyden/syövyttävyyden selvittämiseksi, selostetaan tämän menetelmän liitteessä. Tämä menettelytapa kehitettiin OECD:n seminaarissa (8), jonka osanottajat suosittelevat sitä yksimielisesti, ja hyväksyttiin suositeltavaksi testimenettelyksi Globally Harmonised System for the Classification of Chemical Substances (GHS) -kokouksessa (9). Vaikka tämä menettely ei olekaan olennainen osa testimenetelmää B.4, sen käyttöä suositellaan ennen in vivo -testin suorittamista. Uusia aineita testattaessa se on suositeltava vaiheittainen menettelytapa, jonka avulla voidaan kehittää tieteellisesti päteviä tuloksia aineen ärsyttävyydestä/syövyttävyydestä. Sellaisten aineiden kohdalla, joiden iho- ja silmä-ärsyttävyydestä/-syövyttävyydestä ei ole riittävästi tietoja, menettelytapaa voidaan käyttää puuttuvien tietojen hankkimiseen. Jos päätetään käyttää jotain muuta menettelytapaa tai olla käyttämättä vaiheittaista menettelytapaa, päätös on perusteltava.
1.2 MÄÄRITELMÄT
Silmä-ärsytys: silmän muutokset, jotka syntyvät, kun testiainetta on annosteltu silmän etupinnalle, ja korjautuvat täysin 21 päivän kuluessa annostelusta.
Silmän syöpyminen: silmän kudosvauriot tai vakava fyysinen näön rappeutuminen, joka syntyy, kun testiainetta on annosteltu silmän etupinnalle, eikä se korjaudu täysin 21 päivän kuluessa annostelusta.
1.3 TESTIMENETELMÄN PERIAATE
Testiaine annostellaan yhtenä annoksena koe-eläimen toiseen silmään. Käsittelemätön silmä toimii kontrollina. Silmän ärtymisen/syöpymisen aste arvioidaan pisteyttämällä sidekalvon, sarveiskalvon ja värikalvon vammat tietyin väliajoin. Muut silmään kohdistuvat vaikutukset ja koko elimistöön kohdistuvat haittavaikutukset kuvataan myös, jotta vaikutuksia voidaan arvioida kokonaisuudessaan. Testin on kestettävä niin pitkään, että havaittujen vaikutusten korjautuvuus tai korjautumattomuus voidaan arvioida.
Eläimet, joissa havaitaan merkkejä jatkuvasta vakavasta stressistä ja/tai tuskista missä tahansa testin vaiheessa, on lopetettava inhimillisellä tavalla, ja tämä on otettava huomioon testiaineen arvioinnissa. Kuolevien ja kärsivien eläinten lopettamiskriteerit ovat lähteessä (10).
1.4 TESTIMENETELMÄN KUVAUS
1.4.1 In vivo -testin valmistelu
1.4.1.1 Eläinlajin valinta
Suositeltava koe-eläinlaji on albiinokaniini. Kokeessa käytetään nuoria ja terveitä täysikasvuisia yksilöitä. Muiden lajien käyttö on perusteltava.
1.4.1.2 Koe-eläinten valmistelu
Kunkin alustavasti testiin valitun koe-eläimen molemmat silmät tutkitaan testin alkua edeltävän 24 tunnin aikana. Eläimiä, joilla esiintyy silmien ärtyneisyyttä, silmävikoja tai aiempia sarveiskalvon vaurioita, ei voi käyttää testissä.
1.4.1.3 Eläinten häkit ja ruokinta
Jokaisella eläimellä on oltava oma häkki. Koe-eläinhuoneen lämpötilan on oltava kaniineilla 20 oC (± 3 oC). Vaikka riittää, että suhteellinen kosteus on vähintään 30 % eikä mielellään ylitä 70 %:a muulloin kuin huoneen puhdistuksen aikana, pitäisi kuitenkin pyrkiä 50–60 %:n suhteelliseen kosteuteen. Huoneessa tulee käyttää keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa, 12 tuntia pimeää). Eläinten ruokinnassa voidaan käyttää normaalia laboratorioruokavaliota, eikä juomaveden määrää saa rajoittaa.
1.4.2 Testimenettely
1.4.2.1 Testiaineen annostelu
Eläimen alaluomea vedetään varovasti silmämunasta poispäin ja testiaine annostellaan eläimen toisen silmän sidekalvopussiin. Sen jälkeen luomia pidetään varovasti yhdessä sekunnin ajan, jotta aine ei valuisi ulos silmästä. Toinen silmä, jota ei käsitellä, toimii kontrollina.
1.4.2.2 Huuhtelu
Koe-eläinten silmiä ei saa pestä vähintään 24 tuntiin testiaineen annostelun jälkeen, paitsi jos kyseessä on kiinteä aine (katso kohta 1.4.2.3.2) tai välitön ärsyttävä tai syövyttävä vaikutus. Silmät voidaan pestä 24 tunnin kuluttua, jos se katsotaan tarpeelliseksi.
Pesemisen vaikutuksen selvittämiseksi ei suositella kontrolliryhmää, paitsi jos sille on tieteellisiä perusteita. Jos kontrolliryhmä tarvitaan, käytetään kahta kaniinia. Pesuolosuhteet on dokumentoitava tarkasti, esimerkiksi pesuaika, pesuliuoksen koostumus ja lämpötila, pesun kesto, nesteen tilavuus ja virtausnopeus.
1.4.2.3 Annostaso
1.4.2.3.1 Nesteiden testaus
Testattaessa nesteitä testiannos on 0,1 ml. Ainetta ei saa annostella suoraan suihkepumpusta silmään. Nestesuihke on ensin kerättävä astiaan ennen 0,1 ml:n annostelua silmään.
1.4.2.3.2 Kiinteiden aineiden testaus
Testattaessa kiinteitä aineita, tahnoja ja hiukkasmaisia aineita annoksen tilavuuden on oltava 0,1 ml tai painon enintään 100 mg. Testiaine jauhetaan hienoksi pölyksi. Kiinteän aineen tilavuus mitataan, kun aine on ensin kevyesti tiivistetty esimerkiksi naputtamalla mitta-astiaa. Jos kiinteä aine ei ole poistunut koe-eläimen silmästä fysiologisten mekanismien seurauksena ensimmäiseen havainnointiaikaan mennessä eli tunnin kuluttua käsittelystä, silmä voidaan huuhdella fysiologisella suolaliuoksella tai tislatulla vedellä.
1.4.2.3.3 Aerosolien testaus
On suositeltavaa kerätä kaikki pumpattavat suihkeet ja aerosolit ennen niiden annostelua silmään. Ainoa poikkeus ovat paineistetuissa aerosolisäiliöissä olevat aineet, joita ei voida kerätä höyrystymisen takia. Sellaisessa tapauksessa silmää pidellään auki ja testiaine annostellaan silmään yhtenä sekunnin kestävänä purskauksena 10 cm:n etäisyydeltä suoraan silmän edestä. Välimatka voi vaihdella suihkesäiliön paineen ja sisällön mukaan. On varottava, ettei suihkesäiliön paine vahingoita silmää. Joissakin tapauksissa voi olla syytä arvioida suihkeen voimakkuuden silmälle mahdollisesti aiheuttamat ”mekaaniset” vauriot.
Aerosoliannoksen suuruus voidaan arvioida simuloimalla testiä seuraavalla tavalla. Testiaine suihkutetaan punnituspaperille suoraan paperin edessä olevasta kaniinin silmän kokoisesta aukosta. Paperin painon lisäyksen avulla arvioidaan silmään suihkutettu määrä. Haihtuvien aineiden tapauksessa annoksen suuruus voidaan arvioida punnitsemalla keräysastia ennen ja jälkeen testiaineen poistamisen.
1.4.2.4 Alkutesti (in vivo -silmä-ärsyttävyys/syövyttävyystesti yhdelle eläimelle)
Vaiheittaisen menettelyn mukaan (katso liite 1) on erittäin suositeltavaa suorittaa in vivo -testi aluksi vain yhdelle eläimelle.
Jos testitulos osoittaa, että aine on silmää syövyttävä tai vakavasti ärsyttävä kuvattua menettelyä käytettäessä, silmän ärtymistä ei pidä enää testata.
1.4.2.5 Paikallispuudutusaineet
Paikallispuudutusainetta voidaan käyttää tapauskohtaisesti. Jos painoarvoanalyysi tai vaiheittainen menettely osoittaa, että aine saattaa aiheuttaa tuskia, tai jos alkutestissä on todettu kipureaktio, paikallispuudutusainetta voidaan antaa ennen testiaineen annostelua. Paikallispuudutusaineen laji, konsentraatio ja annos on valittava huolellisesti, jotta varmistetaan, että erot testiaineen aiheuttamissa reaktioissa eivät johdu puudutusaineesta. Testiaineella käsittelemätön silmä on puudutettava samalla tavoin.
1.4.2.6 Vahvistustesti (in vivo -silmä-ärsyttävyystesti useille eläimille)
Jos alkutestissä ei havaita syövyttävää vaikutusta, ärsyttävyys tai negatiivinen vaste on vahvistettava testaamalla vielä enintään kaksi eläintä. Jos alkutestissä todetaan voimakas ärsyttävä vaikutus, joka viittaa mahdolliseen voimakkaaseen (korjautumattomaan) vaikutukseen vahvistustestissä, on suositeltavampaa tehdä vahvistustesti vaiheittaisen menettelyn mukaan yhdelle eläimelle kerrallaan kuin altistaa uudet kaksi eläintä samalla kertaa. Jos toisella eläimellä esiintyy syöpymisoireita tai vakavia ärsytysoireita, testiä ei jatketa. Heikon tai keskinkertaisen ärsyttävän vaikutuksen vahvistamiseksi saattaa olla tarpeen testata useampia eläimiä.
1.4.2.7 Tarkkailujakso
Tarkkailujakson on oltava riittävän pitkä havaittujen vaikutusten voimakkuuden ja korjautuvuuden arvioimiseksi täydellisesti. Testi on kuitenkin lopetettava heti, jos eläin osoittaa jatkuvia kovien tuskien tai stressin merkkejä (9). Vaikutusten korjautuvuuden määrittämiseksi eläimiä on tarkkailtava tavallisesti 21 päivän ajan testiaineen antamisen jälkeen. Jos korjautuvuus todetaan ennen kuin 21 päivää on kulunut, testi on lopetettava silloin.
1.4.2.7.1 Kliiniset havainnot ja silmäreaktioiden pisteytys
Silmät tutkitaan 1, 24, 48 ja 72 tuntia testiaineen annostelun jälkeen. Eläintä ei saa pitää testattavana sen jälkeen kun lopulliset tiedot on saatu. Eläimet, jotka osoittavat jatkuvia stressin tai vakavien tuskien merkkejä, on viipymättä lopetettava inhimillisellä tavalla, ja tämä on otettava huomioon testiaineen vaikutusten arvioinnissa. Inhimillisellä tavalla on lopetettava eläimet, joilla esiintyy testiaineen annostelun jälkeen seuraavia silmävammoja: sarveiskalvon puhkeaminen tai huomattava sarveiskalvon haavauma mukaan luettuna pullistuma, verta silmän etukammiossa, asteen 4 sarveiskalvosamentuma, joka jatkuu 48 tuntia, valorefleksin puuttuminen (värikalvon vaste 2), joka jatkuu 72 tuntia, sidekalvon haavauma, sidekalvon tai vilkkukalvon kuolio tai arpeutuminen. Näin menetellään siksi, että kyseiset vauriot ovat yleensä korjautumattomia.
Eläimet, joille ei kehity silmävammoja, voidaan lopettaa aikaisintaan kolme päivää testiaineen annostelun jälkeen. Eläimiä, joilla esiintyy lieviä tai keskinkertaisia vaurioita, on tarkkailtava, kunnes vauriot häviävät, tai 21 päivää, jolloin testi lopetetaan. Havainnot on tehtävä päivinä 7, 14 ja 21, jotta voidaan määrittää vaurioiden tila ja niiden korjautuvuus tai korjautumattomuus.
Silmäreaktioiden (sidekalvon, sarveiskalvon ja värikalvon) asteet on kirjattava joka kerta, kun eläintä tutkitaan (taulukko I). Kaikki muut silmävauriot (esimerkiksi sarveiskalvoverho, värjäytyminen) tai koko elimistöön kohdistuvat haittavaikutukset on myös raportoitava.
Reaktioiden tutkimista helpottaa luuppilasien, lampun, biomikroskoopin tai muiden sopivien laitteiden käyttö. Kun havainnot on kirjattu 24 tunnin jälkeen, silmiä voidaan edelleen tutkia fluoreskeiinin avulla.
Silmävasteiden pisteytys on väistämättä subjektiivista. Silmävasteiden pisteytyksen yhdenmukaistamiseksi sekä testilaboratorion ja havaintoja tekevien ja tulkitsevien henkilöiden työn helpottamiseksi havaintoja tekevän henkilöstön on oltava riittävän perehtynyttä pisteytysjärjestelmään. Silmävasteiden pisteytys on arvioitava sokkona.
2. MÄÄRITYSTULOKSET
2.2 TULOSTEN ARVIOINTI
Silmä-ärsytyspisteet on arvioitava yhdessä vammojen luonteen ja vakavuuden sekä niiden korjautuvuuden tai korjautumattomuuden kanssa. Yksittäiset pisteet eivät edusta aineen ärsyttävyysominaisuuksien absoluuttista tasoa, koska testiaineen muutkin vaikutukset ovat arvioinnissa mukana. Sen sijaan yksittäisiä pisteitä pitäisi tarkastella viitearvoina, jotka ovat merkitseviä vain, kun kaikki muut havainnot ja niiden arviointi tukevat pisteiden antamaa tietoa.
3. TULOSTEN ILMOITTAMINEN
3.1 LOPPURAPORTTI
Loppuraportissa on annettava seuraavat tiedot:
|
|
Perustelut in vivo -testin tekemiselle: aiemmista tutkimuksista saatujen testitulosten painoarvon analyysi, mukaan luettuna vaiheittaisen menettelyn tulokset:
|
|
|
Testiaine:
|
|
|
Kantaja-aine:
|
|
|
Koe-eläimet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
3.2 TULOSTEN TULKINTA
Koe-eläimille tehtyjen silmä-ärsytystestien tulosten ekstrapolointi ihmisiä koskeviksi on vain rajoitetusti pätevää. Monissa tapauksissa albiinokaniini on ihmistä herkempi silmää ärsyttäville tai syövyttäville aineille.
Tulosten tulkinnassa on huolellisesti erotettava sekundäärisestä tulehduksesta johtuva ärsytys.
4. LÄHDELUETTELO
|
(1) |
Barratt, M. D., Castell, J. V., Chamberlain, M., Combes, R. D., Dearden, J. C, Fentem, J. H., Gerner, I., Giuliani, A., Gray, T. J. B., Livingston, D. J., Provan, W. M., Rutten, F. A. J. J. L., Verhaar, H. J. M., Zbinden, P. (1995). The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410–429. |
|
(2) |
de Silva, O., Cottin, M., Dami, N., Roguet, R., Catroux, P., Toufic, A., Sicard, C, Dossou, K. G., Gerner, I., Schlede, E., Spielmann, H., Gupta, K. C, Hill, R. N. (1997). Evaluation of Eye Irritation Potential: Statistical Analysis and Tier Testing Strategies. Food Chem. Toxicol 35, 159–164. |
|
(3) |
Worth A. P. and Fentem J. H. (1999). A general approach for evaluating stepwise testing strategies ATLA 27, 161–177. |
|
(4) |
Young, J. R., How, M. J., Walker, A. P., Worth W. M. H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19–26. |
|
(5) |
Neun, D. J. (1993). Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227–231. |
|
(6) |
Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Edsaile, D. J., Holzhutter, H. G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, s. 483–524. |
|
(6a) |
Testimenetelmä B.40. Ihosyövyttävyys. |
|
(7) |
Testimenetelmä B.4. Akuutti toksisuus: ihoärsyttävyys/-syövyttävyys. |
|
(8) |
OECD (1996). OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Pidetty Solnassa, Ruotsissa, 22.–24. tammikuuta 1996 (http://www.oecd.org/ehs/test/background.htm). |
|
(9) |
OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, marraskuu 1998 (http://www.oecd.org/ehs/Class/HCL6.htm). |
|
(10) |
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://www.oecd.org/ehs/test/monos.htm). |
Taulukko I
SILMÄVAURIOIDEN PISTEYTYS
Sarveiskalvo
Samentuma: tiheysaste (mittausarvot otettava tiheimmästä kohdasta) (1)
|
Ei haavaumia tai samentumaa … |
0 |
|
Yksittäisiä tai hajanaisia samentuma-alueita (muu kuin lievä normaalin kiillon himmentyminen); värikalvon yksityiskohdat selvästi nähtävissä … |
1 |
|
Selvästi erottuva läpinäkyvä alue; värikalvon yksityiskohdat hiukan peittyneet … |
2 |
|
Helmiäishohtoinen alue; värikalvon yksityiskohtia ei erotu lainkaan; pupilli tuskin erottuva … |
3 |
|
Samea sarveiskalvo; värikalvo ei erotu samentuman läpi … |
4 |
Suurin mahdollinen pistemäärä: 4
HUOMAUTUKSET
Värikalvo
|
Normaali … |
0 |
|
Selvästi syventyneet poimut, verentungosta, turvotusta, keskinkertaista verekkyyttä sarveiskalvon ympärillä; värikalvon reagoiminen valoon (viivästynyt reaktio katsotaan testiaineen vaikutukseksi) … |
1 |
|
Verenvuotoa, vakavasti tuhoutunut värikalvo tai ei reaktiota valoon … |
2 |
Suurin mahdollinen pistemäärä: 2
Sidekalvo
|
Normaali punaisuus (viittaa luomen ja silmämunan sidekalvoon; pois lukien sarveiskalvo ja värikalvo) … |
0 |
|
Joitakin hypereemisiä verisuonia … |
1 |
|
Laajalle levinnyt helakka punaisuus; yksittäiset suonet eivät erotu selvästi … |
2 |
|
Laajalle levinnyt voimakas punaisuus … |
3 |
Suurin mahdollinen pistemäärä: 3
Sidekalvopöhö
Turvotus (viittaa luomiin ja/tai vilkkukalvoon)
|
Normaali … |
0 |
|
Hiukan normaalia enemmän turvotusta … |
1 |
|
Selvää turvotusta, luomet osittain kääntyneet ympäri … |
2 |
|
Turvotusta, luomet puoliksi muurautuneet umpeen … |
3 |
|
Turvotusta, luomet enemmän kuin puoliksi muurautuneet umpeen … |
4 |
Suurin mahdollinen pistemäärä: 4
LIITE
Silmä-ärsyttävyyden ja -syövyttävyyden vaiheittainen testaus
YLEISIÄ NÄKÖKOHTIA
Sekä järkevien tieteellisten menettelytapojen että eläinten hyvinvoinnin vuoksi on tärkeää välttää tarpeettomia eläinkokeita ja tehdä mahdollisimman vähän sellaisia testejä, jotka todennäköisesti aiheuttavat elämissä vakavia vasteita. Ennen in vivo -testin suunnittelemista on arvioitava kaikki tiedot testiaineen mahdollisesta silmä-ärsyttävyydestä/-syövyttävyydestä. Riittävät todisteet testiaineen silmä-ärsyttävyyden/-syövyttävyyden luokittelemiseksi voivat jo olla olemassa, jolloin koe-eläintestejä ei tarvita. Painoarvoanalyysin ja vaiheittaisen menettelyn käyttö vähentää in vivo -testien tarvetta, erityisesti jos on todennäköistä, että testiaine aiheuttaa vakavia reaktioita.
On suositeltavaa arvioida aineiden silmä-ärsyttävyydestä/-syövyttävyydestä saatavissa olevien tietojen painoarvo, jotta voidaan päättää, tarvitaanko aineen silmä-ärsyttävyyspotentiaalin määrittämiseksi muita testejä kuin in vivo -silmätesti. Jos muita testejä tarvitaan, on suositeltavaa käyttää vaiheittaista menettelyä relevanttien koetulosten hankkimiseksi. Jos ainetta ei ole testattu aikaisemmin, vaiheittaisen menettelyn avulla voidaan hankkia silmä-ärsyttävyyden/-syövyttävyyden arviointiin tarvittavat tulokset. Tässä liitteessä kuvattu testimenettely on kehitetty OECD:n seminaarissa (1), ja se on vahvistettu ja laajennettu myöhemmin järjestelmässä Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, sellaisena kuin se vahvistettiin kemikaalikomitean ja kemikaalityöryhmän 28. yhteisessä kokouksessa marraskuussa 1998 (2).
Vaikka tämä vaiheittainen testausstrategia ei ole olennainen osa testimenetelmää B.4, siinä kuvataan suositeltavaa lähestymistapaa aineen silmä-ärsyttävyys-/-syövyttävyysominaisuuksien määrittämiseen. Tämä lähestymistapa edustaa sekä parhaita käytäntöjä että eettistä vertailukohdetta silmä-ärsyttävyyden/-syövyttävyyden in vivo -testauksessa. Siinä annetaan ohjeita in vivo -testin suorittamiseen ja esitetään yhteenveto tekijöistä, jotka on käsiteltävä ennen testin aloittamista. Strategia tarjoaa lähestymistavan aiemmin saatujen tulosten arviointiin testiaineen silmä-ärsyttävyys-/-syövyttävyysominaisuuksien selvittämiseksi, ja sen avulla voidaan vaihe vaiheelta tuottaa merkitseviä tuloksia aineista, joista tarvitaan lisätietoja tai joita ei ole aikaisemmin tutkittu. Strategiassa suositellaan myös tietyissä tapauksissa käyttämään validoituja ja hyväksyttyjä in vitro- tai ex vivo -testejä silmä-ärsyttävyyden/-syövyttävyyden toteamiseksi (3) (4).
VAIHEITTAISEN TESTAUSSTRATEGIAN KUVAUS
Ennen vaiheittaiseen menettelyyn sisältyvien testien suorittamista (kaavio) on analysoitava kaikki saatavissa olevat tiedot, jotta in vivo -silmätestauksen tarve voidaan määrittää. Vaikka yksittäisistä parametreista (esimerkiksi äärimmäiset pH-arvot) voidaan saada merkitseviä tietoja, on syytä ottaa huomioon tulokset kokonaisuudessaan. Kaikkien kyseessä olevan aineen tai sitä rakenteeltaan vastaavan aineen vaikutustietojen painoarvo on arvioitava testauspäätöksen yhteydessä, ja päätökselle on esitettävä perustelut. Ensisijaisesti on painotettava sekä ihmis- että eläintesteillä aineesta aiemmin saatuja tuloksia ja seuraavaksi in vitro- tai ex vivo -testien tuloksia. Syövyttävien aineiden in vivo -testejä on vältettävä aina kun se on mahdollista. Testimenettelyssä on otettava huomioon seuraavat asiat:
Ihmisillä ja eläimillä aiemmin saatujen tulosten arviointi (vaihe 1). Aiemmat ihmisillä saadut tulokset, esimerkiksi kliiniset tai työperäiseen altistukseen liittyvät tutkimustulokset ja tapausselostukset ja/tai eläinkokeiden tulokset silmätesteistä, on otettava ensiksi huomioon, koska niistä saadaan suoraan aineen silmävaikutuksiin liittyviä tietoja. Sen jälkeen on arvioitava saatavissa olevat tiedot ihmisillä ja/tai eläimillä tehdyistä ihoärsyttävyys/-syövyttävyystesteistä. Eläinten silmiin ei saa annostella aineita, joiden tiedetään olevan syövyttäviä tai voimakkaasti ärsyttäviä, eikä aineita, joilla on ihoa ärsyttävä/syövyttävä vaikutus; sellaisten aineiden voidaan katsoa vaikuttavan samoin myös silmiin. In vivo -testejä ei tarvitse tehdä aineille, joiden silmä-ärsyttävyys tai -syövyttävyys tiedetään, eikä aineille, joista on selvästi todistettu, että ne eivät ole ärsyttäviä tai syövyttäviä.
Rakenne-aktiivisuusanalyysi (SAR) (vaihe 2). Jos saatavilla on rakenteellisesti samankaltaisten aineiden testituloksia, ne on otettava huomioon. Kun rakenteellisesti samankaltaisista aineista tai niitä sisältävistä seoksista on saatavilla riittävästi ihmisille tehtyjen testien ja eläinkokeiden tuloksia, jotka osoittavat niiden silmä-ärsyttävyys/-syövyttävyyspotentiaalin, voidaan olettaa, että arvioitava testiaine tuottaa samanlaiset vasteet. Tällaisessa tapauksessa ainetta ei kenties tarvitse testata. Negatiiviset tulokset rakenteellisesti samankaltaisten aineiden tai sellaisista aineista koostuvien seosten tutkimuksista eivät vaiheittaisessa menettelyssä ole riittävä todiste siitä, että aine ei ole ärsyttävä tai syövyttävä. Sekä silmä- että ihoärsyttävyys ja -syövyttävyys on selvitettävä validoitujen ja hyväksyttyjen SAR-menettelytapojen avulla.
Fysikokemialliset ominaisuudet ja kemiallinen reaktiivisuus (vaihe 3). Aineella, jolla esiintyy äärimmäisiä pH-arvoja, kuten ≤ 2,0 ja ≥ 11,5, voi olla voimakkaita paikallisvaikutuksia. Jos aine määritetään silmää syövyttäväksi äärimmäisen pH-arvon perusteella, sen happo-/emäsreservi (eli puskurointikyky) voidaan myös ottaa huomioon (5) (6). Jos puskurointikyky viittaa siihen, että aine ei ole silmää syövyttävä, tämän vahvistamiseksi on tehtävä jatkotesti, jonka on ensisijaisesti oltava validoitu ja hyväksytty in vitro- tai ex vivo -testi (katso vaiheet 5 ja 6).
Muiden aiempien tietojen ottaminen huomioon (vaihe 4). Kaikki saatavissa olevat tiedot koko elimistöön ihon kautta kohdistuvasta toksisuudesta on arvioitava tässä vaiheessa. Testiaineen akuutti toksisuus ihon kautta saatuna on myös otettava huomioon. Jos testiaine on osoitettu erittäin toksiseksi ihon kautta saatuna, sitä ei kenties tarvitse testata silmille. Vaikkakaan akuutin ihotoksisuuden ja silmä-ärsyttävyyden/-syövyttävyyden välillä ei välttämättä ole suhdetta, voidaan olettaa, että jos aine on erittäin toksinen ihon kautta saatuna, se on erittäin toksinen myös silmään annosteltuna. Tällaiset tiedot voidaan ottaa huomioon myös vaiheiden 2 ja 3 välissä.
In vitro- tai ex vivo -testien tulokset (vaiheet 5 ja 6). Aineita, joilla on todettu olevan syövyttäviä tai vakavasti ärsyttäviä ominaisuuksia validoiduissa ja hyväksytyissä, nimenomaan silmä- ja ihoärsyttävyyden/-syövyttävyyden mittaamista varten kehitetyissä in vitro- tai ex vivo -testeissä (7)(8), ei tarvitse testata eläimillä. Voidaan olettaa, että tällaiset aineet aiheuttavat samoja vaikutuksia in vivo -testeissä. Jos validoituja ja hyväksyttyjä in vitro- / ex vivo -testejä ei ole saatavissa, vaiheet 5 ja 6 ohitetaan ja siirrytään suoraan vaiheeseen 7.
Testiaineen in vivo -ihoärsyttävyyden/-syövyttävyyden arviointi (vaihe 7). Kun testiaineesta ei ole saatavilla riittäviä todisteita painoarvoanalyysin ja lopullisen johtopäätöksen tekemiseksi testiaineen ihoärsyttävyys/-syövyttävyyspotentiaalista edellä lueteltujen tutkimusten tietojen perusteella, in vivo -ihoärsyttävyys/-syövyttävyyspotentiaali on arvioitava ensiksi testimenetelmän B.4 (4) ja sen liitteen mukaisesti (9). Jos aineen on osoitettu aiheuttavan ihon syöpymistä tai vakavaa ärsytystä, sitä on syytä pitää syövyttävänä ja silmä-ärsytystä aiheuttavana, mikäli muut tiedot eivät tue toisenlaista johtopäätöstä. Tällöin in vivo -silmätestiä ei tarvita. Jos aine ei ole ihoa syövyttävä tai vakavasti ärsyttävä, in vivo -silmätesti on tehtävä.
In vivo -testi kaniineilla (vaiheet 8 ja 9). In vivo -silmätesti on aloitettava testaamalla ensin yksi eläin. Jos tämän testin tulokset osoittavat, että aine on silmiä vakavasti ärsyttävä tai syövyttävä, jatkotestiä ei pidä tehdä. Jos alkutestissä ei todeta vakavasti ärsyttävää tai syövyttävää vaikutusta, ärsyttävyys tai negatiivinen vaste on vahvistettava testaamalla vielä enintään kaksi eläintä.
LÄHDELUETTELO
|
1) |
OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Pidetty Solnassa, Ruotsissa 22.–24. tammikuuta 1996 (http://www.oecd.org/ehs/test/background.htm). |
|
2) |
OECD (1998) Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, marraskuu 1998 (http://www.oecd.org/ehs/Class/HCL6.htm). |
|
3) |
Worth, A. P. and Fentem J. H. (1999). A General Approach for Evaluating Stepwise Testing Strategies. ATLA 27, 161–177. |
|
4) |
Testimenetelmä B.4. Akuutti toksisuus: ihoärsyttävyys/-syövyttävyys. |
|
5) |
Young, J. R., How, M. J., Walker, A. P., Worth, W. M. H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19–26. |
|
6) |
Neun, D. J. (1993). Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227–231. |
|
7) |
Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Edsail, D. J., Holzhutter, H. G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, s. 483–524. |
|
8) |
Testimenetelmä B.40. Ihosyövyttävyys. |
|
9) |
Testimenetelmän B.4 liite: Ihoärsyttävyyden ja -syövyttävyyden vaiheittainen tutkimusmenettely. |
Kaavio
SILMÄ-ÄRSYTTÄVYYDEN/-SYÖVYTTÄVYYDEN TESTAUS- JA ARVIOINTIMENETTELY


B.6. IHON HERKISTYMINEN
1. MENETELMÄ
1.1 JOHDANTO
Huomautukset:
Testien herkkyys ja kyky havaita ihmisen ihoa mahdollisesti herkistäviä aineita on tärkeä kansanterveyteen liittyvän toksisuuden luokitusjärjestelmän kannalta.
Kaikkia ihmisen ihoa mahdollisesti herkistäviä aineita ei voida adekvaatisti tunnistaa millään yksittäisellä testimenetelmällä, joka myös sopisi kaikille aineille.
Sellaiset tekijät kuten aineen fysikaaliset ominaisuudet, mukaan lukien sen ihon läpäisykyky, on otettava huomioon testin valinnassa.
On kehitetty kahdentyyppisiä marsutestejä: adjuvanttityyppiset testit, joissa allergista tilaa voimistetaan liuottamalla tai suspensoimalla testiaine Freundin täydelliseen adjuvanttiin (FCA, Freunds Complete Adjuvant), ja muut kuin adjuvanttitestit.
Adjuvanttityyppiset testit todennäköisesti ennustavat aineen ihmisen ihoa mahdollisesti herkistävää vaikutusta tarkemmin kuin menetelmät, joissa ei käytetä FCA:ta, minkä vuoksi adjuvantti-tyyppisiä testejä suositaan.
Marsun maksimaatiotesti (Guinea-Pig Maximisation test, GPMT) on laajalti käytetty adjuvantti-tyyppinen testi. Vaikka aineen ihon herkistämisriski voidaan todeta useilla muillakin menetelmillä, marsun maksimaatiotesti on suositeltavin adjuvanttimenetelmistä.
Monien kemikaalien kohdalla muita kuin adjuvanttitestejä (joista suositeltavin on Buehlerin testi) pidetään vähemmän herkkinä.
Tietyissä tapauksissa voi olla perusteltua valita Buehlerin testi, jossa aine annostellaan paikallisesti eikä ihonsisäisesti kuten marsun maksimaatiotestissä. Buehlerin testin käytölle on esitettävä tieteelliset perusteet.
Marsun maksimaatiotesti ja Buehlerin testi kuvataan tässä menetelmässä. Myös muita menetelmiä voidaan käyttää edellyttäen, että ne on validoitu hyvin ja niiden käyttö on tieteellisesti perusteltua.
Jos tunnustetussa seulontatutkimuksessa saadaan positiivinen tulos, testiaine voidaan määrittää mahdollisesti herkistäväksi aineeksi eikä ole tarpeen enää tehdä marsutestiä. Jos tunnustetussa seulontatutkimuksessa saadaan negatiivinen tulos, marsutesti on tehtävä tämän testimenetelmän yhteydessä kuvattua menetelmää käyttäen.
Ks. myös yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ihon herkistyminen: (allerginen kosketusihottuma) Aineen aiheuttama immunologisesti välittyvä ihoreaktio. Ihmisellä vastereaktio voi olla kutina, punoitus, turvotus, näppylät, vesirakkulat, vesikellot tai jokin näiden yhdistelmä. Muilla eläinlajeilla reaktiot voivat olla erilaisia ja vain punoitusta ja turvotusta voi esiintyä.
lnduktioaltistus: Koehenkilön kokeellinen altistaminen testiaineelle tarkoituksena aikaansaada yliherkistymistila.
Induktiojakso: Induktioaltistusta seuraava vähintään viikon kestävä jakso, jonka aikana yliherkistymistila voi kehittyä.
Haastealtistus: Aiemmin käsitellyn koehenkilön kokeellinen altistaminen testiaineelle induktiojakson jälkeen koehenkilön mahdollisen yliherkistymisreaktion määrittämiseksi.
1.3. VERTAILUAINEET
Käytetyn koemenetelmän herkkyys ja luotettavuus tulee tutkia puolen vuoden välein aineilla, joiden tiedetään herkistävän ihoa lievästi tai kohtalaisesti.
Oikein suoritetussa adjuvanttitestissä vasteen voidaan odottaa olevan vähintään 30 % ja muussa kuin adjuvanttitestissä vähintään 15 % lievillä/kohtalaisilla herkistäjillä.
Seuraavia aineita suositellaan:
|
CAS-numerot |
EINECS-numerot |
EINECS-nimet |
Geneeriset nimet |
|
101-86-0 |
202-983-3 |
α-heksyylisinnaamialdehydi |
α-heksyylisinnaamialdehydi |
|
149-30-4 |
205-736-8 |
bentsotiatsoli-2-tioli (merkaptobentsotiatsoli) |
kaptaksi |
|
94-09-7 |
202-303-5 |
bentsokaiini |
norkaiini |
Joissakin olosuhteissa voidaan riittävin perustein käyttää muita vertailuaineita, jotka täyttävät edellä mainitut perusteet.
1.4 KOEMENETELMÄN PERIAATE
Koe-eläimet altistetaan testiaineelle aluksi ruiskuttamalla ainetta ihonsisäisesti ja/tai levittämällä sitä iholle (induktioaltistus). Lepojakson (10–14 vrk:n induktiojakso) aikana voi kehittyä immuunivaste. Lepojakson jälkeen eläimet altistetaan haasteannokselle. Haastealtistuksen testiryhmässä aiheuttamaa ihoreaktion laajuutta ja voimakkuutta verrataan verrokkieläimiin, joille annetaan induktion aikana lumekäsittely, mutta jotka saavat kuitenkin haastealtistuksen.
1.5 KOEMENETELMIEN KUVAUS
Jos testiaine on välttämättä poistettava, se tulee tehdä vedellä ja sopivalla liuottimella niin ettei saavutettu vaste muutu eikä ihon pinta rikkoonnu.
1.5.1 Marsun maksimaatiotesti
1.5.1.1
Terveet nuoret täysikasvuiset albiinomarsut totutetaan laboratorio-olosuhteisiin vähintään viiden päivän ajan ennen testiä. Ennen testiä eläimet jaetaan satunnaisotannalla testi- ja verrokkiryhmiin. Karvat poistetaan leikkaamalla, ajelemalla tai mahdollisesti kemiallisella depilaatiolla käytetystä testimenetelmästä riippuen. Varovaisuutta on noudatettava, ettei iho naarmuunnu rikki. Eläimet punnitaan ennen testiä ja sen jälkeen.
1.5.1.2
1.5.1.2.1 Koe-eläimet
Koe-eläiminä käytetään yleisesti käytettyjä albiinomarsun laboratoriokantoja.
1.5.1.2.2 Lukumäärä ja sukupuoli
Testissä voidaan käyttää sekä uroksia että naaraita. Naaraat eivät saa olla synnyttäneitä eivätkä tiineinä.
Testiryhmässä on oltava vähintään kymmenen eläintä ja verrokkiryhmässä vähintään viisi. Testeissä, joissa on käytetty alle 20 testimarsua ja alle 10 verrokkimarsua, eikä testiaineen herkistävyydestä voida tehdä johtopäätöksiä, suositellaan voimakkaasti lisätestejä siten, että testieläimiä on yhteensä vähintään 20 ja verrokkieläimiä kymmenen.
1.5.1.2.3 Annostasot
Testiaineen pitoisuus kutakin induktioaltistusta kohti tulee olla hyvin siedetty systeemisesti ja korkein mahdollinen lievän tai kohtalaisen ihoärsytyksen aiheuttamiseksi. Haastealtistuspitoisuuden tulee olla suurin ärsyttämätön annos. Mikäli on tarpeen, sopivat pitoisuudet voidaan määrittää esitutkimuksessa kahdella tai kolmella eläimellä. Tähän tarkoitukseen tulisi käyttää FCA:lla käsiteltyjä eläimiä.
1.5.1.3
1.5.1.3.1 Induktio
Päivä 0 — testiryhmä
Lapojen alueelle, jolta on poistettu karvat, pistetään kuusi ihonsisäistä 0,1 ml:n ruisketta pareittain siten, että puolet (3) on keskiviivan vasemmalla ja puolet (3) oikealla puolella.
1. ruiske: 1:1 sekoitus (v/v) FCA:ta ja vettä tai fysiologista keittosuolaliuosta
2. ruiske: testiaine sopivassa vehikkelissä valitulla pitoisuudella
3. ruiske: testiaine valitulla pitoisuudella 1:1 seoksessa (v/v) FCA:ta ja vettä tai fysiologista keittosuolaliuosta.
Kolmannen ruiskeen vesiliukoiset aineet liuotetaan vesifaasiin ennen FCA:han sekoittamista. Rasvaliukoiset tai liukenemattomat aineet suspensoidaan FCA:han ennen vesifaasiin yhdistämistä. Testiaineen lopullisen pitoisuuden on oltava sama kuin toisessa ruiskeessa.
Ensimmäinen ja toinen ruiske pistetään lähekkäin lähimmäksi päätä. Kolmas ruiske pistetään testialueen hännänpuoleiseen osaan.
Päivä 0 — verrokkiryhmä
Kuusi ihonsisäistä 0,1 ml:n ruisketta pistetään samoihin kohtiin kuin testiryhmään kuuluville eläimille.
1. ruiske: 1:1 seos (v/v) FCA:ta ja vettä tai fysiologista keittosuolaliuosta
2. ruiske: laimentamatonta vehikkeliä
3. ruiske: 50-prosenttinen v/v -sekoitus vehikkeliä FCA:n ja veden tai fysiologisen keittosuolaliuoksen seoksessa suhteessa 1:1 (v/v).
Päivät 5. – 7. — testi- ja verrokkiryhmät
Jos aine on ihoa ärsyttämätön, testialuetta käsitellään noin 24 tuntia ennen paikallista induktiota karvojen huolellisen poisleikkaamisen ja/tai ajelemisen jälkeen 0,5 ml:lla 10-prosenttista natrium-lauryylisulfaatti-vaseliinia paikallisärsytyksen aiheuttamiseksi.
Päivät 6. – 8. — testiryhmä
Testialueelta poistetaan jälleen karvat. Sopivassa vehikkelissä olevalla testiaineella läpikotaisin kyllästetty suodatinpaperi (2 x 4 cm) asetetaan testialueelle ihoa vasten ja peitetään okkluusiositeellä 48 tunniksi. Vehikkelin valinta tulee perustella. Kiinteät aineet hienonnetaan ja yhdistetään sopivaan vehikkeliin. Nesteitä voidaan käyttää laimentamattomina, jos se on tarkoituksenmukaista.
Päivät 6. – 8. — verrokkiryhmä
Testialueelta poistetaan jälleen karvat. Pelkkä vehikkeli asetetaan testiaineen tavoin testialueelle ja peitetään okkluusiositeellä 48 tunniksi.
1.5.1.3.2 Haastealtistus
Päivät 20. – 22. — testi- ja verrokkiryhmät
Testi- ja verrokkieläinten kyljistä poistetaan karvapeite. Testiaineella kyllästetty lappu tai kupu asetetaan eläinten toiseen kylkeen ja tarvittaessa pelkällä vehikkelillä kyllästetty lappu tai kupu toiseen kylkeen. Lappujen annetaan olla ihoa vasten okkluusiositeen alla 24 tuntia.
1.5.1.3.3 Havainnointi ja pisteytys: testi- ja verrokkiryhmät
|
— |
noin 21 tuntia lapun poistamisen jälkeen haastealue puhdistetaan ja tarvittaessa karvat leikataan huolellisesti pois ja/tai ajellaan tai poistetaan depilaatiolla, |
|
— |
noin kolme tuntia myöhemmin (noin 48 tunnin kuluttua haastealtistuksen aloittamisesta) havainnoidaan ihoreaktiota ja kirjataan se liitteen pisteytysasteikon mukaisesti, |
|
— |
noin 24 tunnin kuluttua ensimmäisestä havainnoinnista ihoreaktiota havainnoidaan uudestaan (72 h) ja tulokset kirjataan jälleen. |
Testi- ja verrokkieläinten sokkoarviointia suositellaan.
Jos ensimmäisen haastealtistuksen tulokset vaativat selventämistä, on harkittava haastealtistuksen uusimista mahdollisesti uudella verrokkiryhmällä, jos se on tarkoituksenmukaista, noin viikon kuluttua ensimmäisestä haastealtistuksesta. Haastealtistus voidaan uusia myös alkuperäisellä verrokkiryhmällä.
Kaikki induktiosta ja haastetoimenpiteistä johtuvat ihoreaktiot ja epätavalliset löydökset, mukaan lukien systeemiset reaktiot, tulee havainnoida ja kirjata Magnusson/Kligman -pisteytysasteikon mukaan (ks. liite). Muita toimenpiteitä, esimerkiksi histopatologinen tutkimus ja ihopoimumittaus, voidaan suorittaa epäilyttävien reaktioiden selventämiseksi.
1.5.2 Buehlerin testi
1.5.2.1
Terveet nuoret täysikasvuiset albiinomarsut totutetaan laboratorio-olosuhteisiin vähintään viiden päivän ajan ennen testiä. Ennen testiä eläimet jaetaan satunnaisotannalla testi- ja verrokkiryhmiin. Karvat poistetaan leikkaamalla, ajelemalla tai mahdollisesti kemiallisella depilaatiolla käytetystä testimenetelmästä riippuen. Varovaisuutta on noudatettava, ettei ihon pinta naarmuunnu rikki. Eläimet punnitaan ennen testiä ja sen jälkeen.
1.5.2.2
1.5.2.2.1 Koe-eläimet
Koe-eläiminä käytetään yleisesti käytettyjä albiinomarsun laboratoriokantoja.
1.5.2.2.2 Lukumäärä ja sukupuoli
Testissä voidaan käyttää sekä uroksia että naaraita. Naaraat eivät saa olla synnyttäneitä eivätkä tiineinä.
Testiryhmässä on oltava vähintään 20 eläintä ja verrokkiryhmässä vähintään kymmenen.
1.5.2.2.3 Annostasot
Testiaineen pitoisuuden kutakin induktioaltistusta kohti tulee olla korkein mahdollinen lievän, mutta ei liiallisen ärsytyksen tuottamiseksi. Haastealtistuspitoisuuden tulee olla suurin ärsyttämätön annos. Mikäli on tarpeen, sopivat pitoisuudet voidaan määrittää esitutkimuksessa kahdella tai kolmella eläimellä.
Vesiliukoisten testiaineiden vehikkeliksi sopii vesi tai laimennettu ärsyttämätön pinta-aktiivinen liuos. Muiden testiaineiden vehikkeliksi suositellaan 80-prosenttista etanoli-vesiliuosta induktioon ja asetonia haastealtistukseen.
1.5.2.3
1.5.2.3.1 Induktio
Päivä 0 — testiryhmä
Eläimen toisesta kyljestä leikataan huolellisesti karvat pois. Testilapun tulee olla läpikotaisin kyllästetty sopivaan vehikkeliin (vehikkelin valinta tulee perustella; nestemäisiä testiaineita voidaan käyttää laimentamattomina, jos se on tarkoituksenmukaista) sekoitetulla testiaineella.
Testilappu asetetaan testialueelle ihoa vasten ja peitetään tiiviillä lapulla tai kuvulla ja sopivalla siteellä kuudeksi tunniksi.
Testilappujärjestelmän on oltava okklusiivinen. Tarkoitukseen sopii pyöreä tai neliskulmainen vanulappu, jonka pinta-ala on 4–6 cm2. Tiiviyden varmistamiseen suositellaan sopivaa kiinnitysmekanismia. Kääreitä käytettäessä voidaan tarvita lisäaltistuskertoja.
Päivä 0 — verrokkiryhmä
Eläimen toisesta kyljestä leikataan huolellisesti karvat pois. Pelkkä vehikkeli asetetaan samoin kuin testiryhmässä. Testilapun annetaan olla ihoa vasten tiiviin lapun tai kuvun ja sopivan siteen alla kuusi tuntia. Jos voidaan osoittaa, ettei lumeverrokkiryhmää tarvita, voidaan käyttää käsittelemätöntä verrokkiryhmää.
Päivät 6.–8. ja 13.–15. — testi- ja verrokkiryhmät
Päivän 0 toimenpiteet tehdään samalle testialueelle (jolta poistetaan tarvittaessa karvat) eläimen samaan kylkeen päivinä 6.–8. ja uudelleen päivinä 13.–15.
1.5.2.3.2 Haastealtistus
Päivä 27.–29. — testi- ja verrokkiryhmät
Testi- ja verrokkiryhmien eläinten käsittelemättömästä kyljestä poistetaan karvat (huolellisesti leikkaamalla). Tiivis lappu tai kupu, joka sisältää sopivan määrän testiainetta korkeimpana mahdollisena ärsyttämättömänä pitoisuutena, asetetaan molempien ryhmien eläinten käsittelemättömän kyljen takaosaan.
Tarvittaessa asetetaan myös pelkkää vehikkeliä sisältävä tiivis lappu tai kupu molempien ryhmien eläinten käsittelemättömän kyljen etuosaan. Lappujen tai kupujen annetaan olla ihoa vasten sopivalla siteellä peitettyinä kuusi tuntia.
1.5.2.3.3 Havainnointi ja pisteytys
|
— |
noin 21 tuntia lapun poistamisen jälkeen haastealueelta poistetaan karvat, |
|
— |
noin kolme tuntia myöhemmin (noin 30 tunnin kuluttua haastelapun asettamisesta) havainnoidaan ihoreaktioita ja kirjataan ne liitteen pisteytysasteikon mukaisesti, |
|
— |
noin 24 tunnin kuluttua 30 ensimmäisen tunnin jälkeen suoritetusta havainnointikerrasta (noin 54 tuntia haastelapun asettamisesta) havainnoidaan ihoreaktioita uudelleen ja tulokset kirjataan. |
Testi- ja verrokkieläinten sokkoarviointia suositellaan.
Jos ensimmäisen haastealtistuksen tulokset vaativat selventämistä, on harkittava haastealtistuksen uusimista mahdollisesti uudella verrokkiryhmällä, jos se on tarkoituksenmukaista, noin viikon kuluttua ensimmäisestä haastealtistuksesta. Haastealtistus voidaan uusia myös alkuperäisellä verrokkiryhmällä.
Kaikki induktiosta ja haastetoimenpiteistä johtuvat ihoreaktiot ja epätavalliset löydökset, mukaan lukien systeemiset reaktiot, tulee havainnoida ja kirjata Magnusson/Kligman -pisteytysasteikon mukaan (ks. liite). Muita toimenpiteitä, esimerkiksi histopatologinen tutkimus ja ihopoimumittaus, voidaan suorittaa epäilyttävien reaktioiden selventämiseksi.
2. TULOKSET (GPMT JA BUEHLERIN TESTI)
Yhteenveto tuloksista tulee esittää taulukossa, josta ilmenee kunkin eläimen ihoreaktiot kullakin havainnointikerralla.
3. RAPORTOINTI (GPMT JA BUEHLERIN TESTI)
Jos seulontatesti tehdään ennen marsutestiä, testin (esim. paikallinen imusolmuketesti, LLNA; hiiren korvan turpoamistesti, MEST) kuvaus tai viite, mukaan lukien toimenpiteen yksityiskohdat, on ilmoitettava testi- ja vertailuaineella saatujen tulosten yhteydessä.
Testiraportti (GPMT ja Buehlerin testi)
Testiraportin tulee mahdollisuuksien mukaan sisältää seuraavat tiedot:
|
|
Koe-eläimet:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta |
|
|
Johtopäätökset |
4. LÄHDELUETTELO
Tämä menetelmä on analoginen OECD TG 406:n kanssa.
Lisäys
TAULUKKO
Magnusson/Kligman -pisteytysasteikko haastelapputestireaktioiden arvioimiseksi
0 = ei silmin havaittavia muutoksia
1 = lievä tai laikukas punoitus
2 = kohtalainen ja yhtenäinen punoitus
3 = voimakas punoitus ja turvotus
B.7. ORAALINEN TOISTUVAN ANNOSTELUN TOKSISUUSTUTKIMUS (28 VRK)
1. MENETELMÄ
1.1 JOHDANTO
Ks. yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. yleisjohdanto, osa B.
1.3 KOEMENETELMÄN PERIAATE
Testiaine annostellaan useille koe-eläinryhmille suun kautta päivittäin asteittain suurenevina annoksina siten, että yksi ryhmä saa aina yhtä annostasoa 28 päivän ajan. Annostelujakson aikana eläimiä havainnoidaan tarkoin päivittäin toksisuusoireiden varalta. Kokeen aikana kuolleille tai lopetetuille eläimille tehdään ruumiinavaus. Kokeen lopussa vielä elossa olevat eläimet lopetetaan ja niille tehdään ruumiinavaus.
Tämä menetelmä painottaa neurologisia vaikutuksia spesifisenä kohdevaikutuksena ja eläinten tarkan kliinisen havainnoinnin tarvetta, jotta tietoa saataisiin mahdollisimman paljon. Menetelmällä tunnistetaan mahdollisesti neurotoksisia kemikaaleja, jotka voivat vaatia tarkempia tutkimuksia tässä suhteessa. Menetelmällä voidaan saada viitteitä myös aineen immunologisista vaikutuksista ja toksisuudesta lisääntymiselimille.
1.4 KOEMENETELMÄN KUVAUS
1.4.1 Valmistelut
Terveet nuoret täysikasvuiset eläimet jaetaan satunnaisotannalla testi- ja verrokkiryhmiin. Häkit tulee järjestää siten, että niiden sijoittamisesta mahdollisesti aiheutuvat vaikutukset minimoituvat. Jokainen eläinyksilö tunnistetaan, ja eläinten annetaan olla häkeissään vähintään viiden päivän ajan ennen kokeen aloittamista niiden totuttamiseksi laboratorio-oloihin.
Testiaine annetaan mahaletkun kautta tai ravinnon tai juomaveden mukana. Oraalinen annostelutapa riippuu tutkimuksen tarkoituksesta ja aineen fysikaalis-kemiallisista ominaisuuksista.
Testiaine liuotetaan tai suspensoidaan tarvittaessa sopivaan vehikkeliin. Suositusten mukaan ensin tulee mahdollisuuksien mukaan käyttää vesipohjaista nestettä/suspensiota, sitten öljypohjaista nestettä/emulsiota (esim. maissiöljyä) ja viimeiseksi muihin vehikkeleihin sekoitettua nestettä. Jos vehikkeli on muu kuin vesi, toksiset ominaisuudet on oltava tiedossa. Testiaineen stabiliteetti vehikkelissä on määritettävä.
1.4.2 Koeolosuhteet
1.4.2.1 Koe-eläimet
Suositeltavin jyrsijälaji on rotta, tosin muitakin jyrsijöitä voidaan käyttää. Kokeessa tulee käyttää yleisesti käytettyjä nuoria ja terveitä täysikasvuisia koe-eläinkantoja. Naaraat eivät saa olla synnyttäneitä eivätkä tiineinä. Annostelun tulee alkaa mahdollisimman pian vieroituksen jälkeen ja ainakin ennen yhdeksättä elinviikkoa.
Käytettävien eläinten paino ei saisi juurikaan vaihdella eikä ylittää ± 20:tä prosenttia kummankaan sukupuolen keskipainosta kokeen alussa.
Silloin kun toistuvan oraalisen annostelun koetta seuraa pitkäaikaistutkimus, molemmissa tutkimuksissa tulee mieluiten käyttää samasta kannasta ja lähteestä olevia eläimiä.
1.4.2.2 Lukumäärä ja sukupuoli
Kutakin annostasoa tulee testata vähintään kymmenellä eläimellä (viisi naarasta ja viisi urosta). Jos osa eläimistä aiotaan lopettaa kesken kokeen, eläinten määrää tulee lisätä saman verran kuin niitä aiotaan lopettaa ennen kokeen päättymistä.
Lisäksi kymmenen eläimen satelliittiryhmää (viisi kumpaakin sukupuolta) voidaan käsitellä suurella annoksella 28 päivän ajan ja havainnoida toksisten vaikutusten korjaantuvuutta, jatkuvuutta ja ilmenemisen viivästymistä 14 päivän ajan käsittelyn jälkeen. Myös kymmenen verrokkieläimen satelliittiryhmää käytetään.
1.4.2.3 Annostasot
Yleensä tulee käyttää vähintään kolmea testiryhmää ja yhtä verrokkiryhmää. Testiaineen annostelua lukuun ottamatta verrokkieläimiä on käsiteltävä täsmälleen samoin kuin testiryhmän eläimiä. Jos testiaineen annostelussa käytetään vehikkeliä, sitä tulee antaa verrokkiryhmälle suurin käytetty määrä.
Jos muiden tietojen arvioinnin pohjalta vaikutuksia ei ole odotettavissa 1 000 mg/kg:n vuorokausiannoksella, voidaan tehdä raja-annoskoe. Jos saatavilla ei ole sopivia tietoja, voidaan tehdä annosalueen haarukointikoe käytettävien annosten määrittämisen helpottamiseksi.
Annostasot tulee valita ottaen huomioon testiaineesta tai samanlaisista aineista jo olemassa olevat toksisuus- ja (toksiko)kineettiset tiedot. Korkein toksisia vaikutuksia, mutta ei kuolemaa eikä voimakasta kärsimystä aiheuttava annostaso olisi valittava. Sitten valitaan asteittain alenevat annostasot annostukseen liittyvän vasteen ja NOAEL-arvon (no observed adverse effect) osoittamiseksi alhaisimmalla annostasolla. Kaksin-nelinkertaiset välit ovat yleensä ihanteellisia alenevissa annostasoissa ja neljännen testiryhmän käyttöä suositellaan usein erittäin pitkien annosvälien sijasta (esim. kerroin yli 10).
On tärkeää varmistautua, etteivät ravinnon tai juomaveden mukana annosteltavat testiainemäärät häiritse eläimen normaalia ravitsemustilaa tai nestetasapainoa. Ravinnon mukana annosteltava testiaine voidaan vakioida joko sen pitoisuutena ravinnossa (ppm) tai vakioannostasona eläinten ruumiinpainon suhteen. Käytetty vaihtoehto on ilmoitettava erikseen. Mahaletkun kautta annosteltava aine on annettava suurin piirtein samaan aikaan joka päivä ja annosta tulee tarvittaessa muuttaa vakioannostason säilyttämiseksi suhteessa eläimen ruumiinpainoon.
Siiloin kun toistuvan annostelun koetta seuraa pitkäaikaistutkimus, eläimille tulee antaa samanlaista ravintoa molemmissa tutkimuksissa.
1.4.2.4 Raja-annoskoe
Jos koe yhdellä vähintään 1 000 mg/kg/vrk:n annostasolla tai annosteltaessa ravinnon tai juomaveden mukana testiainetta prosentuaalisesti saman verran (ruumiinpainomääritysten perusteella) ei tässä menetelmässä kuvatuilla toimenpiteillä aiheuta havaittavia toksisia vaikutuksia ja jos toksisuutta ei odoteta rakenteellisesti samanlaisista aineista käytössä olevien tietojen perusteella, täydellinen tutkimus kolmella annostasolla ei ehkä ole tarpeen. Raja-annoskoe tehdään paitsi silloin kun ihmisen altistus edellyttää korkeampaa annostasoa.
1.4.2.5 Havainnointijakso
Havainnointijakson on kestettävä 28 päivää. Seurantahavainnointiin tarkoitettuja satelliittiryhmän eläimiä tulisi pitää vähintään 14 päivää ilman annostelua, jotta viivästyneet toksiset vaikutukset, niiden jatkuminen tai niistä toipuminen voidaan todeta.
1.4.3 Kokeen suorittaminen
Testiainetta annetaan eläimille päivittäin seitsemänä päivänä viikossa 28 päivän ajan. Viiden päivän viikkoannostusohjelman käyttö on perusteltava. Pakkoruokinta-annostelussa testiaine annetaan kerta-annoksena mahaletkun tai sopivan intubaatiokanyylin kautta. Kerralla annettavan nesteen enimmäismäärä riippuu koe-eläimen koosta. Määrän on oltava alle 1 ml sataa painogrammaa kohti, lukuun ottamatta vesiliuoksia, joita voidaan antaa 2 ml sataa painogrammaa kohti. Lukuun ottamatta ärsyttäviä tai syövyttäviä aineita, joiden haittavaikutukset yleensä pahenevat korkeammilla pitoisuuksilla, testiainemäärän vaihtelevuus on minimoitava pitoisuutta säätämällä vakiomäärän takaamiseksi kaikilla annostasoilla.
1.4.3.1 Yleishavainnot
Eläimistä on tehtävä kliinisiä yleishavaintoja vähintään kerran päivässä mieluiten suurin piirtein samaan aikaan / samoihin aikoihin joka päivä ja ottaen huomioon, että odotettuja vaikutuksia esiintyy eniten annostelun jälkeen. Eläinten sairastavuus ja kuolleisuus tarkistetaan vähintään kahdesti päivässä. Kuolemaisillaan olevat ja suuresti kärsivät tai kivuliaat eläimet on poistettava tutkimuksesta ja lopetettava humaanilla tavalla ja niille on tehtävä ruumiinavaus.
Kutakin eläintä on havainnoitava kliinisesti seikkaperäisesti kerran ennen ensimmäistä altistuskertaa (samaa koe-eläintä koskevia vertailuja varten) ja sen jälkeen vähintään kerran viikossa. Havainnot tulee tehdä eläimen oman häkin ulkopuolella vakioalueella mieluiten samaan kellonaikaan joka kerta. Havainnot on kirjattava muistiin tarkoin, mieluiten koelaboratorion erikseen määrittelemiä pisteytysjärjestelmiä käyttäen. Vaihtelut koeolosuhteissa on pyrittävä minimoimaan ja havainnoijien on mieluiten oltava annostelusta tietämättömiä henkilöitä. Huomiota tulee kiinnittää mm. ihon, karvapeitteen, silmien, limakalvojen, mahdollisten sisäeritteiden ja kuona-aineiden ja autonomisen toiminnan (esim. kyynelvuoto, piloerektio, mustuaisen koko, hengitys) muutoksiin. Käynnin, asennon ja käsittelyvasteen muutokset, mahdolliset klooniset tai tooniset liikkeet, stereotypiat (esim. ylenmääräinen turkin hoito, jatkuva kehän kiertäminen) tai omituinen käytös (esim. itsensä silpominen, takaperin käveleminen) tulee myös kirjata muistiin.
Neljännellä altistusviikolla arvioidaan aistien reaktiivisuutta erityyppisille ärsykkeille (esim. kuulo, näkö ja asentotunto), tarttumaotteen voimakkuutta ja motorista toimintaa. Mahdollisten toimenpiteiden tarkemmat yksityiskohdat löytyvät kirjallisuudesta (ks. yleisjohdanto, osa B).
Toiminnallisia havaintoja ei tarvitse tehdä neljännellä altistusviikolla, jos kyseessä on subkroonisen (90 päivän) tutkimuksen esitutkimus. Tällöin toiminnalliset havainnot tehdään seurantatutkimuksessa. Toisaalta toistuvan annostelun tutkimuksesta saatavat toiminnallisia havaintoja koskevat tiedot voivat helpottaa annostasojen valintaa subkroonista tutkimusta varten.
Poikkeuksellisesti toiminnallisia havaintoja ei myöskään tarvitse tehdä ryhmillä, joissa muutoin ilmenee merkkejä toksisuudesta laajuudessa, joka häiritsisi merkitsevästi toiminnallisten kokeiden suorittamista.
1.4.3.2 Ruumiinpaino ja ravinnon/veden kulutus
Kukin eläin on punnittava vähintään kerran viikossa. Ravinnon ja veden kulutus on mitattava vähintään viikoittain. Jos testiaine annostellaan juomavedessä, myös veden kulutus on mitattava vähintään viikoittain.
1.4.3.3 Hematologia
Seuraavat verikokeet on tehtävä koejakson päätyttyä: hematokriitti, hemoglobiini, erytrosyyttien määrä, leukosyyttien kokonaismäärä ja erittelylaskenta, trombosyyttien määrä ja veren hyytymisajan/-potentiaalin mittaus.
Verinäytteet tulee ottaa nimetystä kohdasta juuri ennen eläinten lopettamista tai sen yhteydessä. Näytteet tulee säilyttää asianmukaisissa olosuhteissa.
1.4.3.4 Kliininen biokemia
Kliiniset biokemialliset määritykset tärkeimpien toksisten kudosvaikutusten ja erityisesti munuais- ja maksavaikutusten tutkimiseksi tulee tehdä verinäytteistä, jotka otetaan kustakin eläimestä juuri ennen lopettamista tai sen yhteydessä (lukuun ottamatta eläimiä, jotka on löydetty kuolemaisillaan ja/tai lopetettu kesken kokeen). Eläinten ruokinnan siirtämistä yön yli ennen verinäytteen ottoa suositellaan (2). Plasma- ja seerumikokeiden tulee kattaa natrium, kalium, glukoosi, kokonaiskolesteroli, urea, kreatiniini, kokonaisproteiini ja albumiini, vähintään kaksi hepatosellulaarisia vaikutuksia osoittavaa entsyymiä (kuten alaniiniaminotransferaasi, aspartaattiaminotransferaasi, alkalinen fosfataasi, gammaglutamyylitranspeptidaasi ja sorbitolidehydrogenaasi). Muiden entsyymien (maksasta tai muualta peräisin olevien) ja sappihappojen mittauksista voidaan saada hyödyllistä tietoa tietyissä olosuhteissa.
Vaihtoehtoisesti voidaan tehdä seuraavat virtsa-analyysit viimeisellä tutkimusviikolla ajastetun virtsankeräyksen avulla: ulkonäkö, määrä, osmolaliteetti tai suhteellinen tiheys, pH-arvo, proteiini, glukoosi ja veri/verisolut.
Lisäksi tulee tutkia, esiintyykö seerumissa yleisiä kudosvaurioita osoittavia merkkiaineita. Muita määrityksiä, jotka on tehtävä, jos testiaineen tunnetut ominaisuudet voivat vaikuttaa tai niiden epäillään vaikuttavan siihen liittyviin metaboliaprofiileihin, ovat kalsium, fostaatti, triglyseridien paastoarvot, tietyt hormonit, methemoglobiini ja koliiniesteraasi. Nämä on selvitettävä tiettyjen luokkien aineille tai tapauskohtaisesti.
Kaiken kaikkiaan käytännön tulee olla joustava lajin ja annetun aineen havaitun ja/tai odotetun vaikutuksen mukaan.
Jos aiemmat lähtötason tiedot ovat riittämättömiä, hematologiset ja kliiniset biokemialliset muuttujat on määritettävä ennen annostelun aloittamista.
1.4.3.5 Silmämääräinen ruumiinavaus
Jokaiselle koe-eläimelle tehdään täydellinen ja seikkaperäinen silmämääräinen ruumiinavaus, johon kuuluu ruumiin ulkopinnan, kaikkien aukkojen ja kallon-, rinta- ja vatsaontelon ja niiden sisällön huolellinen tutkimus. Jokaisen eläimen maksa, munuaiset, lisämunuaiset, kivekset, lisäkivekset, kateenkorva, perna, aivot ja sydän puhdistetaan kaikista niihin kiinnittyvistä kudoksista tarkoituksenmukaisella tavalla ja elinten märkäpaino punnitaan mahdollisimman pian dissektion jälkeen kuivumisen estämiseksi.
Seuraavat kudokset säilytetään sekä kudostyypin että aiotun histopatologisen tutkimuksen kannalta sopivimmassa kiinnitysaineessa: kaikki silmin havaittavat vauriot, aivot (edustavat alueet, mukaan lukien iso- ja pikkuaivot ja aivosilta), selkäydin, mahalaukku, ohutsuoli, paksusuoli (mukaan lukien Peyerin levy), maksa, munuaiset, lisämunuaiset, perna, sydän, kateenkorva, kilpirauhanen, henkitorvi ja keuhkot (säilytetään puhaltamalla keuhkot täyteen kiinnitysainetta ja upottamalla sitten kiinnitysaiheeseen), sukurauhaset, avustavat sukuelimet (esim. kohtu, eturauhanen), virtsarakko, imusolmukkeet (mieluiten yksi annostelureitin kattava imusolmuke ja yksi annostelureitistä distaalinen imusolmuke systeemisten vaikutusten kattamiseksi), ääreishermo (lonkka- tai säärihermo) mieluiten läheltä lihasta ja osa luuydintä (tai vaihtoehtoisesti tuore luuydinaspiraatti). Kliinisten ja muiden löydösten perusteella on vielä ehkä tutkittava muita kudoksia. Myös testiaineen tunnettujen ominaisuuksien perusteella olevat todennäköiset kohde-elimet on säilytettävä.
1.4.3.6 Histopatologiset tutkimukset
Kaikkien verrokkien ja suuriannoksiseen ryhmään kuuluneiden eläinten säilytetyt elimet ja kudokset tutkitaan perusteellisesti histopatologisesti. Histopatologiset tutkimukset tulee tehdä myös kaikille muiden annostusryhmien eläimille, jos käsittelyyn liittyviä muutoksia havaitaan suuriannoksisessa ryhmässä.
Kaikki silmin havaittavat vauriot on tutkittava.
Mahdolliseen satelliittiryhmään kuuluvilta eläimiltä tulee tutkia histopatologisesti sellaiset kudokset ja elimet, joissa ilmenee samoja vaikutuksia kuin käsitellyillä ryhmillä.
2. TULOKSET
Koetulokset tulee esittää yksilöidysti. Yhteenveto tuloksista on esitettävä myös taulukossa, josta ilmenee kussakin koeryhmässä tutkimuksen alussa käytettyjen eläinten lukumäärä, kokeen aikana kuolleena löydettyjen tai humaaneista syistä lopetettujen eläinten lukumäärä ja niiden kuolinaika, toksisuusmerkkejä osoittaneiden eläinten lukumäärä, havaittujen toksisten vaikutusten kuvaus, mukaan lukien niiden alkamisajankohta, kesto ja vaikeusaste, vaurioita saaneiden eläinten lukumäärä, vauriotyypit ja eläinten prosentuaaliset osuudet vauriotyypeittäin.
Numeeriset tulokset on mahdollisuuksien mukaan arvioitava asianmukaisella ja yleisesti hyväksytyllä tilastollisella menetelmällä. Tilastolliset menetelmät tulee valita tutkimusasetelman suunnitteluvaiheessa.
3. RAPORTOINTI
KOERAPORTTI
Koeraportin tulee mahdollisuuksien mukaan sisältää seuraavat tiedot:
|
|
Koe-eläimet:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta |
|
|
Johtopäätökset |
4. LÄHDELUETTELO
Tämä menetelmä on analoginen OECD TG 407:n kanssa.
B.8. TOISTETUN ANNOKSEN (28 PÄIVÄÄ) MYRKYLLISYYS (HENGITETTYNÄ)
1. MENETELMÄ
1.1 JOHDANTO
On suositeltavaa selvittää aineen hiukkaskokojakauma, höyrynpaine, sulamispiste, kiehumispiste, leimahduspiste ja mahdollinen räjähtävyys ennalta.
Katso myös yleistä johdantoa, osa B (A).
1.2 MÄÄRITELMÄT
Katso yleistä johdantoa, osa B (B).
1.3 VERTAILUAINEET
Vertailuaineita ei ole.
1.4 TESTIMENETELMÄN PERIAATE
Useita koe-eläinryhmiä altistetaan aineelle päivittäin määrätyn ajan käyttäen porrastettuja pitoisuuksia siten, että kukin ryhmä altistuu eri pitoisuudelle. Testijakson pituus on 28 päivää. Jos aineen sopivan pitoisuuden saamiseksi ilmakehään on tarvittu liuotinta, on käytettävä liuotinkontrolliryhmää. Altistusjakson aikana eläimiä tarkkaillaan myrkytysoireiden suhteen. Ruumiinavaus tehdään kokeen aikana kuolleille eläimille ja kokeen päätyttyä myös henkiin jääneille eläimille, kun ne on ensin lopetettu.
1.5 LAATUKRITEERIT
Laatukriteerejä ei ole.
1.6 MENETELMÄKUVAUS
1.6.1 Valmistelut
Ennen testiä eläinten elinolosuhteet pidetään tietyntyyppisinä vähintään viiden päivän ajan testin suorittamista silmälläpitäen. Terveiden aikuisten eläinten joukosta otetaan satunnaisotos, joka jaetaan käsittelyryhmiin. Tarvittaessa käytetään liuotinta, jotta ilmakehään saadaan sopiva pitoisuus ainetta. Jos annostelun apuna käytetään liuotinta tai muita lisäaineita, on varmistettava, että ne eivät aiheuta myrkytysoireita. Aiempia tietoja voidaan käyttää soveltuvin osin.
1.6.2 Testiolosuhteet
1.6.2.1 Koe-eläimet
Ellei kontraindikaatioita ole, rotan käyttöä suositellaan. Testiin käytetään yleisiä laboratoriokantoja. Eläinten on oltava nuoria ja terveitä.
Testin alussa kumpaakaan sukupuolta edustavien eläinten painonvaihtelut eivät saa olla enempää kuin ± 20 % sukupuolen keskiarvosta.
1.6.2.2 Lukumäärä ja sukupuoli
Jokaista annostasoa kohti tarvitaan vähintään kymmenen eläintä (viisi naarasta ja viisi urosta). Naaraat eivät saa olla synnyttäneitä eivätkä tiineitä. Jos suunnitellaan testin kuluessa tapahtuvia lopettamisia, eläinten määrää on lisättävä vastaavasti. Tarvittaessa testiin voidaan ottaa kymmenen eläimen apuryhmä (viisi naarasta ja viisi urosta), jota altistetaan suurille annoksille 28 päivän ajan tarkkaillen myrkytysoireiden palautumista ja pysyvyyttä sekä sitä, esiintyykö käsittelyä seuraavan 14 päivän jakson aikana viivästyneitä myrkytysoireita. Tarvitaan myös kymmenen vertailueläimen (viiden naaran ja viiden uroksen) apuryhmä.
1.6.2.3 Altistuspitoisuudet
On käytettävä vähintään kolmea pitoisuutta ja yhtä kontrolliryhmää. Testattavalla aineella käsittelyä lukuun ottamatta kontrolliryhmän ja käsittelyryhmien eläimiä on käsiteltävä samalla tavalla. Jos annostelun yhteydessä käytetään liuotinta apuaineena, liuotinta annostellaan kontrolliryhmän eläimille samalla menetelmällä kuin käsittelyryhmän eläimille määränä, joka vastaa suurinta käsittelyannosta. Suurimman annostason on aiheutettava myrkytysoireita, mutta vain vähän tai ei lainkaan kuolleisuutta. Pienimmän annostason ei pidä aiheuttaa lainkaan myrkytysoireita. Jos käytettävissä on soveltuva arvio ihmisaltistumisesta, pienimmän annostason on ylitettävä tämä taso. Keskimmäisen annostason tulee aiheuttaa mahdollisimman vähän myrkytysoireita. Jos käytetään useita välitasoja, ne on valittava siten, että myrkytysoireet porrastuvat. Alimman annostason ja välitason ryhmissä sekä kontrolliryhmissä kuolleisuuden on oltava pieni, jotta tuloksia voidaan arvioida merkityksellisellä tavalla.
1.6.2.4 Altistusaika
Päivittäisen altistusajan on oltava kuusi tuntia. Erikoistapauksissa voidaan käyttää myös muunpituisia altistusaikoja.
1.6.2.5 Laite
Eläimiä testataan hengityslaitteella, jonka dynaaminen ilmanvirtaus on vähintään 12 ilmanvaihtoa tunnissa. Näin varmistetaan riittävä happipitoisuus ja altistusilmakehän tasainen jakaantuminen. Jos käytetään kammiota, sen rakenteen on oltava sellainen, että koe-eläimet eivät pääse muodostamaan tungosta, mutta altistuvat kuitenkin hengityksen kautta tehokkaasti. Yleinen sääntö kammion ilmakehän stabiiliuden varmistamiseksi on, että eläinten kokonaistilavuus saa olla enintään 5 % kammion tilavuudesta. Eläinkohtaisissa kammioissa voidaan käyttää oronasaalista, vain päähän kohdistuvaa tai koko kehoon kohdistuvaa altistamista. Kahden ensimmäisen tavan avulla aineen imeytyminen muuta kautta voidaan minimoida.
1.6.2.6 Tarkkailujakso
Kaikkia eläimiä on tarkkailtava päivittäin myrkytysoireiden suhteen koko altistusjakson ja toipumisjakson ajan. Myös kuolinajankohta ja myrkytysoireiden ilmestymis- sekä häviämisajankohta kirjataan.
1.6.3 Testin suorittaminen
Eläimiä altistetaan aineelle päivittäin 5–7 päivänä viikossa 28 päivän ajan. Seurantaa varten koottua apuryhmää tarkkaillaan altistusjakson jälkeen vielä 14 päivän ajan ilman käsittelyä, jotta voitaisiin todeta, ovatko myrkytysoireet häviäviä vai pysyviä. Testilämpötilana käytetään arvoa 22 ± 3 oC.
Suhteellisen kosteuden tulisi olla 30-70 %, mutta joissakin tapauksissa (eräiden aerosolien testauksissa) tämä ei ole ehkä mahdollista. Pitämällä kammiossa alipainetta (≤ 5 mm H2O) voidaan estää aineen vuotaminen ympäristöön. Altistuksen aikana eläimille ei anneta ruokaa eikä vettä.
On käytettävä soveltuvalla analyyttisella pitoisuuden valvontajärjestelmällä varustettua dynaamista inhalaatiojärjestelmää. Sopivien altistuspitoisuuksien löytämiseksi on suositeltavaa tehdä koetesti. Ilmanvirtausta on säädettävä siten, että altistuskammion olosuhteet ovat kauttaaltaan homogeeniset. Järjestelmän avulla on voitava saavuttaa stabiilit altistusolosuhteet niin pian kuin mahdollista.
Seuraavat suureet edellyttävät mittausta ja valvontaa:
|
a) |
Ilmanvirtaus (jatkuvasti). |
|
b) |
Testattavan aineen todellinen pitoisuus hengitysilmassa. Päivittäisen altistuksen aikana pitoisuusvaihtelut eivät saa ylittää ± 15 %:a keskiarvosta. Eräiden aerosolien kohdalla tällaista säätötasoa ei ehkä voida saavuttaa, jolloin on hyväksyttävä laajempi alue. Testijakson aikana pitoisuudet on pidettävä mahdollisimman muuttumattomina päivästä toiseen. Kerran viikossa aerosoleille on tehtävä hiukkaskokoanalyysi koeryhmittäin. |
|
c) |
Lämpötila ja kosteus (jatkuvasti, jos mahdollista). |
Altistuksen aikana ja sen jälkeen eläimiä tarkkaillaan systemaattisesti ja tulokset kirjataan. Jokaiselle yksittäiselle eläimelle tulee olla oma kirjanpitonsa. Kaikkia eläimiä on tarkkailtava päivittäin ja myrkytysoireet (alkamisajankohta, voimakkuus ja kesto) on kirjattava. Tarkkaillaan ihon, turkin, silmien, limakalvojen, hengitysteiden, verenkierron, autonomisen hermoston, keskushermoston, somatomotorisen aktiviteetin ja käyttäytymismallin muutoksia. Eläimet punnitaan kerran viikossa. Ravinnonkulutuksen mittaaminen viikoittain on suositeltavaa. Eläimiä on tarkkailtava säännöllisesti, jotta voidaan varmistaa, että mahdollisimman vähän eläimiä menetetään kannibalismin, kudosten autolyysin tai sijoitusvirheiden takia. Testijakson jälkeen kaikki aineelle altistuneet eläimet lopetetaan. Kuolemaisillaan olevat eläimet tai eläimet, joilla on vakavia ahdistuneisuuden tai kivun oireita, on poistettava ryhmästä ja lopetettava, minkä jälkeen niille tehdään ruumiinavaus.
Testijakson päätyttyä kaikki eläimet, kontrolliryhmien eläimet mukaan lukien, tutkitaan seuraavilta osin:
|
i) |
hematologia — vähintään hematokriitti, hemoglobiinipitoisuus, punasolujen lukumäärä, valkosolujen kokonaismäärä ja erittelylaskenta sekä hyytymistekijät; |
|
ii) |
kliininen veribiokemia — vähintään yksi parametri seuraavista maksan ja munuaisten toimintakokeista, alaniiniaminotransferaasi (ALAT), seeruminaspartaattiaminotransferaasi (ASAT), virtsa-aineen typpi, albumiini, veren kreatiniini, kokonaisbilirubiini ja seerumin kokonaisproteiini. |
Muita, riittävän toksikologisen arvion kannalta tärkeitä määrityksiä ovat kalsium, fosfori, kloridi, natrium, kalium, paastoverensokeri, lipidit, hormonit, happo-emästasapaino, methemoglobiini ja kolinesteraasiaktiivisuus.
Havaittujen oireiden tutkimista voidaan tarvittaessa laajentaa muita kliinisiä biokemianmäärityksiä käyttämällä.
1.6.3.1 Kattava ruumiinavaus
Kaikille kokeeseen osallistuneille eläimille on tehtävä kattava ruumiinavaus. Vähintään maksa, munuaiset, lisämunuaiset, keuhkot ja kivekset on punnittava märkinä mahdollisimman pian dissektion jälkeen. Elimet ja kudokset (hengityselimet, maksa, munuaiset, perna, kivekset, lisämunuaiset, sydän ja muut elimet, joissa on oleellisia vaurioita tai kokomuutoksia) on säilytettävä sopivassa aineessa mahdollisia myöhemmin tehtäviä histopatologisia tutkimuksia varten. Keuhkot on poistettava vahingoittumattomina, minkä jälkeen ne punnitaan ja käsitellään sopivalla kiinnitteellä keuhkojen rakenteen säilymisen varmistamiseksi.
1.6.3.2 Histopatologinen tutkimus
Suurannosryhmän ja kontrolliryhmän eläinten säilötyille elimille ja kudoksille on tehtävä histologinen tutkimus. Jos suurimman annoksen saaneen ryhmän eläinten elimissä ja kudoksissa on testattavasta aineesta johtuvia vaurioita, myös pienempien annoskokojen ryhmien eläinten vastaavat elimet on tutkittava. Kaikkien apuryhmien eläimet on tutkittava histologisesti kiinnittäen erityistä huomiota niihin elimiin ja kudoksiin, joissa on havaittu muutoksia käsiteltyjen ryhmien kohdalla.
2. TIEDOT
Yhteenveto tiedoista esitetään taulukkona, jossa esitetään eläinten määrä kokeen alussa ja eläinten määrä kutakin vauriota kohti ryhmittäin.
Kaikki havaintotulokset on arvioitava soveltuvan tilastollisen menetelmän avulla. Tarkoitukseen voidaan käyttää kaikkia yleisiä menetelmiä.
3. RAPORTOINTI
3.1 TESTIRAPORTTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
laji, kanta, toimittaja, ympäristöolosuhteet, ruokavalio, jne., |
|
— |
testiolosuhteet: altistuslaitteen kuvaus (rakenne, tyyppi, mitat, ilmalähde, aerosolin tuottamiseen käytetty järjestelmä, ilmastointijärjestelmä, poistoilman käsittely, mahdollisen testauskammion olosuhteet ja lämpötilan, kosteuden, aerosolin pitoisuuden stabiiliuden sekä aerosolin hiukkaskokojakauman mittauslaitteiden tiedot). Altistustiedot Altistustiedot kootaan taulukkoon, josta ilmenevät myös keskiarvot ja vaihtelut (esimerkiksi keskihajonta). Mahdollisuuksien mukaan esitetään seuraavat tiedot:
|
|
— |
vastetietojen luokittelu sukupuolen ja pitoisuuden mukaan, |
|
— |
kuolinajankohdat kokeen aikana tai eläinten hengissäpysyminen kokeen loppuun, |
|
— |
myrkytysoireet ja muut vaikutukset sekä oireita aiheuttamaton pitoisuustaso, |
|
— |
ajankohdat, jolloin on havaittu poikkeavuuksia, ja poikkeavuuksien kehittyminen jatkossa, |
|
— |
tiedot ruoasta ja kehonpainosta, |
|
— |
käytetyt hematologiset testit tuloksineen, |
|
— |
käytetyt kliinis-biokemialliset testit tuloksineen, |
|
— |
ruumiinavauslöydökset, |
|
— |
histopatologisten löydösten yksityiskohtaiset kuvaukset, |
|
— |
tulosten tilastollinen käsittely soveltuvin osin, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Katso yleistä johdantoa, osa B (D).
4. VIITTEET
Katso yleistä johdantoa, osa B (E).
B.9. TOISTETUN ANNOKSEN (28 PÄIVÄÄ) MYRKYLLISYYS (IHON KAUTTA NAUTITTAVAT AINEET)
1. MENETELMÄ
1.1 JOHDANTO
Katso yleistä johdantoa, osa B (A).
1.2 MÄÄRITELMÄT
Katso yleistä johdantoa, osa B (B).
1.3 VERTAILUAINEET
Vertailuaineita ei ole.
1.4 TESTIMENETELMÄN PERIAATE
Testattavaa ainetta levitetään useisiin ryhmiin jaettujen eläinten iholle porrastettuina annoksina (yksi annos ryhmää kohti) säännöllisesti 28 päivän koejakson aikana. Jakson aikana eläimiä tarkkaillaan myrkytysoireiden suhteen. Ruumiinavaus tehdään kokeen aikana kuolleille eläimille ja kokeen päätyttyä myös henkiin jääneille eläimille, kun ne on ensin lopetettu.
1.5 LAATUKRITEERIT
Laatukriteerejä ei ole.
1.6 MENETELMÄKUVAUS
1.6.1 Valmistelut
Ennen testiä eläinten elinolosuhteet pidetään tietyntyyppisinä vähintään viiden päivän ajan testin suorittamista silmälläpitäen. Terveiden aikuisten eläinten joukosta otetaan satunnaisotos, joka jaetaan käsittely- ja vertailuyryhmiin. Noin 24 tuntia ennen testiä turkki leikataan tai ajetaan eläinten selkäalueelta varoen naarmuttamasta ihoa, koska naarmut saattavat muuttaa ihon läpäisevyyttä. Turkinpoisto on yleensä uusittava noin viikon välein. Vähintään 10 % kehon pinta-alaa peittävästä karvasta on ajeltava tai leikattava. Koe-eläimen paino on otettava huomioon suunniteltaessa paljastettavan alueen ja siteen suuruutta. Kiinteät aineet voidaan tarvittaessa jauhaa, ja ne on kosteutettava riittävällä vesimäärällä tai tarvittaessa muulla liuottimella hyvän ihokontaktin varmistamiseksi. Nestemäisiä aineita käytetään yleensä laimentamattomina. Käsittely toistetaan päivittäin 5–7 päivänä viikossa.
1.6.2 Testiolosuhteet
1.6.2.1 Koe-eläimet
Koe-eläiminä voidaan käyttää aikuisia rottia, kaneja tai marsuja. Muiden lajien käyttö on perusteltava.
Testin alussa kumpaakaan sukupuolta edustavien eläinten painonvaihtelut eivät saa olla enempää kuin ± 20 % sukupuolen keskiarvosta.
1.6.2.2 Lukumäärä ja sukupuoli
Jokaista annostasoa kohti tarvitaan vähintään kymmenen eläintä (viisi naarasta ja viisi urosta). Naaraat eivät saa olla synnyttäneitä eivätkä tiineitä. Jos suunnitellaan testin kuluessa tapahtuvia lopettamisia, eläinten määrää on lisättävä vastaavasti. Tarvittaessa testiin voidaan ottaa kymmenen eläimen apuryhmä (viisi naarasta ja viisi urosta), jota altistetaan suurille annoksille 28 päivän ajan tarkkaillen myrkytysoireiden palautumista ja pysyvyyttä sekä sitä, esiintyykö käsittelyä seuraavan 14 päivän jakson aikana viivästyneitä myrkytysoireita. Tarvitaan myös kymmenen vertailueläimen (viiden naaran ja viiden uroksen) apuryhmä.
1.6.2.3 Altistuspitoisuudet
Tarvitaan vähintään kolme pitoisuustasoa ja yksi kontrolliryhmä. Jos testattava aine liuotetaan apuaineeseen, tätä varten tarvitaan erillinen kontrolliryhmä. Päivittäisen altistuksen on kestettävä vähintään kuusi tuntia. Ainetta levitetään samaan aikaan joka päivä, ja annosta säädetään 1-2 viikon välein siten, että pitoisuustasot pysyvät vakiona eläimen painoon nähden. Aineella käsittelyä lukuun ottamatta kontrolliryhmän ja käsittelyryhmien eläimiä on käsiteltävä samalla tavalla. Jos annostelun yhteydessä käytetään liuotinta apuaineena, liuotinta annostellaan kontrolliryhmän eläimille samalla menetelmällä kuin käsittelyryhmän eläimille määränä, joka vastaa suurinta käsittelyannosta. Suurimman annostason on aiheutettava myrkytysoireita, mutta vain vähän tai ei lainkaan kuolleisuutta. Pienimmän annostason ei pidä aiheuttaa lainkaan myrkytysoireita. Jos käytettävissä on soveltuva arvio ihmisaltistumisesta, pienimmän annostason on ylitettävä tämä taso. Keskimmäisen annostason tulee aiheuttaa mahdollisimman vähän myrkytysoireita. Jos käytetään useita välitasoja, ne on valittava siten, että myrkytysoireet porrastuvat. Alimman annostason ja välitason ryhmissä sekä kontrolliryhmissä kuolleisuuden on oltava pieni, jotta tuloksia voidaan arvioida merkityksellisellä tavalla.
Jos aine aiheuttaa vakavaa ihoärsytystä iholle levitettynä, pitoisuuksia on pienennettävä, mikä voi aiheuttaa suurannosryhmän eläimille muiden myrkytysoireiden vähenemistä tai oireiden häviämisen. Jos eläimen iho on pahoin vaurioitunut, voi olla tarpeen keskeyttää koe ja uusia se pienempiä pitoisuuksia käyttäen.
1.6.2.4 Rajatesti
Jos suoritetaan alustava koe käyttäen annostasoa 1 000 mg/kg tai tätä korkeampaa tasoa, joka perustuu tunnettuun ihmisaltistukseen, eikä tällainen testi aiheuta myrkytysoireita, lisätestit voidaan katsoa tarpeettomiksi.
1.6.2.5 Tarkkailujakso
Kaikkia eläimiä on tarkkailtava päivittäin myrkytysoireiden suhteen. Kuolinajankohta ja myrkytysoireiden llmestymis- sekä häviämisajankohta kirjataan.
1.6.3 Testin suorittaminen
Eläimiä pidetään yksin häkeissä. Eläimiä käsitellään testattavalla aineella mieluiten seitsemänä päivänä viikossa 28 päivän ajan. Seurantaa varten koottuja apuryhmiä tarkkaillaan altistusjakson jälkeen vielä 14 päivän ajan ilman käsittelyä, jotta voidaan todeta, ovatko myrkytysoireet häviäviä vai pysyviä. Päivittäisen altistuksen on kestettävä vähintään kuusi tuntia.
Testattavaa ainetta levitetään tasaisesti alueelle, joka vastaa noin 10 %:a kehon kokonaispinta-alasta. Erittäin myrkyllisten aineiden kohdalla voidaan käyttää pienempää pinta-alaa, mutta ainetta on levitettävä mahdollisimman ohuelti ja tasaisesti niin suurelle alueelle kuin mahdollista.
Altistuksen aikana ihoalue peitetään harsositeellä ja ärsyttämättömällä laastarilla. Tämän lisäksi alue on peitettävä, niin että harsoside ja aine pysyvät paikallaan eikä eläin pääse syömään ainetta. Eläin voidaan sitoa osittain siten, ettei se pysty syömään ainetta. Täydellistä liikkumattomuutta ei kuitenkaan suositella. Vaihtoehtoisesti voidaan käyttää suojakaulusta.
Altistusjakson jälkeen aineen jäännökset poistetaan vedellä tai muulla sopivalla ihonpuhdistusmenetelmällä.
Eläimiä on tarkkailtava säännöllisesti, jotta voidaan varmistaa, että mahdollisimman vähän eläimiä menetetään kannibalismin, kudosten autolyysin tai sijoitusvirheiden takia. Testijakson jälkeen kaikki aineelle altistuneet eläimet lopetetaan. Kuolemaisillaan olevat eläimet tai eläimet, joilla on vakavia ahdistuneisuuden tai kivun oireita, on poistettava ryhmästä ja lopetettava, minkä jälkeen niille tehdään ruumiinavaus.
Testijakson päätyttyä kaikki eläimet, kontrolliryhmien eläimet mukaan lukien, tutkitaan seuraavilta osin:
|
1) |
hematologia — vähintään hematokriitti, hemoglobiinipitoisuus, punasolujen lukumäärä, valkosolujen kokonaismäärä ja erittelylaskenta sekä hyytymistekijät; |
|
2) |
kliininen veribiokemia — vähintään yksi parametri seuraavista maksan ja munuaisten toimintakokeista, alaniiniaminotransferaasi (ALAT), seeruminaspartaattiaminotransferaasi (ASAT), virtsa-aineen typpi, albumiini, veren kreatiniini, kokonaisbilirubiini ja seerumin kokonaisproteiini. |
Muita, riittävän toksikologisen arvion kannalta tärkeitä määrityksiä ovat kalsium, fosfori, kloridi, natrium, kalium, paastoverensokeri, lipidit, hormonit, happo-emästasapaino, methemoglobiini ja kolinesteraasiaktiivisuus.
Havaittujen oireiden tutkimista voidaan tarvittaessa laajentaa muita kliinisiä biokemianmäärityksiä käyttämällä.
1.6.4 Kattava ruumiinavaus
Kaikille kokeeseen osallistuneille eläimille on tehtävä kattava ruumiinavaus. Vähintään maksa, munuaiset, lisämunuaiset ja kivekset on punnittava märkinä mahdollisimman pian dissektion jälkeen. Elimet ja kudokset (maksa, munuaiset, perna, kivekset, lisämunuaiset, sydän ja muut elimet, joissa on oleellisia vaurioita tai kokomuutoksia) on säilytettävä sopivassa aineessa mahdollisia myöhemmin tehtäviä histopatologisia tutkimuksia varten.
1.6.5 Histopatologinen tutkimus
Suurannosryhmän ja kontrolliryhmän eläinten säilötyille elimille ja kudoksille on tehtävä histologinen tutkimus. Jos suurimman annoksen saaneen ryhmän eläinten elimissä ja kudoksissa on testattavasta aineesta johtuvia vaurioita, myös pienempien annoskokojen ryhmien eläinten vastaavat elimet on tutkittava. Kaikkien apuryhmien eläimet on tutkittava histologisesti kiinnittäen erityistä huomiota niihin elimiin ja kudoksiin, joissa on havaittu muutoksia käsiteltyjen ryhmien kohdalla.
2. TIEDOT
Yhteenveto tiedoista esitetään taulukkona, jossa esitetään eläinten määrä kokeen alussa ja eläinten määrä kutakin vauriota kohti ryhmittäin.
Kaikki havaintotulokset on arvioitava soveltuvan tilastollisen menetelmän avulla. Tarkoitukseen voidaan käyttää kaikkia yleisiä menetelmiä.
3. RAPORTOINTI
3.1 TESTIRAPORTTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
laji, kanta, toimittaja, ympäristöolosuhteet, ruokavalio jne., |
|
— |
testiolosuhteet (mukaan lukien siteen tyyppi, okklusiivinen tai ei-okklusiivinen), |
|
— |
annostasot (annoksen suuruus apuaine mukaan lukien ja mahdollinen testattavan aineen pitoisuus), |
|
— |
oireita tuottamaton annostaso, mikäli mahdollista, |
|
— |
vastetietojen luokittelu sukupuolen ja annostason mukaan, |
|
— |
kuolinajankohdat kokeen aikana tai eläinten hengissäpysyminen kokeen loppuun, |
|
— |
myrkytysoireet ja muut vaikutukset, |
|
— |
ajankohdat, jolloin on havaittu poikkeavuuksia, ja poikkeavuuksien kehittyminen jatkossa, |
|
— |
tiedot ruoasta ja kehonpainosta, |
|
— |
käytetyt hematologiset testit tuloksineen, |
|
— |
käytetyt kliinis-biokemialliset testit tuloksineen, |
|
— |
ruumiinavauslöydökset, |
|
— |
histopatologisten löydösten yksityiskohtaiset kuvaukset, |
|
— |
tulosten tilastollinen käsittely soveltuvin osin, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Katso yleistä johdantoa, osa B (D).
4. VIITTEET
Katso yleistä johdantoa, osa B (E).
B.10. MUTAGEENISUUS — KROMOSOMIPOIKKEAVUUSTESTI NISÄKÄSSOLUILLA IN VITRO
1. MENETELMÄ
Tämä menetelmä on sama kuin OECD TG 473, In Vitro Mammalian Chromosome Aberration Test (1997).
1.1 JOHDANTO
In vitro -kromosomipoikkeavuustestin tarkoituksena on tunnistaa aineet, jotka aiheuttavat rakenteellisia kromosomipoikkeavuuksia viljellyissä nisäkässoluissa (1) (2) (3). Rakenteelliset poikkeavuudet jakautuvat kahteen tyyppiin, kromosomi- ja kromatidipoikkeavuuksiin. Kemiallisten mutageenien aiheuttamat poikkeavuudet ovat useimmiten kromatidityyppisiä, mutta myös kromosomityyppisiä poikkeavuuksia esiintyy. Polyploidian lisääntyminen saattaa osoittaa, että kemiallinen aine voi aiheuttaa numeerisia poikkeavuuksia. Tätä menetelmää ei ole kuitenkaan suunniteltu numeeristen poikkeavuuksien mittaamiseen, eikä sitä käytetä rutiininomaisesti tähän tarkoitukseen. Kromosomimutaatiot ja niihin liittyvät tapahtumat ovat syynä moniin ihmisen geneettisiin sairauksiin, ja on saatu vakuuttavia todisteita siitä, että kromosomimutaatiot ja niihin liittyvät tapahtumat, jotka aiheuttavat muutoksia somaattisten solujen onkogeeneissä ja kasvunrajoitegeeneissä, ovat osallisina syövän synnyssä ihmisillä ja koe-eläimillä.
In vitro -kromosomipoikkeavuustestissä voidaan käyttää pysyvien solulinjojen viljelmiä, solukantoja tai primaarisia soluviljelmiä. Käytettävien solujen valintakriteerejä ovat solujen kasvukyky viljelmässä, karyotyypin pysyvyys, kromosomiluku, kromosomien diversiteetti ja kromosomipoikkeavuuksien spontaanifrekvenssi.
In vitro -testit vaativat yleensä eksogeenista metabolista aktivaatiota. Tällainen metabolinen aktivaatiojärjestelmä ei pysty täysin jäljittelemään in vivo -olosuhteita nisäkkäissä. On pyrittävä välttämään erityisesti sellaisia olosuhteita, joissa saatavat positiiviset tulokset eivät heijasta aineen luontaista mutageenisuutta ja saattavat johtua pH:n muutoksista, osmolaliteetista tai voimakkaasta sytotoksisuudesta (4) (5).
Tätä testiä käytetään nisäkkäiden mahdollisten mutageenien ja karsinogeenien seulontaan. Monet yhdisteet, joilla saadaan positiivinen tulos tässä testissä, ovat nisäkkäiden karsinogeeneja. Tämän testin ja karsinogeenisuuden välillä ei ole kuitenkaan täydellistä korrelaatiota. Korrelaatio riippuu kemiallisista ominaisuuksista, ja yhä useammat tutkimustulokset viittaavat siihen, että on olemassa karsinogeeneja, joita ei voida havaita tällä testillä, koska ne näyttävät vaikuttavan muiden mekanismien kuin suoran DNA-vaurion välityksellä.
Ks. myös Yleisjohdanto, osa B.
1.2. MÄÄRITELMÄT
Kromatidipoikkeavuus: rakenteellinen kromosomivaurio, joka ilmenee yksittäisten kromatidien katkeamisena tai kromatidien katkeamisena ja uudelleen yhtymisenä.
Kromosomipoikkeavuus: rakenteellinen kromosomivaurio, joka ilmenee molempien kromatidien katkeamisena tai katkeamisena ja uudelleen yhtymisenä samassa kohdassa.
Endoreduplikaatio: tapahtumasarja, jossa DNA:n kahdentumisen S-vaiheen tuma ei etene mitoosiin vaan aloittaa uuden S-vaiheen. Tämän seurauksena syntyy kromosomeja, joissa on 4, 8, 16, ... kromatidia.
Aukko: gap, akromaattinen leesio, joka on pienempi kuin yhden kromatidin leveys ja johon liittyy minimaalinen kromatidin (kromatidien) siirtymä.
Mitoosi-indeksi: suhdeluku, joka saadaan jakamalla metafaasissa olevien solujen määrä solupopulaatiossa todettujen solujen kokonaismäärällä; ilmoittaa solujen proliferaatioasteen kyseisessä solupopulaatiossa.
Numeerinen poikkeavuus: käytetyille soluille tyypillisestä normaalista kromosomimäärästä poikkeava kromosomien lukumäärä.
Polyploidia: haploidisen kromosomimäärän (n) esiintyminen moninkertaisena, muu kuin diploidinen kromosomimäärä (3n, 4n jne.).
Rakenteellinen poikkeavuus: kromosomirakenteen muutos, joka voidaan havaita solunjakautumisen meta-faasivaiheen mikroskooppitutkimuksella ja joka ilmenee deleetioina ja fragmentteina, kromosomien sisäisinä tai kromosomien välisinä tekijänvaihdoksina.
1.3 TESTIN PERIAATE
Soluviljelmät altistetaan tutkittavalle aineelle sekä ilman metabolista aktivaatiota että metabolisen aktivaatiojärjestelmän läsnäollessa. Kun soluviljelmät on altistettu tutkittavalle aineelle, ne käsitellään etukäteen määrätyin välein metafaasin pysäyttävällä aineella (esim. Colcemid® tai kolkisiini), solut kerätään ja värjätään, ja metafaasissa olevat solut analysoidaan mikroskooppisesti kromosomipoikkeavuuksien havaitsemiseksi.
1.4 TESTIN KUVAUS
1.4.1 Testin valmistelu
1.4.1.1 Solut
Testissä voidaan käyttää eri solulinjoja, solukantoja tai primaarisia soluviljelmiä, myös ihmisen soluja (esim. kiinanhamsterin fibroblasteja, ihmisen tai muun nisäkkään perifeerisen veren lymfosyyttejä).
1.4.1.2 Kasvatusväliaineet ja viljelyolosuhteet
Soluviljelmien ylläpidossa on käytettävä soveltuvia kasvatusalustoja ja inkubaatio-olosuhteita (kasvatusastiat, CO2-pitoisuus, lämpötila ja kosteus). Pysyvistä solulinjoista ja kannoista on tarkistettava ajoittain modaalisen kromosomimäärän pysyvyys ja mahdollinen mykoplasmakontaminaatio. Kontaminoituneita viljelmiä ei pidä käyttää. Solujen normaali solusyklin kesto ja käytetyt viljelyolosuhteet on tunnettava.
1.4.1.3 Soluviljelmien valmistelu
Pysyvät solulinjat ja solukannat: solut kasvatetaan kantaviljelmistä, kylvetään kasvatusvälineeseen sellaiseen tiheyteen, että soluviljelmät eivät saavuta konfluenttisuutta ennen solujen keräämisajankohtaa, ja inkuboidaan 37 oC:ssa.
Lymfosyytit: antikoagulanteilla (esim. hepariinilla) käsiteltyä kokoverta tai terveiltä luovuttajilta saatuja erotettuja lymfosyyttejä lisätään mitogeenia (esim. fytohemagglutiniinia) sisältävään kasvatusväliaineeseen ja inkuboidaan 37 oC:ssa.
1.4.1.4 Metabolinen aktivaatio
Solut on altistettava tutkittavalle aineelle sekä sopivan metabolisen aktivaatiojärjestelmän läsnäollessa että ilman sitä. Yleisimmin käytetty aktivaatiojärjestelmä on entsyymejä indusoivilla aineilla, kuten Aroclor 1254:11ä (6) (7) (8) (9) tai fenobarbitonin ja ß-naftoflavonin (10) (11) (12) yhdistelmällä käsiteltyjen jyrsijöiden maksasta eristetty postmitokondriaalinen jae (S9), johon on lisätty kofaktoria.
Postmitokondriaalisen jakeen yleisesti käytetty pitoisuusalue lopullisessa testiväliaineessa on 1-10 % v/v. Metabolinen aktivaatiojärjestelmä voi vaihdella sen mukaan, mihin kemiallisten aineiden ryhmään tutkittava aine kuuluu. Joissakin tapauksissa saattaa olla perusteltua käyttää useampaa kuin yhtä postmitokondriaalisen jakeen pitoisuutta.
Monilla kehitetyillä menetelmillä, kuten yhdistelmä-DNA-tekniikalla tuotetuilla solulinjoilla, joissa ilmentyy spesifisiä aktivaatioentysyymejä, saattaa olla endogeenista aktivaatiovaikutusta. Käytettyjen solulinjojen valinnan on oltava tieteellisesti perusteltua (esim. sytokromi P450 -isoentsyymin merkitys tutkittavan aineen metabolialle).
1.4.1.5 Tutkittava aine / valmistelu
Kiinteät tutkittavat aineet liuotetaan tai sekoitetaan sopiviin liuottimiin tai kantaja-aineisiin ja laimennetaan tarvittaessa ennen solujen käsittelyä. Nestemäiset tutkittavat aineet voidaan lisätä suoraan koejärjestelmiin ja/tai laimentaa ennen solujen käsittelyä. Tutkittava aine on valmisteltava juuri ennen altistusta, paitsi jos säilyvyys on osoitettu stabiliteettitutkimuksilla.
1.4.2 Koeolosuhteet
1.4.2.1 Liuotin/kantaja-aine
Liuotin/kantaja-aine ei saa olla sellainen, että sen voidaan epäillä reagoivan kemiallisesti tutkittavan aineen kanssa, eikä se saa vaikuttaa solujen elinkykyyn eikä S9-aktiivisuuteen. Jos käytetään muita kuin hyvin tunnettuja liuottimia/kantaja-aineita, niiden käyttö on perusteltava yhteensopivuuden osoittavilla tutkimustuloksilla. Vesipitoisen liuottimen/kantaja-aineen käyttöä on harkittava ensisijaisesti aina, kun se on mahdollista. Testattaessa aineita, jotka ovat epästabiileja vedessä, orgaanisten liuottimien tulisi olla vedettömiä. Vesi voidaan poistaa lisäämällä molekyylisiivilä.
1.4.2.2 Altistuspitoisuudet
Huomioonotettavia kriteerejä suurinta pitoisuutta määritettäessä ovat sytotoksisuus, liukoisuus testijärjestelmään ja pH:n tai osmolaliteetin muutokset.
Sytotoksisuus on määritettävä pääasiallisessa kokeessa sekä metabolisen aktivaatiojärjestelmän läsnäollessa että ilman sitä käyttäen asianmukaisia solujen eheyden ja solukasvun indikaattoreita, kuten konfluenttisuuden astetta, elinkykyisten solujen määrää tai mitoosi-indeksiä. Sytotoksisuus ja liukoisuus saattaa olla hyödyllistä määrittää alustavassa kokeessa.
Vähintään kolmea analysoitavissa olevaa pitoisuutta on käytettävä. Mikäli sytotoksisuutta esiintyy, näiden pitoisuuksien on katettava alue, jossa suurimmalla pitoisuudella on maksimaalinen myrkkyvaikutus ja pienimmällä vähäinen tai ei lainkaan myrkkyvaikutusta, mikä tarkoittaa yleensä sitä, että pitoisuudet voivat poiketa toisistaan enintään kertoimella 2–10. Solujen keräämisajankohtana suurimpaan pitoisuuteen tulisi liittyä merkittävä konfluenttisuuden asteen, solumäärän tai mitoosi-indeksin pieneneminen (kaikkien osalta yli 50 %). Mitoosi-indeksi on vain epäsuora sytotoksisten/sytostaattisten vaikutusten mitta, ja se riippuu altistuksesta kuluneesta ajasta. Mitoosi-indeksi hyväksytään kuitenkin suspensioviljelmissä, joissa muiden myrkkyvaikutusta mittaavien menetelmien käyttö saattaa olla hankalaa ja epäkäytännöllistä. Tietoja solusyklin kinetiikasta, kuten keskimääräistä generaatioaikaa (average generation time, AGT), voidaan käyttää täydentävinä tietoina. AGT on kuitenkin yleinen keskiarvo, joka ei aina paljasta hidastuneiden alapopulaatioiden olemassaoloa, ja vähäinenkin generaatioajan piteneminen voi siirtää poikkeavuuksien optimaalista toteamisaikaa hyvinkin paljon myöhemmäksi.
Soluille suhteellisen myrkyttömiä aineita tutkittaessa suurimman testattavan pitoisuuden on oltava 5 μl/ml, 5 mg/ml tai 0,01 M, sen mukaan, mikä näistä pitoisuuksista on pienin.
Testattaessa huonosti veteen liukenevia aineita, jotka ovat myrkyttömiä liukenemattoman pitoisuuden alittavina pitoisuuksina, suurimman käytetyn annoksen aikaansaaman pitoisuuden on ylitettävä liukoisuusraja lopullisessa kasvatusväliaineessa altistusjakson lopussa. Joissakin tapauksissa (esim. kun myrkkyvaikutus todetaan ainoastaan pienimmän liukenemattoman pitoisuuden ylittävillä pitoisuuksilla) on suositeltavaa testata useampia kuin yksi pitoisuus, jossa havaitaan näkyvää saostumista. Liukoisuus kannattaa arvioida sekä käsittelyn alussa että lopussa, sillä se voi muuttua koejärjestelmässä altistuksen aikana esimerkiksi solujen, S9:n, seerumin ym. vaikutuksesta. Liukenemattomuus voidaan havaita paljaalla silmällä. Sakan ei pitäisi vaikuttaa laskentaan.
1.4.2.3 Negatiiviset ja positiiviset kontrollit
Jokaisessa kokeessa on käytettävä rinnakkaisia positiivisia ja negatiivisia (liuotin tai kantaja-aine} kontrolleja, sekä metabolisen aktivaation läsnäollessa että ilman sitä. Metabolista aktivaatiota käytettäessä positiivisena kontrollina on käytettävä sellaista kemiallista ainetta, joka vaatii aktivaatiota mutageenisen vasteen aikaansaamiseksi.
Positiivisina kontrollialueina on käytettävä tunnettua klastogeenia altistustasoina, joiden voidaan odottaa aiheuttavan toistettavissa ja havaittavissa olevan lisääntymisen taustaan verrattuna, mikä osoittaa koejärjestelmän herkkyyden.
Positiivisen kontrollialueen pitoisuudet on valittava siten, että vaikutukset ovat selvät mutta eivät paljasta heti lukijalle koodattujen objektilasien identiteettiä. Esimerkkejä positiivisista kontrolliaineista:
|
Metabolinen aktivaatio |
Aine |
CAS nro |
EINECS nro |
|
Ei eksogeenista metabolista aktivaatiota |
metyylimetaanisulfonaatti |
66-27-3 |
200-625-0 |
|
etyylimetaanisulfonaatti |
62-50-0 |
200-536-7 |
|
|
etyylinitrosourea |
759-73-9 |
212-072-2 |
|
|
mitomysiini C |
50-07-7 |
212-072-2 |
|
|
4-nitrokinoliini-N-oksidi |
56-57-5 |
200-281-1 |
|
|
Eksogeeninen metabolinen aktivaatio |
Bentso[a]pyreeni |
50-32-8 |
200-028-5 |
|
syklofosfamidi syklofosfamidimonohydraatti |
50-18-0 6055-19-2 |
200-015-4 |
Muita sopivia positiivisia kontrolliaineita voidaan käyttää. Samaan kemiallisten aineiden ryhmään kuuluvan positiivisen kemiallisen kontrolliaineen käyttöä on harkittava, mikäli tällainen aine on käytettävissä.
Jokaisena solujen keräämisajankohtana on otettava näytteet myös negatiivisista kontrolleista, jotka koostuvat tutkittavaa ainetta sisältävässä kasvatusväliaineessa olevasta liuottimesta tai pelkästä kantaja-aineesta ja joita on käsitelty samalla tavoin kuin altistettuja viljelmiä. Lisäksi on käytettävä myös käsittelemättömiä kontrolleja, paitsi jos aikaisemmat tiedot kontrollista osoittavat, ettei valitulla liuottimella ole haitallisia eikä mutageenisia vaikutuksia.
1.4.3 Testin suorittaminen
1.4.3.1 Altistaminen tutkittavalle aineelle
Lisääntyvät solut altistetaan tutkittavalle aineelle metabolisen aktivaatiojärjestelmän läsnäollessa ja ilman sitä. Lymfosyyttien altistus on aloitettava noin 48 tunnin kuluttua mitogeenisesta stimulaatiosta.
|
1.4.3.2 |
Normaalisti jokaisesta pitoisuudesta tulisi tehdä kaksi rinnakkaista viljelmää, ja niiden käyttöä suositellaan erityisesti negatiivisissa/liuotinkontrolliviljelmissä. Mikäli aikaisemmat tutkimustulokset osoittavat, että rinnakkaisviljelmien välillä on vain hyvin vähäisiä eroja (13) (14), yhden viljelyn käyttö kustakin pitoisuudesta saattaa olla hyväksyttävää. Kaasumaisia tai haihtuvia aineita on testattava asianmukaisilla menetelmillä, kuten suljetuissa kasvatusastioissa (15) (16). |
1.4.3.3 Näytteiden keräämisajankohdat
Ensimmäisessä kokeessa soluja on altistettava tutkittavalle aineelle sekä metabolisen aktivaatiojärjestelmän läsnäollessa että ilman sitä 3–6 tunnin ajan, ja näytteet kerätään suunnilleen 1,5 normaalin solusyklin kuluttua altistuksesta (12). Jos tässä menettelyssä saadaan negatiiviset tulokset sekä metabolisen aktivaation läsnäollessa että ilman sitä, on tehtävä uusi testi ilman aktivaatiota, ja altistusta on jatkettava yhtäjaksoisesti siihen asti, kun näytteet kerätään suunnilleen 1,5 normaalia solusykliä vastaavan ajan kuluttua. Tietyt kemialliset aineet saatetaan havaita helpommin, kun altistus/näytteenottoaika on pitempi kuin 1,5 solusykliä. Metabolisen aktivaation läsnäollessa saadut negatiiviset tulokset on vahvistettava tapauskohtaisesti. Ellei negatiivisten tulosten vahvistamista pidetä tarpeellisena, perustelut on esitettävä.
1.4.3.4 Kromosomipreparaatti
Soluviljelmiä käsitellään Colcemid®illa tai kolkisiinilla yleensä 1–3 tunnin ajan ennen näytteiden keräämistä. Jokaisen viljelmän näytteet kerätään ja käsitellään erikseen kromosomipreparaattien valmistusta varten. Kromosomipreparaattien valmistukseen kuuluu solujen hypotoninen käsittely, fiksointi ja värjäys.
1.4.3.5 Analyysi
Kaikki objektilasit, myös positiiviset ja negatiiviset kontrollit, on koodattava toisistaan riippumattomasti ennen mikroskooppitutkimusta. Koska fiksaatio johtaa usein joidenkin metafaasissa olevien solujen rikkoutumiseen ja kromosomien menettämiseen, lasketuissa soluissa tulisi olla sentromeerejä modaalista lukumäärää vastaava määrä ± 2 kaikissa solutyypeissä. Kustakin pitoisuudesta ja kontrollista olisi laskettava vähintään 200 hyvin levinnyttä metafaasia, jotka jakautuvat tasaisesti rinnakkaisviljelmien kesken, mikäli niitä käytetään. Lukumäärää voidaan pienentää, mikäli aberraatioita todetaan runsaasti.
Vaikka testillä pyritään ensisijaisesti toteamaan rakenteelliset kromosomipoikkeavuudet, on tärkeää rekisteröidä myös polyploidia ja endoreduplikaatio, mikäli näitä esiintyy.
2. TULOKSET
2.1 TULOSTEN KÄSITTELY
Kokeellinen yksikkö on solu, joten on arvioitava niiden solujen prosentuaalinen määrä, joissa on rakenteellinen kromosomipoikkeavuus (poikkeavuuksia). Erityyppiset rakenteelliset kromosomipoikkeavuudet on lueteltava ja niiden lukumäärät ja esiintymistaajuudet altistetuissa viljelmissä ja kontrolliviljelmissä on mainittava. Aukot (gaps) rekisteröidään erikseen ja raportoidaan mutta niitä ei yleensä lasketa mukaan poikkeavuuksien kokonaistaajuuteen.
Lisäksi on rekisteröitävä kaikissa testiviljelmissä ja negatiivisissa kontrolliviljelmissä tehdyt samanaikaiset sytotoksisuusmittaukset pääasiallisissa kromosomipoikkeavuustesteissä.
Tulokset on ilmoitettava kutakin viljelmää kohti. Lisäksi on esitettävä yhteenveto kaikista tiedoista taulukkomuodossa.
Selvää positiivista vastetta ei tarvitse vahvistaa. Epäselvät tulokset on selvitettävä jatkotestauksella mieluiten muunnetuissa koeolosuhteissa. Negatiivisten tulosten vahvistamisen tarvetta on käsitelty kohdassa 1.4.3.3. Jatkokokeissa on harkittava tutkimusparametrien modifiointia arvioitavien olosuhteiden laajentamiseksi. Mahdollisia modifioitavia tutkimusparametreja ovat pitoisuusvälit ja metaboliset aktivaatiojärjestelmät.
2.2 TULOSTEN ARVIOINTI JA TULKINTA
Positiivisten tulosten määrittämiseen on useita kriteerejä, kuten kromosomipoikkeavuuksia sisältävien solujen lukumäärän lisääntyminen, joka on riippuvainen tutkittavan aineen pitoisuudesta tai on toistettavissa. Tulosten biologinen merkitys on otettava ensisijaisesti huomioon. Tilastollisia menetelmiä voidaan käyttää apuna testitulosten arvioinnissa (3) (13). Tilastollinen merkitsevyys ei saa olla ainoa määräävä tekijä positiivisen vasteen arvioinnissa.
Polyploidisten solujen määrän suureneminen saattaa osoittaa, että tutkittava aine pystyy estämään mitoottisia prosesseja ja aiheuttamaan numeerisia kromosomipoikkeavuuksia. Endoreduplikoituneita kromosomeja sisältävien solujen määrän suureneminen saattaa osoittaa, että tutkittava aine kykenee pysäyttämään solusyklin etenemisen (17) (18).
Tutkittava aine, jolla saadut tulokset eivät täytä edellä kuvattuja kriteerejä, katsotaan ei-mutageeniseksi tässä koejärjestelmässä.
Useimmissa testeissä saadaan selvästi positiivisia tai negatiivisia tuloksia, mutta joissakin harvinaisissa tapauksissa saatujen tietojen pohjalta ei voida tehdä varmoja päätelmiä tutkittavan aineen vaikutuksesta. Tulokset saattavat jäädä epäselviksi tai kyseenalaisiksi kokeen toistokertojen määrästä riippumatta.
In vitro -kromosomipoikkeavuustestissä saadut positiiviset tulokset osoittavat, että tutkittava aine aiheuttaa rakenteellisia kromosomipoikkeavuuksia viljellyissä nisäkkäiden somaattisissa soluissa. Negatiiviset tulokset osoittavat, ettei tutkittava aine aiheuta koeolosuhteissa kromosomipoikkeavuuksia viljellyissä nisäkkäiden somaattisissa soluissa.
3. RAPORTOINTI
TUTKIMUSSELOSTUS
Tutkimusselostuksen on sisällettävä seuraavat tiedot:
|
|
Liuotin/kantaja-aine:
|
|
|
Solut:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
|
|
Johtopäätökset. |
4. KIRJALLISUUTTA
|
(1) |
Evans, H.J. (1976). Cytological Methods for Detecting Chemical Mutagens, in: Chemical mutagens, Principles and Methods for their Detection, Vol. 4, Hollaender, A., (ed) Plenum Press, New York and London, s. 1–29. |
|
(2) |
Ishidate, M.Jr. and Sofumi, T. (1985), The In Vitro Chromosomal Aberration Test Using Chinese Hamster Lung (CHL) Fibroblast Cells in Culture, in: Progress in Mutation Research, Vol. 5, Ashby, J. et al., (eds) Elsevier Science Publishers, Amsterdam-New York-Oxford, s. 427–432. |
|
(3) |
Galloway, S.M., Armstrong, M.J., Reuben, C. Colman, S., Brown, B., Cannon, C., Bloom, A.D., Nakamura, F., Ahmed, M., Duk, S., Rimpo, J., Margolin, G.H., Resnick, MA, Anderson, G. and Zeiger, E. (1978). Chromosome aberration and sister chromatic exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals, Environs, Molec. Mutagen 10 (suppl.10), s. 1–175. |
|
(4) |
Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M.Jr., Brusick, D., Ashby, J. and Myhr, B.C. (1991).Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9, Mutation Res., 257, s. 147–204. |
|
(5) |
Morita, T., Nagaki, T., Fukuda, I. and Okumura, K. (1992). Clastogenicity of low pH to Various Cultured Mammalian Cells, Mutation Res., 268, s. 297–305. |
|
(6) |
Ames, B.N., McCann, J. and Yamasaki, E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test. Mutation Res., 31, s. 347–364. |
|
(7) |
Maron, D.M. and Ames, B.N. (1983). Revised Methods for the Salmonella Mutagenicity Test, Mutation Res., 113, s. 173–215. |
|
(8) |
Natarajan, A.T., Tates, A.D., van Buul, P.P.W., Meijers, M. and de Vogel, N. (1976). Cytogenetic Effects of Mutagen/Carcinogens after Activation in a Microsomal System in Vitro, I. Induction of Chromosome Aberrations and Sister Chromatid Exchange by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes, Mutation Res., 37, s. 83–90. |
|
(9) |
Matsuoka, A., Hayashi, M. and Ishidate, M. Jr. (1979). Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In Vitro, Mutation Res., 66, s. 277–290. |
|
(10) |
Elliot, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992). Report of UK Environmental Mutagen Society Working Party. Alternatives to Aroclor 1254-induced S9 in In Vitro Genotoxicity Assays, Mutagenesis, 7, s. 175–177. |
|
(11) |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A. Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems, in: de Serres, F.J. Fouts, J.R. Bend, J.R. and Philpot, R.M. (eds), In Vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, s. 85–88. |
|
(12) |
Galloway, S.M., Aardema, M.J., Ishidate, M.Jr.. Ivett, J.L., Kirkland, D.J., Morita, T., Mosesso, P., Sofuni, T. (1994). Report from Working Group on in In Vitro Tests for Chromosomal Aberrations, Mutation Res., 312, s. 241–261. |
|
(13) |
Richardson, C, Williams, D.A., Allen, J.A., Amphlett, G., Chanter, D.O. and Phillips, B. (1989). Analysis of Data from In Vitro Cytogenetic Assays, in: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D.J., (ed) Cambridge University Press, Cambridge, s. 141–154. |
|
(14) |
Soper, K.A. and Galloway, S.M. (1994), replicate Flasks are not Necessary for In Vitro Chromosome Aberration Assays in CHO Cells, Mutation Res,, 312, s. 139–149. |
|
(15) |
Krahn, D.F., Barsky, F.C. and McCooey, K.T. (1982). CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, in: Tice, R.R., Costa, D.L., Schaich, K.M. (eds), Genotoxic Effects of Airborne Agents, New York, Plenum, s. 91–103. |
|
(16) |
Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983). Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay, Environmental Mutagenesis, 5, s. 795–801. |
|
(17) |
Locke-Huhle, C. (1983). Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest, Mutation Res., 119, s. 403–413. |
|
(18) |
Huang, Y., Change, C. and Trosko, J.E. (1983), Aphidicolin — induced endoreduplication in Chinese hamster cells, Cancer Res., 43, s. 1362–1364. |
B.11. MUTAGEENISUUS — KROMOSOMIPOIKKEAVUUSTESTI NISÄKKÄIDEN LUUYTIMESSÄ IN VIVO
1. MENETELMÄ
Tämä menetelmä on sama kuin OECD TG 475, Mammalian Bone Marrow Chromosome Aberration Test (1997).
1.1 JOHDANTO
Nisäkkäillä in vivo tehtävää kromosomipoikkeavuustestiä käytetään tutkittavan aineen aiheuttamien rakenteellisten kromosomipoikkeavuuksien osoittamiseen nisäkkäiden, yleensä jyrsijöiden, luuydinsoluissa (1) (2) (3) (4). Rakenteelliset kromosomipoikkeavuudet jakautuvat kahteen tyyppiin, kromosomi- ja kromatidipoikkeavuuksiin. Polyploidian lisääntyminen saattaa osoittaa, että kemiallinen aine voi aiheuttaa numeerisia poikkeavuuksia. Kemiallisten mutageenien aiheuttamat poikkeavuudet ovat useimmiten kromatidityyppisiä, mutta myös kromosomityyppisiä mutaatioita esiintyy. Kromosomimutaatiot ja niihin liittyvät tapahtumat ovat syynä moniin ihmisen geneettisiin sairauksiin, ja on saatu vakuuttavia todisteita siitä, että kromosomimutaatiot ja niihin liittyvä tapahtumat, jotka aiheuttavat muutoksia somaattisten solujen onkogeeneissä ja kasvunrajoitegeeneissä, ovat osallisina syövän synnyssä ihmisillä ja kokeellisissa järjestelmissä.
Tässä testissä käytetään rutiinimaisesti jyrsijöitä. Luuydin on tämän testin kohdekudos, sillä sen verisuonitus on hyvin runsasta ja se sisältää solupopulaation, jonka solusykli on nopea ja joka on helppo eristää ja prosessoida. Tätä menetelmää ei käytetä muilla lajeilla eikä muissa kohdekudoksissa.
Tämä kromosomipoikkeavuustesti soveltuu erityisesti mutageenisuuden vaaran arvioimiseen, sillä siinä voidaan ottaa huomioon tekijöitä, jotka liittyvät in vivo -metaboliaan, farmakokinetiikkaan ja DNA:n korjautumisprosesseihin, joskin näissä saattaa esiintyä eroja lajien ja kudosten välillä. In vivo -testiä voidaan käyttää myös in vitro -testissä havaitun mutageenisen vaikutuksen jatkotutkimuksena.
Jos on saatu viitteitä siitä, ettei tutkittava aine tai sen reaktiivinen metaboliitti pääse kohdekudokseen, tätä testiä ei pidä käyttää.
Ks. myös Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Kromatidipoikkeavuus: rakenteellinen kromosomivaurio, joka ilmenee yksittäisten kromatidien katkeamisena tai kromatidien katkeamisena ja uudelleenyhtymisenä.
Kromosomipoikkeavuus: rakenteellinen kromosomivaurio, joka ilmenee molempien kromatidien katkeamisena tai katkeamisena ja uudelleenyhtymisenä samassa kohdassa.
Endoreduplikaatio: tapahtumasarja, jossa DNA:n kahdentumisen S-vaiheen jälkeen tuma ei etene mitoosiin vaan aloittaa uuden S-vaiheen. Tämän seurauksena syntyy kromosomeja, joissa on 4, 8, 16, ... kromatidia.
Aukko: gap, akromaattinen leesio, joka on pienempi kuin yhden kromatidin leveys, ja johon liittyy minimaalinen kromatidin (kromatidien) siirtymä.
Numeerinen poikkeavuus: käytetyille soluille tyypillisestä normaalista kromosomimäärästä poikkeava kromosomien lukumäärä.
Polyploidia: haploidisen kromosomimäärän (n) esiintyminen moninkertaisena, muu kuin diploidinen kromosomimäärä (3n, 4n jne.).
Rakenteellinen poikkeavuus: kromosomirakenteen muutos, joka voidaan havaita solunjakautumisen metafaasivaiheen mikroskooppitutkimuksella ja joka ilmenee deleetioina ja fragmentteina, kromosomien sisäisinä tai kromosomien välisinä tekijänvaihdoksina.
1.3 TESTIN PERIAATE
Eläimet altistetaan tutkittavalle aineelle soveltuvaa altistusreittiä käyttäen ja lopetetaan sopivan ajan kuluttua altistuksesta. Ennen lopettamista eläimille annetaan ainetta, joka pysäyttää solunjakautumisen metafaasiin (esim. kolkisiinia tai Colcemid®ia). Tämän jälkeen luuydinsoluista tehdään kromosomipreparaatit ja ne värjätään, ja metafaasissa olevien solujen kromosomipoikkeavuudet analysoidaan.
1.4 TESTIN KUVAUS
1.4.1 Testin valmistelu
1.4.1.1 Eläinlajien valinta
Yleisesti käytettyjä eläinlajeja ovat rotta, hiiri ja kiinanhamsteri, mutta myös muita soveltuvia nisäkäslajeja voidaan käyttää. Koe-eläinten on oltava yleisesti käytettyä laboratoriokantaa olevia nuoria terveitä aikuisia eläimiä. Testin alkaessa eläinten painon vaihtelun on oltava minimaalista, enintään ± 20 % kummankin sukupuolen keskipainosta.
1.4.1.2 Asuinolot ja ruokinta
Yleiset olosuhteet ovat samat kuin osan B Yleisjohdannossa, mutta kosteustavoitteen on oltava 50–60 %.
1.4.1.3 Eläinten valmistelu
Terveet nuoret aikuiset eläimet jaetaan satunnaistetusti koe- ja kontrolliryhmiin. Häkit on sijoitettava siten, että häkin sijainnista johtuvat vaikutukset ovat mahdollisimman vähäisiä. Eläimet tunnistetaan yksilöllisesti. Eläimiä sopeutetaan laboratorio-olosuhteisiin vähintään viiden päivän ajan.
1.4.1.4 Annosten valmistelu
Kiinteät tutkittavat aineet liuotetaan tai sekoitetaan sopiviin liuottimiin tai kantaja-aineisiin ja laimennetaan tarvittaessa ennen kuin niitä annetaan koe-eläimille. Nestemäiset tutkittavat aineet voidaan antaa suoraan tai laimentaa ennen antamista. Tutkittava aine on valmistettava juuri ennen annostelua, paitsi jos sen säilyvyys on osoitettu stabiliteettitesteillä.
1.4.2 Koeolosuhteet
1.4.2.1 Liuotin/kantaja-aine
Liuottimella/kantaja-aineella ei saa olla myrkkyvaikutuksia käytetyillä annostasoilla, eikä sen käyttöön saa liittyä epäilyjä mahdollisista kemiallisista reaktioista tutkittavan aineen kanssa. Jos käytetään muita kuin hyvin tunnettuja liuottimia/kantaja-aineita, niiden käyttö on perusteltava niiden yhteensopivuuden osoittavilla tutkimustuloksilla. Ensisijaisesti on harkittava vesipitoisen liuottimen/kantaja-aineen käyttöä, mikäli mahdollista.
1.4.2.2 Kontrollit
Jokaiseen testiin on otettava mukaan kumpaakin sukupuolta olevat rinnakkaiset positiiviset ja negatiiviset (liuotin/kantaja-aine) kontrollit. Kontrolliryhmän eläimiä on käsiteltävä samalla tavoin kuin koeryhmän eläimiä, mutta niille ei anneta tutkittavaa ainetta.
Positiivisten kontrollien tulisi aiheuttaa rakenteellisia poikkeavuuksia in vivo -altistustasoilla, joiden odotetaan aiheuttavan poikkeavuuksien havaittavaa lisääntymistä taustaan verrattuna. Positiivisten kontrollien annokset on valittava siten, että vaikutukset ovat selvät mutta eivät paljasta heti lukijalle koodattujen objektilasien identiteettiä. Positiivinen kontrolli voidaan antaa eri reittiä kuin tutkittava aine ja näytteet voidaan ottaa vain kerran. Positiivisina kontrolleina tulisi käyttää samaan kemiallisten aineiden ryhmään kuuluvia aineita, mikäli mahdollista. Esimerkkejä positiivisista kontrolleista:
|
Aine |
CAS-nro |
EINECS-nro |
|
Etyylimetaanisulfonaatti |
62-50-0 |
200-536-7 |
|
Etyylinitrosourea |
759-73-9 |
212-072-2 |
|
Mitomysiini C |
50-07-7 |
200-008-6 |
|
Syklofosfamidi Syklofosfamidimonohydraatti |
50-18-0 6055-19-2 |
200-015-4 |
|
Trietyleenimelamiini |
51-18-3 |
200-083-5 |
Pelkkää liuotinta tai kantaja-ainetta saaneista negatiivisista kontrolleista, joita muuten on käsitelty samalla tavoin kuin koeryhmiä, on otettava näytteet jokaisella näytteenottokerralla, paitsi jos aikaisemmat tutkimustulokset osoittavat, että eläinten väliset erot ja vaihtelut kromosomipoikkeavuuksia sisältävien solujen esiintymistaajuudessa ovat hyväksyttävällä tasolla. Jos negatiivisista kontrolleista otetaan vain yksi näyte, se tulisi ottaa ensimmäisellä näytteenottokerralla. Lisäksi on käytettävä myös käsittelemättömiä kontrolleja, paitsi jos kontrolleilla aikaisemmin tehdyt tutkimukset tai julkaistut tulokset osoittavat, että valittu liuotin/kantaja-aine ei aiheuta haitallisia eikä mutageenisia vaikutuksia.
1.5 TESTIN SUORITTAMINEN
1.5.1 Eläinten lukumäärä ja sukupuoli
Jokaisessa koe- ja kontrolliryhmässä on oltava vähintään 5 analysoitavissa olevaa eläintä kumpaakin sukupuolta. Vain toista sukupuolta voidaan käyttää, mikäli tutkimusajankohtana on käytettävissä samalla eläinlajilla samaa altistusreittiä käyttäen tehtyjä tutkimuksia, joiden tulokset osoittavat, ettei myrkkyvaikutuksessa ole huomattavia eroja sukupuolten välillä. Jos ihmisen altistuminen tutkittavalle kemialliselle aineelle voi olla sukupuolesta riippuvaa, kuten joidenkin lääkeaineiden kohdalla, testi on tehtävä asianomaista sukupuolta olevilla eläimillä.
1.5.2 Altistusohjelma
Tutkittavat aineet tulisi antaa mieluiten kerta-annoksena. Ne voidaan kuitenkin antaa myös jaettuina annoksina, eli kahtena altistuksena saman päivän aikana vain muutaman tunnin välein, mikä helpottaa suurten ainemäärien antamista. Muut annosteluohjelmat on perusteltava tieteellisesti.
Näytteet on otettava kahtena ajankohtana saman päivän aikana altistuksen jälkeen. Jyrsijöillä ensimmäisen näytteenottovälin pituus on 1,5 normaalia solusykliä (solusyklin pituus on normaalisti 12–18 tuntia) altistuksen jälkeen. Koska tutkittavan aineen soluunottoon ja metaboloitumiseen kuluva aika ja sen vaikutus solusyklin kinetiikkaan voi muuttaa kromosomipoikkeavuuksien optimaalista havaitsemisajankohtaa, myöhempi näyte tulisi kerätä 24 tunnin kuluttua ensimmäisestä näytteestä. Jos tutkittavaa ainetta annetaan pitempään kuin yhden päivän ajan. yksi näyte on otettava 1,5 normaalin solusyklin kuluttua viimeisestä altistusajankohdasta.
Ennen lopettamista eläimille annetaan injektiona vatsaonteloon sopiva annos ainetta, joka pysäyttää solut metafaasivaiheeseen (esim. Colcemid®ia tai kolkisiinia). Eläimistä otetaan näytteet sopivan ajan kuluttua tämän jälkeen. Hiirillä tämä väli on noin 3–5 tuntia; kiinanhamstereilla se on noin 4–5 tuntia. Solut kerätään luuytimestä ja analysoidaan kromosomipoikkeavuuksien toteamiseksi.
1.5.3 Annostasot
Jos tehdään annoksenmääritystutkimus, koska soveltuvia tietoja ei ole käytettävissä, se on tehtävä samassa laboratoriossa käyttäen samaa lajia, samaa kantaa, samaa sukupuolta olevia eläimiä ja samaa altistusohjelmaa kuin päätutkimuksessa on tarkoitus käyttää (5). Mikäli myrkkyvaikutuksia esiintyy, ensimmäiseen näytteenottoajankohtaan asti käytetään kolmea annostasoa. Näistä suurimmalla annoksella on oltava maksimaalinen myrkkyvaikutus ja pienimmällä vähäinen tai ei lainkaan myrkkyvaikutusta. Myöhemmän näytteenottoajankohdan edellä voidaan käyttää vain suurinta annosta. Suurin annos määritellään annokseksi, joka aiheuttaa sen kaltaisia myrkyllisyysoireita, että samaa annosteluohjelmaa käytettäessä suurempien annosten voitaisiin odottaa johtavan kuolemaan. Aineet, joilla on spesifisiä biologisia vaikutuksia pieninä, myrkyttöminä annoksina (kuten hormonit ja mitogeenit), saattavat edellyttää toisenlaisia annoksenmäärityskriteerejä, ja niitä pitäisi arvioida tapauskohtaisesti. Suurin annos voidaan määritellä myös annokseksi, joka aiheuttaa joitakin myrkyllisyyteen viittaavia muutoksia luuytimessä (esim. mitoosi-indeksi pienenee yli 50 %).
1.5.4 Raja-annostesti
Ellei havaittavia myrkkyvaikutuksia esiinny testattaessa yhtä annostasoa, joka on vähintään 2 000 mg/kg (eläimen painokiloa kohti) ja joka annetaan kerta-annoksena tai kahtena annoksena saman päivän aikana, ja ellei genotoksisuutta ole odotettavissa kemialliselta rakenteeltaan samanlaisilla aineilla saatujen tutkimustulosten perusteella, täydellinen tutkimus kolmella eri annostasolla ei ehkä ole välttämätön. Pitempään kestävissä tutkimuksissa raja-annos on 2 000 mg painokiloa kohti vuorokaudessa, jos altistusta jatketaan enintään 14 vuorokautta, ja 1 000 mg/kg/vrk, jos altistus kestää yli 14 vuorokautta. Ihmisten odotettu altistus saattaa edellyttää suurempien annostasojen käyttöä raja-annostestissä.
1.5.5 Antotapa
Tutkittava aine annetaan yleensä ruokintaletkulla tai sopivalla intubaatiokanyylillä tai injektiona vatsaonteloon. Myös muut antotavat ovat mahdollisia, mikäli ne voidaan perustella. Koe-eläimen koosta riippuu, kuinka paljon nestettä voidaan antaa kerralla ruokintaletkun kautta tai injektiona. Määrä ei kuitenkaan saa olla yli 2 ml/100 g eläimen painon mukaan mitattuna. Mikäli käytetään suurempia nestemääriä, ne on perusteltava. Lukuun ottamatta ärsyttäviä tai syövyttäviä aineita, joiden vaikutukset yleensä pahenevat suurempia pitoisuuksia käytettäessä, nestemäärien vaihtelu olisi pidettävä mahdollisimman pienenä säätämällä tutkittavan aineen pitoisuuksia siten, että kokonaisnestemäärä pysyy samana kaikilla annostasoilla.
1.5.6 Kromosomipreparaatin valmistus
Luuydintä kerätään heti eläinten lopettamisen jälkeen, käsitellään hypotonisella liuoksella ja fiksoidaan. Tämän jälkeen solut levitetään objektilaseille ja värjätään.
1.5.7 Analyysi
Mitoosi-indeksi on määritettävä sytotoksisuuden mittana vähintään 1 000 solusta eläintä kohti kaikista tutkittavalle aineelle altistetuista eläimistä (myös positiivisista kontrolleista) ja altistamattomista negatiivisista kontrollieläimistä.
Jokaisesta eläimestä on analysoitava vähintään 100 solua. Määrä voi olla pienempi, mikäli havaitaan runsaasti poikkeavuuksia. Kaikki objektilasit, myös ne, joilla on positiiviset ja negatiiviset kontrollit, on koodattava toisistaan riippumattomasti ennen mikroskooppitutkimusta. Koska objektilasien valmistelu johtaa usein joidenkin metafaasissa olevien solujen rikkoutumiseen ja kromosomien menettämiseen, sentromeerien lukumäärän lasketuissa soluissa on vastattava lukua 2n ± 2.
2. TULOKSET
2.1 TULOSTEN KÄSITTELY
Yksittäisten eläinten tulokset on esitettävä taulukkomuodossa. Kokeellinen yksikkö on eläin. Jokaisesta eläimestä on arvioitava laskettujen solujen lukumäärä, poikkeavuuksien lukumäärä solua kohti ja niiden solujen prosentuaalinen osuus, joissa on yksi tai useampia rakenteellisia kromosomipoikkeavuuksia. Erityyppiset rakenteelliset kromosomipoikkeavuudet on lueteltava ja niiden lukumäärä ja esiintymistaajuus on ilmoitettava koe- ja kontrolliryhmien osalta. Aukot (gaps) rekisteröidään erikseen ja raportoidaan, mutta niitä ei yleensä lasketa mukaan kromosomipoikkeavuuksien kokonaistaajuuteen. Ellei viitteitä sukupuolten välisistä vaste-eroista ole havaittavissa, molempien sukupuolten tiedot voidaan yhdistää tilastollista analyysiä tehtäessä.
2.2 TULOSTEN ARVIOINTI JA TULKINTA
Positiivisille tuloksille on useita kriteerejä, kuten kromosomipoikkeavuuksia sisältävien solujen suhteellisen lukumäärän annoksesta riippuva suureneminen tai kromosomipoikkeavuuksia sisältävien solujen lukumäärän selvä suureneminen yksittäisessä annosryhmässä yhdellä näytteenottokerralla. Tulosten biologinen merkitys on otettava ensisijaisesti huomioon. Tilastollisia menetelmiä voidaan käyttää apuna testitulosten arvioinnissa (6). Tilastollinen merkitsevyys ei saa olla ainoa määräävä tekijä positiivisen vasteen arvioinnissa. Epäselviä tuloksia on selkeytettävä jatkotestauksella mieluiten muunnetuissa koeolosuhteissa.
Polyploidian lisääntyminen saattaa osoittaa, että tutkittava aine pystyy aiheuttamaan numeerisia kromosomipoikkeavuuksia. Endoreduplikaation lisääntyminen saattaa osoittaa, että tutkittava aine kykenee pysäyttämään solusyklin etenemisen (7) (8).
Tutkittava aine, jolla saadut tulokset eivät täytä edellä kuvattuja kriteerejä, katsotaan ei-mutageeniseksi tässä testissä.
Useimmissa testeissä saadaan selvästi positiivisia tai negatiivisia tuloksia, mutta joissakin harvinaisissa tapauksissa saatujen tulosten pohjalta ei voida tehdä varmoja päätelmiä tutkittavan aineen vaikutuksesta. Tulokset saattavat jäädä epäselviksi tai kyseenalaisiksi tehtyjen kokeiden lukumäärästä riippumatta.
In vivo -kromosomipoikkeavuustestissä saadut positiiviset tulokset osoittavat, että tutkittava aine aiheuttaa kromosomipoikkeavuuksia testatun lajin luuytimessä. Negatiiviset tulokset osoittavat, ettei tutkittava aine aiheuta koeolosuhteissa kromosomipoikkeavuuksia testatun lajin luuytimessä.
Tutkittavan aineen tai sen metaboliittien todennäköistä pääsyä yleiseen verenkiertoon tai erityisesti kohdekudokseen (esim. systeeminen toksisuus) on pohdittava.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on sisällettävä seuraavat tiedot:
|
|
Liuotin/kantaja-aine:
|
|
|
Koe-eläimet:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
|
|
Johtopäätökset. |
4. KIRJALLISUUTTA
|
(1) |
Adler, I.D. (1984). Cytogenetic Tests in Mammals, in: Mutagenicity Testing: a Practical Approach, S. Venitt and J.M. Party (eds). IRL Press, Oxford, Washington D.C., s. 275–306. |
|
(2) |
Preston, R.J., Dean, B.J., Galloway, S., Holden, H., McFee, A.F. and Shelby, M. (1987). Mammalian In Vivo Cytogenetic Assays: Analysis of Chromosome Aberrations in Bone Marrow Cells, Mutation Res., 189, s. 57–165. |
|
(3) |
Richold, M., Chandley, A., Ashby, J., Gatehouse, D.G., Bootman, J. and Henderson, L. (1990). In Vivo Cytogenetic Assays, in: D.J. Kirkland (Ed.), Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report. Part I revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, s. 115–141. |
|
(4) |
Tice, R.R., Hayashi, M., MacGregor, J.T., Anderson, D., Blakey, D.H., Holden, H.E., Kirsch-Volders, M., Oleson Jr., F.B., Pacchierotti, K, Preston, R.J., Romagna, F., Shimada, H., Sutou, S. and Vannier, B. (1994). Report from the Working Group on the In Vivo Mammalian Bone Marrow Chromosomal Aberration Test. Mutation Res., s. 312, 305–312. |
|
(5) |
Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Richold, M. (1992). Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, s. 313–319. |
|
(6) |
Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K. (1989). Statistical Analysis of In Vivo Cytogenetic Assays, in: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report Part III. Statistical Evaluation of Mutagenicity Test Data, D.J. Kirkland, (Ed.) Cambridge University Press, Cambridge, s. 184–232. |
|
(7) |
Locke-Huhle, C. (1983). Endoreduplication in Chinese hamster cells during alpha-radiation-induced G2 arrest. Mutation Res., 11 9, s. 403–413. |
|
(8) |
Huang, Y., Change, C. and Trosko, J.E. (1983). Aphidicolin — induced endoreduplication in Chinese hamster cells, Cancer Res., 43, s. 1362–1364. |
B.12. MUTAGEENISUUS — MIKROTUMATESTI NISÄKKÄÄN PUNASOLUISSA IN VIVO
1. MENETELMÄ
Tämä menetelmä on sama kuin OECD TG 474, Mammalian Erythrocyte Micronucleus Test (1997).
1.1 JOHDANTO
Nisäkkäiden in vivo -mikrotumatestiä käytetään tutkittavan aineen aiheuttamien kromosomivaurioiden tai mitoosilaitteen vaurioiden toteamiseen erytroblasteissa analysoimalla eläinten, yleensä jyrsijöiden, luuytimestä kerättyjä punasoluja ja/tai perifeerisiä verisoluja.
Mikrotumatestin tarkoituksena on tunnistaa sellaisia sytogeneettisiä vaurioita aiheuttavat aineet, jotka johtavat hitaasti liikkuvia (lagging) kromosomifragmentteja tai kokonaisia kromosomeja sisältävien mikrotumien muodostumiseen.
Kun luuytimen erytroblasti kehittyy polykromaattiseksi punasoluksi, päätuma irtoaa solusta, ja mahdollinen muodostunut mikrotuma saattaa jäädä muutoin tumattomaan solulimaan. Päätuman puuttuminen helpottaa mikrotumien havaitsemista näissä soluissa. Mikrotumaisten polykromaattisten punasolujen suurentunut esiintymistaajuus altistetuilla eläimillä on osoitus tutkittavan aineen aiheuttamasta kromosomivauriosta.
Tässä testissä käytetään rutiinimaisesti jyrsijöiden luuydintä, sillä polykromaattiset punasolut muodostuvat luuytimessä. Mikrotumaiset epäkypsät (polykromaattiset) punasolut voidaan mitata yhtä hyvin perifeerisestä verestä miltä tahansa eläinlajilta, jonka perna ei kykene poistamaan mikrotumaisia punasoluja tai jonka on todettu olevan riittävän herkkä rakenteellisia tai numeerisia kromosomipoikkeavuuksia aiheuttavien aineiden osoittamiseen. Mikrotumien erottamisessa voidaan käyttää useita kriteerejä. Näitä ovat kinetokorin tai sentromeerisen DNA:n osoittaminen mikrotumissa tai puuttuminen niistä. Mikrotumaisten epäkypsien (polykromaattisten) punasolujen esiintymistaajuus on pääasiallinen tulos. Perifeerisen veren kypsien (normokromaattisten) punasolujen lukumäärää, jossa esiintyy mikrotumia tietyssä määrässä kypsiä punasoluja, voidaan myös käyttää analyysin tuloksena, kun eläimet saavat tutkittavaa ainetta jatkuvasti vähintään 4 viikon ajan.
Tämä nisäkkäiden in vivo -mikrotumatesti soveltuu erityisesti mutageenisuuden vaaran arvioimiseen, sillä siinä voidaan ottaa huomioon tekijöitä, jotka liittyvät in vivo -metaboliaan, farmakokinetiikkaan ja DNA:n korjautumisprosesseihin, joskin näissä saattaa esiintyä eroja eri lajeilla, eri kudoksissa ja geneettisissä tuloksissa. In vivo -analyysi on hyödyllinen myös in vitro -koejärjestelmässä havaitun mutageenisen vaikutuksen jatkotutkimuksena.
Jos on saatu viitteitä siitä, että testattava aine, tai sen reaktiivinen metaboliitti, ei pääse kohdekudokseen, tätä testiä ei pidä käyttää.
Ks. myös Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Sentromeeri (kinetokori): Kromosomin alue (alueita), joihin sukkularihmat ovat kiinnittyneet solunjakautumisen aikana. Tähän perustuu tytärkromosomien järjestäytynyt siirtyminen tytärsolujen napoihin.
Mikrotumat: Pieniä solun päätumasta erillisiä ja niiden rinnalla esiintyviä tumia, jotka muodostuvat mitoosin (meioosin) telofaasin aikana hitaasti liikkuvista (lagging) kromosomikappaleista tai kokonaisista kromosomeista.
Normokromaattinen punasolu: Kypsä punasolu, josta puuttuvat ribosomit ja joka voidaan erottaa polykromaattisista punasolujen esiasteista ribosomiselektiivisillä väriaineilla.
Polykromaattinen punasolu: Punasolun esiaste, kehityksen välivaiheessa oleva (epäkypsä) punasolu, jossa on edelleen ribosomeja ja joka voidaan tämän perusteella erottaa kypsistä, normokromaattisista punasoluista ribosomiselektiivisillä väriaineilla.
1.3 TESTIN PERIAATE
Eläimet altistetaan tutkittavalle aineelle sopivaa antotapaa käyttäen. Jos käytetään luuydintä, eläimet lopetetaan sopivan ajan kuluttua altistuksesta, luuydin poistetaan ja preparaatit valmistetaan ja värjätään (1) (2) (3) (4) (5) (6) (7). Käytettäessä perifeeristä verta verinäytteet otetaan sopivina ajankohtina altistuksen jälkeen, tehdään sivelyvalmisteet ja värjätään (4) (8) (9) (10). Perifeeristä verta käyttävissä tutkimuksissa viimeisen altistuksen ja solujen keräämisen välisen ajan tulisi olla mahdollisimman lyhyt. Preparaatit analysoidaan mikrotumien toteamiseksi.
1.4 TESTIN KUVAUS
1.4.1 Testin valmistelu
1.4.1.1 Eläinlajin valinta
Luuydintä käytettäessä hiiret tai rotat ovat suositeltavia koe-eläimiä, mutta myös muita soveltuvia nisäkäslajeja voidaan käyttää. Perifeerisestä verestä tehtävissä tutkimuksissa koe-eläimiksi suositellaan hiiriä. Koe-eläimenä voidaan kuitenkin käyttää mitä tahansa sopivaa nisäkäslajia, jonka perna ei poista mikrotumaisia punasoluja tai jonka on osoitettu olevan riittävän herkkä rakenteellisia tai numeerisia poikkeavuuksia aiheuttavien aineiden toteamiseen. Koe-eläinten on oltava yleisesti käytettyä laboratoriokantaa olevia nuoria terveitä eläimiä. Tutkimuksen alkaessa eläinten painon vaihtelun on oltava minimaalista, enintään ± 20 % kummankin sukupuolen keskipainosta.
1.4.1.2 Asuinolot ja ruokinta
Yleiset olosuhteet ovat samat kuin osan B Yleisjohdannossa mainitut, mutta kosteustavoitteen on oltava 50–60 %.
1.4.1.3 Eläimen valmistelu
Terveet nuoret aikuiset eläimet jaetaan satunnaistetusti koe- ja kontrolliryhmiin. Eläimet tunnistetaan yksilöllisesti. Eläimiä sopeutetaan laboratorio-olosuhteisiin vähintään viiden päivän ajan. Häkit on sijoitettava siten, että häkin sijainnista johtuvat vaikutukset ovat mahdollisimman vähäisiä.
1.4.1.4 Annosten valmistelu
Kiinteät tutkittavat aineet liuotetaan tai sekoitetaan sopiviin liuottimiin tai kantaja-aineisiin ja laimennetaan tarvittaessa ennen kuin niitä annetaan koe-eläimille. Nestemäiset tutkittavat aineet voidaan antaa suoraan tai laimentaa ennen antamista. Tutkittava aine on valmisteltava juuri ennen annostelua, paitsi jos sen säilyvyys on osoitettu stabiliteettitesteillä.
1.4.2 Koeolosuhteet
1.4.2.1 Liuotin/kantaja-aine
Liuottimella/kantaja-aineella ei saa olla myrkkyvaikutuksia käytetyillä annostasoilla, eikä sen käyttöön saa liittyä epäilyjä mahdollisista kemiallisista reaktioista tutkittavan aineen kanssa. Jos käytetään muita kuin hyvin tunnettuja liuottimia/kantaja-aineita, niiden käyttö on perusteltava niiden yhteensopivuuden osoittavilla tutkimustuloksilla. Ensisijaisesti on harkittava vesipitoisen liuottimen/kantaja-aineen käyttöä, mikäli mahdollista.
1.4.2.2 Kontrollit
Jokaiseen testiin on otettava mukaan kumpaakin sukupuolta olevat rinnakkaiset positiiviset ja negatiiviset (liuotin/kantaja-aine) kontrollit. Kontrolliryhmän eläimiä on käsiteltävä samalla tavoin kuin koeryhmän eläimiä, mutta niille ei anneta tutkittavaa ainetta.
Positiivisten kontrollien tulisi aiheuttaa mikrotumia in vivo -altistustasoilla, joiden odotetaan aiheuttavan havaittavaa lisääntymistä taustaan verrattuna. Positiivisten kontrolliaineiden annokset on valittava siten, että vaikutukset ovat selvät mutta eivät paljasta heti lukijalle koodattujen objektilasien identiteettiä. Positiivinen kontrolliaine voidaan antaa eri reittiä pitkin kuin tutkittava aine ja näytteet voidaan ottaa vain kerran. Lisäksi positiivisina kontrolleina tulisi käyttää samaan kemiallisten aineiden ryhmän kuuluvia aineita, mikäli mahdollista. Esimerkkejä positiivisista kontrolliaineista:
|
Aine |
CAS-nro |
EINECS-nro |
|
Etyylimetaanisulfonaatti |
62-50-0 |
200-536-7 |
|
N-etyyli-N-nitrosourea |
759-73-9 |
212-072-2 |
|
Mitomysiini C |
50-07-7 |
200-008-6 |
|
Syklofosfamidi Syklofosfamidimonohydraatti |
50-18-0 6055-19-2 |
200-015-4 |
|
Trietyleenimelamiini |
51-18-3 |
200-083-5 |
Negatiivisista kontrolleista, jotka ovat saaneet pelkkää liuotinta tai kantaja-ainetta ja joita muuten on käsitelty samalla tavoin kuin koeryhmiä, on otettava näytteet jokaisella näytteenottokerralla, paitsi jos aikaisemmat tutkimustulokset osoittavat, että eläinten väliset erot ja vaihtelut mikrotumia sisältävien solujen esiintymistaajuudessa ovat hyväksyttävällä tasolla. Jos negatiivisista kontrolleista otetaan vain yksi näyte, se tulisi ottaa ensimmäisellä näytteenottokerralla. Lisäksi on käytettävä käsittelemättömiä kontrolleja, paitsi jos aikaisemmat kontrolleista tehdyt tutkimukset ja julkaistut tulokset osoittavat, ettei valittu liuotin/kantaja-aine aiheuta haitallisia eikä mutageenisia vaikutuksia.
Jos käytetään perifeeristä verta, rinnakkaiseksi negatiiviseksi kontrolliksi voidaan hyväksyä myös ennen altistusta otettu näyte, mutta vain lyhytaikaisissa perifeerisestä verestä tehtävissä testeissä (esim. 1-3 altistusta), mikäli saadut tulokset ovat aikaisempiin kontrollista saatuihin tutkimustuloksiin perustuvalla odotetulla alueella.
1.5 TESTIN SUORITTAMINEN
1.5.1 Eläinten lukumäärä ja sukupuoli
Jokaisessa koe- ja kontrolliryhmässä on oltava vähintään 5 analysoitavissa olevaa eläintä kumpaakin sukupuolta (11). Vain toista sukupuolta voidaan käyttää, mikäli tutkimusajankohtana on käytettävissä samalla eläinlajilla ja samaa antoreittiä käyttämällä tehtyjä tutkimuksia, joiden tulokset osoittavat, ettei myrkkyvaikutuksessa ole huomattavia eroja sukupuolten välillä. Jos ihmisen altistuminen tutkittavalle kemialliselle aineelle voi olla sukupuolesta riippuvaa, kuten joidenkin lääkeaineiden kohdalla, testi on tehtävä asianomaista sukupuolta olevilla eläimillä.
1.5.2 Altistusohjelma
Mitään standardia altistusohjelmaa (kuten 1, 2 tai useampia altistuksia 24 tunnin välein) ei voida suositella. Pitempien altistusohjelmien aikana kerätyt näytteet ovat hyväksyttäviä, mikäli positiivinen vaikutus on osoitettu tässä tutkimuksessa tai negatiivisessa tutkimuksessa on osoitettu myrkkyvaikutusta tai raja-annosta on käytetty ja annostelua on jatkettu näytteenoton ajankohtaan asti. Tutkittavat aineet voidaan antaa myös jaettuina annoksina, eli kaksi altistuskertaa samana päivänä muutaman tunnin välein, mikä helpottaa suurten ainemäärien antamista.
Testi voidaan tehdä kahdella tavalla:
|
a) |
Eläimet altistetaan tutkittavalle aineelle yhden kerran. Luuydinnäytteitä otetaan vähintään kaksi kertaa siten, että ensimmäinen näyte otetaan aikaisintaan 24 tunnin kuluttua altistuksesta ja viimeinen viimeistään 48 tunnin kuluttua altistuksesta ja näytteenottokertojen välillä on sopiva väli. Mikäli näytteitä otetaan aikaisemmin kuin 24 tunnin kuluttua, perustelut on esitettävä. Perifeerisestä verestä otetaan näytteitä vähintään kaksi kertaa siten, että ensimmäinen näyte otetaan aikaisintaan 36 tunnin kuluttua altistuksesta ja seuraavat sopivan ajan kuluttua siitä, kuitenkin viimeistään 72 tunnin kuluttua altistuksesta. Mikäli positiivinen vaste havaitaan yhden näytteenottokerran jälkeen, lisänäytteitä ei tarvita. |
|
b) |
Jos päivittäisiä altistuskertoja on 2 tai enemmän (esim. kaksi tai useampia altistuksia 24 tunnin välein), näytteet on kerättävä luuytimestä kerran 18-24 tunnin kuluttua viimeisestä altistuksesta ja perifeerisestä verestä kerran 36–48 tunnin kuluttua viimeisestä altistuksesta (12). |
Tarvittaessa voidaan näytteitä ottaa muinakin ajankohtina.
1.5.3 Annostasot
Jos tehdään annoksenmääritystutkimus, koska soveltuvia tietoja ci ole käytettävissä, se on tehtävä samassa laboratoriossa käyttäen samaa lajia, samaa kantaa, samaa sukupuolta olevia eläimiä ja samaa altistusohjelmaa kuin päätutkimuksessa on tarkoitus käyttää (13). Mikäli myrkkyvaikutuksia esiintyy, ensimmäiseen näytteenottoajankohtaan asti käytetään kolmea annostasoa. Näistä suurimmalla annoksella on oltava maksimaalinen myrkkyvaikutus ja pienimmällä vähäinen tai ei lainkaan myrkkyvaikutusta. Myöhemmän näytteenottoajankohdan edellä voidaan käyttää vain suurinta annosta. Suurin annos määritellään annokseksi, joka aiheuttaa sen kaltaisia myrkyllisyysoireita, että samaa annosteluohjelmaa käytettäessä suurempien annosten voitaisiin odottaa johtavan kuolemaan. Aineet, joilla on spesifisiä biologisia vaikutuksia pieninä, myrkyttöminä annoksina (kuten hormonit ja mitogeenit) saattavat edellyttää toisenlaisia annoksenmäärityskriteerejä, ja niitä pitäisi arvioida tapauskohtaisesti. Suurin annos voidaan määritellä myös annokseksi, joka aiheuttaa joitakin myrkyllisyyteen viittaavia muutoksia luuytimessä (esim. punasolujen esiasteiden osuuden pieneneminen punasolujen kokonaismäärästä luuytimessä tai perifeerisessä veressä).
1.5.4 Raja-annostesti
Ellei havaittavia myrkkyvaikutuksia esiinny testattaessa yhtä annostasoa, joka on vähintään 2 000 mg/kg (eläimen painokiloa kohti) ja joka annetaan kerta-annoksena tai kahtena annoksena saman päivän aikana, ja ellei genotoksisuutta ole odotettavissa kemialliselta rakenteeltaan samanlaisilla aineilla saatujen tutkimustulosten perusteella, täydellinen tutkimus kolmella eri annostasolla ei ehkä ole välttämätön. Pitempään kestävissä tutkimuksissa raja-annos on 2 000 mg painokiloa kohti vuorokaudessa, jos altistusta jatketaan enintään 14 vuorokautta, ja 1 000 mg/kg/vrk, jos altistus kestää yli 14 vuorokautta. Ihmisten odotettu altistus saattaa edellyttää suurempien annostasojen käyttöä raja-annostestissä.
1.5.5 Antotapa
Tutkittava aine annetaan yleensä ruokintaletkulla tai sopivalla intubaatiokanyylillä tai injektiona vatsaonteloon. Myös muut antotavat ovat mahdollisia, mikäli ne voidaan perustella. Koe-eläimen koosta riippuu, kuinka paljon nestettä voidaan antaa kerralla ruokintaletkun kautta tai injektiona. Määrä ei kuitenkaan saa olla yli 2 ml/100 g eläimen painon mukaan mitattuna. Mikäli käytetään suurempia nestemääriä, ne on perusteltava. Lukuun ottamatta ärsyttäviä tai syövyttäviä aineita, joiden vaikutukset yleensä pahenevat suurempia pitoisuuksia käytettäessä, nestemäärien vaihtelu olisi pidettävä mahdollisimman pienenä säätämällä tutkittavan aineen pitoisuuksia siten, että kokonaisnestemäärä pysyy samana kaikilla annostasoilla.
1.5.6 Luuydin-/veripreparaatit
Luuydinsolut kerätään yleensä reisiluista tai sääriluista heti koe-eläinten lopettamisen jälkeen. Solut otetaan reisi- tai sääriluista, niistä tehdään preparaatit ja ne värjätään vakiintuneilla värjäysmenetelmillä. Perifeerinen veri kerätään häntälaskimosta tai muusta sopivasta verisuonesta. Verisolut värjätään heti supravitaaliväreillä (8) (9) (10) tai niistä tehdään ensin sivelyvalmisteet ja värjätään sen jälkeen. DNA-spesifisten väriaineiden käyttö [esim. akridiinioranssi (14) tai Hoechst 33258 plus pyroniini-Y (15)] voi eliminoida joitakin ei-DNA-spesifisen väriaineen käyttöön liittyviä artefakteja. Tämä etu ei sulje pois tavanomaisten väriaineiden (esim. Giemsa) käyttöä. Myös muita järjestelmiä [esim. selluloosapylväitä tumallisten solujen poistamiseksi (16)] voidaan käyttää, mikäli nämä menetelmät on laboratoriossa osoitettu riittävän toimiviksi mikrotumapreparaattien valmistamisessa.
1.5.7 Analyysi
Punasolujen esiasteiden osuus koko punasolumäärästä (esiasteet + kypsät punasolut) määritetään jokaisen eläimen osalta erikseen laskemalla yhteensä vähintään 200 punasolua luuytimestä ja 1 000 punasolua perifeerisestä verestä (17). Kaikki objektilasit, myös ne, joilla on positiiviset ja negatiiviset kontrollit, on koodattava toisistaan riippumattomasti ennen mikroskooppitutkimusta. Vähintään 2 000 punasolun esiastetta lasketaan eläintä kohti mikrotumaisten punasolujen esiasteiden esiintymistiheyden määrittämistä varten. Lisätietoja voidaan saada laskemalla mikrotumat kypsistä punasoluista. Objektilaseja analysoitaessa punasolujen esiasteiden osuuden punasolujen kokonaismäärästä tulisi olla vähintään 20 % kontrolliarvosta. Kun koe-eläimille annetaan tutkittavaa ainetta jatkuvasti 4 viikon ajan tai pitempään, voidaan laskea myös vähintään 2 000 kypsää punasolua eläintä kohti mikrotumien esiintymistiheyden toteamiseksi. Automaattiset analyysijärjestelmät (kuva-analyysi ja solususpensioiden virtaussytometria) ovat hyväksyttäviä vaihtoehtoja manuaaliselle arvioinnille, mikäli ne perustellaan ja validoidaan asianmukaisesti.
2. TULOKSET
2.1 TULOSTEN KÄSITTELY
Yksittäisten eläinten tulokset on esitettävä taulukkomuodossa. Kokeellinen yksikkö on eläin. Punasolujen esiasteiden laskettu määrä, mikrotumaisten punasolujen esiasteiden lukumäärä ja punasolujen esiasteiden osuus koko punasolumäärästä on lueteltava kunkin analysoidun eläimen osalta erikseen. Mikäli eläimille annetaan tutkittavaa ainetta jatkuvasti 4 viikon ajan tai pitempään, myös kypsien punasolujen tiedot on ilmoitettava, mikäli niitä on kerätty. Punasolujen esiasteiden osuus koko punasolumäärästä ja, jos katsotaan aiheelliseksi, mikrotumaisten punasolujen prosentuaalinen määrä ilmoitetaan jokaisen eläimen osalta. Ellei viitteitä sukupuolten välisistä vaste-eroista ole havaittavissa, molempien sukupuolten tiedot voidaan yhdistää tilastollista analyysiä tehtäessä.
2.2 TULOSTEN ARVIOINTI JA TULKINTA
Positiivisille tuloksille on useita kriteerejä, kuten mikrotumaisten solujen lukumäärän annoksesta riippuva suureneminen tai mikrotumaisten solujen lukumäärän selvä suureneminen yksittäisessä annosryhmässä yhdellä näytteenottokerralla. Tulosten biologinen merkitys on otettava ensisijaisesti huomioon. Tilastollisia menetelmiä voidaan käyttää apuna testitulosten arvioinnissa (18) (19). Tilastollinen merkitsevyys ei saa olla ainoa määräävä tekijä positiivisen vasteen arvioinnissa. Epäselviä tuloksia on selkeytettävä jatkotestauksella, mieluiten muunnetuissa koeolosuhteissa.
Testattava aine, jolla saadut tulokset eivät täytä edellä kuvattuja kriteerejä, katsotaan ei-mutageeniseksi tässä testissä.
Useimmissa testeissä saadaan selvästi positiivisia tai negatiivisia tuloksia, mutta joissakin harvinaisissa tapauksissa saatujen tietojen pohjalta ei voida tehdä varmoja päätelmiä tutkittavan aineen vaikutuksesta. Tulokset saattavat jäädä epäselviksi tai kyseenalaisiksi kokeen toistokertojen määrästä riippumatta.
Mikrotumatestissä saadut positiiviset tulokset osoittavat, että tutkittava aine aiheuttaa mikrotumia, jotka ovat seurausta kromosomivauriosta tai mitoosilaitteen vauriosta testatun lajin punasoluissa. Negatiiviset tulokset osoittavat, ettei tutkittava aine aiheuta koeolosuhteissa mikrotumia testattujen lajien punasolujen esiasteissa.
Tutkittavan aineen tai sen metaboliittien todennäköistä pääsyä yleiseen verenkiertoon tai erityisesti kohdekudokseen (esim. systeeminen toksisuus) on pohdittava.
3. RAPORTOINTI
TUTKIMUSSELOSTUS
Tutkimusselostuksen on sisällettävä seuraavat tiedot:
|
|
Liuotin/kantaja-aine:
|
|
|
Koe-eläimet:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
|
|
Johtopäätökset. |
4. KIRJALLISUUTTA
|
(1) |
Heddle, J.A. (1973), A Rapid In Vivo Test for Chromosomal Damage, Mutation Res., 18, s. 187–190. |
|
(2) |
Schmid, W. (1975), The Micronucleus Test, Mutation Res., 31, s. 9–15. |
|
(3) |
Heddle, J.A., Salamonc, M.F., Hite, M., Kirkhart, B., Mavournin, K., MacGregor, J.G. and Newell, G.W. (1983), The Induction of Micronuclei as a Measure of Genotoxicity, Mutation Res. 123, s. 61–118. |
|
(4) |
Mavournin, K. H., Blakey, D.H., Cimino, M.C., Salamone, M.F. and Heddle, J.A. (1990), The In Vivo Micronucleus Assay in Mammalian Bone Marrow and Peripheral Blood. A report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 239, s. 29–80. |
|
(5) |
MacGregor, J.T., Schlegel, R., Choy, W.N. and Wehr, C.M. (1983), Micronuclei in Circulating Erythrocytes: A Rapid Screen for Chromosomal Damage During Routine Toxicity Testing in Mice, in: Developments in Science and Practice of Toxicology, ed. A.W. Hayes, R.C. Schnell and T.S. Miya, Elsevier, Amsterdam, s. 555–558. |
|
(6) |
MacGregor, J.T., Heddle, J.A., Hite, M., Margolin, G.H., Ramel, C., Salamone, M.F., Tice, R.R., and Wild, D. (1987), Guidelines for the Conduct of Micronucleus Assays in Mammalian Bone Marrow Erythrocytes, Mutation Res., 189, s. 103–112. |
|
(7) |
MacGregor, J.T., Wehr, C.M., Henika, P.R. and Shelby, M.E. (1990), The in vivo Erythrocyte Micronucleus Test: Measurement at Steady State Increases Assay Efficiency and Permits Integration with Toxicity Studies, Fund. Appl. Toxicol. 14, s. 513–522. |
|
(8) |
Hayashi, M., Morita, T., Kodama, Y., Sofuni, T. and Ishidate, M. Jr. (1990), The Micronucleus Assay with Mouse Peripheral Blood Reticulocytes Using Acridine Orange-Coated Slides, Mutation Res., 245, s. 245–249. |
|
(9) |
The Collaborative Study Group for the Micronucleus Test (1992), Micronucleus Test with Mouse Peripheral Blood Erythrocytes by Acridime Orange Supravital Staining: The Summary Report of the 5th Collaborative Study by CSGMT/JEMMS. MMS, Mutation Res., 278, s. 83–98. |
|
(10) |
The Collaborative Study Group for the Micronucleus Test (CSGMT/JEMMS. MMS: The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan) (1995), Protocol recommended for the short-term mouse peripheral blood micronucleus test, Mutagenesis, 10, s. 53–159. |
|
(11) |
Hayashi, M., Tice, R.R., MacGregor, J.T., Anderson, D., Blackey, D.H., Kirsch-Volders, M., Oleson, Jr.F.B., Pacchicrotti, F., Romagna, F., Shimada, H. Sutou, S. and Vannier, B. (1994), In Vivo Rodent Erythrocyte Micronucleus Assay, Mutation Res., 312, s. 293–304. |
|
(12) |
Higashikuni, N. and Sutou, S. (1995). An optimal, generalized sampling time of 30 ± 6 h after double dosing in the mouse peripheral micronucleus test, Mutagenesis, 10, s. 313–319. |
|
(13) |
Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Rochold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose Setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, s. 313–319. |
|
(14) |
Hayashi, M., Sofuni, T. and Ishidate, M. Jr. (1983), An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test, Mutation Res., 120, s. 241–247. |
|
(15) |
MacGregor, J.T., Wehr, C.M. and Langlois, R.G. (1983), A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyronin Y, Mutation Res., 120, s. 269–275. |
|
(16) |
Romagna, F. and Staniforth, C.D. (1989), The automated bone marrow micronucleus test, Mutation Res., 213, s. 91–104. |
|
(17) |
Gollapudi, B. and McFadden, L.G. (1995), Sample size for the estimation of polychromatic to normochromatic erythrocyte ratio in the bone marrow micronucleus test, Mutation Res., 347, s. 97–99. |
|
(18) |
Richold, M., Ashby, J., Bootman, J., Chandley, A., Gatehouse, D.G. and Henderson, L. (1990), In Vivo Cytogenetics Assay, in: D.J. Kirkland (ed.), Basic Mutagenicity tests, UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part I, revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, s. 115–141. |
|
(19) |
Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson R., Richold, M., Papworth, D.G. and Savage, J.R.K. (1989), Statistical Analysis of In Vivo Cytogenetic Assays, in: D.J. Kirkland (ed.), Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part III, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, s. 184–232. |
B.13/14. MUTAGEENISUUS — TAKAISINMUTAATIOTESTI BAKTEEREILLA
1. MENETELMÄ
Tämä menetelmä on sama kuin OECD TG 471 Bacterial Reverse Mutation Test (1997).
1.1 JOHDANTO
Bakteereilla tehtävässä takaisinmutaatiotestissä käytetään Salmonella typhimurium- ja Escherichia coli -bakteereiden aminohappoja vaativia kantoja sellaisten pistemutaatioiden havaitsemiseksi, joihin liittyy DNA:n yhden tai useamman emäsparin korvautuminen, ylimäärä tai deleetio (1) (2) (3). Tämän bakteereilla tehtävän takaisinmutaatiotestin periaate on, että se paljastaa mutaatiot, jotka korjaavat testikannassa olevat mutaatiot ja palauttavat bakteerien toiminnallisen kyvyn syntetisoida essentiaalista aminohappoa. Revertantit bakteerit tunnistetaan siitä, että ne pystyvät kasvamaan, vaikka testibakteerikannan ennen takaisinmutaatiota tarvitsema aminohappo puuttuu.
Pistemutaatiot aiheuttavat monia ihmisen geneettisiä sairauksia, ja on saatu vakuuttavia todisteita siitä, että somaattisten solujen onkogeeneissä ja kasvunrajoitegeeneissä olevat pistemutaatiot ovat osallisina ihmisten ja koe-eläinten kasvainten muodostumisessa. Bakteereilla tehtävä takaisinmutaatiotesti on nopea, edullinen ja suhteellisen helposti toteutettava testi. Monilla testikannoilla on useita ominaisuuksia, joiden ansiosta ne osoittavat herkästi mutaatiot. Näitä ovat esimerkiksi herkästi reagoivat DNA-jaksot takaisinmutaatiokohdissa, solujen lisääntynyt läpäisevyys suurille molekyyleille ja DNA:n korjausjärjestelmien eliminoituminen tai virheille alttiiden DNA:n korjausprosessien lisääntyminen. Testikantojen spesifisyys voi tuottaa hyödyllistä tietoa genotoksisten aineiden aiheuttamien mutaatioiden tyypistä. Käytettävissä on hyvin laaja tietokanta bakteerien takaisinmutaatiotestien tuloksista erittäin monissa rakenteissa, ja vakiintuneita menetelmiä on kehitetty fysikaalis-kemiallisilta ominaisuuksiltaan erilaisten kemiallisten aineiden, myös haihtuvien yhdisteiden, testaamista varten.
Ks. myös yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Takaisinmutaatiotesti joko Salmonella typhimurium- tai Escherichia coli -bakteereilla osoittaa aminohappoa vaativassa kannassa (edellisessä histidiini ja jälkimmäisessä tryptofaani) mutaation, jonka seurauksena syntyy ulkopuolisesta aminohapon saannista riippumaton kanta.
Emäsparin korvautumista aiheuttavat mutageenit ovat aineita, jotka aiheuttavat emäksen vaihtumisen DNA:ssa. Takaisinmutaatiotestissä tämä vaihtuminen saattaa tapahtua alkuperäisen mutaation kohdassa tai jossakin muussa bakteerigenomin kohdassa.
Lukukehyksensiirtomutageenit ovat aineita, jotka aiheuttavat yhden tai useamman emäsparin ylimäärän tai vajauksen DNA:ssa, mikä muuttaa lukukehystä (reading frame) RNA:ssa.
1.3 ALUSTAVAT VALMISTELUT
Bakteereilla tehtävässä takaisinmutaatiotestissä käytetään prokaryoottisoluja, jotka poikkeavat nisäkässoluista soluunoton, metabolian, kromosomirakenteen ja DNA:n korjautumisprosessien suhteen. In vitro -testit vaativat yleensä eksogeenista metabolista aktivaatiojärjestelmää. In vitro -metaboliset aktivaatiojärjestelmät eivät pysty täysin jäljittelemään nisäkässolujen in vivo -olosuhteita. Testistä ei sen vuoksi voida suoraan päätellä aineen mutageenisuutta ja karsinogeenisuutta nisäkkäillä.
Bakteereilla tehtävää takaisinmutaatiotestiä käytetään yleisesti genotoksisuuden, ja varsinkin pistemutaatioita aiheuttavan vaikutuksen, alustavana seulontamenetelmänä. Laaja tietokanta on osoittanut, että monilla kemiallisilla aineilla, joilla saadaan positiivinen tulos tässä tutkimuksessa, todetaan mutageenista vaikutusta myös muissa tutkimuksissa. On myös esimerkkejä mutageenisista aineista, joita ei voida todeta tällä testillä. Nämä epäonnistumiset voivat johtua todetun tulostapahtuman spesifisestä luonteesta, metabolisen aktivaation eroista tai aineen erilaisesta biologisesta hyödynnettävyydestä. Toisaalta takaisinmutaatiotestin herkkyyttä lisäävät tekijät voivat johtaa mutageenisen aktiivisuuden liialliseen stimulaatioon.
Bakteereilla tehtävä takaisinmutaatiotesti ei välttämättä sovellu tiettyjen kemiallisten aineryhmien testaamiseen. Tällaisia ovat esimerkiksi voimakkaasti bakterisidiset yhdisteet (esim. tietyt antibiootit) ja aineet, joiden arvellaan (tai tiedetään) vaikuttavan erityisesti nisäkässolun kahdentumisjärjestelmään (esim. jotkut topoisomeraasin estäjät ja jotkut nukleosidianalogit). Nisäkkäillä tehtävät mutaatiotestit saattavat soveltua paremmin näihin tapauksiin.
Vaikka monet tässä testissä positiivisen tuloksen antavat kemialliset aineet ovat karsinogeenisia nisäkkäillä, korrelaatio ei ole ehdoton. Se riippuu aineryhmän kemiallisista ominaisuuksista, eikä kaikkia karsinogeeneja voida todeta tällä testillä, koska ne vaikuttavat muiden, ei-genotoksisten mekanismien tai bakteerisoluista puuttuvien mekanismien välityksellä.
1.4 TESTIN PERIAATE
Bakteerisolususpensiot altistetaan tutkittavalle aineelle eksogeenisen metabolisen aktivaatiojärjestelmän läsnäollessa tai ilman sitä. Maljainkorporoitumismenetelmässä nämä suspensiot sekoitetaan overlay-agariin ja levitetään heti minimaalisen kasvualustan pinnalle. Preinkubaatiomenetelmässä tutkittavaa ainetta sisältävää seosta inkuboidaan, minkä jälkeen se sekoitetaan overlay-agariin ennen kuin se levitetään minimaalisen kasvualustan pinnalle. Molemmissa menetelmissä revertantit pesäkkeet lasketaan 2–3 päivän inkubaatioajan jälkeen ja niiden määrää verrataan spontaanien revertanttien pesäkkeiden määrään pelkkää liuotinta sisältävissä kontrollimaljoissa.
Takaisinmutaatiotesti bakteereilla voidaan tehdä useilla eri menetelmillä. Yleisesti käytettyjä ovat maljainkorpo-roitumismenetelmä (1) (2) (3) (4), preinkubaatiomenetelmä (2) (3) (5) (6) (7) (8), fluktuaatiomenetelmä (9) (10) ja suspensiomenetelmä (11). Kaasujen ja höyryjen testaamiseen käytettäviä muunnelmia on myös kuvattu (12).
Tässä menetelmässä kuvataan pääasiassa maljainkorporoitumis- ja preinkubaatiomenetelmiä. Niillä molemmilla voidaan tehdä kokeita sekä metabolisen aktivaatiojärjestelmän läsnäollessa että ilman sitä. Jotkut aineet voidaan havaita tehokkaammin preinkubaatiomenetelmällä. Nämä kuuluvat sellaisiin kemiallisten aineiden ryhmiin, joihin kuuluu lyhytketjuisia alifaattisia nitrosoamiineja, kaksiarvoisia metalleja, aldehydejä, atsovärejä ja diatsoyhdisteitä, pyrollitsidiinialkaloideja, allyyliyhdisteitä ja nitroyhdisteitä (3). On todettu myös, että tiettyjä mutageeniryhmiä ei pystytä aina toteamaan standardeilla menetelmillä, kuten maljainkorporoitumis- tai preinkubaatiomenetelmällä. Näitä on pidettävä erikoistapauksina, ja niiden toteamiseen tulisi ehdottomasti käyttää vaihtoehtoisia menetelmiä. Seuraavat erikoistapaukset on voitu tunnistaa (sekä esimerkkejä toimenpiteistä, joita voidaan käyttää niiden toteamisessa): atsovärit ja diatsoyhdisteet (3) (5) (6) (13), kaasut ja haihtuvat kemialliset aineet (12) (14) (15) (16) ja glykosidit (17) (18). Poikkeaminen standardista menetelmästä on perusteltava tieteellisesti.
1.5 TESTIN KUVAUS
1.5.1 Testin valmistelu
1.5.1.1 Bakteerit
Tuoreita bakteeriviljelmiä on kasvatettava myöhäiseen eksponentiaaliseen tai varhaiseen stationääriseen kasvuaiheeseen (noin 109 solua/ml). Myöhäisessä stationäärivaiheessa olevia viljelmiä ei pidä käyttää. Oleellista on, että kokeessa käytettävät viljelmät sisältävät elinkykyisiä soluja suurina tittereinä. Titteri voidaan osoittaa joko aikaisemmissa kontrollitutkimuksissa saatujen kasvukäyrien perusteella tai määrittämällä jokaisessa analyysissä elinkykyisten solujen lukumäärät maljakokeella.
Suositeltu inkubaatiolämpötila on 37 oC.
On käytettävä vähintään viittä bakteerikantaa. Näihin tulee sisältyä neljä S. typhimurium -kantaa (TA 1535; TA 1537 tai TA97a tai TA97; TA98; ja TA100), joiden on osoitettu olevan luotettavia ja joilla on saatu toistettavissa oleva vaste eri laboratorioissa. Näissä neljässä S. typhimurium -kannassa on GC-emäsparit primaarisessa takaisinmutaatiokohdassa, ja tiedetään, että ne eivät ehkä paljasta tiettyjä hapettavia mutageeneja, ristisidoksia muodostavia aineita eivätkä hydratsiineja. Tällaiset aineet voidaan todeta E. coli WP2 -kannoilla tai S. typhimurium TA 102 -kannalla (19), joissa on AT-emäspari primaarisessa takaisinmutaatiokohdassa. Suositeltava kantojen yhdistelmä on tämän vuoksi:
|
— |
S. typhimurium TA 1535, ja |
|
— |
S. typhimurium TA 1537 tai TA97 tai TA97a, ja |
|
— |
S. typhimurium TA98, ja |
|
— |
S. typhimurium TA100, ja |
|
— |
E. coli WP2 uvrA tai E. coli WP2 uvrA (pKM101) tai S. typhimurium TA102. |
Ristisidoksia muodostavien mutageenien toteamiseksi mukaan tulisi ehkä käyttää TA102-kantaa tai käyttää lisäksi DNA:n korjautumiseen kykenevää E. coli -kantaa (esim. E. coli WP2 tai E. coli WP2 (pKM101)).
Varastoviljelmien valmistuksessa, markkerien vahvistamisessa ja säilytyksessä on käytettävä vakiintuneita menetelmiä. Kasvuun vaadittavien aminohappojen tarve on osoitettava kunkin jäädytetyn varastoviljelmäpreparaatin osalta erikseen (S. typhimurium -kannoilla histidiini ja E. coli -kannoilla tryptofaani). Muut fenotyyppiset ominaisuudet on tarkistettava vastaavasti. Niitä ovat: R-tekijäplasmidien esiintyminen tai puuttuminen, mikäli sillä on merkitystä (ampisilliiniresistenssi kannoissa TA98, TA100 ja TA97a tai TA97, WP2 uvrA ja WP2 uvrA (pKM101) ja ampisilliini- ja tetrasykliiniresistenssi kannassa TA102); tyypillisten mutaatioiden esiintyminen (kristalliviolettiherkkyyden aiheuttama rfa-mutaatio S. typhimurium -bakteerissa ja ultraviolettivaloherkkyyden aiheuttama uvrA-mutaatio E. coli -bakteerissa tai uvrB-mutaatio S. typhimurium -bakteerissa) (2) (3). Kantojen tuottamien spontaanien revertanttien pesäkkeiden määrän tulisi myös olla laboratoriokohtaisten vertailuarvojen esiintymistiheysalueella ja mieluiten kirjallisuudessa raportoidulla alueella.
1.5.1.2 Kasvatusväliaine
Käytetään sopivaa minimaalista agaria (sisältää esim. Vogel-Bonner minimal medium E:tä ja glukoosia) ja ’overlay’-agaria. joka sisältää histidiiniä ja biotiinia tai tryptofaania, jotta muutama solunjakautuminen voi tapahtua (1) (2) (9).
1.5.1.3 Metabolinen aktivaatio
Bakteerit on altistettava tutkittavalle aineelle sekä sopivan metabolisen aktivaatiojärjestelmän läsnäollessa että ilman sitä. Yleisimmin käytetty aktivaatiojärjestelmä on entsyymejä indusoivilla aineilla, kuten Aroclor 1254:11ä (1) (2) tai fenobarbitonin ja ß-naftoflavonin (18) (20) (21) yhdistelmällä, käsiteltyjen jyrsijöiden maksasta eristetty postmitokondriaalinen jae (S9), johon on lisätty kofaktoria. Käytetty postmitokondriaalisen jakeen pitoisuus S9-seoksessa on yleensä 5–30 % v/v. Metabolisen aktivaatiojärjestelmän valinta tai sen pois jättäminen saattaa riippua siitä, millaiseen kemiallisten aineiden ryhmään tutkittava aine kuuluu. joissakin tapauksissa saattaa olla perusteltua käyttää useampia kuin yhtä postmitokondriaalisen jakeen pitoisuutta. Pelkistävä metabolinen aktivaatiojärjestelmä saattaa soveltua paremmin atsovärien ja diatsoyhdisteiden tutkimiseen (6) (13).
1.5.1.4 Tutkittava aine/valmistelu
Kiinteät tutkittavat aineet liuotetaan tai sekoitetaan sopiviin liuottimiin tai kantaja-aineisiin ja laimennetaan tarvittaessa ennen bakteerien altistamista. Nestemäiset tutkittavat aineet voidaan lisätä suoraan koejärjestelmään ja/tai laimentaa ennen käsittelyä. Tutkittava aine on valmisteltava juuri ennen altistusta, paitsi jos säilyvyys on osoitettu stabiliteettitutkimuksilla.
Liuotin/kantaja-aine ei saa olla sellainen, että sen voidaan epäillä reagoivan kemiallisesti tutkittavan aineen kanssa, eikä se saa vaikutta solujen elinkykyyn eikä S9-aktiivisuuteen (22). Jos käytetään muita kuin hyvin tunnettuja liuottimia/kantaja-aineita, niiden yhteensopivuuden osoittavat tutkimustulokset on esitettävä. Vesipitoisen liuottimen/kantaja-aineen käyttöä tulisi harkita ensisijaisesti aina, kun se on mahdollista. Testattaessa aineita, jotka ovat epästabiileja vedessä, orgaanisten liuottimien tulisi olla vedettömiä.
1.5.2 Koeolosuhteet
1.5.2.1 Testikannat (ks. 1.5.1.1)
1.5.2.2 Altistuspitoisuus
Tutkittavan aineen suurinta testattavaa pitoisuutta määritettäessä on otettava huomioon aineen sytotoksisuus ja liukoisuus altistuksessa käytettävään lopulliseen seokseen.
Myrkkyvaikutus ja liukenemattomuus saattaa olla hyödyllistä määrittää alustavalla kokeella. Sytotoksisuus voidaan havaita revertanttien pesäkkeiden lukumäärän pienenemisestä, taustakasvuston kirkastumisesta tai vähenemisestä tai solujen eloonjäämisasteesta käsitellyissä viljelmissä. Aineen sytotoksisuus saattaa muuttua metabolisten aktivaatiojärjestelmien läsnäollessa. Liukenemattomuus on arvioitava lopullisen seoksen paljaalla silmällä havaittavan sakkautumisen perusteella todellisissa koeolosuhteissa.
Liukoisten, ei-sytotoksisten aineiden suositeltu testattava maksimipitoisuus on 5 mg/malja tai 5 ul/malia. Testattaessa ei-sytotoksisia aineita, jotka eivät ole liukoisia pitoisuuksissa 5 mg/malja tai 5 μl/malja. yhden tai useamman testattavan pitoisuuden on oltava liukenemattomia lopullisessa altistusseoksessa. Jos tutkittava aine on sytotoksinen jo pienempinä pitoisuuksina kuin 5 mg/malja tai 5 μl/malja, se olisi testattava sytotoksiseen pitoisuuteen asti. Sakka ei saisi vaikuttaa laskentaan.
Alustavassa kokeessa on käytettävä ainakin viittä erisuuruista tutkittavan aineen analysoitavissa olevaa pitoisuutta siten, että testauspisteiden välillä on noin puolen log:n (√10) väli. Pitoisuus-vastesuhdetta tutkittaessa voi olla syytä käyttää pienempiä välejä. Arvioitaessa aineita, jotka sisältävät huomattavia määriä mahdollisia mutageenisia epäpuhtauksia, voidaan harkita testaamista myös suuremmilla pitoisuuksilla kuin 5 mg/malja tai 5 μl/malja.
1.5.2.3 Negatiiviset ja positiiviset kontrollit
Jokaisessa testissä on käytettävä myös kannan suhteen spesifisiä rinnakkaisia positiivisia ja negatiivisia (liuotin tai kantaja-aine) kontrolleja sekä metabolisen aktivaatiojärjestelmän läsnäollessa että ilman sitä. Positiivisen kontrolliaineen pitoisuudet on valittava siten, että ne tuovat esiin kunkin testin tehokkuuden.
Testeissä, joissa käytetään metabolista aktivaatiojärjestelmää, positiivinen (positiiviset) kontrolliaine(et) on valittava käytettävien bakteerikantojen tyypin perusteella.
Seuraavassa on esimerkkejä sopivista positiivisista kontrolliaineista testeissä, joissa käytetään metabolista aktivaatiota:
|
Aine |
CAS-nro |
EINECS-nro |
|
9,10-dimetyyliantraseeni |
781-43-1 |
212-308-4 |
|
7,12-dimetyylibents[a]antraseeni |
57-97-6 |
200-359-5 |
|
bentso[a]pyreeni |
50-32-8 |
200-028-5 |
|
2-aminoantraseeni |
613-13-8 |
210-330-9 |
|
syklofosfamidi |
50-18-0 |
|
|
syklofosfamidimonohydraatti |
6055-19-2 |
200-015-4 |
Seuraava aine sopii positiiviseksi kontrollialueeksi pelkistävää metabolista aktivaatiota käytettäessä:
|
Aine |
CAS-nro |
EINECS-nro |
|
Congo Red |
573-58-0 |
209-358-4 |
2-aminoantraseenia ei pidä käyttää ainoana S9-seoksen tehon indikaattorina. Jos 2-aminoantraseenia käytetään, jokainen S9-erä on karakterisoitava myös mutageenilla, joka vaatii mikrosomaalisiin entsyymeihin perustuvaa metabolista aktivaatiota, esim. bentso[a]pyreenilla, dimetyylibentsantraseenilla.
Seuraavat aineet ovat esimerkkejä kannan suhteen spesifisistä positiivisista kontrolleista, joita voidaan käyttää ilman eksogeenista metabolista aktivaatiojärjestelmää tehtävissä testeissä:
|
Aine |
CAS-nro |
EINECS-nro |
Kanta |
|
natriumatsidi |
26628-22-8 |
247-852-1 |
TA 1535 ja TA 100 |
|
2-nitrofluoreeni |
607-57-8 |
210-138-5 |
TA 98 |
|
9-aminoakridiini |
90-45-9 |
201-995-6 |
TA 1537, TA 97 ja TA 97a |
|
ICR 191 |
17070-45-0 |
241-129-4 |
TA 1537, TA 97 ja TA 97a |
|
kumeenihydroperoksidi |
80-15-9 |
201-254-7 |
TA 102 |
|
mitomysiini C |
50-07-7 |
200-008-6 |
WP2uvrA ja TA 102 |
|
N-etyyli-N-nitro-N-nitrosoguanidiini |
70-25-7 |
200-730-1 |
WP2, WP2uvrA ja WP2uvrA(pKM101) |
|
4-nitrokinoliini-l-oksidi |
56-57-5 |
200-281-1 |
WP2, WP2uvrA ja WP2uvrA(pKM101) |
|
furyylifuramidi (AF2) |
3688-53-7 |
|
plasmidin sisältävät kannat |
Myös muita soveltuvia positiivisia kontrolleja voidaan käyttää. Samaan kemiallisten aineiden ryhmään kuuluvien positiivisten kontrollien käyttöä on harkittava, mikäli niitä on käytettävissä.
Lisäksi on käytettävä pelkkää liuotinta tai kantaja-ainetta negatiivisina kontrolleina, jotka eivät sisällä tutkittavaa ainetta mutta joita muutoin käsitellään samalla tavoin. Lisäksi on käytettävä käsittelemättömiä kontrolleja, paitsi jos kontrolleista saadut aikaisemmat tutkimustulokset osoittavat, ettei valittu liuotin aiheuta haitallisia eikä mutageenisia vaikutuksia.
1.5.3 Testin suorittaminen
Maljainkorporoitumismenetelmässä (1) (2) (3) (4), jossa ei käytetä metabolista aktivaatiota, 0,05 ml tai 0,1 ml tutkittavia liuoksia, 0,1 ml tuoretta bakteeriviljelmää (noin 108 elinkykyistä solua) ja 0,5 ml steriiliä puskuria sekoitetaan 2 ml:aan ’overlay’-agaria. Metabolista aktivaatiojärjestelmää käytettäessä 0,5 ml metabolista aktivaatioseosta. jossa on riittävä määrä postmitokondriaalista jaetta (pitoisuus 5–30 % v/v metabolisessa aktivaatioseoksessa), sekoitetaan ’overlay’-agariin (2,0 ml) yhdessä bakteerien ja tutkittavan aineen/tutkittavan liuoksen kanssa. Jokaisen koeputken sisältö sekoitetaan ja kaadetaan minimaalisen agarmaljan pinnalle. ’Overlay’-agarin annetaan jähmettyä ennen inkubaatiota.
Preinkubaatiomenetelmässä (2) (3) (5) (6) tutkittavaa ainetta/tutkittavaa liuosta esi-inkuboidaan testikannan (noin 108 elinkykyistä solua) ja steriilin puskurin tai metabolisen aktivaatiojärjestelmän (0,5 ml) kanssa yleensä vähintään 20 minuuttia 30–37 oC:ssa, ennen kuin se sekoitetaan ’overlay’-agariin ja kaadetaan minimaalisen agarmaljan pinnalle. Yleensä 0,05 tai 0,1 ml tutkittavaa ainetta/tutkittavaa liuosta, 0,1 ml bakteereja ja 0,5 ml S9-seosta tai steriiliä puskuria sekoitetaan 2,0 ml:aan ’overlay’-agaria. Koeputket tulisi ilmata preinkubaation aikana sekoittajaa käyttäen.
Riittävän arvion tekemiseksi hajonnasta on käytettävä kolmea rinnakkaista maljaa kullakin annostasolla. Kaksoismaljauksen käyttö on mahdollista, mikäli se voidaan perustella tieteellisesti. Satunnainen maljan menetys ei välttämättä mitätöi analyysiä.
Kaasumaisia tai haihtuvia aineita tulisi testata asianmukaisin menetelmin, esimerkiksi suljetuissa astioissa (12) (14) (15) (16).
1.5.4 Inkubaatio
Kaikkia tiettyyn testiin kuuluvia maljoja on inkuboitava 37 oC:ssa 48–72 tunnin ajan. Inkubaatioajan jälkeen lasketaan revertanttien pesäkkeiden lukumäärä maljaa kohti.
2. TULOKSET
2.1 TULOSTEN KÄSITTELY
Tulokset on ilmoitettava revertanttien pesäkkeiden lukumääränä maljaa kohti. Revertanttien pesäkkeiden määrä sekä negatiivisissa (liuotinainekontrolli ja käsittelemätön kontrolli, jos käytetty) että positiivisissa kontrollimaljoissa on myös ilmoitettava. Maljakohtaiset lukumäärät, revertanttien pesäkkeiden maljakohtaisten määrien keskiarvo ja keskihajonta on ilmoitettava tutkittavan aineen ja positiivisten ja negatiivisten (käsittelemättömät ja/tai liuotinaine) kontrollien osalta.
Selvää positiivista vastetta ei tarvitse vahvistaa. Epäselvät tulokset on selvitettävä jatkotestauksella mieluiten muunnelluissa koeolosuhteissa. Negatiiviset tulokset on vahvistettava tapauskohtaisesti. Ellei negatiivisten tulosten vahvistamista jossakin tapauksessa pidetä tarpeellisena, tämä päätös on perusteltava. Tutkimusparametrien muuttamista koeolosuhteiden monipuolistamiseksi on harkittava seurantatutkimuksia tehtäessä. Mahdollisia muutettavia tutkimusparametreja ovat pitoisuusvälit, altistusmenetelmä (maljainkorporoitumiskoe tai nesteen preinkubointi) ja metaboliset aktivaatiojärjestelmät.
2.2 TULOSTEN ARVIOINTI JA TULKINTA
Positiivisille tuloksille on useita kriteerejä, kuten pitoisuudesta riippuva revertanttien pesäkkeiden maljakohtaisen lukumäärän suureneminen koko testatulla annosalueella ja/tai toistettavissa oleva lisääntyminen yhdellä tai useammalla pitoisuustasolla vähintään yhdessä kannassa joko metabolista aktivaatiojärjestelmää käytettäessä tai ilman sitä (23). Tulosten biologinen merkitys on otettava ensisijaisesti huomioon. Tilastollisia menetelmiä voidaan käyttää apuna testitulosten arvioinnissa (24). Tilastollinen merkitsevyys ei saa kuitenkaan olla ainoa määräävä tekijä positiivisen vasteen arvioinnissa.
Tutkittava aine, jolla saadut tulokset eivät täytä edellä kuvattuja kriteerejä, katsotaan ei-mutageeniseksi tässä testissä.
Useimmissa testeissä saadaan selvästi positiivisia tai negatiivisia tuloksia, mutta joissakin harvinaisissa tapauksissa saatujen tietojen pohjalta ei voida tehdä varmoja päätelmiä tutkittavan aineen vaikutuksesta. Tulokset saattavat jäädä epäselviksi tai kyseenalaisiksi kokeen toistokertojen määrästä riippumatta.
Bakteereilla tehtävässä takaisinmutaatiotestissä saadut positiiviset tulokset osoittavat, että tutkittava aine aiheuttaa pistemutaatioita emässubstituutioiden tai lukukehyksensiirtojen kautta joko Salmonella typhimurium- ja/tai Escherichia coli -bakteerien genomissa. Negatiiviset tulokset osoittavat, ettei testattava aine ole koeolosuhteissa mutageeninen testatulla lajilla.
3. RAPORTOINTI
TUTKIMUSSELOSTUS
Tutkimusselostuksen on sisällettävä seuraavat tiedot:
|
|
Liuotin/kantaja-aine:
|
|
|
Kannat:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
|
|
Johtopäätökset. |
4. KIRJALLISUUTTA
|
(1) |
Ames, B. N., McCann, J. and Yamasaki E. (1975), Methods of Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test, Mutation Res., 31, s. 347–364. |
|
(2) |
Maron, D. M. and Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation Res., 113, s. 173–215. |
|
(3) |
Gatehouse, D., Haworth, S., Cebula, T., Gocke, E., Kier, L., Matsushima, T., Melcion, C, Nohmi, T., Venitt, S. and Zeiger, E. (1994), Recommendations for the Performance of Bacterial Mutation Assays, Mutation Res., 312, s. 217–233. |
|
(4) |
Kier, L. D., Brusick D. J., Auletta, A. E., Von Halle, E. S., Brown, M. M., Simmon, V. F., Dunkel, V., McCann, J., Mortelmans, K., Prival, M., Rao, T. K. and Ray V. (1986), The Salmonella typhimurium/Mammalian Microsomal Assay: A Report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 168, s. 69–240. |
|
(5) |
Yahagi, T., Degawa, M., Seino, Y. Y., Matsushima, T., Nagao, M., Sugimura, T. and Hashimoto, Y. (1975), Mutagenicity of Carcinogen Azo Dyes and their Derivatives, Cancer Letters 1, s. 91-96. |
|
(6) |
Matsushima, M., Sugimura, T., Nagao, M., Yahagi, T., Shirai, A. and Sawamura, M. (1980), Factors Modulating Mutagenicity Microbial Tests, in: Short-term Test Systems for Delecting Carcinogens, ed. Norpoth K. H. and Garner, R. C, Springer, Berlin-Heidelberg-New York, s. 273–285. |
|
(7) |
Gatehouse, D. G., Rowland. I. R., Wilcox, P., Callender, R. D. and Foster, R. (1980), Bacterial Mutation Assays, in: Basic Mutagenicity Tests: UKEMS Part I Revised, ed. D. J. Kirkland, Cambridge University Press, s. 13–61. |
|
(8) |
Aeschacher, H. U., Wolleb. U. and Porchet, E. (1987), Liquid Preincubation Mutagenicity Test for Foods. J. Food Safety, 8, s. 167–77. |
|
(9) |
Green, M. H. L., Muriel, W. J. and Bridges, B. A. (1976), Use of a simplified fluctuation test to detect low levels of mutagens, Mutation Res., 38, s. 33–42. |
|
(10) |
Hubbard, S. A., Green, M. H. L, Gatehouse, D. and Bridges, J. W. (1984), The Fluctuation Test in Bacteria, in: Handbook of Mutagenicity Test Procedures, 2nd Edition, ed. Kilbey, B. J., Legator, M., Nichols, W. and Ramel, C, Elsevier, Amsterdam-New York-Oxford, s. 141–161. |
|
(11) |
Thompson, E. D. and Melampy, P. J. (1981), An Examination of the Quantitative Suspension Assay for Mutagenesis With Strains of Salmonella typhimurium, Environmental Mutagenesis, 3, s. 45–465. |
|
(12) |
Araki, A., Noguchi, T., Kato, F. and Matsushima, T. (1994), Improved Method for Mutagenicity Testing of Gaseous Compounds by Using a Gas Sampling Bag, Mutation Res., 307, s. 335–344. |
|
(13) |
Prival, M. J., Bell, S. J., Mitchell, V. D., Reipert, M. D. and Vaughan, V. L. (1984), Mutagenicity of Benzidine and Benzidinc-Congener Dyes and Selected Monoazo Dyes in a Modified Salmonella Assay, Mutation Res., 136, s. 33–47. |
|
(14) |
Zeiger, E., Anderson. B. E., Haworth, S., Lawlor, T. and Mortelmans, K. (1992), Salmonella Mutagenicity Tests. V. Results from the Testing of 311 Chemicals, Environ. Mol. Mutagen., 19, s. 2–141. |
|
(15) |
Simmon, V., Kauhanen, K. and Tardiff, R. G. (1977), Mutagenic Activity of Chemicals Identified in Drinking Water, in Progress in Genetic Toxicology, D. Scott, B. Bridges and F., Sobels (eds.) Elsevier, Amsterdam, s. 249–258. |
|
(16) |
Hughes, T. J., Simmons, D. M., Monteith, I. G. and Claxton, L. D. (1987), Vaporisation Technique to Measure Mutagenic Activity of Volatile Organic Chemicals in the Ames /Salmonella Assay, Environmental Mutagenesis, 9, s. 421–441. |
|
(17) |
Matsushima, T., Matsumoto, A., Shirai, M., Sawamura, M., and Sugimura, T. (1979), Mutagenicity of the Naturally Occurring Carcinogen Cycasin and Synthetic Methylazoxy Methane Conjugates in Salmonella typhimurium, Cancer Res., 39, s. 3780–3782. |
|
(18) |
Tamura, G., Gold, C, Ferro-Luzzi, A. and Ames, B. N. (1980), Fecalase: A Model for Activation of Dietary Glycosides to Mutagens by Intestinal Flora, Proc. Natl. Acad. Sci. USA, 77, s. 4961–4965. |
|
(19) |
Wilcox, P., Naidoo, A., Wedd, D. J. and Gatehouse, D. G. (1990), Comparison of .Salmonella typhimurium TA 102 with Escherichia coli WP2 Tester strains, Mutagenesis, 5, s. 285–291. |
|
(20) |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A Safe Substitute for Polychlorinated Biphenyls as an Inducer or Metabolic Activation Systems, in: In vitro Metabolic Activation in Mutagenesis Testing, eds. F. J. de Serres et al. Elsevier, North Holland, s. 85–88. |
|
(21) |
Elliot. B. M., Combes, R. D., Elcombe, C. R., Gatehouse, D. G., Gibson, G. G., Mackay, J. M. and Wolf, R. C. (1992), Alternativcs to Aroclor 1254-induccd 89 in in vitro Genotoxicity Assays, Mutagenesis, 7, s. 175–177. |
|
(22) |
Maron, D., Katzenellenbogen, J. and Ames, B. N. (1981), Compatibility of Organic Solvents with the Salmonella/Microsome Test, Mutation Res., 88, s. 343–350. |
|
(23) |
Claxton, L. D., Allen, J., Auletta, A., Mortelmans, K., Nestmann, E. and Zeiger, E. (1987), Guide for the Salmonella typhimurium/Mammalian Microsome Tests for Bacterial Mutagenicity, Mutation Res., 189, s. 83–91. |
|
(24) |
Mahon, G. A. T., Green, M. H. L, Middleton, B., Mitchel, I., Robinson, W. D. and Tweats, D. J. (1989), Analysis of Data from Microbial Colony Assays, in: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, Part II. Statistical Evaluation of Mutagenicity Test Data, ed. Kirkland, D. J., Cambridge University Press, s. 28–65. |
B.15. MUTAGEENISUUSTESTAUS JA KARSINOGEENISTEN AINEIDEN SEULONTA GEENIMUTAATIOT — SACCHAROMYCES CEREVISIAE
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Saccharomyces cerevisiae -hiivalla on joukko haploidisia ja diploidisia kantoja, joiden avulla voidaan mitata kemiallisten aineitten kykyä aiheuttaa geenimutaatioita ilman metabolista aktivaatiota tai metabolisen aktivaation jälkeen.
Testeissä on käytetty haploidisten kantojen mutaatioita, esim. punaisen, adeniinia vaativan kannan (ade-1 ade-2) mutaatiota kaksinkertaisen määrän adeniinia vaativaksi valkoiseksi kannaksi, ja selektiivisiä koejärjestelyitä, kuten kanavnaiini- ja sykloheksimidiresistenssin induktiota.
Laajimmin tutkitussa takaisinmutaatiojärjestelmässä käytetään haploidista XV 185-14C -kantaa, jolla on ’ochre’-nonsense- mutaatiot ade 2-1, arg 4-17, lys 1-1 ja trp 5-48, joiden takaisinmutaatiota saavat aikaan sellaiset emäsvaihdoksia aiheuttavat mutageenit, jotka aiheuttavat paikkaspesifisiä mutaatioita tai ’ochre’-suppressorimutaatioita. XV 185-14C -kannalla on myös his 1-7 -markkeri, missensemutaatio, jonka takaisinmutaatiota saavat aikaan lähinnä muissa kohdissa tapahtuvat mutaatiot, ja hom 3-10 -markkeri, jonka takaisinmutaatiota saavat aikaan lukuraamiinsiirtomutageenit.
Diploidisista S. cerevisiae -kannoista ainoa laajassa käytössä oleva on D7, joka on homotsygoottinen geenin ilv 1-92 suhteen.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Tutkittavat aineet ja kontrolliaineet tulee sekoittaa soveltuvaan kantaja-aineeseen juuri ennen testiä. Veteen liukenemattomia orgaanisia yhdisteitä tutkittaessa saa orgaanisen liuottimen, kuten etanolin, asetonin tai dimetyylisulfoksidin (UMSO) loppupitoisuus olla korkeintaan 2 tilavuus- %. Kantaja-aineen loppupitoisuus ei saa merkitsevästi vaikuttaa solujen elinkykyyn ja kasvuominaisuuksiin.
Solut on altistettava tutkittaville aineille sekä ilman eksogeenista metabolista aktivaatiojärjestelmää että soveltuvan eksogeenisen aktivaatiojärjestelmän läsnäollessa.
Yleisimmin käytetty aktivaatiojärjestelmä on entsyymejä indusoivilla aineilla käsiteltyjen jyrsijöiden maksoista eristetty postmitokondriaalinen jae, johon on lisätty kofaktoreita. Myös muista lajeista, muista kudoksista tai muista postmitokondriaalisista jakeista peräisin olevat valmisteet tai muut menetelmät saattavat soveltua metaboliseen aktivaatioon.
Koeolosuhteet
Geenimutaatiotutkimuksissa yleisimmin käytetyt kannat ovat haploidinen XV 185-14C -kanta ja diploidinen D7-kanta. Myös muut kannat saattavat soveltua tarkoitukseen.
Hiivojen kuolleisuuden määrittämiseen ja mutanttien määrien laskemiseen käytetään soveltuvia kasvatusalustoja.
Testissä on käytettävä rinnakkaisia altistamattomia, testattavan aineen liuottimelle altistettuja ja positiivisia kontrolliviljelmiä. Kunkin tutkittavan mutaation kohdalla on käytettävä soveltuvia positiivisia kontrolliaineita.
Tutkittava aine on testattava vähintään viitenä eri pitoisuutena, joiden keskinäiset erot ovat sopivat. Myrkyllisillä aineilla korkein testattu pitoisuus ei saa aiheuttaa yli 5-10 %.m kuolleisuutta. Huonosti veteen liukenevilla aineilla liukoisuus määrää korkeimman tutkittavan pitoisuuden. Vesiliukoisten myrkyttömien aineiden korkein tutkittava pitoisuus on päätettävä tapauskohtaisesti.
Maljoja inkuboidaan pimeässä 28–30 oC:n lämpötilassa 4–7 vrk:n ajan.
Testissä on käytettävä jatkoviljelmiä, joiden spontaanimutaatioiden frekvenssi on normaalina pidettävällä tasolla.
Kussakin pitoisuudessa maljat tehdään ainakin kolmena kappaleena geenimutaation tuottamien prototrofien määrän laskemista ja solujen kuolleisuuden määrittämistä varten. Kokeissa, joissa käytetään alhaisen mutaatiofrekvenssin omaavia markkereita, kuten hom 3–10, rinnakkaisten maljojen määrää on lisättävä tilastollisesti käyttökelpoisten tulosten saamiseksi.
Testin suorittaminen
S. cerevisiae -solujen altistus suoritetaan tavallisesti nesteessä stationäärivaiheessa olevilla tai kasvavilla soluilla. Ensimmäinen koe on tehtävä kasvavilla soluilla, siten että 1-5 x 107 solua/ml altistetaan tutkittavalle aineelle ja seosta ravistellaan 18 tunnin ajan 28–37 oC:ssa; altistuksen aikana seokseen lisätään sopiva määrä metabolista aktivaatioseosta, tarpeen mukaan. Altistuksen jälkeen solut sentrifugoidaan, huuhdotaan ja kylvetään sopivalle kasvatusalustalle. Inkubaation jälkeen maljoilta lasketaan solujen kuolleisuus ja tapahtuneet geenimutaatiot. Jos ensimmäisen kokeen tulos on negatiivinen, tehdään toinen koe stationäärivaiheessa olevilla soluilla. Jos ensimmäisen kokeen tulos on positiivinen, tulos varmistetaan soveltuvalla erillisellä kokeella.
2. TULOKSET
Tulokset on esitettävä taulukkoina siten, että niistä käyvät ilmi pesäkkeiden lukumäärä, mutanttien lukumäärä, kuolleisuus ja mutaatiofrekvenssi. Kaikki tulokset on varmistettava erillisellä kokeella. Tulosten merkitsevyys on arvioitava soveltuvin tilastollisin menetelmin.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
käytetty kanta, |
|
— |
koeolosuhteet: stationäärivaiheessa olevien tai kasvavien solujen käyttö, kasvatusalustojen koostumus, inkubaatiolämpötila ja inkubaatioaika, metabolinen aktivaatiojärjestelmä, |
|
— |
altistusolosuhteet: altistuspitoisuudet, altistusmenetelmä ja altistuksen kesto, altistuslämpötila, positiiviset ja negatiiviset kontrollit, |
|
— |
pesäkkeiden lukumäärä, mutanttien lukumäärä, kuolleisuus, mutaatiofrekvenssi, annos/vastesuhde mikäli mahdollista, tulosten tilastollinen käsittely, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.16. MITOOTTINEN REKOMBINAATIO — SACCHAROMYCES CEREVISIAE
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Saccharomyces cerevisiae -hiivalla esiintyy mitoottista rekombinaatiota sekä geenien välillä (tai yleisemmin ottaen geenin ja sentromeerin välillä) että geenien sisällä. Ensin mainittu ilmiö on nimeltään mitoottinen tekijäinvaihto ja siinä kaksi sisarkromatidia vaihtaa keskenään osia. Jälkimmäinen ilmiö on yleensä yksisuuntainen ja nimeltään geenikonversio. Tekijäinvaihtotutkimukset perustuvat yleensä heterotsygoottiseen kantaan ilmaantuvien resessiivisten homotsygoottisten pesäkkeiden tai maljasektoreiden laskentaan, kun taas geenikonversioiden tutkiminen perustuu prototrofisten revertanttien laskentaan auksotrofisilla heteroalleelisilla kannoilla, joilla on kaksi erilaista viallista alleelia samasta geenistä. Yleisimmin mitoottisen geenikonversion tutkimiseen käytettyjä kantoja ovat D4 (heteroalleelinen ade 2 ja trp 5 -lokusten suhteen), D7 (heteroalleelinen trp 5 -lokuksen suhteen), BZ34 (heteroalleelinen arg 4 -lokuksen suhteen) ja JD1 (heteroalleelinen his 4 ja trp 5 -lokusten suhteen). Mitoottista tekijäinvaihtoa voidaan testata kannoilla D5 ja D7 (jälkimmäisellä voidaan havainnoida myös mitoottista geenikonversiota ja takaisinmutaatiota ilv 1-92 -lokuksessa), jotka kummatkin ovat heteroalleelisia ade 2 -lokuksen komplementtigeenien suhteen ja joissa mitoottinen tekijäinvaihdos ilmenee maljoilla punaisina tai vaaleanpunaisina homotsygoottisina sektoreina.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Tutkittavat aineet sekä kontrolli- tai vertailuyhdisteet on sekoitettava soveltuvaan kantaja-aineeseen juuri ennen testiä. Veteen liukenemattomia orgaanisia yhdisteitä tutkittaessa saa orgaanisen liuottimen, kuten etanolin, asetonin tai dimetyylisulfoksidin (DMSO) loppupitoisuus olla korkeintaan 2 tilavuus- %. Kantaja-aineen loppupitoisuus ei saa merkitsevästi vaikuttaa solujen elinkykyyn ja kasvuominaisuuksiin.
Solut on altistettava tutkittaville aineille sekä ilman eksogeenista metabolista aktivaatiojärjestelmää että soveltuvan eksogeenisen aktivaatiojärjestelmän läsnäollessa. Yleisimmin käytetty aktivaatiojärjestelmä on entsyymejä indusoivilla aineilla käsiteltyjen jyrsijöiden maksoista eristetty postmitokondriaalinen jae, johon on lisätty kofaktoreita. Myös muista lajeista, muista kudoksista tai muista postmitokondriallisista jakeista peräisin olevat valmisteet tai muut menetelmät saattavat soveltua metaboliseen aktivaatioon.
Koeolosuhteet
Yleisimmin käytettyjä ovat diploidiset kannat D4, D5, D7 ja JD1. Myös muut kannat saattavat soveltua tarkoitukseen.
Hiivojen kuolleisuuden ja mitoottisen rekombinaatiofrekvenssin määrittämiseen käytetään soveltuvia kasvatusalustoja.
Testissä on käytettävä rinnakkaisia altistamattomia, testattavan aineen liuottimelle altistettuja ja positiivisia kontrolliviljelmiä. Kunkin tutkittavan rekombinaation kohdalla on käytettävä soveltuvia positiivisia kontrolliaineita.
Tutkittava aine on testattava vähintään viitenä eri pitoisuutena, joiden keskinäiset erot ovat sopivat. Huomioon otettavia seikkoja ovat mm. aineen sytomyrkyllisyys ja liukoisuus. Alin pitoisuus ei saa lainkaan lisätä solujen kuolleisuutta. Myrkyllisillä aineilla korkein testattu pitoisuus ei saa aiheuttaa yli 5–10 %:n kuolleisuutta. Huonosti veteen liukenevilla aineilla liukoisuus määrää korkeimman tutkittavan pitoisuuden. Vesiliukoisten myrkyttömien aineiden korkein tutkittava pitoisuus on päätettävä tapauskohtaisesti.
Solut voidaan altistaa tutkittavalle aineelle joko stationäärivaiheessa tai kasvuvaiheessa, ja pisin altistusaika voi olla 18 tuntia. Pitkässä altistuksessa viljelmiä on kuitenkin seurattava mikroskoopilla mahdollisen itiönmuodostuksen varalta, sillä itiönmuodostus pilaa testin.
Maljoja inkuboidaan pimeässä 28–30 oC:n lämpötilassa 4–7 vrk:n ajan. Maljoja, joilta tutkitaan mitoottisen tekijäinvaihdoksen aikaansaamat punaiset ja vaaleanpunaiset homotsygoottiset sektorit, on inkuboinnin jälkeen säilytettävä jääkaapissa (noin 4 oC:ssa) yhdestä kahteen vuorokautta ennen laskemista, jotta pesäkkeiden väri ehtii kehittyä.
Testissä on käytettävä jatkoviljelmiä, joiden spontaaninen mitoottinen rekombinaatiofrekvenssi on normaalina pidettävällä tasolla.
Kussakin pitoisuudessa maljat tehdään ainakin kolmena kappaleena mitoottisen geenikonversion tuottamien prototrofien määrän laskemista ja solujen kuolleisuuden määrittämistä varten. Kokeissa, joissa lasketaan mitoottisen tekijäinvaihdon aikaansaamia resessiivisiä homotsygootteja, rinnakkaisten maljojen määrää on lisättävä riittävän pesäkemäärän saamiseksi.
Testin suorittaminen
S. cerevisiae -solujen altistus suoritetaan tavallisesti nesteessä stationäärivaiheessa olevilla tai kasvavilla soluilla. Ensimmäinen koe on tehtävä kasvavilla soluilla, siten että 1-5 x 107 solua/ml altistetaan tutkittavalle aineelle ja seosta ravistellaan 18 tunnin ajan 28–37 oC:ssa; altistuksen aikana seokseen lisätään sopiva määrä metabolista aktivaatioseosta, mikäli tarpeellista.
Altistuksen jälkeen solut sentrifugoidaan, huuhdotaan ja kylvetään sopivalle kasvatusalustalle. Inkubaation jälkeen maljoilta lasketaan solujen kuolleisuus ja tapahtuneet mitoottiset rekombinaatiot.
Jos ensimmäisen kokeen tulos on negatiivinen, tehdään toinen koe stationäärivaiheessa olevilla soluilla. Jos ensimmäisen kokeen tulos on positiivinen, tulos varmistetaan erillisellä kokeella.
2. TULOKSET
Tulokset on esitettävä taulukkoina siten, että niistä käyvät ilmi pesäkkeiden lukumäärä, rekombinanttien lukumäärä, kuolleisuus ja rekombinaatiofrekvenssi.
Tulokset on varmistettava erillisellä kokeella.
Tulosten merkitsevyys on arvioitava soveltuvin tilastollisin menetelmin.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
käytetty kanta, |
|
— |
koeolosuhteet: stationäärivaiheessa olevien tai kasvavien solujen käyttö, kasvatusalustojen koostumus, inkubaatiolämpötila ja inkubaatioaika, aineenvaihdunnallinen aktivaatiojärjestelmä, |
|
— |
altistusolosuhteet: altistuspitoisuudet, altistusmenetelmä ja altistuksen kesto, altistuslämpötila, positiiviset ja negatiiviset kontrollit, |
|
— |
pesäkkeiden lukumäärä, rekombinanttien lukumäärä, kuolleisuus, rekombinaatiofrekvenssi, annos/vastesuhde mikäli mahdollista, tulosten tilastollinen käsittely, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta, |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.17. MUTAGEENISUUS — GEENIMUTAATIOTESTI NISÄKÄSSOLUILLA IN VITRO
1. MENETELMÄ
Tämä menetelmä on sama kuin OECD TG 476, In Vitro Mammalian Cell Gene Mutation Test (1997).
1.1 JOHDANTO
Nisäkässoluviljelmissä tehtävää in vitro -geenimutaatiotestiä voidaan käyttää kemiallisten aineiden aiheuttamien geenimutaatioiden toteamiseen. Sopivia solulinjoja ovat hiiren lymfoomasolulinja L5178Y, kiinanhamsterin solulinjat CHO, CHO-AS52 ja V79 ja ihmisen lymfoblastoidisolulinja TK6 (1). Näissä solulinjoissa yleisimmin käytetyt geneettiset tulostapahtumat mittaavat tymidiinikinaasi- (TK) ja hypoksantiini-guaniinifosforibosyyli-transferaasilokusten (HPRT) mutaatioita ja ksantiiniguaniinifosforibosyylitransferaasin (XPRT) transgeeniä. TK-, HPRT- ja XPRT-mutaatiotesteillä voidaan havaita erilaisia geneettisiä tapahtumia. Koska TK ja XPRT sijaitsevat autosomissa, niiden avulla voidaan ehkä havaita sellaisia geneettisiä tapahtumia (esim. suuria deleetioita), joita ei voida havaita X-kromosomicn HPRT-lokuksessa (2) (3) (4) (5) (6).
Nisäkässoluilla tehtävissä in vitro -geenimutaatiotesteissä voidaan käyttää pysyvien solulinjojen tai solukantojen viljelmiä. Solujen valintakriteereinä käytetään niiden kykyä kasvaa viljelmässä ja niiden spontaanimutaatiotaajuuden stabiliteettia.
In vitro tehtävät testit vaativat yleensä eksogeenista metabolista aktivaatiota. Tällainen metabolinen aktivaatiojärjestelmä ei pysty täysin jäljittelemään in vivo -olosuhteita nisäkkäissä. On pyrittävä välttämään erityisesti sellaisia olosuhteita, joissa saatavat positiiviset tulokset eivät heijasta aineen luontaista mutageenisuutta ja saattavat johtua pH:n muutoksista, osmolaliteetista tai voimakkaasta sytotoksisuudesta (7).
Tätä testiä käytetään nisäkkäiden mahdollisten mutageenien ja karsinogeenien seulontaan. Monet yhdisteet, joilla saadaan positiivinen tulos tässä testissä, ovat nisäkkäiden karsinogeeneja. Tämän testin ja karsinogeenisuuden välillä ei kuitenkaan ole täydellistä korrelaatiota. Korrelaatio riippuu aineryhmän kemiallisista ominaisuuksista, ja yhä useammat tutkimustulokset viittaavat siihen, että on olemassa karsinogeeneja, joita ei voida havaita tällä testillä, koska ne näyttävät vaikuttavan muiden, ei-genotoksisten mekanismien tai bakteerisoluista puuttuvien mekanismien välityksellä (6).
Ks. myös Yleinen johdanto Osa B.
1.2 MÄÄRITELMÄT
Forward-mutaatio: geenin mutaatio parentaalisesta tyypistä mutanttimuotoon, minkä seurauksena geenin koodittama valkuaisaine menettää entsymaattisen aktiivisuutensa tai sen entsyymiaktiivisuus muuttuu.
Emäsparien korvautumista aiheuttavat mutageenit: aineita, jotka aiheuttavat yhden tai useamman emäsparin substituution DNA:ssa.
Lukukehyksensiirtomutageenit: aineita, jotka aiheuttavat yhden tai useamman emäsparin ylimäärän tai vajauksen DNA-molekyylissä.
Fenotyypin ilmentymisaika: ajanjakso, jonka aikana muuttumattomat geenituotteet poistuvat hiljattain mutatoituneista soluista.
Mutaatiotaajuus: todettu mutanttien solujen lukumäärä jaettuna elinkykyisten solujen määrällä.
Suhteellinen kokonaiskasvu: solumäärän suureneminen tietyssä ajassa verrattuna kontrollina käytettävään solupopulaatioon; lasketaan tulona, joka saadaan kertomalla keskenään suspensiokasvu suhteessa negatiiviseen kontrolliin ja kloonaustehokkuus suhteessa negatiiviseen kontrolliin.
Suhteellinen suspensiokasvu: solujen lukumäärän suureneminen ilmentymisajan kuluessa verrattuna negatiiviseen kontrolliin.
Elinkykyisyys: tutkittavalle aineelle altistettujen solujen kloonaustehokkuus maljausajankohtana selektiivisissä olosuhteissa ilmentymisajan jälkeen.
Eloonjääneisyys: tutkittavalle aineelle altistettujen solujen kloonaustehokkuus maljattaessa altistusjakson lopussa; eloonjääneisyys ilmoitetaan yleensä suhteessa kontrollina käytetyn solupopulaation eloonjääneisyyteen.
1.3 TESTIN PERIAATE
Solut, joista TK+/- → TK-/- -mutaation seurauksena puuttuu tymidiinikinaasi (TK), ovat resistenttejä pyrimidiinianalogitrifluorotymidiinin (TFT) sytotoksisille vaikutuksille. Tymidiinikinaasin läsnä ollessa solut ovat herkkiä TFT:lle, joka estää solun aineenvaihduntaa ja pysäyttää solunjakautumisen. Mutantit solut kykenevät siis lisääntymään TFT:n läsnä ollessa, kun taas normaalit, tymidiinikinaasia sisältävät, solut eivät kykene. Vastaavasti solut, joista puuttuu HPRT- tai XPRT-entsyymi, ovat resistenttejä 6-tioguaniinille (TG) tai 8-atsaguaniinille (AG). Tutkittavan aineen ominaisuuksiin on kiinnitettävä erityistä huomiota, jos selektiivisen aineen emäsanalogia tai sille kemiallisesti sukua olevaa ainetta testataan millä tahansa nisäkässoluissa tehtävällä geenimutaatiotestillä. Esimerkiksi tutkittavan aineen mahdollinen epäilty selektiivinen myrkkyvaikutus mutantteihin ja ei-mutantteihin soluihin on selvitettävä. Selektiivisen järjestelmän/aineen toimintakyky on sen vuoksi vahvistettava testattaessa kemiallisia aineita, jotka ovat rakenteeltaan selektiivisen aineen kaltaisia (8).
Suspensiossa tai yksikerrosviljelmässä olevat solut altistetaan sopivaksi ajaksi testattavalle aineelle sekä metabolisen aktivaatiojärjestelmän läsnä ollessa että ilman sitä ja jatkoviljellään sytotoksisuuden toteamiseksi ja fenotyypin ilmentymisen aikaansaamiseksi ennen mutanttien selektiota (9) (10) (11) (12) (13). Sytotoksisuus määritetään yleensä mittaamalla viljelmien suhteellinen kloonaustehokkuus (eloonjääneisyys) tai suhteellinen kokonaiskasvu altistusjakson jälkeen. Altistettuja viljelmiä pidetään kasvatusväliaineessa riittävän pitkä aika, joka on jokaiselle valitulle lokukselle ja solutyypille ominainen, jotta aikaansaatujen mutanttien fenotyypin ilmentyminen olisi lähellä optimaalista. Mutaatiotaajuus lasketaan siten, että tunnettu lukumäärä soluja kylvetään toisaalta mutanttien toteamiseksi selektiivistä ainetta sisältävälle alustalle, toisaalta kloonaustehokkuuden (elinkykyisyyden) määrittämiseksi alustalle, joka ei sisällä selektiivistä ainetta. Sopivan inkubaatioajan kuluttua lasketaan pesäkkeet. Mutaatiotaajuus lasketaan selektiivisellä alustalla todettujen mutanttipesäkkeiden lukumäärän ja ei-selektiivisellä alustalla todettujen pesäkkeiden lukumäärän perusteella.
1.4 MENETELMÄN KUVAUS
1.4.1 Testin valmistelu
1.4.1.1 Solut
Tässä testissä voidaan käyttää useita eri solutyyppejä, kuten L5178Y-, CHO-, CHO-AS52-, V79- tai TK6-solulinjojen subklooneja. Tässä testissä on käytettävä solutyyppejä, joiden on osoitettu olevan herkkiä kemiallisille mutageeneille ja joilla on hyvä kloonaustehokkuus ja stabiili spontaanimutaatiotaajuus. Solujen mahdollinen mykoplasmakontaminaatio on tutkittava. Kontaminoituneita soluja ei saa käyttää.
Testi on suunniteltava siten, että sillä on tietty herkkyys ja teho. Solujen lukumäärän, viljelmien ja käytettyjen tutkittavan aineen pitoisuuksien tulee olla näiden määriteltyjen parametrien mukaisia (14). Altistuksen jälkeen elossa olevien ja kussakin testivaiheessa käytettävien elinkykyisten solujen vähimmäismäärän tulee perustua spontaanimutaatiotaajuuteen. Yleisohje on. että solujen lukumäärän on oltava vähintään kymmenen kertaa spontaanimutaatiotaajuuden käänteisluvun suuruinen, vähimmäismääräksi suositellaan kuitenkin 106 solua. Käytetystä solujärjestelmästä on oltava riittävästi aikaisempaa tutkimustietoa, joka osoittaa, että testillä saadaan pysyvästi päteviä tuloksia.
1.4.1.2 Kasvatusväliaineet ja viljelyolosuhteet
Testissä on käytettävä soveltuvia kasvatusväliaineita ja inkubaatio-olosuhteita (kasvatusastiat, lämpötila, CO2-pitoisuus ja kosteus). Kasvatusväliaineet on valittava käytettävän selektiojärjestelmän ja solutyypin mukaan. On erityisen tärkeää valita viljelyolosuhteet, jotka takaavat optimaalisen solukasvun ilmentymisaikana ja sekä mutanttien että ei-mutanttien solujen optimaalisen pesäkkeenmuodostuskyvyn.
1.4.1.3 Viljelmien valmistelu
Solut kasvatetaan varastoviljelmistä, kylvetään kasvatusväliaineeseen ja inkuboidaan 37 oC:ssa. Viljelmät on ehkä puhdistettava aikaisemmista mutanteista soluista, ennen kuin niitä käytetään tässä testissä.
1.4.1.4 Metabolinen aktivaatio
Solut on altistettava tutkittavalle aineelle sekä sopivan metabolisen aktivaatiojärjestelmän läsnä ollessa että ilman sitä. Yleisimmin käytetty aktivaatiojärjestelmä on entsyymejä indusoivilla aineilla, kuten Aroclor 1254:llä (15) (16) (17) (18) tai fenobarbitonin ja ß-naftoflavonin (19) (20) yhdistelmällä, käsiteltyjen jyrsijöiden maksasta eristetty postmitokondriaalinen jae (S9), johon on lisätty kofaktoria.
Postmitokondriaalisen jakeen yleisesti käytetty pitoisuusalue lopullisessa kasvatusväliaineessa on 1–10 % v/v. Metabolisen aktivaatiojärjestelmän valinta tai sen pois jättäminen saattaa riippua siitä, mihin kemiallisten aineiden ryhmään tutkittava aine kuuluu. Joissakin tapauksissa saattaa olla perusteltua käyttää useampaa kuin yhtä postmitokondriaalisen jakeen pitoisuutta.
Monilla uusilla menetelmillä, kuten yhdistelmä-DNA-tekniikalla tuotetuilla solulinjoilla, jotka ilmentävät spesifisiä aktivaatioentsyymejä, saattaa olla endogeenista aktivaatiovaikutusta. Käytettyjen solulinjojen valinnan on oltava tieteellisesti perusteltua (esim. sytokromi P450 -isoentsyymin merkitys tutkittavan aineen metabolialle).
1.4.1.5 Tulkittava aine/valmistelu
Kiinteät tutkittavat aineet liuotetaan tai sekoitetaan sopiviin liuottimiin tai kantaja-aineisiin ja laimennetaan tarvittaessa ennen solujen käsittelyä. Nestemäiset tutkittavat aineet voidaan lisätä suoraan koejärjestelmiin ja/tai laimentaa ennen solujen käsittelyä. Tutkittava aine on valmisteltava juuri ennen altistusta, paitsi jos säilyvyys on osoitettu stabiliteettitutkimuksilla.
1.4.2 Koeolosuhteet
1.4.2.1 Liuotin/kantaja-aine
Liuotin/kantaja-aine ei saa olla sellainen, että sen voidaan epäillä reagoivan kemiallisesti tutkittavan aineen kanssa, eikä se saa vaikuttaa solujen elinkykyyn eikä S9-aktiivisuuteen. Jos käytetään muita kuin hyvin tunnettuja liuottimia/kantaja-aineita, niiden käyttö on perusteltava yhteensopivuuden osoittavilla tutkimustuloksilla. Vesipitoisen liuottimen/kantaja-aineen käyttöä on harkittava ensisijaisesti aina, kun se on mahdollista. Testattaessa aineita, jotka ovat epästabiileja vedessä, orgaanisten liuottimien tulisi olla vedettömiä. Vesi voidaan poistaa lisäämällä molekyylisiivilä.
1.4.2.2 Altistuspitoisuudet
Huomioon otettavia kriteerejä suurinta pitoisuutta määritettäessä ovat sytotoksisuus, liukoisuus testijärjestelmään ja pH:n tai osmolaliteetin muutokset.
Sytotoksisuus on määritettävä pääasiallisessa kokeessa sekä metabolisen aktivaatiojärjestelmän läsnä ollessa että ilman sitä käyttäen asianmukaisia solujen eheyden ja solukasvun indikaattoreita, kuten suhteellista kloonaustehokkuutta (eloonjääneisyyttä) tai suhteellista kokonaiskasvua. Sytotoksisuus ja liukoisuus saattaa olla hyödyllistä määrittää alustavassa kokeessa.
Vähintään neljää analysoitavissa olevaa pitoisuutta on käytettävä. Mikäli sytotoksisuutta esiintyy, näiden pitoisuuksien on katettava alue, jossa suurimmalla pitoisuudella on maksimaalinen myrkkyvaikutus ja pienimmällä vähäinen tai ei lainkaan myrkkyvaikutusta, mikä tarkoittaa yleensä sitä, että pitoisuudet voivat poiketa toisistaan enintään kertoimella 2–√10. Mikäli suurin pitoisuus perustuu sytotoksisuuteen, siihen liittyvän suhteellisen eloonjääneisyyden (suhteellisen kloonaustehokkuuden) tai suhteellisen kokonaiskasvun tulisi olla noin 10–20 % (mutta ei alle 10 %). Suhteellisen ei-sytotoksisia aineita testattaessa suurimman testattavan pitoisuuden tulisi olla 5 mg/ml, 5 μl/ml tai 0,01 M sen mukaan, mikä näistä on pienin.
Huonosti liukenevia aineita on testattava viljelyolosuhteissa liukoisuusrajaan asti tai sen yli. Liukenemattomuuteen viittaavat muutokset on määritettävä lopullisessa kasvatusväliaineessa, jolle solut altistetaan. Liukoisuus kannattaa arvioida sekä käsittelyn alussa että lopussa, sillä se voi muuttua koejärjestelmässä altistuksen aikana esimerkiksi solujen, S9:n, seerumin ym. vaikutuksesta. Liukenemattomuus voidaan havaita paljaalla silmällä. Sakan ei pitäisi vaikuttaa laskentaan.
1.4.2.3 Kontrollit
Jokaisessa kokeessa on käytettävä rinnakkaisia positiivisia ja negatiivisia (liuotin tai kantaja-aine) kontrolleja, sekä metabolisen aktivaatiojärjestelmän läsnä ollessa että ilman sitä. Metabolista aktivaatiota käytettäessä positiivisena kontrollina on käytettävä sellaista kemiallista ainetta, joka vaatii aktivaatiota mutageenisen vasteen aikaansaamiseksi.
Esimerkkejä positiivisista kontrolliaineista:
|
Metabolinen aktivaatio |
Lokus |
Aine |
CAS-nro |
EINECS-nro |
|
Ei eksogeenista metabolista aktivaatiota |
HPRT |
etyylimetaanisulfonaatti |
62-50-0 |
200-536-7 |
|
etyylinitrosourea |
759-73-9 |
212-072-2 |
||
|
TK (pienet ja suuret pesäkkeet) |
metyylimetaanisulfonaatti |
66-27-3 |
200-625-0 |
|
|
XPRT |
etyylimetaanisulfonaatti |
62-50-0 |
200-536-7 |
|
|
etyylinitrosourea |
759-73-9 |
212-072-2 |
||
|
Eksogeeninen metabolinen aktivaatio |
HPRT |
3-metyylikolantreeni |
56-49-5 |
200-276-4 |
|
N-nitrosodimetyyliamiini |
62-75-9 |
200-549-8 |
||
|
7,12-dimetyylibentsantraseeni |
57-97-6 |
200-359-5 |
||
|
TK (pienet ja suuret pesäkkeet) |
syklofosfamidi |
50-18-0 |
200-015-4 |
|
|
syklofosfamidimonohydraatti |
6055-19-2 |
|
||
|
bentso[a]pyreeni |
50-32-8 |
200-028-5 |
||
|
3-metyylikolantreeni |
56-49-5 |
200-276-5 |
||
|
XPRT |
N-nitrosodimetvyliamiini (suurilla S-9-pitoisuuksilla) |
62-75-9 |
200-549-S |
|
|
bentso[a]pyreeni |
50-32-8 |
200-028-5 |
Muita sopivia positiivisia kontrolliaineita voidaan käyttää, esim. jos käytettävissä on laboratoriokohtainen tietokanta 5-bromo-2'-deoksiuridiinista (CAS-nro 59-14-3, Einecs-nro 200-415-9), myös tätä vertailuainetta voidaan käyttää. Samaan kemiallisten aineiden ryhmään kuuluvien positiivisten kontrolliaineiden käyttöä tulisi harkita, mikäli niitä on käytettävissä.
Mukana on oltava myös negatiivisia kontrolleja, jotka koostuvat liuottimesta tai pelkästä kantaja-aineesta kasvatusväliaineessa ja joita on käsitelty samalla tavoin kuin altistettuja ryhmiä. Lisäksi on käytettävä käsittelemättömiä kontrolleja, paitsi jos aikaisemmat tiedot kontrollista osoittavat, ettei valitulla liuottimella ole haitallisia eikä mutageenisia vaikutuksia.
1.4.3 Testin suorittaminen
1.4.3.1 Altistuminen tutkittavalle aineelle
Lisääntyvät solut on altistettava testattavalle aineelle sekä metabolisen aktivaatiojärjestelmän läsnä ollessa että ilman sitä. Altistusajan on oltava sopiva (tehokas aika on yleensä 3–6 tuntia). Altistusta voidaan jatkaa yhden tai useamman solusyklin ajan.
Kullekin testattavalle pitoisuudelle voidaan altistaa kaksi rinnakkaista viljelmää tai vain yksi viljelmä. Yksittäisiä viljelmiä käytettäessä pitoisuuksien määrää on suurennettava, jotta saadaan riittävä määrä viljelmiä analyysiä varten (esim. vähintään 8 analysoitavissa olevaa pitoisuutta). Rinnakkaisia negatiivisia (liuotin) kontrolliviljelmiä on käytettävä.
Kaasumaisia tai haihtuvia aineita on testattava asianmukaisin menetelmin, esimerkiksi suljetuissa kasvatusastioissa (21) (22).
1.4.3.2 Eloonjääneisyyden, elinkykyisyyden ja mutaatiotaajuuden mittaaminen
Altistusajan päätyttyä solut pestään ja viljellään eloonjääneisyyden määrittämiseksi ja mutanttifenotyypin ilmentymisen aikaansaamiseksi. Sytotoksisuuden mittaus aloitetaan yleensä altistusajan jälkeen määrittämällä viljelmien suhteellinen kloonaustehokkuus (eloonjääneisyys) tai suhteellinen kokonaiskasvu.
Jokainen lokus vaatii määrätyn minimiajan, jotta hiljattain aiheutettujen mutanttien fenotyypin ilmentyminen olisi lähellä optimaalista (HPRT ja XPRT vaativat vähintään 6–8 vuorokautta ja TK vähintään 2 vuorokautta). Soluja kasvatetaan selektiivistä ainetta (aineita) sisältävillä alustoilla mutanttien lukumäärän määrittämiseksi ja ilman selektiivisiä aineita kloonaustehokkuuden määrittämiseksi. Elinkykyisyyden mittaaminen (käytetään mutaatiotaajuuden laskemiseen) aloitetaan altistusajan päätyttyä maljaamalla soluja ei-selektiivisessä kasvatusväliaineessa.
Jos tutkittavalla aineella saadaan positiivinen tulos L5178Y TK+/- -testissä, pesäkkeiden koko on määritettävä ainakin yhdessä koeviljelmässä (suurin positiivinen pitoisuus) ja negatiivisissa ja positiivisissa kontrolleissa. Jos tutkittavalla aineella saadaan negatiivinen tulos L5178Y TK+/- -testissä, pesäkkeiden koko on määritettävä negatiivisissa ja positiivisissa kontrolleissa. Pesäkkeiden koon määritys voidaan tehdä myös tutkimuksissa, joissa käytetään TK6TK+/- -testiä.
2. TULOKSET
2.1 TULOSTEN KÄSITTELY
Tulosten tulee sisältää tiedot sytotoksisuuden ja elinkykyisyyden määrityksistä, pesäkkeiden lukumäärästä ja mutaatiotaajuudesta altistetuissa viljelmissä ja kontrolliviljelmissä. Mikäli vaste on positiivinen L5178Y TK +/- -testissä, pesäkkeet lasketaan pienten ja suurten pesäkkeiden kriteeriä käyttäen vähintään yhdestä testattavan aineen pitoisuudesta (suurin positiivinen pitoisuus) ja negatiivisista ja positiivisista kontrolleista. Sekä suurten että pienten mutaatiopesäkkeiden molekulaarinen ja sytogeneettinen luonne on selvitetty yksityiskohtaisesti (23) (24). TK+/- -testissä pesäkkeet lasketaan käyttäen kriteereinä normaalin kasvun (suuri) ja hitaan kasvun (pieni) pesäkkeitä (25). Mutanteilla soluilla, joissa geneettinen vaurio on kaikkein suurin, on pitkittynyt kahdentumisaika, joten ne muodostavat pieniä pesäkkeitä. Tällaiset vauriot ulottuvat tyypillisesti kokonaisen geenin puuttumisesta karyotyypissä näkyviin kromosomipoikkeavuuksiin. Pienten mutaatiopesäkkeiden muodostuminen on yhdistetty suuria kromosomipoikkeavuuksia aiheuttaviin kemiallisiin aineisiin (26). Lievemmin vaurioituneet mutantit solut kasvavat yhtä nopeasti kuin parentaalisetkin solut ja muodostavat suuria pesäkkeitä.
Eloonjääneisyys (suhteelliset kloonaustehokkuudet) tai suhteellinen kokonaiskasvu on ilmoitettava. Mutaatiotaajuus on ilmoitettava mutanttien solujen lukumäärän suhteena eloonjääneiden solujen lukumäärään.
Viljelmäkohtaiset tulokset on ilmoitettava. Lisäksi yhteenveto kaikista tiedoista on ilmoitettava taulukkomuodossa.
Selvää positiivista vastetta ei tarvitse vahvistaa. Epäselvät tulokset on selvitettävä jatkotestauksella mieluiten muunnetuissa koeolosuhteissa. Negatiiviset tulokset on vahvistettava tapauskohtaisesti. Ellei negatiivisten tulosten vahvistamista jossakin tapauksessa pidetä tarpeellisena, tämä päätös on perusteltava. Tutkimusparametrien muuttamista on harkittava epäselvien tai negatiivisten tulosten seurantakokeissa arvioitavien koeolosuhteiden monipuolistamiseksi. Mahdollisia muutettavia tutkimusparametreja ovat pitoisuusvälit ja metaboliset aktivaatiojärjestelmät.
2.2 TULOSTEN ARVIOINTI JA TULKINTA
Positiivisille tuloksille on useita kriteerejä, kuten pitoisuuteen liittyvä tai toistettavissa oleva mutaatiotaajuuden suureneminen. Tulosten biologinen merkitys on otettava ensisijaisesti huomioon. Tilastollisia menetelmiä voidaan käyttää apuna testitulosten arvioinnissa. Tilastollinen merkitsevyys ei saa olla ainoa määräävä tekijä positiivisen vasteen arvioinnissa.
Tutkittava aine. jolla saadut tulokset eivät täytä edellä kuvattuja kriteerejä, katsotaan ei-mutageeniseksi tässä koejärjestelmässä.
Useimmissa testeissä saadaan selvästi positiivisia tai negatiivisia tuloksia, mutta joissakin harvinaisissa tapauksissa saatujen tietojen pohjalta ei voida tehdä varmoja päätelmiä tutkittavan aineen vaikutuksesta. Tulokset saattavat jäädä epäselviksi tai kyseenalaisiksi kokeen toistokertojen määrästä riippumatta.
Nisäkässoluilla tehtävässä in vitro -geenimutaatiotestissä saadut positiiviset tulokset osoittavat, että tutkittava aine aiheuttaa geenimutaatioita käytetyissä viljellyissä nisäkässoluissa. Toistettavissa oleva positiivinen pitoisuus-vastesuhde on kaikkein merkityksellisin. Negatiiviset tulokset osoittavat, ettei tutkittava aine aiheuta koeolosuhteissa geenimutaatioita testatuissa viljellyissä nisäkässoluissa.
3. RAPORTOINTI
TUTKIMUSSELOSTUS
Tutkimusselostuksen on sisällettävä seuraavat tiedot:
|
|
Liuotin/kantaja-aine:
|
|
|
Solut:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
|
|
Johtopäätökset. |
4. KIRJALLISUUTTA
|
(1) |
Moore, M. M, DeMarini, D. M., DeSerres, F. J. and Tindall, K. R. (Eds.) (1987), Banbury Report 28: Mammalian Cell Mutagenesis, Cold Spring Harbor Laboratory, New York. |
|
(2) |
Chu, E. H. Y. and Mailing, H. V. (1968), Mammalian Cell Genetics. II. Chemical Induction of Specific Locus Mutations in Chinese Hamster Cells In Vitro, Proc. Natl Acad. Sci., USA, 61, s. 1306–1312. |
|
(3) |
Liber, H. L. and Thilly, W. G. (1982), Mutation Assay at the Thymidine Kinase Locus in Diploid Human Lymphoblasts, Mutation Res., 94, s. 467–485. |
|
(4) |
Moore, M. M., Harington-Brock, K., Doerr, C. L. and Dearfield, K. L. (1989), Differential Mutant Quantitation at the Mouse Lymphoma TK and CHO HGPRT Lori, Mutagenesis, 4, s. 394–403. |
|
(5) |
Aaron, C. S. and Stankowski. Jr. L. F. (1989). Comparison of the AS52/XPRT and the CHO/HPRT Assays: Evaluation of Six Drug Candidates, Mutation Res., 223, s. 121–128. |
|
(6) |
Aaron, G S., Bolcsfoldi, G.. Glatt, H. R., Moore, M., Nishi, Y., Stankowski, Jr. L. F., Theiss, J. and Thompson, E. (1994), Mammalian Cell Gene Mutation Assays Working Group Report. Report of the International Workshop on Standardisation of Genotoxicitv Test Procedures, Mutation Res., 312, s. 235–239. |
|
(7) |
Scott, D, Galloway, S. M., Marshall, R. K., Ishidate, M., Brusick, D., Ashby, J. and Myhr, B. C. (1991), Genotoxicitv Under Extremc Culture Conditions. A report from ICPEMC Task Group 9, Mutation Res., 257, s. 147–204. |
|
(8) |
Clive. D., McCuen, R., Spector, J. F. S., Piper, C. and Mavournin, K. H. (1983), Specific Gene Mutations in L5178Y Cells in Culture. A Report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 115, s. 225–251. |
|
(9) |
Li, A. P., Gupta, R. S., Heflich, R. H. and Wasson, J. S. (1988), A Review and Analysis of the Chinese Hamster Ovary/Hypoxanthine Guanine Phosphoribosyl Transferase System to Determine the Mutagenicity of Chemical Agents: A Report of Phase III of the U.S. Environmental Protection Agcncy Gene-Tox Program, Mutation Res., 196, s. 17–36. |
|
(10) |
Li, A. P., Carver, J. H., Choy, W. N., Hsie, A. W., Gupta, R. S., Loveday, K. S., O'Neill, J. P., Riddle, J. C., Standkowski, L. F. Jr. and Yang, L. L. (1987), A Guide for the Performance of the Chinese Hamster Ovary Cell/Hypoxanthine-Guanine Phosphoribosyl Transferase Gene Mutation Assay, Mutation Res., 189, s. 135–141. |
|
(11) |
Liber, H. L., Yandell, D. W. and Little, J. B. (1989), A Comparison of Mutation Induction at the TK and HPRT Loci in Human Lymphoblastoid Cells: Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK Locus, Mutation Res., 216, s. 9–17. |
|
(12) |
Stankowski, L. F. Jr., Tindall, K. R. and Hsie, A. W. (1986), Quantitative and Molecular Anaylses of Ethyl Methanosulphonate — and ICR 191-Induced Molecular Analyses of Ethyl Methanosulphonate — and ICR 191-Induced Mutation in AS52 Cells, Mutation Res., 160, s. 133–147. |
|
(13) |
Turner, N. T., Batson, A. G. and Clive, D. (1984), Procedures for the L5178Y/TK+/- — TK+/- Mouse Lymphoma Cell Mutagenicity Assay, in: Kilbey, B. J. et al. (eds.) Handbook of Mutagenicity Test Procedures, Elsevier Science Publishers, New York, s. 239–268. |
|
(14) |
Arlett, C. F., Smith, D. M., Clarke, G. M., Green, M. H. L., Cole, J., McGregor, D. B. and Asquith, J. C. (1989), Mammalian Cell Gene Mutation Assays Based upon Colony Formation, in: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D. J., Ed., Cambridge University Press, s. 66–101. |
|
(15) |
Abbondandolo, A., Bonatti, S., Corti, G., Fiorio, R., Loprieno, N. and Mazzaccaro, A. (1977), Induction of 6-Thioguanine-Rcsistant Mutants in V79 Chinese Hamster Cells by Mouse-Liver Microsome-Activated Dimethylnitrosamine, Mutation Res., 46, s. 365–373. |
|
(16) |
Ames, B. N., McCann, J. and Yamasaki, E. (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test, Mutation Res., 31, s. 347–364. |
|
(17) |
Clive, D., Johnson, K. O., Spector, J. E. S., Batson, A. G. and Brown M. M. M. (1979), Validation and Characterisation of the L5178/TK+/- Mouse Lymphoma Mutagen Assay System, Mutat. Res., 59, s. 61–108. |
|
(18) |
Maron, D. M. and Ames, B. N. (198 3), Revised Methods for the Salmonella Mutagenicity Test, Mutation Res., 113, s. 173–215. |
|
(19) |
Elliott, B. M., Combes, R. D., Elcombe, C. R., Catehouse, D. G., Gibson, G. G., Mackay, J. M. and Wolf, R. C. (1992), Alternatives to Aroclor 1254-Induced S9 in In Vitro Genotoxicity Assays, Mutagenesis, 7, s. 175–177. |
|
(20) |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation System, in: In Vitro Metabolic Activation in Mutagenesis Testing,, de Serres, F. J., Fouts, J. R., Bend, J. R. and Philpot, R. M. (eds), Elsevier, North-Holland, s. 85–88. |
|
(21) |
Krahn, D. F., Barsky, F. C. and McCooney, K. T. (1982), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, in: Tice, R. R., Costa, D. L., Schaich, K. M. (eds), Genotoxic Effects of Airborne Agents, New York, Plenum, s. 91–103. |
|
(22) |
Zamora, P. O., Benson, J. M., Li, A. P. and Brooks, A. L. (1983), Evaluation of an Exposure System Using Cells Crown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay, Environmental Mutagenesis, 5, s. 795–801. |
|
(23) |
Applegate, M. L., Moore, M. M., Broder, C. B., Burrell, A. and Hozier, J. C. (1990), Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells, Proc. Natl. Acad. Sci. USA, 87, s. 51–55. |
|
(24) |
Moore, M. M., Clive, D., Hozier, J. C, Howard, B. E., Batson, A. G., Turner, N. T. and Sawyer, J. (1985), Analysis of Trifluorothymidine-Resistant TFTr Mutants of L5178Y/TK+/- Mouse Lymphoma Cells, Mutation Res., 151, s. 161–174. |
|
(25) |
Yandell, D. W., Dryja, T. P. and Little, J. B. (1990), Molecular Genetic Analysis of Recessive Mutations at a Heterozygous Autosomal Locus in Human Cells, Mutation Res., 229, s. 89–102. |
|
(26) |
Moore, M. M. and Doerr, C. L. (1990), Comparison of Chromosome Aberration Frequency and Small-Colony TK-Deficient Mutant Frequency in L5178Y/TK+/- — 3.7.2C Mouse Lymphoma Cells, Mutagenesis, 5, s. 609–614. |
B.18. DNA-VAURIO JA SEN KORJAANTUMINEN — UDS-TESTI NISÄKÄSSOLUVILJELMÄLLÄ
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄ
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
UDS-testissä (Unscheduled DNA Synthesis test) nisäkässolu altistetaan kemiallisille tai fysikaalisille tekijöille, minkä jälkeen näiden mahdollisesti vaurioittama DNA-segmentti leikkautuu irti ja poistuu kromosomista. Testi perustuu tritiumilla leimatun tymidiinin (3H-TdR) sitoutumiseen nisäkässolun DNA:han solunjakautumissyklin S-vaiheen ulkopuolella. 3H-TdR:n sitoutuminen voidaan todeta altistettujen solujen DNA:sta autoradiografisesti tai nestetuikelaskennalla. Testissä altistetaan primaarisia rotan maksasoluja tai nisäkässoluviljelmä tutkittavalle aineelle sekä ilman metabolista aktivaatiota että eksogeenisen metabolisen aktivaatiojärjestelmän läsnäollessa. UDS-testi voidaan myös suorittaa in vivo.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Tutkittava aine ja kontrolli- tai vertailuaineet on sekoitettava kasvatusalustaan tai liuotettava tai sekoitettava soveltuvaan kantaja-aineeseen ja sen jälkeen edelleen kasvatusalustaan testiä varten. Kantaja-aineen loppupitoisuus ei saa vaikuttaa solujen elinkykyyn.
Testissä voidaan käyttää primaarisia rotan maksasoluviljelmiä, primaarisia ihmisen lymfosyyttiviljelmiä tai pysyviä solulinjoja (esim. ihmisen diploidisia fibroblasteja).
Solut on altistettava tutkittavalle aineelle sekä ilman metabolista aktivaatiota että soveltuvan metabolisen aktivaatiojärjestelmän läsnäollessa.
Koeolosuhteet
Autoradiografiaa käytettäessä tarvitaan ainakin kaksi ja nestetuikelaskentaa käytettäessä kuusi (tai vähemmän, mikäli tämä on tieteellisesti perusteltua) soluviljelmää kutakin parametriyhdistelmää kohti.
Kuhunkin kokeeseen on sisällyttävä samanaikaisia positiivisia ja negatiivisia (altistamattomia ja/tai kantaja-aineelle altistettuja) kontrolleja sekä ilman metabolista aktivaatiota että metabolisen aktivaatiojärjestelmän läsnäollessa.
Rotan maksasoluilla suoritettavan testin positiivisia kontrolleja voivat olla esimerkiksi 7,12-dimetyylibentsantraseeni (7,12-DMBA) tai 2-asetyyliaminofluoreeni (2-AAF). Pysyvien solulinjojen osalta 4-nitrokinoliini-N-oksidi (4-NQO) on esimerkki positiivisesta kontrollista, jota voidaan käyttää ilman metabolista aktivaatiota autoradiografisesti tai nestetuikelaskennalla suoritettavissa testeissä; N-dimentyylinitrosamiini puolestaan on esimerkki positiivisesta kontrolliyhdisteestä, jota käytetään metabolisten aktivaatiojärjestelmien läsnäollessa.
Tutkittava aine on testattava useana eri pitoisuutena, siten että käytetty pitoisuusalue mahdollistaa annos/vastesuhteen selvittämisen. Korkeimmalla pitoisuudella on oltava jonkinasteinen sytomyrkkyvaikutus. Huonosti veteen liukenevilla aineilla pitoisuus määräytyy liukoisuuden mukaan. Vesiliukoisten myrkyttömien aineiden korkein tutkittava pitoisuus on päätettävä tapauskohtaisesti.
Soluviljelmien kasvatuksessa on käytettävä soveltuvia kasvatusalustoja, CO2-pitoisuuksia, lämpötiloja ja kosteusarvoja. Pysyvät solulinjat on tarkastettava ajoittain Mycoplasma-kontaminaation varalta.
Primaarisissa maksasoluviljelmissä ei käytetä metabolista aktivaatiojärjestelmää. Pysyvät solulinjat ja lymfosyytit altistetaan tutkittavalle aineelle sekä ilman metabolista aktivaatiota että soveltuvan metabolisen aktivaatiojärjestelmän läsnäollessa.
Testin suorittaminen
Testissä käytettävät pysyvät solulinjat erotetaan kantaviljelmistä esim. trypsiinin avulla tai ravistelemalla, kylvetään kasvatusastioihin sopivaan tiheyteen ja inkuboidaan 37 oC:ssa.
Rotan maksasoluista tehdään lyhytaikaisviljelmät antamalla vastaeroteltujen maksasolujen kiinnittyä kasvupinnalle soveltuvassa kasvualustassa.
Ihmisen lymfosyyttiviljelmät perustetaan soveltuvin menetelmin.
Primaariset rotan maksasolut:
Vastaeristettyjä rotan maksasoluja altistetaan sopivan pituiseksi ajaksi tutkittavalle aineelle alustassa, joka sisältää 3H-TdR:ä. Altistuksen jälkeen kasvatusalusta poistetaan kasvatusastiasta, ja solut huuhdellaan, fiksoidaan ja kuivataan. Objektilasit kastetaan autoradiografiaemulsioon (vaihtoehtoisesti voidaan käyttää valmista ’stripping’-filmiä) ja valottumisajan jälkeen lasit kehitetään, värjätään ja lasketaan.
Pysyvät solulinjat ja lymfosyytit:
Autoradiografiset menetelmät: Soluviljelmiä altistetaan sopivaksi ajaksi tutkittavalle aineelle, minkä jälkeen ne käsitellään 3H-TdR:llä. Altistus- ja käsittelyajat määräytyvät tutkittavan aineen luonteen, metaboliajärjestelmien aktiivisuuden ja solutyypin mukaan. Maksimaalisen S-vaiheen ulkopuolisen DNA-synteesin (unscheduled DNA-synthesis) havaitsemiseksi tulee 3H-TdR lisätä kasvatusalustaan yhtä aikaa kuin tutkittava aine tai muutama minuutti tutkittavalle aineelle altistuksen jälkeen. Tutkittavan aineen ja 3H-TdR:n väliset mahdolliset vuorovaikutukset vaikuttavat valintaan näiden kahden menetelmän välillä. S-vaiheen ulkopuolisen DNA-synteesin ja semikonservatiivisen DNA-replikaation erottamiseksi toisistaan jälkimmäinen voidaan estää esimerkiksi käyttämällä kasvatusalustaa, josta puuttuu arginiini tai jonka seerumipitoisuus on alhainen tai joka sisältää hydroksiureaa.
S-vaiheen ulkopuolisen DNA-synteesin mittaaminen nestetuikelaskennan avulla: Ennen solujen altistamista tutkittavalle aineelle solunjakautumisen S-vaiheen alkaminen estetään edellä kuvatulla tavalla, minkä jälkeen altistaminen suoritetaan samoin kuin autoradiografiaa käytettäessä. Inkubaation jälkeen DNA eristetään soluista, ja DNA:n kokonaismäärä sekä sitoutuneen 3H-TdR:n määrä mitataan.
On huomattava, että semikonservatiivisen DNA-replikaation estäminen ei ole tarpeen stimuloimattomissa ihmisen lymfosyyttiviljelmissä.
Analyysi
S-vaiheessa olevat tumat jätetään laskennan ulkopuolelle määritettäessä viljeltyjen solujen S-vaiheen ulkopuolista DNA-synteesiä. Kutakin tutkittavan aineen pitoisuutta kohti on laskettava vähintään 50 solua. Objektilasit on kooditettava ennen laskemista. Kultakin lasilta lasketaan useita sattumanvaraisesti valittuja, selvästi toisistaan erillään olevia näkökenttiä. Sytoplasmaan sitoutunut 3H-TdR määritetään laskemalla kolme tuman suuruista sytoplasma-aluetta kustakin laskettavasta solusta.
Nestetuikelaskentaa käytettäessä on kutakin pitoisuutta ja kontrollia kohti oltava riittävä määrä rinnakkaisia soluviljelmiä.
Kaikki tulokset on varmistettava erillisellä kokeella.
2. TULOKSET
Tulokset on esitettävä taulukkomuodossa.
2.1 AUTORADIOGRAFINEN MÄÄRITYS
3H-TdR:n sitoutuminen sytoplasmaan ja tuman kohdalla olevien valottuneiden pisteiden lukumäärä on esitettävä erikseen.
3H-TdR:n sytoplasmaattisen sitoutumisen ja tumassa olevien valottuneiden pisteiden lukumäärän jakautumia voidaan kuvata keskiarvolla, mediaanilla ja moodilla.
2.2 NESTETUIKELASKENTAAN PERUSTUVA MÄÄRITYS
Ilmoitettaessa sitoutuneen 3H-TdR:n määrää nestetuikelaskentaan perustuvassa määrityksessä tulee yksikkönä olla dpm/μg DNA. Sitoutuneen 3H-TdR:n määrän jakautumaa kuvaamaan voidaan käyttää saatujen dpm/|μg DNA -lukemien keskiarvoa ja keskihajontaa.
Tulosten merkitsevyys on arvioitava soveltuvin tilastollisin menetelmin.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
käytetyt solut, solutiheys ja altistettujen jatkoviljelmien järjestysluku, soluviljelmien lukumäärä, |
|
— |
soluviljelmien ylläpitomenetelmät, kuten kasvatusalusta, lämpötila ja CO2-pitoisuus, |
|
— |
tutkittu aine, kantaja-aine, testissä käytetyt pitoisuudet ja pitoisuuksien valinnassa käytetyt perusteet, |
|
— |
metabolisten aktivaatiojärjestelmien yksityiskohtainen kuvaus, |
|
— |
altistusohjelma, |
|
— |
positiiviset ja negatiiviset kontrollit, |
|
— |
käytetty autoradiografiamenetelmä, |
|
— |
solunjakautumisen S-vaiheen estämisessä käytetyt menetelmät, |
|
— |
DNA:n eristämisessä ja kokonais-DNA:n määrittämisessä käytetyt menetelmät nestetuikelaskentaan perustuvassa testissä, |
|
— |
annos/vastesuhde mikäli mahdollista, |
|
— |
tulosten tilastollinen käsittely, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.19. SISARKROMATIDIVAIHDOSTESTI
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Sisarkromatidivaihdostesti (Sister Chromatid Exchange, SCE) on lyhytaikainen testi kahdentuvan kromosomin sisarkromatidien kesken tapahtuvan DNA:n vaihtumisen toteamiseksi. Sisarkromatidivaihdoksessa tapahtuu DNA:n replikaatiotuotteiden vaihtumista kahden, ilmeisesti homologisen lokuksen välillä. Vaihtumistapahtumassa oletetaan DNA-ketjun katkeavan ja liittyvän uudelleen yhteen, vaikka ilmiön molekyylitason tapahtumia ei juuri tunneta. Sisarkromatidivaihdosten toteaminen edellyttää sisarkromatidien differentiaalileimausta, joka suoritetaan antamalla bromodeoksiuridiinin sitoutua kromosomaaliseen DNA:han kahden solusyklin ajan.
Nisäkässoluviljelmä altistetaan tutkittavalle aineelle tarpeen mukaan sekä ilman metabolista aktivaatiota että nisäkäsperäisen eksogeenisen metabolisen aktivaatiojärjestelmän läsnäollessa. Soluviljelmää kasvatetaan kahden DNA:n replikaatiosyklin ajan alustassa, joka sisältää bromodeoksiuridiinia. Soluja käsitellään tämän jälkeen tumasukkulan muodostumisen inhibiittorilla (esim. kolkisiinilla) solujen pysäyttämiseksi mitoosin metafaasivaiheeseen (c-metafaasiin), minkä jälkeen solut kerätään ja niistä tehdään kromosomipreparaatit.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
|
— |
Testissä voidaan käyttää primaarisia soluviljelmiä, (ihmisen lymfosyyttejä) tai pysyviä solulinjoja (esim. kiinanhamsterin ovariosoluja). Solulinjat on tarkastettava Mycoplasma-kontaminaation varalta. |
|
— |
Testissä on käytettävä soveltuvia kasvatusalustoja ja inkubaatio-olosuhteita (esim. lämpötila, kasvatusastiat, CO2- pitoisuus ja kosteus). |
|
— |
Tutkittavat aineet voidaan sekoittaa kasvatusalustaan tai liuotettava tai sekoitettava soveltuviin kantaja-aineisiin ennen solujen altistamista. Kantaja-aineen loppupitoisuus kasvatusastiassa ei saa merkitsevästi vaikuttaa solujen elinkykyyn tai kasvunopeuteen, ja sen vaikutusta sisarkromatidivaihdosfrekvenssiin on seurattava kontrollikokeella, jossa altisteena on tutkittavan aineen kantaja-aine. |
|
— |
Solut on altistettava tutkittavalle aineelle sekä ilman metabolista aktivaatiota että nisäkäsperäisen eksogeenisen metabolisen aktivaatiojärjestelmän läsnäollessa. Jos käytetään solutyyppejä, joilla on itsessään kyky metaboloida vierasaineita, tämän metabolisen aktiivisuuden on oltava nopeudeltaan ja luonteeltaan tutkittavalle aineryhmälle soveltuva. |
Koeolosuhteet
Kutakin parametriyhdistelmää kohti on oltava ainakin kaksi rinnakkaista soluviljelmää.
Kuhunkin kokeeseen on sisällyttävä sekä suoraan vaikuttavia että metabolista aktivaatiota vaativia positiivisia kontrolleja; myös kantaja-ainekontrollia on käytettävä.
Seuraavat ovat esimerkkejä aineista, joita voidaan käyttää positiivisina kontrolleina:
|
— |
suoraan vaikuttava aine:
|
|
— |
epäsuorasti vaikuttava aine:
|
Tarvittaessa kokeessa voidaan lisäksi käyttää ylimääräistä positiivista kontrollia, joka kuuluu samaan kemiallisten aineitten ryhmään kuin tutkittava aine.
Tutkittava aine on testattava vähintään kolmena eri pitoisuutena, joiden keskinäiset erot ovat sopivat. Korkeimmalla pitoisuudella on oltava merkitsevä myrkkyvaikutus, mutta se ei saa silti estää riittävää solunjakautumista. Huonosti veteen liukenevilla aineilla pitoisuus määräytyy liukoisuuden mukaan. Vesiliukoisten myrkyttömien aineiden korkein tutkittava pitoisuus on päätettävä tapauskohtaisesti.
Testin suorittaminen
Testissä käytettävät pysyvät solulinjat erotetaan kantaviljelmistä esim. trypsiinin avulla tai ravistelemalla, kylvetään kasvatusastioihin sopivaan tiheyteen ja inkuboidaan 37 oC:ssa. Yksikerrosviljelmissä solujen lukumäärä kasvatusastiaa kohti on säädettävä siten, että viljelmien konfluenttisuus ei juuri ylitä 50 prosenttia solujen keräyshetkellä. Vaihtoehtoisesti voidaan käyttää suspensioviljelmiä. Ihmisen lymfosyyttiviljelmät perustetaan heparinisoidusta verestä soveltuvin menetelmin, ja viljelmiä inkuboidaan 37 oC:ssa.
Eksponentiaalisessa kasvuvaiheessa olevat solut altistetaan sopivaksi ajaksi tutkittavalle aineelle; useimmissa tapauksissa 1–2 tuntia voi olla riittävä, mutta tietyissä tapauksissa altistusaikaa voidaan pidentää aina kahteen täyteen solunjakautumissykliin saakka. Solut, joilla ei itsessään ole riittävää kykyä metaboloida vierasaineita, on altistettava tutkittavalle aineelle sekä ilman metabolista aktivaatiota että soveltuvan metabolisen aktivaatiojärjestelmän läsnäollessa. Altistuksen jälkeen solut huuhdellaan puhtaiksi tutkittavasta aineesta ja niitä viljellään kahden solunjakautumissyklin ajan bromodeoksiuridiinin läsnäollessa. Vaihtoehtoisesti solut voidaan altistaa samanaikaisesti tutkittavalle aineelle ja bromodeoksiuridiinille siten, että kokonaisviljelyaika on kaksi solunjakautumissykliä.
Ihmisen lymfosyytit altistetaan niiden ollessa semisynkronisessa kasvuvaiheessa.
Solut analysoidaan niiden ollessa toisessa altistuksen alkamisen jälkeisessä jakautumisvaiheessa, kun on varmistettu, että solunjakautumissyklin herkimmät vaiheet ovat altistuneet tutkittavalle aineelle. Bromodeoksiuridiinia sisältävän DNA:n fotolysoitumisen minimoimiseksi kaikkia bromodeoksiuridiinia sisältäviä soluviljelmiä on käsiteltävä pimeässä tai heikossa hehkulampun valossa solujen keräämiseen saakka.
Soluja käsitellään tumasukkulan muodostumisen inhibiittorilla (esim. kolkisiinilla) 1–4 tuntia ennen solujen keräämistä. Jokaisen viljelmän solut kerätään ja käsitellään erikseen kromosomipreparaattien valmistamiseksi.
Kromosomipreparaatit valmistetaan normaalein sytogeneettisin menetelmin. Objektilasien värjäys sisarkromatidivaihdosten osoittamiseksi voidaan tehdä useilla eri menetelmillä (esim. fluoresenssi + Giemsa-värjäys).
Analysoitavien solujen lukumäärä perustuu kontrolliviljelmien spontaaniin sisarkromatidivaihdosfrekvenssiin. Yleensä kustakin viljelmästä lasketaan ainakin 25 hyvin levinneen metafaasin sisarkromatidivaihdokset. Objektilasit koodataan ennen analyysiä. Ihmisen lymfosyyteistä analysoidaan ainoastaan 46 sentromeeriä sisältävät metafaasit. Pysyvistä solulinjoista analysoidaan ainoastaan metafaasit, joiden sentromeerien lukumäärä on moodi ± 2. Tuloksissa on ilmaistava, onko sentromeerin kohdalla havaittu leiman vaihtuminen tulkittu sisarkromatidivaihdokseksi vai ei. Tulokset on varmistettava erillisellä kokeella.
2. TULOKSET
Tulokset on esitettävä taulukkomuodossa. Sisarkromatidivaihdosten lukumäärä kussakin metafaasissa ja sisarkromatidivaihdosten keskimääräinen lukumäärä kromosomia kohti kussakin metafaasissa on kirjattava erikseen kunkin altistetun viljelmän ja kontrolliviljelmän osalta.
Tulosten merkitsevyys on arvioitava soveltuvin tilastollisin menetelmin.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
käytetyt solut, soluviljelmien ylläpitomenetelmät, |
|
— |
koeolosuhteet: kasvatusalustojen koostumus, CO2-pitoisuus, tutkitun aineen pitoisuus, käytetty kantaja-aine, inkubaatiolämpötila, altistusaika, käytetty tumasukkulan muodostumisen inhibiittori ja sen pitoisuus sekä käsittelyaika, käytetty nisäkäsperäinen aktivaatiojärjestelmä, positiiviset ja negatiiviset kontrollit, |
|
— |
viljelmien lukumäärä parametriyhdistelmää kohti, |
|
— |
kromosomipreparaattien valmistusmenetelmän yksityiskohtainen kuvaus, |
|
— |
analysoitujen metafaasien lukumäärä (erikseen kustakin soluviljelmästä), |
|
— |
sisarkromatidivaihdosten keskimääräinen lukumäärä solua kohti ja kromosomia kohti (erikseen kustakin soluviljelmästä), |
|
— |
sisarkromatidivaihdosten laskentaperusteet, |
|
— |
annostusten valintaperusteet, |
|
— |
annos/vastesuhde mikäli mahdollista, |
|
— |
tulosten tilastollinen käsittely, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.20. RESESSIIVI LETAALI -TESTI BANAANIKARPÄSELLÄ (DROSOPHILA MELANOGASTER)
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄ
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Resessiivi letaali -testillä voidaan todeta pistemutaatiot ja pienet deleetiot banaanikärpäsen ituradan soluissa. Testillä havaitaan mutaatiot noin 800:ssa X-kromosomin lokuksessa, jotka muodostavat noin 80 % kaikista X-kromosomin lokuksista. X-kromosomi puolestaan edustaa noin yhtä viidesosaa banaanikärpäsen koko haploidisesta perintöaineksesta.
Banaanikärpäsen X-kromosomissa tapahtuvat mutaatiot ilmenevät mutanttigeeniä kantavien koiraiden fenotyypissä. Jos mutaatio on hemitsygoottisena letaali, mutaation tapahtuminen voidaan päätellä siitä, että jälkeläissukupolvesta puuttuu toinen niistä kahdesta koirastyypistä, jotka normaalisti esiintyvät heterotsygoottisen naaraan jälkeläisten joukossa. Resessiivi letaali -testissä näitä ilmiöitä hyödynnetään spesifisiä markkereita ja uudelleen järjestynyttä geenimateriaalia sisältävien kromosomien avulla.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Testissä voidaan käyttää hyvin kuvaillun villikannan koiraita ja Muller-5-kannan naaraita. Myös muita sopivalla tavalla merkittyjä naaraskantoja, joilla on multippeleita inversioita X-kromosomeissa, voidaan käyttää.
Tutkittava aine on liuotettava veteen. Veteen liukenemattomat aineet voidaan liuottaa tai sekoittaa soveltuviin kantaja-aineisiin (esim. etanolin ja Tween-60:n tai Tween-80:n seokseen) ja sen jälkeen laimentaa vedellä tai suolaliuoksella ennen kärpäsille antamista. Dimetyylisulfoksidin (DMSO:n) käyttöä kantaja-aineena tulee välttää.
Testi on suunniteltava etukäteen määriteltyjen tilastollisten herkkyys- ja tehokkuusvaatimusten mukaisesti. Sopivalla kontrollikokeella todettu spontaanimutaatiofrekvenssi vaikuttaa suuresti analysoitavien altistettujen kromosomien lukumäärään.
Altistus voidaan toteuttaa antamalla altiste suun kautta, ruiskeena tai kaasu- tai höyryaltistuksena. Tutkittava aine voidaan syöttää sokeriliuoksessa. Tarpeen mukaan aineet voidaan liuottaa 0,7 % NaCl-liuokseen ja injektoida rintakehään tai vatsaan.
Testiin on sisällytettävä negatiivisia (kantaja-ainekontrolleja) ja positiivisia kontrolleja. Jos kuitenkin on käytettävissä laboratoriokohtaiset oletusarvot (laboratory historical Control data), samanaikaisia negatiivisia kontrolleja ei tarvita.
Testissä on käytettävä kolmea eri altistustasoa. Alustavassa tutkimuksessa voidaan tutkittavasta aineesta käyttää yhtä altistustasoa, jonka on oltava suurin siedetty pitoisuus tai pitoisuus, jolla on joitakin myrkkyvaikutuksia. Myrkyttömien aineitten kohdalla on käytettävä suurinta pitoisuutta, joka on käytännössä mahdollinen.
Villikoiraat (ikä 3–5 vrk) altistetaan tutkittavalle aineelle, minkä jälkeen niiden kunkin annetaan pariutua useiden Muller-5-kannan tai jonkin muun asianmukaisesti (multippeleilla X-kromosomi-inversioilla) merkityn kannan nuorten naaraiden kanssa. Naaraat vaihdetaan uusiin joka toinen tai kolmas vuorokausi koko sukusolusyklin kattamiseksi. Naaraiden jälkeläisten laskennalla havaittavat letaalivaikutukset voidaan luokitella valmiisiin siittiöihin, keski- tai myöhäisasteen spermatideihin, varhaisasteen spermatideihin, spermatosyytteihin ja spermatogonioihin kohdistuneista altistusvaikutuksista johtuviksi.
Edellä kuvatusta risteytyksestä saatujen heterotsygoottisten F1-polven naaraiden annetaan kunkin pariutua (so. yksi naaras kussakin kasvatuspullossa) saman jälkeläisparven koiraiden kanssa. F2-polvessa kukin kärpäsviljelmä tarkastetaan villikoiraiden puuttumisen toteamiseksi. Jos jokin viljelmä näyttää saaneen alkunsa sellaisesta F1-naaraasta, joka on edellisestä polvesta saanut letaalimutaation sisältävän X-kromosomin (eli viljelmässä ei havaita lainkaan koiraita, joilla olisi altistettu X-kromosomi), tällaisen naaraan naaraspuoliset, saman genotyypin omaavat jälkeläiset on testattava, jotta nähdään, toistuuko letaalivaikutus seuraavassa sukupolvessa.
2. TULOKSET
Tulokset on taulukoitava siten, että niistä ilmenee testattujen X-kromosomien lukumäärä, steriilien koiraiden lukumäärä sekä kullakin altistuspitoisuudella ja pariutumisjaksolla havaittujen letaalikromosomien lukumäärä kullakin altistetulla koiraalla. Tuloksissa on ilmaistava myös letaalimutaatioiden lukumäärien jakautuma koirasta kohti. Nämä tulokset on varmistettava erillisellä kokeella.
Resessiivinen letaali -testien tulosten merkitsevyys on arvioitava soveltuvin tilastollisin menetelmin. Resessiivisten letaalimutaatioiden kasaantuminen yhden koiraan kohdalle on otettava huomioon ja käsiteltävä soveltuvin tilastollisin menetelmin.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
kanta: käytetyt banaanikärpäskannat, hyönteisten ikä, altistettujen koiraiden lukumäärä, steriilien koiraiden lukumäärä, perustettujen F2-viljelmien lukumäärä, jälkeläisiä tuottamattomien F2-viljelmien lukumäärä, kussakin sukusolusyklin vaiheessa letaalimutaation saaneiden kromosomien lukumäärä, |
|
— |
altistettavien ryhmien koon määrittelyssä käytetyt perusteet, |
|
— |
koeolosuhteet: altistus- ja näytteenotto-ohjelman yksityiskohtainen kuvaus, altistustasot, tiedot myrkyllisyydestä, negatiiviset (liuotinkontrollit) ja mahdolliset positiiviset kontrollit, |
|
— |
käytetyt letaalimutaation kriteerit, |
|
— |
altistus/vastesuhde, jos mahdollista, |
|
— |
tulosten tilastollinen käsittely, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.21. SOLUTRANSFORMAATIOTESTIT NISÄKÄSSOLUVILJELMILLÄ
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄ
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Nisäkässoluviljelmillä voidaan tutkia in vitro sellaisten aineitten aikaansaamia fenotyyppisiä muutoksia, jotka in vivo aiheuttavat pahanlaatuista transformaatiota. Laajassa käytössä olevia soluja ovat mm. C3H10T1/2, 3T3, SHE ja Fischer rotan solut. Testit perustuvat solujen morfologian muutoksiin, fokusten muodostukseen tai muutoksiin kasvukyvyn pehmytagarissa. On olemassa myös vähäisemmässä käytössä olevia testejä, joilla voidaan tutkia muita, karsinogeenisille aineille altistumisen aiheuttamia fysiologisia tai morfologisia muutoksia soluissa. Millään in vitro -testeissä havainnoidulla tulostapahtumalla ei ole osoitettu olevan suoraa mekaanista yhteyttä syövän syntyyn. Joillakin testeillä voidaan havaita tuumoripromoottoreiden muodostuminen. Sytomyrkyllisyys voidaan todeta havainnoimalla tutkittavan aineen vaikutusta soluviljelmien pesäkkeenmuodostuskykyyn (kloonaustehokkuuteen) tai kasvunopeuteen. Sytotoksisuuden mittauksen tarkoituksena on varmistaa, että altistustaso on toksikologisesti mielekäs, mutta kaikissa testeissä tätä mittausta ei voida käyttää transformaatiofrekvenssin laskemiseen, sillä eräät testit edellyttävät pitkää inkubaatiota ja/tai jatkomaljausta.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Testeissä voidaan käyttää useita erilaisia solulinjoja tai primaarisoluja transformaatiotestistä riippuen. Tutkijan on varmistettava, että testissä käytettävissä soluissa ilmenee haluttu fenotyyppinen muutos tunnetuille karsinogeeneille altistamisen jälkeen ja että testin kelpoisuus ja luotettavuus on osoitettu ja kirjattu tutkijan omassa laboratoriossa.
Kasvatusalustojen ja koeolosuhteiden on sovelluttava käytettävälle transformaatiotestille.
Tutkittavat aineet voidaan sekoittaa kasvatusalustaan tai liuottaa tai sekoittaa soveltuvaan kantaja-aineeseen ennen solujen altistamista. Kantaja-aineen loppupitoisuus kasvatusalustassa ei saa vaikuttaa solujen elinkykyyn, kasvunopeuteen tai transformaatiofrekvenssiin.
Solut on altistettava tutkittavalle aineelle sekä ilman metabolista aktivaatiota että soveltuvan metabolisen aktivaatiojärjestelmän läsnäollessa. Jos käytetään solutyyppejä, joilla on itsessään kyky metaboloida vierasaineita, tämän metabolisen aktiivisuuden on oltava luonteeltaan tunnetusti soveltuva tutkittavalle aineryhmälle.
Koeolosuhteet
Kuhunkin kokeeseen on sisällyttävä sekä suoraan vaikuttavia että metabolista aktivaatiota vaativia positiivisia kontrolleja; myös negatiivista kontrollia (kantaja-ainekontrollia) on käytettävä.
Seuraavassa esimerkkejä aineista, joita voidaan käyttää positiivisina kontrolleina:
|
— |
suoraan vaikuttavat aineet:
|
|
— |
metabolista aktivaatiota vaativat aineet:
|
Tarvittaessa kokeessa voidaan lisäksi käyttää ylimääräistä positiivista kontrollia, joka kuuluu samaan kemiallisten aineitten ryhmään kuin tutkittava yhdiste.
Tutkittava aine on testattava useana eri pitoisuutena, joiden on saatava aikaan pitoisuudesta riippuva myrkkyvaikutus siten, että korkein pitoisuus aiheuttaa suuren solujen kuolleisuuden ja että alhaisimman pitoisuuden aiheuttama kuolleisuus on likimäärin sama kuin negatiivisen kontrollin aikaansaama. Huonosti veteen liukenevilla aineilla pitoisuus määräytyy liukoisuuden mukaan. Vesiliukoisten myrkyttömien aineiden korkein tutkittava pitoisuus on päätettävä tapauskohtaisesti.
Testin suorittaminen
Solujen altistusajan on oltava käytettävään testiin sopiva; jos altistusaika on pitkä, saattaa olla välttämätöntä sen kuluessa vaihtaa soluille tuore kasvatusalusta (ja mahdollisesti tuore metabolinen aktivaatioseos) sekä annostella tutkittava aine uudelleen. Solut, joilla ei itsessään ole riittävää kykyä metaboloida vierasaineita, on altistettava tutkittavalle aineelle sekä ilman metabolista aktivaatiota että soveltuvan metabolisen aktivaatiojärjestelmän läsnäollessa. Altistuksen jälkeen solut huuhdellaan puhtaiksi tutkittavasta aineesta ja niitä viljellään olosuhteissa, jotka mahdollistavat tarkasteltavana olevan transformoituneen fenotyypin ilmaantumisen ja transformaatiofrekvenssin määrittämisen. Kaikki tulokset varmistetaan erillisellä kokeella.
2. TULOKSET
Tulokset on esitettävä taulukkomuodossa. Tarkka esitysmuoto riippuu käytetystä testistä, ja se voi sisältää esim. maljakohtaiset tulokset, positiivisten maljojen lukumäärät tai transformoituneiden solujen lukumäärät. Kuolleisuus mahdollisuuksien mukaan on ilmaistava prosenttiosuutena kontrolliviljelmien solujen lukumäärästä ja transformaatiofrekvenssi transformoituneiden solujen osuutena eloonjääneistä soluista. Tulosten merkitsevyys on arvioitava soveltuvin tilastollisin menetelmin.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
käytetty solutyyppi, soluviljelmien lukumäärä, soluviljelmien edelläpitomenetelmät, |
|
— |
koeolosuhteet: tutkittavan aineen pitoisuus, käytetty kantaja-aine, inkubaatioaika, altistuksen kesto ja toistokerrat, solutiheys altistuksen aikana, käytetty eksogeeninen metabolinen aktivaatiojärjestelmä, positiiviset ja negatiiviset kontrollit, tarkasteltavana olleen fenotyypin kuvaus, mahdollisesti käytetty valikointimenetelmä, annostuksen valinnassa käytetyt perusteet, |
|
— |
eloonjääneiden ja transformoituneiden solujen laskentamenetelmä, |
|
— |
tulosten tilastollinen käsittely, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.22. DOMINOIVA LETAALITESTI JYRSIJÖILLÄ
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Dominoivat letaalivaikutukset aiheuttavat alkio- tai sikiökuolemia. Kun kemialliselle aineelle altistus aiheuttaa dominoivia letaalivaikutuksia, on syytä olettaa, että aineella on testattavan lajin sukusoluihin kohdistuvia vaikutuksia. Dominoivia letaalivaikutuksia pidetään yleisesti kromosomivaurioista (rakenteellisista ja numeerisista poikkeamista) johtuvina. Sikiökuolemat voivat myös johtua toksisista vaikutuksista, mikäli naaraat on altistettu.
Tässä testissä altistetaan tavallisesti urokset testattavalle yhdisteelle ja pariutetaan altistamattomien ennen pariutumattomien naaraiden kanssa. Sukusolujen eri asteita voidaan tutkia erikseen jaksottamalla pariuttamisvälit. Kuolleiden munasolujen lisääntyminen testiryhmän naarasta kohden verrattuna kontrolliryhmän naaraisiin osoittaa munasolun kohdun seinämään kiinnittymisen jälkeen tapahtuneet menetykset. Ennen sitä tapahtuneet menetykset voidaan arvioida laskemalla munasarjojen keltarauhaset tai vertaamalla kiinnittyneiden munasolujen kokonaismäärää naarasta kohden testiryhmässä ja kontrolliryhmässä. Dominoiva kokonaisletaalivaikutus on ennen ja jälkeen kiinnittymisen kuolleitten munasolujen yhteismäärä. Se lasketaan vertaamalla elävien kohdun seinämään kiinnittyneiden munasolujen määrää testiryhmän naarasta kohden vastaavasti kontrolliryhmän naarasta kohden. Tietyin väliajoin tapahtuva määrän väheneminen voi johtua solujen (spermatosyyttien ja spermatogonioiden) kuolemasta.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Jos mahdollista, testattavat aineet olisi liuotettava tai seostettava isotoniseen suolaliuokseen. Veteen liukenemattomat kemikaalit liuotetaan sopivia liuottimia käyttäen. Liuottimella ei saa olla testattavaan kemikaaliin kohdistuvia vaikutuksia eikä myrkkyvaikutuksia. Käyttöliuoksen on oltava vastavalmistettua.
Koe-olosuhteet
Testattava yhdiste annetaan tavallisesti yhtenä annoksena. Toistuvaa annostelua voidaan käyttää, jos aineen tiedossa olevat myrkkyvaikutukset edellyttävät sitä. Tavanomaiset antotavat ovat suun kautta ruokintaletkulla ja vatsaontelonsisäinen ruiske. Muitakin antotapoja voidaan käyttää.
Rotta tai hiiri on suositeltavin eläinlaji. Terveet, täysin sukukypsät eläimet jaetaan satunnaisesti tutkimus- ja kontrolliryhmiin.
Altistettujen urosten lukumäärästä päätettäessä on otettava huomioon määritettävänä olevan biologisen ominaisuuden spontaani vaihtelu. Lukumäärän on perustuttava ennalta määritettyyn toteamisherkkyyteen ja merkitsevyyteen. Tyypillisessä testissä on uroksia kussakin annosryhmässä oltava niin monta, että 30-50 naarasta tulee kantavaksi kunkin pariutumisajan kuluessa.
Kuhunkin testiin on yleensä liitettävä positiivinen ja negatiivinen (liuotin) kontrolli. Jos kokeen suorittavassa laboratoriossa on käytettävissä äskettäin tehtyjen kokeiden positiivisia kontrollituloksia, näitä voidaan käyttää meneillään olevan testin positiivisen kontrollin asemesta. Positiivia kontrolliaineita on käytettävä alhaisina annoksina (esimerkiksi MMS:ää vatsaontelon sisäisesti 10 mg/kg) osoittamaan testiherkkyyttä.
Tavallisesti käytetään kolmea annostasoa. Korkeimman annoksen olisi aiheutettava altistetuissa koe-eläimissä myrkkyoireita tai lisääntymiskyvyn alenemista. Eräissä tapauksissa pelkästään korkein kerta-annos saattaa olla riittävä.
Myrkyttömiä aineita käytetään 5 g/kg, kun annoskertoja on yksi, tai 1 g/kg/päivä, kun annostelu on toistuvaa.
Testin suorittaminen
Altistustapoja on useita. Testattavan aineen antaminen kerta-annoksena on yleisimmin käytetty tapa. Muitakin tapoja voidaan käyttää.
Yksittäiset urokset pariutetaan peräkkäin yhden tai kahden altistamattoman ja astuttamattoman naaraan kanssa määräajoin altistuksen jälkeen. Naaraita on pidettävä uroksen luona vähintään yhden estrussyklin ajan tai kunnes pariutumisen on todettu tapahtuneen emättimessä esiintyvän sperman tai emätintulpan perusteella.
Altistustapa määrää altistamisen jälkeen tapahtuvien pariutumisten määrän. Pariutumisia olisi oltava niin monta, että kaikista sukusoluasteista saadaan näytteet altistuksen jälkeen.
Naaraat lopetetaan tiineyden puolenvälin jälkeen ja kohdusta lasketaan kuolleet ja elävät sikiöt. Munasarjoista voidaan laskea keltarauhasten määrä.
2. TULOKSET
Tulokset esitetään taulukkomuodossa, josta ilmenee urosten ja kantavien naaraiden sekä hedelmöittymättömien naaraiden lukumäärä. Jokaisen pariutumisen tulos esitetään kunkin yksittäisen uroksen ja naaraan osalta. Naaraiden osalta kirjataan pariutumisviikko, uroksen saama annostaso, elävien ja kuolleiden alkioiden luku.
Dominoivaa kokonaisletaalivaikutusta määritettäessä testiryhmän ja kontrolliryhmän kunkin naaraan elävien alkioiden määrää vertaillaan keskenään. Testiryhmän kuolleiden alkioiden suhde eläviin verrattuna kontrolliryhmän vastaavaan suhteeseen analysoidaan munasolun kohdun seinämään kiinnittymisen jälkeen tapahtuneiden menetysten määrittämiseksi.
Jos aineisto on käsitelty siten, että tuloksina ilmoitetaan varhaiset ja myöhäiset kuolemat, tämä on ilmoitettava taulukoissa selvästi. Jos menetykset ennen kohdun seinämään kiinnittymistä on arvioitu, tämä on ilmoitettava. Ennen kiinnittymistä tapahtuneet menetykset voidaan määrittää keltarauhasten ja munasolujen määrän välisenä erona tai kiinnittymisten määränä kohtua kohden kontrolliryhmän pariutumistuloksiin verrattuna.
Tulosten merkitsevyys arvioidaan soveltuvin tilastollisin menetelmin.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
koe-eläinten laji, kanta, ikä ja paino, eläinten lukumäärä sukupuolta kohden koe- ja kontrolliryhmissä, |
|
— |
testattava aine, liuotin, käytetyt annostasot ja annostasojen valintaperusteet, negatiiviset ja positiiviset kontrollit, tiedot myrkyllisyydestä, |
|
— |
altistustie ja annostelutapa, |
|
— |
pariutumisaikataulu, |
|
— |
pariutumisen toteamistapa, |
|
— |
eläinten lopettamisaika, |
|
— |
dominoivien letaalitekijöiden määritysperusteet, |
|
— |
annos/vastesuhde, jos sovellettavissa, |
|
— |
tilastollinen arviointi, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.23. NISÄKKÄIDEN SPERMATOGONIOIDEN KROMOSOMIPOIKKEAVUUSTESTI
1. MENETELMÄ
Tämä menetelmä on sama kuin OECD TG 48 3, Mammalian Spermatogonial Chromosome Aberration Test (1997).
1.1 JOHDANTO
Tämän nisäkkäiden spermatogonioilla tehtävän in vivo -kromosomipoikkeavuustestin tarkoituksena on tunnistaa aineet, jotka aiheuttavat rakenteellisia kromosomipoikkeavuuksia nisäkkäiden spermatogonioissa (1) (2) (3) (4) (5). Rakenteelliset poikkeavuudet jakautuvat kahteen tyyppiin, kromosomi- ja kromatidipoikkeavuuksiin. Kemiallisten mutageenien aiheuttamat poikkeavuudet ovat useimmiten kromatidityyppisiä, mutta myös kromosomityyppisiä poikkeavuuksia esiintyy. Tätä menetelmää ei ole suunniteltu numeeristen poikkeavuuksien mittaamiseen, eikä sitä käytetä rutiinimaisesti tähän tarkoitukseen. Kromosomimutaatiot ja niihin liittyvät tapahtumat ovat syynä moniin ihmisen geneettisiin sairauksiin.
Tämä testi niittaa kromosomipoikkeavuuksia spermatogoniaalisissa itusoluissa, joten sen odotetaan voivan ennustaa itusolujen periytyviä mutaatioita.
Testissä käytetään yleensä jyrsijöitä. Tämä in vivo -sytogeneettinen testi paljastaa kromosomipoikkeavuudet spermatogonioiden mitooseissa. Tällä menetelmällä ei tutkita muita kohdesoluja.
Spermatogonioiden kromatidityyppisten poikkeavuuksien havaitsemiseksi on tutkittava ensimmäistä mitoottista solunjakautumista altistuksen jälkeen, ennen kuin nämä leesiot häviävät myöhemmissä solunjakautumisissa. Altistetuista spermatogoniaalisista kantasoluista voidaan saada lisätietoja tekemällä meioottisia kromosomianalyysejä kromosomityyppisten poikkeavuuksien toteamiseksi diakineesi-metafaasi I:ssä altistettujen solujen muuttuessa spermatosyyteiksi.
Tällä in vivo -testillä pyritään selvittämään, vaikuttavatko somaattisten solujen mutageenit myös itusoluihin. Spermatogonioilla tehtävä testi soveltuu myös mutageenisuuden vaaran arvioimiseen, sillä siinä voidaan ottaa huomioon tekijöitä, jotka liittyvät in vivo metaboliaan, farmakokinetiikkaan ja DNA:n korjautumisprosesseihin.
Kiveksissä on yhtaikaa monia spermatogonioiden sukupolvia, joiden herkkyys kemiallisten aineiden vaikutuksille vaihtelee. Havaitut poikkeavuudet edustavat siten käsiteltyjen spermatogoniopopulaatioiden kokonaisvastetta, jossa hallitsevassa asemassa ovat muita suurempina määrinä esiintyvät erilaistuneet spermatogoniot. Eri sukupolviin kuuluvien spermatogonioiden yhteys yleiseen verenkiertoon riippuu niiden sijainnista kiveksissä. Kaikki spermatogoniot eivät ole yhteydessä verenkiertoon Sertolin solujen muodostaman fysikaalisen ja fysiologisen esteen ja veri-kivesesteen vuoksi.
Jos on saatu viitteitä siitä, että tutkittava aine tai sen reaktiivinen metaboliitti ei pääse kohdekudokseen, tätä testiä ei pidä käyttää.
Ks. myös Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Kromatidipoikkeavuus: rakenteellinen kromosomivaurio, joka ilmenee yksittäisten kromatidien katkeamisena tai kromatidien katkeamisena ja uudelleenyhtymisenä.
Kromosomipoikkeavuus: rakenteellinen kromosomivaurio, joka ilmenee molempien kromatidien katkeamisena tai katkeamisena ja uudelleenyhtymisenä samassa kohdassa.
Aukko: gap, akromaattinen leesio, joka on pienempi kuin yhden kromatidin leveys, ja johon liittyy minimaalinen kromatidien siirtymä.
Numeerinen poikkeavuus: testissä käytetyille eläimille tyypillisestä normaalista kromosomimäärästä poikkeava kromosomien lukumäärä.
Polyploidia: haploidisen kromosomimäärän (n) esiintyminen moninkertaisena, muu kuin diploidinen kromosomimäärä (3n, 4n jne.).
Rakenteellinen poikkeama: kromosomirakenteen muutos, joka voidaan havaita solunjakautumisen metafaasivaiheen mikroskooppitutkimuksella ja joka ilmenee deleetioina, kromosomien sisäisinä tai kromosomien välisinä tekijänvaihdoksina.
1.3 TESTIN PERIAATE
Eläimet altistetaan tutkittavalle aineelle soveltuvaa altistusreittiä käyttäen ja lopetetaan sopivan ajan kuluttua altistuksesta. Ennen lopettamista eläimille annetaan ainetta, joka pysäyttää solunjakautumisen metafaasiin (esim. kolkisiini tai Colcemid®). Tämän jälkeen itusoluista valmistetaan kromosomipreparaatit ja ne värjätään, ja metafaasissa olevista soluista analysoidaan kromosomipoikkeavuudet.
1.4 TESTIN KUVAUS
1.4.1 Testin valmistelu
1.4.1.1 Eläinlajin valinta
Yleisesti käytettyjä eläinlajeja ovat kiinanhamsteri- ja hiiriurokset. Myös muiden soveltuvien nisäkäslajien uroksia voidaan käyttää. Koe-eläinten on oltava yleisesti käytettyä laboratoriokantaa olevia nuoria terveitä täysikasvuisia eläimiä. Testin alkaessa eläinten painon vaihtelun on oltava minimaalista, enintään ± 20 % keskipainosta.
1.4.1.2 Asuinolot ja ruokinta
Yleiset olosuhteet ovat samat kuin osan B Yleisjohdannossa mainitut, mutta kosteustavoitteen on oltava 50–60 %.
1.4.1.3 Eläinten valmistelu
Terveet nuoret täysikasvuiset urokset jaetaan satunnaistetusti koe- ja kontrolliryhmiin. Häkit on sijoitettava siten, että häkin sijainnista johtuvat vaikutukset ovat mahdollisimman vähäisiä. Eläimet tunnistetaan yksilöllisesti. Eläimiä sopeutetaan laboratorio-olosuhteisiin vähintään viiden päivän ajan ennen tutkimuksen aloittamista.
1.4.1.4 Annosten valmistelu
Kiinteät tutkittavat aineet liuotetaan tai sekoitetaan sopiviin liuottimiin tai kantaja-aineisiin ja laimennetaan tarvittaessa ennen kuin niitä annetaan koe-eläimille. Nestemäiset tutkittavat aineet voidaan antaa suoraan tai laimentaa ennen antamista. Tutkittava aine on valmisteltava juuri ennen annostelua, paitsi jos sen säilyvyys on osoitettu stabiliteettitesteillä.
1.4.2 Koeolosuhteet
1.4.2.1 Liuotin /kantaja-aine
Liuottimella/kantaja-aineella ei saa olla myrkkyvaikutuksia käytetyillä annostasoilla, eikä sen käyttöön saa liittyä epäilyjä mahdollisista kemiallisista reaktioista tutkittavan aineen kanssa. Jos käytetään muita kuin hyvin tunnettuja liuottimia/kantaja-aineita, niiden käyttö on perusteltava niiden yhteensopivuuden osoittavilla tutkimustuloksilla. Ensisijaisesti on harkittava vesipitoisen liuottimen/kantaja-aineen käyttöä, mikäli mahdollista.
1.4.2.2 Kontrollit
Jokaiseen testiin on otettava mukaan rinnakkaiset positiiviset ja negatiiviset (liuotin/kantaja-aine) kontrollit. Kontrolliryhmän eläimiä on käsiteltävä samalla tavoin kuin koeryhmän eläimiä, mutta niille ei anneta tutkittavaa ainetta.
Positiivisten kontrollien tulisi aiheuttaa spermatogonioissa rakenteellisia kromosomipoikkeavuuksia in vivo altistustasoilla, joiden odotetaan aiheuttavan havaittavaa lisääntymistä taustaan verrattuna.
Positiivisten kontrolliaineiden annokset on valittava siten, että vaikutukset ovat selvät mutta eivät paljasta heti lukijalle koodattujen objektilasien identiteettiä. Positiivinen kontrolliaine voidaan antaa eri reittiä pitkin kuin testattava aine ja näytteet voidaan ottaa vain kerran. Lisäksi positiivisina kontrolleina tulisi käyttää samaan kemiallisten aineiden ryhmään kuuluvia aineita, mikäli mahdollista. Esimerkkejä positiivisista kontrolliaineista:
|
Aine |
CAS-nro |
EINECS-nro |
|
syklofosfamidi syklofosfamidimonohydraatti |
50-18-0 6055-19-2 |
200-015-4 |
|
sykloheksyyliamiini |
108-91-8 |
203-629-0 |
|
mitomysiini C |
50-07-7 |
200-008-6 |
|
monomeerinen akryyliamidi |
79-06-1 |
201-173-7 |
|
trietyleenimelamiini |
51-18-3 |
200-083-5 |
Pelkkää liuotinta tai kantaja-ainetta saaneista negatiivisista kontrolleista, joita muuten on käsitelty samalla tavoin kuin koeryhmiä, on otettava näytteet jokaisella näytteenottokerralla, paitsi jos aikaisemmat tutkimustulokset osoittavat, että eläinten väliset erot ja vaihtelut kromosomipoikkeavuuksia sisältävien solujen esiintymistaajuudcssa ovat hyväksyttävällä tasolla. Lisäksi on käytettävä käsittelemättömiä kontrolleja, paitsi jos kontrolleilla aikaisemmin tehdyt tutkimukset tai julkaistut tulokset osoittavat, että valittu liuotin/kantaja-aine ei aiheuta haitallisia eikä mutageenisia vaikutuksia.
1.5 TESTIN SUORITTAMINEN
1.5.1 Eläinten lukumäärä
Jokaisessa koe- ja kontrolliryhmässä on oltava vähintään 5 analysoitavissa olevaa urosta.
1.5.2 Altistusohjelma
Tutkittavia aineita tulisi antaa mieluiten kerran tai kaksi kertaa (kerta-annoksena tai kahtena altistuksena). Ne voidaan antaa myös jaettuina annoksina eli kahtena altistuksena saman päivän aikana vain muutaman tunnin välein, mikä helpottaa suurten ainemäärien antamista. Muunlaiset annosteluohjelmat on perusteltava tieteellisesti.
Suurinta annosta saavassa ryhmässä käytetään kahta näytteenottokertaa altistuksen jälkeen. Koska tutkittava aine voi vaikuttaa solusyklin kinetiikkaan, näytteet kerätään yhtenä aikaisempana ja yhtenä myöhempänä ajankohtana noin 24–48 tunnin kuluttua altistuksesta. Muissa kuin suurimmassa annosryhmässä näytteet kerätään kerran 24 tunnin tai 1,5 solusyklin kuluttua altistuksesta, paitsi jos jonkin muun näytteenottoajankohdan tiedetään soveltuvan paremmin vaikutusten toteamiseen (6).
Näytteitä voidaan ottaa lisäksi myös muina ajankohtina. Varhaisemmat näytteenottoajat saattavat olla perusteltuja esimerkiksi testattaessa kemiallisia aineita, jotka voivat aiheuttaa kromosomien hidastumista (lagging) tai joilla saattaa olla S-vaiheesta riippumattomia vaikutuksia (1).
Toistuvien altistusten soveltuvuus on osoitettava tapauskohtaisesti. Toistuvan altistuksen jälkeen eläimet on lopetettava 24 tunnin (1,5 solusyklin) kuluttua viimeisestä altistuksesta. Tarvittaessa voidaan käyttää ylimääräisiä näytteenottokertoja.
Ennen lopettamista eläimille annetaan injektiona vatsaonteloon sopiva annos ainetta, joka pysäyttää solut metafaasivaiheeseen (esim. Colcemid®ia tai kolkisiinia). Elämistä otetaan näytteet sopivan ajan kuluttua tämän jälkeen. Hiirillä tämä väli on noin 3–5 tuntia: kiinanhamstereilla se on noin 4–5 tuntia.
1.5.3 Annostasot
Jos tehdään annoksenmääritystutkimus, koska soveltuvia tietoja ei ole käytettävissä, se on tehtävä samassa laboratoriossa käyttäen samaa lajia, samaa kantaa ja samaa altistusohjelmaa kuin päätutkimuksessa on tarkoitus käyttää (7). Mikäli myrkkyvaikutuksia esiintyy, ensimmäiseen näytteenottoajankohtaan asti käytetään kolmea annostasoa. Näistä suurimmalla annoksella on oltava maksimaalinen myrkkyvaikutus ja pienimmällä vähäinen tai ei lainkaan myrkkyvaikutusta. Myöhemmän näytteenottoajankohdan edellä voidaan käyttää vain suurinta annosta. Suurin annos määritellään annokseksi, joka aiheuttaa sen kaltaisia myrkyllisyysoireita, että samaan annosteluohjelmaan perustuvien suurempien annosten voitaisiin odottaa johtavan kuolemaan.
Aineet, joilla on spesifisiä biologisia vaikutuksia pieninä, myrkyttöminä annoksina (kuten hormonit ja mitogeenit), saattavat edellyttää muita annoksenmäärityskriteerejä, ja ne pitäisi arvioida tapauskohtaisesti. Suurin annos voidaan määritellä myös annokseksi, joka aiheuttaa joitakin myrkkyvaikutukseen viittaavia muutoksia spermatogonioissa (esim. spermatogonioiden mitoosien suhde ensimmäiseen ja toiseen meioottiseen metafaa-siin on pienentynyt; tämä pieneneminen ei saa olla yli 50 %).
1.5.4 Raja-annostesti
Ellei havaittavia myrkkyvaikutuksia esiinny testattaessa yhtä annostasoa, joka on vähintään 2 000 mg eläimen painokiloa kohti vuorokaudessa (mg/kg/vrk) ja joka annetaan kerta-annoksena tai kahtena annoksena saman päivän aikana, ja ellei genotoksisuutta ole odotettavissa kemialliselta rakenteeltaan samanlaisilla aineilla saatujen tutkimustulosten perusteella, täydellinen tutkimus kolmella eri annostasolla ei ehkä ole välttämätön. Ihmisten odotettu altistus saattaa edellyttää suurempien annostasojen käyttöä raja-annostestissä.
1.5.5 Antotapa
Tutkittava aine annetaan yleensä ruokintaletkulla tai sopivalla intubaatiokanyylillä tai injektiona vatsaonteloon. Myös muut antotavat ovat mahdollisia, mikäli ne voidaan perustella. Koe-eläimen koosta riippuu, kuinka paljon nestettä voidaan antaa kerralla ruokintaletkun kautta tai injektiona. Määrä ei kuitenkaan saa olla yli 2 ml/100 g eläimen painon mukaan mitattuna. Mikäli käytetään suurempia nestemääriä, ne on perusteltava. Lukuun ottamatta ärsyttäviä tai syövyttäviä aineita, joiden vaikutukset yleensä pahenevat suurempia pitoisuuksia käytettäessä, nestemäärien vaihtelu olisi pidettävä mahdollisimman pienenä säätämällä tutkittavan aineen pitoisuuksia siten, että kokonaisnestemäärä pysyy samana kaikilla annostasoilla.
1.5.6 Kromosomipreparaattien valmistus
Heti eläinten lopettamisen jälkeen toisesta kiveksestä tai molemmista kiveksistä otetaan solususpensioita, jotka pannaan hypotoniseen liuokseen ja fiksoidaan. Tämän jälkeen solut levitetään objektilaseille ja värjätään.
1.5.7 Analyysi
Jokaista eläintä kohti tulisi analysoida vähintään 100 hyvin levinnyttä metafaasia (vähintään 500 metafaasia/ ryhmä). Tätä määrää voidaan pienentää, jos havaitaan runsaasti poikkeavuuksia. Kaikki objektilasit, myös positiiviset ja negatiiviset kontrollit, on koodattava toisistaan riippumattomasti ennen mikroskooppitutkimusta. Koska fiksaatiotoimenpiteet johtavat usein joidenkin metafaasien rikkoutumiseen ja kromosomien menetykseen, sentromeerien lukumäärän lasketuissa soluissa on vastattava lukua 2n ± 2.
2. TULOKSET
2.1 TULOSTEN KÄSITTELY
Eläinkohtaiset tiedot on esitettävä taulukkomuodossa. Kokeellinen yksikkö on eläin. Jokaisesta yksittäisestä eläimestä on arvioitava rakenteellisia kromosomipoikkeavuuksia sisältävien solujen lukumäärä ja kromosomipoikkeavuuksien lukumäärä solua kohti. Eri tyyppiset rakenteelliset kromosomipoikkeavuudet on lueteltava, ja niiden lukumäärä ja esiintymistaajuus koe- ja kontrolliryhmien osalta on ilmoitettava. Aukot (gaps) rekisteröidään erikseen ja raportoidaan, mutta niitä ei yleensä lasketa mukaan kromosomipoikkeavuuksien kokonaistaajuuteen.
Jos havaitaan sekä mitoosia että meioosia, spermatogonioiden mitoosien suhde ensimmäiseen ja toiseen meioottiseen metafaasiin on määritettävä sytotoksisuuden mittana kaikista tutkittavalle aineelle altistetuista eläimistä ja negatiivisista kontrolleista yhteensä 100 jakautuvan solun näytteestä eläintä kohti mahdollisen sytotoksisen vaikutuksen osoittamiseksi. Jos tarkastellaan ainoastaan mitoosia, mitoosi-indeksi on määritettävä vähintään 1 000 solusta jokaista eläintä kohti.
2.2 TULOSTEN ARVIOINTI JA TULKINTA
Positiivisille tuloksille on useita kriteerejä, kuten annoksesta riippuva kromosomipoikkeavuuksia sisältävien solujen suhteellisen lukumäärän suureneminen tai kromosomipoikkeavuuksia sisältävien solujen lukumäärän selvä suureneminen yksittäisen annoksen osalta yhdellä näytteenottokerralla. Tulosten biologinen merkitys on otettava ensisijaisesti huomioon. Tilastollisia menetelmiä voidaan käyttää apuna testitulosten arvioinnissa (8). Tilastollinen merkitsevyys ei saa olla ainoa määräävä tekijä positiivisen vasteen arvioinnissa. Epäselviä tuloksia on selkeytettävä jatkotestauksella mieluiten muunnetuissa koeolosuhteissa.
Tutkittava aine, jolla saadut tulokset eivät täytä edellä kuvattuja kriteerejä, katsotaan ei-mutageeniseksi tässä testissä.
Useimmissa testeissä saadaan selvästi positiivisia tai negatiivisia tuloksia, mutta joissakin harvinaisissa tapauksissa saatujen tietojen pohjalta ei voida tehdä varmoja päätelmiä testattavan aineen vaikutuksesta. Tulokset saattavat jäädä epäselviksi tai kyseenalaisiksi kokeen toistokertojen määrästä riippumatta.
Spermatogonioiden in vivo -kromosomipoikkeavuustestissä saadut positiiviset tulokset osoittavat, että tutkittava aine aiheuttaa rakenteellisia kromosomipoikkeavuuksia testatun lajin itusoluissa. Negatiiviset tulokset osoittavat, ettei tutkittava aine aiheuta koeolosuhteissa kromosomipoikkeavuuksia testatun lajin itusoluissa.
Tutkittavan aineen tai sen metaboliittien todennäköistä pääsyä kohdekudokseen on pohdittava.
3. RAPORTOINTI
TUTKIMUSSELOSTUS
Tutkimusselostuksen on sisällettävä seuraavat tiedot:
|
|
Liuotin/kantaja-aine:
|
|
|
Koe-eläimet:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
|
|
Johtopäätökset. |
4. KIRJALLISUUTTA
|
(1) |
Adler, I. D. (1986), Clastogenic Potential in Mouse Spermatogonia of Chemical Mutagens Related to their Cell-Cycle Specifications, in: Genetic Toxicology of Environmental Chemicals, Part B: Genetic Effects and Applied Mutagenesis, Ramel, C, Lambert, B. and Magnusson, J. (eds.) Liss, New York, s. 477–484. |
|
(2) |
Adler. I. D., (1984). Cytogenetic tests in Mammals, in: Mutagenicity Testing: a Practical Approach, ed. S. Venitt and J. M. Parry, IR.L Press, Oxford, Washington DC, s. 275–306. |
|
(3) |
Evans, E. P., Breckon, G. and Ford, C. E., (1964), An Air-drying Method for Meiotic Preparations from Mammalian Testes, Cytogenetics and Cell Genetics, 3, s. 289–294. |
|
(4) |
Richold, M., Ashby, J., Chandley, A., Gatehouse, D. G. and Henderson, L. (1990), In Vivo Cytogenetic Assays, in: D. J. Kirkland (Ed.) Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part I revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, s. 115–141. |
|
(5) |
Yamamoto, K. and Kikuchi, Y. (1978), A New Method for Preparation of Mammalian Spermatogonial Chromosomes, Mutation Res., 52, s. 207–209. |
|
(6) |
Adler, I. D., Shelby, M. D., Bootman, J., Favor, J., Generoso, W., Pacchierotti, F., Shibuya, T. and Tanaka N. (1994), International Workshop on Standardisation of Genotoxicity Test Procedures. Summary Report of the Working Group on Mammalian Germ Cell Tests, Mutation Res., 312, s. 313–318. |
|
(7) |
Fielder, R. J., Allen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G., Hodson-Walker, G., Morton, D. B., Kirkland, D. J. and Richold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, s. 313–319. |
|
(8) |
Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson, R., Richold, M., Papworth, D. G. and Savage, J. R. K. (1989), Statistical Analysis of In Vivo Cytogenetic Assays, in: D. J. Kirkland (ed.), Statistical Evaluation of Mutagenicity Test Data. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. report. Part III, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, s. 184–232. |
B.24. HIIREN SPOT-TESTI
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄ
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Tässä hiirellä tehdyssä in vivo -testissä kehittyvät sikiöt altistetaan kemikaaleille. Kehittyvien sikiöiden kohdesolut ovat melanoblasteja ja kohdegeenit niitä, jotka säätelevät karvapeitteen karvojen pigmentaatiota. Kehittyvät sikiöt ovat heterotsygootteja useiden karvapeitteen värigeenien osalta. Melanoblastin tällaisen geenin dominoivan alleelin mutaatio tai (jonkin geneettisen tapahtuman aiheuttama) poistuma aiheuttaa resessiivisen fenotyypin ilmenemisen siitä syntyvissä soluissa, ja se näkyy värimuutostäplänä kehityksen lopputuloksena olevan hiiren turkissa. Täplikkäiden poikasten määrä ja mutaatioiden yleisyys kirjataan ja sitä verrataan ainoastaan liuottimelle sikiöasteella altistettuihin poikasiin. Hiiren spot-testillä voidaan määrittää sikiösolujen oletetut somaattiset mutaatiot.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Jos mahdollista, testattavat kemikaalit liuotetaan isotoniseen suolaliuokseen. Veteen liukenemattomat kemikaalit liuotetaan tai sekoitetaan sopiviin liuottimiin. Liuottimella ei saa olla testattavaan yhdisteeseen kohdistuvia vaikutuksia eikä myrkkyvaikutuksia. Testattavia yhdisteitä on käytettävä vastavalmistettuina liuoksina.
T-kantaa olevat hiiret (nonagouti, a/a; chinchilla, pink eye, cchp/cchp; brown, b/b; dilute, short ear, d se/d se; piebald spotting, s/s) pariutetaan joko HT-kantaa (pallid, nonagouti, brachypody, pa a bp/pa a bp; leaden fuzzy, ln fz/ln fz; pearl pe/pe) tai C57 BL-kantaa (nonagouti, a/a) olevien hiirten kanssa. Muitakin sopivia risteytyksiä, esimerkiksi NMRI-kantaa (nonagouti, a/a; albino, c/c) ja DBA-kantaa (nonagouti, a/a; brown, b/b; dilute d/d), voidaan käyttää edellyttäen, että ne tuottavat nonagoutijälkeläisiä.
Riittävä määrä tiineitä naaraita altistetaan siten, että kutakin annostasoa kohden saadaan tarpeellinen määrä elossa olevia poikasia. Määrä riippuu altistetuissa hiirissä havaittujen täplien lukumäärästä ja kontrollitulosten kattavuudesta. Negatiivinen tulos voidaan hyväksyä ainoastaan, kun korkeimmalla annoksella käsiteltyjen naaraiden poikasia on tutkittu vähintään 300.
Tulokset kontrollitesteistä, joissa hiirille on annettu ainoastaan liuotinta (negatiivinen kontrolli) on oltava käytettävissä. Samasta laboratoriosta peräisin olevat aikaisempien kontrollitutkimusten tulokset voidaan yhdistää testin herkkyyden lisäämiseksi edellyttäen, että ne ovat yhtenäiset. Kokeensuorittavassa laboratoriossa olisi oltava käytettävissä positiivisia kontrollituloksia sellaisella kemikaalilla tehdyistä kokeista, jonka tiedetään tässä testissä osoittavan mutageenisuutta, ellei nyt testattavana oleva kemikaali osoittaudu mutageeniseksi.
Ainetta annetaan tiineille naaraille tavallisesti suun kautta ruokintaletkulla tai vatsaontelonsisäisenä ruiskeena. Altistus voidaan tarvittaessa tehdä hengitysteiden kautta ja muitakin antotapoja voidaan käyttää.
Testissä käytetään vähintään kahta annostasoa, joista toinen aiheuttaa myrkkyoireita tai pienentää poikueen kokoa. Myrkyttömiä kemikaaleja testattaessa on käytettävä mahdollisimman suurta annosta.
Testin suorittaminen
Kerta-annos annetaan yleensä raskauden 8., 9. tai 10. päivänä. Raskauden 1. päivä on emätintulpan havaitsemispäivä. Nämä päivät vastaavat 7,25, 8,25 ja 9,25 päivää hedelmöityksestä. Näiden päivien aikana voidaan antaa toistuvia annoksia.
Poikaset koodataan ja niiden täplikkyys tutkitaan 3–4 viikon ikäisinä. Täplät eritellään kolmeen ryhmään:
|
a) |
valkeat täplät 5 mm:n alueella vatsan keskiviivasta, joiden oletetaan aiheutuvan solukuolemista (WMVS); |
|
b) |
keltaiset, agouti-tyyppiset täplät nisien ja sukupuolielinten yhteydessä, kaulassa, kainaloiden ja nivusten alueella ja otsan keskiosassa, joiden oletetaan aiheutuvan erilaistumisvirheistä (misdifferentiation, MDS); sekä |
|
c) |
pigmentoidut ja valkeat sattumanvaraisesti karvapeitteessä esiintyvät täplät, joiden oletetaan aiheutuvan somaattisista mutaatioista (RS). |
Kaikki kolme ryhmää kirjataan, mutta ainoastaan viimeinen, RS, on geneettisesti merkitsevä. MDS- ja RS-täplät voidaan erottaa toisistaan tutkimalla näytekarvat fluoresoivalla mikroskoopilla.
Poikasten selvästi näkyvät morfologiset poikkeamat on kirjattava.
2. TULOKSET
Tuloksina ilmoitetaan tutkittujen poikasten kokonaismäärä sekä niiden poikasten määrä, joissa esiintyy yksi tai useampia oletetusta somaattisesta mutaatiosta johtuvia täpliä. Altistus- ja kontrollitulosten vertailu suoritetaan jollakin soveltuvalla menetelmällä. Tulokset esitetään myös poikuekohtaisesti.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
risteytyksessä käytetyt kannat, |
|
— |
tiineiden naaraiden lukumäärä koe- ja kontrolliryhmissä, |
|
— |
poikueiden keskikoko koe- ja kontrolliryhmissä syntymähetkellä ja vieroituksen tapahtuessa, |
|
— |
testattavan kemikaalin annostaso(t), |
|
— |
käytetty liuotin, |
|
— |
tiineyspäivä, jolloin annos annettiin, |
|
— |
annostelutapa, |
|
— |
poikasten kokonaismäärä sekä koe- ja kontrolliryhmissä esiintyneiden WMVS-, MDS- ja RS-ryhmän täplikkäiden poikasten lukumäärä, |
|
— |
näkyvät morfologiset poikkeamat, |
|
— |
RS-ryhmän osalta annos/vastesuhde, jos mahdollista, |
|
— |
tulosten tilastollinen käsittely, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.25. HIIREN PERIYTYVÄ TRANSLOKAATIO
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄ
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Hiiren periytyvä translokaatiotesti tutkii nisäkkäiden sukusolujen rakenteellisia ja lukumääräisiä kromosomimuutoksia ensimmäisen polven jälkeläisistä. Havaittuja kromosomimuutoksia ovat vastavuoroiset translokaatiot sekä X-kromosomin häviämät naaraspuolisissa jälkeläisissä. Translokaatiokantajat ja XO-naaraat osoittavat hedelmällisyyden alenemista, jonka perusteella F1-jälkeläiset valitaan sytogeneenisuustutkimuksiin. Eräät translokaatiotyypit aiheuttavat täydellisen steriliteetin (X-autosomi ja c-t-tyyppi). Translokaatioita tutkitaan sytogeneettisesti joko F1-urosten tai F1-naaraiden urospuolisten poikasten meioottisista diakineesi-metafaasi I -vaiheessa olevista soluista. XO-naaraat tunnistetaan sytogeneettisesti siitä, että niillä on ainoastaan 39 kromosomia luuydinmitoosissa.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Testattavat kemikaalit liuotetaan isotoniseen suolaliuokseen. Veteen liukenemattomat kemikaalit liuotetaan tai sekoitetaan sopiviin liuottimiin. Jos käytetään liuotinta annostelun helpottamiseksi, sillä ei saa olla testattavaan yhdisteeseen kohdistuvia vaikutuksia eikä myrkkyvaikutuksia.
Altistus suoritetaan tavallisesti suun kautta ruokintaletkulla tai vatsaontelonsisäisenä ruiskeena. Muitakin antotapoja voidaan käyttää.
Testit suoritetaan hiirillä, koska niiden kasvatus ja solututkimukset eivät aiheuta ongelmia. Kantaa ei ole määrätty. Kannan keskimääräisen poikuekoon on kuitenkin oltava yli kahdeksan ja pysyä suhteellisen vakiona.
Koe-eläiminä käytetään terveitä sukukypsiä hiiriä.
Tarvittavien eläinten määrä riippuu spontaanin translokaation esiintymistiheydestä ja minimiannoksesta, joka tarvitaan positiivisen tuloksen aikaansaamiseksi.
Testi suoritetaan yleensä analysoimalla F1-urospuolisia jälkeläisiä. Vähintään 500 F1-sukupolven urospuolista jälkeläistä on tutkittava kutakin annosryhmää kohden. Mikäli myös F1-sukupolven naaraspuoliset jälkeläiset kuuluvat tutkimuksen piiriin, tarvitaan 300 naarasta ja 300 urosta.
Käytettävissä on oltava riittävästi sekä meneillään olevista että aikaisemmista tutkimuksista saatuja kontrollituloksia. Mikäli testin suorittavassa laboratoriossa on käytettävissä äskettäin tehtyjen kokeiden positiivisia kontrollituloksia, näitä voidaan käyttää meneillään olevan kokeen positiivisen kontrollin asemesta.
Tutkimuksessa käytetään yhtä annostasoa. Se on yleensä korkein annos, joka aiheuttaa pienimmät havaittavissa olevat myrkkyvaikutukset, mutta ei vaikuta lisääntymiskäyttäytymiseen eikä eloonjäämiseen. Annos/vastesuhteen määrittämiseksi tarvitaan lisäksi kaksi alempaa annostasoa. Myrkyttömiä kemikaaleja testattaessa on käytettävä mahdollisimman suurta annosta.
Testin suorittaminen
Käytettävissä on kaksi annostustapaa. Testattava aine annetaan yleensä kerta-annoksena. Testattavaa ainetta voidaan myös antaa viikon jokaisena päivänä 35 päivän aikana. Annostelutapa määrää altistusta seuraavien pariuttamisten määrän. On tärkeää, että kaikista sukusoluasteista saadaan näyte. Pariuttamisajan lopussa naaraat siirretään yksittäishäkkeihin. Kun naaraat synnyttävät, synnytyspäivä, poikueen koko ja jälkeläisten sukupuoli kirjataan. Kaikki urospuoliset jälkeläiset vieroitetaan ja naaraspuoliset lopetetaan, elleivät ne kuulu tutkimuksen piiriin.
Jompaakumpaa jäljempänä esitetyistä menetelmistä voidaan käyttää:
|
— |
F1-jälkeläisten hedelmällisyystutkimus ja sen jälkeen translokaatiokantajien varmistus sytogeneettisen analyysin avulla. |
|
— |
Kaikkien F1-urospuolisten jälkeläisten sytogeneettinen analyysi ilman edeltävää hedelmällisyystutkimusta. |
|
a) |
Hedelmällisyystutkimus: F1-eläimen alentunut hedelmällisyys voidaan määrittää tutkimalla poikueiden kokoa ja/tai analysoimalla naaraiden kohdun sisältö. Käytetyn hiirikannan normaalin ja alentuneen hedelmällisyyden arviointikriteerit on määritettävä. Poikueen koon tutkiminen: testattavat F1-urokset pannaan yksittäishäkkeihin samasta testistä tai samasta yhdyskunnasta peräisin olevien naaraiden kanssa. Häkit tutkitaan päivittäin 18 päivän kuluttua pariutumisesta alkaen. Synnytyksen tapahduttua poikueen koko ja F2-jälkeläisten sukupuoli kirjataan ja poikueet hävitetään. Kun tutkitaan naaraspuolisia F1-jälkeläisiä, pienten poikueiden F2-jälkeläiset säilytetään jatkotutkimuksia varten. Naaraspuoliset translokaatiokantajat varmistetaan tekemällä sytogeneettinen translokaatioanalyysi jostakin niiden urospuolisesta jälkeläisestä. XO-naaraat tunnistetaan siitä, että niiden jälkeläisten sukupuolijakautuma 1:1 muuttuu suhteeksi 1:2 uroksia/naaraita. Sarjatutkimuksissa normaalien F1-eläimien lisätutkimuksia ei suoriteta, jos ensimmäinen F2-poikue on ennalta määritetyn normaalipoikueen kokoinen tai sitä suurempi. Muussa tapauksessa tutkitaan toinen tai kolmas F2-poikue. Niille F1-eläimille, joita ei voida pitää normaaleina kolmen F2-poikueen tutkimisen perusteella, suoritetaan lisätutkimuksia joko analysoimalla emojen kohdun sisältö tai tekemällä niistä suoraan sytogeneettinen analyysi. Kohdun sisällön tutkiminen: translokaatiokantajien poikueiden pieneminen johtuu sikiökuolemista, joten kohdun seinämään kiinnittyneiden kuolleiden munasolujen suuri määrä viittaa tutkittavana olevassa eläimessä tapahtuneeseen translokaatioon. Kukin testattava F1-uros pariutetaan kahden tai kolmen naaraan kanssa. Hedelmöitys varmistetaan joka aamu tutkimalla, onko naaraille kehittynyt emätintulppa. Naaraat lopetetaan 14–16 päivän kuluttua ja kohdussa olevien elävien ja kuolleiden alkioiden määrä kirjataan. |
|
b) |
Sytogeneettinen analyysi: Kivekset preparoidaan ilmakuivatusmenetelmää käyttäen. Translokaatiokantajat tunnistetaan primaarispermatogyyttien ensimmäisen diakineesimetafaasin multivalenttien rakennemuotojen perusteella. Vähintään kahdessa solussa esiintyvä multivalentti yhdistyminen on riittävä osoitus siitä, että tutkittava eläin on translokaatiokantaja. Ellei siitosvalintaa ole tehty, kaikki F1-urokset tutkitaan sytogeneettisesti. Vähintään 25 ensimmäisen diakineesimetafaasin solua on mikroskopoitava urosta kohden. Mitoosin metafaasit spermatogonioista tai luuytimestä on tutkittava F1-uroksilta, joilla on pienet kivekset ja diakineesia edeltävä meioosin jakautumisvaihe F1-naarailta, joiden epäillään olevan XO-naaraita. Epätavallisen pitkän ja/tai lyhyen kromosomin esiintyminen 10 solussa osoittaa steriiliä translokaatiota yksittäisessä uroksessa (c-tyyppi). Eräät urosten steriliteettiä aiheuttavat X-autosomi-translokaatiot voidaan todeta ainoastaan mitoottisten kromosomien raita-analyysin perusteella. Kun kaikissa 10 mitoosissa esiintyy 39 kromosomia, tämä osoittaa, että kysymyksessä on XO-naaras. |
2. TULOKSET
Tulokset esitetään taulukkomuodossa.
Parentaalisukupolven poikueiden keskikoko ja sukupuolijakautuma syntymis- ja vieroitusajankohtana ilmoitetaan jokaista pariutumisjaksoa kohden.
F1-eläinten hedelmällisyystutkimusten osalta ilmoitetaan kaikkien normaalien pariutumisten tuottamien poikueiden keskikoko ja F1-translokaatiokantajien kunkin poikueen koko. Kohdun sisällön analyyseistä ilmoitetaan normaalien pariutumisten tuottamat elävät ja kuolleet kohdun seinämään kiinnittyneet munasolut ja F1-translokaatiokantajien jokaisen pariutumisen tuottamat elävät ja kuolleet kohdun seinämään kiinnittyneet munasolut.
Ensimmäisen diakineesimetafaasin sytogeneettisistä analyyseistä ilmoitetaan multivalenttien raken-nemuutostyyppien määrät ja kokonaissolumäärä kutakin translokaatiokantajaa kohden.
Steriilien F1-yksilöiden osalta ilmoitetaan pariutumisien kokonaismäärä ja pariuttamisajan kesto. Ilmoitetaan kivesten paino ja sytogeneettisen analyysin tulokset.
XO-naaraiden osalta ilmoitetaan poikueiden keskikoko, F2-jälkeläisten sukupuolijakautuma sekä sytogeneettisen analyysin tulokset.
Jos mahdolliset F1-translokaatiokantajat valittiin ennakolta hedelmällisyystutkimusten perusteella, taulukosta on ilmettävä, kuinka moni näistä varmistui translokaatioheterotsygootiksi.
Negatiiviset kontrollitulokset ja positiivisten kontrollitestien tulokset ilmoitetaan.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
hiirikanta, eläinten ikä, altistettujen eläinten paino, |
|
— |
parentaalieläinten lukumäärä sukupuolta kohden koe- ja kontrolliryhmissä, |
|
— |
koeolosuhteet, tarkka kuvaus altistuksesta, annostasot, liuottimet, pariutumisaikataulu, |
|
— |
poikasten lukumäärä ja sukupuoli naarasta kohden, translokaatioanalyysiä varten kasvatettujen poikasten lukumäärä ja sukupuoli, |
|
— |
translokaatioanalyysin ajankohta ja perusteet, |
|
— |
translokaatiokantajien lukumäärä ja tarkka selostus translokaatiokantajista, risteyttämisestä ja kohdun sisällöstä soveltuvin osin, |
|
— |
sytogeneettiset menettelytavat sekä selostus mikroskooppisesta analyysistä mieluimmin kuvien kera, |
|
— |
tilastollinen arviointi, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.26. SUBKROONINEN ORAALINEN MYRKYLLISYYSTESTI TOISTETUILLA ANNOKSILLA TEHTÄVÄ 90 VUOROKAUDEN ORAALINEN MYRKYLLISYYSTUTKIMUS JYRSIJÖILLÄ
1. MENETELMÄ
Tämä subkrooninen oraalinen myrkyllisyystesti on toisinto OECD:n testiohjeesta nro 408 (1998).
1.1 JOHDANTO
Määritettäessä ja arvioitaessa kemikaalin myrkyllisyysominaisuuksia voidaan subkrooninen toistetuilla annoksilla aiheutettu suun kautta vaikuttava myrkyllisyys määrittää sen jälkeen, kun alustavia myrkyllisyyttä koskevia tietoja on saatu välittömän myrkyllisyyden testistä tai toistetuilla annoksilla suoritetusta 28 vuorokauden myrkvllisyystestistä. 90 vuorokauden tutkimuksesta saadaan tietoja terveyshaitoista, joita todennäköisesti seuraa toistuvasta altistuksesta pitkähkön ajanjakson aikana, myös vieroittamisen jälkeen eläimen kehittyessä ja kasvaessa täysikasvuiseksi. Tutkimuksessa saadaan tietoa tärkeimmistä myrkyllisyysvaikutuksista, siinä käyvät ilmi kohde-elimet ja aineen mahdollinen kertyminen ja siinä voidaan saada arvio haitattomista altistustasoista (NO-AEL), joita voidaan käyttää valittaessa annoksia pitkäaikaisten vaikutusten tutkimiseen sekä turvallisuuskriteerien asettamiseen ihmisten altistukselle.
Menetelmässä korostetaan neurologisia loppupisteitä, ja siinä saadaan tietoa immunologisista ja lisääntymisfysiologisista vaikutuksista. Menetelmässä korostetaan myös sitä, että eläimistä on tehtävä huolellisesti kliinisiä havaintoja, jotta saadaan mahdollisimman paljon tietoa. Tämän tutkimuksen avulla pitäisi olla mahdollista tunnistaa kemikaaleja, joilla voi olla perusteellisempia tutkimuksia vaativia myrkyllisiä vaikutuksia hermostoon, immuunijärjestelmään ja lisääntymiselimiin.
Ks. myös Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Annos: annetun testiaineen määrä. Annos ilmaistaan painoyksikköinä (g, mg) tai testiaineen painona koe-eläi-men painoyksikköä kohti (esim. mg/kg) tai vakioina pidettävinä ruokavalion pitoisuuksina (ppm).
Annostelu: yleinen termi, joka kattaa annoksen, annostelutaajuuden ja annostelun keston.
NOAEL: lyhennys määritelmälle ’no observed adverse effect level’ eli korkein annostaso, jolla ei havaita mitään haitallisia käsittelyyn liittyviä vaikutuksia.
1.3 TESTIMENETELMÄN PERIAATE
Testiainetta annetaan suun kautta päivittäin asteittain suurenevina annoksina useille koe-eläinryhmil!e niin, että yhtä annostasoa annetaan ryhmää kohti 90 vuorokauden ajan. Tänä aikana eläimiä havainnoidaan tarkasti myrkkyvaikutusten havaitsemiseksi. Testin kuluessa kuolleille tai tapetuille eläimille tehdään ruumiinavaus, ja testin päättyessä myös vielä elossa olevat eläimet tapetaan ja niille tehdään ruumiinavaus.
1.4 TESTIN KUVAUS
1.4.1 Eläinten valmistelu
Testissä olisi käytettävä terveitä eläimiä, jotka on totutettu laboratorio-olosuhteisiin vähintään viiden vuorokauden ajan ja joita ei ole käytetty kokeisiin aiemmin. Koe-eläinten laji, kanta, alkuperä, sukupuoli, paino ja/tai ikä on tunnettava. Eläimet jaetaan satunnaistetusti kontrolli- ja käsittelyryhmiin. Häkit on sijoitettava siten, että häkin sijainnista johtuvat vaikutukset ovat mahdollisimman vähäisiä. Kullekin eläimelle annetaan oma tunnistenumero.
1.4.2 Annosten valmistelu
Testiainetta annetaan letkuruokinnalla tai ravinnon tai juomaveden mukana. Menetelmä riippuu tutkimuksen tarkoituksesta ja testiaineen fysikaalisista ja kemiallisista ominaisuuksista.
Tarvittaessa testiaine liuotetaan tai suspendoidaan sopivaan kantaja-aineeseen. On suositeltavaa, että ensin harkitaan vesiliuosta tai suspensiota aina, kun se on mahdollista, ja sen jälkeen öljyyn (esim. maissiöljyyn) tehtävää liuosta tai emulsiota ja sitten mahdollisesti muita liuottimia. Jos liuotin on muu kuin vesi, sen myrkkyominaisuudet on tunnettava. Testiaineen stabiilisuus annosteluolosuhteissa olisi määritettävä.
1.4.3 Testiolosuhteet
1.4.3.1 Koe-eläimet
Rotta on suositeltava koe-cläin, vaikka muita jyrsijöitä, kuten hiirtä, voidaan myös käyttää. Koe-eläinten on oltava yleisesti käytettyä laboratoriokantaa ja nuoria terveitä täysikasvuisia eläimiä. Naaraat eivät saa olla synnyttäneitä eivätkä tiineinä. Annostelu on aloitettava mahdollisimman pian vieroittamisen jälkeen ja joka tapauksessa ennen kuin eläimet ovat yhdeksän viikon ikäisiä. Tutkimuksen alkaessa eläinten painot saavat erota toisistaan mahdollisimman vähän, enintään ± 20 % kummankin sukupuolen keskipainosta. Jos tutkimuksen on tarkoitus olla alustava tutkimus pitkäaikaiselle myrkyilisyystutkimukselle, molemmissa tutkimuksissa olisi käytettävä samaa kantaa ja samalta toimittajalta hankittuja eläimiä.
1.4.3.2 Määrä ja sukupuoli
Kullakin annostasolla olisi käytettävä vähintään 20:tä eläintä (10 naarasta ja 10 koirasta). Jos eläimiä tapetaan kokeen aikana, määrän on oltava saman verran suurempi kuin ennen tutkimuksen päättymistä tapettavien eläinten määrä. Kemikaalista tai sitä läheisesti muistuttavasta aineesta saatavilla olevien aiempien tietojen perusteella olisi harkittava kymmenen eläimen (viisi kumpaakin sukupuolta) lisäryhmän sisällyttämistä kontrolliryhmään ja suurimman annoksen ryhmään sitä varten, että niitä havainnoitaisiin käsittelyjakson jälkeen mahdollisten myrkkyvaikutusten palautumisen tai jatkumisen havaitsemiseksi. Tämä käsittelyn jälkeinen aika olisi asetettava havaittujen vaikutusten mukaan.
1.4.3.3 Annostasot
Tutkimuksessa on käytettävä vähintään kolmea annostasoa ja testin kanssa samaan aikaan on tehtävä kontrolli paitsi jos tehdään raja-arvotesti (ks. 1.4.3.4). Annostasot voidaan asettaa toistetuilla annoksilla tehdyn testin tai raja-arvotestin tulosten perusteella, ja kaikki mahdolliset testiaineesta tai samanlaisista aineista saatavilla olevat toksikologiset ja toksikokineettiset tiedot on otettava huomioon. Mikäli testiaineen fysikokemialliset ominaisuudet tai biologiset vaikutukset eivät rajoita korkeimman annostason valintaa, annostaso olisi valittava siten, että se on myrkyllinen, mutta ei johda kuolemaan eikä aiheuta suurta kärsimystä. Annostasojen on oltava laskevia, jotta voitaisiin osoittaa kaikki annokseen liittyvät vasteet ja haitaton taso alhaisimmalla annostasolla. Kaksinkertaiset-nelinkertaiset erot annostasojen välillä ovat usein parhaimmat alenevassa annossarjassa, ja usein on hyödyllisempää lisätä neljäs testiryhmä kuin käyttää hyvin suuria annosvälejä (ts. suurempia kuin n. 6–10-ker-taisia).
Kontrolliryhmän on oltava käsittelemätön ryhmä tai kantaja-ainetta saava ryhmä, jos testiaineen antamiseen käytetään kantaja-ainetta. Kontrolliryhmän eläimiä on käsiteltävä samalla tavoin kuin koeryhmän eläimiä, mutta niille ei anneta testiainetta. Jos käytetään kantaja-ainetta, kontrolliryhmälle on annettava testiainetta suurimmassa käytetyssä kantaja-aineen tilavuudessa. Jos testiaine annetaan ravinnon mukana ja siitä aiheutuu ravinnonoton vähenemistä, voi normaaliravintoa saava kontrolliryhmä olla hyödyllinen, jotta erotettaisiin maittavuudesta aiheutunut ravinnonoton väheneminen sellaisesta, joka aiheutuu testimallin toksikologisista muutoksista.
Seuraavat mahdollisen kantaja-aineen ja muiden lisäaineiden ominaisuudet on otettava huomioon: vaikutukset imeytymiseen, elimistöön jakautumiseen, aineenvaihduntaan tai testiaineen pidättymiseen (retentioon) elimistössä; sellaiset vaikutukset testiaineen kemiallisiin ominaisuuksiin, jotka voivat muuttaa sen myrkkyominaisuuksia; vaikutukset ravinnon tai veden nauttimiseen tai eläinten ravitsemustilanteeseen.
1.4.3.4 Raja-annostesti
Ellei yhdellä annostasolla, joka on vähintään 1 000 mg/kg (eläimen painokiloa kohti) / vrk ja joka annetaan tälle tutkimukselle annettujen ohjeiden mukaan, havaita haittavaikutuksia ja jos myrkyllisyyttä ei ole odotettavissa kemialliselta rakenteeltaan samanlaisilla aineilla saatujen tutkimustulosten perusteella, täydellinen tutkimus kolmella eri annostasolla ei ehkä ole välttämätön. Rajatestisääntöä sovelletaan, paitsi jos ihmisten altistumisesta voidaan päätellä, että on käytettävä korkeampaa annostasoa.
1.5 TESTIN SUORITUS
1.5.1 Antotapa
Eläimille annetaan testiainetta päivittäin seitsemänä päivänä viikossa 90 vuorokauden ajan. Jos käytetään muunlaista koejärjestelyä, esim. testiainetta annetaan viitenä päivänä viikossa, se on perusteltava. Jos testiaine annetaan letkuruokinnalla, se on annettava yhtenä annoksena mahaletkulla tai sopivalla intubaatiokanyylillä. Suurin yhdellä kerralla annettava nestetilavuus riippuu koe-eläimen koosta. Tilavuus ei saisi olla suurempi kuin 1 ml/100 g painoa. Lukuun ottamatta ärsyttäviä tai syövyttäviä aineita, joiden vaikutukset yleensä pahenevat suurempia pitoisuuksia käytettäessä, nestemäärien vaihtelu olisi pidettävä mahdollisimman pienenä säätämällä tutkittavan aineen pitoisuuksia siten, että kokonaisnestemäärä pysyy samana kaikilla annostasoilla.
Kun aine annetaan ravinnon tai juomaveden kanssa, on tärkeää varmistaa, ettei testiainemäärä häiritse normaalia ravitsemusta tai vesitasetta. Kun testiaine annetaan ravinnon kanssa, voidaan käyttää joko vakiopitoisuutta (ppm) ravinnossa tai eläimen painoon suhteutettua annoksen vakiotasoa. Valittu vaihtoehto on mainittava. Kun aine annetaan letkulla, annos olisi annettava joka päivä suunnilleen samaan aikaan, ja sitä olisi säädettävä tarvittaessa, jotta annostaso voitaisiin pitää vakiona suhteutettuna eläimen painoon. Kun 90 vuorokauden testin on tarkoitus olla alustava testi ennen pitkäaikaisen myrkyllisyystestin suorittamista, olisi molemmissa testeissä käytettävä samanlaista ruokavaliota.
1.5.2 Havainnot
Havainnointiajan olisi oltava vähintään 90 vuorokautta. Pitkäaikaiseen havainnointiin tarkoitetun ryhmän eläimiä olisi pidettävä sopiva aika ilman käsittelyä, jotta voitaisiin osoittaa myrkkyvaikutusten pysyvyys tai eläinten toipuminen niistä.
Yleiset kliiniset havainnot olisi tehtävä vähintään kerran päivässä, mieluiten samaan kellonaikaan (samoihin kellonaikoihin). Tässä olisi otettava huomioon se, milloin annoksen antamisen jälkeen odotetut vaikutukset ovat suurimmillaan. Eläinten kliininen tila on kirjattava. Kaikki eläimet tarkastetaan sairastavuuden ja kuolleisuuden havaitsemiseksi vähintään kahdesti päivässä, tavallisesti aamulla ja illalla.
Kaikista eläimistä olisi tehtävä yksityiskohtaiset kliiniset havainnot vähintään kerran ennen ensimmäistä altistusta (jotta eläimessä havaittavia muutoksia voidaan verrata alkutilaan) ja kerran viikossa sen jälkeen. Havainnointi olisi tehtävä niin, että eläin on häkin ulkopuolella, mieluiten vakioalueella ja suunnilleen samaan vuorokaudenaikaan. Havainnot olisi kirjattava huolellisesti, ja mieluiten olisi käytettävä testilaboratorion nimenomaisesti määrittelemää pisteytysmenctelmää. Olisi pyrittävä siihen, että havainnointiolosuhteissa olisi mahdollisimman vähän vaihtelua. Kirjattavia havaintoja olisivat mm. muutokset nahassa, turkissa, silmissä ja limakalvoissa, eritykset ja eritteet, autonominen aktiviteetti (esim. kyynelet, karvojen jäykistyminen, silmäterän koko, epätavallinen hengitys). Muutokset käynnissä, asennossa ja reagoimisessa käsittelyyn sekä kouristusliikkeet ja jäykkyys, kaavamaiset liikkeet (esim. liioiteltu siistiminen, toistuva ympyrää kulkeminen) tai omituinen käyttäytyminen (esim. itseään vahingoittaminen, takaperin kävely) olisi myös kirjattava (1).
Silmät olisi tutkittava oftalmoskoopilla tai muulla sopivalla laitteella ennen testiaineen antamista ja testin lopussa mieluiten kaikilta koe-eläimiltä ja ainakin suuren annoksen ryhmään ja kontrolliryhmään kuuluvilta. Jos silmissä havaitaan muutoksia, olisi tutkittava kaikki eläimet.
Altistusajanjakson loppua kohti, mutta ei aikaisemmin kuin viikolla 11 olisi tutkittava aistien reagointi erilaisiin ärsykkeisiin (1) (esim. kuulo-, näkö- ja proprioseptiiviset ärsykkeet) (2), (3), (4), tarttumisotteen voimakkuus (5) ja motorinen aktiivisuus (6). Lisätietoja käytettävistä menetelmistä annetaan vastaavissa viitteissä. Myös muita menetelmiä saa käyttää.
Tutkimuksen loppupuolella tehtäviä toiminnallisia havaintoja ei tarvitse suorittaa, jos muista tutkimuksista on saatavilla toiminnallisia havaintoja koskevia tietoja ja päivittäisissä kliinisissä havainnoissa ei ole tullut ilmi toiminnallisia vajavaisuuksia.
Poikkeuksellisesti toiminnallisia havaintoja ei tarvitse myöskään tehdä ryhmille, joissa havaitaan muita myrkkyvaikutuksia siinä määrin, että ne haittaisivat merkittävästi toiminnallista testiä.
1.5.2.1 Eläimen paino ja ravinnon ja/tai veden nauttiminen
Kaikki eläimet olisi punnittava vähintään kerran viikossa. Ravinnonotto olisi mitattava vähintään viikoittain. Jos testiaine annetaan juomaveden mukana, veden nauttiminen olisi myös mitattava vähintään viikoittain. Veden nauttimisen mittaamista voidaan harkita myös sellaisissa ruoka- tai letkuruokintatutkimuksissa, joiden aikana juomisessa voi esiintyä muutoksia.
1.5.2.2 Hematologia ja kliininen biokemia
Verinäytteet olisi otettava nimetystä paikasta ja säilytettävä tarvittaessa asianmukaisissa olosuhteissa. Testiajanjakson lopussa näytteet otetaan juuri ennen tappamista tai sen yhteydessä.
Verestä olisi tehtävä testiajanjakson lopussa ja aina, kun on otettu verinäytteitä, seuraavat määritykset: hematokriitti, hemoglobiinikonsentraatio, punasolujen määrä, valkosolujen kokonaismäärä ja niiden erittelylaskenta, verihiutaleiden määrä ja veren hyytymisaika tai hyytymiskyky.
Kliinisen biokemian määritykset, joilla tutkitaan tärkeimpiä myrkkyvaikutuksia kudoksissa ja erityisesti munuaisissa ja maksassa, olisi tehtävä verinäytteistä, jotka on otettu kustakin eläimestä juuri ennen tappamista tai sen yhteydessä (lukuun ottamatta kuolleina löydettyjä ja/tai kesken koetta tapettuja). Samoin kuin hematologisia tutkimuksia varten myös kliinisen biokemian testejä varten voidaan näytteitä ottaa kokeen kestäessäkin. Suositellaan, että eläimet paastoaisivat yli yön ennen verinäytteiden ottoa (3). Plasmasta tai seerumista olisi määritettävä natrium, kalium, glukoosi, kokonaiskolesteroli, urea, veren ureatyppi, kreatiniini, kokonaisvalkuainen ja albumiini sekä enemmän kuin kaksi entsyymiä, jotka osoittavat maksasoluvaikutuksia {kuten alaniini-aminotransferaasi, asparagiinihappoaminotransferaasi, alkalinen fosfataasi, gamma-glutamiinihappotranspeptidaasi ja sorbitolidehydrogenaasi). Muitakin (maksan tai muiden elimien) entsyymejä ja sappihapot, jotka voivat antaa hyödyllistä tietoa tietyissä olosuhteissa, voidaan määrittää.
Seuraavat virtsamääritykset voidaan tehdä valinnaisesti tutkimuksen viimeisen viikon aikana (tällöin on mitattava virtsan keruuaika): ulkonäkö, tilavuus, osmolaalisuus tai ominaistiheys, pH, valkuainen, glukoosi ja veri ja/ tai verisolut.
Lisäksi olisi harkittava yleistä kudosvauriota osoittavien seerumissa esiintyvien merkkiaineiden määritystä. Muita määrityksiä, jotka olisi tehtävä, jos testiaineen tunnetut ominaisuudet saattavat vaikuttaa tai niiden epäillään vaikuttavan kyseisiin määrityksiin liittyvään aineenvaihduntaan, ovat kalsium, fosfori, paasto-triglyseridit, tietyt hormonit, methemoglobiini ja koliinicsteraasi. Tarvittavat määritykset olisi yksilöitävä tiettyihin luokkiin kuuluville kemikaaleille tai tapauskohtaisesti.
Kaiken kaikkiaan lähestymistavan on oltava joustava. Se riippuu eläinlajista ja aineen havaituista ja/tai odotetuista vaikutuksista.
Jos aiemmat tiedot ovat puutteelliset, olisi harkittava, täytyykö hematologisia ja kliinisen biokemian määrityksiä tehdä ennen annosten antamisen aloittamista. Yleensä ei suositella, että tällaisia tietoja tuotettaisiin ennen käsittelyä (7).
1.5.2.3 Ruumiinavaustutkimukset
Kaikille tutkimukseen sisältyville eläimille on tehtävä täydellinen ja yksityiskohtainen ruumiinavaus, jossa tutkitaan huolellisesti eläimen ruumis päältä päin, kaikki ruumiin aukot sekä kallo-, rinta- ja vatsaontelot ja niiden sisältö. Kaikkien eläinten (lukuun ottamatta kuolleina löydettyjä ja/tai kesken koetta tapettuja) maksa, munuaiset, lisämunuaiset, kivekset, lisäkivekset, kohtu, munasarjat, kateenkorva, perna, aivot ja sydän olisi puhdistettava muusta kudoksesta tapauksen mukaan, ja ne olisi punnittava mahdollisimman nopeasti avauksen jälkeen kuivumisen estämiseksi.
Seuraavat kudokset olisi säilöttävä sellaiseen kiinnitysväliaineeseen, joka sopii parhaiten kyseiselle kudostyypille ja aiottuun histopatologiseen tutkimukseen: kaikki suuret leesiot, aivot (edustavat alueet, mukaan luettuina iso-aivot, pikkuaivot ja ydin/aivosilta), selkäydin (kolmesta kohdasta: kaularanka, rintarangan keskiosa ja lanneranka), aivolisäke, kilpirauhanen, lisäkilpirauhanen, kateenkorva, ruokatorvi, sylkirauhaset, maha, ohut- ja paksusuoli (mukaan lukien Peyerin imukerässikermät), maksa, haima, munuaiset, lisämunuaiset, perna, sydän, rintakehä ja keuhkot (säilötään puhaltamalla täyteen kiinnitysainetta ja upottamalla sitten siihen), aortta, sukurauhaset, kohtu, lisäsukupuolirauhaset, naaraan rintarauhanen, eturauhanen, virtsarakko, sappirakko (hiiri), imusolmukkeet (mieluiten yksi imusolmuke, joka kattaa antotien ja toinen, joka on kaukana antotiestä ja kattaa systeemiset vaikutukset), ääreishermo (lonkkahermo tai säärihermo), mieluiten lähellä kyseessä olevaa lihasta, näyte luuytimestä (ja/tai tuore luuydinnestenäyte}, nahkaa, silmät (jos oftalmologisessa tutkimuksessa havaittiin muutoksia). Kliiniset ja muut löydökset voivat antaa aihetta muiden kudosten tutkimiseen. Myös muut elimet, joihin testiaineen oletetaan vaikuttavan ennestään tunnettujen ominaisuuksien perusteella, olisi säilöttävä.
1.5.2.4 Histopatologia
Täydellinen histopatologinen tutkimus olisi tehtävä kontrolliryhmän ja suuren annoksen ryhmän kaikkien eläinten säilötyistä elimistä ja kudoksista. Nämä tutkimukset on tehtävä myös muiden annosryhmien eläimille, jos suuren annoksen ryhmässä havaitaan käsittelyyn liittyviä muutoksia.
Kaikki suuret leesiot olisi tutkittava.
Jos tutkimuksessa on mukana testiryhmä, jolle testiä on jatkettu pitempään sen jälkeen, kun testiaineen antaminen lopetettiin, histopatologiset tutkimukset on tehtävä niille kudoksille ja elimille, joissa on näkynyt muutoksia käsitellyissä ryhmissä.
2. MÄÄRITYSTULOKSET JA TULOSTEN ILMOITTAMINEN
2.1 MÄÄRITYSTULOKSET
Tutkimuksessa on ilmoitettava yksilökohtaiset tulokset. Tulokset on lisäksi esitettävä taulukoituina, ja niistä on käytävä ilmi seuraavat tiedot: kuhunkin ryhmään kuuluvien eläinten lukumäärä testin alussa: testin aikana kuolleena löydettyjen tai inhimillisistä syistä tapettujen eläinten lukumäärä ja kuoleman tai tappamisen ajankohta: niiden eläinten lukumäärä, joissa näkyy myrkkyvaikutuksia; havaittujen myrkkyvaikutusten kuvaus, mukaan luettuna myrkytysoireiden alku, kesto ja vakavuus; niiden eläinten lukumäärä, joissa havaitaan leesioita: leesioiden tyyppi ja kunkin tyypin leesioista kärsivien eläinten prosenttiosuus.
Kun on numeerisia tuloksia, ne on arvioitava asianmukaisella ja yleisesti hyväksytyllä tilastomenetelmällä. Tilastomenetelmät ja analysoitavat määritystulokset on valittava tutkimusta suunniteltaessa.
2.2 TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot:
2.2.1 Testiaine:
|
— |
fysikaalinen olomuoto, puhtaus ja fysikokemialliset ominaisuudet, |
|
— |
tunnistetiedot, |
|
— |
kantaja-aine (tarvittaessa): jos kantaja-aine on muu kuin vesi, sen valinta on perusteltava. |
2.2.2 Koe-eläinlajit:
|
— |
käytetty eläinlaji ja kanta, |
|
— |
eläinten lukumäärä, ikä ja sukupuoli, |
|
— |
toimittaja, häkit, ravinto jne. |
|
— |
kunkin eläimen paino testin alkaessa. |
2.2.3 Koeolosuhteet:
|
— |
annostasojen valintaperusteet, |
|
— |
yksityiskohtaiset tiedot testiainevalmisteesta/ravintovalmisteesta, pitoisuus, stabiilisuus ja tasalaatuisuus valmisteessa. |
|
— |
yksityiskohtaiset tiedot testiaineen antotavasta, |
|
— |
todellinen annos (mg/painokilo/vrk) ja muuntokerroin ravintoon/juomaveteen sekoitetun testiaineen pitoisuudelle (ppm) tarvittaessa, |
|
— |
yksityiskohtaiset tiedot ravinnon ja veden laadusta. |
2.2.4 Tulokset:
|
— |
eläimen paino ja painon muutokset, |
|
— |
ravinnon nauttiminen ja veden nauttiminen tarvittaessa, |
|
— |
myrkyllisyysvaste sukupuolittain ja annostasoittain, mukaan lukien myrkyllisyysvaikutuksen merkit, |
|
— |
kliinisten havaintojen laatu, vakavuus ja kesto (sekä palautuvat vaikutukset että muut), |
|
— |
silmätutkimuksen tulokset, |
|
— |
aistitoiminta, tarttumisvoimakkuus ja motorisen aktiivisuuden arviointi (jos saatavilla), |
|
— |
hematologiset testit ja kyseisiä testejä koskevat perustasot, |
|
— |
kliinisen biokemian testit ja kyseisiä testejä koskevat perustasot, |
|
— |
eläimen paino testin lopussa, elinten painot sekä elinten ja eläinten painosuhteet, |
|
— |
ruumiinavauslöydökset, |
|
— |
yksityiskohtainen kuvaus kaikista histopatologisista löydöksistä, |
|
— |
imeytymistiedot, jos saatavilla, |
|
— |
tulosten tilastollinen käsittely tarvittaessa. |
Tulosten pohdinta.
Johtopäätökset.
3. LÄHDELUETTELO
|
(1) |
IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document No 60. |
|
(2) |
Tupper. D. E., Wallace, R.B. (1980). Utility of the Neurologie Examination in Rats. Acta Neurobiol. Exp., 40, pp. 999–1003. |
|
(3) |
Gad, S. C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, pp. 691–704. |
|
(4) |
Moser, V. C, Mc Daniel, K. M., Phillips, P. M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, pp. 267–283. |
|
(5) |
Meyer O. A., Tilson H. A., Byrd W. C, Riley M. T. (1979). A Method for the Routine Assessment of Fore- and Hind- limb grip Strength of Rats and Mice. Neurobehav. Toxivol, 1, pp. 233–236. |
|
(6) |
Crofton K. M., Howard J. L, Moser V. C, Gill M. W., Reiter L. W., Tilson H. A., MacPhail R. C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, pp. 599–609. |
|
(7) |
Weingand K., Brown G., Hall R. et al. (1996). ’Harmonisation of Animal Clinic Pathology Testing in Toxicity and Safety Studies’, Fundam. & Appl. Toxicol., 29, pp. 198–201. |
B.27. SUBKROONINEN ORAALINEN MYRKYLLISYYSTESTI TOISTETUILLA ANNOKSILLA TEHTÄVÄ 90 VUOROKAUDEN ORAALINEN MYRKYLLISYYSTUTKIMUS MUILLA KUIN JYRSIJÖILLÄ
1. MENETELMÄ
Tämä subkrooninen oraalinen myrkyllisyystesti on toisinto OECD:n testiohjeesta N:o 409 (1998).
1.1 JOHDANTO
Määritettäessä ja arvioitaessa kemikaalin myrkyllisyysominaisuuksia voidaan subkrooninen toistetuilla annoksilla aiheutettu suun kautta vaikuttava myrkyllisyys määrittää sen jälkeen, kun alustavia myrkyllisyyttä koskevia tietoja on saatu välittömän myrkyllisyyden testistä tai toistetuilla annoksilla suoritetusta vuorokauden myrkyllisyystestistä. 90 vuorokauden tutkimuksesta saadaan tietoja mahdollisista terveyshaitoista, joita todennäköisesti seuraa toistuvasta altistuksesta aikana, jolloin eläin kasvaa nopeasti nuoreksi aikuiseksi. Tutkimuksessa saadaan tietoa tärkeimmistä myrkyllisyysvaikutuksista, siinä käyvät ilmi kohde-elimet ja aineen mahdollinen kertyminen ja siinä voidaan saada arvio haitattomista altistustasoista (NOAEL), joita voidaan käyttää valittaessa annoksia pitkäaikaisten vaikutusten tutkimiseen sekä turvallisuuskriteerien asettamiseen ihmisten altistukselle.
Tällä testimenetelmällä voidaan tunnistaa kemikaalialtistuksen haittavaikutukset muissa kuin jyrsijöissä, ja sitä olisi käytettävä ainoastaan silloin, kun
|
— |
muissa tutkimuksissa havaitut vaikutukset edellyttävät selvennystä tai tarkempaa ominaisuuksien määrittämistä jossain muussa lajissa, joka ei ole jyrsijä, |
|
— |
oksikokineettisten tutkimusten perusteella muu kuin jyrsijä on paras koe-eläinlaji, tai |
|
— |
muun kuin jyrsijän käyttö on perusteltua muista erityisistä syistä. |
Ks. myös Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Annos: annetun testiaineen määrä. Annos ilmaistaan painoyksikköinä (g, mg) tai testiaineen painona koe-eläimen painoyksikköä kohti (esim. mg/kg) tai vakiopitoisuuksina ravinnossa (ppm).
Annostelu: yleinen termi, joka kattaa annoksen, annostelutaajuuden ja annostelun keston.
NOAEL: lyhennys määritelmälle ’no observed adverse effect level’ eli korkein annostaso, jolla ei havaita mitään haitallisia käsittelyyn liittyviä vaikutuksia.
1.3 TESTIMENETELMÄN PERIAATE
Testiainetta annetaan suun kautta päivittäin asteittain vaihtelevina annoksina useille koe-eläinryhmille niin, että yhtä annostasoa annetaan ryhmää kohti 90 vuorokauden ajan. Tänä aikana eläimiä havainnoidaan tarkasti myrkyllisyysvaikutusten havaitsemiseksi. Testin kuluessa kuolleille tai tapetuille eläimille tehdään ruumiinavaus, ja testin päättyessä myös vielä elossa olevat eläimet tapetaan ja niille tehdään ruumiinavaus.
1.4 TESTIMENETELMÄN KUVAUS
1.4.1 Eläinlajin valinta
Jos käytetään muuta eläinlajia kuin jyrsijää, yleisesti käytetty koe-eläinlaji on koira. Koirarodun pitäisi olla tarkasti määritelty; usein käytetään beaglea. Muitakin lajeja, esim. sikaa tai minisikaa, voi käyttää. Kädellisiä ei suositella, ja niiden käytön olisi oltava perusteltua. Eläinten olisi oltava nuoria ja terveitä. Jos on kyseessä koira, annostelu olisi aloitettava mieluiten 4–6 kuukauden iässä ja viimeistään 9 kuukauden iässä. Jos tutkimuksen on tarkoitus olla alustava tutkimus pitkäaikaiselle myrkyllisyystutkimukselle, molemmissa tutkimuksissa olisi käytettävä samaa lajia/rotua.
1.4.2 Eläinten valmistelu
Testissä olisi käytettävä terveitä eläimiä, jotka on totutettu laboratorio-olosuhteisiin ja joita ei ole käytetty kokeisiin aiemmin. Totuttamisajan pituus riippuu valitusta koe-eläinlajista ja sen alkuperästä. Suositellaan vähintään viittä päivää koirille tai kyseistä tarkoitusta varten omassa siittolassa kasvatetuille sioille ja vähintään kahta viikkoa, jos eläimet ovat peräisin ulkopuoliselta toimittajalta. Koe-eläinten laji, kanta, alkuperä, sukupuoli, paino ja/tai ikä on tunnettava. Eläimet jaetaan satunnaistetusti kontrolli- ja käsittelyryhmiin. Häkit on sijoitettava siten, että häkin sijainnista johtuvat vaikutukset ovat mahdollisimman vähäisiä. Kullekin eläimelle annetaan oma tunnistenumero.
1.4.3 Annosten valmistelu
Testiaine voidaan antaa ruokavaliossa tai juomavedessä, letkuruokinnalla tai kapseleina. Menetelmä riippuu tutkimuksen tarkoituksesta ja testiaineen fysikaalisista ja kemiallisista ominaisuuksista.
Tarvittaessa testiaine liuotetaan tai suspendoidaan sopivaan kantaja-aineeseen. On suositeltavaa, että ensin harkitaan vesiliuosta tai suspensiota aina, kun se on mahdollista, ja sen jälkeen öljyyn (esim. maissiöljyyn) tehtävää liuosta tai emulsiota ja sitten mahdollisesti muita liuottimia. Jos liuotin on muu kuin vesi, sen myr-kyllisyysominaisuudet on tunnettava. Testiaineen stabiilisuus annosteluolosuhteissa olisi määritettävä.
1.5 TESTIN SUORITUS
1.5.1 Eläinten lukumäärä ja sukupuoli
Kullakin annostasolla olisi käytettävä vähintään kahdeksaa eläintä (neljä naarasta ja neljä koirasta). Jos eläimiä tapetaan kokeen aikana, testiin on otettava alussa sen verran enemmän eläimiä kuin niitä tapetaan ennen tutkimuksen päättymistä. Eläinten lukumäärän testin päättyessä on oltava riittävä myrkyllisyysvaikutusten järkevään arviointiin. Kemikaalista tai sitä läheisesti muistuttavasta aineesta saatavilla olevien aiempien tietojen perusteella olisi harkittava kahdeksan eläimen (neljä kumpaakin sukupuolta) lisäryhmän sisällyttämistä kontrolliryhmään ja suurimman annoksen ryhmään sitä varten, että niitä havainnoitaisiin käsittelyjakson jälkeen mahdollisten myrkyllisyysvaikutusten palautumisen tai jatkumisen havaitsemiseksi. Tämä käsittelyn jälkeinen aika olisi asetettava havaittujen vaikutusten mukaan.
1.5.2 Annokset
Tutkimuksessa on käytettävä vähintään kolmea annostasoa, ja testin kanssa samaan aikaan on tehtävä kontrolli, paitsi jos tehdään raja-arvotesti (ks. 1.5.3). Annostasot voidaan asettaa toistetuilla annoksilla tehdyn testin tai raja-arvotestin tulosten perusteella, ja kaikki mahdolliset testiaineesta tai samanlaisista aineista saatavilla olevat toksikologiset ja toksikokineettiset tiedot on otettava huomioon. Mikäli testiaineen fysikokemialliset ominaisuudet tai biologiset vaikutukset eivät rajoita korkeimman annostason valintaa, annostaso olisi valittava siten, että se on myrkyllinen, mutta ei johda kuolemaan eikä aiheuta suurta kärsimystä. Annostasojen on oltava laskevia, jotta voitaisiin osoittaa kaikki annokseen liittyvät vasteet ja haitaton taso alhaisimmalla annostasolla. Kaksin-nelinkertaiset erot annostasojen välillä ovat usein parhaimmat alenevassa annossarjassa, ja usein on hyödyllisempää lisätä neljäs testiryhmä kuin käyttää hyvin suuria annosvälejä (ts. suurempia kuin n. 6–10-kertaisia).
Kontrolliryhmän on oltava käsittelemätön ryhmä tai kantaja-ainetta saava ryhmä, jos testiaineen antamiseen käytetään kantaja-ainetta. Kontrolliryhmän eläimiä on käsiteltävä samalla tavoin kuin testiryhmän cläimiä, mutta niille ei anneta testiainetta. Jos käytetään kantaja-ainetta, kontrolliryhmän on saatava kantaja-aine suurimmassa käytetyssä tilavuudessa. Jos testiaine annetaan ravinnon mukana ja siitä aiheutuu ravinnonoton vähenemistä, voi normaaliravintoa saava kontrolliryhmä olla hyödyllinen, jotta erotettaisiin maittavuudesta aiheutunut ravinnonoton väheneminen sellaisesta, joka aiheutuu testimallin toksikologisista muutoksista.
Seuraavat mahdollisen kantaja-aineen ja muiden lisäaineiden ominaisuudet on otettava huomioon: vaikutukset imeytymiseen, elimistöön jakautumiseen, aineenvaihduntaan tai testiaineen retentioon elimistössä; sellaiset vaikutukset testiaineen kemiallisiin ominaisuuksiin, jotka voivat muuttaa sen myrkyllisyysominaisuuksia; sekä vaikutukset ravinnon tai veden nauttimiseen tai eläinten ravitsemustilanteeseen.
1.5.3 Raja-annostesti
Ellei yhdellä annostasolla, joka on vähintään 1 000 mg/kg (eläimen painokiloa kohti) / vrk ja joka annetaan tälle tutkimukselle annettujen ohjeiden mukaan, havaita haittavaikutuksia ja jos myrkyllisyyttä ei ole odotettavissa kemialliselta rakenteeltaan samanlaisilla aineilla saatujen tutkimustulosten perusteella, täydellinen tutkimus kolmella eri annostasolla ei ehkä ole välttämätön. Rajatestisääntöä sovelletaan, paitsi jos ihmisten altistumisesta voidaan päätellä, että on käytettävä korkeampaa annostasoa.
1.5.4 Antotapa
Eläimille annetaan testiainetta päivittäin seitsemänä päivänä viikossa 90 vuorokauden ajan. Jos käytetään muunlaista koejärjestelyä, esim. testiainetta annetaan viitenä päivänä viikossa, se on perusteltava. Jos testiaine annetaan letkuruokinnalla, se on annettava yhtenä annoksena mahaletkulla tai sopivalla intubaatiokanyylillä. Suurin yhdellä kerralla annettava nestetilavuus riippuu koe-eläimen koosta. Tilavuuden pitäisi yleensä olla mahdollisimman pieni. Testitilavuuksien tilavuuden vaihtelun pitäisi olla mahdollisimman pientä (testiannos-ten pitoisuutta olisi säädeltävä niin, että tilavuus olisi sama kaikilla annostasoilla), paitsi jos käytetään ärsyttäviä tai syövyttäviä aineita, joiden vaikutus suuremmissa pitoisuuksissa on yleensä voimakkaampi.
Kun testiaine annetaan ravinnon tai juomaveden kanssa, on tärkeää varmistaa, ettei testiainemäärä häiritse normaalia ravitsemusta tai vesitasetta. Kun testiaine annetaan ravinnon kanssa, voidaan käyttää joko vakiopitoisuutta (ppm) ravinnossa tai eläimen painoon suhteutettua annoksen vakiotasoa. Mahdolliset muut antotavat on mainittava. Kun aine annetaan letkulla tai kapseleina, annos olisi annettava joka päivä suunnilleen samaan aikaan, ja sitä olisi mukautettava tarvittaessa, jotta annostaso voitaisiin pitää vakiona suhteutettuna eläimen painoon. Kun 90 vuorokauden testin on tarkoitus olla alustava testi ennen pitkäaikaisen myrkyllisyystestin suorittamista, olisi molemmissa testeissä käytettävä samanlaista ruokavaliota.
1.5.5 Havainnot
Havainnointiajan olisi oltava vähintään 90 vuorokautta. Pitkäaikaiseen havainnointiin tarkoitetun ryhmän eläimiä olisi pidettävä sopiva aika ilman käsittelyä, jotta voitaisiin osoittaa myrkyllisyysvaikutusten pysyvyys tai eläinten toipuminen niistä.
Yleiset kliiniset havainnot olisi tehtävä vähintään kerran päivässä, mieluiten samaan kellonaikaan (samoihin kellonaikoihin). Tässä olisi otettava huomioon se, milloin annoksen antamisen jälkeen odotetut vaikutukset ovat suurimmillaan. Eläinten kliininen tila on kirjattava. Kaikki eläimet tarkastetaan sairastavuuden ja kuolleisuuden havaitsemiseksi vähintään kahdesti päivässä, tavallisesti aamulla ja illalla.
Kaikista eläimistä olisi tehtävä yksityiskohtaiset kliiniset havainnot vähintään kerran ennen ensimmäistä altistusta (jotta eläimessä havaittavia muutoksia voidaan verrata lähtötilaan) ja kerran viikossa sen jälkeen. Havainnointi olisi tehtävä niin, että eläin on häkin ulkopuolella, mieluiten vakioalueella ja suunnilleen samaan vuorokaudenaikaan. Olisi pyrittävä siihen, että havainnointiolosuhteissa olisi mahdollisimman vähän vaihtelua. Myrkyllisyyden merkit olisi kirjattava huolellisesti, mukaan luettuna niiden alkamisajankohta, aste ja kesto. Kirjattavia havaintoja olisivat mm. muutokset nahassa, turkissa, silmissä ja limakalvoissa, eritykset ja eritteet, autonominen aktiviteetti (esim. kyynelet, karvojen jäykistyminen, silmäterän koko, epätavallinen hengitys). Muutokset käynnissä, asennossa ja reagoimisessa käsittelyyn sekä kouristusliikkeet ja jäykkyys, kaavamaiset liikkeet (esim. liioiteltu siistiminen, toistuva ympyrää kulkeminen) tai omituinen käyttäytyminen olisi myös kirjattava (1).
Silmät olisi tutkittava oftalmoskoopilla tai muulla sopivalla laitteella ennen testiaineen antamista ja testin lopussa mieluiten kaikilta koe-eläimiltä ja ainakin suuren annoksen ryhmään ja kontrolliryhmään kuuluvilta. Jos silmissä havaitaan käsittelyyn liittyviä muutoksia, olisi tutkittava kaikki eläimet.
1.5.5.1 Eläimen paino ja ravinnon ja/lai veden nauttiminen
Kaikki eläimet olisi punnittava vähintään kerran viikossa. Ravinnonotto olisi mitattava vähintään viikoittain. Jos testiaine annetaan juomaveden mukana, veden nauttiminen olisi myös mitattava vähintään viikoittain. Veden nauttimisen mittaamista voidaan harkita myös sellaisissa ruoka- tai letkuruokintatutkimuksissa, joiden aikana juomisessa voi esiintyä muutoksia.
1.5.5.2 Hematologia ja kliininen biokemia
Verinäytteet olisi otettava nimetystä paikasta ja säilytettävä tarvittaessa asianmukaisissa olosuhteissa. Testiajanjakson lopussa näytteet otetaan juuri ennen tappamista tai sen yhteydessä.
Verestä olisi tehtävä tutkimuksen alussa ja sitten joko kuukauden välein tai testiajanjakson puolivälissä ja lopuksi testiajanjakson päättyessä seuraavat määritykset: hematokriitti, hemoglobiinikonsentraatio, punasolujen määrä, valkosolujen kokonaismäärä ja niiden erittelylaskenta, verihiutaleiden määrä ja veren hyytymiskykyä kuvaavia määrityksiä, kuten hyytymisaika, protrombiiniaika tai tromboplastiiniaika.
Kliinisen biokemian määritykset, joilla tutkitaan tärkeimpiä myrkyllisyysvaikutuksia kudoksissa ja erityisesti munuaisissa ja maksassa, olisi tehtävä verinäytteistä, jotka on otettu kaikista eläimistä tutkimuksen alussa ja sitten joko kuukauden välein tai testiajanjakson puolivälissä ja lopuksi testiajanjakson päättyessä. Testattavaksi harkittavia kohteita ovat elektrolyyttitasapaino, hiilihydraattiaineenvaihdunta sekä maksan ja munuaisten toiminta. Erityistestien valinta riippuu testiaineen vaikutustavasta tehdyistä havainnoista. Eläimiä olisi pidettävä paastossa sopiva aika ennen verinäytteiden ottamista. Suositeltavia määrityksiä ovat mm. kalsium, fosfori, kloridi, natrium, kalium, paastoglukoosi, alaniiniaminotransferaasi, asparagiinihappoaminotransferaasi, omitiinidekarboksylaasi, gamma-glutamiinihappotranspeptidaasi, urcatyppi, albumiini, veren kreatiniini, kokonaisbilirubiini ja seerumin kokonaisproteiinipitoisuus.
Virtsamäärityksiä olisi tehtävä ainakin tutkimuksen alussa, sitten tutkimuksen puolivälissä ja lopuksi sen päättyessä (virtsan keruuaika on mitattava). Virtsasta on määritettävä ulkonäkö, tilavuus, osmolaalisuus tai ominaistiheys, pH, valkuainen, glukoosi ja veri ja/tai verisolut. Muita muuttujia voidaan mitata tarvittaessa.
Lisäksi olisi harkittava yleistä kudosvauriota osoittavien merkkiaineiden määritystä. Muita myrkyllisyyden arviointiin mahdollisesti tarvittavia määrityksiä ovat esim. lipidi-, hormoni-, happo/emäs-, methemoglobiini- ja koliiniesteraasi-inhibiittorimääritykset. Muita kliinisen biokemian määrityksiä voidaan tehdä tarvittaessa havaittujen vaikutusten tutkimisen laajentamiseksi. Tarvittavat määritykset olisi yksilöitävä tiettyihin luokkiin kuuluville kemikaaleille tai tapauskohtaisesti.
Kaiken kaikkiaan lähestymistavan on oltava joustava. Se riippuu eläinlajista ja aineen havaitusta ja/tai odotetusta vaikutuksesta.
1.5.5.3 Ruumiinavaustutkimukset
Kaikille tutkimukseen sisältyville eläimille on tehtävä täydellinen ja yksityiskohtainen ruumiinavaus, jossa tutkitaan huolellisesti eläimen ruumis päältä päin, kaikki ruumiin aukot sekä kallo-, rinta- ja vatsaontelot ja niiden sisältö. Kaikkien eläinten (lukuun ottamatta kuolleina löydettyjä ja/tai kesken koetta tapettuja) maksa ja sappirakko, munuaiset, lisämunuaiset, kivekset, lisäkivekset, munasarjat, kohtu, kilpirauhanen (ja lisäkilpirauhaset), kateenkorva. perna, aivot ja sydän olisi puhdistettava muusta kudoksesta tapauksen mukaan, ja ne olisi punnittava mahdollisimman nopeasti avauksen jälkeen kuivumisen estämiseksi.
Seuraavat kudokset olisi säilöttävä sellaiseen kiinnitysväliaineeseen, joka sopii parhaiten kyseiselle kudostyypille ja aiottuun histopatologiseen tutkimukseen: kaikki suuret leesiot, aivot (edustavat alueet, mukaan luettuina isoaivot, pikkuaivot ja ydin/aivosilta), selkäydin (kolmesta kohdasta: kaularanka, rintarangan keskiosa ja lanneranka), aivolisäke, kilpirauhanen, lisäkilpirauhanen, kateenkorva, ruokatorvi, sylkirauhaset, maha, ohut- ja paksusuoli (mukaan luettuna Peyerin imukerässikermät), maksa, sappirakko, haima, munuaiset, lisämunuaiset, perna, sydän, rintakehä ja keuhkot, aortta, sukurauhaset, kohtu, lisäsukupuolirauhaset, naaraan rintarauhanen, eturauhanen, virtsarakko, imusolmukkeet (mieluiten yksi imusolmuke, joka kattaa antotien ja toinen, joka on kaukana autotiestä ja kattaa systeemiset vaikutukset), ääreishermo (lonkkahermo tai säärihermo), mieluiten lähellä kyseessä olevaa lihasta, näyte luuytimestä (ja/tai tuore luuydinnestenäyte) ja nahkaa. Kliiniset ja muut löydökset voivat antaa aihetta muiden kudosten tutkimiseen. Myös muut elimet, joihin testiaineen oletetaan vaikuttavan ennestään tunnettujen ominaisuuksien perusteella, olisi säilöttävä.
1.5.5.4 Histopatologia
Täydellinen histopatologinen tutkimus olisi tehtävä kontrolliryhmän ja suuren annoksen ryhmän kaikkien eläinten säilötyistä elimistä ja kudoksista. Nämä tutkimukset on tehtävä myös muiden annosryhmien eläimille, jos suuren annoksen tyhmässä havaitaan käsittelyyn liittyviä muutoksia.
Kaikki suuret leesiot olisi tutkittava.
Jos tutkimuksessa on mukana testiryhmä, jolle testiä on jatkettu pitempään sen jälkeen, kun testiaineen antaminen lopetettiin, histopatologiset tutkimukset on tehtävä niille kudoksille ja elimille, joissa on näkynyt muutoksia käsitellyissä ryhmissä.
2. MÄÄRITYSTULOKSET JA TULOSTEN ILMOITTAMINEN
2.1 MÄÄRITYSTULOKSET
Tutkimuksessa on ilmoitettava yksilökohtaiset tulokset. Tulokset on lisäksi esitettävä taulukoituina, ja niistä on käytävä ilmi seuraavat tiedot: kuhunkin ryhmään kuuluvien eläinten lukumäärä testin alussa; testin aikana kuolleena löydettyjen tai inhimillisistä syistä tapettujen eläinten lukumäärä ja kuoleman tai tappamisen ajankohta; niiden eläinten lukumäärä, joissa näkyy myrkkyvaikutuksia; havaittujen myrkkyvaikutusten kuvaus, mukaan luettuina myrkytysoireiden alku, kesto ja vakavuus; niiden eläinten lukumäärä, joissa havaitaan leesioita; leesioiden tyyppi ja kunkin tyypin leesioista kärsivien eläinten prosenttiosuus.
Kun on numeerisia tuloksia, ne on arvioitava asianmukaisella ja yleisesti hyväksytyllä tilastomenetelmällä. Tilastomenetelmät ja analysoitavat määritystulokset on valittava tutkimusta suunniteltaessa.
2.2 TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot:
2.2.1 Testiaine:
|
— |
fysikaalinen olomuoto, puhtaus ja fysikokemialliset ominaisuudet, |
|
— |
tunnistetiedot, |
|
— |
kantaja-aine (tarvittaessa): jos kantaja-aine on muu kuin vesi, sen valinta on perusteltava. |
2.2.2 Koe-eläinlajit:
|
— |
käytetty eläinlaji ja kanta, |
|
— |
eläinten lukumäärä, ikä ja sukupuoli, |
|
— |
toimittaja, häkit, ravinto jne., |
|
— |
kunkin eläimen paino testin alkaessa. |
2.2.3 Koeolosuhteet:
|
— |
annostasojen valintaperusteet, |
|
— |
yksityiskohtaiset tiedot testiainevalmisteesta/ravintovalmisteesta, pitoisuus, stabiilisuus ja tasalaatuisuus valmisteessa, |
|
— |
yksityiskohtaiset tiedot testiaineen antotavasta, |
|
— |
todellinen annos (mg/painokilo/vrk) ja muuntokerroin ravintoon/juomaveteen sekoitetun testiaineen pitoisuudelle (ppm) tarvittaessa, |
|
— |
yksityiskohtaiset tiedot ravinnon ja veden laadusta. |
2.2.4 Tulokset:
|
— |
eläimen paino ja painon muutokset, |
|
— |
ravinnon nauttiminen ja veden nauttiminen tarvittaessa, |
|
— |
myrkkyvaste sukupuolittain ja annostasoittain, mukaan luettuina myrkkyvaikutuksen merkit, |
|
— |
kliinisten havaintojen laatu, vakavuus ja kesto (sekä palautuvat vaikutukset että muut), |
|
— |
silmätutkimukset, |
|
— |
hematologiset testit ja kyseisiä testejä koskevat perustasot, |
|
— |
kliinisen biokemian testit ja kyseisiä testejä koskevat perustasot, |
|
— |
eläimen paino testin lopussa, elinten painot sekä elinten ja eläinten painosuhteet, |
|
— |
ruumiinavauslöydökset, |
|
— |
yksityiskohtainen kuvaus kaikista histopatologisista löydöksistä, |
|
— |
imeytymistiedot, jos saatavilla, |
|
— |
tulosten tilastollinen käsittely tarvittaessa. |
Tulosten pohdinta.
Johtopäätökset.
B.28. SUBKROONINEN MYRKYLLISYYSTESTI (IHON KAUTTA) TOISTUVA ANNOSTELU IHON KAUTTA, 90 VUOROKAUTTA, JYRSIJÄT
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Testattavaa ainetta annostellaan päivittäin 90 vuorokauden ajan useisiin ryhmiin jaettujen koe-eläinten iholle eri pitoisuuksina, yksi pitoisuus kullekin ryhmälle. Tutkimuksen kuluessa eläimiä tarkkaillaan päivittäin myrkkyoireiden toteamiseksi. Kokeen aikana kuolleille eläimille ja sen loputtua elossa oleville eläimille suoritetaan ruumiinavaus.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Eläimet siirretään koetiloihin ja testin aikana annettava ruokinta aloitetaan vähintään viisi päivää ennen testin alkua. Nuoret, terveet eläimet jaetaan satunnaisesti koe- ja kontrolliryhmiin. Juuri ennen kokeen alkua eläinten selästä poistetaan karvapeite leikkaamalla. Karvapeite voidaan myös ajella, mutta se tulee tehdä noin vuorokautta ennen testin alkua. Karvanpoisto on yleensä toistettava noin viikon välein. Karvapeitettä poistettaessa on varottava vahingoittamasta ihoa. Vähintään 10 % ruumiin pinnasta on oltava ajeltuna, jotta siihen voidaan annostellaan testattavaa ainetta. Koealueen suuruus ja peitesiteen mitat riippuvat eläimen painosta. Kun testataan kiinteitä aineita, jotka voidaan tarvittaessa jauhaa, aine kostutetaan vedellä tai sopivalla liuottimella, jotta ihoon saadaan hyvä kosketus. Testattavia nesteitä ei yleensä laimenneta. Päivittäinen altistus tehdään 5–7 kertaa viikossa.
Koeolosuhteet
Voidaan käyttää täysikasvuisia rottia, kaneja tai marsuja. Muitakin lajeja voidaan käyttää, mutta niiden käyttö on perusteltava. Tutkimuksen alkaessa koe-eläinten paino saa vaihdella korkeintaan ± 20 % keskiarvosta. Mikäli pitkäaikaistutkimuksen esitestinä on tehty subkrooninen ihon kautta tapahtuva altistustesti, kummassakin kokeessa on käytettävä samaa lajia ja kantaa.
Kutakin annostasoa varten tarvitaan vähintään 20 terveihoista eläintä (10 naarasta ja 10 urosta). Naaraiden on oltava synnyttämättömiä, eivätkä ne saa olla tiineenä. Mikäli tutkimussuunnitelma edellyttää eläinten lopettamista tutkimuksen kuluessa, eläinmäärään on lisättävä lopettaviksi aiottujen eläinten määrä. Lisäksi voidaan muodostaa 20 eläimen satelliittiryhmä (10 eläintä kumpaakin sukupuolta), jolle annetaan suurin annos 90 vuorokauden aikana ja jota tarkkaillaan 28 päivän ajan kokeen loputtua myrkytysoireiden ohimenevyyden, pysyvyyden tai viivästyneen esiintymisen toteamiseksi.
Testissä käytetään vähintään kolmea annostasoa ja kontrolliryhmää tai liuotinkontrolliryhmää, jos liuotinta käytetään. Päivittäinen altistusaika on vähintään kuusi tuntia. Eläimet altistetaan testattavalle aineelle samaan aikaan joka päivä ja annosta säädetään määräajoin (viikoittain tai joka toinen viikko), jotta annostaso pysyy muuttumattomana suhteessa eläimen painoon. Kontrolliryhmän eläimille ei anneta testattavaa ainetta, mutta muuten niitä käsitellään aivan samoin kuin testiryhmän eläimiä. Mikäli liuotinta käytetään annostelun helpottamiseksi, kontrolleille annostellaan liuotinta samalla tavoin kuin testiryhmille ja liuottimen määrä on yhtä suuri kuin suurimman annostason saavan testiryhmän liuotinmäärä. Suurimman annoksen tulisi aiheuttaa myrkytysoireita, mutta ei lainkaan tai hyvin vähän kuolemantapauksia. Pienimmällä annoksella ei saisi olla myrkkyvaikutusta. Mikäli ihmisten altistustasosta on tietoja, pienimmän testiannoksen on oltava tätä suurempi. Keskimmäisen annostason olisi aiheutettava pienimmät havaittavissa olevat myrkytysoireet. Käytettäessä useampia väliannostasoja ne on porrastettava niin, että myrkytysoireet lisääntyvät asteittain. Pienimmän ja keskisuuren annoksen saavissa ryhmissä sekä kontrolliryhmässä kuolemantapausten luvun on oltava pieni, jotta tuloksista voidaan tehdä luotettava arviointi.
Mikäli testattava aine aiheuttaa voimakasta ihon ärsytystä, aineen pitoisuutta pienennetään ja tämä voi aiheuttaa muiden myrkytysoireiden poisjäämisen tai vähenemisen korkeimmalla annostasolla. Jos iho on pahoin vaurioitunut, voi olla tarpeen lopettaa tutkimus ja aloittaa uusi pienemmillä pitoisuuksilla.
Raja-annostesti
Jos esitutkimuksessa ei esiinny testattavaan aineeseen liittyviä myrkkyvaikututuksia 1 000 mg/kg:n tai sitä suuremmalla, ihmisten altistumisen perusteella määritetyllä annostasolla, jatkotestejä ei yleensä tarvitse tehdä.
Tarkkailuaika
Eläimiä tarkkaillaan päivittäin myrkytysoireiden toteamiseksi. Kuolinaika sekä myrkytysoireiden alkamis- ja loppumisaika kirjataan.
Testin suorittaminen
Eläimet säilytetään yksittäishäkeissä. Niitä käsitellään testattavalla aineella mieluimmin viikon jokaisena päivänä 90 vuorokauden ajan.
Mikäli tutkimukseen sisältyy satelliittiryhmä, sitä tarkkaillaan vielä 28 päivän ajan altistamisen loputtua myrkkyvaikutusten ohimenevyyden tai pysyvyyden toteamiseksi. Altistamisajan on oltava kuusi tuntia päivässä.
Testattavaa ainetta annostellaan tasaisesti alueelle, joka on n. 10 % ruumiin koko pinta-alasta. Testattaessa erittäin myrkyllisiä aineita altistusalue voi olla pienempi, mutta aine tulisi levittää alueelle mahdollisimman ohuena ja tasaisena kalvona.
Testattava aine pidetään kosketuksessa ihoon huokoisen sideharson ja ärsyttämättömän teipin avulla. Testialueelle on asetettava jokin sopiva peite pitämään harsosidos ja testattava aine paikoillaan ja estämään eläintä syömästä sitä. Eläimen liikkumista voidaan rajoittaa, mutta täydellisesti liikkumattomaksi saattaminen ei ole suositeltava menettelytapa.
Altistusajan päätyttyä jäljellä oleva aine poistetaan vedellä tai puhdistamalla iho jollakin muulla sopivalla tavalla.
Eläimiä tarkkaillaan päivittäin ja myrkytysoireet, niiden alkamis- ja kestoaika sekä voimakkuus kirjataan. Eläimiä tarkkailtaessa kiinnitetään huomiota muutoksiin, joita tapahtuu karvapeitteessä ja ihossa, silmissä ja limakalvoissa sekä hengitys- ja verenkiertoelimissä, autonomisessa ja keskushermostossa, somatomotorisissa toiminnoissa ja käyttäytymistavassa. Ruoan kulutus mitataan ja eläimet punnitaan viikoittain. Tarkkailua on suoritettava säännöllisesti, jotta koe-eläimiä ei menetettäisi kannibalismin, kudosten autolyysin tai virheellisen sijoituksen vuoksi. Tutkimuksen päätyttyä eloonjääneille eläimille satelliittiryhmää lukuun ottamatta suoritetaan ruumiinavaus. Kuolemaisillaan olevat eläimet poistetaan viipymättä ja niille suoritetaan ruumiinavaus.
Seuraavat tutkimukset tehdään testin päätyttyä kaikille eläimille, mukaan lukien kontrolliryhmän eläimet:
|
a) |
Silmätutkimus on suoritettava oftalmoskoopilla tai vastaavalla laitteella ennen aineen antamista ja testin päätyttyä mieluimmin kaikille eläimille, mutta vähintään suurimman annoksen saaneille sekä kontrolliryhmälle. Mikäli silmissä havaitaan muutoksia, kaikki eläimet tutkitaan. |
|
b) |
Veritutkimus, jossa määritetään hematokriitti, hemoglobiini, erytrosyyttien määrä, leukosyyttien määrä ja erittely sekä joitakin hyytymisominaisuuksia kuten hyytymisaika, protrombiiniaika, tromboplastiiniaika tai trombosyyttien määrä, tehdään tutkimusajanjakson päätyttyä. |
|
c) |
Veren kliininen biokemiallinen tutkimus on suoritettava tutkimusajanjakson päätyttyä. Kaikkiin tutkimuksiin soveltuvia määrityskohteita ovat elektrolyyttitasapaino, hiilihydraattien metabolia sekä, maksan ja munuaisten toiminta. Testien valintaperusteena on aineen todettu vaikutustapa. Suositeltavia määrityskohteita ovat: kalsium, fosfori, kloridi, natrium, kalium, glukoosin paastoarvo (lajille soveltuva paaston pituus), seerumin glutamiinipyruviinitransaminaasi (4), seerumin glutamiinioksaloasetaattitransaminaasi (5), ornitiinidekarboksylaasi, gammaglutamyylitranspeptidaasi, virtsan typpi, albumiini, veren kreatiniinin kokonaisbilirubiini ja seerumin proteiinit. Myrkyllisyyden arvioinnissa auttavat tarvittaessa lisävalaistusta esimerkiksi lipidi-, hormoni-, happo/emästasapaino-, methemoglobiini- ja kolinesteraasiaktiivisuuden analyysit. Muitakin kliinisiä biokemiallisia testejä voidaan tehdä, jos todettujen vaikutusten laajempi tutkimus on tarpeen. |
|
d) |
Virtsa-analyysia ei yleensä tarvita. Se tehdään silloin, kun oletettu tai todettu myrkyllisyys antaa siihen aihetta. |
Mikäli käytettävissä olevat taustatiedot ovat riittämättömät, hematologisten ja biokemiallisten parametrien määritystä tulisi harkita ennen altistuksen aloittamista.
Kaikille koe-eläimille suoritetaan ruumiinavaus, jossa tutkitaan ruumis ulkopuolelta, kaikki aukot, kallo-, rinta- ja vatsaontelo sekä niiden sisältö. Maksa, munuaiset, lisämunuaiset ja kivekset punnitaan märkinä mahdollisimman pian irrottamisen jälkeen, jotta ne eivät pääse kuivumaan. Seuraavat elimet ja kudokset säilytetään sopivassa aineessa mahdollista myöhempää histopatologista tutkimusta varten: kaikki näkyvät vammat, aivot — ytimen/aivosillan osat mukaan lukien, pikkuaivokuori ja aivokuori, aivolisäke, kilpirauhanen/lisäkilpirauhanen, kateenkorvakudosta, (henkitorvi), keuhkot, sydän, aortta, sylkirauhaset, maksa, perna, munuaiset, lisämunuaiset, haima, sukupuolirauhaset, kohtu, muut sukupuolielimet, sappirakko (jos on), ruokatorvi, mahalaukku, pohjukaissuoli, ohutsuoli, umpisuoli, paksusuoli, peräsuoli, virtsarakko, tyypillinen imusolmuke (naarailta rintarauhanen), (reisilihaksistoa), ääreishermo, (silmät), (rintalasta luuytimineen), (reisiluu ja nivelen pintaa) (selkärankaa kolmesta kohdasta — kaulasta, henkitorven keskiosasta ja lantiosta) sekä (kyynelrauhaset). Suluissa olevat kudokset tutkitaan vain, jos ne tai kohde-elimet osoittavat merkkejä myrkyllisyydestä.
|
a) |
Suurimman annoksen saaneen ryhmän sekä kontrolliryhmän eläinten normaalista ja altistetusta ihosta otetuille näytteille sekä elin- ja kudosnäytteille tehdään täydellinen histopatologinen tutkimus. |
|
b) |
Kaikki näkyvät vammat tutkitaan. |
|
c) |
Muiden annosryhmien eläinten tärkeät elimet tutkitaan. |
|
d) |
Rotan ollessa koe-eläimenä tutkitaan alhaisen ja keskitason annosryhmien eläinten keuhkot infektioiden löytämiseksi, koska niiden perusteella pystytään vaivattomasti arvioimaan eläinten terveydentila. Yleensä ei näiden ryhmien eläimille tarvitse suorittaa muita histopatologisia tutkimuksia, mutta elimet, jotka suurimman annoksen saaneessa ryhmässä olivat vaurioituneet, on aina tutkittava myös näiden ryhmien osalta. |
|
e) |
Kun tutkimukseen sisältyy satelliittiryhmä, histopatologinen tutkimus suoritetaan niille elimille ja kudoksille, joissa muiden ryhmien eläimillä oli vaurioita. |
2. TULOKSET
Tulokset esitetään taulukkomuodossa, josta näkyy kuhunkin testiryhmään kuuluvien eläinten lukumäärä kokeen alussa, vammautuneiden eläinten määrä ja eläinten prosentuaalinen osuus kutakin erityyppistä vammaa kohden. Tulosten merkitsevyys arvioidaan jotakin tilastollista menetelmää käyttäen. Kaikkia tunnettuja tilastointimenetelmiä voidaan käyttää.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
eläinlaji, kanta, hankintapaikka, ympäristöolosuhteet, ruokavalio, |
|
— |
koeolosuhteet, |
|
— |
annostasot (käytetty liuotin) ja pitoisuudet, |
|
— |
myrkyllisyysoireet sukupuolen ja annostason perusteella, |
|
— |
oireeton taso, mikäli mahdollista, |
|
— |
eläinten kuolinaika tutkimuksen kuluessa ja eloonjääneet sen päätyttyä, |
|
— |
selostus myrkyllisyysoireista ja muista vaikutuksista, |
|
— |
kunkin oireen toteamisaika ja kehittyminen, |
|
— |
ruokintaa ja painoa koskevat tiedot, |
|
— |
silmälöydökset, |
|
— |
veritestit ja kaikki tulokset, |
|
— |
kliiniset biokemialliset testit ja kaikki tulokset (myös virtsa-analyysitulokset), |
|
— |
ruumiinavauslöydökset, |
|
— |
tarkka selostus kaikista histopatologisista löydöksistä, |
|
— |
tulosten tilastointitapa, mikäli mahdollista, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.29. SUBKROONINEN MYRKYLLISYYSTUTKIMUS (HENGITYSTEIDEN KAUTTA) TOISTUVA ANNOSTELU HENGITYSTEIDEN KAUTTA, 90 VUOROKAUTTA, JYRSIJÄT
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Koe-eläinryhmät altistetaan päivittäin tietyksi ajaksi testattavalle aineelle asteittain suurenevina annoksina 90 vuorokauden aikana siten, että kukin ryhmä saa eri suuruisen annoksen. Jos käytetään liuotinta sopivan ilmaseospitoisuuden aikaansaamiseksi, tutkimuksessa on käytettävä liuotinkontrolliryhmää. Tutkimuksen kuluessa eläimiä tarkkaillaan päivittäin myrkyllisyysoireiden toteamiseksi. Testin aikana kuolleille eläimille ja sen päättymisen jälkeen vielä elossa oleville eläimille suoritetaan ruumiinavaus.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Eläimet siirretään koetiloihin ja tutkimuksen aikana annettava ruokinta aloitetaan vähintään viisi päivää ennen tutkimuksen alkua. Nuoret, terveet eläimet jaetaan satunnaisesti koe- ja kontrolliryhmiin. Testattaviin aineisiin voidaan tarpeen mukaan lisätä liuotinta, jotta saadaan halutun pitoinen ilmaseos. Mikäli liuotinta tai muita lisäaineita käytetään annostelun helpottamiseksi, niiden myrkyttömyys täytyy olla tiedossa esimerkiksi aikaisempien tutkimustulosten perusteella.
Koeolosuhteet
Rotta on suositeltavin laji, ellei sen käyttö ole kontraindikoitu. Koe-eläimiksi valitaan yleisesti käytettyä laboratoriokantaa olevia nuoria terveitä rottia. Tutkimuksen alkaessa eläinten paino saa vaihdella korkeintaan ± 20 % tavanomaisesta keskiarvosta. Mikäli pitkäaikaistutkimuksen esitestinä tehdään subkrooninen hengitysteiden kautta tapahtuva altistumistesti, kummassakin kokeessa on käytettävä samaa eläinlajia ja -kantaa.
Kutakin annostasoa varten tarvitaan vähintään 20 eläintä (10 naarasta ja 10 urosta). Naaraiden on oltava synnyttämättömiä, eivätkä ne saa olla tiineenä. Mikäli tutkimussuunnitelma edellyttää eläinten lopettamista tutkimuksen kuluessa, eläinmäärään on lisättävä lopettaviksi aiottujen eläinten määrä. Lisäksi voidaan muodostaa 20 eläimen satelliittiryhmä (10 eläintä kumpaakin sukupuolta), jolle annetaan suurin annos 90 vuorokauden aikana ja jota tarkkaillaan 28 vuorokauden ajan tutkimuksen päätyttyä myrkytysoireiden ohimenevyyden, pysyvyyden tai viivästyneen esiintymisen toteamiseksi.
Kokeessa käytetään vähintään kolmea annostasoa ja kontrolliryhmää tai liuotinkontrolliryhmää (jolle annostellaan liuotinta suurimman annoksen sisältävän liuotinmäärän verran). Kontrolliryhmän eläimiä käsitellään aivan samoin kuin testiryhmän eläimiä, paitsi että niille ei annetta testattavaa ainetta. Suurimman annoksen olisi aiheutettava myrkytysoireita, mutta ei lainkaan tai hyvin vähän kuolemantapauksia. Mikäli altistusannoksesta ihmisillä on tietoja, pienimmän testiannoksen on oltava tätä suurempi. Keskimmäinen annostaso olisi säädettävä sellaiseksi, että se aiheuttaa vähäisimmät havaittavissa olevat myrkytysoireet. Käytettäessä useampia väliannostasoja ne on porrastettava niin, että myrkkyvaikutukset lisääntyvät asteittain. Pienimmän ja keskisuuren annoksen saavissa ryhmissä sekä kontrolliryhmässä kuolemantapausten luvun on oltava pieni, jotta tuloksista voidaan tehdä luotettava arviointi.
Päivittäinen altistusaika on kuusi tuntia hengityskammion tasapainotuksen jälkeen. Erityistapauksissa aika voi vaihdella.
Eläinten testauksiin käytetään inhalaatiolaitetta, jonka dynaamisessa ilmavirrassa ilma vaihtuu vähintään 12 kertaa tunnissa, jotta hapen ja tasaisesti jakautuneen altistusaineen saanti voidaan varmistaa. Jos tutkimuksessa käytetään kammiota, sen on oltava suunniteltu siten, että koe-eläimet voidaan sijoittaa mahdollisimman väljästi, ja että ne joutuvat hengittämään mahdollisimman tehokkaasti testattavaa ainetta. Yleissääntönä kammion ilman pitämiseksi vakaana on, että koe-eläinten viemä tila on korkeintaan 5 % kammion tilavuudesta. Eläimen sieraimet ja suu, yksinomaan pää tai koko ruumis voidaan altistaa yksittäiskammiossa; kaksi ensin mainittua tapaa vähentävät testattavan aineen imeytymistä muulla tavoin.
Eläimiä tarkkaillaan päivittäin testin ja toipumisen aikana myrkytysoireiden toteamiseksi. Kuolinaika ja myrkkyvaikutusten alkamis- ja loppumisaika kirjataan.
Testin suorittaminen
Eläimet altistetaan testattavalle aineelle päivittäin viidestä seitsemään päivänä viikossa 90 vuorokauden ajan. Mikäli tutkimukseen kuuluu seurantatarkkailuun tarkoitettu satelliittiryhmä, sitä tarkkaillaan vielä 28 päivän ajan altistamisen jälkeen myrkkyvaikutusten ohimenevyyden tai pysyvyyden toteamiseksi Testin aikana lämpötilan on oltava 22 ± 3 oC. Suositeltavin suhteellinen kosteus on 30–70 %, mutta tietyissä tapauksissa (esim. aerosolitesteissä) tämä ei ole mahdollista käytännössä. Altistamisen aikana ei anneta ruokaa eikä vettä.
Testissä on käytettävä dynaamista inhalointimenetelmää, jossa on analyyttinen pitoisuuden valvontajärjestelmä. Esitestaus on suositeltavaa tarvittavien altistuspitoisuuksien määrittämiseksi. Ilman virtaus säädetään siten, että olosuhteet ovat homogeeniset altistuskammion joka kohdassa. Vakaisiin altistusolosuhteisiin on päästävä mahdollisimman lyhyessä ajassa.
Seuraavat mittaukset tai tarkkailutoimenpiteet on suoritettava:
|
a) |
ilmavirran nopeus (jatkuva tarkkailu), |
|
b) |
testattavan aineen todellinen hengityskohdassa mitattu pitoisuus. Päivittäisen altistuksen aikana pitoisuuden vaihtelu saa olla korkeintaan ± 15 % keskiarvosta. Testattaessa pölyjä ja aerosoleja tämän tason saavuttaminen voi olla vaikeaa ja tällöin hyväksytään suurempi poikkeama. Päivit täisten pitoisuuksien olisi pysyttävä mahdollisimman vakaina koko tutkimuksen ajan. Hiukkas- ja aerosolitestauksissa hiukkasten koko on mitattava tarvittaessa hiukkasten koko jakautuman selvittämiseksi, |
|
c) |
lämpötila ja kosteus, |
|
d) |
altistamisen aikana ja sen jälkeen eläimiä tarkkaillaan ja huomiot kirjataan järjestelmällisesti. Jokaisesta eläimestä pidetään eriksee kirjaa. Eläimiä tarkkaillaan päivittäin ja kaikki myrkytysoireet, niiden alkamisaika, voimakkuus ja kesto kirjataan. Eläimiä tarkkailtaessa on kiinnitettävä huomiota muutoksiin, joita tapahtuu karvapeitteessä ja ihossa, silmissä, limakalvoissa, hengitys- ja verenkiertoelimissä, autonomisessa ja keskushermostossa, somatomotorisissa toiminnoissa ja käyttäytymistavassa. Eläimet punnitaan viikoittain ja viikoittainen ruoan kulutus mitataan. Tarkkailu on suoritettava säännöllisesti, jotta koe-eläimiä ei menetettäisi kannibalismin, kudosten autolyysin tai virheellisen sijoituksen vuoksi. Tutkimuksen päätyttyä eloonjääneille eläimille suoritetaan ruumiinavaus. Kuolemaisillaan olevat eläimet poistetaan ja niille suoritetaan ruumiinavaus. |
Seuraavat tutkimukset tehdään kokeen päätyttyä kaikille eläimille, mukaan lukien kontrolliryhmän eläimet:
|
a) |
Silmätutkimus on suoritettava oftalmoskoopilla tai vastaavalla laitteella ennen aineelle altistusta ja tutkimuksen päätyttyä mieluimmin kaikille eläimille, mutta ainakin korkeimman annoksen saaneille sekä kontrolliryhmälle. Mikäli silmissä havaitaan muutoksia, kaikki eläimet tutkitaan. |
|
b) |
Veritutkimus, jossa määritetään hematokriitti, hemoglobiini, erytrosyyttien määrä, leukosyyttien määrä ja erittely sekä joitakin hyytymisominaisuuksia, kuten hyytymisaika, protrombiiniaika, tromboplastiiniaika tai trombosyyttien määrä, tehdään tutkimusajanjakson päätyttyä. |
|
c) |
Veren kliininen biokemiallinen tutkimus on suoritettava tutkimusajan päätyttyä. Kaikkiin tutkimuksiin soveltuvia määrityskohteita ovat elektrolyyttitasapaino, hiilihydraattien metabolia sekä maksan ja munuaisten toiminta. Testien valintaperusteena on aineen todettu vaikutustapa. Suositeltavia määrityskohteita ovat: kalsium, fosfori, kloridi, natrium, kalium, glukoosin paastoarvo (lajille soveltuva paaston pituus), seerumin glutamiinipyruviinitransaminaasi (4), seerumin glutamiinioksaloasetaattitransaminaasi (5), ornitiinidekarboksylaasi, gammaglutamyyli-transpeptidaasi, virtsan typpi, albumiini, veren kreatiniinin kokonaisbilirubiini ja seerumin proteiinit. Myrkyllisyyden arvioinnissa tarvittaessa esimerkiksi lipidi-, hormoni-, happo/emästasapaino-, methemoglobiini- ja kolinesteraasiaktiivisuuden analyysit. Muitakin kliinisiä biokemiallisia testejä voidaan tehdä, mikäli todettujen vaikutusten laajempi tutkimus on tarpeen. |
|
d) |
Virtsa-analyysia ei yleensä tarvita. Se tehdään silloin, kun odotettu tai todettu myrkyllisyys antaa siihen aihetta. |
Mikäli käytettävissä olevat taustatiedot ovat riittämättömät, hematologisten ja biokemiallisten parametrien määritystä tulisi harkita ennen altistuksen aloittamista.
Kaikille koe-eläimille suoritetaan ruumiinavaus, jossa tutkitaan ruumis ulkopuolelta, kaikki aukot, kallo-, rinta- ja vatsaontelo sekä niiden sisältö. Maksa, munuaiset, lisämunuaiset ja kivekset punnitaan märkinä mahdollisimman pian irrottamisen jälkeen, jotta ne eivät pääse kuivumaan. Seuraavat elimet ja kudokset säilytetään sopivassa aineessa mahdollista myöhempää histopatologista tutkimusta varten: näkyviä vammoja sisältävät kohteet, keuhkot — jotka olisi poistettava kokonaisina, punnittava ja käsiteltävä jollakin fiksatiivilla, jotta keuhkojen rakenne säilyy (fiksatiiviperfuusio on tehokas menetelmä), nenänielun kudokset, aivot — ytimen/aivosillan osat mukaan lukien, pikkuaivokuori ja aivokuori, aivolisäke, kilpirauhanen/lisäkilpirauhanen, kateenkorvakudosta, henkitorvi, keuhkot, sydän, aortta, sylkirauhaset, maksa, perna, munuaiset, lisämunuaiset, haima, sukupuolirauhaset, kohtu, (muut sukupuolielimet), (iho), sappirakko (jos on), ruokatorvi, mahalaukku, pohjukaissuoli, ohutsuoli, umpisuoli, paksusuoli, peräsuoli, virtsarakko, tyypillinen imusolmuke (naaraan rintarauhanen), (reisilihaksistoa), ääreishermo, (silmät), rintalasta luuytimineen, (reisiluu ja nivelen pintaa) sekä (selkärankaa kolmesta kohdasta — kaulasta, henkitorven keskiosasta ja lantiosta). Suluissa olevat kudokset tutkitaan vain, jos ne tai kohde-elimet osoittavat merkkejä myrkyllisyydestä.
|
a) |
Suurimman annoksen saaneen ryhmän ja kontrolliryhmän eläinten hengitystiet sekä elin- ja kudosnäytteet tutkitaan tarkoin. |
|
b) |
Kaikki näkyvät vammat tutkitaan. |
|
c) |
Muiden annosryhmien eläinten kohde-elimet on myös tutkittava. |
|
d) |
Alhaisen ja keskitason annosryhmien eläinten keuhkot tutkitaan histopatologisesti, koska näin pystytään vaivattomasti arvioimaan eläinten terveydentila. Yleensä ei näiden ryhmien eläimille tarvitse suorittaa muita histopatologisia tutkimuksia, mutta elimet, jotka suurimman annoksen saaneessa ryhmässä olivat vaurioituneet, on aina tutkittava myös näiden ryhmien osalta. |
|
e) |
Kun tutkimukseen sisältyy satelliittiryhmä, histopatologinen tutkimus suoritetaan niille elimille ja kudoksille, joissa muiden ryhmien eläimillä oli vaurioita. |
2. TULOKSET
Tulokset esitetään taulukkomuodossa, josta ilmenevät kuhunkin testiryhmään kuuluvien eläinten lukumäärä testin alussa, vammautuneiden eläinten määrä ja eläinten prosentuaalinen osuus kutakin erityyppistä vammaa kohden. Tulosten merkitsevyys arvioidaan jotakin tilastollista menetelmää käyttäen. Kaikkia tunnettuja tilastointimenetelmiä voidaan käyttää.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
eläinlaji, kanta, hankintapaikka, ympäristöolosuhteet, ruokavalio, |
|
— |
koeolosuhteet: Altistamislaitteen kuvaus: merkki, tyyppi, mitat, ilmanlähde, hiukkasten ja aerosolien tuottamistapa, ilmastointitapa, poistoilman käsittelytapa ja eläinten sijainti koekammiossa altistamisen aikana. Lämpötilan, kosteuden, ja tarvittaessa hiukkasten koon ja aerosolin pitoisuuden mittaustapa on mainittava. Altistamistiedot: Altistamistiedot laaditaan taulukon muotoon, jossa esitetään keskiarvo ja poikkeamat (esim. keskihajonta) ja, mikäli mahdollista, seuraavat tiedot:
|
|
— |
myrkyllisyysoireet sukupuolen ja annostason perusteella, |
|
— |
oireeton taso, mikäli mahdollista, |
|
— |
eläinten kuolinaika tutkimuksen kuluessa ja eloonjääneet sen päätyttyä, |
|
— |
selostus myrkyllisyysoireista ja muista vaikutuksista, |
|
— |
kunkin oireen toteamisaika ja kehittyminen, |
|
— |
ruokintaa ja painoa koskevat tiedot, |
|
— |
silmälöydökset, |
|
— |
veritestit ja niiden tulokset, |
|
— |
kliiniset biokemialliset testit ja niiden tulokset (myös virtsa-analyysitulokset), |
|
— |
ruumnnavauslöydökset, |
|
— |
tarkka selostus kaikista histopatologisista löydöksistä, |
|
— |
tulosten tilastointitapa, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.30. KROONINEN MYRKYLLISYYSTESTI
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Testattavaa ainetta annetaan valittua antotapaa käyttäen yleensä viikon jokaisena päivänä useille koe-eläinryhmille suurimman osan niiden elinajasta, niin että kukin ryhmä saa eri suuruisen annoksen. Antoaikana ja sen päätyttyä eläimiä tarkkaillaan päivittäin myrkkyvaikutusten toteamiseksi.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Eläimet siirretään koetiloihin ja testin aikana annettava ruokinta aloitetaan vähintään viisi päivää ennen testin alkua. Nuoret, terveet eläimet jaetaan satunnaisesti koe- ja kontrolliryhmiin.
Koeolosuhteet
Rotta on suositeltavin laji.
Aikaisempien tutkimusten perusteella voidaan valita jokin muu laji (jyrsijä tai muu laji). Koe-eläimiksi valitaan yleisesti käytettyä laboratoriokantaa olevia nuoria terveitä eläimiä ja annostelu aloitetaan niin pian kuin mahdollista vieroituksen jälkeen.
Testin alkaessa eläinten paino saa vaihdella korkeintaan ± 20 % keskiarvosta. Mikäli subkrooninen testi suun kautta annosteltuna on tehty pitkäaikaistutkimuksen esitestinä, samaa lajia ja kantaa on käytettävä kummassakin tutkimuksessa.
Kun tutkimuksessa käytetään jyrsijöitä, kutakin annostasoa ja kontrolliryhmää varten tarvitaan vähintään 40 eläintä (20 naarasta ja 20 urosta). Naaraiden on oltava synnyttämättömiä, eivätkä ne saa olla kantavia. Mikäli tutkimussuunnitelma edellyttää eläinten lopettamista tutkimuksen kuluessa, eläinmäärään on lisättävä lopetettaviksi aiottujen eläinten määrä.
Tutkittaessa muita kuin jyrsijöitä voidaan käyttää pienempää eläinmäärää. Kussakin ryhmässä on kuitenkin oltava vähintään neljä eläintä kumpaakin sukupuolta.
Testissä käytetään vähintään kolmea annostasoa ja kontrolliryhmää. Suurimman annoksen olisi aiheutettava selkeitä myrkytysoireita mutta vähän kuolemantapauksia.
Pienimmällä annoksella ei saisi olla myrkkyvaikutusta.
Väliannostaso (tasot) on porrastettava ylimmän ja alimman annoksen keskiväliin.
Annostasojen valinnassa on otettava huomioon aikaisemmista myrkyllisyystesteistä ja -tutkimuksista saadut tulokset.
Eläimet altistetaan tavallisesti päivittäin. Mikäli kemikaalia annostellaan juomaveteen tai ravintoon sekoitettuna, niitä on oltava jatkuvasti saatavilla.
Tutkimuksessa on käytettävä kontrolliryhmää, joka on aivan samanlainen kuin tutkimusryhmät, paitsi että sille ei anneta tutkittavaa ainetta.
Erityistapauksissa, esimerkiksi aerosoleihin liittyvissä inhalaatiotutkimuksissa tai kun suun kautta annosteltavaa ainetta tutkittaessa käytetään emulgaattoria, jonka biologiset ominaisuudet eivät ole tiedossa, tutkimukseen tulee liittää myös negatiivinen kontrolliryhmä. Negatiivista kontrolliryhmää käsitellään aivan samalla tavalla kuin tutkimusryhmiä, paitsi ettei sitä altisteta tutkittavalle aineelle eikä liuottimelle.
Kaksi pääasiallisesti käytettyä annostelutapaa ovat altistus suun kautta ja hengitysteiden kautta. Valinta nippuu testattavan aineen fysikaalisista ja kemiallisista ominaisuuksista seka ihmisten todennäköisestä altistumistavasta.
Ihon kautta altistamiseen liittyy huomattavia käytännön ongelmia. Johtopäätökset ihon kautta imeytymisestä johtuvasta kroonisista systeemisistä myrkkyvaikutuksista voidaan yleensä tehdä suun kautta annosteltua ainetta koskevan testin sekä niiden tietojen perusteella, joita ihon kautta imeytymisestä on saatu aikaisemmista testeistä, joissa aineen myrkyllisyyttä ihon kautta annosteltuna on testattu,
Kun testattava aine imeytyy ruoansulatuskanavasta sen ollessa myös ihmisten todennäköinen altistumistapa, suun kautta annostelu on paras tapa, ellei kontraindikaatioita ole. Testattavaa ainetta voidaan antaa eläimille ravinnon yhteydessä, juomaveteen liuotettuna tai kapseleina. Eläimille olisi annetteva testattavaa ainetta viikon jokaisena päivänä, koska annostus viitenä päivänä viikossa voi aiheuttaa myrkyllisyysoireiden häviämisen tai niistä toipumisen sen ajan kuluessa, jolloin ainetta ei anneta, ja näin vaikuttaa tuloksiin ja niiden tulkintaan. Lähinnä käytännön syistä annostelu viitenä päivänä viikossa voidaan kuitenkin hyväksyä.
Koska altistus hengitysteiden kautta on teknisesti paljon ongelmallisempi kuin muut altistustavat, seuraavassa selostetaan tarkemmin tätä altistustapaa. On myös huomattava, että aineen tiputus henkitorveen voi joissakin tapauksissa olla hyväksyttävä vaihtoehto.
Pitkäaikaisaltistukset suunnitellaan yleensä ihmisten todennäköisen altistumistavan perusteella. Eläimet altistetaan hengityskammion tasapainotuksen jälkeen joko kuudeksi tunniksi päivittäin viitenä päivänä viikossa (jaksoittainen altistus) tai todennäköisen ympäristöaltistustavan perusteella 22–24 tuntia vuorokaudessa viikon jokaisena päivänä (jatkuva altistus), jolloin eläimillä on noin tunnin mittainen ruokailuaika samaan aikaan joka päivä.
Kummassakaan tapauksessa eläimien saaman testattavan aineen pitoisuutta ei yleensä muuteta. Jaksoittaisen ja jatkuvan altistuksen pääasiallinen ero on, että jaksoittaisessa altistuksessa eläimillä on 17–18 tuntia aikaa toipua päivittäisestä altistuksesta ja viikonloppuisin vielä tätäkin pidempi toipumisaika.
Jaksoittaisen tai jatkuvan altistuksen valinta riippuu tutkimuksen tavoitteista ja siitä, mitä ihmisten altistumistapaa simuloidaan. Tietyt tekniset vaikeudet on joka tapauksessa otettava huomioon. Esimerkiksi eläinten syöttäminen ja juottaminen altistuksen aikana ja monimutkaisemmat (ja luotettavammat) laitteet aerosolien ja höyryn tuottamiseksi sekä niiden valvonta voivat aiheuttaa ongelmia, jotka ovat merkittävämpiä kuin ympäristöolosuhteiden simuloimiseksi valitun jatkuvan altistuksen edut.
Eläinten testauksiin käytetään inhalaatiokammiota, jonka dynaamisessa ilmavirrassa ilma vaihtuu vähintään 12 kertaa tunnissa, jotta hapen ja tasaisesti jakautuneen altistamisaineen saanti voidaan varmistaa. Testattavalle aineelle tapahtuvaa altistusta lukuun ottamatta kontrolli- ja altistuskam-mioiden on oltava rakenteeltaan yhdenmukaisia. Kammiossa on yleensä lievä negatiivinen paine, jotta testattavaa ainetta ei pääsisi vuotamaan ympäristöön. Kammioissa on oltava riittävästi tilaa eläimille. Yleissääntönä kammion ilman pitämiseksi vakaana on, että koe-eläinten viemä ala on korkeintaan 5 % kammion tilavuudesta.
Seuraavat mittaukset tai valvontatoimenpiteet on suoritettava:
|
i) |
Ilman virtaus: ilman virtausnopeutta kammion läpi on tarkkailtava jatkuvasti, |
|
ii) |
Pitoisuus: päivittäisen altistuksen aikana pitoisuuden vaihtelu saa olla korkeintaan ±15 % keskiarvosta, |
|
iii) |
Lämpötila ja kosteus: lämpötilan on oltava 22 ± 2 oC ja kammion kosteuden 30–70 %, paitsi milloin testattavaa ainetta suspensoidaan veden avulla kammion ilmaan. Molempia arvoja on jatkuvasti tarkkailtava, |
|
iv) |
Hiukkasten koon mittaukset: kun testataan nestemäisiä tai kiinteitä aerosoleja, kammion ilmassa olevien hiukkasten koko on määritettävä. Aerosolihiukkasten on oltava kooltaan koe-eläinten hengitykselle sopivia. Näytteet kammion ilmasta on otettava eläinten hengitysalueelta. Otoksen on oltava edustava näyte testattavan aineen hiukkasten jakautumisesta ja gravimetrisesti myös kaikista aerosolin suspensiohiukkasista, vaikka suuri osa aerosolista ei joudu hengitykseen. Hiukkasten koosta on tehtävä analyysi useita kertoja hiukkasten tuottoa säädettäessä ja sen jälkeen koe-eläinten altistuksen aikana niin usein kuin tarvitaan hiukkasten jakautumisen vakaana pysymisen varmistamiseksi. |
Altistusajan on oltava vähintään yksi vuosi.
Testin suorittaminen
Huolellinen kliininen tutkimus on suoritettava ainakin kerran päivässä. Sen ohella eläimiä tarkkaillaan päivittäin ja toimenpiteisiin ryhdytään tarvittaessa, jotta tutkimuksesta ei menetettäisi eläimiä. Kuolleet eläimet pakastetaan tai niille suoritetaan ruumiinavaus ja heikot tai kuolemaisillaan olevat eläimet eristetään tai lopetetaan. Myrkytysoireiden puhkeamista ja kehittymistä tarkkaillaan ja sairauden, autolyysin tai kannibalismin aiheuttamat menetykset pyritään pitämään mahdollisimman vähäisinä.
Kunkin eläimen osalta kirjataan kliiniset oireet, neurologiset ja silmän muutokset sekä kuolleisuus. Myrkkyvaikutusten puhkeaminen ja kehitys sekä epäillyt kasvaimet kirjataan.
Kunkin eläimen paino kirjataan kerran viikossa tutkimusajan 13 ensimmäisen viikon aikana ja sen jälkeen vähintään kerran neljässä viikossa. Ravinnon kulutus mitataan viikoittain 13 ensimmäisen viikon aikana ja sen jälkeen noin kolmen kuukauden välein, ellei eläinten terveydentila tai painon muutokset edellytä useampia määrityksiä.
Veritutkimus (esim. hemoglobiini, puna- ja valkosolujen määrä, trombosyytit tai jokin muu hyytymisominaisuusmääritys) on tehtävä kolmen ja kuuden kuukauden kuluttua ja sen jälkeen noin kuuden kuukauden välein. Tutkimuksen päätyttyä otetaan verinäyte kunkin ryhmän osalta 10 uros- ja 10 naaraspuolisesta rotasta ja kaikista muiden lajien koe-eläimistä. Jos mahdollista, näytteet on otettava joka kerta samoista rotista. Muista kuin jyrsijöistä otetaan tämän lisäksi näyte ennen tutkimuksen alkua.
Mikäli kliiniset havainnot viittaavat eläinten terveydentilan huononemiseen tutkimuksen kuluessa, näiden eläinten verenkuva on tutkittava.
Suurimman annoksen saaneen ryhmän ja kontrolliryhmän eläinten verenkuva tutkitaan. Pienempiä annoksia saaneiden ryhmien osalta verenkuva tutkitaan vain, jos suurimman annosryhmän ja kontrolliryhmän välillä on suuri ero tai jos patologiset löydökset edellyttävät sen tutkimista.
Virtsanäyte otetaan kunkin ryhmän osalta jos mahdollista samoin välein ja samalta 10 uros- ja 10 naaraspuoliselta rotalta, jolta otettiin verinäyte, ja kaikilta muiden lajien koe-eläimiltä. Seuraavat määritykset on tehtävä joko kunkin eläimen näytteestä tai jyrsijöiden osalta sukupuolen ja ryhmän perusteella yhdistetystä näytteestä:
|
— |
ulkonäkö: määrä ja tiheys kunkin eläimen osalta, |
|
— |
proteiinit, glukoosi, ketonit, veri (semikvantitatiivisesti), |
|
— |
sakan mikroskooppitutkimus (semikvantitatiivisesti). |
Otetaan verinäytteet noin kuuden kuukauden välein mieluimmin joka kerta samoilta 10 uros- ja 10 naaraspuoliselta rotalta ja kaikilta muiden lajien koe-eläimiltä kliinisen kemian määrityksiä varten. Muilta kuin jyrsijöiltä otetaan lisäksi näyte ennen tutkimuksen alkua. Näytteiden plasmasta tehdään seuraavat määritykset:
|
— |
kokonaisproteiinipitoisuus, |
|
— |
albumiinipitoisuus, |
|
— |
maksakokeet esim. alkaalifosfataasin, glutamiinipyruviinitransaminaasin (4), glutamiinioksaloasctaattitransaminaasin (5) toiminta, gammaglutamyylitranspeptidaasi, ornitiinidekarboksylaasi, |
|
— |
hiilihydraattien metabolia, esim. glukoosin paastoarvo, |
|
— |
munuaisten toiminta, esim. veren ureatyppi. |
Kaikille, myös tutkimuksen kuluessa kuolleille tai huonokuntoisuuden vuoksi lopetetuille koe-eläimille suoritetaan ruumiinavaus. Ennen eläinten lopettamista niistä otetaan verinäytteet verenkuvan määritystä varten. Kaikki paljain silmin havaittavat vammat, kasvaimet tai kasvaimeksi epäillyt kohteet säilytetään. Silmämääräiset havainnot on pyrittävä korreloimaan mikroskooppisiin löydöksiin.
Kaikki elimet ja kudokset on säilytettävä histopatologista tutkimusta varten. Tämä koskee yleensä seuraavia elimiä ja kudoksia: aivot (6), (ydin/aivosilta, pikkuaivokuori ja aivokuori), aivolisäke, kilpirauhanen (sekä lisäkilpirauhanen), kateenkorva, keuhkot (ja henkitorvi), sydän, aortta, sylkirauhaset, maksa (6), perna, munuaiset (6), lisämunuaiset (6), ruokatorvi, mahalaukku, pohjukaissuoli, ohutsuoli, umpisuoli, paksusuoli, peräsuoli, kohtu, virtsarakko, imusolmukkeet, haima, sukupuolirauhaset (6), muut sukupuolielimet, naaraan rintarauhanen, iho, lihakset, ääreishermo, selkärankaa (kaulasta, henkitorven keskiosasta ja lantiosta), rintalasta luuytimineen, reisiluu (nivelineen) sekä silmät. Keuhkojen ja virtsarakon täyttäminen fiksatiivilla on näiden elinten paras säilytystapa, keuhkojen täyttäminen hengitystietutkimuksissa on välttämätöntä, jotta tarvittava histopatologinen tutkimus voidaan suorittaa. Erityistutkimuksissa, kuten altistustesteissä hengitysteiden kautta, koko hengityselimistö mukaan lukien nenä, nielu ja kurkunpää, tulee tutkia.
Tehtäessä muita kliinisiä tutkimuksia niiden tulosten on oltava selvillä ennen mikroskooppitutkimusta, koska niistä saattaa olla patologille merkittävää apua.
Kaikki näkyvät muutokset, erityisesti jossakin elimessä esiintyvät kasvaimet tai muut vammat tulee tutkia mikroskooppisesti. Lisäksi suositellaan seuraavia toimenpiteitä:
|
a) |
Kaikkien säilytettyjen elinten ja kudosten mikroskooppinen tutkimus ja selostus kaikista vammoista:
|
|
b) |
Alempien annosryhrnien eläinten elimet tai kudokset, joissa esiintyi testattavasta aineesta aiheutuneita tai mahdollisesti aiheutuneita poikkeavuuksia, tutkitaan niin ikään. |
|
c) |
Jos testi osoittaa, että eläinten normaali elinikä on huomattavasti lyhentynyt tai sen tuloksena on syntynyt myrkkyvasteeseen vaikuttavia seurauksia, lähinnä alempi annostaso on tutkittava yllä selostetulla tavalla. |
|
d) |
Tiedot tutkimuksessa käytetyssä eläinkannassa samoissa laboratorio-olosuhteissa yleisesti ilmenevistä vammoista eli aikaisemmat tarkkailutulokset ovat välttämätön tietolähde, jotta altistetuissa koe-eläimissä ilmenneiden muutosten merkitsevyys pystytään arvioimaan. |
2. TULOKSET
Tulokset esitetään taulukkomuodossa, josta ilmenevät kuhunkin testiryhmään kuuluvien eläinten lukumäärä kokeen alussa, vammautuneiden eläinten määrä ja eläinten prosentuaalinen osuus kutakin vammaa kohden. Tulosten merkitsevyys arvioidaan jotakin tilastollista menetelmää käyttäen. Kaikkia tunnettuja tilastointimenetelmiä voidaan käyttää.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
eläinlaji, kanta, hankintapaikka, ympäristöolosuhteet, ruokavalio, |
|
— |
koeolosuhteet: Altistamislaitteen kuvaus: merkki, tyyppi, mitat, ilmanlähde, hiukkasten ja aerosolien tuottamistapa, ilmastointitapa, poistoilman käsittelytapa ja eläinten sijainti koekammiossa altistamisen aikana. Lämpötilan, kosteuden, hiukkasten koon ja aerosolin pitoisuuden mittaustapa on mainittava. Altistamistiedot: Altistamistiedot laaditaan taulukkomuotoon, jossa esitetään keskiarvo ja poikkeamat (esim. keskihajonta) ja seuraavat tiedot:
|
|
— |
annostasot (mukaan lukien liuotin, mikäli sitä on käytetty) |
|
— |
myrkyllisyysvasteen tulokset sukupuolen ja annostason perusteella, |
|
— |
oireeton taso, |
|
— |
eläinten kuolinaika tutkimuksen kuluessa ja eloonjääneet sen päätyttyä, |
|
— |
selostus myrkyllisyysoireista ja muista vaikutuksista, |
|
— |
kunkin oireen toteamisaika ja kehittyminen, |
|
— |
ruokintaa ja painoa koskevat tiedot, |
|
— |
silmälöydökset, |
|
— |
veritestit ja kaikki tulokset, |
|
— |
kliiniset biokemialliset testit ja kaikki tulokset (myös mahdolliset virtsa-analyysitulokset), |
|
— |
ruumiinavauslöydökset, |
|
— |
tarkka selostus kaikista histopatologisista löydöksistä, |
|
— |
tulosten tilastollinen käsittely, jos mahdollista, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisiohdanto, osa B.
B.31. PRENATAALISEN KEHITYKSEN AIKAISTEN MYRKYLLISYYSVAIKUTUSTEN TUTKIMUS
1. MENETELMÄ
Tämä menetelmä on toisinto OECD:n testiohjeesta nro 414 (2001).
1.1 JOHDANTO
Tämän sikiönkehityksen aikaisten myrkyllisyysvaikutusten testimenetelmän tarkoitus on hankkia yleistä tietoa syntymää edeltävän altistuksen vaikutuksista tiineeseen koe-eläimeen ja sen kohdussa kehittyvään organismiin. Testiin voi sisältyä emoon kohdistuvien vaikutusten arviointi sekä sikiön kuoleman, rakenteellisten epämuodostumien tai poikkeavan kehityksen arviointi. Sikiön toiminnallisia häiriöitä, jotka ovat tärkeä osa kehitystä, ei tutkita tässä menetelmässä. Niitä voidaan tutkia erillisellä testillä tai tämän testin ohessa käyttämällä hermostonkehitykseen kohdistuvia myrkyllisyysvaikutuksia selvittävää menetelmää. Toiminnallisten häiriöiden ja muiden syntymän jälkeisten vaikutusten testauksesta saa tietoa kahden sukupolven reproduktiivisten myrkyllisyysvaikutusten tutkimusmenetelmästä sekä hermostonkehitykseen kohdistuvien myrkyllisyysvaikutusten menetelmästä soveltuvin osin.
Tätä testimenetelmää voidaan joutua mukauttamaan yksittäistapauksissa testiaineen fysikokemiallisten tai toksikologisten ominaisuuksien mukaan. Mukauttaminen on hyväksyttävää, jos on olemassa vakuuttavaa tieteellistä viitettä, että testi olisi siten informatiivisempi. Jos testiä mukautetaan, on mainittu tieteellinen näyttö dokumentoitava huolellisesti tutkimusraportissa.
1.2 MÄÄRITELMÄT
Kehitystoksikologia: tieteenala, joka tutkii kehittyvässä organismissa esiintyviä haittavaikutuksia, jotka voivat aiheutua altistuksesta ennen hedelmöitymistä, syntymää edeltävän kehityksen aikana tai syntymän jälkeisenä aikana sukukypsyysikään asti. Sikiönkehityksen aikaisten myrkyllisyysvaikutusten tärkeimmät ilmenemismuodot ovat 1) organismin kuolema 2) rakenteelliset epämuodostumat 3) poikkeava kasvu sekä 4) toiminnalliset häiriöt. Aikaisemmin kehitystoksikologiaa kutsuttiin usein teratologiaksi.
Haittavaikutus: sellainen käsittelyyn liittyvä poikkeama perustasosta, joka vähentää organismin kykyä pysyä hengissä, lisääntyä tai sopeutua ympäristöön. Kehitystoksikologian kannalta haittavaikutus on laajimmassa merkityksessään mikä tahansa vaikutus, joka haittaa conceptuksen normaalia kehitystä sekä ennen syntymää että syntymän jälkeen.
Poikkeava kehitys: poikkeama poikasen elinten tai ruumiin painossa tai koossa.
Poikkeamat (epämuodostumat): kehityksessä ilmenevät rakenteelliset poikkeamat, joihin sisältyvät sekä epämuodostumat että vaihtelu (28).
Epämuodostuma / merkittävä epänormaalius: rakenteellinen muutos, joka katsotaan eläimelle haitalliseksi (voi olla myös letaali) ja jota esiintyy harvoin.
Vaihtelu / vähäinen epänormaalius: rakenteellinen muutos, joka katsotaan eläimelle vähän tai ei lainkaan haitalliseksi. Muutos voi olla ohimenevä ja esiintyä suhteellisen usein vertailupopulaatiossa.
Hedelmöitymisen tulos (conceptus): kaikki hedelmöityneestä munasolusta kehittyneet kudokset kaikissa kehitysvaiheissa hedelmöitymisestä syntymään asti. Sisältää alkion tai sikiön sekä sikiökalvot ja istukan.
Implantaatio: blastokystan kiinnittyminen kohdun epiteeliin, mukaan lukien tunkeutuminen epiteelin läpi ja kiinnittyminen endometriumiin.
Alkio: organismin varhais- tai kehitysvaihe, erityisesti munasolun hedelmöitymisen tuote pituusakselin ilmaantumisen jälkeen siihen saakka, kunnes keskeiset rakenteet ovat kehittyneet.
Alkioon kohdistuva myrkyllisyysvaikutus: alkion normaalia rakennetta, kehitystä, kasvua ja/tai elinkelpoisuutta haittaava vaikutus.
Sikiö: syntymätön organismi alkiokehityksen jälkeen.
Sikiöön kohdistuva myrkyllisyysvaikutus: sikiön normaalia rakennetta, kehitystä, kasvua ja/tai elinkelpoisuutta haittaava vaikutus.
Tiineyden keskeytyminen (abortoituminen): hedelmöitymisen tulosten (alkion tai elinkelvottoman sikiön) ennenaikainen poistuminen kohdusta.
Resorptio: implantaation jälkeen kuollut conceptus, joka resorboituu parhaillaan tai on jo resorboitunut.
Varhainen resorptio: todistettavasti tapahtunut implantaatio ilman tunnistettavaa alkiota tai sikiötä.
Myöhäinen resorptio: kuollut alkio tai sikiö, jossa näkyy ulkoisia degeneratiivisia muutoksia.
NOAEL: lyhennys määritelmälle ’no-observed-adverse-effect level’ (haitaton vaikutustaso). Korkein annos- tai altistustaso, jolla ei havaita mitään haitallisia käsittelyyn liittyviä vaikutuksia.
1.3 VERTAILUAINE
Ei käytössä.
1.4 TESTIMENETELMÄN PERIAATE
Testiainetta annetaan tiineille eläimille ainakin implantaation ja eläimen suunnitellun lopettamisen välisenä aikana. Lopettaminen on tehtävä mahdollisimman lähellä normaalia synnytyspäivää välttäen kuitenkin sitä, että menetettäisiin tutkimustietoja ennenaikaisen synnytyksen johdosta. Testimenetelmän tarkoitus ei ole tutkia yksinomaan organogeneesin eli elinten muodostumisen jaksoa (jyrsijöillä päivät 5–15, kaniinilla päivät 6–18), vaan myös soveltuvissa tapauksissa koko tiineyden aikaisia vaikutuksia alkaen ennen implantaatiota ja päättyen sektiota edeltävään päivään. Hiukan ennen sektiota naaraat lopetetaan, niiden kohdunsisältö tutkitaan ja sikiöistä tutkitaan ulkoiset näkyvät epämuodostumat sekä pehmytkudosten ja luuston muutokset.
1.5 TESTIMENETELMÄN KUVAUS
1.5.1 Eläinlajin valinta
Testissä suositellaan käytettäväksi parhaiten soveltuvaa eläinlajia sekä sellaisia laboratorioeläinlajeja ja -kantoja, joita käytetään yleisesti syntymää edeltävien myrkyllisyysvaikutusten tutkimuksessa. Jyrsijöistä suositeltava koe-eläin on rotta ja muista eläimistä kaniini. Muiden lajien käyttö on erikseen perusteltava.
1.5.2 Koe-eläintilat ja eläinten ruokinta
Koe-eläinhuoneen lämpötilan tulee olla jyrsijöillä 22 oC (+ 3o) ja kaniineilla 18 oC (+ 3o). Vaikka riittää, että suhteellinen kosteus on vähintään 30 % eikä mielellään ylitä 70 %:a muulloin kuin huoneen puhdistuksen aikana, pitäisi kuitenkin pyrkiä 50–60 %:n suhteelliseen kosteuteen. Huoneessa tulee käyttää keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa, 12 tuntia pimeää). Eläinten ruokinnassa voidaan käyttää normaalia laboratorioruokavaliota, eikä juomaveden määrää saa rajoittaa.
Pariutumisen tulee tapahtua tarkoitukseen sopivissa häkeissä. Pariutumisen jälkeen on suositeltavaa pitää kukin eläin omassa häkissään, mutta myös muutaman eläimen pitäminen samassa häkissä on hyväksyttävää.
1.5.3 Eläinten valmistelu
Testissä tulee käyttää terveitä eläimiä, jotka on totutettu laboratorio-olosuhteisiin vähintään viiden vuorokauden ajan ja joita ei ole aiemmin käytetty testeihin. Koe-eläinten laji, kanta, alkuperä, sukupuoli, paino ja/tai ikä on tunnettava. Eläinten tulee kaikissa testiryhmissä olla samanpainoisia ja -ikäisiä niin tarkasti kuin on käytännössä mahdollista. Kullakin annostasolla tulee käyttää nuoria täysikasvuisia naaraita, jotka eivät ole synnyttäneet. Naaraat tulee parittaa saman lajin ja kannan urosten kanssa, ja sisarusten pariutumista tulee välttää. Jyrsijöillä tiineyden alkupäivä (päivä 0) on se, jolloin vaginan tulpitus ja/tai sperma havaitaan; kaniineilla se on yleensä pariutumisen tai keinosiemennyksen päivä, mikäli keinosiemennystä käytetään. Häkit on sijoitettava siten, että häkin sijainnista johtuvat vaikutukset ovat mahdollisimman vähäisiä. Kullekin eläimelle annetaan oma tunnistenumero. Paritetut naaraat jaetaan satunnaisesti kontrolli- ja testiryhmään, ja jos naaraat on paritettu erissä, kunkin erän eläimet tulee jakaa tasaisesti molempiin ryhmiin. Samoin on meneteltävä saman uroksen hedelmöittämien naaraiden kohdalla.
1.6 TESTIN SUORITUS
1.6.1 Eläinten määrä ja sukupuoli
Kussakin testi- ja kontrolliryhmässä tulee olla niin paljon naaraita, että ruumiinavaukseen saadaan noin 20 eläintä, joilla implantaatio voidaan havaita. Ryhmät, joissa tällaisia eläimiä on vähemmän kuin 16, eivät mahdollisesti ole asianmukaisia. Emojen kuolleisuus ei välttämättä heikennä tutkimuksen validiteettia, mikäli kuolleisuus ei ylitä keskimäärin 10 %:a.
1.6.2 Annosten valmistelu
Jos annostelun helpottamiseksi käytetään kantaja-ainetta tai muuta lisäainetta, on syytä selvittää sen vaikutus testiaineen absorboitumiseen ja jakautumiseen, testiaineen metaboloitumiseen, elimistössä säilymiseen ja eritykseen. Lisäksi on selvitettävä sellaiset vaikutukset testiaineen kemiallisiin ominaisuuksiin, jotka saattavat muuttaa testiaineen myrkyllisyyttä, sekä vaikutukset koe-eläinten ravinnon ja juoman nauttimiseen tai ravitsemustilaan. Kantaja-aineella ei saa olla sikiönkehitykseen tai lisääntymiseen kohdistuvia myrkyllisyysvaikutuksia.
1.6.3 Annostasot
Normaalisti testiainetta annetaan päivittäin alkaen implantaatiosta (esim. päivä 5 pariutumisen jälkeen) suunniteltua sektiota edeltävään päivään asti. Jos aikaisemmat tutkimukset, mikäli sellaisia on tehty, eivät osoita merkittävää ennen implantaatiota tapahtuvan alkionmenetyksen mahdollisuutta, ainetta voidaan antaa koko tiineyden ajan parittelusta eläimen suunniteltua lopettamista edeltävään päivään. Eläimen virheellinen käsittely tai tiineyden aikainen stressi voivat johtaa sikiön menetykseen. Jotta sikiön menetys muista kuin testiin liittyvistä syistä estettäisiin, tiineiden eläinten tarpeetonta käsittelyä sekä ulkoisten tekijöiden kuten melun aiheuttamaa stressiä tulee välttää.
Testissä tulee käyttää vähintään kolmea annostasoa ja testin kanssa samaan aikaan tehtäviä kontrolleja. Terveet eläimet jaetaan satunnaisesti kontrolli- ja testiryhmään. Annostasojen välit määritetään siten, että toksiset vaikutukset saadaan porrastettua. Jos testiaineen fysikaalinen/kemiallinen olomuoto tai biologiset ominaisuudet eivät aseta rajoituksia, suurin annos määritetään sellaiseksi, että se on jonkin verran myrkyllinen kehittyvälle sikiölle ja/tai emolle (kliinisiä löydöksiä tai ruumiinpainon väheneminen), mutta ei aiheuta kuolemaa tai kovia tuskia. Ainakin yksi suurimman ja pienimmän välillä oleva annostaso asetetaan sellaiseksi, että se aiheuttaa erittäin pienen havaittavan myrkyllisyysvaikutuksen. Pienin annos asetetaan sellaiseksi, että sillä ei ole mitään myrkyllisyysvaikutuksia kehittyvään sikiöön tai emoon. Annostasot on porrastettava siten, että tutkimuksessa saadaan esiin mahdolliset annostasoihin liittyvät reaktiot sekä haitaton altistustaso (NOAEL). Kaksinkertaiset–nelinkertaiset erot annostasojen välillä ovat usein parhaimmat alenevissa annossarjoissa, ja usein on parempi lisätä neljäs testiryhmä kuin käyttää hyvin suuria annosvälejä (esimerkiksi yli 10-kertaisia annosvälejä). Vaikka tavoitteena onkin määrittää emon haitaton altistustaso, hyväksyttäviä voivat olla myös tutkimukset, joissa tällaista tasoa ei määritetä (1).
Annostasojen valinnassa tulee ottaa huomioon aikaisemmat myrkyllisyystiedot sekä tiedot testiaineen tai muiden sen kanssa samantyyppisten materiaalien metaboloitumisesta elimistössä samoin kuin niiden toksikokineettisistä ominaisuuksista. Nämä tiedot auttavat myös osoittamaan, että annostasot on valittu oikein.
Testissä on käytettävä samanaikaista kontrolliryhmää. Sen tulee olla joko plaseboa saava kontrolliryhmä tai kantaja-ainetta saava kontrolliryhmä, mikäli testiaineen antamisen yhteydessä käytetään kantaja-ainetta. Kaikille ryhmille annetaan tilavuudeltaan sama määrä joko testi- tai kantaja-ainetta. Kontrolliryhmän tai -ryhmien eläimiä tulee käsitellä samalla tavoin kuin testiryhmän eläimiä. Kantaja-aineen kontrolliryhmille tulee antaa suurin käytetty määrä kantaja-ainetta (kuten alimmassa testiryhmässä).
1.6.4 Raja-annostesti
Jos jokin testin annostaso, joka on vähintään 1 000 mg/kg (eläimen painokilo)/vrk ja joka annetaan suun kautta tässä testimenetelmässä kuvattujen menettelyjen mukaisesti, ei aiheuta lainkaan havaittavaa myrkyllisyysvaikututusta tiineissä eläimissä tai niiden jälkeläisissä ja jos myrkyllisyysvaikutusta ei aikaisempien tutkimustulosten perusteella ole odotettavissa (esimerkiksi rakenteellisesti ja/tai metabolisesti samantyyppiset yhdisteet), täydellinen kolmea annostasoa käyttävä testi ei välttämättä ole tarpeen. Jos odotettavissa on ihmisten altistuminen aineelle, voi olla tarpeen käyttää raja-annostestissä suurempaa annostasoa, kun aine annetaan suun kautta. Muita antotapoja kuten inhalaatiota tai ihoapplikaatiota käytettäessä testiaineen fysikokemialliset ominaisuudet saattavat usein osoittaa altistuksen enimmäistason (esimerkiksi ihoapplikaatio ei saa aiheuttaa vakavaa paikallista myrkyllisyysvaikutusta).
1.6.5 Antotapa
Testiaine tai kantaja-aine annetaan yleensä suun kautta letkulla. Jos käytetään muuta antotapaa, testin tekijän on perusteltava sen käyttö ja muutettava muita kohtia vastaavasti (2) (3) (4). Testiaine annetaan päivittäin suunnilleen samaan aikaan.
Kunkin eläinyksilön annoksen tulee yleensä perustua viimeiseen eläimen ruumiin painon määritykseen. Annoskoon määrittämisessä on kuitenkin oltava erityisen huolellinen viimeisen tiineyskolmanneksen aikana. Aikaisempien tutkimustietojen perusteella on valittava sellainen annoskoko, joka ei aiheuta liikaa myrkyllisyysvaikutuksia emolle. Jos kuitenkin havaitaan liian suuria myrkyllisyysvaikutuksia testiainetta saaneissa emoissa, nämä eläimet on lopetettava inhimillisellä tavalla. Jos useissa tiineissä eläimissä havaitaan liian suuren myrkyllisyysvaikutuksen merkkejä, on syytä harkita koko kyseisen annostasoryhmän lopettamista. Letkuruokinnassa aine on annettava eläimelle yhtenä annoksena mahaletkun tai sopivan intubaatiokanyylin kautta. Suurin kerralla annettava nestemäärä määräytyy koe-eläimen koon mukaan. Nestemäärän tilavuus ei saa ylittää 1 ml/100 g painoa. Poikkeuksen muodostavat vesiliuokset, joita käytettäessä tilavuus voi olla 2 ml/100 g painoa. Kun kantaja-aineena on maissiöljy, tilavuus ei saa olla suurempi kuin 0,4 ml/100 g painoa. Testiaineen nestemäärän tilavuusvaihtelu tulee minimoida pitoisuutta muuttamalla, jotta kaikilla annostasoilla voidaan käyttää tilavuudeltaan samaa nestemäärää.
1.6.6 Emojen havainnointi
Kliinisiä havaintoja tulee tehdä ja kirjata ainakin kerran päivässä, mieluiten samaan aikaan joka päivä ottaen huomioon se, milloin annoksen antamisen jälkeen odotetut vaikutukset ovat suurimmillaan. Eläinten kliinisestä tilasta kirjataan kuolleisuus, kuoleman lähestyminen, testiin liittyvät käytösmuutokset ja kaikki ilmeisten myrkyllisyysvaikutusten merkit.
1.6.7 Eläimen paino ja ravinnon nauttiminen
Eläimet punnitaan tiineyden päivänä 0 (tai viimeistään päivänä 3, jos käytetään ulkopuolisen kasvattajan toimittamia aikaparitettuja eläimiä), ensimmäisen annoksen antopäivänä, vähintään joka kolmas päivä annosten antamisjaksolla sekä eläinten suunniteltuna lopettamispäivänä.
Ravinnonotto kirjataan kolmen päivän välein ruumiinpainon määrityspäivinä.
1.6.8 Post mortem -tutkimus
Naaraat lopetetaan päivää ennen odotettua synnytyspäivää. Naaraat, joissa havaitaan tiineyden keskeytymisen tai ennenaikaisen synnytyksen merkkejä ennen suunniteltua lopetuspäivää, on lopetettava, ja niille on tehtävä perusteellinen makroskooppinen tutkimus.
Kun naaras lopetetaan tai kun se kuolee testin aikana, siitä on makroskooppisesti tutkittava mahdolliset rakenteelliset epämuodostumat tai patologiset muutokset. Systemaattisen virheen minimoimiseksi naaraiden arviointi sektion aikana ja sitä seuraavat sikiöanalyysit tulisi tehdä tietämättä, mihin ryhmään kyseinen naaras kuuluu.
1.6.9 Kohdunsisällön tutkiminen
Välittömästi eläimen lopettamisen jälkeen tai mahdollisimman pian kuoleman jälkeen kohtu poistetaan ja tiineys varmistetaan. Kohdut, joissa ei ole näkyviä tiineyden merkkejä, on tutkittava tarkemmin (jyrsijät esimerkiksi ammoniumsulfidivärjäyksellä ja kaniinit Salewski-värjäyksellä tai vastaavalla menetelmällä) asian varmistamiseksi (5).
Tiineiden eläinten kohdut punnitaan, mukaan lukien kohdunkaula. Jos eläimet ovat kuolleet testin aikana, kohtuja ei punnita.
Tiineiden eläinten keltarauhasten määrä määritetään.
Kuolleiden alkioiden tai sikiöiden määrä sekä elinkelpoisten sikiöiden määrä määritetään kohdunsisältöä tutkimalla. Resorptioaste kuvataan, jotta voidaan arvioida conceptuksen suhteellinen kuolinaika (katso kohta 1.2).
1.6.10 Sikiöiden tutkiminen
Kunkin sikiön sukupuoli ja ruumiinpaino määritetään.
Kustakin sikiöstä tutkitaan ulkoiset muutokset (6).
Sikiöistä tutkitaan luuston ja pehmytkudosten muutokset (esimerkiksi vaihtelut ja epämuodostumat) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24). Sikiömuutosten luokittelu on suositeltavaa, mutta ei pakollista. Jos luokitus tehdään, on kunkin luokan määrityskriteerit esitettävä selvästi. Erityistä huomiota on kiinnitettävä lisääntymiselimiin, joista tutkitaan poikkeavan kehityksen merkit.
Kustakin jyrsijäpoikueesta noin puolet preparoidaan luustomuutosten tutkimista varten ja tutkitaan. Toinen puoli preparoidaan pehmytkudosmuutosten tutkimista varten ja tutkitaan käyttäen hyväksyttyjä tai soveltuvia mikrotomiamenetelmiä tai huolellista dissektiomenetelmää.
Muiden eläinten kuin jyrsijöiden, esimerkiksi kaniinien, poikueista tutkitaan kaikilta sikiöiltä sekä pehmytkudos- että luustomuutokset. Näiden sikiöiden ruumiista tutkitaan pehmytkudosmuutokset huolellisen dissektion avulla. Tähän voi liittyä jatkotoimia sydämen sisäisten rakenteiden (25) arvioimiseksi. Puolelta näin tutkituista sikiöistä irrotetaan päät, joiden pehmytkudosmuutokset (muun muassa silmät, aivot, nenäontelot ja kieli) tutkitaan käyttäen tavanomaisia sarjaleikemenetelmiä (26) tai muita yhtä herkkiä menetelmiä. Näiden sikiöiden vartalo-osat sekä muut sikiöt, joita ei ole tutkittu, preparoidaan luustomuutosten tutkimista varten ja tutkitaan samoilla menetelmillä kuin jyrsijät.
2. MÄÄRITYSTULOKSET
2.1 TULOSTEN KÄSITTELY
Tiedot raportoidaan erikseen kustakin emosta ja sen jälkeläisistä ja esitetään taulukossa, jossa on eritelty testiryhmittäin eläinten määrä testin alussa, testin aikana kuolleiden tai inhimillisistä syistä lopetettujen eläinten määrä, kuoleman tai lopettamisen aika, tiineiden naaraiden määrä, niiden eläinten määrä, joissa myrkyllisyysvaikutuksia on havaittavissa, kuvaus havaituista myrkyllisyysvaikutuksista mukaan lukien myrkytysoireiden alkamisaika, kesto ja vakavuus, alkiosta tai sikiöstä tehtyjen havaintojen laji sekä kaikki asiaankuuluvat tiedot poikueesta.
Numeeriset tulokset arvioidaan sopivalla tilastollisella menetelmällä käyttäen poikuetta analyysin yksikkönä. Tilastollisen menetelmän on oltava yleisesti hyväksytty, se on valittava tutkimusta suunniteltaessa ja sen valinta on perusteltava. Myös sellaisten eläinten tiedot, jotka kuolevat ennen niiden suunniteltua lopettamista, on raportoitava. Nämä tiedot voidaan sisällyttää ryhmäkeskiarvoihin, mikäli se on perusteltua. Tällaisista eläimistä saatujen tietojen relevanssi ja niin muodoin näiden tietojen sisällyttäminen ryhmäkeskiarvoihin tai jättäminen niistä pois tulee perustella ja arvioida tapauskohtaisesti.
2.2 TULOSTEN ARVIOINTI
Syntymää edeltävien kehitysmyrkyllisyysvaikutusten testin löydökset arvioidaan tarkastelemalla havaittuja vaikutuksia. Arviointiin tulee sisältyä seuraavat tiedot:
|
— |
emon ja alkion/sikiön testitulokset sekä eläinten testiainealtistuksen ja toisaalta kaikkien löydösten esiintyvyyden ja vakavuuden välisen mahdollisen suhteen arvioiminen |
|
— |
sikiön ulkoisten muutosten sekä pehmytkudos- ja luustomuutosten luokittelussa käytetyt kriteerit, jos luokittelua on käytetty |
|
— |
soveltuvissa tapauksissa historiallinen kontrolliaineisto, joka tehostaa tutkimustulosten tulkintaa |
|
— |
kaikkien prosenttiosuuksien tai indeksien laskennassa käytetyt luvut |
|
— |
soveltuvissa tapauksissa tutkimustulosten asianmukainen tilastollinen analyysi, joka sisältää analyysimenetelmästä sellaiset tiedot, että riippumaton arvioija/tilastoasiantuntija voi niiden avulla arvioida ja rekonstruoida analyysin. |
Jos kehitykseen kohdistuvia myrkyllisyysvaikutuksia ei voida osoittaa, on syytä harkita jatkoselvitystä, jossa määritetään absorptio ja testiaineen hyötyosuus.
2.3 TULOSTEN TULKINTA
Syntymää edeltävien myrkyllisyysvaikutusten tutkimuksen tulee antaa tietoja toistuvan tiineydenaikaisen testiainealtistuksen vaikutuksista emoihin sekä niiden jälkeläisten kohdunsisäiseen kehitykseen. Tutkimuksen tulokset on tulkittava yhdessä subkroonisten, lisääntymisfysiologisten, toksikokineettisten ja muiden tutkimusten kanssa. Koska tutkimuksessa painotetaan sekä yleisiä myrkyllisyysvaikutuksia (emoon kohdistuvat vaikutukset) että sikiön kehitykseen vaikuttavien myrkyllisyysvaikutusten loppupisteitä, tutkimustulosten perusteella voidaan jossain määrin erotella toisaalta ne sikiön kehitykseen kohdistuvat vaikutukset, jotka esiintyvät yleisten myrkyllisyysvaikutusten puuttuessa, sekä toisaalta ne vaikutukset, jotka esiintyvät vain sellaisilla annostasoilla, jotka ovat myrkyllisiä myös emolle (27).
3. TULOSTEN ILMOITTAMINEN
3.1 TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot:
|
|
Testiaine:
|
|
|
Kantaja-aine (tarvittaessa)
|
|
|
Koe-eläinlajit
|
|
|
Testiolosuhteet:
|
|
|
Tulokset: |
|
|
Ainakin seuraavat tiedot emon vasteesta myrkylliseen aineeseen:
|
|
|
Kehitykseen liittyvät loppupisteet annostasoittain poikueille, joissa on implantaatioita, mukaan lukien seuraavat tiedot:
|
|
|
Kehitykseen liittyvät loppupisteet annostasoittain poikueille, joissa on eläviä sikiöitä, mukaan lukien seuraavat tiedot:
|
|
|
Tulosten pohdinta. |
|
|
Johtopäätökset. |
4. LÄHDELUETTELO
|
(1) |
Kavlock R.J. et al. (1996) A Simulation Study of the Influence of Study Design on the Estimation of Benchmark Doses for Developmental Toxicity. Risk Analysis 16; 399–410. |
|
(2) |
Kimmel, C.A. and Francis, E.Z. (1990) Proceedings of the Workshop on the Acceptability and Interpretation of Dermal Developmental Toxicity Studies. Fundamental and Applied Toxicologv 14; 386–398. |
|
(3) |
Wong, B.A., et al. (1997) Developing Specialized Inhalation Exposure Systems to Address Toxicological Problems. CIIT Activities 17; 1–8. |
|
(4) |
US Environmental Protection Agency (1985) Subpart E-Specific Organ/Tissue Toxicity, 40 CFR 798.4350: Inhalation Developmental Toxicity Study. |
|
(5) |
Salewski, E. (1964) Faerbermethode zum Makroskopischen Nachweis von Implantations Stellen am Uterus der Ratte. Naunyn-Schmeidebergs Archiv für Pharmakologie und Experimentelle Pathologie 247:367. |
|
(6) |
Edwards, J.A. (1968) The external Development of the Rabbit and Rat Embryo. In Advances in Teratology. D.H.M. Woolam (ed.) Vol. 3. Academic Press, NY. |
|
(7) |
Inouye, M. (1976) Differential Staining of Cartilage and Bone in Fetal Mouse Skeleton by Alcian Blue and Alizarin Red S. Congenital Anomalies 16; 171–173. |
|
(8) |
Igarashi, E. et al. (1992) Frequency Of Spontaneous Axial Skeletal Variations Detected by the Double Staining Techniquefor Ossified and Cartilaginous Skeleton in Rat Foetuses. Congenital Anomalies 32; :381–391. |
|
(9) |
Kimmel, C.A. et al. (1993) Skeletal Development Following Heat Exposure in the Rat. Teratology 47:229–242. |
|
(10) |
Marr, M.C. et al. (1988) Comparison of Single and Double Staining for Evaluation of Skeletal Development: The Effects of Ethylene Glycol (EG) in CD Rats. Teratology 37; 476. |
|
(11) |
Barrow, M.V. and Taylor, W.J. (1969) A Rapid Method for Detecting Malformations in Rat Foetuses. Journal of Morphology 127:291–306. |
|
(12) |
Fritz, H. (1974) Prenatal Ossification in Rabbits ss Indicative of Foetal Maturity. Teratology 11; 313–320. |
|
(13) |
Gibson, J.P. et al. (1966) Use of the Rabbit in Teratogenicity Studies. Toxicology and Applied Pharmacology 9; :398–408. |
|
(14) |
Kimmel, C.A. and Wilson, J.G. (1973) Skeletal Deviation in Rats: Malformations or Variations? Teratology 8; 309–316. |
|
(15) |
Marr, M.C. et al. (1992) Developmental Stages of the CD (Sprague-Dawley) Rat Skeleton after Maternal Exposure to Ethylene Glycol. Teratology 46; 169–181. |
|
(16) |
Monie, I.W. et al. (1965) Dissection Procedures for Rat Foetuses Permitting Alizarin Red Staining of Skeleton and Histological Study of Viscera. Supplement to Teratology Workshop Manual, pp. 163–173. |
|
(17) |
Spark, C. and Dawson, A.B. (1928) The Order and Time of appearance of Centers of Ossification in the Fore and Hind Limbs of the Albino Rat, with Special Reference to the Possible Influence of the Sex Factor. American Journal of Anatomy 41; 411–445. |
|
(18) |
Staples, R.E. and Schnell, V.L. (1964) Refinements in Rapid Clearing Technique in the KOH-Alizarin Red S Method for Fetal Bone. Stain Technology 39; 61–63. |
|
(19) |
Strong, R.M. (1928) The Order Time and Rate of Ossification of the Albino Rat (Mus Norvegicus Albinus) Skeleton. American Journal of Anatomy 36; 313–355. |
|
(20) |
Stuckhardt, J.L. and Poppe, S.M. (1984) Fresh Visceral Examination of Rat and Rabbit Foetuses Used in Teratogenicity Testing. Teratogenesis, Carcinogenesis, and Mutagenesis 4; 181–188. |
|
(21) |
Walker, D.G. and Wirtschafter, Z.T. (1957) The Genesis of the Rat Skeleton. Thomas, Springfield, IL. |
|
(22) |
Wilson, J.G. (1965) Embryological Considerations in Teratology. In Teratology: Principles and Techniques, Wilson J.G. and Warkany J. (eds). University of Chicago, Chicago, IL, pp 251–277. |
|
(23) |
Wilson, J.G. and Fraser, F.C. (eds). (1977) Handbook of Teratology, Vol. 4. Plenum, NY. |
|
(24) |
Varnagy, L. (1980) Use of Recent Fetal Bone Staining Techniques in the Evaluation of Pesticide Teratogenicity. Acta Vet. Acad. Sci. Hung. 28; 233–239. |
|
(25) |
Staples, R.E. (1974) Detection of visceral Alterations in Mammalian Foetuses. Teratology 9; 37–38. |
|
(26) |
Van Julsingha, E.B. and C.G. Bennett (1977) A Dissecting Procedure for the Detection of Anomalies in the Rabbit Foetal Head. In: Methods in Prenatal Toxicology Neubert, D., Merker, H.J. and Kwasigroch, T.E. (eds.). University of Chicago, Chicago, IL, pp. 126–144. |
|
(27) |
US Environmental Protection Agency (1991) Guidelines for Developmental Toxicity Risk Assessment. Federal Register 56; 63798–63826. |
|
(28) |
Wise, D.L. et al. (1997) Terminology of Developmental Abnormalities in Common Laboratory Mammals (Version 1) Teratology 55; 249–292. |
B.32. KARSINOGEENISUUSTESTL
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Testattavaa ainetta annetaan valittua antotapaa käyttäen yleensä viikon jokaisena päivänä useille koe-eläinryhmille suurimman osan niiden elinajasta siten, että kukin ryhmä saa eri suuruisen annoksen. Antoaikana ja sen päätyttyä eläimiä tarkkaillaan päivittäin myrkkyvaikutusten ja erityisesti kasvainten kehittymisen toteamiseksi.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Eläimet siirretään koetiloihin ja testin aikana annettava ruokinta aloitetaan vähintään viisi päivää ennen testin alkua. Nuoret, terveet eläimet jaetaan satunnaisesti koe- ja kontrolliryhmiin.
Laji (jyrsijä tai muu laji) valitaan aikaisempien tutkimusten perusteella. Koe-eläimiksi valitaan yleisesti käytettyä laboratoriokantaa olevia nuoria terveitä eläimiä ja annostelu aloitetaan vieroituksen jälkeen niin pian kuin mahdollista.
Testin alkaessa eläinten paino saa vaihdella korkeintaan ± 20 % keskiarvosta. Mikäli subkrooninen testi suun kautta annosteltuna on tehty pitkäaikaistutkimuksen esitestinä, samaa lajia/kantaa on käytettävä kummassakin tutkimuksessa.
Kun tutkimuksessa käytetään jyrsijöitä, kutakin annostasoa ja kontrolliryhmää varten tarvitaan vähintään 100 eläintä (50 naarasta ja 50 urosta). Naaraiden on oltava synnyttämättömiä, eivätkä ne saa olla tiineenä. Mikäli tutkimussuunnitelma edellyttää eläinten lopettamista tutkimuksen kuluessa, eläinmäärään on lisättävä lopettaviksi aiottujen eläinten määrä.
Testissä käytetään vähintään kolmea annostasoa ja kontrolliryhmää. Suurimman annoksen olisi aiheutettava vähäisiä myrkytysoireita, kuten lievää painon nousun hidastumista (alle 10 %), eikä sen tuloksena saisi olla huomattavia muutoksia normaaliin elinikään kasvainten aiheuttamia vaikutuksia lukuun ottamalta.
Pienin annos ei saisi vaikuttaa eläimen normaaliin kasvuun, kehitykseen ja elinikään eikä aiheuttaa mitään myrkyllisyysoireita. Pienimmän annoksen on yleensä oltava vähintään 10 % suurimmasta annoksesta.
Väliannostaso (tasot) on porrastettava ylimmän ja alimman annoksen keskiväliin.
Annostasojen valinnassa on otettava huomioon aikaisemmista myrkyllisyystesteistä ja -tutkimuksista saadut tulokset.
Eläimet altistetaan tavallisesti päivittäin.
Mikäli kemikaalia annostellaan juomaveteen tai ravintoon sekoitettuna, niitä on oltava jatkuvasti saatavilla.
Tutkimuksessa on käytettävä kontrolliryhmää, joka on aivan samanlainen kuin tutkimusryhmät, paitsi että sille ei anneta tutkittavaa ainetta.
Erityistapauksissa, esimerkiksi aerosoleihin liittyvissä inhalaatiotutkimuksissa, tai kun suun kautta annosteltavaa ainetta tutkittaessa käytetään emulgaattoria, jonka biologiset ominaisuudet eivät ole tiedossa, tutkimukseen tulee liittää vielä yksi kontrolliryhmä, jolle ei anneta liuotinta.
Kolme pääasiallisesti käytettyä annostelutapaa ovat altistus suun kautta, ihon kautta ja hengitysteiden kautta. Valinta tehdään testattavan aineen fysikaalisten ja kemiallisten ominaisuuksien sekä ihmisten todennäköisen altistumistavan mukaan.
1.6.5.1 Tutkimukset, joissa annostelu tapahtuu suun kautta
Kun testattava aine imeytyy ruoansulatuskanavasta sen ollessa myös ihmisten todennäköinen altistumistapa, suun kautta annostelu on paras tapa, ellei kontraindikaatioita ole. Testattavaa ainetta voidaan antaa eläimille ravinnon yhteydessä, juomaveteen liuotettuna tai kapseleina.
Eläimille olisi annettava testattavaa ainetta viikon jokaisena päivänä, koska annostus viitenä päivänä viikossa voi aiheuttaa myrkyllisyysoireiden häviämisen tai niistä toipumisen sen ajan kuluessa, jolloin ainetta ei anneta, ja näin vaikuttaa tuloksiin ja niiden tulkintaan, Lähinnä käytännön syistä annostelu viitenä päivänä viikossa voidaan kuitenkin hyväksyä.
1.6.5.2 Tutkimukset, joissa altistus tapahtuu ihon kautta
Altistusmenetelmäksi voidaan valita ihon altistus, joko sen vuoksi, että se simuloi ihmisten pääasiallista altistumistapaa tai esimerkkimenetelmäksi ihovaurioiden tuottamisesta.
1.6.5.3 Tutkimukset, joissa altistus tapahtuu hengitysteiden kautta
Koska altistus hengitysteiden kautta on teknisesti paljon ongelmallisempi kuin muut altistustavat, seuraavassa selostetaan tarkemmin tätä menetelmää. On myös huomattava, että aineen tiputus henkitorveen voi joissakin tapauksissa olla hyväksyttävä vaihtoehto.
Pitkäaikaisaltistukset suunnitellaan yleensä ihmisten todennäköisen altistumistavan perusteella. Eläimet altistetaan hengityskammion tasapainotuksen jälkeen joko kuudeksi tunniksi päivittäin viitenä päivänä viikossa (jaksoittainen altistus) tai todennäköisen ympäristöaltistustavan perusteella 22–24 tuntia vuorokaudessa viikon jokaisena päivänä (jatkuva altistus), jolloin eläimillä on noin tunnin mittainen ruokailuaika samaan aikaan joka päivä. Kummassakaan tapauksessa eläimien saaman testattavan aineen pitoisuutta ei yleensä muuteta. Jaksoittaisen ja jatkuvan altistuksen pääasiallinen erona on, että jaksoittaisessa altistuksessa eläimillä on 17–18 tuntia aikaa toipua päivittäisestä altistuksesta ja viikonloppuisin vielä tätäkin pidempi toipumisaika.
Jaksoittaisen tai jatkuvan altistuksen valinta riippuu tutkimuksen tavoitteista ja siitä, mitä ihmisten altistumistapaa simuloidaan. Tietyt tekniset vaikeudet on joka tapauksessa otettava huomioon. Esimerkiksi eläinten syöttäminen ja juottaminen altistuksen aikana ja monimutkaisemmat (ja luotettavammat) laitteet aerosolien ja höyryn tuottamiseksi sekä niiden valvonta voivat aiheuttaa ongelmia, jotka ovat merkittävämpiä kuin ympäristöolosuhteiden simuloimiseksi valitun jatkuvan altistuksen edut.
Eläinten testauksiin käytetään inhalaatiokammioita, joiden dynaamisessa ilmavirrassa ilma vaihtuu vähintään 12 kertaa tunnissa, jotta hapen ja tasaisesti jakautuneen altistusaineen saanti voidaan varmistaa. Testattavalle aineelle tapahtuvaa altistusta lukuun ottamatta kontrolli- ja altistuskammioiden on oltava rakenteeltaan yhdenmukaisia. Kammiossa on yleensä lievä negatiivinen paine, jotta testattavaa ainetta ei pääsisi vuotamaan ympäristöön. Kammioissa on oltava riittävästi tilaa eläimille. Yleissääntönä kammion ilman pitämiseksi vakaana on, että koe-eläinten viemä tila on korkeintaan 5 % kammion tilavuudesta.
Seuraavat mittaukset tai valvontatoimenpiteet on suoritettava:
|
i) |
Ilman virtaus: ilman virtausnopeutta kammion läpi tulee tarkkailla jatkuvasti; |
|
ii) |
Pitoisuus: päivittäisen altistuksen aikana pitoisuuden vaihtelun saa olla korkeintaan ± 15 % keskiarvosta. Tutkimuksen koko kestoajan päivittäiset pitoisuudet on pidettävä mahdollisimman vakaana; |
|
iii) |
Lämpötila ja kosteus: kun jyrsijöitä käytetään koe-eläiminä, lämpötilan on oltava 22 ± 2 oC ja kammion kosteuden 30–70 %, paitsi milloin testattavaa ainetta suspensoidaan veden avulla kammion ilmaan. Molempia arvoja on jatkuvasti tarkkailtava; |
|
iv) |
Hiukkasten koon mittaukset: kun testataan nestemäisiä tai kiinteitä aerosoleja, kammion ilmassa olevien hiukkasten koko on määritettävä. Aerosolihiukkasten on oltava kooltaan koe-eläinten hengitykselle sopivia. Näytteet kammion ilmasta on otettava eläinten hengitysalueelta. Otoksen on oltava edustava näyte testattavan aineen hiukkasten jakautumisesta ja gravimetrisesti myös kaikista aerosolin suspensiohiukkasista, vaikka suuri osa aerosolista ei joudu hengitykseen. Hiukkasten koosta on tehtävä analyysi useita kertoja niiden tuottoa säädettäessä ja sen jälkeen koe-eläinten altistuksen aikana niin usein kuin tarvitaan hiukkasten jakautumisen vakaana pysymisen varmistamiseksi. |
Karsinogeenisuustesti kattaa suurimman osan koe-eläinten normaalista elinajasta. Koe päättyy hiiriä ja hamstereita testattaessa 18 kuukauden kuluttua ja rottia testattaessa 24 kuukauden kuluttua, mutta jos testattavat eläinkannat ovat pitkäikäisempiä ja/tai niille kehittyy hitaasti spontaaneja kasvaimia, koe on lopetettava 24 kuukauden kuluttua hiiri- ja hamsteritesteissä ja 30 kuukauden kuluttua rotan ollessa koe-eläimenä. Vaihtoehtoisesti näin pitkäaikaisen tutkimuksen lopettaminen on mahdollista silloin, kun pienimmän annoksen saaneessa ryhmässä tai kontrolliryhmässä on elossa enää 25 %. Sellaisen tutkimuksen päättyessä, jossa eri sukupuolien vasteessa on selkeä ero, kumpikin sukupuoli on arvioitava erikseen. Kun ainoastaan suurimman annoksen saanut ryhmä kuolee ennenaikaisesti selkeisiin myrkkyvaikutuksiin, tämän ei tarvitse merkitä tutkimuksen lopettamista, jos myrkyllisyysoireet eivät aiheuta vaikeuksia muissa ryhmissä. Negatiivinen tulos on hyväksyttävä, jos tutkimuksesta on menetetty korkeintaan 10 % jostakin ryhmästä autolyysin, kannibalismin tai hoito-ongelmien ja vähintään 50 % kaikkien ryhmien eläimistä on elossa 18 kuukauden kuluttua käytettäessä hiiriä tai hamstereita ja 24 kuukauden kuluttua, kun koe-eläiminä käytetään rottia.
Testin suorittaminen
Eläinten päivittäisessä tarkkailussa on kiinnitettävä huomiota muutoksiin, joita tapahtuu karvapeitteessä ja ihossa, silmissä ja limakalvoissa sekä hengitys- ja verenkiertoelimissä, autonomisessa ja keskushermostossa, somatomotorisissa toiminnoissa sekä käyttäytymistavassa.
Säännöllinen tarkkailu on tarpeen, jotta eläimiä ei menetettäisi kannibalismin, kudosten autolyysin tai hoitovirheiden vuoksi. Huonokuntoiset eläimet poistetaan ja niille suoritetaan ruumiinavaus.
Kunkin eläimen osalta kirjataan kliiniset oireet sekä kuolleisuus. Kasvainten kehittymiseen on kiinnitettävä erityistä huomiota. Jokaisen paljain silmin tai käsin tunnustelemalla havaittavissa olevan kasvaimen toteamisaika, paikka, koko, ulkonäkö ja kehitys kirjataan.
Ravinnon kulutus (ja veden kulutus, kun testattava aine annetaan juomavedessä) mitataan viikoittain 13 ensimmäisen viikon aikana ja sen jälkeen noin kolmen kuukauden välein, elleivät eläinten terveydentila tai painon muutokset edellytä useampia määrityksiä.
Kunkin eläimen paino kirjataan kerran viikossa tutkimusajan 13 ensimmäisen viikon aikana ja sen jälkeen vähintään kerran neljässä viikossa.
Kliiniset tutkimukset
Jos eläinten terveydentilan todetaan huonontuneen tutkimuksen kuluessa, näiden eläinten verenkuva on tutkittava.
Koe-eläimistä otetaan verinäyte 12 ja 18 kuukauden kuluttua ja ennen eläinten lopettamista. Suurimman annoksen saaneen ryhmän ja kontrolliryhmän eläinten verenkuva tutkitaan. Pienempiä annoksia saaneiden ryhmien osalta verenkuva tutkitaan, jos suurimman annoksen ryhmästä erityisesti juuri ennen eläinten lopetusta otetuista näytteistä saadut tulokset tai patologiset löydökset edellyttävät sen tutkimista.
Kaikille, myös tutkimuksen kuluessa kuolleille tai huonokuntoisuuden vuoksi lopetetuille koe-eläimille suoritetaan ruumiinavaus. Kaikki paljain silmin havaittavat kasvaimet, vammoja tai kasvaimeksi epäiltyjä vaurioita sisältävät kohteet säilytetään.
Seuraavat elimet ja kudokset on säilytettävä histopatologista tutkimusta varten: aivot, (sekä osia ytimestä/aivosillasta, pikkuaivokuori ja aivokuori), aivolisäke, kilpirauhanen/lisäkilpirauhanen, kateenkorvakudosta, henkitorvi ja keuhkot, sydän, aortta, sylkirauhaset, maksa, perna, munuaiset, lisämunuaiset, haima, sukupuolirauhaset, kohtu, muut sukupuolielimet, iho, ruokatorvi, mahalaukku, pohjukaissuoli, ohutsuoli, umpisuoli, paksusuoli, peräsuoli, virtsarakko, tyypillinen imusolmuke, naaraan rintarauhanen, reiden lihaksistoa, ääreishermo, rintalasta luuytimineen, reisiluu (nivelineen), selkärankaa kolmesta kohdasta (kaulasta, henkitorven keskiosasta ja lantiosta) sekä silmät.
Keuhkojen ja virtsarakon täyttäminen fiksatiivilla on näiden elinten paras säilytystapa. Keuhkojen täyttäminen hengitystietutkimuksissa on välttämätöntä, jotta tarvittava histopatologinen tutkimus voidaan suorittaa. Kun altistumista tutkitaan hengitysteiden kautta, koko hengityselimistö mukaan lukien nenä, nielu ja kurkunpää, on säilytettävä.
|
a) |
Tutkimuksen aikana kuolleiden ja lopetettujen eläinten sekä suurimman annoksen saaneen ryhmän ja kontrolliryhmän eläinten elimille ja kudoksille on tehtävä täydellinen histopatologinen tutkimus. |
|
b) |
Kaikki paljain silmin havaittavat kasvaimet tai kasvaimiksi epäillyt vauriot on tutkittava mikroskooppisesti kaikkien ryhmien osalta. |
|
c) |
Jos suurimman annoksen saaneessa ryhmässä ja kontrolliryhmässä esiintyvien uudismuodostumien määrä poikkeaa huomattavasti toisistaan, muiden ryhmien vastaaville elimille tai kudoksille on suoritettava histopatologinen tutkimus. |
|
d) |
Jos suurimman annoksen saaneessa ryhmässä eloonjääneiden osuus on huomattavasti kontrolliryhmää pienempi, seuraavaksi alempi ryhmä on tutkittava perusteellisesti. |
|
e) |
Jos testi osoittaa, että suurimman annoksen saaneessa ryhmässä on syntynyt uudiskasvainvasteeseen vaikuttavia myrkky- tai muita vaikutuksia, lähinnä alempi annostaso on tutkittava perusteellisesti. |
2. TULOKSET
Tulokset esitetään taulukkomuodossa, josta ilmenevät kuhunkin testiryhmään kuuluvien eläinten lukumäärä kokeen alussa, kasvaimia kehittäneiden eläinten määrä, kasvaimien toteamisajankohta ja eläinten lukumäärä, joilla todettiin kasvaimia niiden lopettamisen jälkeen. Tulosten merkitsevyys arvioidaan jotakin tilastollista menetelmää käyttäen. Kaikkia tunnettuja tilastointimenetelmiä voidaan käyttää.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
eläinlaji, kanta, hankintapaikka, ympäristöolosuhteet, ruokavalio, |
|
— |
koeolosuhteet: Altistamislaitteen kuvaus: merkki, tyyppi, mitat, ilmanlähde, hiukkasten ja aerosolien tuottamistapa, ilmastointitapa, poistoilman käsittelytapa ja eläinten sijainti koekammiossa altistamisen aikana. Lämpötilan, kosteuden, hiukkasten koon ja aerosolin pitoisuuden mittaustapa on mainittava. Altistamistiedot: Altistamistiedot laaditaan taulukon muotoon, jossa esitetään keskiarvo ja poikkeamat (esim. keskihajonta) ja seuraavat tiedot:
|
|
— |
annostasot (mukaan lukien liuotin, mikäli sitä on käytetty), |
|
— |
selostus kasvainten esiintymisestä sukupuolen ja kasvaimen laadun perusteella, |
|
— |
eläinten kuolinaika tutkimuksen kuluessa ja eloonjääneet sen päätyttyä, |
|
— |
myrkkyvastetulokset sukupuolen ja annostason perusteella, |
|
— |
selostus myrkyllisyysoireista ja muista vaikutuksista, |
|
— |
poikkeavuuksien toteamisaika ja kehittyminen, |
|
— |
ruokintaa ja painoa koskevat tiedot, |
|
— |
veritestit ja kaikki tulokset, |
|
— |
ruumiinavauslöydökset, |
|
— |
tarkka selostus kaikista histopatologisista löydöksistä, |
|
— |
tulosten tilastollinen käsittely, jos mahdollista, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.33. YHDISTETTY KROONINEN MYRKYLLISYYS/KARSINOGEENISUUSTESTI
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Yhdistetyn myrkyllisyys/karsinogeenisuustestin tarkoituksena on määrittää pitkäaikaisen altistuksen aiheuttamat krooniset ja karsinogeeniset vaikutukset johonkin nisäkäslajiin.
Karsinogeenisuustestiä täydentää ainakin yksi satelliittiryhmä, joka altistetaan, sekä kontrollisatelliittiryhmä. Suurimman annoksen saavan satelliittiryhmän annos voi olla suurempi kuin karsinogeenisuustestin suurimman annoksen ryhmälle annettu. Karsinogeenisuustestin koe-eläimistä tutkitaan yleiset myrkkyvaikutukset sekä karsinogeenisuusvaste. Altistetun satelliittiryhmän koe-eläimistä tutkitaan yleiset myrkkyvaikutukset.
Testattavaa ainetta annetaan valittua antotapaa käyttäen yleensä viikon jokaisena päivänä useille koe-eläinryhmille suurimman osan niiden elinajasta, niin että kukin ryhmä saa erisuuruisen annoksen. Antoaikana ja sen päätyttyä eläimiä tarkkaillaan päivittäin myrkkyvaikutusten ja kasvainten kehittymisen toteamiseksi.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Eläimet siirretään koetiloihin ja testin aikana annettava ruokinta aloitetaan vähintään viisi päivää ennen testin alkua. Nuoret, terveet eläimet jaetaan satunnaisesti koe- ja kontrolliryhmiin.
Rotta on suositeltavin laji. Aikaisempien tutkimusten perusteella voidaan valita jokin muu laji (jyrsijä tai muu kuin jyrsijä). Koe-eläimiksi valitaan yleisesti käytettyä laboratoriokantaa olevia nuoria terveitä eläimiä ja annostelu aloitetaan vieroituksen jälkeen niin pian kuin mahdollista.
Testin alkaessa eläinten paino saa vaihdella korkeintaan ± 20 % keskiarvosta. Mikäli subkrooninen testi suun kautta annosteltuna on tehty pitkäaikaistutkimuksen esitestinä, kummassakin tutkimuksessa on käytettävä samaa lajia ja kantaa.
Kun tutkimuksessa käytetään jyrsijöitä, kutakin annostasoa ja kontrolliryhmää varten tarvitaan vähintään 100 eläintä (50 naarasta ja 50 urosta). Naaraiden on oltava synnyttämättömiä, eivätkä ne saa olla tiineinä. Mikäli tutkimussuunnitelma edellyttää eläinten lopettamista tutkimuksen kuluessa, eläinmäärään on lisättävä lopettaviksi aiottujen eläinten määrä.
Altistetussa satelliittiryhmässä(ryhmissä), jo(i)sta tutkitaan muut kuin kasvaimia koskevat myrkkyvaikutukset, on oltava 20 ja kontrollisatelliittiryhmässä 10 eläintä kumpaakin sukupuolta.
Karsinogeenisuuden määrittämiseksi testissä käytetään vähintään kolmea annostasoa kontrolliryhmän ohella. Suurimman annoksen olisi aiheutettava vähäisiä myrkytysoireita, kuten lievää painon nousun hidastumista (alle 10 %), eikä sen tuloksena saisi olla huomattavia muutoksia normaaliin elinikään kasvainten aiheuttamia muutoksia lukuun ottamatta.
Pienin annos ei saisi vaikuttaa eläimen normaaliin kasvuun, kehitykseen ja elinikään eikä aiheuttaa mitään myrkyllisyysoireita. Pienimmän annoksen on yleensä oltava vähintään 10 % korkeimmasta annoksesta.
Väliannostaso(tasot) on porrastettava ylimmän ja alimman annoksen keskiväliin.
Annostasojen valinnassa on otettava huomioon aikaisemmista myrkyllisyystesteistä ja -tutkimuksista saadut tulokset.
Kroonisten myrkkyvaikutusten määrittämiseksi kokeessa käytetään muita altistettuja ryhmiä ja kontrollisatelliittiryhmää. Satelliittiryhmän saaman suurimman annoksen on aiheutettava selkeitä myrkyllisyysoireita.
Eläimet altistetaan tavallisesti päivittäin.
Mikäli kemikaalia annostellaan juomaveteen tai ravintoon sekoitettuna, niitä on oltava jatkuvasti saatavilla.
Tutkimuksessa on käytettävä kontrolliryhmää, joka on aivan samanlainen kuin tutkimusryhmät, paitsi että sille ei anneta tutkittavaa ainetta.
Erityistapauksissa, esimerkiksi aerosoleihin liittyvissä inhalaatiotutkimuksissa tai kun suun kautta annosteltavaa ainetta tutkittaessa käytetään emulgaattoria, jonka biologiset ominaisuudet eivät ole tiedossa, tutkimukseen tulee liittää myös toinen kontrolliryhmä, jolle ei anneta liuotinta.
Kolme pääasiallisesti käytettyä annostelutapaa ovat suun kautta, ihon kautta ja hengitysteiden kautta. Valinta riippuu testattavan aineen fysikaalisista ja kemiallisista ominaisuuksista sekä ihmisten todennäköisestä altistumistavasta.
Tutkimukset, joissa annostelu tapahtuu suun kautta
Kun testattava aine imeytyy ruoansulatuskanavasta ja sen ollessa myös ihmisten todennäköinen altistumistapa, suun kautta annostelu on paras tapa, ellei kontraindikaatioita ole. Testattavaa ainetta voidaan antaa koe-eläimille ravinnon yhteydessä, juomaveteen liuotettuna tai kapseleina.
Eläimille olisi annettava testattavaa ainetta viikon jokaisena päivänä, koska annostus viitenä päivänä viikossa voi aiheuttaa myrkyllisyysoireiden häviämisen tai niistä toipumisen sen ajan kuluessa, jolloin ainetta ei anneta, ja näin vaikuttaa tuloksiin ja niiden tulkintaan. Lähinnä käytännön syistä annostelu viitenä päivänä viikossa voidaan kuitenkin hyväksyä.
Tutkimukset, joissa altistus tapahtuu ihon kautta
Altistusmenetelmäksi voidaan valita ihon altistus, joko sen vuoksi, että se simuloi ihmisten pääasiallista altistumistapaa tai esimerkkimenetelmänä ihovaurioiden tuottamista.
Tutkimukset, joissa altistus tapahtuu hengitysteiden kautta
Koska altistus hengitysteiden kautta on teknisesti paljon ongelmallisempi kuin muut altistustavat, seuraavassa selostetaan tarkemmin tätä altistustapaa. On myös huomattava, että aineen tiputus henkitorveen voi joissakin tapauksissa olla hyväksyttävä vaihtoehto.
Pitkäaikaisaltistukset suunnitellaan yleensä ihmisten todennäköisen altistumistavan perusteella. Eläimet altistetaan hengityskammion tasapainotuksen jälkeen joko kuudeksi tunniksi päivittäin viitenä päivänä viikossa (jaksoittainen altistus) tai todennäköisen ympäristöaltistustavan perusteella 22-24 tuntia vuorokaudessa viikon jokaisena päivänä (jatkuva altistus), jolloin eläimillä on noin tunnin mittainen ruokailuaika samaan aikaan joka päivä. Kummassakaan tapauksessa eläimien saaman testattavan aineen pitoisuutta ei yleensä muuteta. Jaksoittaisen ja jatkuvan altistuksen pääasiallinen ero on, että jaksoittaisessa altistuksessa eläimillä on 17-18 tuntia aikaa toipua päivittäisestä altistuksesta ja viikonloppuisin vielä tätäkin pidempi toipumisaika.
Jaksoittaisen tai jatkuvan altistuksen valinta riippuu tutkimuksen tavoitteista ja siitä, mitä ihmisten altistumistapaa simuloidaan. Tietyt tekniset vaikeudet on joka tapauksessa otettava huomioon. Esimerkiksi eläinten syöttäminen ja juottaminen altistuksen aikana ja monimutkaisemmat (ja luotettavammat) laitteet aerosolien ja höyryn tuottamiseksi sekä niiden valvonta voivat aiheuttaa ongelmia, jotka ovat merkittävämpiä kuin ympäristöolosuhteiden simuloimiseksi valitun jatkuvan altistuksen edut.
Eläinten testauksiin käytetään inhalaatiokammioita, joiden dynaamisessa ilmavirrassa ilma vaihtuu vähintään 12 kertaa tunnissa, jotta hapen ja tasaisesti jakautuneen altistusaineen saanti voidaan varmistaa. Testattavalle aineelle tapahtuvaa altistusta lukuun ottamatta kontrolli- ja altistuskammioiden on oltava rakenteeltaan yhdenmukaisia. Kammiossa on yleensä lievä negatiivinen paine, jotta testattavaa ainetta ei pääsisi vuotamaan ympäristöön. Kammioissa on oltava riittävästi tilaa eläimille. Yleissääntönä kammion ilman pitämiseksi vakaana on, että koe-eläinten viemä tila on korkeintaan 5 % kammion tilavuudesta.
Seuraavat mittaukset tai valvontatoimenpiteet on suoritettava:
|
i) |
Ilman virtaus: ilman virtausnopeutta kammion läpi on tarkkailtava jatkuvasti. |
|
ii) |
Pitoisuus: päivittäisen altistuksen aikana pitoisuuden vaihtelu saa olla korkeintaan ±15 % keskiarvosta. Tutkimuksen koko keston ajan päivittäiset pitoisuudet on pidettävä mahdollisimman vakaana. |
|
iii) |
Lämpötila ja kosteus: kun jyrsijöitä käytetään koe-eläiminä, lämpötilan on oltava 22 ± 2 oC ja kammion kosteuden 30–70 %, paitsi silloin, kuin testattavaa ainetta suspendoidaan veden avulla kammion ilmaan. Molempia arvoja on jatkuvasti tarkkailtava. |
|
iv) |
Hiukkasten koon mittaukset: kun testataan nestemäisiä tai kiinteitä aerosoleja, kammion ilmassa olevien hiukkasten koko tulee määrittää. Aerosolihiukkasten on oltava kooltaan koe-eläinten hengitykselle sopivia. Näytteet kammion ilmasta on otettava eläinten hengitysalueelta. Otoksen on oltava edustava näyte testattavan aineen hiukkasten jakautumisesta ja gravimetrisesti myös kaikista aerosolin suspensiohiukkasista, vaikka suuri osa aerosolista ei joudu hengitykseen. Hiukkasten koosta on tehtävä analyysi useita kertoja niiden tuottoa säädettäessä ja sen jälkeen koe-eläinten altistuksen aikana riittävän usein hiukkasten jakautumisen vakaana pysymisen varmistamiseksi. |
Tutkimuksen karsinogeenisuusosan kestoaika kattaa suurimman osan koe-eläinten normaalista elinajasta. Koe tulee päättää hiiriä ja hamstereita testattaessa 18 kuukauden kuluttua ja rottia testattaessa 24 kuukauden kuluttua, mutta jos testattavat eläinkannat ovat pitkäikäisempiä ja/tai niille kehittyy hitaasti spontaaneja kasvaimia, koe on lopetettava 24 kuukauden kuluttua hiiri- ja hamsteritesteissä ja 30 kuukauden kuluttua rotan ollessa koe-eläimenä. Näin pitkäaikaisen tutkimuksen lopettaminen on vaihtoehtoisesti mahdollista silloin, kun pienimmän annoksen saaneessa ryhmässä tai kontrolliryhmässä on elossa enää 25 %. Sellaisen tutkimuksen päättyessä, jossa eri sukupuolien vasteessa on selkeä ero, kumpikin sukupuoli on arvioitava erikseen. Kun ainoastaan suurimman annoksen saanut ryhmä kuolee ennenaikaisesti selkeisiin myrkkyvaikutuksiin, tämän ei tarvitse merkitä tutkimuksen lopettamista, jos myrkyllisyysoireet eivät aiheuta vaikeuksia muissa ryhmissä. Negatiivinen tulos on hyväksyttävä, jos tutkimuksesta on menetetty korkeintaan 10 % jostakin ryhmästä autolyysin, kannibalismin tai hoito-ongelmien vuoksi ja vähintään 50 % kaikkien ryhmien eläimistä on elossa 18 kuukauden kuluttua käytettäessä hiiriä tai hamstereita ja 24 kuukauden kuluttua, kun koe-eläiminä käytetään rottia.
Satelliittiryhmiä, joissa on 20 kumpaakin sukupuolta olevaa altistettua eläintä ja krooniseen myrkyllisyystutkimukseen tarkoitettua 10 kumpaakin sukupuolta olevaa kontrollieläintä, on tutkittava vähintään 12 kuukauden ajan. Nämä eläimet on tarkoitettu testattavaan aineeseen liittyviin patologisiin tutkimuksiin ilman gerontologisten muutosten aiheuttamia vaikutuksia.
Testin suorittaminen
Eläimiä tarkkaillaan päivittäin ja tarkkailussa on kiinnitettävä huomiota muutoksiin, joita tapahtuu karvapeitteessä ja ihossa, silmissä ja limakalvoissa sekä hengitys- ja verenkiertoelimissä, autonomisessa ja keskushermostossa, somatomotorisissa toiminnoissa sekä käyttäytymistavassa.
Altistetun satelliittiryhmän (ryhmien) eläimille on suoritettava määräajoin kliininen tutkimus.
Säännöllinen tarkkailu on tarpeen, jotta eläimiä ei menetettäisi kannibalismin, kudosten autolyysin tai hoitovirheiden vuoksi. Huonokuntoiset eläimet poistetaan ja niille suoritetaan ruumiinavaus.
Kunkin eläimen osalta kirjataan kliiniset oireet, neurologiset ja silmän muutokset sekä kuolleisuus. Kasvainten kehittymiseen on kiinnitettävä erityistä huomiota. Jokaisen paljain silmin tai käsin tunnustelemalla havaittavissa olevan kasvaimen toteamisaika, paikka, koko, ulkonäkö ja kehitys on kirjattava.
Ravinnon kulutus (ja veden kulutus, kun testattava aine annetaan juomavedessä) mitataan viikoittain 13 ensimmäisen viikon aikana ja sen jälkeen noin kolmen kuukauden välein, elleivät eläinten terveydentila tai painonmuutokset edellytä useampia määrityksiä.
Kunkin eläimen paino kirjataan kerran viikossa tutkimusajan 13 ensimmäisen viikon aikana ja sen jälkeen vähintään kerran neljässä viikossa.
Kliiniset tutkimukset
Veritutkimus (esim. hemoglobiini, puna- ja valkosolujen määrä, trombosyytit tai jokin muu hyytymisominaisuusmääritys) on tehtävä kolmen ja kuuden kuukauden kuluttua ja sen jälkeen noin kuuden kuukauden välein. Tutkimuksen päätyttyä otetaan verinäyte kunkin ryhmän osalta 10 uros- ja 10 naaraspuolisesta rotasta. Mikäli mahdollista, näytteet on otettava joka kerta samoista rotista.
Mikäli eläinten terveydentilan todetaan huonontuneen tutkimuksen kuluessa, näiden eläinten verenkuva on tutkittava. Suurimman annoksen saaneen ryhmän ja kontrolliryhmien eläinten verenkuva tutkitaan. Pienempiä annoksia saaneiden ryhmien osalta verenkuva tutkitaan vain, jos suurimman annoksen ryhmän ja kontrolliryhmien välillä on suuri ero tai jos patologiset löydökset edellyttävät sen tutkimista.
Virtsanäyte otetaan kunkin ryhmän osalta jos mahdollista samoin välein ja samalta 10 uros- ja 10 naaraspuoliselta rotalta, jolta otettiin verinäyte. Seuraavat määritykset on tehtävä joko kunkin eläimen näytteestä tai jyrsijöiden osalta sukupuolen ja ryhmän perusteella yhdistetystä näytteestä:
|
— |
ulkonäkö: määrä ja tiheys kunkin eläimen osalta, |
|
— |
proteiinit, glukoosi, ketonit, veri (semikvantitatiivisesti), |
|
— |
sakan mikroskooppitutkimus (semikvantitatiivisesti). |
Noin kuuden kuukauden välein sekä tutkimuksen päätyttyä otetaan verinäyte mieluimmin joka kerta samalta 10 uros- ja 10 naaraspuoliselta rotalta sekä kaikilta muiden lajien koe-eläimiltä kliinisen kemian määrityksiä varten. Muilta kuin jyrsijöiltä otetaan lisäksi näyte ennen tutkimuksen alkua. Näytteiden plasmasta tehdään seuraavat määritykset:
|
— |
kokonaisproteiinipitoisuus, |
|
— |
albumiinipitoisuus, |
|
— |
maksakokeet (esim. alkaalifosfataasin, glutamiinipyruviinitransaminaasin (4) ja glutamiinioksaloasetaattitransaminaasin (5) toiminta), gammaglutamyylitranspeptidaasi, ornitiinidekarboksylaasi, |
|
— |
hiilihydraattien metabolia, esim. glukoosin paastoarvo, |
|
— |
munuaisten toiminta, esim. veren ureatyppi. |
Kaikille, myös tutkimuksen kuluessa kuolleille tai huonokuntoisuuden vuoksi lopetetuille koe-eläimille suoritetaan ruumiinavaus. Ennen eläinten lopettamista niistä otetaan verinäytteet verenkuvan määritystä varten. Kaikki paljain silmin havaittavat kasvaimet tai kasvaimeksi epäillyt vauriokohteet säilytetään. Silmämääräiset havainnot on pyrittävä korreloimaan mikroskooppisiin löydöksiin.
Kaikki elimet ja kudokset säilytetään histopatologista tutkimusta varten. Tämä koskee yleensä seuraavia elimiä ja kudoksia: aivot (7), (ydin/aivosilta, pikkuaivokuori ja aivokuori), aivolisäke, kilpirauhanen (sekä lisäkilpirauhanen), kateenkorva, keuhkot (ja henkitorvi), sydän, aortta, sylkirauhaset, maksa (7), perna, munuaiset (7), lisämunuaiset (7), ruokatorvi, mahalaukku, pohjukaissuoli, ohutsuoli, umpisuoli, paksusuoli, peräsuoli, virtsarakko, imusolmukkeet, haima, sukupuolirauhaset (7), muut sukupuolielimet, naaraan rintarauhanen, iho, lihakset, ääreishermo, selkärankaa (kaulasta, henkitorven keskiosasta ja lantiosta), rintalasta luuytimineen, reisiluu (nivelineen) sekä silmät.
Keuhkojen ja virtsarakon täyttäminen fiksatiivilla on näiden elinten paras säilytystapa; keuhkojen täyttäminen hengitystietutkimuksissa on välttämätöntä, jotta tarvittava histopatologinen tutkimus voidaan suorittaa. Erityistutkimuksissa, kuten altistustesteissä hengitysteiden kautta, koko hengityselimistö mukaan lukien nenä, nielu ja kurkunpää, on tutkittava.
Muita kliinisiä tutkimuksia tehtäessä niiden tulosten on oltava selvillä ennen mikroskooppitutkimusta, koska niistä saattaa olla patologille merkittävää apua.
Kroonisen myrkyllisyystutkimuksen osalta:
Suurimman annoksen saaneen satelliittiryhmän ja kontrolliryhmien eläinten kaikki säilytetyt elimet on tutkittava huolellisesti. Jos satelliittiryhmässä havaitaan testattavaan aineeseen liittyviä muutoksia, kaikkien muiden altistettujen satelliittiryhmien eläinten sekä karsinogeenisuustutkimuksessa altistettujen ryhmien eläinten kohde-elimet on tutkittava perusteellisesti tutkimuksen päätyttyä.
Karsinogeenisuustutkimuksen osalta:
|
a) |
Tutkimuksen aikana kuolleiden ja lopetettujen eläinten sekä suurimman annoksen saaneen ryhmän ja kontrolliryhmän eläinten elimille ja kudoksill ontehtävä täydellinen histopatologinen tutkimus. |
|
b) |
Kaikki paljain silmin havaittavat elinten kasvaimet tai kasvaimiksi epäillyt muutokset on tutkittava mikroskooppisesti kaikkien ryhmien osalta. |
|
c) |
Jos suurimman annoksen saaneessa ryhmässä ja kontrolliryhmässä esiintyvien uudisvaurioiden määrä poikkeaa huomattavasti toisistaan, histopatologinen tutkimus on suoritettava muiden ryhmien vastaaville elimille tai kudoksille. |
|
d) |
Jos suurimman annoksen saaneessa ryhmässä eloonjääneiden osuus on huomattavasti kontrolliryhmää pienempi, seuraavaksi alempi ryhmä on tutkittava perusteellisesti. |
|
e) |
Jos testi osoittaa, että korkeimman annoksen saaneessa ryhmässä on syntynyt uudiskasvainvasteeseen vaikuttavia myrkky- tai muita vaikutuksia, lähinnä alempi annostaso on tutkittava perusteellisesti. |
2. TULOKSET
Tulokset esitetään taulukkomuodossa, josta näkyy kuhunkin testiryhmään kuuluvien eläinten lukumäärä testin alussa, kasvaimia kehittäneiden ja muita myrkkyvaikutuksia osoittavien eläinten määrä, kasvaimien toteamisajankohta ja niiden eläinten lukumäärä, joilla todettiin kasvaimia lopettamisen jälkeen. Tulosten merkitsevyys arvioidaan jotakin tilastollista menetelmää käyttäen. Kaikkia tunnettuja tilastointimenetelmiä voidaan käyttää.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
eläinlaji, kanta, hankintapaikka, ympäristöolosuhteet, ruokavalio, |
|
— |
koeolosuhteet: Altistamislaitteen kuvaus: merkki, tyyppi, mitat, ilmanlähde, hiukkasten ja aerosolien tuottamistapa, ilmastointitapa, poistoilman käsittelytapa ja eläinten sijainti koekammiossa altistamisen aikana. Lämpötilan, kosteuden, hiukkasten koon ja aerosolin pitoisuuden mittaustapa on mainittava. Altistamistiedot: Altistamistiedot laaditaan taulukkomuotoon, jossa esitetään keskiarvo ja poikkeamat (esim. keskihajonta) ja seuraavat tiedot:
|
|
— |
annostasot (mukaan lukien liuotin, jos sitä on käytetty), |
|
— |
selostus kasvainten esiintymisestä sukupuolen ja kasvaimen laadun perusteella, |
|
— |
eläinten kuolinaika tutkimuksen kuluessa ja eloonjääneet sen päätyttyä myös satelliittiryhmän osalta, |
|
— |
myrkkyvastetulokset sukupuolen ja annostason perusteella, |
|
— |
selostus myrkyllisyysoireista ja muista vaikutuksista, |
|
— |
kunkin poikkeavuuden toteamisaika ja kehittyminen, |
|
— |
silmälöydökset, |
|
— |
ruokintaa ja painoa koskevat tiedot, |
|
— |
veritestit ja kaikki tulokset, |
|
— |
kliiniset biokemialliset testit ja kaikki tulokset (myös virtsa-analyysi), |
|
— |
ruumiinavauslöydökset, |
|
— |
tarkka selostus kaikista histopatologisista löydöksistä, |
|
— |
tulosten tilastollinen käsittely ja käytetty tilastointimenetelmä, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.34. MYRKKYJEN VAIKUTUS LISÄÄNTYMISKYKYYN (YHDEN SUKUPOLVEN TESTI)
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Testattavaa ainetta annetaan erisuuruisina annoksina useille uros- ja naarasryhmille. Urokset altistetaan kasvuaikana ja ainakin yhden täydellisen spermatogeneesisyklin ajan (noin 56 päivää hiirellä ja 70 päivää rotalla), jotta voidaan todeta testattavan aineen mahdolliset haittavaikutukset siemennesteen tuottoon.
Parentaalipolven (P) naaraat on altistettava vähintään kahden estrussyklin ajan, jotta voidaan todeta testattavan aineen mahdolliset haittavaikutukset estrukseen. Sen jälkeen eläimet pariutetaan. Pariuttamisaikana testattavaa ainetta annetaan kummallekin sukupuolelle ja sen jälkeen tiineyden ja imetyksen aikana ainoastaan naaraille. Testausmenetelmää on muunneltava, jos altistus tapahtuu hengitysteiden kautta.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Ennen tutkimuksen aloittamista nuoret, terveet eläimet jaetaan satunnaisesti koe- ja kontrolliryhmiin. Eläimet siirretään koetiloihin ja kokeen aikana annettava ruokinta aloitetaan vähintään viisi päivää ennen kokeen alkua. Testattavaa ainetta suositellaan annettavaksi ravintoon tai juomaveteen sekoitettuna. Myös muita antotapoja voidaan käyttää. Samaa antotapaa on käytettävä kaikille koe-eläimille koko koeajan. Jos liuotinta tai muita lisäaineita käytetään annostelun helpottamiseksi, niiden myrkyttömyys on oltava tiedossa. Eläimet on altistettava viikon jokaisena päivänä.
Eläinlajin valinta
Suositeltavimmat lajit ovat rotta tai hiiri. Koe-eläiminä on käytettävä terveitä eläimiä, joilla ei ole tehty aikaisempia kokeita. Kantoja, joiden hedelmällisyys on alhainen, ei saa käyttää. Koe-eläinten laji, kanta, sukupuoli, paino ja/tai ikä on oltava tiedossa.
Hedelmällisyysmäärityksiä tehtäessä tutkitaan sekä urokset että naaraat. Kaikki koe- ja kontrollieläimet on vieroitettava ennen altistuksen alkamista.
Lukumäärä ja sukupuoli
Kussakin koe- ja kontrolliryhmässä on oltava niin monta eläintä, että tutkimukseen saadaan noin 20 kantavaa naarasta, joiden tiineys on päättymässä.
Tarkoituksena on tuottaa niin monta tiineyttä ja poikuetta, että testattavan aineen mahdollisista vaikutuksista P-sukupolven eläinten hedelmällisyyteen, tiineyteen ja emon käyttäytymiseen sekä F1-sukupolven imeväisvaiheeseen, kasvuun ja kehitykseen syntymästä vieroitukseen voidaan tehdä luotettava arviointi.
Ravintoa ja vettä on oltava vapaasti saatavilla. Synnytyksen lähestyessä kantavat naaraat tulee sijoittaa yksitellen synnytyshäkkeihin, joihin voidaan laittaa pesäntekotarvikkeita.
Testissä käytetään vähintään kolmea annostasoa ja kontrolliryhmää. Jos aineen annostelussa käytetään liuotinta, kontrolleille annostellaan liuotinta suurimman annoksen saavalle ryhmälle annettu määrä. Jos testattava aine vähentää ravinnon tarvetta tai hyväksikäyttöä, tutkimukseen voidaan liittää ravintokontrolliryhmä. Elleivät testattavasta aineesta johtuvat fysikaalis-kemialliset tai biologiset vaikutukset aiheuta rajoituksia, suurimman annoksen on aiheutettava parentaalisukupolvessa myrkkyvaikutuksia mutta ei kuolleisuutta. Keskimmäisen annostason(tasojen) on aiheutettava testattavan aineen pienimmät havaittavissa olevat myrkkyvaikutukset eikä pienimmällä annoksella saa olla havaittavia haittavaikutuksia kumpaankaan sukupolveen. Kun annos annetaan kapseleina tai ruokintaletkulla, se tulee määrittää kunkin eläimen painon perusteella ja säätää viikoittain painon muutosten mukaan. Kantavien naaraiden annos voidaan myös määrittää naaraan painon perusteella tiineyden 0-päivänä ja 6. päivänä.
Jos lievästi myrkyllisiä aineita tutkittaessa 1 000 mg/kg ei vaikuta lisääntymiskykyyn, muita annostasoja ei tarvitse tutkia. Mikäli suurimmalla annoksella tehty esitesti aiheuttaa emossa selviä myrkkyvaikutuksia, mutta ei vaikuta hedelmällisyyteen, muita annostasoja ei ole tarpeen tutkia.
Testin suorittaminen
Parentaalipolven (P) urosten päivittäinen altistus on aloitettava vieroituksen jälkeen 5–9 viikon iässä ja vähintään viiden vuorokauden koeolosuhteisiin sopeuttamisen jälkeen. Rottia altistetaan 10 viikkoa ennen pariuttamisaikaa (hiiriä kahdeksan viikkoa). Urokset lopetetaan ja tutkitaan pariuttamisajan kuluttua. Vaihtoehtoisesti ne voidaan pitää testin ruokavaliolla mahdollisen toisen poikueen tuottamista varten. Tällöin ne lopetetaan ja tutkitaan jossakin vaiheessa ennen tutkimuksen päättymistä. Parentaalipolven (P) naaraiden altistuksen on alettava vähintään viiden vuorokauden sopeutumisajan kuluttua ja jatkuttava ainakin kahden viikon ajan ennen pariutumista. P-naaraiden päivittäisen altistuksen on jatkuttava koko kolmen viikon pariuttamisajan ja tiineysajan aina F1-poikasten vieroitukseen asti. Altistusaikataulun muutoksia voidaan harkita testattavasta aineesta saatavilla olevien tietojen, kuten metabolisten vaikutusten tai biokertyvyyden perusteella.
Tutkittaessa myrkkyjen vaikutusta hedelmällisyyteen voidaan eläimet pariuttaa joko 1:1 (yksi uros yhtä naarasta kohden) tai 1:2 (yksi uros kahta naarasta kohden).
Kun pariutetaan 1:1, yhtä naarasta pidetään saman uroksen luona kunnes tiineys alkaa tai kolme viikkoa on kulunut. Naaraat on tutkittava joka aamu sperman tai emätintulpan havaitsemiseksi. Sperman tai emätintulpan toteamispäivä on tiineyden 0-päivä.
Pariutumattomat parit tutkitaan näennäisen lisääntymiskyvyttömyyden selvittämiseksi.
Näihin tutkimuksiin voi kuulua uuden pariutumismahdollisuuden järjestäminen toisen hedelmällisen naaraan tai uroksen kanssa, sukupuolielinten mikroskooppinen tutkimus ja estrussyklin sekä siemennestetuotannon tutkiminen.
Lisääntymiskykytutkimuksen kuluessa altistettujen eläinten annetaan synnyttää normaalisti ja hoitaa poikueensa vieroitukseen asti ilman, että poikueita yhtenäistetään.
Jos poikueet yhtenäistetään, seuraavaa menetelmää suositellaan käytettäväksi. Syntymän jälkeen 1-4 päivän välisenä aikana poikuetta voidaan mukauttaa poistamalla liiat poikaset niin, että poikueeseen jää, jos mahdollista, neljä urosta ja neljä naarasta.
Silloin kun uros- tai naaraspuolisten poikasten määrä on sellainen, että poikueeseen ei jää neljää poikasta kumpaakin sukupuolta, voidaan tehdä osittaismukautus (esimerkiksi viisi urosta ja kolme naarasta). Alle kahdeksan poikasen poikueita ei mukauteta.
Kaikkien eläinten tarkkailu suoritetaan vähintään kerran päivässä koko tutkimuksen ajan. Käyttäytymistavan muutokset, vaikeat tai pitkittyneet synnytysoireet ja kaikki myrkkyoireet sekä kuolleisuus on kirjattava. Ennen pariutumista ja pariutumisajan kuluessa ravinnon kulutus voidaan mitata päivittäin. Synnytyksen jälkeinen ja imetyksen aikainen ravinnon kulutus (ja veden kulutus kun testattava aine annetaan juomavedessä) mitataan samana päivänä kun poikue punnitaan. P-urokset ja P-naaraat on punnittava ensimmäisenä altistuspäivänä ja sen jälkeen viikoittain. Nämä huomiot on kirjattava jokaisesta täysikasvuisesta koe-eläimestä erikseen.
Tiineysajan pituus on laskettava tiineyden 0-päivästä. Kukin poikue on tutkittava mahdollisimman pian synnytyksen jälkeen sekä kirjattava poikasten lukumäärä ja sukupuoli, kuolleena syntyneet, elävänä syntyneet ja paljain silmin havaittavat poikkeavuudet.
Kuolleet ja neljäntenä päivänä lopetetut poikaset säilytetään ja tutkitaan poikkeavuuksien havaitsemiseksi. Elävät poikaset lasketaan ja poikue punnitaan synnytystä seuraavana aamuna sekä neljäntenä ja seitsemäntenä päivänä ja sen jälkeen viikoittain tutkimuksen päättymiseen saakka, jolloin eläimet punnitaan yksitellen.
Emojen ja poikasten fyysiset poikkeavuudet ja käyttäytymishäiriöt kirjataan.
Patologia
Tutkimuksen kuluessa kuolleet tai lopetetut P-sukupolven eläimet tutkitaan mikroskooppisesti rakenteellisten poikkeavuuksien tai patologisten muutosten toteamiseksi. Huomiota kiinnitetään erityisesti sukupuolielimiin. Kuolleet tai huonokuntoiset poikaset tutkitaan poikkeavuuksien toteamiseksi.
Kaikkien P-eläinten munasarjat, kohtu, kohdunkaula, emätin, kivekset, lisäkivekset, rakkularauhaset, eturauhanen, koagulaatiorauhanen, aivolisäke ja kohde-elimet on säilytettävä mikroskooppista tutkimusta varten. Ellei niitä ole tutkittu muissa moniannostutkimuksissa, ne on tutkittava mikroskooppisesti kaikkien suurimman annoksen saaneiden ja kontrollieläinten osalta sekä, mikäli mahdollista, tutkimuksen aikana kuolleiden eläinten osalta.
Elimet, joissa näillä eläimillä esiintyy poikkeavuuksia, on myös tutkittava kaikkien muiden P-eläinten osalta. Näissä tapauksissa on kaikki näkyviä patologisia muutoksia osoittavat kudokset tutkittava mikroskooppisesti. Kuten pariuttamismenettelyä selostavassa kohdassa esitetään, lisääntymiskyvyttömiksi epäiltyjen eläinten sukupuolielimet voidaan tutkia mikroskooppisesti.
2. TULOKSET
Tulokset voidaan esittää taulukkomuodossa, josta ilmenevät kuhunkin koeryhmään kuuluvien eläinten lukumäärä testin alussa, hedelmällisten urosten määrä, kantavien naaraiden määrä, muutosten laatu ja eläinten prosentuaalinen osuus kutakin muutosta kohden.
Jos mahdollista, tulosten merkitsevyys on arvioitava jotakin tilastollista menetelmää käyttäen. Kaikki tunnetut tilastointimenetelmät ovat sallittuja.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
koe-eläinlaji/kanta, |
|
— |
myrkkyvaikutukset sukupuolen ja annostason perusteella sekä hedelmällisyys, tiineys ja elinkelpoisuus, |
|
— |
eläinten kuolinaika tutkimuksen kuluessa ja elossa olevat ennen lopetusajankohtaa tai tutkimuksen päättyessä, |
|
— |
taulukko, josta ilmenee kunkin poikueen paino, poikasten keskipaino ja kunkin poikasen paino tutkimuksen päättyessä, |
|
— |
lisääntymistä, poikasia ja syntymän jälkeistä kasvua koskevat myrkky- ja muut vaikutukset, |
|
— |
kunkin oireen toteamispäivä ja kehittyminen, |
|
— |
P-eläinten painoa koskevat tiedot, |
|
— |
ruumiinavauslöydökset, |
|
— |
tarkka selostus kaikista mikroskooppilöydöksistä, |
|
— |
tulosten tilastollinen käsittely, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.35. KAKSI SUKUPOLVEA KÄSITTÄVÄ LISÄÄNTYMISKYKYYN KOHDISTUVIEN MYRKYLLISYYSVAIKUTUSTEN TUTKIMUS
1. MENETELMÄ
Tämä menetelmä on toisinto OECD: n testiohjeesta nro 416 (2001).
1.1 JOHDANTO
Tällä kaksi sukupolvea käsittävällä reproduktiotestillä on tarkoitus tuottaa yleistä tietoa testiaineen vaikutuksista urosten ja naaraiden lisääntymiselinten vahingoittumattomuuteen ja toimintaan. Siihen sisältyy sukupuolirauhasten toiminta, kiimasykli, pariutumiskäyttäytyminen, hedelmöityminen, tiineys, synnytys, imetys ja vieroitus sekä testiaineen vaikutukset jälkeläisten kasvuun ja kehitykseen. Tutkimus voi myös tuottaa tietoja testiaineen vaikutuksista vastasyntyneiden sairastuvuuteen ja kuolleisuuteen sekä alustavia tietoja pre- ja postnataalisen kehityksen aikaisista myrkyllisyysvaikutuksista. Tutkimus voi lisäksi ohjata seuraavien tutkimusten suorittamista. F1-sukupolven kasvun ja kehityksen lisäksi tämän testimenetelmän tarkoitus on arvioida F2-sukupolven urosten ja naaraiden lisääntymiselinten vahingoittumattomuutta ja toimintaa sekä kasvua ja kehitystä. Lisätietoja kehityksen aikaisista myrkyllisyysvaikutuksista ja toiminnallisista häiriöistä voidaan hankkia lisäämällä tässä kuvattuun tutkimusohjelmaan muita osatutkimuksia, joissa sovelletaan yleiseen ja/tai hermojen kehitykseen kohdistuvien myrkyllisyysvaikutusten tutkimusmenetelmiä, tai tutkimalla näitä loppupisteitä erillisillä testeillä soveltuvia testimenetelmiä käyttäen.
1.2 TESTIMENETELMÄN PERIAATE
Testiainetta annetaan porrastettuina annoksina useille uros- ja naarasryhmille. P-sukupolven uroksille tulee antaa testiainetta niiden kasvun aikana ja ainakin yhden kokonaisen spermatogeneesisyklin ajan (hiirellä noin 56 päivää ja rotalla 70 päivää), jotta spermatogeneesiin kohdistuvat haittavaikutukset voidaan todeta. Spermaan kohdistuvat vaikutukset määritetään useiden spermaparametrien (esimerkiksi siittiöiden morfologia ja liikkuvuus), kudospreparaattien ja yksityiskohtaisen histopatologisen tutkimuksen avulla. Jos käytettävissä on spermatogeneesiä koskevia tietoja aikaisemmasta toistuvaa annostelua käyttäneestä tutkimuksesta, jonka kesto on riittävä, esimerkiksi 90 päivää, P-sukupolven uroksia ei tarvitse sisällyttää arviointiin. On kuitenkin suositeltavaa säilyttää P-sukupolven spermanäytteet tai digitaaliset tallenteet myöhempää arviointia varten. P-sukupolven naaraille tulee antaa testiainetta niiden kasvun aikana ja useiden kokonaisten kiimasyklien ajan, jotta testiaineen mahdolliset normaalia kiimasykliä häiritsevät haittavaikutukset voidaan todeta. Testiainetta annetaan poikasten vanhemmille (P-sukupolvi) pariutumisen aikana, tiineyden aikana ja niiden F1-poikasten vieroitukseen asti. Vieroituksesta lähtien ainetta annetaan F1-poikasille aikana, jolloin ne kehittyvät sukukypsiksi, pariutumisen aikana sekä F2-sukupolven syntymän jälkeen vieroitukseen asti.
Kaikista eläimistä tutkitaan myrkyllisyysvaikutusten merkit kliinisesti havainnoiden ja patologisten tutkimusten avulla kiinnittäen erityistä huomiota urosten ja naaraiden lisääntymiselinten vahingoittumattomuuteen ja toimintaan sekä jälkeläisten kasvuun ja kehitykseen kohdistuviin vaikutuksiin.
1.3 TESTIMENETELMÄN KUVAUS
1.3.1 Eläinlajin valinta
Suositeltava eläinlaji on rotta. Jos käytetään muita lajeja, niiden käyttö on erikseen perusteltava ja testimenetelmää on tarvittaessa mukautettava. Kantoja, joiden hedelmällisyys on alhainen tai joilla tiedetään esiintyvän kehityshäiriöitä, ei tule käyttää. Tutkimuksen alussa eläinten painon variaation tulisi olla mahdollisimman pieni, eikä se saa olla suurempi kuin 20 % kummankin sukupuolen painokeskiarvosta.
1.3.2 Koe-eläintilat ja eläinten ruokinta
Koe-eläinhuoneen lämpötilan olisi oltava 22 oC (± 3o). Vaikka riittää, että suhteellinen kosteus on vähintään 30 % eikä mielellään ylitä 70 %:a muulloin kuin huoneen puhdistuksen aikana, pitäisi kuitenkin pyrkiä 50-60 %:n suhteelliseen kosteuteen. Huoneessa tulee käyttää keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa, 12 tuntia pimeää). Eläinten ruokinnassa voidaan käyttää normaalia laboratorioruokavaliota, eikä juomaveden määrää saa rajoittaa. Ruokavalion valinnassa on varmistettava, että testiaineen ja ravinnon suhde on sopiva, mikäli testiaine annetaan ravintoon sekoitettuna.
Eläimet voidaan pitää häkeissä yksittäin tai muutaman samaa sukupuolta olevan eläimen ryhmissä. Parituksen tulee tapahtua tarkoitukseen sopivissa häkeissä. Kun parituksen voidaan todeta tapahtuneen, kukin pariutunut naaras siirretään omaan synnytys- tai poikimishäkkiinsä. Paritetut rotat voidaan myös pitää häkeissä pienissä ryhmissä ja erottaa toisistaan yksi tai kaksi päivää ennen synnytystä. Paritetuille eläimille on annettava synnytyksen lähestyessä asianmukaiset ja etukäteen määritellyt pesäntekoaineet.
1.3.3 Eläinten valmistelu
Testissä tulee käyttää terveitä, nuoria eläimiä, jotka on totutettu laboratorio-olosuhteisiin vähintään viiden vuorokauden ajan ja joita ei ole aiemmin käytetty testeihin. Koe-eläinten laji, kanta, alkuperä, sukupuoli, paino ja/tai ikä on tunnettava. Mahdollisista sisarussuhteista eläinten välillä on oltava selvillä, jotta sisarusten parittaminen voidaan välttää. Eläimet jaetaan satunnaisesti kontrolli- ja testiryhmään (jaottelu ruumiinpainon mukaan on suositeltavaa). Häkit on sijoitettava siten, että häkin sijainnista johtuvat vaikutukset ovat mahdollisimman vähäisiä. Kullekin eläimelle annetaan oma tunnistenumero. P-sukupolvelle on annettava tunnistenumerot ennen annostelun aloittamista. F1-sukupolvelle tunnistenumerot annetaan paritukseen valittujen eläinten vieroituksen yhteydessä. F1-sukupolven kaikkien valittujen eläinten alkuperäispoikue on merkittävä muistiin. Lisäksi suositellaan, että poikasille annetaan yksilöllinen tunniste mahdollisimman pian syntymän jälkeen, mikäli yksilöt aiotaan punnita tai mikäli niille aiotaan tehdä toiminnallisia testejä.
P-sukupolven eläinten tulee olla käsittelyn alkaessa noin 5-9 viikon ikäisiä. Eläinten tulee kaikissa testiryhmissä olla samanpainoisia ja -ikäisiä niin tarkasti kuin on käytännössä mahdollista.
1.4 TESTIN SUORITUS
1.4.1 Eläinten lukumäärä ja sukupuoli
Kussakin testi- ja kontrolliryhmässä on oltava riittävä määrä eläimiä, jotta testiin saadaan mielellään vähintään 20 tiinettä naarasta, jotka synnyttävät tai joiden synnytysaika on lähellä. Tämä ei ehkä ole mahdollista testattaessa aineita, jotka aiheuttavat käsittelyyn liittyviä ei-toivottuja vaikutuksia (esimerkiksi steriiliys tai liian suuri myrkyllisyys ylimmällä annostasolla). Tavoitteena on tuottaa tarpeeksi tiineystapauksia, jotta voidaan tehdä merkitsevä arvio testiaineen vaikutuksesta hedelmällisyyteen, tiineyteen, emon käytökseen ja imetykseen, F1-sukupolven poikasten kasvuun ja kehitykseen hedelmöityksestä sukukypsyyteen, sekä F1-sukupolven poikasten (F2) kehitykseen vieroitukseen asti. Jos tutkimuksessa ei päästä tavoiteltuun tiineiden eläinten määrään (20), tutkimus ei silti välttämättä ole epävalidi. Tutkimuksen validiteetti tulee arvioida kussakin tapauksessa erikseen.
1.4.2 Annosten valmistelu
Testiaineen antaminen suun kautta (ravintoon tai juomaveteen sekoitettuna tai letkulla) on suositeltavaa, paitsi jos jokin muu antotapa (esimerkiksi ihoapplikaatio tai inhalaatio) todetaan sopivammaksi.
Tarvittaessa testiaine liuotetaan tai siitä tehdään suspensio sopivaan kantaja-aineeseen. Ensiksi tulisi aina harkita vesiliuoksen/suspension käyttämistä, milloin se on mahdollista, seuraavaksi öljyliuoksen/emulsion (esimerkiksi maissiöljy) käyttämistä ja vasta sitten muiden kantaja-aineiden käyttämistä. Jos kantaja-aineena käytetään muuta kuin vettä, kantaja-aineen toksiset ominaisuudet on tunnettava. Testiaineen stabiilius kantaja-aineessa on määritettävä.
1.4.3 Annostasot
Testissä tulee käyttää vähintään kolmea annostasoa ja testin kanssa samaan aikaan tehtävää kontrollia. Jos testiaineen fysikaalinen/kemiallinen olomuoto tai biologiset ominaisuudet eivät aseta rajoituksia, suurin annos valitaan sellaiseksi, että se aiheuttaa myrkyllisyysvaikutuksen mutta ei aiheuta kuolemaa tai kovia tuskia. Mikäli odottamatonta kuolleisuutta esiintyy, hyväksyttävä on yleensä sellainen tutkimus, jossa P-sukupolven kuolleisuus on alle 10 %. Annostasot on porrastettava laskevasti siten, että tutkimuksessa saadaan esiin mahdolliset annostasoihin liittyvät vaikutukset sekä haitaton altistustaso (NOAEL). Kaksinkertaiset-nelinkertaiset erot annostasojen välillä ovat usein parhaimmat alenevissa annossarjoissa, ja usein on parempi lisätä neljäs testiryhmä kuin käyttää hyvin suuria annosvälejä (esimerkiksi yli kymmenkertaisia annosvälejä). Tutkimuksissa, joissa testiaine annetaan ravintoon sekoitettuna, annostasojen väliset erot saavat olla enintään kolminkertaisia. Annostasojen valinnassa tulee ottaa huomioon aikaisemmat myrkyllisyystiedot ja erityisesti toistettujen annostelututkimusten tulokset. Tutkimuksessa on otettava huomioon myös tiedot testiaineen tai muiden sen kanssa samantyyppisten materiaalien metaboloitumisesta elimistössä samoin kuin niiden toksikokineettisistä ominaisuuksista. Nämä tiedot auttavat myös osoittamaan, että annostasot on valittu oikein.
Kontrolliryhmän tulee olla joko ryhmä, joka ei saa käsittelyä, tai kantaja-ainetta saava ryhmä, mikäli testiaineen antamisen yhteydessä käytetään kantaja-ainetta. Kontrolliryhmän eläimiä tulee käsitellä samalla tavoin kuin testiryhmän eläimiä (testiainekäsittelyä lukuun ottamatta). Jos käytetään kantaja-ainetta, kontrolliryhmälle tulee antaa tilavuudeltaan suurin käytetty kantaja-aineannos. Jos testiaine annetaan ravintoon sekoitettuna ja se vähentää ravinnonottoa tai ravinnon hyväksikäyttöä elimistössä, voi olla tarpeen käyttää parikontrolliryhmää. Samanaikaisen parikontrolliryhmän sijasta voidaan käyttää tietoja, jotka on saatu sellaisista tutkimuksista, joilla on selvitetty vähentyneen ravinnonoton vaikutusta lisääntymisfysiologisiin parametreihin.
Kantaja-ainetta tai muuta lisäainetta käytettäessä aineesta on syytä selvittää seuraavat ominaisuudet: vaikutus testiaineen absorboitumiseen, jakautumiseen, metaboloitumiseen ja elimistössä säilymiseen, sellaiset vaikutukset testiaineen kemiallisiin ominaisuuksiin, jotka saattavat muuttaa testiaineen myrkyllisyyttä, sekä vaikutukset koe-eläinten ravinnon- ja juomanottoon tai ravitsemustilaan.
1.4.4 Raja-annostesti
Jos jokin testin annostaso, joka on vähintään 1 000 mg/kg (eläimen painokilo)/vrk tai vastaava suhteellinen määrä ravinnossa tai juomavedessä, milloin testiaine annetaan ravinnon tai juomaveden seassa, ja joka annetaan tässä testimenetelmässä kuvattujen menettelyjen mukaisesti, ei aiheuta lainkaan havaittavaa myrkyllisyysvaikutusta poikasten vanhemmissa tai poikasissa ja jos myrkyllisyysvaikutusta ei aikaisempien tutkimustulosten perusteella ole odotettavissa (esimerkiksi rakenteellisesti ja/tai metabolisesti samantyyppiset yhdisteet), täydellinen useita annostasoja käyttävä testi ei välttämättä ole tarpeen. Raja-annostestiä voidaan soveltaa, paitsi silloin, kun ihmisten altistuminen viittaa siihen, että on käytettävä suurempaa suun kautta annettavaa annosta. Muita antotapoja, kuten inhalaatiota tai ihoapplikaatiota käytettäessä, testiaineen fysikokemialliset ominaisuudet, esimerkiksi liukoisuus, saattavat usein osoittaa altistuksen enimmäistason ja rajoittaa sitä.
1.4.5 Antotapa
Testiainetta annetaan eläimille seitsemänä päivänä viikossa. Suun kautta tapahtuva antotapa (ravintoon tai juomaveteen sekoitettuna tai letkulla) on suositeltava. Jos käytetään muuta antotapaa, testin tekijän on perusteltava muun antotavan käyttö ja muutettava muita kohtia vastaavasti. Kaikille eläimille tulee antaa testiaineannokset samalla tavalla asianmukaisena koeaikana. Jos testiaine annetaan letkulla, on syytä käyttää mahaletkua. Kerralla annettavan nesteen tilavuus ei saa ylittää 1 ml/100 g eläimen painoa (maissiöljyä käytettäessä tilavuus saa olla enintään 0,4 ml/100 g eläimen painoa), paitsi käytettäessä vesiliuosta, jolloin enimmäistilavuus voi olla 2 ml/100 g eläimen painoa. Testiaineen tilavuuden vaihtelu tulee minimoida pitoisuutta muuttamalla, jotta kaikilla annostasoilla voidaan käyttää tilavuudeltaan samaa nestemäärää. Poikkeuksena tästä ovat ärsyttävät tai syövyttävät aineet, joiden kohdalla voidaan yleensä todeta vaikutusten voimistuminen suurempia pitoisuuksia käytettäessä. Letkuannostelua käyttävissä tutkimuksissa poikaset saavat yleensä testiainetta vain epäsuorasti emon maidosta vieroitukseen asti, jolloin annosten antaminen poikasille aloitetaan. Tutkimuksissa, joissa testiaine annetaan ravintoon tai juomaveteen sekoitettuna, poikaset saavat lisäksi testiainetta suoraan, kun ne alkavat itse syödä imetysajan viimeisellä viikolla.
Jos aineita annetaan eläimille ravintoon tai juomaveteen sekoitettuna, on tärkeää varmistaa, että testiainemäärät eivät häiritse normaalia ravinto- tai nestetasapainoa. Jos testiaine annetaan ravintoon sekoitettuna, voidaan ilmoittaa joko testiaineen pitoisuus ravinnossa (ppm) tai eläimen painoon suhteutettu annos; käytetty tapa on mainittava. Jos testiaine annetaan letkulla, annos tulee antaa päivittäin samaan aikaan ja sitä on mukautettava vähintään viikoittain siten, että annostaso pysyy samana eläimen ruumiinpainoon nähden. Näin meneteltäessä on otettava huomioon tiedot testiaineen leviämisestä istukan kautta.
1.4.6 Testiaikataulu
P-sukupolven urosten ja naaraiden päivittäinen käsittely aloitetaan, kun eläimet ovat 5–9 viikon ikäisiä. F1-sukupolven urosten ja naaraiden päivittäinen käsittely aloitetaan vieroituksen yhteydessä pitäen kuitenkin mielessä, että jos testiaine annetaan ravintoon tai juomaveteen sekoitettuna, F1-sukupolven poikaset saattavat altistua testiaineelle jo imetysaikana. Molempien sukupuolten käsittelyä jatketaan sekä P- että F1-ryhmissä ainakin kymmenen viikon ajan ennen parittamisvaihetta. Molempien sukupuolten käsittelyä jatketaan myös kahden viikon parittamisjakson aikana. Urokset lopetetaan inhimillisellä tavalla ja tutkitaan, kun niitä ei enää tarvita lisääntymisfysiologisten vaikutusten arviointiin. P-sukupolven naaraiden käsittelyä jatketaan koko tiineysajan ja F1-sukupolven poikasten vieroitukseen asti. Annosteluaikataulun mukauttamista harkittaessa tulee ottaa huomioon käytettävissä olevat tiedot testiaineesta, mukaan lukien aikaisemmat myrkyllisyystiedot sekä metaboloituminen tai biologinen kertyminen. Kunkin eläimen annos on yleensä määriteltävä eläimen viimeksi määritetyn ruumiinpainon mukaan. Annoksen mukauttamisessa viimeisen tiineyskolmanneksen aikana on kuitenkin oltava varovainen.
P- ja F1-sukupolvien urosten ja naaraiden käsittelyä jatketaan eläinten lopettamiseen asti. P- ja F1-sukupolvien kaikki aikuiset urokset ja naaraat tulee lopettaa inhimillisellä tavalla, kun eläimiä ei enää tarvita lisääntymisfysiologisten vaikutusten arviointiin. F1-sukupolven poikaset, joita ei valita paritukseen, ja kaikki F2-sukupolven poikaset lopetetaan inhimillisellä tavalla vieroituksen jälkeen.
1.4.7 Paritus
1.4.7.1 P-sukupolven paritus
Kussakin parituksessa jokainen naaras on samassa häkissä yhden, samalla annostasolla olevan uroksen kanssa (1:1-paritus) siihen saakka, kunnes eläimet parittelevat tai kunnes kaksi viikkoa on kulunut. Naaraat tutkitaan päivittäin sperman tai vaginan tulpituksen toteamiseksi. Tiineyden päivä 0 katsotaan päiväksi, jolloin jompikumpi todetaan. Jos parittelua ei tapahdu, voidaan harkita naaraan uutta paritusta saman ryhmän hedelmällisiksi todettujen urosten kanssa. Pariutuneet eläinparit on merkittävä muistiin. Sisarusten parittamista on vältettävä.
1.4.7.2 F1 -sukupolven paritus
F1-sukupolven eläinten paritus tapahtuu siten, että kustakin poikueesta valitaan vieroituksen yhteydessä vähintään yksi uros ja yksi naaras, jotka paritetaan samalla annostasolla olevien eri poikueeseen kuuluvien poikasten kanssa. Näin syntyvä sukupolvi on F2-sukupolvi. Poikaset valitaan kustakin poikueesta satunnaisesti, jos poikasten ruumiinpainossa tai ulkomuodossa ei ole merkittäviä eroja. Jos tällaisia eroja havaitaan, kustakin poikueesta on valittava sitä parhaiten edustavat yksilöt. Käytännössä valinta on paras tehdä ruumiinpainon perusteella, mutta se voidaan tehdä myös ulkomuodon perusteella. F1-sukupolven poikasia ei saa parittaa ennen kuin ne ovat saavuttaneet täyden sukukypsyyden.
Poikimattomien parien hedelmättömyyden todennäköinen syy on arvioitava. Menetelminä voidaan käyttää toista paritusta muiden hedelmällisiksi todettujen urosten tai naaraiden kanssa, lisääntymiselinten mikroskooppitutkimusta sekä kiimasyklien ja spermatogeneesin tutkimista.
1.4.7.3 Toinen paritus
Joissakin tapauksissa, esimerkiksi kun havaitaan käsittelyyn liittyviä muutoksia poikueen koossa tai epäselviä vaikutuksia ensimmäisessä parituksessa, on suositeltavaa parittaa P- tai F1-sukupolven aikuiset eläimet uudelleen toisen poikueen tuottamiseksi. Suositeltava tapa on parittaa uudelleen naaraat tai urokset, jotka eivät ole tuottaneet poikuetta vastakkaisen sukupuolen hedelmälliseksi todetun eläimen kanssa. Jos toisen poikueen tuottamista pidetään tarpeellisena jommassakummassa sukupolvessa, eläimet on paritettava uudelleen noin viikon kuluttua viimeisen poikueen vieroituksesta.
1.4.7.4 Poikueen koko
Eläinten on annettava poikia normaalisti ja kasvattaa poikaset vieroitukseen asti. Poikueen koon vakioiminen ei ole välttämätöntä. Jos vakiointia käytetään, vakiointimenetelmä on kuvattava yksityiskohtaisesti.
1.5 HAVAINNOT
1.5.1 Kliiniset havainnot
Yleinen kliininen havainnointi on tehtävä päivittäin, ja letkuruokinnassa havainnoinnin ajoitusta suunniteltaessa on syytä ottaa huomioon se, milloin annoksen antamisen jälkeen odotetut myrkyllisyysvaikutukset ovat suurimmillaan. Käytösmuutokset, vaikean tai pitkittyneen synnytyksen merkit ja kaikki myrkyllisyysvaikutusten merkit on kirjattava. Kukin eläin on lisäksi tutkittava yksityiskohtaisesti esimerkiksi punnituksen yhteydessä ainakin viikoittain. Kaikkia eläimiä havainnoidaan kaksi kertaa päivässä ja tarvittaessa viikonloppuisin kerran päivässä sairastuvuuden ja kuolleisuuden toteamiseksi.
1.5.2 Poikasia saaneiden eläinten paino sekä ravinnon- ja nesteenotto
Poikasia saaneet eläimet (P ja F1) punnitaan annostelun aloituspäivänä ja sen jälkeen ainakin kerran viikossa. Poikasia saaneet naaraat (P ja F1) punnitaan ainakin tiineyspäivinä 0, 7, 14 ja 20 tai 21 sekä imetyksen aikana poikueiden punnituspäivinä sekä eläinten lopetuspäivänä. Havainnot raportoidaan erikseen kustakin täysikasvuisesta eläimestä. Paritusta edeltävänä aikana ja tiineysjaksojen aikana ravinnonotto tulee mitata vähintään viikoittain. Juomanotto mitataan vähintään viikoittain, jos testiaine annetaan juomaveteen sekoitettuna.
1.5.3 Kiimasykli
Kiimasyklin pituus ja normaalius arvioidaan P- ja F1-sukupolven naaraista ottamalla vaginasta irtosolunäyte ennen pariutumista sekä haluttaessa myös pariutumisjakson aikana, kunnes pariutumisen voidaan todeta tapahtuneen. Otettaessa irtosolunäytettä vaginasta tai kohdunkaulasta on varottava limakalvojen vahingoittamista ja siitä seuraavaa valeraskautta (1).
1.5.4 Siemennesteen muuttujat
Lopettamisen yhteydessä kaikilta P- ja F1-uroksilta kirjataan kivesten ja lisäkivesten paino ja yksi kappale kumpaakin elintä säilötään histopatologista tutkimusta varten (katso kohdat 1.5.7 ja 1.5.8.1). Sekä P- että F1-sukupolven kustakin ryhmästä erotetaan vähintään kymmenen uroksen osajoukko, jonka lopuista kiveksistä ja lisäkiveksistä lasketaan homogenisoinnille resistentit spermatidit ja lisäkiveksen häntään varastoituneen siemennesteen määrä. Samalta osajoukolta kerätään siemenneste lisäkiveksen hännästä tai siemenjohtimesta siittiöiden liikkuvuuden ja morfologian arviointia varten. Jos havaitaan käsittelyyn liittyviä vaikutuksia tai jos muissa tutkimuksissa on osoitettu mahdollisia vaikutuksia spermatogeneesiin, jokaisen ryhmän kaikkien urosten siemenneste tulee arvioida. Muussa tapauksessa riittää, että laskenta tehdään kontrolliryhmän ja korkean annostasoryhmän P- ja F1-eläimille.
Homogenisoinnille resistenttien kiveksissä olevien spermatidien ja lisäkiveksen häntään varastoituneiden siittiöiden määrä on laskettava (2)(3). Lisäkiveksen häntään varastoituneiden siittiöiden määrä voidaan johtaa kvalitatiiviseen arviointiin käytetyn suspension sisältämien siittiöiden pitoisuudesta ja tilavuudesta sekä jäljelle jääneen lisäkiveksen hännän kudoksen jauhamisen ja/tai homogenoinnin jälkeen saadusta siittiöiden lukumäärästä. Laskenta tulee tehdä valitulle urosten osajoukolle kaikissa annosryhmissä heti eläinten lopettamisen jälkeen, paitsi jos käytetään video- tai digitaalista tallennusta tai jos näytteet jäädytetään myöhempää analyysia varten. Näissä tapauksissa kontrolliryhmät ja ylin annosryhmä voidaan analysoida ensin. Jos mitään käsittelyyn liittyviä vaikutuksia (esimerkiksi vaikutukset siittiöiden määrään, liikkuvuuteen tai morfologiaan) ei havaita, muita annosryhmiä ei tarvitse analysoida. Jos taas ylimmässä annosryhmässä havaitaan käsittelyyn liittyviä vaikutuksia, myös alemmat annosryhmät on arvioitava.
Lisäkiveksessä (tai siemenjohtimessa) olevien siittiöiden liikkuvuus tulee arvioida tai videoida heti eläimen lopettamisen jälkeen. Siittiöt kerätään niitä mahdollisimman vähän vaurioittaen ja sperma laimennetaan liikkuvuusanalyysia varten hyväksyttyjä menetelmiä käyttäen (4). Progressiivisesti liikkuvien siittiöiden prosenttiosuus tulee määrittää joko subjektiivisesti tai objektiivisesti. Kun tehdään tietokoneavusteinen liikkuvuusanalyysi (5) (6) (7) (8) (9) (10), progressiivinen liikkuvuus johdetaan käyttäjän määrittelemien keskimääräisten nopeuden ja suoruuden kynnysarvojen eli lineaarisen indeksin mukaan. Jos näytteet on videoitu (11) tai kuvat on muulla tavoin tallennettu ruumiinavauksen yhteydessä, jatkoanalyysi tarvitsee tehdä vain kontrolliryhmän ja ylimmän annosryhmän P- ja F1-sukupolvien uroksille. Jos kuitenkin havaitaan käsittelyyn liittyviä vaikutuksia, myös alemmat annosryhmät on arvioitava. Jos video- tai digitaalitallenteita ei ole tehty, kaikkien testiryhmien kaikki näytteet tulee analysoida ruumiinavauksen yhteydessä.
Lisäkiveksen (tai siemenjohtimen) siemennestenäytteestä tehdään morfologinen arvio. Siemenneste (vähintään 200 siittiötä/näyte) tutkitaan fiksatiivikäsiteltynä märkäpreparaattina (12) ja luokitetaan joko normaaliksi tai epänormaaliksi. Morfologisiin siemennesteen epänormaaliuksiin kuuluvat siittiöiden fuusio, eristyneet päät sekä päiden tai häntien epämuodostumat. Arviointi on tehtävä kaikista annosryhmistä valitulle urosten osajoukolle joko heti eläinten lopettamisen jälkeen tai myöhemmin video- tai digitaalitallenteiden pohjalta. Kun preparaatit on käsitelty fiksatiivilla, ne voidaan tutkia myöhemminkin. Näissä tapauksissa kontrolliryhmä ja ylin annosryhmä voidaan tutkia ensin. Jos mitään käsittelyyn liittyviä vaikutuksia (esimerkiksi vaikutuksia sperman morfologiaan) ei havaita, alempia annosryhmiä ei tarvitse analysoida. Jos käsittelyyn liittyviä vaikutuksia esiintyy ylimmässä annosryhmässä, myös alemmat annostasoryhmät on arvioitava.
Jos jokin edellä kuvatuista siemennesteen muuttujista on jo tutkittu vähintään 90 päivää kestäneissä systeemisen myrkyllisyyden tutkimuksissa, tutkimusta ei tarvitse toistaa tässä yhteydessä. On kuitenkin suositeltavaa tallentaa P-sukupolven näytteet tai siemennesteen digitaalinen tallenne mahdollista myöhempää tutkimusta varten.
1.5.5 Poikaset
Kukin poikue tutkitaan mahdollisimman pian synnytyksen jälkeen (imetyspäivä 0) ja poikueista määritetään poikasten lukumäärä ja sukupuoli, kuolleena ja elävänä syntyneiden poikasten määrä sekä merkittävien poikkeavuuksien esiintyminen. Poikasista, jotka löydetään kuolleina päivänä 0, on mielellään tutkittava mahdolliset kehityshäiriöt ja kuolinsyy, mikäli mahdollista, ja ruumiit säilötään. Elävät poikaset lasketaan ja punnitaan kukin erikseen synnytyksen yhteydessä (imetyspäivä 0) tai päivänä 1 sekä säännöllisesti punnituspäivinä, esimerkiksi imetyspäivinä 4, 7, 14 ja 21. Emoissa tai poikasissa havaitut ruumiilliset epämuodostumat tai epänormaali käyttäytyminen on merkittävä muistiin.
Poikasten ruumiillisesta kehityksestä kirjataan lähinnä painonlisäys. Muista fyysisistä muuttujista (esimerkiksi korvien ja silmien avautuminen, hampaiden puhkeaminen, karvankasvu) voidaan saada täydentäviä tietoja, mutta tällaiset tiedot tulee mielellään arvioida sukukypsyystietojen pohjalta (esimerkiksi ikä ja ruumiinpaino emättimen avautuessa tai terskan ja esinahan erotessa) (13). Toiminnalliset tutkimukset (esimerkiksi motoriset toiminnot, aistitoiminnot, refleksien kehitys), jotka liittyvät erityisesti sukukypsyyden saavuttamiseen, suositellaan tehtäväksi F1-sukupolven poikasille ennen vieroitusta ja/tai sen jälkeen, mikäli edellä mainittuja tutkimuksia ei ole tehty erillisten tutkimusten yhteydessä. F1-sukupolven vieroitetuista, paritukseen valituista poikasista tulee määrittää ikä emättimen avautuessa ja esinahan irtautuessa. Peräaukon ja sukupuolielinten välinen etäisyys on mitattava F1-sukupolven poikasilta syntymän jälkeisenä päivänä 0, mikäli F1-sukupolven sukupuolijakauman muutokset tai sukukypsyyden saavuttamisen ajoitus antavat siihen aihetta.
Toimintoja koskevia havaintoja ei tarvitse tehdä ryhmistä, jotka muutoin osoittavat selviä haittavaikutusten merkkejä (esimerkiksi merkittävä painonnousun väheneminen). Jos toiminnallisia tutkimuksia tehdään, niitä ei tule tehdä paritettaviksi valituille poikasille.
1.5.6 Ruumiinavaus
Rakenne-epämuodostumat tai patologiset muutokset tutkitaan makroskooppisesti lopettamisen tai tutkimuksen kuluessa sattuneen kuoleman yhteydessä kaikista poikasia saaneista eläimistä (P ja F1), kaikista poikasista, joissa on näkyviä epämuodostumia tai kliinisiä merkkejä, sekä yhdestä satunnaisesti F1- ja F2-sukupolvesta valitusta poikasesta kummastakin sukupuolesta ja kustakin poikueesta. Erityistä huomiota tulee kiinnittää lisääntymiselimiin. Kuolemaisillaan olevista poikasista, jotka lopetetaan inhimillisellä tavalla, sekä kuolleista poikasista (niiden ruumiin kunnon salliessa) tulee tutkia mahdolliset häiriöt ja/tai kuolinsyy, ja ruumiit tulee säilöä.
Kaikkien ensi kertaa poikineiden naaraiden kohduista tutkitaan implantaatiokohtien olemassaolo ja niiden määrä tavalla, joka ei haittaa histopatologista tutkimusta.
1.5.7 Elinten paino
Lopettamisen aikaan P- ja F1-sukupolven vanhemmilta määritetään ruumiinpaino sekä seuraavien elinten paino (parilliset elimet punnitaan erikseen):
|
— |
kohtu ja munasarjat, |
|
— |
kivekset ja lisäkivekset (kokonaispaino ja häntäosan paino), |
|
— |
eturauhanen, |
|
— |
rakkularauhaset ja eturauhasen etuosa sekä niiden nesteet ja eturauhanen (yhtenä kokonaisuutena), |
|
— |
aivot, maksa, munuaiset, perna, aivolisäke, kilpirauhanen ja lisämunuaiset sekä määritetyt kohde-elimet. |
F1- ja F2-sukupolvien ruumiinavaukseen valittujen poikasten paino määritetään lopetuksen yhteydessä. Kummastakin sukupuolesta ja kustakin poikueesta satunnaisesti valitulta poikaselta (katso kohta 1.5.6) punnitaan aivot, perna ja kateenkorva.
Ruumiinavaustulosten ja elinten punnitustulosten arvioinnissa tulee ottaa huomioon muissa toistuvaa annostelua käyttävissä tutkimuksissa tehdyt havainnot, milloin niitä on saatavissa.
1.5.8 Histopatologinen tutkimus
1.5.8.1 Poikasia saaneet eläimet
Poikasia saaneilta eläimiltä (P ja F1) irrotetaan seuraavat elimet ja kudokset tai niiden edustavat näytteet. Kudokset tai näytteet käsitellään fiksatiivilla ja säilötään sopivalla tavalla histopatologista tutkimusta varten.
|
— |
emätin, kohtu ja kohdunkaula sekä munasarjat (säilötään soveltuvassa fiksatiivissa), |
|
— |
yksi kives (säilötään Bouinin fiksatiivissa tai vastaavassa), yksi lisäkives, rakkularauhaset, eturauhanen ja sen etuosa, |
|
— |
etukäteen määritetyt kohde-elimet kaikilta paritukseen valituilta P- ja F1-eläimiltä. |
Kaikille paritukseen valituille ylimpiin annosryhmiin ja kontrolliryhmiin kuuluville P- ja F1-sukupolven eläimille tulee tehdä edellä mainittujen elinten ja kudosten täydellinen histopatologinen tutkimus. P-sukupolven eläinten munasarjojen tutkimus ei ole pakollinen. Elimet, joissa todetaan käsittelyyn liittyviä muutoksia, on tutkittava myös alemmissa ja keskikokoisissa annosryhmissä NOAEL-tason määrityksen helpottamiseksi. Lisäksi on tutkittava histopatologisin menetelmin lisääntymiselimet sellaisilta alempiin ja keskikokoisiin annosryhmiin kuuluvilta eläimiltä, joiden kohdalla epäillään vähentynyttä hedelmällisyyttä, toisin sanoen niiltä, jotka eivät pariutuneet, hedelmöityneet, siittäneet tai synnyttäneet terveitä poikasia, tai niiltä, joiden kiimasykliin tai sperman määrään, liikkuvuuteen tai morfologiaan testiaine vaikutti. Kaikki vakavat vauriot, kuten surkastumat tai kasvaimet on tutkittava.
Kivesten yksityiskohtaisella histopatologisella tutkimuksella (esimerkiksi Bouinin fiksatiivi, parafiinivalu ja 4–5 μm paksut poikittaisleikkeet) tulee määrittää käsittelyn aiheuttamat vaikutukset, kuten rauhaseen jääneet spermatidit, puuttuvat itusolukerrokset tai -tyypit, monitumaiset jättisolut tai spermatogeenisten solujen irtoaminen lumeniin (14). Koskemattomasta lisäkiveksestä tulee tutkia pää-, runko- ja häntäosa pitkittäisleikkeen avulla. Lisäkiveksestä tulee arvioida leukosyytti-infiltraatio, solutyyppien esiintyvyyden muutokset, aberrantit solutyypit sekä siemennesteen fagosytoosi. PAS- ja hematoksyliinivärjäystä voidaan käyttää urosten lisääntymiselinten tutkimukseen.
Imetyksen jälkeisen vaiheen munasarjojen pitäisi sisältää varhaismunarakkuloita ja kasvavia munarakkuloita sekä imetysvaiheen suuria keltarauhasia. Histopatologisessa tutkimuksessa olisi pystyttävä osoittamaan varhaismunarakkuloiden väheneminen kvalitatiivisesti. Varhaismunarakkuloiden kvantitatiivinen arvio tulee tehdä F1-sukupolven naaraille. Eläinten määrän, munasarjaleikkeen valinnan sekä leikkeen näytekoon tulee sopia käytettävään tilastolliseen arviointimenettelyyn. Tutkimuksessa on laskettava varhaismunarakkuloiden määrä, johon voidaan yhdistää pienten kasvavien munarakkuloiden määrä, jotta käsiteltyjä munasarjoja ja kontrolliryhmään kuuluvia munasarjoja voidaan verrata. (15) (16) (17) (18) (19).
1.5.8.2 Vieroitetut poikaset
Vakavasti epämuodostuneet kudokset ja kohde-elimet kaikilta poikasilta, joilla on ulkoisia epämuodostumia tai kliinisiä merkkejä, sekä yhdeltä sellaiselta F1- ja F2-sukupolvesta satunnaisesti valitulta poikaselta kummastakin sukupuolesta ja kustakin poikueesta, jota ei ole valittu paritukseen, käsitellään fiksatiivilla ja säilötään sopivalla tavalla histopatologista tutkimusta varten. Säilötyille kudoksille tehdään täydellinen histopatologinen määritys, jossa pääpaino on lisääntymiselinten tutkimisessa.
2. MÄÄRITYSTULOKSET
2.1 TULOSTEN KÄSITTELY
Tiedot raportoidaan yksilöittäin ja esitetään taulukossa, jossa on eritelty testiryhmittäin ja sukupolvittain eläinten määrä testin alussa, testin aikana kuolleiden tai inhimillisistä syistä lopetettujen eläinten määrä, milloin eläimet ovat kuolleet tai lopetettu, fertiilien eläinten määrä, tiineiden naaraiden määrä, niiden eläinten määrä, joissa myrkyllisyysvaikutuksia on havaittavissa, kuvaus havaituista myrkyllisyysvaikutuksista mukaan lukien myrkytysoireiden alkamisaika, kesto ja vakavuus, millaisia havaintoja vanhemmista ja poikasista on tehty, millaisia histopatologisia muutoksia on havaittu sekä kaikki asiaankuuluvat tiedot poikueesta.
Numeeriset tulokset arvioidaan sopivalla, yleisesti hyväksytyllä tilastollisella menetelmällä, joka on valittava tutkimusta suunniteltaessa ja jonka valinta on perusteltava. Annostasovasteiden tilastolliset mallit voivat olla avuksi tietojen analyysissa. Tutkimusselosteessa on oltava analyysimenetelmästä ja käytetystä tietokoneohjelmasta riittävät tiedot, jotta riippumaton arvioija/tilastoasiantuntija voi niiden avulla arvioida ja rekonstruoida analyysin.
2.2 TULOSTEN ARVIOINTI
Kaksi sukupolvea käsittävän lisääntymiskykyyn kohdistuvien myrkyllisyysvaikutusten tutkimuksen löydökset — mukaan lukien ruumiinavauslöydökset ja mikroskooppiset löydökset — on arvioitava havaittujen vaikutusten pohjalta. Arvioinnissa tulee todeta testiaineen annostason ja epämuodostumien tai häiriöiden — mukaan lukien vakavat vauriot, tietyt kohde-elimet, vaikutukset hedelmällisyyteen, kliiniset häiriöt, vaikutukset lisääntymiskykyyn ja poikueen kokoon/laatuun, ruumiinpainon muutokset, vaikutukset kuolleisuuteen sekä muut myrkyllisyysvaikutukset — esiintyvyyden ja vaikutusten vakavuuden välinen mahdollinen suhde. Testitulosten arvioinnissa on otettava huomioon testiaineen fysikokemialliset ominaisuudet ja toksikokineettiset tiedot, milloin jälkimmäisiä on saatavissa.
Asianmukaisesti toteutetussa lisääntymiskykyyn kohdistuvien myrkyllisyysvaikutusten tutkimuksessa pitäisi saada tyydyttävä arvio haitattomasta annostasosta sekä tietoa haittavaikutuksista lisääntymiskykyyn, synnytykseen, imetykseen sekä syntymän jälkeiseen kehitykseen mukaan lukien kasvu ja sukupuolinen kehitys.
2.3 TULOSTEN TULKINTA
Kaksi sukupolvea käsittävä lisääntymiskykyyn kohdistuvien myrkyllisyysvaikutusten tutkimus tuottaa tietoja toistuvan testiainealtistuksen vaikutuksista kaikissa lisääntymiskierron vaiheissa. Erityisesti tutkimus tuottaa tietoja lisääntymisfysiologisista muuttujista sekä poikasten kehityksestä, kasvusta, sukukypsyyden saavuttamisesta ja eloonjäämisestä. Tutkimuksen tulokset on tulkittava yhdessä subkroonisten, prenataalisen kehityksen aikaisten ja toksikokineettisten sekä muiden käytettävissä olevien tutkimustulosten kanssa. Tämän tutkimuksen tulosten pohjalta voidaan arvioida tietyn kemikaalin jatkotutkimustarve. Tulosten ekstrapolointi koskemaan ihmistä on validia rajoitetussa määrin. Tuloksia voidaan parhaiten käyttää haitattoman annostason ja ihmisille sallitun altistuksen määrittämiseen (20) (21) (22) (23).
3. TULOSTEN ILMOITTAMINEN
3.1. TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot:
|
|
Testiaine:
|
|
|
Kantaja-aine (tarvittaessa):
|
|
|
Koe-eläinlajit:
|
|
|
Testiolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
|
|
Johtopäätökset, mukaan lukien haitattoman altistustason (NOAEL) arvot emojen ja poikasten osalta. |
4. LÄHDELUETTELO
|
(1) |
Sadleir, R.M.F.S. (1979). Cycles and Seasons. Teoksessa: Reproduction in Mammals: I. Germ Cells and Fertilization, C.R. Auston and R.V. Short (toim.), Cambridge, New York. |
|
(2) |
Gray, L.E. et al., (1989). A Dose-Response Analysis of Methoxychlor-Induced Alterations of Reproductive Development and Function in the Rat. Fundamental and Applied Toxicology 12: 92–108. |
|
(3) |
Robb, G.W. et al., (1978). Daily Sperm Production and Epididymal Sperm Reserves of Pubertal and Adult Rats. Journal of Reproduction and Fertility 54: 103–107. |
|
(4) |
Klinefelter, G.R. et al., (1991). The Method of Sperm Collection Significantly Influences Sperm Motion Parameters Following Ethane Dimethanesulfonate Administration in the Rat. Reproductive Toxicology 5: 39–44. |
|
(5) |
Seed, J. et al. (1996). Methods for Assessing Sperm Motility, Morphology, and Counts in the Rat, Rabbit, and Dog: a Consensus Report. Reproductive Toxicology 10(3): 237–244. |
|
(6) |
Chapin, R.E. et al., (1992).Methods for Assessing Rat Sperm Motility. Reproductive Toxicology 6: 267–273 |
|
(7) |
Klinefelter, G.R. et al., (1992). Direct Effects of Ethane Dimethanesulphonate on Epididymal Function in Adult Rats: an In Vitro Demonstration. Journal of Andrology 13: 409–421. |
|
(8) |
Slott, V.L. et al., (1991). Rat Sperm Motility Analysis: Methodologic Considerations. Reproductive Toxicology 5: 449–458. |
|
(9) |
Slott, V.L. and Perreault, S.D., (1993). Computer-Assisted Sperm Analysis of Rodent Epididymal Sperm Motility Using the Hamilton-Thorn Motility Analyzer. Teoksessa: Methods in Toxicology, Part A., Academic, Orlando, Florida, s. 319–333. |
|
(10) |
Toth, G.P. et al. (1989). The Automated Analysis of Rat Sperm Motility Following Subchronic Epichlorhydrin Administration: Methodologic and Statistical Considerations. Journal of Andrology 10: 401–415. |
|
(11) |
Working, P.K. and M. Hurtt, (1987). Computerized Videomicrographic Analysis of Rat Sperm Motility. Journal of Andrology 8: 330–337. |
|
(12) |
Linder, R.E. et al., (1992). Endpoints of Spermatoxicity in the Rat After Short Duration Exposures to Fourteen Reproductive Toxicants. Reproductive Toxicology 6: 491–505. |
|
(13) |
Korenbrot, C.C. et al., (1977). Preputial Separation as an External Sign of Pubertal Development in the Male Rat. Biological Reproduction 17: 298–303. |
|
(14) |
Russell, L.D. et al., (1990). Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, Florida. |
|
(15) |
Heindel, J.J. and R.E. Chapin, (toim.) (1993). Part B. Female Reproductive Systems, Methods in Toxicology, Academic, Orlando, Florida. |
|
(16) |
Heindel, J.J. et al., (1989) Histological Assessment of Ovarian Follicle Number in Mice As a Screen of Ovarian Toxicity. Teoksessa: Growth Factors and the Ovary, A.N. Hirshfield (toim.), Plenum, New York, pp. 421–426. |
|
(17) |
Manson, J.M. and Y.J. Kang, (1989). Test Methods for Assessing Female Reproductive and Developmental Toxicology. Teoksessa: Principles and Methods of Toxicology, A.W. Hayes (toim.), Raven, New York. |
|
(18) |
Smith, B.J. et al,. (1991). Comparison of Random and Serial Sections in Assessment of Ovarian Toxicity. Reproductive Toxicology 5: 379–383. |
|
(19) |
Heindel, J.J. (1999). Oocyte Quantitation and Ovarian Histology. Teoksessa: An Evaluation and Interpretation of Reproductive Endpoints for Human Health Risk Assessment, G. Daston, and C.A. Kimmel, (toim.), ILSI Press, Washington, DC. |
|
(20) |
Thomas, J. A. (1991). Toxic Responses of the Reproductive System. Teoksessa: Casarett and Doull's Toxicology, M.O. Amdur, J. Doull, and C.D. Klaassen (toim.), Pergamon, New York. |
|
(21) |
Zenick, H. and E.D. Clegg, (1989). Assessment of Male Reproductive Toxicity: A Risk Assessment Approach. Teoksessa: Principles and Methods of Toxicology, A.W. Hayes (toim.), Raven Press, New York. |
|
(22) |
Palmer, A.K. (1981). Teoksessa: Developmental Toxicology, Kimmel, C.A. and J. Buelke-Sam (toim.), Raven Press, New York. |
|
(23) |
Palmer, A.K. (1978). Teoksessa: Handbook of Teratology, Vol. 4, J.G. Wilson and F.C. Fraser (toim.), Plenum Press, New York. |
B.36. MYRKKYKINETIIKKA
1. MENETELMÄ
1.1 JOHDANTO
Ks. Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Ks. Yleisjohdanto, osa B.
1.3 VERTAILUAINEET
Ei ole.
1.4 TESTIN PERIAATE
Testattavaa ainetta annetaan jotakin sopivaa annostelutapaa käyttäen. Ainetta voidaan antaa tutkimuksen tavoitteiden mukaan joko yhtenä tai useina annoksina määrätyn ajan kuluessa yhdelle tai usealle koe-eläinryhmälle. Tutkimuksen jälkeen määritetään tutkimuksen tavoitteiden mukaisesti aine ja/tai metaboliitit ruumiin nesteistä, kudoksista ja/tai eritteistä.
Tutkimukset voidaan suorittaa joko ’merkitsemättömillä’ tai ’merkityillä’ ainemuodoilla. Kun merkintää käytetään, se on tehtävä niin, että yhdisteestä saadaan mahdollisimman monipuolista tietoa.
1.5 LAATUKRITEERIT
Ei ole.
1.6 TESTIN KUVAUS
Testin valmistelu
Nuoria, terveitä täysikasvuisia eläimiä sopeutetaan koetiloihin vähintään viisi päivää ennen kokeen alkua. Koe-eläimet jaetaan satunnaisesti koeryhmiin. Erityistapauksissa voidaan käyttää hyvin nuoria, kantavia tai aiemmin käsiteltyjä eläimiä.
Koeolosuhteet
Koe-eläimet
Myrkkyjen kinetiikkaa tutkivissa testeissä voidaan käyttää yhtä tai useampaa koe-eläinlajia sen mukaan, mitä lajeja on käytetty tai käytetään muissa samaa ainetta koskevissa myrkyllisyystutkimuksissa. Jyrsijöitä käytettäessä niiden paino saa vaihdella korkeintaan ± 20 % keskipainosta.
Lukumäärä ja sukupuoli
Imeytymis- ja eritystesteissä kutakin annostasoa kohden on oltava neljä koe-eläintä. Sukupuoli on valinnainen, mutta tietyissä olosuhteissa voi olla tarpeen tutkia kumpaakin sukupuolta. Jos vasteessa on sukupuolten välisiä eroja, on testattava neljä eläintä kumpaakin sukupuolta. Kun testiin käytetään muita lajeja kuin jyrsijöitä, eläinten lukumäärä voi olla pienempi. Kun tutkitaan aineen jakautumista kudoksiin, alkuryhmän kokoa suunniteltaessa on otettava huomioon kunakin ajankohtana lopetettavien eläinten määrä sekaätutkittavien ajankohtien lukumäärä.
Kun tutkitaan metaboliaa, ryhmän koko sovitetaan tutkimuksen tarpeiden mukaiseksi. Moniannostutkimuksissa, joiden kuluessa suoritetaan useina ajankohtina tutkimuksia, ajankohtien lukumäärä ja suunniteltu eläimen/eläinten lopettaminen on otettava huomioon ryhmän kokoa suunniteltaessa siten, että ryhmässä on oltava vähintään kaksi eläintä. Ryhmän on oltava kooltaan sellainen, että siitä voidaan hyväksyttävästi määrittää testattavan aineen imeytyminen, tasanne ja poistuminen (tarvittaessa) sekä/tai metaboliitit.
Annostasot
Kerta-annosta käytettäessä annostasoja on oltava vähintään kaksi; myrkkyvaikutukseton alhainen annos ja korkea annos, joka saattaa aiheuttaa myrkkykineettisten parametrien muutoksia, tai jonka tuloksena on myrkkyvaikutuksia.
Toistuvaa annostelua käytettäessä alhainen annos on yleensä riittävä, mutta tietyissä olosuhteissa korkea annos voi olla tarpeen.
Annostelutapa
Myrkkykineettiset tutkimukset on tehtävä käyttäen samaa annostelutapaa ja samaa liuotinta kuin muissa myrkyllisyystutkimuksissa on käytetty tai suunnitellaan käytettäväksi. Testattavaa ainetta annetaan koe-eläinryhmille määrätyn pituisen ajan kuluessa yleensä suun kautta ruokintaletkulla tai ravinnon yhteydessä, ihon kautta tai hengitysteiden kautta. Testattavan aineen laskimonsisäistä annostusta voidaan käyttää muilla antotavoilla todetun imeytymisen vertailuun. Lisäksi laskimonsisäisen annostelun avulla saadaan nopeasti tietoja aineen jakautumisesta.
Liuottimen mahdollinen vaikutus testattavaan aineeseen on otettava huomioon. Huomiota on myös kiinnitettävä ruokintaletkulla ja ravinnon yhteydessä annetun testattavan aineen imeytymiseroihin ja ravinnon yhteydessä annetun annoksen tarkkaan määritykseen.
Eläinten tarkkailu
Eläimiä on tarkkailtava päivittäin ja myrkky- sekä muut kliiniset oireet, niiden alkaminen, vakavuusaste ja kesto on kirjattava.
Testin suorittaminen
Kun eläimet on punnittu, testattavaa ainetta annetaan valitulla tavalla. Tarvittaessa eläinten annetaan paastota ennen testattavan aineen antamista.
Imeytyminen
Imeytymisen nopeus ja laajuus voidaan määrittää usealla tavalla joko käyttämällä vertailuryhmiä (8) tai ilman niitä, kuten esimerkiksi:
|
— |
määrittämällä testattavan aineen määrä ja/tai metaboliitit eritteistä kuten virtsasta, sapesta, ulosteista, uloshengitetystä ilmasta ja ruumiiseen jäänyt osa, |
|
— |
vertaamalla koe- ja kontrolliryhmien ja/tai vertailuryhmien biologista vastetta (esimerkiksi akuutin myrkyllisyyden tutkimukset), |
|
— |
vertaamalla koe- ja vertailuryhmien munuaisten kautta erittynyttä ainetta ja/tai metaboliitteja, |
|
— |
määrittämällä testattavan aineen ja/tai sen metaboliittien plasmataso/aikakäyrän alle jäävä pinta-ala ja vertaamalla vertailuryhmästä saatuihin tuloksiin. |
Jakautuminen
Tällä hetkellä on käytettävissä kaksi jakautumisen analysointitapaa, joista voidaan käyttää jompaakumpaa tai molempia:
|
— |
koko ruumiin autoradiografian avulla saadaan hyödyllisiä kvalitatiivisia tietoja, |
|
— |
kvantitatiivisia tietoja saadaan lopettamalla eläimet eri aikoina altistuksen jälkeen ja määrittämällä kudosten ja elinten sisältämä testattavan aineen ja/tai metaboliittien pitoisuus ja määrä. |
Eritys
Eritystutkimuksiin käytetään virtsaa, ulosteita, uloshengitettyä ilmaa sekä joissakin tapauksissa sappea. Näistä eritteistä määritetään testattava aine ja/tai metaboliitit useita kertoja altistuksen jälkeen, kunnes joko 95 % annetusta aineesta on erittynyt tai seitsemän päivää on kulunut sen mukaan, kumpi ehdoista täyttyy ensin.
Joissakin tapauksissa voi olla syytä tutkia testattavan aineen erittymistä imettävien koe-eläinten maitoon.
Metabolia
Aineenvaihduntamäärityksiä tehtäessä biologiset näytteet analysoidaan sopivaa menetelmää käyttäen. Metaboliittien rakenteet on selvitettävä ja todennäköiset aineenvaihduntatiet arvioitava aikaisempien myrkyllisyystutkimuksien avoimeksi jättämien seikkojen selvittämiseksi. Aineenvaihduntateiden selvittämiseksi voi olla tarpeen suorittaa tutkimuksia soluviljelmillä.
Biokemiallisten tutkimusten avulla voidaan saada lisäselvityksiä aineenvaihdunnan suhteesta myrkyllisuuteen. Tällaisia tutkimuksia ovat esimerkiksi aineenvaihduntaentsyymien vaikutuksen määritys, endogeenisten proteiinittomien sulfhydryyliyhdisteiden poistuma ja aineen sitoutuminen makromolekyyleihin.
2. TULOKSET
Tulokset esitetään tutkimustyypin perusteella taulukkomuodossa, jota täydentää mahdollisuuksien mukaan graafinen esitys. Jokaisen testiryhmän osalta ilmoitetaan määritysten keskiarvo ja tilastollinen poikkeama suhteessa aikaan, annokseen, kudoksiin ja elimiin. Imeytymisaste ja eritteiden määrä ja kertymisnopeus on määritettävä asianmukaisin menetelmin. Aineenvaihduntatutkimuksista on ilmettävä määritettyjen metaboliittien rakenne ja mahdolliset aineenvaihduntatiet.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimuksen laadusta riippuen tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
koe-eläinlaji, kanta, hankintapaikka, ympäristöolosuhteet, ravinto, |
|
— |
selvitys aineen merkitsemistavasta, |
|
— |
annostasot ja -välit, |
|
— |
annostelutiet ja käytetyt liuottimet, |
|
— |
myrkky- ja muut vaikutukset, |
|
— |
testattavan aineen ja/tai metaboliittien määritystapa biologisista näytteistä ja uloshengitetystä ilmasta, |
|
— |
taulukko, jossa esitetään määritystulokset sukupuolen, annoksen, annostustavan, ajan, kudosten ja elinten suhteen, |
|
— |
imeytyminen ja erittyminen suhteessa aikaan, |
|
— |
biologisten näytteiden metaboliittien määritys- ja tunnistamistavat, |
|
— |
aineenvaihduntaa koskevat biokemialliset määritysmenetelmät, |
|
— |
todennäköiset aineenvaihduntatiet, |
|
— |
tulosten pohdinta, |
|
— |
tulosten tulkinta. |
3.2 ARVIOINTI JA TULKINTA
Ks. Yleisjohdanto, osa B.
4. LÄHDELUETTELO
Ks. Yleisjohdanto, osa B.
B.37. ORGANOFOSFAATTIEN AIHEUTTAMA VIIVÄSTYNYT NEUROTOKSISUUS AKUUTIN ALTISTUKSEN JÄLKEEN
1. MENETELMÄ
1.1 JOHDANTO
Aineiden toksisten vaikutusten arvioinnissa on tärkeää ottaa huomioon mahdollisuus, että tietyt aineluokat voivat aiheuttaa erityistä neurotoksisuutta, jota ei ehkä todeta muissa toksisuuskokeissa. Tiettyjen organofosfaattien on havaittu aiheuttavan viivästynyttä neurotoksisuutta, ja niitä tulisi pitää mahdollisina tutkimuskohteina.
Viivästynyttä polyneuropatiaa aiheuttavat aineet voidaan tunnistaa in vitro -seulontatesteillä. Negatiiviset tulokset näistä tutkimuksista eivät kuitenkaan todista, ettei testiaine ole neurotoksinen.
Ks. myös Yleisjohdanto, osa 8.
1.2 MÄÄRITELMÄT
Organofosfaatteja ovat varauksettomat organofosfaattiesterit, tioesterit tai organofosfori-, organofosfoni- tai organofosforamidihappoanhydridit tai samantyyppisten fosforotioidi-, fosfonotioidi- tai fosforotioamidihappoanhydridit tai muut tässä aineluokassa joskus tavattavat aineet, jotka voivat aiheuttaa viivästynyttä neurotoksisuutta.
Viivästynyt neurotoksisuus on oireryhmä, johon liittyy ataksian, selkäytimen ja ääreishermon distaalisten aksonopatioiden pitkittynyt viivästynyt ilmeneminen ja neuropatian kohde-esteraasin (NTE) esto ja vanheneminen hermokudoksessa.
1.3 VERTAILUAINEET
Vertailuainetta voidaan testata positiivisella verrokkiryhmällä sen osoittamiseksi, ettei testatun lajin vaste muutu laboratoriokoeolosuhteissa merkitsevästi.
Yksi esimerkki laajalti käytetystä neurotoksisesta aineesta on tri-o-tolyylifosfaatti (CAS 78-30-8, EINECS 201-103-5, CAS-nimistö: fosforihappo, tris(2-metyylifenyyli)esteri), tunnettu myös nimellä tris-o-kresyylifosfaatti.
1.4 KOEMENETELMÄN PERIAATE
Testiaine annostellaan kerta-annoksena suun kautta kanoille, joita on suojeltu akuuteilta kolinergisiltä vaikutuksilta silloin kun se on ollut tarkoituksenmukaista. Eläimiä havainnoidaan 21 päivän ajan käyttäytymispoikkeavuuksien, ataksian ja paralyysin suhteen. Kustakin ryhmästä satunnaisesti valituille kanoille tehdään biokemialliset määritykset, erityisesti neuropatian kohde-esteraasin (NTE) esto, yleensä 24 ja 48 tunnin kuluttua annostelusta. Kahdenkymmenenyhden päivän kuluttua altistuksesta loput kanat lopetetaan ja valitut hermokudokset tutkitaan histopatologisesti.
1.5 KOEMENETELMÄN KUVAUS
1.5.1 Valmistelut
Terveet nuoret täysikasvuiset kanat, joilla ei ole häiritseviä virussairauksia, lääkitystä eikä käynnin poikkeavuuksia, jaetaan satunnaisotannalla koe- ja verrokkiryhmiin ja niitä totutetaan laboratorio-olosuhteisiin vähintään viiden päivän ajan ennen tutkimuksen alkua.
Kokeessa käytettävien testihäkkien on oltava tarpeeksi tilavia, jotta kanat voivat liikkua vapaasti ja käynnin havainnointi käy helposti.
Testiainetta pitäisi yleensä annostella suun kautta mahaletkun avulla, liivatekapseleina tai vastaavalla menetelmällä. Nesteet voidaan antaa laimentamattomina tai liuotettuna sopivaan vehikkeliin, kuten maissiöljyyn. Kiinteät aineet tulee mahdollisuuksien mukaan liuottaa, koska suuret määrät kiinteää ainetta liivatekapseleissa eivät välttämättä imeydy tehokkaasti. Muiden kuin vesipitoisten vehikkelien toksiset ominaisuudet on oltava tiedossa ja jos ne eivät ole, on ne määritettävä ennen koetta.
1.5.2 Koeolosuhteet
1.5.2.1 Koe-eläimet
Kokeessa suositellaan käytettäväksi nuoria täysikasvuisia kanoja (Gallus gallus domesticus), jotka ovat iältään 8–12 kuukautta. Kanojen tulee olla normaalikokoisia, -lajisia ja -kantaisia ja mieluiten kasvatettu oloissa, joissa ne ovat voineet liikkua vapaasti.
1.5.2.2 Lukumäärä ja sukupuoli
Kokeessa tulee käyttää koeryhmän lisäksi yhtä vehikkeliä saavaa verrokkiryhmää ja yhtä positiivista verrokkiryhmää. Vehikkeliä saavaa verrokkiryhmää tulee käsitellä täsmälleen samoin kuin koeryhmää testiaineen annostelua lukuun ottamatta.
Kussakin ryhmässä tulee olla riittävä määrä lintuja, jotta vähintään kuusi lintua voidaan lopettaa biokemiallisia määrityksiä varten (kolme kanaa kahtena eri ajankohtana) ja kuusi lintua säilyy hengissä 21 päivän havaintojakson ajan patologisia tutkimuksia varten.
Positiivista verrokkiryhmää voidaan tutkia samanaikaisesti tai se voi olla tuore historiallinen verrokkiryhmä. Siinä on oltava vähintään kuusi kanaa, joita on käsitelty tunnetulla viivästynyttä neurotoksisuutta aiheuttavalla aineella. Näistä kuudesta kanasta kolmelle tehdään biokemialliset määritykset ja kolmelle patologiset tutkimukset. Historiallisten tietojen ajoittaista päivitystä suositellaan. Uusia positiivisia kontrollitietoja pitäisi kehittää, kun kokeen suorittava laboratorio muuttaa joitakin olennaisia seikkoja koekäytännössä (esim. kanta, ravinto, elinolosuhteet).
1.5.2.3 Annostasot
Päätutkimuksessa käytettävä annostaso on määritettävä alustavassa tutkimuksessa, johon sisältyy tarkoituksenmukainen määrä kanoja ja annostasoryhmiä. Jonkinasteinen letaliteetti alustavassa tutkimuksessa on tyypillisesti välttämätöntä riittävän annoksen määrittämiseksi päätutkimusta varten. Akuuttien kolinergisten vaikutusten aiheuttaman kuoleman estämiseksi voidaan kanoille antaa atropiinia tai muuta suoja-ainetta, joka ei tiettävästi vaikuta viivästyneisiin neurotoksisiin vasteisiin. Testiaineiden ei-letaali enimmäisannos voidaan määrittää erilaisilla koemenetelmillä (ks. menetelmä B.1 bis). Kanoja koskevat historialliset tiedot tai muut toksikologiset tiedot voivat helpottaa annosten valintaa.
Päätutkimuksen testiaineen annostason tulee olla mahdollisimman korkea ottaen huomioon alustavan annosvalintatutkimuksen tulokset ja 2 000 mg/kg:n yläraja-annos. Mahdollisesti ilmenevä kuolleisuus ei saisi olla niin laajaa, etteikö riittävä määrä eläimiä säilyisi hengissä 21. päivänä tehtäviä biokemiallisia (kuusi eläintä) ja histologisia (kuusi eläintä) tutkimuksia varten. Atropiinia tai muuta suoja-ainetta, jotka eivät tiettävästi vaikuta viivästyneisiin neurotoksisiin vasteisiin, tulisi käyttää akuuteista kolinergisistä vaikutuksista johtuvien kuolemien estämiseksi.
1.5.2.4 Raja-annoskoe
Jos kokeessa ei vähintään 2 000 mg/kg/vrk:n annostasolla tässä tutkimuksessa kuvatuilla toimenpiteillä todeta havaittavia toksisia vaikutuksia ja jos toksisuutta ei ole odotettavissa rakenteellisesti samantyyppisistä aineista olevien tietojen perusteella, tutkimusta suuremmalla annoksella ei pidetä tarpeellisena. Raja-annoskoe voidaan tehdä paitsi silloin kun odotettavissa oleva altistus ihmisellä viittaa tarpeeseen käyttää korkeampaa annostasoa.
1.5.2.5 Havainnointijakso
Havainnointijakso kestää 21 päivää.
1.5.3 Kokeen suorittaminen
Kun eläimille on annettu suoja-ainetta akuutista kolinergisestä vaikutuksesta johtuvan kuoleman estämiseksi, annostellaan testiaine kerta-annoksena.
1.5.3.1 Yleishavainnot
Havainnoinnin tulee alkaa heti käsittelyn alettua. Kaikkia kanoja tulee havainnoida tarkoin useita kertoja kahden ensimmäisen päivän aikana ja sen jälkeen vähintään kerran päivässä 21 päivän ajan tai siihen asti kunnes eläin aiotaan lopettaa. Kaikki toksisuusoireet tulee kirjata muistiin, mukaan lukien niiden alkamisajankohta, tyyppi, voimakkuus ja kesto. Ataksia tulee mitata vähintään neliportaisella ordinaaliasteikolla, ja paralyysi tulee kirjata muistiin. Patologisia tutkimuksia varten valitut kanat on päästettävä häkistä vähintään kahdesti viikossa ja pakotettava joksikin aikaa liikkumaan, kuten kiipeämään tikkaita, vähäisten toksisten vaikutusten havainnoinnin helpottamiseksi. Kuolemaisillaan olevat ja voimakasta kärsimystä tai kipua osoittavat eläimet tulee poistaa heti kun niiden tila huomataan ja lopettaa humaanilla tavalla ja niille tulee tehdä ruumiinavaus.
1.5.3.2 Ruumiinpaino
Kaikki kanat on punnittava juuri ennen testiaineen annostelua ja vähintään kerran viikossa sen jälkeen.
1.5.3.3 Biokemia
Kuusi satunnaisesti kustakin käsittelyä saavasta koeryhmästä ja vehikkeliä saavasta verrokkiryhmästä valittua kanaa sekä kolme kanaa positiivisesta verrokkiryhmästä (silloin kun tätä ryhmää tutkitaan samanaikaisesti) lopetetaan muutaman päivän kuluttua annostelusta ja niiden aivoista ja lannerangasta tehtyjä preparaatteja arvioidaan neuropatian kohde-esteraasin (NTE) estovaikutuksen osalta. Lisäksi voi olla hyödyllistä tehdä preparaatti lonkkahermokudoksesta neuropatian kohde-esteraasin (NTE) estovaikutuksen arvioimiseksi. Yleensä kolme lintua sekä verrokki- että kustakin koeryhmästä lopetetaan 24 tunnin kuluttua ja toiset kolme 48 tunnin kuluttua annostelusta. Positiivisesta kontrolliryhmästä sen sijaan lopetetaan kolme kanaa 24 tunnin kuluttua annostelusta. Jos havainnot myrkytyksen kliinisistä oireista (tämä voidaan usein arvioida havainnoimalla kolinergisten merkkien alkamisajankohtaa) viittaavat toksisen aineen erittäin hitaaseen eliminaatioon, voi olla suositeltavaa ottaa kudosnäyte kolmesta linnusta kahtena eri ajankohtana 24–72 tunnin sisällä annostelusta.
Näille näytteille voidaan tehdä myös asetyylikoliiniesteraasi (AChE)-analyysit, jos se katsotaan tarkoituksenmukaiseksi. AChE voi kuitenkin reaktivoitua spontaanisti in vivo ja johtaa aineen voimakkuuden aliarviointiin AChE:n estäjänä.
1.5.3.4 Silmämääräinen ruumiinavaus
Jokaisen eläimen (sekä lopetettavaksi suunniteltujen ja kuolemaisillaan olevien) silmämääräiseen ruumiinavaukseen tulee sisältyä aivojen ja selkäytimen ulkonäön havainnointi.
1.5.3.5 Histopatologinen tutkimus
Havainnointijaksosta hengissä säilyneiden ja biokemiallisissa tutkimuksessa käyttämättömien eläinten hermokudos tutkitaan mikroskooppisesti Kudokset on kiinnitettävä perusfuusiotekniikoilla in situ. Sektiot tulee ottaa pikkuaivoista (keskellä kulkeva pitkittäistaso), ydinjatkeesta, selkäytimestä ja ääreishermoista. Selkäydinsektiot tulee ottaa kaularangan yläosasta, rintarangan keskiosasta ja lannerstirangan alueelta. Säärihermon distaalialueelta ja sen kaksoiskantalihasta (m. gastrocnemicus) huoltavista haaroista ja lonkkahermosta otetaan näyte. Sektiot värjätään sopivalla myeliini- ja aksonispesifisillä aineilla.
2. TULOKSET
Negatiiviset tulokset tässä menetelmässä valituilla kohdevaikutuksilla (biokemia, histopatologia ja käyttäytymisen havainnointi) eivät normaalisti vaadi viivästyneen neurotoksisuuden lisätestausta. Kohdevaikutuksia koskevat epävarmat tai keskeneräiset tulokset voivat vaatia lisätutkimuksia.
Yksilötiedot on esitettävä. Ne on myös esitettävä yhteenvetona taulukossa, josta käy ilmi eläinten lukumäärä koeryhmittäin testin alussa, leesioita, käyttäytymis- tai biokemiallisia vaikutuksia osoittaneiden eläinten lukumäärä, leesio- tai vaikutustyypit ja niiden vaikeusaste sekä eläinten prosentuaaliset määrät kutakin erityyppistä ja vaikeusasteeltaan erilaisia leesioita tai vaikutusta kohti.
Tämän tutkimuksen tuloksia tulee arvioida käyttäytymis-, biokemiallisten ja histopatologisten vaikutusten esiintyvyyden, vaikeusasteen ja korrelaation perusteella ja kussakin koe- ja verrokkiryhmässä havaittujen muiden vaikutusten suhteen.
Numeerisia tuloksia tulee arvioida tarkoituksenmukaisin ja yleisesti hyväksytyin tilastollisin menetelmin. Tilastolliset menetelmät tulee valita tutkimuksen suunnitteluvaiheessa.
3. RAPORTOINTI
TESTIRAPORTTI
Testiraportin tulee mahdollisuuksien mukaan sisältää seuraavat tiedot:
|
|
Koe-eläimet:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta |
|
|
Johtopäätökset |
4. LÄHDELUETTELO
Tämä menetelmä on analoginen OECD TG 418:n kanssa.
B.38. ORGANOFOSFAATTIEN AIHEUTTAMA VIIVÄSTYNYT NEUROTOKSISUUS 28 PÄIVÄN TOISTUVAN ANNOSTELUN TUTKIMUKSESSA
1. MENETELMÄ
1.1 JOHDANTO
Aineiden toksisten vaikutusten arvioinnissa on tärkeää ottaa huomioon mahdollisuus, että tietyt aineluokat voivat aiheuttaa erityistä neurotoksisuutta, jota ei ehkä todeta muissa toksisuuskokeissa. Tiettyjen organofosfaattien on havaittu aiheuttavan viivästynyttä neurotoksisuutta, ja niitä tulisi pitää mahdollisina tutkimuskohteina.
Viivästynyttä polyneuropatiaa aiheuttavat aineet voidaan tunnistaa in vitro -seulontatesteillä. Negatiiviset tulokset näistä tutkimuksista eivät kuitenkaan todista, ettei testiaine ole neurotoksinen.
Tästä 28 päivää kestävästä viivästynyttä neurotoksisuutta koskevasta kokeesta saadaan tietoa mahdollisista terveyshaitoista, joita toistuvat altistukset rajoitetun aikajakson sisällä todennäköisesti aiheuttavat. Kokeesta saadaan tietoa annosvasteesta ja sen avulla voidaan arvioida haitatonta vaikutustasoa (NOAEL), mistä voi olla hyötyä altistuksen turvallisuusperusteiden määrittelyssä.
Ks. myös yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Organofosfaatteja ovat varauksettomat organofosfaattiesterit, tioesterit tai organofosfori-, organofosfoni- tai organofosforamidihappoanhydridit tai samantyyppisten fosforotioidi-, fosfonotioidi- tai fosforotioamidihappoanhydridit tai muut tässä aineluokassa joskus tavattavat aineet, jotka voivat aiheuttaa viivästynyttä neurotoksisuutta.
Viivästynyt neurotoksisuus on oireyhtymä, johon liittyy ataksian, selkäytimen ja ääreishermon distaalisten aksonopatioiden pitkittynyt viivästynyt ilmeneminen ja neuropatian kohde-esteraasin (NTE) esto ja vanheneminen hermokudoksessa.
1.3 KOEMENETELMÄN PERIAATE
Testiainetta annostellaan kanoille päivittäin suun kautta 28 päivän ajan. Eläimiä havainnoidaan vähintään kerran päivässä käyttäytymispoikkeavuuksien, ataksian ja paralyysin suhteen 14 päivän ajan viimeisestä annoksesta laskettuna. Kustakin ryhmästä satunnaisesti valituille kanoille tehdään biokemialliset määritykset, erityisesti neuropatian kohde-esteraasin (NTE) esto, yleensä 24 ja 48 tunnin kuluttua viimeisestä annoksesta. Kaksi viikkoa viimeisen annoksen jälkeen loput kanat lopetetaan ja valitut hermokudokset tutkitaan histopatologisesti.
1.4 KOEMENETELMÄN KUVAUS
1.4.1 Valmistelut
Terveet nuoret täysikasvuiset kanat, joilla ei ole häiritseviä virussairauksia, lääkitystä eikä käynnin poikkeavuuksia, jaetaan satunnaisotannalla koe- ja verrokkiryhmiin ja niitä totutetaan laboratorio-olosuhteisiin vähintään viiden päivän ajan ennen tutkimuksen alkua.
Kokeessa käytettävien testihäkkien on oltava tarpeeksi tilavia, jotta kanat voivat liikkua vapaasti ja käynnin havainnointi käy helposti.
Testiainetta annostellaan päivittäin seitsemänä päivänä viikossa mieluiten mahaletkun kautta tai liivatekapseleina. Nesteet voidaan antaa laimentamattomina tai liuotettuna sopivaan vehikkeliin, kuten maissiöljyyn. Kiinteät aineet tulee mahdollisuuksien mukaan liuottaa, koska suuret määrät kiinteää ainetta liivatekapseleissa eivät välttämättä imeydy tehokkaasti. Muiden kuin vesipitoisten vehikkelien toksiset ominaisuudet on oltava tiedossa ja jos ne eivät ole, on ne määritettävä ennen koetta.
1.4.2 Koeolosuhteet
1.4.2.1 Koe-eläimet
Kokeessa suositellaan käytettäväksi nuoria täysikasvuisia kanoja (Gallus gallus domesticus), jotka ovat iältään 8–12 kuukautta. Kanojen tulee olla normaalikokoisia, -lajisia ja -kantaisia ja mieluiten kasvatettu oloissa, joissa ne ovat voineet liikkua vapaasti.
1.4.2.2 Lukumäärä ja sukupuoli
Kokeessa tulee yleensä käyttää vähintään kolmea koeryhmää ja yhtä vehikkeliä saavaa verrokkiryhmää. Vehikkeliä saavaa verrokkiryhmää tulee käsitellä täsmälleen samoin kuin koeryhmää lukuun ottamatta testiaineen annostelua.
Kussakin ryhmässä tulee olla riittävä määrä lintuja, jotta vähintään kuusi lintua voidaan lopettaa biokemiallisia määrityksiä varten (kolme kanaa kahtena eri ajankohtana) ja kuusi lintua säilyy hengissä 14 päivän havaintojakson ajan patologiaa varten.
1.4.2.3 Annostasot
Annostasojen valinnassa tulee ottaa huomioon viivästynyttä neurotoksisuutta koskevan akuutin testin tulokset ja kaikki muut testiyhdisteestä saatavilla olevat toksisuus- tai kinetiikkatiedot. Korkein annostaso tulee valita siten, että se aiheuttaa toksisia vaikutuksia, mieluiten viivästynyttä neurotoksisuutta, mutta ei kuolemaa eikä ilmeistä kärsimystä. Tämän jälkeen annostasot valitaan asteittain alenevasti mahdollisen annosvasteen ja haitattoman vaikutustason (NOAEL) osoittamiseksi alhaisimmalla annostasolla.
1.4.2.4 Raja-annoskoe
Jos kokeessa ei vähintään 1 000 mg/kg/vrk:n annostasolla tässä tutkimuksessa kuvatuilla toimenpiteillä todeta havaittavia toksisia vaikutuksia ja jos toksisuutta ei ole odotettavissa rakenteellisesti samantyyppisistä aineista olevien tietojen perusteella, tutkimusta suuremmalla annoksella ei pidetä tarpeellisena. Raja-annoskoe voidaan tehdä paitsi silloin kun odotettavissa oleva altistus ihmisellä viittaa tarpeeseen käyttää korkeampaa annostasoa.
1.4.2.5 Havainnointijakso
Kaikkia eläimiä tulee havainnoida vähintään kerran päivässä altistusaikana ja 14 päivän ajan sen jälkeen, lukuun ottamatta eläimiä, joille aiotaan tehdä ruumiinavaus.
1.4.3 Kokeen suorittaminen
Eläimille annetaan testiainetta seitsemänä päivänä viikossa 28 päivän ajan.
1.4.3.1 Yleishavainnot
Havainnoinnin tulee alkaa heti käsittelyn alettua. Kaikkia kanoja tulee havainnoida tarkoin vähintään kerran päivässä kunakin 28 käsittelypäivänä ja 14 päivän ajan annostelun päätyttyä tai siihen asti kunnes eläin aiotaan lopettaa. Kaikki toksisuusoireet tulee kirjata muistiin, mukaan lukien niiden alkamisajankohta, tyyppi, voimakkuus ja kesto. Havaintoihin tulee sisältyä muun muassa käyttäytymispoikkeavuudet. Ataksia tulee mitata vähintään neliportaisella ordinaaliasteikolla ja paralyysi tulee kirjata muistiin. Kanat on päästettävä häkistä vähintään kahdesti viikossa ja pakotettava joksikin aikaa liikkumaan, kuten kiipeämään tikkaita, vähäisten toksisten vaikutusten havainnoinnin helpottamiseksi. Kuolemaisillaan olevat ja voimakasta kärsimystä tai kipua osoittavat eläimet tulee poistaa heti kun niiden tila huomataan ja lopettaa humaanilla tavalla ja niille tulee tehdä ruumiinavaus.
1.4.3.2 Ruumiinpaino
Kaikki kanat on punnittava juuri ennen testiaineen ensimmäistä annostelua ja vähintään kerran viikossa sen jälkeen.
1.4.3.3 Biokemia
Kuusi satunnaisesti kustakin käsittelyä saavasta koeryhmästä ja vehikkeliä saavasta verrokkiryhmästä valittua kanaa lopetetaan muutaman päivän kuluttua viimeisen annoksen antamisesta ja niiden aivoista ja lannerangasta tehtyjä preparaatteja arvioidaan neuropatian kohde-esteraasin (NTE) estovaikutuksen osalta. Lisäksi voi olla hyödyllistä tehdä preparaatti lonkkahermokudoksesta neuropatian kohde-esteraasin (NTE) estovaikutuksen arvioimiseksi. Tavallisesti kolme lintua sekä verrokki- että kustakin koeryhmästä lopetetaan 24 tunnin kuluttua ja toiset kolme 48 tunnin kuluttua viimeisestä annoksesta laskettuna. Jos tiedot akuutista tutkimuksesta tai muista tutkimuksista (esim. toksikokinetiikka) viittaavat siihen, että eläimet tulisi mieluiten lopettaa joinakin muina ajankohtina viimeisen annostelun jälkeen, tulisi näitä aikoja noudattaa ja perustelut dokumentoida.
Näille näytteille voidaan tehdä myös asetyylikoliiniesteraasi (AChE)-analyysit, jos se katsotaan tarkoituksenmukaiseksi. AChE voi kuitenkin reaktivoitua spontaanisti in vivo ja johtaa aineen voimakkuuden aliarviointiin AChE:n estäjänä.
1.4.3.4 Silmämääräinen ruumiinavaus
Jokaisen eläimen (sekä lopetettavaksi suunniteltujen ja kuolemaisillaan olevien) silmämääräiseen ruumiinavaukseen tulee sisältyä aivojen ja selkäytimen ulkonäön havainnointi.
1.4.3.5 Histopatologinen tutkimus
Havainnointijaksosta hengissä säilyneiden ja biokemiallisissa tutkimuksessa käyttämättömien eläinten hermokudos tutkitaan mikroskooppisesti. Kudokset on kiinnitettävä perfuusiotekniikoilla in situ. Sektiot tulee ottaa pikkuaivoista (keskellä kulkeva pitkittäistaso), ydinjatkeesta, selkäytimestä ja ääreishermoista. Selkäydinsektiot tulee ottaa kaularangan yläosasta, rintarangan keskiosasta ja lanneristirangan alueelta. Säärihermon distaalialueelta ja sen kaksoiskantalihasta (m. gastrocnemicus) huoltavista haaroista ja lonkkahermosta otetaan näyte. Sektiot värjätään sopivilla myeliini- ja aksonispesifisillä aineilla. Ensin tehdään mikroskooppitutkimukset verrokki- ja suuriannoksisen ryhmän eläinten säilytetyille kudoksille. Kun vaikutuksista suuriannoksisessa ryhmässä on näyttöä, tehdään mikroskooppitutkimukset myös keskisuurten ja pienen annoksen ryhmissä.
2. TULOKSET
Negatiiviset tulokset tässä menetelmässä valituilla kohdevaikutuksilla (biokemia, histopatologia ja käyttäytymisen havainnointi) eivät normaalisti vaadi viivästyneen neurotoksisuuden lisätestausta. Kohdevaikutuksia koskevat epävarmat tai keskeneräiset tulokset voivat vaatia lisätutkimuksia.
Yksilötiedot on esitettävä. Ne on myös esitettävä yhteenvetona taulukossa, josta käy ilmi eläinten lukumäärä koeryhmittäin testin alussa, leesioita, käyttäytymis- tai biokemiallisia vaikutuksia osoittaneiden eläinten lukumäärä, leesio- tai vaikutustyypit ja niiden vaikeusaste sekä eläinten prosentuaaliset määrät kutakin erityyppistä ja vaikeusasteeltaan erilaista leesiota tai vaikutusta kohti.
Tämän tutkimuksen tuloksia tulee arvioida käyttäytymis-, biokemiallisten ja histopatologisten vaikutusten esiintyvyyden, vaikeusasteen ja korrelaation perusteella ja kussakin koe- ja verrokkiryhmässä havaittujen muiden vaikutusten suhteen.
Numeerisia tuloksia tulee arvioida tarkoituksenmukaisin ja yleisesti hyväksytyin tilastollisin menetelmin. Tilastolliset menetelmät tulee valita tutkimuksen suunnitteluvaiheessa.
3. RAPORTOINTI
TESTIRAPORTTI
Testiraportin tulee mahdollisuuksien mukaan sisältää seuraavat tiedot:
|
|
Koe-eläimet:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta |
|
|
Johtopäätökset |
4. LÄHDELUETTELO
Tämä menetelmä on analoginen OECD RG 419:n kanssa.
B.39. UDS-TESTI NISÄKKÄIDEN MAKSASOLUILLA IN VIVO
1. MENETELMÄ
Tämä menetelmä on sama kuin OECD TG 486, Unscheduled DNA Synthesis (UDS) Test with Mammalian Liver Cells In Vivo (1997).
1.1 JOHDANTO
Nisäkkäiden maksasoluilla in vivo tehtävän UDS-testin (unscheduled DNA Synthesis (UDS) test) tarkoituksena on tunnistaa tutkittavat aineet, jotka aiheuttavat DNA:n korjautumista altistettujen eläinten maksasoluissa (1) (2) (3) (4).
Tällä in vivo -testillä voidaan tutkia kemiallisten aineiden genotoksisia vaikutuksia maksassa. Mitattava tulostapahtuma ilmaisee DNA-vaurion ja sen myöhemmän korjautumisen maksasoluissa. Elimistöön imeytyvät kemialliset aineet metaboloituvat yleensä pääasiassa maksassa. Se soveltuu siten hyvin DNA-vaurioiden mittaamiseen in vivo.
Jos on saatu viitteitä siitä, että tutkittava aine ei pääse kohdekudokseen, tätä testiä ei pidä käyttää.
Lopputapahtuma, S-vaiheen ulkopuolinen DNA-synteesi (unscheduled DNA-synthesis), mitataan määrittämällä radioaktiivisesti merkittyjen nukleosidien inkorporoitumista DNA:han solunjakautumissyklin S-vaiheen ulkopuolella. Yleisimmin käytetty menetelmä on tritiumilla merkityn tymidiinin (3H-TdR) inkorporoitumisen määrittäminen autoradiografisesti. In vivo UDS-testeissä käytetään pääasiassa rotan maksaa. Myös muita kudoksia kuin maksaa voidaan käyttää, mutta niitä ei kuvata tämän menetelmän yhteydessä.
UDS-vasteen toteaminen riippuu irtileikkautuneiden ja korvautuneiden DNA-segmenttien lukumäärästä vauriokohdassa. UDS-testi on sen vuoksi erityisen arvokas kemiallisten aineiden aiheuttamien ’pitkien DNA-pätkien korjautumisten’ (’longpatch repair’) (20–30 emästä) toteamisessa. Testin herkkyys on sen sijaan huomattavasti heikompi ’lyhyiden pätkien korjautumisen’ (’shortpatch repair’) (1–3 emästä) toteamisessa. Mutageenisia muutoksia saattaa lisäksi syntyä DNA-vaurioiden korjautumattomuuden, korjautumisvirheiden tai kahdentumisvirheiden seurauksena. UDS-vasteen laajuus ei anna viitteitä korjausprosessien luotettavuudesta. On myös mahdollista, että mutageeni reagoi DNA:n kanssa mutta DNA-vaurio ei korjaudu leikkautumiskorjautumisprosessin kautta. Koska tämä lopputapahtuma mitataan koko genomista, sen potentiaalinen herkkyys kompensoi sitä, ettei UDS-testi tuota spesifistä tietoa tutkittavan aineen mutageenisesta aktiivisuudesta.
Ks. myös Yleisjohdanto, osa B.
1.2 MÄÄRITELMÄT
Korjautuvat solut: jyvästen nettomäärä tumissa eli NNG-arvo on suurempi kuin etukäteen asetettu arvo, joka on määriteltävä testin suorittavassa laboratoriossa.
NNG-arvo (net nuclear grains): solujen UDS-aktiivisuuden kvantitatiivinen mitta autoradiografialla tehdyissä UDS-testeissä laskettuna siten, että sytoplasmisten jyvästen keskimääräinen lukumäärä tumaa vastaavilla sytoplasma-alueilla (CG) vähennetään tumissa havaittavien jyvästen (NG) lukumäärästä (NG): NNG = NG — CG. NNG-määrät lasketaan yksittäisistä soluista, minkä jälkeen luvut yhdistetään saman viljelmän solujen osalta, rinnakkaisviljelmien solujen osalta jne.
UDS (Unscheduled DNA Synthesis): DNA:n korjautumissynteesi sen jälkeen, kun kemiallisten aineiden tai fysikaalisten tekijöiden aiheuttaman vaurion alueen sisältävä DNA-jakso on leikkautunut irti ja poistunut kromosomista.
1.3 TESTIN PERIAATE
UDS-testi nisäkkään maksasoluilla in vivo osoittaa DNA korjautumissynteesin sen jälkeen, kun kemiallisten aineiden tai fysikaalisten tekijöiden aiheuttaman vaurion alueen sisältävä DNA-jakso on leikkautunut irti ja poistunut kromosomista. Testi perustuu yleensä 3H-TdR:n inkorporoitumiseen solujen DNA:han maksassa, jossa on yleensä vain vähän solusyklin S-vaiheessa olevia soluja. 3H-TdR:n inkorporoituminen määritetään yleensä autoradiografisesti, sillä tämä tekniikka ei ole herkkä S-vaiheessa oleville soluille kuten esimerkiksi nestetuikelaskenta.
1.4 TESTIN KUVAUS
1.4.1 Testin valmistelut
1.4.1.1 Eläinlajin valinta
Yleisesti käytetty eläinlaji on rotta, mutta myös muita soveltuvia nisäkäslajeja voidaan käyttää. Koe-eläinten on oltava yleisesti käytettyä laboratoriokantaa olevia nuoria terveitä täysikasvuisia eläimiä. Testin alkaessa eläinten painon vaihtelun on oltava minimaalista, enintään ± 20 % kummankin sukupuolen keskipainosta.
1.4.1.2 Asuinolot ja ruokinta
Yleiset olosuhteet ovat samat kuin osan B yleisjohdannossa mainitut, mutta kosteustavoitteen on oltava 50–60 %.
1.4.1.3 Eläinten valmistelu
Terveet nuoret täysikasvuiset eläimet jaetaan satunnaistetusti koe- ja kontrolliryhmiin. Häkit on sijoitettava siten, että häkin sijainnista johtuvat vaikutukset ovat mahdollisimman vähäisiä. Eläimet tunnistetaan yksilöllisesti ja pidetään häkeissään vähintään viisi päivää ennen tutkimuksen aloittamista, jotta ne ehtivät sopeutua laboratorio-olosuhteisiin.
1.4.1.4 Tutkittava aine / valmistelu
Kiinteät tutkittavat aineet liuotetaan tai sekoitetaan sopiviin liuottimiin tai kantaja-aineisiin ja laimennetaan tarvittaessa ennen kuin ne annetaan koe-eläimille. Nestemäiset tutkittavat aineet voidaan antaa suoraan tai laimentaa ennen antamista. Tutkittava aine on valmisteltava juuri ennen annostelua, paitsi jos sen säilyvyys on osoitettu stabiliteettitesteillä.
1.4.2 Koeolosuhteet
1.4.2.1 Liuotin/kantaja-aine
Liuottimella/kantaja-aineella ei saa olla myrkkyvaikutuksia käytetyillä annostasoilla, eikä sen käyttöön saa liittyä epäilyjä mahdollisista kemiallisista reaktioista tutkittavan aineen kanssa. Jos käytetään muita kuin hyvin tunnettuja liuottimia/kantaja-aineita, niiden käyttö on perusteltava niiden yhteensopivuuden osoittavilla tutkimustuloksilla. Ensisijaisesti on harkittava vesipitoisen liuottimen/kantaja-aineen käyttöä, mikäli se on mahdollista.
1.4.2.2 Kontrollit
Jokaiseen itsenäisesti suoritettavaan testin osaan on otettava mukaan rinnakkaiset positiiviset ja negatiiviset (liuotin/kantaja-aine) kontrollit. Kontrolliryhmän eläimiä on käsiteltävä samalla tavoin kuin koeryhmän eläimiä, mutta niille ei anneta tutkittavaa ainetta.
Positiivisten kontrolliaineiden on oltava aineita, joiden tiedetään aiheuttavan UDS-reaktion, kun niitä annetaan pitoisuuksina, joiden odotetaan aiheuttavan havaittavaa lisääntymistä taustaan verrattuna. Metabolista aktivaatiota vaativia positiivisia kontrolliaineita on käytettävä annoksina, jotka aiheuttavat kohtalaisen vasteen (4). Annokset on valittava siten, että vaikutukset ovat selvät mutta eivät heti paljasta lukijalle koodattujen objektilasien identiteettiä. Esimerkkejä positiivisista kontrolliaineista:
|
Näytteidenottoajat |
Aine |
CAS-nro |
EINECS-nro |
|
Varhaiset näytteidenottoajat (2–4 tuntia) |
N-nitrosodimetyyliamiini |
62-75-9 |
200-249-8 |
|
Myöhäiset näytteidenottoajat (12–16 tuntia) |
N-2-fluorenyyliasetamidi (2-AAF) |
53-96-3 |
200-188-6 |
Myös muita sopivia positiivisia kontrolliaineita voidaan käyttää. Positiiviset kontrolliaineet voidaan antaa myös muuta reittiä pitkin kuin testattava aine.
1.5 TESTIN SUORITTAMINEN
1.5.1 Eläinten lukumäärä ja sukupuoli
Koe-eläinten määrän on oltava riittävä testivasteen luonnollinen biologinen vaihtelu huomioon ottaen. Analysoitavissa olevia eläimiä on oltava vähintään kolme ryhmää kohti. Mikäli merkittävä tietokanta on kerätty jo aikaisemmin, rinnakkaisiin negatiivisiin ja positiivisiin kontrolliryhmiin tarvitaan vain yksi tai kaksi eläintä.
Vain toista sukupuolta, mieluiten uroksia, voidaan käyttää, mikäli tutkimusajankohtana on käytettävissä samalla eläinlajilla ja samalla altistustavalla tehtyjä tutkimuksia, joiden tulokset osoittavat, ettei myrkkyvaikutuksessa ole huomattavia eroja sukupuolten välillä. Jos ihmisen altistuminen tutkittavalle kemialliselle aineelle voi olla sukupuolesta riippuvaa, kuten joidenkin lääkeaineiden kohdalla, testi on tehtävä asianomaista sukupuolta olevilla eläimillä.
1.5.2 Altistusohjelma
Tutkittavia aineita annetaan yleensä yhtenä altistuksena.
1.5.3 Annostasot
Normaalisti käytetään vähintään kahta annostasoa. Suurin annos määritellään annokseksi, joka aiheuttaa sen kaltaisia myrkyllisyysoireita, että samalla annosteluohjelmalla suurempien annosten voitaisiin odottaa johtavan kuolemaan. Pienemmän annoksen pitäisi yleensä olla 50–25 % suuresta annoksesta.
Aineet, joilla on spesifisiä biologisia vaikutuksia pieninä, myrkyttöminä annoksina (kuten hormonit ja mitogeenit), saattavat edellyttää muita annoksenmäärityskriteerejä, ja ne pitäisi arvioida tapauskohtaisesti. Jos tehdään annoksenmääritystutkimus, koska soveltuvia tietoja ei ole käytettävissä, se on tehtävä samassa laboratoriossa käyttäen samaa lajia, samaa kantaa, samaa sukupuolta olevia eläimiä ja samaa annosteluohjelmaa kuin päätutkimuksessa on tarkoitus käyttää.
Suurin annos voidaan määritellä myös annokseksi, joka aiheuttaa joitakin myrkyllisyyteen viittaavia muutoksia maksassa (esim. pyknoottisia tumia).
1.5.4 Raja-annostesti
Ellei havaittavia myrkkyvaikutuksia esiinny testattaessa yhtä annostasoa, joka on vähintään 2 000 mg/kg (eläimen painokiloa kohti) ja joka annetaan kerta-annoksena tai kahtena annoksena saman päivän aikana, ja ellei genotoksisuutta ole odotettavissa kemialliselta rakenteeltaan samanlaisilla aineilla saatujen tutkimustulosten perusteella, täydellinen tutkimus ei ehkä ole välttämätön. Ihmisten odotettu altistus saattaa edellyttää suurempien annostasojen käyttöä raja-annostestissä.
1.5.5 Antotapa
Tutkittava aine annetaan yleensä ruokintaletkulla tai sopivalla intubaatiokanyylillä. Myös muut antotavat ovat mahdollisia, mikäli ne voidaan perustella. Vatsaontelonsisäistä annostelua ei kuitenkaan suositella, koska maksa saattaisi tällöin altistua tutkittavalle aineelle suoraan eikä verenkierron kautta. Koc-eläimen koosta riippuu, kuinka paljon nestettä voidaan antaa kerralla ruokintaletkun kautta tai injektiona. Määrä ei kuitenkaan saa olla yli 2 ml/100 g eläimen painon mukaan mitattuna. Mikäli käytetään suurempia nestemääriä, ne on perusteltava. Lukuun ottamatta ärsyttäviä tai syövyttäviä aineita, joiden vaikutukset yleensä pahenevat suurempia pitoisuuksia käytettäessä, nestemäärien vaihtelu olisi pidettävä mahdollisimman pienenä säätämällä tutkittavan aineen pitoisuuksia siten, että kokonaisnestemäärä pysyy samana kaikilla annostasoilla.
1.5.6 Maksasolujen preparointi
Maksasolut preparoidaan tutkittavalle aineelle altistetuista eläimistä yleensä 12–16 tunnin kuluttua annostelusta. Ylimääräinen varhaisempi näytteenottoajankohta (yleensä 2–4 tunnin kuluttua altistuksesta) on yleensä tarpeen, ellei selvää positiivista vastetta havaita 12–16 tunnin kuluttua. Myös muut näytteidenottoajankohdat ovat kuitenkin mahdollisia, mikäli ne voidaan perustella toksikokineettisten tutkimustulosten perusteella.
Lyhytaikaisviljelmät nisäkkäiden maksasoluista perustetaan yleensä siten, että maksaa perfusoidaan kollagenaasilla in situ ja tuoreiden irronneiden maksasolujen annetaan kiinnittyä sopivaan pintaan. Negatiivisista kontrollieläimistä kerättyjen maksasolujen elinkykyisyyden (5) pitäisi olla vähintään 50 prosenttia.
1.5.7 UDS:n määrittäminen
Hiljattain eristettyjä nisäkkäiden maksasoluja inkuboidaan yleensä 3H-TdR:ää sisältävässä kasvatusväliaineessa sopivan pituinen aika, esim. 3–8 tuntia. Inkubaatioajan päätyttyä kasvatusväliaine erotetaan soluista, minkä jälkeen soluja voidaan inkuboida kasvatusväliaineessa, joka sisältää ylimääräistä merkitsemätöntä tymidiiniä inkorporoitumattoman radioaktiivisuuden vähentämiseksi. Tämän jälkeen solut huuhdellaan, fiksoidaan ja kuivataan. Pitempiä inkubaatioaikoja käytettäessä käsittely merkitsemättömällä tymidiinillä ei ehkä ole tarpeen. Objektilasit kastetaan autoradiografiemulsioon, valotetaan pimeässä (esim. säilytetään jääkaapissa 7–14 päivää), kehitetään, värjätään ja lasketaan valottuneet hopeajyväset. Jokaisesta eläimestä valmistetaan 2–3 objektilasia.
1.5.8 Analyysi
Objektilasipreparaattien tulisi sisältää riittävästi soluja, joiden morfologia on normaali, jotta luotettava UDS-analyysi voidaan tehdä. Preparaateista tehdään mikroskooppitutkimus selvän sytotoksisuuden merkkien havaitsemiseksi (esim. pyknoosi, radioaktiivisuuden väheneminen).
Objektilasit on koodattava ennen jyvästen laskemista. Normaalisti jokaisesta eläimestä lasketaan 100 solua vähintään kahdesta objektilasista; jos lasketaan alle 100 solua/eläin, tämä on perusteltava. Jyvästen määrää ei lasketa S-vaiheessa olevista tumista, mutta S-vaiheessa olevien solujen suhteellinen osuus voidaan rekisteröidä.
Morfologisesti normaalien solujen tumaan ja sytoplasmaan inkorporoituneen 3H-TdR:n määrä, joka näkyy hopeajyvästen kertymänä, on määritettävä soveltuvilla menetelmillä.
Hopeajyvästen määrä määritetään tumien kohdalta (tumassa esiintyvät jyväset, NG) ja tumaa vastaavilta alueilta sytoplasman kohdalta (sytoplasmiset jyväset, CG). CG-määrät mitataan joko valitsemalla sytoplasmasta kaikkein eniten radioaktiivisesti merkittyä ainetta sisältävä alue tai valitsemalla keskimäärin kaksi tai kolme satunnaisesti valittua tuman vierestä laskettua sytoplasmisten jyvästen määrää. Myös muita laskentamenetelmiä (esim. kokosolulaskentaa) voidaan käyttää, jos ne voidaan perustella (6).
2. TULOKSET
2.1 TULOSTEN KÄSITTELY
Jokaisen objektilasin ja jokaisen eläimen tiedot on esitettävä erikseen. Lisäksi kaikkien tietojen yhteenveto on esitettävä taulukkomuodossa. Tumassa esiintyvien jyvästen nettomäärät (NNG) on laskettava jokaisesta solusta, jokaisesta eläimestä ja jokaisesta annoksesta ja ajankohdasta erikseen vähentämällä CG-lukemat NG-lukemista. Jos ’korjautuvat solut’ lasketaan, käsitteen ’korjautuvat solut’ kriteerit on perusteltava ja niiden on perustuttava negatiivisista kontrolleista aikaisemmin tai tämän tutkimuksen yhteydessä saatuihin tietoihin. Numeeriset tulokset voidaan arvioida tilastollisin menetelmin. Jos tilastollisia testejä käytetään, ne on valittava ja perusteltava ennen tutkimusta.
2.2 TULOSTEN ARVIOINTI JA TULKINTA
Esimerkkejä positiivisten/negatiivisten vasteiden kriteereistä:
|
positiivinen |
i) |
NNG-arvot ovat aikaisemmin asetettujen, laboratoriokohtaisiin vertailuarvoihin perustuvien kynnysarvojen yläpuolella; tai |
|
|
ii) |
NNG-arvot ovat merkitsevästi suurempia kuin rinnakkaisessa kontrollissa; |
|
negatiivinen |
i) |
NNG-arvot ovat laboratoriokohtaisiin vertailuarvoihin perustuvan kynnysarvon tasalla tai sen alapuolella; tai |
|
|
ii) |
NNG-arvot eivät ole merkitsevästi suuremmat kuin rinnakkaisessa kontrollissa. |
Tulosten biologista merkitystä on pohdittava: huomioitavia parametreja ovat eläinten väliset erot, annos-vastesuhde ja sytotoksisuus. Tilastollisia menetelmiä voidaan käyttää apuna testitulosten arvioinnissa. Tilastollinen merkitsevyys ei saa kuitenkaan olla ainoa määräävä tekijä positiivisen vasteen arvioinnissa.
Useimmissa testeissä saadaan selvästi positiivisia tai negatiivisia tuloksia, mutta joissakin harvinaisissa tapauksissa saatujen tulosten pohjalta ei voida tehdä varmoja päätelmiä tutkittavan aineen vaikutuksesta. Tulokset saattavat jäädä epäselviksi tai kyseenalaisiksi kokeen määrästä riippumatta.
Nisäkkäiden maksasoluissa in vivo tehdyssä UDS-testissä saadut positiiviset tulokset osoittavat, että tutkittava aine aiheuttaa nisäkkäiden maksasoluissa in vivo DNA-vaurioita, jotka S-vaiheen ulkopuolinen DNA-synteesi (unscheduled DNA synthesis) voi korjata in vitro. Negatiivinen tulos osoittaa, ettei tutkittava aine aiheuta koeolosuhteissa sellaisia DNA-vaurioita, jotka voidaan todeta tällä testillä.
Tutkittavan aineen tai sen metaboliittien todennäköistä pääsyä yleiseen verenkiertoon tai erityisesti kohdekudokseen on pohdittava.
3. RAPORTOINTI
TUTKIMUSSELOSTUS
Tutkimusselostuksen on sisällettävä seuraavat tiedot:
|
|
Liuotin/kantaja-aine:
|
|
|
Koe-eläimet:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
|
|
Johtopäätökset. |
4. KIRJALLISUUTTA
|
(1) |
Ashby, J., Lefevre, P. A., Burlinson, B. and Penman, M. G. (1985), An Assessment of the In Vivo Rat Hepatocyte DNA Repair Assay, Mutation Res., 156, s. 1–18. |
|
(2) |
Butterworth, B. E., Ashby, J., Bermudez, E., Casciano, D., Mirsalis, J., Probst, G. and Williams, G. (1987), A Protocol and Guide for the In Vivo Rat Hepatocyte DNA-Repair Assay, Mutation Res., 189, s. 123–133. |
|
(3) |
Kennelly, J. C., Waters, R., Ashby, J., Lefevre, P. A., Burlinson, B., Benford, D. J., Dean, S. W. and Mitchell, I. de G. (1993), In Vivo Rat Liver UDS Assay, in: Kirkland, D. J. and Fox, M., (eds) Supplementary Mutagenicity Tests: UKEM Recommended Procedures. UKEMS Subcommitte on Guidelines for Mutagenicity Testing. Report. Part II revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, s. 52–77. |
|
(4) |
Madle, S., Dean, S. W., Andrae, U., Brambilla, G., Burlinson, B., Doolittle, D. J., Furihata, C, Hertner, T., McQueen, C. A. and Mori, H. (1993), Recommendations for the Performance of UDS Tests In Vitro and In Vivo. Mutation Res., 312, s. 263–285. |
|
(5) |
Fautz, R., Hussain, B., Efstathiou, E. and Hechenberger-Freudl, C. (1993), Assessment of the Relation Between the Initial Viability and the Attachment of Freshly Isolated Rat Hepatocytes Used for the In Vivo/In Vitro DNA Repair Assay (UDS), Mutation Res., 291, s. 21–27. |
|
(6) |
Mirsalis, J. C., Tyson, C. K. and Butterworth, B. E. (1982), Detection of Genotoxic Carcinogens in the In Vivo/In Vitro Hepatocyte DNA Repair Assay, Environ. Mutagen, 4, s. 553–562. |
B.40. IN VITRO IHOSYÖVYTTÄVYYS: IHON SÄHKÖVASTUSMÄÄRITYSTESTI (TER)
1. MENETELMÄ
Tämä menetelmä vastaa OECD:n testiohjetta nro TG 430 (2004)
1.1. JOHDANTO
Ihosyövyttävyydellä tarkoitetaan palautumattoman kudosvaurion ilmenemistä ihossa testiaineen aplikaation jälkeen [määritelmä sisältyy GHS-järjestelmään (Globally Harmonised System for the Classification and Labelling of Chemical Substances and Mixtures)] (1). Seuraavassa kuvatulla testimenetelmällä voidaan arvioida syövyttävyys tarvitsematta käyttää eläviä koe-eläimiä.
Ihosyövyttävyyden arviointi on tyypillisesti edellyttänyt koe-eläinten käyttöä (2). Huoli testissä käytettäville eläimille aiheutuvasta kärsimyksestä on otettu huomioon testimenetelmän B.4 tarkistetussa versiossa, jossa ihosyövyttävyys voidaan määrittää käyttämällä vaihtoehtoisia in vitro -menetelmiä, joissa eläimille ei aiheuteta kipua tai kärsimystä.
Sääntelytarkoituksiin käytettävien vaihtoehtoisten ihosyövyttävyystestien kehittäminen aloitettiin validointia edeltävillä tutkimuksilla (3). Tämän jälkeen tehtiin ihosyövyttävyyden arviointiin käytettävien in vitro -menetelmien (4) (5) virallinen validointitutkimus (6) (7) (8). Näiden tutkimusten tulokset ja muu julkaistu kirjallisuus johtivat siihen suositukseen, että ihosyövyttävyyden arviointiin in vivo voitaisiin käyttää seuraavia testejä (9) (10) (11): ihmisihomallitesti (testimenetelmä B.40 a) ja sähkövastusmääritystesti (tässä kuvattu menetelmä).
Validointitutkimus ja muut julkaistut tutkimukset osoittivat, että rotan ihon sähkövastusmäärityksellä (TER) (12) (13) voidaan luotettavasti erottaa tunnetut ihoa syövyttävät kemikaalit sellaisista kemikaaleista, jotka eivät syövytä ihoa (5) (9).
Tässä kuvatulla testimenetelmällä voidaan tunnistaa syövyttävät kemialliset aineet ja seokset. Sillä voidaan tunnistaa myös sellaiset aineet ja seokset, jotka eivät syövytä ihoa, kunhan tukena on muista käytettävissä olevista tiedoista saatua näyttöä (esim. pH, rakenne-aktiivisuussuhteet, koehenkilöillä ja/tai -eläimillä tehdyistä kokeista saadut tiedot) (1) (2) (11) (14). Se ei tarjoa tietoa ihoärsytyksestä, eikä sen perusteella ole mahdollista luokitella syövyttäviä aineita GHS-järjestelmän (Globally Harmonised Classification System) mukaisiin alaluokkiin (1).
Haluttaessa arvioida kattavasti ihoaltistuksen jälkeiset paikalliset ihovaikutukset suositellaan käytettäväksi testimenetelmän B.4 liitteessä esitettyä monivaiheista testausta (2), joka on esitetty GHS-järjestelmässä (1). Kyseiseen testaukseen kuuluu ihosyövyttävyystestien (tässä kuvattu testimenetelmä) ja ihoärsytystestien suorittaminen in vitro ennen testauksen harkitsemista elävillä eläimillä.
1.2. MÄÄRITELMÄT
Ihosyövyttävyys in vivo: korjautumattoman ihovaurion eli orvaskeden läpi verinahkaan ulottuvan näkyvän kuolion ilmaantuminen enintään neljä tuntia kestäneen testiaineen annostelun jälkeen. Tyypillisiä syöpymisreaktioita ovat haavaumat, verenvuoto, veriset ruvet sekä 14 päivän tarkkailujakson lopussa ihon vaalenemisen aiheuttama värinmuutos, kokonaan kaljuuntuneet alueet ja arvet. Epäselvien vaurioiden tapauksessa olisi harkittava histopatologista tutkimusta.
Ihon sähkövastus (TER) on ihon sähköisen impedanssin mittayksikkö (kilo-ohmeina). Kyseessä on ihon suojaavan vaikutuksen arviointiin käytettävä yksinkertainen ja luotettava menetelmä, jossa rekisteröidään ihon läpi kulkevat ionit Wheatstone-siltamittauksella.
1.3. VERTAILUAINEET
Taulukko 1
Vertailukemikaalit
|
Nimi |
EINECS-numero |
CAS-numero |
|
|
1,2-Diaminopropaani |
201-155-9 |
78-90-0 |
Erittäin syövyttävä |
|
Akryylihappo |
201-177-9 |
79-10-7 |
Erittäin syövyttävä |
|
2-tert-Butyylifenoli |
201-807-2 |
88-18-6 |
Syövyttävä |
|
Kaliumhydroksidi (10 %) |
215-181-3 |
1310-58-3 |
Syövyttävä |
|
Rikkihappo (10 %) |
231-639-5 |
7664-93-9 |
Syövyttävä |
|
Oktaanihappo (kapryylihappo) |
204-677-5 |
124-07-02 |
Syövyttävä |
|
4-Amino-1,2,4-triatsoli |
209-533-5 |
584-13-4 |
Ei syövyttävä |
|
Eugenoli |
202-589-1 |
97-53-0 |
Ei syövyttävä |
|
Fenetyylibromidi |
203-130-8 |
103-63-9 |
Ei syövyttävä |
|
Tetrakloorietyleeni |
204-825-9 |
27-18-4 |
Ei syövyttävä |
|
Isosteariinihappo |
250-178-0 |
30399-84-9 |
Ei syövyttävä |
|
4-(Metyylitio)-bentsaldehydi |
222-365-7 |
3446-89-7 |
Ei syövyttävä |
Useimmat taulukossa mainituista kemikaaleista on valittu ECVAM:in kansainvälisessä validointitutkimuksessa käytettyjen kemikaalien joukosta (4). Ne valittiin seuraavilla perusteilla:
|
i) |
Syövyttäviä ja ei-syövyttäviä aineita on oltava yhtä paljon. |
|
ii) |
Niiden on oltava kaupallisesti saatavilla olevia aineita, jotka kattavat useimmat relevantit kemikaaliluokat. |
|
iii) |
Mukana on oltava sekä erittäin syövyttäviä että vähemmän syövyttäviä aineita, jotta mahdollistettaisiin syövyttävyysvoimakkuuden mukainen luokittelu. |
|
iv) |
Kemikaaleja on voitava käsitellä laboratoriossa aiheuttamatta vakavia riskejä (syövyttävyyttä lukuun ottamatta). |
1.4. TESTIMENETELMÄN PERIAATE
Testiainetta aplikoidaan enintään 24 tunnin ajan ihonäytteiden orvaskesipinnalle kaksikammioisessa testijärjestelmässä, jossa ihonäytelevyt toimivat kammioiden välisenä erotusseinänä. Ihonäytteet otetaan inhimillisellä tavalla lopetetuista 28–30 päivän ikäisistä rotista. Aineen katsotaan olevan syövyttävä, jos marraskesi tulee läpäiseväksi, mikä mitataan ihon sähkövastuksen pienenemisenä tietyn raja-arvon alapuolelle (12). Rotan ihon sähkövastuksen raja-arvoksi valittiin 5 kΏ. Valinta perustui laajoihin tietoihin useista kemikaaleista, joiden osalta arvot olivat (valtaenemmistössä) selvästi yli kyseisen arvon (usein > 10 kΩ) tai ali sen (usein < 3 kΩ). Yleensä materiaalit, jotka eivät ole syövyttäviä eläimissä (mutta voivat olla joko ärsyttäviä tai ei-ärsyttäviä), eivät laske ihon sähkövastusta alle kyseisen erottavan arvon. Lisäksi muiden ihonäytteiden tai muiden laitteiden käyttö voi muuttaa raja-arvoa, mikä edellyttää lisävalidointia.
Testimenetelmään lisätään väriaineensitomisvaihe, jotta voidaan vahvistaa positiiviset tulokset tapauksissa, joissa arvo on lähellä 5 kΩ:ia. Väriaineensitomisvaiheessa voidaan määrittää, johtuuko ionien läpäisykyvyn lisääntyminen marraskeden rakenteen tuhoutumisesta. Rotan ihoa käyttävän menetelmän on osoitettu kykenevän ennustamaan syövyttävyyttä in vivo kanissa, jota käytettiin koe-eläimenä testimenetelmän B.4 mukaisessa testissä (2). On huomattava, että in vivo -kanitesti on karkea ihosyövyttävyyden ja -ärsytyksen suhteen verrattuna ihmisiholla suoritettavaan lapputestiin (15).
1.5. TESTIMENETELMÄN KUVAUS
1.5.1. Eläimet
Testiä varten valittu laji on rotta, koska rottien ihon herkkyys testattaville kemikaaleille on osoitettu aikaisemmissa tutkimuksissa (10). Rotan iällä (jossa ihonäyte otetaan) ja kannalla on erityinen merkitys, sillä testi edellyttää, että rottien karvatupet ovat vielä uinuvassa tilassa ennen aikuisen yksilön karvankasvun alkua.
Nuorten (noin 22 päivän ikäisten) uros- tai naarasrottien (Wistar tai vastaava kanta) selästä ja kyljistä ajetaan karvat tarkasti pienillä karvaleikkureilla. Eläimet pestään pyyhkimällä huolellisesti, ja aluetta, jolta on poistettu karvat, käsitellään runsaalla määrällä antibioottiliuosta (jossa on bakteerikasvua tehokkaasti estävät pitoisuudet esim. streptomysiiniä, penisilliiniä, kloramfenikolia ja amfoterisiiniä). Eläimet pestään jälleen antibioottiliuoksella kolmantena tai neljäntenä päivänä ensimmäisen pesun jälkeen ja käytetään kokeisiin kolmen päivän sisällä toisesta pesusta, kun marraskesi on toipunut karvojen poistosta.
1.5.2. Ihonäytteiden valmistus
Eläimet lopetetaan inhimillisesti 28–30 päivän ikäisinä; ikävaatimus on ehdoton. Kunkin eläimen selkä- ja kylkinahka poistetaan ja nahasta kuoritaan tarkasti ylimääräinen ihonalainen rasva. Ihosta otetaan läpimitaltaan noin 20 mm:n suuruiset näytteet. Ihonäytteet voidaan varastoida ennen niiden käyttöä, jos voidaan osoittaa, että positiivisilla ja negatiivisilla kontrolleilla saatavat tiedot vastaavat tuoreilla näytteillä saatuja.
Kukin ihonäyte asetetaan polytetrafluoroetyleeniputken (PTFE-putken) toisen pään yli siten, että orvaskesipinta on kosketuksissa putken kanssa. Ihonäyte kiristetään paikalleen kumisella O-renkaalla, ja liika nahka leikataan pois. Kuvassa 2 esitetään putken ja O-renkaan mitat. O-rengas tiivistetään huolellisesti PTFE-putken päähän vaseliinilla. Putki kiinnitetään jousipidikkeellä koeastian sisälle, jossa on MgSO4-liuosta (154 mM) (kuva 1). Ihonäyte on kokonaan upotettava MgSO4-liuokseen. Yhdestä rotan nahasta on mahdollista saada 10–15 ihonäytettä.
Ennen testauksen alkua mitataan kahden ihonäytteen sähkövastus kunkin eläimen nahan laadunvarmistusmenettelynä. Kummankin näytteen vastusarvon on oltava yli 10 kΩ, jotta muita nahasta saatuja ihonäytteitä voidaan käyttää testissä. Jos vastusarvo on alle 10 kΩ, kaikki samasta nahasta saadut näytteet on hylättävä.
1.5.3. Testi-ja kontrolliaineen aplikoiminen
Kussakin testissä on käytettävä samaan aikaan tehtyjä positiivisia ja negatiivisia kontrollimäärityksiä, jotta voidaan varmistaa testimallin riittävä suorituskyky. Testissä käytetään vain yhdestä eläimestä otettuja ihonäytteitä. Suositellut kontrolliaineet ovat 10 M suolahappo (positiivinen kontrolli) ja tislattu vesi (negatiivinen kontrolli).
Nestemäiset testiaineet (150 μl) aplikoidaan tasaisesti putken sisäpuolella olevalle orvaskesipinnalle. Kun testataan kiinteitä aineita, ainetta on pantava tasaisesti näytepalan päälle riittävä määrä, että se peittää koko orvaskesipinnan. Kiinteän aineen päälle lisätään sitten deionisoitua vettä (150 μl) ja putkea ravistellaan varovasti. Jotta kiinteä testiaine olisi mahdollisimman hyvin kosketuksissa ihon kanssa, ainetta voidaan sulattaa tai pehmentää lämmittämällä se 30 oC:een tai se voidaan jauhaa rakeiseksi tai pulverimaiseksi.
Kutakin testi-ja kontrolliainetta varten käytetään kolme ihonäytettä. Testiaineita aplikoidaan 24 tunnin ajaksi lämpötilassa 20–23 oC. Testiaine poistetaan pesemällä vesihanan alla enintään 30 oC:n lämpötilassa, kunnes ainetta ei enää irtoa.
1.5.4. Ihon sähkövastuksen mittaukset
Ihon impedanssi mitataan ihon sähkövastuksena matalajännitevaihtovirtasillalla (Wheatstone-silta) (13). Sillan yleiset eritelmät ovat: käyttöjännite 1–3 volttia, vaihtovirta 50–1 000 Hz (sini- tai suorakaideaalto) ja mittausalue vähintään 0,1-30 kΩ. Validointitutkimuksessa käytetty silta mittasi induktanssin aina arvoon 2 000 H, kapasitanssin arvoon 2 000 μF ja vastuksen arvoon 2 MΩ taajuuksilla 100 Hz tai 1 kHz sarja-arvoina tai rinnakkaisina arvoina. Ihon sähkövastusmääritystä varten mittaukset kirjataan vastuksena taajuudella 100 Hz ja sarja-arvoina. Ennen sähkövastuksen mittausta ihon pintajännitystä pienennetään lisäämällä putkeen 70-prosenttista etanolia riittävästi orvaskeden peittämiseksi. Etanoli poistetaan putkesta muutaman sekunnin kuluttua, ja kudos hydratoidaan lisäämällä 3 ml MgSO4-liuosta (154 mM). Mittaussillan elektrodit asetetaan ihonäytteen molemmille puolille vastuksen mittaamiseksi kilo-ohmeina ihonäytettä kohti (kuva 1). Elektrodien mitat ja hauenleukapidikkeen alapuolella olevan elektrodin pituus esitetään kuvassa 2. Sisemmän elektrodin pidike pidetään mittauksen aikana PTFE-putken päällä sen varmistamiseksi, että sama pituusmäärä elektrodia on upotettuna MgSO4-liuokseen. Ulompi elektrodi asetetaan koeastian sisälle siten, että se lepää astian pohjalla. Jousipidikkeen ja PTFE-putken pohjan välinen etäisyys pidetään vakiona (kuva 2), koska tämä etäisyys vaikuttaa mitattavaan vastuksen arvoon. Samoin sisemmän elektrodin ja ihonäytteen välisen etäisyyden on oltava vakio ja mahdollisimman pieni (1–2 mm).
Jos mitattu vastuksen arvo on yli 20 kΩ, se voi johtua siitä, että jäljellä oleva testiaine peittää ihonäytteen orvaskesipinnan. Tätä kerrosta voidaan yrittää poistaa esim. sulkemalla PTFE-putki peukalolla (hansikas kädessä) ja ravistelemalla putkea noin 10 sekuntia; MgSO4-liuos heitetään pois ja vastusmittaus toistetaan tuoreen MgSO4 -liuoksen kanssa.
Testauslaitteiden ominaisuudet ja mitat sekä koemenetelmä voivat vaikuttaa saatuihin ihon sähkövastusarvoihin. Viiden kΩ:n syövyttävyysraja perustuu tässä ohjeessa selostetuilla erityislaitteilla ja -menetelmällä saatuihin mittaustuloksiin. Jos testiolosuhteita muutetaan tai jos käytetään erilaisia laitteita, voi olla tarpeen käyttää eri raja- ja kontrolliarvoja. Siksi on tarpeen kalibroida menetelmä ja vastuksen raja-arvot testaamalla vertailukemikaaleja, jotka on valittu validointitutkimuksessa käytettyjen kemikaalien joukosta (4) (5) tai vastaavista kemikaaliluokista kuin testattavat kemikaalit. Taulukossa 1 on luettelo sopivista vertailukemikaaleista.
1.5.5. Väriaineen sitomista mittaavat menetelmät
Altistus tietyille ei-syövyttäville materiaaleille voi vähentää vastusta alle raja-arvon 5 kΩ ja mahdollistaa ionien pääsyn marraskeden läpi ja sitä kautta vähentää sähkövastusta (5). Esimerkiksi neutraalit orgaaniset aineet ja pinta-aktiiviset kemikaalit (mm. puhdistusaineet, emulgointiaineet ja muut pinta-aktiiviset aineet) voivat poistaa ihon lipidejä ja lisätä ihon läpäisevyyttä ioneille. Niinpä jos testiaineilla saadut ihon sähkövastusarvot ovat alle tai noin 5 kΩ, mutta näkyvää vauriota ei ole, on määritettävä väriaineen tunkeutuminen kontrollinäytteiden ja käsiteltyjen näytteiden kudokseen sen määrittämiseksi, ovatko ihon sähkövastusarvot tulosta ihon läpäisevyyden kasvusta vai ihon syöpymästä (3) (5). Kun on kyse syöpymästä, jossa marraskesi on vaurioitunut, ihon pinnalle aplikoitu sulforodamiini B -väriaine tunkeutuu nopeasti ihoon ja värjää pinnanalaisen kudoksen. Kyseinen väriaine on stabiili useiden eri kemikaalien kanssa, eikä alla kuvattu uuttomenettely vaikuta siihen.
1.5.5.1. Sulforodamiini B -väriaineen aplikaatio ja poistaminen
Ihon sähkövastusmäärityksen jälkeen magnesiumsulfaattiliuos poistetaan putkesta. Tämän jälkeen tutkitaan tarkasti, onko ihossa vaurioita. Jos ilmeisiä vaurioita ei ole, kunkin ihonäytteen orvaskesipinnalle aplikoidaan 2 tunniksi 150 μl 10-prosenttista (paino/tilavuus) sulforodamiini B -liuosta (Acid Red 52; C.I. 45100; EINECS-numero 222-529-8; CAS-numero 3520-42-1) tislatussa vedessä. Ihonäytteitä pestään sen jälkeen vesihanan alla huoneenlämpötilassa noin 10 sekuntia liian tai sitoutumattoman väriaineen poistamiseksi. Ihonäytteet poistetaan varovasti PTFE-putkista ja pannaan pulloon (esim. 20 ml:n lasinen tuikelaskentapullo), jossa on deionisoitua vettä (8 ml). Pulloja ravistellaan varovasti 5 minuuttia mahdollisen jäljellä olevan sitoutumattoman väriaineen poistamiseksi. Huuhtelu toistetaan. Ihonäytteet otetaan pulloista, pannaan toisiin pulloihin, joissa on 5 ml 30-prosenttista (paino/tilavuus) natriumdodekyylisulfaattia (SDS) tislatussa vedessä, ja inkuboidaan yli yön 60 oC:ssa.
Inkubaation jälkeen ihonäytteet otetaan pulloista ja heitetään pois. Jäljellä olevaa liuosta sentrifugoidaan 8 minuuttia 21 oC:ssa (suhteellinen keskipakoisvoima ~175 x g). Supernatantista otetaan 1 ml:n näyte, joka laimennetaan 1:5:een (tilavuus/tilavuus) [ts. 1 ml + 4 ml] 30-prosenttisella (paino/tilavuus) SDS:llä tislatussa vedessä. Liuoksen optinen tiheys (OD) mitataan aallonpituudella 565 nm.
1.5.5.2. Väriaineen pitoisuuden laskeminen
Sulforodamiini B -väriaineen pitoisuus ihonäytteessä lasketaan OD-arvoista (5) (sulforodamiini B:n molaarinen ekstinktiokerroin aallonpituudella 565 nm = 8,7 × 104; molekyylipaino = 580). Väriaineen pitoisuus ihonäytteessä määritellään käyttämällä sopivaa kalibrointikäyrää, ja väriaineen keskiarvopitoisuus lasketaan sitten rinnakkaisnäytteistä.
2. TULOKSET
Testiaineiden ja positiivisten ja negatiivisten kontrollien vastusarvot (kΩ) ja väriainepitoisuuden keskiarvot (μg/näyte) on esitettävä taulukkomuodossa (yksittäiset koetulokset ja keskiarvot ± keskihajonta). Samoin esitetään rinnakkaiskokeista tai toistetuista kokeista saadut tulokset, keskiarvot ja yksittäiset arvot.
2.1. TULOSTEN TULKINTA
Ihon sähkövastusmittausten keskiarvot hyväksytään, jos samaan aikaan mitatut positiivisten ja negatiivisten kontrollinäytteiden määritysten tulokset ovat tälle menetelmälle määritellyissä hyväksyttävissä rajoissa (testilaboratoriossa). Hyväksyttävät vastusalueet käytettäessä tätä menetelmää ja näitä laitteita esitetään seuraavassa taulukossa:
|
Kontrolli |
Aine |
Vastusalue (kΩ) |
|
Positiivinen |
10 M kloorivetyhappo |
0,5–1,0 |
|
Negatiivinen |
Tislattu vesi |
10–25 |
Väriaineen sitoutumiskokeen keskiarvotulokset hyväksytään, jos samaan aikaan tehtyjen kontrolliaineiden määritysten tulokset ovat tälle menetelmälle määritellyissä hyväksyttävissä rajoissa. Suositellut kontrolliaineiden hyväksyttävät väriainepitoisuusalueet käytettäessä tätä menetelmää ja näitä laitteita ovat:
|
Kontrolli |
Aine |
Väriaineen pitoisuusalue (μg/näyte) |
|
Positiivinen |
10 M kloorivetyhappo |
40–100 |
|
Negatiivinen |
Tislattu vesi |
15–35 |
Testiainetta ei katsota ihosyövyttäväksi
|
i) |
jos testiaineelle saatu ihon sähkövastusarvo (keskiarvo) on yli 5 kΩ, tai |
|
ii) |
ihon sähkövastusarvo (keskiarvo) on enintään 5 kΩ, ja
|
Testiaine katsotaan ihosyövyttäväksi
|
i) |
jos ihon sähkövastusarvo (keskiarvo) on enintään 5 kΩ ja ihonäyte on selvästi vaurioitunut tai |
|
ii) |
ihon sähkövastusarvo (keskiarvo) on enintään 5 kΩ ja
|
3. RAPORTOINTI
3.1 TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot:
|
|
Testi- ja kontrolliaineet:
|
|
|
Koe-eläimet:
|
|
|
Testiolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
|
|
Päätelmät. |
4. KIRJALLISUUSVIITTEET
|
1. |
OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6. |
|
2. |
Testing Method B.4. Acute Toxicity: Dermal Irritation/Corrosion. |
|
3. |
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report and recommendations of ECVAM Workshop 6. ATLA 23, 219–255. |
|
4. |
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. in Vitro 12, 471–482. |
|
5. |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhütter, H.-G., and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. in Vitro 12, 483–524. |
|
6. |
OECD (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62pp. |
|
7. |
Balls, M., Blaauboer, B.J., Fentem. J.H., Bruner. L., Combes, R.D., Ekwall, B., Fielder. R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski. D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. The report and recommendations of ECVAM workshops. ATLA 23, 129–147. |
|
8. |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf |
|
9. |
ECVAM (1998). ECVAM News & Views. ATLA 26, 275–280. |
|
10. |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf. |
|
11. |
OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st - 2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat |
|
12. |
Oliver, G.J.A., Pemberton, M.A., and Rhodes, C. (1986). An in vitro skin corrosivity test –modifications and validation. Fd. Chem. Toxicol. 24, 507–512. |
|
13. |
Botham, P.A., Hall, T.J., Dennett, R., McCall, J.C., Basketter, D.A., Whittle, E., Cheeseman, M., Esdaile, D.J., and Gardner, J. (1992). The skin corrosivity test in vitro: results of an interlaboratory trial. Toxic. in Vitro 6, 191–194. |
|
14. |
Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709–720. |
|
15. |
Basketter, D.A., Chamberlain, M., Griffiths, H.A., Rowson, M., Whittle, E., York, M. (1997). The classification of skin irritants by human patch test. Fd. Chem. Toxicol. 35, 845–852. |
|
16. |
Oliver G.J.A, Pemberton M.A and Rhodes C. (1988). An In Vitro model for identifying skin-corrosive chemicals. I. Initial Validation. Toxic. in Vitro. 2, 7–17. |
Kuva 1
Rotan ihon sähkövastuksen määrityslaite

Kuva 2:
Polytetrafluoroetyleeniputken (PFTE-putken), koeastioiden ja elektrodien mitat
Yllä kuvattujen laitteiden kriittiset tekijät:
|
— |
PTFE-putken sisähalkaisija |
|
— |
elektrodien pituus suhteessa PTFE-putkeen ja koeastiaan siten, että ihonäyte ei ole kosketuksissa elektrodeihin ja että vakiomitta elektrodia on kosketuksissa MgSO4-liuoksen kanssa |
|
— |
MgSO4-liuosta on oltava koeastiassa sellainen määrä, että nesteellä on tietty syvyys suhteessa nesteen tasoon PFTE-putkessa (kuvassa 1 esitetyllä tavalla) |
|
— |
ihonäyte on kiinnitettävä tarpeeksi hyvin PFTE-putkeen, jotta sähkövastus ilmentäisi ihon ominaisuuksia oikein. |
B.40 a. IN VITRO IHOSYÖVYTTÄVYYS: IHMISIHOMALLITESTI
1. MENETELMÄ
Tämä menetelmä vastaa OECD:n testiohjetta nro TG 431 (2004)
1.1 JOHDANTO
Ihosyövyttävyydellä tarkoitetaan palautumattoman kudosvaurion ilmenemistä ihossa testiaineen aplikaation jälkeen [määritelmä sisältyy GHS-järjestelmään (Globally Harmonised System for the Classification and Labelling of Chemical Substances and Mixtures)] (1). Testimenetelmä ei edellytä elävien eläinten tai eläinkudoksen käyttöä ihosyövyttävyyden määrittämiseksi.
Ihosyövyttävyyden arviointi on tyypillisesti edellyttänyt koe-eläinten käyttöä (2). Huoli testissä käytettäville eläimille aiheutuvasta kärsimyksestä on otettu huomioon testimenetelmän B.4 tarkistetussa versiossa, jossa ihosyövyttävyys voidaan määrittää käyttämällä vaihtoehtoisia in vitro -menetelmiä, joissa eläimille ei aiheuteta kipua tai kärsimystä.
Sääntelytarkoituksiin käytettävien vaihtoehtoisten ihosyövyttävyystestien kehittäminen aloitettiin validointia edeltävillä tutkimuksilla (3). Tämän jälkeen tehtiin ihosyövyttävyyden arviointiin käytettävien in vitro -menetelmien (4) (5) virallinen validointitutkimus (6) (7) (8). Näiden tutkimusten tulokset ja muu julkaistu kirjallisuus (9) johtivat siihen suositukseen, että ihosyövyttävyyden arviointiin in vivo voitaisiin käyttää seuraavia testejä (10) (11) (12) (13): ihmisihomallitesti (tässä kuvattu menetelmä) ja sähkövastusmääritystesti (testimenetelmä B.40).
Validointitutkimukset ovat osoittaneet, että ihmisihomalleja käyttävillä testeillä (3) (4) (5) (9) voidaan luotettavasti erottaa tunnetut ihoa syövyttävät kemikaalit sellaisista kemikaaleista, jotka eivät syövytä ihoa. Lisäksi on mahdollista, että testillä voidaan erotella erittäin syövyttäviä kemikaaleja vähemmän syövyttävistä.
Tässä kuvatulla testimenetelmällä voidaan tunnistaa syövyttävät kemialliset aineet ja seokset. Sillä voidaan tunnistaa myös sellaiset aineet ja seokset, jotka eivät syövytä ihoa, kunhan tukena on muista käytettävissä olevista tiedoista saatua näyttöä (esim. pH, rakenne-aktiivisuussuhteet, koehenkilöillä ja/tai -eläimillä tehdyistä kokeista saadut tiedot) (1) (2) (13) (14). Se ei yleensä tarjoa riittävää tietoa ihoärsytyksestä, eikä sen perusteella ole mahdollista luokitella syövyttäviä aineita GHS-järjestelmän mukaisiin alaluokkiin (1).
Haluttaessa arvioida kattavasti ihoaltistuksen jälkeiset paikalliset ihovaikutukset suositellaan käytettäväksi testimenetelmän B.4 liitteessä esitettyä monivaiheista testausta (2), joka on esitetty GHS-järjestelmässä (1). Kyseiseen testaukseen kuuluu ihosyövyttävyystestien (tässä kuvattu testimenetelmä) ja ihoärsytystestien suorittaminen in vitro ennen testauksen harkitsemista elävillä eläimillä.
1.2 MÄÄRITELMÄT
Ihosyövyttävyys in vivo: korjautumattoman ihovaurion eli orvaskeden läpi verinahkaan ulottuvan näkyvän kuolion ilmaantuminen enintään neljä tuntia kestäneen testiaineen annostelun jälkeen. Tyypillisiä syöpymisreaktioita ovat haavaumat, verenvuoto, veriset ruvet sekä 14 päivän tarkkailujakson lopussa ihon vaalenemisen aiheuttama värinmuutos, kokonaan kaljuuntuneet alueet ja arvet. Epäselvien vaurioiden tapauksessa olisi harkittava histopalogista tutkimusta.
Solujen elävyys: muuttuja, jolla mitataan solupopulaation kokonaisaktiivisuutta (esim. solujen mitokondrioiden dehydrogenaasien kyky pelkistää väriaine MTT), joka mittaussuureesta ja testimenetelmästä riippuen korreloi solujen kokonaismäärään ja/tai elinkykyyn.
1.3 VERTAILUAINEET
Taulukko 1
Vertailukemikaalit
|
Nimi |
EINECS-numero |
CAS-numero |
|
|
1,2-Diaminopropaani |
201-155-9 |
78-90-0 |
Erittäin syövyttävä |
|
Akryylihappo |
201-177-9 |
79-10-7 |
Erittäin syövyttävä |
|
2-tert-Butyylifenoli |
201-807-2 |
88-18-6 |
Syövyttävä |
|
Kaliumhydroksidi (10 %) |
215-181-3 |
1310-58-3 |
Syövyttävä |
|
Rikkihappo (10 %) |
231-639-5 |
7664-93-9 |
Syövyttävä |
|
Oktaanihappo (kapryylihappo) |
204-677-5 |
124-07-02 |
Syövyttävä |
|
4-Amino-1,2,4-triatsoli |
209-533-5 |
584-13-4 |
Ei syövyttävä |
|
Eugenoli |
202-589-1 |
97-53-0 |
Ei syövyttävä |
|
Fenetyylibromidi |
203-130-8 |
103-63-9 |
Ei syövyttävä |
|
Tetrakloorietyleeni |
204-825-9 |
27-18-4 |
Ei syövyttävä |
|
Isosteariinihappo |
250-178-0 |
30399-84-9 |
Ei syövyttävä |
|
4-(Metyylitio)-bentsaldehydi |
222-365-7 |
3446-89-7 |
Ei syövyttävä |
Useimmat taulukossa mainituista kemikaaleista on valittu ECVAM:in kansainvälisessä validointitutkimuksessa käytettyjen kemikaalien joukosta (4). Ne valittiin seuraavilla perusteilla:
|
(i) |
Syövyttäviä ja ei-syövyttäviä aineita on oltava yhtä paljon. |
|
(ii) |
Niiden on oltava kaupallisesti saatavilla olevia aineita, jotka kattavat useimmat relevantit kemikaaliluokat. |
|
(iii) |
Mukana on oltava sekä erittäin syövyttäviä että vähemmän syövyttäviä aineita, jotta mahdollistettaisiin syövyttävyysvoimakkuuden mukainen luokittelu. |
|
(iv) |
Kemikaaleja on voitava käsitellä laboratoriossa aiheuttamatta vakavia riskejä (syövyttävyyttä lukuun ottamatta). |
1.4 TESTIMENETELMÄN PERIAATE
Testiainetta aplikoidaan kolmiulotteiseen ihmisihomalliin, jossa on ainakin rekonstruoitu orvaskesi ja toimiva marraskesi. Syövyttävät materiaalit tunnistetaan niiden kyvystä vähentää solujen elävyyttä [joka arvioidaan esim. MTT:n pelkistyskokeella (15)] määriteltyjen raja-arvojen alapuolelle spesifioitujen altistusaikojen jälkeen. Ihmisihomallimäärityksen periaate perustuu oletukseen, jonka mukaan syövyttäviä kemikaaleja ovat ne, jotka pystyvät tunkeutumaan marrasketeen (diffundoitumalla tai eroosion seurauksena) ja ovat myrkyllisiä soluille allaolevissa solukerroksissa.
1.4.1 Menettely
1.4.1.1 Ihmisihomallit
Ihmisihomallit voidaan valmistaa tai hankkia kaupallisesti (esim. the EpiDermTM- ja EPISKINTM-mallit) (16) (17) (18) (19) tai ne voidaan kehittää testilaboratoriossa (20) (21). Ihmisihon käyttöön on sovellettava kansallisia ja kansainvälisiä eettisiä käytäntöjä ja ehtoja. Kaikki uudet mallit on validoitava (vähintään kohdassa 1.4.1.1.2 mainituilta osin). Tässä testissä käytettävien ihmisihomallien on täytettävä seuraavassa mainitut ehdot:
1.4.1.1.1
Epiteelin valmistamiseen on käytettävä ihmisen keratinosyyttejä. Toimivan marraskeden alla on oltava useita kerroksia eläviä epiteelisoluja. Ihomallissa voi olla myös stroomakerros. Marraskedessa on oltava useita kerroksia ja sopiva lipidiprofiili, jotta se voi tarjota toimivan esteen ja kykenee torjumaan solumyrkyllisten merkkinaineiden nopean tunkeutumisen. Mallin on oltava sellainen, että marraskeden ympärillä olevan materiaalin pääsy elävään kudokseen estyy. Marraskeden ympärillä olevien testikemikaalien pääsy kudokseen heikentää mallin kykyä mallintaa ihoaltistusta. Ihomallissa ei saa olla bakteerikontaminaatiota (esim. mykoplasmat) tai sieni-itiöitä.
1.4.1.1.2
Elävyyden aste kvantifioidaan yleensä käyttämällä MTT-väriainetta tai muita metabolisesti muuntuvia väriaineita. Näissä tapauksissa negatiivisesta kontrollikudoksesta uutetun (liuotetun) väriaineen optisen tiheyden (OD) on oltava ainakin 20 kertaa suurempi kuin uuttamisliuottimen OD-arvon [yleiset tiedot: katso (22)]. Negatiivisen kontrollikudoksen on oltava stabiili viljelyssä (solujen elävyyttä koskevien mittaustulosten on oltava samanlaisia) testin koko altistusajan. Marraskeden on oltava riittävän vahva, jotta se estää tiettyjen solumyrkyllisten merkkikemikaalien (esim. 1 % Triton X-100) nopean tunkeutumisen. Kyseinen ominaisuus voidaan arvioida sen altistusajan perusteella, joka tarvitaan, jotta solujen elävyys vähenee 50 % (ET50) (esim. EpiDermTM- ja EPISKINTM-malleilla > 2 tuntia). On osoitettava, että kudosta voidaan käyttää toistuvasti ajan myötä ja mielellään laboratorioiden välillä. Lisäksi sen avulla on voitava ennustaa vertailukemikaalien (taulukko 1) syövyttävyyspotentiaali, kun sitä käytetään valitussa testimenettelyssä.
1.4.1.2. Testi- ja kontrolliaineen aplikoiminen
Kutakin käsittelyä (altistusaikaa) kohti käytetään kahta rinnakkaista kudosnäytettä (myös kontrolleista). Nestemäistä testiainetta aplikoidaan riittävä määrä (vähintään 25 μL/cm2), että se peittää ihopinnan tasaisesti. Kiinteää testiainetta aplikoidaan riittävä määrä, että se peittää tasaisesti ihon, ja ainetta pitäisi kostuttaa deionisoidulla tai tislatulla vedellä, jotta se olisi hyvin kosketuksissa ihoon. Tarvittaessa kiinteät aineet on jauhettava aplikointia varten. Aplikaatiomenetelmän on sovelluttava testiaineelle (katso esim. kirjallisuusviite 5). Altistuksen jälkeen testiaine pestään huolellisesti ihon pinnalta sopivalla puskuriliuoksella tai 0,9 % NaCl:lla.
Kussakin testissä on tehtävä samaan aikaan positiiviset ja negatiiviset kontrollimääritykset, jotta voidaan varmistaa testimallin riittävä suorituskyky. Suositeltavat positiiviset kontrolliaineet ovat jääetikka tai 8N KOH. Suositellut negatiiviset kontrollit ovat 0,9 % NaC1 tai vesi.
1.4.1.3 Solujen elävyysmittaukset
Solujen elävyyden määrittämiseksi voidaan käyttää vain kvantitatiivisia ja validoituja menetelmiä. Lisäksi elävyyden määrityksen on sovelluttava kolmiulotteiseen kudosrakenteeseen. Ei-spesifinen väriaineen sitominen ei saa vaikuttaa solujen elävyyden määritykseen. Proteiineja sitovat väriaineet ja väriaineet, jotka eivät muunnu metabolisesti (esim. neutraalipuna), eivät sen vuoksi ole sopivia. Tavallisin määritysmenetelmä on MTT:n 3-(4,5-dimetyylitiatsol-2yyli)-2,5-difenyylitetratsoliumbromidi, tiatsolyylisininen: EINECS-numero 206-069-5, CAS-numero 298-93-1)] pelkistys. MTT:n on osoitettu antavan tarkkoja ja toistettavia tuloksia (5), mutta myös muita voidaan käyttää. Ihonäyte pannaan MTT-liuokseen, jonka pitoisuus on sopiva (esim. 0,3–1 mg/ml), sopivassa inkubointilämpötilassa 3 tunniksi. Saostunut sininen formatsaani uutetaan liuottimella (isopropanoli), ja formatsaanipitoisuus määritetään mittaamalla OD-arvo aallonpituudella 540–595 nm.
Testiaineen kemiallinen reaktio vitaaliväriaineen kanssa voi jäljitellä solujen aineenvaihduntaa, mikä voi johtaa väärään arvioon solujen elävyydestä. Tämän on osoitettu tapahtuvan, jos testiainetta ei ole kokonaan poistettu iholta huuhtelemalla (9). Jos testiaine reagoi suoraan vitaaliväriaineen kanssa, on käytettävä lisäkontrolleja, jotta voidaan havaita ja korjata testiaineen vaikutus solujen elävyyden mittaukseen (9) (23).
2. MITTAUSTULOKSET
Testiaineiden sekä positiivisten ja negatiivisten kontrollien OD-arvot ja lasketut prosentuaaliset solujen elävyysarvot olisi esitettävä kunkin kudosnäytteen osalta taulukkomuodossa, sekä myös tulokset rinnakkaiskokeista tai toistetuista kokeista (tarvittaessa), keskiarvot ja yksittäiset arvot.
2.1 TULOSTEN TULKINTA
Negatiivisen kontrollin OD-arvon katsotaan testissä edustavan 100-prosenttista solujen elävyyttä. Siksi kullekin testinäytteelle saaduista OD-arvoista voidaan laskea solujen elävyys prosentteina negatiivisesta kontrollista. Prosentuaalinen solujen elävyyden raja-arvo, jolla erotetaan syövyttävät testiaineet ei-syövyttävistä (tai eri syövyttävyysluokat), taikka tulosten arviointiin ja syövyttävien aineiden tunnistamiseen käytettävät tilastomenetelmät, on määriteltävä selvästi ja dokumentoitava ja niiden on osoitettava olevan soveltuvia. Yleensä nämä erottelevat arvot määritetään testin optimoinnin aikana, testataan validointia edeltävässä vaiheessa ja vahvistetaan validointitutkimuksessa. Esimerkiksi EpiDermTM-mallilla syövyttävyys ennustetaan seuraavasti (9):
Testiaine on syövyttävä iholle:
|
i) |
jos solujen elävyys kolmen minuutin altistuksen jälkeen on alle 50 % tai |
|
ii) |
jos solujen elävyys kolmen minuutin altistuksen jälkeen on 50 % tai suurempi ja yhden tunnin altistuksen jälkeen alle 15 %. |
Testiaine ei ole syövyttävä iholle:
|
i) |
jos solujen elävyys kolmen minuutin altistuksen jälkeen on 50 % tai suurempi ja yhden tunnin altistuksen jälkeen 15 % tai suurempi. |
3. RAPORTOINTI
3.1 TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot:
|
|
Testi- ja kontrolliaine:
|
|
|
Käytetyn ihomallin ja testisuunnitelman perustelut. |
|
|
Testiolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten tarkastelu. |
|
|
Päätelmät. |
4. KIRJALLISUUSVIITTEET
|
1. |
OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6. |
|
2. |
Testing Method B.4. Acute Toxicity: Dermal Irritation/Corrosion. |
|
3. |
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report recommendations of ECVAM Workshop 6 ATLA 23,219–255. |
|
4. |
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. In Vitro 12, 471–482. |
|
5. |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. In Vitro 12, 483–524. |
|
6. |
OECD (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62pp. |
|
7. |
Balls, M., Blaauboer, B.J., Fentem, J.H., Bruner, L., Combes, R.D., Ekwall, B., Fielder, R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski, D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. Test report and recommendations of ECVAM workshops. ATLA 23, 129–147. |
|
8. |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf. |
|
9. |
Liebsch, M., Traue, D., Barrabas, C., Spielmann, H., Uphill, P., Wilkins, S., McPherson, J.P., Wiemann, C., Kaufmann, T., Remmele, M. and Holzhutter, H.G. (2000). The ECVAM prevalidation study on the use of EpiDerm for skin Corrosivity testing. ATLA 28, pp.371–401. |
|
10. |
ECVAM (1998). ECVAM News & Views. ATLA 26, 275–280. |
|
11. |
ECVAM (2000). ECVAM News & Views. ATLA 28, 365–67. |
|
12. |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf. |
|
13. |
OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st–2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat |
|
14. |
Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709–720. |
|
15. |
Mosmann, T. (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity asssays. J.Immunol. Meth. 65, 55–63. |
|
16. |
Cannon, C.L., Neal, P.J., Southee, J.A., Kubilus, J., and Klausner, M., 1994. New epidermal model for dermal irritancy testing. Toxic. In Vitro 8, 889–891. |
|
17. |
Ponec, M., Boelsma, E., Weerheim, A., Mulder, A., Boutwstra, J., and Mommaas, M., 2000. Lipid and ultrastructural characterization of reconstructed skin models. International Journal of Pharmaceutics. 203, 211–225. |
|
18. |
Tinois E, Gaetani Q, Gayraud B, Dupont D, Rougier A, Pouradier DX (1994). The Episkin model: Successful reconstruction of human epidermis in vitro. In In vitro Skin Toxicology. Edited by A Rougier, AM Goldberg and HI Maibach: 133–140 |
|
19. |
Tinois E, Tiollier J, Gaucherand M, Dumas H, Tardy M, Thivolet J (1991). In vitro and post -transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute. Experimental Cell Research 193: 310–319 |
|
20. |
Parentau, N.L., Bilbo, P., Molte, C.J., Mason, V.S., and Rosenberg, H. (1992). The organotypic culture of human skin keratinocytes and fibroblasts to achieve form and function. Cytotechnology 9, 163–171. |
|
21. |
Wilkins, L.M., Watson, S.R., Prosky, S.J., Meunier, S.F., Parentau, N.L. (1994). Development of a bilayered living skin construct for clinical applications. Biotechnology and Bioengineering 43/8, 747–756. |
|
22. |
Marshall, N.J., Goodwin, C.J., Holt, S.J. (1995). A critical assessment of the use of microculture tetrazolium assays to measure cell growth and function. Growth Regulation 5, 69–84. |
|
23. |
Fentem, J.H., Briggs, D., Chesne, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Rouget, R., and van de Sandt, J.J.M., and Botham, P.A. (2001). A prevalidation study on in vitro tests for acute skin irritation: results and evaluation by the Management Team. Toxic. InVItro 15, 57–93. |
B.41. IN VITRO 3T3 NRU -VALOMYRKYLLISYYSTESTI
1. MENETELMÄ
Tämä menetelmä vastaa OECD:n testiohjetta nro 432 (2004).
1.1 JOHDANTO
Valomyrkyllisyys on kehon toksinen vaste, joka ilmenee tai kasvaa (todettavissa pienemmillä annoksilla), kun keholle on aplikoitu kyseistä ainetta ja iho on altistettu valolle, tai jonka aiheuttaa ihon säteilytys sen jälkeen, kun ainetta on annettu elimistöön.
In vitro 3T3 NRU -valomyrkyllisyystestiä käytetään tunnistamaan testiaineen valomyrkyllisyyspotentiaali sen jälkeen, kun valo on eksitoinut sen valolle altistuksen jälkeen. Testillä arvioidaan fotosytotoksisuus kemikaalille altistuneiden solujen elävyyden vähenemisenä valoaltistuksessa verrattuna tilanteeseen, jossa ei ole valoaltistusta. Tällä testillä tunnistetut aineet ovat todennäköisesti valomyrkyllisiä in vivo elimistöön annettuna ja ihoon jakautuneina tai aplikoituina iholle paikallisesti.
Useantyyppisten kemikaalien on ilmoitettu olevan valomyrkyllisiä (1) (2) (3) (4). Niiden yhteinen ominaisuus on kyky absorboida energiaa auringonvalon spektrialueella. Valokemian ensimmäisen lain (Grotthaus-Draperin lain) mukaan valoreaktio edellyttää riittävää valokvanttien absorptiota. Tämä merkitsee sitä, että ennen kuin harkitaan biologista testausta, testikemikaalin absorptiospektri UV-valon ja näkyvän valon alueella on määritettävä OECD:n testiohjeen 101 mukaisesti. On esitetty, että jos kemikaalin mooliekstinktio- tai absorptiokerroin on pienempi kuin 10 litraa × mol-1 × cm-1, kemikaalilla ei todennäköisesti ole valoreaktiokykyä eikä sitä todennäköisesti tarvitse testata in vitro 3T3 NRU -valomyrkyllisyystestillä tai millään muulla haitallisia valokemiallisia vaikutuksia määrittävällä biologisella testillä (1) (5). Katso myös liite 1.
In vitro 3T3 NRU -valomyrkyllisyystestin luotettavuus ja relevanssi on arvioitu hiljattain (6) (7) (8) (9). In vitro 3T3 NRU -valomyrkyllisyystestin osoitettiin kykenevän ennustamaan akuutteja valomyrkyllisyysvaikutuksia eläimissä ja ihmisissä in vivo. Testin tarkoituksena ei ole ennustaa muita kemikaalien ja valon yhteisvaikutuksesta aiheutuvia haitallisia vaikutuksia, esim. fotogenotoksisuutta, valoallergiaa ja fotokarsinogeenisuutta. Testi ei pysty myöskään arvioimaan aineen valomyrkyllisyyspotenssia kvantitatiivisesti. Sen tarkoituksena ei myöskään ole arvioida valomyrkyllisyyden epäsuoria mekamismeja, testiaineen metaboliittien vaikutuksia tai sekoitusten vaikutuksia.
Vaikka metaboloivia järjestelmiä yleensä tarvitaan kaikissa in vitro -testeissä, joilla ennustetaan genotoksisuutta ja karsinogeenisuutta, tunnetaan toistaiseksi vain harvoja kemikaaleja, jotka edellyttäisivät metabolista aktivaatiota, jotta ne voisivat olla valomyrkyllisiä in vivo tai in vitro. Siten ei katsota olevan tarpeellista eikä tieteellisesti perusteltua suorittaa tätä testiä metabolisen aktivaatiojärjestelmän kanssa.
1.2 MÄÄRITELMÄT
Säteilyvoimakkuus: pintaan kohdistuvan ultraviolettivalon (UV) tai näkyvän valon (VIS) intensiteetti mitattuna watteina neliömetriä kohti tai watteina neliösenttimetriä kohti (W/m2 tai mW/cm2).
Valoannos: pintaan kohdistuvan ultraviolettisäteilyn (UV) tai näkyvän valon säteilyn määrä (= intensiteetti × aika) ilmaistuna jouleina (= W × s) pinta-alayksikköä kohti, esim. J/m2 tai J/cm2.
UV-valon aallonpituusalueet: Kansainvälisen valaistustoimikunnan (ICI) suosittelemat määritelmät ovat: UVA (315–400 nm), UVB (280–315 nm) ja UVC (100–280 nm). Muitakin määritelmiä käytetään: UVB- ja UVA-alueen raja asetetaan usein 320 nanometriin ja UVA-alue voidaan jakaa alueisiin UV-A1 ja UV-A2, jolloin raja on noin 340 nanometrissä.
Solujen elävyys: muuttuja, jolla mitataan solupopulaation kokonaisaktiivisuutta (esim. neutraalipunan ottoa solujen lysosomeihin), joka mittaussuureesta ja testimenetelmästä riippuen korreloi solujen kokonaismäärään ja/tai elinkykyyn.
Suhteellinen solujen elävyys: solujen elävyys ilmaistuna suhteessa liuotinkontrolleihin (negatiivisiin kontrolleihin), jotka käyvät läpi testin muuten (joko +Irr tai -Irr), mutta joita ei ole käsitelty testikemikaalilla.
PIF (valoärsyttävyystekijä): tekijä, joka muodostetaan vertaamalla testikemikaalin kahta yhtä tehokasta solumyrkyllisyyspitoisuutta (IC50) sen jälkeen, kun soluja säteilytetään UVA-/näkyvällä valolla (+Irr), joka ei ole solumyrkyllistä, ja kun soluja ei säteilytetä (-Irr).
IC 50 : testikemikaalin pitoisuus, jossa solujen elävyys on vähentynyt 50 %
MPE (keskimääräinen valovaikutus): suure, joka saadaan analysoimalla matemaattisesti pitoisuus-vastekuvaajat, jotka on saatu, kun soluja säteilytetään UVA-/näkyvällä valolla (+Irr), joka ei ole solumyrkyllistä, ja kun soluja ei säteilytetä (-Irr).
Valomyrkyllisyys: akuutti toksinen vaste, joka ilmenee sen jälkeen, kun iho on ensimmäisen kerran altistettu tietyille kemikaaleille ja sen jälkeen valolle, tai jonka ihon säteilytys aiheuttaa samalla tavalla sen jälkeen, kun kemikaalia on annettu elimistöön.
1.3 TESTIMENETELMÄN PERIAATE
In vitro 3T3 NRU -valomyrkyllisyystesti perustuu kemikaalin solumyrkyllisyyden vertaamiseen, kun kemikaalia testataan altistettaessa kohdetta sellaiselle simuloidulle auringonvalolle, joka ei ole solumyrkyllinen, ja ilman tällaista valoaltistusta. Solumyrkyllisyys ilmaistaan tässä testissä pitoisuudesta riippuvana neutraalipunan (vitaaliväri) soluunoton vähenemisenä 24 tuntia kemikaalikäsittelyn ja säteilytyksen jälkeen (10). Neutraalipuna on heikosti kationinen väriaine, joka läpäisee solukalvot muulla tavalla kuin diffundoitumalla ja keräytyy solunsisäisiin lysosomeihin. Lysosomien herkän kalvon pinnan muutokset johtavat lysosomien haurastumiseen ja muihin muutoksiin, joista tulee vähitellen peruuttamattomia. Tällaiset vierasaineiden toiminnan aikaansaamat muutokset johtavat neutraalipunan oton ja sitoutumisen vähenemiseen. Tämän perusteella on mahdollista erotella elinkykyiset, vaurioituneet ja kuolleet solut, mikä on perustana tälle testille.
Balb/c 3T3 -soluja viljellään 24 tuntia yhden solun vahvuisen kerroksen aikaansaamiseksi. Kutakin testikemikaalia kohti inkuboidaan aluksi yhden tunnin ajan kahta 96 kuopan levyä, joissa on kahdeksaa eri pitoisuutta testattavaa kemikaalia Sen jälkeen toinen levyistä altistetaan suurimmalle ei-solumyrkylliselle säteilytysannokselle ja toinen levy pidetään pimeässä. Sitten kummankin levyn käsittelyneste korvataan viljelynesteellä, inkuboidaan toiset 24 tuntia, ja määritetään solujen elävyys neutraalipunan ottona. Solujen elävyys, joka ilmaistaan prosenttiosuutena käsittelemättömistä liuotinkontrolleista, lasketaan kullekin testipitoisuudelle. Valomyrkyllisyyskyvyn ennustamiseksi verrataan pitoisuusvasteita, jotka on saatu säteilytyksen kanssa ja ilman sitä, yleensä IC50-tasolla, ts. siinä pitoisuudessa, joka vähentää solujen elävyyttä 50 prosentilla verrattuna käsittelemättömiin kontrolleihin.
1.4 TESTIMENETELMÄN KUVAUS
1.4.1 Testin valmistelut
1.4.1.1 Solut
Validointitutkimuksessa käytettiin joko ATCC:stä (American Type Culture Collection, Manassas, VA, USA) tai ECACC:stä (European Collection of Cell Cultures, Salisbury, Wiltshire, UK) hankittua pysyvää hiiren fibroblastisolulinjaa Balb/c 3T3, kloonia 31, ja siksi sen hankkimista suositellaan (laadukkaasta solupankista). Muita soluja tai solulinjoja voidaan käyttää, kun testimenettely on sama, jos viljelyolosuhteet mukautetaan solujen erityistarpeisiin. Samanlaisuus on tällöin osoitettava.
Mykoplasmakontaminaatio on tutkittava säännöllisesti, ja soluja saa käyttää vain jos mykoplasmakontaminaatiota ei todeta (11).
On tärkeää, että solujen UV-herkkyys tarkistetaan säännöllisesti tässä menetelmässä selostetun laadunvalvontamenettelyn mukaisesti. Koska solujen UVA-herkkyys voi lisääntyä siirrostamisten myötä, pitäisi käyttää sellaisia Balb/c 3T3 -soluja, joita on siirrostettu mahdollisimman harvoja kertoja, mieluiten alle 100 kertaa. (Katso kohta 1.4.2.2.2 ja liite 2).
1.4.1.2 Kasvatusväliaineet ja viljelyolosuhteet
Sopivaa viljelynestettä ja inkubaatio-olosuhteita olisi käytettävä solujen tavanomaiseen siirrostamiseen ja testin aikana. Esimerkiksi Balb/c 3T3 -soluille käytetään DMEM:iä (Dulbecco's Modified Eagle's Medium), jossa on 10 % vastasyntyneen vasikan seerumia, 4 mM glutamiinia, penisilliiniä (100 IU) ja streptomysiiniä (100 μg/mL), ja soluja inkuboidaan kaapissa, jonka lämpötila on 37 oC ja CO2-pitoisuus 5–7,5 % riippuen puskurista (katso kohdan 1.4.1.4 toinen alakohta). On erityisen tärkeää, että viljelyolosuhteet ovat sellaiset, että solusykli pysyy samanlaisena kuin se käytetyillä soluilla tai solulinjalla on aiemminkin ollut.
1.4.1.3 Viljelmien valmistelu
Pakastetuista varastoviljelmistä otettuja soluja inokuloidaan viljelynesteeseen sopivassa tiheydessä, ja niitä siirrostetaan vähintään kerran ennen kuin ne käytetään in vitro 3T3 NRU -valomyrkyllisyystestissä.
Valomyrkyllisyystestiä varten soluja inokuloidaan viljelynesteeseen sellaisessa tiheydessä, että viljelmät eivät ole konfluentteja testin päättyessä 48 tunnin kuluttua solujen inokuloinnista, kun solujen elävyys määritetään. Balb/c 3T3 -soluille, joita viljellään 96-kuoppalevyillä, suositellaan solutiheyttä 1 × 104 solua kuoppaa kohti.
Kutakin testikemikaalia varten soluja inokuloidaan täysin samalla tavalla kahdelle erilliselle 96-kuoppalevylle, jotka käyvät läpi samanaikaisesti koko testiohjelman täysin samanlaisissa olosuhteissa, lukuun ottamatta aikaa, jolloin yhtä kuoppalevyä säteilytetään (+Irr) ja toinen pidetään pimeässä (-Irr).
1.4.1.4 Testiaineen valmistaminen
Testikemikaalit on valmistettava välittömästi ennen käyttöä, ellei tiedoista ilmene, että ne pysyvät stabiileina varastoitaessa. Kaikki kemikaalien käsittely ja valmistelu suositellaan tehtäväksi sellaisissa valo-olosuhteissa, että vältetään testettavan aineen valoaktivaatio tai hajoaminen ennen säteilytystä.
Testikemikaali pitäisi liuottaa puskuroituun suolaliuokseen, esim. Earlin tasapainotettuun suolaliuokseen (EBSS) tai muihin fysiologisesti tasapainoisiin puskuriliuoksiin, joissa ei saa olla proteiineja tai valoa absorboivia aineita (esim. pH-indikaattorivärejä ja vitamiineja), etteivät ne häiritsisi reaktioita säteilytyksen aikana. Koska soluja pidetään säteilytyksen aikana noin 50 minuuttia CO2-inkubaattorin ulkopuolella, on vältettävä huolellisesti alkalisaatio. Käytettäessä laimeita puskureita, kuten EBSS:ää, tähän päästään inkuboimalla soluja siten, että CO2 -pitoisuus on 7,5 %. Jos solut inkuboidaan ainoastaan 5 prosentin CO2 -pitoisuudella, olisi valittava voimakkaampi puskuri.
Huonosti vesiliukoiset testikemikaalit pitäisi liuottaa sopivaan liuottimeen. Jos käytetään liuotinta, sitä on oltava vakiotilavuudessa kaikissa viljelmissä, ts. negatiivisissa kontrolleissa (liuotinkontrolleissa) ja kaikissa testikemikaalipitoisuuksissa, ja se ei saa olla solumyrkyllistä käytetyssä pitoisuudessa. Testikemikaalipitoisuudet olisi valittava siten, että vältetään liuoksen saostuminen tai sameus.
Dimetyylisulfoksidi (DMSO) ja etanoli (ETOH) ovat suositeltavia liuottimia. Myös muut liuottimet, jotka eivät ole kovin solumyrkyllisiä, voivat olla sopivia. Kaikkien liuottimien erityisominaisuudet (esim. reaktiivisuus testikemikaalin kanssa, valomyrkyllisyysvaikutuksen vaimeneminen, radikaalien sitomisominaisuus ja/tai kemiallinen stabiilius) on arvioitava ennen käyttöä.
Vortex-sekoitusta ja/tai ultraäänihajoitusta ja/tai lämmittämistä sopiviin lämpötiloihin voidaan käyttää liukenemisen helpottamiseksi, kunhan tämä ei vaikutatestikemikaalin stabiiliuteen.
1.4.1.5 Säteilytysolosuhteet
1.4.1.5.1
Sopivan valolähteen ja sopivien suodattimien valitseminen on keskeinen asia valomyrkyllisyyden testauksessa. UVA ja näkyvä valo liittyvät yleensä valomyrkyllisiin reaktioihin in vivo (3) (12), kun taas UVB on vähemmän tärkeä, mutta soluille erittäin myrkyllinen. Sen solumyrkyllisyys lisääntyy 1 000-kertaiseksi aallonpituudelta 313 nm aallonpituudelle 280 nm (13). Perusteena sopivan valolähteen valitsemiseen pitäisi olla mm. vaatimus, että valolähde emittoi aallonpituuksia, joita testikemikaali absorboi (absorptiospektri), ja että valoannoksen (joka pitää saavuttaa järkevässä ajassa) pitäisi olla riittävä tunnettujen fotosytotoksisten kemikaalien osoittamiseksi. Lisäksi käytetyt aallonpituudet ja annokset eivät saisi olla liian tuhoisia testijärjestelmälle; tällainen vaikutus olisi mm. lämpö (infrapuna-alue).
Simuloitua auringonvaloa pidetään parhaimpana keinotekoisena valolähteenä. Suodatetun auringonvalosimulaattorin valon säteilytehojakauman olisi oltava lähellä auringonvalon säteilytehojakaumaa (14). Sekä ksenonkaarilamppuja että (seostettuja) elohopeahalidikaarilamppuja käytetään auringonvalosimulaattoreina (15). Jälkimmäisillä on se etu, että ne muodostavat vähemmän lämpöä ja ovat halvempia, mutta niiden spektri ei vastaa auringonvalon spektriä yhtä hyvin kuin ksenonkaarilampuissa. Koska kaikki auringonvalosimulaattorit lähettävät huomattavia määriä UVB-valoa, niiden valo pitäisi suodattaa sopivasti erittäin solumyrkyllisten UVB-aallonpituuksien vaimentamiseksi. Koska soluviljelmissä käytettävät muovimateriaalit sisältävät UV-stabilisaattoreja, spektri pitäisi mitata samantyyppisen 96-kuoppalevyn kannen läpi, jollaista käytetään määrityksessä. Huolimatta laitteiston väistämättömistä suodatinvaikutuksista tai toimenpiteistä, joilla spektrin osia vaimennetaan suodattamalla, näin suodatetun valon spektri ei saisi poiketa standardiauringonvalosta (14). Viitteissä (8) ja (16) annetaan esimerkki in vitro 3T3 NRU -valomyrkyllisyystestin validointitutkimuksessa käytetyn auringonvalosimulaattorin suodatetun valon spektrijakaumasta. Katso myös liitteen 2 kuva 1.
1.4.1.5.2
Valon voimakkuus (säteilyvoimakkuus, radianssi) olisi tarkistettava säännöllisesti ennen jokaista valomyrkyllisyystestiä käyttämällä sopivaa leveäkaistaista UV-mittaria. Voimakkuus olisi mitattava käyttäen samantyyppistä 96-kuoppalevyn kantta kuin itse testissä. UV-mittarin on oltava kalibroitu valolähteen suhteen. Sen suorituskyky pitäisi tarkistaa, mitä varten suositetaan toisen, samantyyppisen ja täysin samalla tavalla kalibroidun vertailu-UV-mittarin käyttöä. On toivottavaa, että tasaisin välein käytettäisiin spektrometriä suodatetun valolähteen säteilyvoimakkuusspektrin mittaamiseen ja leveäkaista-UV-mittarin kalibroinnin tarkistamiseen.
On todettu, että annos 5 J/cm2 (UVA-alueella mitattuna) ei ollut myrkyllinen Balb/c 3T3 -soluille ja että se pystyi eksitoimaan kemikaaleja siten, että ilmeni valomyrkyllisiä vaikutuksia (6) (17). Esimerkiksi arvo 5 J/cm2 saavutettiin 50 minuutin aikana säätämällä säteilyvoimakkuus arvoon 1,7 mW/cm2 (ks. liitteen 2 kuva 2). Jos käytetään muuta solulinjaa tai eri valolähdettä, säteilytysannos voi olla tarpeen kalibroida, jotta voidaan valita annos, joka ei vahingoita soluja, mutta riittää valomyrkyllisten standardiaineiden eksitoimiseksi. Valoaltistusaika lasketaan seuraavasti:
|
|
(1 J = 1 Wsec) |
1.4.2 Koeolosuhteet
1.4.2.1 Testiaineiden pitoisuudet
Valon kanssa (+ Irr) ja ilman sitä (- Irr) testattavan kemikaalin pitoisuusalue on määritettävä riittävän laajasti pitoisuusalueenmäärittelykokeissa. Voi olla tarpeen määritellä liukoisuus alussa ja 60 minuutin kuluttua (riippuen käsittelyajasta), koska liukoisuus voi muuttua ajan myötä tai altistuksen aikana. Jotta vältettäisiin epäasianmukaisten viljelyolosuhteiden tai hyvin happamien tai alkalisten kemikaalien aiheuttama myrkyllisyys, soluviljelmien, joihin on lisätty testikemikaali, pH:n pitäisi olla välillä 6,5–7,8.
Testiaineen suurimman pitoisuuden pitäisi olla fysiologisten testiolosuhteiden rajoissa eli pitäisi välttää osmoottista ja pH-stressiä. Testikemikaalista riippuen voi olla tarpeen ottaa huomioon myös muita fysikokemiallisia ominaisuuksia, jotka voivat asettaa rajoituksia suurimmalle testipitoisuudelle. Kun on kyse suhteellisen huonoliukoisista aineista, jotka eivät ole myrkyllisiä kyllästymispisteessä tai sitä alemmilla pitoisuuksilla, suurin saavutettavissa oleva pitoisuus olisi testattava. Testikemikaalin saostumista olisi yleisesti vältettävä kaikilla testipitoisuuksilla. Testiaineen suurin pitoisuus ei saisi olla yli 1 000 μg/mL; osmolaarisuus ei saisi olla yli 10mMol. Olisi käytettävä geometrista laimennussarjaa, jossa on kahdeksan testiaineen pitoisuutta ja laimennuskerroin vakio (katso kohta 2.1, toinen alakohta).
Jos (pitoisuusalueenmäärittelykokeiden perusteella) tiedetään, että testikemikaali ei ole myrkyllinen soluille edes suurimmassa pitoisuudessa pimeäkokeessa (-Irr), mutta on erittäin myrkyllinen soluille säteilytettäessä (+ Irr), voi olla tarpeen valita (+ Irr)-kokeeseen eri pitoisuusalue kuin (- Irr)-kokeeseen, jotta mittaustulosten riittävää laatua koskevat vaatimukset täyttyvät.
1.4.2.2 Kontrollit
1.4.2.2.1
Solujen herkkyys valolähteelle pitäisi tarkistaa säännöllisesti (noin joka viidennen siirrostamisen jälkeen) arvioimalla niiden elävyys sen jälkeen, kun niitä on altistettu suuremmille säteilytysannoksille. Tässä arvioinnissa pitäisi käyttää useita säteilytysannoksia, myös huomattavasti suurempia kuin 3T3 NRU -valomyrkyllisyystestissä käytetyt. Annokset voidaan kvantifioida helpoimmin mittaamalla valolähteen UV-valon määrä. Solut inokuloidaan tiheydessä, jota käytetään in vitro 3T3 NRU -valomyrkyllisyystestissä, ja säteilytetään seuraavana päivänä. Solujen elävyys määritellään yhtä päivää myöhemmin neutraalipunan ottona. On osoitettava, että suurin ei-solumyrkyllinen annos (esim. validointitutkimuksessa 5 J/cm2 [UVA]) oli riittävä vertailukemikaalien luokittelemiseksi (taulukko) oikein.
1.4.2.2.2
Testi täyttää laatuvaatimukset, jos säteilytettyjen negatiivisten kontrollien (liuotinkontrollien) elävyys on yli 80 % verrattuna säteilyttämättömiin negatiivisiin kontrolleihin (liuotinkontrolleihin).
1.4.2.2.3
Liuotinkontrollien neutraalipunauutteesta mitattu absoluuttinen optinen tiheys (OD540 NRU) osoittaa, ovatko kuoppaa kohti inokuloidut 1 × 104 solua lisääntyneet normaalilla nopeudella määritykseen kuuluvien kahden päivän aikana. Testi täyttää hyväksymisvaatimukset, jos käsittelemättömien kontrollien keskimääräinen OD540 NRU on ≥ 0,4 (noin 20 kertaa liuottimen tausta-absorbanssi).
1.4.2.2.4
Kussakin in vitro 3T3 NRU -valomyrkyllisyystestissä on testattava samanaikaisesti jokin tunnetusti valomyrkyllinen kemikaali. Käytettäväksi suositellaan klooripromatsiinia (CPZ). CPZ:n testaukselle in vitro 3T3 NRU -valomyrkyllisyyden standardiprotokollassa määriteltiin seuraavat hyväksyntävaatimukset: CPZ, säteilytetty (+ Irr): IC50 = 0,1-2,0 g/ml; CPZ, ei säteilytetty (- Irr): IC50 = 7,0 -90,0 μg/ml. Valoärsyttävyystekijän (PIF) pi täisi olla > 6. Positiivisen kontrollin suorituskykyä olisi seurattava pitkän ajan kuluessa.
Klooripromatsiinin sijasta voidaan samanaikaisesti testattavina positiivisina kontrolleina käyttää muita valomyrkyllisiä kemikaaleja, jotka sopivat kyseessä olevalle kemikaaliluokalle tai arvioitavana olevan kemikaalin liukoisuusominaisuuksiin.
1.4.3 Testimenetelmä (6) (7) (8) (16) (17):
1.4.3.1 1. päivä:
Pipetoidaan 100 μlviljelynestettä 96-mikrotitterikuoppalevyn laitimmaisiin kuoppiin (= nollakokeet). Muihin kuoppiin pipetoidaan 100 μlsolususpensiota, jossa on 1 × 105 solua/ml viljelynesteessä (= 1 × 104 solua/kuoppa). Kullekin yksittäisen testiaineen pitoisuuksien sarjalle sekä liuotin- ja positiivisille kontrolleille on valmistettava kaksi levyä.
Soluja inkuboidaan 24 h (katso kohta 1.4.1.2), kunnes ne muodostavat puoliksi konfluentin yhden solun vahvuisen kerroksen. Tässä ajassa solut toipuvat, tarttuvat levyn pohjaan ja alkavat kasvaa eksponentiaalisesti.
1.4.3.2 2. päivä:
Inkubaation jälkeen viljelyneste kaadetaan kuopista pois ja solut pestään huolellisesti 150 μl:lla puskuriliuosta, jota käytettiin inkubaatiossa. Lisätään 100 μL puskuria, jossa on testikemikaalia tai liuotinta (liuotinkontrolli). Kuoppiin lisätään kahdeksaa eri pitoisuutta testikemikaalia. Soluja inkuboidaan testikemikaalin kanssa pimeässä 60 minuuttia (katso kohta 1.4.1.2 ja kohta 1.4.1.4, toinen alakohta).
Kullekin yksittäisen testiaineen pitoisuuksien sarjalle sekä kontrolleille valmistetuista kahdesta levystä valitaan yksi (yleensä sattumanvaraisesti) sytotoksisuuden määritystä varten (- Irr) (kontrollilevy) ja toinen (testilevy) fotosytotoksisuuden määritystä varten (+ Irr).
Testin (+ Irr)-osaa varten soluja säteilytetään huoneenlämpötilassa 50 minuuttia 96-kuoppalevyn kannen läpi suurimmalla ei-solumyrkyllisellä säteilyannoksella (katso myös liite 2). Säteilyttämättömät levyt (- Irr) pidetään huoneenlämpötilassa pimeässä laatikossa 50 min (= valoaltistusaika).
Testiliuos kaadetaan pois ja solut pestään huolellisesti kahdesti 150 μl:lla puskuriliuosta, jota käytettiin inkubaatiossa, mutta jossa ei ole testiainetta. Puskuri korvataan viljelynesteellä, ja soluja inkuboidaan (katso kohta 1.4.1.2) yli yön (18–22 h).
1.4.3.3 3. päivä:
1.4.3.3.1
Solujen lisääntyminen, morfologia ja yhden solun vahvuisen kerroksen eheys on tutkittava käyttäen faasikontrastimikroskooppia. Solujen muodonmuutokset ja vaikutukset solujen lisääntymiseen on kirjattava.
1.4.3.3.2
Solut pestään 150 μl:lla esilämmitettyä puskuriliuosta. Pesuliuos kaadetaan pois ravistamalla levyä varovasti. Kuoppiin lisätään 100 € neutra alipunaa (NR) (3-amino-7-dimetyyliamino-2-metyylifenatsiinihydrokloridi, EINECS-numero 209-035-8; CAS-numero 553-24-2; C.I. 50040) viljelynesteessä ilman seerumia (16) ja soluja inkuboidaan 3 tunnin ajan kohdassa 1.4.1.2 kuvatulla tavalla. Inkubaation jälkeen NR-viljelyneste poistetaan ja solut pestään 150 μl:lla puskuriliuosta. Puskuriliuos kaadetaan pois ja kuopat kuivataan täysin imeyttäen neste paperiin tai sentrifugoimalla.
Lisätään tarkasti 150 μl NR-desorbointiliuosta (juuri valmistettu, 49 osaa vettä + 50 osaa etanolia + 1 osa etikkahappoa).
Mikrotitterilevyä heilutetaan varovasti ravistajassa 10 minuutin ajan, kunnes NR on uuttunut soluista ja muodostanut tasaisen liuoksen.
NR-uutteen optinen tiheys luetaan aallonpituudella 540 nm spektrofotometrissä käyttäen vertailuliuoksena nollanäytteitä. Mittaustulokset tallennetaan sopivassa sähköisessä muodossa myöhempää analysointia varten.
2. MITTAUSTULOKSET
2.1 MITTAUSTULOSTEN LAATU JA MÄÄRÄ
Mittaustulosten avulla pitäisi voida analysoida järkevästi säteilytyksellä ja ilman sitä saadut pitoisuusvasteet sekä mahdollisuuksien mukaan se testikemikaalin pitoisuus, jossa solujen elävyys on vähentynyt 50 prosenttiin (IC50). Jos havaitaan sytotoksisuutta, sekä pitoisuusalue että yksittäiset pitoisuudet on valittava siten, että koetuloksiin voidaan sovittaa kuvaaja.
Selvästi positiivisia tai selvästi negatiivisia tuloksia ei tarvitse tarkistaa toistamalla koetta (katso kohta 2.3, ensimmäinen alakohta). Tällaisissa tapauksissa riittää yksi koe, jota tukee yksi tai useampia annoksen pitoisuusaluetta määrittäviä alustavia kokeita.
Moniselitteiset tai epäselvät tulokset tai rajatapaukset olisi selvennettävä uudella testillä (katso kohdan 2.4 toinen alakohta). Tällaisissa tapauksissa olisi harkittava koeolosuhteiden muuttamista. Voidaan muuttaa pitoisuusalue tai pitoisuuksien välit, esi-inkubaatioaika ja altistusaika säteilytykselle. Vedessä hajoaville kemikaaleille voi lyhyt altistusaika olla tarkoituksenmukainen.
2.2 TULOSTEN ARVIOINTI
Tulosten arvioimiseksi voidaan laskea valoärsyttävyystekijä (PIF) tai keskimääräinen valovaikutus (MPE).
Valomyrkyllisyyden arvojen laskemiseksi (ks. jäljempänä) on yksittäisiä konsentraatio-vastearvoja aproksimoitava jatkuvalla konsentraatio-vastekuvaajalla (malli). Kuvaaja sovitetaan tuloksiin tavallisesti soveltamalla ei-lineaarista regressiomenetelmää (18). Jotta voidaan arvioida tietojen vaihtelevuuden vaikutus kuvaajaan, suositellaan bootstrap-menetelmää.
Valoärsyttävyystekijä (PIF) lasketaan seuraavasta kaavasta:
![]()
Jos IC50:tä (joko valon kanssa tai ilman valoa) ei voida laskea, PIF:iä ei voida määrittää testiaineelle. Keskimääräinen valovaikutus (MPE) perustuu täydellisten pitoisuus-vastekuvaajien vertailuun (19). Se määritellään edustavien valovaikutusarvojen painotetuksi keskiarvoksi.

Valovaikutus PEc missä tahansa pitoisuudessa C määritellään vastevaikutuksen REc ja annosvaikutuksen DEc tulona PEc = REc x DEc. Vastevaikutus REc on ilman valoa ja valon kanssa havaittujen vasteiden erotus REc = Rc (- Irr) - Rc (+ Irr). Annosvaikutus lasketaan kaavasta

jossa C* on ekvivalenssipitoisuus eli pitoisuus, jossa + Irr-vaste vastaa - Irr-vastetta pitoisuudessa C. Jos C*:tä ei voida määrittää, koska + Irr-kuvaajan vastearvot ovat järjestelmällisesti suurempia tai pienempiä kuin RC (- Irr), annosvaikutuksen arvo on 1. Painotuskertoimet (WI) saadaan suurimmasta vastearvosta: wi = MAX {Ri (+ Irr), Ri (- Irr)}. Pitoisuusvälit Ci valitaan siten, että kuhunkin pitoisuusväliin kuuluu sama määrä pisteitä. MPE:n laskeminen rajoittuu siihen suurimpaan pitoisuusarvoon, jossa ainakin toinen kuvaajista edelleen antaa vähintään 10 prosentin vastearvon. Jos tämä suurin pitoisuus on suurempi kuin + Irr-kokeessa käytetty suurin pitoisuus, + Irr-kuvaajan jäljelle jäävässä osassa vastearvo on 0. Riippuen siitä, onko MPE:n arvo suurempi kuin asianmukaisesti valittu erotteleva raja-arvo (MPEc=0,15) vai ei, kemikaali luokitellaan valomyrkylliseksi.
PIF:n ja MPE:n laskemista varten on saatavissa ohjelmistopaketti (20).
2.3 TULOSTEN TULKINTA
Validointitutkimuksen perusteella (8) testiaineen, jonka PIF < 2 tai MPE < 0,1 ennuste on: ”ei valomyrkyllinen”. Kun PIF > 2 ja < 5, tai kun MPE > 0,1 ja < 0,15, ennuste on: ”todennäköisesti valomyrkyllinen”; kun PIF > 5, tai kun MPE > 0,15, ennuste on: ”valomyrkyllinen”.
Laboratorion, joka ottaa käyttöön tämän määrityksen, olisi testattava ensin taulukossa 1 mainitut vertailumateriaalit ennen kuin aloitetaan testinaineiden testaaminen valomyrkyllisyyden arvioimiseksi. PIF- ja MPE-arvojen tulisi olla lähellä taulukossa 1 mainittuja arvoja.
Taulukko 1
|
Kemiallinen nimi |
EINECS nro |
CAS nro |
PIF |
MPE |
Absorptio-huippu |
Liuotin (9) |
|
Amiodaroni-HCL |
243-293-2 |
[19774-82-4] |
> 3,25 |
0,27-0,54 |
242 nm 300 nm (olkapää) |
ethanoli |
|
Klooripromatsiini-HCL |
200-701-3 |
[69-09-0] |
> 14,4 |
0,33-0,63 |
309 nm |
ethanoli |
|
Norfloksasiini |
274-614-4 |
[70458-96-7] |
> 71,6 |
0,34-0,90 |
316 nm |
asetonitriili |
|
Antraseeni |
204-371-1 |
[120-12-7] |
> 18,5 |
0,19-0,81 |
356 nm |
asetonitriili |
|
Protoporfyriini IX, dinatrium |
256-815-9 |
[50865-01-5] |
> 45,3 |
0,54-0,74 |
402 nm |
ethanoli |
|
L-histidiini |
|
[7006-35-1] |
ei PIF-arvoa |
0,05-0,10 |
211 nm |
vesi |
|
Heksaklorofeeni |
200-733-8 |
[70-30-4] |
1,1-1,7 |
0,00-0,05 |
299 nm 317nm (olkapää) |
ethanoli |
|
Natriumlauryylisulfaatti |
205-788-1 |
[151-21-3] |
1,0-1,9 |
0,00-0,05 |
Ei absorptiota |
vesi |
2.4 TULOSTEN TULKINTA
Jos valomyrkyllisyysvaikutuksia havaitaan vain suurimmilla testipitoisuuksilla (erityisesti vesiliukoisilla testikemikaaleilla), vaaran arvioimiseksi voidaan tarvita lisätestaamista muilla pitoisuuksilla. Lisätietoja voidaan tarvita esimerkiksi kemikaalin imeytymisestä ja kertymisestä ihoon, ja/tai kemikaali on testattava muulla testillä, esimerkiksi ihmisen tai eläimen ihoa käyttävällä in vitro -testillä tai ihomallien avulla.
Jos myrkyllisyyttä ei voida osoittaa (+ Irr ja - Irr) ja jos aineen huonoliukoisuus rajoittaa testattavia pitoisuuksia, voidaan asettaa kyseenalaiseksi, sopiiko testiaine kyseiseen määritykseen, ja on harkittava vahvistavaa määritystä (esim. käyttämällä muuta mallia).
3. RAPORTOINTI
TESTIRAPORTTI
Testiraportissa on esitettävä vähintään seuraavat tiedot:
|
|
Testiaine:
|
|
|
Liuotin:
|
|
|
Solut:
|
|
|
Testiolosuhteet (1) — inkubointi ennen käsittelyä ja sen jälkeen:
|
|
|
Testiolosuhteet (2) — käsittely kemikaalilla:
|
|
|
Testiolosuhteet (3) — säteilytys:
|
|
|
Testiolosuhteet (4) — neutraalipunatesti:
|
|
|
Tulokset:
|
|
|
Tulosten tarkastelu. |
|
|
Päätelmät. |
4. KIRJALLISUUSVIITTEET
|
1. |
Lovell W.W. (1993). A scheme for in vitro screening of substances for photoallergenic potential. Toxic. In Vitro 7: 95–102. |
|
2. |
Santamaria, L. and Prino, G. (1972). List of the photodynamic substances. In ”Research Progress in Organic, Biological and Medicinal Chemistry” Vol. 3 part 1. North Holland Publishing Co. Amsterdam. p XI–XXXV. |
|
3. |
Spielmann, H., Lovell, W.W., Hölzle, E., Johnson, B.E., Maurer, T., Miranda, M.A., Pape, W.J.W., Sapora, O., and Sladowski, D. (1994). In vitro phototoxicity testing: The report and recommendations of ECVAM Workshop 2. ATLA, 22, 314–348. |
|
4. |
Spikes, J.D. (1989). Photosensitization. In ”The science of Photobiology” Edited by K.C. Smith. Plenum Press, New York. 2nd edition, p 79–110. |
|
5. |
OECD (1997) Environmental Health and Safety Publications, Series on Testing and Assessment No.7 ”Guidance Document On Direct Phototransformation Of Chemicals In Water” Environment Directorate, OECD, Paris. |
|
6. |
Spielmann, H., Balls, M., Döring, B., Holzhütter, H.G., Kalweit, S., Klecak, G., L'Eplattenier, H., Liebsch, M., Lovell, W.W., Maurer, T., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W., and Willshaw, A. (1994). EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay. Toxic. In Vitro 8, 793–796. |
|
7. |
Anon (1998). Statement on the scientific validity of the 3T3 NRU PT test (an in vitro test for phototoxicity), European Commission, Joint Research Centre: ECVAM and DGXI/E/2, 3 November 1997, ATLA, 26, 7–8. |
|
8. |
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., Pechovitch, G. De Silva, O., Holzhütter, H.G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W.W., Maurer, T., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W., and Brantom, P. (1998). The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test. Toxic. In Vitro 12, 305–327. |
|
9. |
OECD (2002) Extended Expert Consultation Meeting on The In Vitro 3T3 NRU Phototoxicity Test Guideline Proposal, Berlin, 30th-31th October 2001, Secretariat's Final Summary Report, 15th March 2002, OECD ENV/EHS, available upon request from the Secretariat. |
|
10. |
Borenfreund, E., and Puerner, J.A. (1985). Toxicity determination in vitro by morphological alterations and neutral red absorption. Toxicology Lett., 24, 119–124. |
|
11. |
Hay, R.J. (1988) The seed stock concept and quality control for cell lines. Analytical Biochemistry 171, 225–237. |
|
12. |
Lambert L.A, Warner W.G., and Kornhauser A. (1996) Animal models for phototoxicity testing. In ”Dermatotoxicology”, edited by F.N. Marzulli and H.I. Maibach. Taylor & Francis, Washington DC. 5th Edition, p 515–530. |
|
13. |
Tyrrell R.M., Pidoux M (1987) Action spectra for human skin cells: estimates of the relative cytotoxicity of the middle ultraviolet, near ultraviolet and violet regions of sunlight on epidermal keratinocytes. Cancer Res., 47, 1825–1829. |
|
14. |
ISO 10977. (1993). Photography — Processed photographic colour films and paper prints — Methods for measuring image stability. |
|
15. |
Sunscreen Testing (UV.B) TECHNICALREPORT, CIE, International Commission on Illumnation, Publication No. 90, Vienna, 1993, ISBN 3 900 734 275 |
|
16. |
ZEBET/ECVAM/COLIPA — Standard Operating Procedure: In Vitro 3T3 NRU Phototoxicity Test. Final Version, 7 September, 1998. 18 pgs. |
|
17. |
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., De Silva, O., Holzhütter, H.G., Gerberick, F., Liebsch, M., Lovell, W.W., and Pfannenbecker, U. (1998) A study on UV filter chemicals from Annex VII of the European Union Directive 76/768/EEC, in the in vitro 3T3 NRU phototoxicity test. ATLA 26, 679–708. |
|
18. |
Holzhütter, H.G., and Quedenau, J. (1995) Mathematical modeling of cellular responses to external signals. J. Biol. Systems 3, 127–138. |
|
19. |
Holzhütter, H.G. (1997). A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals. ATLA, 25, 445–462. |
|
20. |
http://www.oecd.org/document/55/0,2340,en_2649_34377_2349687_1_1_1_1, 00.html |
LIITE 1
3T3 NRU -valomyrkyllisyystestin asema kemikaalien valomyrkyllisyyden vaiheittaisessa määrittämisessä

LIITE 2
Kuva 1
Suodatetun auringonvalosimulaattorin valon spektritehojakauma
(katso kohdan 1.4.1.5 toinen alakohta)
Kuvassa 1 oleva kaavio on esimerkki hyväksyttävästä suodatetun auringonvalosimulaattorin spektrin säteilyvoimakkuusjakaumasta. Kyseessä on (seostettu) metallihalidikaarilamppu, jota käytettiin 3T3 NRU -valomyrkyllisyystestin validointikokeessa (6) (8) (17). Kaaviosta käy ilmi kahden eri suodattimen suodatinvaikutus sekä soluviljelmien 96-kuoppalevyn kannen lisäsuodatinvaikutus. H2-suodatinta käytettiin vain testijärjestelmissä, jota sietävät suurempia määriä UVB-säteilyä (ihomallitesti ja punaisten verisolujen fotohemolyysitesti). 3T3 NRU -valomyrkyllisyystestissä käytettiin H1-suodatinta. Kaaviosta käy ilmi, että kuoppalevyn kannen lisäsuodatinvaikutus todetaan pääasiallisesti UVB-alueella. Suodatinvaikutus jättää säteilyspektriin tarpeeksi UVB-säteilyä, jotta voidaan eksitoida kemikaaleja, jotka absorboivat säteilyä tyypillisesti UVB-alueella (esim. amiodaroni) (katso taulukko 1).
Kuva 2
Balb/c 3T3 -solujen säteilyherkkyys (mitattuna UVA-alueella)
Solujen elävyys (neutraalipunan otto prosentteina pimeässä pidettyjen kontrollien neutraalipunan otosta)

(katso kohdan 1.4.1.5.2 toinen alakohta sekä kohdat 1.4.2.2.1 ja 1.4.2.2.2)
Kaavio kuvaa Balb/c 3T3 -solujen herkkyyttä 3T3 NRU -valomyrkyllisyystestin validointikokeessa käytetyn auringonvalosimulaattorin valolle (mitattuna UVA-alueella). Kuvaajasta näkyvät validointia edeltäneessä tutkimuksessa (seitsemässä eri laboratoriossa) saadut tulokset (1). Valkoisilla symboleilla merkityt kaksi kuvaajaa saatiin vanhoilla soluilla (paljon siirrostamisia), jotka oli korvattava uusilla soluilla. Mustilla symboleilla merkityt kuvaajat saatiin soluilla, joiden säteilyherkkyys oli hyväksyttävä.
Näistä tiedoista johdettiin suurimmaksi ei-solumyrkylliseksi säteilytysannokseksi 5 J/cm2 (pystysuora katkoviiva). Vaakasuora katkoviiva osoittaa lisäksi suurimman hyväksyttävän säteilyvaikutuksen (katso kohta 1.4.2.2.).
B.42. IHOHERKISTYS: PAIKALLINEN IMUSOLMUKEMÄÄRITYSMENETELMÄ
1. MENETELMÄ
Tämä menetelmä on toisinto OECD:n testiohjeesta nro 429 (2002).
1.1 JOHDANTO
Paikallinen imusolmukemääritysmenetelmä (Local Lymph Node Assay, LLNA) on riittävästi validoitu ja hyväksytty, joten se voidaan perustellusti määrätä uudeksi menetelmäksi (1)(2)(3). Tämä on toinen menetelmä kemikaalien ihoherkistyspotentiaalin arvioimiseksi eläimillä. Ensimmäisessä menetelmässä (B.6) käytetään marsutestejä, erityisesti marsuilla tehtävää maksimisaatiotestiä ja Bühlerin testiä (4).
LLNA on vaihtoehtoinen menetelmä, jonka avulla voidaan tunnistaa ihoa herkistävät kemikaalit ja varmistaa, että kemikaaleilla ei ole merkittävää ihoherkistyspotentiaalia. Tämä ei välttämättä merkitse sitä, että LLNA-menetelmää pitäisi käyttää kaikissa tapauksissa marsutestin asemesta, vaan pikemminkin sitä, että menetelmä on yhtä hyvä ja sitä voidaan käyttää vaihtoehtona, jossa positiivisia ja negatiivisia tuloksia ei yleensä enää tarvitse varmistaa uudelleen.
LLNA-menetelmällä on joitakin etuja sekä tieteen edistyksen että eläinten hyvinvoinnin kannalta. Menetelmällä tutkitaan ihoherkistyksen induktiovaihetta ja tuotetaan annosvasteen arviointiin sopivia kvantitatiivisia tuloksia. LLNA-menetelmän validointitiedot sekä siihen liittyvien tutkimusten tarkastelu on julkaistu lähteissä (5), (6), (7) ja (8). Lisäksi on syytä huomata, että lievää tai keskimääräistä herkistystä aiheuttavia aineita, joita suositellaan positiivisiksi kontrolliaineiksi marsutestimenetelmissä, voidaan käyttää myös LLNA-menetelmän yhteydessä (6) (8) (9).
LLNA on in vivo -menetelmä, joten sillä ei lopeteta koe-eläinten käyttöä kosketusherkistyksen arvioinnissa. Sen sijaan sillä voidaan vähentää tähän tarkoitukseen tarvittavien eläinten määrää. Lisäksi LLNA-menetelmässä käytetty tapa testata kosketusherkistytä eläimillä on huomattavasti aikaisempia edistyneempi. LLNA-menetelmän perustana on kemikaalien aiheuttamien immunologisten tapahtumien tarkastelu ihoherkistyksen induktiovaiheen aikana. Marsutesteistä poiketen LLNA-menetelmässä ei edellytetä tarkoituksellista ihon yliherkkyysreaktioiden tuottamista. LLNA-menetelmä ei myöskään edellytä adjuvantin käyttöä, kuten marsuilla tehtävä maksimisaatiotesti. LLNA-menetelmään liittyy siis vähemmän eläinten kärsimystä. Vaikka LLNA-menetelmällä onkin perinteisiin marsutesteihin verrattuna etuja, on syytä huomata, että siihen liittyy joitakin rajoituksia, joiden vuoksi voi olla tarpeen käyttää perinteisiä marsutestejä (esimerkiksi väärät negatiiviset löydökset LLNA-menetelmällä joidenkin metallien kohdalla ja väärät positiiviset löydökset joidenkin ihoa ärsyttävien aineiden kohdalla) (10).
Katso myös osan B johdanto.
1.2 TESTIMENETELMÄN PERIAATE
LLNA-menetelmän perusperiaate on, että ihoa herkistävät aineet aiheuttavat primaaria lymfosyyttien proliferaatiota imusolmukkeessa, joka kuljettaa kemiallisen aineen alueelta. Tämä proliferaatio on suhteessa käytettyyn annokseen (ja allergeenin voimakkuuteen) ja tarjoaa yksinkertaisen keinon ihoherkistyksen mittaamiseksi objektiivisella ja kvantitatiivisella tavalla. LLNA-menetelmässä arvioidaan proliferaatio annos-vastesuhteena, jossa testiryhmässä tapahtuvaa proliferaatiota verrataan kantaja-aineella käsitellyssä kontrolliryhmässä tapahtuvaan. Testiryhmien ja kontrolliryhmien proliferaation suhde (stimulaatioindeksi) määritetään, ja sen on oltava vähintään 3, ennen kuin testiaine voidaan arvioida mahdollisesti ihoherkistystä aiheuttavaksi. Tässä kuvatut menetelmät perustuvat solujen proliferaation mittaamiseen radioaktiivisen merkkiaineen avulla. Proliferaation arvioimiseksi voidaan kuitenkin käyttää myös muita päätepisteitä edellyttäen, että niiden käyttö on perusteltua, tutkimukset tukevat sitä ja mukaan liitetään täydelliset viitteet ja menetelmän kuvaus.
1.3 TESTIMENETELMÄN KUVAUS
1.3.1 Valmistelut
1.3.1.1 Koe-eläintilat ja eläinten ruokinta
Jokaisella eläimellä on oltava oma häkki. Koe-eläintilan lämpötilan on oltava 22 oC (+3 oC). Vaikka riittää, että suhteellinen kosteus on vähintään 30 % eikä mielellään ylitä 70 %:a muulloin kuin huoneen puhdistuksen aikana, pitäisi kuitenkin pyrkiä 50–60 %:n suhteelliseen kosteuteen. Huoneessa on käytettävä keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa, 12 tuntia pimeää). Eläinten ruokinnassa voidaan käyttää normaalia laboratorioruokavaliota, eikä juomaveden määrää saa rajoittaa.
1.3.1.2 Eläinten valmistelu
Eläimet valitaan satunnaistetusti, merkitään niin, että yksilöt voidaan erottaa toisistaan (ei kuitenkaan korvamerkeillä), ja pidetään häkeissä vähintään viiden päivän ajan ennen testiaineen annostelun aloittamista, jotta ne tottuvat laboratorio-olosuhteisiin. Ennen käsittelyn alkua kaikki eläimet on tutkittava sen varmistamiseksi, ettei niillä ole havaittavia ihovaurioita.
1.3.2 Testiolosuhteet
1.3.2.1 Koe-eläimet
Tähän testiin paras eläinlaji on hiiri. Testissä käytetään nuoria täysikasvuisia CBA/Ca- tai CBA/J-kannan naarashiiriä, jotka eivät ole synnyttäneet eivätkä ole raskaana. Testin alussa eläinten on oltava 8–12 viikon ikäisiä ja eläinten painoerojen on oltava vähäisiä eli enintään 20 % keskipainosta. Muita kantoja tai uroseläimiä voidaan käyttää, jos tulostietoja tuotetaan riittävästi sen osoittamiseksi, että LLNA-vasteessa ei esiinny merkitseviä koe-eläinkantaan tai sukupuoleen liittyviä eroja.
1.3.2.2 Reliabiliteetin tarkistus
Positiivisten kontrollien tarkoitus on osoittaa määritysmenetelmän toimivuus ja laboratorion pätevyys menetelmän käyttämisessä. Positiivisen kontrolliryhmän on tuotettava positiivinen LLNA-vaste altistustasolla, jonka odotetaan antavan stimulaatioindeksin (SI), joka on >3 verrattuna negatiiviseen kontrolliryhmään. Positiivisen kontrolliryhmän annostaso on valittava siten, että induktio on selvä mutta ei liiallinen. Suositeltavia aineita ovat heksyylikanelialdehydi (CAS-numero 101-86-0, EINECS-numero 202-983-3) ja merkaptobentsotiatsoli (CAS-numero 149-30-4, EINECS-numero 205-736-8). Joissakin olosuhteissa, jos on riittävät perusteet, voidaan käyttää muita kontrolliaineita, jotka täyttävät edellä mainitut kriteerit. Vaikka määritysmenetelmissä tavallisesti edellytetään positiivisen kontrolliryhmän käyttöä, testilaboratoriolla voi joissakin tapauksissa olla historiallisia positiivisen kontrolliryhmän määritystuloksia, jotka osoittavat tyydyttävän vasteen pysyvyyttä kuuden kuukauden jaksolta tai pitemmältä ajalta. Tällaisessa tapauksessa positiivisia kontrolliryhmiä voidaan testata harvemmin, kuitenkin enintään kuuden kuukauden välein. Vaikka positiivisen kontrolliryhmän testiaineet on testattava kantaja-aineessa, jonka tiedetään antavan aina samanlaisen vasteen (esimerkiksi asetoni: oliiviöljy), joidenkin säännösten mukaan testaus epästandardissa kantaja-aineessa (kliinisesti/kemiallisesti relevantissa aineessa) saattaa myös olla tarpeen. Tällöin on testattava positiivisen kontrolliaineen mahdollinen vuorovaikutus epästandardin kantaja-aineen kanssa.
1.3.2.3 Koe-eläinten määrä, annostasot ja kantaja-aineen valinta
Kussakin annostasoryhmässä on oltava vähintään neljä eläintä, ja testiaineesta on käytettävä vähintään kolmea konsentraatiota; lisäksi käytetään negatiivista kontrolliryhmää, joka käsitellään vain testiaineen kantaja-aineella, sekä tarpeen mukaan positiivista kontrolliryhmää. Tapauksissa, joissa kerätään yksittäisten eläinten tietoja, kussakin annosryhmässä on oltava vähintään viisi eläintä. Kontrolliryhmän eläimiä on kohdeltava samalla tavoin kuin testiryhmän eläimiä, paitsi että niitä ei käsitellä testiaineella.
Annostason ja kantaja-aineen valinnan on perustuttava lähteessä (1) esitettyihin suosituksiin. Annostasot valitaan konsentraatiosarjasta 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 % ja niin edelleen. Jos käytettävissä on aiempia tietoja aineen akuutista toksisuudesta ja ihoärsytyksestä, ne on otettava huomioon kolmen peräkkäisen konsentraation valinnassa siten, että suurin konsentraatio edustaa maksimialtistusta, kuitenkin niin, että vältetään koko elimistöön kohdistuvaa toksisuutta ja liian voimakasta paikallista ihoärsytystä (2) (11).
Kantaja-aine on valittava siten, että testikonsentraatiot ja niiden liukoisuus voidaan maksimoida ja saadaan testiaineen annostelua varten sopiva liuos/suspensio. Suositeltavat kantaja-aineet suosituimmuusjärjestyksessä ovat asetoni/oliiviöljy (4:1 v/v), dimetyyliformamidi, metyylietyyliketoni, propyleeniglykoli ja dimetyylisulfoksidi (2) (10); muitakin kantaja-aineita voidaan käyttää riittävin tieteellisin perustein. Joissakin tilanteissa voi olla tarpeen käyttää lisäkontrolliaineena kliinisesti perusteltua liuotinta tai kaupallista valmistetta, jossa testiainetta markkinoidaan. Erityisesti on varmistettava, että kantaja-ainejärjestelmässä on hydrofiilisiä aineita, jotta aine vettää ihon eikä valu heti pois. Pelkkiä vesiliuoksia on siis syytä välttää.
1.3.3 Testin suoritus
1.3.3.1 Testiaikataulu
Määritysmenetelmän aikataulu on seuraava:
|
|
Päivä 1: Määritetään ja kirjataan kunkin koe-eläimen paino. Koe-eläimen kummankin korvan takaosaan annostellaan avoannosteluna 25 μl testiaineen, kantaja-aineen tai positiivisen kontrolliaineen sopivaa laimennosta. |
|
|
Päivät 2 ja 3: Toistetaan päivänä 1 toteutettu menettely. |
|
|
Päivät 4 ja 5 : Ei käsittelyä. |
|
|
Päivä 6 : Kirjataan kunkin eläimen paino. Ruiskutetaan 250 μl fosfaattipuskuroitua suolaliuosta (PBS), joka sisältää 20 μCi (7,4e + 8 Bq) H-metyylitymidiiniä, kaikkiin testi- ja kontrolliryhmän hiiriin häntävaltimon kautta. Vaihtoehtoisesti ruiskutetaan 250 μL PBS:ää, joka sisältää 2 μCi (7,4e + 7 Bq) l25I-jododeoksiuridiinia ja 10-5 M-fluorodeoksiuridiinia, kaikkiin hiiriin häntävaltimon kautta. Viiden tunnin kuluttua eläimet lopetetaan. Kummastakin korvasta leikataan irti nestettä vievät korvalehden imusolmukkeet ja koko koeryhmän imusolmukkeet upotetaan PBS:ään (käsittelyryhmän näytteet yhdistetään); vaihtoehtoisesti kultakin eläinyksilöltä voidaan leikata imusolmukepari ja upottaa se yksilöittäin PBS:ään (vain yhden yksilön näytteet). Imusolmukkeiden tunnistukseen ja leikkaamiseen liittyvät tiedot ja kaaviot ovat lähteen (10) liitteessä 1. |
1.3.3.2 Solususpensioiden valmistus
Testiryhmien yhdistetyistä imusolmukesoluista tai yksittäisten eläinten imusolmukeparien soluista valmistetaan suspensio, jossa kaikki solut ovat irrallaan muista (yksisolususpensio), mekaanisesti hajottamalla solukertymät painamalla ne varovaisesti ruostumattoman terässeulan läpi (silmäkoko 200 μm). Imusolmukesolut pestään kahdesti runsaalla PBS:llä ja saostetaan 5 %:ssa trikloorietikkahapossa 4 oC:n lämpötilassa 18 tunnin ajan (1). Pelletit voidaan joko resuspendoida 1 ml:aan trikloorietikkahappoa ja siirtää tuikeputkiin, joissa on 10 ml tuikenestettä 3H-laskentaa varten, tai siirtää suoraan gammalaskentaputkiin l25I-laskentaa varten.
1.3.3.3 Solujen proliferaation (inkorporoituneen radioaktiivisuuden) määritys
H-metyylitymidiiniin inkorporoituminen mitataan ß-tuikelaskennalla hajoamisina minuutissa (DPM). 125I-jododeoksiuridiinin inkorporoituminen mitataan 125I-laskennalla ja ilmoitetaan niin ikään DPM-arvona. Inkorporoituminen ilmoitetaan DPM:nä joko testiryhmää kohti tai eläintä kohti.
1.3.3.4 Havainnot
1.3.3.4.1
Eläimistä on päivittäin havainnoitava huolellisesti mahdolliset kliiniset merkit joko annostelualueen paikallisesta ärsytyksestä tai koko elimistöön kohdistuvasta toksisuudesta. Kaikki havainnot kirjataan järjestelmällisesti erikseen kustakin eläinyksilöstä.
1.3.3.4.2
Kuten kohdassa 1.3.3.1 mainitaan, kukin eläin on punnittava erikseen testin alussa ja aikataulun mukaisen lopettamisen yhteydessä.
1.3.4 Tulosten laskeminen
Tulokset ilmoitetaan stimulaatioindeksinä (SI). Ryhmänäytteistä Sl-arvo saadaan jakamalla kunkin testiryhmän yhdistetty radioaktiivinen inkorporoituminen kantaja-ainekontrolliryhmän yhdistetyllä inkorporoitumisella, jolloin saadaan SI:n keskiarvo. Yksilönäytteistä Sl-arvo saadaan jakamalla testiaineryhmän ja positiivikontrolliryhmän eläinkohtaisista DMP-arvoista laskettu keskiarvo liuotin/kantaja-aine kontrolliryhmän vastaavalla tuloksella. Kantaja-aineella käsiteltyjen kontrolliryhmien SI:n keskiarvo on 1.
Kun Sl-arvo lasketaan yksilönäytteistä, määritystulokset voidaan analysoida tilastollisesti. Sopivaa tilastollista menetelmää valittaessa tutkijan on syytä pitää mielessä varianssien mahdolliset erot ja muut vastaavat ongelmat, jotka saattavat edellyttää määritystulosten muuntamista tai non-parametrista tilastollista analyysia. Sopiva käytäntö määritystulosten tulkintaan on arvioida testi- ja kontrolliryhmien yksittäiset määritystulokset ja derivoida näistä parhaiten sopiva annos-vastekäyrä, jossa luottamusvälit on otettu huomioon (8)(12)(13). Tutkijan on kuitenkin tarkattava ryhmissä mahdollisesti esiintyviä yksittäisten eläinten vasteita, jotka ovat käyrän ulkopuolella ja saattavat vaatia vasteen mittaamista vaihtoehtoisella menetelmällä (esimerkiksi mediaanina eikä keskiarvona) tai käyrän ulkopuolella olevan arvon poistamista.
Tuloksen voidaan katsoa olevan positiivinen, kun stimulaatioindeksi on > 3, kun annosvaste ja tapauksen mukaan tilastollinen merkitsevyys on otettu huomioon(3) (6) (8) (12)(14).
Jos saatuja tuloksia pitää selventää, on syytä ottaa huomioon testiaineen erilaiset ominaisuudet, mukaan luettuina mahdolliset rakenteelliset yhtäläisyydet tunnettuihin ihon herkistystä aiheuttaviin aineisiin, sen mahdollisesti aiheuttama liiallinen ihoärsytys ja havaitun annosvasteen luonne. Näitä ja muita huomionarvoisia seikkoja käsitellään yksityiskohtaisesti lähteessä (7).
2. MÄÄRITYSTULOKSET
Tulokset on esitettävä taulukkona, josta käyvät ilmi DPM-arvojen keskiarvot ja yksittäiset arvot sekä kunkin annosryhmän (myös kantaja-ainekontrolliryhmän) stimulaatioindeksi.
3. TULOSTEN ILMOITTAMINEN
3.1 LOPPURAPORTTI
Loppuraportti on annettava seuraavat tiedot:
|
|
Testiaine:
|
|
|
Kantaja-aine:
|
|
|
Koe-eläimet:
|
|
|
Testiolosuhteet:
|
|
|
Reliabiliteetin tarkistus:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta:
|
4. LÄHDELUETTELO
|
1. |
Kimber, I. and Basketter, D. A. (1992). The murine local lymph node assay; collaborative Studies and new directions: A commentary. Food and Chemical Toxicology 30, 165–169. |
|
2. |
Kimber, I, Derman, R. J., Scholes E. W, and Basketter, D. A. (1994). The local lymph node assay: developments and applications. Toxicology, 93, 13–31. |
|
3. |
Kimber, I., Hilton, J., Dearman, R. J., Gerberick, G. F., Ryan, C. A., Basketter, D. A., Lea, L., House, R. V., Ladies, G. S., Loveless, S. E., Hastings, K. L. (1998). Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. Journal of Toxicology and Environmental Health, 53, 563–79. |
|
4. |
Testimenetelmä B.6. |
|
5. |
Chamberlain, M. and Basketter, D. A. (1996). The local lymph node assay: status of validation. Food and Chemical Toxicology, 34, 999–1002. |
|
6. |
Basketter, D. A., Gerberick, G. F., Kimber, 1. and Loveless, S. E (1996). The local lymph node assay — A viable alternative to currently accepted skin sensitisation tests. Food and Chemical Toxicology, 34, 985–997. |
|
7. |
Basketter, D. A., Gerberick, G. F. and Kimber, I. (1998). Strategies for identifying false positive responses in predictive sensitisation tests. Food and Chemical Toxicology. 36, 327–33. |
|
8. |
Van Och, F. M. M, Slob, W., De Jong, W. H., Vandebriel, R. J., Van Loveren, H. (2000). A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employement of a regression method that includes determination of uncertainty margins. Toxicology, 146, 49–59. |
|
9. |
Dearman, R. J., Hilton, J., Evans, P., Harvey, P., Basketter, D. A. and Kimber, I. (1998). Temporal stability of local lymph node assay responses to hexyl cinnamic aldehyde. Journal of Applied Toxicology, 18, 281–4. |
|
10. |
National Institute of Environmental Health Sciences (1999). The Murine Local Lymph Node Assay: A Test Method for Assessing the Allergic Contact Dermatitis Potential of Chemicals/Compounds: The Results of an Independent Peer Review Evaluation Coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494, Research Triangle Park, N.C. (http://iccvam.niehs.nih.gov). |
|
11. |
Testimenetelmä B.4. |
|
12. |
Basketter, D. A., Selbie, E., Scholes, E. W. Lees, D. Kimber, I. and Botham, P. A. (1993). Results with OECD recommended positive control sensitisers in the maximisation, Buehler and local lymph node assays. Food and Chemical Toxicology, 31, 63–67. |
|
13. |
Basketter D. A., Lea L. J., Dickens A., Briggs D., Pate I., Dearman R. J., Kimber I. (1999). A comparison of statistical approaches to the derivation of EC3 values from local lymph node assay dose responses. J. Appl. Toxicology, 19, 261–266. |
|
14. |
Basketter D. A., Blaikie L., Derman R. J., Kimber I., Ryan C. A., Gerberick G. F., Harvey P., Evans P., White I. R. and Rycroft R. T. G. (2000). Use of local lymph node assay for the estimation of relative contact allergenic potency. Contact Dermatitis 42 ,344–48. |
B.43. NEUROTOKSISUUSTUTKIMUS JYRSIJÖILLÄ
1. MENETELMÄ
Tämä menetelmä vastaa OECD:n testiohjetta nro 424 (1997).
Tämän testimenetelmän tarkoituksena on tuottaa tiedot, joilla voidaan varmistaa kemikaalien mahdollinen neurotoksisuus täysikasvuisilla eläimillä tai kuvata se tarkemmin. Testi voidaan joko yhdistää toistuvan annostelun toksisuustutkimusten nykyisiin testimenetelmiin tai suorittaa erillisenä tutkimuksena. Tällä testimenetelmällä tehtävien tutkimusten suunnittelussa on suositeltavaa käyttää apuna OECD:n ohjeasiakirjaa neurotoksisuuden testistrategioista ja -menetelmistä (Guidance Document on Neurotoxicity Testing Strategies and Methods (1)). Tämä on erityisen tärkeää suunniteltaessa muutoksia menetelmän rutiinikäyttöön suositeltuihin havaintoihin ja testin suoritukseen. Ohjeasiakirjan tarkoituksena on helpottaa muiden testien valintaa tiettyissä oloissa.
Tällä menetelmällä ei arvioida sikiönkehitykseen liittyvää neurotoksisuutta.
1.1 JOHDANTO
Arvioitaessa kemikaalien toksisia ominaisuuksia on tärkeää ottaa huomioon mahdolliset neurotoksiset vaikutukset. Toistuvan annostelun systeemisen toksisuuden testimenetelmään sisältyy jo havaintojen tekoa mahdollisen neurotoksisuuden seulomiseksi. Tämän testimenetelmän avulla voidaan suunnitella tutkimus, jolla saadaan lisätietoja toistuvan annostelun systeemisen toksisuuden tutkimuksissa havaituista neurotoksisista vaikutuksista tai varmistetaan nämä vaikutukset. Tiettyjen kemikaaliluokkien mahdollinen neurotoksisuus voi kuitenkin antaa viitteitä siitä, että niiden arviointi on tarkoituksenmukaisempaa tällä menetelmällä, kun mahdollista neurotoksisuutta ei ole aiemmin osoitettu toistuvan annostelun systeemisen toksisuuden tutkimuksissa. Huomioon otettavia seikkoja ovat esimerkiksi
|
— |
havainnot hermostollisista oireista tai neuropatologisista vaurioista muissa toksisuustutkimuksissa kuin toistuvan annostelun systeemisen toksisuuden tutkimuksissa tai |
|
— |
rakenteellinen sukulaisuus tai muut tiedot, jotka yhdistävät kyseiset kemikaalit tunnettuihin neurotoksisiin aineisiin. |
Tämän testimenetelmän käyttäminen voi olla tarkoituksenmukaista muissakin tapauksissa. Yksityiskohtaisempia tietoja viitteessä (1).
Menetelmä on kehitetty sellaiseksi, että se voidaan räätälöidä erityistarpeisiin, jotta voidaan varmistaa kemikaalin spesifinen histopatologinen ja käyttäytymiseen vaikuttava neurotoksisuus sekä kuvata neurotoksiset vasteet ja kvantifioida ne.
Aiemmin neurotoksisuus rinnastettiin neuropatiaan, johon liittyi neuropatologisia vaurioita tai hermoston toimintahäiriöitä kuten kohtauksia, halvaus tai vapinaa. Vaikka neuropatia onkin tärkeä neurotoksisuuden ilmenemismuoto, nykyään on selvää, että hermostoon kohdistuvaan toksisuuteen liittyy monia muitakin oireita (esimerkiksi motorisen koordinaation puute, aistitoiminnan vajaukset, oppimis- ja muistihäiriöt), jotka eivät ilmene neuropatiaan liittyvissä tai muun tyyppisissä tutkimuksissa.
Tämän neurotoksisuuden testimenetelmän tarkoituksena on saada selville tärkeimmät hermostoperäiset käyttäytymiseen kohdistuvat ja neuropatologiset vaikutukset täysikasvuisilla jyrsijöillä. Vaikka morfologisia muutoksia ei esiintyisi, vaikutukset käyttäytymiseen voivat ilmentää elimistöön kohdistuvaa haitallista vaikutusta. Kaikki käyttäytymismuutokset eivät kuitenkaan ole nimenomaan hermostoperäisiä. Siksi kaikkia havaittuja muutoksia on arvioitava vastaavien histopatologisten, hematologisten tai biokemiallisten sekä muun tyyppiseen systeemiseen toksisuuteen liittyvien tietojen perusteella. Tässä menetelmässä neurotoksisten vasteiden kuvaamiseksi ja kvantifioimiseksi tehtäviin testeihin kuuluu erityisiä histopatologisia ja käyttäytymiseen liittyviä testejä. Niiden lisätukena voidaan käyttää sähköfysiologisia ja/tai biokemiallisia tutkimuksia (1)(2)(3)(4).
Neurotoksiset aineet voivat vaikuttaa monin tavoin useisiin kohteisiin hermostossa. Koska yhdelläkään koesarjalla ei voida täysin arvioida kaikkien aineiden mahdollista neurotoksisuutta, saatetaan tarvita muita in vivo tai in vitro -testejä, jotka on erityisesti tarkoitettu havaitun tai ennakoidun neurotoksisuustyypin tutkimiseen.
Soveltamalla yhdessä neurotoksisuuden testistrategioita ja -menetelmiä koskevan OECD:n ohjeasiakirjan (1) ohjeita ja tätä testimenetelmää voidaan myös suunnitella tutkimuksia, joiden tarkoituksena on kuvata tarkemmin annosvasteen kvantifiointia ja lisätä sen herkkyyttä. Näin voidaan paremmin arvioida haitaton vaikutustaso (no-observed-adverse effect level, NOAEL) tai osoittaa kemikaalin tiedetyt tai epäillyt haittavaikutukset. Voidaan esimerkiksi suunnitella tutkimuksia, joilla tunnistetaan ja arvioidaan neurotoksisuusmekanismeja tai täydennetään tietoja, joita on jo saatu käyttämällä tavanomaisia hermostoperäisiin käyttäytymisoireisiin kohdistuvia ja neuropatologisia havainnointimenetelmiä. Tällaisissa tutkimuksissa ei tarvitse yrittää hankkia tietoja, jotka saataisiin jo tässä menetelmässä suositelluilla tavanomaisilla kokeilla, mikäli nämä tiedot ovat jo saatavilla eikä niitä pidetä välttämättöminä tutkimustulosten tulkinnan kannalta.
Käytettäessä tätä neurotoksisuustutkimusta yksin tai yhdessä jonkin muun tutkimuksen kanssa saadaan tietoja, joiden avulla voidaan
|
— |
todeta, onko testattu kemikaali vahingoittanut hermostoa pysyvästi, vai ovatko vauriot palautuvia |
|
— |
kuvata kemikaalialtistumiseen liittyviä hermostonmuutoksia ja ymmärtää niiden taustalla olevia mekanismeja |
|
— |
määritellä annos-vaste- ja aika-vaste-suhteet haitattoman vaikutustason arvioimiseksi (jota voidaan käyttää kemikaalin turvallisuuskriteerien määrittelemisessä). |
Tässä testimenetelmässä testiaine annostellaan suun kautta. Muut antotiet (esimerkiksi ihon kautta tai inhalaationa) voivat olla sopivampia ja edellyttää suorituksen yksityiskohtien muuttamista. Antotavan valintaan vaikuttavat ihmisen altistusominaisuudet ja saatavilla olevat toksikologiset tai kineettiset tiedot.
1.2 MÄÄRITELMÄT
Haittavaikutus: sellainen käsittelyyn liittyvä poikkeama perustasosta, joka vähentää organismin kykyä pysyä hengissä, lisääntyä tai sopeutua ympäristöön.
Annos: annettavan testiaineen määrä. Annos ilmaistaan painoyksikköinä (g, mg) tai testiaineen painona koe-eläimen painoyksikköä kohti (esimerkiksi mg/kg) tai vakiopitoisuuksina ravinnossa (ppm).
Annostus: yleistermi, joka käsittää annoksen, annostusvälit ja annostelun keston.
Neurotoksisuus: kemikaalille tai biologiselle tai fysikaaliselle aineelle altistumisesta aiheutuva haitallinen muutos hermoston rakenteessa tai toiminnassa.
Neurotoksinen aine: kemikaali tai biologinen tai fysikaalinen aine, joka voi aiheuttaa neurotoksisuutta.
NOAEL: (lyhenne sanoista no-observed-adverse effect level). Korkein annostaso, jolla ei havaita käsittelyyn liittyviä haitallisia löydöksiä.
1.3 TESTIMENETELMÄN PERIAATE
Testattavaa kemikaalia annostellaan suun kautta erilaisina annoksina useille koe-eläinryhmille, jotka ovat laboratoriokokeissa käytettäviä jyrsijöitä. Tavallisesti käytetään toistuvaa annostusta. Annosteluohjelma voi kestää 28 päivää, 90 päivää (subkrooninen) tai yhden vuoden tai pidempään (krooninen). Tässä testimenetelmässä esitettyjä menettelyjä voidaan käyttää myös akuutin neurotoksisuuden tutkimuksessa. Eläimiä testataan käyttäytymiseen ja/tai hermostoon liittyvien poikkeavuuksien selvittämiseksi tai niiden kuvaamiseksi. Jokaisen havainnointijakson aikana arvioidaan monentyyppisiä käyttäytymisilmiöitä, johon neurotoksiset aineet voivat vaikuttaa. Testin lopussa osalle eläimistä (kaikista ryhmistä, kummastakin sukupuolesta) tehdään perfuusio in situ, ja aivoista, selkäytimestä ja ääreishermostosta preparoidaan leikkeitä, jotka tutkitaan.
Kun tutkimus suoritetaan erillisenä tutkimuksena neurotoksisuuden seulomiseksi tai neurotoksisten vaikutusten kuvaamiseksi, voidaan kustakin ryhmästä ne eläimet, joita ei käytetä perfuusioon tai myöhempiin histopatologisiin tutkimuksiin (katso taulukko 1), käyttää erityisiin hermostoperäisiin käyttäytymisoireisiin liittyviin, neuropatologisiin, neurokemiallisiin tai sähköfysiologisiin tutkimuksiin. Näillä tutkimuksilla täydennetään tämän menetelmän perustutkimuksa (1). Täydentävät tutkimukset voivat olla erityisen hyödyllisiä, kun empiiriset havainnot tai ennakoidut vaikutukset osoittavat kemikaalin neurotoksisuuden olevan tietyn tyyppistä, tai että sillä on erityinen kohde. Vaihtoehtoisesti jäljelle jääneet eläimet voidaan käyttää arviointeihin, joita edellytetään jyrsijöillä tehtävien toistuvan annostelun toksisuustutkimusten tutkimusmenetelmissä.
Kun tämän testimenetelmän menettelyt yhdistetään muiden testimenetelmien menettelyihin, on käytettävä riittävää määrää eläimiä, jotta molempien tutkimusten havainnointiin liittyvät vaatimukset voidaan täyttää.
1.4 MENETELMÄN KUVAUS
1.4.1 Eläinlajin valinta
Suositeltavin jyrsijälaji on rotta, tosin muitakin jyrsijöitä voidaan käyttää, mikäli se on perusteltua. Testiin on käytettävä nuoria, täysikasvuisia ja terveitä eläimiä, jotka edustavat yleisesti käytettyjä koe-eläinkantoja. Naaraat eivät saa olla synnyttäneitä eivätkä kantavia. Annostelu aloitetaan yleensä mahdollisimman pian vieroituksen jälkeen, mieluiten eläinten ollessa kuuden viikon ikäisiä, ja joka tapauksessa ennen kuin ne ovat yhdeksän viikon ikäisiä. Kun tämä tutkimus yhdistetään muihin tutkimuksiin, ikävaatimusta saatetaan joutua mukauttamaan. Käytettyjen eläinten paino saa tutkimuksen alussa vaihdella korkeintaan + 20 % kummankin sukupuolen keskipainosta. Kun lyhytaikaista toistuvan annostelun tutkimusta seuraa pitkäaikaistutkimus, on molemmissa tutkimuksissa käytettävä samasta kannasta ja samasta lähteestä olevia eläimiä.
1.4.2 Koe-eläintilat ja eläinten ruokinta
Koe-eläinhuoneen lämpötilan tulee olla 22 oC (+ 3 oC). Vaikka riittävät vaatimukset suhteellisen kosteuden suhteen ovat vähintään 30 % eikä mielellään yli 70 % muulloin kuin huoneen puhdistuksen aikana, pitäisi kuitenkin pyrkiä 50–60 %:n suhteelliseen kosteuteen. Huoneessa tulee käyttää keinovalaistusta 12 tunnin jaksoissa (12 tuntia valoa, 12 tuntia pimeää). Pitäisi välttää äkkinäisiä kovia ääniä. Eläinten ruokinnassa voidaan käyttää normaalia laboratoriorehua, eikä juomaveden määrää saa rajoittaa. Rehun valintaan voi vaikuttaa se, miten testiaine voidaan sekoittaa rehuun tällä menetelmällä annosteltaessa. Eläimet voidaan pitää häkeissä yksittäin tai muutaman samaa sukupuolta olevan eläimen ryhmissä.
1.4.3 Eläinten valmistelu
Nuoret, terveet eläimet jaetaan satunnaisotannalla testi- ja verrokkiryhmiin. Häkit tulee järjestää siten, että niiden sijoittamisesta mahdollisesti aiheutuvat vaikutukset ovat mahdollisimman vähäisiä. Eläimet merkitään yksilöllisesti ja pidetään häkeissään vähintään viiden päivän ajan ennen tutkimuksen aloittamista, jotta ne tottuvat laboratorio-oloihin.
1.4.4 Antotie ja annosten valmistelu
Tutkimusmenetelmässä edellytetään nimenomaan testiaineen annostelua suun kautta. Suun kautta annostelu voi tapahtua letkuruokinnalla, rehun tai juomaveden mukana tai kapseleina. Muita antotapoja (esimerkiksi ihon kautta tai inhalaationa) voidaan käyttää, mutta suoritustapaa saatetaan joutua muuttamaan. Antotavan valintaan vaikuttavat ihmisen altistusominaisuudet sekä saatavilla olevat toksikologiset ja kineettiset tiedot. Antotien valintaperusteet sekä siitä tämän testimenetelmän suoritukseen aiheutuvat muutokset on ilmoitettava.
Testiaine liuotetaan tai suspensoidaan tarvittaessa sopivaan kantaja-aineeseen. Suositusten mukaan ensin tulee käyttää vesipohjaista liuosta/suspensiota, sitten öljypohjaista (esimerkiksi maissiöljy) liuosta/suspensiota ja vasta sitten mahdollisesti muuhun kantaja-aineeseen pohjautuvaa liuosta/suspensiota. Kantaja-aineen toksiset ominaisuudet on tunnettava. Lisäksi on kiinnitettävä huomiota seuraaviin kantaja-aineen ominaisuuksiin: kantaja-aineen vaikutukset testiaineen imeytymiseen, jakautumiseen, metaboloitumiseen ja elimistössä säilymiseen. Edellä mainitut tekijät voivat vaikuttaa testiaineen toksisiin ominaisuuksiin. Lisäksi on otettava huomioon kantaja-aineen vaikutus eläinten ravinnon ja veden kulutukseen sekä niiden ravitsemustilaan.
1.5 TESTIN SUORITUS
1.5.1 Eläinten määrä ja sukupuoli
Kun tutkimus suoritetaan erillisenä tutkimuksena, on kunkin annoksen testaamiseen sekä verrokkiryhmään, jolla arvioidaan yksityiskohtaisia kliinisiä ja toiminnallisia havaintoja, käytettävä vähintään 20 eläintä (10 naarasta ja 10 urosta). Ainakin viidelle urokselle ja viidelle naaraalle näistä kymmenestä uroksesta ja kymmenestä naaraasta on tehtävä perfuusio in situ, ja niitä on käytettävä yksityiskohtaisiin neurohistopatologisiin tutkimuksiin tutkimuksen lopussa. Silloin, kun tietystä annosryhmästä havainnoidaan vain muutamia eläimiä neurotoksisten vaikutusten osoittamiseksi, nämä eläimet olisi mahdollisesti otettava perfuusioon valittujen eläinten joukkoon. Kun tutkimus suoritetaan yhdessä toistuvan annostelun toksisuustutkimuksen kanssa, on käytettävä riittävästi eläimiä molempien tutkimusten tavoitteiden saavuttamiseksi. Taulukossa 1 on esitetty eläinten vähimmäismäärät ryhmää kohti useissa tutkimusyhdistelmissä. Jos osa eläimistä aiotaan lopettaa kesken tutkimuksen tai suunnitellaan toipuvista eläimistä koostuvia ryhmiä toksisten vaikutusten palautuvuuden, jatkuvuuden ja ilmenemisen viivästymisen havainnoimiseksi testin jälkeen tai harkitaan täydentävien havaintojen tekemistä, eläinten määrää on lisättävä. Näin varmistetaan, että saatavilla on tarvittava määrä eläimiä havainnointia ja histopatologisia tutkimuksia varten.
1.5.2 Testiryhmä ja verrokkiryhmä
Yleensä käytetään vähintään kolmea annosryhmää ja yhtä verrokkiryhmää. Jos vaikutuksia ei muiden tietojen arvioinnin perusteella ole odotettavissa toistetulla vuorokausiannoksella 1 000 mg/kg, voidaan tehdä raja-annostesti. Jos sopivia tietoja ei ole saatavilla, voidaan tehdä annosalueen haarukointitesti käytettävien annosten määrittämisen helpottamiseksi. Testiaineen annostelua lukuun ottamatta verrokkiryhmän eläimiä on käsiteltävä täsmälleen samoin kuin testiryhmän eläimiä. Jos testiaineen annostelussa käytetään kantaja-ainetta, sitä tulee antaa verrokkiryhmälle suurin käytetty määrä.
1.5.3 Luotettavuuden tarkistus
Tutkimuksen suorittavan laboratorion on esitettävä tiedot, joista ilmenevät sen kyky suorittaa tutkimus sekä käytettyjen menetelmien herkkyys. Näistä tiedoista tulisi ilmetä kyky osoittaa ja kvantifioida muutokset päätepisteissä, joiden havainnointia suositellaan. Näitä ovat autonomiset oireet, aistien reaktiivisuus, tarttumaotteen voimakkuus ja motorinen aktiivisuus. Viitteissä 2–9 on tietoja eri tyyppisiä neurotoksisia vasteita aiheuttavista kemikaaleista, joita voidaan käyttää positiivisina kontrolliaineina. Aiemmin saatuja tietoja voidaan käyttää, jos koemenetelmien oleelliset osatekijät pysyvät ennallaan. Aiempien tietojen ajoittaista päivitystä suositellaan. Menetelmien herkkyyden säilymistä osoittavia uusia tietoja on tuotettava, kun testin suorittava laboratorio muuttaa jonkin testin toimenpiteiden suorittamisen kannalta olennaisen tekijän.
1.5.4 Annoksen valinta
Annostasojen valinnassa tulee ottaa huomioon kaikki testattavasta yhdisteestä tai sen sukulaisaineista saatavilla olevat aiemmin saadut toksisuus- ja kinetiikkatiedot. Korkein annostaso tulee valita siten, että sen tarkoituksena on aiheuttaa neurotoksisia vaikutuksia tai selviä systeemisen toksisuuden vaikutuksia. Tämän jälkeen annostasot valitaan asteittain alenevasti mahdollisen annosvasteen osoittamiseksi ja haitattoman vaikutustason (NOAEL) osoittamiseksi alhaisimmalla annostasolla. Periaatteessa annostasot tulee määrätä siten, että ensisijaiset hermostoon kohdistuvat toksiset vaikutukset voidaan erottaa systeemiseen toksisuuteen liittyvistä vaikutuksista. Kaksi tai kolme eri suuruista annosta on yleensä ihanteellisin määrä, ja usein on suositeltavaa käyttää neljättä testiryhmää erittäin pitkien annosvälien sijaan (esimerkiksi kerroin yli 10). Jos ihmisen altistumisesta on olemassa järkevä arvio, se on otettava huomioon.
1.5.5 Raja-annostesti
Jos tutkimus yhdellä annostasolla (vähintään 1 000 mg/kg/vrk) ei tässä kuvatulla suoritustavalla aiheuta havaittavia neurotoksisia vaikutuksia ja jos toksisuus ei ole todennäköistä rakenteellisesti samanlaisista yhdisteistä saatujen tietojen perusteella, täydellinen tutkimus kolmella annostasolla ei välttämättä ole tarpeen. Odotettavissa olevan ihmisen altistuksen perusteella raja-annostestissä on mahdollisesti käytettävä korkeampaa annostasoa suun kautta annettuna. Muiden antotapojen kuten inhalaation tai ihoapplikaation osalta korkein saavutettavissa oleva altistumistaso määräytyy yleensä testiaineen fysikaalis-kemiallisten ominaisuuksien perusteella. Akuutin oraalisen tutkimuksen tekemiseksi raja-annostestin annoksen tulee olla vähintään 2 000 mg/kg.
1.5.6 Annostelu
Eläimille annetaan testiainetta päivittäin seitsemänä päivänä viikossa vähintään 28 päivän ajan. Viisipäiväisen annosteluohjelman käyttö tai lyhyempi altistusaika on perusteltava. Letkuruokinnassa testiaine on annettava yhtenä annoksena mahaletkun tai sopivan intubaatiokanyylin kautta. Kerralla annettavan nesteen enimmäismäärä riippuu koe-eläinten koosta. Määrä ei saa olla yli 1 ml sataa painogrammaa kohti. Vesiliuoksia voidaan kuitenkin antaa 2 ml:aan asti sataa painogrammaa kohti. Lukuun ottamatta ärsyttäviä tai syövyttäviä aineita, joiden vaikutukset yleensä pahenevat korkeammilla pitoisuuksilla, testiainemäärän vaihtelu olisi minimoitava säätämällä pitoisuuksia vakiotilavuuden takaamiseksi kaikilla annostasoilla.
Jos aineita annetaan eläimille rehuun tai juomaveteen sekoitettuna, on tärkeää varmistaa, etteivät testiainemäärät häiritse normaalia ravinto- tai nestetasapainoa. Kun testiaine annetaan ravintoon sekoitettuna, sen määrä mitataan joko vakiopitoisuutena rehussa (ppm) tai eläimen painoon suhteutettuna vakioannostasona. Käytetty tapa pitää mainita. Jos testiaine annetaan letkulla, annos tulee antaa joka päivä samaan aikaan, ja annosta on mukautettava tarvittaessa siten, että annostaso pysyy samana eläimen painoon nähden. Kun toistuvan annostelun tutkimuksen jälkeen tehdään pitkäaikaistutkimus, eläimille on annettava samanlaista ravintoa molemmissa tutkimuksissa. Jos kerta-annos ei akuutissa tutkimuksessa ole mahdollinen, annos voidaan antaa pienemmissä osissa vuorokauden kuluessa.
1.6 HAVAINNOINTI
1.6.1 Havainnoinnin ja testien määrä
Toistuvan annostelun tutkimuksissa havainnointijakson tulee kattaa annostelujakso. Akuuteissa tutkimuksissa havaintoja on tehtävä käsittelyn jälkeen 14 päivän aikana. Satelliittiryhmien eläimiä, joita ei altisteta käsittelyn jälkeisen jakson aikana, on myös havainnoitava tällä jaksolla.
Havaintoja on tehtävä riittävän usein, jotta kaikki käyttäytymiseen liittyvät ja/tai hermostolliset poikkeavuudet voitaisiin havaita. Havainnot on mieluiten tehtävä samoihin aikoihin joka päivä ja ottaen huomioon, milloin odotettuja vaikutuksia esiintyy eniten. Kliinisten havaintojen ja toiminnallisten kokeiden aikataulu (taajuus) on esitetty yhteenvetona taulukossa 2. Jos aikaisemmista tutkimuksista saadut kineettiset tai muut tiedot osoittavat, että havainnoinnin, testien tai havainnoinnin jälkeisten jaksojen ajankohtaa on muutettava, on laadittava uusi aikataulu tiedonsaannin maksimoimiseksi. Aikatauluun tehtävät muutokset on perusteltava.
1.6.1.1 Havainnot yleisestä terveydentilasta ja kuolleisuudesta/sairastavuudesta
Kaikkien eläinten terveydentilaa on havainnoitava tarkoin vähintään kerran päivässä, ja niiden sairastavuutta tai kuolleisuutta vähintään kahdesti päivässä.
1.6.1.2 Yksityiskohtaiset kliiniset havainnot
Kaikista tätä tarkoitusta varten valituista eläimistä on tehtävä yksityiskohtaisia kliinisiä havaintoja (katso taulukko 1) kerran ennen ensimmäistä altistuskertaa (samaa koe-eläintä koskevia vertailuja varten) ja eri väliajoin sen jälkeen tutkimuksen kestosta riippuen (katso taulukko 2). Yksityiskohtaiset kliiniset havainnot toipuvien eläinten satelliittiryhmistä on tehtävä toipumisjakson lopussa. Yksityiskohtaiset kliiniset havainnot on tehtävä eläimen oman häkin ulkopuolella vakioalueella. Havainnot on kirjattava tarkasti käyttämällä pisteytysjärjestelmiä, joihin sisältyvät kriteerit tai pisteytysasteikot jokaista havainnointiin kuuluvaa mittausta varten. Testilaboratorion on määriteltävä käytetyt kriteerit ja asteikot tarkasti. On pyrittävä varmistamaan, että testiolosuhteet (jotka eivät liity järjestelmällisesti käsittelyyn) vaihtelevat mahdollisimman vähän, ja että havainnoinnin suorittavat eläinten käsittelystä tietämättömät koulutetut havainnoijat.
On suositeltavaa, että havainnointi toteutetaan suunnitelmallisesti siten, että tarkoin määriteltyjä kriteereitä (mukaan lukien normaalit ”vaihtelun rajat”) sovelletaan järjestelmällisesti kuhunkin eläimeen jokaisen havainnointiajankohdan aikana. ”Normaalit vaihtelun rajat” on dokumentoitava tarkoituksenmukaisesti. Kaikki havaitut oireet on kirjattava. Myös havaittujen oireiden voimakkuus on kirjattava mahdollisuuksien mukaan. Kliinisiä havaintoja on tehtävä muun muassa ihon, karvapeitteen, silmien, limakalvojen, mahdollisten eritteiden erityksen sekä autonomisen hermoston toiminnan (esimerkiksi kyynelvuoto, piloerektio, mustuaisen koko, poikkeavuudet hengityksessä ja/tai ilman haukkominen, kaikki virtsaamiseen tai ulostamiseen liittyvät epätavalliset oireet sekä virtsan värjäytyminen) muutoksista.
Myös kaikki kehon asentoon, aktiivisuustasoon (esimerkiksi vakioalueen vähentynyt tai lisääntynyt tutkiminen) ja liikekoordinaatioon liittyvät epätavalliset vasteet on kirjattava. Muutokset käynnissä (esimerkiksi vaappuminen ja ataksia), asennossa (esimerkiksi selän köyristäminen) ja käsittelyyn, paikkaan tai muihin ympäristön ärsykkeisiin liittyvässä reaktiivisuudessa sekä klooniset tai tooniset liikkeet, kouristukset tai vapina, stereotypiat (esimerkiksi ylenmääräinen turkin hoito, epätavalliset pään liikkeet, jatkuva kehän kiertäminen) tai omituinen käytös (esimerkiksi pureminen tai ylenmääräinen nuoleminen, itsensä silpominen, takaperin käveleminen, ääntely) tai aggressiivisuus on kirjattava.
1.6.1.3 Toiminnalliset kokeet
Yksityiskohtaisten kliinisten havaintojen tavoin myös toiminnallisia kokeita on tehtävä kerran ennen altistusta ja useasti sen jälkeen kaikilla tätä tarkoitusta varten valituilla eläimillä (katso taulukko 1). Myös toiminnallisten kokeiden lukumäärä riippuu tutkimuksen kestosta (katso taulukko 2). Taulukossa 2 esitettyjen havainnointijaksojen lisäksi toipuvien eläinten muodostamista satelliittiryhmistä on tehtävä toiminnallisia havaintoja mahdollisimman lähellä eläinten lopettamisajankohtaa. Toiminnallisissa kokeissa testataan aistien reaktiivisuutta erilaisille ärsykkeille (esimerkiksi kuulo, näkö ja asentotunto (5)(6)(7)), arvioidaan tarttumaotteen voimakkuutta (S) ja motorista toimintaa (9). Motorista toimintaa on mitattava automaattilaitteella, jolla voidaan selvittää sekä toiminnan väheneminen että lisääntyminen. Jos käytetään jotakin muuta määriteltyä järjestelmää, sen on oltava kvantitatiivinen, ja sen herkkyys ja luotettavuus on osoitettava. Kaikki laitteet on testattava sen varmistamiseksi, että laitteet ovat luotettavia koko tutkimuksen ajan ja ja antavat toistettavia tuloksia. Lisätietoja sopivista suoritustavoista on esitetty viitteissä. Jos ei ole saatavissa tietoja, jotka viittaisivat mahdollisiin neurotoksisiin vaikutuksiin (esimerkiksi rakenne-aktiivisuus-tiedot, epidemiologiset tiedot, muut toksikologiset tutkimukset), on harkittava aistitoiminnan ja motorisen toiminnan sekä oppimisen ja muistin testaamiseen erityistestien tekemistä mahdollisten vaikutusten tutkimiseksi tarkemmin. Lisätietoja erityistesteistä ja niiden käytöstä on esitetty viitteessä (1).
Eläimet, joissa ilmenee toksisuuden oireita siinä määrin, että se häiritsisi merkittävästi toiminnallisten kokeiden suorittamista, voidaan poistaa kyseisestä kokeesta. Eläinten poistaminen toiminnallisesta kokeesta on perusteltava.
1.6.2 Ruumiinpaino ja ravinnon/veden kulutus
Korkeintaan 90 päivää kestävissä tutkimuksissa eläimet on punnittava vähintään kerran viikossa, ja ravinnon kulutus (veden kulutus, jos testiaine annetaan veteen sekoitettuna) on mitattava vähintään viikoittain. Pitkäaikaistutkimuksissa kaikki eläimet on punnittava vähintään kerran viikossa ensimmäisten 13 viikon ajan ja sen jälkeen vähintään kerran neljässä viikossa. Ravinnon kulutus (veden kulutus, jos testiaine annetaan veteen sekoitettuna) on mitattava vähintään kerran viikossa ensimmäisten 13 viikon ajan ja sen jälkeen noin kolmen kuukauden välein, elleivät muutokset terveydentilassa tai ruumiinpainossa muuta edellytä.
1.6.3 Silmätutkimukset
Yli 28 päivää kestävissä tutkimuksissa on tehtävä silmätutkimus oftalmoskoopilla tai vastaavalla sopivalla välineellä ennen testiaineen annostelua ja tutkimuksen päättyessä mieluiten kaikille eläimille, mutta ainakin korkean annostason ryhmän ja verrokkiryhmän eläimille. Jos silmistä löydetään muutoksia tai jos se on kliinisten oireiden vuoksi tarpeen, kaikki eläimet on tutkittava. Pitkäaikaistutkimuksissa silmätutkimus on tehtävä myös 13. viikolla. Silmätutkimuksia ei tarvitse tehdä, jos tiedot ovat jo saatavissa muista saman pituisista ja samalla annostasolla tehdyistä tutkimuksista.
1.6.4 Hematologia ja kliininen biokemia
Kun neurotoksisuustutkimus tehdään toistuvan annostelun systeemisen toksisuuden tutkimuksen yhteydessä, verikokeet ja kliiniset biokemialliset määritykset on tehtävä systeemisen toksisuuden tutkimusmenetelmässä esitetyllä tavalla. Näytteiden kerääminen on tehtävä siten, että mahdolliset vaikutukset hermostoperäiseen käyttäytymiseen minimoidaan.
1.6.5 Histopatologia
Neuropatologinen tutkimus on suunniteltava täydentämään ja laajentamaan tutkimuksen in vivo -vaiheen aikana tehtyjä havaintoja. Näytteet vähintään viiden eläimen kudoksista sukupuolta ja ryhmää kohti (katso taulukko 1 ja seuraava kappale) on kiinnitettävä in situ käyttämällä yleisesti hyväksyttyjä perfuusio- ja kiinnitystekniikoita (katso viite 3, luku 5 ja viite 4, luku 50). Kaikki havaittavat suuret muutokset on kirjattava. Kun tutkimus suoritetaan yksittäisenä neurotoksisuuden seulontatutkimuksena tai neurotoksisten vaikutusten kuvaamiseksi, jäljelle jääneet eläimet voidaan käyttää joko erityisiin hermostoperäiseen käyttäytymiseen liittyviin (10) (11), neuropatologisiin (10) (11) (12) (13), neurokemiallisiin (10) (11) (14) (15) tai sähköfysiologisiin (10) (11) (16) (17) tutkimuksiin, jotka voivat täydentää tässä kuvattuja toimenpiteitä ja tutkimuksia. Nämä eläimet voidaan myös käyttää histopatologisiin tutkimuksiin. Täydentävät toimenpiteet ovat erityisen hyödyllisiä, kun empiiriset havainnot tai odotetut vaikutukset viittaavat tietyn tyyppiseen tai tiettyyn kohteeseen vaikuttavaan neurotoksisuuteen (2) (3). Vaihtoehtoisesti jäljelle jääneet eläimet voidaan käyttää toistuvan annostelun testimenetelmässä kuvattuihin tavanomaisiin patologisiin arviointeihin.
Kaikki parafiiniin valetut kudosnäytteet on värjättävä yleisellä värjäysmenetelmällä kuten hematoksyliini-eosiini-menetelmällä (H&E), ja ne on tutkittava mikroskooppisesti. Jos havaitaan tai epäillään merkkejä ääreishermoston neuropatiasta, on tutkittava muoviin valettuja ääreishermoston kudosnäytteitä. Myös kliiniset oireet voivat antaa aihetta uusien kohteiden tutkimiseen tai erityisten värjäysmenetelmien käyttämiseen. Viitteissä (3) ja (4) on annettu ohjeita lisätutkimuksen kohteista. Myös sopivat erikoisvärit voivat olla hyödyllisiä tietyn tyyppisten patologisten muutosten osoittamiseksi (18).
Keskus- ja ääreishermostosta otettuja edustavia leikkeitä on tutkittava histologisesti (katso viite 3, luku 5 ja viite 4, luku 50). Yleensä on tutkittava seuraavat alueet: etuaivot, isojen aivojen keskiosa mukaan luettuna aivoturson läpi menevä leike, keskiaivot, pikkuaivot, aivosilta, ydinjatke, silmä näköhermo ja verkkokalvo mukaan luettuna, selkäydin kaularangan ja lannerangan kohdalta, takajuuren hermosolmu, taka- ja etujuuren hermosäikeet, proksimaalinen lonkkahermo, proksimaalinen säärihermo (polven kohdalta) ja säärihermon puoleiset pohjelihaksen haarat. Selkäytimestä ja ääreishermostosta on tehtävä sekä poikittais- että pitkittäisleikkeet. Hermoston verisuonistoon on kiinnitettävä huomiota. Lisäksi on tutkittava luurankolihaksesta, erityisesti pohjelihaksesta otettu näyte. Erityistä huomiota on kiinnitettävä keskus- ja ääreishermoston alueisiin, joiden solu- ja säierakenteeseen sekä -tyyppiin neurotoksisen aineen tiedetään vaikuttavan erityisen haitallisesti.
Viitteissä (3) ja (4) on annettu ohjeita neuropatologisista muutoksista, joita toksisille aineille altistuminen yleisesti aiheuttaa. Kudosnäytteet on suositeltavaa tutkia vaiheittain siten, että korkean annostason ryhmästä otettuja leikkeitä verrataan aluksi verrokkiryhmästä otettuihin leikkeisiin. Jos näiden ryhmien näytteissä ei havaita neuropatologisia muutoksia, myöhempää analyysia ei tarvita. Jos korkean annoksen ryhmässä havaitaan neuropatologisia muutoksia, on keskisuuren ja pienen annoksen ryhmän kustakin mahdollisesti vahingoittuneesta kudoksesta otettava näytteet, jotka on koodattava ja tutkittava järjestyksessä.
Jos kvalitatiivisessa tutkimuksessa löydetään näyttöä neuropatologisista muutoksista, on tehtävä lisätutkimus niille hermoston alueille, joissa näitä muutoksia esiintyy. Kaikkien annosryhmien mahdollisesti vahingoittuneista alueista on otettava leikkeitä, jotka on koodattava ja tutkittava satunnaisotannalla niiden koodia tietämättä. Kaikkien vaurioiden määrä ja vaikeusaste on kirjattava. Kun kaikki alueet kaikista annosryhmistä on arvioitu, voidaan koodi paljastaa ja tehdä tilastollinen analyysi annosvasteiden suhteen arvioimiseksi. Kunkin vaurion eri vaikeusasteista on kuvailtava esimerkkejä.
Neuropatologiset löydökset on arvioitava yhdessä käyttäytymiseen liittyvien havaintojen ja mittausten sekä muista testiaineella tehdyistä edeltävistä ja samanaikaisista systeemisen toksisuuden tutkimuksista saatujen tietojen kanssa.
2. TULOKSET
2.1 TULOSTEN KÄSITTELY
Tuloksina on esitettävä yksittäisiä eläimiä koskevat tulokset. Kaikki tulokset tulee esittää myös yhteenvetona taulukossa, josta käy ilmi kussakin testi- ja verrokkiryhmässä käytettyjen eläinten lukumäärä kokeen alussa, kokeen aikana kuolleena löydettyjen tai humaaneista syistä lopetettujen eläinten lukumäärä sekä niiden kuolinajankohta, toksisuusoireita osoittaneiden eläinten lukumäärä, havaittujen toksisten vaikutusten kuvaus mukaan lukien niiden alkamisajankohta, kesto, tyyppi ja vaikeusaste, vaurioita saaneiden eläinten määrä mukaan lukien vaurioiden tyyppi ja vaikeusaste.
2.2 TULOSTEN ARVIOINTI JA TULKINTA
Tutkimuksessa on arvioitava hermostoperäiseen käyttäytymiseen kohdistuvien ja neuropatologisten vaikutusten esiintyvyys, vaikeusaste ja korrelaatio (myös neurokemialliset tai sähköfysiologiset vaikutukset, jos on tehty täydentäviä tutkimuksia) sekä muut havaitut haittavaikutukset. Numeeriset tulokset on mahdollisuuksien mukaan arvioitava asianmukaisella ja yleisesti hyväksytyllä tilastollisella menetelmällä. Tilastolliset menetelmät on valittava tutkimuksen suunnitteluvaiheessa.
3. TULOSTEN ILMOITTAMINEN
3.1 LOPPURAPORTTI
Loppuraportissa on annettava seuraavat tiedot:
|
|
Testiaine:
|
|
|
Kantaja-aine (tarvittaessa):
|
|
|
Koe-eläimet:
|
|
|
Koeolosuhteet:
|
|
|
Havainnointi ja testausmenetelmät:
|
|
|
Tulokset:
|
|
|
Tulosten tarkastelu:
|
|
|
Johtopäätökset:
|
4. KIRJALLISUUSVIITTEET
|
1. |
OECD Giudance Document on Neurotoxicity Testing Strategies and Test Methods. OECD, Paris, valmisteilla. |
|
2. |
Test Guidline for a Developmental Neurotoxicitu Study, OECD Guidelines for the Testing of Chemicals. Valmisteilla. |
|
3. |
World Health Organization (WHO) (1986). Environmental Health Criteria document 60: Principles and Methods for the Assessment of Neurotoxicity associated with Exposure to Chemicals. |
|
4. |
Spencer, P.S. and Schaumburg, H.H. (1980). Experimental and Clinical Neurotoxicology. Eds. Spencer, P.S. and Schaumburg, H.H. eds. Williams and Wilkins, Baltimore/London. |
|
5. |
Tupper, D.E. and Wallace, R.B. (1980). Utility of the Neurological Examination in Rats. Acta Neurobiol. Exp., 40, 999–1003. |
|
6. |
Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, 691–704. |
|
7. |
Moser, V.C., McDaniel, K.M. and Phillips, P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of amitraz. Toxic. Appl. Pharmacol., 108, 267–283. |
|
8. |
Meyer, O.A., Tilson, H.A., Byrd, W.C. and Riley, M.T. (1979). A Method for the Routine Assessment of Fore- and Hind- limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, 233–236. |
|
9. |
Crofton, K.M., Haward, J.L., Moser, V.C., Gill, M.W., Reirer, L.W., Tilson, H.A. and MacPhail, R.C. (1991) Interlaboratory Comparison of Motor Activity Experiments: Implication for NeurotoxicologicalAssessments. Neurotoxicol. Teratol., 13, 599–609. |
|
10. |
Tilson, H.A., and Mitchell, CL. eds. (1992). Neurotoxicology Target Organ Toxicology Series. Raven Press, New York. |
|
11. |
Chang, L.W., ed. (1995). Principles of Neurotoxicology. Marcel Dekker, New York. |
|
12. |
Broxup, B. (1991). Neuopathology as a screen for Neurotoxicity Assessment. J. Amer. Coll. Toxicol., 10, 689–695. |
|
13. |
Moser, V.C., Anthony, D.C., Sette, W.F. and MacPhail, R.C. (1992). Comparison of Subchronic Neurotoxicity of 2-Hydroxyethyl Acrylate and Acrylamide in Rats. Fund. Appl.Toxicol., 18, 343–352. |
|
14. |
O'Callaghan, J.P. (1988). Neurotypic and Gliotypic Proteins as Biochemical Markers of Neurotoxicity. Eurotoxicol. Teratol., 10, 445–452. |
|
15. |
O'Callaghan J.P. and Miller, D.B. (1988). Acute Exposure of the Neonatal Rat to Triethyltin Results in Persistent Changes in Neurotypic and Gliotypic Proteins. J. Pharmacol. Exp. Ther., 244, 368–378. |
|
16. |
Fox. D.A., Lowndes, H.E. and Birkamper, G.G. (1982). Electrophysiological Techniques in Neurotoxicology. In: Nervous System Toxicology. Mitchell, C.L. ed. Raven Press, New York, pp 299–335. |
|
17. |
Johnson, B.L. (1980). Electrophysiological Methods in neurotoxicity Testing. In: Experimental and Clinical Neurotoxicology. Spencer, P.S. and Schaumburg, H.H. eds., Williams and Wilkins Co.,. Baltimore/London, pp. 726–742. |
|
18. |
Bancroft, J.D. and Steven A. (1990). Theory and Pratice of Histological Techniques. Chapter 17, Neuropathological Techniques. Lowe, James and Cox, Gordon eds. Churchill Livingstone. |
Taulukko 1
Eläinten vähimmäismäärä ryhmää kohti kun neurotoksisuustutkimus tehdään erikseen tai muiden tutkimusten yhteydessä
|
|
NEUROTOKSISUUSTUTKIMUKSEN TYYPPI: |
|||
|
Erillinen tutkimus |
28-päiväisen tutkimuksen yhteydessä |
90-päiväisen tutkimuksen yhteydessä |
Kroonisen toksisuustutkimuksen yhteydessä |
|
|
Eläinten kokonaismäärä ryhmää kohti |
10 urosta ja 10 naarasta |
10 urosta ja 10 naarasta |
15 urosta ja 15 naarasta |
25 urosta ja 25 naarasta |
|
Toiminnallisiin kokeisiin ja yksityiskohtaiseen kliiniseen havainnointiin valittujen eläinten lukumäärä |
10 urosta ja 10 naarasta |
10 urosta ja 10 naarasta |
10 urosta ja 10 naarasta |
10 urosta ja 10 naarasta |
|
In situ -perfuusioon ja neurohistopatologisiin tutkimuksiin valittujen eläinten lukumäärä |
5 urosta ja 5 naarasta |
5 urosta ja 5 naarasta |
5 urosta ja 5 naarasta |
5 urosta ja 5 naarasta |
|
Toistuvan annostelun/subkroonisen/kroo-nisen toksisuuden havainnointiin, hematologian, kliinisen biokemian ja histopatologian kokeisiin jne. valittujen eläinten lukumäärä vastaavien ohjeasiakirjojen mukaisesti |
|
5 urosta ja 5 naarasta |
||
|
Täydentävät havainnot tarvittaessa |
5 urosta ja 5 naarasta |
|
|
|
Taulukko 2
Kliinisten havaintojen ja toiminnallisten kokeiden taajuus
|
Havaintotyyppi |
Tutkimuksen kesto |
||||||||||||||||||||||||||
|
Akuutti |
28-päiväinen |
90-päiväinen |
Krooninen |
||||||||||||||||||||||||
|
Kaikille eläimille |
Yleinen terveydentila |
päivittäin |
päivittäin |
päivittäin |
päivittäin |
||||||||||||||||||||||
|
Kuolleisuus/sairas- tavuus |
kahdesti päivässä |
kahdesti päivässä |
kahdesti päivässä |
kahdesti päivässä |
|||||||||||||||||||||||
|
Toiminnallisiin havaintoihin valituille eläimille |
Yksityiskohtaiset kliiniset havainnot |
|
|
|
|
||||||||||||||||||||||
|
Toiminnalliset kokeet |
|
|
|
|
|||||||||||||||||||||||
B.44. IHON KAUTTA IMEYTYMINEN: IN VIVO -MENETELMÄ
1. MENETELMÄ
Tämä menetelmä vastaa OECD:n testiohjetta nro TG 427 (2004)
1.1 JOHDANTO
Altistuminen tapahtuu monille kemikaaleille ihon kautta. Suurimmassa osassa laboratorioelämillä tehtävistä toksikologista kokeista käytetään kuitenkin suun kautta annostelua. Tässä testiohjeessa esitelty in vivo -ihoabsorptiotesti mahdollistaa ekstrapoloinnin suuannostelua käyttävien kokeiden tulosaineiston perusteella, kun arvioidaan kemikaalien turvallisuutta ihoaltistuksen jälkeen.
Aineen on läpäistävä runsaasti ihon solukerroksia ennen kuin se päätyy verenkiertoon. Nopeuden kannalta ratkaiseva kerros on useimpien aineiden osalta marraskesi, joka koostuu kuolleista soluista. Aineen pääsy ihon läpi riippuu sen rasvaliukoisuudesta ja orvaskeden ulomman kerroksen paksuudesta sekä myös esimerkiksi molekyylipainosta ja aineen pitoisuudesta. Rottien ja kanien iho on yleensä läpäisevämpi kuin ihmisten, kun taas marsujen ja apinoiden ihon läpäisevyys vastaa enemmän ihmisen ihon läpäisevyyttä.
Menetelmät, joilla mitataan ihon kautta imeytymistä, voidaan jakaa kahteen luokkaan: in vivo -menetelmiin ja in vitro -menetelmiin. In vivo -menetelmällä voidaan saada luotettavaa tietoa useilla koe-eläinlajeilla. Sittemmin on kehitetty in vitro -menetelmiä. Niissä tutkitaan testiaineen kulkeutumista ihmisestä tai eläimestä otetun ohennetun ihonäytteen tai kokoihonäytteen läpi nesteisiin. In vitro -menetelmä kuvataan erillisessä testiohjeessa (1). OECD:n asiakirjasta ”Guidance Document for the Conduct of Skin Absorption Studies” (2) on apua valittaessa sopivinta menetelmää kulloiseenkin erityistilanteeseen. Teos tarjoaa lisätietoa sekä in vivo -menetelmien että in vitro -menetelmien soveltuvuudesta.
Tässä testiohjeessa kuvatulla in vivo -menetelmällä määritetään testiaineen penetraatio ihon läpi verenkiertoon. Menetelmä on ollut laajassa käytössä useiden vuosien ajan (3) (4) (5) (6) (7). Vaikka in vitro -ihoabsorptiotestit voivat monissa tapauksissa olla sopivia, on tilanteita, joissa vain in vivo -kokeella saadaan tarvittavat tiedot.
In vivo -menetelmän etuna on, että siinä käytetään fysiologisesti ja metabolisesti ehyttä järjestelmää sekä useille myrkyllisyystesteille yhteistä lajia. Lisäksi in vivo -menetelmää voidaan mukauttaa siten, että siinä voidaan käyttää myös muita lajeja. Haittana on, että siinä käytetään eläviä eläimiä ja radioaktiivia merkkiaineita, jotta taattaisiin tulosten luotettavuus. In vivo -testissä on myös vaikea määrittää varhainen imeytymisvaihe. Lisäksi testiä varten suositeltavan koe-eläimen (rotan) ja ihmisen ihon läpäisevyysominaisuudet poikkeavat toisistaan. Eläimen iho on yleensä läpäisevämpi, minkä vuoksi eläimillä tehdyissä kokeissa voidaan yliarvioida ihmisen ihoabsorptio (6) (8) (9). Syövyttäviä emäksiä tai muita syövyttäviä aineita ei pitäisi testata elävillä elämillä.
1.2 MÄÄRITELMÄT
Imeytymätön annos: se testiaineen määrä, joka pestään iholta altistuksen jälkeen ja joka on jäänyt ei-okklusiivisen suojan pinnalle, mukaan lukien se testiaineen määrä, jonka voidaan osoittaa haihtuneen iholta altistuksen aikana
Imeytynyt annos (in vivo) se testiaineen määrä, joka on virtsassa, koe-eläinhäkin pesuvedessä, ulosteessa, uloshengitysilmassa (jos mitattu), veressä, kudoksissa (jos kerätty) sekä eläimen ruumiissa sen jälkeen, kun aplikointialueen iho on poistettu.
Mahdollisesti imeytyvä annos: se testiaineen määrä, joka on iholla tai ihossa sen jälkeen, kun iho on pesty.
1.3 TESTIMENETELMÄN PERIAATE
Testiaine, joka suositellaan leimattavaksi radioaktiivisella merkkiaineella, aplikoidaan eläinten iholle, jolta on leikattu karvat. Testiaine annostellaan yleisesti käytössä olevan valmisteen muodossa, ja annostelussa käytetään yhtä tai useampaa sopivaa annostasoa. Testiaineen annetaan olla kosketuksissa ihon kanssa tietyn ajan sopivan suojan alla (ei-okklusiivinen, puoliokklusiivinen tai okklusiivinen), jotta eläin ei voi niellä testiainetta. Altistusajan lopussa suoja poistetaan ja iho puhdistetaan sopivalla puhdistusaineella. Suoja ja puhdistuksessa käytetyt materiaalit kerätään talteen analyysiä varten, ja ihon päälle pannaan uusi suoja. Eläimet ovat ennen altistusta, altistuksen aikana ja altistuksen jälkeen kukin erillisessä aineenvaihduntahäkissä, jossa eritteet ja uloshengitysilma kerätään koko ajalta talteen analyysiä varten. Uloshengitysilman kerääminen ei ole välttämätöntä, jos on riittävää näyttöä siitä, että haihtuvia radioaktiivisia metaboliitteja muodostuu vain vähän tai ei lainkaan. Kussakin tutkimuksessa käytetään normaalisti useita eläinryhmiä, jotka altistetaan testiaineelle. Yksi ryhmä lopetetaan altistusajan lopussa. Muut ryhmät lopetetaan määräaikavälein sen jälkeen (2). Näytteenottoajan lopussa lopetetaan jäljellä olevat eläimet, veri kerätään talteen analyysiä varten, altistusalueen iho poistetaan analyysiä varten ja tutkitaan, onko eläimen kehossa erittymätöntä materiaalia. Näytteistä tehdään määritykset sopivin menetelmin ja ihoabsorption aste arvioidaan (6) (8) (9).
1.4 MENETELMÄN KUVAUS
1.4.1 Koe-eläinten valinta
Yleisimmin käytetty laji on rotta, mutta voidaan käyttää myös muita karvattomia kantoja ja lajeja, joiden ihoabsorption nopeus vastaa enemmän ihmisen ihon abosorptionopeutta (3) (6) (7) (8) (9). Testissä pitäisi käyttää nuoria täysikasvuisia elämiä, jotka ovat samaa sukupuolta (oletusarvoisesti uroksia) ja peräisin yleisesti käytetyistä laboratoriokannoista. Testin alussa koe-eläinten paino saa vaihdella enintään ± 20 % keskipainosta. Esimerkiksi 200–250 g painavat urosrotat ovat sopivia (erityisesti painoasteikon yläosassa).
1.4.2 Eläinten lukumäärä ja sukupuoli
Kunkin testiaineen ja kunkin lopetusajankohdan osalta on käytettävä vähintään neljä samaa sukupuolta edustavan eläimen ryhmää. Kukin eläinryhmä lopetetaan eri ajankohtina, esimerkiksi altistusajan lopussa (tyypillisesti 6 tai 24 tuntia) ja sen jälkeen määräajankohtina (esim. 48 ja 72 tunnin kuluttua). Jos on näyttöä merkittävistä eroista uros- ja naarasyksilöiden ihomyrkyllisyydessä, on valittava herkempi sukupuoli. Jos tällaista näyttöä ei ole, voidaan valita kumpi tahansa sukupuoli.
1.4.3 Häkit ja ruokinta
Koe-eläinhuoneen lämpötilan on oltava 22 oC (± 3 oC). Suhteellisen kosteuden on oltava vähintään 30 % eikä mielellään yli 70 % muulloin kuin huoneen siivouksen aikana. Suhteellinen kosteus pitäisi kuitenkin pyrkiä pitämään välillä 50–60 %. Valolähteenä on keinovalo, jaksoittaisuus 12 tuntia valoa, 12 tuntia pimeyttä. Ravintona voidaan käyttää tavanomaista laboratoriorehua, jota pitäisi olla jatkuvasti eläinten saatavilla samoin kuin juomavettä. Testin ja mielellään myös laboratorio-olosuhteisiin totutuksen aikana eläimet ovat aineenvaihduntahäkeissä (yksi kussakin). Koska ruoan ja veden läikkyminen vaikuttaisi tuloksiin, sen todennäköisyys on minimoitava.
1.4.4 Eläinten preparointi
Eläimet merkitään, jotta ne voidaan tunnistaa yksilökohtaisesti, ja pidetään häkeissä vähintään viisi päivää ennen testin alkua, jotta ne voidaan totuttaa laboratorio-olosuhteisiin.
Totutusajan lopussa ja noin 24 tuntia ennen testiaineen annostelua kultakin eläimeltä leikataan karvat osalta hartioiden ja selän alueen ihoa. Vahingoittuneen ihon läpäisevyysominaisuudet poikkeavat ehyen ihon läpäisevyysominaisuuksista, minkä vuoksi on vältettävä ihon raapiintuminen tai hiertyminen. Karvojen leikkaamisen jälkeen ja noin 24 tuntia ennen testiaineen aplikointia (ks. kohta 1.4.7) ihonäytteen pinta pyyhitään asetonilla talin poistamiseksi. Muuta pesua saippualla ja vedellä ei suositella, koska saippuajäämät voivat edistää testiaineen imeytymistä. Pinta-alan on oltava tarpeeksi suuri (mielellään aikakin 10 cm2), jotta voidaan luotettavasti määrittää testikemikaalin imeytynyt määrä ihoneliösenttimetriä kohti. Kymmenen neliösentimetrin näyte saadaan rotista, joiden paino on 200–250 g. Preparoinnin jälkeen eläimet pannaan takaisin aineenvaihduntahäkkeihin.
1.4.5 Testiaine
Testiaine on aine, jonka penetraatio-ominaisuuksia testissä tutkitaan. Testiaine suositellaan leimattavaksi radioaktiivisella merkkiaineella.
1.4.6 Testin valmistelu
Testiainevalmisteen (esim. testiaineen sisältävä laimentamaton tai laimennettu materiaali tai formulaatio, joka aplikoidaan iholle) on oltava sama kuin valmiste, jolle ihmiset tai muut kohdelajit voivat altistua, tai kyseisen valmisteen realistinen korvike. Käytössä olevasta valmisteesta poikkeaminen on perusteltava. Tarvittaessa testiaine on liuotettava tai suspendoitava sopivaan kantaja-aineeseen. Jos kantaja-aineena käytetään muuta kuin vettä, sen imeytymisominaisuudet ja mahdollinen reagointi testiaineen kanssa on tunnettava.
1.4.7 Aplikointi iholle
Ihon pinnalle määritetään aplikointialue (tietty pinta-ala). Tunnettu määrä testiainetta aplikoidaan tasaisesti tälle alueelle. Määrän olisi jäljiteltävä altistumista ihmisissä, minkä vuoksi se on tyypillisesti 1–5 mg/cm2, kun testiaine on kiinteä, ja enintään 10 μl/cm2, kun testiaine on nestemäinen. Jos käytetään muuta määrää, tämä pitäisi perustella ennakoiduilla käyttöolosuhteilla, tutkimuksen tavoitteilla ja testiaineen fysikaalisilla ominaisuuksilla. Aplikoinnin jälkeen on estettävä se, että eläin puhdistaa alueen. Kuvassa 1 on esimerkki tyypillisestä laitteesta. Tavallisesti aplikointialue peitetään ei-okklusiivisella suojalla (esim. läpäisevällä nailonharsolla). Jos on kyse rajoittamattomasta annoksesta, aplikointialue on peitettävä okklusiivisella suojalla. Jos puolihaihtuvien testiaineiden haihtuminen vähentää testiaineen saantonopeutta liikaa (ks. myös kohta 1.4.10, ensimmäinen alakohta), haihtunut aine on kerättävä laitteen peittävään hiilisuodattimeen (ks. kuva 1). On tärkeää huolehtia siitä, että mikään väline ei vahingoita ihoa eikä absorboi testiainetta tai reagoi sen kanssa. Eläimet palautetaan aineenvaihduntahäkkeihin eritteiden keräämiseksi.
1.4.8 Altistus- ja näytteenottoaika
Altistusaika on aika, joka kuluu testiaineen aplikoinnista sen poistamiseen (ihon pesemiseen). Altistusaika (tyypillisesti 6 tai 24 tuntia) valitaan sen mukaan, mikä on ennakoitu altistusaika ihmisissä. Altistusajan jälkeen eläimiä pidetään aineenvaihduntahäkeissä niiden lopettamisajankohtaan asti. Koko testin ajan on tarkistettava määrävälein, onko eläimissä merkkejä toksisuudesta tai esiintyykö epänormaaleja reaktioita. Altistusajan lopussa on tarkistettava, onko käsitellyssä ihossa näkyviä merkkejä ärsytyksestä.
Aineenvaihduntahäkkien on oltava sellaisia, että virtsa ja ulosteet voidaan kerätä kumpikin erikseen koko testin ajan. Lisäksi 14C-hiilidioksidi ja haihtuvat 14C-hiiliyhdisteet on voitava kerätä. Nämä on analysoitava, jos niiden määrä on > 5 %. Virtsa, ulosteet ja haihtuvien aineiden keräämiseen tarkoitettu neste (esim. 14C-hiilidioksidi ja haihtuvat 14C-yhdisteet) on kerättävä kukin erikseen kustakin ryhmästä kunakin näytteenottoajankohtana. Jos on riittävää näyttöä, että haihtuvia radioaktiivisia metaboliitteja muodostuu vain vähän tai ei lainkaan, voidaan käyttää avoimia häkkejä.
Eritteet kerätään altistuaikana 24 tunnin ajalta ensimmäisen ihokontaktin jälkeen ja tämän jälkeen päivittäin testin loppuun asti. Yleensä riittää, että eritteet kerätään kolme kertaa, mutta testiaineen ennakoidun käyttötarkoituksen tai käytettävissä olevien kineettisten tietojen perusteella ajankohtia voidaan lisätä tai niitä voidaan muuttaa.
Altistusajan lopussa suoja poistetaan kustakin eläimestä ja pannaan talteen erillistä analyysiä varten. Kaikkien eläinten käsitelty iho pestään vähintään kolme kertaa puhdistusaineella käyttäen sopivia tuppoja. Muiden ruumiinosien kontaminoituminen on huolellisesti vältettävä. Puhdistusaineen pitäisi olla normaalien hygieniakäytäntöjen mukainen (esim. vesi-saippualiuos). Lopuksi iho kuivataan. Kaikki tupot ja pesuvedet pannaan talteen analyysiä varten. Ennen eläinten siirtämistä häkkeihin asetetaan paikalleen uusi suoja suojaamaan käsiteltyä aluetta niissä eläimissä, joiden ryhmät lopetetaan vasta myöhemmin.
1.4.9 Lopetus
Kunkin ryhmän eläimet lopetetaan määräajankohtana ja veri kerätään talteen analyysiä varten. Suoja tai peite poistetaan analyysiä varten. Aplikointialueen iho ja vastaava alue ihoa, jolta on leikattu karvat mutta jota ei ole altistettu testiaineelle, poistetaan kustakin eläimestä erillistä analyysiä varten. Aplikointialueen iho voidaan jaottaa erottamalla marraskesi sen alla olevasta orvaskedestä, jotta saataisiin tarkemmat tiedot testikemikaalin jakautumisesta. Tämän jakautumisen määrittäminen tietyltä ajalta altistusajan jälkeen tarjoaa tietoa siitä, miten testikemikaali läpäisee marraskeden. Ihon jaotuksen helpottamiseksi (ihon viimeisen pesun ja eläimen lopettamisen jälkeen) kukin suoja poistetaan. Aplikointialue (ja rengasmainen alue ympäröivää ihoa) leikataan rotasta ja kiinnitetään levylle. Pala teippiä painetaan varovasti ihon pinnalle ja irrotetaan sitten niin että osa marraskettä tulee mukaan. Menettely toistetaan uusilla teipinpaloilla, kunnes teippi ei enää kiinnity ihon pintaan (kun koko marraskesi on poistettu). Kunkin eläimen kaikki teipinpalat pannaan samaan astiaan, johon lisätään liuotinta, joka pystyy liuottamaan marraskeden täydellisesti. Mahdolliset kohdekudokset voidaan poistaa erillistä analyysiä varten ennen kuin jäljellä olevan eläimen ruumis analysoidaan (ruumiiseen imeytynyt annos). Yksittäiset eläinten ruumiit pannaan talteen analyysiä varten. Yleensä riittää kokonaissisällön analyysi. Kohde-elimet voidaan kuitenkin ottaa erilleen erillistä analyysiä varten (jos muut tutkimukset antavat tähän aihetta). Virtsarakossa eläinten lopettamishetkellä oleva virtsa lisätään aikaisemmin kerättyyn virtsamäärään. Kun aineenvaihduntahäkeistä on kerätty eritteet eläinten lopettamisen yhteydessä, häkit ja niiden keräyslaitteet pestään sopivalla liuottimella. Myös muut mahdollisesti kontaminoituneet välineet on analysoitava.
1.4.10 Analyysi
Kaikissa kokeissa on päästävä riittävään saantoon (keskiarvon on oltava 100 ± 10 % radioaktiivisuudesta). Poikkeamat tästä on perusteltava. Kussakin näytteessä oleva määrä analysoidaan asianmukaisesti validoiduilla menetelmillä.
Kunkin aplikoinnin osalta on määritettävä rinnakkaisnäytteiden hajonta.
2. TULOKSET
Kunkin eläimen osalta on tehtävä testikemikaalista ja/tai metaboliiteista kunakin näytteenottoajankohtana seuraavat mittaukset. Yksittäisten tulosten lisäksi on ilmoitettava kootut tulokset näytteenottoajankohdittain keskiarvoina.
|
— |
suojan pinnalle jäänyt määrä, |
|
— |
määrä, joka voidaan irrottaa iholta, |
|
— |
ihossa tai iholla oleva määrä, jota ei voida pestä siitä, |
|
— |
näytteenä otetussa veressä oleva määrä, |
|
— |
eritteissä ja uloshengitysilmassa oleva määrä (jos määritetty), |
|
— |
kuolleen eläimen ruumiissa ja erillistä analyysiä varten poistetuissa elimissä oleva määrä. |
Eritteissä, uloshengitysilmassa, veressä ja kuolleen eläimen kehossa olevan testiaineen ja/tai metaboliittien määrän perusteella voidaan määrittää kunakin ajankohtana imeytynyt kokonaismäärä. Lisäksi voidaan laskea altistusaikana imeytynyt testikemikaalin määrä ihoneliösenttimetriä kohti.
3. RAPORTOINTI
3.1 TESTISELOSTE
Testiselosteessa on esitettävä, miten testiohjeessa asetetut vaatimukset on täytetty (mm. käytetyn testijärjestelmän perustelut). Siinä on oltava seuraavat tiedot:
|
|
Testiaine:
|
|
|
Testiainevalmiste:
|
|
|
Koe-eläin:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
|
|
Johtopäätökset. |
4. KIRJALLISUUSVIITTEET
|
1. |
Testing Method B.45. Skin Absorption: In vitro Method. |
|
2. |
OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris. |
|
3. |
ECETOC (1993) Percutaneous Absorption. European Centre for Ecotoxicology and Toxicology of Chemicals, Monograph No. 20. |
|
4. |
Zendzian RP (1989) Skin Penetration Method suggested for Environmental Protection Agency Requirements. J. Am. Coll. Toxicol. 8(5), 829–835. |
|
5. |
Kemppainen BW, Reifenrath WG (1990) Methods for skin absorption. CRC Press Boca Raton, FL, USA. |
|
6. |
EPA (1992) Dermal Exposure Assessment: Principles and Applications. Exposure Assessment Group, Office of Health and Environmental Assessment. |
|
7. |
EPA (1998) Health Effects Test Guidelines, OPPTS 870-7600, Dermal Penetration. Office of Prevention, Pedsticides and Toxic Substances. |
|
8. |
Bronaugh RL, Wester RC, Bucks D, Maibach HI and Sarason R (1990) In vivo percutaneous absorption of fragrance ingredients in reshus monkeys and humans. Fd. Chem. Toxic. 28, 369–373. |
|
9. |
Feldman RJ and Maibach HI (1970) Absorption of some organic compounds through the skin in man. J. Invest Dermatol. 54, 399–404. |
Kuva 1
Esimerkki tyypillisestä laitteesta, jota käytetään suojaamaan aplikointialue in vivo -ihoabsorptiotestissä

B.45. IHON KAUTTA IMEYTYMINEN: IN VITRO -MENETELMÄ
1. MENETELMÄ
Tämä menetelmä vastaa OECD:n testiohjetta nro TG 428 (2004)
1.1. JOHDANTO
Tämän testimenetelmän tarkoituksena on tarjota tietoa poisleikatulle ihonäytteelle aplikoidun testiaineen imeytymisestä. Se voidaan suorittaa yhdessä testimenetelmän ”Ihon kautta imeytyminen: In vivo -menetelmä” (1) kanssa tai erikseen. Tähän testimenetelmään perustuvien kokeiden suunnittelussa suositellaan käytettäväksi apuna OECD:n asiakirjaa ”Guidance Document for the Conduct of Skin Absorption Studies” (2). OECD:n asiakirjasta on apua valittaessa sopivaa in vitro-menetelmää erityisolosuhteisiin, jotta voidaan varmistaa testimenetelmällä saatavien tulosten luotettavuus.
Menetelmät, joilla määritetään aineen imeytymistä ja vapautumista elimistöön ihon kautta, voidaan jakaa kahteen luokkaan: in vivo -menetelmiin ja in vitro -menetelmiin. Ihoabsorption in vivo -määritysmenetelmät ovat vakiintuneita ja tarjoavat farmakokineettistä tietoa useiden eri eläinlajien osalta. In vivo -menetelmä kuvataan erillisessä testiohjeessa (1). Myös in vitro -menetelmiä on käytetty useiden vuosien ajan ihoabsorption määrittämiseen. Vaikka tämän testiohjeen kattamista in vitro -menetelmistä ei ole tehty virallisia validointitutkimuksia, OECD:n asiantuntijat katsoivat vuonna 1999, että in vitro -menetelmän tueksi oli riittävä määrä eveluoituja tutkimustuloksia (3). OECD:n asiakirjassa annetaan tämän tueksi lisätietoja (mm. runsaasti in vitro -menetelmien ja in vivo -menetelmien suoraa vertailutietoa) (2). Aiheesta on tehty useita erityisteoksia, jotka tarjoavat yksityiskohtaista taustatietoja in vitro -menetelmän käytön tueksi (4) (5) (6) (7) (8) (9) (10) (11) (12). In vitro -menetelmillä mitataan kemikaalien diffundoitumista ihoon ja ihon läpi nesteisiin. Niissä voidaan käyttää ei-elävää ihoa, kun määritetään vain diffundoituminen, tai tuoretta aineenvaihdunnallisesti aktiivia ihoa, jos määritetään samalla sekä diffundoituminen että ihon aineenvaihdunta. Näille menetelmille on erityistä käyttöä luokiteltaessa erityyppisiä kemikaaleja sen mukaan, miten ne voidaan vapauttaa erilaisista formulaatioista ihoon tai ihon läpi. Ne ovat myös hyödyllisiä malleja arvioitaessa ihon läpi imeytymistä ihmisissä.
In vitro -menetelmää ei voida soveltaa kaikissa tilanteissa eikä kaikkiin kemikaaleihin. In vitro -testimenetelmää voi olla mahdollista soveltaa ihopenetraation alustavaan laadulliseen arviointiin. Joissain tapauksissa tämä voi vaatia tuekseen in vivo -testejä. OECD:n asiakirja (2) antaa lisätietoja tilanteista, joihin in vitro -menetelmä soveltuu. Muuta lisätietoa päätöksen tueksi: kirjallisuusviite (3).
Tässä testiohjeessa esitetään yleiset periaatteet testiaineen ihoabsorption määrittämiseksi käyttämällä ihopalaa näytteenä. Siinä voidaan käyttää useiden nisäkäslajien (myös ihmisen) ihoa. Ihon läpäisevyysominaisuudet säilyvät sen jälkeen, kun iho on leikattu kehosta, koska diffundoitumisen pääasiallinen este on ihon kuollut pintakerros eli marraskesi; kemikaalien aktiivista kuljetusta ihon läpi ei ole voitu todeta. Ihon on todettu kykenevän metabolisoimaan joitakin kemikaaleja imeytymisen aikana (6), mutta tämä ei rajoita varsinaisen annoksen imeytymisnopeutta. Se voi kuitenkin vaikuttaa verenkiertoon pääsevän aineen luonteeseen.
1.2. MÄÄRITELMÄT
Imeytymätön annos: se testiaineen määrä, joka pestään iholta altistuksen jälkeen ja joka on jäänyt ei-okklusiivisen suojan pinnalle, mukaan lukien se testiaineen määrä, jonka voidaan osoittaa haihtuneen iholta altistuksen aikana
Imeytynyt annos (in vitro): se testiaineen määrä, joka päätyy vastaanottonesteeseen tai verenkiertoon tietyn ajan kuluessa
Mahdollisesti imeytyvä annos (in vitro): se testiaineen määrä, joka on iholla tai ihossa sen jälkeen, kun iho on pesty.
1.3. TESTIMENETELMÄN PERIAATE
Testiaine, joka voi olla radioaktiivisella merkkiaineella leimattu, aplikoidaan diffuusiokammion eri osastojen väliin asetetun ihonäytteen pinnalle. Kemikaalia pidetään iholla tietyn ajan tietyissä olosuhteissa, minkä jälkeen se poistetaan sopivalla puhdistusmenetelmällä. Vastaanottonesteestä otetaan koko testin ajan määräajankohdin näytteet sen tarkistamiseksi, onko vastaanottonesteessä testikemikaalia ja/tai sen metaboliitteja.
Käytettäessä aineenvaihdunnallisesti aktiiveja järjestelmiä testikemikaalin metaboliitit voidaan analysoida sopivin menetelmin. Testin lopussa testikemikaalin ja (tapauksesta riippuen) sen metaboliittien jakautuminen kvantifioidaan.
Testiaineen imeytyminen tietyn ajan kuluessa määritetään analysoimalla vastaanottoneste ja käsitelty iho. Vaadittavat olosuhteet kuvataan tässä testiohjeessa ja OECD:n asiakirjassa (2). Ihossa edelleen oleva testiaine on katsottava imeytyneeksi, ellei voida osoittaa, että imeytyminen voidaan määrittää vain vastaanottonestettä analysoimalla. Analysoimalla muut testijärjestelmän komponentit (iholta pesty materiaali ja ihokerroksissa edelleen oleva materiaali) voidaan saada lisätietoja, joiden perusteella voidaan määrittää muun muassa testiaineen eri komponentteihin jakautuminen ja saantoprosentti (kokonaismäärät).
Jotta voidaan osoittaa testijärjestelmän suorituskyky ja luotettavuus laboratoriossa, käytettävissä on oltava sopivilla vertailukemikaaleilla hankitut tulokset, joiden on oltava sopusoinnussa käytettyä menetelmää koskevan julkaistun kirjallisuuden kanssa. Tämä vaatimus voidaan täyttää testaamalla sopiva vertailuaine (mielellään testiainetta muistuttava rasvaliukoinen aine) samanaikaisesti testiaineen kanssa tai tarjoamalla riittävät aiemmat tiedot useista vertailuaineista, joiden rasvaliukoisuus poikkeaa toisistaan (esim. kafeiini, bentsoehappo ja testosteroni).
1.4. TESTIMENETELMÄN KUVAUS
1.4.1 Diffuusiokammio
Diffuusiokammio muodostuu lähettäjä- ja vastaanotto-osastosta, joiden väliin ihonäyte asetetaan (tyypillinen diffuusiokammio esitetään kuvassa 1). Ihopalan reunat on kiinnitettävä tiiviisti kammioon, ja kammion pitäisi mahdollistaa helppo näytteidenotto. Ihonäytteen alapinnan kanssa kosketuksissa olevan vastaanottoliuoksen pitäisi voida sekoittua hyvin. Diffuusiokammion ja sen sisällön lämpötilan on oltava säädettävissä. Sekä staattista että läpivirtausjärjestelmää käyttäviä diffuusiokammioita voidaan käyttää. Tavallisesti lähettäjäosastossa ei käytetä okkluusiota, kun ihonäytettä altistetaan rajalliselle määrälle testiainetta. Lähettäjäosastossa voidaan kuitenkin käyttää okkluusiota, jos altistusannosta ei ole rajoitettu, sekä myös tietyissä rajallisilla annoksilla tehtävissä kokeissa.
1.4.2. Vastaanottoneste
Fysiologisesti yhteensopivan vastaanottoliuoksen käyttö on suositeltavaa, mutta myös muunlaisia vastaanottoliuksia voidaan käyttää, kunhan tämä perustellaan. Vastaanottonesteen tarkka koostumus on ilmoitettava. On osoitettava, että testikemikaalilla on riittävä liukenevuus vastaanottonesteessä, jotta tämä ei toimi esteenä imeytymiselle. Lisäksi vastaanottoneste ei saa vaikuttaa ihonäytteen funktionaaliseen eheyteen. Läpivirtausjärjestelmässä virtausnopeus ei saa haitata testiaineen diffundoitumista vastaanottonesteeseen. Staattisessa kammiojärjestelmässä nestettä on jatkuvasti sekoitettava ja siitä on otettava näytteitä säännöllisesti. Jos tutkitaan metaboliaa, ihonäytteen on pysyttävä elävänä koko testin ajan.
1.4.3 Ihonäytteet
Testissä käytetään ihmisestä tai eläimestä otettua ihoa. Ihmisihon käyttöön on sovellettava kansallisia ja kansainvälisiä eettisiä käytäntöjä ja ehtoja. On suositeltavaa käyttää elävää ihoa, mutta myös kuollutta ihoa voidaan käyttää, kunhan osoitetaan ihon funktionaalinen eheys. Hyväksyttäviä ovat joko (entsyymi, lämpö- tai kemiallisilla menetelmillä erotetut) orvaskesikalvot tai ihohöylällä (dermatomilla) irrotetut ohennetut ihonäytteet (split thickness skin) (paksuus tyypillisesti 200–400 μm). Myös kokoihonäytteitä (full thickness skin) voidaan käyttää, mutta liiallista ihonäytteen paksuutta (n. > 1 mm) pitäisi välttää, ellei sitä erityisesti edellytetä testikemikaalin määrittämiseksi ihokerroksissa. Laji, anatominen näytteenottopaikka ja käytetty menetelmä on perusteltava. Hyväksyttävät testitulokset tarvitaan vähintään neljästä rinnakkaisesta näytteestä testiä kohti.
1.4.4 Ihonäytteen eheys
On tärkeää, että ihonäyte valmistetaan oikein. Epäasianmukainen käsittely voi vahingoittaa marraskettä, minkä vuoksi ihonäytteen eheys on varmistettava. Jos tutkimuskohteena on ihon metabolia, vastaleikattu ihonäyte pitäisi käyttää testissä mahdollisimman pian ja olosuhteissa, joiden tiedetään tukevan metabolista toimintaa. Yleissääntönä on, että vastaleikattu iho käytetään 24 tunnin kuluessa, mutta hyväksyttävä varastointiaika voi vaihdella riippuen aineenvaihduntaan osallistuvasta entsyymijärjestelmästä ja varastointilämpötilasta (13). Jos ihonäytteet on varastoitu ennen käyttöä, on osoitettava, että ihon läpäisyä estävät ominaisuudet ovat testiajankohtana ennallaan.
1.4.5 Testiaine
Testiaine on aine, jonka penetraatio-ominaisuuksia testissä tutkitaan. Testiaine suositellaan leimattavaksi radioaktiivisella merkkiaineella.
1.4.6 Testin valmistelu
Testiainevalmisteen (esim. testiaineen sisältävä laimentamaton tai laimennettu materiaali tai formulaatio, joka aplikoidaan iholle) olisi mielellään oltava sama kuin valmiste, jolle ihmiset tai muut kohdelajit voivat altistua, tai kyseisen valmisteen realistinen korvike. Käytössä olevasta valmisteesta poikkeaminen on perusteltava.
1.4.7 Testiaineen pitoisuudet ja formulaatiot
Normaalisti käytetään useampaa kuin yhtä testiaineen pitoisuutta siten, että pitoisuudet kattavat potentiaalisen altistuksen yläpään arvot (ihmisissä). Samoin on harkittava useiden tyypillisten formulaatioiden testaamista.
1.4.8 Aplikointi iholle
Ihmisen altistuessa kemikaaleille annokset ovat normaalioloissa rajallisia. Siksi altistumista jäljittelevässä annostelussa testiainetta aplikoidaan iholle tavallisesti 1-5 mg/cm2, kun testiaine on kiinteä, ja enintään 10 μl/cm2, kun testiaine on nestemäinen. Aplikoitavan määrän perusteluina ovat ennakoidut käyttöolosuhteet, tutkimuksen tavoitteet ja testivalmisteen fysikaaliset ominaisuudet. Esimerkiksi testiaineen aplikointi voi olla rajoittamatonta tapauksissa, joissa valmistetta aplikoidaan suuria määriä pinta-alayksikköä kohti.
1.4.9 Lämpötila
Lämpötila vaikuttaa kemikaalien passiiviseen diffuusioon (ja näin ollen niiden imeytymiseen ihon läpi). Diffuusiokammion ja ihonäytteen lämpötila on pidettävä vakiona lähellä ihon normaalilämpötilaa 32 ± 1 oC. Erilaiset diffuusiokammiot edellyttävät erilaisia vesihauteen ja blokkikuumentimen lämpötiloja, jotta varmistetaan, että vastaanottofaasi tai ihonäyte on fysiologisessa vakiotilassaan. Suhteellisen kosteuden arvoksi suositellaan 30–70 %.
1.4.10 Altistusaika ja näytteenotto
Ihoa voidaan altistaa testiaineelle koko testin ajan tai lyhyempiä aikoja (esim. jonkin tietyntyyppisen altistuksen jäljittelemiseksi). Iholta pestään ylimääräinen testiaine sopivalla puhdistusaineella, ja huuhteluvesi kerätään talteen analyysiä varten. Menetelmä, jolla testiaine poistetaan, riippuu ennakoiduista käyttöolosuhteista, ja se on perusteltava. Näytteenottoaika on tavallisesti 24 tuntia, jotta absorptioprofiili voitaisiin karakterisoida riittävästi. Koska ihon eheys voi alkaa heikentyä 24 tunnin kuluttua, näytteenottoaika ei tavallisesti saisi ylittää 24 tuntia. Jotkin aineet edellyttävät pitempää näytteenottoaikaa (24 tuntia), mutta nopeasti imeytyville se ei ehkä ole tarpeen. Vastaanottonesteestä on otettava näytteitä tarpeeksi tiheästi, jotta testiaineen absorptioprofiili voidaan esittää graafisesti.
1.4.11 Loppumenettelyt
Kaikki testijärjestelmän komponentit on analysoitava ja saanto määritettävä. Komponetteihin kuuluvat lähettäjäosasto, ihonäytteen pinnan huuhteluvesi, ihonäyte ja vastaanottoneste/osasto. Joissain tapauksissa iho voidaan erillistä analyysiä varten jaottaa ihon altistuneeseen osaan, kammion reunan alla olevaan osaan, marrasketeen, orvasketeen ja verinahkaan.
1.4.11 Analyysi
Kaikissa kokeissa on saavutettava riittävä saanto (keskiarvon on oltava 100 ± 10 % radioaktiivisuudesta; poikkeaminen tästä on perusteltava). Vastaanottonesteessä, ihonäytteessä sekä ihon pinnan ja laitteiden huuhteluvedessä oleva testiaine on analysoita sopivalla menetelmällä.
2. TULOKSET
Tuloksina esitetään vastaanottonesteen analyysi, testiaineen jakauma testijärjestelmässä ja absorptioprofiili ajan funktiona. Kun aplikoitu annos on rajallinen, iholta pesty määrä, ihossa (ihon eri kerroksissa, jos analysoitu erikseen) ja vastaanottonesteessä oleva määrä (imeytymisnopeus sekä määrä tai prosenttiosuus aplikoidusta annoksesta) on määritettävä. Ihon läpi imeytyminen voidaan joskus ilmaista käyttämällä pelkästään vastaanottonesteen analyysistä saatuja tuloksia. Jos testiainetta on kuitenkin edelleen ihossa testin lopussa, se saattaa olla tarpeen sisällyttää imeytyneeseen kokonaismäärään (ks. kirjallisuusviite [3], kohta 66). Jos on käytetty rajoittamatonta annosta, testitulosten perusteella voi olla mahdollista määrittää läpäisyvakio (Kp). Viimeksi mainitussa tapauksessa imeytymisprosentti ei ole merkityksellinen.
3. RAPORTOINTI
3.1. TESTISELOSTE
Testiselosteessa on esitettävä, miten testiohjeessa asetetut vaatimukset on täytetty (mm. käytetyn testijärjestelmän perustelut). Siinä on oltava seuraavat tiedot:
|
|
Testiaine:
|
|
|
Testiainevalmiste:
|
|
|
Koeolosuhteet:
|
|
|
Tulokset:
|
|
|
Tulosten pohdinta. |
|
|
Päätelmät. |
4. KIRJALLISUUSVIITTEET
|
1. |
Testing Method B.44. Skin Absorption: In vivo Method. |
|
2. |
OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris. |
|
3. |
OECD (2000). Report of the Meeting of the OECD Extended Steering Committee for Percutaneous Absorption Testing, Annex 1 to ENV/JM/TG(2000)5. OECD, Paris. |
|
4. |
Kemppainen BW and Reifenrath WG. (1990). Methods for skin absorption. CRC Press, Boca Raton. |
|
5. |
Bronaugh RL and Collier, SW. (1991). Protocol for In vitro Percutaneous Absorption Studies, in In vitro Percutaneous Absorption: Principles, Fundamentals and Applications, RL Bronaugh and HI Maibach, Eds., CRC Press, Boca Raton, pp. 237–241. |
|
6. |
Bronaugh RL and Maibach HI. (1991). In vitro Percutaneous Absorption: Principles, Fundamentals and Applications. CRC Press, Boca Raton. |
|
7. |
European Centre for Ecotoxicology and Toxicology of Chemicals (1993). Monograph No. 20, Percutaneous Absorption, ECETOC, Brussels. |
|
8. |
Diembeck W, Beck H, Benech-Kieffer F, Courtellemont P, Dupuis J, Lovell W, Paye M, Spengler J, Steiling W (1999). Test Guidelines for In Vitro Assessment of Dermal Absorption and Percutaneous Penetration of Cosmetic Ingredients, Fd Chem Tox, 37, 191–205. |
|
9. |
Recommended Protocol for In vitro Percutaneous Absorption Rate Studies (1996). US Federal Register, Vol. 61, No. 65. |
|
10. |
Howes D, Guy R, Hadgraft J, Heylings JR et al. (1996). Methods for assessing Percutaneous absorption. ECVAM Workshop Report ATLA 24, 81 R10. |
|
11. |
Schaefer H and Redelmeier TE. (1996). Skin barrier: principles of percutaneous absorption. Karger, Basel. |
|
12. |
Roberts MS and Walters KA. (1998). Dermal absorption and toxicity assessment. Marcel Dekker, New York. |
|
13. |
Jewell, C., Heylings, JR., Clowes, HM. And Williams, FM. (2000). Percutaneous absorption and metabolism of dinitrochlorobenzene in vitro. Arch Toxicol 74: 356–365. |
Kuva 1
Esimerkki tyypillisestä in vitro -ihoabsorptiotestissä käytettävästä staattisesta diffuusiokammiosta

(1) Sarveiskalvosamentuman alue on mainittava.
(2) Ruokinnan siirtämistä yön yli suositellaan monissa seerumi- ja plasmamittauksissa, etenkin glukoosimittauksessa. Tärkein syy tälle suositukselle on, että syöminen väistämättä lisää vaihtelua, mikä voi estää lievien vaikutusten havaitsemisen ja vaikeuttaa tulosten tulkintaa. Toisaalta ruokinnan siirtäminen yön yli voi häiritä eläinten yleistä metaboliaa ja etenkin ruokintatutkimuksissa häiritä päivittäistä altistusta testiaineelle. Jos eläimen ruokinta siirretään yli yön, kliiniset biokemialliset määritykset tulee tehdä neljännellä tutkimusviikolla suoritettavien toiminnallisten havaintojen jälkeen.
(3) Monia seerumista ja plasmasta tehtäviä määrityksiä, esimerkiksi glukoosia varten olisi paasto yön yli suositeltava. Tärkeimmät syyt tähän ovat se, että ilman paastoa näytteissä olisi luonnollisesti paljon enemmän vaihtelua, mikä saattaisi peittää vähäisempiä vaikutuksia ja vaikeuttaa tulkintaa. Toisaalta paastoaminen yli yön saattaa häiritä eläinten yleistä aineenvaihduntaa ja myös päivittäistä altistamista testiaineelle erityisesti ruokintatutkimuksissa. Jos eläimet paastoavat yli yön, kliinisen biokemian määritykset olisi tehtävä sen jälkeen, kun on tehty toiminnalliset havainnot.
(4) Nykyisin seerumin alaniiniaminotransferaasi.
(5) Nykyisin seerumin aspartaattiaminotransferaasi.
(6) Nämä elimet, 10 jyrsijästä ryhmää ja sukupuolta kohden ja kaikista muista eläimistä, sekä muiden eläinten kilpirauhanen (ja lisäkilpirauhanen), on punnittava.
(7) Nämä kunkin ryhmän 10 naaras- ja 10 urospuolisen jyrsijän elimet tulee punnita.
(8) Tässä tarkoitettu vertailuryhmä saa testattavaa ainetta jotakin muuta tietä, joka takaa annoksen täydellisen käyttökelpoisuuden.
(9) Absorption määritykseen käytetty liuotin.
|
† |
Tähän ryhmään kuuluu viisi eläintä, jotka on valittu toiminnallisiin kokeisiin ja yksityiskohtaiseen kliiniseen havainnointiin osana neurotoksisuustutkimusta |
OSA C: EKOMYRKYLLISYYDEN MÄÄRITTÄMISMENETELMÄT
SISÄLLYSLUETTELO
|
C.1. |
AKUUTTI MYRKYLLISYYS KALALLE |
|
C.2. |
AKUUTIN IMMOBILISAATION TESTI |
|
C.3. |
LEVÄN INHIBITIOKOE |
|
C.4. |
BIOHAJOAVUUDEN MÄÄRITYS |
|
OSA I. |
YLEISTÄ |
|
OSA II. |
DOC DIE-AWAY-KOE (Menetelmä C.4-A) |
|
OSA III. |
MUUNNELTU OECD-SEULONTAKOE (Menetelmä C.4-B) |
|
OSA IV. |
HIILIDIOKSIDIN MUODOSTUMISKOE (Menetelmä C.4-C) |
|
OSA V. |
MANOMETRINEN RESPIROMETRIAKOE (Menetelmä C.4-D) |
|
OSA VI. |
SULJETUN PULLON MENETELMÄ (Menetelmä C.4-E) |
|
OSA VII. |
MITI-KOE (Menetelmä C.4-F) |
|
C.5. |
HAJOAMINEN — BIOKEMIALLINEN HAPENKULUTUS |
|
C.6. |
HAJOAMINEN — KEMIALLINEN HAPENKULUTUS |
|
C.7. |
HAJOAMINEN — ABIOOTTINEN HAJOAMINEN: HYDROLYYSI PH:NFUNKTIONA |
|
C.8. |
MYRKYLLISYYSTUTKIMUS MADOILLA |
|
C.9. |
BIOLOGINEN HAJOAMINEN — ZAHN-WELLENS-TESTI |
|
C.10. |
BIOLOGINEN HAJOAMINEN — AKTIIVILIETTEEN SIMULOINTITESTIT |
|
C.11. |
BIOLOGINEN HAJOAMINEN — AKTIIVILIETTEEN SOLUHENGITYKSEN INHIBITIOTESTI |
|
C.12. |
BIOLOGINEN HAJOAMINEN — MODIFIOITU SCAS-TESTI |
|
C.13. |
BIOKERTYVYYS: TESTI KALOILLA LÄPIVIRTAUSOLOSUHTEISSA |
|
C.14. |
KALANPOIKASILLA TEHTÄVÄ KASVUTESTI |
|
C.15. |
KALAN ALKIO- JA RUSKUAISPUSSIVAIHEEN POIKASILLA TEHTÄVÄ LYHYTAIKAINEN MYRKYLLISYYSTESTI |
|
C.16. |
MEHILÄISET — SUUN KAUTTA TAPAHTUNEEN ALTISTUKSEN JÄLKEEN ILMENEVÄN VÄLITTÖMÄN MYRKYLLISYYDEN TESTI |
|
C.17. |
MEHILÄISET — KOSKETUS ALTISTUKSEN JÄLKEEN ILMENEVÄN VÄLITTÖMÄN MYRKYLLISYYDEN TESTI |
|
C.18. |
ADSORPTIO/DESORPTIO ERÄTASAPAINOMENETELMÄÄ KÄYTTÄEN |
|
C.19. |
MAA-AINEKSIIN JA VIEMÄRILIETTEESEEN SOVELLETTAVAN ADSORPTIOKERTOIMEN (KOC) MÄÄRITYS KORKEAN SUORITUSKYVYN NESTEKROMATOGRAFIALLA (HPLC) |
|
C.20. |
LISÄÄNTYMISTESTI VESIKIRPULLA (DAPHNIA MAGNA) |
|
C.21. |
MAAPERÄN MIKROBIT: TYPEN MUUNTUMISTESTI |
|
C.22. |
MAAPERÄN MIKROBIT: HIILEN MUUNTUMISTESTI |
|
C.23. |
KEMIKAALIEN AEROBINEN JA ANAEROBINEN HAJOAMINEN MAAPERÄSSÄ |
|
C.24. |
AEROBINEN JA ANAEROBINEN HAJOAMINEN VESIYMPÄRISTÖN SEDIMENTTIJÄRJESTELMISSÄ |
C.1 AKUUTTI MYRKYLLISYYS KALALLE
1. MENETELMÄ
1.1 JOHDANTO
Tällä menetelmällä voidaan määrittää aineen akuutti tappava myrkyllisyys kalalle makeassa vedessä. Sopivimman testimenetelmän (staattinen, puolistaattinen tai läpivirtaus) löytämiseksi on suositeltavaa hankkia mahdollisuuksien mukaan tietoa aineen vesiliukoisuudesta, höyrynpaineesta, kemiallisesta stabiiliudesta, dissosiaatiovakiosta ja biohajoavuudesta. Näin voidaan varmistaa, että aineen pitoisuus pysyy lähes vakiona koejakson aikana.
Kokeen suunnittelussa ja tulosten tulkinnassa on otettava huomioon mahdolliset lisätiedot (esimerkiksi aineen rakennekaava, puhtausaste, merkittävien epäpuhtauksien laatu ja pitoisuus, lisäaineiden läsnäolo ja määrä sekä n-oktanoli/vesi-jakautumiskerroin).
1.2 MÄÄRITELMÄT
Akuutti myrkyllisyys on selvästi havaittava haitta, joka aiheutuu eliölle lyhyen ajan kuluessa aineelle altistumisen jälkeen. Kuvattavassa kokeessa akuutti myrkyllisyys ilmaistaan tappavan pitoisuuden mediaanina (LC50). Tappavaa pitoisuutta käytettäessä 50 % vedessä olevasta kalaerästä kuolee määritetyn altistusajan kuluessa.
Testattavan aineen kaikki pitoisuudet ilmaistaan painoyksikköinä tilavuutta kohti (mg/l). Pitoisuus voidaan ilmaista myös painoyksikköinä painoa kohti (mg/kg-1).
1.3 VERTAILUAINEET
Vertailuainetta testaamalla voidaan osoittaa, että laboratorio-olosuhteissa testattavien lajien vaste ei ole merkittävästi muuttunut.
Kuvattavaa koetta varten ei ole määritetty vertailuainetta.
1.4 TESTIMENETELMÄN PERIAATE
Rajatestin (100 mg/l) avulla voidaan osoittaa, että LC50-arvo on suurempi kuin rajatestipitoisuus.
Kaloja altistetaan veteen lisätylle aineelle eri pitoisuuksia käyttäen 96 tunnin ajan. Kuolleisuus kirjataan vähintään 24 tunnin väliajoin ja mahdollisuuksien mukaan lasketaan kunkin havaintohetken pitoisuus, joka on tappanut 50 % kaloista (LC50).
1.5 LAATUKRITEERIT
Laatukriteerejä on sovellettava sekä rajatestiin että kattavaan testiin.
Kontrolliryhmien kuolleisuus kokeen päätyttyä ei saa ylittää 10:tä % (tai yhtä kalaa, jos ryhmän koko on alle kymmenen kalaa).
Veteen liuenneen hapen pitoisuuden on ollut oltava yli 60 % testilämpötilan ilmakyllästymisarvosta.
Testattavan aineen pitoisuuden on koko testin ajan oltava vähintään 80 % alkupitoisuudesta.
Jos aine liukenee helposti veteen muodostaen stabiilin liuoksen (aine ei merkittävästi haihdu, pilkkoudu, hydrolysoidu tai adsorboidu), alkupitoisuutta voidaan pitää nimellisenä pitoisuutena. On esitettävä todisteet siitä, että pitoisuudet on pidetty vakiona testin ajan ja että laatukriteerit on täytetty.
Jos aine
|
i) |
on huonosti veteen liukenevaa, |
|
ii) |
pystyy muodostamaan stabiileja emulsioita tai dispersioita, |
|
iii) |
ei ole stabiilia vesiliuoksissa, |
alkupitoisuutena pidetään liuoksesta mitattua pitoisuutta (jos tämä ei ole teknisesti mahdollista, pitoisuus mitataan vesipatsaasta) testin alussa. Pitoisuus määritetään tasapainon saavuttamisen jälkeen, mutta ennen testattavien kalojen lisäämistä.
Tällaisissa tapauksissa testin kuluessa on tehtävä lisämittauksia, joilla voidaan varmistaa todelliset altistuspitoisuudet ja laatukriteerien täyttyminen.
pH-arvo saa vaihdella enintään yhden yksikön verran.
1.6 MENETELMÄKUVAUS
Käytettävissä on kolme erityyppistä menetelmää:
Staattinen koe
Tässä myrkyllisyyskokeessa vesiliuos ei virtaa (liuokset pysyvät muuttumattomina testin ajan).
Puolistaattinen koe
Tässä kokeessa vesiliuos ei virtaa, mutta se vaihdetaan säännöllisesti (esimerkiksi 24 tunnin väliajoin) eräkohtaisesti.
Läpivirtauskoe
Myrkyllisyyskoe, jossa testikammioiden vesi vaihtuu jatkuvasti. Testattava kemikaali kulkeutuu veden mukana.
1.6.1 Reagenssit
1.6.1.1 Testattavien aineiden liuokset
Valmistetaan halutun pitoisia kantaliuoksia liuottamalla ainetta ionisoimattomaan veteen tai kohdan 1.6.1.2 mukaiseen veteen.
Halutut testipitoisuudet valmistetaan kantaliuosta laimentamalla. jos testataan suuria pitoisuuksia, aine voidaan liuottaa suoraan laimennusveteen.
Yleensä aineita ei pidä testata liukoisuusrajan ylittävinä pitoisuuksina. Joidenkin aineiden kohdalla — esimerkiksi sellaisten, jotka liukenevat huonosti veteen (suuri Pow-arvo) ja sellaisten, jotka muodostavat dispersioita todellisen liuoksen sijasta — on hyväksyttävää käyttää liukoisuusrajan ylittävää testipitoisuutta, jotta voidaan varmistaa, että ainetta on liuennut mahdollisimman paljon ja että liuos on stabiili. On kuitenkin tärkeää, että tämä pitoisuus ei muutoin häiritse testijärjestelmää (esimerkiksi muodostamalla veden pinnalle kalvon, joka estää veden hapettumisen).
Jos aine liukenee huonosti veteen, kantaliuoksen valmistamisessa tai aineen dispergoimisessa testiliuokseen voidaan käyttää apuna ultraäänidispersiota, orgaanisia liuottimia, emulsioliuottimia tai dispergoimisaineita. Jos tällaisia apuaineita käytetään, kaikkien testipitoisuuksien on sisällettävä sama määrä apuainetta ja erillinen kalojen kontrolliryhmä on altistettava testisarjan apuainepitoisuudelle. Tällaisten apuaineiden pitoisuudet on pidettävä mahdollisimman matalina, eivätkä ne koskaan saa ylittää arvoa 100 mg/l testiliuosta.
Koe suoritetaan ilman pH-arvon säätöjä. Jos havaitaan merkkejä pH-arvon merkittävästä muutoksesta, on suositeltavaa tehdä toinen koe, jossa käytetään pH-säätöä, ja raportoida tulokset. Tässä tapauksessa kantaliuoksen pH-arvo säädetään samaksi kuin laimennusveden pH-arvo, ellei tätä vastaan ole erityistä syytä. Suositeltavat pH-säätöaineet ovat HCl ja NaOH; pH-säätö on tehtävä siten, ettei kantaliuoksen testiainepitoisuus muutu merkittävästi. Jos pH-säädön seurauksena tapahtuu jokin kemiallinen reaktio tai testiaine saostuu, ilmiö on raportoitava.
1.6.1.2 Säilytys- ja laimennusvesi
Voidaan käyttää juomavettä (jossa ei ole potentiaalisesti vaarallisia pitoisuuksia klooria, raskasmetalleja tai muita aineita), hyvänlaatuista luonnonvettä tai sekoitevettä (katso liitettä I). Suositeltavat kovuusarvot ovat 10–250 mg/l CaCO3 ja suositeltavat pH-arvot 6,0–8,5.
1.6.2 Laite
Laitteiden on oltava kemiallisesti inerttiä materiaalia. Seuraavat laitteet tarvitaan:
|
— |
automaattinen laimennusjärjestelmä (läpivirtauskoetta varten), |
|
— |
happimittari, |
|
— |
laite veden kovuuden määritykseen, |
|
— |
lämpötilan säätölaite, |
|
— |
pH-mittari. |
1.6.3 Testattavat kalat
Kalojen on oltava terveitä, eikä niissä saa olla näkyviä epämuodostumia.
Lajit valitaan käytännöllisten seikkojen perusteella. Tällaisia perusteita ovat esimerkiksi ympärivuotinen saatavuus, ylläpidon helppous, soveltuvuus testaukseen, suhteellinen kemikaaliherkkyys ja muut taloudelliset, biologiset sekä ekologiset tekijät, joilla voi olla vaikutusta. Kalalajien valinnassa on otettava huomioon myös saatujen tietojen vertailukelpoisuus ja voimassa oleva kansainvälinen yhdenmukaistaminen (viite 1).
Luettelo tätä koetta varten suositeltavista kalalajeista on liitteessä 2. Suositeltavia lajeja ovat seeprakala ja kirjolohi.
1.6.3.1 Säilytys
Kalat on mieluiten otettava yhdestä ainoasta samanpituisesta ja -ikäisestä kannasta. Kaloja on säilytettävä vähintään 12 päivän ajan seuraavissa olosuhteissa:
Täyttötapa
Täyttötavan on oltava sopiva järjestelmää ja kalalajia ajatellen.
Vesi
Katso kohtaa 1.6.1.2.
Valo
Päivittäisen valojakson pituus on 12–16 tuntia.
Liuenneen hapen pitoisuus
Vähintään 80 % kyllästysarvosta.
Ruokinta
Kaloja ruokitaan kolme kertaa viikossa tai päivittäin. Ruokinta lopetetaan 24 tuntia ennen kokeen alkua.
1.6.3.2 Kuolleisuus
48 tunnin asettumisajan jälkeen kuolleisuus kirjataan seuraavia kriteerejä soveltaen:
|
— |
yli 10 % populaatiosta seitsemässä päivässä: koko erä hylätään |
|
— |
5–10 % populaatiosta: tarkkailujaksoa jatketaan seitsemällä päivällä. Ellei lisäkuolleisuutta esiinny, erä hyväksytään |
|
— |
alle 5 % populaatiosta: erä hyväksytään. |
1.6.4 Sopeutuminen
Kaloja on altistettava kokeessa käytettävälle vedelle ja lämpötilalle vähintään seitsemän päivän ajan ennen kalojen käyttöä.
1.6.5 Testin suorittaminen
Ennen varsinaista testiä voidaan tehdä alueenmäärityskoe, jonka avulla saadaan tietoja varsinaisessa testissä käytettävistä pitoisuuksista.
Testiryhmän lisäksi käytetään kontrolliryhmää, jota ei altisteta aineelle. Jos aineen liuottamiseen on käytetty apuainetta, on käytettävä toista kontrolliryhmää, joka altistetaan apuaineelle.
Valitaan staattinen, puolistaattinen tai läpivirtaukseen perustuva menetelmä testattavan aineen fysikaalisten ja kemiallisten ominaisuuksien mukaan.
Kalat altistetaan aineelle seuraavasti:
|
— |
aika: 96 tuntia, |
|
— |
eläinten määrä: vähintään 7 kalaa pitoisuutta kohti, |
|
— |
säiliöt: tilavuus on mukautettava kuormitussuosituksen mukaan, |
|
— |
kuormitus: staattista ja puolistaattista koetta varten kuormituksen enimmäisarvoksi suositellaan 1 g/l (läpivirtausjärjestelmissä kuormitus voi olla suurempi), |
|
— |
aineen pitoisuus: vähintään viisi pitoisuutta, jotka poikkeavat toisistaan kertoimella, jonka enimmäisarvo on 2,2, ja jotka kattavat kuolleisuusalueen 0–100 % mahdollisimman hyvin, |
|
— |
vesi: katso kohtaa 1.6.1.2, |
|
— |
valo: 12–16 tuntia valoa päivittäin, |
|
— |
lämpötila: lajille sopiva lämpötila (katso liitettä 2), joka saa vaihdella yksittäisen kokeen aikana enintään ± 1 oC, |
|
— |
veteen liuennut happi: vähintään 60 % valitun lämpötilan ilmakyllästymisarvosta, |
|
— |
ruokinta: kaloja ei ruokita. |
Kalat tutkitaan ensimmäisten 2–4 tunnin aikana ja vähintään 24 tunnin väliajoin. Kalat katsotaan kuolleiksi, jos pyrstön koskettaminen ei tuota mitään reaktiota eikä hengitysliikkeitä voi havaita. Kuolleet kalat poistetaan ja kuolleisuudet kirjataan. Näkyvistä poikkeavuuksista pidetään kirjaa. Näitä ovat esimerkiksi tasapainon menettäminen ja muutokset uintitavassa, hengitystoiminnoissa sekä pigmentaatiossa.
Liuoksen pH, liuennut happi ja lämpötila mitataan päivittäin.
Rajatesti
Tämän testimenetelmän avulla voidaan suorittaa rajatesti pitoisuudella 100 mg/l, millä osoitetaan, että LC50-arvo on suurempi kuin rajapitoisuus.
Jos aineesta ei saada vesiliuosta, jonka pitoisuus on 100 mg/l, rajatesti tehdään pitoisuudella, joka vastaa aineen liukoisuutta (tai enimmäispitoisuutta, jolla saadaan stabiili dispersio) käytettävään veteen (katso myös kohtaa 1.6.1.1).
Rajatestiin tarvitaan 7–10 kalaa ja samankokoinen kontrolliryhmä (yksi tai kaksi kontrolliryhmää). (Binomiteorian mukaan LC50-arvo on 99,9 prosentin varmuudella suurempi kuin rajatestissä käytetty pitoisuus, jos yhtään kalaa kymmenestä ei kuole. Jos käytetään 7, 8 tai 9 kalaa, nollakuolleisuus osoittaa vähintään 99 prosentin varmuudella, että LC50-arvo on suurempi kuin käytetty pitoisuus.)
Jos kaloja kuolee, on tehtävä kattava testi. Jos havaitaan vaikutuksia, jotka eivät ole hengenvaarallisia, ne on kirjattava.
2. TIEDOT JA ARVIOINTI
Jokaista havaintohetkeä (24:ää, 48:aa, 72:ta ja 96:ta tuntia) kohden piirretään jokaisen suositellun altistusjakson kuolleisuusprosentti pitoisuuden funktiona logaritmitodennäköisyyspaperille.
LC50-arvo ja luottamusvälit (p = 0,05) arvioidaan havaintohetkittäin mahdollisuuksien mukaan yleisiä menetelmiä käyttäen. Arvot pyöristetään yhteen tai enintään kahteen merkitsevään numeroon (esimerkki pyöristyksestä kahteen merkitsevään numeroon: 173,5 > 170; 0,127 > 0,13; 1,21 > 1,2).
Jos pitoisuus/vaste ( %) -käyrä on liian jyrkkä LC50-arvon laskemiseksi, arvon graafinen arvio on riittävän tarkka.
Jos kaksi peräkkäistä pitoisuutta (käyttäen kerrointa 2,2) antavat tulokseksi vain 0 %:n ja 100 %:n kuolleisuuden, nämä kaksi arvoa riittävät osoittamaan alueen, johon LC50 osuu.
Jos todetaan, että testattavan aineen stabiiliutta tai homogeenisuutta ei voida ylläpitää, tämä on raportoitava ja otettava huomioon tulosten tulkinnassa.
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
kalan tiedot kunkin pitoisuuden osalta (tieteellinen nimi, kanta, toimittaja, mahdolliset esikäsittelyt, koko ja määrä), |
|
— |
laimennusveden lähde ja tärkeimmät kemialliset ominaisuudet (pH, kovuus, lämpötila), |
|
— |
kantaliuoksen ja testiliuoksen valmistustapa, jos aine on huonosti veteen liukenevaa, |
|
— |
mahdollisten apuaineiden pitoisuudet, |
|
— |
luettelo käytetyistä pitoisuuksista ja käytettävissä olevat tiedot testattavan kemikaalin näiden pitoisuuksien stabiiliudesta käytetyssä testiliuoksessa, |
|
— |
käytetyt menetelmät ja saadut tulokset, jos on tehty kemiallisia analyysejä, |
|
— |
mahdollisen rajatestin tulokset, |
|
— |
käytetyn menetelmän valintaperusteet ja yksityiskohtaiset tiedot (staattinen, puolistaattinen, annostelunopeus, läpivirtausnopeus, onko käytetty ilmastusta, kalakuormitus jne.), |
|
— |
laitteen kuvaus, |
|
— |
valo-olosuhteet, |
|
— |
testiliuokscn liuenneen hapen pitoisuus, pH-arvo ja lämpötila 24 tunnin väliajoin, |
|
— |
todisteet laatukriteereiden täyttämisestä, |
|
— |
taulukko, josta ilmenee kumulatiivinen kuolleisuus kussakin pitoisuudessa ja kontrolliryhmän (sekä tarvittaessa apuaineen kontrolliryhmän) tulokset kunakin suositeltuna tarkkailuajankohtana, |
|
— |
pitoisuus/vaste ( %) -käyrä kokeen päätyttyä, |
|
— |
mahdollisuuksien mukaan LC50-arvot kunakin suositeltuna tarkkailuajankohtana (95 prosentin luottamusrajoin), |
|
— |
LC50-arvon määrityksessä käytetyt tilastolliset menetelmät, |
|
— |
mahdollisen vertailuainetta avulla saadut tulokset, |
|
— |
suurin testiliuoksen pitoisuus, joka ei ole aiheuttanut kuolleisuutta kokeen aikana, |
|
— |
pienin testiliuoksen pitoisuus, joka on aiheuttanut 100 prosentin kuolleisuuden kokeen aikana. |
4. VIITTEET
|
(1) |
OECD, Paris, 1981, Test Guideline 203, Decision of the Council C(81) 30 final and updates. |
|
(2) |
AFNOR — Determination of the acute toxity of a substance to Brachydanio rerio — Static and Flow Through methods — NFT 90-303 June 1985. |
|
(3) |
AFNOR — Determination of the acute toxity of a substance to Salmo gairdneri — Static and Flow Through methods — NFT 90-305 June 1985. |
|
(4) |
ISO 7346/1,11 and /3 — Water Quality — Determination of the acute lethal toxicity of substances to a fresh water fish (Brachydanio rerio Hamilton-Buchanan — Teleostei, Cyprinidae). Part 1: Static method. Part 2: Semi-static method. Part 3: Flow-through method. |
|
(5) |
Eidgenössisches Department des Innern, Schweiz: Richtlinien für Probenahme und Normung von Wasseruntersuchungsmethoden — Part II 1974. |
|
(6) |
DIN Testverfahren mit Wasserorganismen, 38 412 (L1) und L(15). |
|
(7) |
JIS K 0102, Acute toxicity test for fish. |
|
(8) |
NEN 6506 — Water — Bepaling van de akute toxiciteit met behulp van Poecilia reticulata, 1980. |
|
(9) |
Environmental Protection Agency, Methods for the acute toxicity tests with fish, macroinvertebrates and amphibians. The Committee on Methods for Toxicity Tests with Aquatic Organisms, Ecological Research Series EPA-660-75-009, 1975. |
|
(10) |
Environmental Protection Agency, Environmental monitoring and support laboratory, Office of Research and Development, EPA-600/4-78-012, January 1978. |
|
(11) |
Environmental Protection Agency, Toxic Substance Control, Part IV, 16 March 1979. |
|
(12) |
Standard methods for the examination of water and wastewater, 14th edition, APHA-AWWA-WPCK, 1975. |
|
(1) (13) |
Commission of the European Communities, Inter-Laboratory test programme concerning the study of the ecotoxicity of a chemical substance with respect to the fish. EEC Study D.8368, 22 March 1979. |
|
(14) |
Verfahrensvorschlag des Umweltbundesamtes zum akuten Fisch-Test. Rudolph, P. und Boje, R. Ökotoxikologie, Grundlagen für die Ökotoxikologische Bewertung von Umweltchemikalien nach dem Chemikaliengesetz, ecomed 1986. |
|
(15) |
Litchfield, J. T. and Wilcoxon, F., A simplified method for evaluating dose effects experiments, J. Pharm. and Exp. Therap., 1949, vol 96, 99. |
|
(16) |
Finney, D. J. Statistical Methods in Biological Assay. Griffin, Weycombe, U. K, 1978. |
|
(17) |
Sprague, J. B. Measurement of pollutant toxicity to fish. I Bioassay methods for acute toxicity. Water Res., 1969, vol. 3, 793–821. |
|
(18) |
Sprague, J. B. Measurement of pollutant toxicity to fish. II Utilising and applying bioassay results. Water Res., 1970, vol. 4, 3–32. |
|
(19) |
Stephan, C. E. Methods for calculating an LC50. In Aquatic Toxicology and Hasard Evaluation (edited by F. I. Mayer and J. L. Hamelink). American Society for Testing and Materials. ASTM STP 634, 1977, 65–84. |
|
(20) |
Stephan, C. E., Busch, K. A., Smith, R., Burke, J. and Andrews, R. W. A computer program for calculating an LC50. US EPA. |
Lisäys 1
Sekoitevesi
Esimerkki sopivasta laimennusvedestä
Kaikkien kemikaalien on oltava analyyttistä laatua.
Veden on oltava hyvänlaatuista tislattua tai ionisoimatonta vettä, jonka johtavuus on alle 5 μS/cm-1.
Veden tislauslaite ei saa sisältää kuparista valmistettuja osia.
Kantaliuokset
|
CaCl2 x 2 H2O (kalsiumklorididihydraatti): Liuotetaan veteen ja laimennetaan litran tilavuuteen |
11,76 g |
|
MgSO4 x 7 H2O (magnesiumsulfaattiheptahydraatti): Liuotetaan veteen ja laimennetaan litran tilavuuteen |
4,93 g |
|
NaHCO3 (natriumvetykarbonaatti): Liuotetaan veteen ja laimennetaan litran tilavuuteen |
2,59 g |
|
KO (kaliumkloridi): Liuotetaan veteen ja laimennetaan litran tilavuuteen |
0,23 g |
Sekoitettu laimennusvesi
25 ml kutakin kantaseosta sekoitetaan ja liuos laimennetaan litran tilavuuteen.
Liuosta ilmastetaan, kunnes liuenneen hapen pitoisuus saavuttaa ilmakyllästymisarvon.
pH-arvon on oltava 7,8±0,2.
pH:ta säädetään tarvittaessa NaOH:lla (natriumhydroksidilla) tai HCl:llä (suolahapolla).
Näin valmistettu sekoitevesi pannaan syrjään noin 12 tunniksi, eikä sitä tarvitse enää ilmastaa.
Liuoksen Ca- ja Mg-ionien yhteenlaskettu pitoisuus on 2,5 millimoolia/1. Ca- ja Mg-ionien suhde on 4:1 ja Na- ja K-ionien suhde 10:1. Liuoksen kokonaisalkalisuus on 0,8 millimoolia/1.
Mahdolliset poikkeavuudet laimennusveden valmistuksessa eivät saa vaikuttaa veden koostumukseen tai sen ominaisuuksiin.
Liite 2
Suositeltavat kalalajit
|
Suositeltava laji |
Suositeltava testilämpötila-alue ( oC) |
Koe-eläimen suositeltava kokonaispituus (cm) |
|
Bracbydanio rerio (Teleostei, Cyprinidae) (Hamilton-Buchanan) seeprakala |
20–24 |
3,0 ± 0,5 |
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) Fathead minnow |
20–24 |
5,0 ± 2,0 |
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus 1758) karppi |
20–24 |
6,0 ± 2,0 |
|
Oryzias latipes (Teleostei, Poeciliidae) Cyprinodontidae (Tomminck et Schlegel 1850) Red killifish |
20–24 |
3,0 ± 1,0 |
|
Poecilia reticulata (Teleostei, Poeciliidae) (Peters 1859) miljoonakala |
20–24 |
3,0 ± 1,0 |
|
Lepomis macrochirus(Teleostei, Centrarchidae) (Rafinesque Linnaeus 1758) Bluegill |
20–24 |
5,0 ± 2,0 |
|
Onchorhynchus mykiss (Teleostei, Salmonidae) (Walbaum 1988) kirjolohi |
12–17 |
6,0 ± 2,0 |
|
Leuciscus idus (Teleostei, Cyprinidae) (Linnaeus 1758) säyne |
20–24 |
6,0 ± 2,0 |
Saatavuus
Edellä luetellut kalalajit ovat helposti viljeltävissä tai yleisesti saatavissa läpi koko vuoden. Niitä voidaan viljellä kalanviljelylaitoksissa tai laboratorioissa, edellyttäen, että sairauden ja loisten esiintymistä valvotaan. Näin saadaan terveitä koe-eläimiä, joiden tausta on tiedossa. Näitä kalalajeja on saatavana suuressa osassa maailmaa.
Liite 3
Pitoisuusesimerkki: prosentuaalinen kuolleisuus
Esimerkki LC50-määrityksestä logaritmitodennäköisyyspaperin avulla
C.2. DAPHNIA SP. AKUUTIN IMMOBILISAATION TESTI
1. MENETELMÄ
Tämä testimenetelmä vastaa OECD:n testiohjetta TG 2002 (2004).
1.1 JOHDANTO
Tällä menetelmällä testataan akuuttia myrkyllisyyttä arvioimalla kemikaalien vaikutuksia vesikirppuihin (Daphnia). Jo olemassa olevia testimenetelmiä käytetään hyväksi mahdollisuuksien mukaan (1) (2) (3).
1.2 MÄÄRITELMÄT
Tässä testimenetelmässä käytetään seuraavia määritelmiä:
|
|
EC 50 : pitoisuus, jossa 50 % vesikirpuista arvioidaan immobilisoituvan määrätyn altistusajan kuluessa. Jos käytetään muuta määritelmää, se on ilmoitettava viittauksineen. |
|
|
Immobilisaatio: Eläimet, jotka eivät kykene uimaan 15 sekunnin kuluessa sen jälkeen, kun testiastiaa on heilutettu varovasti, katsotaan immobilisoituneiksi (vaikka ne voisivat edelleen liikuttaa tuntosarviaan). |
1.3 TESTIMENETELMÄN PERIAATE
Nuoria vesikirppuja (testin alussa alle 24 tunnin ikäisiä) altistetaan testiaineelle sopivaksi arvioidulla pitoisuusalueella 48 tunnin ajan. Immobilisaatio kirjataan 24 ja 48 tunnin kuluttua ja sitä verrataan kontrolliarvoihin. Tulokset analysoidaan EC50:n laskemiseksi 48 tunnin kohdalla (katso määritelmät kohdassa 1.2). EC50:n määrittely 24 tunnin kohdalla on vapaaehtoista.
1.4 TESTIAINETTA KOSKEVAT TIEDOT
Testiaineen vesiliukoisuus ja höyrynpaine on oltava tiedossa, ja aineen kvantifioimiseksi testiliuoksissa on oltava käytettävissä luotettava analyysimenetelmä, jonka saantoteho on raportoitu, ja määritysraja pitäisi olla saatavissa. Tarpeellisia tietoja ovat mm. rakennekaava, aineen puhtaus, stabiilisuus vedessä tai valossa, Pow ja helpon biohajoavuuden testin (ks. testimenetelmä C.4) tulokset.
Huom.: Ohjeita sellaista tapausta varten, kun fysikokemialliset ominaisuudet tekevät testiaineista vaikeasti testattavia: kirjallisuusviite (4).
1.5 VERTAILUAINEET
Testiolosuhteiden luotettavuuden varmistamiseksi EC50 voidaan testata vertailuaineella. Tätä tarkoitusta varten suositellaan kansainvälisissä yhteistutkimuksissa (ring test) käytettyjä myrkyllisiä kemikaaleja (1) (5) (1). Suosituksena on, että vertailuaineella tehtävä koe tai kokeet suoritetaan joka kuukausi ja ainakin kahdesti vuodessa.
1.6 LAATUVAATIMUKSET
Jotta testi olisi validi, seuraavien vaatimusten on täytyttävä:
|
— |
Kontrolleissa (mukaan lukien liuotusapuaineen sisältävä kontrolli) enintään 10 % vesikirpuista saa immobilisoitua. |
|
— |
Liuenneen hapen pitoisuuden testin lopussa on oltava ≥ 3 mg/l kontrolli- ja koeastioissa. |
Huom.: Ensimmäinen vaatimus merkitsee, että enintään 10 prosenttia kontrollivesikirpuista saa immobilisoitua tai osoittaa muita sairauden tai stressin merkkejä, esimerkiksi värimuutoksia tai epätavallista käyttäytymistä (esim. jääminen pysyvästi vedenpinnalle).
1.7 TESTIMENETELMÄN KUVAUS
1.7.1 Laitteet
Astioiden ja muiden laitteiden, jotka joutuvat kosketuksiin testiliuosten kanssa, on oltava kokonaan lasia tai muuta kemiallisesti inerttiä materiaalia. Testiastiat ovat tavallisesti lasisia koeputkia tai dekanterilaseja. Ne on puhdistettava ennen jokaista käyttöä laboratorion normaaleilla menettelyillä. Koeastiat on peitettävä väljästi, jotta vältettäisiin veden menetys haihtumisen kautta ja pölyn pääsy liuoksiin. Haihtuvat aineet pitäisi testata täysin suljetuissa astioissa, jotka ovat tarpeeksi suuria, ettei happipitoisuus muodostu rajoittavaksi tekijäksi tai alene liiaksi (ks. kohta 1.6 ja kohdan 1.8.3 ensimmäinen alakohta).
Lisäksi tarvitaan joitakin tai kaikkia seuraavista laitteista: happimittari (joka on varustettu mikroelektrodilla tai muulla sopivalla laitteella, jolla voidaan mitata liuennut happi pienitilavuuksisissa näytteissä); pH-mittari; asianmukaiset laitteet lämpötilan säätöön; laitteet orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaispitoisuuden (TOC) mittaamiseen; laitteet kemiallisen hapenkulutuksen (COD) mittaamiseen; laitteet veden kovuuden mittaamiseen jne.
1.7.2 Testiorganismi
Testissä suositellaan käytettäväksi Daphnia magna Straus -organismia. Muita sopivia vesikirppulajeja (e.g. Daphnia pulex) saa myös käyttää. Testin alussa eläinten on oltava alle 24 tunnin ikäisiä, ja ominaisuuksien vaihtelun vähentämiseksi suositellaan painokkaasti, että ne eivät ole ensimmäistä sikiösarjaa. Niiden olisi oltava peräisin terveestä varastokannasta (ts. niissä ei saa näkyä merkkejä stressistä, kuten korkeaa kuolleisuutta, koiraita ja lepomunia, viivästymistä ensimmäisten sikiöiden tuottamisessa, värihäiriöisiä eläimiä jne.). Kaikkien tietyssä testissä käytettävien organismien on oltava peräisin saman vesikirppukannan viljelystä. Varastokannan eläimiä on pidettävä samanlaisissa viljelyoloissa (valo, lämpötila, viljelyneste) kuin testissä käytettäviä. Jos testissä käytettävä viljelyneste eroaa vesikirpun viljelyssä normaalisti käytetystä viljelynesteestä, on hyvä noudattaa käytäntöä, että eläimet totutetaan viljelyoloihin ennen testiä. Viljelystä saatuja vesikirppuja on tätä varten pidettävä laimennusvedessä testilämpötilassa vähintään 48 tunnin ajan ennen testin alkua.
1.7.3 Viljely- ja laimennusvesi
Luonnonvesi (pinta- tai pohjavesi), synteettinen vesi tai talousvesi, josta on poistettu kloori, ovat hyväksyttäviä viljely- ja laimennusvesiä, jos vesikirput voivat elää siinä viljelyn, totuttamisen ja testauksen ajan osoittamatta stressaantumisen merkkejä. Mikä tahansa vesi, joka täyttää liitteessä 1 mainitut hyväksyttävän liuoksen kemialliset ominaisuudet, soveltuu käytettäväksi testissä. Veden laadun on oltava tasainen testin ajan. Synteettinen vesi voidaan valmistaa lisäämällä tietyt määrät reagensseja (tunnustettu analyyttinen laatu) deionisoituun tai tislattuun veteen. Kirjallisuusviitteissä (1) ja (6) ja liitteessä 2 annetaan esimerkkejä synteettisestä vedestä. On huomattava, että tunnettuja kelatoivia aineita sisältäviä viljelynesteitä, kuten M4- ja M7-viljelynesteitä (ks. liite 2), ei suositella metalleja sisältävien aineiden testaukseen. pH-arvon pitäisi olla 6–9. Daphnia Magna -organismia varten suositellaan kovuutta 140–250 mg/l (CaCO3), mutta muita Daphnia-organismeja varten käy myös vähäisempi kovuus. Laimennusvettä voidaan ilmastaa ennen testin alkua, jotta liuenneen hapen pitoisuus saavuttaa kyllästymispisteen.
Jos käytetään luonnonvettä, laatuparametrit on tarkistettava vähintään kahdesti vuodessa tai aina kun on epäilystä siitä, että nämä ominaisuudet ovat voineet muuttua merkittävästi (ks. edellinen kohta ja liite 1). Lisäksi on määritettävä raskasmetallit (esim. Cu, Pb, Zn, Hg, Cd ja Ni). Käytettäessä vettä, josta on poistettu kloori, suositellaan päivittäistä kloorianalyysiä. Jos laimennusvesi on pinta- tai pohjavesilähteestä, johtokyky, orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaispitoisuus (TOC) tai kemiallinen hapenkulutus (COD) on mitattava.
1.7.4 Testiliuokset
Halutun pitoiset testiliuokset valmistetaan yleensä laimentamalla varastoliuosta. Varastoliuokset olisi mieluiten tehtävä liuottamalla testiaine laimennusveteen. Liuottimien, emulgointiaineiden tai dispergointiaineiden käyttöä olisi mahdollisuuksien mukaan vältettävä. Niitä voidaan kuitenkin tarvita joissakin tapauksissa sopivan väkevyisen varastoliuoksen valmistamiseksi. Kirjallisuusviitteessä (4) on tietoa sopivien liuottimien, emulgointiaineiden tai dispergointiaineiden käytöstä. Testiaineen pitoisuus testiliuoksissa ei saa missään tapauksessa ylittää aineen liukoisuusrajaa laimennusvedessä.
Testi on suoritettava säätämättä pH:ta. Jos pH ei pysy välillä 6–9, voidaan suorittaa toinen testi, jossa varastoliuoksen pH säädetään vastaamaan laimennusveden pH:ta ennen testiaineen lisäämistä. pH:ta säädettäessä on huolehdittava siitä, että varastoliuoksen pitoisuus ei muutu merkittävässä määrin ja ettei aiheuteta kemiallisia reaktioita eikä saostumista testiaineessa. Suositeltavia aineita ovat HCl ja NaOH.
1.8 MENETTELY
1.8.1 Altistusolosuhteet
1.8.1.1 Testi- ja kontrolliryhmät
Koeastiat täytetään sopivaan tilavuuteen laimennusvedellä ja testiaineen sisältävillä liuoksilla. Ilman ja veden tilavuuden keskinäisen suhteen astiassa pitäisi olla sama sekä testi- että kontrolliryhmässä. Vesikirput pannaan astioihin. Kutakin testipitoisuutta ja kontrolliryhmää varten olisi käytettävä vähintään 20 eläintä, mielellään jaettuina neljään viiden eläimen ryhmään. Kutakin eläintä varten olisi varattava vähintään 2 ml testiliuosta (ts. 10 ml testiliuosta viittä vesikirppua ja yhtä koeastiaa kohti). Testi suoritetaan siten, että liuos vaihtuu semistaattisissa oloissa tai läpivirtausolosuhteissa, jos testiaineen pitoisuus ei ole stabiili.
Testisarjan lisäksi on suoritettava yksi laimennusvesikontrollisarja ja tarvittaessa myös yksi liuotusapuaineen sisältävä kontrollisarja.
1.8.1.2 Testipitoisuudet
Varsinaisen testin pitoisuusalueiden määrittämiseksi voidaan tehdä pitoisuusalueen määrittelykoe, jollei testiaineen myrkyllisyydestä ole saatavilla tietoa. Tätä varten vesikirput altistetaan useille testiaineen pitoisuuksille laajoin pitoisuusvälein. Viisi vesikirppua on altistettava kullekin pitoisuudella enintään 48 tunnin ajaksi. Rinnakkaiskokeita ei tarvita. Altistusaika voidaan lyhentää (esim. 24 tuntiin tai tämän alle), jos pitoisuusalueen määrittelyyn sopivat tiedot saadaan lyhyemmässä ajassa.
Kokeessa pitäisi olla vähintään viisi testipitoisuutta geometrisessa sarjassa, eikä kerroin saisi olla suurempi kuin 2,2. Jos käytetään vähempää määrää pitoisuuksia, tämä on perusteltava. Suosituksena on, että suurin testattava pitoisuus johtaa 100 prosentin immobilisaatioon ja että pienin testattava pitoisuus ei aiheuta havaittavaa vaikutusta.
1.8.1.3 Inkubaatio-olosuhteet
Lämpötilan pitäisi olla välillä 18–22 oC ja pysyä kussakin yksittäisessä testissä vakiona (± 1 oC). Testissä suositellaan käytettäväksi sykliä, jossa on 16 tuntia valoa ja 8 tuntia pimeyttä. Myös jatkuva pimeys hyväksytään, erityisesti jos testiaine on epästabiili valossa.
Koeastioita ei saa ilmastaa testin aikana. Testi suoritetaan säätämättä pH:ta. Vesikirppuja ei saa ruokkia testin aikana.
1.8.1.4 Kesto
Testin kesto on 48 tuntia.
1.8.2 Huomautukset
Kunkin koeastian osalta on tarkistettava 24 ja 48 tunnin kuluttua testin alusta, onko siinä immobilisoituneita vesikirppuja (ks. määritelmät kohdassa 1.2). Immobilisaation lisäksi on kirjattava mahdollinen epänormaali käyttäytyminen tai ulkonäkö.
1.8.3 Mittaukset
Liuennut happi ja pH määritetään testin alussa ja lopussa kontrollissa (tai kontrolleissa) ja testiaineen suurimmassa pitoisuudessa. Kontrolleissa todetun liuenneen hapen pitoisuuden olisi oltava laatuvaatimuksen mukainen (ks. kohta 1.6). pH-arvo ei tavallisesti saisi vaihdella enemmän kuin 1,5 yksikköä yksittäisessä testissä. Lämpötila mitataan yleensä kontrolliastioista tai ilmasta, ja sitä on rekisteröitävä mielellään jatkuvaluonteisesti testin aikana tai vähintään testin alussa ja lopussa.
Vähintään suurin ja pienin testiaineen pitoisuus olisi mitattava testin alussa ja lopussa (4). Tulokset on suositeltavaa määritellä mitattujen pitoisuuksien perusteella. Jos on näyttöä siitä, että testattavan aineen pitoisuus on pysynyt tyydyttävällä tavalla ± 20 prosentissa nimellispitoisuudesta tai mitatusta alkupitoisuudesta koko testin ajan, tulokset voivat perustua nimellispitoisuuksiin tai alkupitoisuuksiin.
1.9 RAJA-ANNOSTESTI
Tässä testimenetelmässä kuvattuja menettelyjä käyttäen voidaan suorittaa raja-annostesti, jossa testiaineen pitoisuus on 100 mg/l tai sama kuin aineen liukoisuusraja-arvo testissä käytettävässä viljelynesteessä (sen mukaan, kumpi on alempi), sen osoittamiseksi, että EC50 on suurempi kuin kyseinen pitoisuus. Raja-annostesti on suoritettava 20 vesikirpulla (jotka suositellaan jaettaviksi neljään viiden eläimen ryhmään). Kontrollissa (tai kontrolleissa) niitä on oltava sama määrä. Jos immobilisaatiota havaitaan, on tehtävä täydellinen testi. Mahdollinen epänormaali käyttäytyminen on kirjattava.
2. TULOKSET
Tulokset on esitettävä taulukkomuodossa siten, että sekä testi- että kontrolliryhmistä ilmoitetaan käytetty vesikirppujen määrä ja immobilisaatio kunakin havaintoajankohtana. Prosentuaalinen immobilisaatio 24 ja 48 tunnin kohdalla on esitettävä graafisesti testipitoisuuksien funktiona. Tulokset analysoidaan sopivilla tilastomenetelmillä (esim. probittianalyysi), ja kuvaajien kulmakertoimet ja EC50 lasketaan 95 prosentin luottamusvälillä (p = 0,05) (7) (8).
Jos EC50:n tavanomaiset laskentamenetelmät eivät sovellu saatuun aineistoon, sitä suurinta pitoisuutta, joka ei aiheuta immobilisaatiota, ja sitä pienintä pitoisuutta, joka aiheuttaa 100 prosentin immobilisaation, on käytettävä likiarvon laskemiseen siten, että EC50 katsotaan kyseisten kahden pitoisuuden geometriseksi keskiarvoksi.
3. RAPORTOINTI
3.1 TESTISELOSTE
Testiselosteessa on ilmoitettava seuraavat tiedot:
Testiaine:
|
— |
fysikaalinen olomuoto ja fysikokemialliset ominaisuudet, jos niillä on merkitystä, |
|
— |
kemialliset tunnistetiedot, mukaan lukien puhtaus. |
Koelajit:
|
— |
Daphnian laji ja hankintapaikka tai alkuperä (jos se tunnetaan) sekä käytetyt viljelyolosuhteet (mm. ravinnon lähde, tyyppi ja määrä, ruokintatiheys). |
Koeolosuhteet:
|
— |
koeastioiden kuvaus: astioiden tyyppi, liuoksen tilavuus, vesikirppujen määrä koeastiaa kohti, koeastioiden (rinnakkaiskokeet) määrä pitoisuutta kohti, |
|
— |
varasto- ja testiliuosten valmistusmenetelmät (mahdollisen liuottimen tai dispergointiaineen nimi ja pitoisuus on ilmoitettava), |
|
— |
laimennusvedet: lähde ja veden laatu (pH, kovuus, Ca/Mg-suhde, Na/K-suhde, emäksisyys, johtokyky jne.); synteettisen veden koostumus (jos käytetty), |
|
— |
inkubaatio-olosuhteet: lämpötila, valon voimakkuus ja jaksoittaisuus, liuennut happi, pH jne. |
Tulokset:
|
— |
niiden vesikirppujen määrä ja prosentuaalinen osuus, joka immobilisoituivat tai osoittivat haitallisia vaikutuksia (mm. epänormaali käyttäytyminen) kontrolleissa ja kussakin testiryhmässä kunakin havaintoajankohtana, sekä havaittujen vaikutusten luonne, |
|
— |
vertailuaineella tehdyn testin tulokset ja päivämäärä (jos käytettävissä), |
|
— |
nimelliset testipitoisuudet sekä tulokset kaikista analyyseistä, joilla määritetään testiaineen pitoisuus koeastioissa; lisäksi on ilmoitettava menetelmän saantoteho sekä määritysraja, |
|
— |
kaikki testin aikana tehdyt fysikokemialliset lämpötilan, pH:n ja liuenneet hapen pitoisuuden mittaustulokset, |
|
— |
EC50 immobilisaatiolle 48 tunnin kohdalla, luottamusvälit, EC50:n laskemiseen käytetyn sovitetun mallin graafiset kuvaajat, annos-vastekäyrien kulmakertoimet ja niiden keskivirhe; EC50:n määrittämiseen käytettyjen tilastomenetelmien kuvaus (jos nämä tulokset määritettiin myös 24 tunnin kohdalla, myös ne on ilmoitettava), |
|
— |
selitykset mahdolliseen testimenetelmästä poikkeamiseen ja vaikuttiko poikkeaminen tuloksiin. |
4. KIRJALLISUUSVIITTEET
|
1. |
ISO 6341. (1996). Water quality — Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) — Acute toxicity test. Third edition, 1996. |
|
2. |
EPA OPPTS 850.1010. (1996). Ecological Effects Test Guidelines — Aquatic Invertebrate Acute Toxicity Test, Freshwater Daphnids. |
|
3. |
Environment Canada. (1996) Biological test method. Acute Lethality Test Using Daphnia spp. EPS 1/RM/11. Environment Canada, Ottawa, Ontario, Canada. |
|
4. |
Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publication. Series on Testing and Assessment. No. 23. Paris 2000. |
|
5. |
Commission of the European Communities. Study D8369. (1979). Inter-laboratory Test Programme concerning the study of the ecotoxicity of a chemical substance with respect to Daphnia. |
|
6. |
OECD Guidelines for the Testing of Chemicals. Guideline 211: Daphnia magna Reproduction Test, adopted September 1998. |
|
7. |
Stephan C.E. (1977). Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). ASTM STP 634 — American Society for Testing and Materials. Pp. 65–84. |
|
8. |
Finney D.J. (1978). Statistical Methods in Biological Assay. 3rd ed. London. Griffin, Weycombe, UK. |
LIITE 1
JOITAKIN HYVÄKSYTTÄVÄN LAIMENNUSVEDEN KEMIALLISIA OMINAISUUKSIA
|
Aine |
Pitoisuus |
|
Hiukkaset |
< 20 mg/l |
|
Orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaismäärä |
< 2 mg/l |
|
Ammoniakki (ionisoitumaton) |
< 1 μg/l |
|
Jäännöskloori |
< 10 μg/l |
|
Orgaanista fosforia sisältävien torjunta-aineiden kokonaismäärä |
< 50 ng/l |
|
Orgaanista klooria sisältävien torjunta-aineiden kokonaismäärä ja polyklooratut bifenyylit |
< 50 ng/l |
|
Orgaanisiin yhdisteisiin sitoutuneen kloorin kokonaismäärä |
< 25 ng/l |
Liite 2
ESIMERKKEJÄ SOPIVASTA SYNTEETTISESTÄ TESTIVEDESTÄ
ISO-testivesi (1)
|
Varastoliuokset (yksi aine) |
Synteettinen vesi valmistetaan lisäämällä seuraavat määrät varastoliuosta 1 litraan vettä (2) |
|
|
Aine |
1 vesilitraan lisätty määrä (2) |
|
|
Kalsiumkloridi CaCl2 , 2H2O |
11,76 g |
25 ml |
|
Magnesiumsulfaatti MgSO4 , 7H2O |
4,93 g |
25 ml |
|
Natriumbikarbonaatti NaHCO3 |
2,59 g |
25 ml |
|
Kaliumkloridi KCl |
0,23 g |
25 ml |
Elendt M7- ja M4-viljelynesteet
Totuttaminen Elendt M7- ja M4-viljelynesteeseen
Joissakin laboratorioissa on ollut vaikeuksia, kun ne ovat siirtäneet vesikirput suoraan M4- tai M7-viljelynesteeseen. Siirto onnistuu paremmin totuttamalla vesikirput asteittain uuteen viljelynesteeseen: ensin siirretään entisestä viljelynesteestä 30-prosenttiseen, sitten 60-prosenttiseen ja lopulta 100-prosenttiseen Elendt-viljelynesteeseen. Totuttamisvaiheen pitää mahdollisesti olla jopa kuukauden pituinen.
Valmistelu
Hivenaineet
Ensin valmistetaan erilliset varastoliuokset (I) yksittäisistä mineraaleista sopivan puhtaaseen (esim. deionisoituun, tislattuun tai käänteisosmoosilla puhdistettuun) veteen. Näistä eri varastoliuoksista (I) valmistetaan yksi ainoa varastoliuos (II), jossa on kaikkia hivenaineita (yhdistetty liuos), ts.:
|
Varastoliuokset I (yksi aine) |
Veteen lisätty määrä (mg/l) |
Pitoisuus (M4-viljelynesteessä) kertainen |
Valmistettaessa yhdistettyä varastoliuosta II lisätään veteen seuraavat määrät varastoliuosta I (ml/l) |
|
|
M4 |
M7 |
|||
|
H3 BO3 |
57 190 |
20 000 |
1,0 |
0,25 |
|
MnCl2 . 4H2O |
7 210 |
20 000 |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000 |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000 |
1,0 |
0,25 |
|
SrCl2 . 6H2O |
3 040 |
20 000 |
1,0 |
0,25 |
|
NaBr |
320 |
20 000 |
1,0 |
0,25 |
|
Na2 MoO4 . 2H2O |
1 230 |
20 000 |
1,0 |
0,25 |
|
CuCl2 . 2H2O |
335 |
20 000 |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000 |
1,0 |
1,0 |
|
CoCl2 . 6H2O |
200 |
20 000 |
1,0 |
1,0 |
|
KI |
65 |
20 000 |
1,0 |
1,0 |
|
Na2 SeO3 |
43,8 |
20 000 |
1,0 |
1,0 |
|
NH4VO3 |
11,5 |
20 000 |
1,0 |
1,0 |
|
Na2 EDTA . 2H2O |
5 000 |
2 000 |
— |
— |
|
FeSO4 . 7H2O |
1 991 |
2 000 |
— |
— |
|
Sekä Na2 EDTA- että FeSO4-liuokset valmistetaan erikseen, yhdistetään ja autoklavoidaan välittömästi. |
||||
|
Tuloksena on: |
||||
|
21Fe-EDTA-liuos |
|
1 000 |
20,0 |
5,0 |
M4- ja M7-viljelyneste
M4- ja M7-viljelynesteet valmistetaan käyttäen varastoliuosta II, makroravinteita ja vitamiineja seuraavasti:
|
|
Veteen lisätty määrä (mg/l) |
Pitoisuus (M4-viljelynesteessä) -kertainen |
Viljelynesteen valmistamiseen tarvittava varastoliuoksen määrä (ml/l) |
|
|
M4 |
M7 |
|||
|
Varastoliuos II (yhdistetyt hivenaineet) |
|
20 |
50 |
50 |
|
Makroravinteiden varastoliuos (yksittäisiä aineita) |
|
|
|
|
|
CaCl2 · 2H2O |
293 800 |
1 000 |
1,0 |
1,0 |
|
MgSO4 · 7H2O |
246 600 |
2 000 |
0,5 |
0,5 |
|
KCl |
58 000 |
10 000 |
0,1 |
0,1 |
|
NaHCO3 |
64 800 |
1 000 |
1,0 |
1,0 |
|
Na2 SiO3 · 9H2O |
50 000 |
5 000 |
0,2 |
0,2 |
|
NaNO3 |
2 740 |
10 000 |
0,1 |
0,1 |
|
KH2PO4 |
1 430 |
10 000 |
0,1 |
0,1 |
|
K2HPO4 |
1 840 |
10 000 |
0,1 |
0,1 |
|
Yhdistetty vitamiinien varastoliuos |
— |
10 000 |
0,1 |
0,1 |
|
Yhdistetty vitamiinien varastoliuos valmistetaan lisäämällä kaikkia kolmea vitamiinia 1 litraan vettä seuraavasti: |
||||
|
Tiamiini-hydrokloridi |
750 |
10 000 |
|
|
|
Syaani-kobalamiini (B12) |
10 |
10 000 |
|
|
|
Biotiini |
7,5 |
10 000 |
|
|
Yhdistetty vitamiinien varastoliuos säilytetään jäädytettynä pienissä erissä. Vitamiinit lisätään viljelynesteeseen vähän ennen käyttöä.
|
Huom. |
: |
Jotta suolat eivät saostuisi lopullista viljelynesteliuosta valmistettaessa, varastoliuokset lisätään 500–800 ml:aan deionisoitua vettä ja täytetään sitten 1 litraksi. |
|
Huom. |
: |
M4-viljelynesteen kokoonpanoa koskeva ensimmäinen julkaisuviite on Elendt, B.P. (1990). Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25–33. |
C.3. LEVÄN INHIBITIOKOE
1. MENETELMÄ
1.1 JOHDANTO
Tällä kokeella voidaan määrittää testattavan aineen vaikutukset yksisoluisten viherlevälajien kasvuun. Suhteellisen lyhyellä (72 h) kokeella voidaan kattaa useita sukupolvia. Menetelmää voidaan käyttää useiden yksisoluisten viherlevien testaukseen. Testiraporttiin on tällöin sisällytettävä kuvaus käytetystä menetelmästä.
Menetelmää voidaan parhaiten soveltaa vesiliukoisiin aineisiin, jotka todennäköisesti eivät ole haihtuvia.
Menetelmää voidaan soveltaa aineisiin, jotka eivät suoraan häiritse leväkasvun mittausta.
Ennen testiä on suositeltavaa hankkia mahdollisuuksien mukaan tietoa aineen vesiliukoisuudesta, höyrynpaineesta, kemiallisesta stabiiliudesta, dissosiaatiovakiosta ja biohajoavuudesta.
Kokeen suunnittelussa ja tulosten tulkinnassa on otettava huomioon mahdolliset lisätiedot (esimerkiksi aineen rakennekaava, puhtausaste, merkittävien epäpuhtauksien laatu ja pitoisuus, lisäaineet ja niiden määrä sekä n-oktanoli/vesi-jakautumiskerroin).
1.2 MÄÄRITELMÄT JA YKSIKÖT
Solutiheys: solujen määrä millilitrassa
Kasvu: solutiheyden kasvu testijakson aikana
EC50: tällä menetelmällä voidaan mitata joko kasvun (EbC50) tai kasvunopeuden (ErC50) 50-prosenttinen lasku kontrolliviljelmään verrattuna.
NOEC-pitoisuus (ei havaittua vaikutusta): tässä menetelmässä NOEC-pitoisuudella tarkoitetaan suurinta pitoisuutta, josta ei seuraa havaittavaa kasvun estymistä kontrolliviljelmään verrattuna.
Testattavan aineen kaikki pitoisuudet ilmaistaan painoyksikköinä tilavuutta kohti (mg/l). Pitoisuus voidaan ilmaista myös painoyksikköinä painoa kohti (mg/kg-1).
1.3 VERTAILUAINEET
Vertailuainetta testaamalla voidaan osoittaa, että testattavien lajien vaste ei ole merkittävästi muuttunut laboratorio-olosuhteissa.
Jos käytetään vertailuainetta, tulokset on sisällytettävä testiraporttiin. Voidaan käyttää kaliumdikromaattia, joskin sen väri voi vaikuttaa solujen käytettävissä olevan valon laatuun ja intensiteettiin sekä mahdollisiin spektrofotometrisiin määrityksiin. Kaliumdikromaattia on käytetty kansainvälisessä laboratorioiden välisessä testissä (katso viitettä (3) ja liitettä 2).
1.4 TESTIMENETELMÄN PERIAATE
Rajatestin (100 mg/l) avulla voidaan osoittaa, että EC50-arvo on suurempi kuin rajatestipitoisuus.
Eksponentiaalisesti kasvavia viherleväviljelmiä altistetaan testattavan aineen eri pitoisuuksille määritetyissä olosuhteissa.
Testiliuoksia inkuboidaan 72 tunnin ajan. Tämän jakson aikana kunkin liuoksen tiheys mitataan vähintään 24 tunnin väliajoin. Määritetään kasvun inhibitio kontrolliviljelmään verrattuna.
1.5 LAATUKRITEERIT
Laatukriteerejä sovelletaan sekä rajatestiin että kattavaan testiin.
Kontrolliviljelmien solutiheyden on kasvettava vähintään kertoimella 16 kolmen päivän kuluessa.
Testattavan aineen pitoisuuden on koko testin ajan oltava vähintään 80 % alkupitoisuudesta.
Jos aine liukenee helposti veteen muodostaen stabiilin liuoksen (aine ei merkittävästi haihdu, pilkkoudu, hydrolysoidu tai adsorboidu), alkupitoisuutta voidaan pitää nimellisenä pitoisuutena. On esitettävä todisteet siitä, että pitoisuudet on pidetty vakiona testin ajan ja että laatukriteerit on täytetty.
Jos aine;
|
i) |
on huonosti veteen liukenevaa, |
|
ii) |
pystyy muodostamaan stabiileja emulsioita tai dispersioita, |
|
iii) |
ei ole stabiili vesiliuoksissa, |
alkupitoisuutena pidetään kokeen alussa mitattua pitoisuutta. Pitoisuus määritetään tasapainon saavuttamisen jälkeen.
Tällaisissa tapauksissa testin aikana on tehtävä lisämittauksia, joilla voidaan vahvistaa todellinen altistuspitoisuus tai laatukriteereiden täyttyminen.
On todettu, että merkittäviä määriä testattavaa ainetta voi joutua leväbiomassaan testijakson aikana. Jotta voitaisiin osoittaa laatukriteereiden täyttyneen, on otettava huomioon sekä leväbiomassaan sisältyvä ainemäärä että liuoksessa oleva määrä (jos tämä ei ole teknisesti mahdollista, vesipatsaasta mitattu ainemäärä). Koska aineen määrittäminen biomassasta voi olla teknisesti vaikeata, laatukriteereiden täyttyminen voidaan osoittaa suorittamalla testi suurimmalla mahdollisella aineen pitoisuudella, mutta ilman levää ja mittaamalla liuoksen pitoisuus (jos tämä ei ole teknisesti mahdollista, vesipatsaasta mitattu pitoisuus) testijakson alussa ja lopussa.
1.6 MENETELMÄKUVAUS
1.6.1 Reagenssit
1.6.1.1 Testattavien aineiden liuokset
Valmistetaan määrätynpitoiset kantaliuokset liuottamalla ainetta ionisoimattomaan veteen tai kohdan 1.6.1.2 mukaiseen veteen.
Tarvittavat testipitoisuudet valmistetaan lisäämällä levien esiviljelmiin sopivia alikvootteja (katso liitettä 1).
Yleensä aineita ei pidä testata liukoisuusrajan ylittävinä pitoisuuksina. Joidenkin aineiden kohdalla (esimerkiksi sellaisten, jotka liukenevat huonosti veteen (suun Pow-arvo) ja sellaisten, jotka muodostavat dispersioita todellisen liuoksen sijasta) on hyväksyttävää käyttää liukoisuusrajan ylittävää testipitoisuutta, jotta voitaisiin varmistaa, että ainetta on liuennut mahdollisimman paljon ja että liuos on stabiili. On kuitenkin tärkeää, että tämä pitoisuus ei muutoin häiritse testijärjestelmää (esimerkiksi muodostamalla veden pinnalle kalvon, joka estää veden hapettumisen).
Jos aine on huonosti veteen liukenevaa, kantaliuoksen valmistamisessa tai aineen dispergoimisessa testiliuokseen voidaan käyttää apuna ultraäänidispersiota, orgaanisia liuottimia, emulsioliuottimia tai dispergoimisaineita. Jos tällaisia apuaineita käytetään, kaikkien testipitoisuuksien on sisällettävä sama määrä apuainetta ja erillinen kontrolliviljelmä on altistettava testisarjan apuainepitoisuudelle. Tällaisten apuaineiden pitoisuudet on pidettävä mahdollisimman pieninä, eivätkä ne koskaan saa ylittää arvoa 100 mg/l testiliuosta.
Koe suoritetaan ilman pH-arvon säätöjä. Jos havaitaan merkkejä pH-arvon merkittävästä muutoksesta, on suositeltavaa tehdä toinen koe, jossa käytetään pH-säätöä, ja raportoida tulokset. Tässä tapauksessa kantaliuoksen pH-arvo säädetään samaksi kuin laimennusveden pH-arvo, ellei tätä vastaan ole erityistä syytä. Suositeltavat pH-säätöaineet ovat HC1 ja NaOH. pH-säätö on tehtävä siten, ettei kantaliuoksen testiainepitoisuus muutu merkittävästi. Jos pH-säädön seurauksena tapahtuu jokin kemiallinen reaktio tai testiaine saostuu, ilmiö on raportoitava.
1.6.1.2 Testiliuos
Veden on oltava hyvänlaatuista tislattua tai ionisoimatonta vettä, jonka johtavuus on alle 5 μS/cm-1. Veden tislauslaite ei saa sisältää kuparista valmistettuja osia.
Seuraavia liuoksia suositellaan:
Valmistetaan neljä kantaliuosta jäljempänä olevan taulukon mukaan. Kantaliuokset steriloidaan kalvosuodatus- tai autoklaavikäsittelyllä ja niitä säilytetään pimeässä (4 oC:ssä). Kantaliuos numero 4 steriloidaan pelkällä kalvosuodatuskäsittelyllä. Testiliuosten lopullinen ravinnepitoisuus saadaan aikaan laimentamalla kantaliuoksia.
|
Ravinne |
Pitoisuus kantaliuoksessa |
Lopullinen pitoisuus testiliuoksessa |
|
Kantaliuos 1: makroravinteet |
||
|
NH4Cl |
1,5 g/l |
15 mg/l |
|
MgCl2.6H2O |
1,2 g/l |
12 mg/l |
|
CaCl2.2H2O |
1,8 g/l |
18 mg/l |
|
MgSO4.7H2O |
1,5 g/l |
15 mg/l |
|
KH2PO4 |
0,16 g/l |
1,6 mg/l |
|
Kantaliuos 2: Fe-EDTA |
||
|
FeCl3.6H2O |
80 mg/l |
0,08 mg/l |
|
Na2EDTA.2H2O |
100 mg/l |
0,1 mg/l |
|
Kantaliuos 3: hivenaineet |
||
|
H3BO3 |
185 mg/l |
0,185 mg/l |
|
MnCl2.4H2O |
415 mg/l |
0,415 mg/l |
|
ZnCl2 |
3 mg/l |
3 x 10-3 mg/l |
|
CoCl2.6H2O |
1,5 mg/l |
1,5 x 10-3 mg/l |
|
CuCl2.2H2O |
0,01 mg/l |
10-5 mg/l |
|
Na2MoO4.2H2O |
7 mg/l |
7 x 10-3 mg/l |
|
Kantaliuos 4: NaHCO 3 |
||
|
NaHCO3 |
50 g/l |
50 mg/l |
Ilmalla tehtävän tasapainotuksen jälkeen liuoksen pH-arvo on noin 8.
1.6.2 Laite
|
— |
Normaalit laboratorion laitteet. |
|
— |
Sopivan kokoisia pulloja (esimerkiksi 250 ml:n erlenmeyerpullo, kun liuoksen tilavuus on 100 ml), joiden on oltava samanmittaisia ja valmistettu samasta materiaalista. |
|
— |
Viljelylaite: kaappi tai kammio, jossa lämpötilaväliä 21–25 oC voidaan pitää yllä tarkkuudella ± 2 oC ja jossa on tasainen valaistus spektrialueella 400–700 nm. Jos kontrolliviljelmien kasvunopeus on suositusten mukainen, voidaan olettaa, että viljelyolosuhteet, valo-olosuhteet mukaan lukien, ovat olleet sopivat. Suositeltava valon intensiteetti testiliuoksen keskikorkeudella on 60–120 μE.m-2.s-1 (35–70 x 1018 fotonia/m-2.s-1) mitattuna 400–700 nm:n alueelta sopivalla mittausanturilla. Jos valonmittauslaitteet on kalibroitu lux-yksikköä varten, vastaava alue on 6 000–10 000 lx. Sopiva valon intensiteetti saadaan esimerkiksi sijoittamalla 4–7 tavallista valkoista 30 W:n loistevalaisinta (värilämpötila noin 4 300 K) 0,35 m:n etäisyydelle leväviljelmästä. |
|
— |
Solutiheyden mittaukset on tehtävä laskemalla elävät solut suoraan, esimerkiksi laskulaitteella varustetun mikroskoopin avulla. Myös muita menetelmiä (esimerkiksi fotometriaa tai sameudenmittausta) voidaan käyttää, edellyttäen, että ne ovat tarpeeksi herkkiä ja riittävän hyvin korreloitavissa solutiheyden suhteen. |
1.6.3 Testattavat eliöt
Suositeltava eliö on viherlevä, joka on nopeasti kasvava ja soveltuu viljelyyn sekä testaukseen. Suositukset ovat seuraavat:
|
— |
Selenastrum capricomutum, esimerkiksi ATCC 22662 tai CCAP 278/4, |
|
— |
Scenedesmus subspicatus, esimerkiksi 86.81 SAG. |
Huomautus:
|
ATCC |
= |
American Type Culture Collection (USA) |
|
CCAP |
= |
Culture Centre of Algae and Protozoa (Englanti) |
|
SAG |
= |
Collection of algal culture (Göttingen, Saksa) |
Jos käytetään muita lajeja, kanta on ilmoitettava.
1.6.4 Testin suorittaminen
Testiin käytettävä pitoisuusalue määritetään alueenmäärityskokeella.
Kun käytetään kasvusuureita biomassa ja kasvunopeus, tulokseksi voidaan saada hyvinkin erilaisia kasvun inhibitioarvoja. Siksi alueenmäärityskokeessa on käytettävä molempia suureita, jotta voitaisiin varmistua siitä, että pitoisuuksien geometrinen porrastus suo mahdollisuuden sekä EbC50- että ErC50-arvon määritykseen.
Solutiheys kokeen alussa
Suosituksen mukaan viljelmien solutiheyden on oltava kokeen alussa noin 104 solua/ml Selenastrum capricomutum- ja Scenedesmus subspicatus -lajeja käytettäessä. Jos käytetään muita lajeja, biomassan on oltava vertailukelpoinen.
Testattavan aineen pitoisuudet
Koetta varten valmistetaan geometrisenä sarjana vähintään viisi pitoisuutta, joiden poikkeamiskerroin on enintään 2,2. Alin pitoisuus ei saa aiheuttaa havaittavia vaikutuksia levän kasvunopeuteen. Suurimman pitoisuuden on estettävä kasvu vähintään 50-prosenttisesti vertailunäytteeseen verrattuna tai mieluiten estettävä kasvu kokonaan.
Toistot ja kontrollit
Kokeeseen on kuuluttava kolme toistoa kutakin pitoisuutta kohti. Käytetään kolmea vertailunäytettä ilman testattavaa ainetta ja tarpeen mukaan kolmea vertailunäytettä, jotka sisältävät mahdollista apuainetta. Jos erityiset syyt sitä edellyttävät, pitoisuuksien määrää voidaan suurentaa ja toistojen määrää pitoisuutta kohti pienentää.
Testin suorittaminen
Valmistetaan testiviljelmät, joissa on testattavaa ainetta haluttuna pitoisuutena ja haluttu määrä siirroslevää lisäämällä testattavan aineen kantaliuoksen alikvootteja sopiviin määriin levän esiviljelmiä (katso liitettä 1).
Viljelypulloja ravistetaan ja ne asetetaan viljelylaitteeseen. Leväsolut pidetään suspendoituneina ravistamalla, hämmentämällä tai ilmakuplien avulla. Näin parannetaan kaasunvaihto ja pienennetään testiliuoksen pH-arvon vaihteluita. Viljelmien lämpötila pidetään alueella 21–25 oC ± 2 oC.
Kunkin pullon solutiheys määritetään vähintään 24, 48 ja 72 tunnin kuluttua kokeen alusta lukien. Jos käytetään muita tiheyden määrittämismenetelmiä kuin suoraa laskentaa, tausta määritetään sopivan pitoisuuden testattavaa kemikaalia sisältävän suodatetun levän avulla.
pH-arvo määritetään kokeen alussa ja 72 tunnin kuluttua.
Yleensä vertailunäytteen pH-arvo saa kokeen aikana vaihdella enintään 1,5 yksikön verran.
Haihtuvien aineiden testaus
Haihtuvien aineiden testaamiseen ei ole yleisesti hyväksyttyä menetelmää. Jos aineen tiedetään olevan haihtuvaa, voidaan käyttää suljettuja pulloja, joissa on tavallista suurempi ylätila. Suljettujen pullojen ylätilan laskemisessa on otettava huomioon mahdollinen hiilidioksidin puute. Viitteessä 4 on maininta vaihtoehtoisista menetelmistä.
Liuokseen jäävän aineen määrä on yritettävä määrittää. On noudatettava äärimmäistä varovaisuutta tulkittaessa tuloksia kokeista, joissa on testattu haihtuvia kemikaaleja suljetuissa järjestelmissä.
Rajatesti
Rajatestin (100 mg/l) avulla voidaan, osoittaa että EC50-arvo on suurempi kuin rajatestipitoisuus.
Jos aineesta ei saada vesiliuosta, jonka pitoisuus on 100 mg/l, rajatesti tehdään pitoisuudella, joka vastaa aineen liukoisuutta (tai enimmäispitoisuutta, jolla saadaan stabiili dispersio) käytettävään veteen (katso myös kohtaa 1.6.1.1).
Rajatesti on suoritettava vähintään kolmena toistona samaa vertailunäytteiden määrää käyttäen. Rajatestissä on käytettävä kahta kasvun suuretta (biomassaa ja kasvunopeutta).
Jos rajatestin tuloksena on biomassan tai kasvunopeuden pieneneminen keskimäärin vähintään 25 %, on suoritettava kattava testi.
2. TIEDOT JA ARVIOINTI
Testi- ja kontrolliviljelmien mitattu solutiheys esitetään taulukkona, josta ilmenevät testattavan aineen pitoisuudet ja mittausajankohdat. Kasvukäyrät saadaan piirtämällä solutiheyden muuttuminen ajan funktiona (0–72 tuntia) käsiteltyjen näytteiden ja kontrolliviljelmien osalta kutakin testattavaa ainepitoisuutta kohti.
Pitoisuuden ja vaikutuksen suhde määritetään kahden jäljempänä kuvatun menetelmän mukaan. Eräiden aineiden kohdalla kasvua voidaan simuloida matalien pitoisuuksien osalta. Kelpuutetaan vain pisteet, jotka osoittavat 0–100 prosentin inhibitiota.
2.1 KASVUKÄYRIEN ALAISTEN PINTA-ALOJEN VERTAILU
Kasvukäyrän ja vaakasuoran N = No välinen pinta-ala voidaan laskea seuraavan suureyhtälön avulla;

jossa
|
A |
= |
pinta-ala |
|
No |
= |
solujen määrä millilitrassa hetkellä t0 (kokeen alussa), |
|
N1 |
= |
mitattu solujen määrä millilitrassa hetkellä t, |
|
Nn |
= |
mitattu solujen määrä millilitrassa hetkellä tn, |
|
t1 |
= |
kokeen alusta mittaushetkeen 1 kulunut aika, |
|
tn |
= |
kokeen alusta mittaushetkeen n kulunut aika, |
|
n |
= |
mittausten määrä kokeen alkamisen jälkeen. |
Solukasvun suhteellinen estyminen ( %) kutakin testattavan aineen pitoisuutta kohti (IA) lasketaan seuraavan suureyhtälön avulla:

jossa
|
Ac |
= |
vertailunäytteen kasvukäyrän ja vaakasuoran N = No välinen pinta ala |
|
At |
= |
pitoisuuden t kasvukäyrän ja vaakasuoran N = No välinen pinta ala |
|
IA |
= |
-arvot piirretään puolilogaritmipaperille tai puolilogaritmiselle probit-paperille kunkin pitoisuuden osalta. Jos arvot piirretään probit-paperille, pisteet sovitetaan (joko silmämääräisesti tai lasketun regression avulla) siten, että ne muodostavat suoran. |
EC50-arvo määritetään regressioviivasta lukemalla pitoisuus, joka vastaa 50 prosentin inhibitiota (IA = 50 %). Jotta luettu arvo voitaisiin tunnistaa tähän laskentamenetelmään liittyväksi, ehdotetaan symbolin EbC50 käyttöä. On tärkeää, että EbC50-arvon yhteydessä viitataan myös altistusjaksoon, esimerkiksi EbC50 (0–72 h).
2.2 KASVUNOPEUKSIEN VERTAILU
Eksponentiaalisesti kasvavien viljelmien keskimääräinen spesifinen kasvunopeus (μ) voidaan ilmaista seuraavasti:

jossa t0 on kokeen alkuaika.
Vaihtoehtoisesti voidaan johtaa keskimääräinen spesifinen kasvunopeus regressiosuoran kaltevuudesta piirtämällä In N ajan funktiona.
Spesifisen kasvunopeuden prosentuaalinen estyminen kutakin testattavan aineen pitoisuutta kohti (Iμt) voidaan laskea seuraavan suureyhtälön avulla:
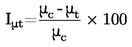
jossa
|
μc |
= |
vertailunäytteen keskimääräinen spesifinen kasvunopeus |
|
μt |
= |
testattavan aineen pitoisuuden t keskimääräinen spesifinen kasvunopeus |
Piirretään kutakin testattavan aineen pitoisuutta kohti keskimääräisen spesifisen kasvunopeuden pieneneminen vertailuarvoon verrattuna, pitoisuuden logaritmin funktiona. EC50-arvo voidaan lukea tuloksena saatavasta käyrästä. Jotta luettu EC50-arvo voitaisiin tunnistaa tähän menetelmään liittyväksi, ehdotetaan symbolin ErC50 käyttöä. Myös mittausajat on ilmoitettava. Jos esimerkiksi arvo viittaa 0 ja 72 tunnin jälkeen tehtyihin mittauksiin, käytetään symbolia ErC50 (0–72 h).
Huomautus: Spesifinen kasvunopeus on logaritminen suure, joten pienet kasvunopeuden muutokset voivat aiheuttaa suuria biomassan muutoksia. Siksi EbC- ja ErC-arvoja ei voi verrata numeerisesti.
2.3 NOEC-ARVON LASKENTA
NOEC-arvo (No Observed Effect Concentration — pitoisuus, joka ei aiheuta havaittavaa vaikutusta) määritetään soveltuvan tilastollisen, useiden näytteiden vertailumenetelmän mukaan (tehdään esimerkiksi varianssianalyysi ja Dunnetin testi) käyttäen yksittäisiä toistoarvoja kasvukäyrien A alaisesta pinta-alasta (katso kohtaa 2.1) tai spesifisiä kasvunopeuksia μ (katso kohtaa 2.2).
3. RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
testattava aine: kemialliset tunnistetiedot, |
|
— |
testattavat eliöt: lähde, laboratorioviljelmä, kannan numero, viljelymenetelmä, |
|
— |
testiolosuhteet:
|
|
— |
tulokset:
|
4. VIITTEET
|
(1) |
OECD, Paris, 1981, Test Guideline 201, Decision of the Council C(81) 30 final. |
|
(2) |
Umweltbundesamt, Berlin, 1984, Verfahrensvorschlag ”Hemmung der Zellvermehrung bei der Grünalge Scenedesmus subspicatus” in: Rudolph/Boje: Ökotoxikologie, ecomed, Landsberg, 1986. |
|
(3) |
ISO 8692 Water quality — Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum. |
|
(4) |
S. Galassi and M. Vighi — Chemosphere, 1981, vol. 10, 1123–1126. |
Liite 1
Esimerkki levänviljelymenetelmästä
Yleisiä havaintoja
Tässä kuvattavan menetelmän avulla voidaan viljellä leviä myrkyllisyyskokeita varten.
Soveltuvien menetelmien avulla on varmistettava, että leväviljelmissä ei ole bakteeritartuntaa (ISO 4833). On aina varmistettava, että viljelmissä esiintyy vain yhtä levälajia. Tämä pätee myös akseenisia viljelmiä käytettäessä.
Bakteerien tai muiden levien pääsy viljelmään on estettävä tekemällä kaikki toimet steriileissä olosuhteissa. Kontaminoituneet viljelmät on hylättävä.
Leväviljelmien tuottaminen
Elatusaineen valmistelu:
Elatusaineet voidaan valmistaa laimentamalla väkevää kantaliuosta. Jos elatusaine on kiinteä, lisätään 0,8 % agaria. Elatusaineen on oltava steriili. Sterilointi autoklaavikäsittelyllä voi aiheuttaa ammoniakkihäviöitä.
Kantaviljelmä:
Kantaviljelmät ovat pieniä leväviljelmiä, jotka siirretään säännöllisesti tuoreeseen elatusaineeseen, jossa ne toimivat testin alkumateriaalina. Jos viljelmiä ei käytetä säännöllisesti, ne valutetaan kallistettuihin agarputkiin. Putket siirretään tuoreeseen elatusaineeseen vähintään kahden kuukauden väliajoin.
Kantaviljelmiä viljellään sopivaa elatusainetta sisältävissä erlenmeyerpulloissa (tilavuus noin 100 ml). Kun leviä inkuboidaan 20 oC:ssa jatkuvassa valaistuksessa, siirrot on tehtävä viikoittain.
Siirrossa ”vanhan” viljelmän osa siirretään steriilin pipetin avulla tuoretta elatusainetta sisältävään pulloon. Jos laji on nopeasti kasvava, alkupitoisuuden on oltava noin sadasosa vanhan viljelmän pitoisuudesta.
Lajin kasvunopeus voidaan määrittää kasvukäyrän avulla. Näin on mahdollista arvioida, kuinka usein viljelmä on siirrettävä uuteen elatusaineeseen. Siirto on tehtävä, ennen kuin viljelmä kuolee.
Esiviljely
Esiviljelyn avulla saadaan levämäärä, joka on sopiva testiviljelmien siirrostukseen. Esiviljelmää inkuboidaan testiolosuhteissa, ja viljelmä käytetään sen ollessa vielä eksponentiaalisessa kasvuvaiheessa, yleensä noin kolmen päivän pituisen inkubaation jälkeen. Leväviljelmät, jotka sisältävät epämuodostuneita tai poikkeavia soluja, on hylättävä.
Liite 2
Taulukossa on tulokset vedenlaatustandardin ISO 8692 mukaisesta makeavesilevien kasvunestotestistä, jossa on käytetty lajeja Scenedesmus subspicatus ja Selenastrum caprtcomutum (16 laboratoriota käsittävä laboratorioiden välinen kaliumdikromaatin testaus).
|
|
Keskiarvo (mg/l) |
Alue (mg/l) |
|
ErC50 (0–72 h) |
0,84 |
0,60–1,03 |
|
EbC50 (0–72 h) |
0,53 |
0,20–0,75 |
C.4 BIOHAJOAVUUDEN MÄÄRITYS
OSA I YLEISTÄ
I.1 JOHDANTO
Jäljempänä kuvataan kuusi menetelmää, joiden avulla voidaan tutkia kemikaalin biohajoavuutta aerobisessa vesiliuoksessa. Menetelmät ovat seuraavat:
|
a) |
Liukoinen orgaaninen hiili (DOC — Dissolved Organic Carbon) Die-Away -menetelmä C.4-A, |
|
b) |
Muunneltu OECD-seulonta (DOC Die-Away) -menetelmä C.4-B, |
|
c) |
Hiilidioksidin (CO2) muodostus (muunneltu Sturm-testi) — menetelmä C.4-C |
|
d) |
Manometrinen respirometria -menetelmä C.4-D |
|
e) |
Suljettu pullo -menetelmä C.4-E |
|
f) |
MITI (Ministry of International Trade and Industry, Japani) -menetelmä C.4-E |
Menetelmäkuvausten osassa I on kunkin testin yleiskuvaus. Osissa II–VII on kuvattu menetelmän erityispiirteet. Liitteissä on määritelmiä, suureyhtälöitä ja ohjeita.
OECD-maiden laboratorioiden välinen, vuonna 1988 suoritettu testi osoitti, että menetelmillä saadut tulokset ovat yhtenäiset. Menetelmää valittaessa on kuitenkin otettava huomioon testattavan aineen fysikaaliset ominaisuudet.
I.2 MENETELMÄN VALINTA
Sopivimman menetelmän löytämiseksi on hankittava tietoja aineen kemiallisesta liukoisuudesta, höyrynpaineesta ja adsorptio-ominaisuuksista. Aineen kemiallinen rakenne tai kaava on selvitettävä teoreettisten arvojen laskentaa tai mitattujen parametrien — esimerkiksi ThOD:n, ThCO2:n, DOC:n, TOC:n ja COD:n — tarkistamista varten (katso liitteitä I ja II).
Kemikaaleja, joiden vesiliukoisuus on vähintään 100 mg/l, voidaan tutkia kaikilla menetelmillä, edellyttäen, etteivät kemikaalit ole haihtuvia tai adsorboivia. Huonosti veteen liukenevia, haihtuvia tai adsorboivia kemikaaleja varten soveltuvat menetelmät luetellaan taulukossa 1. Esimerkkejä huonosti veteen liukenevien ja haihtuvien kemikaalien käsittelymahdollisuuksista kuvataan liitteessä III. Lievästi haihtuvia kemikaaleja voidaan testata DOC Die-Away -menetelmällä, edellyttäen että testausastiassa on riittävä kaasutila (astian on oltava suljettua tyyppiä). Tällöin on tehtävä abioottisia tarkistuksia mahdollista fysikaalista hukkaa ajatellen.
Taulukko 1
Testimenetelmien soveltuvuus
|
Testi |
Analyyttinen menetelmä |
Soveltuvuus |
||
|
huonosti liukenevat aineet |
haihtuvat aineet |
adsorboivat aineet |
||
|
DOC Die-Away |
Liuennut orgaaninen hiili |
— |
— |
+/- |
|
Muunneltu OECD Die-Away |
Liuennut orgaaninen hiili |
— |
— |
+/- |
|
CO2:n muodostus |
Respirometria: CO2:n muodostus |
+ |
— |
+ |
|
Manometrinen respirometria |
Manometrinen respirometria: hapenkulutus |
+ |
+/- |
+ |
|
Suljettu pullo |
Respirometria: liuennut happi |
+/- |
+ |
+ |
|
MITI |
Respirometria: hapenkulutus |
+ |
+/- |
+ |
Tulosten tulkintaa varten tarvitaan tietoja testattavan aineen pääosien puhtaudesta tai niiden suhteellisista osuuksista, etenkin jos tuloksena saatavat arvot ovat pieniä tai marginaalisia.
Sopivan testauspitoisuuden löytämiseksi on suositeltavaa selvittää aineen myrkyllisyys bakteereille (liite IV). Näiden tietojen avulla voidaan usein varmistaa oikea tulkinta, jos tuloksena saatu biohajoavuus on heikko.
I.3 VERTAILUAINEET
Menetelmän tarkistamiseksi biohajoavuuskriteerin täyttäviä vertailukemikaaleja testataan rinnan testiajojen kanssa tarkoitukseen sopivassa pullossa.
Sopivia vertailukemikaaleja ovat (vastatislattu) aniliini, natriumasetaatti ja natriumbentsoaatti, jotka kaikki hajoavat näiden menetelmien mukaan käsiteltynä, myös ilman siirrosaineen lisäystä.
On ehdotettu sellaisen vertailukemikaalin etsimistä, jolla olisi hyvä biohajoavuus, mutta joka edellyttäisi siirrosaineen lisäystä. Tarkoitukseen on ehdotettu kaliumvetyftalaattia, josta on kuitenkin saatava lisätodisteita, ennen kuin se voidaan hyväksyä vertailuaineeksi.
Respirometrisissä testeissä typpeä sisältävät yhdisteet voivat häiritä hapenottoa nitrifikaation vuoksi (katso liitteitä II ja V).
I.4 TESTIMENETELMIEN PERIAATE
Testattavaa ainetta, joka on liuotettu tai suspendoitu epäorgaaniseen aineeseen, siirrostetaan ja inkuboidaan aerobisissa olosuhteissa pimeässä tai heikossa valaistuksessa. Testiliuoksen siirrostuksesta saadun DOC-määrän on oltava mahdollisimman pieni testattavasta aineesta saatuun DOC-määrään verrattuna. Siirrosaineen endogeeninen aktiviteetti otetaan huomioon ajamalla rinnan taustakokeita käyttäen pelkää siirrosainetta ilman testattavaa ainetta, vaikka solujen endogeeninen aktiviteetti testattavan aineen vaikutusten vuoksi ei ole täysin sama kontrolliliuoksessa ja testiliuoksessa. Menetelmien tarkistamiseksi ajetaan rinnakkaiskoe vertailuainetta käyttäen.
Hajoamisvaiheen jälkeen seuraa yleensä parametrien (esimerkiksi DOC:n, CO2-tuotannon ja hapenoton) määritys. Biohajoavuusvaiheen alku ja loppu voidaan todeta tekemällä mittauksia riittävän usein. Jos käytetään automaattisia respirometrejä, mittaaminen on jatkuvaa. DOC-arvo mitataan eräissä tapauksissa toisen parametrin mittauksen yhteydessä, mutta tavallisimmin DOC-mittaus tehdään kokeen alussa ja lopussa. Spesifisen kemiallisen analyysin avulla voidaan määrittää myös testattavan aineen primaarinen hajoaminen ja mahdollisesti muodostuvat välituotteet (pakollinen osa MITI-testiä).
Kokeen kesto on yleensä 28 päivää. Koe voidaan keskeyttää aiemmin, jos biohajoavuuskäyrässä on vähintään kolmen mittauksen pituinen tasanne. Koetta voidaan myös jatkaa 28. päivän jälkeen, jos biohajoavuuskäyrästä nähdään, että biohajoamisvaihe on alkanut, mutta ei vielä ole saavuttanut tasannetta 28. päivän kohdalla.
I.5 LAATUKRITEERIT
I.5.1 Toistettavuus
Biohajoavuuden ominaisuuksien ja siirrosaineksena käytettyjen yhdistettyjen bakteeriviljelmien ominaisuuksien vuoksi määritykset on tehtävä vähintään kaksi kertaa.
Käytäntö on osoittanut, että mitä suurempi on kokeen alussa testiliuokseen lisättyjen pieneliöiden pitoisuus, sitä vähäisempi on toistojen välinen vaihtelu. Rengastesteillä on voitu osoittaa, että eri laboratorioista saadut tulokset voivat vaihdella merkittävästi. Niiden aineiden osalta, joiden biohajoavuus on hyvä, on kuitenkin yleensä saatu varsin yhteneviä tuloksia.
I.5.2 Kokeen hyväksyminen
Koe hyväksytään, jos kemikaalin hajoamisarvojen ero biohajoavuuskäyrän tasanteen kohdalla (testin alussa tai 10-päiväisen jakson lopussa) toistojen ääriarvojen osalta on enintään 20 % ja jos vertailuaineen prosentuaalinen hajoaminen on saavuttanut hyvän biohajoavuuden tason 14 päivän kuluessa. Jos jompikumpi näistä ehdoista ei täyty, koe on toistettava. Koska menetelmien valinnanvara on vähäinen, pienet arvot eivät välttämättä tarkoita sitä, ettei aineen biohajoavuus luonnonympäristössä voisi olla hyvä. Pienet arvot osoittavat kuitenkin, että aineen biohajoavuuden määrittämiseksi tarvitaan lisätutkimuksia.
Jos myrkyllisyystestissä, jossa käytetään sekä testattavaa ainetta että vertailukemikaalia, saadaan tulokseksi hajoaminen, joka 14 päivän kuluessa on DOC-pohjaisena enintään 35 % tai THOD- tai ThCO2-pohjaisena enintään 25 %, voidaan olettaa, että testattavalla kemikaalilla on inhibitonsia ominaisuuksia (katso myös liitettä IV). Tällöin koesarja on toistettava, mahdollisesti pienempää kemikaalin pitoisuutta tai suurempaa siirrosaineen pitoisuutta käyttäen, ei kuitenkaan yli 30 mg:aa kuiva-ainetta litraa kohti.
I.6 YLEISIÄ MENETELMIÄ JA VALMISTELUJA
Taulukossa 2 on yhteenveto testiin sovellettavista yleisistä olosuhteista. Yksittäisten kokeiden laitteet ja olosuhteet kuvataan tarkemmin kokeiden omissa menetelmäkuvauksissa.
Taulukko 2
Testiolosuhteet
|
Koe |
DOC Die-Away |
CO2-muodostus |
Manometrinen respirometria |
Muunneltu OECD-seulonta |
Suljettu pullo |
MITI (I) |
|||||||||
|
Testattavan aineen pitoisuus |
|
|
|
|
|
|
|||||||||
|
mg/l |
|
|
100 |
|
2–10 |
100 |
|||||||||
|
mg DOC/l |
10–40 |
10–20 |
10–40 |
|
|
|
|||||||||
|
mg ThOD/1 |
|
|
50–100 |
|
5–10 |
|
|||||||||
|
Siirrosaineen pitoisuus (soluja/l, likiarvo) |
≤ 30 mg/l SS tai ≤ 100 ml jätevettä/l (107 – 108) |
0,5 ml sekundaarista jätevettä/l (105) |
≤ 5 ml jätevettä/l (104-106) |
30 mg/l SS (107-108) |
|||||||||||
|
Epäorgaanisen liuoksen koostumus (mg/l): |
|
|
|
|
|
|
|||||||||
|
P |
116 |
11,6 |
29 |
||||||||||||
|
N |
1,3 |
0,13 |
1,3 |
||||||||||||
|
Na |
86 |
8,6 |
17,2 |
||||||||||||
|
K |
122 |
12,2 |
36,5 |
||||||||||||
|
Mg |
2,2 |
2,2 |
6,6 |
||||||||||||
|
Ca |
9,9 |
9,9 |
29,7 |
||||||||||||
|
Fe |
0,05-0,1 |
0,05-0,1 |
0,15 |
||||||||||||
|
pH |
7,4±0,2 |
suositus: 7,0 |
|||||||||||||
|
Lämpötila |
22 ± 2 oC |
25 ± 1 oC |
|||||||||||||
|
|
|
|||||||||||||
I.6.1 Laimennusvesi
Laimennukseen käytetään ionivaihdettua tai tislattua vettä, jossa ei ole inhibitoorisia pitoisuuksia myrkyllisiä aineita (esimerkiksi Cu++-ioneja). Vedessä saa olla enintään 10 % testattavasta materiaalista saatua orgaanista hiiltä. Erittäin puhtaan veden käyttö on oleellista suurten tausta-arvojen välttämiseksi. Veteen voi tulla saasteita luontaisista epäpuhtauksista, ioninvaihtohartseista tai bakteereista ja levistä liuenneista aineista. Koesarjoittain on käytettävä samaa vesierää, jolle on ensin tehtävä DOC-analyysi. Suljetun pullon koetta varten tätä tarkistusta ei tarvita, mutta veden hapenkulutuksen on oltava pieni.
I.6.2 Epäorgaanisten ainesosien kantaliuos
Testiliuokset valmistetaan epäorgaanisia aineita sisältävistä kantaliuoksista. Jäljempänä luetellut kantaliuokset soveltuvat (sopivasti laimennettuina) seuraaviin menetelmiin: DOC Die-Away, muunneltu OECD-seulonta, CO2-muodostus, manometrinen respirometria, suljetun pullon koe.
Laimennuskertoimet ja MITI-kokeen epäorgaanisen liuoksen spesifinen valmistelutapa mainitaan kunkin kokeen otsikon alla.
Kantaliuokset:
Valmistetaan seuraavat kantaliuokset analyyttisen puhtaita reagensseja käyttäen:
|
a) |
Kaliumdivetyortofosfaattia, KH2PO4 |
8,50 g |
|
Dikaliummonovetyortofosfaattia, K2HPO4 |
21,75 g |
|
|
Dinatriummonovetyortofosfaattidihydraattia, Na2HPO4 x 2H2O |
33,40 g |
|
|
Ammoniumkloridia, NH4CI |
0,50 g |
|
|
Liuotetaan veteen ja laimennetaan litran tilavuuteen. Liuoksen pH-arvon on oltava 7,4. |
|
|
|
b) |
Kalsiumkloridia, CaCl2 |
27,50 g |
|
tai kalsiumklorididihydraattia, CaCl2 x 2H2O |
36,40 g |
|
|
Liuotetaan veteen ja laimennetaan litran tilavuuteen. |
|
|
|
c) |
Magnesiumsulfaattiheptahydraattia, MgSO4 x 7H2O |
22,50 g |
|
Liuotetaan veteen ja laimennetaan litran tilavuuteen. |
|
|
|
d) |
Rauta(III)kloridi-heksahydraattia, FeCl3 x 6H2O |
0,25 g |
|
Liuotetaan veteen ja laimennetaan litran tilavuuteen. |
|
Huomautus: Jotta liuosta ei tarvitsisi valmistaa välittömästi ennen käyttöä, siihen voidaan lisätä tippa väkevää suolahappoa tai 0,4 g EDTA:ta litraa kohti.
I.6.3 Kemikaaleista valmistetut kantaliuokset
Jos aineen liukoisuus on yli 1 g/1, 1–10 g testattavaa tai kontrollina käytettävää kemikaalia liuotetaan ionivaihdettuun veteen ja liuos laimennetaan yhden litran tilavuuteen. Muussa tapauksessa kantaliuos voidaan valmistaa epäorgaaniseen liuokseen tai kemikaalia voidaan lisätä suoraan epäorgaaniseen liuokseen. Huonosti liukenevien kemikaalien käsittely kuvataan liitteessä ITL MITI-kokeessa (menetelmä C.4-F) ei saa käyttää liuottimia tai emulgaattoreita.
I.6.4 Siirrosaine
Siirrosaine voi olla peräisin useasta lähteestä: aktivoidusta lietteestä, jätevedestä (ilman kloorikäsittelyä), pintavedestä, maa-aineksesta tai näiden seoksesta. Jos DOC Die-Away-, CO2-muodostus- ja manometrinen respirometria -kokeissa käytetään aktiivilietettä, se on otettava käsittelylaitoksesta tai laboratoriolaitoksesta, johon syötetään pääosin kotitalouksista tulevaa jätevettä. Muista lähteistä otetun siirrosaineen on todettu aiheuttavan varsin epäyhtenäisiä tuloksia. Muunneltua OECD-seulontamenetelmää ja suljetun pullon menetelmää varten tarvitaan matalapitoista siirrosainetta ilman lieteflokkeja. Tällöin suositellaan talousveden esikäsittelylaitoksesta tai laboratoriolaitokscsta saatua sekundaarista jätevettä. MITI-menetelmää varten tarvittava siirrosaine saadaan sekoittamalla eri lähteistä saatuja aineita (tarkempi kuvaus löytyy MITI-menetelmän otsikon alta).
I.6.4.1 Siirrosaine aktiivilietteestä
Aktiivilietenäyte otetaan sellaisenaan pääosin kotitalouksien jätevettä käsittelevän vedenpuhdistamon tai laboratoriolaitoksen ilmastussäiliöstä. Tarvittaessa karkeat hiukkaset poistetaan suodattamalla hienon seulan läpi, minkä jälkeen liete pidetään aerobisena.
Lietteen annetaan asettua tai se sentrifugoidaan (esimerkiksi 1 100 g 10 minuutin ajan) karkeiden hiukkasten poiston jälkeen. Pintaliete hylätään. Lietettä voidaan pestä epäorgaanisessa liuoksessa. Väkevöity liete suspendoidaan epäorgaaniseen liuokseen (lopullinen pitoisuus 3–5 g kuiva-ainetta/1) ja säilötään ilmastettuna.
Lietteen on tultava tehokkaasti toimivasta, perinteisen tekniikan mukaisesta laitoksesta. Jos liete on otettava suurkuormituslaitoksesta tai jos epäillään lietteen sisältävän inhibiittoreita, liete on pestävä. Liete sekoitetaan hyvin, minkä jälkeen uudelleen suspendoitunut liete saa asettua tai se sentrifugoidaan. Pintaliete hylätään ja pesty liete suspendoidaan uudelleen uuteen epäorgaaniseen liuokseen. Menettelyä toistetaan, kunnes voidaan katsoa, ettei lietteessä ole enää ylimääräistä substraattia tai inhibiittoria.
Kun liete on täysin uudelleensuspendoitunut (tai jos lietettä käytetään sellaisenaan), näyte kerätään välittömästi ennen käyttöä. Suspendoituneen kuiva-aineen pitoisuus määritetään näytteestä.
Yksi vaihtoehto on lisäksi aktiivilietteen homogenointi (3–5 g suspendoitunutta kuiva-ainetta/l). Lietettä käsitellään mekaanisessa sekoittimessa keskinopeudella 2 minuutin ajan. Sekoitetun lietteen annetaan asettua 30 minuutin ajan (tai tarvittaessa kauemmin), ja neste dekantoidaan. Näin saatua nestettä käytetään siirrosaineena (pitoisuus: 10 ml/l epäorgaanista liuosta).
I.6.4.2 Muita siirrosainelähteitä
Siirrosainetta voidaan valmistaa myös pääosin kotitalouksien jätevettä käsittelevän laitoksen tai laboratoriolaitoksen sekundaarisesta jätevedestä. Kerätään tuore näyte, joka pidetään aerobisena kuljetuksen ajan. Näytteen annetaan asettua tunnin ajan tai se suodatetaan karkean suodatinpaperin läpi. Näin saatua dekantoitua jätevettä tai suodosta säilytetään aerobisena, kunnes sitä tarvitaan. Tämäntyyppistä siirrosainetta voidaan käyttää enintään 100 ml liuoslitraa kohti.
Siirrosainetta voidaan ottaa myös pintavedestä. Esimerkiksi joen tai järven pintavedestä otetaan näyte, jota säilytetään aerobisena, kunnes sitä tarvitaan. Tarvittaessa siirrosaine voidaan väkevöidä suodattamalla tai sentrifugoimalla.
I.6.5 Siirrosaineen esikäsittely
Esikäsittelyn avulla siirrosaine voidaan sopeuttaa testiolosuhteisiin, mutta ei testattavaan kemikaaliin. Esikäsittelyssä aktiivilietettä ilmastetaan epäorgaanisessa liuoksessa tai sekundaarisessa jätevedessä 5–7 päivän ajan testilämpötilassa. Esikäsittelyn avulla on mahdollista saada tarkempia tuloksia, koska tausta-arvot jäävät pois. MITI-menetelmän avulla valmistettua siirrosainetta ei tarvitse esikäsitellä.
I.6.6 Abioottiset tarkistukset
Tarvittaessa testattavan aineen mahdollinen abioottinen hajoaminen on tarkistettava määrittämällä DOC:n poistuma, hapenotto tai hiilidioksidinmuodostus steriilistä vertailunäytteestä, jossa ei ole siirrosainetta. Sterilointi tehdään kalvosuodatuksella (0,2–0,45 μm) tai lisäämällä sopiva määrä soveltuvaa myrkyllistä ainetta. Jos käytetään kalvosuodatusta, näytteet on otettava aseptisesti steriiliyden varmistamiseksi. Ellei testattavan kemikaalin adsorptiomahdollisuutta ole voitu sulkea pois, testeihin, joissa mitataan biohajoamista DOC:n poistuman avulla (etenkin käytettäessä aktiivilietettä siirrosaineena), on sisällytettävä abioottinen (siirrostettu ja myrkytetty) vertailunäyte.
I.6.7 Pullojen määrä
Tyypillisessä kokeessa käytettävä pullomäärä mainitaan kunkin kokeen otsikon alla.
Seuraavia pullotyyppejä voidaan käyttää:
|
— |
Testisuspensio: pullossa testattavaa ainetta ja siirrosainetta |
|
— |
Siirrosaineen taustanäyte: pullossa pelkkää siirrosainetta |
|
— |
Menetelmän vertailunäyte: pullossa vertailu- ja siirrosainetta |
|
— |
Steriili abioottinen vertailunäyte: steriili pullo, jossa on testattavaa ainetta |
|
— |
Adsorptiotarkistus: pullossa testattavaa ainetta, siirrosainetta ja steriloivaa ainetta |
|
— |
Myrkyllisyyskoe: pullossa testattavaa ainetta, vertailuainetta ja siirrosainetta. |
Testisuspension ja siirrosaineen taustanäytteen määritykset on ehdottomasti tehtävä rinnan. On suositeltavaa tehdä myös muiden pullojen määritykset rinnan.
Tämä ei ehkä aina ole mahdollista. On tärkeää, että otetaan riittävä määrä näytteitä tai lukemia, jotta 10-päiväisen jakson aikana syntyvä prosentuaalinen poistuma voidaan määrittää.
I.7 TIEDOT JA ARVIOINTI
Dt-arvon laskennassa käytetään prosentuaalista hajoamista, parametrin kaksoismittausten keskiarvoja molempien testisäiliöiden osalta ja siirrosaineen taustanäytettä. Laskentaan käytettävät suureyhtälöt mainitaan jäljempänä kunkin kokeen yhteydessä. Hajoaminen esitetään graafisessa muodossa (10-päiväinen jakso merkitään). Lasketaan ja raportoidaan saavutettu prosentuaalinen poistuma 10-päiväisen jakson lopussa samoin kuin käyrän tasanteen arvo tai arvo kokeen päätyttyä (valitaan sopivampi arvo).
Respirometrisissä testeissä typpeä sisältävät yhdisteet voivat häiritä hapenottoa nitrifikaation vuoksi (katso liitteitä II jaV).
I.7.1 DOC-määrityksen avulla mitattu hajoaminen
Lasketaan jokaisen näytteenoton ajankohdan prosentuaalisen hajonnan arvo Dt kutakin testattavaa ainetta kohti DOC-kaksoismittausten keskiarvoja käyttäen (kaksoismittausten avulla voidaan vahvistaa kokeen hyväksyttävyys — katso kohtaa 1,5.2). Dt-arvo lasketaan seuraavan suureyhtälön avulla:

jossa
|
Dt |
= |
prosentuaalinen hajoaminen ajankohtana t, |
|
Co |
= |
siirrostetun, testiainetta sisältävän viljelmän keskimääräinen DOC-pitoisuus kokeen alussa (mg DOC/l), |
|
Ct |
= |
siirrostetun, testiainetta sisältävän viljelmän keskimääräinen DOC-pitoisuus hetkellä t (mg DOC/l), |
|
Cbo |
= |
siirrostetun, taustanäytteenä käytettävän epäorgaanisen liuoksen keskimääräinen DOC-pitoisuus kokeen alussa (mg DOC/l) |
|
Cbt |
= |
siirrostetun, taustanäytteenä käytettävän epäorgaanisen liuoksen keskimääräinen DOC-pitoisuus hetkellä t (mg DOC/l). |
Kaikki pitoisuudet mitataan kokeellisesti.
I.7.2 Spesifisen analyysin avulla mitattava hajoaminen
Jos käytettävissä on spesifisiä analyyttisiä tietoja primaarinen biohajoaminen voidaan laskea seuraavan suureyhtälön avulla:
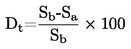
jossa:
|
Dt |
= |
prosentuaalinen hajonta hetkellä t (yleensä 28 päivää) |
|
Sa |
= |
testattavan aineen jäännösmäärä (mg) siirrostetussa liuoksessa kokeen lopussa |
|
Sb |
= |
testattavan aineen jäännösmäärä (mg) taustanäytteessä (vettä/liuosta, johon on lisätty vain testattavaa ainetta) |
I.7.3 Abioottinen hajoaminen
Jos käytetään abioottista, steriiliä vertailunäytettä, prosentuaalinen abioottinen hajoaminen voidaan laskea seuraavan suureyhtälön avulla:

jossa
|
Cs(o) |
= |
steriilin vertailunäytteen DOC-pitoisuus päivänä 0 (kokeen alussa) |
|
Cs(t) |
= |
steriilin vertailunäytteen DOC-pitoisuus päivänä t |
I.8 RAPORTOINTI
Testiraporttiin tulee mahdollisuuksien mukaan sisällyttää seuraavat tiedot:
|
— |
testattavat aineet ja vertailuaineet sekä niiden puhtausluokka, |
|
— |
testiolosuhteet, |
|
— |
siirrosaineen laatu ja ottopaikka (-paikat), pitoisuus ja mahdolliset esikäsittelyt, |
|
— |
jäteveden teollisuusjätteiden osuus ja laatu (jos tunnetaan), |
|
— |
kokeen kesto ja lämpötila, |
|
— |
mahdollisten huonosti liukenevien käsittely, |
|
— |
käytetty testimenetelmä; kaikista muutoksista on annettava tieteelliset perustelut ja selvitykset, |
|
— |
tietolomake, |
|
— |
mahdollisesti havaitut inhibiitioilmiöt, |
|
— |
mahdollisesti havaittu abioottinen hajoaminen, |
|
— |
spesifiset kemialliset analyysitiedot (jos käytettävissä), |
|
— |
välituotteiden analyyttiset tiedot (jos käytettävissä), |
|
— |
käyrät, jotka esittävät testattavan aineen ja vertailuaineiden prosentuaalisen hajoamisen ajan funktiona; lepovaihe, hajoamisvaihe, 10-päiväinen jakso ja kaltevuus on merkittävä selvästi (liite I). Jos testi täyttää testikriteent, käyrässä voidaan käyttää testattavan aineen prosentuaalisen hajoamisen keskiarvoa, |
|
— |
prosentuaalinen poistuma 10-päiväisen jakson jälkeen ja käyrän tasanteella tai kokeen lopussa. |
OSA II. DOC DIE-AWAY-KOE (menetelmä C.4-A)
II. 1 MENETELMÄN PERIAATE
Mitattu tilavuus siirrostettua epäorgaanista liuosta, jossa on tunnettu pitoisuus testattavaa ainetta (10–40 mg DOC/l) ainoana nimellisenä hiililähteenä, ilmastetaan heikossa valossa tai pimeässä pitäen yllä lämpötilaa 22 ± 2 oC.
Hajoamista seurataan usein tehtävien DOC-analyysien avulla 28 päivän jakson aikana. Hajoamisaste lasketaan ilmaisemalla poistuneen DOC:n (siirrostetun taustanäytteen arvolla korjattuna) prosenttiosuus alkupitoisuudesta. Primaarisen biohajoamisen aste voidaan laskea myös inkubaation alussa ja lopussa tehdyn kemiallisen analyysin avulla.
II.2 MENETELMÄKUVAUS
II.2.1 Laite
|
a) |
erlenmeyerpulloja (tilavuudeltaan esimerkiksi 250 ml–2 1) DOC-analyysin edellyttämän tilavuuden mukaan, |
|
b) |
ravistuskone pulloja varten (koneessa on oltava automaattinen lämpötilan säätö tai sitä on käytettävä lämpötilasäädetyssä huoneessa, ja sen on pystyttävä ylläpitämään aerobisia olosuhteita kaikissa pulloissa), |
|
c) |
sopivin kalvoin varustettu suodatuslaite, |
|
d) |
DOC-analysaattori, |
|
e) |
liuenneen hapen määrityslaite, |
|
f) |
sentrifugi. |
II.2.2 Epäorgaanisen liuoksen valmistus
Kantaliuoksen valmistus kuvataan kohdassa I.6.2.
10 ml a-liuosta sekoitetaan 800 ml:aan laimennusvettä, lisätään b-, c- ja d-liuosta 1 ml kutakin ja laimennetaan liuos yhden litran tilavuuteen.
II.2.3 Siirrosaineen valmistelu ja esikäsittely
Siirrosaineen lähteinä voidaan käyttää aktiivilietettä, jätevettä, pintavettä, maata tai näiden sekoitusta.
Katso kohtia I.6.4, I.6.4.1, I.6.4.2 ja I.6.5.
II.2.4 Pullojen valmistelu
Pannaan epäorgaanista liuosta 2 litran erlenmeyerpulloihin esimerkiksi 800 ml:n annoksina. Riittävä määrä testattavan aineen ja vertailuaineen kantaliuosta lisätään eri pulloihin siten, että saadaan kemikaalipitoisuus, joka vastaa pitoisuutta 10–40 ml DOC/l. Tarkistetaan pH ja säädetään se tarvittaessa arvoon 7,4. Pullot siirrostetaan aktiivilietteellä tai muulla siirrosaineella (katso kohtaa I.6.4) siten, että lopullinen pitoisuus on enintään 30 mg suspendoitunutta kuiva-ainetta/l. Valmistetaan myös siirrosaineen vertailunäytteet epäorgaaniseen liuokseen, mutta ilman testattavaa kemikaalia ja vertailukemikaalia.
Tarvittaessa testattavan kemikaalin mahdolliset inhibitooriset ominaisuudet on tarkistettava siirrostamalla yhteen pulloista epäorgaanista liuosta, jossa on vertailukelpoiset pitoisuudet testattavaa kemikaalia ja vertailukemikaalia.
Tarvittaessa valmistetaan myös erillinen steriili pullo, jonka avulla tarkistetaan testattavan kemikaalin abioottinen hajoaminen käyttäen kemikaalin liuosta, johon ei ole lisätty siirrosainetta (katso kohtaa I.6.6).
Jos epäillään, että testattava kemikaali adsorboituu merkittävissä määrin esimerkiksi lasiin tai lietteeseen, voidaan tehdä alustava kemikaalin adsorption todennäköisen laajuuden määritys, jonka perusteella voidaan arvioida testimenetelmän soveltuvuutta tälle kemikaalille (katso taulukkoa 1). Alustavaa määritystä varten pulloon lisätään testattavaa ainetta, siirrosainetta ja sterilointiainetta.
Kaikkien pullojen sisältö laimennetaan epäorgaanisella liuoksella yhden litran tilavuuteen. Sekoituksen jälkeen jokaisesta pullosta otetaan näyte alkuperäisen DOC-pitoisuuden määritystä varten (katso liitettä II.4). Pullojen suut peitetään esimerkiksi alumiinifoliolla siten, että ilma pääsee vapaasti vaihtumaan pullon ja ympäristön välillä. Tämän jälkeen pullot pannaan ravistuskoneeseen kokeen aloittamista varten.
II.2.5 Tyypillisen kokeen pullomäärä
Pullot 1 ja 2: Testisuspensio
Pullot 3 ja 4: Siirrosaineen taustanäyte
Pullo 5: Menetelmän vertailunäyte
Seuraavia pulloja on käytettävä tarpeen mukaan, ja niiden käyttö on muutenkin suositeltavaa:
Pullo 6: Steriili abioottinen vertailunäyte
Pullo 7: Adsorption vertailunäyte
Pullo 8: Myrkyllisyystarkistus
Katso myös kohtaa I.6.7.
II.2.6 Testin suorittaminen
Testin aikana kunkin pullon DOC-pitoisuus määritetään kahdesti tietyin välein. Määritykset on tehtävä riittävän usein, jotta voidaan määrittää 10-päiväisen jakson alku ja prosentuaalinen poistuma tämän jakson lopussa. Määrityksiä varten otetaan pienin mahdollinen määrä testisuspensiota.
Ennen näytteenottoa pulloista haihtunut vesimäärä on kompensoitava lisäämällä pulloihin tarpeellinen määrä laimennusvettä (I.6.1). Pullojen sisältö sekoitetaan huolellisesti varmistaen, että pullojen seinämiin kiinnittynyt aines liukenee tai suspendoituu ennen näytteenottoa. Näytteet kalvosuodatetaan tai sentnfugoidaan heti näytteenoton jälkeen (katso liitettä II.4). Ellei näytteitä analysoida samana päivänä, niitä voidaan säilyttää 2–4 oC:ssa enintään 48 tuntia tai alle –18 oC:ssa, jos ne joutuvat odottamaan tätä pitempään.
II.3 TIEDOT JA RAPORTOINTI
II.3.1 Tulosten käsittely
Annetun hetken t prosentuaalinen hajoaminen lasketaan kohdan I.7.1 mukaan (DOC-määritys) ja vaihtoehtoisesti kohdan I.7.2 mukaan (spesifinen analyysi).
Tulokset kirjataan jäljempänä kuvattavaan tietolomakkeeseen.
II.3.2 Tulosten hyväksyttävyys
Katso kohtaa I.5.2.
II.3.3 Raportointi
Katso kohtaa I.8.
II.4 TIETOLOMAKE
Ohessa on esimerkki tietolomakkeesta.
DOC DIE-AWAY -KOE
|
1 |
LABORATORIO |
|
2 |
KOKEEN ALKUPÄIVÄMÄÄRÄ |
3 TESTATTAVA AINE
Nimi:
Kantaliuoksen pitoisuus: mg/l kemikaalina
Liuoksen alkupitoisuus, to: mg/l kemikaalina
4 SIIRROSAINE
Lähde:
Käsittelyt:
Esikäsittely (jos esikäsittely on tehty):
Reaktioseoksen pitoisuus suspendoitunutta kuiva-ainetta: mg/l
5 HIILIMÄÄRITYKSET
Hiilianalysaattori:
|
|
Pullon numero |
|
DOC-arvo n päivän jälkeen (mg/l) |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Testattavaa kemikaalia ja siirrosainetta |
1 |
a1 |
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a:n keskiarvo Ca(t) |
|
|
|
|
|
||
|
2 |
b1 |
|
|
|
|
|
|
|
b2 |
|
|
|
|
|
||
|
b:n keskiarvo Cb(t) |
|
|
|
|
|
||
|
Siirrosaineen taustanäyte ilman testattavaa kemikaalia |
3 |
c1 |
|
|
|
|
|
|
c2 |
|
|
|
|
|
||
|
c:n keskiarvo Cc(t) |
|
|
|
|
|
||
|
4 |
d1 |
|
|
|
|
|
|
|
d2 |
|
|
|
|
|
||
|
d:n keskiarvo Cd(t) |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
6. LÄHDETIETOJEN ARVIOINTI
|
Pullon numero |
|
Prosentuaalinen hajoaminen n päivän jälkeen |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
||
|
1 |
|
0 |
|
|
|
|
|
2 |
|
0 |
|
|
|
|
|
Keskiarvo (3) |
|
0 |
|
|
|
|
Huomautus: Vertailukemikaalien ja myrkyllisyysvertailunäytteiden osalta tiedot voidaan esittää samalla tavoin kuin tässä.
7. ABIOOTTINEN TARKISTUS (valinnainen)
|
|
Aika (päivää) |
|
|
0 |
t |
|
|
Steriilin vertailunäytteen DOC-pitoisuus (mg/l) |
Cs(o) |
Cs(t) |

8. SPESIFINEN KEMIALLINEN ANALYYSI (valinnainen)
|
|
Testattavan kemikaalin jäännösmäärä kokeen lopussa (mg/l) |
Prosentuaalinen primaarinen hajoaminen |
|
Steriili vertailunäyte |
sb |
|
|
Siirrostettu testiliuos |
Sa |
|
OSA III MUUNNELTU OECD-SEULONTAKOE (menetelmä C.4-B)
III.1 MENETELMÄN PERIAATE
Mitattuun tilavuuteen epäorgaanista liuosta, jossa on tunnettu pitoisuus testattavaa ainetta (10–40 mg DOC/l) ainoana nimellisenä hiililähteenä, siirrostetaan 0,5 ml jätevettä liuoslitraa kohti. Seos ilmastetaan heikossa valossa tai pimeässä pitäen yllä lämpötilaa 22 ± 2 oC.
Hajoamista seurataan usein tehtävien DOC-analyysien avulla 28 päivän jakson aikana. Hajoamisaste lasketaan ilmaisemalla poistuneen DOC:n (siirrostetun taustanäytteen arvolla korjattuna) prosenttiosuus alkupitoisuudesta. Primaarisen biohajoamisen aste voidaan laskea myös inkubaation alussa ja lopussa tehtävän kemiallisen analyysin avulla.
III.2 MENETELMÄKUVAUS
III.2.1 Laite
|
a) |
erlenmeyerpulloja (tilavuudeltaan esimerkiksi 250 ml–21) DOC-analyysin edellyttämän tilavuuden mukaan, |
|
b) |
ravistuskone pulloja varten (koneessa on oltava automaattinen lämpötilan säätö tai sitä on käytettävä lämpötilasäädetyssä huoneessa, ja sen on pystyttävä ylläpitämään aerobisia olosuhteita kaikissa pulloissa), |
|
c) |
sopivin kalvoin varustettu suodatuslaite, |
|
d) |
DOC-analysaattori, |
|
e) |
liuenneen hapen määrityslaite, |
|
f) |
sentrifugi. |
III.2.2 Epäorgaanisen liuoksen valmistus
Kantaliuoksen valmistus kuvataan kohdassa I.6.2.
10 ml a-liuosta sekoitetaan 80 ml:aan laimennusvettä, lisätään b-, c- ja d-liuosta 1 ml kutakin ja laimennetaan liuos yhden litran tilavuuteen.
Tässä menetelmässä siirrostukseen käytetään vain 0,5 ml jätevettä/l, joten liuosta on eräissä tapauksissa rikastettava hivenaineilla ja kasvutekijöillä. Tämä tehdään lisäämällä liuokseen jokaista lopullista liuoslitraa kohti 1 ml kutakin seuraavaa liuosta:
Hivenaineliuos:
|
Mangaanisulfaattitetrahydraatti, MnSO4 · 4H2O |
39,9 mg |
|
Boorihappoa, H3BO3 |
57,2 mg |
|
Sinkkisulfaattiheptahydraatti, ZnSO4 ·7H2O |
42,8 mg |
|
Ammoniumheptamolybdaatti (NH4)6Mo7O24 |
34,7 mg |
|
Rautakelaatti (FeCl3-etyleenidiamiinitetraetikkahappo) |
100,0 mg |
|
Liuotetaan laimennusveteen ja laimennetaan 1 000 ml:n tilavuuteen. |
|
|
Vitamiiniliuos: |
|
|
Hiivauute |
15,0 mg |
Hiivauute liuotetaan 100 ml:aan vettä. Liuos steriloidaan kalvolla, jonka huokoskoko on 0,2 mikronia, tai käytetään sellaisenaan.
III.2.3 Siirrosaineen valmistelu ja esikäsittely
Siirrosaineen lähteenä käytetään pääosin kotitalousjätevesiä puhdistavasta käsittelylaitoksesta tai laboratoriolaitoksesta saatavaa sekundaarista jätevettä. (Katso kohtia 1.6.4.2 ja 1.6.5.)
Käytetään 0,5 ml siirrosainetta epäorgaanisen liuoksen litraa kohti.
III.2.4 Pullojen valmistelu
Epäorgaanista liuosta pannaan 2 litran erlenmeyerpulloihin esimerkiksi 800 ml:n annoksina. Riittävä määrä testattavan aineen ja vertailuaineen kantaliuosta lisätään eri pulloihin siten, että saadaan kemikaalipitoisuus, joka vastaa pitoisuutta 10–40 ml DOC/l. Tarkistetaan pH ja säädetään se tarvittaessa arvoon 7,4. Pullot siirrostetaan 0,5 ml:lla jätevettä pulloissa olevaa liuoslitraa kohti (katso kohtaa I.6.4.2). Valmistetaan myös siirrosaineen vertailunäytteet epäorgaaniseen liuokseen, mutta ilman testattavaa kemikaalia ja vertailukemikaalia.
Tarvittaessa testattavan kemikaalin mahdollisten inhibitooriset ominaisuudet on tarkistettava siirrostamalla yhteen pulloista epäorgaanista liuosta, jossa on vertailukelpoiset pitoisuudet testattavaa kemikaalia ja vertailukemikaalia.
Tarvittaessa valmistetaan myös erillinen steriili pullo, jonka avulla tarkistetaan testattavan kemikaalin abioottinen hajoaminen. Tällöin käytetään kemikaalin liuosta, johon ei ole lisätty siirrosainetta (katso kohtaa I.6.6).
Jos epäillään, että testattava kemikaali adsorboituu merkittävissä määrin esimerkiksi lasiin tai lietteeseen, voidaan tehdä alustava kemikaalin adsorption todennäköisen laajuuden määritys, jonka perusteella voidaan arvioida testimenetelmän soveltuvuutta tälle kemikaalille (katso taulukkoa 1). Alustavaa määritystä varten pulloon lisätään testattavaa ainetta, siirrosainetta ja sterilointiainetta.
Kaikkien pullojen sisältö laimennetaan epäorgaanisella liuoksella yhden litran tilavuuteen. Sekoituksen jälkeen jokaisesta pullosta otetaan näyte alkuperäisen DOC-pitoisuuden määritystä varten (katso liitettä II.4). Pullojen suut peitetään esimerkiksi alumiinifoliolla siten, että ilma pääsee vapaasti vaihtumaan pullon ja ympäristön välillä. Tämän jälkeen pullot pannaan ravistuskoneeseen kokeen aloittamista varten.
III.2.5 Tyypillisen kokeen pullomäärä
Pullot 1 ja 2: Testisuspensio
Pullot 3 ja 4: Siirrosaineen taustanäyte
Pullo 5: Menetelmän vertailunäyte
Seuraavia pulloja on käytettävä tarpeen mukaan, ja niiden käyttö on muutenkin suositeltavaa:
Pullo 6: Steriili abioottinen vertailunäyte
Pullo 7: Adsorption vertailunäyte
Pullo 8: Myrkyllisyystarkistus
Katso myös kohtaa I.6.7.
III.2.6 Testin suorittaminen
Testin aikana kunkin pullon DOC-pitoisuus määritetään kahdesti tietyin välein. Määritykset on tehtävä riittävän usein, jotta voidaan määrittää 10-päiväisen jakson alku ja prosentuaalinen poistuma tämän jakson lopussa. Määrityksiä varten otetaan pienin mahdollinen määrä testisuspensiota.
Ennen näytteenottoa pulloista haihtunut vesimäärä on kompensoitava lisäämällä pulloihin tarpeellinen määrä laimennusvettä (I.6.1). Pullojen sisältö sekoitetaan huolellisesti varmistaen, että pullojen seinämiin kiinnittynyt aines liukenee tai suspendoituu ennen näytteenottoa. Näytteet kalvosuodatetaan tai sentrifugoidaan heti näytteenoton jälkeen (katso liitettä II.4). Ellei näytteitä analysoida samana päivänä, niitä voidaan säilyttää 2–4 oC:ssa enintään 48 tuntia tai alle –18 oC:ssa, jos ne joutuvat odottamaan tätä pitempään.
III.3 TIEDOT JA RAPORTOINTI
III.3.1 Tulosten käsittely
Annetun ajankohdan t prosentuaalinen hajoaminen lasketaan kohdan I.7.1 mukaan (DOC-määritys) ja vaihtoehtoisesti kohdan I.7.2 mukaan (spesifinen analyysi).
Tulokset kirjataan jäljempänä kuvattavaan tietolomakkeeseen.
III.3.2 Tulosten hyväksyttävyys
Katso kohtaa I.5.2.
III.3.3 Raportointi
Katso kohtaa I.8.
III.4 TIETOLOMAKE
Ohessa on esimerkki tietolomakkeesta.
MUUNNELTU OECD-SEULONTAKOE
|
1 |
LABORATORIO |
|
2 |
KOKEEN ALKUPÄIVÄMÄÄRÄ |
3 TESTATTAVA AINE
Nimi:
Kantaliuoksen pitoisuus: mg/l kemikaalina
Liuoksen alkupitoisuus, t0: mg/l kemikaalina
4 SIIRROSAINE
Lähde:
Käsittelyt:
Esikäsittely (jos esikäsittely on tehty):
Reaktioseoksen pitoisuus suspendoitunutta kuiva-ainetta: mg/l
5 HIILIMÄÄRITYKSET
Hiilianalysaattori:
|
|
Pullon numero |
|
DOC-arvo n päivän jälkeen mg/l) |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Testattavaa kemikaalia ja siirrosainetta |
1 |
a1 |
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a:n keskiarvo Ca(t) |
|
|
|
|
|
||
|
2 |
b1 |
|
|
|
|
|
|
|
b2 |
|
|
|
|
|
||
|
b:n keskiarvo Cb(t) |
|
|
|
|
|
||
|
Siirrosaineen taustanäyte ilman testattavaa kemikaalia |
3 |
c1 |
|
|
|
|
|
|
c2 |
|
|
|
|
|
||
|
c:n keskiarvo Cc(t) |
|
|
|
|
|
||
|
4 |
d1 |
|
|
|
|
|
|
|
d2 |
|
|
|
|
|
||
|
d:n keskiarvo Cd(t) |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
6. LÄHDETIETOJEN ARVIOINTI
|
Pullon numero |
|
Prosentuaalinen hajoaminen n päivän jälkeen |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
||
|
1 |
|
0 |
|
|
|
|
|
2 |
|
0 |
|
|
|
|
|
Keskiarvo (4) |
|
0 |
|
|
|
|
Huomautus: Vertailukemikaalien ja myrkyllisyysvertailunäytteiden osalta tiedot voidaan esittää samalla tavoin kuin tässä.
7. ABIOOTTINEN TARKISTUS (valinnainen)
|
|
Aika (päivää) |
|
|
0 |
t |
|
|
Steriilin vertailunäytteen DOC-pitoisuus (mg/l) |
Cs(o) |
Cs(t) |

8. SPESIFINEN KEMIALLINEN ANALYYSI (valinnainen)
|
|
Testattavan kemikaalin jäännösmäärä kokeen lopussa (mg/l) |
Prosentuaalinen primaarinen hajoaminen |
|
Steriili vertailunäyte |
sb |
|
|
Siirrostettu testiliuos |
sa |
|
OSA IV. HIILIDIOKSIDIN MUODOSTUMISKOE (menetelmä C.4-C)
IV.1 MENETELMÄN PERIAATE
Mitattu tilavuus siirrostettua epäorgaanista liuosta, jossa on tunnettu pitoisuus testattavaa ainetta (10–20 mg DOC tai TOC/1) ainoana nimellisenä hiililähteenä, ilmastetaan johtamalla liuoksen läpi hiilidioksiditonta ilmaa, jonka virtausta säädetään. Ilmastus tehdään heikossa valossa tai pimeässä. Hajoamista seurataan 28 päivän ajan määrittämällä muodostuvan hiilidioksidin määrä. Tätä varten hiilidioksidi kerätään barium- tai natriumhydroksidiin, ja hiilidioksidimäärä mitataan titraamalla jäännöshydroksidi tai mittaamalla epäorgaanisen hiilen määrä. Testattavasta kemikaalista muodostetun hiilidioksidin määrä (korjattuna siirrostetun taustanäytteen arvolla) ilmaistaan ThCO2-prosenttiarvona. Biohajoamisaste voidaan laskea myös inkubaation alussa ja lopussa tehtävän DOC-analyysin avulla.
IV.2 MENETELMÄKUVAUS
IV.2.1 Laite
|
a) |
pulloja (tilavuudeltaan 2–5 litraa), jotka on varustettu lähes pullon pohjaan ulottuvalla ilmastusletkulla ja ulostulolla, |
|
b) |
magneettisia sekoittimia (kun tutkitaan huonosti liukenevia kemikaaleja), |
|
c) |
kaasuabsorptiopulloja, |
|
d) |
ilmanvirtauksen säätö- ja mittauslaite, |
|
e) |
kaasunpesulaite, jonka avulla saadaan hiilidioksiditonta ilmaa (vaihtoehtoisesti voidaan käyttää painepulloista otetun hiilidioksidittoman hapen ja hiilidioksidittoman typen seosta suhteessa 20 % happea ja 80 % typpeä), |
|
f) |
hiilidioksidin määrityslaite, jonka toiminta perustuu titraukseen tai epäorgaanisen hiilen analysointiin, |
|
g) |
kalvosuodatin (valinnainen), |
|
h) |
DOC-analysaattori (valinnainen). |
IV.2.2 Epäorgaanisen liuoksen valmistus
Kantaliuoksen valmistus kuvataan kohdassa I.6.2.
10 ml a-liuosta sekoitetaan 800 ml:aan laimennusvettä, lisätään b-, c- ja d-liuosta 1 ml kutakin ja laimennetaan liuos yhden litran tilavuuteen.
IV.2.3 Siirrosaineen valmistelu ja esikäsittely
Siirrosaineen lähteinä voidaan käyttää aktiivilietettä, jätevettä, pintavettä, maata tai näiden sekoitusta.
Katso kohtia I.6.4, 1.6.4.1, I.6.4.2 ja I.6.5.
IV.2.4 Pullojen valmistelu
Seuraavassa kappaleessa kuvattavat tilavuudet ja painot koskevat 5 l:n pulloja, joissa on 3 1 suspensiota. Myös tätä pienempiä tilavuuksia voidaan käyttää arvoja korjaamalla, edellyttäen, että muodostunut hiilidioksidi voidaan mitata riittävän tarkasti.
2 400 ml epäorgaanista liuosta johdetaan 5 l:n pulloihin. Pulloihin lisätään sopiva määrä valmistettua aktiivilietettä (katso kohtia I.6.4 ja I.6.5), niin että lopullisessa 3 l:n liuoksessa on enintään 30 mg suspendoitunutta kuiva-ainetta litraa kohti. Vaihtoehtoisesti voidaan ensin laimentaa valmistettu liete suspensioksi (500–1 000 mg/l epäorgaanista liuosta) ja lisätä tämän jälkeen alikvootti 5 l;n pulloon siten, että lopullinen pitoisuus on 30 mg/l. Vaihtoehtoinen menetelmä on tarkempi. Myös muita siirroslähteitä voidaan käyttää (katso kohtaa I.6.4.2).
Siirrostetuista seoksista poistetaan hiilidioksidi ilmastamalla niitä yön yli hiilidioksidittomalla ilmalla.
Testattavaa ainetta ja vertailuainetta lisätään pulloihin erikseen kantaliuoksen tunnettuna tilavuutena (jokaista pitoisuutta kohti tarvitaan kaksi pulloa), niin että pullojen sisällön DOC- tai TOC-pitoisuus on 10–20 mg/l. Muutama pullo tarvitaan siirrosainekontrolleiksi, joten niihin ei lisätä kemikaaleja. Huonosti liukenevat aineet lisätään suoraan pulloihin tunnettuna painona tai tilavuutena (katso liitettä III).
Yhden pullon avulla voidaan tarvittaessa selvittää testattavan kemikaalin inhibitoorisia ominaisuuksia. Tähän pulloon lisätään testattavaa kemikaalia ja vertailukemikaalia, niin että niiden pitoisuudet ovat samat kuin muissa pulloissa.
Tarvittaessa selvitetään steriilin pullon ja siirrostamattoman kemikaaliliuoksen avulla, onko testattava kemikaali abioottisesti hajoavaa (katso kohtaa I.6.6). Sterilointi tehdään lisäämällä liuokseen myrkyllistä ainetta sopivana pitoisuutena.
Kaikkien pullojen suspensioiden tilavuus säädetään 3 l:ksi lisäämällä pulloihin epäorgaanista liuosta, joka on ilmastettu hiilidioksidittomalla ilmalla. Vaihtoehtoisesti pulloista voidaan ottaa näytteet DOC-analyysiä (katso liitettä II.4) tai spesifistä analyysiä varten. Kunkin pullon ilmaventtiiliin liitetään absorptiopullo.
Jos käytetään bariumhydroksidia, jokaiseen 5 l:n testipulloon liitetään sarjaan kolme absorptiopulloa, joissa kaikissa on 100 ml 0,0125-molaarista bariumhydroksidia. Liuoksessa ei saa olla saostunutta sulfaattia tai karbonaattia, ja liuoksen väkevyys on määritettävä välittömästi ennen liuoksen käyttöä. Jos käytetään natriumhydroksidia, jokaiseen testipulloon liitetään kaksi loukkua. Toisen loukun avulla tarkistetaan, että kaikki hiilidioksidi on imeytynyt ensimmäiseen loukkuun. Imeytyspulloina käytetään pullotyyppiä, jossa on seerumipullon suljin, Jokaiseen pulloon lisätään 200 ml 0,05-molaarista natriumhydroksidia. Tämä määrä riittää absorboimaan kaiken hiilidioksidin, joka syntyy testattavan kemikaalin hajoamistuotteena. Natriumhydroksidiliuos sisältää aina — myös vastavalmistettuna — pienen määrän karbonaattia, joka kompensoidaan vähentämällä taustanäytteen karbonaatin määrää.
IV.2.5 Tyypillisen kokeen pullomäärä
Pullot 1 ja 2: Testisuspensio
Pullot 3 ja 4: Siirrosaineen taustanäyte
Pullo 5: Menetelmän vertailunäyte
Seuraavia pulloja on käytettävä tarpeen mukaan, ja niiden käyttö on muutenkin suositeltavaa:
Pullo 6: Steriili abioottinen vertailunäyte
Pullo 7: Myrkyllisyystarkistus
Katso myös kohtaa I.6.7.
IV.2.6 Testin suorittaminen
Testi aloitetaan johtamalla suspensioiden läpi hiilidioksidittomia ilmakuplia virtausnopeudella 30–100 ml/ minuutti. Hiilidioksidiabsorbentista otetaan säännöllisin välein näytteitä suspensioiden hiilidioksidipitoisuuden analyysiä varten. Ensimmäisen kymmenen päivän jakson näytteenottoväliksi suositellaan kahta tai kolmea päivää. Tämän jälkeen näytteitä otetaan joka viides päivä 28. päivään asti 10-päiväisen jakson löytämiseksi.
Päivänä 28 otetaan näytteet mahdollista DOC-analyysiä tai spesifistä analyysiä varten, mitataan suspensioiden pH ja lisätään jokaiseen pulloon 1 ml väkevää suolahappoa. Tämän jälkeen hiilidioksidi poistetaan testisuspensioista yön yli jatkuvalla pullojen ilmastuksella, Viimeinen hiilidioksidianalyysi tehdään 29. päivänä.
Hiilidioksidianalyysipäivinä pulloa lähinnä oleva bariumhydroksidi-imeytin irrotetaan pullosta ja hydroksidiliuos titrataan 0,05-molaarisella suolahapolla. Indikaattorina käytetään fenoliftaleiinia. Sarjan jäljellä olevat imeyttimet siirretään lähemmäksi testipulloa, ja sarjan loppuun lisätään uusi, 100 ml tuoretta 0,0125-molaarista bariumhydroksidia sisältävä imeytin. Titrauksia tehdään tarvittaessa (jos esimerkiksi ensimmäiseen loukkuun kertyy paljon sakkaa, titraus on tehtävä ennen kuin sakkaa alkaa kertyä toiseen loukkuun) — kuitenkin vähintään viikoittain. Jos absorbenttina käytetään natriumhydroksidia, ruiskuun imetään pieni määrä natriumhydroksidiliuosta (tarvittava määrä vaihtelee käytettävän hiilianalysaattorin mukaan) lähinnä testipulloa olevasta imeyttimestä. Jos muodostunut hiilidioksidi halutaan analysoida heti, näyte ruiskutetaan hiilianalysaattorin epäorgaaniseen hiileen.
Toisen loukun sisältö analysoidaan vain testin lopussa, jotta hiilidioksidin mahdollisen läpipääsyn aiheuttama virhe voitaisiin korjata.
IV.3 TIEDOT JA RAPORTOINTI
IV.3.1 Tulosten käsittely
Imeyttimeen jäänyt hiilidioksidimäärä lasketaan titrauksen jälkeen seuraavan suureyhtälön avulla:
mgCO2 = (100 x CB-0,5 x V x CA) x 44
jossa
|
V |
= |
imeyttimen 100 ml:n sisällön titraukseen käytetty suolahappo (ml) |
|
CB |
= |
bariumhydroksidiliuoksen väkevyys (M) |
|
CA |
= |
suolahappohuoksen väkevyys (M). |
Jos CB = 0,0125 M, CA = 0,05 M ja 100 ml:n puhtaan bariumhydroksidiliuoksen titraustulokseksi saadaan 50 ml, hiilidioksidin paino voidaan laskea seuraavasti:
Tässä tapauksessa titraukseen käytetty suolahappotilavuus voidaan muuntaa hiilidioksidin painoksi käyttämällä kerrointa 1,1.
Titrausarvojen avulla lasketaan pelkän siirrosaineen ja siirrosaineen ja testattavan kemikaalin seoksen muodostaman hiilidioksidin painot. Näiden painojen ero vastaa pelkän testattavan kemikaalin muodostaman hiilidioksidin painoa.
Jos esimerkiksi pelkän siirrosaineen titrauksesta saadaan tulokseksi 48 ml ja siirrosaineen sekä testattavan kemikaalin seoksen titrauksesta 45 ml, määrät ovat seuraavat:
Siirrosaineen CO2 = 1,1 x (50 - 48) = 2,2 mg.
Siirrosaineen ja testattavan kemikaalin seoksen CO2 = 1,1 x (50 - 45) = 5,5 mg.
Täten testattavan kemikaalin muodostama CO2 = 3,3 mg.
Prosentuaalinen biohajoavuus lasketaan seuraavan suureyhtälön avulla:

tai
![]()
jossa 3,67 on hiili-hiilidioksidimuunnoskerroin.
Minkä tahansa aikavälin jälkeinen prosentuaalinen hajoaminen saadaan kumuloimalla kunkin päivän laskettujen ThCO2-arvojen prosenttiluvut mittaushetkeen asti.
Natriumhydroksidiabsorbenteille muodostetun hiilidioksidin määrä voidaan laskea milligrammoina epäorgaanista hiiltä (IC) kertomalla absorbentin IC-pitoisuus absorbentin tilavuudella.
Prosentuaalinen hajoaminen voidaan laskea seuraavan suureyhtälön avulla:

DOC-poistumat voidaan haluttaessa laskea kohdan I.7 mukaan. Tulokset kirjataan tietolomakkeelle yhdessä muiden tulosten kanssa.
IV.3.2 Tulosten hyväksyttävyys
Testin alussa epäorgaanisessa liuoksessa olevan kemikaalisuspension IC-pitoisuus saa olla enintään 5 % TC-arvosta, ja testin lopussa siirrostuksen taustahuoksen hiilidioksidin kokonaismuodoslus saa yleensä olla enintään 40 mg/l. Jos tulokseksi saadaan 70 mg CO2/1 ylittäviä arvoja, tietoja ja koetekniikoita on tarkasteltava erityisen kriittisesti.
Katso myös kohtaa I.5.2.
IV.3.3 Raportointi
Katso kohtaa I.8.
IV.4 TIETOLOMAKE
Ohessa on esimerkki tietolomakkeesta.
HIILIDIOKSIDIN MUODOSTUMISKOE
|
1. |
LABORATORIO |
|
2. |
KOKEEN ALKUPÄIVÄMÄÄRÄ |
3. TESTATTAVA AINE
Nimi:
Kantaliuoksen pitoisuus: mg/l kemikaalina
Liuoksen alkupitoisuus, t0: mg/l kemikaalina
Pulloon lisätty kokonaismäärä hiiltä (C): mg C
ThCO2: mg CO2
4. SIIRROSAINE
Lähde:
Käsittelyt:
Esikäsittely (jos esikäsittely on tehty):
Reaktioseoksen pitoisuus suspendoitunutta kuiva-ainetta: mg/l
|
5. |
HIILIDIOKSIDIN MUODOSTUS JA HAJOAVUUS Menetelmä: Ba(OH)2/NaOH/muu |
|
Aika (päivä) |
Testiliuoksen muodostunut CO2 (mg) |
Taustanäytteen muodostunut CO2 (mg) |
Kumulatiivinen muodostunut CO2 (testiliuos vähennettynä taustaliuoksen keskiarvolla) |
ThCO2 kumulatiivinen |
|||||
|
1 2 |
keskiarvo |
3 4 |
keskiarvo |
1 |
2 |
1 |
2 |
keskiarvo |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
n1 |
|
|
|
|
|
|
|
|
|
|
n2 |
|
|
|
|
|
|
|
|
|
|
n3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28 |
|
|
|
|
|
|
|
|
|
Huomautus: Vertailukemikaalien ja myrkyllisyysvertailunäytteiden osalta tiedot voidaan esittää samalla tavoin kuin tässä.
6. HIILIANALYYSI (valinnainen)
Hiilianalysaattori:
|
Aika (päivä) |
Taustanäyte mg/l |
Testattava kemikaali mg/1 |
|
0 |
Cb(o) |
Co |
|
28 (5) |
Cb(t) |
Ct |

7. ABIOOTTINEN HAJOAMINEN (valinnainen)

OSA V MANOMETRINEN RESPIROMETRIAKOE (menetelmä C.4-D)
V.l TESTIMENETELMÄN PERIAATE
Mitattua tilavuutta siirrostettua epäorgaanista liuosta, jossa on tunnettu pitoisuus testattavaa kemikaalia (100 mg kemikaalia/l testattavaa ainetta — ThOD-pitoisuus vähintään 50–100 mg/l) ainoana nimellisenä orgaanisena hiililähteenä, ravistetaan suljetussa pullossa vakiolämpötilassa (vaihteluväli enintään ± 1 oC) enintään 28 päivän ajan. Hapenkulutus määritetään joko mittaamalla (elektrolyyttisesti muodostettu) happimäärä, joka tarvitaan pitämään respirometripullon kaasun tilavuus vakiona, tai mittaamalla laitteen tilavuuden tai paineen muutos (tai molempien yhdistelmä). Muodostunut hiilidioksidi imeytetään kaliumhydroksidiliuokseen tai muuhun sopivaan absorbenttiin. Testattavan kemikaalin hapenkulutus (korjattuna pelkän siirrosaineen hapenkulutuksella, joka mitataan rinnakkaisen taustanäytteen avulla) ilmaistaan ThOD- tai COD-prosenttiarvona. Haluttaessa voidaan laskea myös primaarinen biohajonta inkubaation alussa ja lopussa tehtävän spesifisen analyysin tuloksien avulla tai määrittää lopullinen biohajonta DOC-analyysin avulla.
V.2 MENETELMÄKUVAUS
V.2.1 Laite
|
a) |
tarkoitukseen sopiva respirometri, |
|
b) |
lämpötilan säätöjärjestelmä (enintään ± 1 oC:n vaihteluväli), |
|
c) |
kalvosuodatin (valinnainen), |
|
d) |
hiilisuodatin (valinnainen). |
V.2.2 Epäorgaanisen liuoksen valmistus
Kantaliuoksen valmistus kuvataan kohdassa I.6.2.
10 ml a-liuosta sekoitetaan 800 ml:aan laimennusvettä, lisätään 1 ml b-, c- ja d-liuosta sekä laimennetaan liuos yhden litran tilavuuteen.
V.2.3 Siirrosaineen valmistelu ja esikäsittely
Siirrosaineen lähteinä voidaan käyttää aktiivilietettä, jätevettä, pintavettä, maata tai näiden sekoitusta.
Katso kohtia I.6.4, I.6.4.1,1.6.4.2 ja I.6.5.
V.2.4 Pullojen valmistelu
Valmistetaan erilliset erät testi- ja kontrolliliuosta liuottamalla testattavaa ainetta ja vertailuainetta epäorgaaniseen liuokseen (100 mg kemikaalia/l — vähintään 50–100 mg ThOD/1) kantaliuoksia käyttäen.
ThOD-arvo lasketaan käyttäen oletuksena ammoniumsuolojen muodostusta, ellei odotettavissa ole nitrifikaatiota, missä tapauksessa laskelmien on perustuttava nitraattien muodostukseen (katso liitettä II.2).
Määritetään pH-arvot ja säädetään ne tarvittaessa
arvoon 7,4±0,2. Huonosti liukenevat aineet lisätään myöhemmin (katso jäljempänä).
Testattavan kemikaalin myrkyllisyysmäärityksissä epäorgaaniseen liuokseen on valmistettava erillinen liuos, jossa on testattavaa kemikaalia ja vertailukemikaalia samoina pitoisuuksina kuin yksittäisissä liuoksissa.
Jos tarvitaan hapen fysikaalis-kemiallisen kulutuksen mittauksia, valmistetaan liuos, jossa on testattavaa kemikaalia pitoisuutena, joka vastaa arvoa 100 mg ThOD/1. Liuos steriloidaan lisäämällä siihen sopivaa myrkyllistä ainetta (katso kohtaa I.6.6).
Lisätään tarvittavat tilavuudet testattavaa kemikaalia ja vertailukemikaalia vähintään kahteen pullosarjaan. Tarvittaessa lisätään erillisiin pulloihin pelkkää epäorgaanista liuosta (siirrostarkistusta varten), testattavan kemikaalin ja vertailukemikaalin seosliuosta sekä steriiliä liuosta.
Jos testattava kemikaali on huonosti liukenevaa, se voidaan lisätä tässä vaiheessa tunnettuna painomääränä tai sitä voidaan käsitellä liitteessä III kuvatulla tavalla. Hiilidioksidi-imeyttimiin lisätään kaliumhydroksidia, kalkkisoodapellettejä tai muuta absorbenttia.
V.2.5 Tyypillisen kokeen pullomäärä
Pullot 1 ja 2: Testisuspensio
Pullot 3 ja 4: Siirrosaineen taustanäyte
Pullo 5: Menetelmän vertailunäyte
Seuraavia pulloja on käytettävä tarpeen mukaan, ja niiden käyttö on muutenkin suositeltavaa:
Pullo 6: Steriili vertailunäyte
Pullo 7: Myrkyllisyystarkistus
Katso myös kohtaa I.6.7.
V.2.6 Testin suorittaminen
Kun pullojen lämpötila on oikea, niihin siirrostetaan valmistettua aktiivilietettä tai muuta siirrosainetta testiohjelman mukaan. Suspendoituneen kuiva-aineen pitoisuus saa olla enintään 30 mg/l. Pullot pannaan ravistuslaitteeseen, joka käynnistetään. Pullojen ilmatiiviyden tarkastuksen jälkeen aloitetaan hapenkulutuksen mittaukset. Ohjelmanmukaisten mittausten lisäksi ei yleensä tarvita muuta valvontaa kuin päivittäisiä lämpötilan ja ravistustoiminnon tarkastuksia,
Hapenkulutus lasketaan säännöllisten ja tiheiden mittausten tulosten perusteella laitevalmistajan ohjeiden mukaan. Inkubaation lopussa (yleensä 28 päivän kuluttua) mitataan pulloissa olevien liuosten pH-arvot, mikä on erityisen tärkeää, jos hapenkulutusarvot ovat pieniä tai suurempia kuin ThODNH4 (typpeä sisältävät yhdisteet).
Tarvittaessa kokeen alussa ja lopussa otetaan respirometripulloista näytteet DOC:n tai spesifisen kemikaalin analyysiä varten (katso liitettä II.4). Kokeen alussa tehtävän näytteenoton yhteydessä on varmistettava, että pulloon jäljelle jäävä testisuspension tilavuus on tunnettu. Kun happea kuluttava yhdiste sisältää typpeä, nitriitti- ja nitraattipitoisuuksien suureneminen 28 päivän aikana määritetään nitrifikaation vaatima hapenkulutus huomioon ottaen (katso liitettä V).
V.3 TIEDOT JA RAPORTOINTI
V.3.1 Tulosten käsittely
Testattavan kemikaalin hapenkulutus (mg) tunnetun ajan kuluessa (korjattuna siirrostetun taustanäytteen hapenkulutuksella) jaetaan testattavan kemikaalin käytetyllä painolla. Tulokseksi saadaan BOD-arvo ilmaistuna hapen painona testattavan kemikaalin painoa kohti:

= mg O2 mg:aa testattavaa kemikaalia kohti
Prosentuaalinen biohajoavuus voidaan laskea näin:

tai näin:
![]()
Huomautus: Molemmat menetelmät eivät välttämättä anna tulokseksi samaa arvoa. Jälkimmäisen menetelmän käyttöä suositellaan.
Kun testattava aine sisältää typpeä, käytetään joko NH4:n tai NO3:n perusteella laskettua ThOD-arvoa sen mukaan, mitä nitrifikaation esiintymisen suhteen on odotettavissa (katso liitettä II.2). Jos nitrifikaatio on vain osittaista, nitrifikaation hapenkulutuksen korjaus lasketaan nitriitti- ja nitraattipitoisuuksien muutoksen perusteella (katso liitettä V).
Jos tehdään myös orgaanisen hiilen tai spesifisen kemikaalin määritykset, prosentuaalinen hajoaminen lasketaan kohdassa I.7 kuvatun menetelmän mukaan.
Tulokset kirjataan oheisiin tietolomakkeisiin.
V.3.2 Tulosten hyväksyminen
Siirrostuksen taustanäytteen hapenkulutus on yleensä 20–30 mg O2/l. Arvo saa olla 28 päivän kuluessa enintään 60 mg/l. Jos arvo on tätä suurempi, tietoja ja koetekniikoita on tarkasteltava erityisen kriittisesti. Jos pH-arvo on alueen 6–8,5 ulkopuolella ja testattavan kemikaalin hapenkulutus on alle 60 %, testattavan kemikaalin pitoisuutta on pienennettävä ja testi on toistettava.
Katso myös kohtaa I.5.2.
V.3.3 Raportointi
Katso kohtaa I.8.
V.4 TIETOLOMAKE
Jäljempänä on esimerkki tietolomakkeesta.
MANOMETRINEN RESPIROMETRIAKOE
|
1. |
LABORATORIO |
|
2. |
KOKEEN ALKUPÄIVÄMÄÄRÄ |
3. TESTATTAVA AINE
Nimi:
Kantaliuoksen pitoisuus: mg/l
Liuoksen alkupitoisuus, Co: mg/l
Testipullon tilavuus (V): ml
ThOD tai COD: mg O2 / mg testattavaa ainetta (NH4, NO3)
4. SIIRROSAINE
Lähde:
Käsittelyt:
Esikäsittelyt:
Seoksen suspendoituneen kuiva-aineen pitoisuus: mg/l
5. HAPENKULUTUS: BIOHAJOAVUUS
|
|
Aika (päivää) |
||||||||||||
|
0 |
|
7 |
|
14 |
|
|
21 |
|
|
28 |
|
||
|
O2-kulutus (mg), testattava kemikaali |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a, keskiarvo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O2-kulutus (mg), taustanäyte |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b, keskiarvo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Korjattu BOD (mg) |
(a1 - bm) |
|
|
|
|
|
|
|
|
|
|
|
|
|
(a2 - bm) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BOD mg:aa testattavaa kemikaalia kohti |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hajoaminen ( %)
|
D1 (a1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
D2 (a2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Keskiarvo (6) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V = testipullon sisällön tilavuus |
|||||||||||||
Huomautus: Vertailukemikaalien ja myrkyllisyysvertailunäytteiden osalta tiedot voidaan esittää samalla tavoin kuin tässä.
6. NITRIFIKAATIOKORJAUS (katso liitettä V)
|
Päivä |
0 |
28 |
Erotus |
||
|
|
|
(N) |
||
|
— |
— |
|
||
|
|
|
(N) |
||
|
— |
— |
|
||
|
— |
— |
|
7. HIILIANALYYSI (valinnainen)
Hiilianalysaattori:
|
Aika (päivä) |
Taustanäyte (mg/l) |
Testattava kemikaali (mg/l) |
|
0 |
(Cblo) |
(Co) |
|
28 (7) |
(Cblt) |
(Ct) |

8. SPESIFINEN KEMIKAALI (valinnainen)
|
Sb |
= |
fysikaalis-kemiallisen (steriilin) vertailunäytteen pitoisuus 28 päivän kuluttua |
|
Sa |
= |
siirrostettujen pullojen pitoisuus 28 päivän kuluttua |
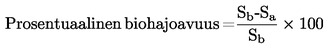
9. ABIOOTTINEN HAJOAVUUS (valinnainen)
|
a |
= |
steriilien pullojen hapenkulutus (mg) 28 päivän kuluttua |

(Katso jaksoja 1 ja 3.)

hapenkulutus mg:aa testattavaa kemikaalia kohti =
OSA VI SULJETUN PULLON MENETELMÄ (menetelmä C.4-E)
VI.1 TESTIMENETELMÄN PERIAATE
Testattavan kemikaalin ja epäorgaanisen liuoksen seokseen (2–5 mg kemikaalia/l) siirrostetaan suhteellisen pieni määrä sekapopulaatiosta otettuja mikroeliöitä. Näin saatua seosta pidetään täysissä, suljetuissa pulloissa pimeässä ja vakiolämpötilassa. Hajoamista seurataan analysoimalla liuennutta happea 28 päivän ajan. Testattavan kemikaalin hapenkulutus vähennettynä siirrostetun taustanäytteen hapenkulutuksella ilmaistaan ThOD- tai COD-prosenttilukuna.
VI.2 MENETELMÄKUVAUS
VI.2.1 Laite
|
a) |
Lasitulpalla varustettuja BOD-pulloja (vetoisuudeltaan esimerkiksi 250–300 ml). |
|
b) |
Vesihaude tai inkubaattori, jossa pulloja voidaan pitää vakiolämpötilassa (vaihteluväli enintään ± 1 oC) ja pimeässä. |
|
c) |
Suuria lasipulloja (2–5 l) epäorgaanisen liuoksen valmistusta ja BOD-pullojen täyttöä varten. |
|
d) |
Happielektrodi ja happimittari tai Winkler-titrauksen edellyttämät varusteet ja reagenssit. |
VI.2.2 Epäorgaanisen liuoksen valmistus
Kantaliuoksen valmistus kuvataan kohdassa I.6.2.
Sekoitetaan a-, b-, c- ja d-liuosta 1 ml kutakin ja laimennetaan liuos yhden litran tilavuuteen.
VI.2.3 Siirrosaineen valmistelu
Siirrosaine saadaan yleensä pääosin kotitalouksien jätevettä käsittelevän laitoksen tai laboratoriolaitoksen sekundaarisesta jätevedestä. Myös pintavettä voidaan käyttää. Yleensä käytetään 0,05–5 ml suodosta epäorgaanisen liuoksen litraa kohti. Tarvittaessa määrätystä päästövedestä saadun siirrosaineen optimaalinen testitilavuus on määritettävä kokeellisesti (katso kohtia I.6.4.2 ja I.6.5).
VI.2.4 Pullojen valmistelu
Epäorgaanista liuosta ilmastetaan voimakkaasti 20 minuutin ajan. Jokaiseen testisarjaan on käytettävä samasta erästä otettua epäorgaanista liuosta. Epäorgaaninen liuos on yleensä käyttövalmis, kun sitä on pidetty testilämpötilassa 20 tunnin ajan. Tarkistuksena määritetään liuenneen hapen pitoisuus, jonka arvo saa olla enintään 9 mg/l liuoksen lämpötilan ollessa 20 oC. Ilmalla kyllästetyn liuoksen kaikki siirrot ja täytöt on tehtävä kuplia välttäen, esimerkiksi sifonien avulla.
Valmistellaan rinnakkaiset ryhmät BOD-pulloja, joiden avulla voidaan toteuttaa rinnakkaisia koesarjoja testattavan kemikaalin ja vertailukemikaalin määritystä varten. BOD-pulloja on valmisteltava sellainen määrä (siirrosaineen taustanäytepullot mukaan lukien), että voidaan tehdä vähintään kaksinkertaiset hapenkulutuksen mittaukset halutuin välein (esimerkiksi 0, 7, 14, 21 ja 28 päivän kuluttua). Joissakin tapauksissa suurempi määrä pulloja on tarpeen 10-päiväisen jakson löytämiseksi.
Ilmalla kyllästettyä epäorgaanista liuosta kaadetaan suuriin pulloihin. Pullot täytetään kolmannekseen asti. Sitten eri pulloihin lisätään riittävä määrä testattavan kemikaalin ja vertailukemikaalin kantaliuosta, niin että kemikaalien lopullinen pitoisuus on enintään 10 mg/l. Erillisessä suuressa pullossa olevaan taustanäytteeseen ei lisätä kemikaaleja.
Siirrosaineen aktiviteetin varmistamiseksi BOD-pullojen liuenneen hapen pitoisuutta ei saa päästää alle arvon 0,5 mg/l, mikä rajoittaa testattavan kemikaalin pitoisuuden arvoon 2 mg/l. Jos yhdiste on huonosti liukenevaa tai jos sillä on pieni ThOD-arvo, voidaan käyttää pitoisuutta 5–10 mg/l. Joissakin tapauksissa on suositeltavaa ajaa rinnakkaisia testisarjoja kahta eri pitoisuutta (esimerkiksi arvoja 2 mg/l ja 5 mg/l) käyttäen. ThOD-arvo lasketaan yleensä ensisijaisesti ammoniumsuolojen muodostuksesta, ellei odotettavissa ole nitrifikaatiota, missä tapauksessa laskelmien on perustuttava nitraattien muodostukseen (ThODNO3, katso liitettä II.2). Jos nitrifikaatio on vain osittaista, nitrifikaation hapenkulutuksen korjaus lasketaan nitriitti- ja nitraattipitoisuuksien muutoksen perusteella (katso liitettä V).
Jos on tarpeen määrittää testattavan kemikaalin myrkyllisyys (jos esimerkiksi aiempien kokeiden tuloksena on saatu pieni biohajoavuusarvo), myrkyllisyysmääritystä varten on valmisteltava erillinen pullosarja.
Erilliseen suureen pulloon lisätään ilmastettua epäorgaanista liuosta (suunnilleen kolmannes pullon tilavuudesta), testattavaa kemikaalia ja vertailukemikaalia, niin että lopulliset pitoisuudet ovat samat kuin muissa suurissa pulloissa.
Suurissa pulloissa olevat liuokset siirrostetaan sekundaarisella jätevedellä (0,5–5 ml/l) tai muulla siirrosaineella (esimerkiksi jokivedellä, katso kohtaa I.6.4.2). Lopuksi pullojen sisältö laimennetaan epäorgaanisella liuoksella täyteen tilavuuteen. Riittävä sekoittuminen varmistetaan käyttämällä pullon pohjaan asti ulottuvaa letkua.
VI.2.5 Tyypillisen kokeen pullomäärä
Tyyppillisessä ajossa käytetään seuraavia pulloja:
|
— |
vähintään 10:tä pulloa, joissa on testattavaa kemikaalia ja siirrosainetta (testisuspensio), |
|
— |
vähintään 10:tä pulloa, jossa on pelkkää siirrosainetta (siirrosaineen taustanäyte), |
|
— |
vähintään 10:tä pulloa, jossa on vertailukemikaalia ja siirrosainetta (menetelmän tarkistusnäyte). |
|
— |
Tarvittaessa käytetään lisäksi 6:ta pulloa, joissa on testattavaa kemikaalia, vertailukemikaalia ja siirrosainetta (myrkyllisyystarkistus). 10-päiväisen jakson löytämisen varmistamiseksi tarvitaan kuitenkin kaksinkertainen pullomäärä. |
VI.2.6 Testin suorittaminen
Kutakin valmisteltua liuosta annostellaan heti vastaaviin BOD-pulloryhmiin letkulla, joka ulottuu suuren pullon alimpaan neljännekseen (ei pohjaan). BOD-pullot täytetään kokonaan. Ilmakuplat poistetaan koputtamalla pulloja kevyesti. Nollahetkipullojen liuenneen hapen määritys tehdään heti Winkler- tai elektrodimenetelmällä. Pullojen sisältö voidaan säästää myöhemmin tehtävää Winkler-analyysia varten lisäämällä pulloihin mangaani(II)sulfaattia ja natriumhydroksidia (ensimmäistä Winkler-reagenssia). Huolella suljettuja pulloja, joissa happi on sidottuna ruskeaan mangaani(III)oksidihydraattiin, säilytetään pimeässä 10–20 oC:ssa enintään 24 tuntia ennen Winkler-menetelmän seuraavien vaiheiden aloittamista. Loput rinnakkaispullot suljetaan varmistaen, ettei pulloihin jää ilmakuplia, minkä jälkeen pulloja inkuboidaan pimeässä 20 oC:ssa. Jokaista pullosarjaa kohti on käytettävä kattavaa rinnakkaissarjaa, joka sisältää siirrostettua taustanäytettä. Jokaisesta sarjasta on poimittava koko 28 päivän inkubaatiojakson ajan säännöllisin välein (vähintään kerran viikossa) vähintään kaksi pulloa liuenneen hapen analyysiä varten.
Viikoittaisten näytteiden avulla pitäisi voida arvioida prosentuaalinen poistuma 14-päiväisen jakson aikana, ja 3–4 päivän välein tapahtuvan näytteenoton avulla pitäisi voida määrittää 10-päiväinen jakso, mikä edellyttää noin kaksinkertaisen pullomäärän käyttöä.
Jos testattava aine sisältää typpeä, nitrifikaation aiheuttama hapenkulutus on otettava huomioon. Korjaus tehdään määrittämällä ensin liuenneen hapen pitoisuus O2-elektrodilla, minkä jälkeen BOD-pullosta otetaan näyte nitriitti- ja nitraattianalyysia varten. Hapenkulutus lasketaan nitriitti- ja nitraattipitoisuuden kasvun perusteella (katso liitettä V).
VI.3 TIEDOT JA RAPORTOINTI
V.3.1 Tulosten käsittely
Ensin lasketaan kunkin jakson jälkeinen BOD-arvo vähentämällä siirrosaineen taustanäytteen hapenpoistuma (mg O2/l) testattavan aineen hapenpoistumasta. Näin korjattu poistuma jaetaan testattavan kemikaalin pitoisuudella (mg/l), jolloin saadaan spesifinen BOD-arvo ilmaistuna hapen painona (mg) testattavan kemikaalin painoa (mg) kohti. Prosentuaalinen biohajoavuus lasketaan jakamalla spesifinen BOD-arvo spesifisellä liitteen II.2 mukaan lasketulla ThOD-arvolla tai liitteessä II.3 esitettävän analyysin avulla määritetyllä COD-arvolla seuraavasti:

= mg O2 mg:aa testattavaa kemikaalia kohti

tai

On otettava huomioon, että molemmat menetelmät eivät välttämättä anna tulokseksi samaa arvoa. Ensin mainitun menetelmän käyttöä suositellaan.
Jos testattava aine sisältää typpeä, on käytettävä NH4:n tai NO3:n perusteella laskettua ThOD-arvoa sen mukaan, mitä nitrifikaation suhteen on odotettavissa (katso liitettä II.2). Jos nitrifikaatio on vain osittaista, nitrifikaation hapenkulutuksen korjaus lasketaan nitriitti- ja nitraattipitoisuuksien muutoksen perusteella (katso liitettä V).
VI.3.2 Tulosten hyväksyminen
Kun 28 päivää on kulunut, siirrostuksen taustanäytteen hapenpoistuma ei saa ylittää arvoa 1,5 mg liuennutta happea litraa kohti. Jos arvo on suurempi, koetekniikoita on tarkasteltava erityisen kriittisesti. Testipullojen hapen jäännöspitotsuus ei saa missään vaiheessa alittaa arvoa 0,5 mg/l. Näin pienet happipitoisuudet ovat hyväksyttäviä vain siinä tapauksessa, että liuenneen hapen määritysmenetelmä on riittävän tarkka mittaamaan tällaisia pitoisuuksia.
Katso myös kohtaa I.5.2.
VI.3.3 Raportointi
Katso kohtaa 1.8.
VI.4 TIETOLOMAKE
Jäljempänä on esimerkki tietolomakkeesta.
SULJETUN PULLON MENETELMÄ
|
1. |
LABORATORIO |
|
2. |
KOKEEN ALKUPÄIVÄMÄÄRÄ |
3. TESTATTAVA AINE
Nimi:
Kantaliuoksen pitoisuus: mg/l
Liuoksen alkupitoisuus: mg/l
ThOD tai COD: mg O2 / mg testattavaa ainetta
4. SIIRROSAINE
Lähde:
Käsittelyt:
Esikäsittelyt:
Pitoisuus testiseoksessa: mg/l
5. DO-MÄÄRITYS
Menetelmä: Winkler/elektrodi
Pulloanalyysit
|
Inkubaatioaika (d) |
DO (mg/l) |
|||||
|
0 |
n1 |
n2 |
|
|||
|
Taustanäyte (ilman kemikaalia) |
1 |
C1 |
|
|
|
|
|
2 |
C2 |
|
|
|
|
|
|
Keskiarvo |
|
|
|
|
|
|
|
Testattava kemikaali |
1 |
a1 |
|
|
|
|
|
|
2 |
a2 |
|
|
|
|
|
Keskiarvo |
|
|
|
|
|
|
Huomautus: Vertailukemikaalien ja myrkyllisyysvertailunäytteiden osalta tiedot voidaan esittää samalla tavoin kuin tässä.
6. NITRIFIKAATIOKORJAUS (katso liitettä V)
|
Inkubaatioaika (d) |
0 |
n1 |
n2 |
n3 |
||
|
|
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
||
|
|
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
7. DO-VÄHENNYS: PROSENTUAALINEN HAJOAMINEN
|
|
Vähennys päivän n jälkeen (mg/l) |
|||
|
n1 |
n2 |
n3 |
|
|
|
PULLO 1: (mto - mtx) (mbo - mbx) |
|
|
|
|
|
PULLO 2: (mto rmtx) (mbo - mbx) |
|
|
|
|
|
PULLO 1:
|
|
|
|
|
|
PULLO 2:
|
|
|
|
|
| % D keskiarvo (8) =
|
|
|
|
|
|
mt0 |
= |
testipullon arvo hetkellä 0 |
|
mtx |
= |
testipullon arvo hetkellä x |
|
mb0 |
= |
taustanäytteen keskiarvo hetkellä 0 |
|
mbx |
= |
taustanäytteen keskiarvo hetkellä x |
Käytetään myös osan 6, kohtien iii ja vi mukaista nitrifikaatiokorjausta.
8. TAUSTANÄYTTEEN DO-VÄHENNYKSET
Taustanäytteen hapenkulutus on (mb0-mb28) mg/l. Taustanäytteen hapenkulutus on tärkeä tekijä kokeen hyväksyttävyyden kannalta. Hapenkulutus ei saa ylittää arvoa 1,5 mg/l.
OSA VII MITI-KOE (menetelmä C.4-F)
VII. 1 MENETELMÄN PERIAATE
Testattavaa kemikaalia lisätään epäorgaaniseen liuokseen, jota siirrostetaan erikoisviljelmästä otetuilla, adaptoimattomilla mikroeliöillä. Liuosta tai suspensiota hämmennetään ja sen hapenkulutusta mitataan automaattisella laitteella 28 päivän ajan pimennetyssä ja suljetussa respirometrissä lämpötilassa 25 ± 1 oC. Muodostunut hiilidioksidi imeytetään kalkkisoodaan. Biohajoavuus ilmaistaan prosentuaalisena hapenkulutuksena (taustanäytteen kulutuksella korjattuna) teoreettisesta hapenkulutuksesta (ThOD). Prosentuaalinen primaarinen biohajoavuus lasketaan spesifisen, inkubaation alussa ja lopussa tehtävän kemiallisen analyysin perusteella. Lisäksi voidaan tehdä DOC-analyysi.
VII.2 MENETELMÄKUVAUS
VII.2.1 Laite
|
a) |
Automaattinen elektrolyyttinen BOD-mittari tai respirometri, jossa on 6 kpl 300 ml:n pulloja ja kupit CO2-absorbenttia varten |
|
b) |
Huone, jossa on vakiolämpötila, tai vesihaude, jonka lämpötila voidaan pitää arvossa 25 oC (suurin sallittu vaihteluväli ± 1 oC) |
|
c) |
Kalvosuodatinlaite (valinnainen) |
|
d) |
Hiilianalysaattori (valinnainen). |
VII.2.2 Epäorgaanisen liuoksen valmistus
Valmistetaan seuraavat kantaliuokset käyttäen analyyttisen puhtaita reagensseja ja vettä (I.6.1):
|
a) |
Monokaliumdivetyortofosfaattia, KH2PO4 |
8,50 g |
|
Dikaliummonovetyortofosfaattia, K2HPO4 |
21,75 g |
|
|
Dinatriummonovetyortofosfaattidodekahydraattia, Na2HPO4 x 12H2O |
44,60 g |
|
|
Ammoniumkloridia, NH4Cl |
1,70 g |
|
|
Liuotetaan veteen ja laimennetaan litran tilavuuteen. |
|
|
|
Liuoksen pH-arvon on oltava 7,2. |
|
|
|
b) |
Magnesiumsulfaattiheptahydraattia, MgSO4 7 H2O |
22,50 g |
|
Liuotetaan veteen ja laimennetaan litran tilavuuteen. |
|
|
|
c) |
Kalsiumkloridia, CaCl2 |
27,50 g |
|
Liuotetaan veteen ja laimennetaan litran tilavuuteen. |
|
|
|
d) |
Rauta(III)kloridiheksahydraattia, FeCl3 x 6H2O |
0,25 g |
|
Liuotetaan veteen ja laimennetaan litran tilavuuteen. |
|
Otetaan 3 ml kutakin liuosta a, b, c ja d ja laimennetaan litran tilavuuteen.
VII.2.3 Siirrosaineen valmistelu
Kerätään tuoreita näytteitä vähintään kymmenestä paikasta, pääosin alueilta, joilla käytetään ja päästetään useita eri kemikaaleja. Kerätään esimerkiksi kuntien ja teollisuuslaitosten jätevesilaitoksista, joista, järvistä ja muista sopivista paikoista 1 l:n näytteitä (esimerkiksi lietettä, pintamaata ja vettä), jotka sekoitetaan huolellisesti. Kelluva aines poistetaan. Kun seos on laskeutunut, pintalietteen pH säädetään natriumhydroksidilla tai fosforihapolla arvoon 7 ± 1.
Sopiva tilavuus suodatettua pintalietettä lisätään aktiivilieteastiaan ja nestettä ilmastetaan noin 23,5 tunnin ajan. Kolmekymmentä minuuttia ilmastuksen päättymisen jälkeen suunnilleen kolmasosa pintalietteestä kaadetaan pois ja laskeutuneeseen aineeseen lisätään poiskaadettua liuosta vastaava määrä liuosta, jonka pH-arvo on 7 ja joka sisältää 0,1 % glukoosia, 0,1 % peptonia ja 0,1 % monokaliumortofosfaattia. Tämän jälkeen ilmastus käynnistetään uudelleen. Menettely toistetaan kerran päivässä. Lietejärjestelmän käytössä on noudatettava huolellisuutta: päästövesien on oltava kirkkaita, lämpötila on pidettävä arvossa 25 ± 2 oC, pH-arvon on oltava 7 ± 1, lietteen on laskeuduttava hyvin, ilmastuksen on oltava riittävää liuoksen jatkuvan aerobisuuden varmistamiseksi, lietteessä on oltava yksisoluisia eliöitä ja lietteen aktiivisuutta on testattava vertailuaineeseen verrattuna vähintään joka kolmas kuukausi. Lietettä ei saa käyttää siirrosaineena, ennen kuin se on ollut järjestelmässä vähintään kuukauden. Neljä kuukautta vanhempaa lietettä ei saa käyttää. Tämän jälkeen näytteitä on otettava vähintään 10 paikasta säännöllisin väliajoin (kerran kolmessa kuukaudessa).
Jotta tuoreen ja vanhan lietteen aktiivisuus voitaisiin pitää samalla tasolla, käytössä olevan aktiivilietteen suodatettua pintalietettä sekoitetaan samaan tilavuuteen vastavalmistettua sekoitetta, jonka osat ovat peräisin 10:stä eri paikasta. Tämän jälkeen seosta viljellään edellä kuvatulla tavalla. Lietettä otetaan siirrosaineeksi 18–24 tuntia yksikön syötön jälkeen.
VII.2.4 Pullojen valmistelu
Valmistellaan seuraavat kuusi pulloa:
Pullo 1: testattavaa kemikaalia laimennusvedessä (100 mg/l)
Pullot 2, 3 ja 4: testattavaa kemikaalia epäorgaanisessa liuoksessa (100 mg/l)
Pullo 5: vertailukemikaalia (esimerkiksi aniliinia) epäorgaanisessa liuoksessa (100 mg/l)
Pullo 6: pelkkää epäorgaanista liuosta.
Huonosti liukenevia testattavia kemikaaleja lisätään suoraan painon tai tilavuuden mukaan, tai niitä käsitellään liitteessä II kuvattavalla tavalla (liuottimia tai emulgaattoreita ei kuitenkaan saa käyttää). Imeytinkuppeihin lisätään CO2-absorbenttia. Pullojen 2, 3 ja 4 pH säädetään arvoon 7,0.
VI1.2.5 Testin suorittaminen
Pulloihin 2, 3 ja 4 (testisuspensiot), 5 (aktiviteettikontrolli) ja 6 (siirrostuksen taustanäyte) lisätään pieni tilavuus siirrosainetta, niin että suspendoituneen kuiva-aineen lopullinen pitoisuus on 30 mg/l. Pulloon 1 ei lisätä siirrosainetta. Pullot asetetaan sekoituslaitteeseen, pullojen ilmatiiviys tarkistetaan, sekoittimet käynnistetään ja hapenkulutuksen mittaus aloitetaan pimeässä. Lämpötila, sekoituslaite ja hapenkulutuksen kulometrinen rekisteröintilaite on tarkistettava päivittäin. Pullojen sisällön mahdolliset värimuutokset on merkittävä muistiin. Kuuden pullon hapenkulutus luetaan suoraan esimerkiksi BOD-käyriä tuottavasta kuusikärkisestä piirturista. Kun inkubaatio on päättynyt (yleensä 28 päivän kuluttua), pullojen sisällön pH-arvot mitataan. Sitten määritetään jäljelle jääneen testattavan kemikaalin ja mahdollisen välituotteen pitoisuus sekä (jos kyseessä on vesiliukoinen aine) DOC-pitoisuus (katso liitettä II.4). Haihtuvien kemikaalien kohdalla on noudatettava erityistä huolellisuutta. Jos nitrifikaatiota on odotettavissa, nitriitti- ja nitraattipitoisuus määritetään mahdollisuuksien mukaan.
VII.3 TIEDOT JA RAPORTOINTI
VII.3.1 Tulosten käsittely
Testattavan kemikaalin hapenkulutus (mg) määrätyn ajan kuluttua, korjattuna siirrostuksen taustanäytteen kulutuksella, jaetaan testattavan kemikaalin painolla. Tuloksena saadaan BOD-arvo ilmaistu hapen painona kemikaalin painoa kohti (mg/mg), seuraavan suureyhtälön mukaan:

= mg O2/mg testattavaa kemikaalia
Prosentuaalinen biohajoavuus lasketaan seuraavan suureyhtälön mukaan:

Seosten osalta ThOD lasketaan yksinkertaisten yhdisteiden tapaan alkuaineanalyysin perusteella. Käytettävä ThOD-arvo (ThODNH4 tai ThODNO3) valitaan sen mukaan, esiintyykö nitrifikaatiota vai ei (katso liitettä II.2). Jos nitrifikaatio on vain osittaista, nitrifikaation hapenkulutuksen korjaus lasketaan nitriitti- ja nitraattipitoisuuksien muutoksen perusteella (katso liitettä V).
Prosentuaalinen primaarinen biohajoavuus lasketaan spesifisen lähtökemikaalin poistuman perusteella (katso osaa I.7.2).
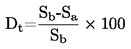
Jos pullossa 1 on on havaittu testattavan kemikaalin häviötä fysikaalis-kemiallisen poistuman mittauksen yhteydessä, häviö on raportoitava. Tällöin prosentuaalisen biohajoavuuden laskennassa käytetään pullon 1 testattavan kemikaalin pitoisuutta (Sb) 28 päivän kuluttua.
Jos DOC-määrityksiä (valinnainen toimi) tehdään, lopullinen prosentuaalinen biohajoavuus lasketaan seuraavan suureyhtälön mukaan (katso kohtaa I.7.1):

Jos pullossa 1 on havaittu DOC-häviötä fysikaalis-kemiallisen poistuman mittauksen yhteydessä, prosentuaalisen biohajoavuuden laskennassa käytetään tämän pullon DOC-pitoisuutta.
Tulokset kirjataan oheisiin tietolomakkeisiin.
VII.3.2 Tulosten hyväksyminen
Siirrostuksen taustanäytteen hapenkulutus on yleensä 20-30 mg O2/l. Arvo saa olla 28 päivän kuluessa enintään 60 mg/l. Jos arvo on tätä suurempi, tietoja ja koetekniikoita on tarkasteltava erityisen kriittisesti. Jos pH-arvo on alueen 6–8,5 ulkopuolella ja testattavan kemikaalin hapenkulutus on alle 60 %, testattavan kemikaalin pitoisuutta on pienennettävä ja testi on toistettava.
Katso myös kohtaa I.5.2.
Jos aniliinin hapenkulutuksen perusteella laskettu prosentuaalinen hajoaminen ei ylitä 7 päivän kuluessa arvoa 40 % ja 14 päivän kuluessa arvoa 65 %, koe hylätään.
VII.3.3 Raportointi
Katso kohtaa I.8.
VII.4 TIETOLOMAKE
Jäljempänä on esimerkki tietolomakkeesta.
MITI (I) -KOE
|
1. |
LABORATORIO |
|
2. |
KOKEEN ALKUPÄIVÄMÄÄRÄ |
3. TESTATTAVA AINE
Nimi:
Kantaliuoksen pitoisuus: mg/l kemikaalina
Liuoksen alkupitoisuus, Co: mg/l kemikaalina
Seoksen tilavuus, V: ml
ThOD: mg O2/l
4. SIIRROSAINE
Lietteen näytteenottopaikat:
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
Aktiivilietteen suspendoituneen kuiva-aineen pitoisuus, kun aktiivilietettä on akklimatisoitu synteettisellä jätevedellä = … mg/l
Aktiivilietteen tilavuus lopullisen seoksen tilavuutta (litraa) kohti: = … ml
Lietteen pitoisuus lopullisessa seoksessa = … mg/l
5. HAPENKULUTUS: BIOHAJOAVUUS
Käytetyn respirometrin tyyppi:
|
|
Aika (päivää) |
||||||
|
0 |
7 |
14 |
21 |
28 |
|||
|
O2-kulutus (mg), testattava kemikaali |
a1 |
|
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a3 |
|
|
|
|
|
||
|
O2-kulutus (mg), taustanäyte |
b |
|
|
|
|
|
|
|
Korjattu O2-kulutus (mg) |
(a1-b) (a2-b) (a3-b) |
|
|
|
|
|
|
|
BOD testattavan kemikaalin painoa (mg) kohti |
|
Pullo 1 |
|
|
|
|
|
|
Pullo 2 |
|
|
|
|
|
||
|
Pullo 3 |
|
|
|
|
|
||
|
Prosentuaalinen hajoavuus
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
||
|
3 |
|
|
|
|
|
||
|
keskiarvo (9) |
|
|
|
|
|
||
Huomautus: Vertailukemikaalien osalta tiedot voidaan esittää samalla tavoin kuin tässä.
6. HIILIANALYYSI (valinnainen)
Hiilianalysaattori:
|
Pullo |
DOC |
DOC-poistuma ( %) |
Keskiarvo |
|||
|
Mitattu arvo |
Korjattu arvo |
|||||
|
Vesi + testattava aine |
a |
|
|
|
— |
— |
|
Liete + testattava aine |
b1 |
|
bl-c |
|
|
|
|
Liete + testattava aine |
b2 |
|
b2-c |
|
|
|
|
Liete + testattava aine |
b3 |
|
b3-c |
|
|
|
|
Taustanäyte |
c |
|
— |
|
— |
— |

7. SPESIFISEN KEMIKAALIN ANALYYTTISET TIEDOT
|
|
Testattavan kemikaalin jäännösmäärä kokeen lopussa |
Prosentuaalinen hajoaminen |
|
Veteen sekoitettu taustanäyte |
Sb |
|
|
Siirrostettu näyte |
sa1 |
|
|
sa2 |
|
|
|
sa3 |
|
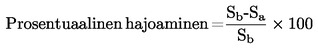
Pullojen a1, a2 ja a3 prosentuaalinen hajoaminen lasketaan vastaavalla tavalla.
8. HUOMAUTUKSET
Jos käytettävissä on käyrä, johon on piirretty BOD-arvot ajan funktiona, se on liitettävä raporttiin.
LIITE I
LYHENTEITÄ JA MÄÄRITELMIÄ
|
DO |
: |
”Dissolved oxygen” (mg/l) -Vesinäytteeseen liuenneen hapen pitoisuus. |
|
BOD |
: |
”Biochemical oxygen demand” (g) — Happimäärä, jonka pieneliöt kuluttavat testattavan yhdisteen metaboloinnin yhteydessä. BOD ilmaistaan myös hapenkulutuksena (g) testattavan aineen painoa (g) kohti (katso menetelmää C.5). |
|
COD |
: |
”Chemical oxygen demand” (g) — Hapenkulutus, kun testattavaa yhdistettä hapetetaan kuumalla, happamalla dikromaatilla. Suure, joka ilmaisee hapetuskelpoisen aineksen määrän yhdisteessä. COD ilmaistaan myös hapenkulutuksena (g) testattavan aineen massaa (g) kohti (katso menetelmää C.6). |
|
DOC |
: |
”Dissolved organic carbon” — Liuoksessa oleva orgaaninen hiili tai orgaaninen hiili, joka läpäisee 0,45 μm:n suodattimen tai jää pinnalle, kun liuosta on sentrifugoitu nopeudella 40 000 m.s-2 (±4 000 g) 15 minuutin ajan. |
|
ThOD |
: |
”Theoretical oxygen demand” (mg) — Happimäärä, joka tarvitaan kemikaalin täydelliseen hapettamiseen. Lasketaan molekyylikaavan avulla (katso liitettä II.2). ThOD ilmaistaan hapenkulutuksena (mg) testattavan aineen massaa kohti (mg). |
|
ThCO2 |
: |
”Theoretical carbon dioxide” (mg) — Hiilidioksidimäärä, joka lasketaan saatavan testattavan aineen tunnetusta tai mitatusta, epäorgaaniseen muotoon muunnetusta hiilestä. ThCO2 ilmaistaan myös muodostuneen hiilidioksidin painona (mg) testattavan aineen massaa (mg) kohti. |
|
TOC |
: |
”Total organic carbon” — Näytteen orgaanisen hiilen summa liuoksesta ja supensiosta mitattuna. |
|
IC |
: |
”Inorganic carbon” — Epäorgaaninen hiili. |
|
TC |
: |
”Total carbon” — Näytteen orgaanisen ja epäorgaanisen hiilen summa. |
Primaarinen biohajoaminen
Biologisen aktiviteetin aiheuttama aineen kemiallisen rakenteen muuttuminen, jonka seurauksena aine menettää spesifisen ominaisuutensa.
Lopullinen (aerobinen) biohajoaminen
Hajoamisen taso, joka saavutetaan, kun eliöt ovat hyödyntäneet testattavan aineen täysin. Tämän prosessin tuloksena syntyy hiilidioksidia, vettä, epäorgaanisia suoloja ja uutta mikrobista solukkoa (biomassaa).
Helposti biohajoava
Tietyt lopullisen biohajoamisen seulontatestit läpäisseiden kemikaalien yleisluokitus. Kyseiset testit ovat niin tiukkoja, että tällaisten aineiden voidaan katsoa olevan nopeasti ja täydellisesti biohajoavia vedessä ja aerobisissa olosuhteissa.
Itsestään biohajoava
Kemikaali, jonka tiedetään varmojen todisteiden perusteella olevan primäärisesti tai lopullisesti biohajoava kaikissa tunnetuissa biohajoavuustesteissä.
Käsiteltävyys
Yhdisteiden poistettavuus jätevedestä sen biologisen käsittelyn yhteydessä ilman käsittelyprosessien normaalille toiminnalle koituvia häiriöitä. Helposti biohajoavat yhdisteet ovat yleensä käsiteltäviä, mutta kaikki itsestään biohajoavat yhdisteet eivät. Myös abioottisia prosesseja tapahtuu.
Latenssiaika
Aika, joka kuluu vaimennuskokeessa / die-away –kokeessa siirroshetkestä vähintään 10 %:n hajoamistason saavuttamiseen. Latenssiaika on usein erittäin vaihteleva, ja sen toistettavuus on huono.
Hajoamisaika
Hajoamisaika on latenssiajan päättymistä seuraava, 90 %:n hajoamistason saavuttamiseen kuluva ajanjakso.
10-päiväinen jakso
10 %:n hajoamistason saavuttamista seuraavat 10 päivää.
LIITE II
SOPIVIEN YHTEENVETOPARAMETRIEN LASKENTA JA MÄÄRITYS
Joissakin menetelmissä tarvitaan määrättyjä yhteenvetoparametreja. Näiden arvojen laskeminen kuvataan jäljempänä. Parametrien käyttö kuvataan yksittäisten menetelmien yhteydessä.
1. Hiilimäärä
Hiilimäärä lasketaan tunnetusta alkuainekokoonpanosta tai määritetään testattavan aineen alkuaineanalyysin avulla.
2. Teoreettinen hapenkulutus (ThOD)
ThOD-arvo voidaan laskea alkuainekokoonpanosta tai määrittää alkuaineanalyysin avulla. Jos alkuainekokoonpano on esimerkiksi:
CcHhClclNnNanaOoPpSs
eikä nitrifikaatiota tapahdu, ThOD-arvo voidaan laskea seuraavan suureyhtälön avulla:
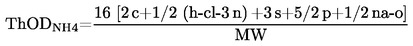 mg/mg
mg/mg
Jos tapahtuu nitrifikaatiota, ThOD-arvo voidaan laskea seuraavan suureyhtälön avulla:
 mg/mg
mg/mg
3. Kemiallinen hapenkulutus (COD)
Kemiallinen hapenkulutus (COD) määritetään menetelmän C.6 mukaan.
4. Liuennut orgaaninen hiili (DOC)
Määritelmän mukaan liuennut orgaaninen hiili (DOC) on kemikaalin tai seoksen veteen liuennut aines, joka läpäisee 0,45 μm:n suodattimen.
Testiastioista otetaan näytteet, jotka suodatetaan heti kalvosuodatinlaitteessa. Suodoksen ensimmäinen 20 ml:n osuus (jos käytetään pieniä suodattimia, määrä voi olla pienempi) hylätään. Hiilianalyysiä varten käytetään 10–20 ml (tai pienempi määrä, jos näyte annetaan ruiskulla; määrä vaihtelee hiilianalysaattorin mukaan). DOC-pitoisuus määritetään orgaanisella hiilianalysaattorilla, jonka tarkkuuden on oltava riittävä sellaisten pitoisuuksien mittaamiseen, jotka ovat enintään 10 % testin alussa vallinneesta DOC-pitoisuudesta.
Jos suodatettuja näytteitä ei pystytä analysoimaan samana päivänä, niitä voidaan säilyttää 2–4 oC:n lämpötilassa enintään 48 tuntia. Jos säilytysaika on tätä pitempi, näytteitä on säilytettävä - 18 oC:ssa tai tätä alhaisemmassa lämpötilassa.
Huomautuksia:
Hydrofiilisyyden parantamiseksi kalvosuodattimet on usein kyllästetty pinta-aktiivisilla aineilla. Tämän vuoksi suodattimessa voi olla useita milligrammoja liukoista orgaanista hiiltä, mikä voi häiritä biohajoavuusmäärityksiä. Pinta-aktiiviset aineet ja muut liukoiset orgaaniset yhdisteet poistetaan keittämällä suodattimia ionisoimattomassa vedessä tunnin ajan. Käsittely toistetaan kolme kertaa. Keittämisen jälkeen suodattimia voidaan säilyttää vedessä viikon ajan. Jos käytetään kertakäyttösuodattimia, jokainen erä on tarkastettava liukenevan orgaanisen hiilen suhteen.
Joidenkin kalvosuodatintyyppien kohdalla testattavaa kemikaalia voi kiinnittyä suodattimeen adsorption kautta. Siksi on suositeltavaa varmistaa, että testattava kemikaali ei kiinnity käytettävään suodattimeen.
TOC:n ja DOC:n osuudet näytteessä voidaan määrittää sentrifugoimalla (4 000 g: 40 000 ms-2, 15 minuuttia) suodatuksen asemesta. Sentrifugoinnin tuloksiin ei voi luottaa, jos alkuperäinen DOC-pitoisuus on pienempi kuin 10 mg/l, koska tällöin kaikki bakteerit eivät välttämättä poistu tai bakteeriplasman orgaaninen hiili liukenee uudelleen.
VIITTEET
|
— |
Standard Methods for the Examination of Water and Wastewater, 12th ed, Am. Publ. Hlth. Ass., Am. Wat. Poll. Control Fed., Oxygen Demand, 1965, p 65. |
|
— |
Wagner, R. Von Wasser, 1976, Vol. 46, 139. |
|
— |
DIN-Entwurf 38 409 Teil 41 — Deutsches Einheitsverfahren zur Wasser-, Abwasser- und Schlammuntersuchung, Summarische Wirkungs — und Stoffkenngrößen (Gruppe H). Bestimmung des chemischen Sauerstoffbedarfs (CSB) (H 41), Normenausschuß Wasserwesen (NAW) in DIN Deutsches Institut für Normung e. V. |
|
— |
Gerike, P., The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, Vol. 13(1), 169. |
Liite III
HUONOSTI LIUKENEVIEN AINEIDEN BIOHAJOAVUUDEN ARVIOINTI
Huonosti liukenevien aineiden biohajoavuustesteissä on otettava huomioon eräitä erityisseikkoja, jotka kuvataan jäljempänä.
Homogeenisten nesteiden kohdalla ei yleensä ole näytteenotto-ongelmia. Kiinteät aineet sen sijaan on suositeltavaa homogenisoida sopivalla tavalla. Kun tarvitaan muutaman milligramman suuruinen, edustava näyte paljon epäpuhtauksia sisältävästä kemikaaliseoksesta tai aineesta, on noudatettava erityistä tarkkuutta.
Testin aikana voidaan käyttää erilaisia hämmennysmenetelmiä. Hämmennyksen on oltava riittävää pitämään kemikaali dispergoituneena, mutta ei niin voimakasta, että syntyy ylikuumenemista, vaahdonmuodostusta tai tarpeettoman suuria leikkaavia voimia.
Stabiili dispersio voidaan tuottaa myös emulgaattorin avulla. Testiolosuhteissa emulgaattori ei saa olla bakteereille myrkyllinen tai biohajoava, eikä se saa aiheuttaa vaahdonmuodostusta.
Liuottimia koskevat vaatimukset ovat samat kuin emulgaattoreiden kohdalla.
Kiinteitä kantoaineita ei ole suositeltavaa käyttää kiinteiden aineiden testauksessa. Ne voivat kuitenkin sopia öljymäisten aineiden testaukseen.
Kun käytetään apuaineita (emulgaattoreita, liuottimia tai kantoaineita), testiin on sisällytettävä apuainetta sisältävä taustanäyte.
Huonosti liukenevien aineiden biohajoavuusmäärityksissä voidaan käyttää mitä tahansa kolmesta edellä kuvatusta respirometriatestistä (CO2-, BOD- tai MITI-menetelmää).
VIITTEET
|
— |
de Morsier, A. et al. Biodegradation tests for poorly soluble compounds. Chemosphere, 1987, Vol. 16, 833. |
|
— |
Gerike, P. The Biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, Vol. 13, 169. |
Liite 4
BIOHAJOAVUUDEN ARVIOINTI, KUN EPÄILLÄÄN, ETTÄ TESTATTAVA KEMIKAALI ON SIIRROSAINEELLE MYRKYLLINEN
Jos biohajoavuustesti osoittaa, että kemikaali ei ole biohajoava, jäljempänä kuvattavan menetelmän avulla voidaan tarvittaessa määrittää, johtuuko tämä inhibitiosta vai testattavan kemikaalin inerttiydestä (Reynolds et al., 1987).
Myrkyllisyys- ja biohajoavuustesteissä on käytettävä samaa tai samankaltaista siirrosainetta.
Kun kemikaalin biohajoavuutta testataan, kemikaalin myrkyllisyyttä voidaan arvioida käyttämällä aktiivilietteen hengityksenestotestiä (direktiivi 88/302/ETY), BOD-määritystä tai kasvunestomenetelmää yhdessä tai erikseen.
Jos testattavan aineen myrkyllisyyden aiheuttamaa inhibitiota on vältettävä, ehdotetaan, että testattavan aineen pitoisuus pidetään biohajoavuustesteissä enintään kymmenesosana myrkyllisyystestin tuloksena saadusta EC50-arvosta (tai pienempänä kuin EC20-arvo). Yhdisteet, joiden EC50-arvo on suurempi kuin 300 mg/l, eivät todennäköisesti aiheuta myrkyllisyysongelmia hyvää biohajoavuutta testattaessa.
Jos aineen EC50-arvo on pienempi kuin 20 mg/l, testissä on odotettavissa ongelmia. Tällöin testattavaa ainetta on käytettävä pieninä pitoisuuksina, joten suljetun pullon testimenetelmää tai 14C-merkittyjä aineita suositellaan. Vaihtoehtoisesti voidaan käyttää siirrosaineen akklimatisointia, joka mahdollistaa testattavan aineen annostelun suurempina pitoisuuksina kuin edellä mainittuja menetelmiä käytettäessä (tällöin hyvää biohajoavuutta ei kuitenkaan voida määrittää).
VIITTEET
Reynolds, L. et al. Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 1987, Vol. 16, 2259.
Liite V
NITRIFIKAATION AIHEUTTAMAN HAPENKULUTUKSEN HÄIRIÖN KORJAUS
Kun typpeä sisältämättömän aineen biohajoavuutta arvioidaan hapenkulutuksen avulla, nitrifikaation aiheuttama virhe on marginaalinen (enintään 5 %) siitä huolimatta, että liuoksen ammoniakin typpi hapettuu epäsäännöllisesti testattavaa ainetta ja taustanäytettä sisältävissä astioissa. Jos testattava aine sisältää typpeä, nitrifikaation aiheuttamat virheet voivat olla suuria.
Jos nitrifikaatiota on tapahtunut, mutta vain osittain, reaktioseoksen havaittua hapenkulutusta voidaan korjata sen happimäärän osalta, joka tarvitaan ammoniakin hapettamiseen nitriitiksi ja nitraatiksi. Tämä edellyttää sitä, että inkubaation aikana syntyvät nitriitti- ja nitraattipitoisuuksien muutokset määritetään seuraavien suureyhtälöiden avulla:
Yhtälöstä 1 nähdään, että ammoniumkloridin (NH4Cl:n) typpisisällön (28 g) hapettamiseen nitriitiksi tarvitaan 96 g happea, eli kerroin on 3,43 (96/28).
|
2 NH4Cl + 3 O2 = 2 HNO2 + 2 HCl + 2 H2O |
(1) |
|
2 HNO2 + O2 = 2 HNO3 |
(2) |
|
Summayhtälö on seuraava |
|
|
2 NH4Cl + 4 O2 = 2 HNO3 + 2 HCl + 2 H2O |
(3) |
Yhtälöstä 3 nähdään samoin, että 28 g:n typpimäärän hapettamiseen nitraatiksi tarvitaan 128 g happea, eli kerroin on 4,57 (128/28).
Koska reaktiot tapahtuvat peräkkäin ja erilaisten bakteerien vaikutuksesta, nitriittipitoisuus voi vaihdella. Jos se on pieni, nitraattipitoisuus on vastaavasti suurempi. Tällöin nitraatin muodostukseen kuluva happimäärä on 4,57 kerrottuna nitraattipitoisuuden kasvulla ja nitriitinmuodostukseen kuluva happimäärä on 3,43 kerrottuna nitriittipitoisuuden kasvulla. Jos nitriittipitoisuus on pienentynyt, hapenkulutus on -3,43 kerrottuna pitoisuuden pienenemisellä.
Tästä seuraa, että
|
nitraatinmuodostuksen kuluttama happimäärä = 4,57 x nitriittipitoisuuden kasvu |
(4) |
|
ja |
|
|
nitriitinmuodostuksen kuluttama happimäärä = 3,43 x nitriittipitoisuuden kasvu |
(5) |
|
ja |
|
|
nitriittipitoisuuden pienenemisen myötä hävinnyt happimäärä = -3,43 x nitraattipitoisuuden pieneneminen, |
(6) |
|
joten |
|
|
nitrifikaation aiheuttama hapenkulutus = ±3,43 x nitriittipitoisuuden muutos +4,57 x nitraattipitoisuuden kasvu, |
(7) |
|
mistä seuraa, että |
|
|
hiilen hapettumiseen kuluva happimäärä = havaittu yhteiskulutus — nitrifikaatioon kuluva happimäärä. |
(8) |
Jos vain hapettuneen typen kokonaismäärä määritetään, voidaan olettaa, että nitrifikaation edellyttämä hapenkulutus on suunnilleen 4,57 x hapettuneen typen kasvu.
Tämän jälkeen hiilen hapettumisen edellyttämää, korjattua happimäärää verrataan ThOD NH3 -arvoon (katso liitettä II).
C.5 HAJOAMINEN — BIOKEMIALLINEN HAPENKULUTUS
1. MENETELMÄ
1.1 JOHDANTO
Tällä menetelmällä mitataan kiinteiden tai nestemäisten orgaanisten aineiden biokemiallista hapenkulutusta (BOD).
Testin tiedot koskevat vesiliukoisia aineita, mutta testillä voidaan — ainakin periaatteessa — testata myös haihtuvia ja huonosti veteen liukenevia aineita.
Menetelmää voidaan soveltaa vain sellaisiin orgaanisiin aineisiin, jotka eivät estä bakteerien toimintaa testipitoisuutta käytettäessä. Jos testattava aine ei liukene testipitoisuutta käytettäessä, aineen riittävä dispersio voidaan varmistaa erikoismenetelmien (esimerkiksi ultraäänidispersion) avulla.
Jos tulokseksi saadaan pieniä arvoja, tulosten tulkinnassa ja testipitoisuuksien valinnassa voidaan käyttää kemikaalien myrkyllisyystietoja.
1.2 YKSIKÖT JA MÄÄRITELMÄT
Määritelmän mukaan BOD on liuenneen hapen massa, joka tarvitaan testattavan aineen annetun liuostilavuuden biokemialliseen hapettamiseen annetuissa olosuhteissa.
Tulokset ilmaistaan BOD-massana (g) testattavan aineen massaa (g) kohti.
1.3 VERTAILUAINEET
Sopivan vertailuaineen käyttöä siirrosaineen aktiviteetin tarkistamiseksi suositellaan.
1.4 TESTIMENETELMÄN PERIAATE
Tunnettuun määrään ainetta, joka on liuotettu tai dispergoitu hyvin ilmastettuun, sopivaan liuokseen, siirrostetaan mikroeliöitä, ja siirrostettua liuosta inkuboidaan pimeässä ja vakiolämpötilassa.
BOD-arvo määritetään liuenneen hapen alku- ja loppupitoisuuden perusteella. Testin kesto on 5–28 päivää.
Rinnan testiliuoksen kanssa on käytettävä taustaliuosta, jossa ei ole testattavaa ainetta.
1.5 LAATUKRITEERIT
BOD-määritystä ei hyväksytä aineen biohajoavuuden määrityksenä. BOD-määritystä voidaan käyttää vain seulontatestinä.
1.6 MENETELMÄKUVAUS
Aineesta valmistetaan alustava liuos tai dispersio, jonka BOD-pitoisuus on sopiva testimenetelmää varten. Liuoksen tai dispersion BOD-arvo määritetään sopivan kansallisen tai kansainvälisen standardisoidun menetelmän avulla.
2. TIEDOT JA ARVIOINTI
Alustavan liuoksen BOD-arvo lasketaan valitun menetelmän mukaan, ja tulos muunnetaan BOD-massaksi (g) testattavan aineen massaa (g) kohti.
3. RAPORTOINTI
Käytetty menetelmä ilmoitetaan.
Ilmoitettavan biokemiallisen hapenkulutuksen arvon on oltava vähintään kolmen hyväksyttävän mittauksen keskiarvo.
Kaikki tiedot ja huomautukset, joilla on merkitystä tulosten tulkinnan kannalta, on ilmoitettava. Tämä koskee erityisesti epäpuhtauksia, aineen fysikaalista olomuotoa, myrkyllisyyttä ja muita aineen ominaisuuksia, jotka voivat vaikuttaa tuloksiin.
Jos apuainetta on käytetty biologisen nitrifikaation estämiseksi, tämä on raportoitava.
4. VIITTEET
Seuraavassa on esimerkkejä standardisoiduista menetelmistä:
|
|
NF T 90-103: Determination of the biochemical oxygen demand. |
|
|
NBN 407: Biochemical oxygen demand. |
|
|
NEN 3235 5.4: Bepaling van het biochemish zuurstofverbruik (BZV). |
|
|
The determination of biochemical oxygen demand, Methods for the examination of water and associated materials, HMSO, London. |
|
|
ISO 5815: Determination of biochemical oxygen demand after n days. |
C.6 HAJOAMINEN — KEMIALLINEN HAPENKULUTUS
1. MENETELMÄ
1.1 JOHDANTO
Menetelmällä mitataan kiinteiden ja nestemäisten aineiden kemiallista hapenkulutusta (COD) valvotuissa laboratorio-olosuhteissa haluttua standardisoitua menettelyä noudattaen.
Testattavan aineen kemiallisen kaavan tunteminen (onko aine halogeenisuola, orgaanisen aineen ferrisuola, orgaaninen klooriyhdiste tms.) helpottaa testin suorittamista ja tulosten tulkintaa.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Kemiallinen hapenkulutus on aineen hapetettavuuden mitta. Aineen kemiallinen hapenkulutus ilmaistaan hapetusaineen kulutusta vastaavana happimääränä, kun ainetta hapetetaan valvotuissa laboratorio-olosuhteissa.
Kemiallinen hapenkulutus ilmaistaan COD-massana (g) testattavan aineen massaa (g) kohti.
1.3 VERTAILUAINEET
Uutta ainetta tutkittaessa ei aina tarvitse käyttää vertailuaineita. Vertailuaineita käytetään lähinnä menetelmän toimivuuden ajoittaiseen tarkistamiseen ja verrattaessa tuloksia muiden menetelmien avulla saatuihin tuloksiin.
1.4 TESTIMENETELMÄN PERIAATE
Tunnettua määrää veteen liuotettua tai dispergoitua ainetta hapetetaan kaliumdikromaatilla väkevässä rikkihapossa vastavirtaperiaatteen mukaan kahden tunnin ajan. Katalysaattorina käytetään hopeasulfaattia. Dikromaattijäännös määritetään standardisoidulla ferriammoniumsulfaatilla titraamalla.
Jos testattava aine sisältää klooria, liuokseen lisätään elohopeasulfaattia (10) kloridin aiheuttaman häiriön vähentämiseksi.
1.5 LAATUKRITEERIT
Koska COD-arvon määritysmenetelmä on tulkinnanvarainen,
COD-arvo on ”hapetettavuusindikaattori” ja sellaisenaan käytännöllinen tapa mitata orgaanista ainetta.
Jotkin rengasyhdisteet ja monet haihtuvat aineet (esimerkiksi lyhytketjuiset rasvahapot) eivät hapetu tässä testissä täysin.
1.6 TESTIMENETELMÄN PERIAATE
Valmistetaan aineen alustava liuos tai dispersio siten, että tuloksena saatava COD-arvo on 250–600 mg/l.
Huomautuksia:
Jos aine on huonosti liukenevaa tai dispergoitumatonta, testilaitteeseen voidaan panna veteen sekoitettuna hienoksi jauhettua tai nestemäistä ainetta, joka vastaa määrältään noin 5 mg:aa COD:tä.
Kemiallinen hapenkulutus (COD) voidaan usein — etenkin huonosti liukenevien aineiden kohdalla — määrittää käyttäen menetelmän muunnosta, joka perustuu paineentasaajalla varustettuun suljettuun järjestelmään (H. Kelkenberg, 1975). Muunnoksen avulla voidaan usein tehdä menestyksekkäästi kvantitatiivinen määritys aineista (esimerkiksi etikkahaposta), joiden määrittäminen perinteisellä menetelmällä on vaikeaa. Menetelmää ei kuitenkaan voida soveltaa pyridiiniin. Kaliumdikromaattipitoisuuden (katso viitettä 1) nostaminen arvoon 0,25 N (0,0416 M) mahdollistaa testattavan aineen suorapunnituksen 5–10 mg:n annoksena, mikä on tärkeää huonosti veteen liukenevien aineiden COD-määrityksessä (katso viitettä 2).
Muussa tapauksessa COD-arvo määritetään sopivan kansallisen tai kansainvälisen standardisoidun menetelmän avulla.
2. TIEDOT JA ARVIOINTI
Testipullojen sisällön COD lasketaan valitun normalisoidun menetelmän mukaan ja muunnetaan COD-massaksi (g) testatun aineen massaa (g) kohti.
3. RAPORTOINTI
Raportissa on oltava maininta käytetystä vertailumenetelmästä.
Ilmoitetun kemiallisen hapenkulutuksen arvon on oltava vähintään kolmen mittauksen keskiarvo. Kaikki tiedot ja huomautukset, joilla on merkitystä tulosten tulkinnan kannalta, on ilmoitettava. Tämä koskee erityisesti epäpuhtauksia, aineen fysikaalista olomuotoa, myrkyllisyyttä tai aineen muita tunnettuja ominaisuuksia, jotka voivat vaikuttaa tuloksiin.
Jos kloridin häiritsevä vaikutus on pyritty minimoimaan elohopeasulfaatilla, tämä on raportoitava.
4. VIITTEET
|
1) |
Kelkenberg, H., Z. von Wasser und Abwasserforschung, 1975, vol. 8, 146. |
|
2) |
Gerike, P. The biodegradability testing of poorly water soluble compounds. Chemosphcre, 1984, vol. 13, 169. Seuraavassa on esimerkkejä normalisoiduista menetelmistä.
|
C.7. HAJOAMINEN — ABIOOTTINEN HAJOAMINEN: HYDROLYYSI PH:N FUNKTIONA
1. MENETELMÄ
Tämä menetelmä vastaa OECD:n testiohjetta nro TG 111 (2004).
1.1 JOHDANTO
Kemikaalit voivat päästä pintavesiin esimerkiksi suoraan laskettuina, lentosumutuksen yhteydessä, valumana sekä viemäröinnin, jätteiden käsittelyn, teollisuuden, kotitalouden tai maanviljelyn päästöinä ja ilmakehän laskeumina. Ne voivat sen jälkeen hajota vesissä kemiallisten (esim. hydrolyysi ja hapettuminen), valokemiallisten ja/tai mikrobiprosessien kautta. Tässä testiohjeessa kuvataan laboratoriotestimenetelmä, jolla voidaan arvioida kemikaalien abioottinen hydrolyyttinen hajoaminen vesiympäristössä pH-arvoilla, jotka siellä tavallisesti vallitsevat (pH 4–9). Menetelmä perustuu jo olemassa oleviin testiohjeisiin (1) (2) (3) (4) (5) (6) (7).
Kokeissa määritetään i) testiaineen hydrolyysinopeus pH:n funktiona ja ii) hydrolyysituotteet, joille organismit voivat altistua, sekä niiden muodostumis- ja hajoamisnopeudet. Tällaisia tutkimuksia voivat edellyttää kemikaalit, jotka annostellaan suoraan veteen tai jotka päätyvät ympäristöön edellä mainittujen muiden reittien kautta.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Katso liite 2.
1.3 MENETELMÄN SOVELTAMISALA
Testi soveltuu kemiallisille aineille (merkityille tai merkitsemättömille), joille on olemassa analyysimenetelmä, jota voidaan soveltaa riittävällä tarkkuudella ja herkkyydellä. Tässä kuvattua menetelmää voidaan soveltaa lievästi haihtuviin ja haihtumattomiin yhdisteisiin, jotka ovat riittävän vesiliukoisia. Menetelmää ei voida soveltaa kemikaaleihin, jotka haihtuvat helposti vedestä (esim. savuavat aineet tai orgaaniset liuottimet) ja jotka eivät siis säily liuoksessa tässä kuvatuissa testiolosuhteissa. Testiä voi olla vaikea toteuttaa aineilla, joiden vesiliukoisuus on hyvin vähäinen (8).
1.4 TESTIMENETELMÄN PERIAATE
Testiaine lisätään steriileihin vesipohjaisiin puskuriliuoksiin, joilla on eri pH-arvot (pH 4, 7 ja 9). Liuoksia inkuboidaan sitten pimeässä valvotuissa laboratorio-olosuhteissa (vakiolämpötiloissa). Puskuriliuoksissa oleva testiaine ja hydrolyysituotteet analysoidaan sopivin väliajoin. Kun testiaine on merkitty jollain merkkiaineella (esim. 14C), massatase voidaan määrittää helpommin.
Testimenetelmä on suunniteltu monivaiheiseksi liitteessä 1 kuvatulla tavalla. Kukin vaihe riippuu edellisen vaiheen tuloksista.
1.5 TESTIAINETTA KOSKEVAT TIEDOT
Hydrolyysinopeuden mittaamiseen voidaan käyttää merkittyä tai merkitsemätöntä testiainetta. Merkittyä testiainetta suositellaan yleensä hydrolyysireittien tutkimiseen ja massataseen määrittämiseen. On kuitenkin tapauksia, joissa merkkiaineen käyttö ei ole ehdottoman välttämätöntä. 14C on suositeltava leima, mutta muitakin isotooppeja, kuten 13C, 15N tai 3H, voidaan käyttää. Leiman pitäisi mahdollisuuksien mukaan sijaita molekyylin stabiileimmassa osassa tai osissa. Jos testiainemolekyyli sisältää esimerkiksi yhden renkaan, tämä rengas täytyy merkitä. Jos testiaine sisältää kaksi tai useampia renkaita, saatetaan tarvita erillinen testi kunkin merkityn renkaan reitin arvioimiseksi ja tarvittavan tiedon saamiseksi hydrolyysituotteiden muodostumisesta. Testiaineen puhtausasteen tulisi olla vähintään 95 %.
Ennen hydrolyysitestin tekemistä testiaineesta on oltava saatavilla seuraavat tiedot:
|
(a) |
vesiliukoisuus [testimenetelmä A.6]; |
|
(b) |
liukoisuus orgaanisiin liuottimiin; |
|
(c) |
höyrynpaine [testimenetelmä A.4] ja/tai Henryn lain vakio; |
|
(d) |
n-oktanoli/vesi-jakaantumiskerroin [testimenetelmä A. 8]; |
|
(e) |
dissosiaatiovakio (pKa) [OECD:n testiohje 112] (9); |
|
(f) |
suoran ja epäsuoran valokemiallisen muuntumisen nopeus vedessä (valoherkän aineen ollessa kyseessä). |
Käytettävissä on oltava analyysimenetelmät testiaineen kvantifioimiseksi sekä tarvittaessa hydrolyysituotteiden tunnistamiseksi ja kvantifioimiseksi vesiliuoksista (katso myös kohta 1.7.2).
1.6 VERTAILUAINEET
Mikäli mahdollista, hydrolyysituotteiden tunnistukseen ja kvantifiointiin on käytettävä vertailuaineita. Menetelminä käytetään spektroskopiaa ja kromatografiaa tai muita menetelmiä, joiden herkkyys on sopiva.
1.7 LAATUVAATIMUKSET
1.7.1 Saanto
Vähintään kahden puskuriliuoksen tai niiden uutteiden analysointi heti testiaineen lisäämisen jälkeen antaa alustavia tietoja analyysimenetelmän toistettavuudesta ja testiaineen lisäämismenetelmän tasaisuudesta. Saanto testin myöhemmissä vaiheissa määritetään vastaavan massataseen mukaan (kun käytetään merkittyä ainetta). Saantojen tulisi olla 90–110 % sekä merkittyä että merkitsemätöntä ainetta käytettäessä (7). Jos tätä on teknisesti vaikea saavuttaa, merkitsemättömien aineiden osalta hyväksytään 70 prosentin saanto, mutta tämä on perusteltava.
1.7.2 Analyysimenetelmän toistettavuus ja herkkyys
Testiaineen ja hydrolyysituotteiden myöhempään kvantifiointiin käytettävän analyysimenetelmän tai -menetelmien toistettavuus voidaan tarkistaa kaksoismäärittämällä samat puskuriliuokset (tai niiden uutteet) sen jälkeen, kun on muodostunut riittävästi hydrolyysituotteita kvantifioitavaksi.
Analyysimenetelmän on oltava riittävän herkkä, jotta sen avulla voidaan kvantifioida testiaineen pitoisuudet, jotka ovat 10 % alkuperäisestä pitoisuudesta tai tätä vähemmän. Tarvittaessa analyysimenetelmien pitäisi olla myös riittävän herkkiä, jotta niiden avulla voidaan (milloin tahansa tutkimuksen aikana) kvantifioida hydrolyysituotteet, jotka ovat 10 prosenttia tai enemmän annostellusta testiaineesta, ja kvantifioinnin on oltava mahdollista pitoisuuksissa, jotka ovat 25 % suurimmasta pitoisuudesta tai tätä vähemmän.
1.7.3 Hydrolyysin kineettisten mittaustietojen luottamusvälit
Luottamusvälit on laskettava ja esitettävä kaikille regressiokertoimille, nopeusvakioille, puoliintumisajoille ja mahdollisille muille kineettisille parametreille (esim. DT50).
1.8 TESTIMENETELMÄN KUVAUS
1.8.1 Laitteet
Testi on suoritettava lasiastioissa (esimerkiksi koeputkissa tai pulloissa), tarvittaessa pimeässä ja steriileissä olosuhteissa, paitsi jos esitiedot (kuten n-oktanoli-vesi-jakaantumiskerroin) osoittavat, että testiaine saattaa kiinnittyä lasiin. Tällöin voidaan harkita jonkin muun materiaalin, esimerkiksi teflonin, käyttöä. Jos testiaineen tiedetään kiinnittyvän lasiin, ongelmaa voidaan helpottaa myös yhdellä tai useammilla seuraavista tavoista:
|
— |
Määritetään testiastiaan kiinnittyneen testiaineen ja hydrolyysituotteiden massa. |
|
— |
Käytetään ultraäänihaudetta. |
|
— |
Pestään kaikki lasitavarat liuottimella kunkin näytteenottokerran jälkeen. |
|
— |
Käytetään kaupallisia valmisteita. |
|
— |
Lisätään testiaine järjestelmään lisäliuottimen avulla; tällöin lisäliuottimen on oltava aine, joka ei hydrolysoi testiainetta. |
Yleensä vaatimuksena on, että eri testiliuosten inkubointiin käytetään lämpötilakontrolloituja vesihauderavistimia tai termostaattisesti ohjattuja inkubaattoreita.
Testissä tarvitaan tavanomaisia laboratoriolaitteita, erityisesti seuraavia:
|
— |
pH-mittari, |
|
— |
analyyttiset laitteet, kuten GC-, HPLC- ja TLC-laitteet, mukaan luettuina radioaktiivisten tai muiden kuin radioaktiivisten merkkiaineiden osoittamiseen soveltuvat järjestelmät tai käänteinen isotooppilaimennusmenetelmä, |
|
— |
tunnistukseen käytettävät laitteet (esimerkiksi MS-, GC-MS-, HPLC-MS-spektrometri tai NMR-laite), |
|
— |
nestetuikelaskin, |
|
— |
erotussuppilot neste-neste-uuttoa varten, |
|
— |
liuosten ja uutteiden konsentrointivälineet (esimerkiksi pyöröhaihdutin), |
|
— |
lämpötilakontrolloitu laite (esim. vesihaude). |
Esimerkiksi seuraavia kemiallisia reagensseja tarvitaan:
|
— |
orgaaniset liuottimet (analyysilaatu), kuten heksaani tai dikloorimetaani, |
|
— |
tuikeneste, |
|
— |
puskuriliuokset (tiedot kohdassa 1.8.3). |
Kaikki hydrolyysitesteissä käytettävät lasiastiat, vesi (reagenssilaatu) ja puskuriliuokset on steriloitava.
1.8.2 Testiaineen annostelu
Testiaine annostellaan vesiliuoksena eri puskuriliuoksiin (katso liite 3). Jos riittävä liukeneminen sitä edellyttää, testiaineen annostelussa voidaan käyttää pieniä määriä veteen sekoittuvia liuottimia (esimerkiksi asetonitriiliä, asetonia tai etanolia), mutta niiden määrä ei saa yleensä olla enempää kuin 1 tilavuusprosentti. Mikäli liuottimia aiotaan käyttää suurempina pitoisuuksina (esim. kun on kyse huonoliukoisista testiaineista), tämä sallitaan vain, jos voidaan osoittaa, että liuottimella ei ole vaikutusta testiaineiden hydrolyysiin.
Kaupallisten valmisteiden käyttö testissä ei ole yleensä suositeltavaa, koska ei voida sulkea pois sitä mahdollisuutta, että valmisteen ainesosat voivat vaikuttaa hydrolyysiprosessiin. Mikäli on kuitenkin kyse huonosti vesiliukoisista aineista tai lasiin kiinnittyvistä aineista (katso kohta 1.8.1), kaupallisten valmisteiden käyttö voi olla sopiva vaihtoehto.
Testiainetta saisi käyttää vain yhdessä pitoisuudessa, joka ei saisi olla yli 0,01 M tai yli puolet kyllästymispitoisuudesta (katso liite 1).
1.8.3 Puskuriliuokset
Hydrolyysitesti olisi toteutettava pH-arvoilla 4, 7 ja 9. Tätä varten puskuriliuokset olisi valmistettava käyttäen reagenssilaadun kemikaaleja ja vettä. Joitain sopivia puskurijärjestelmiä esitellään liitteessä 3. On huomattava, että puskurijärjestelmä voi vaikuttaa hydrolyysin nopeuteen. Jos tällainen vaikutus havaitaan, olisi käytettävä jotain muuta puskurijärjestelmää1 (11).
Kunkin puskuriliuoksen pH olisi tarkistettava kalibroidulla pH-mittarilla vähintään pH-yksikön kymmenesosan tarkkuudella ja vaaditussa lämpötilassa.
1.8.4 Koeolosuhteet
1.8.4.1 Testilämpötila
Hydrolyysikokeet on suoritettava vakioiduissa lämpötiloissa. Ekstrapolointitarkoituksia varten on tärkeää, että lämpötilaa ylläpidetään vähintään tarkkuudella 0,5 oC.
Alustava testi (vaihe 1) olisi suoritettava lämpötilassa 50 oC, jos testiaineen hydrolyyttinen käyttäytyminen on tuntematon. Seuraavan vaiheen kineettiset testit olisi suoritettava vähintään kolmessa lämpötilassa (mukaan lukien 50 oC:ssa suoritettava testi), ellei vaiheen 1 testissä todettu, että testiaine on hydrolyyttisesti stabiili. Suositeltava lämpötila-alue on 10–70 oC (mielellään siten, että ainakin yksi käytetty lämpötila on alle 25 oC). Tämä lämpötila-alue kattaa raportointilämpötilan 25 oC ja useimmat kentällä vallitsevat lämpötilat.
1.8.4.2 Valo ja happi
Kaikki hydrolyysitestit on suoritettava käyttäen sopivaa menetelmää, jolla vältetään fotolyyttiset vaikutukset. Happi pitäisi pyrkiä poistamaan kaikin sopivin tavoin (esim. poreiluttamalla heliumia, typpeä tai argonia viiden minuutin ajan ennen liuoksen valmistamista).
1.8.4.3 Testin kesto
Alustavan testin kesto on viisi päivää, ja myöhempien vaiheiden testejä tulisi jatkaa, kunnes 90 % testiaineesta on hydrolysoitunut, tai 30 päivän ajan sen mukaan, kumpi on varhaisempi.
1.8.5 Testin suorittaminen
1.8.5.1 Alustava testi (vaihe 1)
Alustava testi suoritetaan lämpötilassa 50 ±0,5 oC ja pH-arvoilla 4,0, 7,0 ja 9,0. Jos viiden päivän jälkeen havaittu hydrolyysi on vähemmän kuin 10 % (t0,525 oC > 1 vuosi), testiaine katsotaan hydrolyyttisesti stabiiliksi ja lisätestausta ei yleensä tarvita. Jos aineen tiedetään olevan epästabiili sellaisissa ympäristön lämpötiloissa (12), joissa aine esiintyy, alustavaa testiä ei vaadita. Analyysimenetelmän on oltava riittävän tarkka ja herkkä, jotta sillä voidaan havaita 10 prosentin vähennys alkuperäisestä pitoisuudesta.
1.8.5.2 Epästabiilien aineiden hydrolyysi (vaihe 2)
Seuraavan vaiheen testi suoritetaan niillä pH-arvoilla, joilla testiaine todettiin epästabiiliksi alustavassa testissä. Testiaineen puskuriliuosten lämpötila säädetään valittuihin lämpötiloihin termostaatin avulla. Ensimmäisen kertaluvun reaktioiden testaamiseksi kukin reaktioliuos analysoidaan sellaisin aikavälein, että saadaan ainakin kuusi datapistettä, yleensä alueella, joka vastaa 10–90 prosentin hydrolyysiä. Yksittäiset rinnakkaiset testinäytteet (vähintään kaksi rinnakkaista näytettä erillisissä reaktioastioissa) otetaan ja niiden sisältö analysoidaan kussakin vähintään kuudesta näytteenottoajankohdasta (ts. vähintään kaksitoista kaksoismääritettyä datapistettä). Ei riitä, että käytetään yhtä ainoaa näytettä, josta otetaan yhtä suuret määrät testiliuosta kunakin näytteenottoajankohtana, koska tämä ei mahdollista vaihtelukertoimen määritystä ja voi johtaa ongelmiin testiliuoksen kontaminoitumisen vuoksi. Tämän vaiheen lopussa (ts. kun hydrolyysi on 90-prosenttinen tai 30 päivän jälkeen) on suoritettava testi steriiliyden vahvistamiseksi. Jos hajoamista ei havaita, steriiliystestiä ei katsota tarpeelliseksi.
1.8.5.3 Hydrolyysituotteiden tunnistaminen (vaihe 3)
Hydrolyysituotteet ja ainakin sellaiset, jotka edustavat > 10 %:a annostellusta määrästä, on tunnistettava sopivilla analyysimenetelmillä.
1.8.5.4 Vapaaehtoiset lisätestit
Hydrolyyttisesti epästabiili testiaine voi edellyttää lisätestejä myös muilla pH-arvoilla kuin 4, 7 ja 9. Esimerkiksi fysiologisia tarkoituksia varten voidaan tarvita happamampien olosuhteiden testi (esim. pH 1,2), jossa käytetään yhtä ainoaa fysiologisesti relevanttia lämpötilaa (37 oC).
2. TULOKSET
Testiaineen ja hydrolyysituotteiden määrät annetaan prosentteina annostellusta lähtöpitoisuudesta ja tarvittaessa yksikkönä mg/l kunkin näytteenottovälin osalta ja kunkin pH-arvon ja testilämpötilan osalta. Lisäksi massatase pitäisi antaa prosentteina annostellusta lähtöpitoisuudesta, jos on käytetty leimattua testiainetta.
Testiaineen pitoisuuksista ajan funktiona olisi annettava graafinen esitys logaritmiasteikolla. Mahdolliset hydrolyysituotteet ja ainakin sellaiset, jotka edustavat ≥ 10 %:a annostellusta määrästä, on tunnistettava ja niiden pitoisuuksia koskevat tiedot esitettävä samalla tavalla graafisesti logaritmiasteikolla kuin alkutuotteen osalta siten, että niiden muodostumis- ja hajoamisnopeudet voidaan määrittää.
2.1 TULOSTEN KÄSITTELY
Puoliintumisajat tai DT50-arvot on määriteltävä tarkemmin sopivalla kinetiikkamalliin perustuvalla laskutavalla. Puoliintumisaikojen arvot ja/tai DT50-arvot (mukaan luettuina luottamusvälit) on ilmoitettava kunkin pH-arvon ja lämpötilan osalta. Samalla on ilmoitettava käytetty malli, kinetiikan kertaluku ja determinaatiokerroin (r2). Tarvittaessa laskelmat on tehtävä myös hydrolyysituotteista.
Suoritettaessa nopeustutkimuksia eri lämpötiloissa pseudo-ensimmäisen kertaluvun hydrolyysireaktion nopeusvakiot (kobs = khav) pitäisi esittää lämpötilan funktiona. Laskemisen täytyisi pohjautua sekä hydrolyysityypeittäin (happokatalysoitu, neutraali tai emäskatalysoitu) eriteltyihin havaittuihin nopeusvakioihin (vastaavasti kH, kneutraali tai kOH) että Arrheniuksen yhtälöön:

jossa Ai ja Bi ovat regressiovakioita parhaiten sopivien suorien vastaavasta leikkauskohdasta ja kulmakertoimesta. Vakiot on saatu lineaarisella regressiolla kuvaajasta ln (ki) vs. 1/T. Soveltamalla Arrheniuksen yhtälöä hapon katalysoimaan, neutraaliin tai emäksen katalysoimaan hydrolyysiin voidaan pseudo-ensimmäisen kertaluvun hydrolyysin nopeusvakiot ja siten myös puoliintumisajat laskea muille lämpötiloille, joille ei ole mahdollista toteuttaa suoraa, kokeellista nopeusvakion määrittämistä (10).
2.2 TULOSTEN ARVIOINTI JA TULKINTA
Useimpien hydrolyysireaktioiden reaktionopeus on lähellä ensimmäisen kertaluvun reaktion nopeutta, joten puoliintumisajat riippuvat pitoisuudesta (katso yhtälö 4 liitteessä 2). Tämä merkitsee sitä, että välillä 10-2-10-3 määritetyt laboratoriotulokset ovat siirrettävissä ympäristöolosuhteisiin (≤ 10-6 M) (10). Mabey ja Mill (11) mainitsevat useita esimerkkejä puhtaassa vedessä ja luonnonvesissä mitattujen hydrolyysinopeuksien hyvästä keskinäisestä vastaavuudesta useiden kemikaalien osalta, edellyttäen että sekä pH että lämpötila oli mitattu.
3. TULOSTEN ILMOITTAMINEN
3.1 TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot:
Testiaine:
|
— |
yleisnimi, kemiallinen nimi, CAS-numero, rakennekaava (josta käy ilmi leiman sijainti käytettäessä radioaktiivista merkkiainetta) ja merkitykselliset fysikokemialliset ominaisuudet (katso kohta 1.5), |
|
— |
testiaineen puhtaus (epäpuhtaudet), |
|
— |
merkkiaineella leimatun kemikaalin leiman puhtaus ja molaarinen aktiivisuus tapauksen mukaan. |
|
— |
Puskuriliuokset: |
|
— |
valmistusajankohdat ja –tiedot, |
|
— |
käytetyt puskurit ja vedet, |
|
— |
puskuriliuosten molaarisuus ja pH. |
Testiolosuhteet:
|
— |
testien suorituspäivämäärät, |
|
— |
testiaineen annosteltu määrä, |
|
— |
testiaineen annostelutapa ja annostelussa käytetyt liuottimet (tyyppi ja määrä), |
|
— |
testiaineen sisältävien puskuriliuosten inkuboinnissa käytetty volyymi, |
|
— |
kuvaus käytetystä inkubointijärjestelmästä, |
|
— |
pH ja lämpötila testin aikana, |
|
— |
näytteenottoajankohdat, |
|
— |
erotusmenetelmä(t), |
|
— |
menetelmät testiaineen ja hydrolyysituotteiden kvantifioimiseksi ja tunnistamiseksi puskuriliuoksista, |
|
— |
rinnakkaisnäytteiden määrä. |
Tulokset:
|
— |
käytettyjen analyysimenetelmien toistettavuus ja herkkyys, |
|
— |
saannot (kohdassa 1.7.1 annetaan validissa testissä saavutettavat prosenttiarvot), |
|
— |
rinnakkaisnäytteiden mittaustulokset ja keskiarvot taulukkomuodossa, |
|
— |
massatase testien aikana ja niiden lopuksi (kun käytetään merkkiainetta), |
|
— |
alustavan testin tulokset, |
|
— |
tulosten pohdinta ja tulkinta, |
|
— |
kaikki alkuperäiset mittaustulokset ja luvut. |
Seuraavat tiedot tarvitaan vain, kun määritetään hydrolyysinopeus:
|
— |
graafiset esitykset testiaineiden ja tarvittaessa hydrolyysituotteiden pitoisuuksista ajan funktiona ja kussakin pH-arvossa ja lämpötilassa, |
|
— |
Arrheniuksen yhtälöstä saadut tulokset lämpötilalle 20 oC/25 oC, mukana pH, nopeusvakio [h-1 tai päivä-1], puoliintumisaika tai DT50, lämpötilat [ oC] (mukaan luettuina luottamusvälit) sekä korrelaatiokertoimet (r2) tai vastaavat tiedot, |
|
— |
ehdotettu hydrolyysireitti. |
4. KIRJALLISUUSVIITTEET
|
(1) |
OECD (1981). Hydrolysis as a Function of pH. OECD Guideline for Testing of Chemicals Nr. 111, adopted 12 May 1981. |
|
(2) |
US-Environmental Protection Agency (1982). 40 CFR 796.3500, Hydrolysis as a Function of pH at 25 oC. Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate. |
|
(3) |
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada. |
|
(4) |
European Union (EU) (1995). Commission Directive 95/36/EC amending Council Directive 91/414/EEC concerning the placing of plant protection products on the market. Annex V: Fate and Behaviour in the Environment. |
|
(5) |
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air. |
|
(6) |
BBA (1980). Merkblatt Nr. 55, Teil I und II: Prüfung des Verhaltensvon Pflanzenbehandlungsmitteln im Wasser (October 1980). |
|
(7) |
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed. |
|
(8) |
OECD (2000). Guidance document on aquatic toxicity testing of difficult substances and mixtures, OECD Environmental Health and Safety Publications Series on Testing and Assessment Nr.23. |
|
(9) |
OECD (1993). Guidelines for the Testing of Chemicals. Paris. OECD (1994 — 2000): Addenda 6-11 to Guidelines for the Testing of Chemicals. |
|
(10) |
Nelson, H, Laskowski D, Thermes S, and Hendley P. (1997) Recommended changes in pesticide fate study guidelines for improving input to computer models. (Text version of oral presentation at the 14th Annual Meeting of the Society of Environmental Toxicology and Chemistry, Dallas TX, November 1993). |
|
(11) |
Mabey, W. and Mill, T. (1978). Critical review of hydrolysis of organic compounds in water under environmental conditions. J. Phys. Chem. Ref. Data 7, 383–415. |
Liite 1
Vaiheittainen hydrolyysitestimalli

Liite 2
Määritelmät ja yksiköt
Kaikissa tapauksissa on käytettävä kansainvälisen SI-standardin mukaisia yksikköjä.
Testiaine: mikä tahansa aine, joko lähtöaine tai merkitykselliset hajoamistuotteet.
Muuntumistuotteet: kaikki aineet, jotka syntyvät testiaineen bioottisista tai abioottisista muuntumisreaktioista.
Hydrolyysituotteet: kaikki aineet, jotka syntyvät testiaineen hydrolyyttisistä muuntumisreaktioista.
Hydrolyysi: testiaineen RX reaktio veden kanssa sillä lopputuloksella, että ryhmä X vaihtuu OH:n kanssa reaktiokeskuksessa.
|
RX + HOH → ROH + HX |
[1] |
Tässä yksinkertaistetussa prosessissa nopeus, jolla RX:n pitoisuus vähenee, on seuraavien kaavojen mukainen:
|
nopeus = k [H2O] [RX] |
toisen kertaluvun reaktio |
|
tai |
|
|
nopeus = k [RX] |
ensimmäisen kertaluvun reaktio |
riippuen reaktionopeutta määräävästä vaiheesta. Koska vettä on paljon enemmän kuin testiainetta, tämäntyyppinen reaktio kuvataan yleensä pseudo-ensimmäisen kertaluvun reaktiona, jossa havaittu nopeusvakio on
|
kobs = k [H2O] |
[2] |
ja reaktionopeus voidaan määrittää lausekkeesta (13)
|
|
[3] |
jossa
t= aika
ja Co, Ct= RX:n pitoisuudet ajankohdissa 0 ja t.
Tämän vakion yksiköiden dimensio on (aika)-1, ja reaktion puoliintumisaika (aika, jossa 50 % RX:stä on reagoinut) on
|
|
[4] |
Puoliintumisaika: (t0,5) on aika, joka kuluu testiaineen 50-prosenttiseen hydrolyysiin tapauksissa, joissa hajoaminen voidaan kuvata ensimmäisen kertaluvun kinetiikan avulla; se ei riipu pitoisuudesta.
DT 50 (häviämisaika 50): aika, jonka kuluessa testiaineen pitoisuus vähenee 50 %:lla; se eroaa puoliintumisajasta t0,5, kun reaktio ei ole ensimmäisen kertaluvun kinetiikan reaktio.
k:n arvioiminen eri lämpötiloissa
Kun nopeusvakiot tiedetään kahdessa lämpötilassa, nopeusvakiot voidaan laskea muiden lämpötilojen osalta käyttämällä Arrheniuksen yhtälöä:
![]() or
or 
Kun ln k esitetään graafisesti 1/T:n funktiona, saadaan suora viiva, jonka kulmakerroin on -E/R.
Tällöin:
|
k |
= |
eri lämpötiloissa mitattu nopeusvakio |
|
E |
= |
aktivaatioenergia [kJ/mol] |
|
T |
= |
absoluuttinen lämpötila [K] |
|
R |
= |
kaasuvakio [8,314 J/mol.K] |
Aktivaatioenergia lasketaan regressioanalyysillä tai seuraavalla yhtälöllä:

Tällöin: T2>T1.
Liite 3
Puskurijärjestelmät
A. CLARK JA LUBS:
Clarkin ja Lubsin puskuriseokset (14)
|
Koostumus |
pH |
|
0,2 N HC1 JA 0,2 N KC1 20 oC:ssa |
|
|
47,5 ml. HC1 + 25 ml. KC1 laimennettuna 100 ml:aan |
1,0 |
|
32,25 ml. HC1 + 25 ml. KC1 laimennettuna 100 ml:aan |
1,2 |
|
20,75 ml. HC1 + 25 ml. KC1 laimennettuna 100 ml:aan |
1,4 |
|
13,15 ml. HC1 + 25 ml. KC1 laimennettuna 100 ml:aan |
1,6 |
|
8,3 ml. HC1 + 25 ml. KC1 laimennettuna 100 ml:aan |
1,8 |
|
5,3 ml. HC1 + 25 ml. KC1 laimennettuna 100 ml:aan |
2,0 |
|
3,35 ml. HC1 + 25 ml. KC1 laimennettuna 100 ml:aan |
2,2 |
|
0,1 M kaliumbiftalaatti +0,1 N HC1 20 oC:ssa |
|
|
46,70 ml. 0,1 N HC1 + 50 ml. biftalaattia 100 ml:aan |
2,2 |
|
39,60 ml. 0,1 N HC1 + 50 ml. biftalaattia 100 ml:aan |
2,4 |
|
32,95 ml. 0,1 N HC1 + 50 ml. biftalaattia 100 ml:aan |
2,6 |
|
26,42 ml. 0,1 N HC1 + 50 ml. biftalaattia 100 ml:aan |
2,8 |
|
20,32 ml. 0,1 N HC1 + 50 ml. biftalaattia 100 ml:aan |
3,0 |
|
14,70 ml. 0,1 N HC1 + 50 ml. biftalaattia 100 ml:aan |
3,2 |
|
9,90 ml. 0,1 N HC1 + 50 ml. biftalaattia 100 ml:aan |
3,4 |
|
5,97 ml. 0,1 N HC1 + 50 ml. biftalaattia 100 ml:aan |
3,6 |
|
2,63 ml. 0,1 N HC1 + 50 ml. biftalaattia 100 ml:aan |
3,8 |
|
0,1 M kaliumbiftalaatti +0,1 N NaOH 20 oC:ssa |
|
|
0,40 ml. 0,1 N NaOH + 50 ml. biftalaattia 100 ml:aan |
4,0 |
|
3,70 ml. 0,1 N NaOH + 50 ml. biftalaattia 100 ml:aan |
4,2 |
|
7,50 ml. 0,1 N NaOH + 50 ml. biftalaattia 100 ml:aan |
4,4 |
|
12,15 ml. 0,1 N NaOH + 50 ml. biftalaattia 100 ml:aan |
4,6 |
|
17,70 ml. 0,1 N NaOH + 50 ml. biftalaattia 100 ml:aan |
4,8 |
|
23,85 ml. 0,1 N NaOH + 50 ml. biftalaattia 100 ml:aan |
5,0 |
|
29,95 ml. 0,1 N NaOH + 50 ml. biftalaattia 100 ml:aan |
5,2 |
|
35,45 ml. 0,1 N NaOH + 50 ml. biftalaattia 100 ml:aan |
5,4 |
|
39,85 ml. 0,1 N NaOH + 50 ml. biftalaattia 100 ml:aan |
5,6 |
|
43,00 ml. 0,1 N NaOH + 50 ml. biftalaattia 100 ml:aan |
5,8 |
|
45,45 ml. 0,1 N NaOH + 50 ml. biftalaattia 100 ml:aan |
6,0 |
|
0,1 M monokaliumfosfaatti +0,1 N NaOH 20 oC:ssa |
|
|
5,70 ml. 0,1 N NaOH + 50 ml. fosfaattia 100 ml:aan |
6,0 |
|
8,60 ml. 0,1 N NaOH + 50 ml. fosfaattia 100 ml:aan |
6,2 |
|
12,60 ml. 0,1 N NaOH + 50 ml. fosfaattia 100 ml:aan |
6,4 |
|
17,80 ml. 0,1 N NaOH + 50 ml. fosfaattia 100 ml:aan |
6,6 |
|
23,45 ml. 0,1 N NaOH + 50 ml. fosfaattia 100 ml:aan |
6,8 |
|
29,63 ml. 0,1 N NaOH + 50 ml. fosfaattia 100 ml:aan |
7,0 |
|
35,00 ml. 0,1 N NaOH + 50 ml. fosfaattia 100 ml:aan |
7,2 |
|
39,50 ml. 0,1 N NaOH + 50 ml. fosfaattia 100 ml:aan |
7,4 |
|
42,80 ml. 0,1 N NaOH + 50 ml. fosfaattia 100 ml:aan |
7,6 |
|
45,20 ml. 0,1 N NaOH + 50 ml. fosfaattia 100 ml:aan |
7,8 |
|
46,80 ml. 0,1 N NaOH + 50 ml. fosfaattia 100 ml:aan |
8,0 |
|
0,1 M H3B03 0,1 M KC1:ssa +0,1 N NaOH 20 oC:ssa |
|
|
2,61 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
7,8 |
|
3,97 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
8,0 |
|
5,90 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
8,2 |
|
8,50 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
8,4 |
|
12,00 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
8,6 |
|
16,30 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
8,8 |
|
21,30 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
9,0 |
|
26,70 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
9,2 |
|
32,00 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
9,4 |
|
36,85 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
9,6 |
|
40,80 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
9,8 |
|
43,90 ml. 0,1 N NaOH + 50 ml. boorihappoa 100 ml:aan |
10,0 |
B. KOLTHOFF JA VLEESCHHOUWER:
Kolthoffin ja Vleeschhouwerin sitraattipuskurit
|
Koostumus |
pH |
|
0,1 M monokaliumsitraatti ja 0,1 N HC1 18 oC:ssa (15) |
|
|
49,7 ml. 0,1 N HC1 + 50 ml. sitraattia 100 ml:aan |
2,2 |
|
43,4 ml. 0,1 N HC1 + 50 ml. sitraattia 100 ml:aan |
2,4 |
|
36,8 ml. 0,1 N HC1 + 50 ml. sitraattia 100 ml:aan |
2,6 |
|
30,2 ml. 0,1 N HC1 + 50 ml. sitraattia 100 ml:aan |
2,8 |
|
23,6 ml. 0,1 N HC1 + 50 ml. sitraattia 100 ml:aan |
3,0 |
|
17,2 ml. 0,1 N HC1 + 50 ml. sitraattia 100 ml:aan |
3,2 |
|
10,7 ml. 0,1 N HC1 + 50 ml. sitraattia 100 ml:aan |
3,4 |
|
4,2 ml. 0,1 N HC1 + 50 ml. sitraattia 100 ml:aan |
3,6 |
|
0,1 M monokaliumsitraatti ja 0,1 N NaOH 18 oC:ssa (15) |
|
|
2,0 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
3,8 |
|
9,0 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
4,0 |
|
16,3 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
4,2 |
|
23,7 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
4,4 |
|
31,5 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
4,6 |
|
39,2 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
4,8 |
|
46,7 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
5,0 |
|
54,2 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
5,2 |
|
61,0 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
5,4 |
|
68,0 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
5,6 |
|
74,4 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
5,8 |
|
81,2 ml. 0,1 N NaOH + 50 ml. sitraattia 100 ml:aan |
6,0 |
C. SÖRENSEN:
Sörensenin boraattiseokset
|
Koostumus |
Sörensen 18 oC |
Walbum, pH |
|||
|
ml. Borax |
ml. HC1/NaO H |
10 oC |
40 oC |
70 oC |
|
|
0,05 M borax + +0,1 N HC1 |
|||||
|
5,25 |
4,75 |
7,62 |
7,64 |
7,55 |
7,47 |
|
5,50 |
4,50 |
7,94 |
7,98 |
7,86 |
7,76 |
|
5,75 |
4,25 |
8,14 |
8,17 |
8,06 |
7,95 |
|
6,00 |
4,00 |
8,29 |
8,32 |
8,19 |
8,08 |
|
6,50 |
3,50 |
8,51 |
8,54 |
8,40 |
8,28 |
|
7,00 |
3,00 |
8,08 |
8,72 |
8,56 |
8,40 |
|
7,50 |
2,50 |
8,80 |
8,84 |
8,67 |
8,50 |
|
8,00 |
2,00 |
8,91 |
8,96 |
8,77 |
8,59 |
|
8,50 |
1,50 |
9,01 |
9,06 |
8,86 |
8,67 |
|
9,00 |
1,00 |
9,09 |
9,14 |
8,94 |
8,74 |
|
9,50 |
0,50 |
9,17 |
9,22 |
9,01 |
8,80 |
|
10,00 |
0,00 |
9,24 |
9,30 |
9,08 |
8,86 |
|
0,05 M borax + +0,1 N NaOH |
|||||
|
10,0 |
0,0 |
9,24 |
9,30 |
9,08 |
8,86 |
|
9,0 |
1,0 |
9,36 |
9,42 |
9,18 |
8,94 |
|
8,0 |
2,0 |
9,50 |
9,57 |
9,30 |
9,02 |
|
7,0 |
3,0 |
9,68 |
9,76 |
9,44 |
9,12 |
|
6,0 |
4,0 |
9,97 |
10,06 |
9,67 |
9,28 |
Sörensenin fosfaattiseokset
|
Koostumus |
pH |
|
0,0667 M monokaliumfosfaatti +0,0667 M dinatriumfosfaatti 20 oC:ssa |
|
|
99,2 ml KH2PO4+0,8 ml Na2HPO4 |
5,0 |
|
98,4 ml KH2PO4+1,6 ml Na2HPO4 |
5,2 |
|
97,3 ml KH2PO4 +2,7 ml Na2HPO4 |
5,4 |
|
95,5 ml KH2PO4 +4,5 ml Na2HPO4 |
5,6 |
|
92,8 ml KH2PO4+7,2 ml Na2HPO4 |
5,8 |
|
88,9 ml KH2PO4+11,1 ml Na2HPO4 |
6,0 |
|
83,0 ml KH2PO4+17,0 ml Na2HPO4 |
6,2 |
|
75,4 ml KH2PO4+24,6 ml Na2HPO4 |
6,4 |
|
65,3 ml KH2PO4+34,7 ml Na2HPO4 |
6,6 |
|
53,4 ml KH2PO4+46,6 ml Na2HPO4 |
6,8 |
|
41,3 ml KH2PO4+58,7 ml Na2HPO4 |
7,0 |
|
29,6 ml KH2PO4+70,4 ml Na2HPO4 |
7,2 |
|
19,7 ml KH2PO4+80,3 ml Na2HPO4 |
7,4 |
|
12,8 ml KH2PO4+87,2 ml Na2HPO4 |
7,6 |
|
7,4 ml KH2PO4+92,6 ml Na2HPO4 |
7,8 |
|
3,7 ml KH2PO4+96,3 ml Na2HPO4 |
8,0 |
C.8 MYRKYLLISYYSTUTKIMUS MADOILLA
KEINOMAATESTI
1. MENETELMÄ
1.1 JOHDANTO
Tässä laboratoriokokeessa testattavaa ainetta lisätään keinotekoiseen maahan, jossa matoja pidetään 14 vuorokautta. Tämän ajan kuluttua (ja valinnaisesti 7 vuorokauden kuluttua) aineen tappava vaikutus matoihin tutkitaan. Tällä testillä voidaan suhteellisen lyhyen ajan kuluessa seuloa ravinnon yhteydessä saatujen tai ihon kautta imeytyneiden kemikaalien vaikutukset matoihin.
1.2 MÄÄRITELMÄ JA YKSIKKÖ
LC50: Aineen pitoisuus, jonka arvioidaan tappavan 50 % koe-eläimistä koeajan kuluessa.
1.3 VERTAILUAINE
Vertailuainetta käytetään ajoittain osoittamaan, että testin herkkyys ei ole merkittävästi muuttunut.
Vertailuaineena suositellaan käytettäväksi analyysilaatuista klooriasetamidia.
1.4 TESTIN PERIAATE
Koska mullan koostumus vaihtelee, tässä testissä käytetään tarkoin määritettyä keinotekoista savimaata. Eisenia foetida -lajin (ks. lisäyksen huomautus) täysikasvuisia matoja kasvatetaan koostumukseltaan tunnetussa keinotekoisessa savimaassa, johon on lisätty testattavaa ainetta erisuuruisina pitoisuuksina. Astioiden sisältö levitetään tarjottimelle 14 vuorokauden (ja valinnaisesti 7 vuorokauden) kuluttua testin alkamisesta ja elossaolevien matojen määrä lasketaan kutakin pitoisuutta kohden.
1.5 LAATUKRITEERIT
Testi on suunniteltu siten, että se on mahdollisimman helppo toistaa suhteessa käytettyyn substraattiin ja organismiin. Kontrollien kuolleisuus saa olla korkeintaan 10 % testin lopussa, muussa tapauksessa testi hylätään.
1.6 TESTIN KUVAUS
1.6.1 Materiaalit
1.6.1.1
Testin perussubstraattina käytetään määrätyn laatuista keinotekoista maata.
|
a) |
Perussubstraatti (prosentit tarkoittavat kuivapainoa):
|
|
b) |
Testissä käytettävä substraatti: Testissä käytettävä substraatti sisältää perussubstraattia, testattavaa ainetta ja ionisoimatonta vettä. Vesipitoisuus on noin 25–42 % perussubstraatin kuivapainosta. Substraatin vesipitoisuus määritetään kuivaamalla näyte vakiopainoon 105 oC:n lämmössä. Päävaatimuksena on, että keinomaata on kostutettava siten, ettei siihen jää seisovaa vettä. Testattava aine on sekoitettava tasaisesti substraattiin. Testattavan aineen ja substraatin yhdistämistapa on ilmoitettava. |
|
c) |
Kontrollisubstraatti: Kontrollisubstraatti sisältää perussubstraattia ja vettä. Lisäaineita käytettäessä valmistetaan toinen kontrollisubstraatti, joka sisältää saman määrän lisäainetta. |
1.6.1.2
Noin litran vetoisiin lasiastioihin (jotka peitetään muovikannella, lautasella tai rei'itetyllä muovikalvolla) laitetaan märkää koe- tai kontrollisubstraattia 500 g:n kuivapainoa vastaava määrä.
1.6.2 Koeolosuhteet
Astiat laitetaan ilmastoituun kammioon, jossa on 20 ± 2 oC:n lämpötila ja jatkuva valaistus. Valon voimakkuuden on oltava 400–800 luxia.
Koeaika on 14 vuorokautta, mutta kuolleisuus voidaan määrittää myös seitsemän vuorokauden kuluttua testin aloittamisesta.
1.6.3 Testin suorittaminen
Testattavan aineen pitoisuudet ilmoitetaan aineen painona suhteessa perussubstraatin kuivapainoon (mg/kg).
Raja-annostestillä voidaan määrittää pitoisuusrajat, jotka aiheuttavat 0–100 % kuolleisuuden. Näiden rajojen perusteella määrätään varsinaisessa testissä käytettävät pitoisuudet.
Seuraavat pitoisuudet on testattava: 1 000, 100, 10, 1, 0,1 mg testattavaa ainetta/kg testissä käytettyä substraattia (kuivapaino).
Mikäli varsinainen testi tehdään täydellisenä, kunkin pitoisuuden ja yhden alustamattoman kontrollin testaaminen 10 madon erällä saattaa olla riittävän tarkka raja-annostesti.
Raja-annostestin tulosten perusteella määritetään vähintään viisi pitoisuutta geometrisenä sarjana, joka kattaa 0–100 % kuolleisuuden, ja jonka erottava vakiotekijä on korkeintaan 1,8.
Tätä pitoisuussarjaa käyttävillä testeillä olisi voitava arvioida LC50-arvo ja sen luotettavuusrajat mahdollisimman tarkasti.
Varsinaisessa testissä käytetään vähintään neljää testiryhmää kullakin annostasolla sekä neljää altistamatonta kontrolliryhmää, joissa on kussakin 10 matoa. Tuloksia ilmoitettaessa näistä rinnakkaisryhmistä ilmoitetaan keskiarvot ja keskipoikkeamat.
Kun kaksi peräkkäistä pitoisuutta, joiden erottava tekijä on 1,8, antavat ainoastaan 0 % ja 100 % kuolleisuuden, nämä kaksi arvoa riittävät osoittamaan LC50-välin.
Testissä käytettävä substraatti on valmistettava, jos mahdollista, ilman muita lisäaineita kuin vettä, ionisoimattomaan veteen tai muuhun liuottimeen emulgoitu tai dispergoitu testattava aine sekoitetaan perussubstraattiin tai suihkutetaan tasaisesti sen pintaan hienolla kromatografisella tai vastaavalla sumuttimella juuri ennen testin alkua.
Jos aine ei liukene veteen, se voidaan liuottaa mahdollisimman pieneen määrään jotakin orgaanista liuotinta (esimerkiksi heksaamiin, asetoniin tai kloroformiin).
Vain herkästi haihtuvia liuottimia voidaan käyttää testattavan aineen liuottamiseen, dispergoimiseen tai emulgoimiseen. Testissä käytettävä substraatti on tuuletettava ennen käyttöä. Haihtuneen veden määrä on korvattava. Kontrollin on sisällettävä sama määrä apuainetta.
Ellei testattavaa ainetta voida liuottaa, dispergoida tai emulgoida orgaanisiin liuottimiin, 10 g hienoksi jauhettua kvartsihiekkaa ja kuivapainoltaan 500 grammaan keinomaata tarvittava määrä testattavaa ainetta yhdistetään ja sekoitetaan 490 grammaan (kuivapaino) testissä käytettävää substraattia.
Kutakin koe-erää varten laitetaan lasiastiaan 500 gramman kuivapainoa vastaava määrä märkää koesubstraattia ja asetetaan 10 matoa koesubstraatin pinnalle. Matoja on tätä ennen sopeutettu 24 tuntia samanlaiseen märkään perussubstraattiin, jonka jälkeen ne on pesty nopeasti ja liika vesi imeytetty suodatinpaperiin.
Astiat peitetään rei'itetyillä muovikansilla, lautasilla tai kalvolla kuivumisen estämiseksi ja pidetään koeolosuhteissa 14 vuorokautta.
Määritykset suoritetaan 14 vuorokauden (ja valinnaisesti 7 vuorokauden) kuluttua testin alkamisesta. Substraatti levitetään lasia tai ruostumatonta terästä olevalle levylle. Madot tutkitaan ja elossa olevien matojen määrä lasketaan. Mato katsotaan kuolleeksi, ellei se reagoi keveään mekaaniseen etupään ärsytykseen.
Jos tutkimus tehdään 7 vuorokauden kuluttua, sama substraatti laitetaan takaisin astiaan ja elossa olevat madot sen pinnalle.
1.6.4 Koeorganismit
Koeorganismeina käytetään täysikasvuisia Eisenia foetida -matoja (ks. lisäyksen huomautus) (vähintään kahden kuukauden ikäisiä matoja, joilla on clitellum-paksunnos), joiden märkäpaino on 300–600 mg. (Kasvatus — ks. lisäys.)
2. TULOKSET
2.1 TULOSTEN KÄSITTELY JA ARVIOINTI
Ilmoitetaan testatun aineen pitoisuudet ja matojen kuolleisuusprosentti kutakin pitoisuutta kohden.
Mikäli LC50-arvo ja luotettavuusrajat (p = 0,05) pystytään määrittämään tulosten perusteella, määritys on tehtävä jotakin standardimenetelmää käyttäen (Litchfield ja Wilcoxon, 1949 tai vastaava menetelmä). LC50 ilmoitetaan milligrammoina testattavaa ainetta testissä käytettyä substraattikilogrammaa (kuivapaino) kohden.
Jos pitoisuuskäyrän kaltevuus on liian jyrkkä LC50-arvon laskemiseksi, graafinen arvio tästä arvosta riittää.
Kun kaksi peräkkäistä pitoisuutta, joiden erottava tekijä on 1,8, antavat ainoastaan 0 % ja 100 % kuolleisuuden, nämä kaksi arvoa riittävät osoittamaan LC50-välin.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
vakuutus, että koe on suoritettu edellä olevien laatuvaatimusten mukaisesti, |
|
— |
tehty testi (raja-annostesti ja/tai varsinainen testi), |
|
— |
tarkka selostus koeolosuhteista tai vakuutus, että testi on suoritettu menetelmän mukaisesti; poikkeamat on ilmoitettava, |
|
— |
tarkka selostus siitä, millä tavoin testattava aine sekoitettiin testissä käytettyyn substraattiin, |
|
— |
tiedot koeorganismeista, (laji, ikä, keskipaino ja painorajat, elin- ja kasvatusolosuhteet, hankintapaikka), |
|
— |
LC50-arvon määritysmenetelmä, |
|
— |
testitulokset ja kaikki käytetyt tiedot, |
|
— |
selostus koe-organismeissa havaituista oireista tai käyttäytymismuutoksista, |
|
— |
kontrollien kuolleisuus, |
|
— |
LC50 tai korkein testattu pitoisuus, joka ei aiheuttanut kuolleisuutta ja alin testattu pitoisuus, joka aiheutti 100 % kuolleisuuden 14 vuorokauden (sekä valinnaisesti 7 vuorokauden) kuluttua testin alkamisesta, |
|
— |
pitoisuus/vastekäyrä, |
|
— |
vertailuaineella joko tästä testistä tai aikaisemmista laaduntarkkailukokeista saadut tulokset. |
4. LÄHDELUETTELO
|
1) |
OECD, Paris, 1981, Test Guideline 207, Decision of the Council C(81) 30 final. |
|
2) |
Edwards, C. A. and Lofty, J.R., 1977, Biology of Earthworms, Chapman and Hall, London, 331 s. |
|
3) |
Bouche, M. B., 1972, Lombriciens de France, Ecologie et Systematique, Institut National de la Recherche Agronomique, 671 s. |
|
4) |
Litchfield, J. T. and Wilcoxon, F, A simplified method of evaluation dose effect experiments, J. Pharm. Exs. Therap., vol. 96, 1949, s. 99. |
|
5) |
Euroopan yhteisöjen komissio, Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms, Report EUR 8714 EN, 1983. |
|
6) |
Umweltbundesamt/Biologische Bundesanstalt für Land- und Forstwirtschaft, Berlin, 1984, Verfahrensvorschlag ”Toxizitätstest am Regenworm Eisenia foetida in künstlichem Boden” in: Rudolph/Boje, Ökotoxikologie, ecomed, Landsberg, 1986. |
Lisäys
Matojen lisääminen ja kasvatus ennen testausta
Matoja lisättäessä 30–50 täysikasvuista matoa pannaan tuoretta substraattia sisältävään lisääntymislaatikkoon 14 vuorokauden ajaksi. Niitä voidaan käyttää lisääntymiseen useita kertoja. Munista syntyneitä matoja käytetään kokeisiin niiden tultua täysikasvuisiksi (määritellyissä olosuhteissa parin kolmen kuukauden kuluttua).
Kasvatus- ja lisääntymisolosuhteet
|
Ilmastoitu kammio |
: |
20 ± 2 oC:n lämpötila ja jatkuva valaistus (valon voimakkuus 400-800 luxia). |
|
Lisäyslaatikot |
: |
matalia 10–20 litran vetoisia astioita. |
|
Substraatti |
: |
Eisenia foetida -matoja voidaan kasvattaa eläinten lannassa. Suositeltava lisäysalusta on sekoitus, jossa on 50 % turvetta ja 50 % hevosen tai lehmän lantaa. Elatusalustan pH-arvon on oltava 6–7 (säädetään kalsiumkarbonaatilla) ja sen ionijohtavuuden alhainen (alle 6 mm hos tai 0,5 % suolapitoisuus). Substraatin on oltava kosteaa, mutta ei märkää. Edellä esitetyn lisäksi voidaan käyttää muitakin menettelytapoja. |
Huom. Eisenia foetidaa on kahta rotua, jotka eräät taksonomit ovat erottaneet eri lajeiksi (Bouche, 1972). Ne ovat morfologisesti samanlaisia, mutta toisen, Eisenia foetida foetidan, jaokkeissa on tyypillinen poikittainen raidoitus tai juovaisuus kun taas toiselta, vaihtelevan punaväriseltä Eisenia foetida andreilta, raidoitus puuttuu. Eisenia foetida andrei on suositeltavin koelaji. Muitakin lajeja voidaan käyttää, tarvittavien menetelmien ollessa käytössä
C.9 BIOLOGINEN HAJOAMINEN
ZAHN-WELLENS-TESTI
1. MENETELMÄ
1.1 JOHDANTO
Tämän menetelmän tarkoituksena on määrittää vesiliukoisten haihtumattomien orgaanisten aineiden mahdollinen lopullinen biologinen hajoaminen, kun ne altistetaan suurehkoille mikro-organismipitoisuuksille staattisessa testissä.
Kiinteiden aineiden suspensioissa voi tapahtua fysikaalis-kemiallista adsorpiota, ja tämä on otettava huomioon tuloksia tulkittaessa (ks. 3.2).
Tutkittavista aineista käytetään 50–400 mg/l DOC-arvoja tai 100–1 000 mg/l COD-arvoja vastaavaa pitoisuutta (DOC= dissolved organic carbon, liuennut orgaaninen hiili; COD= chemical oxygen demand, kemiallinen hapenkulutus). Näiden suurehkojen pitoisuuksien etuna on analyyttinen luotettavuus. Yhdisteet, joilla on myrkyllisiä ominaisuuksia, voivat hidastaa hajoamistapahtumaa tai estää sen.
Tässä menetelmässä testattavan aineen lopullisen biologisen hajoamisen määrittämiseen käytetään liuenneen orgaanisen hiilen määrää tai kemiallista hapenkulutusta.
Samanaikaisesti käytetyllä ominaisella analyysimenetelmällä voidaan määrittää aineen biologinen primaarihajoaminen (alkuperäisen kemiallisen rakenteen häviäminen).
Tällä menetelmällä voidaan tutkia vain sellaisia orgaanisia aineita, jotka testissä käytetyn pitoisuuden osalta täyttävät seuraavat edellytykset:
|
— |
ne ovat vesiliukoisia koeolosuhteissa, |
|
— |
niiden höyrynpaine on mitätön koeolosuhteissa, |
|
— |
ne eivät estä bakteeritoimintaa, |
|
— |
ne adsorboituvat käytetyssä testissä vain rajoitetusti, |
|
— |
ne eivät poistu testiliuoksesta vaahtoamisen vuoksi. |
Tiedot testattavan materiaalin pääaineosien suhteellisista osuuksista auttavat tulosten tulkinnassa, varsinkin jos tulokset ovat alhaisia tai marginaalisia.
Tiedot aineen myrkyllisyydestä mikro-organismeille auttavat alhaisten tulosten tulkinnassa ja oikeiden pitoisuuksien valinnassa.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Testin lopussa saavutettu hajoamisaste ilmoitetaan muodossa ”Biologinen hajoaminen Zahn-Wellens-testissä”
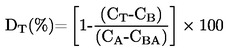
jossa
|
DT |
= |
biologinen hajoaminen ( %) ajan hetkellä T, |
|
CA |
= |
testattavan seoksen DOC (tai COD)-arvot mitattuna kolmen tunnin kuluttua testin alkamisesta (mg/l), (DOC = dissolved organic carbon, liuennut orgaaninen hiili; COD = chemical oxygen demand, kemiallinen hapenkulutus), |
|
CT |
= |
testattavan seoksen DOC- tai COD-arvot näytteenottohetkellä (mg/l), |
|
CB |
= |
nollakokeen DOC- tai COD-arvot näytteenottoaikana (mg/l), |
|
CBA |
= |
nollakokeen DOC- tai COD-arvot mitattuna kolmen tunnin kuluttua testin alkamisesta (mg/l). |
Hajoamisaste pyöristetään lähimpään kokonaiseen prosenttiin.
Hajoamisprosentti ilmoitetaan testattavasta aineesta poistuneen liuenneen orgaanisen hiilen (tai kemiallisen hapenkulutuksen) poistumaprosenttina.
Kolmen tunnin kuluttua määritetyn arvon ja lasketun tai mieluimmin määritetyn alkuarvon ero voi antaa hyödyllistä tietoa aineen poistumasta (ks. 3.2, tulosten tulkinta).
1.3 VERTAILUAINEET
Uusia aineita tutkittaessa vertailuaineista saattaa joissakin tapauksissa olla hyötyä. Sopivia vertailuaineita ei kuitenkaan voida vielä suositella.
1.4 TESTIN PERIAATE
Laitetaan aktiivilietettä, mineraaliravinteita ja testattavaa ainetta ainoana hiilen lähteenä sisältävää vesiliuosta 1–4 litran vetoiseen, sekoittajalla ja ilmastajalla varustettuun lasiastiaan. Seosta sekoitetaan ja ilmastetaan 20–25 oC:n lämpötilassa hajavalossa tai pimeässä enintään 28 päivää. Hajoamistapahtumaa seurataan määrittämällä DOC- (tai COD-)arvot suodatetusta liuoksesta päivittäin tai jotakin muuta määräaikaa noudattaen. Kukin määräajoin mitattu DOC- (tai COD-) poistuma suhteessa kolme tuntia testin alkamisen jälkeen suoritettuun määritykseen ilmoitetaan biologisena hajoamisprosenttina ja se osoittaa senhetkisen hajoamisasteen. Tulos esitetään graafisesti suhteessa aikaan, jolloin saadaan biologinen hajoamiskäyrä.
Alkuperäisen molekyylipitoisuuden biologisesta hajoamisesta johtuvat muutokset voidaan mitata käyttämällä jotakin analyyttistä menetelmää (biologinen primaarihajoaminen).
1.5 LAATUVAATIMUKSET
Tämän testin toistettavuus on todettu tyydyttäväksi rengasreaktion avulla.
Menetelmän herkkyys määräytyy suurelta osin nollatestin vaihtelevuuden ja jossakin määrin liuenneen orgaanisen hiilen määritystarkkuuden sekä liuoksen sisältämän testattavan aineen pitoisuuden mukaan.
1.6 TESTIN KUVAUS
1.6.1 Testin valmistelu
1.6.1.1
Testissä käytetty vesi: juomavettä, jonka orgaaninen hiilipitoisuus on < 5 mg/l. Kalsium- ja magnesiumionien yhteispitoisuus saa olla enintään 2,7 mmol/1, muussa tapauksessa on suoritettava tarvittava laimennus ionisoimattomalla tai tislatulla vedellä.
|
Rikkihappo, analyyttinen laatu (A. R.): |
50 g/l |
|
Natriumhydroksidiliuos, A. R.: |
40 g/l |
|
Mineraaliravinneliuos: liuotetaan litraan ionisoimatonta vettä: |
|
|
ammoniumkloridia, NH4Cl, A. R.: |
38,5 g, |
|
natriumdivetyfosfaattia, NaH2PO4.2H2O, A. R.: |
33,4 g, |
|
kaliumdivetyfosfaattia, KH2PO4, A. R.: |
8,5 g, |
|
dikaliummonovetyfosfaattia K2HPO4, A. R.: |
21,75 g. |
Seos toimii sekä ravinteena että puskurijärjestelmänä.
1.6.1.2
Lasiastioita, joiden vetoisuus on 1–4 litraa (esimerkiksi sylinterimäisiä astioita).
Sähkösekoittaja, jossa on varrellinen lasi- tai metallisekoitin (sekoittimen on pyörittävä 5–10 cm astian pohjan yläpuolella). Vaihtoehtoisesti voidaan käyttää magneettisekoitinta, jossa sauvan pituus on 7–10 cm.
Lasiputki, jonka sisähalkaisija on 2-4 mm, ilmastusta varten. Putken pään on oltava noin 1 cm astian pohjasta.
Sentrifugi (noin 3 550 g).
pH-mittari.
Liuenneen hapen mittari.
Paperisuodattimia.
Kalvosuodatinlaite.
Kalvosuodattimia, huokoskoko 0,45 μm. Kalvosuodattimia voidaan käyttää, jos on varmistuttu siitä, että ne eivät vapauta hiiltä eivätkä absorboi testattavaa ainetta suodatusvaiheessa.
Analyysilaitteet orgaanisen hiilen pitoisuuden ja kemiallisen hapen tarpeen määritystä varten.
1.6.1.3
Biologisesta käsittelylaitoksesta peräisin oleva aktiiviliete pestään sentrifugoimalla (toistuvasti) tai antamalla sen laskeutua testissä käytettävässä vedessä (edellä).
Aktiivilietteen on oltava laadultaan soveltuvaa. Tällaista lietettä on saatavilla hyvin toimivasta jätevesien käsittelylaitoksesta. Jotta lietteessä olisi mahdollisimman monta bakteerilajia tai -kantaa, saattaa olla tarpeen sekoittaa useasta lähteestä otettuja inokulaatteja (esimerkiksi eri jätteenkäsittelylaitokset, maaperä, jokivedet jne.). Seos käsitellään edellä selostetulla tavalla.
Aktiivilietteen tehokkuuden tarkistus — ks. ”toimivuuskontrolli” jäljempänä.
1.6.1.4
Koeastiaan pannaan 500 ml testissä käytettävää vettä, 2,5 ml/l mineraaliravinneliuosta ja aktiivilietettä niin paljon, että sen määrä lopullisessa seoksessa vastaa 0,2-1,0 g/l kuiva-ainetta. Testattavasta aineesta valmistettua varastoliuosta lisätään niin paljon, että lopullisen seoksen DOC-pitoisuus on 50–400 mg/l. Vastaavat COD-arvot ovat 100–1 000 mg/l. Testissä käytettävää vettä lisätään niin paljon, että liuoksen kokonaismääräksi saadaan 1–4 litraa. Kokonaismäärä riippuu siitä, kuinka monta näytettä otetaan DOC- tai COD-määrityksiä varten ja paljonko seosta tarvitaan analyyseihin.
Yleensä kaksi litraa on riittävä määrä. Testiin sisältyy vähintään yksi kontrolliastia (nollakoe), joka sisältää ainoastaan aktiivilietettä ja mineraaliravinneliuosta ja testissä käytettyä vettä niin paljon, että sen kokonaismäärä on sama kuin koeastioissa oleva.
1.6.2 Testin suorittaminen
Koeastioita sekoitetaan magneetti- tai potkurisekoittajalla hajavalossa tai pimeässä huoneessa 20–25 oC:n lämpötilassa. Ilmastus tehdään paineilmalla, joka puhdistetaan tarvittaessa pesupullon ja vanusuodattimen avulla. On pidettävä huolta siitä, ettei liete laskeudu eikä happipitoisuus putoa alle 2 mg/l.
pH-arvo on tarkistettava määräajoin (esimerkiksi päivittäin) ja pH-arvoksi säädettävä tarvittaessa 7–8.
Haihtunut nestemäärä korvataan ennen kutakin näytteenottoa lisäämällä tarvittava määrä ionisoimatonta tai tislattua vettä. Suositeltavaa on merkitä nesteen taso astian kylkeen ennen testin aloittamista. Uusi merkintä tehdään kunkin näytteenoton jälkeen (ilmastamatta ja sekoittamatta). Ensimmäiset näytteet otetaan aina kolmen tunnin kuluttua testin alkamisesta, jotta voidaan todeta, adsorboituuko testattava aine aktiivilietteeseen.
Testattavan aineen häviämistä seurataan DOC- tai COD-määrityksin, jotka tehdään päivittäin tai muuten säännöllisin väliajoin. Koeastiasta ja nollakoeastiasta otetut näytteet suodatetaan huolellisesti pestyn paperisuodattimen läpi. Ensimmäiset 5 ml testattavan aineen suodosta heitetään pois. Vaikeasti suodatettavat lietteet voidaan poistaa suodatusta edeltävällä 10 minuutin sentrifugoinnilla. DOC- ja COD-määritykset tehdään vähintään kahtena kappaleena. Testin kesto on enintään 28 päivää.
Huom. Sameina pysyvät näytteet suodatetaan kalvosuodattimella. Kalvosuodattimet eivät saa päästää eivätkä adsorboida mitään orgaanista ainetta.
Kuhunkin koesarjaan on sisällytettävä tunnettua ainetta sisältävä koeastia aktiivilietteen toiminnan testaamista varten. Dietyleeniglykoli on osoittautunut tähän tarkoitukseen sopivaksi.
Kun analyysejä tehdään suhteellisen lyhyin väliajoin (esim. päivittäin), adaptaatio voidaan selvästi todeta hajoamiskäyrältä (ks. kuva 2). Sen vuoksi testiä ei saa aloittaa juuri ennen viikonloppua.
Jos adaptaatio tapahtuu koeajan lopulla, koetta voidaan jatkaa, kunnes hajoaminen loppuu.
Huom. Jos adaptoituneesta lietteestä tarvitaan laajempia tietoja, samaa aktiivilietettä testataan uudelleen saman koemateriaalin kanssa seuraavasti:
Sekoitus ja ilmastus lopetetaan ja aktiivilietteen annetaan laskeutua. Kelluva neste poistetaan, testissä käytettyä vettä lisätään, kunnes kokonaismäärä on kaksi litraa, sekoitetaan 15 minuuttia ja annetaan laskeutua uudelleen. Kun kelluva neste on jälleen poistettu, testi uusitaan jäljellä olevalla lietteellä samaa materiaalia käyttäen 1.6.1.4 ja 1.6.2 kohtien mukaisesti. Aktiiviliete voidaan myös erottaa sentrifugoimalla selkeyttämisen sijasta.
Adaptoinutta lietettä voidaan sekoittaa tuoreeseen lietteeseen siten, että kuivapainopitoisuus on 0,2–1 g/l.
Näytteet suodatetaan yleensä huolellisesti pestyllä paperisuodattimella (pesuun käytetään ionisoimatonta vettä).
Sameiksi jäävät näytteet suodatetaan kalvosuodattimella (0,45 μm).
Näytteiden suodoksista (ensimmäiset 5 ml kaadetaan pois) määritetään TOC-mittauslaitteen avulla DOC- ja/tai COD-pitoisuudet kahtena kappaleena. Ellei suodosta analysoida samana päivänä, se on säilytettävä jääkaapissa seuraavaan päivään. Pidempää säilytysaikaa ei suositella.
COD-pitoisuus määritetään näytesuodoksista COD-analyysilaitteilla allaolevassa lähdeviitteessä (2) esitetyllä tavalla.
2. TULOKSET JA NIIDEN ARVIOINTI
DOC- ja/tai COD-pitoisuudet määritetään näytteistä vähintään kahtena kappaleena edelläolevan 1.6.2 kohdan mukaisesti. Aikana T tapahtunut hajoaminen lasketaan 1.2 kohdassa annetun kaavan (ja määritelmien) mukaisesti.
Hajoamisaste pyöristetään lähimpään kokonaiseen prosenttiin. Testin lopussa saavutettu hajoamisaste ilmoitetaan muodossa ”Biologinen hajoaminen Zahn-Wellens-testissä”.
Huomautus: Jos täydellinen hajoaminen tapahtuu ennen testin loppua ja tämä tulos varmistetaan uudella analyysillä seuraavana päivänä, koe voidaan lopettaa.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat kohdat:
|
— |
aineen alkupitoisuus, |
|
— |
kaikki muut testattua ainetta, vertailuainetta ja nollakoetta koskevat tiedot ja tutkimustulokset, |
|
— |
pitoisuus kolmen tunnin kuluttua, |
|
— |
hajoamiskäyrä ja selostus, |
|
— |
koeorganismien hankintapaikka ja -aika, adaptaatioaste, käytetyt pitoisuudet jne., |
|
— |
testausmenetelmään tehtyjen muutosten tieteelliset perustelut. |
3.2 TULOSTEN TULKINTA
DOC- (COD)-poistuma, joka tapahtuu asteittain päivien tai viikkojen kuluessa, osoittaa testattavan aineen biologisen hajoamisen.
Fysikaalis-kemiallisella adsorptiolla voi kuitenkin eräissä tapauksissa olla tietty vaikutus, joka ilmenee testin alussa ensimmäisten kolmen tunnin aikana tapahtuvana täydellisenä tai osittaisena poistumana ja kontrolli- ja koeliuosten kelluvien nesteiden eron pysymisenä odottamattoman pienenä.
Lisätutkimuksia tarvitaan, jos biologinen hajoaminen (tai osittainen biologinen hajoaminen) ja adsorptio halutaan erottaa toisistaan.
Tämä voidaan tehdä usealla tavalla, mutta luotettavin tapa on käyttää kelluvaa nestettä tai lietettä inokulaattina perussarjan testissä (mieluimmin respirometritestissä).
Testattavia aineita, joiden DOC- (COD)-poistuma ilman adsorptiota on tässä testissä korkea, voidaan pitää biologisesti hajoavina. Osittainen poistuma ilman adsorptiota osoittaa, että kemikaali hajoaa biologisesti ainakin jossakin määrin. Alhainen tai nollapoistuma saattaa johtua testattavan aineen mikro-organismeihin kohdistuvasta inhibitiosta, joka voi myös ilmetä lietteen liukenemisena ja häviämisenä, jolloin kelluva neste on sameaa. Koe on uusittava käyttämällä testattavasta aineesta alhaisempaa pitoisuutta.
Suurempi herkkyys saadaan käyttämällä yhdistekohtaista analyysimenetelmää tai 14C:llä merkittyä testattavaa ainetta. Mikäli testattava yhdiste on merkitty 14C:llä, 14CO2:n toteaminen osoittaa, että biologista hajoamista on tapahtunut.
Kun tulokset ilmoitetaan ensisijaisena hajoamisena, alkuperäisen testattavan aineen reagoimattomuuteen johtanut kemiallinen rakennemuutos tulisi mahdollisuuksien mukaan selvittää.
Analyysimenetelmän kelpoisuus on ilmoitettava samoin kuin nollakokeen elatusaineesta saatu vaste.
4. LÄHDELUETTELO
|
1) |
OECD, Paris, 1981, Test Guideline 302 B, Decision of the Council C(81) 30 final. |
|
2) |
Annex V C.9 Degradation: Chemical Oxygen Demand, Commission Directive 84/449/EEC, Official Journal of the European Communities, No L 251, 19.9.1984. |
Lisäys
ARVIOINTIESIMERKKI
|
Orgaaninen yhdiste: |
4-Etoksibentsoehappo |
|
Teoreettinen testipitoisuus: |
600 mg/l |
|
Teoreettinen DOC: |
390 mg/l |
|
Inokulaatti: |
Jätteenpuhdistuslaitoksen nimi |
|
Pitoisuus: |
1 gramma kuivamateriaalia/litra |
|
Adaptaatioaste: |
ei adaptoitunut |
|
Analyysi: |
DOC-määritys |
|
Näytteen koko: |
3 ml |
|
Kontrollialue: |
Dietyleeniglykoli |
|
Yhdisteen myrkyllisyys: |
Ei myrkyllisiä vaikutuksia alle 1 000 mg/l Käytetty testi: Fermentaatioputkitesti |
|
Ajat |
Kontrolliaine |
Testattava aine |
|||||
|
DOC (16) mg/l |
DOC (16) mg/l |
netto DOC mg/l |
Hajoaminen % |
DOC (16) mg/l |
netto DOC mg/l |
Hajoaminen % |
|
|
0 |
— |
— |
300,0 |
— |
— |
390,0 |
— |
|
3 tuntia |
4,0 |
298,0 |
294,0 |
2 |
371,6 |
367,6 |
6 |
|
1 päivä |
6,1 |
288,3 |
282,2 |
6 |
373,3 |
367,2 |
6 |
|
2 päivää |
5,0 |
281,2 |
276,2 |
8 |
360,0 |
355,0 |
9 |
|
5 päivää |
6,3 |
270,5 |
264,2 |
12 |
193,8 |
187,5 |
52 |
|
6 päivää |
7,4 |
253,3 |
245,9 |
18 |
143,9 |
136,5 |
65 |
|
7 päivää |
11,3 |
212,5 |
201,2 |
33 |
104,5 |
93,2 |
76 |
|
8 päivää |
7,8 |
142,5 |
134,7 |
55 |
58,9 |
51,1 |
87 |
|
9 päivää |
7,0 |
35,0 |
28,0 |
91 |
18,1 |
11,1 |
97 |
|
10 päivää |
18,0 |
37,0 |
19,0 |
94 |
20,0 |
2,0 |
99 |
Kuva 1
Esimerkkejä biologisista hajoamiskäyristä
Kuva 1
Esimerkkejä lietten adaptaatiosta

C.10. BIOLOGINEN HAJOAMINEN
AKTIIVILIETTEEN SIMULOINTITESTIT
1. MENETELMÄ
1.1 JOHDANTO
1.1.1 Yleishuomautukset
Tällä menetelmällä voidaan tutkia vain sellaisia orgaanisia aineita, jotka testissä käytetyn pitoisuuden osalta täyttävät seuraavat edellytykset:
|
— |
ne ovat siinä määrin vesiliukoisia, että kokeessa käytetty liuos voidaan valmistaa, |
|
— |
niiden höyrynpaine on mitätön koeolosuhteissa, |
|
— |
ne eivät estä bakteeritoimintaa. |
Tiedot testattavan materiaalin pääaineosien suhteellisista osuuksista auttavat tulosten tulkinnassa, varsinkin jos tulokset ovat alhaisia tai marginaalisia.
Tiedot aineen myrkyllisyydestä mikro-organismeille auttavat alhaisten tulosten tulkinnassa ja oikeiden pitoisuuksien valinnassa.
1.1.2 Lopullisen hajoamisen määrittäminen (DOC/COD-analyysi)
Menetelmän tarkoituksena on määrittää lopullinen hajoaminen mittaamalla aineen ja mahdollisten metaboliittien poistuma simuloidussa aktiivilietelaitoksessa, kun pitoisuus vastaa > 12 mg DOC/l (tai noin 40 mg COD/1) optimaalisen arvon ollessa 20 mg DOC/l. (DOC = Dissolved Organic Carbon, liuennut orgaaninen hiili; COD = Chemical Oxygen Demand, kemiallinen hapenkulutus).
Testattavan aineen orgaanisen hiilen määrä (tai kemiallinen hapenkulutus) on määritettävä.
1.1.3 Biologisen primaarihajoamisen määritys (ominaisanalyysi)
Menetelmän tarkoituksena on määrittää ominaisanalyysin avulla aineen biologinen primaarihajoaminen simuloidussa aktiivilietelaitoksessa mittaamalla aineen ja mahdollisten metaboliittien poistuma aktiivilietelaitosmallissa, kun pitoisuus on noin 20 mg/l (pienempää tai suurempaa pitoisuutta voidaan käyttää, analyyttisen menetelmän ja myrkyllisyysnäkökohtien sen salliessa). Näin voidaan arvioida aineen biologinen primaanhajoaminen (alkuperäisen kemiallisen rakenteen häviäminen).
Tämän menetelmän tarkoituksena ei ole testattavan aineen mineralisoitumisen määrittäminen.
Käytettävissä on oltava tarkoituksenmukainen analyyttinen menetelmä testattavan aineen määrityksiä varten.
1.2 MÄÄRITELMÄT JA YKSIKÖT
1.2.1 DOC/COD-analyysi
Aineen poistuma saadaan seuraavasti:
|
|
[1 (a)] |
jossa:
|
DR |
= |
DOC (tai COD) -poistuma prosentteina annetun testattavan aineen keskimääräisen retentioajan puitteissa |
|
T |
= |
testattavan aineen pitoisuus sisääntulovedessä mg DOC/l (tai mg COD/1), |
|
E |
= |
koeyksikön poistovirran DOC (tai COD)-pitoisuus mg DOC/l (Tai mg COD/1), |
|
Eo |
= |
nollakokeen poistovirran DOC (tai COD)-pitoisuus mg DOC/l (tai mg COD/1). |
Hajoaminen ilmoitetaan DOC (tai COD) -poistumaprosentteina testattavan aineen annetun retentioajan puitteissa.
1.2.2 Ominaisanalyysi
Testattavan aineen prosentuaalinen poistuma vesifaasista (Rw) annetun retentioajan puitteissa lasketaan seuraavasti:
|
|
[1 (b)] |
jossa:
|
C1 |
= |
aineen pitoisuus testiyksikön sisäänvirtauksessa (mg ainetta/l, määritettynä ominaisanalyysillä), |
|
Co |
= |
aineen pitoisuus testiyksikön ulosvirtauksessa (mg ainetta/l, määritettynä ominaisanalyysillä). |
1.3 VERTAILUAINEET
Uutta ainetta tutkittaessa vertailuaineista saattaa joissakin tapauksissa olla hyötyä. Sopivia vertailuaineita ei kuitenkaan vielä voida suositella.
1.4 TESTIN PERIAATE
Lopullisen hajoamisen määrittämiseksi kahta aktiivilietekoeyksikköä käytetään rinnakkain (OECD:n toteamiskoe tai huokoiset astiayksiköt). Testattavaa ainetta lisätään toisen yksikön sisääntuloveteen (synteettiseen tai kotitalousjäteveteen) toisen saadessa pelkkää jätevettä. Ominaisanalyysillä määritetään biologinen primaarihajoaminen ainoastaan yhden yksikön tulo- ja poistovedestä.
DOC (tai COD) -pitoisuudet mitataan poistovirroista tai aineen pitoisuudet määritetään ominaisanalyysillä.
Testattavaan aineeseen kuuluvaa DOC-määrää ei mitata vaan se ainoastaan ilmoitetaan.
Kun DOC (tai COD)-määritykset suoritetaan, koe- ja kontrollipoistovirtojen keskipitoisuuksien eron oletetaan johtuvan hajoamattomasta koemateriaalista.
Ominaisanalyysejä tehtäessä voidaan alkuperäismolekyylipitoisuuden muutokset mitata (biologinen primaarihajoaminen).
Yksiköitä voidaan käsitellä ”yhdistettyinä yksikköinä” käyttämällä ristiinymppäystä.
1.5 LAATUKRITEERIT
Aineen alkupitoisuus määräytyy käytetyn analyyttisen menetelmän ja sen asettamien rajoitusten mukaan.
1.6 TESTIN KUVAUS
1.6.1 Testin valmistelu
1.6.1.1
Testissä käytetään kahta samaa tyyppiä olevaa yksikköä, paitsi ominaisanalyysejä tehtäessä. Kahta laitetyyppiä voidaan käyttää:
OECD:n toteamiskoe:
Laitteen osat ovat (Lisäys 1) synteettisen jäteveden säiliö (A), annostelupumppu (B), ilmastusastia (C), erotusastia (D), paineilmapumppu (E) aktiivilietteen kierrättämiseksi ja käsitellyn poistovirran keräämisastia (F).
A- ja F-astioiden on oltava lasia tai sopivanlaatuista muovia ja vähintään 24 litran vetoisia. Pumpun (B) on pumpattava synteettistä jätevettä jatkuvana virtana ilmastusastiaan. Pumppaus voidaan tehdä usealla tavalla, mutta virtaus ja pitoisuus on varmistettava. Normaalin testin aikana erotusastia (D) on niin
korkealla, että ilmastusastiassa on kolme litraa seosta. Sintrattu ilmastuskuutio (G) sijaitsee C-astiassa kartion kärjen yläpuolella. Ilmastuslaitteen puhaltaman ilman määrää voidaan valvoa virtausmittarilla. Paineilmapumppu (E) on asennettu siten, että aktiivilietteen kierrätys erottimesta ilmastusastiaan (C) on jatkuvaa ja säännöllistä.
”Huokoinen astia”
Huokoinen astia on huokoista polyeteenilevyä (paksuus 2 mm, suurin huokoskoko 95 (μm), josta tehdään 14 cm:n läpimittainen, 45o kartiokulmapohjainen sylinteri (Lisäyksen 2 kuvat 1 ja 2). Huokoinen astia pannaan 15 cm:n läpimittaiseen läpäisemättömään muoviastiaan, jossa on aukko 17,2 cm:n korkeudella. Huokoisen astian tilavuus määräytyy aukon sijainnin mukaan (3 litraa). Sisäastian reunassa on jäykkä muovirengas, jonka ansiosta sisä- ja ulkoastian väliin jää 0,5 cm tilaa poistovirtaa varten.
Huokoiset astiat voidaan kiinnittää lämpösäädellyn vesihauteen jalustaan. Sisäastian pohjassa on hajottimilla varustettu ilmastusputki.
A- ja F-astioiden on oltava lasia tai sopivanlaatuista muovia ja vähintään 24 litran vetoisia. Pumpun (B) on pumpattava synteettistä jätevettä jatkuvana virtana ilmastusastiaan. Pumppaus voidaan tehdä usealla tavalla, mutta virtaus ja pitoisuus on varmistettava.
Huokoisia vara-astioita on pidettävä saatavilla käytössä tukkeutuneiden astioiden korvaamiseksi. Tukkeutuneet astiat puhdistetaan upottamalla ne vuorokaudeksi hypokloriittiliuokseen ja pesemällä ne sen jälkeen huolellisesti vesijohtovedellä.
1.6.1.2
Kalvosuodatinlaite ja kalvosuodattimia, joiden huokoskoko on 0,45 μm. Kalvosuodattimet ovat sopivia, mikäli ne eivät vapauta hiiltä eivätkä adsorboi ainetta suodatuksen aikana.
1.6.1.3
Vaihtoehtoisesti voidaan käyttää synteettistä ravinneliuosta tai kotitalousjätevettä.
Esimerkki synteettisestä ravinneliuoksesta
Kukin aineosa liuotetaan litraan vesijohtovettä:
|
Peptoni: |
160 mg, |
|
Lihauute: |
110 mg, |
|
Urea: |
30 mg, |
|
NaCl: |
7 mg, |
|
CaCl2.2H2O: |
4 mg, |
|
MgSO4.7H2O: |
2 mg, |
|
K2HPO4: |
28 mg. |
Kotitalousjätevesi
Tuoretta jätevettä on hankittava päivittäin pääasiallisesti kotitalouksien jätevettä käsittelevän laitoksen esiselkeytyssäiliön ylivuotoputkesta.
1.6.1.4
Testattavasta aineesta on valmistettava esimerkiksi 1-prosenttinen liuos, jota lisätään testiyksikköön. Aineen pitoisuuden on oltava tiedossa, koska sen perusteella lasketaan, kuinka paljon jäteveteen tai toisen pumpun avulla suoraan yksikköön on liuosta lisättävä, jotta saadaan testissä käytetty pitoisuus.
1.6.1.5
Huomautus: Kun käytetään kotitalousjätevettä, bakteeripitoisuudeltaan alhaisen inokulaatin käyttö ei ole tarkoituksenmukaista, mutta aktiivilietettä voidaan käyttää.
Testissä voidaan käyttää monenlaisia inokulaatteja.
Seuraavassa kolme esimerkkiä sopivista inokulaateista:
|
a) |
Inokulaatti jälkiselkeytysvedestä: Inokulaattina on käytettävä korkealaatuista jälkiselkeytysvettä puhdistamosta, jossa käsitellään pääasiassa kotitalouksista peräisin olevaa jätevettä. Näyte on pidettävä aerobisissa olosuhteissa näytteenotosta käyttöön asti. Inokulaatin valmistamiseksi näyte suodatetaan karkealla suodattimella ja ensimmäiset 200 ml heitetään pois. Suodos säilytetään aerobisissa olosuhteissa, kunnes se käytetään. Inokulaatti on käytettävä hankintapäivänä. Ymppäykseen tarvitaan vähintään 3 ml. |
|
b) |
Yhdistetty inokulaatti Jälkiselkeytysvedestä tehty inokulaatti: Ks. edellä olevaa selostusta. Mullasta tehty inokulaatti Suspendoidaan 100 g puutarhamaata (viljavaa, ei steriiliä) 1 000 ml:aan klooritonta juomavettä (maalaadut, jotka ovat hyvin suurelta osalta savea, hiekkaa tai orgaanista hiiltä, eivät ole sopivia). Sekoituksen jälkeen suspension annetaan asettua 30 minuuttia. Kelluva neste suodatetaan karkean suodatinpaperin lävitse ja ensimmäiset 200 ml heitetään pois, Suodos ilmastetaan välittömästi ja ilmastusta jatketaan käyttöön asti. Inokulaatti on käytettävä hankintapäivänä. Pintavedestä tehty inokulaatti Inokulaatin seuraava osa tehdään mesosaprobisesta pintavedestä. Näyte suodatetaan karkean suodattimen lävitse ja ensimmäiset 200 ml heitetään pois. Suodos säilytetään aerobisissa olosuhteissa, kunnes se käytetään. Inokulaatti on käytettävä hankintapäivänä. Yhtä suuri osa kutakin kolmea inokulaattia sekoitetaan hyvin ja lopullinen inokulaatti otetaan tästä seoksesta. Ymppäykseen käytetään vähintään 3 ml. |
|
c) |
Aktiivilieteinokulaatti Pääasiallisesti kotitalousjätevettä puhdistavan laitoksen ilmastustankista otettua aktiivilietettä (enintään 3 litraa) voidaan käyttää mokulaattina (suspendoituneiden kiintoaineiden pitoisuus enintään 2,5 g/l). |
1.6.2 Testin suorittaminen
Testi tehdään huoneenlämmössä, jonka on oltava 18–25 oC.
Tietyissä tapauksissa testi voidaan suorittaa tätä alemmassa lämpötilassa (ei alle 10 oC). Mikäli aine hajoaa, muita toimenpiteitä ei yleensä tarvita. Ellei aine hajoa, koe on tehtävä tasaisessa 18–25 oC:n lämpötilassa.
1.6.2.1
Lictteen kasvu/stabiloitumisajalla tarkoitetaan sitä aikaa, jonka kuluessa aktiivilietteessä olevat kiintoaineet ja toiminta yksiköt saavuttavat koeolosuhteiden vallitessa stationääritilan.
Esivaiheella tarkoitetaan aikaa testattavan aineen lisäämisestä siihen asti, kunnes sen poistuma saavuttaa tasanteen (suhteellisen vakioisen arvon). Tämä ajanjakso saa kestää enintään kuusi viikkoa.
Arviointiaika kestää kolme viikkoa siitä, kun testattavan aineen poistuma saavuttaa suhteellisen vakaioisen ja yleensä korkean arvon. Kun testataan sellaisia aineita, jotka ensimmäisten kuuden viikon kuluessa hajoavat huonosti tai eivät hajoa lainkaan, arviointiaika on seuraavat kolme viikkoa.
Täytetään aluksi yhteen testiin tarvittava yksikkö (yksiköt) tuloveteen sekoitetulla inokulaatilla.
Ilmastin (ja paineilmapumppu (E) OECD:n toteamiskoeyksiköissä) sekä annostuspumppu käynnistetään.
Veden, jossa ei ole testattavaa ainetta, täytyy kulkea ilmastusastian (C) läpi joko yhden litran tai puolen litran tuntinopeudella; tämä antaa retentioajan keskiarvoksi joko kolme tai kuusi tuntia.
Ilmastusnopeus on säädettävä siten, että C-astian sisältö pysyy suspensiona ja liuenneen hapen pitoisuus on vähintään 2 mg/1.
Vaahtoaminen on estettävä soveltuvin tavoin, mutta aktiivilietteen toimintaa estäviä vaahdonestoaineita ei saa käyttää.
Ilmastusastian (C) yläreunaan (ja OECD:n toteamiskoeyksiköissä erotusastian (D) pohjaan ja kier-rätysputkeen) kertynyt liete on palautettava suspensioon vähintään kerran päivässä harjaamalla tai jollakin muulla tavalla.
Jos liete ei selkeydy, sitä voidaan sakeuttaa lisäämällä 5-prosenttista rautakloridiliuosta 2 ml:n annoksina tarpeen mukaan.
Poistovirta kerätään astiaan (E tai F) 20 tai 24 tunnin ajaksi, ja siitä otetaan huolellisen sekoituksen jälkeen näyte. Astian (E tai F) on oltava huolellisesti puhdistettu.
Kokeen kulku tarkistetaan mittaamalla kerätyn poistovirran suodoksesta kemiallinen hapenkulutus (COD) tai liuennut orgaaninen hiili (DOC) vähintään kahdesti viikossa. Sama mittaus suoritetaan tuloveden suodoksesta (käyttäen 0,45 μm huokoskoon kalvoa ja kaatamalla noin 20 ml ensiksi suodatettua nestettä pois).
COD- tai DOC-arvojen pienenemisen tulisi tasaantua, kun suurin piirtein säännöllinen päivittäinen hajoamistaso on saavutettu.
Ilmastustankissa olevan aktiivilietteen kuiva-ainepitoisuus on määritettävä kahdesti viikossa (grammoina litraa kohden). Tämä voidaan tehdä yksiköissä kahdella tavalla: aktiivilietteen kuiva-ainepitoisuus määritetään kahdesti viikossa ja sen ylittäessä 2,5 g/l ylimääräinen aktiiviliete heitetään pois, tai 500 ml liuosta heitetään pois kustakin huokoisesta astiasta päivittäin, jolloin lietteen keskimääräiseksi retentioajaksi tulee kuusi päivää.
Kun näiden kahden yksikön mitatut ja arvioidut parametrit (menetelmän tehokkuus (COD- tai DOC-poistumana ilmaistuna), lietteen pitoisuus, lietteen selkeytymisominaisuudet, poistovirtojen sameus jne.) ovat kyllin vakaita, testattava aine voidaan lisätä toisen yksikön sisääntuloveteen 1.6.2.2. kohdassa selostetulla tavalla.
Testattava aine voidaan vaihtoehtoisesti lisätä lietteen kasvuajan alkaessa (1.6.2.1), varsinkin jos lietettä käytetään inokulaattina.
1.6.2.2
Koeolosuhteet pidetään samoina kuin esivaiheen aikana ja koeyksikön tuloveteen lisätään testattavan aineen varastohuosta (noin 1-prosenttista) niin paljon, että jäteveteen saadaan haluttu pitoisuus (noin 10–20 mg DOC/l tai 40 mg COD/1). Tämä voidaan tehdä sekoittamalla varastoliuosta jäteveteen päivittäin tai käyttämällä erillistä pumppua. Pitoisuutta voidaan lisätä asteittain, kunnes haluttu pitoisuus on saavutettu. Ellei testattava aine aiheuta aktiivilietteessä myrkkyvaikutuksia, korkeampiakin pitoisuuksia voidaan testata.
Nollakoeyksikköön syötetään pelkästään tulovettä ilman lisäaineita. Poistovedestä otetaan anlysoitavaksi riittävät näytteet, jotka suodatetaan kalvosuodattimilla (0,45 μm) ja noin 20 ml ensin saatua suodosta heitetään pois.
Suodokset on analysoitava samana päivänä. Muussa tapauksessa ne on säilöttävä jollakin sopivalla tavalla, esimerkiksi lisäämällä 0,05 ml 1-prosenttista elohopeaklondia (HgCl2) suodoksen kutakin 10 mg:a kohden tai varastoimalla näytteet 2–4 oC:n lämpötilassa korkeintaan yhden vuorokauden tai alle –18 oC:n lämpötilassa tätä pidemmän ajan.
Esivaihe, jolloin testattava aine lisätään, saa kestää enintään kuusi viikkoa ja arviointiajan on oltava vähintään kolme viikkoa, jolloin käytettävissä on noin 14–20 määritystä lopullisen tuloksen laskemista varten.
Parittaiset yksiköt -menetelmä:
Yksiköt yhdistetään pareiksi vaihtamalla 1,5 l (lietepitoista) suspensiota aktiivilietteen ilmastusastiasta kahden yksikön välillä kerran päivässä. Jos testattava materiaali on voimakkaasti absorboivaa, otetaan selkeytysastioista 1,5 l pelkkää kelluvaa nestettä, joka siirretään toisen yksikön aktiivilieteastiaan.
1.6.2.3
Aineen käyttäytymistä voidaan seurata kahden analyysin avulla:
DOC ja COD:
DOC-pitoisuudet määritetään kahtena kappaleena hiilianalysaattorilla ja /tai COD-arvot lähdeluettelon 2 kohdan mukaisesti.
Ominaisanalyysi:
Testattavan aineen pitoisuudet määritetään jollakin analyyttisellä menetelmällä. Jos mahdollista, aineen absorboituminen lietteeseen on määritettävä erikseen.
2. TULOKSET JA NIIDEN ARVIOINTI
2.1 PAREIKSI YHDISTETYT YKSIKÖT
Kun käytetään yksikköpareja, päivittäinen poistuma-aste, (daily degree of removal, DR) määritetään 1.2.1 kohdan mukaisesti.
Nämä päivittäiset poistumat, DR, korjataan muotoon DRc; ristiinymppäyksestä johtuvaksi aineen siirtymäksi, yhtälöllä (2) kolmen tunnin tai yhtälöllä (3) kuuden tunnin keskimääräisen retentioajan osalta.
|
|
(2) |
|
|
(3) |
DRc-arvosarjan keskiarvo sekä keskipoikkeama lasketaan yhtälöllä (4)
|
|
(4) |
jossa:
|
SDRC |
= |
DRc-arvosarjan keskipoikkeama, |
|
|
= |
DRc-arvon keskiarvo, |
|
n |
= |
määritysten lukumäärä. |
DRc-sarjan vieraat havainnot eliminoidaan soveltuvin tilastollisin menetelmin, esim. Nalimov (6), 95 %:n todennäköisyydellä, jonka jälkeen keskiarvo ja keskipoikkeama lasketaan uudelleen.
Lopullinen tulos lasketaan sen jälkeen yhtälöllä (5)
|
|
(5) |
jossa:
|
tn-1;α |
= |
E:n ja Eo:n n-arvoparien t:n taulukkoarvo ja tilastollinen luotettavuus P (P = 1 – α), jolloin P on 95 % (1). |
Tuloksena ilmoitetaan keskiarvo sallituin poikkeamin 95 %:n todennäköisyydellä, vastaava keskipoikkeama ja DRc-arvosarjan arvojen lukumäärä vieraiden havaintojen eliminoinnin jälkeen sekä vieraiden havaintojen lukumäärä, esim.
|
DRc |
= |
98,6±2,3 % DOC-poistuma, |
|
s |
= |
4,65 % DOC-poistuma, |
|
n |
= |
18, |
|
x |
= |
vieraiden havaintojen lukumäärä. |
2.2 TOISIINSA YHDISTÄMÄTTÖMÄT YKSIKÖT
Yksikköjen toimintaa voidaan valvoa seuraavasti:
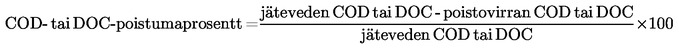
Nämä päivittäiset poistumat voidaan esittää graafisesti käyränä, jolloin esim. akklimatisaatio saadaan esiin.
2.2.1 COD/DOC-määritysten käyttö
Päivittäinen DR-poistuma lasketaan 1.2.1 kohdan mukaisesti.
DR-arvosarjan keskiarvo sekä keskipoikkeama lasketaan seuraavasti:
|
|
(6) |
jossa:
|
SDR |
= |
DRi-arvosarjan keskipoikkeama, |
|
|
= |
DRr arvojen keskiarvo, |
|
n |
= |
määritysten lukumäärä. |
DRc-sarjan vieraat havainnot eliminoidaan soveltuvin tilastollisin menetelmin, esim. Nalimov (6), 95 %:n todennäköisyydellä, jonka jälkeen keskiarvo ja keskipoikkeama lasketaan uudelleen.
Lopullinen tulos lasketaan sen jälkeen yhtälöllä (7)
|
|
(7) |
jossa:
|
tn-1;α |
= |
E:n ja Eo:n n-arvoparien t:n taulukkoarvo ja tilastollinen luotettavuus P (P = 1 – α), jolloin P on 95 % (1). |
Tuloksena ilmoitetaan keskiarvo sallituin poikkeamin 95 %:n todennäköisyydellä, vastaava keskipoikkeama ja DR-arvosarjan arvojen lukumäärä vieraiden havaintojen eliminoinnin jälkeen sekä vieraiden havaintojen lukumäärä, esim.
|
DR |
= |
(98,6±2,3 %) DOC-poistuma, |
|
s |
= |
4,65 % DOC-poistuma, |
|
n |
= |
18, |
|
x |
= |
vieraiden havaintojen lukumäärä. |
2.2.2 Ominaisanalyysin käyttö
Testattavan aineen poistumaprosentti vesifaasista (Rw) lasketaan 1.2.2 kohdan mukaisesti.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat kohdat:
|
— |
lisäyksessä 3 oleva kaavake, joka sisältää tiedot koeolosuhteista, |
|
— |
laitevalinta (OECD:n toteamiskoe vai huokoiset astiat), |
|
— |
menetelmän valinta: pareittain yhdistetyt yksiköt vai yhdistämättömät yksiköt, |
|
— |
jäteveden valinta: synteettinen vai kotitalousjätevesi — jälkimmäisessä tapauksessa näytteenottopaikka ja -aika, |
|
— |
inokulaatin valinta sekä näytteenottopaikka ja -aika, |
|
— |
selostus analyyttisestä menetelmästä, mikäli ominaisanalyysejä tehtiin, |
|
— |
COD- tai DOC-poistumakäyrät suhteessa aikaan esivaiheen ja arviointivaiheen osalta, |
|
— |
testattavan aineen liuennut orgaaninen hiili (DOC) tai kemiallinen hapenkulutus (COD) varastoliuoksesta analysoituna, |
|
— |
mikäli ominaisanalyysejä on tehty, testattavan aineen poistumaprosentti vesifaasista (Rw) käyränä suhteessa aikaan (esivaihe ja arviointivaihe), |
|
— |
testattavan aineen DOC- tai COD-poistuman keskiarvo ja keskipoikkeama laskettuna arviointiajan tuloksista eli aikana, jolloin testattavan aineen poistuma oli pysyvä tai kokeen kulku vakaa, |
|
— |
käyrä aktiivilietepitoisuudesta suhteessa aikaan, |
|
— |
aktiivilietteeseen liittyvät huomautukset (liian lietteen poistaminen, tilavuuden kasvu, FeCl3 jne.), |
|
— |
aineen testipitoisuus, |
|
— |
mahdollisen lieteanalyysin tulokset, |
|
— |
kaikki testattavaa ainetta ja mahdollista vertailuainetta koskevat tiedot ja koetulokset, |
|
— |
testausmenetelmään tehtyjen muutosten tieteelliset perustelut. |
3.2 TULOSTEN TULKINTA
Testattavan aineen alhainen poistuma saattaa olla seurausta sen mikro-organismeihin kohdistuvasta inhibitiosta. Tämä voi myös ilmetä lietteen liukenemisena ja häviämisenä, jolloin kelluva neste on sameaa, sekä COD (tai DOC) -poistumistehon alenemisena esitestissä.
Fysikaalis-kemiallisella adsorptiolla voi eräissä tapauksissa olla tietty vaikutus. Molekyyliin kohdistuvan biologisen toiminnan ja fysikaalis-kemiallisen adsorption väliset erot voidaan selvittää analysoimalla jätevesi riittävän desorpcion jälkeen.
Lisätutkimuksia tarvitaan mikäli biologinen hajoaminen (tai osittainen biologinen hajoaminen) ja adsorptio halutaan erottaa toisistaan.
Tämä voidaan tehdä usealla tavalla, mutta luotettavin tapa on käyttää kelluvaa nestettä inokulaattina perussarjan testissä (mieluimmin respirometritestissä).
Kun todetaan korkeita DOC- tai COD-poistumia, ne ovat seurausta biologisesta hajoamisesta, kun taas alhaisten poistumien ollessa kyseessä biologista hajoamista ei pystytä erottamaan eliminaatiosta. Jos esimerkiksi liukenevalla yhdisteellä on 98 %:n adsorptiovakio ja ylimääräisen lietteen hukka on 10 % päivässä, 40-prosenttinen eliminaatio on mahdollista; kun ylimääräisen lietteen hukka on 30 %, ylimääräiseen lietteeseen adsorboitumisesta ja sen mukana poistumisesta johtuva eliminaatio voi olla jopa 65 % (4).
Kun käytetään ominaisanalyysiä, huomiota on kiinnitettävä aineen rakenteen ja käytetyn ominaisanalyysin väliseen suhteeseen. Tässä tapauksessa ei todettua ilmiötä voida pitää aineen mineralisoitumisena.
4. LÄHDELUETTELO
|
1) |
OECD, Paris, 1981, Test Guideline 303 A, Decision of the Council C(81) 30 final. |
|
2) |
Liite V C9 Hajoamistesti — Kemiallinen hapenkulutus, komission direktiivi 84/449/ETY, Euroopan yhteisöjen virallinen lehti L 251, 19.9.1984. |
|
3) |
Painter, H. A., King, E. F., WRC Porous-Pot method for assessing biodegradability, Technical Report TR70, June 1978, Water Research Centre, United Kingdom. |
|
4) |
Wierich, P., Gerike, P., The fate of soluble, recalcitrant, and adsorbing compounds in activated sludge plants, Ecotoxicology and Environmental Safety, vol. 5, No 2, June 1981, s. 161–171. |
|
5) |
Pesuaineiden biologisesta hajoamisesta annettujen neuvoston direktiivien 73/404/ETY ja 73/405/ETY, Euroopan yhteisöjen virallinen lehti L 347, 17.12.1973, muuttamisesta annetut neuvoston direktiivit 82/242/ETY ja 82/243/ETY, Euroopan yhteisöjen virallinen lehti L 109, 22.4.1982. |
|
6) |
Streuli, H., Fehlerhafte Interpretation und Anwendung von Ausreissertests, insbesondere bei Ringversuchen zur Uberprüfung analytisch-chemischer Untersuchungsmethoden, Fresenius-Zeitschrift für Analytische Chemie, 303 (1980), s. 406–409. |
Lisäys 1
Kuva 1

Kuva 2

Lisäys 2
Kuva 1
Biologisen hajoamisen määrityslaitteisto
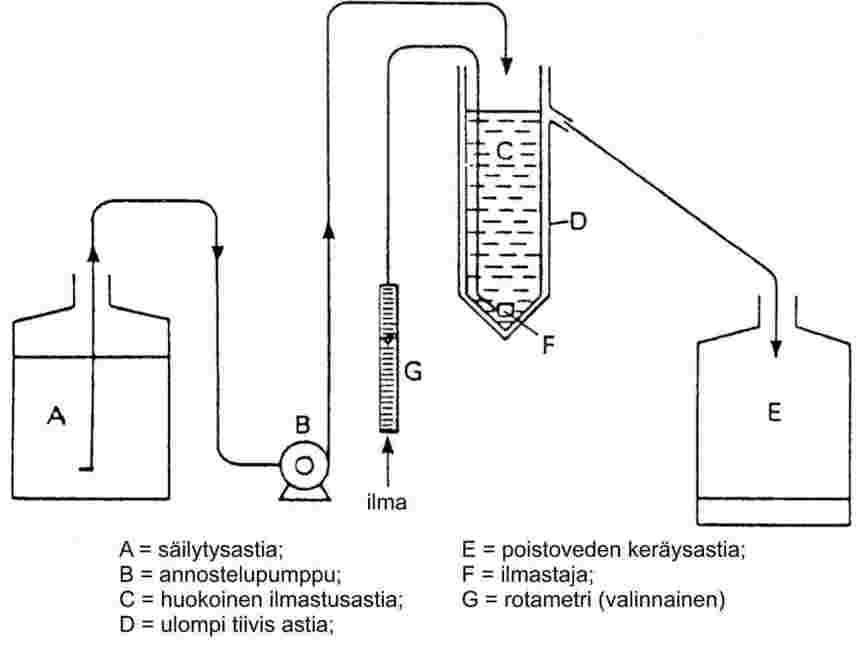
Kuva 2
Kolmen litran huokoisen ilmastusastian yksityiskohdat

Lisäys 3
Aktiivilietteen simulointitestin suoritusolosuhteet
Jokainen ryhmä tarkistetaan
Laitteet
|
OECD:n toteamiskoe |
|
|
Huokoiset astiat |
|
Toimintatapa
|
Yksittäinen yksikkö |
|
|
Parittaiset yksiköt |
|
|
Ei-parittaiset yksiköt |
|
Ristiinymppäys
|
Ei käytetä |
|
|
Aktiiviliete |
|
|
Kelluva neste |
|
Keskimääräinen retentioaika
|
Kolme tuntia |
|
|
Kuusi tuntia |
|
Perusravinne
|
Kotitalousjätevesi |
|
|
Synteettinen jätevesi |
|
Inokulaatti
|
Jälkiselkeytyspoistovesi |
|
|
Yhdistetty |
|
|
Aktiiviliete |
|
Testattavan aineen lisäys
|
Kokeen alusta alkaen |
|
|
Asteittain suureneva |
|
|
Lietteen muodostumisen jälkeen |
|
Analyysi
|
Ominaisanalyysi |
|
|
COD |
|
|
DOC |
|
C.11. BIOLOGINEN HAJOAMINEN
AKTIIVILIETTEEN SOLUHENGITYKSEN INHIBITIOTESTI
1. MENETELMÄ
1.1 JOHDANTO
Tässä kuvatun menetelmän avulla arvioidaan testattavan aineen vaikutus mikro-organismeihin määrittämällä soluhengitysaste tietyissä olosuhteissa, joissa testattavaa ainetta on läsnä eri suuruisina pitoisuuksina.
Tällä seulontamenetelmällä voidaan nopeasti määrittää aineet, jotka saattavat vaikuttaa haitallisesti aerobisiin mikrobikasvustoihin sekä määrittää testattavien aineiden biologisiin hajoamiskokeisiin sopivat pitoisuudet, joilla ei ole inhibitiovaikutusta.
Ennen varsinaista koetta voidaan tehdä raja-annostesti. Sen avulla määritetään varsinaisessa kokeessa käytettävien pitoisuuksien rajat.
Tutkimussuunnitelma sisältää kaksi kontrollia, joissa ei käytetä tutkittavaa ainetta, toinen koesarjan alussa ja toinen koesarjan lopussa. Jokainen aktiiviliete-erä tulee lisäksi tarkistaa vertailuaineen avulla.
Tämä menetelmä soveltuu parhaiten sellaisten aineiden tutkimiseen, jotka vesiliukoisuutensa ja alhaisen haihtuvuutensa ansiosta todennäköisesti jäävät veteen.
Rajoitetusti väliaineisiin liukenevien aineiden EC50-määritys saattaa olla vaikeaa.
Hapenkulutukseen perustuvat tulokset saattavat olla harhaanjohtavia, mikäli testattavalla aineella on taipumusta osallistua hapettavaan fosforylaatioon.
Seuraavat tiedot helpottavat testin suorittamista:
|
— |
vesiliukoisuus, |
|
— |
höyrynpaine, |
|
— |
rakennekaava, |
|
— |
aineen puhtaus. |
Suositus:
Aktiiviliete saattaa sisältää patogeenejä ja sitä on sen vuoksi käsiteltävä varoen.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Soluhengitysasteella tarkoitetaan aerobisessa lietteessä olevien jäteveden mikro-organismien hapenkulutusta, joka yleensä ilmoitetaan muodossa mg O2/mg lietettä tunnissa.
Kun lasketaan testattavan aineen tietyn pitoisuuden inhibitiovaikutus, soluhengitysaste ilmoitetaan prosentteina kahden kontrollin soluhengitysasteen keskiarvosta:

jossa:
|
Rs |
= |
testatun aineen hapenkulutusaste koepitoisuuden, |
|
Rc1 |
= |
hapenkulutusaste, kontrolli 1, |
|
Rc2 |
= |
hapenkulutusaste, kontrolli 2. |
Tässä menetelmässä EC50:llä tarkoitetaan testattavan aineen pitoisuutta, jota käytettäessä hengitysaste on 50 % kokeessa käytetyn kontrollin soluhengitysasteesta.
1.3 VERTAILUAINEET
Vertailuaineena suositellaan käytettäväksi 3,5-dikloorifenolia, joka on tunnettu hengitysinhibiittori. Jokaisen aktiiviliete-erän EC50 testataan tällä aineella, jotta voidaan varmistua siitä, että lietteen herkkyys ei ole epänormaali.
1.4 TESTIN PERIAATE
Standardiannoksella synteettistä jätevesiravinnetta ravitun aktiivilietteen soluhengitysaste mitataan 30 minuutin ja/tai kolmen tunnin kontaktiajan kuluttua. Saman aktiivilietteen soluhengitysaste mitataan samoissa koeolosuhteissa, kun siihen on lisätty erisuuruisia pitoisuuksia testattavaa ainetta. Testattavan aineen tietyn pitoisuuden inhiboiva vaikutus ilmaistaan prosentteina kahden kontrollin soluhengitysasteen keskiarvosta. EC50-arvo lasketaan eri pitoisuuksilla tehdyistä määrityksistä.
1.5 LAATUVAATIMUKSET
Testitulokset ovat hyväksyttäviä, jos
|
— |
kahden kontrollin hengitysasteissa on korkeintaan 15 %:n ero, |
|
— |
3,5-dikloorifenolin EC50-arvo (30 minuuttia ja/tai 3 tuntia) on välillä 5–30 mg/l. |
1.6 TESTIN KUVAUS
1.6.1 Reagenssit
1.6.1.1
Tutkimuksen alkaessa testattavasta aineesta tehdään tuore liuos käyttämällä varastoliuosta. Varastohuoksen soveltuva pitoisuus on 0,5 g/l, kun testi suoritetaan alla selostettua menettelytapaa noudattaen.
1.6.1.2
3,5-dikloorifenoliliuos voidaan valmistaa esimerkiksi seuraavasti: liuotetaan 0,5 g 3,5-dikloorifenolia 10 ml:aan 1 M NaOH:a, laimennetaan noin 30 ml:aan tislatulla vedellä, liuokseen sekoitetaan 0,5 M H2SO4:a kunnes saostuminen alkaa — tähän tarvitaan noin 8 ml 0,5 M H2SO4:ää — ja lopuksi seoksesta tehdään litra liuosta lisäämällä tislattua vettä. Liuoksen pH on tällöin 7–8.
1.6.1.3
Synteettinen jätevesiravinneliuos valmistetaan liuottamalla seuraavat ainemäärät litraan vettä:
|
— |
16 g peptonia, |
|
— |
11 g lihauutetta, |
|
— |
3 g ureaa, |
|
— |
0,7 g NaCl, |
|
— |
0,4 g CaCl2.2H2O, |
|
— |
0,2 g MgSO4.7H2O, |
|
— |
2,8 g K2HPO4. |
Huomautus 1: Tämä synteettinen jätevesi on 100-kertainen tiiviste OECD:n teknisessä raportissa ”Proposed method for the determination of the biodegrability of surfactants used in synthetic detergents” (June 11, 1976) esitetystä jätevedestä, paitsi että se sisältää myös dikaliumvetyfosfaattia.
Huomautus 2: Ellei ravintoainetta käytetä välittömästi valmistuksen jälkeen, sitä säilytetään pimeässä 0–4 oC:n lämpötilassa enintään viikon ajan. Aineen koostumus ei saa muuttua säilytyksen aikana. Ravintoaine voidaan myös steriloida ennen säilytystä tai peptoni ja lihauute voidaan lisätä vasta juuri ennen testin suorittamista. Ennen käyttöä liuos sekoitetaan huolellisesti ja sen pH säädetään.
1.6.2 Laitteet
Mittauslaite: Mittauslaitetta ei ole tarkoin määrätty. Nesteen yläpuolella ei saisi kuitenkaan olla tilaa ja elektrodin olisi sovittava tiukasti mittapullon kaulaan.
Testiin tarvitaan tavanomaisia laboratoriovälineitä ja erityisesti jäljempänä lueteltuja laitteita:
|
— |
mittauslaite, |
|
— |
ilmastuslaite, |
|
— |
pH-elektrodi |a mittauslaite, |
|
— |
O2-elektrodi. |
1.6.3 Inokulaatin valmistus
Testissä käytetään mikrobi-inokulaattia, joka on tehty pääasiassa kotitalousjätevesiä puhdistavan laitoksen aktiivilietteestä.
Suuret hiukkaset poistetaan antamalla laboratorioon tuodun lietteen selkeytyä jonkin aikaa, esim. 15 minuuttia, jonka jälkeen hienojakoisempi pintakerros otetaan talteen. Toinen tapa on sekoittaa lietettä sekoittimella muutaman sekunnin ajan.
Jos lietteessä arvellaan olevan inhiboivaa ainetta, liete pestään vesijohtovedellä tai isotonisella liuoksella. Sentrifugoinnin jälkeen kelluva neste poistetaan (tämä menettely toistetaan kolme kertaa).
Pieni määrä lietettä kuivataan ja punnitaan. Tämän perusteella voidaan laskea, paljonko märkää lietettä on sekoitettava veteen, jotta saadaan aktiivilieteliuos, jonka kiinteiden aineiden osuus on 2–4 g/l. Tämä taso edellyttää 0,8–1,6 gramman pitoisuutta litrassa testiliuosta, kun käytetään jäljempänä suositeltua menettelytapaa.
Ellei lietettä voida käyttää hankintapäivänä, lisätään edellä selostetulla tavalla valmistettuun aktiivilietteeseen 50 ml synteettistä jätevettä litraa kohden. Seosta ilmastetaan 20 ± 2 oC:n lämpötilassa yön yli ja pidetään ilmastettuna, kunnes se käytetään seuraavana päivänä. Ennen käyttöä pH määritetään ja pH-arvoksi säädetään 6–8. Kiinteiden aineiden osuus liuoksessa määritetään edellisessä kappaleessa selostetulla tavalla.
Jos samaa liete-erää käytetään useana peräkkäisenä päivänä (enintään neljänä päivänä), lietteeseen lisätään jokaisen käyttöpäivän iltana synteettistä jätevettä 50 ml litraa kohden.
1.6.4 Testin suorittaminen
|
Kesto/kontaktiaika: |
30 minuuttia ja/tai kolme tuntia, jonka kuluessa tapahtuu ilmastus |
|
Vesi: |
juomavettä (tarpeen vaatiessa kloori poistettu) |
|
Ilmansaanti: |
puhdasta, öljytöntä ilmaa. Ilman virtaus 0,5–1 l/minuutti |
|
Määrityslaite: |
tasapohjainen pullo, esim. BOD-pullo |
|
Happimittari: |
piirturilla varustettu happielektrodi |
|
Ravinneliuos: |
synteettinen jätevesi (ks. edellä) |
|
Testattava aine: |
testissä käytetään testin alkaessa valmistettua tuoretta liuosta |
|
Vertailuaine: |
esim. 3,5-dikloorifenoli (vähintään kolme pitoisuutta) |
|
Kontrollit: |
inokuloitu näyte ilman testattavaa ainetta |
|
Lämpötila: |
20 ± 2 oC. |
Jäljempänä esitettyä menettelytapaa voidaan noudattaa sekä testattavan aineen että vertailuaineen osalta kolmen tunnin kontaktiajan testissä.
Testiin tarvitaan useita astioita (esim. yhden litran dekantterilaseja).
Testissä on käytettävä vähintään viittä pitoisuutta, joiden vakioero on enintään 3,2.
Kokeen alkaessa eli ajassa ”0” tehdään 300 ml liuosta liuottamalla 16 ml synteettistä jätevettä veteen. Tähän lisätään 200 ml mikrobi-inokulaattia ja näin saatu seos (500 ml) kaadetaan ensimmäiseen astiaan (ensimmäinen kontrolli C1).
Koeastioita ilmastetaan jatkuvasti, jotta liuennut O2 ei pääse laskemaan alle 2,5 mg/l, ja jotta juuri ennen soluhengityksen mittaamista O2-pitoisuus olisi noin 6,5 mg/l.
Ajassa ”15 minuuttia” (15 minuuttia on valinnainen, mutta käyttökelpoinen aika) edelläoleva toistetaan, paitsi että 100 ml testattavan aineen varastoliuosta lisätään 16 ml:aan synteettistä jätevettä. Sen jälkeen lisätään vettä, jotta saadaan 300 ml liuosta ja mikrobi-inokulaatti, jolloin määräksi tulee 500 ml. Seos kaadetaan astiaan numero kaksi ja ilmastetaan kuten edellä. Tämä toistetaan 15 minuutin välein muuttaen testattavan aineen varastohuoksen määrää siten, että saadaan sarja astioita, joissa on testattavaa ainetta eri suuruisina pitoisuuksina. Lopuksi valmistetaan toinen kontrolli (C2).
Kolmen tunnin kuluttua kirjataan pH; ensimmäisestä astiasta otettu hyvin sekoitettu näyte kaadetaan määrityslaitteeseen ja soluhengitysaste mitataan enintään 10 minuutin ajalta.
Sama toimenpide suoritetaan kunkin astian osalta 15 minuutin välein siten, että jokaisen astian kontaktiaika on kolme tuntia.
Jokainen mikrobi-inokulaattierä testataan vertailuaineella samalla tavoin.
Kun määritykset suoritetaan 30 minuutin kontaktiajan jälkeen, menettelytapaa täytyy muuttaa (esim. yksi happimittari ei riitä).
Jos kemiallisen hapenkulutuksen mittaus on tarpeen, valmistetaan koeastioita, jotka sisältävät testattavaa ainetta, synteettistä jätevesiravinnetta ja vettä, mutta ei aktiivilietettä. Hapenkulutus määritetään ja kirjataan 30 minuutin ja/tai kolmen tunnin (kontaktiaika) ilmastuksen jälkeen.
2. TULOKSET JA NIIDEN ARVIOINTI
Soluhengitysaste lasketaan piirturilta väliltä 6,5 mg O2/l–2,5 mg O2/l tai 10 minuutin ajalta soluhengitysasteen ollessa alhainen. Hengitysaste on määritettävä hengityskäyrän lineaarisesta kohdasta.
Elleivät kahden kontrollin soluhengitysasteet ole 15 %:n sisällä toisistaan tai vertailuaineen EC50 (30 minuuttia ja/tai kolme tuntia) ole hyväksyttävä (5–30 mg/l käytettäessä 3,5-dikloorifenolia), testiä ei voida hyväksyä ja se on uusittava.
Prosentuaalinen inhibitio määritetään kunkin pitoisuuden osalta (ks. 1.2). Se esitetään pitoisuutta kohden log-normaali- (tai log-todennäköisyys-) paperilla ja johdetaan EC50-arvo.
EC50-arvojen 95 %:n luotettavuusrajat lasketaan standardimenetelmiä käyttäen.
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
testattava aine: kemiallinen rakenne, |
|
— |
testausmenetelmä: aktiivilietteen hankintapaikka, pitoisuus ja mahdollinen esikäsittely, |
|
— |
koeolosuhteet:
|
|
— |
tulokset:
|
3.2 TULOSTEN TULKINTA
EC50-arvoa on pidettävä ainoastaan viitteenä testattavan aineen mahdollisista myrkyllisistä vaikutuksista, jotka kohdistuvat jäteveden puhdistukseen aktiivilietemenetelmällä tai jäteveden mikro-organismeihin, koska ympäristössä syntyviä monimutkaisia keskinäisiä vaikutuksia ei pystytä tarkoin simuloimaan laboratoriokokeissa. Ammoniakin hapettumista inhiboivien testattavien aineiden inhibitiokäyrät saattavat lisäksi olla epätyypillisiä. Niitä on tulkittava varovaisuutta noudattaen.
4. LÄHDELUETTELO
|
1) |
Kansainvälinen standardi ISO 8192-1986. |
|
2) |
Broecker, B., Zahn, R., Water Research 11, 1977, s. 165. |
|
3) |
Brown, D., Hitz, H. R., Schaefer, L., Chemosphere 10, 1981, s. 245. |
|
4) |
ETAD, (Ecological and Toxicological Association of Dyestuffs Manufacturing Industries), Recommended Method No 103, selostettu myöskin seuraavissa: |
|
5) |
Robra, B., Wasser/Abwasser 117, 1976, s. 80. |
|
6) |
Schefer, W., Textdveredlung 6, 1977, s. 247. |
|
7) |
OECD, Paris, 1981, Test Guideline 209, Decision of the Council C(84) 30 final. |
C.12. BIOLOGINEN HAJOAMINEN
MODIFIOITU SCAS-TESTI
1. MENETELMÄ
1.1 JOHDANTO
Menetelmän tarkoituksena on arvioida vesiliukoisten, haihtumattomien orgaanisten aineiden mahdollinen lopullinen biologinen hajoaminen, kun ne altistetaan pitkäksi ajaksi mikro-organismien suurille pitoisuuksille. Mikro-organismien elinkykyä pidetään edellä tämän ajan kuluessa lisäämällä selkeytettyä jätevesiravinnetta päivittäin. (Viikonloppuina tarvittava jätevesi voidaan varastoida 4 oC:ssa. Vaihtoehtoisesti voidaan käyttää OECD:n toteamiskokeen synteettistä jätevettä.)
Liuokseen suspensoituneisiin kiinteisiin aineosiin voi tapahtua fysikaalis-kemiallista adsorptiota ja tämä on otettava huomioon tuloksia tulkittaessa (ks. 3.2).
Nestefaasin pitkän pidätysajan (36 tuntia) ja ravinteiden ajoittaisen lisäämisen vuoksi koe ei simuloi jätevesipuhdistamossa vallitsevia olosuhteita. Testattavilla aineilla saadut tulokset viittaavat siihen, että biologinen hajoamispotentiaali on testissä suuri.
Tämä testi antaa erittäin sopivat puitteet testattavan yhdisteen hajottamiseen sopivien mikro-organismien valinnalle ja/tai adaptaatiolle. (Menetelmällä voidaan myös tuottaa adaptoituja inokulaatteja muita kokeita varten.)
Tässä menetelmässä liuenneen orgaanisen hiilen pitoisuuden määritystä käytetään testattavien aineiden lopullisen biologisen hajoamisen arviointiperusteena. Liuenneen hiilen määrittäminen happamaksi tekemisen ja huuhtelun jälkeen on suositeltavampaa kuin sen määrittäminen Ckokonais -Cepaorgaaninen erona.
Samanaikaisesti käytetyllä ominaisanalyysimenetelmällä voidaan määrittää aineen biologinen primaarihajoaminen (alkuperäisen kemiallisen rakenteen häviäminen).
Tällä menetelmällä voidaan tutkia vain sellaisia orgaanisia aineita, jotka testissä käytetyn pitoisuuden osalta täyttävät seuraavat edellytykset:
|
— |
ovat vesiliukoisia (vähintään 20 mg liuennutta orgaanista hiiltä/l), |
|
— |
joiden höyrynpaine on mitätön, |
|
— |
eivät estä bakteeritoimimaa, |
|
— |
eivät merkitsevästi absorboidu käytetyssä testissä, |
|
— |
eivät poistu testiliuoksesta vaahtoamisen vuoksi. |
Testattavan aineen sisältämä orgaaninen hiili on määritettävä.
Tiedot testattavan materiaalin pääaineosien suhteellisista osuuksista auttavat tulosten tulkinnassa, varsinkin jos tulokset ovat alhaisia tai marginaalisia.
Tiedot aineen myrkyllisistä vaikutuksista mikro-organismeihin ovat avuksi alhaisten tulosten tulkinnassa ja oikeiden pitoisuuksien valinnassa.
1.2 MÄÄRITELMÄT JA YKSIKÖT
|
CT |
= |
testattavan yhdisteen pitoisuus joko selkeytetyssä jätevedessä olevana tai siihen lisättynä orgaanisena hiilenä ilmastusjakson alkaessa (mg/l), |
|
C1 |
= |
testissä käytetyn liuoksen kelluvaan nesteeseen liuenneen orgaanisen hiilen pitoisuus ilmastusjakson lopussa (mg/l), |
|
Cc |
= |
kontrolliliuoksen kelluvaan nesteeseen liuenneen orgaanisen hiilen pitoisuus ilmastusjakson lopussa (mg/l), |
Tässä menetelmässä biologinen hajoaminen ilmenee orgaanisen hiilen katoamisena. Biologinen hajoaminen voidaan ilmaista seuraavasti:
|
1. |
Prosentuaalinen poistuma Dda päivittäin lisätyn aineen määrästä:
jossa
|
|
2. |
Prosentuaalinen poistuma Dssd aineen määrästä päivän alkaessa:
jossa
indeksit i ja (i + 1) viittaavat määrityspäivään. Yhtälöä 2 (a) suositellaan käytettäväksi, mikäli poistoveteen liuennut orgaaninen hiili vaihtelee päivästä toiseen, kun taas yhtälö 2 (b) sopii käytettäväksi määrän pysyessä suhteellisen vakiona päivästä päivään. |
1.3 VERTAILUAINEET
Tutkittaessa uutta ainetta vertailuaineista saattaa joissakin tapauksissa olla apua, mutta mitään tiettyä vertailuainetta ei kuitenkaan suositella.
Joidenkin yhdisteiden rengasreaktioiden tulokset esitetään lisäyksessä 1, jotta menetelmä voidaan kalibroida aika ajoin ja suorittaa tulosten vertailua jotakin toista menetelmää käytettäessä.
1.4 TESTIN PERIAATE
Jätevesipuhdistamosta peräisin olevaa aktiivilietettä pannaan puolijatkuvaan aktiivilieteyksikköön (semi-continuous activated sludge unit, SCAS). Testattava yhdiste selkeytetään, lisätään selkeytettyä kotitalousjätevettä ja seosta ilmastetaan 23 tuntia. Tämän jälkeen ilmastus lopetetaan, lietteen annetaan selkeytyä ja kelluva neste poistetaan.
Ilmastuskammioon jäävään lietteeseen sekoitetaan uusi määräannos testattavaa yhdistettä ja jätevettä ja sykli toistetaan.
Biologinen hajoaminen määritetään mittaamalla kelluvasta nesteestä liuenneen orgaanisen hiilen pitoisuus. Saatua arvoa verrataan kontrolliin, johon on lisätty ainoastaan selkeytettyä jätevettä.
Ominaisanalyyttisellä menetelmällä voidaan määrittää biologisesta hajoamisesta johtuvat muutokset alkuperäismolekyylin pitoisuudessa (biologinen primaarihajoaminen).
1.5 LAATUVAATIMUKSET
Tämän liuenneen orgaanisen hiilen poistumiseen perustuvan menetelmän toistettavuutta ei vielä ole vahvistettu. (Biologisen primaarihajoamisen osalta saadaan hyvin tarkkoja tietoja aineista, joiden hajoavuus on hyvä.)
Menetelmän herkkyys riippuu suuresti nollakokeen vaihteluista ja jonkin verran myös liuenneen orgaanisen hiilen määrityksen tarkkuudesta sekä nesteessä olevan testattavan yhdisteen määrästä kunkin syklin alussa.
1.6 TESTIN KUVAUS
1.6.1 Testin valmistelu
Testiä varten varataan puhtaita ilmastusyksiköitä tai vaihtoehtoisesti alkuperäinen 1,5 litran SCAS-testiyksikkö ja ilmaputki kutakin testattavaa ainetta ja kontrollia varten (kuva 1). Koeyksikköihin pumpataan vanusuodattimella puhdistettua paineilmaa, jossa ei ole orgaanista hiiltä, ja joka on esikyllästetty vedellä haihtumisesta johtuvan hävikin vähentämiseksi.
Pääasiassa kotitalousjätevettä käsittelevästä puhdistamosta otetaan nestenäyte, jossa on 1–4 g kiinteitä aineita litraa kohden. Tätä nestettä tarvitaan kutakin ilmastusyksikköä kohden noin 150 ml.
Testattavasta aineesta tehdään varastoliuokset tislattuun veteen. Tarvittava pitoisuus on yleensä 400 mg/l orgaanista hiiltä, joka antaa testattavan yhdisteen pitoisuudeksi 20 mg/l hiiltä kunkin ilmastussyklin alkaessa, ellei biologista hajoamista tapahdu.
Suurempia pitoisuuksia voidaan käyttää, jos mikro-organismeihin kohdistuvat myrkkyvaikutukset eivät ole esteenä sille.
Varastoliuosten orgaanisen hiilen pitoisuus määritetään.
1.6.2 Koeolosuhteet
Testi on suoritettava 20–25 oC:n lämpötilassa.
Testissä käytetään korkeita aerobisia mikro-organismipitoisuuksia (1–4 g/l suspendoituja kiinteitä aineita) ja tehokas retentioaika on 36 tuntia. Jätevesiravinteessa oleva hiilipitoinen aines hapettuu suuresti yleensä kahdeksan tunnin kuluessa ilmastussyklin alkamisesta. Sen jälkeen lietteessä tapahtuu endogeenista uloshengitystä ilmastuksen loppuajan, ja tämän ajan kuluessa testattava yhdiste on ainoa substraatti, ellei tämäkin metaboloidu helposti. Nämä ominaisuudet yhdessä päivittäisen uudelleenymppäyksen kanssa, kun kotitalousjätevettä käytetään ravinteena, antavat hyvät mukautumis- ja biologiset hajoamisedellytykset.
1.6.3 Testin suorittaminen
Pääasiassa kotitalousjätevettä käsittelevästä aktiivilietelaitoksesta, tai laboratorioyksiköstä, hankittu nesteseos pidetään aerobisena laboratoriokäyttöön asti. Kuhunkin ilmastus- ja kontrolliyksikköön pannaan 150 ml nesteseosta (alkuperäistä SCAS-yksikköä käytettäessä käytetään kymmenkertaista määrää) ja ilmastus aloitetaan. Ilmastus lopetetaan 23 tunnin kuluttua ja lietteen annetaan selkeytyä 45 minuuttia. Kunkin astian hana avataan vuorollaan ja 100 ml erä kelluvaa nestettä poistetaan. Juuri ennen käyttöä hankittua selkeytettyä kotitalousjätevettä lisätään 100 ml kuhunkin ilmastusyksikköön jäävään lietteeseen ja ilmastus aloitetaan uudelleen. Tässä vaiheessa ei lisätä testattavaa ainetta ja yksikköihin lisätään ainoastaan kotitalousjätevettä päivittäin, kunnes selkeytyksen jälkeinen kelluva neste on kirkasta. Tähän kuluu yleensä korkeintaan kaksi viikkoa, jolloin kelluvaan nesteeseen liuenneen orgaanisen hiilen määrä jokaisen ilmastussyklin lopussa lähestyy vakio arvoa.
Tämän ajan lopussa yksiköissä olevat lietteet sekoitetaan keskenään ja 50 ml näin yhdistettyä lietettä lisätään kuhunkin yksikköön.
Kontrolliyksikköihin lisätään 95 ml selkeytettyä jätevettä ja 5 ml vettä ja testiyksikköihin 95 ml selkeytettyä jätevettä ja 5 ml testattavan yhdisteen varastoliuosta (400 mg/l). Ilmastus aloitetaan jälleen ja sitä jatketaan 23 tuntia. Sen jälkeen lietteen annetaan selkeytyä 45 minuuttia, kelluva neste poistetaan ja siitä analysoidaan liuennut orgaaninen hiilipitoisuus.
Edellä esitetyt täyttö- ja poistotoimenpiteet suoritetaan testin aikana päivittäin.
Ennen selkeytystä voi olla tarpeen puhdistaa yksikön seinämät, jotta nestepinnan yläpuolelle ei pääse kertymään kiinteitä aineita. Kutakin yksikköä varten on varattava oma kaavin tai harja, jotta yksikköjen välillä ei pääse tapahtumaan kontaminaatiota.
Kelluvissa nesteissä oleva liuennut orgaaninen hiili tulee mieluimmin määrittää päivittäin, mutta harvemminkin tapahtuvat määritykset ovat hyväksyttäviä. Ennen analyysiä nesteet suodatetaan pestyillä 0,45 μm kalvosuodattimilla tai sentrifugoidaan. Kalvosuodattimet ovat sopivia, jos ne eivät vapauta hiiltä eivätkä absorboi ainetta suodatusvaiheessa. Aineen lämpötila sentrifugissa ei saa ylittää 40 oC:+ta.
Testin kestoaikaa ei ole määrätty testattaessa yhdisteitä, jotka hajoavat heikosti tai ei lainkaan, mutta kokemus on osoittanut, että ajan tulisi yleensä olla vähintään 12 viikkoa ja korkeintaan 26 viikkoa.
2. TULOKSET JA NIIDEN ARVIOINTI
Koe- ja kontrolliyksikköjen kelluviin nesteisiin liuenneen orgaanisen hiilen arvot esitetään käyränä suhteessa aikaan.
Kun biologinen hajoaminen saavutetaan, testissä saavutettu taso lähenee kontrollien tasoa. Kun ero on pysyvä kolmessa peräkkäisessä määrityksessä, määrityksiä tehdään vielä tietojen tilastollisen käsittelyn edellyttämä määrä ja testattavan yhdisteen biologinen hajoamisprosentti lasketaan (Dja tai Dssd, ks. 1.2).
3. RAPORTOINTI
3.1 TUTKIMUSSELOSTUS
Tutkimusselostuksen on, jos mahdollista, sisällettävä seuraavat tiedot:
|
— |
kaikki jätevettä ja käytettyä koeyksikköä koskevat tiedot ja testattavalla aineella ja mahdollisella vertailuaineella saadut tulokset sekä nollakokeen tulokset, |
|
— |
lämpötila, |
|
— |
poistumakäyrä ja selostus, laskutapa (ks. 1.2), |
|
— |
aktiivilietteen ja jäteveden hankintapaikka ja -aika, adaptaatiotiedot, pitoisuus jne., |
|
— |
testausmenetelmään tehtyjen muutosten tieteelliset perustelut, |
|
— |
allekirjoitus ja päiväys. |
3.2 TULOSTEN TULKINTA
Koska testattava aine ei ole tällä menetelmällä biologisesti helposti hajoavaa, pelkästään biologisesta hajoamisesta johtuva liuennut orgaaninen hiili poistuu yleensä vähitellen päivien tai viikkojen kuluessa, paitsi milloin mukautuminen tapahtuu äkillisesti, mikä näkyy äkillisenä poistumana muutamien viikkojen kuluttua.
Fysikaalis-kemiallisella adsorptiolla voi joskus olla huomattava vaikutus. Tähän viittaa lisätyn liuenneen orgaanisen hiilen täydellinen tai osittainen poistuma kokeen alussa. Sen jälkeinen kehitys riippuu adsorption asteesta sekä poistettuun poistovirtaan suspendoituneiden kiinteiden aineiden pitoisuudesta. Kontrollin ja kokeen kelluviin nesteisiin liuenneen orgaanisen hiilipitoisuuden ero kasvaa tavallisesti asteittain kokeen alun alhaisesta arvosta ja tämä ero pysyy sitten saavuttamallaan uudella tasolla testin loppuajan, ellei adaptaatiota tapahdu.
Lisätutkimuksia tarvitaan, mikäli biologinen hajoaminen (tai osittainen biologinen hajoaminen) ja adsorptio halutaan erottaa toisistaan. Tämä voidaan tehdä usealla tavalla, mutta luotettavin tapa on käyttää kelluvaa nestettä tai lietettä inokulaattina perussarjan testissä (mieluimmin respirometritestissä).
Testattavia aineita, joiden liuenneen orgaanisen hiilen täydellinen tai osittainen poistuma ilman adsorptiota on tässä testissä korkea, voidaan pitää biologisesti hajoavina. Osittainen poistuma ilman adsorptiota osoittaa, että kemikaali hajoaa biologisesti ainakin jossakin määrin.
Alhainen tai nollapoistuma saattaa johtua testattavan aineen mikro-organismeihin kohdistuvasta inhibitiovaikutuksesta, joka voi myös ilmetä lietteen liukenemisena ja häviämisenä, jolloin kelluva neste on sameaa. Koe on uusittava testattavan aineen alhaisemmalla pitoisuudella.
Suurempi herkkyys saadaan käyttämällä ominaisanalyysiä tai 14C:llä merkittyä testattavaa ainetta. Mikäli testattava yhdiste on merkitty 14C:llä, 14CO2:n toteaminen osoittaa, että biologista hajoamista on tapahtunut.
Kun tulokset ilmoitetaan myös primaarihajoamisena, alkuperäisen testattavan aineen reagoimattomuuteen johtanut kemiallinen rakennemuutos tulisi mahdollisuuksien mukaan selvittää.
Analyysimenetelmän kelpoisuus samoin kuin nollakokeen elatusaineesta saatu vaste on ilmoitettava.
4. LÄHDELUETTELO
|
1) |
OECD, Paris, 1981, Test Guideline 302 A, Decision of the Council C(81)30 final. |
Lisäys 1
SCAS-testi: esimerkki tuloksista
|
Aine |
CT (mg/l) |
Ct — Cc (mg/1) |
Biologinen hajoamisprosentti, Dda, |
Kokeen kesto (päiviä) |
|
4-asetyyliaminobentseemsulfonaatt] |
17,2 |
2,0 |
85 |
40 |
|
Tetrapropyleembentseenisulfonaatti |
17,3 |
8,4 |
51,4 |
40 |
|
4-nitrofenoli |
16,9 |
0,8 |
95,3 |
40 |
|
Dietyleeniglykoli |
16,5 |
0,2 |
98,8 |
40 |
|
Aniliini |
16,9 |
1,7 |
95,9 |
40 |
|
Syklopentaanitetrakarboksylaatti |
17,9 |
3,2 |
81,1 |
120 |
Lisäys 2
Esimerkki koelaitteesta
Figure 1

C.13. BIOKERTYVYYS: TESTI KALOILLA LÄPIVIRTAUSOLOSUHTEISSA
1. MENETELMÄ
Tämä biokertyvyysmenetelmä on toisinto OECD:n testausohjeesta N:o 305 (1996).
1.1 JOHDANTO
Tällä menetelmällä karakterisoidaan kemiallisten aineiden biokertymispotentiaalia kaloihin läpivir-tausolosuhteissa. Vaikka läpivirtausolosuhteissa suoritettu testaus on paras, puolistaattiset olosuhteet ovat hyväksyttäviä, jos validiteetti on varmistettu.
Menetelmässä annetaan riittävän tarkat ohjeet testin suorittamiseksi samalla kun on mahdollista mukauttaa koejärjestelyä laboratorioiden erityisolosuhteisiin ja testattavien aineiden erilaisiin ominaisuuksiin. Luotettavimmin voidaan testata stabiileja orgaanisia aineita, joiden log Pow-arvot ovat 1,5–6,0 (1), mutta myös erityisen lipofiilisiä aineita (logPow > 6,0). Alustava arvio tällaisten erityisen lipofiilisten aineiden biokertyvyystekijälle (bioconcentration factor, BCF), josta käytetään joskus merkintää KB, on todennäköisesti korkeampi kuin laboratoriokokeista saatava biokertyvyystekijä tasapainotilassa (BCFSS). Orgaanisille aineille, joiden log Pow-arvot saattavat olla jopa 9,0, voidaan saada biokertyvyystekijän alustavia arvioita Binteinin et al (2) yhtälön avulla. Biokertyvyyspotentiaalia luonnehtivia muuttujia ovat mm. kertymävakio (k1), poistumavakio (k2) ja BCFSS.
Radioaktiivisilla isotoopeilla leimatut aineet saattavat helpottaa vesi- ja kalanäytteiden analysointia, ja niitä voi käyttää sen arvioimiseksi, onko hajoamistuotteet tunnistettava ja kvantifioitava. Jos mitataan radioaktiivisten jäämien kokonaismäärä (esim. polttamalla tai kudosta liuottamalla), BCF perustuu perusyhdisteeseen, mahdollisesti jäljellä oleviin aineenvaihduntatuotteisiin sekä assimiloituneeseen hiileen. Radioaktiivisten jäämien kokonaismäärään perustuva BCF ei siis ole välttämättä suoraan verrattavissa BCF:ään, joka on johdettu pelkästään perusyhdisteen spesifisestä kemiallisesta analyysistä.
Jos käytetään radioaktiivisia leimoja, voidaan tehdä puhdistustoimenpiteitä perusyhdisteeseen perustuvan BCF:n määrittämiseksi, ja tärkeimmät aineenvaihduntatuotteet voidaan karakterisoida, jos se katsotaan tarpeelliseksi. On myös mahdollista yhdistää kalan aineenvaihduntatutkimus ja biokertyvyystutkimus, jossa kudoksissa esiintyvät jäämät analysoidaan ja tunnistetaan.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Biokertyvyys (biokonsentraatio) on organismissa tai sen pinnalla (sen tietyssä kudoksessa) olevan testattavan aineen pitoisuuden lisääntyminen verrattuna testattavan aineen pitoisuuteen väliaineessa.
Biokertyvyystekijä (bioconcentration factor BCF tai KB) minä tahansa tämän kertyvyystestin kertymä-vaiheen ajankohtana on testattavan aineen pitoisuus kalassa (kalan pinnalla) tai tietyssä kalan kudoksessa [Cf, ug/g (ppm)] jaettuna kyseisen aineen pitoisuudella väliaineessa [Cw, μg/ml (ppm)].
Biokertyvyystekijä tasapainotilassa (steady state) (BCFSS tai KB) ei muutu merkittävästi pitkän ajanjakson aikana, kun testattavan aineen pitoisuus väliaineessa on vakio tänä aikana.
Tasapainotila saavutetaan kalassa esiintyvän testattavan aineen määrää (Ct) ajan funktiona esittävässä käyrässä silloin, kun käyrä on aika-akselin suuntainen, kolme peräkkäistä vähintään kahden vuorokauden välein otetuista näytteistä tehtyä Ct-määritystä ovat samat ± 20 prosenttia eikä näiden kolmen näytteenottoajanjakson välillä ole merkittäviä eroja. Yhdistettyjä näytteitä määritettäessä vaaditaan vähintään neljä peräkkäistä määritystä. Kun testataan aineita, joiden kertyminen kudoksiin tapahtuu hitaasti, välit voivat olla pikemminkin seitsemän vuorokautta.
Biokertyvyystekijöitä, jotka lasketaan suoraan kineettisistä nopeusvakioista (k1/k2) sanotaan kineettisiksi kertyvyystekijöiksi BCFk.
Oktanoli-vesi-jakautumiskerroin (PJ on kemiallisen aineen n-oktanoliliukoisuuden ja vesiliukoisuuden suhde tasapainotilassa (menetelmä A.8), josta käytetään myös merkintää Kow. Pow:n logaritmia käytetään merkitsemään kemiallisen aineen biokertyvyyttä vesieliöissä.
Altistumis- eli kertymisvaibe on aika, jona kalat altistetaan testattavalle kemikaalille.
Kertymävakio (K1) on numeerinen arvo, joka määrittelee testattavan aineen pitoisuuden lisääntymisen nopeuden kalassa tai kalan pinnalla (tai sen tietyssä kudoksessa), kun kalat altistetaan kyseiselle kemikaalille (k1:n laatu on päivää-1).
Poistumavaihe (altistuksen jälkeinen vaihe) on se ajanjakso (sen jälkeen kun testattavat kalat on siirretty testattavaa ainetta sisältävästä väliaineesta sellaiseen väliaineeseen, jossa ei ole kyseistä ainetta), jonka aikana kyseisen aineen (netto)poistumaa testattavista kaloista (tai niiden tietyistä kudoksista) tutkitaan.
Poistumavakio (k2) on numeerinen arvo, joka kuvaa testattavan aineen pitoisuuden alenemisen nopeutta kalassa (tai sen tietyssä kudoksessa), kun kalat on siirretty testattavaa ainetta sisältävästä väliaineesta sellaiseen väliaineeseen, jossa ei ole kyseistä ainetta (k2:n laatu on päivää1).
1.3 TESTIMENETELMÄN PERIAATE
Testissä on kaksi vaihetta: kertymävaihe (altistusvaihe) ja poistumavaihe (altistuksen jälkeinen vaihe). Kertymävaiheessa yhtä lajia olevat erilliset kalaryhmät altistetaan vähintään kahdelle testattavan aineen pitoisuudelle. Kalat siirretään tämän jälkeen poistumavaihetta varten sellaiseen väliaineeseen, jossa ei ole testattavaa ainetta. Kokeessa on aina oltava poistumavaihe, ellei aineen kertyminen kertymisvaiheen aikana ole ollut mitättömän pieni (esim. BCF alle 10). Testattavan aineen pitoisuutta kalassa tai kalan pinnalla (tai sen tietyssä kudoksessa) seurataan testin molempien vaiheiden aikana. Kahden testipitoisuuden lisäksi pidetään kalojen vertailuryhmää samoissa olosuhteissa (lukuun ottamatta testattavan aineen läsnäoloa), jotta biokertyvyyskokeessa mahdollisesti havaittavia haitallisia vaikutuksia voidaan verrata vertailukelpoiseen vertailuryhmään ja jotta saadaan testattavan aineen taustapitoisuudet.
Kertymisvaihe on 28 vuorokautta, jollei osoiteta, että tasapainotila on saavutettu aikaisemmin. Kertymisvaiheen kestoa ja tasapainotilan saavuttamiseen tarvittavaa aikaa voidaan ennustaa liitteessä 3 olevan yhtälön avulla. Poistumavaihe aloitetaan siirtämällä kalat puhtaaseen kammioon samaan väliaineeseen, jossa ei ole testattavaa ainetta. Biokertyvyystekijä lasketaan mahdollisuuksien mukaan sekä kalassa olevan pitoisuuden Cf ja vedessä olevan pitoisuuden Cw suhteena (BCFSS), kun tasapainotila näyttää olevan saavutettu, että kineettisenä biokertyvyystekijänä (BCFK) kertymävakion k1 ja poistuma-vakion k2 suhteena, kun oletetaan, että reaktio noudattaa ensimmäisen asteen kinetiikkaa. Jos on ilmeistä, että reaktio ei noudata ensimmäisen asteen kinetiikkaa, olisi käytettävä monimutkaisempia malleja (liite 5).
Jos tasapainotilaa ei ole saavutettu 28 vuorokaudessa, kertymavaihetta on pidennettävä, kunnes tasapainotila saavutetaan, tai 60 vuorokauteen, sen mukaan, kumpi on ensin; minkä jälkeen aloitetaan poistumavaihe.
Kertymävakio, poistumavakio (tai vakiot, jos käytetään monimutkaisempia malleja), biokertyvyystekijä ja mahdollisuuksien mukaan näiden muuttujien luottamusvälit lasketaan mallista, joka parhaiten kuvaa testattavan aineen mitattuja pitoisuuksia kaloissa ja vedessä.
BCF ilmaistaan kalan kokonaismärkäpainoa kohti. Erityissyistä voi kuitenkin käyttää tiettyjä kudoksia tai elimiä (esim. lihas, maksa), jos kala on riittävän suurikokoinen tai jos se voidaan jakaa syötävään (filee) ja syömäkelvottomaan (sisälmykset) osaan. Koska monien orgaanisten aineiden biokertyvyyspotentiaalin ja lipofiilisyyden välillä on selvä suhde, on myös testattavan kalan rasvapitoisuuden ja kyseisten aineiden havaitun biokertyvyyden välillä vastaava suhde. Jotta tästä johtuvaa testitulosten vaihtelua hyvin lipofiilisten aineiden (log Pow > 3) osalta voidaan pienentää, biokertyvyys olisi ilmaistava sekä rasvapitoisuutta että kokonaiselopainoa kohti.
Rasvapitoisuus olisi mahdollisuuksien mukaan määritettävä samasta biologisesta aineksesta, jota käytetään testattavan aineen pitoisuuden määrittämiseksi.
1.4 TESTATTAVAA AINETTA KOSKEVAT TIEDOT
Ennen biokertyvyystestin suorittamista pitäisi testattavasta aineesta olla käytettävissä seuraavat tiedot:
|
a) |
aineen vesiliukoisuus |
|
b) |
oktanoli-vesi-jakautumiskerroin Pow (josta käytetään myös merkintää Kow, ja joka määritetään HPLC-menetelmällä, liite A.8) |
|
c) |
hydrolyysi |
|
d) |
valomuuntuminen vedessä määritettynä oikeassa tai jäljitellyssä auringonvalossa ja samoissa säteilyolosuhteissa kuin ne, joissa biokertyvyyskoe tehdään (3) |
|
e) |
pintajännitys (aineet, joiden log Pow:ta ei voida määrittää) |
|
f) |
höyrynpaine |
|
g) |
nopea biologinen hajoavuus (tapauksen mukaan). |
Muita tarvittavia tietoja ovat toksisuus testissä käytettävälle kalalajille, mieluiten asymptoottinen (ajasta riippumaton) LC50. Koeliuoksissa ja biologisessa aineksessa olevan testattavan aineen kvantifioimiseksi täytyy olla käytettävissä sopiva määritysmenetelmä, jonka tarkkuus, täsmällisyys ja herkkyys tunnetaan, ja samoin on oltava olemassa näytteen valmistusta ja säilyttämistä koskevat yksityiskohtaiset tiedot. Testattavan aineen määritysraja sekä vedessä että kalan kudoksissa pitäisi myös olla tiedossa. Käytettäessä 14C-merkittyä testattavaa ainetta on tunnettava epäpuhtauksiin liittyvän radioaktiivisuuden prosenttiosuus.
1.5 TESTIN LUOTETTAVUUS (VALIDITEETTI)
Testi on luotettava (validi), jos
|
— |
lämpötilavaihtelu on vähemmän kuin ± 2 oC, |
|
— |
liuenneen hapen pitoisuus ei laske alemmaksi kuin 60 % kyllästy misarvosta, |
|
— |
testattavan aineen pitoisuus testauskammiossa pidetään 20 prosentin rajoissa kertymävaiheessa mitattujen arvojen keskiarvosta, |
|
— |
kuolleisuus tai muut haitalliset vaikutukset tai sairaudet sekä vertailu- että koekaloissa on alle 10 % testin lopussa; jos koe kestää useita viikkoja tai kuukausia, kuolleisuuden tai muiden haitallisten vaikutuksien olisi oltava molemmissa ryhmissä alle 5 % kuukautta kohti, eikä se saisi kaikkiaan olla enemmän kuin 30 %. |
1.6 VERTAILUAINEET
Tunnetun biokertyvyyskyvyn omaavien vertailuyhdisteiden käyttö olisi hyödyllistä koejärjestelyjen tarkistamiseksi tarvittaessa. Vielä ei kuitenkaan voida suositella mitään tiettyjä aineita.
1.7 TESTIMENETELMÄN KUVAUS
1.7.1 Laitteisto
Missään laitteiston osissa ei saisi käyttää materiaaleja, jotka voivat liueta, sorboitua tai uuttua ja vaikuttaa kaloihin haitallisesti. Tavallisia laatikon- tai lieriönmuotoisia säiliöitä, jotka on tehty kemiallisesti inertistä aineesta ja jotka ovat kooltaan sopivia syöttönopeus huomioon ottaen, voidaan käyttää. Pehmeää muoviletkua pitäisi käyttää mahdollisimman vähän. Mieluummin käytetään teflonista (R), ruostumattomasta teräksestä ja/tai lasista valmistettua putkea/letkua. Kokemus on osoittanut, että aineille, joilla on korkea adsorptiokorroin, kuten synteettiset pyretroidit, voi olla tarpeen käyttää silanoitua lasia. Tällöin välineet on heitettävä pois käytön jälkeen.
1.7.2 Vesi
Testissä käytetään yleensä luonnon vettä, jonka on oltava pilaantumatonta ja laadultaan tasaista. Laimennusveden on oltava laadultaan sellaista, että kokeeseen valitut kalat elävät siinä totuttautumis-vaiheen ja testin aikana ilman, että niiden ulkonäössä tai käyttäytymisessä havaitaan mitään epänormaalia muutosta. Olisi ihanteellista pystyä osoittamaan, että koelaji elää, kasvaa ja lisääntyy laimennus-vedessä (esim. laboratoriokasvatuksessa tai koko sukupolven kierron käsittävässä toksisuustestissä). Vedestä on tunnettava ainakin pH, kovuus, kiinteiden aineiden kokonaispitoisuus, orgaanisissa yhdisteissä olevan hiilen kokonaismäärä ja mieluiten myös ammonium-ioni- ja nitriittipitoisuus sekä emäksisyys ja merieliöiden osalta suolapitoisuus. Kalojen hyvinvoinnille tärkeät tekijät tunnetaan hyvin, mutta liitteessä 1 annetaan suositeltavat enimmäispitoisuudet useille makean ja meriveden testivesien muuttujille.
Veden laadun on oltava tasainen testin ajan. pH-arvo voi olla 6,0–8,5, mutta vaihtelun on pysyttävä tietyn testin ajan 0,5 pH-yksikön sisällä. Sen varmistamiseksi, ettei laimennusvesi vaikuta liikaa testituloksiin (esimerkiksi kompleksoimalla testattavaa ainetta) tai vaikuta haitallisesti kalakannan vointiin, näytteitä olisi otettava säännöllisin väliajoin määrityksiä varten. Raskasmetallit (esim. Cu, Pb, Zn, Hg, Cd, Ni), tärkeimmät anionit ja kationit (esim. Ca, Mg, Na, K, Cl, SO4), torjunta-aineet (esim. orgaanista fosforia ja orgaanista klooria sisältävien torjunta-aineiden kokonaispitoisuudet), orgaanisen hiilen kokonaispitoisuus ja suspendoitunect kiinteät aineet olisi määritettävä esimerkiksi kolmen kuukauden välein, jos laimennusveden laatu tiedetään suhteellisen vakioksi. Jos veden laadun on osoitettu pysyvän vakiona ainakin vuoden ajan, määrityksiä voidaan tehdä harvemmin (esim. kuuden kuukauden välein).
Luonnosta peräisin olevien hiukkasten samoin kuin orgaanisen hiilen kokonaismäärän (TOC) laimennusvedessä olisi oltava mahdollisimman alhainen, jotta testiaine ei absorboituisi orgaanisen aineen pintaan, mikä vähentäisi sen biologista hyötyosuutta (4). Suurin hyväksyttävä arvo on 5 mg/l hiukkasille (kuiva-aine, joka ei läpäise 0,45 μm:n suodatinta) ja 2 mg/l orgaanisen hiilen kokonaismäärälle (katso liite 1). Vesi on tarvittaessa suodatettava ennen käyttöä. Testattavista kaloista (ulosteet) ja ruoanjätteistä peräisin olevan orgaanisen hiilen määrän pitäisi olla mahdollisimman alhainen. Koko testin aikana orgaanisen hiilen pitoisuus testausastiassa ei saa ylittää testattavasta aineesta ja mahdollisesti käytetystä liuotusaineesta peräisin olevaa pitoisuutta yli 10 milligrammalla litraa kohti (± 20 %).
1.7.3 Testiliuokset
Testattavasta aineesta tehdään kantaliuos, jonka pitoisuus on sopiva. Kantaliuos valmistetaan mieluiten joko sekoittamalla tai sekoittamalla voimakkaasti testattava aine laimennusveteen. Liuottimien tai liuotusaineiden (dispergoivien aineiden) käyttöä ei suositella. Niitä voi kuitenkin joskus käyttää, jotta saadaan tehdyksi väkevä kantaliuos. Sallittuja liuottimia ovat etanoli, metanoli, etyleeniglykolimonometyylieetteri, etyleeniglykolidimetyylieetteri, dimetyyliformamidi ja trietyleeniglykoli. Sallittuja liuotusaineita ovat Cremophor RH40, Tween 80, 0,01 % metyyliselluloosa ja HCO-40. Helposti biohajoavia aineita käytettäessä on oltava varovainen, koska ne voivat aiheuttaa ongelmia bakteerikasvuston takia läpivirtaustesteissä. Testattava aine voi olla leimattu radioaktiivisella aineella ja sen pitäisi olla mahdollisimman puhdasta kemiallisesti (mielellään esimerkiksi yli 98-prosenttista).
Läpivirtaustestissä on käytettävä testattavan aineen kantaliuosta jatkuvasti annostelevaa ja laimentavaa järjestelmää (esim. annostelupumppua, laimenninta, kyllästävää järjestelmää) testipitoisuuksien annostelemiseksi testikammioihin. Testikammioiden veden pitäisi vaihtua mielellään ainakin viisi kertaa vuorokaudessa. Läpivirtausmalli on paras, mutta jos sitä ei voida käyttää (jos se esimerkiksi haittaa testattavia eliöitä), voidaan käyttää puolistaattista järjestelmää, mikäli validiteettikriteerit täyttyvät. Kantaliuosten ja laimennusveden virtausnopeudet on tarkistettava sekä 48 h ennen testiä että vähintään kerran päivässä testin aikana. Tässä tarkistuksessa mitataan myös läpivirtausnopeus kaikissa testikammioissa ja varmistetaan, ettei se vaihtele yli 20 %:a yhdessä kammiossa tai kammioiden välillä.
1.7.4 Lajin valinta
Tärkeitä perusteita lajin valinnassa ovat se, että lajia on helposti saatavilla, sitä voi saada sopivan kokoisina yksilöinä ja sitä voidaan helposti ylläpitää laboratoriossa. Muita perusteita kalalajin valitsemiselle voivat olla virkistyskäyttö, kaupallinen tai ekologinen merkitys sekä samanlainen herkkyys, onnistunut käyttö aikaisemmin ym.
Suositeltavat lajit luetellaan liitteessä 2. Muita lajeja voidaan käyttää, mutta testausmenetelmää voi joutua muuttamaan siten, että saadaan sopivat koeolosuhteet. Tällaisessa tapauksessa olisi selostettava syyt lajin valitsemiseen ja koemenetelmä.
1.7.5 Kalojen olosuhteet testauskammioissa
Kalojen kantapopulaatiota totutetaan vähintään kahden viikon ajan testauslämpötilassa ja kaloja ruokitaan riittävästija samantyyppisellä rehulla kuin se, jota annetaan testin aikana.
Kuolleiden kalojen määrä kirjataan 48 tunnin alkutotuttelun jälkeen, jonka jälkeen noudatetaan seuraavia periaatteita:
|
— |
jos kuolleita kaloja on yli 10 % populaatiosta seitsemän vuorokauden aikana, koko erä hylätään, |
|
— |
jos kuolleita kaloja on 5–10 % populaatiosta seitsemän vuorokauden aikana, kaloja totutetaan vielä seitsemän vuorokautta, |
|
— |
jos kuolleita kaloja on alle 5 % populaatiosta seitsemän vuorokauden aikana, erä hyväksytään, mutta jos kuolleita on yli 5 % seuraavien seitsemän vuorokauden aikana, koko erä hylätään. |
On tarkastettava, ettei testeissä käytettävissä kaloissa ole havaittavia tauteja tai poikkeavuuksia. Sairaat kalat on heitettävä pois. Kaloja ei saisi hoitaa sairauden takia kahden viikon aikana ennen testiä tai testin aikana.
1.8 TESTIN SUORITTAMINEN
1.8.1 Esitesti
Voi olla hyvä tehdä esitesti lopullisen kokeen olosuhteiden optimoimiseksi, esim. testattavan aineen pitoisuuden (pitoisuuksien) valitseminen, kertymä- ja poistumavaiheen kesto.
1.8.2 Altistumisolosuhteet
1.8.2.1
Kertymävaiheen kestoa voi arvioida käytännön kokemuksen perusteella (esim. aiemmasta kemikaalin kertyvyystutkimuksesta) tai tietyistä kokemusperäisistä suhteista käyttämällä joko testattavan aineen vesiliukoisuutta tai oktanoli-vesi-jakaantumiskerrointa koskevia tietoja (ks. liite 3).
Kertymävaiheen on kestettävä 28 vuorokautta, ellei voida osoittaa, että tasapainotila on saavutettu aikaisemmin. Jos tasapainotilaa ei ole saavutettu 28 vuorokauden kuluessa, kertymävaihetta jatketaan ja mittauksia tehdään, kunnes tasapainotila saavutetaan tai 60 vuorokautta on kulunut, sen mukaan, kumpi tapahtuu aiemmin.
1.8.2.2
Puolet kertymävaiheesta riittää tavallisesti asianmukaiseen (esim. 95 %) vähenemiseen kalaan kertyneessä aineessa (katso liite 3, arvioinnin selostus). Jos 95 prosentin vähenemiseen pääseminen kestää erittäin kauan, esimerkiksi yli kaksi kertaa kertymävaiheen normaali kesto (ts. yli 56 vuorokautta), voidaan hyväksyä lyhyempi aika (ts. kunnes testattavan aineen pitoisuus on alle 10 % tasapainotilasta). Jos aineen kertymä- ja poistumakinetiikka on monimutkaisempi kuin yhden osaston mallissa, jota voidaan kuvata ensimmäisen asteen kinetiikalla, on poistumavaiheen oltava pitempi poistumavakion määrittämiseksi. Tämä aika voidaan kuitenkin määrätä esim. sen perusteella, kuinka kauan testattavan aineen pitoisuus kalassa pysyy määritysrajan yläpuolella.
1.8.2.3
Kalojen lukumäärän jokaista testipitoisuutta kohti on oltava sellainen, että on saatavilla vähintään neljä kalaa näytettä kohti. Jos tarvitaan suurempaa tilastotehoa, tarvitaan enemmän kaloja näytettä kohti.
Jos käytetään täysikasvuisia kaloja, ilmoitetaan, ovatko ne koiraita, naaraita vai molempia. Jos käytetään molempia sukupuolia, on osoitettava ennen totuttautumisvaihetta, että erot rasva-ainepitoisuudessa sukupuolien välillä ovat merkityksettömät. Määritystä varten voi olla tarpeen yhdistää kaikki koiraat ja kaikki naaraat.
Jokaiseen testiin on valittava samanpainoisia kaloja, jolloin pienimpien on painettava vähintään kaksi kolmasosaa suurimmista. Kaikkien pitäisi olla samaa vuosiluokkaa ja peräisin samasta lähteestä. Koska paino ja ikä näyttävät vaikuttavan joskus merkittävästi BCF-arvoihin (1), on ne kirjattava tarkasti. Suositellaan, että osa näytekaloista punnitaan ennen testiä keskipainon arvioimiseksi.
1.8.2.4
Vesimäärän on oltava suuri suhteessa kalojen määrään, jotta Cw laskee mahdollisimman vähän, kun kalat lisätään kammioon testin alussa, ja myös siksi, ettei liuenneen hapen pitoisuus laske. On tärkeää, ettei kaloja lisätä kammioon liian nopeasti. Joka tapauksessa lastausnopeudeksi suositellaan normaalisti 0,1–1,0 g kalaa (märkäpainona) litraa vettä kohti vuorokaudessa. Lastaus voidaan tehdä nopeammin, jos osoitetaan, että testattavan aineen pitoisuus voidaan pitää nimellisarvossa ± 20 prosenttia eikä liuenneen hapen pitoisuus laske alemmaksi kuin 60 prosenttia kyllästyneisyysarvosta.
Valittaessa sopiva lastaustapa on otettava huomioon kalalajin luonnollinen elinympäristö. Esimerkiksi pohjakalat voivat vaatia samaa vesitilavuutta kohti suuremman pohjapinta-alan kuin pelagiset kalalajit.
1.8.2.5
Totuttamisvaiheessa ja testin aikana kalojen ravinnossa noudatetaan ruokavaliota, jonka rasvapitoisuus ja valkuaisaineiden kokonaispitoisuus tunnetaan. Rehua annetaan riittävästi niin, että kalat pysyvät terveinä ja niiden paino ei laske. Rehua annetaan päivittäin totuttamisvaiheessa ja testin aikana noin 1–2 % kalan painosta vuorokaudessa. Tällöin useimpien kalalajien rasvapitoisuus pysyy suhteellisen vakiona testin aikana. Rehun määrä olisi laskettava uudelleen esimerkiksi kerran viikossa, jotta kalan paino ja rasvapitoisuus pysyisivät samana. Tässä laskutoimituksessa kussakin kammiossa olevien kalojen paino voidaan arvioida viimeksi kyseisestä kammiosta näytteeksi otetun kalan painosta. Kammiossa olevia kaloja ei punnita.
Syömättä jäänyt rehu ja ulosteet poistetaan testikammioista päivittäin vähän ruokinnan jälkeen (30 minuuttia – 1 tunti). Kammiot pidetään mahdollisimman puhtaina koko testin ajan, jotta orgaanisen aineksen pitoisuus pysyy mahdollisimman alhaisena, koska orgaaninen hiili saattaa vaikuttaa haitallisesti testattavan aineen biologiseen hyötyosuuteen (1).
Koska monet rehut on valmistettu kalajauhoista, on määritettävä, onko rehussa testattavaa ainetta. On suotavaa määrittää myös, onko rehussa torjunta-aineita ja raskasmetalleja.
1.8.2.6
Valoisa aika on tavallisesti 12–16 tuntia. Lämpötilan pitäisi olla kalalajille sopiva eikä se saisi vaihdella enempää kuin ± 2 oC. Valaistuksen tyyppi ja ominaisuudet on tunnettava. Testattavan aineen mahdollinen muuntuminen tutkimuksen säteilyolosuhteissa on otettava huomioon. Valaistusolosuhteiden olisi oltava asianmukaiset, ja on vältettävä kalojen altistumista epäluonnolliselle valolle. Joskus voi olla tarpeen suodattaa pois alle 290 nm:n UV-säteily.
1.8.2.7
Kalat altistetaan läpivirtausolosuhteissä vähintään kahdelle testattavan aineen pitoisuudelle vedessä. Tavallisesti valitaan korkeampi (tai korkein) testattavan aineen pitoisuus siten, että se on noin 1 % aineen akuutista asymptoottisesta LC50-arvosta ja vähintään 10 kertaa korkeampi kuin sen havaitsemis-raja vedessä käytettävällä määritysmenetelmällä.
Korkein testipitoisuus voidaan myös määrittää jakamalla akuutti 96 tunnin LC50-arvo asianmukaisella akuutti/krooninen-suhteella (asianmukaiset suhteet joillekin kemikaaleille voivat olla noin 3–100). Jos se on mahdollista, valitaan toinen pitoisuus (toiset pitoisuudet) siten, että sen ero edelliseen pitoisuuteen on kymmenkertainen, jos tämä ei ole mahdollista, kun otetaan huomioon kriteeri ”1 % LC50-arvosta” ja määritysraja, voidaan käyttää pienempää tekijää kuin 10 tai harkita l4C-leimatun aineen käyttöä. Mikään testipitoisuus ei saa olla suurempi kuin testattavan aineen liukoisuus.
Jos käytetään liuotusainetta, sen pitoisuus ei saisi olla suurempi kuin 0,1 ml/l, pitoisuuden on oltava sama kaikissa testiastioissa. Sen osuus orgaanisen hiilen kokonaismäärästä, samoin kuin testattavan aineen osuus, on tunnettava. Näitä aineita on kuitenkin pyrittävä välttämään mahdollisimman täydellisesti.
1.8.2.8
Testisarjan lisäksi on tehtävä yksi kontrolli laimennusvedellä tai — jos liuotusainetta on käytetty — yksi kontrolli, jossa on liuotusainetta, jos on osoitettu, ettei liuotusaine vaikuta kaloihin. Ellei tätä ole osoitettu, on tehtävä molemmat kontrollit.
1.8.3 Veden laatua koskevien mittausten taajuus
Testin aikana on mitattava liuennut happi, TOC (orgaanisen hiilen kokonaismäärä), pH ja lämpötila kaikista astioista. Veden kokonaiskovuus ja suola, mikäli se on aiheellista, mitataan kontrolleista ja yhdestä astiasta, jossa on korkeampi (korkein) pitoisuus. Vähintään on mitattava kolme kertaa liuennut happi ja suola, mikäli aiheellista (alussa, kertymävaiheen keski- ja loppuvaiheessa) ja kerran viikossa poistumavaiheen aikana. TOC on mitattava testin alussa (24 ja 48 tuntia ennen kertymävaiheen alkua), ennen kalojen lisäämistä astiaan ja vähintään kerran viikossa sekä kertymä- että poistumisvaiheen aikana. Lämpötila on mitattava joka päivä, pH kunkin vaiheen alussa ja lopussa ja kovuus kerran testin aikana. Lämpötilaa olisi mieluiten mitattava jatkuvasti vähintään yhdessä astiassa.
1.8.4 Näytteenotto ja mittaukset kaloista ja vedestä
1.8.4.1
Testattavan aineen pitoisuuden määrittämiseen käytetyistä testauskammioista otetaan vesinäyte ennen kalojen lisäystä sekä kertymä- ja poistumisvaiheen aikana. Vedestä on otettava näytteet vähintään samoina aikoina kuin kaloista ja ennen ruokkimista. Kertymävaiheen aikana määritetään testattavan aineen pitoisuudet sen tarkistamiseksi, täyttyvätkö validiteettikriteerit.
Kaloista otetaan näyte ainakin viidesti kertymävaiheen aikana ja neljästi poistumavaiheen aikana. Koska voi olla joskus vaikea laskea kohtuullisen tarkkaa arviota BCF-arvosta tämän näytemäärän perusteella (erityisesti, jos näyttää siltä, että poistuma noudattaa muuta kuin yksinkertaista ensimmäisen asteen kinetiikkaa), voi olla suositeltavaa ottaa näytteitä tiheämmin molemmissa vaiheissa (katso liite 4). Ylimääräiset näytteet säilytetään ja analysoidaan vain, jos ensimmäisen analyysikierroksen tulokset osoittautuvat riittämättömiksi BCF:n laskemiseksi halutulla tarkkuudella.
Hyväksyttävästä näytteenottoaikataulusta on esimerkki liitteessä 4. Muunlaisia aikatauluja voi laskea helposti käyttäen muita oletettuja Pow-arvoja 95 prosentin kertymään tarvittavan altistusajan laskemiseksi.
Näytteenottoa jatketaan kertymävaiheen aikana, kunnes saavutetaan tasapainotila tai 28 vuorokauden ajan, kumpi tapahtuu aikaisemmin. Jos tasapainotilaa ei ole saavutettu 28 vuorokauden kuluessa, näytteenottoa jatketaan, kunnes tasapainotila saavutetaan tai 60 vuorokauden ajan, sen mukaan, kumpi tapahtuu aikaisemmin. Ennen poistumisvaiheen aloittamista kalat siirretään puhtaisiin kammioihin.
1.8.4.2
Vesinäytteet otetaan esimerkiksi lapolla inertin putken/letkun kautta kammion keskivaiheilla olevasta kohdasta. Koska sen enempää suodatuksella kuin sentrifugoinnillakaan ei aina ilmeisesti voida erottaa toisistaan niitä testattavan aineen osia, joita kala ei biohyödynnä ja joita se biohyödyntää (erityisesti superlipofiilisten kemikaalien, ts. kemikaalien, joiden log Pow > 5) osalta) (1) (5), näytteille ei tarvitse välttämättä tehdä näitä toimenpiteitä.
Sen sijaan on huolehdittava siitä, että kammiot pidetään mahdollisimman puhtaina, ja orgaanisen hiilen kokonaismäärää on seurattava sekä kertymä- että poistumavaiheessa.
Sopiva määrä kaloja (normaalisti vähintään neljä) otetaan testikammioista kutakin näytettä varten. Näytteeksi otetut kalat huuhdellaan nopeasti vedellä, kuivataan (pyyhkeellä), tapetaan välittömästi sopivimmalla ja inhimillisimmällä tavalla ja punnitaan.
On suositeltavaa tehdä määritykset kaloista ja vedestä heti näytteenoton jälkeen, jotta ei tapahtuisi hajoamista tai muuta ainehävikkiä ja jotta voidaan laskea likimääräiset kertymä- ja poistumanopeudet testin edetessä. Kun näytteet määritetään heti, voidaan myös nähdä nopeasti, milloin tasapainotila on saavutettu.
Jos näytteitä ei voi määrittää heti, ne säilytetään sopivalla tavalla. Ennen testin aloittamista on hankittava tietoja kyseisen testattavan aineen oikeasta säilytystavasta, esimerkiksi pakastamisesta, säilyttämisestä 4 oC:ssa, säilytysajasta, uuttamisesta jne.
1.8.4.3
Koska koko menetelmä riippuu olennaisesti testattavan aineen määritykseen käytettävän menetelmän tarkkuudesta, täsmällisyydestä ja herkkyydestä, on todettava kokeellisesti, että kyseisessä menetelmässä kemiallisen määrityksen täsmällisyys ja toistettavuus samoin kuin testattavan aineen saalis sekä vedestä että kaloista ovat tyydyttäviä. On myös tarkastettava, ettei testattavaa ainetta ole laimennukseen käytetyssä vedessä mitattavia määriä.
Tarvittaessa testissä saadut Cw- ja Cf-arvot korjataan kontrollien saaliin ja tausta-arvojen suhteen. Kalaja vesinäytteitä käsitellään koko ajan siten, että kontaminoituminen ja hävikki (joka voi johtua esimerkiksi adsorboitumisesta näytteenottolaitteistoon) ovat mahdollisimman pienet.
1.8.4.4
Jos testissä käytetään radioaktiivisia merkkiaineita, on mahdollista määrittää kokonaisradioaktiivisuus (ts. perusyhdiste ja siitä syntyneet aineenvaihduntatuotteet) tai näytteet voidaan puhdistaa siten, että perusyhdiste voidaan määrittää erikseen. Myös tärkeimmät aineenvaihduntatuotteet voidaan karakterisoida tasapainotilassa tai kertymävaiheen lopussa, sen mukaan, kumpi tapahtuu aikaisemmin. Jos BCF on ≥ 1 000 % ilmaistuna radioaktiivisten jäämien kokonaismääränä, voi olla suositeltavaa — ja tiettyihin luokkiin kuuluvien kemikaalien kuten torjunta-aineiden ollessa kyseessä erittäin suositeltavaa — tunnistaa ja määrittää kvantitatiivisesti hajoamistuotteet, joiden määrä on > 10 % kalan kudoksissa tasapainotilassa olevista jäämistä. Jos kaloista tunnistetaan ja määritetään kvantitatiivisesti ≥ 10 %:n luokkaa olevia hajoamistuotemääriä, niin on suositeltavaa tunnistaa ja määrittää kvantitatiivisesti hajoamistuotteet myös testivedestä.
Testattavan aineen pitoisuus olisi tavallisesti määritettävä kustakin yksittäisestä punnitusta kalasta. Jos tämä ei ole mahdollista, voidaan samaan aikaan otetut näytekalat yhdistää, mutta yhdistäminen rajoittaa tilastomenetelmiä, joita voidaan käyttää tulosten käsittelyyn. Jos on tärkeää, että käytetään tiettyä ja tietyn tehoista tilastollista menetelmää, pitäisi testissä olla riittävä määrä kaloja, jotta haluttu kalojen yhdistäminen ja tilastollinen teho voidaan ottaa huomioon (6) (7).
BCF pitäisi ilmaista sekä kokonaismärkäpainoa kohti että erittäin lipofiilisten aineiden osalta myös rasvapitoisuutta kohti. Kalojen rasvapitoisuus määritetään jokaisen näytteenoton yhteydessä, jos mahdollista. Sopivia menetelmiä on käytettävä rasvapitoisuuden määrittämiseksi (liitteessä 3 olevat viitteet 8 ja 2). Kloroformi-metanoliuuttoa voi suositella standardimenetelmänä (9). Eri menetelmillä ei saada samoja arvoja (10), joten on tärkeää kuvailla käytetty menetelmä. Aina kun se on mahdollista, rasvat olisi määritettävä samasta uutteesta, josta testattava aine määritetään, koska rasvat täytyy usein poistaa uutteesta ennen kuin sitä voi käyttää kromatografiseen määritykseen. Kalan rasvapitoisuus (mg/kg märkäpainoa kohti) kokeen lopussa ei saisi poiketa rasvapitoisuudesta kokeen alussa enempää kuin ±25 %. Kudoksen kiinteän aineen prosenttiosuus pitää myös ilmoittaa, jotta rasvapitoisuus voidaan muuntaa märkäarvosta kuiva-arvoksi.
2. MÄÄRITYSTULOKSET
2.1 TULOSTEN KÄSITTELY
Testattavan aineen kertymäkäyrä saadaan esittämällä kalassa tai kalan pinnalla (tai määritellyissä kudoksissa) kertymävaiheen aikana olevan aineen pitoisuus ajan funktiona aritmeettisella asteikolla, jos käyrä osoittaa tasapainotilaa (ts. käyrä on suunnilleen asymptoottinen aika-akselin kanssa), tasapainotilaa vastaava BCFss lasketaan kaavasta
![]()
Jos tasapainotilaa ei saavuteta, voi olla mahdollista laskea vaarallisuuden arviointiin riittävän tarkka BCFSS 80 (1,6/kJ prosentin tai 95 prosentin (3,0/k2)”tasapainon” perusteella.
Myös konsentraatiotekijä (BCFk) määritetään kahden ensimmäisen asteen kineettisen vakion suhteena (k1/k2). Poistumisvakio (k2) määritetään tavallisesti poistumakäyrästä (ts. käyrästä, joka kuvaa testattavan aineen pitoisuuden vähenemistä kalassa ajan funktiona). Kertymävakio (k1) lasketaan sitten, kun tunnetaan k2 ja jokin kertymäkäyrästä saatu Cf:n arvo, (katso myös liite 5). Paras menetelmä BCFk:n ja nopeusvakioiden k1 ja k2 laskemiseksi on estimoida tietokoneella epälineaariset parametrit (11). Muuten voidaan käyttää graafisia menetelmiä k1 ja k2:n määrittämiseksi. Jos poistumakäyrä ei selvästikään noudata ensimmäisen asteen kinetiikkaa, pitäisi käyttää monimutkaisempia malleja (katso liitteessä 3 olevat viitteet) ja pyytää neuvoa biostatistiikan asiantuntijoilta.
2.2 TULOSTEN TULKINTA
Tulosten tulkinnassa on oltava varovainen, jos testiliuoksista mitatut tulokset ovat lähellä määritysmenetelmän havaitsemisrajaa.
Selvät kertymä- ja poistumakäyrät osoittavat hyviä biokonsentraatiotuloksia. Vaihtelun kertymä/poistu-mavakioissa kahden testi pitoisuuden välillä pitäisi olla alle 20 %. Jos havaitaan merkittäviä eroja kertymä-/poistumanopeuksien välillä käytettyjen kahden testipitoisuuden välillä, ne on kirjattava ja selitettävä, jos voidaan. BCF:ien luotettavuusväli hyvin suunnitelluissa kokeissa on yleensä lähellä ± 20:tä prosenttia.
3. TULOSTEN ILMOITTAMINEN
Testiraportissa on ilmoitettava seuraavat tiedot:
3.1 TESTATTAVA AINE
|
— |
fysikaalinen olomuoto ja fysikokemialliset ominaisuudet, jos niillä on merkitystä; |
|
— |
kemialliset tunnistetiedot (mukaan lukien orgaanisen hiilen pitoisuus tarvittaessa); |
|
— |
jos aine on radioaktiivisesti leimattu, leimatun atomin (leimattujen atomien) tarkka sijainti ja epäpuhtauksiin liittyvän radioaktiivisuuden määrä. |
3.2 TESTATTAVA LAJI
|
— |
tieteellinen nimi, kanta, lähde, mahdollinen esikäsittely, totuttamistiedot, ikä, koko jne. |
3.3 TESTIOLOSUHTEET
|
— |
käytetty testimenettely, esim. läpivirtaus- tai puolistaattinen; |
|
— |
käytetty valaistustyyppi ja valon ominaisuudet sekä valoperiodi(t); |
|
— |
testimenetelmän kuvaus, esim. testikammioiden lukumäärä ja koko, veden vaihtumisnopeus, rinnakkaisnäytteiden määrä, kalojen lukumäärä nnnakkaisnäytteessä, testipitoisuuksien lukumäärä, kertymä- ja poistumavaiheiden kesto, kala- ja vesinäytteiden näytteenottotaajuus; |
|
— |
kantaliuosten valmistus ja niiden uusimistaajuus (liuotusaine ja sen pitoisuus sekä sen osuus testivedessä olevan orgaanisen hiilen kokonaismäärästä on ilmoitettava, jos liuotusainetta käyte tään); |
|
— |
nimelliset testipitoisuudet, testikammioissa mitattujen arvojen keskiarvot ja niiden keskihajonnat ja menetelmä, jolla ne on laskettu; |
|
— |
laimennusveden alkuperä, mahdolliset esikäsittelyt, osoitukset kalojen kyvystä elää tässä vedessä sekä vettä koskevat tiedot: pH, kovuus, lämpötila, liuenneen hapen pitoisuus, jäännöskloorin tasot (jos ne on mitattu), orgaanisen hiilen kokonaispitoisuus, suspensiossa olevat kiinteät aineet, testiväliaineen suolapitoisuus (jos aiheellista) ja muut mahdolliset mittaukset; |
|
— |
testikammioissa olevan veden laatu, pH, kovuus, TOC, lämpötila ja liuenneen hapen pitoisuus; |
|
— |
yksityiskohtaiset tiedot ruokkimisesta (esim. rehutyyppi, sen alkuperä, koostumus — vähintään rasva- ja valkuaisainepitoisuus mahdollisuuksien mukaan, annetut määrät ja syöttötaajuus); |
|
— |
kala- ja vesinäytteiden käsittelyä koskevat tiedot, mukaan lukien testattavan aineen valmistusta, säilyttämistä, uuttamista ja määritysmenetelmiä (ja niiden täsmällisyyttä) sekä rasvapitoisuutta koskevat tiedot (JOS on mitattu). |
3.4 TULOKSET:
|
— |
mahdollisista esikokeista saadut tulokset; |
|
— |
vertailukalojen ja kussakin altistuskammiossa olevien kalojen kuolleisuus sekä mahdollinen tavalli suudesta poikkeava käyttäytyminen; |
|
— |
kalojen rasvapitoisuus (jos se on määritetty testin yhteydessä); |
|
— |
testattavan kemikaalin kertymää ja poistumaa kuvaavat käyrät (mukaan lukien kaikki mittaustu lokset) ja tasapainotilan saavuttamiseen tarvittu aika; |
|
— |
Ct ja Cw (sekä keskihajonta ja vaihteluväli, jos aiheellista) kaikkien näytteenottoaikojen osalta (C1 ilmaistuna mikrogrammoina grammaa märkäpainoa kohti tai ppm:inä koko kalaa tai sen tiettyjä kudoksia, esim. rasvakudosta kohti, ja C mikrogrammoina millilitraa kohti eli ppm:inä); Cw-arvot verrokkisarjalle (tausta) on myös ilmoitettava; |
|
— |
tasapainotilassa mitattu biokonsentraatiotekijä (BCFss) ja/tai kineettinen konsentraatiotekijä (BCFk) sekä mahdolliset 95 prosentin luotettavuusvälit kertymä- ja poistumavakioille (kaikki ilmaistuna eläimen tai sen tiettyjen kudosten kokonaispainoa tai kokonaisrasvapitoisuutta kohti, jos ne on mitattu), luotettavuusvälit ja keskihajonta, jos ovat saatavina, sekä tuloksiin sovellettu tietokone analyysi kullekin käytetylle testipitoisuudelle; |
|
— |
jos on käytetty radioaktiivisesti leimattuja aineita, voidaan tarvittaessa esittää mahdollisten havait tujen aineenvaihduntatuotteiden kertymistä koskevat tiedot; |
|
— |
mahdolliset epätavalliset tapahtumat testin aikana, poikkeamat näistä menettelyistä ja muut mahdolliset asiaan liittyvät tiedot. |
On vältettävä ilmoittamasta ”ei havaittu havaitsemisrajalla”. Menetelmää ja koejärjestelyä on kehitettävä ennen testiä, koska edellä mainitunlaisia tuloksia ei voi käyttää nopeusvakioiden laskemiseen.
4. KIRJALLISUUSVIITTEET
|
(1) |
Connell D.W. (1988). Bioaccumulacion behaviour of persistent chemicals with aquatic organisms.Rev. Environ. Contam. Toxicol. 102, pp 117–156. |
|
(2) |
Bintein S., Devillers, J. and Karcher W. (1993). Nonlinear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR and QSAR in Environmental Research, 1, 2–390. |
|
(3) |
OECD, Paris (1996). Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals. No 3. |
|
(4) |
Kristensen P. (1991). Bioconcentration in fish: Comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Denmark. |
|
(1) (5) |
US EPA 822-R-94-002 (1994) Great Lake Water Quality Initiative Technical Support Doc. for the Procedure to Determine Bioaccumulation Factors. July 1994. |
|
(6) |
US FDA (Food and Drug Administration) Revision. Pesticide analytical manual, 1, 5600 Fisher's Lane Rockville, MD 20852, July 1975. |
|
(7) |
US EPA (1974). Section 5, A(l). Analysis of Human Adipose Tissue, in Analysis of Pesticide Recidues in Human and Environmental Samples, Thompson J.F. (ed.) Research Triangle Park, N.C. 27711. |
|
(8) |
Compaan H. (1980) in ”The determination of the possible effects of chemicals and wastes on the aquatic environment: degradation, toxicity, bioaccumulation”, Ch. 2.3, Part II. Government Publishing Office, The Hague, The Netherlands. |
|
(9) |
Gardner et al. (1995). Limn. & Oceanogr. 30, 1099–1105. |
|
(10) |
Randall R.C., Lee H., Ozretich R.J., Lake J.L. and Pruell R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Toxicol. Chem. 10, pp 1431–1436. |
|
(11) |
CEC. Bioconcentration of chemical substances in fish: the flow-through method-Ring Test Programme, 1984–1985. Final report March 1987. Authors: P. Kristensen and N. Nyholm. |
|
(12) |
ASTME E-1022-84 (Reapproved 1988). Standard Practice for conducting Bioconcentration Tests with Fishes and Saltwater Bivalve Molluscs. |
Liite 1
Hyväksyttävän laimennusveden kemialliset ominaisuudet
|
|
Aine |
Raja-pitoisuus |
|
1 |
Kiinteät aineet/hiukkaset |
5 mg/l |
|
2 |
Orgaanisen hiilen kokonaismäärä |
2 mg/l |
|
3 |
Ionisoitumaton ammoniakki |
l μg/1 |
|
4 |
Jäännöskloori |
10 μg/l |
|
5 |
Orgaanista fosforia sisältävien torjunta-aineiden kokonaismäärä |
50 ng/l |
|
6 |
Orgaanista klooria sisältävät torjunta-aineet ja polyklooratut bife-nyylit |
50 ng/1 |
|
7 |
Orgaanisen kloorin kokonaismäärä |
25 ng/1 |
|
8 |
Alumiini |
1 μg/l |
|
9 |
Arseeni |
1 μg/1 |
|
10 |
Kromi |
1 ng/1 |
|
1 1 |
Koboltti |
1 ng/1 |
|
12 |
Kupari |
1 μg/l |
|
13 |
Rauta |
1 μg/l |
|
14 |
Lyijy |
1 μg/l |
|
15 |
Nikkeli |
1 μg/l |
|
16 |
Sinkki |
1 μg/l |
|
17 |
Kadmium |
100 ng/1 |
|
18 |
Elohopea |
100 ng/1 |
|
19 |
Hopea |
100 ng/1 |
Liite 2
Testaukseen suositellut kalalajit
|
|
Suositeltu laji |
Suositeltu lämpötilaväli ( oC) |
Suositeltu koe-eläimen kokonaispituus (cm) |
|
1 |
Danio rerio (17) (Teleostei, Cyprinidae) (Hamilton-Buchanan) seeprakala |
20–25 |
3,0±0,5 |
|
2 |
Pimepbales promelas (Teleostei, Cyprinidae) (Rafinesque) paksupäämutu |
20–25 |
5,0±2,0 |
|
3 |
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) karppi |
20–25 |
5,0±3,0 |
|
4 |
Oryzias latipes (Teleostei, Poeciliidae) (Temminck and Schlegel) (engl. ricefish) |
20–25 |
4,0±1,0 |
|
5 |
Poecilia reticuIata (Teleostei, Poeciliidae) (Peters) (engl. guppy) |
20–25 |
3,0±1,0 |
|
6 |
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque) isoaurinkoahven |
20–25 |
5,0±2,0 |
|
7 |
Oncorhynchus mykiss (Teleostei, Salmonidae) (Walbaum) kirjolohi |
13–17 |
8,0±4,0 |
|
8 |
Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) kolmipiikki |
18–20 |
3,0±1,0 |
Erilaisia suisto- ja merikalalajeja on käytetty eri maissa, esimerkiksi:
|
(engl.) Spot |
Leiostomus xanthurus |
|
(engl.) Sheepshead minnow |
Cyprinodon variegatus |
|
Hopeakylki |
Menidia beryllina |
|
(engl.) Shiner perch |
Cymatogaster aggregata |
|
(engl.) English sole, eräs kielikampela |
Parophrys vetulus |
|
Simppu |
Leptocottus armatus |
|
Kolmipiikki |
Gasterosteus aculeatus |
|
Meriahven |
Dicentraeus labrax |
|
Salakka |
AIburnus alburnus |
Kalojen saatavuus
Edellä olevassa taulukossa lueteltuja makean veden kaloja on helppo kasvattaa ja/tai niitä on helposti saatavissa läpi vuoden, kun taas meri- tai suistokalalajeja on lähinnä saatavissa vastaavissa maissa. Niitä voidaan kasvattaa joko kalanviljelylaitoksissa tai laboratorioissa taudeilta ja loisilta valvotuissa olosuhteissa niin, että saadaan terveitä koe-eläimiä, joiden alku/sukuperä tunnetaan. Näitä kaloja on saatavissa monissa osissa maailmaa.
Liite 3
Kertymä- ja poistumavaiheen keston arvioiminen
1. Kertymdvaiheen keston arvioiminen
Ennen testin suorittamista voidaan saada arvio k2:sta ja siten jokin prosenttimäärä tasapainotilan saavuttamiseksi tarvittavasta ajasta, kun tunnetaan empiirisiä suhteita k2:n ja n-oktanoli-vesi -jakautumiskertoimen (Pow) tai k2:n ja vesiliukoisuuden (s) välillä.
Arvio k2:sta (vuorokautta1) saadaan esimerkiksi seuraavasta empiirisestä suhteesta:
|
log10k2 = -0,414 log10(Pow) + 1,47 (r2 = 0,95) |
(yhtälö 1) |
Muita suhteita on viitteessä (2).
Jos jakautumiskerrointa (Pow) ei tunneta, voidaan tehdä arvio (3), jos tunnetaan aineen vesiliukoisuus (s):
|
log10(Pow) = 0,862 log10(s) + 0,710 (r2 = 0,994) |
(yhtälö 2) |
jossa
s = liukoisuus (moolia/l): (n = 36).
Nämä suhteet koskevat vain kemiallisia aineita, joiden log Pow-arvot ovat 2–6,5 (4).
Aika, joka tarvitaan jonkin prosenttiasteisen tasapainotilan saavuttamiseksi, voidaan saada k2-arviota soveltamalla yleisestä kertymä- ja poistumavaihetta kuvaavasta yhtälöstä (ensimmäisen asteen kinetiikka):

tai jos Cw on vakio:
|
|
(yhtälö 3) |
Kun lähestytään tasapainotilaa (t — ∞), yhtälö 3 voidaan muuttaa (5) (6) seuraavasti:
 or Cf/Cw = k1/k2
= BCF
or Cf/Cw = k1/k2
= BCF
Tällöin k1/k2.Cw lähenee pitoisuutta kalassa ”tasapainotilassa” (Ct, s).
Yhtälö 3 voidaan kirjoittaa seuraavasti:
|
|
(yhtälö 4) |
Soveltamalla yhtälöä 4 voidaan arvioida jonkin prosenttiasteen tasapainotilan saavuttamiseksi tarvittava aika, kun k, on arvioitu ensin yhtälöstä 1 tai 2.
Tilastollisesti paras kertymävaiheen kesto tilastollisesti hyväksyttävien tulosten saamiseksi (BCFk) on aika, joka tarvitaan, jotta kalassa olevan testattavan aineen pitoisuuden logaritmia lineaarisen ajan funktiona kuvaava käyrä tulee keskikohtaansa, eli 1,6/k, tai 80 % tasapainotilasta, mutta ei enempää kuin 3,0 k2/ tai 95 % tasapainotilasta (7).
Aika, joka tarvitaan 80-prosenttisen tasapainotilan saavuttamiseen on (yhtälö 4):
|
|
(yhtälö 5) |
Samaten 95 % tasapainotilasta on:
|
|
(yhtälö 6) |
Esimerkiksi kertymävaiheen (uptake phase, up) kesto testattavalle aineelle, jonka log Pow = 4, olisi (käyttäen yhtälöitä 1, 5, 6):
|
log10k2 = -0,414.(4) + 1,47 |
k2 = 0,652 vrk-1 |
up (80 %) = 1,6/0,652; ts. 2,45 vrk (59 tuntia)
tai up (95 %) = 3,0/0,652; ts. 4,60 vrk (110 tuntia).
Samaten testattavalle aineelle, jonka s = 10-5 mol/l (log(s) = —5,0), kertymävaiheen kesto olisi (käyttäen yhtälöitä 1, 2, 5, 6):
log10 (Pow) =-0,862 (-5,0) + 0,710 = 5,02
log10k2 = -0,414 (5,02) + 1,47
k2 = 0,246 vrk-1
up (80 %) = 1,6/0,246; ts. 6,5 vrk (156 tuntia)
tai up (95 %) = 3,0/0,246; ts. 12,2 vrk (293 tuntia).
Vaihtoehtoisesti yhtälöä
teq = 6,54 × 103 Pow + 55,31 (tuntia)
voidaan käyttää tosiasiallisen tasapainotilan saavuttamiseksi tarvittavan ajan laskemiseen (4).
2. Poistumavaiheen keston arvioiminen
Ennakkoarvio ajasta, joka tarvitaan eläimeen kertyneen aineen pitoisuuden jonkin prosenttimäärän poistumiseen, voidaan myös saada kertymä- ja poistumavaihetta (ensimmäisen asteen kinetiikka) kuvaavasta yleisestä yhtälöstä (1) (8).
Oletetaan, että Cw on poistumavaiheessa nolla. Yhtälö saa seuraavan muodon:
 or
or 
jossa Ct.o on pitoisuus poistumavaiheen alussa. Siten saavutetaan 50 prosentin poistuma ajankohtana (t50):
 or
or 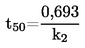
Samaten 95 prosentin poistuma saavutetaan ajankohtana:

Jos 80 %:n kertymää käytetään ensimmäisessä vaiheessa (1,6/k2) ja 95 prosentin poistumaa poistumavaiheessa (3,0/k2), niin poistumavaihe on suunnilleen kaksi kertaa niin pitkä kuin kertymävaihe.
On kuitenkin tärkeää huomata, että nämä arviot perustuvat siihen, että kertymä- ja poistumavaihe noudattavat ensimmäisen asteen kinetiikkaa. Jos näin ei selvästikään ole, on käytettävä monimutkaisempia malleja (esim. viite (1)).
Kirjallisuusviitteet (liite 3)
|
(1) |
Spacie A. and Hamelink J.L. (1982), Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. and Chem. 1, pp 309–320. |
|
(2) |
Kristensen P. (1991), Bioconcentration in fish: comparison of BCF's derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute. |
|
(3) |
Chiou CT. and Schmedding D.W. (1982), Partitioning of organic compounds in octano!-water Systems. Environ. Sci. Technol. 16 (1), pp 4–10. |
|
(4) |
Hawker D.W. and Connell D.W. (1988), Influence of partition coefficient of lipophilie compounds on bioconcentration kinetics with fish. Wat. Res. 22 (6), pp 701—707. |
|
(5) |
Branson D.R., Blau G.E, Alexander H.C. and Neely \X'.B. (1975), Transactions of the American Fisheries Society, 104 (4), pp 785–-792. |
|
(6) |
Ernst W. (1985), Accumulation in aquatic organisms. In: Appraisal of tests to predict the environmental behaviour of chemicals. Ed. by Sheehman P., Korte F., Klein W. and Bourdeau P.H. Part 4.4 pp 243–255. SCOPE, 1985, John Wiley & Sons Ltd N.Y. |
|
(7) |
Reilly P.M., Bajramovic R., Blau G.E., Branson D.R. and Sauerhoff M.W. (1977), Guidelines for the optimal design of experiments to estimate parameters in first order kinetic models, Can. J. Chem. Eng. 55, pp 614–622. |
|
|
Könemann H. and Van Leeuwen K. (1980), Toxicokinetics in fish: Accumulation and Elimination of six Chlorobenzenes by Guppies. Chemosphere, 9, pp 3–19. |
LIITE 4
Teoreettinen esimerkki kertymätestin aikataulusta aineille, joiden log Pow = 4
|
Kalanäytteiden otto |
Näytteenottoaikataulu |
Vesinäytteiden lukumäärä |
Kalojen lukumäärä näytettä kohti |
||||
|
Vaadittu vähimmäis-taajuus (vrk) |
Lisä-näytteet |
||||||
|
Kertymä-vaihe |
- 1 0 |
|
2 (18) 2 |
lisättävä 45-80 kalaa |
|||
|
1. |
0,3 |
0,4 |
2 (2) |
4 (4) |
|||
|
2. |
0,6 |
0,9 |
2 (2) |
4 (4) |
|||
|
3. |
1,2 |
1,7 |
2 (2) |
4 (4) |
|||
|
4. |
2,4 |
3,3 |
2 (2) |
4 (4) |
|||
|
5. |
4,7 |
|
2 |
6 |
|||
|
Poistuma-vaihe |
|
|
|
Siirto veteen, jossa ei ole testattavaa kemikaalia |
|||
|
6. |
5,0 |
5,3 |
|
4 (4) |
|||
|
7 |
5,9 |
7,0 |
|
4 (4) |
|||
|
8. |
9,3 |
11,2 |
|
4 (4) |
|||
|
9. |
14,0 |
17,5 |
|
6 (4) |
|||
|
Suluissa olevat luvut ovat mahdollisten lisänäytteiden (vesi, kala) määrä.
|
|||||||
Liite 5
Mallin valitseminen
Biokertymistulosten on yleensä oletettu noudattavan ”kohtuullisesti” yksinkertaista kahden osaston ja kahden muuttujan mallia. Sen osoittaa suora kuvaaja, joka vastaa kalassa poistumavaiheessa havaittuja pitoisuuksia, kun ne esitetään puolilogaritmipaperilla. (Jos näistä pitoisuuksista ei muodostu suoraa kuvaajaa, olisi käytettävä monimutkaisempia malleja, katso esim. Spacie ja Hamelink, liitteen 3 viite 1).
Graafinen menetelmä poistumavakion k2 määrittämiseksi
Kussakin kalanäytteessä mitattu testattavan aineen pitoisuus esitetään näytteenottoajankohdan funktiona puolilogaritmipaperilla. Tämän kuvaajan kulmakerroin on k2.


On huomattava, että poikkeamat suorasta viivasta voivat viitata monimutkaisempaan poistumaan kuin ensimmäisen asteen kinetiikkaa noudattavaan poistumaan. Graafista menetelmää voidaan käyttää sellaisten poistumatyyppien selvittämiseen, jotka poikkeavat ensimmäisen asteen kinetiikasta.
Graafinen menetelmä kertymävakion k1 määrittämiseksi
Kun tunnetaan k2, lasketaan k1 seuraavasti:
|
|
(yhtälö 1). |
Cf:n arvo luetaan mittaustuloksista saadun tasaisen käyrän keskikohdasta, kun pitoisuuden logaritmi on esitetty ajan funktiona (aritmeettisella asteikolla).
Kertymä- ja poistumavakioiden laskeminen tietokoneella
Biokertyvyystekijä sekä k1- ja k2-nopeusvakiot lasketaan mieluiten tietokoneella käyttäen epälineaarisia parametrien arviointimenetelmiä. Tällaisilla ohjelmilla saadaan arvot k1:lle ja k2:lle, jos on sarja peräkkäisiä aikakonsentraatiotuloksia ja malli:
|
|
(yhtälö 2). |
|
|
(yhtälö 3). |
joissa tc = aika, jolloin kertymävaihe loppuu.
Tällä menetelmällä saadaan myös k1:n ja k2:n keskihajonnan keskivirheet.
Koska k2 voidaan useimmissa tapauksissa arvioida poistumiskäyrästä suhteellisen suurella tarkkuudella ja koska k1 ja k2 korreloivat vahvasti, jos ne arvioidaan samanaikaisesti, voi olla suositeltavaa laskea ensin k2 poistumavaiheen tuloksista ainoastaan ja laskea sitten k1 kertymävaiheen tuloksista käyttäen epälineaarisen regression menetelmää.
C.14. KALANPOIKASILLA TEHTÄVÄ KASVUTESTI
1. MENETELMÄ
Tämä kasvun mittaukseen perustuva myrkyllisyystesti on toisinto OECD:n testiohjeesta nro 215 (2000).
1.1 JOHDANTO
Testin tarkoituksena on arvioida vaikutukset, jotka pitkäaikaisella altistuksella kemikaaleille on kalanpoikasten kasvuun. Testi perustuu Euroopan unionissa kehitettyyn ja rengastestattuun (1) (3) menetelmään, jolla arvioidaan kemikaalien vaikutus kirjolohen poikasen (Oncorynchus mykiss) kasvuun läpivirtausolosuhteissa. Muitakin hyvin dokumentoituja lajeja voidaan käyttää. Kokemusta on esimerkiksi seeprakalalla (Danio rerio) (2) (4) (5) ja medakalla (Oryzias latipes) (6) (7) (8) tehdyistä kasvutesteistä.
Ks. myös osan C Yleisjohdanto.
1.2 MÄÄRITELMÄT
LOEC (Lowest Observed Effect Concentration, pienin havaittavan vaikutuksen aiheuttava pitoisuus): Pienin testiaineen testattu pitoisuus, jolla aineen havaitaan aiheuttavan merkitsevän vaikutuksen (arvolla p < 0,05) verrattuna kontrolliin. Kuitenkin kaikilla LOEC-tasoa suuremmilla testipitoisuuksilla on oltava vähintään yhtä haitallinen vaikutus kuin LOEC-tasolla.
NOEC (No Observed Effect Concentration, vaikutukseton pitoisuus): Välittömästi LOEC-tasoa pienempi testipitoisuus.
ECX: tässä testimenetelmässä se testiaineen pitoisuus, joka aiheuttaa x prosentin muutoksen kalan kasvunopeudessa verrattuna kontrolleihin.
Lastaustiheys: kalojen märkäpaino tilavuusyksikköä kohti.
Varastotiheys: kalojen lukumäärä tilavuusyksikköä kohti.
Yksittäisen kalan spesifinen kasvunopeus: yksittäisen kalan kasvunopeus verrattuna sen alkupainoon.
Tankkikohtainen keskimääräinen spesifinen kasvunopeus: tankin populaation keskimääräinen kasvunopeus yhdessä pitoisuudessa.
Spesifinen pseudokasvunopeus: yksittäisen kalan kasvunopeus verrattuna tankkipopulaation keskimääräiseen alkupainoon.
1.3 TESTIN PERIAATE
Eksponentiaalisessa kasvuvaiheessa olevat kalanpoikaset punnitaan ja pannaan testiastioihin, jossa ne altistetaan useille veteen liuotettujen testiaineiden subletaaleille pitoisuuksille mieluiten läpivirtausolosuhteissa, tai jos se ei ole mahdollista, sopivissa puolistaattisissa (staattinen järjestelmä, jossa liuokset vaihdetaan) olosuhteissa. Testin kesto on 28 vuorokautta. Kalat ruokitaan päivittäin. Rehun määrä suhteutetaan kalojen alkupainoon, ja se voidaan laskea uudelleen 14 vuorokauden kuluttua. Testin lopussa kalat punnitaan uudelleen. Vaikutukset kasvunopeuteen analysoidaan käyttämällä regressiomallia sen pitoisuuden estimoimiseksi, joka aiheuttaisi x prosentin vaikutuksen kasvunopeuteen, ts. EC X(esim. EC10,EC,20 tai EC30). Vaihtoehtoisesti tuloksia voidaan verrata kontrolliarvoihin pienimmän havaittavan vaikutuksen aiheuttavan pitoisuuden arvioimiseksi ja siitä edelleen sen pitoisuuden arvioimiseksi, joka ei aiheuta havaittavaa vaikutusta.
1.4 TESTIAINETTA KOSKEVAT TIEDOT
Välittömän myrkyllisyyden testin (ks. menetelmä C.l), joka on mieluiten tehty tähän testiin valitulla lajilla, tulosten pitäisi olla käytettävissä. Tämä tarkoittaa sitä. että testiaineen vesiliukoisuus ja höyrvnpaine tunnetaan, että käytettävissä on luotettava analyyttinen menetelmä aineen kvantifioimiseksi testiliuoksissa ja että menetelmän tarkkuus ja detektioraja tunnetaan ja ne on raportoitu.
Hyödyllisiä tietoja ovat mm. rakennekaava, aineen puhtaus, stabiilisuus vedessä ja valossa, pKa, POW. ja nopean biohajoavuuden testin tulokset (ks. menetelmä C.4).
1.5 TESTIN LUOTETTAVUUS
Testi on luotettava, jos
|
— |
kontrollien kuolleisuus ei ole suurempi kuin 10 % testin lopussa, |
|
— |
kontrollikalojen keskimääräinen paino on noussut niin paljon, että voidaan osoittaa merkitseväksi katsottu kasvunopeuden minimivaihtelu. Rengastestissä (2) on osoitettu, että kirjolohelle kontrollikalojen keskimää räisen painon on noustava 28 vuorokaudessa vähintään puolella (ts. 50 %) verrattuna niiden alkupainoon. Esim: alkupaino: 1 g/kala (= 100 %), loppupaino 28 vuorokauden kuluttua: ≥ 1,5 g/kala (≥ 150 %), |
|
— |
liuenneen hapen pitoisuus on vähintään 60 % ilman kyllästysarvosta koko testin ajan. |
|
— |
veden lämpötila vaihtelee enintään 1 oC testiastioiden välillä milloin tahansa testin aikana ja poikkeaa enintään 2 oC siitä lämpötila-alueesta, joka on määritelty kyseiselle testilajille (lisäys 1). |
1.6 TESTIMENETELMÄN KUVAUS
1.6.1 Laitteet ja tarvikkeet
Tavallisia laboratoriolaitteita ja erityisesti seuraavat:
|
— |
a) happi- ja pH-mittarit: |
|
— |
b) laitteet veden kovuuden ja emäksisyyden mittaamiseen; |
|
— |
c) asianmukaiset laitteet lämpötilan säätöön ja mieluiten sen jatkuvaan seurantaan; |
|
— |
d) tankkeja, jotka ovat kemiallisesti inerttiä materiaalia ja riittävän suuria suhteessa suositeltuun lastaus- ja varastotiheyteen (ks. kohta 1.8.5 ja lisäys 1); |
|
— |
e) riittävän tarkka vaaka (ts. ±0,5 %). |
1.6.2 Vesi
Testissä voidaan käyttää mitä tahansa sellaista vettä, jossa testilaji elää ja kasvaa sopivan kauan. Veden laadun pitäisi pysyä vakiona testin ajan. Veden pH:n olisi oltava välillä 6,5–8,5, mutta kunkin testin aikana se ei saa vaihdella enempää kuin 0,5 pH-yksikköä. Suositeltava veden kovuus on yli 140 mg/l (CaCO3). Sen varmistamiseksi, ettei laimennusvesi vaikuta liikaa testituloksiin (esimerkiksi kompleksoimalla testattavaa ainetta), näytteitä olisi otettava säännöllisin väliajoin määrityksiä varten. Raskasmetallit (esim. Cu, Pb, Zn, Hg, Cd, Ni), tärkeimmät anionit ja kationit (esim. Ca, Mg, Na. K, C1, SO4), torjunta-aineet (esim. orgaanista fosforia ja orgaanista klooria sisältävien torjunta-aineiden kokonaispitoisuudet), orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaispitoisuus ja suspendoituneet kiinteät aineet olisi määritettävä esimerkiksi kolmen kuukauden välein, jos laimennusveden laatu tiedetään suhteellisen vakioksi. Jos veden laadun on osoitettu pysyvän vakiona ainakin vuoden ajan, määrityksiä voidaan tehdä harvemmin (esim. kuuden kuukauden välein). Lisäyksessä 2 luetellaan joitakin hyväksyttävän laimennusveden ominaisuuksia.
1.6.3 Testiliuokset
Halutunpitoiset testiliuokset valmistetaan varastoliuoksista laimentamalla.
Varastoliuos valmistetaan mieluiten yksinkertaisesti sekoittamalla testattava aine laimennusveteen käyttäen mekaanisia menetelmiä tai ultraääntä. Saturaatiopylväitä (liukoisuuspylväitä) voidaan käyttää riittävän väkevän varastoliuoksen valmistamiseksi.
Liuottimien tai liuotusapuaineiden (dispergointiaineiden) käyttö voi olla tarpeen joissakin tapauksissa riittävän väkevän varastoliuoksen valmistamiseksi. Sopivia liuottimia ovat esimerkiksi asetoni, etanoli, metanoli, dimetyylisulfoksidi, dimenyliformamidi ja trietyleeniglykoli. Sopivia dispergointiaineita ovat esimerkiksi Cremophor RH40, Tween 80, 0,01-prosenttincn metyyliselluloosa ja HCO-40. Helposti biohajoavia aineita (kuten asetonia) ja/tai helposti haihtuvia aineita käytettäessä on oltava varovainen, koska ne voivat aiheuttaa ongelmia bakteerikasvuston takia läpivirtaustesteissä. Jos käytetään liuotusapuaineita, niillä ei saa olla merkittävää vaikutusta kalojen kasvuun eikä näkyviä haitallisia vaikutuksia kalanpoikasiin. Se on osoitettava ainoastaan liuotinta sisältävän kontrollin avulla.
Läpivirtaustesteissä on käytettävä testiaineen varastoliuosta jatkuvasti annostelevaa ja laimentavaa järjestelmää (esim. annostelupumppua, laimenninta, kyllästävää järjestelmää) eri pitoisuuksia sisältävien näytteiden annostelemiseksi testiastioihin. Varastoliuosten ja laimennusveden virtausnopeudet on tarkistettava säännöllisin väliajoin, mieluiten kerran päivässä, ja virtausnopeus saisi vaihdella enintään 10 % koko testin aikana. Rengastestissä (3) on osoitettu, että hyväksyttävä vedenvaihtotaajuus on kirjolohelle 6 litraa grammaa kalaa kohti päivässä (ks. kohta 1.8.2.2).
Puolistaattisissa (joissa liuokset vaihdetaan) testeissä kasvatusnesteen vaihtoväli riippuu testiaineen stabiilisuudesta, mutta vaihtoa suositellaan kerran päivässä, jos alustavista stabiilisuustesteistä (ks. kohta 1.4) tiedetään, ettei testiaineen pitoisuus pysy vakiona (ts. se ei ole välillä 80–120 % nimellisarvosta tai se laskee alle 80 prosenttiin mitatusta alkupitoisuudesta) vaihtojen välillä, olisi harkittava läpivirtaustestiä.
1.6.4 Kalalajin valinta
Kirjolohi (Oncorhynchus mykiss) on suositeltava laji tähän testiin, koska rengastestissä on eniten kokemusta siitä (1) (3). Muutakin hyvin dokumentoitua lajia saa käyttää, mutta testimenetelmää on mahdollisesti mukautettava, jotta testiolosuhteet olisivat sopivat. Kokemusta on esim. seeprakalasta (Danio rerio) (4) (5) ja medakasta (Oryzias latipes) (6) (7) (8). Tällaisessa tapauksessa olisi selostettava syyt lajin ja koemenetelmän valitsemiseen.
1.6.5 Kalojen hoito
Testikalat on valittava yhdestä populaatiosta, mieluiten samasta poikueesta, jota on pidetty vähintään kaksi viikkoa ennen testiä samanlaatuisessa vedessä ja samanlaisissa valaistusolosuhteissa kuin ne, joita käytetään testissä. Kaloille olisi annettava ravintoa vähintään 2 % ja mieluiten 4 % elopainoa kohti päivässä niiden kasvatus-aikana ja testin aikana.
Kalojen kuolleisuus rekisteröidään 48 tunnin sopeutumisajanjakson jälkeen. Tämän jälkeen sovelletaan seuraavia perusteita:
|
— |
jos kuolleisuus on yli 10 % populaatiosta seitsemässä vuorokaudessa: koko erä hylätään, |
|
— |
jos kuolleisuus on välillä 5-10 % populaatiosta: kaloja totutetaan vielä seitsemän päivää. Jos kuolleisuus on yli 5 % näiden toisten seitsemän päivän aikana, koko erä hylätään, |
|
— |
jos kuolleisuus on alle 5 % populaatiosta seitsemässä vuorokaudessa: erä hyväksytään. |
Kaloille ei saisi antaa mitään hoitoa sairautta varten testiä edeltävien kahden viikon aikana eikä testin aikana.
1.7 TESTIN SUUNNITTELU
”Testin suunnittelu” tarkoittaa testipitoisuuksien lukumäärän ja pitoisuusvälien valintaa, tankkien lukumäärää kutakin pitoisuutta kohti ja kalojen lukumäärää tankkia kohti. Testi pitäisi suunnitella mieluiten niin, että otetaan huomioon
|
— |
a) tutkimuksen tarkoitus; |
|
— |
b) käytettävä tilastollisen analyysin menetelmä; |
|
— |
c) kokeessa tarvittavien resurssien saatavuus ja kustannukset. |
Tavoitteita ilmoitettaessa olisi mahdollisuuksien mukaan spesifioitava, millä tilastollisella teholla tietynsuuruinen ero (esim. kasvunopeudessa) on osoitettava tai vaihtoehtoisesti millä tarkkuudella ECX (esim. kun x = 10, 20 tai 30, ja mieluiten vähintään 10) on estimoitava. Muuten tutkimuksen kokoa ei voida määritellä tarkasti.
On tärkeää huomata, että suunnitelma, joka on optimaalinen (hyödyntää resurssit parhaiten) yhdelle tilastoanalyysimenetelmälle, ei ole välttämättä optimaalinen toiselle menetelmälle. LOEC/NOEC-arvon estimoinnille suositeltava suunnitelma ei siis olisi sama kuin regressioanalyysiä varten suositeltava.
Useimmissa tapauksissa regressioanalyysi on parempi kuin varianssianalyysi. Syitä ovat käsitelleet Stephan ja Rogers (9). Jos kuitenkaan ei löydetä sopivaa regressiomallia (r2 < 0,9), olisi käytettävä NOEC|LOEC-menetelmää.
1.7.1 Regressioanalyysille suositeltava testisuunnitelma
Regressioanalyysillä käsiteltävän testin suunnitelmassa on otettava huomioon seuraavat seikat:
|
— |
a) Testissä käytettävien pitoisuuksien on katettava vaikutuspitoisuus (esim. EC10, 20, 30) ja se pitoisuusalue, joka on merkityksellinen kyseisen testiaineen kannalta. Tarkkuus, jolla vaikutuspitoisuuksien estimaatit voidaan tehdä, on paras, kun vaikutuspitoisuus sijoittuu testattujen pitoisuuksien keskialueelle. Alustava pitoisuusalueen määrittely voi auttaa sopivien testipitoisuuksien valinnassa. |
|
— |
b) Jotta tilastollinen mallitus olisi mahdollista, testissä pitäisi olla vähintään yksi kontrollitankki ja viisi muuta tankkia, joissa on eri pitoisuudet. Jos käytetään liuotusapuaineita, on testisarjan lisäksi määritettävä yksi kontrolli, joka sisältää liuotusapuainetta suurimmassa testipitoisuudessa (ks. kohdat 1.8.3 ja 1.8.4), |
|
— |
c) Sopivaa geometrista tai logaritmista sarjaa (10) (ks. lisäys 3) voidaan käyttää. On suositeltavaa tehdä pitoi suuksista logaritminen sarja. |
|
— |
d) Jos käytettävissä on enemmän kuin kuusi tankkia, lisätankit olisi käytettävä joko rinnakkaismäärityksiin tai niissä olevat pitoisuudet olisi sijoitettava koko pitoisuusalueen yli, jotta pitoisuuksien eroja voidaan pie nentää. Kumpikin tapa on yhtä hyvä. |
1.7.2 Varianssianalyysillä (ANOVA) käsiteltävälle NOEC/LOEC-menetelmälle suositeltava testisuunnitelma
Kullekin pitoisuudelle pitäisi olla mieluiten rinnakkaiset tankit, ja tilastollinen analyysi pitäisi tehdä tankkien tasolla (11). Ilman rinnakkaisia tankkeja ei voida tehdä korjauksia tankkien välisen vaihtelun ottamiseksi huomioon sen vaihtelun lisäksi, joka johtuu yksittäisistä kaloista. Kokemus on kuitenkin osoittanut (12), että tankkien välinen vaihtelu on erittäin pieni verrattuna tankin sisäiseen (ts. kalojen väliseen) vaihteluun. Suhteellisen hyväksyttävä vaihtoehto on siksi tehdä tilastollinen analyysi yksittäisten kalojen tasolla.
Tavanomaisesti käytetään vähintään viittä testipitoisuutta geometrisessa sarjassa, jolloin kerroin ei mielellään saa ylittää arvoa 3,2.
Yleensä kun testeissä on rinnakkaisia tankkeja, rinnakkaisten kontrollitankkien lukumäärän ja siten kalojen määrän pitäisi olla kaksi kertaa niiden määrä kussakin testipitoisuudessa, joiden pitäisi olla samansuuruiset (13) (14) (15). Jos sen sijaan ei käytetä rinnakkaisia tankkeja, kontrolliryhmän kalojen lukumäärän olisi oltava sama kuin niiden lukumäärä kussakin testipitoisuudessa.
Jos ANOVA-analyysin on määrä perustua tankkeihin eikä yksittäisiin kaloihin (mikä edellyttäisi joko kalojen yksilöllistä merkitsemistä tai spesifisen pseudokasvunopeuden käyttöä (ks. kohta 2.1.2)), on rinnakkaisia tankkeja oltava niin paljon, että kutakin pitoisuutta varten käytettävien tankkien välinen keskihajonta voidaan määrittää. Tämä tarkoittaa sitä. etta virhettä koskevien vapausasteiden määrän varianssianalyysissä on oltava vähintään 5 (11). Jos vain kontrolleista on rinnakkaiset, on vaara, että virheen vaihtelu vääristyy, koska se voi kasvaa kyseessä olevan kasvunopeuden keskiarvon mukana. Koska kasvunopeus todennäköisesti pienenee pitoisuuden noustessa, tämä saattaa johtaa vaihtelun estimointiin liian suureksi.
l.8. MENETTELY
l.8.l Kalojen valinta ja punnitus
On tärkeää minimoida kalojen painon vaihtelu testin alussa. Lisäyksessä 1 mainitaan, minkälainen kokovaih-telu sopii tähän testiin suositelluille eri lajeille. Testissä käytettävässä koko kalaerässä yksittäisten kalojen painot eivät saisi vaihdella testin alussa mielellään enempää kuin ±10 % aritmeettisesta keskiarvosta eikä missään tapauksessa enemmän kuin 25 %. Suositellaan, että punnitaan alustava erä kaloja keskimääräisen painon arvioimiseksi.
Kantapopulaatiota ei saisi ruokkia 24 tuntiin ennen testin alkua. Kalat valitaan sitten satunnaistetusti. Kalat anestetisoidaan yleisellä anestesia-aineella (esim. vesiliuos, jossa on 100 mg/l trikaiinimetaanisulfonaattia (MS 222), joka on neutralisoitu lisäämällä kaksi osaa natriumbikarbonaattia yhtä osaa MS 222:ta kohti) ja punnitaan yksittäin (märkäpaino; pyyhekuivattuna) Lisäyksessä 1 mainitulla tarkkuudella. Kalat, joiden paino on annetuissa rajoissa, otetaan testiin ja jaetaan satunnaistetusti testiastioihin. Kalojen kokonaismärkäpaino kussakin testiastiassa kirjataan. Anestesia samoin kuin kalojen käsittely (kuten kuivaaminen ja punnitus) voi aiheuttaa kalanpoikasille, erityisesti pienikokoisille kaloille, stressiä ja vaurioita. Kalanpoikasia on siksi käsiteltävä äärimmäisen varoen stressin ja vahingoittumisen välttämiseksi.
Kalat punnitaan uudelleen päivänä 28 (ks. kohta 1.8.6), Jos katsotaan, että ruoka-annos on laskettava uudelleen, kalat voidaan punnita uudelleen päivänä 14 (ks. kohta 1.8.2.3). Muitakin menetelmiä, kuten valokuvaamista, voidaan käyttää kalojen koon muutosten määrittämiseksi. Rehun määrä voidaan siten mukauttaa koon muutoksiin.
1.8.2 Altistusolosuhteet
1.8.2.1 Testin kesto
Testin kesto on ≥ 28 vuorokautta.
1.8.2.2 Lastaus- ja varastotiheys
On tärkeää, että lastaus- ja varastotiheys ovat käytetylle kalalajille sopivia (ks. lisäys 1). Jos varastotiheys on liian suuri, ahtaus aiheuttaa stressiä, jonka seurauksena kasvunopeus laskee ja kalat voivat sairastua. Jos varas-totiheys on liian pieni, voi aiheutua territoriaalikäyttäytymistä, joka voi myös vaikuttaa kasvuun. Joka tapauksessa lastaustiheyden pitäisi olla niin pieni, että liuenneen hapen pitoisuus voidaan pitää vähintään arvossa 60 % ilman ilmastusta. Rengastestissä (3) on osoitettu, että hyväksyttävä lastaustiheys kirjolohelle on 16 kirjolohta (paino 3–5 g) 40 litrassa. Suositeltava veden vaihtamistaajuus testin aikana on 6 litraa grammaa kohti kalaa vuorokaudessa.
1.8.2.3 Ruokkiminen
Kaloille pitäisi antaa sopivaa ravintoa (lisäys 1) riittävästi, jotta kasvunopeus on hyväksyttävä. On varottava, ettei vedessä kasva mikrobeja eikä se samennu. Kirjolohelle mainitut edellytykset todennäköisesti täyttävä ruokintatiheys on 4 % elopainosta vuorokaudessa (3) (16) (17) (18). Päiväannos voidaan jakaa kahteen yhtä suureen osaan ja antaa kahtena kertana päivässä. Ruokintojen välin on oltava vähintään 5 tuntia. Annoksen määrä perustuu kalojen kokonaispainoon kutakin testiastiaa kohti testin alussa. Jos kalat punnitaan uudelleen päivänä 14, annos lasketaan uudelleen. Kaloja ei saa ruokkia 24 tuntiin ennen punnitusta.
Syömättä jäänyt rehu ja ulosteet on poistettava testiastioista päivittäin puhdistamalla tankkien pohjat huolellisesti imulaitteella.
1.8.2.4 Valo ja lämpötila
Valoisan ajan ja testiveden lämpötilan pitäisi olla sopivia käytetylle testilajille (lisäys 1).
1.8.3 Testipitoisuudet
Yleensä tarvitaan viisi testipitoisuutta riippumatta testisuunnitelmasta (ks. kohta 1.7.2). Jos testiaineen myrkyllisyydestä on aiempia tietoja (esim. akuutista testistä ja/tai alustavista pitoisuusalueen määrityksistä), ne auttavat sopivien testipitoisuuksien valinnassa. Jos käytetään vähempää kuin viittä testipitoisuutta, se on perusteltava. Suurin testipitoisuus ei saisi olla suurempi kuin aineen liukoisuus veteen.
Kun varastoliuosten valmistuksessa käytetään jotakin liuotusapuainetta, sen lopputilavuus testiastioissa ei saisi olla suurempi kuin 0,1 ml/l, ja tilavuuden pitäisi olla sama kaikissa testiastioissa (ks. kohta 1.6.3). Näiden aineiden käyttöä on kuitenkin vältettävä mahdollisimman pitkälle.
1.8.4 Kontrollit
Laimennusvesikontrollien lukumäärä riippuu testisuunnitelmasta (ks. kohdat 1.7–1.7.2). Jos käytetään liuotusapuainetta, testiin on otettava mukaan yhtä monta liuotusapuainekontrollia kuin laimennusvesikontrolleja.
1.8.5 Analyyttisten määritysten ja mittausten taajuus
Testiaineen pitoisuudet on määritettävä säännöllisin määräajoin testin aikana (ks. jäljempänä).
Läpivirtaustesteissä laimennusveden ja myrkyllistä ainetta sisältävän varastoliuoksen virtausnopeudet on tarkistettava säännöllisin väliajoin, mieluiten kerran päivässä, ja virtausnopeus saisi vaihdella enintään 10 prosenttia koko testin aikana. Jos testiainepitoisuuksien odotetaan pysyvän 20 prosentin sisällä nimellisarvosta (ts. välillä 80–120 %, ks. kohdat 1.6.2 ja 1.6.3), suositellaan, että määritetään vähintään suurimmat ja pienimmät pitoisuudet testin alussa ja viikon välein sen jälkeen, jos testiaineen pitoisuuden ei odoteta pysyvän 20 prosentin sisällä nimellisarvosta (aineen stabiilisuutta koskevien tietojen perusteella), on analysoitava kaikki pitoisuudet noudattaen samanlaista järjestelmää.
Puolistaattisissa (jossa liuokset vaihdetaan) testeissä suositellaan, että määritetään vähintään suurimmat ja pienimmät pitoisuudet tuoreesta liuoksesta ja juuri ennen liuoksen vaihtoa testin alussa ja viikon välein sen jälkeen, jos testiainepitoisuuksien odotetaan pysyvän 20 prosentin sisällä nimellisarvosta. Jos testiaineen pitoisuuden ei odoteta pysyvän 20 prosentin sisällä nimellisarvosta, on analysoitava kaikki pitoisuudet noudattaen samanlaista järjestelmää kuin stabiilimmille aineille.
Suositellaan, että tulosten perusteina käytetään mitattuja pitoisuuksia. Jos kuitenkin on näyttöä siitä, että testiaineen pitoisuus pysyy tyydyttävästi 20 prosentin sisällä nimellispitoisuudesta tai mitatusta alkupitoisuudesta koko testin ajan, tulosten perustana voidaan käyttää nimellispitoisuuksia tai mitattuja pitoisuuksia.
Näytteet voivat edellyttää sentrifugointia tai suodatusta (esim. 0,45 um:n huokoskoon suotimella). Sentrifugointia suositellaan. Jos testiaine ei adsorboidu suotimiin, voi myös suodatus olla hyväksyttävää.
Liuennut happi, pH ja lämpötila on mitattava testin aikana kaikista testiastioista. Veden kokonaiskovuus, emäksisyys ja suolapitoisuus (jos sillä on merkitystä) mitataan kontrolleista ja yhdestä astiasta, jossa on suurin pitoisuus. Vähintään olisi mitattava liuennut happi ja suolapitoisuus (jos sillä on merkitystä) kolmesti (testin alussa, keskivaiheilla ja lopussa). Suositellaan, että puolistaattisissa testeissä liuennut happi mitataan useammin, mieluiten ennen kutakin veden vaihtoa ja sen jälkeen tai vähintään kerran viikossa. pH olisi mitattava kunkin vedenvaihdon alussa ja lopussa puolistaattisissa testeissä ja vähintään viikoittain läpivirtaustesteissä. Kovuus ja emäksisyys olisi mitattava kerran testin aikana. Lämpötilaa olisi mielellään seurattava jatkuvasti vähintään yhdessä testiastiassa.
1.8.6 Havainnot
Paino: Testin lopussa on määritettävä kaikkien elossa olevien kalojen märkäpaino (pyyhekuivattuna) joko ryhmittäin testiastiaa kohti tai yksittäin. Punnitseminen testiastiaa kohti on parempi kuin yksittäisten kalojen punnitseminen, jolloin kalat olisi merkittävä yksilöllisesti. Jos mitataan kunkin kalan paino yksilöspesifisen kasvunopeuden määrittämiseksi, olisi valittava sellainen merkintätapa, joka ei stressaisi eläimiä (kylmämerkinnän vaihtoehdot, esim. hienon värillisen siiman käyttö, voivat olla sopivia).
Kaloja on havainnoitava päivittäin testin aikana, ja kaikki ulkoiset poikkeavuudet (kuten verenvuoto, värin muutokset) olisi pantava merkille. Mahdolliset kuolemantapaukset on kirjattava ja kuolleet kalat poistettava mahdollisimman nopeasti tankista. Kuolleiden kalojen tilalle ei panna uusia, sillä lastaus- ja varastotiheys ovat niin suuret, että kunkin tankin kalojen määrän muutokset eivät vaikuta kasvuun. Ruokkimistaajuutta on kuitenkin mukautettava.
2. MÄÄRITYSTULOKSET JA TULOSTEN ILMOITTAMINEN
2.1 TULOSTEN KÄSITTELY
Suositellaan, että sekä testin suunnittelussa että analysoinnissa on mukana tilastotieteilijä, koska menetelmä mahdollistaa huomattavaa joustoa kokeen suunnittelussa. Esim. testiastioiden lukumäärä, testipitoisuuksien lukumäärä ja kalojen lukumäärä voivat olla erilaiset.
Kasvunopeuksia ei lasketa sellaisille testiastioille, joissa kuolleisuus on yli 10 %. Kuolleisuus olisi kuitenkin ilmoitettava kaikille testipitoisuuksille.
Riippumatta tulosten analysointiin käytettävästä menetelmästä keskeinen käsite on spesifinen kasvunopeus r ajankohtien t1, ja t2 välillä. Se voidaan määritellä useilla tavoilla riippuen siitä, onko kalat merkitty yksilöllisesti vai ei ja siitä, tarvitaanko tankin keskiarvoa.

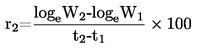

jossa
|
r1 |
= |
yksittäisen kalan spesifinen kasvunopeus |
|
r2 |
= |
tankkikohtainen keskimääräinen kasvunopeus |
|
r3 |
= |
spesifinen pseudokasvunopeus |
|
W1, W2 |
= |
tietyn kalan paino ajankohdalla t1, ja t2 |
|
logeW1 |
= |
yksittäisen kalan painon logaritmi testin alussa |
|
loge, W2 |
= |
yksittäisen kalan painon logaritmi testin lopussa |
|
loge W1 |
= |
w1-arvojen logaritmien keskiarvo tankin kaloille testin alussa |
|
loge W2 |
= |
w2-arvojen logaritmien keskiarvo tankin kaloille testin alussa |
|
t1,t2 |
= |
aika (päiviä) testin alussa ja lopussa |
r1, r2, r3 voidaan laskea ajalle 0–28 vuorokautta ja tarvittaessa (ts. kun päivänä 14 on tehty mittaus) ajalle 0–14 vuorokautta ja 14–28 vuorokautta.
2.1.1 Tulosten regressioanalyysi (pitoisuus-vastemallitus)
Tässä analyysimenetelmässä sovitetaan sopiva matemaattinen vastaavuussuhde spesifisen kasvunopeuden ja pitoisuuden välille, ja sen avulla voidaan estimoida ECx ts. mikä tahansa LC-arvo. Tämä menetelmä ei edellytä r-arvon laskemista yksittäisille kaloille (r1); sen sijaan analyysi perustuu tankkia kohti määritettyyn keskiarvoon (r2). Jälkimmäinen menetelmä on suositeltava. Se on parempi myös pienikokoisille kalalajeille.
Tankkikohtainen keskimääräinen spesifinen kasvunopeus (r2) esitetään kuvaajassa pitoisuuden funktiona, jotta voidaan tarkastella pitoisuus-vastesuhdetta.
Jotta r2-arvon ja pitoisuuden välinen suhde voidaan ilmaista, on valittava sopiva malli, ja valinnan tueksi on esitettävä asianmukaiset perustelut.
Jos elossa olevien kalojen määrä tankeissa on erilainen, on mallin sovitus — olipa se yksinkertainen tai epälineaarinen — painotettava siten, että siinä otetaan huomioon ryhmien epätasainen koko.
Mallin sovitusmenetelmän on oltava sellainen, että voidaan estimoida esim. EC20 ja laskea sen hajonta (joko keskivirhe tai luottamusväli). Sovitetun mallin kuvaaja on esitettävä mittaustulosten kanssa, jotta mallin sopivuus voidaan nähdä (8) (18) (19) (20).
2.1.2 Tulosten analysointi LOEC-arvon estimoimiseksi
Jos testissä on rinnakkaiset tankit kaikilla pitoisuuksilla, LOEC-arvon estimointi voi perustua tankkikohtaisen keskimääräisen spesifisen kasvunopeuden varianssianalyysiin (ANOVA) (ks. kohta 2.1), jonka jälkeen sopivalla menetelmällä (esim. Dunnettin tai Williamsin testillä (12) (13) (14) (21) verrataan kullakin pitoisuudella saatua r-arvoa kontrollien keskimääräiseen r-arvoon, jotta voidaan tunnistaa pienin pitoisuus, jolla kyseinen ero on merkitsevä todennäköisyystasolla 0,05. Jos parametristen menetelmien edellyttämät vaatimukset eivät täyty –epänormaali jakauma (esim. Shapiro-Wilkin testi) tai heterogeeninen varianssi (Bartlettin testi) — olisi harkittava mittaustulosten muuntamista varianssien homogenisoimiseksi ennen ANOVA-analyysiä tai painotetun ANOVAn tekemistä.
Jos testissä ei ole rinnakkaisia tankkeja kaikilla pitoisuuksilla, tankkeihin perustuva ANOVA on epäherkkä tai mahdoton suorittaa. Tällaisessa tilanteessa on hyväksyttävää perustaa ANOVA yksittäisten kalojen spesifiseen pseudokasvunopeuteen r3.
Kunkin testipitoisuuden keskimääräistä r3-arvoa voidaan sitten verrata kontrollien keskimääräiseen r3-arvoon. LOEC-arvo voidaan sitten määrittää kuten edellä. On todettava, että tässä menetelmässä ei voida ottaa lainkaan huomioon suurempaa tankkien välistä vaihtelua kuin minkä yksittäisten kalojen välinen vaihtelu selittää. Kokemus on kuitenkin osoittanut (9), että tankkien välinen vaihtelu on erittäin pieni verrattuna tankinsisäiseen (ts. kalojen väliseen) vaihteluun. Jos analyysi ei ota huomioon yksittäisiä kaloja, on selostettava suuresti poikkeavien näytteiden tunnistamiseen käytetty menetelmä ja perusteltava se.
2.2 TULOSTEN TULKINTA
Tulosten tulkinnassa on oltava varovainen, jos testiliuosten myrkyllisen aineen pitoisuudet ovat lähellä määritysmenetelmän havaitsemisrajaa tai jos puolistaattisessa testissä testiaineen pitoisuus ennen liuoksen vaihtoa on pienempi kuin juuri valmistetussa liuoksessa.
2.3 TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot:
2.3.1 Testiaine
|
— |
fysikaalinen olomuoto ja fysikokemialliset ominaisuudet, jos niillä on merkitystä, |
|
— |
kemialliset tunnistetiedot, mukaan luettuna puhtausaste, ja testiaineen kvantifiointiin käytettävä analyyttinen menetelmä (tarvittaessa). |
2.3.2 Testissä käytettävät kalalajit
|
— |
mahdollisesti tieteellinen nimi, |
|
— |
kanta, koko, toimittaja, mahdolliset esikäsittelyt jne. |
2.3.3 Koeolosuhteet:
|
— |
käytetty testimenetelmätyyppi (esim. puolistaattinen tai läpivirtausmenetelmä, lastaustiheys, varastotiheys), |
|
— |
testin suunnittelu (esim. testiastioiden, testipitoisuuksien ja rinnakkaisten näytteiden lukumäärä, kalojen lukumäärä astiaa kohti), |
|
— |
varastoliuosten valmistusmenetelmä ja nesteen vaihtojen väli (liuotusapuaine ja sen pitoisuus on ilmoitet tava, jos sellaista käytetään), |
|
— |
nimelliset testipitoisuudet, mitattujen arvojen keskiarvot ja niiden keskihajonnat testiastioissa, niiden laske miseen käytetty menetelmä sekä näyttö siitä, että mittaukset on tehty todella liuoksessa olevasta testi aineesta, |
|
— |
laimennukseen käytetyn veden ominaisuudet: pH, kovuus, lämpötila, liuenneen hapen pitoisuus, jäännösklooripitoisuus (jos se on mitattu), orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaismäärä, suspensiossa olevat kiinteät aineet, testiväliaineen suolapitoisuus (jos se on mitattu) ja muut mahdolliset mittaukset, |
|
— |
testiastioissa olevan veden laatu: pH, kovuus, lämpötila ja liuenneen hapen pitoisuus, |
|
— |
yksityiskohtaiset tiedot ruokinnasta (esim. rehu(je)n tyyppi, alkuperä, annettu määrä ja antotaajuus). |
2.3.4 Tulokset:
|
— |
näyttö siitä, että kontrollit täyttivät eloonjäämistä koskevan validiteettivaatimuksen, ja missä tahansa pitoi suudessa esiintynyttä kuolleisuutta koskevat tarkat tiedot, |
|
— |
käytetyt analyyttiset tilastomenetelmät, rinnakkaisnäyte- tai kalaperusteiset tilastot, mittaustulosten käsittely ja käytettyjen tekniikoiden perustelut, |
|
— |
taulukoidut mittaustulokset yksittäisten kalojen painoista ja keskimääräisistä painoista päivinä 0, 14 {jos on mitattu) ja 28, tankkikohtaiset keskimääräiset kasvunopeudet tai spesifiset pseudokasvunopeudet ajan jaksoille 0–28 vuorokautta tai mahdollisesti ajanjaksoille 0–14 ja 14–28 vuorokautta, |
|
— |
tilastollisen analyysin (ts. regressioanalyysin tai ANOVAn) tulokset mieluiten taulukko- ja kuvaajamuodossa sekä LOEC-arvo (p = 0,05) ja NOEC-arvo tai ECx-arvo sekä keskivirheet, jos mahdollista, |
|
— |
kalojen mahdolliset epätavalliset reaktiot ja testiaineen aiheuttamat mahdolliset näkyvät vaikutukset. |
3. LÄHDELUETTELO
|
(1) |
Solbe J. F. de LG (1987). Environmental Effects of Chemicals (CFM 9350 SLD). Report on a UK Ring Test of a Method for Studying the Effects of Chemicals on the Growth Rate of Fish. WRc Report No PRD 1388-M/2. |
|
(2) |
Ashley S., Mallett M. J. and Grandy N. J. (1990). EEC Ring Test of a Method for Determining the Effects of Chemicals on the Growth Rate of Fish. Final Report to the Commission of the European Communities. WRc Report No EEC 2600-M. |
|
(3) |
Crossland N. O. (1985). A method to evaluate effects of toxic chemicals on fish growth. Chemosphere, 14, pp. 1855–1870. |
|
(4) |
Nagel R., Bresh H., Caspers N., Hansen P. D., Market M., Munk R., Scholz N. and Höfte B. B. (1991). Effect of 3,4-dichloroaniline on the early life stages of the Zebrafish (Brachydanio rerio): rcsults of a comparative laboratory study. Ecotox. Environ. Safety, 21, pp. 157–164. |
|
(5) |
Yamamoto, Tokio. (1975). Series of stock cultures in biological field. Medaka (killifish) biology and strains. Keigaku Publish. Tokio, Japan. |
|
(6) |
Holcombe, G. VV., Benoit D. A., Hammermeister, D. E., Leonard, E. N. and Johnson, R. D. (199 5). Acute and long-term effects of nine chemicals on the Japanese medaka (Oryzias latipes). Arch. Environ. Conta. Toxicol.28, pp. 287–297. |
|
(7) |
Benoit, D. A., Holcombe, G. VV. and Spehar, R. L. (1991). Guidelines for conducting early life toxicity tests with Japanese medaka (Oryzias latipes). Ecological Research Series EPA-600/3-91-063. US Environmental Protection Agency, Duluth. Minnesota. |
|
(8) |
Stephan C. E. and Rogers J. W. (1985). Advantages of using regression analysis to calculate results of chronic toxicity tests. Aquatic Toxicology and Hazard Assessment: Eighth Symposium, ASTM STP 891, R. C. Bahner and D. J. Hansen, eds., American Society for Testing and Materials, Philadelphia, pp. 328-338. |
|
(9) |
Environment Canada (1992). Biological test method: toxicity tests using early life stages of salmonid fish (rainbow trout, coho salmon, or atlantic salmon). Conservation and Protection, Ontario, Report EPS l/RM/28, 81 pp. |
|
(10) |
Cox D. R. (1958). Planning of experiments, Wiley Edt. |
|
(11) |
Pack S. (1991). Statistical issues concerning the design of tests for determining the effects of chemicals on the growth rate of fish. Room Document 4, OECD Ad Hoc Meeting of Experts on Aquatic Toxicology, WRc Medmenham, UK, 10-12 December 1991. |
|
(12) |
Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control, J. Amer. Statist. Assoc, 50, pp. 1096-1121. |
|
(13) |
Dunnett C. W. (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482-491. |
|
(14) |
Williams D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, pp. 103-117. |
|
(15) |
Johnston, W. L., Atkinson, J. L., Glanville N. T. (1994). A technique using sequential feedings of different coloured food to determine food intake by individual rainbow trout, Oncorhynchus mykiss: effect of feeding level. Aquaculture 120, pp. 123-133. |
|
(16) |
Quinton, J. C. and Blake, R. W. (1990). The effect of feed cycling and ration level on the compensatory growth response in rainbow trout, Oncorhynchus mykiss. Journal of Fish Biology, 37, pp. 33-41. |
|
(17) |
Post, G. (1987). Nutrition and Nutritional Diseases of Fish. Chapter IX in Testbook of Fish Health. T.F.H. Publications, Inc. Neptune City, New Jersey, USA. 288 pp. |
|
(18) |
Bruce, R. D. and Versteeg D. J. (1992). A statistical procedure for modelling continuous toxicity data. Environ. Toxicol. Chem. 11, pp. 1485-1494. |
|
(19) |
DeGraeve, G. M., Cooney, J. M., Pollock, T. L., Reichenbach, J. H., Dean, Marcus, M. D. and McIntyre, D. O. (1989). Precision of EPA seven-day fathead minnow larval survival and growth test; intra and interlaboratory study. Report EA-6189 (American Petroleum Institute Publication, No 4468). Electric Power Research Institute, Palo Alto, CA. |
|
(20) |
Norbert-King T. J. (1988). An interpolation estimate for chronic toxicity: the ICp approach. US Environmental Protection Agency. Environmental Research Lab., Duluth, Minnesota. Tech. Rep. No 05-88 of National Effluent Toxicity Assesment Center. Sept. 1988. 12 pp. |
|
(21) |
Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, pp. 510-531. |
Lisäys 1
TESTIIN SUOSITELLUT KALALAJIT JA SOPIVAT TESTIOLOSUHTEET
|
Laji |
Suositeltu lämpötila-alue ( oC) |
Valojaksot (tuntia) |
Suositellut kalojen painorajat testin alussa (g) |
Vaadittu mittaustarkkuus |
Lastaustiheys (g/l) |
Varastotiheys (litraa kohti) |
Rehu |
Testin kesto (vrk) |
|
Suositellut kalalajit: |
|
|
|
|
|
|
|
|
|
Oncorhynchus mykiss Kirjolohi |
12,5–16,0 |
12–16 |
1–5 |
100 mg |
1,2–2,0 |
4 |
Kaupallinen lohikalojen poikasten kuivarehu |
≥ 28 |
|
Muita hyvin dokumentoituja lajeja: |
|
|
|
|
|
|
|
|
|
Danio rerio Seeprakala |
21–25 |
12–16 |
0,050–0,100 |
1 mg |
0,2–1,0 |
5–10 |
Elävää ravintoa (Brachionus Artemia) |
≥ 28 |
|
Oryzias latipes Medaka |
21–25 |
12–16 |
0,050–0,100 |
1 mg |
0,2–1,0 |
5–20 |
Elävää ravintoa (Brachionus Artemia) |
≥ 28 |
Lisäys 2
JOITAKIN HYVÄKSYTTÄVÄN LAIMENNUSVEDEN KEMIALLISIA OMINAISUUKSIA
|
Aine |
Pitoisuus |
|
Kiinteät aineet |
< 20 mg/1 |
|
Orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaismäärä |
< 2 mg/l |
|
Ammoniakki (ionisoitumaton) |
< 1 μg/l |
|
Jäännöskloori |
< 10 μg/l |
|
Orgaanista fosforia sisältävien torjunta-aineiden kokonaismäärä |
< 50 ng/1 |
|
Orgaanista klooria sisältävien torjunta-aineiden kokonaismäärä ja polyklooratut bifebyylit |
< 50 ng/1 |
|
Orgaanisiin yhdisteisiin sitoutuneen kloorin kokonaismäärä |
< 25 ng/1 |
Lisäys 3
Myrkyllisyystestiin soveltuvien pitoisuuksien logaritmiset sarjat (9)
|
Sarake välillä 100-10 tai välillä 10-1 olevien pitoisuuksien lukumäärä) (19) |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
32 |
46 |
56 |
63 |
68 |
72 |
75 |
|
10 |
22 |
32 |
40 |
46 |
52 |
56 |
|
3,2 |
10 |
18 |
25 |
32 |
37 |
42 |
|
1,0 |
4,6 |
10 |
16 |
22 |
27 |
32 |
|
|
2,2 |
5,6 |
10 |
15 |
19 |
24 |
|
|
1,0 |
3,2 |
6,3 |
10 |
14 |
18 |
|
|
|
1,8 |
4,0 |
6,8 |
10 |
13 |
|
|
|
1,0 |
2,5 |
4,6 |
7,2 |
10 |
|
|
|
|
1,6 |
3,2 |
5,2 |
7,5 |
|
|
|
|
1,0 |
2,2 |
3,7 |
5,6 |
|
|
|
|
|
1,5 |
2,7 |
4,2 |
|
|
|
|
|
1,0 |
1,9 |
3,2 |
|
|
|
|
|
|
1,4 |
2,4 |
|
|
|
|
|
|
1,0 |
1,8 |
|
|
|
|
|
|
|
1,3 |
|
|
|
|
|
|
|
1,0 |
C.15 KALAN ALKIO- JA RUSKUAISPUSSIVAIHEEN POIKASILLA TEHTÄVÄ LYHYTAIKAINEN MYRKYLLISYYSTESTI
1. MENETELMÄ
Tämä lyhytaikainen myrkyllisyystesti on toisinto OECD:n testiohjeesta nro 212 (1998).
1.1 JOHDANTO
Tämä lyhytaikainen kalan alkio- ja ruskuaispussivaiheen poikasilla tehtävä myrkyllisyystesti on lyhytaikainen testi, jossa altistetaan testiaineelle varhaisessa kehitysvaiheessa olevia kalan alkioita juuri hedelmöityneistä munista ruskuaispussivaiheen loppuun asti. Alkio- ja ruskuaispussivaihetestissä ci anneta ravintoa, joten testi pitäisi lopettaa vaiheessa, jossa ruskuaispussivaihealkio saa vielä ravintonsa ruskuaispussista.
Testissä on tarkoitus määrittää kemikaalien letaalit ja rajoitetussa määrin subletaalit vaikutukset tietyn lajin tietyissä kehitysvaiheissa oleviin poikasiin. Tästä testistä saatavat tiedot olisivat hyödyllisiä, koska a) testin avulla voitaisiin muodostaa yhteys letaalien ja subletaalien vaikutusten välille, b) sitä voitaisiin käyttää joko täydellisen varhaiskehitysvaiheiden testin tai pitkäaikaisten myrkyllisyystestien seulontatestinä ja c) sillä voitaisiin testata lajeja, joiden kasvatusmenetelmät eivät ole vielä niin kehittyneet, että hallittaisiin vaihe, jolloin eläin siirtyy endogeenisestä ravinnonotosta eksogeeniseen ravinnonottoon.
Olisi muistettava, että kemikaalien pitkäaikainen myrkyllisyys kaloille voidaan yleensä arvioida tarkasti vain testeillä, jotka kattavat kaikki kalan elinkierron vaiheet. Jos altistetaan vain tietyissä kehitysvaiheissa olevia kaloja, testin herkkyys kärsii, ja pitkäaikainen myrkyllisyys voidaan aliarvioida. Sen vuoksi on odotettavissa, että alkio- ja ruskuaispussivaihetesti on vähemmän herkkä kuin täydellinen varhaiskehitysvaiheiden testi, erityisesti kun kysymyksessä ovat erittäin lipofiiliset (log Pow > 4) kemikaalit ja sellaiset kemikaalit, joiden myrkyllisyysvaikutus on spesifinen. Kuitenkin voidaan odottaa, että kyseisten kahden testin väliset herkkyyserot ovat pienempiä kemikaaleilla, joilla on epäspesifinen narkoottinen vaikutus (1).
Ennen tämän testin julkaisemista useimmat tiedot alkio- ja ruskuaispussivaiheen kaloilla on saatu makeassa vedessä elävällä Danio rerio Hamilton-Buchanan -kalalla (Teleostei, Cyprinidae; yleinen nimi seeprakala). Tällä kalalla suoritettavasta testistä annetaan siksi yksityiskohtaisemmat ohjeet lisäyksessä 1. Muitakin lajeja, joista on kokemusta, voidaan kuitenkin käyttää (Taulukot 1 A ja 1 B).
1.2 MÄÄRITELMÄT
LOEC (Lowest Observed Effect Concentration): Pienin testiaineen testattu pitoisuus, jolla aineen havaitaan aiheuttavan merkitsevän vaikutuksen (arvolla p < 0,05) verrattuna kontrolliin. Kuitenkin kaikilla LOEC-tasoa suuremmilla testipitoisuuksilla on oltava vähintään yhtä haitallinen vaikutus kuin LOEC-tasolla.
NOEC (No Observed Effect Concentration): Välittömästi LOEC-tasoa pienempi testipitoisuus.
1.3 TESTIN PERIAATE
Alkio- ja ruskuaispussivaiheessa olevia kaloja altistetaan veteen liuotetun testiaineen eri pitoisuuksille. Testi voidaan tehdä testiaineesta riippuen joko puolistaattisena tai läpivirtaustestinä. Testin alussa hedelmöityneet munat pannaan testiastioihin, ja testi lopetetaan juuri ennen kuin mahdollisten toukkien ruskuaispussi on imeytynyt täydellisesti yhdessäkään testiastiassa tai ennen kuin kontrolleissa havaitaan ravinnonpuutteesta johtuvia kuolemantapauksia. Letaalit ja subletaalit vaikutukset arvioidaan ja niitä verrataan kontrolliarvoihin pienimmän havaittavan vaikutuksen aiheuttavan pitoisuuden arvioimiseksi ja siitä edelleen sen pitoisuuden arvioimiseksi, joka ei aiheuta havaittavaa vaikutusta. Vaihtoehtoisesti vaikutukset voidaan arvioida käyttämällä regressiomallia sen pitoisuuden estimoimiseksi, joka aiheuttaisi tietyn prosentuaalisen vaikutuksen (ts. LC/ECX, jossa x on määritelty prosenttiarvo).
1.4 TESTIAINETTA KOSKEVAT TIEDOT
Välittömän myrkyllisyyden testin (ks. menetelmä C.1) tulosten pitäisi olla käytettävissä. Mieluiten samalla lajilla tehdyn testin tuloksista voi olla hyötyä valittaessa sopivaa pitoisuusaluetta varhaisten kehitysvaiheiden testiin. Testiaineen vesiliukoisuuden (myös liukoisuuden testissä käytettävään veteen) ja höyrynpaineen pitäisi olla tiedossa. Käytettävissä pitäisi olla myös tarkkuudeltaan ja määritysrajaltaan tunnettu sopiva analyyttinen menetelmä aineen määrittämiseksi kvantitatiivisesti testiliuoksissa.
Testiainetta koskevia tietoja, joista on hyötyä testiolosuhteiden määrittelemiseksi, ovat mm. rakennekaava, aineen puhtaus, valostabiilisuus, stabiilisuus testiolosuhteissa, pKa, Pow ja helpon biohajoavuuden testin tulokset (ks. menetelmä C.4).
1.5 TESTIN LUOTETTAVUUS
Testi on luotettava, jos
|
— |
hedelmöityneiden munien eloonjäämisaste kontrolleissa ja tapauksen mukaan ainoastaan liuotinta sisältävissä astioissa on vähintään yhtä suuri kuin lisäyksissä 2 ja 3 on määritelty, |
|
— |
liuenneen hapen pitoisuus on 60-100 % ilman kyllästysarvosta koko testin ajan, |
|
— |
veden lämpötila vaihtelee enintään ±1,5 oC testiastioiden välillä tai peräkkäisinä päivinä milloin tahansa testin aikana ja on niissä rajoissa, jotka on määritelty kyseiselle testilajille (lisäykset 2 ja 3). |
1.6 TESTIMENETELMÄN KUVAUS
1.6.1 Testiastiat
Mitä tahansa lasista tai kemiallisesti inertistä materiaalista valmistettua astiaa voi käyttää. Astian pitäisi olla riittävän suuri kalamäärään nähden (ks. kohta 1.7.1.2). Suositellaan, että testiastiat sijoitetaan satunnaistetusti koealueelle. Satunnaistettu eristetty sijoittelu siten, että kussakin käsittelyssä olevia testiastioita on kussakin eristetyssä sijoituspaikassa, on parempi kuin täysin satunnaistettu järjestely, jos laboratoriossa on järjestelmällisiä vaikutuksia, jotka voidaan hallita eristyksellä. Jos eristystä käytetään, se on otettava huomioon tulostietojen käsittelyssä. Testiastiat olisi suojattava ei-toivotuilta häiriöiltä.
1.6.2 Kalalajin valinta
Suositeltavat kalalajit luetellaan taulukossa 1 A. Muitakin lajeja voidaan käyttää (esimerkkejä annetaan taulukossa 1 B), mutta testimenetelmää on silloin ehkä muutettava, jotta testiolosuhteet olisivat sopivat. Tällaisessa tapauksessa olisi selostettava syyt lajin ja koemenetelmän valitsemiseen.
1.6.3 Siitoskalojen kasvatus
Siitoskannan kasvatuksesta tyydyttävissä oloissa annetaan yksityiskohtaiset ohjeet OECD:n testiohjeessa nro 210 (20) ja viitteissä (2) (3) (4) (5) (6).
1.6.4 Alkioiden ja toukkien käsittely
Alkioiden ja toukkien altistus voidaan tehdä ison astian sisällä olevissa pienemmissä astioissa, joiden laidoissa tai päädyissä on verkot, jolloin testiliuos pääsee virtaamaan astian läpi. Pienten astioiden läpi johdetaan pyörteeton virtaus ripustamalla astiat varteen, jota voidaan nostaa ja laskea astiassa siten, että eliöt ovat nestepinnan alla koko ajan. Myös lappoa ja nesteenlisäysjärjestelmää voidaan käyttää. Hedelmöityneitä lohensukuisten kalojen munia voidaan pitää telineissä tai verkoissa, joiden reiät ovat niin suuret, että toukat putoavat niistä läpi kuoriuduttuaan. Pasteur-pipettejä voidaan käyttää alkioiden ja toukkien poistamiseksi puolistaattisissa testeissä, jossa neste vaihdetaan päivittäin (ks. kohta 1.6.6).
Jos munien pitämiseksi isossa testiastiassa käytetään telineitä, ritilöitä tai verkkoja, ne olisi poistettava toukkien kuoriutumisen jälkeen (20). Verkot pitäisi kuitenkin säilyttää kalojen karkaamisen estämiseksi. Jos toukkia on siirrettävä, niitä ei saisi ottaa vedestä ilmaan eikä verkkoja saisi käyttää kalojen irrottamiseksi munatelineistä (tämä varokeino ei ehkä ole tarpeen, jos käytetään kestävämpiä kalalajeja, kuten karppeja). Siirtoajankohta vaihtelee lajeittain, eikä siirto ehkä ole aina välttämätöntä. Puolistaattisessa menetelmässä voidaan käyttää dekanterilaseja tai matalia astioita, ja niihin voi tarvittaessa kiinnittää verkon hieman pohjan yläpuolelle. Jos astiat ovat riittävän suuria kalamäärään nähden (ks. 1.7.1.2), alkioita tai toukkia ei ehkä tarvitse siirtää.
1.6.5 Vesi
Testivedeksi käy vesi, joka täyttää lisäyksessä 4 mainitut hyväksyttävän laimennusveden kemiallisia ominaisuuksia koskevat vaatimukset ja jossa testilaji säilyy elossa vähintään yhtä kauan kuin lisäyksissä 2 ja 3 edellytetään. Veden laadun on oltava tasainen testin ajan. pH:n vaihtelu ei saisi olla suurempi kuin ±0,5 pH-yksikköä. Sen varmistamiseksi, ettei laimennusvesi vaikuta liikaa testituloksiin (esimerkiksi kompleksoimalla testattavaa ainetta) tai haitallisesti siitoskalakannan vointiin, näytteitä olisi otettava säännöllisin väliajoin määrityksiä varten. Raskasmetallit (esim. Cu, Pb, Zn, Hg, Cd, Ni), tärkeimmät anionit ja kationit (esim. Ca, Mg, Na, K, Cl, SO4), torjunta-aineet (esim. orgaanista fosforia ja orgaanista klooria sisältävien torjunta-aineiden kokonaispitoisuudet), orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaispitoisuus ja suspendoituneet kiinteät aineet olisi määritettävä esimerkiksi kolmen kuukauden välein, jos laimennusveden laatu tiedetään suhteellisen vakioksi. Jos veden laadun on osoitettu pysyvän vakiona ainakin vuoden ajan, määrityksiä voidaan tehdä harvemmin (esim. kuuden kuukauden välein).
1.6.6 Testiliuokset
Halutunpitoiset testiliuokset valmistetaan varastoliuoksista laimentamalla.
Varastoliuos valmistetaan sekoittamalla testattava aine laimennusveteen käyttäen mieluiten mekaanisia menetelmiä tai ultraääntä. Saturaatiopylväitä (liukoisuuspylväitä) voi käyttää riittävän väkevän varastoliuoksen valmistamiseksi. Liuottimien tai dispergointiaineiden (liuotusapuaineiden) käyttöä on vältettävä, jos mahdollista. Ne voivat kuitenkin olla joskus välttämättömiä riittävän väkevän varastoliuoksen valmistamiseksi. Sopivia liuottimia ovat esimerkiksi asetoni, etanoli, metanoli, dimetyyliformamidi ja trietyleeniglykoli. Sopivia dispergointiaineita ovat esimerkiksi Cremophor RH40, Tween 80, 0,01-prosenttinen metyyliselluloosa ja HCO-40. Helposti biohajoavia aineita (kuten asetonia) ja/tai helposti haihtuvia aineita käytettäessä on oltava varovainen, koska ne voivat aiheuttaa ongelmia bakteerikasvuston takia läpivirtaustesteissä. Jos käytetään liuotusapuaineita, niillä ei saa olla merkittävää vaikutusta eloonjäämiseen eikä näkyviä haitallisia vaikutuksia varhaisiin kehitysvaiheisiin. Tämä on osoitettava pelkkää liuotinta sisältävällä kontrollilla. Tällaisten aineiden käyttöä on kuitenkin pyrittävä välttämään aina, kun se on mahdollista.
Puolistaattisessa testissä voidaan käyttää kahta eri liuoksenvaihtomenetelmää: i) uudet testiliuokset valmistetaan puhtaissa astioissa ja elossa pysyneet munat ja toukat siirretään varovasti uusiin astioihin pienessä määrässä vanhaa liuosta välttäen kosketusta ilman kanssa tai ii) testieliöt pidetään astioissa ja osa (vähintään kolme neljäsosaa) testivedestä vaihdetaan. Kasvatusnesteen vaihtoväli riippuu testiaineen stabiilisuudesta, mutta vaihtoa suositellaan kerran päivässä. Jos alustavista stabiilisuustesteistä (ks. kohta 1.4) tiedetään, ettei testiaineen pitoisuus pysy vakiona (ts. se ei ole välillä 80-120 % nimellisarvosta tai se laskee alle 80 prosentin mitatusta alkupitoisuudesta) vaihtojen välillä, olisi harkittava läpivirtaustestiä. Joka tapauksessa olisi varottava stressaamasta toukkia veden vaihdon yhteydessä.
Läpivirtaustesteissä on käytettävä testiaineen varastoliuosta jatkuvasti annostelevaa ja laimentavaa järjestelmää (esim. annostelupumppua, laimenninta, kyllästävää järjestelmää) testipitoisuuksien annostelemiseksi testiastioihin. Varastoliuosten ja laimennusveden virtausnopeudet on tarkistettava säännöllisin väliajoin, mieluiten kerran päivässä, ja virtausnopeus saisi vaihdella enintään 10 % koko testin aikana. Virtausnopeus, joka on vähintään viisi kertaa testiastian tilavuus 24 tunnissa, on havaittu sopivaksi (2).
1.7 MENETTELY
Kirjallisuudesta löytyy hyödyllistä tietoa kalan alkio- ja ruskuaispussivaiheen myrkyllisyystestin suorituskyvystä. Joitakin esimerkkejä on tämän ohjeen kirjallisuusluettelossa (7) (8) (9).
1.7.1 Altistusolosuhteet
1.7.1.1 Testin kesto
Testi olisi aloitettava 30 minuutin kuluessa munien hedelmöityksestä. Alkiot upotetaan testiliuokseen ennen alkiolevyn jakaantumisvaihetta tai mahdollisimman pian sen jälkeen, ja joka tapauksessa ennen gastrulavaiheen alkamista. Jos munat on hankittu kaupalliselta toimittajalta, ei testiä voi ehkä aloittaa heti hedelmöityksen jälkeen. Koska testin herkkyys voi kärsiä huomattavasti aloituksen viivästymisen johdosta, testi olisi aloitettava 8 tunnin kuluessa hedelmöityksestä. Koska toukkia ei ruokita altistuksen aikana, testi olisi lopetettava juuri ennen kuin mahdollisten toukkien ruskuaispussi on imeytynyt täydellisesti yhdessäkään testiastiassa tai ennen kuin kontrolleissa havaitaan ravinnonpuutteesta johtuvia kuolemantapauksia.Testin kesto riippuu käytetystä lajista. Lisäyksissä 2 ja 3 annetaan joitakin suosituksia testin kestosta.
1.7.1.2 Kalojen lisääminen testiastiaan
Hedelmöityneiden munien määrän testin alussa pitäisi olla riittävä tilastollista käsittelyä varten. Munat olisi jaettava satunnaistetusti eri käsittelyryhmiin, ja yhtä pitoisuutta kohti olisi käytettävä vähintään 30 hedelmöitynyttä munaa tasaisesti jaettuina (tai niin tasaisesti kuin mahdollista, koska voi olla vaikeaa saada aikaan yhtä suuria eriä joillakin lajeilla) vähintään kolmeen rinnakkaiseen testiastiaan. Kalojen määrän (biomassa testiliuoksen tilavuusyksikköä kohti) pitäisi olla niin pieni, että liuenneen hapen pitoisuus voidaan pitää vähintään arvossa 60 % ilman ilmastusta. On suositeltu, että läpivirtaustesteissä kalojen määrä saa olla enintään 5 g/l per 24 tuntia ja enintään 5 g/l liuosta minä tahansa ajankohtana (2).
1.7.1.3 Valo ja lämpötila
Valoisan ajan ja testiveden lämpötilan pitäisi olla sopivia käytetylle testilajille (lisäykset 2 ja 3). Lämpötilan seurantaa varten voi olla tarpeen ylimääräinen testiastia.
1.7.2 Testipitoisuudet
Tavallisesti tarvitaan viisi testiaineen pitoisuutta, joiden välinen ero on vakio ja enintään 3,2-kertainen. Käyrää, jossa esitetään LC50 välittömän myrkyllisyystestin altistusajan funktiona, olisi käytettävä apuna valittaessa testipitoisuusaluetta. Vähemmän kuin viisi pitoisuutta voi olla riittävä määrä esim. raja-arvotesteissä, ja pitoisuuksien väli voi olla pienempi joissakin tapauksissa. Jos käytetään alle viittä testipitoisuutta, se on perusteltava. Pitoisuuksia, jotka ovat suurempia kuin 96 tunnin LC50, tai 100 mg/l (näistä alhaisempi arvo), ei tarvitse testata. Kemikaaleja ei pitäisi testata niiden liukoisuusrajaa suuremmissa pitoisuuksissa.
Kun testiliuosten valmistuksessa käytetään jotakin liuotusapuainetta (ks. kohta 1.6.6), sen lopputilavuus testiastioissa ei saisi olla suurempi kuin 0,1 ml/1, ja tilavuuden pitäisi olla sama kaikissa testiastioissa.
1.7.3 Kontrollit
Testisarjan lisäksi on määritettävä yksi laimennusvesikontrolli (ja rinnakkaiset) sekä tapauksen mukaan yksi kontrolli, jossa on liuotusapuainetta (ja asianmukaiset rinnakkaiset).
1.7.4 Analyyttisten määritysten ja mittausten taajuus
Testiaineen pitoisuudet on määritettävä määräajoin testin aikana.
Suositellaan, että puolistaattisissa testeissä, joissa testiainepitoisuuden odotetaan pysyvän 20 prosentin sisällä nimellisarvosta (ts. välillä 80-120 %; ks. kohta 1.4 ja 1.6.6), analysoidaan vähintään suurin ja pienin pitoisuus juuri valmistetusta liuoksesta ja juuri ennen liuoksen vaihtoa vähintään kolme kertaa testin aikana tasaisin väliajoin (ts. samasta liuoksesta otetaan näyte, kun liuos on juuri valmistettu ja liuosta vaihdettaessa).
Jos testiaineen pitoisuuden ei odoteta pysyvän 20 prosentin sisällä nimellisarvosta (aineen stabiilisuutta koskevien tietojen perusteella), on analysoitava kaikki pitoisuudet tuoreesta liuoksesta ja liuosta vaihdettaessa noudattaen samanlaista järjestelmää (eli vähintään kolme kertaa testin aikana tasaisin väliajoin). Ennen liuoksen vaihtoa tehtävä määritys tarvitsee tehdä vain yhdestä rinnakkaisnäytteestä kullakin testipitoisuudella. Määritysten väli saa olla enintään seitsemän vuorokautta. Suositellaan, että tulosten perusteina käytetään mitattuja pitoisuuksia. Jos kuitenkin on näyttöä siitä, että testiaineen pitoisuus pysyy tyydyttävästi 20 prosentin sisällä nimellispitoisuudesta tai mitatusta alkupitoisuudesta koko testin ajan, tulosten perustana voidaan käyttää nimellispitoisuutta tai mitattua alkupitoisuutta.
Läpivirtaustesteille sopii samanlainen näytteenottojärjestelmä kuin puolistaattisille testeille (vaikka ”vanhoja” liuoksia ei mitata). Jos testi kuitenkin kestää yli seitsemän vuorokautta, voi olla suositeltavaa lisätä näytteiden lukumäärää ensimmäisen viikon aikana (esim. kolme sarjaa määrityksiä) sen varmistamiseksi, että testipitoisuudet ovat pysyneet stabiileina.
Näytteet voivat edellyttää sentrifugointia tai suodatusta (esim. 0,45 μm:n huokoskoon suotimella). Koska sen enempää sentrifugoimalla kuin suodattamallakaan ei aina pystytä erottamaan testiaineen biologisesti hyödyntämiskelvotonta osaa biologisesti hyödynnettävästä osasta, näytteille ei tarvitse välttämättä tehdä kyseisiä toimenpiteitä.
Liuennut happi, pH ja lämpötila on mitattava testin aikana kaikista testiastioista. Veden kokonaiskovuus ja suolapitoisuus, jos se on merkityksellinen, mitataan kontrolleista ja yhdestä astiasta, jossa on suurin pitoisuus. Liuennut happi ja suolapitoisuus, jos se on merkityksellinen, olisi mitattava kolmesti (testin alussa, keskivaiheilla ja lopussa). Suositellaan, että puolistaattisissa testeissä liuennut happi mitataan useammin, mieluiten ennen kutakin veden vaihtoa ja sen jälkeen tai vähintään kerran viikossa. pH olisi mitattava kunkin vedenvaihdon alussa ja lopussa puolistaattisissa testeissä ja vähintään viikoittain läpivirtaustesteissä. Kovuus olisi mitattava kerran testin aikana. Lämpötila olisi mitattava päivittäin, ja sitä olisi mielellään seurattava jatkuvasti vähintään yhdessä testiastiassa.
1.7.5 Havainnot
1.7.5.1 Alkiokehityksen vaiheet
Alkiokehitysvaihe altistuksen alussa (ts. gastrulaatiovaihe) olisi varmistettava mahdollisimman tarkasti. Siinä voidaan käyttää sopivasti säilytettyä ja kirkastettua edustavaa näytettä munista. Kuvauksia ja kuvia alkiokehitykscn vaiheista löytyy kirjallisuudesta (2) (5) (10) (11).
1.7.5.2 Kuoriutuminen ja eloonjääminen
Kuoriutumisesta ja eloonjäämisestä olisi tehtävä havaintoja vähintään kerran päivässä, ja yksilöiden lukumäärät on kirjattava. Voi olla toivottavaa tehdä havaintoja tiheämmin testin alussa (esim. 30 minuutin välein kolmen ensimmäisen tunnin aikana), koska joissakin tapauksissa elossapysymisaika voi olla merkityksellisempi kuin kuolemantapauksien lukumäärä (esim. silloin kun on välittömiä myrkkyvaikutuksia). Kuolleet alkiot ja toukat olisi poistettava heti, kun ne havaitaan, koska ne voivat hajota nopeasti. Kuolleita yksilöitä poistettaessa on oltava erittäin varovainen, ettei vieressä olevia munia tai toukkia kosketa tai vahingoiteta fyysisesti, sillä ne ovat hyvin herkkiä ja hauraita. Kuolemantapaukset todetaan eri kehitysvaiheessa eri tavoin:
|
— |
munat: erityisesti varhaisvaiheissa läpikuultavuus vähenee ja väri muuttuu, mikä johtuu valkuaisaineiden hyytymisestä ja/tai saostumisesta, josta on seurauksena valkoinen väri ja läpinäkymättömyys, |
|
— |
alkiot: vartalo ei liiku ja/tai sydän ei lyö ja/tai läpinäkymättömyys tai värinmuutos sellaisessa lajissa, jonka alkiot ovat normaalisti läpikuultavia, |
|
— |
toukat: toukat eivät liiku ja/tai niiden hengitysliikkeet puuttuvat ja/tai sydän ei lyö ja/tai keskushermosto on valkoinen ja läpinäkymätön ja/tai toukka ei reagoi mekaanisiin ärsykkeisiin. |
1.7.5.3 Epänormaali ulkonäkö
Sellaisten toukkien, joiden ruumiinmuodossa havaitaan epänormaalisuutta ja/tai pigmentaatiota, lukumäärä, sekä ruskuaispussin absorptioaste olisi kirjattava määräajoin testin kestosta ja kuvatun epänormaalisuuden laadusta riippuen. Huomattakoon, että epänormaaleja alkioita ja toukkia esiintyy luonnollisesti, ja niiden määrä voi olla useita prosentteja kontroll(e)issa joissakin lajeissa. Epänormaalit eläimet olisi vain poistettava testiastioista, kun ne kuolevat.
1.7.5.4 Epänormaali käyttäytyminen
Epänormaali käyttäytyminen, esimerkiksi hyperventilaatio, koordinoimaton uinti ja epätyypillinen liikkumattomuus, olisi kirjattava sopivin väliajoin testin aikana. Vaikka tällaisia vaikutuksia on vaikea kvantifioida, niiden havainnoiminen voi auttaa kuolleisuusdatan tulkinnassa, ts. niistä voi saada tietoa aineen myrkkyvaikutuksen laadusta.
1.7.5.5 Pituus
Suositellaan, että testin lopussa mitataan yksilöiden pituus. Voidaan käyttää vakio-, lovi- tai kokonaispituutta. Jos pyrstöevä tai muut evät ovat syöpyneet, on käytettävä vakiopituutta. Hyvin tehdyssä testissä kontrollirinnakkaisten pituuden vaihtelukerroin saisi olla enintään 20 %.
1.7.5.6 Paino
Testin lopussa voidaan punnita yksittäiset eläimet. Kuivapaino (24 tuntia, 60 oC) on suositeltavampi kuin märkäpaino (eläimet kuivataan pinnalta). Hyvin tehdyssä testissä kontrollirinnakkaisten painon vaihtelukerroin saisi olla enintään 20 %.
Näistä havainnoista saadaan tietoja seuraaviin tilastollisiin analyyseihin:
|
— |
kertyvä kuolleisuus, |
|
— |
terveiden toukkien lukumäärä testin lopussa, |
|
— |
aika kuoriutumisvaiheen alkuun ja loppuun (ts. kun 90 % kuoriutunut kussakin rinnakkaisnäytteessä), |
|
— |
kunakin päivänä kuoriutuneiden toukkien lukumäärä, |
|
— |
elossa olevien eläinten pituus (ja paino) testin lopussa, |
|
— |
epämuodostuneiden tai epätavalliselta näyttävien toukkien lukumäärä, |
|
— |
epätavallisesti käyttäytyvien toukkien lukumäärä. |
2. MÄÄRITYSTULOKSET JA TULOSTEN ILMOITTAMINEN
2.1 TULOSTEN KÄSITTELY
Suositellaan, että sekä testin suunnittelussa että analysoinnissa on mukana tilastotieteilijä, koska menetelmä mahdollistaa huomattavan vaihtelun kokeen suunnittelussa. Esim. testiastioiden lukumäärä, testipitoisuuksien lukumäärä, hedelmöityneiden munien lukumäärä testin alussa ja mitattava muuttuja voivat vaihdella. Koska testi voidaan suunnitella monella tavalla, tässä ei anneta erityisohjeita tilastomenetelmistä.
Jos on tarkoitus arvioida LOEC/NOEC, on variaatiot analysoitava kussakin rinnakkaisten joukossa varianssianalyysillä (ANOVA) tai kontingenssitaulukkomenetelmillä. Jos halutaan tehdä yhteisvertailu yksittäisten pitoisuuksien ja kontrollien välillä, Dunnettin menetelmästä voi olla hyötyä (12) (13). Muitakin hyviä esimerkkejä on saatavilla (14) (15). ANOVAA tai muita menetelmiä käyttämällä saatujen vaikutusten suuruus (ts. testin suorituskyky) olisi laskettava ja ilmoitettava. On huomattava, etteivät kaikki kohdassa 1.7.5.6 luetellut havainnot sovellu ANOVA-analyysiin. Esimerkiksi kertyvä kuolleisuus ja testin lopussa elossa olevien toukkien määrät voitaisiin analysoida probittimenetelmillä.
Jos on tarkoitus arvioida LC/ECX, olisi sovitettava sopiva(t) käyrä(t), kuten logistinen käyrä, kyseessä oleviin mittaustietoihin käyttäen jotakin tilastomenetelmää, kuten pienimmän neliösumman menetelmää tai epälineaarista pienimmän neliösumman menetelmää. Käyrissä on käytettävä sellaisia muuttujia, että haluttu LC/ECx ja sen vakiopoikkeama voidaan estimoida suoraan. Se helpottaa suuresti luottamusrajojen laskemista LC/ECx:lle. Sovitusmenetelmän olisi oltava sellainen, että sen avulla voitaisiin arvioida sovituksen onnistumisen (tai sen puutteen) merkitsevyys. Ellei ole painavia syitä muunsuuruisten luottamusvälien käyttöön, olisi ilmoitettava kaksipuolinen 95 prosentin luottamuusväli. Käyrien sovittamiseen voidaan käyttää graafisia menetelmiä. Regressioanalvysi soveltuu kaikkiin kohdassa 1.7.5.6 mainittuihin havaintoihin.
2.2 TULOSTEN TULKINTA
Tulosten tulkinnassa on oltava varovainen, jos testiliuoksista mitatut myrkyllisen aineen pitoisuudet ovat lähellä määritysmenetelmän havaitsemisrajaa. Myös aineen liukoisuustuloa suuremmilla pitoisuuksilla saatujen tulosten tulkinnassa on oltava varovainen.
2.3 TEST1SELOSTE
Testiselosteessa on annettava seuraavat tiedot:
2.3.1 Testiaine
|
— |
fysikaalinen olomuoto ja fysikokemialliset ominaisuudet, jos niillä on merkitystä, |
|
— |
kemialliset tunnistetiedot, mukaan luettuna puhtaus, ja testiaineen kvantifiointiin käytettävä analyyttinen menetelmä (tarvittaessa). |
2.3.2 Testissä käytettävät kalalajit
|
— |
tieteellinen nimi, kanta, siitoskalojen lukumäärä (ts. kuinka monta naarasta käytettiin testissä käytettyjen munien tuottamiseen), hedelmöityneiden munien toimittaja ja keräysmenetelmä sekä munien myöhempi käsittely. |
2.3.3 Koeolosuhteet:
|
— |
käytetty testimenetelmätyyppi (esim. puolistaattinen tai läpivirtausmenetelmä, aika hedelmöitymisestä testin alkuun, testiastiaan lisättyjen emokalojen määrä), |
|
— |
valoisa aika (valoisat aikajaksot), |
|
— |
testin suunnittelu (esim. testiastioiden ja rinnakkaisten näytteiden lukumäärä, alkioiden määrä kussakin rinnakkaisastiassa), |
|
— |
varastoliuosten valmistusmenetelmä ja nesteen vaihtojen väli (liuotusapuaine ja sen pitoisuus on ilmoitettava, jos sellaista käytetään), |
|
— |
nimelliset testipitoisuudet, mitatut arvot, niiden keskiarvot ja keskihajonnat testiastioissa, niiden laskemiseen käytetty menetelmä sekä näyttö siitä, että mittaukset on tehty liuoksessa olevasta testiaineesta, mikäli testiaine on vesiliukoinen testipitoisuuksia pienemmissä pitoisuuksissa, |
|
— |
laimennukseen käytetyn veden ominaisuudet: pH, kovuus, lämpötila, liuenneen hapen pitoisuus, jäännösklooripitoisuudet (jos ne on mitattu), orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaismäärä, suspensiossa olevat kiinteät aineet, testiväliaineen suolapitoisuus (jos se on mitattu) ja muut mahdolliset mittaukset, |
|
— |
testiastioissa olevan veden laatu: pH, kovuus, lämpötila ja liuenneen hapen pitoisuus. |
2.3.4 Tulokset:
|
— |
mahdollisista alustavista kokeista saadut testiaineen stabiilisuutta koskevat tulokset, |
|
— |
näyttö siitä, että kontrollit täyttivät yleiset testilajin elinkyvyn hyväksyttävyyttä koskevat vaatimukset (lisäykset 2 ja 3), |
|
— |
alkio- ja toukkavaiheen sekä yleistä kuolleisuutta/elinkykyä koskevat tulokset, |
|
— |
päivien lukumäärä kuoriutumiseen ja kuoriutuneiden toukkien lukumäärä, |
|
— |
pituus (ja paino), |
|
— |
mahdollisten epämuodostumien ilmaantuvuus ja kuvaus, |
|
— |
mahdollisten käyttäytymismuutosten ilmaantuvuus ja kuvaus, |
|
— |
tulosten tilastollinen analyysi ja käsittely, |
|
— |
ANOVALLA analysoiduille testeille LOEC (pienin havaittavan vaikutuksen aiheuttava pitoisuus) arvolla p = 0,05 ja NOEC (pitoisuus, joka ei aiheuta havaittavaa vaikutusta) kullekin arvioidulle vasteelle sekä käytettyjen tilastomenetelmien kuvaus ja ilmoitus havaitun vaikutuksen suuruudesta, |
|
— |
regressiotekniikoilla arvioiduille testeille LC/ECx ja luottamusvälit sekä sen laskemiseen käytetyn sovitusmallin kuvaaja. |
|
— |
selitys mahdollisiin poikkeamiin tästä testimenetelmästä. |
3. LÄHDELUETTELO
|
(1) |
Kristensen P. (1990). Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, 60 pp. June 1990. |
|
(2) |
ASTM (1988). Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. 26 pp. |
|
(3) |
Brauhn J. L. and Schoettger R. A. (1975). Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. p. 54, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota. |
|
(4) |
Brungs W. A. and Jones B. R. (1977). Temperature Criteria for Freshwater Fish: Protocol and Procedures, p. 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota. |
|
(5) |
Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Biol. 10, pp. 121-173. |
|
(6) |
Legault R. (1958). A Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, pp. 328-330. |
|
(7) |
Dave G., Damgaard B., Grande M., Martelin J. E., Rosander B. and Viktor T. (1987). Ring Test of an Embryo-larval Toxicity Test with Zebrafish (Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, pp. 61-71. |
|
(8) |
Birge J. W., Black J. A. and Westerman A. G. (1985). Short-term Fish and Amphibian Embryo-larval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, pp. 807-821. |
|
(9) |
Van Leeuwen C. J., Espeldoom A. and Mol F. (1986). Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. III. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, pp. 129-145. |
|
(10) |
Kirchen R. V. and W. R. West (1969). Teleostean Development. Carolina Tips 32(4): 1-4. Carolina Biological Supply Company. |
|
(11) |
Kirchen R. V. and W. R. West (1976). The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina. 36 pp. |
|
(12) |
Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc., 50, pp. 1096-1121. |
|
(13) |
Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482-491. |
|
(14) |
Mc Clave J. T., Sullivan J. H. and Pearson J.G. (1980). Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia. |
|
(15) |
Van Leeuwen C. J., Adema D. M. M. and Hermes J. (1990). Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, pp. 321-334. |
|
(16) |
Environment Canada. (1992). Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS 1/RM/28, December 1992, 81 pp. |
|
(17) |
Dave G. and Xiu R. (1991). Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio rerio. Arch. of Environmental Contamination and Toxicology, 21, pp. 126-134. |
|
(18) |
Meyer A., Bierman C. H. and Orti G. (1993). The phylogenetic position of the Zebrafish (Danio rerio), a model system in developmental biology — an invitation to the comperative methods. Proc. Royal Society of London, Series B, 252: pp. 231-236. |
|
(19) |
Ghillebaert F., Chaillou C., Deschamps F. and Roubaud P. (1995). Toxic Effects, at Three pH Levels, of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, pp. 19-28. |
|
(20) |
US EPA, (1991). Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPA report EPA/600/3-91/064, Dec. 1991, EPA, Duluth. |
|
(21) |
US EPA, (1991). Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Oryzias latipes). EPA report EPA/600/3-91/063, Dec. 1991, EPA, Duluth. |
|
(22) |
De Graeve G. M., Cooney J. D., McIntyre D. O., Poccocic T. L, Reichenbach N. G., Dean J. H. and Marcus M, D. (1991). Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, pp. 1189-1203. |
|
(23) |
Calow P. (1993). Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, Chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish. |
|
(24) |
Balon E. K. (1985). Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, 280 pp. |
|
(25) |
Blaxter J. H. S. (1988). Pattern and variety in development, in: W. S. Hoar and D. J. Randall eds., Fish Physiology, Vol. XIA, Academic press, pp. 1-58. |
Taulukko 1 A
Kalalajit, joita suositellaan käytettäväksi testissä
|
Makean veden kalat |
|
Oncorhynchus mykiss Kirjolohi (9) (16) |
|
Danio rerio Seeprakala (7) (17) (18) |
|
Cyprinus caprio Karppi (8) (19) |
|
Oryzias latipes Medaka (20) (21) |
|
Pimephales promelas Paksupäämutu (8) (22) |
Taulukko 1 B
Esimerkkejä muista hyvin dokumentoiduista lajeista, joita on myös käytetty
|
Makean veden kalat |
Suolaisen veden kalat |
|
Carassius auratus Kultakala (8) |
Menidia peninsulae Tidewater silverside (23) (24) (25) |
|
Lepomis macrochirus Isoaurinkoahven (8) |
Clupea harengus Silli (24) (25) |
|
Gadus morhua Turska (24) (25) |
|
|
Cyprinodon variegatus Loistohammaskarppi (23) (24) (25) |
LISÄYS 1
OHJEITA SEEPRAKALAN (BRACHYDANIO RERIO) ALKIO- JA RUSKUAISPUSSIVAIHEEN POIKASILLA TEHTÄVÄN MYRKYLLISYYSTESTIN SUORITTAMISEKSI
JOHDANTO
Seeprakala on peräisin Intian Coromandel-rannikolta, jossa se asuu voimakkaasti virtaavissa joissa. Se on yleinen karpinsukuinen akvaariokala, ja ohjeita sen hoidosta ja kasvatuksesta annetaan trooppisia kaloja koskevissa kirjoissa. Seepra-kalan biologiaa ja käyttöä kalatutkimuksessa on selostettu viitteessä Laale (1).
Seeprakala on harvoin pitempi kuin 45 mm. Ruumis on lieriömäinen, ja siinä on 7–9 tummansinistä vaakasuoraa hopeanhohtavaa raitaa. Raidat päättyvät pyrstö- ja peräeviin. Selkä on oliivinvihreä. Koiraat ovat naaraita hoikempia. Naarailla on voimakkaampi hopeanväri kuin koirailla ja niiden vatsa on isompi, erityisesti ennen mätimunien laskua.
Aikuiset kalat sietävät suuria lämpötilan, pH:n ja veden kovuuden vaihteluja. Jotta kalat olisivat terveitä ja tuottaisivat hyvälaatuisia munia, niille on kuitenkin tarjottava hyvät elinolot.
Parittelun yhteydessä koiras jahtaa ja puskee naarasta, ja mätimunat hedelmöittyvät, kun naaras laskee munat. Munat ovat läpikuultavia ja liukkaita ja vajoavat pohjaan. Aikuiset kalat voivat syödä niitä. Valo vaikuttaa paritteluun. Jos aamuvalo on riittävä, seeprakala parittelee yleensä aamunkoiton jälkeisinä tunteina.
Naaras voi tuottaa useita satoja munia viikon välein.
EMOKALAT, LISÄÄNTYMINEN JA VARHAISET KEHITYSVAIHEET
Valitaan sopiva määrä terveitä kaloja ja pidetään niitä sopivanlaatuisessa vedessä (esim. lisäys 4) vähintään 2 viikkoa ennen aiottua parittelua. Kalaryhmän pitäisi antaa paritella vähintään kerran ennen kuin tuotetaan testiä varten tarkoitettu munaerä. Kalojen määrä tänä aikana saisi olla enintään 1 gramma kalaa litrassa. Kalojen määrä voi olla suurempi, jos vesi vaihdetaan säännöllisesti tai käytetään puhdistusjärjestelmää. Kasvatustankkien lämpötilan olisi oltava 25 ± 2 oC. Kaloille pitäisi antaa vaihtelevaa ravintoa, jossa voi olla esimerkiksi sopivaa kaupallista kuivarehua, eläviä vasta kuoriutuneita Arthemia-vesikirppuja, surviaissääskiä, Daphnia-vesikirppuja ja ankyrimatoja (Enchytracids).
Seuraavassa selostetaan kaksi menetelmää, joilla on saatu käytännössä riittävä määrä terveitä, hedelmöityneitä munia testiä varten:
|
i) |
Kahdeksan naarasta ja 16 koirasta pannaan tankkiin, jossa on 50 litraa laimennusvettä ja joka on suojattu suoralta auringonvalolta. Tankin annetaan olla mahdollisimman häiriöttä vähintään 48 tuntia. Testiä edeltävänä päivänä iltapäivällä akvaarion pohjalle asetetaan parittelutarjotin, jossa on 5–7 cm korkea kehys (pleksilasia tai muuta sopivaa materiaalia), 2–5 mm:n isoreikäinen verkko yläosassa ja 10–30 μm:n hieno verkko pohjassa. Kehyksen isoreikäiseen verkkoon kiinnitetään useita auki kierretystä nailonnarusta tehtyjä ”parittelupuita”. Kun kalat ovat olleet pimeässä 12 tuntia, sytytetään heikko valo, joka käynnistää parittelun. Kahdesta neljään tuntia parittelun jälkeen tarjotin otetaan pois ja munat kerätään. Tarjotin estää kaloja syömästä munia, ja samalla munat on helppo kerätä siitä. Kalaryhmän pitäisi antaa paritella vähintään kerran ennen kuin tuotetaan testiä varten tarkoitettu munaerä. |
|
ii) |
Viidestä kymmeneen koiras- ja naaraskalaa kasvatetaan yksittäin vähintään 2 viikkoa ennen aiottua parittelua. 5–10 päivän kuluttua naaraiden vatsat ovat isot ja genitaalinystyt näkyviä. Koiraskaloilla ei ole kyseisiä nystyjä. Parittelu tapahtuu parittelutankeissa, joissa on verkosta tehty valepohja (kuten edellä). Tankki täytetään laimennusvedellä niin, että vettä on verkon päällä 5–10 cm. Yksi naaras ja kaksi koirasta pannaan tankkiin päivää ennen aiottua parittelua. Veden lämpötilaa nostetaan vähitellen yhden asteen korkeammalle kuin totuttelulämpötila. Valo sammutetaan ja tankki jätetään mahdollisimman häiriöttä. Aamulla sytytään heikko valo, joka käynnistää parittelun. Kahdesta neljään tuntia parittelun jälkeen kalat otetaan pois ja munat kerätään. Jos tarvitaan enemmän munia kuin yhdeltä naaraalta saadaan, käytetään useampia parittelutankkeja. Kirjaamalla yksittäisten naaraiden jälkeläistentuotto ennen testiä (munien määrä ja laatu) voidaan valita parhaimmat naaraat poikasten tuottoon. |
Munat olisi siirrettävä testiastioihin ohuilla lasiputkilla (sisähalkaisija vähintään 4 mm), joissa on imututti. Munien kanssa tulevan veden määrän pitäisi olla mahdollisimman pieni. Munat ovat vettä raskaampia ja putoavat putkesta. Munat (ja toukat) eivät saisi joutua kosketuksiin ilman kanssa. Munista pitäisi ottaa näytteitä ja tutkia niitä mikroskoopissa sen varmistamiseksi, ettei ensimmäisissä kehitysvaiheissa esiinny epänormaaleja ilmiöitä. Munia ei saa desinfioida.
Munien kuolleisuus on suurin ensimmäisten 24 tunnin aikana hedelmöityksestä. Kuolleisuus on tänä aikana usein 5–40 prosenttia. Munat hajoavat hedelmöittymisen epäonnistumisen tai kehityshäiriöiden takia. Munien laatu näyttää riippuvan naaraista, koska jotkut naaraat tuottavat jatkuvasti hyvälaatuisia munia ja toiset eivät koskaan. Myös kehittymis- ja kuoriutumisnopeus vaihtelevat munaerien välillä. Jos munien hedelmöitys on onnistunut, munat ja ruskuaispussivaiheen toukat (eloonjäämisprosentti yli 90) pysyvät hyvin elossa. Munat kuoriutuvat 25 oC:n lämpötilassa 3–5 päivää hedelmöityksen jälkeen, ja ruskuaispussi absorboituu noin 13 päivää hedelmöityksen jälkeen.
Hisaoka ja Battle (2) ovat kuvanneet hyvin sikiökehityksen. Koska munat ja toukat (kuoriutumisen jälkeen) ovat läpinäkyviä, kalojen kehitystä voidaan seurata ja epämuodostumia havainnoida. Noin 4 tuntia parittelun jälkeen hedelmöitymättömät munat voidaan erottaa hedelmöityneistä (3). Tätä tutkimusta varten munat ja toukat pannaan pieniin astioihin ja niitä tarkastellaan mikroskoopissa.
Lisäyksessä 2 kuvataan varhaisiin kehitysvaiheisiin sovellettavat testiolosuhteet. Optimiarvo pH:lle on 7,8 ja laimennusveden kovuudelle 250 mg CaCO3/l.
LASKUTOIMITUKSET JA TILASTOLLINEN KÄSITTELY
Suositellaan, että tulosten käsittelyssä on kaksi vaihetta. Ensin käsitellään tilastollisesti kuolleisuutta, epänormaalia kehittymistä ja kuoriutumisaikaa koskevat tulostiedot. Sitten arvioidaan tilastollisesti ruumiin pituus niillä pitoisuuksilla, joilla ei havaittu haitallisia vaikutuksia edellä mainituissa muuttujissa. Tällaista menettelyä suositellaan, koska myrkky saattaa tappaa selektiivisesti pieniä kaloja, viivästyttää kuoriutumista ja aiheuttaa vakavia epämuodostumia, mikä johtaa vääristyneisiin pituuden mittauksiin. Lisäksi tällä tavoin menettelemällä saadaan suunnilleen sama määrä kaloja käsittelyä kohti, mikä varmistaa testin validiteetin.
LC50- JA EC-50-MÄÄRITYKSET
Eloonjääneiden munien ja toukkien määrä lasketaan prosentteina ja korjataan kontrollien kuolleisuuden suhteen Abbottin kaavalla (4):

jossa
|
P |
= |
korjattu eloonjäämisprosentti |
|
P' |
= |
testipitoisuudessa havaittu eloonjäämisprosentti |
|
C |
= |
kontrollien eloonjäämisprosentti |
Jos mahdollista, LC50 määritetään sopivalla menetelmällä testin lopussa.
Jos EC50-tilastoihin halutaan sisällyttää epämuotoisuudet, ohjeita on viitteessä Stephan (5).
LOEC:N JA NOEC:N ESTIMOINTI
Muna- ja ruskuaispussitestin tarkoitus on verrata kontrolleja ja nollasta poikkeavia pitoisuuksia, ts. määrittää LOEC. Sen vuoksi olisi käytettävä yhteisvertailumenetelmiä (6) (7) (8) (9) (10).
LÄHDELUETTELO
|
(1) |
Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Fish Biol. 10, pp. 121–173. |
|
(2) |
Hisaoka K. K. and Battle H. I. (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio (Hamilton-Buchanan) J. Morph., 102, 311 pp. |
|
(3) |
Nagel R. (1986). Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachydanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, pp. 173–181. |
|
(4) |
Finney D. J. (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, pp. 1–333. |
|
(5) |
Stephan C. E. (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment: Fifth Conference, ASTM STP 766, J. G. Pearson, R. B. Foster and W. F. Bishop, Eds., American Society for Testing and Materials, pp. 69–81. |
|
(6) |
Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc., 50, pp. 1096–1121. |
|
(7) |
Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482–491. |
|
(8) |
Williams D. A. (1971). A Test for Differences Between Treatment Means when Several Dose Levels are Compared with a Zero Dose Control. Biometrics, 27, pp. 103–117. |
|
(9) |
Williams D. A. (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, pp. 519–531. |
|
(10) |
Sokal R. R. and Rohlf F. J. (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W. H. Freeman and Co., San Francisco. |
Lisäys 2
TESTIOLOSUHTEET, TESTIN KESTO JA ELOONJÄÄMISKRITEERIT SUOSITELLUILLE LAJEILLE
|
Laji |
Lämpötila CO |
Suolapitoisuus (0/00) |
Valoisa aika (tuntia) |
Kehitysvaiheiden kesto (päivää) |
Tyypillinen testin kesto |
Kontrollien eloonjäämisprosentti (vähintään) |
||
|
Alkio |
Ruskuaispussi |
Kuoriutumisprosentti |
Kuoriutumisen jälkeen |
|||||
|
MAKEAN VEDEN KALA |
||||||||
|
Brachydanio rerio Seeprakala |
25 ± 1 |
— |
12–16 |
3-5 |
8–10 |
Mahdollisimman pian hedelmöityksen jälkeen (varhainen gastrulavaihe) — 5 vrk kuoriutumisen jälkeen (8–10 vrk) |
80 |
90 |
|
Oncorhynchus mykiss Kirjolohi |
10 ± 1 (21) 12 ± 1 (22) |
— |
0 (23) |
30–35 |
25–30 |
Mahdollisimman pian hedelmöityksen jälkeen (varhainen gastrulavaihe) — 20 vrk kuoriutumisen jälkeen (50–55 vrk) |
66 |
70 |
|
Cyprinus carpio Karppi |
21–25 |
— |
12–16 |
5 |
> 4 |
Mahdollisimman pian hedelmöityksen jälkeen (varhainen gastrulavaihe) — 4 vrk kuoriutumisen jälkeen (8–9 vrk) |
80 |
75 |
|
Oryzias latipes Medaka |
24 ± 1 (21) 23 ± 1 (22) |
— |
12–16 |
8–11 |
4–8 |
Mahdollisimman pian hedelmöityksen jälkeen (varhainen gastrulavaihe) — 5 vrk kuoriutumisen jälkeen 13–16 vrk) |
80 |
80 |
|
Pimephales promelas Paksupäämutu |
25 ± 2 |
— |
16 |
4–5 |
5 |
Mahdollisimman pian hedelmöityksen jälkeen (varhainen gastrulavaihe) — 4 vrk kuoriutumisen jälkeen (8–9 vrk) |
60 |
70 |
Lisäys 3
Testiolosuhteet, testin kesto ja eloonjäämiskriteerit muille hyvin dokumentoiduille lajeille
|
Laji |
Lämpötila ( oC) |
Suolapitoisuus (0/00) |
Valoisa aika (tuntia) |
Kehitysvaiheiden kesto (vrk) |
Tyypillinen alkio- ja ruskuaispussivaihetestin kesto |
Kontrollien eloonjaamisprosentti |
||
|
|
|
|
|
Alkiovaihe |
Ruskuais-pussivaihe |
Kuoriutumisprosentti |
Kuoriutumisen jälkeen |
|
|
MAKEAN VEDEN KALAT |
||||||||
|
Carassius auratus Kultakala |
24 ± 1 |
— |
— |
3–4 |
> 4 |
Mahdollisimman pian hedelmöityksen jälkeen (varhainen gastrulavaihe) — 4 vrk kuoriutumisen jälkeen (7 vrk) |
— |
80 |
|
Leopomis macrochirus Isoaurinkoahven |
21 ± 1 |
— |
16 |
3 |
> 4 |
Mahdollisimman pian hedelmöityksen jälkeen (varhainen gastrulavaihe) — 4 vrk kuoriutumisen jälkeen (7 vrk) |
— |
75 |
|
SUOLAISEN VEDEN KALAT |
||||||||
|
Menidia peninsulae Tidewater silverside |
22–25 |
15–22 |
12 |
1,5 |
10 |
Mahdollisimman pian hedelmöityksen jälkeen (varhainen gastrulavaihe) — 5 vrk kuoriutumisen jälkeen (6–7 vrk) |
80 |
60 |
|
Clupea harengus Silli |
10 ± 1 |
8–15 |
12 |
20–25 |
3–5 |
Mahdollisimman pian hedelmöityksen jälkeen (varhainen gastrulavaihe) — 3 vrk kuoriutumisen jälkeen (23–27 vrk) |
60 |
80 |
|
Gadus morhua Turska |
5 ± 1 |
5–30 |
12 |
14–16 |
3–5 |
Mahdollisimman pian hedelmöityksen jälkeen (varhainen gastrulavaihe) — 3 vrk kuoriutumisen jälkeen (18 vrk) |
60 |
80 |
|
Cyprinodon variegatus Loistohammaskarppi |
25 ± 1 |
15–30 |
12 |
— |
— |
Mahdollisimman pian hedelmöityksen jälkeen (varhainen gastrulavaihe) — 4/7 vrk kuoriutumisen jälkeen (28 vrk) |
> 75 |
80 |
Lisäys 4
JOITAKIN HYVÄKSYTTÄVÄN LAIMENNUSVEDEN KEMIALLISIA OMINAISUUKSIA
|
Aine |
Pitoisuus |
|
Kiinteät aineet |
< 20 mg/l |
|
Orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaismäärä |
< 2 mg/l |
|
Ammoniakki (ionisoitumaton) |
< 1 μg/l |
|
Jäännöskloori |
< 10 μg/l |
|
Orgaanista fosforia sisältävien torjunta-aineiden kokonaismäärä |
< 50 ng/l |
|
Orgaanista klooria sisältävien torjunta-aineiden kokonaismäärä ja polyklooratut bifebyylit |
< 50 ng/l |
|
Orgaanisiin yhdisteisiin sitoutuneen kloorin kokonaismäärä |
< 25 ng/l |
C.16. MEHILÄISET — SUUN KAUTTA TAPAHTUNEEN ALTISTUKSEN JÄLKEEN ILMENEVÄN VÄLITTÖMÄN MYRKYLLISYYDEN TESTI
1. MENETELMÄ
Tämä välittömän myrkyllisyyden testimenetelmä on toisinto OECD:n testiohjeesta nro 213 (1998).
1.1 JOHDANTO
Tämä myrkyllisyystesti on laboratoriomenetelmä, jonka tarkoituksena on arvioida kasvinsuojeluaineiden ja muiden kemikaalien välitöntä myrkyllisyyttä täysikasvuisille työmehiläisille oraalisen eli suun kautta tapahtuneen altistuksen jälkeen.
Arvioitaessa kemikaalien myrkyllisiä ominaisuuksia voidaan vaatia välittömän myrkyllisyyden määrittämistä mehiläisillä oraalisen altistuksen jälkeen esimerkiksi silloin, kun mehiläisten altistuminen tietylle kemikaalille on todennäköistä. Välittömän myrkyllisyyden testi tehdään mehiläisille myrkyllisten torjunta-aineiden ja muiden kemikaalien aineelle ominaisen myrkyllisyyden määrittämiseksi. Testituloksien avulla määritellään lisäarvioinnin tarve. Tätä menetelmää voidaan käyttää erityisesti ohjelmissa, joissa torjunta-aineista mehiläisille aiheutuvaa vaaraa arvioidaan vaiheittain, jolloin laboratoriossa tehtävien myrkyllisyystestien jälkeen edetään puoliksi kenttäolosuhteissa tehtäviin kokeisiin ja kenttäkokeisiin (1). Torjunta-aineita voidaan testata sekä tehoaineina että valmisteina.
Mehiläisten herkkyyden ja testimenetelmän tarkkuuden todentamiseksi olisi käytettävä myrkyllistä standardia.
1.2 MÄÄRITELMÄT
Välitön myrkyllisyys suun kautta: Haittavaikutukset, jotka ilmenevät enintään 96 tunnin kuluttua siitä, kun testiainetta on annettu yksi annos suun kautta.
Annos: Nautitun testiaineen määrä. Annos ilmaistaan testiaineen massana (μg) testieläintä kohti (μg/mehiläinen). Todellista annosta kutakin mehiläistä kohti ei voida laskea, koska mehiläisiä ruokitaan yhtenä ryhmänä, mutta keskimääräinen annos voidaan arvioida (nautitun testiaineen kokonaismäärä / testimehiläisten lukumäärä yhdessä häkissä).
LD 50 ((puolet tappava annos) suun kautta annosteltuna: Tilastollisesti laskettu yksittäinen annos, joka aiheuttaa kuoleman 50 %:ssa eläimistä suun kautta annosteltuna. LD50 ilmaistaan mikrogrammana testiainetta mehiläistä kohti. Kun on kysymys torjunta-aineesta, testiaine voi olla joko tehoaine tai valmiste, jossa on yksi tai useampia tehoaineita.
Kuolleisuus: Eläin katsotaan kuolleeksi, kun se on täysin liikkumaton.
1.3 TESTIMENETELMÄN PERIAATE
Täysikasvuisia työmehiläisiä (Apis mellifera) altistetaan sarjalle sakkaroosiliuokseen liuotetun testiaineen annoksia. Mehiläisille annetaan tämän jälkeen sakkaroosiliuosta, jossa ei ole testiainetta. Kuolleisuus kirjataan päivittäin vähintään 48 tunnin ajan, ja sitä verrataan kontrolliarvoihin. Jos kuolleisuus lisääntyy 24 tunnin ja 48 tunnin välillä, mutta kontrollien kuolleisuus pysyy hyväksytyllä tasolla eli < 10 %, testiä jatketaan enintään 96 tuntiin saakka. Tulokset analysoidaan ja lasketaan 24 tunnin ja 48 tunnin LD50 sekä 72 tunnin ja 96 tunnin LD50, jos testiä on jatkettu.
1.4 TESTIN LUOTETTAVUUS
Testi on luotettava, jos:
|
— |
keskimääräinen kuolleisuus kaikilla kontrolleilla ei ole suurempi kuin 10 % testin lopussa, ja |
|
— |
myrkyllisen standardin LD50 on määritellyissä rajoissa. |
1.5 TESTIMENETELMÄN KUVAUS
1.5.1 Mehiläisten kerääminen
Testissä olisi käytettävä samaa rotua olevia täysikasvuisia työmehiläisiä. Niiden pitäisi olla saman ikäisiä, samalla tavalla ruokittuja jne. Testimehiläisten olisi oltava asianmukaisesti ruokittuja ja hyväkuntoisia, niissä ei saisi olla tauteja ja ne olisi otettava emollisista pesistä. Yhdyskuntien fysiologinen tila ja aiempi historia pitäisi tuntea. Mehiläiset olisi kerättävä sen päivän aamuna, jolloin ne käytetään, tai edellisenä iltana ja pidettävä testiolosuhteissa seuraavaan päivään. Sikiöttömiltä kakuilta kerätyt mehiläiset ovat sopivia. Keräämistä aikaisin keväällä tai myöhään syksyllä olisi vältettävä, koska mehiläisten fysiologia on erilainen näinä aikoina. Jos testit on tehtävä aikaisin keväällä tai myöhään syksyllä, mehiläisten voi antaa kuoriutua lämpökaapissa ja niitä voi kasvattaa viikon verran ”mesileivällä” (kakusta kerätyllä siitepölyllä) ja sakkaroosiliuoksella. Kemiallisilla aineilla kuten antibiooteilla ja varroapunkkilääkkeillä käsiteltyjä mehiläisiä ei saisi käyttää myrkyllisyystesteihin neljään viikkoon viimeisen käsittelyn lopusta.
1.5.2 Häkit ja ruokinta
Häkkien on oltava helposti puhdistettavia ja niissä on oltava hyvä ilmanvaihto. Kaikkia sopivia materiaaleja voi käyttää, kuten ruostumatonta terästä, metalliverkkoa tai muovia, tai häkit voivat olla kertakäyttöisiä puuhäkkejä. Kymmenen mehiläistä häkkiä kohti on sopivin määrä. Testihäkkien on oltava kooltaan riittävän tilavia mehiläismäärälle.
Mehiläisiä olisi pidettävä pimeässä koehuoneessa lämpötilassa 25 ± 2 oC. Suhteellinen kosteus, jonka pitäisi olla normaalisti 50-70 %, olisi rekisteröitävä koko testin ajan. Käsittelytoimenpiteet ja havainnot voidaan suorittaa (päivän)valossa. Ravintona käytetään sakkaroosiliuosta, jonka pitoisuus on 500 g/l (50 % w/v). Testiannosten antamisen jälkeen ravintoa on annettava ad libitum. Ruokintajärjestelmän olisi oltava sellainen, että ravinnonotto voidaan rekisteröidä jokaista häkkiä kohti (ks. kohta 1.6.3.1). Ravinnon annosteluun voidaan käyttää lasiputkea, joka on n. 50 mm pitkä ja 10 mm paksu ja jonka pää kapenee niin, että halkaisija on noin 2 mm.
1.5.3 Mehiläisten valmistelu
Kerätyt mehiläiset jaetaan satunnaisesti testihäkkeihin, jotka sijoitetaan satunnaisesti koehuoneeseen.
Mehiläisiä voidaan pitää ilman ravintoa enintään 2 tuntia ennen testin alkua. Suositellaan, että mehiläisiä pidetään ilman ravintoa ennen käsittelyä, jotta niiden suolen sisältö olisi samanlainen testin alkaessa. Kuolevat mehiläiset on hylättävä, ja niiden tilalle on otettava terveitä mehiläisiä ennen testin aloittamista.
1.5.4 Annosten valmistus
Jos testiaine on vesiliukoinen, se voidaan liuottaa suoraan 50-prosenttiseen sakkaroosiliuokseen. Tekniset valmisteet ja huonosti vesiliukoiset aineet voidaan liuottaa esimerkiksi sellaisen orgaanisen liuottimen tai emulgointi- tai dispergointiaineen avulla, jonka myrkyllisyys mehiläisille on vähäinen (esim. asetoni, dimetyyliformamidi, dimetyylisulfoksidi). Liuotinapuaineen pitoisuus riippuu testiaineen liukoisuudesta, ja sen pitäisi olla sama kaikille testattaville pitoisuuksille. Yhden prosentin pitoisuus on yleensä hyväksyttävä, eikä sitä saisi ylittää.
On myös valmistettava asianmukaiset kontrolliliuokset. Jos testiaineen liuottamiseen on käytetty liuotinta tai dispergointiainetta, pitäisi käyttää kahta erillistä kontrolliaineiden ryhmää: toinen olisi vesiliuos ja toinen sakkaroosiliuos, jossa on liuotinta / kantaja-ainetta siinä pitoisuudessa kuin sitä käytetään annosteluliuoksissa.
1.6 TESTIN SUORITUS
1.6.1 Testi- ja kontrolliryhmät
Testiannosten ja rinnakkaismääritysten määrän on täytettävä tilastolliset vaatimukset LD50:n määrittämiseksi 95 %:n luottamusvälein. Tavallisesti vaaditaan viisi annosta, joiden pitoisuudet ovat geometrisessa sarjassa, jonka kerroin on enintään 2,2, ja jotka kattavat LD50:n määrittämiseksi tarvittavan pitoisuusalueen. Laimennustekijä ja annosteltavien pitoisuuksien lukumäärä on kuitenkin määriteltävä myrkyllisyyskäyrän (kuolleisuus annoksen funktiona) kulmakertoimen mukaan, ja tulosten analysointiin valittu tilastollinen menetelmä on myös otettava huomioon. Alustavilla testeillä on määriteltävä sopivat annostelupitoisuudet.
Sama testipitoisuusannos olisi annettava vähintään kolmelle rinnakkaiselle testiryhmälle, joista kussakin on kymmenen mehiläistä. Testisarjan lisäksi olisi oltava vähintään kolme kontrollierää, joista kussakin on kymmenen mehiläistä. Käytetyille liuottimille tai kantaja-aineille (ks. kohta 1.5.4) on oltava myös kontrollierät.
1.6.2 Myrkyllinen standardi
Testisarjassa on oltava myös myrkyllinen standardi. Siitä on oltava vähintään kolme annosta, jotka kattavat odotetun LD50-arvon. Kutakin testiannosta varten on oltava vähintään kolme rinnakkaishäkkiä, joista kussakin kymmenen mehiläistä. Suositeltava myrkyllinen standardi on dimetoaatti, jonka 24 tunnin LD50-arvon on raportoitu olevan alueella 0,10-0,35 μg tehoainetta / mehiläinen (2). Muutkin myrkylliset standardit ovat hyväksyttäviä, jos toimitetaan riittävästi tietoja odotetun annos-vastesuhteen todentamiseksi (esim. parationi).
1.6.3 Altistus
1.6.3.1 Antotapa
Kullekin mehiläisten testiryhmälle on annettava 100-200 μl 50-prosenttista sakkaroosin vesiliuosta, joka sisältää testiainetta sopivassa pitoisuudessa. Aineille, jotka ovat niukkaliukoisia, joiden myrkyllisyys on vähäinen tai joiden pitoisuus valmisteessa on pieni, tarvitaan suurempi nestetilavuus, koska on käytettävä aineiden suurempia osuuksia sakkaroosiliuoksessa. Ryhmää kohti kulunutta käsitellyn ravinnon määrää on seurattava. Kun ravinto on nautittu (tavallisesti 3-4 tunnin kuluessa), ruokintalaite on poistettava häkistä ja sen tilalle on pantava pelkästään sakkaroosiliuosta. Sitä annetaan sitten ad libitum. Joitakin aineita mehiläiset eivät ehkä syö, kun aineiden pitoisuus on suuri. Enintään 6 tunnin kuluttua nauttimatta jäänyt käsitelty ravinto otetaan pois ja korvataan sakkaroosiliuoksella. Nautitun käsitellyn ravinnon määrä on arvioitava (esim. mittaamalla jäljelle jääneen ravinnon tilavuus / paino).
1.6.3.2 Testin kesto
Testin kestoksi suositellaan 48 tuntia sen jälkeen kun testiliuos on korvattu sakkaroosiliuoksella. Jos kuolleisuus nousee edelleen yli 10 prosentilla ensimmäisten 24 tunnin jälkeen, koetta on jatkettava enintään 96 tuntiin saakka edellyttäen, ettei kontrollien kuolleisuus ole suurempi kuin 10 %.
1.6.4 Havainnot
Kuolleisuus kirjataan 4 tunnin kuluttua testin alusta ja sen jälkeen 24 tunnin ja 48 tunnin kuluttua (ts. annoksen antamisesta). Jos on tarpeen jatkaa havainnointia, havainnot on tehtävä 24 tunnin välein enintään 96 tuntiin saakka.
Ryhmää kohti kuluneen ravinnon määrä olisi arvioitava. Vertaamalla käsitellyn ja käsittelemättömän ravinnon nauttimisnopeutta 6 tunnin kuluessa voidaan saada käsitys käsitellyn ravinnon maittavuudesta.
Kaikki epänormaali käyttäytyminen testauksen aikana on kirjattava.
1.6.5 Raja-annostesti
Joissakin tapauksissa (esim. kun testiaineen myrkyllisyys oletetaan alhaiseksi) voidaan tehdä raja-arvotesti, jolloin käytetään 100 μg tehoainetta mehiläistä kohti sen osoittamiseksi, että LD50 on kyseistä arvoa suurempi. Raja-annostestissä olisi käytettävä samaa menettelyä kuin varsinaisessa testissä, ts. siinä on oltava kolme rinnakkaistestiryhmää annosta kohti, tarvittavat kontrollit, myrkyllinen standardi, ja nautitun käsitellyn ravinnon määrä on arvioitava. Jos esiintyy kuolleisuutta, on tehtävä täydellinen tutkimus. Jos havaitaan subletaaleja vaikutuksia (ks. kohta 1.6.4), ne on kirjattava.
2. MÄÄRITYSTULOKSET JA TULOSTEN ILMOITTAMINEN
2.1 MÄÄRITYSTULOKSET
Määritystulokset on esitettävä taulukoituna, ja esityksestä on käytävä ilmi kussakin testiryhmässä sekä kontrolliryhmässä ja myrkyllistä standardia saaneessa ryhmässä käytettyjen mehiläisten lukumäärä, kuolleisuus kunakin havainnointihetkenä ja niiden mehiläisten lukumäärä, joissa havaitaan haittavaikutuksia. Kuolleisuustulokset on analysoitava sopivilla tilastomenetelmillä (esim. probittianalyysi, liukuva keskiarvo, binomiaalinen todennäköisyys) (3) (4). Annos-vastekuvaajat tehdään kutakin suositeltua havainnointiajankohtaa kohti, ja kuvaajien kulmakertoimet ja puolet tappava annos (LD50) lasketaan 95 prosentin luottamusvälillä. Kontrollikuolleisuudesta johtuvat korjaukset voitaisiin tehdä Abbottin korjauksella (4) (5). Jos käsiteltyä ravintoa ei ole nautittu kokonaan, olisi määritettävä nautitun testiaineen annos ryhmää kohti. LD50, olisi ilmaistava mikrogrammoina testiainetta mehiläistä kohti.
2.2 TESTISELOSTE
Testiselosteessa on oltava seuraavat tiedot:
2.2.1 Testiaine:
|
— |
fysikaalinen olomuoto ja asian kannalta merkitsevät fysikokemialliset ominaisuudet (esim. stabiilisuus vedessä, höyrynpaine), |
|
— |
kemialliset tunnistetiedot, mukaan lukien rakennekaava ja puhtaus (ts. torjunta-aineille tunnistetiedot ja tehoaine(id)en pitoisuus). |
2.2.2 Testilaji:
|
— |
tieteellinen nimi, rotu, ikä suunnilleen (viikkoa), keräysmenetelmä, keräyspäivä, |
|
— |
testimehiläisten keräykseen käytettyjä pesiä koskevat tiedot, mukaan lukien esim. mehiläisten terveydentila, mahdolliset täysikasvuisten taudit, mahdolliset esikäsittelyt. |
2.2.3 Testiolosuhteet:
|
— |
koetilojen lämpötila ja suhteellinen kosteus, |
|
— |
häkkien tyyppi, koko ja materiaali, |
|
— |
varasto- ja testiliuosten valmistusmenetelmät (jos on käytetty liuotinta, sen nimi ja pitoisuus on mainittava), |
|
— |
testin suunnittelu, esim. testipitoisuudet ja niiden määrä, kontrollien lukumäärä sekä kutakin testipitoisuutta ja kontrollia kohti rinnakkaisten häkkien määrä ja mehiläisten määrä häkkiä kohti, |
|
— |
testin päivämäärä. |
2.2.4 Tulokset:
|
— |
mahdolliset alustavan annosaluetutkimuksen tulokset, |
|
— |
käsittelemättömät tulokset: kuolleisuus kullakin testipitoisuudella ja kullakin havainnointihetkellä, |
|
— |
annos-vastekuvaajat testin lopussa, |
|
— |
testiaineen ja myrkyllisen standardin LD50-arvot 95 prosentin luottamusvälein kullakin suositellulla havainnointihetkellä, |
|
— |
LD50-arvon määrittämiseen käytetyt tilastomenetelmät, |
|
— |
kontrollien kuolleisuus, |
|
— |
muut havaitut tai mitatut biologiset vaikutukset ja mehiläisissä mahdollisesti havaitut epänormaalit vasteet, |
|
— |
mahdolliset poikkeamat tässä kuvatuista testimenettelyistä ja kaikki mahdollisesti tärkeät tiedot. |
3. LÄHDELUETTELO
|
(1) |
EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products — Honeybees. EPPO Bulletin, Vol. 23, N.1, pp. 151-165. March 1993. |
|
(2) |
Gough, H. J., McIndoe, E.C., Lewis, G.B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.) 1981-1992. Journal of Apicultural Research, 22, pp. 119-125. |
|
(3) |
Litchfield. J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol, and Exper. Ther., 96, pp. 99-113. |
|
(4) |
Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York. |
|
(5) |
Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol., 18, pp. 265-267. |
C.17 MEHILÄISET — KOSKETUSALTISTUKSEN JÄLKEEN ILMENEVÄN VÄLITTÖMÄN MYRKYLLISYYDEN TESTI
1. MENETELMÄ
Tämä välittömän myrkyllisyyden testimenetelmä on toisinto OECD:n testausohjeesta N:o 214 (1998).
1.1 JOHDANTO
Tämä myrkyllisyystesti on laboratoriomenetelmä, jonka tarkoituksena on arvioida kasvinsuojeluaineiden ja muiden kemikaalien välitöntä myrkyllisyyttä täysikasvuisille työmehiläisille kosketusaltistuksen jälkeen.
Arvioitaessa kemikaalien myrkyllisiä ominaisuuksia voidaan vaatia välittömän myrkyllisyyden määrittämistä mehiläisillä kosketusaltistuksen jälkeen esimerkiksi silloin, kun mehiläisten altistuminen tietylle kemikaalille on todennäköistä. Kosketusaltistuksen jälkeen ilmenevän välittömän myrkyllisyyden testin tarkoituksena on määrittää mehiläisille myrkyllisten torjunta-aineiden ja muiden kemikaalien aineelle ominainen myrkyllisyys. Testituloksien avulla määritellään lisäarvioinnin tarve. Tätä menetelmää voidaan käyttää erityisesti ohjelmissa, joissa torjunta-aineista mehiläisille aiheutuvaa vaaraa arvioidaan vaiheittain, jolloin laboratoriossa tehtävien myrkyllisyystestien jälkeen edetään puoliksi kenttäolosuhteissa tehtäviin kokeisiin ja kenttäkokeisiin (1). Torjunta-aineita voidaan testata sekä tehoaineina että valmisteina.
Mehiläisten herkkyyden ja testimenetelmän tarkkuuden todentamiseksi olisi käytettävä myrkyllistä standardia.
1.2 MÄÄRITELMÄT
Kosketusaltistuksen jälkeen ilmenevä välitön myrkyllisyys: Haittavaikutukset, jotka ilmenevät enintään 96 tunnin kuluttua siitä, kun testiainetta on aplikoitu paikallisesti yksi annos.
Annos: Aplikoidun testiaineen määrä. Annos ilmaistaan testiaineen massana (μg) testieläintä kohti (μg/mehiläinen).
LD 50 (puolet tappava annos) ihon kautta annosteltuna: Tilastollisesti laskettu yksittäinen annos, joka aiheuttaa kuoleman 50 %:ssa eläimistä ihon kautta annosteltuna. LD50 ilmaistaan mikrogrammana testiainetta mehiläistä kohti. Kun on kysymys torjunta-aineesta, testiaine voi olla joko tehoaine tai valmiste, jossa on yksi tai useampia tehoaineita.
Kuolleisuus: Eläin katsotaan kuolleeksi, kun se on täysin liikkumaton.
1.3 TESTIMENETELMÄN PERIAATE
Täysikasvuisia työmehiläisiä (Apis mellifera) altistetaan sopivaan kantaja-aineeseen liuotetun testiaineen annoksille siten, että ainetta aplikoidaan suoraan rintakehälle (tippoina). Testin kesto on 48 h. Jos kuolleisuus kasvaa 24 tunnin ja 48 tunnin välillä kontrollien kuolleisuuden pysyessä hyväksyttävällä tasolla, ts. < 10 %, testiä pitäisi jatkaa enintään 96 tuntiin saakka. Kuolleisuus kirjataan päivittäin, ja sitä verrataan kontrolliarvoihin. Tuloksista lasketaan LD50 24 tunnin ja 48 tunnin kuluttua sekä 72 tunnin ja 96 tunnin kuluttua, jos testiä on jatkettu.
1.4 TESTIN LUOTETTAVUUS
Testi on luotettava, jos:
|
— |
keskimääräinen kuolleisuus kaikilla kontrolleilla ci ole suurempi kuin 10 % testin lopussa, ja |
|
— |
myrkyllisen standardin LD50 on määritellyissä rajoissa. |
1.5 TESTIN KUVAUS
1.5.1 Mehiläisten kerääminen
Testiin pitäisi käyttää nuoria täysikasvuisia työmehiläisiä, ts. sellaisia, jotka ovat saman ikäisiä, samalla tavoin ruokittuja, saman rotuisia jne. Testimehiläisten olisi oltava asianmukaisesti ruokittuja ja hyväkuntoisia, niissä ei saisi olla tauteja ja ne olisi kerättävä emollisista pesistä, joiden fysiologinen tila ja aiempi historia tunnetaan. Mehiläiset olisi kerättävä sen päivän aamuna, jolloin ne käytetään, tai edellisenä iltana ja pidettävä testiolosuhteissa seuraavaan päivään. Sikiöttömiltä kakuilta kerätyt mehiläiset ovat sopivia. Keräämistä aikaisin keväällä tai myöhään syksyllä olisi vältettävä, koska mehiläisten fysiologia on erilainen näinä aikoina. Jos testit on tehtävä aikaisin keväällä tai myöhään syksyllä, mehiläisten voi antaa kuoriutua lämpökaapissa ja niitä voi kasvattaa viikon verran ”mesileivällä” (kakusta kerätyllä siitepölyllä) ja sakkaroosiliuoksella. Kemiallisilla aineilla kuten antibiooteilla ja varroapunkkilääkkeillä käsiteltyjä mehiläisiä ei saisi käyttää myrkyllisyystesteihin neljään viikkoon viimeisen käsittelyn lopusta.
1.5.2 Häkit ja ruokinta
Häkkien on oltava helposti puhdistettavia ja niissä on oltava hyvä ilmanvaihto. Kaikkia sopivia materiaaleja voi käyttää, kuten ruostumatonta terästä, metalliverkkoa tai muovia, tai häkit voivat olla kertakäyttöisiä puuhäkkejä. Testihäkkien on oltava kooltaan riittävän tilavia mehiläismäärälle. Kymmenen mehiläistä häkkiä kohti on sopivin määrä
Mehiläisiä olisi pidettävä pimeässä koehuoneessa lämpötilassa 25 ± 2 oC. Suhteellinen kosteus, jonka pitäisi olla normaalisti 50-70 %, olisi rekisteröitävä koko testin ajan. Käsittelytoimenpiteet ja havainnot voidaan suorittaa (päivän)valossa. Ravintona käytetään sakkaroosiliuosta, jonka pitoisuus on 500 g/l (50 % w/v), ja sitä annetaan ad libitum testin ajan annostelulaitteen avulla, joka voi olla lasiputki (n. 50 mm pitkä ja 10 mm paksu ja jonka pää kapenee niin, että halkaisija on noin 2 mm).
1.5.3 Mehiläisten valmistelu
Mehiläiset voidaan keräyksen jälkeen anestesoida hiilidioksidilla tai typpikaasulla, jotta testiaine voidaan aplikoida. Anestesia-ainetta on käytettävä mahdollisimman pieni määrä ja mahdollisimman lyhyen aikaa. Kuolevat mehiläiset on hylättävä, ja niiden tilalle on otettava terveitä mehiläisiä ennen testin aloittamista.
1.5.4 Annosten valmistelu
Testiaine aplikoidaan kantaja-aineeseen, ts. orgaaniseen liuottimeen tai veteen tehtynä liuoksena, jossa on vettymistä edistävää ainetta. Orgaanisista liuottimista suositeltavin on asetoni, mutta muitakin orgaanisia liuottimia, joiden myrkyllisyys mehiläisille on vähäinen, voidaan käyttää (esim. dimetyyliformamidia tai dimetyylisulfoksidia). Orgaanisiin kantaja-aineisiin liukenemattomien veteen dispergoitujen valmisteiden ja erittäin polaaristen orgaanisten kemikaalien aplikointi voi olla helpompaa, jos niiden liuokset tehdään laimeaan kaupalliseen vettymistä edistävään aineeseen (esim. Agral, Cittowett, Lubrol, Triton, Tween).
Testissä olisi käytettävä asianmukaisia kontrolliliuoksia, ts. jos testiaineen liuottamiseen on käytetty liuotinta tai dispergointiainetta, pitäisi käyttää kahta erillistä kontrolliryhmää: sellaista, joka on käsitelty vedellä ja sellaista, joka on käsitelty liuottimella tai dispergointiaineella.
1.6 TESTIN SUORITUS
1.6.1 Testi- ja kontrolliryhmät
Testiannosten ja rinnakkaismääritysten määrän on täytettävä tilastolliset vaatimukset LD50:n määrittämiseksi 9 5 %:n luottamusvälein. Tavallisesti vaaditaan viisi annosta, joiden pitoisuudet ovat geometrisessa sarjassa, jonka kerroin on enintään 2,2, ja jotka kattavat LD50:n määrittämiseksi tarvittavan pitoisuusalueen. Annosteltavien pitoisuuksien lukumäärä on kuitenkin määriteltävä myrkyllisyyskäyrän (kuolleisuus annoksen funktiona) kulmakertoimen mukaan, ja tulosten analysointiin valittu tilastollinen menetelmä on myös otettava huomioon. Alustavilla testeillä on määriteltävä sopivat annostelupitoisuudet.
Sama testipitoisuusannos olisi annettava vähintään kolmelle rinnakkaiselle testiryhmälle, joista kussakin on kymmenen mehiläistä.
Testisarjan lisäksi olisi oltava vähintään kolme kontrollierää, joista kussakin on kymmenen mehiläistä. Jos käytetään orgaanista liuotinta tai vettymistä edistävää ainetta, on testissä oltava myös orgaanista liuotinta tai vettymistä edistävää ainetta varten kolme kontrollierää, joista kussakin on kymmenen mehiläistä.
1.6.2 Myrkyllinen standardi
Testisarjassa on oltava myös myrkyllinen standardi. Siitä on oltava vähintään kolme annosta, jotka kattavat odotetun LD50-arvon. Kutakin testiannosta varten on oltava vähintään kolme rinnakkaishäkkiä, joista kussakin kymmenen mehiläistä. Suositeltava myrkyllinen standardi on dimetoaatti, jonka 24 tunnin LD50-arvo on alueella 0,10-0,30 μg tehoainetta / mehiläinen (2). Muutkin myrkylliset standardit ovat hyväksyttäviä, jos toimitetaan riittävästi tietoja odotetun annos-vastesuhteen todentamiseksi (esim. parationi).
1.6.3 Altistus
1.6.3.1 Antotapa
Anestesoidut mehiläiset käsitellään yksitellen. Mehiläiset jaetaan satunnaistetusti eri testiannos- ja kontrolliryhmiin. Liuosta, joka sisältää 1 mikrolitran testiainetta sopivassa pitoisuudessa, aplikoidaan mikroaplikaattorilla kunkin mehiläisen rintakehän selkäpuolelle. Muita tilavuuksia voi käyttää, jos se on perusteltua. Mehiläiset jaetaan aplikaation jälkeen testihäkkeihin ja niille annetaan sakkaroosiliuosta.
1.6.3.2 Testin kesto
Testin keston olisi oltava mieluiten 48 tuntia. Jos kuolleisuus nousee edelleen yli 10 prosentilla 24 tunnin ja 48 tunnin välillä, testiä on jatkettava, kuitenkin enintään 96 tuntiin saakka, edellyttäen, ettei kontrollien kuolleisuus ole suurempi kuin 10 %.
1.6.4 Havainnot
Kuolleisuus kirjataan 4 tunnin kuluttua annostelusta ja 24 tunnin sekä 48 tunnin kuluttua. Jos on tarpeen jatkaa havainnointia, havaintoja on tehtävä 24 tunnin väliajoin enintään 96 tuntiin saakka, mikäli kontrollikuolleisuus ei ylitä 10:tä prosenttia.
Kaikki epänormaali käyttäytyminen testin aikana on kirjattava.
1.6.5 Raja-annostesti
Joissakin tapauksissa (esim. kun testiaineen myrkyllisyys oletetaan alhaiseksi) voidaan tehdä raja-arvotesti, jolloin käytetään 100 μg tehoainetta mehiläistä kohti sen osoittamiseksi, että LD50 on kyseistä arvoa suurempi. Raja-annostestissä olisi käytettävä samaa menettelyä kuin varsinaisessa testissä, ts. siinä on oltava kolme rinnakkaistestiryhmää annosta kohti, tarvittavat kontrollit ja myrkyllinen standardi. Jos esiintyy kuolleisuutta, on tehtävä täydellinen tutkimus. Jos havaitaan subletaaleja vaikutuksia (ks. kohta 1.6.4), ne on kirjattava.
2. MÄÄRITYSTULOKSET JA TULOSTEN ILMOITTAMINEN
2.1 MÄÄRITYSTULOKSET
Määritystulokset on esitettävä taulukoituna, ja esityksestä on käytävä ilmi kussakin testiryhmässä sekä kontrolliryhmässä ja myrkyllistä standardia saaneessa ryhmässä käytettyjen mehiläisten lukumäärä, kuolleisuus kunakin havainnointihetkenä ja niiden mehiläisten lukumäärä, joissa havaitaan haittavaikutuksia. Kuolleisuustulokset on analysoitava sopivilla tilastomenetelmillä (esim. probittianalyysi, liukuva keskiarvo, binomiaalinen todennäköisyys) (3) (4). Annos-vastekuvaajat tehdään kutakin suositeltua havainnointiajankohtaa (ts. 24, 48 ja tarvittaessa 72 ja 96 tuntia) kohti, ja kuvaajien kulmakertoimet ja puolet tappava annos (LD50) lasketaan 95 prosentin luottamusvälillä. Kontrollikuolleisuudesta johtuvat korjaukset voitaisiin tehdä Abbottin korjauksella (4) (5). LD5() olisi ilmaistava mikrogrammoina testiainetta mehiläistä kohti.
2.2 TESTISELOSTE
Testiselosteessa on oltava seuraavat tiedot:
2.2.1 Testiaine:
|
— |
fysikaalinen olomuoto ja fysikokemialliset ominaisuudet (esim. stabiilisuus vedessä, höyrynpaine), |
|
— |
kemialliset tunnistetiedot, mukaan lukien rakennekaava ja puhtaus (ts. torjunta-aineille tunnistetiedot ja tehoaine(id)en pitoisuus). |
2.2.2 Testilajit:
|
— |
tieteellinen nimi, rotu, ikä suunnilleen (viikkoa), keräysmenetelmä, keräyspäivä, |
|
— |
testimehiläisten keräykseen käytettyjä pesiä koskevat tiedot, mukaan lukien esim. mehiläisten terveydentila, mahdolliset täysikasvuisten taudit, mahdolliset esikäsittelyt. |
2.2.3 Testiolosuhteet:
|
— |
koetilojen lämpötila ja suhteellinen kosteus, |
|
— |
häkkien tyyppi, koko ja materiaali, |
|
— |
testiaineen antotapa, esim. käytetty kantaja-aine, aplikoidun testiliuoksen tilavuus, käytetty anestesia-aine, |
|
— |
testin suunnittelu, esim. testiannokset ja niiden lukumäärä, kontrollien lukumäärä sekä kutakin testiannosta ja kontrollia kohti rinnakkaisten häkkien määrä ja mehiläisten määrä häkkiä kohti, |
|
— |
testin päivämäärä. |
2.2.4 Tulokset:
|
— |
mahdolliset raja-annostutkimuksen tulokset, |
|
— |
käsittelemättömät tulokset: kuolleisuus kullakin testipitoisuudella ja kullakin havainnointihetkellä, |
|
— |
annos-vastekuvaajat testin lopussa, |
|
— |
testiaineen ja kontrollin LD50-arvot 95 % prosentin luottamusvälein kullakin havainnointihetkellä, |
|
— |
LD50-arvon määrittämiseen käytetyt tilastomenetelmät, |
|
— |
kontrollien kuolleisuus, |
|
— |
muut havaitut tai mitatut biologiset vaikutukset ja mehiläisten mahdolliset epänormaalit vasteet, |
|
— |
mahdolliset poikkeamat tässä kuvatuista testimenettelyistä ja kaikki mahdollisesti tärkeät tiedot. |
3. VIITTEET
|
(1) |
EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products — Honeybees. EPPO bulletin, Vol. 23, N.1, pp. 151-165. March 1993. |
|
(2) |
Gough, H. J., McIndoe, E. C., Lewis, G. B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.), 1981-1992. Journal of Apicultural Research 22, pp. 119-125. |
|
(3) |
Litchfield, J. T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, pp. 99-113. |
|
(4) |
Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York. |
|
(5) |
Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol. 8, pp. 265-267. |
C.18 ADSORPTIO/DESORPTIO ERÄTASAPAINOMENETELMÄÄ KÄYTTÄEN
1. MENETELMÄ
Tämä menetelmä on toisinto OECD TG 106:sta, maa-aineksen adsorptio/desorptio-ominaisuuksien määrittämiseksi erätasapainomenetelmää käyttäen (2000).
1.1 JOHDANTO
Menetelmässä otetaan huomioon ”ring”-testi sekä maa-aineksen valitsemista koskeva seminaari (1) (2) (3) (4) adsorptiotestin kehittämiseksi samoin kuin kansallisella tasolla käytettävät ohjeet (5) (6) (7) (8) (9) (10) (11).
Adsorptio- ja desorptiotutkimuksista saadaan hyödyllisiä tietoja kemikaalien kulkeutumisesta ja niiden jakautumisesta biosfäärin maa-, vesi- ja ilmakerroksiin (12) (13) (14) (15) (16) (17) (18) (19) (20) (21). Tietoja voidaan käyttää esimerkiksi sen ennustamiseksi tai arvioimiseksi, miten kemikaalit hajoavat (22) (23), muuntuvat tai joutuvat eliöihin (24), uuttuvat maalajien läpi (16) (18) (19) (21) (25) (26) (27) (28), haihtuvat maa-aineksesta (21) (29) (30) tai huuhtoutuvat maan pintakerroksista luonnonvesiin (18) (31) (32). Adsorptiotietoja voidaan käyttää vertailu- ja mallintamistarkoituksiin (19) (33) (34) (35).
Kemikaalin jakautuminen maa-ainekseen ja vesifaasiin on monimutkainen prosessi, joka riippuu lukuisista eri tekijöistä: aineen kemiallisesta luonteesta (12) (36) (37) (38) (39) (40), maa-aineksen ominaisuuksista (4) (12) (13) (14) (41) (42) (43) (44) (45) (46) (47) (48) (49) sekä ilmastollisista tekijöistä kuten sateista, lämpötilasta, auringosta ja tuulista. Näin ollen kemikaalin maa-aineksessa tapahtuvaan adsorptioprosessiin liittyviä moninaisia ilmiöitä ja mekanismeja ei voida täysin määritellä yksinkertaistetulla laboratoriomallilla, kuten tässä esitetyllä menetelmällä. Vaikka tällä menetelmällä ei ole mahdollista kattaa kaikkia ympäristön kannalta mahdollisia tapauksia, se antaa kuitenkin riittävästi tietoa kemikaalin adsorboitumisesta ympäristön kannalta merkityksellisellä tavalla.
Katso myös yleinen johdanto.
1.2 SOVELTAMISALA
Menetelmän tarkoituksena on arvioida, miten kemikaalit adsorboituvat maa-ainekseen tai desorboituvat siitä. Tavoitteena on saada sorptioarvo, jota voidaan käyttää ennustamaan jakautumista erilaisissa ympäristöolosuhteissa; tätä varten määritetään tasapainotilan adsorptiokertoimet kemikaalille erilaisissa maa-aineksissa maa-aineksen ominaisuuksien (esimerkiksi orgaanisen hiilen pitoisuus, savipitoisuus ja maaperän rakenne sekä pH) funktiona. On käytettävä erilaisia maalajeja, jotta tietyn aineen ja luonnossa esiintyvien maa-ainesten väliset vuorovaikutukset voidaan kattaa mahdollisimman laajasti.
Tässä menetelmässä adsorptio edustaa kemikaalin sitoutumista maa-ainesten pintakerroksiin; siinä ei erotella erilaisia adsorptioprosesseja (fysikaalinen ja kemiallinen adsorptio) eikä esim. pintakatalysoitua hajoamista, massa-adsorptiota tai kemiallista reaktiota. Adsorptiota, joka tapahtuu maa-aineksesta syntyviin kolloidipartikkeleihin (halkaisija < 0,2 μm), ei ole otettu huomioon.
Tärkeimpinä adsorptiokäyttäytymiseen vaikuttavina maa-ainekseen liittyvinä muuttujina pidetään orgaanisen hiilen pitoisuutta (3) (4) (12) (13) (14) (41) (4 3) (44) (45) (46) (47) (48); savipitoisuutta ja maaperän rakennetta (3) (4) (41) (42) (43) (44) (45) (46) (47) (48) sekä ionisoituvien yhdisteiden pH:ta (3) (4) (42). Muut maa-ainekseen liittyvät muuttujat, joilla saattaa olla vaikutusta tietyn aineen adsorptioon/desorptiooon ovat efektiivinen kationinvaihtokyky (ECEC), amorfisen raudan ja alumiinioksidien pitoisuus, erityisesti tulivuorialueiden ja trooppisten maa-ainesten (4) tapauksessa, samoin kuin ominaispinta-ala (49) ovat tärkeitä.
Testillä on tarkoitus arvioida kemikaalin adsorboitumista erityyppisiin maalajeihin, joiden orgaanisen hiilen pitoisuus, savipitoisuus ja maaperän rakenne sekä pH vaihtelevat eri tavoin. Testi käsittää kolme tasoa:
|
Taso 1 |
: Alustava tutkimus, jolloin määritetään:
|
|
Taso 2 |
: Seulontatesti: adsorptiokinetiikka tutkitaan viidessä erilaisessa maalajissa yhdellä pitoisuudella ja määritetään jakautumiskertoimet Kd ja KOC. |
|
Taso 3 |
: Freundlichin adsorptioisotermien määritys, jotta voidaan määrittää pitoisuuden vaikutus maa-aineksiin tapahtuvan adsorption laajuuteen. Desorptiokinetiikka ja Freundlichin desorptioisotermit (lisäys 1). |
1.3 MÄÄRITELMÄT JA YKSIKÖT
|
Symboli |
Määritelmä |
Yksiköt |
|
|
adsorboitumisprosentti ajanhetkellä ti |
% |
|
Aeq |
adsorboitumisprosentti adsorptiotasapainotilassa |
% |
|
|
maa-ainekseen adsorboituneen testiaineen massa ajanhetkellä ti |
μg |
|
|
maa-ainekseen adsorboituneen testiaineen massa aikavälillä Δti |
μg |
|
|
maa-ainekseen adsorboituneen testiaineen massa adsorptiotasapainossa |
μg |
|
m0 |
testiaineen massa koeputkessa, adsorptiotestin alussa |
μg |
|
|
testiaineen massa mitattuna
|
μg |
|
|
aineen massa liuoksessa adsorptiotasapainotilassa |
μg |
|
msoil |
maa-ainesfaasin määrä, maa-aineksen kuiva-aineena ilmaistuna |
g |
|
Cst |
aineen varastoliuoksen massakonsentraatio |
μg cm-3 |
|
Co |
maa-aineksen kanssa kosketuksiin joutuvan testiliuoksen massakonsentraatio alussa |
μg cm-3 |
|
|
aineen massakonsentraatio vesifaasissa analyysin suorituksen ajanhetkellä ti |
μg cm-3 |
|
|
maa-ainekseen adsorboituneen aineen konsentraatio adsorptiotasapainotilassa |
μg g-1 |
|
|
aineen massakonsentraatio vesifaasissa adsorptiotasapainotilassa |
μg cm-3 |
|
V0 |
adsorptiotestin aikana maa-aineksen kanssa kosketuksiin joutuvan vesifaasin alkutilavuus |
cm3 |
|
|
määräosan tilavuus, jossa testiaine mitataan |
cm3 |
|
Kd |
jakautumiskerroin adsorptiolle |
cm3 g-1 |
|
Koc |
orgaanisen hiilen suhteen normalisoitu adsorptiokerroin |
cm3 g-1 |
|
Kom |
orgaanisen aineksen suhteen normalisoitu jakautumiskerroin |
cm3 g1 |
|
|
Freundlichin adsorptiokerroin |
|
|
l/n |
Freundlichin eksponentti |
|
|
|
desorboitumisprosentti ajanhetkellä t1 |
% |
|
|
desorboitumisprosentti aikavälillä Δti |
% |
|
Kdes |
näennäinen desorptiokerroin |
cm3 g-1 |
|
|
Freundlichin desorptiokerroin |
|
|
|
maa-aineksesta desorboituneen testiaineen massa ajanhetkellä t1 |
μg |
|
|
maa-aineksesta desorboituneen testiaineen massa aikavälillä Δti |
μg |
|
|
analyyttisesti määritetyn aineen massa vesifaasissa desorptiotasapainotilassa |
μg |
|
|
desorboituneen testiaineen kokonaismassa desorptiotasapainotilassa |
μg |
|
|
maa-ainekseen adsorboituneeksi jääneen aineen massa aikavälin Δti jälkeen |
μg |
|
|
epätäydellisestä tilavuustäydennyksestä johtuen adsorptiotasapainotilan ulkopuolelle jääneen aineen massa |
μg |
|
|
maa-ainekseen adsorboituneeksi jääneen testiaineen pitoisuus desorptiotasapainotilassa |
μg g-1 |
|
|
testiaineen massakonsentraatio vesifaasissa desorptiotasapainotilassa |
μg cm-3 |
|
VT |
maa-aineksen kanssa kosketuksiin joutuvan vesifaasin kokonaistilavuus sarjamenetelmällä suoritettavan desorptiokinetiikkakokeen aikana |
cm3 |
|
VR |
adsorptiotasapainotilan saavuttamisen jälkeen koeputkesta poistetun supernatantin tilavuus, joka korvataan samalla tilavuudella 0,01 M CaCl2-liuosta |
cm3 |
|
|
koeputkesta (i) analyysitarkoituksiin otetun määräosan tilavuus sarjamenetelmällä suoritettavan desorptiokinetiikkakokeen aikana |
cm3 |
|
|
koeputkesta (i) testiaineen mittaamiseksi otetun liuoksen tilavuus desorptiokinetiikkakokeessa (rinnakkaismenetelmä) |
cm3 |
|
|
koeputkesta testiaineen mittaamiseksi otetun liuoksen tilavuus desorptiotasapainotilassa |
cm3 |
|
MB |
massatase |
% |
|
mE |
maa-aineksesta ja koeastiaseinämistä kahdessa vaiheessa uutetun testiaineen kokonaismassa |
μg |
|
Vrec |
adsorptiotasapainotilan saavuttamisen jälkeen talteen otetun supernatantin tilavuus |
cm3 |
|
Pow |
oktanol-vesijakautumiskerroin |
|
|
pKa |
hajoamisvakio |
|
|
Sw |
vesiliukoisuus |
g'"1 |
1.4 TESTIMENETELMÄN PERIAATE
Tunnetut tilavuudet testiaineliuoksia, merkitsemättöminä tai radioaktiivisesti merkittyinä, tunnettuina pitoisuuksina 0,01 M CaCl2:ssa lisätään kuivapainoltaan tunnettuihin maa-ainesnäytteisiin, jotka on esitasapainotettu 0,01 M CaCl2:ssa. Seosta ravistellaan riittävästi. Maa-ainessuspensiot sentrifugoidaan, suodatetaan haluttaessa ja vesifaasi analysoidaan. Maa-ainesnäytteeseen adsorboituneen testiaineen määrä lasketaan liuoksessa alussa olleen testiaineen määrän ja kokeen lopussa jäljellä olevan määrän välisenä erotuksena (epäsuora menetelmä).
Vaihtoehtoisesti adsorboituneen testiaineen määrä voidaan määrittää myös suoraan maa-ainesanalyysin avulla (suora menetelmä). Tätä menettelytapaa, johon kuuluu asteittainen maa-aineksen uutto sopivalla liuottimella, suositellaan silloin, kun aineen liuoskonsentraatioeroja ei voida täsmällisesti määrittää. Esimerkkejä tällaisista tapauksista ovat testiaineen adsorboituminen koeastioiden pintaan, testiaineen epästabiilius kokeen aikana, heikko adsorptio, mikä aiheuttaa vain pienen konsentraatiomuutoksen liuoksessa, sekä voimakas adsorptio, mikä saa aikaan alhaisen konsentraation, jota ei voida täsmällisesti määrittää, jos käytetään radioaktiivisesti merkittyä ainetta, maa-aineksen uutto voidaan välttää suorittamalla maa-ainesfaasin analyysi polttoa ja nestetuikelaskentaa käyttäen. Nestetuikelaskenta on kuitenkin epäspesifinen tekniikka, jolla ei voida erottaa lähtöaineita ja muunnostuotteita; siksi sitä olisi käytettävä ainoastaan silloin, kun testikemikaali on stabiili koko tutkimuksen keston ajan.
1.5 TESTIAINETTA KOSKEVAT TIEDOT
Kemiallisten reagenssien on oltava analyysilaatua. Suositellaan merkitsemättömien, koostumukseltaan tunnettujen ja mieluiten puhtaudeltaan vähintään 95-prosenttisten testiaineiden käyttöä tai koostumukseltaan ja radio-isotooppipuhtaudeltaan tunnettujen radioaktiivisesti merkittyjen testiaineiden käyttöä. Jos merkkiaineiden puoliintumisajat ovat lyhyitä, on tehtävä hajoamiskorjauksia.
Testiaineesta on oltava seuraavat tiedot ennen adsorptio-desorptiotestin suorittamista:
|
a) |
vesiliukoisuus (A.6); |
|
b) |
höyrynpaine (A.4) ja/tai Henryn lain vakio; |
|
c) |
abioottinen hajoaminen: hydrolyysi pH:n funktiona (C.7); |
|
d) |
jakautumiskerroin (A.8); |
|
e) |
biologinen hajoavuus (C.4) tai aerobinen ja anaerobinen muuntuminen maa-aineksessa; |
|
f) |
ionisoituvien aineiden pKa; |
|
g) |
suora fotolyysi vedessä (eli UV-Vis-absorptiospektri vedessä, kvanttisaanto) ja fotohajoaminen maa-aineksessa. |
1.6 TESTIN SOVELTUVUUS
Testi soveltuu kemiallisille aineille, joille on olemassa analyysimenetelmä, jota voidaan soveltaa riittävällä tarkkuudella. Tärkeä muuttuja, joka voi vaikuttaa tulosten luotettavuuteen, erityisesti epäsuoraa menetelmää käytettäessä, on testiaineen stabiilius testin aikana. Siksi edellytyksenä on tarkistaa stabiilius alustavassa tutkimuksessa; jos testin aikana havaitaan muuttumista, suositellaan, että varsinainen tutkimus suoritetaan analysoimalla sekä maa-aines- että vesifaasi.
Tätä testiä suoritettaessa ongelmia saattavat aiheuttaa testiaineet, joiden vesiliukoisuus on alhainen (Sw < 10-4 g l-1), tai paljon varauksia sisältävät aineet. Vaikeudet johtuvat siitä, että konsentraatiota vesifaasissa ei voida tällöin mitata analyyttisesti riittävällä tarkkuudella. Näissä tapauksissa tarvitaan lisävaiheita. Ohjeita näiden ongelmien ratkaisemiseksi annetaan tätä menetelmää koskevissa kappaleissa.
Kun testataan haihtuvia aineita, on huolehdittava siitä, ettei käsittelyn aikana tapahdu häviöitä.
1.7 MENETELMÄN KUVAUS
1.7.1 Laitteet ja kemialliset reagenssit
Standardi laboratoriolaitteisto, erityisesti seuraavat:
|
a) |
Koeputket tai astiat kokeiden suorittamiseksi. On tärkeää, että nämä koeputket tai astiat
|
|
b) |
Ravistelulaite: kääntelevä ravistelija tai vastaava laitteisto; ravistelulaitteen on pidettävä maa-aines suspensiona sekoituksen aikana. |
|
c) |
Sentrifugi: mieluiten suurinopeuksinen, esimerkiksi keskipakovoima > 3 000 g, lämpötilaltaan säädettävä, pystyy erottelemaan halkaisijaltaan yli 0,2 μm olevat partikkelit vesiliuoksesta. Säiliöt on pidettävä suljettuina ravistelun ja sentrifugoinnin aikana haihtuvuus- ja vesihäviöiden välttämiseksi. Korkkeihin kohdistuvan adsorboitumisen minimoimiseksi on käytettävä deaktivoituja korkkeja, kuten teflonpäällysteisiä kierrekorkkeja. |
|
d) |
Valinnainen: suodatuslaite; huokoisuudeltaan 0,2 μm:n steriilit kertakäyttösuodattimet. Suodatinmateriaalin valintaan on kiinnitettävä erityistä huomiota, jotta testiaine ci tartu siihen; orgaanista suodatinmateriaalia ei suositella niukkaliukoisille testiaineille. |
|
e) |
Analyysivälineet, jotka soveltuvat testikemikaalin konsentraation mittaamiseen. |
|
f) |
Laboratoriouuni, joka voidaan pitää lämpötilassa 103-110 oC. |
1.7.2 Maa-ainesten luonnehdinta ja valinta
Maa-aineksista on määritettävä kolme ominaisuutta, joiden katsotaan pääasiassa vaikuttavan adsorptiokykyyn. Nämä ovat orgaaninen hiili, savipitoisuus ja maaperän rakenne sekä pH. Kuten jo mainittiin (katso soveltamisala}, muutkin maa-aineksen fysikaalis-kemialliset ominaisuudet voivat vaikuttaa tietyn aineen adsorptioon ja desorptioon, ja ne täytyy ottaa huomioon kyseisissä tapauksissa.
Maa-aineksen luonnehdinnassa käytettävät menetelmät ovat hyvin tärkeitä, ja niillä voi olla merkittävä vaikutus tuloksiin. Siksi suositellaan, että maa-aineksen pH mitataan 0,01 M CaCl2-liuoksessa (liuos, jota käytetään adsorptio/desorptiotestissä) ISO-menetelmän 10390-1 mukaisesti). Myös muita tärkeitä maa-aineksen ominaisuuksia suositellaan määritettäväksi standardimenetelmien mukaisesti (ISO Handbook of soil analysis). Tällöin sorptiotietojen analysointi voi perustua yleisesti standardoituihin maa-ainesta koskeviin muuttujiin. Joitakin käytössä olevien maa-aineksen analysointia ja luonnehdintaa koskevien standardimenetelmien ohjeita löytyy lähteistä 50-52. Maa-aineksen testimenetelmien kalibrointiin suositellaan vertailumaa-ainesten käyttöä.
Ohjeita maa-ainesten valitsemiseksi adsorptio/desorptiokokeisiin annetaan taulukossa 1. Seitsemän valittua maa-ainesta kattaa lauhkeilla maantieteellisillä alueilla esiintyvät maalajit. Ionisoituvien testiaineiden ollessa kyseessä valittujen maa-ainesten olisi katettava laaja pH-alue, jotta aineen adsorboituminen ionisoituneessa ja ionisoitumattomassa muodossa voidaan arvioida. Ohjeita siitä, kuinka montaa erilaista maa-ainesta käytetään testin eri vaiheissa, annetaan 1.9 kohdassa ”Testin suorittaminen”.
Jos muita maalajeja pidetään edellä mainittuja soveltuvampina, niistä on määritettävä samat muuttujat ja niillä on oltava erilaisia ominaisuuksia samalla tavoin kuin taulukossa 1 on esitetty, vaikka ne eivät täyttäisikään täsmälleen perusteita.
Taulukko 1
Ohjeet maa-ainesnäytteiden valitsemiseksi adsorptio-desorptiokokeisiin
|
Maalaji |
pH-alue (0,01 M CaCl2:ssa) |
Orgaanisen hiilen pitoisuus ( %) |
Savipitoisuus ( %) |
Maaperän rakenne (24) |
|
1 |
4,5-5,5 |
1,0-2,0 |
65-80 |
savi |
|
2 |
> 7,5 |
3,5-5,0 |
20-40 |
hiuesavi |
|
3 |
5,5-7,0 |
1,5-3,0 |
15-25 |
hiesusavi |
|
4 |
4,0-5,5 |
3,0-4,0 |
15-30 |
savikko |
|
5 |
< 4,0-6,0 (25) |
< 10-15 (25) |
savinen hiekka |
|
|
6 |
> 7,0 |
40-65 |
hiuesavi/savi |
|
|
7 |
< 4,5 |
> 10 |
< 10 |
hiekka / savinen hiekka |
1.7.3 Maa-ainesnäytteiden kerääminen ja säilytys
1.7.3.1 Kerääminen
Mitään erityistä näytteenottotekniikkaa tai -välineitä ei suositella; näytteenottotekniikka määräytyy tutkimuksen tarkoituksen mukaisesti (53) (54) (55) (56) (57) (58).
Seuraavat seikat on otettava huomioon:
|
a) |
yksityiskohtaiset tiedot kenttäalueen sijainnista, kasvillisuudesta ja aiemmasta käytöstä (torjunta-aine- ja/tai lannoitekäsittelyt, biologiset lisäykset) tai tahattomasta kontaminaatiosta ovat välttämättömät. Maa-ainesten näytteenotossa olisi noudatettava näytteenottopaikan kuvausta koskevia ISO-standardin 10381-6 suosituksia; |
|
b) |
näytteenottopaikka on määriteltävä UTM:n (Universal Transversal Mercator –projektio / European Horizontal Datum) mukaisesti tai maantieteellisten koordinaattien mukaisesti; näin tietyn maa-aineksen uudelleen kerääminen myöhemmin on mahdollista tai tästä voi olla apua määriteltäessä maa-aineksia eri maissa käytettyjen erilaisten luokitusjärjestelmien mukaisesti. Lisäksi A-kerroksesta olisi kerättävä ainoastaan enintään 20 cm:n syvyydeltä. Erityisesti maalajista nro 7 on otettava näyte Oh-kerroksesta, jos sitä esiintyy maa-aineksen osana. |
Maa-ainesnäytteet on kuljetettava sellaisissa säiliöissä ja lämpöolosuhteissa, jotka takaavat, etteivät alkuperäiset maa-aineksen ominaisuudet muutu merkittävästi.
1.7.3.2 Säilytys
Käytetään mieluiten tuoreita kentältä otettuja maa-aineksia. Ainoastaan silloin, kun tämä ei ole mahdollista, maa-aines säilytetään huoneenlämpötilassa ja pidetään ilmakuivana. Mitään takarajaa säilytykselle ei suositella, mutta maa-ainekset, joita on säilytetty yli kolme vuotta, on analysoitava uudelleen ennen käyttöä niiden orgaanisen hiilen pitoisuuden, pH:n ja kationinvaihtokyvyn (CEC) osalta.
1.7.3.3 Maa-ainesnäytteiden käsittely ja valmistelu testiä varten
Maa-ainekset ilmakuivataan huoneenlämpötilassa (mieluiten lämpötilassa 20-25 oC). Kokonaisuuden pilkkominen on suoritettava mahdollisimman varovasti, jotta maaperän alkuperäinen rakenne muuttuisi mahdollisimman vähän. Maa-ainekset seulotaan partikkelikokoon < 2 mm; seulonnassa noudatetaan maa-ainesten näytteenottoa koskevia ISO-standardin suosituksia (ISO 10381-6). Huolellista homogenointia suositellaan sen vuoksi, että se parantaa tulosten uusittavuutta. Kunkin maa-aineksen kosteuspitoisuus määritetään kolmesta määräosasta kuumentamalla lämpötilassa 105 oC, kunnes painonmuutos ei ole merkittävä (noin 12 h). Kaikissa laskelmissa maa-aineksen massalla tarkoitetaan uunikuivaa massaa eli maa-aineksen kosteuspitoisuuskorjattua painoa.
1.7.4 Testiaineen valmistus maa-ainekseen lisättäväksi
Testiaine liuotetaan tislattuun tai deionisoituun veteen valmistettuun 0,01 M CaCl2-liuokseen; CaCl2-liuosta käytetään vesipitoisena liuotinfaasina parantamaan sentrifugointia ja minimoimaan kationinvaihtoa. Varastoliuoksen konsentraation on mieluiten oltava suuruusluokaltaan tuhatkertainen käytetyn analyysimenetelmän herkkyyteen verrattuna. Tällöin tällä menetelmällä saadaan tarkkoja mittauksia; lisäksi varastoliuoskonsentraation on oltava testiaineen vesiliukoisuusrajaa pienempi.
Varastoliuos valmistetaan mieluiten juuri ennen sen lisäämistä maa-ainesnäytteisiin, ja se säilytetään suljettuna pimeässä 4 oC:n lämpötilassa. Säilytysaika riippuu testiaineen stabiiliudesta ja sen konsentraatiosta liuoksessa.
Ainoastaan niukkaliukoisille aineille (Sw < 10 -4 g l-1) saatetaan tarvita soveltuvaa liuottavaa ainetta silloin, kun testiaineen liuottaminen on vaikeaa. Tämän liuottavan aineen on sekoituttava veteen (esim. metanoli tai asetonitriili); sen konsentraatio ei saa ylittää yhtä prosenttia varastoliuoksen kokonaistilavuudesta ja sitä saa olla enintään tämän verran testiaineliuoksessa, joka joutuu kosketuksiin maa-aineksen kanssa (mieluiten alle 0,1 %). Se ei myöskään saa olla pinta-aktiivinen aine eikä se saa osallistua solvataatioreaktioihin testikemikaalin kanssa. Liuottavan aineen käytöstä on määrättävä ja sen käyttö on perusteltava tuloksia raportoitaessa.
Toisena vaihtoehtona on lisätä niukkaliukoinen testiaine koejärjestelmään siten, että testiaine liuotetaan orgaaniseen liuottimeen, ja määräosa tästä lisätään järjestelmään, jossa on maa-ainesta ja tislattuun tai deionisoituun veteen valmistettua 0,01 M CaCl2-liuosta. Orgaanisen liuottimen pitoisuus vesifaasissa on pidettävä mahdollisimman alhaisena, tavallisesti alle 0,1 prosentin. Testiaineen lisäys orgaanisessa liuoksessa voi vaikuttaa virheellisesti tilavuusmäärän toistettavuuteen. Näin ollen lisävirhe on mahdollinen, kun testiaineen ja lisäliuottimen konsentraatiot eivät ole samat kaikissa testeissä.
1.8 EDELLYTYKSET ADSORPTIO-DESORPTIOTESTIN SUORITTAMISELLE
1.8.1 Analyysimenetelmä
Tärkeimmät tekijät, jotka voivat vaikuttaa sorptiomittausten tarkkuuteen, ovat sekä liuos- että adsorptiofaasien analyyseissä käytettävän analyyttisen menetelmän tarkkuus, testiaineen stabiilius ja puhtaus, sorptiotasapainotilan saavuttamisaste, liuoskonsentraatiomuutoksen suuruus, maa-aines/liuos-suhde sekä muutokset maa-aineksen rakenteessa tasapainoprosessin aikana (35) (59-62). Lisäyksessä 2 esitetään joitakin esimerkkejä tarkkuutta koskevista kysymyksistä.
Käytetyn analyysimenetelmän luotettavuus on tarkistettava sillä konsentraatioalueella, joka todennäköisesti esiintyy testin aikana. Kokeen suorittaja voi vapaasti kehittää soveltuvan menetelmän, jonka tarkkuus, täsmällisyys, uusittavuus, herkkyys ja saanto ovat tarkoituksenmukaisia. Ohjeita tällaisen testin suorittamiseksi saadaan jäljempänä esitettävästä kokeesta.
Sopivaa määrää 0,01 M CaCl2-liuosta, esimerkiksi 100 cm3, ravistellaan 4 tunnin ajan yhdessä maa-ainesmäärän kanssa, esimerkiksi 20 g, jonka adsorptiokyky on hyvä, eli jonka orgaanisen hiilen pitoisuus ja savipitoisuus on korkea; nämä painot ja tilavuudet voivat vaihdella analyysitarpeiden mukaisesti. Sopivana lähtökohtana voidaan pitää maa-aines/liuos-suhdetta 1:5. Seos sentrifugoidaan ja vesifaasi voidaan suodattaa. Vesifaasiin lisätään tietty tilavuusmäärä testiaineen varastoliuosta, jotta saadaan nimellinen konsentraatio sille konsentraatioalueelle, joka todennäköisesti esiintyy testin aikana. Tämä tilavuusmäärä ei saa ylittää 10:tä prosenttia vesifaasin lopputilavuudesta — tällöin se muuttaa esitasapainotusliuoksen ominaisuuksia mahdollisimman vähän. Liuos analysoidaan.
Testaukseen on sisällytettävä yksi nollakoe, jossa on vain maa-aines ja CaCl2-liuos (ilman testiainetta), jotta voidaan tarkistaa, johtuuko analyysimenetelmästä artefaktoja ja maa-aineksesta matriisivaikutuksia.
Analyysimenetelmät, joita voidaan käyttää sorptiomittauksiin, käsittävät kaasu-nestekromatografian (GLC), korkean suorituskyvyn nestekromatografian (HPLC), spektrofotometrian (esimerkiksi GC-massaspektrometria, HPLC-massaspektrometria) ja nestetuikelaskennan (vain radioaktiivisesti merkityille aineille). Käytetystä analyysimenetelmästä riippumatta pidetään sopivana, että saannot ovat 90-110 prosenttia nimellisarvosta. Jotta kromatografisen erotuksen jälkeen voidaan tulos detektoida ja arvioida, analyyttisen menetelmän herkkyyden olisi oltava suuruusluokaltaan nimelliskonsentraatiota vähintään kaksi kertaluokkaa pienempi.
Adsorptiotutkimuksiin käytettävän analyysimenetelmän ominaisuudet ja herkkyys ovat tärkeitä tekijöitä määriteltäessä koeolosuhteita ja testin koko suorituskykyä. Tässä menetelmässä noudatetaan yleisiä koekäytäntöjä ja annetaan suosituksia ja ohjeita vaihtoehtoisille ratkaisuille, jos analyysimenetelmä tai laboratoriomahdollisuudet asettavat rajoituksia.
1.8.2 Optimaalisten maa-aines/liuos-suhteiden valinta
Sopivien maa-aines/liuos-suhteiden valinta sorptiotutkimuksiin riippuu jakautumiskertoimesta Kd ja halutusta suhteellisesta adsorboitumisasteesta. Aineen konsentraationmuutos liuoksessa taas vaikuttaa adsorptioyhtälöön perustuvan mittauksen tilastolliseen tarkkuuteen ja on osoitus analyyttisen menetelmän herkkyydestä. Siksi käytännössä on hyödyllistä valita muutama kiinteä suhde, joilla adsorboitumisprosentti on yli 20 prosenttia ja mieluiten > 50 prosenttia (62); samalla on huolehdittava siitä, että testiaineen konsentraatio vesifaasissa on riittävän korkea tarkan mittauksen mahdollistamiseksi. Tämä on erityisen tärkeää silloin, kun adsorboitumisprosentit ovat suuria.
Sopiva lähestymistapa soveltuvien maa-aines/vesi-suhteiden valitsemiseksi perustuu joko alustavissa tutkimuksissa tai hyväksytyin arviointitekniikoin (lisäys 3) arvioituun Kd-arvoon. Soveltuvan suhteen valinta voidaan tehdä sitten Kd:n funktiona esitetyn maa-aines/liuos-suhdediagrammin pohjalta määrätyille adsorboitumisprosenteille (kuva 1). Esityksessä oletetaan, että adsorptioyhtälö on lineaarinen (27). Sopiva suhde saadaan järjestämällä Kd:n yhtälö (4) yhtälön (1) muotoon:
|
|
(1) |
tai sen logaritmiseen muotoon olettaen että R = msoil/V0 ja Aeq %/100 =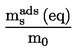
|
|
(2) |

Kuvassa 1 esitetään tarvittavat maa-aines/liuos-suhteet Kd:n funktiona eri adsorboitumisasteille. Esimerkiksi maa-aines/liuos-suhteen ollessa 1:5 ja Kd:n ollessa 20 adsorboituminen on 80 prosentin luokkaa. Jotta saavutettaisiin 50 prosentin adsorboituminen samalla Kd-arvolla, on käytettävä suhdetta 1:25. Tällainen lähestymistapa sopivan maa-aines/liuos-suhteiden valitsemisessa antaa tutkijalle joustavuutta.
Vaikeammin käsiteltäviä tapauksia ovat ne, joissa kemikaali on voimakkaasti tai hyvin heikosti adsorboitunut. Silloin kun adsorboituminen on heikkoa, suositellaan maa-aines/liuos-suhteeksi 1:1, vaikkakin eräille hyvin orgaanisille maalajeille saatetaan tarvita pienempiä suhteita lietteen saamiseksi. Pienten liuoskonsentraatiomuutosten mittaamiseksi käytettävien analyysimenetelmien kanssa on oltava huolellinen: muutoin adsorptiomittaukset ovat epätarkkoja. Toisaalta Kd-jakautumiskertoimien ollessa hyvin suuria saatetaan maa-aines/liuos-suhteissa mennä jopa suhteisiin 1:100, jotta liuokseen jäisi merkittävä määrä kemikaalia. Huolellisuutta on kuitenkin noudatettava hyvän sekoituksen varmistamiseksi ja systeemin tasapainottumiseen on jätettävä riittävästi aikaa. Vaihtoehtoisena lähestymistapana on ennustaa Kd-arvo arviointitekniikkoja käyttäen, esimerkiksi Pow-arvoihin (lisäys 3) perustuvaa tekniikkaa käyttäen. Tämä voi olla hyödyllistä erityisesti heikosti adsorboituville/polaarisille kemikaaleille, joiden Pow < 20, ja lipofiilisille tai helposti sorboituville kemikaaleille, joiden Pow > 104.
1.9 TESTIN SUORITTAMINEN
1.9.1 Koeolosuhteet
Kaikki kokeet suoritetaan huoneenlämpötilassa ja vakiolämpötilassa 20-25 oC, jos mahdollista.
Sentrifugoinnilla olisi voitava erottaa liuoksesta yli 0,2 μm:n kokoiset partikkelit. Tätä pidetään kiintoainepartikkelin ja kolloidipartikkelin raja-arvona. Ohjeita sentrifugointiolosuhteiden määrittelemiseksi annetaan lisäyksessä 4.
Jos sentrifugoinnilla ei voida poistaa yli 0,2 μm:n kokoisia partikkeleita, voidaan käyttää sentrifugoinnin ja yli 0,2 μm:n suodattimilla suoritettavan suodatuksen yhdistelmää. Näiden suodattimien on oltava sopivaa inerttiä materiaalia, jotta niiden pinnalle takertumisesta aiheutuvat testiaineen häviöt voitaisiin välttää. Joka tapauksessa on osoitettava, ettei suodatuksen aikana tapahdu testiainehäviöitä.
1.9.2 Taso 1 — Alustava tutkimus
Alustavan tutkimuksen tarkoitus on selvitetty jo kohdassa ”Soveltamisala”. Ohjeita kyseisen tutkimuksen toteuttamiseksi annetaan jäljempänä esitettävässä kokeessa.
1.9.2.1 Optimaalisten maa-aines/liuos-suhteiden valitseminen
Käytetään kahta maalajia ja kolmea maa-aines/liuos-suhdetta (kuusi koetta). Toisessa maalajissa orgaanisen hiilen pitoisuus on korkea ja savipitoisuus matala, ja toisessa maalajissa orgaanisen hiilen pitoisuus on matala ja savipitoisuus korkea. Suositellaan seuraavia suhteita:
|
— |
50 g maa-ainesta ja 50 cm3 testiaineen vesiliuosta (suhde 1/1), |
|
— |
10 g maa-ainesta ja 50 cm3 testiaineen vesiliuosta (suhde 1/5), |
|
— |
2 g maa-ainesta ja 50 cm3 testiaineen vesiliuosta (suhde 1/25). |
Vähimmäismäärä maa-ainesta, jolla koe voidaan suorittaa, riippuu laboratoriomahdollisuuksista ja käytettyjen analyysimenetelmien suorituskyvystä. Käytettäväksi suositellaan kuitenkin vähintään l:tä grammaa ja mieluiten 2:ta grammaa maa-ainesta luotettavien testitulosten saamiseksi.
Yhdelle vertailunäytteelle. jossa on ainoastaan testiainetta 0,01 M CaCl2-liuoksessa (ei maa-ainesta), suoritetaan täsmälleen samat toimenpiteet kuin testisysteemeille, jotta testiaineen stabiilius CaCl2-liuoksessa ja sen mahdollinen adsorboituminen koeastioiden pinnalle voidaan tarkistaa.
Nollakokeella, jossa on sama määrä maa-ainesta ja liuoksen kokonaistilavuus 50 cm30,01 M CaCl2-liuosta (ilman testiainetta), suoritetaan samat testaustoimenpiteet kutakin maa-ainesta kohden. Tämä toimii taustavertailuna analyysin aikana häiritsevien aineiden tai kontaminoituneiden maa-ainesten havaitsemiseksi.
Kaikki kokeet, vertailu- ja nollakokeet mukaan lukien, suoritetaan vähintään rinnakkaisnäytteillä. Tutkimusta varten valmistettavien näytteiden kokonaismäärä voidaan laskea käytettävän menetelmän mukaisesti.
Alustava tutkimus ja varsinainen tutkimus tehdään yleisesti ottaen samoilla menetelmillä. Poikkeuksista mainitaan tarvittaessa.
Ilmakuivatut maa-ainesnäytteet saatetaan tasapainoon ravistelemalla niitä vähintään 45 cm3:n kanssa 0,01 M CaCl2-liuosta yön yli (12 h) ennen koepäivää. Myöhemmin lisätään tietty tilavuusmäärä testiaineen varastoliuosta, jotta lopputilavuudeksi saadaan 50 cm3. Tämän lisättävän varastoliuoksen tilavuus ei saa ylittää 10:tä prosenttia vesifaasin lopputilavuudesta (50 cm3), jotta esitasapainotusliuoksen ominaisuudet muuttuisivat mahdollisimman vähän, ja sen olisi mieluiten oltava sellainen, että maa-aineksen kanssa kosketuksiin joutuvan testiaineen alkukonsentraatio C0 on suuruusluokaltaan vähintään satakertainen analyysimenetelmän herkkyyteen verrattuna; tällainen konsentraatio takaa tarkkojen mittausten suorittamisen myös silloin, kun adsorptio on voimakas (> 90 %) ja sen, että adsorptioisotermit voidaan myöhemmin määrittää. Suositellaan myös, jos mahdollista, ettei aineen alkukonsentraatio (C0) ylittäisi puolta siitä, mikä on sen liukoisuusraja.
Jäljempänä esitetään esimerkki siitä, kuinka varastoliuoksen konsentraatio (Cst) lasketaan. Oletetaan, että toteamisraja on 0,01 μg cm-3 ja adsorptio 90 prosenttia; tällöin maa-aineksen kanssa kosketuksiin joutuvan testiaineen alkukonsentraation olisi mieluiten oltava 1 μg cm-3 (suuruusluokaltaan satakertainen toteamisrajaan verrattuna). Oletetaan, että varastoliuosta lisätään suositeltu enimmäismäärä eli 5 cm3 45 cm3:iin 0,01 M CaCl2-tasapainoliuosta (= varastoliuos 10 % vesifaasin 50 cm3:n kokonaistilavuudesta), jolloin varastoliuoksen konsentraation on oltava 10 μg cm-3; tämä on suuruusluokaltaan tuhatkertainen analyysimenetelmän toteamisrajaan verrattuna.
Vesifaasin pH on mitattava ennen ja jälkeen maa-aineksen kanssa kosketuksiin joutumista, koska tällä on tärkeä merkitys koko adsorptioprosessissa, erityisesti ionisoituvien aineiden ollessa kyseessä.
Seosta ravistellaan, kunnes adsorptiotasapainotila on saavutettu. Aika tasapainotilan saavuttamiseksi maa-aineksissa vaihtelee suuresti kemikaalin ja maa-aineksen mukaisesti; 24 tunnin jakso on yleensä riittävä (77). Alustavassa tutkimuksessa näytteitä voidaan kerätä järjestyksessä 48 tunnin sekoitusjakson aikana (esimerkiksi 4, 8, 24, 48 tunnin kohdalla). Analyysiajat on kuitenkin sovitettava joustavasti laboratorion työaikataluluun.
Testiaineen vesiliuoksen analysoimiseksi on kaksi vaihtoehtoa: a) rinnakkaismenetelmä ja b) sarjamenetelmä. On korostettava sitä, että vaikka rinnakkaismenetelmä vie kokeellisesti enemmän aikaa, tulosten matemaattinen käsittely on yksinkertaisempaa (liite 5). Käytettävän menetelmän valitsee kuitenkin kokeen suorittaja, jonka on otettava huomioon käytettävissä olevat mahdollisuudet ja resurssit laboratoriossa.
|
a) |
Rinnakkaismenetelmä: valmistetaan samalla maa-aines/liuos-suhteella niin monta näytettä kuin adsorptiokinetiikan tutkimiseksi halutaan näytteenottohetkiä. Sentrifugoinnin ja mahdollisen suodatuksen jälkeen ensimmäisen koeputken vesifaasi otetaan talteen mahdollisimman tarkasti ja mitataan esimerkiksi 4 tunnin jälkeen, vastaavasti toiselle koeputkelle 8 tunnin, kolmannelle koeputkelle 24 tunnin jälkeen ja niin edelleen. |
|
b) |
Sarjamenetelmä: kullekin maa-aines/liuos-suhteelle valmistetaan ainoastaan yksi kaksoisnäyte. Tietyin aikavälein seos sentrifugoidaan faasien erottamiseksi. Vesifaasista otetaan pieni määräosa, josta testiaine analysoidaan välittömästi: koe jatkuu sitten alkuperäisellä seoksella. Jos käytetään suodatusta sentrifugoinnin jälkeen, laboratoriossa olisi oltava mahdollisuudet pienten vesipitoisten määräosien suodatuskäsittelyyn. Suositellaan, että otettujen määräosien kokonaismäärä ei ylitä yhtä prosenttia liuoksen kokonaistilavuudesta. Tämä siksi, ettei maa-aines/liuos-suhde muuttuisi merkittävästi ja ettei testin aikana adsorboituvissa olevan liukoisen massan määrä myöskään vähenisi. |
Adsorboitumisprosentti, lasketaan kullakin ajanhetkellä (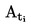 ) nimellisen alkukonsentraation pohjalta ja näytteenottohetkellä (
) nimellisen alkukonsentraation pohjalta ja näytteenottohetkellä ( ) mitattu konsentraatio korjataan nollakoearvon perusteella. Ajan funktiona esitettäviä käyriä (kuva 1, liite 5) käytetään tasapainotilan saavuttamisen arvioimiseksi (28). Lasketaan myös Kd-arvo tasapainotilassa. Tämän Kd-arvon pohjalta valitaan kuvasta 1 sopivat maa-aines/liuos-suhteet siten, että adsorboitumisprosentti on yli 20 prosenttia, mieluiten > 50 prosenttia (61). Kaikki diagrammeissa käytettävät yhtälöt ja periaatteet esitetään kohdassa ”Tulokset ja niiden raportointi” sekä lisäyksessä 5.
) mitattu konsentraatio korjataan nollakoearvon perusteella. Ajan funktiona esitettäviä käyriä (kuva 1, liite 5) käytetään tasapainotilan saavuttamisen arvioimiseksi (28). Lasketaan myös Kd-arvo tasapainotilassa. Tämän Kd-arvon pohjalta valitaan kuvasta 1 sopivat maa-aines/liuos-suhteet siten, että adsorboitumisprosentti on yli 20 prosenttia, mieluiten > 50 prosenttia (61). Kaikki diagrammeissa käytettävät yhtälöt ja periaatteet esitetään kohdassa ”Tulokset ja niiden raportointi” sekä lisäyksessä 5.
1.9.2.2 Adsorptiotasapainotilan saavuttamisajan määrittäminen ja adsorboituneen testiaineen määrittäminen tasapainotilassa
Kuten jo mainittiin, ajan funktiona esitettävien 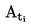 tai
tai  -käyrien avulla on mahdollista arvioida adsorptiotasapainotilan saavuttamista ja adsorboituneen testiaineen määrää tasapainotilassa. Lisäyksessä 5 esitetyissä kuvissa 1 ja 2 on esimerkkejä tällaisista käyristä. Tasapainottumisaika on se aika, jonka systeemi tarvitsee tasapainon saavuttamiseen.
-käyrien avulla on mahdollista arvioida adsorptiotasapainotilan saavuttamista ja adsorboituneen testiaineen määrää tasapainotilassa. Lisäyksessä 5 esitetyissä kuvissa 1 ja 2 on esimerkkejä tällaisista käyristä. Tasapainottumisaika on se aika, jonka systeemi tarvitsee tasapainon saavuttamiseen.
Jos jotain tiettyä maa-ainesta tutkittaessa tasapainotilaa ei saavuteta, vaan konsentraatio nousee jatkuvasti, tämä voi johtua sekoittavista tekijöistä kuten biohajoamisesta tai hitaasta diffuusiosta. Biohajoaminen voidaan osoittaa toistamalla koe steriloitua maa-ainesnäytettä käyttäen. Jos tasapainotilaa ei tällöinkään saavuteta, kokeen suorittajan on etsittävä muita ilmiöitä, jotka saattaisivat liittyä kyseisiin tutkimuksiin: tämä voidaan tehdä muuntelemalla koeolosuhteita sopivasti (lämpötila, ravisteluajat, maa-aines/liuos-suhteet). Kokeen suorittajan päätettävissä on, jatkaako hän testin suoritusta, vaikka tasapainotila saattaa jäädä saavuttamatta.
1.9.2.3 Adsorptio koeastian pintaan ja testiaineen stabiilius
Joitakin tietoja testiaineen adsorboitumisesta koeastioiden pintaan samoin kuin sen stabiiliudesta voidaan johtaa vertailunäytteiden analysoinnista. Jos havaitaan konsentraation pienenevän enemmän kuin analyysimenetelmän keskivirhe, kyseessä saattaa olla abioottinen hajoaminen ja/tai adsorptio koeastian pintaan. Nämä ilmiöt voidaan erottaa toisistaan siten, että astian seinämät huuhdellaan huolellisesti tunnetulla määrällä sopivaa liuotinta ja analysoidaan pesuliuos testiaineen osalta. Jos adsorptiota koeastioiden pintaan ei havaita, vähennys osoittaa testiaineen abioottista epästabiiliutta. Jos adsorboitumista havaitaan, koeastiamateriaali on vaihdettava. Tästä kokeesta saatuja tietoja koeastioiden pintaan tapahtuvasta adsorboitumisesta ei voida kuitenkaan ekstrapoloida suoraan maa-aines/liuos-kokeeseen. Maa-aineksen läsnäolo vaikuttaa tähän adsorboitumiseen.
Lisätietoja testiaineen stabiiliudesta voidaan johtaa määrittämällä kokonaismassatase kokeen aikana. Tämä tarkoittaa sitä, että testiaine määritetään vesifaasista, maa-ainesuutteista ja koeastian seinämistä. Lisätyn testikemikaalin massan ja vesifaasissa olevien testikemikaalimassojen ja maa-aineksesta sekä koeastiaseinämistä saatujen uutteiden summan välinen ero on yhtä kuin hajonnut ja/tai haihtunut ja/tai uuttumaton massa. Massataseen määrittämiseksi adsorptiotasapainotila on saavutettava koejakson aikana.
Massatase määritetään sekä maa-aineksesta että yhdestä sellaisesta maa-aines/liuos-suhteesta maa-ainesta kohden, josta vähenee yli 20 prosenttia ja mieluiten > 50 prosenttia tasapainotilassa. Kun suhteenmäärityskokeen lopussa on viimeinen näyte vesifaasista määritetty 48 tunnin jälkeen, faasit erotetaan sentrifugoimalla, ja mahdollisesti suodattamalla. Vesifaasi otetaan talteen mahdollisimman tarkasti, ja sopivaa uuttoliuotinta (uuttokerroin vähintään 95 %) lisätään maa-ainekseen testiaineen uuttamiseksi. Suositellaan vähintään kahta peräkkäistä uuttoa. Testiaine määritetään maa-aines- ja koeastiauutteista ja lasketaan massatase (yhtälö 10, ”Tiedot ja raportointi”). Jos se on alle 90 prosenttia, katsotaan, että testiaine on epästabiili testin aikana. Tutkimukset voivat kuitenkin yhä jatkua, kunhan testiaineen epästabiilius otetaan huomioon; tässä tapauksessa varsinaiseen tutkimukseen suositellaan molempien faasien analysointia.
1.9.2.4 Taso 2 — Adsorptiokinetiikka yhdellä testiainekonsentraatiolla
Käytetään viittä maa-ainesta, jotka valitaan taulukosta 1. Näihin viiteen maa-ainekseen olisi hyvä sisällyttää kaikki alustavassa tutkimuksessa käytetyt maa-ainekset tai joitakin niistä. Tällöin tasoa 2 ei tarvitse toistaa alustavassa tutkimuksessa käytetyille maa-aineksille.
Tasapainotilan saavuttamisaika, maa-aines/liuos-suhde, maa-ainesnäytteen paino, maa-aineksen kanssa kosketuksiin joutuvan vesifaasin tilavuus ja testiaineen konsentraatio liuoksessa valitaan alustavan tutkimuksen tulosten perusteella. Analyysi on suoritettava mieluiten noin 2, 4, 6, 8 (mahdollisesti myös 10) ja 24 tunnin kontaktiajan jälkeen; ravisteluaika voidaan ulottaa enintään 48 tuntiin silloin, kun kemikaali tarvitsee pidemmän ajan tasapainotilan saavuttamiseen suhteenmääritystulosten perusteella. Analyysiaikoihin voidaan kuitenkin suhtautua joustavasti.
Jokainen koe (yksi maa-aines ja yksi liuos) suoritetaan vähintään rinnakkaisnäytteillä tulosten varianssin arvioimiseksi. Jokaisessa kokeessa suoritetaan yksi nollakoe. Siinä käytetään maa-ainesta ja 0,01 M CaCl2-liuosta ilman testiainetta, ja painon ja tilavuuden on oltava samat kuin varsinaisessa kokeessa. Vertailunäytteelle, jossa on ainoastaan testiainetta 0,01 M CaCl2-liuoksessa (ilman maa-ainesta), suoritetaan sama testimenettely, jotta voitaisiin varautua yllättäviin tilanteisiin.
Adsorboitumisprosentti lasketaan kullakin ajanhetkellä, 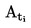 ja/tai aikavälillä
ja/tai aikavälillä 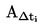 (tarpeen mukaan) ja esitetään ajan funktiona. Lasketaan myös jakautumiskerroin Kd tasapainotilassa samoin kuin orgaanisen hiilen suhteen normalisoitu adsorptiokerroin Koc. (ei-polaarisille orgaanisille kemikaaleille).
(tarpeen mukaan) ja esitetään ajan funktiona. Lasketaan myös jakautumiskerroin Kd tasapainotilassa samoin kuin orgaanisen hiilen suhteen normalisoitu adsorptiokerroin Koc. (ei-polaarisille orgaanisille kemikaaleille).
Adsorptiokinetiikkatestin tulokset
Lineaarinen Kd-arvo on yleensä tarkka kuvaamaan sorptiokäyttäytymistä maa-aineksessa (35) (78) ja se kuvaa kemikaalien luontaista kulkeutumista maaperässä. Esimerkiksi kemikaaleja, joiden Kd ≤ 1 cm3 g-1, pidetään yleensä helposti kulkeutuvina. MacCall et al. (16) ovat kehittäneet Koc-arvoihin perustuvan kulkeutuvuusluokituskaavion. Lisäksi käytetään Koc:n ja DT-506:n väliseen suhteeseen (29) (32) (79) perustuvia uuttumisluokituskaavioita.
Virheanalyysitutkimusten mukaan (61) alle 0,3 cm3 g-1 olevia Kd-arvoja ei myöskään voida arvioida tarkasti vesifaasikonsentraation pienenemisen pohjalta, ei edes silloin, kun käytetään soveltuvinta (tarkkuuden kannalta soveltuvinta) maa-aines/liuos-suhdetta, eli 1:1. Tällaisessa tapauksessa suositellaan molempien faasien, sekä maa-aineksen että liuoksen, analysointia.
Edellä esitettyjen huomautusten pohjalta suositellaan, että kemikaalin adsorptiokäyttäytymistä ja mahdollista kulkeutumista maaperässä koskevaa tutkimusta jatketaan määrittämällä Freundlichin adsorptioisotermit näille systeemeille. Kd:n tarkka määrittäminen kyseisille systeemeille on mahdollista tässä testimenetelmässä esitettävän koejärjestelyn avulla. Täsmällinen määritys on mahdollinen, jos Kd kerrottuna maa-aines/liuos-suhteella antaa tulokseksi arvon > 0.3 silloin, kun mittaukset perustuvat vesifaasikonsentraation pienenemiseen (epäsuora menetelmä), tai arvon > 0,1 silloin, kun molemmat faasit analysoidaan (suora menetelmä) (61).
1.9.2.5 Taso 3 — Adsorptioisotermit ja desorptiokinetiikka/desorptioisotermit
1.9.2.5.1
Käytetään viittä testiainekonsentraatiota, jotka kattavat mieluiten kaksi suuruusluokkaa; näitä konsentraatioita valittaessa on otettava huomioon vesiliukoisuus ja syntyvät tasapainokonsentraatiot vesiliuoksissa. Kullakin maa-aineksella on säilytettävä sama maa-aines/liuos-suhde läpi tutkimuksen. Adsorptiotesti suoritetaan edellä kuvatulla tavalla lukuun ottamatta sitä, että vesifaasi analysoidaan vain kerran ja sillä ajanhetkellä, joka tarvitaan tasapainotilan saavuttamiseen (ja joka määritettiin edellä 2-tason kokeessa). Liuoksen tasapainokonsentraatiot määritetään ja adsorboitunut määrä lasketaan testiaineen vähentymisestä liuoksesta tai suoraa menetelmää käyttäen. Adsorboitunut massa maa-aineksen massayksikköä kohden esitetään testiaineen tasapainokonsentraation funktiona (katso ”Tulokset ja niiden raportointi”).
Adsorptioisotermikokeen tulokset
Tähän mennessä esitetyistä matemaattisista adsorptiomalleista Freundlichin isotermi on se, jota useimmin käytetään adsorptioprosessien kuvaamiseen. Yksityiskohtaisempia tietoja adsorptiomallien tulkinnasta ja merkityksestä esitetään lähteissä (41) (45) (80) (81) (82).
Huomautus: Eri aineiden KF-arvojen (Freundlichin adsorptiokertoimien) vertailu on mahdollista ainoastaan silloin, kun nämä KF-arvot ilmaistaan samoina yksikköinä (83).
1.9.2.5.2
Tämän kokeen tarkoituksena on tutkia, adsorboituuko kemikaali maa-ainekseen reversiibelisti vai irreversiibelisti. Tämä tieto on tärkeä, koska desorptioprosessilla on tärkeä merkitys myös kemikaalin käyttäytymisessä maaperässä kenttäolosuhteissa. Desorptiotiedot ovat lisäksi käyttökelpoisia syöttötietoja uuttumista kuvaavassa tietokonemallintamisessa ja liuenneita aineita sisältävien valumien simuloinnissa. Jos halutaan tehdä desorptiotutkimus, suositellaan, että jäljempänä kuvattava tutkimus suoritetaan jokaiselle systeemille, jolle edellisessä adsorptiokinetiikkakokeessa on ollut mahdollista määrittää tarkka Kd-arvo.
Kuten adsorptiokinetiikkatutkimuksessakin, desorptiokinetiikkakokeessa on käytettävissä kaksi vaihtoehtoa: a) rinnakkaismenetelmä ja b) sarjamenetelmä. Käytettävän menetelmän valitsee kokeen suorittaja, jonka on otettava huomioon käytettävissä olevat mahdollisuudet ja resurssit laboratoriossa.
|
a) |
Rinnakkaismenetelmä: jokaiselle maa-ainekselle, joka valitaan desorptiotutkimukseen, valmistetaan näytteet samalla maa-aines/liuos-suhteella ja niin monta näytettä kuin desorptiokinetiikan tutkimiseksi halutaan näytteenottohetkiä. Mieluiten käytetään samoja aikavälejä kuin adsorptiokinetiikkakokeessa; kokonaisaikaa voidaan kuitenkin tarvittaessa pidentää systeemin desorptiotasapainotilan saavuttamiseksi. Jokaisessa kokeessa (yksi maa-aines, yksi liuos) suoritetaan yksi nollakoe. Siinä on maa-ainesta ja 0,01 M CaCl2-liuosta ilman testiainetta, ja painon ja tilavuuden on oltava samat kuin varsinaisessa kokeessa. Vertailunäytteenä suoritetaan testiaineelle 0,01 M CaCl2-liuoksessa (ilman maa-ainesta) sama testimenettely. Kaikkia maa-aines-liuos-seoksia ravistellaan, kunnes adsorptiotasapainotila on saavutettu (mikä määritettiin 2-tason kokeessa). Tämän jälkeen faasit erotetaan sentrifugoimalla ja vesifaasit poistetaan mahdollisimman tarkasti. Poistettu liuostilavuus korvataan samalla tilavuudella 0,01 M CaCl2-liuosta, joka ei sisällä testiainetta, ja uusia seoksia ravistellaan uudelleen. Ensimmäisen koeputken vesifaasi otetaan talteen mahdollisimman tarkasti ja mitataan esimerkiksi 2 tunnin jälkeen, toisen koeputken vesifaasi 4 tunnin, kolmannen koeputken 6 tunnin jälkeen ja niin edelleen, kunnes desorptiotasapainotila on saavutettu. |
|
b) |
Sarjamenetelmä: adsorptiokinetiikkakokeen jälkeen seos sentrifugoidaan ja vesifaasi poistetaan mahdollisimman tarkasti. Poistettu liuostilavuus korvataan yhtä suurella tilavuudella 0,01 M CaCl2-liuosta, joka ei sisällä testiainetta. Uutta seosta ravistellaan, kunnes desorptiotasapainotila on saavutettu. Tämän ajanjakson aikana seosta sentrifugoidaan tietyin aikavälein faasien erottamiseksi. Testiaine määritetään pienestä määräosasta vesifaasia välittömästi; tämän jälkeen koe jatkuu alkuperäisellä seoksella. Kunkin yksittäisen määräosan tilavuuden on oltava alle yhden prosentin kokonaistilavuudesta. Seokseen lisätään sama määrä tuoretta 0,01 M CaCl2-liuosta maa-aines/liuos-suhteen säilyttämiseksi, ja ravistelu jatkuu seuraavan aikavälin ajan. |
Desorboitumisprosentti lasketaan kullakin ajanhetkellä  ja/tai aikavälillä
ja/tai aikavälillä  (tutkimuksen tarpeiden mukaisesti) ja se esitetään ajan funktiona. Lasketaan myös tasapainotilan desorptiokerroin Kdes. Kaikki käytettävät yhtälöt esitetään kohdassa ”Tulokset ja niiden raportointi” sekä lisäyksessä 5.
(tutkimuksen tarpeiden mukaisesti) ja se esitetään ajan funktiona. Lasketaan myös tasapainotilan desorptiokerroin Kdes. Kaikki käytettävät yhtälöt esitetään kohdassa ”Tulokset ja niiden raportointi” sekä lisäyksessä 5.
Desorptiokinetiikkakokeen tulokset
Yleisten ajan funktiona esitettävien desorboitumisprosentti-  ja adsorboitumisprosentti-
ja adsorboitumisprosentti- 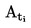 diagrammien avulla on mahdollista arvioida adsorptioprosessin reversiibeliyttä. Vaikka desorptiotasapainotilan saavuttamiseen menisikin jopa kaksinkertainen aika adsorptiotasapainotilan saavuttamiseen verrattuna ja kokonaisdesorptio olisi yli 75 prosenttia adsorboituneesta maarasta, adsorptiota pidetään reversiibelinä.
diagrammien avulla on mahdollista arvioida adsorptioprosessin reversiibeliyttä. Vaikka desorptiotasapainotilan saavuttamiseen menisikin jopa kaksinkertainen aika adsorptiotasapainotilan saavuttamiseen verrattuna ja kokonaisdesorptio olisi yli 75 prosenttia adsorboituneesta maarasta, adsorptiota pidetään reversiibelinä.
1.9.2.5.3
Freundlichin desorptioisotermit määritetään maa-aineksista, joita on käytetty adsorptioisotermikokeessa. Desorptiotesti suoritetaan kohdassa ”Desorptiokinetiikka” kuvatulla tavalla lukuun ottamatta sitä, että vesifaasi analysoidaan vain kerran, desorptiotasapainotilassa. Lasketaan desorboituneen testiaineen määrä. Maa-ainekseen desorptiotasapainotilassa adsorboituneeksi jääneen testiaineen pitoisuus esitetään liuoksessa olevan testiaineen tasapainokonsentraation funktiona (katso ”Tulokset ja niiden raportointi” sekä lisäys 5).
2. TULOKSET JA NIIDEN RAPORTOINTI
Analyysitiedot esitetään taulukkomuodossa (katso lisäys 6). Niissä esitetään yksittäiset mittaukset ja lasketut keskiarvot sekä adsorptioisotermien graafiset kuvaajat. Laskutoimitukset tehdään jäljempänä kuvatulla tavalla.
Testin tarkoituksia varten sovitaan, että 1 cm3 vesiliuosta painaa 1 g. Näin maa-aines/liuos-suhde voidaan ilmaista yksikköinä w/w tai w/vol samalla numerolla.
2.1 ADSORPTIO
Adsorptio ( ) määritellään maa-ainekseen adsorboituneen aineen prosenttiosuutena testin alussa lisätystä aineen määrästä. Jos testiaine on stabiili eikä adsorboidu merkittävästi astiaseinämiin,
) määritellään maa-ainekseen adsorboituneen aineen prosenttiosuutena testin alussa lisätystä aineen määrästä. Jos testiaine on stabiili eikä adsorboidu merkittävästi astiaseinämiin,  lasketaan kullakin ajanhetkellä ti seuraavan yhtälön mukaisesti:
lasketaan kullakin ajanhetkellä ti seuraavan yhtälön mukaisesti:
|
|
(3) |
jossa:
|
|
= |
adsorboitumisprosentti ajanhetkellä ti ( %) |
|
|
= |
maa-ainekseen adsorboituneen testiaineen massa (μg) ajanhetkellä ti |
|
mo |
= |
testiaineen massa koeputkessa testin alussa (μg). |
Yksityiskohtaiset tiedot siitä, kuinka adsorboitumisprosentti  lasketaan rinnakkais- ja sarjamenetelmälle, annetaan liitteessä 5.
lasketaan rinnakkais- ja sarjamenetelmälle, annetaan liitteessä 5.
Jakautumiskerroin Kd on maa-ainesfaasissa olevan aineen pitoisuuden ja vesiliuoksessa olevan aineen massakonsentraation välinen suhde koeolosuhteissa adsorptiotasapainotilassa.
|
|
(4) |
jossa:
|
|
= |
maa-ainekseen adsorboituneen aineen pitoisuus adsorptiotasapainotilassa (μg g-1) |
|
|
= |
vesifaasissa olevan aineen massakonsentraatio adsorptiotasapainotilassa (μg cm-3). Tämä konsentraatio määritetään analyyttisesti nollakokeiden antamat arvot huomioon ottaen |
|
|
= |
maa-ainekseen adsorboituneen aineen massa adsorptiotasapainotilassa (μg) |
|
|
= |
liuoksessa olevan aineen massa adsorptiotasapainotilassa (μg) |
|
msoil |
= |
maa-ainesfaasin määrä, maa-aineksen kuiva-aineena ilmaistuna (g) |
|
Vo |
= |
maa-aineksen kanssa kosketuksiin joutuvan vesifaasin alkutilavuus (cm3). |
Aeq:n ja Kd :n välinen suhde saadaan yhtälöstä
|
|
(5) |
jossa:
|
Aeq |
= |
adsorboitumisprosentti adsorptiotasapainotilassa, %. |
Orgaanisen hiilen suhteen normalisoitu adsorptiokerroin Koc liittää jakautumiskertoimen Kd maa-ainesnäytteen orgaanisen hiilen pitoisuuteen:
|
|
(6) |
jossa:
|
% oc |
= |
maa-ainesnäytteessä olevan orgaanisen hiilen prosenttiosuus (g g-1). |
Koc-kerroin edustaa yksittäistä arvoa, joka kuvaa pääasiassa ei-polaaristen orgaanisten kemikaalien jakautumista maa-aineksessa tai sedimentissä olevaan orgaaniseen hiileen ja veteen. Näiden kemikaalien adsorboituminen korreloi sorboivan kiintoaineen orgaanisten ainesten pitoisuuden kanssa (7); näin ollen Koc-arvot riippuvat humusjakeiden erityisominaisuuksista, joiden sorptiokyvyt vaihtelevat huomattavasti — tämä johtuu eroista alkuperässä, syntytavassa ja niin edelleen.
2.1.1 Adsorptioisotermit
Freundlichin adsorptioisotermien yhtälö liittää adsorboituneen testiaineen määrän tasapainotilassa liuoksessa olevan testiaineen konsentraatioon (yhtälö 8).
Mittaustuloksia käsitellään kuten kohdassa ”Adsorptio”. Kullekin koeputkelle lasketaan adsorptiotestin jälkeen maa-ainekseen adsorboituneen testiaineen pitoisuus (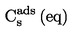 , ilmaistu muualla muodossa x/m). Oletetaan, että tasapainotila on saavutettu ja että
, ilmaistu muualla muodossa x/m). Oletetaan, että tasapainotila on saavutettu ja että  kuvaa tasapainoarvoa:
kuvaa tasapainoarvoa:
|
|
(7) |
Yhtälö (8) on Freundlichin adsorptioyhtälö:
|
|
(8) |
tai lineaarisessa muodossa:
|
|
(9) |
jossa:
|
|
= |
Freundlichin adsorptiokerroin; sen yksikkö on cm3 g-1 ainoastaan silloin, kun l/n = 1; kaikissa muissa tapauksissa kulmakerroin 1/n esiintyy |
|
n |
= |
regressiovakio: l/n vaihtelee yleensä välillä 0,7-1,0, mikä osoittaa, että sorptiotiedot ovat usein hieman epälineaarisia. |
Piirretään yhtälöt (8) ja (9) ja lasketaan 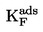 ja l/n -arvot regressioanalyysillä yhtälöä 9 käyttäen. Lasketaan myös logaritmiyhtälön korrelaatiokerroin r2. Esimerkit tällaisista käyristä esitetään kuvassa 2.
ja l/n -arvot regressioanalyysillä yhtälöä 9 käyttäen. Lasketaan myös logaritmiyhtälön korrelaatiokerroin r2. Esimerkit tällaisista käyristä esitetään kuvassa 2.

2.1.2 Massatase
Massatase (MB) on se aineen prosenttiosuus testin alussa lisätystä aineen nimellismäärästä, joka voidaan ottaa analyyttisesti talteen adsorptiotestin jälkeen.
Tulokset käsitellään eri tavalla, kun liuotin sekoittuu täysin veteen. Veteen sekoittuvan liuottimen tapauksessa tulokset voidaan käsitellä kuten kohdassa ”Desorptio” liuotinuuton avulla talteen saadun aineen määrän määrittämiseksi. Jos liuotin sekoittuu veteen niukasti, on talteenotettu määrä mitattava.
Massatase MB adsorptiolle lasketaan seuraavasti: oletetaan, että tekijä (mE) vastaa maa-aineksesta ja koeastiaseinämistä orgaanisella liuottimella uutettujen testikemikaalimassojen summaa:
|
|
(10) |
jossa:
|
MB |
= |
massatase ( %) |
|
mE |
= |
kahdessa vaiheessa maa-aineksesta ja koeastiaseinämistä uutetun testiaineen kokonaismassa (μg) |
|
Co |
= |
maa-aineksen kanssa kosketuksiin joutuvan testiliuoksen massakonsentraatio alussa (μg cm-3) |
|
Vrec |
= |
adsorptiotasapainotilan saavuttamisen jälkeen talteen otetun supernatantin tilavuus (cm-3) |
2.2 DESORPTIO
Desorptio (D) määritellään desorboituneen testiaineen prosenttiosuutena aiemmin adsorboituneen aineen määrästä koeolosuhteissa:
|
|
(11) |
jossa:
|
|
= |
desorboitumisprosentti ajanhetkellä t1 ( %) |
|
|
= |
maa-aineksesta desorboituneen testiaineen massa ti (μg) ajanhetkellä ti |
|
|
= |
maa-ainekseen adsorboituneen testiaineen massa adsorptiotasapainotilassa (μg). |
Yksityiskohtaiset tiedot siitä, kuinka lasketaan desorboitumisprosentti  rinnakkais- ja sarjamenetelmälle, annetaan lisäyksessä 5.
rinnakkais- ja sarjamenetelmälle, annetaan lisäyksessä 5.
Näennäinen desorptiokerroin (Kdes) on koeolosuhteissa maa-ainesfaasiin jääneen aineen pitoisuuden suhde desorboituneen aineen massakonsentraatioon vesiliuoksessa silloin, kun desorptiotasapainotila on saavutettu:
|
|
(12) |
jossa:
|
Kdes |
= |
desorptiokerroin (cm3 g-1) |
|
|
= |
maa-aineksesta desorboituneen testiaineen kokonaismassa desorptiotasapainotilassa (μg) |
|
VT |
= |
maa-aineksen kanssa desorptiokinetiikkatestin aikana kosketuksiin joutuvan vesifaasin kokonaistilavuus (cm3). |
Ohjeet  :n laskemiseksi annetaan lisäyksessä 5 kohdassa ”Desorptio”.
:n laskemiseksi annetaan lisäyksessä 5 kohdassa ”Desorptio”.
Huomautus:
Jos edeltävä adsorptiotesti suoritettiin rinnakkaismenetelmää käyttäen, niin yhtälössä (12) esiintyvä tilavuus VT oletetaan yhtä suureksi kuin Vo.
2.2.1 Desorptioisotermit
Freundlichin desorptioisotermien yhtälö yhdistää maa-ainekseen adsorboituneeksi jääneen testiaineen pitoisuuden liuoksessa olevan testiaineen konsentraatioon desorptiotasapainotilassa (yhtälö 16).
Kullekin koeputkelle lasketaan maa-ainekseen adsorboituneeksi jääneen aineen pitoisuus desorptiotasapainotilassa seuraavasti:
|
|
(13) |
 määritellään seuraavasti:
määritellään seuraavasti:
|
|
(14) |
jossa:
|
|
= |
maa-ainekseen adsorboituneeksi jääneen testiaineen pitoisuus desorptiotasapainotilassa (μg g-1) |
|
|
= |
vesifaasista desorptiotasapainotilassa analyyttisesti määritetyn aineen massa (μg) |
|
|
= |
epätäydellisestä tilavuustäydennyksestä johtuen adsorptiotasapainotilan ulkopuolelle jääneen testiaineen massa (μg) |
|
|
= |
liuoksessa olevan aineen massa adsorptiotasapainotilassa (μg) |
|
|
(15) |
|
|
= |
koeputkesta testiaineen mittaamiseksi otetun liuoksen tilavuus, desorptiotasapainotilassa (cm3) |
|
VR |
= |
koeputkesta adsorptiotasapainotilan saavuttamisen jälkeen poistetun supernatantin tilavuus, joka korvataan samalla tilavuudella 0,01 M CaCl2-liuosta (cm3). |
Yhtälö (16) on Freundlichin desorptioyhtälö:
|
|
(16) |
tai lineaarisessa muodossa:
|
|
(17) |
jossa:
|
|
= |
Freundlichin desorptiokerroin |
|
n |
= |
regressiovakio |
|
|
= |
vesifaasissa olevan aineen massakonsentraatio desorptiotasapainotilassa (μg cm-3). |
Yhtälöt (16) ja (17) voidaan piirtää ja  ja l/n -arvot lasketaan regressioanalyysin avulla yhtälöä 17 käyttäen.
ja l/n -arvot lasketaan regressioanalyysin avulla yhtälöä 17 käyttäen.
Huomautus:
Jos Freundlichin adsorptio- tai desorptioeksponentti l/n on yhtä kuin 1, Freundlichin adsorption tai desorption sitoutumisvakio ( ja
ja  ) on yhtä suuri kuin adsorptio- tai desorptiotasapainovakiot (vastaavasti Kd ja Kdes), jolloin CS vs Caq -käyrät ovat lineaariset. Jos eksponentit ovat erisuuria kuin 1, Cs vs Caq -käyrät eivät ole lineaarisia ja adsorptio- ja desorptiovakiot vaihtelevat isotermien eri kohdissa.
) on yhtä suuri kuin adsorptio- tai desorptiotasapainovakiot (vastaavasti Kd ja Kdes), jolloin CS vs Caq -käyrät ovat lineaariset. Jos eksponentit ovat erisuuria kuin 1, Cs vs Caq -käyrät eivät ole lineaarisia ja adsorptio- ja desorptiovakiot vaihtelevat isotermien eri kohdissa.
2.2.2 Testiraportti
Testiraportissa on esitettävä seuraavat tiedot:
|
— |
Käytettyjen maa-ainesnäytteiden täydelliset tunnistetiedot, johon sisältyy: |
|
— |
maantieteellinen sijainti (leveysasteet, pituusasteet), |
|
— |
näytteenottopäivämäärä, |
|
— |
käyttömuoto (esimerkiksi maatalousmaa, metsä), |
|
— |
näytteenottosyvyys, |
|
— |
hiekka-, liete- ja savipitoisuus, |
|
— |
pH-arvot (0,01 M CaCl2:ssa), |
|
— |
orgaanisen hiilen pitoisuus, |
|
— |
orgaanisen aineksen pitoisuus, |
|
— |
typpipitoisuus, |
|
— |
C/N-suhde, |
|
— |
kationinvaihtokyky (mmol/kg), |
|
— |
kaikki maa-ainesnäytteiden keräämiseen ja säilyttämiseen liittyvät tiedot, |
|
— |
soveltuvin osin kaikki testiaineen adsorptio-desorptiotulkinnan kannalta merkitykselliset tiedot, |
|
— |
kunkin muuttujan määrittämiseksi käytettyjen menetelmien kirjallisuusviitteet, |
|
— |
testiainetta koskevat tiedot soveltuvin osin, |
|
— |
koelämpötilat, |
|
— |
sentrifugointiolosuhteet, |
|
— |
analyysimenetelmä testiaineen analysoimiseksi, |
|
— |
perustelut kaikelle liuottavien aineiden käytölle testiaineen varastoliuosten valmistuksessa, |
|
— |
selvitykset laskelmissa tehdyistä korjauksista, |
|
— |
tiedot taulukkomuodossa (liite 6) ja graafiset esitykset, |
|
— |
kaikki tiedot ja havainnot, jotka helpottavat testitulosten tulkintaa. |
3. LÄHDELUETTELO
|
(1) |
Kukowski H. and Brümmer G, (1987). Investigations on the Adsorption and Desorption of Selected Chemicals in Soils. UBA Report 106 02 045, Part II. |
|
(2) |
Fränzle O., Kuhnt G. and Vetter L., (1987). Selection of Representative Soils in the EC-Territory. UBA Report 106 02 045, Part I. |
|
(3) |
Kuhnt G. and Muntau H. (Eds.) EURO-Soils: Identification, Collection, Treatment, Characterisation. Special Publication No 1.94.60, Joint Research Centre. European Commission, ISPRA, December 1994. |
|
(4) |
OECD Test Guidelines Programme, Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995 (June 1995). |
|
(5) |
US Environment Protection Agency: Pesticide Assessment Guidelines, Subdivision N, Chemistry: Environmental Fate, Scries 163-1, Leaching and Adsorption/Desorption Studies, Addendum 6 on Data Reporting, 540/09-88-096, Date: 1/1988. |
|
(6) |
US Environment Protection Agency: Prevention, Pesticides and Toxic Substances, OPPTS Harmonized Test Guidelines, Series 835-Fate, Transport and Transformation Test Guidelines, OPPTS No: 835.1220 Sediment and Soil Adsorption/Desorption Isotherm. EPA No: 712-C-96-048, April 1996. |
|
(7) |
ASTM Standards, E 1195-85, Standard Test Method for Determining a Sorption Constant (Koc) for an Organic Chemical in Soil and Sediments. |
|
(8) |
Agriculture Canada: Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada, 15 July 1987. |
|
(9) |
Netherlands Commission Registration Pesticides (1995): Application for registration of a pesticide. Section G. Behaviour of the product and its metabolites in soil, water and air. |
|
(10) |
Danish National Agency of Environmental Protection (October 1988): Criteria for registration of pesticides as especially dangerous to health or especially harmful to the environment. |
|
(11) |
BBA (1990), Guidelines for the Official Testing of Plant Protection Products, Biological Research Centre for Agriculture and Forestry, Braunschweig, Germany. |
|
(12) |
Calvet R., (1989), ’Evaluation of adsorption coefficients and the prediction of the mobilities of pesticides in soils’, in Methodological Aspects of the Study of Pesticide Behaviour in Soil (ed. P. Jamet), INRA, Paris, (Review). |
|
(13) |
Calvet R., (1980), ’Adsorption-Desorption Phenomena’ in Interactions between herbicides and the soil. (R. J. Hance ed.), Academic Press, London, pp. 83-122. |
|
(14) |
Hasset J. J., and Banwart W.L., (1989), ’The sorption of nonpolar organics by soils and sediments’ in Reactions and Movement of Organic Chemicals in Soils. Soil Science Society of America (S.S.S.A), Special Publication no. 22, pp. 31-44. |
|
(15) |
van Genuchten M. Th., Davidson J. M., and Wierenga P. J., (1974), ’An evaluation of kinetic and equilibrium equations for the prediction of pesticide movement through porous media’. Soil Sci. Soc. Am. Proc., Vol. 38(1), pp. 29-35. |
|
(16) |
McCall P. J., Laskowski D. A., Swann R. L., and Dishburger H. J., (1981), ’Measurement of sorption coefficients of organic chemicals and their use, in environmental fate analysis’, in Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington DC. |
|
(17) |
Lambert S. M., Porter P. E., and Schieferrstein R. H., (1965), ’Movement and sorption of chemicals applied to the soil’. Weeds, 13, pp. 185-190. |
|
(18) |
Rhodes R. C., Belasco I. J., and Pease H. L., (1970) ’Determination of mobility and adsorption of agrochemicals in soils’. J.Agric.Food Chem., 18, pp. 524-528. |
|
(19) |
Russell M. H., (1995), ’Recommended approaches to assess pesticide mobility in soil’ in Environmental Behavior of Agrochemicals (ed. T. R. Roberts and P. C. Kearney). John Wiley & Sons Ltd. |
|
(20) |
Esser H. O., Hemingway R. J., Klein W., Sharp D. B., Vonk J. W. and Holland P. T., (1988), ’Recommended approach to the evaluation of the environmental behavior of pesticides’, IUPAC Reports on Pesticides (24). Pure Appl. Chem., 60, pp. 901-932. |
|
(21) |
Guth J. A., Burkhard N., and D. O. Eberle, (1976), ’Experimental models for studying the persistence of pesticides in soils’. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, pp. 137-157, BCPC, Surrey, UK. |
|
(22) |
Furminge C. G. L, and Osgerby J. M., (1967), ’Persistence of herbicides in soil’. J. Sci. Fd Agric., 18, pp. 269-273. |
|
(23) |
Burkhard N., and Guth J. A., (1981), ’Chemical hydrolysis of 2-Chloro-4,6-bis(alkylamino)-1,3,5-triazine herbicides and their breakdown in soil under the influence of adsorption’. Pestic. Sci. 12, pp. 45-52. |
|
(24) |
Guth J. A., Gerber H. R., and Schlaepfer T., (1977). ’Effect of adsorption, movement and persistence on the biological availability of soil-applied pesticides’. Proc. Br. Crop Prot. Conf., 3, pp. 961-971. |
|
(25) |
Osgerby J. M., (1973), ’Process affecting herbicide action in soil’. Pestic. Sci., 4, pp. 247-258. |
|
(26) |
Guth J. A., (1972), ’Adsorptions- und Einwascheverhalten von Pflanzenschutzmitteln in Böden’. Schr. Reihe Ver. Wass. -Boden-Lufthyg. Berlin-Dahlem, Heft 37, pp. 143-154. |
|
(27) |
Hamaker J. W., (1975), ’The interpretation of soil leaching experiments’, in Environmental Dynamics of Pesticides (eds R. Haque and V.H. freed), pp. 135-172. Plenum Press. NY. |
|
(28) |
Helling C. S., (1971). ’Pesticide mobility in soils’. Soil Sci. Soc. Amer. Proc, 35, pp. 732-210. |
|
(29) |
Hamaker J. W., (1972), ’Diffusion and volatilization’ in Organic chemicals in the soil environment (C.A.I. Goring and J. W. Hamaker eds). Vol. 1, pp. 49-143. |
|
(30) |
Burkhard N. and Guth J. A., (1981), ’Rate of volatilisation of pesticides from soil surfaces; Comparison of calculated results with those determined in a laboratory model system’. Pestic. Sci. 12, pp. 37-44. |
|
(31) |
Cohen S. Z., Creeger S. M., Carsel R.F., and Enfield C.G., (1984), ’Potential pesticide contamination of groundwater from agricultural uses’, in Treatment and Disposal of Pesticide Wastes, pp. 297-325, Acs Symp. Ser. 2 59, American Chemical Society, Washington, DC. |
|
(32) |
Gustafson D. I., (1989), ’Groundwater ubiquity score: a simple method for assessing pesticide leachability’. J. Environ. Toxic. Chem., 8(4), pp. 339-357. |
|
(33) |
Leistra M., and Dekkers W. A., (1976). ’Computed effects of adsorption kinetics on pesticide movement in soils’. J. of Soil Sci., 28, pp. 340-350. |
|
(34) |
Bromilov R. H., and Leistra M., (1980), ’Measured and simulated behavior of aldicarb and its oxydation products in fallow soils’. Pest. Sci., 11, pp. 389-395. |
|
(35) |
Green R. E., and Karickoff S. W., (1990), ’Sorption estimates for modeling’, in Pesticides in the Soil Environment: Process, Impacts and Modeling (ed. H.H. Cheng). Soil Sci. Soc. Am., Book Series no. 2, pp. 80-101, |
|
(36) |
Lambert S. M., (1967), ’Functional relationship between sorption in soil and chemical structure’. J. Agri. Food Chem., 15, pp. 572-576. |
|
(37) |
Hance R. J., (1969), ’An empirical relationship between chemical structure and the sorption of some herbicides by soils’. J. Agri. Food Chem., 17, pp. 667-668. |
|
(38) |
Briggs G. G., (1969), ’Molecular structure of herbicides and their sorption by soils’. Nature, 223, 1288. |
|
(39) |
Briggs G. G., (1981). ’Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor’. J. Agric. Food Chem., 29, pp. 1050-1059. |
|
(40) |
Sabljic A., (1984), ’Predictions of the nature and strength of soil sorption of organic polutance by molecular topology’. J. Agric. Food Chem., 32, pp. 243-246. |
|
(41) |
Bailey G. W., and White J. L., (1970), ’Factors influencing the adsorption, desorption, and movement of pesticides in soil’. Residue Rev., 32, pp. 29-92. |
|
(42) |
Bailey G. W., J. L. White and Y. Rothberg, (1968). ’Adsorption of organic herbicides by montomorillonite: Role of pH and chemical character of adsorbate’. Soil Sci. Soc. Amer. Proc. 32: pp. 222-234. |
|
(43) |
Karickhoff S. W., (1981), ’Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils’. Chemosphere 10, pp. 833-846. |
|
(44) |
Paya-Perez A., Riaz M. and Larsen B., (1989), ’Soil Sorption of 6 Chlorobenzenes and 20 PCB Congeners’. Environ. Toxicol. Safety 21, pp. 1-17. |
|
(45) |
Hamaker J. W., and Thompson J. M., (1972), ’Adsorption in organic chemicals’ in Organic Chemicals in the Soil Environment (Goring C.A.I. and Hamaker J.W., eds), Vol I and II, Marcel Dekker, Inc., New York, NY, 1972, pp. 49-143. |
|
(46) |
Deli J., and Warren G. F., 1971, ’Adsorption, desorption and leaching of diphenamid in soils’. Weed Sci. 19: pp. 6 7-69. |
|
(47) |
Chu-Huang Wu, Buehring N., Davinson J. M. and Santelmann, (1975). ’Napropamide Adsorption, desorption and Movement in soils’. Weed Science, Vol. 23, pp. 454-457. |
|
(48) |
Haues M. H. B., Stacey M., and Thompson J. M., (1968), ’Adsorption of s-triazine herbicides by soil organic preparations’ in Isotopes and Radiation in Soil Organic Studies, p. 75, International. Atomic Energy Agency, Vienna. |
|
(49) |
Pionke H. B., and Deangelis R. J., (1980). ’Methods for distributing pesticide loss in field run-off between the solution and adsorbed phase’, CREAMS, in A Field Scale Model for Chemicals, Run-off and Erosion from Agricultural Management Systems, Chapter 19, Vol. III: Supporting Documentation, USDA Conservation Research report. |
|
(50) |
ISO Standard Compendium Environment: Soil Quality — General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition (1994). |
|
(51) |
Scheffer F., and Schachtschabel, Lehrbuch der Bodenkunde, F. Enke Verlag, Stuttgart (1982), 11th edition. |
|
(52) |
Black, Evans D. D., White J. L., Ensminger L. E., and Clark F. E., eds. ’Methods of Soil Analysis’, Vol 1 and 2, American Society of Agronomy, Madison, WI, 1982. |
|
(53) |
ISO/D1S 10381-1 Soil Quality — Sampling — Part 1: Guidance on the design of sampling programmes. |
|
(54) |
1SO/D1S 10381-2 Soil Quality — Sampling — Part 2: Guidance on sampling techniques. |
|
(55) |
ISO/DIS 10381-3 Soil Quality — Sampling — Part 3: Guidance on safety of sampling. |
|
(56) |
ISO/DIS 10381-4 Soil Quality — Sampling — Part 4: Guidance on the investigation of natural and cultivated soils. |
|
(57) |
ISO/DIS 10381-5 Soil Quality — Sampling — Part 5: Guidance on the investigation of soil contamination of urban and industrial sites. |
|
(58) |
ISO 10381-6, 1993: Soil Quality — Sampling — Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(59) |
Green R. E., and Yamane V. K., (1970), ’Precision in pesticide adsorption measurements’. Soil Sci. Am. Proc., 34, pp. 353-354. |
|
(60) |
Grover R., and Hance R. J., (1970), ’Effect of ratio of soil to water on adsorption of linuron and atrazine’. Soil Sci., pp. 109-138. |
|
(61) |
Boesten, J. J. T. I, ’Influence of soil/liquid ratio on the experimental error of sorption coefficients in pesticide/soil system’. Pest. Sci. 1990, 30, pp. 31-41. |
|
(62) |
Boesten, J. J. T. I. ’Influence of soil/liquid ratio on the experimental error of sorption coefficients in relation to OECD guideline 106’. Proceedings of 5th international workshop on environmental behaviour of pesticides and regulatory aspects, Brussels, 26-29 April 1994. |
|
(63) |
Bastide J., Cantier J. M., et Coste C., (1980), ’Comportement de substances herbicides dans le sol en fonction de leur structure chimique’. Weed Res. 21, pp. 227-231. |
|
(64) |
Brown D. S., and Flagg E. W., (1981), ’Empirical prediction of organic pollutants sorption in natural sediments’. J. Environ.Qual., 10(3), pp. 382-386. |
|
(65) |
Chiou C. T., Porter P. E., and Schmedding D. W., (1983), ’Partition equilibria of non-ionic organic compounds between soil organic matter and water’. Environ. Sci. Technol., 17(4), pp. 227-231. |
|
(66) |
Gerstl Z., and Mingelgrin U., (1984), ’Sorption of organic substances by soils and sediments’. J. Environm. Sci. Health, B19 (3), pp. 297-312. |
|
(67) |
Vowles P. D., and Mantoura R. E. C., (1987), ’Sediment-water partition coefficient and HPLC retention factors of aromatic hydrocarbons’. Chemosphere, 16(1), pp. 109-116. |
|
(68) |
Lyman W. J., Reehl W. F., and Rosenblatt D. H., (1990). Handbook of Chemical Property Estimation Methods. Environmental Behaviour of Organic Compounds. American Chemical Society, Washington DC. |
|
(69) |
Keniga E. E., and Goring, C. A. I., (1980). ’Relationship between water solubility, soil sorption, octanol-water partitioning and concentration of chemicals in the biota’ in Aquatic Toxicology (eds J.G. Eaton, et al.), pp. 78-115, ASTM STP 707, Philadelphia. |
|
(70) |
Chiou C. T., Peters L. J., and Freed V. H., (1979), ’A physical concept of soil-water equilibria for non-ionic organic compounds’. Science, Vol. 206, pp. 831-832. |
|
(71) |
Hassett J. J., Banwart W. I., Wood S. G., and Means J. C., (1981), ’Sorption of/-Naphtol: implications concerning the limits of hydrophobic sorption’. Soil Sci. Soc. Am. J. 45, pp. 38-42. |
|
(72) |
Karickhoff S. W., (1981), ’Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils’. Chemosphere Vol. 10(8), pp. 833-846. |
|
(73) |
Moreale A., van Bladel R., (1981), ’Adsorption de 13 herbicides et insecticides par le sol. Relation solubilite-reactivite’. Revue de l'Agric, 34 (4), pp. 319-322. |
|
(74) |
Müller M., Kördel W., (1996). ’Comparison of screening methods for the determination/estimation of adsorption coefficients on soil’. Chemosphere, 32(12), pp. 249 3-2504. |
|
(75) |
Kördel W., Kotthoff G., Müller M., (1995), ’HPLC — screening method for the determination of the adsorption coefficient on soil — results of a ring test’. Chemosphere 30 (7), pp. 1 3 73-1384. |
|
(76) |
Kördel W., Stutte J., Kotthoff G., (1993), ’HPLC — screening method for the determination of the adsorption coefficient on soil — comparison of different stationary phases’. Chemosphere 27 (12), pp. 2341-2352. |
|
(77) |
Hance, R. J., (1967), ’The Speed of Attainment of Sorption Equilibria in Some Systems Involving Herbicides’. Weed Research, Vol. 7, pp. 29-36. |
|
(78) |
Koskinen W. C., and Harper S. S., (1990), ’The retention processes: mechanisms’ in Pesticides in the Soil Environment: Processes, Impacts and Modelling (ed. H.H. Cheng). Soil Sci. Soc. Am. Book Series, No. 2, Madison, Wisconsin. |
|
(79) |
Cohen S. Z., Creeger S. M., Carsel R. F., and Enfield C. G. (1984), ’Potential pesticide contamination of groundwater from agricultural uses’, in Treatment and Disposal of Pesticide Wastes, pp. 297-325, ACS Symp. Ser. 259, American Chemical Society, Washington, DC. |
|
(80) |
Giles C. H., (1970), ’Interpretation and use of sorption isotherms’ in Sorption and Transport Processes in Soils. S.C.I. Monograph No. 37, pp. 14-32. |
|
(81) |
Giles, C. H.; McEwan J. H.; Nakhwa, S.N. and Smith, D., (1960), ’Studies in adsorption: XI. A system of classification of solution adsorption isotherms and its use in the diagnosis of adsorption mechanisms and in measurements of pesticides surface areas of soils’. J. Chem. Soc, pp. 3973-93. |
|
(82) |
Calvet R., Tercé M., and Arvien J. C., (1980), ’Adsorption des pesticides par les sols et leurs constituants: 3. Caractéristiques générales de l'adsorption’. Ann. Agron. 31: pp. 239-251. |
|
(83) |
Bedbur E., (1996), ’Anomalies in the Freundlich equation’, Proc. COST 66 Workshop, Pesticides in soil and the environment, 13-15 May 1996, Stratford-upon-Avon, UK. |
|
(84) |
Guth, J. A., (1985), ’Adsorption/desorption’, in Joint International Symposium, Physicochemical Properties and their Role in Environmental Hazard Assessment, July 1-3, Canterbury, UK. |
|
(85) |
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962). |
LISÄYS 1
Testikaavio

Lisäys 2
ANALYYSIMENETELMÄN TARKKUUDEN JA KONSENTRAATIOMUUTOKSEN VAIKUTUS ADSORPTIOTULOSTEN TARKKUUTEEN
Seuraavasta taulukosta (84) käy ilmi, että silloin kun alkuperäisen massan ( = 110 μg) ja liuoksessa olevan testiaineen tasapainomassan (
= 110 μg) ja liuoksessa olevan testiaineen tasapainomassan (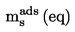 = 100 μg) välinen ero on hyvin pieni, 5 prosentin virhe tasapainokonsentraation mittaustuloksissa johtaa 50 prosentin virheeseen maa-ainekseen adsorboituneen aineen pitoisuuslaskelmissa (
= 100 μg) välinen ero on hyvin pieni, 5 prosentin virhe tasapainokonsentraation mittaustuloksissa johtaa 50 prosentin virheeseen maa-ainekseen adsorboituneen aineen pitoisuuslaskelmissa ( ) ja 52,4 prosentin virheeseen Kd-laskelmissa.
) ja 52,4 prosentin virheeseen Kd-laskelmissa.
|
Maa-aineksen määrä |
msoil |
= 10 g |
|
Liuoksen tilavuus |
Vo |
=100 cm3 |
|
|
FOR-L_2008142FI.01044401.notes.0188.xml.jpg (μg) |
FOR-L_2008142FI.01044401.notes.0189.xml.jpg (μg cm-3) |
R |
FOR-L_2008142FI.01044401.notes.0190.xml.jpg (μg) |
FOR-L_2008142FI.01044401.notes.0191.xml.jpg (μg g-1) |
R‡ |
Kd* |
R‡ |
|
KUN A = 9 % |
||||||||
|
m0 = 110 μg tai C0 = 1,100 μg/cm3 |
100 |
1,000 |
todell. arvo |
10 |
1,00 |
todell. arvo |
1 |
|
|
101 |
1,010 |
1 % |
9 |
0,90 |
10 % |
0,891 |
10,9 % |
|
|
105 |
1,050 |
5 % |
5 |
0,50 |
50 % |
0,476 |
52,4 % |
|
|
109 |
1,090 |
9 % |
1 |
0,10 |
90 % |
0,092 |
90,8 % |
|
|
KUN A = 55 % |
||||||||
|
m0 = 110 μg tai C0 = 1,100 μg/cm3 |
50,0 |
0,500 |
todell. arvo |
60,0 |
6,00 |
todell. arvo |
12,00 |
|
|
50,5 |
0,505 |
1 % |
59,5 |
5,95 |
0,8 % |
11,78 |
1,8 % |
|
|
52,5 |
0,525 |
5 % |
57,5 |
5,75 |
4,0 % |
10,95 |
8,8 % |
|
|
55,0 |
0,550 |
10 % |
55,0 |
5,50 |
8,3 % |
10,00 |
16,7 % |
|
|
KUN A = 99 % |
||||||||
|
m0 = 110 μg tai C0 = 1,100 μg/cm3 |
1,100 |
0,011 |
todell. arvo |
108,9 |
10,89 |
todell. arvo |
990 |
|
|
1,111 |
0,01111 |
1 % |
108,889 |
10,8889 |
0,01 % |
980 |
1,0 % |
|
|
1,155 |
0,01155 |
5 % |
108,845 |
10,8845 |
0,05 % |
942 |
4,8 % |
|
|
1,21 |
0,0121 |
10 % |
108,790 |
10,8790 |
0,10 % |
899 |
9,2 % |
|
|
|
= |
|
|
|
= |
maa-ainesfaasissa olevan testiaineen massa tasapainotilassa, μg |
|
|
= |
vesifaasissa olevan testiaineen massa tasapainotilassa, μg |
|
|
= |
testiaineen pitoisuus maa-ainesfaasissa tasapainotilassa, μg g-1 |
|
|
= |
testiaineen massakonsentraatio vesifaasissa tasapainotilassa, μg cm-3 |
|
R |
= |
analyyttinen virhe |
|
R‡ |
= |
analyyttisestä virheestä R johtuva laskettu virhe. |
LISÄYS 3
Kd:N ARVIOINTITEKNIIKAT
|
1. |
Arviointitekniikoiden avulla on mahdollista ennustaa Kd-arvoja, jotka perustuvat korrelaatioon esimerkiksi Pow-arvojen kanssa (12) (39) (63-68), vesiliukoisuustietojen kanssa (12) (19) (21) (39) (68-73) tai käänteisfaasi-HPLC:sta johdettujen polaarisuustietojen kanssa (74-76). Taulukoissa 1 ja 2 esitetyt Koc tai Kom -arvot on laskettu näistä yhtälöistä ja Kd sitten epäsuorasti yhtälöistä:
|
|
2. |
Tämä korrelaatiokäsite perustuu kahteen oletukseen: 1) aineen adsorboitumiseen vaikuttaa pääasiassa juuri maa-aineksen orgaaninen aines; ja 2) kyseeseen tulevat vuorovaikutukset ovat pääasiassa polaarittomia. Täten näitä korrelaatioita ei voida soveltaa polaarisiin aineisiin tai soveltaminen voidaan ulottaa vain tiettyyn rajaan asti, ja niitä ei voida soveltaa silloin, kun orgaanisen aineksen pitoisuus maa-aineksessa on hyvin pieni (12). Vaikka tyydyttäviä Pow:n ja adsorption (19) välisiä korrelaatioita onkin löydetty, samaa ei voida sanoa vesiliukoisuuden ja adsorboitumisasteen (19) (21) välisistä yhteyksistä; tutkimustulokset ovat toistaiseksi hyvin ristiriitaisia. |
|
3. |
Joitakin esimerkkejä adsorptiokertoimen ja oktanoli-vesi-jakautumiskertoimen välisistä korrelaatioista samoin kuin suhteesta vesiliukoisuuteen esitetään taulukoissa 1 ja 2. Taulukko 1. Esimerkkejä adsorptiojakautumiskertoimen ja oktanoli-vesi-jakautumiskertoimen välisistä korrelaatioista; lisäesimerkkejä lähteistä (12) (68).
Taulukko 2. Esimerkkejä adsorptiojakautumiskertoimen ja vesiliukoisuuden välisistä korrelaatioista; katso lisäesimerkkejä lähteistä (68) (69).
|
Lisäys 4
SENTRIFUGOINTIOLOSUHTEIDEN LASKEMINEN
|
1. |
Sentrifugointiaika saadaan seuraavasta kaavasta olettaen, että partikkelit ovat pallomaisia:
Yksinkertaisuuden vuoksi kaikki muuttujat esitetään muina kuin SI-yksikköinä (g, cm), jossa:
Käytännössä lasketut ajat yleensä kaksinkertaistetaan täydellisen erottumisen varmistamiseksi. |
|
2. |
Yhtälöä (1) voidaan edelleen yksinkertaistaa, jos oletetaan, että liuoksen viskositeetti (η) ja tiheys (ρaq) on yhtä suuri kuin veden viskositeetti ja tiheys lämpötilassa 25 oC; tällöin η = 8,95 x 10-3 g s-1 cm-1 ja ρaq = 1,0 g. cm-3. Tämän jälkeen sentrifugointiaika saadaan yhtälöstä (2):
|
|
3. |
Yhtälöstä (2) käy ilmi, että sentrifugointiolosuhteiden eli ajan (t) ja nopeuden (rpm) määrittäminen perustuu kahteen tärkeään muuttujaan, jotta määrätynkokoiset partikkelit saadaan erotetuksi (tässä tapauksessa säde on 0,1 μm): 1) maa-aineksen tiheys ja 2) seoksen pituus sentrifugiputkessa (Rb-Rt), eli väli, jolla esiintyy maa-ainespartikkeleita liuoksen yläreunasta koeputken pohjaan; tällöin on selvää, että kun putkessa olevan seoksen tilavuus on sama, seoksen pituus koeputkessa riippuu koeputken säteen neliöstä. |
|
4. |
Kuvassa 1 esitetään, kuinka sentrifugointinopeuden (rpm) funktiona esitetty sentrifugointiaika (t) vaihtelee eri maa-ainestiheyksillä (ρs) (kuva 1b) ja silloin, kun seoksen pituus sentrifugiputkissa on erilainen (kuva 2a). Kuvassa 1a näkyy selvästi maa-aineksen tiheyden vaikutus; esimerkiksi klassisella 3 000 rpm:n sentrifugoinnilla sentrifugointiaika on noin 240 minuuttia, kun maa-aineksen tiheys on 1,2 g/cm3, ja vain 50 minuuttia, kun tiheys on 2,0 g/cm3. Vastaavasti kuvasta 1b näkyy, kuinka klassisella 3 000 rpm:n sentrifugoinnilla sentrifugointiaika on noin 50 minuuttia, kun seoksen pituus on 10 cm, ja vain 7 minuuttia, kun pituus on 1 cm. Sentrifugointituloksen kannalta on edullisinta, jos putkessa olevan seoksen pituus on mahdollisimman pieni, ja käsittely taas on helpointa, jos putkessa olevan seoksen pituus on suuri; tässä on löydettävä paras kompromissi. |
|
5. |
Lisäksi silloin, kun määritellään koeolosuhteita maa-aines/liuos-faasien erottelemiseksi, on tärkeää ottaa huomioon mahdollinen kolmannen ”pseudofaasin” eli kolloidien olemassaolo. Näillä partikkeleilla, joiden koko on alle 0,2 μm, voi olla merkittävä vaikutus aineen koko adsorptiomekanismiin maa-ainessuspensiossa. Kun sentrifugointi suoritetaan edellä kuvatulla tavalla, jäävät kolloidit vesifaasiin ja joutuvat analyysiin yhdessä vesifaasin kanssa. Tällöin tiedot niiden vaikutuksista jäävät saamatta. Jos suorittavalla laboratoriolla on ultrasentrifugointi- tai ultrasuodatusmahdollisuus, aineen adsorptiota/desorptiota maa-aineksessa voidaan tutkia syvemmin, mukaan lukien tiedot aineen adsorboitumisesta kolloideihin. Tällöin olisi käytettävä ultrasentrifugointinopeutta 60 000 rpm/min tai ultrasuodatusta suodatinhuokoisuudella 100 000 Daltonia, jotta nämä kolme faasia voidaan erottaa: maa-aines, kolloidit, liuos. Testimenetelmää on myös muunneltava tämän mukaisesti, jotta kaikista kolmesta faasista voitaisiin suorittaa aineen analysointi. |
Kuva 1a.

Kuva 1b.

LISÄYS 5
ADSORPTION A ( %) JA DESORPTION D ( %) LASKEMINEN
Menettelyn aikakaavio on:

Kaikissa laskelmissa oletetaan, että testiaine on stabiili eikä adsorboidu merkittävästi astiaseinämiin.
ADSORPTIO A (A %)
a) Rinnakkaismenetelmä
Adsorboitumisprosentti lasketaan kullekin koeputkelle (i) kullakin ajanhetkellä (ti) seuraavan yhtälön mukaisesti:
|
|
(1) |
Tämän yhtälön tekijät voidaan puolestaan laskea seuraavasti:
|
m0 = C0 · V0 (μg) |
(2) |
|
|
(3) |
joissa:
|
|
= |
adsorboitumisprosentti ( %) ajanhetkellä ti |
|
|
= |
testiaineen massa maa-aineksessa ajanhetkellä ti, kun analyysi suoritetaan (μg) |
|
mo |
= |
testiaineen massa koeputkessa testin alussa (μg) |
|
Co |
= |
maa-aineksen kanssa kosketuksiin joutuvan testiliuoksen massakonsentraatio alussa (μg cm-3) |
|
|
= |
aineen massakonsentraatio vesifaasissa ajanhetkellä ti, kun analyysi suoritetaan (μg cm-3); tämä konsentraatio määritetään analyyttisesti ottaen huomioon nollakokeista saadut arvot |
|
Vo |
= |
maa-aineksen kanssa kosketuksiin joutuvan testiliuoksen alkutilavuus (cm3). |
Adsorboitumisprosenttien arvot 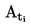 tai
tai  esitetään ajan funktiona ja määritetään aika, joka kuluu sorptiotasapainotilan saavuttamiseen. Esimerkkejä tällaisista käyristä esitetään kuvassa 1 ja kuvassa 2.
esitetään ajan funktiona ja määritetään aika, joka kuluu sorptiotasapainotilan saavuttamiseen. Esimerkkejä tällaisista käyristä esitetään kuvassa 1 ja kuvassa 2.


b) Sarjamenetelmä
Seuraavissa yhtälöissä otetaan huomioon, että adsorptiokoe suoritetaan mittaamalla testiaine vesifaasin pienistä määräosista ja määrätyin aikavälein.
|
— |
Kullakin aikavälillä maa-ainekseen adsorboituneen aineen määrä lasketaan seuraavasti:
|
|
— |
Adsorboitumisprosentti kullakin aikavälillä,
kun taas adsorboitumisprosentti
Adsorptioarvot |
|
— |
Ajanhetkellä, jolloin tasapainotila on saavutettu teq:
|
Edellä käytetyt muuttujat määritellään seuraavasti:
|
|
= |
maa-ainekseen aikavälillä Δt1, Δt2,..., Δtn adsorboituneeksi jääneen aineen massa (µg) |
|
|
= |
määräosasta |
|
|
= |
maa-ainekseen adsorboituneen aineen massa adsorptiotasapainotilassa (µg) |
|
|
= |
liuoksessa olevan aineen massa adsorptiotasapainotilassa (μg) |
|
|
= |
määräosan tilavuus, josta testiaine mitataan (cm3) |
|
|
= |
aikaväliä Δti vastaava adsorboitumisprosentti ( %) |
|
|
= |
adsorboitumisprosentti adsorptiotasapainotilassa ( %). |
DESORPTIO D ( %)
Ajanhetki t0, jolloin desorptiokinetiikkakoe alkaa, on hetki, jolloin talteenotettu testiaineliuos, jonka tilavuus on suurimmillaan kun adsorptiotasapainotila on saavutettu, korvataan yhtä suurella tilavuusmäärällä 0,01 M CaCl2-liuosta.
a) Rinnakkaismenetelmä
Ajanhetkellä ti mitataan testiaineen massa koeputkesta i ( ) otetusta vesifaasista ja desorboitunut massa lasketaan seuraavan yhtälön mukaisesti:
) otetusta vesifaasista ja desorboitunut massa lasketaan seuraavan yhtälön mukaisesti:
|
|
(13) |
Desorptiotasapainotilassa ti = teq ja siten  =
= 
Aikavälillä (Δti) desorboituneen testiaineen massa saadaan yhtälöstä:
|
|
(14) |
Desorboitumisprosentti lasketaan:
ajanhetkellä ti yhtälöstä:
|
|
(15) |
ja aikavälillä (Δti) yhtälöstä:
|
|
(16) |
jossa
|
|
= |
desorboitumisprosentti ajanhetkellä ti ( %) |
|
|
= |
aikaväliä Δti vastaava desorboitumisprosentti ( %) |
|
|
= |
ajanhetkellä ti desorboituneen testiaineen massa (μg) |
|
|
= |
aikavälillä Δti desorboituneen testiaineen massa (μg) |
|
|
= |
analyyttisesti mitatun testiaineen massa ajanhetkellä ti liuostilavuudessa |
|
|
= |
epätäydellisen tilavuustäydennyksen vuoksi adsorptiotasapainotilan ulkopuolelle jääneen testiaineen massa (μg) |
|
|
(17) |
|
|
= |
liuoksessa olevan testiaineen massa adsorptiotasapainotilassa (μg) |
|
VR |
= |
adsorptiotasapainotilan saavuttamisen jälkeen koeputkesta poistetun supernatantin tilavuus, joka korvataan samalla tilavuusmäärällä 0,01 M CaCl2-liuosta (cm3) |
|
|
= |
testiaineen mittaamiseksi koeputkesta (i) otetun liuoksen tilavuus, desorptiokinetiikkakokeessa (cm3). |
Desorptioarvot  tai
tai  (tutkimustarpeiden mukaisesti) esitetään ajan funktiona, ja desorptiotasapainotilan saavuttamiseen kuluva aika määritetään.
(tutkimustarpeiden mukaisesti) esitetään ajan funktiona, ja desorptiotasapainotilan saavuttamiseen kuluva aika määritetään.
b) Sarjamenetelmä
Seuraavissa yhtälöissä otetaan huomioon se, että edeltänyt adsorptiokoe on suoritettu määrittämällä testiaine vesifaasin pienistä määräosista  (sarjamenetelmä 1.9 kohdassa ”Testin suorittaminen”). Oletetaan, että: a) adsorptiokinetiikkakokeen jälkeen koeputkesta poistetun supernatantin tilavuus on korvattu samalla tilavuusmäärällä 0,01 M CaCl2-liuosta (VR) ja b) maa-aineksen kanssa kosketuksiin joutuvan vesifaasin kokonaistilavuus (VT) säilyy desorptiokinetiikkakokeen aikana vakiona ja se saadaan yhtälöstä:
(sarjamenetelmä 1.9 kohdassa ”Testin suorittaminen”). Oletetaan, että: a) adsorptiokinetiikkakokeen jälkeen koeputkesta poistetun supernatantin tilavuus on korvattu samalla tilavuusmäärällä 0,01 M CaCl2-liuosta (VR) ja b) maa-aineksen kanssa kosketuksiin joutuvan vesifaasin kokonaistilavuus (VT) säilyy desorptiokinetiikkakokeen aikana vakiona ja se saadaan yhtälöstä:
|
|
(18) |
Ajanhetkellä ti:
|
— |
Testiaineen massa mitataan pienistä määräosista
|
|
— |
Desorptiotasapainotilassa ti = teq ja siten |
|
— |
Desorboitumisprosentti
|
Aikavälillä (Δti):
Kullakin aikavälillä desorboituneen aineen määrä lasketaan seuraavasti:
|
— |
ensimmäisellä aikavälillä Δt1 = t1 - t0
|
|
— |
toisellä aikavälillä Δt2 = t2 - t1
|
|
— |
ninnellä aikavälillä nth Δtn = tn - tn-1
|
Lopuksi lasketaan desorboitumisprosentti kullakin aikavälillä,  , seuraavaa yhtälöä käyttäen:
, seuraavaa yhtälöä käyttäen:
|
|
(24) |
kun taas desorboitumisprosentti  , ajanhetkellä ti saadaan yhtälöstä:
, ajanhetkellä ti saadaan yhtälöstä:
|
|
(25) |
jossa edellä käytetyt muuttujat määritellään seuraavasti:
|
|
= |
maa-ainekseen aikavälillä Δt1, Δt2, ..., Δtn adsorboituneeksi jääneen aineen massa (μg) |
||
|
|
= |
aikavälillä Δt1, Δt2, ..., Δtn desorboituneen testiaineen massa (μg) |
||
|
|
= |
määräosasta |
||
|
VT |
= |
maa-aineksen kanssa kosketuksiin joutuvan vesifaasin kokonaistilavuus sarjamenetelmällä suoritetun desorptiokinetiikkakokeen aikana (cm3) |
||
|
|
= |
epätäydellisen tilavuustäydennyksen vuoksi adsorptiotasapainotilan ulkopuolelle jääneen testiaineen massa (μg)
|
||
|
VR |
= |
adsorptiotasapainotilan saavuttamisen jälkeen koeputkesta poistetun supernatantin tilavuus, joka korvataan samalla tilavuusmäärällä 0,01 M CaCl2-liuosta (cm3) |
||
|
|
= |
sarjamenetelmällä suoritetun desorptiokinetiikkakokeen aikana koeputkesta (i) analysoitavaksi otetun määräosan tilavuus (cm3)
|
LISÄYS 6
ADSORPTIO-DESORPTIO MAA-AINEKSISSA: TULOSTEN RAPORTOINTILOMAKE
Testattu aine:
Testattu maa-aines:
Maa-aineksen kuiva-ainepitoisuus (105 oC. 12 h): %
Lämpötila: oC
Analyysimenetelmän soveltuvuus
|
Punnittu maa-aines |
g |
|
|
Maa-aines: kuivapaino |
g |
|
|
CaCl2-liuoksen tilavuus |
cm3 |
|
|
Loppuliuoksen nimelliskonsentraatio |
μg cm-3 |
|
|
Loppuliuoksen analyyttinen konsentraatio |
μg cm-3 |
|
Käytetyn analyysimenetelmän periaate: Analyysimenetelmän kalibrointi:
Testattu aine:
Testattu maa-aines:
Maa-aineksen kuiva-ainepitoisuus (105 oC, 12 h): %
Lämpötila: oC
|
Käytetty analyysimenetelmä: |
Epäsuora |
|
Rinnakkais |
|
Sarja |
|
|
|
Suora |
|
|
|
|
|
Adsorptiotesti: testinäytteet
|
|
Symboli |
Yksikkö |
Tasapainottumisaika |
Tasapainottumisaika |
Tasapainottumisaika |
Tasapainottumisaika |
||||
|
Koeputki n:o |
|
|
|
|
|
|
|
|
|
|
|
Punnittu maa-aines |
— |
g |
|
|
|
|
|
|
|
|
|
Maa-aines: |
msoil |
g |
|
|
|
|
|
|
|
|
|
Veden tilavuus punnitussa maa-aineksessa (laskettu) |
VWS |
cm3 |
|
|
|
|
|
|
|
|
|
Maa-aineksen tasapainottamiseksi käytetyn 0,01 M CaCl2-liuoksen tilavuus |
|
cm3 |
|
|
|
|
|
|
|
|
|
Varastoliuoksen tilavuus |
|
cm3 |
|
|
|
|
|
|
|
|
|
Maa-aineksen kanssa kosketuksiin joutuvan vesifaasin kokonaistilavuus |
V0 |
cm3 |
|
|
|
|
|
|
|
|
|
Testiliuoksen alkukonsentraatio |
C0 |
μg cm-3 |
|
|
|
|
|
|
|
|
|
Testiaineen massa testin alussa |
m0 |
μg |
|
|
|
|
|
|
|
|
|
Ravistelun ja sentrifugoinnin jälkeen |
||||||||||
|
EPÄSUORA MENETELMÄ |
||||||||||
|
Rinnakkaismenetelmä |
||||||||||
|
Testiaineen konsentraatio vesifaa-sissa nollakokeen korjaus huomioituna |
|
μg cm-3 |
|
|
|
|
|
|
|
|
|
Sarjamenetelmä |
||||||||||
|
Testiaineen mitattu massa määräosassa VA a |
|
μg |
|
|
|
|
|
|
|
|
|
SUORA MENETELMÄ |
||||||||||
|
Maa-ainekseen adsorboituneen testiaineen massa |
|
μg |
|
|
|
|
|
|
|
|
|
Adsorption laskeminen |
||||||||||
|
Adsorptio |
|
% |
|
|
|
|
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
|
|
|
Keskiarvo |
|
|
|
|
|
|
||||
|
Adsorptiokerroin |
Kd |
cm3 g-1 |
|
|
|
|
|
|
|
|
|
Keskiarvo |
|
|
|
|
|
|
||||
|
Adsorptiokerroin |
Koc |
cm3 g-1 |
|
|
|
|
|
|
|
|
|
Keskiarvo |
|
|
|
|
|
|
||||
Testattu aine:
Testattu maa-aines:
Maa-aineksen kuiva-ainepitoisuus (105 oC, 12 h): %
Lämpötila: oC
Adsorptiotesti: nolla- ja vertailukokeet
|
|
Symboli |
Yksikkö |
Nollakoe |
Nollakoe |
Vertailukoe |
|||
|
Koeputki n:o |
|
|
|
|
|
|
|
|
|
Punnitut maa-ainekset |
|
g |
|
|
|
|
0 |
0 |
|
Veden määrä punnitussa maa-aineksessa (laskettu) |
|
cm3 |
|
|
|
|
— |
— |
|
Lisätyn 0,01 M CaCl2,-liuoksen tilavuus |
|
cm3 |
|
|
|
|
|
|
|
Lisätyn testiaineen varastoliuoksen tilavuus |
|
cm3 |
0 |
0 |
|
|
|
|
|
Vesifaasin kokonaistilavuus (laskettu) |
|
cm3 |
|
|
|
|
— |
— |
|
Vesifaasissa olevan testiaineen alkukonsentraatio |
|
μg cm-3 |
|
|
|
|
|
|
|
Ravistelun ja sentrifugoinnin jälkeen |
||||||||
|
Konsentraatio vesifaasissa |
|
μg cm-3 |
|
|
|
|
|
|
Huomautus: sarakkeita voidaan tarvittaessa lisätä.
Testattu aine:
Testattu maa-aines:
Maa-aineksen kuiva-ainepitoisuus (105 oC, 12 h): %
Lämpötila: oC
Massatase
|
|
Symboli |
Yksikkö |
|
|
|
|
|
Koeputki n:o |
|
|
|
|
|
|
|
Punnittu maa-aines |
— |
g |
|
|
|
|
|
Maa-aines: kuivapaino |
msoil |
g |
|
|
|
|
|
Punnitussa maa-aineksessa olevan veden tilavuus (laskettu) |
VWS |
ml |
|
|
|
|
|
Maa-aineksen tasapainottamiseksi käytetyn 0,01 M CaCl2-liuoksen määrä |
|
ml |
|
|
|
|
|
Varastoliuoksen tilavuus |
|
cm3 |
|
|
|
|
|
Maa-aineksen kanssa kosketuksiin joutuvan vesifaasin kokonaistilavuus |
V0 |
cm3 |
|
|
|
|
|
Testiliuoksen |
C0 |
μg cm-3 |
|
|
|
|
|
Tasapainottumisaika |
— |
h |
|
|
|
|
|
Ravistelun ja sentrifugoinnin jälkeen |
||||||
|
Testiainekonsentraatio vesifaasissa adsorptiotasapainotilassa nollakokeen korjaus huomioituna |
|
μg cm-3 |
|
|
|
|
|
Tasapainottumisaika |
teq |
h |
|
|
|
|
|
1. laimennus liuotinta käyttäen |
||||||
|
Poistetun vesifaasin tilavuus |
Vrec |
cm3 |
|
|
|
|
|
Lisätyn liuottimen tilavuus |
ΔV |
cm3 |
|
|
|
|
|
1. uutto liuotinta käyttäen |
||||||
|
Analysaattorisignaali — liuotin |
SE1 |
eril. |
|
|
|
|
|
Testiaineen konsentraatio liuottimessa |
CE1 |
μg cm-3 |
|
|
|
|
|
Maa-aineksesta ja astiaseinämistä uutetun aineen massa |
mE1 |
μg |
|
|
|
|
|
2. laimennus liuotinta käyttäen |
||||||
|
Poistetun liuottimen tilavuus |
ΔVs |
cm3 |
|
|
|
|
|
Lisätyn liuottimen tilavuus |
ΔV' |
cm3 |
|
|
|
|
|
2. uutto liuotinta käyttäen |
||||||
|
Analysaattorisignaali — liuotinfaasi |
SE2 |
eril. |
|
|
|
|
|
Testiaineen konsentraatio liuottimessa |
CE2 |
μg cm-3 |
|
|
|
|
|
Maa-aineksesta ja astiaseinämistä uutetun aineen massa |
mE2 |
μg |
|
|
|
|
|
Kahdessa vaiheessa uutetun testiaineen kokonaismassa |
mE |
μg |
|
|
|
|
|
Massatase |
MB |
% |
|
|
|
|
Testattu aine:
Testattu maa-aines:
Maa-aineksen kuiva-ainepitoisuus (105 oC, 12 h):
Lämpötila:
Adsorptioisotermit
|
|
Symboli |
Yksikkö |
|
|
|
|
|
|
|
|
|
Koeputki n:o |
|
|
|
|
|
|
|
|
|
|
|
Punnittu maa-aines |
— |
g |
|
|
|
|
|
|
|
|
|
Maa-aines: kuivapaino |
E |
g |
|
|
|
|
|
|
|
|
|
Veden tilavuus punnitussa maa-aineksessa (laskettu) |
VWS |
cm3 |
|
|
|
|
|
|
|
|
|
Maa-aineksen tasapainottamiseksi käytetyn 0,01 M CaCl2-liuoksen tilavuus |
|
cm3 |
|
|
|
|
|
|
|
|
|
Lisätyn varastoliuoksen tilavuus |
|
cm3 |
|
|
|
|
|
|
|
|
|
Maa-aineksen kanssa kosketuksiin joutuvan vesifaasin kokonaistilavuus (laskettu) |
V0 |
cm3 |
|
|
|
|
|
|
|
|
|
Liuoskonsentraatio |
C0 |
μg cm-3 |
|
|
|
|
|
|
|
|
|
Tasapainottumisaika |
— |
h |
|
|
|
|
|
|
|
|
|
Ravistelun ja sentrifugoinnin jälkeen |
||||||||||
|
Aineen konsentraatio vesifaasissa nollakokeen korjaus huomioituna |
|
μg cm-3 |
|
|
|
|
|
|
|
|
|
Lämpötila |
|
oC |
|
|
|
|
|
|
|
|
|
Maa-ainesyksikköä kohden adsorboitunut massa |
|
μg g-1 |
|
|
|
|
|
|
|
|
Regressioanalyysi:
KF ads-arvo:
l/n-arvo:
regressiokerroin r2:
Testattu aine:
Testattu maa-aines:
Maa-aineksen kuiva-ainepitoisuus (105 oC, 12 h):
Lämpötila:
|
Käytetty analyysimenetelmä: |
Epäsuora |
|
Rinnakkais |
|
Sarja |
|
Desorptiotesti
|
|
Symboli |
Yksiköt |
Aikaväli |
Aikaväli |
Aikaväli |
Aikaväli |
|
|
Adsorptiovaiheesta saatavan koeputken n:o |
|
|
|
|
|
|
|
|
Maa-ainekseen adsorboituneen aineen massa adsorptiotasapainotilassa |
|
μg |
|
|
|
|
|
|
Poistetun vesifaasin tilavuus, korvataan 0,01 M CaCl2:lla |
VR |
cm3 |
|
|
|
|
|
|
Maa-aineksen kanssa kosketuksiin joutuvan vesifaasin kokonaistilavuus |
RM |
V0 |
cm3 |
|
|
|
|
|
SM |
VT |
cm3 |
|
|
|
|
|
|
Epätäydellisen tilavuustäydennyksen vuoksi adsorptiotasapainotilan ulkopuolelle jäävän testiaineen massa |
|
μg |
|
|
|
|
|
|
Desorptiokinetiikka |
|||||||
|
Ajanhetkellä ti mitatun maa-aineksesta desorboituneen aineen massa |
|
μg |
|
|
|
|
|
|
Koeputkesta (i) testiaineen mittaamiseksi otetun liuoksen tilavuus |
RM |
Vr i |
cm3 |
|
|
|
|
|
SM |
va D |
cm3 |
|
|
|
|
|
|
Ajanhetkellä ti maa-aineksesta desorboituneen aineen massa (laskettu) |
|
μg |
|
|
|
|
|
|
Aikavälillä Δti maa-aineksesta desorboituneen aineen massa (laskettu) |
|
μg |
|
|
|
|
|
|
Desorboitumisprosentti |
|||||||
|
Desorptio ajanhetkellä ti |
Dti |
% |
|
|
|
|
|
|
Desorptio aikavälillä Δti |
|
% |
|
|
|
|
|
|
Näennäinen desorptiokerroin |
Kdes |
|
|
|
|
|
|
RM: Rinnakkaismenetelmä
SM: Sarjamenetelmä
C.19 MAA-AINEKSIIN JA VIEMÄRILIETTEESEEN SOVELLETTAVAN ADSORPTIOKERTOIMEN (Koc) MÄÄRITYS KORKEAN SUORITUSKYVYN NESTEKROMATOGRAFIALLA (HPLC)
1. MENETELMÄ
Tämä menetelmä on toisinto OECD:n testimenetelmästä TG 121 (2000).
1.1 JOHDANTO
Aineiden sorptiokäyttäytymistä maa-aineksiin ja viemärilietteeseen voidaan kuvata muuttujilla, jotka voidaan määrittää kokeellisesti testimenetelmällä C 18. Tärkeä muuttuja on adsorptiokerroin, joka on määritelmän mukaan aineen maa-aineksessa tai viemärilietteessä olevan konsentraation ja adsorptiotasapainossa vesifaasissa olevan konsentraation suhde. Maa-aineksen orgaanisen hiilen pitoisuuden suhteen normalisoitua adsorptiokerrointa Koc voidaan käyttää osoittamaan kemiallisen aineen sitoutumiskykyä maa-aineksen tai viemärilietteen orgaaniseen ainekseen, jolloin eri kemikaaleja voidaan verrata. Tämä muuttuja voidaan arvioida vesiliukoisuuden ja n-oktanoli-vesijakautumiskertoimen suhteen tehtyjen korrelaatioiden avulla (1) (2) (3) (4) (5) {6} (7).
Tässä testiohjeessa kuvatussa menetelmässä käytetään HPLC:tä adsorptiokertoimen Koc määrittämiseksi maa-aineksessa ja viemärilietteessä (8). Estimaatit ovat luotettavampia kuin QSAR-laskelmista saadut (9). Estimointimenetelmänä tämä menetelmä ei kuitenkaan voi täysin korvata testimenetelmässä C 18 kuvattua erätasapainomenetelmää. Estimoitua Koc-arvoa voidaan kuitenkin käyttää valittaessa testimuuttujia testimenetelmän C 18 mukaan tehtäviin adsorptio-desorptiokokeisiin laskemalla Kd (jakautumiskerroin) tai Kf (Freundlichin adsorptiokerroin) yhtälöstä 3 (jakso 1.2).
1.2 MÄÄRITELMÄT
K d : jakautumiskerroin: liuenneen testiaineen tasapainokonsentraatioiden C suhde kaksifaasijärjestelmässä, joka koostuu sorbentista (maa-aines tai viemäriliete) ja vesifaasista. Arvo on paljas luku, jos konsentraatiot on ilmaistu molemmissa faaseissa painoyksiköissä. Jos vesifaasin konsentraatio ilmaistaan painoyksikköinä tilavuusyksikköä kohti, laatu on ml · g-1. Kd voi vaihdella sorbentin ominaisuuksien mukaan, ja se voi olla konsentraatiosta riippuvainen.
|
|
(1) |
jossa:
|
Csoil |
= |
testiaineen tasapainokonsentraatio maa-aineksessa (μg · g-1) |
|
Csludge |
= |
testiaineen tasapainokonsentraatio viemärilietteessä (μg · g-1) |
|
Caq| |
= |
testiaineen tasapainokonsentraatio vesifaasissa (μg · g-1, μg · ml-1). |
Kf: Freundlichin adsorptiokerroin: testiaineen konsentraatio maa-aineksessa tai viemärilietteessä (x/m), kun tasapainokonsentraatio vesifaasissa (Caq) on yksi; laatu on μg · g-1 sorbenttia. Arvo voi vaihdella sorbentin ominaisuuksien mukaan.
|
|
(2) |
jossa:
|
x/m |
= |
sorbentin määrään m (g) adsorboituneen testiaineen määrä x (μg) tasapainotilassa |
|
l/n |
= |
Freundlichin adsorptioisotermikuvaajan kulmakerroin |
|
Caq |
= |
testiaineen tasapainokonsentraatio vesifaasissa (μg · ml-1) |
At
Koc: Sorbentin orgaanisen hiilen pitoisuuden (foc) suhteen normalisoitu aineen jakautumiskerroin (Kd) tai ainetta koskeva Freundlichin adsorptiokerroin (Kf). Erityisesti ionisoitumattomille kemikaaleille se osoittaa suunnilleen aineen ja sorbentin välisen adsorption määrän, ja sen avulla voidaan verrata eri kemikaaleja. Kd:n ja Kf:n laaduista riippuen Koc voi olla laaduton tai sen laatu voi olla ml · g-1 tai μg · g-1 orgaanista ainetta.
|
|
(3) |
Koc:n ja Kd:n suhde ei ole aina lineaarinen, ja siten Koc-arvot voivat vaihdella maa-ainesten välillä, mutta vaihtelun määrä on paljon pienempi kuin Kd- tai Kf-arvojen vaihtelu.
Adsorptiokerroin (Koc) johdetaan kapasiteettikertoimesta (k'} käyttämällä kuvaajaa, jossa log k' esitetään log Koc:n funktiona valikoiduille vertailuyhdisteille.
|
|
(4) |
jossa:
|
tR |
= |
testiaineen ja vertailuaineen HPLC-retentioaika (minuuttia) |
|
t0 |
= |
HPLC:n kuollut aika (minuuttia) (ks. jakso 1.8.2). |
Pow: Oktanoli-vesijakautumiskerroin: n-oktanoliin liukenevan ja veteen liukenevan aineen konsentraatioiden suhde, joka on laaduton suure.
|
|
(5) |
1.3 VERTAILUAINEET
Aineen rakennekaava, puhtaus ja hajoamisvakio (tarvittaessa) olisi tiedettävä ennen kuin menetelmää käytetään. Veteen ja orgaanisiin liuottimiin liukenemista, oktanoli-vesijakautumiskerrointa ja hydrolyysiominaisuuksia koskevat tiedot ovat hyödyllisiä.
Jotta mitatut HPLC-retentiotulokset voidaan korreloida aineen adsorptiokertoimen Koc kanssa, on laadittava kalibrointikuvaaja, jossa log Koc esitetään log k':n funktiona. Kuvaajassa on oltava vähintään kuusi referenssipistettä, joista vähintään yhden on oltava testiaineen odotetun arvon yläpuolella ja yhden sen alapuolella. Menetelmän tarkkuus paranee huomattavasti, jos vertailuaineet ovat rakenteeltaan testiaineen kaltaisia. Jos tällaisia tietoja ci ole saatavilla, käyttäjän on valittava sopivat kalibrointiaineet. Siinä tapauksessa olisi valittava rakenteellisesti heterogeenisiä aineita. Käyttökelpoisia aineita ja Koc-arvoja esitetään viemärilietteelle lisäyksen taulukossa 1 ja maa-aineksille taulukossa 3. Jos valitaan muita kalibrointiaineita, ne on perusteltava.
1.4 TESTIMENETELMÄN PERIAATE
HPLC tehdään analyyttisillä pylväillä, jotka on pakattu kaupallisesti saatavilla lipofiilisiä ja polaarisia osia sisältävillä syanopropyylipohjaisilla kiinteillä faaseilla. Stationaarifaasina käytetään suhteellisen polaarista silikamatriisipohjaista ainetta:
|
— O — Si |
— CH2 — CH2 — CH2 |
— CN |
|
silika |
pooliton spacer-aine |
polaarinen osa |
Testimenetelmän periaate on samankaltainen kuin testimenetelmän A 8 (jakautumiskerroin, HPLC-menetelmä) periaate. Kun testiaine kulkee pylvään läpi liikkuvan faasin mukana, se reagoi stationaarifaasin kanssa. Koska testiaine jakautuu liikkuvaan ja stationaariseen faasiin, sen kulku hidastuu. Koska stationaarifaasissa on sekä polaarisia että poolittomia paikkoja, sekä molekyylin polaariset että poolittomat ryhmät voivat reagoida samalla tavalla kuin maa-aineksen tai viemärilietteen sisältämän orgaanisen aineksen kanssa. Tämän ansiosta voidaan määrittää pylvääseen liittyvän retentioajan ja orgaaniseen aineeseen tapahtuvan imeytymisen adsorptiokertoimen välinen suhde.
pH:lla on huomattava vaikutus sorptiokäyttäytymiseen erityisesti polaarisilla aineilla. Maanviljelysmaa-aineksissa tai viemärivesien käsittelylaitosten tankeissa pH vaihtelee tavallisesti välillä 5,5-7,5. Ionisoituville aineille olisi tehtävä kaksi testiä sekä ionisoituneessa että ionittomassa muodossa sopivissa puskuriliuoksissa, mutta vain silloin, kun vähintään 10 % testiaineesta dissosioituu välillä pH 5,5-7,5.
Koska arviointiin käytetään vain HPLC-pylvästä koskevan retentioajan ja adsorptiokertoimen välistä suhdetta, kvantitatiivista määritysmenetelmää ei tarvita ja vain retentioajan määritys on tarpeen. Jos on käytettävissä sopivia vertailuaineita ja koeolosuhteet ovat vakioidut, tämä menetelmä on nopea ja tehokas keino arvioida adsorptiokerroin Koc.
1.5 TESTIN SOVELTAMISALA
HPLC-menetelmä sopii sellaisille kemiallisille aineille (riippumatta siitä, onko niissä erityisiä merkkiaineita tai esim. radioaktiivista leimaa), joille on käytettävissä sopiva detektiomenetelmä (esim. spektrofotometrinen tai radioaktiivisen säteilyn mittalaite) ja jotka pysyvät riittävän stabiileina kokeen aikana. Menetelmä voi olla erityisen hyvä sellaisille aineille, joita on vaikea tutkia muunlaisissa koejärjestelyissä (ts. haihtuvat aineet tai aineet, jotka eivät liukene veteen sellaisessa pitoisuudessa, että se voidaan mitata tarkasti; aineet, joilla on suuri affiniteetti inkubaatiojärjestelmien pintaan). Menetelmää voidaan käyttää seoksille, joiden eluutiovyöhykkeet eivät erotu toisistaan. Silloin olisi ilmoitettava testiseokseen sisältyvien yhdisteiden log Koc-arvojen ylä- ja alarajat.
Epäpuhtaudet voivat joskus aiheuttaa ongelmia HPLC-tulosten tulkinnassa, mutta ne eivät juurikaan aiheuta ongelmia, jos testiaine voidaan tunnistaa analyyttisesti ja erottaa epäpuhtauksista.
Menetelmä on validoitu lisäyksessä olevassa taulukossa 1 luetelluille aineille. Sitä sovellettiin myös useille muille kemikaaleille, jotka kuuluivat seuraaviin kemiallisiin luokkiin:
|
— |
aromaattiset amiinit (esim. trifluraliini, 4-kloorianiliini, 3,5-dinitroaniliini, 4-metyylianiliini, N-metyylianiliini, 1-naftyyliamiini) |
|
— |
aromaattiset karboksyylihappoesterit (esim. bentsoehappometyyliesteri, 3,5-dinitrobentsoehappometyyliesteri) |
|
— |
aromaattiset hiilivedyt (esim. tolueeni, ksyleeni, etyylibentseeni, nitrobentseeni) |
|
— |
aryylioksifenoksipropionihappoesterit (esim. diklofoppi-metyyli, fenoksaproppi-etyyli, fenoksaproppi-P-etyyli) |
|
— |
bentsimidatsoli- ja imidatsolifungisidit (esim. karbendatsiimi, fuberidatsoli, triatsoksidi) |
|
— |
karboksyylihappoamidit (esim. 2-klooribentsamidi, N,N-dimetyylibentsamidi, 3,5-dinitrobentsamidi, N-metyylibentsamidi, 2-nitrobentsamidi, 3-nitrobentsamidi) |
|
— |
klooratut hiilivedyt (esim. endosulfaani, DDT, heksaklooribentseeni, kvintotseeni, 1,2,3-triklooribentseeni) |
|
— |
orgaanisia fosforiyhdisteitä sisältävät torjunta-aineet (esim. atsinfossi-metyyli, disulfotoni, fenamifossi, isofenfossi, pyratsofossi, sulprofossi, triatsofossi) |
|
— |
fenolit (esim. fenoli, 2-nitrofenoli, 4-nitrofenoli, pentakloorifenoli, 2,4,6-trikloorifenoli, 1-naftoli) |
|
— |
tenyyliurea-johdannaiset (esim. isoproturoni, monolinuroni, pensykuroni) |
|
— |
väriaineet (esim. Acid Yellow 219, Basic Blue 41, Direct Red 81) |
|
— |
polyaromaattiset hiilivedyt (esim. asenafteeni, naftaleeni) |
|
— |
1,3,5-triatsiinia sisältävät kasvinsuojeluaineet (esim. prometryyni, propatsiini, simatsiini, terbutryyni) |
|
— |
triatsolijohdannaiset (esim. tebukonatsoli, triadimefoni, tradimenoli, triapentenoli). |
Menetelmä ei sovellu aineille, jotka reagoivat joko eluentin tai stationaarifaasin kanssa. Se ei myöskään sovellu aineille, jotka reagoivat spesifisellä tavalla epäorgaanisten yhdisteiden kanssa (jos esim. muodostuu klusterikomplekseja saven mineraalien kanssa). Menetelmä ei mahdollisesti sovellu myöskään pinta-aktiivisille aineille, epäorgaanisille yhdisteille eikä vahvoille tai melko vahvoille hapoille ja emäksille. Välillä 1,5-5,0 olevia log Koc-arvoja voidaan määrittää. Ionisoituvat yhdisteet on määritettävä käyttäen puskuroitua liikkuvaa faasia, mutta on varottava, etteivät puskurin sisältämät aineet tai testiaine saostu.
1.6 LAATUVAATIMUKSET
1.6.1 Tarkkuus
Testiaineen adsorptiokerroin voidaan tavallisesti arvioida ±0,5 logaritmiyksikön tarkkuudella verrattuna erätasapainomenetelmällä määritettyyn arvoon (ks. lisäyksessä oleva taulukko 1). Suurempaan tarkkuuteen voidaan päästä, jos vertailuaineet ovat rakenteellisesti testiaineen kaltaisia.
1.6.2 Toistettavuus
Määritykset olisi tehtävä vähintään kaksoismäärityksinä. Yksittäisistä mittauksista lasketut log Koc-arvot eivät saisi erota toisistaan enemmän kuin 0,25 logaritmiyksikköä.
1.6.3 Uusittavuus
Menetelmää sovellettaessa saadut kokemukset tukevat käsitystä menetelmän validiteetista. Kun HPLC-menetelmää tutkittiin 48 aineella (enimmäkseen torjunta-aineita), joista oli saatavilla luotettavia maa-ainesten Koc:tä koskevia tietoja, saatiin korrelaatiokertoimeksi R = 0,95 (10) (11).
Menetelmän parantamiseksi ja validoimiseksi tehtiin laboratorioiden välinen vertailukoe, johon osallistui 11 laboratoriota (12). Tulokset esitetään lisäyksessä olevassa taulukossa 2.
1.7 TESTIMENETELMÄN KUVAUS
1.7.1 Adsorptiokertoimen alustava määritys
Oktanoli-vesijakautumiskerrointa Pow (= Kow) ja (jossain määrin) vesiliukoisuutta voidaan käyttää osoittamaan adsorption määrää erityisesti ionisoitumattomille yhdisteille, ja siten sen avulla voidaan alustavasti määrittää kyseeseen tuleva mittausalue. Useille kemikaaliryhmille on julkaistu useita käyttökelpoisia korrelaatioita (1) (2) (3) (4) (5) (6) (7).
1.7.2 Laitteet
Menetelmässä tarvitaan nestekromatografi, jossa on pulssittomasti toimiva pumppu ja sopiva detektori. On suositeltavaa käyttää injektioventtiiliä ja injektiosilmukkaa. Pylvään pakkausaineena on käytettävä kaupallista kemiallisesti sidottua silikapohjaista syaanopropyylihartsia (esim. Hypersil ja Zorbax CN). Samaa ainetta oleva esipylväs voidaan liittää injektiojärjestelmän ja analyyttisen pylvään väliin. Eri valmistajien pylväiden erotustehot voivat erota huomattavasti toisistaan. Ohjeellisesti pitäisi pyrkiä seuraavanlaisiin kapasiteettikertoimiin k': log k' > 0,0, kun log Koc = 3,0 ja log k' > -0,4, kun log Koc = 2,0 käytettäessä metanoli/vesiseosta (55/45 %) liikkuvana faasina.
1.7.3 Liikkuva faasi
Useita liikkuvia faaseja on testattu, ja seuraavia kahta suositetaan:
|
— |
metanoli/vesi (55/45 % v/v) |
|
— |
metanoli/0,01 M sitraattipuskuri, pH 6,0 (55/45 % v/v) |
Eluutioliuoksen valmistukseen on käytettävä HPLC-laatuista metanolia ja tislattua vettä tai sitraattipuskuria. Seoksesta poistetaan kaasut ennen käyttöä. Eluution pitäisi olla isokraattinen. Jos metanoli-vesiseokset eivät sovellu, voidaan kokeilla muita orgaanisen liuottimen ja veden seoksia, esim. etanoli-vesi- tai asetonitriili-vesiseoksia. Ionisoituville yhdisteille suositetaan puskuriliuoksen käyttöä pH:n pitämiseksi vakiona. Suolan saostumista ja pylvään suoritustehon heikentymistä on pyrittävä välttämään. Se voi tapahtua käytettäessä tiettyjä orgaanisia faaseja ja puskuriseoksia.
Mitään sellaisia lisäaineita kuten ioniparireagensseja ei saa käyttää, koska ne voivat vaikuttaa stationaarifaasin sorptio-ominaisuuksiin. Tällaiset stationaarifaasin muutokset voivat olla palautumattomia. Siksi kokeet, joissa käytetään lisäaineita, on ehdottomasti tehtävä eri pylväillä.
1.7.4 Liuotetut aineet
Testi- ja vertailuaine olisi liuotettava liikkuvaan faasiin.
1.8 TESTIN SUORITUSTEHO
1.8.1 Testiolosuhteet
Lämpötila olisi rekisteröitävä mittausten aikana. Suositellaan, että käytetään termostoitua pylvästä, jotta voidaan varmistaa vakio-olosuhteet kalibrointimittausten ja alustavien ajojen sekä testiaineen määritysten aikana.
1.8.2 Kuollut aika to
Kuollut aika to voidaan määrittää kahdella eri menetelmällä (ks. myös jakso 1.2).
1.8.2.1 Kuolleen ajan to määritys homologisen sarjan avulla
Tämän menetelmän on osoitettu antavan luotettavia ja vakioituja to-arvoja. Menetelmä selostetaan yksityiskohtaisesti testimenetelmässä A.8: Partitiokerroin (n-oktanoli/vesi), HPLC-menetelmä.
1.8.2.2 Kuolleen ajan to määritys inerteillä aineilla, jotka eivät tartu pylvääseen
Tämä menetelmä perustuu formamidi-, urea- tai natriumnitraattiliuosten injektoimiseen. Määritykset olisi tehtävä vähintään kaksoismäärityksinä.
1.8.3 Retentioaikojen tR määritys
Vertailuaineet olisi valittava kuten jaksossa 1.3 selostetaan. Ne voidaan injektoida seosstandardina retentioaikojen määrittämiseksi, mikäli on vahvistettu, että toisten vertailuaineiden läsnäolo ei vaikuta yksittäisten vertailuaineiden retentioaikoihin. Kalibrointi olisi tehtävä säännöllisin väliajoin vähintään kahdesti päivässä, jotta pylväiden mahdolliset suorituskyvyn muutokset voidaan selittää. Kalibrointiajot olisi tehtävä mieluiten ennen testiaineen injektioita ja niiden jälkeen, jotta voidaan varmistaa, etteivät retentioajat ole muuttuneet. Testiaineet injektoidaan erikseen mahdollisimman pieninä määrinä (pylvään ylikuormituksen estämiseksi), ja niiden retentioajat määritetään.
Määritysten luotettavuuden lisäämiseksi olisi tehtävä vähintään kaksoismääritykset. Yksittäisistä mittauksista lasketut log Koc-arvot eivät saisi erota toisistaan enemmän kuin 0,25 logaritmiyksikköä.
1.8.4 Arviointi
Kapasiteettikertoimet k' lasketaan valittujen vertailuaineiden kuolleesta ajasta to ja retentioajoista tR yhtälön 4 avulla (ks. jakso 1.2). Laaditaan kuvaaja, jossa esitetään vertailuaineiden log k' -arvot erätasapainokokeesta saatujen, lisäyksen taulukoissa 1 ja 3 esitettyjen vertailuaineita koskevien log Koc -arvojen funktiona. Testiaineen log Koc -arvo määritetään sen log k' -arvon perusteella kyseisen kuvaajan avulla. Jos testiaineen log Koc osoittautuu todellisten tulosten perusteella olevan kalibrointialueen ulkopuolella, testi olisi toistettava käyttäen sopivampia vertailuaineita.
2. MITTAUSTULOKSET JA TESTISELOSTEET
Testiselosteessa on esitettävä tai selostettava seuraavat asiat:
|
— |
testiaineiden ja vertailuaineiden tunnistetiedot ja niiden puhtaus sekä pKa-arvot tarvittaessa, |
|
— |
laitteet ja toimintaolosuhteet, esim. analyyttisen (ja esi-) pylvään tyyppi ja mitat, detektiomenetelmä, liikkuva faasi (ainesten suhteelliset osuudet ja pH), lämpötila-alue mittausten aikana, |
|
— |
kuollut aika ja sen määrittämiseen käytetty menetelmä, |
|
— |
pylvääseen injektoitujen testiaineiden ja vertailuaineiden määrät, |
|
— |
kalibrointiin käytettyjen vertailuaineiden retentioajat, |
|
— |
sovitettua regressiokuvaajaa (log k' vs log Koc) koskevat tiedot ja itse kuvaaja, |
|
— |
testatun yhdisteen keskimääräinen retentioaika ja estimoitu d log Koc-arvo, |
|
— |
kromatogrammit. |
3. KIRJALLISUUSVIITTEET
|
(1) |
W. J. Lyman, W. F. Reehl, D. H. Rosenblatt (ed). (1990). Handbook of chemical property estimation methods, Chapt. 4, McGraw-Hill, New York. |
|
(2) |
J. Hodson, N. A. Williams (1988). The estimation of the adsorption coefficient (Koc) for soils by HPLC. Chemosphere, 17, 167. |
|
(3) |
G. G. Briggs (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem., 29, pp. 1050-1059. |
|
(4) |
C. T. Chiou, P. E. Porter, D.W. Schmedding (1983). Partition equilibria of nonionic organic compounds between soil organic matter and water. Environ. Sci. Technol., 17, pp. 227-231. |
|
(5) |
Z. Gerstl, U. Mingelgrin (1984). Sorption of organic substances by soils and sediment. J. Environm. Sci. Health, B19, pp. 297-312. |
|
(6) |
C. T. Chiou, L. J. Peters, V. H. Freed (1979). A physical concept of soil water equilibria for nonionic organic compounds, Science, 106, pp. 831-832. |
|
(7) |
S. W. Karickhoff (1981). Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils. Chemosphere, 10, pp. 833-846. |
|
(8) |
W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), pp. 121-128. |
|
(9) |
M. Mueller, W. Kördel (1996).Comparison of screening methods for the estimation of adsorption coefficients on soil. Chemosphere, 32(12), pp. 2493-2504. |
|
(10) |
W. Kördel, J. Stutte, G. Kotthoff (1993). HPLC-screening method for the determination of the adsorption coefficient in soil-comparison of different stationary phases, Chemosphere, 27(12), pp. 2341-2352. |
|
(11) |
B. von Oepen, W. Kördel, W. Klein (1991). Sorption of nonpolar and polar compounds to soils: Processes, measurements and experience with the applicability of the modified OECD Guideline 106, Chemosphere, 22, pp. 285-304. |
|
(12) |
W. Kördel, G. Kotthoff, J. Muller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), pp. 1373-1384. |
LISÄYS
Taulukko 1
Maa-ainesten ja viemärilietteiden Koc-arvojen ja kartoittavan HPLC menetelmän perusteella laskettujen arvojen vertailu (30) (31)
|
Aine |
CAS-nro |
Log Koc viemärilietteet |
Log Koc HPLC |
Δ |
Log Koc maa-ainekset |
Log Koc HPLC |
Δ |
|
Atratsiini |
1912-24-9 |
1,66 |
2,14 |
0,48 |
1,81 |
2,20 |
0,39 |
|
Linuroni |
330-55-2 |
2,43 |
2,96 |
0,53 |
2,59 |
2,89 |
0,30 |
|
Fentioni |
55-38-9 |
3,75 |
3,58 |
0,17 |
3,31 |
3,40 |
0,09 |
|
Monuroni |
150-68-5 |
1,46 |
2,21 |
0,75 |
1,99 |
2,26 |
0,27 |
|
Fenantreeni |
85-01-8 |
4,35 |
3,72 |
0,63 |
4,09 |
3,52 |
0,57 |
|
Bentsoehappofenyyliesteri |
93-99-2 |
3,26 |
3,03 |
0,23 |
2,87 |
2,94 |
0,07 |
|
Bentsamidi |
55-21-0 |
1,60 |
1,00 |
0,60 |
1,26 |
1,25 |
0,01 |
|
4-Nitrobcntsamidi |
619-80-7 |
1,52 |
1,49 |
0,03 |
1,93 |
1,66 |
0,27 |
|
Asetanilidi |
103-84-4 |
1,52 |
1,53 |
0,01 |
1,26 |
1,69 |
0,08 |
|
Aniliini |
62-53-3 |
1,74 |
1,47 |
0,27 |
2,07 |
1,64 |
0,43 |
|
2,5-Dikloorianiliini |
95-82-9 |
2,45 |
2,59 |
0,14 |
2,55 |
2,58 |
0,03 |
Taulukko 2
Tulokset 11 laboratorion välisestä vertailusta, jonka tarkoituksena oli parantaa ja validoida HPLC-menetelmä (32)
|
Aine |
CAS-nro |
log Koc |
Koc |
log Koc |
|
[OECD 106] |
[HPLC-menetelmä] |
|||
|
Atratsiini |
1912-24-9 |
1,81 |
78 ± 16 |
1,89 |
|
Monuroni |
150-68-5 |
1,99 |
100 ± 8 |
2,00 |
|
Triapentenoli |
77608-88-3 |
2,37 |
292 ± 58 |
2,47 |
|
Linuroni |
330-55-2 |
2,59 |
465 ± 62 |
2,67 |
|
Fentioni |
55-38-9 |
3,31 |
2062 ± 648 |
3,31 |
Taulukko 3
Kartoittavaan HPLC-menetelmään suositellut vertailuaineet; tiedot perustuvat maa-ainesten adsorptiotuloksiin
|
Vertailuaine |
CAS-nro |
Erätasapainosta saadut log Koc -arvojen keskiarvot |
Koc -tulosten lukumäärä |
Log S.D. |
Lähde |
|
Asetanilidi |
103-84-4 |
1,25 |
4 |
0,48 |
|
|
Fenoli |
108-95-2 |
1,32 |
4 |
0,70 |
|
|
2-Nitrobentsamidi |
610-15-1 |
1,45 |
3 |
0,90 |
|
|
N, N-Dimetyylibentsamidi |
611-74-5 |
1,52 |
2 |
0,45 |
|
|
4-Metyylibentsamidi |
619-55-6 |
1,78 |
3 |
1,76 |
|
|
Metyylibentsoaatti |
93-58-3 |
1,80 |
4 |
1,08 |
|
|
Atratsiini |
1912-24-9 |
1,81 |
3 |
1,08 |
|
|
Isoproturoni |
34123-59-6 |
1,86 |
5 |
1,53 |
|
|
3-Nitrobentsamidi |
645-09-0 |
1,95 |
3 |
1,31 |
|
|
Aniliini |
62-53-3 |
2,07 |
4 |
1,73 |
|
|
3,5-Dinitrobentsamidi |
121-81-3 |
2,31 |
3 |
1,27 |
|
|
Karbendatsiimi |
10605-21-7 |
2,35 |
3 |
1,37 |
|
|
Triadimenoli |
55219-65-3 |
2,40 |
3 |
1,85 |
|
|
Triatsoksidi |
72459-58-6 |
2,44 |
3 |
1,66 |
|
|
Triatsofossi |
24017-47-8 |
2,55 |
3 |
1,78 |
|
|
Linuroni |
330-55-2 |
2,59 |
3 |
1,97 |
|
|
Naftaleeni |
91-20-3 |
2,75 |
4 |
2,20 |
|
|
Endosulfaani-dioli |
2157-19-9 |
3,02 |
5 |
2,29 |
|
|
Metiokarbi |
2032-65-7 |
3,10 |
4 |
2,39 |
|
|
Acid Yellow 219 |
63405-85-6 |
3,16 |
4 |
2,83 |
|
|
1,2,3-Triklooribentseeni |
87-61-6 |
3,16 |
4 |
1,40 |
|
|
γ-HCH |
58-89-9 |
3,23 |
5 |
2,94 |
|
|
Fentioni |
55-38-9 |
3,31 |
3 |
2,49 |
|
|
Direct Red 81 |
2610-11-9 |
3,43 |
4 |
2,68 |
|
|
Pyratsofossi |
13457-18-6 |
3,65 |
3 |
2,70 |
|
|
α-Endosulfaani |
959-98-8 |
4,09 |
5 |
3,74 |
|
|
Diklofoppi-metyyli |
51338-27-3 |
4,20 |
3 |
3,77 |
|
|
Fenantreeni |
85-01-8 |
4,09 |
4 |
3,83 |
|
|
Basic Blue 41 (seos) |
26850-47-5 12270-13-2 |
4,89 |
4 |
4,46 |
|
|
DDT |
50-29-3 |
5,63 |
1 |
— |
C.20. LISÄÄNTYMISTESTI VESIKIRPULLA (DAPHNIA MAGNA)
1. MENETELMÄ
Tämä lisääntymismyrkyllisyyden testimenetelmä on toisinto OECD:n testiohjeesta TG 211 (1998).
1.1 JOHDANTO
Testin pääasiallinen tarkoitus on määrittää kemikaalien vaikutus vesikirpun lisääntymistuotokseen.
1.2 MÄÄRITELMÄT JA YKSIKÖT
Emoeläimet: Naarasvesikirput, jotka ovat mukana testin alussa ja joiden lisääntymistuotos määritetään.
Jälkeläiset: Nuoret vesikirput, joita emoeläimet tuottavat testin aikana.
LOEC (Lowest Observed Effect Concentration): Pienin testipitoisuus, jolla aineen havaitaan aiheuttavan tilastollisesti merkittävän vaikutuksen (todennäköisyystasolla p < 0,05) lisääntymiseen ja emokuolleisuuteen kontrolliin verrattuna tietyllä altistusajanjaksolla. Kaikilla LOEC:tä suuremmilla testipitoisuuksilla on kuitenkin oltava vähintään yhtä suuri haittavaikutus kuin LOEC-tasolla havaittu vaikutus. Jos nämä kaksi eivät täyty, on annettava täydellinen selitys siitä, miten LOEC (ja myös NOEC) on valittu.
NOEC (No Observed Effect Concentration): LOEC:tä pienempi testipitoisuus, jolla ei ole kontrolliin verrattuna tietyllä altistusajanjaksolla tilastollisesti merkittävää vaikutusta (todennäköisyystasolla p < 0,05).
EC X : Veteen liuotetun testiaineen pitoisuus, joka aiheuttaa x prosentin laskun vesikirpun lisääntymisessä tietyllä altistusajanjaksolla.
Ominaiskasvu: Populaation kasvu, jossa yhdentyvät lisääntyminen ja ikäspesifinen kuolleisuus (20) (21) (22). Dynaamisessa tasapainossa olevassa populaatiossa ominaiskasvu on nolla. Suurenevissa populaatioissa se on positiivinen ja pienenevissä negatiivinen. Negatiivinen arvo johtaa luonnollisesti lopulta populaation häviämiseen.
Osoittamisraja: Pienin pitoisuus, joka voidaan osoittaa, mutta ei mitata kvantitatiivisesti.
Määritysraja: Pienin pitoisuus, joka voidaan mitata kvantitatiivisesti.
Kuolleisuus: Eläin katsotaan kuolleeksi, kun se ei liiku, ts. ei pysty uimaan tai sen raajoissa tai takaruumiissa ei havaita mitään liikettä sen jälkeen kun testiastiaa on ravisteltu varovasti 15 sekuntia. (Jos käytetään muuta määritelmää, se on ilmoitettava testiselosteessa ja sille on annettava lähdeviite.)
1.3 TESTIMENETELMÄN PERIAATE
Nuoria naarasvesikirppuja (emot), joiden ikä on alle 24 tuntia testin alussa, altistetaan testiaineelle, jota on lisätty veteen useissa pitoisuuksissa. Testin kesto on 21 vuorokautta. Testin lopussa määritetään vielä testin lopussa elossa olevien emojen tuottamien elävien jälkeläisten kokonaismäärä. Tämä tarkoittaa sitä, että testin aikana kuolleiden aikuisten tuottamia poikasia ei sisällytetä tulokseen. Emojen lisääntymistuotos voidaan ilmaista muillakin tavoin (esim. elävien jälkeläisten määrä eläintä kohti päivässä siitä päivästä lähtien, jolloin jälkeläisiä havaittiin ensimmäisen kerran), mutta nämä pitäisi ilmoittaa testin lopussa elossa olevien emojen tuottamien elävien jälkeläisten kokonaismäärän lisäksi. Testiaineelle altistettujen eläinten lisääntymistuotosta verrataan kontrolli(e)n tuotokseen LOEC:n määrittämiseksi ja siten myös NOEC:n määrittämiseksi. Tuloksia analysoidaan lisäksi mahdollisuuksien mukaan regressiomenetelmällä sellaisen pitoisuuden arvioimiseksi, joka aiheuttaisi x prosentin laskun lisääntymistuotoksessa (ts. EC50, EC20 tai EC10)).
Myös emojen eloonjääminen ja ensimmäisten sikiöiden tuottamisen ajankohta on ilmoitettava. Muita testiaineeseen liittyviä, esim. kasvuun (pituus) ja mahdollisesti lisääntymisen ominaisnopeuteen kohdistuvia vaikutuksia voidaan tutkia.
1.4 TESTIAINETTA KOSKEVAT TIEDOT
Vesikirpulla tehdyn välittömän myrkyllisyyden testin tulokset (ks. menetelmä C.2, osa I) pitäisi olla saatavilla. Tuloksesta voi olla hyötyä valittaessa lisääntymistestiin sopivaa testipitoisuusaluetta. Testiaineen vesiliukoisuuden ja höyrynpaineen pitäisi olla tiedossa, ja aineen määrittämiseksi testiliuoksissa pitäisi olla käytettävissä luotettava analyyttinen menetelmä, jonka avulla voidaan ilmoittaa myös saantoteho ja määritysraja.
Sellaisia tietoja, joista voi olla hyötyä testiolosuhteiden määrittelemisessä, ovat mm. rakennekaava, aineen puhtaus, stabiilisuus valossa, stabiilisuus testiolosuhteissa, pKa, Pow. ja helpon biohajoavuuden testin (ks. menetelmä C.4) tulokset.
1.5 TESTIN LUOTETTAVUUS
Jotta testi olisi luotettava, kontrolli(e)n pitäisi täyttää seuraavat kriteerit:
|
— |
emojen (naarasvesikirppujen) kuolleisuus on enintään 20 % testin lopussa, |
|
— |
testin lopussa elossa olevan emon tuottamia eläviä jälkeläisiä on keskimäärin vähintään 60. |
1.6 TESTIMENETELMÄN KUVAUS
1.6.1 Laitteisto
Astioiden ja muiden laitteiden, jotka joutuvat kosketuksiin testiliuosten kanssa, on oltava kokonaan lasia tai muuta kemiallisesti inerttiä materiaalia. Testiastiat ovat tavallisesti lasisia dekantterilaseja.
Lisäksi tarvitaan joitakin tai kaikkia seuraavista laitteista:
|
— |
happimittari (joka on varustettu mikroelektrodilla tai muulla sopivalla laitteella, jolla voidaan mitata liuennut happi pienitilavuuksisissa näytteissä), |
|
— |
asianmukaiset laitteet lämpötilan säätöön, |
|
— |
pH-mittari, |
|
— |
laitteet veden kovuuden mittaamiseen, |
|
— |
laitteet veden orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaispitoisuuden (TOC) mittaamiseen tai kemiallisen hapenkulutuksen (COD) mittaamiseen, |
|
— |
asianmukaiset laitteet valojärjestelmän ja valon intensiteetin säätöön. |
1.6.2 Testiorganismi
Testissä olisi käytettävä Daphnia magna Straus -organismia. Muita vesikirppulajeja saa käyttää, jos ne täyttävät asianmukaiset vaatimukset (kontrollien lisääntymistuottavuutta koskevan vaatimukset pitäisi olla ominainen kyseiselle vesikirppulajille). Jos käytetään muita vesikirppulajeja, niiden täytyy olla selvästi tunnistettuja ja niiden käytön perusteltua.
Klooni olisi mieluiten tunnistettava genotyypin määrityksellä. Tutkimuksissa (1) on osoitettu, että kloonin A (joka on peräisin IRCHA:sta Ranskasta) (3) lisääntymistuottavuus täyttää jatkuvasti vaatimuksen, jonka mukaan tässä menetelmässä kuvatuissa olosuhteissa tuotto on keskimäärin vähintään 60 jälkeläistä kutakin elävää emoa kohti. Muutkin kloonit ovat kuitenkin hyväksyttäviä, jos vesikirppuviljelmän osoitetaan täyttävän testiä koskevan validiteettiperusteen.
Testin alussa eläinten on oltava alle 24 tunnin ikäisiä, eivätkä ne saa olla ensimmäistä sikiösarjaa. Niiden olisi oltava peräisin terveestä varastokannasta (ts. niissä ei saa näkyä merkkejä stressistä kuten korkeaa kuolleisuutta, koiraita ja lepomunia, viivästymistä ensimmäisten sikiöiden tuottamisessa, värihäiriöisiä eläimiä jne.). Varastokannan eläimiä on pidettävä samanlaisissa viljelyoloissa (valo, lämpötila, viljelyneste, ravinto ja eläinten määrä tilavuusyksikköä kohti) kuin testissä käytettäviä. Jos testissä käytettävä viljelyneste eroaa vesikirpun viljelyssä normaalisti käytetystä viljelynesteestä, on hyvä noudattaa käytäntöä, että eläimet totutetaan viljelyoloihin ennen testiä noin kolmen viikon ajan (ts. yhden sukupolven ajan), jotta emojen stressaantuminen vältettäisiin.
1.6.3 Testissä käytettävä viljelyneste
Testiin suositellaan täysin määriteltyä viljelynestettä. Siten voidaan välttää sellaisten lisäaineiden (esim. levät, maaperäuute) käyttö, joiden ominaisuuksia ei voida hallita täydellisesti, ja parannetaan siten mahdollisuuksia laboratorioiden väliseen vakiointiin. Elendtin M4- (4) ja M7-viljelynesteet (ks. lisäys 1) on todettu sopiviksi tähän tarkoitukseen. Muitakin viljelynesteitä (esim. (5) (6)) voidaan käyttää, jos vesikirppuviljelmän osoitetaan täyttävän testiä koskevan validiteettiperusteen.
Jos käytetään viljelynestettä, jossa on kemiallisesti määrittelemättömiä lisäaineita, lisäaineet on spesifioitava selvästi ja testiselosteessa on annettava tietoa niiden koostumuksesta, erityisesti hiilipitoisuudesta, koska se voi vaikuttaa annettavaan ravintoon. Suositellaan, että orgaanisen lisäaineen varastovalmisteen orgaanisiin yhdisteisiin sitoutuneen hiilen kokonaispitoisuus (TOC) ja/tai kemiallinen hapenkulutus (COD) määritetään ja valmisteen vaikutus testissä käytettävän viljelynesteen TOC- ja/tai COD-arvoihin arvioidaan. Viljelynesteen TOC-tason olisi oltava (ennen levien lisäämistä) alle 2 mg/l (7).
Kun testataan metalleja sisältäviä aineita, on tärkeää ottaa huomioon, että testissä käytettävän viljelynesteen ominaisuudet (esim. kovuus, kelaatiokyky) voivat vaikuttaa testiaineen myrkyllisyyteen. Tästä syystä on toivottavaa käyttää kemiallisesti määriteltyä viljelynestettä. Tällä hetkellä kuitenkin ainoat kemiallisesti määritellyt viljelynesteet, joiden tiedetään sopivan Daphnia magnan pitkäaikaiseen viljelyyn, ovat Elendtin M4 ja M7. Molemmissa viljelynesteissä on kelatoivaa ainetta EDTA:ta. On osoitettu (2), että kadmiumin ”näennäinen myrkyllisyys” on yleensä pienempi, kun testi tehdään M4- ja M7-viljelynestcessä kuin nesteessä, joka ei sisällä EDTA:ta. M4- ja M7-viljelynesteitä ei siksi suositella metalleja sisältävien aineiden testaukseen, ja myös muita viljelynesteitä, joissa on tunnettuja kelatoivia aineita, olisi vältettävä. Metalleja sisältäville aineille voi olla suositeltavaa käyttää jotain muuta viljelynestettä, esimerkiksi ASTM:n rekonstituoitua kovaa makeaa vettä (7), joka ei sisällä EDTA:ta ja johon on lisätty leväuutetta (8). Tämä ASTM:n kovan makean veden ja leväuutteen yhdistelmä sopii myös vesikirpun pitkäaikaiseen viljelyyn ja testaukseen (2), vaikka sillä on vielä lievä kelatoiva vaikutus, joka johtuu lisätyn leväuutteen orgaanisista aineista.
Testin alussa ja sen aikana liuenneen hapen pitoisuuden olisi oltava yli 3 mg/l. pH:n olisi oltava välillä 6-9, eikä se saisi yleensä vaihdella enemmän kuin 1,5 yksikköä testin aikana. Kovuudeksi suositellaan yli 140 mg/l (ilmaistuna CaCO3:na). Tällä ja suuremmalla pitoisuudella tehdyissä testeissä on osoitettu validiteettiperusteiden mukaista lisääntymistuottavuutta (9) (10).
1.6.4 Testiliuokset
Halutun pitoiset testiliuokset valmistetaan yleensä laimentamalla varastoliuosta. Varastoliuokset olisi mieluiten tehtävä liuottamalla aine testissä käytettävään viljelynesteeseen.
Orgaanisia liuottimia tai dispergointiaineita voidaan tarvita joissakin tapauksissa sopivan väkevyisen varastoliuoksen valmistamiseksi, mutta tällaisten aineiden käyttöä olisi vältettävä. Sopivia liuottimia ovat esim. asetoni, etanoli, metanoli, dimetyyliformamidi ja trietyleeniglykoli. Sopivia dispergointiaineita ovat esim. Cremophor RH40, 0,01-prosenttinen metyyliselluloosa ja HCO-40. Missään tapauksessa testiaineen pitoisuus testi-liuoksissa ei saa ylittää aineen liukoisuusrajaa testissä käytettävässä viljelynesteessä.
Liuottimia käytetään sellaisen varastoliuoksen valmistamiseksi, joka voidaan annostella veteen tarkasti. Edellä mainitut liuottimet eivät ole myrkyllisiä eivätkä lisää aineen vesiliukoisuutta siinä pitoisuudessa, jota liuottimelle suositellaan lopullisessa testissä käytettävässä viljelynesteessä (ts. ≤ 0,1 ml/l).
Dispergointiaineet voivat helpottaa tarkkaa annostelua ja dispergointia. Edellä mainitut dispergointiaineet eivät ole myrkyllisiä eivätkä lisää aineen vesiliukoisuutta siinä pitoisuudessa, jota dispergointiaineelle suositellaan lopullisessa testissä käytettävässä viljelynesteessä (ts. ≤ 0,1 ml/l).
1.7 TESTIN SUUNNITTELU
Testiaineet jaetaan testiastioihin, joita on tämän jälkeen käsiteltävä satunnaistetusti. Jollei satunnaisteta, saattaa tästä johtua systemaattinen virhe, joka voidaan tulkita pitoisuudesta aiheutuvaksi vaikutukseksi. Erityisesti jos koeastioita käsitellään annostelu- tai pitoisuusjärjestyksessä, saattaa jokin aikaan liittyvä tekijä, kuten työntekijän väsymys tai muu virhe, aiheuttaa voimakkaampia vaikutuksia suuremmilla pitoisuuksilla. Jos lisäksi olosuhteet testin alussa tai ympäristöolosuhteet, kuten sijoituspaikka laboratoriossa, saattavat vaikuttaa testituloksiin, olisi harkittava testin eristämistä.
1.8 TESTIN SUORITUS
1.8.1 Altistumisolosuhteet
1.8.1.1 Testin kesto
Testin kesto on 21 vuorokautta.
1.8.1.2 Vesikirppujen määrä testiastiassa
Emoja pidetään testiastiassa yksi eläin astiaa kohti. Astiaan pannaan 50-100 ml viljelynestettä.
Suurempi tilavuus voi olla joskus tarpeen testiaineen pitoisuuden määritykseen käytettävän analyyttisen menetelmän vaatimusten vuoksi, vaikka rinnakkaisnäytteet voidaan myös yhdistää kemiallista analyysiä varten. Jos tilavuus on yli 100 ml, vesikirpulle annettavaa annosta on ehkä suurennettava, jotta varmistetaan ravinnon riittävyys ja validiteettiperusteiden noudattaminen. Läpivirtaustesteille voidaan harkita muunlaisia suoritustapoja teknisistä syistä (esimerkiksi neljä 10 vesikirpun ryhmää suuressa testitilavuudessa), mutta kaikki muutokset testin suunnittelussa on kirjattava.
1.8.1.3 Eläinten lukumäärä
Puolistaattisissa oloissa tehtävässä testissä on oltava vähintään 10 yksittäin kasvatettua vesikirppua kutakin testipitoisuutta kohti ja vähintään 10 yksittäin pidettyä vesikirppua kontrollisarjassa.
Läpivirtaustesteissä 40 vesikirppua neljään 10 vesikirpun ryhmään jaettuna on osoittautunut sopivaksi (1). Pienempääkin määrää eläimiä voi käyttää. Suositellaan vähintään 20:tä vesikirppua pitoisuutta kohti jaettuna kahdeksi tai useammaksi yhtä monta vesikirppua käsittäväksi rinnakkaisnäytteeksi (esim. neljä rinnakkaista, joista kussakin viisi vesikirppua). On huomattava, että jos vesikirppuja kasvatetaan ryhminä, lisääntymistuotosta ei voi ilmaista elävien jälkeläisten kokonaismääränä testin lopussa elossa olevia emoja kohti, jos emoja kuolee. Tällöin lisääntymistuotos olisi ilmaistava elävien jälkeläisten kokonaismääränä testin alussa mukana olevia emoja kohti.
1.8.1.4 Ruokkiminen
Puolistaattisissa oloissa tehtävässä testissä vesikirppuja olisi ruokittava mieluiten joka päivä mutta ainakin kolmesti viikossa (ts. silloin kun viljelyneste vaihdetaan). Jos tästä poiketaan (esim. läpivirtaustestissä), siitä olisi ilmoitettava.
Testin aikana emojen ruokavalion pitäisi koostua mieluiten seuraavien lajien (yhden tai useamman) elävistä levistä: Chlorella sp., Selenastrum capricornutum (nykyisin Pseudokirchneriella subcapitata (11)) ja Scenedesmus subspicatus. Ruokavalion pitäisi perustua siihen orgaanisen hiilen (C) määrään, joka on annettava kullekin emolle. Tutkimuksissa (12) on osoitettu, että annokset 0,1-0,2 mg C/vesikirppu/vrk riittävät vesikirpulla siihen, että jälkeläisiä saadaan riittävä määrä, jotta testin validiteettiperusteet täyttyvät. Ravintoannos voidaan annostella joko vakionopeudella koko testin ajan tai haluttaessa voidaan alussa käyttää alhaisempaa nopeutta, jota lisätään testin aikana emojen kasvun huomioon ottamiseksi. Tällöinkin annoksen on pysyttävä samana suositellulla alueella 0,1-0,2 mg C/vesikirppu/vuorokausi koko testin ajan.
Jos käytetään muita menetelmiä (kuten leväsolujen määrää tai valon absorptiota) vaaditun ravintoannoksen määrittämiseksi esimerkiksi siksi, että hiilipitoisuuden määritys on aikaa vievää, laboratorioiden on laadittava omat nomogramminsa, josta saadaan leväviljelmän hiilipitoisuus (ks. lisäys 2, ohjeet nomogrammien laatimiseksi). Nomogrammit olisi tarkistettava vähintään kerran vuodessa ja useamminkin, jos levien viljelyolosuhteet muuttuvat. On havaittu että valon absorptio on parempi menetelmä hiilipitoisuuden määrittämiseksi kuin solumäärä (1 3).
Vesikirpulle olisi annettava ravinnoksi konsentroitua leväsuspensiota, jotta testiastioihin lisätyn levänviljelynesteen tilavuus olisi mahdollisimman pieni. Leviä voidaan konsentroida sentrifugoimalla, jonka jälkeen ne suspendoidaan uudelleen veteen, deionisoituun veteen tai vesikirpun viljelynesteeseen.
1.8.1.5 Valo
16 tuntia valoa, jonka intensiteetti on enintään 15-20 μE · m-2 · s-1.
1.8.1.6 Lämpötila
Testissä käytettävän viljelynesteen lämpötilan on oltava 18-22 oC. Lämpötila ei saisi kuitenkaan, jos mahdollista, vaihdella missään testissä enempää kuin 2 oC kyseisissä rajoissa (esim. 18-20, 19-21 tai 20-22 oC). Lämpötilan seuraamista varten voi olla tarpeen lisätä yksi testiastia.
1.8.1.7 Ilmastus
Testiastioita ei saa ilmastaa testin aikana.
1.8.2 Testipitoisuudet
Kokeessa pitäisi olla yleensä vähintään viisi testipitoisuutta geometrisessa sarjassa, eikä kerroin saisi olla suurempi kuin 3,2. Kutakin pitoisuutta kohti olisi käytettävä asianmukaista rinnakkaisnäytteiden määrää, (ks. kohta 1.8.1.3). Jos pitoisuuksien määrä on vähemmän kuin viisi, se on perusteltava. Aineita ei saisi testata niiden liukoisuusrajaa suuremmassa pitoisuudessa.
Pitoisuusalueen valinnassa on otettava huomioon seuraavat seikat:
|
i) |
Jos tarkoitus on määrittää LOEC/NOEC, pienimmän testipitoisuuden on oltava niin pieni, ettei hedelmällisyys tällä pitoisuudella ole merkitsevästi pienempi kuin kontrollilla. Mikäli näin ei ole, testi on toistettava vielä pienemmällä pitoisuudella. |
|
ii) |
Jos tarkoitus on määrittää LOEC/NOEC, suurimman testipitoisuuden on oltava niin suuri, että hedelmällisyys tällä pitoisuudella on merkitsevästi pienempi kuin kontrolleilla. Mikäli näin ei ole, testi on toistettava suuremmalla pitoisuudella. |
|
iii) |
Jos arvioidaan ECX lisääntymisvaikutuksille, suositellaan, että käytetään niin suurta määrää pitoisuuksia, että ECX voidaan määrittää asianmukaisella luotettavuustasolla. Jos arvioidaan EC50 lisääntymisvaikutuksille, suositellaan, että suurin testipitoisuus on suurempi kuin kyseinen EC 50 . Muuten EC50:n luottamusväli on kovin suuri ja voi olla mahdotonta arvioida tyydyttävästi sovitetun mallin asianmukaisuutta, vaikka onkin mahdollista arvioida EC50. |
|
iv) |
Testipitoisuuden joukossa ei saisi olla sellaista pitoisuutta, jolla olisi tilastollisesti merkitsevä vaikutus täysikasvuisten eläinten eloonjäämiseen, koska testi ei silloin olisi enää pelkästään lisääntymistesti, vaan yhdistetty lisääntymis- ja kuolleisuustesti, joka vaatisi paljon monimutkaisempaa tilastollista analyysiä. |
Aikaisemmat tiedot testiaineen myrkyllisyydestä (esim. välittömän myrkyllisyyden testistä ja/tai alustavista pitoisuuskartoitustesteistä saadut tiedot) auttanevat sopivien testipitoisuuksien valitsemisessa.
Jos testiliuosten valmistuksessa käytetään liuottimia tai dispergointiaineita (ks. kohta 1.6.4), niiden lopullinen pitoisuus testiastioissa saisi olla enintään 0,1 ml/l, ja sen olisi oltava sama kaikissa testiastioissa.
1.8.3 Kontrollit
Testisarjan lisäksi on määritettävä yksi viljelynestettä sisältävä kontrollisarja ja tapauksen mukaan yksi kontrollisarja. joka sisältää liuotinta tai dispergointiainetta. Mahdollisen liuottimen tai dispergointiaineen pitoisuuden olisi oltava sama kuin testiainetta sisältävissä testiastioissa. Riittävä määrä rinnakkaisnäytteitä olisi määritettävä (ks. kohta 1.8.1.3).
Yleensä hyvin suoritetussa testissä kontrollinäytteiden emojen tuottamien elävien jälkeläisten määrän keskiarvon vaihtelukerroin saisi olla enintään 25 %, ja tämä olisi ilmoitettava testeille, joissa käytetään yksittäin kasvatettuja eläimiä.
1.8.4 Testissä käytettävän viljelynesteen vaihto
Viljelynesteen vaihtoväli riippuu testiaineen stabiilisuudesta. mutta viljelyneste pitäisi vaihtaa vähintään kolme kertaa viikossa. Jos testiainepitoisuus alustavien testien perusteella (ks. kohta 1.4) ei ole stabiili (ts. ei ole välillä 80-120 % nimellispitoisuudesta tai laskee alle 80 prosentin mitatusta alkupitoisuudesta) pisimmän hyväksytyn vaihtovälin aikana (ts. 3 vrk), olisi harkittava viljelynesteen vaihtamista useammin tai siirtymistä läpivirtaustestiin.
Kun viljelyneste vaihdetaan puolistaattisessa testissä, valmistetaan toinen sarja testiastioita ja emovesikirput siirretään niihin esim. sopivan kokoisella lasipipetillä. Vesikirpun kanssa siirrettävän viljelynesteen tilavuuden pitäisi olla mahdollisimman pieni.
1.8.5 Havainnot
Testin aikana tehtyjen havaintojen tulokset olisi kirjattava testilomakkeille (ks. lisäys 3 ja 4). Jos on tehtävä muita mittauksia (ks. 1.3 ja 1.8.8), on ehkä tehtävä lisähavaintoja.
1.8.6 Jälkeläiset
Kunkin emon tuottamat jälkeläiset olisi mieluiten otettava astiasta ja laskettava päivittäin ensimmäisistä jälkeläisistä lähtien, jotta ne eivät söisi aikuisille tarkoitettua ravintoa. Tässä testissä tarvitsee laskea vain elävät jälkeläiset, mutta kuolleiden munien tai poikasten esiintyminen olisi kirjattava.
1.8.7 Kuolleisuus
Emojen kuolleisuus olisi kirjattava mieluiten päivittäin tai ainakin silloin, kun poikaset lasketaan.
1.8.8 Muut muuttujat
Vaikka tämän menetelmän pääasiallisena tarkoituksena on lisääntymisvaikutusten arviointi, on mahdollista, että muitakin vaikutuksia esiintyy siinä määrin, että ne voidaan analysoida tilastollisesti. Kasvumittaukset ovat hyvin toivottavia, koska niistä saa mahdollisia subletaaleja vaikutuksia koskevia tietoja, jotka voivat olla hyödyllisempiä kuin pelkästään lisääntymisen määrittäminen. Emojen pituuden (ts. pituus ilman pyrstörankaa) mittausta testin lopussa suositellaan. Muita muuttujia, jotka voidaan mitata tai laskea, ovat esim. emon ikä ensimmäisten (ja myöhempien) jälkeläisten syntyessä, jälkeläisten lukumäärä ja koko, ennenaikaisesti syntyneiden jälkeläisten määrä, koiraiden tai lepomunien esiintyminen sekä populaation ominaiskasvunopeus.
1.8.9 Analyyttisten määritysten ja mittausten taajuus
Happipitoisuus, lämpötila, veden kovuus ja pH olisi mitattava vähintään kerran viikossa sekä tuoreesta että vanhasta viljelynesteestä, kontroll(e)ista ja testistä, jossa on suurin testiaineen pitoisuus.
Testin aikana testiaineen pitoisuus määritetään säännöllisin väliajoin.
Suositellaan, että puolistaattisissa testeissä, joissa testiaineen pitoisuuden odotetaan pysyvän ± 20 prosentissa (ts. välillä 80-120 %) nimellispitoisuudesta (ks. kohta 1.4 ja 1.8.4), suurimmat ja pienimmät testissä käytetyt pitoisuudet määritetään tuoreista testiliuoksista ja viljelynestettä vaihdettaessa kerran ensimmäisen testiviikon aikana (ts. määritys olisi tehtävä samasta liuoksesta, kun se on tuore ja kun se vaihdetaan). Nämä määritykset olisi tehtävä tämän jälkeen uudelleen vähintään viikon välein.
Testeissä, joissa testiaineen pitoisuuden ei odoteta pysyvän ± 20 prosentissa nimellisarvosta, on välttämätöntä määrittää testipitoisuudet sekä tuoreesta liuoksesta että liuosta vaihdettaessa. Kuitenkin jos mitattu testiaineen alkupitoisuus ei ole ± 20 prosentissa nimellisarvosta, mutta jos on riittävästi näyttöä siitä, että alkupitoisuudet ovat toistettavia ja stabiileja (ts. välillä 80-120 % alkupitoisuudesta), viikolla 2 ja 3 voitaisiin määrittää vain suurin ja pienin testipitoisuus. Joka tapauksessa testiaineen pitoisuus tarvitsee määrittää liuosta vaihdettaessa vain yhdestä rinnakkaisnäytteestä kullekin pitoisuudelle.
Jos kyseessä on läpivirtaustesti, samanlainen näytteenotto-ohjelma on sopiva kuin puolistaattisissa testeissä (vaikka ”vanhasta” liuoksesta ei tehdä määritystä). Voi kuitenkin olla suositeltavaa lisätä näytteenottoajankohtia ensimmäisen viikon aikana (esim. kolme määrityssarjaa) sen varmistamiseksi, että testipitoisuudet ovat pysyneet muuttumattomina. Tällaisissa testeissä laimentimen ja testiaineen virtausnopeus on tarkistettava päivittäin.
Jos on näyttöä siitä, että testattavan aineen pitoisuus on pysynyt tyydyttävällä tavalla ± 20 prosentissa nimellispitoisuudesta tai alkupitoisuudesta koko testin ajan, tulokset voivat perustua nimellispitoisuuksiin tai alkupitoisuuksiin. Jos poikkeama nimellispitoisuudesta tai alkupitoisuudesta on suurempi kuin ± 20 %, tulokset olisi ilmaistava aikapainotettuina keskiarvoina (ks. lisäys 5).
2. MÄÄRITYSTULOKSET JA TULOSTEN ILMOITTAMINEN
2.1 TULOSTEN KÄSITTELY
Tämän testin tarkoituksena on määrittää testiaineen vaikutus elävien jälkeläisten kokonaismäärään testin lopussa elossa olevien emojen määrää kohti. Elävien jälkeläisten kokonaismäärä emojen määrää kohti olisi laskettava jokaiselle testiastialle (ts. rinnakkaisnäytteille). Jos jossakin rinnakkaisnäytteessä emo kuolee testin aikana tai osoittautuu koiraaksi, kyseinen rinnakkaisnäyte jätetään testin ulkopuolelle. Analyysi perustuu silloin pienempään määrään rinnakkaisnäytteitä.
Kun selvitettäessä kemikaalin vaikutuksia lisääntymistuotokseen määritetään LOEC ja siitä NOEC, on laskettava kaikkien rinnakkaisnäytteiden keskimääräinen lisääntymistuotos kullekin pitoisuudelle ja painotettu jäännösvakiopoikkeama. Tämä voidaan tehdä varianssianalyysillä (ANOVA). Kunkin pitoisuuden keskiarvoa on tämän jälkeen verrattava kontrollien keskiarvoon käyttämällä sopivaa vertailumenetelmää. Dunnettin tai Williamsin testit voivat olla hyödyllisiä (14) (15) (16) (17). On myös tarkistettava, pitääkö ANOVAn olettamus varianssin homogeenisuudesta paikkansa. Suositellaan, että tämä tehdään graafisesti mieluummin kuin formaalilla merkitsevyystestillä (18); sopiva vaihtoehto on Bartlettin testi. Jos oletus ei pidä paikkaansa, on harkittava tulostietojen muuntamista varianssien tasoittamiseksi ennen ANOVAa tai painotetun ANOVAn tekemistä. ANOVAlla määritetty havaittavan vaikutuksen suuruus (ts. pienin merkitsevä ero) olisi laskettava ja ilmoitettava.
Sellaisen pitoisuuden arvioimiseksi, joka aiheuttaisi 50 prosentin pienenemisen lisääntymistuotoksessa (ts. EC50), tulostietoihin olisi sovitettava jokin sopiva käyrä, kuten logistinen käyrä, käyttämällä jotakin tilastomenetelmää, kuten pienimmän neliösumman menetelmää. Käyrään voitaisiin valita sellaiset muuttujat, että EC50 ja sen keskivirhe voidaan määrittää käyrästä suoraan. Tämä helpottaisi suuresti EC50:n luottamusrajojen laskemista. Ellei ole erityisiä syitä käyttää erilaisia luottamusrajoja, kaksipuolinen 95 prosentin raja olisi ilmoitettava. Sovitusmenetelmän pitäisi mielellään olla sellainen, että voidaan arvioida sovituksen onnistumisen (tai sen puutteen) merkitsevyys. Tämä voidaan tehdä graafisesti tai jakamalla jäännösneliösumma sovituksen onnistumista ja puhdasta virhettä koskeviin komponentteihin ja tekemällä merkitsevyystesti sovituksen onnistumiselle. Koska korkeaan hedelmällisyyteen johtavilla käsittelyillä on todennäköisesti suurempi tuotettujen nuorten yksilöiden määrän varianssi kuin alhaiseen hedelmällisyyteen johtavilla käsittelyillä, olisi harkittava havaittujen arvojen painottamista siten, että ne heijastaisivat eri käsittelyryhmien erilaisia variansseja (ks. taustatietoa viitteessä 18).
Lopullisen rengastestin (2) tulostietoja analysoitaessa niihin sovitettiin logistinen käyrä käyttämällä seuraavaa mallia, vaikka muitakin sopivia malleja voi käyttää:

jossa:
|
Y |
= |
nuorten eläinten kokonaismäärä testin lopussa elossa olevaa aikuista eläintä kohti (laskettu kullekin testiastialle) |
|
x: |
= |
testiaineen pitoisuus |
|
c |
= |
nuorten eläinten oletettu määrä, kun x = 0 |
|
x0 |
= |
populaation EC50-arvo |
|
b |
= |
kulmakertoimen laskemisessa käytetty muuttuja. |
Tämä malli sopii todennäköisesti moniin tapauksiin, mutta kaikkiin testeihin se ei ehkä sovi. Mallin validiteetti olisi tarkistettava, kuten edellä on mainittu. Joissakin tapauksissa sopiva malli voi olla sellainen, jossa pienet pitoisuudet aiheuttavat huomattavia vaikutuksia (19).
Muita vaikutuksiin liittyviä pitoisuuksia, kuten EC10 tai EC20, voidaan myös arvioida, vaikka voi olla parempi käyttää mallissa erilaisia muuttujia kuin EC50:n arvioimiseksi käytettyjä.
2.2 TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot:
2.2.1 Testiaine
|
— |
fysikaalinen olomuoto ja fysikokemialliset ominaisuudet, jos niillä on merkitystä, |
|
— |
kemialliset tunnistetiedot, mukaan lukien puhtaus. |
2.2.2 Koelajit
|
— |
kyseessä oleva klooni (onko genotyyppi määritetty), hankintapaikka tai alkuperä (jos se tunnetaan) sekä käytetyt viljelyolosuhteet. Jos käytetään muuta lajia kuin Daphnia magna, se on perusteltava ja ilmoitettava. |
2.2.3 Koeolosuhteet:
|
— |
käytetty testimenetelmä (esim. puolistaattinen tai läpivirtausmenetelmä, vesikirppujen lukumäärä litrassa kokeen alussa, |
|
— |
valoisa aika ja valon intensiteetti, |
|
— |
testin suunnittelu (esim. rinnakkaisnäytteiden määrä, emojen määrä rinnakkaisnäytettä kohti), |
|
— |
käytetty viljelyneste yksityiskohtaisesti, |
|
— |
mahdollisesti käytetyn orgaanisen aineen koostumus, alkuperä, valmistusmenetelmä, varastovalmisteiden TOC/COD, testissä käytetyn viljelynesteen TOC/COD:n arviointi, |
|
— |
yksityiskohtaiset ruokintaa koskevat tiedot, mukaan lukien määrä (mg C/vesikirppu/vrk) ja esim. rehu(je)n tyyppi, myös mahdollisten levien spesifiset nimet (lajit) ja kanta, jos ne tunnetaan, sekä viljelyolosuhteet, |
|
— |
varastoliuosten valmistusmenetelmä ja viljelynesteen vaihtotaajuus (mahdollisen liuottimen tai dispergointiaineen nimi ja pitoisuus on ilmoitettava). |
2.2.4 Tulokset:
|
— |
mahdollisista alustavista testiaineen stabiilisuutta koskevista kokeista saadut tulokset, |
|
— |
nimelliset testipitoisuudet ja kaikkien analyysien tulokset, joissa on määritetty testiaineen pitoisuus testiastiassa (ks. esimerkiksi annetut tuloslomakkeet, lisäys 4); myös menetelmän saantoteho ja määritysraja olisi ilmoitettava, |
|
— |
testiastioissa käytetyn veden laatu (ts. pH, lämpötila ja liuenneen hapen pitoisuus sekä tarvittaessa TOC ja/tai COD ja veden kovuus) (ks. esimerkiksi annettu tuloslomake, lisäys 3), |
|
— |
täydelliset kirjaustiedot kunkin emon elävistä jälkeläisistä (ks. esimerkiksi annettu tuloslomake, liite 3), |
|
— |
emojen kuolemantapausten lukumäärä ja päivämäärät (ks. esimerkiksi annettu tuloslomake, lisäys 3, |
|
— |
kontrollihedelmällisyyden vaihtelukerroin (joka perustuu elävien jälkeläisten kokonaismäärään testin lopussa elossa olevaa emoa kohti), |
|
— |
kuvaaja, josta käy ilmi elävien jälkeläisten kokonaismäärä testin lopussa elossa olevaa emoa kohti (kullekin rinnakkaisnäytteelle) testiaineen pitoisuuden funktiona, |
|
— |
LOEC (Lowest Observed Effect Concentration) lisääntymiselle; käytettyjen tilastomenetelmien kuvaus; maininta siitä, minkä kokoinen vaikutus voitiin osoittaa; NOEC (No Observed Effect Concentration) lisääntymiselle tarvittaessa; tapauksen mukaan myös LOEC/NOEC emojen kuolleisuudelle olisi ilmoitettava, |
|
— |
tarvittaessa ECX lisääntymiselle, luottamusvälit, sen laskemiseen käytetyn sovitetun mallin graafinen kuvaaja, annos-vastekäyrän kulmakerroin ja sen keskivirhe, |
|
— |
muut havaitut biologiset vaikutukset tai muut mittaukset: ilmoitetaan kaikki mahdolliset havaitut tai mitatut biologiset vaikutukset (esim. emojen kasvu) sekä kaikki asianmukaiset perustelut, |
|
— |
selitykset testimenetelmästä poikkeamiseen. |
3. LÄHDELUETTELO
|
(1) |
OECD Test Guideline Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20-21 March 1993. |
|
(2) |
OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997. |
|
(3) |
Baird D. J., Barber J., Bradley M. C., Soares A. M. V. M. and Calow P. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, pp. 257-265. |
|
(4) |
Elendt B. P., (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, pp. 25-33. |
|
(5) |
EPA (1993). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohio. |
|
(6) |
Vigano L., (1991) Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, pp. 775-782. |
|
(7) |
ASTM (1988). Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P.A. 20 pp. |
|
(8) |
Baird D. J., Soares A. M. V. M., Girling A., Barber J., Bradley M. C. and Calow P. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H.Løkke, H. Tyle & F. Bro-Rasmussen. Eds.), pp. 144-148. |
|
(9) |
Parkhurst B. R., Forte J. L. and Wright G. P. (1981). Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, pp. 1-8. |
|
(10) |
Cowgill U. M. and Milazzo D. P. (1990) The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), pp. 185-196. |
|
(11) |
Korshikov (1990). Pseudokirchneriella subcapitata Hindak, F-1990. Biologice Prace, 36, 209. |
|
(12) |
Sims I. R., Watson S. and Holmes D. (1993). Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, pp. 2053-2058. |
|
(13) |
Sims 1. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol.. 128, pp. 459-466. |
|
(14) |
Dunnett C. W., (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, pp. 1096-1121. |
|
(15) |
Dunnett C. W., (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482-491. |
|
(16) |
Williams D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, pp. 103-117. |
|
(17) |
Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, pp. 510-531. |
|
(18) |
Draper N. R. and Smith H. (1981). Applied Regression Analysis, second edition, Wiley, N.Y. |
|
(19) |
Brain P. and Cousens R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, pp. 93-96. |
|
(20) |
Wilson E. O. and Bossert, W. H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers. |
|
(21) |
Poole R. W. (1974). An Introduction to quantitative Ecology. McGraw-Hill Series in Population Biology, New York, pp. 532. |
|
(22) |
Meyer J. S., Ingersoll C. G., McDonald L. L. and Boyce M. S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap tcchniques. Ecology, 67, pp. 1156-1166. |
Lisäys 1
KEMIALLISESTI MÄÄRITELTYJEN ELENDT M7- JA M4-VILJELYNESTEIDEN VALMISTUS
Totuttaminen Elendt M7- ja M4-viljelynesteeseen
Joissakin laboratorioissa on ollut vaikeuksia, kun ne ovat siirtäneet vesikirput suoraan M4- (1) tai M7-viljelynesteeseen. Siirto onnistuu paremmin totuttamalla vesikirput asteittain uuteen viljelynesteeseen: ensin siirretään entisestä viljelynesteestä 30-prosenttiseen, sitten 60-prosenttiseen ja lopulta 100-prosenttiseen Elendt-viljelynesteeseen. Totuttamisvaiheen pitää mahdollisesti olla jopa kuukauden pituinen.
VALMISTELU
Hivenaineet
Ensin valmistetaan erilliset varastoliuokset (1) yksittäisistä hivenaineista sopivalla tavalla, esim. deionisoimalla, tislaamalla tai käänteisosmoosilla puhdistettuun veteen. Näistä eri varastoliuoksista (1) valmistetaan yksi ainoa varastoliuos (11), jossa on kaikkia hivenaineita (yhdistetty liuos), ts:
|
Varastoliuokset I (yksi aine) |
Veteen lisätty määrä (mg/l) |
Pitoisuus (M4-viljelynesteessä) (-kertainen) |
Valmistettaessa yhdistettyä varastoliuosta II lisätään veteen seuraavat määrät varastoliuoksia I (ml/l) |
|
|
M 4 |
M 7 |
|||
|
H3BO3 |
57 190 |
20 000 |
1,0 |
0,25 |
|
MnCl2 * 4 H2O |
7 210 |
20 000 |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000 |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000 |
1,0 |
0,25 |
|
SrCl2 * 6 H2o |
3 040 |
20 000 |
1,0 |
0,25 |
|
NaBr |
320 |
20 000 |
1,0 |
0,25 |
|
Na2MoO4 * 2 H2O |
1 260 |
20 000 |
1,0 |
0,25 |
|
CuCl2 * 2 H2O |
335 |
20 000 |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000 |
1,0 |
1,0 |
|
CoCl2 * 6 H2O |
200 |
20 000 |
1,0 |
1,0 |
|
KI |
65 |
20 000 |
1,0 |
1,0 |
|
Na2SeO3 |
43,8 |
20 000 |
1,0 |
1,0 |
|
NH4VO3 |
11,5 |
20 000 |
1,0 |
1,0 |
|
Na2EDTA * 2 H2O |
5 000 |
2 000 |
— |
— |
|
FeSO4 * 7 H2O |
1 991 |
2 000 |
— |
— |
|
Sekä Na2EDTA- että FeSO4-liuokset valmistetaan erikseen, yhdistetään ja autoklavoidaan välittömästi. Tuloksena on: |
||||
|
21 Fe-EDTA-liuos |
|
1 000 |
20,0 |
5,0 |
M4- ja M7-viljelyneste
M4- ja M7-viljelynesteet valmistetaan käyttäen varastoliuosta II, makroravinteita ja vitamiineja seuraavasti:
|
|
Veteen lisätty määrä (mg/l) |
Pitoisuus (M4-viljelynesteessä) (-kertainen) |
Viljelynesteen valmistamiseen tarvittava varastoliuoksen määrä (ml/l) |
|||||
|
M 4 |
M 7 |
|||||||
|
Varastoliuos II yhdistetyt hivenaineet |
|
20 |
50 |
50 |
||||
|
Makroravinteiden varastoliuos (yksittäisiä aineita) |
||||||||
|
CaCl2 * 2 H2O |
293 800 |
1 000 |
1,0 |
1,0 |
||||
|
MgSO4 * 7 H2O |
246 600 |
2 000 |
0,5 |
0,5 |
||||
|
KCl |
58 000 |
10 000 |
0,1 |
0,1 |
||||
|
NaHCO3 |
64 800 |
1 000 |
1,0 |
1,0 |
||||
|
Na2SiO3 * 9 H2O |
50 000 |
5 000 |
0,2 |
0,2 |
||||
|
NaNO3 |
2 740 |
10 000 |
0,1 |
0,1 |
||||
|
KH2PO4 |
1 430 |
10 000 |
0,1 |
0,1 |
||||
|
K2HPO4 |
1 840 |
10 000 |
0,1 |
0,1 |
||||
|
Yhdistetty vitamiinien varastoliuos |
— |
10 000 |
0,1 |
0,1 |
||||
|
Yhdistetty vitamiinien varastoliuos valmistetaan lisäämällä kaikkia kolmea vitamiinia 1 litraan vettä seuraavasti: |
||||||||
|
Tiamiinihydrokloridi |
750 |
10 000 |
— |
— |
||||
|
Syaanikobalamiini (B12) |
10 |
10 000 |
— |
— |
||||
|
Biotiini |
7,5 |
10 000 |
— |
— |
||||
|
Yhdistetty vitamiinien varastoliuos säilytetään jäädytettynä pienissä erissä. Vitamiinit lisätään viljelynesteeseen vähän ennen käyttöä.
|
||||||||
Lisäys 2
ORGAANISIIN YHDISTEISIIN SITOUTUNEEN HIILEN KOKONAISMÄÄRÄN (TOC) MÄÄRITYS JA NOMOGRAMMIN LAATIMINEN LEVÄREHUN TOC-PITOISUUDELLE
Levärehun hiilipitoisuutta ei tunnetusti mitata suoraan, vaan se määritetään korvaavilla menetelmillä kuten levysolujen määrän tai valon absorption perusteella laadittujen nomogrammien avulla.
TOC olisi mitattava mieluummin korkeassa lämpötilassa tapahtuvan oksidaation avulla kuin UV- tai persulfaattimenetelmällä. (ks. The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinants 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB).
Nomogrammin laatimista varten levät olisi erotettava viljelynesteestä sentrifugoimalla, jonka jälkeen ne suspendoidaan uudelleen tislattuun veteen. Korvaava muuttuja ja TOC-pitoisuus määritetään kustakin näytteestä (kolme rinnakkaista). Tislattuun veteen perustuvat nollanäytteet määritetään ja niiden TOC-pitoisuus vähennetään levänäytteen TOC-pitoisuudesta.
Nomogrammin olisi oltava lineaarinen tarvittavalla hiilipitoisuusalueella. Jäljempänä annetaan esimerkkejä.
Huom. Näitä nomogrammeja ei saisi käyttää muuntamiseen. Jokaisen laboratorion on laadittava omat nomogrammit.



LISÄYS 3
ESIMERKKI LOMAKKEESTA, JOHON KIRJATAAN VILJELYNESTEEN VAIHDOT, FYSIKAALISET JA/TAI KEMIALLISET SEURANTATIEDOT, RUOKKIMINEN. VESIKIRPUN LISÄÄNTYMINEN JA TÄYSIKASVUISTEN KUOLLEISUUS
|
Koe nro: |
Aloituspvm: |
Klooni: |
Viljelyneste |
Ravintotyyppi: |
Testiaine: |
Nimellispitoisuus: |
||||||||||||||||||
|
Päivä |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
|
|
Viljelynesteen vaihto (rasti) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (36) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
tuore |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
vanha |
|
|
|
O2 mg/l (36) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
tuore |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
vanha |
|
|
|
Lämpötila ( oC) (36) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
tuore |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
vanha |
|
|
|
Ruokkiminen (rasti) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Elävien jälkeläisten määrä (37) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Yhteensä |
|
Astia 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Yhteensä |
|
|
Kumulatiivinen aikuisten kuolleisuus (38) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Lisäys 4
ESIMERKKI LOMAKKEESTA, JOHON KIRJATAAN KEMIALLISTEN MÄÄRITYSTEN TULOKSET
(a) Mitatut pitoisuudet
|
Nimellispitoisuus |
Viikon 1 näyte |
Viikon 2 näyte |
Viikon 3 näyte |
|||
|
tuore |
vanha |
tuore |
vanha |
tuore |
vanha |
|
|
|
|
|
|
|
|
|
(b) Mitatut pitoisuudet prosentteina nimellisarvoista
|
Nimellispitoisuus |
Viikon 1 näyte |
Viikon 2 näyte |
Viikon 3 näyte |
|||
|
tuore |
vanha |
tuore |
vanha |
tuore |
vanha |
|
|
|
|
|
|
|
|
|
Lisäys 5
AIKAPAINOTETUN KESKIARVON LASKEMINEN
Aikapainotettu keskiarvo
Koska testiaineen pitoisuus voi laskea viljelynesteen vaihtojen välillä, on harkittava, mikä pitoisuus olisi valittava edustamaan sitä pitoisuusaluetta, jossa emovesikirppu on elänyt. Valinnan pitäisi perustua sekä biologisiin että tilastollisiiin näkökohtiin. Jos esimerkiksi oletetaan, että lisääntymiseen vaikuttaa lähinnä huippupitoisuus, olisi käytettävä suurinta pitoisuutta. Jos taas oletetaan, että myrkyllisen aineen kerääntynyt tai pitkän aikavälin vaikutus on tärkeämpi, keskipitoisuus sopii paremmin. Silloin käytettäväksi sopiva asianmukainen keskiarvo on aikapainotettu keskipitoisuus, koska siinä otetaan huomioon hetkellisten pitoisuuksien vaihtelu ajan funktiona.
Kuva 1
Esimerkki aikapainotetusta keskiarvosta
Kuvassa 1 on (yksinkertaistettu) esimerkki testistä, joka kestää seitsemän päivää ja jossa viljelyneste vaihdetaan päivinä 0, 2 ja 4.
|
— |
Ohut sahaviiva kuvaa pitoisuutta eri ajankohtina. Pitoisuuden laskun oletetaan noudattavan eksponentiaalista hajoamisprosessia. |
|
— |
Kuusi kuvaajaan merkittyä pistettä edustavat havaittuja pitoisuuksia, jotka on mitattu kunkin vaihtoperiodin alussa ja lopussa. |
|
— |
Paksu yhtenäinen viiva esittää aikapainotetun keskiarvon sijaintia. |
Aikapainotettu keskiarvo lasketaan siten, että aikapainotetun keskiarvon kuvaajan alle jäävä pinta-ala on yhtä suuri kuin pitoisuuskäyrän alle jäävä pinta-ala. Edellä olevaa esimerkkiä varten tehty laskutoimitus kuvataan taulukossa 1.
Taulukko 1
Aikapainotetun keskiarvon laskeminen
|
Vaihto nro |
Päiviä |
Conc 0 |
Conc 1 |
Ln(Conc 0) |
Ln(Conc 1) |
Pinta-ala |
|
1 |
2 |
10,000 |
4,493 |
2,303 |
1,503 |
13,767 |
|
2 |
2 |
11,000 |
6,037 |
2,398 |
1,798 |
16,544 |
|
3 |
3 |
10,000 |
4,066 |
2,303 |
1,403 |
19,781 |
|
Päivien kokonaismäärä: 7 |
Kokonaispinta-ala |
50,091 |
||||
|
Aikapainotettu keskiarvo |
7,156 |
|||||
|
”Päiviä” on vaihtojen välissä olevien päivien määrä ”Conc 0” on kunkin vaihtoperiodin alussa mitattu pitoisuus ”Conc 1” on kunkin vaihtoperiodin lopussa mitattu pitoisuus ”Ln(Conc 0)” on Conc 0:n luonnonlogaritmi ”Ln(Conc 1)” on Conc 1:n luonnonlogaritmi ”Pinta-ala” on kutakin vaihtoperiodia vastaavan eksponentiaalisen käyrän alle jäävä pinta-ala
|
||||||
Aikapainotettu keskiarvo on kokonaispinta-ala jaettuna päivien kokonaismäärällä.
Vesikirpun lisääntymistestiä varten taulukon on tietysti katettava 21 päivää.
On selvää, että kun havaintoja tehdään vain kunkin vaihtoperiodin alussa ja lopussa, ei voida olla varmoja siitä, että hajoaminen on todella eksponentiaalista. Erilaisesta käyrästä olisi seurauksena erilainen pinta-ala. Eksponentiaalinen hajoamisprosessi ei kuitenkaan ole epätodennäköinen, ja sitä kuvaava käyrä on todennäköisesti paras, jota voidaan käyttää, kun muuta tietoa ei ole.
On kuitenkin esitettävä varoitus siltä varalta, että kemiallisessa määrityksessä ei havaita kyseistä ainetta lainkaan vaihtoperiodin lopussa. Ellei voida arvioida, kuinka nopeasti aine on hävinnyt liuoksesta, on mahdotonta saada todenmukaista pinta-alaa käyrän alle ja myös mahdotonta määrittää järkevää aikapainotettua keskiarvoa.
C.21. MAAPERÄN MIKROBIT: TYPEN MUUNTUMISTESTI
1. MENETELMÄ
Tämä menetelmä on toisinto OECD:n testiohjeesta nro 216 (2000).
1.1 JOHDANTO
Tämän menetelmän tarkoitus on tutkia laboratoriomenetelmin kemikaalien pitkäaikaisvaikutuksia maaperän mikrobien typpeä muuntavaan toimintaan (typen transformaatioon) kerta-altistuksen jälkeen. Menetelmä perustuu pääosin EPPO:n (Euroopan ja Välimeren maiden kasvinsuojelujärjestön) (1) suosituksiin. Myös muita, esimerkiksi Saksan Biologische Bundesanstaltin (2), Yhdysvaltain ympäristönsuojeluviraston (3), SETACin (4) ja Kansainvälisen standardisoimisjärjestön (5) laatimia ohjeita on otettu huomioon. Menetelmässä käytettävien maanäytteiden määrästä ja tyypistä on sovittu maalajin ja sedimentin valintaa käsitelleessä OECD:n työryhmässä, joka kokoontui Belgiratessa Italiassa vuonna 1995 (6). Maanäytteiden keräämiseen, käsittelyyn ja varastointiin liittyvät suositukset perustuvat ISO:n ohjeisiin (7) sekä Belgiraten työryhmän suosituksiin. Testiaineiden toksisten ominaisuuksien arvioinnin yhteydessä voi olla tarpeen määrittää niiden vaikutukset maaperän mikrobien toimintaan, esimerkiksi kun tarvitaan tietoja kasvinsuojeluaineiden mahdollisista sivuvaikutuksista maaperän pieneliöstöön tai kun on odotettavissa maaperän mikrobien altistuminen muille kemikaaleille kuin kasvinsuojeluaineille. Typen muuntumistestin avulla voidaan määrittää kyseisten kemikaalien vaikutukset maaperän pieneliöstöön. Jos testattavat aineet ovat maatalouskemikaaleja (esimerkiksi kasvinsuojeluaineita, lannoitteita tai metsätalouskemikaaleja), on tehtävä sekä typen että hiilen muuntumistestit. Jos testattavat aineet ovat muita kuin maataloudessa käytettäviä kemikaaleja, pelkkä typen muuntumistesti riittää. Mikäli kyseisten kemikaalien typen muuntumistestistä saadut EC50-arvot ovat kaupallisissa nitrifikaatiota estävissä aineissa (esimerkiksi nitrapyriini) esiintyvällä alueella, hiilen muuntumistesti voidaan tehdä lisätietojen saamiseksi.
Maaperä muodostuu elävästä ja elottomasta aineesta, joka esiintyy erilaisina, heterogeenisina seoksina. Mikrobeilla on tärkeä osuus viljavien maannosten orgaanisen aineen hajottamisessa ja muuttamisessa, ja monet eliölajit vaikuttavat maannoksen viljavuuden eri tekijöihin. Kaikki pitkäaikaiset vaikutukset näihin biokemiallisiin prosesseihin saattavat muuttaa ravinnekiertoa, jolloin maannoksen viljavuus saattaa muuttua. Hiilen ja typen muuntuminen tapahtuu kaikissa viljavissa maannoksissa. Vaikka nämä prosessit aiheuttava mikrobiyhteisö on erilainen eri maalajeissa, muuntumisreitit ovat olennaisilta osin samat.
Tässä kuvatun menetelmän tarkoitus on osoittaa testiaineen pitkäaikaiset haittavaikutukset typen muuntumisprosessiin aerobisissa pintamaissa. Menetelmän avulla voidaan myös arvioida aineiden vaikutusta maaperän pieneliöstön aiheuttamaan hiilen muuntumiseen. Nitraatin muodostuminen tapahtuu hiili-typpisidosten hajoamisen jälkeen. Jos siis nitraatin tuotannon havaitaan olevan samalla tasolla käsitellyissä maanäytteissä ja kontrollinäytteissä, on hyvin todennäköistä, että pääasialliset hiilisidosten hajoamisreitit toimivat hyvin. Menetelmässä käytettävän kasvualustan (jauhettu sinimailasseos) hiili-typpisuhde on edullinen (yleensä 12/1-16/1). Tästä syystä hiilen puute ei ole merkittävää testin aikana, ja jos kemikaali vahingoittaa mikrobiyhteisöjä, ne saattavat toipua 100 päivän kuluessa.
Tämän menetelmän perustana olevat testit ovat olleet tarkoitettuja pääasiassa aineille, joiden maaperään päätyvä määrä on ennakoitavissa. Tällaisia aineita ovat esimerkiksi kasvinsuojeluaineet, sillä niiden annostelu pellolle tiedetään. Maataloudessa käytettävien kemikaalien kohdalla riittää, kun testataan kaksi annostasoa oletetun annostelutiheyden mukaan. Maataloudessa käytettävien kemikaalien osalta voidaan testata tehoaine tai kaupallinen valmiste. Tässä esitetyn menetelmän soveltamisala ei kuitenkaan rajoitu maataloudessa käytettäviin kemikaaleihin. Muuttamalla sekä maaperään annosteltavan testiaineen määrää että tulosten arviointia menetelmällä voidaan testata myös sellaisia kemikaaleja, joiden maaperään päätyvästä määrästä ei ole tietoa. Muista kuin maataloudessa käytettävistä kemikaaleista määritetään useiden konsentraatioiden vaikutukset typen muuntumiseen. Testitulosten perusteella laaditaan annos-vastekäyrä ja lasketaan ECx-arvot, joissa x on määritelty vaikutus prosentteina.
1.2 MÄÄRITELMÄT
Typen muuntuminen: mikrobien toiminnan tuloksena ammonifikaatio- ja nitrifikaatioprosessin kautta tapahtuva, typpeä sisältävän orgaanisen aineen lopullinen hajoaminen vastaavaksi epäorgaaniseksi lopputuotteeksi, nitraatiksi.
EC X (efektiivinen konsentraatio): maaperässä esiintyvä testiaineen konsentraatio, joka estää typen muuntumista nitraatiksi x prosentilla.
EC50 (efektiivinen mediaanikonsentraatio): maaperässä esiintyvä testiaineen konsentraatio, joka estää typen muuntumista nitraatiksi 50 prosentilla.
1.3 VERTAILUAINE
Ei käytössä.
1.4 TESTIMENETELMÄN PERIAATE
Seulottua maa-ainesta parannetaan jauhetulla kasviseoksella, ja se joko käsitellään testiaineella tai jätetään käsittelemättä (kontrollinäyte). Maataloudessa käytettäviä kemikaaleja testattaessa suositellaan käytettäväksi vähintään kahta testikonsentraatiota, ja ne tulee valita suhteessa suurimpaan konsentraatioon, jonka odotetaan esiintyvän kentällä. Näytteitä inkuboidaan, päivinä 0, 7, 14 ja 28 käsitellyt näytteet ja kontrollinäytteet uutetaan sopivaan liuottimeen, ja uutteista määritetään nitraattimäärät. Nitraatinmuodostuksen nopeutta käsitellyissä näytteissä verrataan vastaavaan nopeuteen kontrollinäytteissä ja käsiteltyjen näytteiden ja kontrollinäytteiden välinen prosentuaalinen ero lasketaan. Kaikkia testejä jatketaan vähintään 28 päivän ajan. Jos päivänä 28 käsiteltyjen näytteiden ja kontrollinäytteiden välinen ero on 25 % tai enemmän, mittauksia jatketaan (enintään 100 päivään asti). Jos testattavana on muu kuin maataloudessa käytettävä kemikaali, maanäytteisiin lisätään sarja testiaineen konsentraatioita ja muodostuneen nitraatin määrä mitataan käsitellyistä näytteistä ja kontrollinäytteistä 28 päivän inkubaation jälkeen. Useita konsentraatioita käyttäneiden testien tulokset analysoidaan regressiomallia käyttäen ja ECx-arvot lasketaan (EC50, EC25 ja/tai EC10). Katso kohta Määritelmät.
1.5 TESTIN VALIDITEETTI
Maataloudessa käytettävien kemikaalien testitulosten arviot perustuvat suhteellisen pieniin eroihin (esimerkiksi keskiarvo ± 25 %) käsiteltyjen näytteiden ja kontrollinäytteiden nitraattikonsentraatioiden välillä, joten kontrollinäytteiden suuri vaihtelu voi johtaa virheellisiin tuloksiin. Tästä syystä rinnakkaisten kontrollinäytteiden välisen vaihtelun tulisi olla alle ± 15 %.
1.6 TESTIMENETELMÄN KUVAUS
1.6.1 Laitteet
Testissä käytetään säiliöitä, jotka on valmistettu kemiallisesti inertistä materiaalista. Säiliöiden koon tulee sopia maanäytteiden inkubaatiomenettelyyn (joko massana tai sarjana erillisiä maanäytteitä, katso kohta 1.7.1.2). On syytä varmistaa, että veden haihtuminen testin aikana on minimaalista ja kaasujen vaihtuminen on mahdollista (testisäiliö voidaan esimerkiksi peittää rei’itetyllä polyetyleenikalvolla). Testattaessa helposti haihtuvia aineita tulee käyttää kannellisia ja kaasutiiviitä säiliöitä. Niiden koon tulisi olla sellainen, että maanäyte täyttää noin neljäsosan niiden tilavuudesta.
Testissä käytetään seuraavia tavanomaisia laboratoriovälineitä:
|
— |
sekoituslaite: mekaaninen ravistin tai vastaava laite, |
|
— |
sentrifugi (3 000 g) tai suodatin (käytetään nitraattia sisältämätöntä suodatinpaperia), |
|
— |
nitraattianalyysia varten riittävän herkkä mittalaite, jonka mittaustulos on toistettavissa. |
—1.6.2 Testattavien maalajien valinta ja määrä
Testissä käytetään yhtä maalajia. Näytteeksi valittavan maannoksen suositeltavat ominaisuudet ovat seuraavat:
|
— |
hiekkapitoisuus: vähintään 50 % ja enintään 75 %, |
|
— |
pH: 5,5-7,5, |
|
— |
orgaanisen hiilen pitoisuus: 0,5-1,5 % |
|
— |
mikrobibiomassa mitataan (8)(9), ja sen hiilipitoisuuden tulee olla vähintään 1 % maaperän orgaanisen hiilen kokonaispitoisuudesta. |
Useimmissa tapauksissa tällainen maannos edustaa pahinta mahdollista tapausta, koska testiaineen adsorboituminen on minimaalista ja sen saatavuus pieneliöstölle maksimaalista. Tämän takia ei yleensä ole tarpeen testata muita maalajeja. Kuitenkin joissain olosuhteissa, esimerkiksi kun testiainetta ennakoidaan käytettäväksi ennen kaikkea happamien metsämaiden tapaisissa maannoksissa tai kun kemikaali on elektrostaattisesti varautunut, voi olla tarpeen käyttää testissä myös toista maalajia.
1.6.3 Maanäytteiden kerääminen ja varastointi
1.6.3.1 Kerääminen
Käytettävissä tulisi olla yksityiskohtaiset tiedot näytteenkeräyspaikan historiasta. Näitä tietoja ovat tarkka paikka, kasvipeite, kasvinsuojeluainekäsittelyjen päivämäärät, käsittelyt orgaanisilla ja epäorgaanisilla lannoitteilla, biologisten materiaalien lisäykset tai satunnaiset saastumiskerrat. Näytteenkeräyspaikaksi valitun paikan tulisi olla pitkäaikainen. Sopivia paikkoja ovat jatkuvasti laidunmaana käytettävät alueet, vuosittain korjattavien viljakasvien (paitsi maissin) pellot tai tiheään kylvetyt viherkesannot. Näytteenottopaikaksi soveltuu alue, jota ei ole käsitelty kasvinsuojeluaineilla vähintään vuoteen ennen näytteenottoa. Soveltuvalla alueella ei myöskään ole käytetty orgaanista lannoitetta vähintään kuuteen kuukauteen. Mineraalilannoitteiden käyttö on hyväksyttävää vain silloin, kun se on viljeltävän kasvin vaatimusten mukaista, ja maanäytteet voidaan tällöin ottaa vasta vähintään kolmen kuukauden kuluttua lannoitteen käytöstä. Näytteiden ottamista maasta, jota on käsitelty biosidin tavoin vaikuttavalla lannoitteella (esimerkiksi kalsiumsyanamidilla), tulisi välttää.
Näytteenottoa tulisi välttää pitkien (yli 30 päivää) kuivien tai vedellä kyllästymisjaksojen aikana tai välittömästi niiden jälkeen. Auratuilla mailla näytteet on otettava 0-20 cm:n syvyydestä. Nurmimailla (laitumilla) tai muilla maa-alueilla, joita ei aurata pitkään aikaan (vähintään yhteen kasvukauteen), näytteenoton enimmäissyvyys voi olla hiukan yli 20 cm (esimerkiksi 25 cm).
Maanäytteet tulee kuljettaa säiliöissä ja sellaisessa lämpötilassa, jossa maanäytteen alkuperäiset ominaisuudet eivät muutu merkittävästi.
1.6.3.2 Varastointi
Käytetyn maa-aineksen on mahdollisuuksien mukaan oltava äskettäin maasta otettua. Jos varastointi on välttämätöntä, maanäytteet voidaan varastoida pimeässä 4 (±2) C:n lämpötilassa enintään kolmen kuukauden ajan. Näytteiden varastoinnin aikana on varmistettava, että olosuhteet ovat aerobiset. Jos näytteet on kerätty alueilta, joilla maaperä on jäässä vähintään kolme kuukautta vuodesta, varastointi kuuden kuukauden ajan - 18 — - 22 oC:n lämpötilassa voi tulla kysymykseen. Varastoitavien näytteiden mikrobibiomassa mitataan ennen kutakin koetta. Biomassan hiilipitoisuuden tulee olla vähintään 1 % näytteen orgaanisen hiilen kokonaispitoisuudesta (katso kohta 1.6.2).
1.6.4 Näytteiden käsittely ja valmistelu testiä varten
1.6.4.1 Esi-inkubaatio
Jos näytettä on varastoitu (katso kohta 1.6.3.2), suositellaan sen esi-inkuboimista 2-28 päivän ajan. Esi-inkubaation aikana näytteen lämpötilan ja kosteuspitoisuuden tulisi olla samanlaiset kuin testissä käytetyt (katso kohdat 1.6.4.2 ja 1.7.1.3).
1.6.4.2 Fysiko-kemialliset ominaisuudet
Näytteestä puhdistetaan manuaalisesti suuret hiukkaset (esimerkiksi kivet ja kasvinosat), minkä jälkeen se märkäseulotaan liikaa kuivaamatta 2 mm:n tai tätä pienempään raekokoon. Näytteen kosteuspitoisuus tulee säätää tislatulla tai ionipuhdistetulla vedellä 40-60 %:iin maksimaalisesta vedenpidätyskyvystä.
1.6.4.3 Parannus orgaanisella substraatilla
Maanäytettä tulee parantaa sopivalla orgaanisella substraatilla, esimerkiksi jauhetulla sinimailas-ruohoseoksella (pääaineksena Medicago sativa), jonka hiili-typpisuhde on 12/1-16/1. Suositeltu sinimailasen ja maa-aineksen suhde on 5 g sinimailasta yhteen kiloon maa-ainesta (kuivapaino).
1.6.5 Testiaineen valmistelu näytteeseen annostelua varten
Testiaine annostellaan tavallisesti kantaja-aineen avulla. Kantaja-aineena voi olla vesi (vesiliukoisten testiaineiden tapauksessa) tai inertti kiintoaine, kuten hieno kvartsihiekka (raekoko 0,1-0,5 mm). Muita nestemäisiä kantaja-aineita kuin vettä (esimerkiksi orgaanisia liuottimia, kuten asetonia ja kloroformia) tulee välttää, koska ne saattavat vahingoittaa pieneliöstöä. Jos kantaja-aineena käytetään hiekkaa, se voidaan pinnoittaa testiaineella, joka on liuotettu tai suspendoitu sopivaan liuottimeen. Tällaisissa tapauksissa liuotin tulee poistaa haihduttamalla ennen kuin kantaja-aine sekoitetaan maa-ainekseen. Jotta testiaine leviäisi näytteessä optimaalisesti, suositellaan suhteeksi 10 g hiekkaa yhtä näytteen kuivapainokiloa kohti. Kontrollinäytteet käsitellään vastaavalla määrällä pelkkää vettä ja/tai kvartsihiekkaa.
Testattaessa helposti haihtuvia kemikaaleja tulisi mahdollisuuksien mukaan välttää aineen hävikkiä käsittelyn aikana ja pyrkiä varmistamaan aineen tasainen leviäminen näytteeseen (esimerkiksi ruiskuttamalla testiaine näytteeseen useisiin kohtiin).
1.6.6 Testikonsentraatiot
Jos testataan maataloudessa käytettäviä kemikaaleja, tulee käyttää ainakin kahta konsentraatiota. Pienemmän konsentraation tulee kuvastaa vähintään testiaineen käytännössä maaperään pääsevää maksimimäärää, ja suuremman konsentraation puolestaan tulee olla pienemmän kerrannainen. Maanäytteeseen lisättävät testiaineen konsentraatiot lasketaan olettaen, että aine imeytyy tasaisesti 5 cm:n syvyyteen ja että maamassan tiheyden arvo on 1,5. Testattaessa maataloudessa käytettäviä, suoraan maaperään annosteltavia kemikaaleja tai kemikaaleja, joiden maaperään pääsevä määrä on ennakoitavissa, suositeltavat testikonsentraatiot ovat suurin odotettavissa oleva konsentraatio ympäristössä (Predicted Environmental Concentration, PEC) sekä mainittu konsentraatio kerrottuna viidellä. Testattaessa aineita, joita ennakoidaan annosteltaviksi maaperään useita kertoja kasvukaudessa, testikonsentraatio tulee johtaa kertomalla odotettavissa oleva ympäristössä havaittava enimmäiskonsentraatio ennakoitujen annostelukertojen määrällä. Suurin testikonsentraatio ei kuitenkaan saa olla suurempi kuin kymmenen kertaa suurin yksittäinen annos. Jos testataan muita kuin maataloudessa käytettäviä kemikaaleja, tulee testissä käyttää vähintään viiden konsentraation geometrista sarjaa. Valittujen testikonsentraatioiden tulee kattaa ECx-arvojen määrittämiseksi tarvittava alue.
1.7 TESTIN SUORITUS
1.7.1 Altistusolosuhteet
1.7.1.1 Testinäytteet ja kontrollinäytteet
Jos testataan maataloudessa käytettäviä kemikaaleja, maanäyte jaetaan kolmeen samanpainoiseen osaan. Kahteen osaan sekoitetaan testiaineen sisältävää kantaja-ainetta ja kolmanteen sekoitetaan kantaja-ainetta, joka ei sisällä testiainetta (kontrollinäyte). On suositeltavaa käyttää vähintään kolmea rinnakkaisnäytettä sekä testi- että kontrollinäytteestä. Jos testataan muita kuin maataloudessa käytettäviä kemikaaleja, maanäyte jaetaan kuuteen samanpainoiseen osaan. Viiteen osaan sekoitetaan testiaineen sisältävää kantaja-ainetta ja kuudenteen sekoitetaan kantaja-ainetta, joka ei sisällä testiainetta. On suositeltavaa käyttää kolmea rinnakkaisnäytettä sekä testi- että kontrollinäytteestä. Testiaineen tasainen leviäminen testinäytteisiin tulee varmistaa. Sekoittamisen aikana on vältettävä näytteen tiivistämistä tai muotoutumista palloksi.
1.7.1.2 Maanäytteiden inkubointi
Maanäytteiden inkubointi voidaan toteuttaa kahdella tavalla: massana testi- ja kontrollinäytteestä tai sarjana yksittäisiä, samankokoisia osanäytteitä testi- ja kontrollinäytteestä. Helposti haihtuvien aineiden testi on kuitenkin toteutettava sarjalle yksittäisiä osanäytteitä. Kun maanäytteet inkuboidaan massana, kutakin testi- ja kontrollinäytettä valmistetaan suuri määrä, josta analysoitavat osanäytteet otetaan tarpeen mukaan testin aikana. Alun perin valmistettava testi- ja kontrollinäytteen määrä riippuu osanäytteiden koosta, analysoitavien rinnakkaisnäytteiden määrästä sekä arvioitujen näytteenottokertojen enimmäismäärästä. Massana inkuboidut maanäytteet tulee sekoittaa huolellisesti ennen osanäytteen ottoa. Kun maanäytteet inkuboidaan yksittäisten näytteiden sarjana, kukin testi- ja kontrollimassanäyte jaetaan tarvittaviin osanäytteisiin, joita sitten käytetään tarpeen mukaan. Kokeissa, joissa näytteenottokertoja ennakoidaan olevan enemmän kuin kaksi, osanäytteitä tulee valmistaa riittävästi kaikkia rinnakkaisnäytteitä ja näytteenottokertoja varten. Vähintään kolme testattavan maanäytteen rinnakkaisnäytettä tulee inkuboida aerobisissa olosuhteissa (katso kohta 1.7.1.1). Kaikkien testien aikana tulee käyttää asianmukaisia säiliöitä, joissa on riittävästi ilmatilaa, jotta vältetään anaerobisten olosuhteiden kehittyminen. Kun testataan haihtuvia aineita, testi tulee aina tehdä sarjalle yksittäisiä osanäytteitä.
1.7.1.3 Testiolosuhteet ja testin kesto
Testi toteutetaan pimeässä 20 (±2) oC:n huoneenlämmössä. Maanäytteiden kosteuspitoisuus tulee pitää testin aikana 40-60 %:ssa näytteen maksimaalisesta vedenpidätyskyvystä (katso kohta 1.6.4.2) vaihteluvälillä ± 5 %. Tarvittaessa voidaan lisätä tislattua, ionipuhdistettua vettä.
Testien vähimmäiskesto on 28 päivää. Testattaessa maataloudessa käytettäviä kemikaaleja verrataan testi- ja kontrollinäytteiden nitraatinmuodostusnopeutta. Jos näiden ero on yli 25 % päivänä 28, testiä jatketaan, kunnes saavutetaan 25 %:n tai tätä pienempi ero, tai sadan päivän ajan sen mukaan, kumpaan menee vähemmän aikaa. Testattaessa muita kuin maataloudessa käytettäviä kemikaaleja testi lopetetaan 28 päivän kuluttua. Päivänä 28 määritetään nitraattimäärät testi- ja kontrollinäytteissä sekä lasketaan ECx-arvot.
1.7.2 Näytteenotto ja näytteiden analyysi
1.7.2.1 Näytteenottoaikataulu
Jos testataan maataloudessa käytettäviä kemikaaleja, maanäytteistä analysoidaan nitraatti päivinä 0, 7, 14 ja 28. Jos testiä on jatkettava, jatkomittaukset tehdään 14 päivän välein päivästä 28 lähtien.
Jos testataan muita kuin maataloudessa käytettäviä kemikaaleja, tulee käyttää vähintään viittä testikonsentraatiota ja näytteistä analysoidaan nitraatti testin alussa (päivä 0) ja altistusjakson lopussa (28 päivää). Tarvittaessa voidaan tehdä välimittaus esimerkiksi päivänä 7. Päivänä 28 saatavien tietojen mukaan määritetään kemikaalin ECx-arvo. Haluttaessa voidaan raportoida maanäytteen alkuperäinen nitraattimäärä päivän 0 tietojen perusteella.
1.7.2.2 Maanäytteiden analyysi
Muodostuneen nitraatin määrä määritetään kaikista testi- ja kontrollinäytteiden rinnakkaisnäytteistä kullakin näytteenottokerralla. Nitraatti erotetaan maanäytteestä ravistamalla näytettä sopivassa liuottimessa, esimerkiksi kaliumkloridiliuoksessa (0,1 M). Suositeltava suhde on 5 ml kaliumkloridiliuosta maanäytteen yhtä kuivapainogrammaa kohti. Erotuksen optimoimiseksi maanäytteen ja liuottimen sisältävien säiliöiden tulee olla täytetty vain puolilleen. Sekoituksia ravistellaan 150 rpm 60 minuutin ajan. Sekoitukset sentrifugoidaan tai suodatetaan ja nestefaasista analysoidaan nitraatti. Nestemäiset uutteet, joissa ei ole hiukkasia, voidaan säilyttää ennen analyysia - 20 ± 5 oC:n lämpötilassa enintään kuuden kuukauden ajan.
2. MÄÄRITYSTULOKSET
2.1 TULOSTEN KÄSITTELY
Jos tutkitaan maataloudessa käytettäviä kemikaaleja, kaikissa rinnakkaisnäytteissä muodostuneen nitraatin määrä raportoidaan ja kaikkien rinnakkaisnäytteiden keskiarvoista laaditaan taulukko. Typen muuntumisnopeudet tulee arvioida asianmukaisilla ja yleisesti hyväksytyillä tilastollisilla menetelmillä (esimerkiksi F-testi, 5 %:n merkitsevyystaso). Muodostuneen nitraatin määrät ilmoitetaan milligrammoina per maanäytteen kuivapainokilo per päivä. Kunkin käsittelyn yhteydessä ilmenevää nitraatinmuodostusnopeutta verrataan kontrollinäytteeseen ja prosentuaalinen ero kontrollinäytteeseen verrattuna lasketaan.
Jos testataan muita kuin maataloudessa käytettäviä kemikaaleja, kussakin rinnakkaisnäytteessä muodostuneen nitraatin määrä määritetään ja laaditaan annos-vastekäyrä ECx-arvojen arvioimista varten. Testinäytteissä 28 päivän jälkeen havaittuja nitraattimääriä (mg / maanäytteen kuivapainokilo) verrataan kontrollinäytteissä havaittuihin nitraattimääriin. Näistä tiedoista lasketaan prosentuaaliset estoarvot kaikille testikonsentraatioille. Laaditaan kuvaaja, jossa nämä prosenttiarvot esitetään konsentraation funktiona, ja ECx-arvot lasketaan tilastollisin menetelmin. Luottamusvälit (p = 0,95) lasketuille ECx-arvoille määritetään myös standardimenetelmillä (10)(11)(12).
Suuria typpimääriä sisältävät testiaineet saattavat vaikuttaa testin aikana syntyvän nitraatin määrään. Jos näitä aineita testataan suurilla konsentraatioilla (esimerkiksi kemikaalit, joita ennakoidaan annosteltavan toistuvasti), testiin tulee sisällyttää asianmukaiset kontrollit (esimerkiksi maanäyte ja testiaine ilman kasviseosta). Näistä kontrolleista saadut tiedot tulee ottaa huomioon ECx-arvojen laskennassa.
2.2 TULOSTEN TULKINTA
Kun maataloudessa käytettävien kemikaalien testituloksia arvioitaessa nitraatinmuodostusnopeuden ero alimman testiaineannostuksen (joka vastaa ennakoitua enimmäiskonsentraatiota) ja kontrollinäytteen välillä on 25 % tai vähemmän millä tahansa näytteenottokerralla päivän 28 jälkeen, voidaan arvioida, että testiaineella ei ole pitkäaikaista vaikutusta typen muuntumiseen maaperässä. Arvioitaessa muita kuin maataloudessa käytettäviä kemikaaleja tuloksissa esitetään EC50-, EC25- ja/tai EC10-arvot.
3. TULOSTEN ILMOITTAMINEN
Testiselosteessa on annettava seuraavat tiedot.
|
|
Tunnistetiedot testinäytteestä, mukaan lukien:
|
|
|
Testiaine:
|
|
|
Kasvualusta:
|
|
|
Testiolosuhteet:
|
|
|
Tulokset:
|
4. LÄHDELUETTELO
|
(1) |
EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994. |
|
(2) |
BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (toinen painos 1990). |
|
(3) |
EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. 28. syyskuuta 1987. |
|
(4) |
SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Bryssel. |
|
(5) |
ISO/DIS 14238 (1995). Soil Quality — Determination of Nitrogen Mineralisation and Nitrification in Soils and the Influence of Chemicals on these Processes. Technical Committee ISO/TC 190/SC 4: Soil Quality — Biological Methods. |
|
(6) |
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italia, 18. -20. tammikuuta 1995. |
|
(7) |
ISO 10381-6 (1993). Soil quality — Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(8) |
ISO 14240-1 (1997). Soil quality — Determination of soil microbial biomass — Part 1: Substrate-induced respiration method. |
|
(9) |
ISO 14240-2 (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigation-extraction method. |
|
(10) |
Litchfield, J.T. and Wilcoxon F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113. |
|
(11) |
Finney, D.J. (1971). Probit Analysis. Kolmas painos, Cambridge, Lontoo ja New York. |
|
(12) |
Finney, D.J. (1978). Statistical Methods in Biological Assay. Griffin, Weycombe, Iso-Britannia. |
C.22. MAAPERÄN MIKROBIT: HIILEN MUUNTUMISTESTI
1. MENETELMÄ
Tämä menetelmä on toisinto OECD:n testiohjeesta nro 217 (2000).
1.1 JOHDANTO
Tämän menetelmän tarkoitus on tutkia laboratoriomenetelmin kasvinsuojeluaineiden ja mahdollisesti muiden kemikaalien pitkäaikaisia vaikutuksia maaperän mikrobien hiiltä muuntavaan toimintaan kerta-altistuksen jälkeen. Testi perustuu pääosin Euroopan ja Välimeren alueen kasvinsuojelujärjestön (OEPP) antamiin suosituksiin (1). Myös muiden elinten, esimerkiksi Saksan Biologische Bundesanstaltin (2), Yhdysvaltain ympäristönsuojeluviraston (3), ja SETACin (4) laatimat ohjeet on otettu huomioon. Menetelmässä käytettävien maanäytteiden määrästä ja tyypistä on sovittu maalajin ja sedimentin valintaa käsitelleessä OECD:n työryhmässä, joka kokoontui Belgiratessa Italiassa vuonna 1995 (5). Maanäytteiden keräämiseen, käsittelyyn ja varastointiin liittyvät suositukset perustuvat ISO:n ohjeisiin (6) sekä Belgiraten työryhmän suosituksiin.
Testiaineiden toksisten ominaisuuksien arvioinnin yhteydessä voi olla tarpeen määrittää niiden vaikutukset maaperän mikrobien toimintaan, esimerkiksi silloin kun tarvitaan tietoja kasvinsuojeluaineiden mahdollisista sivuvaikutuksista maaperän pieneliöstöön tai kun on odotettavissa maaperän mikrobien altistuminen muille kemikaaleille kuin kasvinsuojeluaineille. Hiilen muuntumistestin tarkoituksena on määrittää kyseisten kemikaalien vaikutukset maaperän pieneliöstöön. Jos testattavat aineet ovat maatalouskemikaaleja (esimerkiksi kasvinsuojeluaineita, lannoitteita tai metsätalouskemikaaleja), on tehtävä sekä hiilen että typen muuntumistestit. Jos testattavat aineet ovat muita kuin maatalouskemikaaleja, pelkkä typen muuntumistesti riittää. Mikäli kyseisten kemikaalien typen muuntumistestistä saadut EC50-arvot ovat kaupallisissa nitrifikaatiota estävien aineiden (esimerkiksi nitrapyriini) alueella, hiilen muuntumistesti voidaan tehdä lisätietojen saamiseksi.
Maaperä muodostuu elävästä ja elottomasta aineesta, joka esiintyy erilaisina, heterogeenisina seoksina. Mikrobeilla on tärkeä osuus viljavien maannosten orgaanisen aineen hajottamisessa ja muuntamisessa, ja monet eliölajit vaikuttavat maannoksen viljavuuden eri tekijöihin. Kaikki pitkäaikaiset vaikutukset näihin biokemiallisiin prosesseihin saattavat muuttaa ravinnekiertoa, jolloin maannoksen viljavuus saattaa muuttua. Hiilen ja typen muuntumista tapahtuu kaikissa viljavissa maannoksissa. Vaikka nämä prosessit aiheuttava mikrobiyhteisö on erilainen eri maalajeissa, muuntumisreitit ovat olennaisilta osin samat.
Tässä kuvatun menetelmän tarkoitus on todeta testiaineen pitkäaikaiset haittavaikutukset hiilen muuntumisprosessiin aerobisissa pintamaissa. Testin avulla voidaan havaita hiiltä muuntavien mikrobiyhteisöjen koon ja toiminnan muutoksia, koska testi altistaa mikrobiyhteisöt sekä kemialliselle stressille että hiilenpuutteelle. Testissä käytetään hiekkaista maannosta, joka sisältää niukasti orgaanista ainetta. Maannos käsitellään testiaineella ja inkuboidaan olosuhteissa, joissa mikrobien aineenvaihdunta on nopeaa. Tällaisissa olosuhteissa maannoksen sisältämä helposti saatava hiili loppuu nopeasti. Tämä aiheuttaa hiilenpuutteen, joka sekä tappaa mikrobisoluja että aiheuttaa horroksen ja/tai lepoitiöiden muodostumisen. Jos testiä jatketaan yli 28 päivän ajan, näiden reaktioiden summa voidaan mitata (käsittelemätöntä maa-ainesta sisältävistä) kontrollinäytteistä metabolisesti aktiivisen mikrobibiomassan asteittain etenevänä vähenemisenä (7). Jos hiilikadosta kärsivän maa-aineksen biomassaan kohdistuu testiolosuhteissa jonkin kemikaalin vaikutus, testinäytteen biomassa ei mahdollisesti palaudu samalle tasolle kuin kontrollinäytteen. Niinpä testiaineen milloin tahansa testin aikana aiheuttamat häiriöt kestävät usein testin loppuun asti.
Tämän menetelmän perustana olevat testit ovat olleet tarkoitetut pääasiassa aineille, joiden maaperään päätyvä määrä on ennakoitavissa. Tällaisia aineita ovat esimerkiksi kasvinsuojeluaineet, sillä niiden levitystiheys pellolle tiedetään. Maataloudessa käytettävien kemikaalien osalta riittää kahden sellaisen annoksen testaaminen, jotka kuvastavat oletettua levitysannosta. Maatalouskemikaalit voidaan testata tehoaineena tai (kaupallisena) valmisteena. Tässä esitetyn menetelmän soveltamisala ei kuitenkaan rajoitu kemikaaleihin, joiden ympäristössä havaittavat konsentraatiot ovat ennustettavissa. Muuttamalla sekä maannokseen levitettävän testiaineen määrää että tulosten arviointitapaa menetelmällä voidaan testata myös sellaisia kemikaaleja, joiden maaperään päätyvää määrää ei tunneta. Muista kuin maataloudessa käytettävistä kemikaaleista määritetään useiden konsentraatioiden vaikutukset hiilen muuntumiseen. Testitulosten perusteella laaditaan annos-vastekäyrä ja lasketaan ECx-arvot, joissa x on määritelty vaikutus prosentteina.
1.2 MÄÄRITELMÄT
Hiilen muuntuminen: mikrobien toiminnan tuloksena tapahtuva orgaanisen aineen hajoaminen epäorgaaniseksi lopputuotteeksi, hiilidioksidiksi.
EC X (efektiivinen konsentraatio): maaperässä esiintyvä testiaineen konsentraatio, joka estää hiilen muuntumista hiilidioksidiksi x prosentilla.
EC50 (efektiivinen mediaanikonsentraatio): maaperässä esiintyvä testiaineen konsentraatio, joka estää hiilen muuntumista hiilidioksidiksi 50 prosentilla.
1.3 VERTAILUAINE
Ei käytössä.
1.4 TESTIMENETELMÄN PERIAATE
Seulottua maa-ainesta joko käsitellään testiaineella tai käsittely jätetään tekemättä (kontrollinäyte). Maataloudessa käytettäviä kemikaaleja testattaessa suositellaan käytettäväksi vähintään kahta testikonsentraatiota, ja ne tulee valita suhteessa suurimpaan konsentraatioon, jonka odotetaan esiintyvän testattavassa ympäristössä. Inkubaatioajan (0, 7, 14 ja 28 päivää) jälkeen käsiteltyihin näytteisiin ja kontrollinäytteisiin sekoitetaan glukoosia, ja glukoosin aiheuttaman soluhengityksen nopeutta mitataan yhtäjaksoisesti 12 tunnin ajan. Soluhengitysnopeus ilmoitetaan vapautuneena hiilidioksidina (milligrammaa hiilidioksidia/kuivapainokilo/tunti) tai kulutettuna happena (milligrammaa happea / maanäytteen kilo / tunti). Soluhengitysnopeuden keskiarvoa käsitellyissä näytteissä verrataan vastaavaan nopeuteen kontrollinäytteissä ja käsiteltyjen näytteiden ja kontrollinäytteiden välinen prosentuaalinen ero lasketaan. Kaikkia testejä jatketaan vähintään 28 päivän ajan. Jos päivänä 28 käsiteltyjen näytteiden ja kontrollinäytteiden välinen ero on 25 % tai enemmän, mittauksia jatketaan 14 päivän välein enintään 100 päivään asti. Jos testattavana on muu kuin maataloudessa käytettävä kemikaali, maanäytteisiin lisätään sarja testiaineen konsentraatioita, ja muodostuneen glukoosin aiheuttama soluhengitysnopeus (muodostuneen hiilidioksidin tai kulutetun hapen määrän keskiarvo) mitataan käsitellyistä näytteistä ja kontrollinäytteistä 28 päivän inkubaation jälkeen. Useita konsentraatioita käyttäneiden testien tulokset analysoidaan regressiomallia käyttäen ja ECx-arvot lasketaan (EC50, EC25 ja/tai EC10). Katso kohta Määritelmät.
1.5 TESTIN VALIDITEETTI
Maatalouskemikaalien testitulosten arviot perustuvat suhteellisen pieniin eroihin (esimerkiksi keskiarvo ±25 %) käsitellyissä näytteissä ja kontrollinäytteissä vapautuneen hiilidioksidin tai näytteiden kuluttaman hapen välillä, joten kontrollinäytteiden suuri vaihtelu voi johtaa virheellisiin tuloksiin. Tästä syystä rinnakkaisten kontrollinäytteiden välisen vaihtelun pitäisi olla alle ±15 %.
1.6 TESTIMENETELMÄN KUVAUS
1.6.1 Laitteet
Testissä käytetään säiliöitä, jotka on valmistettu kemiallisesti inertistä materiaalista. Säiliöiden on sovittava kooltaan maanäytteiden inkubaatiomenettelyyn (joko koko massana tai sarjana erillisiä maanäytteitä, katso kohta 1.7.1.2). Testin aikana on syytä varmistaa, että veden haihtuminen on mahdollisimman vähäistä ja että kaasujen vaihtuminen on mahdollista (testisäiliö voidaan esimerkiksi peittää rei’itetyllä polyetyleenikalvolla). Testattaessa helposti haihtuvia aineita tulee käyttää kannellisia ja kaasutiiviitä säiliöitä. Niiden koon tulisi olla sellainen, että maanäyte täyttää noin neljäsosan niiden tilavuudesta.
Glukoosin aiheuttaman soluhengityksen mittaamiseksi tarvitaan inkubointijärjestelmä ja mittauslaitteet, joilla voidaan mitata hiilidioksidin tuotantoa tai hapen kulutusta. Tällaisia järjestelmiä ja mittauslaitteita kuvataan jäljempänä mainituissa kirjallisuusviitteissä (8) (9) (10) (11).
1.6.2 Testattavien maalajien valinta ja määrä
Testissä käytetään yhtä maalajia. Näytteeksi valittavan maannoksen suositeltavat ominaisuudet ovat seuraavat:
|
— |
hiekkapitoisuus: vähintään 50 % ja enintään 75 %, |
|
— |
pH: 5,5-7,5, |
|
— |
orgaanisen hiilen pitoisuus: 0,5-1,5 %, |
|
— |
mikrobibiomassa mitataan (12)(13), ja sen hiilipitoisuuden tulee olla vähintään 1 % maaperän orgaanisen hiilen kokonaispitoisuudesta. |
Useimmissa tapauksissa tällainen maannos on hankalin mahdollinen tapaus, koska testiaineen adsorboituminen on minimaalista ja sen saatavuus pieneliöstölle maksimaalista. Tämän vuoksi ei yleensä ole tarpeen testata muita maalajeja. Kuitenkin joissain olosuhteissa, esimerkiksi kun testiainetta ennakoidaan käytettäväksi runsaasti ennen kaikkea happamien metsämaiden tapaisissa maannoksissa tai kun kemikaali on elektrostaattisesti varautunut, voi olla tarpeen käyttää testissä toista maalajia.
1.6.3 Maanäytteiden kerääminen ja varastointi
1.6.3.1 Kerääminen
Näytteenkeräyspaikasta tulisi olla käytettävissä yksityiskohtaiset taustatiedot. Näitä tietoja ovat tarkka sijainti, kasvipeite, kasvinsuojeluainekäsittelyjen päivämäärät, käsittelyt orgaanisilla ja epäorgaanisilla lannoitteilla, biologisten materiaalien lisäykset tai satunnaiset saastumiskerrat. Näytteenkeräyspaikaksi valitun paikan tulisi olla pitkäaikainen. Sopivia paikkoja ovat jatkuvasti laidunmaana käytettävät alueet, vuosittain korjattavien viljakasvien (paitsi maissin) pellot tai tiheään kylvetyt viherkesannot. Näytteenottopaikaksi soveltuu alue, jota ei ole käsitelty kasvinsuojeluaineilla vähintään vuoteen ennen näytteenottoa. Soveltuvalla alueella ei myöskään ole käytetty orgaanista lannoitetta vähintään kuuteen kuukauteen. Mineraalilannoitteiden käyttö on hyväksyttävää vain silloin, kun se on viljeltävän kasvin kannalta tarpeen; maanäytteet voidaan tällöin ottaa vasta vähintään kolmen kuukauden kuluttua lannoitteen käytöstä. Näytteiden ottamista maasta, jota on käsitelty biosidin tavoin vaikuttavalla lannoitteella (esimerkiksi kalsiumsyanamidilla), tulisi välttää.
Näytteenottoa tulisi välttää pitkien (yli 30 päivän) kuivuuden tai vettymisjaksojen aikana tai välittömästi niiden jälkeen. Auratuilla mailla näytteet on otettava 0-20 cm:n syvyydestä. Nurmimailla (laitumilla) tai muilla maa-alueilla, joita ei aurata pitkään aikaan (vähintään yhteen kasvukauteen), näytteenoton enimmäissyvyys voi olla hiukan yli 20 cm (esimerkiksi enintään 25 cm). Maanäytteet on kuljetettava säiliöissä sellaisessa lämpötilassa, jossa maanäytteen alkuperäiset ominaisuudet eivät muutu merkittävästi.
1.6.3.2 Varastointi
Käytetyn maa-aineksen on oltava mieluiten äskettäin maasta otettua. Jos on välttämätöntä käyttää laboratoriossa varastoitua maa-ainesta, maanäytteet voidaan varastoida pimeässä 4 (±2) oC:n lämpötilassa enintään kolmen kuukauden ajan. Näytteiden varastoinnin aikana on varmistettava, että olosuhteet ovat aerobiset. Jos näytteet on kerätty alueilta, joilla maaperä on jäässä vähintään kolme kuukautta vuodesta, varastointi kuuden kuukauden ajan - 18 oC:n lämpötilassa voi tulla kysymykseen. Varastoitavien näytteiden mikrobibiomassa mitataan ennen kutakin koetta. Biomassan hiilipitoisuuden on oltava vähintään 1 % näytteen orgaanisen hiilen kokonaispitoisuudesta (katso kohta 1.6.2).
1.6.4 Näytteiden käsittely ja valmistelu testiä varten
1.6.4.1 Esi-inkubaatio
Jos näytettä on varastoitu (katso kohta 1.6.4.2 ja 1.7.1.3), suositellaan sen esi-inkuboimista 2-28 päivän ajan. Esi-inkubaation aikana näytteen lämpötilan ja kosteuspitoisuuden tulisi olla samanlaiset kuin testissä käytetyt (katso kohdat 1.6.4.2 ja 1.7.1.3)
1.6.4.2 Fysiko-kemialliset ominaisuudet
Näytteestä puhdistetaan manuaalisesti suuret vieraat esineet (esimerkiksi kivet ja kasvinosat), minkä jälkeen se märkäseulotaan liikaa kuivaamatta enintään 2 mm:n raekokoon. Näytteen kosteuspitoisuus tulee säätää tislatulla tai ionipuhdistetulla vedellä 40-60 %:iin maksimaalisesta vedenpidätyskyvystä.
1.6.5 Testiaineen valmistelu näytteeseen annostelua varten
Testiaine annostellaan tavallisesti kantaja-aineen avulla. Kantaja-aineena voi olla vesi (vesiliukoisten testiaineiden yhteydessä) tai inertti kiintoaine, kuten hieno kvartsihiekka (raekoko 0,1-0,5 mm). Muita nestemäisiä kantaja-aineita kuin vettä (esimerkiksi orgaanisia liuottimia, kuten asetonia ja kloroformia) tulee välttää, koska ne saattavat vahingoittaa pieneliöstöä. Jos kantaja-aineena käytetään hiekkaa, se voidaan pinnoittaa testiaineella, joka on liuotettu tai suspendoitu sopivaan liuottimeen. Tällaisissa tapauksissa liuotin tulee poistaa haihduttamalla ennen kuin kantaja-aine sekoitetaan maannokseen. Jotta testiaine leviäisi näytteessä optimaalisesti, suositellaan suhteeksi 10 g hiekkaa yhtä näytteen kuivapainokiloa kohti. Kontrollinäytteet käsitellään vastaavalla määrällä pelkkää vettä ja/tai kvartsihiekkaa.
Testattaessa helposti haihtuvia kemikaaleja tulisi mahdollisuuksien mukaan välttää aineen hävikkiä käsittelyn aikana ja pyrkiä varmistamaan aineen tasainen leviäminen näytteeseen (esimerkiksi ruiskuttamalla testiaine näytteeseen useisiin kohtiin).
1.6.6 Testikonsentraatiot
Jos testataan maataloudessa käytettäviä kemikaaleja tai muita kemikaaleja, joiden pitoisuus ympäristössä on ennustettavissa, tulee käyttää ainakin kahta konsentraatiota. Pienemmän konsentraation tulee kuvastaa vähintään testiaineen käytännössä maaperään pääsevää enimmäismäärää, ja suuremman konsentraation puolestaan tulee olla pienemmän kerrannainen. Maanäytteeseen lisättävät testiaineen konsentraatiot lasketaan olettaen, että aine imeytyy tasaisesti 5 cm:n syvyyteen ja että maamassan tiheyden arvo on 1,5. Testattaessa maataloudessa käytettäviä, suoraan maaperään levitettäviä kemikaaleja tai kemikaaleja, joiden maaperään pääsevä määrä on ennakoitavissa, suositeltavat testikonsentraatiot ovat suurin odotettavissa oleva konsentraatio ympäristössä sekä mainittu konsentraatio kerrottuna viidellä. Testattaessa mahdollisesti useita kertoja kasvukaudessa maaperään levitettäviä aineita testikonsentraatio johdetaan kertomalla suurin odotettavissa oleva konsentraatio ympäristössä ennakoitujen levityskertojen määrällä. Suurin testikonsentraatio voi kuitenkin olla enintään kymmenen kertaa suurempi kuin suurin yksittäinen annos.
Jos testataan muita kuin maataloudessa käytettäviä kemikaaleja, tulee testissä käyttää vähintään viiden konsentraation geometrista sarjaa. Valittujen testikonsentraatioiden tulee kattaa ECx-arvojen määrittämiseksi tarvittava alue.
1.7 TESTIN SUORITUS
1.7.1 Altistusolosuhteet
1.7.1.1 Testinäytteet ja kontrollinäytteet
Jos testataan maataloudessa käytettäviä kemikaaleja, maanäyte jaetaan kolmeen samanpainoiseen osaan. Kahteen osaan sekoitetaan testiaineen sisältävää kantaja-ainetta ja kolmanteen sekoitetaan kantaja-ainetta, joka ei sisällä testiainetta (kontrollinäyte). On suositeltavaa käyttää vähintään kolmea rinnakkaisnäytettä sekä testi- että kontrollinäytteestä. Jos testataan muita kuin maataloudessa käytettäviä kemikaaleja, maanäyte jaetaan kuuteen samanpainoiseen osaan. Viiteen osaan sekoitetaan testiaineen sisältävää kantaja-ainetta ja kuudenteen sekoitetaan kantaja-ainetta, joka ei sisällä testiainetta. On suositeltavaa käyttää kolmea rinnakkaisnäytettä sekä testi- että kontrollinäytteestä. Testiaineen tasainen leviäminen testinäytteisiin tulee varmistaa. Sekoittamisen aikana on vältettävä näytteen tiivistämistä tai muotoutumista palloksi.
1.7.1.2 Maanäytteiden inkubointi
Maanäytteiden inkubointi voidaan toteuttaa kahdella tavalla: massana testi- ja kontrollinäytteestä tai sarjana yksittäisiä, samankokoisia osanäytteitä testi- ja kontrollinäytteestä. Helposti haihtuvien aineiden testi on kuitenkin toteutettava sarjalle yksittäisiä osanäytteitä. Kun maanäytteet inkuboidaan massana, kutakin testi- ja kontrollinäytettä valmistetaan suuri määrä, josta analysoitavat osanäytteet otetaan tarpeen mukaan testin aikana. Alun perin valmistettava testi- ja kontrollinäytteen määrä riippuu osanäytteiden koosta, analysoitavien rinnakkaisnäytteiden määrästä sekä arvioitujen näytteenottokertojen enimmäismäärästä. Massana inkuboidut maanäytteet tulee sekoittaa huolellisesti ennen osanäytteen ottoa. Kun maanäytteet inkuboidaan yksittäisten näytteiden sarjana, kukin testi- ja kontrollimassanäyte jaetaan tarvittaviin osanäytteisiin, joita sitten käytetään tarpeen mukaan. Kokeissa, joissa näytteenottokertoja ennakoidaan olevan enemmän kuin kaksi, osanäytteitä tulee valmistaa riittävästi kaikkia rinnakkaisnäytteitä ja näytteenottokertoja varten. Vähintään kolme testattavan maanäytteen rinnakkaisnäytettä tulee inkuboida aerobisissa olosuhteissa (katso kohta 1.7.1.1). Kaikkien testien aikana tulee käyttää asianmukaisia säiliöitä, joissa on riittävästi ilmatilaa, jotta vältetään anaerobisten olosuhteiden kehittyminen. Kun testataan haihtuvia aineita, testi tulee aina tehdä sarjalle yksittäisiä osanäytteitä.
1.7.1.3 Testiolosuhteet ja testin kesto
Testi toteutetaan pimeässä 20 (±2) oC:n huoneenlämmössä. Maanäytteiden kosteuspitoisuus tulee pitää testin aikana 40-60 %:ssa näytteen maksimaalisesta vedenpidätyskyvystä (katso kohta 1.6.4.2) vaihteluvälillä ±5 %. Tarvittaessa voidaan lisätä tislattua, ionipuhdistettua vettä.
Testien vähimmäiskesto on 28 päivää. Testattaessa maataloudessa käytettäviä kemikaaleja verrataan testi- ja kontrollinäytteissä vapautuneen hiilidioksidin tai kulutetun hapen määrää. Jos näiden ero on yli 25 % päivänä 28, testiä jatketaan, kunnes saavutetaan enintään 25 % suuruinen ero, tai 100 päivän ajan sen mukaan, kumpaan kuluu vähemmän aikaa. Testattaessa muita kuin maataloudessa käytettäviä kemikaaleja testi lopetetaan 28 päivän kuluttua. Päivänä 28 määritetään vapautuneen hiilidioksidin tai kulutetun hapen määrät testi- ja kontrollinäytteissä sekä lasketaan ECx-arvot.
1.7.2 Näytteenotto ja näytteiden analyysi
1.7.2.1 Näytteenottoaikataulu
Jos testataan maataloudessa käytettäviä kemikaaleja, maanäytteistä analysoidaan glukoosin aiheuttama soluhengitysnopeus päivinä 0, 7, 14 ja 28. Jos testiä on jatkettava, jatkomittaukset tehdään 14 päivän välein päivästä 28 lähtien.
Jos testataan muita kuin maataloudessa käytettäviä kemikaaleja, tulee käyttää vähintään viittä testikonsentraatiota, ja näytteistä analysoidaan glukoosin aiheuttama soluhengitys testin alussa (päivä 0) ja altistusjakson lopussa (28 päivää). Tarvittaessa voidaan tehdä välimittaus esimerkiksi päivänä 7. Päivänä 28 saatuja tietoja käytetään kemikaalin ECx-arvon määrittämiseksi. Haluttaessa voidaan arvioida maanäytteen alkuperäinen metabolisesti aktiivisen mikrobibiomassan määrä päivän 0 tietojen perusteella (12).
1.7.2.2 Glukoosin aiheuttaman soluhengitysnopeuden mittaaminen
Glukoosin aiheuttama soluhengitysnopeus mitataan kustakin testi- ja kontrollinäytteestä jokaisella näytteenottokerralla. Maanäytteisiin sekoitetaan sellainen glukoosimäärä, joka riittää aiheuttamaan välittömästi maksimaalisen soluhengitysvasteen. Kullekin maalajille riittävä määrä voidaan määrittää testaamalla esitestissä sarja glukoosipitoisuuksia (14). Hiekkamaannoksille, joiden orgaanisen hiilen pitoisuus on 0,5-1,5 %, riittävä annos on kuitenkin yleensä 2 000-4 000 mg glukoosia / maanäytteen kuivapainokilo. Glukoosi voidaan jauhaa hienoksi yhdessä puhtaan kvartsihiekan kanssa (10 g hiekkaa / maanäytteen kuivapainokilo) ja sekoittaa tasaisesti maanäytteeseen.
Glukoosilla parannettuja maanäytteitä inkuboidaan laitteessa, josta soluhengitysnopeus voidaan mitata joko jatkuvasti, joka tunti tai joka toinen tunti (katso kohta 1.6.1) 20 oC:n (±2) lämpötilassa. Vapautunut hiilidioksidi tai kulutettu happi mitataan yhtäjaksoisesti 12 tunnin aikana. Mittaukset tulee aloittaa mahdollisimman pian eli 1-2 tunnin kuluttua glukoosin lisäämisestä. Mitataan 12 tunnin aikana vapautuneen hiilidioksidin tai kulutetun hapen kokonaismäärä ja määritetään soluhengityksen keskinopeus.
2. MÄÄRITYSTULOKSET
2.1 TULOSTEN KÄSITTELY
Jos tutkitaan maatalouskemikaaleja, kunkin rinnakkaisnäytteessä vapautuneen hiilidioksidin tai kunkin maanäytteen kuluttaman hapen määrä raportoidaan, ja kaikkien rinnakkaisnäytteiden keskiarvoista laaditaan taulukko. Tulokset tulee arvioida asianmukaisilla ja yleisesti hyväksytyillä tilastollisilla menetelmillä (esimerkiksi F-testi, 5 %:n merkitsevyystaso). Glukoosin aiheuttama soluhengitysnopeus ilmoitetaan milligrammoina hiilidioksidia / maanäytteen kuivapainokilo / tunti tai milligrammoina happea / maanäytteen kuivapainokilo / tunti. Kustakin testinäytteestä saatua hiilidioksidin muodostumisnopeuden keskiarvoa tai hapen kulutusnopeuden keskiarvoa verrataan kontrollinäytteen arvoihin ja lasketaan prosentuaalinen poikkeama kontrollista.
Jos testataan muita kuin maataloudessa käytettäviä kemikaaleja, kussakin rinnakkaisnäytteessä vapautuneen hiilidioksidin tai kulutetun hapen määrä määritetään ja laaditaan annos-vastekäyrä ECx-arvojen arvioimista varten. Testinäytteistä 28 päivän jälkeen havaittuja glukoosin aiheuttaman soluhengitysnopeuden arvoja (mg hiilidioksidia / maanäytteen kuivapainokilo / tunti tai mg happea / maanäytteen kuivapainokilo / tunti) verrataan kontrollinäytteistä havaittuihin arvoihin. Näistä tiedoista lasketaan prosentuaaliset estoarvot kaikille testikonsentraatioille. Laaditaan kuvaaja, jossa esitetään prosenttiosuudet konsentraation funktiona, ja ECx-arvot lasketaan tilastollisin menetelmin. Luottamusvälit (p = 0,95) lasketuille ECx-arvoille määritetään myös standardimenetelmillä (15)(16)(17).
2.2 TULOSTEN TULKINTA
Kun maatalouskemikaalien testituloksia arvioitaessa soluhengitysnopeuden ero alimman testiaineannostuksen (joka vastaa ennakoitua enimmäiskonsentraatiota) ja kontrollinäytteen välillä on 25 % tai vähemmän millä tahansa näytteenottokerralla päivän 28 jälkeen, voidaan arvioida, että testiaineella ei ole pitkäaikaista vaikutusta hiilen muuntumiseen maaperässä. Arvioitaessa muita kuin maatalouskemikaaleja tuloksissa esitetään EC50-, EC25-ja/tai EC10-arvot.
3. TULOSTEN ILMOITTAMINEN
TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot:
|
|
Testinäytteen täydelliset tunnistetiedot mukaan luettuina
|
|
|
Testiaine:
|
|
|
Testiolosuhteet:
|
|
|
Tulokset:
|
4. LÄHDELUETTELO
|
(1) |
EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994. |
|
(2) |
BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (toinen painos, 1990). |
|
(3) |
EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. 28. syyskuuta 1987. |
|
(4) |
SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Bryssel. |
|
(5) |
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italia, 18. -20. tammikuuta 1995. |
|
(6) |
ISO 10381-6 (1993). Soil quality — Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(7) |
Anderson, J.P.E. (1987). Handling and Storage of Soils for Pesticide Experiments, teoksessa ”Pesticide Effects on Soil Microflora”. Toim. L. Somerville and M.P. Greaves, luku 3: 45-60. |
|
(8) |
Anderson, J.P.E. (1982). Soil Respiration, teoksessa ”Methods of Soil Analysis — Part 2: Chemical and Microbiological Properties”. Agronomy Monograph № 9. Toim. A.L. Page, R.H. Miller and D.R. Keeney. 41: 831-871. |
|
(9) |
ISO 11266-1. (1993). Soil Quality — Guidance on Laboratory Tests for Biodegradation in Soil: Part 1. Aerobic Conditions. |
|
(10) |
ISO 14239 (1997E). Soil Quality — Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions. |
|
(11) |
Heinemeyer, O., Insam, H., Kaiser, E.A, and Walenzik, G. (1989). Soil microbial biomass and respiration measurements; an automated technique based on infrared gas analyses. Plant and Soil, 116: 77-81. |
|
(12) |
ISO 14240-1 (1997). Soil quality — Determination of soil microbial biomass — Part 1: Substrate-induced respiration method. |
|
(13) |
ISO 14240-2 (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigation- extraction method. |
|
(14) |
Malkomes, H.-P. (1986). Einfluß von Glukosemenge auf die Reaktion der Kurzzeit-Atmung im Boden Gegenüber Pflanzenschutzmitteln, Dargestellt am Beispiel eines Herbizide. (Influence of the Amount of Glucose Added to the Soil on the Effect of Pesticides in Short-Term Respiration, using a Herbicide as an Example). Nachrichtenbl. Deut. Pflanzenschutzd., Braunschweig, 38: 113-120. |
|
(15) |
Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113. |
|
(16) |
Finney, D.J. (1971). Probit Analysis. 3. painos, toim., Cambridge, Lontoo ja New York. |
|
(17) |
Finney D.J. (1978). Statistical Methods in Biological Assay. Griffin, Weycombe, Iso-Britannia. |
(1) C.23. KEMIKAALIEN AEROBINEN JA ANAEROBINEN HAJOAMINEN MAAPERÄSSÄ
1. MENETELMÄ
Tämä menetelmä on toisinto OECD:n testiohjeesta nro 307 (2002)
1.1 JOHDANTO
Tämä menetelmä perustuu aikaisempiin ohjeisiin 1, 2, 3, 4, 5, 6, 7, 8 ja 9. Kuvatun testimenetelmän tarkoitus on arvioida kemikaalien aerobista ja anaerobista hajoamista maaperässä. Testien avulla määritetään i) testiaineen hajoamisnopeus sekä ii) sellaisten hajoamistuotteiden laatu, joille kasvit ja maaperän mikrobit saattavat altistua, ja niiden muodostumis- ja häviämisnopeus. Nämä tutkimukset on tehtävä kemikaaleille, joita levitetään suoraan maaperään tai jotka todennäköisesti päätyvät maaperään. Laboratoriotutkimusten tulosten pohjalta voidaan myös kehittää vastaavissa kenttätutkimuksissa käytettäviä näytteenotto- ja analyysikäytäntöjä.
Hajoamisreittien arvioimiseksi riittää yleensä aerobinen ja anaerobinen testi yhdellä maannostyypillä (8)(10)(11). Hajoamisnopeuksien määrittämiseksi on käytettävä sen lisäksi vähintään kolmea maannostyyppiä (8)(10).
Belgiratessa Italiassa vuonna 1995 pidetyssä maannosten ja sedimenttien valintaa käsitelleessä OECD:n työryhmän kokouksessa sovittiin erityisesti tässä testissä käytettävien maannosten määrästä ja tyypeistä (10). Testattavien maannostyyppien pitää edustaa kattavasti ympäristöolosuhteita, joissa testiainetta käytetään tai joissa päästöt tapahtuvat. Esimerkiksi testattaessa kemikaaleja, joiden päästöjä saattaa tapahtua subtrooppisissa tai trooppisissa ilmastotyypeissä, täytyy käyttää FAO:n järjestelmän mukaisia Ferrasol (rauta-alu-maannos)- ja Nitosol (hohtosavimaannos) -tyyppejä. Työryhmä esitti myös maanäytteiden keräämiseen, käsittelyyn ja varastointiin liittyviä suosituksia, jotka perustuvat ISO:n ohjeisiin (15). Menetelmässä otetaan huomioon myös riisin kosteikkoviljelyyn käytettävät maannokset.
1.2 MÄÄRITELMÄT
Testiaine: mikä tahansa aine, joko alkutuote tai merkitykselliset hajoamistuotteet.
Hajoamistuotteet: kaikki aineet, jotka syntyvät testiaineen bioottisista tai abioottisista hajoamisreaktioista, mukaan luettuina CO2 ja tuotteet, jotka ovat sitoutuneissa jäämissä.
Sitoutuneet jäämät: maaperässä, kasveissa tai eläimissä esiintyvät yhdisteet, jotka uuttamisen jälkeen säilyvät matriisissa alkutuotteen tai sen metaboliitin (metaboliittien) / hajoamistuotteiden muodossa. Uuttomenetelmä ei saa olennaisesti muuttaa itse yhdisteitä tai matriisin rakennetta. Sidoksen luonnetta voidaan osittain selventää matriisia muuttavilla uuttomenetelmillä ja kehittyneillä analyysitekniikoilla. Tähän mennessä on tunnistettu tällä tavalla esimerkiksi kovalentit ioni- ja sorptiosidokset sekä sulkeuma-aineet. Yleisesti voidaan todeta, että sitoutuneiden jäämien muodostuminen vähentää aineen biologista saatavuutta ja hyötyosuutta merkittävästi (12) [vuodelta 1984 olevaan IUPAC-nimikkeistön tehty muutos (13)].
Aerobinen hajoaminen: reaktiot, joihin osallistuu molekyylistä happea (14).
Anaerobinen hajoaminen: reaktiot, joihin ei osallistu molekyylistä happea (14).
Maaperä: pienten organismien (pääasiassa mikro-organismien) eloperäiseksi tekemä sekoitus mineraalisia ja orgaanisia kemiallisia ainesosia, joista jälkimmäisiin sisältyy suuren hiili- ja typpipitoisuuden sisältäviä yhdisteitä sekä molekyylipainoltaan suuria yhdisteitä. Maaperää voidaan käsitellä kahdessa eri tilassa:
|
a) |
luonnontilaisena eli siinä muodossa, johon se on ajan kuluessa kehittynyt maannostyypilleen luonteenomaisiksi kerrostumiksi; |
|
b) |
häiriintyneenä eli siinä muodossa, jossa se yleensä esiintyy viljellyissä peltomaissa tai tätä testimenetelmää varten kaivetuissa näytteissä (14). |
Mineralisaatio: orgaanisen yhdisteen täydellinen hajoaminen CO2:ksi ja H2O:ksi aerobisissa olosuhteissa sekä CH4:ksi, CO2:ksi ja H2O:ksi anaerobisissa olosuhteissa. Tässä testimenetelmässä käytettäessä merkkiaineena l4C:ta mineralisaatio tarkoittaa laajaa hajoamista, jonka aikana merkitty hiiliatomi hapettuu ja vapautuu asianmukainen määrä 14CO2:ta (14).
Puoliintumisaika: t0,5 on aika, joka kuluu testiaineen 50-prosenttiseen hajoamiseen tapauksissa, joissa hajoaminen voidaan kuvata ensimmäisen asteen kinetiikan avulla. Puoliintumisaika ei riipu konsentraatiosta.
Häviämisaika 50 (DT 50 ): aika, jonka kuluessa testiaineen konsentraatio vähenee 50 %:lla; tämä arvo on eri kuin puoliintumisaika t0,5 silloin kun hajoamista ei voi kuvata ensimmäisen asteen kinetiikan avulla.
Häviämisaika 75 (DT 75 ): aika, jonka kuluessa testiaineen konsentraatio vähenee 75 %:lla.
Häviämisaika 90 (DT 90 ): aika, jonka kuluessa testiaineen konsentraatio vähenee 90 %:lla.
1.3 VERTAILUAINEET
Hajoamistuotteiden karakterisointiin ja/tai tunnistukseen spektroskopia- ja krotomatografiamenetelmillä olisi käytettävä vertailuaineita.
1.4 TESTIN SOVELLUSALA
Menetelmää voidaan soveltaa kaikkiin kemiallisiin aineisiin (joita ei ole merkitty merkkiaineella tai jotka on merkitty radioaktiivisella merkkiaineella), joiden analysointiin on olemassa riittävän tarkka ja herkkä menetelmä. Tässä kuvattua menetelmää voidaan soveltaa lievästi haihtuviin, haihtumattomiin, vesiliukoisiin tai veteen liukenemattomiin yhdisteisiin. Menetelmää ei voida soveltaa kemikaaleihin, jotka haihtuvat helposti maaperästä (esimerkiksi savuavat aineet tai orgaaniset liuottimet) ja jotka eivät siis säily maaperässä tässä kuvatuissa testiolosuhteissa.
1.5 TESTIAINETTA KOSKEVAT TIEDOT
Hajoamisnopeuden mittaamiseen voidaan käyttää merkittyä tai merkitsemätöntä testiainetta. Merkkiaineen (leiman) käyttö on välttämätöntä tutkittaessa hajoamisreittejä ja määritettäessä massatasetta. 14C on suositeltava merkkiaine, mutta muitakin isotooppeja, kuten 13C:ta, 15N:ta, 3H:ta tai 32P:ta voidaan käyttää. Leiman pitäisi mahdollisuuksien mukaan sijaita molekyylin stabiileimmassa osassa tai osissa (39). Testiaineen puhtausasteen tulisi olla vähintään 95 %.
Ennen kuin tehdään testi, joka koskee aerobista ja anaerobista hajoamista maaperässä, testiaineesta täytyy selvittää seuraavat tiedot:
|
a) |
vesiliukoisuus (menetelmä A.6); |
|
b) |
liukoisuus orgaanisiin liuottimiin; |
|
c) |
höyrynpaine (menetelmä A.4) ja Henryn lain vakio |
|
d) |
n-oktanoli/vesi-jakaantumiskerroin (menetelmä A.8); |
|
e) |
kemiallinen pysyvyys pimeässä (hydrolyysi) (menetelmä C.7); |
|
f) |
pKa, jos molekyylilla on taipumus protonoitua tai deprotonoitua [OECD:n ohje 112] (16). |
Muita tarpeellisia tietoja saattavat olla tiedot testiaineen myrkyllisyydestä maaperän mikrobeille [testimenetelmät C.21 ja C.22] (16).
Testiaineen sekä sen hajoamistuotteiden määrien mittaamiseen ja tunnistukseen on oltava käytettävissä sopivat analyysimenetelmät (myös uutto-ja puhdistusmenetelmät).
1.6 TESTIMENETELMÄN PERIAATE
Maanäytteet käsitellään testiaineella ja inkuboidaan pimeässä Erlenmeyer-pulloissa tai läpivirtausjärjestelmässä valvotuissa laboratorio-olosuhteissa (lämpötilan ja maaperänäytteen kosteuspitoisuuden ollessa vakio). Maanäytteet uutetaan sopivin väliajoin ja niistä analysoidaan alkutuote ja hajoamistuotteet. Myös helposti haihtuvat hajoamistuotteet kerätään analysoitaviksi sopivien absorptiolaitteiden avulla. Kun käytetään 14C-merkkiainetta, voidaan eri mineralisaationopeudet mitata ottamalla talteen näytteessä kehittynyt 14CO2, jolloin massatase sekä muodostuneet maannokseen sitoutuneet jäämät voidaan määrittää.
1.7 LAATUVAATIMUKSET
1.7.1 Saanto
Vähintään kahden maanäytteen uutto ja analysointi heti testiaineen lisäämisen jälkeen antaa alustavia tietoja analyysimenetelmän toistettavuudesta ja sen testiaineeseen lisäämisen tasaisuudesta. Saanto testin myöhemmissä vaiheissa saadaan massataseista. Saantojen tulisi olla 90-110 % käytettäessä merkkiainetta (S) ja 70-110 %, kun merkkiainetta ei käytetä (3).
1.7.2 Analyysimenetelmän toistettavuus ja herkkyys
Analyysimenetelmän toistettavuus (lukuun ottamatta alussa tehtävän uuton tehokkuutta) testiaineen ja hajoamistuotteiden kvantifioinnin osalta voidaan varmistaa kaksoismäärittämällä samasta maannoksesta tehty uute, jota on inkuboitu niin kauan, että hajoamistuotteita on ehtinyt muodostua.
Testiaineen ja hajoamistuotteiden osalta analyysimenetelmän osoitusrajan (LOD) on oltava vähintään 0,01 mg·kg-1 maanäytettä (testiaine) tai 1 % käytetystä annoksesta sen mukaan, kumpi on pienempi. Kvantifiointiraja (LOQ) on myös määritettävä.
1.7.3 Hajoamisreaktiossa saatujen mittaustulosten tarkkuus (luotettavuus)
Hajoamista kuvaavan käyrän luotettavuudesta saadaan tarvittavat tiedot tekemällä regressioanalyysi testiaineen konsentraatioista ajan funktiona, jolloin voidaan laskea puoliintumisaikojen luottamusvälit (kun reaktio noudattaa näennäistä ensimmäisen asteen kinetiikkaa) tai DT50-arvot sekä tarvittaessa DT75- ja DT90-arvot.
1.8 TESTIMENETELMÄN KUVAUS
1.8.1 Laitteet ja kemialliset reagenssit
Inkubointijärjestelmänä voi olla staattinen suljettu järjestelmä tai sopiva läpivirtausjärjestelmä (7)(17). Esimerkit maanäytteen inkubointiin soveltuvasta läpivirtausjärjestelmästä ja Erlenmeyer-pullosta ovat kuvissa 1 ja 2. Molemmilla järjestelmillä on omat etunsa ja rajoituksensa (7)(17).
Testiin tarvitaan tavanomaisia laboratoriolaitteita ja erityisesti seuraavia:
|
— |
analyyttisiä laitteita, kuten GLC-, HPLC- ja TLC-laitteet, mukaan luettuina radioaktiivisten tai muiden kuin radioaktiivisten merkkiaineiden osoittamiseen soveltuvat järjestelmät tai käänteinen isotooppilaimennusmenetelmä, |
|
— |
tunnistukseen käytettävät laitteet (esimerkiksi MS-, GC-MS-, HPLC-MS-spektrometri tai NMR-laite), |
|
— |
nestetuikelaskin, |
|
— |
hapetin radioaktiivisten aineiden polttamista varten, |
|
— |
sentrifugi, |
|
— |
uuttovälineet (esimerkiksi sentrifugiputkia kylmäuuttoa varten ja Soxhlet-uuttolaite jatkuvaa takaisinvirtausuuttoa varten), |
|
— |
liuosten ja uutteiden konsentrointivälineet (esimerkiksi pyöröhaihdutin), |
|
— |
vesihaude, |
|
— |
mekaaninen sekoituslaite (esimerkiksi sekoituskone tai pyörivä sekoitin). |
Esimerkiksi seuraavia kemiallisia reagensseja tarvitaan:
|
— |
NaOH, analyysilaatu, 2 mol · dm-3, tai muu sopiva emäs (esimerkiksi KOH, etanoliamiini), |
|
— |
H2SO4, analyysilaatu, 0,05 mol · dm-3, |
|
— |
etyleeniglykoli, analyysilaatu, |
|
— |
kiinteät absorptiomateriaalit, kuten natronkalkki ja polyuretaanitulpat, |
|
— |
orgaaniset liuottimet, analyysilaatu, kuten asetoni tai metanoli, |
|
— |
tuikeneste. |
1.8.2 Testiaineen annostelu
Maanäytteeseen annostelua ja levittämistä varten testiaine voidaan liuottaa (ionipuhdistettuun tai tislattuun) veteen tai tarvittaessa pienimpään mahdolliseen määrään asetonia tai muuta orgaanista liuotinta (6), jossa testiaine on riittävän liukoinen ja stabiili. Valittu liuotin ei kuitenkaan saa vaikuttaa merkittävästi maaperän mikrobien toimintaan (katso kohdat 1.5 ja 1.9.2-1.9.3). Testissä on vältettävä käyttämästä mikrobien toimintaa estävien liuottimien, kuten kloroformin, dikloorimetaanin ja muiden halogenoitujen liuottimien käyttöä.
Testiaine voidaan annostella myös kiinteässä muodossa, esimerkiksi sekoitettuna kvartsihiekkaan (6) tai pieneen maanäytteen osanäytteeseen, joka on ilmakuivattu ja steriloitu. Jos testiaine lisätään liuottimen avulla, liuottimen on annettava haihtua ennen testiainetta sisältävän osanäytteen lisäämistä alkuperäiseen epästeriiliin maanäytteeseen.
Testattaessa yleiskemikaaleja, jotka joutuvat maaperään pääasiassa jätevesilietteen kautta tai maatalouskäytön yhteydessä, testiaine on ensin lisättävä lietteeseen, joka sitten annostellaan maanäytteeseen (katso kohdat 1.9.2 ja 1.9.3).
Kaupallisten valmisteiden käyttäminen testissä ei ole yleensä suositeltavaa. Se voi kuitenkin tulla kysymykseen esimerkiksi heikosti liukenevien testiaineiden kohdalla.
1.8.3 Maannokset
1.8.3.1 Muunnoksen valinta
Hajoamisreitin määrittämiseksi voidaan käyttää edustavaa maannostyyppiä. Suositeltava maannostyyppi on [FAO:n ja USDA:n luokituksen mukaan (18)] hiekkapitoinen hiesu, silttipitoinen hiesu, hiesu tai hiesupitoinen hiekka, jonka pH on 5,5-8,0, orgaanisen hiilen pitoisuus 0,5-2,5 % ja mikrobibiomassa vähintään 1 % orgaanisen hiilen kokonaismäärästä (10).
Hajoamisnopeuden määrittämiseksi on lisäksi testattava vähintään kolme erilaista edustavaa maannostyyppiä. Kunkin maannostyypin orgaanisen hiilen pitoisuuden, pH:n, savipitoisuuden ja mikrobibiomassan on oltava erilaiset (10).
Kaikista maannostyypeistä on tutkittava ainakin rakenne (hiekka-, siltti- ja saviprosentti) [FAO:n ja USDA:n luokituksen mukaan (18)] ja määritettävä pH, kationinvaihtokyky, orgaaninen hiili, bulkkitiheys, vedenpidätyskyky (40) ja mikrobibiomassa (vain aerobisissa testeissä). Tulosten tulkinnassa muistakin maannoksen ominaisuuksia koskevista tiedoista voi olla hyötyä. Maannoksen ominaisuuksia voidaan määrittää lähteissä (19), (20), (21), (22) ja (23) suositeltujen menetelmien avulla. Mikrobibiomassa on määritettävä substraatin indusoiman soluhengityksen (SIR) menetelmällä (25)(26) tai muulla vastaavalla menetelmällä (20).
1.8.3.2 Maanäytteiden kerääminen, käsittely ja varastointi
Yksityiskohtaiset taustatiedot maanäytteiden keruupaikasta on oltava saatavilla. Tarvittavat tiedot ovat tarkka paikka, kasvipeite, kemikaalikäsittelyt, käsittelyt orgaanisilla ja epäorgaanisilla lannoitteilla, biologisten materiaalien lisääminen tai muu saastuminen. Hajoamistestissä ei pitäisi käyttää maannoksia, joita on käsitelty testiaineella tai sen kanssa rakenteellisesti analogisella aineella edeltävän neljän vuoden aikana (10)(15).
Maa-aineksen on oltava äskettäin maasta otettua (A-horisontista eli ylimmän 20 cm:n kerroksesta), ja sen vesipitoisuuden tulisi olla seulomiseen sopiva. Näytteenottoa muista maannostyypeistä kuin kosteikkoviljelmistä on vältettävä pitkien (> 30 päivää) kuivuus-, jäätymis- tai tulvajaksojen (14) aikana tai heti niiden jälkeen. Maanäytteet on kuljetettava siten, että niiden vesipitoisuus muuttuu mahdollisimman vähän, ja ne on säilytettävä pimeässä ja ilmavassa tilassa. Tähän tarkoitukseen sopii yleensä löyhästi sidottu polyetyleenipussi.
Maanäytteet on käsiteltävä mahdollisimman pian näytteenoton jälkeen. Kasvit, maaperän suuremmat eliöt ja kivet on poistettava ennen näytteen seulomista 2 mm:n seulalla, joka poistaa pikkukivet, eläimet ja kasvinosat. Näytteen liiallista kuivaamista ja murskaamista ennen seulontaa on vältettävä (15).
Kun näytteen ottaminen pellolta on talvella vaikeaa (maan ollessa jäässä tai lumikerroksen peitossa), näyte voidaan ottaa maannoserästä, joka on varastoitu kasvihuoneessa kasvipeitteen alla (esimerkiksi ruohon tai ruohon ja apilan sekoituksen alla). Testissä on erittäin suotavaa käyttää juuri kerättyjä näytteitä, mutta jos kerätty ja käsitelty näyte on varastoitava ennen testin alkua, varastointiolosuhteiden on oltava asianmukaiset ja varastointiajan lyhyt (4 ± 2 oC enintään kolmen kuukauden ajan), jotta mikrobien toiminta ei keskeydy (41). Biomuuntumiskokeissa käytettävien maanäytteiden keräämistä, käsittelyä ja varastointia koskevat yksityiskohtaiset ohjeet esitetään lähdeviitteissä (8)(10)(15)(26)(27).
Ennen kuin käsitelty maannos testataan, se on esi-inkuboitava, jotta siinä olevat siemenet saadaan itämään ja voidaan poistaa ja jotta mikrobien aineenvaihdunnan tasapaino ehtii palautua ennalleen, kun näyte siirretään näytteenotto- tai varastointiolosuhteista inkubointiolosuhteisiin. Yleensä riittää 2-28 päivän inkubointijakso, jonka aikana lämpötila- ja kosteusolosuhteet vastaavat varsinaisen testin olosuhteita (15). Yhteenlaskettu varastointi- ja esi-inkubointiaika saa olla enintään kolme kuukautta.
1.9 TESTIN SUORITUS
1.9.1 Testiolosuhteet
1.9.1.1 Testilämpötila
Koko testijakson aikana maanäytteitä on inkuboitava pimeässä tasaisessa lämpötilassa, joka muistuttaa niitä ilmasto-olosuhteita, joissa testiainetta käytetään tai joissa sen päästöt tapahtuvat. Kaikkien lauhkeissa ilmasto-olosuhteissa maaperään päätyvien testiaineiden lämpötilaksi suositellaan 20 (± 2) oC. Lämpötilaa on tarkkailtava testin aikana.
Testattaessa kemikaaleja, joiden käyttö tai päästöt tapahtuvat kylmemmissä ilmasto-olosuhteissa (esimerkiksi pohjoisen pallonpuoliskon maissa, syys-/talvikauden aikana), on inkuboitava lisänäytteitä myös alhaisemmassa lämpötilassa (esimerkiksi 10 (± 2) oC).
1.9.1.2 Kosteuspitoisuus
Aerobisissa olosuhteissa tehtävissä hajoamistesteissä maanäytteen kosteuspitoisuuden (42) pF-arvoa tulisi säädellä niin, että se on 2,0-2,5 (3). Maaperän kosteuspitoisuus ilmoitetaan veden massana kuivan maannoksen massaa kohti, ja sitä on tarkkailtava säännöllisesti (esimerkiksi kahden viikon välein) punnitsemalla inkubointiastiat ja korvaamalla veden menetys lisäämällä näytteeseen vettä (mieluiten steriilisti suodatettua vesijohtovettä). Nestettä lisättäessä testiaineen ja/tai hajoamistuotteiden hävikki haihtumalla ja/tai fotolyysi (jos sitä tapahtuu) on estettävä tai pidettävä mahdollisimman vähäisenä.
Kun hajoamistesti on tehtävä anaerobisissa olosuhteissa ja kosteikkoviljellyissä maanäytteissä, maanäyte kyllästetään vedellä upottamalla se veteen.
1.9.1.3 Aerobiset inkubaatio-olosuhteet
Läpivirtausjärjestelmissä aerobiset olosuhteet säilytetään vaihtamalla näyteastian ilma säännöllisin väliajoin tai ilmastamalla jatkuvasti kosteutetulla ilmalla. Erlenmeyer-pulloissa ilmanvaihtoa pidetään yllä diffuusion avulla.
1.9.1.4 Steriilit aerobiset olosuhteet
Haluttaessa selvittää abioottisen hajoamisen merkitystä testiaineelle maanäytteet voidaan steriloida (lisätietoja sterilointimenetelmistä on lähdeviitteissä 16 ja 29), käsitellä steriilillä testiaineella (esimerkiksi suodattamalla liuos steriilin suodattimen läpi) ja ilmastaa se kosteutetulla steriilillä ilmalla kohdan 1.9.1.3 mukaisesti. Kosteikkoviljellyissä maanäytteissä maannos ja vesi steriloidaan ja näyte inkuboidaan kohdassa 1.9.1.6 kuvatulla tavalla.
1.9.1.5 Anaerobiset inkubaatio-olosuhteet
Anaerobisten olosuhteiden luomiseksi ja ylläpitämiseksi testiaineella käsitelty maanäyte, joka on inkuboitu aerobisissa olosuhteissa 30 päivän tai yhden puoliintumisajan tai DT50:n ajan (sen mukaan, mihin kuluu vähimmin aikaa) kyllästetään vedellä (1-3 cm:n vesikerros), ja inkubointijärjestelmä huuhdellaan inertillä kaasulla (esimerkiksi typellä tai argonilla) (43). Testijärjestelmästä on voitava mitata pH, happipitoisuus ja hapetus-pelkistyspotentiaali, ja siinä on oltava haihtuvien aineiden talteenottolaitteet. Käytettäessä Erlenmeyer-pulloista koostuvaa järjestelmää sen on oltava suljettu, jotta vältetään ilman tunkeutuminen järjestelmään diffuusion kautta.
1.9.1.6 Kosteikkoviljellyn maanäytteen inkubaatio-olosuhteet
Testattaessa aineen hajoamista riisin kosteikkoviljelyyn käytetyssä maannoksessa maanäyte upotetaan noin 1-5 cm:n syvyiseen veteen ja testiaine lisätään vesifaasiin (9). Suositeltava maakerroksen paksuus on vähintään 5 cm. Järjestelmän ilmansaannista huolehditaan samaan tapaan kuin aerobisissakin olosuhteissa. Vesikerroksen pH:ta, happipitoisuutta ja hapetus-pelkistyspotentiaalia tarkkaillaan ja ne ilmoitetaan testiselosteessa. Ennen hajoamistestin aloittamista näytettä on esi-inkuboitava vähintään kahden viikon ajan (katso kohta 1.8.3.2).
1.9.1.7 Testin kesto
Nopeutta ja hajoamisreittejä koskevat tutkimukset eivät tavallisesti saa kestää yli 120 päivää (44) (3)(6)(8), koska sen jälkeen mikrobien toiminnan odotetaan vähenevän keinotekoisessa laboratoriojärjestelmässä, johon ei tule luonnollista ravinnetäydennystä. Testiä voidaan jatkaa pitempään (esimerkiksi 6 tai 12 kuukautta) (8) silloin kun se on tarpeen testiaineen ja pääasiallisten hajoamistuotteiden muodostumisen ja hajoamisen määrittämiseksi. Tätä pidemmät inkubointiajat on perusteltava testiselosteessa, ja niiden yhteydessä on esitettävä biomassan mittaustulokset inkubointijaksojen aikana ja niiden lopussa.
1.9.2 Testin suoritus
Noin 50-200 g maanäytettä (kuivapaino) asetetaan kuhunkin inkubaatiopulloon (katso liitteessä 3 olevat kuvat 1 ja 2) ja maanäyte käsitellään testiaineella käyttäen jotakin kohdassa 1.8.2 kuvattua menetelmää. Jos testiaine annostellaan orgaanisten liuotinten avulla, ne on poistettava näytteestä haihduttamalla. Sen jälkeen maanäyte sekoitetaan huolellisesti lastalla ja/tai ravistamalla pulloa. Jos testi tehdään kosteikkoviljellylle maanäytteelle, maannos ja vesi on sekoitettava huolellisesti testiaineen lisäämisen jälkeen. Käsitellyistä näytteistä on analysoitava pieniä määräosia (esimerkiksi 1 g), jotta voidaan varmistua sen tasaisesta leviämisestä näytteeseen. Vaihtoehtoinen tapa on kuvattu alla.
Annostellaan määrä siten, että se vastaa kasvinsuojeluaineen käyttöohjeissa suositeltua suurinta annostusta ja tasaista leviämistä käytettyyn syvyyteen (esimerkiksi maannoksen ylin 10 cm:n kerros (45). Esimerkiksi kemikaaleille, jotka levitetään kasvien lehtiin tai maannoksen päälle ilman, että ne tunkeutuvat kasviin tai maannokseen, sopiva annostelumäärä kuhunkin astiaan lasketaan 2,5 cm:n annostelusyvyyden mukaan. Kemikaaleille, jotka tunkeutuvat maannokseen, sopiva annostelusyvyys on aineen käyttöohjeissa ilmoitettu tunkeutumissyvyys. Yleiskemikaaleille annostus on arvioitava tärkeimmän leviämisreitin mukaan. Jos aineen pääasiallinen leviäminen maannokseen tapahtuu esimerkiksi jätevesilietteen kautta, kemikaali on annosteltava lietteeseen konsentraationa, joka vastaa lietteen ennakoitua konsentraatiota. Maannokseen lisättävän lietteen määrän on vastattava maatalousmaihin tavanomaisesti lisättävää lietemäärää. Jos tämä konsentraatio ei ole riittävä pääasiallisten hajoamistuotteiden havaitsemiseksi, erillisten suuremman konsentraation sisältävien näytteiden inkubointi voi olla hyödyllistä. On kuitenkin syytä välttää liian suuria annosmääriä, koska ne haittaavat maaperän mikrobien toimintaa (katso kohdat 1.5 ja 1.8.2).
Vaihtoehtoisesti myös suurempi maanäyte-erä (esimerkiksi 1-2 kg) voidaan käsitellä testiaineella, sekoittaa seos huolellisesti sopivassa sekoituslaitteessa ja sitten siirtää se pienissä 50-200 g:n annoksissa inkubointipulloihin (esimerkiksi näytekauhan avulla). Käsitellystä maanäyte-erästä on analysoitava testiaine pieninä määräosina (esimerkiksi 1 g) aineen tasaisen leviämisen varmistamiseksi. Tämä menetelmä on suositeltava, koska sen avulla testiaine saadaan levitettyä maanäytteeseen tasaisesti.
Myös käsittelemättömät maanäytteet inkuboidaan samoissa (aerobisissa) olosuhteissa kuin testiaineella käsitellyt näytteet. Näitä näytteitä käytetään biomassan mittaamiseen testien aikana ja niiden lopuksi.
Jos testiaine annostellaan maanäytteeseen orgaanisen liuottimen tai liuottimien avulla, samalla määrällä liuotinta tai liuottimia käsitellyt maanäytteet inkuboidaan samoissa (aerobisissa) olosuhteissa kuin testiaineella käsitellyt näytteet. Näistä näytteistä mitataan biomassa testin aluksi, sen aikana ja sen lopuksi, jotta liuottimen tai liuottimien vaikutus mikrobibiomassaan voidaan tarkistaa.
Pullot, jotka sisältävät käsitellyt maanäytteet, joko kiinnitetään kuvassa 1 esitettyyn läpivirtausjärjestelmään tai suljetaan kuvassa 2 esitettyyn absorptiokolonnilla. (katso liite 3).
1.9.3 Näytteenotto ja mittaus
Rinnakkaiset inkubaatiopullot poistetaan sopivin väliajoin, maanäytteet uutetaan sopivilla liuottimilla, joilla on eri polariteetti, ja niistä analysoidaan testiaine ja/tai hajoamistuotteet. Hyvin suunnitellussa testissä on varauduttava siihen, että joka näytteenottokerralla tarvitaan kaksi pulloa. Myös absorptioliuokset tai kiinteät absorptiomateriaalit poistetaan tietyin väliajoin (7 päivän välein ensimmäisen kuukauden aikana ja sen jälkeen 17 päivän välein) kunkin maanäytteen inkuboinnin aikana ja sen lopuksi, ja niistä analysoidaan haihtuvat hajoamistuotteet. Heti testiaineen annostelun jälkeen (päivän 0 näyte) otetun maanäytteen lisäksi testeihin tulisi sisällyttää ainakin viisi eri väliajoin tehtyä testiä. Näytteenottoajat on valittava siten, että testiaineen hajoamisajat sekä hajoamistuotteiden muodostumis- ja hajoamisajat voidaan määrittää (esimerkiksi 0, 1, 3 ja 7 päivää; 2 ja 3 viikkoa; 1, 2 ja 3 kuukautta).
Käytettäessä 14C-merkkiainetta uuttumattomien radioaktiivisten aineiden määrä määritetään polttamalla, ja kullekin näytteenottoajalle lasketaan massatase.
Anaerobisen ja kosteikkoviljelynäytteen osalta testiaine ja hajoamistuotteet analysoidaan yhdistetystä maa- ja vesifaasista, tai maa- ja vesifaasit erotetaan suodattamalla tai sentrifugoimalla ennen uuttoa ja analyysia.
1.9.4 Vapaaehtoiset lisätestit
Aerobisella epästeriilillä testillä, joissa käytetään muita lämpötiloja ja näytteen kosteuspitoisuuksia, voidaan arvioida maaperän lämpötilan ja kosteuspitoisuuden vaikutusta testiaineen ja/tai sen hajoamistuotteiden hajoamisnopeuteen maaperässä.
Uuttumattomia radioaktiivisia aineita voidaan lisäksi yrittää karakterisoida esimerkiksi ylikriittisellä nesteuutolla.
2. MITTAUSTULOKSET
2.1 TULOSTEN KÄSITTELY
Testiaineen, hajoamistuotteiden, haihtuvien aineiden (vain prosentteina) ja uuttumattomien aineiden määrät on ilmoitettava prosentteina alkuperäisestä konsentraatiosta ja tarvittaessa mg·kg-1 maanäytettä (kuivapaino) kutakin näytteenottokertaa kohti. Massatase ilmoitetaan prosenttina alkuperäisestä konsentraatiosta kutakin näytteenottokertaa kohti. Esittämällä testiaineen konsentraatiot ajan funktiona voidaan arvioida aineen hajoamisen puoliintumisaika tai DT50-arvo. Pääasialliset hajoamistuotteet olisi tunnistettava ja niiden konsentraatiot olisi myös esitettävä ajan funktiona, jolloin voidaan määrittää niiden muodostumis- ja hajoamisnopeus. Pääasiallinen hajoamistuote on mikä tahansa tuote, jota esiintyy milloin tahansa testin aikana ≥ 10 % testiaineen annoksesta.
Talteen otetut haihtuvat yhdisteet antavat viitteitä testiaineen ja sen hajoamistuotteiden haihtuvuuspotentiaalista maaperässä.
Tarkemmat puoliintumisaikojen tai DT50-arvojen sekä tarvittaessa DT75- ja DT90-arvojen määritykset on tehtävä asianmukaisen kineettisen mallin mukaisilla laskelmilla. Puoliintumisajan ja DT50-arvojen ilmoittamisen yhteydessä on kuvattava käytetty malli, kinetiikan aste ja määrityskerroin (r2). Ensimmäisen asteen kinetiikan käyttö on yleensä suositeltavaa paitsi silloin, kun r2 < 0,7. Tarvittaessa laskelmat on tehtävä myös pääasiallisista hajoamistuotteista. Esimerkkejä sopivista malleista on esitetty lähteissä 31-35.
Testattaessa muodostumis- ja hajoamisnopeuksia eri lämpötiloissa hajoamisnopeudet on kuvattava lämpötilan funktiona testissä käytetyn lämpötila-alueen sisällä käyttäen Arrheniuksen lakia muodossa:
 or
or 
missä ln A ja B ovat Y-akselin leikkauspisteestä ja kulmakertoimesta saatavat regressiovakiot suoralle, joka saadaan ln k- ja 1/T-arvon lineaarisen regressioanalyysin tuloksena, k on nopeusvakio lämpötilassa T ja T on lämpötila Kelvin-asteina. Jos aineen hajoamista säätelee mikrobien toiminta, on otettava huomioon lämpötila-alue, jolla Arreheniuksen laki on validi.
2.2 TULOSTEN ARVIOINTI JA TULKINTA
Vaikka testit toteutetaan keinotekoisessa laboratoriojärjestelmässä, tulosten perusteella voidaan arvioida testiaineen hajoamisnopeutta sekä hajoamistuotteiden muodostumis- ja hajoamisnopeutta kenttäolosuhteissa (36)(37).
Testiaineen hajoamisreitin tutkimus antaa tietoja siitä, miten aineen rakenne muuttuu maaperässä kemiallisten reaktioiden ja mikrobien toiminnan tuloksena.
3. TULOSTEN ILMOITTAMINEN
TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot.
|
|
Testiaine:
|
|
|
Vertailuaineet:
|
|
|
Testimaannokset:
|
|
|
Testiolosuhteet:
|
|
|
Tulokset:
|
4. LÄHDELUETTELO
|
(1) |
US- Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate. |
|
(2) |
Agriculture Canada (1987). Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada. |
|
(3) |
European Union (EU) (1995). Commission Directive 95/36/EC of 14 July 1995 amending Council Directive 91/414/EEC concerning the placing of plant protection products on the market. Annex II, Part A and Annex III, Part A: Fate and Behaviour in the Environment. |
|
(4) |
Dutch Commission for Registration of Pesticides (1995). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air. |
|
(5) |
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-1. Verbleib von Pflanzenschutzmitteln im Boden — Abbau, Umwandlung und Metabolismus. |
|
(6) |
ISO/DIS 11266-1 (1994). Soil Quality — Guidance on laboratory tests for biodegradation of organic chemicals in soil — Part 1: Aerobic conditions. |
|
(7) |
ISO 14239 (1997). Soil Quality — Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions. |
|
(8) |
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, toim. |
|
(9) |
MAFF — Japan 2000 — Draft Guidelines for transformation Studies of pesticides in soil — Aerobic metabolism study in soil under paddy field conditions (flooded). |
|
(10) |
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italia, 18.-20. tammikuuta 1995. |
|
(11) |
Guth, J.A. (1980). The study of transformations. Teoksessa Interactions between Herbicides and the Soil (R.J. Hance, toim.), Academic Press, 123-157. |
|
(12) |
DFG: Pesticide Bound Residues in Soil. Wiley — VCH (1998). |
|
(13) |
T.R. Roberts: Non-extractable pesticide residue in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984) |
|
(14) |
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981) |
|
(15) |
ISO 10381-6 (1993). Soil Quality — Sampling — Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(16) |
Annex V to Dir. 67/548/EEC |
|
(17) |
Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. Teoksessa Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, toim. J. Wiley & Sons. Vol 1, 85-114. |
|
(18) |
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962). |
|
(19) |
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods. A. Klute, toim. Agronomy Series No 9, 2. painos. |
|
(20) |
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties. A.L. Page, R.H. Miller and D.R. Kelney, toim. Agronomy Series No 9, 2. painos. |
|
(21) |
ISO Standard Compendium Environment (1994). Soil Quality — General aspects; chemical and physical methods of analysis; biological methods of analysis. 1. painos. |
|
(22) |
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main. |
|
(23) |
Scheffer, F., Schachtschabel, P. (1975). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart. |
|
(24) |
Anderson, J.P.E., Domsch, K.H. (1978). A physiological method for the quantitative measurement of microbial biomass in soils. Soil Biol. Biochem. 10, 215-221. |
|
(25) |
ISO 14240-1 and 2 (1997). Soil Quality — Determination of soil microbial biomass — Part 1: Substrate-induced respiration method. Part 2: fumigation-extraction method. |
|
(18) (26) |
Anderson, J.P.E. (1987). Handling and Storage of soils for pesticide experiments. Teoksessa Pesticide Effects on Soil Microflora. L. Somerville, M.P. Greaves, toim. Taylor & Francis, 45-60. |
|
(27) |
Kato, Yasuhiro. (1998). Mechanism of pesticide transformation in the environment: Aerobic and biotransformation of pesticides in aqueous environment. Proceedings of the 16th Symposium on Environmental Science of Pesticide, 105-120. |
|
(28) |
Keuken O., Anderson J.P.E. (1996). Influence of storage on biochemical processes in soil. Teoksessa Pesticides, Soil Microbiology and Soil Quality, 59-63 (SETAC-Europe). |
|
(29) |
Stenberg B., Johansson M., Pell M., Sjödahl-Svensson K., Stenström J., Torstensson L. (1996). Effect of freeze and cold storage of soil on microbial activities and biomass. Teoksessa Pesticides, Soil Microbiology and Soil Quality, 68-69 (SETAC-Europe). |
|
(30) |
Gennari, M., Negre, M., Ambrosoli, R. (1987). Effects of ethylene oxide on soil microbial content and some Chemical characteristics. Plant and Soil 102, 197-200. |
|
(31) |
Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141-146. |
|
(32) |
Hamaker, J.W. (1976). The application of mathematical modelling to the soil persistence and accumulation of pesticides. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, 181-199. |
|
(33) |
Goring, C.A.I., Laskowski, D.A., Hamaker, J.W., Meikle, R.W. (1975). Principles of pesticide degradation in soil. Teoksessa ”Environmental Dynamics of Pesticides”. R. Haque and V.H. Freed, toim., 135-172. |
|
(34) |
Timme, G., Frehse, H., Laska, V. (1986). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. II. Pflanzenschutz — Nachrichten Bayer 39, 188-204. |
|
(35) |
Timme, G., Frehse, H. (1980). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. I. Pflanzenschutz — Nachrichten Bayer 33, 47-60. |
|
(36) |
Gustafson D.I., Holden L.R. (1990). Non-linear pesticide dissipation in soil; a new model based on spatial variability. Environm. Sci. Technol. 24, 1032-1041. |
|
(37) |
Hurle K., Walker A. (1980). Persistence and its prediction. Teoksessa Interactions between Herbicides and the Soil (R.J. Hance, toim.), Academic Press, 83-122. |
LIITE 1
VEDEN JÄNNITYS, KENTTÄKAPASITEETTI (FC) JA VEDENPIDÄTYSKYKY (WHC) (46)
|
Vesipatsaan korkeus [cm] |
PF (47) |
bar (48) |
Huomautuksia |
|
107 |
7 |
104 |
kuiva maannos |
|
1,6 · 104 |
4,2 |
16 |
lakastumisraja |
|
104 |
4 |
10 |
|
|
103 |
3 |
1 |
|
|
6 · 102 |
2,8 |
0,6 |
|
|
3,3 · 102 |
2,5 |
0,33 (49) |
kenttäkapasiteetin alue (50) |
|
102 |
2 |
0,1 |
|
|
60 |
1,8 |
0,06 |
|
|
33 |
1,5 |
0,033 |
|
|
10 |
1 |
0,01 |
vedenpidätyskyky (arvio) |
|
1 |
0 |
0,001 |
vedellä kyllästetty maannos |
Veden jännitys mitataan vesipatsaan korkeutena (cm) tai baareina. Imupaineen laajan vaihtelun vuoksi jännitys ilmaistaan yksinkertaisesti pF-arvona, joka vastaa vesipatsaan korkeuden (cm) logaritmia.
Kenttäkapasiteetti on veden määrä, joka voi varastoitua ilmakehän paineessa luonnonmaannokseen 2 päivän kuluessa pitkästä sadejaksosta tai riittävästä kastelusta. Tämä arvo määritetään luonnontilaisesta maannoksesta tutkittavassa ympäristössä. Mittausta ei siis voida soveltaa käsiteltyihin maanäyte-eriin laboratorio-olosuhteissa. FC-arvoissa, jotka on määritetty käsiteltyjen maanäytteiden perusteella, voi esiintyä suurta järjestelmällistä vaihtelua.
Vedenpidätyskyky (WHC) määritetään laboratoriossa sekä luonnontilaisesta että käsitellystä maannoksesta kyllästämällä maapatsas vedellä kapillaari-ilmiön avulla. Tämä arvo on erityisen käyttökelpoinen käsiteltyjen maannosten yhteydessä ja se voi olla jopa 30 % suurempi kuin kenttäkapasiteetti (1). Se on myös kokeellisesti helpompi määrittää kuin luotettava FC-arvo.
Huomautukset
LIITE 2
ERILAISTEN MAANNOSTYYPPIEN KOSTEUSPITOISUUDET (g vettä per 100 g kuivaa maannosta) ERI VALTIOISSA
|
|
|
Maannoksen kosteuspitoisuus arvolla |
||
|
Maannos |
Valtio |
|||
|
|
|
WHC (51) |
pF= 1,8 |
pF = 2,5 |
|
Hiekka |
Saksa |
28,7 |
8,8 |
3,9 |
|
Hiesupitoinen hiekka |
Saksa |
50,4 |
17,9 |
12,1 |
|
Hiesupitoinen hiekka |
Sveitsi |
44,0 |
35,3 |
9,2 |
|
Silttipitoinen hiesu |
Sveitsi |
72,8 |
56,6 |
28,4 |
|
Savipitoinen hiesu |
Brasilia |
69,7 |
38,4 |
27,3 |
|
Savipitoinen hiesu |
Japani |
74,4 |
57,8 |
31,4 |
|
Hiekkapitoinen hiesu |
Japani |
82,4 |
59,2 |
36,0 |
|
Silttipitoinen hiesu |
USA |
47,2 |
33,2 |
18,8 |
|
Hiekkapitoinen hiesu |
USA |
40,4 |
25,2 |
13,3 |
LIITE 3
Kuva 1
Esimerkki läpivirtausjärjestelmästä, jolla tutkitaan kemikaalien hajoamista maannoksessa (52) (53)

Kuva 2
Esimerkki Erlenmeyer-pullosta, jolla tutkitaan kemikaalien hajoamista maannoksessa (54)

C.24. AEROBINEN JA ANAEROBINEN HAJOAMINEN VESIYMPÄRISTÖN SEDIMENTTIJÄRJESTELMISSÄ
1. MENETELMÄ
Tämä menetelmä on toisinto OECD:n testiohjeesta nro 308 (2002).
1.1 JOHDANTO
Kemikaalit voivat päästä mataliin tai syviin pintavesiin esimerkiksi suoraan annosteltuina, lentosumutuksen yhteydessä, valumana sekä viemäröinnin, jätteiden käsittelyn, teollisuuden, kotitalouden tai maanviljelyn päästöinä ja ilmakehän laskeumina. Kuvatun testimenetelmän tarkoitus on arvioida laboratorio-olosuhteissa orgaanisten kemikaalien aerobista ja anaerobista hajoamista vesiympäristön sedimenttijärjestelmissä. Menetelmä perustuu aikaisempiin ohjeisiin (1)(2)(3)(4)(5)(6). Belgiratessa Italiassa vuonna 1995 pidetyssä maannosten ja sedimenttien valintaa käsitelleessä OECD:n työryhmän kokouksessa sovittiin erityisesti tässä testissä käytettävien sedimenttien lukumäärästä ja tyypeistä (7). Työryhmä esitti myös sedimenttinäytteiden keräämiseen, käsittelyyn ja varastointiin liittyviä suosituksia, jotka perustuvat ISO:n ohjeisiin (8). Testit ovat pakollisia kemikaaleille, jotka tarkoituksella tai todennäköisesti päätyvät vesiympäristöön edellä mainituilla tavoilla.
Luonnollisten vesiympäristön sedimenttijärjestelmien olosuhteet ovat usein aerobiset ylemmässä vesifaasissa. Sedimentin pintakerros voi olla joko aerobinen tai anaerobinen, kun taas syvemmällä sijaitseva sedimenttikerros on yleensä anaerobinen. Kaikkien näiden vaihtoehtojen huomioon ottamiseksi tässä asiakirjassa selostetaan sekä aerobisia että anaerobisia testejä. Aerobisessa testissä simuloidaan aerobista vesipatsasta, jonka alla on aerobinen sedimenttikerros ja sen alla anaerobinen gradientti. Anaerobisessa testissä simuloidaan täysin anaerobista vesi-sedimenttijärjestelmää. Jos olosuhteet edellyttävät merkittävää poikkeamista näistä suosituksista, esimerkiksi sedimentistä otettujen käsittelemättömien kairausnäytteiden tai testiaineelle mahdollisesti altistuneiden sedimenttien käyttöä, voidaan käyttää muita testimenetelmiä (9).
1.2 MÄÄRITELMÄT
Kaikissa tapauksissa on käytettävä kansainvälisen SI-standardin mukaisia yksikköjä.
Testiaine: mikä tahansa aine, joko alkutuote tai merkitykselliset hajoamistuotteet.
Hajoamistuotteet: kaikki aineet, jotka syntyvät testiaineen bioottisista tai abioottisista hajoamisreaktioista, mukaan luettuina CO2 ja tuotteet, jotka ovat sitoutuneissa jäämissä.
Sitoutuneet jäämät: maaperässä, kasveissa tai eläimissä esiintyvät yhdisteet, jotka uuttamisen jälkeen säilyvät matriisissa alkutuotteen tai sen metaboliitin/hajoamistuotteen muodossa. Uuttomenetelmä ei saa olennaisesti muuttaa itse yhdisteitä tai matriisin rakennetta. Sidoksen luonnetta voidaan osittain selventää matriisia muuttavilla uuttomenetelmillä ja kehittyneillä analyysitekniikoilla. Tähän mennessä on tunnistettu esimerkiksi kovalenttisia ioni- ja sorptiosidoksia sekä eri materiaalien sisään jääneitä aineita (sulkeuma-aineita) tällä menetelmällä. Yleisesti voidaan todeta, että sitoutuneiden jäämien muodostuminen vähentää aineen biologista saatavuutta ja käytettävyyttä merkittävästi (10) [vuodelta 1984 olevaan IUPAC-nimikkeistöön tehty muutos (11)].
Aerobinen hajoaminen (muuntuminen): reaktiot, jotka tapahtuvat molekyylisen hapen läsnäollessa (12).
Anaerobinen hajoaminen: reaktiot, joihin ei osallistu molekyylistä happea (12).
Luonnonvedet: esimerkiksi lammista, joista ja virroista saadut pintavedet.
Sedimentti: sekoitus mineraalisia ja orgaanisia kemiallisia aineksia, joista jälkimmäiset sisältävät paljon hiiltä ja typpeä sisältäviä suurimolekyylisiä aineita. Sedimentti kerrostuu luonnonvesiin ja muodostaa rajapinnan veteen.
Mineralisaatio: orgaanisen yhdisteen täydellinen hajoaminen CO2:ksi ja H2O:ksi aerobisissa olosuhteissa sekä CH4:ksi, CO2:ksi ja H2O:ksi anaerobisissa olosuhteissa. Kun käytetään leimana l4C:ta tässä testimenetelmässä, mineralisaatio tarkoittaa laajaa hajoamista, jonka aikana leimattu hiiliatomi hapettuu tai pelkistyy ja vapauttaa vastaavan määrän l4CO2:ta tai CH4:ää.
Puoliintumisaika: t0,5 on aika, joka kuluu testiaineen 50-prosenttiseen hajoamiseen tapauksissa, joissa hajoaminen voidaan kuvata ensimmäisen asteen kinetiikan avulla. Puoliintumisaika ei riipu konsentraatiosta.
Häviämisaika 50 (DT 50 ): aika, jonka kuluessa testiaineen konsentraatio vähenee 50 %:lla.
Häviämisaika 75 (DT 75 ): aika, jonka kuluessa testiaineen konsentraatio vähenee 75 %:lla.
Häviämisaika 90 (DT 90 ): aika, jonka kuluessa testiaineen konsentraatio vähenee 90 %:lla.
1.3 VERTAILUAINEET
Vertailuaineita on käytettävä hajoamistuotteiden karakterisointiin ja/tai tunnistukseen spektroskopia- ja krotomatografiamenetelmillä.
1.4 TESTIAINETTA KOSKEVAT TIEDOT
Hajoamisnopeuden mittaamiseen voidaan käyttää leimattua tai leimaamatonta testiainetta, vaikka leimatun aineen käyttöä suositellaan. Merkkiaineen käyttö on välttämätöntä tutkittaessa hajoamisreittejä ja määritettäessä massatasetta. l4C on suositeltava leima, mutta muitakin isotooppeja, kuten 13C:ta, 15N:ta, 3H:ta tai 32P:ta, voidaan käyttää. Leiman pitäisi mahdollisuuksien mukaan sijaita molekyylin stabiileimmassa osassa tai osissa (55). Testiaineen kemiallisen ja/tai radiokemiallisen puhtausasteen on oltava vähintään 95 %.
Ennen testin tekemistä testiaineesta on oltava saatavilla seuraavat tiedot:
|
(a) |
vesiliukoisuus (menetelmä A.6); |
|
(b) |
liukoisuus orgaanisiin liuottimiin; |
|
(c) |
höyrynpaine (menetelmä A.4) ja Henryn lain vakio; |
|
(d) |
n-oktanoli/vesi-jakaantumiskerroin (menetelmä A.8); |
|
(e) |
adsorptiokerroin (Kd, Kf tai Koc, tapauksen mukaan) (menetelmä C. 18); |
|
(f) |
hydrolyysi (menetelmä C.7); |
|
(g) |
dissosiaatiovakio (pKa) [OECD:n ohje 112] (13); |
|
(h) |
testiaineen kemiallinen rakenne ja merkkiaineen isotoopin sijainti, jos merkkiainetta käytetään. |
Huomautus: Raportissa on ilmoitettava lämpötila, jossa mittaukset on tehty.
Muita tarpeellisia tietoja saattavat olla tiedot testiaineen myrkyllisyydestä mikrobeille, tiedot nopeasta ja/tai inherentistä biologisesta hajoavuudesta sekä tiedot testiaineen aerobisesta ja anaerobisesta hajoamisesta maaperässä.
Käytettävissä on oltava analyysimenetelmät (myös uutto- ja puhdistusmenetelmät) testiaineen sekä sen hajoamistuotteiden kvantifioimiseksi ja tunnistamiseksi vedestä ja sedimentistä (katso kohta 1.7.2).
1.5 TESTIMENETELMÄN PERIAATE
Tässä kuvatussa menetelmässä käytetään yhtä aerobista ja yhtä anaerobista vesiympäristön sedimenttijärjestelmää (katso liite 1), jolloin voidaan
|
i) |
mitata testiaineen muuttumisnopeus vesi-sedimenttijärjestelmässä; |
|
ii) |
mitata testiaineen muuttumisnopeus sedimentissä; |
|
iii) |
mitata testiaineen ja/tai sen hajoamistuotteiden mineralisaationopeus (kun leimana on 14C); |
|
(iv) |
tunnistaa ja määrittää hajoamistuotteet vesi- ja sedimenttifaasissa, mukaan luettuna massatase (kun käytetään merkkiainetta); |
|
(v) |
mitata testiaineen ja sen hajoamistuotteiden jakautuminen kahteen faasiin pimeässä (esimerkiksi leväkukinnan välttämiseksi) tietyn inkubaatiojakson aikana vakiolämpötilassa. Puoliintumisajat, DT50-, DT75- ja DT90-arvot määritetään, jos mittaustulokset sallivat sen, mutta arvoja ei pidä ekstrapoloida pitkälle koejakson yli (katso kohta 1.2). |
Sekä aerobiseen että anaerobiseen tutkimukseen tarvitaan vähintään kaksi sedimenttinäytettä ja näytteet niihin kuuluvista vesistä (7). Joissakin tapauksissa voi kuitenkin olla tarpeen käyttää useampia kuin kahta vesiympäristön sedimenttiä, esimerkiksi jos kemikaali voi esiintyä makean veden ympäristössä ja/tai merivesiympäristössä.
1.6 TESTIN SOVELLUSALA
Menetelmää voidaan soveltaa kaikkiin kemiallisiin aineisiin (leimaamattomiin tai radioaktiivisella isotoopilla leimattuihin), joiden analysoimiseen on riittävän tarkka ja herkkä menetelmä. Tässä kuvattua menetelmää voidaan soveltaa lievästi haihtuviin, haihtumattomiin, vesiliukoisiin tai veteen liukenemattomiin yhdisteisiin. Menetelmää ei voida soveltaa kemikaaleihin, jotka haihtuvat helposti vedestä (esimerkiksi savuavat aineet tai orgaaniset liuottimet) ja jotka eivät siis säily vedessä ja/tai sedimentissä tässä kuvatuissa testiolosuhteissa.
Tähän mennessä menetelmällä on tutkittu kemikaalien muuntumista makeassa vedessä ja sedimenteissä, mutta periaatteessa menetelmää voidaan soveltaa jokisuisto- ja meriympäristöihin. Menetelmä ei sovellu virtaavien vesien, kuten jokien, tai avomeren olosuhteiden simulointiin.
1.7 LAATUVAATIMUKSET
1.7.1 Saanto
Vähintään kahden maaperänäytteen uutto ja analysointi heti testiaineen lisäämisen jälkeen antaa alustavia tietoja analyysimenetelmän toistettavuudesta ja sen testiaineeseen lisäämisen tasaisuudesta. Saanto testin myöhemmissä vaiheissa määritetään vastaavan massataseen mukaan. Saantojen tulisi olla 90-110 % käytettäessä merkkiainetta (6) ja 70-110 %, kun merkkiainetta ei käytetä.
1.7.2 Analyysimenetelmän toistettavuus ja herkkyys
Analyysimenetelmän toistettavuus (lukuun ottamatta alussa tehtävän uuton tehokkuutta) testiaineen ja hajoamistuotteiden määritysten osalta voidaan tarkistaa kaksoismäärittämällä samasta vesi- tai sedimenttinäytteestä tehty uute, jota on inkuboitu niin kauan, että hajoamistuotteita on ehtinyt muodostua.
Testiaineen ja hajoamistuotteiden osalta analyysimenetelmän osoitusrajan (LOD) on oltava vähintään 0,01 mg·kg-1 vesi- tai sedimenttinäytettä (testiaine) tai 1 % käytetystä annoksesta sen mukaan, kumpi on pienempi. Määritysraja (LOQ) on myös määritettävä.
1.7.3 Hajoamistesteissä saatujen tulosten luotettavuus
Tiedot hajoamista kuvaavan käyrän luotettavuudesta saadaan tekemällä regressioanalyysi testiaineen konsentraatioista ajan funktiona, jolloin voidaan laskea puoliintumisaikojen luottamusvälit (näennäisen ensimmäisen asteen kinetiikan osalta) tai DT50-arvot sekä tarvittaessa DT75- ja DT90-arvot.
1.8 MENETELMÄN KUVAUS
1.8.1 Testijärjestelmä ja -laitteet
Testi on suoritettava lasiastioissa (esimerkiksi pulloissa tai sentrifugiputkissa), paitsi jos esitiedot (kuten n-oktanoli-vesi-jakaantumiskerroin tai sorptiotiedot) osoittavat, että testiaine saattaa kiinnittyä lasiin; tällöin voidaan harkita jonkin muun materiaalin, esimerkiksi teflonin, käyttöä. Jos testiaineen tiedetään kiinnittyvän lasiin, ongelmaa voidaan helpottaa yhdellä tai usealla seuraavista tavoista:
|
— |
Määritetään lasiin kiinnittyneen testiaineen ja hajoamistuotteiden massa. |
|
— |
Pestään kaikki lasitavarat liuottimella testin päätyttyä. |
|
— |
Käytetään kaupallisia valmisteita (katso myös kohta 1.9.2). |
|
— |
Lisätään testiaine järjestelmään lisäliuottimen avulla; tällöin lisäliuottimen on oltava aine, joka ei aiheuta testiaineen hajaantumista. |
Esimerkkejä tyypillisistä testilaitteista, eli läpivirtaus- ja Erlenmeyer-tyyppisistä järjestelmistä, on liitteissä 2 ja 3 (14). Muita käyttökelpoisia inkubointijärjestelmiä on esitetty lähteessä 15. Testilaitteiston on oltava rakenteeltaan sellainen, että ilman tai typen vaihto ja helposti haihtuvien tuotteiden talteenotto on mahdollista. Laitteiston mittojen täytyy täyttää testivaatimukset (katso kohta 1.9.1). Ilmanvaihto voidaan järjestää joko varovaisena kuplailmastuksena tai viemällä ilmaa tai typpeä veden pinnalle. Jälkimmäisessä tapauksessa on suositeltavaa sekoittaa vettä varovasti ylhäältäpäin, jotta happi tai typpi leviäisi paremmin veteen. CO2:ta sisältämätöntä ilmaa ei pidä käyttää, koska se saattaa nostaa veden pH-arvoa. Molemmissa tapauksissa sedimentin häiritseminen ei ole suotavaa, ja sitä pitää mahdollisuuksien mukaan välttää. Haihtuvat kemikaalit on testattava Erlenmeyer-tyyppisessä järjestelmässä sekoittamalla veden pintaa varovasti. Voidaan myös käyttää suljettuja säiliöitä, joiden ilmatilassa on joko ilmakehän ilmaa tai typpeä ja astiat helposti haihtuvien aineiden talteen ottamiseksi (16). Aerobisessa testissä vaatimuksena on ilmatilan kaasun säännöllinen vaihtuminen, jolla kompensoidaan biomassan hapenkulutusta.
Sopivia erottimia helposti haihtuvien hajoamistuotteiden keräämiseen ovat muun muassa, mutta eivät ainoastaan, kaliumhydroksidi- tai natriumhydroksidiliuokset (1 mol · dm-3) hiilidioksidin (56) keräämiseen sekä etyleeniglykoli, etanoliamiini tai ksyleeniin liuotettu 2-prosenttinen parafiini orgaanisten yhdisteiden keräämiseen. Anaerobisissa olosuhteissa muodostuneet helposti haihtuvat aineet, kuten metaani, voidaan kerätä esimerkiksi molekyyliseulalla. Tällaiset helposti haihtuvat aineet voidaan hapettaa esimerkiksi CO2:ksi viemällä kaasu CuO:lla täytetyn kvartsiputken läpi 900 oC:n lämpötilassa ja erottamalla muodostunut CO2 absorboivaan emäksiseen aineeseen (17).
Testiaineen ja sen hajoamistuotteiden kemiallista analyysia varten tarvitaan laboratoriolaitteita (esimerkiksi GLC eli kaasu-nestekromatograafi, HPLC eli korkean suorituskyvyn nestekromatograafi ja TLC eli ohutlevykromatografialaite, MS eli massaspektrometri tai GC-MS eli kaasukromatograafi-massaspektrometri tai NMR eli ydinmagneettiseen resonanssiin perustuva tutkimuslaite) sekä detektiojärjestelmät radioaktiivisia merkkiaineita sisältäville tai leimaamattomille kemikaaleille. Käytettäessä radioaktiivisia merkkiaineita tarvitaan myös nestetuikelaskin ja poltto- eli hapetinlaite (sedimenttinäytteiden polttamiseen ennen radioaktiivisten aineiden analyysia.
Testissä voidaan tarvita myös muita tavanomaisia laboratoriolaitteita fysikaalis-kemiallisiin tai biologisiin määrityksiin (katso taulukko 1, kohta 1.8.2.2), lasitavaraa, kemikaaleja ja reagensseja.
1.8.2 Vesiympäristön sedimenttien valinta ja määrä
Näytteenottopaikat on kaikissa tilanteissa valittava testin tarkoituksen mukaan. Näytteenottopaikkojen valinnassa on otettava huomioon valuma-alueen ja yläjuoksun mahdolliset maanviljely-, teollisuus- tai kotitaloussyötteet. Testissä ei saa käyttää sedimenttejä, jotka ovat altistuneet testiaineelle tai sen kanssa rakenteellisesti analogiselle aineelle viimeisten neljän vuoden aikana.
1.8.2.1 Sedimentin valinta
Aerobisissa testeissä käytetään tavallisesti kahta sedimenttiä (7). Valittujen kahden sedimentin on poikettava toisistaan orgaanisen hiilen pitoisuuden ja rakenteen osalta. Yhdessä sedimentissä on oltava suuri orgaanisen hiilen pitoisuus (2,5-7,5 %) ja hieno rakenne, toisessa taas pieni orgaanisen hiilen pitoisuus (0,5-2,5 %) ja karkea rakenne. Orgaanisen hiilen pitoisuuksien eron pitäisi yleensä olla vähintään 2 %. ”Hieno rakenne” merkitsee määritelmän mukaan > 50 %:n [savi + siltti] (57) -pitoisuutta, ja ”karkea rakenne” merkitsee < 50 %:n [savi + siltti]-pitoisuutta. Kahden sedimentin [savi + siltti]-pitoisuuden välisen eron pitäisi yleensä olla vähintään 20 %. Jos kemikaali saattaa päästä myös merivesiin, vähintään yhden vesiympäristösedimenttijärjestelmän on oltava peräisin merestä.
Pelkässä anaerobisessa testissä näytteet on otettava kahdesta sedimentistä (ja niihin kuuluvista vesistä) pintavesimassan anaerobiselta alueelta (7). Sekä sedimentti- että vesifaasi on käsiteltävä ja kuljetettava huolellisesti hapettomissa olosuhteissa.
Sedimenttien valintaan saattavat vaikuttaa muutkin parametrit, jotka on harkittava kussakin tapauksessa erikseen. Jos esimerkiksi testataan kemikaaleja, joiden muuntuminen ja/tai sorptio saattaa riippua pH-arvosta, sedimenttien pH-arvoalue on merkitsevä parametri. Sorption pH-riippuvuus saattaa heijastua testiaineen pKa-arvossa.
1.8.2.2 Vesi-sedimenttinäytteiden karakterisointi
Seuraavassa taulukossa on esitetty keskeiset parametrit, jotka on mitattava ja raportoitava (käytetyn menetelmän lisäksi) sekä veden että sedimentin osalta, sekä testin vaihe, jonka kuluessa ne on määritettävä. Näiden parametrien määritysmenetelmät esitetään lähteissä 18, 19, 20 ja 21.
Lisäksi voi olla tarpeen mitata ja raportoida muitakin parametreja tapauskohtaisesti (esimerkiksi makean veden järjestelmistä hiukkaset, emäksisyys, kovuus, sähkönjohtokyky, NO3/PO4 (suhde ja erilliset arvot); sedimenteistä kationinvaihtokyky, vedenpidätyskyky, karbonaatti, typen ja fosforin kokonaismäärä; merivesijärjestelmistä suolaisuus). Nitraatin, sulfaatin, biologisesti käyttökelpoisen raudan ja mahdollisesti muiden elektronin vastaanottajien analysoiminen sedimenteistä ja vedestä voi myös olla tarpeen hapetus-pelkistysolosuhteiden arviointia varten, erityisesti anaerobisen muuttumisen osalta.
Vesi-sedimenttinäytteiden karakterisointiin tarvittavien parametrien mittaaminen (7)(22)(23)
|
Parametri |
Testin vaihe |
|||||
|
Näytteenotto kentältä |
Jälkikäsittely |
Akklimatisoitumisen alku |
Testin alku |
Testin aikana |
Testin loppu |
|
|
Vesi |
||||||
|
Alkuperä/lähde |
X |
|
|
|
|
|
|
Lämpötila |
X |
|
|
|
|
|
|
pH |
X |
|
X |
X |
X |
X |
|
Orgaanisen hiilen kokonaispitoisuus |
|
|
X |
X |
|
X |
|
O2-pitoisuus (58) |
X |
|
X |
X |
X |
X |
|
Hapetus-pelkistvspotentiaali (58) |
|
|
X |
X |
X |
X |
|
Sedimentti |
||||||
|
Alkuperä/lähde |
X |
|
|
|
|
|
|
Kerroksen paksuus |
X |
|
|
|
|
|
|
pH |
|
X |
X |
X |
X |
X |
|
Partikkelien kokojakauma |
|
X |
|
|
|
|
|
Orgaanisen hiilen kokonaispitoisuus |
|
X |
X |
X |
|
X |
|
Mikrobibiomassa (58) |
|
X |
|
X |
|
X |
|
Hapetus-pelkistyspotentiaali (59) |
Havainnot (väri/haju) |
|
X |
X |
X |
X |
1.8.3 Näytteiden kerääminen, käsittely ja varastointi
1.8.3.1 Kerääminen
Sedimenttinäytteitä otettaessa on sovellettava ISO:n pohjasedimenttinäytteiden ottamista koskevaa alustavaa ohjetta (S). Sedimenttinäytteet on otettava sedimentin ylimmästä kerroksesta (5-10 cm ylärajasta) koko kerroksen alueelta. Sedimenttiin kuuluvat vesinäytteet on kerättävä samasta paikasta ja samaan aikaan kuin sedimenttinäytekin. Anaerobisia tutkimuksia varten sedimenttinäyte ja siihen kuuluva vesinäyte on otettava ja kuljetettava hapettomissa olosuhteissa (28)(katso kohta 1.8.2.1). Joitakin näytteenottovälineitä kuvataan lähteissä (8)(23).
1.8.3.2 Käsittely
Sedimentti erotetaan vedestä suodattamalla ja märkäseulotaan 2 mm:n seulalla käyttäen ylimäärää tutkimuspaikalta otettua vettä, joka sitten heitetään pois. Tunnetut määrät sedimenttiä ja vettä sekoitetaan halutussa suhteessa (katso kohta 1.9.1) inkubointipulloissa ja valmistellaan akklimatisaatiojaksoa varten (katso kohta 1.8.4). Kun kyseessä on anaerobinen tutkimus, kaikki käsittelyn vaiheet on tehtävä hapettomissa olosuhteissa (29)(30)(31)(32)(33).
1.8.3.3 Varastointi
Sedimentti- ja vesinäytteet on mieluiten käytettävä juuri kerättyinä, mutta jos näytteiden varastointi on välttämätöntä, sedimentti ja vesi on seulottava edellä kuvatulla tavalla ja varastoitava yhdessä vedellä kyllästettynä (6-10 cm:n vesikerroksessa) pimeässä, 4 ± 2 oC (60) -asteen lämpötilassa enintään neljän viikon ajan (7)(8)(23). Aerobisiin tutkimuksiin tarkoitetut näytteet on varastoitava niin, että ilmaa on vapaasti saatavilla (esimerkiksi avoimissa säiliöissä); anaerobisiin tutkimuksiin tarkoitetut näytteet puolestaan on varastoitava hapettomissa olosuhteissa. Kuljetuksen ja varastoinnin aikana sedimentti- ja vesinäytteet eivät saa jäätyä eikä sedimentti kuivua.
1.8.4 Sedimentti- ja vesinäytteiden valmistelu testiä varten
Ennen testiaineen lisäämistä näytteen on käytävä läpi akklimatisaatiojakso, jonka aikana kukin sedimentti- ja vesinäyte sijoitetaan varsinaisessa testissä käytettävään inkubaatiosäiliöön, ja akklimatisaation on tapahduttava täsmälleen samoissa olosuhteissa kuin testin inkubaatiojakson (katso kohta 1.9.1). Akklimatisaatiojakso on tarpeen, jotta järjestelmä saavuttaa kohtuullisen stabiilin tilan pH:n, veden happikonsentraation, sedimentin ja veden hapetus-pelkistyspotentiaalin sekä faasien makroskooppisen erottumisen osalta. Akklimatisaatiojakson suositeltu kesto on tavallisesti viikosta kahteen viikkoon, kuitenkin enintään neljä viikkoa. Tänä aikana mitatut määritystulokset on raportoitava.
1.9 TESTIN SUORITUS
1.9.1 Testiolosuhteet
Testi on suoritettava inkubointilaitteistossa (katso kohta 1.8.1), jossa veden ja sedimentin tilavuuden suhde on 3:1-4:1 ja sedimenttikerroksen paksuus on 2,5 cm (±0,5 cm). Vähintään 50 g sedimenttiä (kuivapaino) suositellaan laitettavaksi inkubaatiosäiliöön.
Testi on suoritettava pimeässä vakioidussa lämpötilassa, jonka alue voi olla 10-30 oC. Suositeltava lämpötila on 20 ± 2 oC. Tarvittaessa voidaan tapauskohtaisesti käyttää toista, alempaa lämpötilaa (esimerkiksi 10 oC), sen mukaan, millaisia tietoja testistä halutaan saada. Inkubointilämpötilaa on tarkkailtava ja se on raportoitava.
1.9.2 Testiaineen käsittely ja annostelu
Testissä käytetään yhtä testiaineen konsentraatiota (61). Kun testiaine on suoraan vesimassaan annosteltava kasvinsuojeluaine, aineen käyttöohjeissa oleva enimmäisannos tulkitaan enimmäisannostelumääräksi, joka lasketaan testisäiliössä olevan veden pinta-alan mukaan. Muissa tapauksissa testikonsentraation on perustuttava ympäristöpäästöjen perusteella tehtyihin ennusteisiin. Testiaineen oikea konsentraatio on valittava huolellisesti, jotta voidaan karakterisoida hajoamistuotteiden muodostuminen ja hajoaminen sekä niiden hajoamisreitit. Suurempienkin (esimerkiksi 10-kertaisten) testiaineannosten käyttö voi olla tarpeen tilanteissa, joissa testiaineen konsentraatiot ovat testin alussa lähellä havaitsemisrajaa ja/tai joissa pääasiallisia hajoamistuotteita ei voida helposti havaita, kun niiden osuus on 10 % testiaineen annostelumäärästä. Jos käytetään suurempia testiaineen konsentraatioita, ne eivät saa merkittävästi haitata vesi-sedimenttijärjestelmän mikrobien toimintaa. Jotta testiaineen konsentraatio erikokoisissa säiliöissä olisi sama, testiaineen määrää voidaan mukauttaa säiliön vesipatsaan syvyyden mukaan suhteessa veden syvyyteen tutkittavassa ympäristössä (oletusarvo on 100 cm, mutta muitakin syvyyksiä voidaan käyttää). Esimerkkilaskelma on liitteessä 4.
Ihannetapauksessa testiaine annostellaan vesiliuoksena testijärjestelmän vesifaasiin. Pakottavista syistä testiaineen annostelussa ja levittämisessä voidaan käyttää pieniä määriä veteen sekoittuvia liuottimia (esimerkiksi asetonia ja etanolia), mutta niiden määrä ei saa olla enempää kuin 1 % v/v, eivätkä ne saa haitata testijärjestelmän mikrobien toimintaa. Testiaineen vesiliuos on valmistettava huolella; täydellisen homogeenisyyden varmistamiseksi voi olla tarpeen käyttää kehitinkolonneja ja esisekoitusta. Kun vesiliuos on lisätty testijärjestelmään, on suositeltavaa sekoittaa vettä varovasti siten, että sedimenttiä häiritään mahdollisimman vähän.
Kaupallisten valmisteiden käyttö testissä ei ole yleensä suositeltavaa, koska valmisteen ainesosat voivat vaikuttaa testiaineen ja/tai hajoamistuotteiden jakautumiseen vesi- ja sedimenttifaasin välillä. Se voi kuitenkin tulla kysymykseen esimerkiksi veteen heikosti liukenevien testiaineiden kohdalla.
Inkubointisäiliöiden määrä riippuu näytteenottokertojen määrästä (katso kohta 1.9.3). Testissä on oltava riittävästi mitattavia näytteitä, sillä kullakin näytteenottokerralla kuluu kaksi mittausnäytettä. Jos kustakin vesiympäristön sedimenttijärjestelmästä tehdään kontrollinäyte, niitä ei käsitellä testiaineella. Kontrollinäytteitä voidaan käyttää sedimentin mikrobibiomassan sekä veden ja sedimentin orgaanisen hiilen kokonaismäärän määrittämiseen testin lopuksi. Kahta kontrollinäytettä (yksi kontrollinäyte kustakin vesiympäristön sedimentistä) voidaan käyttää akklimatisaatiojakson aikana tarvittavien vesi- ja sedimenttiparametrien tarkkailemiseen (katso taulukko kohdassa 1.8.2.2). Jos testiaine annostellaan liuottimen avulla, tarvitaan lisäksi kaksi kontrollinäytettä, jotta voidaan mitata testijärjestelmän haittavaikutukset mikrobien toimintaan.
1.9.3 Testin kesto ja näytteenotto
Testi saa tavallisesti kestää enintään 100 päivää (6), ja sitä on jatkettava niin kauan, kunnes hajoamisreitit sekä jakautuminen veteen ja sedimenttiin on selvitetty tai 90 % testiaineesta on hävinnyt muuntumisen tai haihtumisen kautta. Näytteenottokertoja on oltava ainakin kuusi (mukaan luettuna näytteenottokerta 0), ja ennen testiä voidaan tehdä vapaaehtoinen esitesti (katso kohta 1.9.4), jonka aikana päätetään asianmukaiset näytteenottojärjestelyt sekä testin kesto, mikäli riittäviä tietoja testiaineesta ei ole saatavissa aikaisemmista tutkimuksista. Kun testataan hydrofobisia aineita, testin alkuvaiheessa saatetaan tarvita ylimääräisiä näytteenottoajankohtia, jotta voidaan määrittää testiaineen jakautumisnopeus vesifaasin ja sedimenttifaasin välillä.
Asianmukaisina näytteenottoaikoina inkubointisäiliöt (rinnakkaisnäytteineen) irrotetaan kokonaisuudessaan analyysia varten. Sedimentti ja sen päällä oleva vesi analysoidaan erikseen (62). Pintavesi on poistettava varovasti niin, että sedimenttiä häiritään mahdollisimman vähän. Testiaineen ja hajoamistuotteiden eristämisessä ja karakterisoinnissa on noudatettava asianmukaisia analyysikäytäntöjä. Myös inkubointisäiliöön tai haihtuvien aineiden erottimen putkiin mahdollisesti adsorboitunut materiaali on huolellisesti poistettava.
1.9.4 Vapaaehtoinen esitesti
Jos testin kestoa ja näytteenottokäytäntöä ei voida päättää muiden testiainetta koskevien relevanttien tutkimusten perusteella, vapaaehtoinen esitesti voi olla tarpeen. Esitesti on tehtävä samoissa olosuhteissa, joissa varsinainen testi suunnitellaan tehtävän. Jos esitesti tehdään, olennaiset testiolosuhteet ja määritystulokset on lyhyesti raportoitava.
1.9.5 Mittaukset ja analyysi
Jokaisella näytteenottokerralla mitataan ja raportoidaan testiaineen ja hajoamistuotteiden konsentraatio vedessä ja sedimentissä (konsentraationa ja prosenttina testiaineen annostellusta määrästä). Yleisesti voidaan todeta, että hajoamistuotteet, jotka havaitaan ≥ 10 %:n pitoisuuksina annostellusta radioaktiivisesta aineesta vesi-sedimenttikokonaisjärjestelmässä millä tahansa näytteenottokerralla, on tunnistettava, paitsi mikäli muulle menettelylle on pätevät perusteet. On myös syytä harkita sellaisten hajoamistuotteiden tunnistusta, joiden konsentraatiot kasvavat jatkuvasti testin aikana, vaikka niiden konsentraatiot eivät ylittäisikään edellä esitettyjä rajoja, koska tämä voi merkitä tuotteiden pysyvyyttä. Nämä seikat on harkittava tapauskohtaisesti ja perustelut on esitettävä testiselosteessa.
Määritystulokset kaasujen tai helposti haihtuvien aineiden (CO2:n ja vastaavien helposti haihtuvien orgaanisten yhdisteiden) erotinjärjestelmistä on raportoitava kullakin näytteenottokerralla. Mineralisaationopeus on myös raportoitava. Uuttumattomat (sitoutuneet) jäämät sedimentissä on raportoitava kullakin näytteenottokerralla.
2. MITTAUSTULOKSET
2.1 TULOSTEN KÄSITTELY
Lisätyn radioaktiivisen aineen kokonaismassatase tai saanto (katso kohta 1.7.1) on laskettava jokaisella näytteenottokerralla. Määritystulokset on raportoitava prosenttina lisätystä radioaktiivisesta aineesta. Radioaktiivisen aineen jakautuminen veden ja sedimentin välille on raportoitava konsentraationa ja prosenttiosuutena jokaisella näytteenottokerralla.
Testiaineen puoliintumisaika, DT50- ja tarvittaessa DT75- ja DT90-arvot on laskettava luottamusväleineen (katso kohta 1.7.3). Tiedot testiaineen häviämisnopeudesta vedessä ja sedimentissä saadaan asianmukaisin arviointimenetelmin. Tällaisia voivat olla näennäisen ensimmäisen asteen kinetiikan käyttö, graafisia tai numeerisia ratkaisuja käyttävät empiiriset käyrän sovitukset sekä monimutkaisemmat arviointimenetelmät, joissa käytetään esimerkiksi yhden tai usean lohkon malleja. Lisätietoja on esitetty lähteissä (35)(36)(37).
Kaikissa lähestymistavoissa on omat vahvuutensa ja heikkoutensa, ja niiden monimutkaisuus vaihtelee suuresti. Ensimmäisen asteen kinetiikka voi yksinkertaistaa hajoamis- ja jakautumisprosesseja liikaa, mutta tapauksissa, joissa sitä voidaan käyttää, sen avulla saadaan suure (nopeusvakio tai puoliintumisaika), joka on helppotajuinen ja käyttökelpoinen simulaatiomallinnuksessa ja ennustettujen ympäristökonsentraatioiden laskennassa. Empiirisillä lähestymistavoilla tai lineaarisilla muunnoksilla voidaan tuottaa paremmin aineistoon sopivia käyriä ja siten tarkempia arvioita puoliintumisajoista, DT50- ja tarvittaessa DT75- ja DT90-arvoista. Derivoitujen vakioiden käyttökelpoisuus on kuitenkin rajoitettua. Lohkomalleilla voidaan luoda riskien arviointia varten useita käyttökelpoisia vakioita, jotka kuvaavat hajoamisnopeutta eri lohkoissa sekä kemikaalin jakautumista. Lohkomalleja on käytettävä myös pääasiallisten hajoamistuotteiden muodostumis- ja hajoamisnopeusvakioiden arviointiin. Valitun menetelmän on kaikissa tapauksissa oltava perusteltu, ja testaajan on esitettävä sovituksen hyvyys graafisesti ja/tai tilastollisesti.
3. TULOSTEN ILMOITTAMINEN
3.1 TESTISELOSTE
Testiselosteessa on annettava seuraavat tiedot:
|
|
Testiaine:
|
|
|
Vertailuaineet:
|
|
|
Testissä käytettävät sedimentti- ja vesinäytteet:
|
|
|
Testiolosuhteet:
|
|
|
Tulokset:
|
4. LÄHDELUETTELO
|
(1) |
BBA-Guidelines for the examination of plant protectors in the registration process. (1990). Part IV, Section 5-1: Degradability and fate of plant protectors in the water/sediment system. Germany. |
|
(2) |
Commission for registration of pesticides: Application for registration of a pesticide. (1991). Part G. Behaviour of the product and its metabolites in soil, water and air, Section G.2.1 (a). The Netherlands. |
|
(3) |
MAFF Pesticides Safety Directorate. (1992). Preliminary guideline for the conduct of biodegradability tests on pesticides in natural sediment/water systems. Ref No SC 9046. United Kingdom. |
|
(4) |
Agriculture Canada: Environmental chemistry and fate. (1987). Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) — Anaerobic and aerobic. Canada. pp 35-37. |
|
(5) |
US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982). Section 162-3, Anaerobic aquatic metabolism. |
|
(6) |
SETAC-Europe publication. (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides. Ed. Dr Mark R. Lynch. SETAC-Europe, Brussels. |
|
(7) |
OECD Test Guidelines Programme. (1995). Final Report of the OECD Workshop on Selection of Soils/sediments, Belgirate, Italy, 18-20 January 1995. |
|
(8) |
ISO/DIS 5667-12. (1994). Water quality — Sampling — Part 12: Guidance on sampling of bottom sediments. |
|
(9) |
US-EPA (1998a). Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPA 712-C-98-080. |
|
(10) |
DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998). |
|
(11) |
T.R. Roberts: Non-extractable pesticide residues in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984). |
|
(1) (12) |
OECD Test Guideline 304A: Inherent Biodegradability in Soil (adopted 12 May 1981). |
|
(13) |
OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals. |
|
(14) |
Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic model ecosystem. BCPC — Pests and Diseases, 3B-4, 149-158. |
|
(15) |
Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D.H. Hutson, T.R. Roberts, Eds.), Vol. 1, 85-114. J. Wiley & Sons. |
|
(16) |
Madsen, T., Kristensen, P. (1997). Effects of bacterial inoculation and non-ionic surfactants on degradation of polycyclic aromatic hydrocarbons in soil. Environ. Toxicol. Chem. 16, 631-637. |
|
(17) |
Steber, J., Wierich, P. (1987). The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with 14C-labelled model surfactants. Water Research 21, 661-667. |
|
(18) |
Black, C.A. (1965). Methods of Soil Analysis. Agronomy Monograph No. 9. American Society of Agronomy, Madison. |
|
(19) |
APHA (1989). Standard Methods for Examination of Water and Wastewater (17th edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C. |
|
(20) |
Rowell, D.L. (1994). Soil Science Methods and Applications. Longman. |
|
(21) |
Light, T.S. (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, 1038-1039. |
|
(22) |
SETAC-Europe publication (1991). Guidance document on testing procedures for pesticides in freshwater mesocosms. From the Workshop ”A Meeting of Experts on Guidelines for Static Field Mesocosms Tests”, 3-4 July 1991. |
|
(23) |
SETAC-Europe publication. (1993). Guidance document on sediment toxicity tests and bioassays for freshwater and marine environments. From the Workshop On Sediment Toxicity Assessment (WOSTA), 8-10 November 1993. Eds.: I.R. Hill, P. Matthiessen and F. Heimbach. |
|
(24) |
Vink, J.P.M., van der Zee, S.E.A.T.M. (1997). Pesticide biotransformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, 2858-2868. |
|
(25) |
Vink, J.P.M., Schraa, G., van der Zee, S.E.A.T.M. (1999). Nutrient effects on microbial transformation of pesticides in nitrifying waters. Environ. Toxicol, 329-338. |
|
(26) |
Anderson, T.H., Domsch, K.H. (1985). Maintenance carbon requirements of actively-metabolising microbial populations under in-situ conditions. Soil Biol. Biochem. 17, 197-203. |
|
(27) |
ISO-14240-2. (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigation- extraction method. |
|
(28) |
Beelen, P. Van and F. Van Keulen. (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), 13-21. |
|
(29) |
Shelton, D.R. and Tiedje, J.M. (1984). General method for determining anaerobic biodegradation potential. App. Environ. Microbiol. 47, 850-857. |
|
(30) |
Birch, R.R., Biver, C., Campagna, R., Gledhill, W.E., Pagga, U., Steber, J., Reust, H. and Bontinck, W.J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550. |
|
(31) |
Pagga, U. and Beimborn, D.B. (1993). Anaerobic biodegradation tests for organic compounds. Chemoshpere 27, 1499-1509. |
|
(32) |
Nuck, B.A. and Federle, T.W. (1986). A batch test for assessing the mineralisation of 14C-radiolabelled compounds under realistic anaerobic conditions. Environ. Sci. Technol. 30, 3597-3603. |
|
(33) |
US-EPA (1998b). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPA 712-C-98-090. |
|
(12) (34) |
Sijm, Haller and Schrap (1997). Influence of storage on sediment characteristics and drying sediment on sorption coefficients of organic contaminants. Bulletin Environ. Contam. Toxicol. 58, 961-968. |
|
(35) |
Timme, G., Frehse H. and Laska V. (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues II. Pflanzenschutz — Nachrichten Bayer, 39, 187-203. |
|
(36) |
Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues I. Pflanzenschutz — Nachrichten Bayer, 33, 47-60. |
|
(37) |
Carlton, R.R. and Allen, R. (1994). The use of a compartment model for evaluating the fate of pesticides in sediment/water systems. Brighton Crop Protection Conference — Pest and Diseases, pp 1349-1354. |
LIITE 1
AEROBISIIN JA ANAEROBISIIN TESTIJÄRJESTELMIIN LIITTYVIÄ OHJEITA
Aerobinen testijärjestelmä
Tässä menetelmässä kuvattu aerobinen testijärjestelmä koostuu aerobisesta vesikerroksesta (tyypillinen happikonsentraatio on 7-10 mg · l-1) ja sedimenttikerroksesta, joka on aerobinen pinnalta ja anaerobinen sen alta (tyypillinen hapetus-pelkistyspotentiaalien (Eh) keskiarvo sedimentin anaerobisella alueella on - 80 ... - 190 mV). Kussakin inkubointiyksikössä viedään kosteutettua ilmaa veden pinnalle riittävän happimäärän varmistamiseksi ilmatilassa.
Anaerobinen testijärjestelmä
Anaerobisessa testijärjestelmässä testimenettely on olennaisilta osin sama kuin aerobisessa järjestelmässä sillä poikkeuksella, että kussakin inkubointiyksikössä veden pinnalle viedään kosteutettua typpeä riittävän typpimäärän varmistamiseksi ilmatilassa. Sedimenttiä ja vettä voidaan pitää anaerobisina heti, kun hapetus-pelkistyspotentiaali (Eh) on alle - 100 mV.
Anaerobisessa testissä mineralisaation arviointiin kuuluu myös näytteessä kehittyneen hiilidioksidin ja metaanin mittaus.
LIITE 2
ESIMERKKI LÄPIVIRTAUSJÄRJESTELMÄSTÄ

LIITE 3
ESIMERKKI ERLENMEYER-LAITTEESTA (BIOMETER)
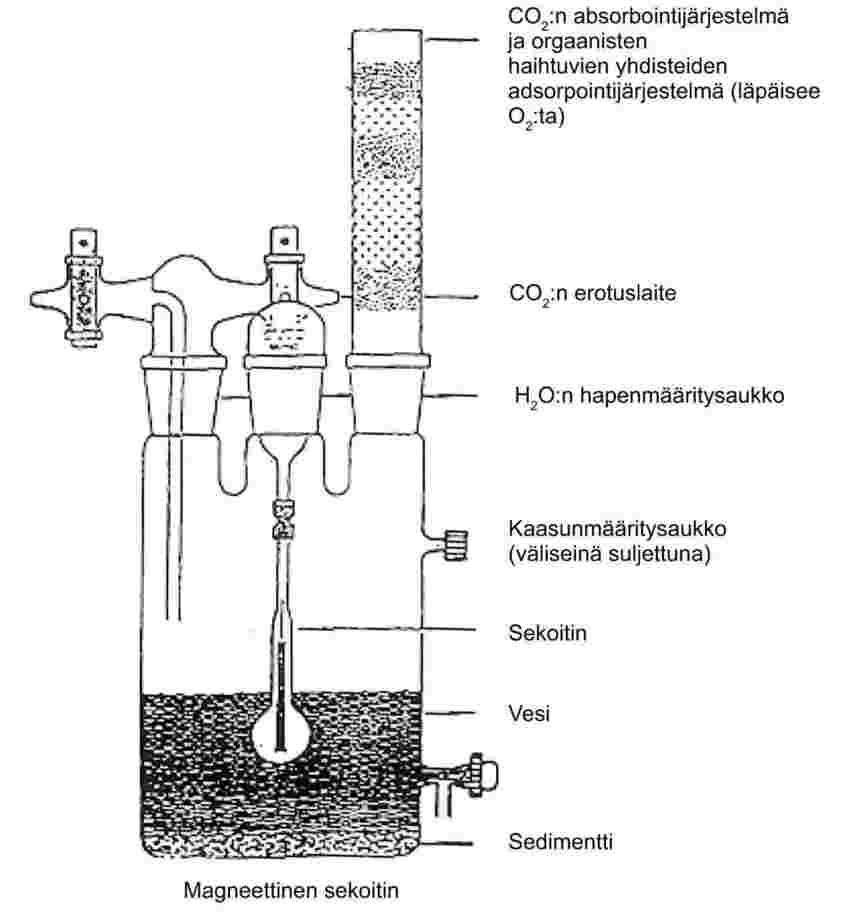
LIITE 4
ESIMERKKILASKELMA TESTIAINEEN ANNOSTELUSTA TESTISÄILIÖIHIN
|
Lieriön sisähalkaisija: |
= 8 cm |
|
Vesipatsaan syvyys sedimentti poisluettuna: |
= 12 cm |
|
Pinta-ala: 3,142 x42 |
= 50,3 cm2 |
|
Annostus: 500 g testiainetta/ha vastaa 5 μg/cm2 |
|
|
Yhteensä μg: 5 x 50,3 |
= 251,5 μg |
|
Mukautettu määrä suhteessa 100 cm:n syvyyteen: 12 x 251,5 ÷ 100 |
= 30,18 μg |
|
Vesipatsaan tilavuus: 50,3 x 12 |
= 603 ml |
|
Konsentraatio vedessä: 30,18 ÷ 603 |
= 0,050 μg/ml tai 50 μg/l |
(1) Näiden monilaboratoriotestien tulosten sekä oikaistun ISO 634 -standardin mukaan kaliumdikromaatin (K2Cr2O7) EC50 (24 h) sijoittuu välille 0,6 mg/l–1,7 mg/l.
(2) Veden on oltava sopivan puhdasta, esimerkiksi deionisoitua, tislattua tai käänteisosmoosilla puhdistettua, ja johtavuus ei saisi olla yli 10 μS.cm-1.
(3) Jos D1- ja D2-arvojen ero on suuri, arvojen keskiarvoa ei pidä käyttää
(4) Jos D1- ja D2-arvojen ero on suuri, arvojen keskiarvoa ei pidä käyttää
(5) tai inkubaation lopussa
(6) Jos D1- ja D2-arvojen ero on suuri, arvojen keskiarvoa ei pidä käyttää.
(7) tai inkubaation lopussa
(8) Jos D1 ja D2-arvojen ero on suuri, arvojen keskiarvoa ei pidä käyttää.
(9) Jos toistoarvojen ero on suuri, toistoarvojen keskiarvoa ei pidä käyttää.
(10) Elohopeasuoloja sisältävät liuokset on käytön jälkeen käsiteltävä siten, ettei ympäristöön pääse elohopeaa.
(11) Mabey ja Mill suosittelevat boraatti- tai asetaattipuskurin käyttöä fosfaattipuskurin sijaan (11).
(12) Tällainen tieto voi olla peräisin muista lähteistä, kuten rakenteellisesti samankaltaisten yhdisteiden hydrolyysitiedoista (kirjallisuudesta) tai muista alustavista semikvantitatiivisista hydrolyysitesteistä, joissa testiainetta on testattu aiemmassa kehitysvaiheessa.
(13) Jos mittaustulosten esitys logaritmisessa asteikossa ajan funktiona ei osoita lineaarista funktiota (joka vastaa ensimmäisen kertaluvun reaktionopeutta), yhtälöä [3] ei voida käyttää testiyhdisteen hydrolyysivakion määrittämiseen.
(14) Näissä taulukoissa ilmoitetut pH-arvot on laskettu potentiaalimittausten perusteella käyttäen Sörensenin vakioyhtälöitä (1909). Vastaavat pH-arvot ovat 0,04 yksikköä suuremmat kuin taulukossa olevat arvot.
(15) Lisätään pieni tymolikide tai muuta samantyyppistä ainetta homesienien kasvun estämiseksi.
(16) Kolminkertaisten määritysten keskiarvo.
(17) Meyer A., Orti G. (1993} Proc. Royal Society of London, Series B., Vol. 252, p. 231.
(18) Vedestä otetaan näyte, kun kammioon on lisätty vähintään 3 kammion tilavuutta vettä.
Suluissa olevat luvut ovat mahdollisten lisänäytteiden (vesi, kala) määrä.
|
Huom. |
: |
Ennen testiä tehty arvio k2:lle, kun log Pow on 4,0 on 0,652 vrk-1. Koko kokeen kesto on 3 X up = 3 x 4,6 vrk eli 14 vrk. Ottovaiheen (up) arviota varten katso liite 3. |
(19) Sarakkeesta voi valita viiden (tai useamman) peräkkäisen pitoisuuden sarjan. Sarakkeessa (x) olevien pitoisuuksien keskivälillä olevia arvoja on sarakkeessa (2x + 1). Luetellut arvot voivat olla prosenttiosuuksina tilavuusyksikköä tai painoyksikköä kohti ilmaistuja pitoisuuksia (mg/l tai μg/l). Arvot voidaan tarvittaessa jakaa tai kertoa kymmenen potensseilla. Saraketta 1 voidaan käyttää, jos myrkyllisyystaso on hyvin epävarma
(20) OECD, Pariisi, 1992, Test Guideline 210, Fish. Early-life Stage Toxicity Test.
(21) Alkioille.
(22) Toukille.
(23) Alkiot ja toukat pidetään pimeässä viikon ajan kuoriutumisen jälkeen paitsi silloin, kun niitä tarkastellaan. Sen jälkeen heikko valaistus testin loppuun asti.
(24) FAO- ja US-järjestelmän mukaisesti (85).
(25) Vastaavien muuttuja-arvojen olisi mieluiten oltava annetulla alueella. Jos sopivan maa-ainesmateriaalin löytämisessä kuitenkin ilmenee vaikeuksia, annettujen vähimmäisarvojen alapuolelle jäävät arvot hyväksytään.
(26) Maa-ainekset, joiden orgaanisen hiilen pitoisuus on alle 0,3 %, voivat häiritä orgaanisen aineen pitoisuuden ja adsorption välistä korrelaatiota. Siksi suositellaan käytettäväksi maa-aineksia, joiden orgaanisen hiilen vähimmäispitoisuus on 0,3 %.
(28) Vesifaasissa olevan testiaineen konsentraatiota 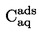 ajan funktiona kuvaavia diagrammeja voidaan käyttää myös tasapainotilan saavuttamisen arviointiin (katso kuva 2 lisäyksessä 5).
ajan funktiona kuvaavia diagrammeja voidaan käyttää myös tasapainotilan saavuttamisen arviointiin (katso kuva 2 lisäyksessä 5).
(29) DT-50: aika, jolloin 50 % testiaineesta on hajonnut.
(30) W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), s. 121–128.
(31) W. Kördel, D. Hennecke, C. Franke (1997). Determination of the adsorption-coefficients of organic substances on sewage sludges. Chemosphere, 35 (1/2), s. 107–119.
(32) W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), s. 1373–1384.
(33) W. Kördel. J. Müller (1994). Bestimmung des Adsorptionskoeffizienten organischer Chemikalien mit der HPLC. UBA R & D Report No 106 01 044 (1994).
(34) B.V. Oepen, W. Kördel, W. Klein (1991). Chemosphere, 22. s. 285–304.
(35) Data provided by industry.
(36) Ilmoitettava, mitä astiaa käytettiin kokeeseen.
(37) Kuolleet aikuiset kirjataan merkinnällä ’M’ asianomaiseen ruutuun.
(38) Abortoituneet jälkeläiset kirjataan merkinnällä ’AB’ asianomaiseen ruutuun.
(39) Jos testiainemolekyyli sisältää esimerkiksi yhden renkaan, tämä rengas täytyy merkitä; jos testiainemolekyyli sisältää kaksi tai useampia renkaita, saatetaan tarvita erillinen testi kunkin merkityn renkaan reitin arvioimiseksi ja tarvittavan tiedon saamiseksi hajoamistuotteiden muodostumisesta.
(40) Maannoksen vedenpidätyskyky voidaan mitata joko vedenpidätyslukuna, vedenpidätyskykynä tai imupaineena (pF). Lisätietoja asiasta on liitteessä 1. Testiraportissa on ilmoitettava, onko maannoksen vedenpidätysominaisuudet ja bulkkitiheys määritetty luonnontilaisista vai häiriintyneistä (käsitellyistä) maannosnäytteistä.
(41) Viimeaikaiset tutkimustulokset osoittavat, että myös lauhkeilta ilmastovyöhykkeiltä kerätyt maannokset voidaan varastoida - 20 oC:ssa yli kolmen kuukauden ajan (28)(29) mikrobien toiminnan siitä merkittävästi häiriintymättä.
(42) Maanäyte ei saa olla liian kostea eikä liian kuiva, jotta maaperän pieneliöiden ilmastus ja ravitsemustila pysyy sopivana. Optimaalisen mikrobien kasvun kannalta suositeltava kosteuspitoisuus on 40-60 % vedenpidätyskyvystä ja paine 0,1-0,33 bar (6). Jälkimmäinen arvo vastaa pF-arvoja 2,0-2,5. Eri maannostyyppien tyypilliset kosteuspitoisuudet esitetään liitteessä 2.
(43) Pintamaissa ja jopa jankossa vallitsevat yleensä aerobiset olosuhteet, kuten käy ilmi EY:n rahoittamasta tutkimushankkeesta [K. Takagi et al. (1992). Microbial diversity and activity in subsoils: Methods, field site, seasonal variation in subsoil temperatures and oxygen contents. Proc. Internat. Symp. Environm. Aspects Pesticides Microbiol., 270-277, 17-21 August 1992, Sigtuna, Ruotsi]. Anaerobisia olosuhteita esiintyy vain ajoittain maannosten tulvimisen aikaan rankkasateiden jälkeen tai riisipeltojen kosteikkoviljelyssä.
(44) Aerobiset testit voidaan lopettaa paljon ennen 120:tä päivää, jos lopullinen hajoamisreitti ja lopullinen mineralisaatio on selkeästi tapahtunut siihen mennessä. Testi voidaan lopettaa 120 päivän kuluttua tai silloin kun vähintään 90 % testiaineesta on hajonnut, mutta vasta silloin kun CO2:ta on muodostunut vähintään 5 %.
(45) Alkuperäinen konsentraatio pinta-alan perusteella voidaan laskea seuraavasta yhtälöstä:

|
Csoil |
= |
Alkuperäinen konsentraatio maanäytteessä [mg·kg-1] |
|
A |
= |
Annostus [kg·ha-1]; l = maannoksen paksuus tutkittavassa ympäristössä [m]; d = maannoksen kuivabulkkitiheys [kg·m-3]. |
Nyrkkisääntö on, että annostuksella 1 kg·ha-1 maannoksen konsentraatioksi tulee noin 1 mg·kg-1 kymmenen sentin kerroksena (olettaen, että bulkkitiheys on 1 g·cm-3).
(46) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
(47) pF = vesipatsaan korkeuden (cm) logaritmi.
(48) 1 bar= 105 Pa.
(49) Vastaa noin 10 %:n vesipitoisuutta hiekassa, 35 %:n hiesussa ja 45 %:n savessa.
(50) Kenttäkapasiteetti ei ole vakio, vaan vaihtelee maannostyypin mukaan pF-arvojen 1,5 ja 2,5 välillä.
(51) Vedenpidätyskyky
(52) Guth, J.A. (1980). The study of transformations. Teoksessa Interactions between Herbicides and the Soil (R.J. Hance, toim.), Academic Press, 123–157.
(53) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. Teoksessa Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, toim. J. Wiley & Sons. Vol 1, 85–114.
(54) Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141–146.
(55) Jos testiaine sisältää esimerkiksi yhden renkaan, tämä rengas täytyy merkitä; jos testiaine sisältää kaksi tai useampia renkaita, saatetaan tarvita erillinen testi kunkin merkityn renkaan reitin arvioimiseksi ja tarvittavan tiedon saamiseksi hajoamistuotteiden muodostumisesta.
(56) Koska nämä emäksiset absorptioliuokset imevät myös tuuletusilman hiilidioksidin sekä aerobisissa testeissä soluhengityksen tuloksena syntyneen hiilidioksidin, ne on vaihdettava säännöllisesti, jotta vältetään niiden kyllästyminen ja siitä seuraava absorptiokyvyn menettäminen.
(57) [Savi + siltti] on sedimentin mineraaliosa, jonka raekoko on <50 μm.
(58) Aerobisissa tutkimuksissa mikrobien hengitysnopeusmenetelmä (26), savutusmenetelmä (27) tai pesäkkeiden laskeminen Petri-maljassa (esimerkiksi bakteerit, aktinomykeetit eli sädesienet, sienet ja pesäkkeiden kokonaismäärä); anaerobisissa tutkimuksissa metaanin muodostumisnopeus.
(59) Viimeaikaiset tutkimukset ovat osoittaneet, että veden happipitoisuuden ja hapetus-pelkistyspotentiaalin mittauksilla ei ole sen paremmin mekanistista kuin ennustavaa arvoa, kun kysymys on pintavesien mikrobipopulaatioiden kasvusta ja kehityksestä (24)(25). Parempia välineitä aerobisen biomuuntumisen nopeuden ja reittien tulkintaan ja arvioimiseen voivat olla biokemiallinen hapenkulutus (näytteenoton yhteydessä sekä testin alussa ja lopussa mitattuna) sekä hivenaineiden/makroravinteiden Ca, Mg ja Mn konsentraatiot (testin alussa ja lopussa) vedessä sekä N:n ja P:n kokonaismäärät sedimentissä (näytettä otettaessa sekä testin lopussa).
(60) Viimeaikaiset tutkimukset ovat osoittaneet, että varastointi 4 oC:n lämpötilassa saattaa vähentää sedimentin orgaanisen hiilen pitoisuutta, mikä puolestaan saattaa vähentää mikrobien toimintaa (34).
(61) Kahden konsentraation käyttäminen voi olla hyödyllistä testattaessa kemikaaleja, jotka päätyvät pintavesiin eri reittejä ja esiintyvät niissä merkittävästi erilaisina konsentraatioina, kunhan pienempi konsentraatio on analysoitavissa riittävän tarkasti.
(62) Tapauksissa, joissa anaerobiset hajoamistuotteet voivat hapettua uudelleen nopeasti, on huolehdittava anaerobisten olosuhteiden säilymisestä näytteenoton ja analyysin aikana.






 (mN/m)
(mN/m)







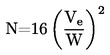

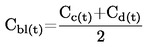
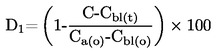




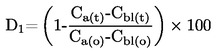

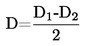


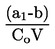




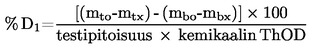
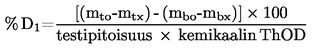


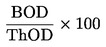


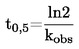


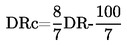

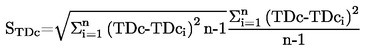

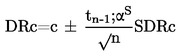






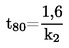
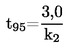






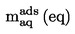

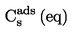
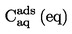
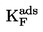







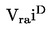


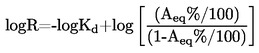







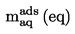
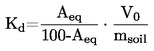


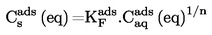


 :n laatua osoittavassa yksikössä
:n laatua osoittavassa yksikössä 









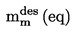

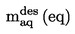
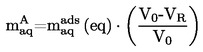

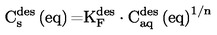



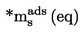





 :n määrityksessä
:n määrityksessä
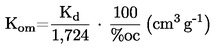


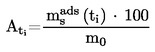


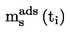
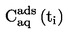

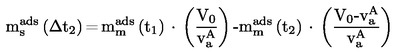


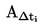 , lasketaan seuraavaa yhtälöä käyttäen:
, lasketaan seuraavaa yhtälöä käyttäen: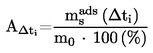
 ajanhetkellä t
ajanhetkellä t
 tai
tai  (tutkimuksen tarpeiden mukaisesti) esitetään ajan funktiona ja määritetään aika, joka kuluu sorptiotasapainotilan saavuttamiseen.
(tutkimuksen tarpeiden mukaisesti) esitetään ajan funktiona ja määritetään aika, joka kuluu sorptiotasapainotilan saavuttamiseen.


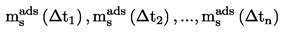



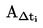

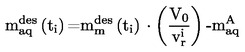



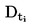

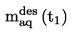
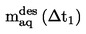
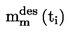
 , joka otetaan analyysiä varten (μg)
, joka otetaan analyysiä varten (μg)




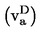 ja desorboitunut massa lasketaan seuraavan yhtälön mukaisesti:
ja desorboitunut massa lasketaan seuraavan yhtälön mukaisesti:
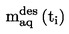 =
=  .
. lasketaan seuraavasta yhtälöstä:
lasketaan seuraavasta yhtälöstä:


 and
and
 and
and

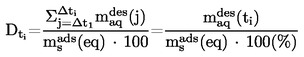

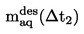




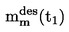
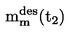

 mitatun aineen massa ajanhetkellä t
mitatun aineen massa ajanhetkellä t