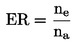|
6)
|
Lisatakse järgmised peatükid C.31–C.46: „C.31. KATSE MAISMAATAIMEDEGA: TÄRKAMINE JA SEEMIKU KASV
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 208 (2006). Katsemeetodeid vaadatakse korrapäraselt läbi, et võtta arvesse teaduse arengut ja kaaluda nende kasutatavust regulatiivsete vajaduste rahuldamiseks. Käesoleva ajakohastatud katsemeetodi abil hinnatakse kemikaalide võimalikku mõju seemikute tärkamisele ja kasvule. Meetod ei hõlma kroonilist mõju ega mõju paljunemisvõimele (st seemnete valmimisele, õitsemisele, viljade küpsemisele). Et tagada sobiva katsemeetodi kasutamine, tuleb arvesse võtta uuritava kemikaali omadusi ja kokkupuutetingimusi (näiteks tuleks metallide/metalliühendite puhul arvesse võtta nendega seotud vastasioonide ja pH mõju) (1). Käesolev katsemeetod ei hõlma taimede kokkupuudet kemikaaliaurudega. Meetod on kasutatav üldotstarbeliste kemikaalide, biotsiidide ja taimekaitsevahendite (pestitsiidide) mõju hindamiseks. See on välja töötatud olemasolevate meetodite põhjal (2, 3, 4, 5, 6, 7). Samuti võeti arvesse taimedega tehtavaid katseid käsitlevaid muid allikaid (8, 9, 10). Kasutatud mõisted on esitatud 1. liites.
|
KATSE PÕHIMÕTE
|
2.
|
Katsega hinnatakse kõrgemate taimede seemikute tärkamisele ja varajasele kasvule avalduvat mõju kokkupuutel mullas (või muus sobiva koostisega pinnases) esineva uuritava kemikaaliga. Seemned viiakse kokkupuutesse uuritava kemikaaliga töödeldud pinnasega ja neile avalduvat mõju hinnatakse tavaliselt 14–21 päeva jooksul pärast 50 % seemikute tärkamist kontrollrühmas. Katses mõõdetavad näitajad on silmaga hinnatav tärkamine, võrsete kuivmass (või märgmass) ja teatud juhtudel võrsete kõrgus, samuti silmaga hinnatav kahjulik mõju taime eri osadele. Neid mõõtmistulemusi ja vaatlusi võrreldakse kemikaaliga mitte kokku puutunud kontrolltaimede vastavate näitajatega.
|
|
3.
|
Olenevalt eeldatavast kokkupuuteviisist viiakse uuritav kemikaal mulda (või kunstlikku pinnasesse) või töödeldakse sellega mullapinda, vastavalt sellele, kumb kemikaaliga kokkupuutumise viis peegeldab võimalikku tegelikku olukorda. Mulda viimise korral töödeldakse kogu mulda korraga. Pärast töötlemist jaotatakse muld pottidesse ja seejärel pannakse asjaomase taimeliigi seemned mulda. Kui kemikaaliga töödeldakse mullapinda, tehakse seda pottides oleva mullaga pärast seemnete muldapanekut. Seejärel tagatakse katseüksustele (kontrollid ja töödeldud muld koos seemnetega) sobivad tingimused seemnete idanemise ja taimede kasvu võimaldamiseks.
|
|
4.
|
Katse eesmärgist sõltuvalt võib selle läbi viia koguse ja mõju vahelise sõltuvuse kõvera saamiseks või piirsisalduskatsena, milles kasutatakse ühte kindlat kontsentratsiooni või koguselist määra. Kui ühel kontsentratsioonil või koguselisel määral põhineva katse tulemustest nähtub, et mürgisus ületab teatud taseme (nt täheldatakse suuremat mõju kui x %), tehakse mürgisuse ülem- ja alampiiri määramiseks kogusevahemiku leidmise katse ja seejärel mitmel kontsentratsioonil või koguselisel määral põhinev katse koguse ja mõju vahelise sõltuvuse kõvera koostamiseks. Sobiva statistilise analüüsimeetodiga leitakse kõige tundlikuma(te) vaadeldava(te) näitaja(te) alusel efektiivne kontsentratsioon ECx või efektiivne kogus ERx (nt EC25, ER25, EC50, ER50). Kõnealuse katsega saab kindlaks teha ka täheldatavat toimet mitteavaldava kontsentratsiooni (NOEC) ja vähima täheldatavat toimet avaldava kontsentratsiooni (LOEC).
|
TEAVE UURITAVA KEMIKAALI KOHTA
|
5.
|
Kemikaaliga kokkupuutumise eeldatava viisi kindlakstegemisel ja katseplaani koostamisel on kasu järgmisest teabest: struktuurivalem, puhtus, lahustuvus vees, lahustuvus orgaanilistes lahustites, jaotuskoefitsient süsteemis 1-oktanool/vesi, aururõhk, sorbeeruvus pinnases, keemiline püsivus vees ja valguse käes ning biolagunduvus.
|
KATSE NÕUETEKOHASUS
|
6.
|
Katse loetakse nõuetekohaseks, kui kontrollrühmas on täidetud järgmised kriteeriumid:
|
—
|
seemikute tärkamine on vähemalt 70 %;
|
|
—
|
seemikutel ei täheldata nähtavaid fütotoksilisuse ilminguid (nt kloroos, nekroos, närbumine, varre või lehtede moondumine) ning varieeruvus taimede kasvus ja morfoloogias jääb konkreetsele liigile iseloomulikku vahemikku;
|
|
—
|
tärganud seemikute keskmine ellujäämise määr katse vältel on kontrollrühmas vähemalt 90 %;
|
|
—
|
keskkonnatingimused on konkreetse liigi puhul ühesugused ning kasvukeskkond sisaldab ühesuguses koguses ja samast allikast pärit mulda, kasvu toetavaid koostisosi või substraati.
|
|
VÕRDLUSKEMIKAAL
|
7.
|
Võrdluskemikaali abil võib korrapäraselt kontrollida, kas katsetulemused, konkreetsete katsetaimede reaktsioon ja katsetingimused on aja jooksul üldjoontes samaks jäänud. Teise võimalusena võib kasutada varasemaid kontrolltaimede biomassi- või kasvuandmeid, mis võimaldavad teha laboritevahelist kvaliteedikontrolli ja hinnata katsesüsteemi usaldusväärsust konkreetses laboris.
|
MEETODI KIRJELDUS
Looduslik muld ja kunstlik substraat
|
8.
|
Taimi võib kasvatada pottides, kasutades liivsavimulda või kerget või keskmist saviliivmulda, mis sisaldab kuni 1,5 % orgaanilist süsinikku (umbes 3 % orgaanilist ainet). Võib kasutada ka müügilolevat potimulda või sünteetilist mullasegu, mis sisaldab kuni 1,5 % orgaanilist süsinikku. Savimuldasid ei tohiks kasutada, kui on teada, et uuritava kemikaali afiinsus savi suhtes on suur. Põllumuld tuleks homogeensuse tagamiseks ja suurte osakeste kõrvaldamiseks selliselt läbi sõeluda, et osakeste suurus ei oleks üle 2 mm. Tuleks esitada kasutusvalmis mulla tüüp ja lõimis, orgaanilise süsiniku protsentuaalne sisaldus, pH ja soolasisaldust kajastav elektrijuhtivus. Muld tuleks klassifitseerida vastavalt standardsele klassifitseerimissüsteemile (11). Mulla patogeenide mõju vähendamiseks võib mulla pastöriseerida või seda kuumtöödelda.
|
|
9.
|
Loodusliku mulla puhul võib selle füüsikalis-keemiliste omaduste ja mikroobipopulatsioonide varieeruvuse tõttu olla tulemuste varieeruvus suurem ja nende tõlgendamine raskem. Need muutujad mõjutavad omakorda mulla niiskusmahtuvust, kemikaalide sidumise võimet, aereeritust ning toitainete ja mikroelementide sisaldust. Lisaks nimetatud füüsikalistele teguritele varieeruvad ka mulla keemilised omadused, näiteks pH ja redokspotentsiaal, mis võivad mõjutada uuritava kemikaali biokättesaadavust (12, 13, 14).
|
|
10.
|
Taimekaitsevahendite mõju hindamisel ei kasutata tavaliselt kunstlikke substraate, kuid neist võib olla kasu üldotstarbeliste kemikaalide mõju hindamisel või juhul, kui soovitakse minimeerida loodusliku mulla varieeruvust ja parandada katsetulemuste võrreldavust. Kasutatavad substraadid peaksid koosnema inertsest materjalist, mille puhul vastasmõju uuritava kemikaali, kasutatava lahusti või mõlemaga on minimaalne. On leitud, et sobivad inertsed materjalid, mis absorbeerivad uuritavat kemikaali minimaalselt ja mille puhul on tagatud kemikaali maksimaalne kättesaadavus seemikule juurte kaudu, on happega pestud kvartsliiv, mineraalvill ja klaashelmed (nt läbimõõduga 0,35–0,85 mm). Sobimatud substraadid on näiteks vermikuliit, perliit ja muud tugevalt absorbeerivad materjalid. Tuleks tagada taimekasvu soodustavate toitainete olemasolu, et taimedel ei tekiks toitainevaegusest tingitud stressi, ning võimaluse korral tuleks selle hindamiseks teha kontrolltaimedele keemiline analüüs või neid visuaalselt hinnata.
|
Katseliigi valimise kriteeriumid
|
11.
|
Valitavad liigid peaksid esindama piisavalt laia spektrit, näiteks lähtuvalt nende taksonoomilisest kuuluvusest taimeriigis, nende levikust, arvukusest, elutsükliga seotud liigispetsiifilistest omadustest ja looduslikust levialast, et oleks võimalik vaadelda rida eri reaktsioone uuritavale kemikaalile (8, 10, 16, 17, 18, 19, 20). Võimaliku katseliigi valimisel tuleks arvesse võtta järgmisi kriteeriume:
|
—
|
asjaomase liigi seemned on ühetaolised ja usaldusväärsest standardsest seemnepangast hõlpsalt kättesaadavad ning nende puhul on tagatud järjepidev, kindel ja ühtlane seemnete idanemine ja seemikute ühetaoline kasv;
|
|
—
|
asjaomased taimed sobivad laborikatsetes kasutamiseks ning nendega saadavad tulemused on usaldusväärsed ja nii ühes uurimislaboris kui ka eri laborites reprodutseeritavad;
|
|
—
|
katseliigi tundlikkus peaks vastama keskkonnas kemikaaliga kokku puutuvate taimede puhul täheldatavale tundlikkusele;
|
|
—
|
asjaomaseid taimi on teataval määral kasutatud varasemates mürgisuse hindamise katsetes ja nende kasutamisel näiteks herbitsiididega tehtavates biokatsetes, raskmetallide mõju või soolsusest või mineraalainetest tingitud stressi hindamise katsetes või allelopaatiauuringutes on täheldatud tundlikkust paljude stressiallikate suhtes;
|
|
—
|
käesoleva katsemeetodi puhul kasutatavad kasvutingimused on asjaomastele taimedele sobivad;
|
|
—
|
asjaomased taimed vastavad katse nõuetekohasuse kriteeriumidele.
|
Mõned varem kõige sagedamini kasutatud katseliigid on loetletud 2. liites ja võimalikud põllumajanduskultuuride hulka mittekuuluvad liigid 3. liites.
|
|
12.
|
Katses kasutatavate liikide arv sõltub asjakohastest õiguslikest nõuetest ja seepärast seda käesolevas katsemeetodis ei määratleta.
|
Uuritava kemikaaliga töötlemine
|
13.
|
Kemikaaliga töötlemiseks tuleks kasutada sobivat kandeainet (nt vesi, atsetoon, etanool, polüetüleenglükool, kummiaraabik, liiv). Katses võib kasutada ka segusid (kindlaksmääratud koostisega tooted või valmistised), mis sisaldavad toimeaineid ja eri abiaineid.
|
Kemikaali viimine mulda või kunstlikku substraati
|
14.
|
Vees lahustuvad või vees suspensiooni moodustavad kemikaalid võib lisada veele ja seejärel segada saadud lahuse sobiva segamisseadme abil mullaga. Sellist tüüpi katse võib olla sobiv juhul, kui kokkupuude kemikaaliga toimub mulla või mullapoorides oleva vee kaudu ja soovitakse hinnata kemikaali omastamist juurte kaudu. Uuritava kemikaali lisamisel ei tohiks vedeliku kogus ületada mulla veemahutavust. Lisatav veekogus peaks olema iga katses kasutatava kontsentratsiooni puhul sama ning piiratud, et hoida ära mullaosakeste kokkukleepumist.
|
|
15.
|
Vees raskesti lahustuvad kemikaalid tuleks lahustada sobivas lenduvas lahustis (nt atsetoon või etanool) ja segada liivaga. Seejärel saab lahusti liivast õhujoa abil kõrvaldada, segades liiva samal ajal pidevalt. Töödeldud liiv segatakse katses kasutatava mullaga. Täiendava kontrollina kasutatakse mulda, millele lisatakse üksnes lahustiga töödeldud liiva. Täiendava kontrolli ja iga kasutatava kontsentratsiooni puhul lisatakse ühesugune kogus liiva, mis on lahustiga segatud ja millest lahusti on kõrvaldatud. Kui uuritav tahke kemikaal on lahustumatu, segatakse see sobiva segamisseadme abil kuiva mullaga. Seejärel viiakse muld pottidesse ja sellesse külvatakse viivitamata seemned.
|
|
16.
|
Kui mulla asemel kasutatakse kunstlikku substraati, võib vees lahustuva kemikaali lahustada vahetult enne katse algust toitainelahuses. Kui kemikaal on vees lahustumatu, kuid seda on võimalik lahusti abil vees suspendeerida, tuleks see lisada toitainelahusesse koos lahustiga. Vees lahustumatu kemikaal, mille jaoks ei ole mittemürgist vees lahustuvat lahustit, tuleks lahustada sobivas lenduvas lahustis. Lahus segatakse liiva või klaashelmestega, segu pannakse vaakumpöördaurustisse, lahustil lastakse aurustuda ning selle tulemusena saadakse ühtlaselt kemikaaliga kaetud liiv või helmed. Enne pottide täitmist tuleks kemikaal teatava koguse kaalutud helmeste pinnalt sama orgaanilise lahustiga ekstraheerida ja seda analüüsida.
|
Mullapinna töötlemine
|
17.
|
Taimekaitsevahendite puhul kasutatakse uuritava kemikaaliga töötlemiseks sageli katselahuse pihustamist mullapinnale. Kõnealuste katsete tegemiseks kasutatavad seadmed, sealhulgas uuritava kemikaali lahuse valmistamiseks ja mullapinnale kandmiseks kasutatavad seadmed, peaksid olema sellise ehituse ja töökindlusega, et nende abil saaks teha täpseid katseid, mille puhul oleks tagatud katvuse reprodutseeritavus. Katvus peaks olema kõikjal mullapinnal ühtlane. Tuleks hoolikalt jälgida, et kemikaal ei adsorbeeruks seadmetele (nt plasttorud, lipofiilsed kemikaalid või terasosad ja -detailid) ega reageeriks nendega. Uuritavat kemikaali pihustatakse mullapinnale viisil, millega jäljendatakse tüüpilist töötlemist pihustusseadme abil. Üldjuhul peaks pihustatavad kogused jääma põllumajanduses tavapäraselt kasutatavasse vahemikku ning asjaomased kogused (vee hulk jne) tuleks märkida katseprotokolli. Tuleks valida sellist tüüpi otsik, mille puhul mullapind saaks ühtlaselt kaetud. Lahusti või kandeaine kasutamise korral tuleks moodustada täiendav rühm kontrolltaimi, mille puhul lisatakse üksnes lahustit/kandeainet. Kindlaksmääratud koostisega taimekaitsevahendite puhul ei ole see vajalik.
|
Uuritava kemikaali sisalduse või koguselise määra kontrollimine
|
18.
|
Kasutatavaid kontsentratsioone või koguselisi määru tuleb asjakohase analüüsi teel kontrollida. Lahustuva kemikaali puhul võib kõikide katses kasutatavate kontsentratsioonide või koguseliste määrade kontrollimiseks analüüsida suurima kontsentratsiooniga katselahust ja dokumenteerida järgnevad lahjendused ning kasutada kemikaaliga töötlemiseks kaliibritud seadmeid (nt klaasist kaliibritud analüüsinõud, kaliibritud pihustusseadmed). Lahustumatu kemikaali puhul tuleb selle sisalduse tõendamiseks registreerida mullale lisatavad uuritava kemikaali kaalutud kogused. Kui on vaja tõendada homogeensust, võib olla vaja mulda analüüsida.
|
KATSE KÄIK
Katseplaan
|
19.
|
Sama taimeliigi seemned külvatakse pottidesse. Seemnete arv poti kohta sõltub liigist, poti suurusest ja katse kestusest. Taimede arv potis peaks olema selline, et katse vältel oleksid tagatud sobivad kasvutingimused ja taimi ei oleks liiga palju. Maksimaalne tihedus peaks olenevalt seemnete suurusest olema 3–10 seemet 100 cm2 kohta. Näiteks on taimede soovitatav tihedus 15-sentimeetrise läbimõõduga potis maisi, sojaoa, tomati, kurgi ja suhkrupeedi puhul 1–2 taime, rapsi ja herne puhul 3 taime ning sibula, nisu ja muude väikese seemnega taimede puhul 5–10 taime. Seemnete ja paralleelpottide arv (paralleelüksusena käsitatakse potti, seepärast ei ole samas potis kasvavad taimed vaadeldavad paralleelidena) peaks olema optimaalse statistilise analüüsi jaoks piisav (21). Tuleks tähele panna, et katseliikidel, mille puhul kasutatakse väiksemat arvu suuri seemneid poti (paralleelüksuse) kohta, on varieeruvus suurem kui katseliikidel, mille puhul on võimalik kasutada suuremat arvu väikseid seemneid poti kohta. Sellist varieeruvust saab minimeerida igasse potti võrdse arvu seemnete külvamisega.
|
|
20.
|
Et veenduda, et täheldatav mõju tuleneb üksnes kokkupuutest uuritava kemikaaliga või on üksnes sellega seotud, kasutatakse kontrollrühmi. Sobiv kontrollrühm peaks olema katserühmaga identne kõiges muus peale uuritava kemikaaliga kokkupuute. Kõik samas katses kasutatavad katsetaimed, sealhulgas kontrolltaimed, peaksid pärinema samast allikast. Ebavõrdse jaotuse ärahoidmiseks tuleb katse- ja kontrollpotid määrata juhuslikult.
|
|
21.
|
Tuleks hoiduda insektitsiidi või fungitsiidiga kaetud seemnete (st puhitud seemnete) kasutamisest. Mõni reguleeriv asutus lubab siiski kasutada teatud mittesüsteemseid kontaktfungitsiide (nt kaptaan, tiraam) (22). Kui muret teevad seemnetega levivad patogeenid, võib seemneid hoida lühikest aega lahjas, viieprotsendilises hüpokloriti lahuses ning seejärel neid voolava veega korralikult loputada ja need kuivatada. Töötlemine mõne muu taimekaitsevahendiga ei ole lubatud.
|
Katsetingimused
|
22.
|
Katsetingimused peaksid üldjoontes vastama tingimustele, mis on vajalikud katses kasutatavatesse liikidesse ja sortidesse kuuluvate taimede tavapäraseks kasvuks (katsetingimuste näited on esitatud 4. liites). Tärkavaid taimi tuleks kasvatada kontrollitava keskkonnaga kambris, fütotronis või kasvuhoones kooskõlas hea aiandustavaga. Taimekasvatuseks ette nähtud ruumi kasutamisel hõlmab see tava harilikult temperatuuri, õhuniiskuse, süsihappegaasi sisalduse, valguse (valgustustiheduse, lainepikkuse, fotosünteesiks sobiva kiirguse), valgustusperioodi, kastmisviisi jmt reguleerimist ja piisavalt sagedast (nt igapäevast) registreerimist, et tagada hea taimekasv, mida hinnatakse asjaomase liigi kontrolltaimede kasvu alusel. Kasvuhoones tuleks temperatuuri reguleerida ventilatsiooni-, kütte- ja/või jahutussüsteemi abil. Kasvuhoones tehtava katse puhul soovitatakse üldjuhul kasutada järgmisi tingimusi:
|
—
|
temperatuur: 22 ± 10 °C;
|
|
—
|
valgustusperiood: vähemalt 16 tundi;
|
|
—
|
valgustustihedus: 350 ± 50 μE m– 2 s– 1. Kui valgustustihedus lainepikkuste vahemikus 400–700 nm langeb alla 200 μE m– 2 s– 1, võib olla vaja kasutada lisavalgustust, välja arvatud teatud liikide puhul, mille valgusevajadus on väiksem.
|
Keskkonnatingimusi tuleks katse vältel jälgida ja need registreerida. Taimi tuleks kasvatada mittepoorsetes plast- või glasuuritud pottides, mille alla on paigutatud kandik või alustass. Potte võib korrapäraselt ümber paigutada, et minimeerida kasvukeskkonna tingimuste erinevustest tulenevat varieeruvust taimede kasvus. Potid peavad olema tavapärase kasvu võimaldamiseks piisava suurusega.
|
|
23.
|
Taimede elujõulisuse tagamiseks võib mullale lisada toitaineid. Lisatoitainetega varustamise vajaduse ja sageduse üle saab otsustada kontrolltaimede vaatlemise põhjal. Soovitatakse kasutada katsenõude altkastmist (nt klaaskiudnööri abil). Alguses võib siiski kasutada ülaltkastmist, et aidata kaasa seemnete idanemisele ja hõlbustada mullapinna töötlemise puhul kemikaali kandumist mulda.
|
|
24.
|
Konkreetsed kasvutingimused peaksid olema katses kasutatava liigi ja uuritava kemikaali jaoks sobivad. Kontrolltaimi ja kemikaaliga kokku puutuvaid taimi tuleks kasvatada samades keskkonnatingimustes, kuid tuleks võtta asjakohased meetmed, et takistada uuritava kemikaali (nt lenduva kemikaali) ülekandumist ühest katserühmast teise ja katserühmast kontrollrühma.
|
Ühel kontsentratsioonil või koguselisel määral põhinev katse
|
25.
|
Ühel kemikaali kontsentratsioonil või koguselisel määral põhineva katse (piirsisalduskatse) jaoks sobiva kontsentratsiooni või koguselise määra kindlaksmääramisel tuleb arvesse võtta mitut tegurit. Üldotstarbeliste kemikaalide puhul hõlmab see kemikaali füüsikalis-keemilisi omadusi. Taimekaitsevahendite puhul tuleb arvesse võtta uuritava kemikaali füüsikalis-keemilisi omadusi ja kasutusrežiimi, selle maksimaalset kontsentratsiooni või töötlemisel kasutatavat kogust, töötlemiskordade arvu hooaja kohta ja/või kemikaali püsivust. Et teha kindlaks, kas üldotstarbeline kemikaal on fütotoksiline, võib olla asjakohane teha katse maksimaalsel sisaldusel 1 000 mg kuiva mulla kilogrammi kohta.
|
Kogusevahemiku leidmise katse
|
26.
|
Vajaduse korral võib teha kogusevahemiku leidmise katse, et leida lõplikus koguse ja mõju vahelise sõltuvuse uuringus kasutamiseks sobivad kontsentratsioonid või koguselised määrad. Kogusevahemiku leidmise katses kasutatavad kontsentratsioonid või koguselised määrad tuleks valida suure intervalliga (nt 0,1, 1,0, 10, 100 ja 1 000 mg kuiva mulla kilogrammi kohta). Taimekaitsevahendite puhul võib kontsentratsioonide või koguseliste määrade valimisel lähtuda soovitatavast või maksimaalsest kontsentratsioonist või töötlemisel kasutatavast kogusest ning kasutada sellest näiteks 1/100, 1/10 ja 1/1.
|
Mitmel kontsentratsioonil või koguselisel määral põhinev katse
|
27.
|
Mitmel kontsentratsioonil või koguselisel määral põhineva katse eesmärk on teha kindlaks koguse ja mõju vaheline sõltuvus ja määrata vastavalt reguleerivate asutuste nõuetele ECx või ERx väärtus taimede tärkamise, biomassi ja/või visuaalselt hinnatava mõju puhul, kasutades võrdlusalusena kemikaaliga mitte kokku puutuvaid kontrolltaimi.
|
|
28.
|
Kontsentratsioonide või koguste arv ja intervall peaks olema piisav, et võimaldada usaldusväärselt hinnata koguse ja mõju vahelist sõltuvust, koostada regressioonivõrrand ja arvutada hinnanguline ECx või ERx väärtus. Valitud kontsentratsioonid või koguselised määrad peaksid hõlmama määratavaid ECx või ERx väärtusi. Kui on näiteks vaja leida EC50 väärtus, on soovitatav kasutada katses koguseid, mille puhul mõju ulatus on 20–80 %. Selle saavutamiseks soovitatakse kasutada lisaks kemikaaliga töötlemata kontrollile vähemalt viit kontsentratsiooni või koguselist määra geomeetrilises jadas, mille tegur ei ole suurem kui kolm. Paralleelpottide arv igas katse- ja kontrollrühmas peaks olema vähemalt neli ja seemnete üldarv vähemalt 20. Teatud taimede puhul, mille seemnete idanevuse määr on väike või mille kasv tavapäraselt varieerub, võib olla vaja kasutada katse statistilise usaldusväärsuse tõstmiseks suuremat arvu paralleelpotte. Kui katses kasutatakse suuremat arvu kontsentratsioone või koguselisi määru, võib paralleelpottide arvu vähendada. Kui soovitakse leida täheldatavat toimet mitteavaldavat kontsentratsiooni, võib olla vaja kasutada vajaliku statistilise usaldusväärsuse saavutamiseks suuremat arvu paralleelpotte (23).
|
Vaatlused
|
29.
|
Vaatlusperioodi vältel, st 14–21 päeva jooksul pärast 50 % kontrolltaimede (vajaduse korral ka lahustiga kokku puutuvate kontrolltaimede) tärkamist vaadeldakse taimi sageli (vähemalt kord nädalas ja võimaluse korral iga päev) ning jälgitakse tärkamist, visuaalselt hinnatavaid fütotoksilisuse ilminguid ja suremust. Katse lõpus tuleks registreerida tärganud taimede protsentuaalne osakaal ja ellujäänud taimede biomass, samuti silmaga nähtav kahjulik mõju taime eri osadele. See kahjulik mõju hõlmab tärganud seemikute ebanormaalset välimust, kasvu kängumist, kloroosi, värvusemuutusi, suremist ja mõju taimede arengule. Lõpliku biomassi mõõtmiseks võib kasutada ellujäänud taimede võrse lõplikku keskmist kuivmassi; selleks lõigatakse võrse mullapinna tasandilt ära ja kuivatatakse seda 60 °C juures, kuni selle kaal enam ei muutu. Teise võimalusena võib lõpliku biomassi määramiseks kasutada võrse märgmassi. Kui reguleerivad asutused seda nõuavad, võib mõõdetav näitaja olla ka võrse kõrgus. Vaadeldava toksilise mõju määramiseks tuleks kasutada ühtset silmaga nähtavate kahjustuste hindamise süsteemi. Näited kvalitatiivse ja kvantitatiivse visuaalse hindamise kohta on esitatud allikates 23 ja 24.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Statistiline analüüs
Ühel kontsentratsioonil või koguselisel määral põhinev katse
|
30.
|
Iga taimeliigi kohta saadud andmete analüüsimiseks tuleks kasutada sobivat statistilist meetodit (21). Tuleks esitada katses kasutatud kontsentratsiooni või koguselise määra puhul täheldatava toime määr või teave selle kohta, et toime jääb allapoole teatavat määra (nt kontsentratsiooni või koguselise määra y puhul täheldatav mõju on < x %).
|
Mitmel kontsentratsioonil või koguselisel määral põhinev katse
|
31.
|
Koostatakse koguse ja mõju vahelist sõltuvust väljendav regressioonivõrrand. Võib kasutada eri mudeleid: näiteks võib binaarse muutujana käsitletava tärkamise puhul sobida ECx või ERx (nt EC25, ER25, EC50, ER50) väärtuse ja asjaomaste usalduspiiride leidmiseks logit-, probit-, Weibulli, Spearmani-Kärberi või kohandatud Spearmani-Kärberi meetod. Seemikute kasvu (kaalu ja kõrguse) kui lõppnäitajana hinnatava pideva muutuja puhul võib ECx või ERx väärtuse ja vastavate usalduspiiride määramiseks kasutada sobivat regressioonanalüüsi (nt Bruce'i-Versteegi mittelineaarset regressiooni (25)). Võimaluse korral peaks R2 olema kõige tundlikuma liigi puhul alati 0,7 või suurem ja mõju ulatus katses kasutatavate kontsentratsioonide või koguseliste määrade juures hõlmama vahemikku 20–80 %. Kui soovitakse määrata täheldatavat toimet mitteavaldav kontsentratsioon, tuleks eelistada suure usaldusväärsusega statistilisi mudeleid, mille valimisel tuleks lähtuda andmete jaotusest (21, 26).
|
Katseprotokoll
|
32.
|
Katseprotokollis tuleks esitada katsetulemused koos katsetingimuste üksikasjaliku kirjelduse, tulemusi käsitleva põhjaliku arutelu, andmeanalüüsi tulemuste ja nende põhjal tehtud järeldustega. Tuleks esitada tulemusi käsitlev kokkuvõtlik tabel ja lühikokkuvõte. Katseprotokollis esitatakse järgmine teave.
|
|
Uuritav kemikaal:
|
—
|
uuritava kemikaali identifitseerimisandmed ja asjakohased omadused (nt log Pow, lahustuvus vees, aururõhk ning võimaluse korral säilivus ja käitumine keskkonnas);
|
|
—
|
üksikasjad katselahuse valmistamise ja punkti 18 kohase kasutatavate kontsentratsioonide kontrollimise kohta.
|
|
|
|
Katseliik:
|
—
|
üksikasjalikud andmed katseorganismi kohta: liik/sort, sugukond, teaduslik nimetus ja tavanimetus, võimalikult üksikasjalik teave seemnete päritolu kohta (st tarnija nimi, idanemise protsentuaalne määr, seemnete suurusklass, partii number, seemnete kogumise aasta või kasvuperiood, idanemise hindamise kuupäev), elujõulisus jne;
|
|
—
|
katses kasutatud ühe- ja kaheiduleheliste liikide arv;
|
|
—
|
liikide valimise põhjendus;
|
|
—
|
seemnete hoiustamise, töötlemise ja säilitamise kirjeldus.
|
|
|
|
Katsetingimused:
|
—
|
katseruum (nt kasvukamber, fütotron või kasvuhoone);
|
|
—
|
katsesüsteemi kirjeldus (nt poti mõõtmed, poti materjal ja mulla kogus);
|
|
—
|
mulla omadused (mulla lõimis või tüüp: mullaosakeste jaotus ja liigitus, füüsikalised ja keemilised omadused, sealhulgas orgaanilise aine protsentuaalne sisaldus, orgaanilise süsiniku protsentuaalne sisaldus ja pH);
|
|
—
|
mulla/substraadi (nt muld, kunstlik pinnas, liiv jm) ettevalmistamine enne katset;
|
|
—
|
toitainete lisamise korral nende kirjeldus;
|
|
—
|
uuritava kemikaaliga töötlemine: töötlemismeetodi kirjeldus, seadmete, kokkupuutemäärade ja asjaomaste koguste, sealhulgas kemikaalisisalduse kontrollimise kirjeldus, kaliibrimismeetodi kirjeldus ja töötlemise ajal valitsenud keskkonnatingimuste kirjeldus;
|
|
—
|
kasvutingimused: valgustustihedus (nt fotosünteesiks sobiva kiirguse puhul), valgustusperiood, maksimaalne ja minimaalne temperatuur, kastmisrežiim ja -meetod, väetamine;
|
|
—
|
seemnete arv poti kohta, taimede arv kemikaali iga koguse puhul, paralleelpottide arv iga kokkupuutemäära puhul;
|
|
—
|
kontrollide tüüp ja arv (negatiivsed ja/või positiivsed kontrollid, vajaduse korral lahustiga kontrollid);
|
|
|
|
Tulemused:
|
—
|
tabel, mis sisaldab kõiki lõppnäitajaid iga paralleelpoti, kasutatud kontsentratsiooni või koguselise määra ja liigi kohta;
|
|
—
|
tärganud taimede arv ja protsentuaalne määr võrreldes kontrollrühma näitajaga;
|
|
—
|
taimede mõõdetud biomassi (võrsete kuivmass või märgmass) protsentuaalne määr võrreldes kontrollrühma näitajaga;
|
|
—
|
kui mõõdeti võrsete kõrgust, siis selle protsentuaalne määr võrreldes kontrollrühma näitajaga;
|
|
—
|
uuritava kemikaali põhjustatud visuaalselt hinnatavate kahjustuste protsentuaalne määr võrreldes kontrollrühmaga ning selliste kahjustuste kvalitatiivne ja kvantitatiivne kirjeldus (kloroos, nekroos, närbumine, varre või lehtede moondumine, samuti sellise mõju puudumine);
|
|
—
|
kui visuaalselt hinnatavate kahjustuste puhul kasutatakse hindamisskaalat, siis sellise skaala kirjeldus;
|
|
—
|
ühel kogusel põhineva katse puhul tuleks märkida kahjustuste protsentuaalne määr;
|
|
—
|
ECx või ERx (nt EC50, ER50, EC25, ER25) väärtus ja asjaomased usalduspiirid. Regressioonanalüüsi tegemise korral esitatakse regressioonivõrrandiga seotud standardviga ja konkreetsete parameetrite (nt tõus, algordinaat) hinnangulise väärtuse standardviga;
|
|
—
|
täheldatavat toimet mitteavaldav kontsentratsioon (ja vähim täheldatavat toimet avaldav kontsentratsioon), kui see on teada;
|
|
—
|
kasutatud statistiliste meetodite ja eelduste kirjeldus;
|
|
—
|
graafik eespool kirjeldatud andmete ning koguse ja mõju vahelise sõltuvuse kohta katses kasutatud liigi puhul.
|
|
Kõrvalekalded käesolevast katsemeetodist ja kõik katse ajal täheldatavad ebatavalised ilmingud.
|
KIRJANDUS
|
(1)
|
Schrader, G., Metge, K., ja Bahadir, M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Appl. Soil Ecol. 7: 189–193.
|
|
(2)
|
Rahvusvaheline Standardiorganisatsioon (1993). ISO 11269-1: Soil Quality – Determination of the Effects of Pollutants on Soil Flora – Part 1: Method for the Measurement of Inhibition of Root Growth.
|
|
(3)
|
Rahvusvaheline Standardiorganisatsioon (1995). ISO 11269-2: Soil Quality – Determination of the Effects of Pollutants on Soil Flora – Part 2: Effects of Chemicals on the Emergence and Growth of Higher Plants.
|
|
(4)
|
USA Materjalide Katsetamise Ühing (ASTM) (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
USA Keskkonnakaitseamet (1982). FIFRA, 40CFR, osa 158.540. Alajaotis J, osad 122-1 ja 123-1.
|
|
(6)
|
USA Keskkonnakaitseamet (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background – Non-target Plant Testing;
|
|
—
|
850.4025: Target Area Phytotoxicity;
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850.4225: Seedling Emergence, Tier II;
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR X31-201 (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1 (1993). Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K. E., ja Keddy, C. J. (1993). Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Technical Report Series No. 145. Canadian Wildlife Service (peakorter), Environment Canada, Hull, Québec, Kanada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C., ja Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms – A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. 48.
|
|
(10)
|
Hale, B., Hall, J. C., Solomon, K., ja Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Centre for Toxicology, University of Guelph, Ontario, Kanada.
|
|
(11)
|
Mulla lõimise klassifitseerimine (USA põllumajandusministeeriumi ja ÜRO Toidu- ja Põllumajandusorganisatsiooni süsteemid): Weed Sci. 33, Suppl. 1 (1985) ja Soil Sci. Soc. Am. Proc. 26: 305 (1962).
|
|
(12)
|
Audus, L. J. (1964). Herbicide behaviour in the soil. Väljaandes: Audus, L. J. (toim.), The Physiology and Biochemistry of Herbicides. London, New York, Academic Press, NY, 5. peatükk, lk 163–206.
|
|
(13)
|
Beall, M. L., Jr., ja Nash, R. G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil. J. Agro. 61: 571–575.
|
|
(14)
|
Beetsman, G. D., Kenney, D. R., ja Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties. J. Agro. 61: 247–250.
|
|
(15)
|
USA Toidu- ja Ravimiamet (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 lk, USA Toidu- ja Ravimiamet, Washington, DC.
|
|
(16)
|
McKelvey, R. A., Wright, J. P., Honegger, J. L., ja Warren, L. W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Manag. Sci. 58: 1161–1174.
|
|
(17)
|
Boutin, C., Elmegaard, N., ja Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology 13: 349–369.
|
|
(18)
|
Boutin, C., ja Rogers, C. A. (2000). Patterns of sensitivity of plant species to various herbicides – An analysis with two databases. Ecotoxicology 9: 255–271.
|
|
(19)
|
Boutin, C., ja Harper, J. L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9: 155–271.
|
|
(20)
|
Boutin, C., Lee, H.-B., Peart, T. E., Batchelor, S. P., ja Maguire, R. J. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environ. Toxicol. Chem. 19: 2532–2541.
|
|
(21)
|
OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment No. 54. Majanduskoostöö ja Arengu Organisatsioon, Pariis.
|
|
(22)
|
Hatzios, K. K., ja Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1: 1–63.
|
|
(23)
|
Hamill, P. B., Marriage, P. B., ja Friesen, G. (1977). A method for assessing herbicide performance in small plot experiments. Weed Sci. 25: 386–389.
|
|
(24)
|
Frans, R. E., ja Talbert, R. E. (1992). Design of field experiments and the measurement and analysis of plant response. Väljaandes: Truelove, B. (toim.), Research Methods in Weed Science, 2. väljaanne. Southern Weed Science Society, Auburn, lk 15–23.
|
|
(25)
|
Bruce, R. D., ja Versteeg, D. J. (1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environ. Toxicol. Chem. 11: 1485–1492.
|
|
(26)
|
Käesoleva lisa peatükk C.33 „Vihmausside (Eisenia fetida / Eisenia andrei) sigivuse katse”.
|
1. liide
Mõisted
Toimeaine
– aine, millel on ettenähtud spetsiifiline bioloogiline mõju (nt putukatõrje, taimehaiguste tõrje või umbrohutõrje töödeldaval alal); tuntud ka kui tehnilise puhtusastmega toimeaine.
Kemikaal
– aine või segu.
Taimekaitsevahend või pestitsiid
– spetsiifilise bioloogilise mõjuga materjal, mida kasutatakse eesmärgiga kaitsta taimi kahjurite (nt seenhaigused, putukad ja konkureerivad taimed) eest.
ECx
või ERx
(vastavalt kontsentratsioon või kogus, mille puhul mõju ulatus on x %)– kontsentratsioon või kogus, mille juures katse lõppnäitajale avalduva ebasoodsa mõju ulatus on x % kontrollrühma asjaomase näitaja väärtusest (nt EC25/ER25 ja EC50/ER50 tähistavad kontsentratsiooni või koguselist määra, mille puhul seemikute tärkamise määr, võrsete kaal või ellujäänud taimede lõpparv väheneb või visuaalselt hinnatavate kahjustuste määr suureneb vastavalt 25 % ja 50 % võrra).
Tärkamine
– koleoptiili või idulehe ilmumine mullapinnale.
Valmistis
– asjaomast toimeainet sisaldav kaubanduslik valmistoode, tuntud ka kui lõppvalmistis (8) ja tüüpiline lõpptoode.
Vähim täheldatavat toimet avaldav kontsentratsioon (LOEC)
– uuritava kemikaali väikseim kontsentratsioon, mille juures täheldatakse teatavat mõju. Käesoleva katsemeetodi puhul täheldatakse sellisel kontsentratsioonil teatava kokkupuuteperioodi vältel kontrollrühmaga võrreldes statistiliselt olulist (p < 0,05) mõju ning selline kontsentratsioon on suurem kui täheldatavat toimet mitteavaldav kontsentratsioon.
Muud kui sihttaimed
– taimed, mis paiknevad väljaspool sihttaimede ala. Taimekaitsevahendite puhul tähistatakse selle mõistega tavaliselt taimi, mis paiknevad väljaspool kemikaaliga töötlemise ala.
Täheldatavat toimet mitteavaldav kontsentratsioon (NOEC)
– uuritava kemikaali suurim kontsentratsioon, mille juures ei täheldata mingit mõju. Käesoleva katsemeetodi puhul ei täheldata sellisel kontsentratsioonil teatava kokkupuuteperioodi vältel kontrollrühmaga võrreldes statistiliselt olulist (p < 0,05) mõju.
Fütotoksilisus
– asjaomase kemikaali toimel ilmnevad kahjulikud kõrvalekalded taimede tavapärasest välimusest ja kasvust, mida mõõdetakse ja hinnatakse visuaalselt.
Paralleelüksus
– kontrollrühma ja/või katserühma esindav katseüksus. Käesoleva katsemeetodi puhul on paralleelüksusena määratletud pott.
Visuaalne hindamine
– silmaga nähtavate kahjustuste hindamine taimede väliskuju, elujõulisuse, väärarengute, kloroosi, nekroosi ja üldise välimuse põhjal võrdluses kontrolltaimedega.
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil.
2. liide
Taimekatsetes varem kasutatud liikide loetelu
|
Sugukond
|
Liik
|
Tavanimetus
|
|
DICOTYLEDONAE
|
|
Apiaceae (Umbelliferae)
|
Daucus carota
|
Porgand
|
|
Asteraceae (Compositae)
|
Helianthus annuus
|
Päevalill
|
|
Asteraceae (Compositae)
|
Lactuca sativa
|
Aedsalat
|
|
Brassicaceae (Cruciferae)
|
Sinapis alba
|
Valge sinep
|
|
Brassicaceae (Cruciferae)
|
Brassica campestris var. chinensis
|
Hiina kapsas
|
|
Brassicaceae (Cruciferae)
|
Brassica napus
|
Raps
|
|
Brassicaceae (Cruciferae)
|
Brassica oleracea var. capitata
|
Peakapsas
|
|
Brassicaceae (Cruciferae)
|
Brassica rapa
|
Naeris
|
|
Brassicaceae (Cruciferae)
|
Lepidium sativum
|
Salatkress
|
|
Brassicaceae (Cruciferae)
|
Raphanus sativus
|
Redis
|
|
Chenopodiaceae
|
Beta vulgaris
|
Suhkrupeet
|
|
Cucurbitaceae
|
Cucumis sativus
|
Kurk
|
|
Fabaceae (Leguminosae)
|
Glycine max (G. soja)
|
Sojauba
|
|
Fabaceae (Leguminosae)
|
Phaseolus aureus
|
Munguba
|
|
Fabaceae (Leguminosae)
|
Phaseolus vulgaris
|
Põõsasuba, lattuba, harilik aeduba
|
|
Fabaceae (Leguminosae)
|
Pisum sativum
|
Hernes
|
|
Fabaceae (Leguminosae)
|
Trigonella foenum-graecum
|
Põld-lambalääts
|
|
Fabaceae (Leguminosae)
|
Lotus corniculatus
|
Harilik nõiahammas
|
|
Fabaceae (Leguminosae)
|
Trifolium pratense
|
Aasristik
|
|
Fabaceae (Leguminosae)
|
Vicia sativa
|
Vikk
|
|
Linaceae
|
Linum usitatissimum
|
Lina
|
|
Polygonaceae
|
Fagopyrum esculentum
|
Harilik tatar
|
|
Solanaceae
|
Solanum lycopersicon
|
Tomat
|
|
MONOCOTYLEDONAE
|
|
Liliaceae (Amarylladaceae)
|
Allium cepa
|
Harilik sibul
|
|
Poaceae (Gramineae)
|
Avena sativa
|
Harilik kaer
|
|
Poaceae (Gramineae)
|
Hordeum vulgare
|
Harilik oder
|
|
Poaceae (Gramineae)
|
Lolium perenne
|
Karjamaa-raihein
|
|
Poaceae (Gramineae)
|
Oryza sativa
|
Harilik riis
|
|
Poaceae (Gramineae)
|
Secale cereale
|
Harilik rukis
|
|
Poaceae (Gramineae)
|
Sorghum bicolor
|
Terasorgo, sudaani sorgo
|
|
Poaceae (Gramineae)
|
Triticum aestivum
|
Harilik nisu
|
|
Poaceae (Gramineae)
|
Zea mays
|
Harilik mais
|
3. liide
Põllumajanduskultuuride hulka mittekuuluvate võimalike liikide loetelu
Võimalike fütotoksilisuse hindamiseks sobivate liikide OECD loetelu
Märkus: allpool esitatud tabel sisaldab teavet 52 põllumajanduskultuuride hulka mittekuuluva liigi kohta (allikaviited on märgitud iga kande puhul sulgudes). Seemikute tärkamise määrad on esitatud avaldatud kirjanduse põhjal ja üksnes üldise ettekujutuse loomiseks. Konkreetsed katsetulemused võivad sõltuvalt seemnete päritolust ja muudest teguritest varieeruda.
|
SUGUKOND Liigi botaaniline nimetus
(eestikeelne tavanimetus)
|
Eluiga (9) ja elupaik
|
Seemne kaal
(mg)
|
Idanemiseks või kasvuks vajalik valgustusperiood (10)
|
Külvamissügavus
(mm) (11)
|
Idanemiseks vajalik aeg
(päeva) (12)
|
Eritöötlus (13)
|
Mürgisuse hindamise katse (14)
|
Seemnete tarnijad (15)
|
Muud allikaviited (16)
|
|
APIACEAE
Torilis japonica
(jaapani harjasputk)
|
Ü, K; häiritud kooslusega alad, hekid, karjamaad (16, 19)
|
1,7–1,9 (14, 19)
|
V = P (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
Külmtöötlus (7, 14, 18, 19); küpsemine võib olla vajalik (19); pimedus pärsib idanemist (1, 19); eritöötluseta (5)
|
PÄRAST (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(harilik kirikakar)
|
M;
rohumaad, haritavad põllud, rohukamar (16, 19)
|
0,09–0,17 (4, 19)
|
V = P (14)
|
0
(4)
|
3 (50 %) (19);
11 (100 %) (18)
|
Kiirgus ei mõjuta idanemist (18, 19); eritöötluseta (4, 14)
|
PÄRAST (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(rukkilill)
|
Ü;
põllud, teeperved, lagealad (16)
|
4,1–4,9 (4, 14)
|
V = P (14)
|
0–3 (2, 4, 14)
|
14–21 (100 %) (14)
|
Eritöötluseta (2, 4)
|
PÄRAST (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(must jumikas)
|
M;
põllud, teeperved, lagealad (16, 19)
|
2,4–2,6 (14, 19)
|
V = P (14)
|
0 (19)
|
3 (50 %) (19);
4 (97 %) (18)
|
Küpsemine võib olla vajalik (18, 19); pimedus pärsib idanemist (19); eritöötluseta (5, 14, 26)
|
PÄRAST (5, 22, 26)
|
A
|
|
|
Inula helenium
(aedvaak)
|
M;
häiritud kooslusega niisked alad
(16)
|
1–1,3 (4, 14, 29)
|
|
0
(4, 29)
|
|
Eritöötluseta (4)
|
PÄRAST (4)
|
A, F
|
|
|
Leontodon hispidus
(kare seanupp)
|
M;
põllud, teeperved, häiritud kooslusega alad (16, 19)
|
0,85–1,2 (14, 19)
|
V = P (14)
|
0 (19)
|
4 (50 %) (19);
7 (80 %) (18)
|
Pimedus pärsib idanemist (17, 18, 19); eritöötluseta (5, 23)
|
PÄRAST (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(karvane päevakübar)
|
K, M; häiritud kooslusega alad
(16)
|
0,3 (4, 14)
|
V = P (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
Eritöötluseta
(4, 14, 33)
|
PÄRAST (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(kanada kuldvits)
|
M;
karjamaad, lagendikud (16)
|
0,06–0,08 (4, 14)
|
V = P (11)
|
0
(4)
|
14–21
(11)
|
Segatakse võrdse koguse liivaga ja hoitakse 24 tundi giberelliinhappe lahuses kontsentratsiooniga 500 ppm (11); eritöötluseta (4)
|
PÄRAST (4)
|
E, F
|
|
|
Xanthium pensylvanicum
(pensilvaania väärtakjas)
|
Ü;
põllud, lagealad (16)
|
25–61 (14, 29)
|
|
0 (1);
5 (29)
|
|
Pimedus võib idanemist pärssida (1); hoitakse 12 tundi soojas vees (29)
|
ENNE ja PÄRAST (31)
|
A
|
|
|
Xanthium spinosum
(astel-väärtakjas)
|
Ü;
lagealad (16)
|
200 (14)
|
V = P (14);
V > P (6)
|
10
(6)
|
|
Skarifitseerimine (14); eritöötluseta (6)
|
ENNE ja PÄRAST (6)
|
A
|
|
|
Xanthium strumarium
(kallas-väärtakjas)
|
Ü;
põllud, lagealad (16)
|
67,4 (14)
|
V = P (14)
|
10–20 (6, 21)
|
|
Eritöötluseta
(6, 14, 21)
|
ENNE ja PÄRAST (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Cardamine pratensis
(aas-jürilill)
|
M;
põllud, teeperved, rohukamar (16, 19)
|
0,6 (14, 19)
|
V = P (14)
|
0 (19)
|
5 (50 %) (19);
15 (98 %) (18)
|
Pimedus pärsib idanemist (18, 19); eritöötluseta (5, 14, 22)
|
PÄRAST (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
(harilik käokann)
|
M
(16)
|
0,21 (14)
|
V = P (14)
|
|
< 14 (100 %) (14, 25)
|
Küpsemine võib olla vajalik (18); eritöötluseta (5, 14, 15, 22–26)
|
PÄRAST (5, 15, 22–26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(valge hanemalts)
|
Ü;
põlluservad, häiritud kooslusega alad (16, 19)
|
0,7–1,5 (14, 19, 34)
|
V = P (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
Töötlemisviis sõltub seemnete värvusest (19); puhkeperiood kuivladustamisel (19); pimedus pärsib idanemist (1, 18, 19); külmtöötlus (18); eritöötluseta (14, 34)
|
ENNE ja PÄRAST (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(liht-naistepuna)
|
M;
põllud, haritavad maad, lagealad (16, 19)
|
0,1–0,23
(14, 19)
|
V = P
(14)
|
0
(1, 19)
|
3 (19);
11 (90 %) (18)
|
Pimedus pärsib idanemist (1, 18, 19);
eritöötluseta (5, 14, 15, 25, 27)
|
PÄRAST
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
(luuderohi-lehtertapp)
|
Ü;
teeperved, lagealad, viljapõllud (16)
|
28,2
(14)
|
V > P
(6, 10)
|
10–20
(6, 10, 21)
|
4 (100 %)
(10)
|
Kiirgus ei mõjuta idanemist (1);
eritöötluseta (6, 21)
|
ENNE ja PÄRAST
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
(visa lõikhein)
|
M;
haritavad maad, karjamaad, teeperved (16, 30)
|
0,2
(14)
|
V = P
(14)
|
0 (1);
10–20 (6, 10)
|
12 (91 %)
(10)
|
Pimedus pärsib idanemist (1);
eritöötluseta (6, 10, 14)
|
ENNE ja PÄRAST
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
(harilik nõiahammas)
|
M;
rohualad, teeperved, lagealad (16, 19)
|
1–1,67
(14, 19)
|
V = P (14)
|
|
1 (50 %)
(19)
|
Skarifitseerimine (14, 19);
kiirgus ei mõjuta idanemist (18, 19); eritöötluseta (23, 25)
|
PÄRAST
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(tömbilehine kassia)
|
Ü;
niisked metsad (16)
|
23–28
(9)
|
V = P (14);
V > P (9)
|
10–20
(6,9)
|
|
Seemneid hoitakse 24 tundi vees (9);
skarifitseerimine (14); seemnete elujõulisus on sõltuvalt värvusest erinev (1); eritöötluseta (6)
|
PÄRAST
(6,9)
|
A
|
|
|
Sesbania exaltata
(koloraado sesbaania)
|
Ü;
lammimullad (16)
|
11–13
(9, 14)
|
V > P (9)
|
10–20
(9, 21)
|
|
Seemneid hoitakse 24 tundi vees (9);
kiirgus ei mõjuta idanemist (1); eritöötluseta (21)
|
ENNE ja PÄRAST
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(aasristik)
|
M;
põllud, teeperved, haritavad maad (16, 19)
|
1,4–1,7
(14, 19)
|
V = P (14)
|
|
1 (50 %)
(19)
|
Skarifitseerimine (14, 18);
küpsemine võib olla vajalik (19); kiirgus ei mõjuta idanemist (1, 19); eritöötluseta (5)
|
PÄRAST
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(lääne-südamerohi)
|
M;
lagendikud (16)
|
0,75–1,0
(4, 14)
|
V = P (14)
|
0
(4)
|
|
Eritöötluseta
(4, 14)
|
PÄRAST
(4)
|
F
|
|
|
Mentha spicata
(rohemünt)
|
M;
niisked alad (16)
|
2,21
(4)
|
|
0
(4)
|
|
Eritöötluseta
(4)
|
PÄRAST
(4)
|
F
|
|
|
Nepeta cataria
(harilik naistenõges)
|
M;
häiritud kooslusega alad (16)
|
0,54
(4, 14)
|
V = P (14)
|
0
(4)
|
|
Eritöötluseta
(2, 4, 14)
|
PÄRAST
(2,4)
|
F
|
|
|
Prunella vulgaris
(harilik käbihein)
|
M;
haritavad põllud, rohualad, häiritud kooslusega alad (16, 19)
|
0,58–1,2
(4, 14, 19)
|
V = P (14)
|
0
(4, 19)
|
5 (50 %) (19);
7 (91 %) (18)
|
Pimedus pärsib idanemist (18, 19);
suuremate seemnete idanevuse määr on suurem (1); eritöötluseta (4, 14, 22)
|
PÄRAST
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(harilik tõnnike)
|
M;
rohumaad, põlluservad (19)
|
14–18
(14, 19)
|
V = P (14)
|
|
7 (50 %)
(19)
|
Eritöötluseta
(5, 14, 22)
|
PÄRAST
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilon theophrasti
(pärn-abuutilon)
|
Ü;
põllud, lagealad (16)
|
8,8
(14)
|
V = P (14)
|
10–20
(6, 10, 21)
|
4 (84 %)
(10)
|
Skarifitseerimine (14);
eritöötluseta (5, 10, 21)
|
ENNE ja PÄRAST
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(torkav siida)
|
Ü;
põllud, teeperved (16)
|
3,8
(14)
|
V = P (14)
|
10–20
(6, 21)
|
|
Skarifitseerimine (14);
kiirgus ei mõjuta idanemist (1); eritöötluseta (6, 21)
|
ENNE ja PÄRAST
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(kukemagun)
|
Ü;
põllud, haritavad maad, häiritud kooslusega alad (16, 19)
|
0,1–0,3
(4, 14, 19, 29)
|
V = P (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
Külmtöötlus ja skarifitseerimine (1, 19, 32);
eritöötluseta (4, 14, 29)
|
PÄRAST
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis
(harilik kastehein)
|
Muru, karjamaad (16)
|
0,07 (14)
|
V > P (Ю)
|
20 (10)
|
10 (62 %) (10)
|
Pimedus pärsib idanemist (1, 17–19); eritöötluseta (10)
|
PÄRAST (10)
|
A, E
|
|
|
Alopecurus myosuroides
(põld-rebasesaba)
|
Ü;
põllud, lagealad (16)
|
0,9–1,6
(29, 34)
|
V = P (14)
|
2
(29)
|
< 24 (30 %) (34)
|
Skarifitseerimine (14); töötlus KNO3 lahusega, mille kontsentratsioon on 101 mg/l (14); stratifitseerimine soojas (1); pimedus pärsib idanemist (1); eritöötluseta (34)
|
ENNE ja PÄRAST
(28, 34)
|
A
|
32
|
|
Avena fatua
(tuulekaer)
|
Ü;
haritavad alad, lagealad (16)
|
7–37,5 (14, 30)
|
V = P (14);
V > P (6)
|
10–20 (6, 10)
|
3 (70 %) (18)
|
Skarifitseerimine (7, 32); pimedus pärsib idanemist (1);
külmtöötlus (1, 18); eritöötluseta (6, 10, 14)
|
ENNE ja PÄRAST (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(müürluste)
|
Ü;
põllud, teeperved, haritavad maad (16)
|
0,45–2,28 (14, 29)
|
V = P (14)
|
3 (29)
|
|
Küpsemisperiood (1, 7, 32); valgus pärsib idanemist (1); eritöötluseta (14)
|
ENNE ja PÄRAST (28, 31)
|
A
|
|
|
Cynosurus cristatus
(harilik sugapea)
|
M;
põllud, teeperved, lagealad (16, 19)
|
0,5–0,7 (14, 19, 29)
|
V = P (14)
|
0 (29)
|
3 (50 %) (19)
|
Kiirgus ei mõjuta idanemist (19); eritöötluseta (14, 29)
|
PÄRAST (5)
|
A
|
|
|
Digitaria sanguinalis
(verev paelhirss)
|
Ü;
põllud, rohukamar, lagealad (16)
|
0,52–0,6 (14, 30)
|
V = P (14)
|
10–20 (21)
|
7 (75 %),
14 (94 %) (7)
|
Skarifitseerimine, külmtöötlus ja küpsemine (1, 7, 14, 32); töötlus KNO3 lahusega, mille kontsentratsioon on 101 mg/l (14); pimedus pärsib idanemist (1); eritöötluseta (21)
|
ENNE ja PÄRAST (18, 25, 31)
|
A
|
|
|
Echinochloa crus-galli
(tähk-kukehirss)
|
Ü
(16)
|
1,5 (14)
|
V = P (14);
V > P (3)
|
10–20 (7, 21)
|
|
Skarifitseerimine (7, 32);; kiirgus ei mõjuta idanemist (1); eritöötluseta (3, 14, 21)
|
ENNE ja PÄRAST (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(kanada orashein)
|
M;
häiritud kooslusega jõeäärsed alad (16)
|
4–5 (14, 30)
|
V = P (11)
|
1
(11)
|
14–28
(11)
|
Eritöötluseta
(2, 11)
|
PÄRAST (2)
|
C, D, E
|
|
|
Festuca pratensis
(harilik aruhein)
|
M;
põllud, niisked alad (16, 19)
|
1,53–2,2 (16, 19)
|
V = P (14);
V > P (10)
|
20 (10)
|
9 (74 %) (10);
2 (50 %) (19)
|
Eritöötluseta
(10, 19)
|
PÄRAST (10)
|
A
|
7
|
|
Hordeum pusillum
(väike oder)
|
Ü;
karjamaad, teeperved, lagealad (16)
|
3,28 (14)
|
|
|
|
Stratifitseerimine soojas (1); kiirgus ei mõjuta idanemist (1)
|
ENNE (31)
|
|
7
|
|
Phleum pratense
(põldtimut)
|
M;
karjamaad, haritavad põllud, häiritud kooslusega alad (16, 19)
|
0,45 (14, 19)
|
V > P (10, 14)
|
0–10 (10, 19)
|
2 (74 %) (10);
8 (50 %) (19)
|
Pimedus pärsib idanemist (19); kiirgus ei mõjuta idanemist (17); eritöötluseta (10, 14, 17, 19)
|
PÄRAST (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(põld-konnatatar)
|
Ü;
lagealad, teeperved (16)
|
5–8 (4, 14, 29)
|
V = P (20)
|
0–2 (4, 29)
|
|
Külmtöötlus 4–8 nädala vältel (1, 2, 4, 20, 29); kiirgus ei mõjuta idanemist (1)
|
ENNE ja PÄRAST 1, 2, 20, 28, 31
|
A
|
32
|
|
Polygonum lapathifolium
(kahar kirburohi)
|
Ü;
niisked mullad (16)
|
1,8–2,5 (14)
|
V > P (6)
|
|
5 (94 %) (18)
|
Kiirgus ei mõjuta idanemist (1); pimedus pärsib idanemist (18); külmtöötlus (1); eritöötluseta (5)
|
ENNE ja PÄRAST (6)
|
A, E
|
|
|
Polygonum pensylvanicum
(pensilvaania kirburohi)
|
Ü;
põllud, lagealad (16)
|
3,6–7 (14, 29)
|
|
2 (29)
|
|
Külmtöötlus 0–5 °C juures 4 nädala vältel (1, 29); pimedus pärsib idanemist (1)
|
ENNE (31)
|
A, E
|
|
|
Polygonum persicaria
(harilik kirburohi)
|
Ü;
häiritud kooslusega alad, haritavad maad (16, 19)
|
2,1–2,3 (14, 19)
|
V > P (13)
|
0 (19)
|
< 14 (13);
2 (50 %) (19)
|
Skarifitseerimine, külmtöötlus, töötlus giberelliinhappega (14); külmtöötlus, küpsemine (17–19); pimedus pärsib idanemist (19); eritöötluseta (13)
|
PÄRAST (13)
|
A
|
32
|
|
Rumex crispus
(kärnoblikas)
|
M;
haritavad põllud, teeperved, lagendikud (16, 19)
|
1,3–1,5 (4, 14, 19)
|
V = P (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19);
6 (100 %) (33)
|
Pimedus pärsib idanemist (18, 19); küpsemine võib olla vajalik (18); eritöötluseta (4, 14, 33)
|
PÄRAST (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
(põld-varsapõlv)
|
Ü;
haritavad põllud, lagendikud, häiritud kooslusega alad (16, 19)
|
0,4–0,5 (4, 14, 19)
|
V = P (14)
|
|
1 (50 %) (19)
|
Külmtöötlus, töötlus giberelliinhappega (1,14, 18, 19, 32); idanemine nõuab valgust (1); eritöötluseta (2, 4)
|
PÄRAST (2, 4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(kibe tulikas)
|
M;
haritavad põllud, teeperved, lagendikud (16, 19)
|
1,5–2 (14, 19, 29)
|
V = P (14)
|
1
(29)
|
41–56 (19, 29)
|
Eritöötluseta
(5, 14, 22, 24–26)
|
PÄRAST (5, 22, 24–26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(maamõõl)
|
M;
hekid, niisked alad
(16, 19)
|
0,8–1,5 (14, 19)
|
V = P (14)
|
0 (19)
|
5 (50 %) (19);
16 (79 %) (18)
|
Pimedus pärsib idanemist (18, 19) stratifitseerimine soojas (1); eritöötluseta (5, 14, 22, 25, 26)
|
PÄRAST (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(roomav madar)
|
Ü;
haritavad põllud, niisked alad, häiritud kooslusega alad (16, 19)
|
7–9 (14, 19)
|
V = P (14)
|
|
5 (50 %) (19);
6 (100 %) (18)
|
Külmtöötlus (1, 18, 19); kiirgus ei mõjuta idanemist (18, 19); valgus pärsib idanemist (1); eritöötluseta (6, 14)
|
ENNE ja PÄRAST (6, 28)
|
A
|
32
|
|
Galium mollugo
(pehme madar)
|
M;
hekivallid, lagendikud (8)
|
7
(29)
|
V = P (14)
|
2
(29)
|
|
Eritöötluseta
(5, 14, 22, 24, 26, 29)
|
PÄRAST (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(verev sõrmkübar)
|
K, M; hekid, lagendikud (16, 19)
|
0,1–0,6 (4, 14, 19)
|
V = P (14)
|
0
(4, 19)
|
6 (50 %) (19);
8 (99 %) (18)
|
Pimedus pärsib idanemist (1, 17–19); eritöötluseta (4, 22–26)
|
PÄRAST (4, 22–26)
|
D, G, F
|
|
|
Veronica persica
(pärsia mailane)
|
Ü;
haritavad põllud, lagendikud, häiritud kooslusega alad (16, 19)
|
0,5–0,6 (14, 19)
|
V = P (14)
|
0 (19)
|
3 (19);
5 (96 %) (18)
|
Pimedus pärsib idanemist (18, 19); külmtöötlus (18); eritöötluseta (14)
|
ENNE ja PÄRAST (28)
|
A
|
32
|
Osutatud seemnetarnijad
|
Tarnija tähis
|
Tarnija andmed
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ, INGLISMAA, +44 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771–3948, USA,
|
|
(727) 344 4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla – Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0, KANADA, (519) 586 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002, USA, (303) 431 7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335, USA,
|
|
(800) 873 3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB, INGLISMAA,
|
|
+44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7, KANADA, (800) 274 7333
|
|
www.thompson-morgan.com
|
|
OSUTATUD KIRJANDUS
|
(1)
|
Baskin, C. C., ja Baskin, J. M. (1998). Seeds. Academic Press, Toronto.
|
|
(2)
|
Blackburn, L. G., ja Boutin, C. (2003). Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology 12: 271–285.
|
|
(3)
|
Boutin, C., Lee, H.-B., Peart, T., Batchelor, P. S., ja Maguire, R. J. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environ. Toxicol. Chem. 19: 2532–2541.
|
|
(4)
|
Boutin, C., Elmegaard, N., ja Kjaer, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology 13: 349–369.
|
|
(5)
|
Breeze, V., Thomas, G., ja Butler, R. (1992). Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Ann. Appl. Biol. 121: 669–677.
|
|
(6)
|
Brown, R. A., ja Farmer, D. (1991). Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. Väljaandes: Plants for toxicity assessment, 2. köide. ASTM STP 1115, Gorsuch, J. W., Lower, W. R., Wang, W., ja Lewis, M. A. (toim.), USA Materjalide Katsetamise Ühing, Philadelphia, lk 197–208.
|
|
(7)
|
Buhler, D. D., ja Hoffman, M. L. (1999). Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, KS.
|
|
(8)
|
Clapham, A. R., Tutin, T. G., ja Warburg, E. F. (1981). Excursion flora of the British Isles, 3. väljaanne. Cambridge University Press, Cambridge.
|
|
(9)
|
Clay, P. A., ja Griffin, J. L. (2000). Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Sci. 48: 481–486.
|
|
(10)
|
Cole, J. F. H., ja Canning, L. (1993). Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC – Weeds, lk 151–156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds) (2004). Isiklik suhtlus. (www.ernstseed.com)
|
|
(12)
|
Fletcher, J. S., Johnson, F. L., ja McFarlane, J. C. (1990). Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environ. Toxicol. Chem. 9: 769–776.
|
|
(13)
|
Fletcher, J. S., Pfleeger, T. G., Ratsch, H. C., ja Hayes, R. (1996). Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environ. Toxicol. Chem. 15: 1189–1196.
|
|
(14)
|
Flynn, S., Turner, R. M., ja Dickie, J. B. (2004). Seed Information Database (versioon 6.0, oktoober 2004). Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid).
|
|
(15)
|
Franzaring, J., Kempenaar, C., ja van der Eerden, L. J. M. (2001). Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environ. Pollut. 114: 21–28.
|
|
(16)
|
Gleason, H. A., ja Cronquist, A. (1991). Manual of vascular plants of northeastern United States and adjacent Canada, 2. väljaane. New York Botanical Garden, Bronx, NY.
|
|
(17)
|
Grime, J. P. (1981). The role of seed dormancy in vegetation dynamics. Ann. Appl. Biol. 98: 555–558.
|
|
(18)
|
Grime, J. P., Mason, G., Curtis, A. V., Rodman, J., Band, S. R., Mowforth, M. A. G., Neal, A. M., ja Shaw, S. (1981). A comparative study of germination characteristics in a local flora. J. Ecol. 69: 1017–1059.
|
|
(19)
|
Grime, J. P., Hodgson, J. G., ja Hunt, R. (1988). Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London.
|
|
(20)
|
Kjaer, C. (1994). Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Res. 34: 453–459.
|
|
(21)
|
Klingaman, T. E., King, C. A., ja Oliver, L. R. (1992). Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Sci. 40: 227–232.
|
|
(22)
|
Marrs, R. H., Williams, C. T., Frost, A. J., ja Plant, R. A. (1989). Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environ. Pollut. 59: 71–86.
|
|
(23)
|
Marrs, R. H., Frost, A. J., ja Plant, R. A. (1991). Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environ. Pollut. 69: 223–235.
|
|
(24)
|
Marrs, R. H., Frost, A. J., ja Plant, R. A. (1991). Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environ. Pollut. 73: 25–42.
|
|
(25)
|
Marrs, R. H., Frost, A. J., Plant, R. A., ja Lunnis, P. (1993). Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agr. Ecosyst. Environ. 45: 283–293.
|
|
(26)
|
Marrs, R. H., ja Frost, A. J. (1997). A microcosm approach to detection of the effects of herbicide spray drift in plant communities. J. Environ. Manage. 50: 369–388.
|
|
(27)
|
Marshall, E. J. P., ja Bernie, J. E. (1985). Herbicide effects on field margin flora. BCPC – Weeds, lk 1021–1028.
|
|
(28)
|
McKelvey, R. A., Wright, J. P., ja Honegger, J. L. (2002). A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Manag. Sci. 58: 1161–1174.
|
|
(29)
|
Morton, S. (Herbiseed) (2004). Isiklik suhtlus. (http://www.herbiseed.com)
|
|
(30)
|
USA põllumajandusministeeriumi loodusvarade kaitse amet (NRCS) (2004). The Plants Database, versioon 3.5 (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490, USA.
|
|
(31)
|
USA Keskkonnakaitseamet (1999). One-Liner Database (USA Keskkonnakaitseamet, pestitsiidiprogrammide büroo, keskkonnas säilivuse ja keskkonnamõju talitus, keskkonnaepidemioloogia üksus).
|
|
(32)
|
Webster, R. H. (1979). Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L., ja Boutin, C. (National Wildlife Research Centre, Environment Canada) (2004). Isiklik suhtlus.
|
|
(34)
|
Zwerger, P., ja Pestemer, W. (2000). Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. Pflanzenk. Pflanzen, Sonderh., 17: 711–718.
|
4. liide
Näited teatavate põllumajanduskultuuride jaoks sobivate kasvutingimuste kohta
Allpool esitatud tingimused on leitud olevat sobivad 10 põllumajanduskultuuri jaoks ning neid võib kasutada orientiirina ka kasvukambris teatavate muude liikidega tehtavate katsete puhul.
|
|
Süsihappegaasi sisaldus: 350 ± 50 ppm.
|
|
|
Suhteline õhuniiskus: valgel ajal 70 ± 5 % ja pimedal ajal 90 ± 5 %.
|
|
|
Temperatuur: päeval 25 ± 3 °C ja öösel 20 ± 3 °C.
|
|
|
Valgustusperiood: 16 tundi valgust ja 8 tundi pimedust, kui keskmine lainepikkus on vahemikus 400–700 nm.
|
|
|
Valgustustihedus: 350 ± 50 μE m– 2 s– 1, mõõdetuna lehestiku ülapinna tasandil.
|
Asjaomased põllumajanduskultuurid on järgmised:
|
—
|
tomat (Solanum lycopersicon);
|
|
—
|
kurk (Cucumis sativus);
|
|
—
|
aedsalat (Lactuca sativa);
|
|
—
|
peakapsas (Brassica oleracea var. capitata);
|
|
—
|
porgand (Daucus carota);
|
|
—
|
harilik kaer (Avena sativa);
|
|
—
|
karjamaa-raihein (Lolium perenne);
|
|
—
|
harilik mais (Zea mays);
|
|
—
|
harilik sibul (Allium cepa).
|
C.32. VALGELIIMUKLASTE SIGIVUSE KATSE
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 220 (2004). See meetod on ette nähtud selleks, et hinnata kemikaalide mõju hariliku valgeliimuka (Enchytraeus albidus Henle, 1873) sigivusele mullas. Meetod põhineb üldjoontes Saksamaa asutuse Umweltbundesamt välja töötatud meetodil (1), mis on võrdlusuuringuga valideeritud (2). Samuti on kaalutud muid meetodeid kemikaalide mürgisuse hindamiseks valgeliimuklastel ja vihmaussidel (3, 4, 5, 6, 7, 8).
|
LÄHTEKAALUTLUSED
|
2.
|
Perekonda Enchytraeus kuuluvad mullas elavad rõngussid esindavad ökotoksikoloogiliste katsete jaoks sobivaid ökoloogiliselt olulisi liike. Valgeliimuklasi leidub sageli vihmausse sisaldavas mullas, ent samal ajal esineb neid tihti arvukalt ka paljudes muldades, kus vihmaussid puuduvad. Valgeliimuklasi saab kasutada nii laborikatsetes kui ka poolväli- ja välikatsetes. Praktilisest seisukohast on paljud perekonna Enchytraeus liigid hõlpsalt kasutatavad ja kasvatatavad ning nende generatsiooniaeg on oluliselt lühem kui vihmaussidel. Valgeliimuklaste puhul on sigivuskatse kestus üksnes 4–6 nädalat, samas kui vihmausside (Eisenia fetida) puhul on see 8 nädalat.
|
|
3.
|
Põhiteave maismaakeskkonnas elavate valgeliimuklaste ökoloogia ja nendega seotud ökotoksikoloogia kohta on esitatud allikates 9, 10, 11 ja 12.
|
KATSE PÕHIMÕTE
|
4.
|
Täiskasvanud valgeliimukad viiakse kokkupuutesse uuritava kemikaaliga, mis on eri kontsentratsioonides segatud kunstliku mullaga. Katse võib jagada kahte etappi: a) kontsentratsioonivahemiku leidmise katse, mis tehakse juhul, kui kättesaadav teave ei ole piisav, ja milles kahenädalase kokkupuuteperioodi järel hinnatav peamine lõppnäitaja on suremus, ning b) lõplik sigivuskatse, milles hinnatakse vanema sigitatud noorloomade koguarvu ja vanemate ellujäämise määra. Lõpliku katse kestus on kuus nädalat. Esimese kolme nädala möödudes eemaldatakse täiskasvanud ussid ja registreeritakse neil esinevad morfoloogilised muutused. Järgmise kolme nädala möödudes loendatakse täiskasvanute moodustatud kookonitest koorunud järglased. Uuritava kemikaaliga kokku puutunud loomade sigivust võrreldakse sigivusega kontrollrühma(de)s, et teha kindlaks: i) täheldatavat toimet mitteavaldav kontsentratsioon ja/või ii) ECx (nt EC10, EC50), kasutades regressioonimudelit sellise hinnangulise kontsentratsiooni leidmiseks, mille puhul sigivus väheneb x % võrra. Katses kasutatav kontsentratsioonivahemik peaks hõlmama ECx (nt EC10, EC50) väärtust, nii et ECx leitakse interpoleerimise, mitte ekstrapoleerimise teel.
|
TEAVE UURITAVA KEMIKAALI KOHTA
|
5.
|
Soovitatavalt peaks olema teada uuritava kemikaali lahustuvus vees, log Kow, jaotuskoefitsient süsteemis muld/vesi (nt käesoleva lisa peatükk C.18 või C.19) ja aururõhk. Samuti on soovitatav lisateabe olemasolu uuritava kemikaali säilivuse kohta mullas, näiteks kemikaali fotolüüsi ja hüdrolüüsi kiirus.
|
|
6.
|
Käesolevat katsemeetodit võib kasutada nii vees lahustuvate kui ka vees lahustumatute kemikaalide puhul. Uuritava kemikaaliga töötlemise viis on neil kahel juhul siiski erinev. Katsemeetodit ei saa kasutada lenduvate kemikaalide puhul, mille Henry konstant või jaotuskoefitsient süsteemis õhk/vesi on suurem kui üks, ega kemikaalide puhul, mille aururõhk 25 °C juures on suurem kui 0,0133 Pa.
|
KATSE NÕUETEKOHASUS
|
7.
|
Katse vastab nõuetele, kui kontrollrühmas on täidetud järgmised kriteeriumid:
|
—
|
täiskasvanud isendite suremus ei tohiks kontsentratsioonivahemiku leidmise katse lõpus ja sigivuskatse esimese kolme nädala möödudes olla suurem kui 20 %;
|
|
—
|
kui katset alustatakse 10 täiskasvanud isendiga nõu kohta, peaks katse lõpuks olema igas nõus sigitatud keskmiselt 25 noorlooma;
|
|
—
|
noorloomade keskmise arvu variatsioonikordaja ei tohiks sigivuskatse lõpus olla suurem kui 50 %.
|
Kui katse ei vasta eespool nimetatud nõuetekohasuse kriteeriumidele, tuleks see lõpetada, välja arvatud juhul, kui katse jätkamist on võimalik põhjendada. Selline põhjendus tuleks esitada katseprotokollis.
|
VÕRDLUSKEMIKAAL
|
8.
|
Võrdluskemikaali abil tuleks korrapäraselt või võimaluse korral igas katses kontrollida, kas katseorganismide reaktsioon on aja jooksul üldjoontes samaks jäänud. Sobiv võrdluskemikaal on karbendasiim, mis teadaolevalt mõjutab valgeliimuklaste ellujäämise määra ja sigivust (13, 14); võib kasutada ka muid kemikaale, mille mürgisuse andmed on hästi dokumenteeritud. Võrdlusuuringus kasutati karbendasiimi valmistoote kujul, mida tarnib kaubanime Derosal™ all ettevõte AgrEvo Company (Frankfurt, Saksamaa) ja milles toimeaine sisaldus on 360 g/l (32,18 %) (2). Võrdlusuuringus sigivuse kohta määratud EC50 jäi vahemikku 1,2 ± 0,8 mg toimeainet kuivmassi kilogrammi kohta (2). Kui katseseerias kasutatakse positiivse kontrollina mürgist võrdluskemikaali, kasutatakse ühte kontsentratsiooni ning asjaomaste paralleelnõude arv peaks olema sama kui kemikaalita kontrollrühmas. Karbendasiimi puhul soovitatakse teha katse kontsentratsioonil 1,2 mg toimeainet kuivmassi kilogrammi kohta (kui kasutatakse vedelat valmistoodet).
|
KATSEMEETODI KIRJELDUS
Seadmed
|
9.
|
Katsenõud peaksid olema klaasist või muust keemiliselt inertsest materjalist. Selleks sobivad klaaspurgid (nt mahuga 0,20–0,25 liitrit ja diameetriga umbes 6 cm). Nõudel peaks olema läbipaistev (nt klaasist või polüetüleenist) kaas, mis vähendab vee aurumist ja võimaldab samal ajal gaasivahetust mulla ja atmosfääri vahel. Kaane läbipaistvus on vajalik valguse läbilaskmiseks.
|
|
10.
|
On vaja tavapäraseid laboriseadmeid, täpsemalt järgmist:
|
—
|
pH-meeter ja fotomeeter;
|
|
—
|
sobivad temperatuuri reguleerimise seadmed;
|
|
—
|
sobivad niiskuse reguleerimise seadmed (ei ole hädavajalikud, kui kokkupuutenõu on kaanega);
|
|
—
|
inkubaator või väike kliimaseadmega ruum;
|
|
—
|
pintsetid, konksud või aasad;
|
|
Kunstliku mulla valmistamine
|
11.
|
Käesoleva katsemeetodi puhul kasutatakse kunstlikku mulda (5, 7), mille koostis on järgmine (kuivmassi põhjal pärast kuumutamist 105 °C juures, kuni mass enam ei muutu):
|
—
|
10 % turbasamblaturvast, mis on õhu käes kuivatatud ja peeneks jahvatatud (osakeste suurus võib olla 2 ± 1 mm); enne katse tegemist soovitatakse kontrollida, kas värskest turbapartiist valmistatud pinnas sobib valgeliimuka kasvatamiseks;
|
|
—
|
20 % kaoliinsavi (soovitatav kaoliniidisisaldus üle 30 %);
|
|
—
|
umbes 0,3–1,0 % kaltsiumkarbonaati (CaCO3, pulbristatud, analüütilise puhtusastmega), et saavutada pH väärtus 6,0 ± 0,5; lisatava kaltsiumkarbonaadi kogus võib sõltuda eelkõige turba kvaliteedist ja omadustest;
|
|
—
|
umbes 70 % kvartsliiva (sõltuvalt vajalikust CaCO3 kogusest), mis on õhu käes kuivatatud ja koosneb peamiselt peenest liivast, millest üle 50 % moodustavad osakesed suurusega 50–200 mikromeetrit.
|
Enne kunstliku mulla kasutamist lõplikus katses on soovitatav veenduda selle sobivuses valgeliimuka kasvatamiseks ja katse nõuetekohasuse kriteeriumide saavutamiseks. Sellist kontrollimist soovitatakse eelkõige selleks, et oleks võimalik veenduda, et katsetulemused ei halvene, kui orgaanilise süsiniku sisaldus kunstlikus mullas on väiksem, näiteks kui turbasisaldust vähendatakse 4–5 protsendini ja liivasisaldust vastavalt suurendatakse. Orgaanilise süsiniku sisalduse sellise vähendamise tulemusena võib väheneda mulla (orgaanilise süsiniku) võime uuritavat kemikaali adsorbeerida ning kemikaali saadavus ussidele võib suureneda. On tõendatud, et Enchytraeus albidus'e puhul on sigivust käsitlevad nõuetekohasuse kriteeriumid täidetavad, kui katse tehakse põllumullas, milles orgaanilise süsiniku sisaldus on väiksem (näiteks 2,7 %) (15), ning seniste piiratud kogemuste põhjal on võimalik seda saavutada ka kunstlikus mullas, mille turbasisaldus on 5 %.
Märkus: kui tehakse lisakatseid (nt kõrgema tasandi katseid) loodusliku mullaga, tuleks tõendada ka sellise mulla sobivust ja katse nõuetekohasuse kriteeriumide täidetavust.
|
|
12.
|
Mulla kuivad koostisosad segatakse põhjalikult (nt suure mahutavusega laborisegistis). Seda tuleks teha vähemalt üks nädal enne katse alustamist. Segatud muld tuleks kaheks päevaks seisma jätta, et happesus stabiliseeruks. Mulla pH mõõtmiseks kasutatakse mulla ja 1 M kaaliumkloriidi (KCl) või 0,01 M kaltsiumkloriidi (CaCl2) lahuse segu suhtega 1:5 (vt allikas 16 ja 3. liide). Kui mulla happesus on suurem kui nõutavasse vahemikku jäävad väärtused (vt punkt 11), võib selle reguleerimiseks lisada sobiva koguse CaCO3. Kui muld on liiga leeliseline, võib happesuse suurendamiseks lisada punktis 11 osutatud segu, millest on välja jäetud CaCO3.
|
|
13.
|
Kunstliku mulla maksimaalne veemahutavus määratakse vastavalt 2. liites kirjeldatud meetodile. Üks kuni kaks päeva enne katse alustamist eelniisutatakse kuiva kunstlikku mulda piisava koguse deioniseeritud vee lisamise teel, et saavutada veesisaldus, mis on umbes poole väiksem kui lõplik veesisaldus, mis jääb vahemikku 40–60 % maksimaalsest veemahutavusest. Katse alguses jagatakse eelniisutatud muld nii mitmeks osaks, kui palju on kasutatavatele uuritava kemikaali kontsentratsioonidele vastavaid (ja vajaduse korral võrdluskemikaaliga) katserühmi ja kontrollrühmi. Niiskusesisaldus viiakse 40–60 protsendini maksimaalsest veemahutavusest, lisades uuritava kemikaali lahust ja/või destilleeritud või deioniseeritud vett (vt punktid 19–21). Niiskusesisaldus määratakse katse alguses ja lõpus (kuivatades mulda 105 °C juures, kuni selle kaal enam ei muutu) ning see peaks jääma usside ellujäämiseks optimaalsesse vahemikku. Mulla niiskusesisalduse ligikaudseks kontrollimiseks võib mulda õrnalt peos pigistada: sobiva niiskusesisalduse korral peaksid sõrmede vahele ilmuma väikesed veetilgad.
|
Katseloomade valimine ja ettevalmistamine
|
14.
|
Soovitatav katseliik on sugukonda Enchytraeidae (alamklass Oligochaeta, hõimkond Annelida) kuuluv harilik valgeliimukas (Enchytraeus albidus Henle, 1837). E. albidus on üks suuremaid valgeliimuklaste liike ning selle liigi isendite pikkuseks on mõõdetud kuni 35 mm (17, 18). E. albidus on ülemaailmse levikuga liik, keda leidub nii meres, mageveekogudes kui ka maismaa elupaikades, peamiselt lagunevas orgaanilises aines (merevetikad, kompost) ja harva ka niitudel (9). Selle liigi taluvus eri ökoloogiliste tingimuste suhtes ja teatav morfoloogiline varieeruvus võivad osutada eri liigisiseste rühmade olemasolule.
|
|
15.
|
E. albidus on turul kättesaadav kalasöödana. Tuleks kontrollida, kas kultuur on saastunud muude, tavaliselt väiksemate liikidega (1, 19). Saastumise korral tuleks kõiki usse Petri tassis veega pesta. Seejärel tuleks uue kultuuri loomiseks valida stereomikroskoobi abil välja E. albidus'e suured täiskasvanud isendid ja kõik muud ussid kõrvaldada. E. albidus't saab hõlpsalt kasvatada paljudes eri orgaanilistes materjalides (vt 4. liide). E. albidus'e elutsükkel on lühike, kuna suguküpsuse saavutamiseks kulub 33 päeva (18 °C juures) kuni 74 päeva (12 °C juures) (1). Katses kasutatakse üksnes kultuure, mida on kasvatatud laboris probleemideta vähemalt 5 nädalat (ühe põlvkonna vältel).
|
|
16.
|
Sobivad ka muud perekonna Enchytraeus liigid, näiteks E. buchholzi (Vejdovský, 1879) või E. crypticus (Westheide & Graefe, 1992) (vt 5. liide). Muude perekonna Enchytraeus liikide kasutamise korral tuleb selgelt märkida asjaomane liik ja esitada selle valimise põhjendus.
|
|
17.
|
Katses kasutatakse täiskasvanud usse. Neil peaksid olema vöö piirkonnas näha munad (valged laigud) ja nad peaksid olema umbes ühesuurused (ligikaudu 1 cm pikkused). Kasvatatava kultuuri sünkroonimine ei ole vajalik.
|
|
18.
|
Kui valgeliimuklasi ei kasvatata sama tüüpi mullas ja samades tingimustes (sh söötmistingimused), mida kasutatakse lõplikus katses, tuleb neil lasta kohaneda vähemalt 24 tundi ja kuni kolm päeva. Algselt tuleks lasta kohaneda suuremal arvul täiskasvanud isenditel, kui on vaja katse tegemiseks, et luua varu vigastatud või muul põhjusel sobimatute isendite kõrvaldamiseks. Kohanemisperioodi lõpus valitakse katse jaoks välja üksnes munadega ussid, kelle käitumises ei täheldata kõrvalekaldeid (nt püüdu mullast lahkuda). Ussid eemaldatakse ettevaatlikult juveliiripintsettide, konksu või aasa abil ja viiakse Petri tassi, mis sisaldab väikeses koguses magedat vett. Soovitatakse kasutada käesoleva lisa peatükis C.20 („Hiidkiivriku (Daphnia magna) sigivuse katse”) osutatud taastatud magedat vett, kuna deioniseeritud, demineraliseeritud või kraanivesi võib olla ussidele kahjulik. Usse kontrollitakse stereomikroskoobi all ja kõik munadeta ussid kõrvaldatakse. Jälgitakse hoolikalt, et kõik kultuuri nakatada võivad lestad ja hooghännalised saaksid eemaldatud ja kõrvaldatud. Terved ussid, keda katses ei kasutata, viiakse tagasi tüvikultuuri.
|
Katsekontsentratsiooniga segude valmistamine
Vees lahustuv uuritav kemikaal
|
19.
|
Uuritava kemikaali lahus valmistatakse deioniseeritud vee sellises koguses, millest piisab kõikidele ühe katsekontsentratsiooni puhul kasutatavatele paralleelkultuuridele. Soovitatakse kasutada sobivas koguses vett, et saavutada nõutav niiskusesisaldus, st 40–60 % maksimaalsest veemahutavusest (vt punkt 13). Enne katsenõusse viimist segatakse uuritava kemikaali iga lahus põhjalikult ühe partii eelniisutatud mullaga.
|
Vees lahustumatu uuritav kemikaal
|
20.
|
Vees lahustumatu, kuid orgaanilises lahustis lahustuva kemikaali võib lahustada võimalikult väikeses koguses sobivas kandeaines (nt atsetoonis). Tuleks kasutada üksnes lenduvaid lahusteid. Kandeaine pihustatakse väikesele kogusele, näiteks 2,5 grammile peenele kvartsliivale või segatakse sellega. Kandeaine kõrvaldatakse vähemalt üks tund kestva tõmbekapis aurustamise teel. Kvartsliiva ja uuritava kemikaali segu lisatakse eelniisutatud mullale ja pärast nõutava niiskusesisalduse saavutamiseks vajaliku koguse deioniseeritud vee lisamist segatakse saadav segu põhjalikult läbi. Lõplik segu viiakse katsenõudesse.
|
|
21.
|
Vees ja orgaanilistes lahustites raskesti lahustuva kemikaali puhul segatakse soovitava katsekontsentratsiooni saavutamiseks vajalik kogus uuritavat kemikaali sellise koguse peeneks jahvatatud kvartsliivaga, mis vastab 2,5 grammile katsenõu kohta. Kõnealune kvartsliiva ja uuritava kemikaali segu lisatakse eelniisutatud mullale ja pärast nõutava niiskusesisalduse saavutamiseks vajaliku koguse deioniseeritud vee lisamist segatakse saadav segu põhjalikult läbi. Lõplik segu jaotatakse katsenõudesse. Kirjeldatud toiminguid korratakse iga katsekontsentratsiooni puhul ning valmistatakse ka sobiv kontrollsegu.
|
|
22.
|
Kemikaale ei tohiks üldjuhul testida suuremal kontsentratsioonil kui 1 000 mg mulla kuivmassi kilogrammi kohta. Mõne konkreetse katse eesmärkide saavutamiseks võib suurema kontsentratsiooni kasutamine siiski vajalik olla.
|
KATSE KÄIK
Katse- ja kontrollrühmad
|
23.
|
Iga katses kasutatava kontsentratsiooni puhul viiakse katsenõusse 20 grammile kuivmassile vastav kogus katsemulda (vt punktid 19–21). Valmistatakse ka uuritava kemikaalita kontrollsegud. Igasse nõusse lisatakse sööt punktis 29 kirjeldatud viisil. Igasse katsenõusse viiakse juhuvaliku alusel 10 ussi. Ussid pannakse näiteks juveliiripintsette, konksu või aasa kasutades ettevaatlikult igasse katsenõusse mullapinnale. Paralleelnõude arv iga katses kasutatava kontsentratsiooni puhul ja kontrollrühmades sõltub kasutatavast katseplaanist (vt punkt 34). Katsenõud paigutatakse inkubaatorisse juhuslikult ja nende paigutust muudetakse juhuslikkuse alusel igal nädalal.
|
|
24.
|
Kui uuritava kemikaaliga töötlemiseks kasutatakse kandeainet, tuleks moodustada lisaks katserühmadele üks kontrollrühm, kus kasutatakse kvartsliiva, millega on segatud või millele on pihustatud lahustit. Asjaomase lahusti või dispergeeriva aine kontsentratsioon peaks olema sama kui uuritavat kemikaali sisaldavates katsenõudes. Kemikaalide puhul, millega töötlemisel on vaja järgida punktis 21 kirjeldatud korda, tuleks moodustada kontrollrühm, kus kasutatakse täiendavalt kvartsliiva (2,5 g nõu kohta).
|
Katsetingimused
|
25.
|
Katsetemperatuur on 20 ± 2 °C. Et hoida ära usside põgenemist mullast, kasutatakse katses kontrollitavat valgustusrežiimi (soovitatavalt 16 tundi valgust ja 8 tundi pimedust) ja katsenõude inkubeerimisalal valgustustihedus 400–800 luksi.
|
|
26.
|
Mulla niiskusesisalduse kontrollimiseks kaalutakse katsenõusid katse alguses ja seejärel kord nädalas. Kaalu vähenemist kompenseeritakse sobiva koguse deioniseeritud vee lisamisega. Tuleks tähele panna, et veekadu on võimalik vähendada, hoides inkubaatoris kõrget õhuniiskuse taset (> 80 %).
|
|
27.
|
Niiskusesisaldust ja pH-d tuleks mõõta nii kontsentratsioonivahemiku leidmise katse kui ka lõpliku katse alguses ja lõpus. Mõõtmiste tegemiseks tuleks kasutada kemikaaliga igal kontsentratsioonil töödeldud mullaproove ja kontrollproove, mis on valmistatud ja mida inkubeeritakse samal viisil kui katsekultuure, kuid mis ei sisalda usse. Nendesse mullaproovidesse tuleks sööta lisada üksnes katse alguses, et soodustada mikroobide elutegevust. Lisatava sööda kogus peaks olema sama kui katsekultuuridesse lisatav kogus. Nendesse nõudesse ei ole vaja katse vältel enam sööta juurde lisada.
|
Söötmine
|
28.
|
Võib kasutada sööta, mille puhul on tagatud valgeliimuklaste populatsiooni säilimine. On kindlaks tehtud, et söödamaterjalina on sobiv kasutada valtsitud kaera, mis on soovitatav mikroobidega saastumise ärahoidmiseks enne kasutamist autoklaavida (sobib ka kuumutamine).
|
|
29.
|
Sööda esmakordseks lisamiseks segatakse 50 mg jahvatatud valtsitud kaera igas nõus mullaga enne usside lisamist. Seejärel lisatakse sööta igal nädalal kuni 21. katsepäevani. Sööta ei lisata 28. katsepäeval, kuna selleks ajaks on täiskasvanud ussid juba eemaldatud ja noored ussid vajavad pärast seda suhteliselt vähe lisatoitu. Katse ajal lisatakse söödana 25 mg jahvatatud valtsitud kaera nõu kohta, pannes need ettevaatlikult mullapinnale, et usse mitte vigastada. Seente kasvu pärssimiseks tuleks kaerahelbed mulla sisse viia, kattes need väikese koguse mullaga. Kui sööt jäetakse söömata, tuleks söödakogust vähendada.
|
Kontsentratsioonivahemiku leidmise katse plaan
|
30.
|
Vajaduse korral tehakse kontsentratsioonivahemiku leidmise katse, milles kasutatakse näiteks viit uuritava kemikaali kontsentratsiooni: 0,1, 1,0, 10, 100 ja 1 000 mg mulla kuivmassi kilogrammi kohta. Iga katserühma ja kontrollrühma puhul piisab ühest nõust.
|
|
31.
|
Kontsentratsioonivahemiku leidmise katse kestus on kaks nädalat. Katse lõpus hinnatakse usside suremust. Uss loetakse surnuks, kui ta ei reageeri esiotsa mehaanilisele ärritamisele. Lõplikus katses kasutamiseks sobiva kontsentratsioonivahemiku kindlaksmääramiseks võib olla kasu ka muust teabest peale suremuse. Seepärast tuleks registreerida ka muutused täiskasvanud isendite käitumises (nt võimetus mulda kaevuda või katsenõu klaasseina vastas liikumatult lamamine) ja morfoloogias (nt lahtiste haavade esinemine), samuti noorloomade esinemine. Viimaste kindlakstegemiseks võib kasutada 6. liites kirjeldatud värvimismeetodit.
|
|
32.
|
LC50 ligikaudseks määramiseks võib arvutada suremuse määra geomeetrilise keskväärtuse. Lõplikus katses kasutatava kontsentratsioonivahemiku kindlaksmääramisel eeldatakse, et mõju sigivusele avaldub kuni 10 korda väiksemal kontsentratsioonil kui LC50. See suhe on siiski katseliselt leitud ja võib igal konkreetsel juhul olla erinev. Lõplikus katses kasutatavat uuritava kemikaali kontsentratsioonide vahemikku võivad aidata kindlaks määrata ka muud kontsentratsioonivahemiku leidmise katses tehtud tähelepanekud, näiteks noorloomade esinemine.
|
|
33.
|
LC50 täpseks määramiseks soovitatakse kasutada katses vähemalt nelja paralleelnõu uuritava kemikaali iga kontsentratsiooni kohta ja piisavat arvu eri kontsentratsioone, et saada vähemalt neli statistiliselt oluliselt erinevat vastuse keskväärtust. Vajaduse korral kasutatakse kontrollrühmade puhul sarnast arvu kontsentratsioone ja paralleelnõusid.
|
Lõpliku sigivuskatse plaan
|
34.
|
Võrdlusuuringu (2) alusel välja töötatud soovitustest lähtuvalt pakutakse välja kolm katseplaani.
|
—
|
Täheldatavat toimet mitteavaldava kontsentratsiooni määramiseks tuleks kasutada vähemalt viit kontsentratsiooni geomeetrilises jadas. Soovitatakse kasutada nelja paralleelnõu kontsentratsiooni kohta ja lisaks kaheksat kontrollnõu. Kontsentratsioonide jada tegur ei tohiks olla suurem kui 1,8.
|
|
—
|
ECx (nt EC10, EC50) määramiseks tuleks katses kasutada vähemalt viit kontsentratsiooni ja kasutatav kontsentratsioonivahemik peaks hõlmama ECx väärtust, et võimaldada määrata ECx interpoleerimise, mitte ekstrapoleerimise teel. Soovitatakse kasutada vähemalt nelja paralleelnõu kontsentratsiooni kohta ja nelja paralleelnõu kontrollrühmas. Kontsentratsioonide jada tegur võib varieeruda, st olla eeldatavas mõju avaldumise vahemikus 1,8 või väiksem ning sellest vahemikust väljaspool olevate suuremate ja väiksemate kontsentratsioonide puhul üle 1,8.
|
|
—
|
Kombineeritud lähenemisviis võimaldab määrata nii täheldatavat toimet mitteavaldava kontsentratsiooni kui ka ECx. Tuleks kasutada kaheksat uuritava kemikaali kontsentratsiooni geomeetrilises jadas. Soovitatakse kasutada nelja paralleelnõu kontsentratsiooni kohta ja lisaks kaheksat kontrollnõu. Kontsentratsioonide jada tegur ei tohiks olla suurem kui 1,8.
|
|
|
35.
|
Tuleks kasutada 10 täiskasvanud ussi katsenõu kohta (vt punkt 23). Sööta lisatakse katsenõudesse katse alguses ja seejärel kord nädalas (vt punkt 29) kuni 21. katsepäeva lõpuni. Kahekümne esimesel katsepäeval vaadatakse mullaproovid käsitsi hoolikalt läbi ning elusad täiskasvanud ussid loendatakse, neid vaadeldakse ja registreeritakse muutused nende käitumises (nt võimetus mulda kaevuda või katsenõu klaasseina vastas liikumatult lamamine) ja morfoloogias (nt lahtiste haavade esinemine). Seejärel eemaldatakse kõik täiskasvanud ussid katsenõudest ja katsemullast. Katsemulda koos kõikide selles sisalduvate moodustatud kookonitega inkubeeritakse veel kolm nädalat samades katsetingimustes; ainsa erinevusena lisatakse sööta (st 25 mg jahvatatud valtsitud kaera nõu kohta) üksnes 35. katsepäeval.
|
|
36.
|
Kuue nädala möödudes loendatakse katse vältel koorunud ussid. Soovitatakse kasutada bengali punasega värvimisel põhinevat meetodit (vt 6. liide), kuid sobivaks on osutunud ka muud vedelikuga (kuid mitte kuumusega) ekstraheerimise ja vedelikupinnale toomise meetodid (vt 6. liide) (4, 10, 11, 20). Bengali punasega värvimist soovitatakse kasutada seepärast, et mullasubstraadist vedelikuga ekstraheerimise puhul võib segavaks teguriks olla suspendeeritud saviosakeste põhjustatud hägusus.
|
Piirsisalduskatse
|
37.
|
Kui kontsentratsioonivahemiku leidmise katses ei täheldata suurimal kasutatud kontsentratsioonil (nt kontsentratsioonil 1 000 mg/kg) mingit mõju, võib sigivuskatse teha piirsisalduskatsena, kasutades kontsentratsiooni 1 000 mg/kg, et tõendada, et täheldatavat toimet mitteavaldav kontsentratsioon on sigivuse puhul sellest väärtusest suurem.
|
Katse lühikirjeldus ja ajakava
|
38.
|
Katse etapid võib kokku võtta järgmiselt.
|
Aeg
|
Kontsentratsioonivahemiku leidmise katse
|
Lõplik katse
|
|
7 päeva enne katset või varem
|
|
—
|
Valmistatakse kunstlik muld (segatakse kokku kuivad koostisosad)
|
|
|
—
|
Valmistatakse kunstlik muld (segatakse kokku kuivad koostisosad)
|
|
|
5 päeva enne katset
|
|
—
|
Kontrollitakse kunstliku mulla pH-d
|
|
—
|
Mõõdetakse mulla maksimaalne veemahutavus
|
|
|
—
|
Kontrollitakse kunstliku mulla pH-d
|
|
—
|
Mõõdetakse mulla maksimaalne veemahutavus
|
|
|
5 kuni 3 päeva enne katset
|
|
—
|
Valitakse välja ussid katsetingimustega kohandamiseks
|
|
|
—
|
Valitakse välja ussid katsetingimustega kohandamiseks
|
|
|
3 kuni 0 päeva enne katset
|
|
—
|
Ussidel lastakse vähemalt 24 tundi kohaneda
|
|
|
—
|
Ussidel lastakse vähemalt 24 tundi kohaneda
|
|
|
1 päev enne katset
|
|
—
|
Kunstlik muld eelniisutatakse ja jagatakse partiideks
|
|
|
—
|
Kunstlik muld eelniisutatakse ja jagatakse partiideks
|
|
|
Katse alustamise päev (0-päev)
|
|
—
|
Valmistatakse põhilahused
|
|
—
|
Töödeldakse uuritava kemikaaliga
|
|
—
|
Kaalutud kogus katsesubstraati viiakse katsenõudesse
|
|
—
|
Mõõdetakse mulla pH ja niiskusesisaldus
|
|
|
—
|
Valmistatakse põhilahused
|
|
—
|
Töödeldakse uuritava kemikaaliga
|
|
—
|
Kaalutud kogus katsesubstraati viiakse katsenõudesse
|
|
—
|
Mõõdetakse mulla pH ja niiskusesisaldus
|
|
|
7. päev
|
|
—
|
Kontrollitakse mulla niiskusesisaldust
|
|
|
—
|
Kontrollitakse mulla niiskusesisaldust
|
|
|
14. päev
|
|
—
|
Määratakse täiskasvanud usside suremus
|
|
—
|
Määratakse noorloomade hinnanguline arv
|
|
—
|
Mõõdetakse mulla pH ja niiskusesisaldus
|
|
|
—
|
Kontrollitakse mulla niiskusesisaldust
|
|
|
21. päev
|
|
|
—
|
Jälgitakse täiskasvanud usside käitumist
|
|
—
|
Eemaldatakse täiskasvanud ussid
|
|
—
|
Määratakse täiskasvanud usside suremus
|
|
—
|
Kontrollitakse mulla niiskusesisaldust
|
|
|
28. päev
|
|
|
—
|
Kontrollitakse mulla niiskusesisaldust
|
|
|
35. päev
|
|
|
—
|
Kontrollitakse mulla niiskusesisaldust
|
|
|
42. päev
|
|
|
—
|
Mõõdetakse mulla pH ja niiskusesisaldus
|
|
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Andmete töötlemine
|
39.
|
Käesolevas katsemeetodis ei anta lõplikke juhiseid katsetulemuste statistilise analüüsi kohta; 7. liites on siiski esitatud asjakohane ülevaade.
|
|
40.
|
Kontsentratsioonivahemiku leidmise katses on peamine lõppnäitaja suremus. Siiski tuleks registreerida ka muutused täiskasvanud isendite käitumises (nt võimetus mulda kaevuda või katsenõu klaasseina vastas liikumatult lamamine) ja morfoloogias (nt lahtiste haavade esinemine), samuti noorloomade esinemine. Üldjuhul tuleks kasutada LC50 leidmiseks probitanalüüsi (21) või logistilist regressiooni. Selle analüüsimeetodi sobimatuse korral (nt kui andmed hõlmavad vähem kui kolme kontsentratsiooni, mille puhul täheldatakse osalist suremust) võib kasutada mõnda alternatiivset meetodit. Kõnealuse meetodina võib muu hulgas kasutada libiseva keskmise meetodit (22), kohandatud Spearmani-Kärberi meetodit (23) või lihtsat interpoleerimist (nt LC0 ja LC100 geomeetrilist keskmist, mis on saadud LC0 ja LC100 korrutisest ruutjuure võtmise teel).
|
|
41.
|
Lõplikus katses on lõppnäitaja sigivus (st sigitatud noorloomade arv). Sarnaselt kontsentratsioonivahemiku leidmise katsele tuleks lõpp-protokolli siiski märkida ka kõik muud kahjuliku mõju ilmingud. Statistilise analüüsi käigus on vaja arvutada sigivuse aritmeetiline keskmine ja standardhälve igas katse- ja kontrollrühmas.
|
|
42.
|
Dispersioonanalüüsi tegemise korral võib standardhälbe s ja selle vabadusastmete arvu df asendada vastavalt dispersioonianalüüsi (ANOVA) tulemusena leitud hajuvuse hinnangulise koondmäära ja selle vabadusastmete arvuga, eeldusel, et hajuvus ei sõltu kontsentratsioonist. Sellisel juhul kasutatakse kontroll- ja katserühmade puhul ühte hajuvuse väärtust. Kõnealused väärtused arvutatakse tavaliselt müügiloleva statistilise analüüsi programmi abil, kasutades paralleelidena igas eraldi nõus saadud tulemusi. Kui ilmneb, et negatiivse kontrolli ja lahustiga kontrolli andmete koondamine on mõistlikum kui võrdlemine ühe nimetatud kontrolliga, tuleks veenduda, et asjaomased andmed ei ole oluliselt erinevad (selleks sobivatele meetoditele osutatakse punktis 45 ja 7. liites).
|
|
43.
|
Edasine statistiline analüüs ja järeldused sõltuvad sellest, kas paralleelnõudes saadud väärtused on normaaljaotusega ja kas nende hajuvus on homogeenne.
|
Täheldatavat toimet mitteavaldava kontsentratsiooni (NOEC) hindamine
|
44.
|
Soovitatavalt tuleks kasutada suure võimsusega meetodit. Et hinnata andmete jaotuse ligikaudset vastavust normaaljaotusele, tuleks kasutada varasemal kogemusel, näiteks võrdlusuuringu andmetel või muudel varasematel andmetel põhinevat teavet. Hajuvuse homogeensus (homoskedastiivsus) on suurema tähtsusega. Kogemusest nähtub, et hajuvus suureneb sageli keskväärtuse suurenedes. Sellisel juhul võib homoskedastiivsuse saavutamiseks olla kasu andmete teisendamisest. Kõnealuse teisendamise puhul tuleks siiski lähtuda varasematel andmetel põhinevast kogemusest, mitte analüüsitavatest andmetest. Homogeensete andmete puhul tuleks kasutada mitmest t-testi, näiteks Williamsi testi (α = 0,05; ühepoolne) (24, 25) või teatavatel juhtudel Dunnetti testi (26, 27). Tuleks tähele panna, et paralleelnõude andmete ebavõrdse hajuvuse korral tuleb tabelis esitatud t-väärtusi Dunnetti ja Williamsi kirjeldatud viisil korrigeerida. Mõnikord ei suurene/vähene saadud väärtused suurest varieeruvusest tingituna korrapäraselt. Sellise suure monotoonsusest kõrvalekaldumise puhul on asjakohasem kasutada Dunnetti testi. Homoskedastiivsusest kõrvalekaldumise puhul võib olla mõistlik hinnata võimalikku mõju hajuvusele lähemalt, et oleks võimalik otsustada, kas asjaomaseid t-teste saab kasutada võimsust oluliselt kaotamata (28). Teise võimalusena võib kasutada mitmest U-testi, näiteks Bonferroni U-testi vastavalt Holmile (29), või heteroskedastiivsete andmete puhul, mis muidu vastavad üldisele monotoonsele kontsentratsioonist sõltuvusele, mõnda muud mitteparameetrilist (nt Jonckheere'i-Terpstra (30, 31) või Shirley (32, 33)) testi; sellist testi tuleks üldjuhul eelistada ebavõrdse hajuvuse suhtes kohandatud t-testile (vt ka skeem, 7. liide).
|
|
45.
|
Kui on tehtud piirsisalduskatse ja parameetrilise testi eeldused (normaaljaotus, homogeensus) on täidetud, võib kasutada paariviisilist Studenti t-testi või ka Manni-Whitney U-testi (29).
|
ECx leidmine
|
46.
|
Mis tahes ECx väärtuse arvutamiseks regressioonanalüüsi (lineaarse või mittelineaarse regressiooni) teel kasutatakse katserühmade andmete keskväärtusi, mille alusel leitakse kontsentratsiooni ja mõju vahelist sõltuvust kirjeldav sobiv funktsioon. Pideva tunnusena vaadeldava usside kasvu puhul võib ECx väärtuste leidmiseks kasutada sobivat regressioonanalüüsi (35). Binaarsete andmete (suremus/elulemus) ja sigitatud järglaste arvu puhul sobivad funktsioonid on muu hulgas normaaljaotuse sigmoidfunktsioon, logistiline funktsioon ja Weibulli funktsioon, mis hõlmavad kahte kuni nelja parameetrit ja millest mõni sobib ka hormeetilise mõju modelleerimiseks. Kui kontsentratsiooni ja mõju vahelist sõltuvust väljendava funktsiooni leidmiseks kasutatakse lineaarset regressiooni, tuleks enne ECx määramist veenduda regressioonanalüüsi teel r2 (määratusekordaja) ja/või tõusu väärtuse olulisuses; ECx arvutamiseks sisestatakse regressioonanalüüsi tulemusena saadud võrrandisse väärtus, mis vastab x protsendile kontrollrühma keskväärtusest. Usalduspiirid usaldusnivool 95 % arvutatakse vastavalt Fiellerile (viidanud Finney (21)) või mõne muu sobiva kaasaegse meetodi abil.
|
|
47.
|
Teise võimalusena väljendatakse mõju protsentuaalse või lihtosakaaluna mudeli parameetrina käsitatavast kontrollrühma näitaja keskväärtusest. Sellisel juhul on normaaljaotusele vastava (logistilise, Weibulli) sigmoidse kõvera lähendamiseks andmetele sageli võimalik hõlpsalt kasutada probitanalüüsil põhinevat regressioonimeetodit (21). Kõnealusel juhul tuleb kaalufunktsiooni kohandada arvulise tunnuse analüüsimiseks, nagu on kirjeldanud Christensen (36). Hormeesi ilmnemisel tuleks probitanalüüsi asemel siiski rakendada neljaparameetrilist logistilist või Weibulli funktsiooni, kasutades lähendamiseks mittelineaarset regressiooni (36). Kui kontsentratsiooni ja mõju vahelist sõltuvust väljendava sobiva funktsiooni lähendamine andmetele ei ole võimalik, võib ECx hinnangulise väärtuse ja asjaomaste usalduspiiride määramiseks kasutada muud meetodit, näiteks libiseva keskmise meetodit vastavalt Thompsonile (22) või kohandatud Spearmani-Kärberi meetodit (23).
|
KATSEPROTOKOLL
|
48.
|
Katseprotokollis esitatakse järgmine teave.
|
|
Uuritav kemikaal:
|
—
|
füüsikaline iseloomustus ja vajaduse korral füüsikalis-keemilised omadused (nt lahustuvus vees, aururõhk);
|
|
—
|
uuritava kemikaali identifitseerimisandmed vastavalt IUPACi nomenklatuurile, kemikaali CASi number, partii, struktuurivalem ja puhtus;
|
|
—
|
proovi kõlblikkusaja lõppkuupäev.
|
|
|
|
Katseliik:
|
—
|
kasutatud katseloomad: liik, teaduslik nimetus, organismide päritolu ja kasvatustingimused.
|
|
|
|
Katsetingimused:
|
—
|
kunstliku mulla koostisosad ja valmistamine;
|
|
—
|
uuritava kemikaaliga töötlemise meetod;
|
|
—
|
katsetingimuste kirjeldus, sealhulgas temperatuur, niiskusesisaldus, pH jne;
|
|
—
|
katseplaani ja katse läbiviimise täielik kirjeldus.
|
|
|
|
Katsetulemused:
|
—
|
täiskasvanud usside suremus kaks nädalat pärast kontsentratsioonivahemiku leidmise katse alustamist ja noorloomade arv katse lõpus;
|
|
—
|
täiskasvanud usside suremus kolm nädalat pärast lõpliku katse alustamist ja täielikud andmed noorloomade kohta katse lõpus;
|
|
—
|
katseorganismidel täheldatavad mis tahes füüsilised või patoloogilised sümptomid ja käitumuslikud muutused;
|
|
—
|
vastavalt vajadusele LC50, sigivuse puhul määratud täheldatavat toimet mitteavaldav kontsentratsioon ja/või ECx (nt EC50, EC10) koos usaldusvahemikuga ning graafik asjaomase näitaja arvutamiseks kasutatud lähendatud kõveraga, samuti kõik tulemuste tõlgendamist hõlbustavad andmed ja tähelepanekud.
|
|
Kõrvalekalded käesolevast katsemeetodist ja kõik katse ajal täheldatavad ebatavalised ilmingud.
|
KIRJANDUS
|
(1)
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen – Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke, J., ja Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 lk.
|
|
(3)
|
Westheide, W., ja Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results. Väljaandes: Modern Ecology: Basic and Applied Aspects. Toim. Esser, G., ja Overdieck, D., lk 497–508. Elsevier, Amsterdam.
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R., ja Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 lk.
|
|
(5)
|
Käesoleva lisa peatükk C.8 „Toksilisus vihmaussidele”.
|
|
(6)
|
Rahvusvaheline Standardiorganisatsioon (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using artificial soil substrate, No. 11268-1. Rahvusvaheline Standardiorganisatsioon, Genf.
|
|
(7)
|
Rahvusvaheline Standardiorganisatsioon (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. Rahvusvaheline Standardiorganisatsioon, Genf.
|
|
(8)
|
Rundgren, S., ja Augustsson, A. K. (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovský, 1877). Väljaandes: Løkke, H., ja Van Gestel, C. A. M., Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, lk 73–94.
|
|
(9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23: 217–232.
|
|
(10)
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator. UWSF – Z. Umweltchem. Ökotox. 7: 246–249.
|
|
(11)
|
Dunger, W., ja Fiedler, H. J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
(12)
|
Didden, W. A. M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37: 2–29.
|
|
(13)
|
Becker, H. (1991). Bodenorganismen – Prüfungskategorien der Forschung. UWSF – Z. Umweltchem. Ökotox. 3: 19–24.
|
|
(14)
|
Römbke, J., ja Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests. Newsletter on Enchytraeidae No. 4, lk 79–96.
|
|
(15)
|
Römbke, J., Riepert, F., ja Achazi, R. (2000). Enchytraeen als Testorganismen. Väljaandes: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W., ja Eisentraeger, A. (toim.). Spektrum Verl., Heidelberg. Lk 59–81.
|
|
(16)
|
Rahvusvaheline Standardiorganisatsioon (1994). Soil Quality – Determination of pH, No. 10390. Rahvusvaheline Standardiorganisatsioon, Genf.
|
|
(17)
|
Bell, A. W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, lk 1–13.
|
|
(18)
|
Nielsen, C. O., ja Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8–9, lk 1–160.
|
|
(19)
|
Bouguenec, V., ja Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23: 9–22.
|
|
(20)
|
Korinkova, J., ja Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting. Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, lk 300–305.
|
|
(21)
|
Finney, D. J. (1971). Probit Analysis (3. väljaanne), lk 19–76. Cambridge Univ. Press.
|
|
(22)
|
Finney, D. J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
(23)
|
Hamilton, M. A., Russo, R. C., ja Thurston, R. V. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11: 714–719; parandus: Environ. Sci. Technol. 12 (1978): 417.
|
|
(24)
|
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103–117.
|
|
(25)
|
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 519–531.
|
|
(26)
|
Dunnett, C. W. (1955). A multiple comparison procedure for comparing several treatments with a control. J. Am. Stat. Assoc. 50: 1096–1121.
|
|
(27)
|
Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics 20: 482–491.
|
|
(28)
|
van der Hoeven, N. (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355–361.
|
|
(29)
|
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Stat. 6: 65–70.
|
|
(30)
|
Jonckheere, A. R. (1954). A Distribution-free k-Sample Test Against Ordered Alternatives. Biometrika 41: 133–145.
|
|
(31)
|
Terpstra, T. J. (1952). The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking. Indagat. Math. 14: 327–333.
|
|
(32)
|
Shirley, E. A. (1979). The comparison of treatment to control group means in toxicology studies. Appl. Stat. 28: 144–151.
|
|
(33)
|
Williams, D. A. (1986). A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control. Biometrics 42: 183–186.
|
|
(34)
|
Sokal, R. R., ja Rohlf, F. J. (1981). Biometry. The Principles and Practice of Statistics in Biological Research. 2. väljaanne. W. H. Freeman and Company, New York.
|
|
(35)
|
Christensen, E. R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Res. 18: 213–221.
|
|
(36)
|
Van Ewijk, P. H., ja Hoekstra, J. A. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox. Environ. Safe. 25: 25–32.
|
1. liide
Mõisted
Käesoleva katsemeetodi puhul kasutatakse järgmisi mõisteid.
Kemikaal
– aine või segu.
ECx
(kontsentratsioon, mille puhul mõju ulatus on x %)– kontsentratsioon, mille juures teatava kokkupuuteperioodi vältel katseorganismidele avalduva mõju ulatus on x % kontrollrühma asjaomase näitaja väärtusest. Käesoleva katsemeetodi puhul väljendatakse sellist kontsentratsiooni uuritava kemikaali massina katsemulla kuivmassi ühiku kohta.
LC0
(kontsentratsioon, mille puhul surmav mõju puudub)– kontsentratsioon, mille juures uuritav kemikaal ei surma teatava aja jooksul ühtki kemikaaliga kokku puutunud katseorganismi. Käesoleva katsemeetodi puhul väljendatakse sellist kontsentratsiooni uuritava kemikaali massina katsemulla kuivmassi ühiku kohta.
LC50
(kontsentratsioon, mille puhul sureb pool katseorganismidest)– kontsentratsioon, mille juures uuritav kemikaal surmab teatava aja jooksul 50 % kemikaaliga kokku puutunud katseorganismidest. Käesoleva katsemeetodi puhul väljendatakse LC50 uuritava kemikaali massina katsemulla kuivmassi ühiku kohta.
LC100
(kontsentratsioon, mille puhul surevad kõik katseorganismid)– kontsentratsioon, mille juures uuritav kemikaal surmab teatava aja jooksul 100 % kemikaaliga kokku puutunud katseorganismidest. Käesoleva katsemeetodi puhul väljendatakse LC100 uuritava kemikaali massina katsemulla kuivmassi ühiku kohta.
Vähim täheldatavat toimet avaldav kontsentratsioon (LOEC)
– uuritava kemikaali väikseim kontsentratsioon, mille juures täheldatakse statistiliselt olulist (p < 0,05) mõju. Käesoleva katsemeetodi puhul väljendatakse sellist kontsentratsiooni uuritava kemikaali massina katsemulla kuivmassi ühiku kohta. Kõikidel sellisest kontsentratsioonist suurematel katsekontsentratsioonidel peaks üldjuhul täheldatama kontrollrühmaga võrreldes statistiliselt olulist mõju. Kõnealuse kontsentratsiooni määramisega seotud mis tahes kõrvalekaldeid eespool esitatud määratlusest tuleb katseprotokollis põhjendada.
Täheldatavat toimet mitteavaldav kontsentratsioon (NOEC)
– uuritava kemikaali kontsentratsioon, mille juures ei täheldata mingit mõju ja mis on kasutatud kontsentratsioonide jadas vahetult allpool vähimat täheldatavat toimet avaldavat kontsentratsiooni. Käesoleva katsemeetodi puhul ei täheldata sellisel kontsentratsioonil teatava kokkupuuteperioodi vältel kontrollrühmaga võrreldes statistiliselt olulist (p < 0,05) mõju.
Sigivuse määr
– katseperioodi jooksul sigitatud noorloomade keskmine arv teatava arvu täiskasvanud usside kohta.
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil.
2. liide
Maksimaalse veemahutavuse määramine
Kunstliku mulla veemahutavuse määramine
On leitud, et veemahutavuse määramiseks sobib järgmine meetod. Seda kirjeldatakse standardi ISO/DIS 11268-2 C lisas.
Sobiva seadme (puuriga toru vmt) abil kogutakse kindlaksmääratud kogus (nt 5 g) katsemulda. Toru alumine ots kaetakse filterpaberi tükiga ja pärast veega täitmist pannakse toru resti peale veevanni. Toru tuleks vette lasta vähehaaval, kuni veetase on mullapinnast kõrgemal. Seejärel tuleks toru umbes kolmeks tunniks vette jätta. Kuna muld ei suuda hoida kogu kapillaaridesse absorbeerunud vett, tuleks mullaproovil lasta kahe tunni vältel nõrguda, asetades toru väga märja peeneks jahvatatud kvartsliiva kihile, mis paikneb kuivamise ärahoidmiseks suletud nõus. Seejärel tuleks proov kaaluda ning kuivatada seda 105 °C juures, kuni selle kaal enam ei muutu. Veemahutavuse saab seejärel arvutada järgmise valemiga:
 , ,
kus:
|
|
S on veega küllastunud substraadi mass + toru mass + filterpaberi mass;
|
|
|
T on tühimass (toru mass + filterpaberi mass);
|
|
|
D on substraadi kuivmass.
|
VIIDE
Rahvusvaheline Standardiorganisatsioon (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. Rahvusvaheline Standardiorganisatsioon, Genf.
3. liide
Mulla pH määramine
Allpool kirjeldatud meetod mullaproovi pH määramiseks põhineb standardis ISO 10390 („Soil Quality – Determination of pH”) esitatud kirjeldusel.
Kindlaksmääratud mullakogusel lastakse toatemperatuuril vähemalt 12 tundi kuivada. Seejärel valmistatakse vähemalt 5 grammi mulda sisaldav suspensioon, kasutades 1 M analüütilise puhtusastmega kaaliumkloriidi (KCl) või 0,01 M analüütilise puhtusastmega kaltsiumkloriidi (CaCl2) lahust, mille maht on mulla mahust viis korda suurem. Suspensiooni loksutatakse põhjalikult viis minutit. Pärast loksutamist lastakse suspensioonil settida vähemalt kaks tundi, kuid mitte kauem kui 24 tundi. Seejärel mõõdetakse vedela faasi pH väärtus pH-meetriga, mis kaliibritakse enne iga mõõtmist sobiva rea puhverlahustega (nt pH väärtustel 4,0 ja 7,0).
VIIDE
Rahvusvaheline Standardiorganisatsioon (1994). Soil Quality – Determination of pH, No. 10390. Rahvusvaheline Standardiorganisatsioon, Genf.
4. liide
Perekonna Enchytraeus liikide kultiveerimistingimused
Liigi Enchytraeus albidus (ja muude perekonna Enchytraeus liikide) valgeliimukaid võib kasvatada suurtes plastkarpides (nt mõõtmetega 30 × 60 × 10 cm), mis on täidetud mullaseguga, milles kunstliku mulla ja loodusliku saastumata aiamulla vahekord on 1:1. Tuleks hoiduda komposti kasutamisest, kuna see võib sisaldada mürgiseid kemikaale, näiteks raskmetalle. Enne mulla kasutamist tuleks sellest eemaldada fauna (nt sügavkülmutamise teel). Võib kasutada ka üksnes kunstlikust mullast koosnevat substraati, kuid sel juhul võib sigivuse määr olla väiksem kui segatud mullasubstraadi puhul. Kultiveerimiseks kasutatava substraadi pH peaks olema 6,0 ± 0,5.
Kultuuri hoitakse pimedas temperatuuril 15 kuni 20 °C ± 2 °C. Tuleks hoiduda kasutamast kõrgemat temperatuuri kui 23 °C. Mulda tuleks hoida niiskena, kuid see ei tohiks olla märg. Muld on sobiva niiskusesisaldusega, kui mulda õrnalt peos pigistades ilmuvad sõrmede vahele väikesed veetilgad. Hapnikuvaeguse ärahoidmiseks tuleb tagada, et kultiveerimisnõu kaas võimaldaks piisavat gaasivahetust atmosfääriga. Mulda tuleks aereerituse tagamiseks igal nädalal hoolikalt kobestada.
Usse võib sööta valtsitud kaeraga. Kaera tuleks hoida suletud nõudes ning enne kasutamist tuleks seda autoklaavida või kuumutada, et takistada saastumist aidalestadega (näiteks Glycyphagus sp., Astigmata, Acarina) või röövlestadega (näiteks Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina). Pärast kuumtöötlust tuleks sööt jahvatada, et seda oleks lihtne mullapinnale puistata. Aeg-ajalt võib peale valtsitud kaera lisada ka vitamiine, piima ja tursamaksaõli. Muu sobiv sööt on pagaripärm ja kalasööt TetraMin.
Usse söödetakse umbes kaks korda nädalas. Sobiv kogus valtsitud kaera puistatakse mullapinnale või segatakse ettevaatlikult substraadiga mulla aereerituse tagamiseks tehtava kobestamise käigus. Lisatava sööda absoluutkogus sõltub substraadis olevate usside arvust. Üldiselt tuleks söödakogust suurendada, kui kogu lisatav sööt tarbitakse ära ühe ööpäeva jooksul. Kui aga järgmise söötmise ajal (üks nädal hiljem) on mullapinnal veel sööta alles, tuleks söödakogust vähendada. Seentega saastunud sööt tuleks kõrvaldada ja uuega asendada. Kolme kuu möödudes tuleks ussid viia üle värskelt valmistatud substraati.
Kultiveerimistingimused loetakse rahuldavaks, kui: a) ussid ei püüa mullasubstraadist lahkuda, b) nad liiguvad mullas kiiresti, c) nende nahapind on läikiv ja sellele ei kleepu mullaosakesed, d) nad on enam-vähem valkja värvusega, e) neid leidub kultuurides mitmes eri vanuserühmas ning f) nad sigivad pidevalt.
5. liide
Katse käik muude perekonna Enchytraeus liikide puhul
Liigi valimine
E. albidus'e asemel võib kasutada mõnda muud liiki, kuid sel juhul tuleks katse käiku ja nõuetekohasuse kriteeriume vastavalt kohandada. Kuna paljud perekonna Enchytraeus liigid on hõlpsalt kättesaadavad ja neid on võimalik laboris rahuldavalt kasvatada, siis on E. albidus'e asemel mõne muu liigi valimisel kõige olulisem kriteerium ökoloogiline olulisus ja lisaks sellele ka võrreldav tundlikkus. Katses kasutatava liigi muutmisel võivad olla ka ametlikud põhjused. Näiteks on riikides, kus E. albidus't ei esine ja kuhu seda ei saa importida (nt karantiiniga seotud piirangute tõttu), vaja kasutada mõnda muud perekonna Enchytraeus liiki.
Sobivate alternatiivsete liikide näited
|
—
|
Enchytraeus crypticus (Westheide & Graefe, 1992): seda liiki on viimastel aastatel ökotoksikoloogilistes uuringutes sageli kasutatud, kuna selle esindajaid on lihtne kasvatada ja katsetes kasutada. Selle liigi ussid on siiski väikesed ja seepärast on nende käitlemine E. albidus'ega võrreldes keerukam (eriti värvimismeetodi kasutamisele eelnevates etappides). E. crypticus'e leidumist looduses ei ole veel kindlalt tuvastatud, seda on kirjeldatud üksnes vihmausside kultuurides. Seega ei ole liigi ökoloogilised vajadused teada.
|
|
—
|
Enchytraeus buchholzi (Vejdovský, 1879): selle nimetusega tähistatakse tõenäoliselt rühma lähedasi liike, kelle morfoloogiline eristamine on raske. Selle rühma esindajaid ei soovitata katsetes kasutada enne, kui kasutatavaid isendeid on võimalik määrata liigi tasandil. E. buchholzi't esineb tavaliselt niitudel ja häiritud kooslusega aladel, näiteks teepervedel.
|
|
—
|
Enchytraeus luxuriosus: see liik oli algselt tuntud kui E. minutus, kuid seda on kirjeldatud alles hiljuti (1). Esmakordselt leidis selle liigi esindajaid U. Graefe (Hamburg) ühelt St. Peter-Ordingi (Schleswig-Holstein, Saksamaa) lähedal asuvalt niidult. E. luxuriosus on umbes poole väiksem kui E. albidus, kuid suurem kui muud siin kirjeldatud liigid; sel põhjusel võib sellest kujuneda hea alternatiiv E. albidus'ele.
|
|
—
|
Enchytraeus bulbosus (Nielsen & Christensen, 1963): siiani on teatatud selle liigi esinemisest Saksamaa ja Hispaania mineraalmuldades, kus see on levinud, kuid tavaliselt mitte väga arvukas. Selle perekonna teiste väikeste liikidega võrreldes on E. bulbosus suhteliselt hõlpsalt määratav. Selle liigi käitumise kohta laborikatsetes ja tundlikkuse kohta kemikaalide suhtes andmed puuduvad. On siiski leitud, et seda liiki on kerge kultiveerida (E. Belotti, isiklik suhtlus).
|
Kasvatustingimused
Perekonna Enchytraeus kõiki eespool nimetatud liike saab kultiveerida samades substraatides, mida kasutatakse E. albidus'e puhul. Kuna kõnealused liigid on väiksemad, võib kasutada väiksemaid kultiveerimisnõusid, ning ehkki kasutatav sööt võib olla sama, tuleb sööda kogust kohandada. Nende liikide elutsükkel on lühem kui E. albidus'el ja sööta tuleks lisada sagedamini.
Katsetingimused
Katsetingimused on üldiselt samad kui E. albidus'e puhul, välja arvatud järgmised aspektid:
|
—
|
katsenõud võivad (kuid ei pruugi) olla väiksemad;
|
|
—
|
sigivuskatse kestus võib (kuid ei pruugi) olla lühem, st kuue nädala asemel neli nädalat; kontsentratsioonivahemiku leidmise katse kestust ei tohiks aga muuta;
|
|
—
|
noorloomade väiksusest tulenevalt soovitatakse tungivalt kasutada loendamiseks värvimismeetodit;
|
|
—
|
katse nõuetekohasuse kriteeriumi, milles käsitletakse kontrollrühmas täheldatavat noorloomade arvu katsenõu kohta, tuleks muuta nii, et kõnealune nõutav arv oleks 50.
|
VIIDE
|
(1)
|
Schmelz, R. M., ja Collado, R. (1999). Enchytraeus luxuriosus sp. nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57: 93–100.
|
6. liide
Ekstraheerimismeetodite üksikasjalik kirjeldus
Bengali punasega värvimine
See meetod töötati algselt välja limnoloogias (1) ja ettepaneku selle kasutuselevõtuks valgeliimuka noorloomade loendamiseks valgeliimuklaste sigivuse katses tegi esmakordselt W. de Coen (Ghenti Ülikool, Belgia). Sellest sõltumatult töötati Bilthovenis asuvas Hollandi Riiklikus Rahvatervise ja Keskkonnainstituudis (RIVM) välja meetodi modifikatsioon (bengali punase segamine formaldehüüdiga etanooli asemel) (2, 3).
Lõpliku katse lõpus (st kuue nädala möödudes) viiakse katsenõus olev muld madalasse nõusse. Selleks sobib Bellaplasti nõu või ribilise põhjaga ilmutusvann – viimane seepärast, et ribid piiravad usside liikumist vaateväljas. Noorloomad fikseeritakse etanooliga (umbes 5 ml paralleelnõu kohta). Seejärel lisatakse nõudesse vett, et tekiks 1–2 cm sügavune veekiht. Lisatakse paar tilka (200–300 μl) bengali punast (1 % lahus etanoolis) (võib kasutada ka 0,5 % eosiini) ja segatakse hoolikalt. 12 tunni pärast peaksid ussid olema värvunud punakaks ja neid peaks saama hõlpsalt loendada, kuna nad lebavad substraadi pinnal. Teise võimalusena võib substraadi ja alkoholi segu enne usside loendamist läbi sõela lasta (sõela ava läbimõõt 0,250 mm). Selle tulemusena uhutakse kaoliniit, turvas ja osa liiva välja ning punakaks värvunud usse on lihtsam näha ja loendada. Loendamist hõlbustab ka valgustusega suurendusklaasi kasutamine (klaasi mõõtmed vähemalt 100 × 75 mm ja suurendusvõime 2–3 korda).
Kõnealuse värvimismeetodiga väheneb loendamisaeg mõnele minutile nõu kohta ning ühel inimesel peaks olema võimalik lõpetada kõikide ühest katsest pärit nõude analüüs maksimaalselt kahe päeva jooksul.
Vedelikuga ekstraheerimine
Vedelikuga ekstraheerimist tuleks alustada kohe pärast katse lõppemist. Igast katsenõust pärit muld tõstetakse plastsõelale, mille ava läbimõõt on umbes 1 mm. Sõelad pannakse plastkaussidesse rippuma nii, et sõel ei puuduta kausi põhja. Kausid täidetakse ettevaatlikult veega, kuni sõeltel olevad proovid jäävad täielikult vee alla. Et saada kätte üle 90 % mullas olevatest ussidest, tuleks neid ekstraheerida 3 päeva temperatuuril 20 ± 2 °C. Ekstraheerimisperioodi lõpus sõelad eemaldatakse ja vesi kallatakse aeglaselt ära, jättes alles vaid väikese koguse vett ning jälgides hoolikalt, et kausside põhjas olev sete jääks paigale. Seejärel loksutatakse plastkausse ettevaatlikult, et sete vees suspendeerida. Vesi viiakse Petri tassi ning pärast mullaosakeste settimist saab valgeliimukad tuvastada, pehmete teraspintsettidega eemaldada ja stereomikroskoobi abil loendada.
Vedelikupinnale toomine
Vedelikupinnale toomisel põhinevat meetodit on kirjeldanud oma märkuses R. Kuperman (4). Pärast katsenõu sisu fikseerimist etanooliga ujutatakse muld üle Ludoxiga (AM-30, kolloidse ränidioksiidi 30 massiprotsendiline suspensioon vees), nii et vedeliku tase jääb mullapinnast 10–15 mm kõrgemale. Pärast mulla põhjalikku segamist vedelikuga 2–3 minuti vältel saab pinnale kerkinud noored ussid hõlpsalt ära loendada.
VIITED
|
(1)
|
Korinkova, J., ja Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting. Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, lk 300–305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R., ja Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 lk.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R. P. M., ja Dirven-Van Breemen, E. M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Environ. Safe. 38: 108–121.
|
|
(4)
|
Phillips, C. T., Checkai, R. T., ja Kuperman, R. G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, USA. Abstract Book No. PMP069, lk 157.
|
7. liide
Andmete statistilise analüüsi ülevaade (täheldatavat toimet mitteavaldava kontsentratsiooni määramine)
C.33. VIHMAUSSIDE (EISENIA FETIDA / EISENIA ANDREI) SIGIVUSE KATSE
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 222 (2004). Meetod on ette nähtud selleks, et hinnata pinnases esinevate kemikaalide mõju liikidesse Eisenia fetida (Savigny, 1826) ja Eisenia andrei (Andre, 1963) kuuluvate vihmausside järglaste arvule (ja muudele uuritavatele subletaalsetele näitajatele) (1, 2). See katsemeetod on võrdlusuuringuga valideeritud (3). On olemas katsemeetod vihmaussidele avalduva ägeda mürgisuse hindamiseks (4). Samuti on avaldatud mitmed rahvusvahelised ja siseriiklikud suunised vihmaussidele avalduva ägeda ja kroonilise mürgisuse katsete kohta (5, 6, 7, 8).
|
|
2.
|
Liike Eisenia fetida ja Eisenia andrei käsitatakse mullafauna ja eelkõige vihmausside esindajatena. Taustteave vihmausside ökoloogia kohta ja nende kasutamise kohta ökotoksikoloogilistes katsetes on kättesaadav allikates 7, 9, 10, 11 ja 12.
|
KATSE PÕHIMÕTE
|
3.
|
Täiskasvanud ussid viiakse kokkupuutesse uuritava kemikaaliga, mis on eri kontsentratsioonides kas mullaga segatud või pestitsiidide puhul mulda viidud või mullapinnale kantud meetodil, mis on kooskõlas asjaomase kemikaali kasutusviisiga. Kemikaaliga töötlemise meetod sõltub katse eesmärgist. Katses kasutatav kontsentratsioonivahemik valitakse nii, et see hõlmaks kontsentratsioone, mille puhul kemikaal avaldab kaheksa nädala vältel nii subletaalset kui ka surmavat mõju. Täiskasvanud usside suremust ja mõju nende kasvule hinnatakse pärast 4 nädala pikkust kokkupuuteperioodi. Seejärel eemaldatakse täiskasvanud isendid mullast ja pärast veel 4 nädala möödumist tehakse kindlaks mõju sigivusele, loendades mullas leiduvad järglased. Uuritava kemikaaliga kokku puutunud usside sigivust võrreldakse sigivusega kontrollrühma(de)s, et teha kindlaks: i) täheldatavat toimet mitteavaldav kontsentratsioon ja/või ii) ECx (nt EC10, EC50), kasutades regressioonimudelit sellise hinnangulise kontsentratsiooni leidmiseks, mille puhul sigivus väheneb x % võrra. Katses kasutatav kontsentratsioonivahemik peaks hõlmama ECx (nt EC10, EC50) väärtust, nii et ECx leitakse interpoleerimise, mitte ekstrapoleerimise teel (mõisted on määratletud 1. liites).
|
TEAVE UURITAVA KEMIKAALI KOHTA
|
4.
|
Uuritava kemikaali kohta peaks sobivate katsetingimuste väljatöötamise hõlbustamiseks olema teada järgmised andmed:
|
—
|
võimaluse korral teave kemikaali säilivuse ja omaduste kohta keskkonnas (nt fotolüüsi ja hüdrolüüsi kiirus, kui see on asjaomase töötlemisviisi puhul asjakohane).
|
|
|
5.
|
Käesolevat katsemeetodit kasutatakse kõikide kemikaalide puhul, olenemata nende lahustuvusest vees. Meetodit ei saa kasutada lenduvate kemikaalide puhul, mille Henry konstant või jaotuskoefitsient süsteemis õhk/vesi on suurem kui üks, ega kemikaalide puhul, mille aururõhk 25 °C juures on suurem kui 0,0133 Pa.
|
|
6.
|
Käesolevas katsemeetodis ei võeta arvesse uuritava kemikaali võimalikku lagunemist katse kestel. Sellest tulenevalt ei saa eeldada, et kokkupuutekontsentratsioon jääb kogu katse vältel algsele tasemele. Sellisel juhul on soovitatav teha uuritava kemikaali keemiline analüüs katse alguses ja lõpus.
|
VÕRDLUSKEMIKAAL
|
7.
|
Tuleb määrata võrdluskemikaali ECx ja/või täheldatavat toimet mitteavaldav kontsentratsioon, et tagada laboris kasutatavate katsetingimuste sobivus ja veenduda, et katseorganismide reaktsioon ei muutu aja jooksul statistiliselt olulisel määral. Võrdluskemikaaliga kontrollimist soovitatakse teha vähemalt kord aastas või kui katseid tehakse harvem, siis uuritava kemikaali mürgisuse määramisega samaaegselt. Sobivad võrdluskemikaalid, mille mõju sigivusele on tõendatud, on karbendasiim ja benomüül (3). Oluline mõju peaks olema täheldatav vahemikus a) 1–5 mg toimeainet kuivmassi kilogrammi kohta või b) 250–500 g/ha ehk 25–50 mg/m2. Kui katseseerias kasutatakse positiivse kontrollina mürgist võrdluskemikaali, kasutatakse ühte kontsentratsiooni ning asjaomaste paralleelnõude arv peaks olema sama kui kemikaalita kontrollrühmas.
|
KATSE NÕUETEKOHASUS
|
8.
|
Katsetulemus loetakse nõuetekohaseks, kui kontrollrühmas on täidetud järgmised kriteeriumid:
|
—
|
sigitatud noorloomade arv igas paralleelnõus, mis sisaldab 10 täiskasvanud isendit, on katse lõpuks ≥ 30;
|
|
—
|
sigivuse variatsioonikordaja on ≤ 30 %;
|
|
—
|
täiskasvanud usside suremus esimese 4 katsenädala jooksul on ≤ 10 %.
|
Kui katse ei vasta eespool nimetatud nõuetekohasuse kriteeriumidele, tuleks see lõpetada, välja arvatud juhul, kui katse jätkamist on võimalik põhjendada. Selline põhjendus tuleks esitada katseprotokollis.
|
KATSEMEETODI KIRJELDUS
Seadmed
|
9.
|
Tuleks kasutada klaasist või muust keemiliselt inertsest materjalist katsenõusid mahuga umbes 1–2 liitrit. Nõude põhjapindala peaks olema umbes 200 cm2, nii et 500–600 grammise kuivmassiga substraadi lisamisel saavutatav niiske substraadi sügavus on umbes 5–6 cm. Nõu kaas peaks olema sellise ehitusega, mis võimaldab gaasivahetust substraadi ja atmosfääri vahel ning valguse juurdepääsu (nt läbipaistev augustatud kaas), kuid takistab samal ajal usside põgenemist. Kui katsesubstraadi kogus on oluliselt suurem kui 500–600 g katsenõu kohta, tuleks usside arvu samavõrra suurendada.
|
|
10.
|
On vaja tavapäraseid laboriseadmeid, täpsemalt järgmist:
|
—
|
pH-meeter ja fotomeeter;
|
|
—
|
sobivad temperatuuri reguleerimise seadmed;
|
|
—
|
sobivad niiskuse reguleerimise seadmed (ei ole hädavajalikud, kui kokkupuutenõu on kaanega);
|
|
—
|
inkubaator või väike kliimaseadmega ruum;
|
|
—
|
pintsetid, konksud või aasad;
|
|
Kunstliku mulla valmistamine
|
11.
|
Käesoleva katsemeetodi puhul kasutatakse kunstlikku mulda (5, 7), mille koostis on järgmine (kuivmassi põhjal pärast kuumutamist 105 °C juures, kuni mass enam ei muutu):
|
—
|
10 % turbasamblaturvast (pH võimalikult lähedal väärtusele 5,5–6,0, nähtavate taimejäänusteta, peeneks jahvatatud, teadaoleva niiskusesisalduseni kuivatatud);
|
|
—
|
20 % kaoliinsavi (soovitatav kaoliniidisisaldus üle 30 %);
|
|
—
|
0,3–1,0 % kaltsiumkarbonaati (CaCO3, pulbristatud, analüütilise puhtusastmega), et saavutada pH algväärtus 6,0 ± 0,5;
|
|
—
|
70 % kvartsliiva (sõltuvalt vajalikust CaCO3 kogusest), mis on õhu käes kuivatatud ja koosneb peamiselt peenest liivast, millest üle 50 % moodustavad osakesed suurusega 50–200 mikromeetrit.
|
Märkus 1: vajalik CaCO3 kogus sõltub mullasubstraadi koostisosadest, sealhulgas söödast, ja tuleks mulla osaproovide mõõtmise teel kindlaks teha vahetult enne katset. pH-d kokkusegatud proovis mõõdetakse 1 M kaaliumkloriidi (KCl) või 0,01 M kaltsiumkloriidi (CaCl2) lahuses (13).
Märkus 2: kunstliku mulla orgaanilise süsiniku sisaldust võib vähendada, vähendades näiteks turbasisaldust 4–5 protsendini ja suurendades vastavalt liivasisaldust. Orgaanilise süsiniku sisalduse sellise vähendamise tulemusena võib väheneda mulla (orgaanilise süsiniku) võime uuritavat kemikaali adsorbeerida ning kemikaali saadavus ussidele võib suureneda. On tõendatud, et Eisenia fetida puhul on sigivust käsitlevad nõuetekohasuse kriteeriumid täidetavad, kui katse tehakse põllumullas, milles orgaanilise süsiniku sisaldus on väiksem (näiteks 2,7 %) (14), ning seniste kogemuste põhjal on võimalik seda saavutada ka kunstlikus mullas, mille turbasisaldus on 5 %. Seepärast ei ole enne sellise mulla kasutamist lõplikus katses vaja tõendada, et kõnealuse kunstliku mulla puhul on katse nõuetekohasuse kriteeriumid täidetavad, välja arvatud juhul, kui turbasisaldust vähendatakse eespool osutatust rohkem.
Märkus 3: kui tehakse lisakatseid (nt kõrgema tasandi katseid) loodusliku mullaga, tuleks tõendada ka sellise mulla sobivust ja katse nõuetekohasuse kriteeriumide täidetavust.
|
|
12.
|
Mulla kuivad koostisosad segatakse põhjalikult (nt suure mahutavusega laborisegistis) hästi ventileeritavas kohas. Enne katse alustamist niisutatakse kuiva kunstlikku mulda piisava koguse deioniseeritud vee lisamise teel, et saavutada veesisaldus, mis on umbes poole väiksem kui lõplik veesisaldus, mis jääb vahemikku 40–60 % (50 ± 10 %) maksimaalsest veemahutavusest (vee suurim võimalik sisaldus osakaaluna kuivmassist). Nii saadakse substraat, milles ei täheldata vaba sidumata vett, kui seda peos pigistada. Kunstliku mulla maksimaalne veemahutavus määratakse vastavalt 2. liites, standardis ISO 11274 (15) või sellega samaväärses ELi standardis kirjeldatud meetodile.
|
|
13.
|
Kui uuritav kemikaal kantakse mullapinnale või segatakse mullaga ilma veeta, võib lisada kunstlikule mullale ülejäänud koguse vett mulla valmistamise ajal. Kui uuritava kemikaali segamisel mullaga kasutatakse teatud koguses vett, võib ülejäänud vee lisada koos uuritava kemikaaliga (vt punkt 19).
|
|
14.
|
Mulla niiskusesisaldus määratakse katse alguses ja lõpus vastavalt standardile ISO 11465 (16) või sellega samaväärsele ELi standardile ning mulla pH vastavalt 3. liitele, standardile ISO 10390 (13) või sellega samaväärsele ELi standardile. Kõnealuseks määramiseks tuleks kasutada kontrollmulla proovi ja igale katsekontsentratsioonile vastavat mullaproovi. Kui katses kasutatakse happelist või aluselist kemikaali, ei tohiks mulla pH-d muuta. Niiskusesisaldust tuleks jälgida kogu katse vältel, kaaludes nõusid korrapäraselt (vt punktid 26 ja 30).
|
Katseloomade valimine ja ettevalmistamine
|
15.
|
Katses kasutatav liik on Eisenia fetida või Eisenia andrei (1, 2). Katse alustamiseks on vaja vööga täiskasvanud usse vanuses kaks kuud kuni üks aasta. Ussid tuleks valida sünkroonitud kultuurist, kus vanuseline struktuur on suhteliselt homogeenne (4. liide). Ühe katserühma isendite vanusevahe ei tohiks olla suurem kui 4 nädalat.
|
|
16.
|
Valitud ussidel tuleks lasta vähemalt üks ööpäev kohaneda katses kasutatavaga sama tüüpi kunstlikus mullasubstraadis. Selle aja vältel tuleks ussidele anda sama sööta, mida kasutatakse katses (vt punktid 31–33).
|
|
17.
|
Katse alguses tuleks kümnest ussist koosnevad rühmad ükshaaval ära kaaluda ja juhuslikkuse alusel katsenõudesse jaotada. Enne kaalumist pestakse usse deioniseeritud veega ja liigse vee eemaldamiseks asetatakse ussid lühikeseks ajaks filterpaberile. Iga ussi elusmass peaks jääma vahemikku 250–600 mg.
|
Katsekontsentratsiooniga segude valmistamine
|
18.
|
Uuritava kemikaaliga töötlemiseks võib kasutada kahte meetodit: uuritava kemikaali segamine mullaga (vt punktid 19–21) või kemikaali kandmine mullapinnale (vt punktid 22–24). Sobiva meetodi valimisel lähtutakse katse eesmärgist. Üldjuhul soovitatakse uuritava kemikaali segamist mullaga. Siiski võib olla vaja kasutada töötlemismeetodit, mis on kooskõlas põllumajandustavaga (nt vedelal kujul pihustamine või pestitsiidi erivormide, näiteks graanulite või seemnepuhtimisvahendite kasutamine). Lahustid, mis hõlbustavad mulla töötlemist uuritava kemikaaliga, tuleks valida lähtuvalt nende vähesest mürgisusest vihmaussidele ning katseplaani tuleb lisada asjakohane lahustiga kontroll (vt punkt 27).
|
Uuritava kemikaali segamine mullaga
Vees lahustuv uuritav kemikaal
|
19.
|
Uuritava kemikaali lahus valmistatakse vahetult enne katse algust deioniseeritud vees sellises koguses, millest piisab kõikidele ühe katsekontsentratsiooni puhul kasutatavatele paralleelkultuuridele. Katselahuse valmistamise hõlbustamiseks võib olla vaja kaaslahustit. On otstarbekas valmistada selline kogus lahust, mis on vajalik lõpliku niiskusesisalduse (40–60 % maksimaalsest veemahutavusest) saavutamiseks. Lahus segatakse põhjalikult mullasubstraadiga enne mulla viimist katsenõusse.
|
Vees lahustumatu uuritav kemikaal
|
20.
|
Uuritav kemikaal lahustatakse väikeses koguses sobivas orgaanilises lahustis (nt atsetoon) ning pihustatakse seejärel väikesele kogusele peenele kvartsliivale või segatakse sellega. Lahusti kõrvaldatakse vähemalt mõni minut kestva tõmbekapis aurustamise teel. Seejärel segatakse töödeldud liiv eelniisutatud kunstliku mullaga põhjalikult. Lisatakse vajalik kogus deioniseeritud vett, et saavutada lõplik niiskusesisaldus 40–60 % maksimaalsest veemahutavusest, ja segatakse see mullaga. Seejärel on muld katsenõudesse viimiseks valmis. Tuleks arvestada, et mõni lahusti võib olla vihmaussidele mürgine.
|
Vees ja orgaanilistes lahustites lahustumatu uuritav kemikaal
|
21.
|
Valmistatakse segu, mis sisaldab 10 g peeneks jahvatatud tööstuslikku kvartsliiva ja sellises koguses uuritavat kemikaali, mis on vajalik katsekontsentratsiooni saavutamiseks mullas. Seejärel segatakse kõnealune segu eelniisutatud kunstliku mullaga põhjalikult. Lisatakse vajalik kogus deioniseeritud vett, et saavutada lõplik niiskusesisaldus 40–60 % maksimaalsest veemahutavusest, ja segatakse see mullaga. Seejärel on muld katsenõudesse viimiseks valmis.
|
Kemikaali kandmine mullapinnale
|
22.
|
Mulda töödeldakse pärast usside lisamist. Esmalt täidetakse katsenõud niisutatud mullasubstraadiga ja eelnevalt kaalutud ussid asetatakse mullapinnale. Terved ussid kaevuvad tavaliselt kohe substraati ning seepärast loetakse kõik ussid, kes on 15 minuti pärast veel mullapinnal, kahjustatuks ja need tuleb asendada. Usside väljavahetamisel tuleks asendatavad ja uued ussid kaaluda, et kemikaaliga kokku puutuvate usside rühma summaarne eluskaal ja usse sisaldava nõu üldkaal katse alguses oleks teada.
|
|
23.
|
Lisatakse uuritav kemikaal. Kemikaali ei tohiks lisada mullale usside lisamisele järgneva poole tunni jooksul (või kui usse leidub mullapinnal), et ei toimuks otsest nahakaudset kokkupuudet uuritava kemikaaliga. Kui uuritav kemikaal on pestitsiid, võib olla asjakohane kanda see mullapinnale pihustamise teel. Uuritav kemikaal tuleks mullapinnale kanda võimalikult ühtlaselt, kasutades sobivat laboratoorset pihustusseadet, et jäljendada kemikaali pihustamist välitingimustes. Enne kemikaaliga töötlemist tuleks katsenõu kaas eemaldada ja asendada vooderdisega, mis kaitseb nõu seinu pritsmete eest. Sellise vooderdise võib teha katsenõust, mille põhi on eemaldatud. Kemikaaliga töötlemine peaks toimuma temperatuuril 20 ± 2 °C ning vesilahuste, -emulsioonide ja -dispersioonide puhul peaks töötlemisel kasutatava vee kogus olema 600–800 μl/m2. Õige koguse tagamiseks tuleks kasutada sobivat kaliibrimismeetodit. Erivormid, näiteks graanulid või seemnepuhtimisvahendid tuleks mullapinnale kanda viisil, mis on kooskõlas nende põllumajandusliku kasutusviisiga.
|
|
24.
|
Katsenõud tuleks jätta üheks tunniks kaaneta, et lasta uuritava kemikaaliga töötlemisel kasutatavatel lenduvatel lahustitel aurustuda. Tuleks jälgida, et selle aja jooksul ei lahkuks ükski uss katsenõust.
|
KATSE KÄIK
Katse- ja kontrollrühmad
|
25.
|
Soovitatavalt lisatakse 500–600 grammise kuivmassiga kunstlikku mulda 10 vihmaussi (st 50–60 g mulda ussi kohta). Kui kasutatakse suuremat mullakogust, näiteks töötlemisel sellise pestitsiidi erivormiga nagu seemnepuhtimisvahend, tuleks selleks, et säilitada vahekorda 50–60 g mulda ussi kohta, usside arvu suurendada. Iga kontroll- ja katsenõu kohta valmistatakse ette 10 ussi. Ussid pestakse veega puhtaks, pühitakse kuivaks ja asetatakse lühikeseks ajaks kuivatuspaberile, et liigne vesi saaks ära nõrguda.
|
|
26.
|
Süstemaatiliste vigade ärahoidmiseks usside jaotamisel katsenõudesse tuleks katsepopulatsiooni homogeensuses veendumiseks kaaluda ühekaupa ära 20 ussi, kes valitakse juhuvaliku alusel populatsioonist, millest võetakse katses kasutatavad ussid. Pärast homogeensuses veendumist valitakse välja usside rühmad, kaalutakse need ja viiakse juhuslikkuse alusel katsenõudesse. Usside lisamise järel tuleks määrata iga katsenõu algkaal, et selle põhjal oleks võimalik jälgida mulla niiskusesisaldust katse vältel, nagu on kirjeldatud punktis 30. Seejärel kaetakse katsenõud punktis 9 kirjeldatud viisil ja paigutatakse katsekambrisse.
|
|
27.
|
Iga punktides 18–24 kirjeldatud meetodi puhul, mida kasutatakse uuritava kemikaaliga töötlemiseks, valmistatakse ka asjakohased kontrollkultuurid. Selleks järgitakse asjaomast kirjeldatud meetodit, ent ainsa erinevusena jäetakse uuritav kemikaal lisamata. Seega töödeldakse kontrollkultuure vajaduse korral orgaanilise lahusti, kvartsliiva või muu kandeainega, kasutades sama kontsentratsiooni või koguselist määra kui uuritava kemikaaliga kultuuride puhul. Kui uuritava kemikaali lisamiseks kasutatakse lahustit või muud kandeainet, tuleks katses kasutada veel ühte kandeaineta ja uuritava kemikaalita kontrolli, et veenduda, et kandeaine ei mõjuta katsetulemusi.
|
Katsetingimused
|
28.
|
Katsetemperatuur on 20 ± 2 °C. Katses kasutatakse kontrollitavat valgustusrežiimi (soovitatavalt 16 tundi valgust ja 8 tundi pimedust) ja katsenõude inkubeerimisalal valgustustihedust 400–800 luksi.
|
|
29.
|
Katsenõusid ei aereerita katse vältel, kuid katsenõu kaane ehitus peaks võimaldama gaasivahetust ja samal ajal piirama vee aurustumist (vt punkt 9).
|
|
30.
|
Mullasubstraadi veesisaldust katsenõudes hoitakse katse vältel konstantsena, kaaludes katsenõusid (ilma kaaneta) korrapäraselt. Vajaduse korral lisatakse veekao korvamiseks deioniseeritud vett. Veesisaldus ei tohiks katse alguses täheldatud väärtusega võrreldes kõikuda rohkem kui 10 %.
|
Söötmine
|
31.
|
Vastuvõetavaks loetakse sellise kvaliteediga sööt, mille puhul on tõendatud, et see sobib vähemalt usside kehakaalu säilitamiseks katse vältel. Kogemusest nähtub, et sobiv sööt on kaerajahu, lehmasõnnik või hobusesõnnik. Tuleks kontrollida, et lehmadele või hobustele, kellelt sõnnik pärineb, ei manustata ussidele katse ajal kahjulikku mõju avaldada võivaid ravimeid ega kemikaale, näiteks kasvu soodustavaid aineid, nematotsiide või sarnaseid veterinaarravimeid. Soovitatakse kasutada oma kogutud lehmasõnnikut, kuna kogemusest nähtub, et müügilolev aiaväetisena kasutatav lehmasõnnik võib mõjuda ussidele kahjulikult. Sõnnik tuleks enne kasutamist õhu käes kuivatada, peeneks jahvatada ja pastöriseerida.
|
|
32.
|
Iga uue söödapartii sobivas kvaliteedis veendumiseks tuleks enne selle katses kasutamist sööta sellega usside kultuuri, millega katset ei tehta. Kõnealuste usside kasv ja kookonite moodustamine ei tohiks olla pärsitud nende ussidega võrreldes, keda kasvatatakse substraadis, mis ei sisalda uuest partiist pärit sööta (tingimuste kirjeldus on esitatud katsemeetodis C.8 (4)).
|
|
33.
|
Sööta lisatakse esmakordselt üks ööpäev pärast usside lisamist ja mulla töötlemist uuritava kemikaaliga. Igasse nõusse puistatakse mullapinnale umbes 5 g sööta ja see niisutatakse deioniseeritud veega (umbes 5–6 ml nõu kohta). Edaspidi lisatakse sööta 4 nädala pikkuse katseperioodi vältel kord nädalas. Kui sööt jäetakse söömata, tuleks söödakogust seente kasvu ja hallituse ärahoidmiseks vähendada. Täiskasvanud isendid eemaldatakse mullast 28. katsepäeval. Seejärel lisatakse igasse nõusse veel 5 g sööta. Katse lõpuni jäänud 4 nädala jooksul söötmist enam ei toimu.
|
Katsekontsentratsioonide valimine
|
34.
|
Sobivate katsekontsentratsioonide valimisel on kasu varasemast teabest uuritava kemikaali mürgisuse kohta, näiteks ägeda mürgisuse hindamise katse (4) ja/või kontsentratsioonivahemiku leidmise katse tulemustest. Vajaduse korral tehakse kontsentratsioonivahemiku leidmise katse, milles kasutatakse näiteks viit uuritava kemikaali kontsentratsiooni: 0,1, 1,0, 10, 100 ja 1 000 mg mulla kuivmassi kilogrammi kohta. Iga katserühma ja kontrollrühma puhul piisab ühest nõust. Kontsentratsioonivahemiku leidmise katse kestus on kaks nädalat ja suremust hinnatakse katse lõpus.
|
Katseplaan
|
35.
|
Kuna käesoleva katsemeetodi puhul ei saa sätestada ühte kokkuvõtlikku näitajat, nähakse ette, et määratakse nii täheldatavat toimet mitteavaldav kontsentratsioon kui ka ECx. Lähitulevikus nõuavad reguleerivad asutused tõenäoliselt, et määrataks täheldatavat toimet mitteavaldav kontsentratsioon. ECx võidakse lähemal ajal statistilistel ja ökoloogilistel kaalutlustel laiemalt kasutusele võtta. Seepärast pakutakse välja kolm katseplaani, mis tuginevad valgeliimuklaste sigivuse hindamise meetodit käsitleva võrdlusuuringu põhjal esitatud soovitustele.
|
|
36.
|
Kontsentratsioonivahemiku kindlaksmääramisel tuleks meeles pidada järgmist.
|
—
|
Täheldatavat toimet mitteavaldava kontsentratsiooni määramiseks tuleks kasutada vähemalt viit/kahteteist kontsentratsiooni geomeetrilises jadas. Soovitatakse kasutada nelja paralleelnõu kontsentratsiooni kohta ja lisaks kaheksat kontrollnõu. Kontsentratsioonide jada tegur ei tohiks olla suurem kui 2,0.
|
|
—
|
ECx (nt EC10, EC50) määramiseks soovitatakse kasutada piisavat arvu eri kontsentratsioone, et saada selles kontsentratsioonivahemikus vähemalt neli statistiliselt oluliselt erinevat vastuse keskväärtust. Soovitatakse kasutada vähemalt kahte paralleelnõu kontsentratsiooni kohta ja kuut paralleelnõu kontrollrühmas. Kontsentratsioonide jada tegur võib varieeruda, st olla eeldatavas mõju avaldumise vahemikus 1,8 või väiksem ning sellest vahemikust väljaspool olevate suuremate ja väiksemate kontsentratsioonide puhul üle 1,8.
|
|
—
|
Kombineeritud lähenemisviis võimaldab määrata nii täheldatavat toimet mitteavaldava kontsentratsiooni (NOEC) kui ka ECx. Tuleks kasutada kaheksat uuritava kemikaali kontsentratsiooni geomeetrilises jadas. Soovitatakse kasutada nelja paralleelnõu kontsentratsiooni kohta ja lisaks kaheksat kontrollnõu. Kontsentratsioonide jada tegur ei tohiks olla suurem kui 1,8.
|
|
Katse kestus ja mõõtmised
|
37.
|
Elus täiskasvanud usse jälgitakse ja need loendatakse 28. katsepäeval. Registreeritakse ebaharilik käitumine (nt võimetus mulda kaevuda või liikumatult lamamine) ja muutused morfoloogias (nt lahtiste haavade esinemine). Seejärel eemaldatakse kõik täiskasvanud ussid katsenõudest ning loendatakse ja kaalutakse. Täiskasvanud isendite leidmist võib hõlbustada usse sisaldava mulla tõstmine puhtale kandikule hindamise eel. Mullast eemaldatud usse tuleks enne kaalumist pesta deioniseeritud veega ja asetada need liigse vee eemaldamiseks lühikeseks ajaks filterpaberile. Eemaldamise käigus leidmata jäänud ussid registreeritakse surnud ussidena, kuna tuleb eeldada, et nad surid ja lagundati enne hindamist.
|
|
38.
|
Kui muld on eelnevalt nõust välja tõstetud, viiakse see nõusse tagasi (ilma täiskasvanud ussideta, kuid koos kõikide moodustatud kookonitega). Seejärel inkubeeritakse mulda veel neli nädalat samades katsetingimustes, selle erandiga, et sööta lisatakse vaid ühe korra kõnealuse katseetapi alguses (vt punkt 33).
|
|
39.
|
Teise neljanädalase perioodi lõpus määratakse katsemullas olevate kookonite arv ja neist koorunud noorloomade arv, kasutades 5. liites kirjeldatud meetodit. Katse kestel tuleks registreerida ka kõik ussidel täheldatavad kahjustused ja kahjuliku mõju ilmingud.
|
Piirsisalduskatse
|
40.
|
Kui kontsentratsioonivahemiku leidmise katses ei täheldata suurimal kasutatud kontsentratsioonil (nt kontsentratsioonil 1 000 mg/kg) mingit mõju, tehakse sigivuskatse piirsisalduskatsena, kasutades kontsentratsiooni 1 000 mg/kg. Piirsisalduskatse võimaldab tõendada, et täheldatavat toimet mitteavaldav kontsentratsioon on sigivuse puhul suurem kui kõnealune piirkontsentratsioon, ning samal ajal minimeerida katses kasutatavate usside arvu. Nii uuritava kemikaaliga mulla kui ka kontrollmulla puhul tuleks kasutada kaheksat paralleelnõu.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Andmete töötlemine
|
41.
|
Käesolevas katsemeetodis ei anta lõplikke juhiseid katsetulemuste statistilise analüüsi kohta, kuid asjakohane ülevaade on esitatud 6. liites.
|
|
42.
|
Üks lõppnäitaja on suremus. Siiski tuleks registreerida ka muutused täiskasvanud isendite käitumises (nt võimetus mulda kaevuda või katsenõu klaasseina vastas liikumatult lamamine) ja morfoloogias (nt lahtiste haavade esinemine), samuti noorloomade esinemine. Üldjuhul tuleks kasutada LC50 leidmiseks probitanalüüsi (18) või logistilist regressiooni. Selle analüüsimeetodi sobimatuse korral (nt kui andmed hõlmavad vähem kui kolme kontsentratsiooni, mille puhul täheldatakse osalist suremust) võib kasutada mõnda alternatiivset meetodit. Kõnealuse meetodina võib muu hulgas kasutada libiseva keskmise meetodit (19), kohandatud Spearmani-Kärberi meetodit (20) või lihtsat interpoleerimist (nt LC0 ja LC100 geomeetrilist keskmist, mis on saadud LC0 ja LC100 korrutisest ruutjuure võtmise teel).
|
|
43.
|
Teine lõppnäitaja on sigivus (nt sigitatud noorloomade arv). Sarnaselt kontsentratsioonivahemiku leidmise katsele tuleks lõpp-protokolli siiski märkida ka kõik muud kahjuliku mõju ilmingud. Statistilise analüüsi käigus on vaja arvutada sigivuse aritmeetiline keskmine

ja standardhälve igas katse- ja kontrollrühmas. |
|
44.
|
Dispersioonanalüüsi tegemise korral võib standardhälbe s ja selle vabadusastmete arvu df asendada vastavalt dispersioonianalüüsi (ANOVA) tulemusena leitud hajuvuse hinnangulise koondmäära ja selle vabadusastmete arvuga, eeldusel, et hajuvus ei sõltu kontsentratsioonist. Sellisel juhul kasutatakse kontroll- ja katserühmade puhul ühte hajuvuse väärtust. Kõnealused väärtused arvutatakse tavaliselt müügiloleva statistilise analüüsi programmi abil, kasutades paralleelidena igas eraldi nõus saadud tulemusi. Kui ilmneb, et negatiivse kontrolli ja lahustiga kontrolli andmete koondamine on mõistlikum kui võrdlemine ühe nimetatud kontrolliga, tuleks veenduda, et asjaomased andmed ei ole oluliselt erinevad (selleks sobivatele meetoditele osutatakse punktis 47 ja 6. liites).
|
|
45.
|
Edasine statistiline analüüs ja järeldused sõltuvad sellest, kas paralleelnõudes saadud väärtused on normaaljaotusega ja kas nende hajuvus on homogeenne.
|
Täheldatavat toimet mitteavaldava kontsentratsiooni (NOEC) hindamine
|
46.
|
Soovitatavalt tuleks kasutada suure võimsusega meetodit. Et hinnata andmete jaotuse ligikaudset vastavust normaaljaotusele, tuleks kasutada varasemal kogemusel, näiteks võrdlusuuringu andmetel või muudel varasematel andmetel põhinevat teavet. Hajuvuse homogeensus (homoskedastiivsus) on suurema tähtsusega. Kogemusest nähtub, et hajuvus suureneb sageli keskväärtuse suurenedes. Sellisel juhul võib homoskedastiivsuse saavutamiseks olla kasu andmete teisendamisest. Kõnealuse teisendamise puhul tuleks siiski lähtuda varasematel andmetel põhinevast kogemusest, mitte analüüsitavatest andmetest. Homogeensete andmete puhul tuleks kasutada mitmest t-testi, näiteks Williamsi testi (α = 0,05; ühepoolne) (21, 22) või teatavatel juhtudel Dunnetti testi (23, 24). Tuleks tähele panna, et paralleelnõude andmete ebavõrdse hajuvuse korral tuleb tabelis esitatud t-väärtusi Dunnetti ja Williamsi kirjeldatud viisil korrigeerida. Mõnikord ei suurene/vähene saadud väärtused suurest varieeruvusest tingituna korrapäraselt. Sellise suure monotoonsusest kõrvalekaldumise puhul on asjakohasem kasutada Dunnetti testi. Homoskedastiivsusest kõrvalekaldumise puhul võib olla mõistlik hinnata võimalikku mõju hajuvusele lähemalt, et oleks võimalik otsustada, kas asjaomaseid t-teste saab kasutada võimsust oluliselt kaotamata (25). Teise võimalusena võib kasutada mitmest U-testi, näiteks Bonferroni U-testi vastavalt Holmile (26), või heteroskedastiivsete andmete puhul, mis muidu vastavad üldisele monotoonsele kontsentratsioonist sõltuvusele, mõnda muud mitteparameetrilist (nt Jonckheere'i-Terpstra (27, 28) või Shirley (29, 30)) testi; sellist testi tuleks üldjuhul eelistada ebavõrdse hajuvuse suhtes kohandatud t-testile (vt ka skeem, 6. liide).
|
|
47.
|
Kui on tehtud piirsisalduskatse ja parameetrilise testi eeldused (normaaljaotus, homogeensus) on täidetud, võib kasutada paariviisilist Studenti t-testi või ka Manni-Whitney U-testi (31).
|
ECx leidmine
|
48.
|
Mis tahes ECx väärtuse arvutamiseks regressioonanalüüsi (lineaarse või mittelineaarse regressiooni) teel kasutatakse katserühmade andmete keskväärtusi, mille alusel leitakse kontsentratsiooni ja mõju vahelist sõltuvust kirjeldav sobiv funktsioon. Pideva tunnusena vaadeldava usside kasvu puhul võib ECx väärtuste leidmiseks kasutada sobivat regressioonanalüüsi (32). Binaarsete andmete (suremus/elulemus) ja sigitatud järglaste arvu puhul sobivad funktsioonid on muu hulgas normaaljaotuse sigmoidfunktsioon, logistiline funktsioon ja Weibulli funktsioon, mis hõlmavad kahte kuni nelja parameetrit ja millest mõni sobib ka hormeetilise mõju modelleerimiseks. Kui kontsentratsiooni ja mõju vahelist sõltuvust väljendava funktsiooni leidmiseks kasutatakse lineaarset regressiooni, tuleks enne ECx määramist veenduda regressioonanalüüsi teel r2 (määratusekordaja) ja/või tõusu väärtuse olulisuses; ECx arvutamiseks sisestatakse regressioonanalüüsi tulemusena saadud võrrandisse väärtus, mis vastab x protsendile kontrollrühma keskväärtusest. Usalduspiirid usaldusnivool 95 % arvutatakse vastavalt Fiellerile (viidanud Finney (18)) või mõne muu sobiva kaasaegse meetodi abil.
|
|
49.
|
Teise võimalusena väljendatakse mõju protsentuaalse või lihtosakaaluna kontrollrühma näitaja keskväärtusest, mida käsitatakse mudeli parameetrina. Sellisel juhul on normaaljaotusele vastava (logistilise, Weibulli) sigmoidse kõvera lähendamiseks andmetele sageli võimalik hõlpsalt kasutada probitanalüüsil põhinevat regressioonimeetodit (18). Kõnealusel juhul tuleb kaalufunktsiooni kohandada arvulise tunnuse analüüsimiseks, nagu on kirjeldanud Christensen (33). Hormeesi ilmnemisel tuleks probitanalüüsi asemel siiski rakendada neljaparameetrilist logistilist või Weibulli funktsiooni, kasutades lähendamiseks mittelineaarset regressiooni (34). Kui kontsentratsiooni ja mõju vahelist sõltuvust väljendava sobiva funktsiooni lähendamine andmetele ei ole võimalik, võib ECx hinnangulise väärtuse ja asjaomaste usalduspiiride määramiseks kasutada muud meetodit, näiteks libiseva keskmise meetodit vastavalt Thompsonile (19) või kohandatud Spearmani-Kärberi meetodit (20).
|
KATSEPROTOKOLL
|
50.
|
Katseprotokollis esitatakse järgmine teave.
|
|
Uuritav kemikaal:
|
—
|
uuritava kemikaali täielik kirjeldus, partii, CASi number, puhtus;
|
|
—
|
uuritava kemikaali omadused (nt log Kow, lahustuvus vees, aururõhk, Henry konstant (H) ning teave kemikaali säilivuse ja omaduste kohta keskkonnas).
|
|
|
|
Katseorganismid:
|
—
|
kasutatud katseloomad: liik, teaduslik nimetus, organismide päritolu ja kasvatustingimused;
|
|
—
|
katseorganismide vanus ja suurusevahemik (massivahemik).
|
|
|
|
Katsetingimused:
|
—
|
katsemulla valmistamise üksikasjad;
|
|
—
|
mulla maksimaalne veemahutavus;
|
|
—
|
selle meetodi kirjeldus, mida kasutati mulla töötlemiseks uuritava kemikaaliga;
|
|
—
|
üksikasjad abikemikaalide kohta, mida kasutati uuritava kemikaaliga töötlemiseks;
|
|
—
|
vajaduse korral pihustusseadmete kaliibrimise üksikasjad;
|
|
—
|
katseplaani ja katse läbiviimise kirjeldus;
|
|
—
|
katsenõude suurus ja katsemulla kogus;
|
|
—
|
katsetingimused: valgustustihedus, valgus- ja pimedusperioodi kestus, temperatuur;
|
|
—
|
söötmisrežiimi kirjeldus, katses kasutatud sööda liik ja kogus, söötmiskuupäevad;
|
|
—
|
mulla pH ja veesisaldus katse alguses ja lõpus.
|
|
|
|
Katsetulemused:
|
—
|
täiskasvanud usside suremus (%) igas katsenõus katse esimese 4 nädala möödudes;
|
|
—
|
täiskasvanud usside summaarne mass igas katsenõus katse alguses;
|
|
—
|
elus täiskasvanud usside kehamassi muutus (% algsest kehamassist) igas katsenõus katse esimese 4 nädala möödudes;
|
|
—
|
sigitatud noorloomade arv igas katsenõus katse lõpus;
|
|
—
|
ilmsete ja patoloogiliste sümptomite ning selgete käitumuslike muutuste kirjeldus;
|
|
—
|
võrdluskemikaaliga saadud tulemused;
|
|
—
|
vastavalt vajadusele LC50, sigivuse puhul määratud täheldatavat toimet mitteavaldav kontsentratsioon (NOEC) ja/või ECx (nt EC50, EC10) koos usaldusvahemikuga ning graafik asjaomase näitaja arvutamiseks kasutatud lähendatud kõveraga, samuti kõik tulemuste tõlgendamist hõlbustavad andmed ja tähelepanekud;
|
|
—
|
kontsentratsiooni ja mõju vahelise sõltuvuse graafik;
|
|
—
|
tulemused iga katsenõu kohta.
|
|
Kõrvalekalded käesolevast katsemeetodist ja kõik katse ajal täheldatud ebatavalised ilmingud.
|
KIRJANDUS
|
(1)
|
Jaenicke, J. (1982). „Eisenia foetida” is two biological species. Megadrilogica 4: 6–8.
|
|
(2)
|
Øien, N., ja Stenerson, J. (1984). Esterases of earthworm – III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Phys. C 78: 277–282.
|
|
(3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei – comparison of two ringtests. Väljaandes: Riepert, F., Kula, C. (1996), Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamt Land-Forstwirtsch., Berlin-Dahlem, 320, lk 50–82.
|
|
(4)
|
Käesoleva lisa peatükk C.8 „Toksilisus vihmaussidele”.
|
|
(5)
|
Rahvusvaheline Standardiorganisatsioon (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. Rahvusvaheline Standardiorganisatsioon, Genf.
|
|
(6)
|
Rahvusvaheline Standardiorganisatsioon (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using artificial soil substrate, No. 11268-1. Rahvusvaheline Standardiorganisatsioon, Genf.
|
|
(7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S. C., Bembridge, J. D., Holmstrup, M., ja Posthuma, L. (toim.). SETAC Press, 456 lk.
|
|
(8)
|
USA Keskkonnakaitseamet (1996). Ecological Effects Test Guidelines: Earthworm Subchronic Toxicity Test (850.62.00). USA Keskkonnakaitseamet, ennetamise, pestitsiidide ja mürgiste ainete büroo. EPA 712-C-96-167, aprill 1996.
|
|
(9)
|
Bouché, M. B. (1972). Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C. A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Aruanne EUR 8714 EN, Euroopa Ühenduste Komisjon.
|
|
(11)
|
Greig-Smith, P. W., Becker, H., Edwards, P. J., ja Heimbach, F. (toim.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C. A., ja Bohlen, J. P. (1996). Biology and Ecology of Earthworms, 3. väljaanne. Chapman & Hall, London.
|
|
(13)
|
Rahvusvaheline Standardiorganisatsioon (1994). Soil Quality – Determination of pH, No. 10390. Rahvusvaheline Standardiorganisatsioon, Genf.
|
|
(14)
|
Hund-Rinke, K., Römbke, J., Riepert, F., ja Achazi, R. (2000). Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. Väljaandes: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W., ja Eisentraeger, A. (toim.). Spektrum Verl., Heidelberg. Lk 59–81.
|
|
(15)
|
Rahvusvaheline Standardiorganisatsioon (1992). Soil Quality – Determination of water retention characteristics – Laboratory methods, No. 11274. Rahvusvaheline Standardiorganisatsioon, Genf.
|
|
(16)
|
Rahvusvaheline Standardiorganisatsioon (1993). Soil Quality – Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. Rahvusvaheline Standardiorganisatsioon, Genf.
|
|
(17)
|
Römbke, J., ja Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 lk.
|
|
(18)
|
Finney, D. J. (1971). Probit Analysis (3. väljaanne), lk 19–76. Cambridge Univ. Press.
|
|
(19)
|
Finney, D. J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
(20)
|
Hamilton, M. A., Russo, R. C., ja Thurston, R. V. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11: 714–719; parandus: Environ. Sci. Technol. 12 (1978): 417.
|
|
(21)
|
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103–117.
|
|
(22)
|
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 519–531.
|
|
(23)
|
Dunnett, C. W. (1955). A multiple comparison procedure for comparing several treatments with a control. J. Am. Stat. Assoc. 50: 1096–1121.
|
|
(24)
|
Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics 20: 482–491.
|
|
(25)
|
van der Hoeven, N. (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355–361.
|
|
(26)
|
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Stat. 6: 65–70.
|
|
(27)
|
Jonckheere, A. R. (1954). A Distribution-free k-Sample Test Against Ordered Alternatives. Biometrika 41: 133–145.
|
|
(28)
|
Terpstra, T. J. (1952). The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking. Indagat. Math. 14: 327–333.
|
|
(29)
|
Shirley, E. A. (1979). The comparison of treatment to control group means in toxicology studies. Appl. Stat. 28: 144–151.
|
|
(30)
|
Williams, D. A. (1986). A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control. Biometrics 42: 183–186.
|
|
(31)
|
Sokal, R. R., ja Rohlf, F. J. (1981). Biometry. The Principles and Practice of Statistics in Biological Research. 2. väljaanne. W. H. Freeman and Company, New York.
|
|
(32)
|
Bruce, R. D., ja Versteeg, D. J. (1992). A statistical procedure for modelling continuous toxicity data. Environ. Toxicol. Chem. 11: 1485–1494.
|
|
(33)
|
Christensen, E. R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Res. 18: 213–221.
|
|
(34)
|
Van Ewijk, P. H., ja Hoekstra, J. A. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox. Environ. Safe. 25: 25–32.
|
1. liide
Mõisted
Käesoleva katsemeetodi puhul kasutatakse järgmisi mõisteid.
Kemikaal
– aine või segu.
ECx
(kontsentratsioon, mille puhul mõju ulatus on x %)– kontsentratsioon, mille juures teatava kokkupuuteperioodi vältel katseorganismidele avalduva mõju ulatus on x % kontrollrühma asjaomase näitaja väärtusest. Näiteks EC50 on kontsentratsioon, mille puhul kindlaksmääratud kokkupuuteperioodi vältel avaldub kemikaali mõju katses uuritavale näitajale 50 protsendil kemikaaliga kokku puutuvast populatsioonist. Käesoleva katsemeetodi puhul väljendatakse sellist kontsentratsiooni uuritava kemikaali massina katsemulla kuivmassi ühiku või mulla pindala ühiku kohta.
LC0
(kontsentratsioon, mille puhul surmav mõju puudub)– kontsentratsioon, mille juures uuritav kemikaal ei surma teatava aja jooksul ühtki kemikaaliga kokku puutunud katseorganismi. Käesoleva katsemeetodi puhul väljendatakse LC0 uuritava kemikaali massina katsemulla kuivmassi ühiku kohta.
LC50
(kontsentratsioon, mille puhul sureb pool katseorganismidest)– kontsentratsioon, mille juures uuritav kemikaal surmab teatava aja jooksul 50 % kemikaaliga kokku puutunud katseorganismidest. Käesoleva katsemeetodi puhul väljendatakse LC50 uuritava kemikaali massina katsemulla kuivmassi ühiku või mulla pindala ühiku kohta.
LC100
(kontsentratsioon, mille puhul surevad kõik katseorganismid)– kontsentratsioon, mille juures uuritav kemikaal surmab teatava aja jooksul 100 % kemikaaliga kokku puutunud katseorganismidest. Käesoleva katsemeetodi puhul väljendatakse LC100 uuritava kemikaali massina katsemulla kuivmassi ühiku kohta.
Vähim täheldatavat toimet avaldav kontsentratsioon
– uuritava kemikaali väikseim kontsentratsioon, mille juures täheldatakse statistiliselt olulist (p < 0,05) mõju. Käesoleva katsemeetodi puhul väljendatakse sellist kontsentratsiooni uuritava kemikaali massina katsemulla kuivmassi ühiku või mulla pindala ühiku kohta. Kõikidel sellisest kontsentratsioonist suurematel katsekontsentratsioonidel peaks üldjuhul täheldatama kontrollrühmaga võrreldes statistiliselt olulist mõju. Mis tahes kõrvalekaldeid eespool esitatud määratlusest tuleb katseprotokollis põhjendada.
Täheldatavat toimet mitteavaldav kontsentratsioon
– uuritava kemikaali kontsentratsioon, mille juures ei täheldata mingit mõju ja mis on kasutatud kontsentratsioonide jadas vahetult allpool vähimat täheldatavat toimet avaldavat kontsentratsiooni. Käesoleva katsemeetodi puhul ei täheldata sellisel kontsentratsioonil teatava kokkupuuteperioodi vältel kontrollrühmaga võrreldes statistiliselt olulist (p < 0,05) mõju.
Sigivuse määr
– katseperioodi jooksul sigitatud noorloomade keskmine arv teatava arvu täiskasvanud usside kohta.
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil.
2. liide
Mulla maksimaalse veemahutavuse määramine
On leitud, et mulla maksimaalse veemahutavuse määramiseks sobib järgmine meetod. Seda kirjeldatakse standardi ISO/DIS 11268-2 (1) C lisas.
Sobiva proovivõtuseadme (puuriga toru vmt) abil kogutakse kindlaksmääratud kogus (nt 5 g) katsemulda. Toru alumine ots kaetakse filterpaberi tükiga, toru täidetakse veega ja pannakse resti peale veevanni. Toru tuleks lasta vette vähehaaval, kuni veetase on mullapinnast kõrgemal. Seejärel tuleks toru umbes kolmeks tunniks vette jätta. Kuna muld ei suuda hoida kogu kapillaaridesse absorbeerunud vett, tuleks mullaproovil lasta kahe tunni vältel nõrguda, asetades toru väga märja peeneks jahvatatud kvartsliiva kihile, mis paikneb kuivamise ärahoidmiseks suletud nõus. Seejärel tuleks proov kaaluda ning kuivatada seda 105 °C juures, kuni selle kaal enam ei muutu. Veemahutavuse saab seejärel arvutada järgmise valemiga:
 , ,
kus:
|
|
S on veega küllastunud substraadi mass + toru mass + filterpaberi mass;
|
|
|
T on tühimass (toru mass + filterpaberi mass);
|
|
|
D on substraadi kuivmass.
|
VIIDE
|
(1)
|
Rahvusvaheline Standardiorganisatsioon (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. Rahvusvaheline Standardiorganisatsioon, Genf.
|
3. liide
Mulla pH määramine
Allpool kirjeldatud meetod mulla pH määramiseks põhineb kirjeldusel, mis on esitatud standardis ISO/DIS 10390 „Soil Quality – Determination of pH” (1).
Kindlaksmääratud mullakogusel lastakse toatemperatuuril vähemalt 12 tundi kuivada. Seejärel valmistatakse vähemalt 5 grammi mulda sisaldav suspensioon, kasutades 1 M analüütilise puhtusastmega kaaliumkloriidi (KCl) või 0,01 M analüütilise puhtusastmega kaltsiumkloriidi (CaCl2) lahust, mille maht on mulla mahust viis korda suurem. Suspensiooni loksutatakse põhjalikult viis minutit ja seejärel lastakse sellel settida vähemalt kaks tundi, kuid mitte kauem kui 24 tundi. Seejärel mõõdetakse vedela faasi pH väärtus pH-meetriga, mis kaliibritakse enne iga mõõtmist sobiva rea puhverlahustega (nt pH väärtustel 4,0 ja 7,0).
VIIDE
|
(1)
|
Rahvusvaheline Standardiorganisatsioon (1994). Soil Quality – Determination of pH, No. 10390. Rahvusvaheline Standardiorganisatsioon, Genf.
|
4. liide
Eisenia fetida / Eisenia andrei kasvatamine
Usse tuleks soovitatavalt kasvatada kliimakambris temperatuuril 20 ± 2 °C. Sellel temperatuuril ja piisava sööda olemasolul saavutavad ussid suguküpsuse umbes 2–3 kuu pärast.
Kumbagi liiki võib kasvatada paljudes eri loomsetes jäätmetes. Soovitatav kasvukeskkond on hobuse- või veisesõnniku ja turba segu vahekorras 50:50. Tuleks kontrollida, et lehmadele või hobustele, kellelt sõnnik pärineb, ei manustata ussidele katse ajal kahjulikku mõju avaldada võivaid ravimeid ega kemikaale, näiteks kasvu soodustavaid aineid, nematotsiide või sarnaseid veterinaarravimeid. Soovitatakse kasutada oma kogutud mahesõnnikut, kuna kogemusest nähtub, et müügilolev aiaväetisena kasutatav sõnnik võib mõjuda ussidele kahjulikult. Kasvukeskkonna pH peaks olema umbes 6–7 (reguleeritakse kaltsiumkarbonaadiga), selle ioonjuhtivus peaks olema väike (väiksem kui 6 mS/cm või soolasisaldus väiksem kui 0,5 %) ja see ei tohiks olla ammoniaagi või loomade uriiniga liigselt saastunud. Substraat peaks olema niiske, kuid mitte liiga märg. Kasvatamiseks sobivad kastid mahuga 10–50 liitrit.
Standardse vanuse ja suurusega (kehamassiga) usside saamiseks on parim alustada kasvatamist kookonist. Kasvama pandud kultuuri säilitamiseks viiakse täiskasvanud ussid 14–28 päevaks värsket substraati sisaldavasse kasvatuskasti, et saada kookoneid juurde. Seejärel täiskasvanud ussid eemaldatakse ja kookonist kooruvaid noorloomi kasutatakse järgmise kultuuri saamiseks. Usse söödetakse pidevalt loomsete jäätmetega ja nad viiakse aeg-ajalt üle värskesse substraati. Kogemusest nähtub, et sobiv sööt on õhu käes kuivatatud peeneks jahvatatud lehma- või hobusesõnnik või kaerajahu. Tuleks veenduda, et lehmadele või hobustele, kellelt sõnnik pärineb, ei manustata ussidele pikaajalise kasvatamise käigus kahjulikku mõju avaldada võivaid ravimeid ega kemikaale, näiteks kasvu soodustavaid aineid. Kookonist koorunud usse kasutatakse katses 2–12 kuu vanusena, mil nad loetakse täiskasvanuks.
Usse võib pidada terveks, kui nad liiguvad läbi substraadi, ei püüa substraadist lahkuda ja paljunevad pidevalt. Substraadi ammendumisest annab märku usside väga aeglane liikumine ja nende tagaotsa muutumine kollaseks. Sellisel juhul soovitatakse kasutada värsket substraati ja/või vähendada asustustihedust.
5. liide
Kookonist koorunud noorte usside loendamise meetodid
Usside käsitsi eemaldamine mullasubstraadist on väga aeganõudev. Seepärast soovitatakse kasutada ühte kahest järgmisest alternatiivsest meetodist.
|
a)
|
Katsenõud asetatakse veevanni, mille temperatuur on algselt 40 °C, kuid tõuseb seejärel 60 °C-ni. Umbes 20 minuti pärast peaks noored ussid ilmuma mullapinnale, kust neid saab loendamiseks hõlpsalt eemaldada.
|
|
b)
|
Katsemulla võib uhtuda läbi sõela meetodil, mille töötasid välja van Gestel et al. (1), kui mullale lisatud turvas ja sõnnik või kaerajahu on eelnevalt peeneks pulbriks jahvatatud. Kaks sõela läbimõõduga 30 cm ja ava suurusega 0,5 mm asetatakse teineteise peale. Katsenõu sisu uhutakse tugeva kraaniveejoaga läbi sõelte, nii et noored ussid ja kookonid jäävad enamjaolt ülemisele sõelale. On oluline tähele panna, et selle toimingu vältel tuleks kogu ülemise sõela pinda märjana hoida, et noored ussid jääksid veekihi pinnale ujuma ega saaks läbi sõelaavade ronida. Parimad tulemused saavutatakse dušiotsiku kasutamisel.
|
Kui kogu mullasubstraat on läbi sõela uhutud, saab noorloomad ja kookonid ülemiselt sõelalt kaussi uhtuda. Kausi sisu jäetakse seisma, et tühjad kookonid saaksid veepinnale tõusta ning täis kookonid ja noored ussid põhja vajuda. Seejärel saab seisva vee ära kallata ning tõsta noored ussid ja kookonid veidi vett sisaldavasse Petri tassi. Ussid võib loendamiseks eemaldada nõela või pintsettide abil.
Kogemusest nähtub, et meetod a sobib paremini selliste noorte usside ekstraheerimiseks, kes võidakse uhtuda isegi läbi 0,5 mm suuruste sõelaavade.
Mullasubstraadist usside (ja vajaduse korral kookonite) eemaldamiseks kasutatava meetodi tõhusus tuleks alati eelnevalt kindlaks teha. Kui noorloomad eemaldatakse käsitsi, on soovitatav teha seda toimingut igas kultuuris kaks korda.
VIIDE
|
(1)
|
Van Gestel, C. A. M., van Dis, W. A., van Breemen, E. M., ja Sparenburg, P. M. (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32: 367–371.
|
6. liide
Andmete statistilise analüüsi ülevaade (täheldatavat toimet mitteavaldava kontsentratsiooni määramine)

C.34. ANAEROOBSETE BAKTERITE ELUTEGEVUSE PÄRSSUMISE MÄÄRAMINE – (REOVEE)SETTE KÄÄRIMISEGA KAASNEVA GAASIERITUSE VÄHENEMINE
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 224 (2007). Veekeskkonda sattunud kemikaalid läbivad nii aeroobse kui ka anaeroobse tsooni, kus need võidakse lagundada ja/või kus need võivad pärssida bakterite elutegevust; mõnel juhul võivad kemikaalid püsida anaeroobses tsoonis puutumatult aastakümneid või kauem. Reovee puhastamise esimeses ehk eelsetitusetapis on aeroobne tsoon vedelas supernatandis ja anaeroobne tsoon vedelikukihi all olevas settes. Sellele järgnevas teises etapis on aeroobne tsoon aereerimisbasseini aktiivmudas ja anaeroobne tsoon settebasseinis vedelikukihi all olevas settes. Kummastki etapist pärit muda töödeldakse tavaliselt anaeroobselt; saadakse metaani ja süsihappegaasi, mida üldjuhul kasutatakse elektri tootmiseks. Looduskeskkonnas püsivad lahtedes, jõesuudmetes ja meres olevasse settesse jõudnud kemikaalid, mis ei ole biolagundatavad, selles anaeroobses tsoonis tõenäoliselt määramata aja. Mõne kemikaali puhul jõuab suurem osa sellest kõnealusesse tsooni tulenevalt kemikaali füüsikalistest omadustest – näiteks vähesest vees lahustuvusest või suurest hõljuvainele adsorbeerumise määrast – või asjaolust, et kemikaal ei ole aeroobselt biolagundatav.
|
|
2.
|
Keskkonda sattuv kemikaal peaks soovitatavalt olema küll biolagundatav nii aeroobsetes kui ka anaeroobsetes tingimustes, ent samal ajal on väga oluline, et selline kemikaal ei pärsiks mikroorganismide elutegevust kummaski tsoonis. Ühendkuningriigis on paaril juhul esinenud metaanitootmise täielikku pärssumist tööstuslikus reovees näiteks pentaklorofenooli toimel, mistõttu tuli teha väga suuri kulutusi, et pärssunud muda kääritusmahutitest ohutusse kohta transportida ja naaberkäitistest heas seisukorras kääritusmuda asemele tuua. On esinenud ka palju juhtumeid, kus kääritusprotsessi on väiksemal määral häirinud muud kemikaalid, sealhulgas alifaatsed halogeenitud süsivesinikud (kasutatakse keemilises puhastuses) ja detergendid, mis on põhjustanud kääritusmahutite tõhususe olulist vähenemist.
|
|
3.
|
Bakterite elutegevuse pärssumisega on seotud vaid üks katsemeetod – aktiivmuda mikroorganismide hingamist käsitlev meetod C.11 (1), millega hinnatakse uuritava kemikaali mõju hapnikusidumise kiirusele substraadi juuresolekul. Seda meetodit on laialdaselt kasutatud selleks, et teha varakult kindlaks uuritava kemikaali võimalik kahjulik mõju reovee aeroobsele töötlemisele ja määrata kontsentratsioon, mille juures pärssumist ei toimu ja mida saab kasutada mitmes eri biolagunduvuse katses. Katsemeetod C.43 (2) loob piiratud võimaluse teha kindlaks uuritava kemikaali pärssiv mõju gaasitootmisele anaeroobses mudas, mida on tavapärases kontsentratsioonis tahkeid osakesi sisaldava mudaga võrreldes lahjendatud kümme korda, et võimaldada nõutavat täpsust biolagunemise protsentuaalse määra hindamisel. Kuna lahjendatud muda võib olla pärssivate kemikaalide suhtes tundlikum, otsustas Rahvusvahelise Standardiorganisatsiooni töörühm töötada välja meetodi, mille puhul kasutatakse lahjendamata muda. Tutvuti vähemalt kolme tekstiga (Taanist, Saksamaalt ja Ühendkuningriigist) ja lõpuks koostati kaks ISO standardit – ISO 13641-1 (3) ja ISO 13641-2 (4); neist esimese puhul kasutatakse lahjendamata muda ja teise puhul sajakordselt lahjendatud muda, mis vastab väikese bakterite populatsiooniga mudale ja settele. Kummagi meetodi valideerimiseks tehti võrdlusuuring (5); uuringu 1. osas kinnitati esimese standardi vastuvõetavust, kuid 2. osa suhtes tekkisid lahkarvamused. Ühendkuningriik leidis, et kuna märkimisväärse osa uuringus osalejate andmeil toodeti gaasi väga vähe või üldse mitte – osaliselt seepärast, et vabaruumi protsentuaalne maht oli optimaalse tundlikkuse saavutamiseks liiga suur (75 %) –, on vaja seda meetodit täiendavalt uurida.
|
|
4.
|
Ühendkuningriigis tehtud varasemates uuringutes (6, 7) kirjeldatakse manomeetrilist meetodit, mille puhul on substraadina kasutatud lahjendamata käärivat muda ja lisaks töötlemata reoveesetet kolbides mahuga 500 ml; asjaomased seadmed olid kohmakad ja töötlemata reovee hais oli ülitugev. Hiljem leidsid rakendust Sheltoni ja Tiedje (8) kompaktsemad ja mugavamad seadmed, mida kasutasid Battersby ja Wilsoni (9) välja töötatud kujul edukalt Wilson et al. (10). Kawahara et al. (11) valmistasid laboris edukalt veel standardmuda proove mitme kemikaali anaeroobse biolagunduvuse ja pärssiva mõju hindamise katsetes kasutamiseks. Samuti tehti katse, milles kasutati töötlemata muda asemel substraadina kas sada korda lahjendatud anaeroobset muda või sellist muda, setet vmt, milles ei täheldatud bakterite aktiivset elutegevust.
|
|
5.
|
Selle meetodi abil võib saada kasulikku teavet, mis võimaldab ennustada uuritava kemikaali tõenäolist mõju gaasitootmisele anaeroobsetes kääritusmahutites. Et hinnata, kas mikroorganismid on võimelised uuritava kemikaaliga kohanema või kas kemikaalid, mis tõenäoliselt mudas absorbeeruvad või mudaosakeste pinnale adsorbeeruvad, võivad käesolevas katses ette nähtust pikema perioodi vältel akumuleeruda kontsentratsioonis, mille puhul avaldub mürgine mõju, tuleks siiski teha pikemaajalisi katseid, milles jäljendatakse kääritusmahutite tööd täpsemalt.
|
KATSE PÕHIMÕTE
|
6.
|
Käärivast mudast (tahkete osakeste üldsisaldus 20–40 g/l) ja lagundatava substraadi lahusest koosneva segu alikvoote inkubeeritakse suletud nõudes ilma kemikaalita või eri kontsentratsioonides esineva uuritava kemikaaliga kuni 3 ööpäeva. Toodetud gaasi (metaani ja süsihappegaasi) koguse määramiseks mõõdetakse rõhu (Pa) suurenemist pudelites. Asjaomastes katse- ja kontrollpudelites toodetud gaasikoguste alusel arvutatakse uuritava kemikaali eri kontsentratsioonidel ilmneva gaasitootmise pärssumise protsentuaalne määr. EC50 ja muud mõju iseloomustamiseks määratavad kontsentratsioonid arvutatakse graafiku põhjal, mis väljendab pärssumise protsentuaalset määra sõltuvust uuritava kemikaali kontsentratsioonist või sagedamini selle logaritmist.
|
TEAVE UURITAVA KEMIKAALI KOHTA
|
7.
|
Üldjuhul tuleks uuritavat kemikaali kasutada puhtaimal kättesaadaval kujul, kuna mõne kemikaali, näiteks klorofenoolide puhul võivad lisandid olla palju mürgisemad kui uuritav kemikaal ise. Tuleks siiski kaaluda kemikaali kasutamist katses sellisel kujul, nagu seda toodetakse/müüakse. Valmistoodete kasutamist üldjuhul ei soovitata, kuid raskesti lahustuva uuritava kemikaali puhul võib valmistoote kasutamine olla asjakohane. Uuritava kemikaali kohta kättesaadav teave peaks hõlmama muu hulgas selliseid näitajaid nagu lahustuvus vees ja mõnes orgaanilises lahustis, aururõhk, adsorptsioonitegur, hüdrolüüsi kiirus ja biolagunduvus anaeroobsetes tingimustes.
|
MEETODI KASUTATAVUS
|
8.
|
Käesolev katsemeetod on kasutatav nii vees lahustuvate kui ka vees lahustumatute, sealhulgas lenduvate kemikaalide puhul. Vees raskesti lahustuvate (vt allikas 12) ja suure lenduvusega kemikaalide puhul on siiski vaja olla eriti hoolikas. Võib kasutada ka muust anaeroobsest allikast, näiteks mudast, küllastunud mullast või settest pärit inokulumi. Mürgise kemikaaliga varem kokku puutunud anaeroobsete bakterite süsteemid võivad olla kohanenud nii, et bakterite elutegevus säilib ksenobiootilise kemikaali juuresolekul. Kohanenud bakterisüsteemist pärit inokulumi puhul võib taluvus uuritava kemikaali suhtes olla suurem kui kohanemata süsteemist pärit inokulumi puhul.
|
VÕRDLUSKEMIKAALID
|
9.
|
Katsemeetodi kontrollimiseks hinnatakse tavapärase katse raames ka sobivatesse katsenõudesse lisatavat võrdluskemikaali; on leitud, et 3,5-diklorofenool pärsib järjepidevalt nii anaeroobset gaasitootmist kui ka hapnikutarbimist aktiivmudas ja muid biokeemilisi reaktsioone. Samuti on leitud, et kaks muud kemikaali – metüleenbis(tiotsüanaat) ja pentaklorofenool – pärsivad metaanitootmist rohkem kui 3,5-diklorofenool, kuid nende kemikaalidega saadud tulemused on valideerimata. Pentaklorofenooli ei soovitata kasutada, kuna see ei ole puhtal kujul hõlpsalt kättesaadav.
|
TULEMUSTE REPRODUTSEERITAVUS
|
10.
|
Rahvusvahelises võrdlusuuringus (5) täheldati, et 3,5-diklorofenooli ja 2-bromoetaansulfoonhappe puhul ei ole EC50 reprodutseeritavus uuringus osalenud 10 laboris kuigi hea. (Esimese kemikaali puhul oli kõnealune väärtuste vahemik 32–502 mg/l ja teise puhul 220–2 190 mg/l.)
|
Laborite arv
|
Milligrammides liitri kohta
|
Milligrammides muda grammi kohta
|
|
Keskmine
|
Standardhälve
|
Variatsioonikordaja (%)
|
Keskmine
|
Standardhälve
|
Variatsioonikordaja (%)
|
|
|
3,5-diklorofenool
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
2-bromoetaansulfoonhape
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
EC50 andmed võrdlusuuringust – lahjendamata muda
|
11.
|
Eri laborites saadud tulemuste suur variatsioonikordaja kajastab suurel määral muda mikroorganismide erinevat tundlikkust, olenevalt varasemast kokkupuutest uuritava kemikaali või sellele keemiliselt sarnase kemikaaliga või sellise kokkupuute puudumisest. Muda kogusel põhineva EC50 väärtuse määramise täpsus ei olnud oluliselt suurem kui ruumalal põhineva väärtuse (mg/l) määramise täpsus. Kolmes laboris, kus esitati andmed 3,5-diklorofenooli EC50 väärtuse määramise täpsuse kohta, oli variatsioonikordaja palju väiksem (vastavalt 22, 9 ja 18 %) kui kõigi kümne labori tulemuste keskväärtuse puhul. Kõnealuses kolmes laboris saadud keskmine väärtus oli vastavalt 3,1, 3,2 ja 2,8 mg/g. Asjaolu, et ühes laboris saadud variatsioonikordaja väärtus on vastuvõetav ja palju väiksem kui eri laborites saadud tulemuste variatsioonikordaja ehk 92 % asemel 9–22 %, viitab sellele, et eri mudapartiidel on märkimisväärselt erinevad omadused.
|
MEETODI KIRJELDUS
Seadmed
|
12.
|
Lisaks tavapärastele laboriseadmetele on vaja järgmist:
|
a)
|
inkubaator – sädemekindel ja väärtusele 35 ± 2 °C reguleeritava temperatuuriga;
|
|
b)
|
sobiva nimimahuga (17)
survekindlad klaasist katsenõud, millel on gaasikindel pinnakattega tihendkork ja mis kannatavad rõhku umbes 2 baari ehk 2 × 105 Pa (pinnakattena võib kasutada näiteks polütetrafluoroetüleeni). Soovitatakse kasutada klaasist seerumipudeleid, mille nimimaht on 125 ml ja tegelik maht umbes 160 ml ning millel on seerumi jaoks ette nähtud tihendkork (18) ja alumiiniumist pressrõngas, kuid hästi sobivad ka muud pudelid üldmahuga 0,1–1 liitrit;
|
|
c)
|
täppisrõhumõõtur
(19)
koos nõelakinnitusega – toodetud gaasi (metaani ja süsihappegaasi) üldkoguse mõõtmiseks ja gaasi väljalaskmiseks kohandatud rõhumõõtur. Selleks sobiv seade on näiteks süstlanõelaga ühendatud käeshoitav täppisrõhumõõtur; gaasikindel kolmikventiil hõlbustab ülerõhust vabanemist (1. liide). Rõhuanduri toru ja ventiili siseruumala peab olema võimalikult väike, et seadme siseruumala arvestamata jätmisest tulenev viga oleks tühine;
|
|
d)
|
soojusisolatsiooniga konteinerid kääriva muda transportimiseks;
|
|
e)
|
kolmesuunalised rõhuventiilid;
|
|
f)
|
sõel ava suurusega 1 mm2;
|
|
g)
|
nõu kääriva muda jaoks – umbes 5-liitrise mahuga klaasist või kõrgtihedast polüetüleenist pudel, mis on varustatud segistiga ja seadmetega gaasilise lämmastiku (vt punkt 13) juhtimiseks läbi vabaruumi;
|
|
h)
|
membraanfiltrid (0,2 μm) substraadi steriliseerimiseks;
|
|
i)
|
mikrosüstlad rõhuanduri (vt punkti 12 alapunkt c) gaasikindlaks ühendamiseks pudelis (vt punkti 12 alapunkt b) oleva vabaruumiga ja lahustumatu vedela uuritava kemikaali lisamiseks pudelisse;
|
|
j)
|
kindakamber, mis töötab väikesel lämmastiku ülerõhul – soovitatav, kuid mitte kohustuslik.
|
|
Reaktiivid
|
13.
|
Kogu katse vältel kasutatakse analüütilise puhtusastmega reaktiive. Kogu katse vältel tuleks kasutada kõrge puhtusastmega gaasilist lämmastikku, mille hapnikusisaldus on väiksem kui 5 μl/l.
|
Vesi
|
14.
|
Lahjenduse tegemiseks mis tahes etapis kasutatakse eelnevalt desaereeritud deioniseeritud vett. Sellist vett ei ole vaja analüütiliselt kontrollida, kuid tuleb tagada, et deioniseerimisseadet hooldatakse korrapäraselt. Põhilahuste valmistamiseks kasutatakse samuti deioniseeritud vett. Enne anaeroobse inokulumi lisamist uuritava kemikaali mis tahes lahusele veendutakse, et lahus ei sisalda hapnikku. Selleks juhitakse 1 tunni vältel enne inokulumi lisamist läbi lahjendusvee (või lahjendatud lahuse) gaasilist lämmastikku või kuumutatakse lahjendusvett keemistemperatuurini ja jahutatakse hapnikuvabas keskkonnas toatemperatuurini.
|
Kääriv muda
|
15.
|
Aktiivselt kääriv muda kogutakse reoveepuhasti kääritusmahutist või labori kääritusmahutist, kus töödeldakse peamiselt olmereoveest pärit muda. Praktiline teave labori kääritusmahutist pärit muda kohta on esitatud mujal (11). Kui kavatsetakse kasutada kohandatud inokulumi, võib kaaluda tööstuslikust reoveepuhastist pärit kääriva muda kasutamist. Muda kogumiseks kasutatakse kõrgtihedast polüetüleenist või sarnasest materjalist laia kaelaga pudeleid, mis on võimelised paisuma. Proovivõtupudelid täidetakse mudaga nii, et mudapind jääb pudelisuust umbes 1 cm võrra allapoole, pudelid suletakse tihedalt, kasutades soovitatavalt kaitseventiili (punkti 12 alapunkt e), ning paigutatakse soojusisolatsiooniga konteineritesse (punkti 12 alapunkt d), et minimeerida temperatuurišokki transportimisel temperatuuril 35 ± 2 °C hoitavasse inkubaatorisse. Pudelite avamisel tuleb ülerõhku tekitava gaasi väljalaskmiseks kork ettevaatlikult lahti teha või kasutada kolmesuunalist rõhuventiili (punkti 12 alapunkt e). Soovitatav on kasutada muda mõne tunni jooksul pärast kogumist; vastasel juhul säilitatakse muda temperatuuril 35 ± 2 °C kuni 3 ööpäeva gaasilise lämmastiku all, kus muda aktiivsus tavaliselt oluliselt ei vähene.
Hoiatus – käärivas mudas tekivad tule- ja plahvatusohtlikud gaasid ning samuti võib see sisaldada patogeenseid organisme, mistõttu tuleb muda käsitsemisel võtta asjakohased ettevaatusabinõud. Ohutuse huvides ei kasutata muda kogumiseks klaasnõusid.
|
Inokulum
|
16.
|
Vahetult enne kasutamist segatakse muda ettevaatlikult ning lastakse läbi 1 mm2 suuruste avadega sõela (punkti 12 alapunkt f) sobivasse pudelisse (punkti 12 alapunkt g), mille vabaruumist juhitakse läbi lämmastikujuga. Võetakse proov tahke kuivaine üldsisalduse määramiseks (vt nt ISO 11923 (13) või samaväärne ELi standard). Muda kasutatakse üldjuhul lahjendamata kujul. Tahke aine sisaldus on tavaliselt 2–4 % (massiühikutes mahuühiku kohta). Kontrollitakse muda pH-d ja reguleeritakse see vajaduse korral tasemele 7 ± 0,5 ühikut.
|
Katsesubstraat
|
17.
|
10 g toitepuljongit (nt Oxoid), 10 g pärmiekstrakti ja 10 g D-glükoosi lahustatakse deioniseeritud vees ja lahuse ruumala viiakse 100 milliliitrini. Lahus steriliseeritakse filtrimisega läbi 0,2 μm suuruste pooridega membraanfiltri (punkti 12 alapunkt h) ja seda kasutatakse kohe või säilitatakse 4 °C juures kuni 1 ööpäev.
|
Uuritav kemikaal
|
18.
|
Valmistatakse eraldi iga vees lahustuva uuritava kemikaali põhilahus, mille kemikaalisisaldus hapnikuvabas lahjendusvees (punkt 14) on näiteks 10 g/l. Eri kontsentratsiooniga reaktsioonisegude valmistamiseks kasutatakse sobivas koguses sellist põhilahust. Teise võimalusena valmistatakse igast põhilahusest lahjenduste seeria, nii et katsepudelisse lisatav kogus on iga soovitud lõppkontsentratsiooni puhul sama. Põhilahuse pH tuleks vajaduse korral reguleerida tasemele 7 ± 0,2 ühikut.
|
|
19.
|
Kui uuritav kemikaal ei ole piisaval määral vees lahustuv, juhindutakse standardist ISO 10634 (12) või samaväärsest ELi standardist. Kui on vaja kasutada orgaanilist lahustit, hoidutakse kasutamast näiteks kloroformi ja süsiniktetrakloriidi, mis teadaolevalt pärsivad tugevalt metaanitootmist. Valmistatakse vees lahustumatu kemikaali vajaliku kontsentratsiooniga lahus sobivas lenduvas lahustis, näiteks atsetoonis või dietüüleetris. Nõutav kogus lahustipõhist lahust lisatakse tühja katsepudelisse (punkti 12 alapunkt b) ja lahustil lastakse enne muda lisamist aurustuda. Muul viisil töötlemise puhul kasutatakse standardit ISO 10634 (12) või samaväärset ELi standardit, ent tuleb meeles pidada, et emulgeerimiseks kasutatav pindaktiivne aine võib pärssida anaeroobset gaasitootmist. Kui on alust arvata, et orgaanilise lahusti või emulgeeriva aine juuresolek põhjustab katsevigu, võib uuritava kemikaali lisada pulbri või vedeliku kujul otse katsesegusse. Lenduvad kemikaalid ja vees lahustumatud vedelad uuritavad kemikaalid võib süstida inokulumi sisaldavasse seerumipudelisse mikrosüstla abil (punkti 12 alapunkt i).
|
|
20.
|
Uuritav kemikaal lisatakse pudelitesse nii, et moodustuks kontsentratsioonide geomeetriline jada – näiteks 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l ja 15,6 mg/l. Kui vahemik, milles mürgisus avaldub, ei ole sarnaste kemikaalide andmetest teada, tehakse sobiva vahemiku kindlakstegemiseks esmalt kontsentratsioonivahemiku leidmise eelkatse kontsentratsioonidel 1 000 mg/l, 100 mg/l ja 10 mg/l.
|
Võrdluskemikaal
|
21.
|
Valmistatakse 3,5-diklorofenooli vesilahus (10 g/l), lisades tahkele ainele loksutades vähehaaval minimaalse koguse naatriumhüdroksiidi lahust kontsentratsiooniga 5 mol/l, kuni aine on lahustunud. Seejärel lisatakse vajaliku ruumala saavutamiseks hapnikuvaba lahjendusvett (punkt 14); lahustumist võib hõlbustada ultraheliga töötlemine. Võib kasutada ka muud võrdluskemikaali, kui vähemalt kolme katse põhjal, mis on tehtud eri allikatest pärit või eri aegadel kogutud inokulumidega, on leitud selle kemikaali EC50 väärtuste keskmine vahemik.
|
SEGAVAD ASJAOLUD / VEAD
|
22.
|
Mõni muda koostisosa võib eeldatavalt reageerida võimaliku pärssiva kemikaaliga, muutes selle mikroorganismidele kättesaamatuks ja tuues seeläbi kaasa pärssiva mõju vähenemise või puudumise. Samuti võidakse saada valed tulemused, kui muda juba sisaldab sama pärssivat kemikaali, mida katses uuritakse. Peale nimetatud võimaluste on teada veel mitu tegurit, millest tulenevalt võidakse saada valed tulemused. Need tegurid ja neist tingitud vigade ärahoidmise või vähendamise meetodid on loetletud 3. liites.
|
KATSE KÄIK
|
23.
|
Vajalike paralleelproovide arv sõltub nõutavast täpsusastmest pärssiva mõju määramisel. Kui pudelikork on kogu katse vältel piisavalt gaasikindel, kasutatakse iga vajaliku kontsentratsiooni puhul ainult ühte katsepudelite partiid (vähemalt kolm pudelit). Samuti kasutatakse ühte partiid võrdluskemikaaliga pudeleid ja ühte kontrollpartiid. Kui aga pudelikork on gaasikindel vaid ühe või paari läbitorkamise puhul, kasutatakse uuritava kemikaali igal kontsentratsioonil ühte partiid (nt kolm pudelit) iga ajavahemiku (t) jaoks, mille kohta soovitakse andmeid saada. Samamoodi kasutatakse t väärtuste arvule vastaval arvul pudelipartiisid võrdluskemikaaliga rühmas ja kontrollrühmas.
|
|
24.
|
On soovitatav kasutada kindakambrit (punkti 12 alapunkt j). Vähemalt 30 minutit enne katse algust alustatakse gaasilise lämmastiku juhtimist läbi kõiki vajalikke seadmeid sisaldava kindakambri. Tagatakse, et muda temperatuur jääb pudelite käsitsemise ja sulgemise ajal vahemikku 35 ± 2 °C.
|
Eelkatse
|
25.
|
Kui muda aktiivsus ei ole teada, soovitatakse teha eelkatse. Selleks kasutatakse kontrollsegusid, kus tahke aine sisaldus on näiteks 10 g/l, 20 g/l ja 40 g/l ning mis sisaldavad substraati, kuid mitte uuritavat kemikaali. Samuti kasutatakse reaktsioonisegu eri kogustes, et võrrelda tulemusi vabaruumi mahu ja vedeliku mahu suhtarvu kolmel või neljal eri väärtusel. Eri ajavahemike vältel toodetud gaasikoguste põhjal valitakse välja sobivaimad tingimused, mis võimaldavad toota märkimisväärses koguses gaasi ja teha kaks mõõtmist päevas optimaalse tundlikkusega (20) ning alandada igapäevaselt rõhku plahvatusohtu tekitamata.
|
Uuritava kemikaali lisamine
|
26.
|
Vees lahustuv kemikaal lisatakse tühja katsepudelisse (punkti 12 alapunkt b) vesilahusena (punkt 18). Iga kontsentratsiooni puhul (punkt 20) kasutatakse vähemalt kolmest pudelist koosnevat partiid. Lahustumatu või raskesti lahustuva kemikaali puhul süstitakse see mikrosüstlaga orgaanilises lahustis lahustatud kujul tühjadesse pudelitesse, et saada uuritava kemikaali kõigil viiel kontsentratsioonil partii paralleelpudeleid. Lahusti aurustatakse, juhtides gaasilise lämmastiku joa üle katsepudelis oleva lahuse pinna. Teise võimalusena lisatakse kaalutud kogus tahket kemikaali otse katsepudelisse.
|
|
27.
|
Kui lahustumatu või raskesti lahustuva vedela uuritava kemikaali lisamiseks ei kasutata lahustit, lisatakse see mikrosüstla abil otse katsepudelisse pärast inokulumi ja katsesubstraadi lisamist (vt punkt 30). Lenduva uuritava kemikaali võib lisada samal viisil.
|
Inokulumi ja substraadi lisamine
|
28.
|
Vajalik kogus sõelutud käärivat muda (vt punkt 16) segatakse 5-liitrises pudelis (punkti 12 alapunkt g), juhtides samal ajal gaasilist lämmastikku joana läbi pudeli vabaruumi. Uuritava kemikaali vesilahust või aurustatud lahustiga saadud lahust sisaldavatesse katsepudelitesse suunatakse õhu eemaldamiseks umbes kaheks minutiks gaasilise lämmastiku juga. Hästi segatud muda alikvoot, nt 100 ml, viiakse laiaotsalise pipeti või mõõtesilindri abil katsepudelisse. On oluline täita pipett ühekorraga täpselt vajaliku koguse mudaga, sest muda tahked osakesed settivad kergesti. Kui pipetti võetakse vajalikust suurem kogus, tühjendatakse pipett ja alustatakse uuesti.
|
|
29.
|
Seejärel lisatakse piisavas koguses substraadi lahust (punkt 17), et toitepuljongi, pärmiekstrakti ja D-glükoosi sisaldus saadavas segus oleks iga nimetatud koostisosa puhul 2 g/l; samal ajal jätkatakse lämmastiku juhtimist läbi pudeli. Allpool on esitatud näited katsesegu koostise kohta.
|
Uuritava kemikaali lõplik massikontsentratsioon katsepudelis
(mg/l)
|
Uuritava kemikaali kogus
(ml)
|
Reaktiivid ja segu koostisosad
(ml)
|
|
Põhilahus a:10 g/l(punkt 18)
|
Põhilahus b:1 g/l(punkt 18)
|
Lahjendusvesi
(punkt 14)
|
Inokulum
(punkt 16)
|
Substraat
(punkt 17)
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Pudeli üldmaht – 160 ml. Vedeliku ruumala – 103 ml.
Gaasi ruumala – 57 ml ehk 35,6 % üldmahust.
|
|
|
30.
|
Lenduva või lahustumatu vedela uuritava kemikaali (vt punkt 27) jaoks ette nähtud piisavast arvust tühjadest pudelitest eemaldatakse õhk samal viisil gaasilise lämmastikuga.
|
Kontrollproovid ja võrdluskemikaal
|
31.
|
Kontrollrühm moodustatakse vähemalt kolmest pudelist, mis sisaldavad üksnes muda ja substraati. Peale selle kasutatakse katses paralleelpudeleid, mis sisaldavad lisaks mudale ja substraadile piisavas koguses võrdluskemikaali 3,5-diklorofenooli põhilahust (punkt 21), et saavutada lõppkontsentratsioon 150 mg/l. Sellel kontsentratsioonil peaks gaasitootmise pärssumise määr olema umbes 50 %. Teise võimalusena kasutatakse võrdluskemikaali mitmes eri kontsentratsioonis. Lisaks kasutatakse katses pH määramiseks veel nelja pudelit, mis sisaldavad muda, hapnikuvaba vett ja substraati. Kahte pudelisse lisatakse uuritavat kemikaali katses kasutatavas suurimas kontsentratsioonis ja ülejäänud kahte pudelisse lisatakse hapnikuvaba vett.
|
|
32.
|
Veendutakse, et kõik uuritava kemikaaliga, võrdluskemikaaliga või kontrollseguga pudelid sisaldavad samas koguses (VR) vedelikku; vajaduse korral lisatakse vedelikumahu suurendamiseks hapnikuvaba deioniseeritud vett (punkt 14). Vabaruum peaks moodustama 10–40 % pudeli üldmahust; selle täpne väärtus valitakse eelkatsest saadud andmete põhjal. Pärast kõikide koostisosade lisamist pudelisse eemaldatakse gaasi juhtimiseks kasutatud nõel ja kõik pudelid suletakse kummikorgi ja alumiiniumist pressrõngaga (punkti 12 alapunkt b), niisutades korki paigaldamise hõlbustamiseks tilga deioniseeritud veega. Iga pudeli sisu segatakse loksutamise teel.
|
Pudelite inkubeerimine
|
33.
|
Pudelid paigutatakse reguleeritava temperatuuriga inkubaatorisse, mis on soovitatavalt varustatud loksutamisseadmega, ja neid hoitakse temperatuuril 35 ± 2 °C. Pudeleid inkubeeritakse pimedas. Umbes 1 tunni pärast võrdsustatakse rõhk pudelites atmosfäärirõhuga, torgates rõhumõõturiga (punkti 12 alapunkt c) ühendatud süstlanõela ükshaaval läbi iga pudeli korgi, avades ventiili ja sulgedes selle taas pärast rõhumõõturi näidu langemist nulli. Nõel tuleks gaasi lekkimise ärahoidmiseks sisestada pudelisse umbes 45-kraadise nurga all. Kui pudelite inkubeerimisel ei kasutata loksutamisseadet, loksutatakse pudeleid süsteemi tasakaalustamiseks käsitsi kaks korda päevas kogu inkubeerimisperioodi vältel. Pudelite inkubeerimisel pööratakse need tagurpidi, et hoida ära gaasi lekkimist läbi korgi. Tagurpidi pööramine ei ole siiski sobiv juhtudel, kus lahustumatu kemikaal võib pudeli põhja külge kinni jääda.
|
Rõhu mõõtmine
|
34.
|
Kui temperatuur pudelites on saavutanud väärtuse 35 ± 2 °C, mõõdetakse ja registreeritakse pH kahes neljast selleks ette nähtud pudelist ning nende pudelite sisu kõrvaldatakse; ülejäänud pudeleid inkubeeritakse pimedas edasi. Rõhku pudelites mõõdetakse ja registreeritakse järgneva 48–72 tunni jooksul kaks korda päevas, torgates rõhumõõturi nõela ükshaaval läbi iga pudeli korgi ja kuivatades nõela pärast iga mõõtmist. Pudeli kõiki osi hoitakse mõõtmise ajal inkubeerimistemperatuuril ja mõõtmine tuleks lõpule viia võimalikult kiiresti. Rõhunäidul lastakse stabiliseeruda ja see registreeritakse. Seejärel avatakse ventiil gaasi väljalaskmiseks ja suletakse see pärast rõhunäidu langemist nulli. Katse tavapärane kestus on 48 tundi alates rõhu esmakordse võrdsustamise hetkest ehk aja nullpunktist. Lenduva kemikaali puhul tuleks kemikaali kao minimeerimiseks piirduda rõhu mõõtmise ja võrdsustamisega ühel korral (inkubeerimise lõppedes) või kahel korral (10).
|
|
35.
|
Kui rõhunäit on negatiivne, siis ventiili ei avata. Mõnikord koguneb süstlanõela ja voolikusse niiskust, millest annab märku väike negatiivne rõhunäit. Sellisel juhul eemaldatakse nõel, raputatakse voolikut, kuivatatakse see pehmepaberiga ja paigaldatakse uus nõel.
|
pH mõõtmine
|
36.
|
Pärast viimast rõhu mõõtmist mõõdetakse ja registreeritakse iga pudeli sisu pH.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Tulemuste esitamine
|
37.
|
Iga paralleelpudelite partii puhul arvutatakse igal mõõtmiskorral registreeritud rõhu keskväärtus ja summaarne rõhk ning gaasi keskmine kumulatiivne kogurõhk. Koostatakse keskmise kumulatiivse gaasitoodangu (Pa) ajast sõltuvuse kõverad kontrollproovide, uuritava kemikaaliga proovide ja võrdluskemikaaliga proovide kohta. Kõvera lineaarses osas valitakse üks ajapunkt – tavaliselt 48 tundi – ja arvutatakse pärssumise protsentuaalne määr (I) igal kontsentratsioonil vastavalt järgmisele võrrandile:
|
I = (1 – Pt/PC) × 100
|
[1],
|
kus
|
|
I on pärssumise protsentuaalne määr,
|
|
|
Pt on valitud ajahetkeks uuritava kemikaali juuresolekul toodetud gaasi rõhk paskalites (Pa) ja
|
|
|
Pc on samaks ajahetkeks kontrollrühmas toodetud gaasi rõhk paskalites (Pa).
|
On soovitatav koostada kaks kõverat, millest üks väljendab I sõltuvust kontsentratsioonist ja teine I sõltuvust kontsentratsiooni logaritmist, ning valida neist lineaarsele sõltuvusele lähedasem kõver. Valitud kõvera põhjal määratakse visuaalselt või regressioonanalüüsi teel EC50 hinnanguline väärtus (mg/l). Võrdlemise hõlbustamiseks võib olla otstarbekam väljendada kemikaali kontsentratsiooni milligrammides kuivaine üldmassi grammi kohta. Sellise kontsentratsiooni saamiseks jagatakse kemikaali massikontsentratsioon (mg/l) muda kuivaine massikontsentratsiooniga (g/l) (punkt 16).
|
|
38.
|
Arvutatakse kas pärssumise protsentuaalne määr võrdluskemikaali ainsal kasutatud kontsentratsioonil või piisava arvu kontsentratsioonide kasutamise korral EC50.
|
|
39.
|
Kontrollrühmas toodetud gaasi keskmine rõhk Pc (Pa) teisendatakse rõhumõõturi kaliibrimiskõvera alusel (2. liide) ruumalaks ja selle põhjal arvutatakse gaasisaagis, mida väljendatakse gaasi mahuna, mis on toodetud 48 tunni jooksul 100 ml lahjendamata mudast, mille tahke aine sisaldus on 2–4 % (20–40 g/l).
|
Nõuetekohasuse kriteeriumid
|
40.
|
Rahvusvahelise Standardiorganisatsiooni laboritevahelise uuringu (5) tulemustest nähtub, et võrdluskemikaal (3,5-diklorofenool) pärsib gaasitootmist 50 % võrra kontsentratsioonivahemikus 32–510 mg/l keskväärtusega 153 mg/l (punkt 10). See vahemik on nii lai, et nõuetekohasuse kriteeriumidena ei ole võimalik kehtestada pärssiva mõju usaldusväärseid piirmäärasid; see peaks saama võimalikuks, kui leitakse viis, kuidas muuta inokulumid ühetaolisemaks. Kontrollpudelites 48 tunni jooksul toodetud gaasi kogus jäi vahemikku 21–149 ml muda kuivaine grammi kohta (keskmine: 72 ml/g). Ei täheldatud selget seost toodetud gaasikoguse ja asjaomase EC50 väärtuse vahel. Katse lõpus mõõdetud pH jäi vahemikku 6,1–7,5.
|
|
41.
|
Katse loetakse nõuetekohaseks, kui võrdluskemikaaliga rühmas, kus 3,5-diklorofenooli kontsentratsioon on 150 mg/l, on pärssumise määr üle 20 %, kemikaalita kontrollrühmas toodetakse üle 50 ml gaasi kuivaine grammi kohta ning pH väärtus jääb katse lõpus vahemikku 6,2–7,5.
|
Katseprotokoll
|
42.
|
Katseprotokollis esitatakse järgmine teave.
|
|
Uuritav kemikaal:
|
—
|
tavanimetus, keemiline nimetus, CASi number, struktuurivalem ja asjakohased füüsikalis-keemilised omadused;
|
|
—
|
uuritava kemikaali puhtus (lisandid).
|
|
|
|
Katsetingimused:
|
—
|
katsenõudes oleva vedeliku ja vabaruumi maht;
|
|
—
|
katsenõude ja gaasimõõteseadme kirjeldus (nt rõhumõõturi tüüp);
|
|
—
|
teave uuritava kemikaali ja võrdluskemikaali lisamise kohta katsesüsteemi, katses kasutatud kontsentratsioonide kohta ja lahustite kasutamise kohta;
|
|
—
|
kasutatud inokulumi üksikasjalikud andmed: reoveepuhasti nimi, töödeldava reovee päritolu kirjeldus (nt töötemperatuur, muda retentsiooniaeg, kas tegemist on peamiselt olmereovee või tööstusliku reoveega jne), tahke aine sisaldus, gaasitootmise intensiivsus anaeroobses kääritusmahutis, varasem kokkupuude või võimalik eelnev kohanemine mürgiste kemikaalidega, muda või sette võtmise koht jne;
|
|
—
|
inkubeerimise temperatuur ja kestus;
|
|
|
|
Tulemused:
|
—
|
pH väärtus katse lõpus;
|
|
—
|
kõik asjakohased katsenõudest, kemikaalita kontrollnõudest ja võrdluskemikaaliga nõudest saadud mõõteandmed (nt rõhk paskalites või millibaarides) tabeli kujul;
|
|
—
|
pärssumise protsentuaalne määr katsepudelites ja võrdluskemikaaliga pudelites ning pärssumise määra ja kontsentratsiooni vahelise sõltuvuse kõverad;
|
|
—
|
arvutatud EC50 väärtused, väljendatuna kujul mg/l ja mg/g;
|
|
—
|
gaasitoodang muda grammi kohta 48 tunni jooksul;
|
|
—
|
iga katsetulemuste arvestamata jätmise põhjendus;
|
|
—
|
tulemuste arutelu, milles muu hulgas käsitletakse kõiki kõrvalekaldeid käesolevast katsemeetodist ning kõiki segavatest asjaoludest ja vigadest tulenevaid kõrvalekaldeid eeldatavatest katsetulemustest;
|
|
—
|
teave selle kohta, kas katse eesmärk oli mõõta mürgisust kemikaaliga varem kokku puutunud mikroorganismidele või sellega varem mitte kokku puutunud mikroorganismidele.
|
|
|
KIRJANDUS
|
(1)
|
Käesoleva lisa peatükk C.11 „Aktiivmuda mikroorganismide hingamise (süsiniku ja ammooniumi oksüdeerimise) pärssimise katse”.
|
|
(2)
|
Käesoleva lisa peatükk C.43 „Orgaaniliste ainete anaeroobne biolagunevus läbikäärinud mudas: mõõtmine gaasi eraldumise järgi”.
|
|
(3)
|
Rahvusvaheline Standardiorganisatsioon (2003). ISO 13641-1: Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1: General Test.
|
|
(4)
|
Rahvusvaheline Standardiorganisatsioon (2003). ISO 13641-2: Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 2: Test for low biomass concentrations.
|
|
(5)
|
Rahvusvaheline Standardiorganisatsioon (2000). Ring test of ISO 13641-1 and ISO 13641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans, M. R., ja Painter, H. A. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham TQ5 8BA, Ühendkuningriik.
|
|
(6)
|
Swanwick, J. D., ja Foulkes, M. (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Water Pollut. Control 70: 58–70.
|
|
(7)
|
HMSO (1986). Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X. Väljaandes: Methods for the Examination of Waters and Associated Materials. Ühendkuningriik.
|
|
(8)
|
Shelton, D. R., ja Tiedje, J. M. (1984). General method for determining anaerobic biodegradation potential. Appl. Environ. Microb. 47: 850–857.
|
|
(9)
|
Battersby, N. S., ja Wilson, V. (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17: 2441–2460.
|
|
(10)
|
Wilson, V., Painter, H. A., ja Battersby, N. S. (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. International Symposium on Ecotoxicology. Proceedings: Ecotoxicological Relevance of Test Methods; November 19-20, 1990, GSF-Forschungzentrum Neuherberg. Saksamaa. Toim. Steinberg, C., ja Kettrup, A. Lk 117–132 (1992).
|
|
(11)
|
Kawahara, K., Yakabe, Y., Chida, T., ja Kida, K. (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere 39: 2007–2018.
|
|
(12)
|
Rahvusvaheline Standardiorganisatsioon (1995). ISO 10634: Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(13)
|
Rahvusvaheline Standardiorganisatsioon (1997). ISO 11923: Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
1. liide
Näide seadme kohta, millega mõõdetakse gaasirõhku toodetava biogaasi koguse määramiseks

Selgitus:
|
1
|
–
|
rõhumõõtur
|
|
2
|
–
|
gaasikindel kolmikventiil
|
|
3
|
–
|
süstlanõel
|
|
4
|
–
|
gaasikindel kork (pressrõngas ja tihendkork)
|
|
5
|
–
|
vabaruum
|
|
6
|
–
|
kääriva muda inokulum
|
Katsenõusid hoitakse temperatuuril 35 ± 2 °C.
2. liide
Rõhumõõturi näidu teisendamine
Rõhumõõturi näidu põhjal gaasikoguse arvutamiseks võib kasutada standardkõverat, mille alusel leitakse muda kuivaine grammi kohta 48 tunni jooksul toodetud gaasi kogus. Seda muda aktiivsuse näitajat kasutatakse ühe kriteeriumina katsetulemuste nõuetekohasuse hindamisel. Kaliibrimiskõvera koostamiseks süstitakse teadaolev kogus gaasi temperatuuril 35 ± 2 °C seerumipudelisse, mis sisaldab reaktsioonisegu ruumalale (VR) vastavas koguses vett.
|
—
|
Viide seerumipudelisse viiakse temperatuuril 35 ± 2 °C hoitava vee alikvoot ruumalaga VR (ml). Pudelid suletakse ja paigutatakse tasakaalustamiseks 1 tunniks veevanni, mille temperatuur on 35 ± 2 °C.
|
|
—
|
Rõhumõõtur pannakse tööle, näidul lastakse stabiliseeruda ja see reguleeritakse nulli.
|
|
—
|
Süstlanõel torgatakse läbi ühe pudeli korgi, avatakse ventiil ja suletakse see pärast rõhumõõturi näidu langemist nulli.
|
|
—
|
Seda toimingut korratakse ülejäänud pudelitega.
|
|
—
|
Igasse pudelisse süstitakse 1 ml õhku temperatuuriga 35 ± 2 °C. Mõõturiga ühendatud nõel torgatakse läbi ühe pudeli korgi ja rõhunäidul lastakse stabiliseeruda. Registreeritakse rõhu väärtus, avatakse ventiil ja suletakse see pärast rõhunäidu langemist nulli.
|
|
—
|
Seda toimingut korratakse ülejäänud pudelitega.
|
|
—
|
Kõiki kirjeldatud toiminguid korratakse, kasutades 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml ja 50 ml õhku.
|
|
—
|
Koostatakse rõhu (Pa) ja lisatud gaasikoguse (ml) vahelist sõltuvust väljendav teisendusgraafik. Seadme näidu sõltuvus gaasikogusest on lineaarne vahemikus 0–70 000 Pa ja toodetud gaasikoguste vahemikus 0–50 ml.
|
3. liide
Valesid tulemusi põhjustada võivad teadaolevad tegurid
a) Pudelikorkide kvaliteet
Seerumipudelite jaoks on müügil eri tüüpi tihendkorke; paljud neist – sealhulgas butüülkummist korgid – kaotavad käesoleva katsemeetodi kohastes tingimustes pärast nõelaga läbitorkamist oma gaasikindluse. Mõnikord langeb rõhk pärast süstlanõela korgist läbi torkamist väga aeglaselt. Lekete ärahoidmiseks soovitatakse kasutada gaasikindlaid tihendkorke (punkti 12 alapunkt b).
b) Niiskus süstlanõelas
Mõnikord koguneb süstlanõela ja voolikusse niiskust, millest annab märku väike negatiivne rõhunäit. Olukorra parandamiseks eemaldatakse nõel, raputatakse voolikut, kuivatatakse see pehmepaberiga ja paigaldatakse uus nõel (punkti 12 alapunkt c ja punkt 35).
c) Hapnikuga saastumine
Anaeroobseid protsesse käsitlevate meetoditega võidakse saada valed tulemused hapnikuga saastumise tõttu, mille tagajärjel võib gaasitootmine väheneda. Käesoleva katsemeetodi puhul peaks see võimalus olema väga väike, kuna kasutatakse üksnes anaeroobsete protsesside jaoks ette nähtud metoodikat, sealhulgas kindakambrit.
d) Mudas sisalduvad suuremõõtmelised substraadid
Anaeroobset gaasitootmist ja muda tundlikkust mõjutavad koos inokulumiga katsepudelisse viidavad substraadid. Olmereovee kääritusmahutitest pärit kääriv muda sisaldab sageli veel äratuntavaid koostisosi, näiteks juukseid ja tselluloosist koosnevaid taimejääke, mis võivad muuta representatiivse proovi võtmise raskeks. Mudas leiduvad suured lahustumatud koostisosad saab kõrvaldada sõelumise teel, mis suurendab representatiivsete proovide saamise tõenäosust (punkt 16).
e) Lenduv uuritav kemikaal
Lenduv uuritav kemikaal koguneb katsepudeli vabaruumi. See võib kaasa tuua uuritava kemikaali osalise kao süsteemist rõhu mõõtmisele järgneva gaasi väljalaskmise ajal ning sellest tuleneva EC50 väärtuse ülehindamise. Kõnealust viga on võimalik vähendada, kui valitakse sobiv vabaruumi mahu ja vedelikumahu suhe ega lasta pärast rõhu mõõtmist gaasi välja (10).
f) Toodetava gaasikoguse mittelineaarne suurenemine
Kui kõver, mis väljendab keskmise kumulatiivse toodetud gaasikoguse sõltuvust inkubeerimisajast, ei ole 48 tunni pikkuse perioodi lõikes üldjoontes lineaarne, võib katsetulemuste täpsus väheneda. Selle ärahoidmiseks võib abi olla erinevast allikast pärit kääriva muda kasutamisest ja/või toitepuljongit, pärmiekstrakti ja glükoosi sisaldava katsesubstraadi (punkt 29) sisalduse suurendamisest.
4. liide
Mõju hindamine väikese biomassisisaldusega keskkonnaproovide – anaeroobse muda, sette jmt – puhul
SISSEJUHATUS
A.1. Üldjuhul on mikroobide eriaktiivsus (tahke aine kuivmassi grammi kohta toodetava gaasi kogus) loodusliku anaeroobse muda, sette, mulla jmt puhul palju väiksem kui reoveest pärit anaeroobse muda puhul. Sellest tulenevalt on vaja sellistele väiksema aktiivsusega proovidele avalduva kemikaalide pärssiva mõju hindamiseks teatavaid katsetingimusi muuta. Kõnealuste väiksema aktiivsusega proovide puhul on võimalik kasutada ühte kahest üldisest lähenemisviisist:
|
a)
|
teha muudetud kujul eelkatse (punkt 25) lahjendamata mudaproovi, mullaproovi vmt-ga temperatuuril 35 ± 2 °C või keskkonnatingimuste täpsemaks jäljendamiseks proovi kogumiskohas valitseval temperatuuril (nagu on kirjeldatud standardi ISO 13641 1. osas);
|
|
b)
|
teha katse kääritusmahutist pärit sajakordselt lahjendatud reoveemudaga, et jäljendada keskkonnaproovi eeldatavalt väikest aktiivsust, ent hoida temperatuuri väärtusel 35 ± 2 °C (nagu on kirjeldatud standardi ISO 13 641 2. osas).
|
A.2. Valiku a puhul võib järgida siin kirjeldatud meetodit (mis on samaväärne standardi ISO 13641 1. osaga), kuid on oluline teha eelkatse (punkt 25) optimaalsete tingimuste kindlakstegemiseks, kui need ei ole varasematest katsetest juba teada. Muda- või setteproov tuleks näiteks segisti abil põhjalikult läbi segada ning lahjendada seda vajaduse korral väikese koguse desaereeritud lahjendusveega (punkt 14), et muuta see laiaotsalise pipeti või mõõtesilindriga ülekandmiseks piisavalt vedelaks. Kui leitakse, et toitaineid on liiga vähe, võib mudaproovi tsentrifuugida (anaeroobsetes tingimustes) ja suspendeerida selle uuesti pärmiekstrakti sisaldavas mineraalses toitelahuses (A.11).
A.3. Valik b. Selle valiku puhul jäljendatakse piisavalt hästi keskkonnaproovide väikest aktiivsust, saavutamata samal ajal sellistele proovidele omast suurt hõljuvaine sisaldust. Kõnealuse hõljuvaine roll pärssiva mõju avaldumisel ei ole teada, kuid on võimalik, et uuritava kemikaali reageerimine muda koostisosadega ja adsorbeerumine tahketele osakestele vähendab uuritava kemikaali mürgisust.
A.4. Üks oluline tegur on ka temperatuur: tingimuste range jäljendamise huvides tuleks katse teha proovivõtukoha temperatuuril, kuna on teada, et eri rühmadesse kuuluvad metaani tootvad bakterid eelistavad eri temperatuurivahemikke – termofiilid temperatuuri umbes 30–35 °C, mesofiilid temperatuuri 20–25 °C ja psührofiilid temperatuuri alla 20 °C – ning neile avalduv pärssiv mõju võib olla erinev.
A.5. Kestus. Võrdlusuuringus täheldati, et 1. osa kohases üldkatses lahjendamata reoveemudaga toodetakse 2–4 ööpäeva jooksul alati piisavas koguses gaasi, kuid 2. osa kohases katses sajakordselt lahjendatud reoveemudaga toodetakse sama perioodi jooksul liiga vähe gaasi või ei toodeta seda üldse. Madsen et al. (1996) on viimati nimetatud katset kirjeldades seisukohal, et katse kestus peaks olema vähemalt 7 ööpäeva.
Katse väikesel biomassi kontsentratsioonil (valik b)
Põhitekstis tuleks teha järgmised muudatused ja parandused, millega täiendatakse mõnda olemasolevat punkti või alapunkti või asendatakse need.
A.6. Punkti 6 „Katse põhimõte” täiendatakse järgmiselt:
„Seda meetodit võib kasutada sajakordselt lahjendatud anaeroobse reoveemuda puhul, millega osaliselt jäljendatakse loodusliku muda ja sette väikest aktiivsust. Inkubeerimistemperatuur võib olla kas 35 °C või proovi kogumiskohas valitsev temperatuur. Kuna bakterite aktiivsus sellises proovis on oluliselt väiksem kui lahjendamata reoveemudas, tuleks inkubeerimisperioodi pikendada vähemalt 7 ööpäevani.”
A.7. Punkti 12 alapunkti a täiendatakse järgmiselt:
„inkubaator peaks olema võimeline hoidma ka madalamat, 15 °C-ni ulatuvat temperatuuri;”
A.8. Punkti 13 lõppu lisatakse järgmine reaktiiv:
„Fosforhape (H3PO4) – 85 massiprotsendiline vesilahus.”
A.9. Punkti 16 lõppu lisatakse järgmine lause:
„Katses kasutava tahke kuivaine lõplik üldsisaldus on 0,20 ± 0,05 g/l.”
A.10. Punkt 17: katsesubstraat.
Seda substraati ei kasutata, vaid see asendatakse pärmiekstraktiga (vt punktid 17, A.11, A.12 ja A.13).
A.11. Anaeroobse reoveemuda lahjendamiseks on vaja mikroelemente sisaldavat mineraalset toitelahust, millele mugavuse huvides lisatakse orgaanilise substraadina pärmiekstrakt.
Punkti 17 lõppu lisatakse järgmine tekst:
|
„a)
|
Katses kasutatav mineraalne toitelahus pärmiekstraktiga.
|
See toitelahus valmistatakse 10 korda kontsentreeritumast toitelahusest (punkti 17 alapunkt b ja punkt A.12) ja mikroelementide lahusest (punkti 17 alapunkt c ja punkt A.13). Kasutatakse äsja tarnitud naatriumsulfiidnonahüdraati (punkti 17 alapunkt b ja punkt A.12) või pestakse ja kuivatatakse see enne kasutamist, et tagada selle piisav redutseerimisvõime. Kui katse tegemisel ei kasutata kindakambrit (punkti 12 alapunkt j), tuleks suurendada naatriumsulfiidi sisaldust põhilahuses nii, et see oleks 1 g/l asemel 2 g/l. Naatriumsulfiidi võib oksüdeerumisohu vähendamiseks lisada sobiva põhilahuse kujul ka suletud katsepudeli korgi kaudu, et saavutada lõppsisaldus 0,2 g/l. Teise võimalusena võib kasutada titaan(III)tsitraati (punkti 17 alapunkt b). See lisatakse suletud katsepudeli korgi kaudu, et saavutada kontsentratsioon 0,8–1,0 mmol/l. Titaan(III)tsitraat on vähemürgine ja väga tõhus redutseeriv aine, mis valmistatakse järgmiselt: 2,94 g trinaatriumtsitraatdihüdraati lahustatakse 50 ml hapnikuvabas lahjendusvees (punkt 14), et saada lahus kontsentratsiooniga 200 mmol/l, ning lisatakse 5 ml titaan(III)kloriidi lahust (15 g ainet 100 ml lahjendusvee kohta). Lahuse pH reguleeritakse naatriumkarbonaadiga tasemele 7 ± 0,5 ühikut ja see viiakse gaasilise lämmastiku joa all sobivasse seerumipudelisse. Titaan(III)tsitraadi kontsentratsioon selles põhilahuses on 164 mmol/l. Toitelahust kasutatakse kohe või säilitatakse 4 °C juures kuni 1 ööpäev.
|
A.12.
|
b)
|
Kümme korda kontsentreeritum toitelahus – valmistatakse järgmistest koostisainetest:
|
veevaba kaaliumdivesinikfosfaat (KH2PO4)
|
2,7 g;
|
|
dinaatriumvesinikfosfaat (Na2HPO4)
|
4,4 g
|
|
(või 11,2 g dodekahüdraati);
ammooniumkloriid (NH4Cl)
|
5,3 g;
|
|
kaltsiumkloriiddihüdraat (CaCl2 · 2H2O)
|
0,75 g;
|
|
magneesiumkloriidheksahüdraat (MgCl2 · 6H2O)
|
1,0 g;
|
|
raud(II)kloriidtetrahüdraat (FeCl2 · 4H2O)
|
0,2 g;
|
|
resasuriin (redoksindikaator)
|
0,01 g;
|
|
naatriumsulfiidnonahüdraat (Na2S · 9H2O)
|
1,0 g
|
|
või titaan(III)tsitraat lõppkontsentratsiooniga
|
0,8–1,0 mmol/l;
|
|
mikroelementide lahus (vt punkti 17 alapunkt c ja punkt A.13)
|
10,0 ml;
|
|
pärmiekstrakt
|
100 g.
|
|
Ained lahustatakse lahjendusvees (punkt 14) ja lahuse ruumala viiakse
|
1 000 milliliitrini.
|
|
|
A.13.
|
c)
|
Mikroelementide lahus – valmistatakse järgmistest koostisainetest:
|
mangaan(II)kloriidtetrahüdraat (MnCl2 · 4H2O)
|
0,5 g;
|
|
ortoboorhape (H3BO3)
|
0,05 g;
|
|
tsinkkloriid (ZnCl2)
|
0,05 g;
|
|
vask(II)kloriid (CuCl2)
|
0,03 g;
|
|
naatriummolübdaatdihüdraat (Na2MoO4 · 2H2O)
|
0,01 g;
|
|
koobalt(II)kloriidheksahüdraat (CoCl2 · 6H2O)
|
1,0 g;
|
|
nikkel(II)kloriidheksahüdraat (NiCl2 · 6H2O)
|
0,1 g;
|
|
dinaatriumselenit (Na2SeO3)
|
0,05 g.
|
|
Ained lahustatakse lahjendusvees (punkt 14) ja lahuse ruumala viiakse
|
1 000 milliliitrini.”
|
|
A.14. Punkt 25: eelkatse.
On oluline teha eelkatse punktis 24 kirjeldatud viisil; ainsa erinevusena peaks muda tahke aine sisaldus olema kirjeldatust sada korda väiksem ehk 0,1 g/l, 0,2 g/l ja 0,4 g/l. Inkubeerimise kestus peaks olema vähemalt 7 ööpäeva.
Märkus: võrdlusuuringus (5) oli vabaruumi maht liiga suur – 75 % üldruumalast; see peaks jääma soovitatavasse vahemikku 10–40 %. Siin tuleks asjakohase kriteeriumina tagada, et umbes 80-protsendilise pärssumise puhul toodetav gaasikogus oleks mõõdetav vastuvõetava täpsusega (nt ± 5 % kuni ± 10 %).
A.15. Punktid 26–30: uuritava kemikaali, inokulumi ja substraadi lisamine.
Kõnealused koostisosad lisatakse nimetatud punktides kirjeldatud viisil, kuid substraadilahus (punkt 17) asendatakse toitelahusega, mis sisaldab substraadina pärmiekstrakti (A.11).
Samuti vähendatakse muda kuivaine lõppsisaldust nii, et see on 2–4 g/l asemel 0,2 ± 0,05 g/l (A.9). Koostisosade lisamise kohta on esitatud kaks näidet tabelis A.1, millega asendatakse tabel punktis 29.
A.16. Punkt 33: pudelite inkubeerimine.
Kuna gaasitootmise kiirus on eeldatavalt väiksem, kestab inkubeerimine vähemalt 7 ööpäeva.
A.17. Punkt 34: rõhu mõõtmine.
Kui on vaja registreerida gaasikogus gaasifaasis, kasutatakse pudelite vabaruumis rõhu mõõtmiseks punktis 34 kirjeldatud meetodit. Kui soovitakse mõõta CO2 ja CH4 summaarset üldkogust, vähendatakse vedela faasi pH väärtust tasemeni 2 ühikut, süstides igasse asjaomasesse pudelisse H3PO4, ja mõõdetakse rõhku pärast 30 minuti pikkust loksutamist katsetemperatuuril. Inokulumi kvaliteedi kohta täpsema teabe saamiseks tuleks mõõta rõhku igas pudelis siiski nii enne kui ka pärast hapestamist. Näiteks kui CO2 tootmise kiirus on metaanitootmise kiirusest palju suurem, võib kääritavate bakterite tundlikkus muutuda ja/või uuritava kemikaali mõju metaani tootvatele bakteritele on suurem.
A.18. Punkt 36: pH mõõtmine.
H3PO4 kasutamise korral tuleb kasutada eelkõige pH mõõtmiseks täiendavalt paari lisapudelit, kuhu ei lisata H3PO4.
VIIDE:
Madsen, T., Rasmussen, H. B., ja Nilsson, L. (1996). Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No. 336. Veekvaliteedi Instituut, Taani Keskkonnakaitseamet, Kopenhaagen.
Tabel A.1.
Katsepartiide valmistamise näited.
|
Reaktsioonisegu koostisosad
|
Näide 1
|
Näide 2
|
Tavapärane lisamise järjekord
|
|
Valmistatud inokulumi kontsentratsioon (g/l)
|
0,42
|
2,1
|
—
|
|
Lisatav inokulumi kogus (ml)
|
45
|
9
|
4
|
|
Inokulumi sisaldus katsepudelis (g/l)
|
0,20
|
0,20
|
—
|
|
Lisatav toitelahuse kogus (ml)
|
9
|
9
|
2
|
|
Lisatav lahjendusvee kogus (ml)
|
36
|
72
|
3
|
|
Pärmiekstrakti sisaldus katsepudelis (g/l)
|
9,7
|
9,7
|
—
|
|
Uuritava kemikaali põhilahuse kogus (ml)
|
3
|
3
|
1
|
|
Vedeliku üldmaht (ml)
|
93
|
93
|
—
|
5. liide
Mõisted
Käesoleva katsemeetodi puhul kasutatakse järgmisi mõisteid.
Kemikaal
– aine või segu.
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil.
C.35.
LUMBRICULUS'ELE AVALDUVA MÜRGISUSE HINDAMISE KATSE RIKASTATUD SETTEGA SÜSTEEMIS SETE/VESI
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 225 (2007). Põhjasettes elavate setet neelavate loomade kokkupuude settes leiduvate kemikaalidega võib olla ulatuslik ja seepärast tuleks neile erilist tähelepanu pöörata (nt allikad 1, 2, 3). Selliste setet neelavate loomade hulka kuuluvad veekeskkonna väheharjasussid, kes täidavad olulist rolli veeökosüsteemides esinevas settes. Need loomad võivad sette bioturbatsiooni kaudu ja saakloomaks olles mõjutada olulisel määral asjaomaste kemikaalide biosaadavust muudele organismidele, näiteks põhjatoidulistele kaladele. Erinevalt põhjasette pinnal elavatest organismidest kaevuvad põhjasettes elavad veekeskkonna väheharjasussid (nt Lumbriculus variegatus) sette sisse ja neelavad sette pinnast sügavamal paiknevaid setteosakesi. Sellest tulenevalt puutuvad kõnealused katseorganismid uuritava kemikaaliga kokku igal võimalikul viisil (nt nahakaudsel kontaktil ja saastunud setteosakeste allaneelamisel, kuid samuti poorides oleva vee ja sette kohal oleva vee kaudu).
|
|
2.
|
Käesolev katsemeetod on välja töötatud selleks, et hinnata põhjasettes elavale väheharjasussile Lumbriculus variegatus (Müller) avalduvat mõju pikaajalisel kokkupuutel settes esinevate kemikaalidega. Meetod põhineb olemasolevatel sette mürgisuse ja bioakumuleerumise hindamise meetoditel (nt allikad 3, 4, 5, 6, 7, 8, 9, 10). Selles käsitletakse staatilisi katsetingimusi. Käesolevas katsemeetodis kasutatakse kokkupuute saavutamiseks sette rikastamist uuritava kemikaaliga. Rikastatud sette kasutamisega jäljendatakse sette saastumist uuritava kemikaaliga.
|
|
3.
|
Kemikaalid, mille mõju settes elavatele organismidele on vaja hinnata, säilivad selles keskkonnas tavaliselt pikka aega. Settes elavad organismid võivad kemikaaliga kokku puutuda mitmel viisil. Iga kokkupuuteviisi suhteline tähtsus ja üldisse mürgisesse mõjusse panuse andmiseks kuluv aeg sõltub asjaomase kemikaali füüsikalis-keemilistest omadustest ja säilivusest looma organismis. Tugevasti adsorbeeruvate kemikaalide (näiteks kemikaalid, mille log Kow > 5) või settega kovalentseid sidemeid moodustavate kemikaalide puhul võib üks oluline kokkupuuteviis olla saastunud toidu allaneelamine. Et selliste kemikaalide mürgisust mitte alahinnata, lisatakse katseorganismide paljunemiseks ja kasvamiseks vajalik sööt settele enne uuritava kemikaaliga töötlemist (11). Kirjeldatav katsemeetod on katse tegemiseks piisavalt üksikasjalik, kuid võimaldab samal ajal kohandada katseplaani vastavalt tingimustele igas konkreetses laboris ja lähtuvalt uuritavate kemikaalide omadustest.
|
|
4.
|
Katsemeetodiga hinnatakse uuritava kemikaali mõju katseorganismide paljunemisele ja biomassile. Katses mõõdetavad bioloogilised näitajad on ellujäänud usside üldarv ja biomass (kuivmass) kokkupuuteperioodi lõpus. Nende andmete analüüsimiseks kasutatakse kas regressioonimudelit, et leida hinnanguline kontsentratsioon, mille puhul mõju ulatus on x % (nt EC50, EC25 või EC10), või statistilise hüpoteesi kontrollimist, et määrata täheldatavat toimet mitteavaldav kontsentratsioon ja vähim täheldatavat toimet avaldav kontsentratsioon.
|
|
5.
|
Paljud olulised ja kasulikud üksikasjad sette mürgisuse hindamist käsitleva käesoleva katsemeetodi väljatöötamiseks pärinevad käesoleva lisa peatükist C.27 „Sette-vee mürgisuskatse surusääsklastel rikastatud sette kasutamisega” (6). See peatükk võeti seega aluseks ning seda muudeti vajalikul viisil, et kohandada seda sette mürgisuse hindamise katsete tegemiseks Lumbriculus variegatus'ega. Peale selle osutatakse muudele dokumentidele, mille hulgas on näiteks USA Materjalide Katsetamise Ühingu dokument „Standard guide for determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates” (3), USA Keskkonnakaitseameti dokument „Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates” (7) ja USA Materjalide Katsetamise Ühingu dokument „Standard guide for collection, storage, characterization, and manipulation of sediments for toxicological testing and for selection of samplers used to collect benthic invertebrates” (12). Lisaks on käesoleva meetodi väljatöötamisel kasutatud olulise teabeallikana katsemeetodi valideerimiseks tehtud võrdlusuuringust (allikas 13: võrdlusuuringu aruanne) saadud praktilisi kogemusi ja kirjanduse andmeid.
|
NÕUTAV TEAVE JA ABITEAVE
|
6.
|
Enne katse alustamist peaksid uuritava kemikaali kohta olema teada näiteks asjakohased ohutusabinõud, sobivad säilitustingimused ja analüüsimeetodid. Juhised selliste kemikaalide mõju hindamiseks, mille füüsikalis-keemilised omadused muudavad katse tegemise raskeks, on esitatud allikas 14.
|
|
7.
|
Enne katse alustamist peaksid uuritava kemikaali kohta olema teada järgmised andmed:
|
—
|
tavanimetus, keemiline nimetus (soovitatavalt IUPACi nimetus), struktuurivalem, CASi registrinumber, puhtus;
|
|
|
8.
|
Lisaks on enne katse alustamist kasulik teada järgmisi andmeid:
|
—
|
jaotuskoefitsient süsteemis oktanool/vesi (Kow);
|
|
—
|
jaotuskoefitsient süsteemis orgaaniline süsinik/vesi (Koc);
|
|
—
|
andmed fotokeemilise muundumise kohta vees;
|
|
|
9.
|
Enne katse alustamist peaksid olema teada ka kasutatava sette teatavad omadused (7). Üksikasjad on esitatud punktides 22–25.
|
KATSE PÕHIMÕTE
|
10.
|
Sarnases füsioloogilises seisundis ussid (sünkroonitud vastavalt 5. liites kirjeldatule) viiakse kokkupuutesse mürgise kemikaaliga, millega on eri kontsentratsioonides töödeldud settefaasi süsteemis sete/vesi. Katsekeskkonnana tuleks kasutada kunstlikku setet ja taastatud vett. Kontrollina kasutatakse katsenõusid, millesse ei lisata uuritavat kemikaali. Uuritav kemikaal lisatakse iga kontsentratsiooni puhul settesse enne sette nõudesse jaotamist, et varieeruvus igale kontsentratsioonile vastavate paralleelnõude vahel oleks minimaalne, ning seejärel lisatakse katseorganismid katsenõudesse, milles kemikaal on saavutanud settes ja vees tasakaalukontsentratsiooni (vt punkt 29). Katseloomadel lastakse süsteemiga sete/vesi kokku puutuda 28 päeva vältel. Tulenevalt kunstliku sette väikesest toitainesisaldusest tuleks settele lisada sööta (vt punktid 22–23 ja 4. liide), et tagada usside kasvamine ja paljunemine kontrolltingimustes. Sel viisil tagatakse, et katseloomad puutuvad kemikaaliga kokku nii vee ja sette kui ka toidu kaudu.
|
|
11.
|
Seda tüüpi katse puhul on soovitatav lõppnäitaja nii sigivuse kui ka biomassi puhul ECx (nt EC50, EC25 või EC10; kontsentratsioon, mille puhul mõju avaldub x protsendile organismidest), mis leitakse võrdluses kontrollrühma andmetega. Tuleks siiski märkida, et arvestades väiksemat mõju väljendava ECx (nt EC10, EC25) väikest täpsusastet, mille puhul usaldusvahemik usaldusnivool 95 % on äärmiselt lai (nt allikas 15) ja hüpoteesi kontrollimise käigus arvutatud statistiline võimsus on väike, loetakse kõige usaldusväärsemaks lõppnäitajaks EC50. Peale selle võib juhul, kui katseplaan ja andmed seda võimaldavad, nii sigivuse kui ka biomassi puhul arvutada täheldatavat toimet mitteavaldava kontsentratsiooni ja vähima täheldatavat toimet avaldava kontsentratsiooni (vt punktid 34–38). Katseplaani koostamisel lähtutakse katse eesmärgist: kas soovitakse määrata ECx või täheldatavat toimet mitteavaldav kontsentratsioon.
|
VÕRDLUSKATSED
|
12.
|
Kontrollrühma organismidega saadud tulemused on eeldatavalt piisav tõendus labori võimekusest kõnealust katset läbi viia ja varasemate andmete olemasolu korral ka tõendus katse korratavuse kohta. Peale selle võib teha korrapäraselt mürgisuse võrdluskatseid, kasutades katseorganismide tundlikkuse hindamiseks mürgist võrdluskemikaali. Katseloomade tundlikkuse ja seisundi rahuldavaks hindamiseks sobib 96 h pikkune mürgisuse võrdluskatse, mis tehakse üksnes vees (4, 7). Teave pentaklorofenooli mürgisuse kohta täismahus katses (28 päeva pikkune kokkupuude rikastatud settega) on esitatud 6. liites ja käesolevat katsemeetodit käsitleva võrdlusuuringu aruandes (13). Pentaklorofenooli ägedat mürgisust üksnes vees kirjeldatakse näiteks allikas 16. Seda teavet saab kasutada katseorganismide tundlikkuse võrdlemiseks võrdluskatsetes, kus mürgise võrdluskemikaalina kasutatakse pentaklorofenooli. L. variegatus'e puhul on soovitatud kasutada mürgise võrdluskemikaalina kaaliumkloriidi (KCl) või vasksulfaati (CuSO4) (4, 7). KCl mürgisust käsitlevate andmete põhjal kvaliteedikriteeriumide kehtestamine on raske, kuna praegu puuduvad kirjanduse andmed L. variegatus'e kohta. Teave vase mürgisuse kohta L. variegatus'ele on esitatud allikates 17–21.
|
KATSE NÕUETEKOHASUS
|
13.
|
Katse vastab nõuetele, kui on täidetud järgmised kriteeriumid.
|
—
|
Võrdlusuuringust (13) nähtub, et Lumbriculus variegatus'e puhul peaks elus usside keskmine arv kontrollrühma paralleelnõu kohta suurenema kokkupuuteperioodi algusega võrreldes kokkupuuteperioodi lõpuks vähemalt 1,8 korda.
|
|
—
|
Sette kohal oleva vee pH jääb kogu katse vältel vahemikku 6–9.
|
|
—
|
Hapnikusisaldus sette kohal olevas vees ei tohiks katse vältel olla väiksem kui 30 % õhu küllastuskontsentratsioonist katsetemperatuuril.
|
|
KATSEMEETODI KIRJELDUS
Katsesüsteem
|
14.
|
Soovitatakse kasutada staatilist süsteemi, mille puhul sette kohal olevat vett ei uuendata. Sette ja vee sobiva vahekorra puhul (vt punkt 15) piisab tavaliselt kergest aereerimisest, et säilitada katseorganismidele vastuvõetav vee kvaliteet (nt tagada võimalikult suur lahustunud hapniku sisaldus ja võimalikult vähene väljaheidete kuhjumine). Poolstaatilist või läbivooluga süsteemi, mille puhul sette kohal olevat vett perioodiliselt või pidevalt uuendatakse, tuleks kasutada üksnes erandjuhul, kuna vee korrapärane uuendamine mõjutab eeldatavalt kemikaali tasakaalukontsentratsiooni (nt põhjustab kemikaali kadu katsesüsteemist).
|
Katsenõud ja seadmed
|
15.
|
Katse läbiviimiseks tuleks kasutada keeduklaase, näiteks mahuga 250 ml ja diameetriga 6 cm. Võib kasutada muid sobivaid klaasnõusid, kui nende puhul tagatakse sette ja selle kohal oleva vee piisav sügavus. Igasse nõusse tuleks kanda umbes 1,5–3 cm paksune kiht valmistatud setet. Settekihi paksuse ja selle kohal oleva veekihi paksuse suhe peaks olema 1:4. Nõude maht peaks vastama asustamistihedusele, st sette massiühiku kohta lisatavale katseusside arvule (vt ka punkt 39).
|
|
16.
|
Katsenõud ja muud seadmed, mis puutuvad kokku uuritava kemikaaliga, peaksid olema üleni klaasist või muust keemiliselt inertsest materjalist. Tuleks hoolikalt jälgida, et seadmete üheski osas ei kasutataks materjale, mis võivad lahustuda, uuritavat kemikaali absorbeerida või muid kemikaale eraldada ning katseloomadele kahjulikku mõju avaldada. Katse kasvukeskkonnaga kokku puutuvates seadmetes tuleks kasutada polütetrafluoroetüleeni, roostevaba terast ja/või klaasi. Orgaaniliste kemikaalide puhul, mis teadaolevalt adsorbeeruvad klaasile, võib olla vaja kasutada silaanitud klaasi. Sellisel juhul tuleb seadmed pärast kasutamist ära visata.
|
Katseliik
|
17.
|
Siin kirjeldatud tüüpi katses kasutatav katseliik on magevee väheharjasuss Lumbriculus variegatus (Müller). See liik on tolerantne paljude eri tüüpi setete suhtes ning seda kasutatakse laialdaselt sette mürgisuse ja bioakumuleerumise hindamise katsetes (nt allikad 3, 5, 7, 9, 13, 15, 16, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35). Tuleks esitada teave katseloomade päritolu, liigi kinnitava määramise (nt allikas 36) ja kultiveerimistingimuste kohta. Liigi määramine iga katse eel ei ole vajalik, kui katseorganismid pärinevad kohapealsest kultuurist.
|
Katseorganismide kultiveerimine
|
18.
|
Sette mürgisuse hindamise katse jaoks piisava arvu usside saamiseks on kasulik säilitada usse alalises laborikultuuris. Lumbriculus variegatus'e laborikultuuris kasvatamise meetodeid käsitlevad juhised ja lähtekultuuride allikad on esitatud 5. liites. Üksikasjalik teave selle liigi kultiveerimise kohta on esitatud allikates 3, 7 ja 27.
|
|
19.
|
On tungivalt soovitatav luua ühte liiki sisaldav kultuur, mis võimaldab tagada, et katsed viiakse läbi sama liigi loomadega. Veendutakse, et kultuuris ja eelkõige katsete jaoks kasutatavatel ussidel ei esine nähtavaid haigustunnuseid ega hälbeid.
|
Vesi
|
20.
|
Katses soovitatakse sette kohal oleva veena kasutada käesoleva lisa peatükis C.1 kirjeldatud taastatud vett; seda võib kasutada ka usside laborikultuuri puhul (selle valmistamist kirjeldatakse 2. liites). Vajaduse korral võib kasutada looduslikku vett. Kasutamiseks valitud vesi peab olema sellise kvaliteediga, mis võimaldab katseloomadel nii kohanemis- kui ka katseperioodi vältel selles kasvada ja paljuneda, ilma et nende välimus või käitumine muutuks ebanormaalseks. On tõendatud, et Lumbriculus variegatus suudab kõnealuses taastatud vees elada, kasvada ja paljuneda (30), ning selline vesi võimaldab katse- ja kultiveerimistingimusi maksimaalselt standardiseerida. Taastatud vee kasutamise korral tuleks esitada selle koostis ning enne kasutamist tuleks määrata vähemalt selle pH, hapnikusisaldus ja karedus (väljendatuna CaCO3 sisaldusena milligrammides liitri kohta). Kasulikku teavet võib anda ka vee kasutuseelne analüüsimine mikrosaasteainete suhtes (vt nt 3. liide).
|
|
21.
|
Sette kohal oleva vee pH peaks jääma vahemikku 6,0–9,0 (vt punkt 13). Kui võib eeldada, et tekib suurem kogus ammoniaaki, peetakse otstarbekaks hoida pH väärtus vahemikus 6,0–8,0. Kui katses hinnatakse näiteks nõrka orgaanilist hapet, on soovitatav kasutada pH reguleerimiseks katses kasutatava vee puhverdamist, näiteks allikas 16 kirjeldatud viisil. Katses kasutatava vee üldkaredus peaks jääma loodusliku vee puhul vahemikku 90–300 mg CaCO3 liitri kohta. OECD juhendi nr 210 (38) kohased lahjendusvee vastuvõetavuse lisakriteeriumid on kokkuvõtlikult esitatud 3. liites.
|
Sete
|
22.
|
Kuna ühest konkreetsest allikast pärit saastumata looduslik sete ei pruugi olla kogu aasta vältel kättesaadav ning selles looduslikult esinevad organismid ja võimalikud mikrosaasteained võivad mõjutada katsetulemusi, tuleks soovitatavalt kasutada valmistatud setet (tuntud ka kui taastatud, kunstlik või sünteetiline sete). Valmistatud sette kasutamisega minimeeritakse katsetingimuste varieeruvus ja looduslikus settes eluneva fauna esinemise võimalus. Allpool kirjeldatud valmistatud sette puhul on lähtutud allikate 6, 39 ja 40 kohasest kunstlikust settest. Seda soovitatakse kasutada siin kirjeldatud tüüpi katse puhul (6, 10, 30, 41, 42, 43).
|
a)
|
4–5 % (kuivmass) turbasamblaturvast; on oluline kasutada keskmise lagunemisastmega, üksnes õhu käes kuivatatud peeneks jahvatatud pulbrilist turvast osakeste suurusega ≤ 0,5 mm.
|
|
b)
|
20 ± 1 % (kuivmass) kaoliinsavi (soovitatav kaoliniidisisaldus üle 30 %).
|
|
c)
|
75–76 % (kuivmass) kvartsliiva (peen liiv tera suurusega ≤ 2 mm, kusjuures > 50 % osakestest peaks olema vahemikus 50–200 μm.
|
|
d)
|
Sette kuivadele koostisosadele lisatav deioniseeritud vesi, 30–50 % sette kuivmassist.
|
|
e)
|
Lõpliku settesegu pH reguleerimiseks lisatakse keemiliselt puhast kaltsiumkarbonaati (CaCO3).
|
|
f)
|
Lõpliku segu orgaanilise süsiniku üldsisaldus peaks olema 2 ± 0,5 % sette kuivmassist ja selle reguleerimiseks tuleks kasutada sobivas koguses alapunktide a ja c kohast turvast ja liiva.
|
|
g)
|
Sette kuivadele koostisosadele lisatav sööt, näiteks farmaatsiastandarditele vastavad inimtarbimiseks ette nähtud kõrvenõgese (Urtica sp.) pulbristatud lehed või selliste lehtede ja α-tselluloosi segu (vahekorras 1:1), 0,4–0,5 % sette kuivmassist; üksikasjalik teave on esitatud 4. liites.
|
|
|
23.
|
Turba, kaoliinsavi, söödamaterjali ja liiva päritolu peaks olema teada. Peale alapunktis g nimetatu on käesoleva lisa peatükis C.27 (6) loetletud võimaliku muu kasutatava toiteallikana järgmine taimne materjal: mooruspuu (Morus alba), valge ristiku (Trifolium repens), spinati (Spinacia oleracea) või orase kuivatatud lehed.
|
|
24.
|
Valitud sööt tuleks lisada settele enne uuritava kemikaali lisamist või sellega samaaegselt. Valitud sööt peaks tagama vähemalt vastuvõetava sigivuse kontrollrühmas. Kasulikku teavet võib anda kunstliku sette või selle koostisosade analüüsimine mikrosaasteainete suhtes. Kunstliku sette valmistamise näide on esitatud 4. liites. Kuivade koostisosade segamine on samuti lubatav, kui tõendatakse, et pärast vee lisamist settele ei toimu sette koostisosade eraldumist (näiteks turbaosakeste kerkimine veepinnale) ja et turvas või sete on ümbritseva keskkonna tingimustes piisavalt tasakaalustunud (vt ka punkt 25 ja 4. liide). Kunstliku sette iseloomustamiseks tuleks esitada vähemalt selle koostisosade päritolu, osakeste suurusjaotus (liiva, aleuriidi ja savi protsentuaalne sisaldus), orgaanilise süsiniku üldsisaldus, veesisaldus ja pH. Redokspotentsiaali mõõtmine ei ole kohustuslik.
|
|
25.
|
Vajaduse korral, näiteks kui katse spetsiifika seda nõuab, võib katse- ja/või kultiveerimissettena kasutada ka saastevabast allikast pärit looduslikku setet (3). Loodusliku sette kasutamisel tuleks esitada vähemalt selle päritolu (kogumiskoht), poorides oleva vee pH ja ammoniaagisisaldus, orgaanilise süsiniku ja lämmastiku üldsisaldus, osakeste suurusjaotus (liiva, aleuriidi ja savi protsentuaalne sisaldus) ja vee protsentuaalne sisaldus (7) ning selline sete ei tohiks olla saastunud ega sisaldada katseorganismidega konkureerida või neist toituda võivaid muid organisme. Redokspotentsiaali ja katioonivahetusmahtuvuse mõõtmine ei ole kohustuslik. Looduslikul settel on enne sellele kemikaali lisamist soovitatav lasta seitsme päeva vältel tasakaalustuda samades tingimustes, mida kasutatakse järgneva katse ajal. Selle kohandamisperioodi lõpus tuleks sette kohal olev vesi eemaldada ja ära visata.
|
|
26.
|
Kasutatav sete peab olema sellise kvaliteediga, mis võimaldab kontrollrühma organismidel kokkupuuteperioodi vältel selles ellu jääda ja paljuneda, ilma et nende välimus või käitumine muutuks ebanormaalseks. Kontrollrühma ussid peaksid settesse kaevuma ja seda alla neelama. Paljunemine kontrollrühmas peaks vastama vähemalt punktis 13 kirjeldatud nõuetekohasuse kriteeriumidele. Tuleks registreerida väljaheitegraanulite esinemine või puudumine sette pinnal – see annab märku sellest, kas ussid neelavad setet, ning võib kokkupuuteviisile osutamise kaudu hõlbustada katsetulemuste tõlgendamist. Sette neelamist käsitleva lisateabe saamiseks võib kasutada allikates 24, 25, 44 ja 45 kirjeldatud meetodeid, milles määratletakse täpsemalt katseorganismide puhul täheldatav sette neelamine või osakeste valimine.
|
|
27.
|
Meetodeid loodusliku sette käitlemiseks enne selle laboris kasutamist kirjeldatakse allikates 3, 7 ja 12. Lumbriculus'ega tehtava katse jaoks soovitatava kunstliku sette valmistamist ja säilitamist kirjeldatakse 4. liites.
|
Uuritava kemikaaliga töötlemine
|
28.
|
Uuritav kemikaal lisatakse settesse. Kuna enamik uuritavaid kemikaale on eeldatavalt vees raskesti lahustuvad, tuleks need põhilahuse valmistamiseks lahustada võimalikult väikeses koguses sobivas orgaanilises lahustis (nt atsetoon, n-heksaan, tsükloheksaan). Katselahuste valmistamiseks tuleks põhilahust lahjendada sama lahustiga. Sobiva lahusti valimisel peaksid peamised kriteeriumid olema lahusti mürgisus ja lenduvus ning uuritava kemikaali lahustuvus valitud lahustis. Iga kontsentratsiooni puhul tuleks kasutada sama kogust asjaomast lahust. Uuritav kemikaal lisatakse iga kontsentratsiooni puhul settesse enne sette nõudesse jaotamist, et kemikaalisisalduse varieeruvus paralleelnõude vahel oleks minimaalne. Iga katselahus segatakse kvartsliivaga, nagu on kirjeldatud punktis 22 (nt 10 g kvartsliiva katsenõu kohta). On leitud, et kvartsliiva täielikuks küllastamiseks piisab 0,20–0,25 ml lahusest grammi liiva kohta. Seejärel tuleb lahustil lasta aurustuda, kuni liiv on kuiv. Uuritava kemikaali samaaegsest aurustumisest tuleneva (nt kemikaali aururõhust sõltuva) kao minimeerimiseks tuleks kemikaaliga kaetud liiva kasutada vahetult pärast kuivatamist. Iga asjaomase kontsentratsiooni puhul segatakse kuiv liiv sobiva koguse valmistatud settega. Sette valmistamisel tuleks arvesse võtta uuritava aine ja liiva seguna lisatavat liivakogust (st sette valmistamisel kasutatav liivakogus peaks olema selle võrra väiksem). Selle meetodi peamine eelis on see, et settesse ei viida praktiliselt üldse lahustit (7). Teise võimalusena võib näiteks loodusliku sette puhul kasutada uuritava kemikaali lisamiseks eespool kirjeldatud viisil kvartsliiva asemel teatud osa settest, mis on kuivatatud ja peeneks jahvatatud, või segada uuritava kemikaali märja settega ja lasta kasutatud lahustil seejärel aurustuda. Tuleks jälgida, et settele lisatav uuritav kemikaal seguneks settega põhjalikult ja jaotuks selles ühtlaselt. Vajaduse korral võib kemikaali soovitud sisaldust settes ja selle jaotumise homogeensust kontrollida osaproovide analüüsimise teel. Kemikaali soovitud sisaldust settes võib olla kasulik kontrollida ka katselahuste osaproovide analüüsimise teel. Kuna kvartsliiva katmiseks uuritava kemikaaliga kasutatakse lahustit, tuleks valmistada ka lahustiga kontrollproovid, millesse lisatakse samas koguses lahustit kui uuritava kemikaaliga proovidesse. Katseprotokolli tuleks märkida rikastamiseks kasutatud meetod ja eespool kirjeldatutest erineva muu meetodi kasutamise korral selle valimise põhjendus. Rikastamismeetodit võib kohandada vastavalt uuritava kemikaali füüsikalis-keemilistele omadustele, näiteks selleks, et hoida ära lendumisest tulenevat kadu kemikaali lisamise või tasakaalustamise ajal. Rikastamismeetodeid käsitlevad lisajuhised on esitatud Environment Canada 1995. aasta dokumendis (46).
|
|
29.
|
Pärast rikastatud sette valmistamist, katsenõudesse jaotamist ja katses kasutatava veega katmist on soovitatav lasta uuritaval kemikaalil jaotuda settefaasi ja veefaasi vahel (nt allikad 3, 7, 9). Seda tuleks soovitatavalt teha katsetemperatuuril ja katses kasutatavates aereerimistingimustes. Vajalik tasakaalustamisaeg sõltub settest ja kemikaalist ning võib ulatuda tundidest päevade ja harvadel juhtudel isegi mitme (4–5) nädalani (nt allikad 27, 47). Käesoleva katsemeetodi puhul ei oodata tasakaalu saabumiseni, vaid kasutatakse soovitatavalt tasakaalustusperioodi kestusega 48 tundi kuni 7 ööpäeva. Sellega minimeeritakse uuritava kemikaali lagunemine. Olenevalt katse eesmärgist, näiteks kui soovitakse jäljendada keskkonnatingimusi, võib rikastatud sette tasakaalustus- või vanandamisperiood olla pikem.
|
|
30.
|
Tasakaalustusperioodi lõpus tuleks uuritava kemikaali sisalduse analüüsimiseks võtta miinimumnõudena proovid sette koondproovist ja selle kohal olevast veest vähemalt suurimal kasutataval kontsentratsioonil ja ühel väiksemal kontsentratsioonil. Kõnealune uuritava kemikaali analüütiline määramine peaks võimaldama arvutada massibilanssi ja väljendada tulemusi lähtuvalt mõõdetud algkontsentratsioonist. Üldjuhul häirib proovivõtmine süsteemi sete/vesi tasakaalu või hävitab selle. Seepärast ei ole tavaliselt võimalik kasutada sama paralleelproovi nii setteproovi võtmiseks kui ka usside jaoks. Analüüsimiseks tuleb võtta kasutusele sobiva suurusega lisanõud, mida käideldakse samal viisil ja mis sisaldavad muu hulgas katseorganisme, kuid mida ei kasutata bioloogiliste vaatluste tegemiseks. Selliste nõude suurus valitakse nii, et see võimaldaks võtta asjaomase analüüsimeetodi puhul vajaliku koguse proovi. Proovivõtmist kirjeldatakse üksikasjalikult punktis 53.
|
KATSE KÄIK
Eelkatse
|
31.
|
Kui uuritava kemikaali mürgisuse kohta Lumbriculus variegatus'ele puuduvad andmed, võib olla kasulik teha eelkatse, et teha kindlaks lõpliku katse jaoks sobiv kontsentratsioonivahemik ja lõplikus katses kasutatavad optimaalsed tingimused. Selleks kasutatakse uuritava kemikaali laia kontsentratsioonide vahemikku. Ussidel lastakse teatava perioodi vältel (nt 28 päeva jooksul, nagu lõplikus katseski) puutuda kokku uuritava kemikaaliga igal kasutataval kontsentratsioonil, et teha kindlaks lõpliku katse jaoks sobivad kontsentratsioonid; paralleelproove ei ole vaja kasutada. Eelkatse käigus tuleks jälgida usside käitumist ja see registreerida, näiteks kui täheldatakse sette vältimist uuritava kemikaali ja/või sette enda tõttu. Eelkatses ei tohiks kasutada kontsentratsiooni, mis on suurem kui 1 000 mg sette kuivmassi kilogrammi kohta.
|
Lõplik katse
|
32.
|
Lõplikus katses tuleks kasutada vähemalt viit kontsentratsiooni, mis on valitud näiteks kontsentratsioonivahemiku leidmiseks tehtud eelkatse (punkt 31) tulemuste põhjal ja mis vastavad punktides 35, 36, 37 ja 38 kirjeldatule.
|
|
33.
|
Lisaks uuritava kemikaaliga proovidele kasutatakse katses kontrollproove (nõutav paralleelproovide arv on esitatud punktides 36, 37 ja 38), mis sisaldavad kõiki koostisosi peale uuritava kemikaali. Kui uuritava kemikaaliga töötlemiseks kasutatakse lahustit, ei tohiks see avaldada katseorganismidele märkimisväärset mõju; selle hindamiseks kasutatakse üksnes lahustiga töödeldud täiendavat kontrolli.
|
Katseplaan
|
34.
|
Katseplaanis nähakse ette katses kasutatavate kontsentratsioonide arv ja intervall, igal kontsentratsioonil kasutatavate nõude arv ning igasse nõusse lisatavate usside arv. Katseplaane ECx ja täheldatavat toimet mitteavaldava kontsentratsiooni hinnangulise väärtuse leidmiseks ning piirsisalduskatse tegemiseks kirjeldatakse punktides 35, 36, 37 ja 38.
|
|
35.
|
Katses kasutatav kontsentratsioonivahemik peaks hõlmama ECx (nt EC50, EC25, EC10) väärtust ja kontsentratsioonivahemikku, mille puhul uuritav kemikaal avaldab huvipakkuvat mõju. Tuleks hoiduda ekstrapoleerimisest väärtuseni, mis on oluliselt väiksem kui väikseim kontsentratsioon, mille puhul täheldatakse mõju katseorganismidele, või suurem kui suurim katses kasutatav kontsentratsioon. Kui sellist ekstrapoleerimist erandjuhul siiski kasutatakse, tuleb katseprotokollis esitada selle kohta ammendav selgitus.
|
|
36.
|
Kui soovitakse leida ECx hinnanguline väärtus, tuleks katses kasutada vähemalt viit kontsentratsiooni ja iga kontsentratsiooni kohta vähemalt kolme paralleelproovi; kontrollrühmas esineva varieeruvuse täpsemaks hindamiseks soovitatakse kontrollproovide puhul ja lahusti kasutamise korral ka lahustiga kontrollproovide puhul kasutada kuut paralleeli. Usaldusväärse mudelipõhise hinnangulise väärtuse saamiseks on kõikidel juhtudel soovitatav kasutada piisavat arvu katsekontsentratsioone. Kontsentratsioonide jada tegur ei tohiks olla suurem kui kaks (erandi võib teha juhul, kui kontsentratsiooni ja mõju vahelise sõltuvuse kõvera tõus on lauge). Paralleelproovide arvu igal kontsentratsioonil võib vähendada, kui suurendatakse selliste katsekontsentratsioonide arvu, mille puhul mõju ulatus on 5–95 %. Paralleelproovide arvu suurendamise või katsekontsentratsioonide intervalli vähendamise korral muutub usaldusvahemik tavaliselt kitsamaks.
|
|
37.
|
Kui soovitakse leida vähim täheldatavat toimet avaldav kontsentratsioon või täheldatavat toimet mitteavaldav kontsentratsioon, tuleks kasutada vähemalt viit katsekontsentratsiooni ja iga kontsentratsiooni kohta vähemalt nelja paralleelproovi (kontrollrühmas esineva varieeruvuse täpsemaks hindamiseks soovitatakse kontrollproovide puhul ja lahusti kasutamise korral ka lahustiga kontrollproovide puhul kasutada kuut paralleeli) ning kontsentratsioonide jada tegur ei tohiks olla suurem kui kaks. Teave käesolevat katsemeetodit käsitlevas võrdlusuuringus hüpoteesi kontrollimise käigus arvutatud statistilise võimsuse kohta on esitatud 6. liites.
|
|
38.
|
Kui võib eeldada (nt kontsentratsioonivahemiku leidmiseks tehtud eelkatse põhjal), et kemikaal ei avalda kuni kontsentratsioonini 1 000 mg sette kuivmassi kilogrammi kohta mingit mõju, või kui ühest kontsentratsioonist piisab huvipakkuva täheldatavat toimet mitteavaldava kontsentratsiooni määramiseks, võib teha piirsisalduskatse, mis hõlmab ühte katsekontsentratsiooni ja kontrollproove. Sellisel juhul tuleks katseprotokollis esitada piirkontsentratsiooni valimise üksikasjalik põhjendus. Piirsisalduskatse eesmärk on määrata kontsentratsioon, mis on piisavalt suur, et võimaldada otsustajatel välistada kemikaali võimalik mürgine mõju, ning piirsisaldusena sätestatakse kontsentratsioon, mida eeldatavalt üheski olukorras ei saavutata. Soovitatakse kasutada kontsentratsiooni 1 000 mg kuivmassi kilogrammi kohta. Tavaliselt on nii uuritava kemikaaliga rühmas kui ka kontrollrühmas vaja kasutada vähemalt kuut paralleelproovi. Teave käesolevat katsemeetodit käsitlevas võrdlusuuringus hüpoteesi kontrollimise käigus arvutatud statistilise võimsuse kohta on esitatud 6. liites.
|
Kokkupuutetingimused
Katseorganismid
|
39.
|
Katses kasutatakse iga bioloogiliste näitajate määramiseks kasutatava proovi kohta vähemalt 10 ussi. See vastab umbes 50–100 milligrammile märjale biomassile. Kuivmassi eeldatava 17,1-protsendilise osakaalu puhul (48) vastab see umbes 9–17 milligrammile kuivale biomassile nõu kohta. USA Keskkonnakaitseameti 2000. aasta dokumendis (7) soovitatakse kasutada usside kogust, mille puhul kuiva biomassi ja orgaanilise süsiniku üldsisalduse vahekord ei oleks suurem kui 1:50. Punktis 22 kirjeldatud valmistatud sette puhul vastab see 2,0-protsendilise orgaanilise süsiniku üldsisaldusega sette kuivmassile umbes 43 grammi 10 ussi kohta. Kui kasutatakse rohkem kui 10 ussi nõu kohta, tuleks sette ja selle kohal oleva vee kogust vastavalt suurendada.
|
|
40.
|
Kõik samas katses kasutatavad ussid peaksid olema sama päritoluga ja sarnases füsioloogilises seisundis (vt 5. liide). Tuleks valida umbes ühesuurused ussid (vt punkt 39). Enne katse algust soovitatakse võtta kaalumiseks usside partiist või tüvikultuurist osaproov, et hinnata usside keskmist kaalu.
|
|
41.
|
Katses kasutatavad ussid eemaldatakse kultuurist (üksikasjalik teave on esitatud 5. liites). Suured (täiskasvanud) loomad, kellel ei täheldata hiljutise fragmenteerumise märke, viiakse puhast vett sisaldavatesse klaasnõudesse (nt Petri tassidesse). Seejärel usside elutegevus sünkroonitakse, nagu on kirjeldatud 5. liites. Pärast 10–14 ööpäeva kestvat regenereerumist tuleks katse jaoks valida sarnase suurusega terved täispikad ussid, kes reageerivad nõrgale mehaanilisele ärritajale aktiivse ujumise või roomamisega. Kui katsetingimused erinevad kultiveerimistingimustest (nt temperatuuri, valgusrežiimi või sette kohal oleva vee omaduste poolest), peaks usside kohandamiseks katsetingimustega piisama näiteks 24 tunni pikkusest kohanemisperioodist katses kasutataval temperatuuril ja valgusrežiimil ning samas vees, mida kasutatakse katses. Katsetingimustega kohanenud väheharjasussid tuleks juhuslikkuse alusel katsenõudesse jaotada.
|
Söötmine
|
42.
|
Ussidele ei anta katse käigus lisasööta, kuna sööt lisatakse settele juba enne uuritava kemikaaliga töötlemist või sellega samaaegselt.
|
Valgus ja temperatuur
|
43.
|
Valgustusperiood on kultuuris ja katse vältel tavaliselt 16 tundi (3, 7). Tuleks kasutada väikest valgustustihedust (nt 100–500 luksi), et jäljendada settepinnale iseloomulikke looduslikke tingimusi, ning selle väärtust tuleks kokkupuuteperioodi vältel mõõta vähemalt ühel korral. Temperatuur peaks olema kogu katse vältel 20 ± 2 °C. Samal temperatuuri mõõtmise päeval ei tohiks katsenõude vaheline temperatuurierinevus olla suurem kui ± 1 °C. Katsenõude paigutus inkubaatoris või katsepinnal peaks olema juhuslik, näiteks selleks, et minimeerida nõude paigutusest tulenevaid erinevusi sigivuse määras.
|
Aereerimine
|
44.
|
Katsenõudes sette kohal olevat vett tuleks kergelt aereerida (nt 2–4 mulli sekundis), kasutades Pasteuri pipetti, mis jääb settepinnast umbes 2 cm kõrgusele, et setet võimalikult vähe häirida. Tuleks jälgida, et lahustunud hapniku sisaldus ei langeks alla 30 % õhu küllastuskontsentratsioonist. Õhu juurdevoolu tuleks kontrollida ja vajaduse korral reguleerida tööpäeviti vähemalt kord päevas.
|
Veekvaliteedi mõõtmine
|
45.
|
Sette kohal asuvas vees tuleks määrata järgmised veekvaliteedi näitajad.
|
Temperatuur:
|
kord nädalas ning kokkupuuteperioodi alguses ja lõpus vähemalt ühes katsenõus iga kontsentratsiooni ja kontrollrühma kohta; peale selle võib võimaluse korral mõõta näiteks iga tunni järel ümbritseva keskkonna (õhu või veevanni vee) temperatuuri.
|
|
Lahustunud hapniku sisaldus:
|
kord nädalas ning kokkupuuteperioodi alguses ja lõpus vähemalt ühes katsenõus iga kontsentratsiooni ja kontrollrühma kohta; väljendatakse milligrammides liitri kohta ja protsentuaalse osakaaluna õhu küllastuskontsentratsioonist.
|
|
Õhu juurdevool:
|
tuleks kontrollida ja vajaduse korral reguleerida tööpäeviti vähemalt kord päevas.
|
|
pH:
|
kord nädalas ning kokkupuuteperioodi alguses ja lõpus vähemalt ühes katsenõus iga kontsentratsiooni ja kontrollrühma kohta.
|
|
Vee üldkaredus:
|
kokkupuuteperioodi alguses ja lõpus vähemalt ühes kontrollrühma paralleelnõus ja ühes suurima kontsentratsiooniga katsenõus; väljendatakse CaCO3 sisaldusena milligrammides liitri kohta.
|
|
Ammoniaagi üldsisaldus:
|
kokkupuuteperioodi alguses ja seejärel 3 korda nädalas vähemalt ühes kontrollrühma paralleelnõus ja ühes katsenõus iga kontsentratsiooni kohta; väljendatakse NH4
+ või NH3 sisaldusena või ammoniaaklämmastiku üldsisaldusena milligrammides liitri kohta.
|
Kui veekvaliteedi näitajate mõõtmiseks on vaja nõudest eemaldada märkimisväärses koguses vett, võib olla soovitatav kasutada veekvaliteedi mõõtmiseks eraldi nõusid, et vee ja sette ruumalasuhe jääks muutumatuks.
|
Bioloogilised vaatlused
|
46.
|
Katsenõusid tuleks kokkupuuteperioodi vältel jälgida, et hinnata visuaalselt muutusi usside käitumises, võrrelduna käitumisega kontrollrühmas (nt sette vältimine, nähtavad väljaheitegraanulid settepinnal). Vaatluste tulemused tuleks registreerida.
|
|
47.
|
Katse lõpus hinnatakse tulemusi igas paralleelnõus (keemiliseks analüüsiks ette nähtud lisanõud võib vaatluse alt välja jätta). Katsenõust usside eemaldamiseks tuleks kasutada sobivat meetodit. Tuleks jälgida, et ükski uss ei saaks eemaldamise käigus vigastada. Üks võimalik meetod on usside väljasõelumine settest. Selleks võib kasutada sobiva ava suurusega roostevabast terasest sõela. Enamik sette kohal olevast veest kallatakse ettevaatlikult ära ning allesjäänud setet ja vett loksutatakse, et tekiks suspensioon, mille saab läbi sõela lasta. Kui kasutatakse sõela, mille ava suurus on 500 μm, läbib valdav osa setteosakestest sõela väga kiiresti, kuid sõelumine tuleks kiiresti lõpule viia, et hoida ära usside roomamist sõela sisse või läbi selle. Kui kasutatakse sõela, mille ava suurus on 250 μm, ei rooma ussid sõela sisse ega sellest läbi, kuid tuleks jälgida, et sõelale jääks võimalikult vähe setteosakesi. Igast paralleelnõust pärit sõelutud suspensiooni võib veel teist korda läbi sõeluda, et tagada kõikide usside eemaldamine. Teise võimalusena võib kasutada meetodit, mille puhul katsenõud paigutatakse sette soojendamiseks veevanni, mille temperatuur on 50–60 °C; ussid lahkuvad settest ja need saab leegis töödeldud laia suuga pipeti abil settepinnalt kokku koguda. Veel ühe võimaliku meetodina võib tekitada settesuspensiooni ja kallata selle sobiva suurusega madalasse kaussi. Ussid saab madalast suspensioonikihist välja korjata, kasutades terasnõela või kellassepapintsette (neid kasutatakse pigem kahvlina kui tangidena, et hoida ära usside vigastamist), ning puhtasse vette paigutada. Pärast usside eraldamist settesuspensioonist loputatakse neid katselahusega ja ussid loendatakse.
|
|
48.
|
Tuleks tõendada, et labori töötajad on kasutatavast meetodist olenemata võimelised saama kätte vähemalt 90 % kõigist settes leiduvatest organismidest. Näiteks võib kontrollrühmas või katserühmas kasutatavale settele lisada teatud kindla arvu katseorganisme ja määrata 1 tunni pärast kättesaadud usside osakaalu (7).
|
|
49.
|
Tuleks määrata ja registreerida elus ja surnud isendite üldarv paralleelnõu kohta. Surnuks loetakse ussid, kes kuuluvad ühte järgmistest rühmadest:
|
a)
|
ussid, kes ei reageeri nõrgale mehaanilisele ärritajale;
|
|
b)
|
ussid, kellel täheldatakse lagunemise tundemärke (koos alapunktis a kirjeldatuga);
|
Elus ussid võib jagada järgmisse kolme rühma:
|
a)
|
suured (täiskasvanud) terviklikud ussid, kellel puuduvad regenereerunud kehapiirkonnad;
|
|
b)
|
terviklikud ussid, kellel esineb heledamaid regenereerunud kehapiirkondi (st ussid, kellel on uus eesosa, uus tagaosa või nii üks kui ka teine);
|
|
c)
|
ussid, kes ei ole terviklikud (st äsja fragmenteerunud ussid, kellel puuduvad regenereerunud kehapiirkonnad).
|
Kõnealuste lisatähelepanekute tegemine ei ole kohustuslik, kuid neid saab kasutada bioloogiliste vaatluste tulemuste täpsemaks tõlgendamiseks (näiteks võib rühma c kuuluvate usside suur arv viidata tavapärasest hilisemale paljunemisele või regenereerumisele asjaomase kemikaaliga nõudes). Peale selle tuleks registreerida kõik kemikaaliga kokku puutuvate usside välimuses täheldatavad erinevused kontrollrühma usside välimusega võrreldes (nt nahakahjustuste või turses kehapiirkondade esinemine).
|
|
50.
|
Igast paralleelnõust leitud elus ussid asetatakse kohe pärast loendamist/hindamist eelnevalt kaalutud kuivale märgistatud kaalukausile (üks iga paralleelproovi kohta) ning ussid surmatakse ühe tilga etanooliga kaalukausi kohta. Kaalukausid pannakse kuivatuskappi temperatuurile 100 ± 5 °C, ussidel lastakse öö läbi kuivada ning pärast eksikaatoris jahutamist määratakse kaalumise teel usside kuivmass (väljendatuna soovitatavalt grammides täpsusega vähemalt 4 kohta pärast koma).
|
|
51.
|
Peale üldise kuivmassi võib määrata ka tuhavaba materjali kuivmassi, nagu on kirjeldatud allikas 49, et võtta arvesse usside seedekulglas olevast allaneelatud settest pärit anorgaanilisi koostisaineid.
|
|
52.
|
Arvutatav biomass on määratletud kui täiskasvanud ja noori usse hõlmav üldine biomass paralleelproovi kohta. Paralleelproovi biomassi määramisel ei tohiks võtta arvesse surnud usse.
|
Uuritava kemikaali sisalduse kontrollimine
Proovide võtmine
|
53.
|
Proovid uuritava kemikaali keemilise analüüsi tegemiseks tuleks võtta vähemalt suurimal kasutataval kontsentratsioonil ja ühel väiksemal kontsentratsioonil vähemalt tasakaalustusetapi lõpus (enne katseorganismide lisamist) ja katse lõpus. Analüüsimiseks tuleks proovid võtta vähemalt sette koondproovist ja selle kohal olevast veest. Igal proovivõtukuupäeval tuleks võtta vähemalt kaks proovi analüüsitava keskkonna ja kontsentratsiooni kohta. Ühte kahest proovist võib säilitada varuproovina (analüüsitakse juhul, kui algse analüüsi tulemused jäävad väljapoole vahemikku ± 20 % nominaalsest sisaldusest). Kemikaali eriomadustest lähtuvalt – näiteks kui kemikaali lagunemine on eeldatavalt kiire – võib analüüsiplaani eksperdihinnangu alusel muuta (nt sagedasem proovivõtt, analüüsimine suuremal arvul kontsentratsioonidel). Sel juhul võib võtta proove ka vahepealsetel proovivõtukuupäevadel (nt kokkupuuteperioodi seitsmendal päeval).
|
|
54.
|
Sette kohal olevast veest proovi võtmiseks tuleks vesi ettevaatlikult ära kallata või nõust välja juhtida, et setet võimalikult vähe häirida. Proovi maht tuleks registreerida.
|
|
55.
|
Pärast sette kohal oleva vee eemaldamist tuleks sete homogeniseerida ja sobivasse nõusse tõsta. Registreeritakse märja sette kaal.
|
|
56.
|
Kui on vaja analüüsida uuritava kemikaali sisaldust ka poorides olevas vees, tuleks homogeniseeritud ja kaalutud setteproovi poorivee eraldamiseks tsentrifuugida. Näiteks võib 250-milliliitrise mahuga tsentrifuugitopsid täita umbes 200 ml märja settega. Seejärel tuleks proove poorivee eraldamiseks ilma filtrimata tsentrifuugida näiteks 30–60 minutit kiirendusel 10 000 ± 600 g temperatuuril, mis ei ületa katses kasutatavat temperatuuri. Pärast tsentrifuugimist kallatakse supernatant ära või eemaldatakse pipeti abil, jälgides, et sellesse ei satuks setteosakesi, ning registreeritakse selle maht. Registreeritakse allesjäänud sadenenud sette kaal. Et hõlbustada uuritava kemikaali massibilansi või sisalduse hindamist süsteemis sete/vesi, võib määrata sette kuivmassi igal proovivõtukuupäeval. Mõnel juhul ei pruugi kemikaali sisalduse määramine poorivees proovi liiga väikese mahu tõttu võimalik olla.
|
|
57.
|
Kui proove ei ole võimalik analüüsida kohe, tuleks nende säilitamiseks kasutada sobivat meetodit, näiteks soovitatavaid säilitustingimusi, mille puhul asjaomase uuritava kemikaali lagunemine on minimaalne (nt keskkonnaproove säilitatakse tavaliselt – 18 °C juures pimedas). Teave asjaomase uuritava kemikaali õigete säilitustingimuste, näiteks säilitamise kestuse ja temperatuuri, ekstraheerimismeetodite jms kohta tuleb hankida enne katse alustamist.
|
Analüüsimeetod
|
58.
|
Kuna uuritava kemikaali määramiseks kasutatava analüüsimeetodi usaldusväärsus sõltub peamiselt meetodi mõõtetäpsusest, kordustäpsusest ja tundlikkusest, tuleb katseliselt kontrollida, kas keemilise analüüsi täpsus ja reprodutseeritavus ning uuritava kemikaali mõõdetud sisaldus vee- ja setteproovides on asjaomase meetodi puhul vähemalt suurimal ja väikseimal kasutataval kontsentratsioonil rahuldav. Samuti kontrollitakse, et uuritav kemikaal ei oleks kontrollnõudes tuvastatav määramispiirist suuremas kontsentratsioonis. Vajaduse korral parandatakse nominaalse sisalduse väärtust vastavalt kvaliteedikontrolli eesmärgil proovile lisatud kemikaali mõõdetud sisaldusele (nt kui mõõdetud sisaldus jääb väljapoole vahemikku 80–120 % lisatud kogusest). Kõiki proove tuleks kogu katse vältel käidelda nii, et saastumine ja uuritava kemikaali kadu (näiteks proovivõtuseadmele adsorbeerumise tõttu) oleks minimaalne.
|
|
59.
|
Tuleks registreerida ja esitada uuritava kemikaali mõõdetud sisaldus, määramispiir ning settes ja vees tuvastamise alampiir.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Andmete töötlemine
|
60.
|
Katsest saadavad peamised kohustuslikud statistiliselt hinnatavad uuritavad muutujad on biomass ja usside üldarv paralleelproovi kohta. Peale selle võib hinnata ka sigivust (usside arvu suurenemine) ja kasvu (kuiva biomassi suurenemine). Sellisel juhul tuleks teha kindlaks usside hinnanguline kuivmass kokkupuuteperioodi alguses, näiteks nii, et mõõdetakse katses kasutatavate sünkroonitud usside partiist võetud representatiivse osaproovi kuivmass.
|
|
61.
|
Ehkki suremust ei kasutata käesoleva katsemeetodi puhul lõppnäitajana, tuleks võimaluse korral hinnata siiski ka suremust. Suremuse hindamisel tuleks surnuks lugeda ussid, kes ei reageeri nõrgale mehaanilisele ärritajale või kellel täheldatakse lagunemise tundemärke, samuti puuduvad ussid. Suremus tuleks vähemalt registreerida ja seda katsetulemuste tõlgendamisel arvesse võtta.
|
|
62.
|
Kontsentratsiooni, mille puhul mõju avaldub teatud kindlal määral, tuleks väljendada milligrammides sette kuivmassi kilogrammi kohta. Kui uuritava kemikaali mõõdetud sisaldus settes või settes ja selle kohal olevas vees on kokkupuuteperioodi alguses 80–120 % nominaalsest sisaldusest, võib asjaomast kontsentratsiooni (ECx, NOEC või LOEC) väljendada lähtuvalt nominaalsest sisaldusest. Kui mõõdetud sisaldus erineb nominaalsest sisaldusest enam kui ± 20 % võrra, tuleks eespool nimetatud asjaomase kontsentratsiooni väljendamisel lähtuda kokkupuuteperioodi alguses mõõdetud algsisaldusest, võttes näiteks arvesse uuritava kemikaali massibilanssi katsesüsteemis (vt punkt 30). Sellisel juhul saab lisateabe hankimiseks analüüsida põhilahust ja/või töötlemiseks kasutatavaid lahuseid, et veenduda, et katses kasutatavad setteproovid on valmistatud õigesti.
|
ECx
|
63.
|
Punktis 60 kirjeldatud näitajaid iseloomustavad ECx väärtused arvutatakse asjakohaste statistiliste meetoditega (nt probitanalüüs, logistiline või Weibulli funktsioon, kohandatud Spearmani-Kärberi meetod või lihtne interpoleerimine). Statistilise hindamise juhised on esitatud allikates 15 ja 50. ECx leidmiseks sisestatakse kasutatavasse võrrandisse kontrollproovide keskväärtusest x % moodustav väärtus. EC50 või mõne muu ECx arvutamiseks tuleks kasutatud kontsentratsioonidele vastavate keskmiste (

) suhtes kohaldada regressioonanalüüsi. |
Täheldatavat toimet mitteavaldav kontsentratsioon (NOEC) / vähim täheldatavat toimet avaldav kontsentratsioon (LOEC)
|
64.
|
Kui statistilise analüüsi eesmärk on teha kindlaks NOEC või LOEC, on vaja statistilisi andmeid iga nõu kohta (eraldi nõusid käsitletakse paralleelproovidena). Tuleks kasutada asjakohaseid statistilisi meetodeid. Et hinnata uuritava kemikaali pärssivat mõju kontrollrühmaga võrreldes, kasutatakse üldjuhul hüpoteesi ühepoolset (väiksemamahulist) kontrollimist p väärtusel ≤ 0,05. Sellekohased näited on esitatud järgmistes punktides. Asjakohaste statistiliste meetodite valimise juhised on esitatud allikates 15 ja 50.
|
|
65.
|
Andmete normaaljaotust saab kontrollida näiteks andmete mudeliga sobivuse hindamiseks kasutatava Kolmogorovi-Smirnovi testi, variatsiooniulatuse ja standardhälbe suhtel põhineva testi või Shapiro-Wilki testiga (kahepoolne, p ≤ 0,05). Hajuvuse homogeensuse kontrollimiseks võib kasutada Cochrani, Levene'i või Bartletti testi (kahepoolne, p ≤ 0,05). Kui parameetrilise testi eeldused (normaaljaotus, hajuvuse homogeensus) on täidetud, võib kasutada ühepoolset dispersioonanalüüsi ja seejärel mitmese võrdluse teste. Et teha kindlaks, kas kontrollrühm ja uuritava kemikaali eri kontsentratsioonidele vastavad katserühmad on üksteisest oluliselt erinevad (p ≤ 0,05), võib kasutada paariviisilist võrdlemist (nt Dunnetti t-testi) või muutujate sammuviisilise elimineerimisega trenditesti (nt Williamsi testi). Et määrata NOEC ja LOEC, tuleks kasutada mitteparameetrilist meetodit (nt Bonferroni U-testi vastavalt Holmile või Jonckheere'i-Terpstra trenditesti).
|
Piirsisalduskatse
|
66.
|
Kui on tehtud piirsisalduskatse (kontrollrühma võrdlemine ainult ühele kontsentratsioonile vastava katserühmaga) ja parameetrilise testi eeldused (normaaljaotus, homogeensus) on täidetud, võib arvulise tunnuse (usside üldarv ja usside kuivmassina väljendatav biomass) analüüsimiseks kasutada Studenti t-testi. Kui need nõuded ei ole täidetud, võib kasutada ebavõrdse hajuvuse suhtes kohandatud t-testi (Welchi t-test) või mitteparameetrilist testi, näiteks Manni-Whitney U-testi. Teave käesolevat katsemeetodit käsitlevas võrdlusuuringus hüpoteesi kontrollimise käigus arvutatud statistilise võimsuse kohta on esitatud 6. liites.
|
|
67.
|
Kontrollrühmade (lahustita ja lahustiga kontrollproovide) vaheliste oluliste erinevuste kindlakstegemiseks võib kummagi kontrollrühma paralleelproove analüüsida piirsisalduskatse puhul kirjeldatud viisil. Kui kõnealuste testidega ei tuvastata olulisi erinevusi, võib kõikide lahustita ja lahustiga kontrollproovide andmed ühte koondada. Vastasel juhul tuleks kõikide katserühmade andmeid võrrelda lahustiga kontrollproovide andmetega.
|
Tulemuste tõlgendamine
|
68.
|
Kui esineb kõrvalekaldeid käesolevast katsemeetodist ja katsekontsentratsioonide puhul jäävad mõõdetud kontsentratsioonid kasutatava analüüsimeetodi määramispiiri lähedale, tuleks olla tulemuste tõlgendamisel ettevaatlik. Kõik kõrvalekalded käesolevast katsemeetodist tuleb registreerida.
|
Katseprotokoll
|
69.
|
Katseprotokollis tuleks esitada vähemalt järgmine teave.
|
—
|
Uuritav kemikaal:
|
—
|
kemikaali identifitseerimisandmed (tavanimetus, keemiline nimetus, struktuurivalem, CASi number jne), sealhulgas puhtus ja kemikaali kvantitatiivse analüüsi meetod; kemikaali päritolu ning lahusti kasutamise korral lahusti identifitseerimisandmed ja kontsentratsioon;
|
|
—
|
kõik katse eel kogutud kättesaadavad andmed kemikaali füüsikaliste ja füüsikalis-keemiliste omaduste kohta (nt lahustuvus vees, aururõhk, jaotuskoefitsient mullas (või andmete olemasolu korral settes), log Kow, püsivus vees jne).
|
|
|
—
|
Katseliik:
|
—
|
teaduslik nimetus, päritolu, kõik eeltöötlused, kohandamine, kultiveerimistingimused jne.
|
|
|
—
|
Katsetingimused:
|
—
|
kasutatud katserežiim (nt staatiline, poolstaatiline või läbivoolurežiim);
|
|
—
|
katseplaan (nt katsenõude arv, materjal ja suurus, vee maht nõu kohta (poolstaatilise ja läbivoolurežiimi puhul veekoguse vahetumiskiirus), sette mass ja maht nõu kohta, katse eel ja ajal kasutatavad aereerimistingimused, paralleelproovide arv, usside arv paralleelproovi kohta kokkupuuteperioodi alguses, katsekontsentratsioonide arv, kohandamis-, tasakaalustus- ja kokkupuuteperioodi kestus, proovivõtusagedus);
|
|
—
|
settekihi ja selle kohal oleva veekihi paksus;
|
|
—
|
uuritava kemikaali eeltöötluseks ja proovile lisamiseks kasutatud meetod;
|
|
—
|
nominaalsed katsekontsentratsioonid, keemilise analüüsi jaoks proovide võtmise üksikasjalik kirjeldus ja uuritava kemikaali sisalduse määramiseks kasutatud analüüsimeetodid;
|
|
—
|
sette omadused vastavalt punktides 24–25 kirjeldatule ja kõik muud mõõtmistulemused; kunstliku sette valmistamine;
|
|
—
|
katsevee valmistamine (kui kasutatakse taastatud vett) ja omadused (hapnikusisaldus, pH, elektrijuhtivus, karedus ja kõik muud mõõtmistulemused) enne katse algust;
|
|
—
|
üksikasjalik teave söötmise kohta, sealhulgas sööda liik, selle valmistamine, kogus ja söötmisrežiim;
|
|
—
|
valgustustihedus ja valgustusperiood(id);
|
|
—
|
kõik meetodid, mille abil on määratud bioloogilised näitajad (nt katseorganismide proovide võtmine, nende vaatlemine ja kaalumine) ja abiootilised näitajad (nt vee ja sette kvaliteedinäitajad);
|
|
—
|
kõikide keemiliseks analüüsiks võetud proovide maht ja/või kaal;
|
|
—
|
üksikasjalik teave kõikide keemiliseks analüüsiks võetud proovide töötlemise kohta, sealhulgas andmed uuritava kemikaali valmistamise, säilitamise, rikastamise, ekstraheerimise ja analüüsimise meetodite (ja nende täpsuse) kohta ning uuritava kemikaali mõõdetud sisalduse kohta.
|
|
|
—
|
Tulemused:
|
—
|
katsenõudes oleva vee kvaliteet (pH, temperatuur, lahustunud hapniku sisaldus, karedus, ammoniaagisisaldus ja kõik muud mõõtmistulemused);
|
|
—
|
sette orgaanilise süsiniku üldsisaldus, kuivmassi ja märgmassi suhe, pH ja kõik muud mõõtmistulemused;
|
|
—
|
katse lõpus igas katsenõus loendatud usside üldarv ning samuti terviklike ja mitteterviklike usside arv, kui see määrati;
|
|
—
|
usside kuivmass igas katsenõus katse lõpus ja kui see määrati, siis ka usside osaproovi kuivmass katse alguses;
|
|
—
|
kõik ebanormaalse käitumise ilmingud kontrollrühmaga võrreldes (nt sette vältimine, väljaheitegraanulite esinemine või puudumine);
|
|
—
|
kõik suremust käsitlevad vaatlustulemused;
|
|
—
|
mürgisuse lõppnäitajate (nt ECx, NOEC ja/või LOEC) hinnanguline väärtus ja selle leidmiseks kasutatud statistilised meetodid;
|
|
—
|
nominaalsed katsekontsentratsioonid, mõõdetud katsekontsentratsioonid ja kõikide selliste analüüside tulemused, millega määrati uuritava kemikaali kontsentratsioon katsenõus;
|
|
—
|
kõik kõrvalekalded nõuetekohasuse kriteeriumidest.
|
|
|
—
|
Tulemuste hindamine:
|
—
|
tulemuste vastavus punktis 13 loetletud nõuetekohasuse kriteeriumidele;
|
|
—
|
tulemuste arutelu, milles muu hulgas käsitletakse võimaliku käesolevast katsemeetodist kõrvalekaldumise mõju katsetulemustele.
|
|
|
KIRJANDUS
|
(1)
|
EÜ (2003). Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I–IV. Euroopa Ühenduste Ametlike Väljaannete Talitus, Luksemburg.
|
|
(2)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Majanduskoostöö ja Arengu Organisatsioon, Pariis.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. Väljaandes: ASTM International 2004 Annual Book of Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. Väljaandes: ASTM International 2004 Annual Book of Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G. L., Ankley, G. T., Benoit, D. A., ja Mattson, V. R. (1993). Use of the aquatic oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ. Toxicol. Chem. 12: 269–279.
|
|
(6)
|
Käesoleva lisa peatükk C.27 „Sette-vee mürgisuskatse surusääsklastel rikastatud sette kasutamisega”.
|
|
(7)
|
USA Keskkonnakaitseamet (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Teine väljaanne. EPA 600/R-99/064, USA Keskkonnakaitseamet, Duluth, MN, märts 2000.
|
|
(8)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Aruanne SPE 1/RM/32. Detsember 1997.
|
|
(9)
|
Hill, I. R., Matthiessen, P., Heimbach, F. (toim.) (1993). Guidance Document on Sediment Toxicity Tests and Bioassays for Freshwater and Marine Environments. Seminarilt „SETAC Europe Workshop On Sediment Toxicity Assessment”, 8.–10. november 1993, Renesse, Madalmaad.
|
|
(10)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Toim. Streloke, M., ja Köpp, H. Berliin, 1995.
|
|
(11)
|
Riedhammer, C., ja Schwarz-Schulz, B. (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1: 105–110.
|
|
(12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. USA Materjalide Katsetamise Ühing, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H. J., ja Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. Koostöös R. Nageli ja B. Karaoglaniga. Aruanne Saksamaa Keskkonnaametile (Umweltbundesamt, Berliin), teadus- ja arendustegevuse projekt nr 202 67 429.
|
|
(14)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(15)
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests, viies kavand, märts 2003; aruanne EPS 1/RM/.
|
|
(16)
|
Nikkilä, A., Halme, A., ja Kukkonen, J. V. K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35–46.
|
|
(17)
|
Baily, H. C., ja Liu, D. H. W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. Lk 205–215. Väljaandes: Eaton, J. C., Parrish, P. R., ja Hendricks, A. C. (toim.), Aquatic Toxicology. ASTM STP 707. USA Materjalide Katsetamise Ühing.
|
|
(18)
|
Chapman, K. K., Benton, M. J., Brinkhurst, R. O., ja Scheuerman, P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environ. Toxicol. 14: 271–278.
|
|
(19)
|
Meyer, J. S., Boese, C. J., ja Collyard, S. A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Phys. C 133: 99–109.
|
|
(20)
|
Schubauer-Berigan, M. K., Dierkes, J. R., Monson, P. D., ja Ankley, G. T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxicol. Chem. 12: 1261–1266.
|
|
(21)
|
West, C. W., Mattson, V. R., Leonard, E. N., Phipps, G. L., ja Ankley, G. T. (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiologia 262: 57–63.
|
|
(22)
|
Ingersoll, C. G., Ankley, G. T., Benoit, D. A., Brunson, E. L., Burton, G. A., Dwyer, F. J., Hoke, R. A., Landrum, P. F., Norberg-King, T. J., ja Winger, P. V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14: 1885–1894.
|
|
(23)
|
Kukkonen, J., ja Landrum, P. F. (1994). Toxicokinetics and toxicity of sediment-associated pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13: 1457–1468.
|
|
(24)
|
Leppänen, M. T., ja Kukkonen, J. V. K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196–2202.
|
|
(25)
|
Leppänen, M. T., ja Kukkonen, J. V. K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183–194.
|
|
(26)
|
Landrum, P. F., Gedeon, M. L., Burton, G. A., Greenberg, M. S., ja Rowland, C. D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Con. Tox. 42: 292–302.
|
|
(27)
|
Brunson, E. L., Canfield, T. J., Ingersoll, C. J., ja Kemble, N. E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Con. Tox. 35: 191–201.
|
|
(28)
|
Ingersoll, C. G., Brunson, E. L., Wang, N., Dwyer, F. J., Ankley, G. T., Mount, D. R., Huckins, J., Petty, J., ja Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environ. Toxicol. Chem. 22: 872–885.
|
|
(29)
|
Rodriguez, P., ja Reynoldson, T. B. (1999). Laboratory methods and criteria for sediment bioassessment. Väljaandes: Mudroch, A., Azcue, J. M., ja Mudroch, P. (toim.), Manual of bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph., Oehlmann, J., ja Knacker, Th. (2005). Bioaccumulation of 14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59: 271–280.
|
|
(31)
|
Brust, K., Licht, O., Hultsch, V., Jungmann, D., ja Nagel, R. (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chem. 20: 2000–2007.
|
|
(32)
|
Oetken, M., Ludwichowski, K.-U., ja Nagel, R. (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-Altstoff-V. Saksamaa Keskkonnaameti (Umweltbundesamt, Berliin) tellimusel; FKZ 360 12 001, märts 2000.
|
|
(33)
|
Leppänen, M. T., ja Kukkonen, J. V. K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Technol. 32: 1503–1508.
|
|
(34)
|
Dermott, R., ja Munawar, M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407–414.
|
|
(35)
|
Drewes, C. D., ja Fourtner, C. R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Dev. Biol. 138: 94–103.
|
|
(36)
|
Brinkhurst, R. O. (1971). A guide for the identification of British aquatic oligochaeta. Freshwater Biological Association, Scientific Publication No. 22.
|
|
(37)
|
Käesoleva lisa peatükk C.1 „Äge mürgisus kaladele”.
|
|
(38)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Pariis.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G., ja Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35: 835–852.
|
|
(40)
|
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R., ja Streit, B. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. Environ. Safe. 39: 10–20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C., ja Studinger, G. (1999). Seminar „Bioaccumulation: Sediment test using benthic oligochaetes”, 26.–27.04.1999, Hochheim/Main, Saksamaa. Aruanne teadus- ja arendustegevuse projekti nr 298 67 419 kohta, Umweltbundesamt, Berliin.
|
|
(42)
|
Suedel, B. C., ja Rodgers, J. H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13: 1163–1175.
|
|
(43)
|
Naylor, C., ja Rodrigues, C. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291–3303.
|
|
(44)
|
Kaster, J. L., Klump, J. V., Meyer, J., Krezoski, J., ja Smith, M. E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11: 181–184.
|
|
(45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J. I., ja Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8: 111–124.
|
|
(46)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(47)
|
Landrum, P. F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23: 588–595.
|
|
(48)
|
Brooke, L. T., Ankley, G. T., Call, D. J., ja Cook, P. M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15: 223–228.
|
|
(49)
|
Mount, D. R., Dawson, T. D., ja Burkhard, L. P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18: 1244–1249.
|
|
(50)
|
OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD Series on Testing and Assessment No. 54, OECD, Pariis, Prantsusmaa.
|
|
(51)
|
Liebig, M., Meller, M., ja Egeler, P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Veranstaltungen 5/2004: Statusseminar – Sedimentkontakttests. 24.–25. märts 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Saksamaa. Lk 107–119.
|
Täiendavad kirjandusallikad statistiliste meetodite kohta
Dunnett, C. W. (1955). A multiple comparison procedure for comparing several treatments with a control. J. Am. Stat. Assoc. 50: 1096–1121.
Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics 20: 482–491.
Finney, D. J. (1971). Probit Analysis (3. väljaanne), lk 19–76. Cambridge Univ. Press.
Finney, D. J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M. A., Russo, R. C., ja Thurston, R. V. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11: 714–719; parandus: Environ. Sci. Technol. 12 (1978): 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Stat. 6: 65–70.
Sokal, R. R., ja Rohlf, F. J. (1981). Biometry. The Principles and Practice of Statistics in Biological Research. 2. väljaanne. W. H. Freeman and Company, New York.
Miller, R. G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons, New York.
Shapiro, S. S., ja Wilk, M. B. (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591–611.
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103–117.
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 519–531.
1. liide
Mõisted
Käesoleva katsemeetodi puhul kasutatakse järgmisi mõisteid.
Kemikaal
– aine või segu.
Kohandamisperiood
– periood, mille jooksul lastakse sette koostises olevatel mikroobipopulatsioonidel stabiliseeruda ja kõrvaldatakse näiteks sette koostisosadest pärit ammoniaak; see toimub enne settele uuritava kemikaali lisamist. Tavaliselt eemaldatakse kohandamisperioodi lõpus sette kohal olev vesi.
ECx
– settes sisalduva uuritava kemikaali kontsentratsioon, mille puhul bioloogilisele näitajale avalduva mõju ulatus on kindlaksmääratud kokkupuuteperioodi jooksul X % (nt 50 %).
Tasakaalustusperiood
– periood, mille jooksul lastakse uuritaval kemikaalil jaotuda tahke faasi, poorivee ja sette kohal oleva vee vahel; see toimub pärast settele uuritava kemikaali lisamist ja enne katseorganismide lisamist.
Kokkupuuteperiood
– aeg, mille vältel katseorganismid puutuvad kokku uuritava kemikaaliga.
Valmistatud sete (ehk taastatud, kunstlik või sünteetiline sete)– selliste materjalide segu, mida kasutatakse loodusliku sette koostisosade imiteerimiseks.
Vähim täheldatavat toimet avaldav kontsentratsioon
– uuritava kemikaali väikseim kasutatud kontsentratsioon, mille puhul täheldatakse kemikaali olulist (p ≤ 0,05) mürgist mõju võrdluses kontrolliga. Kemikaal peab kõikidel kõnealusest kontsentratsioonist suurematel kontsentratsioonidel avaldama vähemalt sama tugevat kahjulikku mõju kui kõnealusel kontsentratsioonil avalduv kahjulik mõju. Kui nimetatud kahte tingimust ei ole võimalik täita, tuleb lisada ammendav selgitus, kuidas kõnealune kontsentratsioon (ja sellest lähtuvalt ka täheldatavat toimet mitteavaldav kontsentratsioon) on valitud.
Täheldatavat toimet mitteavaldav kontsentratsioon
– uuritava kemikaali kontsentratsioon, mille juures ei täheldata kindlaksmääratud kokkupuuteperioodi jooksul kontrolliga võrreldes statistiliselt olulist (p ≤ 0,05) mõju ja mis on kasutatud kontsentratsioonide jadas vahetult allpool vähimat täheldatavat toimet avaldavat kontsentratsiooni.
Jaotuskoefitsient süsteemis oktanool/vesi (Kow; mõnikord kasutatakse ka tähist Pow)– n-oktanoolis lahustunud kemikaali ja vees lahustunud kemikaali tasakaalukontsentratsioonide suhe, millega iseloomustatakse kemikaali lipofiilsust (käesoleva lisa peatükk A.24). Koefitsienti Kow või selle logaritmi (log Kow) kasutatakse näitajana, mis võimaldab hinnata kemikaali veeorganismides bioakumuleerumise tõenäosust.
Jaotuskoefitsient süsteemis orgaaniline süsinik/vesi (Koc)– sette orgaanilise süsiniku fraktsioonis ja selle pinnal esineva kemikaali ning vees lahustunud kemikaali tasakaalukontsentratsioonide suhe.
Sette kohal olev vesi
– katsenõus setet kattev veekiht.
Poorivesi
– sette- või mullaosakeste vahelist ruumi täitev vesi.
Rikastatud sete
– sete, millele on lisatud uuritavat kemikaali.
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil.
2. liide
Soovitatava taastatud vee koostis
(käesoleva lisa peatüki C.1 (1) põhjal)
|
a)
|
Kaltsiumkloriidi lahus
11,76 g CaCl2 · 2H2O lahustatakse deioniseeritud vees ja lahuse ruumala viiakse deioniseeritud veega 1 liitrini.
|
|
b)
|
Magneesiumsulfaadi lahus
4,93 g MgSO4 · 7H2O lahustatakse deioniseeritud vees ja lahuse ruumala viiakse deioniseeritud veega 1 liitrini.
|
|
c)
|
Naatriumvesinikkarbonaadi lahus
2,59 g NaHCO3 lahustatakse deioniseeritud vees ja lahuse ruumala viiakse deioniseeritud veega 1 liitrini.
|
|
d)
|
Kaaliumkloriidi lahus
0,23 g KCl lahustatakse deioniseeritud vees ja lahuse ruumala viiakse deioniseeritud veega 1 liitrini.
|
Kõik kemikaalid peavad olema analüütilise puhtusastmega.
Destilleeritud või deioniseeritud vee elektrijuhtivus ei tohiks ületada väärtust 10 μS cm– 1.
Võetakse 25 ml iga lahust a–d ja segatakse omavahel ning saadud lahuse ruumala viiakse deioniseeritud veega 1 liitrini. Kaltsiumi- ja magneesiumiioonide summaarne sisaldus sellises lahuses on 2,5 mmol/l.
Kaltsiumi- ja magneesiumiioonide suhe lahuses on 4:1 ning naatriumi- ja kaaliumiioonide suhe 10:1. Kõnealuse lahuse happeneutraliseerimisvõime KS4,3 on 0,8 mmol/l.
Lahjendusvett aereeritakse seni, kuni saavutatakse hapniku küllastuskontsentratsioon, ning seejärel lastakse sel enne kasutamist umbes kaks ööpäeva aereerimata seista.
VIIDE
|
(1)
|
Käesoleva lisa peatükk C.1 „Äge mürgisus kaladele”.
|
3. liide
Nõuetekohase lahjendusvee füüsikalis-keemilised omadused
|
Koostisaine
|
Kontsentratsioon
|
|
Tahked osakesed
|
< 20 mg/l
|
|
Orgaanilise süsiniku üldsisaldus
|
< 2 μg/l
|
|
Ioniseerimata ammoniaak
|
< 1 μg/l
|
|
Jääkkloor
|
< 10 μg/l
|
|
Fosfororgaaniliste pestitsiide üldsisaldus
|
< 50 ng/l
|
|
Kloororgaaniliste pestitsiidide ja polüklooritud bifenüülide summaarne üldsisaldus
|
< 50 ng/l
|
|
Orgaanilistes ühendites sisalduva kloori üldsisaldus
|
< 25 ng/l
|
|
(OECD 1992. aasta juhendi (1) põhjal)
|
VIIDE
|
(1)
|
OECD (1992). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Pariis.
|
4. liide
Soovitatav kunstlik sete – valmistamis- ja säilitamisjuhised
Sette koostisosad
|
Koostisosa
|
Kirjeldus
|
Protsentuaalne osakaal sette kuivmassist
|
|
Turvas
|
Turbasamblaturvas, keskmise lagunemisastmega, õhu käes kuivatatud, nähtavate taimejäänusteta, peeneks jahvatatud (osakeste suurus ≤ 0,5 mm)
|
5 ± 0,5
|
|
Kvartsliiv
|
Tera suurus ≤ 2 mm, kusjuures > 50 % osakestest peaks olema vahemikus 50–200 μm
|
75–76
|
|
Kaoliinsavi
|
Kaoliniidisisaldus ≥ 30 %
|
20 ± 1
|
|
Sööt
|
Nt pulbristatud nõgeselehed (folia urticae), kõrvenõgese (Urtica dioica) peeneks jahvatatud lehed (osakeste suurus ≤ 0,5 mm), farmaatsiastandarditele vastavad, inimtarbimiseks ette nähtud; lisatakse kuivale settele
|
0,4–0,5
|
|
Orgaaniline süsinik
|
Reguleeritakse turba ja liiva lisamisega
|
2 ± 0,5
|
|
Kaltsiumkarbonaat
|
CaCO3, pulbristatud, keemiliselt puhas; lisatakse kuivale settele
|
0,05–1
|
|
Deioniseeritud vesi
|
Elektrijuhtivus ≤ 10 μS/cm; lisatakse kuivale settele
|
30–50
|
Märkus: Kui võib eeldada, et ammoniaagisisaldus muutub tavapärasest suuremaks – näiteks kui on teada, et uuritav kemikaal pärsib nitrifitseerimist –, võib olla otstarbekas asendada 50 % lämmastikurikkast nõgeselehtede pulbrist tselluloosiga (nt keemiliselt puhta pulbrilise α-tselluloosiga osakeste suurusega ≤ 0,5 mm (1, 2)).
Valmistamine
Turvas kuivatatakse õhu käes ja jahvatatakse peeneks pulbriks. Tõhusa homogenisaatori abil valmistatakse vajaliku koguse turbapulbri suspensioon deioniseeritud vees. Selle suspensiooni pH reguleeritakse CaCO3 abil väärtusele 5,5 ± 0,5. Suspensiooni hoitakse ettevaatlikult segades vähemalt kaks ööpäeva temperatuuril 20 ± 2 °C, et lasta pH-l ja mikroobipopulatsioonidel stabiliseeruda. Pärast seda määratakse pH uuesti; see peaks olema 6,0 ± 0,5. Seejärel segatakse turbasuspensioon muude koostisosadega (liiv ja kaoliinsavi) ning deioniseeritud veega, et saada homogeenne sete, mille veesisaldus on vahemikus 30–50 % sette kuivmassist. Lõpliku segu pH määratakse uuesti ja see reguleeritakse vajaduse korral CaCO3 abil väärtusele 6,5–7,5. Kui võib eeldada ammoniaagi teket, võib olla otstarbekas hoida sette pH väärtus alla 7,0 (nt vahemikus 6,0–6,5). Settest võetakse proovid kuivmassi ja orgaanilise süsiniku sisalduse määramiseks. Kui võib eeldada ammoniaagi teket, võib valmistatud setet hoida enne uuritava kemikaali lisamist seitse ööpäeva samades tingimustes, mida kasutatakse järgnevas katses (nt sette ja vee suhe 1:4, settekihi paksus sama kui katsenõudes), st sete tuleks katta veekihiga, mida tuleks aereerida. Selle kohandamisperioodi lõpus tuleks sette kohal olev vesi eemaldada ja ära visata. Seejärel segatakse iga kontsentratsiooni puhul settesse uuritavat kemikaali sisaldav kvartsliiv, sete jaotatakse katses kasutatavatesse paralleelnõudesse ja kaetakse katseveega. Nõusid inkubeeritakse samades tingimustes, mida kasutatakse järgnevas katses. Sellega algab tasakaalustusperiood. Sette kohal olevat vett tuleks aereerida.
Valitud sööt tuleks lisada settele enne uuritava kemikaali lisamist või sellega samaaegselt. Sööda võib algselt segada turbasuspensiooniga (vt eespool). Sööda ulatuslikku lagunemist katseorganismide lisamise eel – näiteks pika tasakaalustusperioodi puhul – saab ära hoida, kui jätta sööda lisamise ja kokkupuuteperioodi alguse vahele võimalikult lühike ajavahemik. Et tagada uuritava kemikaali segunemine söödaga, tuleks sööt segada settega hiljemalt uuritava kemikaali settele lisamise päeval.
Säilitamine
Kunstliku sette kuivi koostisosi võib säilitada kuivas ja jahedas kohas või toatemperatuuril. Uuritavat kemikaali sisaldav valmistatud sete tuleks katses viivitamata ära kasutada. Rikastatud mulla proove võib nende analüüsimiseni säilitada konkreetse uuritava kemikaali jaoks soovitatavates tingimustes.
VIITED
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H. J., ja Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. Koostöös R. Nageli ja B. Karaoglaniga. Aruanne Saksamaa Keskkonnaametile (Umweltbundesamt, Berliin), teadus- ja arendustegevuse projekt nr 202 67 429.
|
|
(2)
|
Liebig, M., Meller, M., ja Egeler, P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Veranstaltungen 5/2004: Statusseminar – Sedimentkontakttests. 24.–25. märts 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Saksamaa. Lk 107–119.
|
5. liide
Lumbriculus variegatus'e kultiveerimise meetodid
Alamklassi Oligochaeta sugukonda Lumbriculidae kuuluv Lumbriculus variegatus (Müller) elab mageveesettes ja on ökotoksikoloogilistes katsetes laialdaselt kasutusel. Seda liiki saab laboritingimustes hõlpsalt kultiveerida. Kultiveerimismeetodite ülevaade on esitatud allpool.
Kultiveerimismeetodid
Üksikasjaliku ülevaate Lumbriculus variegatus'e kultiveerimise tingimustest on esitanud Phipps et al. (1993) (1), Brunson et al. (1998) (2), USA Materjalide Katsetamise Ühing (2000) (3) ja USA Keskkonnakaitseamet (2000) (4). Allpool on esitatud nende tingimuste lühikokkuvõte. L. variegatus'e kasutamise oluline eelis on selle liigi isendite kiire paljunemine ja sellest tulenev kiire biomassi suurenemine laboris kultiveeritavates populatsioonides (nt allikad 1, 3, 4, 5).
Usse võib kasvatada suurtes akvaariumides (mahuga 57–80 l) temperatuuril 23 °C valgustusperioodiga 16 tundi valgust (100–1 000 luksi) ja 8 tundi pimedust, kasutades looduslikku vett, mida uuendatakse iga päev (45–50 l akvaariumi kohta). Substraadi valmistamiseks lõigatakse pleegitamata pruunist paberist käterätikud ribadeks ning need võib seejärel segada mõne sekundiga kultiveerimisveega, et saada väikesed pabersubstraadi tükid. Saadud substraati võib seejärel kohe kasutada Lumbriculus'e kultiveerimisakvaariumis, kattes sellega akvaariumi põhja, või säilitada seda hilisemaks kasutamiseks deioniseeritud vees külmutatuna. Üldjuhul jagub uuest substraadist akvaariumis umbes kaheks kuuks.
Iga ussikultuuri loomist alustatakse 500–1 000 ussiga, keda söödetakse perioodiliselt uuendatavas vees või läbivoolurežiimis 3 korda nädalas 10 ml suspensiooniga, mis sisaldab 6 g forelli noorkalade sööta. Staatilises või poolstaatilises kultuuris tuleks bakterite ja seente kasvu ärahoidmiseks söötmissagedust vähendada.
Nendes tingimustes kahekordistub isendite arv kultuuris üldjuhul umbes 10–14 päeva jooksul.
Teise võimalusena võib Lumbriculus variegatus't kultiveerida süsteemis, mis koosneb kunstliku sette valmistamisel kasutatava kvartsliiva kihist (paksus 1–2 cm) ja taastatud veest. Kultiveerimisnõudena võib kasutada 12–20 cm kõrgusi klaasist või roostevabast terasest nõusid. Vett nõudes tuleks kergelt aereerida (nt 2–4 mulli sekundis), kasutades Pasteuri pipetti, mis jääb settepinnast umbes 2 cm kõrgusele. Et hoida ära näiteks ammoniaagi akumuleerumist, tuleks sette kohal oleva vee uuendamiseks kasutada läbivoolusüsteemi või uuendada vett käsitsi vähemalt kord nädalas. Väheharjasusse võib kasvatada toatemperatuuril valgustusperioodiga 16 tundi valgust (valgustustihedus 100–1 000 luksi) ja 8 tundi pimedust. Poolstaatilise kultuuri puhul (vee uuendamine kord nädalas) söödetakse usse kaks korda nädalas söödaga TetraMin (nt 0,6–0,8 mg settepinna cm2 kohta), mille võib lisada suspensioonina, mis sisaldab 50 mg söödet milliliitri deioniseeritud vee kohta.
Lumbriculus variegatus'e eemaldamiseks kultuurist võib näiteks viia substraadi väikese avaga võrgu abil või ainult organismid leegis töödeldud laia (umbes 5-millimeetrise läbimõõduga) suuga klaaspipeti abil eraldi keeduklaasi. Kui ussid viiakse keeduklaasi koos substraadiga, lastakse usse ja substraati sisaldaval keeduklaasil läbivoolurežiimis öö läbi seista, et kõrvaldada keeduklaasist substraat; ussid jäävad nõu põhja. Seejärel saab ussid viia värske kultiveerimiskeskkonnaga akvaariumidesse või neid katse jaoks täiendavalt töödelda, nagu on kirjeldatud allikates 3 ja 4 ning allpool.
L. variegatus'e kasutamisel settekatsetes on oluline pöörata tähelepanu selle liigi paljunemisviisile (arhitoomia ehk morfallaksis, vt nt allikas 6). Sellise mittesugulise paljunemise tulemusena tekib kaks fragmenti, mis teatava aja jooksul ei toitu, kuni pea- või sabaosa on regenereerunud (nt allikad 7, 8). See tähendab, et L. variegatus'e puhul ei ole kokkupuude saastunud sette allaneelamise kaudu pidev.
Seepärast tuleks kontrollimatu paljunemise ja regenereerumise minimeerimiseks ja katsetulemuste suure varieeruvuse ärahoidmiseks ussid sünkroonida. Katsetulemused võivad varieeruda, kui isendid, kes on fragmenteerunud ja seepärast teatava perioodi vältel ei toitu, puutuvad uuritava kemikaaliga kokku vähem kui isendid, kes katse vältel ei fragmenteeru (9, 10, 11). Ussid tuleks 10–14 päeva enne kokkupuuteperioodi algust kunstlikult fragmenteerida (sünkroonimine). Sünkroonimiseks tuleks valida suured (täiskasvanud) ussid, kellel soovitatavalt ei esine hiljutise morfallaksise tundemärke. Valitud ussid võib asetada alusklaasile tilka kultiveerimisvette ja need keha keskosast skalpelliga pooleks lõigata. Tuleks jälgida, et tagaosade suurus oleks sarnane. Seejärel tuleks tagaosadel lasta regenereerida uus peaosa kultiveerimisnõudes, mis sisaldavad sama substraati, mida kasutatakse kultuuris ja taastatud vees kuni kokkupuuteperioodi alguseni. Uue peaosa regenereerumisest annab märku sünkroonitud usside kaevumine substraati (peaosa regenereerumises veendumiseks võib vaadelda usside representatiivset osaproovi binokulaarmikroskoobi all). Pärast seda on katseorganismide füsioloogiline seisund eeldatavalt sarnane. See tähendab, et kui katse ajal toimub sünkroonitud usside paljunemine morfallaksise teel, puutuvad praktiliselt kõik loomad rikastatud settega kokku eeldatavalt samal määral. Sünkroonitud usse tuleks sööta ühe korra niipea, kui ussid hakkavad substraati kaevuma, või 7 päeva pärast pooleks lõikamist. Söötmisrežiim peaks olema võrreldav söötmisrežiimiga tavapärases kultuuris, kuid sünkroonitud usside söötmiseks võib olla soovitatav kasutada sama sööta kui katses. Usse tuleks hoida katses kasutataval temperatuuril 20 ± 2 °C. Pärast regenereerumist tuleks katse jaoks valida terved täispikad ussid, kes reageerivad nõrgale mehaanilisele ärritajale aktiivse ujumise või roomamisega. Et hoida ära selliste usside vigastusi või autotoomiat, tuleks nende käsitsemisel kasutada näiteks leegis töödeldud servadega pipette või roostevabast terasest hambaorke.
Lumbriculus variegatus'e lähtekultuuride allikad (aadressid USAs pärinevad kirjandusallikast 4)
|
Euroopa
|
|
ECT Ökotoxikologie GmbH
|
|
Böttgerstr. 2–14
|
|
D-65439 Flörsheim/Main
|
|
Saksamaa
|
|
|
Bayer Crop Science AG
|
|
Forschung und Entwicklung – Ökotoxikologie
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Saksamaa
|
|
|
|
|
|
Itä-Suomen yliopisto
|
|
Vesistötoksikologian laboratorio
|
|
Biologian laitos
|
|
Yliopistokatu 7, PL 111
|
|
FIN-80101 Joensuu
|
|
Soome
|
|
|
Technische Universität Dresden
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Saksamaa
|
|
|
|
|
|
C.N.R.– I.R.S.A.
|
|
Consiglio Nationale delle Ricerche
|
|
Istituto di Ricerca sulle Acque
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
USA
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
VIITED
|
(1)
|
Phipps, G. L., Ankley, G. T., Benoit, D. A., ja Mattson, V. R. (1993). Use of the aquatic oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ. Toxicol. Chem/ 12: 269–279.
|
|
(2)
|
Brunson, E. L., Canfield, T. J., Ingersoll, C. J., ja Kemble, N. E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Con. Tox. 35: 191–201.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. Väljaandes: ASTM International 2004 Annual Book of Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
USA Keskkonnakaitseamet (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Teine väljaanne. EPA 600/R-99/064, USA Keskkonnakaitseamet, Duluth, MN, märts 2000.
|
|
(5)
|
Kukkonen, J., ja Landrum, P. F. (1994). Toxicokinetics and toxicity of sediment-associated pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13: 1457–1468.
|
|
(6)
|
Drewes, C. D., ja Fourtner, C. R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Dev. Biol. 138: 94–103.
|
|
(7)
|
Leppänen, M. T., ja Kukkonen, J. V. K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196–2202.
|
|
(8)
|
Leppänen, M. T., ja Kukkonen, J. V. K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183–194.
|
|
(9)
|
Brust, K., Licht, O., Hultsch, V., Jungmann, D., ja Nagel, R. (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chem. 20: 2000–2007.
|
|
(10)
|
Oetken, M., Ludwichowski, K.-U., ja Nagel, R. (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-Altstoff-V. Saksamaa Keskkonnaameti (Umweltbundesamt, Berliin) tellimusel; FKZ 360 12 001, märts 2000.
|
|
(11)
|
Leppänen, M. T., ja Kukkonen, J. V. K. (1998c). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32: 1503–1508.
|
6. liide
Võrdlusuuringu „sette mürgisuse hindamise katse Lumbriculus variegatus'ega”
tulemuste kokkuvõte
Tabel 1.
Võrdlusuuringu raames tehtud eraldi katsete tulemused: usside keskmine arv lahustita ja lahustiga kontrollrühmas katse lõpus; SH = standardhälve; V = variatsioonikordaja.
|
|
Usside keskmine arv lahustita kontrollrühmas
|
SH
|
V (%)
|
n
|
Usside keskmine arv lahustiga kontrollrühmas
|
SH
|
V (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
Laboritevaheline keskmine
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SH
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
Minimaalne
|
16,3
|
|
|
|
15,0
|
|
|
|
|
Maksimaalne
|
42,0
|
|
|
|
43,7
|
|
|
|
|
V (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Tabel 2.
Võrdlusuuringu raames tehtud eraldi katsete tulemused: usside keskmine summaarne kuivmass paralleelproovi kohta lahustita ja lahustiga kontrollrühmas katse lõpus; SH = standardhälve; V = variatsioonikordaja.
|
|
Usside keskmine summaarne kuivmass paralleelproovi kohta lahustita kontrollrühmas
|
SH
|
V (%)
|
n
|
Usside keskmine summaarne kuivmass paralleelproovi kohta lahustiga kontrollrühmas
|
SH
|
V (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
Laboritevaheline keskmine
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SH
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
Minimaalne
|
12,9
|
|
|
|
10,5
|
|
|
|
|
Maksimaalne
|
41,3
|
|
|
|
41,4
|
|
|
|
|
V (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Tabel 3.
Pentaklorofenooli mürgisus: kokkuvõtlikud andmed võrdlusuuringus kasutatud lõppnäitajate kohta – EC50, NOEC ja LOEC laboritevaheline keskväärtus; NOEC = täheldatavat toimet mitteavaldav kontsentratsioon; LOEC = vähim täheldatavat toimet avaldav kontsentratsioon; SH = standardhälve; V = variatsioonikordaja.
|
Bioloogiline näitaja
|
|
Laboritevaheline keskmine (mg/kg)
|
Minimaalne
|
Maksimaalne
|
Laboritevaheline tegur
|
SH
|
V (%)
|
Geomeetriline keskmine (mg/kg)
|
|
Usside üldarv
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
VTE (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
Usside summaarne kuivmass
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
VTE (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
Suremus/elulemus
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
Sigivus (usside arvu suurenemine paralleelproovi kohta)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
VTE (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
Kasv (biomassi suurenemine paralleelproovi kohta)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
VTE (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
VTE – väikseim tuvastatav erinevus kontrollväärtusest hüpoteesi kontrollimise ajal; kasutatakse statistilise võimsuse väljendamiseks.
|
VIIDE
Egeler, Ph., Meller, M., Schallnaß, H. J., ja Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. Koostöös R. Nageli ja B. Karaoglaniga. Aruanne Saksamaa Keskkonnaametile (Umweltbundesamt, Berliin), teadus- ja arendustegevuse projekt nr 202 67 429.
C.36. RÖÖVLESTA (HYPOASPIS (GEOLAELAPS) ACULEIFER) SIGIVUSE KATSE MULLAS
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 226 (2008). Katsemeetod on ette nähtud selleks, et hinnata mullas esinevate kemikaalide mõju mullas elavale lestaliigile Hypoaspis (Geolaelaps) aculeifer Canestrini (sugukond Laelapidae, alamklass Acari) ning teha seeläbi kindlaks populatsiooni kasvu erikiiruse vähenemise hinnanguline määr (1, 2). Sigivuse määra all mõeldakse siin noorloomade arvu katseperioodi lõpus. H. aculeifer esindab täiendavat troofilist taset nende liikide kõrval, kelle jaoks katsemeetodid on juba olemas. Leitakse, et käesolev katsemeetod on sigivuskatse jaoks piisav ning paljunemistsükli eri etappide eristamine ja eraldi hindamine ei ole vajalik. Keemiliste ainete puhul, millega kokkupuude toimub muul viisil kui mulla kaudu, võib sobida mõni muu lähenemisviis (3).
|
|
2.
|
Lesta Hypoaspis (Geolaelaps) aculeifer peetakse sobivaks mullafauna ja eelkõige röövlestade esindajaks. See liik on ülemaailmse levikuga (5) ning neid lesti saab hõlpsalt koguda ja laboris kasvatada. Ülevaade H. aculeifer'i bioloogia kohta on esitatud 7. liites. Taustteave kõnealuse liigi lestade ökoloogia kohta ja nende kasutamise kohta ökotoksikoloogilistes katsetes on kättesaadav allikates 4, 5, 6, 7, 8, 9, 10, 11 ja 12.
|
KATSE PÕHIMÕTE
|
3.
|
Täiskasvanud emasloomad viiakse kokkupuutesse uuritava kemikaaliga, mis on eri kontsentratsioonides segatud mullaga. Katset alustatakse 10 täiskasvanud emasloomaga paralleelnõu kohta. Isasloomi katsesse ei kaasata, kuna kogemusest nähtub, et isaste juuresolekul paarituvad emased kohe või veidi aega pärast deutonümfi staadiumile järgnevat koorumist. Peale selle muudaks isaste lisamine katse nii palju pikemaks, et tekiks vajadus keerulise vanuserühmade eristamise järele. Seepärast ei hõlma katse paaritumist. Emasloomadega alustatakse katset 28–35 päeva pärast sünkroonimiseks vajaliku munemisperioodi algust (vt 4. liide), sest siis võib emasloomad lugeda juba paaritunuks ja munemiseelse etapi läbinuks. Kui katse tehakse temperatuuril 20 °C, lõpeb see 14. päeval pärast emasloomade viimist katsenõusse (katse alustamise päev); selle aja jooksul jõuavad esimesed järglased kontrollrühmas deutonümfi staadiumisse (vt 4. liide). Peamise mõõdetava muutujana määratakse noorloomade arv katsenõu kohta ja lisaks määratakse ellujäänud emasloomade arv. Uuritava kemikaaliga kokku puutuvate lestade sigivuse määra võrreldakse vastava näitajaga kontrollrühmas ning olenevalt katseplaanist (vt punkt 29) tehakse kindlaks kas ECx (nt EC10, EC50) või täheldatavat toimet mitteavaldav kontsentratsioon (mõisted on määratletud 1. liites). Katse ülevaatlik ajakava on esitatud 8. liites.
|
TEAVE UURITAVA KEMIKAALI KOHTA
|
4.
|
Soovitatavalt peaks olema teada uuritava kemikaali lahustuvus vees, log Kow, jaotuskoefitsient süsteemis muld/vesi ja aururõhk. Samuti on soovitatav lisateabe olemasolu uuritava kemikaali säilivuse kohta mullas, näiteks kemikaali biootilise ja abiootilise lagunemise kiirus.
|
|
5.
|
Käesolevat katsemeetodit võib kasutada nii vees lahustuvate kui ka vees lahustumatute kemikaalide puhul. Uuritava kemikaaliga töötlemise viis on neil kahel juhul siiski erinev. Katsemeetodit ei saa kasutada lenduvate kemikaalide puhul, mille Henry konstant või jaotuskoefitsient süsteemis õhk/vesi on suurem kui üks, ega kemikaalide puhul, mille aururõhk 25 °C juures on suurem kui 0,0133 Pa.
|
KATSE NÕUETEKOHASUS
|
6.
|
Katsetulemus loetakse nõuetekohaseks, kui kemikaaliga mitte kokku puutuvas kontrollrühmas on täidetud järgmised kriteeriumid:
|
—
|
emasloomade keskmine suremus ei tohiks katse lõpus olla suurem kui 20 %;
|
|
—
|
noorloomade keskmine arv paralleelproovi kohta peaks katse lõpuks olema vähemalt 50 (kui katset alustatakse 10 täiskasvanud emasloomaga);
|
|
—
|
paralleelnõu kohta saadud noorte lestade keskmise arvu variatsioonikordaja ei tohiks lõpliku katse lõpus olla suurem kui 30 %.
|
|
VÕRDLUSKEMIKAAL
|
7.
|
Tuleb määrata võrdluskemikaali ECx ja/või täheldatavat toimet mitteavaldav kontsentratsioon, et tagada laboris kasutatavate katsetingimuste sobivus ja veenduda, et katseorganismide reaktsioon ei ole aja jooksul muutunud. Sobiv võrdluskemikaal on dimetoaat (CASi nr 60-51-5), mille mõju populatsiooni arvukusele on tõendatud (4). Teise võimaliku võrdluskemikaalina võib kasutada boorhapet (CASi nr 10043-35-3). Viimati nimetatud kemikaaliga on vähem kogemusi. On võimalik kasutada kahte lähenemisviisi.
|
—
|
Võrdluskemikaali võib hinnata samaaegselt iga uuritava kemikaali mürgisuse määramisega, kasutades ühte kontsentratsiooni, mille puhul on kontsentratsiooni ja mõju vahelise sõltuvuse uuringuga eelnevalt tõendatud, et järglaste arv väheneb > 50 % võrra. Sellisel juhul peaks paralleelproovide arv olema sama kui kontrollrühmas (vt punkt 29).
|
|
—
|
Teise võimalusena tehakse katse võrdluskemikaaliga 1–2 korda aastas kontsentratsiooni ja mõju vahelise sõltuvuse katsena. Olenevalt valitud lähenemisviisist on kontsentratsioonide ja paralleelproovide arv ning kontsentratsioonide jada tegur erinevad (vt punkt 29), ent saavutatava mõju määr peaks jääma vahemikku 10–90 % (jada tegur 1,8). Noorloomade arvu põhjal leitav EC50 peaks dimetoaadi puhul jääma vahemikku 3,0–7,0 mg mulla kuivmassi kilogrammi kohta. Boorhappe puhul peaks noorloomade arvu põhjal leitav EC50 jääma praeguseks saadud andmete kohaselt vahemikku 100–500 mg mulla kuivmassi kilogrammi kohta.
|
|
KATSEMEETODI KIRJELDUS
Katsenõud ja seadmed
|
8.
|
Tuleks kasutada klaasist või muust keemiliselt inertsest materjalist ja tihedalt sulguva kaanega katsenõusid läbimõõduga 3–5 cm (mullakihi paksus ≥ 1,5 cm). Eelistatakse keeratava kaanega nõusid ning sel juhul tuleks neid aereerida kaks korda nädalas. Teise võimalusena võib kasutada katet, mis võimaldab otsest gaasivahetust substraadi ja atmosfääri vahel (nt marli). Kuna niiskusesisaldus peab katse vältel olema piisavalt suur, on väga oluline kontrollida katse kestel iga katsenõu kaalu ja vajaduse korral vett juurde lisada. See võib olla eriti oluline juhul, kui ei kasutata keeratavaid kaasi. Läbipaistmatu katsenõu kasutamise korral peaks kaas olema valguse juurdepääsu võimaldavast materjalist (nt läbipaistev augustatud kaas), kuid samal ajal takistama lestade põgenemist. Katsenõu suurus ja tüüp sõltuvad ekstraheerimismeetodist (üksikasjalik kirjeldus on esitatud 5. liites). Kui kuumusega ekstraheerimine viiakse läbi otse katsenõus, võib lisada sobiva suurusega avadega põhjavõrgu (kuni ekstraheerimiseni kinni kaetud) ning mulla sügavus peaks olema temperatuuri ja niiskuse gradiendi tekkimiseks piisav.
|
|
9.
|
On vaja tavapäraseid laboriseadmeid, täpsemalt järgmist:
|
—
|
soovitatavalt klaasnõud keeratava kaanega;
|
|
—
|
harjad lestade teisaldamiseks;
|
|
—
|
pH-meeter ja fotomeeter;
|
|
—
|
sobivad temperatuuri reguleerimise seadmed;
|
|
—
|
sobivad õhuniiskuse reguleerimise seadmed (ei ole hädavajalikud, kui kokkupuutenõu on kaanega);
|
|
—
|
reguleeritava temperatuuriga inkubaator või väike ruum;
|
|
—
|
ekstraheerimisseadmed (vt 5. liide) (13);
|
|
—
|
reguleeritava ülaltvalgustusega valguspaneel;
|
|
—
|
purgid ekstraheeritud lestade kogumiseks.
|
|
Kunstliku mulla valmistamine
|
10.
|
Käesoleva katsemeetodi puhul kasutatakse kunstlikku mulda. See koosneb järgmistest koostisosadest (kõik väärtused põhinevad kuivmassil):
|
—
|
5 % turbasamblaturvast, mis on õhu käes kuivatatud ja peeneks jahvatatud (lubatav osakeste suurus on 2 ± 1 mm);
|
|
—
|
20 % kaoliinsavi (soovitatav kaoliniidisisaldus üle 30 %);
|
|
—
|
umbes 74 % tööstuslikku liiva (sõltuvalt vajalikust CaCO3 kogusest), mis on õhu käes kuivatatud ja koosneb peamiselt peenest liivast, millest üle 50 % moodustavad osakesed suurusega 50–200 mikromeetrit. Liiva täpne kogus sõltub CaCO3 kogusest (vt allpool): nende koostisosade summaarne osakaal peaks olema 75 %;
|
|
—
|
< 1,0 % kaltsiumkarbonaati (CaCO3, pulbristatud, analüütilise puhtusastmega), et saavutada pH väärtus 6,0 ± 0,5; lisatava kaltsiumkarbonaadi kogus võib sõltuda eelkõige turba kvaliteedist ja omadustest (vt märkus 1).
|
Märkus 1: vajalik CaCO3 kogus sõltub mullasubstraadi koostisosadest ja tuleks mulla osaproovide pH mõõtmise teel kindlaks teha vahetult enne katset (14).
Märkus 2: kunstliku mulla turbasisaldus erineb mullaorganismide puhul kasutatavate muude katsemeetoditega ette nähtud turbasisaldusest, mis on enamikul juhtudel 10 % (nt allikas 15). Euroopa Taimekaitseorganisatsiooni (EPPO) andmetel (16) ei sisalda tüüpiline põllumajanduslik muld siiski üle 5 % orgaanilist ainet ning seega peegeldab väiksem turbasisaldus loodusliku mulla väiksemat võimet tagada uuritava kemikaali sorbeerumine orgaanilisele süsinikule.
Märkus 3: vajaduse korral, näiteks katse konkreetsete eesmärkide saavutamiseks võib katse- ja/või kultiveerimissubstraadina kasutada ka saastevabast allikast pärit looduslikku mulda. Loodusliku mulla kasutamisel tuleks esitada vähemalt selle päritolu (kogumiskoht), pH, lõimis (osakeste suurusjaotus) ja orgaanilise aine sisaldus. Võimaluse korral tuleks lisada ka mulla tüüp ja nimetus vastavalt mulla klassifitseerimissüsteemile ning selline muld peaks olema saastevaba. Kui uuritav kemikaal on metall või metallorgaaniline ühend, tuleks määrata ka loodusliku mulla katioonivahetusmahtuvus. Nõuetekohasuse kriteeriumide täitmisele tuleks pöörata erilist tähelepanu, kuna üldjuhul on taustteave loodusliku mulla kohta harva kättesaadav.
|
|
11.
|
Mulla kuivad koostisosad segatakse põhjalikult (nt suure mahutavusega laborisegistis). Mulla pH mõõtmiseks kasutatakse mulla ja 1 M kaaliumkloriidi (KCl) või 0,01 M kaltsiumkloriidi (CaCl2) lahuse segu suhtega 1:5 (vt allikas 14 ja 3. liide). Kui mulla happesus on suurem kui nõutavasse vahemikku jäävad väärtused (vt punkt 10), võib selle reguleerimiseks lisada sobiva koguse CaCO3. Kui muld on liiga leeliseline, võib happesuse suurendamiseks lisada punktis 10 kirjeldatud esimesest kolmest koostisosast koosnevat segu, millest on välja jäetud CaCO3.
|
|
12.
|
Kunstliku mulla maksimaalne veemahutavus määratakse vastavalt 2. liites kirjeldatud meetodile. Kaks kuni seitse päeva enne katse alustamist eelniisutatakse kuiva kunstlikku mulda piisava koguse destilleeritud või deioniseeritud vee lisamise teel, et saavutada veesisaldus, mis on umbes poole väiksem kui lõplik veesisaldus, mis jääb vahemikku 40–60 % maksimaalsest veemahutavusest. Niiskusesisaldus viiakse 40–60 protsendini maksimaalsest veemahutavusest, lisades uuritava kemikaali lahust ja/või destilleeritud või deioniseeritud vett (vt punktid 16–18). Mulla niiskusesisalduse täiendavaks ligikaudseks kontrollimiseks tuleks mulda õrnalt peos pigistada: sobiva niiskusesisalduse korral peaksid sõrmede vahele ilmuma väikesed veetilgad.
|
|
13.
|
Mulla niiskusesisaldus määratakse katse alguses ja lõpus vastavalt standardile ISO 11465 (17), kuivatades mulda 105 °C juures, kuni selle kaal enam ei muutu, ning mulla pH määratakse vastavalt 3. liitele või standardile ISO 10390 (14). Nende mõõtmiste tegemiseks tuleks kasutada lestadeta lisaproove nii kontrollmullast kui ka igale katsekontsentratsioonile vastavast mullast. Kui katses kasutatakse happelist või aluselist kemikaali, ei tohiks mulla pH-d muuta. Niiskusesisaldust tuleks jälgida kogu katse vältel, kaaludes nõusid korrapäraselt (vt punktid 20 ja 24).
|
Katseloomade valimine ja ettevalmistamine
|
14.
|
Katses kasutatav liik on Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). Katse alustamiseks on vaja sünkroonitud kultuurist pärit täiskasvanud emaseid lesti. Lestadega alustatakse katset umbes 7–14 päeva pärast nende täiskasvanuks saamist ehk 28–35 päeva pärast sünkroonimiseks vajaliku munemisperioodi algust (vt punkt 3 ja 4. liide). Tuleks registreerida lestade päritolu või tarnija ja laborikultuuri säilitamise andmed. Laborikultuuri säilitamise korral soovitatakse viia liigi kinnitav määramine läbi vähemalt kord aastas. Määramiseks kasutatav vorm on esitatud 6. liites.
|
Katsekontsentratsiooniga segude valmistamine
|
15.
|
Uuritav kemikaal segatakse mulla sisse. Orgaanilised lahustid, mis hõlbustavad mulla töötlemist uuritava kemikaaliga, tuleks valida lähtuvalt nende vähesest mürgisusest lestadele ning katseplaani tuleb lisada asjakohane lahustiga kontroll (vt punkt 29).
|
Vees lahustuv uuritav kemikaal
|
16.
|
Uuritava kemikaali lahus valmistatakse deioniseeritud vees sellises koguses, millest piisab kõikidele ühe katsekontsentratsiooni puhul kasutatavatele paralleelkultuuridele. Soovitatakse kasutada sobivas koguses vett, et saavutada nõutav niiskusesisaldus, st 40–60 % maksimaalsest veemahutavusest (vt punkt 12). Enne katsenõusse viimist segatakse uuritava kemikaali iga lahus põhjalikult ühe partii eelniisutatud mullaga.
|
Vees lahustumatu uuritav kemikaal
|
17.
|
Vees lahustumatu, kuid orgaanilises lahustis lahustuva kemikaali võib lahustada võimalikult väikeses koguses sobivas kandeaines (nt atsetoonis). Tuleks kasutada üksnes lenduvaid lahusteid. Kandeaine kasutamisel tuleks kõikide katsekontsentratsioonide ja kontrollrühma puhul kasutada kandeaine sama miinimumkogust. Kandeaine pihustatakse väikesele kogusele, näiteks 10 grammile peenele kvartsliivale või segatakse sellega. Substraadi liivasisaldust tuleks selle koguse võrra muuta. Kandeaine kõrvaldatakse vähemalt üks tund kestva tõmbekapis aurustamise teel. Kvartsliiva ja uuritava kemikaali segu lisatakse eelniisutatud mullale ja pärast nõutava niiskusesisalduse saavutamiseks vajaliku koguse deioniseeritud vee lisamist segatakse saadav segu põhjalikult läbi. Lõplik segu viiakse katsenõudesse. Tuleb arvestada, et mõni lahusti võib olla lestadele mürgine. Seepärast on juhul, kui lahusti mürgisus lestadele ei ole teada, soovitatav kasutada täiendavat veega kontrolli, mis ei sisalda lahustit. Kui on veenvalt tõendatud, et lahusti ei avalda (kasutatavatel kontsentratsioonidel) mingit mõju, võib veega kontrolli ära jätta.
|
Vees ja orgaanilistes lahustites raskesti lahustuv uuritav kemikaal
|
18.
|
Vees ja orgaanilistes lahustites raskesti lahustuva kemikaali puhul segatakse soovitava katsekontsentratsiooni saavutamiseks vajalik kogus uuritavat kemikaali sellise koguse peeneks jahvatatud kvartsliivaga, mis vastab 2,5 grammile katsenõu kohta (nt 10 g peent kvartsliiva nelja paralleelnõu kohta). Substraadi liivasisaldust tuleks selle koguse võrra muuta. Kõnealune kvartsliiva ja uuritava kemikaali segu lisatakse eelniisutatud mullale ja pärast nõutava niiskusesisalduse saavutamiseks vajaliku koguse deioniseeritud vee lisamist segatakse saadav segu põhjalikult läbi. Lõplik segu jaotatakse katsenõudesse. Kirjeldatud toiminguid korratakse iga katsekontsentratsiooni puhul ning valmistatakse ka sobiv kontrollsegu.
|
KATSE KÄIK
Katse- ja kontrollrühmad
|
19.
|
Iga kontroll- ja katsenõu puhul soovitatakse lisada 10 täiskasvanud emaslooma kunstlikusse mulda kuivmassiga 20 g. Katseorganismid tuleks lisada kahe tunni jooksul pärast lõpliku katsesubstraadi valmistamist (st pärast uuritava kemikaali lisamist). Erijuhul (nt kui vanandamist peetakse määravaks teguriks) võib lõpliku katsesubstraadi valmistamisest lestade lisamiseni jäävat ajavahemikku pikendada (sellist vanandamist käsitletakse üksikasjalikult allikas 18). Sellisel juhul tuleb aga esitada asjakohane teaduslik põhjendus.
|
|
20.
|
Pärast lestade lisamist mullale lisatakse lestade sööt ja seejärel tuleks määrata iga katsenõu algkaal, et kasutada seda võrdlusalusena mulla niiskusesisalduse jälgimiseks katse vältel vastavalt punktis 24 kirjeldatule. Seejärel kaetakse katsenõud punktis 8 kirjeldatud viisil ja paigutatakse katsekambrisse.
|
|
21.
|
Iga punktides 15–18 kirjeldatud meetodi puhul, mida kasutatakse uuritava kemikaaliga töötlemiseks, valmistatakse ka asjakohased kontrollkultuurid. Selleks järgitakse asjaomast kirjeldatud meetodit, ent ainsa erinevusena jäetakse uuritav kemikaal lisamata. Seega töödeldakse kontrollkultuure vajaduse korral orgaanilise lahusti, kvartsliiva või muu kandeainega, kasutades sama kontsentratsiooni või koguselist määra kui uuritava kemikaaliga kultuuride puhul. Kui uuritava kemikaali lisamiseks kasutatakse lahustit või muud kandeainet ja selle mürgisus ei ole teada, tuleks katses kasutada veel ühte kandeaineta ja uuritava kemikaalita kontrolli (vt punkt 17).
|
Katsetingimused
|
22.
|
Katsetemperatuur peaks olema 20 ± 2 °C. Temperatuur tuleks registreerida vähemalt kord päevas ja vajaduse korral tuleks seda reguleerida. Katses kasutatakse kontrollitavat valgustusrežiimi (soovitatavalt 16 tundi valgust ja 8 tundi pimedust) ja katsenõude läheduses valgustustihedust 400–800 luksi. Võrdlemise võimaldamiseks on need tingimused samad kui muude ökotoksikoloogiliste mullakatsete puhul (nt allikas 15).
|
|
23.
|
Kui kasutatakse keeratavaid kaasi, tuleks gaasivahetuse tagamiseks aereerida katsenõusid vähemalt kaks korda nädalas. Kui kasutatakse marlikatet, tuleks pöörata erilist tähelepanu mulla niiskusesisalduse säilitamisele (vt punktid 8 ja 24).
|
|
24.
|
Katsenõus oleva mullasubstraadi veesisaldus hoitakse kogu katse vältel konstantsena; selleks kaalutakse nõusid korrapäraselt (nt kord nädalas) ja lisatakse vajaduse korral vett juurde. Võimaliku veekao korvamiseks lisatakse deioniseeritud vett. Niiskusesisaldus ei tohiks katse kestel erineda algväärtusest rohkem kui 10 %.
|
Söötmine
|
25.
|
On leitud, et söödaks sobib juustulest (Tyrophagus putrescentiae (Schrank, 1781)). Samuti võivad söödaks sobida väikesed hooghännalised (nt noorloomad liigist Folsomia candida Willem, 1902 või Onychiurus fimatus) (19, 20), valgeliimuklased (nt Enchytraeus crypticus (Westheide & Graefe, 1992)) ja ümarussid (nt Turbatrix silusiae de Man, 1913) (21). Sööta soovitatakse enne katses kasutamist kontrollida. Sööda liik ja kogus peaksid olema sellised, millega saadakse nõuetekohasuse kriteeriumide täitmiseks piisav arv noorloomi (punkt 6). Saaklooma valimisel tuleks arvesse võtta uuritava kemikaali toimemehhanismi (nt akaritsiid võib olla mürgine ka söödaks kasutatavatele lestadele; vt punkt 26).
|
|
26.
|
Sööt peaks olema kättesaadav ad libitum (st iga kord lisatakse väike kogus (spaatliotsatäis)). Selleks otstarbeks võib kasutada ka hooghännalisi käsitlevas katsemeetodis kirjeldatud väikese võimsusega imurit või väikest värvipintslit. Tavaliselt piisab, kui lisada sööta katse alguses ja seejärel kaks kuni kolm korda nädalas. Kui ilmneb, et uuritav kemikaal on saakloomale mürgine, tuleks kaaluda söötmissageduse suurendamist ja/või muu sööda kasutamist.
|
Katsekontsentratsioonide valimine
|
27.
|
Sobivate katsekontsentratsioonide valimisel on kasu varasemast teabest uuritava kemikaali mürgisuse kohta, näiteks kontsentratsioonivahemiku leidmise katse tulemustest. Vajaduse korral tehakse kontsentratsioonivahemiku leidmise katse, kasutades viit uuritava kemikaali kontsentratsiooni vahemikus 0,1–1 000 mg kuiva mulla kilogrammi kohta ning iga kontsentratsiooni ja kontrolli puhul vähemalt ühte paralleelproovi. Kontsentratsioonivahemiku leidmise katse kestus on 14 päeva; seejärel määratakse täiskasvanud lestade suremus ja noorloomade arv. Lõplikus katses tuleks kontsentratsioonivahemik soovitatavalt valida nii, et see hõlmaks kontsentratsioone, mille juures täheldatakse mõju noorloomade arvule, kuid mitte täiskasvanud emasloomade elulemusele. Kemikaalide puhul, mis avaldavad surmavat ja subletaalset mõju peaaegu samal kontsentratsioonil, ei pruugi see siiski võimalik olla. Katses kasutatav kontsentratsioonivahemik peaks hõlmama ECx (nt EC50, EC25, EC10) väärtust ja kontsentratsioonivahemikku, mille puhul uuritav kemikaal avaldab huvipakkuvat mõju. Ekstrapoleerimist väärtuseni, mis on oluliselt väiksem kui väikseim kontsentratsioon, mille puhul täheldatakse mõju katseorganismidele, või suurem kui suurim katses kasutatav kontsentratsioon, tuleks kasutada üksnes erandjuhul ja selle kohta tuleks katseprotokollis esitada ammendav selgitus.
|
Katseplaan
Kontsentratsiooni ja mõju vahelise sõltuvuse katse
|
28.
|
Ühe muu võrdlusuuringu (valgeliimuklaste sigivuse katse (22)) alusel välja töötatud soovitustest lähtuvalt pakutakse välja kolm katseplaani. H. aculeifer'iga tehtud valideerimise tulemused kinnitavad kõikide kõnealuste katseplaanide üldist sobivust.
|
|
29.
|
Kontsentratsioonivahemiku kindlaksmääramisel tuleks meeles pidada järgmist.
|
—
|
ECx (nt EC10, EC50) määramiseks tuleks katses kasutada kahtteist kontsentratsiooni. Soovitatakse kasutada vähemalt kahte paralleelnõu kontsentratsiooni kohta ja kuut paralleelnõu kontrollrühmas. Kontsentratsioonide jada tegur võib varieeruda, st olla eeldatavas mõju avaldumise vahemikus 1,8 või väiksem ning sellest vahemikust väljaspool olevate suuremate ja väiksemate kontsentratsioonide puhul üle 1,8.
|
|
—
|
Täheldatavat toimet mitteavaldava kontsentratsiooni määramiseks tuleks kasutada vähemalt viit kontsentratsiooni geomeetrilises jadas. Soovitatakse kasutada nelja paralleelnõu kontsentratsiooni kohta ja lisaks kaheksat kontrollnõu. Kontsentratsioonide jada tegur ei tohiks olla suurem kui 2,0.
|
|
—
|
Kombineeritud lähenemisviis võimaldab määrata nii täheldatavat toimet mitteavaldava kontsentratsiooni kui ka ECx. Tuleks kasutada kaheksat uuritava kemikaali kontsentratsiooni geomeetrilises jadas. Soovitatakse kasutada nelja paralleelnõu kontsentratsiooni kohta ja lisaks kaheksat kontrollnõu. Kontsentratsioonide jada tegur ei tohiks olla suurem kui 1,8.
|
|
Piirsisalduskatse
|
30.
|
Kui kontsentratsioonivahemiku leidmise katses ei täheldata suurimal kasutatud kontsentratsioonil (nt kontsentratsioonil 1 000 mg mulla kuivmassi kilogrammi kohta) mingit mõju, võib lõpliku sigivuskatse teha piirsisalduskatsena, kasutades kontsentratsiooni 1 000 mg mulla kuivmassi kilogrammi kohta. Piirsisalduskatse võimaldab tõendada, et täheldatavat toimet mitteavaldav kontsentratsioon või EC10 on sigivuse puhul suurem kui kõnealune piirkontsentratsioon, ning samal ajal minimeerida katses kasutatavate lestade arvu. Nii uuritava kemikaaliga mulla kui ka kontrollmulla puhul tuleks kasutada kaheksat paralleelnõu.
|
Katse kestus ja mõõtmised
|
31.
|
Kõik täheldatud erinevused uuritava kemikaaliga nõudes ja kontrollnõudes olevate lestade käitumises ja morfoloogias tuleks registreerida.
|
|
32.
|
Ellujäänud lestad eemaldatakse mullast 14. katsepäeval kuumusega/valgusega ekstraheerimise teel või muu sobiva meetodiga (vt 5. liide). Noorloomad (st vastsed, protonümfid ja deutonümfid) ja täiskasvanud loomad loendatakse eraldi. Ekstraheerimise käigus leidmata jäänud täiskasvanud lestad registreeritakse surnud lestadena, kuna eeldatavalt surid nad ja lagundati enne hindamist. Ekstraheerimise tõhusust tuleb kontrollida kord või kaks aastas, kasutades kontrollrühma, milles täiskasvanud ja noorloomade arv on teada. Ekstraheerimise keskmine tõhusus peaks kõiki arenguetappe hõlmavate koondtulemuste puhul olema üle 90 % (vt 5. liide). Täiskasvanud ja noorloomade arvu ei korrigeerita ekstraheerimise tõhususe suhtes.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Andmete töötlemine
|
33.
|
Teave statistiliste meetodite kohta, mida võib kasutada katsetulemuste analüüsimiseks, on esitatud punktides 36–41. Peale selle tuleks tutvuda OECD dokumendiga nr 54 „Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application” („Praegused meetodid ökotoksilisuse andmete statistiliseks analüüsiks: rakendamissuunised”) (31).
|
|
34.
|
Katse peamine lõppnäitaja on sigivus, mida siin väljendatakse katsenõu kohta saadud noorloomade arvuna (alustades katset 10 täiskasvanud emasloomaga). Statistilise analüüsi käigus tuleb arvutada sigivuse määra aritmeetiline keskmine (X) ja hajuvus (s2) uuritava kemikaaliga rühmades ja kontrollrühmas. Näitajaid X ja s2 kasutatakse selliste dispersioonanalüüsi meetodite puhul nagu Studenti t-test, Dunnetti test või Williamsi test, samuti usaldusvahemiku leidmiseks usaldusnivool 95 %.
Märkus: kõnealune peamine lõppnäitaja on samaväärne sigivuse määraga, mida väljendatakse katses saadud elus noorloomade arvu ja katse alguses lisatud täiskasvanud emasloomade arvu jagatisena.
|
|
35.
|
Ellujäänud emasloomade arv kemikaalita kontrollrühmas on üks oluline nõuetekohasuse kriteerium ja see tuleb registreerida. Sarnaselt kontsentratsioonivahemiku leidmise katsele tuleks lõpp-protokolli märkida ka kõik muud kahjuliku mõju ilmingud.
|
ECx
|
36.
|
Punktis 34 kirjeldatud näitajat iseloomustavad ECx väärtused ning nende alumised ja ülemised usalduspiirid usaldusnivool 95 % arvutatakse asjakohaste statistiliste meetoditega (nt probitanalüüs, logistiline või Weibulli funktsioon, kohandatud Spearmani-Kärberi meetod või lihtne interpoleerimine). ECx leidmiseks sisestatakse kasutatavasse võrrandisse kontrollproovide keskväärtusest x % moodustav väärtus. EC50 või mõne muu ECx arvutamiseks tuleks kasutatud kontsentratsioonidele vastavate keskmiste (X) suhtes kohaldada regressioonanalüüsi.
|
Täheldatavat toimet mitteavaldav kontsentratsioon / vähim täheldatavat toimet avaldav kontsentratsioon
|
37.
|
Kui statistilise analüüsi eesmärk on teha kindlaks täheldatavat toimet mitteavaldav kontsentratsioon või vähim täheldatavat toimet avaldav kontsentratsioon, on vaja statistilisi andmeid iga nõu kohta (eraldi nõusid käsitletakse paralleelproovidena). Tuleks kasutada asjakohaseid statistilisi meetodeid kooskõlas OECD dokumendiga nr 54 „Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application”. Uuritava kemikaali pärssiva mõju hindamiseks kontrollrühmaga võrreldes kasutatakse üldjuhul hüpoteesi ühepoolset (väiksemamahulist) kontrollimist p väärtusel ≤ 0,05. Sellekohased näited on esitatud järgnevates punktides.
|
|
38.
|
Andmete normaaljaotust saab kontrollida näiteks andmete mudeliga sobivuse hindamiseks kasutatava Kolmogorovi-Smirnovi testi, variatsiooniulatuse ja standardhälbe suhtel põhineva testi või Shapiro-Wilki testiga (kahepoolne, p ≤ 0,05). Hajuvuse homogeensuse kontrollimiseks võib kasutada Cochrani, Levene'i või Bartletti testi (kahepoolne, p ≤ 0,05). Kui parameetrilise testi eeldused (normaaljaotus, hajuvuse homogeensus) on täidetud, võib kasutada ühepoolset dispersioonanalüüsi (ANOVA) ja järgnevaid mitmese võrdluse teste. Et teha kindlaks, kas kontrollrühm ja uuritava kemikaali eri kontsentratsioonidele vastavad katserühmad on üksteisest oluliselt erinevad (p ≤ 0,05), võib kasutada mitmese võrdluse testi (nt Dunnetti t-testi) või muutujate sammuviisilise elimineerimisega trenditesti (kontsentratsiooni ja mõju vahelise monotoonse sõltuvuse korral nt Williamsi testi) (soovitatava testi valimisel lähtutakse OECD dokumendist nr 54 „Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application”). Et määrata LOEC ja NOEC, tuleks kasutada mitteparameetrilist meetodit (nt Bonferroni U-testi vastavalt Holmile või Jonckheere'i-Terpstra trenditesti).
|
Piirsisalduskatse
|
39.
|
Kui on tehtud piirsisalduskatse (kontrollrühma võrdlemine ainult ühele kontsentratsioonile vastava katserühmaga) ja parameetrilise testi eeldused (normaaljaotus, homogeensus) on täidetud, võib arvulise tunnuse analüüsimiseks kasutada Studenti t-testi. Kui need nõuded ei ole täidetud, võib kasutada ebavõrdse hajuvuse suhtes kohandatud t-testi (Welchi t-test) või mitteparameetrilist testi, näiteks Manni-Whitney U-testi.
|
|
40.
|
Kontrollrühmade (lahustita ja lahustiga kontrollproovide) vaheliste oluliste erinevuste kindlakstegemiseks võib kummagi kontrollrühma paralleelproove analüüsida piirsisalduskatse puhul kirjeldatud viisil. Kui kõnealuste testidega ei tuvastata olulisi erinevusi, võib kõikide lahustita ja lahustiga kontrollproovide andmed ühte koondada. Vastasel juhul tuleks kõikide katserühmade andmeid võrrelda lahustiga kontrollproovide andmetega.
|
Katseprotokoll
|
41.
|
Katseprotokollis tuleks esitada vähemalt järgmine teave.
|
—
|
Uuritav kemikaal:
|
—
|
uuritava kemikaali identifitseerimisandmed, nimetus, partii, CASi number, puhtus;
|
|
—
|
uuritava kemikaali füüsikalis-keemilised omadused (nt log Kow, vees lahustuvus, aururõhk, Henry konstant (H) ja soovitatavalt teave kemikaali säilivuse kohta mullas).
|
|
|
—
|
Katseorganismid:
|
—
|
katseorganismide identifitseerimisandmed ja tarnija, kultiveerimistingimuste kirjeldus;
|
|
—
|
katseorganismide vanusevahemik.
|
|
|
—
|
Katsetingimused:
|
—
|
katseplaani ja katse läbiviimise kirjeldus;
|
|
—
|
katsemulla valmistamise üksikasjad; loodusliku mulla kasutamise korral mulla üksikasjalikud andmed (päritolu, taust, osakeste suurusjaotus, pH, orgaanilise aine sisaldus ja võimaluse korral mulla klassifitseerimisandmed);
|
|
—
|
mulla maksimaalne veemahutavus;
|
|
—
|
selle meetodi kirjeldus, mida kasutati mulla töötlemiseks uuritava kemikaaliga;
|
|
—
|
üksikasjad abikemikaalide kohta, mida kasutati uuritava kemikaaliga töötlemiseks;
|
|
—
|
katsenõude suurus ja katsemulla kuivmass nõu kohta;
|
|
—
|
katsetingimused: valgustustihedus, valgus- ja pimedusperioodi kestus, temperatuur;
|
|
—
|
söötmisrežiimi kirjeldus, katses kasutatud sööda liik ja kogus, söötmiskuupäevad;
|
|
—
|
mulla pH ja veesisaldus katse alguses ja kestel (kontrollrühmas ja igas uuritava kemikaaliga rühmas);
|
|
—
|
ekstraheerimismeetodi üksikasjalik kirjeldus ja ekstraheerimise tõhusus.
|
|
|
—
|
Katsetulemused:
|
—
|
noorloomade arv igas katsenõus katse lõpus;
|
|
—
|
täiskasvanud emasloomade arv ja täiskasvanud loomade suremus (%) igas katsenõus katse lõpus;
|
|
—
|
ilmsete sümptomite ja selgete käitumuslike muutuste kirjeldus;
|
|
—
|
võrdluskemikaaliga saadud tulemused;
|
|
—
|
kokkuvõtlikud näitajad (ECx ja/või täheldatavat toimet mitteavaldav kontsentratsioon) koos usalduspiiridega usaldusnivool 95 % ning nende arvutamise meetodi kirjeldus;
|
|
—
|
kontsentratsiooni ja mõju vahelise sõltuvuse graafik;
|
|
—
|
kõrvalekalded käesolevast katsemeetodist ja kõik katse ajal täheldatud ebatavalised ilmingud.
|
|
|
KIRJANDUS
|
(1)
|
Casanueva, M. E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57: 21–46.
|
|
(2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pac. Insects 24: 259–274.
|
|
(3)
|
Bakker, F. M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E. D., ja van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. J. Soils Sediments 3: 73–77.
|
|
(4)
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. 2. väljaanne. Väljaandes: Dahl, F. (toim.), Die Tierwelt Deutschlands, 59. Teil. G. Fischer, Jena, 523 lk.
|
|
(5)
|
Ruf, A. (1991). Do females eat males? Laboratory studies on the popualation development of Hypoaspis aculeifer (Acari: Parasitiformes). Väljaandes: Dusbabek, F., ja Bukva, V. (toim.), Modern Acarology. Academia Prague & SPD Academic Publishing bv, Haag. 1. köide, lk 487–492.
|
|
(6)
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC, lk 241–249.
|
|
(7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio, lk 621–628.
|
|
(8)
|
Krogh, P. H., ja Axelsen, J. A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. Väljaandes: Løkke, H., ja van Gestel, C. A. M., Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, lk 239–251.
|
|
(9)
|
Løkke, H., Janssen, C. R., Lanno, R. P., Römbke, J., Rundgren, S., ja Van Straalen, N. M. (2002). Soil Toxicity Tests – Invertebrates. Väljaandes: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P. W., Van Straalen, N. M., ja Tarazona, J. V. (toim.). SETAC Press, Pensacola, USA. 128 lk.
|
|
(10)
|
Schlosser, H.-J., ja Riepert, F. (1992a). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beitr. N. F. 34: 395–412.
|
|
(11)
|
Schlosser, H.-J., ja Riepert, F. (1992b). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N. F. 34: 413–433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K., ja Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environ. Sci. Technol. 39: 7154–7157.
|
|
(13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, lk 95–122.
|
|
(14)
|
Rahvusvaheline Standardiorganisatsioon (1994). Soil Quality – Determination of pH, No. 10390. Rahvusvaheline Standardiorganisatsioon, Genf.
|
|
(15)
|
Käesoleva lisa peatükk C.8 „Toksilisus vihmaussidele”.
|
|
(16)
|
EPPO (2003). EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP / EPPO Bull. 33, lk 195–209.
|
|
(17)
|
Rahvusvaheline Standardiorganisatsioon (1993). Soil Quality – Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. Rahvusvaheline Standardiorganisatsioon, Genf.
|
|
(18)
|
Fairbrother, A., Glazebrock, P. W., Van Straalen, N. M., ja Tarazona, J. V. (2002). Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. SETAC Press, Pensacola, FL, USA.
|
|
(19)
|
Chi, H. (1981). Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Mitt. Dtsch. Ges. Allg. Angew. Entomol. 3: 122–125.
|
|
(20)
|
Schlosser, H.-J., ja Riepert, F. (1992c). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Zool. Beitr. N. F. 34: 395–433.
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M., ja Krogh, P. H. (2007). Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Appl. Soil Ecol. 36: 130–135.
|
|
(22)
|
Käesoleva lisa peatükk C.32 „Valgeliimuklaste sigivuse katse”.
|
|
(23)
|
Rahvusvaheline Standardiorganisatsioon (1994). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. Rahvusvaheline Standardiorganisatsioon, Genf.
|
|
(24)
|
Southwood, T. R. E. (1991). Ecological methods: With particular reference to the study of insect populations. (2. väljaanne.) Chapman & Hall, London, 524 lk.
|
|
(25)
|
Dunger, W., ja Fiedler, H. J. (1997). Methoden der Bodenbiologie. (2. väljaanne.) G. Fischer, Jena, 539 lk.
|
|
(26)
|
Lesna, I., ja Sabelis, M. W. (1999). Diet-dependent female choice for males with „good genes” in a soil predatory mite. Nature 401: 581–583.
|
|
(27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Dtsch. Ges. Allg. Angew. Entomol. 7: 103–107.
|
|
(28)
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
(29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zool. Pol. 24: 11–59.
|
|
(30)
|
Kevan, D. K. McE., ja Sharma, G. D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6: 647–658.
|
|
(31)
|
OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No. 54, ENV/JM/MONO(2006)18.
|
1. liide
Mõisted
Käesoleva katsemeetodi puhul kasutatakse järgmisi mõisteid (kõiki kontsentratsioone, mille puhul mõju avaldub teatud kindlal määral, väljendatakse uuritava kemikaali massina katsemulla kuivmassi ühiku kohta).
Kemikaal
– aine või segu.
Täheldatavat toimet mitteavaldav kontsentratsioon (NOEC)
– uuritava kemikaali kontsentratsioon, mille juures ei täheldata mingit mõju. Käesoleva katsemeetodi puhul ei täheldata sellisel kontsentratsioonil teatava kokkupuuteperioodi vältel kontrollrühmaga võrreldes statistiliselt olulist (p < 0,05) mõju.
Vähim täheldatavat toimet avaldav kontsentratsioon (LOEC)
– uuritava kemikaali väikseim kontsentratsioon, mille juures täheldatakse teatava kokkupuuteperioodi vältel kontrollrühmaga võrreldes statistiliselt olulist (p < 0,05) mõju.
ECx
(kontsentratsioon, mille puhul toime on x %)– kontsentratsioon, mille juures teatava kokkupuuteperioodi vältel katseorganismidele avalduva mõju ulatus on x % kontrollrühma asjaomase näitaja väärtusest. Näiteks EC50 on kontsentratsioon, mille puhul kindlaksmääratud kokkupuuteperioodi vältel avaldub kemikaali mõju katses uuritavale näitajale 50 protsendil kemikaaliga kokku puutuvast populatsioonist.
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil.
2. liide
Mulla maksimaalse veemahutavuse määramine
Mulla maksimaalse veemahutavuse määramiseks peetakse sobivaks järgmist meetodit. Seda kirjeldatakse standardi ISO/DIS 11268-2 („Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction”) (23) C lisas.
Sobiva proovivõtuseadme (puuriga toru vmt) abil kogutakse kindlaksmääratud kogus (nt 5 g) katsemulda. Toru alumine ots kaetakse filterpaberi tükiga, toru täidetakse veega ja pannakse resti peale veevanni. Toru tuleks vette lasta vähehaaval, kuni veetase on mullapinnast kõrgemal. Seejärel tuleks toru umbes kolmeks tunniks vette jätta. Kuna muld ei suuda hoida kogu kapillaaridesse absorbeerunud vett, tuleks mullaproovil lasta kahe tunni vältel nõrguda, asetades toru väga märja peeneks jahvatatud kvartsliiva kihile, mis paikneb kuivamise ärahoidmiseks suletud nõus. Seejärel tuleks proov kaaluda ning kuivatada seda 105 °C juures, kuni selle kaal enam ei muutu. Veemahutavuse saab seejärel arvutada järgmise valemiga:
 , ,
kus:
|
|
S on veega küllastunud substraadi mass + toru mass + filterpaberi mass;
|
|
|
T on tühimass (toru mass + filterpaberi mass);
|
|
|
D on substraadi kuivmass.
|
3. liide
Mulla pH määramine
Allpool kirjeldatud meetod mulla pH määramiseks põhineb kirjeldusel, mis on esitatud standardis ISO/DIS 10390 „Soil Quality – Determination of pH” (16).
Kindlaksmääratud mullakogusel lastakse toatemperatuuril vähemalt 12 tundi kuivada. Seejärel valmistatakse vähemalt 5 grammi mulda sisaldav suspensioon, kasutades 1 M analüütilise puhtusastmega kaaliumkloriidi (KCl) või 0,01 M analüütilise puhtusastmega kaltsiumkloriidi (CaCl2) lahust, mille maht on mulla mahust viis korda suurem. Suspensiooni loksutatakse põhjalikult viis minutit ja seejärel lastakse sellel settida vähemalt kaks tundi, kuid mitte kauem kui 24 tundi. Seejärel mõõdetakse vedela faasi pH väärtus pH-meetriga, mis kaliibritakse enne iga mõõtmist sobiva rea puhverlahustega (nt pH väärtustel 4,0 ja 7,0).
4. liide
Hypoaspis (Geolaelaps) aculeifer'i ja söödaks kasutatavate lestade kasvatamine ning kultuuri sünkroonimine
Hypoaspis (Geolaelaps) aculeifer'i kasvatamine
Kultuure võib säilitada plastnõudes või klaaspurkides, mis on täidetud kipsi ja söepulbri seguga (9:1). Kipsi niiskena hoidmiseks võib vajaduse korral lisada mõne tilga destilleeritud või deioniseeritud vett. Optimaalne kasvatustemperatuur on 20 ± 2 °C; valgus- ja pimedusperioodi pikkus ei ole selle liigi puhul oluline. Saakloomana võib kasutada lesti liigist Typrophagus putrescentiae või Caloglyphus sp. (söödaks kasutatavate lestade käsitsemisel tuleb olla ettevaatlik, kuna need võivad inimesel allergiat põhjustada), ent sobivad ka ümarussid, valgeliimuklased ja hooghännalised. Saaklooma päritolu tuleks registreerida. Populatsioon võib tekkida ühestainsast emasloomast, sest isasloomad arenevad viljastamata munarakkudest. Põlvkonnad eksisteerivad suures osas samaaegselt. Emaslooma eluiga võib ulatuda vähemalt 100 päevani ja ta võib muneda elu jooksul umbes 100 muna. Maksimaalne munemissagedus saavutatakse 10–40 päeva pärast täiskasvanuks saamist ja see on 2,2 muna emaslooma kohta päevas. Aeg munast täiskasvanud emaslooma väljaarenemiseni on 20 °C juures umbes 20 päeva. Eelnevalt tuleks säilitada ja kasvatada enam kui ühte kultuuri.
Typrophagus putrescentiae kasvatamine
Lesti hoitakse klaasnõus, mis on täidetud peene õllepärmipulbriga ja mis paigutatakse põgenemise ärahoidmiseks KNO3 lahusega täidetud plastämbrisse. Söödaks kasutatavad lestad pannakse selle pulbri pinnale. Seejärel segatakse need spaatli abil ettevaatlikult pulbriga (mida tuleb vahetada kaks korda nädalas).
Kultuuri sünkroonimine
Katses kasutatavad isendid peaksid olema umbes ühevanused (täiskasvanuks saamisest peaks olema möödunud umbes 7 päeva). Kasvatustemperatuuril 20 °C on see saavutatav järgmiselt:
emasloomad viiakse puhtasse kasvatusnõusse ja lisatakse piisavas koguses sööta;
|
—
|
loomadel lastakse kaks kuni kolm päeva muneda ja seejärel emasloomad eemaldatakse;
|
|
—
|
28–35 päeva pärast täiskasvanud emasloomade viimist puhtasse kasvatusnõusse võetakse nõust täiskasvanud emasloomad katse tegemiseks.
|
Täiskasvanud emasloomi saab muus arenguetapis olevaist loomadest ja isasloomadest hõlpsalt eristada nende suuremate mõõtmete, paisunud kehakuju (isasloomad on peenemad ja lamedad) ja seljakilbi pruuni värvuse järgi: ebaküpsete lestade värvus varieerub valgest kreemikani. Lestade areng temperatuuril 20 °C toimub üldjoontes vastavalt allpool kirjeldatud skeemile (joonis): munastaadium 5 päeva, vastsestaadium 2 päeva, protonümfi staadium 5 päeva, deutonümfi staadium 7 päeva, emaslooma munemiseelne periood 2 päeva. Seejärel on lestad täiskasvanud.
Joonis.
Hypoaspis (Geolaelaps) aculeifer'i areng temperatuuril 20 °C. („Eemaldamine” – katses kasutatavate emasloomade eemaldamine.)

Täiskasvanud katseloomad eemaldatakse sünkroonitud kultuurist ja viiakse katsenõudesse 28–35 päeva pärast seda, kui eelmise põlvkonna emasloomad on alustanud munemist (st 7–14 päeva pärast täiskasvanuks saamist). Sellega tagatakse, et katseloomad on munemiseelse etapi juba läbinud ja kultiveerimisnõus olevate isasloomadega paaritunud. Laborikultuurides tehtud vaatlustest nähtub, et isasloomade juuresolekul paarituvad emasloomad kohe või veidi aega pärast täiskasvanuks saamist (Ruf, Vaninnen, isiklikud tähelepanekud). Seitsme päeva pikkune periood on valitud selleks, et hõlbustada ühildamist laboritöö tavarütmiga ja jätta ruumi individuaalse varieeruvuse jaoks lestade arengus. Munemist peaks alustama vähemalt sama palju emasloomi, kui vajatakse hiljem katse jaoks. Näiteks kui katse jaoks on vaja 400 emaslooma, tuleks lasta vähemalt 400 emasloomal kaks kuni kolm päeva muneda. Sünkroonitud populatsiooni saamiseks on vaja vähemalt 1 200 muna (emasloomade osakaal umbes 0,5; suremus umbes 0,2). Kannibalismi ärahoidmiseks on otstarbekas hoida ühes nõus kõige rohkem 20–30 munevat emaslooma.
5. liide
Ekstraheerimismeetodid
Mikrolülijalgsete puhul on sobiv meetod isendite mullast/substraadist eraldamiseks kuumusega ekstraheerimine (vt joonis allpool). See meetod põhineb organismide aktiivsusel, seega on võimalik registreerida üksnes liikuvad isendid. Kuumusega ekstraheerimise põhimõte seisneb selles, et organismide elutingimusi proovis halvendatakse järk-järgult, mistõttu nad lahkuvad substraadist ja kukuvad fikseerimisvedelikku (nt etanool). Olulised aspektid on seejuures ekstraheerimise kestus ning organismide elutingimuste heast mõõdukaks ja mõõdukast halvaks muutumise gradient. Ekstraheerimise kestus peaks ökotoksikoloogiliste katsete puhul olema võimalikult lühike, sest populatsiooni juurdekasv ekstraheerimise ajal muudaks tulemused ebausaldusväärseks. Teisest küljest peavad proovide temperatuur ja niiskustingimused jääma alati vahemikku, mille puhul lestadel on võimalik liikuda. Mullaproovi kuumutamine toob kaasa substraadi kuivamise. Kui kuivamine on liiga kiire, võib ka mõni lest ära kuivada, enne kui ta jõuab põgeneda.
Seepärast pakutakse välja järgmine meetod (24, 25).
|
|
Seade: Tullgreni lehter või muu võrreldav seade, näiteks MacFadyeni lehter (ülaltkuumutusega, proov asetatakse lehtri kohale).
|
|
|
Kuumutusrežiim: 12 tunni vältel 25 °C, 12 tunni vältel 35 °C, 24 tunni vältel 45 °C (kokku 48 tundi). Temperatuuri tuleks mõõta substraadi sees.
|
|
|
Fikseerimisvedelik: 70 % etanool.
|
|
|
Üksikasjalik käik: võetakse katses kasutatud klaasnõu. Selle kaas eemaldatakse ja nõu suu ümber mähitakse tükk võrku või kangast. Kanga ava suurus peaks olema 1,0–1,5 mm. Kangas kinnitatakse kummipaelaga. Nõu pööratakse ettevaatlikult tagurpidi ja asetatakse ekstraheerimisseadmesse. Kangas hoiab ära substraadi pudenemise fikseerimisvedelikku, kuid võimaldab lestadel proovist lahkuda. Kui kõik nõud on paigale asetatud, alustatakse kuumutamist. Ekstraheerimine lõpetatakse 48 tunni pärast. Fikseerimisnõud eemaldatakse ja lestad loendatakse anatoomilise mikroskoobi abil.
|
Valitud meetodiga saavutatav ekstraheerimise tõhusus peab olema tõendatud üks või kaks korda aastas tehtava katsega, milles kasutatakse kemikaaliga töötlemata katsesubstraati sisaldavaid nõusid, kus hoitakse teadaoleval arvul noorloomi ja täiskasvanud lesti. Ekstraheerimise keskmine tõhusus peaks kõiki arenguetappe hõlmavate koondtulemuste puhul olema ≥ 90 %.
Tullgreni ekstraheerimisseade

Katsenõu ettevalmistamine ekstraheerimiseks pärast katse lõppemist
6. liide
Hypoaspis (Geolaelaps) aculeifer'i määramine
|
Alamklass/selts/alamselts
|
|
Sugukond
|
|
Perekond/alamperekond/liik
|
|
Acari/Parasitiformes/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Autor ja kuupäev
|
F. Faraji, Ph.D. (MITOX), 23. jaanuar 2007
|
|
Kasutatud kirjandus
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Die Tierwelt Deutschlands, 59. Teil. (2. muudetud väljaanne.) Lk 1–523.
Hughes, A. M. (1976). The mites of stored food and houses. Ministry of Agriculture, Fisheries and Food, Technical Bulletin 9. 400 lk.
Krantz, G. W. (1978). A Manual of Acarology. Oregon State University Book Stores, Inc. 509 lk.
|
|
Määramiseks olulised tunnused
|
Kilp kumera hammasja servaga; hüpostoomi soontes üle 6 hambakese; tagumised seljaharjased Z4 mitte väga pikad; seljaharjased harjasekujulised; genitaalkilp tavapärase suurusega, mitte oluliselt suurenenud, ei ulatu anaalkilbini; seljakilbi tagumisel poolel puuduvad paarumata harjased; II ja IV jalapaaril mõned suured paksud harjased; seljaharjased Z5 umbes kaks korda pikemad kui J5; lõugtundla liikumatul lülil 12–14 hammast ja liikuval lülil 2 hammast; idiosoomi pikkus 520–680 μm.
Bioloogilises tõrjes kasutatakse ka liiki Hypoaspis miles ning see võidakse H. aculeifer iga segi ajada. Peamine erinevus on järgmine:
H. miles kuulub alamperekonda Cosmolaelaps ja sellel liigil on noakujulised seljaharjased, samas kui H. aculeifer kuulub alamperekonda Geolaelaps ja tema seljaharjased on harjasekujulised.
|

7. liide
Põhiteave Hypoaspis (Geolaelaps) aculeifer'i bioloogia kohta
Hypoaspis aculeifer kuulub sugukonda Laelapidae, seltsi Acari (lestad), klassi Arachnida, hõimkonda Arthropoda. Selle liigi esindajaid leidub iga tüüpi mullas ning nad toituvad teistest lestadest, ümarussidest, valgeliimuklastest ja hooghännalistest (26). Toidunappuse korral lähevad nad üle kannibalismile (27). Röövlestade keha jaguneb idiosoomiks ja gnatosoomiks. Idiosoom ei ole selgelt jagunenud prosoomiks (pearindmik) ja opistosoomiks (tagakeha). Gnatosoomil (näokilp) paiknevad toitumiseks kasutatavad suised: lõugkobijad ja lõugtundlad. Lõugtundlad on kolmeharulised ja neil on eri kujuga hambad. Isasloomad kasutavad lõugtundlaid peale toiduneelamise peamiselt spermatofooride ülekandmiseks emasloomadele. Seljakilp katab peaaegu kogu idiosoomi. Suure osa emaslooma idiosoomist võtavad enda alla suguorganid, mis muutuvad eriti märgatavaks veidi aega enne munemist. Kõhuosal on kaks kilpi: rinnakukilp ja genitaalkilp. Kõik jalad on varustatud harjaste ja ogadega. Harjaseid kasutavad lestad enda kohalhoidmiseks mullas või mullapinnal liikumisel. Esimest paari jalgu kasutatakse peamiselt tundlatena. Teist paari jalgu kasutatakse liikumise kõrval ka saagi haaramiseks. Neljandal jalapaaril paiknevaid ogasid kasutatakse nii kaitseks kui ka edasiliikumiseks (28). Isasloomade pikkus on 0,55–0,65 mm ja kaal 10–15 μg. Emasloomade pikkus on 0,8–0,9 mm ja nad kaaluvad 50–60 μg (8, 28) (joonis 1).
Joonis 1.
H. aculeifer'i emasloom, isasloom, protonümf ja vastne.

Temperatuuril 23 °C saavad lestad suguküpseks 16 päevaga (emasloomad) või 18 päevaga (isasloomad) (6). Seemnerakud viiakse emaslooma solenostoomi ja sealt liiguvad need edasi munasarja. Munasarjas toimub seemnerakkude küpsemine ja säilitamine. Viljastamine leiab aset alles pärast seemnerakkude küpsemist munasarjas. Emasloomad munevad viljastatud või viljastamata munarakud eraldi või kogumikena eelistatult pragudesse või aukudesse. Paaritunud emasloomad saavad kummastki soost järglasi, samas kui paaritumata emasloomadel kooruvad üksnes isased noorloomad. Täiskasvanuks saamiseks läbitakse neli arenguetappi (munast vastseks, vastsest protonümfiks, protonümfist deutonümfiks, deutonümfist täiskasvanuks).
Munad on piimjasvalged, klaasjad, ovaalsed, umbes 0,37 mm pikkused ja kõva kestaga. Vastavalt allikale 8 on vastsete pikkus 0,42–0,45 mm. Neil on vaid kolm paari jalgu. Peaosas on lõugkobijad ja lõugtundlad juba välja arenenud. Mõne väikese hambaga lõugtundlaid kasutatakse munast koorumiseks. Esimese kestamise järel, mis toimub 1–2 päeva pärast koorumist, arenevad välja protonümfid. Nad on samuti valged, nende pikkus on 0,45–0,62 mm (8) ja neil on neli paari jalgu. Lõugtundlatel on kõik hambad olemas. Selles etapis alustavad lestad toitumist. Sel otstarbel torgatakse lõugtundlad läbi saaklooma kutiikuli ja tema kehasse eritatakse sekreeti kehaväliseks seedimiseks. Seejärel saab lest vedeldatud toidu sisse imeda. Lõugtundlaid saab kasutada ka toidutükkidest suuremate osakeste rebimiseks (28). Pärast veel ühte kestamist arenevad välja deutonümfid. Nad on 0,60–0,80 mm pikkused (8) ja nende värvus varieerub kollasest helepruunini. Alates sellest etapist on võimalik eristada emasloomi isasloomadest. Veel ühe kestamise järel, mille vältel loomad ei ole aktiivsed ja neil areneb välja pruun kilp (umbes 14 päeva möödudes), on lestad täiskasvanud (28, 29, 30). Nende eluiga 25 °C juures on 48–100 päeva (27).
8. liide
Hypoaspis'ega katse tegemiseks vajalike toimingute kokkuvõte ja ajakava
|
Aeg (päevades)
(katse alustamise päev = 0-päev)
|
Tegevus/ülesanne
|
|
28–35 päeva enne katset
|
Emasloomad viiakse sünkroonimise alustamiseks tüvikultuurist puhastesse nõudesse
2 päeva hiljem: emasloomad eemaldatakse
Kaks kuni kolm korda nädalas: lisatakse piisavas koguses sööta
|
|
5 (± 2) päeva enne katset
|
Valmistatakse kunstlik muld
|
|
4 (± 2) päeva enne katset
|
Määratakse kunstliku mulla veemahutavus
Lastakse öö läbi kuivada
Järgmisel päeval: proovid kaalutakse ja arvutatakse veemahutavus
|
|
4 (± 2) päeva enne katset
|
Kunstlik muld eelniisutatakse, et saavutada niiskusesisaldus 20–30 % veemahutavusest
|
|
Katse alustamise päev (0-päev)
|
Alustatakse katset: uuritav kemikaal lisatakse kunstlikule mullale
Igasse paralleelnõusse viiakse 10 emaslooma
Kõik paralleelnõud kaalutakse
Valmistatakse abiootilised kontrollproovid niiskusesisalduse ja pH mõõtmiseks – 2 paralleelproovi iga kontsentratsiooni kohta
Niiskusesisalduse määramiseks valmistatud kontrollproovidel lastakse öö läbi kuivada
Järgmisel päeval: niiskusesisalduse määramiseks valmistatud kontrollproovid kaalutakse
Järgmisel päeval: mõõdetakse kuivatatud abiootiliste kontrollproovide pH
|
|
3., 6., 9., 12. päev (ligikaudne)
|
Igasse paralleelnõusse lisatakse piisav kogus saakloomi
Kõik paralleelnõud kaalutakse ja lisatakse vett aurustunud vee asendamiseks
|
|
14. päev
|
Katse lõpetatakse, alustatakse ekstraheerimist kõikidest paralleelproovidest ja ekstraheerimise tõhususe hindamiseks valmistatud kontrollproovidest
Veesisalduse määramiseks valmistatud kontrollproovidel lastakse öö läbi kuivada
Järgmisel päeval: veesisalduse määramiseks valmistatud kontrollproovid kaalutakse
Järgmisel päeval: mõõdetakse kuivatatud kontrollproovide pH
|
|
16. päev
|
Ekstraheerimine lõpetatakse
|
|
16. päevale järgnevad päevad
|
Registreeritakse täiskasvanud ja noorloomade arv ekstraheeritud materjalis
Esitatakse tulemused, kasutades näidistabeleid
Esitatakse katseprotokoll, kasutades katseprotokolli vormi
|
C.37. 21-PÄEVANE KATSE KALADEGA: LÜHIAJALINE SÕELKATSE ÖSTROGEENSE JA ANDROGEENSE TOIME NING AROMATAASI INHIBEERIMISE KONTROLLIMISEKS
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 230 (2009). Vajadus töötada välja ja valideerida kaladega tehtav katse, millega saab välja selgitada teatavaid endokriinsüsteemi mõjutavaid kemikaale, tuleneb murest, et keskkonnas esinev kemikaali kontsentratsioon võib avaldada kahjulikku mõju nii inimesele kui ka loomadele, kuna kõnealused kemikaalid mõjutavad endokriinsüsteemi. OECD algatas 1998. aastal prioriteetse tegevussuunana olemasolevate juhendite läbivaatamise ja uute väljatöötamise, et sõeluuringutega selgitada välja võimalikud endokriinsüsteemi kahjustajad ja katsetada neid. Üks tegevussuund oli töötada välja katsejuhend kemikaalide sõeluuringu tegemiseks, et selgitada välja kemikaale, mis mõjutavad kalade endokriinsüsteemi. 21-päevane kalade endokriinsüsteemi sõeluuring on läbinud ulatusliku valideerimisprogrammi teatavate kemikaalide laboritevaheliste uuringutega, millega tõendati, et katse annab asjakohaseid ja usaldusväärseid tulemusi östrogeense toimega või aromataasi inhibeerivate kemikaalide kindlakstegemisel (1, 2, 3, 4, 5) kolme kalaliigi puhul (tüse tömpnina, jaapani riisikala ja vöötdaanio); androgeense toime kindlakstegemine on võimalik tüseda tömpnina ja jaapani riisikala, kuid mitte vöötdaanio puhul. Käesolev katsemeetod ei võimalda kindlaks teha antiandrogeenseid kemikaale. Valideerimise on vastastikuse eksperdihinnangu korras läbi vaadanud katsejuhendite programmi (6) riiklike koordinaatorite määratud ekspertide komisjon. Katse eesmärk ei ole määrata konkreetset hormonaalse häire mehhanismi, kuna katseloomadel on töökorras hüpotalamuse-ajuripatsi-sugunäärmete (HAS-) telg, mis võib reageerida kemikaalidele, mis mõjutavad HAS-telge eri tasanditel. Kalade lühiajalises paljunemise katses (OECD katsejuhend nr 229) uuritakse tüseda tömpnina sigivust ja, kui see on asjakohane, sugunäärmete histopatoloogiat, samuti määratakse kõiki näitajaid, mida uuritakse käesoleva katsemeetodiga. OECD katsejuhend nr 229 võimaldab sõelkatsega kindlaks teha kemikaale, mis eri mehhanismide, sealhulgas endokriinsüsteemi kaudu mõjutavad paljunemist. Neid võimalikke mehhanisme tuleks kaaluda, et valida kõige sobivam katsemeetod.
|
|
2.
|
Käesolevas katsemeetodis kirjeldatud in vivo sõeluuringus hoitakse marja heitvaid emaskalu ja suguküpseid isaskalu koos ja kemikaaliga kokkupuutes nende elutsükli piiratud osa (21 päeva) jooksul. 21-päevase kokkupuuteperioodi lõpus mõõdetakse isas- ja emaskaladel, sõltuvalt liigist, üht või kaht bioloogilist näitajat, millest tehakse järeldused uuritava kemikaali östrogeense, aromataasi inhibeeriva või androgeense toime kohta; need näitajad on vitellogeniin ja teisesed sootunnused. Vitellogeniini määratakse nii tüseda tömpnina, jaapani riisikala kui ka vöötdaanio puhul; teiseseid sootunnuseid mõõdetakse üksnes tüseda tömpnina ja jaapani riisikala puhul.
|
|
3.
|
Käesolevat bioloogilist katsemeetodit saab kasutada in vivo sõeluuringuks teatavate endokriinsete toimete puhul ja selle kasutamist tuleks vaadelda „Endokriinsüsteemi kahjustavate kemikaalide kontrollimise ja hindamise OECD kontseptuaalse raamistiku” osana (28).
|
LÄHTEKAALUTLUSED JA PIIRANGUD
|
4.
|
Vitellogeniini sünteesitakse tavaliselt ovipaarsete selgroogsete emasloomade maksas vastuseks veres ringlevale endogeensele östrogeenile. See on munarebu valkude eelkäija ja pärast sünteesimist maksas liigub see verega munasarjadesse, kus arenevad munarakud seda seovad ja modifitseerivad. Vitellogeniin on peaaegu tuvastamatu isaskalade ja ebaküpsete emaskalade vereplasmas, kuna sellistel kaladel ei ole vereringes piisavalt östrogeeni, kuid nende maks on võimeline vitellogeniini sünteesima ja verre eritama vastuseks stimuleerimisele eksogeense östrogeeniga.
|
|
5.
|
Vitellogeniini mõõtmise kaudu tehakse kindlaks kemikaalid, millel on mitmesuguseid östrogeenseid toimeid. Östrogeense toimega kemikaale on võimalik tuvastada vitellogeniini mõõtmisega isaskalades ja see on eelretsenseeritud teaduskirjanduses hästi tõendatud (nt (7)). Samuti on tõendatud, et vitellogeniini toodetakse pärast kokkupuudet aromatiseeritavate androgeenidega (8, 9). Kui emaskalade veres vähendatakse östrogeeni taset, näiteks sellega, et inhibeeritakse ensüüm aromataasi, mis muundab endogeense androgeeni looduslikuks östrogeeniks 17β-östradiooliks, põhjustab see vitellogeniini kontsentratsiooni vähenemise; seda kasutatakse selliste kemikaalide leidmiseks, mis inhibeerivad aromataasi (10, 11). Vitellogeniini tasemes pärast kokkupuudet östrogeeniga või aromataasi inhibiitoriga ilmneva toime bioloogiline olulisus on hästi tõendatud. Siiski on võimalik, et vitellogeniini sünteesi emaskalades võib mõjutada ka kemikaali üldine mürgisus ja muu kui endokriinse mehhanismi kaudu avalduv mürgisus, näiteks hepatotoksilisus.
|
|
6.
|
Välja on töötatud ja tavakasutamiseks edukalt standarditud mitu mõõtmismeetodit. Nende hulgas on liigispetsiifilised ensüümimmuunsorptsioonanalüüsi (ELISA) meetodid, milles vitellogeniini mõõtmiseks üksikisenditelt saadud väikestes vere- või maksaproovides kasutatakse immunokeemiat (12, 13, 14, 15, 16, 17, 18). Vitellogeniini mõõtmiseks võetakse tüseda tömpnina vereproov, vöötdaanio vereproov või pea-saba homogenaat ja jaapani riisikala maks. Jaapani riisikala puhul on vitellogeniini verest ja maksast määramise tulemused omavahel heas korrelatsioonis (19). 6. liites on esitatud soovitatavad proovivõtumeetodid vitellogeniini määramiseks. Laialdaselt kättesaadavad on vitellogeniini mõõtmise komplektid; sellised komplektid peaksid põhinema valideeritud liigispetsiifilisel ELISA meetodil.
|
|
7.
|
Teatavate liikide isaskalade teisesed sootunnused on väliselt nähtavad, mõõdetavad ja sõltuvad endogeensete androgeenide tasemest vereringes; see on nii tüseda tömpnina ja jaapani riisikala puhul, kuid mitte vöötdaanio puhul, kellel ei ole mõõdetavaid teiseseid sootunnuseid. Emaskaladel säilib võime omandada isaskalale iseloomulikud teisesed sootunnused, kui nad puutuvad kokku vees olevate androgeensete kemikaalidega. Teaduskirjandusest võib leida mitu uuringut, milles on tõendatud tüseda tömpnina (20) ja jaapani riisikala (21) selline reageerimine androgeensetele kemikaalidele. Teiseste sootunnuste vähenemist isaskaladel tuleks tõlgendada ettevaatusega, kuna selliste andmete statistiline võimsus on väike; tõlgendamisel tuleks toetuda eksperdiarvamusele ja võtta arvesse tõendite kaalukust. Vöötdaanio kasutamisele selles katses on piiranguid, kuna sellel kalal puuduvad mõõdetavad teisesed sootunnused, mille kaudu hinnata reaktsiooni androgeense toimega kemikaalidele.
|
|
8.
|
Tüseda tömpnina puhul on eksogeensete androgeenidega kokkupuute peamine näitaja pulmarüü köbrukeste arv emaskala ninamikul. Jaapani riisikala puhul on nn papillaarjätked peamine tunnus, et emaskala on kokku puutunud eksogeensete androgeensete kemikaalidega. 5.A ja 5.B liites on esitatud soovitatavad meetodid vastavalt tüseda tömpnina ja jaapani riisikala sootunnuste hindamiseks.
|
|
9.
|
Käesolevas katsemeetodis kasutatud mõisted on määratletud 1. liites.
|
KATSE PÕHIMÕTE
|
10.
|
Katses viiakse paljunemisvõimelised isas- ja emaskalad katsenõudes kokkupuutesse uuritava kemikaaliga. Kuna nad on täiskasvanud ja paljunemiseas, on kumbagi sugu kerge eristada; samuti on võimalik analüüsida nende sootunnuseid iga otsitava näitaja määramiseks ning see tagab ka nende tundlikkuse väliste kemikaalide suhtes. Katse lõpus määratakse nende sugu sugunäärmete makroskoopilise vaatlusega pärast seda, kui kõht on kääridega lahti lõigatud. Vastavate biokatse tingimuste ülevaade on esitatud 2. liites. Katset alustatakse tavaliselt kaladega, kes on võetud kudemisvalmis populatsioonist; vanu kalu ei tohiks kasutada. Juhised kalade vanuse ja paljunemisvõimelisuse kohta on esitatud kalade valikut käsitlevas punktis. Katse tehakse kemikaali kolmel kokkupuutekontsentratsioonil ning, vee kontrollrühmaga ja vajaduse korral ka lahusti kontrollrühmaga. Uuritava kemikaali iga kontsentratsiooni kohta kasutatakse jaapani riisikala ja vöötdaanio puhul kahte nõu või paralleelkatset (kummaski nõus 5 isas- ja 5 emaskala) ning tüseda tömpnina korral nelja nõu või paralleelkatset (igas nõus 2 isas- ja 4 emaskala). Sellega võetakse arvesse isase tüseda tömpnina territooriumikäitumist, kuid säilitatakse samal ajal katse piisav statistiline võimsus. Kokkupuude kemikaaliga toimub 21 päeva ja kaladelt võetakse proovid kokkupuute 21. päeval.
|
|
11.
|
Proovivõtmisel 21. päeval surmatakse kõik kalad humaanselt. Tüseda tömpnina ja jaapani riisikala puhul mõõdetakse teisesed sootunnused (vt 5.A ja 5.B liide); vöötdaaniolt ja tüsedalt tömpninalt võetakse vereproovid vitellogeniini määramiseks; vöötdaaniolt võib selle asemel koguda vitellogeniini määramiseks pea ja saba (6. liide); jaapani riisikalalt võetakse vitellogeniini määramiseks maks (6. liide).
|
KATSE NÕUETEKOHASUSE KRITEERIUMID
|
12.
|
Katsetulemused on nõuetekohased, kui on täidetud järgmised tingimused:
|
—
|
suremus vee (või lahusti) kontrollrühmades ei tohiks kokkupuuteperioodi lõpuks ületada 10 %;
|
|
—
|
lahustunud hapniku kontsentratsioon peaks olema vähemalt 60 % õhu küllastuskontsentratsioonist kogu kokkupuuteperioodi jooksul;
|
|
—
|
vee temperatuur ei tohiks kogu kokkupuuteperioodi jooksul katsenõudes erineda rohkem kui ± 1,5 °C ja see tuleks hoida vahemikus ± 2 °C katsealusele liigile ettenähtud temperatuurist (2. liide);
|
|
—
|
peaksid olema tõendid selle kohta, et uuritava kemikaali kontsentratsiooni lahuses on suudetud hoida rahuldavalt vahemikus ± 20 % mõõdetud keskmisest väärtusest.
|
|
MEETODI KIRJELDUS
Seadmed
|
13.
|
Tavalised laboriseadmed, eeskätt järgmised:
|
a)
|
hapniku- ja pH-mõõtur;
|
|
b)
|
seadmed vee kareduse ja leelisuse määramiseks;
|
|
c)
|
asjakohased temperatuuri reguleerimise ja eelistatavalt pideva jälgimise seadmed;
|
|
d)
|
soovitatava laadimisnormi ja loomkoormuse jaoks piisava suurusega keemiliselt inertsest materjalist mahutid (vt 2. liide);
|
|
e)
|
tüseda tömpnina ja vöötdaanio kudemissubstraat; vajalikud üksikasjad vt 4. liide;
|
|
f)
|
sobiva täpsusega kaalud (st täpsusega ± 0,5 mg).
|
|
Vesi
|
14.
|
Uuringus võib kasutada sellist vett, milles katsealune liik kasvab ja milles tal on piisavalt pikk eluiga. Vesi peab olema kogu katse jooksul püsiva kvaliteediga. Vee pH peaks olema vahemikus 6,5–8,5, kuid ei tohiks ühe katse jooksul muutuda rohkem kui ± 0,5 pH-ühikut. Selle tagamiseks, et lahjendusvesi ei mõjutaks liigselt katsetulemusi (näiteks uuritava kemikaaliga kompleksimoodustamise kaudu), tuleks vaheaegade järel võtta proove analüüsimiseks. Kui lahjendusvesi on teadaolevalt suhteliselt püsiva kvaliteediga, tuleks raskmetallide (näiteks Cu, Pb, Zn, Hg, Cd ja Ni), peamiste anioonide ja katioonide (näiteks Ca2+, Mg2+, Na+, K+, Cl– ja SO4
2–) ning pestitsiidide sisaldus (näiteks fosfororgaaniliste ja kloororgaaniliste pestitsiidide üldsisaldus), orgaanilise süsiniku üldsisaldus ja hõljuvaine sisaldus määrata näiteks iga kolme kuu järel. Kui on tõendatud, et vee kvaliteet on vähemalt ühe aasta jooksul püsiv, võib neid määramisi teha harvem (nt iga kuue kuu järel). 3. liites on esitatud mõned lahjendusvee nõutavad keemilised omadused.
|
Katselahused
|
15.
|
Valitud kontsentratsiooniga katselahused valmistatakse põhilahuse lahjendamisega. Põhilahus tuleks eelistatavalt valmistada lihtsalt uuritava kemikaali segamise või loksutamisega lahjendusvees, kasutades selleks mehaanilisi vahendeid (nt segamist või ultraheli). Sobiva kontsentratsiooniga põhilahuse saamiseks võib kasutada küllastuskolonne (lahustuvuskolonne). Lahusti kasutamine ei ole soovitatav. Kui lahusti on ikkagi hädavajalik, tuleb katses paralleelselt teha lahusti kontrolli katse samal lahusti kontsentratsioonil, mida kasutatakse uuritava kemikaaliga kokkupuute katsetes. Raskesti uuritava kemikaali puhul võib lahusti olla tehniliselt parim lahendus; sel juhul tuleks vaadata OECD juhenddokumenti (22) raskesti uuritavate ainete ja segude veekeskkonnas avalduva mürgisuse uurimise kohta. Lahusti valiku määravad kemikaali füüsikalis-keemilised omadused. OECD juhenddokumendis soovitatakse kontsentratsiooni kuni 100 μl/l, millest tuleks kinni pidada. Kuid hiljutises ülevaates (23) tõsteti esile täiendavaid probleeme, mis tekivad, kui endokriinse toime uurimisel kasutatakse lahustit. Seetõttu soovitatakse, et kui lahusti on vajalik, peaks selle kontsentratsioon olema tehnilist teostatavust arvestades minimaalne (see sõltub uuritava kemikaali füüsikalis-keemilistest omadustest).
|
|
16.
|
Katses kasutatakse läbivoolusüsteemi. Sellises süsteemis lisatakse ja lahjendatakse uuritava kemikaali põhilahust pidevalt (nt dosaatorpumba, proportsionaalse lahjendamise seadme ja küllastamissüsteemiga), et tekitada eri katsekambrites rida erinevaid kontsentratsioone. Põhilahuste ja lahjendusvee voolukiirust tuleb kontrollida katse jooksul kindlate ajavahemike järel, eelistatavalt iga päev, ja see ei tohiks varieeruda rohkem kui 10 % kogu katse jooksul. Tuleks hoiduda kasutamast ebakvaliteetseid plastiktorusid või muid materjale, mis võivad sisaldada bioloogiliselt aktiivseid kemikaale. Materjali valimisel läbivoolusüsteemi jaoks tuleks arvesse võtta uuritava kemikaali võimalikku adsorbeerumist.
|
Kalade pidamine
|
17.
|
Katsealused kalad tuleks valida ühest laboripopulatsioonist, eelistatavalt samast parvest, mida on vähemalt kahe nädala vältel enne katset kohandatud selliste veekvaliteedi ja valgustustingimustega, mis sarnanevad katses kasutatavatele. On oluline, et laadimisnorm ja loomkoormus (vt mõisted, 1. liide) sobiksid katses kasutatavale liigile (vt 2. liide).
|
|
18.
|
Pärast 48-tunnist stabiliseerumisperioodi registreeritakse surmajuhtumid ja rakendatakse järgmisi kriteeriume:
|
—
|
kui suremus on seitsme päeva jooksul suurem kui 10 % populatsioonist, jäetakse kogu partii kõrvale;
|
|
—
|
kui suremus on populatsioonist 5–10 %, lastakse kaladel kohaneda veel seitse päeva; kui nende järgmise seitsme päeva jooksul on suremus suurem kui 5 %, jäetakse kogu partii kõrvale;
|
|
—
|
kui suremus on seitsme päeva jooksul väiksem kui 5 % populatsioonist, loetakse partii vastuvõetavaks.
|
|
|
19.
|
Kohanemise ajal, kokkupuutele eelneval perioodil ja kokkupuute ajal ei tohiks kaladel haigusi ravida.
|
Kokkupuute-eelne periood ja kalade valimine
|
20.
|
Soovitatakse kasutada ühenädalast kokkupuute-eelset perioodi, kus kalad pannakse nõudesse, mis on sarnased tegelikus katses kasutatavatele. Kalu tuleks sööta ad libitum kogu pidamisperioodi ja katse vältel. Kokkupuuteperioodi tuleks alustada eristatavate sootunnustega kummastki soost täiskasvanud kaladega, kes pärinevad labori suguküpsete kalade varudest (nt nende teisesed sootunnused on tüseda tömpnina ja jaapani riisikala puhul selgelt nähtavad) ning kes aktiivselt koevad. Üksnes üldiseks orienteerumiseks tuleb öelda (ja seejuures ei tohi jätta arvestamata konkreetse kalapartii tegelikku paljunemiskäitumist), et tüseda tömpnina vanus peaks olema ligikaudu 20 (± 2) nädalat eeldusel, et neid kalu on kogu nende elu jooksul peetud temperatuuril 25 ± 2 °C. Jaapani riisikala vanus peaks olema ligikaudu 16 (± 2) nädalat eeldusel, et neid kalu on kogu nende elu jooksul peetud temperatuuril 25 ± 2 °C. Vöötdaanio vanus peaks olema ligikaudu 16 (± 2) nädalat eeldusel, et neid kalu on kogu nende elu jooksul peetud temperatuuril 26 ± 2 °C.
|
KATSE KAVANDAMINE
|
21.
|
Kasutatakse uuritava kemikaali kolme kontsentratsiooniga rühmi, üht (vee) kontrollrühma ja vajaduse korral üht lahusti kontrollrühma. Andmeid võib analüüsida, et teha kindlaks statistiliselt olulised erinevused kemikaaliga kokku puutunud rühma ja kontrollrühma näitajate vahel. Kõnealune analüüs näitab, kas uuritava kemikaaliga saadud andmeid võib kasutada riskihindamisel või oleks vaja teha täiendav pikemaajaline katse kahjuliku mõju (ellujäämisele, arengule, kasvule ja paljunemisele avalduv mõju) väljaselgitamiseks (24).
|
|
22.
|
Vöötdaanio ja jaapani riisikala puhul võetakse katse 21. päeval isas- ja emaskalad igast kontsentratsioonitaseme rühmast (5 isas- ja 5 emaskala kummastki paralleelkatsest) ja kontrollrühma(de)st, et mõõta vitellogeniin ja vajaduse korral teisesed sootunnused. Tüseda tömpnina puhul võetakse kokkupuute 21. päeval isas- ja emaskalad igast kontsentratsioonitaseme rühmast (2 isas- ja 4 emaskala igast paralleelkatsest; paralleelkatseid tehakse neli) ja kontrollrühma(de)st, et mõõta vitellogeniin ja teisesed sootunnused.
|
Katsekontsentratsioonide valimine
|
23.
|
Selle katse puhul peab kõrgeim katsekontsentratsioon olema maksimaalne talutav kontsentratsioon (MTC), mis tehakse kindlaks vahemiku leidmise katsega või muude mürgisuse andmete põhjal, 10 mg/l või vees lahustuvuse piirkontsentratsioon, olenevalt sellest, milline neist on väikseim. Uuritava kemikaali maksimaalne talutav kontsentratsioon on suurim kontsentratsioon, mille puhul suremus on väiksem kui 10 %. Sellise lähenemisviisi kasutamiseks on vaja empiirilisi andmeid ägeda mürgisuse kohta või muid mürgisuse andmeid, mille põhjal saab hinnata maksimaalse talutava kontsentratsiooni. Sellise kontsentratsiooni hindamine võib olla ebatäpne ja tavaliselt nõuab see erialateadmisi.
|
|
24.
|
Katse on vaja teha kolmel kontsentratsioonil, mis erinevad konstantse kordaja võrra, mis võib olla kuni 10; lisaks tuleb teha kontrollkatse lahjendusveega (ja vajaduse korral ka lahusti kontrollkatse). Soovitatav on, et kontsentratsioonide suhtarv oleks vahemikus 3,2 kuni 10.
|
KATSE KÄIK
Katsealuste kalade valimine ja kaalumine
|
25.
|
Tähtis on, et kalade kehamassi erinevused katse alguses oleksid minimaalsed. 2. liites on esitatud käesolevas katsemeetodis eri liikide puhul soovitatavad suurusevahemikud. Kogu katses kasutatava kalade partii puhul peaksid katse alguses isas- ja emaskalade individuaalse kehamassi erinevused olema vahemikus ± 20 % samasooliste kalade aritmeetilisest keskmisest. Soovitatav on enne katset kaaluda samast kalade partiist osaproov, et arvutada välja keskmine kaal.
|
Kokkupuutetingimused
Kestus
|
26.
|
Katse kestab 21 päeva alates kokkupuute-eelse perioodi lõppemisest. Soovitatav kokkupuute-eelne periood on üks nädal.
|
Söötmine
|
27.
|
Kalu tuleks sööta sobiva söödaga (2. liide) ad libitum ja piisaval määral, et nende organism oleks heas seisundis. Hoolt tuleb kanda mikroobide kasvu ja vee hägustumise ärahoidmise eest. Üldreeglina võib päevaratsiooni jagada kaheks või kolmeks võrdseks osaks ja sööta kalu mitu korda päevas vähemalt kolmetunniste vaheaegadega. Ühekordne suurem söödakogus on samuti lubatav, eelkõige nädalalõpul. Kalu ei tohiks sööta 12 tunni jooksul enne proovivõtmist/lahkamist.
|
|
28.
|
Kalasööda kohta peaks olema teada saasteainete, näiteks kloororgaaniliste pestitsiidide, polütsükliliste aromaatsete süsivesinike (PAH) ja polüklooritud bifenüülide (PCB) sisaldus. Suure fütoöstrogeenisisaldusega sööta, mis maskeeriks kalade reaktsiooni teadaolevale östrogeeni agonistile (nt 17β-östradiool), ei tohiks kasutada.
|
|
29.
|
Sööda ülejäägid ja väljaheited tuleks eemaldada katsenõudest vähemalt kaks korda nädalas, näiteks iga nõu põhja ettevaatliku puhastamisega sifooni abil.
|
Valgus ja temperatuur
|
30.
|
Valgustusperiood ja veetemperatuur peaksid olema katseliigile sobivad (vt 2. liide).
|
Analüütiliste määramiste ja mõõtmiste sagedus
|
31.
|
Enne kokkupuuteperioodi alustamist tuleks tagada kemikaali lisamise süsteemi nõuetekohane toimimine. Kõik vajalikud analüüsimeetodid peaksid olema kontrollitud, sealhulgas peaks olema kontrollitud uuritava kemikaali stabiilsus katsesüsteemis. Katse ajal määratakse uuritava kemikaali kontsentratsioonid korrapäraste ajavahemike tagant järgmiselt: lahjendusvee ja põhilahuste voolu kiirust tuleks katse jooksul eelistatavalt kontrollida iga päev, kuid vähemalt kaks korda nädalas, ja see ei tohiks kogu uuringu jooksul varieeruda rohkem kui 10 %. Uuritava kemikaali tegelik kontsentratsioon soovitatakse määrata kõikides nõudes katse alguses ja seejärel nädalaste vaheaegadega.
|
|
32.
|
On soovitatav, et tulemused põhineksid mõõdetud kontsentratsioonidel. Kui uuritava kemikaali kontsentratsiooni lahuses on suudetud säilitada rahuldavalt vahemikus ± 20 % nominaalsest kontsentratsioonist kogu katse jooksul, võivad tulemused põhineda nominaalsetel või mõõdetud väärtustel.
|
|
33.
|
Proove võib olla vaja filtrida (nt läbi 0,45 μm suuruste pooridega filtri) või tsentrifuugida. Sellise vajaduse korral tuleks eelistada tsentrifuugimist. Kuid kui uuritav aine ei adsorbeeru filtritel, on ka filtrimine lubatud.
|
|
34.
|
Katse ajal mõõdetakse lahustunud hapniku sisaldust, temperatuuri ja pH-d kõigis katsenõudes vähemalt kord nädalas. Üldkaredust ja leelisust tuleks kontrollkatse nõudes ja ühes suurima kontsentratsiooniga katse nõus mõõta vähemalt kord nädalas. Temperatuuri tuleks eelistatavalt jälgida pidevalt vähemalt ühes katseanumas.
|
Vaatlused
|
35.
|
Katse käigus või katse lõpetamisel hinnatakse mitut üldist näitajat (nt ellujäämine) ja mitut bioloogilist põhinäitajat (nt vitellogeniini tase). Allpool on kirjeldatud nende näitajate mõõtmist ja hindamist ning nende kasulikkust.
|
Ellujäämine
|
36.
|
Kalad tuleks katseperioodi jooksul üle vaadata iga päev; kõik surmajuhtumid tuleks registreerida ja surnud kalad eemaldada võimalikult kiiresti. Surnud kalu ei tohiks asendada ei kontrollrühma(de) ega ka katserühmade nõudes. Katse ajal surnud kalade sugu tuleks määrata sugunäärmete makroskoopilise hindamisega.
|
Käitumine ja välimus
|
37.
|
Igasugune ebatavaline käitumine (võrreldes kontrollrühmaga) tuleks registreerida; see võib hõlmata üldise mürgisuse tunnuseid, nagu hingeldamine, koordineerimata ujumine, tasakaalu kaotamine, ebatüüpiline liikumatus või söömine. Lisaks tuleb registreerida välised anomaaliad (näiteks veritsus, värvuse nõrgenemine). Selliseid mürgisuse tunnuseid tuleks andmete tõlgendamisel hoolikalt kaaluda, kuna need võivad viidata kemikaali kontsentratsioonile, millel endokriinse toime biomarkerid ei ole usaldusväärsed. Sellised käitumise vaatlused võivad samuti anda kasulikku kvalitatiivset teavet selle kohta, milliseid nõudeid tuleks edaspidi järgida kaladega tehtavate katsete puhul. Näiteks on tüseda tömpnina puhul täheldatud normaalsetel isaskaladel või maskuliniseerunud emaskaladel androgeense kemikaaliga kokkupuute tagajärjel territooriumiga seotud agressiivsust; vöötdaanio puhul on tavaline paaritumis- ja kudemiskäitumine – koidikul pärast valgeks minemist – östrogeense või antiandrogeense kemikaaliga kokkupuute tagajärjel takistatud või ilmneb vähem.
|
|
38.
|
Kuna mõned välistunnused (eelkõige värvus) võivad kala käsitsemise käigus kiiresti muutuda, on oluline registreerida kvalitatiivsed tähelepanekud enne kalade katsesüsteemist välja võtmist. Tüseda tömpninaga saadud seniste kogemuste kohaselt võivad mõned endokriinse toimega kemikaalid esialgu tekitada muutusi järgmistes välistes tunnustes: keha värvus (hele või tume), värvumismuster (vertikaalsete vöötide olemasolu) ja kehakuju (pea ja rinnaosa). Seepärast tuleks kogu katse jooksul ja pärast katse lõpetamist jälgida kalade füüsilist välimust ja registreerida muutused.
|
Kalade humaanne surmamine
|
39.
|
21. päeval, st kemikaaliga kokkupuute lõpetamisel tuleks kalad humaanselt surmata vajaliku koguse trikaiiniga (trikaiinmetaansulfonaat, metakaiin, MS-222 (CASi nr 886-86-2), 100–500 mg/l), mis on limaskesta ärrituse vähendamiseks puhverdatud 300 mg/l NaHCO3-ga (naatriumvesinikkarbonaat, CASi nr 144-55-8); seejärel võetakse veri või koed vitellogeniini määramiseks, nagu on selgitatud jaotises „Vitellogeniin”.
|
Teiseste sootunnuste vaatlemine
|
40.
|
Mõned endokriinse toimega kemikaalid võivad põhjustada muutusi spetsiifilistes teisestes sootunnustes (pulmarüü köbrukeste arv isasel tüsedal tömpninal, isase jaapani riisikala papillaarjätked). Teatava toimemehhanismiga kemikaalid võivad põhjustada teiseste sootunnuste ebanormaalset ilmumist vastassoost isenditel; näiteks sellised androgeeniretseptori agonistid nagu trenboloon, metüültestosteroon ja dihüdrotestosteroon võivad põhjustada emasel tüsedal tömpninal silmapaistvate pulmarüü köbrukeste tekkimise või emasel riisikalal papillaarjätkete väljaarenemise (11, 20, 21). Samuti on teatatud, et östrogeeniretseptori agonistid võivad vähendada pulmarüü köbrukeste arvu ja täiskasvanud isaskala turjapadjandi suurust (25, 26). Sellised üldised morfoloogilised vaatlused võivad samuti anda kasulikku kvalitatiivset ja kvantitatiivset teavet selle kohta, milliseid nõudeid tuleks edaspidi järgida kaladega tehtavate katsete puhul. Tüseda tömpnina pulmarüü köbrukeste arvu ja suurust ning jaapani riisikala papillaarjätkeid saab kas otse või mugavamini mõõta fikseeritud isenditel. Tüseda tömpnina ja jaapani riisikala teiseste sootunnuste hindamise soovitatav kord on esitatud vastavalt 5.A ja 5.B liites.
|
Vitellogeniin
|
41.
|
Veri võetakse sabaarterist või -veenist hematokriti määramiseks ette nähtud hepariniseeritud mikrokapillaartoruga või selle asemel süstla abil tehtava südamepunktsiooniga. Sõltuvalt kala suurusest on kogutava vere maht tüseda tömpnina isendi puhul üldiselt vahemikus 5–60 μl ja vöötdaanio isendi puhul 5–15 μl. Plasma eraldatakse verest tsentrifuugimisega ja seda hoitakse koos proteaasiinhibiitoritega – 80 °C juures kuni vitellogeniini määramiseni. Teise võimalusena kasutatakse vitellogeniini määramiseks kudede allikana jaapani riisikala maksa või vöötdaanio pea-saba homogenaati (6. liide). Vitellogeniin tuleks mõõta valideeritud homoloogse ELISA meetodiga, kasutades homoloogset vitellogeniini standardit ja homoloogseid antikehi. Soovitatav on kasutada meetodit, millega on võimalik tuvastada vitellogeniini nii väikeses sisalduses kui mõni ng plasma ml kohta (või ng koe mg kohta), mis on tausttase kemikaaliga mitte kokku puutunud isaskalas.
|
|
42.
|
Vitellogeniini mõõtmise kvaliteeti kontrollitakse standardite ja tühikatsetega ning vähemalt kahe mõõtmise tegemisega. Iga ELISA meetodi puhul tuleb teha maatriksiefekti (proovi lahjendamise mõju) katse, et määrata proovi minimaalne lahjendustegur. Igal ELISA plaadil, mida kasutatakse vitellogeniini määramiseks, peaksid olema järgmised kvaliteedikontrolli proovid: vähemalt 6 kaliibrimisstandardit, mille kontsentratsioonivahemik hõlmab vitellogeniini kontsentratsiooni eeldatavat vahemikku, ja vähemalt üks mittespetsiifilise sidumise tühikatse (kaks paralleelkatset). Nendes tühikatsetes peaks neeldumine olema vähem kui 5 % kaliibrimisstandardi puhul täheldatavast maksimaalsest neeldumisest. Igast proovi lahjendusest analüüsitakse vähemalt kahte alikvooti (kahes paralleelaugus). Kui tulemused paralleelaukudes erinevad rohkem kui 20 %, tuleb teha kordusanalüüs.
|
|
43.
|
Kaliibrimisgraafiku korrelatsioonikordaja (R2) peab olema suurem kui 0,99. Hea korrelatsioon ei ole siiski piisav, et tagada ennustatavate väärtuste õigsus kõigis kontsentratsioonivahemikes. Lisaks kaliibrimisgraafiku piisavalt heale korrelatsioonile peab ka iga standardi kontsentratsioon, mis arvutatakse kaliibrimisgraafiku põhjal, olema vahemikus 70–120 % oma nominaalsest kontsentratsioonist. Kui nominaalsed kontsentratsioonid kalduvad eemalduma kaliibrimise regressioonisirgest (nt madalatel kontsentratsioonidel), võib olla vajalik jagada kaliibrimisgraafik madalale ja kõrgele kontsentratsioonile vastavateks osadeks või kasutada neeldumisandmete lähendamiseks mittelineaarset mudelit, mis neid õigesti kirjeldaks. Kui graafik jagatakse kaheks osaks, peaks kummaski osas olema R2 > 0,99.
|
|
44.
|
Avastamispiir (limit of detection, LOD) on määratletud kui madalaim analüüsistandardi kontsentratsioon ning määramispiir (limit of quantitation, LOQ) on määratletud kui madalaim analüüsistandardi kontsentratsioon, mis on korrutatud väikseima lahjendusteguriga.
|
|
45.
|
Igal vitellogeniinianalüüsi tegemise päeval mõõdetakse ka rikastatud proovi, mis on valmistatud eri katsetes kasutatava võrdlusstandardiga (7. liide). Eeldatava kontsentratsiooni ja mõõdetud kontsentratsiooni suhtarv esitatakse koos samal päeval tehtud määramiste tulemustega.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Biomarkerite põhjal mõju hindamine dispersioonanalüüsiga (ANOVA)
|
46.
|
Kemikaali võimaliku endokriinse mõju tuvastamiseks võrreldakse biomarkerite väärtusi kontrollrühma vastavate näitajatega, kasutades dispersioonanalüüsi (ANOVA). Kui kasutatakse lahusti kontrollrühma, tuleb iga tulemusnäitaja puhul teha asjakohane statistiline test lahjendusvee ja lahusti kontrollrühmade vahel iga tulemusnäitaja jaoks. Juhendid, kuidas kasutada lahjendusvee ja lahusti kontrollrühmade andmeid edasises statistilises analüüsis, võib leida OECD 2006. aasta dokumendis (27). Kõiki bioloogiliste vastuste andmeid tuleks analüüsida ja need esitada eraldi kummagi soo kohta. Kui parameetriliste meetodite vajalikud eeldused ei ole täidetud – tegemist on normaaljaotusest erineva jaotuse (nt Shapiro-Wilki test) või heterogeense hajuvusega (Bartletti test või Levene'i test), tuleks kaaluda andmete teisendamist, et muuta hajuvus enne ANOVA tegemist homogeenseks, või kaalutud ANOVA kasutamist. Kui toime sõltuvus kontsentratsioonist ei ole monotoonne, võib kasutada Dunnetti testi (parameetriline) või mitmest paariviisilist võrdlemist või Manni-Whitney testi Bonferroni parandusega (mitteparameetriline). Kui toime sõltuvus kontsentratsioonist on ligikaudu monotoonne, võib kasutada muid statistilisi teste (nt Jonckheere'i-Terpstra või Williamsi test). 8. liites on esitatud statistilist analüüsi käsitlev otsustusskeem, mis aitab leida kasutamiseks kõige sobivama statistilise testi. Täiendav teave on kättesaadav ka OECD dokumendis, milles käsitletakse praegusi meetodeid ökotoksilisuse andmete statistiliseks analüüsiks (27).
|
Katsetulemuste esitamine
|
47.
|
Uuringu andmed peavad hõlmama järgmist.
|
|
Uurimislabor:
|
—
|
vastutavad töötajad ja nende kohustused uuringu tegemisel;
|
|
—
|
iga labor peaks olema tõendanud oma oskusi, kasutades mitmesuguseid esindavaid kemikaale.
|
|
|
|
Uuritav kemikaal:
|
—
|
uuritava kemikaali iseloomustus;
|
|
—
|
füüsikalised ja asjakohased füüsikalis-keemilised omadused;
|
|
—
|
katses kasutatud kontsentratsiooniga lahuste valmistamise meetod ja sagedus;
|
|
—
|
teave stabiilsuse ja biolagunduvuse kohta.
|
|
|
|
Lahusti:
|
—
|
lahusti iseloomustus (kirjeldus, kasutatud kontsentratsioon);
|
|
—
|
lahusti valimise põhjendus (kui lahusti on muu kui vesi).
|
|
|
|
Katseloomad:
|
—
|
tarnija ja tema konkreetne käitis;
|
|
—
|
kalade vanus katse alguses ja paljunemis-/kudemisseisund;
|
|
—
|
loomade aklimatiseerimise korra üksikasjad;
|
|
—
|
kalade kehamass kemikaaliga kokkupuute alguses (kalaparvest võetud osaproovi põhjal).
|
|
|
|
Katsetingimused:
|
—
|
kasutatud katsemeetod (katse tüüp, laadimisnorm, loomkoormus jne);
|
|
—
|
põhilahuse valmistamise meetod ja voolukiirus;
|
|
—
|
nominaalsed katsekontsentratsioonid, iga nädal mõõdetud katselahuste kontsentratsioonid ja kasutatud analüüsimeetod, katsenõudes mõõdetud väärtuste keskmised ja nende standardhälbed ning tõendid selle kohta, et need mõõtmised näitavad uuritava kemikaali kontsentratsiooni tegelikus lahuses;
|
|
—
|
lahjendusvee omadused (pH, karedus, leelisus, temperatuur, lahustunud hapniku kontsentratsioon, kloorisisaldus, orgaanilise süsiniku üldsisaldus, hõljuvaine sisaldus ja kõik muud mõõdetud näitajad);
|
|
—
|
vee kvaliteet katsenõus: pH, karedus, temperatuur ja lahustunud hapniku kontsentratsioon;
|
|
—
|
üksikasjalik teave söötmise kohta (nt sööda (söötade) tüüp, päritolu, lisatud kogus ja söötmise sagedus ning asjakohaste saasteainete analüüs (nt polüklooritud bifenüülid, polütsüklilised aromaatsed süsivesinikud ja kloororgaanilised pestitsiidid).
|
|
|
|
Tulemused:
|
—
|
tõendid selle kohta, et kontrollkatsed vastasid nõuetekohasuse kriteeriumidele;
|
|
—
|
andmed suremuse kohta iga katsekontsentratsiooni rühmades ja kontrollrühmas;
|
|
—
|
kasutatud statistilise analüüsi meetodid, andmete töötlemine ja kasutatud meetodite valimise põhjendus;
|
|
—
|
bioloogiliste vaatluste andmed üldiste morfoloogiliste muutuste kohta, sealhulgas teiseste sootunnuste ja vitellogeniini kohta;
|
|
—
|
andmete analüüsi tulemused, eelistatavalt tabelite ja graafikute kujul;
|
|
—
|
kalade ebatavalised reaktsioonid ja nähtavad ilmingud, mida põhjustas uuritav kemikaal.
|
|
|
TULEMUSTE TÕLGENDAMISE JA KATSETULEMUSTE KEHTIVAKS TUNNISTAMISE JUHISED
|
48.
|
Käesolevas osas on esitatud mõningad kaalutlused, mida tuleks arvesse võtta mitmesuguste mõõdetavate näitajate kohta saadud katsetulemuste tõlgendamisel. Tulemuste tõlgendamisel tuleb olla ettevaatlik, kui uuritav kemikaal põhjustab selgelt mürgitust või mõjutab katseloomade üldist seisundit.
|
|
49.
|
Katsekontsentratsioonide vahemiku valimisel tuleks jälgida, et ei ületataks maksimaalset talutavat kontsentratsiooni, muidu ei saa andmeid mõistlikult tõlgendada. On oluline, et vähemalt ühe kontsentratsiooni juures ei ilmneks märke mürgisuse kohta. Haiguse ja toksilise mõju tundemärke tuleks põhjalikult hinnata ja esitada need katseprotokollis. Näiteks on võimalik, et vitellogeniini sünteesi emaskalades võib mõjutada ka kemikaali üldine mürgisus ja muu kui endokriinse mehhanismi kaudu avalduv mürgisus, näiteks hepatotoksilisus. Mõju tõlgendamist võivad hõlbustada andmed sellistel kontsentratsioonidel, kus andmeid ei moonuta süsteemne toksilisus.
|
|
50.
|
Katsetulemuste kehtivaks tunnistamisel tuleb arvesse võtta mitut aspekti. Juhinduda tuleb sellest, et vitellogeniini tase kontrollrühmades peaks isas- ja emaskaladel olema erinev; erinevus peaks olema ligikaudu kolm suurusjärku tüseda tömpnina ja vöötdaanio puhul ning umbes üks suurusjärk jaapani riisikala puhul. Valideerimisprotokollides (1, 2, 3, 4) on esitatud näited väärtuste kohta, mis määrati kontrollrühmade ja uuritava kemikaaliga rühmade puhul. Kõrge vitellogeniinitase kontrollrühma isaskaladel võib negatiivselt mõjutada meetodi tundlikkust ja nõrkade östrogeeni agonistide tuvastamise võimet. Madal vitellogeniinitase kontrollrühma emaskaladel võib negatiivselt mõjutada meetodi tundlikkust ning aromataasi inhibiitorite ja östrogeeni antagonistide tuvastamise võimet. Valideerimisuuringuid kasutati selliste suuniste väljatöötamiseks.
|
|
51.
|
Kui laboris ei ole asjaomast katset varem tehtud või seal on toimunud olulisi muudatusi (nt on muutunud kalade liin või tarnija), siis on soovitatav teha tehnilise pädevuse uuring. Soovitatav on kasutada kemikaale, millel on terve rida toimemehhanisme või mis avaldavad mõju mitmele otsitavale näitajale. Praktikas kutsutakse iga laborit üles looma varasemate kontrollrühma andmete põhjal oma andmekogu isas- ja emaskalade näitajate kohta ning tegema positiivse kontrolli katse östrogeense toimega kemikaaliga (nt 17β-östradiool kontsentratsioonis 100 ng/l või mõni teadaolev nõrk agonist), mille mõjul tõuseb vitellogeniini tase isaskalades, positiivse kontrolli katse aromataasi pärssiva kemikaaliga (nt fadrosool või prokloraas kontsentratsioonis 300 μg/l), mille tõttu väheneb emaskalade vitellogeniinisisaldus, ning positiivse kontrolli katse androgeense toimega kemikaaliga (nt 17β-trenboloon kontsentratsioonis 5 μg/l), mis põhjustab emastel tüsedatel tömpninadel ja jaapani riisikaladel isaskalade teiseste sootunnuste ilmumist. Kõiki neid andmeid võib võrrelda kättesaadavate valideerimisuuringute andmetega (1, 2, 3), et kinnitada labori pädevust.
|
|
52.
|
Üldiselt tuleks vitellogeniini mõõtmised lugeda positiivseks, kui tuvastatakse vitellogeniinitaseme statistiliselt oluline (p < 0,05) tõus isaskalades või statistiliselt oluline (p < 0,05) langus emaskalades vähemalt suurimal katses kasutatud kontsentratsioonil kontrollrühmaga võrreldes, kui samas ei ilmne üldise mürgisuse märke. Positiivset tulemust toetab täiendavalt bioloogiliselt usutava kontsentratsiooni ja toime vahelise sõltuvuse tuvastamine. Nagu eespool märgitud, ei tarvitse vitellogeniini sisalduse vähenemine olla tingitud üksnes endokriinsest mehhanismist, kuid positiivset tulemust tuleks üldiselt tõlgendada tõendina endokriinse mõju kohta in vivo ja seda tuleks selguse saamiseks tavaliselt täiendavalt uurida.
|
KIRJANDUS
|
(1)
|
OECD (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 60, ENV/JM/MONO(2006)27.
|
|
(2)
|
OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1 B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 61, ENV/JM/MONO(2006)29.
|
|
(3)
|
OECD (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 78, ENV/JM/MONO(2007)25.
|
|
(4)
|
Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (accessed 18/09/08).
|
|
(5)
|
US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Unpublished report dated 15 December 2007. US Environmental Protection Agency, Washington, DC. 104 pp.
|
|
(6)
|
OECD, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 94, ENV/JM/MONO(2008)21.
|
|
(7)
|
Sumpter and Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7:173-8 Review.
|
|
(8)
|
Pawlowski S, Sauer A, Shears JA, Tyler CR, Braunbeck T (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277-91.
|
|
(9)
|
Andersen L, Goto-Kazato R, Trant JM, Nash JP, Korsgaard B, Bjerregaard P (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4):343-52.
|
|
(10)
|
Ankley GT, Kahl MD, Jensen KM, Hornung MW, Korte JJ, Makynen EA, Leino RL (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences;67(1):121-30.
|
|
(11)
|
Panter GH, Hutchinson TH, Hurd KS, Sherren A, Stanley RD, Tyler CR (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11-21.
|
|
(12)
|
Parks LG, Cheek AO, Denslow ND, Heppell SA, McLachlan JA, LeBlanc GA, Sullivan CV (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2):113-25.
|
|
(13)
|
Panter GH, Tyler CR, Maddix S, Campbell PM, Hutchinson TH, Länge R, Lye C, Sumpter JP, 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Brussels, Belgium.
|
|
(14)
|
Fenske M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217-232.
|
|
(15)
|
Holbech H, Andersen L, Petersen GI, Korsgaard B, Pedersen KL, Bjerregaard P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119-131.
|
|
(16)
|
Rose J, Holbech H, Lindholst C, Noerum U, Povlsen A, Korsgaard B, Bjerregaard P. 2002. Vitellogenin induction by 17β-estradiol and 17β-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131: 531-539.
|
|
(17)
|
Brion F, Nilsen BM, Eidem JK, Goksoyr A, Porcher JM, Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699-1708.
|
|
(18)
|
Yokota H, Morita H, Nakano N, Kang IJ, Tadokoro H, Oshima Y, Honjo T, Kobayashi K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4: 87–98.
|
|
(19)
|
Tatarazako N, Koshio M, Hori H, Morita M ja Iguchi T., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50: 301-308.
|
|
(20)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray LE (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350-60.
|
|
(21)
|
Seki M, Yokota H, Matsubara H, Maeda M, Tadokoro H, Kobayashi K (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3): 774-81.
|
|
(22)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris.
|
|
(23)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp.69–92.
|
|
(24)
|
Hutchinson TH, Ankley GT, Segner H, Tyler CR, 2006b. Screening and testing for endocrine disruption in fish-biomarkers as „signposts,” not „traffic lights,” in risk assessment. Environmental Health Perspectives;114 Suppl 1:106-14.
|
|
(25)
|
Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure to 17B-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129-145.
|
|
(26)
|
Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve ja G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478-488.
|
|
(27)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No. 54. ENV/JM/MONO(2006)18.
|
|
(28)
|
OECD (2012). OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No 150. ENV/JM/MONO(2012)22.
|
1. liide
Lühendid ja mõisted
Kemikaal
– aine või segu.
CV
– variatsioonikordaja.
ELISA
– ensüümimmuunsorptsioonanalüüs.
Laadimisnorm
– kalade märgmass vee ruumalaühiku kohta.
Loomkoormus
– kalade arv vee ruumalaühiku kohta.
VTG (vitellogeniin)
– fosfolipoglükoproteiin, mis on munakollases esineva valgu eelkäija ja mida tavaliselt leidub kõikides munemise teel paljunevate liikide seksuaalselt aktiivsetes emasloomades.
HAS-telg
– hüpotalamuse-ajuripatsi-sugunäärmete telg.
MTC
– maksimaalne talutav kontsentratsioon, mis on ligikaudu 10 % LC50 väärtusest.
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil.
2. liide
Kalade endokriinsüsteemi mõjutavate kemikaalide sõeluuringu katse tingimused
|
|
Tüse tömpnina
(Pimephales promelas)
|
Jaapani riisikala
(Oryzias latipes)
|
Vöötdaanio
(Danio rerio)
|
|
|
Läbivooluga
|
Läbivooluga
|
Läbivooluga
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
|
Luminofoorlambid (laia spektriga)
|
Luminofoorlambid (laia spektriga)
|
Luminofoorlambid (laia spektriga)
|
|
|
10–20 μE/m2/s, 540–1 000 luksi (labori üldvalgustus)
|
10–20 μE/m2/s, 540–1 000 luksi (labori üldvalgustus)
|
10–20 μE/m2/s, 540–1 000 luksi (labori üldvalgustus)
|
|
6.
|
Valgustusperiood (koidu/hämariku üleminekuid võib korraldada, kuid neid ei peeta tingimata vajalikuks)
|
|
16 tundi valgust, 8 tundi pimedust
|
12–16 tundi valgust, 12–8 tundi pimedust
|
12–16 tundi valgust, 12–8 tundi pimedust
|
|
|
< 5 g/l
|
< 5 g/l
|
< 5 g/l
|
|
|
10 l (miinimum)
|
2 l (miinimum)
|
5 l (miinimum)
|
|
|
8 l (miinimum)
|
1,5 l (miinimum)
|
4 l (miinimum)
|
|
10.
|
Katselahuse kogu ruumala asendamine
|
|
Vähemalt 6 korda päevas
|
Vähemalt 5 korda päevas
|
Vähemalt 5 korda päevas
|
|
|
Vt punkt 20
|
Vt punkt 20
|
Vt punkt 20
|
|
12.
|
Täiskasvanud kala ligikaudne märgkaal (g)
|
|
Emased: 1,5 ± 20 %
Isased: 2,5 ± 20 %
|
Emased: 0,35 ± 20 %
Isased: 0,35 ± 20 %
|
Emased: 0,65 ± 20 %
Isased: 0,4 ± 20 %
|
|
13.
|
Kalade arv katsenõu kohta
|
|
6 (2 isaskala ja 4 emaskala)
|
10 (5 isaskala ja 5 emaskala)
|
10 (5 isaskala ja 5 emaskala)
|
|
14.
|
Kontsentratsioonide arv
|
|
= 3 (pluss vajalikud kontrollkatsed)
|
= 3 (pluss vajalikud kontrollkatsed)
|
= 3 (pluss vajalikud kontrollkatsed)
|
|
15.
|
Nõude arv ühe kemikaalikontsentratsiooni kohta
|
|
Vähemalt 4
|
Vähemalt 2
|
Vähemalt 2
|
|
16.
|
Kalade arv ühe katses kasutatud kontsentratsiooni kohta
|
|
16 täiskasvanud emaslooma ja 8 isaslooma (4 emaslooma ja 2 isaslooma igas paralleelkatsenõus)
|
10 täiskasvanud emaslooma ja 10 isaslooma (5 emaslooma ja 5 isaslooma igas paralleelkatsenõus)
|
10 täiskasvanud emaslooma ja 10 isaslooma (5 emaslooma ja 5 isaslooma igas paralleelkatsenõus)
|
|
|
Elus või külmutatud soolase vee krevettide täiskasvanud või noorjärgus isendid 2–3 korda päevas (ad libitum), müügil olev kalasööt või nende kombinatsioon
|
Soolase vee krevettide noorjärgus isendid 2–3 korda päevas (ad libitum), müügil olev kalasööt või nende kombinatsioon
|
Soolase vee krevettide noorjärgus isendid 2–3 korda päevas (ad libitum), müügil olev kalasööt või nende kombinatsioon
|
|
|
Üksnes siis, kui lahustunud hapnikku on alla 60 % küllastuskontsentratsioonist
|
Üksnes siis, kui lahustunud hapnikku on alla 60 % küllastuskontsentratsioonist
|
Üksnes siis, kui lahustunud hapnikku on alla 60 % küllastuskontsentratsioonist
|
|
|
Puhas pinnavesi, kaevuvesi, taastatud vesi või deklooritud kraanivesi
|
Puhas pinnavesi, kaevuvesi, taastatud vesi või deklooritud kraanivesi
|
Puhas pinnavesi, kaevuvesi, taastatud vesi või deklooritud kraanivesi
|
|
20.
|
Kokkupuute-eelne periood
|
|
Soovitatavalt 7 päeva
|
Soovitatavalt 7 päeva
|
Soovitatavalt 7 päeva
|
|
21.
|
Kemikaaliga kokkupuute kestus
|
|
21 päeva
|
21 päeva
|
21 päeva
|
|
22.
|
Bioloogilised näitajad
|
|
ellujäämine,
käitumine,
teisesed sootunnused,
vitellogeniin
|
ellujäämine,
käitumine,
teisesed sootunnused,
vitellogeniin
|
ellujäämine,
käitumine,
vitellogeniin
|
|
|
Lahustunud hapnikku > 60 % küllastuskontsentratsioonist; keskmine temperatuur 25 ± 2 °C; kontrollrühma(de)s jäi ellu 90 % kaladest; katse ajal mõõdetud kontsentratsioonid vahemikus ± 20 % mõõdetud väärtuste keskväärtusest igal kontsentratsioonil
|
Lahustunud hapnikku > 60 % küllastuskontsentratsioonist; keskmine temperatuur 24 ± 2 °C; kontrollrühma(de)s jäi ellu 90 % kaladest; katse ajal mõõdetud kontsentratsioonid vahemikus ± 20 % mõõdetud väärtuste keskväärtusest igal kontsentratsioonil
|
Lahustunud hapnikku > 60 % küllastuskontsentratsioonist; keskmine temperatuur 26 ± 2 °C; kontrollrühma(de)s jäi ellu 90 % kaladest; katse ajal mõõdetud kontsentratsioonid vahemikus ± 20 % mõõdetud väärtuste keskväärtusest igal kontsentratsioonil
|
3. liide
Mõned lahjendusvee nõutavad keemilised omadused
|
Koostisosa
|
Kontsentratsioon
|
|
Tahked osakesed
|
< 20 mg/l
|
|
Orgaanilise süsiniku üldsisaldus
|
< 2 mg/l
|
|
Ioniseerimata ammoniaak
|
< 1 μg/l
|
|
Jääkkloor
|
< 10 μg/l
|
|
Fosfororgaaniliste pestitsiidide üldsisaldus
|
< 50 ng/l
|
|
Kloororgaaniliste pestitsiidide ja polüklooritud bifenüülide üldsisaldus
|
< 50 ng/l
|
|
Orgaanilise kloori üldsisaldus
|
< 25 ng/l
|
4.A liide
Vöötdaanio kudemissubstraat
Kudemisalus
: üleni klaasist instrumendinõu, näiteks 22 × 15 × 5,5 cm (pikkus × laius × sügavus), kaetud eemaldatava roostevabast terastraadist võrega (võresilma suurus 2 mm). Võre peaks katma instrumendinõu valendiku allpool nõu äärt.

Võre peale tuleks kinnitada kudemissubstraat. See peaks moodustama struktuuri, millesse kalad saavad siseneda. Sobivad näiteks rohelisest plastikmaterjalist kunstlikud akvaariumitaimed (NB! tuleb arvestada uuritava kemikaali võimaliku adsorbeerumisega plastikmaterjalile). Plastikmaterjali tuleb leostada piisava koguse sooja veega piisavalt kaua, et hoida ära kemikaalide leostumine vette katse ajal. Klaasmaterjali kasutamisel tuleks tagada, et kalad ei saaks vigastusi ega peaks oma aktiivse tegevuse käigus taluma ruumikitsikust.
Vahemaa aluse ja kambri klaasseinte vahel peaks olema vähemalt 3 cm, et kudemine toimuks kindlalt vaagnale. Alusele koetud marjaterad langevad läbi võre ja need võib koguda 45–60 minutit pärast valgustuse sisselülitamist. Läbipaistvad marjaterad ei ole kleepuvad ja on külgvalguses kergesti loendatavad. Kui ühe nõu kohta kasutatakse viit emaskala, võib marjaterade arvu kuni 20 ühe päeva kohta pidada väikeseks, kuni 100 – keskmiseks ja üle 100 – rikkalikuks saagiseks. Kudemisalus tuleks eemaldada, marjaterad kokku koguda ja kudemisalus uuesti katsenõusse tagasi panna kas võimalikult hilja õhtul või väga vara hommikul. Aeg kudemisaluse tagasipanekuni ei tohiks olla pikem kui üks tund, sest vastasel juhul võib kudemissubstraadi olemasolu mõjutada kalu individuaalselt paarituma ja kudema ebatavalisel ajal. Kui olukord tingib kudemisaluse hilisema sissepanemise, tuleks seda teha vähemalt 9 tundi pärast valgustuse sisselülitamist. Sellisel hilisel kellaajal kudemist enam ei toimu.
4.B liide
Tüseda tömpnina kudemissubstraat
Igasse katsekambrisse pannakse kaks või kolm plastikust, klaasist, keraamilist või roostevabast terasest kudemisvõlvi ja kandikut (nt 80 mm pikkune hall kaarja ristlõikega rentslikivi, mis asub 130 mm pikkusel servadega kandikul) (vt joonis). Korralikult vanandatud polüvinüülkloriid- või keraamilised võlvid on tõendatult sobiv kudemissubstraat (Thorpe et al., 2007).
On soovitatav võlvid karestada, et parandada nakkuvust. Kandikud tuleks samuti varustada kaitsevõrega, et takistada kalade juurdepääsu koetud marjale, kui marjaterade tõhus nakkuvus kasutatava kudemissubstraadiga ei ole tõendatud.

Alus on tehtud nii, et see peaks kinni kõik marjaterad, mis ei nakku kudemisvõlvi pinnaga ja kukuvad sellepärast alusele (või marjaterad, mis on koetud otse lamedale plastikalusele). Kõiki kudemissubstraate tuleks enne kasutamist vähemalt 12 tundi lahjendusveega leostada.
VIIDE
Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98.
5.A liide
Teiseste sootunnuste hindamine tüseda tömpnina puhul endokriinse mõjuga kemikaalide tuvastamiseks
Ülevaade
Endokriinse mõjuga kemikaalide tuvastamiseks sobivad täiskasvanud tüseda tömpnina potentsiaalselt olulised välistunnused hõlmavad järgmist: värvus (st hele/tume), värvumismuster (st vertikaalsete vöötide olemasolu või puudumine), kehakuju (st pea ja rinnaosa kuju, kõhu väljavenitatus) ja spetsiifilised teisesed sootunnused (st pulmarüüköbrukeste arv ja suurus, turjapadjandi ja kudemiselundi suurus).
Pulmarüü köbrukesed asuvad tüseda tömpnina suguliselt aktiivse isaskala pea peal (turjapadjandil) ja on tavaliselt paigutatud bilateraalsümmeetriliselt (Jensen et al., 2001). Kontrollrühma emaskaladel ning noortel isas- ja emaskaladel köbrukesi ei ole (Jensen et al., 2001). Isaskala silmade ümber ja sõõrmete vahel võib olla kuni kaheksa eraldi köbrukest. Suurim arv köbrukesi ja suurimad köbrukesed asuvad kahel paralleelsel joonel otse sõõrmete all ja suu kohal. Paljudel kaladel on köbrukeste rühmad alalõua all; suule kõige lähemaid köbrukesi on tavaliselt üks paar, edasi kõhu poole võib neid olla kuni neli tükki. Köbrukeste tegelik arv on harva üle 30 (vahemik 18–28; Jensen et al., 2001). Suurem osa (arvuliselt) köbrukesi kujutab endast eraldi võrdlemisi ümmargust struktuuri, mille kõrgus on ligikaudu võrdne selle raadiusega. Enamikul suguliselt aktiivsetel isaskaladel on vähemalt mõned köbrukesed suurenenud ja esil, nii et neid ei ole võimalik eristada eraldi struktuurina.
Endokriinsüsteemi mõjutavate kemikaalide hulgas võivad teatavat liiki kemikaalid põhjustada teatavate vastassoo teiseste sootunnuste ebanormaalse ilmumise; näiteks sellised androgeeniretseptori agonistid nagu 17β-metüültestosteroon ja 17β-trenboloon võivad põhjustada emasel tüsedal tömpninal pulmarüü köbrukeste ilmumise (Smith, 1974; Ankley et al., 2001, 2003), samal ajal kui östrogeeniretseptori agonistid võivad vähendada isaskaladel pulmarüü köbrukeste arvu või suurust (Miles-Richardson et al., 1999; Harries et al., 2000).
Allpool on esitatud tüseda tömpnina pulmarüüköbrukeste kirjeldamise meetod, mida kasutatakse Minnesota osariigis Duluthis asuvas Ameerika Ühendriikide Keskkonnakaitseameti laboris. Konkreetsed tooted ja/või seadmed võib asendada võrreldavate kättesaadavate materjalidega.
Köbrukesi on kõige parem vaadelda valgustusega suurendusklaasi või valgustusega (3X) lahkamismikroskoobiga. Vaadelge kala selja poolt ja eest (peaga vaataja poole).
|
a)
|
Pange kala väiksele Petri tassile (läbimõõt nt 100 mm), esiotsaga enda poole ja kõhuga allapoole. Seadke objektiivi fookus nii, et oleks võimalik vaadelda köbrukesi. Pöörake kala ettevaatlikult ja aeglaselt küljelt küljele, et tuvastada köbrukeste piirkonnad. Loendage ja hinnake köbrukesed.
|
|
b)
|
Korrake vaatlust pea kõhupoolel, olles pannud kala Petri tassil selili esiotsaga enda poole.
|
|
c)
|
Iga kala vaatlus tuleks viia lõpule kahe minutiga.
|
Köbrukeste arv ja hindamine
Täiskasvanud tüseda tömpnina köbrukeste olemasolu ja suuruse hindamiseks on määratletud kuus konkreetset ala. Olemasolevate köbrukeste asukoha ja arvu kaardistamiseks on välja töötatud vorm (vt käesoleva liite lõpus). Iga kala köbrukeste arv ja suurus registreeritakse kvantitatiivselt järgmiselt: 0 – puuduvad, 1– olemas, 2 – suurenenud ja 3 – tugevasti väljendunud (joonis 1).
0 punkti – köbrukesi ei ole. 1 punkt – köbrukesed on olemas, igal köbrukesel on üks kõrgeim punkt, mille kõrgus on ligikaudu võrdne raadiusega (diameetriga). 2 punkti – suurenenud köbrukesed, mille kude meenutab kujult tärni, millel on tavaliselt lai alus keskelt algavate radiaalsete vagudega. Köbrukeste tipp on sageli ebakorrapärasem, mõnikord võib olla mõnevõrra ümardunud. 3 punkti – selgelt väljendunud köbrukesed, on tavaliselt üsna suured ja ümmargused; struktuur on ebaselgem. Mõnikord on need köbrukesed kokku kasvanud ja moodustavad ühtse massi, mis hõlmab üht või mitut ala (B, C ja D, mida on kirjeldatud allpool). Värvumine ja muster on sarnased 2 punktile vastavate köbrukeste omale, kuid on mõnikord raskesti eristatavad. Selle süsteemi kasutamise korral on normaalsel kontrollrühma isasel, kelle köbrukeste arv on 18–20, üldine köbrukeste punktisumma < 50 (Jensen et al., 2001).
Joonis 1
Tegelik köbrukeste arv võib mõnel kalal olla suurem, kui on vormil (liide A) asjaomases hindamispiirkonnas lahtreid. Kui see on nii, võib täiendavad hinded märkida lahtri sisse, lahtrist paremale või vasakule. Vormist ei pea olema näha sümmeetriat. Täiendav meetod selliste köbrukeste kaardistamiseks, mis paiknevad piki suu horisontaaltasapinda vertikaalselt paaris või ühendatuna, on märkida kummagi köbrukese hinne samasse lahtrisse.
Kaardistamispiirkonnad on järgmised.
A– silmade ümber olevad köbrukesed. Kaardistatakse selja poolt kõhu poole piki silma eesmist äärt. Tavaliselt on kontrollrühma isaskaladel neid mitu, kontrollrühma emaskaladel neid ei ole; androgeenidega kokku puutunud emaskaladel esinevad need paaris (üks kummagi silma juures) või üksikult.
B– sõõrmete (meeleelundikanalite avade) vahel olevad köbrukesed. Kontrollrühma kõrgema hindega (2 – suurenenud või 3 – selgelt väljendunud) isaskaladel on need tavaliselt paaris. Kontrollrühma emaskaladel neid ei ole; androgeenidega kokku puutunud emaskaladel võib neid esineda ja need võivad olla teataval määral arenenud.
C– otse sõõrmetest eespool suuga paralleelselt asuvad köbrukesed. Suguküpsetel kontrollrühma isaskaladel on need tavaliselt suurenenud ja selgelt väljendunud. Vähem arenenud isaskaladel ja androgeeniga kokku puutunud emaskaladel on need olemas või suurenenud.
D– köbrukesed, mis paiknevad paralleelselt piki suujoont. Üldiselt klassifitseeritakse need kontrollrühma isaskaladel „arenenuks”. Kontrollrühma emaskaladel neid ei ole, kuid androgeenidega kokku puutunud emaskaladel on need olemas.
E– alalõual suu kõrval paiknevad köbrukesed, tavaliselt väiksed ja paarikaupa. Kontrollrühma isaskaladel ning kemikaaliga kokku puutunud isaskaladel ja emaskaladel võivad need olla mitmesugused.
F– köbrukesed, mis paiknevad alast E kõhu pool. Tavaliselt väiksed ja paaris. Neid esineb kontrollrühma isastel ja androgeeniga kokku puutunud emaskaladel.
VIITED
|
(1)
|
Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276-1290.
|
|
(2)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Hornung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray EL. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22:1350-1360.
|
|
(3)
|
Harries JE, Runnalls T, Hill E, Harris CA,Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003-3011.
|
|
(4)
|
Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128:127-141.
|
|
(5)
|
Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515-523.
|
|
(6)
|
Miles-Richardson SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47:129-145.
|
|
(7)
|
Smith RJF. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52:1031-1038.
|
|
Köbrukeste hindamise vorm
|
Numbriline hinnang
|
|
ID
|
1 – on olemas
|
|
Kuupäev
|
2 – suurenenud
|
|
Üldsumma
|
3 – tugevasti väljendunud
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
5.B liide
Teiseste sootunnuste hindamine jaapani riisikala puhul endokriinse mõjuga kemikaalide tuvastamiseks
Allpool on kirjeldatud papillaarjätkete (21) mõõtmist; nimetatud jätked on jaapani riisikala (Oryzias latipes) teisesed sootunnused.
|
(1)
|
Pärast maksa väljalõikamist (6. liide) pannakse rümp (pea ülespoole, saba allapoole) koonilisse katseklaasi, mis sisaldab ligikaudu 10 ml puhverdatud neutraalse pH-ga 10 % formaliinilahust. Kui sugunäärmed fikseeritakse mingi muu lahusega kui neutraalne puhverdatud 10 % formaliinilahus, tehke pärakuuime eesosa ja päraku vahelt žiletiteraga ristilõige läbi rümba, hoolitsedes selle eest, et gonopoorid ja sugunäärmed ise ei saaks viga (joonis 3). Pange kala keha peapoolne osa fikseerimislahusesse, et fikseerida sugunäärmed, ja sabapoolne osa neutraalsesse puhverdatud 10 % formaliinilahusesse, nagu on kirjeldatud eespool.
|
|
(2)
|
Pärast seda, kui kala keha on pandud 10 % neutraalsesse puhverdatud formaliini, võtke pärakuuime eesosast pintsettidega kinni ja tõmmake seda umbes 30 sekundit, et hoida pärakuuim lahti. Pärakuuimest kinnivõtmisel võtke pintsettide vahele mõned uimekiired uime eesosas ja jälgige, et papillaarjätked ei saaks kriimustada.
|
|
(3)
|
Pärast seda, kui olete pärakuuime hoidnud lahti ligikaudu 30 sekundit, hoidke kala keha 10 % neutraalses puhverdatud formaliinis toatemperatuuril kuni papillaarjätkete mõõtmiseni (neid tuleks mõõta pärast vähemalt 24 tunni pikkust fikseerimist).
|
Mõõtmine
|
(1)
|
Pärast kala keha fikseerimist 10 % neutraalses puhverdatud formaliinis vähemalt 24 tundi võtke kala rümp koonilisest katseklaasist ja pühkige formaliin filterpaberisse (või paberrätikusse).
|
|
(2)
|
Pange kala kõhuga ülespoole. Seejärel lõigake väikeste lahkamiskääridega pärakuuim ettevaatlikult ära (parem on lõigata uim ära koos väikse koguse seda toestava koega).
|
|
(3)
|
Võtke äralõigatud pärakuuime eesosast pintsettidega kinni ja pange see objektiklaasile, millel on mõni tilk vett. Seejärel katke pärakuuim katteklaasiga. Olge ettevaatlik, et pintsettidega pärakuuimest kinni võttes ei saaks papillaarjätked kriimustada.
|
|
(4)
|
Loendage bioloogilise mikroskoobi abil (tavaline või invertmikroskoop) loenduri abil papillaarjätketega liigeseplaatide arv. Papillaarjätketeks loetakse väikest rühma jätkeid liigeseplaadi tagumisel serval. Kirjutage iga uimekiire papillaarjätketega liigeseplaatide arv töölehele (nt esimene uimekiir: 0, teine uimekiir: 10, kolmas uimekiir: 12 jne) ning sisestage nende arvude summa iga kala kohta Exceli tabelisse. Vajaduse korral tehke pärakuuimest pilt ja loendage papillaarjätketega liigeseplaatide arv fotolt.
|
|
(5)
|
Pärast mõõtmist pange pärakuuim koonilisse katseklaasi (1) ja hoidke see alles.
|
Joonis 1.
Pärakuuime kuju ja suuruse soolised erinevused. A – isaskala; B – emaskala. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

Joonis 2.
A. Jätked pärakuuime kiire liigeseplaatidel. J.P. (joint plate) – liigeseplaat; A.S. (axial space) – teljesuunaline vahekaugus; P. (process) – jätke. B. Uimekiire lõpuosa. Otsas on aktinotrihhiumid (Act.) (luuniidid). Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

Joonis 3.
Kala keha, millel on näidatud lõikamiskoht, kui sugunäärmed fikseeritakse muus lahuses kui neutraalne puhverdatud 10 % formaliinilahus. Sellisel juhul lõigatakse keha pärakuuime eesosa ja päraku vahelt žiletiga läbi (punane joon); peapoolne osa pannakse sugunäärmete fikseerimiseks ette nähtud lahusesse ja sabapoolne osa neutraalsesse puhverdatud 10 % formaliinilahusesse.
6. liide
Vitellogeniini määramise puhul soovitatav proovi võtmise kord
Tuleks olla hoolikas, et hoida ära isas- ja emaskalade vitellogeniiniproovide ristsaastumist.
Meetod 1A. Tüseda tömpnina vere võtmine sabaveenist/-arterist
Pärast tuimestamist lõigatakse sabavars skalpelliteraga osaliselt läbi ja veri kogutakse sabaveenist/-arterist hematokriti määramiseks ette nähtud hepariniseeritud mikrokapillaartorusse. Kui veri on kogutud, eraldatakse kiiresti plasma tsentrifuugimisega 3 minuti jooksul 15 000g juures (või selle asemel 10 minuti jooksul 15 000g ja 4 °C juures). Soovi korral võib määrata pärast tsentrifuugimist hematokriti. Plasmakogus eemaldatakse seejärel hematokriti määramiseks ette nähtud mikrokapillaartorust ja säilitatakse tsentrifuugitopsis 0,13 ühiku aprotiniini (proteaasiinhibiitor) juuresolekul – 80 °C juures, kuni on võimalik määrata vitellogeniin. Olenevalt tüseda tömpnina suurusest (see sõltub soost), on ühest kalast kogutava plasma maht tavaliselt vahemikus 5–60 mikroliitrit (Jensen et al., 2001).
Meetod 1B. Tüseda tömpnina vere võtmine südamest
Teise võimalusena võib vere koguda südamepunktsiooniga, kasutades hepariniseeritud süstalt (1 000 ühikut hepariini ml kohta). Veri viiakse üle Eppendorfi katsutisse (mida hoitakse jää peal) ja seejärel tsentrifuugitakse (5 minutit, 7 000 g, toatemperatuuril). Plasma kantakse üle puhastesse Eppendorfi katsutitesse (alikvootidena, kui plasma maht seda võimaldab) ja külmutatakse viivitamata – 80 °C juures, kus seda säilitatakse kuni analüüsimiseni (Panter et al., 1998).
Meetod 2A. Jaapani riisikala maksa väljalõikamine
Katses kasutatavate kalade eemaldamine katsekambrist
|
(1)
|
Katses kasutatavad kalad tuleks katsekambrist eemaldada väikse kahvaga. Olge hoolikas, et mitte pillata neid teise katsekambrisse.
|
|
(2)
|
Üldiselt tuleks katses kasutatavad kalad eemaldada järgmises järjekorras: kontrollrühm, lahusti kontrollrühm (vajaduse korral), madalaima kontsentratsiooniga rühm, keskmise kontsentratsiooniga rühm, kõrgeima kontsentratsiooniga rühm ja positiivne kontroll. Lisaks tuleks ühest katsekambrist eemaldada kõigepealt kõik isaskalad ja seejärel allesjäänud emaskalad.
|
|
(3)
|
Iga kala sugu tehakse kindlaks väliste teiseste sootunnuste järgi (nt pärakuuime kuju).
|
|
(4)
|
Paigutage uuritavad kalad transpordimahutisse ja viige nad maksa väljalõikamiseks töölauale. Kontrollige katsekambri ja mahuti märgistuse õigsust ning veenduge, et katsekambrist võetud kalade arv ja katsekambrisse jäänud kalade arv vastavad eeldustele.
|
|
(5)
|
Kui kalade sugu ei ole võimalik tuvastada välise vaatlusega, eemaldatakse katsekambrist kõik kalad. Sellisel juhul tuleks nende sugu määrata sugunäärmete või teiseste sootunnuste vaatlemisega stereomikroskoobi abil.
|
Maksa väljalõikamine
|
(1)
|
Viige kala väikse kahvaga transpordimahutist üle tuimastilahusesse.
|
|
(2)
|
Pärast seda, kui kala on tuimestatud, viige ta tavaliste pintsettidega üle filterpaberile (või paberrätikule). Kala võtmisel haarake pintsettidega peast, et mitte murda saba.
|
|
(3)
|
Pühkige vesi kala pealt filterpaberisse (või paberrätikusse).
|
|
(4)
|
Pange kala kõhuga ülespoole. Seejärel tehke lahkamiskääridega väike lõige risti üle kõhupoolse kaelaosa ja kõhu keskosa.
|
|
(5)
|
Pistke lahkamiskäärid väiksesse sisselõikesse ja lõigake kõht piki keskjoont lahti lõpusekattest saba pool asuvast punktist kuni päraku peapoolse servani. Olge ettevaatlik ja ärge torgake kääre liiga sügavale, et mitte vigastada maksa või sugunäärmeid.
|
|
(6)
|
Järgmised toimingud tehke stereomikroskoobi all.
|
|
(7)
|
Pange kala kõhuga ülespoole paberrätikule (või klaasist Petri tassile või objektiklaasile).
|
|
(8)
|
Venitage kõhuõõne seinad laiali täppistööks ette nähtud pintsettidega ja võtke siseelundid välja. Vajaduse korral võib siseelundid välja võtta ka kõhuõõne ühe seina kõrvaldamisega.
|
|
(9)
|
Teise paari täppispintsettide abil tooge esile maksa ja sapipõie ühenduskoht. Haarake kinni sapijuhast ja lõigake sapipõis ära. Olge ettevaatlik, et sapipõis ei läheks katki.
|
|
(10)
|
Haarake kinni söögitorust ja lõigake seedekulgla maksast samal viisil lahti. Olge ettevaatlik, et seedekulgla sisu ei voolaks välja. Lõigake sabapoolne seedekulgla osa pärakust lahti ja eemaldage seedekulgla kõhuõõnest.
|
|
(11)
|
Kärpige maksa kõrval olevat rasva ja muid kudesid. Olge ettevaatlik, et maks ei saaks kriimustada.
|
|
(12)
|
Haarake täppispintsettidega maksa väratipiirkonnast ja tõstke maks kõhuõõnest välja.
|
|
(13)
|
Pange maks objektiklaasile. Eemaldage vajaduse korral täppispintsettidega maksa pinnalt kogu rasv ja muu kude (nt kõhukelme).
|
|
(14)
|
Mõõtke maksa mass elektroonilise analüütilise kaaluga, kasutades taarana 1,5 ml mikrokatsutit. Märkige maksa mass töölehele (täpsusega 0,1 mg). Kontrollige mikrokatsuti etiketil oleva identifitseerimisteabe õigsust.
|
|
(15)
|
Sulgege maksa sisaldava mikrokatsuti kork. Pange mikrokatsuti jahutusega (või jääl olevasse) hoidjasse.
|
|
(16)
|
Pärast ühe maksa väljalõikamist puhastage lahkamisriistad või asendage need puhastega.
|
|
(17)
|
Eemaldage eespool kirjeldatud viisil maks kõikidelt transpordimahutis olevatelt kaladelt.
|
|
(18)
|
Pärast seda, kui maks on eemaldatud kõikidelt transpordimahutis olnud kaladelt (st kõigilt katsekambris olnud isas- ja emaskaladelt), pange kõik maksaproovid katsutihoidjasse, millel on identifitseerimisandmetega etikett, ja hoidke seda sügavkülmikus. Kui maksale hakatakse eeltöötlust tegema varsti pärast väljalõikamist, viiakse proovid järgmisele töölauale jahutusega katsutihoidjas (või jääl olevas hoidjas).
|
Pärast kaladelt maksa väljalõikamist on rümp valmis teiseste sootunnuste mõõtmiseks.
Proov
Säilitage maksaproove temperatuuril ≤ – 70 °C, kui neile ei hakata eeltöötlust tegema vahetult pärast väljalõikamist.
Joonis 1.
Lõige kääridega tehakse vahetult rinnauimedest eespool.

Joonis 2.
Kõhu keskjoont mööda lõigatakse kõht lahti punktini, mis asub umbes 2 mm pärakust pea pool.

Joonis 3.
Kõhuseinad lükatakse pintsettidega laiali, et paljastada maks ja muud siseelundid. (Teise võimalusena võib kõhuseinad küljele lahti tõmmatult kinnitada nõeltega.)
Joonis 4.
Maks eraldatakse pintsettide abil ümbritsevatest kudedest.

Joonis 5.
Sooled tõmmatakse ettevaatlikult pintsettidega eemale.
Joonis 6.
Soolestiku mõlemad otsad ja mesenteeriumimanused lõigatakse kääride abil lahti.

Joonis 7 (emaskala).
Emaskala puhul toimitakse samal viisil.

Joonis 8.
Lõpule viidud lahkamine.

Meetod 2B. Jaapani riisikala (Oryzias latipes) maksa eeltöötlemine vitellogeniini määramiseks
Võtke ELISA komplektist homogeniseerimispuhver ja jahutage see purustatud jää abil maha (lahuse temperatuurini ≤ 4 °C). Kui kasutatakse EnBio ELISA süsteemi homogeniseerimispuhvrit, sulatage lahus toatemperatuuril ja siis jahutage pudelit purustatud jääs.
Arvutage maksa jaoks vajalik homogeniseerimispuhvri maht, lähtudes maksa massist (lisage 50 μl homogeniseerimispuhvrit homogeniseeritava maksa mg kohta). Kui maksa mass on näiteks 4,5 mg, on vajalik homogeniseerimispuhvri kogus 225 μl. Koostage homogeniseerimispuhvri mahtude loetelu kõikide maksade jaoks.
Maksa ettevalmistamine eeltöötlemiseks
|
(1)
|
Võtke 1,5 ml mikrokatsuti maksaga sügavkülmikust välja vahetult enne eeltöötlemist.
|
|
(2)
|
Isaskalade maksa eeltöötlus peaks toimuma enne emaskalade maksa eeltöötlust, et hoida ära vitellogeniiniga saastumist. Peale selle peaks katserühmade kalade maksade eeltöötlemine toimuma järgmises järjekorras: kontrollrühm, lahusti kontrollrühm (vajaduse korral), madalaima kontsentratsiooniga rühm, keskmise kontsentratsiooniga rühm, kõrgeima kontsentratsiooniga rühm ja positiivne kontroll.
|
|
(3)
|
Sügavkülmikust teataval ajahetkel võetavate maksaproove sisaldavate 1,5 ml mikrokatsutite arv ei tohiks ületada proovide arvu, mida saab samaaegselt tsentrifuugida.
|
|
(4)
|
Paigutage maksa sisaldavad 1,5 ml mikrokatsutid proovi numbri järgi jääga hoidjasse (maksa üles sulatada ei ole vaja).
|
Eeltöötluse tegemine
1. Homogeniseerimispuhvri lisamine
|
(1)
|
Vaadake homogeniseerimispuhvri mahtude loetelust, milline kogus puhvrit tuleb lisada konkreetsele maksaproovile, ja seadke mikropipett (mahuvahemikuga 100–1 000 μl) vajalikule mahule. Pange mikropipeti otsa puhas otsik.
|
|
(2)
|
Võtke vajalik homogeniseerimispuhvri kogus reaktiivipudelist ja lisage 1,5 ml mikrokatsutisse, milles on maks.
|
|
(3)
|
Lisage samal viisil homogeniseerimispuhver kõikidesse 1,5 ml mikrokatsutitesse, milles on maks. Mikropipeti otsikut ei ole seejuures vaja vahetada uue vastu. Kui aga otsik saastub või tekib saastumise kahtlus, tuleks otsik välja vahetada.
|
2. Maksa homogeniseerimine
|
(1)
|
Pange mikrokatsutis homogeniseerimise seadmele uus nui.
|
|
(2)
|
Viige nui 1,5 ml mikrokatsutisse. Hoidke mikrokatsutis homogeniseerimise seadet nii, et maks oleks pressitud nuia ja 1,5 ml mikrokatsuti seina vahele.
|
|
(3)
|
Laske homogenisaatoril mikrokatsutis töötada 10–20 sekundit. Jahutage homogeniseerimise ajal 1,5 ml mikrokatsutit purustatud jääga.
|
|
(4)
|
Tõstke nui 1,5 ml mikrokatsutist välja ja jätke segu seisma umbes 10 sekundiks. Seejärel vaadelge suspensiooni.
|
|
(5)
|
Kui suspensioonis on näha maksatükikesi, korrake toiminguid (3) ja (4), et saada rahuldav maksahomogenaat.
|
|
(6)
|
Jahutage maksasuspensiooni jääga katsutihoidjas kuni tsentrifuugimiseni.
|
|
(7)
|
Vahetage homogenisaatori nui uue vastu enne iga homogeniseerimist.
|
|
(8)
|
Homogeniseerige kõik maksad homogeniseerimispuhvriga vastavalt eespool kirjeldatud korrale.
|
3. Homogeniseeritud maksasuspensiooni tsentrifuugimine
|
(1)
|
Kontrollige, et jahutatud tsentrifuugikambri temperatuur oleks ≤ 5 °C.
|
|
(2)
|
Pange 1,5 ml mikrokatsutid homogeniseeritud maksa suspensiooniga jahutatud tsentrifuugi (vajaduse korral tasakaalustage tsentrifuug).
|
|
(3)
|
Tsentrifuugige homogeniseeritud maksa suspensiooni 13 000g juures 10 minutit temperatuuril ≤ 5 °C. Kui supernatant eraldub korralikult, võite tsentrifugaaljõudu ja aega vastavalt vajadusele muuta.
|
|
(4)
|
Pärast tsentrifuugimist kontrollige, et supernatant on piisaval määral eraldunud (pinnal – lipiidid, keskel – supernatant, alumine kiht – maksakude). Kui eraldumine ei ole piisav, tsentrifuugitakse suspensiooni uuesti samades tingimustes.
|
|
(5)
|
Võtke kõik proovid jahutatud tsentrifuugist ja pange need proovi numbri järgi jääga katsutihoidjasse. Olge ettevaatlik, et tsentrifuugimisega eraldatud kihte mitte uuesti suspendeerida.
|
4. Supernatandi kogumine
|
(1)
|
Pange neli supernatandi säilitamiseks ette nähtud 0,5 ml mikrokatsutit katsutihoidjasse.
|
|
(2)
|
Võtke mikropipetiga 30 μl supernatanti (keskmine kiht) ja viige see ühte 0,5 ml mikrokatsutitest. Olge ettevaatlik, et mitte võtta lipiide pinnalt ega maksakudet alumisest kihist.
|
|
(3)
|
Võtke veel supernatanti ja pange see eespool kirjeldatud viisil veel kahte 0,5 ml mikrokatsutisse.
|
|
(4)
|
Võtke mikropipetiga ülejäänud supernatant (võimaluse korral ≥ 100 μl). Seejärel pange see supernatant viimasesse 0,5 ml mikrokatsutisse. Olge ettevaatlik, et mitte võtta pinnalt lipiide ega alumisest kihist maksakudet.
|
|
(5)
|
Sulgege 0,5 ml mikrokatsuti kork ja kirjutage supernatandi maht etiketile. Seejärel jahutage mikrokatsutid jääga katsutihoidjas viivitamata maha.
|
|
(6)
|
Vahetage mikropipeti otsik uue vastu iga kord enne uue supernatandi võtmist. Kui otsiku külge kleepub suur kogus lipiide, vahetage otsik kohe, et hoida ära maksaekstrakti saastumist rasvaga.
|
|
(7)
|
Pange kogu tsentrifuugitud supernatant nelja 0,5 ml mikrokatsutisse vastavalt eespool kirjeldatud korrale.
|
|
(8)
|
Pärast supernatandi viimist 0,5 ml mikrokatsutitesse pange need kõik identifitseerimisetiketiga katsutihoidjasse ja seejärel külmutage need kohe sügavkülmikus. Kui vitellogeniini kontsentratsioonid mõõdetakse kohe pärast eeltöötlemist, hoidke üks 30 μl supernatanti sisaldav 0,5 ml mikrokatsuti jahutatult katsutihoidjas ja viige see töölauale, kus tehakse ELISA. Sellisel juhul pange ülejäänud mikrokatsutid katsutihoidjatesse ja külmutage need sügavkülmikus.
|
|
(9)
|
Pärast supernatandi võtmist visake ülejäänud materjal ära.
|
Proovi säilitamine
Säilitage maksahomogenaadi supernatandiga 0,5 ml mikrokatsuteid temperatuuril ≤ – 70 °C, kuni neid kasutatakse ELISA tegemiseks.
Meetod 3A. Vöötdaanio vere võtmine sabaveenist/-arterist
Kohe pärast tuimestamist lõigatakse sabavars risti läbi ja veri kogutakse sabaveenist/-arterist hematokriti määramiseks ette nähtud hepariniseeritud mikrokapillaartorusse. Vere kogus on vahemikus 5–15 μl, sõltuvalt kala suurusest. Mikrokapillaartorusse lisatakse võrdne kogus aprotiniiniga puhvrit (6 μg/ml fosfaatpuhvrilisandiga soolalahuses (PBS)) ja plasma eraldatakse verest tsentrifuugimise teel (5 minutit, 600 g). Plasma kogutakse katseklaasidesse ja säilitatakse temperatuuril – 20 °C kuni vitellogeniini või muude huvipakkuvate valkude määramiseni.
Meetod 3B. Vöötdaanio vere võtmine südamepunktsiooniga
Vere hüübimise ja valkude lagunemise takistamiseks võetakse proovid fosfaatpuhvrilisandiga soolalahusesse (PBS), mis sisaldab hepariini (1 000 ühikut/ml) ja proteaaside inhibiitorit aprotiniini (2 trüpsiiniinhibiitori ühikut (TIU) / ml). Puhvrikomponentidena soovitatakse kasutada hepariini ammooniumsoola ja lüofiliseeritud aprotiniini. Vereproovi võtmiseks soovitatakse kasutada 1 ml süstalt, millel on fikseeritud peen nõel (nt Braun Omnikan-F). Süstlasse tuleks eelnevalt võtta puhverlahust (ligikaudu 100 μl), et iga kala väike verekogus süstlast puhverlahusega täielikult kätte saada. Vereproovid võetakse südamepunktsiooniga. Kõigepealt tuleks kala tuimestada MS-222-ga (100 mg/l). Nõuetekohane tuimestus võimaldab kasutajal eristada vöötdaanio südamelööke. Südame punkteerimisel hoidke süstla kolbi nõrga tõmbe all. Kogutava vere maht on vahemikus 20–40 mikroliitrit. Pärast südamepunktsiooni tuleks vere ja puhvri segu panna katsutisse. Plasma eraldatakse verest tsentrifuugimise teel (20 minutit, 5 000 g) ja seda tuleks säilitada – 80 °C juures kuni analüüsi tegemiseni.
Meetod 3C. Standardne töökord vöötdaanio pea ja saba homogeniseerimiseks
|
(1)
|
Kalad tuimestatakse ja surmatakse humaansel viisil kooskõlas katsemeetodi kirjeldusega.
|
|
(2)
|
Kala pea ja saba lõigatakse ära nii, nagu on näidatud joonisel 1.
|
Oluline märkus: kõik lõikeriistad ja lõikelaud tuleks enne iga kala lõikamist loputada ja korralikult puhastada (näiteks 96 % etanooliga), et hoida ära kemikaaliga mitte kokku puutunud isaskalade saastumist emaskalade ja kemikaaliga kokku puutunud isaskalade vitellogeniiniga.
Joonis 1

|
(3)
|
Iga kala pea ja saba pannakse kokku ja nende summaarne mass mõõdetakse milligrammi täpsusega.
|
|
(4)
|
Pärast kaalumist pannakse need kehaosad sobivasse nõusse (nt 1,5 ml Eppendorfi katsuti) ja külmutatakse – 80 °C juures kuni homogeniseerimiseni või homogeniseeritakse kohe jää peal kahe plastikvarda abil. (Võib kasutada ka muid meetodeid, kui homogeniseerimine toimub jää peal ja saadakse homogeenne mass.) Oluline märkus: katsutid peavad olema korralikult nummerdatud, nii et kala pea ja saba on kokkuviidavad vastava kehatükiga, mida kasutatakse sugunäärmete histoloogiliseks uurimiseks.
|
|
(5)
|
Pärast ühtlase massi saavutamist lisatakse koemassiga võrreldes neljakordne kogus jääkülma homogeniseerimispuhvrit (22). Jätkatakse töötamist varrastega, kuni segu on homogeenne. Oluline märkus: iga kala puhul kasutatakse uusi vardaid.
|
|
(6)
|
Proovid pannakse jääle kuni tsentrifuugimiseni 4 °C ja 50 000g juures 30 minuti jooksul.
|
|
(7)
|
Pipetiga pannakse vähemalt kahte katsutisse 20 μl supernatanti; pipeti ots viiakse allapoole pindmist rasvakihti ja supernatant eemaldatakse nii, et rasva- ja sademefraktsioon kaasa ei tuleks.
|
|
(8)
|
Katsuteid säilitatakse temperatuuril – 80 °C kuni kasutamiseni.
|
7. liide
Vitellogeniiniga rikastatud proovid ja eri analüüsides kasutatav vitellogeniini võrdlusstandard
Igal vitellogeniinianalüüsi tegemise päeval mõõdetakse ka rikastatud proovi, mis on valmistatud eri katsetes kasutatava võrdlusstandardiga. Vitellogeniin, millest valmistatakse eri katsetes kasutatav võrdlusstandard, peab olema muust partiist kui see, mida kasutatakse katse kaliibrimisstandardite tegemiseks.
Rikastud proov valmistatakse teadaoleva koguse võrdlusstandardi lisamisega kontrollrühma isaskalade plasmaproovile. Proovi rikastatakse nii, et saavutatakse vitellogeniini kontsentratsioon, mis on 10–100 korda suurem kui kontrollrühma isaskalade plasmas olev eeldatav kontsentratsioon. Kontrollrühma isaskalade plasma, mida rikastatakse, võib pärineda kas ühelt või mitmelt kalalt.
Kontrollrühma isaskalade rikastamata plasma osaproovi analüüsitakse vähemalt kahes paralleelaugus. Rikastatud plasmat analüüsitakse samuti vähemalt kahes paralleelaugus. Eeldatava kontsentratsiooni määramiseks liidetakse kontrollrühma isaskalade kahes rikastamata proovis sisalduva vitellogeniinikoguse keskväärtusele rikastamisel lisatud arvutuslik vitellogeniinikogus. Eeldatava kontsentratsiooni ja mõõdetud kontsentratsiooni suhtarv esitatakse koos samal päeval tehtud määramiste tulemustega.
8. liide
Statistilise analüüsi otsustamisskeem

C.38. KAHEPAIKSETE METAMORFOOSI KATSE
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 231 (2009). Vajadus töötada välja ja valideerida katse, mille abil saaks välja selgitada kemikaale, mis avaldavad mõju selgroogsete loomade kilpnäärmesüsteemile, tuleneb kartustest, et kemikaalid võivad juba keskkonnas oleva kontsentratsiooni juures avaldada kahjulikku mõju nii inimestele kui ka elusloodusele. OECD algatas 1998. aastal prioriteetse tegevussuunana olemasolevate katsejuhendite läbivaatamise ja uute väljatöötamise, et sõeluuringutega selgitada välja kemikaalid, mis võivad kahjustada endokriinsüsteemi, ja teha kindlaks nende mõju. Üks tegevussuund oli töötada välja katsejuhend sõeluuringu tegemiseks, millega selgitatakse välja kemikaale, mis mõjutavad selgroogsete kilpnäärmesüsteemi. Tehti ettepanek tõhustada selleks suukaudse kordusdoosi toksilisuse 28-päevast uuringut närilistel (vt käesoleva lisa peatükk B.7) ja kahepaiksete metamorfoosi katset (Amphibian Metamorphosis Assay, AMA). Tõhustatud katsemeetod B.7 on läbinud valideerimise ja läbivaadatud katsemeetod on avaldatud. Kahepaiksete metamorfoosi katse on läbinud ulatusliku valideerimisprogrammi, mis hõlmas laborisiseseid ja laboritevahelisi uuringuid, millega tõendati katsemeetodi asjakohasust ja usaldusväärsust (1, 2). Seejärel läbis katse valideerimine vastastikuse hindamise sõltumatute ekspertide rühma poolt (3). Käesolev katsemeetod põhineb kogemustel, mis on saadud kilpnääret mõjutavate kemikaalide väljaselgitamiseks kasutatava meetodi valideerimisel, ning mujal OECD riikides tehtud töödel.
|
KATSE PÕHIMÕTE
|
2.
|
Kahepaiksete metamorfoosi katse on sõeluuring, mis on ette nähtud selliste kemikaalide empiiriliseks kindlakstegemiseks, mis võivad takistada hüpotalamuse-ajuripatsi-kilpnäärme telje normaalset talitlust. Nimetatud katse kujutab endast üldistatud selgroogsete mudelit, kuivõrd see põhineb hüpotalamuse-ajuripatsi-kilpnäärme telje evolutsioonis konserveerunud struktuuridel ja funktsioonidel. See on oluline katse, kuna kahepaiksete metamorfoos on hästi uuritud ja kilpnäärmest sõltuv protsess, mis reageerib hüpotalamuse-ajuripatsi-kilpnäärme telge mõjutavatele kemikaalidele ja on ainus olemasolev meetod, millega saab uurida kilpnäärme aktiivsust looma morfoloogilise arengu käigus.
|
|
3.
|
Katse üldise korralduse kohaselt viiakse Xenopus laevis'e kullesed arengustaadiumis 51 kokkupuutesse uuritava kemikaali vähemalt kolme eri kontsentratsiooniga ja kontrolliks ka lahjendusveega 21 päeva jooksul. Iga kokkupuuteuuring tehakse nelja paralleelkatsega. Kulleste tihedus katse alustamise ajal on 20 kullest katseakvaariumi kohta iga katserühma puhul. Uuritavad näitajad on tagajäseme pikkus, vahemaa ninamikust kuni pärakuavani (snout to vent length, SVL), arengustaadium, märgkaal, kilpnäärme histoloogia ja igapäevased tähelepanekud surmajuhtumite kohta.
|
MEETODI KIRJELDUS
Katses kasutatav liik
|
4.
|
Xenopus laevis't kasvatatakse plaaniliselt kogu maailma laborites ja see liik on kaubanduslikult kergesti kättesaadav. Selle liigi esindajateesindajate paljunemist on kerge aastaringselt esile kutsuda inimese kooriongonadotropiini süstimisega ja saadavaid vastseid võib regulaarselt kasvatada valitud arengustaadiumideni suurtes kogustes, mis võimaldab kasutada konkreetse arengujärguga seotud katse-eeskirja. Katses on soovitatav kasutada vastseid, kes on saadud samas laboris elavatelt täiskasvanud konnadelt. Vähem soovitatava asendusvõimalusena võib katse tegemist kavandav labor tellida mune või looteid ja lasta neil aklimatiseeruda; vastse-järkudes noorloomade tellimine katses kasutamiseks on lubamatu.
|
Seadmed ja vajalikud vahendid
|
5.
|
Käesoleva katse tegemiseks on vaja järgmisi seadmeid ja vahendeid:
|
a)
|
süsteem kemikaaliga kokkupuutesse viimiseks (vt kirjeldus allpool);
|
|
b)
|
klaasist või roostevabast terasest akvaariumid (vt kirjeldus allpool);
|
|
d)
|
temperatuuri kontrollimise seade (nt jahutid või kütteseadmed, mis on reguleeritavad temperatuurile 22 ± 1 °C);
|
|
f)
|
binokulaarne lahkamismikroskoop;
|
|
g)
|
mikroskoobiga ühendatav digitaalne fotoaparaat vähemalt 4-megapikslise lahutusvõimega;
|
|
h)
|
kujutise digiteerimise tarkvara;
|
|
i)
|
Petri tass (nt 100 × 15 mm) või võrreldava suurusega läbipaistvast plastikust kamber;
|
|
j)
|
analüütiline kaal, millega on võimalik kaaluda kolme kümnendkoha (mg) täpsusega;
|
|
k)
|
lahustunud hapniku kontsentratsiooni mõõtja;
|
|
m)
|
valgustatuse mõõtja, mis võimaldab mõõta tulemust luksides;
|
|
n)
|
mitmesugused klaasist laborinõud ja muud vahendid;
|
|
o)
|
reguleeritavad pipetid (10–5 000 μl) või valik muid sama suurusvahemiku pipette;
|
|
p)
|
uuritav kemikaal piisavas koguses uuringu läbiviimiseks, eelistatavalt ühest partiist;
|
|
q)
|
analüüsivahendid, mis sobivad uuritava kemikaali määramiseks või leping analüüsiteenuste saamiseks.
|
|
Kemikaali uuritavus
|
6.
|
Kahepaiksete metamorfoosi katse põhineb veekaudse kokkupuute eeskirjal, mille puhul uuritav kemikaal viiakse katsekambritesse läbivoolusüsteemi kaudu. Läbivoolumeetoditega saab aga uurida ainult piiratud hulka kemikaalitüüpe, ja uuritavus oleneb kemikaali füüsikalis-keemilistest omadustest. Seepärast tuleb enne käesoleva eeskirja kasutamist koguda kemikaali kohta teavet, mis on vajalik tema uuritavuse kindlakstegemiseks, ning tutvuda OECD juhendiga, milles käsitletakse veekeskkonna jaoks mürgisuse määramist uurimisel raskusi valmistavate ainete ja segude (4) puhul. Omadused, mis näitavad, et kemikaali mõju veesüsteemides võib olla raske uurida: kõrge oktanooli-vee jaotuskoefitsient (log Kow), suur lenduvus, kalduvus hüdrolüüsiks, kalduvus fotolüüsiks tavalistes labori valgustustingimustes. Ka muud tegurid võivad olla asjakohased uuritavuse seisukohast ja neid tuleks määrata iga juhtumi puhul eraldi. Kui uuritavat kemikaali ei ole võimalik korralikult uurida läbivoolukatse süsteemis, võib kasutada staatilist uuendussüsteemi. Kui uuritavat kemikaali ei ole võimalik uurida kummagi süsteemi abil, siis tuleb loobuda selle uurimisest käesoleva eeskirja järgi.
|
Kokkupuutesüsteem
|
7.
|
Võimaluse korral tuleb eelistada läbivooluga lahjendussüsteemi staatilise uuendussüsteemi ees. Kui uuritava kemikaali füüsikalised või keemilised omadused ei sobi läbivooluga lahjendussüsteemi kasutamiseks, võib selle asemel kasutada muud kemikaaliga kokkupuute süsteemi (nt staatilist uuendussüsteemi). Süsteemi kõik veega kokkupuutuvad osad peaksid olema klaasist, roostevabast terasest või polütetrafluoroetüleenist. Kasutada võib ka sobivaid plastikuid, kui need ei kahjusta tulemuste usaldusväärsust. Kokkupuutenõudeks peaksid olema klaasist või roostevabast terasest akvaariumid, mis on varustatud püsttorudega, mis tagavad nõus oleva vee ligikaudse ruumala vahemikus 4,0–10,0 liitrit ja minimaalse veesügavuse 10–15 cm. Süsteem peaks võimaldama kasutada kõiki kokkupuutekontsentratsioone ja teha kontrollkatset, nelja paralleelkatsega iga doosirühma kohta. Voolukiirus igas nõus peaks olema konstantne, nii et oleks võimalik säilitada bioloogilisi tingimusi kui ka kemikaaliga kokkupuute tingimusi (nt 25 ml/min). Kokkupuutenõud tuleks kokkupuutesüsteemis kohtadele paigutada juhuvaliku alusel, et vähendada asukoha, sealhulgas temperatuuri, valgustuse intensiivsuse jm väikeste erinevuste võimalikku mõju. Kasutada tuleks luminofoorlampe ning valgustusperioodi 12 tundi valgust ja 12 tundi pimedust; valguse intensiivsus vee pinnal peab olema 600–2 000 luksi (luumen/m2). Igas katsenõus tuleks vesi hoida temperatuuril 22 ± 1 °C, pH vahemikus 6,5–8,5 ning lahustunud hapniku (DO) kontsentratsioon > 3,5 mg/l (> 40 % õhu küllastuskontsentratsioonist). Vee temperatuuri, pH-d ja lahustunud hapniku kontsentratsiooni tuleks mõõta vähemalt kord nädalas; temperatuuri tuleks eelistatavalt mõõta pidevalt vähemalt ühes katseanumas. 1. liites on kirjeldatud katsetingimusi, mida tuleks kasutada käesoleva eeskirja järgi katse tegemisel. Lisateavet läbivooluga kokkupuutesüsteemi ja/või staatilise uuendussüsteemi koostamise kohta võib leida katsejuhendis ASTM Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians (5) ja üldistes veekeskkonna suhtes mürgisuse määramise juhendites.
|
Vee kvaliteet
|
8.
|
Kasutada võib iga kohapeal kättesaadavat vett (nt allikavesi või aktiivsöel filtritud kraanivesi), mis võimaldab X. laevis'e kulleste normaalset kasvu ja arengut. Kuna kohaliku vee kvaliteet võib olenevalt asukohast oluliselt erineda, tuleb teha vee kvaliteedi analüüs, eriti juhul, kui puuduvad varasemad andmed selle vee kasutamise kohta Xenopus'e kasvatamiseks. Erilist tähelepanu tuleks pöörata sellele, et vesi ei sisaldaks vaske, kloori ja kloramiini, mis on konnade ja kulleste jaoks mürgised. Lisaks soovitatakse vees analüüsida (joogivee desinfitseerimise kõrvalsaaduste) fluoriidi, perkloraadi ja kloraadi sisaldust, kuna kõik need anioonid on kilpnäärmes joodi transportiva süsteemi substraadid ja nendest ükskõik millise kõrgem sisaldus muudab uuringu tulemuse mitte usaldatavaks. Analüüs tuleks teha enne katse algust ja katse ajal ei tohiks vees neid anioone tavaliselt olla.
|
Jodiidi kontsentratsioon katsevees
|
9.
|
Selleks et kilpnääre saaks sünteesida kilpnäärmehormoone, peab vastsele olema vee ja sööda kaudu kättesaadav piisav kogus jodiidi. Praegu ei ole empiirilisi suuniseid minimaalse jodiidi kontsentratsiooni kohta. Siiski võib jodiidi kättesaadavus mõjutada kilpnäärmesüsteemi reageerimisvõimet kilpnääret aktiveerivatele teguritele ja on teada, et see mõjutab kilpnäärme baasaktiivsust; see aspekt väärib tähelepanu kilpnäärme histopatoloogia alaste tulemuste tõlgendamisel. Seepärast tuleb katsearuandes ära märkida katseks kasutatud vees mõõdetud jodiidi kontsentratsioonid. Olemasolevate valideerimisuuringute tulemuste põhjal on käesolev eeskiri andnud häid tulemusi, kui jodiidi (I–) sisaldus katseks kasutatud vees oli vahemikus 0,5–10 μg/l. Ideaaljuhul peaks jodiidi kontsentratsioon katseks kasutatud vees olema vähemalt 0,5 μg/l. Kui katseks kasutatav vesi saadakse deioniseeritud veest kunstlikult, tuleks sellele lisada jodiidi minimaalses kontsentratsioonis 0,5 μg/l. Katsearuandesse tuleks märkida joodi või muude soolade täiendav lisamine katseks kasutatud vette.
|
Loomade pidamine
Täiskasvanute hooldus ja järglaste saamine
|
10.
|
Täiskasvanud konnade hooldamine ja nendelt järglaste saamine toimub vastavalt üldistele suunistele ja lugeja leiab selle kohta üksikasjalikuma teabe konnaloote teratogeneesi katse (Frog Embryo Teratogenesis Assay, FETAX) juhendist (6). Sellistes üldistes suunistes on esitatud näide sobivate hooldamis- ja järglaste saamise meetodite kohta, kuid ranget kinnipidamist neist suunistest ei nõuta. Paljunemise algatamiseks süstitakse kolmele kuni viiele täiskasvanud emas- ja isaslooma paarile inimese kooriongonadotropiini (hCG). Emas- ja isasisenditele süstitakse vastavalt ligikaudu 800–1 000 RÜd ja 600–800 RÜd hCG-d, mis on lahustatud 0,6–0,9 % soolalahuses. Paljunduspaare hoitakse suurtes nõudes, häirimata ja püsivates tingimustes, et esile kutsuda kopulatsiooni (ampleks). Igas paljundusnõus peaks olema roostevabast terasest või plastikvõrgust topeltpõhi, läbi mille munamassid kukuvad nõu põhjale. Hilisel pärastlõunal süstitud konnad koevad enamiku mune järgmise päeva hommikupoolikul. Kui on koetud ja viljastatud piisav kogus mune, eemaldatakse täiskasvanud isendid paljundusnõust.
|
Vastsete eest hoolitsemine ja vastsete valimine
|
11.
|
Pärast täiskasvanud isendite eemaldamist paljundusnõust kogutakse munad ja hinnatakse nende eluvõimet, kasutades esindavat loodete valikut kõikidest paljundusnõudest. Parim kudu (parimad kudud) (soovitatakse valida 2-3 kudu nende kvaliteedi hindamiseks) valitakse välja loodete elujõulisuse ja piisava arvu (vähemalt 1 500 loodet) põhjal ja tuleks säilitada. Kõik uuringus kasutatavad organismid peavad pärinema ühest kudemissündmusest (s.o kudusid ei tohi kokku segada). Looted viiakse üle suurele lamedale vaagnale või pannile ning kõik ilmselt surnud või ebanormaalsed munad (vt määratlus (5)) kõrvaldatakse pipeti või silmapipeti abil. Kõigi kolme kudu terved looted viiakse üle kolme eraldi koorumisnõusse. Neli päeva pärast koorumisnõusse üleviimist valitakse välja parim kudu, arvestades elujõulisust ja koorumise edukust, ning vastsed kantakse üle kasvatusnõudesse, mida võetakse vajalik arv ja milles temperatuur on 22 ± 1 °C. Lisaks võetakse veel täiendavaid vastseid lisanõudesse, et kasutada neid asendusmaterjalina, kui kasvatusnõudes peaks osa vastseid esimese nädala jooksul surema. Selliselt toimides hoitakse isendite tihedust ühtlasena ja sellega vähendatakse ühe kudu kohordis esinevaid arenguerinevusi. Kõiki kasvatusnõusid tuleb sifoonimisega iga päev puhastada. Ettevaatusabinõuna tuleb eelistatult kasutada vinüülist või nitriilkummist, mitte lateksist kindaid. Esimesel nädalal tuleks iga päev kõrvaldada surnud vastsed ja asendada need asendusvastsetega, et säilitada organismide tihedust. Vastseid tuleks sööta vähemalt kaks korda päevas.
|
|
12.
|
Kokkupuute-eelse etapi jooksul harjutatakse kulleseid tegeliku kokkupuuteetapi tingimustega nagu sööda liik, temperatuur, valguse ja pimeduse vaheldumise tsükkel ja kasvukeskkond. Seepärast on soovitatav, et sama kasvukeskkonna- ja lahjendusvett kasutataks nii kokkupuute-eelsel ajal kui ka kokkupuute ajal. Kui kulleste kasvatamiseks kokkupuute-eelsel etapil kasutatakse staatilist kasvatamissüsteemi, tuleks kasvukeskkond täielikult asendada vähemalt kaks korda nädalas. Tuleks vältida vastsete liigset tihedust kokkupuute-eelsel etapil, mis põhjustab „trügimist”, kuna sellised efektid võivad märgatavalt mõjutada kulleste arengut edasisel katseetapil. Seepärast ei tohiks kasvatamistihedus olla suurem kui ligikaudu neli kullest kasvukeskkonna liitri kohta (staatilise kokkupuutesüsteemi puhul) või kümme kullest kasvukeskkonna liitri kohta (kusjuures läbivoolu kiirus on näiteks 50 ml/min kokkupuute-eelsel etapil või kasvatamissüsteemis). Sellistes tingimustes peaksid kullesed arenema staadiumist 45/46 staadiumini 51 kaheteistkümne päevaga. Sellist põhipopulatsiooni esindavat kulleste valikut tuleks iga päev uurida arengustaadiumi määramiseks, et leida sobiv aeg kemikaaliga kokkupuute alustamiseks. Kullestele stressi ja traumade tekitamine, eriti nende ümbertõstmise, akvaariumi puhastamise ja vastsete käsitsemise ajal tuleb püüda viia miinimumini. Tuleb vältida stressi tekitavaid tingimusi, nagu vali ja/või lakkamatu müra, akvaariumile koputamine, akvaariumi vibreerimine, liigne askeldamine laboriruumis ja keskkonnatingimuste (valgustatus, temperatuur, pH, lahustunud hapniku sisaldus, vee voolukiirus, jne) järsud muutused. Kui kullesed ei jõua 17 päevaga pärast viljastamist staadiumini 51, tuleb üheks võimalikuks süüdlaseks pidada liigset stressi.
|
Vastsete kasvatamine ja söötmine
|
13.
|
Kulleseid söödetakse müügil oleva kullesesöödaga, mida kasutati valideerimisuuringus (vt ka 1. liide), kogu kokkupuute-eelsel ajal (pärast Nieuwkoopi ja Faberi (NF) staadiumi 45/46 (8)) ja kogu 21 päeva kestva katseperioodi jooksul; võib kasutada ka muud sööta, mille kohta on tõendatud, et kahepaiksete metamorfoosi katses annab see sama häid tulemusi. Kokkupuute-eelse perioodi söötmisrežiim tuleks hoolikalt kohandada vastavaks arenevate kulleste vajadustele. See tähendab, et vastkoorunud kullestele tuleb pakkuda väikseid söödakoguseid mitu (vähemalt kaks) korda päevas. Liigseid söödakoguseid tuleks vältida, et i) säilitada vee kvaliteeti ja ii), et vältida lõpusefiltrite ummistumist söödaosakeste ja detriidiga. Valideerimisuuringus kasutatud kullesesööda igapäevast kogust tuleks suurendada vastavalt kulleste kasvule kuni ligikaudu 30 mg-ni looma kohta päevas enne katse alustamist. Valideerimisuuringud on näidanud, et kõnealune müügil olev sööt tagab X. laevis'e kulleste korraliku kasvu ja arengu ning et see koosneb peentest osakestest, mis püsivad vees kaua aega hõljuvas olekus ning uhutakse lõpuks veevooluga nõust välja. Seepärast tuleks päevane söödakogus jagada väiksemateks osadeks, mida söödetakse kullestele vähemalt kaks korda päevas. Kõnealuse sööda kasutamise kord on esitatud tabelis 1. Söödetavad kogused tuleks registreerida. Sööta võib anda kuivana või valmistada lahjendamisveega põhilahus ja sööta sellega. Sellist põhilahust tuleks uuesti valmistada üle päeva ja muul kui kasutamise ajal hoitakse seda temperatuuril 4 °C.
Tabel 1.
Kahepaiksete metamorfoosi katse valideerimisuuringu elupuhuses järgus kasutatud X. laevis'e kulleste kaubandusliku sööda kasutamise kord läbivoolumeetodi tingimustes
|
Uuringu päev
|
Söödaratsioon (mg sööta looma kohta päevas)
|
|
0–4
|
30
|
|
5–7
|
40
|
|
8–10
|
50
|
|
11–14
|
70
|
|
15–21
|
80
|
|
Analüütiline keemia
|
14.
|
Enne uuringu tegemist tuleb hinnata uuritava kemikaali stabiilsust, kasutades olemasolevat teavet kemikaali lahustuvuse, lagundatavuse ja lenduvuse kohta. Igast paralleelkatsenõust tuleb igal kontsentratsioonil võtta proovid analüütilise keemia analüüside jaoks katse alustamise päeval (katse 0-päev) ja seejärel katse jooksul igal nädalal, et saada vähemalt neli proovi. Samuti on soovitatav analüüsida iga uuritavat kontsentratsiooni süsteemi ettevalmistamise ajal, enne katse alustamist, et kontrollida süsteemi toimimist. Lisaks on soovitatav analüüsida põhilahuseid, kui neid vahetatakse, eriti kui põhilahuse ruumala ei ole piisavalt suur, et tagada vajaliku kemikaalikoguse olemasolu keskkonnas kogu rutiinse proovivõtuperioodi kestel. Kui kemikaali ei ole võimalik määrata mõne katses kasutatava kontsentratsiooni või kõigi kontsentratsioonide juures, tuleb määrata kemikaali sisaldus põhilahustes ja registreerida süsteemi voolukiirused, et saaks arvutada nimikontsentratsioonid.
|
Kemikaali lisamine
|
15.
|
Meetod, mida kasutatakse uuritava kemikaali lisamiseks süsteemi, sõltub kemikaali füüsikalis-keemilistest omadustest. Vees lahustuvat kemikaali võib lahustada katsekeskkonna alikvootides, mis võimaldab kemikaali lisada uuritava kontsentratsiooni saavutamiseks läbivoolusüsteemis. Kui kemikaal on toatemperatuuril vedel ja vees halvasti lahustuv, saab seda lisada vedelik-vedeliku küllastusseadme meetoditega. Kui kemikaal on toatemperatuuril tahke ja vees halvasti lahustuv, saab seda lisada klaasvatt-täidisega küllastuskolonni abil (7). Parem oleks kasutada kandeaineta katsesüsteemi, kuid uuritavatel kemikaalidel on erinevad füüsikalis-keemilised omadused, mistõttu tõenäoliselt on vaja kasutada erinevaid meetodeid kemikaali viimiseks vette, milles korraldatakse kokkupuude kemikaaliga. Tuleks püüda toime tulla ilma lahustita või kandeaineta, kuna: i) teatavad lahustid võivad ise olla mürgised või avaldada ebasoovitavat või ootamatut endokrinoloogilist mõju, ii) kemikaalide uurimine kõrgemal kontsentratsioonil kui nende lahustuvus vees (nagu lahustite kasutamisel võib sageli juhtuda) võib põhjustada vigu tegeliku kontsentratsiooni määramisel ja iii) lahusti kasutamine pikaajalises katses võib põhjustada olulist biokilede tekkimist, mis on seotud mikroobide tegevusega. Raskusi valmistava kemikaali uurimisel võib lahustit kasutada viimase võimalusena ning tuleb arvesse võtta OECD juhendit raskesti uuritavate ainete ja segude veekeskkonna suhtes avalduva mürgisuse uurimise kohta (4), et teha kindlaks parim meetod. Lahusti valiku määravad kemikaali füüsikalis-keemilised omadused. Veekeskkonna suhtes avalduva mürgisuse uurimisel on edukalt kasutatud lahustina atsetooni, etanooli, metanooli, dimetüülformamiidi ja trietüleenglükooli. Kui kandeainena kasutatakse lahustit, peab lahusti kontsentratsioon olema tunduvalt allpool pikaajaliselt täheldatavat toimet mitteavaldavat kontsentratsiooni (NOEC); OECD juhenddokumendis soovitatakse kontsentratsiooni kuni 100 μl/l; hiljutises ülevaates (12) on soovitatud kasutada lahusti kontsentratsiooni 20 μl lahjendamiseks kasutatava vee 1 liitri kohta. Kui kandeainena kasutatakse lahustit, tuleks hinnata vastavaid lahusti kontrollkatseid, lisaks lahustivabadele kontrollkatsetele (puhas vesi). Kui uuritavat kemikaali ei ole võimalik vee kaudu manustada, kas kemikaali füüsikalis-keemiliste omaduste (madal lahustuvus) või piiratud kättesaadavuse tõttu, võib kaaluda kemikaali manustamist söödaga. Söödaga manustamise teel saavutatud kokkupuute kohta on tehtud eeltöid, kuid sellist kokkupuuteviisi tavaliselt ei kasutata. Meetodi valimine tuleks dokumenteerida ja seda tuleks analüüsi tegemisega kontrollida.
|
Uuritavate kontsentratsioonide valimine
Suurima uuritava kontsentratsiooni määramine
|
16.
|
Kõnealuse katse puhul peaks suurima uuritava kontsentratsiooni määrama uuritava kemikaali lahustuvuse piir, ägedat mürgitust põhjustava kemikaali korral suurim talutav kontsentratsioon või tuleks valida kontsentratsioon 100 mg/l, olenevalt sellest, milline neist on väikseim.
|
|
17.
|
Uuritava kemikaali suurim talutav kontsentratsioon on suurim kontsentratsioon, mille puhul suremus ägeda mürgituse tõttu on väiksem kui 10 %. Sellise lähenemisviisi kasutamiseks on vaja empiirilisi andmeid suremuse kohta ägeda mürgituse tagajärjel, millest saab hinnata suurima talutava kontsentratsiooni. Sellise kontsentratsiooni hindamine võib olla ebatäpne ja tavaliselt nõuab see professionaalseid teadmisi. Kuigi suurima talutava kontsentratsiooni määramiseks on tehniliselt võib-olla kõige õigem kasutada regressioonimudeleid, võib selle kontsentratsiooni hea lähenduse leida olemasolevatest andmetest ägeda mürgisuse kohta: võetakse 1/3 keskmise letaalse kontsentratsiooni LC50 väärtusest. Katses kasutatava liigi kohta ei tarvitse ägeda mürgisuse andmeid siiski olemas olla. Kui liigispetsiifilisi ägeda mürgisuse andmeid ei ole, võib teha 96-tunnise LC50 katse kullestega, kes on esindavad (st samas arengustaadiumis) kahepaiksete metamorfoosi katses kasutatavate kulleste suhtes. Kui on olemas andmed muude liikide (nt LC50 kalade või muu kahepaikseliigi) kohta, võib kasutada asjatundlikku hindamist, et liikidevahelise ekstrapolatsiooniga hinnata suurim talutav kontsentratsioon.
|
|
18.
|
Kui kemikaal ei ole akuutselt toksiline ja on lahustuv üle 100 mg/l, tuleks suurimaks katses kasutatavaks kontsentratsiooniks võtta 100 mg/l, kuna seda loetakse enamasti „praktiliselt mittetoksiliseks.”
|
|
19.
|
Kui läbivoolumeetodiga ei ole võimalik saavutada suurimat talutavat kontsentratsiooni, võib kasutada staatilist uuendussüsteemi, kuigi see ei ole soovitatav meetod. Kui kasutatakse staatilisi uuendamismeetodeid, tuleb dokumenteerida uuritava kemikaali kontsentratsiooni stabiilsus; kontsentratsioon peab püsima lubatava vea piirides. Uuendamise ajavahemikuks soovitatakse võtta 24 tundi. Uuendamise ajavahemik, mis on pikem kui 72 tundi, ei ole lubatav. Lisaks tuleks iga uuendamisajavahemiku lõpus vahetult enne uuendamist mõõta vee kvaliteedi näitajaid (nt lahustunud hapniku sisaldus, temperatuur, pH jne).
|
Uuritavate kontsentratsioonide vahemik
|
20.
|
On vaja vähemalt kolme uuritava aine kontsentratsiooni ja kontrollkatset puhta veega (ning kandeaine kontrollkatset, kui kandeaine on vajalik). Katses kasutatud suurima ja väikseima kontsentratsiooni minimaalne erinevus peaks olema umbes üks suurusjärk. Kasutatavate dooside suhe võib olla kuni 0,1 ja võib minimaalselt olla 0,33.
|
MÄÄRAMISE KÄIK
Katse alustamine ja läbiviimine
Nullpäev
|
21.
|
Kokkupuudet tuleks alustada siis, kui piisav arv kulleseid kokkupuute-eelses populatsioonis on jõudnud arengustaadiumi 51 vastavalt Nieuwkoopile ja Faberile (8) ja nende vanus on kuni 17 päeva pärast viljastamist. Katseloomade valimiseks võetakse põhipopulatsioonist terveid normaalse välimusega kulleseid ühte anumasse, milles on piisav kogus lahjendusvett. Arengustaadiumi määramiseks tuleks kulleseid ükshaaval võtta kogumisnõust väikse võrgu või võrkfiltriga ja kanda läbipaistvasse mõõtmiskambrisse (nt 100 millimeetrine Petri tass), milles on lahjendusvesi. Staadiumi määramisel on eelistatav mitte kasutada tuimastust, kuid ükshaaval võib kulleseid enne käitlemist tuimastada, kasutades trikaiinmetaansulfonaati (100 mg/l) (nt MS-222), mis on sobivalt puhverdatud naatriumvesinikkarbonaadiga (pH 7,0). Kui tuimastust (näiteks MS-222-ga) kasutatakse, tuleb selle meetodi korralik rakendamine omandada kogenud laboris ja seda tuleks kirjeldada katsetulemuste esitamise juures. Loomi tuleks selle ülekandmise ajal käidelda ettevaatlikult, et viia käitlemisest tingitud stress miinimumini ja vältida nende vigastamist.
|
|
22.
|
Looma arengustaadium määratakse kindlaks binokulaarse lahkamismikroskoobi abil. Arengustaadiumi lõpliku varieeruvuse vähendamiseks on oluline viia staadiumi määramine läbi võimalikult täpselt. Vastavalt Nieuwkoopile ja Faberile (8) on staadiumis 51 olevate loomade väljavalimisel esmatähtsaks arengunäitajaks tagajäseme morfoloogia. Tagajäseme morfoloogilisi näitajaid tuleks uurida mikroskoobi all. Kulleste arengustaadiumi kohta põhjaliku teabe saamiseks tuleks kasutada Nieuwkoopi ja Faberi juhendit (8), kuid staadiumi saab usaldatavalt ära määrata silmatorkavate morfoloogiliste tunnuste järgi. Arengustaadiumi määramise lihtsustamiseks ja standardimiseks kogu katse ajal võib kasutada järgmist tabelit, mille kohaselt määratakse silmatorkavad morfoloogilised tunnused, mis on seotud eri staadiumidega, kui eeldatakse normaalset arengut.
Tabel 2.
Silmatorkavad morfoloogilised tunnused arengustaadiumi määramiseks Nieuwkoopi ja Faberi juhendi järgi.
|
Silmatorkavad morfoloogilised tunnused
|
Arengustaadium
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Tagajäse
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Esijäse
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Kraniofatsiaalne struktuur
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Haistmisnärvi morfoloogia
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Saba pikkus
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
Katse alustamisel peaksid kõik kullesed olema staadiumis 51. Selle staadiumi kõige silmatorkavam morfoloogiline tunnus on tagajäseme morfoloogia, mis on näidatud joonisel 1.
Joonis 1.
Xenopus laevis'e kullese tagajäseme morfoloogia arengustaadiumis 51.

|
|
24.
|
Lisaks arengustaadiumi valikule võib katseloomi soovi korral valida veel suuruse järgi. Selleks tuleks nullpäeval mõõta keha kogupikkus (mitte vahemaa ninamikust pärakuavani) ligikaudu 20st kullesest koosneva alarühma jaoks, kes on Nieuwkoopi ja Faberi (NF) staadiumis 51. Pärast keskmise keha kogupikkuse arvutamist selle kulleste alarühma jaoks võib katseloomade kogupikkuse jaoks seada ülem- ja alampiiri vahemikus keskmine pikkus ± 3 mm (staadiumi 51 kulleste keskmine keha kogupikkus on vahemikus 24,0–28,1 mm ). Siiski määratakse iga katselooma küpsus katses osalemiseks peamiselt arengustaadiumi järgi. Kullesed, kellel esineb selgelt nähtavaid väärarendeid või vigastusi, tuleks katsest välja jätta.
|
|
25.
|
Kullesed, kes vastavad eespool kirjeldatud arengustaadiumi etapi kriteeriumidele, pannakse puhta kasvatamisveega nõusse, kuni staadiumi määramine on lõpule viidud. Kui staadiumide määramine on lõpetatud, jaotatakse kullesed juhuslikult uuritava kemikaaliga kokkupuute nõudesse, kuni igas nõus on 20 kullest. Iga kokkupuutenõu loomad vaadatakse seejärel üle ebanormaalse välimuse suhtes (näiteks vigastused, ebanormaalne ujumisviis, jne). Selgelt haiglase välimusega kullesed tuleks kokkupuutenõudest kõrvaldada ja asendada värskelt valitud kullestega kogumisnõust.
|
Vaatlused
|
26.
|
Põhjalikum teave katse lõpetamise korra ja kulleste töötlemise kohta on esitatud kahepaiksete kilpnäärme histoloogiat käsitlevas OECD juhenddokumendis (9).
|
7. päeval tehtavad mõõtmised
|
27.
|
Igast paralleelkatsenõust eemaldatakse 7. päeval viis juhuslikult valitud kullest. Kasutatav juhusliku valiku kord peaks tagama igale katseloomale ühesuguse tõenäosuse olla valitud. Seda on võimalik saavutada iga juhuvalikumeetodiga, kuid selle jaoks tuleb kõik kullesed püüda võrku. Valimata jäänud kullesed lastakse esialgsesse nõusse tagasi ja väljavalitud kullesed surmatakse humaanselt näiteks MS-222 lahuses kontsentratsiooniga 150–200 mg/l, mille pH on naatriumvesinikkarbonaadi juuresolekul viidud 7,0 juurde. Humaanselt surmatud kullesed loputatakse veega ja pühitakse kuivaks; seejärel määratakse kehamass milligrammi täpsusega. Iga kullese puhul määratakse tagajäseme pikkus, vahemaa ninamikust kuni pärakuavani ja (binokulaarse lahkamismikroskoobi abil) arengustaadium.
|
21. päeval tehtavad mõõtmised (katse lõpetamine)
|
28.
|
Katse lõpetamisel (21. päeval) eemaldatakse ülejäänud kullesed katsenõudest ja surmatakse humaanselt näiteks MS-222 lahuses (150–200 mg/l), mis on puhverdatud naatriumvesinikkarbonaadiga, nagu eespool kirjeldatud. Kullesed loputatakse veega ja pühitakse kuivaks; seejärel määratakse kehamass milligrammi täpsusega. Iga kullese puhul määratakse arengustaadium, vahemaa ninamikust kuni pärakuavani ja tagajäseme pikkus.
|
|
29.
|
Kõik vastsed paigutatakse Davidsoni fikseerimislahusesse 48–72 tunniks, kas kogukehaproovina või kärbitud, aga alalõuga sisaldava pea kudede proovina histoloogiliseks hindamiseks. Histopatoloogiliste uuringute jaoks valitakse kokku viis kullest igast paralleelkatsenõust. Kuna folliikulirakkude kõrgus sõltub arengustaadiumist (10), on histoloogiliseks analüüsiks kulleste valimisel kõige sobivam meetod kasutada alati samas staadiumis olevaid isendeid, kui see on võimalik. Samas arengustaadiumis isendite valimiseks tuleb enne nende väljavalimist ja andmete saamiseks ja säilitamiseks vajalikku edasist töötlemist määrata kõigi kulleste arengustaadium. See on vajalik, kuna arengus ilmneb normaalne divergents, mille tõttu igas paralleelkatsenõus tekib erinev jaotus arengustaadiumide järgi.
|
|
30.
|
Histopatoloogiliseks analüüsiks valitud loomi (n = 5 igast paralleelkatsenõust) tuleks võrrelda kontrollkatse (ühendatud paralleelkatsed) mediaanses arengustaadiumis olevate loomadega, kui see on võimalik. Kui paralleelkatsenõus on rohkem kui viis kullest sobivas staadiumis, valitakse viis kullest juhuvalikuga.
|
|
31.
|
Kui paralleelkatsenõus on vähem kui viis kullest sobivas staadiumis, võetakse lähimast madalamast või kõrgemast arengustaadiumist viis juhuslikult valitud kullest, et jõuda valimi üldsuuruseni viis kullest paralleelkatse kohta. Eelistatavalt tuleks otsus – võtta valimisse täiendavaid vastseid lähimast madalamast või kõrgemast arengustaadiumist – teha üldise hinnangu põhjal, milline on kulleste jaotus arengustaadiumide järgi kontrollkatsenõudes ja kemikaaliga kokkupuute uurimise nõudes. See tähendab, et kui kemikaaliga kokkupuude pidurdab arengut, peaksid täiendavad kullesed olema võetud lähimast madalamast staadiumist. Kui kemikaaliga kokkupuude aga kiirendab arengut, peaksid täiendavad kullesed olema võetud lähimast kõrgemast staadiumist.
|
|
32.
|
Kui kokkupuude uuritava kemikaaliga tekitab suuri muutusi kulleste arengus, ei tarvitse kemikaaliga kokkupuutesse viidud rühmadel olla arengustaadiumide jaotuse poolest kontrollkatse arvutatud mediaanse arengustaadiumiga kattuvust. Ainult sellistel juhtudel tuleks valimismeetodit muuta ja kasutada kontrollrühma mediaansest staadiumist erinevat arengustaadiumi, et saada arengustaadiumi järgi sobitatud proovid kulleste kilpnäärme histopatoloogia uurimiseks. Lisaks sellele, kui arengustaadiume ei saa määrata (nt asünkroonia tõttu), tuleks igast paralleelkatsenõust võtta juhuslikult viis kullest histoloogilise analüüsi jaoks. Aruandes tuleks selgitada, milliste põhimõtete alusel võeti valimisse kullesed, kes on muus arengustaadiumis kui kontrollrühma mediaanne arengustaadium.
|
Bioloogiliste näitajate määramine
|
33.
|
21-päevase kokkupuuteetapi ajal mõõdetakse tähtsamaid näitajaid 7. ja 21. päeval, kuid katseloomi on vaja jälgida iga päev. Tabelis 3 on antud ülevaade mõõdetavatest näitajatest ja vastavatest vaatlusaegadest. Üksikasjalikum teave, kuidas apikaalsete näitajate mõõtmisi ja histoloogilisi hindamisi tehniliselt teostatakse, on esitatud OECD juhenddokumendis (9).
Tabel 3.
Tähtsaimate näitajate määramise ajad kahepaiksete metamorfoosi katses.
|
Apikaalsed näitajad
|
Iga päev
|
7. päev
|
21. päev
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
vahemaa ninamikust kuni pärakuavani
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
|
|
|
ߦ
|
|
Apikaalsed näitajad
|
34.
|
Kahepaiksete metamorfoosi katse apikaalsed näitajad on arengustaadium, tagajäseme pikkus, ninamiku-pärakuava vahekaugus ja märgmass ning igaüht neist on lühidalt vaadeldud allpool. Täpsem tehniline lisateave neid näitajaid käsitlevate andmete kogumise ja arvuti abil analüüsimise kohta on esitatud viidatud juhenddokumentides, mida on soovitatav kasutada.
|
Arengustaadium
|
35.
|
X. laevis'e kulleste arengustaadium määratakse vastavalt Nieuwkoopi ja Faberi (8) esitatud arengustaadiumide määramise kriteeriumidele. Arengustaadiumi andmeid kasutatakse selleks, et teha kindlaks, kas areng on kiirenenud, muutunud asünkroonseks, aeglustunud või jäänud mõjutamata. Arengu kiirenemine või aeglustumine määratakse kindlaks kontrollrühma ja katserühmade kulleste saavutatud mediaanse arengustaadiumi võrdlemisel. Asünkroonse arenguga on tegemist siis, kui uuritud koed ei ole väärmoodustistega ega ebanormaalsed, kuid ühe kullese morfogeneesi suhteline ajastus või eri kudede arengu ajastus on häiritud.
|
Tagajäseme pikkus
|
36.
|
Kilpnäärmehormoonide kontrolli all olevad tagajäseme diferentseerumine ja kasv on peamised arengunäitajad, mida on juba kasutatud arengustaadiumi määramisel. Tagajäseme areng on arengustaadiumi määramisel kvalitatiivne näitaja, kuid siin vaadeldakse seda kvantitatiivse näitajana. Seepärast mõõdetakse tagajäseme pikkus kui näitaja, mis võimaldab kindlaks teha mõju kilpnäärmeteljele (joonis 2). Kooskõla tagamiseks mõõdetakse vasema tagajäseme pikkust. Tagajäseme pikkust hinnatakse nii katse 7. kui ka 21. päeval. 7. päeval mõõdetakse tagajäset lihtsalt, nagu on näidatud joonisel 2. 21. päeval on tagajäseme pikkuse mõõtmine aga keerulisem, kuna tagajäsemel on paindekohad. Seepärast tuleks tagajäseme pikkuse mõõtmisel 21. päeval alustada kehaseinast ja mõõta piki jäseme keskjoont, järgides kõiki jäseme kõverusi. Muutusi tagajäseme pikkuses 7. päeval, isegi kui neid ei ole 21. päeval, peetakse ikkagi oluliseks kilpnäärmele avalduva võimaliku mõju kindlakstegemisel. Pikkuse mõõtmise tulemused saadakse digifotolt, kasutades kujutise analüüsi tarkvara, mida on kirjeldatud OECD juhenddokumendis kahepaiksete kilpnäärme histoloogilise uuringu kohta (9).
|
Kehapikkus ja märgkaal
|
37.
|
Ninamiku-pärakuava vahekauguse (SVL) (joonis 2) ja märgmassi mõõtmine on võetud katse-eeskirja, et hinnata uuritava kemikaali võimalikku mõju kulleste kasvukiirusele, võrreldes kontrollrühmaga, ja see on kasulik uuritava kemikaali üldise mürgisuse tuvastamisel. Kuna vee eemaldamine kulleste kehamassi määramiseks võib kullestel tekitada stressi ja põhjustada nahavigastusi, tehakse need mõõtmised 7. päeval valitud kulleste alarühmas ja kõigi ülejäänud kulleste puhul katse lõpus (21. päev). Kooskõla huvides kasutatakse pärakuava koljupoolset serva sabapikkuse mõõtmisel piirina.
|
|
38.
|
Kulleste kasvu hindamiseks kasutatakse ninamiku-pärakuava vahekaugust (SVL), nagu on näidatud joonisel 2.
Joonis 2.
X. laevis'e kulleste kehapikkust iseloomustavad mõõtmised (A) ja tagajäseme pikkuse mõõtmine (B) (1).
|
Kilpnäärme histoloogia
|
39.
|
Kuigi arengustaadium ja tagajäseme pikkus on olulised näitajad, mille järgi hinnatakse kemikaaliga kokkupuutest tingitud muutusi metamorfilises arengus, ei saa arengu aeglustumist iseendast pidada kilpnäärmeaktiivsuse vastaseks diagnostiliseks indikaatoriks. Mõned muutused võivad olla nähtavad üksnes põhjaliku histopatoloogilise analüüsiga. Diagnostiliste kriteeriumide hulka kuuluvad kilpnäärme hüpertroofia/atroofia, folliikulirakkude hüpertroofia ja hüperplaasia ning täiendavate kvalitatiivsete kriteeriumidena: folliikuli valendiku ristlõikepindala, kolloidsus ja folliikulirakkude kõrgus ja kuju. Registreeritakse mõju olulisus (neli astet). Teave histoloogiliseks analüüsiks vajalike proovide saamise ja töötlemise ning koeproovide histoloogilise analüüsi kohta on esitatud juhenddokumentides „Amphibian Metamorphosis Assay: Part 1 – Technical guidance for morphologic sampling and histological preparation” ning „Amphibian Metamorphosis Assay: Part 2 – Approach to reading studies, diagnostic criteria, severity grading and atlas” (9). Labor, milles katset tehakse esimest korda (esimesi kordi), peaks pöörduma õppimiseks ja nõuannete saamiseks kogenud patoloogi poole, enne kui ta asub tegema histoloogilist analüüsi ja hindama kilpnääret. Apikaalsete näitajate ilmsed ja olulised muutused, mis näitavad arengu kiirendamist või asünkroonsust, võivad muuta kilpnäärme histopatoloogilise analüüsi mittevajalikuks. Selgete morfoloogiliste muutuste või arengupeetust näitavate tõendite puudumine tähendavad siiski, et on vaja teha histoloogiline analüüs.
|
Suremus
|
40.
|
Kõiki nõusid tuleb kontrollida iga päev surnud kulleste suhtes ja iga nõu kohta need numbrid registreeritakse. Iga surmajuhtumi kohta registreeritakse kuupäev, kemikaali kontsentratsioon ja nõu number. Surnud loomad tuleks katsenõudest kohe eemaldada, kui neid märgatakse. Suremuse määr üle 10 % võib osutada sobimatutele katsetingimustele või uuritava kemikaali mürgisusele.
|
Täiendavad tähelepanekud
|
41.
|
Ebanormaalse käitumise juhtumid ja selgelt nähtavad väärarendid ning kahjustused tuleks registreerida. Iga ebanormaalse käitumise juhtumi, selgelt nähtava väärarendi või kahjustuse kohta registreeritakse kuupäev, kemikaali kontsentratsioon ja nõu number. Normaalse käitumisega kullesed hõljuvad veesambas, saba peast kõrgemal, sabauim peksleb korrapäraselt kindlas rütmis, nad tõusevad aeg-ajalt pinnale, nende lõpusekatted liiguvad ja nad reageerivad ärritajatele. Ebanormaalse käitumise näideteks on pinnal hõljumine, nõu põhjas lebamine, ümberpööratud või ebakorrapärane ujumine, pinnale mittetõusmine ja ärritajatele mitte reageerimine. Lisaks tuleks protokollis registreerida suured erinevused sööda tarbimises eri kontsentratsiooniga katsenõudes. Olulisteks väärarenditeks ja kahjustusteks võivad olla morfoloogilised kõrvalekalded (näiteks deformeerunud jäsemed), hemorraagilised lesioonid, bakteri- või seennakkused, kui nimetada vaid mõnda. Sellised otsustused on kvalitatiivsed ja neid tuleks käsitleda kui haiguse või stressi kliinilisi tunnuseid võrdluses kontrollrühma loomadega. Kui selliste tunnuste esinemine või esinemismäär on kemikaaliga kokkupuute uurimise nõudes suurem kui kontrollrühmas, tuleks neid käsitada selge mürgisuse tunnustena.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Andmete kogumine
|
42.
|
Kõik andmed tuleks koguda elektrooniliste või käsitsi mõõtmise süsteemide abil, mis vastavad heale laboritavale. Uuringu andmed peavad hõlmama järgmist:
|
|
Uuritav kemikaal:
|
—
|
uuritava kemikaali iseloomustus: füüsikalis-keemilised omadused; teave stabiilsuse ja biolagunevuse kohta;
|
|
—
|
keemiline teave ja andmed: lahjenduste valmistamise meetod ja sagedus. Uuritavat kemikaali käsitlev teave hõlmab selle tegelikke ja nimikontsentratsioone ning mõnel juhul, kui see on asjakohane, ka teavet süsteemis tekkivate ühendite kontsentratsioonide kohta. Uuritavat kemikaali võib olla vajalik määrata nii põhilahuses kui ka uuritavates lahustes;
|
|
—
|
lahusti (kui kandeaine on muu kui vesi): lahusti valiku põhjendus ja lahusti omadused (nimetus, kasutatud lahusti kontsentratsioon);
|
|
|
|
Katsetingimused:
|
—
|
andmed katse läbiviimise kohta: need hõlmavad tähelepanekuid katsesüsteemi, toetava keskkonna ja taristu toimimise kohta. Tüüpilised andmed hõlmavad järgmist: ruumi temperatuur, katsenõude temperatuur, valgustusperiood, kokkupuutesüsteemi oluliste osade (nt pumbad, tsükliloendajad, rõhud) toimimine, voolukiirused, veetasemed, varulahusepudeli vahetamised ja andmed söötmise kohta. Üldised vee kvaliteedi näitajad on järgmised: pH, lahustunud hapniku sisaldus, elektrijuhtivus, joodi üldsisaldus, leelisus ja karedus;
|
|
—
|
kõrvalekalded katsemeetodist: selles osas tuleks esitada teave või selgitused kõigi katsemeetodist kõrvalekaldumiste kohta;
|
|
|
|
Tulemused:
|
—
|
bioloogilised tähelepanekud ja andmed: need hõlmavad iga päev tehtud tähelepanekuid surmajuhtumite, sööda tarbimise, ebanormaalse ujumise, letargia, tasakaalukaotuste, väärarendite, vigastuste jne kohta. Ettenähtud ajavahemike järel kogutavad tähelepanekud ja andmed hõlmavad järgmist: arengustaadium, tagajäseme pikkus, ninamiku-pärakuava vahekaugus ja märgkaal;
|
|
—
|
statistilise analüüsi meetodid ja kasutatud meetodite õigustus; statistilise analüüsi tulemused, eelistatavalt tabelitena;
|
|
—
|
histoloogilised andmed: need hõlmavad jutustavat kirjeldust, samuti konkreetseid tähelepanekuid, millele on omistatud raskusastme ja esinemissageduse hindepunktid, nagu on üksikasjalikult kirjeldatud histopatoloogia juhenddokumendis;
|
|
—
|
konkreetset juhtumit käsitlevad tähelepanekud: sellised tähelepanekud peaksid hõlmama jutustavat kirjeldust kõigest uuringu käigus nähtust, mis ei kuulu eespool kirjeldatud kategooriatesse.
|
|
|
Andmete esitamine
|
43.
|
Iga päev kogutavate andmete tabelid on esitatud 2. liites; neid võib kasutada lähteandmete sisestamise ja kokkuvõtvate statistiliste arvutuste tegemise suunisena. Lisaks on esitatud aruandetabelid, milles on mugav esitada määratavaid näitajaid käsitlevaid koondandmeid. 2. liites on esitatud ka histoloogilise hindamise aruandetabelid.
|
Uuringu kvaliteedi kriteeriumid ja uuringu vastuvõetavus/nõuetekohasus
|
44.
|
Üldiselt tähendavad suured kõrvalekalded katsemeetodist, et andmeid ei saa kasutada tõlgendamiseks ega katsearuandes esitamiseks. Seepärast on töötatud välja allpool tabelis 4 esitatud kriteeriumid, mis aitavad määrata tehtud uuringu kvaliteeti ja hinnata üldist katseloomade olukorda.
Tabel 4.
Kahepaiksete metamorfoosi katse kvaliteedi kriteeriumid
|
Kriteerium
|
Lubatavad piirid
|
|
Uuritava aine kontsentratsioonid katses
|
Katses mõõdetud kontsentratsiooni varieerumine (KV) püsib 21 päeva jooksul vahemikus ≤ 20 %
|
|
Suremus kontrollrühmades
|
≤ 10 % – kontrollrühma paralleelkatsetes ei tohiks suremus olla suurem kui 2 kullest rühma kohta
|
|
Kontrollrühmade minimaalne mediaanne arengustaadium katse lõpus
|
57
|
|
Kontrollrühma arengustaadiumide jaotus
|
Arengustaadiumide jaotuse 10. ja 90. protsentiil ei tohiks erineda rohkem kui 4 staadiumi võrra
|
|
Lahustunud hapniku kontsentratsioon
|
≥ 40 % õhu küllastuskontsentratsioonist (23)
|
|
pH
|
pH peaks olema hoitud vahemikus 6,5–8,5. Paralleelrühmade ja eri kontsentratsioonide rühmade nõudes ei tohi erinevus olla suurem kui 0,5.
|
|
Vee temperatuur
|
22 ± 1 °C. Paralleelrühmade ja eri kontsentratsioonide rühmade nõudes oleva vee temperatuuri erinevus ei tohi olla suurem kui 0,5 °C.
|
|
Katses kasutatud, ilma selge mürgisuseta kontsentratsioonide arv
|
≥ 2
|
|
Paralleelkatsete tulemused
|
Kuni 2 paralleelkatset kogu uuringu kohta võivad ebaõnnestuda
|
|
Eritingimused lahusti kasutamise korral
|
Kui kandeainena kasutatakse lahustit, tuleb teha nii lahusti kontrollkatsed kui ka kontrollkatsed puhta veega ja esitada tulemused
|
|
Statistiliselt olulisi erinevusi lahusti kontrolli ja vee kontrolli vahel töödeldakse eraldi. Vt allpool lisateave
|
|
Staatilise uuendussüsteemi eritingimused
|
Tuleb teatada esindavate keemiliste analüüside tulemused enne ja pärast uuendamist
|
|
Vahetult enne uuendamist tuleks mõõta ammoniaagisisaldust
|
|
Vahetult enne uuendamist tuleks mõõta kõik veekvaliteedi parameetrid, mis on loetletud 1. liite tabelis 1
|
|
Uuendamiste vahel ei tohiks olla rohkem kui 72 tundi
|
|
Sobiv söötmise ajakava (50 % igapäevasest söödaratsioonist peab olema kaubanduses leiduv kullesesööt)
|
|
Katse nõuetekohasus
|
45.
|
Katset võib pidada vastuvõetavaks ja nõuetekohaseks, kui on täidetud järgmised nõuded.
|
|
Katse, mille puhul otsustati, et mõju kilpnäärmele puudub, on nõuetekohane, kui:
|
(1)
|
igas kemikaaliga kokkupuute rühmas ja ka kontrollrühmas ei ületa suremus 10 %. Üheski paralleelkatses ei tohi suremus olla suurem kui kolm kullest, muidu loetakse paralleelkatse kehtetuks;
|
|
(2)
|
vähemalt kahel uuritava kemikaaliga kokkupuute kontsentratsioonil peavad kõik neli paralleelkatset olema õnnestunud ja analüüsiks kasutatavad;
|
|
(3)
|
vähemalt kaks uuritava kemikaaliga kokkupuute kontsentratsiooni, mis ei põhjusta selget mürgistust, peavad olema kasutatavad analüüsiks.
|
|
|
|
Katse, mille puhul otsustati, et kemikaal avaldab mõju kilpnäärmele, on nõuetekohane (kehtib), kui:
|
(1)
|
kontrollrühmades ei ületa suremus kahte kullest paralleelkatse kohta.
|
|
|
Otsustamisskeem kahepaiksete metamorfoosi katse puhul
|
46.
|
Otsustamisskeem kahepaiksete metamorfoosi katse jaoks töötati välja selleks, et see aitaks biokatset läbi viia ja selle tulemusi loogiliselt tõlgendada (vt skeem joonisel 3). Otsustamisskeemis tegelikult kaalutakse määratud näitajaid, kusjuures arengu kiirenemisele, asünkroonsele arengule ja kilpnäärme histopatoloogiale omistatakse suur kaal ning arengu aeglustumisele, ninamiku-päraku vahemaale ja keha märgkaalule, mida võib mõjutada kemikaali üldine mürgisus, omistatakse väiksem kaal.
Joonis 3.
Otsustamisskeem kahepaiksete metamorfoosi katse (KMK, ingl k. AMA) puhul

|
Kiirenenud areng (tehakse kindlaks arengustaadiumi, ninamiku-päraku vahemaa ja tagajäseme pikkuse alusel)
|
47.
|
Kiirenenud areng esineb teadaolevalt üksnes kilpnäärmehormoonidega seotud mõjude toimel. See võib olla mõju perifeersetele kudedele, mida põhjustab kilpnäärmehormooni otsene sidumine selle hormooni retseptorile (näiteks T4-le), või mõju, mis muudab kilpnäärmehormooni sisaldust veres. Kummalgi juhul peetakse seda piisavaks tõendiks, mis näitab, et kemikaal mõjutab kilpnääret. Kiirenenud arengut hinnatakse ühel meetodil kahest. Kõigepealt võib hinnata üldist arengustaadiumi, kasutades standardmeetodit, mida on üksikasjalikult kirjeldanud Nieuwkoop ja Faber (8). Teiseks võib arvuliselt väljendada konkreetseid morfoloogilisi omadusi nagu tagajäseme pikkus 7. ja 21. päeval, millel on positiivne korrelatsioon agonistliku mõjuga kilpnäärmehormooni retseptorile. Kui esineb statistiliselt oluline arengu kiirenemine või tagajäseme pikkuse suurenemine, siis näitab uuring, et kemikaal mõjutab kilpnääret.
|
|
48.
|
Katseloomade arengu kiirenemise hindamine, võrreldes kontrollrühma loomadega, toimub järgmise nelja näitaja statistilise analüüsi tulemuste põhjal:
|
—
|
tagajäseme pikkus (normeeritud ninamiku-päraku vahemaaga) uuringu 7. päeval;
|
|
—
|
tagajäseme pikkus (normeeritud ninamiku-päraku vahemaaga) uuringu 21. päeval;
|
|
—
|
arengustaadium uuringu 7. päeval;
|
|
—
|
arengustaadium uuringu 21. päeval.
|
|
|
49.
|
Tagajäseme pikkuse statistiline analüüs peab põhinema vasaku tagajäseme pikkuse mõõtmise tulemustel. Tagajäseme pikkus normeeritakse; selleks leitakse looma tagajäseme pikkuse ja ninamiku-päraku vahemaa suhtarv. Normeeritud väärtuste keskväärtusi iga kontsentratsioonitaseme juures võrreldakse omavahel. Arengu kiirenemist näitab tagajäseme (normeeritud) pikkuse keskväärtuse oluline suurenemine kemikaaliga kokkupuute rühmades, võrreldes kontrollrühma vastava näitajaga 7. ja/või 21. päeval (vt 3. liide).
|
|
50.
|
Arengustaadiumide statistiline analüüs peaks põhinema arengustaadiumi määramisel, lähtudes Nieuwkoopi ja Faberi (8) morfoloogilistest kriteeriumidest. Arengu kiirenemist näitab see, kui arengustaadiumi väärtuste multikvantaalse analüüsiga leitakse selle oluline suurenemine kemikaaliga kokkupuute rühmades, võrreldes kontrollrühma vastava näitajaga 7. ja/või 21. päeval.
|
|
51.
|
Kahepaiksete metamorfoosi katse puhul loetakse kas või ühelegi eespool nimetatud neljast näitajast avalduvat märkimisväärset mõju piisavaks tõendiks, et areng on kiirenenud. See tähendab, et olulist mõju tagajäseme pikkusele konkreetsel ajahetkel ei pea kinnitama oluline mõju tagajäseme pikkusele teisel ajahetkel ega oluline mõju arengustaadiumile samal ajahetkel. Teiselt poolt, olulist mõju arengustaadiumile konkreetsel ajahetkel ei pea kinnitama oluline mõju arengustaadiumile teisel ajahetkel ega oluline mõju tagajäseme pikkusele samal ajahetkel. Tõendusmaterjal kiirenenud arengu kohta muutub siiski kaalukamaks, kui oluline mõju tuvastatakse mitmele näitajale.
|
Asünkroonne areng (määratakse arengustaadiumide kriteeriumide põhjal)
|
52.
|
Asünkroonsele arengule on iseloomulik see, et ühe kullese morfogeneesi või eri kudede arengu suhteline ajastus on häiritud. Kui iga konkreetse staadiumi puhul tüüpiliseks peetavate morfoloogiliste näitajate komplekti abil ei ole võimalik selgelt kindlaks teha looma arengustaadiumi, näitab see, et koed arenevad metamorfoosi ajal asünkroonselt. Asünkroonne areng näitab, et kemikaal mõjutab kilpnääret. Ainsad asünkroonset arengut põhjustavad teadaolevad toimemehhanismid on kemikaalide mõju kilpnäärmehormoonide perifeersele mõjule ja/või kilpnäärmehormoonide metabolismile arenevates kudedes, nagu on täheldatud dejodinaasi inhibiitorite puhul.
|
|
53.
|
Asünkroonse arengu hindamine katseloomadel võrreldes kontrollrühmade loomadega põhineb üldisel morfoloogilisel hindamisel, mis toimub uuringu 7. ja 21. päeval.
|
|
54.
|
Nieuwkoopi ja Faberi esitatud Xenopus laevis'e normaalse arengu kirjeldus (8) määrab raamistiku, mille põhjal tehakse kindlaks normaalne kudede ümberkujunemise järjestus. Mõiste „asünkroonne areng” osutab konkreetselt sellistele kõrvalekalletele kullese üldises morfoloogilises arengus, mis ei võimalda arengustaadiumi kindlat määramist Nieuwkoopi ja Faberi (8) kriteeriumide alusel, kuna peamised morfoloogilised tunnused osutavad eri arengustaadiumidele.
|
|
55.
|
Nagu ütleb juba termin „asünkroonne areng”, tuleks siin vaadelda üksnes juhtumeid, kus konkreetsete kudede ümberkujunemise käigus esineb kõrvalekalle, võrreldes muude kudede ümberkujunemise käiguga. Mõned klassikalised välised avaldumisvormid on esijäsemete hilinenud moodustumine või moodustumata jäämine, vaatamata sellele, et tagajäsemed ja saba koed arenevad normaalselt või isegi kiiremini, või lõpuste enneaegne resorbeerumine, võrreldes tagajäseme morfogeneesi ja saba resorbeerumise staadiumiga. Looma areng loetakse asünkroonseks, kui talle ei saa omistada arengustaadiumi, kuna ta ei vasta enamikule olulistele Niewkoopi ja Faberi (8) staadiumide kriteeriumidele, või kui tal esineb ühe või mitme olulise tähtsusega tunnuse ilmumise suur hilinemine või kiirenemine (nt saba on täielikult resorbeerunud, kuid esijäsemeid ei ole tekkinud). See hindamine toimub kvalitatiivselt ja seejuures tuleks uurida kõiki Nieuwkoopi ja Faberi (8) loetletud olulisi arengutunnuseid. Siiski ei ole vaja registreerida uuritava looma iga olulise tunnuse arengustaadiumi. Kui loom tunnistatakse asünkroonse arenguga isendiks, siis talle Nieuwkoopi ja Faberi (8) järgi arengustaadiumi ei omistata.
|
|
56.
|
Seega keskne kriteerium, mille järgi ebanormaalse morfoloogilise arengu juhtumid tunnistatakse asünkroonse arengu juhtumiteks, on see, et kudede ümberkujunemise suhteline ajastus ja kudede morfogenees on häiritud, samas kui vastavate kudede morfoloogia ise ei ole selgelt ebanormaalne. Üks suurte morfoloogiliste kõrvalekallete sellist tõlgendust illustreeriv näide on see, et tagajäseme hilinenud morfogenees võrreldes muude kudede arenguga vastab asünkroonse arengu kriteeriumile; juhtumeid, kus tagajäsemed hoopis puuduvad, sõrmed on ebanormaalsed (nt mõni sõrm/varvas või selle osa puudub, esineb lisasõrmi/-varbaid), või muid ilmseid jäsemete väärarenguid ei loeta asünkroonseks arenguks.
|
|
57.
|
Peamised morfoloogilised tunnused, mille koordineeritud toimumist metamorfoosi ajal tuleb hinnata selles kontekstis, peaksid hõlmama tagajäseme morfogeneesi, esijäseme morfogeneesi, esijäseme ilmumist, saba resorbeerumise staadiumi (eelkõige sabauime resorbeerumist) ja pea morfoloogiat (näiteks lõpuste suurus ja resorptsiooni järk, alalõua morfoloogia, Meckeli kõhre esiletungimine).
|
|
58.
|
Olenevalt kemikaali toimest võib esineda mitmesuguseid suuri morfoloogilisi fenotüüpe. Mõned klassikalised välised avaldumisvormid (fenotüübid) on esijäsemete hilinenud moodustumine või puudumine, vaatamata sellele, et tagajäsemed ja saba koed arenevad normaalselt või isegi kiiremini, lõpuste enneaegne resorbeerumine, võrreldes tagajäseme ja saba ümberkujunemisega.
|
Histopatoloogia
|
59.
|
Kui kemikaal ei ole selgelt mürgine, ei kiirenda arengut ega põhjusta asünkroonset arengut, siis hinnatakse asjakohase juhenddokumendi (9) abil kilpnäärme histopatoloogiat. Arengu pidurdumine mürgisuse puudumise korral on selge märk kilpnäärmevastase toime kohta, kuid arengustaadiumide analüüsimine on vähem tundlik ja väiksema diagnostilise väärtusega kui kilpnäärme histopatoloogiline analüüs. Seepärast on sellisel juhul vaja teha kilpnäärme histopatoloogiline analüüs. Mõju kilpnäärme histoloogiale on tõendatud ka siis, kui mõju arengule ei leitud. Kui kilpnäärmes leitakse histopatoloogilisi muutusi, loetakse, et kemikaal mõjutab kilpnääret. Kui ei ole arengu aeglustumisi ega kilpnäärme histoloogilisi kahjustusi, siis loetakse, et kemikaal kilpnääret ei mõjuta. Sellise otsuse aluseks on asjaolu, et kilpnääre on teda stimuleeriva hormooni (thyroid stimulating hormone, TSH) mõju all ja iga kemikaal, mis muudab veres olevat kilpnäärmehormooni taset piisavalt, et muutuks TSH sekretsioon, põhjustab kilpnäärmes histopatoloogilisi muutusi. Kilpnäärmehormooni tase veres võib muutuda mitmesugusel viisil ja mitmesuguse toimemehhanismi kaudu. Seega, kilpnäärmehormooni tase veres küll näitab, et on olemas kilpnäärmega seotud mõju, kuid ei ole piisav selleks, et teha kindlaks, millise toimemehhanismi kaudu mõju avaldub.
|
|
60.
|
Kuna seda näitajat ei saa peamiste statistiliste lähenemisviiside alusel uurida, tehakse kemikaaliga kokkupuute poolt põhjustatud mõju kindlaks patoloogi eksperdiarvamuse abil.
|
Aeglustunud areng (tehakse kindlaks arengustaadiumi, tagajäseme pikkuse, kehamassi ja ninamiku-päraku vahemaa abil)
|
61.
|
Arengu aeglustumist võivad põhjustada kilpnäärmevastased mehhanismid ja ka kaudne mürgisus. Kerged arengupeetuse tunnused koos selge mürgisuse nähtudega näitavad, et tegemist on tõenäoliselt mittespetsiifilise mürgise toimega. Muu kui kilpnäärmega seotud mürgisuse hindamine on uuringu oluline osa, kuna sellega vähendatakse valepositiivsete tulemuste tõenäosust. Ülemäärane suremus näitab selgelt, et olulised on muud mürgisuse mehhanismid. Samuti tähendab kasvu kerge vähenemine, mis tehakse kindlaks märgkaalu ja/või ninamiku-päraku vahemaa kaudu, et tegemist on muu kui kilpnäärmele suunatud mürgisusega. Kasvu ilmset suurenemist täheldatakse sageli kemikaalide puhul, mis mõjutavad normaalset arengut negatiivselt. Järelikult ei tähenda suuremad loomad tingimata, et tegemist on muu kui kilpnäärmele suunatud mürgisusega. Kilpnäärmele suunatud mürgisuse määramisel ei tohiks kunagi toetuda üksnes kasvule. Kilpnäärmele suunatud mürgisuse määramisel tuleks pigem kasutada kasvu koos arengustaadiumi ja kilpnäärme histopatoloogiaga. Ilmse mürgisuse kindlakstegemisel tuleks kaaluda ka muid näitajaid nagu turse, hemorraagilised haavandid, letargia, vähenenud söödatarbimine, korrapäratu/muutunud ujumisviis jne. Kui kõikidel uuritavatel kontsentratsioonidel avalduvad selge mürgisuse nähud, tuleks kemikaali uurida madalama kontsentratsiooni juures, et teha järeldus selle kohta, kas kemikaal võib mõjuda kilpnäärmele või mitte.
|
|
62.
|
Statistiliselt oluline arengu pidurdumine muude selge mürgisuse nähtude puudumise korral näitab, et kemikaal mõjutab kilpnääret (on kilpnäärme antagonist). Tugevate statistiliste muutuste puudumise korral võivad seda järeldust toetada kilpnäärme histopatoloogia tulemused.
|
Statistilised analüüsid
|
63.
|
Andmete statistiline analüüs peaks eelistatavalt toimuma vastavalt korrale, mida on kirjeldatud dokumendis „Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application” (Ökotoksilisuse andmete statistilise analüüsi kaasaegsed meetodid. Rakendamisjuhend) (11). Kõikide pidevate kvantitatiivsete näitajate (tagajäseme pikkus, ninamiku-päraku vahemaa, märgkaal) puhul, kus doosi-toime sõltuvus on monotoonne, tuleks kemikaali olulise toime kindlakstegemiseks astmeliselt kohaldada Jonckheere'i-Terpstra testi.
|
|
64.
|
Pidevate näitajate puhul, kus doosi-toime sõltuvus ei ole monotoonne, tuleks andmeid hinnata normaaljaotuse seisukohast (soovitatavalt Shapiro-Wilki või Anderson-Darlingi testiga) ja dispersiooni homogeensuse seisukohast (soovitatavalt Levene'i testiga). Mõlemad testid tehakse ANOVA analüüsi jääkidega. Normaaljaotuse ja dispersiooni homogeensuse formaalsete testide asemel võib kasutada ka eksperthinnangut, kuid formaalseid teste tuleb eelistada. Kui selgub, et tegemist ei ole normaaljaotusega või dispersioon on heterogeenne, tuleks otsida normaliseeriv, dispersiooni stabiliseeriv teisendus. Kui andmed (võib-olla pärast teisendust) on normaaljaotusega ja dispersioon on homogeenne, leitakse oluline kemikaaliga kokkupuute mõju Dunnetti testiga. Kui andmed (võib-olla pärast teisendust) on normaaljaotusega, kuid dispersioon on heterogeenne, leitakse oluline kemikaaliga kokkupuute mõju Tamhane'i-Dunnetti või T3-testiga või Mann-Whitney-Wilcoxoni U-testiga. Kui ei õnnestu leida normaliseerivat teisendust, leitakse oluline kemikaaliga kokkupuute mõju Mann-Whitney-Wilcoxoni U-testiga, kasutades p-väärtuste kohandamist Bonferroni-Holmi järgi. Dunnetti testi kasutatakse sõltumatult ANOVA F-testist ja Mann-Whitney testi kasutatakse sõltumatult Kruskall-Wallise testist.
|
|
65.
|
Olulist suremust ei eeldata, kuid seda tuleks hinnata astmelise Cochran-Armitage'i testiga, kui andmed on kooskõlas doosi-toime vahelise monotoonse sõltuvusega; vastupidisel juhul tuleks teha Fisheri täpne test Bonferroni-Holmi kohandusega.
|
|
66.
|
Seda, kas kemikaaliga kokkupuude avaldab olulist mõju arengustaadiumile, kontrollitakse Jonckheere'i-Terpstra testi astmelise rakendamisega paralleelkatsete mediaanidele. Teise võimalusena ja eelistatavalt tuleks mõju kindlakstegemiseks kasutada multikvantaalset Jonckheere'i testi 20. kuni 80. protsentiilini, kuna selles võetakse arvesse jaotusprofiili muutusi.
|
|
67.
|
Sobiv analüüsiüksus on paralleelkatse, nii et andmed kujutavad endast paralleelkatsete mediaane, kui kasutatakse Jonckheere'i-Terpstra või Mann-Whitney U-testi või paralleelkatsete keskväärtusi, kui kasutatakse Dunnetti testi. Doosi-toime monotoonsust võib hinnata visuaalselt kokkupuute- ja paralleelrühmade keskväärtuste või mediaanide põhjal või formaalsete testidega, nagu on kirjeldatud eespool (11). Vähem kui viie paralleelkatse puhul ühe kokkupuutetaseme või kontrolli kohta tuleks kasutada Jonckheere'i-Terpstra ja Mann-Whitney testide täpse permutatsiooni versioone, kui need on kättesaadavad. Kõikide osutatud testide statistilist olulisust hinnatakse olulisusnivoo 0,05 juures.
|
|
68.
|
Joonisel 4 on esitatud pideva toime andmete statistiliste testide tegemise otsustamisskeem.
Joonis 4.
Pidevale toimele osutavate andmete statistiliste töötluste otsustamisskeem.

|
Konkreetsed kaalutlused andmete analüüsi puhul
Ebaõnnestunud kokkupuutetasemekatsete kasutamine
|
69.
|
Kui otsustatakse, et kas ühe paralleelkatse või terve kokkupuutetaseme puhul võib avalduda selge mürgisus ja see tuleks analüüsist kõrvale jätta, tuleb arvestada mitut tegurit. Selge mürgisus on määratletud rohkem kui kahe surmajuhtumiga ühes paralleelkatses, mida saab panna üksnes mürgisuse arvele ja mis ei saa olla tingitud tehnilisest veast. Muud selge mürgisuse nähud on järgmised: veritsemine, ebatavaline käitumine, ebatavaline ujumisviis, isutus ja muud kliinilised haigustunnused. Subletaalse mürgisuse puhul võib olla vajalik kvalitatiivne hindamine; selle tegemisel peaks alati olema aluseks võrdlemine puhta vee kontrollrühmaga.
|
Lahusti kontrollkatsed
|
70.
|
Lahusti kasutamist tuleks kaaluda ainult viimase abinõuna, kui kõik muud kemikaali lisamise võimalused on läbi vaadatud. Kui kasutatakse lahustit, tuleb samal ajal teha kontrollkatse puhta veega. Katse lõpetamisel tuleb hinnata lahusti võimalikku mõju. Seda tehakse lahusti kontrollrühma ja puhta vee kontrollrühma statistilise võrdlemisega. Kõige asjakohasemad näitajad, mida tuleks sellise analüüsi juures arvesse võtta, on arengustaadium, ninamiku-päraku vahekaugus ja märgkaal, kuna neid võib mõjutada muu kui kilpnäärmega seotud mürgisus. Kui nende näitajate vahel tuvastatakse statistiliselt olulisi erinevusi vee kontrollrühma ja lahusti kontrollrühma vahel, määratakse uuringu eesmärgiks olevad näitajad mõõdetud toime võrdlusest puhta vee kontrollrühmaga. Kui mõõdetud muutujate puhul puudub statistiliselt oluline erinevus puhta vee kontrollrühma ja lahusti kontrollrühma vahel, määratakse uuringu eesmärgiks olevad näitajad mõõdetud toime võrdlusest lahjendusvee ja lahusti kontrollrühmade ühendatud tulemustega.
|
Kokkupuude kemikaaliga rühmade puhul, kes jõuavad 60. või kõrgema arengustaadiumini
|
71.
|
Pärast 60. arengustaadiumi hakkab kulleste suurus ja mass vähenema kudede resorptsiooni ja absoluutse veesisalduse vähenemise tõttu. Märgkaalu ja ninamiku-päraku vahemaa mõõtmisi ei sobi seetõttu enam kasutada kasvukiiruste statistilises analüüsis. Seepärast tuleks märgkaalu ja pikkuse andmed selliste loomade puhul, kes jõuavad Nieuwkoopi ja Faberi arengustaadiumi üle 60, jätta välja; neid ei tohiks kasutada paralleelkatsete keskväärtuste või mediaanide analüüsis. Selliste kasvuga seotud näitajate analüüsil võib kasutada kahte erinevat lähenemisviisi.
|
|
72.
|
Üks lähenemisviis on võtta märgkaalu ja ninamiku-päraku vahemaa statistilistes analüüsides arvesse vaid kulleseid arengustaadiumiga kuni 60. Arvatakse, et see lähenemisviis annab piisavalt usaldusväärseid andmeid võimaliku mõju kohta kasvule, kui analüüsidest jäetakse välja üksnes väike osa (≤ 20 %) katseloomadest. Kui rohkem kulleseid (≥20 %) on ühel või mitmel nimikontsentratsioonil jõudnud arengus 60. staadiumist kaugemale, tuleks kõikide kulleste puhul kasutada kahefaktorilist ANOVAd, millesse on pesastatud dispersioonistruktuur, et hinnata kemikaaliga kokkupuutest tingitud mõju kasvule, võttes arvesse hiliste arengustaadiumide mõju kasvule. 3. liites on esitatud suunised massi ja pikkuse andmete kahefaktorilise ANOVA analüüsi tegemiseks.
|
KIRJANDUS
|
(1)
|
OECD (2004) Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 – Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 77, Paris.
|
|
(2)
|
OECD (2007) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 – Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 76. Paris
|
|
(3)
|
OECD (2008) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 92. Paris
|
|
(4)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris
|
|
(5)
|
ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729-96(2002), Philadelpia, PA
|
|
(6)
|
ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay – Xenopus (FETAX). E 1439-98
|
|
(7)
|
Kahl,M.D., Russom,C.L., DeFoe,D.L. & Hammermeister,D.E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, pp. 539-551
|
|
(8)
|
Nieuwkoop,P.D. & Faber,J. (1994) Normal Table of Xenopus laevis. Garland Publishing, New York
|
|
(9)
|
OECD (2007) Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 82. Paris
|
|
(10)
|
Dodd,M.H.I. & Dodd,J.M. (1976) Physiology of Amphibia. Lofts,B. (ed.), Academic Press, New York, pp. 467-599
|
|
(11)
|
OECD (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 54. Paris
|
|
(12)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp.69–92.
|
1. liide
Tabel 1.
Kahepaiksete metamorfoosi 21-päevase katse tingimused
|
Katseloomad
|
Xenopus laevis'e vastsed (kullesed)
|
|
Vastsete arengustaadium katse alguses
|
51. arengustaadium Nieuwkoopi ja Faberi järgi
|
|
Kokkupuuteaeg
|
21 päeva
|
|
Kulleste valiku kriteeriumid
|
Arengustaadium ja kogupikkus (valikuline)
|
|
Katses kasutatavad kontsentratsioonid
|
Vähemalt 3 kontsentratsiooni ligikaudu ühe suurusjärgu vahemikus
|
|
Kokkupuuterežiim
|
Läbivooluga (eelistatud) ja/või staatiline uuendussüsteem
|
|
Voolukiirus katsesüsteemis
|
25 ml/min (täielik koguse asendamine ligikaudu iga 2,7 tunni jooksul)
|
|
Peamised määratavad näitajad / määramise päev
|
Suremus
|
Iga päev
|
|
Arengustaadium
|
7. ja 21. päev
|
|
Tagajäseme pikkus
|
7. ja 21. päev
|
|
Vahemaa ninamikust kuni pärakuavani
|
7. ja 21. päev
|
|
Keha märgmass
|
7. ja 21. päev
|
|
Kilpnäärme histoloogia
|
21. päev
|
|
Lahjendamiseks kasutatav vesi / laboratoorne kontroll
|
Aktiivsöel filtrimisega kloorist puhastatud kraanivesi või muu samaväärne laboris kasutatav vesi
|
|
Kulleste tihedus
|
20 kullest katsenõus (5 kullest liitri kohta)
|
|
Uuritav lahus / katsenõu
|
4–10 l nõu (veekiht vähemalt 10–15 cm) / klaasist või roostevabast terasest nõu (nt 22,5 cm × 14 cm × 16,5 cm)
|
|
Paralleelkatsed
|
4 paralleelkatsetega katsenõu uuritava kontsentratsiooni ja kontrolli kohta
|
|
Lubatav suremuse määr kontrollrühmades
|
≤ 10 % igas paralleelkatsenõus
|
|
Kilpnäärme fikseerimine
|
Fikseeritavate kilpnäärmete arv
|
Kõik kullesed (algselt hinnatakse 5 kullest paralleelkatse kohta)
|
|
Piirkond
|
Pea või kogu keha
|
|
Fikseerimisvedelik
|
Davidsoni fikseerimislahus
|
|
Söötmine
|
Sööt
|
Sera Micron® või samaväärne
|
|
Kogus / sagedus
|
Vt tabel 1, kui kasutatakse sööta Sera Micron®
|
|
Valgustus
|
Valgustusperiood
|
12 tundi valgust – 12 tundi pimedust
|
|
Valgustuse intensiivsus
|
600 kuni 2 000 luksi (mõõdetuna vee pinnal)
|
|
Vee temperatuur
|
22 ± 1 °C
|
|
pH
|
6,5–8,5
|
|
Lahustunud hapniku sisaldus (DO)
|
> 3,5 mg/l (> 40 % õhu küllastuskontsentratsioonist)
|
|
Analüütilise keemia proovide võtmise ajakava
|
Üks kord nädalas (4 proovivõtmist katse kohta)
|
2. liide
Tabelid lähteandmete ja koondandmete esitamiseks
Tabel 1.
Üldine teave uuritava kemikaali kohta
|
Keemilised andmed
|
|
|
Sisestage uuritav kemikaal, kontsentratsiooni ühikud ja kokkupuutekontsentratsioonid
|
|
|
Uuritav kemikaal:
|
|
|
|
|
Kontsentratsiooni ühik:
|
|
|
|
|
Kokkupuutekontsentratsioon 1
|
|
|
|
|
Kokkupuutekontsentratsioon 2
|
|
|
|
|
Kokkupuutekontsentratsioon 3
|
|
|
|
|
Kokkupuutekontsentratsioon 4
|
|
|
|
|
|
|
|
|
|
Kuupäev (0-päev):
|
|
Märkida kuupäev (pp/kk/aa)
|
|
|
Kuupäev (7. päev):
|
|
Märkida kuupäev (pp/kk/aa)
|
|
|
Kuupäev (21. päev):
|
|
Märkida kuupäev (pp/kk/aa)
|
Tabel 2.
Tabelid lähteandmete kogumiseks 7. ja 21. päeval
|
PÄEV X
KUUPÄEV 00/00/00
|
|
|
Kontsentratsioon
|
Kokkupuuterühma number
|
Paralleelkatse number
|
Isendi number
|
Isendi tunnus
|
Arengustaadium
|
Ninamiku-pärakuava vahemaa (mm)
|
Tagajäseme pikkus (mm)
|
Kogu organismi märgmass (mg)
|
|
RIDA
|
TRT
|
TRT#
|
REP
|
IND
|
ID#
|
STAGE
|
BL
|
HLL
|
MASS
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Tabel 3.
Uuritavate näitajate 7. ja 21. päeva andmetest arvutatud koondtulemused
|
|
|
Arengustaadium
|
Ninamiku-pärakuava vahemaa (mm)
|
Tagajäseme pikkus (mm)
|
Mass (mg)
|
|
Konts.
|
Parall.
|
MIN
|
Mediaan
|
MAX
|
Keskmine
|
Std-hälve
|
Keskmine
|
Std-hälve
|
Keskmine
|
Std-hälve
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Märkus: arvutused lahtrites on seotud tabelisse 2 sisestatud andmetega.
|
Tabel 4.
Igapäevased suremuse andmed
|
Katsepäev
|
Kuupäev
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Arv paralleelkatses
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Arv kokkupuutetaseme kohta
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Märkus: arvutused lahtrites on seotud tabelisse 1 sisestatud andmetega.
|
Tabel 5.
Vee kvaliteedi kriteeriumid
Kokkupuutesüsteem (läbivooluga / staatiline uuendatav):
Temperatuur:
Valguse intensiivsus:
Valguse-pimeduse tsükkel:
Sööt:
Söötmismäär:
Vee pH
Joodi kontsentratsioon katsevees:
Tabel 6.
Keemiaandmete koondtabel
|
Kemikaali nimetus:
|
|
CASi nr:
|
|
Katsepäev
|
Kuupäev
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Märkus: arvutused lahtrites on seotud tabelisse 1 sisestatud andmetega.
|
Tabel 7.
Tabel histopatoloogiliste leidude esitamiseks põhikriteeriumide järgi
|
Kuup äev:
|
Keemiline aine:
|
|
|
Patoloog:
|
|
|
Kilpnäärme hüpertroofia
|
Kilpnäärme atroofia
|
Follikulaarrakkude hüpertroofia
|
Follikulaarrakkude hüperplaasia
|
|
Kilpnäärme hüpertroofia
|
Kilpnäärme atroofia
|
Follikulaarrakkude hüpertroofia
|
Follikulaarrakkude hüperplaasia
|
|
Kontroll-looma ID – paralleelkatse 1
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kontroll-looma ID – paralleelkatse 2
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kokku:
|
|
|
|
|
Kokku:
|
|
|
|
|
|
|
Kilpnäärme hüpertroofia
|
Kilpnäärme atroofia
|
Follikulaarrakkude hüpertroofia
|
Follikulaarrakkude hüperplaasia
|
|
|
Kilpnäärme hüpertroofia
|
Kilpnäärme atroofia
|
Follikulaarrakkude hüpertroofia
|
Follikulaarrakkude hüperplaasia
|
|
Doosilooma ID – paralleelkatse 1
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 2
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kokku:
|
|
|
|
|
Kokku:
|
|
|
|
|
Tabel 8.
Täiendavad histopatoloogilised kriteeriumid
|
Kuupäev:
|
Keemiline aine:
|
|
|
Patoloog:
|
|
|
|
|
|
|
|
|
Folliikulaarvalendiku ristlõikepindala suurenemine
|
Folliikulaarvalendiku ristlõikepindala vähenemine
|
Folliikulaarvalendiku ristlõikepindala suurenemine
|
Folliikulaarvalendiku ristlõikepindala vähenemine
|
|
Kontroll-looma ID – paralleelkatse 1
|
|
|
|
Doosilooma ID – paralleelkatse 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kontroll-looma ID – paralleelkatse 2
|
|
|
|
Doosilooma ID – paralleelkatse 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kokku:
|
|
|
Kokku:
|
|
|
|
|
Folliikulaarvalendiku ristlõikepindala suurenemine
|
Folliikulaarvalendiku ristlõikepindala vähenemine
|
|
|
Folliikulaarvalendiku ristlõikepindala suurenemine
|
Folliikulaarvalendiku ristlõikepindala vähenemine
|
|
Doosilooma ID – paralleelkatse 1
|
|
|
|
Doosilooma ID – paralleelkatse 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 2
|
|
|
|
Doosilooma ID – paralleelkatse 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kokku:
|
|
|
Kokku:
|
|
|
Tabel 9.
Histopatoloogiliste leidude jutustavad kirjeldused
|
Kuupäev:
|
|
Keemiline aine:
|
|
Patoloog:
|
|
|
Jutustav kirjeldus
|
|
Kontroll-looma ID – paralleelkatse 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kontroll-looma ID – paralleelkatse 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doosilooma ID – paralleelkatse 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabel 10.
Kahepaiksete metamorfoosi katse protokolli koondtabeli vorm päeva X jaoks (7. või 21. päev).
KV – mõõdetud kontsentratsiooni varieerumine
|
|
|
Kontroll
|
Doos 1
|
Doos 2
|
Doos 3
|
|
Näitaja
|
Paralleelkatse
|
Keskmine
|
St-hälve
|
KV
|
N
|
Keskmine
|
St-hälve
|
KV
|
N
|
p-väärtus
|
Keskmine
|
St-hälve
|
KV
|
N
|
p-väärtus
|
Keskmine
|
St-hälve
|
KV
|
N
|
p-väärtus
|
|
Tagajäseme pikkus
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Keskmine:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ninamiku-pärakuava vahemaa
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Keskmine:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Märgmass
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Keskmine:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabel 11.
Kahepaiksete metamorfoosi katse protokolli arengustaadiumi andmete koondtabeli vorm päeva X jaoks (7. või 21. päev)
|
|
|
Kontroll
|
Doos 1
|
Doos 2
|
Doos 3
|
|
|
Paralleelkatse
|
Mediaan
|
Minimaalne
|
Maksimaalne
|
N
|
Mediaan
|
Minimaalne
|
Maksimaalne
|
N
|
p-väärtus
|
Mediaan
|
Minimaalne
|
Maksimaalne
|
N
|
p-väärtus
|
Mediaan
|
Minimaalne
|
Maksimaalne
|
Mediaan
|
p-väärtus
|
|
Arengu-staadium
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Keskmine:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. liide
Massi ja pikkuse alternatiivne analüüs, kui hilisesse arengustaadiumi jõuab ühel või mitmel kontsentratsioonil üle 20 % kullestest
Kui paljud kullesed (≥ 20 %) on ühel või mitmel nominaalsel kontsentratsioonil jõudnud arengus kaugemale kui 60. staadiumini, tuleks kõikide kulleste puhul kasutada kahetegurilist ANOVAd, millesse on pesastatud dispersioonistruktuur, et hinnata kemikaaliga kokkupuutest tingitud mõjusid kasvule, võttes arvesse hiliste arengustaadiumide mõju kasvule.
Ettepanek on kasutada kõiki andmeid, kuid võtta arvesse hiliste arengustaadiumide mõju. Seda saab teha kahetegurilise pesastatud dispersioonistruktuuriga ANOVA abil. Muutuja LateStage väärtuseks võetakse JAH looma puhul, kelle arengustaadium on 61 või hilisem. Vastasel juhul võetakse LateStage väärtuseks EI. Seejärel saab teha kahetegurilise ANOVA, mille tegurid on kontsentratsioon ja LateStage ja nende vastastikune toime, milles Rep(Conc) on üks juhuslik tegur ja Kulles(REP) on teine juhuslik mõju. Sellega käsitletakse paralleelkatset (REP) analüüsi üksusena ja see annab sisuliselt sama tulemuse kui REP*latestage keskväärtuste kaalutud analüüs, milles kaaludena on kasutatud loomade arvu iga keskväärtuse kohta. Kui andmed on vastuolus ANOVA normaaljaotuse või dispersiooni homogeensuse nõuetega, võib teha normeeritud astakteisenduse selle takistuse kõrvaldamiseks.
Lisaks standardsele ANOVA F-testile kontsentratsiooni, LateStage'i ja nende vastastikuse toime mõju selgitamiseks, võib vastastikuse toime F-testi jagada kaheks täiendavaks ANOVA F-testiks, ühe võib teha toime keskväärtustega kõigi kontsentratsioonide puhul, kus LateStage = EI ja teise toime keskväärtustega kõigi kontsentratsioonide puhul, kus LateStage = JAH. Edasised kontsentratsioonirühmade keskmiste võrdlused kontrollrühmade keskmistega tehakse iga LateStage arengustaadiumi jaoks. Võib teha trendi leidmise tüüpi analüüsi, kasutades sobivaid kontraste, või lihtsalt paariviisi võrrelda, kui on tõendeid, et LateStage'i muutuja tasandil võib esineda mittemonotoonne doosi-toime sõltuvus. p-väärtuste kohandus Bonferroni-Holmi järgi tehakse ainult siis, kui vastav F-testi osa ei ole oluline. Seda saab teha statistikaprogrammi SAS ja tõenäoliselt ka muude tarkvarapakettide abil. Probleemid võivad tekkida siis, kui teatavate kontsentratsioonide puhul ei ole hilises arengujärgus loomi, kuid selliseid olukordi on lihtne lahendada.
4. liide
Mõisted
Kemikaal
– aine või segu.
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil.
C.39. HOOGHÄNNALISTE MULLAS PALJUNEMISE KATSE
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 232 (2009). Käesolev katsemeetod on kavandatud selleks, et hinnata kemikaalide mõju hooghännaliste sigivusele mullas. Selle aluseks on olemasolevad meetodid (1, 2). Neitsissigiv Folsomia candida ja suguliselt sigiv Folsomia fimetaria on kaks kõige kättesaadavamat hooghännaliste liiki; neid saab kasvatada ja need on kaubanduslikult kättesaadavad. Kui tuleb hinnata konkreetseid elupaiku, kus neid kaht liiki ei esine, saab käesolevat katse-eeskirja laiendada ka muudele hooghännaliste liikidele, kui need täidavad uuringu nõuetekohasuse kriteeriume.
|
|
2.
|
Mullas elavad hooghännalised on ökotoksikoloogiliste katsete puhul ökoloogiliselt asjakohased loomad. Hooghännalised on kuuejalgsed, kellel on õhuke eksoskelett, mis laseb kergesti läbi õhku ja vett; nad on lülijalgsed, kelle kemikaalidega kokkupuute tee ja määr on teistsugused kui vihmaussidel ja valgeliimuklastel.
|
|
3.
|
Hooghännaliste asustustihedus mullas ja lehekõdu kihtides ulatub paljudes maismaaökosüsteemides tavaliselt 105 isendini m2 kohta (3, 4). Täiskasvanud looma pikkus on tavaliselt 0,5–5 mm, nende panus pinnases elavate loomade summaarsesse biomassi ja hingamisse on madal, hinnanguliselt 1–5 % (5). Nende kõige olulisem osa võib seepärast seisneda mulla protsesside reguleerimises, kuna nad toituvad mikroobidest ja on mikrofauna röövloomad. Hooghännalised on saakloomad paljude mullas ja selle pinnal elavate selgrootute jaoks nagu lestad, sajajalgsed, ämblikud, jooksiklased ja lühitiiblased. Hooghännalised aitavad kaasa lagunemisprotsessidele happelises mullas, kus nad võivad osutuda kõige olulisemateks selgrootuteks valgeliimuklaste kõrval, kuna vihmausse ja tuhatjalgseid seal tavaliselt ei ole.
|
|
4.
|
F. fimetaria on levinud üle kogu maailma ja on tavaline mitmes mullatüübis liivmuldadest liivsavimuldadeni ja kõdumullast huumusmullani. See on silmadeta ja pigmendita hooghännaline. Teda on leitud põllumajanduslikust pinnasest kogu Euroopas (6). Ta on kõigesööja, sööb muu hulgas seeneniite, baktereid, algloomi ja detriiti. Toitumise kaudu puutub ta kokku taimede seenhaiguste tekitajatega (7) ja võib mõjutada seeneniidistikku, nagu on teada F. candida kohta. Nagu enamik hooghännalisi, paljuneb ta suguliselt, seepärast peavad alati kohal olema isasloomad munade viljastamiseks.
|
|
5.
|
Ka F. candida on levinud kogu maailmas. Kuigi ta ei ole tavaline enamikus looduslikest muldadest, esineb teda väga rohkearvuliselt huumusrikastes kohtades. See on silmadeta ja pigmendita hooghännaline. Tal on hästi arenenud furca (hüppamisorgan, hark), ta jookseb aktiivselt ja on häirimise korral kohe valmis hüppama. F. candida ökoloogiline roll on sarnane F. fimetaria omale, kuid tema elupaigaks on rohke orgaanilise aine sisaldusega muld. F. candida paljuneb neitsissigimisega. Isasloomi esineb harvemini kui üks tuhande kohta.
|
KATSE PÕHIMÕTE
|
6.
|
Sünkroonsed täiskasvanud (F. fimetaria) või noorjärgus (F. candida) hooghännalised viiakse kokkupuutesse uuritava kemikaali mitme kontsentratsiooniga; kemikaal on segatud kunstlikku pinnasesse (8), mille puhul kasutatakse 5 % orgaanilise aine sisaldust (või mingisse muusse pinnasesse). Katse käigu võib jagada kahte etappi:
|
—
|
doosipiirkonna määramise katse, kui ei ole piisavalt teavet mürgisuse kohta; katses määratakse kaks peamist näitajat, suremus ja paljunemine, mida hinnatakse pärast 2 nädalat F. fimetaria ja 3 nädalat F. candida puhul;
|
|
—
|
paljunemise põhikatse, millega hinnatakse vanemloomadest saadavate noorloomade arvu ja vanemate ellujäämist. Selle põhikatse kestus on 3 nädalat F. fimetaria või 4 nädalat F. candida puhul.
|
Uuritava kemikaali mürgised mõjud täiskasvanute suremusele ja sigivusele väljendatakse LCx ja ECx kujul, mille leidmiseks töödeldakse andmeid sobiva mittelineaarse regressiooniga, et leida kontsentratsioon, mis põhjustab loomadel x % isendite surma või sigivuse vähenemise x %, või alternatiivina NOEC/LOEC väärtusena (9).
|
ANDMED UURITAVA KEMIKAALI KOHTA
|
7.
|
Oleks hea eelnevalt teada uuritava kemikaali füüsikalisi omadusi, vees lahustuvust, log Kow väärtust, pinnases oleva vee ja pinnase vahel jaotumise koefitsienti ja aururõhku. Soovitatav oleks teada, mis juhtub uuritava kemikaaliga pinnases, näiteks fotolüüsi ja hüdrolüüsi ning biolagunemise kiirust. Protokolli tuleks kanda uuritava kemikaali keemiline nimetus IUPACi nomenklatuuri järgi, CASi number, partii, saadetis, struktuurivalem ja puhtus, kui need on kättesaadavad.
|
|
8.
|
Käesolevat katsemeetodit võib kasutada nii vees lahustuvate kui ka lahustumatute kemikaalide puhul. Uuritava kemikaaliga kokkupuutesse viimise meetod on kummalgi juhul siiski erinev. Katsemeetod ei ole kohaldatav lenduvatele kemikaalidele, s.t kemikaalidele, mille Henry konstant või õhu/vee jaotuskoefitsient on suurem kui 1, või kemikaalidele, mille aururõhk temperatuuril 25 °C on suurem kui 0,0133 Pa.
|
KATSE NÕUETEKOHASUS
|
9.
|
Järgmised kriteeriumid kemikaaliga mitte kokku puutunud kontrollrühmade puhul peaksid olema täidetud selleks, et katse tulemusi saaks lugeda nõuetekohaseks:
|
—
|
täiskasvanud isendite suremus ei ületa katse lõpuks 20 %;
|
|
—
|
noorte keskmine arv nõus peaks katse lõpus olema vähemalt 100;
|
|
—
|
noorloomade arvu jaoks arvutatud dispersioon peaks olema väiksem kui 30 % põhikatse lõpus.
|
|
VÕRDLUSKEMIKAAL
|
10.
|
Katse jaoks valitud mullatüübi puhul tuleks teha katseid võrdluskemikaaliga selle kontsentratsioonil EC50 kas korrapäraste ajavahemike järel või igas uuritava kemikaaliga tehtavas katses; sellega kontrollitakse, et katsesüsteemis reageerivad uuritavad loomad kemikaalile normaalselt. Sobiv võrdluskemikaal on boorhape, mis peaks kontsentratsioonil ligikaudu 100 mg mulla kuivmassi kg kohta (10, 11) vähendama mõlema liigi paljunemist 50 %.
|
KATSE KIRJELDUS
Katsenõud ja seadmed
|
11.
|
Sobiv katsenõu on selline, milles saab hoida 30 g niisket pinnast. Nõu materjal peab olema klaas või inertne plastik (mitte mürgine). Plastiknõude kasutamist tuleks siiski vältida, kui loomade kokkupuude uuritava kemikaaliga selles väheneb, kuna kemikaal sorbeerub nõule. Katsenõu ristlõike pindala peaks olema selline, et tegelik pinnase sügavus nõus on 2–4 cm. Nõud peaksid olema kaanega (nt klaasist või polüetüleenist), ning kaas peaks olema selline, mis vähendab vee aurustumist, kuid võimaldab gaaside vahetust pinnase ja õhu vahel. Nõu peaks olema vähemalt osaliselt läbipaistev, et sellesse pääseks valgus.
|
|
12.
|
Vaja on harilikku laborivarustust, eeskätt järgmisi vahendeid:
|
—
|
pH-meeter ja luksmeeter;
|
|
—
|
temperatuuri reguleerimiseks vajalik varustus;
|
|
—
|
asjakohased seadmed õhuniiskuse kontrolli all hoidmiseks (ei ole kohustuslikud, kui nõud on kaetud kaanega);
|
|
—
|
reguleeritava temperatuuriga inkubaator või väike ruum;
|
|
—
|
pintsetid või õhuvooluga töötav imemisseade.
|
|
Katses kasutatava pinnase ettevalmistamine
|
13.
|
Katses kasutatakse modifitseeritud tehismulda, mille orgaanilise aine sisaldus on 5 % (8). Teise võimalusena võib kasutada looduslikku mulda, kuna tehismuld ei sarnane loodusliku mullaga. Tehismulla soovitatav koostis on järgmine (väljendatud kuivmassina, kuivatatud 105 °C juures püsiva massini):
|
—
|
5 % Sphagnum-turvast, kuivatatud õhu käes ja peeneks jahvatatud (lubatud on osakese suurus 2 ± 1 mm);
|
|
—
|
20 % kaoliinsavi (kaoliniidisisaldus eelistatavalt üle 30 %);
|
|
—
|
ligikaudu 74 % õhukuiva tööstuslikku liiva (olenevalt vajalikust CaCO3 kogusest), valdavalt peen liiv, milles üle 50 % osakestest on vahemikus 50–200 mikronit. Liiva täpne kogus sõltub CaCO3 kogusest (vt allpool); kokku peaksid nad moodustama 75 %;
|
|
—
|
1,0 % kaltsiumkarbonaati (pulbriline CaCO3, analüütiliselt puhas), et viia pH vahemikku 6,0 ± 0,5; lisatava kaltsiumkarbonaadi kogus võib sõltuda peamiselt turba kvaliteedist ja laadist (vt märkus 1).
|
Märkus 1: vajalik CaCO3 kogus sõltub pinnase substraadi komponentidest ja see tuleks määrata eelinkubeeritud niiske pinnase osaproovide pH määramisega vahetult enne katset.
Märkus 2: soovitatav on mõõta pH ja soovi korral ka C/N suhe, katioonivahetuse mahtuvus (Cation Exchange Capacity, CEC) ja orgaanilise aine sisaldus pinnases, et võimaldada nende normaliseerimist hilisemas etapis ja tulemuste paremat tõlgendamist.
Märkus 3: vajaduse korral, näiteks eriotstarbelise katse korraldamisel, võib katses ja/või kasvusubstraadina kasutada ka looduslikku pinnast saastumata kohtadest. Kui kasutatakse looduslikku mulda, tuleb seda iseloomustada, esitada vähemalt päritolu (võtmise koht), pH, tekstuur (osakeste suurusjaotus), katioonivahetuse mahutavus (cation exchange capacity, CEC) ja orgaanilise aine sisaldus ning selles ei tohiks olla mingeid saasteaineid. Loodusliku mulla puhul on soovitatav näidata selle sobivust katse jaoks ja katse nõuetekohasuse kriteeriumide täitmist enne põhikatse tegemist.
|
|
14.
|
Mulla kuivad koostisosad segatakse põhjalikult (näiteks suuremahulises laborisegistis). Tehismulla maksimaalne veemahutavus määratakse 5. liites esitatud meetodiga. Katses kasutatava pinnase niiskusesisaldus tuleks optimeerida, et saavutada kohev poorne mulla struktuur, mis võimaldab hooghännalistel pooridesse siseneda. See on tavaliselt 40–60 % maksimaalsest veemahutavusest.
|
|
15.
|
Kuiv tehismuld tehakse 2–7 päeva enne katse alustamist niiskeks, et tasakaalustada/stabiliseerida happesust; selleks lisatakse piisav kogus deioniseeritud vett, et saada ligikaudu pool lõplikust veesisaldusest. pH määramiseks kasutatakse mulla ja 1 M kaaliumkloriidi (KCl) või 0,01 M kaltsiumkloriidi (CaCl2) lahuse segu suhtega 1:5 (vt 6. liide). Kui pinnas on nõutavast happelisem, võib seda reguleerida vajaliku koguse CaCO3 lisamisega. Kui pinnas on liiga aluseline, saab seda reguleerida mõne hooghännaliste jaoks kahjutu anorgaanilise happe lisamisega.
|
|
16.
|
Eelnevalt niisutatud muld jagatakse nii mitmeks osaks, kui palju on uuritavaid kemikaali (ja vajaduse korral võrdluskemikaali) kontsentratsioone ja kontrollrühmi, mida kasutatakse katses. Lisatakse uuritav kemikaal ja mulla niiskusesisaldus reguleeritakse vastavalt punktile 24.
|
Katsealuste loomade valimine ja ettevalmistamine
|
17.
|
Soovitatav liik on neitsissigiv hooghännaline F. candida, kuna käesoleva meetodi võrdleval katsetamisel eri laborites (11) vastasid ellujäämise tulemused selle liigi korral sagedamini nõuetekohasuse kriteeriumidele kui F. fimetaria puhul. Kui kasutatakse muud liiki, peaks see vastama punktis 9 esitatud nõuetekohasuse kriteeriumidele. Katse alguses peaksid katseloomad olema hästi söödetud ja nende vanus peaks olema vahemikus 23–26 päeva F. fimetaria ja 9–12 päeva F. candida puhul. Igas paralleelkatsenõus tuleks kasutada F. fimetaria puhul 10 isas- ja 10 emaslooma ning F. candida puhul 10 emaslooma (vt 2. ja 3. liide). Sünkroonsed loomad võetakse nõudest juhuvalikuga ning nende tervislikku ja füüsilist seisundit kontrollitakse iga paralleelkatsetes kasutatava partii puhul. Kõik 10 või 20 isendist koosnevad rühmad viiakse üle juhuslikkuse alusel valitud katseanumatesse ning suured F. fimetaria emasloomad valitakse selliselt, et neid saaks korralikult eristada F. fimetaria isasloomadest.
|
Uuritavate kontsentratsioonide valmistamine
|
18.
|
Uuritavat kemikaali võib manustada nelja meetodiga: 1) kemikaal segatakse pinnasesse, kasutades kandeainena vett, 2) kemikaal segatakse pinnasesse, kasutades kandeainena orgaanilist lahustit, 3) kemikaal segatakse pinnasesse, kasutades kandeainena liiva, või 4) kemikaal kantakse mulla pinnale. Sobiva meetodi valik sõltub kemikaali omadustest ja katse eesmärgist. Üldiselt soovitatakse uuritav kemikaal segada mulla sisse. Vajalik võib olla siiski eelistada sellist manustamisviisi, mis on kooskõlas uuritava kemikaali praktilise kasutamisega (näiteks vedelikvormi pihustamine või eriliste pestitsiidivormide, nagu graanulid või seemnete puhtimislahused, kasutamine). Pinnast töödeldakse enne hooghännaliste lisamist, välja arvatud juhul, kui uuritav kemikaal kantakse mulla pinnale – sel juhul tuleks hooghännalistel lasta enne tungida pinnasesse.
|
Vees lahustuv uuritav kemikaal
|
19.
|
Valmistatakse piisav kogus uuritava kemikaali lahust deioniseeritud vees, millest piisab ühe uuritava kontsentratsiooni kõikide paralleelkatsete loomiseks. Iga uuritava kemikaali lahust segatakse põhjalikult eelnevalt niisutatud mullaga, enne kui see viiakse katsenõusse.
|
Vees mittelahustuv uuritav kemikaal
|
20.
|
Kui kemikaal ei lahustu vees, kuid lahustub orgaanilistes lahustites, võib uuritava kemikaali lahustada sobiva lahusti (nt atsetooni) võimalikult väikses koguses, mis veel võimaldab lahuse korraliku segamise mullaga, ja segada see vajaliku kvartsliivakogusega. Tuleks kasutada üksnes lenduvaid lahusteid. Kui kasutatakse orgaanilist lahustit, tuleb kõikide uuritavate kontsentratsioonide ja täiendava lahusti negatiivse kontrolli puhul lisada ühesugune minimaalne kogus lahustit. Nõud, millesse lahusti abil viidi uuritav kemikaal, tuleb jätta teatavaks ajaks ilma katteta, et uuritava kemikaali lisamiseks kasutatud lahusti saaks auruda; tuleb tagada, et mürgine kemikaal ei lenduks selle ajaga.
|
Uuritav kemikaal, mis lahustub halvasti vees ja orgaanilistes lahustites
|
21.
|
Kui kemikaal lahustub halvasti vees ja orgaanilistes lahustites, segatakse uuritavat kemikaali kvartsliivaga, mis peaks olema osa pinnasesse lisatavast liivakogusest, et saada katseks vajalik kontsentratsioon. See kvartsliiva ja uuritava kemikaali segu lisatakse eelnevalt niisutatud mullale ning segatakse sellega põhjalikult läbi pärast sobiva niiskusesisalduse saamiseks vajaliku koguse deioniseeritud vee lisamist. Lõplik segu jaotatakse katsenõudesse. Sama protseduuri korratakse iga uuritava aine kontsentratsiooni puhul ja samuti asjakohase kontrolli valmistamisel.
|
Uuritava kemikaali kandmine mulla pinnale
|
22.
|
Kui uuritav kemikaal on pestitsiid, võib olla asjakohane kanda seda mulla pinnale pihustamise teel. Mulda töödeldakse pärast hooghännaliste lisamist. Katsenõud täidetakse kõigepealt niisutatud pinnasesubstraadiga, seejärel lisatakse katseloomad ja seejärel katsenõud kaalutakse. Selleks, et vältida loomade otsest kokkupuudet uuritava kemikaaliga, lisatakse viimane vähemalt pool tundi pärast hooghännaliste lisamist. Uuritav kemikaal tuleks kanda mulla pinnale võimalikult ühtlaselt, kasutades põllu töötlemise modelleerimiseks sobivat laboratoorset pihustusseadet. Pealekandmine peaks toimuma temperatuuridel, mille vahemik ei ületa ± 2 °C, ning vesilahuste, -emulsioonide või -dispersioonide puhul vee peale kandmise kiirusega, mis on kooskõlas riskihindamise soovitustega. Seda kiirust tuleks kontrollida, kasutades sobivat kaliibrimismeetodit. Erilisi pestitsiidivorme nagu graanulid või seemnete puhtimislahused tuleks peale kanda viisil, mis on kooskõlas põllumajandusliku kasutusega. Sööt lisatakse pärast pihustamist.
|
MÄÄRAMISE KÄIK
Katsetingimused
|
23.
|
Katse keskmine temperatuur peaks olema 20 ± 1 °C temperatuuri vahemikus 20 ± 2 °C. Katse tehakse kontrollitavate valgustustsüklite režiimis (eelistatavalt 12 tundi valgust ja 12 tundi pimedust), valgustatus katsenõude piirkonnas 400 kuni 800 luksi.
|
|
24.
|
Pinnase niiskuse kontrolli all hoidmiseks kaalutakse katsenõud katse alguses, keskel ja lõpus. Kaalu vähenemine > 2 % kompenseeritakse deioniseeritud vee lisamisega. Tuleb märkida, et veekadu saab vähendada kõrge õhuniiskuse sisaldusega (> 80 %) katseinkubaatoris.
|
|
25.
|
pH-d mõõdetakse nii doosipiirkonna leidmise katse kui ka põhikatse alguses ja lõpus. Mõõtmised tuleb teha ühe täiendava kontrollkatse ja ühe täiendava kemikaalikatse (kõik kontsentratsioonid) jaoks valmistatud pinnaseproovidega, mis on valmistatud ja mida säilitatakse samal viisil kui uuritava ainega katsetes, kuid millele hooghännalisi ei lisata.
|
Katse käik ja mõõtmised
|
26.
|
Iga uuritava kontsentratsiooni jaoks pannakse katsenõusse 30 g värsket uuritavat mulda. Samuti valmistatakse ette ka vee kontrollkatsed ilma uuritava kemikaalita. Kui uuritava kemikaali pealekandmiseks kasutatakse kandeainet, tuleks lisaks uuritava kemikaali seeriale teha ka üks kontrollseeria, mis sisaldab üksnes kandeainet. Lahusti või dispergaatori kasutamise korral peaks nende kontsentratsioon olema sama, mida kasutati uuritavat kemikaali sisaldavates nõudes.
|
|
27.
|
Hooghännaliste üksikisendid viiakse hoolikalt üle igasse katsenõusse (mille vahel nad jaotatakse juhuvaliku alusel) ja paigutatakse mulla pinnale. Loomakesi saab tõhusamalt üle kanda õhuvooluga, kasutades nõrgatoimelist imemisseadet. Iga uuritava kontsentratsiooni ja kontrollrühmaga tehtavate paralleelkatsete arv sõltub katse kavandamisest. Katsenõud paigutatakse inkubaatorisse juhuslikult ja need paigutatakse iga nädal uuesti juhuslikkuse alusel ümber.
|
|
28.
|
Igas F. fimetaria'ga tehtavas katses kasutatakse 20 täiskasvanut, 10 isas- ja 10 emaslooma (vanusega 23–26 päeva) katsenõu kohta. 21. päeval võetakse hooghännalised mullast välja ja loendatakse. Sünkroniseeritud loomade partiis eristatakse F. fimetaria isendeid soo järgi suuruse põhjal. Emasloomad on selgelt suuremad kui isasloomad (vt 3. liide).
|
|
29.
|
Kui katse tehakse F. candida'ga, tuleks kasutada kümmet 9–12 päeva vanust noorlooma katsenõu kohta. 28. päeval võetakse hooghännalised mullast välja ja loendatakse.
|
|
30.
|
Sobiva söödaallikana lisatakse katse alguses ja pärast umbes kahte nädalat igasse nõusse piisav kogus, nt 2–10 mg granuleeritud kuivatatud pagaripärmi, mida müüakse koduseks kasutamiseks.
|
|
31.
|
Katse lõpus hinnatakse suremust ja paljunemist. Kolme nädala (F. fimetaria) või nelja nädala (F. candida) pärast võetakse hooghännalised katses kasutatud mullast välja (vt 4. liide) ja loendatakse (12). Hooghännaline loetakse surnuks, kui teda ei ole väljavõetute hulgas. Loomakeste väljavõtmise ja loendamise meetodid peavad olema valideeritud. Valideeritud meetodi puhul on noorloomade väljavõtmise tõhusus üle 95 %; näiteks viiakse neid selle määramiseks pinnasesse loetud arv.
|
|
32.
|
Katse praktilise läbiviimise kokkuvõte ja ajakava on kirjeldatud 2. liites.
|
Katse kavandamine
Doosipiirkonna leidmise katse
|
33.
|
Vajaduse korral tehakse doosipiirkonna leidmise katse, näiteks uuritava kemikaali viie kontsentratsiooniga, 0,1, 1,0, 10, 100 ja 1 000 mg pinnase kuivmassi kg kohta, kasutades iga kokkupuutetaseme juures ja kontrollrühma puhul kaht paralleelkatset. Täiendav teave hooghännaliste suremuse või paljunemise kohta kas sarnaste kemikaalidega tehtud katsetest või kirjandusest võib aidata teha otsust doosipiirkonna määramise katses kasutatava kontsentratsioonivahemiku kohta.
|
|
34.
|
Doosipiirkonna määramise katse kestus on kaks nädalat F. fimetaria ja kolm nädalat F. candida puhul, et tagada ühe põlvkonna järglaste saamine. Katse lõpus hinnatakse hooghännaliste suremust ja paljunemist. Tuleb registreerida täiskasvanute ja noorloomade arv.
|
Põhikatse
|
35.
|
ECx (nt EC10, EC50) määramiseks tuleb teha katse 12 kontsentratsiooniga. Soovitatav on teha vähemalt kaks paralleelkatset iga uuritava kontsentratsiooni juures ja kuus paralleelkatset kontrollrühmaga. Kontsentratsioonide vahekaugused võivad olla mitmesugused, sõltuvalt doosi ja toime seosest.
|
|
36.
|
Täheldatavat toimet mitteavaldava kontsentratsiooni (NOEC) ja vähima täheldatavat toimet avaldava kontsentratsiooni (LOEC) leidmiseks tuleb kasutada vähemalt viit geomeetrilises reas olevat kontsentratsiooni. Soovitatav on teha neli paralleelkatset iga uuritava kontsentratsiooni juures ja lisaks kaheksa katset kontrollrühmaga. Kontsentratsioonide erinevused ei tohiks olla suuremad kui 1,8 korda.
|
|
37.
|
Kombineeritud lähenemisviis võimaldab määrata nii NOEC/LOEC kui ka ECx. Sellise kombineeritud lähenemisviisi puhul tuleks kasutada kaheksat kontsentratsiooni geomeetrilises jadas. Soovitatav on teha neli paralleelkatset iga uuritava kontsentratsiooni juures ja kaheksa katset kontrollrühmaga. Kontsentratsioonide erinevused ei tohiks olla suuremad kui 1,8 korda.
|
|
38.
|
Kui doosipiirkonna määramise katses ei täheldata mingit mõju suurimal kontsentratsioonil (st 1 000 mg/kg juures), võib teha paljunemise katse piirsisalduskatsena, kasutades uuritava aine kontsentratsiooni 1 000 mg/kg ja kontrollrühma. Piirsisalduskatse annab võimaluse näidata, et piirkontsentratsiooni juures ei ole statistiliselt märkimisväärset mõju. Tuleb teha kaheksa paralleelkatset nii kemikaaliga töödeldud mullaproovidega kui ka kontrollrühmadega.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Tulemuste töötlemine
|
39.
|
Sigivus on peamine näitaja (nt saadud noorloomade arv katsenõu kohta). Statistilises analüüsis, näiteks ANOVA arvutustes, võrreldakse kemikaaliga töödeldud rühmade tulemusi Studenti t-testi, Dunnetti testi või Williamsi testi abil. Üksikute kontsentratsioonitasemete keskväärtuste jaoks arvutatakse 95 % usaldusvahemikud.
|
|
40.
|
Ellujäänud täiskasvanud loomade arv kemikaaliga mõjutamata kontrollrühmades on üks peamisi katse nõuetekohasuse kriteeriume ja see tuleb dokumenteerida. Nagu doosipiirkonna määramise katse, nii ka põhikatse puhul tuleks lõpp-protokollis teatada ka kõik muud kahjulikkuse sümptomid.
|
LCx ja ECx
|
41.
|
ECx väärtused koos nendega seotud 95 % usaldusvahemiku ülemise ja alumise piiriga arvutatakse asjakohaste statistiliste meetoditega (nt logistiline või Weibulli funktsioon, kohandatud Spearman-Kärberi meetod või lihtne interpolatsioon). ECx saadakse leitud võrrandisse väärtuse sisestamisega, mis vastab x %-le kontrollrühma keskväärtusest. EC50 või mõne muu ECx arvutamiseks tuleb kõiki andmeid töödelda regressioonanalüüsiga. LC50 määratakse tavaliselt probitanalüüsi vms analüüsiga, milles võetakse arvesse suremusandmete binomiaaljaotust.
|
Täheldatavat toimet mitteavaldav kontsentratsioon (NOEC) / vähim täheldatavat toimet avaldav kontsentratsioon (LOEC)
|
42.
|
Kui statistilise analüüsi eesmärk on määrata NOEC/LOEC, siis on vaja statistikat iga nõu kohta (iga üksik nõu on paralleelkatse). Tuleb kasutada vastavaid statistilisi meetodeid vastavalt OECD dokumendile 54 „Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application” (Ökotoksilisuse andmete statistilise analüüsi kaasaegsed meetodid. Rakendamisjuhend) (9). Üldiselt otsitakse andmetest uuritava kemikaali negatiivset mõju võrreldes kontrollrühmaga, kasutades selleks ühepoolse hüpoteesi testimist p ≤ 0,05 juures.
|
|
43.
|
Normaaljaotuse olemasolu ja dispersiooni homogeensust võib kontrollida asjakohase statistilise testiga, nt Shapiro-Wilki testi ja Levene'i testiga (p ≤ 0,05). Võib teha ühesuunalise dispersioonanalüüsi (ANOVA) ja sellele järgnevad mitmese võrdluse testid. Mitmeseid võrdlusi (nt Dunnetti test) või sammuviisilise muutujate elimineerimise trendi teste (nt Williamsi test) saab kasutada selleks, et arvutada, kas esineb olulisi erinevusi (p ≤ 0,05) kontrollrühmade ja uuritava kemikaali eri kontsentratsioonide vahel (soovitatav test valitakse vastavalt OECD dokumendile nr 54 (9)). Teiselt poolt võib NOEC ja LOEC määramiseks kasutada mitteparameetrilisi meetodeid (nt Bonferroni U-testi vastavalt Holmi või Jonckheere'i-Terpstra trenditestile).
|
Piirsisalduskatse
|
44.
|
Kui tehakse piirsisalduskatse (kontrollrühma võrreldakse uuritava kemikaali üheainsa kontsentratsiooni rühmaga) ja parameetrilise testimismeetodi nõuded (normaalsus, homogeensus) on täidetud, võib meetrilisi reaktsioone hinnata Studenti testiga (t-test). Kui need nõuded ei ole täidetud, võib kasutada mittevõrdse hajumise t-testi (Welchi t-test) või mitteparameetrilist testi nagu Manni-Whitney U-test.
|
|
45.
|
Oluliste erinevuste kindlakstegemiseks kontrollrühmade (kontroll ja lahusti kontroll) vahel võib iga kontrollrühma paralleelkatseid töödelda nii, nagu on kirjeldatud piirsisalduskatse puhul. Kui nende testidega ei leita olulisi erinevusi, võib kontrolli ja lahusti kontrolli paralleelkatsed kokku panna. Vastasel korral tuleb kõiki kemikaaliga töödeldud rühmi võrrelda lahusti kontrolliga.
|
Katseprotokoll
|
46.
|
Katseprotokollis esitatakse vähemalt alljärgnev teave:
|
|
Uuritav kemikaal
|
—
|
uuritava kemikaali nimetus, partii, saadetise ja CASi number, puhtus;
|
|
—
|
uuritava kemikaali füüsikalis-keemilised omadused (nt log Kow, lahustuvus vees, aururõhk, Henry konstant (H)) ja eelistatavalt teave selle kohta, mis juhtub uuritava kemikaaliga mullas, kui see on teada;
|
|
—
|
kui katseid ei tehtud puhta kemikaaliga, tuleks täpsustada uuritava kemikaali koostis ja lisandid;
|
|
|
|
Katseloomad
|
—
|
liigi nimetus ja loomade tarnija, kasvatustingimuste kirjeldus ja vanusevahemik;
|
|
|
|
Katsetingimused
|
—
|
katseplaani ja läbiviimise kirjeldus;
|
|
—
|
katsepinnase valmistamise üksikasjad; kui kasutatakse looduslikku mulda, siis selle üksikasjalik kirjeldus (võtmiskoht, ajalugu, osakeste suurusjaotus, pH, orgaanilise aine sisaldus);
|
|
—
|
kirjeldus, millist meetodit kasutati uuritava kemikaali viimiseks pinnasesse;
|
|
—
|
katsetingimused: valguse intensiivsus, valgustustsüklite kestus, temperatuur;
|
|
—
|
söötmisrežiimi kirjeldus, sööda tüüp ja kogus, mida katses kasutati, söötmisajad;
|
|
—
|
mulla pH ja veesisaldus katse alguses ja lõpus (kontrollnõudes ja igal uuritud kontsentratsioonil);
|
|
—
|
loomakeste väljavõtmise meetodi üksikasjalik kirjeldus ja tõhusus;
|
|
|
|
Katsetulemused
|
—
|
noorloomade arv, mis määratakse igas katsenõus katse lõpus;
|
|
—
|
täiskasvanute arv ja nende suremus ( %) igas katsenõus katse lõpus;
|
|
—
|
ilmnenud füsioloogiliste või patoloogiliste sümptomite või selgete käitumise muutuste kirjeldus;
|
|
—
|
võrdluskemikaaliga saadud tulemused;
|
|
—
|
NOEC/LOEC, suremuse LCx ja paljunemise ECx väärtused (tavaliselt LC50, LC10, EC50 ja EC10) koos 95 % usaldusvahemikuga. Andmete kirjeldamiseks kasutatud mudeli graafik, selle võrrand ja sobitamisega leitud parameetrid (vt (9));
|
|
—
|
kogu teave ja vaatlused, mis aitaksid tõlgendada tulemusi.
|
|
—
|
kui testiti hüpoteesi, siis tegeliku testi võimsus (9);
|
|
—
|
kõrvalekalded käesolevast katsemeetodist ja kõik katse jooksul esinenud ebatavalised nähtused;
|
|
—
|
kui hinnati täheldatavat toimet mitteavaldavat kontsentratsiooni (NOEC), siis minimaalne tuvastatav erinevus.
|
|
|
KIRJANDUS
|
(1)
|
Wiles JA and Krogh PH (1998) Testing with the collembolans I. viridis, F. candida and F. fimetaria. In Handbook of soil invertebrate toxicity tests (ed. H Løkke and CAM Van Gestel), pp. 131-156. John Wiley & Sons, Ltd., Chichester
|
|
(2)
|
ISO (1999) Soil Quality – Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. No. 11267. International Organisation for Standardisation, Geneve
|
|
(3)
|
Burges A and Raw F (Eds) (1967) Soil Biology. Academic Press. London
|
|
(4)
|
Petersen H and Luxton M (1982) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287-388
|
|
(5)
|
Petersen H (1994) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111-118
|
|
(6)
|
Hopkin SP (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330pp (ISBN 0-19-854084-1)
|
|
(7)
|
Ulber B (1983) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In New trends in soil Biology (Lebrun Ph, André HM, De Medts A, Grégoire-Wibo, Wauthy G (Eds), Proceedings of the VI. international colloquium on soil zoology, Louvain-la-neuve (Belgium), 30 August-2 September 1982, I Dieu-Brichart, Ottignies-Louvain-la-Neuve, pp. 261-268
|
|
(8)
|
Käesoleva lisa peatükk C.36, „Röövlesta (Hypoaspis (Geolaelaps) aculeifer) sigivuse katse mullas”.
|
|
(9)
|
OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006)18, OECD Paris
|
|
(10)
|
Scott-Fordsmand JJ and Krogh PH (2005) Background report on prevalidation of an OECD springtail test guideline. Environmental Project Nr. 986. Miljøstyrelsen 61 pp. Danish Ministry for the Environment.
|
|
(11)
|
Krogh, P.H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danish Environmental Protection Agency, Environmental Project No. 1256, pp. 66.
|
|
(12)
|
Krogh PH, Johansen K and Holmstrup M (1998) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201-205
|
|
(13)
|
Fjellberg A (1980) Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
(14)
|
Edwards C.A. (1955) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan D.K. McE., Ed). Butterworths, London, pp. 412-416
|
|
(15)
|
Goto HE (1960) Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96:138-140.
|
1. liide
Mõisted
Käesolevas katsemeetodis on kasutatud järgmisi mõisteid (kõik mõjuga seotud kontsentratsioonid on väljendatud uuritava kemikaali massina katsepinnase kuivmassi kohta):
Kemikaal
– aine või segu.
NOEC (no observed effect concentration
– täheldatavat toimet mitteavaldav kontsentratsioon) – uuritava kemikaali kontsentratsioon, millel puudub täheldatav mõju. Käesoleva katsemeetodi puhul ei avalda NOEC-le vastav kontsentratsioon kontrollrühmaga võrreldes statistiliselt olulist (p < 0,05) täheldatavat toimet teatava kokkupuuteaja jooksul.
LOEC (
lowest observed effect concentration
– vähim täheldatavat toimet avaldav kontsentratsioon)
– uuritava kemikaali madalaim kontsentratsioon, millel on kontrollrühmaga võrreldes statistiliselt oluline mõju (p < 0,05) teatava kokkupuuteaja jooksul.
ECx (x % toimet avaldav kontsentratsioon)
– kontsentratsioon, mis põhjustab katseorganismidel kontrollrühmaga võrreldes x % toimest teatava kokkupuuteaja jooksul. Näiteks EC50 on hinnanguline kontsentratsioon, mis avaldab 50 % kemikaaliga kokkupuutesse viidud isendite puhul teatava kokkupuuteaja jooksul mõju, mida mõõdetakse katses määratava näitajaga.
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil.
2. liide
Hooghännaliste katse peamised toimingud ja ajakava
Katse etapid võib kokku võtta järgmiselt:
|
Aeg (päevad)
|
Toimingud
|
|
– 23 kuni – 26
|
Sünkroonse F. fimetaria kultuuri ettevalmistamine
|
|
– 14
|
Valmistatakse tehismuld (kuivade koostisosade kokkusegamine)
Kontrollitakse tehismulla pH-d ja viiakse see vajaliku väärtuseni
Mõõdetakse mulla maksimaalne veemahutavus
|
|
– 9 kuni – 12
|
Sünkroonse F. candida kultuuri ettevalmistamine
|
|
– 2 kuni – 7
|
Mulla eelnev niisutamine
|
|
– 1
|
Noorloomad jaotatakse partiidesse
Valmistatakse põhilahused ja lisatakse uuritav kemikaal, kui on vajalik lahusti kasutamine
|
|
0
|
Valmistatakse põhilahused ja lisatakse uuritav kemikaal, kui see on vaja lisada tahke kemikaalina, vesilahusena või kui see on vaja kanda pinnale.
Mõõdetakse mulla pH ja kaalutakse nõud.
Lisatakse sööt. Mullale kantakse hooghännalised.
|
|
14
|
Doosipiirkonna leidmise katse F. fimetaria puhul: lõpetatakse katse, võetakse loomad välja, mõõdetakse mulla pH ja veekadu (mass).
Põhikatsed: mõõdetakse niiskusesisaldus ja täiendatakse veega ning lisatakse 2–10 mg pärmi
|
|
21
|
F. fimetaria põhikatse: lõpetatakse katse, võetakse loomad välja, mõõdetakse mulla pH ja veekadu (mass).
Doosipiirkonna leidmise katse F. candida puhul: lõpetatakse katse, võetakse loomad välja, mõõdetakse mulla pH ja veekadu (mass).
|
|
28
|
F. candida põhikatse: lõpetatakse katse, võetakse loomad välja, mõõdetakse mulla pH ja veekadu (mass).
|
3. liide
F. fimetaria ja F. candida kasvatamise ja sünkroniseerimise juhised
Siinses juhendis esitatud aegu ja kestust tuleks kontrollida iga konkreetse hooghännalisetüvega, kuna on vaja tagada, et ajastamine võimaldaks saada piisavalt sünkroniseeritud noorloomad. Põhimõtteliselt määrab sobiva päeva munade ja sünkroonsete noorloomade kogumiseks munemise aeg pärast täiskasvanud loomade viimist värskesse substraati ja munade koorumiseni kuluv aeg.
Soovitatav on kasutada alalist tüvikultuuri, mis koosneb näiteks 50 nõust / Petri tassist. Tüvikultuuri hoitakse heas toitumuses iganädalase söötmise, kastmise ja vana sööda ja laipade kõrvaldamisega. Kui hooghännalisi on substraadil liiga vähe, võib see pärssida nende elutegevust liigse seente kasvu tõttu. Kui tüvikultuuri kasutatakse munade tootmiseks liiga sageli, võib kultuur väsida. Väsimuse tunnused on surnud täiskasvanud ja hallitus substraadil. Kultuuri noorendamiseks võib kasutada sünkroniseeritud loomade saamisest ülejäänud mune.
Sünkroonses kultuuris saab F. fimetaria isasloomi eristada emasloomadest peamiselt suuruse alusel. Isasloomad on emasloomadest selgelt väiksemad ja nende kõndimise kiirus on suurem kui emasloomadel. Õige valimine soo järgi nõuab vaid natuke harjutamist ja tulemust saab kontrollida suguelundipiirkonna vaatlemisega mikroskoobi all (13).
1. Kasvatamine
1.a. Kasvatamissubstraadi valmistamine
Kasvatamissubstraat on nn Pariisi krohv (kips ehk kaltsiumsulfaat) aktiivsöega. Need moodustavad kokku niiske substraadi, milles aktiivsöe ülesanne on siduda eralduvaid gaase ja väljaheiteid (14, 15). Hooghännaliste vaatlemise hõlbustamiseks võib kasutada mitmesuguseid aktiivsöe vorme. Näiteks F. candida ja F. fimetaria puhul kasutatakse pulbrilist aktiivsütt (mille tulemusel saadakse must/hall Pariisi krohv):
Substraadi koostisained:
|
—
|
200 ml destilleeritud vett,
|
või
|
—
|
50 g pulbrilist aktiivsütt,
|
|
—
|
260–300 ml destilleeritud vett,
|
Substraadisegul lastakse enne kasutamist seista.
1.b. Paljundamine
Hooghännalisi hoitakse sellistes nõudes nagu Petri tassid (90 mm × 13 mm), mille põhi on kaetud 0,5 cm paksuse kipsi-söe kihiga. Neid kasvatatakse 20 ± 1 °C juures ja valguse-pimeduse tsükkel on 12-12 tundi (400–800 luksi). Nõusid hoitakse alati niiskena ja tagatakse suhteline õhuniiskus nõudes 100 %. Seda saab tagada vaba vee olemasoluga poorses kipsis, kuid tuleb vältida veekihi tekkimist kipsi pinnal. Veekadu on võimalik vältida, kui ruumis tagatakse kõrge õhuniiskus. Kõik surnud isendid tuleks nõudest kõrvaldada, samuti hallitanud sööt. Munemise stimuleerimiseks on vaja viia täiskasvanud isendid üle Petri tassidesse, milles on kipsist ja aktiivsöest valmistatud värske substraat.
1.c. Sööda päritolu
Nii F. candida kui ka F fimetaria söödana kasutatakse granuleeritud kuivatatud pagaripärmi. Värsket sööta antakse üks või kaks korda nädalas, et vältida sööda hallitamist. Sööt pannakse väikse kuhjakesena otse kipsile. Lisatava pagaripärmi massi tuleb kohandada hooghännaliste populatsiooni suurusele; üldjuhul on piisav 2–15 mg.
2. Sünkroniseerimine
Katse tuleb teha sünkroniseeritud loomadega, et saada homogeensed katseloomad, kellel on üks ja sama arengustaadium ja suurus. Lisaks võimaldab sünkroniseerimine eristada F. fimetaria isas- ja emasloomi alates 3 nädala vanustest loomadest ja kasutada edaspidi soolist dimorfismi st suuruseerinevusi. Allpool esitatud toimimiskäik on ettepanek, kuidas saada sünkroniseeritud loomi (praktilised sammud ei ole kohustuslikud).
2.a. Sünkroniseerimine
|
—
|
Valmistage ette nõud, milles on 0,5 cm paksune kiht kipsi-söe substraati.
|
|
—
|
Munade saamiseks viige 150–200 täiskasvanud F. fimetaria isendit või 50–100 täiskasvanud F. candida isendit 15–20 parimast tüvikultuurinõust, milles on 4–8 nädala vanune substraat, ettevalmistatud nõudesse ja söödaks pange neile 15 mg pagaripärmi. Tuleks vältida noorloomade ülekandmist koos täiskasvanutega, kuna noorloomade juuresolek võib pidurdada munemist.
|
|
—
|
Hoidke kultuuri 20 ± 1 °C juures (keskmine peaks olema 20 °C) ja valguse-pimeduse tsükli juures 12-12 tundi (400–800 luksi). Hoolitsege selle eest, et värske sööt oleks kättesaadav ja õhk oleks veeauruga küllastunud. Sööda puudumisel võivad loomad roojata munade peale, mille tulemusel hakkab munadel kasvama hallitus, või F. candida võib hakata sööma oma mune. 10 päeva pärast koguge munad ettevaatlikult nõela ja spaatli abil ja viige üle nn munapaberile (väiksed filterpaberitükid, mis on kastetud kipsi-aktiivsöe kördisse), ja pange see nõusse, milles on värske kipsi-aktiivsöe- substraat. Lisage substraadile mõned terad pärmi, et noori juurde meelitada ja sundida neid lahkuma munapaberilt. Oluline on, et munapaber ja substraat oleksid niisked, muidu munad kuivavad ära. Teise võimalusena võib täiskasvanud loomad eemaldada sünkroniseerimiskultuuri nõudest pärast seda, kui nad on munenud 2 või 3 päeva.
|
|
—
|
Kolme päeva pärast on koorunud enamik munapaberil olevaid mune ja mõned noorloomad võivad olla juba munapaberi all.
|
|
—
|
Ühesuguse vanusega noorloomade saamiseks kõrvaldage munapaber koorumata munadega Petri tassist pintsettidega. Noorloomad vanusega 0–3 päeva jäävad Petri tassi ja neid söödetakse pagaripärmiga. Koorumata munad visake minema.
|
|
—
|
Hoolitsege munade ja koorunud noorloomade eest samuti kui täiskasvanud loomade eest. Eelkõige F. fimetaria puhul võtke järgmised meetmed: tagage piisav varustatus värske söödaga; kõrvaldage vana hallitanud sööt; ühe nädala pärast jagage noorloomad uutesse Petri tassidesse nii, et nende tihedus oleks üle 200 isendi tassi kohta.
|
2.b. Toimimine hooghännalistega katse alustamisel
|
—
|
9–12 päeva vanused F. candida või 23-26 päeva vanused F. fimetaria isendid kogutakse, näiteks vaakuumiga imemise abil, ning lastakse lahti väiksesse nõusse, milles on niiske kipsi-söe substraat, ja kontrollitakse nende füüsilist seisundit binokulaarmikroskoobiga (vigastuste või kahjustustega loomad visatakse ära). Kogu selle tegevuse vältel tuleb hooghännalisi hoida niiskes atmosfääris, et vältida kuivamisstressi; näiteks tehakse kõik pinnad veega märjaks jne.
|
|
—
|
Nõu pööratakse põhjaga ülespoole ja koputatakse sellele, et kanda hooghännalised üle pinnasele. Tuleks vältida staatilise elektri tekkimist, muidu võivad loomakesed õhku tõusta või kleepuda katsenõu seinale ja ära kuivada. Staatilise elektri neutraliseerimiseks võib kasutada ionisaatorit või märga lappi nõu all.
|
|
—
|
Sööt tuleks jaotada üle kogu mullapinna, et see ei oleks ühe klombina.
|
|
—
|
Nõude transportimise või katse ajal tuleks vältida nõudele koputamist või muud füüsilist häirimist, kuna selle tulemusel võib pinnas kokku vajuda ja see võib takistada hooghännaliste vahelisi toimeid.
|
3. Alternatiivsed hooghännaliseliigid
Käesoleva katsemeetodi järgi katsete tegemiseks võib valida ka muid hooghännaliseliike, nagu Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi, Mesaphorura macrochaeta. Enne muu liigi kasutamist peab olema täidetud rida eeltingimusi:
|
—
|
hooghännalised peavad olema üheselt ära määratud;
|
|
—
|
tuleb esitada muu liigi valimise põhjendus;
|
|
—
|
tuleb tagada, et katsetamisfaas hõlmab paljunemise bioloogiat, nii et see võiks olla kemikaaliga kokkupuute üks võimalikke sihtmärke;
|
|
—
|
nende elutsükli üksikasjad peaksid olema teada: küpseks saamise vanus, munade koorumiseks kuluv aeg ja arengujärk, milles loomad viiakse kokkupuutesse kemikaaliga;
|
|
—
|
katses kasutatava substraadi ja söödaga tuleks tagada nende jaoks optimaalsed kasvu ja paljunemise tingimused;
|
|
—
|
täpseks ja usaldusväärseks mürgisuse hindamiseks peaks variaablus olema piisavalt madal.
|
4. liide
Loomade väljavõtmine ja loendamine
1. Väljavõtmiseks võib kasutada kahte meetodit.
|
1.a.
|
Esimene meetod: võib kasutada MacFaydeni põhimõtete alusel töötavat kontrollitud temperatuurigradiendiga ekstraktorit (1). Väljavõtmiskasti ülaosas paikneb kütteelement, mille poolt antavat soojust reguleeritakse termistoriga, mis on pandud mullaproovi pinnale. Kogumisnõud ümbritseva jahutusvedeliku temperatuuri reguleeritakse termistoriga, mis on pandud kogumiskasti põhjale (pinnasekihi alla). Termistorid on ühendatud programmeeritava juhtimisplokiga, mis tõstab temperatuuri vastavalt programmis ettenähtud ajakavale. Loomad kogutakse jahutatud kogumiskasti (2 °C), mille põhjal on kipsi-aktiivsöe kiht. Väljavõtmist alustatakse 25 °C juures ja temperatuuri tõstetakse automaatselt iga 12 tunni jooksul 5 °C ja kokku kestab väljavõtmine 48 tundi. Pärast 12 tundi temperatuuril 40 °C on väljavõtmine lõppenud.
|
|
1.b.
|
Teine meetod: Pärast eksperimentaalset inkubatsiooniperioodi hinnatakse hooghännaliste noorloomade arvu flotatsiooniga. Sel eesmärgil tehakse katse nõudes, mille maht on ligikaudu 250 ml. Katse lõpus lisatakse umbes 200 ml destilleeritud vett. Pinnast segatakse ettevaatlikult peene värvipintsliga, et lasta hooghännalistel tõusta vee pinnale. Veele võib lisada väikse koguse, umbes 0,5 ml musta Kentmere'i fotovärvainet, et lihtsustada loendamist, suurendades kontrasti vee ja valgete hooghännaliste vahel. See värvaine ei ole hooghännaliste jaoks mürgine.
|
2. Loendamine
Loendada võib silma järgi või valgusmikroskoobiga, kasutades ujutamisnõu pinnale pandud võret, või iga nõu pinna fotografeerimisega; fotod võib hiljem hooghännaliste loendamiseks suurendatult välja trükkida või projekteerida slaididena. Loendada võib ka digitaalsete kujutiste töötlemise meetodiga (12). Kõik meetodid peaksid olema valideeritud.
5. liide
Mulla maksimaalse veemahutavuse määramine
On leitud, et sobiv on kasutada järgmist meetodit mulla maksimaalse veemahutavuse määramiseks. Seda on kirjeldatud standardi ISO DIS 11268-2 (Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction) (Mulla kvaliteet. Saasteainete mõju vihmaussidele (Eisenia fetida). 2. osa. Paljunemisvõimes avalduva mõju määramine) C lisas.
Võetakse teatav kindel kogus (nt 5 g) katses kasutatud pinnast, kasutades sobivat vahendit (tigupuuriga toru vms). Toru põhi kaetakse märja filterpaberiga ja pannakse siis vees olevale tugiraamile. Toru tuleks aeglaselt sukeldada vette, kuni veetase jõuab kõrgemale pinnaseproovi ülemisest osast. Seejärel tuleks see jätta vette ligikaudu kolmeks tunniks. Kuna mitte kogu mulla kapillaaridesse adsorbeerunud vesi ei jää sinna püsima, tuleks pinnaseproovil lasta nõrguda kaks tundi, hoides toru väga peeneks jahvatatud ja väga märjal kvartsliival, mis asub kaanega nõus (et vältida kuivamist). Seejärel tuleks proov kaaluda ja kuivatada konstantse massini 105 °C juures. Veemahutavus (VM) tuleks arvutada järgmiselt:

kus:
|
S
|
=
|
veega küllastunud substraat + toru mass + filterpaberi mass,
|
|
T
|
=
|
taara (toru mass + filterpaberi mass),
|
|
D
|
=
|
substraadi kuivmass.
|
6. liide
Mulla pH määramine
Järgmine meetod mulla pH määramiseks on esitatud standardis ISO DIS 10390: Soil Quality – Determination of pH (Mulla kvaliteet – pH määramine).
Kindlat kogust mulda kuivatatakse toatemperatuuril vähemalt 12 tundi. Seejärel valmistatakse mulla suspensioon (mis sisaldab vähemalt 5 grammi mulda), lisades mullale selle mahuga võrreldes vähemalt viiekordse koguse 1 M analüütiliselt puhta kaaliumkloriidi (KCl) või 0,01 M analüütiliselt puhta kaltsiumkloriidi (CaCl2) lahust. Suspensiooni loksutatakse seejärel tugevasti viis minutit ja jäetakse seejärel settima 2–24 tunniks. Seejärel mõõdetakse vedelfaasi pH pH-meetriga, mis on kaliibritud enne iga mõõtmist sobivate puhverlahustega (nt pH 4,0 ja 7,0).
C.40. SURUSÄÄSKLASTE (CHIRONOMIDAE) ELUTSÜKLI MÜRGISUSKATSE SÜSTEEMIS, MIS KOOSNEB RIKASTATUD SETTEST JA VEEST VÕI SETTEST JA RIKASTATUD VEEST
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 233 (2010). Katsejuhend on ette nähtud selleks, et hinnata kemikaaliga eluaegse kokkupuute mõju magevee kahetiivaliste liigile Chironomus sp.; katse hõlmab 1. põlvkonna (P-põlvkonna) kogu eluea ja 2. põlvkonna (F1-põlvkonna) elu varased järgud. Meetod täiendab olemasolevaid katsemeetodeid C.28 (1) ja C.27 (15); selles kasutatakse kas rikastatud (spaigitud) veega kokkupuudet või rikastatud settega kokkupuudet. Selles võetakse arvesse Chironomus riparius'e ja Chironomus dilutus'e (varasem nimetus C. tentans (2)) kohta olemasolevaid mürgisuse määramise katse-eeskirju, mis on koostatud Euroopas ja Põhja-Ameerikas (3, 4, 5, 6, 7, 8, 9) ning millele hiljem on tehtud laboritevahelised võrdluskatsed (1, 7, 10, 11, 12). Võib kasutada ka muid hästi dokumenteeritud surusääsklaste liike, näiteks Chironomus yoshimatsui'd (13, 14). Täielik kokkupuute kestus on umbes 44 päeva C. riparius'e ja C. yoshimatsui' puhul ning umbes 100 päeva C. dilutus'e puhul.
|
|
2.
|
Käesolevas katsemeetodis on kirjeldatud nii vee kaudu kui ka sette kaudu toimuvat kokkupuudet. Sobiva kokkupuutestsenaariumi valimine oleneb katse kavandatud eesmärgist. Vee kaudu kokkupuute stsenaarium, milles rikastatakse veesammast, peaks modelleerima pihustatud pestitsiidi triivimist ja hõlmab ka esialgset maksimaalset kontsentratsiooni pinnavees. Vee rikastamine on kasulik ka muud tüüpi kokkupuute (sh kemikaalilekke) modelleerimisel, kuid ei võimalda modelleerida katseperioodist pikemat kemikaali kogunemist settesse. Sel juhul ja samuti ka siis, kui sademevee äravool on pestitsiidi jaoks peamine veekogusse sattumise tee, võib rikastatud sete olla asjakohasem. Kui huvi pakuvad muud kokkupuuteviisid, võib katseplaani kergesti kohandada. Näiteks, kui uuritava kemikaali jaotumine vee ja settekihi vahel ei paku huvi ning adsorptsioon settele tuleks minimiseerida, siis võib kaaluda kunstliku asendussette (nt kvartsliiva) kasutamist.
|
|
3.
|
Kemikaalid, mille mõju põhjasetetes elavatele organismidele on vaja katsetada, võivad settes püsida pikka aega. Settes elavad organismid võivad kemikaaliga kokku puutuda mitmel viisil. Iga kokkupuutetee suhteline tähtsus ja aeg, mis on iga kokkupuutetee puhul vajalik üldisse mürgisusse panuse andmiseks, sõltub kõnealuse kemikaali füüsikalis-keemilistest omadustest. Tugevasti adsorbeeruvate kemikaalide või settega kovalentseid sidemeid moodustavate kemikaalide puhul võib tähtis kokkupuutetee olla saastunud sööda allaneelamine. Väga lipofiilsete kemikaalide mürgisuse alahindamise vältimiseks võib kaaluda settele sööda lisamist enne uuritava kemikaali kasutamist (vt punkt 31). Seega on võimalik hõlmata kõik kokkupuuteviisid ja kõikidel eluetappidel.
|
|
4.
|
Mõõdetavad näitajad on järgmised: väljaarenenud täiskasvanute arv (nii 1. kui ka 2. põlvkonna puhul), arengu kiirus (nii 1. kui ka 2. põlvkonna puhul), täielikult arenenud ja elusate täiskasvanute sooline jaotumine (nii 1. kui ka 2. põlvkonna puhul), munanööride arv emassääse kohta (ainult 1. põlvkond) ja munanööride viljakus (ainult 1. põlvkond).
|
|
5.
|
Tungivalt soovitatakse kasutada spetsiaalselt koostatud setet. Spetsiaalselt koostatud settel on loodusliku sette ees mitmeid eeliseid:
|
—
|
väheneb katsete hajuvus, kuna nii saadakse reprodutseeritav standardiseeritud maatriks ja kõrvaldatakse vajadus saastumata ja puhta setteallika leidmiseks;
|
|
—
|
katseid võib alustada ükskõik millal, ei tule arvestada katse setete hooajalist muutlikkust ja setet ei ole vaja eeltöödelda kohaliku fauna kõrvaldamiseks;
|
|
—
|
vähenevad kulud, võrreldes korrapärase töö jaoks vajalike piisavate settekoguste hankimisega välitingimustes;
|
|
—
|
spetsiaalselt koostatud sete võimaldab võrrelda erinevaid mürgisuse uuringuid ja järjestada kemikaale mürgisuse järgi (3).
|
|
|
6.
|
Kasutatud mõisted on esitatud 1. liites.
|
KATSE PÕHIMÕTE
|
7.
|
Kõigepealt puutuvad surusääsklaste esimese kasvujärgu vastsed kokku sette-vee süsteemis teatavas kontsentratsioonivahemikus oleva uuritava kemikaaliga. Katse alguses pannakse esimese kasvujärgu vastsed (1. põlvkond) katsenõudesse, mis sisaldavad rikastatud setet või teise võimalusena rikastatakse uuritava kemikaaliga vett pärast vastsete lisamist. Hinnatakse surusääskede väljaarenemist, selleni kuluvat aega ning täielikult arenenud ja elusate sääskede soolist jaotumist. Väljaarenenud valmikud viiakse üle paljunduspuuridesse, et võimaldada neil parve koguneda, paarituda ja muneda. Hinnatakse munetud munanööride arvu ja nende viljakust. Kõnealustest munanööridest saadakse 2. põlvkonna esimese kasvujärgu vastsed. Need vastsed pannakse värskelt ettevalmistatud katsenõudesse (rikastamine kemikaaliga nagu 1. põlvkonna puhul) et määrata 2. põlvkonna elujõulisus, mille jaoks hinnatakse nende väljaarenemist, selleni kuluvat aega ja täielikult arenenude ja elusate täiskasvanute soolist jaotumist (elutsükli katse skeem on esitatud 5. liites). Kõiki andmeid analüüsitakse kas regressioonimudeli abil, et leida kontsentratsioon, mis põhjustab asjakohase näitaja vähenemise X %, või kasutatakse hüpoteesi testimist, et määrata täheldatavat toimet mitteavaldav kontsentratsioon (NOEC). Selleks on vaja statistiliste testide abil võrrelda tulemusi, mis saadi uuritava kemikaaliga kokkupuutesse viimisel, tulemustega, mis saadi sobivate võrdluskemikaalidega kokkupuutesse viimisel. Tuleks märkida, et rikastatud veega kokkupuute stsenaariumis võivad kiiresti laguneva kemikaali puhul iga põlvkonna hilisemad arenguetapid (nt nukustaadium) puutuda kokku kemikaali oluliselt madalama kontsentratsiooniga vees kui 1. järgu vastsed. Kui see tekitab probleeme ja igal elutsükli etapil peaks olema enam-vähem ühesugune kokkupuude kemikaaliga, võib kaaluda katsemeetodis järgmiste muudatuste tegemist:
|
—
|
paralleelkatsete puhul rikastatakse vett elutsükli eri etappidel, või
|
|
—
|
katse mõlemas faasis (1. ja 2. põlvkond) kasutatakse katsesüsteemi korduvat rikastamist (või katva veekihi uuendamist), kusjuures rikastamise (uuendamise) aegade valimisel arvestatakse uuritava kemikaali lagunemise kiirust.
|
Selliseid muudatusi saab teha üksnes vee rikastamise, kuid mitte sette rikastamise puhul.
|
ANDMED UURITAVA KEMIKAALI KOHTA
|
8.
|
Teada peaks olema uuritava kemikaali lahustuvus vees, aururõhk ja log K
ow, mõõdetud või arvutatud jaotumine settesse ning stabiilsus vees ja settes. Uuritava kemikaali kvantitatiivseks määramiseks katvas veekihis, poorivees ja settes peaks olema usaldusväärne analüüsimeetod; meetodi täpsus ja määramispiir peaksid olema teada. Kasulik on teada uuritava kemikaali struktuurivalemit ja puhtust. Samuti on kasulik teada uuritava kemikaali käitumist (näiteks hajumine, abiootiline ja biootiline lagunemine jne). Täiendavad juhised selliste kemikaalide mõju uurimiseks, mille füüsikalis-keemilised omadused raskendavad selle katse tegemist, on esitatud väljaandes (16).
|
VÕRDLUSKEMIKAALID
|
9.
|
Võrdluskemikaale võib katsetada regulaarselt, et veenduda selles, et laboris kasvatatava populatsiooni tundlikkus ei ole muutunud. Nagu vesikirpudegi puhul, piisab sellest, kui teha 48-tunnine ägeda mürgisuse katse (17). Ent kuni ägeda mürgisuse testimise valideeritud katse-eeskiri muutub kättesaadavaks, võib kaaluda kroonilise mürgisuse katse tegemist vastavalt käesoleva lisa peatükile C.28. Laboritevahelistes võrdlustes ja valideerimisuuringutes edukalt kasutatud võrdlustoksikandid on näiteks: lindaan, trifluraliin, pentaklorofenool, kaadmiumkloriid ja kaaliumkloriid (1, 3, 6, 7, 18).
|
KATSE NÕUETEKOHASUS
|
10.
|
Katse nõuetekohasuse tõendamisel arvestatakse järgmist:
|
—
|
kontrollnõus peab katse lõpuks keskmiselt välja arenema vähemalt 70 % putukaid mõlema põlvkonna puhul (1, 7);
|
|
—
|
C. riparius'e ja C. yoshimatsui puhul peaks 85 % täiskasvanud mõlema põlvkonna sääskedest välja arenema kontrollnõus 12–23 päeva jooksul pärast esimese kasvujärgu vastsete viimist nõudesse; C. dilutus'e puhul on vastuvõetav vahemik 20–65 päeva;
|
|
—
|
täielikult arenenud ja elusate sääskede hulgas peaks sooline jaotumine (emas- ja isassääskede suhtarv) kontrollnõus olema vähemalt 0,4, kuid mitte üle 0,6;
|
|
—
|
igas paljunduspuuris peaks 1. põlvkonna kontrollkatses olema vähemalt 0,6 munanööri iga sellesse puuri viidud emassääse kohta;
|
|
—
|
viljakate munanööride osakaal kontrollrühma 1. põlvkonna igas paljunduspuuris peaks olema vähemalt 0,6;
|
|
—
|
kokkupuuteaja lõpus tuleks mõlema põlvkonna puhul mõõta igas nõus pH ja lahustunud hapniku kontsentratsioon. Hapnikukontsentratsioon peaks olema vähemalt 60 % õhuga küllastamisel saadud väärtusest (ASV (24)) ja katva veekihi pH peaks kõigis katsenõudes olema vahemikus 6–9;
|
|
—
|
vee temperatuur ei tohiks erineda rohkem kui ± 1,0 °C võrra.
|
|
MEETODI KIRJELDUS
Katsenõud ja paljunduspuurid
|
11.
|
Vastsed viiakse kemikaaliga kokkupuutesse 600 ml keeduklaasides läbimõõduga umbes 8,5 cm (vt 5. liide). Muud nõud on ka sobivad, kuid need peaksid tagama katva veekihi ja sette vajaliku paksuse. Sette pind peaks olema piisav, et tagada 2–3 cm2 pinda iga vastse kohta. Settekihi paksuse ja katva veekihi paksuse suhe peaks olema ligikaudu 1:4. Paljundamispuurid (suurusega vähemalt 30 cm kõik kolm mõõdet) on pealt ja vähemalt ühelt küljelt kaetud marliga (võrgusilma suurus on ligikaudu 1 mm) (vt 5. liide). Igasse puuri pannakse munemise jaoks 2-liitrise mahutavusega kristallisaator, mis sisaldab katses kasutatavat vett ja setet. Ka kristallisaatoris peaks settekihi paksuse ja seda katva veekihi paksuse suhe olema ligikaudu 1:4. Pärast munanööride kristallisaatorist eemaldamist pannakse need 12 süvendiga mikrotiiterplaadile (üks nöör igasse mikrotiiterplaadi süvendisse, mis sisaldab vähemalt 2,5 ml kristallisaatorist võetud rikastatud vett), seejärel plaat kaetakse kaanega, et vältida olulist aurumist. Munanööride hoidmiseks võib kasutada ka muid sobivaid nõusid. Peale mikrotiiterplaatide peaksid kõik katsenõud ja muud katsesüsteemiga kokku puutuvad seadmed olema valmistatud täies ulatuses klaasist või muust keemiliselt inertsest materjalist (näiteks polütetrafluoroetüleenist).
|
Liigi valimine
|
12.
|
Katses kasutatav liik on eelistatavalt Chironomus riparius. Võib kasutada ka C. yoshimatsui'd. Sobib ka C. dilutus, aga selle käsitlemine on keerukam ja see nõuab pikemat katseperioodi. 2. liites on esitatud andmed C. riparius'e kasvatamise meetodite kohta. Teave kasvatamistingimuste kohta on kättesaadav ka kirjandusest: C. dilutus (5) ja C. yoshimatsui (14). Enne katset tuleks kinnitada liigi määramist, aga seda ei nõuta enne iga katset, kui organismid pärinevad asutusesisesest kultuurist.
|
Sete
|
13.
|
Eelistatavalt tuleks kasutada spetsiaalselt koostatud setet (mida nimetatakse ka taastatud, tehislikuks või sünteetiliseks setteks). Loodusliku sette kasutamise korral tuleks seda iseloomustada (vähemalt pH, orgaanilise süsiniku sisaldus, samuti on soovitatav määrata muud parameetrid, nagu süsiniku-lämmastiku suhe ja osakeste suurus) ning selles ei tohiks olla mingeid saasteaineid ega muid organisme, kes võiksid surusääsklaste vastsetega konkureerida või neid süüa. Samuti soovitatakse lasta settel enne katse tegemist seitse päeva katsetingimustes tasakaalustuda. Soovitatakse kasutada järgmist spetsiaalselt koostatud setet (1, 20, 21):
|
a.
|
4–5 % (kuivmass) turvast: pH väärtus võimalikult lähedal vahemikule 5,5–6,0; tähtis on kasutada peeneks jahvatatud (osakese suurus ≤ 1 mm) pulbrilist turvast, mida on kuivatatud ainult õhu käes;
|
|
b.
|
20 % (kuivmass) kaoliinsavi (kaoliniidisisaldus eelistatavalt üle 30 %);
|
|
c.
|
75–76 % (kuivmass) kvartsliiva (see peaks peamiselt koosnema peenest liivast ja rohkem kui 50 % osakestest peaksid olema vahemikus 50–200 μm);
|
|
d.
|
lisatakse deioniseeritud vett, et lõplikus segus oleks niiskusesisaldus 30–50 %;
|
|
e.
|
sette lõpliku segu reguleerimiseks pH vahemikku 7,0 ± 0,5 lisatakse keemiliselt puhast kaltsiumkarbonaati (CaCO3);
|
|
f.
|
lõpliku segu orgaanilise süsiniku sisaldus peaks olema 2 % (± 0,5 %) ja see tuleks õigeks seada sobivas koguses turba ja liiva kasutamisega kooskõlas alapunktidega a ja c.
|
|
|
14.
|
Turba, kaoliinsavi ja liiva päritolu peaks olema teada. Sette koostisosi tuleks kontrollida, et tõendada keemilise saaste puudumine (näiteks raskmetallid, kloororgaanilised ühendid, fosfororgaanilised ühendid). Spetsiaalselt koostatud sette valmistamise näidis on esitatud 3. liites. Kuivade koostisosade segamine on samuti lubatav, kui tõendatakse, et pärast katva veekihi lisamist ei toimu sette koostisosade eraldumist (näiteks turbaosakeste hõljumist) ja et turvas või sete on piisavalt konditsioneerunud.
|
Vesi
|
15.
|
Katseveeks sobib vesi, mis vastab 2. ja 4. liites esitatud lahjendamiseks kasutatava vee nõutavatele keemilistele omadustele. Kasvuveena ja katseveena lubatakse kasutada iga sobivat vett, looduslikku vett (pinna- või põhjavesi), taastatud vett (vt 2. liide) või deklooritud kraanivett, kui surusääsklased jäävad selles kasvatamise ja katsetamise ajal ellu ega ilmuta stressi tunnuseid. Katse alguses peaks katsevee pH olema vahemikus 6–9 ja vee summaarne karedus ei tohiks olla suurem kui 400 mg/l CaCO3-na. Kui oletatakse karedust tekitavate ioonide ja uuritava aine omavahelist mõju, tuleks kasutada siiski väiksema karedusega vett (ja seega ei tohiks sel juhul kasutada Elendti kasvukeskkonda M4). Kogu uuringu vältel tuleks kasutada sama tüüpi vett. 4. liites loetletud vee kvaliteedi omadusi tuleks mõõta vähemalt kaks korda aastas või siis, kui kahtlustatakse, et kõnealused omadused võivad olla oluliselt muutunud.
|
Põhilahused. Rikastatud vesi
|
16. a.
|
Uuritava aine kontsentratsioonid arvutatakse veesambas olevate kontsentratsioonide alusel, s.o setet katva veekihi alusel. Valitud kontsentratsiooniga uuritavad lahused valmistatakse tavaliselt põhilahuse lahjendamise teel. Põhilahuse valmistamiseks on soovitatav lahustada uuritav kemikaal katsevees. Mõnel juhul võib sobiva kontsentratsiooniga põhilahuse valmistamiseks olla vajalik lahusti või dispergendi kasutamine. Sobivad lahustid on atsetoon, etüleenglükoolmonoetüüleeter, etüleenglükooldimetüüleeter, dimetüülformamiid ja trietüleenglükool. Sobivad dispergendid on Cremophor RH40, Tween 80, metüültselluloos (0,01 %) ja HCO-40. Solubiliseeriva aine kontsentratsioon lõplikus katse kasvukeskkonnas peaks olema minimaalne (s.o ≤ 0,1 ml/l) ja see peaks olema sama kõigi kokkupuutekontsentratsioonide puhul. Kui kasutatakse solubiliseerivat ainet, ei tohiks see oluliselt mõjutada suremust, mida kontrollitakse lahusti kontrollkatse võrdlemisel negatiivse (vee) kontrollkatsega. Siiski tuleks teha kõik, et vältida selliste kemikaalide kasutamist.
|
Põhilahused. Rikastatud sete
|
16. b.
|
Tavaliselt valmistatakse valitud kontsentratsiooniga rikastatud setted uuritava kemikaali lahuse otse settesse lisamise teel. Deioniseeritud vees lahustatud uuritava kemikaali põhilahus segatakse spetsiaalselt koostatud settega valtsmasina või söödasegaja abil või käsitsi. Vees halvasti lahustuva uuritava kemikaali võib lahustada võimalikult väikses sobiva orgaanilise lahusti (näiteks heksaan, atsetoon või kloroform) koguses. See lahus segatakse seejärel 10 g peene kvartsliivaga iga katsenõu jaoks. Lahustil lastakse auruda ja see tuleks liivast täielikult kõrvaldada; seejärel segatakse liiv sobiva koguse settega. Uuritava aine solubiliseerimiseks, dispergeerimiseks või emulgeerimiseks võib kasutada ainult kergesti lenduvaid kemikaale. Tuleks meeles pidada, et sette valmistamisel tuleks arvesse võtta uuritava kemikaali ja liiva segust pärit liiva (s.o sete tuleks siis valmistada väiksema liivakogusega). Tuleks hoolitseda, et settele lisatud uuritav kemikaal oleks settes põhjalikult ja ühtlaselt jaotatud. Vajaduse korral võib homogeensuse taseme määramiseks analüüsida alamproove.
|
KATSE KAVANDAMINE
|
17.
|
Katse kavandamine hõlmab katse kontsentratsioonide arvu ja vahemike valimist, iga kontsentratsioonitaseme jaoks nõude arvu ning igas nõus olevate vastsete arvu valimist, samuti kristallisaatorite ja paljunduspuuride arvu valimist. Allpool on kirjeldatud katsete kavandamine ECx ja NOEC määramiseks, samuti piirsisalduskatse kavandamine.
|
Katse kavandamine regressioonanalüüsi tegemiseks
|
18.
|
Toimet avaldav kontsentratsioon (ECx) ja kontsentratsioonivahemik, mis pakub huvi uuritava kemikaali mõju uurimisel, tuleks hõlmata katses kasutatavate kontsentratsioonidega, nii et otsitavat näitajat ei tuleks leida ekstrapoleerimisega väljapoole mõõdetud andmete vahemikku. Tuleks vältida suurt ekstrapoleerimist allapoole madalaimat kontsentratsiooni või ülespoole kõrgeimat kontsentratsiooni. Eelnev annusevahemiku leidmise katse katsemeetodi C.27 või C.28. järgi võib aidata valida sobivat uuritavate kontsentratsioonide vahemikku.
|
|
19.
|
ECx lähenemisviisi korral tuleks teha katsed vähemalt viie kontsentratsiooniga ja kaheksa paralleelkatsega igal kontsentratsioonil. Iga kontsentratsiooni puhul tuleks kasutada kahte paljunduspuuri (A ja B). Kaheksa paralleelkatset jagatakse kahte rühma, kummaski neli paralleelkatset, millest valmikud kogutakse kumbagi paljunduspuuri. Selline paralleelkatsete koondamine on vajalik selleks, et saada paljunduspuuri piisav arv valmikuid paljunemise usaldusväärseks hindamiseks. Siiski tehakse ka 2. põlvkonnaga kaheksa paralleelkatset, mida alustatakse kemikaaliga kokkupuutunud populatsioonidest paljunduspuurides. Kontsentratsioonidevaheline kordaja ei tohiks olla suurem kui 2 (erandi võib teha juhul, kui doosi mõju graafiku tõus on madal). Kui suurendatakse eri mõjuga uuritavate kontsentratsioonide arvu, võib iga doosi paralleelkatsete arvu vähendada kuuele (kolm kumbagi paljunduspuuri),. Paralleelkatsete arvu suurendamine või uuritavate kontsentratsioonide vahemiku vähendamine enamasti vähendab usaldusvahemikku ECX ümber.
|
Täheldatavat toimet mitteavaldava kontsentratsiooni (NOEC) hindamise kavandamine
|
20.
|
NOEC lähenemisviisi puhul tuleks kasutada viit uuritavat kontsentratsiooni vähemalt kaheksa paralleelkatsega (neli kumbagi paljunduspuuri A ja B) ja nende kontsentratsioonide erinevuse kordaja ei tohiks olla suurem kui kaks. Paralleelkatsete arv peaks olema piisav, et tagada piisav statistiline võimsus, et tuvastada katse- ja kontrollnõu tulemuste 20 % erinevus 5 % statistilise olulisusega (α = 0,05). Arengu kiiruse, viljakuse ja sigivuse puhul on tavaliselt kohane kasutada dispersioonanalüüsi (ANOVA), millele järgneb Dunnetti või Williamsi test (22–25). Väljaarenemise suhte ja soolise jaotumise suhtarvu puhul võib kasutada Cochran-Armitage'i testi, Fisheri täpset testi (Bonferroni parandusega) või Mantel-Haentzali testi.
|
Piirsisalduskatse
|
21.
|
Kui esialgsetes annusevahemiku leidmise katsetes kuni maksimaalse kontsentratsioonini mõju ei leitud, võib teha piirsisalduskatse (üks uuritava aine kontsentratsioon ja kontrollkatse(d)). Piirsisalduskatse eesmärk on näidata, et uuritava kemikaali mürgine toime avaldub kontsentratsioonil, mis on katses kasutatud piirkontsentratsioonist kõrgem. Vee puhul soovitatakse kontsentratsiooni 100 mg/l ja sette puhul 1 000 mg/kg (kuivmass). Enamasti tuleb nii kemikaaliga kokkupuutuvate rühmadega kui ka kontrollrühmadega teha vähemalt kaheksa paralleelkatset. Tuleks tõendada piisava statistilise võimsuse olemasolu, et tuvastada katse- ja kontrollnõu tulemuste 20 % erinevus 5 % statistilise olulisusega (α = 0,05). Mõõdetavate suuruste (nt arengu kiirus) puhul, kui andmed vastavad käesoleva katse nõuetele (normaalsus, ühtlane hajumine), on statistilise meetodina asjakohane kasutada t-testi. Kui need nõuded ei ole täidetud, võib kasutada mittevõrdse hajumise t-testi või mitteparameetrilist testi, näiteks Wilcoxoni-Manni-Whitney testi. Valmikute väljaarenemise suhte puhul on asjakohane kasutada Fisheri täpset testi.
|
MÄÄRAMISE KÄIK
Kokkupuutetingimused
Vee-sette süsteemi valmistamine (kui rikastatakse vesi)
|
22. a.
|
Spetsiaalselt koostatud sete (vt punktid 13–14 ja 3. liide) lisatakse igasse katsenõusse ja kristallisaatorisse, et see moodustaks kihi paksusega vähemalt 1,5 cm (kristallisaatoris võib olla natuke õhem), kuid mitte üle 3 cm. Lisatakse vesi (vt punkt 15), nii et settekihi paksuse ja veekihi sügavuse suhe ei oleks suurem kui 1:4. Pärast katsenõu ettevalmistamist tuleks sette-vee süsteem jätta kerge aeratsiooniga seisma ligikaudu seitsmeks päevaks enne 1. või 2. põlvkonna esimese kasvujärgu vastsete lisamist (vt punkt 14 ja 3. liide). Kristallisaatori sette-vee süsteemi ei aereerita katse ajal, kuna nendes ei ole vaja tagada vastsete ellujäämist (munanöörid kogutakse juba enne koorumist). Sette koostisosade eraldumise ja veesambas katsevee lisamise ajal peene materjali uue suspensiooni tekkimise vältimiseks võib sette katta plastikkettaga ja valada vett kettale. Ketas eemaldatakse kohe pärast valamist. Võib kasutada ka muid võtteid.
|
Vee-sette süsteemi valmistamine (kui rikastatakse sete)
|
22. b.
|
Rikastatud setted valmistatakse vastavalt punktile 16b, pannakse nõudesse ja kristallisaatoritesse ning neile lisatakse kattev veekiht, et saada sette-vee ruumala suhe 1:4. Settekihi paksus peaks olema 1,5–3 cm (kristallisaatoris võib see olla mõnevõrra õhem). Sette osade eraldumise ja veesambas katsevee lisamisel peene materjali uue suspensiooni tekkimise vältimiseks võib sette katta vee valamise ajaks plastikkettaga, mis pärast vee valamist kohe eemaldatakse. Võib kasutada ka muid võtteid. Kui rikastatud sete koos katva veekihiga on valmistatud, on soovitatav lasta uuritaval kemikaalil jaotuda settefaasist vee faasi (4, 5, 7, 18). Seda tuleks eelistatavalt teha katses kasutatavates temperatuuri- ja õhustustingimustes. Vajalik tasakaalustumisaeg sõltub settest ja kemikaalist ning võib kesta tunde, päevi ja harvadel juhtudel kuni viis nädalat. Kuna paljud kemikaalid võivad sellise aja jooksul laguneda, ei oodata tasakaaluoleku teket, vaid soovitatakse 48-tunnist tasakaalustamise ajavahemikku. Kui aga kemikaali lagunemise poolestusaeg settes on pikk (vt punkt 8), võib tasakaalustumisaega pikendada. Kõnealuse täiendava tasakaalustamise ajavahemiku lõpus tuleks mõõta uuritava kemikaali kontsentratsioon katvas veekihis, poorivees ja settes vähemalt suurimal ja väiksemal kontsentratsioonil (vt punkt 38). Need uuritava kemikaali analüütilised määramised võimaldavad arvutada massitasakaalu ja väljendada tulemusi mõõdetud kontsentratsioonide alusel.
|
|
23.
|
Katsenõud peaksid olema kaetud (näiteks klaasplaadiga). Vajaduse korral lisatakse vee aurumise kompenseerimiseks ja uuringu algse veetaseme saavutamiseks vett. Soolade kogunemise vältimiseks tuleks lisada destilleeritud või deioniseeritud vett. Kristallisaatoreid paljunduspuurides ei kaeta ja nende puhul võib (aga ei tarvitse) olla vajalik veekao kompenseerimine katse ajal, sest munanöörid puutuvad veega kokku ainult ligikaudu ühe päeva ja kristallisaatoreid kasutatakse ainult ühe lühikese katseetapi jooksul.
|
Katseorganismide lisamine
|
24.
|
Neli kuni viis päeva enne 1. põlvkonna katseorganismide esimese kasvujärgu vastsete lisamist katsenõudesse tuleks võtta kultuurist munamassid ja panna need väikestesse nõudesse, milles on kultuuri kasvukeskkond. Võib kasutada põhikultuuri vana kasvukeskkonda või värskelt valmistatud kasvukeskkonda. Igal juhul tuleks lisada kultuuri kasvukeskkonnale väikses koguses sööta, näiteks paar tilka peeneks jahvatatud helbelise kalasööda suspensiooni filtraadist (vt 2. liide). Tuleks kasutada ainult värskelt munetud munamasse. Tavaliselt hakkavad vastsed kooruma paari päeva möödumisel munade munemisest (2–3 päeva C. riparius'e puhul temperatuuril 20 °C ning 1–4 päeva C. dilutus'e puhul temperatuuril 23 °C ja C. yoshimatui puhul temperatuuril 25 °C) ning vastsete kasv toimub neljas kasvujärgus, millest iga kasvujärk kestab 4–8 päeva. Katses tuleks kasutada esimese kasvujärgu vastseid (kuni 48 tundi pärast koorumist). Vastsete kasvujärku on võimalik kontrollida peakapsli laiuse mõõtmisega (7).
|
|
25.
|
Tömbi pipeti abil jaotatakse 20 1. põlvkonna esimese kasvujärgu vastset juhuslikult igasse katsenõusse, mis sisaldavad sette ja vee süsteemi. Vee aereerimine peatatakse vastsete katsenõudesse lisamise ajaks ja seda ei jätkata 24 tunni vältel pärast vastsete lisamist (vt punkt 32). Kasutatava katsekava kohaselt (vt punktid 19 ja 20) on kasutatavate vastsete arv iga kontsentratsiooni kohta toimet avaldava kontsentratsiooni (ECX) hindamise korral vähemalt 120 (6 paralleelkatset igal kontsentratsioonil) ja täheldatavat toimet mitteavaldava kontsentratsiooni määramise korral 160 (8 paralleelkatset igal kontsentratsioonil). Kui rikastatud on sete, algab kokkupuude vastsete lisamisega.
|
Katva veekihi rikastamine
|
26.
|
Kakskümmend neli tundi pärast 1. põlvkonna esimese kasvujärgu vastsete lisamist lisatakse uuritav kemikaal katva veekihi sambasse ja alustatakse uuesti kerget aereerimist (uuringu kava võimalike muudatuste kohta vt punkt 7). Uuritava kemikaali põhilahuseid lisatakse pipeti abil väikses koguses veepinna alla. Seejärel tuleks kattev veekiht ilma setet häirimata ettevaatlikult segada. Rikastatud vee stsenaariumi korral algab kokkupuude veesamba rikastamisega (st üks päev pärast vastsete lisamist).
|
Väljaarenenud valmikute kogumine
|
27.
|
Sääskede 1. põlvkonna väljaarenenud valmikud kogutakse katsenõust vähemalt üks kord, soovitavalt aga kaks korda päevas (vt punkt 36), kasutades aspiraatorit, imurit või samalaadset seadet (vaata 5. liide). Tuleb olla eriti hoolikas, et valmikuid mitte kahjustada. Ühe kemikaalikontsentratsiooni neljast katseanumast kogutud sääsed lastakse nende jaoks eelnevalt ettenähtud paljunduspuuri. Sel päeval, kui areneb välja esimene (isas-)sääsk, rikastatakse kristallisaatorid kemikaaliga, milleks lisatakse pipetiga väike kogus uuritava kemikaali põhilahust (rikastatud veega tehtav katse). Seejärel tuleks kattev veekiht ilma setet häirimata ettevaatlikult segada. Uuritava kemikaali kontsentratsioon kristallisaatoris on nominaalselt sama kui vastava kontsentratsiooniga katsenõus, millest sääsed viiakse üle asjaomasesse paljunduspuuri. Rikastatud settega katses valmistatakse kristallisaatorid ette ligikaudu 11. päeval pärast kokkupuute algust (s.o pärast 1. põlvkonna vastsete lisamist), et kristallisaatorid saaksid tasakaalustuda ligikaudu 48 tundi enne esimeste munanööride munemist
|
|
28.
|
Munanöörid kogutakse paljunduspuuride kristallisaatoritest pintseti või tömbi pipeti abil. Iga munanöör pannakse nõusse, milles on samast kristallisaatorist võetud kasvukeskkond (nt 12 süvendiga mikrotiiterplaadi süvendisse, mis sisaldab vähemalt 2,5 ml kasvukeskkonda). Nõud munanööridega kaetakse kaanega, et vältida olulist aurumist.
Munanööre jälgitakse vähemalt kuus päeva pärast munemist, nii et saaks ära määrata, kas need on viljakad või viljatud. 2. põlvkonna alustamiseks võetakse vähemalt kolm, aga eelistatavalt kuus viljakat munanööri, mis valitakse igast paljunduspuurist, lisatakse veidi sööta ja lastakse kooruda. Need munanöörid peaksid olema munetud munemise tipp-ajal, mis tavaliselt on kontrollkatsetes ligikaudu 19. päev. Ideaaljuhul tuleks kõiki 2. põlvkonna katseid eri kontsentratsioonidel alustada samal päeval, kuid kuna kemikaalid mõjutavad vastsete arengut, ei pruugi see alati olla võimalik. Sellisel juhul võib suurema kontsentratsiooniga katseid alustada hiljem kui väiksema kontsentratsiooniga ja (lahusti) kontrolli katseid.
|
|
29. a.
|
Rikastatud veega tehtava katse puhul valmistatakse sette-vee süsteem 2. põlvkonna jaoks ette, lisades uuritava kemikaali katvasse veekihti, 1 tund enne esimese kasvujärgu vastsete katsenõudesse lisamist. Uuritava kemikaali lahuseid lisatakse pipeti abil väikses koguses veepinna alla. Seejärel tuleks kattev veekiht ilma setet häirimata ettevaatlikult segada. Pärast rikastamist alustatakse kerget aereerimist.
|
|
29. b.
|
Rikastatud settega tehtava katse puhul valmistatakse sette-vee süsteemiga katsenõud 2. põlvkonna jaoks ette samal viisil kui 1. põlvkonna jaoks.
|
|
30.
|
Tömbi pipeti abil jaotatakse 20 2. põlvkonna esimese kasvujärgu vastset (kuni 48 tundi pärast koorumist) juhuslikult igasse katsenõusse, mis sisaldavad rikastatud sette ja vee süsteemi. Vee aereerimine tuleks esimese kasvujärgu vastsete katsenõudesse lisamise ajaks peatada ja seda ei jätkata 24 tunni vältel pärast vastsete lisamist. Kasutatava katsekava kohaselt (vt punktid 19 ja 20) on kasutatavate vastsete arv iga kontsentratsiooni kohta toimet avaldava kontsentratsiooni (ECX) hindamise korral vähemalt 120 (6 paralleelkatset igal kontsentratsioonil) ja täheldatavat toimet mitteavaldava kontsentratsiooni (NOEC) määramise korral 160 (8 paralleelkatset igal kontsentratsioonil).
|
Sööt
|
31.
|
Vastseid tuleb katsenõudes sööta eelistatavalt iga päev või vähemalt kolm korda nädalas. Noorte vastsete esimese kümne arenemispäeva jooksul on sobiv söödakogus vastse kohta päevas 0,25–0,5 mg (0,35–0,5 mg C. yoshimatsui puhul) kalasööta (näiteks Tetra-Min või Tetra-Phyll, mis on kas suspendeeritud vees või jahvatatud peeneks; üksikasjad vt 2. liide). Vanemad vastsed võivad vajada mõnevõrra rohkem sööta: 0,5–1 mg vastse kohta päevas peaks olema piisav ülejäänud katse jooksul. Söödakogust tuleks vähendada kõigi kokkupuute- ja kontrollkatsete puhul, kui täheldatakse seente kasvu või kui kontrollkatses täheldatakse suremust. Kui seente kasvu ei ole võimalik peatada, tuleks katset korrata.
Allaneelamise kaudu toimuv kokkupuude kemikaaliga on toksikoloogilises mõttes üldiselt asjakohasem selliste kemikaalide puhul, millel on suur afiinsus orgaaniliste süsinikuühendite suhtes või mis seovad end kovalentselt settega. Kui uuritakse niisuguste omadustega kemikaali, võib vastsete elus püsimiseks ja normaalseks kasvuks vajaliku koguse sööta lisada spetsiaalselt koostatud settele juba enne stabiliseerumisperioodi, olenevalt regulatiivsetest vajadustest. Vee kvaliteedi halvenemise vältimiseks tuleks kalasööda asemel kasutada taimset materjali; näiteks võib kasutada 0,5 % (kuivmass) kõrvenõgese (Urtica dioica), mooruspuu (Morus alba), valge ristiku (Trifolium repens), spinati (Spinacia oleracea) peeneks jahvatatud lehti või muud taimset materjali (Cerophyl või α-tselluloos). Orgaanilise sööda kogu vajaliku koguse lisamine settele enne rikastamist ei ole lihtne ülesanne vee kvaliteedi ja bioloogilise tulemuslikkuse seisukohast (21) ega ka standardmeetod, kuid hiljutised uuringud näitavad, et see meetod toimib (19, 26). Sääsevalmikud paljunemispuuris tavaliselt ei vaja söötmist, kuid viljakus ja sigivus on tavaliselt paremad, kui täiskasvanud sääskedele pakkuda söödaallikana küllastunud sahharoosilahusega immutatud puuvillavati tükki (34).
|
Inkubeerimistingimused
|
32.
|
24 tundi pärast mõlema põlvkonna esimese kasvujärgu vastsete lisamist hakatakse katsenõudes katvat veekihti kergelt aereerima, mida jätkatakse kogu katse vältel (tuleb olla hoolikas, et lahustunud hapniku kontsentratsioon ei langeks alla 60 % hapniku küllastuskontsentratsioonist). Aereerimiseks kasutatakse klaasist Pasteuri pipetti, mis on kinnitatud nii, et selle otsik on settekihist 2–3 cm kõrgusel, ja millest eraldub mõni mull sekundis. Lenduva kemikaali uurimisel võib kaaluda sette-vee süsteemi aereerimisest loobumist, kuid katse nõuetekohasuse kriteerium, et hapnikusisaldus vees oleks vähemalt 60 % küllastuskontsentratsioonist (punkt 10) peaks olema täidetud. Täpsemad juhendid on esitatud dokumendis (16).
|
|
33.
|
Katse C. riparius'ega tehakse püsival temperatuuril 20 °C (± 2 °C). C. dilutus'e ja C. yoshimatsui puhul on soovitatavad temperatuurid vastavalt 23 °C ja 25 °C (± 2 °C). Kasutatakse 16-tunnist valgustusperioodi ja valguse intensiivsus peaks olema 500 kuni 1 000 luksi. Paljunduspuurides võib lisada veel ühetunnise hämariku ja koidu faasi.
|
Kokkupuute kestus
|
34.
|
Rikastatud veega katse: 1. põlvkonna kokkupuuteperiood algab siis, kui uuritav kemikaal lisatakse katseanumas katvasse veekihti (üks päev pärast vastsete lisamist; kokkupuute võimalike muudatuste kohta vt punkt 7). 2. põlvkonna vastsete kokkupuude algab kohe, sest nemad pannakse sette-vee süsteemi, mis on juba rikastatud. 1. põlvkonna maksimaalne kokkupuute kestus on 27 päeva ja 2. põlvkonna oma 28 päeva (1. põlvkonna vastsed veedavad ühe päeva katsenõudes ilma kemikaaliga kokku puutumata) C. riparius'e ja C. yoshimatui' puhul. Võttes arvesse kõnealust kattumist, on kogu katse kestus on ligikaudu 44 päeva. C. dilutus'e puhul on kokkupuute kestused 1. ja 2. põlvkonna puhul vastavalt kuni 64 päeva ja 65 päeva. Katse kogupikkus on ligikaudu 100 päeva.
Rikastatud settega katse: kokkupuude algab vastsete lisamisega ja kestab mõlema põlvkonna puhul kuni 28 päeva C. riparius'e ja C. yoshimatsui puhul ning 65 päeva C. dilutus'e puhul.
|
Vaatlused
Väljaarenemine
|
35.
|
Kummagi põlvkonna puhul määratakse arengu kogukestus ja täielikult väljaarenenud isas- ja emassääskede koguarv. Isased on tänu sulgjatele tundlatele ja kõhnema keha hoiakule kergesti äratuntavad.
|
|
36.
|
Kummagi põlvkonna katsenõusid tuleks vaadelda vähemalt kolm korda nädalas, et hinnata visuaalselt iga vastsete ebatavalist käitumist (näiteks settest väljumine, ebatavaline ujumine) kontrollnõuga võrreldes. Väljaarenemise ajal, mis algab ligikaudu 12 päeva pärast vastsete sisestamist C. riparius'e ja C. yoshimatui puhul (pärast 20 päeva C. dilutus'e puhul), loetakse väljaarenenud sääsed üle ja määratakse nende sugu vähemalt üks, kuid eelistatavalt kaks korda päevas (hommikul ja hilisel pärastlõunal). Pärast soo määramist eemaldatakse 1. põlvkonna sääsed ettevaatlikult katsenõust ja viiakse üle paljunduspuuri. 2. põlvkonna sääsed kõrvaldatakse ja surmatakse pärast soo määramist. Kõik munanöörid, mis on munetud 1. põlvkonna katsenõudesse, tuleks ükshaaval koguda ja viia koos vähemalt 2,5 ml veega samast nõust 12 süvendiga mikrotiiterplaatidele (või muusse sobivasse nõusse), mis kaetakse olulise aurumise vältimiseks kaanega. Samuti registreeritakse kõigi surnud vastsete ja selliste nähtavate nukkude arv, millest sääske välja ei arenenud. Paljunduspuuri, katsenõu ja imuri näidised on esitatud 5. liites.
|
Paljunemine
|
37.
|
Mõju paljunemisele hinnatakse 1. põlvkonna sääskede munetud munanööride arvu ja nende munanööride fertiilsuse järgi. Üks kord päevas kogutakse munanöörid kristallisaatorist, mis on pandud igasse paljunduspuuri. Munanöörid tuleks koguda ja viia koos vähemalt 2,5 ml veega samast nõust 12 süvendiga mikrotiiterplaatidele (üks munanöör igasse süvendisse) või muusse sobivasse nõusse, mis kaetakse olulise aurumise vältimiseks kaanega. Iga munanööri kohta registreeritakse järgmised omadused: munemise päev, suurus (normaalne, st 1,0 ± 0,3 cm või väike; tavaliselt ≤ 0,5 cm) ja struktuur (normaalne on banaanikujuline spiraalne munanöör või ebanormaalne, nt mittespiraalne munanöör) ja fertiilsus (fertiilne või mitte). Kuue päeva jooksul pärast munanööri munemist hinnatakse selle fertiilsus. Munanöör on fertiilne, kui vähemalt üks kolmandik munadest koorub. Paljunduspuuri viidud emassääskede üldarvu põhjal arvutatakse munanööride arv emassääse kohta ja fertiilsete munanööride arv emassääse kohta. Vajaduse korral saab munade arvu munanööris hinnata seda lõhkumata, kasutades rõngaste lugemise meetodit (üksikasjad vt 32 ja 33).
|
Analüütilised mõõtmised
Uuritava kemikaali kontsentratsioon
|
38.
|
Kokkupuute alguses (vee rikastamise korral eelistatavalt tund aega pärast uuritava kemikaali lisamist) ja lõpus tuleks analüüsida suurimal ja väiksemal kontsentratsioonil vähemalt katva veekihi, poorivee ja sette proove. See kehtib mõlema põlvkonna nõude kohta. Paljunduspuuris olevas kristallisaatoris analüüsitakse ainult katvat veekihti, kuna munanöörid puutuvad kokku just sellega (rikastatud settega katses võib kaaluda settes oleva kontsentratsiooni määramist). Kui peetakse vajalikuks, võib katse ajal teha veel täiendavaid sette, poorivee või katva veekihi analüüse. Kõnealused uuritava kemikaali kontsentratsiooni määramised annavad teavet uuritava kemikaali käitumise/jaotumise kohta vee-sette süsteemis. Sette ja poorivee proovide võtmiseks katse alguses ja ajal (vt punkt 39) on vaja täiendavaid katsenõusid, millest tehakse analüüse. Sette mõõtmised rikastatud veega katse puhul ei tarvitse olla vajalikud, kui uuritava kemikaali jaotumine vee ja sette vahel on vee-sette uuringus võrreldavates tingimustes (näiteks sette ja vee suhtarv, lisamise tüüp, sette orgaanilise süsiniku sisaldus) selgelt ära määratud või kui katvas veekihis mõõdetud kontsentratsioonid on vahemikus 80–120 % nimiväärtusest või alguses mõõdetud kontsentratsioonist.
|
|
39.
|
Kui tehakse vahepealseid mõõtmisi (näiteks 7. ja/või 14. päeval) või kui analüüsi jaoks on vaja suurt proovi, mida ei saa katsenõust ilma katsesüsteemi mõjutamata võtta, tuleks analüüs teha samal viisil töödeldud, kuid bioloogilisteks vaatlusteks mitte kasutatavast täiendavast katsenõust (kus on ka katseorganismid) võetud proovist.
|
|
40.
|
Tsentrifuugimine näiteks 10 000 g ja 4 °C juures 30 minuti vältel on soovitatav meetod poorivee eraldamiseks. Kui on tõendatud, et uuritav kemikaal ei adsorbeeru filtritele, võib sobida ka filtrimine. Mõnel juhul ei pruugi olla võimalik poorivee kontsentratsiooni määramine, kuna saadav proov on liiga väike.
|
Füüsikalis-keemilised parameetrid
|
41.
|
Katsevee pH-d ja lahustunud hapniku sisaldust katsenõudes ja kristallisaatorites ning vee temperatuuri tuleks mõõta asjakohasel viisil (vt punkt 10). Katse alguses ja lõpus tuleks kontrollnõudes ning ühes kõrgeima kontsentratsiooniga katsenõus ja kristallisaatoris mõõta karedust ja ammoniaaki.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Tulemuste töötlemine
|
42.
|
Käesoleva katse eesmärk on määrata uuritava kemikaali poolt kogu elutsükli jooksul avaldatav mõju paljunemisele ning kahe põlvkonna puhul ka arengukiirusele ning elusate ja täielikult väljaarenenud isas- ja emassääskede üldarvule. Isas- ja emassääskede väljaarenemise suhtarvu leidmiseks tuleks andmed koondada. Kui sugupoolte arengukiiruse tundlikkuses kemikaali mõju suhtes ei ole statistiliselt olulisi erinevusi, võib isaste ja emastega saadud tulemused statistilisel analüüsil koondada.
|
|
43.
|
Toimet avaldavad kontsentratsioonid, mis põhinevad kontsentratsioonidel katvas veekihis (rikastatud vesi) või settes (rikastatud sete), arvutatakse tavaliselt katse alguses mõõdetud kontsentratsioonide alusel (vt punkt 38). Seepärast rikastatud vee puhul kontsentratsioonid, mis tavaliselt on mõõdetud mõlema põlvkonna katsenõude katvas veekihis kemikaaliga kokkupuute alguses ja kristallisaatoris, keskmistatakse iga kontsentratsioonitaseme puhul. Rikastatud sette puhul keskmistatakse kontsentratsioonid, mis tavaliselt on mõõdetud mõlema põlvkonna katsenõudes kemikaaliga kokkupuute alguses (ja soovi korral ka kristallisaatoris), iga kontsentratsioonitaseme puhul.
|
|
44.
|
Selleks et arvutada punkti hinnang, näiteks ECx, võib iga katsenõu ja paljunduspuuri statistilisi näitajaid kasutada tegelike paralleelkatsetena. Iga ECx usaldusvahemiku arvutamisel tuleks arvesse võtta eri nõude tulemuste hajumist või tuleks näidata, et kõnealune hajumine on nii väike, et seda võib eirata. Kui andmeid töödeldakse mudeli parameetrite leidmiseks vähimruutude meetodiga, tuleks nõu kohta arvutatud statistilisi andmeid teisendada, et dispersioon oleks ühtlasem. ECx-väärtused tuleks siiski arvutada pärast tulemuse esialgsele väärtusele tagasiteisendamist (31).
|
|
45.
|
Kui statistilise analüüsi eesmärk on teha hüpoteesi katsetamise abil kindlaks täheldatavat toimet mitteavaldav kontsentratsioon (NOEC), tuleb võtta arvesse nõudevahelist hajuvust; selline arvessevõtmine on tagatud ANOVA meetodite kasutamisel (näiteks Williamsi ja Dunnetti testid). Williamsi test on sobiv, kui doosi-toime sõltuvus peaks teooria põhjal olema monotoonne, ja Dunnetti testi tuleks kasutada siis, kui monotoonsuse hüpotees ei pea paika. Teisest küljest, olukorras, kus tavapärased dispersioonanalüüsi (ANOVA) eeldused ei ole täidetud (31), võivad paremini sobida töökindlamad testid (27).
|
Väljaarenemise määr
|
46.
|
Väljaarenemise (väljalennu) määra kirjeldavad binaarsed andmed ja neid on võimalik analüüsida astmeliselt kohaldatava Cochrani-Armitage'i testi abil, kus eeldatakse, et mõju sõltuvus doosist on monotoonne, ja need andmed on selle eeldusega kooskõlas. Vastasel juhul võib kasutada Fisheri täpset testi või Manteli-Haenstzali testi Bonferroni-Holmi kohandatud p-väärtustega. Kui on tõendeid, et ühe kontsentratsiooniga paralleelkatsete hajuvus on suurem kui eeldatakse binoomjaotuse dispersiooni puhul (nn ekstra-binoomjaotuse dispersioon), tuleks kasutada töökindlat Cochrani-Armitage'i või Fisheri täpset testi, nagu on soovitatud (27).
Määratakse elus väljaarenenud sääskede (isas- pluss emasloomad) arv nõu kohta ne
, mis jagatakse sissepandud vastsete arvuga na
:
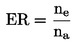
kus
|
ER
|
=
|
väljaarenemise (väljalennu) määr (emergence ratio);
|
|
ne
|
=
|
väljaarenenud sääskede arv nõu kohta
|
|
na
|
=
|
sissepandud vastsete arv nõu kohta (tavaliselt 20)
|
Kui ne
on suurem kui na
(see tähendab, et katsenõusse pandi kogemata rohkem vastseid, kui oli kavas), võetakse na
võrdseks ne
-ga.
|
|
47.
|
Ekstra-binoomjaotuse dispersiooni korral on suurte valimite puhul kõige asjakohasem alternatiivne lähenemisviis käsitleda väljaarenemise määra pideva vastusena ning kasutada selliseid meetodeid, mis on kooskõlas kõnealuste väljaarenemise määra andmetega. Suur valim on siinkohal määratletud kui väljaarenenud sääskede arv ja väljaarenemata jäänud sääskede arv, mis mõlemad on suuremad kui viis paralleelkatse (nõu) kohta.
|
|
48.
|
Dispersioonanalüüsi (ANOVA) meetodite kohaldamiseks tuleks väljaarenemise määra väärtused kõigepealt teisendada arkussiinus-ruutjuure-teisenduse või Tukey-Freemani teisenduse abil, et saada ligikaudne normaaljaotus ja võrdsustada variatsioonid. Cochran-Armitage'i testi, Fisheri täpse testi (Bonferroni) või Mantel-Haentzali testi võib kasutada absoluutsete sageduste kasutamisel. Arkussiinus-ruutjuure-teisendust kohaldatakse, arvutades väljaarenemise määra ruutjuure siinuse pöördarvu (sin– 1).
|
|
49.
|
Väljaarenemismäärade puhul arvutatakse ECx väärtused regressioonanalüüsiga (näiteks probit-, logit- või Weibulli mudel (28)). Kui regressioonanalüüs ebaõnnestub (näiteks kui on vähem kui kaks osalist vastust), võib kasutada muid mitteparameetrilisi meetodeid, näiteks libisevat keskmist või lihtsat interpolatsiooni.
|
Arengu kiirus
|
50.
|
Keskmine arengu aeg väljendab keskmist ajavahemikku vastsete lisamise (katsepäev 0) ja sääskede katsekohordi väljaarenemise vahel (tegeliku arenguaja arvutamisel tuleb arvesse võtta vastsete vanust katsesse sisseviimise ajal). Arengu kiirus (ühik: 1/päev) on pöördvõrdeline arengu ajaga ja väljendab vastsete arengu seda osa, mis toimub ühe päeva jooksul. Kõnealuste sette mürgisuse hindamise uuringute puhul eelistatakse arengu kiirust, kuna selle hajuvus on väiksem ja homogeensem ning normaaljaotusele lähedasem kui arenguaja puhul. Seega võib arengu kiiruse puhul kasutada tugevamaid parameetrilisi testimismeetodeid, mida ei saa kasutada arenguaja puhul. Arengu kiiruse kui pideva vastuse jaoks saab ECx väärtusi hinnata regressioonanalüüsiga (näiteks 29, 30). Arengu kiiruse keskväärtusele täheldatavat toimet mitteavaldava kontsentratsiooni (NOEC) võib määrata ANOVA meetoditega, nt Dunnetti või Williamsi testiga. Kuna isassääsed arenevad välja emassääskedest varem (st nende arengu kiirus on suurem), on mõttekas arvutada arengu kiirus eraldi kummastki soost sääskede jaoks, lisaks üldisele sääskede arengu kiirusele.
|
|
51.
|
Statistiliste testide puhul eeldatakse, et kontrolli päeval x täheldatud sääsed on välja arenenud keskmisel ajavahemikul päeva x ja päeva x – l vahel (l = kontrollimiste vahelise ajavahemiku pikkus, tavaliselt üks päev). Keskmine arengu kiirus nõu kohta (

) arvutatakse järgmise võrrandi alusel:

kus
|

– |
keskmine arengu kiirus nõu i kohta
|
|
i
|
kontrollidevahemiku indeks;
|
|
m
|
kontrollivahemike maksimaalne arv
|
|
fi –
|
kontrollivahemikul i väljaarenenud sääskede arv
|
|
ne
|
eksperimendi lõpuks väljaarenenud sääskede koguarv (Σfi
)
|
|
xi
|
ajavahemikul i väljaarenenud sääskede arengu kiirus,
|

kus:
|
päevi
|
kontrolli päev (päevade arv pärast vastsete sisestamist katsesse)
|
|
li
|
kontrollivahemiku i pikkus (päevades, tavaliselt 1 päev).
|
|
Sooline jaotumine
|
52.
|
Soolist jaotumist kirjeldavad binaarsed-andmed ja seepärast tuleks seda hinnata Fisheri täpse testi või muude sobivate meetoditega. C. riparius'e looduslik sugude suhtarv on 1, st isas- ja emasloomade arv on võrdne. Mõlemas põlvkonnas tuleks soolise jaotumise andmeid töödelda ühte moodi. Kuna sääskede maksimaalne arv nõus (st 20) on korraliku statistilise analüüsi jaoks liiga väike, leitakse kõikidest ühe kontsentratsiooni paralleelkatsetest väljaarenenud elusate isas- ja emassääskede summaarsed arvud. Neid teisendamata andmeid võrreldakse (lahusti) kontrolli või koondatud kontrolli andmetega 2 × 2 kooslustabelis.
|
Paljunemine
|
53.
|
Paljunemist hinnatakse sigivuse kaudu, mida iseloomustatakse munanööride arvuga emassääse kohta. Täpsemalt, paljunduspuuris munetud munanööride arv jagatakse elusate ja kahjustamata emassääskede arvuga, kes viidi sellesse puuri. Sigivusele täheldatavat toimet mitteavaldava kontsentratsiooni (NOEC) võib määrata ANOVA meetoditega, nt Dunnetti või Williamsi testiga.
|
|
54.
|
Munanööride fertiilsust kasutatakse selleks, et määrata viljakate munade arv ühe emassääse kohta. Paljunduspuuris munetud fertiilsete munanööride arv jagatakse elusate ja kahjustamata emassääskede arvuga, kes viidi sellesse puuri. Viljakusele täheldatavat toimet mitteavaldava kontsentratsiooni (NOEC) võib määrata ANOVA meetoditega, nt Dunnetti või Williamsi testiga.
|
Katseprotokoll
|
55.
|
Katseprotokollis esitatakse järgmine teave:
|
|
Uuritav kemikaal:
|
—
|
füüsikaline olek ja füüsikalis-keemilised omadused (lahustuvus vees, aururõhk, log K
ow, jaotuskoefitsient mullas (või settes, kui see on määratud), stabiilsus vees ja settes jne);
|
|
—
|
kemikaali identifitseerimisandmed (tavanimetus, keemiline nimetus, struktuurivalem, CASi number jne), sh puhtus ja uuritava kemikaali kvantitatiivse määramise meetod.
|
|
|
|
Katseliik:
|
—
|
kasutatud katseorganismid: liik, teaduslik nimetus, organismide päritolu ja kasvatustingimused;
|
|
—
|
teave selle kohta, kuidas munamasse ja vastseid käideldi;
|
|
—
|
teave 1. põlvkonna väljaarenenud valmikute käitlemise kohta (imuri vms abil) (vt 5. liide);
|
|
—
|
katseorganismide vanus 1. ja 2. põlvkonna katsenõudesse viimise ajal.
|
|
|
|
Katsetingimused:
|
—
|
kasutatud sete, s.o looduslik või spetsiaalselt koostatud (kunstlik) sete;
|
|
—
|
looduslik sete: setteproovide võtmise koha asukoht ja kirjeldus, kaasa arvatud saastelugu (võimaluse korral); sette omadused: pH, orgaanilise süsiniku sisaldus, süsiniku-lämmastiku suhe ja granulomeetria (kui see on asjakohane);
|
|
—
|
spetsiaalselt koostatud sete: sette valmistamine, koostisosad ja omadused (orgaanilise süsiniku sisaldus, pH, niiskus jne, mis määrati katse alguses);
|
|
—
|
katsevee valmistamine (kui kasutatakse taastatud vett) ja omadused (hapnikusisaldus, pH, karedus jne, mis määrati katse alguses);
|
|
—
|
settekihi paksus ja seda katva veekihi paksus katsenõudes ja kristallisaatoris;
|
|
—
|
katva veekihi ja poorivee ruumala; märja settekihi mass koos pooriveega ja ilma pooriveeta katsenõudes ja kristallisaatoris;
|
|
—
|
katsenõud (materjal ja suurus);
|
|
—
|
kristallisaatorid (materjal ja suurus);
|
|
—
|
paljunduspuurid (materjal ja suurus);
|
|
—
|
põhilahuse valmistamise meetod ja uuritud kontsentratsioonide saamine katsenõudes ja kristallisaatorites;
|
|
—
|
uuritava kemikaali viimine katsenõudesse ja kristallisaatoritesse: kasutatud kontsentratsioonid, paralleelkatsete arv ja lahusti, vajaduse korral;
|
|
—
|
katsenõude inkubatsiooni tingimused: temperatuur, valgustusperiood ja valguse intensiivsus, aereerimine (mulle sekundis);
|
|
—
|
inkubatsioonitingimused paljunduspuurides ja kristallisaatorites: temperatuur, valgustusperiood ja valguse intensiivsus;
|
|
—
|
munanööride inkubeerimise tingimused mikrotiiterplaatidel (vm nõudes): temperatuur, valgustusperiood ja valguse intensiivsus;
|
|
—
|
üksikasjalik teave söötmise kohta, sh sööda tüüp, valmistamine, kogus ja söötmise ajakava.
|
|
|
|
Tulemused:
|
—
|
uuritava aine nimikontsentratsioonid, mõõdetud kontsentratsioonid ja kõigi analüüside tulemused, millega määrati uuritava kemikaali kontsentratsiooni katsenõus ja kristallisaatoris;
|
|
—
|
vee kvaliteet katsenõus ja kristallisaatoris, s.o pH, temperatuur, lahustunud hapnik, karedus ja ammoniaak;
|
|
—
|
aurustunud katsevee asendamine katsenõus, kui seda tehti;
|
|
—
|
väljaarenenud isas- ja emassääskede arv iga 1. ja 2. põlvkonna nõu ja iga päeva kohta;
|
|
—
|
elusate ja väljaarenenud sääskede sooline jaotumine igal katses kasutatud kontsentratsioonil 1. ja 2. põlvkonnas;
|
|
—
|
iga 1. ja 2. põlvkonna nõu kohta nende vastsete arv, kellest sääski ei arenenud;
|
|
—
|
1. ja 2. põlvkonnas väljaarenemise protsent/osakaal iga paralleelkatse ja kontsentratsiooni kohta (isas- ja emassääsed kokku);
|
|
—
|
1. ja 2. põlvkonnas elusate ja väljaarenenud sääskede keskmine arengukiirus igas paralleelkatses ja igal kontsentratsioonil (isas- ja emassääsed eraldi ja ka koos);
|
|
—
|
kristallisaatorisse munetud munanööride arv paljunduspuuri ja iga päeva kohta;
|
|
—
|
iga munanööri kirjeldus (suurus, kuju ja viljakus);
|
|
—
|
sigivus – munanööride üldarv paljunduspuuridesse pandud emassääskede üldarvu kohta;
|
|
—
|
viljakus – viljakate munanööride üldarv paljunduspuuridesse pandud emassääskede üldarvu kohta;
|
|
—
|
mürgisuse näitajate hinnangud, näiteks ECx (ja selle usaldusvahemik), täheldatavat toimet mitteavaldav kontsentratsioon (NOEC) ja selle määramiseks kasutatud statistilised meetodid;
|
|
—
|
tulemuste arutelu, kaasa arvatud käesolevast metoodikast kõrvalekaldumise võimalik mõju katsetulemustele.
|
|
|
KIRJANDUS
|
(1)
|
Käesoleva lisa peatükk C.28 „Sette-vee mürgisuskatse surusääsklastel rikastatud vee kasutamisega”.
|
|
(2)
|
Shobanov, N.A., Kiknadze, I.I. and M.G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311–322.
|
|
(3)
|
Fleming, R. et al. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. August 1994. WRc, UK.
|
|
(4)
|
SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, From the WOSTA Workshop held in the Netherlands.
|
|
(5)
|
ASTM International (2009), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
(6)
|
Environment Canada (1997), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, December 1997.
|
|
(7)
|
US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, Second edition, EPA 600/R-99/064, March 2000, Revision to the first edition dated June 1994.
|
|
(8)
|
US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates.
|
|
(9)
|
US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment toxicity Test.
|
|
(10)
|
Milani, D., Day, K.E., McLeay, D.J. and R.S. Kirby (1996), Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canada.
|
|
(11)
|
Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R. and C.D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662-2674.
|
|
(12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. and L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221-230.
|
|
(13)
|
Sugaya, Y. (1997), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345-350.
|
|
(14)
|
Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47-57.
|
|
(15)
|
Käesoleva lisa peatükk C.27 „Sette-vee mürgisuskatse surusääsklastel rikastatud sette kasutamisega”.
|
|
(16)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000)6, OECD, Paris.
|
|
(17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. and M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
(18)
|
Environment Canada. (1995), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, September 1995.
|
|
(19)
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. and J. Oehlmann (2005), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: 353-361.
|
|
(20)
|
Suedel, B.C. and J.H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163-1175.
|
|
(21)
|
Naylor, C. and C. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291-3303.
|
|
(22)
|
Dunnett, C.W. (1964), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096-1121.
|
|
(23)
|
Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: 482-491.
|
|
(24)
|
Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117.
|
|
(25)
|
Williams, D.A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28: 510-531.
|
|
(26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L. and H.M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94-102.
|
|
(27)
|
Rao, J.N.K. and A.J. Scott (1992), A simple method for the analysis of clustered binary data. Biometrics, 48: 577-585.
|
|
(28)
|
Christensen, E.R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213-221.
|
|
(29)
|
Bruce, R.D. and D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485-1494.
|
|
(30)
|
Slob, W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298-312.
|
|
(31)
|
OECD (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No. 54, 146 pp., ENV/JM/MONO(2006)18, OECD, Paris.
|
|
(32)
|
Benoit, D.A., Sibley, P.K., Juenemann, J.L. and G.T. Ankley (1997), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165-1176.
|
|
(33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. and J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) – baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: 1-9.
|
|
(34)
|
OECD (2010), Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OECD, Paris.
|
1. liide
Mõisted
Käesolevas katsemeetodis kasutatakse järgmisi mõisteid järgmises tähenduses:
Kemikaal
– aine või segu.
Spetsiaalselt koostatud sete ehk taastatud, tehislik või sünteetiline sete– selline materjalide segu, mida kasutatakse loodusliku sette füüsiliste koostisosade imiteerimiseks.
Kattev veekiht
– vesi, mis on pandud katsenõus sette peale.
Poorivesi
– vesi, mis asub sette- ja pinnaseosakeste vahelises ruumis.
Rikastatud vesi
– katses kasutatav vesi, millele on lisatud uuritav kemikaal.
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil.
2. liide
Chironomus riparius'e kasvatamist käsitlevad soovitused
|
1.
|
Chironomus'e vastseid võib kasvatada kristallisatsiooninõus või suuremas mahutis. Mahuti põhi kaetakse ligikaudu 5–10 mm paksuse peene kvartsliiva kihiga. Diatomiit (näiteks Merck, Art 8117) on samuti tõendatult sobiv substraat (piisab õhemast kihist, isegi mõnest millimeetrist). Seejärel lisatakse sobivat vett mitme cm paksuse kihina. Vett tuleks vajaduse korral lisada aurumiskadude asendamiseks ja kuivamise vältimiseks. Vee võib vajaduse korral välja vahetada. Tuleks tagada kerge aereerimine. Vastsete kasvatamise nõusid tuleks hoida sobivas puuris, mis takistab väljaarenenud täiskasvanud isendite väljapääsu. Puur peaks olema piisavalt suur, et võimaldada väljaarenenud valmikute parvedesse kogunemist, vastasel juhul ei pruugi toimuda paljunemist (miinimumsuurus on ligikaudu 30 × 30 × 30 cm).
|
|
2.
|
Puure tuleks hoida toatemperatuuril või püsiva keskkonnaga ruumis temperatuuril 20 ± 2 °C 16-tunnise valgustusperioodiga (intensiivsus ligikaudu 1 000 luksi) ja 8 tunni pimedusega. On teada, et vähem kui 60 %-line suhteline õhuniiskus võib paljunemist takistada.
|
Lahjendusvesi
|
3.
|
Võib kasutada mis tahes looduslikku või sünteetilist vett. Enamasti kasutatakse kaevuvett, deklooritud kraanivett ja tehislikke kasvukeskkondi (näiteks Elendti kasvukeskkond M4 või M7, vt allpool). Vett tuleks enne kasutamist aereerida. Vajaduse korral võib kultuuri kasvuvett uuendada, eemaldades kasutatud vee kultuuri kasvunõudest ettevaatlikult valamise teel või sifooniga, kahjustamata vastsete kestasid.
|
Vastsete söötmine
|
4.
|
Chironomus'e vastseid tuleks sööta helbelise kalasöödaga (Tetra Min®, Tetra Phyll® või muu samalaadne kaubanduslik kalasööda tootemark) koguses ligikaudu 250 mg nõu kohta päevas. Sööta võib anda kuiva jahvatatud pulbrina või suspensioonina vees: 1,0 g helbelist kalasööta lisatakse 20 ml lahjendusveele ja see segatakse homogeense segu saamiseni. Seda preparaati võib sööta koguses 5 ml nõu kohta päevas (loksutage enne kasutamist). Vanemad vastsed võivad vajada rohkem sööta.
|
|
5.
|
Söötmist kohandatakse vee kvaliteediga. Kui kultuuri kasvukeskkond muutub häguseks, tuleks sööda hulka vähendada. Sööda lisamist tuleks hoolikalt jälgida. Liiga vähe sööta põhjustab vastsete rände veesamba suunas ning liiga palju sööta hoogustab mikroobide tegevust ja vähendab vee hapnikusisaldust. Mõlemad tingimused võivad vähendada kasvu kiirust.
|
|
6.
|
Uute kultuuri kasvunõude valmisseadmisel võib lisada ka mõne rohevetika (näiteks Scenedesmus subspicatus, Chlorella vulgaris) rakke.
|
Väljaarenenud valmikute söötmine
|
7.
|
Mõned teadlased on soovitanud väljaarenenud valmikute söötmiseks kasutada küllastunud sahharoosilahuses niisutatud puuvillast lappi.
|
Väljaarenemine
|
8.
|
Temperatuuril 20 ± 2 °C hakkavad ligikaudu 13–15 päeva möödumisel vastsete kasvatamise nõudest väljuma valmikud. Isased on tänu sulgjatele tundlatele ja kõhnemale kehale kergesti äratuntavad.
|
Munamassid
|
9.
|
Kui valmikud on paljunduspuuris, tuleks kõiki vastsete kasvatamise nõusid kontrollida kolm korda nädalas sinna želatiinjate munamasside lisandumise suhtes. Kui leitakse munamass, tuleks see hoolikalt kõrvaldada. See tuleks üle kanda väiksele tassile, mis sisaldab paljundusvee proovi. Munamasse kasutatakse uue kasvunõu kasutusele võtmiseks (näiteks 2–4 munamassi nõu kohta) või mürgisuse katsetes.
|
|
10.
|
Esimese kasvujärgu vastsed peaksid kooruma 2–3 päeva pärast.
|
Uute kasvunõude ülesseadmine
|
11.
|
Kui kultuurid on loodud, peaks iga nädal (või katsenõuetest olenevalt väiksema sagedusega) olema võimalik vastsete uute kasvunõude ülesseadmine, kõrvaldades vanemad nõud pärast täiskasvanud sääskede väljaarenemist. Seda süsteemi kasutades saadakse minimaalse vaevaga regulaarne valmikute varu.
|
Katselahuste M4 ja M7 valmistamine
|
12.
|
Elendt (1990) on kirjeldanud kasvukeskkonda M4. Kasvukeskkond M7 valmistatakse samal viisil kui kasvukeskkond M4, v.a tabelis 1 nimetatud ainete puhul, mille kontsentratsioon kasvukeskkonnas M7 on kasvukeskkonnaga M4 võrreldes neli korda madalam. Katselahust ei tohiks koostada Elendti ja Biasi (1990) järgi, kuna põhilahuste valmistamiseks ei ole antud NaSiO3 · 5H2O, NaNO3, KH2PO4 ja K2HPO4 kontsentratsioon sobiv.
|
Kasvukeskkonna M7 valmistamine
|
13.
|
Iga põhilahus (I) valmistatakse eraldi ja kombineeritud põhilahus (II) valmistatakse kõnealustest põhilahustest (I) (vt tabel 1). Kasvukeskkonna M7 valmistamiseks võetakse 50 ml kombineeritud põhilahust (II), lisatakse iga makrotoitaine põhilahuse kogused, mis on esitatud tabelis 2, ja täiendatakse deioniseeritud veega 1 liitrini. Vitamiinide põhilahuse valmistamiseks lisatakse deioniseeritud veele kolme vitamiini, nagu on näidatud tabelis 3, ja lõplikule M7 kasvukeskkonnale lisatakse vahetult enne selle kasutamist 0,1 ml kombineeritud vitamiinide põhilahust. Vitamiinide põhilahust säilitatakse külmutatult väikeste alikvootidena. Kasvukeskkonda aereeritakse ja see stabiliseeritakse.
|
Tabel 1.
Kasvukeskkondade M4 ja M7 mikroelementide põhilahused
|
Põhilahus (I)
|
Kogus (mg), mis täiendatakse deioniseeritud veega 1 liitrini
|
Kombineeritud põhilahuse (II) valmistamiseks: segage põhilahuste (I) järgmised kogused (ml) ja täiendage need deioniseeritud veega 1 liitrini
|
Lõppkontsentratsioonid katselahustes (mg/l)
|
|
M 4
|
M 7
|
M 4
|
M 7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7H2O (25)
(26)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tabel 2.
Kasvukeskkondade M4 ja M7 makrotoitainete põhilahused
|
|
Kogus, mis täiendatakse deioniseeritud veega 1 liitrini
(mg)
|
Kasvukeskkonna M4 ja M7 valmistamiseks lisatav makrotoitainete põhilahuste kogus
(ml/l)
|
Lõppkontsentratsioonid katselahustes M4 ja M7
(mg/l))
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCI
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabel 3.
Kasvukeskkondade M4 ja M7 vitamiinide põhilahus
Ühe vitamiinide põhilahuse valmistamiseks valatakse kokku kõik kolm vitamiinilahust.
|
|
Kogus, mis täiendatakse deioniseeritud veega 1 liitrini
(mg)
|
Kasvukeskkonna M4 ja M7 valmistamiseks lisatav vitamiinide põhilahuse kogus
(ml/l)
|
Lõppkontsentratsioonid katselahustes M4 ja M7
(mg/l))
|
|
Tiamiinvesinikkloriid
|
750
|
0,1
|
0,075
|
|
Tsüanokobalamiin (B12)
|
10
|
0,1
|
0,0010
|
|
Biotiin
|
7,5
|
0,1
|
0,00075
|
KIRJANDUS
BBA (1995), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, Edited by M. Streloke and H. Köpp. Berlin.
Elendt, B.P. (1990), Selenium deficiency in Crustacea, Protoplasma, 154: 25-33.
Elendt, B.P. and W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157-1167.
3. liide
Spetsiaalselt koostatud sette valmistamine
SETTE KOOSTIS
Spetsiaalselt koostatud sette koostis peaks olema järgmine:
|
Koostisosa
|
Kirjeldus
|
Sette kuivmassi protsent
|
|
Turvas
|
Turbasamblaturvas, mille pH on võimalikult lähedal vahemikule 5,5–6,0, nähtavad taimeosad puuduvad, peeneks jahvatatud (osakese suurus ≤ 1 mm) ja õhu käes kuivatatud
|
4–5
|
|
Kvartsliiv
|
Tera suurus: > 50 % osakestest peaksid olema vahemikus 50–200 μm
|
75–76
|
|
Kaoliinsavi
|
Kaoliniidisisaldus ≥ 30 %
|
20
|
|
Orgaaniline süsinik
|
Reguleeritakse turba ja liiva lisamisega
|
2 (± 0,5)
|
|
Kaltsiumkarbonaat
|
CaCO3, pulbriline, keemiliselt puhas
|
0,05–0,1
|
|
Vesi
|
Juhtivus ≤ 10 μS/cm
|
30–50
|
VALMISTAMINE
Turvas kuivatatakse õhu käes ja jahvatatakse peeneks pulbriks. Valmistatakse vajaliku turbapulbrikoguse suspensioon deioniseeritud vees, kasutades tõhusat homogenisaatorit. Selle suspensiooni pH reguleeritakse CaCO3 abil vahemikku 5,5 ± 0,5. Suspensiooni konditsioneeritakse vähemalt kaks päeva temperatuuril 20 ± 2 °C kerge segamisega, et stabiliseerida pH ja luua stabiilne mikroobikomponent. pH mõõdetakse uuesti ja see peaks olema 6,0 ± 0,5. Seejärel segatakse turba suspensioon muude koostisosadega (liiv ja kaoliinsavi) ning deioniseeritud veega, et saada homogeenne sete, mille veesisaldus on vahemikus 30–50 % sette kuivmassist. Lõpliku segu pH mõõdetakse uuesti ja reguleeritakse vajaduse korral CaCO3 abil vahemikku 6,5–7,5. Kuivmassi ja orgaanilise süsiniku sisalduse määramiseks võetakse sette proovid. Enne, kui spetsiaalselt koostatud setet kasutatakse surusääsklastele mürgisuse katses, on soovitatav seda seitsme päeva jooksul konditsioneerida samades tingimustes, mis valdavalt esinevad edasise katse käigus.
SÄILITAMINE
Tehisliku sette valmistamiseks kasutatavaid kuivi koostisosi võib säilitada kuivas ja jahedas kohas toatemperatuuril. Spetsiaalselt koostatud (märga) setet ei tohiks enne selle katses kasutamist säilitada. Seda tuleks kasutada viivitamata pärast seitsmepäevast kohandamisperioodi, millega selle valmistamine lõpetatakse.
KIRJANDUS
OECD (1984), Earthworm, Acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OECD, Paris.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. and B. Streit (1998), Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10-20.
4. liide
Kasutuskõlbliku lahjendusvee keemilised omadused
|
KOOSTISOSA
|
KONTSENTRATSIOONID
|
|
Tahked osakesed
|
< 20 mg/l
|
|
Orgaanilise süsiniku kogusisaldus
|
< 2 mg/l
|
|
Ioniseerimata ammoniaak
|
< 1 μg/l
|
|
Karedus CaCO3-na
|
< 400 mg/l (27)
|
|
Jääkkloor
|
< 10 μg/l
|
|
Fosfororgaaniliste pestitsiidide üldsisaldus
|
< 50 ng/l
|
|
Kloororgaaniliste pestitsiidide ja polüklooritud bifenüülide üldsisaldus
|
< 50 ng/l
|
|
Orgaanilise kloori üldsisaldus
|
< 25 ng/l
|
5. liide
Juhised katse tegemiseks
Paljunduspuuri näide:

|
A
|
:
|
ažuurne riie puuri peal ja vähemalt ühel küljel (võrgusilma suurus ca 1 mm)
|
|
B
|
:
|
ava väljaarenenud valmikute puuri panemiseks ja munetud munanööride väljavõtmiseks kristallisaatorist (ei ole näidatud sellel pildil).
|
|
C
|
:
|
paljunduspuuri mõõtmed on vähemalt 30 × 30 × 30 cm (pikkus × laius × kõrgus).
|
Katsenõu näide:

|
A
|
:
|
Pasteuri pipett katva veekihi aereerimiseks
|
|
B
|
:
|
klaaskaas, et hoida ära väljaarenenud sääskede väljapääsemine
|
|
C
|
:
|
vee pinnakiht
|
|
D
|
:
|
katsenõu (vähemalt 600 ml keeduklaas)
|
|
E
|
:
|
settekiht
|
Imur sääsevalmikute püüdmiseks (nooled näitavad õhuvoolu suunda):

|
A
|
:
|
klaastoru (sisediameeter ligikaudu 5 mm), mis on ühendatud ise-eeltäituva imipumbaga
|
|
B
|
:
|
vulkaniseeritud kummist kork, läbi mille läheb klaastoru A. Seestpoolt on klaastoru A avaus kaetud vati ja marliga (võrgusilma suurus ligikaudu 1 mm2), et vältida sääskede kahjustamist imurisse tõmbamisel.
|
|
C
|
:
|
läbipaistev nõu (plastikust või klaasist, pikkus ligikaudu 15 cm) kogutud sääskede jaoks.
|
|
D
|
:
|
vulkaniseeritud kummist kork, läbi mille läheb toru E. Sääskede lahtilaskmiseks paljunduspuuri võetakse nõult C ära kork D.
|
|
E
|
:
|
plastikust või klaasist toru (sisediameeter ligikaudu 8 mm) valmikute kogumiseks katsenõust.
|
Elutsüklit hõlmava katse skeem:

|
A
|
:
|
1. põlvkond – katsenõud, mis sisaldavad sette-vee süsteemi, 8 paralleelkatset, 20 esimese kasvujärgu vastset igasse nõusse
|
|
B
|
:
|
neli katsenõud paljunduspuuri kohta, A ja B
|
|
C
|
:
|
paljunduspuurid (A ja B) valmikute parvedesse kogunemiseks, paaritumiseks ja munemiseks
|
|
D
|
:
|
kristallisaatorid munanööride paigutamiseks
|
|
E
|
:
|
mikrotiiterplaat, üks süvend iga munanööri jaoks
|
|
F
|
:
|
2. põlvkond – katsenõud, mis sisaldavad sette-vee süsteemi, 8 paralleelkatset, 20 esimese kasvujärgu vastset igasse nõusse
|
C.41. KALADE SUGULISE ARENGU KATSE
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 234 (2011). See põhineb ühel 1998. aasta otsusel töötada välja uued või ajakohastada olemasolevad katsemeetodid, millega saaks välja sõeluda võimalikke endokriinsüsteemi kahjustajaid. Kalade sugulise arengu katse (Fish Sexual Development Test, FSDT) tunnistati paljulubavaks katsemeetodiks, millega on hõlmatud nii östrogeeni- kui ka androgeenisarnaste kemikaalide toime suhtes tundlikud kalade arengu eluetapid. Katsemeetod läbis laboritevahelise valideerimise ajavahemikul 2006-2010, mille käigus valideeriti jaapani riisikala (Oryzias latipes), vöötdaanio (Danio rerio) ja ogalik (Gasterosteus aculeatus) ning osaliselt valideeriti tüse tömpnina (Pimephales promelas) (41, 42, 43). Käesolevas katsejuhendis on käsitletud jaapani riisikala, ogalikku ja vöötdaaniot. Käesoleva katse-eeskirjaga põhimõtteliselt laiendatakse OECD katsejuhendit 210 (Mürgisuse katse varases elujärgus kaladega) (1), mille puhul jätkatakse kalade kokkupuudet kemikaaliga kuni nende seksuaalse diferentseerumiseni, s.t ligikaudu 60. päevani pärast koorumist (days post-hatch, dph) jaapani riisikala, ogaliku ja vöötdaanio puhul (muude, edaspidi valideeritavate liikide puhul võib kokkupuuteaeg olla lühem või pikem), ning lisatakse sisesekretsiooni suhtes tundlikke näitajaid. Kalade sugulise arengu katsega hinnatakse oletatavate endokriinsüsteemi kahjustavate kemikaalide (nt östrogeenid, androgeenid ja steroidogeneesi inhibiitorid) mõju ja võimalikke kahjulikke tagajärgi kalade sugulisele arengule varasel eluetapil. Kahe tähtsaima endokriinsüsteemi näitaja, vitellogeniini kontsentratsiooni ja fenotüübi soolise jaotumise suhtarvu määramise kombinatsioon võimaldab selle katsega määrata uuritava kemikaali toimemehhanismi. Tänu fenotüübilise soolise jaotumise populatsioonist sõltuvale muutumisele saab kalade sugulise arengu katset kasutada ohtude ja riskide hindamiseks. Siiski, kui katse tehakse ohu või riski hindamiseks, ei tohiks valida ogalikku, kuna senised valideerimisandmed on näidanud, et selle liigi korral on fenotüübilise soolise jaotumise muutused uuritavate kemikaalide toimel olnud ebatavalised.
|
|
2.
|
Katse-eeskiri põhineb kalade vee kaudu kokkupuutesse viimisel uuritavate kemikaalidega sugulise arengu labiilse perioodi jooksul, kus kala peaks olema kõige tundlikum seksuaalset arengut häirivate ja endokriinsüsteemi kahjustavate kemikaalide mõju suhtes. Mõõdetakse endokriinsüsteemist tingitud arenguhäirete kaht peamist näitajat – vitellogeniini kontsentratsiooni ja sugunäärmete histoloogia põhjal soolise jaotumise suhtarve. Sugunäärmete histopatoloogia (munarakkude ja spermatogeneesi määravate rakkude hindamine ja etappidesse jaotamine) on valikuline. Lisaks määratakse geneetiline sugu kui võimalik (nt Jaapani riisikala ja ogaliku puhul). Geneetiliste soomarkerite olemasolu on suur eelis, kuna see suurendab soolise jaotumise statistika võimsust ja võimaldab kindlaks teha individuaalset fenotüübilist soo arengu pöördumist. Muud apikaalsed näitajad, mis tuleks mõõta, on koorumise kiirus, elulemus, pikkus ja kehamass. Meetodit võib kohandada muudele liikidele kui eespool nimetatud, tingimusel et muu liik on läbinud valideerimise, mis on võrdne jaapani riisikala, ogaliku ja vöötdaanio puhul tehtuga, et kontrollrühma kalad on katse lõpuks sooliselt diferentseerunud, et vitellogeniini tase on piisavalt kõrge, et uuritava kemikaali põhjustatud muutused oleksid avastamiseks piisavalt suured, ja et katsesüsteemi tundlikkus on kontrollitud endokriinsüsteemi mõjutavate võrdluskemikaalidega ((anti-)östrogeenid, (anti-)androgeenid, aromataasi inhibiitorid jne). Lisaks sellele peaksid kõik muu liigiga tehtud kalade sugulise arengu katse valideerimisaruanded olema OECD poolt läbi vaadatud ja valideerimise tulemus tunnistatud rahuldavaks.
|
Lähtekaalutlused ja piirangud
|
3.
|
Vitellogeniini sünteesitakse tavaliselt munevate selgroogsete emasloomade maksas vastuseks veres ringlevale endogeensele östrogeenile (2). See on munarebu valkude eelkäija ja pärast sünteesimist maksas liigub ta verega munasarjadesse, kus see seotakse ja seda modifitseeritakse munade arengu käigus. Vitellogeniini süntees on väga piiratud (kuigi siiski avastatav) ebaküpsetes kalades ja isaskalades, kuna nende vereringes ei ole piisavalt östrogeeni. Kuid maks on võimeline seda sünteesima ja verre eritama vastuseks eksogeense östrogeeniga stimuleerimisele (3, 4, 5).
|
|
4.
|
Vitellogeniini mõõtmist kasutatakse östrogeensete, antiöstrogeensete, androgeense toimemehhanismiga ja steroidogeneesi segavate uuritavate kemikaalide, näiteks aromataasi inhibiitorite avastamiseks. Östrogeensete kemikaalide avastamine on võimalik vitellogeniini indutseerimise mõõtmisega isaskalades ja see on teaduslikes eelretsenseeritud ajakirjades hästi tõendatud. Vitellogeniini induktsioon on tõendatud pärast kokkupuudet aromatiseeritavate androgeenidega (6, 7). Kui emasloomade veres vähendatakse östrogeeni taset, näiteks sellega, et inhibeeritakse ensüüm aromataasi, mis muundab endogeense androgeeni looduslikuks östrogeeniks 17β-östradiooliks, põhjustab see vitellogeniini kontsentratsiooni vähenemise, mida kasutatakse selliste kemikaalide kindlakstegemiseks, mis inhibeerivad aromataasi või laiemalt üldse steroidogeneesi (33). Pärast kokkupuudet östrogeeniga või aromataasi inhibiitoriga vitellogeniini tasemes ilmneva muutuse bioloogiline olulisus on hästi tõendatud (8, 9). Siiski on võimalik, et vitellogeniini sünteesi emaskalades võib mõjutada ka kemikaali üldine mürgisus ja muu kui endokriinse mehhanismi kaudu avalduv mürgisus.
|
|
5.
|
Välja on töötatud mitmed mõõtmismeetodid, mis on standarditud igapäevaseks kasutamiseks vitellogeniini taseme mõõtmisel üksikult kalalt võetud vere-, maksa-, kogu keha või pea/saba homogenaadi proovides. See kehtib vöötdaanio, ogaliku ja jaapani riisikala puhul, samuti osaliselt valideeritud tüseda tömpnina puhul; vitellogeniini immunokeemiliseks mõõtmiseks on kättesaadavad liigispetsiifilised ensüümimmuunsorptsioonanalüüsi (ELISA) meetodid (5, 10, 11, 12, 13, 14, 15, 16). Jaapani riisikala ja vöötdaanio puhul on hea korrelatsioon vereplasma-, maksa- ja homogenaadiproovides mõõdetud vitellogeniinisisalduse vahel, kuigi homogenaadis kipub sisaldus olema mõnevõrra väiksem kui plasmas (17, 18, 19). 5. liites on esitatud soovitatavad proovivõtumeetodid vitellogeniini määramiseks.
|
|
6.
|
Fenotüübikohase soolise jaotumise (sugudevahelise suhte) muutus on näitaja, mis iseloomustab soo arengu pöördumist. Põhimõtteliselt võivad arenevate kalade sugu mõjutada östrogeeni, antiöstrogeeni, androgeeni, antiandrogeeni või steroidogeneesi inhibiitori omadustega kemikaalid (20). On näidatud, et soo arengu pöördumine on vöötdaanio korral osaliselt pöörduv (21) pärast kokkupuudet östrogeenisarnase kemikaaliga, samas kui soo arengu pöördumine pärast kokkupuudet androgeenisarnase kemikaaliga on püsiv (30). Sugu on määratletud järgmiselt: emane, isane, vahesugu (interseksuaal; ühes sugunäärmes on nii ovotsüüte kui ka spermatogeneesi rakke) või diferentseerumata, mis määratakse kala sugunäärmete individuaalse histoloogilise uuringuga. Juhendid on esitatud 7. liites ja OECD juhenddokumendis „Guidance Document on the Diagnosis of Endocrine-Related Histopathology of Fish Gonads” (Juhenddokument kalade endokriinsüsteemiga seotud sugunäärmete histopatoloogia diagnoosimiseks) (22).
|
|
7.
|
Geneetilist sugu uuritakse geneetiliste markerite kaudu, kui need on kõnealusel kalaliigil olemas. Jaapani riisikala emase XX- või isase XY-geene saab määrata polümeraasi ahelreaktsiooni (PCR) abil või Y-kromosoomiga seotud DM-domeeni geeni määramisega (DMY-negatiivne või -positiivne), nagu on kirjeldatud töödes (23, 24). Ogaliku puhul on olemas samaväärne PCR-meetod geneetilise soo määramiseks, mida on kirjeldatud 10. liites. Kui geneetilist sugu saab individuaalselt siduda fenotüübikohase sooga, suureneb testi tõhusus, ja seepärast tuleks geneetilist sugu määrata liikidel, kelle jaoks on dokumenteeritud geneetilise soo markerid.
|
|
8.
|
Kaks peamist endokriinsüsteemi iseloomustavat näitajat, vitellogeniin ja sooline jaotumine), võimaldavad koos kindlaks määrata kemikaali endokriinse toimemehhanismi (tabel 1). Sooline jaotumine on populatsiooni asjakohane biomarker (25, 26) ja teatavate hästi uuritud toimemehhanismide puhul saab kalade sugulise arengu katse tulemusi kasutada ohtude ja riskide hindamiseks, kui reguleeriv asutus peab seda vajalikuks. Need toimemehhanismid on praeguse seisuga östrogeenid, androgeenid ja steroidogeneesi inhibiitorid.
Tabel 1.
Endokriinsete näitajate muutumine mitmesuguse toimemehhanismiga kemikaalide mõjul:
VTG – vitellogeniin, ↑ – suureneb, ↓ – väheneb, „—” – ei ole uuritud
|
Toimemehhanism
|
VTG ♂
|
VTG ♀
|
Sooline jaotumine
|
Viited
|
|
Nõrk östrogeeni agonist
|
↑
|
↑
|
↑♀ või ↑dif-mata
|
(27, 40)
|
|
Tugev östrogeeni agonist
|
↑
|
↑
|
↑♀ või ↑dif-mata, mitte ♂
|
(28, 40)
|
|
Östrogeeni antagonist
|
—
|
—
|
↑♀, ↑dif-mata
|
(29)
|
|
Androgeeni agonist
|
↓ või —
|
↓ või —
|
↑ ♂, mitte ♀
|
(28, 30)
|
|
Androgeeni antagonist
|
—
|
—
|
↑♀
↑vahesugu
|
(31)
|
|
Aromataasi inhibiitor
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
Kalade sugulise arengu katse ei hõlma kalade paljunemise eluperioodi, seepärast tuleks kemikaali, mis võib mõjutada viljakust madalamal kontsentratsioonil, kui kasutatakse seksuaalse arengu katses, uurida katses, mis hõlmab paljunemist.
|
|
10.
|
Käesolevas katsemeetodis kasutatud mõisted on määratletud 1. liites.
|
|
11.
|
Kalade sugulise arengu in vivo katse eesmärk on teha kindlaks androgeensete või östrogeensete ning samuti antiandrogeensete, antiöstrogeensete ja steroidogeneesi inhibeerivate omadustega kemikaale. Kalade sugulise arengu katse valideerimise faasid (1 ja 2) hõlmasid östrogeenseid, androgeenseid ja steroidogeneesi pärssivaid kemikaale. Östrogeeni ja androgeeni antagonistide mõju kalade sugulise arengu katsele võib näha tabelist 1, kuid nende toimemehhanisme on senini vähem uuritud.
|
KATSE PÕHIMÕTE
|
12.
|
Katses viiakse kalamaimud, alates äsja viljastatud marjateradest kuni sugulise diferentseerumise lõpuni, kokkupuutesse vees lahustatud uuritava kemikaali vähemalt kolme kontsentratsiooniga. Tuleks kasutada läbivooluga katset, välja arvatud juhtudel, kus see ei ole võimalik kemikaali kättesaadavuse või omaduste, nt piiratud lahustuvuse tõttu. Katse algab värskelt viljastatud marjaterade (enne looteketta jagunemist) panemisega katsekambritesse. Kambrite täitmist iga kalaliigi puhul on kirjeldatud punktis 27. Valideeritud kalaliikide (jaapani riisikala, ogalik ja vöötdaanio) puhul lõpetatakse katse 60. päeval pärast koorumist. Katse lõpus surmatakse kõik kalad humaansel viisil. Igast kalast võetakse bioloogiline proov (vereplasma, maksa või pea/saba homogenaat) vitellogeniini määramiseks ja ülejäänud osa fikseeritakse sugunäärmete histoloogiliseks hindamiseks, et määrata fenotüübikohane sugu; soovi korral võib teha histopatoloogia uuringu (nt sugunäärmete arenguetapi määramine, vahesugulisuse raskusaste). Bioloogiline proov (pärakuuim või seljauim) geneetilise soo määramiseks võetakse liikide puhul, kellel on sobivad sellekohased markerid (9. ja 10. liide).
|
|
13.
|
Ülevaade asjakohastest liigispetsiifilistest katsetingimustest iga valideeritud liigi (jaapani riisikala, ogalik ja vöötdaanio) jaoks on esitatud 2. liites.
|
ANDMED UURITAVA KEMIKAALI KOHTA
|
14.
|
Kättesaadavad peaksid olema ägeda mürgisuse katse või muu lühiajalise mürgisuskatse tulemused [nt katsemeetod C.14 (34) ja OECD katsejuhend nr 210 (1)], eelistatavalt samade liikide kohta, kes on valitud käesoleva katse jaoks. See eeldab, et on teada uuritava kemikaali lahustuvus vees ja aururõhk ning on olemas usaldusväärne analüütiline meetod kemikaali kvantitatiivseks mõõtmiseks katsekambrites teadaoleva ja dokumenteeritud täpsusega ning avastamispiiriga.
|
|
15.
|
Lisaks on kasulik teada järgmist: struktuurvalem, kemikaali puhtus, püsivus vees ja valguse käes, pKa, POW ja kiire biolagundatavuse katse tulemused (vt katsemeetod C.4) (35).
|
Katse nõuetekohasuse tingimused
|
16.
|
Katse nõuetekohasuse tõendamisel arvestatakse järgmist:
|
—
|
lahustunud hapniku kontsentratsioon peaks olema vähemalt 60 % õhuga küllastumisel saadavast väärtusest (air saturation value, ASV) kogu katse jooksul;
|
|
—
|
vee temperatuur ei tohi kemikaaliga kokkupuute ajal eri katsekambrites kunagi erineda rohkem kui ± 1,5 °C ja tuleks hoida katsealusele liigile ettenähtud temperatuurivahemikus (2. liide);
|
|
—
|
Uuritava kemikaali määramiseks peaks olema valideeritud meetod, mille määramispiir on oluliselt allpool nominaalset kontsentratsiooni, ja tuleks koguda tõendeid selle kohta, et uuritava kemikaali kontsentratsiooni lahuses on suudetud säilitada rahuldavalt vahemikus ± 20 % mõõdetud keskmisest väärtusest;
|
|
—
|
viljastatud marjaterade üldine ellujäämine kontrollkatsetes ja, kus see on oluline, ka ainult lahustit sisaldavates kontrollkatsetes ei tohiks olla väiksem kui 2. liites määratletud piirid;
|
|
—
|
vastuvõetavuse kriteeriumid, mis on seotud kasvuga ja soolise jagunemisega katse lõpetamisel, põhinevad kontrollrühmade andmetel (ühendatud lahusti kontrollrühmad ja vee kontrollrühmad, välja arvatud juhud, kui need erinevad oluliselt – siis ainult lahusti kontrollrühmad):
|
|
Jaapani riisikala
|
Vöötdaanio
|
Ogalik
|
|
Kasv
|
Kuivaks pühitud kala märgmass
|
> 150 mg
|
> 75 mg
|
> 120 mg
|
|
Pikkus (standardpikkus)
|
> 20 mm
|
> 14 mm
|
> 20 mm
|
|
Sooline jaotumine (isasloomade või emasloomade %)
|
30–70 %
|
30–70 %
|
30–70 %
|
|
|
—
|
Kui kasutatakse lahustit, ei tohiks sellel olla statistiliselt olulist mõju kalade ellujäämisele ja see ei tohiks mõjutada endokriinsüsteemi ega avaldada muud negatiivset mõju varajastele eluetappidele, mida kontrollitakse lahusti kontrollrühmaga.
|
Kui katse nõuetekohasuse kriteeriumidest leitakse kõrvalekaldumisi, tuleks kaaluda nende mõju katseandmete usaldusväärsusele ja need kaalutlused tuleks esitada katseprotokollis.
|
KATSEMEETODI KIRJELDUS
Katsekambrid
|
17.
|
Kasutada võib igasuguseid klaasist, roostevabast terasest või muust keemiliselt inertsest materjalist katsekambreid. Kambrite mõõtmed peaksid olema piisavalt suured, et oleksid täidetud laadimisnormi kriteeriumid (vt allpool). Katsekambrid soovitatakse paigutada katse läbiviimise piirkonnas juhuslikult. Eelistatav on selline plokkide randomiseeritud paigutus, kus igas plokis on esindatud iga kontsentratsioon; see on parem kui täielikult randomiseeritud paigutus. Katsekambrid tuleks varjestada soovimatute häirimiste eest.
|
Liigi valimine
|
18.
|
Soovitatavad kalaliigid on esitatud 2. liites. Uue liigi lisamise kord on esitatud punktis 2.
|
Sugukalade pidamine
|
19.
|
Sugukalade rahuldavate pidamistingimuste üksikasjad on esitatud OECD katsejuhendis nr 210 (1). Sugukaladele tuleks üks või kaks korda päevas anda sobivat sööta.
|
Embrüote ja vastsete käitlemine
|
20.
|
Algul võivad embrüod ja vastsed kemikaaliga kokku puutuda suurde nõusse paigutatud väiksemates klaasist või roostevabast terasest kambrites, millel on võrkküljed, mis võimaldavad uuritava kemikaali lahuse voolamist läbi kambri. Keeristeta voolu läbi nende väikeste kambrite võib tekitada nii, et kambrid on riputatud kangi külge, mis liigutab neid üles ja alla, kuid hoiab organismid kogu aeg lahuses.
|
|
21.
|
Kui peamises katsenõus on marjaterade hoidmiseks kasutatud marjaterade konteinereid, reste või võrke, tuleks pärast vastsete koorumist need tõkked eemaldada, välja arvatud sellised võrgud, mis tuleb säilitada kalade põgenemise vältimiseks. Kui vastseid on vaja ümber paigutada, ei tohiks nad õhuga kokku puutuda ning kalade väljatõstmiseks marjaterade konteinerist ei tohiks kasutada võrke. Selle ümberpaigutamise ajastamine erineb liigiti ja ümberpaigutamine ei pea alati olema vajalik.
|
Vesi
|
22.
|
Kasutada võib igasugust vett, milles katsealuse liigi kontrollrühma isendid püsivad elusana vähemalt sama hästi kui 3. liites kirjeldatud vees. Vesi peab olema kogu katse jooksul püsiva kvaliteediga. Selle tagamiseks, et lahjendamiseks kasutatav vesi ei mõjutaks liigselt katse tulemusi (näiteks uuritava kemikaaliga reageerimise kaudu) ega mõjutaks negatiivselt sugukarja võimet, tuleb veest perioodiliselt võtta proove analüüsimiseks. Kui lahjendamiseks kasutatav vesi on teadaolevalt suhteliselt püsiva kvaliteediga, tuleks selles näiteks iga kolme kuu järel mõõta orgaanilise süsiniku üldsisaldust, elektrijuhtivust, pH-d ja hõljuvainete sisaldust. Raskmetallide (nt Cu, Pb, Zn, Hg, Cd, Ni), peamiste anioonide ja katioonide (nt Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) ja pestitsiidide sisaldust tuleks mõõta siis, kui vee kvaliteedi suhtes on kahtlusi. Keemilist analüüsi ja vee võtmist on kirjeldatud punktis 34.
|
Katselahused
|
23.
|
Kui see on praktiliselt võimalik, tuleks kasutada läbivooluga süsteemi. Läbivooluga katsete puhul on vaja kasutada süsteemi, mis pidevalt lisab ja lahjendab uuritava kemikaali põhilahust (nt dosaatorpump, proportsionaalse lahjendamise seade ja küllastamissüsteem), et tekitada eri katsekambrites rida erinevaid kontsentratsioone. Põhilahuste ja lahjendamiseks kasutatava vee voolamise kiirust tuleb kontrollida katse jooksul kindlate ajavahemike järel ja see ei tohiks kogu uuringu jooksul varieeruda rohkem kui 10 %. Sobivaks peetakse voolukiirust, mis vastab vähemalt katsekambri viiekordsele ruumalale 24 tunni jooksul (1). Tuleks vältida plastiktorusid või muid materjale, mis võivad sisaldada bioloogiliselt aktiivseid kemikaale või adsorbeerida uuritavat kemikaali.
|
|
24.
|
Põhilahus tuleks eelistatavalt valmistada ilma lahusteid kasutamata, lihtsalt uuritava aine segamise või loksutamisega lahjendamiseks kasutatavas vees, kasutades selleks mehaanilisi vahendeid (nt segamist või ultraheli). Kui uuritav kemikaal on vees raskesti lahustuv, võib kasutada meetodeid, mida on kirjeldatud OECD juhenddokumendis veekeskkonda ohustava mürgisuse katsetamiseks raskesti lahustuvate ainete ja segude puhul (36). Lahusti kasutamist tuleks vältida, kuid mõnel juhul võib see olla vajalik sobiva kontsentratsiooniga põhilahuse valmistamiseks. Sobivad lahustid on esitatud publikatsioonis (36).
|
|
25.
|
Poolstaatilisi katsetingimusi tuleks vältida, välja arvatud juhul, kui nende kasutamiseks esitatakse kaalukad põhjused, mis on seotud uuritava kemikaaliga (nt stabiilsus, piiratud kättesaadavus, suured kulud või ohud). Poolstaatilise meetodi korral võib järgida kahte erinevat uuendamise menetlust. Puhastesse kambritesse võib valmistada uued katselahused ning elus olevad marjaterad ja vastsed kanda ettevaatlikult üle uutesse kambritesse; teise võimalusena võib katseorganisme hoida samades katsekambrites ja uuendatakse osa katseveest (vähemalt kaks kolmandikku) iga päev.
|
KATSE KÄIK
Kokkupuutetingimused
Marjaterade kogumine ja kestus
|
26.
|
Geneetilise hälbe vältimiseks kogutakse marjaterad vähemalt kolmelt kalade paarilt või rühmalt, segatakse ja valitakse katse alustamiseks välja juhuvalikuga. Kunstlikku viljastamist ogaliku puhul on kirjeldatud 11. liites. Katse peaks algama niipea kui võimalik pärast marjaterade viljastamist, embrüod oleks soovitatav viia katselahusesse enne looteketta jagunemise algust või võimalikult kiiresti pärast seda ning mitte hiljem kui 12 tundi pärast viljastamist. Katse peaks jätkuma seni, kuni suguline diferentseerumine kontrollrühmas on lõppenud (jaapani riisikala, ogaliku ja vöötdaanio korral 60 päeva pärast koorumist).
|
Marjaterade panemine katsesse
|
27.
|
Viljastatud marjaterade arv katse alguses peaks iga kontsentratsiooni kohta olema vähemalt 120, mis jagatakse vähemalt 4 paralleelkatse vahel (kontrolliks on lubatud võtta ruutjuur marjaterade arvust katses). Marjaterad tuleks jaotada kontsentratsioonitasemete vahel juhuvaliku alusel (kasutades statistilisi randomiseerimistabeleid). Laadimisnorm (vt mõisted, 1. liide) peaks olema piisavalt madal, et kambrites oleks ilma otsese aereerimiseta võimalik hoida lahustunud hapniku kontsentratsiooni vähemalt 60 % õhuga küllastamisel saadavast väärtusest. Läbivooluga katsetes soovitatakse laadimisnormi, mis ei ületa 0,5 g/l 24 tunni kohta ega 5 g/l lahust mis tahes ajal. Hiljemalt 28 päeva pärast viljastamist tuleks kalade arv paralleelkatsetes ümber jaotada, nii et igas proovis oleks võimalikult ühesugune arv kalu. Kui kokkupuude kemikaaliga põhjustab suremust, tuleks paralleelkatsete arvu vähendada nii, et kalade asustustihedus eri kontsentratsioonidel hoitaks võimalikult ühesugune.
|
Valgus ja temperatuur
|
28.
|
Valgustuse kestus ja veetemperatuur peaksid olema katseliigile sobivad (vt kalade sugulise arengu katses kasutatavad katsetingimused, 2. liide).
|
Söötmine
|
29.
|
Sööt ja söötmine on otsustava tähtsusega ning on oluline, et igal arenguetapil antaks õiget sööta õigete ajavahemike tagant ja normaalse kasvu jaoks vajalikul tasemel. Söötmine peaks olema ad libitum, kuid ülejääk tuleks viia miinimumini. Piisava kasvukiiruse saavutamiseks tuleks kalu sööta vähemalt kaks korda päevas (nädalavahetusel on lubatav üks kord päevas); söötmiste vaheaeg peaks olema vähemalt kolm tundi. Sööda ülejäägid ja väljaheited tuleks vajaduse korral eemaldada, et vältida jäätmete kogunemist. Vastavalt kogemuste omandamisele täiustatakse pidevalt söötmisrežiimi, et vähendada suremust ja optimeerida kasvu. Kavandatav režiim tuleks lasta kinnitada tunnustatud eksperdil. Enne katse lõpetamist ei tohiks kalu 24 tundi sööta. Sobiva sööda näited on loetletud 2. liites (vt ka kaladega tehtavate katsete OECD raamistik (39)).
|
Uuritava kemikaali kontsentratsioonid
|
30.
|
Uuritava kemikaali kontsentratsioonid tuleks valida nii, nagu on kirjeldatud 4. liites. Tuleks kasutada vähemalt kolme kontsentratsiooni vähemalt nelja paralleelkatsega. Uuritavate kontsentratsioonide vahemiku valikul tuleks arvesse võtta ägeda mürgisuse uuringus leitud LC50 ja kokkupuuteperioodi vahelist sõltuvust. Riskide hindamiseks sobivate andmete saamiseks on soovitatav kasutada viit uuritavat kontsentratsiooni.
|
|
31.
|
Kemikaali kontsentratsioone, mis on suuremad kui 10 % täiskasvanud isendi jaoks ägeda mürgistuse LC50 või 10 mg/l, milline neist on madalam, ei ole vaja uurida. Suurim katses kasutatav kontsentratsioon peaks olema 10 % LC50-st vastse- või noorjärgustaadiumi jaoks.
|
Kontrollkatsed
|
32.
|
Lisaks uuritava aine kontsentratsioonidele tuleks teha üks lahjendusvee kontrollkatse (≥ 4 paralleelkatset) ja, kui see on asjakohane, lahusti kontrollkatse (≥ 4 paralleelkatset). Katses tuleks kasutada üksnes lahustit, mida on uuritud ja mille kohta on näidatud, et sellel ei ole statistiliselt olulist mõju katses määratavatele näitajatele.
|
|
33.
|
Kui kasutatakse lahustit, ei tohiks selle lõplik kontsentratsioon olla suurem kui 0,1 ml/l (36) ja see peaks olema ühesugune kõikides katsekambrites, välja arvatud lahjendusvee kontrollkatse. Siiski tuleks teha kõik, et vältida sellise lahusti kasutamist või hoida selle kontsentratsioon võimalikult madal.
|
Analüütiliste määramiste ja mõõtmiste sagedus
|
34.
|
Enne katse alustamist tuleks teha uuritava kemikaali kontsentratsiooni määramine, et kontrollida kõigi katse vastuvõetavuse kriteeriumide täitmist. Iga paralleelkatset tuleks eraldi analüüsida katse alguses ja lõpus. Iga uuritava kontsentratsiooni üht paralleelkatset tuleks katse ajal analüüsida vähemalt kord nädalas, vahetades süstemaatiliselt uuritavat paralleelkatset (1,2,3,4,1,2 …). Kui proove säilitatakse hilisemaks analüüsiks, peaks proovide säilitamise meetod olema eelnevalt valideeritud. Selleks, et olla kindel, et analüüsitakse uuritava kemikaali tõelist lahust, tuleks proovid filtrida (nt läbi filtri, mille poori suurus on 0,45 μm) või tsentrifuugida.
|
|
35.
|
Katse ajal mõõdetakse kõikides katsekambrites lahustunud hapnikku, pH-d, üldkaredust, elektrijuhtivust, soolsust (kui see on asjakohane) ja temperatuuri. Iga nädal tuleks määrata vähemalt lahustunud hapniku kontsentratsiooni, soolsust (kui see on oluline) ja temperatuuri ning katse alguses ja lõpus tuleks mõõta pH-d, elektrijuhtivust ja karedust. Temperatuuri tuleks eelistatavalt jälgida pidevalt vähemalt ühes katsekambris.
|
|
36.
|
Tulemused peaksid põhinema mõõdetud kontsentratsioonidel. Kui uuritava kemikaali kontsentratsiooni lahuses on suudetud säilitada rahuldavalt vahemikus ± 20 % kontsentratsiooni nimiväärtusest kogu katse jooksul, võivad tulemused põhineda nimiväärtustel või mõõdetud väärtustel.
|
Vaatlused ja mõõtmised
Embrüonaalse arengu staadium
|
37.
|
Kokkupuudet tuleks alustada võimalikult kohe pärast viljastamist ning enne looteketta jagunemist ja hiljemalt 12 tundi pärast viljastumist, et tagada kokkupuude varase embrüonaalse arengu jooksul.
|
Koorumine ja ellujäämine
|
38.
|
Koorumise ja ellujäämise vaatlust tuleks teha vähemalt kord päevas ja vastavad arvud tuleks protokollida. Surnud embrüod, vastsed ja noorkalad tuleks eemaldada kohe, kui neid märgatakse, kuna need võivad kiiresti laguneda ning teised kalad võivad need tükkideks lõhkuda. Surnud isendite eemaldamisel tuleks olla eriti hoolikas, et mitte häirida või füüsiliselt kahjustada kõrvalolevaid marjaterasid/vastseid, kuna need on äärmiselt õrnad ja tundlikud. Surma kriteeriumid sõltuvad eluetapist:
|
—
|
marjaterade puhul: eriti varastes etappides, oluline läbipaistvuse kadumine ja värvuse muutus, mis on põhjustatud valkainete koagulatsioonist ja/või sadestumisest, mille tulemusel välimus muutub valgeks ja läbipaistmatuks;
|
|
—
|
vastsete ja noorkalade puhul: liikumatus ja/või hingamisliigutuste puudumine ja/või südamelöökide puudumine ja/või kesknärvisüsteemi värvumine valgeks ja läbipaistmatuks ja/või reaktsiooni puudumine mehaanilisele ärritajale.
|
|
Kõrvalekalded välimuses
|
39.
|
Tuleks registreerida selliste vastsete või kalade arv, kelle kehal esineb nähtavaid kõrvalekaldeid normist, ning kirjeldada kõrvalekalde välist pilti ja laadi. Tuleks märkida, et loomuliku arengu käigus esineb embrüote ja vastsete kõrvalekaldeid ning nende osakaal võib teatud liikidel olla kontrollkatse(te)s mitmeid protsente. Kõrvalekaldega loom tuleb katsekambrist alles siis eemaldada, kui ta sureb. Vastavalt Euroopa Parlamendi ja nõukogu 22. septembri 2010. aasta direktiivile 2010/63/EL (teaduslikel eesmärkidel kasutatavate loomade kaitse kohta) tuleb sellised loomad, kellele kõrvalekalded tekitavad valu, kannatusi, stressi või püsivaid kahjustusi ja usaldusväärselt on võimalik prognoosida surmlõpet, siiski uimastada ja valutult surmata, nagu on kirjeldatud punktis 44, ning võtta neid arvesse suremuse andmete analüüsil.
|
Kõrvalekalded käitumises
|
40.
|
Kui märgatakse kõrvalekaldeid käitumises, nt hingeldamist, rikutud koordinatsiooni ujumisel, ebatüüpilist loidust ja ebatüüpilist toitumiskäitumist, tuleb see registreerida protokollis.
|
Kehamass
|
41.
|
Katse lõpus tuleks kõik ellujäänud kalad surmata (tuimastada, kui tuleks võtta vereproovid) ja määrata iga kala märgmass (pärast kala kuivaks pühkimist).
|
Pikkus
|
42.
|
Katse lõpus tuleks mõõta iga kala pikkus (standardpikkus).
|
|
43.
|
Nendest vaatlustest saadakse järgmised andmed, mis esitatakse katseprotokollis:
|
—
|
tervete kalade arv katse lõpus;
|
|
—
|
aeg koorumise alguse ja lõpuni;
|
|
—
|
ellujäänud loomade pikkus ja mass;
|
|
—
|
deformeerunud vastsete arv;
|
|
—
|
ebatavalise käitumisega kalade arv.
|
|
Proovide võtmine kaladest
|
44.
|
Proovid võetakse kaladest katse lõpus. Prooviks võetud kalad surmatakse valutult näiteks MS-222 abil (100–500 mg/l, puhverdatud NaHCO3 abil, mida lisatakse 200 mg/l) või FA-100 abil (4-allüül-2-metoksüfenool ehk eugenool) ning mõõdetakse eraldi ja kaalutakse märjalt (kuivaks pühituna) või kui neist tuleks võtta vereproov, siis tuimastatakse (vt punkt 49).
|
Proovide võtmine vitellogeniini määramiseks ja soo määramiseks histoloogilise hindamisega
|
45.
|
Kõik kalad tuleb võtta prooviks ja valmistada need ette soo ja vitellogeniini määramiseks. Kõiki kalu tuleks analüüsida histoloogiliselt soo määramiseks. Vitellogeniini mõõtmiseks võib igast paralleelkatsest võtta osaproovina vähemalt 16 kala. Kui osaproovi tulemus on ebaselge, tuleks vitellogeniini suhtes analüüsida rohkem kalu.
|
|
46.
|
Vitellogeniini ja soo määramiseks proovide võtmise kord oleneb vitellogeniini määramise meetodist:
|
Pea/saba homogenaadi meetod vitellogeniini määramiseks
|
47.
|
Kala surmatakse valutult. Iga kala pea ja saba eraldatakse skalpellilõigetega kala kehast; lõiked tehakse otse rinnauime ja otse seljauime tagant (vt joonis 1). Iga kala pea- ja sabaosad ühendatakse, kaalutakse, nummerdatakse eraldi, külmutatakse vedelas lämmastikus ja säilitatakse – 70° juures või madalamal temperatuuril vitellogeniini määramiseks. Iga kala kehaosa nummerdatakse ja fikseeritakse sobiva fikseeriva lahusega histoloogiliseks hindamiseks (22). Selle meetodi kasutamisel hinnatakse vitellogeniin ja histopatoloogia iga üksiku kala puhul eraldi ja vitellogeniini sisalduse võimaliku muutuse võib siduda kala fenotüübikohase või geneetilise sooga (jaapani riisikala ja ogalik). Täiendava teabe saamiseks vt homogeenimise juhised (5. liide) ja vitellogeniini kvantitatiivse määramise juhend (6. liide).
|
Maksa homogenaadi meetod vitellogeniini määramiseks
|
48.
|
Kala surmatakse valutult. Maks lõigatakse välja ja säilitatakse – 70 °C juures või madalamal temperatuuril. Maksa eemaldamiseks ja eeltöötluseks soovitatud meetodid on esitatud OECD katsejuhendis nr 229 (37) või käesoleva lisa peatükis C.37 (38). Iga kala maks seejärel homogeenitakse eraldi, nagu on kirjeldatud OECD katsejuhendis nr 229 ja käesoleva lisa peatükis C.37. Supernatant kogutakse vitellogeniini mõõtmiseks homoloogse ELISA meetodiga (vt vitellogeniini kvantitatiivne mõõtmine vöötdaanio puhul, 6. liide, või jaapani riisikala puhul, OECD katsejuhend nr 229 (37)). Sellise lähenemisviisi kasutamisel saab iga kala jaoks määrata vitellogeniini ja sugunäärmete histoloogia.
|
Vereplasma meetod vitellogeniini määramiseks
|
49.
|
Veri, mis on kogutud tuimastatud kalast südamepunktsiooniga, sabaveenist või sabalõike abil, tsentrifuugitakse 4 C juures plasma kogumiseks. Plasma säilitatakse – 70 C või madalama temperatuuri juures kuni kasutamiseni. Terve kala surmatakse valutult ja fikseeritakse histoloogia uurimiseks. Nii plasmaproovid kui ka kalad nummerdatakse ükshaaval, et vitellogeniini sisalduse saaks siduda kala sooga.
Joonis 1.
Kala lõikamine vitellogeniini mõõtmiseks pea/saba homogenaadist ja keskmise osa histoloogiliseks hindamiseks.

|
Geneetilise soo määramine
|
50.
|
Bioloogiline proov geneetilise soo määramiseks võetakse üksikkaladelt, kes kuuluvad liikidesse, mille isenditel on soomarkerid. Jaapani riisikala puhul võetakse pärakuuim või seljauim. 9. liites on esitatud üksikasjalik kirjeldus, sealhulgas koeproovide võtmise ja PCR-meetodiga soo määramise kohta. 10. liites on esitatud koeproovide võtmise ja PCR-meetodiga soo määramise kirjeldus ogaliku puhul.
|
Vitellogeniini määramine
|
51.
|
Vitellogeniin tuleks määrata kvantitatiivse ja analüütiliselt valideeritud meetodiga. Laboris kasutatava meetodi puhul peaks olema teada selle tulemuste katsetevaheline ja laboritevaheline varieeruvus. Laborisiseste ja laboritevaheliste varieeruvuse põhjuseks on (kõige tõenäolisemalt) kalapopulatsioonide erinev arenguaste. Võttes arvesse vitellogeniini määramise varieeruvust, tuleb üksnes selle alusel leitud täheldatavat toimet mitteavaldava kontsentratsiooni (NOEC) väärtusesse suhtuda suure ettevaatusega. Vitellogeniini sünteesi hindamiseks käesolevas katses kasutatud kalaliikide puhul on mitmesuguseid meetodeid. Küllaltki tundlik ja spetsiifiline meetod on selle valgu kontsentratsioonide mõõtmine ensüümimmuunsorptsioonanalüüsiga (ELISA). Tuleks kasutada sama liigi vitellogeniini suhtes saadud (homoloogseid) antikehasid ja kõige olulisemaid homoloogseid standardeid.
|
Soo määramine
|
52.
|
Sõltuvalt vitellogeniini määramiseks proovi võtmise meetodist pannakse kas terve kala või iga kala allesjäänud keskmine osa eelnevalt märgistatud töötlemiskassetti ja fikseeritakse fikseeriva lahusega, mis sobib kala soo histoloogiliseks määramiseks (ja soovi korral ka sugunäärmete arengustaadiumi hindamiseks). Fikseerimise ja parafiini sisse valamise juhendid on esitatud 7. liites ja OECD juhenddokumendis „Guidance Document on the Diagnosis of Endocrine-Related Histopathology of Fish Gonads” (Juhenddokument kalade endokriinsüsteemiga seotud sugunäärmete histopatoloogia diagnoosimiseks) (22). Pärast töötlemist valatakse kalad parafiinplokkidesse. Üksikud kalad tuleks parafiinplokki paigutada pikisuunas. Igast kalast tehakse vähemalt kuus pikisuunalist frontaaltasandi lõiget (paksusega 3–5 μm), milles on näha mõlema sugunäärme koed. Nende lõigete vahekaugus peaks olema ligikaudu 50 μm isas- ja 250 μm emasloomade puhul. Kuna aga igas parafiinplokis on sageli nii isas- kui ka emasloomi (kui plokis on rohkem kui üks kala), peaks plokkidest tehtavate lõigete vahekaugus olema ligikaudu 50 μm, kuni iga isase sugunäärmetest on saadud vähemalt kuus lõiget. Seejärel võib suurendada lõigete vahekauguse kuni ligikaudu 250 μm-ni emaskalade puhul. Lõiked värvitakse hematoksüliini ja eosiini abil, ning uuritakse valgusmikroskoobiga soo määramiseks (isane, emane, vahesugu või diferentseerumata). Vahesugu on määratletud rohkem kui ühe munaraku leidumisega niisas kuue analüüsitud lõike kohta või spermatogeneesirakkude leidumisega (jah/ei) munasarjades. Munasarjade ja munandite histopatoloogia ja arengustaadiumi määramine on vabatahtlik, kuid kui seda tehakse, tuleks andmeid statistiliselt analüüsida ja need esitada. Tuleks märkida, et mõnel kalaliigil (nt jaapani riisikalal ja mõnikord vöötdaaniol) ei ole looduslikult täielikult väljaarenenud sugunäärmete paari, ja siis võib kalal olla ainult üks sugunääre. Kõik niisugused tähelepanekud tuleks registreerida.
|
|
53.
|
Geneetilise soo määramine üksikul jaapani riisikalal põhineb isast määrava geeni DMY olemasolu või puudumise määramisel; DMY asub Y-kromosoomis. Riisikala genotüübilise soo võib teha kindlaks näiteks päraku- või seljauimetüki DNA-st eraldatud DMY-geeni sekveneerimisega. DMY olemasolu näitab, et tegemist on XY-kromosoomipaariga (isaskala), olenemata kala fenotüübist, samas kui DMY puudumine osutab XX-paarile (emaskala), olenemata fenotüübist (23). Koepreparaatide valmistamise ja PCR-meetodi kasutamise juhendid on esitatud 9. liites. Ka üksiku ogaliku geneetiline sugu määratakse PCR-meetodiga, mida on kirjeldatud 10. liites.
|
|
54.
|
Vahesoo (vt mõisted, 1. liide) esinemine tuleks märkida katseprotokollis.
|
Teisesed sootunnused
|
55.
|
Sellistel liikidel nagu jaapani riisikala on teisesed sootunnused endokriinsüsteemi kontrolli all; seepärast tuleks kemikaaliga kokkupuute lõpus teha võimaluse korral kala füüsilise välimuse vaatlus. Jaapani riisikala puhul on nn papillaari moodustumine pärakuuime tagaosas emaskaladel androgeenisõltuv. Käesoleva lisa peatükis C.37 (38) on esitatud asjakohased fotod isaskalade ja androgeeniga mõjutatud emaskalade teiseste sootunnuste kohta.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Tulemuste töötlemine
|
56.
|
On oluline, et uuritav näitaja määrataks kõige usaldusväärsema statistilise testiga. Eksperimentaalne ühik on paralleelkatse, kuid paralleelkatsete vaheline hajuvus peaks olema statistilises analüüsis arvesse võetud. 8. liites on esitatud otsustamisskeem; see peaks aitama kasutada kõige kohasemat statistilist testi, millega võetaks arvesse katsega saadud andmete omadusi. Statistilise olulisuse tase on 0,05 kõigi määratavate näitajate puhul.
|
Sooline jaotumine ja geneetiline sugu
|
57.
|
Soolises jaotumises tuleks analüüsiga otsida olulist mõju (NOEC/LOEC lähenemisviis), mida on avaldanud kokkupuude kemikaaliga; kui doosi-toime sõltuvus on monotoonne, siis sobib Jonckheere'i-Terpstra (trendi-)test. Mittemonotoonse mõju puhul tuleb rakendada paariviisi võrdlemist: kui saadakse normaaljaotus ja homogeenne dispersioon, tuleb kasutada Dunnetti testi. Heterogeense dispersiooni puhul kasutatakse Tamhane-Dunnetti testi. Muudel juhtudel kasutatakse Mann-Whitney täpset testi koos Bonferroni-Holmi kohandusega. 8. liites on esitatud soolise jaotumise andmete statistilise töötlemise otsustamisskeem. Soolise jaotumise andmed tuleks esitada tabelis: isaste, emaste, vahesoo ja diferentseerumata suguelunditega isendite osakaal igal uuritava kemikaali kontsentratsioonil ± standardhälve. Esile tuleks tõsta statistiline olulisus. Kalade sugulise arengu katse valideerimise 2. etapi aruandes (42) on esitatud sellekohased näited. Geneetiline sugu tuleks esitada protsendina fenotüübi poolest isaste, emaste, vahesoost või sootunnuste osas diferentseerumata kalade hulgas.
|
Vitellogeniini kontsentratsioonid
|
58.
|
Vitellogeniini kontsentratsioonis tuleks analüüsiga otsida olulist mõju (NOEC/LOEC lähenemisviis), mida on avaldanud kokkupuude kemikaaliga. Parem on kasutada Dunnetti testi kui t-testi koos Bonferroni parandusega. Kui kasutatakse Bonferroni parandust, siis on eelistatav Bonferroni-Holmi parandus. Vitellogeniini kontsentratsiooni tuleks vaadelda logaritmilisel kujul, et saavutada normaaljaotus ja dispersiooni homogeensus. Seejärel, kui kontsentratsiooni-toime sõltuvus on monotoonne, tuleks kõikidest eespool kirjeldatutest eelistada Jonckheere'i-Terpstra testi. Kui kasutatakse t-teste või Dunnetti testi, ei ole jätkamiseks vaja ANOVA olulisuse F-testi. Üksikasjad on esitatud 8. liites otsustusskeemis. Tulemused tuleks esitada tabelis: isaskalade, emaskalade, vahesoost kalade ja diferentseerumata suguelunditega kalade puhul mõõdetud keskmine kontsentratsioon ± standardhälve. Esile tuleks tuua statistiline olulisus fenotüübiliste emaste ja fenotüübiliste isaste puhul. Kalade sugulise arengu katse valideerimise 2. etapi aruandes (42) on esitatud sellekohased näited.
|
Uuritava kemikaali tegelikud kontsentratsioonid
|
59.
|
Uuritava kemikaali tegelikke kontsentratsioone katsekambrites tuleks analüüsida sellise sagedusega, nagu on öeldud punktis 34. Tulemused tuleks esitada tabelites: keskmine kontsentratsioon ± standardhälve paralleelkatsete põhjal, samuti kontsentratsiooni põhjal; lisada teave proovide arvu kohta ja tõsta esile suured, ± 20 % kõrvalekalded keskmisest uuritava kemikaali kontsentratsioonist. Kalade sugulise arengu katse valideerimise 2. etapi aruandest (42) võib leida sellekohased näited.
|
Tulemuste tõlgendamine
|
60.
|
Katse tulemuste tõlgendamisel tuleks olla ettevaatlik, kui uuritavates lahustes mõõdetud uuritava kemikaali kontsentratsioonid on analüütilise meetodi määramispiiri lähedal.
|
Katseprotokoll
|
61.
|
Katseprotokollis esitatakse alljärgnev teave.
|
|
Uuritav kemikaal
|
—
|
asjakohased füüsikalis-keemilised omadused, kemikaali identifitseerimisandmed, sh andmed uuritava kemikaali puhtuse kohta ja kvantitatiivse sisalduse mõõtmiseks kasutatud analüütilise meetodi kohta.
|
|
|
|
Katsetingimused
|
—
|
Kasutatud katsemeetod (läbivoolukatse või poolstaatiline uuendamisega katse); katse kava, sealhulgas uuritava kemikaali kontsentratsioonid, põhilahuse valmistamise meetod (lisas), uuendamise sagedus (kui kasutatakse lahustit, siis selle nimetus ja kontsentratsioon);
|
|
—
|
uuritava kemikaali nominaalsed kontsentratsioonid, katsekambrites mõõdetud väärtuste keskmised ja nende standardhälbed ning nende mõõtmismeetod (kasutatud analüüsimeetod tuleb esitada lisas); tõendid selle kohta, et mõõdeti uuritava kemikaali kontsentratsiooni tegelikus lahuses;
|
|
—
|
vee kvaliteet katsekambrites: pH, karedus, temperatuur ja lahustunud hapniku kontsentratsioon;
|
|
—
|
üksikasjalik teave söötmise kohta (nt sööda (söötade) tüüp, päritolu, antud kogus ja söötmise sagedus ning saasteainete analüüs (nt polüklorobifenüülid, polüaromaatsed süsivesinikud ja kloororgaanilised pestitsiidid), kui see on asjakohane.
|
|
|
|
Tulemused
|
—
|
Tõendid selle kohta, et kontrollkatsed vastasid nõuetekohasuse kriteeriumidele: koorumismäära käsitlevad andmed tuleks esitada tabelites protsendina iga paralleelkatse ja uuritava kontsentratsiooni kohta. Võõrväärtused, mis ei vasta heakskiitmise kriteeriumidele (kontrollides), tuleks esile tõsta. Ellujäämismäär tuleks esitada tabelites protsendina iga paralleelkatse ja uuritava kontsentratsiooni kohta. Võõrväärtused, mis ei vasta katse nõuetekohasuse kriteeriumidele (kontrollides), tuleks esile tõsta.
|
|
—
|
Selgelt tuleb esitada otsitavate näitajate jaoks saadud tulemused: embrüote ellujäämine ja koorumise õnnestumine; välised anomaaliad; pikkus ja mass; vitellogeniini mõõtmised (ng homogenaadi g kohta, ng plasma kohta või ng maksa mg kohta); sugunäärmete histoloogia, sooline jaotumine, geneetilise soo andmed; kalade ebatavalised reaktsioonid ja nähtavad muutused, mida on põhjustanud uuritav kemikaal.
|
|
|
|
62.
|
Tulemused tuleks esitada kujul: keskväärtus ± standardhälve (SD) või standardviga (SE). Statistika tuleks käsitleda vähemalt LOEC ja NOEC väärtuste ja usaldusvahemike esitamise juures. Järgida tuleks statistiliste töötluste skeemi (8. liide).
|
KIRJANDUS
|
(1)
|
OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(2)
|
Jobling, S., D. Sheahan, J.A. Osborne, P. Matthiessen, and J.P. Sumpter, 1996, „Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals”, Environmental Toxicology and Chemistry 15, pp. 194-202.
|
|
(3)
|
Sumpter, J.P. and S. Jobling, 1995, „Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment”, Environmental Health Perspectives 103, pp. 173-178.
|
|
(4)
|
Tyler, C.R., R.van Aerle, T.H. Hutchinson, S. Maddix, and H. Trip (1999), „An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin”, Environmental Toxicology and Chemistry 18, pp. 337-347.
|
|
(5)
|
Holbech, H., L. Andersen, G.I. Petersen, B. Korsgaard, K.L. Pedersen, and P. Bjerregaard (2001a), „Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, pp. 119-131.
|
|
(6)
|
Andersen, L., P. Bjerregaard, and B. Korsgaard ( 2003), „Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters”, Fish Physiology and Biochemistry 28, pp. 319-321.
|
|
(7)
|
Orn, S., H. Holbech, T.H. Madsen, L. Norrgren, and G.I. Petersen (2003), „Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone”, Aquatic Toxicology 65, pp. 397-411.
|
|
(8)
|
Panter, G.H., T.H. Hutchinson, R. Lange, C.M. Lye, J.P. Sumpter, M. Zerulla, and C.R. Tyler (2002), „Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances”, Environmental Toxicology and Chemistry 21, pp. 319-326.
|
|
(9)
|
Sun, L.W., J.M. Zha, P.A. Spear, and Z.J. Wang (2007), „Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 533-541.
|
|
(10)
|
Parks, L.G., A.O. Cheek, N.D. Denslow, S.A. Heppell, J.A. McLachlan, G.A. LeBlanc, and C.V.Sullivan (1999), „Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, pp. 113-125.
|
|
(11)
|
Brion, F., B.M. Nilsen, J.K. Eidem, A. Goksoyr, and J.M. Porcher (2002), „Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)”, Environmental Toxicology and Chemistry 21, pp. 1699-1708.
|
|
(12)
|
Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara, and E. Tamiya (2002), „Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, pp. 161-169.
|
|
(13)
|
Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James, and B.E. Bengtsson (2004), „The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption – II – kidney hypertrophy, vitellogenin and spiggin induction”, Aquatic Toxicology 70, pp. 311-326.
|
|
(14)
|
Tatarazako, N., M. Koshio, H. Hori, M. Morita, and T. Iguchi (2004), „Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka”, Journal of Health Science 50, pp. 301-308.
|
|
(15)
|
Eidem, J.K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Panter, T. Hutchinson, and A. Goksoyr (2006), „Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology”, 78, pp. 202-206.
|
|
(16)
|
Jensen, K.M. and G.T. Ankley (2006), „Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)”, Ecotoxicology and Environmental Safety 64, pp. 101-105.
|
|
(17)
|
Holbech, H., Petersen, G. I., Norman, A., Örn, S, Norrgren, L., and Bjerregaard, P (2001b), „Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)”, Nordic Council of Ministers, TemaNord 2001:597, pp. 48-51.
|
|
(18)
|
Nilsen, B.M., K. Berg, J.K. Eidem, S.I. Kristiansen, F. Brion, J.M. Porcher, and A. Goksoyr (2004), „Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening”, Analytical and Bioanalytical Chemistry 378, pp. 621-633.
|
|
(19)
|
Orn, S., S. Yamani, and L. Norrgren (2006), „Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone”, Archives of Environmental Contamination and Toxicology 51, pp. 237-243.
|
|
(20)
|
Scholz, S. and N. Kluver (2009), „Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish, Sexual Development” 3, pp. 136-151.
|
|
(21)
|
Fenske, M., G. Maack, C. Schafers, and H. Segner (2005), „An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio”, Environmental Toxicology and Chemistry 24, pp. 1088-1098.
|
|
(22)
|
OECD (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Paris.
|
|
(23)
|
Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi, A. Suzuki, N. Saito, M. Nakamoto, N. Shibata, and Y. Nagahama (2004), „Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes”, Developmental Dynamics 231, pp. 518-526.
|
|
(24)
|
Shinomiya, A., H. Otake, K. Togashi, S. Hamaguchi, and M. Sakaizumi (2004), „Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations”, Zoological Science 21, pp. 613-619.
|
|
(25)
|
Kidd, K.A., P.J. Blanchfield, K.H. Mills, V.P. Palace, R.E. Evans, J.M. Lazorchak, and R.W. Flick (2007), „Collapse of a fish population after exposure to a synthetic estrogen”, Proceedings of the National Academy of Sciences of the United States of America 104, pp. 8897-8901.
|
|
(26)
|
Palace,V.P., R.E. Evans, K.G. Wautier, K.H. Mills, P.J. Blanchfield, B.J. Park, C.L. Baron, and K.A. Kidd (2009), „Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake”, Canadian Journal of Fisheries and Aquatic Sciences 66, pp. 1920-1935.
|
|
(27)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, J. Bamforth, R.D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno, and C.R. Tyler (2006), „Development of chronic tests for endocrine active chemicals – Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)”, Aquatic Toxicology 77, pp. 279-290.
|
|
(28)
|
Holbech, H., K. Kinnberg, G.I. Petersen, P. Jackson, K. Hylland, L. Norrgren, and P. Bjerregaard (2006), „Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, pp. 57-66.
|
|
(29)
|
Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard, and P. Bjerregaard (2004), „Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)”, Fish Physiology and Biochemistry 30, pp. 257-266.
|
|
(30)
|
Morthorst, J.E., H. Holbech, and P. Bjerregaard (2010), „Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations”, Aquatic Toxicology 98, pp. 336-343.
|
|
(31)
|
Kiparissis,Y., T.L. Metcalfe, G.C. Balch, and C.D. Metcalf (2003), „Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)”, Aquatic Toxicology 63, pp. 391-403.
|
|
(32)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, A. Sherren, R.D. Stanley, and C.R. Tyler (2004), „Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development”, Aquatic Toxicology 70, pp. 11-21.
|
|
(33)
|
Kinnberg, K., H. Holbech, G.I. Petersen, and P. Bjerregaard (2007), „Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 165-170.
|
|
(34)
|
Käesoleva lisa peatükk C.14. Noorkalade kasvukatse.
|
|
(35)
|
Käesoleva lisa peatükk C.4. Kohese biolagunduvuse määramine.
|
|
(36)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OECD, Paris.
|
|
(37)
|
OECD (2009), Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(38)
|
Käesoleva lisa peatükk C.37. 21-päevane katse kaladega – lühiajaline sõelkatse östrogeense ja androgeense toime ning aromataasi inhibeerimise kontrollimiseks.
|
|
(39)
|
OECD (2012), Fish Toxicity Testing Framework, Series on Testing and Assessment No. 171, OECD, Paris
|
|
(40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H (2007), „Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio” Journal of Toxicology and Environmental Health-Part A, 70, 9-10 pp 768-779.
|
|
(41)
|
OECD (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Paris.
|
|
(42)
|
OECD (2011), Validation Report ( Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Paris.
|
|
(43)
|
OECD (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Paris.
|
|
(44)
|
Euroopa Parlamendi ja nõukogu direktiiv 2010/63/EL, 22. september 2010, teaduslikel eesmärkidel kasutatavate loomade kaitse kohta. ELT L 276, 20.10.2010, lk 33.
|
1. liide
Lühendid ja mõisted
Apikaalne näitaja
– näitaja, mis iseloomustab mõju populatsiooni tasandil
ASV
– õhuga küllastamise väärtus (air saturation value)
Biomarker
– näitaja, mis iseloomustab mõju üksikisendi tasandil
Kemikaal
– aine või segu
DPH
– päevad pärast koorumist (Days post hatch)
DMY
– Y-spetsiifiline DM-domeeni geen, mis määrab jaapani riisikala arenemise isaskalaks
ELISA
– ensüümimmuunsorptsioonanalüüs (Enzyme-Linked Immunosorbent Assay)
Kala mass
– kuivaks pühitud kala märgmass
FSDT
– kalade seksuaalse arengu katse
HAS-telg
– hüpotalamuse-ajuripatsi-sugunäärmete telg
Vahesoost kala
– kala, kellel on enam kui üks munarakk niisas kuue analüüsitud lõike kohta või spermatogeneesi rakud munasarjades (jah/ei)
Laadimisnorm
– kalade märgmass vee ruumala kohta
MOA
– toimemehhanism (mode of action)
RT-PCR
– pöördtranskriptaasi polümeraasi ahelreaktsioon
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil
Diferentseerumata kala
– kala, kelle sugunäärmetes ei ole võimalik eristada sugurakke.
VTG
– vitellogeniin
2. liide
Kalade sugulise arengu katse tingimused (mageveekalade liigid)
|
|
Jaapani riisikala (Oryzias latipes)
|
Vöötdaanio (Danio rerio)
|
Harilik ogalik (Gasterostreus aculeatus)
|
|
|
Läbivooluga või poolstaatiline
|
Läbivooluga või poolstaatiline
|
Läbivooluga või poolstaatiline
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
|
Luminofoorlambid (laia spektriga)
|
Luminofoorlambid (laia spektriga)
|
Luminofoorlambid (laia spektriga)
|
|
|
10–20 μE/m2/s, 540–1 080 luksi või 50–100 ft-c (labori üldvalgustus)
|
10–20 μE/m2/s, 540–1 080 luksi või 50–100 ft-c (labori üldvalgustus)
|
10–20 μE/m2/s, 540–1 080 luksi või 50–100 ft-c (labori üldvalgustus)
|
|
|
12–16 tundi valgust, 8–12 tundi pimedust
|
12–16 tundi valgust, 8–12 tundi pimedust
|
16 tundi valgust, 8 tundi pimedust
|
|
7.
|
Minimaalne kambri suurus
|
|
Iga üksikkamber peaks sisaldama vähemalt 7 l vett
|
Iga üksikkamber peaks sisaldama vähemalt 7 l vett
|
Iga üksikkamber peaks sisaldama vähemalt 7 l vett
|
|
8.
|
Uuritava lahuse kogu ruumala asendamine
|
|
Vähemalt 5 korda päevas
|
Vähemalt 5 korda päevas
|
Vähemalt 5 korda päevas
|
|
9.
|
Katseorganismide vanus kemikaaliga kokkupuute alguses
|
|
Värskelt viljastatud marjaterad (varane blastula staadium)
|
Värskelt viljastatud marjaterad (varane blastula staadium)
|
Värskelt viljastatud marjaterad
|
|
10.
|
Marjaterade arv ühe kemikaalikontsentratsiooni kohta
|
|
Vähemalt 120
|
Vähemalt 120
|
Vähemalt 120
|
|
11.
|
Kontsentratsioonide arv
|
|
Vähemalt 3 (pluss vajalikud kontrollkatsed)
|
Vähemalt 3 (pluss vajalikud kontrollkatsed)
|
Vähemalt 3 (pluss vajalikud kontrollkatsed)
|
|
12.
|
Paralleelkatsete arv ühe kemikaalikontsentratsiooni kohta
|
|
Vähemalt 4 (välja arvatud ruutjuurjaotustega kontrollkatsete puhul)
|
Vähemalt 4 (välja arvatud ruutjuurjaotustega kontrollkatsete puhul)
|
Vähemalt 4 (välja arvatud ruutjuurjaotustega kontrollkatsete puhul)
|
|
|
Elus Artemia, külmutatud täiskasvanud soolase vee hall krevett, helvessööt jne. Soovitatakse sööta kaks korda päevas.
|
Spetsiaalne kalamaimude kuivtoit, elus Artemia, külmutatud täiskasvanud soolase vee hall krevett, helvessööt jne. Soovitatakse sööta kaks korda päevas.
|
Elus Artemia, külmutatud täiskasvanud soolase vee hall krevett, helvessööt jne. Soovitatakse sööta kaks korda päevas.
|
|
|
Ei ole vajalik, välja arvatud juhul, kui lahustunud hapniku sisaldus langeb alla 60 % küllastuskontsentratsioonist
|
Ei ole vajalik, välja arvatud juhul, kui lahustunud hapniku sisaldus langeb alla 60 % küllastuskontsentratsioonist
|
Ei ole vajalik, välja arvatud juhul, kui lahustunud hapniku sisaldus langeb alla 70 % küllastuskontsentratsioonist
|
|
|
Puhas pinna-, kaevu- või taastatud vesi
|
Puhas pinna-, kaevu- või taastatud vesi
|
Puhas pinna-, kaevu- või taastatud vesi
|
|
16.
|
Uuritava kemikaaliga kokkupuute kestus
|
|
60 päeva pärast koorumist
|
60 päeva pärast koorumist
|
60 päeva pärast koorumist
|
|
17.
|
Bioloogilised näitajad
|
|
Koorumise edukus, ellujäämine, üldine morfoloogia, vitellogeniinsugunäärmete histoloogia, geneetiline sugu sooline jaotumine
|
Koorumise edukus, ellujäämine üldine morfoloogia, vitellogeniin sugunäärmete histoloogia, sooline jaotumine Koorumise edukus, ellujäämine
|
üldine morfoloogia, vitellogeniin sugunäärmete histoloogia, sooline jaotumine
|
|
18.
|
Katse nõuetekohasuse kriteeriumid kontrollrühmade koondatud paralleelkatsete puhul
|
|
Koorumise edukus > 80 %
|
Koorumise edukus > 80 %
|
Koorumise edukus > 80 %
|
|
Ellujäämine pärast koorumist ≥ 70 %
|
Ellujäämine pärast koorumist ≥ 70 %
|
Ellujäämine pärast koorumist ≥ 70 %
|
|
Kasv (kuivaks pühitud kala märgmass) > 150 mg
|
Kasv (kuivaks pühitud kala märgmass) > 75 mg
|
Kasv (kuivaks pühitud kala märgmass) > 120 mg
|
|
Pikkus (standardpikkus) > 20 mm
|
Pikkus (standardpikkus > 14 mm)
|
Pikkus (standardpikkus) > 20 mm
|
|
Sooline jaotumine (isasloomade või emasloomade %)
30 % – 70 %
|
Sooline jaotumine (isasloomade või emasloomade %) 30 % – 70 %
|
Sooline jaotumine (isasloomade või emasloomade %) 30 % – 70 %
|
3. liide
Kasutuskõlbliku lahjendusvee keemilised omadused
|
KOOSTISOSA
|
KONTSENTRATSIOON
|
|
Tahked osakesed
|
< 20 mg/l
|
|
Orgaanilise süsiniku üldsisaldus
|
< 2 mg/l
|
|
Ioniseerimata ammoniaak
|
< 1 μg/l
|
|
Jääkkloor
|
< 10 μg/l
|
|
Fosfororgaaniliste pestitsiidide üldsisaldus
|
< 50 ng/l
|
|
Kloororgaaniliste pestitsiidide ja polüklooritud bifenüülide üldsisaldus
|
< 50 ng/l
|
|
Orgaanilise kloori üldsisaldus
|
< 25 ng/l
|
4. liide
Tabel katsemeetodist c.14: juhend uuritavate kontsentratsioonide valimiseks
|
Veerg (kontsentratsioonide arv 100 ja 10 või 10 ja 1 vahel) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
5. liide
Juhend noore vöötdaanio, tüseda tömpnina, hariliku ogaliku ja jaapani riisikala pea/saba homogenaadi valmistamiseks
Käesoleva osa eesmärk on kirjeldada vitellogeniini kontsentratsiooni määramise ettevalmistavaid etappe. Vitellogeniini kontsentratsiooni määramiseks võib kasutada ka muid meetodeid, mis annavad sellega võrreldavaid tulemusi. Vitellogeniini kontsentratsiooni võib pea/saba homogenaadi asemel määrata ka vereplasmast või maksast.
Töö käik
|
1.
|
Kalad tuimastatakse ja surmatakse humaansel viisil kooskõlas katse kirjeldusega.
|
|
2.
|
Kala pea ja saba lõigatakse ära kooskõlas katse kooskõlas. Oluline märkus: kõik lõikeriistad ja lõikelaud tuleks loputada ja korralikult puhastada (näiteks 96 % etanooliga) enne iga üksiku kala lõikamist, et hoida ära indutseerimata isaskalade saastamist emaskalade ja indutseeritud isaskalade vitellogeniiniga.
|
|
3.
|
Iga kala pea ja saba summaarne mass mõõdetakse milligrammi täpsusega.
|
|
4.
|
Pärast kaalumist pannakse need kehaosad sobivasse nõusse (nt 1,5 ml Eppendorfi katsuti) ja külmutatakse – 80 °C juures kuni homogeenimiseni või homogeenitakse kohe jää peal kahe plastikvarda abil. (Võib kasutada ka muid meetodeid, kui homogeenimine toimub jää peal ja saadakse homogeenne mass.) Oluline märkus:
Viaalid peavad olema korralikult nummerdatud, nii et kala pea ja saba on kokkuviidavad vastava kehatükiga, mida kasutatakse sugunäärmete histoloogia uurimiseks.
|
|
5.
|
Pärast ühtlase massi saavutamist lisatakse koemassiga võrreldes 4–10-kordne kogus jääkülma homogeenimispuhvrit
(29) (märkige üles lahjendusaste). Töötage varrastega edasi, kuni segu on homogeenne. Oluline märkus:
Iga kala puhul kasutatakse uusi vardaid.
|
|
6.
|
Proovid pannakse jääle kuni tsentrifuugimiseni 4 °C ja 50 000 g juures 30 minuti jooksul.
|
|
7.
|
Pipetiga võetakse 20–50 μl (märkige üles kogus) supernatanti ja pannakse vähemalt kahte viaali; pipeti ots viiakse pinnal olevat rasvakihi alla ja tõmmatakse supernatanti sisse nii, et rasva- ja põhjas oleva sademe fraktsioon kaasa ei tuleks.
|
|
8.
|
Viaale säilitatakse temperatuuril – 80 °C kuni kasutamiseni.
|
Märkus. Homogeenimispuhver peaks olema valmistatud kasutamise päeval. Asetage kasutamise ajaks jääle.
6. liide
Juhend vitellogeniini mõõtmiseks vöötdaanio (Danio rerio) pea/saba homogenaadist (muudetud holbech et al., 2001). võib kasutada muid meetodeid, milles kasutatakse homoloogseid antikehi ja standardeid
|
1.
|
Mikrotiiterplaadid (sertifitseeritud Maxisorp F96, Nunc, Roskilde, Taani), mis on eelnevalt kaetud vöötdaanio lipovitelliini vastase IgG-ga kontsentratsioonis 5 μg/ml, sulatatakse ja pestakse kolm korda pesemispuhvriga (*).
|
|
2.
|
Vöötdaanio puhastatud vitellogeniini standardit (30) lahjendatakse seeriana kontsentratsioonideni 0,2, 0,5, 1, 2, 5, 10, 20 ng 1 ml lahjenduspuhvri (**) kohta ja proove lahjendatakse vähemalt 200 korda (maatriksiefekti vältimiseks) lahjenduspuhvris ja kantakse plaatidele. Kontrollkatse tehakse kahe paralleelkatsena. Mikrotiiterplaadi igasse süvendisse kantakse 150 μl. Standardainega tehakse kaks paralleelmääramist ja proovidega kolm. Inkubeeritakse 4 °C juures üle öö loksutil.
|
|
3.
|
Plaate pestakse 5 korda pesemispuhvriga (*).
|
|
4.
|
Dekstraaniahelale (nt AMDEX A/S, Taani) seotud mädarõika peroksidaas ja konjugeeritud antikehad lahjendatakse pesemispuhvris; kasutatav lahjendus sõltub partiist ja vanusest. Igasse süvendisse pannakse 150 μl ja plaate inkubeeritakse loksutil 1 tund toatemperatuuril.
|
|
5.
|
Plaate pestakse viis korda pesemispuhvriga (*) ja süvendite põhjad puhastatakse hoolikalt etanooliga.
|
|
6.
|
Mikrotiiterplaadi igasse süvendisse kantakse 150 μl lahust TMB plus (***). Plaat varjatakse valguse eest fooliumiga ja jälgitakse värvuse ilmumist loksutil.
|
|
7.
|
Kui standardkõver on täielikult ilmutatud, pidurdatakse ensüümi aktiivsus 150 μl 0,2 M H2SO4 lahuse lisamisega igasse süvendisse.
|
|
8.
|
Neeldumine mõõdetakse lainepikkusel 450 nm (nt Molecular Devices Thermomax'i plaadilugejaga). Andmeid analüüsitakse asjakohase programmiga (nt Softmax).
|
|
(*)
|
Pesemispuhver:
|
PBS-põhilahust (****)
|
500,0
|
ml
|
|
Veise seerumialbumiini BSA)
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
pH viiakse 7,3 peale ja täidetakse 5 l-ni veega, mis on lastud läbi Millipore'i filtri. Säilitatakse temperatuuril 4 °C.
|
|
|
(**)
|
Lahjenduspuhver:
|
PBS-põhilahus (****)
|
100,0
|
ml
|
|
Veise seerumialbumiini (BSA)
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
pH viiakse 7,3 peale ja täidetakse 1 l-ni veega, mis on lastud läbi Millipore'i filtri. Säilitatakse temperatuuril 4 °C
|
|
|
(***)
|
TMB plus on kasutusvalmis substraat, mida toodab KemEnTec (Taani). See on tundlik valguse suhtes. Säilitatakse temperatuuril 4 °C.
|
|
(****)
|
PBS-põhilahust
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4 · 2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
pH viiakse 6,8 peale ja täidetakse 2 l-ni veega, mis on lastud läbi Millipore'i filtri. Säilitatakse toatemperatuuril.
|
|
7. liide
Juhend koelõikude ettevalmistamiseks soo ja sugunäärmete arengustaadiumi määramiseks
Käesoleva osa eesmärk on kirjeldada koelõikude ettevalmistamist histoloogiliseks hindamiseks. Võib kasutada ka muid meetodeid, millega saadakse sarnased soolise jaotumise ja sugunäärmete arengustaadiumi näitajad.
Väheste eranditega on need meetodid samasugused jaapani riisikala ja vöötdaanio puhul.
Valutu surmamine, lahkamine ja kudede fikseerimine
Eesmärgid:
|
1.
|
Tagada kalade humaanne surmamine.
|
|
2.
|
Teha vajalikud kehamassi ja muud mõõtmised.
|
|
3.
|
Hinnata sekundaarseid sootunnuseid.
|
|
4.
|
Lõigata välja koed vitellogeniini määramiseks.
|
|
5.
|
Fikseerida sugunäärmed.
|
Töö käik:
|
1.
|
Kalad tuleks surmata vahetult enne lahkamist. Kui lahkajaid ei ole palju, siis ei tohiks korraga surmata paljusid kalu.
|
|
2.
|
Väikse kahvaga võetakse kala katsekambrist ja viiakse transpordimahutis lahkamiskohta.
|
|
3.
|
Kala pannakse valutu surmamise lahusesse. Kala võetakse lahusest välja, kui hingamisliigutused on lakanud ja kala ei reageeri välistele ärritajatele.
|
|
4.
|
Kala kaalutakse märjalt.
|
|
5.
|
Selleks, et valmistada koed ette vitellogeniini määramiseks, võib kala panna lahkamismikroskoobi korkkattega alusele.
|
a.
|
Vöötdaanio puhul lõigatakse pea maha otse rinnauime tagant ja saba lõigatakse maha otse seljauime tagant.
|
|
b.
|
Jaapani riisikala puhul avatakse kõht hoolika sisselõikega, mis ulatub mööda kõhu keskjoont rinnavöötmest kuni punktini, mis asub kohe päraku peapoolse otsa kõrval. Väikeste pintsettide ja väikeste kääridega eemaldatakse hoolikalt maks.
|
|
|
6.
|
Proov vitellogeniini määramiseks pannakse Eppendorfi katsutisse ja külmutatakse viivitamata vedelas lämmastikus.
|
|
7.
|
Rümp sugunäärmetega pannakse eelnevalt märgistatud plastikust koekassetti, mis paigutatakse Davidsoni või Bouini fikseerivasse lahusesse. Fikseerivat lahust peaks ruumala poolest olema vähemalt 10 korda rohkem kui on koe hinnanguline maht. Fikseeriva lahusega anumat loksutatakse ettevaatlikult viis sekundit, et kõrvaldada kassetist õhumulle.
|
|
8.
|
|
a.
|
Kõik koed jäetakse Davidsoni fikseerivasse lahusesse üheks ööks, järgmisel päeval kantakse need üle eraldi nõudesse, milles on neutraalse puhvriga 10 % formaliini lahus. Nõusid kassettidega loksutatakse ettevaatlikult 5 sekundit, et formaliin saaks vabalt tungida kassettidesse.
|
|
b.
|
Koed jäetakse Bouini fikseerivasse lahusesse 24 tunniks, seejärel viiakse need üle 70 % etanooli.
|
|
Kudede töötlemine
Eesmärgid:
|
1.
|
Veetustada kude parafiini korraliku läbitungimise võimaldamiseks.
|
|
2.
|
Kude immutatakse parafiiniga koe terviklikkuse säilitamiseks ja kindla pinna loomiseks, mis võimaldaks teha mikrotoomilõikeid.
|
Töö käik:
|
3.
|
Märgistatud koekassetid võetakse formaliinist/etanoolist välja ja pannakse töötlemiskorvi(desse). Töötlemiskorv pannakse koeprotsessorisse.
|
|
4.
|
Valitakse töötlemisrežiim.
|
|
5.
|
Kui seade lõpetab töötlemistsükli, võib korvi(d) üle viia sisestamisseadmesse.
|
Sisestamine
Eesmärk:
Orienteerida proov tahkestatud parafiinis õigesti mikrotoomia jaoks.
Töö käik:
|
1.
|
Korv(id) kassettidega võetakse protsessorist välja ja sukeldatakse sisestamisseadme termokonsooli parafiiniga täidetud eeskambrisse või viiakse kassetid üle eraldi parafiinikuumutisse.
|
|
2.
|
Esimene sisestatav kassett võetakse välja termokonsooli eeskambrist või parafiinikuumutist. Kasseti kaas võetakse ära ja visatakse minema ning kassetil olevat märgistust võrreldakse looma kohta registreeritud andmetega, et lahendada võimalikud vastuolud enne sisestamist.
|
|
3.
|
Valitakse sobiva suurusega sisestamisvorm.
|
|
4.
|
Vormi hoitakse dosaatorkonsooli väljalaskeava all ja see täidetakse sula parafiiniga.
|
|
5.
|
Proov võetakse kassetist ja pannakse vormi sulasse parafiini. Nii tehakse iga parafiinivormi puhul 4–8 prooviga. Iga üksiku kala asend märgitakse nii, et kala nr 1 on 180 kraadi all kala nr 2-4/8 suhtes.
|
|
6.
|
Lisatakse parafiini proovi katmiseks.
|
|
7.
|
Vorm kassetialusega pannakse krüokonsooli jahutusplaadile.
|
|
8.
|
Pärast parafiini tahkestumist võetakse plokk (st tahkestunud parafiin, mis sisaldab kudesid ja kassetipõhjasid) vormist välja.
|
Mikrotoomia
Eesmärk:
lõigata ja seada histoloogilised koelõiked valmis värvimiseks.
Töö käik:
|
1.
|
Mikrotoomia algetapil proov positsioneeritakse järgmiselt:
|
a.
|
Parafiiniplokk pannakse mikrotoomi kelgule.
|
|
b.
|
Kelku liigutatakse edasi mikrotoomi ratta abil ja parafiiniploki pinnalt lõigatakse pakse kihte, kuni nuga jõuab sisestatud kudedeni.
|
|
c.
|
Mikrotoomi lõikepaksuseks seatakse 3–5 mikronit. Kelku lükatakse edasi ja plokist tehakse mitu lõiget, et kõrvaldada kõik artefaktid, mis võivad olla tekkinud koelõigu pinnal jämeda kärpimisega.
|
|
d.
|
Ploki võib kelgult maha võtta ja panna jääle esiküljega allapoole koe niisutamiseks.
|
|
|
2.
|
Mikrotoomia järgmine etapp on lõplik lõigete tegemine ja koeliistakute panemine objektiklaasile. See toimub järgmiselt:
|
a.
|
Kui plokk on pandud jääle, võetakse see sealt ära ja pannakse tagasi mikrotoomi kelgule.
|
|
b.
|
Mikrotoomi lõigete paksuseks seatakse 3–5 mikronit, kelku liigutatakse edasi mikrotoomi ratta keeramisega. Plokist tehakse lõikeid, kuni saadakse riba, milles on vähemalt üks korralik sugunäärmeid hõlmav lõige. (Lõikamise puhul võib olla vajalik võtta plokk kelgult, panna koe niisutamiseks jääle ja panna siis tagasi kelgule.)
|
|
c.
|
Lõiked pannakse vesivanni veepinnale lapiti ujuma. Püütakse leida vähemalt üks lõige, millel ei oleks kortse ja mille all ei oleks kinnijäänud õhumulle.
|
|
d.
|
Mikroskoobi objektiklaas pannakse vette parima lõike alla ja tõstetakse see klaasi abil veest välja. See protsess on paigaldamine objektiklaasile.
|
|
e.
|
Ühe kala komplekti jaoks valmistatakse kolm lõiget. Teine ja kolmas lõige tehakse pärast esimest lõiget 50 mikroniliste vahemaade järel. Kui kala ei ole sisestatud nii, et sugunäärmed oleksid ühes ja samas lõiketasapinnas, tuleb teha rohkem lõikeid; iga kala kohta tuleb saada vähemalt kuus sugunäärmeid hõlmavat lõiget.
|
|
f.
|
Markeriga märgitakse objektiklaasile ploki number, millest saadi klaasil olev lõige.
|
|
g.
|
Objektiklaas pannakse värvimisraamile.
|
|
h.
|
Plokk võetakse kelgult ja pannakse hoiukohta esiküljega allapoole.
|
|
Värvimine, kaanetamine ja preparaadi märgistamine
Eesmärgid:
|
—
|
Värvida lõiked histopatoloogiliseks uuringuks.
|
|
—
|
Püsivalt sulgeda objektiklaasile paigutatud ja värvitud kude.
|
|
—
|
Püsivalt märgistada värvitud lõiked nii, et oleks tagatud täielik jälgitavus.
|
Töö käik:
|
1.
|
Värvimine
|
a.
|
Objektiklaase kuivatatakse õhu käes enne värvimist üks öö.
|
|
b.
|
Lõiked värvitakse hematoksüliini ja eosiiniga.
|
|
|
2.
|
Kaanetamine
|
a.
|
Kaaned võib peale panna käsitsi või automaadiga.
|
|
b.
|
Objektiklaas kastetakse ksüleeni või TissueClear'i sisse ja liigne vedelik eemaldatakse klaasi ettevaatliku koputamisega.
|
|
c.
|
Objektiklaasi selle serva lähedale, mis on mati ääre vastasküljel, või kaanele kantakse ligikaudu 0,1 ml kinnituskeskkonda.
|
|
d.
|
Kaant objektiklaasi suhtes väikse nurga all hoides pannakse kaas objektiklaasi peale.
|
|
|
3.
|
Märgistamine
|
a.
|
Igal objektiklaasil esitatakse järgmine teave:
|
iii.
|
Proovi nr / preparaadi nr
|
|
iv.
|
Kemikaal / kontsentratsioonirühm
|
|
|
8. liide
Vitellogeniini määramise tulemuste statistilise analüüsi otsustamisskeem

Soolise jaotumise määramise tulemuste statistilise analüüsi otsustusskeem
9. liide
Geneetilise soo määramiseks vajalike koeproovide võtmise ja PCR-meetodiga geneetilise soo määramise juhend
Jaapani riisikala koeproovide võtmine, ettevalmistamine ja säilitamine enne geneetilise soo määramist PCR-meetodiga (koostanud Bayer CropScience AG veeorganismide labor)
|
1.
|
Iga kala päraku- või seljauim lõigatakse väikeste kääridega ära ja pannakse katseklaasi, milles on 100 μl ekstraheerimispuhvrit 1 (puhvri valmistamise üksikasjad on esitatud allpool). Kääre puhastatakse pärast iga kala lõikamist destilleeritud veega täidetud keeduklaasis ja kuivatatakse pabersalvrätiga.
|
|
2.
|
Uimekoed homogeenitakse nüüd mikrotorus teflonvarda abil rakkude lüüsi saavutamiseks. Iga toru puhul kasutatakse uut varrast, et vältida saastamist. Vardad pannakse ööseks 0,5 M NaOH sisse, loputatakse viis minutit destilleeritud vees ja hoitakse etanoolis või steriilsena pärast autoklaavimist kuni kasutamiseni.
|
|
3.
|
Uimekudet on võimalik hoida ilma ekstraheerimispuhvrita 1 kuival jääl ja seejärel külmkapis – 80 °C juures, et vältida DNA lagunemist. Kuid ekstraheerimine läheb paremini, kui te ekstraheerite DNA kohe samal ajal (käsitsemine vt eespool; proovid tuleks sulatada jääl pärast säilitamist – 80 °C juures, enne kui puhver viiakse torudesse).
|
|
4.
|
Pärast homogeenimist viiakse kõik torud vesivanni ja keedetakse 15 minutit 100 °C juures.
|
|
5.
|
Seejärel lisatakse igasse torusse pipetiga 100 μl ekstraktsioonipuhvrit 2 (puhvri valmistamise üksikasjad vt allpool). Proove hoitakse toatemperatuuril 15 minutit ja selle aja jooksul neid aeg-ajalt loksutatakse käsitsi.
|
|
6.
|
Seejärel pannakse kõik torud jälle vesivanni keedetakse veel 15 minutit 100 °C juures.
|
|
7.
|
Kuni edasise analüüsini torud külmutatakse – 20 °C juures.
|
Puhvrite valmistamine
PCR-puhver 1:
|
|
500 mg N-lauroüülsarkosiini (nt Merck KGaA, Darmstadt, Saksamaa)
|
|
|
lisada dest. vett 100 ml-ni
|
PCR-puhver 2:
|
|
20 g Chelex'it (nt Biorad, München, Saksamaa)
|
|
|
lasta paisuda 100 ml-s dest. vees
|
Jaapani riisikala geneetilise soo määramine PCR-meetodiga (koostanud Bayer CropScience AG veeorganismide labor ja Würzburgi ülikooli biokeskus)
Ettevalmistatud ja külmutatud torud (vt eelmine jagu) sulatatakse jää peal. Pärast seda need tsentrifuugitakse Eppendorfi tsentrifuugis (30 s maksimaalse kiirusega, toatemperatuuril). PCR-analüüsi jaoks kasutatakse sademest eraldatud selget supernatanti. Tuleb kindlalt vältida sademes oleva Chelex'i vähimategi jälgede ülekandmist PCR-reaktsiooni, kuna see segab Taq-polümeraasi aktiivsust. Supernatanti kasutatakse kas kohe või seda võib säilitada külmutatult (– 20 °C juures) ja uuesti üles sulatada (ka mitu korda), ilma et see mõjutaks DNA hilisemat analüüsi.
1. „Reaktsioonisegu” ettevalmistamine (25 μl ühe proovi kohta):
|
|
Maht
|
Lõppkontsentratsioon
|
|
Maatriks-DNAd
|
0,5–2 μl
|
|
|
10x PCR-puhvrit MgCl2-ga
|
2,5 μl
|
1 x
|
|
Nukleotiide (dATP, dCTP, dGTP, dTTP, igaühte)
|
4 μl (5 mM)
|
200 μM
|
|
Päripidist praimerit (10 μM) (vt allpool 3–5)
|
0,5 μl
|
200 nM
|
|
Äraspidist praimerit (10 μM) (vt allpool 3–5)
|
0,5 μl
|
200 nM
|
|
Dimetüülsulfoksiidi (DMSO)
|
1,25 μl
|
5 %
|
|
Vett (PCR jaoks sobiva puhtusega)
|
kuni 25 μl-ni
|
|
|
Taq E-polümeraasi
|
0,3 μl
|
1,5 U
|
|
10x PCR-puhver MgCl2-ga: 670 mM Tris/HCl (pH 8,8 25 °C juures), 160 mM (NH4)2SO4, 25 mM MgCl2, 0,1 % Tween 20
|
Iga PCR-reaktsiooni jaoks (vt allpool 3–5) on vaja spetsiaalset praimerit, mis on uus „reaktsioonisegu” ja matriits-DNA piisava vajaliku koguse kombinatsioon. Vastavad kogused kantakse üle uutesse torudesse pipettidega. Pärast seda kõik katseklaasid suletakse, segatakse (umbes 10 sekundit) ja tsentrifuugitakse (10 sekundit, toatemperatuuril). Nüüd võib alustada vastavaid PCR-programme. Lisaks kasutatakse igas PCR-programmis veel üht positiivset kontrolli (näidis-DNA-proov, millel on teadaolev aktiivsus ja selged tulemused), ja üht negatiivset kontrolli (1 μl dest. H2O).
2. Agaroosgeeli (1 %) valmistamine – PCR-programmi toimumise ajal:
|
—
|
Lahustage 3 g agaroosi 300 ml-s 1 × TAE-puhvris (1 % agaroosgeel)
|
|
—
|
Seda lahust tuleks keeta mikrolaineahjus (ligikaudu 2–3 minutit)
|
|
—
|
Viige kuum lahus üle spetsiaalsesse valamiskarpi, mis asub jää peal
|
|
—
|
Umbes 20 minuti pärast on agaroosgeel valmis kasutamiseks
|
|
—
|
Säilitage agaroosgeeli 1 × TAE-puhvris kuni PCR-programmide lõpuni
|
3. Aktiin-PCR-programm:
Selle PCR-reaktsiooni eesmärk on tõendada, et proovis olev DNA ei ole kahjustatud.
|
—
|
Spetsiaalne praimer:
|
—
|
„Mact1 (upper/forward)” → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
„Mact 2 (lower/reverse)” → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Programm:
|
—
|
5 minutit temperatuuril 95 °C
|
|
—
|
Tsükkel (35 korda):
|
Denatureerimine
|
→ 45 s 95 °C juures
|
|
Karastamine
|
→ 45 s 56 °C juures
|
|
Pikendamine
|
→ 1 minut 68 °C juures
|
|
|
—
|
15 minutit temperatuuril 68 °C
|
|
4. X- ja Y-geeni PCR-programm:
Selles PCR-programmis kasutatakse terve DNA proove selleks, et kontrollida X- ja Y-geene. Isaskala DNA peaks ilmuma kahe vöödina ja emaskala DNA üheainsa vöödina (pärast värvimist ja geel-elektroforeesi). Selle programmi tegemisel kasutatakse ühte isaskala (XY-näidis) ja üht emaskala (XX-näidis) positiivset kontrolli.
|
—
|
Spetsiaalne praimer:
|
—
|
„PG 17.5” (upper/forward) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
„PG 17.6” (lower/reverse) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Programm:
|
—
|
5 minutit temperatuuril 95 °C
|
|
—
|
Tsükkel (40 korda):
|
Denatureerimine
|
→ 45 s 95 °C juures
|
|
Karastamine
|
→ 45 s 55 °C juures
|
|
Pikendamine
|
→ 1 min 30 s 68 °C juures
|
|
|
—
|
15 minutit temperatuuril 68 °C
|
|
5. Y-geeni PCR-programm „kontroll” X- ja Y-geeni PCR-programmi puhul:
Selle PCR-programmiga kontrollitakse X- ja Y-geeni PCR-programmi tulemusi. Isaskala proovidel peaks ilmuma üks vööt ja emaskala proovidel mitte ühtegi vööti (pärast värvimist ja geel-elektroforeesi).
|
—
|
Spetsiaalne praimer:
|
—
|
„DMTYa (upper/forward)” → GGC CGG GTC CCC GGG TG
|
|
—
|
„DMTYd (lower/reverse)” → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Programm:
|
—
|
5 minutit temperatuuril 95 °C
|
|
—
|
Tsükkel (40 korda):
|
Denatureerimine
|
→ 45 s 95 °C juures
|
|
Anniilimine
|
→ 45 s 56 °C juures
|
|
Elongatsioon
|
→ 1 minut 68 °C juures
|
|
|
—
|
15 minutit temperatuuril 68 °C
|
|
6. PCR-proovide värvimine:
Värvimislahus:
Pipetiga kantakse 1 μl värvimislahust igasse torusse
7. Geel-elektroforeesi alustamine:
|
—
|
Ettevalmistatud 1 % agaroosgeel kantakse üle geel-elektroforeesikambrisse, mis on täidetud 1 × TAE-puhvriga
|
|
—
|
10–15 μl igast värvitud PCR-proovist viiakse pipetiga agaroosgeeli pilusse
|
|
—
|
Eraldi pilusse kantakse ka 5–15 μl 1kb-„redelit” (Invitrogen)
|
|
—
|
Elektroforeesi alustatakse 200 V juures
|
|
—
|
Elektroforees peatatakse 30-45 minuti pärast
|
8. Vöötide määramine:
|
—
|
Agaroosgeel puhastatakse destilleeritud vees
|
|
—
|
Seejärel kantakse agaroosgeel etiidiumbromiidi sisse 15–30 minutiks
|
|
—
|
Seejärel pildistatakse agaroosgeeli UV-valguse all
|
|
—
|
Lõpuks analüüsitakse proove ja võrreldakse neid positiivse kontrolli vöödi (või vöötidega) ja redeliga
|
10. liide
Juhend koeproovide võtmiseks, et määrata polümeraasi ahelreaktsiooni (PCR-) meetodil ogaliku geneetiline sugu
Koeproovide võtmine ja DNA eraldamine
DNA saab eraldada mitmesuguste müügil olevate reaktiivide abil kas käsitsi või automaatse DNA-eraldussüsteemiga. Allpool on esitatud Cefas Weymouthi laboris kasutatav eeskiri; sobival juhul on lisatud ka alternatiivseid võimalusi.
|
1.
|
Väikeste kääridega lõigatakse igast kalast väike tükk kude (10–20 mg) seljakülgmisest osast (pärast pea ja saba eemaldamist vitellogeniini analüüsiks). Kude pannakse viaali ja paigutatakse kas vedelasse lämmastikku säilitamiseks temperatuuril – 80 °C või täidetakse viaal 70 % etanooliga (transpordiks ja säilitamiseks temperatuuril 4 °C). Käärid puhastatakse pärast iga kala lõikamist 70 % etanooliga, seejärel destilleeritud veega ja kuivatatakse kuivatuspaberiga.
|
|
2.
|
Etanool (kui see lisati) eemaldatakse aspireerimisega ja kudesid lagundatakse hommikuni proteinaas K-ga 400 μl-s ATL-puhvris (Qiagen). Lagundatud koe alikvoot (200 μl) kantakse üle 96 süvendiga S-plokile (Qiagen) ja DNA eraldatakse 96 süvendiga vormist, kasutades Qiagen'i universaalbiorobotit ja QIamp'i teadlase bioroboti komplekti. DNA-d elueeritakse 50 μl veega, milles ei tohi olla DNaase ega RNaase. Kui DNA eraldamiseks kasutatakse kõvu kudesid (nt lülisammast või rinnauime), võib olla vajalik proovi homogeenimine lüüsipuhvris, kasutades FastPrep® koelagundajat või muud samaväärset kudede purustamise süsteemi.
Teised võimalused
|
a)
|
Kude lagundatakse öö läbi proteinaas K-ga 400 μl-s lüüsipuhvris G2 (Qiagen) ja DNA eraldatakse 200 μl-st lüüsitud lahusest, kasutades kas EZ-1 DNA easy tissue komplekti ja biorobotit EZ-1 või DNA easy tissue minikomplekti. DNA elueeritakse 50 μl veega.
|
|
b)
|
Kudesid töödeldakse reaktiiviga DNAzol. Lühidalt öeldes lüüsitakse koeproove 1 ml DNAzol'iga 10 minutit 1,5 ml mikrotsentrifuugitopsis ja tsentrifuugitakse siis kiirusega 13 000 p/min 5 minutit, et eemaldada kõik tahked osakesed. Lüüsitud proov viiakse seejärel üle uude 1,5 ml mikrotsentrifuugitopsi, milles on 500 μl 100 % molekulaarbioloogias vajaliku puhtusastmega etanooli ja seejärel tsentrifuugitakse kiirusega 13 000 p/min 10 minutit, et sadestada DNA. Etanool eemaldatakse ja asendatakse 400 μl 70 % molekulaarbioloogias vajaliku puhtusastmega etanooliga, tsentrifuugitakse kiirusega 13 000 p/min 5 minutit ja DNAd sisaldav sade lahustatakse 50 μl vees, milles ei tohi olla DNaase ega RNaase. Jällegi, kui kasutatakse kõvu kudesid (nt rinnauime), võib olla vajalik proovi homogeenimine lüüsipuhvris, kasutades FastPrep® koelagundajat või muud samaväärset kudede purustamise süsteemi.
|
|
|
3.
|
DNA säilitatakse – 20 °C juures, kuni seda läheb vaja.
|
Oluline märkus: töö ajal tuleb kanda kindaid.
Polümeraasi ahelreaktsiooni (PCR) analüüs
Amplifitseerimine viidi läbi 2,5 μl eraldatud DNA-ga reaktsioonisegu 50 μl mahu juures, kasutades Idh-lookuse praimereid (nagu on kirjeldatud Peichel et al., 2004. Current Biology 1:1416-1424):
|
Päripidine praimer
|
5' GGG ACG AGC AAG ATT TAT TGG 3'
|
|
Äraspidine praimer
|
5' TAT AGT TAG CCA GGA GAT GG 3'
|
Sobivate PCR-reaktiivide pakkujaid on palju. Allpool kirjeldatud meetodid kasutatakse praegusel ajal Cefas Weymouthi laboris.
1. „Reaktsioonisegu” ettevalmistamine (50 μl ühe proovi kohta):
Põhisegu valmistatakse järgmiselt. Selle saab ette valmistada ja säilitada külmutatult – 20 °C juures, kuni seda vaja läheb. Valmistage piisav kogus põhisegu negatiivse kontrolli jaoks (molekulaarbioloogias vajaliku kvaliteediga vesi).
|
|
Ruumala (põhilahuse konts) /proov
|
Lõppkontsentratsioon
|
|
5xGoTaq® reaktsioonipuhver
|
10 μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nukleotiidid (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (25 mM igaühte)
|
250 μM igaühte
|
|
Päripidine praimer
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Äraspidine praimer
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Molekulaarbioloogias vajaliku puhtusega vesi
|
30,75 μl
|
|
|
GoTaq polümeraas
|
0,25 μl
|
1,25 Ü
|
|
—
|
Viige 47,5 μl märgistatud õhukeseseinalisse 0,5 ml PCR-viaali.
|
|
—
|
Lisage asjakohase märgisega viaali 2,5 μl puhastatud DNAd. Korrake sama kõikide proovide ja negatiivse kontrolli puhul.
|
|
—
|
Lisage selle peale 2 tilka mineraalõli. Teise võimalusena võite kasutada kuumutatud kaanega termotsüklerit.
|
|
—
|
Proovid denatureeriti Peltier PTC-225 termotsükleris 5 minutit temperatuuril 94 ± 2 °C, millele järgnes 39 tsüklit temperatuuril 94 ± 2 °C 1 minut, 55 ± 2 °C 1 minut, 72 ± 2 °C 1 minut ning lõplik pikendamine temperatuuril 72 ± 2 °C 10 minutit.
|
2. Agaroosgeeli (2 %) ettevalmistamine:
Tavaliselt lahutatakse PCR-reaktsiooni saadusi 20 % agaroosgeeliga, mis sisaldab etiidiumbromiidi.
Samuti võib kasutada kapillaaridel põhinevat elektroforeesisüsteemi.
|
—
|
Kaaluge 2 g agaroosi 100 ml-sse 1 × TAE-puhvrisse
|
|
—
|
Kuumutage mikrolaineahjus (ligikaudu 2–3 min), et agaroos lahustuks.
|
|
—
|
Lisage 2 tilka etiidiumbromiidi lõpliku kontsentratsiooni 0,5 μg/ml saamiseks
|
|
—
|
Kandke kuum lahus üle geelivalamisseadmesse.
|
3. Geel-elektroforees:
|
—
|
Viige agaroosgeel üle elektroforeesiseadmesse ja katke see 1 × TAE-puhvriga
|
|
—
|
Laadige 20 μl igast proovist eraldi süvendisse, lisage molekulmassimarker (100 aluspaari DNA-redel, Promega) kasutamata süvendisse.
|
|
—
|
Tehke elektroforeesi 120 V juures 30–45 minutit.
|
4. Amplifikatsioonisaaduste nähtavakstegemine
Kui kasutatakse etiidiumbromiidilisandiga agaroosgeeli, nagu on kirjeldatud eespool, on DNA-saadused nähtavad UV-lambi all. Teise võimalusena võib agaroosgeeli värvida: geel kaetakse etiidiumbromiidi lahja lahusega (0,5 μg/ml vees) 30 minutiks enne tulemuste vaatlemist.
11. liide
Juhend ogaliku marja kunstliku viljastamise kohta
Käesolevas liites kirjeldatakse meetodit ogaliku viljastatud marjaterade saamiseks, et kasutada neid kalade sugulise arengu katses.
Töö käik
Seemnevedeliku kogumine isaskaladelt
|
1.
|
Soovitud populatsioonist valitud hästi värvunud isaskala surmatakse valutult.
|
|
2.
|
Niisk lõigatakse kala kummaltki küljelt välja. Niisk on üldiselt tugevasti pigmenteerunud pulgakujuline elund, mis on kergesti nähtav keha külgjoonel. Kasutatakse üht järgmistest meetoditest:
|
|
3.
|
Väikeste kääridega tehakse üks 1–1,5 cm pikkune sisselõige alates kloaagist umbes 45° nurga all.
|
|
4.
|
Skalpelliga tehakse väike sisselõige kala küljesse veidi tagapool kõhuuime ja kõhu pool küljeplaate.
|
|
5.
|
Niisk eemaldatakse peente näpitsatega ja pannakse Petri tassile.
|
|
6.
|
Kumbki niisk kaetakse 100 μl värskelt valmistatud Hanki lõpliku lahusega
(31).
|
|
7.
|
Niisad lõigatakse žiletitera või skalpelliga väikesteks kuubikuteks. See vabastab seemnevedeliku, mis muudab Hanki lahuse piimjaks.
|
|
8.
|
Seemnevedelikku sisaldav lahus viiakse üle viaali, püüdes pipeteerimisel mitte kaasa võtta koetükke.
|
|
9.
|
Viaali lisatakse 800 μl Hanki lõplikku lahust ja segatakse hoolikalt.
|
|
10.
|
Vajaduse korral võib isaskala säilitada; selleks fikseeritakse ta 100 % etanooli või muu soovitud fikseeriva lahusega. See on eriti oluline juhul, kui uuringuga hinnatakse järglaste vanemlikku päritolu.
|
Oluline märkus:
kuigi enamiku vajaminevatest põhilahustest võib varem valmis teha, tuleb põhilahus 5 ja seejärel lõplik lahus valmistada värskelt kasutamise päeval.
|
Põhilahus 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Destilleeritud vesi (DV)
|
100 ml
|
|
Põhilahus 2
|
|
Na2HPO4 (veevaba)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
DV
|
100 ml
|
|
Põhilahus 3
|
|
CaCl2
|
0,72 g
|
|
DV
|
50 ml
|
|
Põhilahus 4
|
|
MgSO4 · 7H2O
|
1,23 g
|
|
DV
|
50 ml
|
|
Põhilahus 5 (värskelt valmistatud)
|
|
NaHCO3
|
0,35 g
|
|
DV
|
10 ml
|
Märkus: Kui teil on mõni eespool nimetatud sooladest juba olemas, kuid erineva veesisaldusega (nt 2H2O veevaba asemel), võite seda kasutada, olles koguse molekulmassi alusel ümber arvutanud.
Hanki lõpliku lahuse valmistamiseks võtke põhilahuseid järgmises järjekorras:
|
põhilahus 1
|
1,0 ml
|
|
põhilahus 2
|
0,1 ml
|
|
põhilahus 3
|
0,1 ml
|
|
DV
|
8,6 ml
|
|
põhilahus 4
|
0,1 ml
|
|
põhilahus 5
|
0,1 ml
|
Enne kasutamist segada korralikult.
Viljastamine
|
1.
|
Soovitud populatsiooni hulgas tehakse kindlaks suured marja heitmiseks valmis emaskalad; emaskala on selleks valmis üksnes siis, kui marjateri võib näha kloaagist välja tungimas. Valmis emaskalad on iseloomulikus „pea ülespoole” asendis.
|
|
2.
|
Libistage sõrme või pöidlaga ettevaatlikult mööda kala külge saba suunas, et stimuleerida marjakoti heitmist värskele Petri tassile. Korrake sama ka teise küljega ja pange kala oma nõusse tagasi.
|
|
3.
|
Peene pintsliga võib marjaterad lükata laiali, nii et need moodustaksid ühekordse kihi. Oluline on püüda luua marjateradele võimalikult hea kokkupuude seemnevedelikuga; marjaterade pinna maksimeerimine tuleb seepärast kasuks. Oluline märkus: marjateri tuleb hoida niiskena nende ümber oleva niiske lapi abil (on oluline, et need ei puutuks otse kokku veega, kuna see põhjustaks koorioni kõvastumise, mis teeks viljastumise võimatuks). Emaskala koetavate marjaterade arv võib suuresti erineda, aga keskmiselt peaks ühelt kudemisvalmis emaskalalt saama 150 marjatera.
|
|
4.
|
25 μl seemnevedelikku Hanki segus määritakse pintsliga ühtlaselt laiali üle kõigi marjaterade. Marjaterad muutuvad kiiresti (ühe minutiga) kõvaks ja muudavad värvi, kui viljastumine on alanud. Kui marjateri on hinnanguliselt rohkem kui 150, tuleb seda etappi korrata. Kui munad ei kõvene ühe minuti jooksul, lisatakse veidi rohkem seemnevedelikku. Oluline märkus: seemnevedeliku koguse suurendamine ei paranda tingimata viljastumismäära.
|
|
5.
|
Marjaterad ja seemnevedeliku lahus tuleks jätta vastastikku mõjuma vähemalt 15 minutiks ja viljastatud mari tuleks paigutada kemikaaliga kokkupuute akvaariumidesse 1,5 tunni jooksul pärast viljastamist.
|
|
6.
|
Sama tegevust korratakse teiste emaskaladega, kuni on kogutud vajalik arv marjateri.
|
|
7.
|
Mõned marjaterad viimasest partiist jäetakse alles ja fikseeritakse 10 % äädikhappelahuses.
|
Marjaterade loendamine ja jaotamine katseakvaariumidesse
|
1.
|
Marjaterad tuleks kontsentratsioonitasemete vahel jaotada ühtlaselt, et vältida geneetikast tingitud kõrvalekallet. Viljastatud marjaterade iga partii tuleb jaotada võrdse suurusega rühmadesse (mille arv vastab kontsentratsioonitasemete arvule), kasutades nüri instrumenti (nagu laia otsaga entomoloogipintsetid või bakterikülvide tegemisel kasutatav silmus). Kui kavatsete iga kontsentratsiooniga teha neli paralleelkatset à 20 marjatera, tuleks teil iga kontsentratsiooni akvaariumide vahel jaotada 80 marjatera. Oluline märkus: soovitatav on lisada täiendavalt 20 % marjateri (st 96 marjatera kontsentratsioonitaseme kohta), kui te ei ole veendunud, et saavutate viljastumismäära 100 %.
|
|
2.
|
Ogaliku marjaterad on väga tundlikud seenenakkuse suhtes väljaspool pesa, mida kaitseb isakala. Seepärast on kõigi marjaterade töötlemine metüleensinisega esimese viie päeva jooksul äärmiselt oluline. Metüleensinise põhilahus valmistatakse kontsentratsiooniga 1 mg/ml ning seda lisatakse kemikaaliga kokkupuute akvaariumidesse, kuni saavutatakse lõppkontsentratsioon 2,125 mg/l. Oluline märkus: pärast koorumist ei tohiks ogalikud metüleensinisega enam kokku puutuda, nii et süsteem peaks 6. päevaks olema metüleensinisest vaba.
|
|
3.
|
Marjateri kontrollitakse iga päev ja kõik surnud või viljastamata marjatera leidmise juhtumid registreeritakse. Oluline märkus: marjaterad ei tohiks kuni koorumiseni isegi väga lühikest aega olla väljaspool vett.
|
C.42 BIOLAGUNDATAVUS MEREVEES
ÜLDINE SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 306 (1992). Esialgsete katsemeetodite väljatöötamise ajal ei olnud teada, millises ulatuses võib kiire biolagundatavuse sõelkatse tulemusi, mis on saadud magevee, reoveepuhastite väljavoolu ja aktiivmuda inokulumi abil, laiendada merekeskkonnale. Selle kohta on teatatud erinevaid tulemusi (vt näiteks (1)).
|
|
2.
|
Paljud mitmesuguseid kemikaale sisaldavad tööstuslikud reoveed jõuavad merre kas reovee otsese keskkonda juhtimisega või suudmealade ja jõgede kaudu, milles reovesi viibib vähe aega, võrreldes nendes esinevate kemikaalide täielikuks biolagunemiseks kuluva ajaga. Kuna saab üha selgemaks, et merekeskkonda on vaja kaitsta suureneva kemikaalireostuse eest ja on vaja hinnata kemikaalide võimalikku kontsentratsiooni merevees, on välja töötatud meetodid biolagunduvuse määramiseks merevees.
|
|
3.
|
Siin kirjeldatud meetodites on kasutatud looduslikku merevett nii veefaasina kui ka mikroorganismide allikana. Selleks et lähendada seda meetodit kiire biolagunduvuse määramise meetoditele magevee jaoks, uuriti ultrafiltritud ja tsentrifuugitud merevee kasutamist; inokulumina kasutati meresetteid. Need uuringud ei andnud tulemusi. Seepärast on katsekeskkonnaks looduslik merevesi, mida on eelnevalt töödeldud suuremate osakeste eemaldamiseks.
|
|
4.
|
Täieliku biolagunduvuse hindamiseks tuleb loksutatava kolvi meetodi puhul kasutada uuritava aine suhteliselt suurt kontsentratsiooni, kuna lahustunud orgaanilise süsiniku määramise meetod on vähetundlik. See omakorda nõuab merevee mineraalsete toitainete (N ja P) lisamist, kuna muidu piiraks nende kontsentratsioon lahustunud orgaanilise süsiniku eemaldamist. Ka suletud pudeli meetodi puhul tuleb lisatava uuritava aine kontsentratsiooni tõttu lisada toitaineid.
|
|
5.
|
Seega ei uurita kõnealuste meetoditega kiiret biolagunduvust, kuna inokulumi lisaks merevees juba olemasolevatele mikroorganismidele ei lisata. Samuti ei modelleerita nende katsete abil merekeskkonda, kuna lisatakse toitaineid ja uuritava aine kontsentratsioon on palju suurem, kui see oleks merevees. Seetõttu esitatakse need meetodid uues alljaotises „Biolagunduvus merevees”.
|
KOHALDAMINE
|
6.
|
Need katsed, mida tehakse, kuna kõnealuse kemikaali kasutamis- ja kõrvaldamisviis osutavad kemikaali sattumisele merre, annavad tulemuseks esialgse pildi biolagundatavusest merevees. Kui tulemus on positiivne (üle 70 % lahustunud orgaanilisest süsinikust kõrvaldatud; hapnikukulu üle 60 % teoreetilisest hapnikutarbest), võib teha järelduse, et biolagunduvus merekeskkonnas on võimalik. Negatiivne tulemus siiski ei välista biolagunduvuse võimalikkust, kuid näitab, et on vaja täiendavaid uuringuid, näiteks uuritava aine võimalikult madala kontsentratsiooni juures.
|
|
7.
|
Juhul kui on vaja täpsemalt teada biolagunduvuse kiirust või määra merevees kusagil konkreetses kohas, tuleks kasutada keerukamaid ja täiuslikumaid ning seetõttu ka kulukamaid meetodeid. Näiteks modelleerimiskatset võib teha ka uuritava aine kontsentratsiooniga, mis on lähemal oletatavale kontsentratsioonile keskkonnas. Kasutada võib ka toitainetega rikastamata ja eelnevalt töötlemata merevett, mis on võetud huvi pakkuvast kohast ja uurida primaarset biolagunduvust spetsiifilise keemilise analüüsiga. Täieliku biolagunduvuse uurimiseks tuleks kasutada C-märgistatud ainet, nii et oleks võimalik mõõta lahustuva orgaanilise 14C kadumist ja14CO2 tekkimist keskkonna seisukohast realistlikel kontsentratsioonidel.
|
MEETODITE VALIMINE
|
8.
|
Kasutatava meetodi valimine sõltub paljudest teguritest; järgmine tabel peaks hõlbustama valiku tegemist. Kuigi aineid, mille lahustuvus vees on väiksem kui 5 mg C/l vastav kontsentratsioon, ei saa uurida loksutatava kolvi meetodiga, võib vähelahustuvaid aineid siiski uurida kinnise pudeli meetodiga.
Tabel
Loksutatava kolvi ja kinnise pudeli katse eelised ja puudused
|
MEETOD
|
EELISED
|
PUUDUSED
|
|
LOKSUTATAV KOLB
|
|
—
|
lihtne aparatuur, välja arvatud C analüsaator
|
|
—
|
kestus 60 päeva ei ole probleem
|
|
—
|
nitrifikatsioon ei sega uuringut
|
|
—
|
võib kasutada lenduvate ainete puhul
|
|
|
—
|
on vaja C analüsaatorit
|
|
—
|
kasutatakse kontsentratsioone 5–40 mg lah. org. C /1, mis võib olla inhibeeriva toimega
|
|
—
|
lah. org. süsiniku määramine madalatel kontsentratsioonidel merevees on keeruline (kloriidi mõju)
|
|
—
|
lah. org. süsiniku kontsentratsioon on merevees mõnikord suur
|
|
|
KINNINE PUDEL
|
|
—
|
kasutatakse madalat uuritava aine kontsentratsiooni (2 mg/l), seega on vähem inhibeerimise võimalusi
|
|
—
|
kerge on kasutada ka lenduvate ainete puhul
|
|
|
—
|
pudelite hermeetilisuse säilitamine võib olla keeruline
|
|
—
|
bakterite kasv nõu seintel võib põhjustada valesid tulemusi
|
|
—
|
kontrollkatses võib O2 sidumine muutuda intensiivseks eriti pärast 28 päeva; sellest võib üle saada merevee vanandamisega
|
|
—
|
segada võib nitrifikatsiooniga seotud O2 sidumine
|
|
|
LOKSUTATAVA KOLVI MEETOD
SISSEJUHATUS
|
1.
|
Kõnealune meetod on merevee jaoks kohandatud ja muudetud OECD sõelkatse, mida on kirjeldatud käesoleva lisa peatükis C.4B (2). See on lõpuni viimistletud Euroopa Komisjoni ja Taani veekvaliteedi instituudi korraldatud laboritevahelise võrdluskatsega (3).
|
|
2.
|
Samuti kui sellele järgneva suletud pudeli meetodi mereveevariandi puhul, ei tohiks käesoleva meetodi tulemusest teha järeldust kiire biolagunduvuse kohta; meetodiga saadakse konkreetselt teavet biolagunduvuse kohta merekeskkonnas.
|
MEETODI PÕHIMÕTE
|
3.
|
Kindlaksmääratud kogus uuritavat ainet lahustatakse katsekeskkonnas, et saada kontsentratsioon vahemikus 5–40 mg lahustunud orgaanilist süsinikku liitri kohta. Kui orgaanilise süsiniku määramise analüüsi tundlikkust suurendatakse, siis võib olla eelistatud uuritava kemikaali madalama kontsentratsiooni kasutamine, eriti kui tegemist on inhibeeriva ainega. Uuritava kemikaali lahust katsekeskkonnas inkubeeritakse loksutamisega pimedas või hajutatud valguses aeroobsetes tingimustes kindlal temperatuuril (mida hoitakse täpsusega ± 2 °C), mis on tavaliselt vahemikus 15–20 °C. Kui katse eesmärk on modelleerida keskkonnaolukordi, võib katse teha väljaspool seda normaalset temperatuurivahemikku. Katse soovitatav suurim kestus on 60 päeva. Lagunemist jälgitakse lahustunud orgaanilise süsiniku mõõtmisega (täielik lagunemine) ja mõnel juhul spetsiifilise analüüsiga (primaarne lagunemine).
|
ANDMED UURITAVA AINE KOHTA
|
4.
|
Selleks, et otsustada, kas katsemeetodit saab kasutada konkreetse aine puhul, peavad aine mõned omadused olema teada. Aine orgaanilise süsiniku sisaldus peab olema kindlaks määratud, aine lenduvus peab olema selline, et katse jooksul ei tekiks suuri aine kadusid ja aine lahustuvus vees peab olema suurem kui 25–40 mg süsinikku liitris. Samuti ei tohiks uuritav aine oluliselt adsorbeeruda klaasi pinnale. Teave uuritava aine puhtusastme või peamiste lisandite suhteliste koguste kohta on vajalik tulemuste tõlgendamiseks, eriti kui tulemus on biolagunduvuse kriteeriumi piiri lähedal.
|
|
5.
|
Sobivate uuritavate kontsentratsioonide valimiseks võivad vajalikud olla andmed uuritava kemikaali mürgisuse kohta bakteritele, mis on mõõdetud näiteks lühiajalise respiratsioonikiiruse katsega (4); sellised andmed võivad olla ülivajalikud biolagunduvuse väärtuste õigeks tõlgendamiseks. Selline teave ei ole siiski alati piisav biolagunduvuse katse tulemuste tõlgendamiseks ning sobivam on punktis 18 kirjeldatud meetod.
|
VÕRDLUSAINED
|
6.
|
Merevee proovi mikroobse aktiivsuse kontrollimiseks tuleb kasutada sobivaid võrdlusaineid. Selleks otstarbeks sobivad näiteks naatriumbensoaat, naatriumatsetaat ja aniliin. Võrdlusaine peab lagunema sobivalt lühikese ajavahemiku jooksul; vastasel korral soovitatakse katset korrata mõne muu mereveeprooviga.
|
|
7.
|
Euroopa Ühenduse võrdluskatses, kus merevee proovid olid võetud eri kohtadest ja eri aastaaegadel (3), olid naatriumbensoaadi puhul ootefaas (tL) ja 50 % lagunemiseks kuluv aeg (t50) ilma ootefaasita vastavalt 1–4 päeva ja 1–7 päeva. Aniliini puhul oli tL vahemikus 0–10 päeva ja t50 1–10 päeva.
|
ANALÜÜSIMEETODI KORRATAVUS JA TUNDLIKKUS
|
8.
|
Meetodi korratavus määrati laboritevahelise võrdluskatsega (3). Madalaim uuritava aine kontsentratsioon, mille puhul kõnealust meetodit võib kasutada koos lahustunud orgaanilise süsiniku (DOC) sisalduse määramisega, on suuresti määratud orgaanilise süsiniku määramispiiriga (ligikaudu 0,5 mg C/l) ja DOC sisaldusega avamerevees (tavaliselt 3–5 mg/l). DOC taustkontsentratsioon ei tohiks ületada ligikaudu 20 % DOC üldkontsentratsioonist pärast uuritava materjali lisamist. Kui see ei ole teostatav, võib DOC taustkontsentratsiooni mõnikord vähendada merevee vanandamisega enne katse tegemist. Kui seda meetodit kasutatakse ainult koos konkreetse kemikaali määramisega (sel viisil mõõdetakse primaarset lagundamist), peab uurija kirjandusest saadud lisateabe abil näitama, kas võib oletada ka lõplikku lagunduvust. Lisateave võib hõlmata muude katsete tulemusi, millega tõendatakse kiiret või iseeneslikku biolagunduvust.
|
MEETODI KIRJELDUS
Seadmed
|
9.
|
Tavalised laboriseadmed ja:
|
a.
|
loksuti, millesse saab paigutada 0,5–2 liitrise mahuga Erlenmeyeri kolbe, kas temperatuuri automaatse reguleerimisega või võimalusega teha katse ruumis, mille temperatuur on konstantselt vahemikus 15–20 (± 2) °C;
|
|
b.
|
kitsa kaelaga 0,5–2 liitrised Erlenmeyeri kolvid;
|
|
c.
|
membraanfiltrimisseade või tsentrifuug;
|
|
d.
|
membraanfiltrid 0,2–0,45 μm;
|
|
f.
|
varustus spetsiifiliste analüüside jaoks (ei ole kohustuslik).
|
|
Merevesi
|
10.
|
Merevee proov võetakse hoolikalt puhastatud nõusse ja transporditakse laborisse eelistatavalt ühe või kahe päeva jooksul pärast võtmist. Transpordi ajal ei tohi proovi temperatuur tõusta oluliselt kõrgemale katses kasutatavast temperatuurist. Registreeritakse täpne proovivõtu koht ja kirjeldatakse merevee saasteainete ja toitainete sisaldust kõnealuses kohas. Eriti rannikulähedaste vete puhul esitatakse selles kirjelduses ka heterotroofsete mikroorganismide kolooniate arv, samuti lahustunud nitraadi, ammooniumi ja fosfaadi kontsentratsioon.
|
|
11.
|
Merevee proovi enda kohta esitatakse järgmine teave:
|
—
|
proovi välimus – sogane vms;
|
|
—
|
temperatuur proovi võtmise ajal;
|
|
—
|
lahustunud orgaanilise süsiniku sisaldus;
|
|
—
|
ajavahemik proovivõtust kuni katseni.
|
|
|
12.
|
Kui lahustunud orgaanilise süsiniku sisaldus merevees on kõrge (punkt 8), soovitatakse merevett umbes üks nädal vanandada enne kasutamist. Merevett vanandatakse hoidmisega aeroobsetes tingimustes katse temperatuuril ja pimeduses või hajunud valguses. Vajaduse korral tuleb aeroobsete tingimuste säilitamiseks kergelt aereerida. Vanandamise ajal väheneb kergesti biolagundatava orgaanilise materjali sisaldus. Laboritevahelises võrdluskatses (3) ei leitud vanandatud ja värskelt võetud mereveeproovide biolagundamise võimes mingeid erinevusi. Enne kasutamist töödeldakse merevett suuremate osakeste eemaldamiseks näiteks filtrimisega läbi nailonfiltri või jämeda paberfiltri (mitte kasutada membraan- või klaasmikrokiud- (GF/C-)filtrit) või setitamise ja dekanteerimisega. Kasutatud menetlust tuleb kirjeldada. Kui kasutatakse eeltöötlemist, tuleb see teha pärast vanandamist.
|
Mineraaltoitainete põhilahused
|
13.
|
Analüüsipuhastest reaktiividest valmistatakse järgmised põhilahused.
|
a)
|
kaaliumdivesinikortofosfaat, KH2PO4
|
8,50 g
|
|
dikaaliumvesinikortofosfaat, K2HPO4
|
21,75 g
|
|
dinaatriumvesinikortofosfaatdihüdraat, Na2HPO4 · 2H2O
|
33,30 g
|
|
ammooniumkloriid, NH4Cl
|
0,50 g
|
|
lahustatakse destilleeritud vees ja täiendatakse 1 liitrini.
|
|
|
b)
|
kaltsiumkloriid, CaCl2
|
27,50 g
|
|
lahustatakse destilleeritud vees ja täiendatakse 1 liitrini.
|
|
|
c)
|
magneesiumsulfaatheptahüdraat, MgSO4 · 7H2O
|
22,50 g
|
|
lahustatakse destilleeritud vees ja täiendatakse 1 liitrini.
|
|
|
d)
|
raud(III)kloriidheksahüdraat, FeCl3 · 6H2O
|
0,25 g
|
|
lahustatakse destilleeritud vees ja täiendatakse 1 liitrini.
|
|
Sadenemist lahuses d saab ära hoida ühe tilga kontsentreeritud soolhappe või 0,4 g etüleendiamiintetraäädikhappe (EDTA dinaatriumsool) lisamisega 1 liitri lahuse kohta. Kui põhilahuses tekib sade, asendatakse see värskelt valmistatud lahusega.
|
Katsekeskkonna valmistamine
|
14.
|
Eeltöödeldud merevee ühe liitri kohta lisatakse 1 ml kumbagi eespool kirjeldatud põhilahust.
|
Inokulum
|
15.
|
Merevees juba olemasolevatele mikroorganismidele ei lisata spetsiaalset inokulumi. Mereveest saadud katsekeskkonnas (ja soovitatavalt ka esialgses merevee proovis) määratakse (soovi korral) kolooniat moodustavate heterotroofsete bakterite arv, näiteks kolooniate loendamisega mereveeagari plaadil. See on eriti soovitatav proovide puhul, mis on võetud rannikuveest või saastatud merealalt. Heterotroofsete mikroobide aktiivsust kontrollitakse nii, et katse tehakse võrdlusainega.
|
Kolbide ettevalmistamine
|
16.
|
Kõik klaasnõud peavad olema hoolikalt puhastatud (kuigi mitte tingimata steriilsed) näiteks soolhappe alkoholilahusega, loputatud ja kuivatatud, et vältida saastavaid jääke varasematest katsetest. Puhastada tuleb ka kolvid, mida kasutatakse esimest korda.
|
|
17.
|
Uuritavat ainet hinnatakse samaaegselt kahes paralleelkatsekolvis ja lisaks tehakse samal ajal ühes kolvis katse võrdlusainega. Analüüsi tühiproovide määramiseks tehakse tühikatse kahe paralleelkatsena, millesse ei panda ei uuritavat ainet ega võrdlusainet. Uuritav aine lahustatakse katsekeskkonnas – ainet võib mugavalt lisada kontsentreeritud põhilahusena, et saada vajalik lähtekontsentratsioon, mis tavaliselt on 5–40 mg DOC/l. Võrdlusainega tehakse tavaliselt katse lähtekontsentratsioonil, mis vastab kontsentratsioonile 20 mg DOC/l. Kui kasutatakse uuritava kemikaali ja/või võrdluskemikaali põhilahuseid, tuleb tagada, et merevee soolsus katsekeskkonnas oluliselt ei muutuks.
|
|
18.
|
Kui võib eeldada või ei saa välistada toksilist mõju, siis võib olla soovitatav lisada katse kavasse ka inhibeerimiskatse kahe paralleeliga. Ühte ja samasse nõusse lisatakse uuritavat ainet ja võrdlusainet, kusjuures võrdlemise võimaldamiseks on võrdlusaine kontsentratsioon tavaliselt sama kui kontrollkatses (st 20 mg DOC/l).
|
|
19.
|
Erlenmeyeri kolbidesse pannakse vajalikud kogused uuritavat lahust (sobiv lahusekogus on ligikaudu pool kolvi mahust) ning seejärel kaetakse iga kolb vabalt lebava kattega (näiteks alumiiniumfooliumiga), mis võimaldab gaasivahetust kolvis oleva ja ümbritseva õhu vahel. (Puuvillvatist korgid ei sobi lahustunud orgaanilise süsiniku analüüsi puhul.) Nõud pannakse loksutile ja neid loksutatakse kogu katse jooksul pidevalt mõõduka kiirusega (nt 100 pööret minutis). Temperatuur hoitakse vahemikus 15–20 (± 2) °C ning nõusid varjatakse valguse eest, et vältida vetikate kasvu. Tagatakse, et ruumi õhus ei oleks mürgiseid aineid.
|
Füüsikalis-keemilised kontrollkatsed (soovi korral)
|
20.
|
Kui kahtlustatakse abiootilist lagunemist või kadu, nt hüdrolüüsi (mis tekitab raskusi üksnes konkreetse aine määramise puhul), lendumist või adsorptsiooni, on soovitatav teha füüsikalis-keemiline kontrollkatse. Seda võib teha elavhõbe(II)kloriidi (HgCl2) (32) (50–100 mg/l) lisamisega uuritava aine lahusesse, et peatada mikroobide tegevus. Kui lahustunud orgaanilise süsiniku või konkreetse aine kontsentratsioon füüsikalis-keemilises kontrollkatses ikkagi väheneb, osutab see abiootiliste kõrvaldamismehhanismide mõjule. (Kui kasutatakse elavhõbekloriidi, tuleks tähelepanu pöörata lahustunud orgaanilise süsiniku analüüsi segamise või katalüsaatori mürgitamise võimalusele.)
|
Kolbide arv
|
21.
|
Tüüpilises katses kasutatakse järgmisi kolbe:
|
kolvid 1 ja 2
|
sisaldavad uuritavat ainet (uuritavat suspensiooni);
|
|
kolvid 3 ja 4
|
sisaldavad üksnes merevett (tühikatse);
|
|
kolb 5
|
sisaldab võrdlusainet (määramise õigsuse kontroll);
|
|
kolb 6
|
sisaldab uuritavat kemikaali ja võrdlusainet (mürgisuse kontroll – soovi korral);
|
|
kolb 7
|
sisaldab uuritavat kemikaali ja steriliseerivat vahendit (abiootiline steriilne kontroll – soovi korral).
|
|
Lahustunud orgaanilise süsiniku analüüs
|
22.
|
Katse ajal võetakse sobivate ajavahemike järel (1. liide) proovid lahustunud orgaanilise süsiniku analüüsiks. Alati võetakse proovid katse alguses (0-päev) ja 60. päeval. Kokku on lagunemise ajast sõltuvuse graafiku koostamiseks vaja katse ajal võtta vähemalt viis proovi. Proovivõtu kindlat ajagraafikut ei ole võimalik ette näha, kuna biolagunemine võib toimuda mitmesuguse kiirusega. Igast proovist määratakse lahustunud orgaaniline süsinik kaks korda.
|
Proovide võtmine
|
23.
|
Proovi vajalik maht sõltub spetsiifilisest analüüsimeetodist, kasutatavast süsinikuanalüsaatorist ja meetodist, mis valitakse proovi töötlemiseks enne süsiniku määramist (punktid 25 ja 26, membraanfiltrimine või tsentrifuugimine). Enne proovi võtmist tuleb katsekeskkonda hästi segada, et materjal, mis võib olla kleepunud kolvi seina külge, lahustuks või läheks üle suspensiooni.
|
|
24.
|
Kohe pärast proovi võtmist filtritakse proov läbi membraani või tsentrifuugitakse. Vajaduse korral säilitatakse filtritud või tsentrifuugitud proove 2–4 °C juures kuni 48 tundi või allpool – 18 °C pikemat aega (kui on teada, et see ei mõjuta ainet, viiakse pH enne säilitamist 2 juurde).
|
|
25.
|
Membraanfiltreid (0,2–0,45 μm) saab kasutada siis, kui on tõendatud, et need filtrimise ajal ei vabasta süsinikku ega adsorbeeri ainet; sobivad näiteks polükarbonaatmembraanfiltrid. Mõned membraanfiltrid on hüdrofiilsuse suurendamiseks immutatud pindaktiivsete ainetega ja neist võib vabaneda olulises koguses lahustunud süsinikku. Selliseid filtreid tuleb ette valmistada keetmisega deioniseeritud vees kolme järjestikuse ajavahemiku jooksul, iga kord üks tund. Pärast keetmist hoitakse filtreid deioniseeritud vees. Filtraadi esimesed 20 ml visatakse ära.
|
|
26.
|
Membraanfiltrimise asemel võib proove tsentrifuugida. Proovi tsentrifuugitakse kiirendusega 40 000 m·s– 2 (umbes 4 000 g) 15 minutit, eelistatavalt jahutusega tsentrifuugis.
Märkus: Orgaanilise süsiniku üldsisalduse (TOC) ja lahustunud orgaanilise süsiniku (DOC) lahutamine tsentrifuugimisega ei õnnestu väga väikese sisalduse juures, kuna sellega kas ei kõrvaldata kõiki baktereid või läheb osa bakterite rakuplasmas olevast süsinikust lahusesse. Kõrgematel kontsentratsioonidel (> 10 mg C/l) näib tsentrifuugimise viga olevat suhteliselt väike.
|
Proovide võtmise sagedus
|
27.
|
Kui analüüs tehakse kohe pärast proovi võtmist, võib järgmise proovi võtmise aja hinnata analüüsi tulemuse põhjal.
|
|
28.
|
Kui proove säilitatakse, et teha analüüs hiljem (vt punkt 24), võetakse proove rohkem kui viis minimaalselt nõutavat proovi. Tehke viimaste proovide analüüsid kõigepealt, siis võite järk-järgult valida analüüsi tegemiseks varasemaid proove niimoodi, et saada korralik biolagunemise kõver suhteliselt väikse arvu analüüside tegemisega. Kui katse lõpuks ei ole lagunemist toimunud, ei ole rohkem proove vaja analüüsida, ja sellel juhul võib analüüsiks proovide „tagurpidine” valimine aidata analüüsikulusid oluliselt vähendada.
|
|
29.
|
Kui enne 60 päeva möödumist jõuab lagunemise kõver platoole, siis lõpetatakse katse. Kui 60. päevaks on lagunemine selgelt alanud, kuid ei ole platoole jõudnud, tuleb katset pikendada.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Tulemuste töötlemine
|
30.
|
Analüüsi tulemused kantakse lisatud andmelehele (2. liide) ja nii uuritava aine kui ka võrdlusaine biolagundamise väärtused arvutatakse järgmise võrrandi abil:

kus:
|
Dt
|
=
|
lahustunud orgaanilise süsiniku lagunemine või konkreetse aine kadumine keskkonnast protsentides ajahetkeks t,
|
|
Co
|
=
|
lahustunud orgaanilise süsiniku või konkreetse aine algkontsentratsioon katsekeskkonnas,
|
|
Ct
|
=
|
lahustunud orgaanilise süsiniku või konkreetse aine algkontsentratsioon katsekeskkonnas ajahetkeks t,
|
|
Cbl(0)
|
=
|
lahustunud orgaanilise süsiniku või konkreetse aine algkontsentratsioon katsekeskkonnas tühikatses,
|
|
Cbl(t)
|
=
|
lahustunud orgaanilise süsiniku või konkreetse aine algkontsentratsioon katsekeskkonnas tühikatses ajahetkeks t.
|
|
|
31.
|
Lagunemine väljendatakse lahustunud orgaanilise süsiniku kõrvaldamise protsendina (lõplik lagunemine) või konkreetse aine kõrvaldamise protsendina (primaarne lagunemine) ajahetkeks t. Lahustunud orgaanilise süsiniku kontsentratsioonid arvutatakse täpsusega 0,1 mg/l ja Dt keskväärtused ümardatakse ülespoole lähima täisarvulise protsendini.
|
|
32.
|
Lagunemise käik esitatakse graafiliselt, nagu on näidatud joonisel punktis „Tulemuste nõuetekohasus ja tõlgendamine”. Kui tulemusi on piisavalt, arvutatakse kõverast ootefaas (tL) ja aeg, mis kulub ootefaasi lõpust kuni 50 % biolagunemise saavutamiseni (t50).
|
Katseprotokoll
|
33.
|
Katseprotokollis tuleb esitada järgmine teave:
|
|
Uuritav aine:
|
—
|
füüsikaline olek ja vajaduse korral füüsikalis-keemilised omadused;
|
|
—
|
identifitseerimisandmed.
|
|
|
|
Katsetingimused:
|
—
|
proovivõtu koht ja selle kirjeldus; merevee saastatus (kolooniate arv) ja toitainete (nitraat, ammoonium, fosfaat, kui see on asjakohane) sisaldus;
|
|
—
|
proovi iseloomustavad andmed (proovivõtu kuupäev, sügavus, proovi välimus, temperatuur, soolsus, lahustunud orgaaniline süsinik (soovi korral), proovi võtmise ja katses kasutamise vaheline ajavahemik;
|
|
—
|
meetod, mida kasutati merevee vanandamiseks (kui vanandati);
|
|
—
|
meetod, mida kasutati merevee eeltöötluseks (filtrimine/sedimentatsioon);
|
|
—
|
lahustunud orgaanilise süsiniku määramise meetod;
|
|
—
|
meetod konkreetse kemikaali määramiseks (soovi korral);
|
|
—
|
meetod, mida kasutati merevee heterotroofide arvu määramiseks (plaadil loendamise meetod või muu meetod) (soovi korral);
|
|
—
|
muud meetodid (soovi korral) merevee iseloomustamiseks (ATP mõõtmine jne).
|
|
|
|
Tulemused:
|
—
|
analüüsiandmed andmelehel (2. liide);
|
|
—
|
lagunemise käik esitatakse graafikuna diagrammil, mis näitab ootefaasi (tL), tõusu ja aega (alates ootefaasi lõpust), mis kulub 50 % lagunemise saavutamiseks (t50). Ootefaasi pikkuse võib hinnata graafiliselt, nagu on näidatud joonisel punktis „Tulemuste nõuetekohasus ja tõlgendamine”; mugavam on võtta ootefaasiks aeg, mis kulub 10 % lagunemiseks;
|
|
—
|
lagunemise protsent pärast 60 päeva, või katse lõpus.
|
|
|
Tulemuste nõuetekohasus ja tõlgendamine
|
34.
|
Võrdlusainetega nagu naatriumbensoaat, naatriumatsetaat ja aniliin saadud tulemused peaksid olema võrreldavad tulemustega, mis saadi laboritevahelises võrdluskatses (3) (vt punkt 7 „Võrdlusained”) Kui võrdlusainetega saadud tulemused on ebatüüpilised, tuleb katset korrata muu mereveeprooviga. Kuigi inhibeerimiskatsete tulemusi ei saa alati üheselt tõlgendada, kuna uuritav aine annab ka ise panuse lahustunud orgaanilise süsiniku kogusesse, on lahustunud orgaanilise süsiniku kõrvaldamise üldkiiruse oluline vähenemine kontrolliga võrreldes selge tunnus mürgise mõju kohta.
|
|
35.
|
Kuna katses kasutatakse suhteliselt suurt uuritava aine kontsentratsiooni võrreldes enamiku looduses esinevate kontsentratsioonidega (ja seega on uuritava aine ja muude süsinikuallikate suhtarv ebasoodne), peetakse seda meetodit eelkatseks, mis näitab, kas aine on kergesti biolagunduv või ei ole. Sellest tulenevalt ei tähenda madal katsetulemus tingimata seda, et aine ei ole merevees biolagunev; see näitab, et biolagundatavuse kindlakstegemiseks on vaja teha rohkem uuringuid.
Järgmisel joonisel on esitatud lagunemiskatse teoreetiline kõver, mis näitab, kuidas saab hinnata ootefaasi („lag phase”) pikkust tL ja ajavahemikku t50, mis algab ajahetkest tL ja on vajalik 50 % lagunemise saavutamiseks.

|
KINNISE PUDELI MEETOD
SISSEJUHATUS
|
1.
|
See meetod on kinnise pudeli katse (5) mereveevariant ning see on lõpuni viimistletud Euroopa Komisjoni ja Taani veekvaliteedi instituudi korraldatud laboritevahelise võrdluskatsega (3).
|
|
2.
|
Samuti kui loksutatava kolvi meetodi mereveevariandi puhul, ei tohiks käesoleva meetodi tulemusest teha järeldust kiire biolagunduvuse kohta; meetodiga saadakse konkreetset teavet biolagunduvuse kohta merekeskkonnas.
|
MEETODI PÕHIMÕTE
|
3.
|
Eelnevalt kindlaksmääratud kogus uuritavat ainet, tavaliselt 2–10 mg ühe liitri kohta, lahustatakse katsekeskkonnas (võib kasutada ühte või mitut kontsentratsiooni). Lahust hoitakse täidetud suletud pudelis pimeduses konstantsel temperatuuril vannis või termokambris temperatuuril 15–20 (± 1) °C. Juhul, kui katse eesmärk on modelleerida keskkonnaolukordi, võib katse teha väljaspool seda normaalset temperatuurivahemikku, tingimusel et temperatuuri kontrollimine on vajalikul viisil seadistatud. Lagunemist jälgitakse 28 päeva jooksul hapniku analüüside abil.
|
|
4.
|
Laboritevaheline võrdluskatse näitas, et kui katset pikendati üle 28 päeva, ei saadud enamikul juhtudel mingit kasulikku teavet, kuna tekkisid rängad segavad asjaolud. Tühikatse bioloogilise hapnikutarbe (BHT) väärtused olid väga kõrged, arvatavasti mikroorganismide kasvu tõttu pudeli seintel, kuna pudeleid ei loksutata, samuti nitrifikatsiooni tõttu. Seega on soovituslik kestus 28 päeva, kuid kui tühikatse BHT väärtus jääb 30 protsendi juurde (punktid 15 ja 40), siis võiks katset pikendada.
|
ANDMED UURITAVA AINE KOHTA
|
5.
|
Selleks, et otsustada, kas katsemeetodit saab kasutada teatava konkreetse aine puhul, peavad aine mõned omadused olema teada. Empiiriline valem on vajalik teoreetilise hapnikutarbe (THT) arvutamiseks (vt 3. liide); vastasel korral tuleb määrata aine keemiline hapnikutarve (KHT), et kasutada seda võrdlusväärtusena. Keemilise hapnikutarbe kasutamine ei ole eriti hea, kuna mõnda ainet ei oksüdeerita keemilise hapnikutarbe määramise katses täielikult.
|
|
6.
|
Aine lahustuvus peaks olema vähemalt 2 mg/l, kuigi põhimõtteliselt võiks määrata ka halvemini lahustuvaid aineid (nt ultrahelitöötluse abil), samuti saab uurida lenduvaid aineid. Teave uuritava aine puhtusastme või peamiste lisandite suhteliste koguste kohta on vajalik tulemuste tõlgendamiseks, eriti kui tulemus on biolagunduvuse kriteeriumi piiri lähedane.
|
|
7.
|
Sobivate uuritavate kontsentratsioonide valimiseks võivad väga kasulikud olla andmed uuritava aine mürgisuse kohta bakteritele, mis on mõõdetud näiteks lühiajalise respiratsioonikiiruse katsega (4); sellised andmed võivad olla ülivajalikud biolagunduvuse väärtuste õigeks tõlgendamiseks. Selline teave ei ole siiski alati piisav biolagunduvuse katse tulemuste tõlgendamiseks ning sobivam on punktis 27 kirjeldatud meetod.
|
VÕRDLUSAINED
|
8.
|
Merevee proovi mikroobse aktiivsuse kontrollimiseks tuleb kasutada sobivaid võrdlusaineid. Sellel eesmärgil võib kasutada (näiteks) aniliini, naatriumatsetaati või naatriumbensoaati. Võrdlusaine peab lagunema vähemalt 60 % ulatuses (aine THT järgi) mingi sobivalt lühikese ajavahemiku jooksul; vastasel korral soovitatakse katset korrata mõne muu mereveeprooviga.
|
|
9.
|
Euroopa Ühenduse võrdluskatses, kus merevee proovid olid võetud eri kohtadest ja eri aastaaegadel, olid naatriumbensoaadi puhul ootefaas (tL) ja 50 % lagunemiseks kuluv aeg (t50) ilma ootefaasita vastavalt 0–2 päeva ja 1–4 päeva. Aniliini puhul olid tL ja t50 väärtused vastavalt 0–7 ja 2–12 päeva.
|
KORRATAVUS
|
10.
|
Meetodite korratavus määrati ELi laboritevahelise võrdluskatsega (3).
|
MEETODI KIRJELDUS
Seadmed
|
11.
|
Tavalised laboriseadmed ja:
|
a)
|
250–300 ml suurused klaaskorgiga bioloogilise hapnikutarbe (BHT-) pudelid või võib kasutada klaaskorgiga kitsakaelalisi 250 ml suuruseid pudeleid;
|
|
b)
|
mitu 2-, 3- ja 4-liitrist pudelit liitrimärkidega katse ettevalmistamiseks ja BHT-pudelite täitmiseks;
|
|
c)
|
vesivann või püsiva temperatuuriga ruum pudelite hoidmiseks ühtlasel temperatuuril (± 1 °C) pimedas;
|
|
d)
|
seadmed lahustunud hapniku määramiseks;
|
|
e)
|
membraanfiltrid 0,2–0,45 μm (soovi korral);
|
|
f)
|
varustus konkreetse kemikaali määramiseks (soovi korral).
|
|
Merevesi
|
12.
|
Merevee proov võetakse hoolikalt puhastatud nõusse ja transporditakse laborisse eelistatavalt ühe või kahe päeva jooksul pärast võtmist. Transpordi ajal ei tohi proovi temperatuur tõusta oluliselt kõrgemale katses kasutatavast temperatuurist.
|
|
13.
|
Registreeritakse täpne proovivõtu koht ja kirjeldatakse merevee saasteainete ja toitainete sisaldust kõnealuses kohas. Eriti rannikulähedaste või saastatud vete puhul esitatakse selles kirjelduses ka heterotroofsete mikroorganismide kolooniate arv, samuti lahustunud nitraadi, ammooniumi ja fosfaadi kontsentratsioon.
|
|
14.
|
Merevee proovi enda kohta esitatakse järgmine teave:
|
—
|
proovi välimus – sogane vms;
|
|
—
|
temperatuur proovi võtmise ajal;
|
|
—
|
lahustunud orgaaniline süsinik (DOC);
|
|
—
|
ajavahemik proovivõtust kuni katseni.
|
|
|
15.
|
Kui lahustunud orgaanilise süsiniku sisaldus proovis on kõrge või kui arvatakse, et tühikatse bioloogiline hapnikutarve (BHT) 28 päeva pärast on rohkem kui 30 protsenti võrdlusainete omast, siis soovitatakse merevett enne kasutamist umbes üks nädal vanandada.
|
|
16.
|
Mereveeproovi vanandatakse hoides seda aeroobsetes tingimustes katse temperatuuril ja pimeduses või hajunud valguses. Vajaduse korral tuleb aeroobsete tingimuste säilitamiseks kergelt aereerida. Vanandamise ajal väheneb kergesti biolagundatava orgaanilise materjali sisaldus. Laboritevahelises võrdluskatses (3) ei leitud vanandatud ja värskelt võetud mereveeproovide biolagundamise võimes mingeid erinevusi.
|
|
17.
|
Enne kasutamist töödeldakse merevett suuremate osakeste eemaldamiseks näiteks filtrimisega läbi nailonfiltri või jämeda paberfiltri (mitte kasutada membraan- või klaasmikrokiud- (GF/C-)filtrit) või setitamise ja dekanteerimisega. Katseprotokollis kirjeldatakse kasutatud meetodit. Eeltöötlemine tehakse pärast vanandamist, kui seda kasutatakse.
|
Mineraaltoitainete põhilahused
|
18.
|
Analüüsipuhastest reaktiividest valmistatakse järgmised põhilahused.
|
a)
|
kaaliumdivesinikortofosfaat, KH2PO4
|
8,50 g
|
|
dikaaliumvesinikortofosfaat, K2HPO4
|
21,75 g
|
|
dinaatriumvesinikortofosfaatdihüdraat, Na2HPO4 · 2H2O
|
33,30 g
|
|
ammooniumkloriid, NH4Cl
|
0,50 g
|
|
lahustatakse destilleeritud vees ja täiendatakse 1 liitrini.
|
|
|
b)
|
kaltsiumkloriid, CaCl2
|
27,50 g
|
|
lahustatakse destilleeritud vees ja täiendatakse 1 liitrini.
|
|
|
c)
|
magneesiumsulfaatheptahüdraat, MgSO4 · 7H2O
|
22,50 g
|
|
lahustatakse destilleeritud vees ja täiendatakse 1 liitrini.
|
|
|
d)
|
raud(III)kloriidheksahüdraat, FeCl3 · 6H2O
|
0,25 g
|
|
lahustatakse destilleeritud vees ja täiendatakse 1 liitrini.
|
|
Sadenemist lahuses d saab ära hoida ühe tilga kontsentreeritud soolhappe või 0,4 g etüleendiamiintetraäädikhappe (EDTA dinaatriumsool) lisamisega 1 liitri lahuse kohta. Kui põhilahuses tekib sade, asendatakse see värskelt valmistatud lahusega.
|
Uuritava keskkonna valmistamine
|
19.
|
Eeltöödeldud merevee ühe liitri kohta lisatakse 1 ml kumbagi eespool kirjeldatud põhilahust. Katsekeskkond küllastatakse katse temperatuuril õhuga; selleks aereeritakse seda puhta suruõhuga umbes 20 minutit. Kontrollimiseks määratakse lahustunud hapniku kontsentratsioon. Lahustunud hapniku küllastuskontsentratsiooni eri temperatuuride ja soolsuse juures võib lugeda käesolevale katsemeetodile lisatud nomogrammilt (4. liide).
|
Inokulum
|
20.
|
Merevees juba olemasolevatele mikroorganismidele ei lisata spetsiaalset inokulumi. Mereveest saadud katsekeskkonnas (ja soovitatavalt ka esialgses merevee proovis) määratakse (soovi korral) kolooniat moodustavate heterotroofsete bakterite arv, näiteks kolooniate loendamisega mereveeagari plaadil. See on eriti soovitatav proovide puhul, mis on võetud rannikuveest või saastatud merealalt. Heterotroofsete mikroobide aktiivsust kontrollitakse nii, et katse tehakse võrdlusainega.
|
Katsepudelite ettevalmistamine
|
21.
|
Kõik merevee ettevalmistamise toimingud, sealhulgas vanandamine ja eeltöötlemine tehakse valitud temperatuuril vahemikus 15–20 °C; kõik klaasnõud peavad olema puhtad, kuid mitte steriilsed.
|
|
22.
|
Uuritava aine ja võrdlusaine BHT uurimiseks üheaegsetes katseseeriates valmistatakse ette BHT-pudelite rühmad. Kõik analüüsid (tühikatsed, võrdlusaine ja uuritav aine) tehakse kahe paralleelina, st iga määramise jaoks valmistatakse ette kaks pudelit. Analüüsid tehakse vähemalt päevadel 0, 5, 15 ja 28 (neli määramist). Hapnikuanalüüside puhul on nelja määramise jaoks vaja kokku 3 × 2 × 4 = 24 pudelit (tühikatse, võrdlusaine ja uuritav aine), seega ligikaudu 8 liitrit katsekeskkonda (uuritava aine ühe kontsentratsiooni jaoks).
|
|
23.
|
Valmistatakse eraldi uuritava aine ja võrdlusainete lahused suurtes piisava mahuga pudelites (punkt 11); esimesena lisatakse uuritav aine või võrdlusaine kas otse või kontsentreeritud põhilahusena suurde pudelisse, mis on osaliselt täidetud. Lisatakse muud katsekeskkonna komponendid nii, et saadakse lõplikus katsekeskkonnas vajalik kontsentratsioon. Kui kasutatakse uuritava kemikaali ja/või võrdluskemikaali põhilahuseid, tuleb tagada, et merevee soolsus katsekeskkonnas oluliselt ei muutuks.
|
|
24.
|
Uuritava aine ja võrdlusaine kontsentratsioonide valimisel võetakse arvesse järgmist:
|
a)
|
hapniku lahustuvus merevees katse põhilise temperatuuri ja soolsuse juures (vt lisatud nomogramm, 4. liide);
|
|
b)
|
mereveega tehtava tühikatse BHT; ning
|
|
c)
|
uuritava aine eeldatav biolagundatavus.
|
|
|
25.
|
15 °C ja 20 °C ning ookeanivee soolsuse 32/1 000 juures on hapniku lahustuvus vees vastavalt ligikaudu 8,1 ja 7,4 mg/l. Merevee enda hapnikutarbimine (tühikatse hapnikutarve) võib olla 2 mg O2/l või suurem, kui merevett ei ole vanandatud. Selleks et tagada märkimisväärne hapnikusisaldus pärast uuritava aine oksüdeerimist, tuleks kasutada uuritava aine algkontsentratsiooni ligikaudu 2–3 mg/l (sõltuvalt THTst) selliste ainete puhul, mis eeldatavasti lagunevad katse tingimustes täielikult (nagu näiteks võrdlusained). Halvemini lagundatava aine puhul kasutatakse kõrgemat kontsentratsiooni, kuni ligikaudu 10 mg/l, kui ainel ei ole mürgist mõju. Kasulik võib olla teha paralleelselt katsed uuritava aine madala (ligikaudu 2 mg/l) ja kõrge (ligikaudu 10 mg/l) kontsentratsiooniga.
|
|
26.
|
Paralleelselt tuleb teha hapniku tühikatse; pudelitesse ei lisata sel juhul ei uuritavat ainet ega võrdlusainet.
|
|
27.
|
Kui määratakse inhibeerivat toimet, valmistatakse eraldi järgmised lahused suurtes pudelites (punkt 13):
|
a)
|
2 mg/l kergesti lagunevat ainet, see tähendab ühte eespool nimetatud võrdlusainetest;
|
|
b)
|
x mg/l uuritavat ainet (tavaliselt x = 2);
|
|
c)
|
2 mg/l kergesti lagunevat ainet pluss x mg/l uuritavat ainet.
|
|
Füüsikalis-keemiline kontrollkatse (soovi korral)
|
28.
|
Kui kasutatakse spetsiifiliste analüüside võimalust, võib teha füüsikalis-keemilise katse, et kontrollida uuritava aine võimalikku kõrvaldamist mõne abiootilise mehhanismi kaudu, näiteks hüdrolüüsi või adsorptsiooniga. Füüsikalis-keemilise kontrollkatse võib teha elavhõbe(II)kloriidi (HgCl2) (33) lisamisega (50–100 mg/l) uuritava aine lahusega paralleelkatsetesse, et peatada mikroobide tegevus. Kui konkreetse aine kontsentratsioon kontrollkatses oluliselt väheneb, osutab see abiootiliste kõrvaldamismehhanismide mõjule.
|
BHT-pudelite arv tüüpilises katses
|
29.
|
Tüüpilises katses kasutatakse järgmisi pudeleid:
|
—
|
vähemalt 8 pudelit uuritava ainega;
|
|
—
|
vähemalt 8 pudelit, mis sisaldavad üksnes merevett, millele on lisatud toitained;
|
|
—
|
vähemalt 8 pudelit võrdlusainega ja vajaduse korral
|
|
—
|
6 pudelit, mis sisaldavad uuritavat ainet ja võrdlusainet (mürgisuse kontrollkatse).
|
|
KATSE KÄIK
|
30.
|
Kohe pärast lahuste valmistamist viiakse sifoon iga lahust sisaldava suure pudeli alumisse veerandisse (mitte põhja) ja täidetakse kõik vastava rühma BHT-pudelid. Viivitamata määratakse 0-kontrollis (aeg = 0) lahustunud hapnik (punkt 33) või konserveeritakse need hilisemaks keemiliseks analüüsiks MnCl2 (mangaan(II)kloriidi) ja NaOH (naatriumhüdroksiidi) abil sadestamisega.
|
|
31.
|
Ülejäänud BHT-pudelite paralleele inkubeeritakse katse temperatuuril (15–20 °C) pimedas ja võetakse need inkubeerimiskambrist sobivate ajavahemike järel (nt vähemalt 5, 15 ja 28 päeva pärast) ja määratakse nendes lahustunud hapnik (punkt 33).
|
|
32.
|
Konkreetse aine määramiseks (soovi korral) filtritakse proovid läbi membraanfiltri (0,2–0,45 μm) või tsentrifuugitakse 15 minutit. Vajaduse korral säilitatakse filtritud või tsentrifuugitud proove 2–4 °C juures kuni 48 tundi või allpool – 18 °C pikemat aega (kui on teada, et see ei mõjuta ainet, viiakse pH enne säilitamist 2 juurde).
|
Lahustunud hapniku määramine
|
33.
|
Lahustunud hapniku kontsentratsioon määratakse riigi või rahvusvahelisel tasandil tunnustatud keemilise või elektrokeemilise meetodiga.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Andmete töötlemine
|
34.
|
Analüüsi tulemused salvestatakse andmelehtedel (vt 5. liide).
|
|
35.
|
Bioloogiline hapnikutarve (BHT) arvutatakse tühikatse hapnikukao ja uuritava aine lahuse hapnikukao vahena katse tingimustes. Netohapnikukadu jagatakse uuritava aine kontsentratsiooniga (mass/maht), et leida BHT (mg) uuritava aine mg kohta. Lagunemine avaldatakse suhtarvuna: bioloogilise hapnikutarbe suhe teoreetilisse hapnikutarbesse (THT; eelistatav) või keemilisse hapnikutarbesse (KHT) protsentides (vt punkt 36).
|
|
36.
|
Arvutatakse biolagunemise väärtused igal proovide võtmise ajal nii uuritava aine kui ka võrdlusaine puhul, kasutades ühte järgmistest võrranditest:


kus:
|
THT
|
=
|
teoreetiline hapnikutarve (arvutamine, vt 3. liide);
|
|
KHT
|
=
|
keemiline hapnikutarve, mis määratakse katseliselt.
|
Märkus: Mõnel juhul ei anna need kaks arvutamismeetodit (protsent teoreetilise või protsent keemilise hapnikutarbe järgi) sama tulemust; parem on kasutada teoreetilist hapnikutarvet, kuna keemilise hapnikutarbe määramise katses ei oksüdeerita mõnda ainet lõpuni.
|
|
37.
|
Lagunemiskatse käik esitatakse graafiliselt (vt näide punktis „Tulemuste nõuetekohasus ja tõlgendamine”. Kui tulemusi on piisavalt, arvutatakse biolagunemise kõverast ootefaas (tL) ja aeg, mis kulub ootefaasi lõpust kuni 50 % biolagunemise saavutamiseni (t50).
|
|
38.
|
Kui kasutatakse spetsiifilist analüüsi (soovi korral), siis teatatakse konkreetse aine primaarse lagunemise protsent katseaja jooksul (pärast analüüsi tühikatseid arvestavate parandite tegemist).
|
Katseprotokoll
|
39.
|
Katseprotokollis tuleb esitada järgmine teave:
|
|
Uuritav aine:
|
—
|
füüsikaline olek ja vajaduse korral füüsikalis-keemilised omadused;
|
|
—
|
identifitseerimisandmed.
|
|
|
|
Katsetingimused:
|
—
|
proovivõtu koht ja selle kirjeldus; merevee saastatus (kolooniate arv) ja toitainete (nitraat, ammoonium, fosfaat, kui see on asjakohane) sisaldus;
|
|
—
|
proovi iseloomustavad andmed (proovivõtu kuupäev, sügavus, proovi välimus, temperatuur, soolsus, lahustunud orgaaniline süsinik (soovi korral), proovi võtmise ja katses kasutamise vaheline ajavahemik);
|
|
—
|
meetod, mida kasutati merevee vanandamiseks (kui vanandati);
|
|
—
|
meetod, mida kasutati merevee eeltöötluseks (filtrimine/sedimentatsioon);
|
|
—
|
KHT määramisel kasutatud meetod (kui määrati);
|
|
—
|
hapniku mõõtmise meetod;
|
|
—
|
dispergeerimismeetod, mida kasutati katsetingimustes halvasti lahustuva aine puhul;
|
|
—
|
meetod, mida kasutati merevee heterotroofide arvu määramiseks (plaadil loendamise meetod või muu meetod);
|
|
—
|
meetod, mida kasutati merevee lahustunud orgaanilise süsiniku määramiseks (soovi korral);
|
|
—
|
spetsiifilise analüüsi meetod (soovi korral);
|
|
—
|
muud meetodid merevee iseloomustamiseks (ATP mõõtmine jne) (soovi korral).
|
|
|
|
Tulemused:
|
—
|
analüüsiandmed esitatuna andmelehel (vt 5. liide);
|
|
—
|
lagunemise käik graafikuna diagrammil, mis näitab ootefaasi (tL), tõusu ja aega (alates ootefaasi lõpust), mis kulub uuritava aine oksüdeerumiseks kulutatud lõplikust hapnikutarbest 50 % saavutamiseks (t50). Ootefaasi pikkuse võib hinnata graafiliselt, nagu on näidatud juuresoleval joonisel; mugav on võtta ootefaasiks aeg, mis kulub 10 % lagunemiseks;
|
|
—
|
lagunemise protsent pärast 28 päeva möödumist.
|
|
|
Tulemuste arutelu ja tõlgendamine
|
40.
|
Tühikatse hingamine ei tohiks ületada 30 % katsepudelis olevast hapnikust. Kui selle kriteeriumi täitmine värske mereveeproovi puhul ei ole võimalik, peab merevesi olema enne kasutamist vanandatud (stabiliseeritud).
|
|
41.
|
Arvesse tuleb võtta võimalust, et lämmastikku sisaldavad ained võivad mõjutada katse tulemusi.
|
|
42.
|
Võrdlusainetega nagu naatriumbensoaat ja aniliin saadud tulemused peaksid olema võrreldavad tulemustega, mis saadi laboritevahelises võrdluskatses (3) (vt punkt 9). Kui võrdlusainetega saadud tulemused on ebatüüpilised, tuleb katset korrata muu mereveeprooviga.
|
|
43.
|
Uuritavat ainet võib pidada bakterite elutegevust katse kontsentratsioonil pärssivaks, kui võrdlusaine ja uuritava aine segu lahuse BHT on väiksem kui kummagi aine lahuse BHT väärtuste summa.
|
|
44.
|
Kuna uuritava aine kontsentratsioon katses on suhteliselt suur võrreldes enamiku looduses esinevate kontsentratsioonidega ja seega on uuritava aine ja muude süsinikuallikate suhtarv ebasoodne, peetakse seda meetodit eelkatseks, mis näitab, kas aine on kergesti biolagunduv või mitte. Sellest tulenevalt ei tähenda madal katsetulemus tingimata seda, et aine ei ole merevees biolagunev; see näitab, et biolagundatavuse kindlakstegemiseks on vaja teha rohkem uuringuid.
Järgmisel joonisel on esitatud biolagunemiskatse teoreetiline kõver, mis näitab, kuidas saab hinnata ootefaasi (lag phase) pikkust tL ja ajavahemikku t50, mis algab ajahetkest tL ja on vajalik uuritava aine 50 % oksüdeerimiseks.

|
KIRJANDUS
|
(1)
|
de Kreuk J.F. and Hanstveit A.O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561-573.
|
|
(2)
|
Käesoleva lisa peatükk C.4-B. Kohese biolagunduvuse määramine. III osa. Muudetud OECD sõelkatse
|
|
(3)
|
Nyholm N. and Kristensen P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984-1985, March 1987, Commission of the European Communities.
|
|
(4)
|
Käesoleva lisa peatükk B.11. Biodegradatsioon. Aktiivmuda respiratsiooni pärssimise katse.
|
|
(5)
|
Käesoleva lisa peatükk C.4-E. Kohese biolagunduvuse määramine. VI osa. Kinnise pudeli katse.
|
1. liide
Orgaanilise süsiniku määramine merevees
LOKSUTATAVA KOLVI MEETOD
Orgaanilise süsiniku sisalduse määramiseks veeproovis oksüdeeritakse proovi orgaanilised ühendid süsinikdioksiidiks, kasutades üldiselt ühte järgmisest kolmest meetodist:
|
—
|
märgoksüdatsioon persulfaadi/UV-kiirgusega;
|
|
—
|
märgoksüdatsioon persulfaadi/kõrge temperatuuriga (116–130 °C);
|
Tekkiva CO2 kogus mõõdetakse neeldumise järgi infrapunaspektris või titrimeetriliselt. Teine võimalus on taandada CO2 metaaniks, mille kogus mõõdetakse leekionisatsioondetektoriga.
Persulfaadi/UV-meetodit kasutatakse tavaliselt puhtama vee analüüsimiseks, milles on vähe tahkeid osakesi. Viimaseid kahte meetodit võib kasutada enamiku veeproovitüüpide puhul, kusjuures persulfaadi/kõrge temperatuuri oksüdatsiooni meetod on kõige sobivam madala süsinikusisaldusega proovide puhul ja põletamismeetodit saab kasutada proovide jaoks, milles lendumatu orgaanilise süsiniku sisaldus ületab oluliselt 1 mg C/l.
Segavad tegurid
Kõik kolm meetodit sõltuvad proovis sisalduva anorgaanilise süsiniku kõrvaldamisest või arvessevõtmisest. CO2 väljapuhumine hapestatud proovist on kõige sagedamini kasutatav meetod anorgaanilise süsiniku kõrvaldamiseks, kuigi sellega lähevad kaotsi ka lenduvad orgaanilised ühendid (1). Anorgaanilise süsiniku täielik kõrvaldamine või arvessevõtmine tuleb tagada proovi igasuguse koostise puhul ja olenevalt proovi tüübist tuleb lisaks mittelenduvatele orgaanilistele süsinikuühenditele määrata ka lenduvad orgaanilised süsinikuühendid.
Suure kloriidisisalduse puhul väheneb persulfaadi/UV-meetodiga oksüdeerimise tõhusus (2). Elavhõbe(II)nitraadiga modifitseeritud oksüdeeriva reagendi lisamisega saab selle segava toime siiski kõrvaldada. Igasuguste kloriidi sisaldavate proovide puhul soovitatakse kasutada suurimat lubatavat proovi mahtu. Põletamismeetodi kasutamisel võib proovi suur soolasisaldus põhjustada soolakihi tekkimist katalüsaatori pinnale ja põletustoru ulatuslikku korrosiooni. Vastavalt tootja juhendile tuleb sel juhul võtta vajalikud ettevaatusabinõud.
Väga häguse proovi ja tahkeid osakesi sisaldava proovi puhul võib oksüdeerimine persulfaadi/UV-meetodiga jääda ebatäielikuks.
Näide sobiva meetodi kohta
Lendumatud orgaanilised süsinikuühendid määratakse persulfaadi/UV-kiirgusega oksüdeerimisega ja tekkinud CO2 mõõtmisega mittelahutava infrapunaspektromeetria abil.
Oksüdeerimisreagenti muudetakse vastavalt ettepanekutele (2), mida on kirjeldatud tootja käsiraamatus:
|
a)
|
8,2 g HgCl2 ja 9,6 g Hg(NO3)2·H2O lahustatakse mitmesajas milliliitris madala süsinikusisaldusega analüütilise puhtusastmega vees;
|
|
b)
|
elavhõbedasoola lahuses lahustatakse 20 g K2S2O8;
|
|
c)
|
segule lisatakse 5 ml kontsentreeritud HNO3;
|
|
d)
|
reagent lahjendatakse 1 000 ml-ni.
|
Kloriidi segav mõju kõrvaldatakse sellega, et 10 % kloriidisisalduse puhul võetakse proovi mahuks 40 μl ja 1,9 % kloriidisisalduse puhul 200 μl. Suure kloriidisisaldusega või suure mahuga proove võib selle meetodiga analüüsida siis, kui hoitakse ära kloriidi kogunemine oksüdatsiooninõusse. Lenduva orgaanilise süsiniku määramise võib teha hiljem, kui see on kõnealuse proovitüübi puhul asjakohane.
KIRJANDUS
|
(1)
|
ISO, Water quality – determination of total organic carbon. Draft International Standard ISO/DIS 8245, January 16, 1986.
|
|
(2)
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16th edition, 1985.
Samuti pakub huvi (seoses automatiseeritud analüüsisüsteemi kirjeldusega):
|
|
(3)
|
Schreurs W. (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137-142.
|
2. liide
Biolagundatavus merevees
LOKSUTATAVA KOLVI MEETOD
ANDMELEHT
|
3.
|
UURITAV AINE:
Nimetus:
|
Põhilahuse kontsentratsioon:
|
mg/l ainena
|
|
Algkontsentratsioon keskkonnas, to:
|
mg/l ainena
|
|
:
|
mg lah. org. C/l
|
|
|
4.
|
MEREVESI:
Allikas:
Proovivõtu kuupäev:
Proovivõtu sügavus:
Välimus proovi võtmise ajal (nt hägune jne):
|
Soolsus proovi võtmise ajal:
|
‰
|
|
Temperatuur proovi võtmise ajal:
|
°C
|
|
Lahustunud orgaaniline süsinik x tundi pärast proovi võtmist:
|
mg/l
|
Eeltöötlus enne katse tegemist (nt filtrimine, setitamine, vanandamine jne):
|
Mikroobikolooniate arv
|
|
kolooniat/ml
|
|
|
|
kolooniat/ml
|
|
Muud omadused:
|
|
|
|
|
5.
|
SÜSINIKU MÄÄRAMINE:
Süsinikuanalüsaator:
|
|
Kolb nr
|
|
Lahustunud orgaaniline süsinik (DOC) n päeva möödumisel (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Katse: uuritavat ainet sisaldav lisatud toitainetega merevesi
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
keskmine, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
keskmine, Cd(t)
|
|
|
|
|
|
|
Tühikatse: lisatud toitainetega merevesi ilma uuritava aineta
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
keskmine, Cd(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
keskmine, Cb(t)
|
|
|
|
|
|
| keskmine

|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
TÖÖTLEMATA ANDMETE HINDAMINE:
|
Kolb nr
|
Tulemuste arvutamine
|
Lagunemisprotsent n päeva pärast
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|
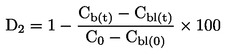
|
0
|
|
|
|
|
|
Keskmine (34)
|

|
0
|
|
|
|
|
|
Märkus:
|
analoogseid tabeleid võib kasutada ka siis, kui lagunemist jälgitakse konkreetse aine analüüsiga, samuti võrdlusaine ja mürgisuse kontrollkatsete puhul.
|
|
|
7.
|
ABIOOTILISE LAGUNEMISE KATSE (pole kohustuslik)
|
|
Aeg (päevad)
|
|
0
|
t
|
|
Lahust. org. süsiniku konts. steriilses kontrollkatses (mg/l)
|
Cs(o)
|
Cs(t)
|

|
3. liide
Teoreetilise biokeemilise hapnikutarbe arvutamine
KINNISE PUDELI MEETOD
Aine CcHhClclNnNanaOoPpSs puhul, mille molekulmass on MW, arvutatakse THT järgmiselt:

Selles arvutuses on eeldatud, et C mineraliseritakse CO2-ks, H – H2O-ks, P – P2O5-ks ja Na – Na2O-ks. Halogeen kõrvaldatakse vesinikhaliidina ja lämmastik ammoniaagina.
Näide:
Glükoos C6H12O6, MW = 180

Muude kui leelismetallide soolade molekulmasside arvutamisel eeldatakse, et soolad on hüdrolüüsunud.
Väävli puhul eeldatakse oksüdeerumist kuni oksüdatsiooniastmeni + 6.
Näide:
Naatrium-n-dodetsüülbenseensulfonaat C18H29SO3Na, MW = 348
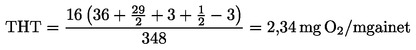
Lämmastikku sisaldavate ainete puhul võib lämmastik muutuda ammoniaagiks, nitrititeks, nitraatideks; iga selline võimalus tähendab erinevat teoreetilist biokeemilist hapnikutarvet.


Oletame sekundaarse amiini puhul täielikku muundumist nitraadiks:
(C12H25)2NH, MW = 353

4. liide

5. liide
Biolagundatavus merevees
KINNISE PUDELI MEETOD
ANDMELEHT
|
3.
|
UURITAV AINE:
Nimetus:
|
Põhilahuse kontsentratsioon:
|
mg/l
|
|
Lähtekontsentratsioon mereveekeskkonnas:
|
mg/l
|
|
THT või KHT:
|
mg O2 uuritava aine mg kohta
|
|
|
4.
|
MEREVESI:
Allikas:
Proovivõtu kuupäev:
Proovivõtu sügavus;
Välimus proovi võtmise ajal (nt hägune jne):
|
Soolsus proovi võtmise ajal:
|
‰
|
|
Temperatuur proovi võtmise ajal:
|
°C
|
|
Lahust. org. süsinik x tundi pärast proovi võtmist:
|
mg/l
|
Eeltöötlus enne katse tegemist (nt filtrimine, setitamine, vanandamine jne):
|
Mikroobikolooniate arv
|
|
kolooniat/ml
|
|
|
|
kolooniat/ml
|
|
Muud omadused:
|
|
|
|
|
5.
|
KATSEKESKKOND:
|
Temperatuur pärast aereerimist:
|
°C
|
|
O2 kontsentratsioon pärast aereerimist ja seismist enne katse algust:
|
mg O2/l
|
|
|
6.
|
LAHUSTUNUD HAPNIKU MÄÄRAMINE:
Meetod: Winkler/elektrood
|
|
Kolb nr
|
|
mg O2/l pärast n päeva
|
|
0
|
5
|
15
|
28
|
|
Katse: uuritavat ainet sisaldav toitainetega merevesi
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Katsete keskmine
|
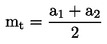
|
|
|
|
|
|
Tühikatse: ilma uuritava aineta toitainetega merevesi
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Tühikatsete keskmine
|

|
|
|
|
|
Märkus: Võrdlusaine ja mürgisuse kontrollkatsete jaoks võib kasutada analoogseid tabeleid.
|
|
7.
|
LAHUSTUNUD HAPNIKU TARBIMINE: LAGUNEMISPROTSENT (%D)
|
|
Lagunemisprotsent n päeva pärast
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|

|
|
|
|
|
C.43. ORGAANILISTE AINETE ANAEROOBNE BIOLAGUNEVUS LÄBIKÄÄRINUD MUDAS: MÕÕTMINE GAASI ERALDUMISE JÄRGI
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 311 (2006). Orgaaniliste ainete biolagunevuse hindamiseks aeroobsetes tingimustes on mitmeid sõelkatsemeetodeid (katsemeetodid C.4, C.9, C.10 ja C.11 (1) ning OECD katsejuhend nr 302C (2)) ja nendega saadud tulemusi on edukalt kasutatud selleks, et ennustada ainete käitumist aeroobses keskkonnas, eriti reovee aeroobse töötlemise staadiumides. Ka vees lahustumatuid aineid, samuti reovee tahketele osakestele adsorbeeruvaid aineid töödeldakse aeroobsetes tingimustes, kuna need jäävad setitatud reovette. Kuid suurem osa sellistest ainetest on seotud reovee esmase settinud mudaga, mis eraldatakse töötlemata reoveest settimistankides enne, kui setitatud reovett ehk supernatanti hakatakse töötlema aeroobsetes tingimustes. Muda, mis osakestevahelises vedelikus sisaldab mõnevõrra ka lahustuvaid aineid, suunatakse seejärel kuumutatavatesse kääritamisnõudesse anaeroobsele töötlemisele. Seni ei ole veel meetodeid anaeroobse biolagundatavuse hindamiseks anaeroobse kääritamise nõudes ja käesoleva katse eesmärk on täita see lünk; see meetod ei tarvitse olla kasutatav muudes hapnikuvabades keskkonnaosades.
|
|
2.
|
Anaeroobse biolagunduvuse hindamiseks on edukalt kasutatud respiromeetrilisi meetodeid, millega mõõdetakse vabanevate gaaside, peamiselt metaani (CH4) ja süsinikdioksiidi (CO2) koguseid. Birch et al (3) on need meetodid läbi vaadanud ja teinud järelduse, et sellel alal on kõige põhjalikum Sheltoni ja Tiedje (4) töö, mis põhineb varasematel töödel (5, 6, 7). Nende meetodis (4), mida hiljem arendasid edasi teised (8) ja mis on saanud Ameerika Ühendriikides standardmeetodiks (9, 10), ei lahendatud raskusi, mis on seotud CO2 ja CH4 erineva lahustumisega katsekeskkonnas ning uuritava aine poolt vabastatava gaaside koguse teoreetilise arvutamisega. ECETOCi aruandes (3) soovitati lahustunud anorgaanilise süsiniku täiendavat mõõtmist supernatandis, tänu millele sai meetodit laiemalt kasutada. ECETOCi meetodiga tehti rahvusvaheline laboritevaheline võrdluskatse (nn kaliibrimine) ja sellest sai ISO standard ISO 11734 (11).
|
|
3.
|
Käesolevas katsemeetodis, mis põhineb standardil ISO 11734 (11), kirjeldatakse sõelkatsemeetodit, millega hinnatakse orgaaniliste ainete potentsiaalset anaeroobset biolagunevust konkreetsetes tingimustes (st anaeroobses sette kääritamistankis teatava aja jooksul ja mikroorganismide teatava kontsentratsiooni juures). Kuna kasutatakse lahjendatud reoveesetet, milles uuritava aine kontsentratsioon on suhteliselt kõrge ja katse kestab tavaliselt kauem kui reovee anaeroobne kääritamine, ei tarvitse katse tingimused tingimata olla samad kui anaeroobses kääritamistankis; samuti ei saa sellega hinnata orgaaniliste ainete biolagunevust muudes erinevates keskkonnatingimustes. Mudal lastakse uuritava ainega kokkupuutes olla kuni 60 päeva; see on pikem aeg kui tavalisel reoveemuda anaeroobsel kääritamisel (25-30 päeva), kuid mõne tehase reoveepuhastis võib muda olla ka hoopis kauem. Käesoleva katse tulemused ei võimalda teha sama põhjendatud ennustusi kui aeroobse biolagunemise katse puhul, kuna uuritavate ainete kohta „kiiretes” aeroobsetes katsetes, modelleerimiskatsetes ja aeroobses keskkonnas saadud andmed on piisavad selleks, et olla veendunud seose olemasolus; anaeroobse keskkonna koha on sarnaseid andmeid väga vähe. Täielikku anaeroobset biolagunemist võib oletada juhul, kui eraldub 75–80 % teoreetiliselt võimalikust gaasikogusest. Uuritava aine ja biomassi kõrge suhtarv, mida kasutati kõnealustes katsetes, tähendab seda, et katse edukalt läbinud aine tõenäoliselt laguneb anaeroobses kääritamistankis. Aine, mida ei õnnestu gaasiks muuta, ei tarvitse siiski olla püsiv keskkonna seisukohast realistlikuma aine-biomassi suhtarvu juures. Toimuvad ka muud anaeroobsed reaktsioonid, näiteks dekloorimine, mille tulemusel võib aine vähemalt osaliselt laguneda, kuid käesoleva katsega selliseid reaktsioone ei tuvastata. Kui kasutada aga uuritava aine määramiseks spetsiifilisi analüüsimeetodeid, saab aine kadumist siiski jälgida (vt punktid 6, 30, 44 ja 53).
|
KATSE PÕHIMÕTE
|
4.
|
Pestud läbikäärinud muda (36), mis sisaldab madalas kontsentratsioonis (< 10 mg/l) anorgaanilist süsinikku, lahjendatakse umbes kümme korda, nii et tahke aine üldsisaldus on 1–3 g/l, ja inkubeeritakse 35 ± 2 °C juures suletud anumas uuritava aine kontsentratsiooni 20–100 mg C/l juures kuni 60 päeva. Nähakse ette muda aktiivsuse mõõtmine, milleks tehakse paralleelselt tühikatse keskkonnas, millesse on viidud muda inokulum, kuid mis ei sisalda uuritavat ainet.
|
|
5.
|
Mõõdetakse rõhu suurenemist anuma vabaruumis, mille põhjuseks on CO2 ja metaani tekkimine. Suur osa tekkinud CO2-st jääb lahustununa vedelfaasi või muutub katse tingimustes karbonaadiks või vesinikkarbonaadiks. Katse lõpus mõõdetakse tekkinud anorgaanilise süsiniku sisaldus.
|
|
6.
|
Süsiniku kogus (anorgaaniline + metaan), mis tekib uuritava aine biolagunemisel, arvutatakse gaasi vabanemisest ja anorgaanilise süsiniku kogusest vedelfaasis, millest on lahutatud tühikatse vastavad näitajad. Biolagunemise määr arvutatakse tekkinud anorgaanilise süsiniku ja metaanis oleva süsiniku protsendina uuritavas aines olnud süsiniku mõõdetud või arvutatud kogusest. Biolagunemise käiku saab jälgida üksnes tekkinud gaasi vahepealsete mõõtmistega. Lisaks sellele võib primaarse biolagunemise määrata konkreetse aine määramisega katse alguses ja lõpus.
|
ANDMED UURITAVA AINE KOHTA
|
7.
|
Tulemuste õigesti tõlgendamiseks on vaja teada uuritava aine puhtust, vees lahustuvust, lenduvus- ja adsorptsiooniomadusi. Uuritava kemikaali orgaanilise süsiniku sisaldus (massiprotsent) peab olema teada kas selle keemilise struktuuri põhjal või mõõtmise teel. Lenduva uuritava aine puhul aitab mõõdetud või arvutatud Henry seaduse konstant otsustada, kas see katse on kohaldatav. Sobiva uuritava kontsentratsiooni valimiseks ning halba biolagunduvust näitavate tulemuste tõlgendamiseks on kasulik omada teavet uuritava aine mürgisuse kohta anaeroobsete bakterite suhtes. Soovitatav on moodustada katses kontrollrühm ka pärssimise kontrollimiseks, välja arvatud juhul kui on on teada, et uuritav aine ei pärsi anaeroobsete mikroobide tegevust (vt punkt 21 ja ISO 13641-1 (12)).
|
KATSEMEETODI KASUTATAVUS
|
8.
|
Meetodit võib rakendada vees lahustuvate ainete puhul; seda võib rakendada ka halvasti lahustuvate või lahustumatute ainete korral eeldusel, et kasutatakse täpse doseerimise meetodit, näiteks vt ISO 10634 (13). Üldiselt tuleb iga lenduva aine puhul teha otsus eraldi. Võib-olla on vaja kasutada erimeetmeid, näiteks mitte lasta gaasi katse ajal välja.
|
VÕRDLUSAINED
|
9.
|
Katse läbiviimise kontrollimiseks tehakse katse võrdluskemikaaliga; selleks pannakse osana tavapärasest katsest käima ka sobivad anumad võrdlusainega. Fenool, naatriumbensoaat ja polüetüleenglükool 400 on näiteks ühendid, millest teoreetilise gaaside (metaani ja anorgaanilise süsiniku) vabanemise järgi peaks 60 päevaga lagunema üle 60 % (3, 14).
|
KATSETULEMUSTE KORRATAVUS
|
10.
|
Rahvusvahelises võrdluskatses (14) oli kolme paralleelkatse korratavus gaasi rõhu mõõtmiste järgi hea. Suhteline standardhälve (variatsioonikordaja, COV) oli üldiselt alla 20 %, kuigi sageli tõusis see väärtus üle 20 % mürgise aine juuresolekul või 60-päevase inkubatsiooniperioodi lõpus. Suuremaid kõrvalekaldeid esines ka nõudes, mille maht oli alla 150 ml. Katsekeskkonna pH oli katse lõpus vahemikus 6,5–7,0.
|
|
11.
|
Laboritevahelises võrdluskatses saadi järgmised tulemused.
|
Uuritav aine
|
Andmeid kokku
n1
|
Keskmine lagunemine
(kõigist andmetest)
(%)
|
Suhteline standardhälve
(kõigist andmetest)
(%)
|
Nõuetekohaseid andmeid
n2
|
Keskmine lagunemine
(nõuetekohastest andmetest)
(%)
|
Suhteline standardhälve
(nõuetekohastest andmetest)
(%)
|
Andmeid lagunemisprotsendiga > 60 % nõuetekohastes katsetes
n3
|
|
Palmitiinhape
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (37)
|
|
Polüetüleen-glükool 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Kõigist palmitiinhappe ja polüetüleenglükool 400 tulemustest leitud keskväärtuse variatsioonikordaja oli vastavalt 45 % (n = 36) ja 35 % (n = 38). Kui väärtused alla 40 % ja üle 100 % jäeti välja (esimeste puhul oletati ebasoodsaid tingimusi, teiste puhul mingeid tundmatuid põhjusi), vähenesid COV väärtused vastavalt 26 % ja 23 %-ni. Selliste „nõuetekohaste” väärtuste osakaal, milles saavutati vähemalt 60 % lagunemine, oli palmitiinhappe puhul 70 % ja polüetüleenglükool 400 puhul 83 %. Biolagunemise protsendi osa, mis määrati lahustunud anorgaanilise süsiniku mõõtmistest, oli suhteliselt madal, kuid muutuv. Palmitiinhappe puhul oli see vahemikus 0–35 %, keskmine 12 % ja COV 92 % ning polüetüleenglükool 4 000 puhul 0–40 %, keskmine 24 % ja COV oli 54 %.
|
KATSEMEETODI KIRJELDUS
Seadmed
|
13.
|
Tavalised laboriseadmed ja järgmised seadmed:
|
a.
|
sädemekindel inkubaator, mis hoiab temperatuuri 35 ± 2 °C;
|
|
b.
|
sobiva nominaalmahuga (38) ja rõhule vastupidavad klaasist katsenõud, millest igaüks on varustatud gaasi mitte läbilaskva membraaniga, mis talub survet ligikaudu 2 baari. Vabaruum peaks olema ligikaudu 10–30 % koguruumalast. Kui biogaasi vabaneb pidevalt, piisab vabaruumist 10 %, kuid kui gaas vabaneb alles katse lõpus, on vajalik vabaruum 30 %. Kui igal proovivõtuajal lastakse rõhul langeda, soovitatakse kasutada klaasist seerumipudeleid nominaalmahuga 125 ml ja üldmahuga ligikaudu 160 ml, mis on suletud seerumimembraaniga (39) ja sellele valtsitud alumiiniumrõngaga;
|
|
c.
|
rõhumõõtmisseade, (40) mis sobib tekkiva gaasi mõõtmiseks ja väljalaskmiseks, näiteks käeshoitav täppismanomeeter, mis on varustatud sobiva süstlanõelaga; gaasipidav 3-käiguline kraan hõlbustab ülerõhu väljalaskmist (1. liide). Oluline on, et rõhu väljalaskmiseks kasutatava toru ja kraani siseruumala oleks võimalikult väike, nii et selle seadme ruumala arvestamata jätmisest tekkiv viga oleks ebaoluline;
Märkus: rõhu näitu kasutatakse otse selleks, et arvutada tekkinud süsiniku kogus vabaruumis (punktid 42–44). Teise võimalusena võib rõhunäidud sobiva teisendusgraafiku abil muuta tekkinud gaasi ruumaladeks (35 °C juures atmosfäärirõhul). Teisendusgraafik koostatakse andmete põhjal, mis saadakse teadaolevate lämmastiku ruumalade süstimisega katsenõudesse (näiteks seerumipudelitesse) 35 ± 2 °C juures ja saadavate stabiliseerunud rõhunäitude registreerimisega (vt 2. liide). Arvutus on esitatud punkti 44 märkuses.
Hoiatus: mikrosüstalde kasutamisel vältige torkevigastusi;
|
|
d.
|
süsinikuanalüsaator, mis sobib anorgaanilise süsiniku otseseks määramiseks vahemikus 1–200 mg/l;
|
|
e.
|
suure täpsusega süstlad gaasi- ja vedelikeproovide võtmiseks;
|
|
f.
|
magnetsegajad ja magnetpulgad (soovi korral);
|
|
g.
|
kindakapp (soovituslik).
|
|
Reagendid
|
14.
|
Kogu katse vältel tuleb kasutada analüütiliselt puhtaid reagente.
|
Vesi
|
15.
|
Destilleeritud või deioniseeritud vesi, mis on vabastatud hapnikust läbipuhumisega, milleks kasutatakse gaasilist lämmastikku hapnikusisaldusega alla 5 μl/l; vesi peab sisaldama vähem kui 2 mg/l lahustunud orgaanilist süsinikku (DOC).
|
Katsekeskkond
|
16.
|
Valmistatakse lahjenduslahus, mis sisaldab järgmisi aineid näidatud koguses:
|
veevaba kaaliumdivesinikfosfaat, KH2PO4
|
0,27 g
|
|
dinaatriumvesinikfosfaatdodekahüdraat, Na2HPO4 · 12H2O
|
1,12 g
|
|
ammooniumkloriid, NH4Cl
|
0,53 g
|
|
kaltsiumkloriiddihüdraat, CaCl2 · 2H2O
|
0,075 g
|
|
magneesiumkloriidheksahüdraat, MgCl2 · 6H2O
|
0,10 g
|
|
raud(II)kloriidtetrahüdraat, FeCl2 · 4H2O
|
0,02 g
|
|
resasuriin (hapniku indikaator)
|
0,001 g
|
|
naatriumsulfiidnonahüdraat, Na2S · 9H2O
|
0,10 g
|
|
mikroelementide põhilahus (soovi korral, punkt 18)
|
10 ml
|
|
lisada hapnikuvaba vett (punkt 15)
|
kuni 1 liitrini
|
Märkus: kasutada tuleks värskelt tarnitud naatriumsulfiidi või see peaks olema pestud ja enne kasutamist kuivatatud, et tagada piisav taandamisvõime. Katse võib teha ilma kindakappi kasutamata (vt punkt 26). Sel juhul peaks naatriumsulfiidi lõppkontsentratsioon katsekeskkonnas olema suurem, 0,20 g Na2S · 9H2O liitris. Naatriumsulfiidi võib lisada ka sobiva anaeroobse põhilahusena läbi suletud katsenõu membraani, kuna see vähendab oksüdeerumisohtu. Naatriumsulfiidi võib asendada titaan(III)tsitraadiga, mida lisatakse läbi suletud katsenõu membraani lõppkontsentratsioonini 0,8–1,0 mmol/l. Titaan(III)tsitraat on väga tõhus ja vähemürgine taandav reagent, mis valmistatakse järgmiselt: lahustakse 2,94 g trinaatriumtsitraatdihüdraati 50 ml hapnikuvabas vees (saadakse kontsentratsioon 200 mmol/l) ja lisatakse 5 ml 15 % (mass/maht) titaan(III)kloriidi lahust; lahuse pH viiakse leelisega 7 ± 0,2 juurde ja lahus viiakse lämmastikujoa all sobivasse nõusse; titaan(III)tsitraadi kontsentratsioon sellises põhilahuses on 164 mmol/l.
|
|
17.
|
Katsekeskkonna komponendid, välja arvatud taandaja (naatriumsulfiid, titaantsitraat) segatakse ja lahusest puhutakse vahetult enne kasutamist läbi gaasilist lämmastikku umbes 20 minutit, et eemaldada hapnik. Seejärel lisatakse sobiv kogus värskelt valmistatud taandaja lahust (valmistatud hapnikuvabas vees) vahetult enne katsekeskkonna kasutamist. Katsekeskkonna pH viiakse vajaduse korral lahjendatud mineraalse happe või leelise abil 7 ± 0,2 peale.
|
Mikroelementide põhilahus (soovi korral)
|
18.
|
On soovitatav, et kasvukeskkond sisaldaks järgmisi mikroelemente, kuna see tõhustab anaeroobse lagunemise protsesse, eriti kui kasutatakse madalat inokulumi kontsentratsiooni (nt 1 g/l) (11).
|
mangaankloriidtetrahüdraat, MnCl2 · 4H2O
|
50 mg
|
|
boorhape, H3BO3
|
5 mg
|
|
tsinkkloriid, ZnCl2
|
5 mg
|
|
vask(II)kloriid, CuCl2
|
3 mg
|
|
dinaatriummolübdaatdihüdraat, Na2MoO4 · 2H2O
|
1 mg
|
|
koobaltkloriidheksahüdraat, CoCl2 · 6H2O
|
100 mg
|
|
nikkelkloriidheksahüdraat, NiCl2 · 6H2O
|
10 mg
|
|
dinaatriumselenit, Na2SeO3
|
5 mg
|
|
lisada hapnikuvaba vett (punkt 15)
|
kuni 1 liitrini
|
|
Uuritav aine
|
19.
|
Uuritav aine lisatakse põhilahuse, suspensiooni või emulsioonina või otse tahke aine või vedelikuna või adsorbeerituna klaaskiudfiltrile, nii et lõppkontsentratsioon ei ületaks 100 mg orgaanilist süsinikku liitris. Kui kasutatakse põhilahust, tehakse sobiv lahus vees (punkt 15) (mis on enne gaasilise lämmastiku läbipuhumisega hapnikust vabastatud) sellise kontsentratsiooniga, et lisatav ruumala ei suurendaks reaktsioonisegu koguruumala rohkem kui 5 %. Põhilahuse pH viiakse vajaduse korral 7 ± 0,2 peale. Kui aine ei ole vees piisavalt lahustuv, tuleb järgida standardit ISO 10634 (13). Lahusti kasutamise korral tehakse täiendav kontroll, milles inokuleeritud kasvukeskkonnale lisatakse ainult lahustit. Orgaanilisi lahusteid nagu kloroform ja süsiniktetrakloriid, mis teadaolevalt takistavad metaani vabanemist, tuleks vältida.
Hoiatus: ettevaatlikult tuleb käsitseda mürgiseid aineid ja aineid, mille omadused ei ole teada.
|
Võrdlusained
|
20.
|
Võrdlusaineid nagu naatriumbensoaat, fenool ja polüetüleenglükool 400 on edukalt kasutatud meetodi õige rakendamise kontrollimiseks; 60 päevaga toimub nendel ainetel biolagunemine enam kui 60 % ulatuses. Valmistatakse valitud võrdlusaine põhilahus (hapnikust vabastatud vees) samal viisil kui uuritava aine korral ning kui see on vajalik, reguleeritakse pH väärtuseni 7 ± 0,2.
|
Inhibeerimise kontroll (tingimisi vajalik)
|
21.
|
Selleks et valida kõige sobivam kontsentratsioon katse jaoks, tuleb hankida teavet uuritava aine mürgisuse kohta anaeroobsetele mikroorganismidele; selleks lisatakse uuritavat ainet ja võrdlusainet katsekeskkonnaga (vt punkt 16) nõusse kumbagi samas kontsentratsioonis kui eespool lisatud (vt punktid 19 ja 20 ning ISO 13641-1 (12)).
|
Läbikäärinud muda
|
22.
|
Kogutakse läbikäärinud muda reoveepuhasti käärimistankist, milles peamiselt töödeldakse olmereovett. Muda tuleks täielikult iseloomustada ja esitada muda kohta taustteave (vt punkt 54). Kui kasutatakse kohandatud inokulumi, võib kaaluda tööstusettevõtte reoveepuhasti läbikäärinud muda kasutamist. Läbikäärinud muda võtmiseks kasutatakse laia kaelaga pudeleid, mis võivad venida, näiteks kõrgtihedast polüetüleenist vms materjalist pudeleid. Pudel täidetakse mudaga kuni umbes 1 cm-ni ülemisest servast, ja suletakse õhukindlalt, eelistatav on kaitseventiiliga kork. Pärast laborisse toomist võib võetud muda kohe kasutada või panna see laboratoorsesse kääritustanki. Biogaasi ülerõhku tuleb pudelite ettevaatliku avamisega välja lasta. Teise võimalusena võib inokulumiallikana kasutada laboris kasvatatud anaeroobset muda, kuid selle aktiivsuse spekter võib olla väiksem.
Hoiatus: läbikäärinud mudast vabaneb süttivaid gaase, mis tekitab tulekahju- ja plahvatusohtu; samuti võib see sisaldada patogeenseid organisme, seepärast tuleb reoveemuda käsitsemisel olla ettevaatlik. Ohutusega seotud põhjustel ei kasutata muda võtmiseks klaasnõusid.
|
|
23.
|
Mudast taustgaaside vabanemise ja tühikatsete mõju vähendamiseks võib kaaluda muda eelnevat kääritamist. Kui on vajalik eelkääritamine, tuleks mudal lasta ilma toitainete või substraatide lisamiseta käärida 35 ± 2 °C kuni 7 päeva. On leitud, et umbes 5-päevane eelkääritamine annab tühikatsest gaasi vabanemise puhul optimaalse tulemuse, ilma et liiga palju pikeneks oote- või inkubatsiooniperiood katsefaasi jooksul või väheneks aktiivsus selle väikse arvu ainete suhtes, mida on uuritud.
|
|
24.
|
Kui uuritav aine on – või eeldatavalt on – halvasti biolagundatav, võib kaaluda muda eelnevat kokkupuutesse viimist uuritava ainega, et saada paremini kohanenud inokulum. Sellisel juhul lisatakse läbikääritatud mudale uuritavat ainet orgaanilise süsiniku sisalduseni 5–20 mg/l ja inkubeeritakse kuni 2 nädalat. Eelnevalt kokkupuutes olnud aktiivmuda pestakse hoolikalt enne kasutamist (vt punkt 25) ning katseprotokollis kirjeldatakse eelneva kokkupuute puhul kasutatud tingimusi.
|
Inokulum
|
25.
|
Aktiivmuda pestakse (vt punktid 22–24) vahetult enne kasutamist, et vähendada anorgaanilise süsiniku kontsentratsioon alla 10 mg/l lõplikus katsesuspensioonis. Muda tsentrifuugitakse suletud topsides (nt 3 000 g 5 minuti jooksul) ja supernatant visatakse ära. Sade tsentrifuugitopsi põhjas suspendeeritakse hapnikuvabas keskkonnas (punktid 16 ja 17), suspensioon tsentrifuugitakse uuesti ja supernatant visatakse jälle ära. Kui anorgaanilise süsiniku sisaldus ei ole veel piisavalt vähenenud, võib muda pesemist korrata kuni kaks korda. Näib, et mikroorganismidele see halvasti ei mõju. Lõpuks suspendeeritakse tsentrifuugimisel saadud sade vajalikus koguses katsekeskkonnas ja määratakse tahkete osakeste üldsisaldus [vt näiteks ISO 11923 (15)]. Tahkete osakeste lõplik kontsentratsioon katsenõus peaks olema vahemikus 1–3 g/l (või ligikaudu 10 % lahjendamata läbikääritatud muda kontsentratsioonist). Eespool nimetatud toimingud tuleb teha nii, et muda kokkupuude hapnikuga oleks minimaalne (võib töötada näiteks lämmastiku atmosfääris).
|
KATSE KÄIK
|
26.
|
Järgmiste ettevalmistavate tööde puhul tuleb läbikääritatud muda ja hapniku kokkupuude viia praktiliselt võimaliku miinimumini, näiteks on võib-olla vajalik töötada kindakapis lämmastiku atmosfääris ja/või puhuda pudelitest läbi lämmastikku (4).
|
Uuringukatsete ja kontrollkatsete ettevalmistamine
|
27.
|
Valmistage ette katsenõud vähemalt kolme paralleelkatse jaoks (vt punkt 13-b) uuritava ainega, tühikatsetega, võrdlusainega, inhibeerimise kontrollkatsega (tingimuslik) ja rõhukontrolli kambritega (soovituslik) (vt punktid 7 ja 19–21). Ette võib valmistada ka täiendavad nõud primaarse biolagundatavuse hindamiseks uuritava aine spetsiifilise määramise teel. Sama tühikatsete komplekti võib kasutada mitme uuritava aine puhul ühes ja samas katses, kui vabaruumi mahud on ühesugused.
|
|
28.
|
Valmistage ette lahjendatud inokulum, enne kui hakkate seda lisama katsenõudesse, näiteks laiaotsalise pipeti abil. Lisage hästi segatud inokulumi alikvoodid (punkt 25), nii et tahkete osakeste üldkontsentratsioon oleks kõikides nõudes ühesugune (vahemikus 1–3 g/l). Lisage uuritava aine ja võrdlusaine põhilahused pärast seda, kui olete vajaduse korral korrigeerinud pH väärtuseni 7 ± 0,2. Uuritav aine ja võrdlusaine tuleb lisada kõige asjakohasema manustamismeetodiga (punkt 19).
|
|
29.
|
Orgaanilise süsiniku kontsentratsioon katses peaks tavaliselt olema vahemikus 20–100 mg/l (punkt 4). Kui uuritav aine on mürgine, tuleks vähendada selle kontsentratsioon katses väärtuseni 20 mg C/l või isegi alla selle, kui mõõdetakse primaarset biolagunemist konkreetse aine spetsiifilise analüüsiga. Tuleks märkida, et madalamal uuritava aine kontsentratsioonil katse tulemuste varieeruvus suureneb.
|
|
30.
|
Tühikatsenõudesse lisage uuritava aine põhilahuse, suspensiooni või emulsiooni asemel samasugused kogused vastavat vedelikku, mida kasutati uuritava aine lisamiseks. Kui uuritav aine lisati klaaskiudfiltri või orgaanilise lahusti kasutamisega, lisage tühikatsenõudesse filter või samasugune kogus lahustit, mis aurustati. Valmistage lisaks ette eraldi paralleelkatsed uuritava ainega pH väärtuse mõõtmiseks. Korrigeerige pH 7 ± 0,2-ni, lisades vajaduse korral väikese koguse lahjendatud mineraalhapet või leelist. Ühesugused kogused pH neutraliseerimiseks kasutatud ainet tuleks lisada kõikidesse nõudesse. Sellised pH korrigeerimised ei peaks olema vajalikud, kuna uuritava aine ja võrdlusaine põhilahuste pH on juba seatud neutraalseks (vt punktid 19 ja 20). Kui tuleb mõõta primaarset biolagunemist, tuleks sobiv proov võtta pH kontrollimise nõust või täiendavast katsenõust ja määrata selles uuritava aine sisaldus spetsiifilise analüüsiga. Kõikidesse nõudesse võib lisada kaetud magnetid (magnetpulgad), kui reaktsioonisegu on vaja segada (ei ole kohustuslik).
|
|
31.
|
Hoolitsege selle eest, et vedeliku üldruumala V1 ja vabaruumi ruumala Vh oleks kõigis nõudes ühesugused; määrake V1 ja Vh ning märkige need üles. Iga nõu tuleks sulgeda gaasimembraaniga ja viia kindakapist (vt punkt 26) üle inkubaatorisse (vt punkt 13-a).
|
Lahustumatu uuritav aine
|
32.
|
Vees halvasti lahustuva aine kaalutud kogus lisage otse ettevalmistatud nõusse. Kui on vaja kasutada lahustit (vt punkt 19), viige uuritava aine lahus või suspensioon tühjadesse nõudesse. Võimaluse korral aurustage lahusti lämmastiku läbijuhtimisega ja seejärel lisage vajalikud kogused ülejäänud koostisaineid, nimelt lahjendatud muda (punkt 25) ja hapnikuvaba vett. Tuleks ette näha ka täiendav lahusti kontrollkatse (vt punkt 19). Lahustumatu aine lisamise muude meetodite kohta vt ISO 10634 (13). Vedelaid uuritavaid aineid võib doseerida süstlaga täielikult ettevalmistatud ja suletud nõudesse, kui eeldatakse, et pH lähteväärtus ei ületa 7 ± 1, muul juhul doseerige nii, nagu eespool kirjeldatud (vt punkt 19).
|
Inkubeerimine ja gaasi rõhu mõõtmised
|
33.
|
Ettevalmistatud nõusid inkubeerige umbes 1 tund temperatuuril 35 ± 2 °C, et toimuks tasakaalustumine ja liigne gaas eralduks atmosfääri; selleks loksutage järjekorras iga nõu, torgake rõhumõõtmisseadme (punkt 13-c) nõel läbi membraani ja avage kraan, kuni manomeeter näitab 0-rõhku. Kui selles staadiumis või vahepealsete mõõtmiste tegemisel on rõhk vabaruumis atmosfäärirõhust madalam, tuleks lisada gaasilist lämmastikku, et rõhk oleks võrdne atmosfäärirõhuga. Sulgege kraan (vt punkt 13-c) ja jätkake inkubeerimist pimedas nii, et kõigi nõude kõik osad oleksid kääritamistemperatuuri juures. Jälgige nõusid pärast inkubeerimist 24–48 tundi. Jätke katsest välja kõik nõud, mille supernatantvedelik värvub selgelt roosaks, mis tähendab, et resasuriin (vt punkt 16) on muutnud värvi, mis näitab hapniku juuresolekut (vt punkt 50). Väikest hapnikukogust võib süsteem taluda, kuid suurem hapniku kontsentratsioon võib oluliselt pärssida anaeroobset biolagundamist. Kolmest paralleelkatsest ühe üksiku nõu väljajätmine on lubatav, kuid kui selliseid nõusid on rohkem, tuleb katse tegemise korraldus läbi vaadata ja katset korrata.
|
|
34.
|
Segage või loksutage iga nõu sisu hoolikalt mõne minuti jooksul vähemalt 2 või 3 korda nädalas ja natuke aega enne iga rõhumõõtmist. Loksutamine viib inokulumi uuesti suspensiooni ja tagab gaaside tasakaalu. Kõik rõhu mõõtmised tuleb teha kiiresti, sest kui mõõtmise ajal temperatuur langeb, saadakse vale näit. Rõhu mõõtmise ajal tuleks kogu katsenõud, kaasa arvatud vabaruum, hoida kääritamistemperatuuril. Mõõtke gaasi rõhk näiteks nii, et surute rõhumõõtmisseadmega ühendatud süstla nõela (punkt 13-c) läbi membraani. Tuleks olla hoolikas, et vältida vee sattumist süstlanõela sisse; kui selline asi juhtub, tuleb märjaks saanud osad kuivatada ja panna süstla otsa uus nõel. Rõhk tuleks mõõta millibaarides (vt punkt 42). Gaasi rõhku nõus võib mõõta perioodiliselt, näiteks kord nädalas, ja soovi korral võib liigse gaasi lasta atmosfääri. Teine võimalus on mõõta rõhk ainult katse lõpul, et määrata moodustunud biogaasi kogus.
|
|
35.
|
Soovitatav on gaasi rõhku mõõta vahepeal, kuna rõhu suurenemine võimaldab hinnata, millal võib katse lõpetada ja nii saab jälgida ka biolagunemise kineetikat (vt punkt 6).
|
|
36.
|
Tavaliselt lõpetatakse katse pärast 60-päevast inkubeerimist, kui rõhu mõõtmisest leitud biolagunemise kõver ei ole juba enne seda platoole jõudnud; platoofaas on faas, kus on jõutud maksimaalse lagunemiseni ja biolagunemise kõver muutub horisontaalseks. Kui platoo väärtus on väiksem kui 60 %, on tulemust raske tõlgendada, kuna see näitab, et ainult osa molekulist on mineraliseeritud või et on tehtud viga. Kui tavalise inkubeerimisaja lõpus gaasi üha tekib ja platoofaasi ilmselt ei ole saavutatud, tuleks kaaluda katse pikendamist, et kontrollida, kas saavutatakse platoo väärtus (> 60 %).
|
Anorgaanilise süsiniku mõõtmine
|
37.
|
Pärast viimast gaasi rõhu mõõtmist katse lõpus laske mudal settida. Avage järjest iga nõu ja võtke kohe proov anorgaanilise süsiniku (IC) kontsentratsiooni (mg/l) määramiseks supernatantvedelikus. Supernatantvedelikku ei tohiks tsentrifuugida ega filtrida, kuna sellele kaasneks lubamatu lahustunud süsinikdioksiidi kadu. Kui vedelikku ei saa analüüsida kohe proovi võtmise ajal, võite säilitada proovi ilma vabaruumita suletud viaalis kuni kaks päeva temperatuuril 4 °C. Pärast anorgaanilise süsiniku mõõtmist mõõdetakse ja registreeritakse pH väärtus.
|
|
38.
|
Teise võimalusena võib anorgaanilise süsiniku supernatandis määrata kaudselt lahustunud anorgaanilise süsiniku ehk süsinikdioksiidi vabanemise kaudu, mille saab mõõta vabaruumis. Pärast viimast gaasi rõhu mõõtmist reguleeritakse rõhk igas katseanumas atmosfäärirõhule. Iga nõu sisu hapustatakse ligikaudu pH 1-ni kontsentreeritud mineraalhappe (nt H2SO4) lisamisega läbi suletud nõu membraani. Loksutatud nõusid inkubeeritakse temperatuuril 35 ± 2 °C umbes 24 tundi ja mõõdetakse rõhumõõtjaga gaasi rõhk, mis on tekkinud süsinikdioksiidi vabanemise tõttu.
|
|
39.
|
Samasugused lugemid võetakse ka vastavate tühikatsete, võrdlusaine ja inhibeerimise kontrollnõu (kui seda kasutati) puhul (vt punkt 21).
|
|
40.
|
Mõnel juhul, eriti kui samu kontrollkatsenõusid kasutatakse mitme uuritava aine puhul, tuleks mõelda vahepealsele anorgaanilise süsiniku kontsentratsiooni mõõtmisele nii katse- kui ka kontrollkatsenõudes, kui see on asjakohane. Sellisel juhul tuleb ette valmistada piisaval arvul nõusid, et jätkuks ka kõigi vahepealsete mõõtmiste jaoks. Selline meetod on eelistatav kõikide proovide võtmisele ainult ühest nõust. Viimast võib teha ainult siis, kui lahustunud anorgaanilise süsiniku määramiseks vajalikku proovi mahtu ei peeta liiga suureks. Lahustunud anorgaaniline süsinik tuleks määrata pärast gaasi rõhu mõõtmist ilma liigset gaasi välja laskmata, nagu on kirjeldatud allpool:
|
—
|
võtke süstla abil läbi membraani ilma nõu avamata võimalikult väiksemahuline proov supernatandist ja määrake proovis anorgaaniline süsinik;
|
|
—
|
pärast proovi võtmist lastakse liigne gaas välja või ei lasta;
|
|
—
|
tuleks võtta arvesse, et isegi väike supernatandi koguse vähenemine (nt 1 %) võib oluliselt suurendada vabaruumis oleva gaasi ruumala (Vh);
|
|
—
|
võrranditesse (vt punkt 44) viiakse vajaduse korral sisse parandid, millega arvestatakse Vh suurenemist võrrandis 3.
|
|
Spetsiifilised analüüsid
|
41.
|
Kui on vaja määrata primaarset anaeroobset lagunemist (vt punkt 30), võtke vajaliku mahuga proov uuritava ainega nõust katse alguses ja lõpus. Kui te seda teete, siis pange tähele, et vabaruumi ja vedelikufaasi ruumalad, vastavalt Vh ja Vl, muutuvad ning seda tuleb võtta arvesse gaasi tekkimise tulemuste arvutamisel. Teise võimalusena võib proove konkreetse aine määramiseks võtta täiendavatest katsesegudest, mis on selleks eelnevalt ette nähtud (punkt 30).
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Tulemuste töötlemine
|
42.
|
Praktilistel põhjustel mõõdetakse gaasi rõhku millibaarides (1 mbar = 1 hPa = 102 Pa; 1 Pa = 1 N/m2), mahtusid liitrites ja temperatuuri Celsiuse kraadides.
|
Süsinik vabaruumis
|
43.
|
Kuna nii 1 mool metaani kui ka üks mool süsinikdioksiidi sisaldab kumbki 12 g süsinikku, võib süsiniku massi tekkinud gaasis väljendada järgmiselt:
kus:
|
m
|
=
|
süsiniku mass (mg) vabanenud gaasi teatavas ruumalas;
|
|
12
|
=
|
süsiniku suhteline aatommass;
|
|
n
|
=
|
gaasi moolide arv antud ruumalas.
|
Kui olulistes kogustes tekib muid gaase peale metaani või süsinikdioksiidi (nt N2O), tuleb võrrandit 1 muuta, et kirjeldada tekkinud gaaside võimalikku mõju.
|
|
44.
|
Gaaside seadustest võib n väljendada järgmiselt:
|

|
Võrrand 2
|
kus:
|
p
|
=
|
gaasi rõhk (paskalites);
|
|
V
|
=
|
gaasi ruumala (m3);
|
|
R
|
=
|
universaalne gaasikonstant [8,314 J/(mol K)]
|
|
T
|
=
|
inkubeerimistemperatuur (kelvinites).
|
Ühendame võrrandid 1 ja 2 ning võtame arvesse ka tühikatses vabaneva gaasi:
|

|
Võrrand 3
|
kus:
|
mh
|
=
|
gaasina vabaruumis oleva puhta süsiniku mass (mg);
|
|
Δp
|
=
|
esialgse ja lõpliku gaasirõhu vahe keskmine, millest on lahutatud vastav tühikatsenõude keskmine (millibaarides);
|
|
Vh
|
=
|
vabaruumi maht nõus (l);
|
|
0,1
|
=
|
tegur, millega teisendatakse njuuton/m2 millibaarideks ja m3 liitriteks.
|
Võrrandit 4 tuleks kasutada tavapärase inkubeerimise puhul temperatuuril 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
Võrrand 4
|
Märkus: Alternatiivne mahu arvutamine. Rõhumõõtja näidud teisendatakse vabanenud gaasi milliliitriteks, kasutades standardkõverat, mis saadakse sissesüstitud ruumala (ml) ja vastavate rõhumõõtja näitude kandmisega graafikule (2. liide). Gaasi moolide arv (n) iga nõu vabaruumis arvutatakse nii, et kumulatiivne vabanenud gaasi ruumala (ml) jagatakse teguriga 25 286 ml/mol, mis on ühe mooli gaasi poolt enda alla võetav ruumala 35 °C juures atmosfäärirõhul. Kuna 1 mool CH4 ja 1 mool CO2 sisaldab kumbki 12 g süsinikku, on süsiniku mass (mg) vabaruumis (mh
) leitav võrrandiga 5:
|
mh
= 12 × 103×n
|
Võrrand 5
|
Tühikatse tulemuste arvessevõtmine, et arvestada gaasi tekkimist tühikatses:
|

|
Võrrand 6
|
kus:
|
mh
|
=
|
gaasina vabaruumis oleva puhta süsiniku mass (mg);
|
|
ΔV
|
=
|
uuritava ainega katsenõude ja tühikatsenõude vabaruumis oleva gaasi ruumala erinevuste keskväärtus;
|
|
25 286
|
=
|
ruumala, mille võtab enda alla 1 mool gaasi temperatuuril 35 °C ja rõhul 1 atmosfäär.
|
|
|
45.
|
Biolagundamise käiku võib vajaduse korral jälgida kumuleeritud rõhu kasvu järgi, pannes graafikule Dp (millibaarides) sõltuvana ajast. Saadud kõvera abil tehakse kindlaks ootefaasi pikkus (päevades), mis kantakse protokolli. Ootefaas on aeg katse algusest kuni olulise lagunemise alguseni (vt näide, 3. liide). Kui supernatandist on võetud ja analüüsitud vahepealseid proove (vt punktid 40, 46 ja 47), võib kumulatiivse rõhu asemel panna graafikule vabanenud üldsüsiniku (gaasi- ja vedelfaasis).
|
Süsinik vedelfaasis
|
46.
|
Metaani kogust vedelfaasis ignoreeritakse, kuna selle lahustuvus vees on teatavasti väga vähene. Anorgaanilise süsiniku mass katsenõude vedelfaasis arvutatakse võrrandi 7 järgi:
kus:
|
ml
|
=
|
anorgaanilise süsiniku mass (mg) vedelfaasis;
|
|
Cnet
|
=
|
anorgaanilise süsiniku kontsentratsioon (mg/l) katseanumates, millest on lahutatud kontsentratsioon kontrollnõudes katse lõpul;
|
|
Vl
|
=
|
vedeliku maht nõus (l);
|
|
Gaasistatud süsiniku kogusisaldus
|
47.
|
Gaasistatud süsiniku kogumass katsenõus arvutatakse võrrandi 8 järgi:
kus:
|
|
mt = gaasistatud süsiniku kogumass (mg);
|
|
|
mh
ja ml
on defineeritud eespool.
|
|
Uuritava aine süsinik
|
48.
|
Uuritavast ainest saadud süsiniku mass katsenõus arvutatakse võrrandi 9 järgi:
kus:
|
mv
|
=
|
uuritavast ainest saadud süsiniku mass (mg);
|
|
Cc
|
=
|
uuritavast ainest saadud süsiniku kontsentratsioon (mg/l) katsenõus
|
|
Vl
|
=
|
vedeliku maht katsenõus (l).
|
|
Biolagunemise määr
|
49.
|
Biolagunemise protsent arvutatakse vabaruumis olevast gaasist võrrandi 10 järgi ja üldise biolagunemise protsent võrrandi 11 järgi:
|
Dh
= (mh
/mv
) × 100
|
Võrrand 10
|
|
Dt
= (mt
/mv
) × 100
|
Võrrand 11
|
kus:
|
|
Dh = biolagunemise protsent vabaruumis oleva gaasikoguse järgi;
|
|
|
Dt = summaarne biolagunemine ( %);
|
|
|
mh
, mv
ja mt
on defineeritud eespool.
|
Primaarse biolagunemise määr arvutatakse uuritava aine kontsentratsiooni mõõtmisest (soovi korral) inkubeerimise alguses ja lõpus võrrandi 12 järgi:
|
Dp
= (1 –Se
/Si
) × 100
|
Võrrand 12
|
kus:
|
Dp
|
=
|
uuritava aine primaarse biolagunemise protsent;
|
|
Si
|
=
|
uuritava aine lähtekontsentratsioon (mg/l)
|
|
Se
|
=
|
uuritava aine kontsentratsioon katse lõpus (mg/l).
|
Kui analüüs näitab uuritava aine olulist kontsentratsiooni anaeroobse muda muutmata inokulumis, tuleb kasutada võrrandit 13:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
Võrrand 13
|
kus:
|
Dp
1
|
=
|
uuritava aine primaarse biolagunemise parandatud protsent;
|
|
Sib
|
=
|
uuritava aine „näiline” lähtekontsentratsioon (mg/l);
|
|
Seb
|
=
|
uuritava aine „näiline” lõppkontsentratsioon (mg/l) tühikatsetes.
|
|
Tulemuste nõuetekohasus
|
50.
|
Tuleks kasutada ainult selliste nõude rõhu mõõtmise tulemusi, milles ei ole märgata roosat värvust (vt punkt 33). Anaeroobse käitlemise meetodite nõuetekohane kasutamine viib hapnikuga saastumise miinimumini.
|
|
51.
|
Katse võib lugeda nõuetekohaseks ainult juhul, kui võrdlusaine jõuab platooni, mis vastab enam kui 60 % biolagunemisele (41).
|
|
52.
|
Kui pH katse lõpus oli läinud välja vahemikust 7 ± 1 ja biolagunemine oli ebapiisav, tuleb katset korrata katsekeskkonnaga, mille puhvermahtuvus on suurem.
|
Lagunemise pärssimine
|
53.
|
Gaasi vabanemine nõudes, milles on nii uuritav aine kui ka võrdlusaine, peaks olema vähemalt sama suur kui nõudes, mis sisaldavad ainult võrdlusainet; vastasel korral on tegemist gaasi tekke pärssimisega. Mõnel juhul on gaasi vabanemine uuritava ainega, kuid ilma võrdlusaineta nõus väiksem kui tühikatse kontrollnõus, mis näitab, et uuritaval ainel on inhibeeriv mõju.
|
Katseprotokoll
|
54.
|
Katseprotokollis esitatakse alljärgnev teave.
|
|
Uuritav aine:
|
—
|
tavanimetus, keemiline nimetus, CASi number, struktuurivalem ja asjakohased füüsikalis-keemilised omadused;
|
|
—
|
uuritava aine puhtusaste (lisandid).
|
|
|
|
Katsetingimused:
|
—
|
lahjendatud kääritusnõuvedeliku maht (Vl
) ja nõu vabaruumi maht (Vh
);
|
|
—
|
katsenõude kirjeldus, biogaasi määramise kirjeldus (näiteks rõhumõõtja tüüp) ja anorgaanilise süsiniku analüsaatori kirjeldus;
|
|
—
|
uuritava aine ja võrdlusaine lisamine katsesüsteemi: katses kasutatud kontsentratsioon ja lahustite kasutamine;
|
|
—
|
andmed kasutatud inokulumi kohta: reoveepuhasti nimi, reoveepuhasti kirjeldus (nt töötemperatuur, muda retentsiooniaeg, peamiselt olmereovesi jne), kontsentratsioon, igasugune teave, mis on vajalik selle põhjendamiseks ja teave inokulumi eeltöötlemise kohta (nt eelkääritamine, eelnevasse kokkupuutesse viimine);
|
|
—
|
inkubatsioonitemperatuur;
|
|
|
|
Tulemused:
|
—
|
pH ja anorgaanilise süsiniku sisaldus katse lõpus;
|
|
—
|
uuritava aine kontsentratsioon katse alguses ja lõpus, kui mõõdeti konkreetset ainet;
|
|
—
|
kõik andmed, mis mõõdeti uuritava aine katses, tühikatses, võrdlusaine katses ja vajaduse korral inhibeerimise kontrollnõudes (nt rõhk millibaarides, anorgaanilise süsiniku kontsentratsioon (mg/l)) tabeli kujul (eraldi tuleb esitada vabaruumis ja vedelikus mõõdetud andmed);
|
|
—
|
andmete statistiline analüüs, katse kestus ja biolagunemise kõver uuritava aine ja võrdlusaine ning inhibeerimise kontrollkatsete korral;
|
|
—
|
uuritava aine ja võrdlusaine biolagunemise protsent;
|
|
—
|
iga katsetulemuste arvestamata jätmise põhjendus;
|
|
|
KIRJANDUS
|
(1)
|
Käesoleva lisa järgmised peatükid:
|
|
C.4, Kohese biolagunduvuse määramine;
|
|
|
C.9, Biodegradatsioon – Zahni-Wellensi test;
|
|
|
C.10, Reovee aeroobse töötlemise simulatsioonikatse:
A: aktiivmuda, B: biokiled
|
|
|
C.11, Biodegradatsioon – aktiivmuda respiratsiooni pärssimise katse
|
|
|
(2)
|
OECD (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OECD, Paris
|
|
(3)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W.E., Pagga,U., Steber, J., Reust, H. and Bontinck, W.J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550. (Also published as ECETOC Technical Report No. 28, June 1988).
|
|
(4)
|
Shelton D.R. and Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. Appl. Environ. Mircobiology, 47, 850-857.
|
|
(5)
|
Owen, W.F., Stuckey, DC., Healy J.B., Jr, Young L.Y. and McCarty, P.L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485-492.
|
|
(6)
|
Healy, J.B.Jr. and Young, L.Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84-89.
|
|
(7)
|
Gledhill, W.E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Philadelphia.
|
|
(8)
|
Battersby, N.S. and Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441-2460.
|
|
(9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
|
|
(10)
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
(11)
|
International Organization for Standardization (1995) ISO 11 734 Water Quality – Evaluation of the ultimate anaerobic biodegradation of organic compounds in digested sludge – Method by measurement of the biogas production.
|
|
(12)
|
International Organization for Standardization (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1 General Test.
|
|
(13)
|
International Organization for Standardization (1995) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(14)
|
Pagga, U. and Beimborn, D.B., (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499-1509.
|
|
(15)
|
International Organization for Standardization (1997) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
1. liide
Näidisseade biogaasi tootmise mõõtmiseks gaasi rõhu järgi
Selgitus:
|
1
|
–
|
rõhumõõtur
|
|
2
|
–
|
gaasipidav 3-käiguline kraan
|
|
3
|
–
|
süstlanõel
|
|
4
|
–
|
gaasi mitte läbilaskev sulgur (valtsitav rõngaskork ja membraan)
|
|
5
|
–
|
vabaruum (Vh
)
|
|
6
|
–
|
läbikääritatud muda inokulum (Vl
)
|
Katsenõusid inkubeeritakse temperatuuril 35 ± 2 °C
2. liide
Rõhumõõturi näitude teisendamine
Rõhumõõturi näitusid võib gaasi ruumalaga siduda standardkõvera abil, mis saadakse teadaoleva ruumalaga õhukoguste süstimisega 35 ± 2 °C juures seerumipudelitesse, milles on reaktsioonisegu ruumalaga V
R võrdne kogus vett:
|
—
|
viiesse seerumipudelisse, mida on hoitud temperatuuril 35 ± 2 °C, viiakse vee alikvoodid ruumalaga V
R ml. Pudelid suletakse ja pannakse veevanni 35 °C juurde 1 tunniks tasakaalustuma;
|
|
—
|
rõhumõõtur lülitatakse sisse, lastakse stabiliseeruda ja viiakse selle näit 0 peale;
|
|
—
|
süstlanõel torgatakse läbi ühe nõu membraani, avatakse kraan, kuni rõhumõõtur näitab rõhku 0 ja suletakse siis kraan;
|
|
—
|
sama korratakse ülejäänud pudelitega;
|
|
—
|
igasse pudelisse süstitakse 1 ml õhku temperatuuriga 35 ± 2 °C. Rõhumõõturiga ühendatud nõel surutakse läbi membraani ühte pudelisse ja lastakse rõhu näidul stabiliseeruda. Märgitakse rõhk üles, avatakse kraan, kuni rõhk on 0, ja seejärel kraan suletakse;
|
|
—
|
sama korratakse ülejäänud pudelitega;
|
|
—
|
kogu seda tegevust korratakse 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml ja 50 ml õhuga;
|
|
—
|
koostatakse kõver rõhunäitude (Pa) sõltuvuse kohta sissesüstitud gaasi mahust (ml). Mõõturi näidud on lineaarsed rõhu vahemikus 0–70 000 Pa ja vabanenud gaasi ruumala vahemikus 0–50 ml.
|
3. liide
Lagunemiskõvera näide (kumulatiivne netorõhu suurenemine)

4. Liide
Anaeroobse biolagunemise katse näidisandmelehed – andmeleht uuritava aine kohta
|
Labor: …
|
Uuritav aine: …
|
Katse nr: …
|
|
Katsetemperatuur, °C: …
|
Vabaruumi maht (Vh): …(l)
|
Vedelfaasi maht (Vl ): …(l)
|
|
Süsinikku uuritavas aines Cc,v: …(mg/l))
|
mv
(42): …(mg)
|
|
|
Päev
|
p
1 (katse)
(mbar)
|
p
2 (katse)
(mbar)
|
p
3 (katse)
(mbar)
|
p (katse)
keskmine
(mbar)
|
p
4 (tühikatse)
(mbar)
|
p
5 (tühikatse)
(mbar)
|
p
6 (tühikatse)
(mbar)
|
p (tühikatse)
keskmine
(mbar)
|
p (neto)
katse – tühikatse
keskmine (mbar)
|
Δp (neto)
kumulatiivne
(mbar)
|
m
h
vabaruumi C
(43)
(mg)
|
D
h
Biolagunemine (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
katse
(mg)
|
C
IC, 2
katse
(mg)
|
C
IC, 3
katse
(mg)
|
C
IC
katse keskmine
(mg)
|
C
IC, 4
tühikatse
(mg)
|
C
IC, 5
tühikatse
(mg)
|
C
IC, 6
tühikatse
(mg)
|
C
IC
tühikatsete keskmine
(mg)
|
C
IC, net
katse – tühikatse
keskmine
(mg)
|
m
l
vedelfaasis C (45)
(mg)
|
m
t
kokku C (46)
(mg)
|
D
t
Biolagunemine (47)
(%)
|
|
Anorg. C (lõpp)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (lõpp)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Labor: …
|
Võrdlusaine: …
|
Katse nr: …
|
|
Katsetemperatuur, °C: …
|
Vabaruumi maht (V
h): …
|
Vedelfaasi maht (Vl ): …(l)
|
|
Süsinikku võrdlusaines Cc,v (mg/l): …
|
mv
(48) (mg):
|
|
|
Päev
|
p
1 (võrdlus)
(mbar)
|
p
2 (võrdlus)
(mbar)
|
p
3 (võrdlus)
(mbar)
|
p (võrdlus)
keskmine
(mbar)
|
p
4 (inhib.)
(mbar)
|
p
5 (inhib.)
(mbar)
|
p
6 (inhib.)
(mbar)
|
p (inhib.)
keskmine
(mbar)
|
p (võrdlus)
võrdlusaine – tühikatse
(mbar)
|
Δp (võrdlus)
kumulatiivne
(mbar)
|
m
h
vabaruumi C
(49)
(mg)
|
D
h
Biolagunemine (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
võrdlusaine
(mg)
|
C
IC, 2
võrdlusaine
(mg)
|
C
IC, 3
võrdlusaine
(mg)
|
C
IC
võrdlusaine keskmine
(mg)
|
C
IC, 4
inhib.
(mg)
|
C
IC, 5
inhib.
(mg)
|
C
IC, 6
inhib.
(mg)
|
C
IC
inhib. keskmine
(mg)
|
C
IC, net
võrdlusaine – inhib.
(mg)
|
m
l
vedelfaasis C (51)
(mg)
|
m
t
kokku C (52)
(mg)
|
D
t
Biolagunemine (53)
(%)
|
|
Anorg. C (lõpp)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (lõpp)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. LEOSTUMINE MULLAKOLONNIS
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 312 (2004). Sünteetilised kemikaalid satuvad pinnasesse kas otse, teadliku pinnasesse viimisega (nt põllumajanduskemikaalid) või kaudselt (nt reovesi → reoveesete → muld või õhk → märg- või kuivsadenemine). Selliste kemikaalide riskihindamiseks on oluline eelnevalt hinnata seda, kas need kemikaalid võivad mullas muunduda ning liikuda (leostuda) edasi mulla sügavamatesse kihtidesse ja lõpuks põhjavette.
|
|
2.
|
Kemikaalide võimaliku mullas leostumise mõõtmiseks kontrollitud laboritingimustes on mitu meetodit, näiteks mulla õhukese kihi kromatograafia, mulla paksu kihi kromatograafia, mulla kolonnkromatograafia ning adsorptsiooni ja desorptsiooni mõõtmised (1, 2). Mitteioniseerunud kemikaalide korral võimaldab n-oktanooli-vee jaotuskoefitsient (Pow) varakult hinnata nende võimalikku adsorptsiooni ja leostumist (3, 4, 5).
|
|
3.
|
Käesolevas katsemeetodis kirjeldatud meetod põhineb häiritud mulla kolonnkromatograafial (mõisted vt 1. liide). Tehakse kahte tüüpi katseid, et määrata kontrollitud laboritingimustes i) uuritava kemikaali võimalik leostumine mullas, ja ii) kemikaali muundumissaaduste võimalik leostumine mullas (uuring vanandatud jääkidega) (54). Katsemeetod põhineb olemasolevatel meetoditel (6, 7, 8, 9, 10, 11).
|
|
4.
|
Käesolevas katses kasutatavate mullaproovide arvu ja tüüpide osas lepiti kokku mulla ja sette valimist käsitlevas OECD töörühmas, mis tuli kokku Itaalias Belgirates 1995. aastal (12). Samuti andis töörühm soovitusi mullaproovide kogumise, käsitsemise ja säilitamise kohta leostumiskatsete puhul
|
KATSEMEETODI PÕHIMÕTE
|
5.
|
Kolonnid, mis on valmistatud sobivast inertsest materjalist (nt klaas, roostevaba teras, alumiinium, teflon, polüvinüülkloriid jne), täidetakse mullaga ja seejärel küllastatakse ja tasakaalustatakse „kunstliku vihma” lahusega (mõiste vt 1. liide) ja nõrutatakse. Seejärel kantakse iga mullakolonni pinnale uuritavat kemikaali ja/või uuritava kemikaali vanandatud jääke. Seejärel hakatakse mullakolonni voolutama kunstliku vihmaga ja kogutakse nõrgvesi. Pärast leostamisprotsessi eemaldatakse muld kolonnist ja jagatakse sobivaks arvuks osadeks olenevalt sellest, millist teavet tahetakse saada. Iga mullasamba osa ja nõrgvett analüüsitakse uuritava kemikaali ja vajaduse korral muundumissaaduste või muude huvipakkuvate kemikaalide määramiseks.
|
KATSEMEETODI KASUTATAVUS
|
6.
|
Katsemeetodit saab kasutada (märgistamata või radioaktiivse märgisega, nt 14C) uuritavate kemikaalide puhul, mille jaoks on olemas piisava täpsuse ja tundlikkusega määramismeetodid. Katsemeetodit ei kasutata kemikaalide puhul, mis lenduvad kergesti pinnasest ja veest ning mida seepärast ei jää selle katsemeetodi tingimustes mulda ega nõrgvette.
|
ANDMED UURITAVA KEMIKAALI KOHTA
|
7.
|
Mullakolonnis leostumise mõõtmiseks võib kasutada märgistamata või radioaktiivse märgisega uuritavat kemikaali. Radioaktiivse märgisega ainet on vaja selleks, et uurida muundumissaaduste (vanandatud uuritava kemikaali jäägid) leostumist ja määrata massibilanssi. Soovitatakse kasutada14C-märgist, kuid muud isotoobid nagu13C,15N,3H,32P võivad samuti olla kasulikud. Kuivõrd see on võimalik, tuleks märgis paigutada molekuli kõige stabiilsema(te) osa(de) külge. Uuritava kemikaali puhtus peab olema vähemalt 95 %.
|
|
8.
|
Enamik kemikaale tuleks peale kanda eraldi ainena. Taimekaitsevahendite koostises oleva toimeaine seostumise uurimiseks võib kasutada ka valmistoodet, kuid uuritava kemikaali enda uurimine on eriti vajalik siis, kui segu tõenäoliselt mõjutab vabanemiskiirust (nt granuleeritud või toimeaine ohjatud eraldumisega tooted). Seoses konkreetset toodet arvestavate võimalike erinõuetega katse korralduse suhtes võib olla kasulik pidada enne katse tegemist nõu reguleeriva asutusega. Vanandatud jääkide leostumise uuringu puhul tuleks kasutada puhast lähtekemikaali.
|
|
9.
|
Enne mullakolonnis leostumise katse tegemist peaks uuritava aine kohta olema kogutud järgmine teave:
|
(1)
|
lahustuvus vees [katsemeetod A.6] (13);
|
|
(2)
|
lahustuvus orgaanilistes lahustites;
|
|
(3)
|
aururõhk [katsemeetod A.4] (13) ja/või Henry konstant;
|
|
(4)
|
jaotuskoefitsient süsteemis n-oktanool-vesi [katsemeetodid A.8 ja A.24] (13);
|
|
(5)
|
adsorptsioonikoefitsient (Kd, Kf või KOC) [katsemeetodid C.18 ja/või C.19] (13);
|
|
(6)
|
hüdrolüüs [katsemeetod C.7] (13);
|
|
(7)
|
dissotsiatsioonikonstant (pKa) [OECD katsejuhend 112] (25);
|
|
(8)
|
aeroobne ja anaeroobne muundumine mullas [katsemeetod C.23] (13).
|
Märkus: Temperatuur, mille juures mõõtmised tehakse, tuleks esitada vastavas katseprotokollis.
|
|
10.
|
Uuritava kemikaali kogus mullakolonnis peaks olema piisav, et võimaldada kindlaks teha vähemalt 0,5 % kasutatud kogusest igas mullasamba osas. Taimekaitsevahendi toimeaine puhul peaks pealekantava uuritava kemikaali kogus vastama suurimale soovitatud kasutamismäärale (üks kasutuskogus).
|
|
11.
|
Kättesaadav peab olema sobiv teadaoleva mõõtetäpsuse, kordustäpsusega ja tundlikkusega analüüsimeetod uuritava kemikaali ning vajaduse korral selle muundumissaaduste määramiseks mullas ja nõrgvees. Uuritava kemikaali ja selle oluliste muundumissaaduste (tavaliselt vähemalt kõik muundumissaadused, mida on ≥ 10 % uuritava aine kogusest täheldatud muundumisteede uuringutes, kuid eelistatavalt kõik probleemsed muundumissaadused) analüüsi tuvastuspiir peaks olema teada (vt punkt 17).
|
VÕRDLUSKEMIKAALID
|
12.
|
Tuleks kasutada võrdluskemikaale nagu atrasiin või monuroon, mis on välitingimustes teadaolevalt mõõdukad leostujad, ja hinnata uuritava kemikaali suhtelist liikuvust mullas nende suhtes (1, 8, 11). Vee liikumise jälgimiseks mullasambas võib kasutada mitte sorbeeruvat ja mitte lagundatavat polaarset võrdlusainet (nt triitium, bromiid, fluorestseiin, eosiin); see võib aidata ka kinnitada mullakolonni hüdrodünaamilisi omadusi.
|
|
13.
|
Mullasamba osades ja nõrgvees leitud muundumissaaduste kirjeldamiseks ja/või kindlakstegemiseks kromatograafiliste, spektroskoopiliste või muude asjakohaste meetoditega võivad olla kasulikud ka analüüsi võrdluskemikaalid.
|
MÕISTED JA ÜHIKUD
KVALITEEDIKRITEERIUMID
Saagis
|
15.
|
Mullasamba osades ja kolonni nõrgvees leitud uuritava kemikaali protsendimäärade summa annab leostumiskatse saagise. Saagis peaks olema vahemikus 90–110 % märgistatud kemikaalide puhul (11) ja 70–110 % märgiseta kemikaalide puhul (8).
|
Analüüsimeetodi korratavus ja tundlikkus
|
16.
|
Uuritava kemikaali ja muundumissaaduste koguste määramise meetodi korratavust saab kontrollida nii, et ühte ja sama mullasamba osa või nõrgvett analüüsitakse kaks korda (vt punkt 11).
|
|
17.
|
Uuritava kemikaali ja muundumissaaduste igas mullasamba osas või nõrgvees määramise analüütilise meetodi avastamispiir peaks olema vähemalt 0,01 mg/kg (uuritava kemikaalina) või 0,5 % lisatud kogusest igas mullasamba osas, olenevalt sellest, kumb on madalam. Kvantitatiivse koguse määramispiir tuleks samuti määrata.
|
KATSEMEETODI KIRJELDUS
Katsesüsteem
|
18.
|
Katse tegemiseks kasutatakse leostumise uurimise kolonni (osadeks jagatavat või mitte), mis on valmistatud sobivast inertsest materjalist (nt klaas, roostevaba teras, alumiinium, teflon, polüvinüülkloriid jne), mille siseläbimõõt on vähemalt 4 cm ja kõrgus vähemalt 35 cm. Tuleks uurida kolonni materjali selles suhtes, ega sel ei ole mingit koostoimet uuritava kemikaali ega selle muundumissaadustega. Mõned näited osadeks jagatava ja mittejagatava kolonni kohta on esitatud 2. liites.
|
|
19.
|
Mullatäidise panemiseks kolonni kasutatakse lusikat, varbkolbi ja vibratsiooniseadet.
|
|
20.
|
Mullakolonni niisutamiseks kunstliku vihmaga kasutatakse kolb- või peristaltilist pumpa, dušiotsikut, Mariotte'i pudelit või lihtsat tilklehtrit.
|
Laboriseadmed ja kemikaalid
|
21.
|
Vaja on harilikku laborivarustust, eeskätt järgmisi vahendeid:
|
(1)
|
analüüsiseadmed, nagu GLC-, HPLC- ja TLC-seadmed, kaasa arvatud vajalikud detekteerimisseadmed radioaktiivse märgisega ja märgiseta kemikaalide määramiseks või pööratud isotooplahjendusmeetodi kasutamiseks;
|
|
(2)
|
seadmed identifitseerimise jaoks (nt MS, GC-MS, HPLC-MS, TMR jne);
|
|
(3)
|
vedelik-stsintillatsiooniloendaja radioaktiivse märgisega uuritava kemikaali puhul;
|
|
(4)
|
oksüdeerija märgisega materjali põletamiseks;
|
|
(5)
|
ekstraheerimisseade (nt tsentrifuugiküvetid külmekstraheerimiseks ja Soxhlet'i seade pidevekstraheerimiseks tagasijooksuga);
|
|
(6)
|
seadmed lahuste ja ekstraktide kontsentreerimiseks (nt rotaatoraurusti).
|
|
|
22.
|
Kasutatavad kemikaalid hõlmavad järgmist: orgaanilised lahustid, analüütiliselt puhtad, nt atsetoon, metanool jt; stsintillatsioonivedelik; 0,01 M CaCl2 lahus destilleeritud või deioniseeritud vees (nn kunstlik vihm).
|
Uuritav kemikaal
|
23.
|
Mullakolonnile kandmiseks tuleks uuritav kemikaal lahustada deioniseeritud või destilleeritud vees. Kui uuritav kemikaal on vees halvasti lahustuv, võib seda kolonnile kanda valmistootena (vajaduse korral pärast vees suspendeerimist või emulgeerimist) või mõnes orgaanilises lahustis. Kui kasutatakse orgaanilist lahustit, peaks selle kogus olema minimaalne ning see tuleks mulla pinnalt aurustada enne kolonni voolutamise algust. Tahked tooted nagu graanulid tuleks kolonnile kanda tahkel kujul ilma veeta; toodet võib enne kasutamist segada väikse koguse (nt 1 g) kvartsliivaga, et tagada selle ühtlasem jaotumine mullakolonni pinnal.
|
|
24.
|
Uuritava kemikaali kogus mullakolonnis peaks olema piisav, et võimaldada kindlaks teha vähemalt 0,5 % kasutatud kogusest igas mullasamba osas. Taimekaitsevahendite toimeainete puhul võib lähtuda soovitatavast kasutamismäärast (üks kasutuskogus) ning nii lähteühendi kui ka vanandatud ühendi leostamine peab olema vastavuses kasutatava mullakolonni pindalaga (55).
|
Võrdluskemikaal
|
25.
|
Leostumiskatse tegemisel tuleks kasutada võrdluskemikaali (vt punkt 12). See tuleks kanda mullakolonni pinnale samal viisil kui uuritav kemikaal ja sobival määral, mis võimaldab seda korralikult tuvastada kas samas mullakolonnis koos uuritava kemikaaliga kasutatava sisestandardina või eraldi kolonnis. Eelistada tuleb mõlema kemikaali voolutamist samas kolonnis, välja arvatud juhul, kui kemikaalid on sarnase märgisega.
|
Mullad
Muldade valimine
|
26.
|
Leostumisuuringutes tuleks ühe uuritava lähtekemikaali puhul kasutada 3–4 mulda, millel on erinev pH, orgaanilise süsiniku sisaldus ja tekstuur (12). Juhised leostumiskatsete jaoks muldade valimiseks on esitatud tabelis 1. Ioniseeritava uuritava aine puhul peavad väljavalitud mullad hõlmama laia pH-vahemikku, et oleks võimalik hinnata aine liikuvust ioniseeritud ja ioniseerimata vormis; vähemalt kolme mulla pH peaks olema selline, mille juures uuritav kemikaal on liikuvas vormis.
Tabel 1.
Leostumisuuringute jaoks muldade valimise juhend
|
Mulla nr
|
pH
|
Orgaaniline süsinik
%
|
Savisisaldus
%
|
Tekstuur (56)
|
|
1
|
> 7,5
|
3,5–5,0
|
20–40
|
raske liivsavi
|
|
2
|
5,5–7,0
|
1,5–3,0
|
15–25
|
tolmjas liivsavi
|
|
3
|
4,0–5,5
|
3,0–4,0
|
15–30
|
keskmine liivsavi
|
|
4
|
< 4,0–6,0 (57)
|
< 0,5–1,5 (57)
(58)
|
< 10–15 (57)
|
saviliiv
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
saviliiv/liiv
|
|
|
27.
|
Mõnikord võib olla vaja uurida muid mullatüüpe, mis esindaksid jaheda või parasvöötme kliimaga või troopilisi piirkondi. Seepärast juhul, kui eelistatakse teisi mullatüüpe, tuleks neid iseloomustada samade parameetritega ja neil peaks olema samalaadne omaduste varieeruvus, nagu on kirjeldatud leostumiskatsete jaoks muldade valimise juhistes (vt tabel 1), isegi kui need mullad ei vasta täpselt nendele kriteeriumidele.
|
|
28.
|
Leostumiskatse tegemisel vanandatud jääkidega tuleks kasutada ühte mulda (12). Selle liivasisaldus peaks olema > 70 % ja orgaanilise süsiniku sisaldus vahemikus 0,5–1,5 % (nt muld nr 4 tabelis 1). Suurema arvu mullatüüpide kasutamine võib olla vajalik siis, kui teave muundumissaaduste kohta on oluline.
|
|
29.
|
Kõiki muldasid tuleks iseloomustada vähemalt nende tekstuuri (liiva-, tolmu- ja saviprotsent vastavalt FAO ja USDA klassifikatsioonile (14)), pH, katioonivahetusvõime, orgaanilise süsiniku sisalduse, mulla lasuvustiheduse (häiritud muld) ja veemahutavuse järgi. Mikroobide biomassi mõõtmine on nõutav ainult sellise mulla puhul, mida kasutatakse vanandamis-/inkubeerimisaja jooksul enne leostumiskatse tegemist vanandatud uuritava ainega. Täiendav teave mulla omaduste kohta (nt mulla klassifikatsioon, savi mineraloogia, eripind) võib olla kasulik katse tulemuste tõlgendamise puhul. Mulla omaduste määramiseks saab kasutada viidetes (15, 16, 17, 18, 19) soovitatud meetodeid.
|
Muldade kogumine ja säilitamine
|
30.
|
Muld tuleks võtta ülemisest kihist (A-horisondist) kuni 20 cm sügavuselt. Taimestiku ja makrofauna jäägid ning kivid tuleks eemaldada. Mullad (välja arvatud uuritava kemikaali vanandamiseks kasutatavad mullad) kuivatatakse õhu käes toatemperatuuril (eelistatavalt vahemikus 20–25 °C). Kogused tuleks murendada võimalikult ettevaatlikult, nii et mulla struktuur muutuks võimalikult vähe. Muld sõelutakse läbi sõela avaga ≤ 2 mm. Soovitatakse hoolikat homogeniseerimist, sest see suurendab tulemuste korratavust. Enne kasutamist võib mulda hoida toatemperatuuril ja õhu käes kuivatatuna (12). Säilitamisaega ei piirata, kuid üle kolme aasta säilitatud mulda tuleks enne kasutamist uuesti analüüsida orgaanilise süsiniku sisalduse ja pH suhtes.
|
|
31.
|
Üksikasjalik teave mullaproovide kogumiskoha ajaloo kohta peaks olema kättesaadav. Üksikasjad hõlmavad järgmist: täpne asukoht [näidatakse täpselt vastavalt UTM-ile (Universal Transversal Mercator-Projection/European Horizontal Datum) või geograafiliste koordinaatide abil], taimkate, töötlemine põllukultuure kaitsvate kemikaalidega, väetamine orgaaniliste ja anorgaaniliste väetistega, bioloogiliste materjalide lisamine või juhuslik saastumine (12). Kui mulda on juba töödeldud uuritava ainega või selle struktuursete analoogidega viimase nelja aasta jooksul, ei tuleks seda leostumisuuringus kasutada.
|
Katsetingimused
|
32.
|
Katse ajal tuleks mullaga leostumiskolonne hoida pimedas toatemperatuuril, kui see temperatuur püsib vahemikus ± 2 °C. Soovitatavad temperatuurid on vahemikus 18–25 °C.
|
|
33.
|
Kunstlikku vihma (0,01 M CaCl2) tuleks lisada pidevalt mullasamba pinnale kiirusega 200 mm 48 tunni jooksul (60); See kiirus vastab 251 ml lahuse lisamisele, kui kolonni siseläbimõõt on 4 cm. Kui katse eesmärk seda nõuab, võib lisaks kasutada muid kunstliku vihma kiirusi ja pikemat katse kestust,
|
Katse käik
Uuritava lähtekemikaali leostumine
|
34.
|
Vähemalt kaks leostumiskolonni täidetakse töötlemata, õhu käes kuivatatud ja sõelutud (< 2 mm) mullaga kuni kõrguseni ligikaudu 30 cm. Ühtlase täitmise saavutamiseks lisatakse mulda kolonni väikeste portsjonitena ja surutakse kokku varbkolviga; samas vibreeritakse kolonni kergelt, kuni kolonni ülemine kiht rohkem enam kokku ei vaju. Ühetaoline täitmine on vajalik selleks, et leostumiskolonnidega saada korratavaid tulemusi. Kolonni täitmise tehnika kohta vt viited (20, 21 ja 22). Kolonni täitmise korratavuse kontrollimiseks mõõdetakse kolonni pandud mulla kogumass (61); paralleelkolonnide massid peaksid olema sarnased.
|
|
35.
|
Pärast täitmist kolonnid eelniisutatakse kunstliku vihmaveega (0,01 M CaCl2 lahus) altpoolt ülespoole, et asendada õhk mulla poorides veega. Seejärel lastakse mullakolonnidel tasakaalustuda ja liigne vesi vajub raskusjõu toimel välja. Vt ülevaade kolonni küllastamismeetoditest, viide (23).
|
|
36.
|
Seejärel kantakse mullakolonnile uuritav kemikaal ja/või võrdluskemikaal (vt ka punktid 23–25). Ühtlase jaotuse saamiseks kantakse uuritava kemikaali ja/või võrdluskemikaali lahused, suspensioonid või emulsioonid ühtlaselt kogu mullasamba pinnale. Kui uuritava kemikaali pealekandmiseks on soovitatud selle segamist mulda, tuleks kemikaal segada väikse koguse (nt 20 g) mullaga ja kanda see mullasamba pinnale.
|
|
37.
|
Mullasamba pind kaetakse seejärel paagutatud klaasfiltriketta, klaashelmeste, klaaskiudfiltri või filterpaberikettaga, et jaotada kunstlikku vihma ühtlaselt üle kogu kolonni pinna ja vältida mullapinna häirimist vihmatilkadega. Mida suurem on kolonni läbimõõt, seda hoolikam tuleb olla kunstliku vihma kolonnile juhtimisega, et tagada vihma ühtlane jaotumine kogu kolonni pinnal. Seejärel lisatakse mullakolonnidele kunstlikku vihma tilkhaaval kolb- või peristaltilise pumba või tilklehtri abil. Eelistatavalt tuleks nõrgvett koguda fraktsioonidena ja märkida üles nende kogused (62).
|
|
38.
|
Pärast kolonnide voolutamist ja nõrguda laskmist jagatakse kolonnid nõutavaks arvuks osadeks, olenevalt sellest, millist teavet tahetakse katsega saada, osasid ekstraheeritakse sobivate lahustite või lahustisegudega ja määratakse nendes uuritav aine või vajaduse korral muundumissaadused, üldradioaktiivsus ja võrdlusaine. Nõrgvett või nõrgveefraktsioone analüüsitakse otse või pärast ekstraheerimist, et määrata nendes samad ained. Kui kasutatakse radioaktiivse märgisega uuritavat kemikaali, tuleb määrata kõik fraktsioonid, mis sisaldavad ≥ 10 % kolonnile kantud radioaktiivsusest.
|
Vanandatud jääkide leostumine
|
39.
|
Värskele mullale (mida ei ole eelnevalt õhu käes kuivatatud) lisatakse radioaktiivse märgisega uuritavat kemikaali sellises koguses, mis vastab mullakolonni pindalale (vt punkt 24), ja inkubeeritakse aeroobsetes tingimustes vastavalt katsemeetodile C.23 (13). Inkubeerimise (vanandamise) aeg peaks olema piisavalt pikk, et tekiks olulisel määral muundumissaadusi; uuritava kemikaali soovitatav vanandamisaeg on selle kemikaali üks poolestusaeg, (63) kuid mitte üle 120 päeva. Enne leostamist määratakse vanandatud mullas uuritava kemikaali ja selle muundumissaaduste sisaldus.
|
|
40.
|
Leostumiskolonnid täidetakse kuni 28 cm kõrguseni samasuguse (kuid õhu käes kuivatatud) mullaga, mida kasutati punktis 34 kirjeldatud vanandamise katses, ja määratakse täidisega mullakolonni kogumass. Seejärel mullakolonnid eelniisutatakse, nagu on kirjeldatud punktis 35.
|
|
41.
|
Seejärel kantakse mullakolonni pinnale 2 cm paksuse kihina vanandatud mulla jääkidena uuritav kemikaal ja selle jäägid (muundumissaadused) (vt punkt 39). Mullakolonni maksimaalne kõrgus (töötlemata muld pluss vanandatud muld) ei tohiks eelistatavalt olla üle 30 cm (vt punkt 34).
|
|
42.
|
Leostumiskatse tehakse vastavalt punktis 37 esitatud kirjeldusele.
|
|
43.
|
Pärast leostumist määratakse mullasamba osades ja nõrgvees vastavalt punktis 38 esitatud kirjeldusele uuritav kemikaal, selle muundumissaadused ja ekstraheerumata radioaktiivsus. Selleks et määrata, kui suur osa vanandamisjääkidest jääb pärast leostumist 2 cm paksusesse pinnakihti, tuleks see mullasamba osa analüüsida eraldi.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Tulemuste töötlemine
|
44.
|
Iga mullasambaosa ja nõrgveefraktsiooni kohta tuleks esitada uuritava kemikaali, muundumissaaduste, ekstraheerumatute ainete ja, kui lisati, võrdluskemikaali kogused protsentidena pealekantud annusest. Iga kolonni kohta esitatakse graafiliselt nende protsendimäärad funktsioonina mullasamba sügavusest.
|
|
45.
|
Kui kolonniga leostumise uuringus lisatakse ka võrdlusaine, saab uuritava kemikaali leostumist hinnata suhtelises skaalas, kasutades suhtelisi liikuvustegureid (relative mobility factor, RMF; määratlus vt 3. liide) (1, 11), mis võimaldab võrrelda mitmesuguste kemikaalide leostumisandmeid, mis on saadud erinevate mullatüüpidega. Mitmete taimekaitsevahendite RMFi väärtuste näited on esitatud 3. lisas.
|
|
46.
|
Kolonnist leostumise katsega võib hinnata ka Koc (orgaanilise süsiniku normeeritud adsorptsioonikoefitsiendi) ja Kom (orgaanilise süsiniku normeeritud jaotuskoefitsiendi) väärtusi, kui kasutada keskmisi leostumisvahemaid või leitud korrelatsioone RMFi ja KOM või KOC vahel (4) või lihtsat kromatograafiateooriat (24). Siiski tuleks viimast meetodit kasutada ettevaatusega, arvestades eelkõige, et leostumisprotsessis ei ole küllastunud voolamise tingimusi, pigem on tegu küllastumata süsteemidega.
|
Tulemuste tõlgendamine
|
47.
|
Käesolevas meetodis kirjeldatud kolonnis leostumise uuringud võimaldavad määrata uuritava kemikaali (lähteaine) ja/või selle muundumissaaduste (vanandatud jääkide) leostumist või liikuvust mullas. Need katsed ei võimalda kvantitatiivselt prognoosida leostumist välitingimustes, kuid neid võib kasutada selleks, et võrrelda ühe kemikaali „leostuvust” muude kemikaalide omaga, mille leostumiskäitumine võib olla teada (24). Samuti ei mõõdeta nende katsetega kvantitatiivselt uuritava kemikaali protsentuaalset kogust, mis võib jõuda põhjavette (11). Siiski võib kolonnis leostumise katse tulemus aidata otsustada, kas on vaja täiendavaid välioludele lähendatud või välikatseid kemikaalide puhul, mis on laborikatsetes näidanud suurt liikuvusvõimet.
|
Katseprotokoll
|
48.
|
Katseprotokollis tuleb esitada järgmine:
|
|
Uuritav kemikaal ja võrdluskemikaal (kui seda kasutatakse):
|
—
|
tavanimetus, keemiline nimetus (IUPACi ja CASi nomenklatuur), CASi number, keemiline struktuur (milles on näidatud märgise asukoht, kui kasutatakse radioaktiivse märgisega materjali) ja olulised füüsikalis-keemilised omadused;
|
|
—
|
uuritava kemikaali puhtus (lisandid).
|
|
—
|
märgisega kemikaalide radiokeemiline puhtusaste ja eriaktiivsus (vajaduse korral).
|
|
|
|
Katsemullad:
|
—
|
üksikasjalikud andmed kogumiskoha koha;
|
|
—
|
mulla omadused, nt pH, orgaanilise süsiniku ja savi sisaldus, tekstuur ja lasuvustihedus (häiritud mulla korral);
|
|
—
|
mulla mikroobne aktiivsus (ainult mulla puhul, mida kasutatakse uuritava kemikaali vanandamiseks);
|
|
—
|
mullaproovide säilitamise kestus ja tingimused.
|
|
|
|
Katsetingimused:
|
—
|
leostumiskolonnide pikkus ja läbimõõt;
|
|
—
|
mullakolonnides oleva mulla üldmass;
|
|
—
|
uuritava kemikaali ja vajaduse korral võrdluskemikaali kogus;
|
|
—
|
kunstliku vihma kogus, vihmutamise sagedus ja kestus;
|
|
—
|
katsesüsteemi temperatuur;
|
|
—
|
paralleelkatsete arv (vähemalt kaks);
|
|
—
|
meetodid uuritava kemikaali, muundumissaaduste ja vajaduse korral võrdluskemikaali määramiseks mullasamba osades ja nõrgvees;
|
|
—
|
meetodid uuritava kemikaali ja muundumissaaduste kindlakstegemiseks ja iseloomustamiseks mullasamba osades ja nõrgvees.
|
|
|
|
Katsetulemused:
|
—
|
tulemused tabeli kujul, väljendatuna kontsentratsioonidena ja protsendina lähteannusest mullasamba osades ja nõrgvees;
|
|
—
|
massibilanss, kui see on asjakohane;
|
|
—
|
leostumisvahemaad ja, kui see on asjakohane, suhtelised liikuvustegurid;
|
|
—
|
graafik, milline % leiti mullasamba osas funktsioonina osa sügavusest;
|
|
—
|
tulemuste arutelu ja tõlgendamine.
|
|
|
KIRJANDUS
|
(1)
|
Guth, J.A., Burkhard, N. and Eberle, D.O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
(2)
|
Russel, M.H. (1995). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals – T.R. Roberts and P.C. Kearney, Eds.). J. Wiley & Sons.
|
|
(3)
|
Briggs, G.G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J.Agric. Food Chem. 29, 1050-1059.
|
|
(4)
|
Chiou, C.T., Porter, P.E. and Schmedding, D.W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227-231.
|
|
(5)
|
Guth, J.A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26-33.
|
|
(6)
|
US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(7)
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
(8)
|
Komisjoni direktiiv 95/36/EÜ, 14. juuli 1995, millega muudetakse nõukogu direktiivi 91/414/EMÜ taimekaitsevahendite turuleviimise kohta, I lisa, EÜT L 172, 22.7.1995, lk 8.
|
|
(9)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in sou, water and air.
|
|
(10)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
(11)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
(12)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995.
|
|
(13)
|
Käesoleva lisa järgmised peatükid:
|
|
Peatükk A.6. Lahustuvus vees
|
|
|
Peatükk A.8. Jaotustegur. Loksutamismeetod
|
|
|
Peatükk A.24 Jaotuskoefitsient, HPLC meetod
|
|
|
Peatükk C.7. Lagunemine – abiootiline lagunemine: hüdrolüüsi sõltuvus pHst
|
|
|
Peatükk C.18. Adsorptsioon/desorptsioon, kasutades partii tasakaalustamise meetodit
|
|
|
Peatükk C.23. Aeroobne ja anaeroobne transformatsioon mullas
|
|
|
(14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
|
|
(15)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods (A. Klute, Ed.). Agronomy Series No. 9, 2nd Edition.
|
|
(16)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A.L. Page, R.H. Miller and D.R. Kelney, Eds.). Agronomy Series No. 9, 2nd Edition.
|
|
(17)
|
ISO Standard Compendium Environment (1994). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
|
|
(18)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
(19)
|
Scheffer, F. and Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(20)
|
Weber, J.B. and Peeper, T.F. (1977). In Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, 73-78.
|
|
(21)
|
Weber, J.B., Swain, L.R., Strek, H.J. and Sartori, J.L. (1986). In Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, 190-200.
|
|
(22)
|
Oliveira, et al. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): 49-53.
|
|
(23)
|
Shackelford, C. D. (1991). Laboratory diffusion testing for waste disposal. – A review. J. Contam. Hydrol. 7, 177-217.
|
|
(24)
|
(Hamaker, J.W. (1975). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V.H. Freed, Eds), 115-133. Plenum Press, New York.
|
|
(25)
|
OECD (1981). Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112, OECD, Paris
|
1. liide
Mõisted ja ühikud
Jäägid vanandatud mullas
– uuritav kemikaal ja muundumissaadused pinnases pärast kemikaali pinnasesse kandmist ja aega, mis on olnud piisavalt pikk kemikaali liikumise, adsorptsiooni, metaboliseerimise ja hajumise jaoks, mis on muutnud kemikaali jaotumist ja keemilist olemust (1).
Kunstlik vihm
– 0,01 M CaCl2 lahus destilleeritud või deioniseeritud vees.
Keskmine leostumisvahemaa
– selle mullasambaosa põhi, milles summaarne taasleitud kemikaalisisaldus on 50 % taasleitud kemikaali üldsisaldusest [tavaline leostumiskatse], või (selle mullasambaosa põhi, milles summaarne taasleitud kemikaalisisaldus on 50 % taasleitud kemikaali üldsisaldusest) – ((vanandatud jääkidega pinnasekihi paksus)/2) [vanandatud jääkide leostumise katse].
Kemikaal
– aine või segu.
Nõrgvesi
– veefaas, mis on läbinud mullaprofiili või mullakolonni (1).
Leostumine
– protsess, mille käigus kemikaal liigub allapoole läbi mullaprofiili või mullakolonni (1).
Leostumisvahemaa
– sügavaim mullasambaosa, milles pärast leostumisprotsessi leiti ≥ 0,5 % pealekantud uuritavast kemikaalist või vanandatud jääkidest (sama kui sissetungimise sügavus).
Avastamispiir ja määramispiir
– avastamispiir on kemikaali kontsentratsioon, millest madalamal väärtusel ei saa kemikaali identsust tõendavat signaali eristada analüüsi artefaktidest. Määramispiir on kemikaali kontsentratsioon, millest madalamal väärtusel ei saa kontsentratsiooni määrata nõutava täpsusega.
Suhteline liikuvustegur (RMF)
– (uuritava kemikaali leostumisvahemaa (cm)) / (võrdluskemikaali leostumisvahemaa (cm))
Uuritav kemikaal
– iga aine või segu, mida uuritakse käesoleva katsemeetodi abil
Muundumissaadus
– iga kemikaal, mis on tekkinud uuritava kemikaali biootiliste või abiootiliste muundumisreaktsioonide tulemusel, kaasa arvatud CO2 ja saadused, mis on seotud jääkides.
Muld
– mineraalsete ja orgaaniliste keemiliste koostisainete segu; orgaanilised koostisained sisaldavad suure süsiniku- ja lämmastikusisalduse ning suure molekulmassiga ühendeid, milles elavad väiksed (enamasti mikro-)organismid. Mulla puhul võib eristada kahte olekut:
|
—
|
looduspärane, nagu see on aja jooksul tekkinud, mitmesuguste mullatüüpide iseloomulike kihtidega;
|
|
—
|
häiritud, nagu see tavaliselt esineb haritavatel aladel või labidaga kaevatud proovides, mis on võetud käesoleva katsemeetodi kohaste katsete tegemiseks (2).
|
|
(1)
|
Holland, P.T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, 1167-1193.
|
|
(2)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981).
|
2. liide
Joonis 1.
Osadeks mitte lahtivõetava klaasist leostumiskolonni näidis;
pikkus 35 cm, siseläbimõõt 5 cm (1)

|
(1)
|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden – 70 Jahre Agrarforschung der BASF AG, 225-236. Verlag Wissenschaft und Politik, Köln.
|
Joonis 2.
Osadeks lahtivõetava metallkolonni näidis; kolonni siseläbimõõt on 4 cm (1)

|
(1)
|
Burkhard, N., Eberle D.O. and Guth, J.A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203-213.
|
3. liide
Suhtelise liikuvusteguri (RMF)
(64)
näiteid eri taimekaitsevahendite puhul (1, 2) ja vastavad liikuvusklassid
(66)
|
RMFi vahemik
|
Kemikaal (RMF)
|
Liikuvusklass
|
|
≤ 0,15
|
Paratioon (< 0,15), flurodifeen (0,15)
|
I
liikumatu
|
|
0,15–0,8
|
Profenofoss (0,18), propikonasool (0,23), diasinoon (0,28), diuroon (0,38), terbutüülasiin (0,52), metidatioon (0,56), prometriin (0,59), propasiin (0,64), alakloor (0,66), metolakloor (0,68)
|
II
veidi liikuv
|
|
0,8–1,3
|
Monuroon (65) (1,00), atrasiin (1,03), simasiin (1,04), fluometuroon (1,18)
|
III
mõõdukalt liikuv
|
|
1,3–2,5
|
Prometoon (1,67), tsüanasiin (1,85), bromatsiil (1,91), karbutilaat (1,98)
|
IV
suhteliselt liikuv
|
|
2,5–5,0
|
Karbofuraan (3,00), dioksakarb (4,33)
|
V
liikuv
|
|
> 5,0
|
Monokrotofoss (> 5,0), dikrotofoss (> 5,0)
|
VI
väga liikuv
|
|
(1)
|
Guth, J.A. (1985). Adsorption/desorption. In Joint International Symposium „Physicochemical Properties and their Role in Environmental Hazard Assessment.” Canterbury, UK, 1-3 July 1985.
|
|
(2)
|
Guth, J.A. and Hörmann, W.D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91-106.
|
|
(3)
|
Harris, C.I. (1967). Movement of herbicides in soil. Weeds 15, 214-216.
|
|
(4)
|
Helling, C.S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, 743-748.
|
|
(5)
|
McCall, P.J., Laskowski, D.A., Swann, R.L. and Dishburger, H.J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
(6)
|
Hollis, J.M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, 165-174.
|
C.45. PUIDUKONSERVANDIGA TÖÖDELDUD PUIDUST KESKKONDA ERALDUVATE HEITKOGUSTE MÄÄRAMINE. LABORATOORNE MEETOD HEITE MÄÄRAMISEKS KATMATA PUIDUST, MIS ON KOKKUPUUTES MAGEVEE VÕI MEREVEEGA
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga nr 313 (2007). Puidukonservandiga töödeldud puidust keskkonda eralduvat heidet on vaja mõõta, et oleks võimalik hinnata töödeldud puidu keskkonnariske. Käesolevas juhendis kirjeldatakse laborimeetodit heite hindamiseks töödeldud puidust kahes olukorras, kus heide võib sattuda keskkonda:
|
—
|
heide töödeldud puidust, mis on kokkupuutes mageveega. Töödeldud puidu pinnalt võib puidukonservant sattuda vette;
|
|
—
|
heide töödeldud puidust, mis on kokkupuutes mereveega. Töödeldud puidu pinnalt võib puidukonservant sattuda merevette.
|
|
|
2.
|
Käesoleva katsemeetodi eesmärk on uurida heidet puidust ja puitesemetest, mis ei ole muu materjaliga kaetud ja on kokkupuutes magevee või mereveega. Kasutamisklasse kasutatakse rahvusvaheliselt selleks, et kategoriseerida bioloogilisi ohte, millega puutub kokku töödeldud puitese. Kasutamisklassid võimaldavad määratleda samuti olukorda, milles kasutatakse töödeldud puitesemeid, ja keskkonna osi (õhk, vesi, pinnas), mida puidukonservandiga töödeldud puit võib ohustada.
|
|
3.
|
Käesolev katsemeetod on laborimeetod, milles töödeldud puiduga kokkupuutes olevast veest (heitekeskkonnast) võetakse üha pikema kokkupuute ajavahemiku järel proove. Heite kogus heitekeskkonnas on seotud puiteseme pindala ja kokkupuute kestusega, millest saab hinnata heitevoogu ühikutes mg/m2/päev. Niimoodi saab hinnata heitevoogu (leostumiskiirust) pärast pikemaid kokkupuuteaegu.
|
|
4.
|
Heite kogust võib kasutada töödeldud puidu keskkonnariski hindamiseks.
|
LÄHTEKAALUTLUSED
|
5.
|
Eeldatakse, et puidu pinnalt konservandi leostumise mehhanism ja intensiivsus ei tarvitse olla magevees samasugune kui merevees. Seega on puidu töötlemiseks kasutatavate konservantide ja segude puhul, mida kasutatakse merevee keskkonnas oleva puidu puhul, vaja uurida leostumist merevees.
|
|
6.
|
Puit, mida on töödeldud puidukonservandiga, peab kaubanduslikult kättesaadava puidu suhtes olema esindav. See peaks olema töödeldud vastavalt konservandi tootja juhistele, asjakohastele normidele ja spetsifikatsioonidele. Puit peab pärast töötlemist ja enne katse algust olema konditsioneeritud; tuleb teatada selle konditsioneerimise tingimused.
|
|
7.
|
Kasutatavad puidu näidised peavad olema kaubanduslike toodete suhtes esindavad (nt puidu liik, tihedus ja muud omadused).
|
|
8.
|
Katset võib kasutada puidu puhul, mida on töödeldud immutamisega või millele konservant on pinnale kantud, samuti töödeldud puidu puhul, mille pinda on kohustuslikus korras täiendavalt töödeldud (näiteks värvitud kaubandusliku kasutuse puhul nõutavas korras).
|
|
9.
|
Vee koostis, kogus, pH ja füüsikaline olek on olulised puidust leostuva heite koguse, sisalduse ja laadi määramiseks.
|
KATSEMEETODI PÕHIMÕTE
|
10.
|
Puidukonservandiga töödeldud katsekehad sukeldatakse vette. Kokkupuuteaja jooksul võetakse mitmesuguste ajavahemike järel nii palju proove veest (heitekeskkond) ja analüüsitakse neid, et piisaks statistiliste arvutuste tegemiseks. Analüüsitulemustest arvutatakse heite kiirus ühikutes mg/m2/päev. Proovivõtuajad tuleks registreerida. Katse töötlemata näidistega võib lõpetada, kui esimese kolme andmepunkti puhul ei leita mingit tausta.
|
|
11.
|
Töötlemata puidunäidiste lisamine katsesse võimaldab määrata ka muude heiteainete kui kasutatud puidukonservantide heite taustkontsentratsioonid.
|
KVALITEEDIKRITEERIUMID
Täpsus
|
12.
|
Heite hindamise meetodi täpsus sõltub analüüsitavatest tootenäidistest – kuivõrd hästi esindavad need kaubanduslikku töödeldud puitu, sellest, kuivõrd hästi esindab vesi tegelikku vett ja kokkupuuterežiim – tegelikke looduslikke tingimusi.
|
|
13.
|
Analüüsimeetodi mõõtetäpsus, kordustäpsus ja korratavus tuleks määrata enne katse tegemist.
|
Korratavus
|
14.
|
Võetakse kolm proovi veest, analüüsitakse need ja leitakse heite väärtuse keskväärtus. Tulemuste korratavus ühes laboris ja eri laborites sõltub immutamisrežiimist ja puidust, mida kasutatakse katsekehade valmistamiseks.
|
Tulemuste lubatav vahemik
|
15.
|
Vastuvõetav on tulemuste vahemik, milles kõrgeimad ja madalaimad tulemused erinevad vähem kui üks suurusjärk.
|
KATSETINGIMUSED
Vesi
|
16.
|
Magedasse vette leostumise stsenaariumid: Puidust magedasse vette leostumise uurimiseks soovitatakse kasutada deioniseeritud vett (nt ASTM D 1193 tüüp II). Vee temperatuur peab olema 20 ± 2 °C ning mõõdetud pH ja temperatuur registreeritakse katseprotokollis. Veeproovidest, mis on võetud enne töödeldud puidu katsekehade viimist vette, saab määrata analüüsitavate kemikaalide (taust-)sisalduse vees. See on kontroll, millega määratakse analüüsitavate kemikaalide taustnivoo.
|
|
17.
|
Merevette leostumise stsenaariumid: Puidust merevette leostumise uurimiseks soovitatakse kasutada sünteetilist merevett (nt ASTM D 1141 asendusmerevesi ilma raskmetallideta). Vee temperatuur peab olema 20 ± 2 °C ning mõõdetud pH ja temperatuur registreeritakse katseprotokollis. Veeproovidest, mis on võetud enne töödeldud puidu katsekehade viimist vette, saab määrata analüüsitavate kemikaalide sisalduse vees. Tegemist on analüüsi kontrollkatsega, millega määratakse oluliste kemikaalide taustsisaldus.
|
Puidust katsekehad
|
18.
|
Puuliik peab olema tüüpiline selliste puuliikide jaoks, mida kasutatakse puidukonservantide tõhususe kontrollimiseks. Soovitatavad liigid on Pinus sylvestris L. (harilik mänd), Pinus resinosa Ait. (vaigumänd) või Pinus spp (lõunamänd). Täiendavaid katseid võib teha muude liikidega.
|
|
19.
|
Kasutada tuleks sirge süüga puitu, milles ei oleks oksakohti. Vaiguse välimusega materjali tuleks vältida. Puit peab olema kaubanduslikult kättesaadava puidu jaoks esindav. Protokolli tuleks kanda puidu allikas, tihedus ja aastaringide tihedus 10 mm kohta.
|
|
20.
|
Puitkatsekehade komplektiks soovitatakse võtta viis standardile EN 113 vastava suurusega klotsi (mõõtmed 25 mm × 50 mm × 15 mm), kus pikikülg on paralleelne süüga, kuigi võib kasutada ka muude mõõtmetega katsekehasid, näiteks 50 mm × 150 mm × 10 mm. Katsekehad tuleb täielikult sukeldada vette. Katsekehad peaksid 100 % ulatuses koosnema maltspuidust. Iga katsekeha on märgistatud nii, et seda oleks võimalik kindlaks teha kogu katse jooksul.
|
|
21.
|
Kõik katsekehad peaksid olema hööveldatud või saetud ja pinnad ei tohi olla lihvitud.
|
|
22.
|
Puitkatsekehasid võetakse analüüsi tegemiseks vähemalt viis komplekti: kolm katsekehade komplekti töödeldakse puidukonservandiga, üks komplekt on töötlemata ja üht komplekt kasutatakse selleks, et hinnata katsekehade niiskusesisaldust pärast ahjus kuivatamist ja enne töötlemist. Valmistatakse ette piisav arv katsekehasid, et nendest saaks valida kolm katsekehakomplekti, milles seotud puidukonservandi kogused oleksid keskväärtuse suhtes 5 % vahemikus.
|
|
23.
|
Kõikide katsekehade otsad on kaetud (suletud) kemikaaliga, mis ei lase puidukonservandil imbuda katsekeha otsast puusüü sisse ega lase konservandil leostuda katsekeha otsa süü kaudu. Otsa sulgeva vahendi pealekandmisel on vaja eristada katsekehasid, millele konservant kantakse pinnale, katsekehadest, millesse konservandil lastakse sisse imbuda. Otsa sulgev vahend tuleb katsekehale kanda enne töötlemist puidukonservandiga ainult juhul, kui konservant kantakse pinnale.
|
|
24.
|
Katsekeha otsa süü peab olema avatud, kui töötlemisel lastakse konservandil imbuda puidu sisse. Seepärast tuleb selliste katsekehade otsad sulgeda alles konditsioneerimisperioodi lõpus. Hinnatakse üksnes heidet, mis toimub läbi pikisüülise pinna. Suletud otsi katvat kihti tuleks kontrollida ja vajaduse korral see uuesti peale kanda, enne kui alustatakse leostumist; seda ei tohiks uuesti peale kanda pärast leostumise alustamist.
|
Mahuti katsekehade sukeldamiseks
|
25.
|
Mahuti on tehtud inertsest materjalist ja on piisavalt suur, et mahutada viis EN113 mõõdus puitkatsekeha 500 ml vees, mille pindala suhe mahusse on 0,4 cm2/ml.
|
Katsekehade hoidja
|
26.
|
Katsekehade komplekt pannakse hoidjale, mis võimaldab katsekehade kõigil avatud pindadel olla kokkupuutes veega.
|
PUIDUKONSERVANDIGA TÖÖTLEMISE KÄIK
Töödeldud katsekehade ettevalmistamine
|
27.
|
Puitkatsekeha töödeldakse uuritava konservandiga vastavalt kõnealuse toote puhul ettenähtud töötlemismeetodile, mis võib olla konservandiga immutamisel põhinev protsess või katsekeha pinnale kandmine kas tootesse kastmise, toote pihustamise või pintsliga pealekandmise abil.
|
Konservandid, millega töötlemine põhineb puidu immutamisel
|
28.
|
Valmistatakse konservandi lahus, millega immutamise tulemusel saavutatakse toote ettenähtud sidumine või peetumine puidus. Puitkatsekeha kaalutakse ja võetakse selle mõõdud. Immutamine peab toimuma vastavalt puidu konservandiga töötlemise kirjeldusele kasutusklassi 4 või 5 puhul. Katsekeha kaalutakse uuesti pärast töötlemist ja konservandi peetumine (kg/m3) puidus arvutatakse järgmise valemi abil:

|
|
29.
|
Katses võib kasutada ka tööstuslikult (nt vaakuumsurveimmutuse meetodiga) töödeldud puitu. Kõik toimingud tuleb registreerida protokollis ning konservandi peetumine sellel viisil töödeldud puidus tuleb välja selgitada ja kanda protokolli.
|
Konservandid, millega töötlemine põhineb toote kandmisel puidu pinnale
|
30.
|
Puitkatsekehade pinna töötlemine hõlmab tootesse kastmist, toote pihustamist või kandmist katsekeha pinnale pintsli abil. Katsekeha töötlemise meetod ja pealekandmise määr (nt l/m2) peab vastama kõnealuse konservandiga pinna töötlemise eeskirjale.
|
|
31.
|
Katses võib kasutada ka tööstuslikult töödeldud puitu. Kõik toimingud tuleb registreerida protokollis ning konservandi peetumine sellel viisil töödeldud puidul tuleb välja selgitada ja kanda protokolli.
|
Katsekehade konditsioneerimine pärast töötlemist
|
32.
|
Pärast töötlemist tuleb töödeldud katsekehad konditsioneerida vastavalt konservandi tarnija soovitustele, mis on esitatud uuritava konservandi märgisel, vastavalt tööstusliku töötlemise tavadele või vastavalt standardile EN 252.
|
Katsekehade ettevalmistamine ja valimine
|
33.
|
Pärast konditsioneerimist arvutatakse katsekehade rühma kohta keskmine konservandi peetumine ning valitakse leostumiskatseks juhuslikkuse alusel kolm esindavat katsekehakomplekti, milles peetumise väärtused erinevad rühma keskväärtusest kuni 5 %.
|
KONSERVANDI HEITE MÕÕTMISE KÄIK
Sukeldamismeetod
|
34.
|
Katsekehad kaalutakse ja sukeldatakse seejärel täielikult vette; märgitakse üles selle kuupäev ja kellaaeg. Nõu kaetakse, et vähendada aurumist.
|
|
35.
|
Vett vahetatakse järgmistel aegadel: 6 tundi, 1 päev, 2 päeva, 4 päeva, 8 päeva, 15 päeva, 22 päeva, 29 päeva pärast katse algust. Märgitakse üles iga veevahetuse kuupäev ja kellaaeg ning nõust saadud vee mass.
|
|
36.
|
Pärast iga veevahetust võetakse veest, millesse katsekehade komplekt on olnud sukeldatud, proov hilisema keemilise analüüsi jaoks.
|
|
37.
|
Proovide võtmise kord võimaldab arvutada heite koguse sõltuvuse ajast. Proove tuleks hoida tingimustes, milles uuritav aine hästi säilib, näiteks külmkapis pimeduses, et vähendada proovis mikroobide kasvu enne analüüsi.
|
HEITE MÕÕTMISED
Töödeldud proovid
|
38.
|
Võetud veeproove analüüsitakse keemiliselt toimeaine ja/või selle lagunemis- või muundumissaaduste määramiseks, kui see on asjakohane.
|
Töötlemata katsekehad
|
39.
|
Vee (heitekeskkonna) kogumine selles süsteemis ja töötlemata puiduproovidest leostunud kemikaalide hilisem määramine võimaldab hinnata konservandi võimaliku heite kiirust töötlemata puidust. Heitekeskkonna proovide kogumine pärast üha pikenevat kokkupuuteaega ja analüüsimine võimaldavad hinnata heitekiiruse sõltuvust ajast. Kõnealuse analüüsi tegemine on kontrollmeetod töötlemata puidus oleva uuritava kemikaali tausttaseme määramiseks; sellega tõendatakse, et katsekehade allikana kasutatud puitu ei ole varem konservandiga töödeldud.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Keemilised analüüsid
|
40.
|
Kogutud veeproove analüüsitakse keemiliselt ja veeanalüüsi tulemused väljendatakse asjakohastes ühikutes, näiteks μg/l.
|
Andmete esitamine
|
41.
|
Kõik tulemused registreeritakse. Liites on esitatud soovitatud registreerimisvormi näide ühe töödeldud katsekehade komplekti jaoks ja kokkuvõtlik tabel heite keskväärtuste arvutamiseks iga proovivõtuajavahemiku puhul.
|
|
42.
|
Päevane heitevoog mg/m2/päev arvutatakse nii, et kolme paralleelkatse kolmest mõõtmisest võetakse keskväärtus ja jagatakse sukelduspäevade arvuga.
|
Katseprotokoll
|
43.
|
Katseprotokollis esitatakse vähemalt järgmine teave:
|
—
|
uuritava puidukonservandi tarnija nimi;
|
|
—
|
uuritava puidukonservandi konkreetne ja spetsiifiline nimi või kood;
|
|
—
|
konservandi toimeaine(te) kaubanduslik või tavanimetus koos komponentide üldise kirjeldusega (nt kaaslahusti, vaik) ja koostisega massiprotsentides;
|
|
—
|
asjakohane peetunud kogus või pealekandmise määr (vastavalt kg/m3 või l/m2) puidu kohta, mis on viidud kokkupuutesse veega;
|
|
—
|
kasutatud puiduliik, tihedus ja aastaringide arv 10 mm kohta;
|
|
—
|
uuritava puidukonservandi peetunud kogus või pealekandmise määr (l/m2 või kg/m3) ja selle arvutamiseks kasutatud valem;
|
|
—
|
konservandiga töötlemise meetod, milles on täpselt kirjeldatud puidu immutamise režiimi või pealekandmise meetodit, kui seda kasutati;
|
|
—
|
konservandiga töötlemise kuupäev ja puitkatsekehade hinnanguline niiskusesisaldus protsentides;
|
|
—
|
kasutatud konditsioneerimismeetod, täpsustades selle tüübi, tingimused ja kestuse;
|
|
—
|
puitkatsekeha otste sulgemise vahendi kirjeldus ja pealekandmiskordade arv;
|
|
—
|
iga järgnenud töötlemise kirjeldus, nt pealekantud värvi tarnija, värvi tüüp, omadused ja pealekandmise määr;
|
|
—
|
iga sukeldamise kohta alguse kuupäev ja kellaaeg, vee kogus, mida kasutati puitkatsekehade igal sukeldamisel, ja puidu poolt sukeldatud olekus sisseimatud vee kogus;
|
|
—
|
kõik kõrvalekalded kirjeldatud meetodist ja kõik asjaolud, mis võivad olla mõjutanud tulemusi.
|
|
KIRJANDUS
|
(1)
|
European Standard, EN 84 – 1997. Wood preservatives. Accelerated ageing of treated wood prior to biological testing. Leaching procedure.
|
|
(2)
|
European Standard, EN 113/A1 – 2004. Wood preservatives. Test method for determining the protective effectiveness against wood destroying basidiomycetes. Determination of the toxic values.
|
|
(3)
|
European Standard, EN 252 – 1989. Field test method for testing the relative protective effectiveness of a wood preservative in ground contact.
|
|
(4)
|
European Standard, EN 335 – Part 1: 2006. Durability of wood and wood-based products – Definition of use classes – Part1: General.
|
|
(5)
|
American Society for Testing and Materials Standards, ASTM D 1141 – 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
(6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II – 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
1. liide
Katsemeetodi tulemuste registreerimise vorm
Puidukonservandiga töödeldud puidust keskkonda toimuva heite hindamine. Laboratoorne meetod heite määramiseks katmata puidust, mis on kokkupuutes magevee või mereveega
|
Katse läbiviinud asutus
|
|
|
Puidukonservant
|
|
Konservandi tarnija
|
|
|
Puidukonservandi konkreetne ja spetsiifiline nimi või kood
|
|
|
Konservandi kaubanduslik või tavanimi
|
|
|
Muud koostisained
|
|
|
Asjakohane peetunud konservandi kogus veega kokkupuutesse viidud puidu kohta
|
|
|
Töötlemine
|
|
Pealekandmisviis
|
|
|
Pealekandmise kuupäev
|
|
|
Peetunud koguse arvutamiseks kasutatud valem:
|
|
|
Konditsioneerimisviis
|
|
|
Konditsioneerimise kestus
|
|
|
Otste sulgemiseks kasutatud vahend ja pealekandmiskordade arv
|
|
|
Edasine töötlemine
|
kui see on asjakohane
|
|
Katsekehad
|
|
Puiduliik
|
|
|
Puidu tihedus
|
(miinimum … keskväärtus … maksimum)
|
|
Kasvu kiirus (aastaringide arv 10 mm kohta)
|
(miinimum … keskväärtus … maksimum)
|
|
Niiskusesisaldus
|
|
|
Katsekehakomplektid
(67)
|
Peetunud kogus (nt kg/m3)
|
|
Töödeldud „x”
|
5 katsekeha keskväärtus ja standardhälve või vahemik
|
|
Töödeldud „y”
|
5 katsekeha keskväärtus ja standardhälve või vahemik
|
|
Töödeldud „z”
|
5 katsekeha keskväärtus ja standardhälve või vahemik
|
|
Töötlemata
|
|
|
Kõrvalekaldumised katsemeetodi näitajatest
|
nt vee kvaliteet, katsekehade mõõtmed jne
|
|
Aeg
|
Veevahetus
|
Katsekeha mass
|
Vee sidumine
|
Veeproov
|
|
Töödeldud (keskmine)
|
Töötlemata
|
Töödeldud (keskmine)
|
Töötlemata
|
|
Katses kasutatav vesi
|
x
|
y
|
z
|
|
|
Kuupäev
|
g
|
g
|
g
|
g
|
Nr
|
pH
|
pH
|
pH
|
pH
|
|
algus
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 tundi
|
|
|
|
|
|
1
|
|
|
|
|
|
24 tundi
|
|
|
|
|
|
2
|
|
|
|
|
|
2 päeva
|
|
|
|
|
|
3
|
|
|
|
|
|
4 päeva
|
|
|
|
|
|
4
|
|
|
|
|
|
8 päeva
|
|
|
|
|
|
5
|
|
|
|
|
|
15 päeva
|
|
|
|
|
|
6
|
|
|
|
|
|
22 päeva
|
|
|
|
|
|
7
|
|
|
|
|
|
29 päeva
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
Palun koostage eraldi tabelid iga toimeaine kohta
|
Aeg
|
Veevahetus
|
Analüüsitulemused:
|
|
Töötlemata katsekehad
|
Töödeldud katsekehad
|
|
Toimeaine kontsentratsioon vees
mg/l
|
Heite kogus
mg/m2
|
Leostumise kiirus
mg/m2/päev
|
Toimeaine kontsentratsioon vees
|
Heite kogus
|
Leostumise kiirus
|
|
x
|
y
|
z
|
Keskmine
|
x
|
y
|
z
|
Keskmine
|
x
|
y
|
z
|
Keskmine
|
|
|
Kuupäev
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/päev
|
mg/m2/päev
|
mg/m2/päev
|
mg/m2/päev
|
|
6 tundi
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 tundi
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 päeva
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 päeva
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 päeva
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 päeva
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 päeva
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 päeva
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Märkus: Kuna töötlemata katsekehade tulemusi võib olla vaja kasutada töödeldud katsekehade tulemuste parandamiseks, tuleks töötlemata katsekehade tulemused esitada esimesena ja kõik töödeldud katsekehadega saadud tulemused peaksid olema parandatud väärtused. Samuti võib olla vajalik kasutada esialgse vee analüüsist saadud parandit.
2. liide
Mõisted
Keemiline aine:
aine või segu
Uuritav kemikaal –
iga aine või segu, mida uuritakse käesoleva katsemeetodi abil
C.46. BIOAKUMULATSIOON PÕHJASETETES ELAVATES VÄHEHARJASUSSIDES
SISSEJUHATUS
|
1.
|
Käesolev katsemeetod on samaväärne OECD katsejuhendiga 315 (2008), milles käsitletakse põhjasetetes elavaid ja nendest toituvaid loomi, kes võivad kokku puutuda setetesse kogunevate ainetega (1). Selliste põhjasetetest toituvate loomade hulgas on oluline osa veekeskkonna väheharjasussidel, kes asuvad veekeskkonna süsteemide alumises otsas. Nad elavad setetes ja on sageli kõige levinum liik elupaikades, mille tingimused ei sobi muudele loomadele. Tänu setete bioturbatsioonile ja muude loomade söödaga varustamisele võib nendel loomadel olla suur mõju selliste ainete biokättesaadavuse tagamisel muude organismide, näiteks põhjaloomadest toituvate kalade jaoks. Vastupidiselt põhjasetete pinnal elavatele organismidele kaevuvad põhjasetetes elavad veekeskkonna väheharjasussid setetesse ja toituvad setteosakestest, mis on setete pinnast allpool. Seepärast puutuvad need organismid saasteainetega kokku mitmel viisil – otsese kontakti, saastunud setteosakeste, poorides oleva vee ja setet katva vee allaneelamise kaudu. Mõnd põhjasetetes elavate väheharjasusside liiki, keda praegu ökotoksikoloogilistes katsetes kasutatakse, on kirjeldatud 6. liites.
|
|
2.
|
Uuritava aine bioakumulatsiooni iseloomustavate näitajate hulka kuuluvad kõigepealt bioakumulatsioonitegur (bioaccumulation factor, BAF), settest omastamise kiiruskonstant (ks) ja eraldumise kiiruskonstant (ke). Nende näitajate üksikasjalikud määratlused on esitatud 1. liites.
|
|
3.
|
Ainete bioakumulatsioonivõime üldiseks hindamiseks ja setete pinnale või sisse kogunema kalduvate ainete bioakumulatsiooni uurimiseks oleks vaja seda keskkonnaosa iseloomustavat katsemeetodit (1, 2, 3, 4).
|
|
4.
|
Käesolev katsemeetod on kavandatud selleks, et hinnata end setetega siduvate ainete bioakumulatsiooni põhjasetetes elavatesse väheharjasussidesse. Setet rikastatakse uuritava ainega. Rikastatud sette kasutamisega soovitakse modelleerida saastunud setet.
|
|
5.
|
Käesolev meetod põhineb olemasolevatel sette mürgisuse ja bioakumulatsiooni katsemeetoditel (1, 4, 5, 6, 7, 8, 9). Muud kasulikud dokumendid on järgmised: rahvusvahelise seminari arutelu ja tulemused (11) ning rahvusvaheliste võrdluskatsete tulemused (12).
|
|
6.
|
Selle katsega uuritakse stabiilseid neutraalseid orgaanilisi aineid, mis seovad end setetega. Käesoleva meetodiga saab uurida ka end setetega siduvate stabiilsete metallorgaaniliste ühendite bioakumulatsiooni (12). Meetodit ei saa kasutada metallide ja muude mikroelementide puhul (11), kui ei muudeta katseplaani – substraadi ja vee ruumalasid ning arvatavasti ka koeproovi suurust.
|
EELTINGIMUS JA TEAVE UURITAVA AINE KOHTA
|
7.
|
Praeguseks on bioakumulatsiooni kohta kindlaks tehtud ainult mõned selged kvantitatiivsed struktuuri-aktiivsuse sõltuvused (Quantitative Structure-Activity Relationships, QSAR) (14). Kõige laialdasemalt kasutatav sõltuvus on stabiilsete orgaaniliste ainete bioakumulatsiooni ja biokontsentratsiooni ning nende lipofiilsuse vahel (mida väljendab oktanooli-vee jaotuskoefitsiendi logaritm (log Kow); mõiste vt 1. liide), mis on välja arendatud aine vee ja kala vahel jaotumise kirjeldamiseks. Ka sette kohta on kindlaks tehtud selliseid sõltuvusi (15, 16, 17, 18). Peamise kvantitatiivse struktuuri-aktiivsuse sõltuvusena võib log Kow-log BCFi sõltuvus (kus BCF on biokontsentratsiooni tegur) abiks olla end settega siduvate ainete bioakumulatsioonivõime esmasel hindamisel. Siiski võib bioakumulatsiooni tegurit mõjutada katseloomaks valitud organismide lipiidisisaldus ja sette orgaanilise süsiniku sisaldus. Seepärast võib ka orgaanilise süsiniku – vee jaotuskoefitsienti (Koc) kasutada olulise tegurina end settega siduvate orgaaniliste ainete bioakumulatsioonivõime määramisel.
|
|
8.
|
Käesolevat katset saab kasutada, kui tegemist on:
|
—
|
stabiilse orgaanilise ainega, mille log Kow väärtus on vahemikus 3,0–6,0 (5, 19), ja ka väga lipofiilse ainega, mille log Kow on suurem kui 6,0 (5);
|
|
—
|
selliste orgaaniliste ainete hulka kuuluva ühendiga, mille kalduvus elusorganismidesse kuhjuda on teada, nt pindaktiivsed ained või tugevasti adsorbeeruma kalduvad ained (nt kõrge Koc väärtus).
|
|
|
9.
|
Enne katse alustamist tuleks uuritava aine kohta koguda näiteks järgmine teave: ohutusabinõud, sobivad säilitamistingimused ja stabiilsus ning analüüsiks sobivad meetodid. Juhised selliste ainete uurimiseks, mille füüsikalis-keemilised omadused raskendavad katse tegemist, on esitatud publikatsioonides (20) ja (21). Enne, kui hakatakse uurima aine bioakumulatsiooni põhjasetetes elavatesse väheharjasussidesse, peaks uuritava aine kohta olemas olema järgmine teave:
|
—
|
tavanimetus, keemiline nimetus (eelistatavalt Rahvusvahelise Puhta ja Rakenduskeemia Liidu (IUPAC) nimetus), struktuurivalem, CASi registreerimisnumber, puhtus;
|
|
—
|
lahustuvus vees [katsemeetod A.6 (22) ];
|
|
—
|
oktanooli-vee jaotuskoefitsient Kow [katsemeetodid A.8, A.24 (22)];
|
|
—
|
sette-vee jaotuskoefitsient, mis on väljendatud Kd või Koc-na [katsemeetod C.19 (22)];
|
|
—
|
hüdrolüüs [katsemeetod C.7 (22);
|
|
—
|
fotokeemiline muundumine vees (23);
|
|
—
|
aururõhk [katsemeetod A.4 (22)];
|
|
—
|
kiire biolagunduvus [katsemeetodid C.4 ja C.29 (22)];
|
|
—
|
pindpinevus [katsemeetod A.5 (22)];
|
|
—
|
kriitiline mitsellimoodustumise kontsentratsioon (24).
|
Lisaks on asjakohane veel järgmine teave, kui see on leitav:
|
—
|
biolagunemine veekeskkonnas [katsemeetodid C.24 ja C.25 (22)];
|
|
|
10.
|
Radioaktiivse märgisega katseaine võib lihtsustada vee, sette ja bioloogiliste proovide analüüsi ning seda võib kasutada otsustamiseks, kas on vaja kindlaks teha ja mõõta ka lagunemissaadusi. Siinkirjeldatud meetod valideeriti rahvusvahelistes võrdluskatsetes (12), milles kasutati 14C-märgisega aineid. Kui mõõdetakse radioaktiivsete jääkide kogusisaldust, põhineb bioakumulatsioonitegur (BAF) lähteainel, hõlmates sealhulgas ka kõiki peetunud lagunemissaadusi. Samuti on võimalik kombineerida metabolismi uuringut bioakumuleerumise uuringuga; selleks analüüsitakse ja määratakse lähteaine ning selle lagunemissaaduste protsent proovidest, mis on võetud omastamisfaasi lõpus või bioakumulatsiooni haripunktis. Igal juhul on soovitatav, et bioakumulatsiooniteguri arvutamine põhineks lähteaine sisaldusel organismides ja mitte ainult radioaktiivsete jääkide kogusisaldusel.
|
|
11.
|
Lisaks uuritava aine omadustele on vaja teada veel tema mürgisust väheharjasussiliikidele, keda kasutatakse katses, näiteks mediaanset surmavat kontsentratsiooni (LC50) selle ajavahemiku jaoks, mis on vajalik omastamisperioodiks, et osata valida mürgisest tasemest oluliselt madalam kokkupuutekontsentratsioon. Andmete olemasolu korral tuleks eelistada subletaalsete näitajate pikaajaliste uuringutega saadud subletaalseid näitajaid (EC50). Kui sellised andmed ei ole kättesaadavad, võivad kasulikku teavet anda muude katseloomadega saadud mürgisusandmed või akuutse toksilisuse katse tingimustel, milles kavatsetakse uurida bioakumulatsiooni.
|
|
12.
|
Kättesaadav peab olema asjakohane teadaoleva täpsuse ja tundlikkusega analüüsimeetod aine kvantitatiivse sisalduse mõõtmiseks katselahustes, settes ja bioloogilises materjalis, samuti andmed proovi valmistamise ja säilitamise kohta ning materjali ohutuskaardid. Samuti peaksid teada olema uuritava aine analüütilised tuvastuspiirid vees, settes ja usside kudedes. Kui kasutatakse radioaktiivse märgisega uuritavat ainet, peaks olema teada eriradioaktiivsus (s.o Bq mol– 1), märgisega aatomi täpne asukoht ja lisanditega seotud radioaktiivsuse protsent. Uuritava aine eriradioaktiivsus peaks olema võimalikult suur, et tuvastada võimalikult väikseid uuritava aine kontsentratsioone (11).
|
|
13.
|
Kättesaadav peaks olema teave sette kohta, mida katses kasutatakse (nt sette või selle koostisosade päritolu, poorivee pH ja ammoniaagi kontsentratsioon (looduslikud setted), orgaanilise süsiniku sisaldus (TOC), osakeste suurusjaotus (liiva, tolmu ja savi % kuivainest) (6).
|
KATSE PÕHIMÕTE
|
14.
|
Katse koosneb kahest faasist: omastamise (kokkupuute) faas ja (aine) eraldumise (kokkupuutejärgne) faas. Omastamisfaasi ajal puutuvad ussid kokku uuritava ainega rikastatud settega, mille kohal on taastatud vesi ja mis on vajaduse korral tasakaalustatud (11). Usside kontrollrühmi hoitakse katseloomade puhul kasutatavatega identsetes tingimustes, aga ilma uuritava aineta.
|
|
15.
|
Eraldumisfaasi ajaks kantakse ussid üle sette ja vee süsteemi, milles ei ole uuritavat ainet. Eraldumisfaas on vajalik selleks, et saada teavet kiiruse kohta, millega uuritavat ainet katseorganismidest väljutatakse (19, 25). Eraldumisfaas on vajalik alati, välja arvatud juhul, kui kokkupuute ajal on uuritava aine omastamine tühiselt väike (näiteks kui uuritava aine kontsentratsioon katse- ja kontrollrühma ussides statistiliselt ei erine). Kui omastamisfaasi ajal statsionaarse olekuni ei jõuta, saab kineetilisi parameetreid (kineetiline bioakumulatsioonitegur BAFk, omastamise ja eraldumise kiiruskonstant/-konstandid) määrata eraldumisfaasi tulemuste kasutamisega. Uuritava aine kontsentratsiooni muutumist ussides/usside peal jälgitakse katse mõlema faasi ajal.
|
|
16.
|
Omastamisfaasi ajal tehakse mõõtmisi, kuni BAF on jõudnud platoole või statsionaarsesse olekusse. Vaikimisi peaks omastamisfaas kestma 28 päeva. Praktilised kogemused on näidanud, et 12–14-päevane omastamisfaas on paljude stabiilsete neutraalsete orgaaniliste ainete puhul piisav statsionaarse oleku saavutamiseks (6, 8, 9).
|
|
17.
|
Kui statsionaarse olekuni ei jõuta 28 päevaga, alustatakse eraldumisfaasi: uuritava ainega kokkupuutes olnud väheharjasussid kantakse üle sama keskkonnaga nõusse, mis aga ei sisalda uuritavat ainet. Eraldumisfaas lõpetatakse, kui uuritava kemikaali sisaldus ussides langeb 10 %-ni sellest, mis mõõdeti 28. päeval, või kui on möödunud kuni 10 päeva. Jääkide sisaldus ussides eraldumisfaasi lõpus (Non-eliminated residues, NER) on üks täiendavaid mõõdetavaid ja teatatavaid näitajaid. Bioakumulatsioonitegur (BAFss) arvutatakse eelistatult nii ussides leitud kontsentratsiooni (Ca) ja settes leitud kontsentratsiooni (Cs) suhtarvuna kui ka settest omastamise kiiruskonstandi (ks) ja eraldumise kiiruskonstandi (ke) suhtarvuna ehk kineetilise bioakumulatsioonitegurina (BAFK), eeldades esimest järku kineetikat. Kui statsionaarse olekuni ei jõuta 28 päeva jooksul, arvutatakse BAFK omastamise kiiruskonstandist ja eraldumise kiiruskonstandist. Arvutused vt 2. liide. Kui kineetika ei ole esimest järku, tuleks kasutada keerulisemaid mudeleid (2. liide ja viide 25).
|
|
18.
|
Kui statsionaarse olekuni ei jõuta 28 päevaga, võib omastamisperioodi soovi korral pikendada ja jätkata kokkupuutes olevate ussirühmade mõõtmisi, kuni saavutatakse statsionaarne olek; paralleelselt sellega tuleks omastamisfaasi 28. päeval siiski alustada eraldumisfaasi.
|
|
19.
|
Omastamise kiiruskonstant, eraldumise kiiruskonstant (või kiiruskonstandid, kui kasutatakse keerulisemaid mudeleid), kineetiline bioakumulatsioonitegur (BAFK) ja võimaluse korral iga nimetatud parameetri usalduspiirid arvutatakse teoreetilise mudeli võrranditest (vt mudelid, 2. liide). Mudeli sobivust katseandmetega saab hinnata korrelatsioonikordaja või determinatsioonikordaja järgi (kui kordaja läheneb 1-le, kirjeldab mudel katseandmeid hästi).
|
|
20.
|
Katsetulemuste varieeruvuse vähendamiseks väga lipofiilsete orgaaniliste ainete puhul tuleks bioakumulatsiooni tegurid täiendavalt esitada ka sõltuvusena katses kasutatavate organismide lipiidisisaldusest ja orgaanilise süsiniku üldsisaldusest (TOC) setetes (biota-sediment accumulation factor, BSAF), väljendatuna sette orgaanilise süsiniku kg usside lipiidisisalduse kg kohta. See lähenemisviis põhineb kogemustel ja veekeskkonna teoreetilistel korrelatsioonidel, kus teatavate keemiliste ainete klasside puhul on leitud selge seos aine bioakumuleerumisvõime ja lipofiilsuse vahel, mis on kindlaks tehtud kalade kui mudelorganismide abil (14, 25, 27). Kõnealuste ainete puhul jälgitav bioakumulatsioon sõltub ka katses kasutatud kalade lipiidisisaldusest. Põhjaorganismide puhul on leitud samalaadseid korrelatsioone (15, 16, 17, 18). Kui usside biomassi on piisavalt, saab katseloomade lipiidisisalduse määrata samast bioloogilisest materjalist, millest määrati uuritava aine kontsentratsioon. Siiski on lipiidisisalduse mõõtmiseks otstarbekas kasutada kohanenud kontroll-loomi vähemalt omastamisfaasi alguses või eelistatavalt lõpus, lipiidisisaldust saab seejärel kasutada bioakumulatsiooniteguri (BAF) normeerimiseks.
|
KATSE NÕUETEKOHASUS
|
21.
|
Katse on nõuetekohane järgmistel tingimustel:
|
—
|
usside kumulatiivne suremus (kontrollrühmas ja kokkupuuterühmas) kuni katse lõpuni ei tohiks ületada 20 % nende esialgsest arvust.
|
|
—
|
lisaks sellele tuleb tõendada, et ussid kaevuvad settesse, nii et kokkupuude oleks maksimaalne. Täpsemalt vt punkt 28.
|
|
MEETODI KIRJELDUS
Katses kasutatavad liigid
|
22.
|
Katse tegemiseks võib kasutada mitut veekeskkonna väheharjasusside liiki. Kõige sagedamini kasutatavad liigid on loetletud 6. liites.
|
|
23.
|
Mürgisuskatseid (96 tundi, üksnes vees) tuleks teha korrapäraste ajavahemike järel (nt kord kuus) võrdlusainega nagu kaaliumkloriid (KCl) või vasksulfaat (CuSO4) (1) selleks, et saada teavet katseloomade terviseseisundi kohta (1, 6). Kui kontroll-mürgisuskatset korrapäraste ajavahemike järel ei tehta, tuleks sette bioakumulatsiooni katses kasutatavate loomade partiid kontrollida võrdlusaine abil. Lipiidisisalduse määramine võib samuti anda kasulikku teavet loomade seisundi kohta.
|
Katses kasutatavate loomade kasvatamine
|
24.
|
Bioakumulatsiooni katsete tegemiseks piisava arvu usside saamiseks võib usse pidada labori alalises ühe-liigi-kultuuris. Valitud katseloomaliikide laboris kasvatamise meetodid on esitatud 6. liites. Üksikasjade kohta vt viited (8, 9, 10, 18, 28, 29, 30, 31, 32).
|
Seadmed
|
25.
|
Tuleks olla tähelepanelik, et vältida seadmete kõigis osades selliste materjalide kasutamist, mis võivad lahustuda, uuritavat ainet adsorbeerida või muid kemikaale eraldada ning avaldada katseloomadele kahjulikku mõju. Võib kasutada tavapäraseid ristkülikukujulisi või silindrilisi kambreid, mis on valmistatud keemiliselt inertsest materjalist ja on sobiva mahuga katseusside paigutamiseks vastavalt lubatud koormuse määrale. Tuleks vältida pehmest plastikust torude kasutamist vee ja õhu lisamiseks. Katse kasvukeskkonnaga kokkupuutuvates seadmetes tuleks kasutada polütetrafluoroetüleeni, roostevaba terast ja/või klaasi. Suure adsorptsioonikoefitsiendiga ainete korral (näiteks sünteetilised püretroidid) võib olla vaja kasutada silaanitud klaasi. Sellistel juhtudel tuleb seadmed pärast kasutamist ära visata (5). Radioaktiivse märgisega uuritava aine ja lenduva aine puhul tuleks olla hoolikas, et vältida uuritava aine väljapuhumist ja väljapuhutud uuritava aine kaotsiminekut. Tuleb kasutada püüdureid (nt sobiva absorbendiga klaasist gaasipesupudelit), mis peab kinni katsekambritest aurustunud jäägid (11).
|
Vesi
|
26.
|
Kattev vesi peab olema sellise kvaliteediga, mis tagab valitud katseloomaliigi ellujäämise aklimatsiooni- ja katseperioodide vältel, ilma et tekiks mingeid ebanormaalse välimuse või käitumise ilminguid. Katva veena katsete ajal ja ka usside laborikultuuris pidamisel soovitatakse kasutada taastatud vett vastavalt katsemeetodile C.1 (25). On näidatud, et sellises vees saavad mitmed katseliigid ellu jääda, kasvada ja paljuneda (8) ning seejuures on tagatud katse- ja kasvatustingimuste maksimaalne standardsus. Kasutatud vee kohta tuleks teatada vähemalt pH, elektrijuhtivus ja karedus. Kasulikku teavet peaks andma vee mikrosaasteainete määramine enne kasutamist (4. liide).
|
|
27.
|
Katseperioodi kestel peaks vesi olema konstantse kvaliteediga. Katva veekihi pH peaks olema vahemikus 6–9. Vee üldkaredus peaks katse alguses olema vahemikus 90–400 mg CaCO3 liitris (7). Kõnealuse taastatud vee pH ja kareduse vahemikud on esitatud katsemeetodis C.1 (25). Kui võib kahtlustada mingit vastastikust mõju karedust tekitavate ioonide ja uuritava aine vahel, tuleks kasutada väiksema karedusega vett. 4. liites on esitatud täiendavad kriteeriumid lahjendusvee vastuvõetavaks tunnistamiseks vastavalt OECD katsejuhendile 210 (34).
|
Sete
|
28.
|
Katses kasutatav sete peab olema sellise kvaliteediga, mis võimaldab katseorganismidel selles elada ja eelistatavalt paljuneda aklimatiseerumise ja katse ajavahemike vältel, ilma et neil tekiks ebatavalisi muutusi välimuses või ebatavalist käitumist. Ussid peaksid saama settesse kaevuda. Katseorganismide kaevumiskäitumine võib mõjutada kokkupuudet uuritava ainega ja seega BAFi väärtust. Seega tuleks jälgida sette vältimist katseloomade poolt ja nende kaevumiskäitumist, kui katva veekihi hägusus võimaldab vaatlusi, ning kanda vaatluste tulemused protokolli. Kontroll- ja kokkupuuterühmade ussid peaksid kaevuma settesse 24 tunni jooksul pärast nende lisamist katsenõudesse. Kui märgatakse, et ussid püsivalt settesse ei kaevu või väldivad setet (näiteks on selliseid usse üle 20 %, kui möödunud on üle poole omastamisfaasist), siis näitab see, et kas ei ole katsetingimused sobivad või ei ole katseloomad terved või põhjustab sellist käitumist uuritav aine. Sellisel juhul tuleks katse peatada ja seda tuleks korrata paremates tingimustes. Täiendavat teavet sette allaneelamise kohta saab publikatsioonides (35, 36) kirjeldatud meetoditest, milles täpsustatakse sette allaneelamist või osakeste valimist katseorganismide poolt. Kui seda on võimalik vaadelda, siis vähemalt sette allaneelamisele osutavate fekaaliterade olemasolu või puudumine sette pinnal tuleks registreerida ja seda tuleb arvesse võtta katse tulemuste tõlgendamisel, kuna see annab teavet usside ja uuritava aine kokkupuuteteede kohta.
|
|
29.
|
Katsetes ja usside laborikultuurides (5. liide) soovitatakse kasutada tehissetet, mis põhineb katsemeetodis C.8 (40) kirjeldatud tehismullal, kuna vajaliku kvaliteediga looduslik sete ei pruugi kogu aasta jooksul olla kättesaadav. Lisaks võib looduslikus settes olla oma fauna ja ka mikrosaasteained, mis võivad mõjutada katse tulemusi. Mitmed katseliigid jäävad tehissettes ellu, kasvavad ja paljunevad (8).
|
|
30.
|
Tehissette kohta esitatakse vähemalt järgmine teave: koostisosade päritolu, osakeste suurusjaotus (liiva, tolmu ja savi protsent), orgaanilise süsiniku üldsisaldus (TOC), veesisaldus ja pH. Redokspotentsiaal mõõdetakse vajaduse korral. Ent ka reostamata kohast pärit looduslikku setet võib kasutada nii katse tegemisel kui ka katseloomade kasvatamisel (1). Loodusliku sette kirjeldamisel tuleks esitada vähemalt järgmised andmed: päritolu (võtmise koht), pH, poorivee ammoniaagisisaldus, orgaanilise süsiniku üldsisaldus (TOC), osakeste suurusjaotus (liiva, tolmu ja savi protsent) ja veesisalduse protsent (6). Enne loodusliku sette rikastamist uuritava ainega on soovitatav seda seitsme päeva jooksul konditsioneerida samades tingimustes, mis valdavalt esinevad edasise katse käigus, kui eeldatakse ammoniaagi tekkimist. Selle konditsioneerimisperioodi lõpus tuleks kattev veekiht eemaldada ja ära visata. Sette või selle koostisosade mikrosaasteainete analüüsi tegemine enne kasutamist peaks andma kasulikku teavet.
|
Valmistamine
|
31.
|
Loodusliku sette käitlemist enne laboris kasutamist on kirjeldatud publikatsioonides (1, 6, 44). Tehissette valmistamist on kirjeldatud 5. liites.
|
Säilitamine
|
32.
|
Loodusliku sette säilitamisaeg laboris peaks olema võimalikult lühike. Ameerika Ühendriikide keskkonnakaitseagentuur soovitab (6) seda säilitada kuni 8 nädalat 4 ± 2 °C juures pimedas. Säilitamisnõus ei tohiks sette kohal olla vabaruumi. Soovitused tehissette säilitamiseks on esitatud 5. liites.
|
Uuritava aine lisamine
|
33.
|
Sete rikastatakse uuritava ainega. Rikastamisel kaetakse üks või mitu sette koostisosa uuritava ainega. Näiteks kvartsliiva või osa sellest (nt 10 g kvartsliiva katsenõu kohta) võib immutada sobivas lahustis lahustatud uuritava ainega; seejärel aurustatakse lahusti aeglaselt kuni kuivamiseni. Ainega kaetud komponendi saab seejärel segada niiske sette sisse. Sette valmistamisel tuleb arvesse võtta uuritava aine ja liiva segust pärit liiva, s.o sete tuleks siis valmistada väiksema liivakogusega (6).
|
|
34.
|
Kui kasutatakse looduslikku setet, võib uuritavat ainet lisada sette õhu käes kuivatatud osa rikastamise teel, nagu on kirjeldatud eespool tehissette puhul, või uuritava aine ja niiske sette segamisega, kasutades seejärel aurustamise etappi (kui kasutatakse lahustit). Sobivad lahustid märja sette rikastamisel on etanool, metanool, etüleenglükoolmonometüüleeter, etüleenglükooldimetüüleeter, dimetüülformamiid ja trietüleenglükool (5, 34). Sobiva lahusti valimisel peaksid peamised kriteeriumid olema lahusti mürgisus ja lenduvus ning uuritava aine lahustuvus valitud lahustis. Täiendavad juhised rikastamismeetodite kohta on esitatud publikatsioonis Environment Canada (1995) (41). Tuleks hoolitseda, et settele lisatud uuritav aine oleks settes põhjalikult ja ühtlaselt jaotatud. Rikastatud settest tuleks võtta mitu osaproovi ja teha nende analüüsid, et kontrollida uuritava aine kontsentratsiooni settes ja teha kindlaks, kuivõrd ühtlane on uuritava aine jaotus.
|
|
35.
|
Kui rikastatud sete koos katva veekihiga on valmistatud, on soovitatav lasta uuritaval ainel jaotuda settefaasi ja veefaasi vahel. Seda tuleks eelistatavalt teha katses kasutatavates temperatuuri- ja õhustustingimustes. Vajalik tasakaalustumisaeg sõltub settest ja ainest ning võib kesta tunde, päevi ja harvadel juhtudel isegi kuni mitu nädalat (4–5 nädalat) (28, 42). Käesolevas katses tasakaalu saabumist ei oodata, kuid soovitatav on jätta tasakaalustumiseks 48 tundi kuni 7 päeva. Olenevalt uuringu eesmärgist võib näiteks keskkonnatingimuste modelleerimisel rikastatud setet tasakaalustada või vanandada pikema aja jooksul (11).
|
KATSE KÄIK
Eelkatse
|
36.
|
Eelkatse on vajalik selleks, et optimeerida lõpliku katse tingimusi nagu uuritava aine kontsentratsioon(id), omastamis- ja eraldumisfaasi kestus. Eelkatse käigus tuleb jälgida usside käitumist, näiteks sette vältimist (st ussid põgenevad settest, mille põhjuseks võib olla uuritav aine ja/või sete ise), ja kõik tähelepanekud tuleks registreerida. Sette vältimist võib kasutada ka subletaalse näitajana eelkatses, mis võimaldab hinnata uuritava aine kontsentratsiooni või kontsentratsioonivahemikku, mida tuleb kasutada bioakumulatsiooni katses.
|
Kokkupuutetingimused
Omastamisfaasi kestus
|
37.
|
Katseorganismid puutuvad uuritava ainega kokku omastamisfaasi ajal. Esimene proov tuleks võtta vahemikus 4–24 tundi pärast omastamisfaasi algust. Omastamisfaasis tuleks katset jätkata, kuni on möödunud 28 päeva (1, 6, 11) või kuni saab tõendada, et juba varem on püstitunud tasakaal. Statsionaarne olek on saabunud siis, kui: i) kõigil proovivõtuaegadel on bioakumulatsiooniteguri ajast sõltuvuse graafik paralleelne ajateljega; ii) vähemalt kahepäevase vahega võetud proovidest määratud kolm järjestikust BAF väärtust erinevad üksteisest vähem kui ± 20 %; ning iii) statistiline analüüs (nt dispersioonanalüüs ja regressioonianalüüs) näitab, et kolme proovivõtuajavahemiku proovide analüüsivastustes ei ole olulisi erinevusi. Kui 28 päevaga statsionaarse olekuni ei jõuta, võib omastamisperioodi lõpetada ja alustada eraldumisfaasi; BAFK saab arvutada omastamise ja eraldumise kiiruskonstantidest (vt ka punktid 16–18).
|
Eraldumisfaasi kestus
|
38.
|
Esimene proov tuleks võtta 4–24 tundi pärast eraldumisfaasi algust, kuna alguses võib jääkide sisaldus kudedes kiiresti muutuda. Eraldumisfaas on soovitatav lõpetada, kui uuritava aine kontsentratsioon on alla 10 % statsionaarse oleku kontsentratsioonist või pärast kuni 10 päeva. Jääkide sisaldus ussides eraldumisfaasi lõpus kantakse protokolli kui eraldumatud jäägid; see on teisene otsitav näitaja. Eraldumisfaasi pikkus võib olla piiratud ajavahemikuga, mille kestel uuritava aine kontsentratsioon ussides jääb veel ülespoole analüütilisest määramispiirist.
|
Katseloomad
Katses kasutatavate usside arv
|
39.
|
Usside arv proovi kohta peab olema piisavalt suur, et tagada sellise usside koemassi olemasolu, milles uuritava aine mass omastamisfaasi alguses ja eraldumisfaasi lõpus oleks oluliselt suurem uuritava aine avastamispiirist bioloogilistes materjalides. Omastamisfaasi ja eraldumisfaasi nimetatud etappides on uuritava aine kontsentratsioon tavaliselt suhteliselt väike (6, 8, 18). Kuna paljude veekeskkonna väheharjasussiliikide üksikisendi mass on väga väike (märgmass on Lumbriculus variegatus'e ja Tubifex tubifex'i puhul 5–10 mg), võib konkreetse katsekambri ussid koondada üheks prooviks kaalumise ja uuritava aine määramise jaoks. Suurema üksikisendi massiga katseliikide (nt Branchiura sowerbyi) puhul võib kasutada ühest isendist koosnevaid paralleelkatseid, kuid sellisel tuleks paralleelkatsete arv suurendada viieni iga proovivõtukorra kohta (11). Tuleb siiski märkida, et B. sowerbyi'd ei olnud laboritevahelise võrdlusuuringu (12) liikide hulgas, ja seepärast ei saa seda soovitada meetodi puhul eelistatava liigina.
|
|
40.
|
Tuleks kasutada ühesuguse suurusega usse (L. variegatus'e kohta vt 6. liide). Ussid peaksid olema pärit ühest allikast ja tegemist peaks olema ühe vanuseklassi täiskasvanud või suurte loomadega (vt 6. liide). Looma mass ja vanus võivad oluliselt mõjutada BAFi väärtust (näiteks erineva lipiidisisalduse ja/või munade olemasolu tõttu); need näitajad tuleks korralikult registreerida. Usside keskmise märg- ja kuivmassi mõõtmiseks tuleks enne katse algust kaaluda usside osaproov.
|
|
41.
|
Tubifex tubifex'i ja Lumbriculus variegatus'e puhul tuleb eeldada paljunemist katse ajal. Kui bioakumulatsiooni katse ajal paljunemist ei toimu, tuleks see registreerida ja seda tuleks arvestada katse tulemuste tõlgendamisel.
|
Usside panemine katsesse
|
42.
|
Tuleks kasutada suurt sette/usside ja vee/usside suhtarvu, et viia uuritava aine kontsentratsiooni vähenemine omastamisfaasi ajal miinimumini ja vältida lahustunud hapniku kontsentratsiooni vähenemist. Valitud koormusnorm peaks vastama ka valitud liigi looduslikule asustustihedusele (43). Näiteks Tubifex tubifex'i puhul soovitatakse koormusnormi 1–4 mg usside kudet (märgmass) 1 grammi märja sette kohta (8, 11). Viidetes (1) ja (6) soovitatakse L. variegatus'e puhul koormusnormi ≤ g usside koe kuivmassi sette 50 g orgaanilise süsiniku kohta.
|
|
43.
|
Katses kasutatavad ussid eemaldatakse nende kasvunõust selles oleva sette sõelumisega. Loomad (täiskasvanud suured isendid, kellel ei ole hiljutise jagunemise märke) viiakse üle klaasnõudesse (nt Petri tassid), milles on puhas vesi. Kui katsetingimused erinevad kultuuri kasvutingimustest, peaks ussidele piisama 24 tunni pikkusest aklimatiseerumisfaasist. Enne kaalumist tuleks liigne vesi usside küljest kõrvaldada. Selleks pannakse ussid ettevaatlikult eelnevalt niisutatud pehmele paberile. Usse ei soovitata kuivatada kuivatuspaberiga, kuna see võiks tekitada neil stressi või vigastusi. Brunson et al. (1998) soovitavad kasutada kuivaks tupsutamata usse, kelle mass on umbes 1,33 korda suurem kui vajalik biomass. Need täiendavad 33 % on erinevus kuivaks tupsutatud ja tupsutamata usside massi vahel (28).
|
|
44.
|
Omastamisfaasi alguses (katse 0-päev) võetakse ussid aklimatisatsioonikambrist ja jaotatakse juhuslikkuse alusel nõudesse (nt Petri tassidele), milles on taastatud vesi; usse lisatakse tassidele kahekaupa, kuni igal tassil on kümme ussi. Iga kõnealuse rühma ussid viiakse juhuslikkuse alusel üle eraldi katsenõudesse, nt pehmete teraspintsettide abil. Katsenõusid inkubeeritakse seejärel katse tingimustes.
|
Söötmine
|
45.
|
Arvestades tehissette vähest toitainesisaldust tuleks settele lisada söödaallikas. Selleks et katseorganismide kokkupuudet mitte alahinnata, näiteks neile saastamata sööda valikulise manustamise tõttu, tuleb katseloomade paljunemiseks ja kasvuks vajalik sööt lisada settesse üks kord enne uuritava kemikaali lisamist või selle lisamise ajal (vt 5. liide).
|
Sette/vee suhtarv
|
46.
|
Soovitatav sette/vee suhtarv on 1:4 (45). Sellist suhtarvu peetakse sobivaks, et hoida hapniku kontsentratsioon vajalikul tasemel ja vältida ammoniaagi teket katvas veekihis. Hapnikusisaldus katvas veekihis peaks pidevalt olema ≥ 40 % küllastuskontsentratsioonist. Katvat veekihti tuleks ettevaatlikult aereerida (nt 2–4 mulli sekundis) Pasteuri pipetiga, mis on paigutatud ligikaudu 2 cm kõrgusele sette pinnast, et setet võimalikult vähe häirida.
|
Valgus ja temperatuur
|
47.
|
Nii kasvatamisel kui ka katses on valgustusperiood 16 tundi (1, 6). Valguse intensiivsus katse piirkonnas peaks olema umbes 500–1 000 luksi. Temperatuur peaks olema kogu katse vältel 20 ± 2 °C.
|
Uuritava kemikaali kontsentratsioonid
|
48.
|
Omastamise kineetika mõõtmiseks kasutatakse üht võimalikult väikest kontsentratsiooni, kuid võib kasutada veel ka teist, kõrgemat kontsentratsiooni (vt näiteks (46)). Sel juhul võetakse proovid pärast 28 päeva või statsionaarse oleku saabumist ja analüüsitakse neid, et kinnitada madalama kontsentratsiooni juures mõõdetud bioakumulatsioonitegurit (11). Suurem kontsentratsioon peaks olema valitud nii, et saab välistada kahjuliku toime (nt ligikaudu 1 % madalaimast teadaolevast kroonilise mürgisuse kontsentratsioonist ECx, mis on saadud asjakohasest kroonilise mürgisuse katsest). Madalam uuritav kontsentratsioon peaks olema oluliselt suurem kui kasutatava analüüsimeetodi avastamispiir settes ja bioloogilistes proovides. Kui uuritava kemikaali toimet avaldav kontsentratsioon on analüütilise tuvastuspiiri lähedal, on soovitatav kasutada radioaktiivse märgisega uuritavat kemikaali, millel on suur eriradioaktiivsus.
|
Ainega kokkupuute katsete ja kontrollkatsete paralleelkatsed
|
49.
|
Kineetika mõõtmiseks tuleb nii omastamis- kui ka eraldumisfaasi jooksul teha vähemalt kolm paralleelset ainega kokkupuute katset iga proovivõtupunkti kohta (11). Kui tahetakse võtta täiendavaid proove katse ajal, tuleks teha ka täiendavaid paralleelkatseid. Eraldumisfaasi jaoks valmistatakse ette sobiv arv paralleelkatseid rikastamata settega ja katva veega, nii et ainega kokkupuutunud ussid saab omastamisperioodi lõpus viia ettenähtud kontsentratsiooniga nõudest rikastamata nõudesse. Ainega kokkupuutumise paralleelkatsete arv peaks olema piisav nii omastamisfaasi kui ka eraldumisfaasi jaoks.
|
|
50.
|
Teise võimalusena võib eraldumisfaasi ajal proovide võtmiseks ettenähtud ussid panna ühte suurde nõusse, milles on sama partii rikastatud sete kui see, mida kasutatakse omastamise kineetika määramiseks. Tuleks näidata, et katse tingimused (näiteks sette sügavus, sette ja vee suhtarv, koormus, temperatuur ja vee kvaliteet) on võrreldavad omastamisfaasi puhul kasutatavate paralleelkatsete tingimustega. Omastamisfaasi lõpus tuleks sellest nõust võtta vee, setete ja usside proovid analüüsi tegemiseks ning piisav arv suuri usse, kellel ei ole hiljutise jagunemise märke, tuleks hoolikalt välja võtta ja kanda üle eraldumisfaasi jaoks ettevalmistatud paralleelkatsetesse (nt kümme katselooma igasse paralleelkatsenõusse).
|
|
51.
|
Kui peale vee ei kasutata muud lahustit, tuleks bioloogiliste ja taustanalüüside jaoks ette näha vähemalt 9 negatiivse kontrolli paralleelkatset (vähemalt 3 võetakse proovideks alguses, 3 omastamisfaasi lõpus ja 3 eraldumisfaasi lõpus). Kui uuritava kemikaali lisamiseks kasutatakse solubiliseerivat vahendit, tuleks lisaks uuritava ainega tehtavatele paralleelkatsetele teha ka lahusti kontrollrühma paralleelkatse (vähemalt 3 võetakse proovideks alguses, 3 omastamisfaasi lõpus ja 3 eraldumisfaasi lõpus). Sel juhul tuleks ette näha negatiivne (ilma lahustita) kontrollrühm nelja täiendava paralleelkatsega proovide võtmiseks omastamisfaasi lõpus. Neid paralleelkatseid võib võrrelda bioloogiliselt lahusti kontrollrühmaga, et saada teavet lahusti võimaliku mõju kohta katseorganismile. Üksikasjad on esitatud 3. liites.
|
Vee kvaliteedi mõõtmise sagedus
|
52.
|
Katvas veekihis tuleks omastamisfaasi ja eraldumisfaasi ajal määrata vähemalt järgmised vee kvaliteedi näitajad:
|
temperatuur
|
ühes nõus iga kontsentratsioonitaseme ja iga proovivõtukuupäeva kohta ja ühes kontrollnõus üks kord nädalas ning omastamisfaasi ja eraldumisfaasi alguses ja lõpus; ümbritseva keskkonna (katseruumi või vesivanni) temperatuuri või temperatuuri ühes esindavas katsenõus võib registreerida ka pidevalt või iga tunni tagant;
|
|
lahustunud hapniku sisaldus
|
ühes nõus iga kontsentratsioonitaseme kohta ja ühes kontrollnõus iga proovivõtukuupäeva kohta; väljendatakse ühikutes mg/l ja protsendina õhuga küllastumisel saadud väärtusest (air saturation value, ASV);
|
|
õhu juurdevool
|
kontrollitakse vähemalt üks kord (töö-)päeva jooksul ja reguleeritakse vajaduse korral;
|
|
pH
|
ühes nõus iga kontsentratsioonitaseme ja iga proovivõtukuupäeva kohta ja ühes kontrollnõus üks kord nädalas ning omastamisfaasi ja eraldumisfaasi alguses ja lõpus;
|
|
vee üldkaredus
|
vähemalt ühes uuritava ainega nõus ja ühes kontrollnõus omastamisfaasi ja eraldumisfaasi alguses ja lõpus, väljendatakse CaCO3 milligrammidena liitris;
|
|
ammoniaagi üldsisaldus
|
vähemalt ühes uuritava ainega nõus ja ühes kontrollnõus omastamisfaasi ja eraldumisfaasi alguses ja lõpus; väljendatakse NH4
+, NH3 või üldlämmastiku milligrammidena liitris.
|
|
Usside, sette ja vee proovide võtmine ja analüüsimine
Proovivõtu ajakava
|
53.
|
28-päevase omastamisfaasi ja 10-päevase eraldumisfaasi proovivõtu ajakavade näidised on esitatud 3. liites.
|
|
54.
|
Katsekambritest võetakse vee- ja setteproov, et määrata uuritava aine kontsentratsioon enne usside lisamist ning omastamisfaasi ja eraldumisfaasi ajal. Katse ajal määratakse uuritava aine kontsentratsioonid ussides, settes ja vees, et jälgida uuritava aine jaotumist katsesüsteemi osades.
|
|
55.
|
Usside, sette ja vee proovid võetakse vähemalt kuuel korral nii omastamisfaasi kui ka eraldumisfaasi ajal.
|
|
56.
|
Jätkake proovide võtmist kuni platoo (statsionaarse oleku) saabumiseni (vt 1. liide) või 28 päeva jooksul. Kui 28 päevaga ei ole platooni jõutud, alustage eraldumisfaasi. Eraldumisfaasi alustamiseks kandke selleks määratud ussid paralleelkatse kambritesse, milles on rikastamata sete ja vesi (vt ka punktid 17 ja 18).
|
Proovi võtmine ja proovi ettevalmistamine
|
57.
|
Dekanteerimise, sifooni või pipeti abil võetakse veest proovid, mille maht on piisav uuritava aine koguse määramiseks proovis.
|
|
58.
|
Ülejäänud veekiht eemaldatakse katsekambritest hoolikalt dekanteerimise või sifooni abil. Sette proovid tuleks võtta ettevaatlikult, et usse võimalikult vähe häirida.
|
|
59.
|
Eemaldage proovivõtmise ajaks paralleelkatsenõust kõik ussid, näiteks nii, et suspendeerite sette katvas veekihis ja kallate iga paralleelkatse laia madalasse nõusse, millelt saab ussid ära korjata pehmete teraspintsettidega. Loputage neid kiiresti veega madalas klaas- või terasnõus. Eemaldage liigne vesi. Tõstke ussid ettevaatlikult eelnevalt kaalutud nõusse ja kaaluge nad. Surmake ussid külmutamise teel (nt ≤ – 18 °C). Registreerida tuleks kookonite ja/või noorjärkude olemasolu ja arv.
|
|
60.
|
Üldiselt tuleks ussid pärast proovi võtmist otsekohe kaaluda ja surmata, ootamata soolestiku tühjendamise faasi, et saada konservatiivne BAF, mis hõlmab ka saastatud soolesisaldist, ning hoida ära kehajääkide kaod, mis võiksid tekkida soolestiku tühjendamisel üksnes vees (8). Aine puhul, mille log Kow on suurem kui 5, ei ole aine eraldumine soolestiku tühjendamise aja jooksul üksnes vees tõenäoline, samas kui aine puhul, mille log Kow on väiksem kui 4, võivad kaod olla olulised (47).
|
|
61.
|
Eraldumisfaasi ajal tühjendavad ussid oma soolestiku puhtasse settesse. See tähendab, et mõõtmistel vahetult enne eraldumisfaasi hõlmavad tulemused ka soolestikus olevat saastunud setet, kuid pärast eraldumisfaasi esimese 4–24 tunni möödumist on enamik soolestiku saastunud sisust asendatud puhta settega (11, 47). Sellises proovis võib kontsentratsiooni ussides käsitada kontsentratsioonina usside kudedes pärast soolestiku tühjendamist. Saastamata settest tingitud uuritava aine kontsentratsiooni lahjenemise arvessevõtmiseks eraldumisfaasis võib hinnata soolesisu massi selliste suhtarvudega nagu usside märgmass / usside tuha mass või usside kuivmass / usside tuha mass.
|
|
62.
|
Kui konkreetse uuringu eesmärk on mõõta biokättesaadavust ja tegelikku jääkide sisaldust ainega kokkupuutunud katselooma kudedes, tuleks võtta vähemalt ainega kokkupuutunud katseloomade osaproov (nt kolmest täiendavat paralleelkatsenõust), eelistatavalt statsionaarse oleku ajal, see tuleks kaaluda, lasta tühjendumiseks seista puhtas vees kuni 6 tundi (47) ning kaaluda uuesti enne analüüsi. Andmeid usside massi ja aine sisalduse kohta kudedes, mis saadakse sellest osaproovist, saab siis võrrelda väärtustega, mis leiti usside puhul, kellel ei lastud soolestikku tühjendada. Ussidel, kes on ette nähtud eraldumise mõõtmiseks, ei tuleks lasta end tühjendada enne üleviimist puhtasse settesse, et mitte tekitada neile asjatut stressi.
|
|
63.
|
Vee, sette- ja ussiproove tuleks eelistatavalt analüüsida kohe pärast eraldamist (s.o 1–2 päeva jooksul), et vältida lagunemist või muid kadusid, ja arvutada juba katse vältel ligikaudsed omastamis- ja eraldumiskiirused. Kohene analüüs hoiab ära ka viivituse platoo saavutamise määramisel.
|
|
64.
|
Kui kohene analüüs ei ole võimalik, tuleks proove säilitada sobivates tingimustes. Enne katse alustamist tuleks hankida teavet konkreetse uuritava aine stabiilsuse ja nõuetekohase säilitamise tingimuste kohta (nt säilitamistemperatuur ja -aeg, ekstraktsioonimeetodid jne). Kui selline teave ei ole kättesaadav ja seda peetakse vajalikuks, võib rikastatud kudedega teha kontrollkatse, et määrata stabiilsus säilitamisel.
|
Analüüsimeetodi kvaliteet
|
65.
|
Kuna kogu meetodi täpsuse määravad peamiselt uuritava aine määramiseks kasutatava analüüsimeetodi mõõtetäpsus, kordustäpsus ja tundlikkus, tuleb eksperimentaalselt kontrollida, kas keemilise analüüsi täpsus ja korratavus ning uuritava aine eraldamine vee, sette ja usside proovidest vastavad selle meetodi tingimustele. Samuti tuleks jälgida, et kontrollkatsekambrites ei oleks uuritava aine kontsentratsioon kõrgem tausttasemest. Vajaduse korral tuleb Cw, Cs ja Ca väärtustesse viia sisse parandid aine eraldamise puuduliku saagise ja kontrollkatsete tausttaseme arvestamiseks. Kogu katse vältel tuleb kõiki proove käidelda nii, et minimeerida saastumine ja kaod (näiteks kaod, mida tekitab uuritava aine adsorbeerumine proovivõtuseadmele).
|
|
66.
|
Tuleks registreerida uuritava kemikaali üldsaagis, saagis ussidest, settest ja veest ning aurunud uuritava kemikaali püüdmiseks kasutatud absorbente sisaldavast püüdurist (kui kasutati) ja esitada katseprotokollis.
|
|
67.
|
Kuna soovitatakse kasutada radioaktiivse märgisega aineid, on võimalik analüüsida kogu radioaktiivsust (st lähteainete ja lagunemissaaduste radioaktiivsus). Kui analüüsimeetod seda võimaldab, pakub olulist teavet uuritava lähtekemikaali ja metaboliitide kvantitatiivne määramine statsionaarses olekus või omastamisfaasi lõpus. Kui kavatsetakse teha selliseid mõõtmisi, tuleks proove sobiva meetodiga ekstraheerida, et lähteühendi sisalduse saaks määrata eraldi. Kui leitud lagunemissaadus moodustab olulise protsendi (nt > 10 %) katseloomas mõõdetud radioaktiivsusest statsionaarses olekus või omastamisfaasi lõpus, on soovitatav selline lagunemissaadus kindlaks teha (5).
|
|
68.
|
Väikse biomassi tõttu ei ole sageli võimalik määrata uuritava aine kontsentratsiooni igas üksikus ussis, kui katseloomana ei kasutata Branchiura sowerbyi't (mille isendi märgkaal on 40–50 mg) (11). Seetõttu on lubatav koondada ühest katsenõust võetud isendid üheks prooviks, kuid see piirab statistilisi meetodeid, millega on võimalik andmeid töödelda. Kui teatud statistilist meetodit ja võimsust peetakse tähtsaks, tuleb katses kasutada piisaval arvul katseloomi ja/või paralleelseid katsekambreid, et tagada soovitud andmete koondamine ja täita statistilise meetodi ja võimsusega seotud nõudeid.
|
|
69.
|
On soovitatav väljendada bioakumulatsioonitegur BAF nii summaarse märgmassi kui ka summaarse kuivmassi funktsioonina ning vajaduse korral (näiteks väga lipofiilse aine puhul) lipiidisisalduse ja sette orgaanilise süsiniku üldsisalduse funktsioonina. Lipiidisisalduse määramiseks tuleks kasutada sobivaid meetodeid (48, 49). Standardmeetodina (48) võib soovitada ekstraheerimist kloroformi/metanooliga (50). Klooritud lahustite kasutamise vältimiseks võiks siiski kasutada Bligh' ja Dyeri meetodi (50) muudetud versiooni (51), mis on kontrollitud laboritevahelises ringkatses. Kuna eri meetodid ei pruugi anda sama tulemust (48), on tähtis, et kasutatud meetod oleks põhjalikult kirjeldatud. Võimaluse korral, s.o kui usside kude on piisavalt, tuleks lipiidid määrata samast proovist või ekstraktist, mida kasutati uuritava aine analüüsiks, kuna lipiidid tuleb ekstraktist sageli kõrvaldada, enne kui ekstrakti on võimalik kromatograafiliselt analüüsida (5). Siiski on lipiidisisalduse mõõtmiseks otstarbekas kasutada kohanenud kontroll-loomi näiteks kolmest proovist vähemalt omastamisfaasi alguses või eelistatavalt lõpus.
|
ANDMED JA KATSEPROTOKOLLI KOOSTAMINE
Tulemuste töötlemine
|
70.
|
Uuritava kemikaali omastamise kõvera saamiseks kantakse aritmeetilises skaalas graafikule uuritava aine kontsentratsioon ussides/ussidel omastamisfaasis sõltuvana ajast. Kui kõver on jõudnud platoole, arvutage statsionaarse oleku BAFss:

|
|
71.
|
Määrake kineetiline bioakumulatsioonitegur (BAFK) suhtena ks/ke. Eraldumise kiiruskonstant (ke) määratakse tavaliselt eraldumise kõvera alusel (s.o eraldumisfaasis ussides leiduva uuritava aine kontsentratsiooni graafikust). Omastamise kiiruskonstant ks arvutatakse omastamiskõvera kineetikast. Kineetilise bioakumulatsiooniteguri ja kiiruskonstantide ks ja ke saamiseks eelistatud meetod on andmete töötlemine arvutiga, kasutades mittelineaarseid parameetri hindamise meetodeid (vt 2. liide). Kui aine eraldumine selgelt ei ole esimest järku, tuleks kasutada keerukamaid mudeleid (25, 27, 52).
|
|
72.
|
Elustiku-sette akumulatsioonitegur (biota-sediment accumulation factor, BSAF) määratakse BAFK normeerimisega, võttes arvesse usside lipiidisisaldust ja sette orgaanilise süsiniku üldsisaldust.
|
Tulemuste tõlgendamine
|
73.
|
Tulemuste tõlgendamisel peab olema ettevaatlik, kui katses mõõdetud kontsentratsioonitasemed on analüüsimeetodi määramispiiri ligidal.
|
|
74.
|
Selgelt määratletud omastamis- ja eraldumiskõverad viitavad hea kvaliteediga bioakumulatsiooni andmetele. Üldiselt ei tohiks hästi kavandatud katse puhul bioakumulatsiooniteguri usalduspiirid ületada 25 % (5).
|
Katseprotokoll
|
75.
|
Katseprotokollis tuleb esitada järgmine teave:
|
|
Uuritav aine
|
—
|
füüsikaline olek ja füüsikalis-keemilised omadused, näiteks log Kow, lahustuvus vees;
|
|
—
|
kemikaali identifitseerimisandmed; uuritava aine päritolu, kasutatud lahusti nimetus ja kontsentratsioon;
|
|
—
|
radioaktiivse märgisega aine puhul: märgistatud aatomite täpne asukoht, eriradioaktiivsus ja lisanditega seotud radioaktiivsuse protsent.
|
|
|
|
Katses kasutatud liik
|
—
|
teaduslik nimetus, liin, päritolu, kõik eeltöötlused, aklimatiseerumine, vanus, suuruse vahemik jms.
|
|
|
|
Katsetingimused
|
—
|
kasutatud katsemeetod (nt staatiline, poolstaatiline või läbivoolukatse);
|
|
—
|
kasutatud valgustuse tüüp ja omadused ning valgustuse kestus(ed);
|
|
—
|
katse kava (nt katsekambrite arv, materjal ja suurus, veekihi maht, settekihi mass ja maht, veemahu asendamise kiirus (poolstaatilise või läbivoolukatse puhul), aeratsioon enne katset ja katse ajal, paralleelkatsete arv, usside arv igas paralleelkatses, uuritava aine kontsentratsioonide arv, omastamisfaasi ja eraldumisfaasi kestus, proovivõtmise sagedus);
|
|
—
|
uuritava aine ettevalmistamise ja kasutamise meetod ning samuti konkreetse meetodi valimise põhjused;
|
|
—
|
nominaalsed uuritavad kontsentratsioonid;
|
|
—
|
tehisvee ja -sette koostisosade allikas või looduslike keskkondade kasutamise puhul vee ja sette päritolu, eeltöötluste kirjeldus, tõendid (katsetulemused) selle kohta, et katseloomad suudavad elada ja paljuneda kasutatavas keskkonnas, sette omadused (pH ja poorivee ammoniaagisisaldus (looduslik sete), orgaanilise süsiniku üldsisaldus (TOC), osakeste suurusjaotus (liiva, tolmu ja savi protsent), veesisaldus, ja muud tehtud mõõtmised) ja vee omadused (pH, karedus, elektrijuhtivus, temperatuur, lahustunud hapniku kontsentratsioon, kloori jääktasemed (kui mõõdeti) ja muud tehtud mõõtmised);
|
|
—
|
tehissette nominaalne ja mõõdetud kuivmass protsendina märgmassist (või kuivmassi-märgmassi suhtarv); loodusliku sette mõõdetud kuivmass protsendina märgmassist (või kuivmassi-märgmassi suhtarv);
|
|
—
|
katsekambrites oleva vee kvaliteet: temperatuur, pH, ammoniaagisisaldus, üldkaredus ja lahustunud hapniku kontsentratsioon;
|
|
—
|
üksikasjalik teave vee-, sette- ja ussiproovide töötlemise kohta, sh andmed uuritava aine ettevalmistamise, säilitamise, rikastamismeetodite, ekstraheerimis- ja analüüsimeetodite (ning täpsuse) kohta ning lipiidisisalduse kohta ja uuritava aine analüüsisaagiste kohta.
|
|
|
|
Tulemused
|
—
|
kontrollrühma usside ja iga katsekambri usside suremus ning muu täheldatud subletaalne toime, sealhulgas ebatavaline käitumine (näiteks sette vältimine, fekaalikübemete olemasolu või puudumine, mittepaljunemine);
|
|
—
|
sette ja katseorganismide mõõdetud kuivmassi ja märgmassi suhtarv (mis on vajalik normeerimise jaoks);
|
|
—
|
usside lipiidisisaldus;
|
|
—
|
kõverad, mis näitavad uuritava aine omastamise ja eraldumise kineetikat ussides ning statsionaarse olekuni jõudmiseks vajalikku aega;
|
|
—
|
Ca, Cs ja Cw (vajaduse korral koos standardhälbe ja usaldusvahemikuga) kõikide proovivõtuaegade jaoks (Ca, g/kg, väljendatakse kogu keha märg- ja kuivmassi kohta, Cs, g/kg, väljendatakse sette märg- ja kuivmassi kohta, ja Cw, mg/l). Kui on vaja määrata elustiku-sette akumulatsioonitegur (BSAF; mõiste vt 1. liide) (näiteks eri lipiidisisaldusega loomadega tehtud katsete tulemuste võrdlemiseks), peaks Ca olema väljendatud ka g-des organismi lipiidisisalduse kg kohta ja Cs peaks olema väljendatud g-des sette orgaanilise süsiniku kg kohta;
|
|
—
|
BAF (sette märgkaalu kg / usside märgkaalu kg), sette omastamise kiiruskonstant ks (sette märgkaalu g / usside märgkaalu kg / päev), ja eraldumise kiiruskonstant ke (1/päev); lisaks võib teatada ka elustiku-sette akumulatsiooniteguri BSAF (sette orgaanilise süsiniku kg / usside lipiidisisalduse kg);
|
|
—
|
eraldumata jäänud jäägid (non-eliminated residues, NER) eraldumisfaasi lõpus;
|
|
—
|
kui mõõdeti: lähteaine, lagunemissaaduste ja seotud jääkide protsent (seotud jäägid – uuritav aine, mida ei ole võimalik ekstraheerida tavaliste ekstraheerimismeetodite abil), mis on tuvastatud katseloomades;
|
|
—
|
meetodid, mida kasutatakse andmete statistilise analüüsi jaoks.
|
|
|
|
Tulemuste hindamine
|
—
|
tulemuste vastavus nõuetekohasuse kriteeriumidele, mis on loetletud punktis 21;
|
|
—
|
ootamatud või ebatavalised tulemused, näiteks uuritava aine mittetäielik eraldumine katseloomadest; sellisel juhul kõikide varasemate uuringute tulemused, mis võivad anda kasulikku teavet.
|
|
|
1. liide
Mõisted ja ühikud
|
|
Tehissete, spetsiaalselt valmistatud sete, taastatud, või sünteetiline sete – selliste materjalide segu, mida kasutatakse loodusliku sette füüsiliste koostisosade imiteerimiseks;
|
|
|
Bioakumulatsioon – uuritava aine kontsentratsiooni suurenemine organismis või organismi peal, võrreldes uuritava aine kontsentratsiooniga ümbritsevas keskkonnas. Bioakumulatsioon on biokontsentratsiooni ja biomagnifikatsiooni (vt allpool) tulemus.
|
|
|
Bioakumulatsioonitegur (BAF) – uuritava aine kontsentratsioon katseorganismis/katseorganismi peal (Ca, g-des·ussi märg- või kuivmassi kg kohta) kõnealuse bioakumulatsiooni katse omastamisfaasis igal ajamomendil, jagatud aine kontsentratsiooniga ümbritsevas kasvukeskkonnas (Cs, g-des sette märg- või kuivmassi kg kohta). Selleks, et BAF oleks kooskõlas Ca ja Cs ühikutega, on BAFi ühik sette kg / usside kg (15).
|
|
|
Bioakumulatsioonitegureid, mis arvutatakse otse settest omastamise kiiruskonstandi jagamisel eraldumise kiiruskonstantidega (ks ja ke, vt allpool), nimetatakse kineetilisteks bioakumulatsiooniteguriks (BAFK).
|
|
|
Biokontsentratsioon – uuritava aine kontsentratsiooni suurenemine organismis või organismi peal, võrreldes uuritava aine kontsentratsiooniga ümbritsevas keskkonnas, mis tuleneb üksnes aine omastamisest keha pinna kaudu.
|
|
|
Biomagnifikatsioon – uuritava kemikaali kontsentratsiooni suurenemine organismis või organismi peal, võrreldes uuritava kemikaali kontsentratsiooniga söödas või saagis, mis tuleneb peamiselt saastunud sööda või saagi kaudu omastamise teel. Biomagnifikatsioon võib viia uuritava aine ülekandumise või kogunemiseni toitumisvõrgustikes.
|
|
|
Elustiku-sette akumulatsioonitegur (BSAF) – lipiidide suhtes normeeritud uuritava kemikaali statsionaarse oleku kontsentratsioon katseorganismis/katseorganismil, jagatuna uuritava aine orgaanilise süsiniku suhtes normeeritud kontsentratsiooniga settes statsionaarses olekus. Ca väljendatakse siis g-des·organismi lipiidide kg kohta ja Cs g-des sette orgaanilise aine kg kohta.
|
|
|
Konditsioneerimisperiood – periood, mida kasutatakse sette mikroobse osa stabiliseerimiseks ja näiteks settekomponentide poolt eraldatava ammoniaagi eemaldamiseks; see on ajavahemik enne sette rikastamist uuritava ainega. Tavaliselt visatakse kattev veekiht pärast konditsioneerimist ära.
|
|
|
Uuritava aine eraldumine – aine kadumine katseorganismi kudedest aktiivsete või passiivsete protsesside tõttu, mis toimivad sõltumatult uuritava aine olemasolust või puudumisest ümbritsevas kasvukeskkonnas.
|
|
|
Eraldumisfaas – aeg, mis järgneb katseorganismide ülekandmisele uuritava ainega rikastatud kasvukeskkonnast uuritava aineta kasvukeskkonda, mille vältel uuritakse aine eraldumist (või netokadu) katseorganismidest.
|
|
|
Eraldumise kiiruskonstant (ke) – numbriline väärtus, millega määratakse uuritava aine kontsentratsiooni vähenemise kiirus katseorganismil/katseorganismis pärast katseorganismide ülekandmist uuritavat ainet sisaldavast kasvukeskkonnast uuritava aineta kasvukeskkonda; ke ühik on d-1 (kus d = päev).
|
|
|
Tasakaalustamisaega kasutatakse selleks, et lasta uuritaval ainel jaotuda tahke faasi, poorivee ja katva veekihi vahel; see toimub pärast sette rikastamist uuritava ainega ja enne katseorganismide lisamist.
|
|
|
Oktanooli-vee jaotuskoefitsient (Kow) – aine n-oktanoolis ja vees lahustuvuse suhe tasakaaluolekus; vahel tähistatakse seda jaotuskoefitsienti ka Pow-ga. Kow logaritmi (log Kow) kasutatakse kui aine veeorganismidesse kogunemise (bioakumulatsiooni) võime üht näitajat.
|
|
|
Orgaanilise süsiniku-vee jaotuskoefitsient (Koc) – tasakaaluolekut iseloomustav suhtarv, mille leidmiseks jagatakse aine kontsentratsioon mulla orgaanilise süsiniku fraktsioonis/fraktsioonil aine kontsentratsiooniga vees.
|
|
|
Kattev veekiht – vesi, mis on katsenõus sette peal.
|
|
|
Platoo või statsionaarne olek – määratletud kui tasakaaluolek omastamise ja eraldumise protsesside vahel, mis toimuvad kokkupuutefaasis ühel ja samal ajal. Statsionaarne olek bioakumulatsiooniteguri ajast sõltuvuse graafikul on saavutatud siis, kui kõver on igal proovivõtuajal ajateljega paralleelne ja vähemalt kahepäevase vahemikuga võetud proovide bioakumulatsiooniteguri kolme järjestikuse analüüsi tulemused on üksteise suhtes 20 % piires ning kolme proovivõtu ajavahemiku vahel ei ole statistiliselt olulisi erinevusi. Uuritava kemikaali puhul, mida omastatakse aeglaselt, oleksid sobivamad seitsmepäevased ajavahemikud (5).
|
|
|
Poorivesi – vesi, mis asub sette- või mullaosakeste vahelises ruumis.
|
|
|
Settest omastamise kiiruskonstant (ks) – numbriline väärtus, millega määratakse uuritava aine kontsentratsiooni suurenemise kiirus katseorganismis/katseorganismi peal, mille on põhjustanud omastamine settefaasist; ks mõõdetakse g setteid kg usside ja päeva kohta.
|
|
|
Rikastatud sete – sete, millele on lisatud uuritavat ainet.
|
|
|
Statsionaarse oleku bioakumulatsioonitegur (BAFss) – bioakumulatsioonitegur statsionaarse oleku puhul, see ei muutu oluliselt pika ajavahemiku jooksul; uuritava aine kontsentratsioon ümbritsevas kasvukeskkonnas (Cs, g-des sette märg- või kuivmassi kg kohta) on selle ajavahemiku vältel konstantne.
|
|
|
Omastamis- või kokkupuutefaas – aeg, mille vältel katseorganismid puutuvad kokku uuritava ainega.
|
2. liide
Omastamise ja eraldumise parameetrite arvutamine
Bioakumulatsiooni katse peamine näitaja on bioakumulatsioonitegur, BAF. Bioakumulatsiooniteguri saab mõõtmistulemustest arvutada, kui jagada statsionaarses olekus uuritava aine kontsentratsioon katseorganismis Ca uuritava aine kontsentratsiooniga settes Cs. Kui omastamisfaasi ajal statsionaarse olekuni ei jõuta, arvutatakse bioakumulatsioonitegur samal viisil 28. päeva jaoks. Siiski tuleks ära märkida, kas bioakumulatsioonitegur põhineb statsionaarse oleku kontsentratsioonidel või mitte.
Tavapärane meetod kineetilise bioakumulatsiooniteguri (BAFK), settest omastamise kiiruskonstandi (ks) ja eraldumise kiiruskonstandi (ke) leidmiseks on kasutada arvutitöötluses mittelineaarseid parameetri hindamise meetodeid. Kui meil on keskmiste akumulatsioonitegurite aegrida (Ca, keskmised väärtused igal proovivõtu kuupäeval / Cs, keskmised väärtused igal proovivõtu kuupäeval = AF) omastamisfaasis, mis põhineb usside ja sette märgkaalul, ning mudeli võrrand
|
AF(t) = BAF × (1 – eke × t)
|
[võrrand 1]
|
kus AF(t) on suhtarv, mille saamiseks jagatakse uuritava aine kontsentratsioon ussides uuritava aine kontsentratsiooniga settes omastamisfaasi igal ajahetkel t, saab arvutiprogrammidega arvutada BAFK, ks ja ke väärtused.
Kui omastamisfaasi vältel jõutakse statsionaarse olekuni (s.o t = ∞), võib võrrandi 1 lihtsustada järgmiselt:
|

|
[võrrand 2]
|
kus
|
ks
|
=
|
kudedesse omastamise kiiruskonstant [g setteid kg usside ja päeva kohta];
|
|
ke
|
=
|
eraldumise kiiruskonstant [d– 1]
|
Sel juhul on ks/ke×Cs üks lähenemisviis uuritava aine kontsentratsiooni leidmiseks usside kudedes statsionaarses olekus (Ca,ss).
Elustiku-sette akumulatsioonitegur (BSAF) tuleks arvutada järgmiselt:

kus foc on sette orgaanilise süsiniku fraktsioon ja flip on usside lipiidifraktsioon, mis on mõlemad kas kuivmassi või märgmassi kohta.
Kui meil on kontsentratsiooni väärtuste aegrida, saab eraldumise kineetikat modelleerida järgmiste mudeli võrranditega ja parameetrite mittelineaarse hindamise programmi abil.
Vaikimisi soovitatakse lähtepunktiks võtta mõõdetud keskmine jääkide kontsentratsioon usside kehas omastamisfaasi lõpus. Omastamisfaasist modelleeritud/hinnatud väärtust tuleks kasutada üksnes siis, kui näiteks mõõdetud väärtus erineb oluliselt mudelile vastavast aine sisaldusest kehas. Vt ka punkt 50, aine eraldumise uurimiseks määratud usside alternatiivne eelnev kokkupuude; selle lähenemisviisi puhul loetakse, et eelnevalt ainega kokkupuutunud usside proovid eraldumisfaasi 0-päeval annavad kehas sisalduva ainekoguse realistliku väärtuse, millest siis algab eraldumise kineetika.
Kui aja järgi graafikule kantud andmepunktid näitavad pidevat eksponentsiaalset uuritava aine kontsentratsiooni vähenemist loomades, võib ajast sõltuva eraldumise kirjeldamiseks kasutada ühe-osa-mudelit (võrrand 4).
|

|
[võrrand 3]
|
Eraldumisprotsessid näivad vahel olevat kahefaasilised: eraldumisfaasi alguses väheneb Ca kiiresti, kuid hiljem, eraldumise hilisemates järkudes muutub uuritava aine kadu aeglasemaks, vt näiteks (8, 19, 25). Kahte faasi on võimalik tõlgendada eeldusega, et organismis on kaks eraldi osa, millest uuritav aine kaob erineva kiirusega. Neil juhtudel tuleks vaadata asjakohaseid publikatsioone, näiteks (15, 16, 17, 25).
Kahest osast eraldumist saab näiteks kirjeldada järgmise valemi abil (25):
|

|
[võrrand 4]
|
A ja B on osade suurused (protsendina kudedes olevate ainejääkide üldsisaldusest), kus A on osa, millest aine kaob kiiresti, ja B on osa, milles aine sisaldus väheneb aeglaselt. A ja B summa võrdub 100 protsendiga looma osade üldmahust statsionaarses olekus. ka ja kb kujutavad endast vastavaid eraldumise kiiruskonstante [d– 1]. Kui eraldumise kineetikat kirjeldatakse kahe osa mudeliga, võib omastamise kiiruskonstandi ks määrata järgmiselt: (53, 54):
|

|
[võrrand 5]
|
Sellest hoolimata tuleks selliseid mudelvõrrandeid kasutades olla ettevaatlik, eelkõige kui katse ajal võib muutuda uuritava aine biosaadavus (42).
Alternatiivina eespool esitatud mudelvõrranditele võib kineetilised parameetrid (ks ja ke) arvutada ka korraga, kohaldades esimese järgu kineetika mudelit korraga kõigile omastamisfaasi ja eraldumisfaasi andmetele. Omastamise ja eraldumise kiiruskonstantide sellise kombineeritud arvutamise meetodi kirjeldus on esitatud publikatsioonides (55, 56 ja 57).
Eraldumata jäänud jäägid (Non-Eliminated Residues, NER) tuleks arvutada teisese olulise näitajana; selleks korrutatakse keskmine kontsentratsioon ussides (Ca) eraldumisfaasi 10. päeval, mis on jagatud keskmise kontsentratsiooniga ussides statsionaarses olekus (omastamisfaasi 28. päeval) (Ca), 100-ga:

3. liide
Proovivõtu ajakava näide 28-päevase bioakumulatsiooni katse puhul
a) omastamisfaas (sealhulgas 4-päevane tasakaalustumisfaas)
|
Päev
|
Tegevused
|
|
– 6
|
Turbasuspensiooni ettevalmistamine sette tegemiseks; suspensiooni konditsioneerimine 48 h vältel.
|
|
– 4
|
Sette või settefraktsiooni rikastamine uuritava ainega; sette kõigi koostisosade segamine; setteproovide võtmine ainega töödeldud settest ja lahusti kontrolli settest uuritava kemikaali kontsentratsiooni määramiseks; katva veekihi lisamine; inkubeerimine katsetingimustes (tasakaalustamisfaas).
|
|
– 3/– 2
|
Katseorganismide eraldamine kultuurist aklimatiseerumiseks.
|
|
0
|
Vee kvaliteedi mõõtmine (vt punkt 52); kõrvaldatakse paralleelkatsed, mis on ette nähtud vee- ja setteproovide võtmiseks ning uuritava aine kontsentratsiooni määramiseks; usside jaotamine juhuslikkuse alusel katsekambritesse; piisava arvu usside alaproovide võtmine analüüsi taustnäitajate määramiseks. Õhuga varustatuse kontrollimine, kui kasutatakse suletud katsesüsteemi.
|
|
1
|
Kõrvaldatakse paralleelkatsed, mis on ette nähtud proovide võtmiseks; kontrollitakse õhuga varustatust, usside käitumist ja vee kvaliteeti (vt punkt 56); võetakse vee-, sette- ja usside proovid uuritava kemikaali kontsentratsiooni määramiseks.
|
|
2
|
Õhuga varustatuse, usside käitumise ja temperatuuri kontrollimine.
|
|
3
|
Sama kui päeval 1.
|
|
4–6
|
Sama kui päeval 2.
|
|
7
|
Sama kui päeval 1; vajaduse korral lisatakse vett aurustumise kompenseerimiseks.
|
|
8–13
|
Sama kui päeval 2.
|
|
14
|
Sama kui päeval 1; vajaduse korral lisatakse vett aurustumise kompenseerimiseks.
|
|
15–20
|
Sama kui päeval 2.
|
|
21
|
Sama kui päeval 1; vajaduse korral lisatakse vett aurustumise kompenseerimiseks.
|
|
22–27
|
Sama kui päeval 2.
|
|
28
|
Sama kui päeval 1; vee kvaliteedi mõõtmine (vt punkt 52); omastamisfaasi lõpp; usside piisavate alaproovide säilitamine analüüsi taustnäitajate, märg- ja kuivmassi ning lipiidisisalduse määramiseks; usside ülekandmine allesolevatest kemikaaliga kokkupuute paralleelkatsetest eraldumisfaasi jaoks puhast setet sisaldavatesse nõudesse (ilma soolestiku tühjendamiseta); vee-, sette- ja usside proovide võtmine lahusti kontrollkatse rühmades; proovide võtmine püüdurlahustest, kui neid kasutatakse.
|
|
|
Kokkupuute-eelsete tegevuste (tasakaalustamisfaasi) ajakava tuleks määrata aine omaduste põhjal. Vajaduse korral tuleb ettevalmistatud setet konditsioneerida katva veekihi all temperatuuril 20 ± 2 °C juures 7 päeva; sellisel juhul tuleb sette tegemist alustada varem.
|
|
|
Päeva 2 jaoks kirjeldatud tegevusi tuleks korrata igal päeval (vähemalt tööpäeviti).
|
b) Eraldumisfaas
|
Päev
|
Tegevused
|
|
– 6
|
Turbasuspensiooni ettevalmistamine sette tegemiseks; suspensiooni konditsioneerimine 48 h vältel.
|
|
– 4
|
Sette kõigi koostisosade segamine; ainega töödeldud settest ja lahusti kontrolli settest setteproovide võtmine uuritava kemikaali kontsentratsiooni määramiseks; katva veekihi lisamine; inkubeerimine katse tingimustes.
|
|
0 (omastamisfaasi 28. päev)
|
Vee kvaliteedi mõõtmise (vt punkt 52); usside ülekandmine allesolevatest ainega kokkupuute paralleelkatsetest puhast setet sisaldavatesse nõudesse; 4–6 tundi hiljem kõrvaldatakse paralleelkatsed, mis on ette nähtud vee-, sette- ja usside proovide võtmiseks, et määrata uuritava aine kontsentratsioon; usside jaotamine juhuslikkuse alusel katsekambritesse.
|
|
1
|
Kõrvaldatakse paralleelkatsed proovide võtmiseks; kontrollitakse õhuga varustatust, usside käitumist ja vee kvaliteeti (vt punkt 52); võetakse vee-, sette- ja usside proovid uuritava kemikaali kontsentratsiooni määramiseks.
|
|
2
|
Õhuga varustatuse, usside käitumise ja temperatuuri kontrollimine.
|
|
3
|
Sama kui päeval 1.
|
|
4
|
Sama kui päeval 2.
|
|
5
|
Sama kui päeval 1.
|
|
6
|
Sama kui päeval 2.
|
|
7
|
Sama kui päeval 1; vajaduse korral lisatakse vett aurustumise kompenseerimiseks.
|
|
8–9
|
Sama kui päeval 2.
|
|
10
|
Sama kui päeval 1; eraldumisfaasi lõpp; vee kvaliteedi mõõtmine (vt punkt 52); vee-, sette- ja usside proovide võtmine lahusti kontrollkatse rühmades; proovide võtmine püüdurlahustest, kui neid kasutatakse.
|
|
|
Sette ettevalmistamine enne eraldumisfaasi tuleks teha samal viisil kui enne omastamisfaasi.
|
|
|
Päeva 2 jaoks kirjeldatud tegevusi tuleks korrata igal päeval (vähemalt tööpäeviti).
|
4. liide
Mõned lahjendamiseks sobiva vee füüsikalis-keemilised omadused
|
KOOSTISOSA
|
KONTSENTRATSIOONID
|
|
Tahked osakesed
|
< 20 mg/l
|
|
Orgaanilise süsiniku üldsisaldus
|
< 2 μg/l
|
|
Ioniseerimata ammoniaak
|
< 1 μg/l
|
|
Jääkkloor
|
< 10 μg/l
|
|
Fosfororgaanilised pestitsiidid, üldsisaldus
|
< 50 ng/l
|
|
Kloororgaaniliste pestitsiidide ja polüklooritud bifenüülide üldsisaldus
|
< 50 ng/l
|
|
Orgaanilise kloori üldsisaldus
|
< 25 ng/l
|
TAASTATUD VEE SOOVITATAV KOOSTIS
|
a.
|
Kaltsiumkloriidi lahus
Lahustage 11,76 g CaCl2 · 2H2O deioniseeritud vees; täiendage sama veega 1 liitrini.
|
|
b.
|
Magneesiumsulfaadi lahus
Lahustage 4,93 g MgSO4 · 7H2O deioniseeritud vees; täiendage sama veega 1 liitrini.
|
|
c.
|
Naatriumvesinikkarbonaadi lahus
Lahustage 2,59 g NaHCO3 deioniseeritud vees; täiendage sama veega 1 liitrini.
|
|
d.
|
Kaaliumkloriidi lahus
Lahustage 0,23 g KCl deioniseeritud vees; täiendage sama veega 1 liitrini.
|
Kõik kemikaalid peavad olema analüüsipuhtad.
Destilleeritud või deioniseeritud vee juhtivus ei tohiks ületada 10 μScm– 1.
25 ml iga lahust a kuni d segatakse ja ruumala viiakse deioniseeritud veega 1 liitrini. Selles lahuses on kaltsium- ja magneesiumioonide kontsentratsioonide summa 2,5 mmol/l.
Ioonide suhtarv Ca:Mg on 4: 1 ning Na:K on 10:1. Selle lahuse puhvermahtuvus happe neutraliseerimisel KS4.3 on 0,8 mmol/l.
Lahjendusvett aereeritakse, kuni on saavutatud vee küllastumine hapnikuga, seejärel hoitakse seda enne kasutamist umbes kaks päeva ilma edasise aereerimiseta.
Sobiva lahjendusvee pH peaks olema vahemikus 6–9.
5. liide
Tehissete – soovitused valmistamise ja säilitamise kohta
Erinevalt katsemeetodist C.8 (40), milles soovitatakse tehissettes kasutada turbasisaldust 10 % kuivmassist, kasutatakse käesolevas meetodis tehissettes turbasisaldust 2 %, et see vastaks looduslike setete väiksele kuni keskmisele orgaanilise aine sisaldusele (58).
Kuivkomponentide protsendiline sisaldus tehissettes:
|
Koostisosa
|
Kirjeldus
|
% kuivas settes
|
|
Turvas
|
Turbasamblaturvas, lagunemisaste: „keskmine”, õhu käes kuivatatud, ilma nähtavate taimejäänusteta, peeneks jahvatatud (osakese suurus ≤ 0,5 mm)
|
2 ± 0,5
|
|
Kvartsliiv
|
Tera suurus: ≤ 2 mm, kuid > 50 % osakestest peaksid olema vahemikus 50–200 μm
|
76
|
|
Kaoliinsavi
|
Kaoliniidisisaldus ≥ 30 %
|
22 ± 1
|
|
Söödaallikas
|
Folia urticae, Urtica sp. (kõrvenõgese) peeneks jahvatatud lehed (osakese suurus ≤ 0,5 mm), või Urtica sp. jahvatatud lehed segus α-tselluloosiga (1: 1); vastavalt farmaatsia nõuetele ja inimtervishoius ettenähtud kvaliteediga; lisaks kuivale settele
|
0,4–0,5 %
|
|
Kaltsiumkarbonaat
|
CaCO3, pulbriks jahvatatud, keemiliselt puhas, lisaks kuivale settele
|
0,05–1
|
|
Deioniseeritud vesi
|
Juhtivus ≤ 10 μS/cm, lisaks kuivale settele
|
30–50
|
Kui võib eeldada suurenevat ammoniaagisisaldust, näiteks kui uuritav aine on teadaolevalt nitrifikatsiooni inhibiitor, võib olla otstarbekas asendada 50 % lämmastikurikast nõgesepulbrit tselluloosiga (nt α-tselluloosi pulber, keemiliselt puhas, osakese suurus ≤ 0,5 mm).
Valmistamine
Turvas kuivatatakse õhu käes ja jahvatatakse peeneks pulbriks (tera suurus on ≤ 0,5 mm, nähtavad taimeosad puuduvad). Vajalik kogus turbapulbrit suspendeeritakse deioniseeritud vees, mis lisatakse kuivale settele (on leitud, et kui veekogus ületab turba kuivmassi 11,5 korda, saadakse hästi segatav turbakört (8)), kasutades tõhusat homogenisaatorit.
Selle suspensiooni pH reguleeritakse CaCO3 abil vahemikku 5,5 ± 0,5. Suspensiooni konditsioneeritakse vähemalt kaks ööpäeva temperatuuril 20 ± 2 °C kerge segamisega, et stabiliseerida pH ja luua stabiilne mikroobikomponent. Segu pH mõõdetakse uuesti ja reguleeritakse vajaduse korral CaCO3 abil vahemikku 6,0 ± 0,5. Seejärel segatakse kogu suspensioon muude kuivade koostisosadega, võttes arvesse koostisosi, mida kasutati rikastamiseks. Lisatakse ülejäänud deioniseeritud vesi, et saada homogeenne sete. pH mõõdetakse uuesti ja reguleeritakse vajaduse korral CaCO3 abil vahemikku 6,5–7,5. Kui eeldatakse ammoniaagi moodustumist, võib olla kasulik hoida sademe pH allpool 7,0 (nt 6,0 ja 6,5 vahel). Kuivmassi ja orgaanilise süsiniku sisalduse määramiseks võetakse sette proovid. Kui eeldatakse ammoniaagi moodustumist, võib tehissetet konditsioneerida seitse päeva samades tingimustes, mis valdavalt esinevad edasise katse käigus (nt sette-vee suhe 1:4, settekihi paksus samasugune kui katsenõudes) enne, kui setet hakatakse rikastama uuritava ainega, st see peab olema kaetud veega, mida tuleb aereerida. Konditsioneerimisperioodi lõpus tuleks kattev veekiht eemaldada ja ära visata. Võetakse sette proovid (nt kolm proovi), et määrata kuivmass ja orgaanilise süsiniku üldsisaldus.
Seejärel segatakse iga kontsentratsioonitaseme settesse rikastatud kvartsliiv, sete jaotatakse paralleelkatsenõudesse ja lisatakse kattev veekiht (nt sette-vee suhe 1:4 settekihi paksus samasugune kui katsenõudes). Nõusid inkubeeritakse seejärel samades tingimustes, mis valdavalt esinevad edasise katse käigus. See on tasakaalustumisperioodi algus. Katvat veekihti tuleks aereerida.
Valitud söödaallikas tuleks lisada enne sette rikastamist uuritava ainega või rikastamise ajal. Selle võib kohe alguses segada turbasuspensiooniga (vt eespool). Söödaallika liigset lagunemist enne katseloomade lisamist, nt pika tasakaalustamisperioodi ajal, saab vältida aga sellega, et aeg söödaallika lisamise ja kokkupuute alguse vahel tehakse võimalikult lühikeseks. Selleks et tagada sööda piisav kokkupuude uuritava ainega, tuleks söödaallikas segada settega hiljemalt sel päeval, kui sete rikastatakse uuritava ainega. Erandeid võib teha juhul, kui tasakaalustumisperioodi pikkuse tõttu jõuaks liiga suur osa söödast mikroobselt laguneda enne katseorganismide lisamist. Võetakse sette proovid (nt kolm proovi rikastatud settest või kontrollkatsest), et määrata kuivmass ja orgaanilise süsiniku üldsisaldus.
Muude koostisainete (turvas, liiv, kaoliin) kuivmass tuleks esitada grammides ja massiprotsendina kogu kuivainest.
Kuivkomponentidele sette valmistamise ajal lisatava vee ruumala tuleks samuti esitada protsendina kuivaine üldmassist (nt 100 % kuivmassi + 46 % vett tähendab, et 1 000 g kuivmassile lisatakse kokku 460 ml vett, mille tulemusena saadakse 1 460 g märga setet).
Säilitamine
Tehisliku sette kuivi koostisosi võib säilitada kuivas ja jahedas kohas toatemperatuuril. Valmistatud märga setet võib säilitada (üksnes edasiseks kasutamiseks katseloomade kasvukultuuris) 4 ± 2 °C juures pimedas 2–4 nädalat alates valmistamise päevast (8).
Uuritava ainega rikastatud setet tuleks kasutada viivitamata, v.a juhul, kui on andmeid selle kohta, et konkreetset setet saab säilitada ilma uuritava aine mürgisust ja biosaadavust mõjutamata. Rikastatud sette proove võib säilitada kuni analüüsini konkreetse uuritava aine jaoks soovitatavates tingimustes.
6. liide
Bioakumulatsiooni uurimiseks soovitatavad väheharjasusside liigid
Harilik mudatupp (Tubifex tubifex (MÜLLER)), mudatuplaste sugukond (Tubificidae), alamklass väheharjasussid (Oligochaeta)
Väheharjasusside (Oligochaeta) hulka kuuluva mudatuplaste perekonna (Tubificidae) esindaja harilik mudatupp Tubifex tubifex (Müller) elab mageveesetetes torudes, mis on vooderdatud limaga. Mudatupp elab nendes torudes pea alaspidi, neelates setteosakesi ja kasutades nende küljes olevaid mikroorganisme ja orgaanikapudemeid. Mudatupe keha tagumine osa tavaliselt lookleb katvas veekihis, et hõlbustada hingamist. Kuigi see liik elutseb paljudes settetüüpides üle kogu põhjapoolkera, eelistab mudatupp suhteliselt peeneteralist muda (59). Selle liigi sobivust ökotoksikoloogilisteks katseteks on kirjeldatud näiteks järgmistes publikatsioonides (8, 29, 31, 39, 60, 62, 63).
Kultuuris pidamise meetodid
Bioakumulatsiooni katsete tegemiseks piisava arvu mudatuppede (Tubifex tubifex) saamiseks võib usse pidada laboris püsikultuuris. Mudatupe kultuuris pidamiseks soovitatakse (8) katsemeetodis C.8 (40) kirjeldatud tehismullal ja katsemeetodis C.1 kirjeldatud taastatud veel põhinevat süsteemi.
Kultuuri saab pidada klaasist või roostevabast terasest mahutites, mille kõrgus on 12–20 cm. Igasse kultuurinõusse pannakse kiht märga tehissetet, mille valmistamist on kirjeldatud 5. liites. Settekihi paksus peaks võimaldama ussidel järgida oma tavalist kaevamiskäitumist (mudatupel vähemalt 2 cm). Süsteemi lisatakse taastatud vett. Tuleks olla ettevaatlik, et vältida sette häirimist. Veefaasi aereeritakse kergelt (nt 2 mulli sekundis läbi 0,45 μm filtri lastud õhku) Pasteuri pipeti abil, mis on paigutatud 2 cm kõrgemale sette pinnast. Kultuuri soovitatav temperatuur on 20 ± 2 °C.
Ussid lisatakse kultuurisüsteemi maksimumkoormusega 20 000 isendit sette pinna ruutmeetri kohta. Suurem koormus võib põhjustada kasvu- ja paljunemiskiiruse vähenemist (43).
Tehissette kultuuris tuleb usse sööta. Täiendavaks söödaallikaks sobib peeneksjahvatatud kalasööt TetraMin® (8); Klerks 1994, erakirjavahetus. Söötmine peaks olema piisav kasvu ja paljunemise tagamiseks ning hoidma ammoniaagi kuhjumise ja seente kasvu minimaalse. Sööta võib lisada kaks korda nädalas (nt 0,6–0,8 mg sette pinna ruutsentimeetri kohta). Praktilised kogemused on näidanud, et ühtlast sööda jaotumist kultuurinõus üle kogu sette pinna aitab tagada deioniseeritud vees valmistatud ja homogeenitud söödasuspensiooni kasutamine.
Ammoniaagi kuhjumise vältimiseks tuleks katvat veekihti vahetada läbivoolusüsteemi kasutamisega või vähemalt üks kord nädalas käsitsi. Setet tuleks tüvikultuuris vahetada iga kolme kuu tagant.
Usside proovide võtmiseks kultuurist võib kultuuri setet sõeluda läbi 1 mm avadega sõela, kui vaja on üksnes täiskasvanud usse. Kookonite kinnipidamiseks on vaja kasutada 0,5 mm avaga sõela ja noorjärkude kinnipidamiseks 0,25 mm avaga sõela. Sõelad võib panna taastatud vette pärast seda, kui sete on neist läbi läinud. Ussid lahkuvad sõelalt ja neid võib siis noppida veest pehmete teraspintsettide või tulel poleeritud otsaga pipeti abil.
Katse tegemiseks või uue kultuuri alustamiseks kasutatakse üksnes vigastamata ja kindlalt määratud mudatupe Tubifex tubifex isendeid (vt näiteks (64)). Haiged või vigastatud ussid, samuti seeneniitidega nakatunud kookonid tuleb ära visata.
Sünkroniseeritud kultuurist võib saada teatud vanuses usse sobivate ajavahemike järel, kui soovitakse. Uued kultuuri kasvunõud seatakse valmis valitud ajavahemike järel (nt iga kahe nädala tagant) ja alustatakse teatavas vanuses loomadest (nt kookonitest). Siin kirjeldatud kasvatustingimuste puhul saavad ussid täiskasvanuks 8–10 nädala pärast. Kultuurist saab hakata usse võtma, kui ussid on munenud uued kookonid, näiteks kümne nädala pärast. Võetud täiskasvanud usse saab kasutada katsete tegemiseks ja kookoneid võib kasutada uue kultuuri alustamiseks.
Rabeliimukas (Lumbriculus variegatus (MÜLLER)), sugukond rabeliimuklased (Lumbriculidae), alamklass väheharjasussid (Oligochaeta)
Rabeliimukas Lumbriculus variegatus (Lumbriculidae, Oligochaeta), elab samuti mageveesetetes üle kogu maailma ja seda kasutatakse laialdaselt ökotoksikoloogiakatsetes. Teavet tema bioloogia, kasvatustingimuste ja tundlikkuse kohta võib saada publikatsioonidest (1, 6, 9, 36). Rabeliimukat võib samuti kasvatada mudatupe jaoks soovitatud tehissettes (8), kuid on teatavad piirangud. Kuna looduses eelistab rabeliimukas jämedamat setet kui mudatupp, võib rabeliimuka kultuur mudatupe puhul kasutatud settes 4–6 kuu pärast välja surra. Praktilised kogemused on näidanud, et rabeliimukat võib kasvatada liivasel põhjal/substraadil (nt kvartsliiv, peen kruus) läbivooluga süsteemis, kasutades söödaallikana kalasööta mitu aastat järjest, ilma substraati uuendamata. Rabeliimuka suur eelis muude vee väheharjasussiliikide ees on kiire paljunemine, mille tulemusena laborikultuuri biomass suureneb kiiresti (1, 6, 9, 10).
Kultuuris pidamise meetodid
Rabeliimuka kasvatustingimused on üksikasjalikult esitatud järgmistes publikatsioonides: Phipps et al. (1993) (10), Brunson et al. (1998) (28), ASTM (2000) (1), U.S. EPA (2000) (6). Lühike kokkuvõte neist on esitatud allpool.
Usse saab kasvatada suures akvaariumis (57–80 l) 23 °C juures, valgustusperiood 16 tundi valgust ja 8 tundi pimedust (valgustatus 100–1 000 luksi), kasutades iga päev vahetatavat looduslikku vett (45–50 liitrit akvaariumi kohta). Substraat valmistatakse pleegitamata pruunide paberrätikute lõikamisega ribadeks, mida võib seejärel mõne sekundi jooksul segada kultuuris kasutatava veega, et saada väiksed pabersubstraadi tükid. Seda substraati saab otse kasutada rabeliimuka kasvatamise akvaariumis, kui laotada see nõu põhjale, või seda võib säilitada külmutatult deioniseeritud vees hilisemaks kasutamiseks. Uus substraat peab kasvatamisnõus tavaliselt vastu ligikaudu kaks kuud.
Iga ussikultuuri alustatakse 500–1 000 ussiga; söödaks antakse neile 3 korda nädalas 10 ml suspensiooni, mis sisaldab 6 g forelli startersööta; kasutada võib nii uuendatavat kasvukeskkonda kui ka läbivoolukatse tingimusi. Staatilises või poolstaatilises kultuuris tuleb söötmist vähendada, et vältida bakterite või seente kasvu. Sööta ja pabersubstraati tuleks analüüsida ainete suhtes, mida uuritakse bioakumulatsiooni katses.
Sellistel tingimustel kahekordistub isendite arv kultuuris üldiselt ligikaudu 10–14 päevaga.
Rabeliimukat võib kasvatamisnõust välja võtta näiteks substraadi eemaldamisega, kasutades peenesilmalist võrku, või usside väljavõtmisega, kasutades tulel poleeritud laiasuulist (läbimõõt umbes 5 mm) klaaspipetti, et tõsta neid eraldi keeduklaasi. Kui koos ussidega satub sellesse keeduklaasi ka substraati, jäetakse keeduklaas usside ja substraadiga üheks ööks läbivoolu alla; vesi kannab substraadi minema ja ussid jäävad nõu põhjale. Seejärel saab ussid üle viia värskelt ettevalmistatud kasvatusnõusse või kasutada neid katse alustamiseks, nagu on kirjeldatud publikatsioonides (1) ja (6). Usside vigastamist või eneseköndistamist tuleks vältida, selleks tuleb nende usside käsitsemiseks kasutada tulel poleeritud otsaga pipette või roostevabast terasest pintsette.
Küsimus, mida tuleb kriitiliselt hinnata rabeliimuka kasutamisel sette bioakumulatsiooni katsetes, on tema paljunemisviis (arhitoomia (jagunemine kaheks fragmendiks), millele järgneb morfallaksis (puuduvate fragmentide moodustamine)). Sellisel mittesugulisel paljunemisel saadakse kaks fragmenti, kes teatava aja jooksul ei toitu, kuni on regenereerinud pea- või sabaosa (näiteks (36, 37)). See tähendab, et sette neelamine ja saasteaine omastamine rabeliimuka poolt võib mitte toimuda pidevalt nagu mudatuplastel, kes ei paljune fragmenteerumisega.
Seepärast tuleks kultuuri sünkroniseerida, et vähendada kontrollimatut paljunemist ja regenereerumist ning selle tõttu katse tulemuste suurt varieeruvust. Selline varieeruvus võib tekkida sellest, kui mõned isendid, kes on jagunenud ja seepärast ei söö teatava ajavahemiku vältel, puutuvad uuritava ainega vähem kokku kui muud isendid, kes katse ajal ei jagune (38). 10–14 päeva enne ainega kokkupuute algust tuleks ussid kunstlikult fragmenteerida (sünkroniseerimine) (65). Tuleks kasutada suuri usse, kellel eelistatavalt ei ole näha hiljutise jagunemise märke. Sellised ussid võib panna objektiklaasile kultuuris kasutatava vee tilga sisse ja lõigata skalpelliga keha keskosas pooleks. Tuleks hoolitseda selle eest, et tagumised otsad oleksid sarnase suurusega. Tagumised otsad tuleks seejärel kuni ainega kokkupuute alguseni jätta regenereerima uusi päid kasvatusnõus, mis sisaldab sama substraati, mida kasutatakse kasvatamisel, ja taastatud vett. Uute, regenereerunud peade olemasolu näitab see, kui sünkroniseeritud ussid kaevuvad substraadisse (regenereerunud pea olemasolu võib tõendada sellega, kui esindavat usside osaproovi vaadeldakse binokulaarmikroskoobiga). Katseorganismid peaksid seejärel olema sarnases füsioloogiaseisundis. See tähendab, et kui sünkroniseeritud ussides toimub katse ajal morfallaksise kaudu regenereerimine, peaksid praktiliselt kõik loomad olema ühtmoodi kokkupuutes rikastatud settega. Sünkroniseeritud usse tuleks sööta kohe, kui ussid hakkavad substraadisse kaevuma, või 7 päeva pärast fragmenteerimist. Söötmisrežiim peaks olema võrreldav tavapärase kultuuri söötmisega, kuid sünkroniseeritud usse võib olla soovitatav sööta samast söödaallikast, mida kasutatakse katse ajal. Usse tuleks hoida katse temperatuuril 20 ± 2 °C juures. Pärast regenereerumist tuleks katses kasutamiseks valida terved tervikliku kehaga ussid, kes väikse mehaanilise ärrituse peale hakkavad aktiivselt ujuma või roomama. Usside vigastamist või eneseköndistamist tuleks vältida, selleks tuleb nende usside käsitsemiseks kasutada tulel poleeritud otsaga pipette või roostevabast terasest pintsette.
Kui katses kasutatakse rabeliimukat, peaks seoses selle liigi erilise paljunemisviisiga usside arv katse jooksul suurenema, kui tingimused on sobivad (6). Kui rabeliimukaga tehtava bioakumulatsiooni katse ajal paljunemist ei toimu, tuleks see registreerida ja seda tuleks arvestada katse tulemuste tõlgendamisel.
Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (ringkatsega kinnitamata)
Branchiura sowerbyi elutseb mitmesuguse settetüübiga veekogudes – jõgedes, järvedes, tiikides, algselt troopilistel aladel. Neid võib leida ka põhjapoolkera sooja veega veekogudes. Siiski on neid sagedamini mudastes-savistes setetes, mille orgaanilise aine sisaldus on suur. Lisaks elavad need ussid settekihi sees. Isegi usside tagaosa on tavaliselt sisse kaevunud. Kõnealune liik on hästi määratav lõpusekiudude järgi nende tagaosas. Täiskasvanud ussid võivad saavutada pikkuse 9–11 cm ja märgkaalu 40–50 mg. Usside paljunemiskiirus on suur, isendite arv kahekordistub vähem kui kahe nädalaga allpool kirjeldatud temperatuuri- ja söötmistingimustes (Aston et al., 1982, (65)). B. sowerbyi't on kasutatud nii toksilisuse kui ka bioakumulatsiooni uuringutes (vastavalt Marchese ja Brinkhurst 1996, (31), Roghair et al. 1996, (67)).
Kultuuris pidamise meetodid
Allpool on esitatud kokkuvõte Branchiura sowerbyi' kultuuris pidamise tingimustest (esitanud Mercedes R. Marchese, INALI, Argentina, ja Carla J. Roghair, RIVM, Madalmaad).
Usside kultuuris pidamiseks ei ole vaja järgida üht kindlat meetodit. Usside kasvatamiseks võib kasutada saastamata looduslikku setet (31). Praktilised kogemused on näidanud, et keskkond, mis koosneb looduslikust settest ja liivast, sobib ussidele paremini kui puhas looduslik sete (32, 67). Kultuuri jaoks sobivad 3 l keeduklaasid, mis sisaldavad 1 500 ml sette ja vee süsteemi, milles on 375 ml saastamata looduslikku setet (orgaanilise süsiniku üldsisaldus ligikaudu 10 %; ligikaudu 17 % osakesi suurusega ≤ 63 μm), 375 ml puhast liiva (M32) ja 750 ml taastatud või deklooritud kraanivett (31, 32, 67). Substraadina võib kasutada ka paberrätikuid, kuid selles kasvab usside arv aeglasemalt kui looduslikus settes. Poolstaatilistes süsteemides aereeritakse keeduklaasis olevat katvat veekihti aeglaselt ja kord nädalas tuleks veekihti uuendada.
Igasse keeduklaasi pannakse alustuseks 25 noort ussi. Kahe kuu pärast nopitakse suured ussid settest pintsettidega välja ja viiakse üle uude keeduklaasi, milles on värskelt valmistatud sette-vee kasvukeskkond. Vana keeduklaas sisaldab ka kookoneid ja usside noorjärke. Sellisel viisil saab igast keeduklaasist koguda kuni 400 noort ussi. Täiskasvanud usse saab paljundamiseks kasutada vähemalt üks aasta.
Kasvukultuure tuleks hoida temperatuuril 21–25 °C. Temperatuuri muutumised tuleks hoida alla 2 °C. Aeg, mis kulub embrüonaalseks arenguks, alates munetud munast kuni noore ussi väljumiseni kookonist, on temperatuuril 25 °C umbes kolm nädalat. Munasaagis ühe elusa ussi kohta B. sowerbyi' kultuuris oli mudas temperatuuril 25 °C alates 6,36st (31) kuni 11,2ni (30). Munade arv kookonis on vahemikus 1,8–2,8 (66, 69) või kuni 8 (68).
Iga nädal tuleks mõõta lahustunud hapniku kontsentratsiooni, vee karedust, temperatuuri ja pH-d. Kalasööta (nt TetraMin®) võib lisada suspensioonina kaks või kolm korda nädalas ad libitum. Usse võib sööta ka ülessulatatud aedsalatiga ad libitum.
Selle liigi üks peamisi suuri eeliseid on isendi suur biomass (isendi märgmass on 40–50 mg). Seepärast saab seda liiki kasutada radioaktiivse märgiseta uuritava aine bioakumulatsiooni katsetes. Selle liigi puhul võib mudatupe või rabeliimuka puhul kasutatud süsteemides viia uuritava ainega kokkupuutesse üheainsa isendi paralleelkatse kohta (11). Paralleelkatseid tuleb siiski teha rohkem, kui ei kasutata suuremaid katsekambreid (11). Ka usside kaevumiskäitumisega seotud katse nõuetekohasuse kriteeriumi tuleb selle liigi puhul muuta.
KIRJANDUS
|
(1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(2)
|
European Commission (EC) (2003). Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I – IV. Office for Official Publications of the European Communities, Luxembourg.
|
|
(3)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(4)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(5)
|
Käesoleva lisa peatükk C.13. Biokontsentratsioon: kaladega läbivoolukatse.
|
|
(6)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(7)
|
Käesoleva lisa peatükk C.27. Sette-vee mürgisuskatse surusääsklastel rikastatud sette kasutamisega.
|
|
(8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(9)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(10)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on „Bioaccumulation: Sediment test using benthic oligochaetes”, 26.-27.04.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(12)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
(13)
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. & Morton, R.D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301-310.
|
|
(14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim
|
|
(15)
|
Landrum, P.F., Lee II, H., & Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709-1725.
|
|
(16)
|
Markwell, R.D., Connell, D.W. & Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443-1450.
|
|
(17)
|
Gabric, A.J., Connell, D.W. & Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24, 1225-1231.
|
|
(18)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. and Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501-1514.
|
|
(20)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(21)
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
(22)
|
Käesoleva lisa järgmised peatükid:
|
|
Peatükk A.5. Pindpinevus.
|
|
|
Peatükk A.6. Lahustuvus vees.
|
|
|
Peatükk A.8. Jaotustegur. Loksutamismeetod.
|
|
|
Peatükk A.24 Jaotuskoefitsient, HPLC meetod.
|
|
|
Peatükk C.7. Lagunemine – abiootiline lagunemine: hüdrolüüsi sõltuvus pHst.
|
|
|
Käesoleva lisa peatükk C.4 A–F. Kohese biolagunduvuse määramine.
|
|
|
Käesoleva lisa peatükk C.19. Adsorptsiooniteguri (KOC) kindlaksmääramine mullas ja reoveesettes kõrgsurvevedelikkromatograafia (HPLC) abil.
|
|
|
Käesoleva lisa peatükk C.29. Kiire biolagundatavus – CO2 suletud nõudes (vabaruumi katse).
|
|
|
(23)
|
OECD (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OECD, Paris.
|
|
(24)
|
Antoine, M.D., Dewanathan, S. & Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165-172.
|
|
(25)
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke & G. Studinger (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation – New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235-276.
|
|
(26)
|
Spacie, A. & Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309-320.
|
|
(27)
|
Hawker, D.W. & Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22, 701-707.
|
|
(28)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(29)
|
Reynoldson, T.B., Thompson, S.P. and Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061-1072.
|
|
(30)
|
Aston, R.J. & Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155-160.
|
|
(31)
|
Marchese, M.R. & Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163-168.
|
|
(32)
|
Roghair, C.J. & Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
(33)
|
Käesoleva lisa peatükk C.1. Äge mürgisus kaladele.
|
|
(34)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(35)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(36)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(37)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(38)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
(39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(40)
|
Käesoleva lisa peatükk C.8, Toksilisus vihmaussidele – tehismulla test.
|
|
(41)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(42)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588-595.
|
|
(43)
|
Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). In: R.O. Brinkhurst and D.G. Cook (eds.): Aquatic Oligochaeta Biology, 175-184. Plenum Press, New York.
|
|
(44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
|
|
(45)
|
Hooftman, R.N., van de Guchte, K. & Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
(46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, 1897-1905.
|
|
(47)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
(48)
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431-1436.
|
|
(49)
|
Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099-1105.
|
|
(50)
|
Bligh, E.G. & Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911-917.
|
|
(51)
|
De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
(52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
(53)
|
Zok, S., Görge, G., Kalsch, W. & Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411-421
|
|
(54)
|
Nagel, R. (1988). Umweltchemikalien und Fische – Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Germany.
|
|
(55)
|
Janssen, M.P.M., A Bruins, T.H. De Vries & Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305-312.
|
|
(56)
|
Van Brummelen, T.C. & Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277-285.
|
|
(57)
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167-1171.
|
|
(58)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
(59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310-386.
|
|
(60)
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785-790.
|
|
(61)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47-67.
|
|
(62)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69-78.
|
|
(63)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(64)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(65)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(66)
|
Aston, R.J., Sadler, K. & Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137-145.
|
|
(67)
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. & Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
(68)
|
Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89-94.
|
|
(69)
|
Bonacina, C., Pasteris, A., Bonomi, G. & Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267-274
|
” |

 In force
In force





































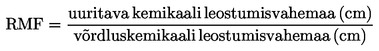


 .
. ,
, ,
, .
.

 ,
, ,
, ,
, ,
,
 ,
,