EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32014R0589
Commission Regulation (EU) No 589/2014 of 2 June 2014 laying down methods of sampling and analysis for the control of levels of dioxins, dioxin-like PCBs and non-dioxin-like PCBs in certain foodstuffs and repealing Regulation (EU) No 252/2012 Text with EEA relevance
Komisjoni määrus (EL) nr 589/2014, 2. juuni 2014 , millega sätestatakse proovivõtu- ja analüüsimeetodid dioksiinide, dioksiinitaoliste PCBde ja mittedioksiinitaoliste PCBde sisalduse kontrollimiseks teatavates toiduainetes ning tunnistatakse kehtetuks määrus (EL) nr 252/2012 EMPs kohaldatav tekst
Komisjoni määrus (EL) nr 589/2014, 2. juuni 2014 , millega sätestatakse proovivõtu- ja analüüsimeetodid dioksiinide, dioksiinitaoliste PCBde ja mittedioksiinitaoliste PCBde sisalduse kontrollimiseks teatavates toiduainetes ning tunnistatakse kehtetuks määrus (EL) nr 252/2012 EMPs kohaldatav tekst
OJ L 164, 3.6.2014, p. 18–40
(BG, ES, CS, DA, DE, ET, EL, EN, FR, HR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 No longer in force, Date of end of validity: 25/04/2017; kehtetuks tunnistatud 32017R0644
No longer in force, Date of end of validity: 25/04/2017; kehtetuks tunnistatud 32017R0644
|
3.6.2014 |
ET |
Euroopa Liidu Teataja |
L 164/18 |
KOMISJONI MÄÄRUS (EL) nr 589/2014,
2. juuni 2014,
millega sätestatakse proovivõtu- ja analüüsimeetodid dioksiinide, dioksiinitaoliste PCBde ja mittedioksiinitaoliste PCBde sisalduse kontrollimiseks teatavates toiduainetes ning tunnistatakse kehtetuks määrus (EL) nr 252/2012
(EMPs kohaldatav tekst)
EUROOPA KOMISJON,
võttes arvesse Euroopa Liidu toimimise lepingut,
võttes arvesse Euroopa Parlamendi ja nõukogu 29. aprilli 2004. aasta määrust (EÜ) nr 882/2004 ametlike kontrollide kohta, mida tehakse sööda- ja toidualaste õigusnormide ning loomatervishoidu ja loomade heaolu käsitlevate eeskirjade täitmise kontrollimise tagamiseks, (1) eriti selle artikli 11 lõiget 4,
ning arvestades järgmist:
|
(1) |
Komisjoni määruses (EÜ) nr 1881/2006 (2) on sätestatud mittedioksiinitaoliste polüklooritud bifenüülide (PCBd), dioksiinide ja furaanide ning dioksiinide, furaanide ja dioksiinitaoliste PCBde summa piirnormid teatavates toiduainetes. |
|
(2) |
Komisjoni soovituses 2013/711/EL (3) on sätestatud häiretasemed, et hoogustada polüklorodibensoparadioksiinide, polüklorodibensofuraanide ja dioksiinitaoliste PCBde sisalduse vähendamist toidus. Selliste häiretasemete abil saavad pädevad asutused ja ettevõtjad tuua välja juhtumid, mille puhul on asjakohane teha kindlaks saasteallikas ja rakendada meetmeid saastamise vähendamiseks või kõrvaldamiseks. |
|
(3) |
Komisjoni 21. märtsi 2012. aasta määruses (EL) nr 252/2012 (4) on sätestatud proovivõtu- ja analüüsimeetodid dioksiinide, dioksiinitaoliste PCBde ja mittedioksiinitaoliste PCBde sisalduse ametlikuks kontrollimiseks. |
|
(4) |
Käesoleva määruse sätetes on käsitletud üksnes dioksiinide, dioksiinitaoliste ja mittedioksiinitaoliste PCBde proovide võtmist ja analüüse määruse (EÜ) nr 1881/2006 ja soovituse 2013/711/EL rakendamise eesmärgil. Sellega ei mõjutata proovivõtustrateegiat, -mahtu ega sagedust, mis on sätestatud nõukogu direktiivi 96/23/EÜ (5) III ja IV lisas. Ka ei mõjuta need sätted komisjoni otsuses 98/179/EÜ (6)sätestatud proovivõtu sihtrühma kriteeriume. |
|
(5) |
Et leida märkimisväärse polüklorodibensoparadioksiinide ja polüklorodibensofuraanide (PCDD/F) ning dioksiinitaoliste PCBde sisaldusega proove, võiks proove uurida üldtunnustatult valideeritud ning suure tõhususega sõeluuringumeetodiga (eelkõige valides häiretaset ületavaid proove ja tagades piirnorme ületava sisaldusega proovide valimise). Selliste proovide PCDD/Fide ja dioksiinitaoliste PCBde sisaldus tuleb määrata kinnitava analüüsimeetodiga. Seepärast tuleb kehtestada asjakohased sõeluuringumeetodi nõuded, millega tagatakse, et piirnormile vastavust kinnitavate valenegatiivsete tulemuste osa jääks alla 5 %, ja ranged kinnitava analüüsimeetodi nõuded. Piisava selektiivsusega kinnitavad meetodid võimaldavad määrata sisaldust ka nõrga tausta korral. See on tähtis, et jälgida ajalisi suundumusi, hinnata kokkupuudet ning ümber hinnata piirnorme ja häiretasemeid. |
|
(6) |
Väga suuremõõduliste kalade puhul on proovivõttu vaja täpsustada, et tagada ühetaoline toimimine kogu liidu ulatuses. |
|
(7) |
Sama liiki ja samast piirkonnast pärinevates kalades võib dioksiinide, dioksiinitaoliste PCBde ja mittedioksiinitaoliste PCBde sisaldus olla sõltuvalt kalade suurusest ja/või vanusest erinev. Ka ei tarvitse olla dioksiinide, dioksiinitaoliste PCBde ja mittedioksiinitaoliste PCBde sisaldus kala kõikides osades ühesugune. Seepärast tuleb proovide võtmise ja valmistamise viis täpselt kindlaks määrata, et tagada ühetaoline toimimine kogu Euroopa Liidus. |
|
(8) |
On tähtis, et analüüsitulemustest teatataks ja neid tõlgendataks ühtmoodi, et tagada ühtne rakendamine kogu Euroopa Liidus. |
|
(9) |
Seoses tehnika arenguga on selgunud, et lisaks gaasikromatograafiale-kõrge lahutusvõimega massispektromeetriale (GC-HRMS) on võimalik kasutada piirnormi nõude vastavuse kinnitava meetodina gaasikromatograafiat-tandemmassispektromeetriat (GC-MS/MS). Seetõttu tuleks määrus (EL) nr 252/2012 asendada uue määrusega, milles sätestatakse, et gaasikromatograafia-tandemmassispektromeetria (GC-MS/MS) on asjakohane kinnitav meetod piirnormile vastavuse kontrollimiseks. |
|
(10) |
Käesoleva määrusega ettenähtud meetmed on kooskõlas toiduahela ja loomatervishoiu alalise komitee arvamusega, |
ON VASTU VÕTNUD KÄESOLEVA MÄÄRUSE:
Artikkel 1
Käesolevas määruses kasutatakse I lisas sätestatud mõisteid ja lühendeid.
Artikkel 2
Määruse (EÜ) nr 1881/2006 lisa 5. jaos loetletud toiduainete polüklorodibensodioksiinide, polüklorodibensofuraanide ning polüklorodibensodioksiinitaoliste ja mittepolüklorodibensodioksiinitaoliste polüklorobifenüülide sisalduse kontrollimiseks tuleb proovid võtta käesoleva määruse II lisas sätestatud viisil.
Artikkel 3
Määruse (EÜ) nr 1881/2006 lisa 5. jaos loetletud toiduainete polüklorodibensodioksiinide, polüklorodibensofuraanide ning polüklorodibensodioksiinitaoliste polüklorobifenüülide sisalduse kontrollimiseks tuleb proovid valmistada ja neid analüüsida käesoleva määruse III lisas sätestatud viisil.
Artikkel 4
Määruse (EÜ) nr 1881/2006 lisa 5. jaos loetletud toiduainete mittedioksiinitaoliste PCBde sisalduse kontrollimiseks tuleb teha analüüsid vastavalt käesoleva määruse IV lisas sätestatud analüüsimeetoditele.
Artikkel 5
Määrus (EL) nr 252/2012 tunnistatakse kehtetuks.
Viiteid kehtetuks tunnistatud määrusele käsitatakse viidetena käesolevale määrusele.
Artikkel 6
Käesolev määrus jõustub kahekümnendal päeval pärast selle avaldamist Euroopa Liidu Teatajas.
Käesolev määrus on tervikuna siduv ja vahetult kohaldatav kõikides liikmesriikides.
Brüssel, 2. juuni 2014
Komisjoni nimel
president
José Manuel BARROSO
(1) ELT L 165, 30.4.2004, lk 1.
(2) Komisjoni 19. detsembri 2006. aasta määrus (EÜ) nr 1881/2006, millega sätestatakse teatavate saasteainete piirnormid toiduainetes (ELT L 364, 20.12.2006, lk 5).
(3) Komisjoni 3. detsembri 2013. aasta soovitus 2013/711/EL dioksiinide, furaanide ja polüklooritud bifenüülide (PCBde) sisalduse vähendamise kohta söödas ja toiduainetes (ELT L 323, 4.12.2013, lk 37).
(4) Komisjoni 21. märtsi 2012. aasta määrus (EL) nr 252/2012, millega sätestatakse proovivõtu- ja analüüsimeetodid dioksiinide, dioksiinitaoliste PCBde ja mittedioksiinitaoliste PCBde sisalduse ametlikuks kontrollimiseks teatavates toiduainetes ning tunnistatakse kehtetuks määrus (EÜ) nr 1883/2006 (ELT L 84, 23.3.2012, lk 1).
(5) Nõukogu 29. aprilli 1996. aasta direktiiv 96/23/EÜ, millega nähakse ette teatavate ainete ja nende jääkide kontrollimise meetmed elusloomades ja loomsetes toodetes ning tunnistatakse kehtetuks direktiivid 85/358/EMÜ ja 86/469/EMÜ ning otsused 89/187/EMÜ ja 91/664/EMÜ (EÜT L 125, 23.5.1996, lk 10).
(6) Komisjoni 23. veebruar 1998. aasta otsus 98/179/EÜ, millega kehtestatakse teatavate elusloomades ja loomsetes toodetes esinevate ainete ja ainejääkide seire üksikasjalikud ametliku proovide võtmise eeskirjad (EÜT L 65, 5.3.1998, lk 31).
I LISA
MÕISTED JA LÜHENDID
I. MÕISTED
Käesolevas määruses kasutatakse komisjoni 14. augusti 2002. aasta otsuse 2002/657/EÜ (millega rakendatakse nõukogu direktiivi 96/23/EÜ analüüsimeetodite tulemuslikkuse ja tulemuste tõlgendamise osas) (1) I lisas sätestatud mõisteid.
Lisaks osutatud mõistetele kasutatakse käesolevas määruses järgmisi mõisteid.
1.1. „Häiretase”— soovituse 2013/711/EL lisas sätestatud asjaomase aine sisaldus, mille puhul algatatakse uurimine, et teha kindlaks aine allikas juhtudel, kui leitakse, et aine sisaldus on suurenenud.
1.2. „Sõeluuringumeetodid”— meetodid selliste proovide väljaselgitamiseks, mille PCDD/Fide ja dioksiinitaoliste PCBde sisaldus ületab piirnormi või häiretaseme. Sõeluuringumeetod peab võimaldama kulutõhusalt töödelda suurt proovide hulka, millega suureneb tarbijate jaoks suurt kokkupuute- ja terviseriski kujutavate uute juhtumite avastamise tõenäosus. Sõeluuringumeetodid peaksid põhinema bioanalüütilistel meetoditel või GC-MS-il. Piirnormi nõude täitmise osas kontrollitakse künnist ületavate proovide tulemusi täieliku kordusanalüüsiga esialgsest proovist, kasutades kinnitavat meetodit.
1.3. „Kinnitavad meetodid”— meetodid, mis annavad täielikku või täiendavat teavet PCDD/Fide ja dioksiinitaoliste PCBde üheseks määramiseks ja sisalduse kindlakstegemiseks vastavalt piirnormile või vajaduse korral häiretasemele. Selliste meetodite puhul kasutatakse gaasikromatograafiat ja kõrge lahutusvõimega massispektromeetriat (GC-HRMS) või gaasikromatograafiat ja tandem-massispektromeetriat (GC-MS/MS).
1.4. „Bioanalüütilised meetodid”— bioloogilistele põhimõtetele tuginevad meetodid, mille puhul kasutatakse nt rakupõhiseid, retseptor- ja immuunanalüüse. Sellised meetodid ei anna tulemusi analoogi tasandil, vaid toksilisusekvivalendi (TEQ) väärtuse, (2) mis väljendatakse bioanalüütilistes ekvivalentides (BEQdes), kuna kõik prooviekstraktis leiduvad ühendid, mille reaktsioon ilmneb analüüsis, ei allu TEQ põhimõtte nõuetele.
1.5. „Bioanalüüsi näiline saagis”— BEQ väärtus, mis arvutatakse tetraklorodibenso-p-dioksiini (TCDD) või PCB 126 kaliibrimiskõvera alusel, mida korrigeeritakse tühiprooviga ja mis jagatakse seejärel kinnitava meetodi abil määratud TEQ väärtusega. Sellega püütakse korrigeerida selliseid tegureid nagu PCDD/Fide ning dioksiinitaoliste ühendite kadu ekstraheerimisel ja puhastamisel, kaasa ekstraheeruvate ühendite mõju, millega tulemus suureneb või väheneb (agonistlik ja antagonistlik toime), kaliibrimiskõvera sobivus ning toksilisusfaktori (TEF) väärtuste ja suhtelise potentsuse (REP) väärtuste lahknevus. Bioanalüüsi näiline saagis arvutatakse sobivate etalonproovide alusel, milles esinduslike analoogide sisaldus ligikaudu vastab ainete sisalduse vahekorrale proovis ning on ligikaudu piirnormile või häiretasemele vastava sisaldusega
1.6. „Poolkvantitatiivsed meetodid”— meetodid, mis näitavad oletatava määratava aine ligikaudset sisaldust, kuigi numbrilised tulemused ei vasta kvantitatiivse meetodi nõuetele.
1.7. „Üksikanaloogi sisalduse aktsepteeritav määramispiir”— väikseim analüüdisisaldus, mida saab mõistliku statistilise usaldusväärsusega määrata ning mis vastab määramiskriteeriumidele, mis on sätestatud rahvusvaheliselt tunnustatud standardites, nagu standard EN 16215:2012 „Animal feed — Determination of dioxins and dioxin-like PCBs by GC/HRMS and of indicator PCBs by GC/HRMS” („Loomasööt — dioksiinide ja dioksiinitaoliste PCBde sisalduse määramine gaasikromatograafia/kõrglahutus-massispektromeetria (GC/HRMS) abil ning indikaator-PCBde sisalduse määramine GC/HRMSi abil”) ja/või EPA meetodid 1613 ja 1668 (läbivaadatud).
Üksikanaloogi sisalduse määramispiiri võib sätestada järgmiselt:
|
a) |
selline prooviekstraktis leiduva analüüdi sisaldus, mis annab kahe mõõdetava iooni jaoks mõõtmistulemuse, mille puhul nõrgema töötlemata andmesignaali signaali ja müra suhe on 3: 1; või kui tehnilistel põhjustel signaali ja müra suhte arvutus ei anna usaldusväärset tulemust, |
|
b) |
väikseima sisaldusega punkt kaliibrimiskõveral, mille puhul saadakse vastuvõetav (≤ 30 %) ja eesmärgipärane (mõõdetud vähemalt proovide analüüsiseeria alguses ja lõpus) kõrvalekalle keskmisest suhtelisest tulemustegurist, mis on arvutatud iga proovisarja kõikide kaliibrimiskõvera punktide järgi (3). |
1.8. „Ülemine tõke”— põhimõte, mille kohaselt iga määramata sisaldusega analoogi korral loetakse tulemus võrdseks määramispiiriga.
1.9. „Alumine tõke”— põhimõte, mille kohaselt iga määramata sisaldusega analoogi korral loetakse tulemus võrdseks nulliga.
1.10. „Vaheväärtus”— põhimõte, mille kohaselt iga määramata sisaldusega analoogi korral tulemus võetakse võrdseks poolega määramispiiri väärtusest.
1.11. „Partii”— eristatav toidukogus, mis on tarnitud korraga ning mille puhul ametnik on kindlaks teinud ühised omadused, nagu päritolu, sort, pakkimisviis, pakkija, saatja või märgistused. Kala ja kalandustoodete puhul peab olema võrreldav ka kalade suurus. Kui kalade suurus ja/või kaal ei ole saadetise ulatuses võrreldav, võib saadetist siiski käsitada partiina, kuid kohaldada tuleb spetsiaalset proovivõtumenetlust.
1.12. „Osapartii”— suure partii kindlaksmääratud osa, millest proovivõtumeetodi kohaselt võetakse proov. Iga osapartii peab olema füüsiliselt eraldatud ja kindlakstehtav.
1.13. „Osaproov”— partii või osapartii ühest kohast võetud proov.
1.14. „Lähteproov”— kõikide partiist või osapartiist võetud osaproovide kogum.
1.15. „Laboriproov”— lähteproovist labori jaoks eraldatud esinduslik kogus/osa.
II. KASUTATUD LÜHENDID
|
BEQ |
bioanalüütilised ekvivalendid |
|
GC |
gaasikromatograafia |
|
HRMS |
kõrglahutus-massispektromeetria |
|
LRMS |
väikese lahutusvõimega massispektromeetria |
|
MS/MS |
tandem-massispektromeetria |
|
PCBd |
polüklooritud bifenüülid |
|
PCDDD |
polüklorodibenso-p-dioksiinid |
|
PCDFid |
polüklorodibensofuraanid |
|
QC |
kvaliteedikontroll |
|
REP |
suhteline potentsus |
|
TEF |
toksilisuse ekvivalentfaktor |
|
TEQ |
toksilisusekvivalent |
|
TCDD |
tetraklorodibensodioksiin |
|
U |
laiendatud mõõtemääramatus |
(1) Komisjoni 14. augusti 2002. aasta otsus 2002/657/EÜ, millega rakendatakse nõukogu direktiivi 96/23/EÜ analüüsimeetodite tulemuslikkuse ja tulemuste tõlgendamise osas (ELT L 221, 17.8.2002, lk 8).
(2) Bioanalüütiliste meetoditega ei saa määrata spetsiifiliselt toksilisusfaktori (TEF) süsteemi kuuluvaid analooge, sest prooviekstrakt võib sisaldada muid sarnase struktuuriga AhR-aktiivseid ühendeid, mis mõjutavad üldist tulemust. Seega ei saa bioanalüütilist tulemust pidada TEQ taseme hinnanguks, pigem on see viide TEQ võimalikule tasemele proovis.
(3) Määramispiir LOQ arvutatakse väikseima sisalduse järgi, võttes arvesse sisestandardite saagist ja suhtelist proovikogust.
II LISA
PROOVIVÕTUMEETODID DIOKSIINIDE (PCDD/PCDF), DIOKSIINITAOLISTE PCBde JA MITTEDIOKSIINITAOLISTE PCBde SISALDUSE AMETLIKUKS KONTROLLIMISEKS TEATAVATES TOIDUAINETES
I. REGULEERIMISALA
Proovid dioksiinide (PCDD/PCDF), dioksiinitaoliste PCBde ja mittedioksiinitaoliste PCBde (edaspidi koos „dioksiinid ja PCBd”) sisalduse ametlikuks kontrollimiseks toiduainetes tuleb võtta käesolevas lisas kirjeldatud meetodite kohaselt. Selliselt võetud lähteproove käsitatakse selle partii või osapartii esinduslike proovidena, millest need on võetud. Komisjoni määruses (EÜ) nr 1881/2006 (millega sätestatakse teatavate saasteainete piirnormid toiduainetes) sätestatud piirnormidele vastavust kontrollitakse laboriproovides määratud sisalduste alusel.
II. ÜLDSÄTTED
1. Töötajad
Proove võtab liikmesriigi määratud volitatud isik.
2. Materjal, millest proovid võetakse
Igast uuritavast partiist või osapartiist võetakse proovid eraldi.
3. Ettevaatusabinõud
Proovide võtmise ja ettevalmistamise käigus võetakse tarvitusele ettevaatusabinõud, et vältida muutusi, mis võivad mõjutada dioksiinide ja PCBde sisaldust, kahjustada analüüsi tulemusi või muuta lähteproovid mitteesinduslikuks.
4. Osaproovid
Võimaluse korral võetakse osaproovid kogu partii või osapartii ulatuses eri kohtadest. Kõrvalekaldumine sellest reeglist tuleb märkida käesoleva lisa II punkti alapunktis 8 ette nähtud protokolli.
5. Lähteproovi valmistamine
Lähteproov saadakse osaproovide ühendamise teel. Lähteproovi mass peab olema vähemalt 1 kg, välja arvatud juhul, kui see ei ole otstarbekas, näiteks kui proov on üksikpakend või kui tootel on väga suur kaubanduslik väärtus.
6. Paralleelproovid
Eeskirjade täitmise tagamiseks, kaitse- ja vahekohtumenetluse eesmärgil võetakse paralleelproovid ühtlustatud lähteproovist, välja arvatud juhul, kui see on vastuolus liikmesriigi eeskirjades kajastatud toidukäitleja õigustega. Eeskirjade täitmise tagamiseks võetavad laboriproovid peavad olema piisavalt suured, et oleks võimalik vähemalt kordusanalüüse teha.
7. Proovide pakkimine ja transport
Iga proov asetatakse puhtasse, inertsest materjalist nõusse, milles proov on kaitstud saastumise eest, määratava aine kao eest (määratav aine ei tohi adsorbeeruda nõu siseseina) ja transpordi ajal tekkida võivate kahjustuste eest. Tuleb võtta kõik vajalikud ettevaatusabinõud, et vältida proovi koostise muutumist transpordi või säilitamise ajal.
8. Proovide pitseerimine ja märgistamine
Iga ametlikuks kasutamiseks võetud proov pitseeritakse proovivõtukohas ja tähistatakse vastavalt liikmesriikide eeskirjadele.
Iga proovivõtt protokollitakse ja protokoll säilitatakse, et oleks võimalik iga partiid üheselt kindlaks teha; protokolli märgitakse proovivõtu aeg ja koht ning muu lisateave, mis võib analüüsi tegijale abiks olla.
III. PROOVIVÕTUKAVA
Kasutatav proovivõtumeetod peab tagama, et lähteproov oleks kontrollitava (osa)partii esinduslik proov.
1. Partiide jagamine osapartiideks
Suured partiid tuleb jagada osapartiideks tingimusel, et osapartiid oleks võimalik füüsiliselt eraldada. Suurte mahtkaubasaadetistena turustatavate toodete puhul (nt taimeõlid) kohaldatakse tabelit 1. Muude toodete puhul kohaldatakse tabelit 2. Võttes arvesse seda, et partii mass ei ole alati osapartiide massi täiskordne, võib osapartii mass ületada ettenähtud massi kuni 20 %.
Tabel 1
Mahtkaubasaadetistena turustatavate toodete partiide jagamine osapartiideks
|
Partii mass (tonnides) |
Osapartiide mass või arv |
|
≥ 1 500 |
500 tonni |
|
> 300 ja < 1 500 |
3 osapartiid |
|
≥ 50 ja ≤ 300 |
100 tonni |
|
< 50 |
– |
Tabel 2
Muude toodete partiide jagamine osapartiideks
|
Partii mass (tonnides) |
Osapartiide mass või arv |
|
≥ 15 |
15–30 tonni |
|
< 15 |
— |
2. Osaproovide arv
Kõikide osaproovide liitmisel saadud lähteproovi mass peab olema vähemalt 1 kg (vt käesoleva lisa II punkti alapunkt 5).
Partiist või osapartiist võetavate osaproovide miinimumarv on esitatud tabelites 3 ja 4.
Müügipakendita turustatavate vedelate toodete puhul segatakse partii või osapartii vahetult enne proovivõtmist kas käsitsi või mehaaniliselt võimalikult põhjalikult läbi, jälgides et see ei mõjuta toote kvaliteeti. Sellisel juhul eeldatakse, et saasteainete jaotus asjaomases partiis või osapartiis on ühtlane. Seepärast piisab, kui lähteproovi jaoks võetakse partiist või osapartiist kolm osaproovi.
Osaproovid peavad olema ühesuguse massiga. Osaproovi mass peab olema vähemalt 100 grammi.
Kõrvalekaldumine sellest menetlusest tuleb märkida käesoleva lisa II punkti alapunktis 8 ette nähtud protokolli. Kooskõlas otsusega 97/747/EÜ (millega määratakse kindlaks nõukogu direktiiviga 96/23/EÜ ettenähtud proovide võtmise mahud ja sagedused teatavate loomsetes toodetes esinevate ainete ja ainejääkide seireks) on kanamunade puhul lähteproovi suurus vähemalt 12 muna (pakendamata ja üksikutest pakenditest koosnevate mahtkaubasaadetise partiide puhul kohaldatakse tabeleid 3 ja 4).
Tabel 3
Partiist või osapartiist võetavate osaproovide miinimumarv
|
Partii/osapartii mass või maht (kilogrammides või liitrites) |
Võetavate osaproovide miinimumarv |
|
< 50 |
3 |
|
50–500 |
5 |
|
> 500 |
10 |
Kui partii või osapartii koosneb üksikutest pakenditest või ühikutest, on lähteproovi saamiseks võetavate pakendite või ühikute arv tabelis 4 esitatud pakendite või ühikute arv.
Tabel 4
Lähteproovi jaoks võetavate pakendite või ühikute (osaproovide) arv, kui partii või osapartii koosneb üksikpakenditest või ühikutest
|
Pakendite või ühikute arv partiis/osapartiis |
Võetavate pakendite või ühikute arv |
|
1–25 |
vähemalt 1 pakend või ühik |
|
26–100 |
ligikaudu 5 %, kuid vähemalt 2 pakendit või ühikut |
|
> 100 |
ligikaudu 5 %, kuid mitte rohkem kui 10 pakendit või ühikut |
3. Võrreldava suuruse ja massiga terveid kalu sisaldavatest partiidest proovide võtmise erinõuded
Kalad on võrreldava suuruse ja massiga, kui suuruse ja massi vahe ei ületa 50 %.
Partiist võetavate osaproovide arv on esitatud tabelis 3. Kõikidest osaproovidest moodustatud lähteproovi mass peab olema vähemalt 1 kg (vt II punkti alapunkt 5).
|
— |
Kui uuritav partii koosneb väikestest kaladest (ühe kala mass on alla 1 kg), võetakse lähteproovi saamiseks osaproovideks terveid kalu. Kui lähteproovi kaal on üle 3 kg, võib lähteproovi koostamiseks osaproovideks võtta kalade keskmised osad, mis kaaluvad vähemalt 100 grammi. Proovi homogeniseerimiseks kasutatakse üldkogust, mille suhtes kohaldatakse piirnormi. Kala keskmine osa on see osa, milles asub kala raskuskese. See asub enamasti seljauime kohal (kui kalal on seljauim) või lõpuseava ja päraku vahelise tüki keskel. |
|
— |
Kui uuritav partii koosneb suurematest kaladest (ühe kala mass on üle 1 kg), võetakse osaproov kala keskmisest osast. Iga osaproov peab kaaluma vähemalt 100 grammi. Keskmise suurusega kalade puhul (massiga umbes 1–6 kg) võetakse osaprooviks selgroost kõhuni ulatuv lõik kala keskmises osas. Väga suurtest kaladest (massiga üle 6 kg) võetakse osaproov (eestvaates) parempoolsest külgmisest seljalihasest kala keskmises osas. Kui kala keskmisest osast sellise tüki eraldamine tekitaks olulist majanduslikku kahju, peetakse partii suurusest olenemata piisavaks kolme vähemalt 350 g osaproovi võtmist; teise võimalusena võib võtta ühe ja sama kala sabaosa lähedalt lihasmassi ja peaosa lähedalt võrdse koguse lihasmassi, et saada osaproov, mida loetakse terve kala dioksiinisisalduse määramisel esinduslikuks. |
4. Proovide võtmine eri suuruse ja/või massiga terveid kalu sisaldavatest partiidest
|
— |
Proovide võtmise suhtes kohaldatakse III punkti alapunkti 3. |
|
— |
Kui teatud suurus- või massiklass/-kategooria on ülekaalus (ligikaudu 80 % või rohkem partiist), võetakse proov ülekaalus olevasse suurus- või massiklassi/-kategooriasse kuuluvatest kaladest. Sellist proovi peetakse kogu partii esinduslikuks prooviks. |
|
— |
Kui ükski suurus- või massiklass/-kategooria ei ole ülekaalus, tuleb tagada, et proovi jaoks valitud kalad on partii suhtes esinduslikud. Erijuhised sellisteks juhtumiteks on esitatud dokumendis „Guidance on sampling of whole fishes of different size and/or weight” (1) („Juhised eri suuruse ja/või massiga tervetest kaladest proovide võtmiseks”). |
5. Proovide võtmine jaemüügijärgus
Jaemüügijärgus tuleb võimaluse korral toiduainetest proove võtta kooskõlas käesoleva lisa III punkti alapunkti 2 sätetega.
Kui see ei ole võimalik, võib jaemüügijärgus kasutada alternatiivseid proovivõtumeetodeid tingimusel, et need tagavad uuritava partii või osapartii suhtes piisava esinduslikkuse.
IV. PARTII VÕI OSAPARTII NÕUETEKOHASUS
1. MITTEDIOKSIINITAOLISED PCBD
Partii loetakse nõuetele vastavaks, kui analüüsi tulemus ei ületa määruses (EÜ) nr 1881/2006 sätestatud mittedioksiinitaoliste PCBde sisalduse piirnormi, võttes arvesse mõõtemääramatust.
Partii ei vasta määruses (EÜ) nr 1881/2006 sätestatud piirnormile, kui kordusanalüüsiga kinnitatud (2) analüüsitulemuse ülemine tõke on mõõtemääramatust arvesse võttes ilma kahtluseta kõrgem kui piirnorm. Nõuetele vastavuse hindamisel kasutatakse kahe analüüsi keskmist, võttes arvesse mõõtemääramatust.
Mõõtemääramatust võib arvestada ühel järgmistest viisidest:
|
— |
arvutatakse laiendatud mõõtemääramatus, kasutades kattetegurit 2, mis tagab ligikaudu 95 %-se usaldusväärsuse. Partii või osapartii ei ole nõuetekohane, kui mõõdetud väärtus, millest lahutatakse U, ületab lubatud normi, |
|
— |
vastavalt komisjoni otsusele 2002/657/EÜ (otsuse I lisa punkt 3.1.2.5 — ained, mille kohta on kehtestatud lubatud piirnormid) määratakse kindlaks otsustuspiir (CCα, decision limit [osutatud otsuse tõlkes „määramispiir”]). Partii või osapartii ei vasta nõuetele, kui mõõdetud väärtus võrdub CCα-ga või on sellest suurem. |
Eespool esitatud eeskirju kohaldatakse ametlikuks kontrollimiseks ette nähtud proovide analüüsitulemuste suhtes. Kaitse või võrdluse eesmärgil tehtavate analüüside puhul kohaldatakse siseriiklikke eeskirju.
2. DIOKSIINID (PCDD/PCDF) JA DIOKSIINITAOLISED PCBD
Partiid peetakse nõuetele vastavaks, kui ühe analüüsi tulemus,
|
— |
mis on saadud sõeluuringumeetodiga, mille valenegatiivsete tulemuste määr on alla 5 %, näitab, et sisaldus ei ületa asjaomast määruses (EÜ) nr 1881/2006 sätestatud dioksiinide (PCDD/PCDF) piirnormi ega dioksiinide ja dioksiinitaoliste PCBde summa piirnormi, |
|
— |
mis on saadud kinnitava meetodiga, näitab, et sisaldus ei ületa asjaomast määruses (EÜ) nr 1881/2006 sätestatud dioksiinide (PCDD/PCDF) piirnormi ega dioksiinide ja dioksiinitaoliste PCBde summa piirnormi, kui võetakse arvesse mõõtemääramatust. |
Sõeluuringu puhul tuleb määrata kindlaks künnis, mille järgi otsustatakse, kas proov vastab kas dioksiinide (PCDD/PCDF) või dioksiinide ja dioksiinitaoliste PCBde summa jaoks kindlaks määratud piirnormile.
Partii ei vasta määruses (EÜ) nr 1881/2006 sätestatud piirnormile, kui kinnitava meetodi abil saadud analüüsitulemuse ülemine tõke, mida kinnitab kordusanalüüs (3), on mõõtemääramatust arvesse võttes ilma kahtluseta kõrgem kui piirnorm. Nõuetele vastavuse hindamisel kasutatakse kahe analüüsi keskmist, arvesse võttes mõõtemääramatust.
Mõõtemääramatust võib arvesse võtta ühel järgmistest viisidest:
|
— |
arvutatakse laiendatud mõõtemääramatus, kasutades kattetegurit 2, mis tagab ligikaudu 95 %-se usaldusväärsuse. Partii või osapartii ei vasta nõuetele, kui mõõdetud väärtus, millest lahutatakse U, ületab lubatud normi. Kui PCDD/Fide ja dioksiinitaoliste PCBde sisaldus määratakse eraldi, tuleb PCDD/Fide ja dioksiinitaoliste PCBde summa hinnangulise laiendatud mõõtemääramatusena kasutada PCDD/Fide tulemuse ja dioksiinitaoliste PCBde tulemuse hinnanguliste laiendatud mõõtemääramatuste summat, |
|
— |
vastavalt otsusele 2002/657/EÜ (otsuse I lisa punkt 3.1.2.5 — ained, mille kohta on kehtestatud lubatud piirnormid) määratakse kindlaks otsustuspiir (CCα); partii või osapartii ei vasta nõuetele, kui mõõdetud väärtus võrdub CCα-ga või on sellest suurem. |
Eespool esitatud eeskirja kohaldatakse ametlikuks kontrollimiseks ettenähtud proovide analüüsitulemuste suhtes. Kaitse või võrdluse eesmärgil tehtavate analüüside puhul kohaldatakse siseriiklikke eeskirju.
V. HÄIRETASEME ÜLETAMINE
Häiretasemete järgi valitakse proove juhul, kui on vaja kindlaks teha saasteallikas ja võtta meetmeid saastamise vähendamiseks või kõrvaldamiseks. Sõeluuringumeetodiga tehakse kindlaks selliste proovide valimiseks sobivad künnised. Kui saasteallika kindlakstegemiseks ja saastamise vähendamiseks või kõrvaldamiseks on vaja teha suuri jõupingutusi, võib olla asjakohane teha häiretaseme ületamise kontrollimiseks kinnitava meetodiga kordusanalüüs ja võtta arvesse mõõtemääramatust (3).
(1) http://ec.europa.eu/food/food/chemicalsafety/contaminants/dioxins_en.htm
(2) Kordusanalüüs tuleb teha siis, kui asjaomaste analüütide esimene määramine (kasutades kinnitavat meetodit 13C-märgisega sisestandardiga) ei anna vastavust kinnitavat tulemust. Kordusanalüüs on vajalik, et välistada sisemise ristsaastumise või proovide juhusliku segiajamise võimalust. Juhul kui analüüse tehakse seoses teadaoleva saastumisjuhtumiga, võidakse kinnitav kordusanalüüs tegemata jätta, kui analüüsiks võetud proovid on jälgitavalt seotud kõnealuse saastumisjuhtumiga ning saadud sisaldus on tunduvalt üle piirnormi.
(3) Häiretasemete kontrollimiseks tehtava kordusanalüüsi suhtes kehtivad samad selgitused ja nõuded, nagu on esitatud joonealuses märkuses (*) piirnormide kohta.
III LISA
PROOVI VALMISTAMINE JA TEATAVATES TOIDUAINETES LEIDUVATE DIOKSIINIDE (PCDDd/PCDFid) JA DIOKSIINITAOLISTE PCBde SISALDUSE AMETLIKUKS KONTROLLIMISEKS KASUTATAVATE ANALÜÜSIMEETODITE NÕUDED
1. KOHALDAMISALA
Käesolevas lisas sätestatud nõudeid kohaldatakse toiduainete analüüsimisel 2,3,7,8-asendatud polüklorodibenso-p-dioksiinide ja polüklorodibensofuraanide (PCDD/Fid) ning dioksiinitaoliste polüklooritud bifenüülide (dioksiinitaolised PCBd) sisalduse ametlikuks kontrollimiseks ja muudel regulatiivsetel eesmärkidel.
PCDD/Fide ja dioksiinitaoliste PCBde esinemist toiduainetes võib kontrollida kahe eri liiki analüüsimeetodiga.
|
a) |
Sõeluuringumeetodid Sõeluuringumeetodite eesmärk on selliste proovide väljaselgitamine, mille PCDD/Fide ja dioksiinitaoliste PCBde sisaldus ületab piirnormi või häiretaseme. Sõeluuringumeetoditega peaks olema võimalik kulutõhusalt töödelda suurt proovide hulka, et selliste meetodite abil kasvaks tarbijate jaoks suurt kokkupuute- ja terviseriski kujutavate uute juhtumite avastamise tõenäosus. Nende kasutamisel tuleks sihiks seada valenegatiivsete tulemuste vältimine. Sõeluuringumeetodid võivad hõlmata bioanalüütilisi ja GC/MSi meetodeid. Sõeluuringumeetoditega võrreldakse analüüsitulemusi künnisega ning saadakse jaatav või eitav vastus selle kohta, kas on ületatud piirnormi või häiretaset. Mittevastavuse kahtlusega proovides leiduvate PCDD/Fide sisaldus ning PCDD/Fide ja dioksiinitaoliste PCBde sisalduse summa tuleb määrata ja kinnitada kinnitava meetodi abil. Lisaks sellele võib sõeluuringumeetoditega saada proovis leiduvate PCDD/Fide ja dioksiinitaoliste PCBde sisalduse hinnangu. Bioanalüütiliste sõeluuringumeetodite puhul väljendatakse tulemus bioanalüütilistes ekvivalentides (BEQdes), füüsikalis-keemiliste GC-MS-meetodite puhul toksilisusekvivalentides (TEQ). Sõeluuringumeetoditega saadud numbriliste tulemustega saab näidata nõuetekohasust, nõuetele mittevastavust ja häiretaseme ületamist ning need annavad näitajate vahemiku hinnangu kinnitavate meetoditega kontrollimiseks. Need meetodid ei sobi tausttaseme ja tarbitavate annuste hindamiseks, sisalduse ajalise muutumise uurimiseks ning häiretaseme ja piirnormi ümberhindamiseks. |
|
b) |
Kinnitavad meetodid Kinnitavate meetoditega on võimalik üheselt määrata PCDD/Fe ja dioksiinitaolisi PCBsid ning leida nende sisaldust proovis ning saada täielik teave analoogide kohta. Seega saab selliste meetoditega kontrollida piirnorme ja häiretasemeid, sealhulgas kinnitada sõeluuringumeetoditega saadud tulemusi. Lisaks võib tulemusi kasutada muudel eesmärkidel, nagu väikese taustsisalduse määramine toiduainete seires, ajaliste suundumuste jälgimine, elanikkonna kokkupuute hindamine ning andmebaasi loomine võimalikuks häiretasemete ja piirnormide ümberhindamiseks. Need meetodid on olulised ka analoogide kombinatsioonide kindlakstegemiseks, et tuvastada võimalik saasteallikas. Nende meetodite puhul kasutatakse GC-HRMSi. Piirnormi nõudele vastavuse või mittevastavuse kinnitamiseks võib kasutada ka GC-MS/MSi. |
2. TAUST
Toksilisusekvivalentides (TEQdes) väljendatud sisalduste arvutamiseks korrutatakse üksikute ainete sisaldused asjaomases proovis vastava toksilisuse ekvivalentfaktoriga (TEF), mille on kindlaks määranud Maailma Terviseorganisatsioon (WHO) ja mis on loetletud käesoleva lisa liites, ja liidetakse seejärel kokku, et saada TEQdes väljendatud dioksiinitaoliste ühendite üldsisaldus.
Sõeluuringu- ja kinnitavaid meetodeid saab kasutada uuritavas materjalis sisalduse kontrollimiseks ainult sel juhul, kui kõnealused meetodid on piisavalt tundlikud, et häiretasemele või piirnormile vastavat sisaldust usaldusväärselt kindlaks teha.
3. KVALITEEDI TAGAMISE NÕUDED
|
— |
Igas proovivõtu- ja analüüsijärgus tuleb võtta meetmed ristsaastumise vältimiseks. |
|
— |
Proove tuleb säilitada ja transportida säilitamiseks sobivates klaas-, alumiinium-, polüpropüleen- või polüetüleennõudes, mis ei mõjuta proovide PCDD/Fide ja dioksiinitaoliste PCBde sisaldust. Paberitolmu jäägid tuleb proovinõust eemaldada. |
|
— |
Proove tuleb säilitada ja transportida nii, et toiduproovi koostises ei toimuks muutusi. |
|
— |
Vajaduse korral laboriproov jahvatatakse ja segatakse põhjalikult meetodil, mis tagab täielikult homogeense proovi (näiteks jahvatatakse proov nii peeneks, et see läheks läbi 1 mm suuruste avadega sõela); kui proovi niiskusesisaldus on liiga suur, tuleb seda enne jahvatamist kuivatada. |
|
— |
Tähtis on kontrollida, et reaktiivid, klaasnõud ja seadmed ei mõjutaks TEQdes või BEQdes väljendatud tulemusi. |
|
— |
Tuleb teha tühikatse, mille puhul läbitakse kõik analüüsijärgud ilma proovita. |
|
— |
Bioanalüütiliste meetodite puhul on väga tähtis kontrollida, et ükski analüüsil kasutatav klaasnõu ega lahusti ei sisaldaks ühendeid, mis segavad uuritava ühendi avastamist töövahemikus. Klaasnõu tuleb loputada lahustitega ja/või kuumutada temperatuuril, mis sobib PCDD/Fide, dioksiinitaoliste ühendite ja segavate ühendite jääkide eemaldamiseks selle pinnalt. |
|
— |
Ekstraheeritava proovi suurus peab olema piisav, et see vastaks nõuetele, mida kohaldatakse piisavalt madala tööpiirkonna korral, sh piirnormile ja häiretasemele vastava sisalduse puhul. |
|
— |
Uuritavatest toodetest võetud proovide ettevalmistamiseks kasutatavate konkreetsete meetodite puhul tuleb järgida rahvusvaheliselt tunnustatud juhiseid. |
|
— |
Kaladelt tuleb eemaldada nahk, sest piirnormi kohaldatakse nahata lihasmassi suhtes. Kõik lihas- ja rasvkoe jäägid tuleb naha sisepinnalt siiski hoolikalt ja täielikult maha kaapida ning lisada analüüsitava proovi hulka. |
4. LABORITE NÕUDED
|
— |
Vastavalt Euroopa Parlamendi ja nõukogu määrusele (EÜ) nr 882/2004 (1) peavad laborid olema ISO juhendi 58 kohaselt tegutseva tunnustatud asutuse poolt akrediteeritud, millega tagatakse, et nad kohaldavad analüüsimisel kvaliteeditagamissüsteemi. Laborid akrediteeritakse standardi EN ISO/IEC 17025 kohaselt. |
|
— |
Labori pädevust tuleb tõendada pideva eduka osalemisega laboritevahelistes uuringutes, mida korraldatakse PCDD/Fide ja dioksiinitaoliste PCBde sisalduse määramiseks asjaomastes toiduainetes ja sisaldusvahemikes. |
|
— |
Laborid, kes kasutavad proovide tavakontrolliks sõeluuringumeetodeid, peavad tegema nii kvaliteedi kontrollimisel kui ka saastekahtlusega proovide analüüside kinnitamisel tihedat koostööd kinnitavat meetodit kasutavate laboritega. |
5. DIOKSIINIDE (PCDD/Fide) JA DIOKSIINITAOLISTE PCBde ANALÜÜSIDE PUHUL ESITATAVAD PÕHINÕUDED
5.1. Väikese sisaldusega töövahemik ja määramispiirid
|
— |
PCDD/Fide avastatavad kogused peavad mõne nimetatud ühendi äärmiselt suure toksilisuse tõttu jääma femtogrammide (10– 15g) ülemisse vahemikku. Enamiku PCBde analoogide puhul piisab nanogrammi täpsusega (10– 9g) määramispiirist. Toksilisemate dioksiinitaoliste PCBde analoogide (eriti orto-asendamata analoogide) sisalduse määramiseks peab töövahemiku alumine osa ulatuma pikogrammide (10– 12g) alumiste väärtusteni. |
5.2. Suur selektiivsus (spetsiifilisus)
|
— |
PCDD/Fisid ja dioksiinitaolisi PCBsid peab olema võimalik eristada paljudest muudest kaasa ekstraheeruvatest ja segada võivatest ühenditest, mille sisaldus võib vaatlusaluste analüütide sisaldusega võrreldes olla mitu suurusjärku suurem. Gaasikromatograafia-massispektromeetria (GC-MS) meetodite puhul peab olema võimalik eristada eri analooge, näiteks toksilisi analooge (nt seitseteist 2,3,7,8-asendatud PCDD/Fi ning kaksteist dioksiinitaolist PCBd) muudest analoogidest. |
|
— |
Bioanalüütiliste meetoditega peab olema võimalik määrata uuritavaid ühendeid PCDD/Fide ja/või dioksiinitaoliste PCBde summana. Proove tuleb puhastada, et kõrvaldada ühendid, mis põhjustavad valepositiivseid tulemusi, ja ühendid, mis võivad tulemust vähendada, põhjustades valenegatiivseid tulemusi. |
5.3. Suur mõõtetäpsus (tõesus ja kordustäpsus, bioanalüüsi näiline saagis)
|
— |
GC-MS-meetodite puhul peab määramine andma pädeva hinnangu aine tegeliku sisalduse kohta proovis. Suur mõõtetäpsus (mõõtetäpsus iseloomustab mõõtmise tulemuse ja tegeliku või etteantud mõõdetava väärtuse kooskõla) on vajalik selleks, et vältida analüüsitulemuse tagasilükkamist kindlaksmääratud TEQ väärtuse vähese usaldusväärsuse tõttu. Mõõtetäpsust väljendatakse tõesuse (sertifitseeritud aine analüüsimisel mõõdetud analüüdi sisalduse keskväärtuse ja selle sertifitseeritud väärtuse lahknevus väljendatuna protsentides) ja kordustäpsusena (RSDR on suhteline standardhälve, mis arvutatakse korratavuse tingimustes saadud tulemuste põhjal). |
|
— |
Bioanalüütiliste meetoditega määratakse bioanalüüsi näiline saagis. |
5.4. Valideerimine piirnormi vahemikus ja üldised kvaliteedikontrolli meetmed
|
— |
Labor tõendab valideerimismenetluse ja/või tavaanalüüsiga meetodi tulemuslikkust piirnormi vahemikus, nt 0,5-, 1- ja 2-kordsel piirnormi sisaldusel, kusjuures kordusanalüüsi variatsioonikordaja peab olema vastuvõetava suurusega. |
|
— |
Sisemiste kvaliteedikontrolli meetmetena tuleb teha regulaarseid tühi- ja rikastamiskatseid või analüüsida kontrollproove (võimaluse korral tuleb eelistada sertifitseeritud etalonaineid). Tühi- ja rikastamiskatsete ning kontrollproovide analüüsi kohta tuleb koostada kvaliteedikontrolli kaardid, mille alusel kontrollitakse, kas analüüside tulemuslikkus vastab nõuetele. |
5.5. Määramispiir
|
— |
Bioanalüütilise sõeluuringumeetodi puhul ei ole määramispiiri tingimata vaja määrata, kuid tuleb tõendada, et meetod võimaldab eristada tühikatsel saavutatud väärtust ja künnist. BEQ väärtuse esitamise korral määratakse kindlaks teatamiskünnis, et tegelda proovidega, mis annavad tulemuse kõnealusest künnisest madalamal tasemel. Tuleb tõendada, et teatamiskünnis erineb menetluse tühiproovide väärtusest vähemalt kolm korda ja tulemus jääb töövahemikust allapoole. Seepärast arvutatakse see proovide alusel, mis sisaldavad uuritavaid ühendeid ligikaudu nõutud miinimumsisaldusega, mitte signaali-müra suhte või tühikatse alusel. |
|
— |
Kinnitava meetodi puhul peab määramispiir (LOQ) olema ligikaudu üks viiendik piirnormist. |
5.6. Analüüsikriteeriumid
|
— |
Kinnitava või sõeluuringumeetodi abil usaldusväärsete tulemuste saamiseks peavad TEQ väärtus ja vastav BEQ väärtus piirnormi või häiretaseme vahemikus vastama järgmistele kriteeriumidele, olenemata sellest, kas sellised väärtused määratakse TEQ koguväärtusena (PCDD/Fide ja dioksiinitaoliste PCBde summana) või PCDD/PCDFi ja dioksiinitaoliste PCBde kohta eraldi.
|
5.7. Sõeluuringumeetodi erinõuded
|
— |
Sõeluuringuks võib kasutada nii GC-MSi meetodit kui ka bioanalüütilisi meetodeid. GC-MSi meetodi suhtes kohaldatakse käesoleva lisa punktis 6 sätestatud nõudeid. Rakupõhise bioanalüütilise meetodi erinõuded on sätestatud käesoleva lisa punktis 7. |
|
— |
Laborid, kes kasutavad proovide tavakontrolliks sõeluuringumeetodeid, peavad tegema tihedat koostööd kinnitavat meetodit kasutavate laboritega. |
|
— |
Tavaanalüüside käigus tuleb kontrollida sõeluuringumeetodi tulemuslikkust analüüsi kvaliteedi kontrollimise ja meetodi pideva valideerimise teel. Nõuetele vastavate tulemuste kontrollimiseks peab olema kehtestatud pidev kava. |
|
— |
Kontrollida tuleb raku reaktsiooni võimalikku pärssumist ja tsütotoksilisust 20 % prooviekstraktidest tuleb kontrollida tavapärase sõeluuringuga, lisades neile või jättes lisamata piirnormile või häiretasemele vastavas koguses 2,3,7,8-TCDDd, et kontrollida, kas prooviekstraktis esinevad segavad ained võivad reaktsiooni pärssida. Rikastatud proovis mõõdetud sisaldust võrreldakse rikastamata ekstrakti sisalduse ja rikastava aine sisalduse summaga. Kui nii mõõdetud sisaldus jääb rohkem kui 25 % arvutatud (summaarsest) sisaldusest väiksemaks, viitab see signaali võimalikule pärssumisele ja asjaomast proovi tuleb uurida kinnitava analüüsiga. Tulemusi kontrollitakse kvaliteedikontrolli kaartide põhjal. |
|
— |
Nõuetele vastavate proovide kvaliteedikontroll Ligikaudu 2–10 % nõuetele vastavate proovide tulemustest tuleb olenevalt uuritava proovi materjalist ja labori kogemustest uurida kinnitava meetodiga. |
|
— |
Valenegatiivsete tulemuste osa arvutamine kvaliteedikontrolli andmete põhjal Määratakse, kui suur on valenegatiivsete tulemuste osa, mis on saadud alla- ja ülespoole piirnorme või häiretasemeid jäävate proovide sõeluuringul. Valenegatiivsete vastuste tegelik osa peab jääma alla 5 %. Kui proovimaterjali/-materjalide rühma kohta on olemas vähemalt 20 nõuetele vastava proovi kvaliteedikontrolliga kinnitatud tulemused, arvutatakse nende andmete põhjal valenegatiivsete tulemuste osa. Valenegatiivsete tulemuste osa arvutamiseks vajaliku minimaalse 20 tulemuse hulka võib arvata ka laboritevahelistes võrdluskatsetes või seoses saastumisjuhtumiga analüüsitud proovide tulemused, milles määratava aine sisaldus ületab piirnormi näiteks kaks korda. Proovid peavad hõlmama levinumaid analoogide kombinatsioone, mis pärinevad eri allikatest. Kuigi sõeluuringu eelistatav eesmärk on teha kindlaks häiretaset ületavad proovid, lähtutakse valenegatiivsete tulemuste osa määramisel piirnormist, võttes arvesse kinnitava meetodi mõõtemääramatust. |
|
— |
Sõeluuringu mittevastavuse kahtlusega proove tuleb alati kontrollida esialgse proovi täieliku kordusanalüüsiga, kasutades kinnitavat meetodit. Neid proove võib kasutada ka valepositiivsete tulemuste osa hindamiseks. Sõeluuringumeetodi puhul on „valepositiivsete tulemuste” määr selliste tulemuste osa, mis tunnistatakse kinnitava analüüsiga nõuetele vastavaks, kuigi varasemal sõeluuringul on proov osutunud nõuetele mittevastavuse kahtlusega prooviks. Sõeluuringumeetodi eeliste hindamisel tuleb valepositiivse tulemuse andnud proovide arvu võrrelda kontrollitud proovide koguarvuga. Saadud osa peab olema piisavalt väike, et sõeluuringumeetodit oleks mõtet kasutada. |
|
— |
Bioanalüütilised meetodid peavad vähemalt valideerimistingimustes näitama usaldusväärselt, milline on BEQdes arvutatud ja väljendatud TEQ väärtus. |
|
— |
Ka bioanalüütiliste meetodite puhul peaks korduvuse tingimustes laborisisene RSDr olema tavaliselt väiksem kui korratavus RSDR. |
6. SÕELUURINGU- VÕI KINNITUSMEETODINA KASUTATAVATE GC-MSi MEETODITE ERINÕUDED
6.1. WHO-TEQ ülemise tõkke ja alumise tõkke vaheline vastuvõetav lahknevus
|
— |
Ülemise ja alumise tõkke vaheline lahknevus ei tohi piirnormi ja vajaduse korral häiretaseme ületamise kinnitamisel olla suurem kui 20 %. |
6.2. Saagiste kontroll
|
— |
Analüüsimeetodi valideerimiseks tuleb analüüsimise alguses, näiteks enne ekstraheerimist, lisada 13C-märgistatud 2,3,7,8-kloorasendatud PCDD/Fide sisestandardeid ja 13C-märgistatud dioksiinitaoliste PCBde sisestandardeid. Iga tetra- kuni oktaklooritud PCDD/Fide homoloogilise rühma kohta ning iga dioksiinitaoliste PCBde homoloogilise rühma kohta tuleb lisada vähemalt üks analoog (alternatiivina võib lisada vähemalt ühe analoogi iga massispektromeetriliselt selekteeritud iooni registreerimisfunktsiooni kohta, mida kasutatakse PCDD/Fide ja dioksiinitaoliste PCBde sisalduse kontrolliks). Kinnitavate meetodite puhul tuleb kasutada kõiki seitsetteist 13C-märgistatud 2,3,7,8-asendatud PCDD/Fide sisestandardit ja kõiki kahtteist 13C-märgistatud dioksiinitaoliste PCBde sisestandardit. |
|
— |
Suhtelised kalibreerimistegurid tuleb asjakohaseid kalibreerimislahuseid kasutades määrata ka neile analoogidele, mille puhul ei lisata 13C-märgistatud analoogi. |
|
— |
Taimsete ja loomsete toiduainete puhul, mille rasvasisaldus on väiksem kui 10 %, tuleb sisestandardid lisada enne ekstraheerimist. Loomsete toiduainete puhul, mille rasvasisaldus on suurem kui 10 %, võib sisestandardid lisada kas enne või pärast rasva ekstraheerimist. Ekstraheerimise tõhusus tuleb valideerida sobival viisil olenevalt sellest, millises analüüsijärgus sisestandardid lisatakse ja kas analüüsitulemused esitatakse toote või rasva kohta. |
|
— |
Enne GC-MSi analüüsi tuleb lisada 1 või 2 saagise (surrogaat)standardit. |
|
— |
Saagist tuleb kontrollida. Kinnitava meetodi puhul peab üksiku sisestandardiga saagis olema vahemikus 60–120 %. Üksikute analoogide, eriti mõnede hepta- ja oktaklooritud dibenso-p-dioksiinide ja dibensofuraanide puhul on väiksemad või suuremad saagised vastuvõetavad üksnes tingimusel, et nende osa TEQ väärtuses ei ületa 10 % TEQ koguväärtusest (PCDD/Fide ja dioksiinitaoliste PCBde summa puhul). Sõeluuringumeetodite puhul peavad saagised olema vahemikus 30–140 %. |
6.3. Segavate ainete eraldamine
|
— |
PCDD/Fid eraldatakse segavatest klooritud ühenditest, näiteks mittedioksiinitaolistest PCBdest ja klooritud difenüüleetritest, sobiva kromatograafilise meetodiga (eelistada tuleks florisil-, alumiiniumoksiid- ja/või süsinikkolonne). |
|
— |
Isomeeride gaasikromatograafiline lahutamine peab olema piisav (1,2,3,4,7,8-HxCDFi ja 1,2,3,6,7,8-HxCDFi piikide kattuvus peab olema < 25 %). |
6.4. Kaliibrimine standardkõveraga
|
— |
Kaliibrimiskõvera vahemik peab hõlmama asjakohast piirnormi või häiretaseme sisaldusvahemikku. |
6.5. Kinnitavate meetodite erikriteeriumid
|
— |
GC-HRMSi puhul:
|
|
— |
GC-MS/MSi puhul:
|
7. BIOANALÜÜTILISTE MEETODITE ERINÕUDED
Bioanalüütilised meetodid on bioloogilistele põhimõtetele tuginevad meetodid, nagu rakupõhine, retseptor- ja immuunanalüüs. Käesolevas punktis 7 sätestatakse bioanalüütiliste meetodite üldnõuded.
Sõeluuringumeetodiga liigitatakse proov põhimõtteliselt nõuetele vastavaks või nõuetele mittevastavuse kahtlusega prooviks. Selleks võrreldakse arvutatud BEQ väärtust künnisega (vt punkt 7.3). Künnisest allapoole jäävad proovid tunnistatakse nõuetele vastavaks; künnisele vastavad või sellest ülespoole jäävad proovid loetakse mittevastavuse kahtlusega proovideks ning neid on vaja analüüsida kinnitava meetodiga. Praktikas võib kõige sobivamaks künniseks olla BEQ väärtus, mis vastab 2/3 piirnormist, eeldusel, et on tagatud valenegatiivsete tulemuste osa jäämine alla 5 % ja vastuvõetav valepositiivsete tulemuste osa. Kui PCDD/Fide piirnorm ning PCDD/Fide ja dioksiinitaoliste PCBde summa piirnorm on erinevad, on proovide nõuetele vastavuse kontrollimiseks ilma fraktsioneerimiseta vaja PCDD/Fide jaoks asjakohaseid bioanalüüsi künniseid. Häiretaset ületavate proovide kontrollimisel on sobivaks künniseks asjakohane protsent vastavatest häiretasemetest.
Lisaks võidakse teatud bioanalüütiliste meetodite puhul määrata töövahemikku jäävatele ja teatamiskünnise ületavatele proovidele BEQdes väljendatud soovituslik sisaldus (vt punktid 7.1.1 ja 7.1.6).
7.1. Analüüsitulemuse hindamine
7.1.1 Üldnõuded
|
— |
Kui sisaldusi arvutatakse TCDD kaliibrimiskõvera alusel, iseloomustab kõvera alumise ja ülemise osa väärtusi suur varieeruvus (variatsioonikordaja CV suur väärtus). Töövahemik on ala, kus CV on väiksem kui 15 %. Töövahemiku alumine piir (teatamiskünnis) peab olema oluliselt (vähemalt kolm korda) suurem tühikatse tulemusest. Töövahemiku ülemine piir esitatakse tavaliselt väärtusena EC70 (70 % suurimast toimet avaldavast sisaldusest), kuid see on väiksem, kui CV on selles vahemikus üle 15 %. Töövahemik määratakse valideerimise käigus. Ka künnised (punkt 7.3) peavad kindlalt jääma töövahemikku. |
|
— |
Standardlahuseid ja prooviekstrakte analüüsitakse vähemalt kaks korda. Kordusanalüüsi korral annab analüüsitav standardlahus või kontrollekstrakt, mida analüüsitaks e4–6 üle plaadi jaotatud pesas, tulemuse või sisalduse (võimalik ainult töövahemikus), mis põhineb CV-l, mis on väiksem kui 15 %. |
7.1.2 Kaliibrimine
7.1.2.1.
|
— |
Proovide dioksiinisisaldust võib hinnata, võrreldes analüüsitulemust TCDD (või PCB 126 või PCDD/Fi/dioksiinitaolise PCB standardsegu) kaliibrimiskõveraga, millest arvutatakse ekstrakti ja seejärel proovi BEQ väärtus. |
|
— |
Kaliibrimiskõver peab hõlmama 8–12 sisaldust (vähemalt kahe paralleelmõõtmisega), nii et kõvera alumises osas (töövahemikus) oleks piisavalt sisaldusi. Erilist tähelepanu tuleb pöörata regressioonikõvera kvaliteedile töövahemikus. Mittelineaarse regressiooni korral ei ole R2 väärtusest regressiooni sobivuse hindamisel eriti või üldse abi. Parem regressioonikõvera sobivus töövahemikus saavutatakse arvutatud ja mõõdetud sisalduste vahede minimeerimisega (nt ruuthälvete summa minimeerimisega). |
|
— |
Seejärel korrigeeritakse proovi ekstrakti hinnangulist dioksiinisisaldust uuritava materjali/lahusti tühikatse alusel arvutatud BEQ väärtuse põhjal (et võtta arvesse kasutatud lahustites ja kemikaalides esinevaid lisandeid) ning näilise saagise põhjal (arvutatakse sellise sobiva etalonproovi BEQ väärtuse alusel, mille esinduslik analoogikombinatsioon vastab umbkaudu piirnormile või häiretasemele). Saagise korrigeerimiseks peab näiline saagis alati olema nõutavas vahemikus (vt punkt 7.1.4). Saagise korrigeerimiseks kasutatavad etalonproovid peavad vastama punktis 7.2 sätestatud nõuetele. |
7.1.2.2.
Teise võimalusena võib kasutada vähemalt nelja etalonproovi alusel koostatud kaliibrimiskõverat (vt punkt 7.2: üks uuritava materjali tühikatse ning kolm etalonproovi sisaldusega, mis võrdub 0,5-, 1,0- ja 2,0-kordse piirnormi või häiretaseme sisaldusega), mille puhul ei ole vaja arvestada tühikatse ja saagise parandit. Sellisel juhul võib otse nende proovide alusel arvutada analüüsitulemuse, mis vastab 2/3 piirnormist (vt punkt 7.3), ja kasutada seda künnisena. Häiretaset ületavate proovide kontrollimisel on sobivaks künniseks asjakohane protsent sellistest häiretasemetest.
7.1.3. PCDD/Fide ja dioksiinitaoliste PCBde eraldi määramine
Ekstraktid võib jagada PCDD/Fisid ja dioksiinitaolisi PCBsid sisaldavateks osadeks, mis võimaldab eraldi määrata PCDD/Fide ja dioksiinitaoliste PCBde TEQ väärtused (BEQdes). Dioksiinitaolisi PCBsid sisaldava osa analüüsimise tulemuste hindamiseks tuleks eelistatavalt kasutada standardiga PCB 126 saadud kaliibrimiskõverat.
7.1.4. Bioanalüüsi näilised saagised
Bioanalüüsi näiline saagis arvutatakse sobivate etalonproovide alusel, mille esinduslik analoogide kombinatsioon vastab ligikaudu piirnormile või häiretasemele ja seda väljendatakse BEQ väärtuse protsendina TEQ väärtusest. Olenevalt analüüsi liigist ja kasutatud TEFist (3) võib dioksiinitaoliste PCBde TEF- ja REP-kordajate erinevuse tõttu dioksiinitaoliste PCBde näiline saagis olla võrreldes PCDD/Fi saagisega väike. Seepärast peab PCDD/Fide ja dioksiinitaoliste PCBde sisalduse eraldi määramisel bioanalüüsi näiline saagis olema järgmine: dioksiinitaolistel PCBdel: 20–60 %, PCDD/Fidel: 50–130 % (vahemik kehtib TCDD kaliibrimiskõvera kasutamisel). Dioksiinitaoliste PCBde panus PCDD/Fide ja dioksiinitaoliste PCBde summasse sõltub uuritavast materjalist ja proovidest ning kajastub summaarses bioanalüüsi näilises saagises, mis peab olema 30–130 %.
7.1.5. Saagiste kontroll puhastamisel
Valideerimisel kontrollitakse ühendite kadu puhastamisel. Analoogide seguga rikastatud tühiproov (paralleelkatsete arv n on vähemalt 3) puhastatakse ning saagist ja varieeruvust kontrollitakse kinnitava meetodiga. Saagis peab olema vahemikus 60–120 %, eelkõige selliste analoogide puhul, mis moodustavad eri segude TEQ väärtusest rohkem kui 10 %.
7.1.6. Teatamiskünnis
BEQ väärtustest teatamisel tuleb teatamiskünnis kindlaks määrata tüüpiliste analoogide kombinatsioonidega asjakohasest materjalist proovide alusel, mitte standardite kaliibrimiskõvera alusel, kuna kõvera alumises osas on täpsus väike. Ekstraheerimise ja puhastamise mõju tuleb arvesse võtta. Teatamiskünnis peab olema tühikatse väärtusest oluliselt (vähemalt kolm korda) suurem.
7.2. Etalonproovide kasutamine
|
— |
Etalonproovid peavad esindama uuritava proovi materjali, analoogide kombinatsioone ja PCDD/Fide ning dioksiinitaoliste PCBde sisaldusi vahemikus, mis vastab piirnormile või häiretasemele. |
|
— |
Igas katseseerias tuleb kasutada tühikatset, eelistatavalt uuritava proovi materjaliga tühikatset ning piirnormile või häiretasemele vastava sisaldusega etalonproovi. Neid proove tuleb ekstraheerida ja analüüsida üheaegselt ja ühesugustes tingimustes. Etalonproovi dioksiinisisaldus peab olema selgelt suurem tühiproovi dioksiinisisaldusest, mis tõendab, et analüüs on tehtud õigesti. Neid proove võib kasutada tühikatset ja saagist arvestava parandi tegemisel. |
|
— |
Saagiseparandi leidmiseks valitud etalonproovid peavad olema analüüsitava proovi suhtes esinduslikud, st analoogide kombinatsioonid ei tohi põhjustada sisalduse alahindamist. |
|
— |
Et tõendada analüüsi nõuetekohast tulemuslikkust huvipakkuvas sisalduste vahemikus piirnormi või häiretaseme kontrollimiseks, võib lisaks kasutada näiteks etalonproove sisaldusega, mis võrdub 0,5- ja 2-kordse piirnormile või häiretasemele vastava sisaldusega. Üheskoos võib neid proove kasutada analüüsitavate proovide BEQ väärtuse arvutamiseks (punkt 7.1.2.2). |
7.3. Künniste leidmine
Tuleb teha kindlaks BEQdes väljendatud bioanalüütiliste tulemuste ja TEQ väärtustes väljendatud kinnitava meetodi tulemuste vaheline sõltuvus (nt asjakohase proovimaterjaliga tehtud kaliibrimiskatsetega, milles kasutatakse etalonproove, mille rikastustasemed on 0, 0,5-, 1- ja 2-kordne piirnorm ja mida korratakse igal tasemel 6 korda (n = 24)). Selle sõltuvuse alusel saab leida (tühiproovi ja saagise) hinnangulised parandid, kuid neid tuleb igas katseseerias kontrollida, lisades proovimaterjalita tühikatse, proovimaterjaliga tühikatse ja saagiseproovid (punkt 7.2).
Künnised tuleb leida selleks, et otsustada, kas proov vastab piirnormile, või vajaduse korral häiretaseme kontrollimiseks, kusjuures asjaomased piirnormid või häiretasemed on kehtestatud kas PCDD/Fide või dioksiinitaoliste PCBde jaoks või PCDD/Fide ja dioksiinitaoliste PCBde summa jaoks. Künnis on bioanalüüsi tulemuste (mida on parandatud tühikatse ja saagise arvestamiseks) jaotuse alumine piir, mis vastab 95 % usaldusväärsusega kinnitava meetodi otsustuspiirile (eeldades, et valenegatiivsete tulemuste osa on < 5 % ja RSDR < 25 %). Kinnitava meetodi otsustuspiir on piirnorm, võttes arvesse mõõtemääramatust.
Praktikas võib künnise (BEQdes) arvutada, kasutades üht järgmistest meetoditest (vt joonis 1).
7.3.1. Künnise määramine 95 % usaldusvahemiku alumise piiri kasutamisega kinnitava meetodi jaoks kindlaksmääratud otsustuspiiri puhul
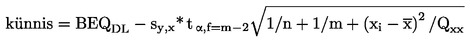
kus:
|
BEQDL |
on BEQ, mis vastab kinnitava meetodi otsustuspiirile ja on piirnorm, mille puhul on arvesse võetud mõõtemääramatust |
|
sy,x |
on jääkstandardhälve |
|
t α,f=m-2 |
on Studenti tegur (α = 5 %, f = vabadusastmete arv, ühepoolse piiranguga) |
|
m |
kaliibrimispunktide koguarv (indeks j) |
|
n |
korduste arv igal tasemel |
|
xi |
proovi sisaldus (TEQdes) kaliibrimispunktis i, nagu määratud kinnitava meetodiga |
|
|
kõikide kaliibrimisproovide keskmine sisaldus (TEQdes) |
|
Qxx |
= |
|
|
i |
= |
kaliibrimispunkti i indeks |
7.3.2. Künnis arvutatakse kinnitava meetodi jaoks kindlaksmääratud otsustuspiirile vastava saastega proovide korduval analüüsimisel (n ≥ 6) saadud (tühikatse ja saagise arvestamiseks parandatud) bioanalüütiliste tulemuste põhjal; see on jaotuse alumine piir vastava keskmise BEQ väärtuse korral:

kus:
|
SDR |
on bioanalüüsi tulemuste standardhälve BEQDL korral, mõõdetuna laborisisese korratavuse tingimustes |
7.3.3. Arvutamine bioanalüüsi tulemuste keskväärtusena (BEQdes, parandatud tühikatse ja saagise arvestamiseks) sellistest proovidest, mille saastesisaldus vastab 2/3 piirnormist või häiretasemest, tehtud kordusanalüüside (n > 6) alusel. See põhineb tähelepanekul, et kõnealune tase vastab ligikaudu punkti 7.3.1 või 7.3.2 alusel määratud künnisele.
Joonis 1

Künniste arvutamine 95 % usaldusnivoo korral eeldusel, et valenegatiivsete tulemuste osa < 5 % ja RSDR < 25 %:
|
1. |
95 % usaldusvahemiku alumise piiri kasutamisega kinnitava meetodi jaoks kindlaksmääratud otsustuspiiri puhul; |
|
2. |
kinnitava meetodi jaoks kindlaksmääratud otsustuspiirile vastava saastega proovide korduva analüüsimise (n ≥ 6) alusel saadud tulemuste jaotuse (joonisel kellukesekujuline kõver) alumise piiri järgi sellekohase keskmise BEQ väärtuse juures. |
7.3.4. Künniste piirangud
BEQ-põhised künnised, mis on arvutatud valideerimise käigus saadud RSDR'i alusel, kasutades piiratud arvu proove erinevate materjalide ning analoogide kombinatsiooniga, võivad olla kõrgemad kui TEQ-põhised piirnormile või häiretasemele vastavad sisaldused, kuna valideerimisel saavutatakse suurem kordustäpsus kui tavaolukorras (kus tuleb kontrollida võimalike analoogide kombinatsioonide tundmatut spektrit). Sellisel juhul võetakse künnise arvutamisel aluseks kas RSDR = 25 % või eelistatakse sisaldust 2/3 piirnormist või häiretasemest.
7.4. Tulemuslikkuse näitajad
|
— |
Bioanalüütiliste meetodite puhul ei ole võimalik kasutada sisestandardeid, seepärast on väga tähtis teha katseseeriasisese ja katseseeriatevahelise standardhälbe kohta andmete saamiseks korduvuskatsed. Korduvus peab olema alla 20 %, laborisisene korratavus alla 25 %. See peab põhinema arvutatud BEQ väärtustel pärast tühikatse- ja saagiseparandi arvessevõtmist. |
|
— |
Valideerimise käigus tuleb näidata, et analüüs võimaldab eristada tühiproovi ja künnisele vastavat sisaldust, mis võimaldab kindlaks teha, millised proovid jäävad künnisest ülespoole (vt punkt 7.1.2). |
|
— |
Määratakse kindlaks uuritavad ühendid, võimalikud segavad tegurid ja tühikatse suurimad lubatud väärtused. |
|
— |
Ühe prooviekstrakti kolmekordsel määramisel saadud tulemuse (võimalik üksnes töövahemikus) alusel arvutatud standardhälve ei tohi analüüsitulemuses või sisalduses ületada 15 %. |
|
— |
Bioanalüütilise meetodi tulemuslikkuse hindamiseks kindlal ajavahemikul kasutatakse etalonproovi(de) (tühikatse ning piirnormile ja häiretasemele vastav sisaldus) korrigeerimata tulemusi, mis on väljendatud BEQdes. |
|
— |
Määramismeetodi tühikatsete ja igat tüüpi etalonproovide kohta tuleb koostada kvaliteedikontrolli kaardid ja kontrollida, kas analüüsi tulemuslikkus vastab nõuetele; eelkõige on nõutav teatava miinimumerinevuse olemasolu määramismeetodi tühikatsete ja töövahemiku alumise piiri vahel ning etalonproovide puhul on nõutav laborisisene korratavus. Määramismeetodi tühikatseid tuleb põhjalikult kontrollida, et vältida valenegatiivsete tulemuste saamist pärast tühikatse tulemuste lahutamist. |
|
— |
Nõuetele mittevastavuse kahtlusega proovide ja 2–10 % nõuetekohaste proovide (vähemalt 20 proovi iga uuritava materjali kohta) kinnitava meetodi tulemused tuleb koondada ning kasutada sõeluuringumeetodi tulemuslikkuse ja BEQ ning TEQ suhte hindamiseks. Neid andmeid võib kasutada tavaproovide suhtes kohaldatavate künniste ümberhindamiseks valideeritud proovimaterjalide jaoks. |
|
— |
Meetodi tulemuslikkust võib tõendada ka laboritevahelistes võrdluskatsetes osalemisega. Võrdluskatsete käigus analüüsitud proovid hõlmavad nt kuni kahekordse piirnormini ulatuvat sisalduste vahemikku ja nende tulemusi võib kasutada ka valenegatiivsete tulemuste osa hindamisel, kui labor suudab tõendada oma suutlikkust. Proovid peavad hõlmama levinumaid analoogide kombinatsioone, mis pärinevad eri allikatest. |
|
— |
Saastumisjuhtumite korral võidakse künnised ümber hinnata, võttes arvesse asjaomase juhtumi materjali ja analoogide kombinatsioone. |
8. TULEMUSTE ESITAMINE
Kinnitavad meetodid
|
— |
Selleks et tulemuste aruanne sisaldaks võimalikult palju andmeid ja võimaldaks tulemuste tõlgendamist erinõuete kohaselt, peavad analüüsitulemused, kui kasutatud analüüsimeetod seda võimaldab, hõlmama üksikute PCDD/Fi ja dioksiinitaoliste PCB analoogide sisaldust ning olema esitatud alumise ja ülemise tõkke ning vaheväärtusena. |
|
— |
Aruandes tuleb esitada ka PCDD/Fide, dioksiinitaoliste PCBde ja lipiidide ekstraheerimiseks kasutatud meetod. Proovi lipiidisisaldus määratakse ja esitatakse rasvapõhise piirnormiga toiduproovide puhul, mille eeldatav rasvasisaldus on vahemikus 0–2 % (kooskõlas kehtivate õigusaktidega); muude proovide puhul määratakse lipiidide sisaldus vajaduse korral. |
|
— |
Üksikute sisestandardite saagised tuleb esitada juhul, kui need jäävad väljapoole punktis 6.2 nimetatud vahemikku, kui on ületatud piirnorm (sellisel juhul ühe korduskatse saagised) ja kui nende teatamist nõutakse. |
|
— |
Kuna proovi vastavuse hindamisel tuleb arvestada mõõtemääramatust, tuleb esitada ka see näitaja. Analüüsitulemused tuleb seega eitada kujul x +/– U, kus x on analüüsitulemus ja U on laiendatud mõõtemääramatus, kusjuures arvutamisel kasutatakse kattetegurit 2, mis annab usaldusnivooks ligikaudu 95 %. Kui PCDD/Fid ja dioksiinitaolised PCBd määratakse eraldi, tuleb PCDD/Fide ja dioksiinitaoliste PCBde summa kohta kasutada PCDD/Fide ja dioksiinitaoliste PCBde eraldi saadud analüüsitulemuste hinnanguliste laiendatud mõõtemääramatuste summat. |
|
— |
Kui mõõtemääramatust võetakse arvesse CCα kaudu (nagu on kirjeldatud II lisa IV punkti alapunktis 2), tuleb see näitaja esitada. |
|
— |
Tulemused tuleb esitada samades ühikutes ja (vähemalt) sama tüvenumbrite arvuga, nagu on esitatud määruses (EÜ) nr 1881/2006 sätestatud piirnormid. |
Bioanalüütilised sõeluuringumeetodid
|
— |
Sõeluuringu tulemus esitatakse järgmisel kujul: nõuetele vastav või nõuetele mittevastavuse kahtlusega („kahtlane”). |
|
— |
Lisaks sellele võib PCDD/Fide ja/või dioksiinitaoliste PCBde sisalduse esitada bioanalüütilistes ekvivalentides (BEQdes) (mitte TEQdes) (vt III lisa punkt 1). Allapoole teatamispiiri jääva tulemusega proovi tulemus esitatakse kui teatamispiirist allapoole jääv proov. |
|
— |
Aruandes tuleb iga proovimaterjali tüübi kohta esitada piirnorm või häiretase, millel hindamine põhineb. |
|
— |
Aruandes esitatakse kasutatud analüüsi liik, peamised analüüsi põhimõtted ja kaliibrimise viis. |
|
— |
Aruandes esitatakse ka PCDD/Fide, dioksiinitaoliste PCBde ja lipiidide ekstraheerimiseks kasutatud meetod. Rasvapõhise piirnormi või rasvapõhise häiretasemega toiduproovide puhul, kui eeldatav rasvasisaldus on vahemikus 0–2 %, määratakse ja esitatakse proovi lipiidisisaldus (kooskõlas kehtivate õigusaktidega); muude proovide puhul esitatakse lipiidisisaldus vajaduse korral. |
|
— |
Mittevastavuse kahtlusega proovide puhul tuleb aruandesse lisada märkus võetavate meetmete kohta. Suurema sisaldusega proovides tuleb PCDD/Fide sisaldus ning PCDD/Fide ja dioksiinitaoliste PCBde summa määrata ja kinnitada kinnitava meetodi abil. |
(1) Euroopa Parlamendi ja nõukogu 29. aprilli 2004. aasta määrus (EÜ) nr 882/2004 ametlike kontrollide kohta, mida tehakse sööda- ja toidualaste õigusnormide ning loomatervishoidu ja loomade heaolu käsitlevate eeskirjade täitmise kontrollimise tagamiseks (EÜT L 165, 30.4.2004, lk 1).
(2) Piirnormide puhul.
(3) Kehtivad nõuded põhinevad TEFidel, mis on avaldatud artiklis: M. Van den Berg et al, Toxicol Sci 93 (2), 223–241 (2006).
III LISA liide
Inimeste tervist ähvardava ohu hindamisel kasutatavad WHO-TEFid põhinevad 2005. aasta juunis Genfis peetud Maailma Terviseorganisatsiooni — rahvusvahelise kemikaaliohutuse programmi (IPCS) ekspertkohtumise järeldustel (Martin Van den Berg et al., The 2005 World Health Organization Re-evaluation of Human and Mammalian Toxic Equivalency Factors for Dioxins and Dioxin-like Compounds. Toxicological Sciences 93(2), 223–241 (2006))
|
Analoog |
TEFi väärtus |
Analoog |
TEFi väärtus |
|
Polüklorodibenso-p-dioksiinid (PCDDd) |
Dioksiinitaolised PCBd Mitte-orto-PCBd + mono-orto-PCBd |
||
|
2,3,7,8-TCDD |
1 |
Orto-asendamata PCBd |
|
|
1,2,3,7,8-PeCDD |
1 |
||
|
1,2,3,4,7,8-HxCDD |
0,1 |
PCB 77 |
0,0001 |
|
1,2,3,6,7,8-HxCDD |
0,1 |
PCB 81 |
0,0003 |
|
1,2,3,7,8,9-HxCDD |
0,1 |
PCB 126 |
0,1 |
|
1,2,3,4,6,7,8-HpCDD |
0,01 |
PCB 169 |
0,03 |
|
OCDD |
0,0003 |
|
|
|
Polüklorodibensofuraanid (PCDFid) |
Mono-orto-asendatud PCBd |
||
|
2,3,7,8-TCDF |
0,1 |
PCB 105 |
0,00003 |
|
1,2,3,7,8-PeCDF |
0,03 |
PCB 114 |
0,00003 |
|
2,3,4,7,8-PeCDF |
0,3 |
PCB 118 |
0,00003 |
|
1,2,3,4,7,8-HxCDF |
0,1 |
PCB 123 |
0,00003 |
|
1,2,3,6,7,8-HxCDF |
0,1 |
PCB 156 |
0,00003 |
|
1,2,3,7,8,9-HxCDF |
0,1 |
PCB 157 |
0,00003 |
|
2,3,4,6,7,8-HxCDF |
0,1 |
PCB 167 |
0,00003 |
|
1,2,3,4,6,7,8-HpCDF |
0,01 |
PCB 189 |
0,00003 |
|
1,2,3,4,7,8,9-HpCDF |
0,01 |
|
|
|
OCDF |
0,0003 |
|
|
|
Kasutatud lühendid: T = tetra; Pe = penta; Hx = heksa; Hp = hepta; O = okta; CDD = klorodibensodioksiin; CDF = klorodibensofuraan; CB = klorobifenüül. |
|||
IV LISA
PROOVIDE ETTEVALMISTAMINE JA SELLISTE ANALÜÜSIMEETODITE NÕUDED, MIDA KASUTATAKSE MITTEDIOKSIINITAOLISTE PCBde (PCB NR 28, 52, 101, 138, 153, 180) SISALDUSE KONTROLLIMISEKS TEATAVATES TOIDUAINETES
Käesolevas lisas sätestatud nõudeid kohaldatakse toiduainete analüüsimisel mittedioksiinitaoliste polüklooritud bifenüülide (mittedioksiinitaoliste PCBde) sisalduse ametlikuks kontrollimiseks ja muudel regulatiivsetel eesmärkidel.
1. Kasutatavad määramismeetodid
Gaasikromatograafia ja elektronhaarde detekteerimine (GC-ECD), GC-LRMS, GC-MS/MS, GC-HRMS või samaväärne meetod.
2. Vaatlusaluste analüütide määramine ja kinnitamine:
|
— |
Suhteline retentsiooniaeg vastavalt sisestandarditele või etalonstandarditele (lubatud hälve +/– 0,25 %). |
|
— |
Tuleb kinnitada kõigi kuue indikaator-PCB (PCB 28, PCB 52, PCB 101, PCB 138, PCB 153 ja PCB 180) gaasikromatograafiline eraldamine segavatest ainetest, eelkõige koos elueeruvatest PCBdest, ennekõike kui proovides leiduvad sisaldused on kehtiva piirnormi piires ning kui tuleb kinnitada nõuetele mittevastavust. (Sageli koos elueeruvad analoogid on nt PCB 28/31, PCB 52/69 ja PCB 138/163/164. GC-MS-meetodi puhul tuleb arvesse võtta ka tugevamalt klooritud analoogide fragmentide võimalikku segavat mõju.) |
|
— |
GC-MSi puhul:
|
|
— |
GC-ECD puhul: tolerantsi ületavate tulemuste kinnitamine kahe GC-kolonniga, millel on eri polaarsusega statsionaarne faas. |
3. Meetodi tulemuslikkuse tõendamine
Meetodi tulemuslikkuse valideerimine piirnormile vastava sisalduse vahemikus (0,5- kuni 2-kordse piirnormi sisalduse korral); tõendatakse, et korduvanalüüsi variatsioonikordaja on vastuvõetav (vt vahetäpsuse nõuded, punkt 8).
4. Määramispiir
Tühikatse väärtused ei tohi ületada 30 % piirnormile vastavast saastetasemest (2).
5. Kvaliteedikontroll
Korrapärased tühikatsed, rikastatud proovide analüüs, kvaliteedikontrolli proovid, osalemine asjaomaste proovimaterjalidega tehtud laboritevahelistes uuringutes.
6. Saagiste kontroll
|
— |
Selliste sobivate sisestandardite kasutamine, millel on vaatlusaluste analüütidega võrreldavad füüsikalis-keemilised omadused. |
|
— |
Sisestandardite lisamine:
|
|
— |
Selliste meetodite nõuded, mille puhul kasutatakse kõiki kuut isotoopmärgistatud indikaator-PCB analoogi:
|
|
— |
Selliste meetodite nõuded, mille puhul ei kasutata kõiki kuut isotoopmärgistatud sisestandardit või kasutatakse muid sisestandardeid:
|
|
— |
Märgistamata analoogide saagiseid kontrollitakse rikastatud proovide või kvaliteedikontrolli proovidega, mille sisaldused on piirnormi sisaldusvahemikus. Selliste analoogide aktsepteeritavad saagised on 70–120 %. |
7. Laborite nõuded
Vastavalt määrusele (EÜ) nr 882/2004 peavad laborid olema ISO juhendi 58 kohaselt tegutseva tunnustatud asutuse poolt akrediteeritud, millega tagatakse, et laborid kohaldavad analüüsimisel kvaliteeditagamissüsteemi. Laboreid tuleb akrediteerida standardi EN ISO/IEC 17025 kohaselt.
8. Tulemuslikkuse näitajad. Kuue piirnormi sisaldusele vastava indikaator-PCB summa suhtes kohaldatavad kriteeriumid
|
Tõesus |
– 30 kuni + 30 % |
|
Vahetäpsus (RSD %) |
≤ 20 % |
|
Ülemise ja alumise tõkke erinevus |
≤ 20 % |
9. Tulemuste esitamine
|
— |
Et tulemuste aruanne sisaldaks võimalikult palju andmeid ja võimaldaks tulemuste tõlgendamist erinõuete kohaselt, peavad analüüsitulemused, kui kasutatud analüüsimeetod seda võimaldab, hõlmama individuaalsete PCB analoogide sisaldust ning olema esitatud alumise ja ülemise tõkke ning vaheväärtusena. |
|
— |
Aruandesse tuleb märkida ka PCBde ja lipiidide ekstraheerimiseks kasutatud meetod. Proovi lipiidisisaldus määratakse ja esitatakse rasvapõhise piirnormiga toiduproovide puhul, mille eeldatav rasvasisaldus on vahemikus 0–2 % (kooskõlas kehtivate õigusaktidega); muude proovide puhul määratakse lipiidide sisaldus vajaduse korral. |
|
— |
Üksikute sisestandardite saagised tuleb esitada juhul, kui need jäävad väljapoole punktis 6 nimetatud vahemikku, kui on ületatud piirnormi ja kui nende teatamist nõutakse. |
|
— |
Kuna proovi nõuetele vastavuse hindamisel tuleb arvestada mõõtemääramatust, tuleb esitada ka see näitaja. Analüüsitulemused tuleb seega eitada kujul x +/– U, kus x on analüüsitulemus ja U on laiendatud mõõtemääramatus, kusjuures arvutamisel kasutatakse kattetegurit 2, mis annab usaldusnivoo ligikaudu 95 %. |
|
— |
Kui mõõtemääramatust võetakse arvesse CCα kohaldamisega (nagu on kirjeldatud II lisa IV punkti alapunktis 1), tuleb see näitaja esitada. |
|
— |
Tulemused tuleb esitada samades ühikutes ja (vähemalt) sama tüvenumbrite arvuga, nagu on esitatud määruses (EÜ) nr 1881/2006 sätestatud piirnormid. |
(1) Ei soovitata kasutada iseloomulikke ioone, mille suhteline intensiivsus on väiksem kui 10 % võrreldes uuritava iooniga, kuna on olemas piisav arv massifragmente, mille suhteline intensiivsus on üle 10 %.
(2) On väga soovitatav, et reaktiivi tühikatse tulemus oleks väike võrreldes proovis leiduva saasteaine sisaldusega. Labor on kohustatud kontrollima tühikatse tulemuse muutumist, eriti siis, kui tühikatse tulemus tuleb lahutada.


