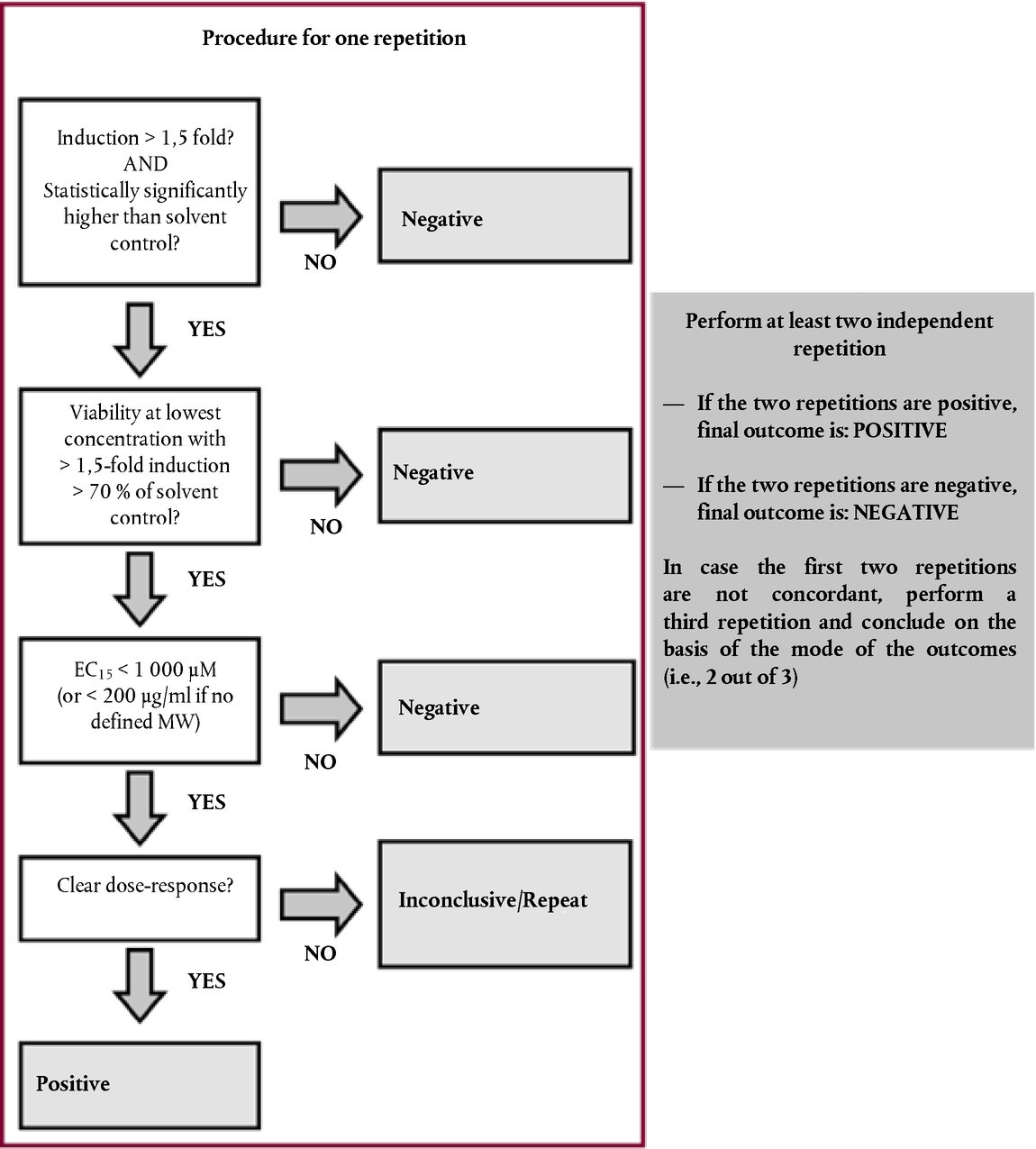
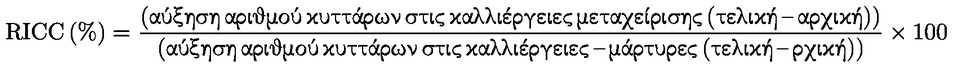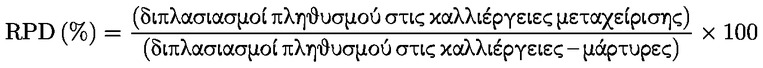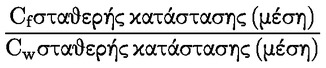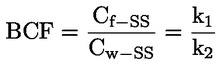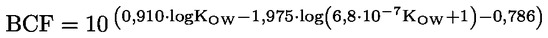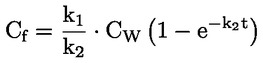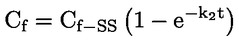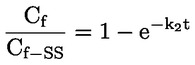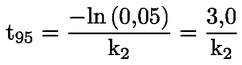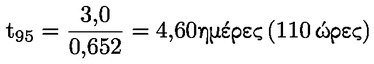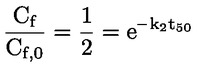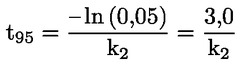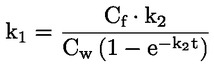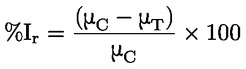ΠΑΡΑΡΤΗΜΑ
Το παράρτημα του κανονισμού (ΕΚ) αριθ. 440/2008 τροποποιείται ως εξής:
|
(1) |
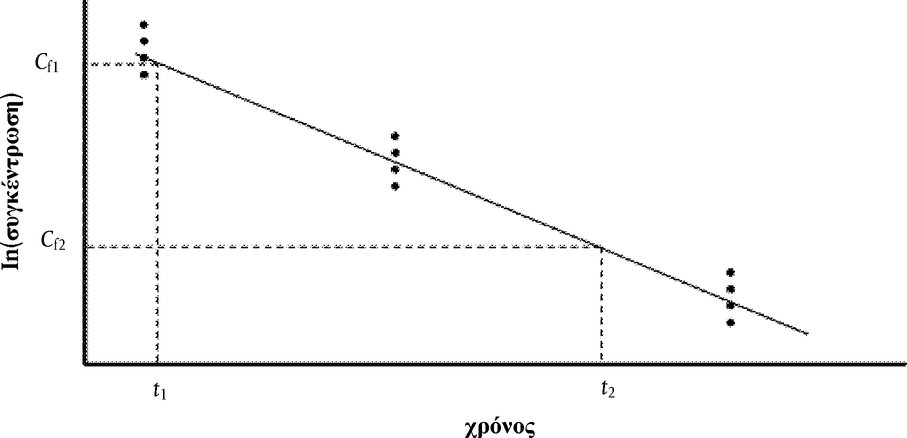
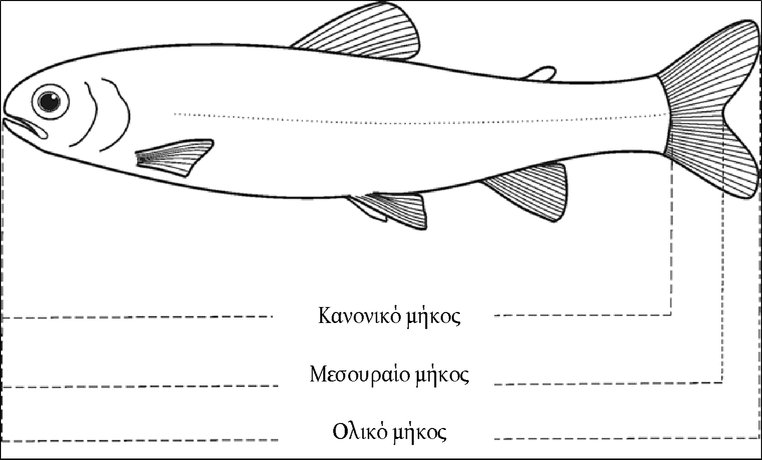
Στο Μέρος Α, προστίθεται το ακόλουθο κεφάλαιο: «A.25 ΣΤΑΘΕΡΕΣ ΔΙΑΣΤΑΣΗΣ ΣΤΟ ΝΕΡΟ (ΤΙΤΛΟΔΟΤΙΚΗ ΜΕΘΟΔΟΣ — ΦΑΣΜΑΤΟΦΩΤΟΜΕΤΡΙΚΗ ΜΕΘΟΔΟΣ — ΑΓΩΓΙΜΟΜΕΤΡΙΚΗ ΜΕΘΟΔΟΣ) ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών 112 του ΟΟΣΑ (1981). Προϋποθέσεις
Πληροφορίες καθοδήγησης
Διευκρινίσεις
Έγγραφα αναφοράς Η παρούσα μέθοδος δοκιμών βασίζεται σε μεθόδους που αναφέρονται στις παραπομπές που περιλαμβάνονται στο τμήμα «Βιβλιογραφία» και στο προσχέδιο καθοδήγησης για τις κοινοποιήσεις πριν από τη βιομηχανική παραγωγή της Υπηρεσίας Προστασίας του Περιβάλλοντος των ΗΠΑ (Preliminary Draft Guidance for Premanufacture Notification EPA), της 18ης Αυγούστου 1978. Η ΜΕΘΟΔΟΣ — ΕΙΣΑΓΩΓΗ, ΣΚΟΠΟΣ, ΠΕΔΙΟ ΕΦΑΡΜΟΓΗΣ, ΚΑΤΑΛΛΗΛΟΤΗΤΑ, ΕΦΑΡΜΟΓΗ ΚΑΙ ΟΡΙΑ ΤΗΣ ΔΟΚΙΜΗΣ Η διάσταση μιας ουσίας στο νερό είναι σημαντική για την εκτίμηση των επιπτώσεών της στο περιβάλλον. Ελέγχει τη μορφή της ουσίας, η οποία με τη σειρά της καθορίζει τη συμπεριφορά και τη μεταφορά της. Μπορεί να επηρεάσει την απορρόφηση της χημικής ουσίας, αφενός από τα εδάφη και τα ιζήματα και, αφετέρου, από τα βιολογικά κύτταρα. Ορισμοί και μονάδες Διάσταση είναι ο αναστρέψιμος διαχωρισμός σε δύο ή περισσότερα χημικά είδη που μπορεί να είναι ιονικά. Η διεργασία αυτή δηλώνεται συνήθως με τη χημική εξίσωση RX ⇌ R ++ X – και η σταθερά ισορροπίας της συγκέντρωσης, που ρυθμίζει την αντίδραση, είναι
Για παράδειγμα, στη συγκεκριμένη περίπτωση όπου R είναι το υδρογόνο (η ουσία είναι οξύ), η σταθερά είναι
ή
Ουσίες αναφοράς Οι κατωτέρω ουσίες αναφοράς δεν είναι απαραίτητο να χρησιμοποιούνται σε όλες τις περιπτώσεις που εξετάζεται μια νέα ουσία. Παρέχονται, κυρίως, για να μπορεί να γίνεται διακρίβωση της μεθόδου κατά περιόδους και για να υπάρχει δυνατότητα σύγκρισης με τα αποτελέσματα από την εφαρμογή άλλης μεθόδου.
Μπορούν να φανούν χρήσιμες οι ουσίες με περισσότερες από μία pK, όπως αναφέρεται στο τμήμα «Αρχή της μεθόδου» κατωτέρω. Μια τέτοια ουσία θα μπορούσε να είναι το:
Αρχή της μεθόδου δοκιμών Κατά κανόνα, η περιγραφόμενη χημική διεργασία εξαρτάται ελάχιστα από τη θερμοκρασία στο θερμοκρασιακό εύρος που συναντάται στο περιβάλλον. Ο προσδιορισμός της σταθεράς διάστασης απαιτεί μέτρηση των συγκεντρώσεων της διασταθείσας και της μη διασταθείσας μορφής της χημικής ουσίας. Από τη γνώση της στοιχειομετρίας της αντίδρασης διάστασης, που αναφέρεται στην ενότητα «Ορισμοί και μονάδες» ανωτέρω, μπορεί να προσδιοριστεί η κατάλληλη σταθερά. Στην ειδική περίπτωση που περιγράφεται στην παρούσα μέθοδο δοκιμών, η ουσία συμπεριφέρεται ως οξύ ή βάση και ο ευχερέστερος τρόπος προσδιορισμού είναι ο προσδιορισμός των σχετικών συγκεντρώσεων των ιονισμένων και μη ιονισμένων μορφών της ουσίας, καθώς και του pH του διαλύματος. Η σχέση μεταξύ των όρων αυτών παρέχεται στην εξίσωση για την pKa στην ενότητα «Ορισμοί και μονάδες» ανωτέρω. Ορισμένες ουσίες παρουσιάζουν περισσότερες από μία σταθερές διάστασης και μπορούν να αναπτυχθούν παρόμοιες εξισώσεις. Ορισμένες από τις μεθόδους που περιγράφονται στο παρόν κεφάλαιο είναι επίσης κατάλληλες για άλλες διαστάσεις εκτός των οξέων/βάσεων. Ποιοτικά κριτήρια Επαναληψιμότητα Η σταθερά διάστασης θα πρέπει να αναπαράγεται (σε τουλάχιστον τρεις προσδιορισμούς) με ακρίβεια ± 0,1 λογαριθμικές μονάδες. ΠΕΡΙΓΡΑΦΗ ΤΩΝ ΔΙΑΔΙΚΑΣΙΩΝ ΔΟΚΙΜΗΣ Υπάρχουν δύο βασικές προσεγγίσεις για τον προσδιορισμό της pKa. Η μία συνίσταται στην τιτλοδότηση γνωστής ποσότητας της ουσίας με πρότυπο οξύ ή βάση, κατά περίπτωση. Η άλλη συνίσταται στον προσδιορισμό των σχετικών συγκεντρώσεων των ιονισμένων και μη ιονισμένων μορφών της ουσίας και της εξάρτησής τους από το pH. Προετοιμασίες Οι μέθοδοι που βασίζονται στις αρχές αυτές μπορούν να χαρακτηρισθούν ως τιτλοδοτική, φασματοφωτομετρική και αγωγιμομετρική διαδικασία. Διαλύματα δοκιμής Για την τιτλοδοτική και την αγωγιμομετρική μέθοδο, η χημική ουσία θα πρέπει να διαλύεται σε απεσταγμένο νερό. Για τη φασματοφωτομετρική και τις άλλες μεθόδους χρησιμοποιούνται ρυθμιστικά διαλύματα. Η συγκέντρωση της υπό δοκιμή ουσίας δεν θα πρέπει να υπερβαίνει τη μικρότερη από τις τιμές 0,01 M ή 1/2 της συγκέντρωσης κορεσμού και για την παρασκευή των διαλυμάτων θα πρέπει να χρησιμοποιείται η καθαρότερη διαθέσιμη μορφή της ουσίας. Εάν η ουσία είναι μετρίως διαλυτή στο νερό, μπορεί να διαλυθεί σε μικρή ποσότητα αναμείξιμου με το νερό διαλύτη, πριν προστεθεί στις προαναφερόμενες συγκεντρώσεις. Τα διαλύματα θα πρέπει να ελέγχονται για την παρουσία γαλακτωμάτων με τη χρήση δέσμης Tyndall, ιδίως εάν έχει χρησιμοποιηθεί συνδιαλύτης για την ενίσχυση της διαλυτότητας. Όταν χρησιμοποιούνται ρυθμιστικά διαλύματα, η συγκέντρωση του ρυθμιστικού διαλύματος δεν θα πρέπει να υπερβαίνει τα 0,05 M. Συνθήκες δοκιμής Θερμοκρασία Η θερμοκρασία θα πρέπει να ρυθμίζεται με ακρίβεια τουλάχιστον ± 1°C. Ο προσδιορισμός θα πρέπει να εκτελείται κατά προτίμηση στους 20°C. Εάν υπάρχουν υπόνοιες σημαντικής θερμοκρασιακής εξάρτησης, θα πρέπει να εκτελείται προσδιορισμός σε τουλάχιστον δύο ακόμη θερμοκρασίες. Τα διαστήματα θερμοκρασίας θα πρέπει να είναι 10°C σε αυτή την περίπτωση και η ακρίβεια ρύθμισης της θερμοκρασίας ± 0,1°C. Αναλύσεις Η μέθοδος καθορίζεται από τη φύση της υπό δοκιμή ουσίας. Θα πρέπει να έχει επαρκή ευαισθησία ώστε να επιτρέπει τον προσδιορισμό των διαφόρων χημικών ειδών σε κάθε συγκέντρωση του διαλύματος δοκιμής. Εκτέλεση της δοκιμής Τιτλοδοτική μέθοδος Το διάλυμα δοκιμής προσδιορίζεται με τιτλοδότηση με πρότυπο διάλυμα βάσης ή οξέος, κατά περίπτωση, και μέτρηση του pH μετά από κάθε προσθήκη τιτλοδότη. Θα πρέπει να γίνονται τουλάχιστον 10 διαδοχικές προσθήκες πριν από το σημείο ισοδυναμίας. Εάν επιτυγχάνεται ισορροπία αρκετά γρήγορα, μπορεί να χρησιμοποιηθεί καταγραφικό ποτενσιόμετρο. Για την παρούσα μέθοδο, πρέπει να είναι επακριβώς γνωστά τόσο η συνολική ποσότητα της ουσίας όσο και η συγκέντρωσή της. Πρέπει να λαμβάνονται προφυλάξεις για τον αποκλεισμό του διοξειδίου του άνθρακα. Λεπτομέρειες για τη διαδικασία, τις προφυλάξεις και τους υπολογισμούς παρέχονται σε πρότυπες δοκιμές, π.χ. στις βιβλιογραφικές παραπομπές (1), (2), (3), (4). Φασματοφωτομετρική μέθοδος Εντοπίζεται το μήκος κύματος στο οποίο οι ιονισμένες και μη ιονισμένες μορφές της ουσίας έχουν αισθητά διαφορετικούς συντελεστές απόσβεσης. Λαμβάνεται το φάσμα απορρόφησης στο υπεριώδες/ορατό τμήμα από διαλύματα σταθερής συγκέντρωσης σε συνθήκες pH στις οποίες η ουσία είναι ουσιαστικά μη ιονισμένη και πλήρως ιονισμένη, καθώς και σε διάφορα ενδιάμεσα pH. Αυτό μπορεί να επιτευχθεί είτε με τη διαδοχική προσθήκη πυκνού οξέος (πυκνής βάσης) σε σχετικά μεγάλο όγκο διαλύματος της ουσίας σε πολυσυστατικό ρυθμιστικό διάλυμα, αρχικά σε υψηλό (χαμηλό) pH (βιβλιογραφική παραπομπή αριθ. 5), είτε με την προσθήκη ίσων όγκων διαλύματος παρακαταθήκης της ουσίας, π.χ. σε νερό ή μεθανόλη, σε σταθερούς όγκους διαφόρων ρυθμιστικών διαλυμάτων που καλύπτουν το επιθυμητό εύρος τιμών pH. Από τις τιμές pH και απορρόφησης στο επιλεγμένο μήκος κύματος υπολογίζεται επαρκής αριθμός τιμών pKa με τη χρήση δεδομένων από τουλάχιστον 5 pH, όπου η ουσία είναι ιονισμένη σε ποσοστό από τουλάχιστον 10 % έως λιγότερο από 90 %. Πρόσθετες λεπτομέρειες για το πείραμα και η μέθοδος υπολογισμού παρατίθενται στη βιβλιογραφική παραπομπή (1). Αγωγιμομετρική μέθοδος Με τη χρήση κυψελίδας μικρής και γνωστής σταθεράς, μετράται η αγωγιμότητα διαλύματος της ουσίας περίπου 0,1 M σε νερό χαμηλής αγωγιμότητας. Μετράται επίσης η αγωγιμότητα ορισμένων αραιώσεων του διαλύματος αυτού που παρασκευάζονται με ακρίβεια. Η συγκέντρωση υποδιπλασιάζεται σε κάθε αραίωση και η σειρά θα πρέπει να καλύπτει τουλάχιστον μία τάξη μεγέθους της συγκέντρωσης. Η περιοριστική αγωγιμότητα σε άπειρη αραίωση υπολογίζεται με την εκτέλεση παρόμοιου πειράματος με το άλας νατρίου και προεκβολή. Από την αγωγιμότητα κάθε διαλύματος μπορεί στη συνέχεια να υπολογιστεί ο βαθμός διάστασης με τη χρήση της εξίσωσης Onsager και, κατ' επέκταση, η σταθερά διάστασης με εφαρμογή του νόμου αραίωσης του Ostwald ως K = α2C/(1 – α)όπου C είναι η συγκέντρωση, σε γραμμομόρια ανά λίτρο και α το διασταθέν κλάσμα. Πρέπει να λαμβάνονται προφυλάξεις για τον αποκλεισμό του CO2. Πρόσθετες λεπτομέρειες σχετικά με το πείραμα και η μέθοδος υπολογισμού παρατίθενται στα έγγραφα αναφοράς και στις βιβλιογραφικές παραπομπές (1), (6) και (7). ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Επεξεργασία αποτελεσμάτων Τιτλοδοτική μέθοδος Η pKa υπολογίζεται για 10 σημεία που έχουν μετρηθεί στην καμπύλη τιτλοδότησης. Υπολογίζονται ο μέσος όρος και η τυπική απόκλιση αυτών των τιμών pKa. Θα πρέπει να περιλαμβάνεται διάγραμμα του pH σε συνάρτηση με τον όγκο της πρότυπης βάσης ή του πρότυπου οξέος, συνοδευόμενο από παρουσίαση σε πίνακα. Φασματοφωτομετρική μέθοδος Για κάθε φάσμα παρουσιάζονται σε πίνακα η απορρόφηση και το pH. Υπολογίζονται τουλάχιστον πέντε τιμές pKa από τα σημεία ενδιάμεσων φασματικών δεδομένων, καθώς επίσης η μέση τιμή και η τυπική απόκλιση των αποτελεσμάτων αυτών. Αγωγιμομετρική μέθοδος Υπολογίζεται η ισοδύναμη αγωγιμότητα Λ για κάθε συγκέντρωση οξέος και για κάθε συγκέντρωση μείγματος ενός ισοδυνάμου οξέος συν 0,98 ισοδύναμα υδροξειδίου του νατρίου χωρίς ανθρακικό άλας. Το οξύ βρίσκεται σε περίσσεια ώστε να αποτρέπεται η περίσσεια OH– λόγω υδρόλυσης. Σχεδιάζεται διάγραμμα του λόγου 1/Λ σε συνάρτηση με την √C ενώ η τιμή του Λo του άλατος μπορεί να υπολογιστεί με προεκβολή στη μηδενική συγκέντρωση. Η τιμή Λo του οξέος μπορεί να υπολογιστεί από τις τιμές της βιβλιογραφίας για τα ιόντα για H+ και Na+. Η τιμή pKa μπορεί να υπολογιστεί από τις εξισώσεις α = Λi /Λo και Ka = α2C/(1 – α)για κάθε συγκέντρωση. Καλύτερες τιμές Ka μπορούν να ληφθούν με διορθώσεις για να ληφθούν υπόψη η κινητικότητα και η ενεργότητα. Θα πρέπει να υπολογίζονται η μέση τιμή και οι τυπικές αποκλίσεις των τιμών pKa. Έκθεση δοκιμής Θα πρέπει να υποβάλλονται όλα τα ανεπεξέργαστα δεδομένα και οι υπολογισμένες τιμές pKa συνοδευόμενα από τη μέθοδο υπολογισμού (κατά προτίμηση σε πίνακα, όπως προτείνεται στη βιβλιογραφική παραπομπή αριθ. 1), καθώς και οι στατιστικές παράμετροι που περιγράφονται ανωτέρω. Για την τιτλοδοτική μέθοδο, θα πρέπει να παρέχονται λεπτομέρειες σχετικά με την τυποποίηση των τιτλοδοτών. Για τη φασματοφωτομετρική μέθοδο, θα πρέπει να υποβάλλονται όλα τα φάσματα. Για την αγωγιμομετρική μέθοδο, θα πρέπει να αναφέρονται λεπτομέρειες για τον προσδιορισμό της σταθεράς της κυψελίδας. Θα πρέπει να υποβάλλονται στοιχεία σχετικά με τη χρησιμοποιούμενη τεχνική, τις αναλυτικές μεθόδους και το είδος των τυχόν χρησιμοποιούμενων ρυθμιστικών διαλυμάτων. Θα πρέπει να αναφέρονται οι θερμοκρασίες της δοκιμής. ΒΙΒΛΙΟΓΡΑΦΙΑ
|
|
(2) |
Στο μέρος B, το Κεφάλαιο 2 αντικαθίσταται από το ακόλουθο κείμενο: «Β.5 ΟΞΕΙΑΣ ΜΟΡΦΗΣ ΕΡΕΘΙΣΜΟΣ/ΔΙΑΒΡΩΣΗ ΤΩΝ ΟΦΘΑΛΜΩΝ ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 405 του ΟΟΣΑ (2012). Οι κατευθυντήριες γραμμές του ΟΟΣΑ για τον έλεγχο των χημικών ουσιών επανεξετάζονται περιοδικά για να εξασφαλίζεται ότι αντανακλούν τις βέλτιστες διαθέσιμες επιστημονικές γνώσεις. Στις προηγούμενες επανεξετάσεις της παρούσας κατευθυντήριας γραμμής δοκιμών, δόθηκε ιδιαίτερη προσοχή στις δυνατότητες βελτίωσης μέσω της αξιολόγησης όλων των υφιστάμενων στοιχείων σχετικά με τις υπό δοκιμή ουσίες, ώστε να μη διεξάγονται περιττές δοκιμές σε πειραματόζωα και, κατ' επέκταση, να λαμβάνονται υπόψη οι ανησυχίες σχετικά με την καλή μεταχείριση των ζώων. Η TG 405 (που εγκρίθηκε το 1981 και επικαιροποιήθηκε το 1987, το 2002 και το 2012) περιλαμβάνει τη σύσταση να διενεργείται ανάλυση βάρους της απόδειξης (1) για τα υφιστάμενα σχετικά δεδομένα, πριν από τη διεξαγωγή της περιγραφόμενης δοκιμής in vivo για οξείας μορφής ερεθισμό/διάβρωση των οφθαλμών. Όταν τα διαθέσιμα δεδομένα είναι ανεπαρκή, συνιστάται να συμπληρώνονται με την εφαρμογή στρατηγικής διαδοχικών δοκιμών (2) (3). Η στρατηγική δοκιμών περιλαμβάνει τη διεξαγωγή επικυρωμένων και αποδεκτών δοκιμών in vitro και παρέχεται ως συμπλήρωμα της παρούσας μεθόδου. Για τους σκοπούς του κανονισμού (ΕΚ) αριθ., 1907/2006 για την καταχώριση, την αξιολόγηση, την αδειοδότηση και τους περιορισμούς των χημικών προϊόντων (REACH) (2), μια στρατηγική ολοκληρωμένων δοκιμών περιλαμβάνεται επίσης στο σχετικό έγγραφο καθοδήγησης του ECHA (21). Οι δοκιμές σε ζώα θα πρέπει να διεξάγονται μόνον αν αυτό κρίνεται απαραίτητο μετά από εξέταση των διαθέσιμων εναλλακτικών μεθόδων, και να χρησιμοποιούν εκείνες που κρίνονται κατάλληλες. Κατά τον χρόνο σύνταξης της παρούσας επικαιροποιημένης μεθόδου δοκιμών, υπάρχουν περιπτώσεις κατά τις οποίες αυτή εξακολουθεί να είναι αναγκαία ή να απαιτείται βάσει ορισμένων κανονιστικών πλαισίων. Η πιο πρόσφατη επικαιροποίηση επικεντρώθηκε κυρίως στη χρήση αναλγητικών και αναισθητικών χωρίς να επηρεάζεται η βασική ιδέα και δομή της κατευθυντήριας γραμμής δοκιμών. Η ICCVAM (3) και μια διεθνής ανεξάρτητη επιστημονική επιτροπή αξιολόγησης από ομότιμους κριτές εξέτασαν τη χρησιμότητα και τους περιορισμούς της χρήσης τοπικών αναισθητικών, συστημικών αναλγητικών και τελικών σημείων ευθανασίας ως συνήθη πρακτική κατά τις δοκιμές ασφάλειας έναντι οφθαλμικού ερεθισμού in vivo (12). Η επανεξέταση κατέληξε στο συμπέρασμα ότι με τη χρήση τοπικών αναισθητικών και συστημικών αναλγητικών μπορούν να αποφευχθούν κατά μεγάλο βαθμό ή και τελείως ο πόνος και η δυσφορία, χωρίς να επηρεάζεται το αποτέλεσμα της δοκιμής, και στη διατύπωση της σύστασης να χρησιμοποιούνται πάντοτε οι εν λόγω ουσίες. Στην παρούσα μέθοδο δοκιμών έχει ληφθεί υπόψη αυτή η επανεξέταση. Κατά τη διάρκεια των δοκιμών in vivo για οξείας μορφής ερεθισμό και διάβρωση των οφθαλμών, θα πρέπει να χρησιμοποιούνται ως συνήθης πρακτική τοπικά αναισθητικά, συστημικά αναλγητικά και τελικά σημεία ευθανασίας. Οι εξαιρέσεις στη χρήση τους θα πρέπει να αιτιολογούνται. Οι βελτιώσεις που περιγράφονται στην παρούσα μέθοδο θα περιορίσουν σημαντικά ή ακόμη και θα αποτρέψουν τον πόνο και τη δυσφορία των ζώων στις περισσότερες περιπτώσεις όπου εξακολουθεί να είναι αναγκαία η διεξαγωγή δοκιμών in vivo για την οφθαλμική ασφάλεια. Η ισόρροπη προληπτική διαχείριση του πόνου θα πρέπει να περιλαμβάνει i) ως συνήθη πρακτική, προκαταρτική αγωγή με τοπικό αναισθητικό (π.χ. προπαρακαΐνη ή τετρακαΐνη) και συστημικό αναλγητικό (π.χ. βουπρενορφίνη), ii) ως συνήθη πρακτική, πρόγραμμα χορήγησης συστημικών αναλγητικών μετά τη μεταχείριση (π.χ. βουπρενορφίνη και μελοξικάμη), iii) προγραμματισμένη παρατήρηση, παρακολούθηση και καταγραφή των ζώων για κλινικά σημεία πόνου και/ή δυσφορίας και iv) προγραμματισμένη παρατήρηση, παρακολούθηση και καταγραφή του είδους, της σοβαρότητας και της πορείας όλων των κακώσεων των οφθαλμών. Περισσότερες λεπτομέρειες περιέχονται στις επικαιροποιημένες διαδικασίες που περιγράφονται κατωτέρω. Μετά τη χορήγηση της υπό δοκιμή χημικής ουσίας, δεν θα πρέπει να εφαρμόζονται τοπικά αναισθητικά ή αναλγητικά ώστε να αποφεύγονται οι παρεμβολές στη μελέτη. Αναλγητικά με αντιφλεγμονώδη δράση (π.χ. μελοξικάμη) δεν θα πρέπει να εφαρμόζονται τοπικά και οι δόσεις που χρησιμοποιούνται συστημικά δεν θα πρέπει να επηρεάζουν τις επιδράσεις στους οφθαλμούς. Οι ορισμοί παρατίθενται στο προσάρτημα της παρούσας μεθόδου δοκιμών. ΑΡΧΙΚΑ ΘΕΜΑΤΑ ΠΡΟΣ ΕΞΕΤΑΣΗ Προς όφελος τόσο της ορθότητας του επιστημονικού έργου, όσο και της καλής μεταχείρισης των ζώων, δεν θα πρέπει να διεξάγονται δοκιμές in vivo πριν αξιολογηθούν, με ανάλυση βάρους της απόδειξης, όλα τα διαθέσιμα δεδομένα σχετικά με την πιθανή διαβρωτική/ερεθιστική επίδραση των ουσιών στους οφθαλμούς. Τα εν λόγω δεδομένα περιλαμβάνουν στοιχεία από προηγούμενες μελέτες στον άνθρωπο και/ή σε πειραματόζωα, στοιχεία που αποδεικνύουν ότι μια ή περισσότερες ουσίες με ανάλογη χημική δομή ή μείγματα τέτοιων ουσιών προκαλούν διάβρωση/ερεθισμό στους οφθαλμούς, δεδομένα που αποδεικνύουν υψηλή οξύτητα ή αλκαλικότητα της χημικής ουσίας (4) (5) και αποτελέσματα έγκυρων και αποδεκτών δοκιμών in vitro ή ex vivo για διάβρωση του δέρματος και διάβρωση/ερεθισμό των οφθαλμών 6) (13) (14) (15) (16) (17). Οι μελέτες αυτές μπορεί να έχουν διεξαχθεί πριν από την ανάλυση βάρους της απόδειξης ή ως επακόλουθό της. Από την ανωτέρω ανάλυση ενδέχεται να προκύπτει ανάγκη μελετών in vivo του διαβρωτικού/ερεθιστικού για τους οφθαλμούς δυναμικού ορισμένων χημικών ουσιών. Σε όλες αυτές τις περιπτώσεις, πριν εξεταστεί το ενδεχόμενο εκτέλεσης της οφθαλμικής δοκιμής in vivo, θα πρέπει κατά προτίμηση να προηγείται μελέτη των διαβρωτικών επιδράσεων της χημικής ουσίας στο δέρμα in vitro και/ή in vivo και η μελέτη να αξιολογείται σύμφωνα με τη στρατηγική διαδοχικών δοκιμών που προβλέπεται στη μέθοδο δοκιμών B.4 (7) ή τη στρατηγική ολοκληρωμένων δοκιμών που περιγράφεται στο έγγραφο καθοδήγησης του ECHA (21). Η στρατηγική διαδοχικών δοκιμών, που περιλαμβάνει τη διεξαγωγή επικυρωμένων δοκιμών διάβρωσης/ερεθισμού των οφθαλμών in vitro ή ex vivo, συμπεριλαμβάνεται ως συμπλήρωμα στην παρούσα μέθοδο δοκιμών και, για τους σκοπούς του κανονισμού REACH, στο έγγραφο καθοδήγησης του ECHA (21). Συνιστάται η εφαρμογή της εν λόγω στρατηγικής διαδοχικών δοκιμών πριν από τη διεξαγωγή δοκιμών in vivo. Για τις νέες χημικές ουσίες, συνιστάται κλιμακωτή προσέγγιση δοκιμών για τη συλλογή επιστημονικώς ορθών δεδομένων σχετικά με τη διαβρωτική/ερεθιστική δράση της χημικής ουσίας. Για τις υφιστάμενες χημικές ουσίες, για τις οποίες δεν υπάρχουν επαρκή δεδομένα όσον αφορά τη δερματική και οφθαλμική διάβρωση/ερεθισμό, η στρατηγική μπορεί να χρησιμοποιείται για να συμπληρωθούν τα κενά στα δεδομένα. Η εφαρμογή διαφορετικής στρατηγικής ή διαδικασίας δοκιμών ή τυχόν απόφαση να μην εφαρμοστεί κλιμακωτή προσέγγιση δοκιμών θα πρέπει να αιτιολογείται. ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ IN VIVO Μετά από προκαταρτική αγωγή με συστημικό αναλγητικό και επαγωγή της κατάλληλης τοπικής αναισθησίας, η προς δοκιμή χημική ουσία εφαρμόζεται εφάπαξ σε έναν από τους οφθαλμούς του πειραματόζωου. Ο οφθαλμός που δεν υποβάλλεται σε αγωγή χρησιμεύει ως μάρτυρας. Ο βαθμός ερεθισμού/διάβρωσης του οφθαλμού αξιολογείται με βαθμολόγηση των βλαβών του επιπεφυκότα, του κερατοειδούς και της ίριδας σε συγκεκριμένα διαστήματα. Περιγράφονται επίσης τυχόν άλλες επιδράσεις στους οφθαλμούς και συστημικές δυσμενείς επιδράσεις με σκοπό την πλήρη αξιολόγηση των επιδράσεων. Η διάρκεια της μελέτης θα πρέπει να είναι επαρκής για να εκτιμηθεί αν οι επιδράσεις είναι αναστρέψιμες ή μη. Τα ζώα που εμφανίζουν σημεία έντονης δυσφορίας και/ή πόνου σε οποιοδήποτε στάδιο της δοκιμής ή βλάβες συμβατές με τα τελικά σημεία ευθανασίας που περιγράφονται στην παρούσα μέθοδο δοκιμών (βλ. παράγραφο 26) θα πρέπει να θανατώνονται ανώδυνα και η χημική ουσία να αξιολογείται ανάλογα. Τα κριτήρια για τη λήψη απόφασης σχετικά με την ανώδυνη θανάτωση ετοιμοθάνατων ή βαρέως πασχόντων ζώων αποτελούν το αντικείμενο εγγράφου καθοδήγησης του ΟΟΣΑ (8). ΠΡΟΕΤΟΙΜΑΣΙΕΣ ΓΙΑ ΤΗ ΔΟΚΙΜΗ IN VIVO Επιλογή ζωικού είδους Το προτιμώμενο πειραματόζωο είναι το αλφικό κουνέλι και χρησιμοποιούνται υγιή νεαρά ενήλικα ζώα. Η χρήση άλλων φυλών ή ειδών θα πρέπει να αιτιολογείται. Προετοιμασία των ζώων Κάθε πειραματόζωο που επιλέγεται αρχικά για τη δοκιμή θα πρέπει, εντός των 24 ωρών που προηγούνται της έναρξής της, να υποβάλλεται σε οφθαλμολογική εξέταση και των δύο οφθαλμών. Δεν θα πρέπει να χρησιμοποιούνται ζώα που εμφανίζουν ερεθισμένους οφθαλμούς, οφθαλμικές ανωμαλίες ή προϋπάρχουσες κακώσεις του κερατοειδούς. Συνθήκες στέγασης και σίτισης Τα ζώα θα πρέπει να στεγάζονται χωριστά. Η θερμοκρασία στην αίθουσα πειραματόζωων θα πρέπει να είναι 20°C (± 3°C) για τα κουνέλια. Αν και η σχετική υγρασία θα πρέπει να είναι τουλάχιστον 30 % και, κατά προτίμηση, να μην υπερβαίνει το 70 %, εκτός από τις περιόδους καθαρισμού της αίθουσας, εν τούτοις θα πρέπει να επιδιώκεται μια τιμή 50-60 %. Ο φωτισμός θα πρέπει να είναι τεχνητός, με φωτοπερίοδο 12 ωρών. Θα πρέπει να αποφεύγεται η υπερβολική φωτεινή ένταση. Για τη διατροφή των ζώων μπορούν να χρησιμοποιούνται τα συνήθη εργαστηριακά σιτηρέσια, με απεριόριστη παροχή πόσιμου νερού. ΔΙΑΔΙΚΑΣΙΑ ΔΟΚΙΜΗΣ Χρήση τοπικών αναισθητικών και συστημικών αναλγητικών Συνιστώνται οι ακόλουθες διαδικασίες για την αποφυγή ή την ελαχιστοποίηση του πόνου και της δυσφορίας σε διαδικασίες δοκιμών οφθαλμικής ασφάλειας. Εναλλακτικά, επιτρέπεται να χρησιμοποιούνται υποκατάστατες διαδικασίες που αποδεδειγμένα εξασφαλίζουν εξίσου αποτελεσματική ή και αποτελεσματικότερη πρόληψη ή ανακούφιση από τον πόνο και τη δυσφορία.
Εφαρμογή της υπό δοκιμή χημικής ουσίας Η υπό δοκιμή χημική ουσία θα πρέπει να τοποθετείται στο θόλο του επιπεφυκότα του ενός οφθαλμού κάθε ζώου, αφού αποτραβηχτεί, με απαλές κινήσεις, το κάτω βλέφαρο από το βολβό. Στη συνέχεια, με απαλές κινήσεις, τα βλέφαρα διατηρούνται κλειστά για ένα περίπου δευτερόλεπτο, για να αποφευχθεί η απώλεια υλικού. Ο άλλος οφθαλμός, που δεν υποβάλλεται σε μεταχείριση, χρησιμεύει ως μάρτυρας. Έκπλυση Οι οφθαλμοί των πειραματόζωων δεν θα πρέπει να εκπλένονται για 24 ώρες τουλάχιστον μετά την ενστάλαξη της υπό δοκιμή ουσίας, εκτός εάν αυτή είναι στερεό (βλ. παράγραφο 18) ή εάν εκδηλωθούν αμέσως διαβρωτικές ή ερεθιστικές επιδράσεις. Σε 24 ώρες μπορεί να γίνει έκπλυση, εάν θεωρηθεί σκόπιμο. Δεν συνιστάται η χρήση δορυφορικής ομάδας ζώων για τη διερεύνηση της επίδρασης της έκπλυσης, εκτός εάν το επιβάλλουν επιστημονικοί λόγοι. Στις περιπτώσεις όπου απαιτείται δορυφορική ομάδα, θα πρέπει να χρησιμοποιούνται δύο κουνέλια. Πρέπει να τεκμηριώνονται επιμελώς οι συνθήκες έκπλυσης, π.χ. χρόνος έκπλυσης, σύνθεση και θερμοκρασία του διαλύματος, διάρκεια, όγκος και ταχύτητα εφαρμογής. Επίπεδα δόσεων (1) Δοκιμή υγρών Για τη δοκιμή υγρών χρησιμοποιείται μία δόση 0,1 ml. Τα εκνεφώματα (σπρέι) δεν θα πρέπει να ενσταλάζονται απευθείας από τον ψεκαστήρα στον οφθαλμό. Το υγρό θα πρέπει να εκβάλλεται από τον περιέκτη, να συλλέγεται σε άλλο δοχείο και κατόπιν να λαμβάνονται 0,1 ml για ενστάλαξη στον οφθαλμό. (2) Δοκιμή στερεών Για τη δοκιμή στερεών, αλοιφών και κοκκωδών χημικών ουσιών, η χρησιμοποιούμενη ποσότητα θα πρέπει να έχει όγκο 0,1 ml ή βάρος που δεν υπερβαίνει τα 100 mg. Η υπό δοκιμή χημική ουσία θα πρέπει να λειοτριβείται σε λεπτή σκόνη. Ο όγκος των στερεών υλικών θα πρέπει να μετριέται αφού αυτά συμπυκνωθούν ελαφρά, π.χ. με μικρά κτυπήματα στο δοχείο μέτρησης. Εάν η στερεά υπό δοκιμή χημική ουσία δεν έχει απομακρυνθεί από τον οφθαλμό του πειραματόζωου με τους φυσιολογικούς μηχανισμούς κατά τον πρώτο χρόνο παρατήρησης, που είναι μία ώρα μετά την εφαρμογή, ο οφθαλμός μπορεί να εκπλυθεί με φυσιολογικό ορό ή απεσταγμένο νερό. (3) Δοκιμή αερολυμάτων Συνιστάται όλα τα εκνεφώματα και αερολύματα να συλλέγονται σε άλλο δοχείο πριν από την ενστάλαξή τους στον οφθαλμό. με μόνη εξαίρεση τις χημικές ουσίες που περιέχονται σε δοχεία υπό πίεση, οι οποίες δεν είναι δυνατόν να συλλεχθούν επειδή εξατμίζονται. Στις περιπτώσεις αυτές, ο οφθαλμός θα πρέπει να κρατείται ανοικτός και η υπό δοκιμή χημική ουσία να χορηγείται με έναν μόνο ψεκασμό διάρκειας ενός δευτερολέπτου περίπου από απόσταση 10 cm, ακριβώς απέναντι από τον οφθαλμό. Αυτή η απόσταση μπορεί να διαφέρει ανάλογα με την πίεση του εκνεφώματος και τα συστατικά του. Θα πρέπει να λαμβάνεται μέριμνα ώστε ο οφθαλμός να μην υφίσταται βλάβη από την πίεση ψεκασμού. Σε ειδικές περιπτώσεις, ενδέχεται να είναι αναγκαία η εκτίμηση της πιθανότητας να προκληθεί «μηχανική» βλάβη στον οφθαλμό από τη δύναμη του αερολύματος. Η δόση του αερολύματος είναι δυνατόν να υπολογιστεί κατά προσέγγιση με την ακόλουθη προσομοίωση της δοκιμής: η χημική ουσία ψεκάζεται διαμέσου οπής μεγέθους ίσου με τον οφθαλμό του κουνελιού επάνω σε χαρτί ζύγισης τοποθετημένο ακριβώς πίσω από την οπή. Η αύξηση του βάρους του χαρτιού παρέχει μια εκτίμηση της ποσότητας που θα ψεκαστεί στον οφθαλμό. Στην περίπτωση των πτητικών χημικών ουσιών, η δόση μπορεί να υπολογιστεί κατά προσέγγιση με ζύγιση του δοχείου που περιέχει την υπό δοκιμή χημική ουσία πριν και μετά την αφαίρεσή της. Αρχική δοκιμή (δοκιμή ερεθισμού/διάβρωσης των οφθαλμών in vivo σε ένα ζώο) Συνιστάται θερμά να διεξάγεται η δοκιμή in vivo πρώτα σε ένα μόνο ζώο (βλ. συμπλήρωμα της παρούσας μεθόδου δοκιμών: Στρατηγική διαδοχικών δοκιμών ερεθισμού και διάβρωσης των οφθαλμών). Οι παρατηρήσεις θα πρέπει να επιτρέπουν τον προσδιορισμό της σοβαρότητας και της αναστρεψιμότητας πριν από τη διεξαγωγή επιβεβαιωτικής δοκιμής σε δεύτερο ζώο. Εάν τα αποτελέσματα της δοκιμής αυτής υποδεικνύουν, σύμφωνα με την περιγραφόμενη διαδικασία, ότι η χημική ουσία είναι διαβρωτικό ή ισχυρό ερεθιστικό των οφθαλμών, δεν θα πρέπει να διεξάγονται άλλες δοκιμές ερεθισμού των οφθαλμών. Επιβεβαιωτική δοκιμή (δοκιμή ερεθισμού των οφθαλμών in vivo σε επιπλέον ζώα) Εάν δεν έχει παρατηρηθεί διαβρωτική ή σοβαρή ερεθιστική επίδραση κατά την αρχική δοκιμή, η ερεθιστική ή αρνητική απόκριση θα πρέπει να επιβεβαιώνεται με τη χρήση έως δύο επιπλέον ζώων. Εάν έχει παρατηρηθεί ερεθιστική επίδραση κατά την αρχική δοκιμή, συνιστάται η διεξαγωγή της επιβεβαιωτικής δοκιμής σε διαδοχικές φάσεις με χρήση ενός ζώου κάθε φορά αντί της ταυτόχρονης έκθεσης των δύο επιπλέον ζώων. Εάν το δεύτερο ζώο εμφανίσει διαβρωτικές ή ισχυρές ερεθιστικές επιδράσεις, η δοκιμή διακόπτεται. Εάν τα αποτελέσματα από το δεύτερο ζώο είναι επαρκή για την απόφαση σχετικά με την ταξινόμηση κινδύνων, δεν θα πρέπει να διεξάγονται άλλες δοκιμές. Περίοδος παρατήρησης Η διάρκεια της περιόδου παρατήρησης θα πρέπει να είναι επαρκής για να εκτιμηθούν πλήρως το μέγεθος και η αναστρεψιμότητα των παρατηρούμενων επιδράσεων. Παρόλα αυτά, το πείραμα θα πρέπει να τερματίζεται αμέσως μόλις το ζώο εμφανίσει σημεία ισχυρού πόνου ή έντονης δυσφορίας (8). Για να κριθεί αν οι επιδράσεις είναι αναστρέψιμες, τα ζώα θα πρέπει να παρατηρούνται κατά κανόνα για χρονικό διάστημα 21 ημερών μετά τη χορήγηση της υπό δοκιμή χημικής ουσίας. Εάν διαπιστωθεί ότι είναι αναστρέψιμες πριν παρέλθουν 21 ημέρες, το πείραμα θα πρέπει να τερματίζεται τη συγκεκριμένη στιγμή. Κλινικές παρατηρήσεις και διαβάθμιση των οφθαλμικών αντιδράσεων Οι οφθαλμοί θα πρέπει να αξιολογούνται πλήρως για την παρουσία ή την απουσία οφθαλμικών βλαβών μία ώρα μετά την ΕΔΧ και να ακολουθούν τουλάχιστον καθημερινές αξιολογήσεις. Τα ζώα θα πρέπει να αξιολογούνται αρκετές φορές την ημέρα κατά τις πρώτες 3 ημέρες για να εξασφαλίζεται η έγκαιρη λήψη αποφάσεων τερματισμού της δοκιμής. Τα υπό δοκιμή ζώα θα πρέπει να αξιολογούνται συστηματικά σε όλη τη διάρκεια της μελέτης για κλινικά σημεία πόνου και/ή δυσφορίας (π.χ. επανειλημμένο άγγιγμα ή τρίψιμο του οφθαλμού με τα οπίσθια ή πρόσθια άκρα, υπερβολικός βλεφαρισμός, υπερβολική δακρύρροια) (9) (10) (11), τουλάχιστον δύο φορές ημερησίως με ελάχιστα διαστήματα 6 ωρών μεταξύ των παρατηρήσεων, ή συχνότερα εάν χρειαστεί. Αυτό είναι αναγκαίο για i) την επαρκή αξιολόγηση των ενδείξεων πόνου και δυσφορίας στα ζώα, έτσι ώστε να λαμβάνονται τεκμηριωμένες αποφάσεις για το αν είναι αναγκαίο να αυξηθεί η δόση των αναλγητικών και ii) την αξιολόγηση της επίτευξης κάποιου από τα καθορισμένα τελικά σημεία ευθανασίας στα ζώα, έτσι ώστε να λαμβάνονται τεκμηριωμένες αποφάσεις για το κατά πόσον είναι σκόπιμη η θανάτωση των ζώων με ευθανασία και να διασφαλίζεται η έγκαιρη λήψη αυτών των αποφάσεων. Θα πρέπει να χρησιμοποιούνται ως συνήθης πρακτική χρώση φλουορεσκεΐνης και βιομικροσκόπιο σχισμοειδούς λυχνίας, όταν αυτό κρίνεται σκόπιμο (π.χ. κατά την αξιολόγηση του βάθους της κάκωσης σε περίπτωση εξέλκωσης του κερατοειδούς), για να υποβοηθούν τον εντοπισμό και τη μέτρηση της οφθαλμικής βλάβης και για να εκτιμάται αν πληρούνται τα καθορισμένα κριτήρια τελικών σημείων για θανάτωση με ευθανασία. Μπορούν να συλλέγονται ψηφιακές φωτογραφίες των παρατηρούμενων βλαβών ως σημεία αναφοράς και για μια μόνιμη καταγραφή της έκτασης της οφθαλμικής βλάβης. Τα ζώα θα πρέπει να παραμένουν υπό δοκιμή μόνο για όσο χρόνο απαιτείται για να ληφθούν οριστικά στοιχεία. Τα ζώα που εμφανίζουν σημεία ισχυρού πόνου ή έντονης δυσφορίας θα πρέπει να θανατώνονται αμέσως με ευθανασία, οπότε η χημική ουσία αξιολογείται ανάλογα. Τα ζώα που εμφανίζουν τις ακόλουθες βλάβες των οφθαλμών μετά την ενστάλαξη της χημικής ουσίας θα πρέπει να θανατώνονται με ευθανασία (βλ. πίνακα 1 για περιγραφή της διαβάθμισης των βλαβών): διάτρηση ή σοβαρή εξέλκωση του κερατοειδούς, συμπεριλαμβανομένου του σταφυλώματος· αιμορραγία στον πρόσθιο θάλαμο του οφθαλμού· αδιαφάνεια (θολερότητα) του κερατοειδούς 4ου βαθμού· απουσία φωτοκινητικού αντανακλαστικού (βαθμός απόκρισης ίριδας 2) για 72 ώρες· εξέλκωση του επιπεφυκότα· νέκρωση του επιπεφυκότα ή της σκαρδαμυκτικής μεμβράνης· ή απόπτωση εσχάρας, επειδή οι συγκεκριμένες βλάβες κατά κανόνα δεν είναι αναστρέψιμες. Επιπλέον, συνιστάται να χρησιμοποιούνται οι ακόλουθες βλάβες των οφθαλμών ως τελικά σημεία ευθανασίας για τον τερματισμό μελετών πριν από τη λήξη της προγραμματισμένης περιόδου παρατήρησης, διάρκειας 21 ημερών. Οι βλάβες αυτές θεωρούνται πρόδρομα σοβαρών ερεθιστικών ή διαβρωτικών κακώσεων και κακώσεων που δεν αναμένεται να αναστραφούν πλήρως μέχρι το τέλος της 21ήμερης περιόδου παρατήρησης: μεγάλο βάθος της κάκωσης (π.χ. επέκταση της εξέλκωσης του κερατοειδούς πέρα από τις επιφανειακές στιβάδες του στρώματος), καταστροφή του σκληροκερατοειδικού ορίου > 50 % (όπως αποδεικνύεται από τη λεύκανση του επιπεφυκότα) και σοβαρή λοίμωξη του οφθαλμού (πυόρροια). Ο συνδυασμός νεοαγγείωσης της επιφάνειας του κερατοειδούς (δηλ. σχηματισμός πάννου), μη συρρίκνωσης της επιφάνειας που χρωματίζεται με τη φλουορεσκεΐνη με την πάροδο του χρόνου βάσει καθημερινής αξιολόγησης και/ή απουσίας επανεπιθηλίωσης 5 ημέρες μετά την εφαρμογή της υπό δοκιμή χημικής ουσίας θα μπορούσαν επίσης να θεωρηθούν δυνητικά χρήσιμα κριτήρια που επηρεάζουν την κλινική απόφαση για πρόωρο τερματισμό της μελέτης. Ωστόσο, καθένα από αυτά τα ευρήματα δεν αρκεί από μόνο του για να δικαιολογήσει τον πρόωρο τερματισμό της μελέτης. Αφού εντοπιστούν σοβαρές επιδράσεις στους οφθαλμούς, θα πρέπει να καλείται θεράπων ή ειδικευμένος στα πειραματόζωα κτηνίατρος ή προσωπικό εκπαιδευμένο να εντοπίζει τις κλινικές βλάβες για κλινική εξέταση, ώστε να διαπιστώνεται αν ο συνδυασμός αυτών των επιδράσεων δικαιολογεί τον πρόωρο τερματισμό της μελέτης. Οι οφθαλμικές αντιδράσεις (του επιπεφυκότα, του κερατοειδούς και της ίριδας) θα πρέπει να βαθμολογούνται και οι βαθμοί να καταγράφονται 1, 24, 48 και 72 ώρες μετά την εφαρμογή της υπό δοκιμή χημικής ουσίας (πίνακας 1). Τα ζώα που δεν εμφανίζουν οφθαλμικές βλάβες μπορούν να απομακρύνονται από τη δοκιμή το νωρίτερο 3 ημέρες μετά την ενστάλαξη της ουσίας. Τα ζώα που δεν εμφανίζουν σοβαρές οφθαλμικές βλάβες θα πρέπει να παρατηρούνται μέχρι αυτές να εξαλειφθούν ή για χρονικό διάστημα 21 ημερών, οπότε η μελέτη τερματίζεται. Οι παρατηρήσεις θα πρέπει να διενεργούνται και να καταγράφονται τουλάχιστον 1 ώρα, 24 ώρες, 48 ώρες, 72 ώρες, 7 ημέρες, 14 ημέρες και 21 ημέρες μετά την ΕΔΧ, με σκοπό να διαπιστώνεται η εξέλιξη των βλαβών και να κρίνεται αν αυτές είναι αναστρέψιμες ή μη. Θα πρέπει να διενεργούνται συχνότερες παρατηρήσεις, εάν είναι αναγκαίο, για να κριθεί αν τα πειραματόζωα θα πρέπει να θανατωθούν με ευθανασία ή να απομακρυνθούν από τη μελέτη λόγω αρνητικών αποτελεσμάτων. Σε κάθε εξέταση θα πρέπει να καταγράφονται οι βαθμοί των οφθαλμικών βλαβών (πίνακας 1). Θα πρέπει επίσης να αναφέρονται τυχόν άλλες βλάβες του οφθαλμού (π.χ. σχηματισμός πάννου, χρώση, αλλαγές στον πρόσθιο θάλαμο) ή συστημικές δυσμενείς επιδράσεις. Η εξέταση των αντιδράσεων μπορεί να διευκολυνθεί με τη χρήση διόφθαλμου οφθαλμοσκοπίου, φορητής σχισμοειδούς λυχνίας, βιομικροσκοπίου ή άλλου κατάλληλου οργάνου. Μετά την καταγραφή των παρατηρήσεων του πρώτου 24ώρου, οι οφθαλμοί μπορούν να εξετάζονται περαιτέρω με τη βοήθεια φλουορεσκεΐνης. Η διαβάθμιση των οφθαλμικών αποκρίσεων είναι κατ' ανάγκη υποκειμενική. Για να διευκολυνθεί η εναρμόνιση της διαβάθμισης των οφθαλμικών αποκρίσεων και να βοηθηθούν, αφενός, τα εργαστήρια δοκιμών και, αφετέρου, το προσωπικό που εκτελεί και ερμηνεύει τις παρατηρήσεις, απαιτείται κατάλληλη εκπαίδευση του εν λόγω προσωπικού στο χρησιμοποιούμενο σύστημα βαθμολόγησης. ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Αξιολόγηση των αποτελεσμάτων Η βαθμολογία του οφθαλμικού ερεθισμού θα πρέπει να αξιολογείται σε συνδυασμό με το είδος και τη σοβαρότητα των βλαβών, καθώς και με το κατά πόσον αυτές είναι αναστρέψιμες. Οι επιμέρους βαθμοί δεν αντιπροσωπεύουν ένα απόλυτο πρότυπο για τις ερεθιστικές ιδιότητες των χημικών ουσιών, δεδομένου ότι αξιολογούνται και άλλες επιδράσεις της υπό δοκιμή ουσίας. Αντίθετα, θα πρέπει να θεωρούνται τιμές αναφοράς και έχουν αξία μόνον εφόσον τεκμηριώνονται με πλήρη περιγραφή και αξιολόγηση όλων των παρατηρήσεων. Έκθεση δοκιμής Στην έκθεση δοκιμής θα πρέπει να περιλαμβάνονται τα ακόλουθα στοιχεία:
Ερμηνεία των αποτελεσμάτων Τα αποτελέσματα των μελετών ερεθισμού των οφθαλμών που έχουν διεξαχθεί σε πειραματόζωα μπορούν να μεταφερθούν στον άνθρωπο μόνον ως ένα σημείο. Σε πολλές περιπτώσεις το αλφικό κουνέλι είναι πιο ευαίσθητο από τον άνθρωπο στα ερεθιστικά ή διαβρωτικά των οφθαλμών. Κατά την ερμηνεία των αποτελεσμάτων θα πρέπει να καταβάλλεται προσοχή για να μη λαμβάνεται υπόψη ο ερεθισμός που οφείλεται σε δευτεροπαθείς λοιμώξεις. ΒΙΒΛΙΟΓΡΑΦΙΑ
Πίνακας 1 Διαβάθμιση των οφθαλμικών κακώσεων
Προσάρτημα ΟΡΙΣΜΟΙ Όξινο/αλκαλικό απόθεμα : Για όξινα παρασκευάσματα, η ποσότητα (g) υδροξειδίου του νατρίου/100 g του παρασκευάσματος που απαιτείται για την επίτευξη συγκεκριμένου pH. Για αλκαλικά παρασκευάσματα, η ποσότητα (g) υδροξειδίου του νατρίου που ισοδυναμεί με τα g θειικού οξέος/100 g του παρασκευάσματος που απαιτούνται για την επίτευξη συγκεκριμένου pH (Young et al. 1988). Χημική ουσία : μια ουσία ή ένα μείγμα. Μη ερεθιστικά : Ουσίες που δεν ταξινομούνται ως ερεθιστικές για τους οφθαλμούς κατηγορίας EPA I, II ή III· ή ουσίες ερεθιστικές για τους οφθαλμούς των κατηγοριών 1, 2, 2Α ή 2Β του GHS· ή των κατηγοριών 1 ή 2 της ΕΕ (17) (18) (19). Διαβρωτικό των οφθαλμών : α) χημική ουσία που προκαλεί μη αναστρέψιμη βλάβη στους οφθαλμικούς ιστούς· β) χημικές ουσίες που ταξινομούνται ως ερεθιστικά των οφθαλμών, κατηγορίας 1 του GHS ή ερεθιστικές για τους οφθαλμούς κατηγορίας I της EPA ή κατηγορίας 1 της ΕΕ (17) (18) (19). Ερεθιστικό των οφθαλμών : α) χημική ουσία που προκαλεί αναστρέψιμη βλάβη στους οφθαλμούς· β) χημικές ουσίες που ταξινομούνται ως ερεθιστικές για τους οφθαλμούς, κατηγορίας II ή III της EPA· ή ερεθιστικά των οφθαλμών ή κατηγορίας 2, 2A ή 2B του GHS· ή κατηγορίας 2 της ΕΕ (17) (18) (19). Ισχυρό ερεθιστικό των οφθαλμών : α) χημική ουσία που προκαλεί βλάβη στους οφθαλμικούς ιστούς, η οποία δεν υποχωρεί εντός 21 ημερών από την εφαρμογή της ή προκαλεί σοβαρή φυσική εξασθένιση της όρασης· β) χημικές ουσίες που ταξινομούνται ως ερεθιστικές για τους οφθαλμούς κατηγορίας 1 του GHS ή ερεθιστικά των οφθαλμών κατηγορίας I της EPA ή κατηγορίας 1 της ΕΕ (17) (18) (19). Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Κλιμακωτή προσέγγιση : στρατηγική δοκιμών κατά στάδια, στο πλαίσιο της οποίας όλες οι υφιστάμενες πληροφορίες για μια υπό δοκιμή χημική ουσία εξετάζονται με συγκεκριμένη σειρά, με χρήση διαδικασίας βάρους της απόδειξης σε κάθε στάδιο, προκειμένου να διαπιστώνεται, πριν από τη μετάβαση στο επόμενο στάδιο, αν για μια απόφαση ταξινόμησης κινδύνου διατίθενται επαρκείς πληροφορίες. Εάν σε υπό δοκιμή χημική ουσία μπορεί να αποδοθεί δυναμικό ερεθιστικότητας βάσει των υφιστάμενων πληροφοριών, δεν απαιτούνται περαιτέρω δοκιμές. Εάν βάσει των υφιστάμενων πληροφοριών δεν είναι εφικτή η απόδοση δυναμικού ερεθιστικότητας σε υπό δοκιμή χημική ουσία, εφαρμόζεται κλιμακωτή διαδικασία διαδοχικών δοκιμών σε ζώα έως ότου καταστεί εφικτή η βέβαιη ταξινόμηση της ουσίας. Ανάλυση βάρους της απόδειξης (διαδικασία) : Τα δυνατά και τα αδύνατα σημεία μιας συλλογής πληροφοριών χρησιμοποιούνται ως βάση για την εξαγωγή συμπεράσματος το οποίο μπορεί να μην είναι προφανές από τα επιμέρους δεδομένα. ΣΥΜΠΛΗΡΩΜΑ ΤΗΣ ΜΕΘΟΔΟΥ ΔΟΚΙΜΩΝ Β. 5 (4) ΣΤΡΑΤΗΓΙΚΗ ΔΙΑΔΟΧΙΚΩΝ ΔΟΚΙΜΩΝ ΓΙΑ ΕΡΕΘΙΣΜΟ ΚΑΙ ΔΙΑΒΡΩΣΗ ΤΩΝ ΟΦΘΑΛΜΩΝ Γενικές παρατηρήσεις Προς όφελος τόσο της ποιότητας του επιστημονικού έργου, όσο και της καλής μεταχείρισης των ζώων, έχει μεγάλη σημασία να αποφεύγεται η περιττή χρήση πειραματόζωων και να ελαχιστοποιείται η διεξαγωγή δοκιμών που είναι πιθανόν να τους προκαλέσουν σοβαρές αντιδράσεις. Πριν αντιμετωπιστεί το ενδεχόμενο διεξαγωγής δοκιμών in vivo, θα πρέπει να αξιολογούνται όλα τα στοιχεία που αφορούν τις πιθανές διαβρωτικές/ερεθιστικές επιδράσεις των χημικών ουσιών στους οφθαλμούς. Ενδέχεται να υπάρχουν ήδη αποδεικτικά στοιχεία που επαρκούν για την ταξινόμηση μιας υπό δοκιμή χημικής ουσίας από πλευράς διαβρωτικού ή ερεθιστικού για τους οφθαλμούς δυναμικού, χωρίς να είναι αναγκαία η διεξαγωγή δοκιμών σε πειραματόζωα. Η χρησιμοποίηση επομένως της ανάλυσης βάρους της απόδειξης και μιας στρατηγικής διαδοχικών δοκιμών ελαχιστοποιεί την ανάγκη διεξαγωγής δοκιμών in vivo, ιδίως εάν πιθανολογείται ότι η ουσία προκαλεί ισχυρές αντιδράσεις. Συνιστάται η χρήση της ανάλυσης βάρους της απόδειξης για την αξιολόγηση των διαθέσιμων στοιχείων σχετικά με τον ερεθισμό και τη διάβρωση των οφθαλμών από χημικές ουσίες και για να κριθεί αν πρέπει να διεξαχθούν συμπληρωματικές μελέτες, εκτός από τις οφθαλμικές μελέτες in vivo, ώστε να διευκολυνθεί ο χαρακτηρισμός των συγκεκριμένων ιδιοτήτων. Εάν χρειάζονται περαιτέρω μελέτες, συνιστάται η εφαρμογή της στρατηγικής διαδοχικών δοκιμών για τη συλλογή των σχετικών πειραματικών δεδομένων. Στην περίπτωση των ουσιών που δεν έχουν υποβληθεί σε δοκιμές στο παρελθόν, η στρατηγική διαδοχικών δοκιμών θα πρέπει να χρησιμοποιείται για τη συλλογή των δεδομένων που απαιτεί η αξιολόγηση της διαβρωτικής/ερεθιστικής για τους οφθαλμούς ικανότητας των ουσιών. Η αρχική στρατηγική δοκιμών που περιγράφεται στο παρόν συμπλήρωμα διαμορφώθηκε σε σεμινάριο εργασίας του ΟΟΣΑ (1). Στη συνέχεια επιβεβαιώθηκε και επεκτάθηκε στο Εναρμονισμένο Ολοκληρωμένο Σύστημα Ταξινόμησης Κινδύνων για τις Επιδράσεις των Χημικών Ουσιών στην Υγεία του ανθρώπου και στο Περιβάλλον, το οποίο εγκρίθηκε από την 28η κοινή συνεδρίαση της επιτροπής χημικών προϊόντων και της ομάδας εργασίας για τα χημικά προϊόντα, τον Νοέμβριο του 1998 (2), και επικαιροποιήθηκε από ομάδα εμπειρογνωμόνων του ΟΟΣΑ το 2011. Η παρούσα στρατηγική δοκιμών δεν αποτελεί αναπόσπαστο μέρος της μεθόδου δοκιμών Β.5, αλλά εκφράζει τη συνιστώμενη προσέγγιση για τον προσδιορισμό των ερεθιστικών/διαβρωτικών για τους οφθαλμούς ιδιοτήτων. Η προσέγγιση αυτή αντιπροσωπεύει αφενός την ορθή πρακτική και, αφετέρου, ένα δεοντολογικό σημείο αναφοράς για τη διεξαγωγή δοκιμών οφθαλμικής διάβρωσης/ερεθισμού in vivo. Η μεθοδολογία δοκιμών παρέχει κατευθύνσεις για τη διεξαγωγή της δοκιμής in vivo και συγκεφαλαιώνει τους παράγοντες που θα πρέπει να εξετάζονται πριν αποφασιστεί η διενέργεια μιας τέτοιας δοκιμής. Η στρατηγική διαδοχικών δοκιμών παρέχει μια προσέγγιση βασισμένη στην ανάλυση βάρους της απόδειξης για την αξιολόγηση των διαθέσιμων δεδομένων σχετικά με τις ερεθιστικές/διαβρωτικές για τους οφθαλμούς ιδιότητες των χημικών ουσιών, καθώς και μια κλιμακωτή προσέγγιση για τη παραγωγή των σχετικών δεδομένων στην περίπτωση των χημικών ουσιών για τις οποίες χρειάζονται συμπληρωματικές μελέτες ή δεν έχουν εκπονηθεί μελέτες. Η εν λόγω στρατηγική περιλαμβάνει καταρχάς τη διεξαγωγή επικυρωμένων και αποδεκτών δοκιμών in vitro ή ex vivo και, στη συνέχεια, μελετών με τη μέθοδο δοκιμών Β.4 σε συγκεκριμένες περιστάσεις (3) (4). Περιγραφή της κλιμακωτής στρατηγικής δοκιμών Πριν από τη διεξαγωγή δοκιμών στο πλαίσιο της στρατηγικής διαδοχικών δοκιμών (διάγραμμα), θα πρέπει να αξιολογούνται όλα τα διαθέσιμα στοιχεία, προκειμένου να κριθεί αν είναι αναγκαίο να διεξαχθούν οφθαλμικές δοκιμές in vivo. Αν και είναι δυνατόν να προκύψουν σημαντικά στοιχεία από την αξιολόγηση μεμονωμένων παραμέτρων (π.χ. ακραίες τιμές pH), θα πρέπει να εξετάζεται το σύνολο των υφισταμένων στοιχείων. Για να ληφθεί απόφαση με βάση ανάλυση βάρους της απόδειξης, θα πρέπει να αξιολογούνται όλα τα σημαντικά δεδομένα που αφορούν τις επιδράσεις της εκάστοτε χημικής ουσίας και των δομικών αναλόγων της και η απόφαση αυτή θα πρέπει να αιτιολογείται. Θα πρέπει να δίδεται έμφαση πρωτίστως στα διαθέσιμα δεδομένα για τις επιδράσεις χημικών ουσιών στον άνθρωπο και στα ζώα και, κατόπιν, στα αποτελέσματα δοκιμών in vitro ή ex vivo. Θα πρέπει να αποφεύγονται, στο μέτρο του δυνατού, οι μελέτες διαβρωτικών ουσιών in vivo. Οι παράγοντες που λαμβάνονται υπόψη στη στρατηγική δοκιμών περιλαμβάνουν:
ΣΤΡΑΤΗΓΙΚΗ ΔΟΚΙΜΩΝ ΚΑΙ ΑΞΙΟΛΟΓΗΣΗΣ ΓΙΑ ΕΡΕΘΙΣΜΟ/ΔΙΑΒΡΩΣΗ ΤΩΝ ΟΦΘΑΛΜΩΝ
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
|
(3) |
Στο μέρος B, το Κεφάλαιο Β.10 αντικαθίσταται από το ακόλουθο κείμενο: «Β.10 Δοκιμή χρωμοσωμικών εκτροπών in vitro σε θηλαστικά ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών 473 του ΟΟΣΑ (2016). Αποτελεί μέρος μιας σειράς μεθόδων δοκιμών γενετικής τοξικολογίας. Έχει συνταχθεί ένα έγγραφο του ΟΟΣΑ με συνοπτικές πληροφορίες για τις δοκιμές γενετικής τοξικολογίας και μια επισκόπηση των πρόσφατων αλλαγών που έγιναν σε αυτές τις κατευθυντήριες γραμμές δοκιμών (1). Σκοπός της δοκιμής χρωμοσωμικών εκτροπών in vitro είναι ο εντοπισμός χημικών ουσιών που προκαλούν δομικές χρωμοσωμικές εκτροπές σε καλλιεργημένα κύτταρα θηλαστικών (2) (3) (4). Οι δομικές εκτροπές μπορεί να είναι δύο τύπων, χρωμοσωμικές ή χρωματιδικές. Στους προσδιορισμούς χρωμοσωμικών εκτροπών in vitro μπορεί να παρουσιαστεί πολυπλοειδία (συμπεριλαμβανομένου του ενδοαναδιπλασιασμού). Ενώ τα ανευπλοειδογόνα μπορούν να επάγουν πολυπλοειδία, η πολυπλοειδία δεν αποτελεί αφ' εαυτής ένδειξη ανευπλοειδογόνου δυναμικού, αλλά μπορεί να υποδηλώνει απλώς διατάραξη του κυτταρικού κύκλου ή κυτταροτοξικότητα (5). Η παρούσα δοκιμή δεν έχει σχεδιαστεί για τη μέτρηση της ανευπλοειδίας. Για την ανίχνευση ανευπλοειδίας συνιστάται η διεξαγωγή δοκιμής μικροπυρήνων in vitro (6). Στη δοκιμή χρωμοσωμικών εκτροπών in vitro μπορούν να χρησιμοποιούνται καλλιέργειες καθιερωμένων κυτταρικών σειρών ή πρωτογενείς καλλιέργειες κυττάρων ανθρώπου ή τρωκτικών. Τα χρησιμοποιούμενα κύτταρα θα πρέπει να επιλέγονται με βάση την ικανότητα ανάπτυξης σε καλλιέργεια, τη σταθερότητα του καρυότυπου (συμπεριλαμβανομένου του χρωμοσωμικού αριθμού) και την αυθόρμητη συχνότητα χρωμοσωμικών εκτροπών (7). Τα μέχρι σήμερα διαθέσιμα δεδομένα δεν επιτρέπουν τη διατύπωση αυστηρών συστάσεων, αλλά υποδηλώνουν ότι είναι σημαντικό να λαμβάνονται υπόψη, κατά την αξιολόγηση των χημικών κινδύνων, η κατάσταση της p53, η γενετική σταθερότητα (καρυότυπος), η ικανότητα επιδιόρθωσης του DNA και η προέλευση (από τρωκτικά ή τον άνθρωπο) των κυττάρων που επιλέγονται για τη δοκιμή. Ως εκ τούτου, παροτρύνονται οι χρήστες της παρούσας μεθόδου δοκιμών να λαμβάνουν υπόψη την επίδραση αυτών και άλλων κυτταρικών χαρακτηριστικών στις επιδόσεις των κυτταρικών σειρών ως προς την ανίχνευση της επαγωγής χρωμοσωμικών εκτροπών, καθώς εξελίσσεται η επιστημονική γνώση σε αυτόν τον τομέα. Οι χρησιμοποιούμενοι ορισμοί παρατίθενται στο προσάρτημα 1. ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ Οι δοκιμές που διεξάγονται in vitro απαιτούν κατά κανόνα τη χρήση εξωγενούς πηγής μεταβολικής ενεργοποίησης, εκτός εάν τα κύτταρα διαθέτουν ικανότητα μεταβολισμού των υπό δοκιμή χημικών ουσιών. Το εξωγενές σύστημα μεταβολικής ενεργοποίησης δεν μιμείται απόλυτα τις συνθήκες που επικρατούν in vivo. Θα πρέπει να λαμβάνεται μέριμνα ώστε να αποφεύγονται συνθήκες που θα μπορούσαν να οδηγήσουν σε τεχνητά θετικά αποτελέσματα, δηλ. χρωμοσωμική βλάβη που δεν προκαλείται από άμεση αλληλεπίδραση μεταξύ των υπό δοκιμή χημικών ουσιών και των χρωμοσωμάτων· στις συνθήκες αυτές περιλαμβάνονται οι μεταβολές του pH ή της ωσμωμοριακότητας (8) (9) (10), η αλληλεπίδραση με τα συστατικά του θρεπτικού μέσου (11) (12) και τα υπέρμετρα επίπεδα κυτταροτοξικότητας (13) (14) (15) (16). Η παρούσα δοκιμή χρησιμοποιείται για την ανίχνευση χρωμοσωμικών εκτροπών που μπορεί να προκύψουν από κλαστογόνα συμβάντα. Η ανάλυση της επαγωγής χρωμοσωμικών εκτροπών θα πρέπει να διενεργείται με τη χρήση κυττάρων στο στάδιο της μετάφασης. Είναι, συνεπώς, απαραίτητο να φθάνουν τα κύτταρα στο στάδιο της μίτωσης, τόσο στις καλλιέργειες που υποβάλλονται σε μεταχείριση όσο και σε εκείνες που δεν υποβάλλονται. Για τα βιομηχανικά νανοϋλικά, ενδέχεται να χρειάζονται ειδικές προσαρμογές της παρούσας μεθόδου δοκιμών, οι οποίες όμως δεν περιγράφονται στην παρούσα μέθοδο δοκιμών. Πριν από τη χρήση της μεθόδου δοκιμών σε μείγμα για την παραγωγή δεδομένων για συγκεκριμένο ρυθμιστικό σκοπό, θα πρέπει να εξετάζεται αν — και, εάν ναι, για ποιον λόγο — αυτή μπορεί να αποδώσει επαρκή αποτελέσματα για τον επιδιωκόμενο σκοπό. Οι εκτιμήσεις αυτές δεν είναι αναγκαίες όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος. ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ Καλλιέργειες ανθρώπινων κυττάρων ή κυττάρων άλλων θηλαστικών εκτίθενται στην υπό δοκιμή χημική ουσία με και χωρίς εξωγενή πηγή μεταβολικής ενεργοποίησης, εκτός εάν χρησιμοποιούνται κύτταρα με επαρκή μεταβολική ικανότητα (βλ. παράγραφο 13). Σε κατάλληλα προκαθορισμένα διαστήματα μετά την έναρξη της έκθεσης των κυτταροκαλλιεργειών στην υπό δοκιμή χημική ουσία, αυτές υποβάλλονται σε μεταχείριση με χημική ουσία διακοπής της μετάφασης (π.χ. Colcemid™ ή κολχικίνη) και ακολουθεί συλλογή, χρώση και μικροσκοπική εξέταση των μεταφασικών κυττάρων για να διαπιστωθεί η παρουσία εκτροπών χρωματιδικού και χρωμοσωμικού τύπου. ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Προετοιμασίες Κύτταρα Μπορούν να χρησιμοποιηθούν διάφορες κυτταρικές σειρές (π.χ. κύτταρα ωοθηκών κινεζικού κρικητού (CHO), κύτταρα πνεύμονα κινέζικου κρικητού V79, κύτταρα πνεύμονα κινεζικού κρικητού (CHL)/IU, TK6) ή πρωτογενείς καλλιέργειες κυττάρων, συμπεριλαμβανομένων των λεμφοκυττάρων περιφερικού αίματος ανθρώπου ή άλλων θηλαστικών (7). Η επιλογή των χρησιμοποιούμενων κυτταρικών σειρών θα πρέπει να αιτιολογείται επιστημονικά. Για λόγους καλής μεταχείρισης των ζώων, όταν χρησιμοποιούνται πρωτογενή κύτταρα, θα πρέπει να εξετάζεται το ενδεχόμενο χρησιμοποίησης, εφόσον είναι εφικτή, ανθρώπινων πρωτογενών κυττάρων που έχουν ληφθεί σύμφωνα με τις σχετικές δεοντολογικές αρχές και κανονιστικές ρυθμίσεις. Τα ανθρώπινα λεμφοκύτταρα περιφερικού αίματος θα πρέπει να λαμβάνονται από νεαρά άτομα (ηλικίας περίπου 18-35 ετών), που δεν καπνίζουν, δεν πάσχουν από γνωστή νόσο και δεν έχουν εκτεθεί πρόσφατα σε γονιδιοτοξικούς παράγοντες (π.χ. χημικές ουσίες, ιοντίζουσες ακτινοβολίες) σε επίπεδα τα οποία θα μπορούσαν να αυξήσουν την επίπτωση (incidence) υποβάθρου των χρωμοσωμικών εκτροπών. Με τον τρόπο αυτό εξασφαλίζεται χαμηλή και σταθερή επίπτωση υποβάθρου των χρωμοσωμικών εκτροπών. Η γραμμή βάσης της επίπτωσης των χρωμοσωμικών εκτροπών αυξάνεται με την ηλικία, τάση που είναι εντονότερη στις γυναίκες απ' ό,τι στους άνδρες (17) (18). Εάν συνδυάζονται προς χρήση κύτταρα από περισσότερους του ενός δότες, θα πρέπει να προσδιορίζεται ο αριθμός των δοτών. Είναι αναγκαίο να αποδεικνύεται ότι τα κύτταρα έχουν διαιρεθεί κατά το διάστημα που μεσολαβεί από την έναρξη της μεταχείρισης με την υπό δοκιμή χημική ουσία μέχρι τη δειγματοληψία τους. Οι κυτταροκαλλιέργειες διατηρούνται σε εκθετική φάση ανάπτυξης κυττάρων (κυτταρικές σειρές) ή διεγείρονται για να διαιρεθούν (πρωτογενείς καλλιέργειες λεμφοκυττάρων), ώστε τα κύτταρα να εκτίθενται σε διάφορα στάδια του κυτταρικού κύκλου, δεδομένου ότι μπορεί να μην είναι γνωστή η ευαισθησία κάθε σταδίου στις υπό δοκιμή χημικές ουσίες. Κατά κανόνα, τα πρωτογενή κύτταρα που χρειάζονται διέγερση από μιτογόνους παράγοντες για τη διαίρεσή τους δεν είναι πλέον συγχρονισμένα κατά τη διάρκεια της έκθεσης στην υπό δοκιμή χημική ουσία (π.χ. ανθρώπινα λεμφοκύτταρα μετά από 48ωρη διέγερση με μιτογόνο). Η χρήση συγχρονισμένων κυττάρων κατά τη διάρκεια της μεταχείρισης δεν συνιστάται, αλλά μπορεί να γίνει δεκτή εφόσον αυτό αιτιολογείται. Θρεπτικά μέσα και συνθήκες καλλιέργειας Για τη διατήρηση των καλλιεργειών θα πρέπει να χρησιμοποιούνται κατάλληλο θρεπτικό μέσο και κατάλληλες συνθήκες επώασης (δοχεία καλλιέργειας, ατμόσφαιρα με ύγρανση και 5 % CO2, κατά περίπτωση, θερμοκρασία επώασης 37 °C). Θα πρέπει να ελέγχονται τακτικά στις κυτταρικές σειρές η σταθερότητα του χαρακτηριστικού χρωμοσωμικού αριθμού και η απουσία μόλυνσης από μυκόπλασμα (7) (19) και τα κύτταρα δεν θα πρέπει να χρησιμοποιούνται εάν έχουν μολυνθεί ή έχει μεταβληθεί ο χαρακτηριστικός χρωμοσωμικός αριθμός. Η φυσιολογική διάρκεια του κυτταρικού κύκλου των κυτταρικών σειρών ή πρωτογενών καλλιεργειών που χρησιμοποιούνται στο εργαστήριο δοκιμών θα πρέπει να καθορίζεται και να είναι συνεπής με τα δημοσιευμένα χαρακτηριστικά των κυττάρων (20). Παρασκευή των καλλιεργειών Κυτταρικές σειρές: τα κύτταρα πολλαπλασιάζονται από αποθεματικές καλλιέργειες, εμβολιαζόμενα σε θρεπτικό μέσο καλλιέργειας σε πυκνότητα τέτοια ώστε τα υπό μορφή εναιωρήματος ή μονοστιβάδας κύτταρα να εξακολουθούν να αναπτύσσονται εκθετικά μέχρι τη συλλογή τους (π.χ. θα πρέπει να αποφεύγεται η συρροή κυττάρων που αναπτύσσονται σε μονοστιβάδες). Λεμφοκύτταρα: ολικό αίμα με αντιπηκτικό (π.χ. ηπαρίνη) ή διαχωρισμένα λεμφοκύτταρα καλλιεργούνται (π.χ. για 48 ώρες προκειμένου για ανθρώπινα λεμφοκύτταρα) παρουσία μιτογόνου [π.χ. φυτοαιμοσυγκολλητίνη (PHA) προκειμένου για ανθρώπινα λεμφοκύτταρα], με σκοπό την επαγωγή κυτταρικής διαίρεσης πριν από την έκθεση στην υπό δοκιμή χημική ουσία. Μεταβολική ενεργοποίηση Όταν χρησιμοποιούνται κύτταρα με ανεπαρκή ενδογενή μεταβολική ικανότητα, θα πρέπει να χρησιμοποιούνται και εξωγενή συστήματα μεταβολισμού. Το ευρύτερα χρησιμοποιούμενο σύστημα, που συνιστάται ως προεπιλογή, εκτός αντίθετης αιτιολόγησης, είναι ένα μεταμιτοχονδριακό κλάσμα εμπλουτισμένο με συμπαράγοντα (S9), το οποίο παρασκευάζεται από ήπαρ τρωκτικών (κατά κανόνα επιμύων), κατεργασμένο με παράγοντα ενζυμικής επαγωγής, όπως το Aroclor 1254 (21) (22) (23) ή ο συνδυασμός φαινοβαρβιτάλης και β-ναφθοφλαβόνης (24) (25) (26) (27) (28) (29). Ο συνδυασμός αυτός δεν αντιβαίνει στη Σύμβαση της Στοκχόλμης για τους έμμονους οργανικούς ρύπους (30) και έχει αποδειχθεί εξίσου αποτελεσματικός με το Aroclor 1254 στην επαγωγή οξειδασών μεικτής λειτουργίας (24) (25) (26) (28). Το κλάσμα S9 χρησιμοποιείται συνήθως σε συγκεντρώσεις που κυμαίνονται από 1 έως 2 % (κ.ό.), αλλά οι οποίες επιτρέπεται να αυξηθούν σε 10 % (κ.ό.) στο τελικό δοκιμαστικό θρεπτικό μέσο. Η χρήση προϊόντων που μειώνουν τον μιτωτικό δείκτη, και ιδίως προϊόντων που συμπλοκοποιούν το ασβέστιο (31), θα πρέπει να αποφεύγεται κατά τη μεταχείριση. Η επιλογή του τύπου και της συγκέντρωσης του χρησιμοποιούμενου εξωγενούς συστήματος μεταβολικής ενεργοποίησης ή μεταβολικού επαγωγέα μπορεί να επηρεαστεί από την κατηγορία των υπό δοκιμή χημικών ουσιών. Παρασκεύασμα της υπό δοκιμή χημικής ουσίας Οι στερεές υπό δοκιμή χημικές ουσίες θα πρέπει να διαλύονται σε κατάλληλους διαλύτες και να αραιώνονται, εφόσον χρειάζεται, πριν από τη μεταχείριση των κυττάρων (βλ. παράγραφο 23). Οι υγρές υπό δοκιμή χημικές ουσίες επιτρέπεται να προστίθενται κατευθείαν στο σύστημα δοκιμής και/ή να αραιώνονται πριν από τη μεταχείριση του συστήματος δοκιμής. Οι αέριες ή πτητικές υπό δοκιμή χημικές ουσίες θα πρέπει να υποβάλλονται στη δοκιμή με κατάλληλες τροποποιήσεις των τυποποιημένων πρωτοκόλλων, π.χ. μεταχείριση σε σφραγισμένα δοχεία καλλιέργειας (32) (33) (34). Τα παρασκευάσματα της υπό δοκιμή χημικής ουσίας θα πρέπει να ετοιμάζονται ακριβώς πριν από τη μεταχείριση, εκτός αν τα στοιχεία σχετικά με τη σταθερότητα της ουσίας αποδεικνύουν ότι είναι αποδεκτή η φύλαξη. Συνθήκες δοκιμής Διαλύτες Θα πρέπει να επιλέγεται διαλύτης που να βελτιστοποιεί τη διαλυτότητα της υπό δοκιμή χημικής ουσίας, χωρίς να επηρεάζει δυσμενώς τη διεξαγωγή της δοκιμής, π.χ. μεταβάλλοντας την ανάπτυξη των κυττάρων, πλήττοντας την ακεραιότητα της υπό δοκιμή χημικής ουσίας, αντιδρώντας με τα δοχεία καλλιέργειας ή αποδυναμώνοντας το σύστημα μεταβολικής ενεργοποίησης. Συνιστάται να εξετάζεται πρώτα, στο μέτρο του δυνατού, αν μπορεί να χρησιμοποιηθεί υδατικός διαλύτης (ή θρεπτικό μέσο καλλιέργειας). Καθιερωμένοι διαλύτες είναι, για παράδειγμα, το νερό και το διμεθυλοσουλφοξείδιο. Η συγκέντρωση του διαλύτη στο τελικό θρεπτικό μέσο μεταχείρισης δεν θα πρέπει να υπερβαίνει γενικά το 1 % (κ.ό.), προκειμένου για οργανικούς διαλύτες, και το 10 % (κ.ό.) στην περίπτωση των υδατικών διαλυτών (αλατούχο διάλυμα ή νερό). Εάν χρησιμοποιούνται μη καθιερωμένοι διαλύτες (π.χ. αιθανόλη ή ακετόνη), η χρήση τους θα πρέπει να τεκμηριώνεται με στοιχεία που αποδεικνύουν τη συμβατότητά τους με τις υπό δοκιμή χημικές ουσίες και με το σύστημα δοκιμής, καθώς και την απουσία γενετικής τοξικότητας στη χρησιμοποιούμενη συγκέντρωση. Εάν δεν υπάρχουν αυτά τα στοιχεία, είναι σημαντικό να συμπεριλαμβάνονται μάρτυρες που δεν υποβάλλονται σε μεταχείριση (βλ. προσάρτημα 1) για να αποδεικνύεται ότι ο επιλεγμένος διαλύτης δεν επάγει επιβλαβείς ή κλαστογόνες επιδράσεις. Μέτρηση του κυτταρικού πολλαπλασιασμού και της κυτταροτοξικότητας και επιλογή των συγκεντρώσεων μεταχείρισης Κατά τον καθορισμό της υψηλότερης συγκέντρωσης της υπό δοκιμή χημικής ουσίας θα πρέπει να αποφεύγονται οι συγκεντρώσεις που μπορούν να οδηγήσουν σε τεχνητά θετικές αποκρίσεις, όπως εκείνες που προκαλούν υπέρμετρη κυτταροτοξικότητα (βλ. παράγραφο 22), καθίζηση στο θρεπτικό μέσο καλλιέργειας (βλ. παράγραφο 23) ή έντονες μεταβολές του pH ή της ωσμωμοριακότητας (βλ. παράγραφο 5). Εάν η υπό δοκιμή χημική ουσία προκαλεί έντονη μεταβολή του pH του θρεπτικού μέσου κατά την προσθήκη της, το pH μπορεί να ρυθμίζεται με προσθήκη ρυθμιστικού διαλύματος στο τελικό θρεπτικό μέσο δοκιμής, με σκοπό να αποφεύγονται τα τεχνητά θετικά αποτελέσματα και να διατηρούνται κατάλληλες συνθήκες καλλιέργειας. Μετράται ο κυτταρικός πολλαπλασιασμός για να εξασφαλίζεται ότι επαρκής αριθμός κυττάρων που υποβάλλονται σε μεταχείριση έχουν φθάσει στο στάδιο της μίτωσης κατά τη διάρκεια της δοκιμής και ότι οι μεταχειρίσεις διεξάγονται σε κατάλληλα επίπεδα κυτταροτοξικότητας (βλ. παραγράφους 18 και 22). Η κυτταροτοξικότητα θα πρέπει να προσδιορίζεται με και χωρίς μεταβολική ενεργοποίηση στο κύριο πείραμα, με τη χρήση κατάλληλης ένδειξης θανάτου και ανάπτυξης των κυττάρων. Μολονότι η αξιολόγηση της κυτταροτοξικότητας σε αρχική δοκιμή μπορεί να είναι χρήσιμη για τον ακριβέστερο καθορισμό των συγκεντρώσεων που θα χρησιμοποιηθούν στο κύριο πείραμα, δεν είναι υποχρεωτική η διεξαγωγή αρχικής δοκιμής. Η διεξαγωγή αρχικής δοκιμής δεν θα πρέπει να αντικαθιστά τη μέτρηση της κυτταροτοξικότητας στο κύριο πείραμα. Ο σχετικός διπλασιασμός του πληθυσμού (Relative Population Doubling/RPD) και η σχετική αύξηση του αριθμού κυττάρων (Relative Increase in Cell Count/RICC) είναι κατάλληλες μέθοδοι εκτίμησης της κυτταροτοξικότητας σε κυτταρογενετικές δοκιμές (13) (15) (35) (36) (55) (βλ. μαθηματικούς τύπους στο προσάρτημα 2). Σε περίπτωση μακροχρόνιας μεταχείρισης και εάν οι χρόνοι δειγματοληψιών μετά την έναρξη της μεταχείρισης είναι μεγαλύτεροι από τη φυσιολογική διάρκεια του κυτταρικού κύκλου, πολλαπλασιαζόμενη επί 1,5 (δηλ. συνολικά υπερτριπλάσιοι της διάρκειας του κυτταρικού κύκλου), η κυτταροτοξικότητα ενδέχεται να υποεκτιμηθεί με τον RPD (37). Υπό αυτές τις συνθήκες, η RICC θα αποτελούσε ενδεχομένως καλύτερο μέσο μέτρησης, ενώ η αξιολόγηση της κυτταροτοξικότητας μετά από χρονικό διάστημα ίσο με το γινόμενο της φυσιολογικής διάρκεια του κυτταρικού κύκλου επί 1,5 θα παρείχε χρήσιμη εκτίμηση με τη βοήθεια του RPD. Για τα λεμφοκύτταρα σε πρωτογενείς καλλιέργειες, ο μιτωτικός δείκτης (MI) είναι μέτρο των κυτταροτοξικών/κυτταροστατικών επιδράσεων, αλλά επηρεάζεται από τον χρόνο μέτρησής του μετά την αγωγή, τον χρησιμοποιούμενο μιτογόνο παράγοντα και την πιθανή διατάραξη του κυτταρικού κύκλου. Ωστόσο, ο MI είναι αποδεκτός, επειδή άλλες μετρήσεις της κυτταροτοξικότητας μπορεί να είναι περίπλοκες και μη πρακτικές και να μην εφαρμόζονται στον στοχευόμενο πληθυσμό λεμφοκυττάρων που αναπτύσσονται αποκρινόμενα σε διέγερση από τη PHA. Ενώ η RICC και ο RPD στην περίπτωση των κυτταρικών σειρών και ο MI για τις πρωτογενείς καλλιέργειες λεμφοκυττάρων είναι οι συνιστώμενες παράμετροι κυτταροτοξικότητας, άλλοι δείκτες (π.χ. ακεραιότητα των κυττάρων, απόπτωση, νέκρωση, κυτταρικός κύκλος) θα μπορούσαν να παράσχουν χρήσιμες επιπλέον πληροφορίες. Θα πρέπει να αξιολογούνται τουλάχιστον τρεις συγκεντρώσεις δοκιμής (χωρίς τον διαλύτη και τους θετικούς μάρτυρες) που πληρούν τα κριτήρια αποδοχής (ενδεδειγμένη κυτταροτοξικότητα, αριθμός κυττάρων, κ.λπ.). Ανεξάρτητα από τα είδη κυττάρων (κυτταρικές σειρές ή πρωτογενείς καλλιέργειες λεμφοκυττάρων), μπορούν να χρησιμοποιούνται σε κάθε συγκέντρωση δοκιμής είτε πολλαπλές πανομοιότυπες καλλιέργειες (επαναλήψεις) είτε μονές καλλιέργειες. Αν και συνιστάται η χρήση διπλών καλλιεργειών, οι μονές καλλιέργειες είναι επίσης αποδεκτές, υπό τον όρο ότι καταμετράται ο ίδιος συνολικός αριθμός κυττάρων, ανεξαρτήτως του αν πρόκειται για μονές ή για διπλές καλλιέργειες. Η χρήση μονών καλλιεργειών ενδείκνυται κατ' εξοχήν όταν αξιολογούνται περισσότερες από 3 συγκεντρώσεις (βλ. παράγραφο 31). Τα αποτελέσματα που προκύπτουν από τις ανεξάρτητες επαναλήψεις σε δεδομένη συγκέντρωση μπορούν να συνενώνονται για την ανάλυση δεδομένων (38). Για τις υπό δοκιμή χημικές ουσίες με ελάχιστη ή μηδενική κυτταροτοξικότητα, κατάλληλες είναι συνήθως οι συγκεντρώσεις που απέχουν μεταξύ τους κατά παράγοντα ίσο με 2 ή 3 περίπου. Σε περίπτωση κυτταροτοξικότητας, οι επιλεγόμενες συγκεντρώσεις δοκιμής θα πρέπει να καλύπτουν ένα εύρος τιμών κυμαινόμενο από τη συγκέντρωση που προκαλεί την κυτταροτοξικότητα η οποία περιγράφεται στην παράγραφο 22 μέχρι τις συγκεντρώσεις στις οποίες παρατηρείται μέτρια και ελάχιστη ή μηδενική κυτταροτοξικότητα. Πολλές υπό δοκιμή χημικές ουσίες παρουσιάζουν καμπύλες συγκέντρωσης-απόκρισης με μεγάλη κλίση και, για να ληφθούν δεδομένα σε χαμηλή ή μέτρια κυτταροτοξικότητα ή για να μελετηθεί λεπτομερώς η σχέση δόσης-απόκρισης, είναι αναγκαία η χρήση συγκεντρώσεων με μικρότερα διαστήματα μεταξύ τους και/ή περισσότερων από τρεις συγκεντρώσεις (μονές καλλιέργειες ή επαναλήψεις), ιδίως σε περιπτώσεις όπου απαιτείται επανάληψη του πειράματος (βλ. παράγραφο 47). Εάν η μέγιστη συγκέντρωση βασίζεται στην κυτταροτοξικότητα, η υψηλότερη συγκέντρωση θα πρέπει να αποσκοπεί στην επίτευξη κυτταροτοξικότητας 55 ± 5 %, με τη χρήση των συνιστώμενων παραμέτρων κυτταροτοξικότητας (δηλ. μείωση της RICC ή του RPD στην περίπτωση των κυτταρικών σειρών και μείωση του MI προκειμένου για πρωτογενείς καλλιέργειες λεμφοκυττάρων σε 45 ± 5 % του παράλληλου αρνητικού μάρτυρα). Τα θετικά αποτελέσματα που προκύπτουν μόνο στο ανώτερο άκρο του εν λόγω εύρους κυτταροτοξικότητας 55 ± 5 % θα πρέπει να ερμηνεύονται με προσοχή (13). Για δυσδιάλυτες υπό δοκιμή χημικές ουσίες που δεν είναι κυτταροτοξικές σε συγκεντρώσεις χαμηλότερες από τη συγκέντρωση μέγιστης διαλυτότητας, η υψηλότερη αναλυόμενη συγκέντρωση θα πρέπει να επιφέρει θολερότητα ή ίζημα ορατό με γυμνό οφθαλμό ή με τη βοήθεια ανεστραμμένου μικροσκοπίου στο τέλος της μεταχείρισης με την υπό δοκιμή χημική ουσία. Ακόμη και αν εμφανίζεται κυτταροτοξικότητα σε συγκεντρώσεις υψηλότερες από τη συγκέντρωση μέγιστης διαλυτότητας, συνιστάται να διεξάγεται η δοκιμή σε μία μόνο συγκέντρωση που επιφέρει θολερότητα ή ορατό ίζημα, διότι μπορεί να προκύψουν τεχνητές επιδράσεις από το ίζημα. Στη συγκέντρωση που επιφέρει ίζημα, θα πρέπει να λαμβάνεται μέριμνα ώστε να διασφαλίζεται ότι το τελευταίο δεν παρεμποδίζει τη διεξαγωγή της δοκιμής (π.χ. τη χρώση ή την καταμέτρηση). Ο προσδιορισμός της διαλυτότητας στο θρεπτικό μέσο καλλιέργειας πριν από το πείραμα μπορεί να είναι χρήσιμος. Εάν δεν παρατηρηθεί ίζημα ούτε περιοριστική κυτταροτοξικότητα, η ανώτατη συγκέντρωση δοκιμής θα πρέπει να αντιστοιχεί στη μικρότερη από τις τιμές 10 mM, 2 mg/ml ή 2 μl/ml (39) (40) (41). Όταν η υπό δοκιμή χημική ουσία δεν έχει καθορισμένη σύνθεση, π.χ. ουσίες άγνωστης ή μεταβλητής σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά (UVCB) (42), εκχυλίσματα από το περιβάλλον κλπ., η ανώτατη συγκέντρωση θα πρέπει ενδεχομένως να είναι υψηλότερη (π.χ. 5 mg/ml), ελλείψει επαρκούς κυτταροτοξικότητας, προκειμένου να αυξηθεί η συγκέντρωση του κάθε συστατικού. Επισημαίνεται, ωστόσο, ότι οι απαιτήσεις αυτές μπορεί να διαφέρουν για τα φαρμακευτικά προϊόντα για τον άνθρωπο (43). Μάρτυρες Σε κάθε χρόνο συλλογής, θα πρέπει να συμπεριλαμβάνονται παράλληλοι αρνητικοί μάρτυρες (βλ. παράγραφο 15), αποτελούμενοι μόνο από τον διαλύτη στο θρεπτικό μέσο της μεταχείρισης και υποβαλλόμενοι στην ίδια μεταχείριση όπως και οι καλλιέργειες. Απαιτούνται παράλληλοι θετικοί μάρτυρες για να αποδεικνύεται αφενός η ικανότητα του εργαστηρίου να αναγνωρίζει τα κλαστογόνα υπό τις συνθήκες του χρησιμοποιούμενου πρωτοκόλλου δοκιμής και, αφετέρου, η αποτελεσματικότητα του εξωγενούς συστήματος μεταβολικής ενεργοποίησης, κατά περίπτωση. Παραδείγματα θετικών μαρτύρων παρέχονται κατωτέρω στον πίνακα 1. Μπορούν να χρησιμοποιηθούν εναλλακτικοί θετικοί χημικοί μάρτυρες, εφόσον η χρήση τους αιτιολογείται. Επειδή οι δοκιμές γενετικής τοξικότητας in vitro σε κύτταρα θηλαστικών είναι επαρκώς τυποποιημένες, η χρήση θετικών μαρτύρων μπορεί να περιορίζεται σε κλαστογόνα που απαιτούν μεταβολική ενεργοποίηση. Αυτή η απόκριση ενός μόνο θετικού μάρτυρα καταδεικνύει τόσο τη δραστικότητα του συστήματος μεταβολικής ενεργοποίησης όσο και την αποκρισιμότητα του συστήματος δοκιμής, υπό την προϋπόθεση ότι εκτελείται ταυτόχρονα με τη δοκιμή χωρίς ενεργοποίηση και επί την ίδια διάρκεια μεταχείρισης. Ωστόσο, σε περίπτωση μακροχρόνιας μεταχείρισης (χωρίς S9) θα πρέπει να προβλέπεται χωριστός θετικός μάρτυρας, διότι η διάρκεια της μεταχείρισης διαφέρει από αυτήν της δοκιμής με μεταβολική ενεργοποίηση. Κάθε θετικός μάρτυρας θα πρέπει να χρησιμοποιείται σε μία ή περισσότερες συγκεντρώσεις που αναμένεται να έχουν ως αποτέλεσμα αναπαραγώγιμη και ανιχνεύσιμη αύξηση σε σχέση με την τιμή υποβάθρου, για να καταδεικνύεται η ευαισθησία του συστήματος δοκιμής (δηλ. σαφείς επιδράσεις, οι οποίες όμως δεν αποκαλύπτουν αμέσως την ταυτότητα των κωδικοποιημένων αντικειμενοφόρων πλακών στον εξεταστή), και η απόκριση δεν θα πρέπει να διακυβεύεται εξαιτίας κυτταροτοξικότητας που υπερβαίνει τα όρια που προβλέπονται στη μέθοδο δοκιμών. Πίνακας 1 Συνιστώμενες χημικές ουσίες αναφοράς για την αξιολόγηση της τεχνικής ικανότητας του εργαστηρίου και την επιλογή θετικών μαρτύρων
ΔΙΑΔΙΚΑΣΙΑ Μεταχείριση με την υπό δοκιμή χημική ουσία Πολλαπλασιαζόμενα κύτταρα υποβάλλονται σε μεταχείριση με την υπό δοκιμή χημική ουσία με και χωρίς σύστημα μεταβολικής ενεργοποίησης. Χρόνος συλλογής καλλιέργειας Για την ενδελεχή αξιολόγηση που θα χρειαστεί προκειμένου να αποφασιστεί ότι η έκβαση της δοκιμής είναι αρνητική, θα πρέπει να τηρούνται και οι τρεις ακόλουθες πειραματικές συνθήκες σε βραχυχρόνια μεταχείριση με και χωρίς μεταβολική ενεργοποίηση και σε μακροχρόνια μεταχείριση χωρίς μεταβολική ενεργοποίηση (βλ. παραγράφους 43, 44 και 45):
Σε περίπτωση που οποιαδήποτε από τις ανωτέρω πειραματικές συνθήκες οδηγεί σε θετική απόκριση, μπορεί να μη χρειάζεται να διερευνηθεί άλλο σχήμα μεταχείρισης. Παρασκευάσματα χρωμοσωμάτων Οι κυτταροκαλλιέργειες υποβάλλονται σε κατεργασία με Colcemid ή κολχικίνη, συνήθως για μία έως τρεις ώρες πριν από τη συλλογή. Κάθε κυτταροκαλλιέργεια συλλέγεται και υποβάλλεται χωριστά σε κατεργασία για την προετοιμασία των παρασκευασμάτων χρωμοσωμάτων. Η προετοιμασία των παρασκευασμάτων χρωμοσωμάτων περιλαμβάνει κατεργασία των κυττάρων με υπότονο διάλυμα, μονιμοποίηση και χρώση. Στο τέλος της μεταχείρισης διάρκειας 3-6 ωρών είναι πιθανή η παρουσία μιτωτικών κυττάρων (αναγνωρίζονται από το στρογγυλό σχήμα τους και από την απόσπασή τους από την επιφάνεια) στις μονοστιβάδες. Επειδή τα εν λόγω μιτωτικά κύτταρα αποσπώνται εύκολα, είναι πιθανή η απώλειά τους κατά την απομάκρυνση του θρεπτικού μέσου που περιέχει την υπό δοκιμή χημική ουσία. Εάν υπάρχουν στοιχεία που υποδεικνύουν σημαντική αύξηση του αριθμού των μιτωτικών κυττάρων σε σχέση με τους μάρτυρες, γεγονός που υποδηλώνει πιθανή διακοπή της μίτωσης, τα κύτταρα θα πρέπει να συλλέγονται με φυγοκέντρηση και να επανεισάγονται στις καλλιέργειες, ώστε να αποφεύγεται η απώλεια κυττάρων που υφίστανται μίτωση και αντιμετωπίζουν κίνδυνο χρωμοσωμικής εκτροπής κατά τον χρόνο της συλλογής. Ανάλυση Όλες οι αντικειμενοφόρες πλάκες, συμπεριλαμβανομένων των πλακών των θετικών και αρνητικών μαρτύρων, θα πρέπει να κωδικοποιούνται χωριστά, πριν από τη μικροσκοπική εξέταση για τον εντοπισμό χρωμοσωμικών εκτροπών. Επειδή οι διαδικασίες μονιμοποίησης συνεπάγονται συχνά απώλεια χρωμοσωμάτων σε ένα ποσοστό των μεταφασικών κυττάρων, τα καταμετρούμενα κύτταρα θα πρέπει να περιέχουν αριθμό κεντρομεριδίων ίσο με τον χαρακτηριστικό αριθμό ± 2. Για να συναχθεί το συμπέρασμα ότι η υπό δοκιμή χημική ουσία είναι σαφώς αρνητική, θα πρέπει να καταμετρώνται τουλάχιστον 300 καλώς επιστρωμένα μεταφασικά κύτταρα ανά συγκέντρωση και ανά μάρτυρα (βλ. παράγραφο 45). Το 300 κύτταρα θα πρέπει να κατανέμονται ισομερώς μεταξύ των επαναλήψεων, όταν χρησιμοποιούνται καλλιέργειες επανάληψης. Όταν χρησιμοποιούνται μονές καλλιέργειες ανά συγκέντρωση (βλ. παράγραφο 21), θα πρέπει να καταμετρώνται τουλάχιστον 300 καλώς επιστρωμένα μεταφασικά κύτταρα από κάθε μονή καλλιέργεια. Η καταμέτρηση 300 κυττάρων έχει το πλεονέκτημα ότι αυξάνει τη στατιστική ισχύ της δοκιμής και επιπλέον σπάνια παρατηρούνται μηδενικές τιμές (εκτιμάται ότι το ποσοστό τους είναι μόλις 5 %) (44). Ο αριθμός των καταμετρούμενων μεταφασικών κυττάρων μπορεί να μειωθεί εάν παρατηρηθεί υψηλός αριθμός κυττάρων με χρωμοσωμικές εκτροπές και η υπό δοκιμή χημική ουσία θεωρείται σαφώς θετική. Θα πρέπει να καταμετρώνται τα κύτταρα με δομικές χρωμοσωμικές εκτροπές, με και χωρίς τα χάσματα. Οι ρήξεις και τα χάσματα ορίζονται στο προσάρτημα 1 σύμφωνα με τις βιβλιογραφικές παραπομπές (45) (46). Οι χρωματιδικού και οι χρωμοσωμικού τύπου εκτροπές θα πρέπει να καταγράφονται χωριστά και να ταξινομούνται σε υποκατηγορίες (ρήξεις, ανταλλαγές). Οι διαδικασίες που χρησιμοποιούνται στο εργαστήριο θα πρέπει να διασφαλίζουν τη διενέργεια της ανάλυσης χρωμοσωμικών εκτροπών από επαρκώς καταρτισμένους εξεταστές και, κατά περίπτωση, την αξιολόγηση της ανάλυσης από ομότιμους κριτές. Αν και σκοπός της δοκιμής είναι ο εντοπισμός δομικών χρωμοσωμικών εκτροπών, είναι σημαντικό να καταγράφονται οι συχνότητες πολυπλοειδίας και ενδοαναδιπλασιασμού, εφόσον παρατηρηθούν. (βλέπε σημείο 2). Τεχνική ικανότητα του εργαστηρίου Για να εξασφαλίσει επαρκή εμπειρία με τη μέθοδο δοκιμών πριν τη χρησιμοποιήσει για δοκιμές ρουτίνας, το εργαστήριο θα πρέπει να έχει εκτελέσει σειρά πειραμάτων με θετικές χημικές ουσίες αναφοράς που δρουν μέσω διαφορετικών μηχανισμών, καθώς και με διάφορους αρνητικούς μάρτυρες (με τη χρήση διαφόρων διαλυτών/φορέων). Οι αποκρίσεις των εν λόγω θετικών και αρνητικών μαρτύρων θα πρέπει να συμφωνούν με τη βιβλιογραφία. Αυτό δεν ισχύει για τα εργαστήρια που έχουν πείρα, δηλ. διαθέτουν βάση ιστορικών δεδομένων, όπως ορίζεται στην παράγραφο 37. Θα πρέπει να διερευνάται μια σειρά επιλεγμένων χημικών ουσιών που αποτελούν θετικούς μάρτυρες (βλ. πίνακα 1 στην παράγραφο 26), με βραχυχρόνια και μακροχρόνια μεταχείριση χωρίς μεταβολική ενεργοποίηση, καθώς και με βραχυχρόνια μεταχείριση με μεταβολική ενεργοποίηση, για να καταδεικνύεται η τεχνική ικανότητα ανίχνευσης κλαστογόνων χημικών ουσιών και να διαπιστώνεται η αποτελεσματικότητα του συστήματος μεταβολικής ενεργοποίησης. Θα πρέπει να επιλέγεται ένα εύρος συγκεντρώσεων των επιλεγμένων χημικών ουσιών που να επιφέρουν αναπαραγώγιμες και σχετιζόμενες με τη συγκέντρωση αυξήσεις σε σχέση με τις τιμές υποβάθρου, για να αποδεικνύονται η ευαισθησία και το δυναμικό εύρος του συστήματος δοκιμής. Ιστορικά δεδομένα για μάρτυρες Το εργαστήριο θα πρέπει να καθορίζει:
Κατά την αρχική συγκέντρωση δεδομένων για ιστορική κατανομή όσον αφορά τους αρνητικούς μάρτυρες, οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει να συμφωνούν με τα δημοσιευμένα δεδομένα για μάρτυρες, εφόσον υπάρχουν. Καθώς θα προστίθενται περισσότερα πειραματικά δεδομένα στην κατανομή των μαρτύρων, οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει, στην ιδανική περίπτωση, να βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 % της εν λόγω κατανομής (44) (47). Η βάση ιστορικών δεδομένων του εργαστηρίου για αρνητικούς μάρτυρες θα πρέπει αρχικά να δημιουργείται με δεδομένα από τουλάχιστον 10 πειράματα, αν και είναι προτιμότερο να αποτελείται από τουλάχιστον 20 πειράματα που έχουν εκτελεστεί σε συγκρίσιμες πειραματικές συνθήκες. Τα εργαστήρια θα πρέπει να χρησιμοποιούν μεθόδους ποιοτικού ελέγχου, όπως διαγράμματα ελέγχου [π.χ. διαγράμματα C ή X-bar (48)], για να προσδιορίζουν τη μεταβλητότητα των δεδομένων τους που αφορούν τους θετικούς και αρνητικούς μάρτυρες και να αποδεικνύουν ότι έχουν «υπό έλεγχο» τη μεθοδολογία (44). Περαιτέρω συστάσεις για τον τρόπο δημιουργίας και χρήσης των ιστορικών δεδομένων (δηλ. κριτήρια προσθήκης στοιχείων στα ιστορικά δεδομένα και αποκλεισμού στοιχείων από αυτά, καθώς και κριτήρια αποδοχής συγκεκριμένου πειράματος) έχουν διατυπωθεί στη βιβλιογραφία (47). Κάθε αλλαγή του πειραματικού πρωτοκόλλου θα πρέπει να μελετάται υπό το πρίσμα της συμφωνίας της με τις υφιστάμενες βάσεις ιστορικών δεδομένων του εργαστηρίου για μάρτυρες. Τυχόν σημαντικές ανακολουθίες θα πρέπει να έχουν ως αποτέλεσμα τη δημιουργία νέας βάσης ιστορικών δεδομένων για μάρτυρες. Τα δεδομένα για αρνητικούς μάρτυρες θα πρέπει να είναι η επίπτωση των κυττάρων με χρωμοσωμικές εκτροπές από μονές καλλιέργειες ή από το άθροισμα των καλλιεργειών επανάληψης, όπως περιγράφεται στην παράγραφο 21. Οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει, στην ιδανική περίπτωση, να βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 % της κατανομής της βάσης ιστορικών δεδομένων του εργαστηρίου για αρνητικούς μάρτυρες (44) (47). Όταν τα δεδομένα για παράλληλους αρνητικούς μάρτυρες δεν βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 %, μπορεί να είναι αποδεκτή η προσθήκη τους στην ιστορική κατανομή μαρτύρων, εφόσον τα εν λόγω δεδομένα δεν είναι ακραίες έκτοπες τιμές και υπάρχουν στοιχεία που αποδεικνύουν ότι το σύστημα δοκιμής είναι «υπό έλεγχο» (βλ. παράγραφο 37) και ότι δεν πρόκειται για τεχνικό ή ανθρώπινο σφάλμα. ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Παρουσίαση των αποτελεσμάτων Το ποσοστό κυττάρων με μία ή περισσότερες δομικές χρωμοσωμικές εκτροπές θα πρέπει να αξιολογείται. Οι χρωματιδικού και οι χρωμοσωμικού τύπου εκτροπές, ταξινομημένες σε υποκατηγορίες (ρήξεις, ανταλλαγές), θα πρέπει να καταγράφονται χωριστά με τον αριθμό και τη συχνότητα με τα οποία εμφανίζονται στις πειραματικές καλλιέργειες και στις καλλιέργειες-μάρτυρες. Τα χάσματα καταγράφονται και αναφέρονται χωριστά, αλλά δεν περιλαμβάνονται στη συνολική συχνότητα εκτροπών. Αναφέρεται το ποσοστό πολυπλοειδίας και/ή ενδοαναδιπλασιασμένων κυττάρων, εφόσον παρατηρούνται. Θα πρέπει επίσης να καταγράφονται οι παράλληλες μετρήσεις κυτταροτοξικότητας για όλες τις υποβληθείσες σε μεταχείριση καλλιέργειες, καθώς και για τις καλλιέργειες που ήταν αρνητικοί και θετικοί μάρτυρες στα κύρια πειράματα προσδιορισμού εκτροπών. Θα πρέπει να παρέχονται δεδομένα για κάθε καλλιέργεια. Επιπλέον, όλα τα δεδομένα θα πρέπει να συγκεφαλαιώνονται σε μορφή πίνακα. Κριτήρια αποδοχής Η αποδοχή μιας δοκιμής βασίζεται στα ακόλουθα κριτήρια:
Αξιολόγηση και ερμηνεία των αποτελεσμάτων Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς θετική εάν, σε οποιαδήποτε από τις πειραματικές συνθήκες που εξετάστηκαν (βλ. παράγραφο 28):
Όταν πληρούνται όλα αυτά τα κριτήρια, η υπό δοκιμή χημική ουσία θεωρείται ικανή να επάγει χρωμοσωμικές εκτροπές σε καλλιεργημένα κύτταρα θηλαστικών σε αυτό το σύστημα δοκιμής. Συστάσεις για τις πλέον κατάλληλες στατιστικές μεθόδους έχουν διατυπωθεί στη βιβλιογραφία (49) (50) (51). Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς αρνητική εάν, σε όλες τις πειραματικές συνθήκες που εξετάστηκαν (βλ. παράγραφο 28):
Θεωρείται τότε ότι η υπό δοκιμή ουσία δεν είναι ικανή να επάγει χρωμοσωμικές εκτροπές σε καλλιεργημένα κύτταρα θηλαστικών σε αυτό το σύστημα δοκιμής. Δεν απαιτείται επαλήθευση των σαφώς θετικών ή αρνητικών αποκρίσεων. Όταν η απόκριση δεν είναι ούτε σαφώς αρνητική ούτε σαφώς θετική, όπως περιγράφεται ανωτέρω, ή για να διαπιστωθεί η βιολογική σημασία ενός αποτελέσματος, τα δεδομένα θα πρέπει να αξιολογούνται με βάση την κρίση των ειδικών και/ή περαιτέρω διερεύνηση. Η καταμέτρηση επιπλέον κυττάρων (κατά περίπτωση) ή η επανάληψη του πειράματος, ενδεχομένως με τη χρήση διαφορετικών πειραματικών συνθηκών [π.χ. διαστήματα μεταξύ των συγκεντρώσεων, άλλες συνθήκες μεταβολικής ενεργοποίησης (δηλ. συγκέντρωση ή προέλευση του S9)] θα μπορούσε να είναι χρήσιμη. Σε σπάνιες περιπτώσεις, ακόμη και μετά από περαιτέρω διερεύνηση, το σύνολο δεδομένων δεν επιτρέπει την εξαγωγή συμπεράσματος για θετικά ή αρνητικά αποτελέσματα και, κατά συνέπεια, η απόκριση της υπό δοκιμή χημικής ουσίας κρίνεται διφορούμενη. Η αύξηση του αριθμού πολυπλοειδών κυττάρων μπορεί να σημαίνει ότι οι υπό δοκιμή χημικές ουσίες είναι δυνάμει ικανές να αναστέλλουν τις μιτωτικές διεργασίες και να επάγουν αριθμητικές χρωμοσωμικές εκτροπές (52). Η αύξηση του αριθμού κυττάρων με ενδοαναδιπλασιασμένα χρωμοσώματα μπορεί να σημαίνει ότι οι υπό δοκιμή χημικές ουσίες είναι δυνάμει ικανές να αναστέλλουν την πρόοδο του κυτταρικού κύκλου (53) (54) (βλ. παράγραφο 2). Επομένως, η επίπτωση των πολυπλοειδών κυττάρων και των κυττάρων με ενδοαναδιπλασιασμένα χρωμοσώματα θα πρέπει να καταγράφεται χωριστά. Έκθεση δοκιμής Στην έκθεση δοκιμής θα πρέπει να περιλαμβάνονται τα ακόλουθα στοιχεία:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Ανευπλοειδία : κάθε απόκλιση από τον φυσιολογικό διπλοειδή (ή απλοειδή) αριθμό χρωμοσωμάτων κατά ένα ή περισσότερα χρωμοσώματα, όχι όμως κατά πλήρεις σειρές χρωμοσωμάτων (πολυπλοειδία). Απόπτωση : προγραμματισμένος κυτταρικός θάνατος, ο οποίος χαρακτηρίζεται από μια σειρά σταδίων που οδηγούν στη διάσπαση των κυττάρων προς περικλειόμενα από κυτταρική μεμβράνη σωματίδια τα οποία, στη συνέχεια, απομακρύνονται με φαγοκυττάρωση ή αποβολή. Κυτταρικός πολλαπλασιασμός : αύξηση του αριθμού των κυττάρων η οποία είναι αποτέλεσμα της μιτωτικής τους διαίρεσης. Χημικό προϊόν : μια ουσία ή ένα μείγμα. Ρήξη χρωματίδας : ασυνέχεια μεμονωμένης χρωματίδας στην οποία υπάρχει σαφής αποστοίχιση μίας από τις χρωματίδες. Χάσμα χρωματίδας : αχρωμάτιστη περιοχή (αχρωματική βλάβη) μεμονωμένης χρωματίδας, στην οποία αυτή εμφανίζει ελάχιστη αποστοίχιση. Εκτροπή χρωματιδικού τύπου : δομική χρωμοσωμική βλάβη που εκδηλώνεται ως ρήξη μεμονωμένων χρωματίδων ή ρήξη και επανένωση μεταξύ χρωματίδων. Εκτροπή χρωμοσωμικού τύπου : δομική χρωμοσωμική βλάβη που εκδηλώνεται ως ρήξη ή ρήξη και επανένωση και των δύο χρωματίδων στην ίδια θέση. Κλαστογόνο : κάθε χημική ουσία που προκαλεί δομικές χρωμοσωμικές εκτροπές σε πληθυσμούς κυττάρων ή ευκαρυωτικούς οργανισμούς. Συγκεντρώσεις : τελικές συγκεντρώσεις της υπό δοκιμή χημικής ουσίας στο θρεπτικό μέσο καλλιέργειας. Κυτταροτοξικότητα : στους προσδιορισμούς που καλύπτονται από την παρούσα μέθοδο δοκιμών και για τους οποίους χρησιμοποιούνται κυτταρικές σειρές, η κυτταροτοξικότητα εκφράζεται ως μείωση του σχετικού διπλασιασμού του πληθυσμού (RPD) ή της σχετικής αύξησης του αριθμού κυττάρων (RICC) των κυττάρων που υποβάλλονται σε μεταχείριση, σε σχέση με τον αρνητικό μάρτυρα (βλ. παράγραφο 17 και προσάρτημα 2). Στους προσδιορισμούς που καλύπτονται από την παρούσα μέθοδο δοκιμών και για τους οποίους χρησιμοποιούνται πρωτογενείς καλλιέργειες λεμφοκυττάρων, η κυτταροτοξικότητα εκφράζεται ως μείωση του μιτωτικού δείκτη (MI) των κυττάρων που υποβάλλονται σε μεταχείριση, σε σχέση με τον αρνητικό μάρτυρα (βλ. παράγραφο 18 και προσάρτημα 2). Ενδοαναδιπλασιασμός : διεργασία κατά την οποία έπειτα από μια φάση S με αντιγραφή του DNA, ο πυρήνας δεν υφίσταται μίτωση αλλά αρχίζει μια νέα φάση S. Το αποτέλεσμα είναι χρωμοσώματα με 4, 8, 16... χρωματίδες. Γονιδιοτοξικός : γενικός όρος που καλύπτει τους παράγοντες που προκαλούν κάθε είδους βλάβη του DNA ή του χρωμοσώματος, μεταξύ των οποίων τις ρήξεις, τις απαλείψεις, τις χημικές προσθήκες, τις τροποποιήσεις και συνδέσεις νουκλεοτιδίων, τις αναδιατάξεις, τις γονιδιακές μεταλλάξεις, τις χρωμοσωμικές εκτροπές και την ανευπλοειδία. Δεν προκαλούν όλα τα είδη γονιδιοτοξικών επιδράσεων μεταλλάξεις ή μόνιμη χρωμοσωμική βλάβη. Μιτωτικός δείκτης (Mitotic index/MI) : ο λόγος του αριθμού κυττάρων που βρίσκονται σε μετάφαση προς τον συνολικό αριθμό κυττάρων που παρατηρούνται σε έναν κυτταρικό πληθυσμό· αποτελεί ένδειξη του βαθμού πολλαπλασιασμού του εν λόγω πληθυσμού. Μίτωση : διαίρεση του κυτταρικού πυρήνα, η οποία συνήθως χωρίζεται σε πρόφαση, προμετάφαση, μετάφαση, ανάφαση και τελόφαση. Μεταλλαξιογόνο : παράγοντας που προκαλεί κληρονομήσιμη μεταβολή μίας ή περισσότερων ακολουθιών ζευγών βάσεων του DNA στα γονίδια ή της δομής των χρωμοσωμάτων (χρωμοσωμικές εκτροπές). Αριθμητική εκτροπή : μεταβολή του χρωμοσωμικού αριθμού από τον φυσιολογικό αριθμό που χαρακτηρίζει τα χρησιμοποιούμενα κύτταρα. Πολυπλοειδία : αριθμητικές χρωμοσωμικές εκτροπές σε κύτταρα ή οργανισμούς, οι οποίες αφορούν πλήρεις σειρές χρωμοσωμάτων, σε αντίθεση με εκείνες που αφορούν ένα ή περισσότερα μεμονωμένα χρωμοσώματα (ανευπλοειδία). Κατάσταση της p53 : η πρωτεΐνη p53 συμμετέχει στη ρύθμιση του κυτταρικού κύκλου, την απόπτωση και την επιδιόρθωση του DNA. Τα κύτταρα που παρουσιάζουν έλλειψη λειτουργικής πρωτεΐνης p53, αδυνατώντας να διακόψουν τον κυτταρικό κύκλο ή να εξαλείψουν τα κύτταρα που έχουν υποστεί βλάβη μέσω της απόπτωσης ή άλλων μηχανισμών (π.χ. επαγωγή της επιδιόρθωσης του DNA) που σχετίζονται με τις λειτουργίες απόκρισης της p53 σε βλάβες του DNA, θα πρέπει θεωρητικά να είναι πιο επιρρεπή σε γονιδιακές μεταλλάξεις ή χρωμοσωμικές εκτροπές. Σχετική αύξηση του αριθμού κυττάρων (Relative Increase in Cell Counts/RICC) : η αύξηση του αριθμού των κυττάρων σε καλλιέργειες που εκτίθενται σε χημικές ουσίες σε σύγκριση με τις καλλιέργειες που δεν εκτίθενται, λόγος που εκφράζεται ως ποσοστό. Σχετικός διπλασιασμός του πληθυσμού (RPD) : η αύξηση των διπλασιασμών του κυτταρικού πληθυσμού σε καλλιέργειες που εκτίθενται σε χημικές ουσίες σε σύγκριση με τις καλλιέργειες που δεν εκτίθενται, λόγος που εκφράζεται ως ποσοστό. Ηπατικό κλάσμα S9 : υπερκείμενο υγρό ομογενοποιήματος ήπατος μετά από φυγοκέντρηση σε 9 000 g, δηλ. ανεπεξέργαστο εκχύλισμα ήπατος. Μείγμα S9 : μείγμα του ηπατικού κλάσματος S9 με συμπαράγοντες που είναι αναγκαίοι για τη δράση των μεταβολικών ενζύμων. Μάρτυρας με διαλύτη : γενικός όρος για τον προσδιορισμό των καλλιεργειών-μαρτύρων που λαμβάνουν μόνο τον διαλύτη ο οποίος χρησιμοποιείται για τη διάλυση της υπό δοκιμή χημικής ουσίας. Δομική εκτροπή : μεταβολή της δομής των χρωμοσωμάτων που μπορεί να ανιχνευθεί με μικροσκοπική εξέταση του σταδίου της μετάφασης της κυτταρικής διαίρεσης και γίνεται αντιληπτή με τη μορφή απαλείψεων και θραυσμάτων, ενδοανταλλαγών ή διανταλλαγών. Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Μάρτυρες που δεν υποβάλλονται σε μεταχείριση : καλλιέργειες που δεν υφίστανται καμία μεταχείριση (δηλ. ούτε με την υπό δοκιμή χημική ουσία ούτε με διαλύτη), αλλά ετοιμάζονται ταυτόχρονα με τις καλλιέργειες που λαμβάνουν την υπό δοκιμή χημική ουσία και με τον ίδιο τρόπο. Προσάρτημα 2 ΜΑΘΗΜΑΤΙΚΟΙ ΤΥΠΟΙ ΓΙΑ ΤΗΝ ΕΚΤΙΜΗΣΗ ΤΗΣ ΚΥΤΤΑΡΟΤΟΞΙΚΟΤΗΤΑΣ Μιτωτικός δείκτης (Mitotic index/MI):
Συνιστάται η σχετική αύξηση του αριθμού κυττάρων (RICC) ή ο σχετικός διπλασιασμός του πληθυσμού (RPD), επειδή και στις δύο αυτές παραμέτρους λαμβάνεται υπόψη το ποσοστό του κυτταρικού πληθυσμού που έχει υποστεί διαίρεση.
όπου: Διπλασιασμός πληθυσμού = [log (αριθ. κυττάρων μετά την μεταχείριση ÷ αρχικός αριθ. κυττάρων)] ÷ log 2 Για παράδειγμα, μια τιμή RICC ή RPD ίση με 53 % υποδηλώνει ποσοστό κυτταροτοξικότητας/ κυτταρόστασης 47 %, ενώ ένα ποσοστό κυτταροτοξικότητας/κυτταρόστασης 55 %, μετρούμενης με τον δείκτη MI, σημαίνει ότι ο πραγματικός MI είναι το 45 % του μάρτυρα. Σε κάθε περίπτωση, θα πρέπει να μετράται ο αριθμός κυττάρων πριν από τη μεταχείριση και να είναι ο ίδιος στις υποβαλλόμενες σε μεταχείριση καλλιέργειες και στις καλλιέργειες που αποτελούν τον αρνητικό μάρτυρα. Ο RCC (δηλ. ο λόγος «αριθμός κυττάρων στις καλλιέργειες μεταχείρισης/αριθμός κυττάρων στις καλλιέργειες-μάρτυρες») είχε χρησιμοποιηθεί ως παράμετρος κυτταροτοξικότητας στο παρελθόν, αλλά δεν συνιστάται πλέον, διότι μπορεί να οδηγήσει σε υποεκτίμηση της κυτταροτοξικότητας. Στις καλλιέργειες που αποτελούν τον αρνητικό μάρτυρα, ο διπλασιασμός του πληθυσμού θα πρέπει να συμβιβάζεται με την υποχρέωση δειγματοληψίας κυττάρων μετά τη μεταχείριση σε χρόνο που ισοδυναμεί περίπου με το γινόμενο της φυσιολογικής διάρκειας του κυτταρικού κύκλου επί 1,5 και ο μιτωτικός δείκτης θα πρέπει να είναι αρκετά υψηλότερος ώστε να επιτυγχάνεται ικανός αριθμός μιτωτικών κυττάρων και αξιόπιστος υπολογισμός της μείωσης κατά 50 %. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(4) |
Στο μέρος B, το Κεφάλαιο Β.11 αντικαθίσταται από το ακόλουθο: «Β.11 Δοκιμή χρωμοσωμικών εκτροπών σε μυελό των οστών θηλαστικών ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών 475 του ΟΟΣΑ (2016). Αποτελεί μέρος μιας σειράς μεθόδων δοκιμών γενετικής τοξικολογίας. Έχει συνταχθεί ένα έγγραφο του ΟΟΣΑ με συνοπτικές πληροφορίες για τις δοκιμές γενετικής τοξικολογίας και μια επισκόπηση των πρόσφατων αλλαγών που έγιναν σε αυτές τις κατευθυντήριες γραμμές δοκιμών (1). Η δοκιμή χρωμοσωμικών εκτροπών in vivo σε μυελό των οστών θηλαστικών είναι ιδιαίτερα σημαντική για την αξιολόγηση της γονιδιοτοξικότητας, διότι οι παράγοντες των διεργασιών μεταβολισμού, φαρμακοκινητικής και επιδιόρθωσης του DΝΑ in vivo, αν και μπορεί να διαφέρουν μεταξύ των ειδών, είναι ενεργοί και συμβάλλουν στις αποκρίσεις. Οι προσδιορισμοί in vivo είναι επίσης χρήσιμοι για την περαιτέρω διερεύνηση της γονιδιοτοξικότητας που ανιχνεύεται με σύστημα in vitro. Η δοκιμή χρωμοσωμικών εκτροπών in vivo σε θηλαστικά χρησιμοποιείται για την ανίχνευση δομικών χρωμοσωμικών εκτροπών που επάγονται από τις υπό δοκιμή χημικές ουσίες στα κύτταρα του μυελού των οστών ζώων, συνήθως τρωκτικών (2) (3) (4) (5). Οι δομικές χρωμοσωμικές εκτροπές μπορεί να είναι δύο τύπων, χρωμοσωμικές ή χρωματιδικές. Αν και οι περισσότερες γονιδιοτοξικές εκτροπές που επάγονται από χημικές ουσίες είναι χρωματιδικού τύπου, εμφανίζονται, ωστόσο, και εκτροπές χρωμοσωμικού τύπου. Οι χρωμοσωμικές βλάβες και τα συναφή συμβάντα αποτελούν το αίτιο πολλών γενετικών ασθενειών του ανθρώπου και υπάρχουν αρκετά στοιχεία που αποδεικνύουν ότι, όταν αυτές οι βλάβες και τα συναφή συμβάντα προκαλούν αλλοιώσεις σε ογκογονίδια και ογκοκατασταλτικά γονίδια, συνδέονται με την εμφάνιση καρκίνου στον άνθρωπο και σε πειραματικά συστήματα. Στους προσδιορισμούς χρωμοσωμικών εκτροπών in vivo μπορεί να παρουσιαστεί πολυπλοειδία (συμπεριλαμβανομένου του ενδοαναδιπλασιασμού). Εντούτοις, η αύξηση της πολυπλοειδίας δεν αποτελεί αφ' εαυτής ένδειξη ανευπλοειδογόνου δυναμικού και μπορεί απλώς να υποδηλώνει διατάραξη του κυτταρικού κύκλου ή κυτταροτοξικότητα. Η παρούσα δοκιμή δεν έχει σχεδιαστεί για τη μέτρηση της ανευπλοειδίας. Οι συνιστώμενες δοκιμές για την ανίχνευση ανευπλοειδίας in vivo και in vitro είναι η δοκιμή μικροπυρήνων in vivo σε ερυθροκύτταρα θηλαστικών (κεφάλαιο Β.12 του παρόντος παραρτήματος) και η δοκιμή μικροπυρήνων in vitro σε κύτταρα θηλαστικών (κεφάλαιο Β. 49 του παρόντος παραρτήματος), αντίστοιχα. Οι ορισμοί των χρησιμοποιούμενων όρων παρατίθενται στο προσάρτημα 1. ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ Στην παρούσα δοκιμή χρησιμοποιούνται συνήθως τρωκτικά, αλλά μπορεί, σε ορισμένες περιπτώσεις, να είναι κατάλληλα και άλλα είδη, εφόσον αυτό αιτιολογείται επιστημονικά. Ο στοχευόμενος ιστός στην παρούσα δοκιμή είναι ο μυελός των οστών, επειδή παρουσιάζει έντονη αγγείωση και περιέχει πληθυσμό κυττάρων με ταχύ κυτταρικό κύκλο που μπορούν εύκολα να απομονωθούν και να υποβληθούν σε επεξεργασία. Η επιστημονική αιτιολόγηση της χρήσης άλλων ειδών εκτός από επίμυες και ποντικούς θα πρέπει να περιλαμβάνεται στην έκθεση δοκιμής. Εάν χρησιμοποιούνται άλλα είδη εκτός των τρωκτικών, συνιστάται να ενσωματώνεται η μέτρηση των χρωμοσωμικών εκτροπών μυελού των οστών σε άλλη κατάλληλη δοκιμή τοξικότητας. Εάν υπάρχουν ενδείξεις ότι η υπό δοκιμή χημική ουσία ή οι μεταβολίτες της δεν θα φθάσουν στον στοχευόμενο ιστό, μπορεί να μην ενδείκνυται η χρήση της παρούσας δοκιμής. Πριν από τη χρήση της μεθόδου δοκιμών σε μείγμα για την παραγωγή δεδομένων για συγκεκριμένο ρυθμιστικό σκοπό, θα πρέπει να εξετάζεται αν — και, εάν ναι, για ποιον λόγο — αυτή μπορεί να αποδώσει επαρκή αποτελέσματα για τον επιδιωκόμενο σκοπό. Οι εκτιμήσεις αυτές δεν είναι αναγκαίες όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος. ΑΡΧΗ ΤΗΣ ΜΕΘΟΔΟΥ ΔΟΚΙΜΩΝ Τα ζώα εκτίθενται στην υπό δοκιμή χημική ουσία από κατάλληλη οδό έκθεσης και θανατώνονται με ευθανασία σε εύθετο χρόνο μετά τη μεταχείριση. Πριν από την ευθανασία, τα ζώα υποβάλλονται σε μεταχείριση με παράγοντα διακοπής της μετάφασης (π.χ. κολχικίνη ή Colcemid). Ακολουθεί ετοιμασία χρωμοσωμικών παρασκευασμάτων από κύτταρα του μυελού των οστών, χρώση των παρασκευασμάτων και ανάλυση των μεταφασικών κυττάρων για τον εντοπισμό χρωμοσωμικών εκτροπών. ΕΛΕΓΧΟΣ ΤΗΣ ΤΕΧΝΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ ΤΟΥ ΕΡΓΑΣΤΗΡΙΟΥ Έρευνες τεχνικής ικανότητας Για να τεκμηριώσει πως διαθέτει επαρκή εμπειρία στη διεξαγωγή της δοκιμής πριν τη χρησιμοποιήσει για δοκιμές ρουτίνας, το εργαστήριο θα πρέπει να έχει αποδείξει την ικανότητά του να αναπαράγει τα αναμενόμενα αποτελέσματα με βάση δημοσιευμένα δεδομένα [π.χ. (6)] για συχνότητες χρωμοσωμικών εκτροπών, με τουλάχιστον δύο χημικές ουσίες ως θετικούς μάρτυρες (συμπεριλαμβανομένων των ασθενών αποκρίσεων που επάγονται από χαμηλές δόσεις θετικών μαρτύρων), όπως αυτές που απαριθμούνται στον πίνακα 1, καθώς και με συμβατούς μάρτυρες με φορέα/διαλύτη (βλ. παράγραφο 22). Στα πειράματα αυτά θα πρέπει να χρησιμοποιούνται δόσεις που παρέχουν αναπαραγώγιμες αυξήσεις σχετιζόμενες με τις δόσεις και καταδεικνύουν την ευαισθησία και τη δυναμική περιοχή του συστήματος δοκιμής στον στοχευόμενο ιστό (μυελό των οστών) και να εφαρμόζεται η μέθοδος καταμέτρησης που πρόκειται να χρησιμοποιηθεί στο εργαστήριο. Η απαίτηση αυτή δεν ισχύει για τα εργαστήρια που έχουν πείρα, δηλ. διαθέτουν βάση ιστορικών δεδομένων, όπως ορίζεται στις παραγράφους 10-14. Ιστορικά δεδομένα μαρτύρων Κατά τη διάρκεια των ερευνών τεχνικής ικανότητας, το εργαστήριο θα πρέπει να καθορίζει:
Κατά την αρχική συγκέντρωση ιστορικών δεδομένων για κατανομή όσον αφορά τους αρνητικούς μάρτυρες, οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει να συμφωνούν με τα δημοσιευμένα δεδομένα για μάρτυρες, εφόσον υπάρχουν. Καθώς θα προστίθενται περισσότερα πειραματικά δεδομένα στην κατανομή των ιστορικών δεδομένων μαρτύρων, οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει, στην ιδανική περίπτωση, να βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 % της εν λόγω κατανομής. Η βάση ιστορικών δεδομένων του εργαστηρίου για αρνητικούς μάρτυρες θα πρέπει να είναι στατιστικά ανθεκτική για να διασφαλίζει την ικανότητα του εργαστηρίου να αξιολογεί την κατανομή των δεδομένων του που αφορούν τους αρνητικούς μάρτυρες. Από τη βιβλιογραφία συνάγεται ότι ενδέχεται να απαιτούνται τουλάχιστον 10 πειράματα, αν και είναι προτιμότερο η βάση δεδομένων να αποτελείται από τουλάχιστον 20 πειράματα που έχουν εκτελεστεί σε συγκρίσιμες πειραματικές συνθήκες. Τα εργαστήρια θα πρέπει να χρησιμοποιούν μεθόδους ποιοτικού ελέγχου, όπως διαγράμματα ελέγχου [π.χ. διαγράμματα C ή X-bar (7)], για να προσδιορίζουν τη μεταβλητότητα των δεδομένων τους και να αποδεικνύουν ότι έχουν «υπό έλεγχο» τη μεθοδολογία. Περαιτέρω συστάσεις για τον τρόπο δημιουργίας και χρήσης των ιστορικών δεδομένων (δηλ. κριτήρια προσθήκης στοιχείων στα ιστορικά δεδομένα και αποκλεισμού στοιχείων από αυτά, καθώς και κριτήρια αποδοχής συγκεκριμένου πειράματος) έχουν διατυπωθεί στη βιβλιογραφία (8). Εάν το εργαστήριο δεν συμπληρώσει επαρκή αριθμό πειραμάτων για τον καθορισμό στατιστικά ανθεκτικής κατανομής αρνητικών μαρτύρων (βλ. παράγραφο 11) κατά τη διάρκεια των ερευνών τεχνικής ικανότητας (που περιγράφονται στην παράγραφο 9), είναι αποδεκτή η κατασκευή της κατανομής κατά τις πρώτες δοκιμές ρουτίνας. Κατά την εφαρμογή της προσέγγισης αυτής θα πρέπει να τηρούνται οι συστάσεις που έχουν διατυπωθεί στη βιβλιογραφία (8) και τα αποτελέσματα που προκύπτουν για τους αρνητικούς μάρτυρες στα σχετικά πειράματα θα πρέπει και πάλι να συμφωνούν με τα δημοσιευμένα δεδομένα για αρνητικούς μάρτυρες. Κάθε αλλαγή του πειραματικού πρωτοκόλλου θα πρέπει να μελετάται υπό το πρίσμα της επίπτωσής της στη διατήρηση της συμφωνίας των δεδομένων που προκύπτουν προς την υφιστάμενη βάση ιστορικών δεδομένων του εργαστηρίου για μάρτυρες. Μόνο σημαντικές ανακολουθίες θα πρέπει να έχουν ως αποτέλεσμα τη δημιουργία νέας βάσης ιστορικών δεδομένων ελέγχου, όταν η κρίση εμπειρογνωμόνων διαπιστώσει ότι διαφέρει από την προηγούμενη κατανομή (βλ. παράγραφο 11). Για τη διεξαγωγή πραγματικής δοκιμής κατά την περίοδο της αντικατάστασης, ενδέχεται να μην είναι αναγκαία μια πλήρης βάση δεδομένων για αρνητικούς μάρτυρες, με την προϋπόθεση ότι το εργαστήριο μπορεί να αποδείξει ότι οι τιμές του για τους παράλληλους αρνητικούς μάρτυρες εξακολουθούν να συμφωνούν είτε με την προηγούμενη βάση δεδομένων του είτε με τα αντίστοιχα δημοσιευμένα δεδομένα. Τα δεδομένα για αρνητικούς μάρτυρες θα πρέπει να είναι η επίπτωση (incidence) των χρωμοσωμικών εκτροπών (χωρίς τα χάσματα) σε κάθε ζώο. Οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει, στην ιδανική περίπτωση, να βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 % της κατανομής της βάσης ιστορικών δεδομένων του εργαστηρίου για αρνητικούς μάρτυρες. Όταν τα δεδομένα για παράλληλους αρνητικούς μάρτυρες δεν βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 %, μπορεί να είναι αποδεκτή η προσθήκη τους στην κατανομή ιστορικών δεδομένων μαρτύρων, εφόσον τα εν λόγω δεδομένα δεν είναι ακραίες έκτοπες τιμές και υπάρχουν στοιχεία που αποδεικνύουν ότι το σύστημα δοκιμής είναι «υπό έλεγχο» (βλ. παράγραφο 11) και ότι δεν πρόκειται για τεχνικό ή ανθρώπινο σφάλμα. ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Προετοιμασίες Επιλογή ζωικού είδους Θα πρέπει να χρησιμοποιούνται υγιή νεαρά ενήλικα ζώα που ανήκουν σε συνήθεις εργαστηριακές φυλές. Συνήθως χρησιμοποιούνται επίμυες, αλλά μπορεί να είναι κατάλληλοι και οι ποντικοί. Η χρήση άλλων κατάλληλων ειδών θηλαστικών επιτρέπεται, εφόσον αιτιολογείται επιστημονικά στην έκθεση. Συνθήκες στέγασης και σίτισης των ζώων Για τα τρωκτικά, η θερμοκρασία στην αίθουσα πειραματόζωων θα πρέπει να είναι 22 °C (± 3 °C). Η σχετική υγρασία, η ιδανική τιμή της οποίας είναι 50-60 %, θα πρέπει να είναι τουλάχιστον 40 % και, κατά προτίμηση, να μην υπερβαίνει το 70 %, εκτός από τις περιόδους καθαρισμού της αίθουσας. Ο φωτισμός θα πρέπει να είναι τεχνητός, με φωτοπερίοδο 12 ωρών. Για τη διατροφή των ζώων μπορούν να χρησιμοποιούνται τα κλασικά εργαστηριακά σιτηρέσια, με απεριόριστη παροχή πόσιμου νερού. Όταν η υπό δοκιμή χημική ουσία χορηγείται με την τροφή, η ανάγκη επαρκούς πρόσμειξης της ουσίας είναι δυνατόν να επηρεάσει την επιλογή σιτηρεσίου. Τα τρωκτικά θα πρέπει να στεγάζονται σε μικρές ομάδες (όχι περισσότερα από πέντε ανά κλωβό) του ίδιου φύλου και της ίδιας μεταχείρισης, εφόσον δεν αναμένεται επιθετική συμπεριφορά, κατά προτίμηση σε κλωβούς με συμπαγές δάπεδο με κατάλληλο εμπλουτισμό του περιβάλλοντος. Η ατομική στέγαση των ζώων επιτρέπεται, μόνον εάν αιτιολογείται επιστημονικά. Προετοιμασία των ζώων Κατά κανόνα χρησιμοποιούνται υγιή νεαρά ενήλικα ζώα (για τα τρωκτικά, η ιδανική ηλικία είναι μεταξύ 6 και 10 εβδομάδων κατά την έναρξη της μεταχείρισης, αν και είναι επίσης αποδεκτά ζώα λίγο μεγαλύτερης ηλικίας), τα οποία κατανέμονται τυχαία στις ομάδες μαρτύρων και μεταχείρισης. Τα ζώα ταυτοποιούνται μοναδικά με χρήση ανώδυνης, ελάχιστα επεμβατικής μεθόδου (π.χ. δακτύλιοι, ετικέτες, μικροτσίπ ή βιομετρική ταυτοποίηση, αλλά όχι αποκοπή τμήματος αυτιού ή δακτύλου). Οι κλωβοί θα πρέπει να διατάσσονται με τρόπο ώστε να ελαχιστοποιούνται οι πιθανές επιδράσεις της θέσης τους. Θα πρέπει να αποφεύγεται η διασταυρούμενη μόλυνση από τον θετικό μάρτυρα και την υπό δοκιμή χημική ουσία. Στην αρχή της δοκιμής, οι διαφορές βάρους των ζώων θα πρέπει να είναι ελάχιστες και να μην υπερβαίνουν το ± 20 % του μέσου βάρους κάθε φύλου. Παρασκευή των δόσεων Οι στερεές υπό δοκιμή χημικές ουσίες θα πρέπει να διαλύονται ή να διασπείρονται (σχηματισμός εναιωρήματος) σε κατάλληλους διαλύτες ή φορείς ή να αναμειγνύονται με την τροφή ή το πόσιμο νερό, πριν χορηγηθούν στα ζώα. Οι υγρές υπό δοκιμή χημικές ουσίες μπορούν να χορηγούνται ως έχουν ή να αραιώνονται πριν από τη χορήγηση. Σε περίπτωση έκθεσης μέσω της εισπνοής, οι υπό δοκιμή χημικές ουσίες μπορούν να χορηγούνται ως αέριο, ατμοί ή αερόλυμα στερεού/υγρού, ανάλογα με τις φυσικοχημικές τους ιδιότητες. Θα πρέπει να χρησιμοποιούνται πρόσφατα παρασκευάσματα της υπό δοκιμή χημικής ουσίας, εκτός αν τα στοιχεία σχετικά με τη σταθερότητά της καταδεικνύουν ότι είναι αποδεκτή η φύλαξή της και καθορίζουν τις κατάλληλες συνθήκες φύλαξης. Διαλύτης/φορέας Ο διαλύτης/φορέας θα πρέπει να μην έχει τοξικές επιδράσεις στα χρησιμοποιούμενα επίπεδα δόσεων ούτε να υπάρχουν υπόνοιες για χημική αντίδρασή του με τις υπό δοκιμή χημικές ουσίες. Εφόσον χρησιμοποιείται άλλος διαλύτης/φορέας εκτός των καθιερωμένων, η χρήση του θα πρέπει να τεκμηριώνεται με δεδομένα αναφοράς που αποδεικνύουν τη συμβατότητά του. Συνιστάται, εφόσον είναι δυνατό, να εξετάζεται πρώτα αν μπορεί να χρησιμοποιηθεί υδατικός διαλύτης/φορέας. Παραδείγματα ευρέως χρησιμοποιούμενων συμβατών διαλυτών/φορέων είναι, μεταξύ άλλων, το νερό, ο φυσιολογικός ορός (ισότονο αλατούχο διάλυμα), το διάλυμα μεθυλοκυτταρίνης, το διάλυμα άλατος της καρβοξυμεθυλοκυτταρίνης με νάτριο, το ελαιόλαδο και το αραβοσιτέλαιο. Εάν δεν υπάρχουν ιστορικά ή δημοσιευμένα δεδομένα για μάρτυρες που να αποδεικνύουν ότι ένας άτυπος διαλύτης/φορέας δεν επάγει δομικές εκτροπές ή άλλες επιβλαβείς επιδράσεις, θα πρέπει να διενεργείται μια αρχική μελέτη για να διαπιστωθεί η δυνατότητα αποδοχής των μαρτύρων με διαλύτη/φορέα. Μάρτυρες Θετικοί μάρτυρες Κάθε δοκιμή θα πρέπει κανονικά να περιλαμβάνει μια ομάδα ζώων που υποβάλλονται σε μεταχείριση με χημική ουσία η οποία χρησιμεύει ως θετικός μάρτυρας. Η εν λόγω ομάδα μπορεί να παραλείπεται, εάν το εργαστήριο δοκιμών έχει αποδείξει την τεχνική του ικανότητα διεξαγωγής της δοκιμής και έχει καθορίσει εύρος ιστορικών δεδομένων για θετικούς μάρτυρες. Εάν δεν συμπεριλαμβάνεται ομάδα παράλληλων θετικών μαρτύρων, κάθε πείραμα θα πρέπει να περιλαμβάνει μάρτυρες καταμέτρησης (μονιμοποιημένες αντικειμενοφόρες πλάκες χωρίς χρώση). Αυτοί μπορούν να ληφθούν με την προσθήκη κατάλληλων δειγμάτων αναφοράς κατά την καταμέτρηση στο πλαίσιο της μελέτης, τα οποία έχουν ληφθεί και φυλαχθεί από χωριστό πείραμα με θετικούς μάρτυρες που εκτελείται σε τακτά διαστήματα (π.χ. ανά 6 έως 18 μήνες) στο εργαστήριο διεξαγωγής της δοκιμής· για παράδειγμα, κατά τον έλεγχο της τεχνικής ικανότητας και, στη συνέχεια, σε τακτική βάση, όποτε είναι αναγκαίο. Οι χημικές ουσίες που χρησιμεύουν ως θετικοί μάρτυρες θα πρέπει να επιφέρουν με αξιοπιστία ανιχνεύσιμη αύξηση της συχνότητας των κυττάρων με δομικές χρωμοσωμικές εκτροπές σε σχέση με την αυθόρμητη συχνότητα. Οι δόσεις των θετικών μαρτύρων θα πρέπει να επιλέγονται έτσι ώστε οι επιδράσεις να είναι σαφείς αλλά να μην αποκαλύπτουν αμέσως την ταυτότητα των κωδικοποιημένων δειγμάτων στον εξεταστή. Είναι αποδεκτό να χορηγούνται οι θετικοί μάρτυρες και από οδό διαφορετική από εκείνη της χορήγησης της υπό δοκιμή χημικής ουσίας, με τη χρήση διαφορετικού προγράμματος αγωγής, και να διενεργείται η δειγματοληψία μόνο σε μία χρονική στιγμή. Επιπροσθέτως, μπορεί να εξετάζεται το ενδεχόμενο χρήσης θετικών μαρτύρων συγγενούς χημικής τάξης, κατά περίπτωση. Παραδείγματα χημικών ουσιών που αποτελούν θετικούς μάρτυρες περιλαμβάνονται στον πίνακα 1. Πίνακας 1 Παραδείγματα χημικών ουσιών που αποτελούν θετικούς μάρτυρες
Αρνητικοί μάρτυρες Σε κάθε χρόνο δειγματοληψίας θα πρέπει να περιλαμβάνεται ομάδα ζώων ως αρνητικός μάρτυρας, η οποία υφίσταται τους ίδιους χειρισμούς όπως οι ομάδες μεταχείρισης, με μόνη διαφορά το ότι δεν εκτίθεται στην υπό δοκιμή χημική ουσία. Εάν για τη χορήγηση της υπό δοκιμή χημικής ουσίας χρησιμοποιείται διαλύτης/φορέας, αυτός θα πρέπει να χορηγείται και στην ομάδα-μάρτυρα. Ωστόσο, εάν από ιστορικά δεδομένα για τους αρνητικούς μάρτυρες προκύπτουν σταθερές τιμές μεταβλητότητας και συχνότητες κυττάρων με χρωμοσωμικές εκτροπές μεταξύ των ζώων σε κάθε δειγματοληψία για το εργαστήριο δοκιμών, μπορεί να απαιτείται μία μόνο δειγματοληψία για τον αρνητικό μάρτυρα. Σε περίπτωση μίας μόνο δειγματοληψίας για τους αρνητικούς μάρτυρες, αυτή θα πρέπει να διενεργείται κατά τον χρόνο της πρώτης δειγματοληψίας στο πλαίσιο της μελέτης. ΔΙΑΔΙΚΑΣΙΑ Αριθμός και φύλο των ζώων Η απόκριση μικροπυρήνων είναι γενικά παρόμοια μεταξύ αρσενικών και θηλυκών ζώων (9) και αναμένεται ότι αυτό θα ισχύει και για τις δομικές χρωμοσωμικές εκτροπές· ως εκ τούτου, οι περισσότερες μελέτες θα μπορούσαν να διεξαχθούν σε οποιοδήποτε φύλο. Δεδομένα που καταδεικνύουν ουσιαστικές διαφορές μεταξύ αρσενικών και θηλυκών ζώων (π.χ. διαφορές συστημικής τοξικότητας, μεταβολισμού, βιοδιαθεσιμότητας, τοξικότητας για τον μυελό των οστών, κ.λπ., συμπεριλαμβανομένων εκείνων που έχουν προκύψει, π.χ., από μελέτη προσδιορισμού εύρους τιμών) υποστηρίζουν τη χρησιμοποίηση ζώων και των δύο φύλων. Στην περίπτωση αυτή, ίσως είναι σκόπιμο να διεξάγεται μελέτη και στα δύο φύλα, π.χ. στο πλαίσιο μελετών τοξικότητας με επαναλαμβανόμενες δόσεις. Σε περίπτωση χρήσης και των δύο φύλων, θα ήταν ενδεχομένως σκόπιμη η εφαρμογή παραγοντικού σχεδιασμού. Λεπτομέρειες σχετικά με τον τρόπο ανάλυσης των δεδομένων με τη χρήση αυτού του σχεδιασμού παρέχονται στο προσάρτημα 2. Το μέγεθος των ομάδων κατά την έναρξη της μελέτης θα πρέπει να καθορίζεται με γνώμονα την εξασφάλιση, ανά ομάδα, 5 τουλάχιστον αναλύσιμων ζώων του ίδιου φύλου ή, εάν χρησιμοποιούνται ζώα και των δύο φύλων, από κάθε φύλο. Όταν η έκθεση του ανθρώπου σε μια χημική ουσία αφορά μόνο το ένα φύλο, όπως π.χ. στην περίπτωση ορισμένων φαρμακευτικών προϊόντων, η δοκιμή θα πρέπει να διεξάγεται σε ζώα του αντίστοιχου φύλου. Ενδεικτικά, όσον αφορά τις τυπικές απαιτήσεις για τον μέγιστο αριθμό ζώων, για μια μελέτη σε μυελό των οστών με δύο χρόνους δειγματοληψίας, τρεις ομάδες δόσης και μια ομάδα παράλληλων αρνητικών μαρτύρων, συν μια ομάδα θετικών μαρτύρων (κάθε ομάδα αποτελούμενη από πέντε ζώα του ίδιου φύλου), θα απαιτούνταν 45 ζώα. Επίπεδα δόσεων Εάν χρειάζεται προκαταρκτική μελέτη προσδιορισμού εύρους τιμών επειδή δεν υπάρχουν ήδη κατάλληλα δεδομένα για να υποβοηθήσουν την επιλογή δόσεων, η εν λόγω μελέτη θα πρέπει να διεξάγεται στο ίδιο εργαστήριο, με τη χρήση του ίδιου είδους, φυλής, φύλου ζώων και σχήματος μεταχείρισης όπως στην κύρια μελέτη (10). Η μελέτη θα πρέπει να αποσκοπεί στον προσδιορισμό της μέγιστης ανεκτής δόσης (ΜΑΔ), η οποία ορίζεται ως η ανώτατη δόση που μπορεί να γίνει ανεκτή χωρίς εκδήλωση τοξικότητας που περιορίζει τη μελέτη, σε σχέση με τη διάρκεια της μελέτης (π.χ. που προκαλεί μείωση του σωματικού βάρους ή κυτταροτοξικότητα για το αιμοποιητικό σύστημα), αλλά δεν προκαλεί θάνατο ούτε εκδήλωση πόνου, ταλαιπωρίας ή δυσφορίας που καθιστούν αναγκαία τη θανάτωση με ευθανασία (11). Η ανώτατη δόση μπορεί επίσης να οριστεί ως η δόση που προκαλεί ορισμένες ενδείξεις τοξικότητας για τον μυελό των οστών. Οι χημικές ουσίες που παρουσιάζουν κορεσμό τοξικοκινητικών ιδιοτήτων ή επάγουν διεργασίες αποτοξίνωσης που μπορεί να επιφέρουν μείωση της έκθεσης μετά από μακροχρόνια αγωγή ίσως αποτελούν εξαιρέσεις από τα κριτήρια καθορισμού των δόσεων και θα πρέπει να αξιολογούνται κατά περίπτωση. Για να ληφθούν πληροφορίες σχετικά με τη σχέση δόσης-απόκρισης, μια ολοκληρωμένη μελέτη θα πρέπει να περιλαμβάνει ομάδα αρνητικού μάρτυρα και τουλάχιστον τρία επίπεδα δόσεων, τα οποία κατά κανόνα διαφέρουν κατά έναν συντελεστή ίσο με το 2, αλλά πάντως όχι μεγαλύτερο του 4. Εάν η υπό δοκιμή χημική ουσία δεν προκαλεί τοξικότητα σε μελέτη προσδιορισμού εύρους τιμών ή με βάση τα υπάρχοντα δεδομένα, η ανώτατη δόση για εφάπαξ χορήγηση θα πρέπει να είναι 2 000 mg/kg σωματικού βάρους. Ωστόσο, εάν η υπό δοκιμή χημική ουσία προκαλεί τοξικότητα, η ΜΑΔ θα πρέπει να είναι η ανώτατη χορηγούμενη δόση και τα χρησιμοποιούμενα επίπεδα δόσεων θα πρέπει, κατά προτίμηση, να καλύπτουν το εύρος από τη μέγιστη δόση μέχρι τη δόση που προκαλεί ελάχιστη ή μηδενική τοξικότητα. Όταν παρατηρείται τοξικότητα στον στοχευόμενο ιστό (μυελό των οστών) σε όλα τα ελεγχόμενα επίπεδα δόσεων, συνιστάται η διεξαγωγή περαιτέρω μελέτης με μη τοξικές δόσεις. Οι μελέτες που αποσκοπούν στον πληρέστερο χαρακτηρισμό των ποσοτικών στοιχείων σχετικά με τη σχέση δόσης-απόκρισης ενδέχεται να απαιτούν πρόσθετες ομάδες δόσης. Για ορισμένα είδη υπό δοκιμή χημικών ουσιών (π.χ. φαρμακευτικά προϊόντα για τον άνθρωπο) που καλύπτονται από ειδικές απαιτήσεις, αυτά τα όρια μπορεί να διαφέρουν. Οριακή δοκιμή Εάν τα πειράματα προσδιορισμού εύρους δόσεων ή υφιστάμενα δεδομένα για συγγενείς φυλές ζώων δείχνουν ότι ένα σχήμα μεταχείρισης με τουλάχιστον την οριακή δόση (που περιγράφεται κατωτέρω) δεν επιφέρει παρατηρήσιμες τοξικές επιδράσεις (που περιλαμβάνουν την απουσία μείωσης του πολλαπλασιασμού του μυελού των οστών ή άλλης ένδειξης κυτταροτοξικότητας στον στοχευόμενο ιστό) και δεν αναμένεται γονιδιοτοξικότητα με βάση μελέτες γονιδιοτοξικότητας in vitro ή δεδομένα για χημικές ουσίες παρόμοιας δομής, μπορεί να κριθεί περιττή η διεξαγωγή πλήρους μελέτης με τρία επίπεδα δόσεων, υπό τον όρο ότι έχει αποδειχθεί ότι οι υπό δοκιμή χημικές ουσίες φθάνουν στον στοχευόμενο ιστό (μυελός των οστών). Σε αυτές τις περιπτώσεις, ενδέχεται να αρκεί ένα μόνο επίπεδο δόσης, ίσο με την οριακή δόση. Για περίοδο χορήγησης > 14 ημερών, η οριακή δόση είναι 1 000 mg/kg βάρους σώματος/ημέρα. Για περιόδους χορήγησης 14 ή λιγότερων ημερών, η οριακή δόση είναι 2 000 mg/kg βάρους σώματος/ημέρα. Χορήγηση των δόσεων Κατά τον σχεδιασμό της δοκιμής θα πρέπει να λαμβάνεται υπόψη η προβλεπόμενη οδός έκθεσης του ανθρώπου. Επιτρέπεται επομένως η αιτιολογημένη επιλογή οδών έκθεσης όπως μέσω της τροφής ή του πόσιμου νερού, με τοπική εφαρμογή, υποδόρια ή ενδοφλέβια ένεση, από το στόμα (με στομαχικό καθετήρα), μέσω της εισπνοής, η ενδοτραχειακή οδός ή η εμφύτευση. Σε κάθε περίπτωση, η οδός έκθεσης θα πρέπει να επιλέγεται κατά τρόπο ώστε να εξασφαλίζεται επαρκής έκθεση του ή των στοχευόμενων ιστών. Η ενδοπεριτοναϊκή ένεση δεν συνιστάται κατά κανόνα, διότι δεν αποτελεί σκοπούμενη οδό έκθεσης του ανθρώπου, και θα πρέπει να χρησιμοποιείται μόνο με ειδική επιστημονική αιτιολόγηση. Εάν η υπό δοκιμή χημική ουσία αναμειγνύεται με την τροφή ή το πόσιμο νερό, ιδίως στην περίπτωση των εφάπαξ δόσεων, θα πρέπει να λαμβάνεται μέριμνα ώστε το χρονικό διάστημα μεταξύ της κατανάλωσης τροφής και νερού και της δειγματοληψίας να επαρκεί για την ανίχνευση των επιδράσεων (βλ. παραγράφους 33-34). Ο μέγιστος όγκος υγρού που μπορεί να χορηγηθεί με στομαχικό καθετήρα ή ένεση κάθε φορά εξαρτάται από το μέγεθος του πειραματόζωου. Ο όγκος δεν θα πρέπει κανονικά να υπερβαίνει το 1 ml/100 g σωματικού βάρους, εκτός από την περίπτωση των υδατικών διαλυμάτων, όπου επιτρέπεται να χρησιμοποιούνται κατά μέγιστο όριο 2 ml/100 g σωματικού βάρους. Η χρήση μεγαλύτερων όγκων θα πρέπει να αιτιολογείται. Η μεταβλητότητα των όγκων δοκιμής θα πρέπει να ελαχιστοποιείται με ρύθμιση της συγκέντρωσης, ώστε να εξασφαλίζεται η χορήγηση σταθερού όγκου σε σχέση με το σωματικό βάρος σε όλα τα επίπεδα δόσεων, εκτός από την περίπτωση των ερεθιστικών ή διαβρωτικών χημικών ουσιών, των οποίων οι επιδράσεις κατά κανόνα επιδεινώνονται όταν αυξάνονται οι συγκεντρώσεις. Πρόγραμμα μεταχείρισης Οι υπό δοκιμή χημικές ουσίες χορηγούνται συνήθως εφάπαξ, αλλά μπορούν να χορηγηθούν και σε διαιρεμένες δόσεις (δηλ. δύο ή περισσότερες δόσεις την ίδια ημέρα, που δεν απέχουν χρονικά μεταξύ τους περισσότερο από 2-3 ώρες) για να διευκολύνεται η χορήγηση μεγάλων όγκων. Υπό τις περιστάσεις αυτές ή κατά τη χορήγηση της υπό δοκιμή χημικής ουσίας μέσω της εισπνοής, ο χρόνος δειγματοληψίας θα πρέπει να προγραμματίζεται με βάση τον χρόνο της τελευταίας χορήγησης ή το τέλος της έκθεσης. Υπάρχουν ελάχιστα διαθέσιμα δεδομένα σχετικά με την καταλληλότητα ενός πρωτοκόλλου επαναλαμβανόμενων δόσεων για την παρούσα δοκιμή. Ωστόσο, όταν είναι σκόπιμη η ενσωμάτωσή της σε δοκιμή τοξικότητας επαναλαμβανόμενων δόσεων, θα πρέπει να λαμβάνεται μέριμνα για την αποφυγή της απώλειας μιτωτικών κυττάρων που έχουν υποστεί χρωμοσωμική βλάβη, όπως θα μπορούσε να συμβεί με τοξικές δόσεις. Η ενοποίηση αυτή είναι αποδεκτή, όταν η ανώτατη δόση είναι μεγαλύτερη ή ίση προς την οριακή δόση (βλ. παράγραφο 29) και σε μία ομάδα δόσης χορηγείται η οριακή δόση για τη διάρκεια της περιόδου μεταχείρισης. Η δοκιμή μικροπυρήνων (μέθοδος δοκιμής Β.12) θα πρέπει να θεωρείται η in vivo δοκιμή πρώτης επιλογής για χρωμοσωμικές εκτροπές, όταν κρίνεται σκόπιμη η ενσωμάτωση σε άλλες μελέτες. Τα δείγματα μυελού των οστών θα πρέπει να λαμβάνονται σε δύο διαφορετικές χρονικές στιγμές μετά τις εφάπαξ μεταχειρίσεις. Για τα τρωκτικά, το πρώτο διάστημα δειγματοληψίας θα πρέπει να είναι ο χρόνος που απαιτείται για τη συμπλήρωση της φυσιολογικής διάρκειας του κυτταρικού κύκλου, πολλαπλασιαζόμενης επί 1,5 (κανονικά 12-18 ώρες μετά την περίοδο μεταχείρισης). Επειδή ο απαιτούμενος χρόνος για την πρόσληψη και τον μεταβολισμό της υπό δοκιμή χημικής ουσίας, καθώς και η επίδρασή της στην κινητική του κυτταρικού κύκλου, μπορεί να επηρεάσει τον βέλτιστο χρόνο για την ανίχνευση χρωμοσωμικής εκτροπής, συνιστάται η διενέργεια και δεύτερης δειγματοληψίας 24 ώρες μετά την πρώτη. Κατά τον χρόνο της πρώτης δειγματοληψίας, θα πρέπει να υποβάλλονται σε μεταχείριση όλες οι ομάδες δόσης και να συλλέγονται δείγματα για ανάλυση· ωστόσο, κατά τους μεταγενέστερους χρόνους δειγματοληψίας, αρκεί να χορηγηθεί μόνον η ανώτατη δόση. Εάν εφαρμόζεται δοσολογικό σχήμα που εκτείνεται σε περισσότερες από μία ημέρες με βάση επιστημονική αιτιολόγηση, θα πρέπει κατά κανόνα να διενεργείται μία δειγματοληψία σε χρόνο που ισοδυναμεί περίπου με τη φυσιολογική διάρκεια του κυτταρικού κύκλου επί 1,5 από την τελική μεταχείριση. Μετά τη μεταχείριση και πριν από τη συλλογή δειγμάτων, χορηγείται στα ζώα με ενδοπεριτοναϊκή έγχυση κατάλληλη δόση παράγοντα διακοπής της μετάφασης (π.χ. Colcemid ή κολχικίνη) και, στη συνέχεια, συλλέγονται δείγματα μετά την παρέλευση κατάλληλου χρονικού διαστήματος. Για τους ποντικούς, η καταλληλότερη στιγμή είναι περίπου 3-5 ώρες πριν από τη συλλογή και για τους επίμυες είναι 2-5 ώρες. Κύτταρα από το μυελό των οστών συλλέγονται, διογκώνονται, μονιμοποιούνται, χρωματίζονται και εξετάζονται για τον εντοπισμό χρωμοσωμικών εκτροπών (12). Παρατηρήσεις Τα πειραματόζωα θα πρέπει να υποβάλλονται σε γενική κλινική εξέταση και τα κλινικά σημεία να καταγράφονται τουλάχιστον μία φορά ημερησίως, κατά προτίμηση την ίδια ώρα και λαμβανομένου υπόψη του χρόνου κορύφωσης των αναμενόμενων επιδράσεων μετά τη χορήγηση της δόσης. Όλα τα ζώα θα πρέπει να εξετάζονται τουλάχιστον δύο φορές ημερησίως κατά την περίοδο της χορήγησης για τη διαπίστωση τυχόν νοσηρότητας και θνησιμότητας. Όλα τα ζώα πρέπει να ζυγίζονται κατά την έναρξη της μελέτης, τουλάχιστον μία φορά την εβδομάδα κατά τη διάρκεια των μελετών για τις επαναλαμβανόμενες δόσεις και κατά την ευθανασία. Σε μελέτες διάρκειας τουλάχιστον μίας εβδομάδας, η κατανάλωση τροφής θα πρέπει να μετράται τουλάχιστον εβδομαδιαίως. Εάν η υπό δοκιμή χημική ουσία χορηγείται με το πόσιμο νερό, η κατανάλωση νερού θα πρέπει να μετράται σε κάθε αλλαγή νερού και τουλάχιστον εβδομαδιαίως. Τα ζώα που εμφανίζουν μη θανατηφόρους δείκτες υπερβολικής τοξικότητας θα πρέπει να υποβάλλονται σε ευθανασία πριν από τη λήξη της περιόδου δοκιμής (11). Έκθεση του στοχευόμενου ιστού Θα πρέπει να λαμβάνεται δείγμα αίματος σε κατάλληλους χρόνους για να είναι δυνατή η διερεύνηση των επιπέδων των υπό δοκιμή χημικών ουσιών στο πλάσμα, ώστε να αποδεικνύεται η έκθεση του μυελού των οστών, όταν αυτό δικαιολογείται και δεν υπάρχουν άλλα δεδομένα έκθεσης (βλ. παράγραφο 44). Παρασκευάσματα μυελού των οστών και χρωμοσωμάτων Αμέσως μετά τη θανάτωση με ευθανασία, λαμβάνονται κύτταρα μυελού των οστών από τα μηριαία ή τα κνημιαία οστά των ζώων, εκτίθενται σε υπότονο διάλυμα και μονιμοποιούνται. Τα μεταφασικά κύτταρα επιστρώνονται έπειτα σε αντικειμενοφόρες πλάκες και χρωματίζονται με τη χρήση καθιερωμένων μεθόδων [βλ. (3) (12)]. Ανάλυση Όλες οι αντικειμενοφόρες πλάκες, συμπεριλαμβανομένων των πλακών με τους θετικούς και αρνητικούς μάρτυρες, θα πρέπει να κωδικοποιούνται χωριστά πριν από την ανάλυση και να τυχαιοποιούνται, έτσι ώστε ο εξεταστής να μη γνωρίζει τη συνθήκη μεταχείρισης. Θα πρέπει να προσδιορίζεται ο μιτωτικός δείκτης ως παράμετρος κυτταροξικότητας σε 1 000 τουλάχιστον κύτταρα ανά ζώο από όλα τα ζώα που υποβάλλονται σε μεταχείριση (και τους θετικούς μάρτυρες), καθώς και από εκείνα που δεν υποβάλλονται σε μεταχείριση ή χρησιμεύουν ως αρνητικοί μάρτυρες με φορέα/διαλύτη. Θα πρέπει να αναλύονται τουλάχιστον 200 μεταφασικά κύτταρα ανά ζώο για τη διαπίστωση δομικών χρωμοσωμικών εκτροπών με και χωρίς τα χάσματα (6). Ωστόσο, εάν η βάση δεδομένων για ιστορικούς αρνητικούς μάρτυρες δείχνει ότι η μέση συχνότητα υποβάθρου των δομικών χρωμοσωμικών εκτροπών είναι < 1 % στο εργαστήριο δοκιμών, θα πρέπει να εξετάζεται το ενδεχόμενο καταμέτρησης πρόσθετων κυττάρων. Οι χρωματιδικού και χρωμοσωμικού τύπου εκτροπές θα πρέπει να καταγράφονται χωριστά και να ταξινομούνται σε υποκατηγορίες (ρήξεις, ανταλλαγές). Οι διαδικασίες που χρησιμοποιούνται στο εργαστήριο θα πρέπει να διασφαλίζουν τη διενέργεια της ανάλυσης χρωμοσωμικών εκτροπών από επαρκώς καταρτισμένους εξεταστές και, κατά περίπτωση, την αξιολόγηση της ανάλυσης από ομότιμους κριτές. Επειδή αναγνωρίζεται ότι οι διαδικασίες ετοιμασίας των αντικειμενοφόρων πλακών προκαλούν συχνά θραύση ενός ποσοστού μεταφασικών κυττάρων με συνακόλουθη απώλεια χρωμοσωμάτων, τα καταμετρούμενα κύτταρα θα πρέπει να περιέχουν αριθμό κεντρομεριδίων τουλάχιστον ίσο με 2n ± 2, όπου n είναι ο απλοειδής αριθμός χρωμοσωμάτων για το εξεταζόμενο ζωικό είδος. ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Επεξεργασία των αποτελεσμάτων Τα δεδομένα για κάθε ζώο θα πρέπει να παρουσιάζονται σε μορφή πίνακα. Ο μιτωτικός δείκτης, ο αριθμός των καταμετρηθέντων μεταφασικών κυττάρων, ο αριθμός εκτροπών ανά μεταφασικό κύτταρο και το ποσοστό των μεταφασικών κυττάρων με δομικές χρωμοσωμικές εκτροπές θα πρέπει να αξιολογούνται για κάθε ζώο. Οι διάφοροι τύποι δομικών χρωμοσωμικών εκτροπών θα πρέπει να αναφέρονται με τον αριθμό και τη συχνότητά τους για τις ομάδες μεταχείρισης και τις ομάδες μαρτύρων. Τα χάσματα, καθώς και τα πολυπλοειδή κύτταρα και τα κύτταρα με ενδοαναδιπλασιασμένα χρωμοσώματα καταγράφονται χωριστά. Η συχνότητα των χασμάτων αναφέρεται αλλά γενικά δεν περιλαμβάνεται στην ανάλυση της συχνότητας των συνολικών δομικών εκτροπών. Εφόσον δεν υπάρχουν ενδείξεις διαφοράς αποκρίσεως μεταξύ των φύλων, τα δεδομένα μπορούν να συνδυάζονται για στατιστική ανάλυση. Θα πρέπει επίσης να αναφέρονται δεδομένα σχετικά με την τοξικότητα για τα ζώα και με τα κλινικά σημεία. Κριτήρια αποδοχής Τα ακόλουθα κριτήρια καθορίζουν την αποδοχή της δοκιμής:
Αξιολόγηση και ερμηνεία των αποτελεσμάτων Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς θετική εάν:
Εάν εξετάζεται μόνο η ανώτατη δόση σε συγκεκριμένο χρόνο δειγματοληψίας, η υπό δοκιμή χημική ουσία θεωρείται σαφώς θετική εάν προκύπτει στατιστικά σημαντική αύξηση σε σχέση με τον παράλληλο αρνητικό μάρτυρα και τα αποτελέσματα βρίσκονται εκτός της κατανομής των ιστορικών δεδομένων για αρνητικούς μάρτυρες (π.χ. όρια ελέγχου σε επίπεδο 95 % με βάση την κατανομή Poisson). Συστάσεις για τις πλέον κατάλληλες στατιστικές μεθόδους παρέχονται στη βιβλιογραφία (13). Όταν διενεργείται ανάλυση της σχέσης δόσης-απόκρισης, θα πρέπει να αναλύονται τουλάχιστον τρεις ομάδες που έλαβαν δόσεις. Στις στατιστικές δοκιμασίες θα πρέπει να χρησιμοποιείται το ζώο ως πειραματική μονάδα. Τα θετικά αποτελέσματα της δοκιμής χρωμοσωμικών εκτροπών υποδηλώνουν ότι η υπό δοκιμή χημική ουσία επάγει δομικές χρωμοσωμικές εκτροπές στον μυελό των οστών του εξεταζόμενου ζωικού είδους. Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς αρνητική εάν, σε όλες τις πειραματικές συνθήκες που εξετάστηκαν:
Συστάσεις για τις πλέον κατάλληλες στατιστικές μεθόδους έχουν διατυπωθεί στη βιβλιογραφία (13). Στα στοιχεία που αποδεικνύουν την έκθεση του μυελού των οστών σε υπό δοκιμή χημική ουσία μπορεί να περιλαμβάνονται η μείωση του μιτωτικού δείκτη και η μέτρηση των επιπέδων της υπό δοκιμή χημικής ουσίας στο πλάσμα ή στο αίμα. Στην περίπτωση ενδοφλέβιας χορήγησης, δεν απαιτούνται αποδεικτικά στοιχεία της έκθεσης. Εναλλακτικά, για να αποδειχθεί η έκθεση του μυελού των οστών, μπορούν να χρησιμοποιηθούν δεδομένα ADME (απορρόφηση-κατανομή-μεταβολισμός-απέκκριση) που προκύπτουν από ανεξάρτητη μελέτη με τη χρησιμοποίηση της ίδιας οδού χορήγησης και του ίδιου ζωικού είδους. Τα αρνητικά αποτελέσματα υποδηλώνουν ότι, στις συνθήκες της δοκιμής, η υπό δοκιμή χημική ουσία δεν επάγει δομικές χρωμοσωμικές εκτροπές στον μυελό των οστών του εξεταζόμενου ζωικού είδους. Δεν απαιτείται επαλήθευση των σαφώς θετικών ή σαφώς αρνητικών αποκρίσεων. Σε περίπτωση που η απόκριση δεν είναι σαφώς θετική ούτε σαφώς αρνητική και για να διαπιστωθεί η βιολογική σημασία ενός αποτελέσματος (π.χ. ασθενής ή οριακή αύξηση), τα δεδομένα θα πρέπει να αξιολογούνται κατά την κρίση των ειδικών και/ή με περαιτέρω διερεύνηση των υφιστάμενων ολοκληρωμένων πειραμάτων. Σε ορισμένες περιπτώσεις, θα είναι ενδεχομένως χρήσιμη η ανάλυση περισσότερων κυττάρων ή η επανάληψη του πειράματος με τη χρήση τροποποιημένων πειραματικών συνθηκών. Σε σπάνιες περιπτώσεις, ακόμη και μετά από περαιτέρω διερεύνηση, τα δεδομένα δεν επιτρέπουν την εξαγωγή συμπεράσματος για θετικά ή αρνητικά αποτελέσματα με την υπό δοκιμή χημική ουσία και, κατά συνέπεια, η μελέτη κρίνεται διφορούμενη. Οι συχνότητες εμφάνισης μεταφασικών κυττάρων με πολυπλοειδία και ενδοαναδιπλασιασμό επί του συνόλου των μεταφασικών κυττάρων θα πρέπει να καταγράφονται χωριστά. Η αύξηση του αριθμού κυττάρων με πολυπλοειδία και/ή ενδοαναδιπλασιασμό μπορεί να σημαίνει ότι η υπό δοκιμή χημική ουσία είναι δυνάμει ικανή να αναστέλλει τις μιτωτικές διεργασίες ή την πρόοδο του κυτταρικού κύκλου (βλ. παράγραφο 3). Έκθεση δοκιμής Στην έκθεση δοκιμής θα πρέπει να περιλαμβάνονται τα ακόλουθα στοιχεία: Συνοπτική παρουσίαση
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Ανευπλοειδία : κάθε απόκλιση από τον φυσιολογικό διπλοειδή (ή απλοειδή) χρωμοσωμικό αριθμό κατά ένα ή περισσότερα χρωμοσώματα, όχι όμως κατά πολλαπλάσια πλήρων σειρών χρωμοσωμάτων (πρβλ. πολυπλοειδία). Κεντρομερίδιο : περιοχή του χρωμοσώματος, με την οποία συνδέονται τα νημάτια της ατράκτου κατά τη διάρκεια της κυτταρικής διαίρεσης, με στόχο την οργανωμένη κίνηση των θυγατρικών χρωμοσωμάτων προς τους πόλους των θυγατρικών κυττάρων. Χημική ουσία : μια ουσία ή ένα μείγμα. Εκτροπή χρωματιδικού τύπου : δομική χρωμοσωμική βλάβη που εκδηλώνεται ως ρήξη μεμονωμένων χρωματίδων ή ρήξη και επανένωση μεταξύ χρωματίδων. Εκτροπή χρωμοσωμικού τύπου : δομική χρωμοσωμική βλάβη που εκδηλώνεται ως ρήξη ή ρήξη και επανένωση και των δύο χρωματίδων στην ίδια θέση. Ενδοαναδιπλασιασμός : διεργασία κατά την οποία έπειτα από μια φάση S με αντιγραφή του DNA, ο πυρήνας δεν υφίσταται μίτωση αλλά αρχίζει μια νέα φάση S. Το αποτέλεσμα είναι χρωμοσώματα με 4, 4,8, 16... χρωματίδες. Χάσμα : αχρωματική βλάβη μικρότερη από το πλάτος μιας χρωματίδας και με ελάχιστη αποστοίχιση των χρωματίδων. Μιτωτικός δείκτης : ο λόγος του αριθμού των κυττάρων που βρίσκονται σε φάση μίτωσης προς τον συνολικό αριθμό κυττάρων σε έναν πληθυσμό, ο οποίος αποτελεί μέτρο της κατάστασης πολλαπλασιασμού του εν λόγω κυτταρικού πληθυσμού. Αριθμητική εκτροπή : μεταβολή του αριθμού των χρωμοσωμάτων από τον φυσιολογικό χαρακτηριστικό αριθμό στα χρησιμοποιούμενα ζώα (ανευπλοειδία). Πολυπλοειδία : αριθμητική χρωμοσωμική εκτροπή που συνεπάγεται μεταβολή του αριθμού της πλήρους σειράς χρωμοσωμάτων, σε αντίθεση με μια αριθμητική μεταβολή σε μέρος της σειράς χρωμοσωμάτων (πρβλ. ανευπλοειδία). Δομική χρωμοσωμική εκτροπή : μεταβολή της δομής των χρωμοσωμάτων που μπορεί να ανιχνευθεί με μικροσκοπική εξέταση του σταδίου της μετάφασης της κυτταρικής διαίρεσης και γίνεται αντιληπτή με τη μορφή απαλείψεων και θραυσμάτων, ενδοανταλλαγών ή διανταλλαγών. Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Προσάρτημα 2 ΠΑΡΑΓΟΝΤΙΚΟΣ ΣΧΕΔΙΑΣΜΟΣ ΓΙΑ ΤΟΝ ΕΝΤΟΠΙΣΜΟ ΔΙΑΦΟΡΩΝ ΜΕΤΑΞΥ ΤΩΝ ΦΥΛΩΝ ΣΤΗ ΔΟΚΙΜΗ ΧΡΩΜΟΣΩΜΙΚΩΝ ΕΚΤΡΟΠΩΝ IN VIVO Ο παραγοντικός σχεδιασμός και η σχετική ανάλυση Σύμφωνα με τον παρόντα σχεδιασμό, υποβάλλονται σε δοκιμή τουλάχιστον 5 αρσενικά και 5 θηλυκά άτομα σε κάθε επίπεδο συγκέντρωσης, με αποτέλεσμα τη χρήση τουλάχιστον 40 ζώων (20 αρσενικών και 20 θηλυκών, συν τους αντίστοιχους θετικούς μάρτυρες). Πρόκειται για έναν από τους απλούστερους παραγοντικούς σχεδιασμούς, που ισοδυναμεί με αμφίδρομη ανάλυση διασποράς στην οποία ως κύριες επιδράσεις θεωρούνται το φύλο και το επίπεδο συγκέντρωσης. Τα δεδομένα μπορούν να αναλυθούν με πολλά τυποποιημένα στατιστικά πακέτα λογισμικού, όπως τα SPSS, SAS, STATA, Genstat, καθώς και με τη χρήση του συστήματος R. Κατά την ανάλυση διαχωρίζεται η μεταβλητότητα του συνόλου δεδομένων σε μεταβλητότητα μεταξύ των φύλων, μεταβλητότητα μεταξύ των συγκεντρώσεων και μεταβλητότητα σχετιζόμενη με την αλληλεπίδραση μεταξύ των φύλων και των συγκεντρώσεων. Καθένας από τους όρους αυτούς συγκρίνεται με την εκτίμηση της μεταβλητότητας μεταξύ των ζώων επανάληψης (replicates) που απαρτίζουν τις ομάδες ζώων του ίδιου φύλου στις οποίες χορηγείται η ίδια συγκέντρωση. Περισσότερες λεπτομέρειες σχετικά με την υποκείμενη μεθοδολογία είναι διαθέσιμες σε πολλά κλασικά εγχειρίδια στατιστικής (βλ. βιβλιογραφία) και στις λειτουργίες βοήθειας (Help) που παρέχονται με τα στατιστικά πακέτα λογισμικού. Στο επόμενο στάδιο της ανάλυσης εξετάζεται ο όρος αλληλεπίδρασης φύλο x συγκέντρωση σε πίνακα ANOVA (5). Ελλείψει σημαντικού όρου αλληλεπίδρασης, οι συνδυασμένες τιμές στα φύλα ή στα επίπεδα συγκέντρωσης τροφοδοτούν έγκυρους στατιστικούς ελέγχους μεταξύ των επιπέδων με βάση τη συγχωνευμένη ενδοομαδική μεταβλητότητα (pooled within-group variability), όρο που παρέχεται από την ANOVA. Η ανάλυση συνεχίζεται με τον διαχωρισμό της εκτίμησης της μεταβλητότητας μεταξύ των συγκεντρώσεων σε αντιθέσεις που τροφοδοτούν έλεγχο για τις γραμμικές και τετραγωνικές αντιθέσεις των αποκρίσεων σε όλα τα επίπεδα συγκέντρωσης. Όταν υπάρχει σημαντική αλληλεπίδραση φύλου x συγκέντρωση, ο όρος αυτός μπορεί επίσης να διαχωριστεί σε αντιθέσεις γραμμικής x φύλο και τετραγωνικής x φύλο αλληλεπίδρασης. Οι εν λόγω όροι τροφοδοτούν ελέγχους με σκοπό να εξακριβωθεί αν οι αποκρίσεις στη συγκέντρωση είναι παράλληλες για τα δύο φύλα ή διαφοροποιούνται ανάλογα με το φύλο. Η εκτίμηση της συγχωνευμένης ενδοομαδικής μεταβλητότητας μπορεί να χρησιμοποιηθεί για κατά ζεύγη ελέγχους της διαφοράς μεταξύ των μέσων τιμών. Οι έλεγχοι αυτοί μπορούν να αφορούν συγκρίσεις μεταξύ των μέσων τιμών στα δύο φύλα και μεταξύ των μέσων τιμών στα διάφορα επίπεδα συγκέντρωσης, όπως π.χ. οι συγκρίσεις με τα επίπεδα των αρνητικών μαρτύρων. Στις περιπτώσεις σημαντικής αλληλεπίδρασης, μπορούν να γίνουν συγκρίσεις μεταξύ των μέσων τιμών των διαφόρων συγκεντρώσεων στο ίδιο φύλο ή μεταξύ των μέσων τιμών των φύλων στην ίδια συγκέντρωση. Βιβλιογραφία Υπάρχουν πολλά εγχειρίδια στατιστικής που πραγματεύονται τη θεωρία, τον σχεδιασμό, τη μεθοδολογία, την ανάλυση και την ερμηνεία παραγοντικών σχεδιασμών οι οποίοι εκτείνονται από τις απλούστερες αναλύσεις δύο παραγόντων έως τις πλέον περίπλοκες μορφές που χρησιμοποιούνται στη μεθοδολογία σχεδιασμού πειραμάτων. Ο κατάλογος που ακολουθεί δεν είναι πλήρης. Ορισμένα βιβλία παρέχουν πρακτικά παραδείγματα εφαρμογής συγκρίσιμων σχεδιασμών, συνοδευόμενα σε ορισμένες περιπτώσεις από κώδικα για τη διενέργεια των αναλύσεων με τη χρήση διαφόρων πακέτων λογισμικού.
|
|
(5) |
Στο μέρος B, το Κεφάλαιο Β.12 αντικαθίσταται από το ακόλουθο κείμενο: «Β.12 Δοκιμή μικροπυρήνων σε ερυθροκύτταρα θηλαστικών ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών 474 του ΟΟΣΑ (2016). Αποτελεί μέρος μιας σειράς μεθόδων δοκιμών γενετικής τοξικολογίας. Έχει συνταχθεί ένα έγγραφο του ΟΟΣΑ με συνοπτικές πληροφορίες για τις δοκιμές γενετικής τοξικολογίας και μια επισκόπηση των πρόσφατων αλλαγών που έγιναν σε αυτές τις κατευθυντήριες γραμμές δοκιμών (1). Η δοκιμή μικροπυρήνων in vivo σε θηλαστικά είναι ιδιαίτερα σημαντική για την αξιολόγηση της γονιδιοτοξικότητας, διότι οι παράγοντες των διεργασιών μεταβολισμού, φαρμακοκινητικής και επιδιόρθωσης του DΝΑ in vivo, αν και μπορεί να διαφέρουν μεταξύ των ειδών, είναι ενεργοί και συμβάλλουν στις αποκρίσεις. Οι προσδιορισμοί in vivo είναι επίσης χρήσιμοι για την περαιτέρω διερεύνηση της γονιδιοτοξικότητας που ανιχνεύεται με σύστημα in vitro. Η δοκιμή μικροπυρήνων in vivo σε θηλαστικά χρησιμοποιείται για την ανίχνευση βλαβών που επάγει η υπό δοκιμή χημική ουσία στα χρωμοσώματα ή στη μιτωτική άτρακτο των ερυθροβλαστών. Με τη δοκιμή αξιολογείται ο σχηματισμός μικροπυρήνων σε δείγματα ερυθροκυττάρων που λαμβάνονται από τον μυελό των οστών ή το περιφερικό αίμα ζώων, συνήθως τρωκτικών. Σκοπός της δοκιμής μικροπυρήνων είναι ο εντοπισμός χημικών ουσιών που προκαλούν κυτταρογενετική βλάβη η οποία απολήγει στον σχηματισμό μικροπυρήνων που περιέχουν είτε καθυστερημένα (lagging) χρωμοσωμικά θραύσματα είτε ολόκληρα χρωμοσώματα. Όταν οι ερυθροβλάστες του μυελού των οστών αναπτυχθούν σε άωρα ερυθροκύτταρα (γνωστά και ως πολυχρωματικά ερυθροκύτταρα ή δικτυοερυθροκύτταρα), ο κύριος πυρήνας εκβάλλεται, ενώ οι μικροπυρήνες που έχουν σχηματιστεί μπορεί να παραμείνουν στο κυτταρόπλασμα. Η απεικόνιση ή ανίχνευση των μικροπυρήνων διευκολύνεται στα κύτταρα αυτά, επειδή δεν έχουν κύριο πυρήνα. Η αύξηση του ποσοστού των άωρων ερυθροκυττάρων με μικροπυρήνες στα ζώα που υποβάλλονται σε μεταχείριση αποτελεί ένδειξη επαγόμενων δομικών ή αριθμητικών χρωμοσωμικών εκτροπών. Τα νεοσχηματισμένα ερυθροκύτταρα με μικροπυρήνες αναγνωρίζονται και ποσοτικοποιούνται με χρώση, την οποία ακολουθεί είτε οπτική καταμέτρηση με μικροσκόπιο είτε αυτόματη ανάλυση. Η καταμέτρηση επαρκούς πλήθους άωρων ερυθροκυττάρων στο περιφερικό αίμα ή στον μυελό των οστών ενήλικων ζώων διευκολύνεται σε μεγάλο βαθμό με τη χρήση συστήματος αυτόματης μέτρησης. Τα συστήματα αυτά είναι αποδεκτές εναλλακτικές επιλογές αντί της μη αυτόματης αξιολόγησης (2). Συγκριτικές μελέτες έχουν δείξει ότι οι εν λόγω μέθοδοι, με τη χρήση κατάλληλων προτύπων διακρίβωσης, μπορούν να παρέχουν καλύτερη ενδοεργαστηριακή και διεργαστηριακή αναπαραγωγιμότητα και ευαισθησία από τη μη αυτόματη μικροσκοπική μέτρηση (3) (4). Στα αυτόματα συστήματα με τα οποία είναι δυνατόν να μετρηθεί η συχνότητα ερυθροκυττάρων με μικροπυρήνες περιλαμβάνονται, μεταξύ άλλων, τα κυτταρόμετρα ροής (5), τα συστήματα ανάλυσης εικόνων (6) (7) και τα κυτταρόμετρα με σάρωση λέιζερ (8). Τα χρωμοσωμικά θραύσματα μπορούν να διακριθούν από τα πλήρη χρωμοσώματα με βάση ορισμένα κριτήρια, αν και η διάκριση αυτή κατά κανόνα δεν αποτελεί μέρος της δοκιμής. Στα κριτήρια αυτά περιλαμβάνεται η διαπίστωση της παρουσίας ή απουσίας κινητοχώρου ή κεντρομεριδιακού DNA, στοιχείων που χαρακτηρίζουν τα ακέραια χρωμοσώματα. Η απουσία κινητοχώρου ή κεντρομεριδιακού DNA δείχνει ότι ο μικροπυρήνας περιέχει μόνο θραύσματα χρωμοσωμάτων, ενώ η παρουσία τους είναι ενδεικτική της απώλειας χρωμοσωμάτων. Οι ορισμοί των χρησιμοποιούμενων όρων παρατίθενται στο προσάρτημα 1. ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ Ο ιστός-στόχος των γενετικών βλαβών στην παρούσα δοκιμή είναι ο μυελός των οστών νεαρών ενήλικων τρωκτικών, καθώς τα ερυθροκύτταρα παράγονται σε αυτόν τον ιστό. Η μέτρηση μικροπυρήνων σε άωρα ερυθροκύτταρα του περιφερικού αίματος είναι αποδεκτή σε άλλα είδη θηλαστικών, για τα οποία έχει καταδειχθεί επαρκής ευαισθησία για την ανίχνευση χημικών ουσιών που προκαλούν δομικές ή αριθμητικές χρωμοσωμικές εκτροπές στα κύτταρα αυτά (με επαγωγή μικροπυρήνων σε άωρα ερυθροκύτταρα) και υπό τον όρο ότι παρέχεται επιστημονική αιτιολόγηση. Η συχνότητα άωρων ερυθροκυττάρων με μικροπυρήνες είναι το κύριο τελικό σημείο. Η συχνότητα ώριμων ερυθροκυττάρων με μικροπυρήνες στο περιφερικό αίμα μπορεί επίσης να χρησιμοποιηθεί ως τελικό σημείο σε είδη χωρίς ισχυρή σπληνική επιλογή κατά των κυττάρων με μικροπυρήνες και όταν τα ζώα υποβάλλονται σε μεταχείριση συνεχώς για περίοδο που υπερβαίνει τη διάρκεια ζωής των ερυθροκυττάρων στο χρησιμοποιούμενο είδος (π.χ. 4 εβδομάδες ή περισσότερο στους ποντικούς). Εάν υπάρχουν ενδείξεις ότι η υπό δοκιμή χημική ουσία ή οι μεταβολίτες της δεν θα φθάσουν στον στοχευόμενο ιστό, μπορεί να μην ενδείκνυται η χρήση της παρούσας δοκιμής. Πριν από τη χρήση της μεθόδου δοκιμών σε μείγμα για την παραγωγή δεδομένων για συγκεκριμένο ρυθμιστικό σκοπό, θα πρέπει να εξετάζεται αν — και, εάν ναι, για ποιον λόγο — αυτή μπορεί να αποδώσει επαρκή αποτελέσματα για τον επιδιωκόμενο σκοπό. Οι εκτιμήσεις αυτές δεν είναι αναγκαίες όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος. ΑΡΧΗ ΤΗΣ ΜΕΘΟΔΟΥ ΔΟΚΙΜΩΝ Τα ζώα εκτίθενται στην υπό δοκιμή χημική ουσία μέσω κατάλληλης οδού. Εάν χρησιμοποιείται μυελός των οστών, τα ζώα θανατώνονται με ευθανασία σε κατάλληλο χρόνο μετά τη μεταχείριση, εξάγεται ο μυελός των οστών και ακολουθεί επίστρωση και χρώση παρασκευασμάτων (9) (10) (11) (12) (13) (14) (15). Όταν χρησιμοποιείται περιφερικό αίμα, το αίμα συλλέγεται σε κατάλληλο χρόνο μετά τη μεταχείριση και ακολουθεί επίστρωση και χρώση παρασκευασμάτων (12) (16) (17) (18). Σε περίπτωση οξείας εκτέλεσης της μεταχείρισης, είναι σημαντικό να επιλέγονται χρόνοι λήψης μυελού των οστών ή αιμοληψιών κατά τους οποίους μπορεί να ανιχνευθεί η σχετιζόμενη με την αγωγή επαγωγή μικροπύρηνων στα άωρα ερυθροκύτταρα. Στην περίπτωση της λήψης περιφερικού αίματος, πρέπει επίσης να έχει παρέλθει αρκετός χρόνος, ώστε τα συμβάντα αυτά να εμφανιστούν στην κυκλοφορία του αίματος. Τα παρασκευάσματα εξετάζονται για να διαπιστωθεί η παρουσία μικροπυρήνων, με παρατήρηση με τη χρήση μικροσκοπίου, ανάλυση εικόνων, κυτταρομετρία ροής ή κυτταρομετρία με σάρωση λέιζερ. ΕΛΕΓΧΟΣ ΤΗΣ ΤΕΧΝΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ ΤΟΥ ΕΡΓΑΣΤΗΡΙΟΥ Έρευνες τεχνικής ικανότητας Για να τεκμηριώσει πως διαθέτει επαρκή εμπειρία στη διεξαγωγή της δοκιμής πριν τη χρησιμοποιήσει για δοκιμές ρουτίνας, το εργαστήριο θα πρέπει να έχει αποδείξει την ικανότητα αναπαραγωγής των αναμενόμενων αποτελεσμάτων από δημοσιευμένα δεδομένα στις βιβλιογραφικές παραπομπές (17) (19) (20) (21) (22) για συχνότητες μικροπυρήνων, με τουλάχιστον δύο χημικές ουσίες που αποτελούν θετικούς μάρτυρες (συμπεριλαμβανομένων ασθενών αποκρίσεων που επάγονται από χαμηλές δόσεις θετικών μαρτύρων), όπως αυτές που απαριθμούνται στον πίνακα 1, καθώς και με συμβατούς μάρτυρες με φορέα/διαλύτη (βλ. παράγραφο 26). Στα πειράματα αυτά θα πρέπει να χρησιμοποιούνται δόσεις που επιφέρουν αναπαραγώγιμες και σχετιζόμενες με τη δόση αυξήσεις και να καταδεικνύονται η ευαισθησία και το δυναμικό εύρος του συστήματος δοκιμής στον στοχευόμενο ιστό (μυελός των οστών ή περιφερικό αίμα) και με τη χρήση της μεθόδου καταμέτρησης που πρόκειται να εφαρμοστεί στο εργαστήριο. Αυτή η απαίτηση δεν ισχύει για τα εργαστήρια που έχουν πείρα, δηλ. διαθέτουν βάση ιστορικών δεδομένων, όπως ορίζεται στις παραγράφους 14-18. Ιστορικά δεδομένα μαρτύρων Κατά τη διάρκεια των ερευνών τεχνικής ικανότητας, το εργαστήριο θα πρέπει να καθορίζει:
Κατά την αρχική συγκέντρωση ιστορικών δεδομένων για κατανομή όσον αφορά τους αρνητικούς μάρτυρες, οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει να συμφωνούν με τα δημοσιευμένα δεδομένα για μάρτυρες, εφόσον υπάρχουν. Καθώς θα προστίθενται περισσότερα πειραματικά δεδομένα στην κατανομή των ιστορικών δεδομένων μαρτύρων, οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει, στην ιδανική περίπτωση, να βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 % της εν λόγω κατανομής. Η βάση ιστορικών δεδομένων του εργαστηρίου για αρνητικούς μάρτυρες θα πρέπει να είναι στατιστικά ανθεκτική για να διασφαλίζει την ικανότητα του εργαστηρίου να αξιολογεί την κατανομή των δεδομένων του που αφορούν τους αρνητικούς μάρτυρες. Από τη βιβλιογραφία συνάγεται ότι ενδέχεται να απαιτούνται τουλάχιστον 10 πειράματα, αν και είναι προτιμότερο η βάση δεδομένων να αποτελείται από τουλάχιστον 20 πειράματα που έχουν εκτελεστεί σε συγκρίσιμες πειραματικές συνθήκες. Τα εργαστήρια θα πρέπει να χρησιμοποιούν μεθόδους ποιοτικού ελέγχου, όπως διαγράμματα ελέγχου [π.χ. διαγράμματα C ή X-bar (23)], για να προσδιορίζουν τη μεταβλητότητα των δεδομένων τους και να αποδεικνύουν ότι έχουν «υπό έλεγχο» τη μεθοδολογία. Περαιτέρω συστάσεις για τον τρόπο δημιουργίας και χρήσης των ιστορικών δεδομένων (δηλ. κριτήρια προσθήκης στοιχείων στα ιστορικά δεδομένα και αποκλεισμού στοιχείων από αυτά, καθώς και κριτήρια αποδοχής συγκεκριμένου πειράματος) έχουν διατυπωθεί στη βιβλιογραφία (24). Εάν το εργαστήριο δεν συμπληρώσει επαρκή αριθμό πειραμάτων για τον καθορισμό στατιστικά ανθεκτικής κατανομής αρνητικών μαρτύρων (βλ. παράγραφο 15) κατά τη διάρκεια των ερευνών τεχνικής ικανότητας (που περιγράφονται στην παράγραφο 13), είναι αποδεκτή η κατασκευή της κατανομής κατά τις πρώτες δοκιμές ρουτίνας. Κατά την εφαρμογή της προσέγγισης αυτής θα πρέπει να τηρούνται οι συστάσεις που έχουν διατυπωθεί στη βιβλιογραφία (24) και τα αποτελέσματα που προκύπτουν για τους αρνητικούς μάρτυρες στα σχετικά πειράματα θα πρέπει και πάλι να συμφωνούν με τα δημοσιευμένα δεδομένα για αρνητικούς μάρτυρες. Κάθε αλλαγή του πειραματικού πρωτοκόλλου θα πρέπει να μελετάται υπό το πρίσμα της επίπτωσής της στη διατήρηση της συμφωνίας των δεδομένων που προκύπτουν προς την υφιστάμενη βάση ιστορικών δεδομένων του εργαστηρίου για μάρτυρες. Μόνο σημαντικές ανακολουθίες θα πρέπει να έχουν ως αποτέλεσμα τη δημιουργία νέας βάσης ιστορικών δεδομένων για μάρτυρες, εφόσον οι ειδικοί κρίνουν ότι διαφέρει από την προηγούμενη κατανομή (βλ. παράγραφο 15). Για τη διεξαγωγή πραγματικής δοκιμής κατά την περίοδο της αντικατάστασης, ενδέχεται να μην είναι αναγκαία μια πλήρης βάση δεδομένων για αρνητικούς μάρτυρες, με την προϋπόθεση ότι το εργαστήριο μπορεί να αποδείξει ότι οι τιμές του για τους παράλληλους αρνητικούς μάρτυρες εξακολουθούν να συμφωνούν είτε με την προηγούμενη βάση δεδομένων του είτε με τα αντίστοιχα δημοσιευμένα δεδομένα. Τα δεδομένα για αρνητικούς μάρτυρες θα πρέπει να είναι η επίπτωση άωρων ερυθροκυττάρων με μικροπυρήνες σε κάθε ζώο. Οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει, στην ιδανική περίπτωση, να βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 % της κατανομής της βάσης ιστορικών δεδομένων του εργαστηρίου για αρνητικούς μάρτυρες. Όταν τα δεδομένα για παράλληλους αρνητικούς μάρτυρες δεν βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 %, μπορεί να είναι αποδεκτή η προσθήκη τους στην κατανομή των ιστορικών δεδομένων μαρτύρων, εφόσον τα εν λόγω δεδομένα δεν είναι ακραίες έκτοπες τιμές και υπάρχουν στοιχεία που αποδεικνύουν ότι το σύστημα δοκιμής είναι «υπό έλεγχο» (βλ. παράγραφο 15) και ότι δεν πρόκειται για τεχνικό ή ανθρώπινο σφάλμα. ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Προετοιμασίες Επιλογή ζωικού είδους Θα πρέπει να χρησιμοποιούνται υγιή νεαρά ενήλικα ζώα που ανήκουν σε συνήθεις εργαστηριακές φυλές. Επιτρέπεται να χρησιμοποιούνται ποντικοί, επίμυες ή άλλο κατάλληλο είδος θηλαστικών. Όταν χρησιμοποιείται περιφερικό αίμα, πρέπει να είναι βέβαιο ότι η απομάκρυνση των μικροπύρηνων κυττάρων από την κυκλοφορία μέσω του σπλήνα δεν υπονομεύει την ανίχνευση επαγόμενων μικροπυρήνων στο επιλεγμένο ζωικό είδος. Αυτό έχει καταδειχθεί σαφώς για το περιφερικό αίμα ποντικών και επίμυων (2). Η επιστημονική αιτιολόγηση της χρήσης άλλων ειδών εκτός από επίμυες και ποντικούς θα πρέπει να περιλαμβάνεται στην έκθεση δοκιμής. Εάν χρησιμοποιούνται άλλα είδη εκτός των τρωκτικών, συνιστάται να ενσωματώνεται η μέτρηση των επαγόμενων μικροπυρήνων σε άλλη κατάλληλη δοκιμή τοξικότητας. Συνθήκες στέγασης και σίτισης των ζώων Για τα τρωκτικά, η θερμοκρασία στην αίθουσα των ζώων θα πρέπει να είναι 22 °C (± 3 °C). Η σχετική υγρασία, η ιδανική τιμή της οποίας είναι 50-60 %, θα πρέπει να είναι τουλάχιστον 40 % και, κατά προτίμηση, να μην υπερβαίνει το 70 %, εκτός από τις περιόδους καθαρισμού της αίθουσας. Ο φωτισμός θα πρέπει να είναι τεχνητός, με φωτοπερίοδο 12 ωρών. Για τη διατροφή των ζώων μπορούν να χρησιμοποιούνται τα κλασικά εργαστηριακά σιτηρέσια, με απεριόριστη παροχή πόσιμου νερού. Όταν η υπό δοκιμή χημική ουσία χορηγείται με την τροφή, η ανάγκη επαρκούς πρόσμειξης της ουσίας είναι δυνατόν να επηρεάσει την επιλογή σιτηρεσίου. Τα τρωκτικά θα πρέπει να στεγάζονται σε μικρές ομάδες (όχι περισσότερα από πέντε ανά κλωβό) του ίδιου φύλου και της ίδιας μεταχείρισης, εφόσον δεν αναμένεται επιθετική συμπεριφορά, κατά προτίμηση σε κλωβούς με συμπαγές δάπεδο με κατάλληλο εμπλουτισμό του περιβάλλοντος. Η ατομική στέγαση των ζώων επιτρέπεται, μόνον εάν αιτιολογείται επιστημονικά. Προετοιμασία των ζώων Κατά κανόνα χρησιμοποιούνται υγιή νεαρά ενήλικα ζώα (για τα τρωκτικά, η ιδανική ηλικία είναι μεταξύ 6 και 10 εβδομάδων κατά την έναρξη της μεταχείρισης, αν και είναι επίσης αποδεκτά ζώα λίγο μεγαλύτερης ηλικίας), τα οποία κατανέμονται τυχαία στις ομάδες μαρτύρων και μεταχείρισης. Τα ζώα ταυτοποιούνται μοναδικά με χρήση ανώδυνης, ελάχιστα επεμβατικής μεθόδου (π.χ. δακτύλιοι, ετικέτες, μικροτσίπ ή βιομετρική ταυτοποίηση, αλλά όχι αποκοπή τμήματος αυτιού ή δακτύλου). Οι κλωβοί θα πρέπει να διατάσσονται με τρόπο ώστε να ελαχιστοποιούνται οι πιθανές επιδράσεις της θέσης τους. Θα πρέπει να αποφεύγεται η διασταυρούμενη μόλυνση από τον θετικό μάρτυρα και την υπό δοκιμή χημική ουσία. Στην αρχή της δοκιμής, οι διαφορές βάρους των ζώων θα πρέπει να είναι ελάχιστες και να μην υπερβαίνουν το ± 20 % του μέσου βάρους κάθε φύλου. Παρασκευή των δόσεων Οι στερεές υπό δοκιμή χημικές ουσίες θα πρέπει να διαλύονται ή να διασπείρονται (σχηματισμός εναιωρήματος) σε κατάλληλους διαλύτες ή φορείς ή να αναμειγνύονται με την τροφή ή το πόσιμο νερό, πριν χορηγηθούν στα ζώα. Οι υγρές υπό δοκιμή χημικές ουσίες μπορούν να χορηγούνται ως έχουν ή να αραιώνονται πριν από τη χορήγηση. Σε περίπτωση έκθεσης μέσω της εισπνοής, οι υπό δοκιμή χημικές ουσίες μπορούν να χορηγούνται ως αέριο, ατμοί ή αερόλυμα στερεού/υγρού, ανάλογα με τις φυσικοχημικές τους ιδιότητες. Θα πρέπει να χρησιμοποιούνται πρόσφατα παρασκευάσματα της υπό δοκιμή χημικής ουσίας, εκτός αν τα στοιχεία σχετικά με τη σταθερότητά της καταδεικνύουν ότι είναι αποδεκτή η φύλαξή της και καθορίζουν τις κατάλληλες συνθήκες φύλαξης. Συνθήκες δοκιμής Διαλύτης/φορέας: Ο διαλύτης/φορέας θα πρέπει να μην έχει τοξικές επιδράσεις στα χρησιμοποιούμενα επίπεδα δόσεων ούτε ικανότητα χημικής αντίδρασης με τις υπό δοκιμή χημικές ουσίες. Εφόσον χρησιμοποιείται άλλος διαλύτης/φορέας εκτός των καθιερωμένων, η χρήση του θα πρέπει να τεκμηριώνεται με δεδομένα αναφοράς που αποδεικνύουν τη συμβατότητά του. Συνιστάται, εφόσον είναι δυνατό, να εξετάζεται πρώτα αν μπορεί να χρησιμοποιηθεί υδατικός διαλύτης/φορέας. Παραδείγματα ευρέως χρησιμοποιούμενων συμβατών διαλυτών/φορέων είναι, μεταξύ άλλων, το νερό, ο φυσιολογικός ορός (ισότονο αλατούχο διάλυμα), το διάλυμα μεθυλοκυτταρίνης, το διάλυμα άλατος της καρβοξυμεθυλοκυτταρίνης με νάτριο, το ελαιόλαδο και το αραβοσιτέλαιο. Εάν δεν υπάρχουν ιστορικά ή δημοσιευμένα δεδομένα για μάρτυρες, που να αποδεικνύουν ότι ο επιλεγμένος ασυνήθης διαλύτης/φορέας δεν επάγει μικροπυρήνες ή άλλες επιβλαβείς επιδράσεις, θα πρέπει να διεξάγεται αρχική μελέτη για να διαπιστώνεται αν είναι αποδεκτός ο μάρτυρας με διαλύτη/φορέα. Μάρτυρες Θετικοί μάρτυρες Κάθε δοκιμή θα πρέπει κανονικά να περιλαμβάνει μια ομάδα ζώων που υποβάλλονται σε μεταχείριση με χημική ουσία η οποία χρησιμεύει ως θετικός μάρτυρας. Η εν λόγω ομάδα μπορεί να παραλείπεται, εάν το εργαστήριο δοκιμών έχει αποδείξει την τεχνική του ικανότητα διεξαγωγής της δοκιμής και έχει καθορίσει εύρος ιστορικών δεδομένων για θετικούς μάρτυρες. Εάν δεν συμπεριλαμβάνεται ομάδα παράλληλων θετικών μαρτύρων, κάθε πείραμα θα πρέπει να περιλαμβάνει μάρτυρες καταμέτρησης (μονιμοποιημένες αντικειμενοφόρες πλάκες χωρίς χρώση ή δείγματα κυτταρικών εναιωρημάτων, όπως ενδείκνυται για τη μέθοδο καταμέτρησης). Οι εν λόγω μάρτυρες μπορούν να ληφθούν με την προσθήκη κατάλληλων δειγμάτων αναφοράς κατά την καταμέτρηση στο πλαίσιο της μελέτης, τα οποία έχουν ληφθεί και φυλαχθεί από χωριστό πείραμα με θετικούς μάρτυρες που εκτελείται σε τακτά διαστήματα (π.χ. ανά 6 έως 18 μήνες), για παράδειγμα, κατά τον έλεγχο της τεχνικής ικανότητας και, στη συνέχεια, σε τακτική βάση, όποτε είναι αναγκαίο. Οι χημικές ουσίες που χρησιμεύουν ως θετικοί μάρτυρες θα πρέπει να προκαλούν με αξιοπιστία ανιχνεύσιμη αύξηση της συχνότητας μικροπυρήνων σε σχέση με την αυθόρμητη συχνότητα. Όταν χρησιμοποιείται μη αυτόματη καταμέτρηση με μικροσκόπιο, οι δόσεις θετικών μαρτύρων θα πρέπει να επιλέγονται κατά τρόπο ώστε οι επιδράσεις να είναι σαφείς, αλλά να μην αποκαλύπτουν αμέσως την ταυτότητα των κωδικοποιημένων δειγμάτων στον εξεταστή. Είναι αποδεκτό να χορηγούνται οι θετικοί μάρτυρες και από οδό διαφορετική από εκείνη της χορήγησης της υπό δοκιμή χημικής ουσίας, με τη χρήση διαφορετικού προγράμματος αγωγής, και να διενεργείται η δειγματοληψία μόνο σε μία χρονική στιγμή. Επιπροσθέτως, μπορεί να εξετάζεται το ενδεχόμενο χρήσης θετικών μαρτύρων συγγενούς χημικής τάξης, κατά περίπτωση. Παραδείγματα χημικών ουσιών που αποτελούν θετικούς μάρτυρες περιλαμβάνονται στον πίνακα 1. Πίνακας 1 Παραδείγματα χημικών ουσιών που αποτελούν θετικούς μάρτυρες Χημικές ουσίες και αριθ. CAS (CASRN) Μεθανοσουλφονικός αιθυλεστέρας [CASRN 62-50-0] Μεθανοσουλφονικός μεθυλεστέρας [CASRN 66-27-3] Αιθυλονιτροζουρία [CASRN 759-73-9] Μιτομυκίνη C [CASRN 50-07-7] Κυκλοφωσφαμίδιο (μονοένυδρο) [CASRN 50-18-0 (CASRN 6055-19-2)] Τριαιθυλενομελαμίνη [CASRN 51-18-3] Κολχικίνη [CASRN 64-86-8] ή βινβλαστίνη [CASRN 865-21-4] — ως ανευπλοειδογόνες ουσίες Αρνητικοί μάρτυρες Σε κάθε χρόνο δειγματοληψίας θα πρέπει να περιλαμβάνεται ομάδα ζώων ως αρνητικός μάρτυρας, η οποία υφίσταται τους ίδιους χειρισμούς όπως οι ομάδες μεταχείρισης, με μόνη διαφορά το ότι δεν εκτίθεται στην υπό δοκιμή χημική ουσία. Εάν για τη χορήγηση της υπό δοκιμή χημικής ουσίας χρησιμοποιείται διαλύτης/φορέας, αυτός θα πρέπει να χορηγείται και στην ομάδα-μάρτυρα. Ωστόσο, εάν από ιστορικά δεδομένα του εργαστηρίου δοκιμών για αρνητικούς μάρτυρες προκύπτει σταθερή μεταβλητότητα και συχνότητα μικροπύρηνων κυττάρων μεταξύ των ζώων σε κάθε δειγματοληψία, μπορεί να απαιτείται μία μόνο δειγματοληψία για τον αρνητικό μάρτυρα. Σε περίπτωση μίας μόνο δειγματοληψίας για τους αρνητικούς μάρτυρες, αυτή θα πρέπει να διενεργείται κατά τον χρόνο της πρώτης δειγματοληψίας στο πλαίσιο της μελέτης. Εάν χρησιμοποιείται περιφερικό αίμα, τότε αντί του παράλληλου αρνητικού μάρτυρα στις βραχυχρόνιες μελέτες επιτρέπεται να χρησιμοποιηθεί δείγμα που λαμβάνεται πριν από τη μεταχείριση, όταν τα προκύπτοντα δεδομένα συμφωνούν με τη βάση ιστορικών δεδομένων για μάρτυρες του εργαστηρίου δοκιμών. Έχει αποδειχθεί στους επίμυες ότι η προ της μεταχείρισης δειγματοληψία μικρών ποσοτήτων (π.χ. κάτω των 100 μl/ημέρα) έχει ελάχιστο αντίκτυπο στη συχνότητα υποβάθρου των μικροπυρήνων (25). ΔΙΑΔΙΚΑΣΙΑ Αριθμός και φύλο των ζώων Σε γενικές γραμμές, η απόκριση μικροπυρήνων είναι παρόμοια μεταξύ των αρσενικών και θηλυκών ζώων και, ως εκ τούτου, οι περισσότερες μελέτες θα μπορούσαν να πραγματοποιούνται σε οποιοδήποτε φύλο (26). Δεδομένα που καταδεικνύουν σημαντικές διαφορές μεταξύ αρσενικών και θηλυκών ζώων (π.χ. διαφορές συστημικής τοξικότητας, μεταβολισμού, βιοδιαθεσιμότητας, τοξικότητας για τον μυελό των οστών, κ.λπ., συμπεριλαμβανομένων, π.χ., δεδομένων από μελέτη προσδιορισμού εύρους τιμών) ενθαρρύνουν τη χρησιμοποίηση ζώων και των δύο φύλων. Στην περίπτωση αυτή, ίσως είναι σκόπιμο να διεξάγεται μελέτη και στα δύο φύλα, π.χ. στο πλαίσιο μελετών τοξικότητας με επαναλαμβανόμενες δόσεις. Σε περίπτωση χρήσης και των δύο φύλων, θα ήταν ενδεχομένως σκόπιμη η εφαρμογή παραγοντικού σχεδιασμού. Λεπτομέρειες σχετικά με τον τρόπο ανάλυσης των δεδομένων με τη χρήση αυτού του σχεδιασμού παρέχονται στο προσάρτημα 2. Το μέγεθος των ομάδων κατά την έναρξη της μελέτης θα πρέπει να καθορίζεται με γνώμονα την εξασφάλιση, ανά ομάδα, 5 τουλάχιστον αναλύσιμων ζώων του ίδιου φύλου ή, εάν χρησιμοποιούνται ζώα και των δύο φύλων, από κάθε φύλο. Όταν η έκθεση του ανθρώπου σε μια χημική ουσία αφορά μόνο το ένα φύλο, όπως π.χ. στην περίπτωση ορισμένων φαρμακευτικών προϊόντων, η δοκιμή θα πρέπει να διεξάγεται σε ζώα του αντίστοιχου φύλου. Ενδεικτικά, όσον αφορά τις μέγιστες τυπικές απαιτήσεις για τα ζώα, για τη διεξαγωγή μελέτης σε μυελό των οστών σύμφωνα με τις παραμέτρους που καθορίζονται στην παράγραφο 37 με τρεις ομάδες δόσης και παράλληλους αρνητικούς και θετικούς μάρτυρες (κάθε ομάδα αποτελούμενη από πέντε ζώα του ίδιου φύλου) θα απαιτούνταν 25 έως 35 ζώα. Επίπεδα δόσεων Εάν χρειάζεται προκαταρκτική μελέτη προσδιορισμού εύρους τιμών επειδή δεν υπάρχουν ήδη κατάλληλα δεδομένα για να υποβοηθήσουν την επιλογή δόσεων, η εν λόγω μελέτη θα πρέπει να διεξάγεται στο ίδιο εργαστήριο, με τη χρήση του ίδιου είδους, φυλής, φύλου ζώων και σχήματος μεταχείρισης όπως στην κύρια μελέτη (27). Η μελέτη θα πρέπει να αποσκοπεί στον προσδιορισμό της μέγιστης ανεκτής δόσης (ΜΑΔ), η οποία ορίζεται ως η ανώτατη δόση που μπορεί να γίνει ανεκτή χωρίς εκδήλωση τοξικότητας η οποία θα περιόριζε τη μελέτη, σε σχέση με τη διάρκεια της μελέτης [π.χ. που προκαλεί μείωση του σωματικού βάρους ή κυτταροτοξικότητα στο αιμοποιητικό σύστημα, αλλά όχι θάνατο ή εκδήλωση πόνου, ταλαιπωρίας ή δυσφορίας που καθιστούν αναγκαία τη θανάτωση με ευθανασία (28)]. Ως ανώτατη δόση μπορεί επίσης να οριστεί η δόση που προκαλεί τοξικότητα στον μυελό των οστών (π.χ. μείωση του ποσοστού άωρων ερυθροκυττάρων επί του συνόλου των ερυθροκυττάρων στον μυελό των οστών ή στο περιφερικό αίμα κατά περισσότερο από 50 %, όχι όμως σε επίπεδα κάτω του 20 % της τιμής του μάρτυρα). Ωστόσο, κατά την ανάλυση των θετικών στον δείκτη CD71 κυττάρων στην περιφερειακή κυκλοφορία του αίματος (δηλ. με κυτταρομετρία ροής), αυτό το πολύ νεαρό κλάσμα άωρων ερυθροκυττάρων αποκρίνεται σε τοξικές προκλήσεις ταχύτερα από ό,τι η μεγαλύτερη κοόρτη άωρων ερυθροκυττάρων που είναι θετική για το RNA. Συνεπώς, ενδέχεται να εκδηλωθεί υψηλότερη φαινομενική τοξικότητα με πειραματικούς σχεδιασμούς οξείας έκθεσης, στους οποίους εξετάζεται το θετικό στον δείκτη CD71 κλάσμα άωρων ερυθροκυττάρων, σε σύγκριση με εκείνους στους οποίους τα άωρα ερυθροκύτταρα ταυτοποιούνται με βάση το RNA που περιέχουν. Για τον λόγο αυτό, όταν στα πειράματα προβλέπονται πέντε ή λιγότερες ημέρες μεταχείρισης, το ανώτατο επίπεδο δόσης για τις υπό δοκιμή χημικές ουσίες που προκαλούν τοξικότητα μπορεί να οριστεί ως η δόση που προκαλεί στατιστικά σημαντική μείωση του ποσοστού των θετικών στον δείκτη CD71 άωρων ερυθροκυττάρων επί του συνόλου των ερυθροκυττάρων, η οποία πάντως δεν φθάνει σε επίπεδα κάτω του 5 % της τιμής του μάρτυρα (29). Οι χημικές ουσίες που παρουσιάζουν κορεσμό τοξικοκινητικών ιδιοτήτων ή επάγουν διεργασίες αποτοξίνωσης που μπορεί να επιφέρουν μείωση της έκθεσης μετά από μακροχρόνια χορήγηση ίσως αποτελούν εξαιρέσεις από τα κριτήρια καθορισμού των δόσεων και θα πρέπει να αξιολογούνται κατά περίπτωση. Για να ληφθούν πληροφορίες σχετικά με τη σχέση δόσης-απόκρισης, μια ολοκληρωμένη μελέτη θα πρέπει να περιλαμβάνει ομάδα αρνητικού μάρτυρα και τουλάχιστον τρία επίπεδα δόσεων, τα οποία κατά κανόνα διαφέρουν κατά έναν συντελεστή ίσο με το 2, αλλά πάντως όχι μεγαλύτερο του 4. Εάν η υπό δοκιμή χημική ουσία δεν προκαλεί τοξικότητα σε μελέτη προσδιορισμού εύρους τιμών ή με βάση τα υπάρχοντα δεδομένα, η ανώτατη δόση για περίοδο χορήγησης 14 ημερών και άνω θα πρέπει να είναι 1 000 mg/kg σωματικού βάρους/ημέρα ή, για περιόδους χορήγησης που δεν υπερβαίνουν τις 14 ημέρες, 2 000 mg/kg βάρους σώματος/ημέρα. Ωστόσο, εάν η υπό δοκιμή χημική ουσία προκαλεί τοξικότητα, η ΜΑΔ θα πρέπει να είναι η ανώτατη χορηγούμενη δόση και τα χρησιμοποιούμενα επίπεδα δόσεων θα πρέπει, κατά προτίμηση, να καλύπτουν το εύρος από τη μέγιστη δόση μέχρι τη δόση που προκαλεί ελάχιστη ή μηδενική τοξικότητα. Όταν παρατηρείται τοξικότητα στον στοχευόμενο ιστό (μυελό των οστών) σε όλα τα ελεγχόμενα επίπεδα δόσεων, συνιστάται η διεξαγωγή περαιτέρω μελέτης με μη τοξικές δόσεις. Οι μελέτες που αποσκοπούν στον πληρέστερο χαρακτηρισμό των ποσοτικών στοιχείων σχετικά με τη σχέση δόσης-απόκρισης ενδέχεται να απαιτούν πρόσθετες ομάδες δόσης. Για ορισμένα είδη υπό δοκιμή χημικών ουσιών (π.χ. φαρμακευτικά προϊόντα για τον άνθρωπο) που καλύπτονται από ειδικές απαιτήσεις, αυτά τα όρια μπορεί να διαφέρουν. Οριακή δοκιμή Εάν τα πειράματα προσδιορισμού εύρους δόσεων ή υφιστάμενα δεδομένα για συγγενείς φυλές ζώων δείχνουν ότι ένα σχήμα μεταχείρισης με τουλάχιστον την οριακή δόση (που περιγράφεται κατωτέρω) δεν επιφέρει παρατηρήσιμες τοξικές επιδράσεις (που περιλαμβάνουν την απουσία μείωσης του πολλαπλασιασμού του μυελού των οστών ή άλλης ένδειξης κυτταροτοξικότητας στον στοχευόμενο ιστό) και δεν αναμένεται γονιδιοτοξικότητα με βάση μελέτες γονιδιοτοξικότητας in vitro ή δεδομένα για χημικές ουσίες παρόμοιας δομής, μπορεί να κριθεί περιττή η διεξαγωγή πλήρους μελέτης με τρία επίπεδα δόσεων, υπό τον όρο ότι έχει αποδειχθεί ότι οι υπό δοκιμή χημικές ουσίες φθάνουν στον στοχευόμενο ιστό (μυελός των οστών). Σε αυτές τις περιπτώσεις, ενδέχεται να αρκεί ένα μόνο επίπεδο δόσης, ίσο με την οριακή δόση. Για περιόδους χορήγησης 14 ημερών και άνω, η οριακή δόση είναι 1 000 mg/kg βάρους σώματος/ημέρα. Για περιόδους χορήγησης που δεν υπερβαίνουν τις 14 ημέρες, η οριακή δόση είναι 2 000 mg/kg βάρους σώματος/ημέρα. Χορήγηση των δόσεων Κατά τον σχεδιασμό της δοκιμής θα πρέπει να λαμβάνεται υπόψη η προβλεπόμενη οδός έκθεσης του ανθρώπου. Επιτρέπεται επομένως η αιτιολογημένη επιλογή οδών έκθεσης όπως μέσω της τροφής ή του πόσιμου νερού, με τοπική εφαρμογή, υποδόρια ή ενδοφλέβια ένεση, από το στόμα (με στομαχικό καθετήρα), μέσω της εισπνοής, η ενδοτραχειακή οδός ή η εμφύτευση. Σε κάθε περίπτωση, η οδός έκθεσης θα πρέπει να επιλέγεται κατά τρόπο ώστε να εξασφαλίζεται επαρκής έκθεση του ή των στοχευόμενων ιστών). Η ενδοπεριτοναϊκή ένεση δεν συνιστάται κατά κανόνα, διότι δεν αποτελεί σκοπούμενη οδό έκθεσης του ανθρώπου, και θα πρέπει να χρησιμοποιείται μόνο με ειδική επιστημονική αιτιολόγηση. Εάν η υπό δοκιμή χημική ουσία αναμειγνύεται με την τροφή ή το πόσιμο νερό, ιδίως στην περίπτωση των εφάπαξ δόσεων, θα πρέπει να λαμβάνεται μέριμνα ώστε το διάστημα μεταξύ της κατανάλωσης νερού και τροφής και της δειγματοληψίας να επαρκεί για την ανίχνευση των επιδράσεων (βλ. παράγραφο 37). Ο μέγιστος όγκος υγρού που μπορεί να χορηγηθεί με στομαχικό καθετήρα ή ένεση κάθε φορά εξαρτάται από το μέγεθος του πειραματόζωου. Ο όγκος δεν θα πρέπει κανονικά να υπερβαίνει το 1 ml/100 g σωματικού βάρους, εκτός από την περίπτωση των υδατικών διαλυμάτων, όπου επιτρέπεται να χρησιμοποιούνται κατά μέγιστο όριο 2 ml/100 g σωματικού βάρους. Η χρήση μεγαλύτερων όγκων θα πρέπει να αιτιολογείται. Η μεταβλητότητα των όγκων δοκιμής θα πρέπει να ελαχιστοποιείται με ρύθμιση της συγκέντρωσης, ώστε να εξασφαλίζεται η χορήγηση σταθερού όγκου σε σχέση με το σωματικό βάρος σε όλα τα επίπεδα δόσεων, εκτός από την περίπτωση των ερεθιστικών ή διαβρωτικών χημικών ουσιών, των οποίων οι επιδράσεις κατά κανόνα επιδεινώνονται όταν αυξάνονται οι συγκεντρώσεις. Πρόγραμμα μεταχείρισης Κατά προτίμηση, εκτελούνται 2 ή περισσότερες μεταχειρίσεις, με μεσοδιαστήματα 24 ωρών, ιδίως στις περιπτώσεις ενσωμάτωσης της παρούσας δοκιμής σε άλλες μελέτες τοξικότητας. Εναλλακτικά, μπορούν να πραγματοποιούνται εφάπαξ μεταχειρίσεις, εάν αυτό αιτιολογείται επιστημονικά (π.χ. υπό δοκιμή χημικές ουσίες που είναι γνωστό ότι παρεμποδίζουν τον κυτταρικό κύκλο). Οι υπό δοκιμή χημικές ουσίες μπορούν επίσης να χορηγούνται σε διαιρεμένες δόσεις, δηλ. δύο ή περισσότερες δόσεις την ίδια ημέρα, με διαφορά μικρότερη από 2-3 ώρες, για να διευκολύνεται η χορήγηση μεγάλων όγκων. Υπό τις περιστάσεις αυτές ή κατά τη χορήγηση της υπό δοκιμή χημικής ουσίας μέσω της εισπνοής, ο χρόνος δειγματοληψίας θα πρέπει να προγραμματίζεται με βάση τον χρόνο της τελευταίας χορήγησης ή το τέλος της έκθεσης. Η δοκιμή μπορεί να διεξαχθεί σε ποντικούς ή επίμυες με τρεις τρόπους:
Επιτρέπεται να χρησιμοποιούνται άλλα σχήματα δοσολογίας ή δειγματοληψίας, εφόσον έχουν σημασία και αιτιολογούνται επιστημονικά, καθώς και για να διευκολυνθεί η ενσωμάτωση σε άλλες τοξικολογικές δοκιμές. Παρατηρήσεις Τα πειραματόζωα θα πρέπει να υποβάλλονται σε γενική κλινική εξέταση και τα κλινικά σημεία να καταγράφονται τουλάχιστον μία φορά ημερησίως, κατά προτίμηση την ίδια ώρα και λαμβανομένου υπόψη του χρόνου κορύφωσης των αναμενόμενων επιδράσεων μετά τη χορήγηση της δόσης. Όλα τα ζώα θα πρέπει να εξετάζονται τουλάχιστον δύο φορές ημερησίως κατά την περίοδο της χορήγησης για τη διαπίστωση τυχόν νοσηρότητας και θνησιμότητας. Όλα τα ζώα θα πρέπει να ζυγίζονται κατά την έναρξη της μελέτης, τουλάχιστον μία φορά εβδομαδιαίως κατά τη διεξαγωγή μελετών επαναλαμβανόμενων δόσεων και κατά την ευθανασία. Σε μελέτες διάρκειας τουλάχιστον μίας εβδομάδας, η κατανάλωση τροφής θα πρέπει να μετράται τουλάχιστον εβδομαδιαίως. Εάν η υπό δοκιμή χημική ουσία χορηγείται με το πόσιμο νερό, η κατανάλωση νερού θα πρέπει να μετράται σε κάθε αλλαγή νερού και τουλάχιστον εβδομαδιαίως. Τα ζώα που εμφανίζουν μη θανατηφόρους δείκτες υπερβολικής τοξικότητας θα πρέπει να υποβάλλονται σε ευθανασία πριν από τη λήξη της περιόδου δοκιμής (28). Υπό ορισμένες περιστάσεις, θα μπορούσε να παρακολουθείται η θερμοκρασία σώματος των ζώων, δεδομένου ότι η οφειλόμενη στη μεταχείριση υπερθερμία και υποθερμία έχει ενοχοποιηθεί για λανθασμένα αποτελέσματα (32) (33) (34). Έκθεση του στοχευόμενου ιστού Θα πρέπει να λαμβάνεται δείγμα αίματος σε κατάλληλους χρόνους για να είναι δυνατή η διερεύνηση των επιπέδων των υπό δοκιμή χημικών ουσιών στο πλάσμα, ώστε να αποδεικνύεται η έκθεση του μυελού των οστών, όταν αυτό δικαιολογείται και δεν υπάρχουν άλλα δεδομένα έκθεσης (βλ. παράγραφο 48). Παρασκεύασμα μυελού των οστών/αίματος Τα κύτταρα μυελού των οστών λαμβάνονται συνήθως από τα μηριαία ή τα κνημιαία οστά των ζώων αμέσως μετά τη θανάτωσή τους με ευθανασία. Τα κύτταρα συνήθως αφαιρούνται και ακολουθεί επίστρωση και χρώση παρασκευασμάτων με τη χρήση καθιερωμένων μεθόδων. Μπορούν να ληφθούν μικρές ποσότητες περιφερικού αίματος, σύμφωνα με τα κατάλληλα πρότυπα καλής μεταχείρισης των ζώων, είτε με τη χρήση μεθόδου που επιτρέπει την επιβίωση του πειραματόζωου, όπως η αιμοληψία από την ουραία φλέβα ή άλλο κατάλληλο αιμοφόρο αγγείο, είτε με καρδιακή παρακέντηση ή δειγματοληψία από μεγάλο αγγείο κατά την ευθανασία του ζώου. Τόσο για τα ερυθροκύτταρα μυελού των οστών όσο και για εκείνα που προέρχονται από περιφερικό αίμα, ανάλογα με την αναλυτική μέθοδο, είναι δυνατή η άμεση υπερζωτική χρώση (16) (17) (18), η παρασκευή επιχρισμάτων ακολουθούμενη από χρώση για μικροσκοπική εξέταση, ή η μονιμοποίηση και κατάλληλη χρώση για ανάλυση με κυτταρομετρία ροής. Με τη χρήση ειδικής για το DNA χρώσης [π.χ. πορτοκαλί της ακριδίνης (35) ή Hoechst 33258 και πυρονίνη-Y (36)] είναι δυνατόν να εξαλειφθούν ορισμένα από τα τεχνητά αποτελέσματα που οφείλονται στη χρήση μη ειδικών για το DNA χρώσεων. Το πλεονέκτημα αυτό δεν αποκλείει τη χρήση συμβατικών χρώσεων (π.χ. Giemsa για μικροσκοπική ανάλυση). Μπορούν επίσης να χρησιμοποιηθούν πρόσθετα συστήματα [π.χ. στήλες κυτταρίνης για την απομάκρυνση εμπύρηνων κυττάρων (37) (38)], υπό την προϋπόθεση ότι τα συστήματα αυτά έχουν αποδειχθεί συμβατά με την προετοιμασία των δειγμάτων στο εργαστήριο. Όταν εφαρμόζονται αυτές οι μέθοδοι, μπορούν να χρησιμοποιούνται αντισώματα κατά του κινητοχώρου (39), φθορίζουσα υβριδοποίηση in situ (Fluorescent In Situ Hybridization/FISH) με παγκεντρομεριδιακούς ανιχνευτές DNA (40) ή σήμανση in situ με ειδικούς για τα παγκεντρομερίδια εκκινητές, σε συνδυασμό με κατάλληλη αντίχρωση του DNA (41), με σκοπό την εξακρίβωση του είδους των μικροπυρήνων (χρωμόσωμα/χρωμοσωμικό θραύσμα), ώστε να διαπιστώνεται αν ο μηχανισμός επαγωγής μικροπυρήνων συνδέεται με κλαστογόνο και/ή ανευπλοειδογόνο δράση. Επιτρέπεται να χρησιμοποιούνται και άλλες μέθοδοι διάκρισης μεταξύ κλαστογόνων και ανευπλοειδογόνων ουσιών, εάν έχει αποδειχθεί η αποτελεσματικότητά τους. Ανάλυση (μη αυτόματη και αυτόματη) Όλες οι αντικειμενοφόρες πλάκες ή τα δείγματα για ανάλυση, συμπεριλαμβανομένων εκείνων που αντιστοιχούν στους θετικούς και αρνητικούς μάρτυρες, θα πρέπει να λαμβάνουν ανεξάρτητο κωδικό προτού γίνει οποιουδήποτε είδους ανάλυση και να τυχαιοποιούνται, έτσι ώστε ο μη αυτόματος εξεταστής να μη γνωρίζει τη συνθήκη μεταχείρισης· τέτοια κωδικοποίηση δεν είναι απαραίτητη όταν χρησιμοποιούνται αυτόματα συστήματα καταμέτρησης που δεν βασίζονται σε οπτική εξέταση και δεν μπορούν να επηρεαστούν από μεροληψία του χειριστή. Προσδιορίζεται για κάθε ζώο το ποσοστό άωρων ερυθροκυττάρων επί του συνόλου των ερυθροκυττάρων (άωρα + ώριμα), με καταμέτρηση τουλάχιστον 500 ερυθροκυττάρων, προκειμένου για μυελό των οστών, και 2 000 ερυθροκυττάρων στην περίπτωση του περιφερικού αίματος (42). Για τον προσδιορισμό της επίπτωσης (incidence) των άωρων ερυθροκυττάρων με μικροπυρήνες θα πρέπει να καταμετρώνται τουλάχιστον 4 000 άωρα ερυθροκύτταρα ανά ζώο (43). Εάν η βάση ιστορικών δεδομένων για αρνητικούς μάρτυρες δείχνει ότι η μέση συχνότητα υποβάθρου των άωρων ερυθροκυττάρων με μικροπυρήνες είναι < 0,1 % στο εργαστήριο δοκιμών, θα πρέπει να εξετάζεται το ενδεχόμενο καταμέτρησης επιπλέον κυττάρων. Κατά την ανάλυση των δειγμάτων, το ποσοστό άωρων ερυθροκυττάρων επί του συνόλου των ερυθροκυττάρων στα ζώα που έχουν υποβληθεί σε μεταχείριση θα πρέπει να μην είναι μικρότερο από το 20 % της τιμής του μάρτυρα με φορέα/διαλύτη κατά την καταμέτρηση με μικροσκόπιο και όχι μικρότερο από το 5 % περίπου της τιμής του μάρτυρα με φορέα/διαλύτη κατά την καταμέτρηση θετικών στον δείκτη CD71 άωρων ερυθροκυττάρων με κυτταρομετρικές μεθόδους (βλ. παράγραφο 31) (29). Για παράδειγμα, στην περίπτωση της δοκιμής σε μυελό των οστών με καταμέτρηση με μικροσκοπία, αν η αναλογία άωρων ερυθροκυττάρων στον μυελό των οστών του μάρτυρα είναι 50 %, το ανώτατο όριο τοξικότητας θα είναι 10 % άωρων ερυθροκυττάρων. Επειδή ο σπλήνας του επίμυος απομονώνει και καταστρέφει τα ερυθροκύτταρα με μικροπυρήνες, για τη διατήρηση υψηλής ευαισθησίας του προσδιορισμού κατά την ανάλυση περιφερικού αίματος επίμυος, είναι προτιμότερο να περιορίζεται στο νεαρότερο κλάσμα η ανάλυση των άωρων ερυθροκυττάρων με μικροπυρήνες. Κατά τη χρήση μεθόδων αυτόματης ανάλυσης, αυτά τα πλέον άωρα ερυθροκύτταρα μπορούν να ταυτοποιούνται με βάση την υψηλή τους περιεκτικότητα σε RNA ή το υψηλό επίπεδο υποδοχέων τρανσφερρίνης (θετικά στον δείκτη CD71) που εκφράζονται στην επιφάνειά τους (31). Ωστόσο, από την άμεση σύγκριση των διαφορετικών μεθόδων χρώσης προέκυψε ότι μπορούν να επιτευχθούν ικανοποιητικά αποτελέσματα με διάφορες μεθόδους, συμπεριλαμβανομένης της συμβατικής χρώσης με πορτοκαλί της ακριδίνης (3) (4). ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Επεξεργασία των αποτελεσμάτων Τα δεδομένα για κάθε ζώο θα πρέπει να παρουσιάζονται σε μορφή πίνακα. Για κάθε εξεταζόμενο ζώο θα πρέπει να καταγράφεται χωριστά ο αριθμός καταμετρηθέντων άωρων ερυθροκυττάρων, ο αριθμός άωρων ερυθροκυττάρων με μικροπυρήνες και η αναλογία των άωρων στο σύνολο των ερυθροκυττάρων. Όταν ποντικοί υποβάλλονται σε μεταχείριση συνεχώς επί 4 εβδομάδες ή περισσότερο, θα πρέπει να παρέχονται και τα δεδομένα που αφορούν τον αριθμό και το ποσοστό των ώριμων ερυθροκυττάρων με μικροπυρήνες, εάν συλλέγονται. Θα πρέπει επίσης να αναφέρονται δεδομένα σχετικά με την τοξικότητα στα ζώα και με τα κλινικά σημεία. Κριτήρια αποδοχής Τα ακόλουθα κριτήρια καθορίζουν την αποδοχή της δοκιμής:
Αξιολόγηση και ερμηνεία των αποτελεσμάτων Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς θετική εάν:
Εάν εξετάζεται μόνο η ανώτατη δόση σε συγκεκριμένο χρόνο δειγματοληψίας, η υπό δοκιμή χημική ουσία θεωρείται σαφώς θετική εάν προκύπτει στατιστικά σημαντική αύξηση σε σχέση με τον παράλληλο αρνητικό μάρτυρα και τα αποτελέσματα βρίσκονται εκτός της κατανομής των ιστορικών δεδομένων για αρνητικούς μάρτυρες (π.χ. όρια ελέγχου σε επίπεδο 95 % με βάση την κατανομή Poisson). Συστάσεις για τις πλέον κατάλληλες στατιστικές μεθόδους έχουν διατυπωθεί στη βιβλιογραφία (44) (45) (46) (47). Όταν διενεργείται ανάλυση της σχέσης δόσης-απόκρισης, θα πρέπει να αναλύονται τουλάχιστον τρεις ομάδες που έλαβαν δόσεις. Στις στατιστικές δοκιμασίες θα πρέπει να χρησιμοποιείται το ζώο ως πειραματική μονάδα. Τα θετικά αποτελέσματα στη δοκιμή μικροπυρήνων δείχνουν ότι η υπό δοκιμή χημική ουσία επάγει τον σχηματισμό μικροπυρήνων, που είναι αποτέλεσμα χρωμοσωμικής βλάβης ή βλάβης στη μιτωτική άτρακτο των ερυθροβλαστών του εξεταζόμενου ζωικού είδους. Σε περίπτωση διεξαγωγής δοκιμής για την ανίχνευση κεντρομεριδίων στο εσωτερικό μικροπυρήνων, η επαγωγή του σχηματισμού μικροπυρήνων που περιέχουν κεντρομερίδια (κεντρομεριδιακό DNA ή κινητοχώρο, ενδεικτικό απώλειας πλήρους χρωμοσώματος) από την υπό δοκιμή ουσία αποδεικνύει ότι αυτή είναι ανευπλοειδογόνο. Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς αρνητική εάν, σε όλες τις πειραματικές συνθήκες που εξετάστηκαν:
Συστάσεις για τις πλέον κατάλληλες στατιστικές μεθόδους έχουν διατυπωθεί στη βιβλιογραφία (44) (45) (46) (47). Τα αποδεικτικά στοιχεία έκθεσης του μυελού των οστών σε υπό δοκιμή χημική ουσία μπορεί να περιλαμβάνουν τη μείωση του λόγου των άωρων προς τα ώριμα ερυθροκύτταρα και τη μέτρηση των επιπέδων της υπό δοκιμή χημικής ουσίας στο πλάσμα ή στο αίμα. Σε περίπτωση ενδοφλέβιας χορήγησης, δεν απαιτούνται αποδεικτικά στοιχεία έκθεσης. Εναλλακτικά, για να αποδειχθεί η έκθεση του μυελού των οστών, μπορούν να χρησιμοποιηθούν δεδομένα ADME (απορρόφηση-κατανομή-μεταβολισμός-απέκκριση) που προκύπτουν από ανεξάρτητη μελέτη με τη χρησιμοποίηση της ίδιας οδού χορήγησης και του ίδιου ζωικού είδους. Τα αρνητικά αποτελέσματα δείχνουν ότι, υπό τις συνθήκες της δοκιμής, η υπό δοκιμή χημική ουσία δεν επιφέρει τον σχηματισμό μικροπυρήνων στα άωρα ερυθροκύτταρα του εξεταζόμενου ζωικού είδους. Δεν απαιτείται επαλήθευση των σαφώς θετικών ή σαφώς αρνητικών αποκρίσεων. Σε περίπτωση που η απόκριση δεν είναι σαφώς θετική ούτε σαφώς αρνητική και για να διαπιστωθεί η βιολογική σημασία ενός αποτελέσματος (π.χ. ασθενής ή οριακή αύξηση), τα δεδομένα θα πρέπει να αξιολογούνται κατά την κρίση των ειδικών και/ή με περαιτέρω διερεύνηση των υφιστάμενων ολοκληρωμένων πειραμάτων. Σε ορισμένες περιπτώσεις, θα είναι ενδεχομένως χρήσιμη η ανάλυση περισσότερων κυττάρων ή η επανάληψη του πειράματος με τη χρήση τροποποιημένων πειραματικών συνθηκών. Σε σπάνιες περιπτώσεις, ακόμη και μετά από περαιτέρω διερεύνηση, τα δεδομένα δεν επιτρέπουν την εξαγωγή συμπεράσματος για θετικά ή αρνητικά αποτελέσματα με την υπό δοκιμή χημική ουσία και, κατά συνέπεια, η μελέτη κρίνεται διφορούμενη. Έκθεση δοκιμής Στην έκθεση δοκιμής θα πρέπει να περιλαμβάνονται τα ακόλουθα στοιχεία:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Κεντρομερίδιο : περιοχή του χρωμοσώματος, με την οποία συνδέονται τα νημάτια της ατράκτου κατά τη διάρκεια της κυτταρικής διαίρεσης, με στόχο την οργανωμένη κίνηση των θυγατρικών χρωμοσωμάτων προς τους πόλους των θυγατρικών κυττάρων. Χημική ουσία : μια ουσία ή ένα μείγμα. Ερυθροβλάστη : πρώιμο στάδιο ανάπτυξης των ερυθροκυττάρων, αμέσως πριν από το άωρο ερυθροκύτταρο, όταν το κύτταρο εξακολουθεί να περιέχει πυρήνα. Κινητοχώρος : η πρωτεϊνική δομή που σχηματίζεται στα κεντρομερίδια των ευκαρυωτικών κυττάρων, συνδέει το χρωμόσωμα με τα πολυμερή των μικροσωληνίσκων που προέρχονται από τη μιτωτική άτρακτο κατά τη μίτωση και τη μείωση και ενεργεί κατά την κυτταρική διαίρεση για τον διαχωρισμό των αδελφών χρωματίδων. Μικροπυρήνες : μικροί πυρήνες, που συνυπάρχουν και διακρίνονται από τους κύριους πυρήνες των κυττάρων και οι οποίοι παράγονται κατά την τελόφαση της μίτωσης (μείωσης) από καθυστερημένα χρωμοσωμικά θραύσματα ή ολόκληρα χρωμοσώματα. Ορθοχρωμικό ή ώριμο ερυθροκύτταρο : πλήρως ώριμο ερυθροκύτταρο που έχει απολέσει το υπολειμματικό RNA, το οποίο απομένει μετά την εκπυρήνωση, και/ή έχει απολέσει άλλους βραχύβιους κυτταρικούς δείκτες που εξαφανίζονται χαρακτηριστικά μετά την εκπυρήνωση που ακολουθεί την τελική διαίρεση των ερυθροβλαστών. Πολυχρωμικό ή άωρο ερυθροκύτταρο : νεοσχηματισμένο ερυθροκύτταρο σε ενδιάμεσο στάδιο ανάπτυξης, που χρωματίζεται τόσο από το κυανό όσο και από το κόκκινο συστατικό των κλασικών χρώσεων δειγμάτων αίματος, όπως η Giemsa του Wright, λόγω της παρουσίας υπολειμματικού RNA. Αυτά τα νεοσχηματισμένα κύτταρα σχεδόν ταυτίζονται με τα δικτυοερυθροκύτταρα, τα οποία καθίστανται ορατά με τη χρήση ζωτικής χρώσης που προκαλεί τον σχηματισμό δικτύου από το υπολειμματικό RNA. Για την ταυτοποίηση νεοσχηματισμένων ερυθρών αιμοσφαιρίων χρησιμοποιούνται πλέον ευρέως και άλλες μέθοδοι, όπως η μονοχρωματική χρώση του RNA με φθορίζουσες χρωστικές ή σήμανση βραχύβιων επιφανειακών δεικτών, όπως ο CD71, με φθορίζοντα αντισώματα. Τα πολυχρωματικά ερυθροκύτταρα, τα δικτυοερυθροκύτταρα και τα θετικά στον δείκτη CD71 ερυθροκύτταρα είναι όλα άωρα ερυθροκύτταρα, αν και το καθένα από αυτά έχει ελαφρώς διαφορετική ηλικιακή κατανομή. Δικτυοερυθροκύτταρο : νεοσχηματισμένο ερυθροκύτταρο που χρωματίζεται με ζωτική χρώση, η οποία προκαλεί τον σχηματισμό χαρακτηριστικού δικτύου από το υπολειμματικό RNA. Τα δικτυοερυθροκύτταρα και τα πολυχρωματικά ερυθροκύτταρα έχουν παρόμοια ηλικιακή κατανομή. Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Προσάρτημα 2 ΠΑΡΑΓΟΝΤΙΚΟΣ ΣΧΕΔΙΑΣΜΟΣ ΓΙΑ ΤΟΝ ΠΡΟΣΔΙΟΡΙΣΜΟ ΤΩΝ ΔΙΑΦΟΡΩΝ ΜΕΤΑΞΥ ΤΩΝ ΦΥΛΩΝ ΣΤΗ ΔΟΚΙΜΗ ΜΙΚΡΟΠΥΡΗΝΩΝ IN VIVO Ο παραγοντικός σχεδιασμός και η σχετική ανάλυση Σύμφωνα με τον παρόντα σχεδιασμό, υποβάλλονται σε δοκιμή τουλάχιστον 5 αρσενικά και 5 θηλυκά άτομα σε κάθε επίπεδο συγκέντρωσης, με αποτέλεσμα τη χρήση τουλάχιστον 40 ζώων (20 αρσενικών και 20 θηλυκών, συν τους αντίστοιχους θετικούς μάρτυρες). Πρόκειται για έναν από τους απλούστερους παραγοντικούς σχεδιασμούς, που ισοδυναμεί με αμφίδρομη ανάλυση διασποράς στην οποία ως κύριες επιδράσεις θεωρούνται το φύλο και το επίπεδο συγκέντρωσης. Τα δεδομένα μπορούν να αναλυθούν με πολλά τυποποιημένα στατιστικά πακέτα λογισμικού, όπως τα SPSS, SAS, STATA, Genstat, καθώς και με τη χρήση του συστήματος R. Κατά την ανάλυση διαχωρίζεται η μεταβλητότητα του συνόλου δεδομένων σε μεταβλητότητα μεταξύ των φύλων, μεταβλητότητα μεταξύ των συγκεντρώσεων και μεταβλητότητα σχετιζόμενη με την αλληλεπίδραση μεταξύ των φύλων και των συγκεντρώσεων. Καθένας από τους όρους αυτούς συγκρίνεται με την εκτίμηση της μεταβλητότητας μεταξύ των ζώων επανάληψης (replicates) που απαρτίζουν τις ομάδες ζώων του ίδιου φύλου στις οποίες χορηγείται η ίδια συγκέντρωση. Περισσότερες λεπτομέρειες σχετικά με την υποκείμενη μεθοδολογία είναι διαθέσιμες σε πολλά κλασικά εγχειρίδια στατιστικής (βλ. βιβλιογραφία) και στις λειτουργίες βοήθειας (Help) που παρέχονται με τα στατιστικά πακέτα λογισμικού. Στο επόμενο στάδιο της ανάλυσης εξετάζεται ο όρος αλληλεπίδρασης φύλο x συγκέντρωση σε πίνακα ANOVA (6). Ελλείψει σημαντικού όρου αλληλεπίδρασης, οι συνδυασμένες τιμές στα φύλα ή στα επίπεδα συγκέντρωσης τροφοδοτούν έγκυρους στατιστικούς ελέγχους μεταξύ των επιπέδων με βάση τη συγχωνευμένη ενδοομαδική μεταβλητότητα (pooled within-group variability), όρο που παρέχεται από την ANOVA. Η ανάλυση συνεχίζεται με τον διαχωρισμό της εκτίμησης της μεταβλητότητας μεταξύ των συγκεντρώσεων σε αντιθέσεις που τροφοδοτούν έλεγχο για τις γραμμικές και τετραγωνικές αντιθέσεις των αποκρίσεων σε όλα τα επίπεδα συγκέντρωσης. Όταν υπάρχει σημαντική αλληλεπίδραση φύλου x συγκέντρωση, ο όρος αυτός μπορεί επίσης να διαχωριστεί σε αντιθέσεις γραμμικής x φύλο και τετραγωνικής x φύλο αλληλεπίδρασης. Οι εν λόγω όροι τροφοδοτούν ελέγχους με σκοπό να εξακριβωθεί αν οι αποκρίσεις στη συγκέντρωση είναι παράλληλες για τα δύο φύλα ή διαφοροποιούνται ανάλογα με το φύλο. Η εκτίμηση της συγχωνευμένης ενδοομαδικής μεταβλητότητας μπορεί να χρησιμοποιηθεί για κατά ζεύγη ελέγχους της διαφοράς μεταξύ των μέσων τιμών. Οι έλεγχοι αυτοί μπορούν να αφορούν συγκρίσεις μεταξύ των μέσων τιμών στα δύο φύλα και μεταξύ των μέσων τιμών στα διάφορα επίπεδα συγκέντρωσης, όπως π.χ. οι συγκρίσεις με τα επίπεδα των αρνητικών μαρτύρων. Στις περιπτώσεις σημαντικής αλληλεπίδρασης, μπορούν να γίνουν συγκρίσεις μεταξύ των μέσων τιμών των διαφόρων συγκεντρώσεων στο ίδιο φύλο ή μεταξύ των μέσων τιμών των φύλων στην ίδια συγκέντρωση. Βιβλιογραφία Υπάρχουν πολλά εγχειρίδια στατιστικής που πραγματεύονται τη θεωρία, τον σχεδιασμό, τη μεθοδολογία, την ανάλυση και την ερμηνεία παραγοντικών σχεδιασμών οι οποίοι εκτείνονται από τις απλούστερες αναλύσεις δύο παραγόντων έως τις πλέον περίπλοκες μορφές που χρησιμοποιούνται στη μεθοδολογία σχεδιασμού πειραμάτων. Ο κατάλογος που ακολουθεί δεν είναι πλήρης. Ορισμένα βιβλία παρέχουν πρακτικά παραδείγματα εφαρμογής συγκρίσιμων σχεδιασμών, συνοδευόμενα σε ορισμένες περιπτώσεις από κώδικα για τη διενέργεια των αναλύσεων με τη χρήση διαφόρων πακέτων λογισμικού.
|
|
(6) |
Στο μέρος Β, το κεφάλαιο Β.15 απαλείφεται. |
|
(7) |
Στο μέρος Β, το κεφάλαιο Β.16 απαλείφεται. |
|
(8) |
Στο μέρος Β, το κεφάλαιο Β.18 απαλείφεται. |
|
(9) |
Στο μέρος Β, το κεφάλαιο Β.19 απαλείφεται. |
|
(10) |
Στο μέρος Β, το κεφάλαιο Β.20 απαλείφεται. |
|
(11) |
Στο μέρος Β, το κεφάλαιο Β.24 απαλείφεται. |
|
(12) |
Στο μέρος B, το Κεφάλαιο Β.47 αντικαθίσταται από το ακόλουθο: «B.47 Μέθοδος δοκιμών αδιαφάνειας και διαπερατότητας του βόειου κερατοειδούς για τον προσδιορισμό i) χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη και ii) χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 437 του ΟΟΣΑ (2013). Η μέθοδος δοκιμών αδιαφάνειας και διαπερατότητας του βόειου κερατοειδούς (Bovine Corneal Opacity and Permeability/BCOP) αξιολογήθηκε από τη Διυπηρεσιακή Συντονιστική Επιτροπή για την Επικύρωση Εναλλακτικών Μεθόδων (ICCVAM) των Ηνωμένων Πολιτειών, σε σύμπραξη με το Ευρωπαϊκό Κέντρο για την Επικύρωση Εναλλακτικών Μεθόδων (ECVAM) και το Ιαπωνικό Κέντρο για την Επικύρωση Εναλλακτικών Μεθόδων (JaCVAM), το 2006 και το 2010 (1)(2). Κατά την πρώτη αξιολόγηση, αξιολογήθηκε η χρησιμότητα της μεθόδου δοκιμών BCOP για τον προσδιορισμό χημικών προϊόντων (ουσιών και μειγμάτων) που προκαλούν σοβαρή οφθαλμική βλάβη (1). Κατά τη δεύτερη αξιολόγηση, αξιολογήθηκε η χρησιμότητα της μεθόδου δοκιμών BCOP για τον προσδιορισμό χημικών προϊόντων (ουσιών και μειγμάτων) που δεν ταξινομούνται ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη (2). Η βάση δεδομένων επικύρωσης της BCOP περιείχε συνολικά 113 ουσίες και 100 μείγματα (2) (3). Από τις εν λόγω αξιολογήσεις και την επανεξέτασή τους από ομότιμους κριτές διαπιστώθηκε ότι με τη μέθοδο δοκιμών μπορούν να προσδιοριστούν σωστά τα χημικά προϊόντα (τόσο οι ουσίες όσο και τα μείγματα) που προκαλούν σοβαρή οφθαλμική βλάβη (κατηγορίας 1), καθώς και εκείνα που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη, όπως ορίζονται στο Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης Χημικών Προϊόντων (Globally Harmonized System of Classification and Labelling of Chemicals/GHS) των Ηνωμένων Εθνών (4) και στον κανονισμό (ΕΚ) αριθ. 1272/2008 για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων (Classification, Labelling and Packaging/CLP) (7) και, ως εκ τούτου, η μέθοδος εγκρίθηκε ως επιστημονικά έγκυρη και για τους δύο σκοπούς. Σοβαρή οφθαλμική βλάβη είναι η πρόκληση βλάβης στους ιστούς των οφθαλμών ή η σοβαρή μείωση της όρασης, η οποία εμφανίζεται μετά την εφαρμογή της υπό δοκιμή χημικής ουσίας στην εμπρόσθια επιφάνεια του οφθαλμού και δεν είναι πλήρως αναστρέψιμη εντός 21 ημερών από την εφαρμογή της ουσίας. Οι υπό δοκιμή χημικές ουσίες που προκαλούν σοβαρή οφθαλμική βλάβη ταξινομούνται ως κατηγορίας 1 του GHS των Ηνωμένων Εθνών. Οι χημικές ουσίες που δεν ταξινομούνται ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη ορίζονται ως εκείνες που δεν πληρούν τις απαιτήσεις για να ταξινομηθούν ως κατηγορίας 1 ή 2 (2Α ή 2Β) του GHS των Ηνωμένων Εθνών, δηλ. οι αναφερόμενες ως «καμίας κατηγορίας» του GHS των Ηνωμένων Εθνών. Η παρούσα μέθοδος δοκιμών περιλαμβάνει τη συνιστώμενη χρήση και τους περιορισμούς της μεθόδου δοκιμών BCOP βάσει των αξιολογήσεών της. Οι βασικές διαφορές μεταξύ του αρχικού κειμένου των κατευθυντήριων γραμμών του ΟΟΣΑ, του 2009, και της επικαιροποιημένης έκδοσης του 2013 περιλαμβάνουν, μεταξύ άλλων, τις εξής: τη χρήση της μεθόδου δοκιμών BCOP για τον χαρακτηρισμό χημικών ουσιών για τις οποίες δεν απαιτείται ταξινόμηση σύμφωνα με το GHS των Ηνωμένων Εθνών (παράγραφοι 2 και 7)· διευκρινίσεις σχετικά με την εφαρμοσιμότητα της μεθόδου δοκιμών BCOP στον έλεγχο αλκοολών, κετονών και στερεών (παράγραφοι 6 και 7), καθώς και ουσιών και μειγμάτων (παράγραφος 8)· διευκρινίσεις σχετικά με τον τρόπο ελέγχου των επιφανειοδραστικών (τασιενεργών) ουσιών και των μειγμάτων που περιέχουν επιφανειοδραστικές ουσίες (παράγραφος 28)· επικαιροποιήσεις και διευκρινίσεις σχετικά με τους θετικούς μάρτυρες (παράγραφοι 39 και 40)· επικαιροποίηση των κριτηρίων της μεθόδου δοκιμών BCOP για τη λήψη αποφάσεων (παράγραφος 47)· επικαιροποίηση των κριτηρίων αποδοχής της μελέτης (παράγραφος 48)· επικαιροποίηση των στοιχείων της έκθεσης δοκιμής (παράγραφος 49)· επικαιροποίηση του προσαρτήματος 1 που περιέχει τους ορισμούς· προσθήκη του προσαρτήματος 2 για την ικανότητα πρόβλεψης της μεθόδου δοκιμών BCOP στο πλαίσιο διαφόρων συστημάτων ταξινόμησης· επικαιροποίηση του προσαρτήματος 3 που περιέχει κατάλογο των χημικών ουσιών ελέγχου ικανότητας· και επικαιροποίηση του προσαρτήματος 4 σχετικά με τη διάταξη συγκράτησης κερατοειδούς στη μέθοδο BCOP (παράγραφος 1) και το αδιαφανόμετρο (παράγραφοι 2 και 3). Επί του παρόντος είναι γενικά αποδεκτό ότι, στο προβλέψιμο μέλλον, καμία μεμονωμένη δοκιμή οφθαλμικού ερεθισμού in vitro δεν θα μπορεί να αντικαταστήσει την in vivo οφθαλμική δοκιμή Draize στην πρόβλεψη σε ολόκληρο το φάσμα ερεθιστικότητας από τις διαφορετικές τάξεις χημικών ουσιών. Εντούτοις, στοχευμένοι συνδυασμοί διαφόρων εναλλακτικών μεθόδων δοκιμών στο πλαίσιο (κλιμακωτής) στρατηγικής δοκιμών θα μπορούσαν ενδεχομένως να αντικαταστήσουν την οφθαλμική δοκιμή Draize (5). Η καθοδική προσέγγιση (top-down) (5) έχει σχεδιαστεί για να χρησιμοποιείται όταν, βάσει των διαθέσιμων πληροφοριών, μια χημική ουσία αναμένεται να έχει υψηλό δυναμικό ερεθιστικότητας, ενώ η ανοδική προσέγγιση (bottom-up) (5) έχει σχεδιαστεί για να χρησιμοποιείται όταν, βάσει των διαθέσιμων πληροφοριών, μια χημική ουσία δεν αναμένεται να προκαλέσει ερεθισμό των οφθαλμών σε βαθμό τέτοιον ώστε να επιβάλλεται η ταξινόμησή της. Η μέθοδος δοκιμών BCOP είναι μέθοδος δοκιμών in vitro που μπορεί να χρησιμοποιείται, υπό ορισμένες περιστάσεις και με ειδικούς περιορισμούς, για την ταξινόμηση και την επισήμανση των χημικών ουσιών ως προς τον κίνδυνο για τους οφθαλμούς. Αν και δεν θεωρείται έγκυρη ως αυτοτελές υποκατάστατο της οφθαλμικής δοκιμής in vivo σε κουνέλια, η μέθοδος δοκιμών BCOP συνιστάται ως πρώτο στάδιο στρατηγικής δοκιμών, όπως η καθοδική προσέγγιση που προτείνουν οι Scott et al. (5), για τον προσδιορισμό χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη, δηλ. χημικών ουσιών που πρέπει να ταξινομούνται ως κατηγορίας 1 του GHS των Ηνωμένων Εθνών, χωρίς περαιτέρω δοκιμή (4). Η μέθοδος δοκιμών BCOP συνιστάται επίσης για τον προσδιορισμό χημικών ουσιών για τις οποίες δεν απαιτείται ταξινόμηση ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη, όπως ορίζονται στο GHS των Ηνωμένων Εθνών («καμίας κατηγορίας» του GHS των Ηνωμένων Εθνών) (4), στο πλαίσιο στρατηγικής δοκιμών όπως η ανοδική προσέγγιση (5). Ωστόσο, για τις χημικές ουσίες οι οποίες, όπως προβλέπεται βάσει της μεθόδου δοκιμών BCOP, δεν προκαλούν σοβαρή οφθαλμική βλάβη ή δεν ταξινομούνται ως προς τον οφθαλμικό ερεθισμό/τη σοβαρή οφθαλμική βλάβη, θα απαιτούνται πρόσθετες δοκιμές (in vitro και/ή in vivo) για να κριθεί η οριστική τους ταξινόμηση. Σκοπός της παρούσας μεθόδου δοκιμών είναι η περιγραφή των διαδικασιών που εφαρμόζονται για την αξιολόγηση του δυναμικού οφθαλμικού κινδύνου από την υπό δοκιμή ουσία, όπως αυτό μετράται από την ικανότητά της να προκαλεί αδιαφάνεια (θολερότητα) και αύξηση της διαπερατότητας σε απομονωμένο βόειο κερατοειδή. Οι τοξικές επιδράσεις στον κερατοειδή μετρώνται μέσω: i) της μειωμένης οπτικής διαπερατότητας (αδιαφάνεια) και ii) της αυξημένης διέλευσης της χρωστικής νατριούχου φλουορεσκεΐνης (διαπερατότητα). Οι αξιολογήσεις της αδιαφάνειας και της διαπερατότητας του κερατοειδούς κατόπιν έκθεσης σε υπό δοκιμή χημική ουσία συνδυάζονται για να εξαχθεί βαθμολογία ερεθιστικότητας in vitro (In Vitro Irritancy Score/IVIS), η οποία χρησιμοποιείται για την ταξινόμηση του βαθμού ερεθιστικότητας της υπό δοκιμή ουσίας. Οι ορισμοί παρατίθενται στο προσάρτημα 1. ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ Η παρούσα μέθοδος δοκιμών βασίζεται στο πρωτόκολλο της ICCVAM για τη μέθοδο δοκιμών BCOP (6) (7), το οποίο αναπτύχθηκε αρχικά βάσει στοιχείων που ελήφθησαν από το πρωτόκολλο του ινστιτούτου Institute for In Vitro Sciences (IIVS) και το πρωτόκολλο INVITTOX 124 (8). Το τελευταίο αποτελεί το πρωτόκολλο που χρησιμοποιήθηκε για τη μελέτη προεπικύρωσης που διενεργήθηκε κατά την περίοδο 1997-1998 με χορηγό την Ευρωπαϊκή Κοινότητα. Και τα δύο αυτά πρωτόκολλα βασίζονται στη μέθοδο δοκιμών BCOP που δημοσιεύτηκε για πρώτη φορά από τους Gautheron et al. (9). Η μέθοδος δοκιμών BCOP μπορεί να χρησιμοποιηθεί για τον προσδιορισμό χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη, όπως ορίζονται στο GHS των Ηνωμένων Εθνών, δηλ. χημικών ουσιών που πρέπει να ταξινομούνται ως κατηγορίας 1 του GHS των Ηνωμένων Εθνών (4). Όταν χρησιμοποιείται για τον σκοπό αυτό, η μέθοδος δοκιμών BCOP έχει συνολική ορθότητα 79 % (150/191), ποσοστό ψευδοθετικής έκβασης 25 % (32/126) και ποσοστό ψευδοαρνητικής έκβασης 14 % (9/65), σε σύγκριση με την ταξινόμηση βάσει δεδομένων από τη μέθοδο οφθαλμικών δοκιμών in vivo σε κουνέλια σύμφωνα με το σύστημα ταξινόμησης GHS των Ηνωμένων Εθνών (3) (βλ. προσάρτημα 2, πίνακας 1). Όταν εξαιρούνται από τη βάση δεδομένων οι υπό δοκιμή χημικές ουσίες ορισμένων τάξεων, χημικών (δηλ. αλκοόλες, κετόνες) ή φυσικών (στερεά), η μέθοδος δοκιμών BCOP έχει συνολική ορθότητα 85 % (111/131), ποσοστό ψευδοθετικής έκβασης 20 % (16/81) και ποσοστό ψευδοαρνητικής έκβασης 8 % (4/50) στο σύστημα ταξινόμησης GHS των Ηνωμένων Εθνών (3). Οι πιθανές αδυναμίες της μεθόδου δοκιμών BCOP, όταν χρησιμοποιείται για τον προσδιορισμό χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη (κατηγορία 1 του GHS των Ηνωμένων Εθνών), οφείλονται στα υψηλά ποσοστά ψευδοθετικής έκβασης για τις αλκοόλες και τις κετόνες και ψευδοαρνητικής έκβασης για τα στερεά, που παρατηρήθηκαν στη βάση δεδομένων επικύρωσης (1)(2)(3). Επειδή, ωστόσο, η υπερπρόβλεψη με τη μέθοδο δοκιμών BCOP δεν αφορά όλες τις αλκοόλες και κετόνες και ορισμένες προβλέπονται σωστά ως ουσίες της κατηγορίας 1 του GHS των Ηνωμένων Εθνών, αυτές οι δύο οργανικές δραστικές ομάδες δεν θεωρούνται εκτός του πεδίου εφαρμογής της μεθόδου δοκιμών. Εναπόκειται στον χρήστη της παρούσας μεθόδου δοκιμών να κρίνει αν η ενδεχόμενη υπερπρόβλεψη για αλκοόλη ή κετόνη είναι αποδεκτή ή αν πρέπει να διεξαχθούν περαιτέρω δοκιμές βασισμένες σε ανάλυση βάρους της απόδειξης. Όσον αφορά τα ποσοστά ψευδοαρνητικής έκβασης για τα στερεά, πρέπει να σημειωθεί ότι τα στερεά μπορεί να οδηγήσουν σε μεταβλητές και ακραίες συνθήκες έκθεσης στην in vivo δοκιμή οφθαλμικού ερεθισμού Draize, με αποτέλεσμα να προκύψουν άστοχες προβλέψεις του πραγματικού ερεθιστικού τους δυναμικού (10). Επισημαίνεται, επίσης, ότι καμία από τις ψευδοαρνητικές αποκρίσεις που εντοπίστηκαν στη βάση δεδομένων επικύρωσης της ICCVAM (2)(3), στο πλαίσιο του προσδιορισμού χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη (κατηγορίας 1 του GHS των Ηνωμένων Εθνών), δεν είχε ως αποτέλεσμα τιμή IVIS ≤ 3, η οποία είναι το κριτήριο που χρησιμοποιείται για τον χαρακτηρισμό μιας υπό δοκιμή ουσίας ως «καμίας κατηγορίας» του GHS των Ηνωμένων Εθνών. Επιπλέον, μια ψευδοαρνητική έκβαση της δοκιμής BCOP στο πλαίσιο αυτό δεν είναι κρίσιμης σημασίας, διότι όλες οι υπό δοκιμή χημικές ουσίες που δίνουν τιμή 3 < IVIS ≤ 55 υποβάλλονται ακολούθως σε άλλες, επαρκώς επικυρωμένες δοκιμές in vitro ή, ως έσχατη επιλογή, σε δοκιμές σε κουνέλια, ανάλογα με τις κανονιστικές απαιτήσεις, με τη χρήση στρατηγικής διαδοχικών δοκιμών με βάση ανάλυση βάρους της απόδειξης. Δεδομένου ότι η μέθοδος δοκιμών BCOP προβλέπει σωστά ότι ορισμένες στερεές χημικές ουσίες είναι κατηγορίας 1 του GHS των Ηνωμένων Εθνών, ούτε αυτή η φυσική κατάσταση θεωρείται εκτός του πεδίου εφαρμογής της μεθόδου δοκιμών. Οι ερευνητές μπορούν να εξετάζουν το ενδεχόμενο χρήσης της παρούσας μεθόδου δοκιμών για όλους τους τύπους χημικών ουσιών, οπότε και οι τιμές IVIS > 55 θα πρέπει να γίνονται δεκτές ως ενδεικτικές απόκρισης η οποία προκαλεί σοβαρή οφθαλμική βλάβη που θα πρέπει να ταξινομηθεί ως κατηγορίας 1 του GHS των Ηνωμένων Εθνών χωρίς περαιτέρω δοκιμή. Πάντως, όπως έχει ήδη αναφερθεί, τυχόν θετικά αποτελέσματα για αλκοόλες ή κετόνες πρέπει να ερμηνεύονται προσεκτικά λόγω πιθανής υπερπρόβλεψης. Η μέθοδος δοκιμών BCOP μπορεί επίσης να χρησιμοποιείται για τον προσδιορισμό χημικών ουσιών για τις οποίες δεν απαιτείται ταξινόμηση ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη βάσει του συστήματος ταξινόμησης GHS των Ηνωμένων Εθνών (4). Όταν χρησιμοποιείται για τον σκοπό αυτό, η μέθοδος δοκιμών BCOP έχει συνολική ορθότητα 69 % (135/196), ποσοστό ψευδοθετικής έκβασης 69 % (61/89) και ποσοστό ψευδοαρνητικής έκβασης 0 % (0/107), σε σύγκριση με την ταξινόμηση βάσει δεδομένων από τη μέθοδο οφθαλμικών δοκιμών in vivo σε κουνέλια σύμφωνα με το σύστημα ταξινόμησης GHS των Ηνωμένων Εθνών (3) (βλ. προσάρτημα 2, πίνακας 2). Το ποσοστό ψευδοθετικής έκβασης που έχει προκύψει (για χημικές ουσίες «καμίας κατηγορίας» του GHS των Ηνωμένων Εθνών in vivo, οι οποίες δίνουν IVIS > 3, βλ. παράγραφο 47) είναι σημαντικά υψηλό, αλλά όχι κρίσιμης σημασίας σε αυτό το πλαίσιο, εφόσον όλες οι υπό δοκιμή χημικές ουσίες που δίνουν τιμές 3 < IVIS ≤ 55 θα υποβάλλονται στη συνέχεια σε άλλες, επαρκώς επικυρωμένες δοκιμές in vitro ή, ως έσχατη επιλογή, σε δοκιμές σε κουνέλια, ανάλογα με τις κανονιστικές απαιτήσεις, με τη χρήση στρατηγικής διαδοχικών δοκιμών με βάση ανάλυση βάρους της απόδειξης. Η μέθοδος δοκιμών BCOP δεν παρουσιάζει ειδικές αδυναμίες όσον αφορά τη διεξαγωγή δοκιμών με αλκοόλες, κετόνες και στερεά, όταν ο σκοπός είναι ο χαρακτηρισμός χημικών ουσιών για τις οποίες δεν απαιτείται ταξινόμηση ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη («καμίας κατηγορίας» του GHS των Ηνωμένων Εθνών) (3). Οι ερευνητές μπορούν να εξετάζουν το ενδεχόμενο χρήσης της παρούσας μεθόδου δοκιμών για όλους τους τύπους χημικών ουσιών, οπότε και τα αρνητικά αποτελέσματα (IVIS ≤ 3) θα πρέπει να γίνονται δεκτά ως ένδειξη ότι δεν απαιτείται ταξινόμηση («καμία κατηγορία» του GHS των Ηνωμένων Εθνών). Εφόσον με τη μέθοδο δοκιμών BCOP είναι δυνατόν να προσδιοριστεί σωστά μόνο το 31 % των χημικών ουσιών για τις οποίες δεν απαιτείται ταξινόμηση ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη, η μέθοδος αυτή δεν θα πρέπει να είναι η πρώτη επιλογή για την έναρξη μιας ανοδικής προσέγγισης (5), εάν είναι διαθέσιμες άλλες επικυρωμένες και αποδεκτές μέθοδοι in vitro με παρόμοια υψηλή ευαισθησία, αλλά ανώτερη ειδικότητα. Η βάση δεδομένων επικύρωσης της BCOP περιείχε συνολικά 113 ουσίες και 100 μείγματα (2) (3). Η μέθοδος δοκιμών BCOP κρίνεται, συνεπώς, εφαρμόσιμη στον έλεγχο τόσο ουσιών όσο και μειγμάτων. Η μέθοδος δοκιμών BCOP δεν συνιστάται για τον προσδιορισμό υπό δοκιμή χημικών ουσιών που θα πρέπει να ταξινομηθούν ως ερεθιστικές για τους οφθαλμούς (κατηγορία 2 ή 2Α του GHS των Ηνωμένων Εθνών) ή ως ήπια ερεθιστικές για τους οφθαλμούς (κατηγορία 2Β του GHS των Ηνωμένων Εθνών), λόγω του σημαντικού αριθμού χημικών ουσιών της κατηγορίας 1 του GHS των Ηνωμένων Εθνών που υποταξινομούνται ως κατηγορίας 2, 2Α ή 2Β και χημικών ουσιών «καμίας κατηγορίας» του GHS των Ηνωμένων Εθνών που υπερταξινομούνται ως κατηγορίας 2, 2A ή 2B (2)(3). Για τον σκοπό αυτό, ενδέχεται να απαιτούνται περαιτέρω δοκιμές με άλλη κατάλληλη μέθοδο. Όλες οι διαδικασίες με βόειους οφθαλμούς και κερατοειδείς θα πρέπει να είναι σύμφωνες προς τους κανονισμούς και τις διαδικασίες που εφαρμόζονται στην εγκατάσταση δοκιμών για τον χειρισμό υλικών ζωικής προέλευσης, συμπεριλαμβανομένων, μεταξύ άλλων, των ιστών και ιστικών υγρών. Συνιστάται η τήρηση των γενικών εργαστηριακών προφυλάξεων (11). Στη μέθοδο δοκιμών BCOP δεν λαμβάνονται υπόψη οι κακώσεις του επιπεφυκότος και της ίριδας, αλλά εξετάζονται οι επιδράσεις στον κερατοειδή, που είναι ο μείζων παράγων ταξινόμησης in vivo όσον αφορά το GHS των Ηνωμένων Εθνών. Ο αναστρέψιμος χαρακτήρας των βλαβών του κερατοειδούς δεν μπορεί να αξιολογηθεί αυτοτελώς στη μέθοδο δοκιμών BCOP. Έχει προταθεί ως δυνατότητα, βάσει των οφθαλμικών μελετών σε κουνέλια, η χρήση της αξιολόγησης του αρχικού βάθους της κάκωσης του κερατοειδούς για τον εντοπισμό ορισμένων τύπων μη αναστρέψιμων επιδράσεων (12). Ωστόσο, απαιτούνται περαιτέρω επιστημονικές γνώσεις για να γίνει κατανοητός ο τρόπος με τον οποίο επέρχονται μη αναστρέψιμες επιδράσεις που δεν συνδέονται με μια αρχική σοβαρή βλάβη. Τέλος, η μέθοδος δοκιμών BCOP δεν καθιστά εφικτή την αξιολόγηση του δυναμικού συστημικής τοξικότητας που συνδέεται με την έκθεση των οφθαλμών. Η παρούσα μέθοδος δοκιμών θα επικαιροποιείται ανά διαστήματα με βάση τις νέες πληροφορίες και τα δεδομένα. Για παράδειγμα, μια ιστοπαθολογική εξέταση ενδέχεται να είναι χρήσιμη όταν απαιτείται πληρέστερος χαρακτηρισμός της βλάβης του κερατοειδούς. Όπως επισημαίνεται στο έγγραφο καθοδήγησης αριθ. 160 του ΟΟΣΑ (13), συνιστάται στους χρήστες να φυλάσσουν τους κερατοειδείς και να ετοιμάζουν δείγματα ιστοπαθολογικής εξέτασης που μπορούν να χρησιμοποιηθούν για την ανάπτυξη βάσης δεδομένων και κριτηρίων λήψης αποφάσεων που θα μπορούσαν να βελτιώσουν περαιτέρω την ορθότητα της παρούσας μεθόδου δοκιμών. Τα εργαστήρια που εφαρμόζουν για πρώτη φορά την παρούσα μέθοδο δοκιμών θα πρέπει να χρησιμοποιούν τις χημικές ουσίες ελέγχου ικανότητας που προβλέπονται στο προσάρτημα 3. Τα εργαστήρια μπορούν να χρησιμοποιούν αυτές τις χημικές ουσίες για να αποδεικνύουν την τεχνική ικανότητά τους όσον αφορά την εφαρμογή της μεθόδου δοκιμών BCOP πριν από την υποβολή δεδομένων που έχουν προκύψει από αυτή για την ταξινόμηση των κινδύνων στο πλαίσιο κανονιστικών ρυθμίσεων. ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ Η μέθοδος δοκιμών BCOP είναι οργανοτυπικό μοντέλο που εξασφαλίζει βραχυχρόνια διατήρηση της κανονικής φυσιολογικής και βιοχημικής λειτουργίας του βόειου κερατοειδούς in vitro. Στη συγκεκριμένη μέθοδο δοκιμών, η βλάβη που προκαλείται από την υπό δοκιμή χημική ουσία αξιολογείται με ποσοτικές μετρήσεις των μεταβολών της αδιαφάνειας και της διαπερατότητας του κερατοειδούς, με τη χρήση αδιαφανομέτρου και φασματοφωτομέτρου ορατού φωτός, αντιστοίχως. Αμφότερες οι μετρήσεις χρησιμοποιούνται για τον υπολογισμό της IVIS, η οποία χρησιμοποιείται για την κατάταξη σε κατηγορία ταξινόμησης κινδύνου ερεθιστικότητας in vitro, με σκοπό την πρόβλεψη του δυναμικού οφθαλμικού ερεθισμού in vivo που ενέχει η υπό δοκιμή χημική ουσία (βλ. κριτήρια λήψης αποφάσεων στην παράγραφο 48). Στη μέθοδο δοκιμών BCOP χρησιμοποιούνται κερατοειδείς που απομονώνονται από τους οφθαλμούς προσφάτως σφαχθέντων βοοειδών. Η κερατοειδική αδιαφάνεια μετράται ποσοτικά ως η ποσότητα φωτός που διέρχεται μέσω του κερατοειδούς. Η διαπερατότητα μετράται ποσοτικά ως η ποσότητα χρωστικής νατριούχου φλουορεσκεΐνης που διέρχεται από το πλήρες πάχος του κερατοειδούς, όπως ανιχνεύεται στο θρεπτικό μέσο του οπίσθιου θαλάμου. Οι υπό δοκιμή χημικές ουσίες εφαρμόζονται στην επιθηλιακή επιφάνεια του κερατοειδούς με προσθήκη στον εμπρόσθιο θάλαμο της διάταξης συγκράτησης του κερατοειδούς. Στο προσάρτημα 4 παρατίθεται περιγραφή και διάγραμμα διάταξης συγκράτησης κερατοειδούς που χρησιμοποιείται στη μέθοδο δοκιμών BCOP. Οι διατάξεις συγκράτησης κερατοειδούς κυκλοφορούν στο εμπόριο ή κατασκευάζονται κατά παραγγελία. Προέλευση και ηλικία των οφθαλμών βοοειδών και επιλογή ζωικού είδους Τα βοοειδή που αποστέλλονται στα σφαγεία θανατώνονται συνήθως για κατανάλωση από τον άνθρωπο ή για άλλες εμπορικές χρήσεις. Οι κερατοειδείς που χρησιμοποιούνται στη μέθοδο δοκιμών BCOP προέρχονται μόνο από υγιή ζώα που θεωρούνται κατάλληλα για είσοδο στην ανθρώπινη τροφική αλυσίδα. Δεδομένου ότι το βάρος των βοοειδών ποικίλλει ανάλογα με τη φυλή, την ηλικία και το φύλο, δεν υπάρχει συνιστώμενο βάρος του ζώου κατά τη σφαγή. Όταν χρησιμοποιούνται οφθαλμοί ζώων διαφορετικών ηλικιών ενδέχεται να προκύψουν διακυμάνσεις των διαστάσεων του κερατοειδούς. Κερατοειδείς με οριζόντια διάμετρο > 30,5 mm και κεντρικό πάχος (CCT) ≥ 1100 μm λαμβάνονται γενικά από βοοειδή ηλικίας άνω των οκτώ ετών, ενώ κερατοειδείς με οριζόντια διάμετρο < 28,5 mm και CCT < 900 μm από βοοειδή ηλικίας κάτω των πέντε ετών (14). Για τον λόγο αυτό, συνήθως δεν χρησιμοποιούνται οφθαλμοί βοοειδών ηλικίας άνω των 60 μηνών. Κατά παράδοση δεν χρησιμοποιούνται ούτε οφθαλμοί βοοειδών ηλικίας κάτω των 12 μηνών, διότι αυτοί δεν έχουν αναπτυχθεί πλήρως και το πάχος και η διάμετρος του κερατοειδούς υπολείπονται σημαντικά των τιμών που αναφέρονται για οφθαλμούς ενήλικων βοοειδών. Εντούτοις, επιτρέπεται η χρήση κερατοειδών νεαρών ζώων (δηλ. ηλικίας 6 έως 12 μηνών), επειδή παρουσιάζει ορισμένα πλεονεκτήματα, όπως η αυξημένη διαθεσιμότητα, το περιορισμένο ηλικιακό εύρος και οι μειωμένοι κίνδυνοι πιθανής έκθεσης των εργαζομένων στη σπογγώδη εγκεφαλοπάθεια των βοοειδών (15). Δεδομένου ότι θα είναι χρήσιμη η περαιτέρω αξιολόγηση της επίδρασης του μεγέθους ή του πάχους του κερατοειδούς στην αποκρισιμότητα σε διαβρωτικές και ερεθιστικές χημικές ουσίες, συνιστάται στους χρήστες να αναφέρουν την εκτιμώμενη ηλικία και/ή το βάρος των ζώων από τα οποία προέρχονται οι κερατοειδείς που χρησιμοποιούνται στις μελέτες. Συλλογή και μεταφορά των οφθαλμών στο εργαστήριο Οι οφθαλμοί συλλέγονται από υπαλλήλους των σφαγείων. Για την αποτροπή μηχανικών και άλλου είδους βλαβών στους οφθαλμούς, οι τελευταίοι θα πρέπει να εξορύσσονται το ταχύτερο δυνατό μετά τον θάνατο του ζώου και να ψύχονται αμέσως μετά την εξόρυξή τους και κατά τη μεταφορά. Για την αποφυγή έκθεσης των οφθαλμών σε πιθανώς ερεθιστικές χημικές ουσίες, οι υπάλληλοι των σφαγείων δεν θα πρέπει να χρησιμοποιούν απορρυπαντικά κατά την έκπλυση της κεφαλής των ζώων. Οι οφθαλμοί θα πρέπει να εμβαπτίζονται τελείως σε ψυχρό αλατούχο διάλυμα Hanks (Hanks' Balanced Salt Solution/HBSS) εντός δοχείου κατάλληλου μεγέθους και να μεταφέρονται στο εργαστήριο κατά τρόπο ώστε να ελαχιστοποιείται η φθορά και/ή η βακτηριακή μόλυνση. Επειδή οι οφθαλμοί συλλέγονται κατά τη διαδικασία σφαγής, ενδέχεται να εκτεθούν σε αίμα και άλλα βιολογικά υλικά, συμπεριλαμβανομένων των βακτηρίων και άλλων μικροοργανισμών. Ως εκ τούτου, είναι σημαντικό να διασφαλίζεται η ελαχιστοποίηση του κινδύνου μόλυνσης (π.χ. με τη διατήρηση του δοχείου που περιέχει τους οφθαλμούς σε υγρό πάγο κατά τη συλλογή και μεταφορά και με την προσθήκη αντιβιοτικών στο διάλυμα HBSS που χρησιμοποιείται για τη φύλαξη των οφθαλμών κατά τη μεταφορά [π.χ. 100 IU πενικιλίνης/mL και 100 μg στρεπτομυκίνης/mL]) Το χρονικό διάστημα που μεσολαβεί μεταξύ της συλλογής των οφθαλμών και της χρήσης των κερατοειδών στη μέθοδο δοκιμών BCOP θα πρέπει να είναι το μικρότερο δυνατόν (συνήθως συλλογή και χρήση την ίδια ημέρα) και θα πρέπει να αποδεικνύεται ότι δεν υπονομεύει τα αποτελέσματα της δοκιμής. Τα αποτελέσματα αυτά βασίζονται στα κριτήρια επιλογής των οφθαλμών, καθώς και στις αποκρίσεις των θετικών και των αρνητικών μαρτύρων. Όλοι οι οφθαλμοί που χρησιμοποιούνται στη δοκιμή θα πρέπει να προέρχονται από την ίδια ομάδα οφθαλμών που συλλέχθηκαν συγκεκριμένη ημέρα. Κριτήρια επιλογής των οφθαλμών που χρησιμοποιούνται στη μέθοδο δοκιμών BCOP Μόλις οι οφθαλμοί φτάσουν στο εργαστήριο, εξετάζονται προσεκτικά για ελαττώματα όπως αυξημένη αδιαφάνεια, αμυχές και νεοαγγείωση. Πρέπει να χρησιμοποιούνται μόνο κερατοειδείς χωρίς ελαττώματα αυτού του είδους. Η ποιότητα κάθε κερατοειδούς αξιολογείται και σε μεταγενέστερα στάδια της δοκιμής. Οι κερατοειδείς με αδιαφάνεια μεγαλύτερη από επτά μονάδες αδιαφάνειας ή ισοδύναμη για τα χρησιμοποιούμενα αδιαφανόμετρα και διατάξεις συγκράτησης κερατοειδούς, μετά από μια αρχική περίοδο εξισορρόπησης μίας ώρας, πρέπει να απορρίπτονται (ΣΗΜΕΙΩΣΗ: το αδιαφανόμετρο θα πρέπει να βαθμονομείται με τα πρότυπα αδιαφάνειας που χρησιμοποιούνται για τον καθορισμό των μονάδων αδιαφάνειας, βλ. προσάρτημα 4). Κάθε ομάδα μεταχείρισης (υπό δοκιμή χημική ουσία, παράλληλοι αρνητικοί και θετικοί μάρτυρες) αποτελείται από τουλάχιστον τρεις οφθαλμούς. Στη μέθοδο δοκιμών BCOP, για τους αρνητικούς μάρτυρες θα πρέπει να χρησιμοποιούνται τρεις κερατοειδείς. Δεδομένου ότι όλοι οι κερατοειδείς εκτέμνονται από τον πλήρη βολβό και στερεώνονται στους θαλάμους της διάταξης συγκράτησης κερατοειδούς, υπάρχει το ενδεχόμενο να προκύψουν τεχνητά σφάλματα αδιαφάνειας και διαπερατότητας για τους επιμέρους κερατοειδείς (συμπεριλαμβανομένου του αρνητικού μάρτυρα), λόγω του χειρισμού. Επιπλέον, στους υπολογισμούς της IVIS, οι τιμές αδιαφάνειας και διαπερατότητας που λαμβάνονται για τους κερατοειδείς οι οποίοι αποτελούν τους αρνητικούς μάρτυρες χρησιμοποιούνται για τη διόρθωση των τιμών αδιαφάνειας και διαπερατότητας των κερατοειδών που υποβάλλονται σε μεταχείριση με την υπό δοκιμή χημική ουσία και τον θετικό μάρτυρα. ΔΙΑΔΙΚΑΣΙΑ Προετοιμασία των οφθαλμών Κερατοειδείς χιτώνες χωρίς ελαττώματα ανατέμνονται κατά τρόπο ώστε να παραμένει δακτύλιος σκληρού χιτώνα 2 έως 3 mm με σκοπό τη διευκόλυνση του μετέπειτα χειρισμού, λαμβανομένης μέριμνας για την αποφυγή φθορών στο κερατοειδικό επιθήλιο και ενδοθήλιο. Οι απομονωθέντες κερατοειδείς στερεώνονται σε ειδικές διατάξεις συγκράτησης κερατοειδούς που αποτελούνται από εμπρόσθιο και οπίσθιο διαμέρισμα, τα οποία εφάπτονται με το επιθήλιο και το ενδοθήλιο του κερατοειδούς, αντιστοίχως. Αμφότεροι οι θάλαμοι πληρούται μέχρι υπερχείλισης με προθερμασμένο θρεπτικό μέσο ελάχιστων τροφικών απαιτήσεων του Eagle χωρίς ερυθρό της φαινόλης (Eagle's Minimum Essential Medium/EMEM) (πρώτα ο οπίσθιος θάλαμος), με τρόπο που εξασφαλίζει ότι δεν σχηματίζονται φυσαλίδες. Η διάταξη αφήνεται εν συνεχεία να σταθεροποιηθεί στους 32 ± 1 °C για τουλάχιστον μία ώρα, ούτως ώστε να εξισορροπηθεί η θερμοκρασία των κερατοειδών με τη θερμοκρασία του θρεπτικού μέσου και να επιτευχθεί, στο μέτρο του δυνατού, φυσιολογική μεταβολική δραστηριότητα (η θερμοκρασία της επιφάνειας του κερατοειδούς in vivo είναι κατά προσέγγιση 32 °C). Μετά την παρέλευση του διαστήματος εξισορρόπησης, προστίθεται πρόσφατα παρασκευασμένο προθερμασμένο EMEM χωρίς ερυθρό της φαινόλης σε αμφότερους τους θαλάμους και σημειώνονται οι τιμές γραμμής βάσης της αδιαφάνειας για κάθε κερατοειδή. Οι κερατοειδείς που εμφανίζουν μακροσκοπικές βλάβες ιστού (π.χ. αμυχές, μελάγχρωση, νεοαγγείωση) ή αδιαφάνεια μεγαλύτερη από επτά μονάδες αδιαφάνειας, ή ισοδύναμη για τα χρησιμοποιούμενα αδιαφανόμετρα και διατάξεις συγκράτησης κερατοειδούς, απορρίπτονται. Τουλάχιστον τρεις κερατοειδείς επιλέγονται ως αρνητικοί μάρτυρες (ή μάρτυρες με διαλύτη). Οι εναπομένοντες κερατοειδείς κατανέμονται στη συνέχεια σε ομάδες μεταχείρισης ή θετικών μαρτύρων. Επειδή η θερμοχωρητικότητα του νερού είναι υψηλότερη από του αέρα, το νερό παρέχει πιο σταθερές συνθήκες θερμοκρασίας για επώαση. Κατά συνέπεια, για τη διατήρηση της διάταξης συγκράτησης κερατοειδούς και του περιεχομένου της σε θερμοκρασία 32 ± 1 °C συνιστάται η χρήση υδατόλουτρου. Εντούτοις, μπορούν να χρησιμοποιούνται και επωαστήρες αέρα, με προφυλάξεις για τη διατήρηση σταθερής θερμοκρασίας (π.χ. με προθέρμανση των διατάξεων συγκράτησης και των θρεπτικών μέσων). Εφαρμογή της υπό δοκιμή χημικής ουσίας Χρησιμοποιούνται δύο διαφορετικά πρωτόκολλα μεταχείρισης, ένα για υγρά και επιφανειοδραστικές ουσίες (στερεές ή υγρές) και ένα για μη επιφανειοδραστικά στερεά. Τα υγρά υποβάλλονται στη δοκιμή χωρίς αραίωση. Τα ημιστερεά, οι κρέμες και οι κηροί υποβάλλονται κατά κανόνα στη δοκιμή ως υγρά. Οι αμιγείς επιφανειοδραστικές ουσίες υποβάλλονται στη δοκιμή σε συγκέντρωση 10 % (κ.β.) σε διάλυμα χλωριούχου νατρίου 0,9 %, απεσταγμένο νερό ή άλλο διαλύτη, για τον οποίο έχει αποδειχθεί ότι δεν έχει δυσμενείς επιδράσεις στο σύστημα δοκιμής. Για διαφορετικές αραιώσεις πρέπει να παρέχεται κατάλληλη αιτιολόγηση. Τα μείγματα που περιέχουν επιφανειοδραστικές ουσίες μπορούν να υποβάλλονται σε δοκιμή αναραίωτα ή αραιωμένα σε κατάλληλη συγκέντρωση ανάλογα με τα αντίστοιχα σενάρια έκθεσης in vivo. Θα πρέπει να παρέχεται κατάλληλη αιτιολόγηση για την υπό δοκιμή αραίωση. Οι κερατοειδείς εκτίθενται στα υγρά και στα επιφανειοδραστικά επί 10 λεπτά. Σε περίπτωση διαφορετικής διάρκειας έκθεσης, πρέπει να παρέχεται κατάλληλη επιστημονική αιτιολόγηση. Βλ. προσάρτημα 1 για ορισμό των επιφανειοδραστικών ουσιών και των μειγμάτων που περιέχουν επιφανειοδραστικές ουσίες. Τα μη επιφανειοδραστικά στερεά υποβάλλονται κατά κανόνα στη δοκιμή ως διαλύματα ή εναιωρήματα σε συγκέντρωση 20 % (κ.β.) σε διάλυμα χλωριούχου νατρίου 0,9 %, απεσταγμένο νερό ή άλλο διαλύτη, για τον οποίο έχει αποδειχθεί ότι δεν έχει δυσμενείς επιδράσεις στο σύστημα δοκιμής. Υπό ορισμένες περιστάσεις και με την κατάλληλη επιστημονική αιτιολόγηση, τα στερεά επιτρέπεται να υποβάλλονται στη δοκιμή και ως έχουν, με απευθείας εφαρμογή στην επιφάνεια του κερατοειδούς με τη μέθοδο του ανοικτού θαλάμου (βλ. παράγραφο 32). Οι κερατοειδείς εκτίθενται στα στερεά επί τέσσερις ώρες, αλλά, όπως και στην περίπτωση των υγρών και των επιφανειοδραστικών ουσιών, επιτρέπεται να χρησιμοποιούνται διαφορετικά διαστήματα έκθεσης κατόπιν κατάλληλης επιστημονικής αιτιολόγησης. Είναι δυνατόν να χρησιμοποιούνται διαφορετικές μέθοδοι μεταχείρισης, ανάλογα με τη φυσική μορφή και τα χημικά χαρακτηριστικά της υπό δοκιμή χημικής ουσίας (π.χ. στερεά, υγρά, παχύρευστα έναντι μη παχύρευστων υγρών). Ο κρίσιμος παράγοντας είναι να εξασφαλίζεται ότι η υπό δοκιμή χημική ουσία καλύπτει επαρκώς την επιφάνεια του επιθηλίου και ότι απομακρύνεται ικανοποιητικά κατά την έκπλυση. Για μη παχύρευστες έως ελαφρώς παχύρευστες υπό δοκιμή χημικές ουσίες χρησιμοποιείται συνήθως μέθοδος κλειστού θαλάμου, ενώ για ημιπαχύρευστες και παχύρευστες, καθώς και για τα στερεά ως έχουν χρησιμοποιείται κατά κανόνα μέθοδος ανοικτού θαλάμου. Στη μέθοδο κλειστού θαλάμου, ποσότητα της υπό δοκιμή χημικής ουσίας που επαρκεί για την κάλυψη του επιθηλίου του κερατοειδούς (750 μl), εισάγεται στον εμπρόσθιο θάλαμο μέσω των δοσιμετρικών οπών στην επάνω επιφάνειά του και, εν συνεχεία, οι οπές σφραγίζονται με τα πώματα του θαλάμου καθ' όλη τη διάρκεια της έκθεσης. Είναι σημαντικό να διασφαλίζεται η έκθεση κάθε κερατοειδούς στην υπό δοκιμή χημική ουσία για το ενδεδειγμένο χρονικό διάστημα. Στη μέθοδο ανοικτού θαλάμου, πριν από τη μεταχείριση αφαιρούνται από τον εμπρόσθιο θάλαμο ο δακτύλιος ασφάλισης της θυρίδας και η γυάλινη θυρίδα. Ο μάρτυρας ή η υπό δοκιμή χημική ουσία (750 μl ή ποσότητα της υπό δοκιμή χημικής ουσίας που επαρκεί για την πλήρη κάλυψη του κερατοειδούς) εφαρμόζεται απευθείας στην επιφάνεια του επιθηλίου του κερατοειδούς με τη βοήθεια μικροσιφωνίου. Εάν είναι δύσκολο να αναρροφηθεί η υπό δοκιμή χημική ουσία, μπορεί να εισαχθεί υπό πίεση σε σιφώνιο θετικής εκτόπισης για να διευκολυνθεί η δοσιμέτρηση. Το ρύγχος του σιφωνίου θετικής εκτόπισης εισάγεται στο άκρο έκχυσης της σύριγγας κατά τρόπο ώστε το υλικό να φέρεται υπό πίεση στο ρύγχος εκτόπισης. Ταυτοχρόνως, πιέζεται το έμβολο της σύριγγας ενόσω το έμβολο του σιφωνίου έλκεται προς τα επάνω. Εάν εμφανιστούν φυσαλίδες αέρα στο ρύγχος του σιφωνίου, η υπό δοκιμή ουσία απομακρύνεται (εξωθείται) και η διαδικασία επαναλαμβάνεται έως ότου το ρύγχος πληρωθεί χωρίς να σχηματίζονται φυσαλίδες αέρα. Εάν χρειαστεί, μπορεί να χρησιμοποιηθεί συνήθης σύριγγα (χωρίς βελόνα), η οποία επιτρέπει τη μέτρηση επακριβούς όγκου της υπό δοκιμή χημικής ουσίας και την ευκολότερη εφαρμογή στο επιθήλιο του κερατοειδούς. Μετά τη δοσιμέτρηση, η γυάλινη θυρίδα επανατοποθετείται στον εμπρόσθιο θάλαμο για να δημιουργηθεί εκ νέου κλειστό σύστημα. Επώαση μετά την έκθεση Μετά την παρέλευση του διαστήματος έκθεσης, η υπό δοκιμή χημική ουσία, ο αρνητικός μάρτυρας ή ο θετικός μάρτυρας απομακρύνεται από τον εμπρόσθιο θάλαμο και το επιθήλιο εκπλένεται τουλάχιστον τρεις φορές (ή έως ότου πάψουν να παρατηρούνται οπτικές ενδείξεις παρουσίας της υπό δοκιμή ουσίας) με EMEM (που περιέχει ερυθρό της φαινόλης). Για την έκπλυση χρησιμοποιείται θρεπτικό μέσο που περιέχει ερυθρό της φαινόλης, διότι η αλλαγή του χρώματος του ερυθρού της φαινόλης δείχνει την αποτελεσματικότητα της έκπλυσης όξινων ή αλκαλικών υπό δοκιμή χημικών ουσιών. Οι κερατοειδείς εκπλένονται περισσότερες από τρεις φορές εάν το ερυθρό της φαινόλης εξακολουθεί να αποχρωματίζεται (προς κίτρινο ή ιώδες) ή εάν παραμένει ορατή η υπό δοκιμή χημική ουσία. Όταν η υπό δοκιμή χημική ουσία απομακρυνθεί πλήρως από το θρεπτικό μέσο, οι κερατοειδείς υποβάλλονται σε τελική έκπλυση με EMEM (χωρίς ερυθρό της φαινόλης). Το EMEM (χωρίς ερυθρό της φαινόλης) χρησιμοποιείται ως διάλυμα τελικής έκπλυσης ούτως ώστε να διασφαλίζεται η απομάκρυνση του ερυθρού της φαινόλης από τον εμπρόσθιο θάλαμο πριν από τη μέτρηση της αδιαφάνειας. Στη συνέχεια, ο εμπρόσθιος θάλαμος πληρώνεται εκ νέου με φρέσκο EMEM που δεν περιέχει ερυθρό της φαινόλης. Όσον αφορά τα υγρά και τις επιφανειοδραστικές ουσίες, μετά την έκπλυσή τους οι κερατοειδείς επωάζονται για δύο επιπλέον ώρες στους 32 ± 1 °C. Σε ορισμένες περιπτώσεις ενδέχεται να είναι σκόπιμη η παράταση της επώασης μετά την έκθεση, κάτι το οποίο κρίνεται κατά περίπτωση. Οι κερατοειδείς που υποβάλλονται σε μεταχείριση με στερεά εκπλένονται σχολαστικά στο τέλος του τετράωρου διαστήματος έκθεσης, αλλά δεν απαιτείται περαιτέρω επώαση. Στο τέλος του διαστήματος επώασης μετά την έκθεση σε υγρά και επιφανειοδραστικά και στο τέλος του τετράωρου διαστήματος έκθεσης σε μη επιφανειοδραστικά στερεά, καταγράφεται η αδιαφάνεια και η διαπερατότητα κάθε κερατοειδούς. Επίσης, κάθε κερατοειδής εξετάζεται οπτικά και καταγράφονται οι σχετικές με τη δοκιμή παρατηρήσεις (π.χ. απογύμνωση ιστού, κατάλοιπα της υπό δοκιμή χημικής ουσίας, ανομοιογενής αδιαφάνεια). Οι παρατηρήσεις αυτές είναι πιθανότατα σημαντικές καθώς ενδέχεται να αντικατοπτρίζονται στις διακυμάνσεις των ενδείξεων του αδιαφανομέτρου. Χημικές ουσίες που χρησιμεύουν ως μάρτυρες Σε κάθε πείραμα περιλαμβάνονται παράλληλοι αρνητικοί μάρτυρες ή μάρτυρες με διαλύτη/φορέα και θετικοί μάρτυρες. Κατά τον έλεγχο υγρής ουσίας χωρίς αραίωση, στη μέθοδο δοκιμών BCOP περιλαμβάνεται παράλληλος αρνητικός μάρτυρας (π.χ. διάλυμα χλωριούχου νατρίου 0,9 % ή απεσταγμένο νερό), ούτως ώστε να ανιχνεύονται μη ειδικές αλλαγές στο σύστημα δοκιμής και να παρέχεται γραμμή βάσης για τα τελικά σημεία της δοκιμής. Κατά τον τρόπο αυτό εξασφαλίζεται επίσης ότι οι συνθήκες δοκιμής δεν προκαλούν άτοπη απόκριση ερεθισμού. Κατά τον έλεγχο αραιωμένου υγρού, επιφανειοδραστικής ουσίας ή στερεού, στη μέθοδο δοκιμών BCOP περιλαμβάνεται παράλληλη ομάδα-μάρτυρας με διαλύτη/φορέα, ούτως ώστε να ανιχνεύονται μη ειδικές αλλαγές στο σύστημα δοκιμής και να παρέχεται γραμμή βάσης για τα τελικά σημεία της δοκιμής. Μπορεί να χρησιμοποιείται μόνο διαλύτης/φορέας για τον οποίο έχει αποδειχθεί ότι δεν έχει δυσμενείς επιδράσεις στο σύστημα δοκιμής. Σε κάθε πείραμα περιλαμβάνεται ως παράλληλος θετικός μάρτυρας μια χημική ουσία που είναι γνωστό ότι επάγει θετική απόκριση, για να επαληθεύεται η ακεραιότητα του συστήματος δοκιμής και η ορθή συμπεριφορά του. Για να διασφαλίζεται, ωστόσο, η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης του θετικού μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της απόκρισης ερεθισμού δεν θα πρέπει να είναι υπερβολικό. Παραδείγματα θετικών μαρτύρων για υγρές υπό δοκιμή χημικές ουσίες είναι 100 % αιθανόλη ή 100 % διμεθυλοφορμαμίδιο. Παράδειγμα θετικού μάρτυρα για στερεές υπό δοκιμή χημικές ουσίες είναι το διάλυμα ιμιδαζολίου 20 % (κ.β.) σε διάλυμα χλωριούχου νατρίου 0,9 %. Οι χημικές ουσίες συγκριτικής αξιολόγησης είναι χρήσιμες για την αξιολόγηση του δυναμικού οφθαλμικής ερεθιστικότητας άγνωστων χημικών ουσιών συγκεκριμένης χημικής τάξης ή κατηγορίας προϊόντων ή για την αξιολόγηση του σχετικού δυναμικού ερεθιστικότητας ενός ερεθιστικού των οφθαλμών εντός συγκεκριμένου εύρους αποκρίσεων ερεθισμού. Μετρούμενα τελικά σημεία Η αδιαφάνεια προσδιορίζεται από την ποσότητα φωτός που διέρχεται μέσω του κερατοειδούς. Η αδιαφάνεια του κερατοειδούς μετράται ποσοτικά με τη χρήση αδιαφανομέτρου, με το οποίο λαμβάνονται τιμές αδιαφάνειας μετρούμενες σε συνεχή κλίμακα. Η διαπερατότητα προσδιορίζεται από την ποσότητα χρωστικής νατριούχου φλουορεσκεΐνης που διαπερνά όλες τις κυτταρικές στιβάδες του κερατοειδούς (δηλ. από το επιθήλιο στην εξωτερική επιφάνεια του κερατοειδούς έως το ενδοθήλιο στην εσωτερική επιφάνειά του). Στον εμπρόσθιο θάλαμο της διάταξης συγκράτησης κερατοειδούς, ο οποίος βρίσκεται σε επαφή με το επιθήλιο του κερατοειδούς, προστίθεται 1 ml διαλύματος νατριούχου φλουορεσκεΐνης (4 ή 5 mg/ml κατά τον έλεγχο υγρών και επιφανειοδραστικών ουσιών ή μη επιφανειοδραστικών στερεών, αντιστοίχως), ενώ ο οπίσθιος θάλαμος, που βρίσκεται σε επαφή με το ενδοθήλιο του κερατοειδούς, πληρούται με πρόσφατα παρασκευασμένο EMEM. Η διάταξη συγκράτησης επωάζεται εν συνεχεία σε οριζόντια θέση επί 90 ± 5 min σε θερμοκρασία 32 ± 1 °C. Η ποσότητα νατριούχου φλουορεσκεΐνης που εισέρχεται στον οπίσθιο θάλαμο μετράται ποσοτικά με φασματοφωτομετρία ορατού/υπεριώδους. Οι φασματοφωτομετρικές μετρήσεις που λαμβάνονται στα 490 nm καταγράφονται ως τιμές οπτικής πυκνότητας (OD490) ή απορρόφησης, μετρούμενες σε συνεχή κλίμακα. Οι τιμές διαπερατότητας για τη φλουορεσκεΐνη προσδιορίζονται βάσει των τιμών OD490 που λαμβάνονται με φασματοφωτόμετρο ορατού φωτός με πρότυπο μήκος διαδρομής 1 cm. Εναλλακτικά, μπορεί να χρησιμοποιηθεί συσκευή ανάγνωσης πλακών μικροτιτλοδότησης 96 μικροκοιλοτήτων, υπό τον όρο ότι i) μπορεί να εξακριβωθεί η κλίμακα γραμμικότητας της συσκευής ανάγνωσης πλακών για τον προσδιορισμό τιμών OD490 για τη φλουορεσκεΐνη· και ii) χρησιμοποιείται ο ορθός όγκος δειγμάτων φλουορεσκεΐνης στην πλάκα 96 μικροκοιλοτήτων για την επίτευξη τιμών OD490 ισοδύναμων με το πρότυπο μήκος διαδρομής 1 cm [αυτό απαιτεί ενδεχομένως εντελώς πλήρεις μικροκοιλότητες (συνήθως 360 μL)]. ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Αξιολόγηση των δεδομένων Μετά τη διόρθωση των τιμών αδιαφάνειας και μέσης διαπερατότητας (OD490) για να ληφθούν υπόψη η αδιαφάνεια υποβάθρου και οι τιμές διαπερατότητας OD490 που αντιστοιχούν στον αρνητικό μάρτυρα, οι μέσες τιμές αδιαφάνειας και διαπερατότητας OD490 για κάθε ομάδα μεταχείρισης θα πρέπει να συνδυάζονται σε εμπειρικό τύπο για τον υπολογισμό της βαθμολογίας ερεθιστικότητας in vitro (IVIS) για κάθε ομάδα μεταχείρισης, ως εξής: IVIS = μέση τιμή αδιαφάνειας + (15 × μέση τιμή διαπερατότητας OD490) Οι Sina et al. (16) αναφέρουν ότι ο συγκεκριμένος τύπος προέκυψε στο πλαίσιο ενδοεργαστηριακών και διεργαστηριακών μελετών. Τα δεδομένα που προέκυψαν για μια σειρά 36 ενώσεων στο πλαίσιο πολυεργαστηριακής μελέτης υποβλήθηκαν σε πολυμεταβλητή ανάλυση για τον καθορισμό της εξίσωσης βέλτιστης προσαρμογής δεδομένων in vivo και in vitro. Η ανάλυση αυτή διενεργήθηκε από επιστήμονες δύο διαφορετικών εταιρειών, οι οποίοι κατέληξαν σε σχεδόν ταυτόσημες εξισώσεις. Οι τιμές αδιαφάνειας και διαπερατότητας θα πρέπει επίσης να αξιολογούνται χωριστά, ούτως ώστε να διαπιστώνεται αν η υπό δοκιμή χημική ουσία προκαλεί διαβρωτικότητα ή σοβαρό ερεθισμό μέσω ενός μόνο από τα δύο τελικά σημεία (βλ. κριτήρια απόφασης). Κριτήρια απόφασης Οι τιμές αποκοπής (cut-off values) IVIS για τον χαρακτηρισμό των υπό δοκιμή χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη (κατηγορία 1 του GHS των Ηνωμένων Εθνών) και των υπό δοκιμή χημικών ουσιών για τις οποίες δεν απαιτείται ταξινόμηση ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη («καμίας κατηγορίας» του GHS των Ηνωμένων Εθνών) είναι οι ακόλουθες:
Κριτήρια αποδοχής της μελέτης Μια δοκιμή θεωρείται αποδεκτή εάν για τον θετικό μάρτυρα προκύπτει IVIS που βρίσκεται εντός δύο τυπικών αποκλίσεων από την τρέχουσα ιστορική μέση τιμή, η οποία πρέπει να επικαιροποιείται τουλάχιστον ανά τρίμηνο ή κάθε φορά που εκτελείται αποδεκτή δοκιμή σε εργαστήρια όπου δεν διεξάγονται συχνά δοκιμές (δηλ. με συχνότητα μικρότερη από μία φορά μηνιαίως). Οι αποκρίσεις του αρνητικού μάρτυρα ή του μάρτυρα με διαλύτη/φορέα θα πρέπει να έχουν ως αποτέλεσμα τιμές αδιαφάνειας και διαπερατότητας μικρότερες από τα καθορισμένα ανώτερα όρια τιμών αδιαφάνειας και διαπερατότητας υποβάθρου για βόειους κερατοειδείς που υποβάλλονται σε μεταχείριση με τον αντίστοιχο αρνητικό μάρτυρα ή μάρτυρα με διαλύτη/φορέα. Για τις υπό δοκιμή χημικές ουσίες των οποίων η ταξινόμηση δεν επιδέχεται αμφισβήτηση, αρκεί μία μόνο σειρά μετρήσεων (ένας «γύρος»), αποτελούμενη από τρεις τουλάχιστον κερατοειδείς. Ωστόσο, όταν τα αποτελέσματα της πρώτης σειράς μετρήσεων είναι οριακά, θα πρέπει να εξετάζεται το ενδεχόμενο εκτέλεσης δεύτερης σειράς (χωρίς, ωστόσο, αυτό να είναι υποχρεωτικό) ή ακόμη και τρίτης, σε περίπτωση ασυμφωνίας μεταξύ των μέσων τιμών IVIS των δύο πρώτων σειρών μετρήσεων. Στο πλαίσιο αυτό, ένα αποτέλεσμα πρώτης σειράς μετρήσεων θεωρείται οριακό, εάν οι προβλέψεις από τους 3 κερατοειδείς δεν συμφωνούν μεταξύ τους, με αποτέλεσμα:
Έκθεση δοκιμής Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει τα ακόλουθα στοιχεία, εφόσον αυτά έχουν σημασία για τη διενέργεια της μελέτης:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Ορθότητα : η εγγύτητα της συμφωνίας μεταξύ των αποτελεσμάτων της μεθόδου δοκιμών και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της μεθόδου δοκιμών και μια από τις πτυχές της «καταλληλότητας». Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς τη «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας μεθόδου δοκιμών. Χημική ουσία συγκριτικής αξιολόγησης : χημική ουσία που χρησιμοποιείται ως πρότυπο για σύγκριση με μια υπό δοκιμή χημική ουσία. Οι χημικές ουσίες συγκριτικής αξιολόγησης θα πρέπει να διαθέτουν τις ακόλουθες ιδιότητες: i) σταθερή/-ές και αξιόπιστη/-ες προέλευση/-εις, ii) δομική και λειτουργική ομοιότητα προς τη χημική τάξη των υπό δοκιμή χημικών ουσιών, iii) γνωστά φυσικά/χημικά χαρακτηριστικά, iv) δεδομένα τεκμηρίωσης γνωστών επιδράσεων, και v) γνωστή ισχύ στο εύρος της επιθυμητής απόκρισης. Ανοδική (bottom-up) προσέγγιση : κλιμακωτή προσέγγιση που χρησιμοποιείται για χημικές ουσίες για τις οποίες υπάρχουν υπόνοιες ότι δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη. Η προσέγγιση αυτή αρχίζει με τον προσδιορισμό των χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν (αρνητική έκβαση) με βάση άλλες χημικές ουσίες (θετική έκβαση). Χημικό προϊόν : μια ουσία ή ένα μείγμα. Κερατοειδής : το διαφανές τμήμα του πρόσθιου τμήματος του οφθαλμικού βολβού, το οποίο καλύπτει την ίριδα και την κόρη και επιτρέπει την είσοδο φωτός στο εσωτερικό του οφθαλμού. Αδιαφάνεια κερατοειδούς : μέτρηση του βαθμού θολερότητας του κερατοειδούς κατόπιν έκθεσης στην υπό δοκιμή ουσία. Η αυξημένη αδιαφάνεια είναι ενδεικτική βλάβης του κερατοειδούς. Η αδιαφάνεια αξιολογείται υποκειμενικά, όπως στην οφθαλμική δοκιμή Draize σε κουνέλια, ή αντικειμενικά με όργανο όπως το «αδιαφανόμετρο». Διαπερατότητα κερατοειδούς : ποσοτική μέτρηση της βλάβης στο επιθήλιο του κερατοειδούς μέσω προσδιορισμού της ποσότητας χρωστικής νατριούχου φλουορεσκεΐνης που διέρχεται διαμέσου όλων των κυτταρικών στιβάδων του κερατοειδούς. Οφθαλμικός ερεθισμός : πρόκληση αλλοιώσεων του οφθαλμού, οι οποίες εμφανίζονται μετά την εφαρμογή της υπό δοκιμή χημικής ουσίας στην εμπρόσθια επιφάνειά του και είναι πλήρως αναστρέψιμες εντός 21 ημερών από την εφαρμογή της ουσίας. Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τους όρους «αναστρέψιμες επιδράσεις στους οφθαλμούς» και «κατηγορία 2 του GHS των Ηνωμένων Εθνών» (4). Ποσοστό ψευδοαρνητικής έκβασης : το ποσοστό του συνόλου των θετικών χημικών ουσιών που εσφαλμένα χαρακτηρίζονται ως αρνητικές με μια μέθοδο δοκιμών. Αποτελεί έναν από τους δείκτες επιδόσεων της μεθόδου δοκιμών. Ποσοστό ψευδοθετικής έκβασης : το ποσοστό του συνόλου των αρνητικών χημικών ουσιών που εσφαλμένα χαρακτηρίζονται ως θετικές με μια μέθοδο δοκιμών. Αποτελεί έναν από τους δείκτες επιδόσεων της μεθόδου δοκιμών. Κίνδυνος : εγγενής ιδιότητα ενός παράγοντα ή μιας κατάστασης που μπορεί να έχει δυσμενείς επιδράσεις όταν οργανισμός, σύστημα ή (υπο)πληθυσμός εκτεθεί στον συγκεκριμένο παράγοντα. Βαθμολογία ερεθιστικότητας in vitro (In Vitro Irritancy Score/IVIS) : εμπειρικός τύπος που χρησιμοποιείται στη μέθοδο δοκιμών BCOP και στον οποίο οι μέσες τιμές αδιαφάνειας και διαπερατότητας για κάθε ομάδα μεταχείρισης συνδυάζονται σε ενιαία βαθμολογία in vitro κάθε ομάδας μεταχείρισης. IVIS = μέση τιμή αδιαφάνειας + (15 × μέση τιμή διαπερατότητας). Μη αναστρέψιμες επιδράσεις στους οφθαλμούς : Βλ. «Σοβαρή οφθαλμική βλάβη». Μείγμα : ένα μείγμα ή διάλυμα που αποτελείται από δύο ή περισσότερες ουσίες οι οποίες δεν αντιδρούν μέσα σε αυτό (4). Αρνητικός μάρτυρας : δείγμα επανάληψης (replicate) που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και δεν υποβάλλεται σε μεταχείριση. Το δείγμα αυτό εξετάζεται μαζί με τα δείγματα που έχουν υποβληθεί σε μεταχείριση με την υπό δοκιμή χημική ουσία και με άλλα δείγματα-μάρτυρες, ούτως ώστε να διαπιστώνεται αν ο διαλύτης αλληλεπιδρά με το σύστημα δοκιμής. Δεν ταξινομείται : οι χημικές ουσίες που δεν ταξινομούνται ως ερεθιστικά για τους οφθαλμούς (κατηγορία 2, 2Α ή 2Β του GHS των Ηνωμένων Εθνών) ούτε ως ουσίες που προκαλούν σοβαρή οφθαλμική βλάβη (κατηγορία 1 του GHS των Ηνωμένων Εθνών). Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τον όρο «καμία κατηγορία του GHS των Ηνωμένων Εθνών». Αδιαφανόμετρο : όργανο που χρησιμοποιείται για τη μέτρηση της «αδιαφάνειας του κερατοειδούς» μέσω ποσοτικής αξιολόγησης της ποσότητας του φωτός που διέρχεται από τον κερατοειδή. Το σύνηθες όργανο περιλαμβάνει δύο διαμερίσματα, το καθένα από τα οποία διαθέτει δική του φωτεινή πηγή και φωτοκύτταρο. Το ένα διαμέρισμα χρησιμοποιείται για τον κερατοειδή που έχει υποβληθεί σε μεταχείριση, ενώ το άλλο χρησιμοποιείται για τη βαθμονόμηση και τον μηδενισμό των ενδείξεων του οργάνου. Το φως από έναν λαμπτήρα αλογόνου διοχετεύεται μέσω διαμερίσματος-μάρτυρα (κενός θάλαμος χωρίς θυρίδες ούτε υγρό) σε φωτοκύτταρο και συγκρίνεται με το φως που διοχετεύεται σε φωτοκύτταρο μέσω του πειραματικού διαμερίσματος, το οποίο περικλείει τον θάλαμο που περιέχει τον κερατοειδή. Συγκρίνεται η διαφορά οπτικής διαπερατότητας από τα φωτοκύτταρα και εμφανίζεται σε ψηφιακή οθόνη μια αριθμητική τιμή αδιαφάνειας. Θετικός μάρτυρας : δείγμα επανάληψης που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και υποβάλλεται σε μεταχείριση με χημική ουσία που είναι γνωστό ότι προκαλεί θετική απόκριση. Για να διασφαλίζεται η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης του θετικού μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της θετικής απόκρισης δεν θα πρέπει να είναι υπερβολικό. Αναστρέψιμες επιδράσεις στους οφθαλμούς : Βλ. «Οφθαλμικός ερεθισμός». Αξιοπιστία : μέτρο του βαθμού στον οποίο μια μέθοδος δοκιμών μπορεί να διεξάγεται με υψηλή αναπαραγωγιμότητα διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας, καθώς και της ενδοεργαστηριακής επαναληψιμότητας. Σοβαρή οφθαλμική βλάβη : πρόκληση βλάβης στους οφθαλμικούς ιστούς ή σοβαρής μείωσης της όρασης, κατόπιν εφαρμογής της υπό δοκιμή χημικής ουσίας στην πρόσθια επιφάνεια του οφθαλμού, η οποία δεν είναι πλήρως αναστρέψιμη εντός 21 ημερών από την εφαρμογή. Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τους όρους «μη αναστρέψιμες επιδράσεις στους οφθαλμούς» και «κατηγορία 1 του GHS των Ηνωμένων Εθνών» (4). Μάρτυρας με διαλύτη/φορέα : δείγμα που δεν υποβάλλεται σε μεταχείριση και περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής, συμπεριλαμβανομένου του διαλύτη ή του φορέα. Το δείγμα αυτό υποβάλλεται σε δοκιμή μαζί με τα δείγματα που έχουν υποβληθεί σε μεταχείριση με την υπό δοκιμή χημική ουσία και με άλλα δείγματα-μάρτυρες, με σκοπό τον καθορισμό της βασικής απόκρισης των δειγμάτων που υποβάλλονται σε μεταχείριση με την υπό δοκιμή χημική ουσία διαλυμένη στον ίδιο διαλύτη ή φορέα. Όταν το εν λόγω δείγμα υποβάλλεται σε δοκιμή με παράλληλο αρνητικό μάρτυρα, καταδεικνύει επίσης αν ο διαλύτης ή ο φορέας αλληλεπιδρά με το σύστημα δοκιμής. Ουσία : τα χημικά στοιχεία και οι ενώσεις τους σε φυσική κατάσταση ή όπως λαμβάνονται με οποιαδήποτε παραγωγική διεργασία, στα οποία συμπεριλαμβάνονται όλα τα πρόσθετα που απαιτούνται για να διατηρείται η σταθερότητα του προϊόντος, καθώς και τυχόν προσμείξεις που προκύπτουν από τη χρησιμοποιούμενη διεργασία, αλλά από τα οποία εξαιρούνται οι διαλύτες που είναι δυνατόν να διαχωριστούν χωρίς να επηρεαστεί η σταθερότητα της ουσίας ούτε να μεταβληθεί η σύνθεσή της (4). Επιφανειοδραστική ουσία : ονομάζεται επίσης τασιενεργή ουσία και είναι ουσία, όπως τα απορρυπαντικά, που μπορεί να μειώσει την επιφανειακή τάση ενός υγρού και, ως εκ τούτου, του επιτρέπει να σχηματίζει αφρό ή να διεισδύει σε στερεά· είναι επίσης γνωστή ως διαβρεκτικό μέσο. Μείγμα που περιέχει επιφανειοδραστικές ουσίες : στο πλαίσιο της παρούσας μεθόδου δοκιμών, είναι ένα μείγμα που περιέχει μία ή περισσότερες επιφανειοδραστικές ουσίες σε τελική συγκέντρωση > 5 %. Καθοδική (top-down) προσέγγιση : κλιμακωτή προσέγγιση που χρησιμοποιείται για χημική ουσία για την οποία υπάρχουν υπόνοιες ότι προκαλεί σοβαρή οφθαλμική βλάβη. Η προσέγγιση αυτή αρχίζει με τον προσδιορισμό των χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη (θετικό αποτέλεσμα) σε σχέση με άλλες χημικές ουσίες (αρνητικό αποτέλεσμα). Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Κλιμακωτή στρατηγική δοκιμών : στρατηγική δοκιμών κατά στάδια, στο πλαίσιο της οποίας όλες οι υφιστάμενες πληροφορίες για μια υπό δοκιμή χημική ουσία εξετάζονται με συγκεκριμένη σειρά, με χρήση διαδικασίας βάρους της απόδειξης σε κάθε στάδιο, προκειμένου να διαπιστώνεται, πριν από τη μετάβαση στο επόμενο στάδιο, αν διατίθενται επαρκείς πληροφορίες για να ληφθεί απόφαση περί ταξινόμησης κινδύνου. Εάν σε υπό δοκιμή χημική ουσία μπορεί να αποδοθεί δυναμικό ερεθιστικότητας βάσει των υφιστάμενων πληροφοριών, δεν απαιτούνται περαιτέρω δοκιμές. Εάν βάσει των υφιστάμενων πληροφοριών δεν είναι εφικτή η απόδοση δυναμικού ερεθιστικότητας σε υπό δοκιμή χημική ουσία, εφαρμόζεται κλιμακωτή διαδικασία διαδοχικών δοκιμών σε ζώα έως ότου καταστεί εφικτή η βέβαιη ταξινόμηση της ουσίας. Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων των Ηνωμένων Εθνών (United Nations Globally Harmonized System of Classification and Labelling of Chemicals) (GHS των Ηνωμένων Εθνών) : σύστημα που προτείνει την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων) με βάση τυποποιημένα είδη και βαθμούς φυσικών κινδύνων και κινδύνων για την υγεία και το περιβάλλον και καλύπτει τα αντίστοιχα επικοινωνιακά στοιχεία, όπως εικονογράμματα, προειδοποιητικές λέξεις, δηλώσεις επικινδυνότητας, δηλώσεις προφύλαξης και δελτία δεδομένων ασφαλείας, για τη μετάδοση πληροφοριών σχετικά με τις δυσμενείς επιδράσεις των εν λόγω προϊόντων με σκοπό την προστασία των ανθρώπων (εργοδοτών, εργαζομένων, μεταφορέων, καταναλωτών και διασωστών) και του περιβάλλοντος (4). Κατηγορία 1 του GHS των Ηνωμένων Εθνών : Βλ. «Σοβαρή οφθαλμική βλάβη». Κατηγορία 2 του GHS των Ηνωμένων Εθνών : Βλ. «Οφθαλμικός ερεθισμός». «Καμία κατηγορία» του GHS των Ηνωμένων Εθνών : τα χημικά προϊόντα που δεν πληρούν τις απαιτήσεις για να ταξινομηθούν ως κατηγορίας 1 ή 2 (2Α ή 2Β) του GHS των Ηνωμένων Εθνών. Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τον όρο «δεν ταξινομείται». Επικυρωμένη μέθοδος δοκιμών : μέθοδος δοκιμών για την οποία έχουν ολοκληρωθεί μελέτες επικύρωσης προκειμένου να προσδιοριστούν η καταλληλότητα (συμπεριλαμβανομένης της ορθότητας) και η αξιοπιστία της για συγκεκριμένο σκοπό. Είναι σημαντικό να σημειωθεί ότι οι επιδόσεις μιας επικυρωμένης μεθόδου δοκιμών όσον αφορά την ορθότητα και την αξιοπιστία ενδέχεται να μην επαρκούν για να κριθεί αποδεκτή για τον προτεινόμενο σκοπό. Βάρος της απόδειξης : διαδικασία εξέτασης της ισχύος και των αδυναμιών διαφόρων πληροφοριών για τη συναγωγή και την τεκμηρίωση συμπεράσματος σχετικά με το δυναμικό κινδύνου που ενέχει μια χημική ουσία. Προσάρτημα 2 ΠΡΟΒΛΕΠΤΙΚΗ ΙΚΑΝΟΤΗΤΑ ΤΗΣ ΜΕΘΟΔΟΥ ΔΟΚΙΜΩΝ BCOP Πίνακας 1 Προβλεπτική ικανότητα της μεθόδου δοκιμών BCOP για τον προσδιορισμό χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη [κατ. 1 του GHS των ΗΕ/CLP της ΕΕ 1 έναντι των λοιπών κατηγοριών (κατ. 2 + «καμία κατηγορία»)· κατ. I της EPA των ΗΠΑ έναντι των λοιπών κατηγοριών (κατ. II + κατ. III + κατ. IV)]
Πίνακας 2 Προβλεπτική ικανότητα της μεθόδου δοκιμών BCOP για τον χαρακτηρισμό χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη («μη ερεθιστικά») [«καμία κατηγορία» του GHS των ΗΕ/CLP της ΕΕ έναντι των λοιπών κατηγοριών του (κατ. 1 + κατ. 2)· κατ. IV της ΕΡΑ των ΗΠΑ έναντι των λοιπών κατηγοριών της (κατ. I + κατ. II + κατ. III)]
Προσάρτημα 3 ΟΥΣΙΕΣ ΕΛΕΓΧΟΥ ΙΚΑΝΟΤΗΤΑΣ ΓΙΑ ΤΗ ΜΕΘΟΔΟ ΔΟΚΙΜΩΝ BCOP Πριν εντάξουν την παρούσα μέθοδο δοκιμών στη συνήθη πρακτική τους, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα προσδιορίζοντας σωστά την ταξινόμηση του κινδύνου για τους οφθαλμούς από τις 13 χημικές ουσίες που συνιστώνται στον πίνακα 1. Οι ουσίες αυτές επιλέχθηκαν ως αντιπροσωπευτικές του φάσματος αποκρίσεων όσον αφορά τους κινδύνους για τους οφθαλμούς, με βάση τα αποτελέσματα της οφθαλμικής δοκιμής in vivo σε κουνέλια (TG 405) (17) και το σύστημα ταξινόμησης GHS των Ηνωμένων Εθνών (δηλ. κατηγορίες 1, 2Α, 2Β και «δεν ταξινομείται») (4). Άλλα κριτήρια επιλογής αφορούσαν τη διαθεσιμότητα των χημικών ουσιών στο εμπόριο και την ύπαρξη υψηλής ποιότητας δεδομένων αναφοράς in vivo, καθώς και υψηλής ποιότητας δεδομένων in vitro από τη μέθοδο δοκιμών BCOP. Δεδομένα αναφοράς είναι διαθέσιμα στο απλουστευμένο συνοπτικό έγγραφο (Streamlined Summary Document) (3) και στο έγγραφο επισκόπησης των διαθέσιμων δεδομένων (Background Review Document) της ICCVAM για τη μέθοδο δοκιμών BCOP (2)(18). Πίνακας 1 Συνιστώμενες χημικές ουσίες για την απόδειξη της τεχνικής ικανότητας ως προς τη μέθοδο δοκιμών BCOP
Προσάρτημα 4 ΔΙΑΤΑΞΗ ΣΥΓΚΡΑΤΗΣΗΣ ΚΕΡΑΤΟΕΙΔΟΥΣ ΣΤΟ ΠΛΑΙΣΙΟ ΤΗΣ ΜΕΘΟΔΟΥ ΔΟΚΙΜΩΝ BCOP Οι διατάξεις συγκράτησης κερατοειδούς στο πλαίσιο της μεθόδου δοκιμών BCOP κατασκευάζονται από αδρανές υλικό (π.χ. πολυπροπυλένιο). Οι διατάξεις αποτελούνται από δύο ημίσεα (εμπρόσθιο και οπίσθιο θάλαμο) και διαθέτουν δύο όμοιους κυλινδρικούς εσωτερικούς θαλάμους. Κάθε θάλαμος είναι σχεδιασμένος να έχει χωρητικότητα περίπου 5 ml και καταλήγει σε γυάλινη θυρίδα, μέσω της οποίας καταγράφονται οι μετρήσεις αδιαφάνειας. Καθένας από τους εσωτερικούς θαλάμους έχει διάμετρο 1,7 cm και βάθος 2,2 cm (11). Για την αποφυγή διαρροών χρησιμοποιείται στεγανοποιητικός δακτύλιος στον οπίσθιο θάλαμο. Ο κερατοειδής τοποθετείται με την πλευρά του ενδοθηλίου προς τα κάτω, επάνω στον στεγανοποιητικό δακτύλιο του οπισθίου θαλάμου, ενώ ο εμπρόσθιος θάλαμος τοποθετείται στην πλευρά του επιθηλίου του κερατοειδούς. Οι θάλαμοι συγκρατούνται στη θέση τους με τρεις κοχλίες από ανοξείδωτο χάλυβα που βρίσκονται στα εξωτερικά άκρα τους. Κάθε θάλαμος καταλήγει σε γυάλινη θυρίδα που μπορεί να αποσπάται για εύκολη πρόσβαση στον κερατοειδή. Μεταξύ της γυάλινης θυρίδας και του θαλάμου παρεμβάλλεται επίσης στεγανοποιητικός δακτύλιος για την αποφυγή διαρροών. Δύο οπές στο άνω τμήμα κάθε θαλάμου καθιστούν εφικτή την προσθήκη και αφαίρεση θρεπτικού μέσου και των υπό δοκιμή χημικών ουσιών. Οι οπές αυτές κλείνουν με πώματα από καουτσούκ κατά τη διάρκεια της μεταχείρισης και της επώασης. Η διέλευση του φωτός μέσω των διατάξεων συγκράτησης κερατοειδούς μπορεί να μεταβληθεί, καθώς οι συνέπειες της φθοράς ή της συσσώρευσης ειδικών χημικών καταλοίπων στις οπές των εσωτερικών θαλάμων ή στις γυάλινες θυρίδες μπορούν να επηρεάσουν τη σκέδαση ή την ανάκλαση του φωτός. Το αποτέλεσμα θα μπορούσε να είναι αυξήσεις ή μειώσεις της γραμμής βάσης οπτικής διαπερατότητας των διατάξεων συγκράτησης (και, αντιστρόφως, των ενδείξεων γραμμής βάσης αδιαφάνειας του κερατοειδούς) και να εκδηλώνεται ως σημαντικές αλλαγές στις αναμενόμενες τιμές γραμμής βάσης από τις αρχικές μετρήσεις αδιαφάνειας του κερατοειδούς σε επιμέρους θαλάμους (δηλ. οι αρχικές τιμές αδιαφάνειας του κερατοειδούς σε συγκεκριμένες διατάξεις συγκράτησης κερατοειδούς μπορεί συχνά να διαφέρουν κατά περισσότερο από 2 ή 3 μονάδες αδιαφάνειας από τις αναμενόμενες τιμές γραμμής βάσης). Κάθε εργαστήριο θα πρέπει να εξετάζει το ενδεχόμενο κατάρτισης προγράμματος για την αξιολόγηση των μεταβολών της οπτικής διαπερατότητας των διατάξεων συγκράτησης του κερατοειδούς, ανάλογα με το είδος των υπό δοκιμή χημικών ουσιών και τη συχνότητα χρήσης των θαλάμων. Για τον καθορισμό των τιμών γραμμής βάσης, οι διατάξεις συγκράτησης του κερατοειδούς μπορούν να ελέγχονται πριν από την εισαγωγή τους σε χρήση, με μέτρηση των τιμών γραμμής βάσης αδιαφάνειας (ή οπτικής διαπερατότητας) των θαλάμων, αφού πληρωθούν με πλήρες θρεπτικό μέσο, χωρίς κερατοειδείς. Στη συνέχεια, οι διατάξεις συγκράτησης κερατοειδούς ελέγχονται περιοδικά για να διαπιστωθούν οι μεταβολές της οπτικής διαπερατότητας κατά τις περιόδους χρήσης. Κάθε εργαστήριο μπορεί να καθορίζει τη συχνότητα ελέγχου των διατάξεων συγκράτησης του κερατοειδούς, με βάση τις υπό δοκιμή χημικές ουσίες, τη συχνότητα χρήσης και τις παρατηρήσεις αλλαγών στις τιμές γραμμής βάσης αδιαφάνειας του κερατοειδούς. Εάν παρατηρηθούν αξιοσημείωτες αλλαγές στη διέλευση του φωτός μέσω των διατάξεων συγκράτησης του κερατοειδούς, θα πρέπει να μελετηθούν κατάλληλες διαδικασίες καθαρισμού και/ή στίλβωσης της εσωτερικής επιφάνειας των διατάξεων ή η αντικατάστασή τους. Διάταξη συγκράτησης κερατοειδούς: διάγραμμα σε ανάπτυξη 
Προσάρτημα 5 ΤΟ ΑΔΙΑΦΑΝΟΜΕΤΡΟ Tο αδιαφανόμετρο είναι διάταξη μέτρησης της οπτικής διαπερατότητας. Για παράδειγμα, στην περίπτωση του εξοπλισμό OP-KIT της εταιρείας Electro Design (Riom, Γαλλία), που χρησιμοποιήθηκε για την επικύρωση της μεθόδου δοκιμών BCOP, το φως από έναν λαμπτήρα αλογόνου διοχετεύεται μέσω διαμερίσματος-μάρτυρα (κενός θάλαμος χωρίς θυρίδες ούτε υγρό) σε φωτοκύτταρο και συγκρίνεται με το φως που διοχετεύεται σε φωτοκύτταρο μέσω του πειραματικού διαμερίσματος, το οποίο περικλείει τον θάλαμο που περιέχει τον κερατοειδή. Συγκρίνεται η διαφορά οπτικής διαπερατότητας από τα φωτοκύτταρα και εμφανίζεται σε ψηφιακή οθόνη μια αριθμητική τιμή αδιαφάνειας. εκφραζόμενη σε μονάδες αδιαφάνειας. Επιτρέπεται να χρησιμοποιούνται άλλα είδη αδιαφανόμετρων με διαφορετική διάταξη (π.χ. που δεν απαιτούν παράλληλες μετρήσεις διαμερίσματος-μάρτυρα και πειραματικού διαμερίσματος), εάν αποδειχθεί ότι τα αποτελέσματά τους είναι παρόμοια με εκείνα του επικυρωμένου εξοπλισμού. Το αδιαφανόμετρο θα πρέπει να παρέχει γραμμική απόκριση σε ένα εύρος ενδείξεων αδιαφάνειας το οποίο καλύπτει τις τιμές αποκοπής που χρησιμοποιούνται για τις διάφορες ταξινομήσεις που περιγράφονται στο προγνωστικό μοντέλο (δηλ. έως και την τιμή αποκοπής που καθορίζει τη διαβρωτικότητα/ισχυρή ερεθιστικότητα). Για να διασφαλίζονται η γραμμικότητα και η ορθότητα των ενδείξεων έως τις 75-80 μονάδες αδιαφάνειας, είναι απαραίτητη η βαθμονόμηση του αδιαφανομέτρου με σειρά βαθμονομητών. Οι βαθμονομητές τοποθετούνται στον θάλαμο βαθμονόμησης (θάλαμος της διάταξης συγκράτησης του κερατοειδούς που προορίζεται να φέρει τους βαθμονομητές) και ακολουθεί μέτρηση στο αδιαφανόμετρο. Ο θάλαμος βαθμονόμησης είναι κατασκευασμένος έτσι ώστε να φέρει τους βαθμονομητές στην ίδια περίπου απόσταση μεταξύ της φωτεινής πηγής και του φωτοκυττάρου με εκείνη στην οποία θα βρίσκονται οι κερατοειδείς κατά τη διάρκεια των μετρήσεων αδιαφάνειας. Οι τιμές αναφοράς και το αρχικό σημείο ρύθμισης εξαρτώνται από τον τύπο του εξοπλισμού που χρησιμοποιείται. Η γραμμικότητα των μετρήσεων αδιαφάνειας θα πρέπει να διασφαλίζεται με κατάλληλες διαδικασίες (ειδικές για το όργανο). Για παράδειγμα, στην περίπτωση του εξοπλισμού OP-KIT της εταιρείας Electro Design (Riom, Γαλλία), το αδιαφανόμετρο βαθμονομείται αρχικά σε 0 μονάδες αδιαφάνειας με τη χρήση του θαλάμου βαθμονόμησης χωρίς βαθμονομητή. Κατόπιν, στον θάλαμο βαθμονόμησης τοποθετούνται διαδοχικά τρεις διαφορετικοί βαθμονομητές και μετρώνται οι τιμές αδιαφάνειας. Οι βαθμονομητές 1, 2 και 3 θα πρέπει να δώσουν ενδείξεις αδιαφάνειας ίσες με τις καθορισμένες τιμές των 75, 150 και 225 μονάδων αδιαφάνειας, αντιστοίχως, με απόκλιση ± 5 %. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(13) |
Στο μέρος B, το Κεφάλαιο Β.48 αντικαθίσταται από το ακόλουθο κείμενο: «B.48 Μέθοδος δοκιμών σε απομονωμένους οφθαλμούς ορνιθίων για τον προσδιορισμό i) χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη και ii) χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 438 του ΟΟΣΑ (2013). Η μέθοδος δοκιμών σε απομονωμένους οφθαλμούς ορνιθίων (Isolated Chicken Eye/ICE) αξιολογήθηκε το 2006 και το 2010 από τη Διυπηρεσιακή Συντονιστική Επιτροπή για την Επικύρωση Εναλλακτικών Μεθόδων (ICCVAM) των ΗΠΑ, σε σύμπραξη με το Ευρωπαϊκό Κέντρο για την Επικύρωση Εναλλακτικών Μεθόδων (ECVAM) και το Ιαπωνικό Κέντρο για την Επικύρωση Εναλλακτικών Μεθόδων (JaCVAM) (1)(2). Κατά την πρώτη αξιολόγηση, η μέθοδος ICE εγκρίθηκε ως επιστημονικά έγκυρη μέθοδος δοκιμών προς χρήση ως δοκιμή διαλογής για τον προσδιορισμό χημικών προϊόντων (ουσιών και μειγμάτων) που επάγουν σοβαρή οφθαλμική βλάβη (κατηγορία 1), όπως ορίζονται στο Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων (GHS) των Ηνωμένων Εθνών (1) (2) (4) και στον κανονισμό (ΕΚ) αριθ. 1272/2008 για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων (Classification, Labelling and Packaging/CLP) (12). Κατά τη δεύτερη αξιολόγηση, η μέθοδος δοκιμών ICE αξιολογήθηκε προς χρήση ως δοκιμή διαλογής για τον προσδιορισμό χημικών ουσιών που δεν ταξινομούνται ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη, όπως ορίζονται στο GHS των Ηνωμένων Εθνών (3) (4). Τα αποτελέσματα της μελέτης επικύρωσης και οι συστάσεις της ομάδας αξιολόγησης από ομότιμους κριτές διατήρησαν σε ισχύ την αρχική σύσταση να χρησιμοποιείται η μέθοδος ICE για την ταξινόμηση χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη (κατηγορία 1 του GHS των Ηνωμένων Εθνών), καθώς η διαθέσιμη βάση δεδομένων παρέμεινε αμετάβλητη στο διάστημα που μεσολάβησε από την αρχική επικύρωση από την ICCVAM. Σε εκείνο το στάδιο, δεν διατυπώθηκαν περαιτέρω συστάσεις για επέκταση του πεδίου εφαρμογής της μεθόδου ICE ώστε να συμπεριληφθούν και άλλες κατηγορίες. Το σύνολο δεδομένων in vitro και in vivo που χρησιμοποιήθηκαν στη μελέτη επικύρωσης επαναξιολογήθηκε με έμφαση στην αξιολόγηση της χρησιμότητας της μεθόδου ICE για τον χαρακτηρισμό χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη (5). Η εν λόγω επαναξιολόγηση κατέληξε στο συμπέρασμα ότι η μέθοδος δοκιμών ICE μπορεί επίσης να χρησιμοποιείται για τον χαρακτηρισμό χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό και τη σοβαρή οφθαλμική βλάβη, όπως ορίζονται στο GHS των Ηνωμένων Εθνών (4) (5). Η παρούσα μέθοδος δοκιμών περιλαμβάνει τις συνιστώμενες χρήσεις και τους περιορισμούς της μεθόδου δοκιμών ICE βάσει αυτών των αξιολογήσεων. Οι βασικές διαφορές μεταξύ του αρχικού κειμένου του 2009 και της επικαιροποιημένης έκδοσης του 2013 των κατευθυντήριων γραμμών δοκιμών του ΟΟΣΑ αφορούν, μεταξύ άλλων, τη χρήση της μεθόδου δοκιμών ICE για τον προσδιορισμό χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν σύμφωνα με το σύστημα ταξινόμησης GHS των Ηνωμένων Εθνών, καθώς και επικαιροποίηση των στοιχείων της έκθεσης δοκιμής, του προσαρτήματος 1 με τους ορισμούς και του προσαρτήματος 2 για τις χημικές ουσίες ελέγχου ικανότητας. Επί του παρόντος είναι γενικά αποδεκτό ότι, στο προβλέψιμο μέλλον, καμία μεμονωμένη δοκιμή οφθαλμικού ερεθισμού in vitro δεν θα μπορεί να αντικαταστήσει την in vivo οφθαλμική δοκιμή Draize στην πρόβλεψη σε ολόκληρο το φάσμα ερεθιστικότητας από τις διαφορετικές τάξεις χημικών ουσιών. Εντούτοις, στοχευμένοι συνδυασμοί διαφόρων εναλλακτικών μεθόδων δοκιμών στο πλαίσιο (κλιμακωτής) στρατηγικής δοκιμών θα μπορούσαν ενδεχομένως να αντικαταστήσουν την οφθαλμική δοκιμή Draize (6). Η καθοδική προσέγγιση (top-down) (7) έχει σχεδιαστεί για να χρησιμοποιείται όταν, βάσει των διαθέσιμων πληροφοριών, μια χημική ουσία αναμένεται να έχει υψηλό δυναμικό ερεθιστικότητας, ενώ η ανοδική προσέγγιση (bottom-up) (7) έχει σχεδιαστεί για να χρησιμοποιείται όταν, βάσει των διαθέσιμων πληροφοριών, μια χημική ουσία δεν αναμένεται να προκαλέσει ερεθισμό των οφθαλμών σε βαθμό τέτοιον ώστε να επιβάλλεται η ταξινόμησή της. Η μέθοδος δοκιμών ICE είναι μέθοδος δοκιμών in vitro που μπορεί να χρησιμοποιείται, υπό ορισμένες περιστάσεις και με ειδικούς περιορισμούς, όπως περιγράφεται στις παραγράφους 8 έως 10, για την ταξινόμηση και την επισήμανση των χημικών ουσιών ως προς τον κίνδυνο για τους οφθαλμούς. Αν και δεν θεωρείται έγκυρη ως αυτοτελές υποκατάστατο της οφθαλμικής δοκιμής in vivo σε κουνέλια, η μέθοδος δοκιμών ICE συνιστάται ως πρώτο στάδιο στρατηγικής δοκιμών, όπως η καθοδική προσέγγιση που προτείνουν οι Scott και συν. (7), για τον προσδιορισμό χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη, δηλ. χημικών ουσιών που πρέπει να ταξινομούνται ως κατηγορίας 1 του GHS των Ηνωμένων Εθνών, χωρίς περαιτέρω δοκιμές (4). Η μέθοδος δοκιμών ICE συνιστάται επίσης για τον προσδιορισμό χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη, όπως ορίζονται στο GHS των Ηνωμένων Εθνών («Καμία κατηγορία») (4) και μπορεί, ως εκ τούτου, να χρησιμοποιείται ως αρχικό στάδιο στο πλαίσιο στρατηγικής δοκιμών με ανοδική προσέγγιση (7). Ωστόσο, για τις χημικές ουσίες οι οποίες, όπως προβλέπεται βάσει της μεθόδου δοκιμών ICE, δεν προκαλούν σοβαρή οφθαλμική βλάβη ή δεν ταξινομούνται ως προς τον οφθαλμικό ερεθισμό/τη σοβαρή οφθαλμική βλάβη, θα απαιτούνται πρόσθετες δοκιμές (in vitro και/ή in vivo) για να κριθεί η οριστική τους ταξινόμηση. Επιπλέον, θα πρέπει να ζητείται η γνώμη των αρμόδιων ρυθμιστικών αρχών πριν από τη χρήση της μεθόδου ICE στο πλαίσιο ανοδικής προσέγγισης βάσει άλλων συστημάτων ταξινόμησης εκτός από το GHS των Ηνωμένων Εθνών. Σκοπός της παρούσας μεθόδου δοκιμών είναι η περιγραφή των διαδικασιών που εφαρμόζονται για την αξιολόγηση του δυναμικού οφθαλμικού κινδύνου που ενέχει η υπό δοκιμή ουσία, όπως αυτό μετράται από την ικανότητά της να προκαλεί ή όχι τοξικότητα σε εξορυγμένο οφθαλμό ορνιθίου. Οι τοξικές επιδράσεις στον κερατοειδή μετρώνται με i) ποιοτική αξιολόγηση της αδιαφάνειας, ii) ποιοτική αξιολόγηση της βλάβης στο επιθήλιο βάσει της εφαρμογής φλουορεσκεΐνης στον οφθαλμό (κατακράτηση φλουορεσκεΐνης), iii) ποσοτική μέτρηση της αύξησης του πάχους (οίδημα), και iv) ποιοτική αξιολόγηση της μακροσκοπικής μορφολογικής βλάβης στην επιφάνεια. Οι αξιολογήσεις της αδιαφάνειας, του οιδήματος και της βλάβης του κερατοειδούς κατόπιν έκθεσης στην υπό δοκιμή χημική ουσία διενεργούνται χωριστά και έπειτα συνδυάζονται για την ταξινόμηση της οφθαλμικής ερεθιστικότητας. Οι ορισμοί παρατίθενται στο προσάρτημα 1. ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ Η παρούσα μέθοδος δοκιμών βασίζεται στο πρωτόκολλο που προτείνεται στο έγγραφο καθοδήγησης αριθ. 160 του ΟΟΣΑ (8), το οποίο καταρτίστηκε μετά τη διεθνή μελέτη επικύρωσης της ICCVAM (1) (3) (9), με τη συνεισφορά του Ευρωπαϊκού Κέντρου για την Επικύρωση Εναλλακτικών Μεθόδων, του Ιαπωνικού Κέντρου για την Επικύρωση Εναλλακτικών Μεθόδων και του Τμήματος Τοξικολογίας και Εφαρμοσμένης Φαρμακολογίας του ερευνητικού οργανισμού ΤΝΟ (Κάτω Χώρες). Το πρωτόκολλο βασίζεται σε στοιχεία που ελήφθησαν από δημοσιευμένα πρωτόκολλα, καθώς και στο πρωτόκολλο που χρησιμοποιείται επί του παρόντος από τον οργανισμό TNO (10) (11) (12) (13) (14). Κατά την επικύρωση στην οποία στηρίζεται η παρούσα μέθοδος δοκιμών ελέγχθηκε ένα ευρύ φάσμα χημικών ουσιών και η εμπειρική βάση δεδομένων της μελέτης επικύρωσης καλύπτει 152 χημικά προϊόντα, και συγκεκριμένα 72 ουσίες και 80 μείγματα (5). Η μέθοδος δοκιμών εφαρμόζεται σε στερεά, υγρά, γαλακτώματα και πηκτές. Τα υγρά μπορούν να είναι υδατικά ή μη και τα στερεά μπορεί να είναι υδατοδιαλυτά ή μη. Αέρια και αερολύματα δεν έχουν αξιολογηθεί ακόμη με μελέτη επικύρωσης. Η μέθοδος δοκιμών ICE μπορεί να χρησιμοποιείται για τον προσδιορισμό χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη, δηλ. χημικών ουσιών που πρέπει να ταξινομούνται ως κατηγορίας 1 του GHS των Ηνωμένων Εθνών (4). Οι περιορισμοί που προσδιορίστηκαν για τη μέθοδο δοκιμών ICE, όταν χρησιμοποιείται για τον σκοπό αυτό, βασίζονται στα υψηλά ποσοστά ψευδοθετικής έκβασης για τις αλκοόλες και τα υψηλά ποσοστά ψευδοαρνητικής έκβασης για τα στερεά και τις επιφανειοδραστικές (τασιενεργές) ουσίες (1) (3) (9). Ωστόσο, τα ποσοστά ψευδοαρνητικής έκβασης σε αυτό το πλαίσιο (ουσίες της κατηγορίας 1 του GHS των Ηνωμένων Εθνών που κρίνεται ότι δεν κατατάσσονται στην κατηγορία αυτή) δεν έχουν κρίσιμη σημασία, δεδομένου ότι όλες οι υπό δοκιμή χημικές ουσίες με αρνητικό αποτέλεσμα θα υποβάλλονται στη συνέχεια σε άλλες, επαρκώς επικυρωμένες δοκιμές in vitro ή, ως έσχατη επιλογή, σε δοκιμές σε κουνέλια, ανάλογα με τις κανονιστικές απαιτήσεις, με τη χρήση στρατηγικής διαδοχικών δοκιμών με βάση ανάλυση βάρους της απόδειξης. Θα πρέπει να σημειωθεί ότι τα στερεά μπορεί να οδηγήσουν σε μεταβλητές και ακραίες συνθήκες έκθεσης στην in vivo δοκιμή οφθαλμικού ερεθισμού Draize, με πιθανό αποτέλεσμα άστοχες προβλέψεις του πραγματικού ερεθιστικού τους δυναμικού (15). Οι ερευνητές μπορούν να εξετάζουν το ενδεχόμενο χρήσης της παρούσας μεθόδου δοκιμών για όλους τους τύπους χημικών ουσιών, οπότε και τα θετικά αποτελέσματα θα πρέπει να γίνονται δεκτά ως ενδεικτικά σοβαρής οφθαλμικής βλάβης, δηλ. ταξινόμηση στην κατηγορία 1 του GHS των Ηνωμένων Εθνών χωρίς περαιτέρω δοκιμές. Πάντως, τα θετικά αποτελέσματα που προκύπτουν με αλκοόλες θα πρέπει να ερμηνεύονται με επιφύλαξη, λόγω κινδύνου υπερπρόβλεψης. Όταν η μέθοδος δοκιμών ICE χρησιμοποιείται για τον χαρακτηρισμό χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη (κατηγορία 1 του GHS των Ηνωμένων Εθνών), έχει συνολική ορθότητα 86 % (120/140), ποσοστό ψευδοθετικής έκβασης 6 % (7/113) και ποσοστό ψευδοαρνητικής έκβασης 48 % (13/27), σε σύγκριση με την ταξινόμηση βάσει δεδομένων από τη μέθοδο οφθαλμικών δοκιμών in vivo σε κουνέλια σύμφωνα με το σύστημα ταξινόμησης GHS των Ηνωμένων Εθνών (4) (5). Η μέθοδος δοκιμών ICE μπορεί επίσης να χρησιμοποιείται για τον προσδιορισμό χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη βάσει του συστήματος ταξινόμησης GHS των Ηνωμένων Εθνών (4). Θα πρέπει να ζητείται η γνώμη των αρμόδιων ρυθμιστικών αρχών πριν από τη χρήση της μεθόδου ICE στο πλαίσιο ανοδικής προσέγγισης βάσει άλλων συστημάτων ταξινόμησης. Η παρούσα μέθοδος δοκιμών μπορεί να χρησιμοποιείται για όλους τους τύπους χημικών ουσιών, οπότε και τα αρνητικά αποτελέσματα θα μπορούσαν να γίνουν δεκτά για τη μη ταξινόμηση μιας χημικής ουσίας ως προς τον οφθαλμικό ερεθισμό και τη σοβαρή οφθαλμική βλάβη. Ωστόσο, με βάση ένα αποτέλεσμα από τη βάση δεδομένων επικύρωσης, υπάρχει πιθανότητα υποπρόβλεψης στην περίπτωση των αντιρρυπαντικών επιχρισμάτων που περιέχουν οργανικούς διαλύτες (5). Όταν η μέθοδος δοκιμών ICE χρησιμοποιείται για τον προσδιορισμό χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη, έχει συνολική ορθότητα 82 % (125/152), ποσοστό ψευδοθετικής έκβασης 33 % (26/79) και ποσοστό ψευδοαρνητικής έκβασης 1 % (1/73), σε σύγκριση με την ταξινόμηση βάσει δεδομένων από τη μέθοδο οφθαλμικών δοκιμών in vivo σε κουνέλια σύμφωνα με το σύστημα ταξινόμησης GHS των Ηνωμένων Εθνών (4) (5). Όταν εξαιρούνται από τη βάση δεδομένων ορισμένες κατηγορίες προϊόντων (δηλ. τα αντιρρυπαντικά επιχρίσματα που περιέχουν οργανικούς διαλύτες), η μέθοδος δοκιμών ICE παρουσιάζει ορθότητα 83 % (123/149), ποσοστό ψευδοθετικής έκβασης 33 % (26/78) και ποσοστό ψευδοαρνητικής έκβασης 0 % (0/71) στο σύστημα ταξινόμησης GHS των Ηνωμένων Εθνών (5). Η μέθοδος δοκιμών ICE δεν συνιστάται για τον προσδιορισμό υπό δοκιμή χημικών ουσιών που θα πρέπει να ταξινομηθούν ως ερεθιστικά των οφθαλμών (κατηγορία 2 ή 2Α του GHS των Ηνωμένων Εθνών) ή ως ήπια ερεθιστικά των οφθαλμών (κατηγορία 2Β του GHS των Ηνωμένων Εθνών), λόγω του σημαντικού αριθμού χημικών ουσιών της κατηγορίας 1 του GHS των Ηνωμένων Εθνών που υποταξινομούνται ως κατηγορίας 2, 2Α ή 2Β και χημικών ουσιών «καμίας κατηγορίας» του GHS των Ηνωμένων Εθνών που υπερταξινομούνται ως κατηγορίας 2, 2A ή 2B. Για τον σκοπό αυτό, ενδέχεται να απαιτούνται περαιτέρω δοκιμές με άλλη κατάλληλη μέθοδο. Όλες οι διαδικασίες με οφθαλμούς ορνιθίων θα πρέπει να είναι σύμφωνες προς τους κανονισμούς και τις διαδικασίες που εφαρμόζονται στην εγκατάσταση δοκιμών για τον χειρισμό υλικών ανθρώπινης ή ζωικής προέλευσης, συμπεριλαμβανομένων, μεταξύ άλλων, των ιστών και ιστικών υγρών. Συνιστάται η τήρηση των γενικών εργαστηριακών προφυλάξεων (16). Στη μέθοδο δοκιμών ICE δεν λαμβάνονται υπόψη οι κακώσεις του επιπεφυκότος και της ίριδας που αξιολογούνται στη μέθοδο δοκιμών οφθαλμικής ερεθιστικότητας σε κουνέλια, αλλά εξετάζονται οι επιδράσεις στον κερατοειδή, που είναι ο μείζων παράγων ταξινόμησης in vivo όσον αφορά το GHS των Ηνωμένων Εθνών. Επίσης, μολονότι η αναστρεψιμότητα των βλαβών του κερατοειδούς δεν μπορεί να αξιολογηθεί αυτοτελώς στη μέθοδο δοκιμών ICE, έχει προταθεί ως δυνατότητα, βάσει των οφθαλμικών μελετών σε κουνέλια, η αξιολόγηση του αρχικού βάθους της κάκωσης του κερατοειδούς για την αναγνώριση ορισμένων τύπων μη αναστρέψιμων επιδράσεων (17). Ειδικότερα, απαιτούνται περισσότερες επιστημονικές γνώσεις για να γίνει κατανοητός ο τρόπος με τον οποίο επέρχονται μη αναστρέψιμες επιδράσεις που δεν συνδέονται με μια αρχική σοβαρή κάκωση. Τέλος, η μέθοδος δοκιμών ICE δεν καθιστά εφικτή την αξιολόγηση του δυναμικού συστημικής τοξικότητας που συνδέεται με την έκθεση των οφθαλμών. Η παρούσα μέθοδος δοκιμών θα επικαιροποιείται ανά χρονικά διαστήματα με βάση τις νέες πληροφορίες και τα δεδομένα. Για παράδειγμα, μια ιστοπαθολογική εξέταση ενδέχεται να είναι χρήσιμη όταν απαιτείται πληρέστερος χαρακτηρισμός της βλάβης του κερατοειδούς. Για την αξιολόγηση αυτής της δυνατότητας, συνιστάται στους χρήστες να συντηρούν τους οφθαλμούς και να ετοιμάζουν δείγματα για ιστοπαθολογική εξέταση, που μπορούν να χρησιμοποιηθούν για την ανάπτυξη βάσης δεδομένων και κριτηρίων λήψης αποφάσεων που θα μπορούσαν να βελτιώσουν περαιτέρω την ορθότητα της παρούσας μεθόδου δοκιμών. Ο ΟΟΣΑ έχει εκπονήσει έγγραφο καθοδήγησης σχετικά με τη χρήση των μεθόδων δοκιμών οφθαλμικής τοξικότητας in vitro, το οποίο περιλαμβάνει λεπτομερείς διαδικασίες για τη συλλογή δειγμάτων ιστοπαθολογικής εξέτασης και πληροφορίες σχετικά με την υποβολή δειγμάτων και/ή ιστοπαθολογικών δεδομένων (8). Τα εργαστήρια που διεξάγουν για πρώτη φορά την παρούσα δοκιμή θα πρέπει να χρησιμοποιούν τις χημικές ουσίες ελέγχου ικανότητας που προβλέπονται στο προσάρτημα 2. Ένα εργαστήριο μπορεί να χρησιμοποιεί αυτές τις χημικές ουσίες για να αποδείξει την τεχνική ικανότητά του όσον αφορά την εφαρμογή της μεθόδου δοκιμών ICE, πριν από την υποβολή δεδομένων που προέρχονται από αυτήν για ταξινόμηση κινδύνων βάσει κανονιστικών ρυθμίσεων. ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ Η μέθοδος δοκιμών ICE είναι οργανοτυπικό μοντέλο που εξασφαλίζει βραχυπρόθεσμη διατήρηση των οφθαλμών ορνιθίων in vitro. Στη συγκεκριμένη μέθοδο δοκιμών, η βλάβη που προκαλείται από την υπό δοκιμή χημική ουσία εκτιμάται μέσω προσδιορισμού του οιδήματος και της αδιαφάνειας του κερατοειδούς, καθώς και της κατακράτησης φλουορεσκεΐνης. Με τις δύο τελευταίες παραμέτρους επιτυγχάνεται ποιοτική εκτίμηση, ενώ η ανάλυση του οιδήματος του κερατοειδούς παρέχει ποσοτική εκτίμηση. Κάθε μέτρηση είτε μετατρέπεται σε ποσοτική βαθμολογία που χρησιμοποιείται για τον υπολογισμό συνολικού δείκτη ερεθισμού είτε κατατάσσεται σε ποιοτική κατηγορία, η οποία χρησιμοποιείται για ταξινόμηση ως προς τον οφθαλμικό κίνδυνο in vitro στην κατηγορία 1 ή στην κατηγορία «Δεν ταξινομείται» του GHS των Ηνωμένων Εθνών. Καθεμία από αυτές τις εκβάσεις μπορεί στη συνέχεια να χρησιμοποιηθεί για να προβλεφθεί ότι η υπό δοκιμή χημική ουσία μπορεί να προκαλέσει σοβαρή οφθαλμική βλάβη in vivo ή ότι δεν επιβάλλεται να ταξινομηθεί ως προς τον κίνδυνο για τους οφθαλμούς (βλ. κριτήρια απόφασης). Ωστόσο, δεν είναι δυνατή η ταξινόμηση των χημικών ουσιών για τις οποίες δεν προβλέπεται ότι προκαλούν σοβαρή οφθαλμική βλάβη ή δεν ταξινομούνται με τη μέθοδο δοκιμών ICE (βλ. παράγραφο 11). Προέλευση και ηλικία των οφθαλμών ορνιθίων Έχει παγιωθεί ιστορικά η χρήση, για την παρούσα δοκιμή, οφθαλμών που συλλέγονται από ορνίθια που θανατώνονται σε σφαγείο για κατανάλωση από τον άνθρωπο, γεγονός που συνεπάγεται ότι δεν απαιτείται η χρήση πειραματόζωων. Χρησιμοποιούνται μόνο οφθαλμοί υγιών ζώων που θεωρούνται κατάλληλα για είσοδο στην ανθρώπινη τροφική αλυσίδα. Αν και δεν έχει διεξαχθεί ελεγχόμενη μελέτη για την αξιολόγηση της βέλτιστης ηλικίας των ορνιθίων, στη συγκεκριμένη μέθοδο δοκιμής χρησιμοποιούνται κατά παράδοση νεαρά ορνίθια που οδηγούνται συνήθως σε σφαγείο πουλερικών (ηλικίας περίπου 7 εβδομάδων και βάρους 1,5-2,5 kg). Συλλογή και μεταφορά των οφθαλμών στο εργαστήριο Οι κεφαλές θα πρέπει να αφαιρούνται αμέσως μετά την αναισθητοποίηση των ορνιθίων, συνήθως με ηλεκτροπληξία, και την τομή στον τράχηλο για αφαίμαξη. Τα ορνίθια θα πρέπει να προέρχονται από τοπική πηγή κοντά στο εργαστήριο, ώστε οι κεφαλές τους να μεταφέρονται ταχέως από το σφαγείο στο εργαστήριο για να ελαχιστοποιείται η φθορά ή/και η βακτηριακή μόλυνση. Το χρονικό διάστημα που μεσολαβεί μεταξύ της συλλογής των κεφαλών των ορνιθίων και της τοποθέτησης των οφθαλμών στον θάλαμο υπερδιαπότισης μετά την εξόρυξη θα πρέπει να περιορίζεται στο ελάχιστο δυνατό (κατά κανόνα δύο ώρες), ώστε να διασφαλίζεται η εκπλήρωση των κριτηρίων αποδοχής της δοκιμής. Όλοι οι οφθαλμοί που χρησιμοποιούνται στη δοκιμή θα πρέπει να προέρχονται από την ίδια ομάδα οφθαλμών που συλλέχθηκαν συγκεκριμένη ημέρα. Επειδή οι οφθαλμοί ανατέμνονται στο εργαστήριο, οι κεφαλές μεταφέρονται από το σφαγείο άθικτες, σε θερμοκρασία περιβάλλοντος (κατά κανόνα μεταξύ 18 °C και 25 °C, μέσα σε πλαστικά δοχεία που υγραίνονται με απορροφητικό χαρτί εμποτισμένο με ισότονο αλατούχο διάλυμα (φυσιολογικό ορό). Κριτήρια επιλογής και αριθμός οφθαλμών που χρησιμοποιούνται στη δοκιμή ICE Οι οφθαλμοί με υψηλή αρχική χρώση φλουορεσκεΐνης (> 0,5) ή τη βαθμολογία αδιαφάνειας κερατοειδούς (> 0,5) μετά την εξόρυξή τους, απορρίπτονται. Κάθε ομάδα μεταχείρισης και ομάδα παράλληλων θετικών μαρτύρων αποτελείται από τρεις τουλάχιστον οφθαλμούς. Η ομάδα αρνητικών μαρτύρων ή μαρτύρων με διαλύτη (εάν δεν χρησιμοποιείται φυσιολογικός ορός ως διαλύτης) αποτελείται από τουλάχιστον έναν οφθαλμό. Όταν η έκβαση της δοκιμής στερεών υλικών είναι «Δεν ταξινομείται» βάσει του GHS, συνιστάται δεύτερη δοκιμή με τρεις οφθαλμούς για την επιβεβαίωση ή την απόρριψη της αρνητικής έκβασης. ΔΙΑΔΙΚΑΣΙΑ Προετοιμασία των οφθαλμών Τα βλέφαρα εκτέμνονται προσεκτικά κατά τρόπο ώστε να μην προκληθεί βλάβη στον κερατοειδή. Η ακεραιότητα του κερατοειδούς αξιολογείται ταχέως με την ενστάλαξη μιας σταγόνας νατριούχου φλουορεσκεΐνης 2 % (κ.β.) στην επιφάνεια του κερατοειδούς για λίγα δευτερόλεπτα, ακολουθούμενη από έκπλυση του κερατοειδούς με ισότονο αλατούχο διάλυμα. Οι οφθαλμοί που έχουν υποβληθεί σε μεταχείριση με φλουορεσκεΐνη εξετάζονται με σχισμοειδή λυχνία για να διαπιστώνεται αν είναι άθικτος ο κερατοειδής (βαθμολογίες κατακράτησης φλουορεσκεΐνης και αδιαφάνειας κερατοειδούς ≤ 0,5). Εάν ο κερατοειδής είναι άθικτος, ο οφθαλμός ανατέμνεται περαιτέρω από το κρανίο με προσοχή, ώστε να μην προκληθεί βλάβη στον κερατοειδή. Ο βολβός απομακρύνεται από τον οφθαλμικό κόγχο με χειρουργική λαβίδα, με την οποία συγκρατείται σταθερά η σκαρδαμυκτική μεμβράνη ενώ αποκόπτονται οι οφθαλμικοί μύες με κυρτό αμβλύ ψαλίδι. Είναι σημαντικό να αποφεύγεται η άσκηση υπερβολικής πίεσης ώστε να μην προκαλείται βλάβη στον κερατοειδή (τεχνητά σφάλματα λόγω συμπίεσης). Κατά την απόσπαση του οφθαλμού από τον οφθαλμικό κόγχο πρέπει να παραμένει συνδεδεμένο ένα ορατό τμήμα του οπτικού νεύρου. Μετά την αφαίρεσή του από τον οφθαλμικό κόγχο, ο οφθαλμός τοποθετείται σε απορροφητικό επίθεμα και αποκόπτονται η σκαρδαμυκτική μεμβράνη και ο λοιπός συνδετικός ιστός. Ο εξορυγμένος οφθαλμός στερεώνεται σε σφιγκτήρα από ανοξείδωτο χάλυβα με τον κερατοειδή σε κατακόρυφη θέση. Ο σφιγκτήρας μεταφέρεται εν συνεχεία σε θάλαμο της συσκευής υπερδιαπότισης (18). Οι σφιγκτήρες θα πρέπει να τοποθετούνται στη συσκευή υπερδιαπότισης κατά τρόπο ώστε ολόκληρος ο κερατοειδής να αρδεύεται με τη στάγδην παροχή ισότονου αλατούχου διαλύματος (3-4 σταγόνες ανά λεπτό ή 0,1-0,15 ml/min). Η θερμοκρασία των θαλάμων της συσκευής υπερδιαπότισης θα πρέπει να είναι ελεγχόμενη και να ρυθμίζεται στους 32 ± 1,5 °C. Στο προσάρτημα 3 παρατίθεται διάγραμμα τυπικής συσκευής υπερδιαπότισης και σφιγκτήρων για οφθαλμούς, που κυκλοφορούν στο εμπόριο ή κατασκευάζονται κατά παραγγελία. Η συσκευή μπορεί να τροποποιείται ώστε να προσαρμόζεται στις ανάγκες του εκάστοτε εργαστηρίου (π.χ. να δέχεται διαφορετικό αριθμό οφθαλμών). Μετά την τοποθέτησή τους στη συσκευή υπερδιαπότισης, οι οφθαλμοί επανεξετάζονται με σχισμοειδή λυχνία για να διαπιστωθεί ότι δεν υπέστησαν βλάβη κατά τη διαδικασία ανατομής. Παράλληλα, θα πρέπει επίσης να μετράται το πάχος του κερατοειδούς στην κορυφή του με το παχύμετρο της σχισμοειδούς λυχνίας. Οι οφθαλμοί με i) βαθμολογία κατακράτησης φλουορεσκεΐνης > 0,5, ii) αδιαφάνεια κερατοειδούς > 0,5 ή iii) άλλες ενδείξεις βλάβης θα πρέπει να αντικαθίστανται. Από τους οφθαλμούς που δεν απορρίπτονται λόγω οποιουδήποτε από αυτά τα κριτήρια, κάθε οφθαλμός με πάχος κερατοειδούς που αποκλίνει κατά περισσότερο από 10 % από τη μέση τιμή του συνόλου των οφθαλμών πρέπει να απορρίπτεται. Οι χρήστες θα πρέπει να γνωρίζουν ότι η ένδειξη της σχισμοειδούς λυχνίας για το πάχος του κερατοειδούς μπορεί να διαφέρει ανάλογα με τη ρύθμιση του πλάτους της σχισμής. Το πλάτος της σχισμής πρέπει να ρυθμίζεται στα 0,095 mm. Όταν όλοι οι οφθαλμοί έχουν εξεταστεί και εγκριθεί, επωάζονται επί 45 έως 60 λεπτά περίπου για την εξισορρόπησή τους με το σύστημα δοκιμής πριν από τη χορήγηση της δόσης. Μετά την παρέλευση του διαστήματος εξισορρόπησης, καταγράφεται η μηδενική μέτρηση αναφοράς ως γραμμή βάσης του πάχους και της αδιαφάνειας του κερατοειδούς (δηλ. χρόνος = 0). Η βαθμολογία κατακράτησης φλουορεσκεΐνης κατά την ανατομή χρησιμοποιείται ως γραμμή βάσης για το συγκεκριμένο τελικό σημείο. Εφαρμογή της υπό δοκιμή χημικής ουσίας Αμέσως μετά τις μηδενικές μετρήσεις αναφοράς, ο οφθαλμός (με τη διάταξη που τον συγκρατεί) απομακρύνεται από τη συσκευή υπερδιαπότισης και τοποθετείται σε οριζόντια θέση και η υπό δοκιμή χημική ουσία εφαρμόζεται στον κερατοειδή. Οι υγρές υπό δοκιμή χημικές ουσίες υποβάλλονται κατά κανόνα σε δοκιμή χωρίς αραίωση, αλλά μπορούν να αραιωθούν, εάν κριθεί απαραίτητο (π.χ. στο πλαίσιο του σχεδιασμού της μελέτης). Ο προτιμώμενος διαλύτης για την αραίωση των υπό δοκιμή χημικών ουσιών είναι ο φυσιολογικός ορός. Μπορούν πάντως να χρησιμοποιούνται και εναλλακτικοί διαλύτες υπό ελεγχόμενες συνθήκες, αλλά πρέπει να αποδεικνύεται η καταλληλότητά τους. Οι υγρές υπό δοκιμή ουσίες εφαρμόζονται στον κερατοειδή κατά τρόπο ώστε να καλύπτουν ομοιογενώς ολόκληρη την επιφάνειά του. Ο τυπικός όγκος είναι 0,03 ml. Εάν είναι εφικτό, οι στερεές ουσίες θα πρέπει να κονιοποιούνται σε όσο το δυνατόν λεπτότερη σκόνη σε ιγδίο με ύπερο ή με συγκρίσιμο εργαλείο άλεσης. Η σκόνη εφαρμόζεται στον κερατοειδή κατά τρόπο ώστε η υπό δοκιμή χημική ουσία να καλύπτει ομοιόμορφα την επιφάνειά του. Η τυπική ποσότητα είναι 0,03 g. Η υπό δοκιμή χημική ουσία (υγρή ή στερεά) εφαρμόζεται επί 10 δευτερόλεπτα και στη συνέχεια εκπλένεται από τον οφθαλμό με ισότονο αλατούχο διάλυμα (περίπου 20 ml) σε θερμοκρασία περιβάλλοντος. Ακολούθως, ο οφθαλμός (με τη διάταξη που τον συγκρατεί) επαναφέρεται στη συσκευή υπερδιαπότισης στην αρχική κατακόρυφη θέση. Σε περίπτωση ανάγκης, μπορεί να πραγματοποιηθεί συμπληρωματική έκπλυση μετά την εφαρμογή επί 10 δευτερόλεπτα, καθώς και σε μεταγενέστερες χρονικές στιγμές (π.χ. όταν εντοπίζονται υπολείμματα της υπό δοκιμή χημικής ουσίας στον κερατοειδή). Γενικά,, η επιπλέον ποσότητα αλατούχου διαλύματος που χρησιμοποιείται για έκπλυση δεν είναι κρίσιμης σημασίας, ενώ αντίθετα είναι σημαντική η παρατήρηση προσκόλλησης της χημικής ουσίας στον κερατοειδή. Χημικές ουσίες που χρησιμεύουν ως μάρτυρες Κάθε πείραμα πρέπει να περιλαμβάνει παράλληλους αρνητικούς μάρτυρες ή μάρτυρες με διαλύτη/φορέα και θετικούς μάρτυρες. Κατά τη δοκιμή υγρών χωρίς αραίωση ή στερεών, ως παράλληλος αρνητικός μάρτυρας στη μέθοδο δοκιμών ICE χρησιμοποιείται φυσιολογικός ορός για την ανίχνευση μη ειδικών αλλαγών στο σύστημα δοκιμής και για να εξασφαλίζεται ότι οι συνθήκες προσδιορισμού δεν προκαλούν άτοπη απόκριση ερεθισμού. Κατά τη δοκιμή αραιωμένων υγρών, στη μέθοδο δοκιμών περιλαμβάνεται ομάδα παράλληλων μαρτύρων με διαλύτη/φορέα για την ανίχνευση μη ειδικών αλλαγών στο σύστημα δοκιμής και για να εξασφαλίζεται ότι οι συνθήκες προσδιορισμού δεν προκαλούν άτοπη απόκριση ερεθισμού. Όπως αναφέρεται στην παράγραφο 31, μπορεί να χρησιμοποιείται μόνο διαλύτης/φορέας για τον οποίο έχει αποδειχθεί ότι δεν έχει δυσμενείς επιδράσεις στο σύστημα δοκιμής. Σε κάθε πείραμα περιλαμβάνεται γνωστό ερεθιστικό των οφθαλμών ως παράλληλος θετικός μάρτυρας ούτως ώστε να επιβεβαιώνεται η πρόκληση της κατάλληλης απόκρισης. Δεδομένου ότι ο προσδιορισμός ICE χρησιμοποιείται στην παρούσα μέθοδο δοκιμών για τον προσδιορισμό διαβρωτικών ή ισχυρών ερεθιστικών, ο θετικός μάρτυρας θα πρέπει να είναι χημική ουσία αναφοράς που επάγει σοβαρή απόκριση με αυτή τη μέθοδο. Ωστόσο, για να διασφαλιστεί η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης στον θετικό μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της σοβαρής απόκρισης δεν θα πρέπει να είναι υπερβολικό. Θα πρέπει να συγκεντρώνονται επαρκή δεδομένα in vitro για τον θετικό μάρτυρα, ώστε να είναι εφικτός ο υπολογισμός στατιστικά καθορισμένου αποδεκτού εύρους αποκρίσεων σε αυτόν. Εάν για συγκεκριμένο θετικό μάρτυρα δεν διατίθενται επαρκή ιστορικά δεδομένα προερχόμενα από τη μέθοδο δοκιμών ICE, ενδέχεται να χρειάζεται η διεξαγωγή μελετών για την απόκτηση αυτών των στοιχείων. Παραδείγματα θετικών μαρτύρων για υγρές υπό δοκιμή χημικές ουσίες είναι το οξικό οξύ 10 % και το χλωριούχο βενζαλκόνιο 5 %, ενώ παραδείγματα θετικών μαρτύρων για στερεές υπό δοκιμή χημικές ουσίες είναι το υδροξείδιο του νατρίου και το ιμιδαζόλιο. Οι χημικές ουσίες συγκριτικής αξιολόγησης είναι χρήσιμες για την αξιολόγηση του δυναμικού οφθαλμικής ερεθιστικότητας άγνωστων χημικών ουσιών συγκεκριμένης χημικής τάξης ή κατηγορίας προϊόντων ή για την αξιολόγηση του σχετικού δυναμικού ερεθιστικότητας ενός ερεθιστικού των οφθαλμών εντός συγκεκριμένου εύρους αποκρίσεων ερεθισμού. Μετρούμενα τελικά σημεία Κερατοειδείς αξιολογούνται πριν από τη μεταχείριση και στα 30, 75, 120, 180 και 240 λεπτά (± 5 λεπτά) μετά την έκπλυση που ακολουθεί τη μεταχείριση. Τα χρονικά αυτά σημεία εξασφαλίζουν επαρκή αριθμό μετρήσεων κατά τη διάρκεια της τετράωρης μεταχείρισης, παρέχοντας παράλληλα επαρκή χρονικά περιθώρια μεταξύ των μετρήσεων ώστε να γίνουν οι απαραίτητες παρατηρήσεις σε όλους τους οφθαλμούς. Τα αξιολογούμενα τελικά σημεία είναι η αδιαφάνεια και το οίδημα του κερατοειδούς, η κατακράτηση φλουορεσκεΐνης και οι μορφολογικές επιδράσεις (π.χ. εντύπωμα ή χαλάρωση του επιθηλίου). Όλα τα τελικά σημεία προσδιορίζονται σε καθένα από τα ανωτέρω χρονικά σημεία με εξαίρεση την κατακράτηση φλουορεσκεΐνης (η οποία προσδιορίζεται μόνο πριν από τη μεταχείριση και 30 λεπτά μετά την έκθεση στην υπό δοκιμή χημική ουσία). Συνιστάται η λήψη φωτογραφιών για την τεκμηρίωση της αδιαφάνειας του κερατοειδούς, της κατακράτησης φλουορεσκεΐνης, των μορφολογικών επιδράσεων και, εάν διενεργείται, της παθολογοανατομικής εξέτασης. Μετά την τελική εξέταση στις τέσσερις ώρες, συνιστάται στους χρήστες να διατηρούν τους οφθαλμούς σε κατάλληλο υλικό μονιμοποίησης [π.χ. ουδέτερο ρυθμιστικό διάλυμα φορμαλδεΰδης (φορμόλη)] για πιθανή ιστολογική εξέταση [βλ. παράγραφο 14 και βιβλιογραφική παραπομπή (8) για λεπτομέρειες]. Το οίδημα του κερατοειδούς προσδιορίζεται βάσει μετρήσεων του πάχους του κερατοειδούς με οπτικό παχύμετρο σε σχισμοειδή λυχνία, εκφράζεται ως ποσοστό επί τοις εκατό και υπολογίζεται βάσει του ακόλουθου τύπου:
Υπολογίζεται το μέσο ποσοστό οιδήματος του κερατοειδούς για όλους τους οφθαλμούς της δοκιμής και για όλα τα χρονικά σημεία παρατήρησης. Βάσει της υψηλότερης μέσης βαθμολογίας οιδήματος του κερατοειδούς, όπως παρατηρείται ανεξαρτήτως χρονικού σημείου, συνάγεται συνολική βαθμολογία κατηγορίας για κάθε υπό δοκιμή χημική ουσία (βλ. παράγραφο 51). Η αδιαφάνεια του κερατοειδούς αξιολογείται στην κερατοειδική περιοχή με τη μέγιστη θολερότητα για να βαθμολογηθεί όπως εμφαίνεται στον πίνακα 1. Υπολογίζεται η μέση τιμή αδιαφάνειας κερατοειδούς για όλους τους οφθαλμούς της δοκιμής και για όλα τα χρονικά σημεία παρατήρησης. Βάσει της υψηλότερης μέσης βαθμολογίας της αδιαφάνειας του κερατοειδούς, όπως παρατηρείται ανεξαρτήτως χρονικού σημείου, εξάγεται συνολική βαθμολογία κατηγορίας για κάθε υπό δοκιμή χημική ουσία (βλ. παράγραφο 51). Πίνακας 1 Βαθμολογία αδιαφάνειας κερατοειδούς
Η κατακράτηση φλουορεσκεΐνης αξιολογείται κατά τον χρόνο παρατήρησης των 30 λεπτών, όπως εμφαίνεται στον πίνακα 2. Η μέση τιμή κατακράτησης φλουορεσκεΐνης για όλους τους οφθαλμούς της δοκιμής υπολογίζεται στο χρονικό σημείο παρατήρησης των 30 λεπτών και χρησιμοποιείται για να εξαχθεί συνολική βαθμολογία κατηγορίας για κάθε υπό δοκιμή χημική ουσία (βλ. παράγραφο Πίνακας 2 Βαθμολογία κατακράτησης φλουορεσκεΐνης
Στις μορφολογικές επιδράσεις περιλαμβάνεται το «εντύπωμα» των κερατοειδικών επιθηλιακών κυττάρων, η «χαλάρωση» του επιθηλίου, η «τράχυνση» της επιφάνειας του κερατοειδούς και η «προσκόλληση» της υπό δοκιμή χημικής ουσίας στον κερατοειδή. Τα ευρήματα αυτά ποικίλλουν σε σοβαρότητα και ενδέχεται να παρατηρούνται ταυτόχρονα. Η ταξινόμησή τους είναι υποκειμενική ανάλογα με την ερμηνεία του ερευνητή. ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Αξιολόγηση των δεδομένων Τα αποτελέσματα του προσδιορισμού της κερατοειδικής αδιαφάνειας, του οιδήματος του κερατοειδούς και της κατακράτησης φλουορεσκεΐνης θα πρέπει να αξιολογούνται χωριστά ώστε να προκύπτει κατηγορία ICE για κάθε τελικό σημείο. Ακολούθως, οι κατηγορίες ICE για κάθε τελικό σημείο συνδυάζονται για την ταξινόμηση της ερεθιστικότητας κάθε υπό έλεγχο χημικής ουσίας. Κριτήρια απόφασης Μετά την αξιολόγηση κάθε τελικού σημείου, είναι εφικτή η κατάταξη σε κατηγορίες ICE βάσει προκαθορισμένου εύρους. Η ερμηνεία του οιδήματος του κερατοειδούς (πίνακας 3), της αδιαφάνειάς του (πίνακας 4) και της κατακράτησης φλουορεσκεΐνης (πίνακας 5) βάσει τεσσάρων κατηγοριών ICE πραγματοποιείται σύμφωνα με τις κλίμακες που παρατίθενται παρακάτω. Επισημαίνεται ότι η βαθμολογία οιδήματος του κερατοειδούς που εμφαίνεται στον πίνακα 3 ισχύει μόνο εάν το πάχος μετράται με μικροσκόπιο σχισμοειδούς λυχνίας (π.χ. Haag-Streit BP 900), με παχύμετρο αριθ. 1 και ρύθμιση του πλάτους σχισμής στο 9 Πίνακας 3 Κριτήρια ταξινόμησης ICE για το οίδημα του κερατοειδούς
Πίνακας 4 Κριτήρια ταξινόμησης ICE για την αδιαφάνεια
Πίνακας 5 Κριτήρια ταξινόμησης ICE για τη μέση κατακράτηση φλουορεσκεΐνης
Η ταξινόμηση in vitro της υπό δοκιμή χημικής ουσίας καθορίζεται από την κατηγορία του GHS που αντιστοιχεί στον συνδυασμό των κατηγοριών που προκύπτουν για το οίδημα του κερατοειδούς, την κερατοειδική αδιαφάνεια και την κατακράτηση φλουορεσκεΐνης, όπως περιγράφεται στον πίνακα 6. Πίνακας 6 Συνολική in vitro ταξινόμηση
Κριτήρια αποδοχής της μελέτης Μια δοκιμή θεωρείται αποδεκτή εάν οι παράλληλοι αρνητικοί μάρτυρες ή μάρτυρες με φορέα/διαλύτη και οι παράλληλοι θετικοί μάρτυρες ταξινομούνται ως «Καμίας κατηγορίας» του GHS και κατηγορίας 1 του GHS αντίστοιχα. Έκθεση δοκιμής Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει τα ακόλουθα στοιχεία, εφόσον αυτά έχουν σημασία για τη διενέργεια της μελέτης:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Ορθότητα : η εγγύτητα της συμφωνίας μεταξύ των αποτελεσμάτων της μεθόδου δοκιμών και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της μεθόδου δοκιμών και μια από τις πτυχές της «καταλληλότητας». Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς τη «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας μεθόδου δοκιμών. Χημική ουσία συγκριτικής αξιολόγησης : χημική ουσία που χρησιμοποιείται ως πρότυπο για σύγκριση με μια υπό δοκιμή χημική ουσία. Οι χημικές ουσίες συγκριτικής αξιολόγησης θα πρέπει να διαθέτουν τις ακόλουθες ιδιότητες: i) σταθερή/-ές και αξιόπιστη/-ες προέλευση/-εις, ii) δομική και λειτουργική ομοιότητα προς τη χημική τάξη των υπό δοκιμή χημικών ουσιών, iii) γνωστά φυσικά/χημικά χαρακτηριστικά, iv) δεδομένα τεκμηρίωσης γνωστών επιδράσεων και (v) γνωστή ισχύ στο εύρος της επιθυμητής απόκρισης. Ανοδική (bottom-up) προσέγγιση : κλιμακωτή προσέγγιση που χρησιμοποιείται για χημικές ουσίες για τις οποίες υπάρχουν υπόνοιες ότι δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη. Η προσέγγιση αυτή αρχίζει με τον προσδιορισμό των χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν (αρνητική έκβαση) με βάση άλλες χημικές ουσίες (θετική έκβαση). Χημικό προϊόν : μια ουσία ή ένα μείγμα. Κερατοειδής : το διαφανές τμήμα του πρόσθιου τμήματος του οφθαλμικού βολβού, το οποίο καλύπτει την ίριδα και την κόρη και επιτρέπει την είσοδο φωτός στο εσωτερικό του οφθαλμού. Αδιαφάνεια κερατοειδούς : μέτρηση του βαθμού θολερότητας του κερατοειδούς κατόπιν έκθεσης στην υπό δοκιμή ουσία. Η αυξημένη αδιαφάνεια είναι ενδεικτική βλάβης του κερατοειδούς. Οίδημα κερατοειδούς : αντικειμενική μέτρηση, στο πλαίσιο της δοκιμής ICE, του βαθμού διάτασης του κερατοειδούς κατόπιν έκθεσης σε υπό δοκιμή χημική ουσία. Εκφράζεται ως ποσοστό επί τοις εκατό και υπολογίζεται βάσει των αρχικών (πριν τη χορήγηση δόσης) μετρήσεων του πάχους του κερατοειδούς και των μετρήσεων του πάχους που καταγράφονται σε τακτά διαστήματα μετά την έκθεση στην υπό δοκιμή χημική ουσία κατά τη δοκιμή ICE. Ο βαθμός οιδήματος του κερατοειδούς είναι ενδεικτικός βλάβης του κερατοειδούς. Οφθαλμικός ερεθισμός : πρόκληση αλλοιώσεων του οφθαλμού, οι οποίες εμφανίζονται μετά την εφαρμογή της υπό δοκιμή χημικής ουσίας στην εμπρόσθια επιφάνειά του και είναι πλήρως αναστρέψιμες εντός 21 ημερών από την εφαρμογή της ουσίας. Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τους όρους «αναστρέψιμες επιδράσεις στους οφθαλμούς» και «κατηγορία 2 του GHS των Ηνωμένων Εθνών» (4). Ποσοστό ψευδοαρνητικής έκβασης : το ποσοστό του συνόλου των θετικών χημικών ουσιών που εσφαλμένα χαρακτηρίζονται ως αρνητικές με μια μέθοδο δοκιμών. Αποτελεί έναν από τους δείκτες επιδόσεων της μεθόδου δοκιμών. Ποσοστό ψευδοθετικής έκβασης : το ποσοστό του συνόλου των αρνητικών χημικών ουσιών που εσφαλμένα χαρακτηρίζονται ως θετικές με μια μέθοδο δοκιμών. Αποτελεί έναν από τους δείκτες επιδόσεων της μεθόδου δοκιμών. Κατακράτηση φλουορεσκεΐνης : υποκειμενική μέτρηση, στο πλαίσιο της δοκιμής ICE, του βαθμού κατακράτησης νατριούχου φλουορεσκεΐνης από τα κερατοειδικά επιθηλιακά κύτταρα κατόπιν έκθεσης στην υπό δοκιμή χημική ουσία. Ο βαθμός κατακράτησης φλουορεσκεΐνης είναι ενδεικτικός βλάβης του κερατοειδικού επιθηλίου. Κίνδυνος : εγγενής ιδιότητα ενός παράγοντα ή μιας κατάστασης που μπορεί να έχει δυσμενείς επιδράσεις όταν οργανισμός, σύστημα ή (υπο)πληθυσμός εκτεθεί στον συγκεκριμένο παράγοντα. Μη αναστρέψιμες επιδράσεις στους οφθαλμούς : βλ. «σοβαρή οφθαλμική βλάβη» και «κατηγορία 1 του GHS των Ηνωμένων Εθνών». Μείγμα : ένα μείγμα ή διάλυμα που αποτελείται από δύο ή περισσότερες ουσίες οι οποίες δεν αντιδρούν μέσα σε αυτό (4). Αρνητικός μάρτυρας : δείγμα επανάληψης (replicate) που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και δεν υποβάλλεται σε μεταχείριση. Το δείγμα αυτό εξετάζεται μαζί με τα δείγματα που έχουν υποβληθεί σε μεταχείριση με την υπό δοκιμή χημική ουσία και με άλλα δείγματα-μάρτυρες, ούτως ώστε να διαπιστώνεται αν ο διαλύτης αλληλεπιδρά με το σύστημα δοκιμής. Δεν ταξινομείται : χημικές ουσίες που δεν ταξινομούνται ως ερεθιστικά για τους οφθαλμούς (κατηγορία 2 του GHS των Ηνωμένων Εθνών) ούτε ως ουσίες που προκαλούν σοβαρή οφθαλμική βλάβη (κατηγορία 1 του GHS των Ηνωμένων Εθνών). Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τον όρο «καμία κατηγορία του GHS των Ηνωμένων Εθνών». Θετικός μάρτυρας : δείγμα επανάληψης που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και υποβάλλεται σε μεταχείριση με χημική ουσία που είναι γνωστό ότι προκαλεί θετική απόκριση. Για να διασφαλισθεί η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης του θετικού μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της σοβαρής απόκρισης δεν πρέπει να είναι υπερβολικό. Αξιοπιστία : μέτρο του βαθμού στον οποίο μια μέθοδος δοκιμών μπορεί να διεξάγεται με υψηλή αναπαραγωγιμότητα διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας, καθώς και της ενδοεργαστηριακής επαναληψιμότητας. Αναστρέψιμες επιδράσεις στους οφθαλμούς : βλ. «ερεθισμός του οφθαλμού» και «κατηγορία 2 του GHS των Ηνωμένων Εθνών». Σοβαρή οφθαλμική βλάβη : πρόκληση βλάβης στους οφθαλμικούς ιστούς ή σοβαρής μείωσης της όρασης, κατόπιν εφαρμογής της υπό δοκιμή χημικής ουσίας στην πρόσθια επιφάνεια του οφθαλμού, η οποία δεν είναι πλήρως αναστρέψιμη εντός 21 ημερών από την εφαρμογή. Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τους όρους «μη αναστρέψιμες επιδράσεις στους οφθαλμούς» και «κατηγορία 1 του GHS των Ηνωμένων Εθνών» (4). Σχισμοειδής λυχνία : όργανο για την απευθείας εξέταση του οφθαλμού υπό μεγέθυνση με διοφθάλμιο μικροσκόπιο μέσω της δημιουργίας στερεοσκοπικής όρθιας εικόνας. Στη μέθοδο δοκιμής ICE, το συγκεκριμένο όργανο χρησιμοποιείται για την παρατήρηση των πρόσθιων μερών του οφθαλμού ορνιθίου καθώς και για την αντικειμενική μέτρηση του πάχους του κερατοειδούς με προσαρτημένο παχύμετρο. Μάρτυρας με διαλύτη/φορέα : δείγμα που δεν υποβάλλεται σε μεταχείριση και περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής, συμπεριλαμβανομένου του διαλύτη ή του φορέα. Το δείγμα αυτό υποβάλλεται σε δοκιμή μαζί με τα δείγματα που έχουν υποβληθεί σε μεταχείριση με την υπό δοκιμή χημική ουσία και με άλλα δείγματα-μάρτυρες, με σκοπό τον καθορισμό της βασικής απόκρισης των δειγμάτων που υποβάλλονται σε μεταχείριση με την υπό δοκιμή χημική ουσία διαλυμένη στον ίδιο διαλύτη ή φορέα. Όταν το εν λόγω δείγμα υποβάλλεται σε δοκιμή με παράλληλο αρνητικό μάρτυρα, καταδεικνύει επίσης αν ο διαλύτης ή ο φορέας αλληλεπιδρά με το σύστημα δοκιμής. Ουσία : τα χημικά στοιχεία και οι ενώσεις τους σε φυσική κατάσταση ή όπως λαμβάνονται με οποιαδήποτε παραγωγική διεργασία, στα οποία συμπεριλαμβάνονται όλα τα πρόσθετα που απαιτούνται για να διατηρείται η σταθερότητα του προϊόντος καθώς και τυχόν προσμείξεις που προκύπτουν από τη χρησιμοποιούμενη διεργασία, αλλά από τα οποία εξαιρούνται οι διαλύτες που είναι δυνατόν να διαχωριστούν χωρίς να επηρεαστεί η σταθερότητα της ουσίας ούτε να μεταβληθεί η σύνθεσή της (4). Επιφανειοδραστική ουσία : ονομάζεται επίσης τασιενεργή ουσία και είναι ουσία, όπως τα απορρυπαντικά, που μπορεί να μειώσει την επιφανειακή τάση ενός υγρού και, ως εκ τούτου, του επιτρέπει να σχηματίζει αφρό ή να διεισδύει σε στερεά· είναι επίσης γνωστή ως διαβρεκτικό μέσο. Καθοδική (top-down) προσέγγιση : κλιμακωτή προσέγγιση που χρησιμοποιείται για χημική ουσία για την οποία υπάρχουν υπόνοιες ότι προκαλεί σοβαρή οφθαλμική βλάβη. Η προσέγγιση αυτή αρχίζει με τον προσδιορισμό των χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη (θετικό αποτέλεσμα) σε σχέση με άλλες χημικές ουσίες (αρνητικό αποτέλεσμα). Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Κλιμακωτή στρατηγική δοκιμών : στρατηγική δοκιμών κατά στάδια, στο πλαίσιο της οποίας όλες οι υφιστάμενες πληροφορίες για μια υπό δοκιμή χημική ουσία εξετάζονται με συγκεκριμένη σειρά, με χρήση διαδικασίας βάρους της απόδειξης σε κάθε στάδιο, προκειμένου να διαπιστώνεται, πριν από τη μετάβαση στο επόμενο στάδιο, αν διατίθενται επαρκείς πληροφορίες για να ληφθεί απόφαση περί ταξινόμησης κινδύνου. Εάν σε υπό δοκιμή χημική ουσία μπορεί να αποδοθεί δυναμικό ερεθιστικότητας βάσει των υφιστάμενων πληροφοριών, δεν απαιτούνται περαιτέρω δοκιμές. Εάν βάσει των υφιστάμενων πληροφοριών δεν είναι εφικτή η απόδοση δυναμικού ερεθιστικότητας σε υπό δοκιμή χημική ουσία, εφαρμόζεται κλιμακωτή διαδικασία διαδοχικών δοκιμών σε ζώα έως ότου καταστεί εφικτή η βέβαιη ταξινόμηση της ουσίας. Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων των Ηνωμένων Εθνών (United Nations Globally Harmonized System of Classification and Labelling of Chemicals) (GHS των Ηνωμένων Εθνών) : σύστημα που προτείνει την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων) με βάση τυποποιημένα είδη και βαθμούς φυσικών κινδύνων και κινδύνων για την υγεία και το περιβάλλον και καλύπτει τα αντίστοιχα επικοινωνιακά στοιχεία, όπως εικονογράμματα, προειδοποιητικές λέξεις, δηλώσεις επικινδυνότητας, δηλώσεις προφύλαξης και δελτία δεδομένων ασφαλείας, για τη μετάδοση πληροφοριών σχετικά με τις δυσμενείς επιδράσεις των εν λόγω προϊόντων με σκοπό την προστασία των ανθρώπων (εργοδοτών, εργαζομένων, μεταφορέων, καταναλωτών και διασωστών) και του περιβάλλοντος (4). Κατηγορία 1 του GHS των Ηνωμένων Εθνών : Βλ. «Σοβαρή οφθαλμική βλάβη» και/ή «μη αναστρέψιμες οφθαλμικές επιδράσεις». Κατηγορία 2 του GHS των Ηνωμένων Εθνών : Βλ. «Οφθαλμικός ερεθισμός» και/ή «Αναστρέψιμες επιδράσεις στον οφθαλμό». «Καμία κατηγορία» του GHS των Ηνωμένων Εθνών : ουσίες που δεν πληρούν τις απαιτήσεις για να ταξινομηθούν ως κατηγορίας 1 ή 2 (2Α ή 2Β) του GHS των Ηνωμένων Εθνών. Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τον όρο «δεν ταξινομείται». Επικυρωμένη μέθοδος δοκιμών : μέθοδος δοκιμών για την οποία έχουν ολοκληρωθεί μελέτες επικύρωσης προκειμένου να προσδιοριστούν η καταλληλότητα (συμπεριλαμβανομένης της ορθότητας) και η αξιοπιστία της για συγκεκριμένο σκοπό. Είναι σημαντικό να σημειωθεί ότι οι επιδόσεις μιας επικυρωμένης μεθόδου δοκιμών όσον αφορά την ορθότητα και την αξιοπιστία ενδέχεται να μην επαρκούν για να κριθεί αποδεκτή για τον προτεινόμενο σκοπό. Βάρος της απόδειξης : η διαδικασία εξέτασης της ισχύος και των αδυναμιών διαφόρων πληροφοριών για τη συναγωγή και την τεκμηρίωση συμπεράσματος σχετικά με το δυναμικό κινδύνου που ενέχει μια χημική ουσία. Προσάρτημα 2 ΟΥΣΙΕΣ ΕΛΕΓΧΟΥ ΙΚΑΝΟΤΗΤΑΣ ΓΙΑ ΤΗ ΜΕΘΟΔΟ ΔΟΚΙΜΩΝ ICE Πριν εντάξουν την παρούσα μέθοδο δοκιμών στη συνήθη πρακτική τους, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα προσδιορίζοντας σωστά την ταξινόμηση του κινδύνου για τους οφθαλμούς από τις 13 χημικές ουσίες που συνιστώνται στον πίνακα 1. Οι ουσίες αυτές επιλέχθηκαν ως αντιπροσωπευτικές του φάσματος αποκρίσεων όσον αφορά τους κινδύνους για τους οφθαλμούς, με βάση τα αποτελέσματα της οφθαλμικής δοκιμής in vivo σε κουνέλια (TG 405) (17) και το σύστημα ταξινόμησης GHS των Ηνωμένων Εθνών (δηλ. κατηγορίες 1, 2Α, 2Β και «δεν ταξινομείται») (4) (6). Άλλα κριτήρια επιλογής αφορούσαν τη διαθεσιμότητα των χημικών ουσιών στο εμπόριο και την ύπαρξη υψηλής ποιότητας δεδομένων αναφοράς in vivo, καθώς και υψηλής ποιότητας δεδομένων in vitro από τη μέθοδο δοκιμών ICE. Δεδομένα αναφοράς είναι διαθέσιμα στο απλουστευμένο συνοπτικό έγγραφο (Streamlined Summary Document) (3) και στο έγγραφο επισκόπησης των διαθέσιμων δεδομένων (Background Review Document) της ICCVAM για τη μέθοδο δοκιμών ICE (9). Πίνακας 1 Συνιστώμενες χημικές ουσίες για την απόδειξη της τεχνικής ικανότητας ως προς τη δοκιμή ICE
Προσάρτημα 3 ΔΙΑΓΡΑΜΜΑΤΑ ΣΥΣΚΕΥΗΣ ΥΠΕΡΔΙΑΠΟΤΙΣΗΣ ΚΑΙ ΣΦΙΓΚΤΗΡΑ ΟΦΘΑΛΜΩΝ ΓΙΑ ΤΗ ΜΕΘΟΔΟ ΔΟΚΙΜΩΝ ICE [Βλ. Burton et al. (18) για επιπλέον γενικές περιγραφές της συσκευής υπερδιαπότισης και του σφιγκτήρα οφθαλμών] 
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(14) |
Στο μέρος B, το Κεφάλαιο Β.49 αντικαθίσταται από το ακόλουθο κείμενο: «Β.49 Δοκιμή μικροπυρήνων in vitro σε κύτταρα θηλαστικών ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών 487 του ΟΟΣΑ (2016). Αποτελεί μέρος μιας σειράς μεθόδων δοκιμών γενετικής τοξικολογίας. Έχει συνταχθεί ένα έγγραφο του ΟΟΣΑ με συνοπτικές πληροφορίες για τις δοκιμές γενετικής τοξικολογίας και μια επισκόπηση των πρόσφατων αλλαγών που έγιναν σε αυτές τις κατευθυντήριες γραμμές δοκιμών (1). Η δοκιμή μικροπυρήνων in vitro (MNvit) αποτελεί δοκιμή γονιδιοτοξικότητας για την ανίχνευση μικροπυρήνων στο κυτταρόπλασμα των μεσοφασικών κυττάρων. Οι μικροπυρήνες μπορεί να προέρχονται από άκεντρα χρωμοσωμικά θραύσματα (δηλαδή χωρίς κεντρομερίδιο) ή από ολόκληρα χρωμοσώματα που δεν είναι ικανά να μετακινηθούν προς τους πόλους κατά το στάδιο ανάφασης της κυτταρικής διαίρεσης. Ως εκ τούτου, η δοκιμή MNvit είναι μέθοδος in vitro που παρέχει ευρεία βάση για την in vitro διερεύνηση του δυναμικού πρόκλησης χρωμοσωμικών βλαβών, διότι τόσο τα ανευπλοειδογόνα όσο και τα κλαστογόνα μπορούν να ανιχνευθούν (2) (3) σε κύτταρα που υφίστανται κυτταρική διαίρεση κατά τη διάρκεια της έκθεσής τους στην υπό δοκιμή χημική ουσία ή μετά από αυτή (βλ. παράγραφο 13 για περισσότερες λεπτομέρειες). Οι μικροπυρήνες αποτελούν βλάβη που έχει μεταβιβαστεί στα θυγατρικά κύτταρα, ενώ οι χρωμοσωμικές εκτροπές που καταγράφονται σε μεταφασικά κύτταρα μπορεί να μη μεταβιβάζονται. Σε κάθε περίπτωση, οι μεταβολές μπορεί να μην είναι συμβατές με την επιβίωση των κυττάρων. Η παρούσα μέθοδος δοκιμών επιτρέπει τη χρήση πρωτοκόλλων με ή χωρίς τον αναστολέα πολυμερισμού της ακτίνης κυτταροχαλασίνη Β (cytoB). Η προσθήκη cytoB πριν από τη μίτωση απολήγει σε διπύρηνα κύτταρα και, ως εκ τούτου, επιτρέπει την αναγνώριση και την ανάλυση μικροπυρήνων μόνο σε κύτταρα που έχουν ολοκληρώσει μία μίτωση (4) (5). Η παρούσα μέθοδος παρέχει επίσης τη δυνατότητα χρήσης πρωτοκόλλων χωρίς αναστολή της κυτταροκίνησης, με την προϋπόθεση ότι υπάρχουν στοιχεία από τα οποία προκύπτει ότι ο αναλυόμενος κυτταρικός πληθυσμός έχει υποστεί μίτωση. Εκτός από τη χρήση της δοκιμής MNvit για τον εντοπισμό χημικών ουσιών που επάγουν μικροπυρήνες, είναι επίσης δυνατόν να χρησιμοποιηθεί η ανοσοχημική σήμανση κινητοχώρων ή η υβριδοποίηση με κεντρομεριδιακούς/τελομερικούς ανιχνευτές (FISH, από τα αρχικά των λέξεων Fluorescence In Situ Hybridisation/υβριδοποίηση in situ με φθορισμό) για τη συγκέντρωση συμπληρωματικών πληροφοριών σχετικά με τους μηχανισμούς πρόκλησης χρωμοσωμικών βλαβών και σχηματισμού μικροπυρήνων (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17). Οι εν λόγω διαδικασίες σήμανσης και υβριδισμού μπορούν να χρησιμοποιούνται όταν αυξάνεται ο σχηματισμός μικροπυρήνων και ο ερευνητής επιθυμεί να διαπιστώσει αν η αύξηση οφείλεται σε κλαστογόνα και/ή ανευπλοειδογόνα συμβάντα. Χάρη στη δυνατότητα σχετικά αντικειμενικής αξιολόγησης των μικροπυρήνων σε μεσοφασικά κύτταρα, το προσωπικό του εργαστηρίου αρκεί απλώς να προσδιορίζει τον αριθμό διπύρηνων κυττάρων, όταν χρησιμοποιείται cytoB, και την επίπτωση (incidence) των κυττάρων με μικροπυρήνες σε όλες τις περιπτώσεις. Συνεπώς, είναι δυνατή η σχετικά ταχεία καταμέτρηση των παρασκευασμάτων και η αυτοματοποίηση της ανάλυσης. Αυτό καθιστά πρακτικά εφικτή την εξέταση χιλιάδων αντί εκατοντάδων κυττάρων ανά μεταχείριση, με αποτέλεσμα να αυξάνεται η ισχύς της δοκιμής. Τέλος, επειδή οι μικροπυρήνες μπορεί να προέρχονται από καθυστερημένα (lagging) χρωμοσώματα, υπάρχει δυνατότητα ανίχνευσης παραγόντων που επάγουν ανευπλοειδία και οι οποίοι είναι δύσκολο να μελετηθούν με τις κλασικές δοκιμές χρωμοσωμικής εκτροπής, π.χ. κεφάλαιο Β.10 του παρόντος παραρτήματος (18). Ωστόσο, με τη δοκιμή MNvit που περιγράφεται στην παρούσα μέθοδο, δεν είναι δυνατόν να γίνει διάκριση μεταξύ των χημικών ουσιών που επάγουν μεταβολές του χρωμοσωμικού αριθμού και/ή πλοειδίες και των κλαστογόνων, χωρίς τη χρήση ειδικών τεχνικών, όπως η FISH που αναφέρεται στην παράγραφο 4. Η δοκιμή MNvit είναι ανθεκτική και μπορεί να διεξαχθεί σε διάφορους τύπους κυττάρων, με ή χωρίς cytoB. Εκτενή δεδομένα υποστηρίζουν την εγκυρότητα της δοκιμής MNvit σε διάφορους τύπους κυττάρων (καλλιέργειες κυτταρικών σειρών ή πρωτογενείς κυτταροκαλλιέργειες) (19) (20) (21) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35) (36). Μεταξύ αυτών συγκαταλέγονται, ειδικότερα, οι διεθνείς μελέτες επικύρωσης που συντόνισε η γαλλική επιστημονική εταιρεία Société Française de Toxicologie Génétique (SFTG) (19) (20) (21) (22) (23) και οι εκθέσεις του International Workshop on Genotoxicity Testing (5) (17). Τα διαθέσιμα δεδομένα επαναξιολογήθηκαν επίσης στο πλαίσιο μελέτης αναδρομικής επικύρωσης με ανάλυση βάρους της απόδειξης, η οποία διεξήχθη από το Ευρωπαϊκό Κέντρο Επικύρωσης Εναλλακτικών Μεθόδων (ECVAM) της Ευρωπαϊκής Επιτροπής, και η μέθοδος δοκιμών κρίθηκε επιστημονικά έγκυρη από την επιστημονική συμβουλευτική επιτροπή (ESAC) του ECVAM (37) (38) (39). Στη δοκιμή κυττάρων θηλαστικών MNvit μπορούν να χρησιμοποιούνται καλλιέργειες κυτταρικών σειρών ή πρωτογενείς καλλιέργειες κυττάρων ανθρώπου ή τρωκτικών. Δεδομένου ότι η συχνότητα υποβάθρου του σχηματισμού μικροπυρήνων επηρεάζει την ευαισθησία της δοκιμής, συνιστάται η χρήση τύπων κυττάρων με σταθερή και καθορισμένη συχνότητα υποβάθρου όσον αφορά τον σχηματισμό μικροπυρήνων. Τα χρησιμοποιούμενα κύτταρα επιλέγονται με βάση την ικανότητά τους να αναπτύσσονται ικανοποιητικά σε καλλιέργεια, τη σταθερότητα του καρυότυπού τους (συμπεριλαμβανομένου του χρωμοσωμικού αριθμού) και την αυθόρμητη συχνότητα σχηματισμού μικροπυρήνων (40). Τα μέχρι σήμερα διαθέσιμα δεδομένα δεν επιτρέπουν τη διατύπωση αυστηρών συστάσεων, αλλά υποδηλώνουν ότι είναι σημαντικό, κατά την αξιολόγηση των χημικών κινδύνων, να λαμβάνονται υπόψη η κατάσταση της p53, η γενετική σταθερότητα (καρυότυπος), η ικανότητα επιδιόρθωσης του DNA και η προέλευση (από τρωκτικά ή τον άνθρωπο) των κυττάρων που επιλέγονται για τη δοκιμή. Ως εκ τούτου, ενθαρρύνονται οι χρήστες της παρούσας μεθόδου δοκιμών να λαμβάνουν υπόψη την επίδραση αυτών και άλλων κυτταρικών χαρακτηριστικών στις επιδόσεις των κυτταρικών σειρών ως προς την ανίχνευση της επαγωγής μικροπυρήνων, καθώς εξελίσσεται η επιστημονική γνώση σε αυτόν τον τομέα. Οι χρησιμοποιούμενοι ορισμοί παρατίθενται στο προσάρτημα 1. ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ Οι δοκιμές που διεξάγονται in vitro απαιτούν κατά κανόνα τη χρήση εξωγενούς πηγής μεταβολικής ενεργοποίησης, εκτός εάν τα κύτταρα διαθέτουν ικανότητα μεταβολισμού των υπό δοκιμή χημικών ουσιών. Το εξωγενές σύστημα μεταβολικής ενεργοποίησης δεν μιμείται απόλυτα τις συνθήκες που επικρατούν in vivo. Θα πρέπει να λαμβάνεται μέριμνα ώστε να αποφεύγονται συνθήκες που θα μπορούσαν να οδηγήσουν σε τεχνητά θετικά αποτελέσματα που δεν αντανακλούν την κυτταροτοξικότητα των υπό δοκιμή χημικών ουσιών· Στις συνθήκες αυτές περιλαμβάνονται οι μεταβολές του pH (41) (42) (43) ή της ωσμωμοριακότητας, η αλληλεπίδραση με το θρεπτικό μέσο της κυτταροκαλλιέργειας (44) (45) και τα υπέρμετρα επίπεδα κυτταροτοξικότητας (βλ. παράγραφο 29). Για την ανάλυση της επαγωγής μικροπυρήνων, έχει καθοριστική σημασία να συντελείται μίτωση τόσο στις καλλιέργειες που υποβάλλονται σε μεταχείριση όσο και σε εκείνες που δεν υποβάλλονται. Το πιο διαφωτιστικό στάδιο για την καταμέτρηση των μικροπυρήνων είναι η ολοκλήρωση μιας μίτωσης των κυττάρων κατά τη διάρκεια της μεταχείρισης με την υπό δοκιμή χημική ουσία ή μετά από αυτή. Για τα βιομηχανικά νανοϋλικά, ενδέχεται να χρειάζονται ειδικές προσαρμογές της παρούσας μεθόδου δοκιμών, αλλά αυτές δεν περιγράφονται στην παρούσα μέθοδο δοκιμών. Πριν από τη χρήση της μεθόδου δοκιμών σε μείγμα για την παραγωγή δεδομένων για συγκεκριμένο ρυθμιστικό σκοπό, θα πρέπει να εξετάζεται αν — και, εάν ναι, για ποιον λόγο — αυτή μπορεί να αποδώσει επαρκή αποτελέσματα για τον επιδιωκόμενο σκοπό. Οι εκτιμήσεις αυτές δεν είναι αναγκαίες όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος. ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ Καλλιέργειες ανθρώπινων κυττάρων ή κυττάρων άλλων θηλαστικών εκτίθενται στην υπό δοκιμή χημική ουσία με και χωρίς εξωγενή πηγή μεταβολικής ενεργοποίησης, εκτός εάν χρησιμοποιούνται κύτταρα με επαρκή μεταβολική ικανότητα (βλ. παράγραφο 19). Κατά τη διάρκεια της έκθεσης στην υπό δοκιμή χημική ουσία ή μετά από αυτήν, τα κύτταρα καλλιεργούνται για επαρκές χρονικό διάστημα, ώστε η χρωμοσωμική βλάβη ή άλλες επιδράσεις στον κυτταρικό κύκλο/την κυτταρική διαίρεση να οδηγήσουν στον σχηματισμό μικροπυρήνων σε μεσοφασικά κύτταρα. Για την επαγωγή ανευπλοειδίας, κανονικά χρειάζεται η παρουσία της υπό δοκιμή χημικής ουσίας κατά τη μίτωση. Τα μεσοφασικά κύτταρα συλλέγονται και, ύστερα από χρώση, αναλύονται για να διαπιστωθεί η παρουσία μικροπυρήνων. Στην ιδανική περίπτωση, θα πρέπει να καταμετρώνται μόνο μικροπυρήνες κυττάρων τα οποία ολοκλήρωσαν μια μίτωση κατά τη διάρκεια της έκθεσης στην υπό δοκιμή χημική ουσία ή της περιόδου μετά την έκθεση, εάν προβλέπεται. Στις καλλιέργειες που υποβάλλονται σε κατεργασία με αναστολέα κυτταροκίνησης, αυτό επιτυγχάνεται εύκολα με την καταμέτρηση μόνο των διπύρηνων κυττάρων. Εάν δεν χρησιμοποιείται αναστολέας κυτταροκίνησης, έχει σημασία να καταδεικνύεται, μέσω της αύξησης του κυτταρικού πληθυσμού, ότι τα αναλυόμενα κύτταρα κατά πάσα πιθανότητα διαιρέθηκαν κατά τη διάρκεια της έκθεσης στην υπό δοκιμή χημική ουσία ή μετά από αυτή. Για όλα τα πρωτόκολλα, έχει σημασία να καταδεικνύεται ο πολλαπλασιασμός των κυττάρων, τόσο στις καλλιέργειες-μάρτυρες όσο και σε εκείνες που υποβάλλονται σε μεταχείριση, και να εκτιμάται ο βαθμός κυτταροτοξικότητας ή κυτταρόστασης που επάγει η υπό δοκιμή χημική ουσία σε όλες τις καλλιέργειες στις οποίες καταμετρώνται οι μικροπυρήνες. ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Κύτταρα Μπορούν να χρησιμοποιούνται καλλιεργημένα πρωτογενή λεμφοκύτταρα περιφερειακού αίματος του ανθρώπου ή άλλων θηλαστικών (7) (20) (46) (47) και ορισμένες κυτταρικές σειρές τρωκτικών, όπως οι CHO, V79, CHL/IU και L5178Y ή κυτταρικές σειρές ανθρώπινης προέλευσης, όπως η TK6 (19) (20) (21) (22) (23) (26) (27) (28) (29) (31) (33) (34) (35) (36) (βλ. παράγραφο 6). Έχουν χρησιμοποιηθεί σε δοκιμές μικροπυρήνων και άλλες κυτταρικές σειρές, όπως κύτταρα HT29 (48), Caco-2 (49), HepaRG (50) (51), HepG2 (52) (53), Α549 και πρωτογενή εμβρυϊκά κύτταρα συριακού κρικητού (54), αλλά επί του παρόντος δεν έχουν επικυρωθεί εκτενώς. Για τον λόγο αυτό, η χρήση αυτών των κυτταρικών σειρών και τύπων θα πρέπει να αιτιολογείται με βάση τις αποδεδειγμένες επιδόσεις τους στη δοκιμή, όπως περιγράφεται στο τμήμα «Κριτήρια αποδοχής». Έχει αναφερθεί ότι η Cyto B μπορεί να επηρεάσει την ανάπτυξη των κυττάρων L5178Y και, ως εκ τούτου, δεν συνιστάται η χρήση της με τη συγκεκριμένη κυτταρική σειρά (23). Για λόγους καλής μεταχείρισης των ζώων, όταν χρησιμοποιούνται πρωτογενή κύτταρα, θα πρέπει να εξετάζεται το ενδεχόμενο χρησιμοποίησης, εφόσον είναι εφικτή, ανθρώπινων κυττάρων που έχουν ληφθεί σύμφωνα με τις σχετικές δεοντολογικές αρχές και κανονιστικές ρυθμίσεις. Τα ανθρώπινα λεμφοκύτταρα περιφερικού αίματος θα πρέπει να λαμβάνονται από νεαρά άτομα (ηλικίας περίπου 18-35 ετών), που δεν καπνίζουν, δεν πάσχουν από γνωστή νόσο και δεν έχουν εκτεθεί πρόσφατα σε γονιδιοτοξικούς παράγοντες (π.χ. χημικές ουσίες, ιοντίζουσες ακτινοβολίες) σε επίπεδα τα οποία θα μπορούσαν να αυξήσουν την επίπτωση υποβάθρου των κυττάρων με μικροπυρήνες. Με τον τρόπο αυτό εξασφαλίζεται χαμηλή και σταθερή επίπτωση υποβάθρου των κυττάρων με μικροπυρήνες. Η γραμμή βάσης της επίπτωσης των κυττάρων με μικροπυρήνες αυξάνεται με την ηλικία, τάση που είναι εντονότερη στις γυναίκες απ' ό,τι στους άνδρες (55). Εάν συνδυάζονται προς χρήση κύτταρα από περισσότερους του ενός δότες, θα πρέπει να προσδιορίζεται ο αριθμός των δοτών. Είναι αναγκαίο να αποδεικνύεται ότι τα κύτταρα έχουν διαιρεθεί κατά το διάστημα που μεσολαβεί από την έναρξη της μεταχείρισης με την υπό δοκιμή χημική ουσία μέχρι τη δειγματοληψία τους. Οι κυτταροκαλλιέργειες διατηρούνται σε εκθετική φάση ανάπτυξης (κυτταρικές σειρές) ή διεγείρονται για να διαιρεθούν (πρωτογενείς καλλιέργειες λεμφοκυττάρων), ώστε τα κύτταρα να εκτίθενται σε διάφορα στάδια του κυτταρικού κύκλου, δεδομένου ότι μπορεί να μην είναι γνωστή η ευαισθησία κάθε σταδίου στις υπό δοκιμή χημικές ουσίες. Κατά κανόνα, τα πρωτογενή κύτταρα που χρειάζονται διέγερση από μιτογόνους παράγοντες για τη διαίρεσή τους δεν είναι πια συγχρονισμένα κατά τη διάρκεια της έκθεσης στην υπό δοκιμή χημική ουσία (π.χ. ανθρώπινα λεμφοκύτταρα μετά από 48ωρη διέγερση με μιτογόνο). Η χρήση συγχρονισμένων κυττάρων κατά τη διάρκεια της μεταχείρισης με την υπό δοκιμή χημική ουσία δεν συνιστάται, αλλά μπορεί να γίνει δεκτή, εφόσον αιτιολογείται. Θρεπτικά μέσα και συνθήκες καλλιέργειας Για τη διατήρηση των καλλιεργειών θα πρέπει να χρησιμοποιούνται κατάλληλο θρεπτικό μέσο και κατάλληλες συνθήκες επώασης (δοχεία καλλιέργειας, ατμόσφαιρα με ύγρανση και 5 % CO2, κατά περίπτωση, θερμοκρασία 37 °C). Θα πρέπει να ελέγχονται τακτικά στις κυτταρικές σειρές η σταθερότητα του χαρακτηριστικού αριθμού χρωμοσωμάτων και η απουσία μόλυνσης από μυκόπλασμα και να μη χρησιμοποιούνται τα κύτταρα, εάν έχουν μολυνθεί ή έχει μεταβληθεί ο χαρακτηριστικός αριθμός χρωμοσωμάτων. Η φυσιολογική διάρκεια του κυτταρικού κύκλου των κυτταρικών σειρών ή πρωτογενών καλλιεργειών που χρησιμοποιούνται στο εργαστήριο δοκιμών θα πρέπει να καθορίζεται και να είναι συνεπής με τα δημοσιευμένα χαρακτηριστικά των κυττάρων. Παρασκευή των καλλιεργειών Κυτταρικές σειρές: τα κύτταρα πολλαπλασιάζονται από αποθεματικές καλλιέργειες, εμβολιαζόμενα σε θρεπτικό μέσο καλλιέργειας σε πυκνότητα τέτοια ώστε τα υπό μορφή εναιωρήματος ή μονοστιβάδας κύτταρα να εξακολουθούν να αναπτύσσονται εκθετικά μέχρι τη συλλογή τους (π.χ. θα πρέπει να αποφεύγεται η συρροή κυττάρων που αναπτύσσονται σε μονοστιβάδες). Λεμφοκύτταρα: ολικό αίμα με αντιπηκτικό (π.χ. ηπαρίνη) ή διαχωρισμένα λεμφοκύτταρα καλλιεργούνται (π.χ. για 48 ώρες προκειμένου για ανθρώπινα λεμφοκύτταρα) παρουσία μιτογόνου παράγονται [π.χ. φυτοαιμοσυγκολλητίνη (PHA) προκειμένου για ανθρώπινα λεμφοκύτταρα], με σκοπό την επαγωγή κυτταρικής διαίρεσης πριν από την έκθεση στην υπό δοκιμή χημική ουσία και τη cytoB. Μεταβολική ενεργοποίηση Όταν χρησιμοποιούνται κύτταρα με ανεπαρκή ενδογενή μεταβολική ικανότητα, πρέπει να χρησιμοποιούνται εξωγενή συστήματα μεταβολικής ενεργοποίησης. Το συνηθέστερα χρησιμοποιούμενο σύστημα, που συνιστάται ως προεπιλογή, εκτός εάν υπάρχει αιτιολόγηση υπέρ άλλου συστήματος, είναι ένα μεταμιτοχονδριακό κλάσμα εμπλουτισμένο με συμπαράγοντα (S9), το οποίο παρασκευάζεται από ήπαρ τρωκτικών (κατά κανόνα επιμύων), κατεργασμένο με παράγοντα ενζυμικής επαγωγής, όπως το Aroclor 1254 (56) (57) ή ο συνδυασμός φαινοβαρβιτάλης και b-ναφθοφλαβόνης (58) (59) (60). Ο συνδυασμός αυτός δεν αντιβαίνει στη Σύμβαση της Στοκχόλμης για τους έμμονους οργανικούς ρύπους (61) και έχει αποδειχθεί εξίσου αποτελεσματικός με το Aroclor 1254 στην επαγωγή οξειδασών μεικτής λειτουργίας (58) (59) (60). Το κλάσμα S9 χρησιμοποιείται συνήθως σε συγκεντρώσεις που κυμαίνονται από 1 έως 2 % (κ.ό.), αλλά οι οποίες επιτρέπεται να αυξηθούν σε 10 % (κ.ό.) στο τελικό δοκιμαστικό θρεπτικό μέσο. Η χρήση προϊόντων που μειώνουν τον μιτωτικό δείκτη, και ιδίως προϊόντων που συμπλοκοποιούν το ασβέστιο (62), θα πρέπει να αποφεύγεται κατά τη μεταχείριση. Η επιλογή του τύπου και της συγκέντρωσης του χρησιμοποιούμενου εξωγενούς συστήματος μεταβολικής ενεργοποίησης ή μεταβολικού επαγωγέα μπορεί να επηρεαστεί από την κατηγορία των υπό δοκιμή χημικών ουσιών. Παρασκεύασμα της υπό δοκιμή χημικής ουσίας Οι στερεές υπό δοκιμή χημικές ουσίες θα πρέπει να διαλύονται σε κατάλληλους διαλύτες και να αραιώνονται, εφόσον χρειάζεται, πριν από τη μεταχείριση των κυττάρων. Οι υγρές υπό δοκιμή χημικές ουσίες επιτρέπεται να προστίθενται κατευθείαν στο σύστημα δοκιμής και/ή να αραιώνονται πριν από τη μεταχείριση του συστήματος δοκιμής. Οι αέριες ή πτητικές υπό δοκιμή χημικές ουσίες θα πρέπει να υποβάλλονται στη δοκιμή με κατάλληλες τροποποιήσεις των τυποποιημένων πρωτοκόλλων, π.χ. μεταχείριση σε σφραγισμένα δοχεία (63) (64) (65). Τα παρασκευάσματα της υπό δοκιμή χημικής ουσίας θα πρέπει να ετοιμάζονται ακριβώς πριν από τη μεταχείριση, εκτός αν τα στοιχεία σχετικά με τη σταθερότητα της ουσίας αποδεικνύουν ότι είναι αποδεκτή η φύλαξη. Συνθήκες δοκιμής Διαλύτες Θα πρέπει να επιλέγεται διαλύτης που να βελτιστοποιεί τη διαλυτότητα της υπό δοκιμή χημικής ουσίας, χωρίς να επηρεάζει δυσμενώς τη διεξαγωγή της δοκιμής, π.χ. μεταβάλλοντας την ανάπτυξη των κυττάρων, πλήττοντας την ακεραιότητα της υπό δοκιμή χημικής ουσίας, αντιδρώντας με τα δοχεία καλλιέργειας ή αποδυναμώνοντας το σύστημα μεταβολικής ενεργοποίησης. Συνιστάται να εξετάζεται πρώτα, στο μέτρο του δυνατού, αν μπορεί να χρησιμοποιηθεί υδατικός διαλύτης (ή θρεπτικό μέσο καλλιέργειας). Καθιερωμένοι διαλύτες είναι το νερό και το διμεθυλοσουλφοξείδιο (DMSO). Κατά κανόνα, οι οργανικοί διαλύτες δεν πρέπει να υπερβαίνουν το 1 % (κ.ό.). Σε περίπτωση διάλυσης cytoB σε DMSO, η συνολική ποσότητα οργανικού διαλύτη που χρησιμοποιείται τόσο για την υπό δοκιμή χημική ουσία όσο και για τη cytoB δεν θα πρέπει να υπερβαίνει το 1 % (κ.ό.)· διαφορετικά, θα πρέπει να χρησιμοποιούνται μάρτυρες που δεν έχουν υποβληθεί σε μεταχείριση, ώστε να εξασφαλίζεται ότι το ποσοστό οργανικού διαλύτη δεν έχει δυσμενείς επιδράσεις. Οι υδατικοί διαλύτες (αλατούχο διάλυμα ή νερό) δεν θα πρέπει να υπερβαίνουν το 10 % (κ.ό.) στο τελικό μέσο μεταχείριση. Εάν χρησιμοποιούνται άλλοι πλην των καθιερωμένων διαλυτών (π.χ. αιθανόλη ή ακετόνη), η χρήση τους θα πρέπει να τεκμηριώνεται με στοιχεία που αποδεικνύουν τη συμβατότητά τους με την υπό δοκιμή χημική ουσία και με το σύστημα δοκιμών, καθώς και την απουσία γενετικής τοξικότητας στη χρησιμοποιούμενη συγκέντρωση. Ελλείψει στοιχείων τεκμηρίωσης, είναι σημαντικό να συμπεριλαμβάνονται μάρτυρες που δεν έχουν υποβληθεί σε κατεργασία (βλ. προσάρτημα 1), καθώς και μάρτυρες με διαλύτη για να αποδεικνύεται ότι ο επιλεγμένος διαλύτης δεν επάγει επιβλαβείς ή χρωμοσωμικές επιδράσεις (π.χ. ανευπλοειδία ή κλαστογένεση). Χρήση cytoB ως αναστολέα κυτταροκίνησης Μια από τις σημαντικότερες παραμέτρους κατά την εκτέλεση της δοκιμής MNvit είναι να εξασφαλίζεται ότι τα καταμετρούμενα κύτταρα έχουν ολοκληρώσει μια μίτωση κατά τη διάρκεια της μεταχείρισης ή της περιόδου επώασης μετά τη μεταχείριση, εάν προβλέπεται. Ως εκ τούτου η καταμέτρηση των μικροπυρήνων θα πρέπει να περιορίζεται μόνο στα κύτταρα που έχουν υποστεί μίτωση κατά τη διάρκεια της μεταχείρισης ή μετά από αυτή. Η cytoB είναι ο ευρύτερα χρησιμοποιούμενος παράγοντας για την αναστολή της κυτταροκίνησης, καθώς αναστέλλει τη συγκρότηση της ακτίνης και, κατ' επέκταση, εμποδίζει τον αποχωρισμό των θυγατρικών κυττάρων μετά τη μίτωση, προκαλώντας τον σχηματισμό διπύρηνων κυττάρων (6) (66) (67). Η επίδραση της υπό δοκιμή χημικής ουσίας στην κινητική του κυτταρικού πολλαπλασιασμού μπορεί να μετρηθεί ταυτόχρονα, όταν χρησιμοποιείται η cytoB. Όταν χρησιμοποιούνται ανθρώπινα λεμφοκύτταρα, πρέπει να χρησιμοποιείται cytoB ως αναστολέας κυτταροκίνησης, επειδή η διάρκεια του κυτταρικού κύκλοι ποικίλλει μεταξύ των δοτών και επειδή δεν αντιδρούν όλα τα λεμφοκύτταρα στη διέγερση με PHA. Η χρήση της cytoB δεν είναι υποχρεωτική για άλλους τύπους κυττάρων, εάν μπορεί να αποδειχθεί ότι αυτά έχουν υποστεί διαίρεση, όπως περιγράφεται στην παράγραφο 27. Επιπλέον, η cytoB δεν χρησιμοποιείται κατά κανόνα κατά την αξιολόγηση δειγμάτων για μικροπυρήνες με τη χρήση μεθόδων κυτταρομετρίας ροής. Το εργαστήριο θα πρέπει να καθορίζει, για κάθε τύπο κυττάρων, την κατάλληλη συγκέντρωση cytoB, με γνώμονα την επίτευξη της βέλτιστης συχνότητας διπύρηνων κυττάρων στις καλλιέργειες-μάρτυρες με διαλύτη, και να αποδεικνύει ότι η συγκέντρωση αυτή έχει ικανοποιητική απόδοση σε διπύρηνα κύτταρα για καταμέτρηση. Η κατάλληλη συγκέντρωση cytoB κυμαίνεται συνήθως μεταξύ 3 και 6 μg/ml (19). Μέτρηση του κυτταρικού πολλαπλασιασμού και της κυτταροτοξικότητας και επιλογή των συγκεντρώσεων μεταχείρισης Κατά τον καθορισμό της υψηλότερης συγκέντρωσης της υπό δοκιμή χημικής ουσίας θα πρέπει να αποφεύγονται οι συγκεντρώσεις που μπορούν να οδηγήσουν σε τεχνητά θετικές αποκρίσεις, όπως εκείνες που προκαλούν υπέρμετρη κυτταροτοξικότητα (βλ. παράγραφο 29), καθίζηση στο θρεπτικό μέσο καλλιέργειας (βλ. παράγραφο 30) ή έντονες μεταβολές του pH ή της ωσμωμοριακότητας (βλ. παράγραφο 9). Εάν η υπό δοκιμή χημική ουσία προκαλεί έντονη μεταβολή του pH του θρεπτικού μέσου κατά την προσθήκη της, το pH μπορεί να ρυθμίζεται με προσθήκη ρυθμιστικού διαλύματος στο τελικό θρεπτικό μέσο δοκιμής, με σκοπό να αποφεύγονται τα τεχνητά θετικά αποτελέσματα και να διατηρούνται κατάλληλες συνθήκες καλλιέργειας. Μετράται ο κυτταρικός πολλαπλασιασμός για να εξασφαλίζεται ότι επαρκής αριθμός από τα υποβαλλόμενα σε μεταχείριση κύτταρα υφίστανται μίτωση κατά τη διάρκεια της δοκιμής και ότι η μεταχείριση διεξάγεται σε κατάλληλα επίπεδα κυτταροτοξικότητας (βλ. παράγραφο 29). Η κυτταροτοξικότητα θα πρέπει να προσδιορίζεται στο κύριο πείραμα με και χωρίς μεταβολική ενεργοποίηση, με χρήση κατάλληλης ένδειξης του θανάτου και της ανάπτυξης των κυττάρων (βλ. παραγράφους 26 και 27). Μολονότι η αξιολόγηση της κυτταροτοξικότητας σε αρχική προκαταρκτική δοκιμή μπορεί να είναι χρήσιμη για τον ακριβέστερο καθορισμό των συγκεντρώσεων που θα χρησιμοποιηθούν στο κύριο πείραμα, δεν είναι υποχρεωτική η διεξαγωγή αρχικής δοκιμής. Η διεξαγωγή αρχικής δοκιμής δεν θα πρέπει να αντικαθιστά τη μέτρηση της κυτταροτοξικότητας στο κύριο πείραμα. Η κατεργασία των καλλιεργειών με cytoB και η μέτρηση της σχετικής συχνότητας των μονοπύρηνων, διπύρηνων και πολυπύρηνων κυττάρων στην καλλιέργεια παρέχουν μια ορθή μέθοδο ποσοτικού προσδιορισμού της επίδρασης της μεταχείρισης στον κυτταρικό πολλαπλασιασμό και της κυτταροτοξικής ή κυτταροστατικής δράσης της (6) και εξασφαλίζουν την καταμέτρηση μόνο των κυττάρων εκείνων που διαιρέθηκαν κατά τη διάρκεια της μεταχείρισης ή μετά από αυτή. Συνιστάται ο δείκτης πολλαπλασιασμού με αναστολή κυτταροκίνησης (CBPI) ή ο δείκτης αναδιπλασιασμού (RI) (6) (27) (68) από 500 τουλάχιστον κύτταρα ανά καλλιέργεια (βλ. μαθηματικούς τύπους στο προσάρτημα 2) για την εκτίμηση της κυτταροτοξικότητας και κυτταροστατικής δραστηριότητας της μεταχείρισης με τη σύγκριση των τιμών που αντιστοιχούν στις καλλιέργειες μεταχείρισης και στις καλλιέργειες-μάρτυρες. Η αξιολόγηση άλλων δεικτών κυτταροτοξικότητας (π.χ. ακεραιότητα κυττάρων, απόπτωση, νέκρωση, καταμέτρηση μετάφασης, κυτταρικός κύκλος) μπορεί να παράσχει χρήσιμες πληροφορίες, αλλά δεν θα πρέπει να χρησιμοποιείται αντί των δεικτών CBPI ή RI. Στις μελέτες χωρίς cytoB, είναι αναγκαίο αποδεικνύεται η διαίρεση των κυττάρων σε καλλιέργεια, έτσι ώστε ένα σημαντικό μέρος των καταμετρηθέντων κυττάρων να έχει διαιρεθεί κατά τη διάρκεια ή μετά τη μεταχείριση με την υπό δοκιμή χημική ουσία· σε διαφορετική περίπτωση, υπάρχει το ενδεχόμενο ψευδαρνητικών αποκρίσεων. Συνιστάται η μέτρηση του σχετικού διπλασιασμού του πληθυσμού (RPD) ή της σχετικής αύξησης του καταμετρούμενου αριθμού κυττάρων (RICC) για την εκτίμηση της κυτταροτοξικότητας και της κυτταροστατικής δραστηριότητας μιας μεταχείρισης (17) (68) (69) (70) (71) (βλ. μαθηματικούς τύπους στο προσάρτημα 2). Σε παρατεταμένους χρόνους δειγματοληψίας (π.χ. μεταχείριση για χρόνο ίσο με την κανονική διάρκεια του κυτταρικού κύκλου επί 1,5-2) και συλλογή μετά από επιπλέον χρόνο ίσο με 1,5-2 φορές την κανονική διάρκεια του κυτταρικού κύκλου, με αποτέλεσμα οι χρόνοι δειγματοληψίας να είναι 3-4 φορές η κανονική διάρκεια του κυτταρικού κύκλου, όπως περιγράφεται στις παραγράφους 38 και 39), η RPD ενδέχεται να υποεκτιμά την κυτταροτοξικότητα (71). Υπό αυτές τις συνθήκες, η RICC θα αποτελούσε ενδεχομένως καλύτερο μέσο μέτρησης, ενώ η αξιολόγηση της κυτταροτοξικότητας μετά από χρόνο ίσο με την κανονική διάρκεια του κυτταρικού κύκλου επί 1,5 θα παρείχε χρήσιμη εκτίμηση. Η αξιολόγηση άλλων δεικτών κυτταροτοξικότητας ή κυτταρόστασης (π.χ. ακεραιότητα των κυττάρων, απόπτωση, νέκρωση, καταμέτρηση μετάφασης, δείκτης πολλαπλασιασμού (PI), κυτταρικός κύκλος, πυρηνοπλασματικές γέφυρες ή πυρηνικές εκβλαστήσεις) θα παρείχαν ενδεχομένως χρήσιμες επιπλέον πληροφορίες, αλλά δεν θα πρέπει να χρησιμοποιούνται αντί της RPD ούτε της RICC. Θα πρέπει να αξιολογούνται τουλάχιστον τρεις συγκεντρώσεις δοκιμής (χωρίς τον διαλύτη και τους θετικούς μάρτυρες) που πληρούν τα κριτήρια αποδοχής (ενδεδειγμένη κυτταροτοξικότητα, αριθμός κυττάρων, κ.λπ.). Ανεξάρτητα από τα είδη κυττάρων (κυτταρικές σειρές ή πρωτογενείς καλλιέργειες λεμφοκυττάρων), μπορούν να χρησιμοποιούνται σε κάθε συγκέντρωση δοκιμής είτε πολλαπλές πανομοιότυπες καλλιέργειες (επαναλήψεις) είτε μοναδικές καλλιέργειες. Αν και συνιστάται η χρήση διπλών καλλιεργειών, οι μονές καλλιέργειες είναι επίσης αποδεκτές, υπό τον όρο ότι καταμετράται ο ίδιος συνολικός αριθμός κυττάρων, ανεξαρτήτως του αν πρόκειται για μονές ή για διπλές καλλιέργειες. Η χρήση μονών καλλιεργειών ενδείκνυται κατ' εξοχήν όταν αξιολογούνται περισσότερες από 3 συγκεντρώσεις (βλ. παραγράφους 44-45). Τα αποτελέσματα που προκύπτουν από τις ανεξάρτητες επαναλήψεις σε δεδομένη συγκέντρωση μπορούν να συνενώνονται για την ανάλυση δεδομένων. Για τις υπό δοκιμή χημικές ουσίες με ελάχιστη ή μηδενική κυτταροτοξικότητα, κατάλληλες είναι συνήθως οι συγκεντρώσεις που απέχουν μεταξύ τους κατά παράγοντα ίσο με 2 ή 3 περίπου. Σε περίπτωση κυτταροτοξικότητας, οι επιλεγόμενες συγκεντρώσεις δοκιμής θα πρέπει να καλύπτουν ένα εύρος τιμών κυμαινόμενο από τη συγκέντρωση που προκαλεί την κυτταροτοξικότητα η οποία περιγράφεται στην παράγραφο 29 μέχρι τις συγκεντρώσεις στις οποίες παρατηρείται μέτρια και ελάχιστη ή μηδενική κυτταροτοξικότητα. Πολλές υπό δοκιμή χημικές ουσίες παρουσιάζουν καμπύλες συγκέντρωσης-απόκρισης με μεγάλη κλίση και, για να ληφθούν δεδομένα σε χαμηλή ή μέτρια κυτταροτοξικότητα ή για να μελετηθεί λεπτομερώς η σχέση δόσης-απόκρισης, είναι αναγκαία η χρήση συγκεντρώσεων με μικρότερα διαστήματα μεταξύ τους και/ή περισσότερων από τρεις συγκεντρώσεις (μονές καλλιέργειες ή επαναλήψεις), ιδίως σε περιπτώσεις όπου απαιτείται επανάληψη του πειράματος (βλ. παράγραφο 60). Εάν η μέγιστη συγκέντρωση βασίζεται στην κυτταροτοξικότητα, η υψηλότερη συγκέντρωση θα πρέπει να αποσκοπεί στην επίτευξη κυτταροτοξικότητας 55 ± 5 %, με τη χρήση των συνιστώμενων παραμέτρων κυτταροτοξικότητας (δηλ. μείωση της RICC ή του RPD στην περίπτωση των κυτταρικών σειρών, όταν δεν χρησιμοποιείται cytoB, και μείωση του CBPI ή του RI όταν χρησιμοποιείται cytoB σε 45 ± 5 % του παράλληλου αρνητικού μάρτυρα) (72). Τα θετικά αποτελέσματα που προκύπτουν μόνο στο ανώτερο άκρο του εν λόγω εύρους κυτταροτοξικότητας 55 ± 5 % θα πρέπει να ερμηνεύονται με προσοχή (71). Για δυσδιάλυτες υπό δοκιμή χημικές ουσίες που δεν είναι κυτταροτοξικές σε συγκεντρώσεις χαμηλότερες από τη συγκέντρωση μέγιστης διαλυτότητας, η αναλυόμενη μέγιστη συγκέντρωση θα πρέπει να επιφέρει θολερότητα ή ίζημα ορατό με γυμνό οφθαλμό ή με τη βοήθεια ανεστραμμένου μικροσκοπίου στο τέλος της μεταχείρισης με την υπό δοκιμή χημική ουσία. Ακόμη και αν εμφανίζεται κυτταροτοξικότητα σε συγκεντρώσεις υψηλότερες από τη συγκέντρωση μέγιστης διαλυτότητας, συνιστάται να διεξάγεται η δοκιμή σε μία μόνο συγκέντρωση που επάγει θολερότητα ή ορατό ίζημα, διότι μπορεί να προκύψουν τεχνητές επιδράσεις από το ίζημα. Στη συγκέντρωση που επιφέρει ίζημα, θα πρέπει να λαμβάνεται μέριμνα ώστε να διασφαλίζεται ότι το τελευταίο δεν παρεμποδίζει τη διεξαγωγή της δοκιμής (π.χ. τη χρώση ή την καταμέτρηση). Ο προσδιορισμός της διαλυτότητας στο θρεπτικό μέσο καλλιέργειας πριν από το πείραμα μπορεί να είναι χρήσιμος. Εάν δεν παρατηρηθεί ίζημα ούτε περιοριστική κυτταροτοξικότητα, η ανώτατη συγκέντρωση δοκιμής θα πρέπει να αντιστοιχεί στη μικρότερη από τις τιμές 10 mM, 2 mg/ml ή 2 μl/ml (73) (74) (75). Όταν η υπό δοκιμή χημική ουσία δεν έχει καθορισμένη σύνθεση, π.χ. ουσίες άγνωστης ή μεταβλητής σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά (UVCB) (76), εκχυλίσματα από το περιβάλλον κλπ., η ανώτατη συγκέντρωση θα πρέπει ενδεχομένως να είναι υψηλότερη (π.χ. 5 mg/ml), ελλείψει επαρκούς κυτταροτοξικότητας, προκειμένου να αυξηθεί η συγκέντρωση του κάθε συστατικού. Επισημαίνεται, ωστόσο, ότι οι απαιτήσεις αυτές μπορεί να διαφέρουν για τα φαρμακευτικά προϊόντα για τον άνθρωπο (93). Μάρτυρες Σε κάθε χρόνο συλλογής, θα πρέπει να συμπεριλαμβάνονται παράλληλοι αρνητικοί μάρτυρες (βλ. παράγραφο 21), αποτελούμενοι μόνο από τον διαλύτη στο θρεπτικό μέσο της μεταχείρισης και υποβαλλόμενοι στην ίδια μεταχείριση όπως και οι καλλιέργειες. Απαιτούνται παράλληλοι θετικοί μάρτυρες για να αποδεικνύεται αφενός η ικανότητα του εργαστηρίου να προσδιορίζει τις κλαστογόνες και ανευπλοειδογόνες ουσίες υπό τις συνθήκες του χρησιμοποιούμενου πρωτοκόλλου δοκιμής και, αφετέρου, η αποτελεσματικότητα του εξωγενούς συστήματος μεταβολικής ενεργοποίησης, κατά περίπτωση. Παραδείγματα θετικών μαρτύρων παρέχονται κατωτέρω στον πίνακα 1. Μπορούν να χρησιμοποιηθούν εναλλακτικοί θετικοί χημικοί μάρτυρες, εφόσον η χρήση τους αιτιολογείται. Μέχρι στιγμής, δεν υπάρχουν ανευπλοειδογόνες ουσίες για τις οποίες να είναι γνωστό ότι απαιτείται μεταβολική ενεργοποίηση προκειμένου να έχουν γονιδιοτοξική δράση (17). Επειδή οι in vitro δοκιμές γενετικής τοξικότητας σε κύτταρα θηλαστικών είναι επαρκώς τυποποιημένες για βραχυχρόνιες μεταχειρίσεις που πραγματοποιούνται ταυτόχρονα με και χωρίς μεταβολική ενεργοποίηση με την ίδια διάρκεια μεταχείρισης, η χρήση θετικών μαρτύρων μπορεί να περιορίζεται σε μια κλαστογόνο ουσία που απαιτεί μεταβολική ενεργοποίηση. Στην περίπτωση αυτή, μία μοναδική απόκριση κλαστογόνου στον θετικό μάρτυρα θα καταδείξει τόσο τη δραστηριότητα του συστήματος μεταβολικής ενεργοποίησης και την αποκρισιμότητα του συστήματος δοκιμών. Ωστόσο, σε περίπτωση μακροχρόνιας μεταχείρισης (χωρίς S9), θα πρέπει να προβλέπεται χωριστός θετικός μάρτυρας, διότι η διάρκεια της μεταχείρισης διαφέρει από αυτήν της δοκιμής με μεταβολική ενεργοποίηση. Εάν επιλεγεί μια κλαστογόνος ουσία ως μοναδικός θετικός μάρτυρας για βραχυχρόνια μεταχείριση με και χωρίς μεταβολική ενεργοποίηση, μια ανευπλοειδογόνος ουσία θα πρέπει να επιλέγεται για τη μακροπρόθεσμη μεταχείριση χωρίς μεταβολική ενεργοποίηση. Οι θετικοί μάρτυρες, τόσο για την κλαστογένεση όσο και για την ανευπλοειδογένεση, πρέπει να χρησιμοποιούνται σε κύτταρα που διαθέτουν ικανότητα μεταβολισμού και δεν απαιτούν S9. Κάθε θετικός μάρτυρας θα πρέπει να χρησιμοποιείται σε μία ή περισσότερες συγκεντρώσεις που αναμένεται να έχουν ως αποτέλεσμα αναπαραγώγιμη και ανιχνεύσιμη αύξηση σε σχέση με την τιμή υποβάθρου, για να καταδεικνύεται η ευαισθησία του συστήματος δοκιμής (δηλ. σαφείς επιδράσεις, οι οποίες όμως δεν αποκαλύπτουν αμέσως την ταυτότητα των κωδικοποιημένων αντικειμενοφόρων πλακών στον παρατηρητή), και η απόκριση δεν θα πρέπει να υπονομεύεται από κυτταροτοξικότητα που υπερβαίνει τα όρια που προβλέπονται στην παρούσα μέθοδο δοκιμών. Πίνακας 1 Συνιστώμενες χημικές ουσίες αναφοράς για την αξιολόγηση της τεχνικής ικανότητας του εργαστηρίου και την επιλογή θετικών μαρτύρων
ΔΙΑΔΙΚΑΣΙΑ Πρόγραμμα μεταχείρισης Για τη μεγιστοποίηση της πιθανότητας ανίχνευσης μιας ανευπλοειδογόνου ή κλαστογόνου ουσίας που δρα σε συγκεκριμένο στάδιο του κυτταρικού κύκλου, έχει μεγάλη σημασία η μεταχείριση επαρκών αριθμών κυττάρων με την υπό δοκιμή χημική ουσία σε όλα τα στάδια του κύκλου τους. Κάθε μεταχείριση πρέπει να αρχίζει και να τελειώνει ενόσω τα κύτταρα αναπτύσσονται εκθετικά και τα κύτταρα θα πρέπει να συνεχίζουν να αναπτύσσονται μέχρι τη στιγμή της δειγματοληψίας. Το πρόγραμμα μεταχείρισης των κυτταρικών σειρών και των καλλιεργειών πρωτογενών κυττάρων μπορεί, επομένως, να διαφέρει ως ένα βαθμό από εκείνο των λεμφοκυττάρων, τα οποία χρειάζονται μιτογόνο διέγερση για να αρχίσουν τον κυτταρικό κύκλο τους (17). Η αποτελεσματικότερη προσέγγιση για τα λεμφοκύτταρα συνίσταται στην έναρξη της μεταχείρισης με την υπό δοκιμή χημική ουσία σε 44-48 ώρες μετά τη διέγερση με PHA, οπότε και τα κύτταρα διαιρούνται ασύγχρονα (6). Σύμφωνα με τα δημοσιευμένα δεδομένα (19), οι περισσότερες ανευπλοειδογόνες και κλαστογόνες ουσίες ανιχνεύονται με βραχύχρονη μεταχείριση 3 έως 6 ωρών, με και χωρίς S9, πριν από την απομάκρυνση της υπό δοκιμή χημικής ουσίας και δειγματοληψία σε χρόνο που ισοδυναμεί περίπου με την κανονική διάρκεια του κυτταρικού κύκλου επί 1,5-2,0 μετά την έναρξη της μεταχείρισης (7). Εντούτοις, για ενδελεχή αξιολόγηση, η οποία θα ήταν αναγκαία για τη διαπίστωση αρνητικού αποτελέσματος, θα πρέπει να πληρούνται και οι τρεις ακόλουθες πειραματικές συνθήκες με τη χρήση βραχυχρόνιας μεταχείρισης με και χωρίς μεταβολική ενεργοποίηση και μακροχρόνιας μεταχείρισης χωρίς μεταβολική ενεργοποίηση (βλ. παραγράφους 56, 57 και 58):
Σε περίπτωση που οποιαδήποτε από τις ανωτέρω πειραματικές συνθήκες οδηγεί σε θετική απόκριση, μπορεί να μη χρειάζεται να διερευνηθεί άλλο σχήμα μεταχείρισης. Εάν είναι γνωστό ή υπάρχουν υπόνοιες ότι η υπό δοκιμή χημική ουσία επηρεάζει τη διάρκεια του κυτταρικού κύκλου (π.χ. στις δοκιμές ουσιών ανάλογων των νουκλεοσιδίων), ιδίως για τα κύτταρα με λειτουργική p53 (35) (36) (77), οι χρόνοι δειγματοληψίας ή αποκατάστασης είναι δυνατόν να παραταθούν επιπλέον κατά την κανονική διάρκεια του κυτταρικού κύκλου επί 1,5 - 2,0 (δηλ. συνολικά για χρονικό διάστημα που ισοδυναμεί με την κανονική διάρκεια του κυτταρικού κύκλου επί 3,0 έως 4,0 φορές μετά την έναρξη της βραχυχρόνιας και της μακροχρόνιας κατεργασίας). Με αυτή τη δυνατότητα επιλογής αντιμετωπίζονται οι περιπτώσεις προβληματισμού σχετικά με τις πιθανές αλληλεπιδράσεις μεταξύ της υπό δοκιμή χημικής ουσίας και της cytoB. Όταν γίνεται χρήση εκτεταμένων περιόδων δειγματοληψίας (δηλ. συνολικός χρόνος καλλιέργειας ισοδύναμος με την κανονική διάρκεια του κυτταρικού κύκλου επί 3,0 έως 4,0), θα πρέπει να λαμβάνεται μέριμνα ώστε να εξασφαλίζεται η συνέχιση της ενεργού διαίρεσης των κυττάρων. Για παράδειγμα, η εκθετική ανάπτυξη των λεμφοκυττάρων ενδέχεται να μειώνεται μετά την πάροδο 96 ωρών από τη διέγερση και κυτταροκαλλιέργειες σε στιβάδες ενδέχεται να παρουσιάζουν συρροή. Τα συνιστώμενα προγράμματα μεταχείρισης κυττάρων παρουσιάζονται συνοπτικά στον πίνακα 2. Τα γενικά αυτά προγράμματα μεταχείρισης μπορούν να τροποποιούνται (και να αιτιολογούνται) ανάλογα με τη σταθερότητα και τη δραστικότητα της υπό δοκιμή χημικής ουσίας ή με τα ιδιαίτερα αυξητικά χαρακτηριστικά των χρησιμοποιούμενων κυττάρων. Πίνακας 2 Χρόνοι μεταχείρισης και συλλογής κυττάρων για τη δοκιμή MNvit
Για τις καλλιέργειες σε μονοστιβάδες, το τέλος της μεταχείρισης διάρκειας 3-6 ωρών, είναι πιθανή η παρουσία μιτωτικών κυττάρων (αναγνωρίζονται από το στρογγυλό σχήμα τους και από την απόσπασή τους από την επιφάνεια). Επειδή τα εν λόγω μιτωτικά κύτταρα αποσπώνται εύκολα, είναι πιθανή η απώλειά τους κατά την απομάκρυνση του θρεπτικού μέσου που περιέχει την υπό δοκιμή χημική ουσία. Εάν υπάρχουν αποδεικτικά στοιχεία για σημαντική αύξηση του αριθμού των μιτωτικών κυττάρων σε σχέση με τους μάρτυρες, με πιθανή διακοπή της μίτωσης, τα κύτταρα θα πρέπει να συλλέγονται με φυγοκέντρηση και να εισάγονται εκ νέου στην καλλιέργεια, ώστε να αποφεύγεται η απώλεια κυττάρων που υφίστανται μίτωση και ενδέχεται να εμφανίζουν μικροπυρήνες ή χρωμοσωμική εκτροπή κατά τον χρόνο της συλλογής. Συλλογή των κυττάρων και ετοιμασία των αντικειμενοφόρων πλακών Η συλλογή και η επεξεργασία των κυττάρων θα πρέπει να πραγματοποιούνται σε κάθε καλλιέργεια χωριστά. Η ετοιμασία των κυτταρικών παρασκευασμάτων μπορεί να περιλαμβάνει κατεργασία με υπότονο διάλυμα. Ωστόσο, το στάδιο αυτό δεν είναι απαραίτητο, εάν επιτυγχάνεται κατάλληλη επίστρωση των κυττάρων με άλλον τρόπο. Μπορούν να χρησιμοποιούνται διάφορες τεχνικές ετοιμασίας αντικειμενοφόρων πλακών, με την προϋπόθεση ότι προκύπτουν υψηλής ποιότητας κυτταρικά παρασκευάσματα για καταμέτρηση. Κύτταρα με άθικτη κυτταρική μεμβράνη και άθικτο κυτταρόπλασμα θα πρέπει να διατηρούνται για να είναι δυνατός ο εντοπισμός μικροπυρήνων και (στη μέθοδο αναστολής της κυτταροκίνησης) ο αξιόπιστος εντοπισμός διπύρηνων κυττάρων. Για τη χρώση των αντικειμενοφόρων πλακών μπορούν να χρησιμοποιούνται διάφορες μέθοδοι, όπως η χρωστική Giemsa ή ειδικά για το DNA φθοριοχρώματα. Με τη χρήση χρώσεων φλουορεσκεΐνης [π.χ. πορτοκαλί της ακριδίνης (78) ή Hoechst 33258 συν πυρονίνη-Y (79)] είναι δυνατόν να εξαλειφθούν ορισμένα από τα τεχνητά αποτελέσματα που οφείλονται στη χρήση μη ειδικών για το DNA χρώσεων. Μπορούν επίσης να χρησιμοποιούνται αντισώματα κατά του κινητοχώρου, FISH με παγκεντρομεριδιακούς ανιχνευτές DNA ή η σήμανση in situ με ειδικούς για τα παγκεντρομερίδια εκκινητές, σε συνδυασμό με κατάλληλη αντίχρωση του DNA, για την εξακρίβωση του περιεχομένου (θα χρωματίζονται τα ολόκληρα χρωμοσώματα, αλλά δεν θα χρωματίζονται τα χωρίς κεντρομερίδιο τμήματα χρωμοσώματος) των μικροπυρήνων, εάν ζητούνται πληροφορίες σχετικά με τον μηχανισμό με τον οποίον αυτοί σχηματίζονται (16) (17). Επιτρέπεται να χρησιμοποιούνται και άλλες μέθοδοι διάκρισης μεταξύ κλαστογόνων και ανευπλοειδογόνων ουσιών, εάν έχει αποδειχθεί και επικυρωθεί η αποτελεσματικότητά τους. Για παράδειγμα, για ορισμένες κυτταρικές σειρές, η καταμέτρηση των πυρήνων με λιγότερα από 2Ν χρωμοσώματα ως συμβάντα υποδιπλοειδίας, με τη χρήση τεχνικών όπως η ανάλυση εικόνων, η κυτταρομετρία με σάρωση λέιζερ ή η κυτταρομετρία ροής, θα μπορούσε επίσης να παρέχει χρήσιμες πληροφορίες (80) (81) (82). Οι μορφολογικές παρατηρήσεις των πυρήνων θα μπορούσαν επίσης να παρέχουν στοιχεία για πιθανή ανευπλοειδία. Επιπλέον, μια δοκιμή χρωμοσωμικών εκτροπών μετάφασης, κατά προτίμηση στον ίδιο τύπο κυττάρων και με χρήση πρωτοκόλλου με συγκρίσιμη ευαισθησία, θα μπορούσε επίσης να είναι ένας χρήσιμος τρόπος για να διαπιστωθεί αν οι μικροπυρήνες οφείλονται σε θραύση χρωμοσωμάτων (δεδομένου ότι η απώλεια χρωμοσώματος δεν θα ανιχνευόταν στη δοκιμή χρωμοσωμικών εκτροπών). Ανάλυση Όλες οι αντικειμενοφόρες πλάκες, τόσο εκείνες με τους μάρτυρες με διαλύτη όσο και εκείνες που φέρουν μάρτυρες χωρίς μεταχείριση (εάν χρησιμοποιήθηκαν) και θετικούς μάρτυρες, θα πρέπει να λαμβάνουν ανεξάρτητο κωδικό πριν από τη μικροσκοπική ανάλυση συχνοτήτων μικροπυρήνων. Θα πρέπει να χρησιμοποιούνται κατάλληλες τεχνικές για τον έλεγχο κάθε μεροληψίας ή ολίσθησης κατά τη χρήση αυτόματου συστήματος καταμέτρησης, όπως η κυτταρομετρία ροής, η κυτταρομετρία με σάρωση λέιζερ ή η ανάλυση εικόνων. Ανεξάρτητα από την αυτοματοποιημένη πλατφόρμα που χρησιμοποιείται για την καταγραφή του σχηματισμού μικροπυρήνων, θα πρέπει να αξιολογούνται παράλληλα οι δείκτες CBPI, RI, RPD ή RICC. Στις κατεργασμένες με cytoB καλλιέργειες, οι συχνότητες μικροπυρήνων θα πρέπει να εξετάζονται τουλάχιστον σε 2 000 διπύρηνα κύτταρα ανά συγκέντρωση και μάρτυρα (83), ισομερώς κατανεμημένα μεταξύ των επαναλήψεων, εάν χρησιμοποιούνται επαναλήψεις. Στην περίπτωση των μονών καλλιεργειών ανά δόση (βλ. παράγραφο 28) θα πρέπει να καταμετρώνται τουλάχιστον 2 000 διπύρηνα κύτταρα ανά καλλιέργεια (83) στη μονή καλλιέργεια. Εάν είναι διαθέσιμα για καταμέτρηση σημαντικά λιγότερα από 1 000 διπύρηνα κύτταρα ανά καλλιέργεια (για διπλές καλλιέργειες) ή λιγότερα από 2 000 κύτταρα (για μονές καλλιέργειες) και εάν δεν διαπιστωθεί σημαντική αύξηση των μικροπυρήνων, η δοκιμή πρέπει να επαναληφθεί με περισσότερα κύτταρα ή σε λιγότερο κυτταροτοξικές συγκεντρώσεις, αναλόγως του ποιο από τα δύο ενδείκνυται. Πρέπει να λαμβάνεται μέριμνα ώστε να μην καταμετρώνται διπύρηνα κύτταρα με ανώμαλο σχήμα ή με μεγάλη διαφορά μεγέθους των δύο πυρήνων. Επιπλέον, δεν πρέπει να συγχέονται τα διπύρηνα κύτταρα με τα ελλιπώς επιστρωμένα πολυπύρηνα κύτταρα. Τα κύτταρα με περισσότερους από δύο κύριους πυρήνες δεν θα πρέπει να εξετάζονται για την παρουσία μικροπυρήνων, εφόσον η βασική συχνότητα μικροπυρήνων μπορεί να είναι υψηλότερη σε αυτά (84). Η καταμέτρηση μονοπύρηνων κυττάρων είναι αποδεκτή, εάν έχει αποδειχθεί ότι η δράση της υπό δοκιμή χημικής ουσίας παρεμποδίζει τη δράση της cytoB. Επανάληψη της δοκιμής χωρίς cytoB θα ήταν ενδεχομένως χρήσιμη σε τέτοιες περιπτώσεις. Η καταμέτρηση μονοπύρηνων κυττάρων επιπλέον των διπύρηνων κυττάρων θα μπορούσε να παράσχει χρήσιμες πληροφορίες (85) (86), αλλά δεν είναι υποχρεωτική. Στις υπό δοκιμή κυτταρικές σειρές χωρίς κατεργασία με cytoB, θα πρέπει να καταμετρώνται οι μικροπυρήνες τουλάχιστον σε 2 000 κύτταρα ανά συγκέντρωση δοκιμής και μάρτυρα (83), ισομερώς κατανεμημένα μεταξύ των επαναλήψεων, εάν χρησιμοποιούνται επαναλήψεις. Όταν χρησιμοποιούνται μονές καλλιέργειες ανά συγκέντρωση (βλ. παράγραφο 28), θα πρέπει να καταμετρώνται τουλάχιστον 2 000 κύτταρα ανά καλλιέργεια σε αυτή τη μονή καλλιέργεια. Εάν είναι διαθέσιμα για καταμέτρηση σημαντικά λιγότερα από 1 000 κύτταρα ανά καλλιέργεια (για διπλές καλλιέργειες) ή λιγότερα από 2 000 κύτταρα (για μονές καλλιέργειες) και εάν δεν διαπιστωθεί σημαντική αύξηση των μικροπυρήνων, η δοκιμή πρέπει να επαναληφθεί με περισσότερα κύτταρα ή σε λιγότερο κυτταροτοξικές συγκεντρώσεις, αναλόγως του ποιο από τα δύο ενδείκνυται. Όταν χρησιμοποιείται cytoB, πρέπει να προσδιορίζεται ο δείκτης CBPI ή RI, τουλάχιστον από 500 κύτταρα ανά καλλιέργεια, για την εκτίμηση του κυτταρικού πολλαπλασιασμού (βλ. προσάρτημα 2). Στις περιπτώσεις μεταχείρισης χωρίς cytoB, είναι απολύτως αναγκαίο να παρέχονται στοιχεία που να αποδεικνύουν τη διαίρεση κυττάρων σε καλλιέργεια, όπως εξηγείται στις παραγράφους 24-28. Τεχνική ικανότητα του εργαστηρίου Για να εξασφαλίσει επαρκή εμπειρία στη διεξαγωγή της δοκιμής πριν την εντάξει στην τρέχουσα πρακτική του, το εργαστήριο θα πρέπει να έχει πραγματοποιήσει σειρά πειραμάτων με θετικές χημικές ουσίες αναφοράς που ενεργούν μέσω διαφόρων μηχανισμών (τουλάχιστον μία με και μία χωρίς μεταβολική ενεργοποίηση, και μία που ενεργεί μέσω ενός ανευπλοειδογόνου μηχανισμού, επιλεγμένες μεταξύ των χημικών ουσιών που απαριθμούνται στον πίνακα 1) και διάφορους αρνητικούς μάρτυρες (περιλαμβανομένων και των καλλιεργειών που δεν υποβάλλονται σε μεταχείριση και διαφόρων διαλυτών/φορέα). Οι αποκρίσεις των εν λόγω θετικών και αρνητικών μαρτύρων θα πρέπει να συμφωνούν με τη βιβλιογραφία. Αυτό δεν ισχύει για τα εργαστήρια που έχουν πείρα, δηλ. διαθέτουν βάση ιστορικών δεδομένων, όπως ορίζεται στις παραγράφους 49 έως 52. Θα πρέπει να διερευνάται ένα σύνολο επιλεγμένων χημικών ουσιών που αποτελούν θετικούς μάρτυρες (βλ. πίνακα 1), με βραχυχρόνια και μακροχρόνια μεταχείριση χωρίς μεταβολική ενεργοποίηση, καθώς και με βραχυχρόνια μεταχείριση με μεταβολική ενεργοποίηση, με σκοπό να καταδειχθεί η τεχνική ικανότητα εντοπισμού κλαστογόνων και ανευπλοειδογόνων χημικών ουσιών, να διαπιστώνεται η αποτελεσματικότητα του συστήματος μεταβολικής ενεργοποίησης και να καταδεικνύεται η καταλληλότητα των διαδικασιών καταμέτρησης (μικροσκοπική οπτική ανάλυση, κυτταρομετρία ροής, κυτταρομετρία με σάρωση λέιζερ, ή ανάλυση εικόνων). Θα πρέπει να επιλέγεται ένα εύρος συγκεντρώσεων των επιλεγμένων χημικών ουσιών που να επιφέρουν αναπαραγώγιμες και σχετιζόμενες με τη συγκέντρωση αυξήσεις σε σχέση με τις τιμές υποβάθρου, για να αποδεικνύονται η ευαισθησία και το δυναμικό εύρος του συστήματος δοκιμής. Ιστορικά δεδομένα για μάρτυρες Το εργαστήριο θα πρέπει να καθορίζει:
Κατά την αρχική συγκέντρωση δεδομένων για ιστορική κατανομή όσον αφορά τους αρνητικούς μάρτυρες, οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει να συμφωνούν με τα δημοσιευμένα δεδομένα για αρνητικούς μάρτυρες, εφόσον υπάρχουν. Καθώς θα προστίθενται περισσότερα πειραματικά δεδομένα στην κατανομή των μαρτύρων, οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει, στην ιδανική περίπτωση, να βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 % της εν λόγω κατανομής (87) (88). Η βάση ιστορικών δεδομένων του εργαστηρίου για αρνητικούς μάρτυρες θα πρέπει αρχικά να δημιουργείται με δεδομένα από τουλάχιστον 10 πειράματα, αν και είναι προτιμότερο να αποτελείται από τουλάχιστον 20 πειράματα που έχουν εκτελεστεί σε συγκρίσιμες πειραματικές συνθήκες. Τα εργαστήρια θα πρέπει να χρησιμοποιούν μεθόδους ποιοτικού ελέγχου, όπως διαγράμματα ελέγχου [π.χ. διαγράμματα C ή X-bar (88)], για να προσδιορίζουν τη μεταβλητότητα των δεδομένων τους που αφορούν τους θετικούς και αρνητικούς μάρτυρες και να αποδεικνύουν ότι έχουν «υπό έλεγχο» τη μεθοδολογία (83). Περαιτέρω συστάσεις για τον τρόπο δημιουργίας και χρήσης των ιστορικών δεδομένων (δηλ. κριτήρια προσθήκης στοιχείων στα ιστορικά δεδομένα και αποκλεισμού στοιχείων από αυτά, καθώς και κριτήρια αποδοχής συγκεκριμένου πειράματος) έχουν διατυπωθεί στη βιβλιογραφία (87). Κάθε αλλαγή του πειραματικού πρωτοκόλλου θα πρέπει να εξετάζεται υπό το πρίσμα της συμφωνίας των δεδομένων με τις υφιστάμενες βάσεις ιστορικών δεδομένων του εργαστηρίου για μάρτυρες. Τυχόν σημαντικές ανακολουθίες θα πρέπει να έχουν ως αποτέλεσμα τη δημιουργία νέας βάσης ιστορικών δεδομένων για μάρτυρες. Τα δεδομένα για αρνητικούς μάρτυρες θα πρέπει να είναι η συχνότητα εμφάνισης μικροκυττάρων από μια μονή καλλιέργεια ή από το άθροισμα των καλλιεργειών επανάληψης, όπως περιγράφεται στην παράγραφο 28. Οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει, στην ιδανική περίπτωση, να βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 % της κατανομής της βάσης ιστορικών δεδομένων του εργαστηρίου για αρνητικούς μάρτυρες (87) (88). Όταν τα δεδομένα για παράλληλους αρνητικούς μάρτυρες δεν βρίσκονται εντός των ορίων ελέγχου σε επίπεδο 95 %, μπορεί να είναι αποδεκτή η προσθήκη τους στην ιστορική κατανομή μαρτύρων, εφόσον τα εν λόγω δεδομένα δεν είναι ακραίες έκτοπες τιμές και υπάρχουν στοιχεία που αποδεικνύουν ότι το σύστημα δοκιμής είναι «υπό έλεγχο» (βλ. παράγραφο 50) και ότι δεν πρόκειται για τεχνικό ή ανθρώπινο σφάλμα. ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Παρουσίαση των αποτελεσμάτων Εάν εφαρμόζεται η τεχνική της αναστολής της κυτταροκίνησης, μόνο οι συχνότητες διπύρηνων κυττάρων με μικροπυρήνες (ανεξαρτήτως του αριθμού μικροπυρήνων ανά κύτταρο) χρησιμοποιούνται για την αξιολόγηση της επαγωγής μικροπυρήνων. Η καταγραφή του αριθμού κυττάρων με έναν, δύο ή περισσότερους μικροπυρήνες μπορεί να αναφέρεται χωριστά και ενδεχομένως παρέχει χρήσιμες πληροφορίες, αλλά δεν είναι υποχρεωτική. Πρέπει να προσδιορίζονται παράλληλες μετρήσεις κυτταροτοξικότητας και/ή κυτταρόστασης για όλες τις καλλιέργειες που υποβάλλονται σε μεταχείριση και τις καλλιέργειες που είναι αρνητικοί και θετικοί μάρτυρες (16). Όταν εφαρμόζεται η μέθοδος αναστολής της κυτταροκίνησης, πρέπει να υπολογίζεται ο δείκτης CBPI ή ο RI ως μέτρο της καθυστέρησης του κυτταρικού κύκλου, για όλες τις καλλιέργειες που υποβάλλονται σε μεταχείριση και τις καλλιέργειες-μάρτυρες. Εάν δεν χρησιμοποιείται cytoB, πρέπει να υπολογίζεται ο δείκτης RPD ή RICC (βλ. προσάρτημα 2). Θα πρέπει να παρέχονται δεδομένα για κάθε καλλιέργεια. Επιπλέον, όλα τα δεδομένα θα πρέπει να συγκεφαλαιώνονται σε μορφή πίνακα. Κριτήρια αποδοχής Η αποδοχή μιας δοκιμής βασίζεται στα ακόλουθα κριτήρια:
Αξιολόγηση και ερμηνεία των αποτελεσμάτων Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς θετική εάν, σε οποιαδήποτε από τις πειραματικές συνθήκες που εξετάστηκαν (βλ. παραγράφους 36-39):
Όταν πληρούνται όλα αυτά τα κριτήρια, η υπό δοκιμή χημική ουσία θεωρείται ικανή να επάγει θραύσεις και/ή προσθήκη ή απώλεια χρωμοσώματος σε αυτό το σύστημα δοκιμών. Συστάσεις για τις πλέον κατάλληλες στατιστικές μεθόδους έχουν διατυπωθεί επίσης στη βιβλιογραφία (90) (91) (92). Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς αρνητική εάν, σε όλες τις πειραματικές συνθήκες που εξετάστηκαν (βλ. παραγράφους 36-39):
Θεωρείται τότε ότι η υπό δοκιμή ουσία δεν είναι ικανή να επάγει θραύσεις και/ή προσθήκη ή απώλεια χρωμοσώματος σε αυτό το σύστημα δοκιμών. Συστάσεις για τις πλέον κατάλληλες στατιστικές μεθόδους έχουν διατυπωθεί επίσης στη βιβλιογραφία (90) (91) (92). Δεν απαιτείται επαλήθευση των σαφώς θετικών ή αρνητικών αποκρίσεων. Όταν η απόκριση δεν είναι ούτε σαφώς αρνητική ούτε θετική, όπως περιγράφεται ανωτέρω, ή για να διαπιστωθεί η βιολογική σημασία ενός αποτελέσματος, τα δεδομένα θα πρέπει να αξιολογούνται με βάση την κρίση των ειδικών και/ή περαιτέρω διερεύνηση. Η καταμέτρηση επιπλέον κυττάρων (κατά περίπτωση) ή η επανάληψη του πειράματος, ενδεχομένως με τη χρήση διαφορετικών πειραματικών συνθηκών [π.χ. διαστήματα μεταξύ των συγκεντρώσεων, άλλες συνθήκες μεταβολικής ενεργοποίησης (δηλ. συγκέντρωση ή προέλευση του S9)] θα μπορούσε να είναι χρήσιμη. Σε σπάνιες περιπτώσεις, ακόμη και μετά από περαιτέρω έρευνες, το σύνολο δεδομένων δεν επιτρέπει την εξαγωγή συμπεράσματος για θετικά ή αρνητικά αποτελέσματα και, κατά συνέπεια, κρίνεται διφορούμενο. Η επαγωγή μικροπυρήνων από χημικές ουσίες στη δοκιμή MNvit ενδέχεται να οφείλεται σε θραύση ή απώλεια χρωμοσώματος ή σε συνδυασμό αυτών. Για να προσδιοριστεί αν ο μηχανισμός επαγωγής μικροπυρήνων συνδέεται με κλαστογόνο ή ανευπλοειδογόνο δράση, είναι δυνατόν να διεξαχθεί περαιτέρω ανάλυση με αντισώματα κινητοχώρου, κεντρομερικούς ανιχνευτές in situ ή με άλλες μεθόδους. Έκθεση δοκιμής Στην έκθεση δοκιμής θα πρέπει να περιλαμβάνονται τα ακόλουθα στοιχεία:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Ανευπλοειδογόνος ουσία : κάθε χημική ουσία ή διεργασία που προκαλεί ανευπλοειδία σε κύτταρα ή οργανισμούς, μέσω της αντίδρασής της με τα συστατικά του μηχανισμού του κυτταρικού κύκλου μιτωτικής και μειωτικής διαίρεσης. Ανευπλοειδία : κάθε απόκλιση από τον φυσιολογικό διπλοειδή (ή απλοειδή) αριθμό χρωμοσωμάτων κατά σε ένα ή περισσότερα χρωμοσώματα, όχι όμως κατά πλήρεις σειρές χρωμοσωμάτων (πολυπλοειδία). Απόπτωση : προγραμματισμένος κυτταρικός θάνατος, ο οποίος χαρακτηρίζεται από μια σειρά σταδίων που οδηγούν στη διάσπαση των κυττάρων προς περικλειόμενα από κυτταρική μεμβράνη σωματίδια τα οποία, στη συνέχεια, απομακρύνονται με φαγοκυττάρωση ή αποβολή. Κυτταρικός πολλαπλασιασμός : η αύξηση του αριθμού των κυττάρων η οποία είναι αποτέλεσμα της μιτωτικής τους διαίρεσης. Κεντρομερίδιο : η περιοχή DNA του χρωμοσώματος στην οποία συγκρατούνται ενωμένες μεταξύ τους οι δύο χρωματίδες και όπου προσδένονται εκατέρωθεν οι δύο κινητοχώροι. Χημικό προϊόν : μια ουσία ή ένα μείγμα. Συγκεντρώσεις : αναφέρεται στις τελικές συγκεντρώσεις της υπό δοκιμή χημικής ουσίας στο θρεπτικό μέσο καλλιέργειας. Κλαστογόνο : κάθε χημική ουσία ή συμβάν που προκαλεί δομικές χρωμοσωμικές εκτροπές σε πληθυσμούς κυττάρων ή ευκαρυωτικούς οργανισμούς. Κυτταροκίνηση : η διαδικασία κυτταρικής διαίρεσης αμέσως μετά τη μίτωση για τον σχηματισμό δύο θυγατρικών κυττάρων, το καθένα από τα οποία περιέχει έναν μόνο πυρήνα. Δείκτης πολλαπλασιασμού με αναστολή κυτταροκίνησης (CBPI) : το ποσοστό κυττάρων από δεύτερη διαίρεση στον υποβαλλόμενο σε μεταχείριση πληθυσμό σε σχέση με τον μάρτυρα που δεν υποβάλλεται σε μεταχείριση (βλ. μαθηματικό τύπο στο προσάρτημα 2). Κυτταρόσταση : αναστολή της ανάπτυξης των κυττάρων (βλ. μαθηματικό τύπο στο προσάρτημα 2). Κυτταροτοξικότητα : στους προσδιορισμούς που καλύπτονται από την παρούσα μέθοδο δοκιμών και διενεργούνται με την παρουσία κυτταροχαλασίνης Β, η κυτταροτοξικότητα διαπιστώνεται ως μείωση του δείκτη πολλαπλασιασμού με αναστολή κυτταροκίνησης (CBPI) ή του δείκτη αναδιπλασιασμού (RI) των κυττάρων υπό μεταχείριση σε σχέση με τον αρνητικό μάρτυρα (βλ. παράγραφο 26 και προσάρτημα 2). Στους προσδιορισμούς που καλύπτονται από την παρούσα μέθοδο δοκιμών απουσία κυτταροχαλασίνης Β, η κυτταροτοξικότητα διαπιστώνεται ως μείωση του σχετικού διπλασιασμού του πληθυσμού (RPD) ή της σχετικής αύξησης του αριθμού κυττάρων (RICC) των κατεργασμένων κυττάρων σε σχέση με τον αρνητικό μάρτυρα (βλ. παράγραφο 27 και προσάρτημα 2). Γονιδιοτοξικός : γενικός όρος που καλύπτει τους παράγοντες που προκαλούν κάθε είδους βλάβη του DNA ή του χρωμοσώματος, μεταξύ των οποίων τις ρήξεις, τις απαλείψεις, τις χημικές προσθήκες, τις τροποποιήσεις και συνδέσεις νουκλεοτιδίων, τις αναδιατάξεις, τις γονιδιακές μεταλλάξεις, τις χρωμοσωμικές εκτροπές και την ανευπλοειδία. Δεν προκαλούν όλα τα είδη γονιδιοτοξικών επιδράσεων μεταλλάξεις ή μόνιμη χρωμοσωμική βλάβη. Μεσοφασικά κύτταρα : κύτταρα που δεν βρίσκονται στο μιτωτικό στάδιο. Κινητοχώρος : πρωτεϊνική δομή που συναρμολογείται στο κεντρομερίδιο του χρωμοσώματος και με την οποία ενώνονται οι μικροσωληνίσκοι της ατράκτου κατά τη διάρκεια της κυτταρικής διαίρεσης, ώστε να κινηθούν οργανωμένα τα θυγατρικά χρωμοσώματα προς τους πόλους των θυγατρικών κυττάρων. Μικροπυρήνες : μικροί πυρήνες, που συνυπάρχουν και διακρίνονται από τους κύριους πυρήνες των κυττάρων και οι οποίοι παράγονται κατά τη διάρκεια της τελόφασης της μίτωσης (μείωσης) από καθυστερούντα χρωμοσωμικά θραύσματα ή ολόκληρα χρωμοσώματα. Μίτωση : διαίρεση του κυτταρικού πυρήνα, η οποία συνήθως χωρίζεται σε πρόφαση, προμετάφαση, μετάφαση, ανάφαση και τελόφαση. Μιτωτικός δείκτης : ο λόγος του αριθμού κυττάρων που βρίσκονται σε μετάφαση προς τον συνολικό αριθμό κυττάρων που παρατηρούνται σε έναν κυτταρικό πληθυσμό· αποτελεί ένδειξη του βαθμού κυτταρικού πολλαπλασιασμού του συγκεκριμένου πληθυσμού. Μεταλλαξιογόνο : παράγοντας που προκαλεί κληρονομήσιμη μεταβολή μίας ή περισσότερων ακολουθιών ζευγών βάσεων του DNA στα γονίδια ή της δομής των χρωμοσωμάτων (χρωμοσωμικές εκτροπές). Μη αποχωρισμός : αδυναμία των ζευγών χρωματίδων να αποχωριστούν και να διαχωριστούν σωστά στα αναπτυσσόμενα θυγατρικά κύτταρα, με αποτέλεσμα τα θυγατρικά κύτταρα να μην έχουν κανονικό αριθμό χρωμοσωμάτων. Κατάσταση της p53 : η πρωτεΐνη p53 συμμετέχει στη ρύθμιση του κυτταρικού κύκλου, την απόπτωση και την επιδιόρθωση του DNA. Τα κύτταρα που παρουσιάζουν έλλειψη λειτουργικής πρωτεΐνης p53, αδυνατώντας να διακόψουν τον κυτταρικό κύκλο ή να εξαλείψουν τα κύτταρα που έχουν υποστεί βλάβη μέσω της απόπτωσης ή άλλων μηχανισμών (π.χ. επαγωγή της επιδιόρθωσης του DNA) που σχετίζονται με τις λειτουργίες απόκρισης της p53 σε βλάβες του DNA, θα πρέπει θεωρητικά να είναι πιο επιρρεπή σε γονιδιακές μεταλλάξεις ή χρωμοσωμικές εκτροπές. Πολυπλοειδία : αριθμητικές χρωμοσωμικές εκτροπές κυττάρων ή οργανισμών, οι οποίες αφορούν πλήρεις σειρές χρωμοσωμάτων, σε αντίθεση με εκείνες που αφορούν ένα ή περισσότερα μεμονωμένα χρωμοσώματα (ανευπλοειδία). Δείκτης πολλαπλασιασμού (PI) : μέθοδος μέτρησης της κυτταροτοξικότητας, όταν δεν χρησιμοποιείται κυτταροχαλασίνη Β (βλ. μαθηματικό τύπο στο προσάρτημα 2). Σχετική αύξηση του αριθμού κυττάρων (RICC) : μέθοδος μέτρησης της κυτταροτοξικότητας, όταν δεν χρησιμοποιείται κυτταροχαλασίνη Β (βλ. μαθηματικό τύπο στο προσάρτημα 2). Σχετικός διπλασιασμός του πληθυσμού (RPD) : μέθοδος μέτρησης της κυτταροτοξικότητας, όταν δεν χρησιμοποιείται κυτταροχαλασίνη Β (βλ. μαθηματικό τύπο στο προσάρτημα 2). Δείκτης αναδιπλασιασμού (RI) : το ποσοστό κυτταρικών κύκλων διαίρεσης που ολοκληρώνονται σε υποβαλλόμενη σε μεταχείριση καλλιέργεια, σε σχέση με τον μάρτυρα που δεν υποβάλλεται σε μεταχείριση, κατά τη διάρκεια της περιόδου έκθεσης και ανάκαμψης (βλ. μαθηματικό τύπο στο προσάρτημα 2). Ηπατικό κλάσμα S9 : υπερκείμενο υγρό ομογενοποιήματος ήπατος μετά από φυγοκέντρηση σε 9 000 g, δηλ. ανεπεξέργαστο εκχύλισμα ήπατος. Μείγμα S9 : μείγμα του ηπατικού κλάσματος S9 με συμπαράγοντες που είναι αναγκαίοι για τη δράση των μεταβολικών ενζύμων. Μάρτυρας με διαλύτη : γενικός όρος για τον προσδιορισμό των καλλιεργειών-μαρτύρων που λαμβάνουν μόνο τον διαλύτη ο οποίος χρησιμοποιείται για τη διάλυση της υπό δοκιμή χημικής ουσίας. Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Μάρτυρες που δεν υποβάλλονται σε μεταχείριση : καλλιέργειες που δεν υφίστανται καμία μεταχείριση (δηλ. ούτε με την υπό δοκιμή χημική ουσία ούτε με διαλύτη), αλλά ετοιμάζονται ταυτόχρονα με τις καλλιέργειες που λαμβάνουν την υπό δοκιμή χημική ουσία και με τον ίδιο τρόπο. Προσάρτημα 2 ΜΑΘΗΜΑΤΙΚΟΙ ΤΥΠΟΙ ΓΙΑ ΤΗΝ ΕΚΤΙΜΗΣΗ ΤΗΣ ΚΥΤΑΡΟΤΟΞΙΚΟΤΗΤΑΣ Όταν χρησιμοποιείται cytoB , η κυτταροτοξικότητα πρέπει να εκτιμάται με βάση τον δείκτη πολλαπλασιασμού με αναστολή κυτταροκίνησης (CBPI) ή τον δείκτη αναδιπλασιασμού (RI) (17) (69). CBPI δείχνει τον μέσο αριθμό κυτταρικών κύκλων ανά κύτταρο κατά τη διάρκεια της περιόδου έκθεσης στην cytoB και μπορεί να χρησιμοποιηθεί για τον υπολογισμό του κυτταρικού πολλαπλασιασμού. Ο RI δείχνει τον σχετικό αριθμό πυρήνων στις υποβαλλόμενες σε μεταχείριση καλλιέργειες σε σχέση με τις καλλιέργειες-μάρτυρες και μπορεί να χρησιμοποιηθεί για τον υπολογισμό του επί τοις εκατό ποσοστού κυτταρόστασης. % Κυτταρόσταση = 100 – 100{(CBPIT – 1) ÷ (CBPIC – 1)} Και:
όπου:
Συνεπώς, μια τιμή CBPI ίση με 1 (όλα τα κύτταρα είναι μονοπύρηνα) ισοδυναμεί με κυτταρόσταση 100 %. Κυτταρόσταση = 100-RI
Συνεπώς, μια τιμή RI ίση με 53 % σημαίνει ότι στην υποβληθείσα σε μεταχείριση καλλιέργεια διαιρέθηκε μόνο το 53 % των κυττάρων σε σχέση με την καλλιέργεια — μάρτυρα προς σχηματισμό διπύρηνων και πολυπύρηνων κυττάρων, δηλαδή κυτταρόσταση 47 %. Όταν δεν χρησιμοποιείται cytoB , συνιστάται η εκτίμηση της κυτταροτοξικότητας με βάση τη σχετική αύξηση του αριθμού κυττάρων (RICC) ή τον σχετικό διπλασιασμό του πληθυσμού (RPD) (69), δεδομένου ότι και στις δύο αυτές παραμέτρους λαμβάνεται υπόψη το ποσοστό του κυτταρικού πληθυσμού που έχει διαιρεθεί.
όπου: Διπλασιασμός πληθυσμού = [log (αριθ. κυττάρων μετά την μεταχείριση ÷ αρχικός αριθ. κυττάρων)] ÷ log 2 Συνεπώς μια τιμή RICC ή RPD ίση με 53 % δείχνει κυτταροτοξικότητα/κυτταρόσταση 47 %. Η κυτταροτοξικότητα είναι δυνατόν να εκτιμηθεί μέσω της καταμέτρησης των κλώνων που αποτελούνται από 1 (cl1), 2 (cl2), 3 έως 4 (cl4) και 5 έως 8 (cl8) κύτταρα, με τη βοήθεια δείκτη πολλαπλασιασμού (PI).
Ο PI έχει χρησιμοποιηθεί ως χρήσιμη και αξιόπιστη παράμετρος κυτταροτοξικότητας και στην περίπτωση των κυτταρικών σειρών που καλλιεργούνται in situ χωρίς cytoB (35) (36) (37) (38) και μπορεί να θεωρηθεί χρήσιμη επιπλέον παράμετρος. Σε κάθε περίπτωση, ο αριθμός κυττάρων πριν από τη μεταχείριση θα πρέπει να είναι ο ίδιος για τις υποβαλλόμενες σε μεταχείριση καλλιέργειες και τις καλλιέργειες που αποτελούν τον αρνητικό μάρτυρα. Ο RCC (δηλ. ο λόγος «αριθμός κυττάρων στις καλλιέργειες μεταχείρισης/αριθμός κυττάρων στις καλλιέργειες-μάρτυρες») είχε χρησιμοποιηθεί ως παράμετρος κυτταροτοξικότητας στο παρελθόν, αλλά δεν συνιστάται πλέον, διότι μπορεί να οδηγήσει σε υποεκτίμηση της κυτταροτοξικότητας. Όταν χρησιμοποιούνται συστήματα αυτόματης καταμέτρησης, π.χ. κυτταρομετρία ροής, κυτταρομετρία με σάρωση λέιζερ ή ανάλυση εικόνων, ο αριθμός των κυττάρων στον τύπο μπορεί να αντικατασταθεί από τον αριθμό των πυρήνων. Στις καλλιέργειες αρνητικού μάρτυρα, ο δείκτης διπλασιασμού του πληθυσμού ή αναδιπλασιασμού θα πρέπει να είναι συμβατός με την απαίτηση για τη δειγματοληψία κυττάρων μετά την μεταχείριση σε χρόνο που ισοδυναμεί περίπου με την κανονική διάρκεια του κυτταρικού κύκλου επί 1,5-2,0. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(15) |
Στο μέρος Β, προστίθενται τα ακόλουθα κεφάλαια: «Β.59 Δερματική ευαισθητοποίηση in chemico: Άμεσος προσδιορισμός πεπτιδικής δραστικότητας (DPRA) ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 442C του ΟΟΣΑ (2015). Ευαισθητοποιητική του δέρματος είναι μια ουσία που, όταν έρχεται επαφή με το δέρμα, προκαλεί αλλεργική αντίδραση, όπως ορίζεται στο Παγκοσμίως Εναρμονισμένο Σύστημα των Ηνωμένων Εθνών για την Ταξινόμηση και Επισήμανση των Χημικών Ουσιών (Globally Harmonized System/GHS των Ηνωμένων Εθνών) (1) και στον κανονισμό (ΕΚ) αριθ. 1272/2008 της Ευρωπαϊκής Ένωσης για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων (Classification, Labelling and Packaging/CLP) (18). Η παρούσα μέθοδος δοκιμών παρέχει μια διαδικασία άμεσου προσδιορισμού της πεπτιδικής δραστικότητας in chemico (Direct Peptide Reactivity Assay/DPRA), προοριζόμενη να χρησιμοποιείται για την υποστήριξη της διάκρισης ανάμεσα σε ευαισθητοποιητικές και μη ευαισθητοποιητικές του δέρματος ουσίες σύμφωνα με το GHS των Ηνωμένων Εθνών και τον κανονισμό CLP. Υπάρχει γενική συμφωνία για τα βασικά υποκείμενα βιολογικά συμβάντα στη δερματική ευαισθητοποίηση. Οι υπάρχουσες γνώσεις σχετικά με τους χημικούς και βιολογικούς μηχανισμούς που συνδέονται με τη δερματική ευαισθητοποίηση έχουν συνοψιστεί με τη μορφή μιας πορείας δυσμενούς έκβασης (Adverse Outcome Pathway/AOP) (2) — από το μοριακό εναρκτήριο συμβάν στα ενδιάμεσα συμβάντα και μέσω αυτών στη δυσμενή επίδραση, δηλ. την αλλεργική δερματίτιδα εξ επαφής στον άνθρωπο και την υπερευαισθησία εξ επαφής στα τρωκτικά. Στην AOP δερματικής ευαισθητοποίησης, το μοριακό εναρκτήριο συμβάν είναι η ομοιοπολική δέσμευση ηλεκτρονιόφιλων ουσιών σε πυρηνόφιλα κέντρα των πρωτεϊνών του δέρματος. Η αξιολόγηση της δερματικής ευαισθητοποίησης περιλαμβάνει συνήθως τη χρήση πειραματόζωων. Στις κλασικές μεθόδους που βασίζονται σε ινδικά χοιρίδια, όπως η δοκιμή Magnusson Kligman με μεγιστοποίηση σε ινδικά χοιρίδια και η δοκιμή Buehler [μέθοδος δοκιμών Β.6 (3)], μελετώνται τόσο το στάδιο επαγωγής όσο και το στάδιο πρόκλησης δερματικής ευαισθητοποίησης. Μια δοκιμή σε ποντικούς, συγκεκριμένα η δοκιμασία επιχώριων λεμφαδένων [LLNA, μέθοδος δοκιμών Β.42 (4)] και οι δύο τροποποιήσεις της που δεν απαιτούν ραδιενέργεια, LLNA: DA [μέθοδος δοκιμών Β.50 (5)] και LLNA: BrdU-ELISA [μέθοδος δοκιμών Β.51 (6)], οι οποίες αξιολογούν αποκλειστικά την επαγωγική απόκριση, έχει επίσης κριθεί αποδεκτή, δεδομένου ότι προσφέρει ένα πλεονέκτημα έναντι των δοκιμών σε ινδικά χοιρίδια όσον αφορά την καλή μεταχείριση των ζώων, καθώς και αντικειμενική μέτρηση του επαγωγικού σταδίου της δερματικής ευαισθητοποίησης. Πιο πρόσφατα, μέθοδοι δοκιμών μηχανιστικής βάσης in chemico και in vitro θεωρήθηκαν επιστημονικά έγκυρες για την αξιολόγηση του κινδύνου ευαισθητοποίησης του δέρματος από χημικές ουσίες. Ωστόσο, λόγω της περιορισμένης κάλυψης από πλευράς μηχανισμών AOP με καθεμία από τις διαθέσιμες μεθόδους δοκιμών χωρίς χρήση ζώων, θα χρειαστούν συνδυασμοί μεθόδων στις οποίες δεν χρησιμοποιούνται ζώα (in silico, in chemico, in vitro) στο πλαίσιο ολοκληρωμένων προσεγγίσεων για τη διεξαγωγή δοκιμών και την αξιολόγηση (Integrated Approaches to Testing and Assessment/IATA), ώστε να καταστεί δυνατή η πλήρης υποκατάσταση των δοκιμών σε ζώα, που χρησιμοποιούνται επί του παρόντος (2) (7). Η DPRA προτείνεται για την εξέταση του μοριακού εναρκτήριου συμβάντος της AOP δερματικής ευαισθητοποίησης, δηλ. της πρωτεϊνικής δραστικότητας, με ποσοτικό προσδιορισμό της δραστικότητας των υπό δοκιμή χημικών ουσιών πάνω σε μοντέλα συνθετικών πεπτιδίων που περιέχουν είτε λυσίνη ή κυστεΐνη (8). Στη συνέχεια, οι τιμές εκατοστιαίας ελάττωσης των κυστεϊνούχων και λυσινούχων πεπτιδίων χρησιμοποιούνται για την κατάταξη των ουσιών σε μία από τέσσερις τάξεις δραστικότητας για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος ουσιών (9). Η DPRA αξιολογήθηκε πρώτα με μελέτη επικύρωσης υπό την αιγίδα του Εργαστηρίου Αναφοράς της Ευρωπαϊκής Ένωσης για Εναλλακτικές Μεθόδους αντί των Δοκιμών σε Ζώα (EURL ECVAM) και, στη συνέχεια, με ανεξάρτητη αξιολόγηση από ομότιμους κριτές, την οποία διενήργησε η επιστημονική συμβουλευτική επιτροπή (ESAC) του EURL ECVAM, και κρίθηκε επιστημονικά έγκυρη (10) προς χρήση στο πλαίσιο μιας προσέγγισης ΙΑΤΑ για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος ουσιών με σκοπό την ταξινόμηση ως προς τον κίνδυνο και την επισήμανση. Παραδείγματα σχετικά με τη χρήση δεδομένων DPRA σε συνδυασμό με άλλα στοιχεία έχουν αναφερθεί στη βιβλιογραφία (11) (12) (13) (14). Οι ορισμοί παρατίθενται στο προσάρτημα 1. ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ, ΕΦΑΡΜΟΣΙΜΟΤΗΤΑ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ Ο συσχετισμός της πρωτεϊνικής δραστικότητας με το δυναμικό δερματικής ευαισθητοποίησης έχει αποδειχθεί επαρκώς (15) (16) (17). Ωστόσο, δεδομένου ότι η δέσμευση πρωτεϊνών αποτελεί μόνον ένα από τα βασικά συμβάντα, έστω και αν πρόκειται για το μοριακό εναρκτήριο συμβάν της AOP δερματικής ευαισθητοποίησης, τα σχετικά με την πρωτεϊνική δραστικότητα στοιχεία που συγκεντρώνονται με μεθόδους με και χωρίς δοκιμές μπορεί να μην επαρκούν από μόνα τους για τη συναγωγή συμπεράσματος σχετικά με την απουσία δυναμικού δερματικής ευαισθητοποίησης από χημικές ουσίες. Ως εκ τούτου, τα δεδομένα που συγκεντρώνονται με την παρούσα μέθοδο δοκιμών θα πρέπει να εντάσσονται στο πλαίσιο ολοκληρωμένων προσεγγίσεων, όπως οι IATA, συνδυαζόμενα με άλλες συμπληρωματικές πληροφορίες, π.χ. αυτές που προκύπτουν από αναλύσεις in vitro με τις οποίες εξετάζονται άλλα βασικά συμβάντα της AOP δερματικής ευαισθητοποίησης, καθώς και από μεθόδους χωρίς δοκιμές, συμπεριλαμβανομένων των συγκριτικών προσεγγίσεων (read-across) με στοιχεία για ουσίες ανάλογης χημικής δομής. Η παρούσα μέθοδος δοκιμών μπορεί να χρησιμοποιείται, σε συνδυασμό με άλλες συμπληρωματικές πληροφορίες, για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών (δηλ. κατηγορίας 1 του GHS των Ηνωμένων Εθνών/κανονισμού CLP) και μη ευαισθητοποιητικών του δέρματος ουσιών στο πλαίσιο μιας προσέγγισης IATA. Δεν μπορεί να χρησιμοποιείται αυτοτελώς για τη λεπτομερέστερη κατάταξη ευαισθητοποιητικών του δέρματος ουσιών στις υποκατηγορίες 1A και 1B κατά GHS/CLP, ούτε για την πρόβλεψη της ευαισθητοποιητικής ισχύος προκειμένου να ληφθούν αποφάσεις εκτίμησης της ασφάλειας. Ωστόσο, ανάλογα με το κανονιστικό πλαίσιο, ένα θετικό αποτέλεσμα στην DPRA μπορεί να χρησιμοποιηθεί αυτοτελώς για την κατάταξη χημικών ουσιών στην κατηγορία 1 κατά GHS/CLP. Η μέθοδος δοκιμών DPRA μπορεί αποδεδειγμένα να μεταφερθεί σε εργαστήρια με εμπειρία στην υγροχρωματογραφία υψηλής απόδοσης (HPLC). Ο βαθμός αναπαραγωγιμότητας των προβλέψεων που αναμένεται να παρέχει η μέθοδος δοκιμών είναι της τάξης του 85 % ενδοεργαστηριακά και 80 % διεργαστηριακά (10). Από τα αποτελέσματα της μελέτης επικύρωσης (18) και δημοσιευμένων μελετών (19) συνάγεται συνολικά ότι, σε σύγκριση με τα αποτελέσματα της LLNA, η ορθότητα της DPRA όσον αφορά τη διάκριση μεταξύ ευαισθητοποιητικών (δηλ. κατηγορίας 1 κατά GHS/CLP) και μη ευαισθητοποιητικών του δέρματος ουσιών είναι 80 % (N = 157), με ευαισθησία 80 % (88/109) και ειδικότητα 77 % (37/48). Η DPRA είναι πιθανότερο να υποτιμήσει την πρόβλεψη για χημικές ουσίες με χαμηλή έως μέτρια ισχύ δερματικής ευαισθητοποίησης (δηλ. υποκατηγορίας 1Β κατά GHS/CLP) έναντι χημικών ουσιών που εμφανίζουν υψηλή ισχύ δερματικής ευαισθητοποίησης (δηλ. υποκατηγορίας 1Α κατά GHS/CLP) (18) (19). Ωστόσο, οι τιμές ορθότητας που παρέχονται εδώ για την DPRA ως αυτοτελή μέθοδο δοκιμών είναι απλώς ενδεικτικές, δεδομένου ότι η μέθοδος δοκιμών θα πρέπει να εξετάζεται σε συνδυασμό με άλλες πηγές πληροφοριών στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις διατάξεις της παραγράφου 9 ανωτέρω. Επιπλέον, κατά την αξιολόγηση των μεθόδων δοκιμών δερματικής ευαισθητοποίησης χωρίς χρήση ζώων, θα πρέπει να μη λησμονείται ότι η δοκιμασία LLNA, καθώς και άλλες δοκιμές σε ζώα, ενδέχεται να μην αντικατοπτρίζουν πλήρως την κατάσταση στο είδος που ενδιαφέρει, δηλ. στον άνθρωπο. Με βάση το σύνολο των διαθέσιμων δεδομένων, η DPRA είναι εφαρμόσιμη σε υπό δοκιμή χημικές ουσίες που καλύπτουν ποικιλία οργανικών δραστικών ομάδων, μηχανισμών αντίδρασης, επιπέδων ισχύος δερματικής ευαισθητοποίησης (όπως προσδιορίζονται με μελέτες in vivo) και φυσικοχημικών ιδιοτήτων (8) (9) (10) (19). Συνολικά, τα στοιχεία αυτά δείχνουν τη χρησιμότητα της DPRA ως εργαλείου που συμβάλλει στον προσδιορισμό των κινδύνων δερματικής ευαισθητοποίησης. Ο όρος «υπό δοκιμή χημική ουσία» χρησιμοποιείται στην παρούσα μέθοδο δοκιμών για να δηλώσει την ύλη που υποβάλλεται στη δοκιμή και δεν σχετίζεται με την εφαρμοσιμότητα της DPRA σε δοκιμές ουσιών και/ή μειγμάτων. Η παρούσα μέθοδος δοκιμών δεν έχει εφαρμογή στις δοκιμές ενώσεων μετάλλων, δεδομένου ότι είναι γνωστό ότι αυτές αντιδρούν με πρωτεΐνες με μηχανισμούς διαφορετικούς από την ομοιοπολική σύνδεση. Η υπό δοκιμή χημική ουσία θα πρέπει να είναι διαλυτή σε κατάλληλο διαλύτη, σε τελική συγκέντρωση 100 mM (βλ. παράγραφο 18). Ωστόσο, μπορούν να δοκιμαστούν και χημικές ουσίες που δεν είναι διαλυτές σε αυτή τη συγκέντρωση, με τη χρήση χαμηλότερων συγκεντρώσεων. Στην περίπτωση αυτή, ένα θετικό αποτέλεσμα θα μπορούσε να χρησιμοποιηθεί για την υποστήριξη του χαρακτηρισμού της υπό δοκιμή χημικής ουσίας ως ευαισθητοποιητικής του δέρματος, ενώ ένα αρνητικό αποτέλεσμα δεν θα πρέπει να οδηγεί σε οριστικό συμπέρασμα περί απουσίας δραστικότητας. Τα διαθέσιμα στοιχεία σχετικά με την εφαρμοσιμότητα της DPRA σε μείγματα γνωστής σύνθεσης είναι επί του παρόντος περιορισμένα (18) (19). Ωστόσο, η DPRA θεωρείται τεχνικά εφαρμόσιμη στον έλεγχο πολυσυστατικών ουσιών και μειγμάτων γνωστής σύνθεσης (βλ. παράγραφο 18). Πριν από την εφαρμογή της παρούσας μεθόδου δοκιμών σε μείγμα για τη συγκέντρωση δεδομένων για ρυθμιστικούς σκοπούς, θα πρέπει να εξετάζεται αν — και, εάν ναι, για ποιον λόγο — μπορεί να αποδώσει επαρκή αποτελέσματα για τον επιδιωκόμενο σκοπό. Οι εκτιμήσεις αυτές δεν είναι αναγκαίες όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος. Το ισχύον μοντέλο πρόβλεψης δεν μπορεί να χρησιμοποιηθεί για πολύπλοκα μείγματα άγνωστης σύνθεσης ούτε για ουσίες άγνωστης ή μεταβλητής σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά (δηλαδή ουσίες UVCB), λόγω της καθορισμένης γραμμομοριακής αναλογίας μεταξύ της υπό δοκιμή χημικής ουσίας και του πεπτιδίου. Για τον σκοπό αυτό, θα χρειαστεί να αναπτυχθεί νέο μοντέλο πρόβλεψης με βάση μια βαρυμετρική προσέγγιση. Εάν υπάρχουν στοιχεία που δείχνουν ότι η μέθοδος δοκιμών δεν μπορεί να εφαρμοστεί σε άλλες ειδικές κατηγορίες χημικών ουσιών, η μέθοδος δεν θα πρέπει να χρησιμοποιείται για τις συγκεκριμένες κατηγορίες. Η παρούσα μέθοδος δοκιμών είναι μέθοδος in chemico που δεν περιλαμβάνει μεταβολικό σύστημα. Οι χημικές ουσίες που χρειάζονται ενζυμική βιοενεργοποίηση για να εκδηλώσουν το δυναμικό δερματικής ευαισθητοποίησής τους (μεταβολικά προαπτένια) δεν μπορούν να ανιχνευθούν με τη μέθοδο δοκιμών. Έχει αναφερθεί ότι με τη μέθοδο δοκιμών ανιχνεύονται σωστά, σε ορισμένες περιπτώσεις, χημικές ουσίες που γίνονται ευαισθητοποιητικές μετά από αβιοτικό μετασχηματισμό (αβιοτικά προαπτένια) (18). Υπό το πρίσμα των ανωτέρω, τα αρνητικά αποτελέσματα που προκύπτουν με τη μέθοδο δοκιμών θα πρέπει να ερμηνεύονται στο πλαίσιο των αναφερόμενων περιορισμών και σε συνάρτηση με άλλες πηγές πληροφοριών στο πλαίσιο ΙΑΤΑ. Οι υπό δοκιμή χημικές ουσίες που δεν συνδέονται με ομοιοπολικό δεσμό με το πεπτίδιο αλλά προάγουν την οξείδωσή του (διμερισμός κυστεΐνης) μπορούν να οδηγήσουν σε ενδεχόμενη υπερεκτίμηση της ελάττωσης του πεπτιδίου, με αποτέλεσμα πιθανές ψευδοθετικές προβλέψεις και/ή κατάταξη σε ανώτερη τάξη δραστικότητας (βλ. παραγράφους 29 και 30). Όπως περιγράφεται, η DPRA υποστηρίζει τη διάκριση μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος ουσιών. Ωστόσο, μπορεί ενδεχομένως να συμβάλει στην εκτίμηση της ευαισθητοποιητικής ισχύος (11), όταν χρησιμοποιείται σε ολοκληρωμένες προσεγγίσεις, όπως οι IATA. Απαιτούνται πάντως περισσότερες εργασίες, κατά προτίμηση με βάση δεδομένα για τον άνθρωπο, για να διαπιστωθεί ο τρόπος με τον οποίο τα αποτελέσματα της DPRA θα μπορούσαν ενδεχομένως να τροφοδοτήσουν την εκτίμηση της ευαισθητοποιητικής ισχύος. ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ Η DPRA είναι μέθοδος in chemico με την οποία προσδιορίζεται ποσοτικά η εναπομένουσα συγκέντρωση κυστεϊνούχου ή λυσινούχου πεπτιδίου μετά από 24ωρη επώαση με την υπό δοκιμή χημική ουσία στους 25 ± 2,5 °C. Τα συνθετικά πεπτίδια περιέχουν φαινυλαλανίνη που υποβοηθά την ανίχνευση. Η σχετική συγκέντρωση πεπτιδίου μετράται με υγροχρωματογραφία υψηλής απόδοσης (HPLC), με βαθμιδωτή έκλουση και ανίχνευση υπεριώδους ακτινοβολίας σε μήκος κύματος 220 nm. Στη συνέχεια οι τιμές εκατοστιαίας ελάττωσης του κυστεϊνούχου ή λυσινούχου πεπτιδίου υπολογίζονται και χρησιμοποιούνται σε μοντέλο πρόβλεψης (βλ. παράγραφο 29), το οποίο επιτρέπει την κατάταξη της υπό δοκιμή χημικής ουσίας σε μία από τις τέσσερις τάξεις δραστικότητας που χρησιμοποιούνται για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος ουσιών. Πριν χρησιμοποιήσουν στην καθημερινή πρακτική τη μέθοδο που περιγράφεται στην παρούσα μέθοδο δοκιμών, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα, χρησιμοποιώντας τις δέκα ουσίες ελέγχου ικανότητας που απαριθμούνται στο προσάρτημα 2. ΔΙΑΔΙΚΑΣΙΑ Η παρούσα μέθοδος δοκιμών βασίζεται στο πρωτόκολλο DPRA DB-ALM αριθ. 154 (20), το οποίο χρησιμοποιήθηκε για τη μελέτη επικύρωσης που συντόνισε το EURL ECVAM. Συνιστάται να χρησιμοποιείται αυτό το πρωτόκολλο κατά την εφαρμογή και χρήση της μεθόδου στο εργαστήριο. Στις επόμενες παραγράφους περιγράφονται τα βασικά στοιχεία και διαδικασίες για την DPRA. Εάν χρησιμοποιείται εναλλακτική πειραματική διάταξη HPLC, θα πρέπει να αποδεικνύεται η ισοδυναμία της με την επικυρωμένη διάταξη που περιγράφεται στο πρωτόκολλο DB-ALM (π.χ. με δοκιμές των ουσιών ελέγχου ικανότητας που απαριθμούνται στο προσάρτημα 2). Παρασκευή των κυστεϊνούχων ή λυσινούχων πεπτιδίων Θα πρέπει να παρασκευάζονται πρόσφατα διαλύματα παρακαταθήκης συνθετικών πεπτιδίων που περιέχουν κυστεΐνη (Ac-RFAACAA-COOH) και λυσίνη (Ac-RFAAKAA-COOH) καθαρότητας άνω του 85 % και, κατά προτίμηση, της τάξης του 90-95 %, ακριβώς πριν από την επώασή τους με την υπό δοκιμή χημική ουσία. Η τελική συγκέντρωση του κυστεϊνούχου πεπτιδίου θα πρέπει να είναι 0,667 mM σε ρυθμιστικό διάλυμα φωσφορικών αλάτων με pH 7,5, ενώ η τελική συγκέντρωση του λυσινούχου πεπτιδίου θα πρέπει να είναι 0,667 mM σε ρυθμιστικό διάλυμα οξικού αμμωνίου με pH 10,2. Η ακολουθία μετρήσεων HPLC θα πρέπει να ρυθμίζεται κατά τρόπο ώστε ο χρόνος ανάλυσης με HPLC να μην ξεπερνά τις 30 ώρες. Με την πειραματική διάταξη HPLC που χρησιμοποιήθηκε στη μελέτη επικύρωσης και περιγράφεται στην παρούσα μέθοδο δοκιμών, μπορούν να διεκπεραιωθούν σε μία σειρά μετρήσεων (έναν «γύρο») HPLC έως και 26 δείγματα ανάλυσης (που περιλαμβάνουν την υπό δοκιμή χημική ουσία, τον θετικό μάρτυρα και κατάλληλο αριθμό μαρτύρων με διαλύτη, ανάλογα με τον αριθμό των διαφορετικών διαλυτών που χρησιμοποιούνται για τη δοκιμή, με μέτρηση κάθε δείγματος εις τριπλούν). Σε όλα τα πολλαπλά δείγματα (επαναλήψεις) που αναλύονται σε κάθε μέτρηση θα πρέπει να χρησιμοποιούνται τα ίδια ακριβώς διαλύματα παρακαταθήκης κυστεϊνούχου και λυσινούχου πεπτιδίου. Πριν από τη χρήση κάθε παρτίδας πεπτιδίου, συνιστάται να επαληθεύεται η ενδεδειγμένη διαλυτότητά της. Προετοιμασία της υπό δοκιμή χημικής ουσίας Πριν από τη διεξαγωγή της δοκιμής θα πρέπει να αξιολογείται η διαλυτότητα της υπό δοκιμή χημικής ουσίας σε κατάλληλο διαλύτη, με τη διαδικασία διαλυτοποίησης που περιγράφεται στο πρωτόκολλο DPRA DB-ALM (20). Κατάλληλος διαλύτης είναι εκείνος στον οποίο η υπό δοκιμή χημική ουσία διαλύεται πλήρως. Δεδομένου ότι στην DPRA η υπό δοκιμή χημική ουσία επωάζεται σε μεγάλη περίσσεια είτε με το κυστεϊνούχο ή με το λυσινούχο πεπτίδιο, η οπτική εξέταση του σχηματισμού διαυγούς διαλύματος θεωρείται επαρκής για την επιβεβαίωση της πλήρους διάλυσης της υπό δοκιμή χημικής ουσίας (και όλων των συστατικών της, σε περίπτωση δοκιμής με πολυσυστατική ουσία ή μείγμα). Κατάλληλοι διαλύτες είναι οι εξής: ακετονιτρίλιο, νερό, μείγμα νερού-ακετονιτριλίου σε αναλογία 1:1, ισοπροπανόλη, ακετόνη και μείγμα ακετόνης-ακετονιτριλίου σε αναλογία 1:1. Μπορούν να χρησιμοποιηθούν και άλλοι διαλύτες, εφόσον δεν επηρεάζουν τη σταθερότητα του πεπτιδίου, η οποία παρακολουθείται με τους μάρτυρες αναφοράς Γ (δηλ. δείγματα αποτελούμενα μόνο από το πεπτίδιο, διαλυμένο σε κατάλληλο διαλύτη· βλ. προσάρτημα 3). Ως έσχατη λύση, εάν η υπό δοκιμή χημική ουσία δεν διαλύεται σε κανέναν από τους διαλύτες αυτούς, θα πρέπει να επιχειρείται η διάλυσή της σε 300 μL DMSO, ακολουθούμενη από αραίωση του προκύπτοντος διαλύματος με 2700 μL ακετονιτριλίου· εάν η υπό δοκιμή χημική ουσία δεν διαλύεται σε αυτό το μείγμα, θα πρέπει να επιχειρείται η διάλυση της ίδιας ποσότητας της ουσίας σε 1 500 μL DMSO, ακολουθούμενη από αραίωση του προκύπτοντος διαλύματος με 1 500 μL ακετονιτριλίου. Η υπό δοκιμή χημική ουσία θα πρέπει να έχει προζυγιστεί σε γυάλινα φιαλίδια και να διαλύεται ακριβώς πριν από τη δοκιμή σε κατάλληλο διαλύτη για την παρασκευή διαλύματος 100 mΜ. Στην περίπτωση των μειγμάτων και των πολυσυστατικών ουσιών γνωστής σύνθεσης, θα πρέπει να προσδιορίζονται μια ενιαία καθαρότητα από το άθροισμα των αναλογιών των συστατικών τους (εκτός του νερού) και ένα ενιαίο φαινόμενο μοριακό βάρος, με συνεκτίμηση του μοριακού βάρους κάθε συστατικού του μείγματος (εκτός του νερού) και της αναλογίας του. Η καθαρότητα και το φαινόμενο μοριακό βάρος που προκύπτουν θα πρέπει στη συνέχεια να χρησιμοποιούνται για τον υπολογισμό του βάρους της υπό δοκιμή χημικής ουσίας που χρειάζεται για την παρασκευή διαλύματος 100 mΜ. Για τα πολυμερή για τα οποία δεν είναι δυνατόν να προσδιοριστεί κυρίαρχο (δεσπόζον) μοριακό βάρος, μπορεί να ληφθεί υπόψη για την παρασκευή διαλύματος 100 mΜ το μοριακό βάρος του μονομερούς (ή το φαινόμενο μοριακό βάρος των διαφόρων μονομερών που αποτελούν το πολυμερές. Ωστόσο, κατά τη διεξαγωγή δοκιμών με μείγματα, πολυσυστατικές ουσίες ή πολυμερή γνωστής σύνθεσης, θα πρέπει να εξετάζεται το ενδεχόμενο υποβολής και της αμιγούς ουσίας στη δοκιμή. Προκειμένου για υγρά, θα πρέπει να ελέγχεται η αμιγής χημική ουσία ως έχει, χωρίς προηγούμενη αραίωση, με επώαση με το κυστεϊνούχο και το λυσινούχο πεπτίδιο σε γραμμομοριακή αναλογία 1:10 και 1:50 αντίστοιχα. Προκειμένου για στερεά, η υπό δοκιμή χημική ουσία θα πρέπει να διαλύεται μέχρι τη μέγιστη διαλυτή συγκέντρωσή της στον διαλύτη που χρησιμοποιείται και για την παρασκευή του διαλύματος φαινόμενης συγκέντρωσης 100 mM. Στη συνέχεια θα πρέπει να υποβάλλεται σε δοκιμή χωρίς άλλη αραίωση, με επώαση με το κυστεϊνούχο και το λυσινούχο πεπτίδιο σε γραμμομοριακή αναλογία 1:10 και 1:50 αντίστοιχα. Η συμφωνία μεταξύ των αποτελεσμάτων (δραστική ή μη δραστική ουσία) για το διάλυμα φαινόμενης συγκέντρωσης 100 mM και την αμιγή χημική ουσία θα πρέπει κανονικά να επιτρέπει τη συναγωγή οριστικού συμπεράσματος σχετικά με το αποτέλεσμα. Παρασκευή του θετικού μάρτυρα, των μαρτύρων αναφοράς και των μαρτύρων συνέκλουσης Ως θετικός μάρτυρας θα πρέπει να χρησιμοποιείται κινναμωμική αλδεΰδη (αριθ. CAS 104-55-2, καθαρότητας κατάλληλης για τρόφιμα ≥ 95 %), σε διάλυμα συγκέντρωσης 100 mM σε ακετονιτρίλιο. Επιτρέπεται να χρησιμοποιούνται και άλλοι κατάλληλοι θετικοί μάρτυρες, που να παρέχουν κατά προτίμηση τιμές ελάττωσης στο μέσο του εύρους τιμών, εάν υπάρχουν ιστορικά δεδομένα από τα οποία προκύπτουν συγκρίσιμα κριτήρια αποδοχής των μετρήσεων. Επιπλέον, θα πρέπει να συμπεριλαμβάνονται στην ακολουθία μετρήσεων HPLC μάρτυρες αναφοράς (δηλ. δείγματα που περιέχουν μόνο το πεπτίδιο διαλυμένο σε κατάλληλο διαλύτη), οι οποίοι χρησιμοποιούνται για να επαληθεύεται η καταλληλότητα του συστήματος HPLC πριν από την ανάλυση (μάρτυρες αναφοράς Α), η σταθερότητα των μαρτύρων αναφοράς με την πάροδο του χρόνου (μάρτυρες αναφοράς Β), καθώς και ότι ο διαλύτης που χρησιμοποιείται για τη διάλυση της υπό δοκιμή χημικής ουσίας δεν επηρεάζει την εκατοστιαία ελάττωση του πεπτιδίου (μάρτυρες αναφοράς Γ) (βλ. προσάρτημα 3). Ο κατάλληλος μάρτυρας αναφοράς για κάθε χημική ουσία χρησιμοποιείται για τον υπολογισμό της εκατοστιαίας ελάττωσης του πεπτιδίου για την εν λόγω χημική ουσία (βλ. παράγραφο 26). Επιπλέον, για καθεμία από τις αναλυόμενες χημικές ουσίες, θα πρέπει να συμπεριλαμβάνεται στην ακολουθία μετρήσεων ένας μάρτυρας συνέκλουσης, αποτελούμενος μόνο από την υπό δοκιμή χημική ουσία, με σκοπό την ανίχνευση πιθανής συνέκλουσής της με το λυσινούχο ή το κυστεϊνούχο πεπτίδιο. Επώαση της υπό δοκιμή χημικής ουσίας με τα διαλύματα κυστεϊνούχου και λυσινούχου πεπτιδίου Τα διαλύματα κυστεϊνούχου και λυσινούχου πεπτιδίου θα πρέπει να επωάζονται σε γυάλινα φιαλίδια αυτόματου δειγματολήπτη με την υπό δοκιμή χημική ουσία σε αναλογία 1:10 και 1:50 αντίστοιχα. Εάν παρατηρηθεί ίζημα αμέσως μετά την προσθήκη του διαλύματος της υπό δοκιμή χημικής ουσίας στο διάλυμα πεπτιδίου, λόγω χαμηλής υδατοδιαλυτότητας της υπό δοκιμή χημικής ουσίας, δεν μπορεί να υπάρχει βεβαιότητα σχετικά με την ποσότητα της ουσίας που παραμένει στο διάλυμα για να αντιδράσει με το πεπτίδιο. Ως εκ τούτου, στην περίπτωση αυτή, μόνο τυχόν θετικό αποτέλεσμα μπορεί να χρησιμοποιηθεί, ενώ ένα αρνητικό αποτέλεσμα είναι αβέβαιο και θα πρέπει να ερμηνεύεται με τη δέουσα προσοχή (βλ. επίσης παράγραφο 11 για τις δοκιμές με χημικές ουσίες που δεν είναι διαλυτές σε συγκέντρωση έως 100 mΜ). Το διάλυμα αντίδρασης θα πρέπει να αφήνεται στο σκοτάδι, σε θερμοκρασία 25 ± 2,5 °C για 24 ± 2 ώρες, πριν από την εκτέλεση της ανάλυσης με HPLC. Κάθε υπό δοκιμή χημική ουσία θα πρέπει να αναλύεται εις τριπλούν και για τα δύο πεπτίδια. Τα δείγματα πρέπει να εξετάζονται οπτικά πριν από την ανάλυση με HPLC. Εάν παρατηρηθεί ίζημα ή διαχωρισμός φάσεων, τα δείγματα μπορούν να φυγοκεντρηθούν προληπτικά σε χαμηλή ταχύτητα (100-400 g) για την ώθηση του ιζήματος προς τον πυθμένα του φιαλιδίου, δεδομένου ότι μεγάλες ποσότητες ιζήματος ενδέχεται να αποφράξουν τις σωληνώσεις ή τις στήλες της HPLC. Εάν παρατηρηθεί ίζημα ή διαχωρισμός φάσεων μετά την περίοδο επώασης, ενδέχεται να υποτιμηθεί η ελάττωση του πεπτιδίου και, σε περίπτωση αρνητικού αποτελέσματος, δεν είναι δυνατόν να συναχθεί με επαρκή εμπιστοσύνη συμπέρασμα περί απουσίας δραστικότητας. Ετοιμασία της πρότυπης καμπύλης βαθμονόμησης της HPLC Απαιτείται πρότυπη καμπύλη βαθμονόμησης, τόσο για το κυστεϊνούχο όσο και για το λυσινούχο πεπτίδιο. Θα πρέπει να παρασκευάζονται πρότυπα διαλύματα πεπτιδίων σε διάλυμα ακετονιτριλίου 20 % ή 25 % σε ρυθμιστικό διάλυμα, με τη χρήση ρυθμιστικού διαλύματος φωσφορικών αλάτων (pH 7,5) για το κυστεϊνούχο πεπτίδιο και ρυθμιστικού διαλύματος οξικού αμμωνίου (pH 10,2) για το λυσινούχο. Με πρότυπα διαλύματα από διαδοχικές αραιώσεις του πεπτιδικού διαλύματος παρακαταθήκης (0,667 mM), θα πρέπει να παρασκευάζονται 6 διαλύματα βαθμονόμησης που να καλύπτουν το εύρος τιμών 0,534 έως 0,0167 mM. Στην πρότυπη καμπύλη βαθμονόμησης θα πρέπει επίσης να συμπεριλαμβάνεται ένα τυφλό δείγμα του ρυθμιστικού διαλύματος αραίωσης. Για να θεωρηθούν κατάλληλες, οι καμπύλες βαθμονόμησης θα πρέπει να έχουν r2 > 0,99. Προετοιμασία και ανάλυση HPLC Πριν από τη διεξαγωγή της ανάλυσης, θα πρέπει να επαληθεύεται η καταλληλότητα του συστήματος HPLC. Η ελάττωση του πεπτιδίου παρακολουθείται με HPLC, συζευγμένη με ανιχνευτή υπεριώδους ακτινοβολίας (ανιχνευτή συστοιχίας φωτοδιόδων ή ανιχνευτή απορρόφησης σταθερού μήκους κύματος με σήμα στα 220 nm). Εγκαθίσταται η κατάλληλη στήλη στο σύστημα HPLC. Στην πειραματική διάταξη HPLC που περιγράφεται στο επικυρωμένο πρωτόκολλο χρησιμοποιείται ως προτιμώμενη στήλη η Zorbax SB-C-18 2,1 mm × 100 mm × 3,5 μm. Με την εν λόγω στήλη HPLC αντίστροφης φάσης, ολόκληρο το σύστημα θα πρέπει να εξισορροπείται σε θερμοκρασία 30 °C με 50 % φάση A (0,1 % κ.ό. τριφθοροοξικού οξέος σε νερό) και 50 % φάση Β (0,085 % κ.ό. τριφθοροοξικού οξέος σε ακετονιτρίλιο) για 2 ώρες τουλάχιστον πριν από τη μέτρηση. Η ανάλυση HPLC θα πρέπει να εκτελείται με παροχή 0,35 ml/min και γραμμική βαθμίδωση του ακετονιτριλίου από 10 % σε 25 % εντός 10 λεπτών, ακολουθούμενη από ταχεία αύξησή του σε 90 % για την απομάκρυνση άλλων υλών. Θα πρέπει να εγχέονται ίσοι όγκοι από κάθε πρότυπο, δείγμα και μάρτυρα. Η στήλη θα πρέπει να εξισορροπείται εκ νέου στις αρχικές συνθήκες για 7 λεπτά μεταξύ των εγχύσεων. Εάν χρησιμοποιείται διαφορετική στήλη HPLC αντίστροφης φάσης, οι παράμετροι της πειραματικής διάταξης που περιγράφονται ανωτέρω μπορεί να χρειαστεί να προσαρμοστούν, ώστε να διασφαλιστεί η ενδεδειγμένη έκλουση και ολοκλήρωση του κυστεϊνούχου και του λυσινούχου πεπτιδίου, συμπεριλαμβανομένου του όγκου έγχυσης, που μπορεί να διαφέρει ανάλογα με το σύστημα που χρησιμοποιείται (συνήθως είναι της τάξεως των 3-10 μl). Εάν χρησιμοποιείται εναλλακτική πειραματική διάταξη HPLC, είναι σημαντικό να καταδεικνύεται η ισοδυναμία της με την επικυρωμένη διάταξη που περιγράφεται ανωτέρω (π.χ. με δοκιμές των ουσιών ελέγχου ικανότητας που απαριθμούνται στο προσάρτημα 2). Παρακολουθείται η απορρόφηση στα 220 nm. Εάν χρησιμοποιείται ανιχνευτής συστοιχίας φωτοδιόδων, θα πρέπει επίσης να καταγράφεται η απορρόφηση στα 258 nm. Σημειωτέον ότι ορισμένες παρτίδες ακετονιτριλίου μπορεί να έχουν αρνητική επίπτωση στη σταθερότητα του πεπτιδίου, η οποία πρέπει να εκτιμάται όταν χρησιμοποιείται μια νέα παρτίδα. Ο λόγος του εμβαδού της κορυφής απορρόφησης στα 220 nm προς το εμβαδόν της κορυφής απορρόφησης στα 258 nm μπορεί να χρησιμοποιείται ως δείκτης συνέκλουσης. Για κάθε δείγμα, ικανοποιητική ένδειξη της απουσίας συνέκλουσης αποτελεί ένας λόγος εμβαδών εντός του εύρους 90 % < μέσος (19) λόγος εμβαδών στα δείγματα-μάρτυρες < 100 %. Ενδέχεται να υπάρχουν υπό δοκιμή χημικές ουσίες που μπορούν να ενισχύσουν την οξείδωση του κυστεϊνούχου πεπτιδίου. Είναι δυνατή η οπτική παρακολούθηση της κορυφής που αντιστοιχεί στη διμερισμένη κυστεΐνη. Εάν φαίνεται να έχει συντελεστεί διμερισμός, αυτό θα πρέπει να σημειώνεται, δεδομένου ότι ενδέχεται να υπερεκτιμηθεί η εκατοστιαία ελάττωση του πεπτιδίου, με συνέπεια ψευδοθετικές προβλέψεις και/ή την κατάταξη σε ανώτερη τάξη δραστικότητας (βλ. παραγράφους 29 και 30). Η ανάλυση με HPLC μπορεί να διεξαχθεί συγχρόνως για το κυστεϊνούχο και το λυσινούχο πεπτίδιο (εάν είναι διαθέσιμα δύο συστήματα HPLC) ή σε διαφορετικές ημέρες. Εάν η ανάλυση διεξάγεται σε διαφορετικές ημέρες, θα πρέπει να παρασκευάζονται πρόσφατα διαλύματα της υπό δοκιμή χημικής ουσίας και για τις δύο δοκιμές κάθε ημέρας. Η ανάλυση θα πρέπει να προγραμματίζεται κατά τρόπο ώστε να διασφαλίζεται ότι η έγχυση του πρώτου δείγματος αρχίζει 22 έως 26 ώρες μετά την ανάμειξη της υπό δοκιμή χημικής ουσίας με το πεπτιδικό διάλυμα. Η ακολουθία μετρήσεων HPLC θα πρέπει να ρυθμίζεται κατά τρόπο ώστε ο χρόνος ανάλυσης με HPLC να μην ξεπερνά τις 30 ώρες. Με την πειραματική διάταξη HPLC που χρησιμοποιήθηκε στη μελέτη επικύρωσης και περιγράφεται στην παρούσα μέθοδο δοκιμών, μπορούν να διεκπεραιωθούν σε μία μόνο σειρά μετρήσεων («γύρο») HPLC έως και 26 δείγματα ανάλυσης (βλ. επίσης παράγραφο 17). Παράδειγμα αναλυτικής ακολουθίας HPLC παρέχει το προσάρτημα 3. ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Αξιολόγηση των δεδομένων Η συγκέντρωση κυστεϊνούχου ή λυσινούχου πεπτιδίου προσδιορίζεται φωτομετρικά σε μήκος κύματος 220 nm για κάθε δείγμα, με μέτρηση του εμβαδού των κατάλληλων κορυφών (εμβαδόν κάτω από την καμπύλη) και υπολογισμό της συγκέντρωσης του πεπτιδίου με τη βοήθεια της γραμμικής καμπύλης βαθμονόμησης που προκύπτει από τα πρότυπα. Η εκατοστιαία ελάττωση του πεπτιδίου προσδιορίζεται για κάθε δείγμα με μέτρηση του εμβαδού κορυφής και διαίρεσή του διά του μέσου εμβαδού των κορυφών που αντιστοιχούν στους σχετικούς μάρτυρες αναφοράς Γ (βλ. προσάρτημα 3) σύμφωνα με τον κατωτέρω τύπο.
Κριτήρια αποδοχής Για να θεωρηθεί έγκυρη μια σειρά μετρήσεων, θα πρέπει να πληρούνται τα ακόλουθα κριτήρια:
Εάν δεν πληρούνται ένα ή περισσότερα από τα κριτήρια αυτά, η σειρά μετρήσεων θα πρέπει να επαναλαμβάνεται. Για να θεωρηθούν έγκυρα τα αποτελέσματα για την υπό δοκιμή χημική ουσία, θα πρέπει να πληρούνται τα ακόλουθα κριτήρια:
Μοντέλο πρόβλεψης Υπολογίζεται για κάθε υπό δοκιμή χημική ουσία η μέση τιμή εκατοστιαίας ελάττωσης της κυστεΐνης και εκατοστιαίας ελάττωσης της λυσίνης. Κατά τον υπολογισμό της μέσης τιμής, τυχόν αρνητική ελάττωση λαμβάνεται ως μηδενική. Με τη βοήθεια του μοντέλου πρόβλεψης κυστεΐνης 1:10/λυσίνης 1:50, που εμφαίνεται στον πίνακα 1, η τιμή κατωφλίου μέσης ελάττωσης πεπτιδίου 6,38 % θα πρέπει να χρησιμοποιείται για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος ουσιών στο πλαίσιο ΙΑΤΑ. Η εφαρμογή του μοντέλου πρόβλεψης για την κατάταξη των υπό δοκιμή χημικών ουσιών σε τάξη δραστικότητας (δηλ. χαμηλή, μέτρια και υψηλή δραστικότητα) ενδέχεται να αποδειχθεί χρήσιμη για την τροφοδότηση εκτιμήσεων της ευαισθητοποιητικής ισχύος στο πλαίσιο ΙΑΤΑ. Πίνακας 1 Μοντέλο πρόβλεψης κυστεΐνης 1:10/λυσίνης 1:50 (20)
Ενδέχεται να υπάρχουν περιπτώσεις στις οποίες η υπό δοκιμή χημική ουσία (η ίδια ή ένα ή περισσότερα από τα συστατικά πολυσυστατικής ουσίας ή μείγματος) παρουσιάζει σημαντική απορρόφηση στα 220 nm και τον ίδιο χρόνο κατακράτησης με εκείνον του πεπτιδίου (συνέκλουση). Το πρόβλημα της συνέκλουσης μπορεί να επιλυθεί με ελαφρά προσαρμογή της πειραματικής διάταξης HPLC με σκοπό τον περαιτέρω διαχωρισμό του χρόνου έκλουσης της υπό δοκιμή χημικής ουσίας και του πεπτιδίου. Εάν στην προσπάθεια εξάλειψης της συνέκλουσης χρησιμοποιείται εναλλακτική πειραματική διάταξη HPLC, θα πρέπει να καταδεικνύεται η ισοδυναμία της με την επικυρωμένη διάταξη (π.χ. με δοκιμές των ουσιών ελέγχου ικανότητας που απαριθμούνται στο προσάρτημα 2). Όταν εμφανίζεται συνέκλουση, δεν είναι δυνατή η ολοκλήρωση της κορυφής του πεπτιδίου και δεν μπορεί να υπολογιστεί η εκατοστιαία ελάττωσή του. Σε περίπτωση συνέκλουσης τέτοιων υπό δοκιμή χημικών ουσιών τόσο με το κυστεϊνούχο πεπτίδιο όσο και με το λυσινούχο, η ανάλυση θα πρέπει να αναφέρεται ως «αβέβαιη». Στις περιπτώσεις συνέκλουσης μόνο με το λυσινούχο πεπτίδιο, μπορεί να χρησιμοποιείται το προγνωστικό μοντέλο κυστεΐνης 1:10 που αναφέρεται στον πίνακα. Πίνακας 2 Προγνωστικό μοντέλο κυστεΐνης 1:10 (22)
Ενδέχεται να υπάρχουν και άλλες περιπτώσεις στις οποίες η αλληλεπικάλυψη της υπό δοκιμή χημικής ουσίας και του πεπτιδίου ως προς τον χρόνο κατακράτησης είναι ατελής. Στις περιπτώσεις αυτές μπορούν να υπολογιστούν τιμές εκατοστιαίας ελάττωσης πεπτιδίου και να χρησιμοποιηθούν στο μοντέλο πρόβλεψης κυστεΐνης 1:10/λυσίνης 1:50, ωστόσο η υπό δοκιμή χημική ουσία δεν είναι δυνατόν να καταταχθεί με ακρίβεια σε τάξη δραστικότητας. Όταν το αποτέλεσμα είναι αδιαμφισβήτητο, θα πρέπει κανονικά να αρκεί για την υπό δοκιμή χημική ουσία μία μόνο ανάλυση με HPLC, τόσο για το κυστεϊνούχο πεπτίδιο όσο και για το λυσινούχο. Ωστόσο, στις περιπτώσεις όπου τα αποτελέσματα προσεγγίζουν την τιμή κατωφλίου που χρησιμοποιείται για τη διάκριση μεταξύ θετικών και αρνητικών αποτελεσμάτων (δηλ. οριακά αποτελέσματα), ενδέχεται να απαιτούνται πρόσθετες δοκιμές. Όταν η μέση εκατοστιαία ελάττωση κυμαίνεται από 3 % έως 10 %, προκειμένου για το μοντέλο πρόβλεψης κυστεΐνης 1:10/λυσίνης 1:50, ή η εκατοστιαία ελάττωση της κυστεΐνης κυμαίνεται από 9 % έως 17 %, προκειμένου για το μοντέλο πρόβλεψης κυστεΐνης 1:10, θα πρέπει να εξετάζεται το ενδεχόμενο εκτέλεσης δεύτερης μέτρησης, ακόμη και τρίτης, σε περίπτωση ασυμφωνίας μεταξύ των αποτελεσμάτων των δύο πρώτων μετρήσεων. Έκθεση δοκιμής Στην έκθεση δοκιμής θα πρέπει να περιλαμβάνονται τα ακόλουθα στοιχεία:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Ορθότητα : η εγγύτητα της συμφωνίας μεταξύ των αποτελεσμάτων της μεθόδου δοκιμών και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της μεθόδου δοκιμών και μια από τις πτυχές της «καταλληλότητας». Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς την «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας μεθόδου δοκιμών (21). AOP (Adverse Outcome Pathway/πορεία δυσμενούς έκβασης) : αλληλουχία συμβάντων, από τη χημική δομή της χημικής ουσίας ή των ομοειδών χημικών ουσιών που αποτελούν στόχο μέχρι την υπό μελέτη έκβαση in vivo, μέσω του μοριακού εναρκτήριου συμβάντος (2). Καμπύλη βαθμονόμησης : η σχέση μεταξύ της πειραματικής τιμής απόκρισης και της αναλυτικής συγκέντρωσης μιας γνωστής ουσίας (καλούμενη επίσης πρότυπη καμπύλη). Χημικό προϊόν : μια ουσία ή ένα μείγμα. Συντελεστής μεταβλητότητας : μέτρο της μεταβλητότητας, που υπολογίζεται για μια ομάδα δεδομένων επανάληψης με διαίρεση της τυπικής απόκλισης διά της μέσης τιμής. Είναι δυνατόν να πολλαπλασιαστεί επί 100 για να εκφραστεί ως ποσοστό. Κίνδυνος : εγγενής ιδιότητα ενός παράγοντα ή μιας κατάστασης που μπορεί να έχει δυσμενείς επιδράσεις όταν οργανισμός, σύστημα ή (υπο)πληθυσμός εκτεθεί στον συγκεκριμένο παράγοντα. IATA (Integrated Approach to Testing and Assessment/Ολοκληρωμένη προσέγγιση για τη διεξαγωγή δοκιμών και την αξιολόγηση) : δομημένη προσέγγιση που χρησιμοποιείται για τον προσδιορισμό του κινδύνου (δυναμικό), τον χαρακτηρισμό του κινδύνου (ισχύς) και/ή την εκτίμηση της ασφάλειας (δυναμικό/ισχύς και έκθεση) μιας χημικής ουσίας ή ομάδας χημικών ουσιών, στην οποία ενσωματώνονται και σταθμίζονται στρατηγικά όλα τα σχετικά δεδομένα, με σκοπό την τροφοδότηση ρυθμιστικών αποφάσεων σχετικά με τον δυνητικό κίνδυνο και/ή την επικινδυνότητα και/ή την ανάγκη για περαιτέρω στοχευμένες και, ως εκ τούτου, ελάχιστες δοκιμές. Μοριακό εναρκτήριο συμβάν : η επαγόμενη από χημική ουσία διατάραξη ενός βιολογικού συστήματος σε μοριακό επίπεδο, που αναγνωρίζεται ως η αφετηρία της πορείας δυσμενούς έκβασης. Μείγμα : μείγμα ή διάλυμα, αποτελούμενο από δύο ή περισσότερες ουσίες που δεν αντιδρούν μέσα σε αυτό (1). Μονοσυστατική ουσία : ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας ένα κύριο συστατικό περιέχεται σε ποσοστό τουλάχιστον 80 % (κ.β.). Πολυσυστατική ουσία : ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας περισσότερα από ένα κύρια συστατικά περιέχονται σε συγκέντρωση ≥ 10 % (κ.β.) και < 80 % (κ.β.). Οι πολυσυστατικές ουσίες είναι προϊόντα μεταποιητικών διεργασιών. Η διαφορά μεταξύ μείγματος και πολυσυστατικής ουσίας είναι ότι το μείγμα λαμβάνεται με ανάμειξη δύο ή περισσότερων ουσιών, χωρίς χημική αντίδραση. Οι πολυσυστατικές ουσίες είναι προϊόντα χημικών αντιδράσεων. Θετικός μάρτυρας : επανάληψη που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και υποβάλλεται σε μεταχείριση με ουσία που είναι γνωστό ότι επάγει θετική απόκριση. Για να διασφαλίζεται η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης του θετικού μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της θετικής απόκρισης δεν θα πρέπει να είναι υπερβολικό. Μάρτυρας αναφοράς : δείγμα που δεν υποβάλλεται σε μεταχείριση και περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής, συμπεριλαμβανομένου του διαλύτη ή του φορέα. Το δείγμα αυτό υφίσταται τις ίδιες διαδικασίες όπως τα δείγματα που υποβάλλονται σε μεταχείριση με την υπό δοκιμή ουσία και άλλα δείγματα-μάρτυρες, με σκοπό τον καθορισμό της βασικής απόκρισης των δειγμάτων που υποβάλλονται σε μεταχείριση με την υπό δοκιμή ουσία, διαλυμένη στον ίδιο διαλύτη ή φορέα. Όταν το εν λόγω δείγμα υποβάλλεται σε δοκιμή με παράλληλο αρνητικό μάρτυρα, καταδεικνύει επίσης αν ο διαλύτης ή ο φορέας αλληλεπιδρά με το σύστημα δοκιμής. Καταλληλότητα : περιγραφή της σχέσης της δοκιμής με την υπό μελέτη επίδραση και του κατά πόσον αυτή έχει σημασία και είναι χρήσιμη για συγκεκριμένο σκοπό. Πρόκειται για τον βαθμό στον οποίο η δοκιμή μετρά ή προβλέπει σωστά τη βιολογική επίδραση υπό μελέτη. Η καταλληλότητα εμπεριέχει συνεκτίμηση της ορθότητας (συμφωνίας) της μεθόδου δοκιμών (21). Αξιοπιστία : μέτρο του βαθμού στον οποίο μια μέθοδος δοκιμών μπορεί να αναπαράγεται διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας, καθώς και της ενδοεργαστηριακής επαναληψιμότητας (21). Αναπαραγωγιμότητα : η συμφωνία μεταξύ των αποτελεσμάτων που προκύπτουν από τη διεξαγωγή δοκιμών με την ίδια χημική ουσία και με τη χρήση του ίδιου πρωτοκόλλου δοκιμών (βλ. αξιοπιστία) (21). Ευαισθησία : το ποσοστό του συνόλου των θετικών/δραστικών χημικών ουσιών που ταξινομείται σωστά με τη μέθοδο δοκιμών. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών (21). Ειδικότητα : το ποσοστό του συνόλου των αρνητικών/αδρανών χημικών ουσιών που ταξινομείται σωστά με τη μέθοδο δοκιμών. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών (21). Ουσία : τα χημικά στοιχεία και οι ενώσεις τους σε φυσική κατάσταση ή όπως λαμβάνονται με οποιαδήποτε παραγωγική διεργασία, στα οποία συμπεριλαμβάνονται όλα τα πρόσθετα που απαιτούνται για να διατηρείται η σταθερότητα του προϊόντος, καθώς και τυχόν προσμείξεις που προκύπτουν από τη χρησιμοποιούμενη διεργασία, αλλά από τα οποία εξαιρούνται οι διαλύτες που είναι δυνατόν να διαχωριστούν χωρίς να επηρεαστεί η σταθερότητα της ουσίας ούτε να μεταβληθεί η σύνθεσή της (1). Καταλληλότητα του συστήματος : προσδιορισμός των επιδόσεων των οργάνων (π.χ. ευαισθησία) με ανάλυση προτύπου αναφοράς πριν από τη μέτρηση της αναλυτικής παρτίδας (22). Υπό δοκιμή χημική ουσία : Ο όρος «υπό δοκιμή χημική ουσία» χρησιμοποιείται για να δηλώσει αυτό που υποβάλλεται σε δοκιμή. Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων των Ηνωμένων Εθνών (United Nations Globally Harmonized System of Classification and Labelling of Chemicals) (GHS των Ηνωμένων Εθνών) : σύστημα που προτείνει την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων) με βάση τυποποιημένα είδη και βαθμούς φυσικών κινδύνων και κινδύνων για την υγεία και το περιβάλλον και καλύπτει τα αντίστοιχα επικοινωνιακά στοιχεία, όπως εικονογράμματα, προειδοποιητικές λέξεις, δηλώσεις επικινδυνότητας, δηλώσεις προφύλαξης και δελτία δεδομένων ασφαλείας, για τη μετάδοση πληροφοριών σχετικά με τις δυσμενείς επιδράσεις των εν λόγω προϊόντων με σκοπό την προστασία των ανθρώπων (εργοδοτών, εργαζομένων, μεταφορέων, καταναλωτών και διασωστών) και του περιβάλλοντος (1). UVCB : ουσίες άγνωστης ή ασταθούς σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά. Έγκυρη μέθοδος δοκιμών : μέθοδος δοκιμών που θεωρείται επαρκούς καταλληλότητας και αξιοπιστίας για συγκεκριμένο σκοπό και βασίζεται σε επιστημονικά τεκμηριωμένες αρχές. Οι μέθοδοι δοκιμών δεν είναι ποτέ έγκυρες με την απόλυτη σημασία του όρου, αλλά μόνο σε σχέση με καθορισμένο σκοπό (21). Προσάρτημα 2 ΟΥΣΙΕΣ ΕΛΕΓΧΟΥ ΙΚΑΝΟΤΗΤΑΣ Δερματική ευαισθητοποίηση in chemico: Άμεση ανάλυση πεπτιδικής δραστικότητας (DPRA) Πριν χρησιμοποιήσουν στην καθημερινή πρακτική την παρούσα μέθοδο δοκιμών, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα επιτυγχάνοντας σωστά την αναμενόμενη πρόβλεψη βάσει της DPRA για τις 10 συνιστώμενες στον πίνακα 1 ουσίες ελέγχου ικανότητας, καθώς και τιμές ελάττωσης της κυστεΐνης και της λυσίνης εντός του αντίστοιχου εύρους τιμών αναφοράς για 8 από τις 10 ουσίες ελέγχου ικανότητας ανά πεπτίδιο. Οι εν λόγω ουσίες ελέγχου ικανότητας επιλέχθηκαν ως αντιπροσωπευτικές του φάσματος αποκρίσεων όσον αφορά τους κινδύνους δερματικής ευαισθητοποίησης. Άλλα κριτήρια επιλογής ήταν το ότι είναι διαθέσιμες στο εμπόριο, ότι υπάρχουν υψηλής ποιότητας δεδομένα αναφοράς in vivo, καθώς και υψηλής ποιότητας δεδομένα in vitro που προέκυψαν από DPRA, όπως επίσης το ότι χρησιμοποιήθηκαν στη μελέτη επικύρωσης που συντόνισε το EURL ECVAM για να καταδειχθεί η επιτυχής εφαρμογή της μεθόδου δοκιμών στα εργαστήρια που συμμετείχαν στη μελέτη. Πίνακας 1 Συνιστώμενες ουσίες ελέγχου ικανότητας για την απόδειξη τεχνικής ικανότητας όσον αφορά την άμεση ανάλυση πεπτιδικής δραστικότητας
Προσάρτημα 3 ΠΑΡΑΔΕΙΓΜΑΤΑ ΑΝΑΛΥΤΙΚΗΣ ΑΚΟΛΟΥΘΙΑΣ
Β.60 Δερματική ευαισθητοποίηση in vitro: Μέθοδος δοκιμών ARE-Nrf2/λουσιφεράσης ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 442D του ΟΟΣΑ (2015). Ευαισθητοποιητική του δέρματος είναι μια ουσία που, όταν έρχεται επαφή με το δέρμα, προκαλεί αλλεργική αντίδραση, όπως ορίζεται στο Παγκοσμίως Εναρμονισμένο Σύστημα των Ηνωμένων Εθνών για την Ταξινόμηση και Επισήμανση των Χημικών Ουσιών (Globally Harmonized System/GHS των Ηνωμένων Εθνών) (1) και στον κανονισμό (ΕΚ) αριθ. 1272/2008 της Ευρωπαϊκής Ένωσης για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων (Classification, Labelling and Packaging/CLP) (27). Η παρούσα μέθοδος δοκιμών παρέχει μια διαδικασία in vitro (προσδιορισμός ARE-Nrf2/λουσιφεράσης), προοριζόμενη να χρησιμοποιείται για την υποστήριξη της διάκρισης ανάμεσα σε ευαισθητοποιητικές και μη ευαισθητοποιητικές του δέρματος ουσίες σύμφωνα με το GHS των Ηνωμένων Εθνών (1) και τον κανονισμό CLP. Υπάρχει γενική συμφωνία για τα βασικά υποκείμενα βιολογικά συμβάντα στη δερματική ευαισθητοποίηση. Οι υπάρχουσες γνώσεις σχετικά με τους χημικούς και βιολογικούς μηχανισμούς που συνδέονται με τη δερματική ευαισθητοποίηση έχουν συνοψιστεί με τη μορφή μιας πορείας δυσμενούς έκβασης (Adverse Outcome Pathway/AOP) (2) — από το μοριακό εναρκτήριο συμβάν στα ενδιάμεσα συμβάντα και μέσω αυτών στη δυσμενή επίδραση, δηλ. την αλλεργική δερματίτιδα εξ επαφής στον άνθρωπο και την υπερευαισθησία εξ επαφής στα τρωκτικά (2) (3). Το μοριακό εναρκτήριο συμβάν είναι η ομοιοπολική δέσμευση ηλεκτρονιόφιλων ουσιών σε πυρηνόφιλα κέντρα των πρωτεϊνών του δέρματος. Το δεύτερο βασικό συμβάν στην εν λόγω AOP επέρχεται στα κερατινοκύτταρα και περιλαμβάνει φλεγμονώδεις αποκρίσεις, καθώς και την έκφραση γονιδίων που συνδέεται με συγκεκριμένες πορείες κυτταρικής σηματοδότησης, όπως εκείνες που εξαρτώνται από το στοιχείο απόκρισης στα αντιοξειδωτικά/ηλεκτρονιόφιλα (Antioxidant Response Element/ARE). Το τρίτο βασικό συμβάν είναι η ενεργοποίηση των δενδριτικών κυττάρων, που συνήθως αξιολογείται με βάση την έκφραση ειδικών δεικτών της κυτταρικής επιφάνειας, χημειοκινών και κυτταροκινών. Το τέταρτο βασικό συμβάν είναι ο πολλαπλασιασμός των κυττάρων Τ, που αξιολογείται έμμεσα με τη δοκιμασία επιχώριων λεμφαδένων σε ποντικό (4). Η αξιολόγηση της δερματικής ευαισθητοποίησης περιλαμβάνει συνήθως τη χρήση πειραματόζωων. Στις κλασικές μεθόδους που βασίζονται σε ινδικά χοιρίδια, όπως η δοκιμή Magnusson Kligman με μεγιστοποίηση σε ινδικά χοιρίδια και η δοκιμή Buehler [μέθοδος δοκιμών Β.6 (3)], μελετώνται τόσο το στάδιο επαγωγής όσο και το στάδιο πρόκλησης δερματικής ευαισθητοποίησης. Μια δοκιμή σε ποντικούς, συγκεκριμένα η δοκιμασία επιχώριων λεμφαδένων [LLNA, μέθοδος δοκιμών Β.42 (4)] και οι δύο τροποποιήσεις της που δεν απαιτούν ραδιενέργεια — LLNA: DA [μέθοδος δοκιμών Β.50 (6)] και LLNA: BrdU-ELISA [μέθοδος δοκιμών Β. 51 (7)], οι οποίες αξιολογούν αποκλειστικά την επαγωγική απόκριση, έχει επίσης κριθεί αποδεκτή, δεδομένου ότι προσφέρει πλεονεκτήματα έναντι των δοκιμών σε ινδικά χοιρίδια, όσον αφορά τόσο την καλή μεταχείριση των ζώων όσο και την αντικειμενική μέτρηση του επαγωγικού σταδίου της δερματικής ευαισθητοποίησης. Πιο πρόσφατα, μέθοδοι δοκιμών μηχανιστικής βάσης in chemico και in vitro θεωρήθηκαν επιστημονικά έγκυρες για την αξιολόγηση του κινδύνου ευαισθητοποίησης του δέρματος από χημικές ουσίες. Ωστόσο, λόγω της περιορισμένης κάλυψης από πλευράς μηχανισμών AOP με καθεμία από τις διαθέσιμες μεθόδους δοκιμών χωρίς χρήση ζώων, θα χρειαστούν συνδυασμοί μεθόδων στις οποίες δεν χρησιμοποιούνται ζώα (in silico, in chemico, in vitro) στο πλαίσιο ολοκληρωμένων προσεγγίσεων για τη διεξαγωγή δοκιμών και την αξιολόγηση (Integrated Approaches to Testing and Assessment/IATA), ώστε να καταστεί δυνατή η πλήρης υποκατάσταση των δοκιμών σε ζώα, που χρησιμοποιούνται επί του παρόντος (2) (3). Η παρούσα μέθοδος δοκιμών (προσδιορισμός ARE-Nrf2/λουσιφεράσης) προτείνεται για την εξέταση του δεύτερου βασικού συμβάντος που επεξηγείται στην παράγραφο 2. Έχει αναφερθεί ότι οι ευαισθητοποιητικές του δέρματος ουσίες επάγουν γονίδια που ρυθμίζονται από το στοιχείο απόκρισης στα αντιοξειδωτικά (ARE) (8) (9). Μικρές ηλεκτρονιόφιλες ουσίες, όπως οι ευαισθητοποιητικές του δέρματος, μπορούν να επιδράσουν στην πρωτεΐνη-αισθητήρα Keap1 (Kelch-like ECH-associated protein 1 / σχετιζόμενη με την πρωτεΐνη Ech πρωτεΐνη τύπου Kelch 1), π.χ. με ομοιοπολική τροποποίηση του κυστεϊνικού καταλοίπου της, με αποτέλεσμα την απόσπασή της από τον μεταγραφικό παράγοντα Nrf2 (nuclear factor-erythroid 2-related factor 2 / παράγοντας 2 σχετικός με τον πυρηνικό παράγοντα ερυθροειδών κυττάρων 2). Ο αποσπασμένος Nrf2 μπορεί έπειτα να ενεργοποιήσει γονίδια που εξαρτώνται από το στοιχείο ARE, όπως εκείνα που κωδικοποιούν τα ένζυμα της φάσης ΙΙ της αποτοξίνωσης (8) (10) (11). Επί του παρόντος, ο μόνος προσδιορισμός ARE-Nrf2/λουσιφεράσης in vitro που καλύπτεται από την παρούσα μέθοδο δοκιμών είναι η ανάλυση KeratinoSensTM, για την οποία έχουν ολοκληρωθεί μελέτες επικύρωσης (9) (12) (13), ακολουθούμενες από ανεξάρτητη αξιολόγηση από ομότιμους κριτές, την οποία διενήργησε το Εργαστήριο Αναφοράς της Ευρωπαϊκής Ένωσης για Εναλλακτικές Μεθόδους αντί των Δοκιμών σε Ζώα (EURL ECVAM) (14). Η ανάλυση KeratinoSensTM κρίθηκε επιστημονικά έγκυρη προς χρήση στο πλαίσιο μιας προσέγγισης ΙΑΤΑ για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος ουσιών με σκοπό την ταξινόμηση ως προς τον κίνδυνο και την επισήμανση (14). Τα εργαστήρια που επιθυμούν να εφαρμόσουν τη μέθοδο δοκιμών μπορούν να αποκτήσουν την ανασυνδυασμένη κυτταρική σειρά που χρησιμοποιείται στην ανάλυση KeratinoSensTM συνάπτοντας συμφωνία παραχώρησης άδειας με τον φορέα ανάπτυξης της μεθόδου (15). Οι ορισμοί παρατίθενται στο προσάρτημα 1. ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ, ΕΦΑΡΜΟΣΙΜΟΤΗΤΑ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ Δεδομένου ότι με την ενεργοποίηση της πορείας Keap1-Nrf2-ARE εξετάζεται μόνο το δεύτερο βασικό συμβάν της AOP δερματικής ευαισθητοποίησης, τα στοιχεία από μεθόδους δοκιμών που βασίζονται στην ενεργοποίηση αυτής της πορείας είναι απίθανο να επαρκούν, εάν χρησιμοποιούνται αυτοτελώς για τη συναγωγή συμπεράσματος σχετικά με το δερματικό ευαισθητοποιητικό δυναμικό των χημικών ουσιών. Ως εκ τούτου, τα δεδομένα που συγκεντρώνονται με την παρούσα μέθοδο δοκιμών θα πρέπει να εντάσσονται στο πλαίσιο ολοκληρωμένων προσεγγίσεων, όπως οι IATA, συνδυαζόμενα με άλλες συμπληρωματικές πληροφορίες, π.χ. αυτές που προκύπτουν από προσδιορισμούς in vitro με τους οποίους εξετάζονται άλλα βασικά συμβάντα της AOP δερματικής ευαισθητοποίησης, καθώς και από μεθόδους χωρίς δοκιμές, συμπεριλαμβανομένων των συγκριτικών προσεγγίσεων (read-across) με πληροφορίες για ουσίες ανάλογης χημικής δομής. Παραδείγματα σχετικά με τον τρόπο χρήσης της μεθόδου δοκιμών ARE-Nrf2/λουσιφεράσης σε συνδυασμό με άλλες πληροφορίες έχουν αναφερθεί στη βιβλιογραφία (13) (16) (17) (18) (19). Η παρούσα μέθοδος δοκιμών μπορεί να χρησιμοποιείται για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών (δηλ. κατηγορίας 1 του GHS των Ηνωμένων Εθνών/κανονισμού CLP) και μη ευαισθητοποιητικών του δέρματος ουσιών στο πλαίσιο μιας προσέγγισης IATA. Δεν μπορεί να χρησιμοποιείται αυτοτελώς για τη λεπτομερέστερη κατάταξη ευαισθητοποιητικών του δέρματος ουσιών στις υποκατηγορίες 1A και 1B κατά GHS/CLP, ούτε για την πρόβλεψη της ευαισθητοποιητικής ισχύος προκειμένου να ληφθούν αποφάσεις εκτίμησης της ασφάλειας. Ωστόσο, ανάλογα με το κανονιστικό πλαίσιο, ένα θετικό αποτέλεσμα μπορεί να χρησιμοποιηθεί αυτοτελώς για την κατάταξη χημικών ουσιών στην κατηγορία 1 κατά GHS/CLP. Με βάση το σύνολο δεδομένων από τη μελέτη επικύρωσης και εσωτερικές δοκιμές που χρησιμοποιήθηκαν για την ανεξάρτητη αξιολόγηση της μεθόδου δοκιμών από ομότιμους κριτές, η ανάλυση KeratinoSensTM μπορεί αποδεδειγμένα να μεταφερθεί σε εργαστήρια με εμπειρία στις κυτταροκαλλιέργειες. Ο βαθμός αναπαραγωγιμότητας των προβλέψεων που αναμένεται να παρέχει η μέθοδος δοκιμών είναι της τάξης του 85 % ενδοεργαστηριακά και διεργαστηριακά (14). Η ορθότητα (77 % - 155/201), η ευαισθησία (78 % - 71/91) και η ειδικότητα (76 % - 84/110) της ανάλυσης KeratinoSensTM για τη διάκριση μεταξύ ευαισθητοποιητικών (δηλ. κατηγορίας 1 κατά GHS/CLP) και μη ευαισθητοποιητικών ουσιών, σε σύγκριση με τα αποτελέσματα της LLNA, υπολογίστηκαν με συνεκτίμηση όλων των δεδομένων που υποβλήθηκαν στο EURL ECVAM για αξιολόγηση και για την εξέταση της μεθόδου δοκιμών από ομότιμους κριτές. Αυτά τα αριθμητικά στοιχεία είναι παρόμοια με εκείνα που δημοσιεύθηκαν πρόσφατα και τα οποία βασίζονται σε εσωτερικές δοκιμές με περίπου 145 ουσίες (ακρίβεια 77 %, ευαισθησία 79 %, ειδικότητα 72 %) (13). Η ανάλυση KeratinoSensTM είναι πιθανότερο να υποτιμήσει την πρόβλεψη για χημικές ουσίες με χαμηλή έως μέτρια ισχύ δερματικής ευαισθητοποίησης (δηλ. υποκατηγορίας 1Β κατά GHS/CLP) έναντι χημικών ουσιών που εμφανίζουν υψηλή ισχύ δερματικής ευαισθητοποίησης (δηλ. υποκατηγορίας 1Α κατά GHS/CLP) (13) (14). Συνολικά, τα στοιχεία αυτά δείχνουν τη χρησιμότητα της ανάλυσης KeratinoSensTM ως εργαλείου που συμβάλλει στον προσδιορισμό των κινδύνων δερματικής ευαισθητοποίησης. Ωστόσο, οι τιμές ορθότητας που παρέχονται εδώ για την ανάλυση KeratinoSensTM ως αυτοτελή μέθοδο δοκιμών είναι απλώς ενδεικτικές, δεδομένου ότι η μέθοδος δοκιμών θα πρέπει να εξετάζεται σε συνδυασμό με άλλες πηγές πληροφοριών στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις διατάξεις της παραγράφου 9 ανωτέρω. Επιπλέον, κατά την αξιολόγηση των μεθόδων δοκιμών δερματικής ευαισθητοποίησης χωρίς χρήση ζώων, θα πρέπει να μη λησμονείται ότι η δοκιμασία LLNA, καθώς και άλλες δοκιμές σε ζώα, ενδέχεται να μην αντικατοπτρίζουν πλήρως την κατάσταση στο είδος που ενδιαφέρει, δηλ. στον άνθρωπο. Ο όρος «υπό δοκιμή χημική ουσία» χρησιμοποιείται στην παρούσα μέθοδο δοκιμών για να δηλώσει την ύλη που υποβάλλεται σε δοκιμή και δεν σχετίζεται με την εφαρμοσιμότητα της μεθόδου δοκιμών ARE-Nrf2/λουσιφεράσης στον έλεγχο ουσιών και/ή μειγμάτων. Με βάση τα διαθέσιμα επί του παρόντος δεδομένα, η ανάλυση KeratinoSensTM είναι εφαρμόσιμη σε υπό δοκιμή χημικές ουσίες που καλύπτουν ποικιλία οργανικών δραστικών ομάδων, μηχανισμών αντίδρασης, επιπέδων ισχύος δερματικής ευαισθητοποίησης (όπως προσδιορίζονται με μελέτες in vivo) και φυσικοχημικών ιδιοτήτων (9) (12) (13) (14). Ελέγχθηκαν κυρίως μονοσυστατικές ουσίες, αν και υπάρχει περιορισμένος όγκος δεδομένων και για τον έλεγχο μειγμάτων (20). Η μέθοδος δοκιμών είναι πάντως τεχνικά εφαρμόσιμη στον έλεγχο πολυσυστατικών ουσιών και μειγμάτων. Ωστόσο, πριν από την εφαρμογή της παρούσας μεθόδου δοκιμών σε μείγμα για την παραγωγή δεδομένων για ρυθμιστικό σκοπό, θα πρέπει να εξετάζεται αν — και, εάν ναι, για ποιον λόγο — μπορεί να αποδώσει επαρκή αποτελέσματα για τον επιδιωκόμενο σκοπό. Οι εκτιμήσεις αυτές δεν είναι αναγκαίες όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος. Επιπλέον, κατά τον έλεγχο πολυσυστατικών ουσιών ή μειγμάτων, θα πρέπει να λαμβάνεται υπόψη η πιθανή παρεμπόδιση των παρατηρούμενων αποκρίσεων από κυτταροτοξικά συστατικά. Η μέθοδος δοκιμών έχει εφαρμογή σε υπό δοκιμή χημικές ουσίες που είναι διαλυτές ή σχηματίζουν σταθερή διασπορά (δηλ. κολλοειδές ή διασπορά στην οποία η υπό δοκιμή χημική ουσία δεν καθιζάνει ούτε διαχωρίζεται από τον διαλύτη σε διαφορετικές φάσεις) σε νερό ή σε DMSO (συμπεριλαμβανομένων όλων των συστατικών της υπό δοκιμή χημικής ουσίας στην περίπτωση των πολυσυστατικών ουσιών ή μειγμάτων). Για τις υπό δοκιμή χημικές ουσίες που δεν πληρούν αυτές τις προϋποθέσεις στην υψηλότερη απαιτούμενη τελική συγκέντρωση των 2 000 μΜ (πρβλ. παράγραφο 22), παραμένει η δυνατότητα δοκιμής σε χαμηλότερες συγκεντρώσεις. Στην περίπτωση αυτή, τα αποτελέσματα που πληρούν τα κριτήρια θετικότητας της παραγράφου 39 μπορούν και πάλι να χρησιμοποιηθούν για την υποστήριξη του χαρακτηρισμού της υπό δοκιμή χημικής ουσίας ως ευαισθητοποιητικής του δέρματος, ενώ τα αρνητικά αποτελέσματα σε συγκεντρώσεις < 1 000 μΜ θα πρέπει να θεωρούνται αβέβαια (βλ. μοντέλο πρόβλεψης στην παράγραφο 39). Γενικά, έχουν ελεγχθεί με επιτυχία ουσίες με logP έως 5, ενώ οι εξαιρετικά υδρόφοβες ουσίες με logP άνω του 7 βρίσκονται εκτός του γνωστού ορίου εφαρμοσιμότητας της μεθόδου δοκιμών (14). Για ουσίες με logP μεταξύ 5 και 7, υπάρχουν μόνο περιορισμένες πληροφορίες. Τα αρνητικά αποτελέσματα θα πρέπει να ερμηνεύονται με επιφύλαξη, δεδομένου ότι ουσίες που αντιδρούν αποκλειστικά με τα κατάλοιπα λυσίνης ενδέχεται να βρεθούν αρνητικές με τη μέθοδο δοκιμών. Επιπλέον, λόγω της περιορισμένης μεταβολικής ικανότητας της χρησιμοποιούμενης κυτταρικής σειράς (21) και λόγω των πειραματικών συνθηκών, τα μεταβολικά προαπτένια (δηλ. οι χημικές ουσίες που απαιτούν ενζυμική ενεργοποίηση, π.χ. μέσω των ενζύμων P450) και τα αβιοτικά προαπτένια (δηλ. οι χημικές ουσίες που ενεργοποιούνται με αυτοοξείδωση), και ιδίως όσα χαρακτηρίζονται από χαμηλή ταχύτητα οξείδωσης, μπορεί επίσης να δώσουν αρνητικά αποτελέσματα. Αντίθετα, υπό δοκιμή χημικές ουσίες που δεν δρουν ως ευαισθητοποιητικές, πλην όμως αποτελούν χημικούς παράγοντες καταπόνησης (στρες), μπορεί να οδηγήσουν σε ψευδοθετικά αποτελέσματα (14). Επιπλέον, δεν είναι πάντα δυνατή η αξιόπιστη αξιολόγηση των υπό δοκιμή χημικών ουσιών υψηλής κυτταροτοξικότητας. Τέλος, υπό δοκιμή χημικές ουσίες που παρεμποδίζουν το ένζυμο λουσιφεράση μπορούν να δημιουργήσουν σύγχυση με τη δραστικότητά του στις αναλύσεις που χρησιμοποιούν κύτταρα, προκαλώντας είτε φαινομενική αναστολή ή αυξημένη φωταύγεια (22). Για παράδειγμα, έχει αναφερθεί ότι συγκεντρώσεις φυτοοιστρογόνων ανώτερες του 1 μM παρεμπόδιζαν τα σήματα φωταύγειας σε άλλους προσδιορισμούς με γονίδιο αναφοράς (reporter) το γονίδιο της λουσιφεράσης, λόγω υπερενεργοποίησης του γονιδίου αναφοράς (23). Κατά συνέπεια, θα πρέπει να εξετάζεται με προσοχή η έκφραση της λουσιφεράσης σε υψηλές συγκεντρώσεις φυτοοιστρογόνων ή παρόμοιων χημικών ουσιών, για τις οποίες υπάρχουν υπόνοιες ότι προκαλούν υπερενεργοποίηση του γονιδίου αναφοράς της λουσιφεράσης ανάλογη με εκείνη που οφείλεται στα φυτοοιστρογόνα (23). Εάν υπάρχουν στοιχεία που δείχνουν ότι η μέθοδος δοκιμών δεν μπορεί να εφαρμοστεί σε άλλες ειδικές κατηγορίες χημικών ουσιών, η μέθοδος δεν θα πρέπει να χρησιμοποιείται για τις συγκεκριμένες κατηγορίες. Εκτός από την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών ουσιών, η ανάλυση KeratinoSensTM παρέχει επίσης πληροφορίες για τη σχέση συγκέντρωσης-απόκρισης που θα μπορούσαν ενδεχομένως να συμβάλουν στην εκτίμηση της ευαισθητοποιητικής ισχύος, όταν χρησιμοποιούνται σε ολοκληρωμένες προσεγγίσεις, όπως οι IATA (19). Απαιτούνται ωστόσο περισσότερες εργασίες, κατά προτίμηση με βάση αξιόπιστα δεδομένα για τον άνθρωπο, για να διαπιστωθεί ο τρόπος με τον οποίο τα αποτελέσματα της ανάλυσης KeratinoSensTM μπορούν να συμβάλουν στην εκτίμηση της ευαισθητοποιητικής ισχύος και στην κατάταξη ευαισθητοποιητικών ουσιών σε υποκατηγορίες κατά GHS/CLP. ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ Στη μέθοδο δοκιμών ARE-Nrf2/λουσιφεράσης χρησιμοποιείται μια αθανατοποιημένη προσκολλώμενη κυτταρική σειρά που προέρχεται από ανθρώπινα κερατινοκύτταρα HaCaT, σταθερά διαμολυσμένα με επιλέξιμο πλασμίδιο. Η κυτταρική σειρά περιέχει το γονίδιο της λουσιφεράσης υπό τον μεταγραφικό έλεγχο ενός ιδιοστατικού υποκινητή, συγχωνευμένου με στοιχείο ARE από γονίδιο που είναι γνωστό ότι υπερεκφράζεται υπό την επίδραση ουσιών ευαισθητοποιητικών με την επαφή (25) (26). Το σήμα της λουσιφεράσης εκφράζει την ενεργοποίηση, από τις ευαισθητοποιητικές ουσίες, γονιδίων εξαρτώμενων από τον ενδογενή παράγοντα Nrf2 και έχει αποδειχθεί ότι το σήμα αυτό στην ανασυνδυασμένη κυτταρική σειρά εξαρτάται από τον Nrf2 (27). Με τον τρόπο αυτό είναι δυνατόν να μετρηθεί ποσοτικά (με ανίχνευση της φωταύγειας) η επαγωγή του γονιδίου της λουσιφεράσης, με τη χρήση καθιερωμένων φωτογόνων υποστρωμάτων λουσιφεράσης ως δείκτη της δραστικότητας του μεταγραφικού παράγοντα Nrf2 στα κύτταρα μετά από έκθεση σε ηλεκτρονιόφιλες ουσίες. Οι υπό δοκιμή χημικές ουσίες θεωρούνται θετικές στην ανάλυση KeratinoSens™ εάν προκαλούν στατιστικά σημαντική επαγωγή δραστικότητας λουσιφεράσης, η οποία υπερβαίνει μια δεδομένη τιμή κατωφλίου (δηλ. > 1,5 φορές ή αύξηση κατά 50 %), σε συγκέντρωση χαμηλότερη από μια καθορισμένη τιμή που δεν επηρεάζει σημαντικά τη βιωσιμότητα των κυττάρων [δηλ. σε συγκέντρωση κάτω των 1 000 μM και στην οποία η κυτταρική βιωσιμότητα υπερβαίνει το 70 % (9) (12)]. Για τον σκοπό αυτό, προσδιορίζεται η μέγιστη πολλαπλάσια επαγωγή δραστικότητας λουσιφεράσης (Imax) σε σχέση με (αρνητικό) μάρτυρα με διαλύτη. Επιπλέον, δεδομένου ότι τα κύτταρα εκτίθενται σε σειρά συγκεντρώσεων των υπό δοκιμή χημικών ουσιών, η αναγκαία συγκέντρωση για στατιστικά σημαντική επαγωγή δραστικότητας λουσιφεράσης που να υπερβαίνει την τιμή κατωφλίου (δηλ. η τιμή EC1,5) θα πρέπει να υπολογίζεται με παρεμβολή από την καμπύλη δόσης-απόκρισης (για τους υπολογισμούς, βλ. παράγραφο 32). Τέλος, θα πρέπει να εκτελούνται παράλληλες μετρήσεις κυτταροτοξικότητας για να εκτιμάται αν τα επίπεδα επαγωγής δραστικότητας λουσιφεράσης εμφανίζονται σε υποκυτταροτοξικές συγκεντρώσεις. Πριν εντάξουν στην καθημερινή πρακτική τον προσδιορισμό ARE-Nrf2/λουσιφεράσης σύμφωνα με την παρούσα μέθοδο δοκιμών, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα, χρησιμοποιώντας τις δέκα ουσίες ελέγχου ικανότητας που απαριθμούνται στο προσάρτημα 2. Διατίθενται πρότυπα επιδόσεων (28) για να διευκολυνθεί η επικύρωση νέων ή τροποποιημένων μεθόδων δοκιμών ARE-Nrf2/λουσιφεράσης in vitro, ανάλογων με την ανάλυση KeratinoSens™, και να καταστεί δυνατή η έγκαιρη τροποποίηση της παρούσας μεθόδου δοκιμών ώστε να συμπεριληφθούν και αυτές. Η αμοιβαία αποδοχή δεδομένων (Mutual Acceptance of Data/MAD) βάσει της συμφωνίας του ΟΟΣΑ είναι διασφαλισμένη μόνο για μεθόδους δοκιμών που έχουν επικυρωθεί σύμφωνα με τα πρότυπα επιδόσεων, εφόσον αυτές έχουν κριθεί από τον ΟΟΣΑ και έχουν περιληφθεί στην αντίστοιχη κατευθυντήρια γραμμή δοκιμών. ΔΙΑΔΙΚΑΣΙΑ Επί του παρόντος, η μόνη τεχνική που καλύπτεται από την παρούσα μέθοδο δοκιμών είναι η επιστημονικά έγκυρη ανάλυση KeratinoSensTM (9) (12) (13) (14). Οι τυποποιημένες διαδικασίες λειτουργίας για την ανάλυση KeratinoSensTM είναι διαθέσιμες και θα πρέπει να χρησιμοποιούνται κατά την εφαρμογή και τη χρήση της μεθόδου δοκιμών στο εργαστήριο (15). Τα εργαστήρια που επιθυμούν να εφαρμόσουν τη μέθοδο δοκιμών μπορούν να αποκτήσουν την ανασυνδυασμένη κυτταρική σειρά που χρησιμοποιείται στην ανάλυση KeratinoSensTM συνάπτοντας συμφωνία παραχώρησης άδειας με τον φορέα ανάπτυξης της μεθόδου. Στις επόμενες παραγράφους περιγράφονται τα βασικά στοιχεία και διαδικασίες της μεθόδου δοκιμών ARE-Nrf2/λουσιφεράσης. Παρασκευή των καλλιεργειών κερατινοκυττάρων Θα πρέπει να χρησιμοποιείται διαγονιδιακή κυτταρική σειρά με σταθερή ένθεση του γονιδίου αναφοράς της λουσιφεράσης υπό τον έλεγχο του στοιχείου ARE (π.χ. η κυτταρική σειρά KeratinoSens™). Μετά την παραλαβή, τα κύτταρα πολλαπλασιάζονται (π.χ. 2 έως 4 ανακαλλιέργειες) και φυλάσσονται στην κατάψυξη ως ομοιογενές απόθεμα. Κύτταρα από αυτό το αρχικό απόθεμα μπορούν να πολλαπλασιαστούν έως τον μέγιστο αριθμό ανακαλλιεργειών (δηλ. 25 στην περίπτωση της KeratinoSensTM) και χρησιμοποιούνται έπειτα στις δοκιμές ρουτίνας, με χρήση του κατάλληλου θρεπτικού μέσου διατήρησης (DMEM που περιέχει ορό και γενετικίνη στην περίπτωση της KeratinoSensTM). Για τη δοκιμή θα πρέπει τα κύτταρα να παρουσιάζουν συρροή 80-90 % και να λαμβάνεται μέριμνα ώστε να διασφαλίζεται ότι δεν φθάνουν ποτέ σε πλήρη συρροή. Μία ημέρα πριν από τη δοκιμή, τα κύτταρα συλλέγονται και διανέμονται σε πλάκες 96 μικροκοιλοτήτων (10 000 κύτταρα/μικροκοιλότητα στην περίπτωση της KeratinoSensTM). Θα πρέπει να καταβάλλεται προσοχή για την αποφυγή της καθίζησης κυττάρων κατά τον εμβολιασμό, ώστε να εξασφαλίζεται ομοιογενής κατανομή του αριθμού κυττάρων μεταξύ των μικροκοιλοτήτων. Σε αντίθετη περίπτωση, το στάδιο αυτό μπορεί να οδηγήσει σε υψηλή μεταβλητότητα μεταξύ των μικροκοιλοτήτων. Σε κάθε επανάληψη, χρησιμοποιούνται τρία πανομοιότυπα δείγματα για τις μετρήσεις της δραστικότητας λουσιφεράσης και ένα παράλληλο πανομοιότυπο δείγμα για τον ποσοτικό προσδιορισμό της βιωσιμότητας των κυττάρων. Προετοιμασία των υπό δοκιμή χημικών ουσιών και των μαρτύρων Η προετοιμασία των υπό δοκιμή χημικών ουσιών και των μαρτύρων γίνεται την ημέρα της δοκιμής. Για την ανάλυση KeratinoSensTM, οι υπό δοκιμή χημικές ουσίες διαλύονται σε διμεθυλοσουλφοξείδιο (DMSO) μέχρι να επιτευχθεί η επιθυμητή τελική συγκέντρωση (π.χ. 200 mΜ). Τα διαλύματα σε DMSO μπορούν να θεωρηθούν αυτοαποστειρούμενα, οπότε δεν χρειάζεται αποστειρωτική διήθηση. Οι υπό δοκιμή χημικές ουσίες που δεν είναι διαλυτές σε DMSO διαλύονται σε αποστειρωμένο νερό ή θρεπτικό μέσο καλλιέργειας και τα διαλύματα αποστειρώνονται, π.χ. με διήθηση. Σε περίπτωση υπό δοκιμή χημικής ουσίας χωρίς καθορισμένο μοριακό βάρος (MΒ), παρασκευάζεται διάλυμα παρακαταθήκης με προκαθορισμένη συγκέντρωση (40 mg/mL ή 4 % κ.β. στην ανάλυση KeratinoSensTM). Εάν χρησιμοποιούνται άλλοι διαλύτες πλην του DMSO, του νερού ή του θρεπτικού μέσου καλλιέργειας, πρέπει να παρέχεται επαρκής επιστημονική αιτιολόγηση. Από τα διαλύματα παρακαταθήκης της υπό δοκιμή χημικής ουσίας σε DMSO παρασκευάζεται σειρά αραιώσεων με DMSO ώστε να προκύψουν 12 κύριες συγκεντρώσεις της υπό δοκιμή χημικής ουσίας (από 0,098 έως 200 mΜ στην ανάλυση KeratinoSensTM). Όταν η υπό δοκιμή χημική ουσία είναι αδιάλυτη σε DMSO, οι αραιώσεις για να προκύψουν οι κύριες συγκεντρώσεις γίνονται με στείρο νερό ή στείρο θρεπτικό μέσο καλλιέργειας. Ανεξάρτητα από τον χρησιμοποιούμενο διαλύτη, οι κύριες συγκεντρώσεις αραιώνονται έπειτα σε αναλογία 1:25 με θρεπτικό υλικό καλλιέργειας που περιέχει ορό και, τέλος, χρησιμοποιούνται για τη μεταχείριση μετά από μία ακόμη αραίωση 1:4, έτσι ώστε η τελική συγκέντρωση της υπό δοκιμή χημικής ουσίας να κυμαίνεται από 0,98 έως 2 000 μM στην ανάλυση KeratinoSensTM. Επιτρέπεται η χρήση εναλλακτικών συγκεντρώσεων, εφόσον αιτιολογείται (π.χ. σε περίπτωση κυτταροτοξικότητας ή χαμηλής διαλυτότητας). Ο αρνητικός μάρτυρας (με διαλύτη) που χρησιμοποιείται στην ανάλυση KeratinoSensTM είναι το DMSO (αριθ. CAS 67-68-5, καθαρότητα, ≥ 99 %), για το οποίο διατίθενται έξι μικροκοιλότητες ανά πλάκα. Υφίσταται την ίδια αραίωση με εκείνη που περιγράφεται στην παράγραφο 22 για τις κύριες συγκεντρώσεις, έτσι ώστε η τελική συγκέντρωση αρνητικού μάρτυρα (με διαλύτη) να είναι 1 %, που είναι γνωστό ότι δεν επηρεάζει τη βιωσιμότητα των κυττάρων και αντιστοιχεί στη συγκέντρωση του DMSO στην υπό δοκιμή χημική ουσία και στον θετικό μάρτυρα. Όταν η υπό δοκιμή χημική ουσία είναι αδιάλυτη σε DMSO και για τις αραιώσεις έχει χρησιμοποιηθεί νερό, τα επίπεδα DMSO στο τελικό διάλυμα δοκιμής σε όλες τις μικροκοιλότητες θα πρέπει να ρυθμίζονται σε 1 %, όπως και για τις άλλες υπό δοκιμή χημικές ουσίες και τους μάρτυρες. Ο θετικός μάρτυρας που χρησιμοποιείται στην ανάλυση KeratinoSensTM είναι η κινναμωμική αλδεΰδη (αριθ. CAS 14371-10-9, ≥ 98 % καθαρότητα), της οποίας παρασκευάζεται σειρά 5 κύριων συγκεντρώσεων από 0,4 έως 6,4 mM σε DMSO (από διάλυμα παρακαταθήκης 6,4 mM) που αραιώνονται όπως περιγράφεται στην παράγραφο 22 για τις κύριες συγκεντρώσεις, έτσι ώστε η τελική συγκέντρωση του θετικού μάρτυρα να κυμαίνεται από 4 έως 64 μM. Επιτρέπεται να χρησιμοποιούνται και άλλοι κατάλληλοι θετικοί μάρτυρες, που να παρέχουν κατά προτίμηση τιμές EC1,5 στο μέσο της κλίμακας, εάν υπάρχουν ιστορικά δεδομένα από τα οποία προκύπτουν συγκρίσιμα κριτήρια αποδοχής των μετρήσεων. Εφαρμογή των υπό δοκιμή χημικών ουσιών και των μαρτύρων Για κάθε υπό δοκιμή χημική ουσία και θετικό μάρτυρα, χρειάζεται ένα πείραμα για να προκύψει πρόβλεψη (θετική ή αρνητική), το οποίο συνίσταται σε δύο τουλάχιστον ανεξάρτητες σειρές επαναλήψεων, η καθεμία εις τριπλούν (δηλ. n = 6). Σε περίπτωση ασυμφωνίας μεταξύ των αποτελεσμάτων των δύο ανεξάρτητων σειρών επαναλήψεων, θα πρέπει να εκτελείται τρίτη σειρά επαναλήψεων εις τριπλούν (δηλ. n = 9). Κάθε ανεξάρτητη σειρά επαναλήψεων πραγματοποιείται διαφορετική ημέρα με πρόσφατο διάλυμα παρακαταθήκης των υπό δοκιμή χημικών ουσιών και κύτταρα που έχουν συλλεγεί ανεξάρτητα. Τα κύτταρα μπορούν ωστόσο να προέρχονται από την ίδια ανακαλλιέργεια. Μετά τον εμβολιασμό, όπως περιγράφεται στην παράγραφο 20, τα κύτταρα καλλιεργούνται για 24 ώρες στις πλάκες μικροτιτλοδότησης των 96 μικροκοιλοτήτων. Στη συνέχεια, αφαιρείται το θρεπτικό μέσο καλλιέργειας και αντικαθίσταται με νέο (150 μl θρεπτικού μέσου καλλιέργειας με ορό αλλά χωρίς γενετικίνη στην περίπτωση της KeratinoSensTM), στο οποίο προστίθενται 50 μl των αραιωμένων σε αναλογία 1:25 υπό δοκιμή χημικών ουσιών και μαρτύρων. Τουλάχιστον μία μικροκοιλότητα ανά πλάκα θα πρέπει να αφήνεται κενή (χωρίς κύτταρα και μεταχείριση), ώστε να μετρηθούν οι τιμές υποβάθρου. Οι πλάκες που έχουν υποβληθεί σε μεταχείριση επωάζονται έπειτα για 48 ώρες περίπου στους 37 ± 1 °C παρουσία 5 % CO2 στην ανάλυση KeratinoSensTM. Θα πρέπει να λαμβάνεται μέριμνα για την αποφυγή της εξάτμισης των πτητικών υπό δοκιμή χημικών ουσιών, καθώς και της διασταυρούμενης μόλυνσης των μικροκοιλοτήτων από τις υπό δοκιμή χημικές ουσίες, π.χ. με κάλυψη των πλακών με μεμβράνη πριν από την επώαση με τις υπό δοκιμή χημικές ουσίες. Μετρήσεις της δραστικότητας λουσιφεράσης Τρεις παράγοντες είναι καθοριστικής σημασίας για να εξασφαλιστούν οι ενδεδειγμένες αναγνώσεις ενδείξεων φωταύγειας:
Πριν από τη δοκιμή, θα πρέπει να εφαρμόζεται η πειραματική διάταξη ελέγχου που περιγράφεται στο προσάρτημα 3, ώστε να εξασφαλίζεται ότι συντρέχουν οι εν λόγω τρεις παράγοντες. Μετά τη 48ωρη έκθεση στην υπό δοκιμή χημική ουσία και στους μάρτυρες στην ανάλυση KeratinoSensTM, τα κύτταρα εκπλένονται με φυσιολογικό ορό σε ρυθμιστικό διάλυμα φωσφορικών αλάτων (PBS) και προστίθεται σε κάθε μικροκοιλότητα το σχετικό ρυθμιστικό διάλυμα λύσης για την ανάγνωση των ενδείξεων φωταύγειας, το οποίο παραμένει για 20 λεπτά σε θερμοκρασία δωματίου. Οι πλάκες με το κυτταρόλυμα τοποθετούνται έπειτα στο λουμινόμετρο για την ανάγνωση των ενδείξεων, η οποία στην ανάλυση KeratinoSensTM προγραμματίζεται ως εξής: i) προσθήκη του υποστρώματος λουσιφεράσης σε κάθε μικροκοιλότητα (ήτοι 50 μl), ii) αναμονή για 1 δευτερόλεπτο και iii) ολοκλήρωση της δραστικότητας λουσιφεράσης για 2 δευτερόλεπτα. Σε περίπτωση που χρησιμοποιούνται εναλλακτικές ρυθμίσεις, π.χ. ανάλογα με το χρησιμοποιούμενο μοντέλο λουμινόμετρου, θα πρέπει να αιτιολογούνται. Επιπλέον, μπορεί επίσης να χρησιμοποιηθεί υπόστρωμα φωτοβολίας, υπό την προϋπόθεση ότι έχει ολοκληρωθεί με επιτυχία το πείραμα ποιοτικού ελέγχου που περιγράφεται στο προσάρτημα 3. Εκτίμηση της κυτταροτοξικότητας Για τον προσδιορισμό της βιωσιμότητας των κυττάρων στην ανάλυση KeratinoSensTM, το θρεπτικό μέσο αντικαθίσταται μετά τη 48ωρη έκθεση με νέο θρεπτικό μέσο που περιέχει MTT [βρωμιούχο 3-(4,5-διμεθυλοθειαζολ-2-υλο)-2,5-διφαινυλοτετραζόλιο, βρωμιούχο τετραζόλιο-κυανό του θειαζολυλίου· αριθ. CAS 298-93-1] και τα κύτταρα επωάζονται επί 4 ώρες στους 37 °C παρουσία 5 % CO2. Το θρεπτικό μέσο με MTT απομακρύνεται και τα κύτταρα λύονται (π.χ. με την προσθήκη διαλύματος 10 % SDS σε κάθε κοιλότητα) καθ' όλη τη διάρκεια της νύκτας. Μετά από ανακίνηση μετριέται η απορρόφηση σε μήκος κύματος 600 nm με φωτόμετρο. ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Αξιολόγηση των δεδομένων Υπολογίζονται οι ακόλουθες παράμετροι στην ανάλυση KeratinoSensTM:
Εξίσωση 1:
όπου
Η EC1,5 υπολογίζεται με γραμμική παρεμβολή σύμφωνα με την εξίσωση 2 και η συνολική EC1,5 είναι ο γεωμετρικός μέσος των επιμέρους επαναλήψεων. Εξίσωση 2:
όπου
Η βιωσιμότητα υπολογίζεται από την εξίσωση 3: Εξίσωση 3:
όπου
Οι τιμές IC50 και IC30 υπολογίζονται με γραμμική παρεμβολή σύμφωνα με την εξίσωση 4 και οι συνολικές τιμές IC50 και IC30 είναι ο γεωμετρικός μέσος των επιμέρους επαναλήψεων. Εξίσωση 4:
όπου
Για κάθε συγκέντρωση που εμφανίζει > 1,5πλάσια επαγωγή δραστικότητας λουσιφεράσης, υπολογίζεται η στατιστική σημαντικότητα (π.χ. με αμφίπλευρο έλεγχο t του Student), με σύγκριση των τιμών φωταύγειας για τα τρία δείγματα επανάληψης με τις τιμές φωταύγειας στις μικροκοιλότητες που περιέχουν τον (αρνητικό) μάρτυρα με διαλύτη, για να διαπιστωθεί αν η επαγωγή δραστικότητας λουσιφεράσης είναι στατιστικά σημαντική (p < 0,05). Η χαμηλότερη συγκέντρωση που επιφέρει > 1,5πλάσια επαγωγή δραστικότητας λουσιφεράσης είναι η τιμή που καθορίζει την τιμή EC1,5. Σε κάθε περίπτωση, ελέγχεται αν η τιμή αυτή είναι χαμηλότερη από την τιμή IC30, γεγονός που υποδηλώνει μείωση της κυτταρικής βιωσιμότητας μικρότερη από 30 % στη συγκέντρωση που καθορίζει την EC1,5. Συνιστάται να ελέγχονται οπτικά τα δεδομένα με τη βοήθεια γραφικών παραστάσεων. Εάν δεν παρατηρείται σαφής καμπύλη δόσης-απόκρισης ή η προκύπτουσα καμπύλη δόσης-απόκρισης είναι διφασική (δηλ. τέμνει δύο φορές την τιμή κατωφλίου 1,5x), το πείραμα θα πρέπει να επαναλαμβάνεται για να εξακριβώνεται κατά πόσον πρόκειται για ειδική συμπεριφορά της υπό δοκιμή χημικής ουσίας ή για τεχνητό πειραματικό αποτέλεσμα. Σε περίπτωση που η διφασική απόκριση είναι αναπαραγώγιμη σε ανεξάρτητο πείραμα, θα πρέπει να αναφέρεται η χαμηλότερη τιμή EC1,5 (η συγκέντρωση στην οποία η καμπύλη τέμνει για πρώτη φορά την τιμή κατωφλίου 1,5x). Στις σπάνιες περιπτώσεις όπου παρατηρείται στατιστικά μη σημαντική επαγωγή πάνω από την 1,5πλάσια, ακολουθούμενη από στατιστικά σημαντική επαγωγή σε υψηλότερη συγκέντρωση, τα αποτελέσματα από τη συγκεκριμένη επανάληψη θεωρούνται έγκυρα και θετικά μόνο εάν η στατιστικά σημαντική επαγωγή που υπερβαίνει την τιμή κατωφλίου 1,5x έχει προκύψει σε μη κυτταροτοξική συγκέντρωση. Τέλος, για τις υπό δοκιμή χημικές ουσίες που επιφέρουν 1,5πλάσια ή και μεγαλύτερη επαγωγή ήδη στην κατώτατη συγκέντρωση δοκιμής των 0,98 μΜ, η τιμή EC1,5 καθορίζεται σε < 0,98 με βάση οπτική εξέταση της καμπύλης δόσης-απόκρισης. Κριτήρια αποδοχής Όταν χρησιμοποιείται η ανάλυση KeratinoSensTM θα πρέπει να πληρούνται τα ακόλουθα κριτήρια αποδοχής. Πρώτον, η επαγωγή δραστικότητας λουσιφεράσης που επιτυγχάνεται με τον θετικό μάρτυρα κινναμωμική αλδεΰδη θα πρέπει να υπερβαίνει με στατιστικά σημαντική διαφορά την τιμή κατωφλίου 1,5x (π.χ. με έλεγχο t) σε μία τουλάχιστον από τις δοκιμασθείσες συγκεντρώσεις (4 έως 64 μM). Δεύτερον, η τιμή EC1,5 θα πρέπει να βρίσκεται εντός ορίου δύο τυπικών αποκλίσεων από την ιστορική μέση τιμή της εγκατάστασης δοκιμών (π.χ. μεταξύ 7 μΜ και 30 μΜ με βάση τo σύνολο δεδομένων από την επικύρωση), η οποία θα πρέπει να επικαιροποιείται τακτικά. Επιπλέον, η μέση επαγωγή στις τρεις επαναλήψεις για την κινναμωμική αλδεΰδη σε συγκέντρωση 64 μΜ θα πρέπει να κυμαίνεται μεταξύ 2 και 8. Εάν δεν πληρούται το τελευταίο αυτό κριτήριο, η σχέση δόσης-απόκρισης για την κινναμωμική αλδεΰδη θα πρέπει να ελέγχεται προσεκτικά και οι δοκιμές μπορούν να γίνονται δεκτές μόνον εάν υπάρχει σαφής σχέση δόσης-απόκρισης με αύξηση της επαγωγής δραστικότητας λουσιφεράσης όταν αυξάνονται οι συγκεντρώσεις του θετικού μάρτυρα. Τέλος, ο μέσος συντελεστής μεταβλητότητας των ενδείξεων φωταύγειας για τον αρνητικό μάρτυρα (με διαλύτη), το DMSO, θα πρέπει να είναι μικρότερος από 20 % σε κάθε σειρά επαναλήψεων, που συνίσταται σε δοκιμή 6 μικροκοιλοτήτων εις τριπλούν. Εάν η μεταβλητότητα είναι μεγαλύτερη, τα αποτελέσματα θα πρέπει να απορρίπτονται. Ερμηνεία των αποτελεσμάτων και μοντέλο πρόβλεψης Οι προβλέψεις KeratinoSensTM θεωρούνται θετικές εάν πληρούνται οι ακόλουθες 4 προϋποθέσεις στις 2 από 2 ή στις ίδιες 2 από 3 σειρές επαναλήψεων, διαφορετικά θεωρούνται αρνητικές (εικόνα 1):
Εάν σε δεδομένη σειρά επαναλήψεων πληρούνται και οι τρεις πρώτες προϋποθέσεις, αλλά δεν παρατηρείται σαφής σχέση δόσης-απόκρισης για την επαγωγή λουσιφεράσης, το αποτέλεσμα της εν λόγω σειράς επαναλήψεων θα πρέπει να θεωρείται αβέβαιο και μπορεί να απαιτούνται περαιτέρω δοκιμές (σχήμα 1). Επιπλέον, ένα αρνητικό αποτέλεσμα με συγκεντρώσεις < 1 000 μΜ (ή < 200 μg/ml για υπό δοκιμή χημικές ουσίες χωρίς καθορισμένο ΜΒ) θα πρέπει επίσης να θεωρείται αβέβαιο (βλ. παράγραφο 11). Σχήμα 1 Μοντέλο πρόβλεψης που χρησιμοποιείται στην ανάλυση KeratinoSensTM. Οι προβλέψεις KeratinoSensTM θα πρέπει να εξετάζονται στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις διατάξεις των παραγράφων 9 και 11.
Σε σπάνιες περιπτώσεις, οι υπό δοκιμή χημικές ουσίες που επάγουν δραστικότητα λουσιφεράσης σε επίπεδα τα οποία προσεγγίζουν πολύ τα κυτταροτοξικά μπορεί σε ορισμένες σειρές επαναλήψεων να βρεθούν θετικές σε μη κυτταροτοξικά επίπεδα (δηλ. η συγκέντρωση που καθορίζει την EC1,5 είναι μικρότερη από την IC30), σε άλλες όμως σειρές επαναλήψεων να βρεθούν θετικές μόνο σε κυτταροτοξικά επίπεδα (δηλ. η συγκέντρωση που καθορίζει την EC1,5 είναι μεγαλύτερη από την IC30). Οι εν λόγω υπό δοκιμή χημικές ουσίες θα πρέπει να υποβάλλονται σε νέα δοκιμή με λεπτομερέστερη ανάλυση της σχέσης δόσης-απόκρισης, κατά την οποία να χρησιμοποιείται μικρότερος συντελεστής αραίωσης [π.χ. αραίωση 1:1,33 ή Ö2 (= 1,41) μεταξύ των μικροκοιλοτήτων], για να διαπιστωθεί αν επήλθε επαγωγή σε κυτταροτοξικά ή μη κυτταροτοξικά επίπεδα (9). Έκθεση δοκιμής Στην έκθεση δοκιμής θα πρέπει να περιλαμβάνονται τα ακόλουθα στοιχεία:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Ορθότητα : η εγγύτητα της συμφωνίας μεταξύ των αποτελεσμάτων της μεθόδου δοκιμών και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της μεθόδου δοκιμών και μια από τις πτυχές της «καταλληλότητας». Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς την «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας μεθόδου δοκιμών (29). AOP (Adverse Outcome Pathway/πορεία δυσμενούς έκβασης) : αλληλουχία συμβάντων, από τη χημική δομή της χημικής ουσίας ή των ομοειδών χημικών ουσιών που αποτελούν στόχο μέχρι την υπό μελέτη έκβαση in vivo, μέσω του μοριακού εναρκτήριου συμβάντος (2). ARE : στοιχείο απόκρισης στα αντιοξειδωτικά, από τα αρχικά των λέξεων Antioxidant Response Element (καλούμενο επίσης EpRE, electrophile response element/στοιχείο απόκρισης στα ηλεκτρονιόφιλα). Πρόκειται για ένα στοιχείο απόκρισης που εντοπίζεται στην περιοχή του ανάντη ευρισκόμενου υποκινητή πολλών κυτταροπροστατευτικών γονιδίων και γονιδίων φάσης II. Όταν ενεργοποιείται από τον παράγοντα Nfr2, διαμεσολαβεί για τη μεταγραφική επαγωγή αυτών των γονιδίων. Χημικό προϊόν : μια ουσία ή ένα μείγμα. Συντελεστής μεταβλητότητας : μέτρο της μεταβλητότητας, που υπολογίζεται για μια ομάδα δεδομένων επανάληψης με διαίρεση της τυπικής απόκλισης διά της μέσης τιμής. Είναι δυνατόν να πολλαπλασιαστεί επί 100 για να εκφραστεί ως ποσοστό. EC1,5 : η συγκέντρωση που αντιστοιχεί σε 1,5πλάσια επαγωγή λουσιφεράσης και υπολογίζεται μέσω παρεμβολής. IC30 : η συγκέντρωση που επιφέρει μείωση της κυτταρικής βιωσιμότητας κατά 30 %. IC50 : η συγκέντρωση που επιφέρει μείωση της κυτταρικής βιωσιμότητας κατά 50 %. Κίνδυνος : εγγενής ιδιότητα ενός παράγοντα ή μιας κατάστασης που μπορεί να έχει δυσμενείς επιδράσεις όταν οργανισμός, σύστημα ή (υπο)πληθυσμός εκτεθεί στον συγκεκριμένο παράγοντα. IATA (Integrated Approach to Testing and Assessment/Ολοκληρωμένη προσέγγιση για τη διεξαγωγή δοκιμών και την αξιολόγηση) : δομημένη προσέγγιση που χρησιμοποιείται για τον προσδιορισμό του κινδύνου (δυναμικό), τον χαρακτηρισμό του κινδύνου (ισχύς) και/ή την εκτίμηση της ασφάλειας (δυναμικό/ισχύς και έκθεση) μιας χημικής ουσίας ή ομάδας χημικών ουσιών, στην οποία ενσωματώνονται και σταθμίζονται στρατηγικά όλα τα σχετικά δεδομένα, με σκοπό την τροφοδότηση ρυθμιστικών αποφάσεων σχετικά με τον δυνητικό κίνδυνο και/ή την επικινδυνότητα και/ή την ανάγκη για περαιτέρω στοχευμένες και, ως εκ τούτου, ελάχιστες δοκιμές. Imax : ο μέγιστος συντελεστής επαγωγής δραστικότητας λουσιφεράσης σε σχέση με τον αρνητικό μάρτυρα (με διαλύτη), μετρούμενος σε οποιαδήποτε συγκέντρωση της υπό δοκιμή χημικής ουσίας. Keap1 : Kelch-like ECH-associated protein 1 (σχετιζόμενη με την πρωτεΐνη Ech πρωτεΐνη τύπου Kelch 1). Πρόκειται για πρωτεΐνη-αισθητήρα που μπορεί να ρυθμίζει τη δραστικότητα του παράγοντα Nrf2. Υπό συνθήκες χωρίς επαγωγή, η πρωτεΐνη-αισθητήρας Keap1 σηματοδοτεί την ουβικινίνωση και την πρωτεολυτική αποδόμηση του μεταγραφικού παράγοντα Nrf2 στο πρωτεόσωμα. Η ομοιοπολική τροποποίηση των δραστικών κυστεϊνικών καταλοίπων της πρωτεΐνης Keap1 από μικρά μόρια μπορεί να έχει ως αποτέλεσμα την απόσπαση του παράγοντα Nrf2 από την Keap1 (8) (10) (11) Μείγμα : μείγμα ή διάλυμα, αποτελούμενο από δύο ή περισσότερες ουσίες που δεν αντιδρούν μέσα σε αυτό (1). Μονοσυστατική ουσία : ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας ένα κύριο συστατικό περιέχεται σε ποσοστό τουλάχιστον 80 % (κ.β.). Πολυσυστατική ουσία : ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας περισσότερα από ένα κύρια συστατικά περιέχονται σε συγκέντρωση ≥ 10 % (κ.β.) και < 80 % (κ.β.). Οι πολυσυστατικές ουσίες είναι προϊόντα μεταποιητικών διεργασιών. Η διαφορά μεταξύ μείγματος και πολυσυστατικής ουσίας είναι ότι το μείγμα λαμβάνεται με ανάμειξη δύο ή περισσότερων ουσιών, χωρίς χημική αντίδραση. Οι πολυσυστατικές ουσίες είναι προϊόντα χημικών αντιδράσεων. Nrf2 : Nuclear factor (erythroid-derived 2)-like 2 (παράγοντας 2 όμοιος με τον πυρηνικό παράγοντα ερυθροειδών κυττάρων 2). Πρόκειται για μεταγραφικό παράγοντα που συμμετέχει στην πορεία απόκρισης στα αντιοξειδωτικά. Όταν ο Nrf2 δεν είναι ουβικιτινωμένος, συσσωρεύεται στο κυτταρόπλασμα και μετατοπίζεται στον πυρήνα, όπου συνδυάζεται με το στοιχείο ARE στην περιοχή του ανάντη ευρισκόμενου υποκινητή πολλών κυτταροπροστατευτικών γονιδίων, εκκινώντας τη μεταγραφή τους (8) (10) (11). Θετικός μάρτυρας : επανάληψη που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και υποβάλλεται σε μεταχείριση με ουσία που είναι γνωστό ότι επάγει θετική απόκριση. Για να διασφαλίζεται η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης του θετικού μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της θετικής απόκρισης δεν θα πρέπει να είναι υπερβολικό. Καταλληλότητα : περιγραφή της σχέσης της δοκιμής με την υπό μελέτη επίδραση και του κατά πόσον αυτή έχει σημασία και είναι χρήσιμη για συγκεκριμένο σκοπό. Πρόκειται για τον βαθμό στον οποίο η δοκιμή μετρά ή προβλέπει σωστά τη βιολογική επίδραση υπό μελέτη. Η καταλληλότητα εμπεριέχει συνεκτίμηση της ορθότητας (συμφωνίας) της μεθόδου δοκιμών (29). Αξιοπιστία : μέτρο του βαθμού στον οποίο μια μέθοδος δοκιμών μπορεί να αναπαράγεται διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας, καθώς και της ενδοεργαστηριακής επαναληψιμότητας (29). Αναπαραγωγιμότητα : η συμφωνία μεταξύ των αποτελεσμάτων που προκύπτουν από τη διεξαγωγή δοκιμών με την ίδια χημική ουσία και με τη χρήση του ίδιου πρωτοκόλλου δοκιμών (βλ. αξιοπιστία) (29). Ευαισθησία : το ποσοστό του συνόλου των θετικών/δραστικών χημικών ουσιών που ταξινομείται σωστά με τη μέθοδο δοκιμών. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών (29). Μάρτυρας με διαλύτη/φορέα : επανάληψη που περιέχει όλα τα στοιχεία του δοκιμαστικού συστήματος, εξαιρουμένης της υπό δοκιμή χημικής ουσίας, αλλά συμπεριλαμβανομένου του χρησιμοποιούμενου διαλύτη. Χρησιμοποιείται για τον καθορισμό της βασικής απόκρισης των δειγμάτων που υποβάλλονται σε μεταχείριση με την υπό δοκιμή ουσία, διαλυμένη στον ίδιο διαλύτη. Ειδικότητα : το ποσοστό του συνόλου των αρνητικών/αδρανών χημικών ουσιών που ταξινομείται σωστά με τη μέθοδο δοκιμών. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών (29). Ουσία : τα χημικά στοιχεία και οι ενώσεις τους σε φυσική κατάσταση ή όπως λαμβάνονται με οποιαδήποτε παραγωγική διεργασία, στα οποία συμπεριλαμβάνονται όλα τα πρόσθετα που απαιτούνται για να διατηρείται η σταθερότητα του προϊόντος, καθώς και τυχόν προσμείξεις που προκύπτουν από τη χρησιμοποιούμενη διεργασία, αλλά από τα οποία εξαιρούνται οι διαλύτες που είναι δυνατόν να διαχωριστούν χωρίς να επηρεαστεί η σταθερότητα της ουσίας ούτε να μεταβληθεί η σύνθεσή της (1). Υπό δοκιμή χημική ουσία : Ο όρος «υπό δοκιμή χημική ουσία» χρησιμοποιείται για να δηλώσει αυτό που υποβάλλεται σε δοκιμή. Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων των Ηνωμένων Εθνών (United Nations Globally Harmonized System of Classification and Labelling of Chemicals) (GHS των Ηνωμένων Εθνών) : σύστημα που προτείνει την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων) με βάση τυποποιημένα είδη και βαθμούς φυσικών κινδύνων και κινδύνων για την υγεία και το περιβάλλον και καλύπτει τα αντίστοιχα επικοινωνιακά στοιχεία, όπως εικονογράμματα, προειδοποιητικές λέξεις, δηλώσεις επικινδυνότητας, δηλώσεις προφύλαξης και δελτία δεδομένων ασφαλείας, για τη μετάδοση πληροφοριών σχετικά με τις δυσμενείς επιδράσεις των εν λόγω προϊόντων με σκοπό την προστασία των ανθρώπων (εργοδοτών, εργαζομένων, μεταφορέων, καταναλωτών και διασωστών) και του περιβάλλοντος (1). UVCB : ουσίες άγνωστης ή ασταθούς σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά. Έγκυρη μέθοδος δοκιμών : μέθοδος δοκιμών που θεωρείται επαρκούς καταλληλότητας και αξιοπιστίας για συγκεκριμένο σκοπό και βασίζεται σε επιστημονικά τεκμηριωμένες αρχές. Οι μέθοδοι δοκιμών δεν είναι ποτέ έγκυρες με την απόλυτη σημασία του όρου, αλλά μόνο σε σχέση με καθορισμένο σκοπό (29). Προσάρτημα 2 ΟΥΣΙΕΣ ΕΛΕΓΧΟΥ ΙΚΑΝΟΤΗΤΑΣ Δερματική ευαισθητοποίηση in vitro: Μέθοδος δοκιμών ARE-Nrf2/λουσιφεράσης Πριν εντάξουν στην καθημερινή πρακτική την παρούσα μέθοδο δοκιμών, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα επιτυγχάνοντας σωστά την αναμενόμενη πρόβλεψη βάσει της ανάλυσης KeratinoSens™ για τις 10 συνιστώμενες στον πίνακα 1 ουσίες ελέγχου ικανότητας, καθώς και τιμές EC1,5 και IC50 εντός του αντίστοιχου εύρους τιμών αναφοράς για 8 τουλάχιστον από τις 10 ουσίες ελέγχου ικανότητας. Οι εν λόγω ουσίες ελέγχου ικανότητας επιλέχθηκαν ως αντιπροσωπευτικές του φάσματος αποκρίσεων όσον αφορά τους κινδύνους δερματικής ευαισθητοποίησης. Άλλα κριτήρια επιλογής ήταν το ότι είναι διαθέσιμες στο εμπόριο, ότι υπάρχουν υψηλής ποιότητας δεδομένα αναφοράς in vivo, καθώς και υψηλής ποιότητας δεδομένα in vitro που προέκυψαν από την ανάλυση KeratinoSensTM. Πίνακας 1 Συνιστώμενες ουσίες για την απόδειξη τεχνικής ικανότητας όσον αφορά την ανάλυση KeratinoSensTM
Προσάρτημα 3 ΠΟΙΟΤΙΚΟΣ ΕΛΕΓΧΟΣ ΤΩΝ ΜΕΤΡΗΣΕΩΝ ΦΩΤΑΥΓΕΙΑΣ Βασικό πείραμα για την εξασφάλιση βέλτιστων μετρήσεων φωταύγειας κατά την ανάλυση KeratinoSensTM Οι ακόλουθες τρεις παράμετροι είναι κρίσιμης σημασίας για να διασφαλιστεί η επίτευξη αξιόπιστων αποτελεσμάτων με το λουμινόμετρο:
Πριν από τη δοκιμή συνιστάται να εξασφαλίζεται ότι οι μετρήσεις φωταύγειας είναι οι ενδεδειγμένες, με τον έλεγχο μιας πλάκας με τη διάταξη που περιγράφεται κατωτέρω (ανάλυση εις τριπλούν). Διάταξη πλάκας για το πρώτο πείραμα εξάσκησης
EGDMA= διμεθακρυλικός εστέρας της αιθυλενογλυκόλης (αριθ. CAS: 97-90-5), ισχυρή επαγωγική χημική ουσία CA= κινναμωμική αλδεΰδη, θετική ουσία αναφοράς (αριθ. CAS: 104-55-2) Η ανάλυση ποιοτικού ελέγχου θα πρέπει να καταδεικνύει:
Β.61 Μέθοδος δοκιμών διαρροής φλουορεσκεΐνης για τον προσδιορισμό διαβρωτικών και ισχυρών ερεθιστικών των οφθαλμών ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 460 του ΟΟΣΑ (2012). Η μέθοδος δοκιμών διαρροής φλουορεσκεΐνης (FL) αποτελεί μέθοδο δοκιμών in vitro που μπορεί να χρησιμοποιείται, υπό ορισμένες περιστάσεις και με ειδικούς περιορισμούς, για την ταξινόμηση χημικών προϊόντων (ουσιών και μειγμάτων) ως διαβρωτικών και ισχυρών ερεθιστικών των οφθαλμών, όπως ορίζονται στο Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων (Globally Harmonized System of Classification and Labelling of Chemicals/GHS) των Ηνωμένων Εθνών (κατηγορία 1), στον κανονισμό (ΕΚ) αριθ. 1272/2008 για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων (Classification, Labelling and Packaging/CLP) (31) (κατηγορία 1) και από την Υπηρεσία Προστασίας του Περιβάλλοντος (Environmental Protection Agency/EPA) των ΗΠΑ (κατηγορία I) (1) (2). Για τους σκοπούς της παρούσας μεθόδου δοκιμών, ως ισχυρά οφθαλμικά ερεθιστικά ορίζονται οι χημικές ουσίες που, μετά τη χορήγησή τους, προκαλούν βλάβη στους οφθαλμικούς ιστούς η οποία δεν είναι αναστρέψιμη εντός 21 ημερών ή έχει ως αποτέλεσμα σοβαρή μείωση της όρασης, ενώ ως διαβρωτικά των οφθαλμών νοούνται οι χημικές ουσίες που προκαλούν μη αναστρέψιμη βλάβη στους οφθαλμικούς ιστούς. Οι εν λόγω χημικές ουσίες ταξινομούνται ως κατηγορίας 1 του GHS των Ηνωμένων Εθνών, κατηγορίας 1 του κανονισμού CLP της ΕΕ ή κατηγορίας I της EPA των ΗΠΑ. Μολονότι η μέθοδος δοκιμών FL δεν θεωρείται έγκυρη ως πλήρες υποκατάστατο της οφθαλμικής δοκιμής in vivo σε κουνέλια, συνιστάται να χρησιμοποιείται στο πλαίσιο κλιμακωτής στρατηγικής δοκιμών για ταξινόμηση και επισήμανση, που επιβάλλεται από κανονιστικές ρυθμίσεις. Ως εκ τούτου, η μέθοδος δοκιμών FL συνιστάται ως αρχικό στάδιο στο πλαίσιο καθοδικής προσέγγισης (top-down) για τον προσδιορισμό διαβρωτικών/ισχυρών ερεθιστικών των οφθαλμών, ειδικά για περιορισμένα είδη χημικών προϊόντων (δηλ. υδατοδιαλυτές ουσίες και μείγματα) (3) (4). Επί του παρόντος είναι γενικά αποδεκτό ότι, στο προβλέψιμο μέλλον, καμία μεμονωμένη δοκιμασία οφθαλμικού ερεθισμού in vitro δεν θα μπορεί να αντικαταστήσει την οφθαλμική δοκιμή in vivo [μέθοδος δοκιμών Β.5 (5)] στην πρόβλεψη σε ολόκληρο το φάσμα ερεθιστικότητας από τις διαφορετικές τάξεις χημικών ουσιών. Εντούτοις, στοχευμένοι συνδυασμοί διαφόρων εναλλακτικών μεθόδων δοκιμών στο πλαίσιο (κλιμακωτής) στρατηγικής δοκιμών θα μπορούσαν ενδεχομένως να αντικαταστήσουν την οφθαλμική δοκιμή in vivo (4). Η καθοδική προσέγγιση (4) έχει σχεδιαστεί για να χρησιμοποιείται όταν, βάσει των διαθέσιμων πληροφοριών, μια χημική ουσία αναμένεται να έχει υψηλό δυναμικό ερεθιστικότητας. Με βάση το μοντέλο πρόβλεψης που περιγράφεται λεπτομερώς στην παράγραφο 35, με τη μέθοδο δοκιμών FL είναι δυνατόν να προσδιοριστούν χημικές ουσίες που εμπίπτουν σε περιορισμένο πεδίο εφαρμογής ως διαβρωτικά/ισχυρά ερεθιστικά των οφθαλμών (κατηγορία 1 του GHS των Ηνωμένων Εθνών· κατηγορίας 1 του CLP της ΕΕ· κατηγορία Ι της ΕΡΑ των ΗΠΑ), χωρίς περαιτέρω δοκιμές. Το ίδιο τεκμαίρεται για τα μείγματα, παρόλο που δεν χρησιμοποιήθηκαν μείγματα κατά την επικύρωση. Ως εκ τούτου, η μέθοδος δοκιμής FL μπορεί να χρησιμοποιείται για τον προσδιορισμό της ερεθιστικότητας και/ή διαβρωτικότητας χημικών ουσιών για τους οφθαλμούς, κατόπιν εφαρμογής της στρατηγικής διαδοχικών δοκιμών που προβλέπεται στη μέθοδο δοκιμών Β.5 (5). Ωστόσο, οι χημικές ουσίες που, βάσει της μεθόδου δοκιμών FL, δεν προβλέπεται να είναι διαβρωτικά ή ισχυρά ερεθιστικά των οφθαλμών είναι αναγκαίο να ελέγχονται με μία ή περισσότερες πρόσθετες μεθόδους δοκιμών (in vitro και/ή in vivo), ικανές να προσδιορίσουν ορθά i) τις χημικές ουσίες που είναι in vitro ψευδώς αρνητικά διαβρωτικά/ισχυρά ερεθιστικά των οφθαλμών βάσει της μεθόδου FL (κατηγορία 1 του GHS των Ηνωμένων Εθνών· κατηγορίας 1 του CLP της ΕΕ· κατηγορία I της ΕΡΑ των ΗΠΑ)· ii) τις χημικές ουσίες που δεν ταξινομούνται ως προς τη διάβρωση/τον ερεθισμό των οφθαλμών («καμία κατηγορία» του GHS των Ηνωμένων Εθνών· «καμία κατηγορία» του κανονισμού CLP της ΕΕ· κατηγορία IV της ΕΡΑ των ΗΠΑ)· και/ή iii) τις χημικές ουσίες που είναι μέτρια/ήπια ερεθιστικά των οφθαλμών (κατηγορίες 2Α και 2Β του GHS των Ηνωμένων Εθνών· κατηγορία 2 του CLP της ΕΕ· κατηγορίες II και III της ΕΡΑ των ΗΠΑ). Σκοπός της παρούσας μεθόδου δοκιμών είναι η περιγραφή των διαδικασιών που χρησιμοποιούνται για την αξιολόγηση της δυνητικής διαβρωτικότητας ή ισχυρής ερεθιστικότητας των υπό δοκιμή χημικών ουσιών για τους οφθαλμούς, όπως αυτή μετράται από την ικανότητά τους να προκαλούν βλάβη σε αδιαπέραστη συνεχή (confluent) μονοστιβάδα επιθηλιακών κυττάρων. Η ακεραιότητα ως προς τη διεπιθηλιακή διαπερατότητα αποτελεί κύρια λειτουργία ενός επιθηλίου, όπως αυτό που συναντάται στον επιπεφυκότα και τον κερατοειδή. Η διεπιθηλιακή διαπερατότητα καθορίζεται από διάφορους στενοσυνδέσμους (tight junctions). Έχει αποδειχθεί ότι η αύξηση της διαπερατότητας του κερατοειδικού επιθηλίου in vivo συσχετίζεται με τον βαθμό της φλεγμονής και της επιφανειακής βλάβης που παρατηρούνται κατά την εξέλιξη του ερεθισμού των οφθαλμών. Στη μέθοδο δοκιμών FL, οι τοξικές επιδράσεις μετά από σύντομης διάρκειας έκθεση στην υπό δοκιμή χημική ουσία μετρώνται με την αύξηση της διαπερατότητας, στη νατριούχο φλουορεσκεΐνη, της μονοστιβάδας επιθηλιακών κυττάρων νεφρού σκύλου Madin-Darby (Madin-Darby Canine Kidney/MDCK), τα οποία καλλιεργούνται σε διαπερατά ενθέματα. Η ποσότητα φλουορεσκεΐνης που διαρρέει είναι ανάλογη προς την επαγόμενη από τη χημική ουσία βλάβη στους στενοσυνδέσμους, στα δεσμοσώματα και στις κυτταρικές μεμβράνες και μπορεί να χρησιμοποιηθεί για την εκτίμηση του δυναμικού οφθαλμικής τοξικότητας των υπό δοκιμή χημικών ουσιών. Στο προσάρτημα 1 παρατίθεται διάγραμμα κυττάρων MDCK καλλιεργημένων σε μεμβράνη ενθέματος για τη μέθοδο δοκιμών FL. Οι ορισμοί παρατίθενται στο προσάρτημα 2. ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ Η παρούσα μέθοδος δοκιμών βασίζεται στο πρωτόκολλο INVITTOX αριθ. 71 (6), το οποίο αξιολογήθηκε με διεθνή μελέτη επικύρωσης που εκπονήθηκε από το Ευρωπαϊκό Κέντρο για την Επικύρωση Εναλλακτικών Μεθόδων (ECVAM), σε συνεργασία με τη Διυπηρεσιακή Συντονιστική Επιτροπή για την Επικύρωση Εναλλακτικών Μεθόδων (ICCVAM) των ΗΠΑ και το Ιαπωνικό Κέντρο για την Επικύρωση Εναλλακτικών Μεθόδων (JaCVAM). Όπως κατέδειξε η μελέτη επικύρωσης, η μέθοδος δοκιμών FL δεν συνιστάται για τον προσδιορισμό χημικών ουσιών που θα πρέπει να ταξινομούνται ως ήπια/μέτρια ερεθιστικά ή διαβρωτικά ούτε χημικών προϊόντων (ουσιών και μειγμάτων) που δεν θα πρέπει να ταξινομούνται ως προς τον οφθαλμικό ερεθισμό (δηλ. κατηγορία 2Α/2Β, «καμία κατηγορία» του GHS. κατηγορία 2, «καμία κατηγορία» του κανονισμού CLP της ΕΕ· κατηγορίες II/III/IV της EPA των ΗΠΑ) (3) (7). Η μέθοδος δοκιμών εφαρμόζεται μόνο σε υδατοδιαλυτά χημικά προϊόντα (ουσίες και μείγματα). Το δυναμικό σοβαρού οφθαλμικού ερεθισμού των χημικών ουσιών που είναι υδατοδιαλυτές και/ή των οποίων η τοξική επίδραση δεν επηρεάζεται από την αραίωση προβλέπεται γενικά με ακρίβεια με τη χρήση της μεθόδου δοκιμών FL (7). Για να χαρακτηριστεί μια χημική ουσία υδατοδιαλυτή σε πειραματικές συνθήκες, θα πρέπει να είναι διαλυτή σε στείρο ισορροπημένο αλατούχο διάλυμα Hanks (Hanks' Balanced Salt Solution/HBSS), που περιέχει ασβέστιο (σε συγκέντρωση 1,0-1,8 mM) και δεν περιέχει ερυθρό της φαινόλης, σε συγκέντρωση ≥ 250 mg/ml (μία δόση πάνω από την τιμή αποκοπής των 100 mg/ml). Εάν, ωστόσο, η υπό δοκιμή χημική ουσία είναι διαλυτή σε συγκέντρωση χαμηλότερη από 100 mg/ml, στην οποία όμως ήδη επάγει FL 20 % (δηλ. FL20 < 100 mg/ml), μπορεί να χαρακτηριστεί ουσία της κατηγορίας 1 του GHS ή κατηγορίας Ι της ΕΡΑ. Οι περιορισμοί που προσδιορίστηκαν για την παρούσα μέθοδο δοκιμών συνίστανται στην εξαίρεση των ισχυρών οξέων και βάσεων, των μονιμοποιητικών των κυττάρων και των εξαιρετικά πτητικών χημικών ουσιών από το πεδίο εφαρμογής. Οι συγκεκριμένες χημικές ουσίες δρουν με μηχανισμούς που δεν μετρώνται με τη μέθοδο δοκιμών FL, π.χ. εκτεταμένη πήξη, σαπωνοποίηση ή ειδικές χημικές αντιδράσεις. Άλλοι περιορισμοί που προσδιορίστηκαν για την παρούσα μέθοδο βασίζονται στα αποτελέσματα που αφορούν την ικανότητα πρόβλεψης της μεθόδου σε περιπτώσεις έγχρωμων ή παχύρρευστων υπό δοκιμή χημικών ουσιών (7). Αναφέρεται ότι και τα δύο αυτά είδη χημικών ουσιών είναι δύσκολο να απομακρυνθούν από τη μονοστιβάδα μετά τη σύντομη περίοδο έκθεσης και προτείνεται να βελτιωθεί η ικανότητα πρόβλεψης της μεθόδου δοκιμών με την αύξηση του αριθμού των εφαρμοζόμενων σταδίων έκπλυσης.. Τα στερεά χημικά προϊόντα σε εναιώρημα σε υγρό έχουν την τάση να καθιζάνουν, γεγονός που δυσχεραίνει τον προσδιορισμό της τελικής συγκέντρωσης στα κύτταρα. Όταν εξαιρούνται από τη βάση δεδομένων οι ουσίες των συγκεκριμένων χημικών και φυσικών τάξεων, βελτιώνεται σημαντικά η ορθότητα της μεθόδου FL στα συστήματα ταξινόμησης της ΕΕ, της EPA και των Ηνωμένων Εθνών (GHS) (7). Με βάση τον σκοπό της παρούσας μεθόδου δοκιμών (που είναι ο προσδιορισμός μόνο διαβρωτικών/ισχυρών ερεθιστικών των οφθαλμών), τα ποσοστά ψευδοαρνητικής έκβασης (βλ. παράγραφο 13) δεν είναι κρίσιμης σημασίας, δεδομένου ότι τέτοιες χημικές ουσίες θα υποβληθούν ακολούθως σε άλλες, επαρκώς επικυρωμένες δοκιμές in vitro ή σε κουνέλια, ανάλογα με τις κανονιστικές απαιτήσεις, με τη χρήση στρατηγικής διαδοχικών δοκιμών με βάση ανάλυση βάρους της απόδειξης (5) (βλ. επίσης παραγράφους 3 και 4). Άλλοι περιορισμοί που προσδιορίστηκαν για τη μέθοδο δοκιμών FL βασίζονται στα ποσοστά ψευδοαρνητικής και ψευδοθετικής έκβασης. Όταν η μέθοδος δοκιμών FL χρησιμοποιείται ως αρχικό στάδιο στο πλαίσιο καθοδικής προσέγγισης για τον προσδιορισμό υδατοδιαλυτών διαβρωτικών/ισχυρών ερεθιστικών για τους οφθαλμούς ουσιών και μειγμάτων (κατηγορία 1 του GHS των Ηνωμένων Εθνών· κατηγορία 1 του CLP της ΕΕ· κατηγορία I της ΕΡΑ των ΗΠΑ), το ποσοστό ψευδοθετικής έκβασης κυμαίνεται από 7 % (7/103· GHS των Ηνωμένων Εθνών και CLP της ΕΕ) έως 9 % (9/99· ΕΡΑ των ΗΠΑ) και το ποσοστό ψευδοαρνητικής έκβασης από 54 % (15/28· ΕΡΑ των ΗΠΑ) έως 56 % (27/48· GHS των Ηνωμένων Εθνών και CLP της ΕΕ) σε σύγκριση με τα αποτελέσματα δοκιμών in vivo. Οι χημικές κατηγορίες που παρουσιάζουν ψευδοθετικά και/ή ψευδοαρνητικά αποτελέσματα στη μέθοδο δοκιμών FL δεν ορίζονται εδώ. Ορισμένοι τεχνικοί περιορισμοί αφορούν ειδικά την κυτταροκαλλιέργεια MDCK. Οι στενοσύνδεσμοι που εμποδίζουν τη διέλευση της χρωστικής νατριούχου φλουορεσκεΐνης μέσω της μονοστιβάδας υποβαθμίζονται όλο και περισσότερο όσο αυξάνεται ο αριθμός ανακαλλιεργειών των κυττάρων. Ο ατελής σχηματισμός στενοσυνδέσμων έχει ως αποτέλεσμα την αύξηση της FL στους μάρτυρες που δεν υποβάλλονται σε μεταχείριση. Ως εκ τούτου, είναι σημαντικό να καθορίζεται η μέγιστη επιτρεπτή διαρροή στους μάρτυρες που δεν υποβάλλονται σε μεταχείριση (βλ. παράγραφο 38: διαρροή 0 %). Όπως συμβαίνει με όλους τους προσδιορισμούς in vitro, υπάρχει πιθανότητα μετασχηματισμού των κυττάρων με την πάροδο του χρόνου και, ως εκ τούτου, είναι ζωτικής σημασίας να δηλώνεται ένα πεδίο αριθμών ανακαλλιεργειών για τις δοκιμές. Το τρέχον πεδίο εφαρμογής θα μπορούσε να επεκταθεί σε ορισμένες περιπτώσεις, αλλά μόνο μετά από ανάλυση διευρυμένου συνόλου δεδομένων για μελετηθείσες υπό δοκιμή χημικές ουσίες, τα οποία θα έχουν κατά προτίμηση αποκτηθεί μέσω δοκιμών (3). Η παρούσα μέθοδος δοκιμών θα επικαιροποιείται αναλόγως, μετά από εξέταση των νέων πληροφοριών και δεδομένων. Τα εργαστήρια που διεξάγουν για πρώτη φορά την παρούσα δοκιμή πρέπει να χρησιμοποιούν τις χημικές ουσίες ελέγχου ικανότητας που προβλέπονται στο προσάρτημα 3. Τα εργαστήρια μπορούν να χρησιμοποιούν αυτές τις χημικές ουσίες για να αποδεικνύουν την τεχνική τους ικανότητα εφαρμογής της μεθόδου δοκιμών FL, πριν από την υποβολή δεδομένων που έχουν προκύψει από αυτήν για την ταξινόμηση του κινδύνου στο πλαίσιο κανονιστικών ρυθμίσεων. ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ Η μέθοδος δοκιμών FL είναι δοκιμή in vitro που βασίζεται στην κυτταροτοξικότητα και την κυτταρική λειτουργία και διεξάγεται σε συνεχή μονοστιβάδα κυλινδρικών επιθηλιακών κυττάρων MDCK CB997, τα οποία καλλιεργούνται σε ημιπερατά ενθέματα και μοντελοποιούν την εκτός πολλαπλασιασμού κατάσταση του κερατοειδικού επιθηλίου in vivo. Η κυτταρική σειρά MDCK είναι καθιερωμένη και σχηματίζει στενοσυνδέσμους και δεσμοσώματα παρόμοια με εκείνα που συναντώνται στην κορυφαία όψη των επιθηλίων του κερατοειδούς και του επιπεφυκότα. Οι στενοσύνδεσμοι και τα δεσμοσώματα αποτρέπουν in vivo τη διείσδυση διαλυμένων ουσιών και ξένων σωμάτων στο κερατοειδικό επιθήλιο. Η απώλεια διεπιθηλιακής αδιαπερατότητας, λόγω βλάβης των στενοσυνδέσμων και των δεσμοσωμάτων, είναι ένα από τα πρώτα συμβάντα στον επαγόμενο από χημική ουσία ερεθισμό των οφθαλμών. Η υπό δοκιμή χημική ουσία εφαρμόζεται στη συνεχή στιβάδα κυττάρων που καλλιεργούνται στην κορυφαία όψη του ενθέματος. Χρησιμοποιείται συνήθως σύντομη έκθεση 1 λεπτού, που αντιστοιχεί στη φυσιολογική ταχύτητα κάθαρσης κατά την έκθεση του ανθρώπου. Ένα πλεονέκτημα της σύντομης διάρκειας έκθεσης είναι η δυνατότητα υποβολής των υδατικής βάσης ουσιών και μειγμάτων στη δοκιμή ως έχουν, εάν είναι εύκολο να απομακρυνθούν μετά την περίοδο έκθεσης. Αυτό επιτρέπει πιο άμεσες συγκρίσεις των αποτελεσμάτων με τις χημικές επιδράσεις στον άνθρωπο. Στη συνέχεια απομακρύνεται η υπό δοκιμή χημική ουσία και προστίθεται στην κορυφαία όψη της μονοστιβάδας η μη τοξική και ισχυρά φθορίζουσα χρωστική νατριούχος φλουορεσκεΐνη για 30 λεπτά. Η βλάβη που προκαλεί η υπό δοκιμή χημική ουσία στους στενοσυνδέσμους προσδιορίζεται με βάση την ποσότητα φλουορεσκεΐνης που διαρρέει την κυτταρική στιβάδα εντός καθορισμένου χρονικού διαστήματος. Η ποσότητα της χρωστικής νατριούχου φλουορεσκεΐνης που διέρχεται από τη μονοστιβάδα και τη μεμβράνη του ενθέματος για να καταλήξει σε καθορισμένο όγκο διαλύματος που περιέχεται στη μικροκοιλότητα (και στο οποίο διαρρέει η χρωστική) προσδιορίζεται με φασματοφθορισμομετρική μέτρηση της συγκέντρωσης της φλουορεσκεΐνης στη μικροκοιλότητα. Η έκταση της διαρροής φλουορεσκεΐνης (FL) υπολογίζεται από τις ενδείξεις έντασης φθορισμού (FI) που λαμβάνονται για δύο μάρτυρες χειρισμού: ένα τυφλό δείγμα και έναν μάρτυρα μέγιστης διαρροής. Το ποσοστό διαρροής και, κατ' επέκταση, η έκταση της βλάβης των στενοσυνδέσμων εκφράζεται σε σχέση με τους εν λόγω μάρτυρες, για κάθε καθορισμένη συγκέντρωση της υπό δοκιμή χημικής ουσίας. Στη συνέχεια υπολογίζεται η τιμή FL20 (δηλ. η συγκέντρωση που προκαλεί FL 20 % σε σχέση με την τιμή που έχει καταγραφεί για τη συνεχή μονοστιβάδα χωρίς μεταχείριση και τα ενθέματα χωρίς κύτταρα. Η τιμή FL20 (mg/ml) χρησιμοποιείται στο μοντέλο πρόβλεψης για τον προσδιορισμό των διαβρωτικών και ισχυρών ερεθιστικών των οφθαλμών (βλ. παράγραφο 35). Η αποκατάσταση αποτελεί σημαντικό μέρος των τοξικολογικών χαρακτηριστικών των υπό δοκιμή χημικών ουσιών και αξιολογείται επίσης στη δοκιμή οφθαλμικού ερεθισμού in vivo. Προκαταρκτικές αναλύσεις έδειξαν ότι τα δεδομένα αποκατάστασης (έως 72 ώρες μετά την έκθεση στη χημική ουσία) θα μπορούσαν ενδεχομένως να ενισχύσουν την προβλεπτική ικανότητα του πρωτοκόλλου INVITTOX αριθ. 71, αλλά χρειάζεται περαιτέρω αξιολόγηση, για την οποία θα ήταν χρήσιμα πρόσθετα δεδομένα, που να έχουν κατά προτίμηση αποκτηθεί μέσω περαιτέρω δοκιμών (6). Η παρούσα μέθοδος δοκιμών θα επικαιροποιείται αναλόγως, μετά από εξέταση των νέων πληροφοριών και δεδομένων. ΔΙΑΔΙΚΑΣΙΑ Παρασκευή της κυτταρικής μονοστιβάδας Η μονοστιβάδα κυττάρων MDCK CB997 παρασκευάζεται με τη χρήση κυττάρων με βαθμό συρροής κάτω του μέγιστου, τα οποία καλλιεργούνται σε φιάλες κυτταροκαλλιέργειας σε θρεπτικό μέσο DMEM/Nutrient Mix F 12 [πυκνό διάλυμα 1x με L-γλουταμίνη, HEPES 15 mΜ, ασβέστιο (σε συγκέντρωση 1,0-1,8 mM) και 10 % αδρανοποιημένου με θέρμανση FCS/FBS]. Είναι σημαντικό να περιέχουν όλα τα θρεπτικά μέσα/διαλύματα που χρησιμοποιούνται καθ' όλη τη διάρκεια της δοκιμής FL ασβέστιο σε συγκέντρωση μεταξύ 1,0 mM (111 mg/l) και 1,8 mM (200 mg/l), ώστε να διασφαλίζονται ο σχηματισμός και η ακεραιότητα των στενοσυνδέσμων. Ο αριθμός των ανακαλλιεργειών θα πρέπει να ελέγχεται, ώστε να εξασφαλίζεται ομοιογενής και αναπαραγώγιμος σχηματισμός στενοσυνδέσμων. Ο αριθμός ανακαλλιεργειών θα πρέπει κατά προτίμηση να κυμαίνεται μεταξύ 3 και 30 από την απόψυξη των κυττάρων, διότι τα κύτταρα αυτού του εύρους έχουν παρόμοια λειτουργικότητα, γεγονός που υποβοηθεί την αναπαραγωγιμότητα των αποτελεσμάτων της δοκιμής. Πριν από την εφαρμογή της μεθόδου δοκιμών FL, τα κύτταρα αποσπώνται από τη φιάλη με θρυψινισμό, φυγοκεντρούνται και κατάλληλη ποσότητα αυτών εμβολιάζεται στα ενθέματα, τα οποία τοποθετούνται σε πλάκες 24 μικροκοιλοτήτων (βλ. προσάρτημα 1). Για τον εμβολιασμό των κυττάρων θα πρέπει να χρησιμοποιούνται ενθέματα διαμέτρου 12 mm με μεμβράνη από μείγμα εστέρων της κυτταρίνης, πάχους 80-150 μm και μεγέθους πόρων 0,45 μm. Στη μελέτη επικύρωσης χρησιμοποιήθηκαν ενθέματα Millicell-HA των 12 mm. Οι ιδιότητες του τύπου ενθέματος και μεμβράνης είναι σημαντικές, καθώς ενδέχεται να επηρεάζουν την ανάπτυξη των κυττάρων και τον σχηματισμό χημικών δεσμών. Οι χημικές ουσίες ορισμένων ειδών ενδέχεται να δεσμευτούν στη μεμβράνη του ενθέματος Millicell-HA, με αποτέλεσμα να επηρεαστεί η ερμηνεία των αποτελεσμάτων. Εάν χρησιμοποιούνται άλλες μεμβράνες, θα πρέπει να αποδεικνύεται η ισοδυναμία τους με τη χρήση χημικών ουσιών ελέγχου ικανότητας (βλ. προσάρτημα 3). Ο σχηματισμός χημικών δεσμών με τη μεμβράνη του ενθέματος είναι συνηθέστερος στην περίπτωση των κατιοντικών χημικών ουσιών, όπως το χλωριούχο βενζαλκόνιο, οι οποίες έλκονται προς τη φορτισμένη μεμβράνη (7). Οι εν λόγω δεσμοί είναι δυνατόν να αυξήσουν τον χρόνο έκθεσης στη χημική ουσία, με συνέπεια την υπερεκτίμηση του τοξικού δυναμικού της, αλλά μπορούν επίσης να μειώσουν με φυσικό τρόπο τη διαρροή φλουορεσκεΐνης από το ένθεμα, λόγω δέσμευσης της χρωστικής από την κατιοντική χημική ουσία που έχει συνδεθεί με τη μεμβράνη του ενθέματος, με αποτέλεσμα την υποεκτίμηση του τοξικού δυναμικού της. Το φαινόμενο αυτό παρακολουθείται εύκολα, με έκθεση μόνο της μεμβράνης στην υψηλότερη συγκέντρωση της υπό δοκιμή χημικής ουσίας και, στη συνέχεια, με προσθήκη της χρωστικής νατριούχου φλουορεσκεΐνης στην κανονική συγκέντρωση για τον συνήθη χρόνο (μάρτυρας χωρίς κύτταρα). Σε περίπτωση δέσμευσης της χρωστικής, η μεμβράνη του ενθέματος χρωματίζεται κίτρινη μετά την πλήρη έκπλυση του δοκιμίου. Συνεπώς, η γνώση των δεσμευτικών ιδιοτήτων της υπό δοκιμή χημικής ουσίας είναι ουσιαστικής σημασίας για την ερμηνεία της επίδρασής της στα κύτταρα. Με τον εμβολιασμό των κυττάρων στα ενθέματα θα πρέπει να σχηματίζεται συνεχής μονοστιβάδα κατά τον χρόνο της έκθεσης στη χημική ουσία. Θα πρέπει να προστίθενται 1,6 × 105 κύτταρα ανά ένθεμα (400 μl κυτταρικού αιωρήματος με πυκνότητα 4 × 102 κύτταρα/ml). Υπό τις συνθήκες αυτές, λαμβάνεται συνήθως συνεχής μονοστιβάδα μετά από 96 ώρες καλλιέργειας. Τα ενθέματα θα πρέπει να εξετάζονται οπτικά πριν από τον εμβολιασμό, ώστε να είναι βέβαιο ότι τυχόν βλάβες που θα καταγραφούν κατά τον οπτικό έλεγχο που περιγράφεται στην παράγραφο 30 οφείλονται στους χειρισμούς. Οι κυτταροκαλλιέργειες MDCK θα πρέπει να φυλάσσονται σε επωαστήρες, σε ατμόσφαιρα με ύγρανση, 5 % ± 1 % CO2 και θερμοκρασία 37 ± 1 °C. Τα κύτταρα θα πρέπει να μην έχουν μολυνθεί από βακτηρίδια, ιούς, μυκόπλασμα ή μύκητες. Εφαρμογή των υπό δοκιμή χημικών ουσιών και των ουσιών-μαρτύρων Για κάθε σειρά μετρήσεων («γύρο») θα πρέπει να παρασκευάζεται νέο διάλυμα παρακαταθήκης της υπό δοκιμή χημικής ουσίας και να χρησιμοποιείται εντός 30 λεπτών από την παρασκευή του. Τα διαλύματα των υπό δοκιμή χημικών ουσιών θα πρέπει να παρασκευάζονται με HBSS χωρίς ερυθρό της φαινόλης, που περιέχει ασβέστιο (σε συγκέντρωση 1,0-1,8 mM), ώστε να αποφεύγεται η δέσμευση πρωτεϊνών του ορού. Η διαλυτότητα της χημικής ουσίας στο HBSS, σε συγκέντρωση 250 mg/ml, θα πρέπει να αξιολογείται πριν από τη δοκιμή. Εάν στη συγκέντρωση αυτή η χημική ουσία σχηματίζει σταθερό εναιώρημα ή γαλάκτωμα (δηλ. διατηρεί την ομοιογένειά της και δεν καθιζάνει ούτε διαχωρίζεται σε περισσότερες από μία φάσεις) για 30 λεπτά, το HBSS μπορεί να εξακολουθήσει να χρησιμοποιείται ως διαλύτης. Εάν όμως διαπιστωθεί ότι η ουσία είναι αδιάλυτη στο HBSS σε αυτή τη συγκέντρωση, θα πρέπει να εξεταστεί το ενδεχόμενο χρήσης άλλων μεθόδων δοκιμών αντί της FL. Η χρήση ελαφρού ορυκτελαίου ως διαλύτη, όταν διαπιστώνεται ότι η χημική ουσία είναι αδιάλυτη στο HBSS, θα πρέπει να μελετάται με προσοχή, δεδομένου ότι δεν υπάρχουν αρκετά δεδομένα για τη συναγωγή συμπεράσματος σχετικά με τις επιδόσεις της δοκιμής FL υπό τις συνθήκες αυτές. Όλα τα διαλύματα των υπό δοκιμή χημικών ουσιών παρασκευάζονται από το διάλυμα παρακαταθήκης με αραίωση, με στείρο HBSS χωρίς ερυθρό της φαινόλης, που περιέχει ασβέστιο (σε συγκέντρωση 1,0-1,8 mM), σε πέντε σταθερές συγκεντρώσεις κατά βάρος προς όγκο: 1, 25, 100, 250 mg/ml και ένα αναραίωτο ή κορεσμένο διάλυμα. Όταν η δοκιμή διεξάγεται με στερεές χημικές ουσίες, θα πρέπει να περιλαμβάνεται μια πολύ υψηλή συγκέντρωση 750 mg/ml. Η συγκεκριμένη συγκέντρωση της χημικής ουσίας ενδέχεται να πρέπει να εφαρμοστεί στα κύτταρα με σιφώνιο θετικής εκτόπισης. Εάν διαπιστωθεί τοξικότητα σε συγκέντρωση μεταξύ 25 και 100 mg/ml, θα πρέπει να ελέγχονται δύο φορές οι ακόλουθες πρόσθετες συγκεντρώσεις: 1, 25, 50, 75, 100 mg/ml. Η τιμή FL20 θα πρέπει να συνάγεται από αυτές τις συγκεντρώσεις, υπό την προϋπόθεση ότι πληρούνται τα κριτήρια αποδοχής. Οι υπό δοκιμή χημικές ουσίες εφαρμόζονται στις συνεχείς κυτταρικές μονοστιβάδες, αφού απομακρυνθεί το θρεπτικό μέσο κυτταροκαλλιέργειας και εκπλυθούν τα κύτταρα δύο φορές με στείρο, θερμό (37 °C) HBSS χωρίς ερυθρό της φαινόλης, που περιέχει ασβέστιο (σε συγκέντρωση 1,0-1,8 mM). Έχει προηγηθεί οπτικός έλεγχος των ηθμών για τυχόν προϋπάρχουσες βλάβες που θα μπορούσαν εσφαλμένα να αποδοθούν σε πιθανές ασυμβατότητες με τις υπό δοκιμή χημικές ουσίες. Σε κάθε σειρά μετρήσεων απαιτούνται τουλάχιστον τρεις επαναλήψεις (replicates) για κάθε συγκέντρωση της υπό δοκιμή χημικής ουσίας και για τους μάρτυρες. Μετά από έκθεση διάρκειας 1 λεπτού σε θερμοκρασία δωματίου, θα πρέπει να απομακρύνεται προσεκτικά η υπό δοκιμή χημική ουσία με αναρρόφηση, να εκπλένεται η μονοστιβάδα δύο φορές με στείρο, θερμό (37 °C) HBSS χωρίς ερυθρό της φαινόλης, που περιέχει ασβέστιο (σε συγκέντρωση 1,0-1,8 mM), και να μετράται αμέσως η διαρροή φλουορεσκεΐνης. Σε κάθε σειρά μετρήσεων θα πρέπει να χρησιμοποιούνται παράλληλοι αρνητικοί και θετικοί μάρτυρες, για να καταδεικνύεται ότι η ακεραιότητα της μονοστιβάδας και η ευαισθησία των κυττάρων εμπίπτουν στο καθορισμένο ιστορικό εύρος τιμών αποδοχής. Ως θετικός μάρτυρας συνιστάται η χημική ουσία Brij 35 (αριθ. CAS 9002-92-0) σε συγκέντρωση 100 mg/ml. Η συγκέντρωση αυτή θα πρέπει να προκαλεί διαρροή φλουορεσκεΐνης σε ποσοστό 30 % περίπου (το αποδεκτό εύρος ποσοστών διαρροής φλουορεσκεΐνης, δηλ. βλαβών στην κυτταρική στιβάδα, είναι 20-40 %). Ως αρνητικός μάρτυρας συνιστάται το διάλυμα HBSS χωρίς ερυθρό της φαινόλης, που περιέχει ασβέστιο (σε συγκέντρωση 1,0-1,8 mM) (τυφλός μάρτυρας χωρίς μεταχείριση). Σε κάθε σειρά μετρήσεων θα πρέπει επίσης να περιλαμβάνεται μάρτυρας μέγιστης διαρροής, ώστε να μπορούν να υπολογιστούν οι τιμές FL20. Η μέγιστη διαρροή προσδιορίζεται με τη χρησιμοποίηση ενός ενθέματος-μάρτυρα χωρίς κύτταρα. Προσδιορισμός της διαπερατότητας στη φλουορεσκεΐνη Αμέσως μετά την απομάκρυνση των υπό δοκιμή χημικών ουσιών και των μαρτύρων, προστίθενται στα ενθέματα (π.χ. Millicell-HA) 400 μl διαλύματος νατριούχου φλουορεσκεΐνης 0,1 mg/ml [0,01 % (κ.β.) σε HBSS χωρίς ερυθρό της φαινόλης, που περιέχει ασβέστιο (σε συγκέντρωση 1,0-1,8 mM)]. Οι καλλιέργειες διατηρούνται για 30 λεπτά σε θερμοκρασία δωματίου. Στο τέλος της επώασης με φλουορεσκεΐνη, τα ενθέματα αφαιρούνται με προσοχή από κάθε μικροκοιλότητα. Κάθε ηθμός υποβάλλεται σε οπτικό έλεγχο και καταγράφεται κάθε βλάβη που μπορεί να έχει προκληθεί κατά τους χειρισμούς. Η ποσότητα φλουορεσκεΐνης που διαρρέει μέσω της μονοστιβάδας και του ενθέματος προσδιορίζεται ποσοτικά στο διάλυμα που απομένει στις μικροκοιλότητες μετά την αφαίρεση των ενθεμάτων. Οι μετρήσεις εκτελούνται με φασματοφθορισμόμετρο σε μήκος κύματος διέγερσης και εκπομπής 485 nm και 530 nm αντίστοιχα. Η ευαισθησία του φασματοφθορισμόμετρου θα πρέπει να ρυθμίζεται κατά τρόπο ώστε να επιτυγχάνεται η μέγιστη αριθμητική διαφορά μεταξύ της μέγιστης FL (ένθεμα χωρίς κύτταρα) και της ελάχιστης (ένθεμα με συνεχή μονοστιβάδα που υποβάλλεται σε μεταχείριση με τον αρνητικό μάρτυρα). Λόγω των διαφορών μεταξύ των χρησιμοποιούμενων φασματοφθορισμόμετρων, προτείνεται η ευαισθησία που αποδίδει ένταση φθορισμού > 4 000 για τον μάρτυρα μέγιστης διαρροής φλουορεσκεΐνης. Η μέγιστη τιμή FL δεν θα πρέπει να είναι μεγαλύτερη από 9 999. Η ένταση φθορισμού που αντιστοιχεί στη μέγιστη διαρροή θα πρέπει να βρίσκεται εντός της γραμμικής κλίμακας ενδείξεων του χρησιμοποιούμενου φασματοφθορισμόμετρου. Ερμηνεία των αποτελεσμάτων και μοντέλο πρόβλεψης Η έκταση της FL είναι ανάλογη προς τη βλάβη που επάγει η χημική ουσία στους στενοσυνδέσμους. Το ποσοστό FL για κάθε εξεταζόμενη συγκέντρωση της υπό δοκιμή χημικής ουσίας υπολογίζεται από τις τιμές FL που προκύπτουν για την ουσία σε σχέση με τις τιμές FL για τον αρνητικό μάρτυρα (ανάγνωση από τη συνεχή μονοστιβάδα κυττάρων που υποβάλλεται σε μεταχείριση με τον αρνητικό μάρτυρα) και τον μάρτυρα μέγιστης διαρροής (ανάγνωση της έκτασης της FL σε ένθεμα χωρίς κύτταρα). Μέση ένταση φθορισμού που αντιστοιχεί στη μέγιστη διαρροή = x Μέση ένταση φθορισμού που αντιστοιχεί σε διαρροή 0 % (αρνητικός μάρτυρας) = y Η μέση διαρροή 100 % υπολογίζεται με αφαίρεση της μέσης διαρροής 0 % από τη μέση μέγιστη διαρροή, δηλ. x – y = z Το ποσοστό διαρροής για κάθε καθορισμένη δόση υπολογίζεται με αφαίρεση της διαρροής 0 % από τη μέση τιμή των ενδείξεων έντασης φθορισμού των τριών επαναλήψεων (m) και διαίρεση της προκύπτουσας διαφοράς διά της διαρροής 100 %, ήτοι %FL = [(m-y)/z] × 100 %, όπου:
Για τον υπολογισμό της συγκέντρωσης της χημικής ουσίας που προκαλεί FL 20 % θα πρέπει να εφαρμόζεται η ακόλουθη εξίσωση: FLD = [(A-B) / (C-B)] × (MC – MB) + MB όπου:
Η τιμή αποκοπής FL20 για την πρόβλεψη της ταξινόμησης χημικών ουσιών ως διαβρωτικών/ισχυρών ερεθιστικών των οφθαλμών είναι η εξής:
Η μέθοδος δοκιμών FL συνιστάται μόνο για τον προσδιορισμό των υδατοδιαλυτών διαβρωτικών και ισχυρών ερεθιστικών των οφθαλμών (κατηγορία 1 του GHS των Ηνωμένων Εθνών, κατηγορία 1 του CLP της ΕΕ, κατηγορία Ι της EPA των ΗΠΑ) (βλ. παραγράφους 1 και 10). Για τον προσδιορισμό υδατοδιαλυτού χημικού προϊόντος (ουσίας ή μείγματος) (3) (6) (7), ως προϊόντος που «προκαλεί σοβαρή οφθαλμική βλάβη» (κατηγορία 1 του GHS των Ηνωμένων Εθνών/CLP της ΕΕ) ή ως «διαβρωτικού ή ισχυρού ερεθιστικού των οφθαλμών» (κατηγορία Ι της EPA των ΗΠΑ), η υπό δοκιμή χημική ουσία θα πρέπει να επάγει FL20 ≤ 100 mg/ml. Αποδοχή αποτελεσμάτων Η μέση τιμή μέγιστης διαρροής φλουορεσκεΐνης (x) θα πρέπει να είναι μεγαλύτερη από 4 000 (βλ. παράγραφο 31), η μέση διαρροή 0 % (y) να είναι ίση με 300 ή μικρότερη και η μέση διαρροή 100 % (z) να κυμαίνεται μεταξύ 3 700 και 6 000. Η δοκιμή θεωρείται αποδεκτή εάν ο θετικός μάρτυρας προκαλεί βλάβη στην κυτταρική στιβάδα σε ποσοστό 20 % έως 40 % (μετρούμενη ως % διαρροής φλουορεσκεΐνης). ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Δεδομένα Για κάθε σειρά μετρήσεων, θα πρέπει να αναφέρονται σε μορφή πίνακα τα δεδομένα που προέκυψαν για κάθε μικροκοιλότητα επανάληψης (π.χ. τιμές έντασης φθορισμού και υπολογισμένα επί τοις εκατό ποσοστά FL για κάθε υπό δοκιμή χημική ουσία, συμπεριλαμβανομένης της ταξινόμησής της). Επιπλέον, θα πρέπει να αναφέρονται οι μέσες τιμές ± SD από τις επιμέρους μετρήσεις επανάληψης σε κάθε σειρά μετρήσεων. Έκθεση δοκιμής Στην έκθεση δοκιμής θα πρέπει να περιλαμβάνονται τα ακόλουθα στοιχεία:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΔΙΑΓΡΑΜΜΑ ΚΥΤΤΑΡΩΝ MDCK ΚΑΛΛΙΕΡΓΗΜΕΝΩΝ ΣΕ ΜΕΜΒΡΑΝΗ ΕΝΘΕΜΑΤΟΣ ΓΙΑ ΤΗ ΜΕΘΟΔΟ ΔΟΚΙΜΩΝ FL Καλλιεργείται συρρέουσα μονοστιβάδα κυττάρων MDCK πάνω στην ημιπερατή μεμβράνη ενθεμάτων. Τα ενθέματα τοποθετούνται στις μικροκοιλότητες πλακών των 24 μικροκοιλοτήτων. 
Πηγή του σχήματος: Wilkinson, P.J. (2006), Development of an in vitro model to investigate repeat ocular exposure, Ph.D. Thesis, University of Nottingham, UK. Προσάρτημα 2 ΟΡΙΣΜΟΙ Ορθότητα : η εγγύτητα της συμφωνίας μεταξύ των αποτελεσμάτων της μεθόδου δοκιμών και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της μεθόδου δοκιμών και μια από τις πτυχές της «καταλληλότητας». Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς την «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας μεθόδου δοκιμών. Χημικό προϊόν : μια ουσία ή ένα μείγμα. Κατηγορία Ι της EPA : χημικές ουσίες που προκαλούν διάβρωση (μη αναστρέψιμη καταστροφή οφθαλμικού ιστού) ή προσβολή ή ερεθισμό του κερατοειδούς που εμμένει για περισσότερες από 21 ημέρες (2). CLP της ΕΕ (κανονισμός (ΕΚ) αριθ. 1272/2008 σχετικά με την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων) : κανονισμός με τον οποίο εφαρμόζεται στην Ευρωπαϊκή Ένωση (ΕΕ) το σύστημα GHS των Ηνωμένων Εθνών για την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων). Ποσοστό ψευδοαρνητικής έκβασης : το ποσοστό του συνόλου των θετικών χημικών ουσιών που εσφαλμένα χαρακτηρίζεται αρνητικό με μια μέθοδο δοκιμών. Αποτελεί έναν από τους δείκτες επιδόσεων της μεθόδου δοκιμών. Ποσοστό ψευδοθετικής έκβασης : το ποσοστό του συνόλου των αρνητικών χημικών ουσιών που εσφαλμένα χαρακτηρίζεται θετικό με μια μέθοδο δοκιμών. Αποτελεί έναν από τους δείκτες επιδόσεων της μεθόδου δοκιμών. FL20 : μπορεί να υπολογιστεί κατ' εκτίμηση με προσδιορισμό της συγκέντρωσης στην οποία η υπό δοκιμή χημική ουσία προκαλεί διαρροή φλουορεσκεΐνης από την κυτταρική στιβάδα σε ποσοστό 20 %. Διαρροή φλουορεσκεΐνης : η ποσότητα φλουορεσκεΐνης που διέρχεται μέσω της κυτταρικής στιβάδας, μετρούμενη με φασματοφθορισμομετρία. GHS (Globally Harmonised System for the Classification and Labelling of Chemicals by the United Nations/Παγκοσμίως Εναρμονισμένο Σύστημα των Ηνωμένων Εθνών για την Ταξινόμηση και Επισήμανση των Χημικών Προϊόντων) : σύστημα που προτείνει την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων) με βάση τυποποιημένα είδη και βαθμούς φυσικών κινδύνων και κινδύνων για την υγεία και το περιβάλλον και καλύπτει τα αντίστοιχα επικοινωνιακά στοιχεία, όπως εικονογράμματα, προειδοποιητικές λέξεις, δηλώσεις επικινδυνότητας, δηλώσεις προφύλαξης και δελτία δεδομένων ασφαλείας, για τη μετάδοση πληροφοριών σχετικά με τις δυσμενείς επιδράσεις των εν λόγω προϊόντων, με σκοπό την προστασία των ανθρώπων (εργοδοτών, εργαζομένων, μεταφορέων, καταναλωτών και διασωστών) και του περιβάλλοντος (1). Κατηγορία 1 του GHS : πρόκληση βλάβης στους οφθαλμικούς ιστούς ή σοβαρής μείωσης της όρασης, κατόπιν εφαρμογής της υπό δοκιμή χημικής ουσίας στην πρόσθια επιφάνεια του οφθαλμού, η οποία δεν είναι πλήρως αναστρέψιμη εντός 21 ημερών από την εφαρμογή. Κίνδυνος : εγγενής ιδιότητα ενός παράγοντα ή μιας κατάστασης που μπορεί να έχει δυσμενείς επιδράσεις όταν οργανισμός, σύστημα ή (υπο)πληθυσμός εκτεθεί στον συγκεκριμένο παράγοντα. Μείγμα : χρησιμοποιείται στο πλαίσιο του GHS των Ηνωμένων Εθνών για να δηλώσει μείγμα ή διάλυμα που αποτελείται από δύο ή περισσότερες ουσίες που δεν αντιδρούν μέσα σε αυτό. Αρνητικός μάρτυρας : δείγμα επανάληψης (replicate) που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και δεν υποβάλλεται σε μεταχείριση. Το δείγμα αυτό υποβάλλεται σε δοκιμή μαζί με τα δείγματα που έχουν υποβληθεί σε μεταχείριση με την υπό δοκιμή χημική ουσία και με άλλα δείγματα-μάρτυρες, ούτως ώστε να διαπιστώνεται αν ο διαλύτης αλληλεπιδρά με το σύστημα δοκιμής. Δεν ταξινομείται : χημική ουσία που δεν ταξινομείται ως ερεθιστικό των οφθαλμών κατηγορίας 1, 2Α ή 2Β του GHS των Ηνωμένων Εθνών· κατηγορίας 1 ή 2 του CLP της ΕΕ 2· ή κατηγορίας I, II ή III της ΕΡΑ των ΗΠΑ. Διαβρωτικό των οφθαλμών : α) χημική ουσία που προκαλεί μη αναστρέψιμη βλάβη στους οφθαλμικούς ιστούς· β) χημική ουσία που ταξινομείται ως ερεθιστικό των οφθαλμών κατηγορίας 1 του GHS των Ηνωμένων Εθνών· κατηγορίας 1 του CLP της ΕΕ· ή κατηγορίας I της EPA των ΗΠΑ. Ερεθιστικό των οφθαλμών : α) χημική ουσία που προκαλεί αναστρέψιμη βλάβη στους οφθαλμικούς ιστούς κατόπιν εφαρμογής στην πρόσθια επιφάνεια του οφθαλμού· β) χημική ουσία που ταξινομείται ως ερεθιστικό των οφθαλμών κατηγορίας 2Α ή 2Β του GHS των Ηνωμένων Εθνών· κατηγορίας 2 του CLP της ΕΕ· ή κατηγορίας ΙΙ ή ΙΙΙ της ΕΡΑ των ΗΠΑ. Ισχυρό ερεθιστικό των οφθαλμών : α) χημική ουσία που προκαλεί βλάβη στους οφθαλμικούς ιστούς, κατόπιν εφαρμογής στην πρόσθια επιφάνεια του οφθαλμού, η οποία δεν είναι αναστρέψιμη εντός 21 ημερών από την εφαρμογή, ή που προκαλεί σοβαρή μείωση της όρασης· β) χημική ουσία που ταξινομείται ως ερεθιστικό των οφθαλμών κατηγορίας 1 του GHS των Ηνωμένων Εθνών· κατηγορίας 1 του CLP της ΕΕ· ή κατηγορίας I της EPA των ΗΠΑ. Θετικός μάρτυρας : δείγμα επανάληψης που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και υποβάλλεται σε μεταχείριση με χημική ουσία που είναι γνωστό ότι προκαλεί θετική απόκριση. Για να διασφαλίζεται η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης του θετικού μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της σοβαρής απόκρισης δεν θα πρέπει να είναι υπερβολικό. Χημικές ουσίες ελέγχου ικανότητας : υποσύνολο του καταλόγου χημικών ουσιών αναφοράς, το οποίο μπορεί να χρησιμοποιηθεί από εργαστήριο που δεν διαθέτει πείρα στην επικυρωμένη μέθοδο δοκιμών αναφοράς, προκειμένου να αποδείξει τη σχετική τεχνική του ικανότητα. Καταλληλότητα : περιγραφή της σχέσης της δοκιμής με την υπό μελέτη επίδραση και του κατά πόσον αυτή έχει σημασία και είναι χρήσιμη για συγκεκριμένο σκοπό. Πρόκειται για τον βαθμό στον οποίο η δοκιμή μετρά ή προβλέπει σωστά τη βιολογική επίδραση υπό μελέτη. Η καταλληλότητα εμπεριέχει συνεκτίμηση της ορθότητας (συμφωνίας) της μεθόδου δοκιμών (8). Αξιοπιστία : μέτρο του βαθμού στον οποίο μια μέθοδος δοκιμών μπορεί να αναπαράγεται διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας, καθώς και της ενδοεργαστηριακής επαναληψιμότητας. Δοκιμή υποκατάστασης : δοκιμή που έχει σχεδιαστεί για να υποκαταστήσει δοκιμή χρησιμοποιούμενη στην καθημερινή πρακτική, και η οποία θεωρείται αποδεκτή για τον προσδιορισμό του κινδύνου και/ή την εκτίμηση κινδύνου και η οποία, όπως έχει διαπιστωθεί, εξασφαλίζει ισοδύναμη ή βελτιωμένη προστασία της υγείας του ανθρώπου ή των ζώων ή του περιβάλλοντος, κατά περίπτωση, σε σύγκριση με την αποδεκτή δοκιμή, για όλες τις πιθανές περιστάσεις δοκιμής και όλες τις υπό δοκιμή χημικές ουσίες. Ευαισθησία : το ποσοστό του συνόλου των θετικών/δραστικών χημικών ουσιών που ταξινομείται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών (8). Σοβαρή οφθαλμική βλάβη : η πρόκληση βλάβης στους ιστούς των οφθαλμών ή η σοβαρή μείωση της όρασης, η οποία εμφανίζεται μετά την εφαρμογή της υπό δοκιμή χημικής ουσίας στην εμπρόσθια επιφάνεια του οφθαλμού και δεν είναι πλήρως αναστρέψιμη εντός 21 ημερών από την εφαρμογή της ουσίας. Μάρτυρας με διαλύτη/φορέα : δείγμα που δεν υποβάλλεται σε μεταχείριση και περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής, συμπεριλαμβανομένου του διαλύτη ή του φορέα. Το δείγμα αυτό υποβάλλεται σε δοκιμή μαζί με τα δείγματα που έχουν υποβληθεί σε μεταχείριση με την υπό δοκιμή χημική ουσία και με άλλα δείγματα-μάρτυρες, με σκοπό τον καθορισμό της βασικής απόκρισης των δειγμάτων που υποβάλλονται σε μεταχείριση με την υπό δοκιμή χημική ουσία διαλυμένη στον ίδιο διαλύτη ή φορέα. Όταν το εν λόγω δείγμα υποβάλλεται σε δοκιμή με παράλληλο αρνητικό μάρτυρα, καταδεικνύει επίσης αν ο διαλύτης ή ο φορέας αλληλεπιδρά με το σύστημα δοκιμής. Ειδικότητα : το ποσοστό του συνόλου των αρνητικών/αδρανών χημικών ουσιών που ταξινομείται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών. Ουσία : χρησιμοποιείται στο πλαίσιο του GHS των Ηνωμένων Εθνών για να δηλώσει τα χημικά στοιχεία και τις ενώσεις τους σε φυσική κατάσταση ή όπως λαμβάνονται με οποιαδήποτε παραγωγική διεργασία, στα οποία συμπεριλαμβάνονται όλα τα πρόσθετα που απαιτούνται για να διατηρείται η σταθερότητα του προϊόντος καθώς και τυχόν προσμείξεις που προκύπτουν από τη χρησιμοποιούμενη διεργασία, αλλά από τα οποία εξαιρούνται οι διαλύτες που είναι δυνατόν να διαχωριστούν χωρίς να επηρεαστεί η σταθερότητα της ουσίας ούτε να μεταβληθεί η σύνθεσή της. Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Κλιμακωτή στρατηγική δοκιμών : στρατηγική δοκιμών κατά στάδια, στο πλαίσιο της οποίας όλες οι υφιστάμενες πληροφορίες για μια υπό δοκιμή χημική ουσία εξετάζονται με συγκεκριμένη σειρά, με χρήση διαδικασίας βάρους της απόδειξης σε κάθε στάδιο, προκειμένου να διαπιστώνεται, πριν από τη μετάβαση στο επόμενο στάδιο, αν διατίθενται επαρκείς πληροφορίες για να ληφθεί απόφαση περί ταξινόμησης κινδύνου. Εάν σε υπό δοκιμή χημική ουσία μπορεί να αποδοθεί δυναμικό ερεθιστικότητας βάσει των υφιστάμενων πληροφοριών, δεν απαιτούνται περαιτέρω δοκιμές. Εάν βάσει των υφιστάμενων πληροφοριών δεν είναι εφικτή η απόδοση δυναμικού ερεθιστικότητας σε υπό δοκιμή χημική ουσία, εφαρμόζεται κλιμακωτή διαδικασία διαδοχικών δοκιμών σε ζώα έως ότου καταστεί εφικτή η βέβαιη ταξινόμηση της ουσίας. Επικυρωμένη μέθοδος δοκιμών : μέθοδος δοκιμών για την οποία έχουν ολοκληρωθεί μελέτες επικύρωσης προκειμένου να προσδιοριστούν η καταλληλότητα (συμπεριλαμβανομένης της ορθότητας) και η αξιοπιστία της για συγκεκριμένο σκοπό. Είναι σημαντικό να σημειωθεί ότι οι επιδόσεις επικυρωμένης μεθόδου δοκιμών από πλευράς ορθότητας και αξιοπιστίας ενδέχεται να μην επαρκούν για να κριθεί αποδεκτή για τον προτεινόμενο σκοπό (8). Βάρος της απόδειξης : η διαδικασία εξέτασης της ισχύος και των αδυναμιών διαφόρων πληροφοριών για τη συναγωγή και την τεκμηρίωση συμπεράσματος σχετικά με το δυναμικό κινδύνου που ενέχει μια χημική ουσία. Προσάρτημα 3 ΟΥΣΙΕΣ ΕΛΕΓΧΟΥ ΙΚΑΝΟΤΗΤΑΣ ΓΙΑ ΤΗ ΜΕΘΟΔΟ ΔΟΚΙΜΩΝ FL Πριν εντάξουν την παρούσα μέθοδο δοκιμών στη συνήθη πρακτική, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα προσδιορίζοντας σωστά την ταξινόμηση της οφθαλμικής διαβρωτικότητας των 8 συνιστώμενων στον πίνακα 1 χημικών ουσιών. Οι ουσίες αυτές επιλέχθηκαν ως αντιπροσωπευτικές του φάσματος αποκρίσεων έναντι τοπικού(-ής) ερεθισμού/διάβρωσης των οφθαλμών, το οποίο βασίζεται σε αποτελέσματα της οφθαλμικής δοκιμής in vivo σε κουνέλια [TG 405, μέθοδος δοκιμών Β.5 (5)] (δηλ. κατηγορίες 1, 2A, 2B και «δεν ταξινομείται» σύμφωνα με το GHS των Ηνωμένων Εθνών). Λαμβανομένης, ωστόσο, υπόψη της επικυρωμένης χρησιμότητας της δοκιμής FL (δηλ. για τον προσδιορισμό μόνο διαβρωτικών/ισχυρών ερεθιστικών των οφθαλμών), η τεχνική ικανότητα αποδεικνύεται μόνο με δύο εκβάσεις δοκιμών για τους σκοπούς της ταξινόμησης (διαβρωτικό/ισχυρό ερεθιστικό ή μη διαβρωτικό/μη ισχυρό ερεθιστικό). Άλλα κριτήρια επιλογής αφορούσαν τη διαθεσιμότητα των χημικών ουσιών στο εμπόριο και την ύπαρξη υψηλής ποιότητας δεδομένων αναφοράς in vivo, καθώς και δεδομένων υψηλής ποιότητας που έχουν προκύψει με τη μέθοδο δοκιμών FL. Για τον λόγο αυτό, οι χημικές ουσίες ελέγχου ικανότητας επιλέχθηκαν από το έγγραφο«Fluorescein Leakage Assay Background Review Document as an Alternative Method for Eye Irritation Testing» (έγγραφο επισκόπησης των διαθέσιμων δεδομένων σχετικά με τον προσδιορισμό της διαρροής φλουορεσκεΐνης ως εναλλακτική μέθοδο δοκιμών οφθαλμικού ερεθισμού) (8), το οποίο χρησιμοποιήθηκε για την αναδρομική επικύρωση της μεθόδου δοκιμών FL. Πίνακας 1 Συνιστώμενες χημικές ουσίες για την απόδειξη τεχνικής ικανότητας ως προς τη δοκιμή FL
Β.62 Προσδιορισμός comet in vivo σε αλκαλικές συνθήκες σε θηλαστικά ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 489 του ΟΟΣΑ (2016). Ο προσδιορισμός comet (ηλεκτροφόρηση μοναδιαίων κυττάρων σε πήκτωμα) in vivo σε αλκαλικές συνθήκες (στο εξής καλούμενος απλώς «προσδιορισμός comet») χρησιμοποιείται για την ανίχνευση ρήξεων των κλώνων του DNA σε κύτταρα ή πυρήνες που απομονώνονται συγχρόνως από διαφορετικούς ιστούς ζώων, συνήθως τρωκτικών, τα οποία έχουν εκτεθεί σε δυνητικά γονιδιοτοξικές ύλες. Ο προσδιορισμός comet επανεξετάστηκε από διάφορες ομάδες εμπειρογνωμόνων που δημοσίευσαν συστάσεις (1) (2) (3) (4) (5) (6) (7) (8) (9) (10). Η παρούσα μέθοδος δοκιμών αποτελεί μέρος μιας σειράς μεθόδων δοκιμών γενετικής τοξικολογίας. Έχει συνταχθεί ένα έγγραφο του ΟΟΣΑ με συνοπτικές πληροφορίες για τις δοκιμές γενετικής τοξικολογίας και μια επισκόπηση των πρόσφατων αλλαγών που έγιναν σε αυτές τις κατευθυντήριες γραμμές δοκιμών (11). Σκοπός του προσδιορισμού comet είναι ο εντοπισμός χημικών ουσιών που προκαλούν βλάβη στο DΝΑ. Υπό αλκαλικές συνθήκες (> pH 13), είναι δυνατόν να ανιχνευθούν με τον προσδιορισμό comet μονόκλωνες και δίκλωνες ρήξεις που οφείλονται, για παράδειγμα, σε άμεσες αλληλεπιδράσεις με το DNA, σε ασταθείς σε αλκαλικές συνθήκες θέσεις ή από παροδικές ρήξεις κλώνων κατά την επιδιόρθωση του DNA με εκτομή. Οι συγκεκριμένες ρήξεις κλώνων μπορεί να επιδιορθωθούν, οπότε οι επιδράσεις τους δεν παραμένουν, αλλά μπορεί και να αποβούν θανατηφόρες για το κύτταρο ή μπορεί να σταθεροποιηθούν σε μετάλλαξη που έχει ως αποτέλεσμα μόνιμη βιώσιμη μεταβολή. Είναι ακόμη δυνατόν να οδηγήσουν σε χρωμοσωμική βλάβη που συσχετίζεται επίσης με πολλές ασθένειες του ανθρώπου, συμπεριλαμβανομένου του καρκίνου. Την περίοδο 2006-2012 διεξήχθη επίσημη μελέτη επικύρωσης του προσδιορισμού comet in vivo σε τρωκτικά, την οποία συντόνισε το Ιαπωνικό Κέντρο για την Επικύρωση Εναλλακτικών Μεθόδων (JaCVAM), σε σύμπραξη με το Ευρωπαϊκό Κέντρο για την Επικύρωση Εναλλακτικών Μεθόδων (ECVAM), καθώς και με τη Διυπηρεσιακή Συντονιστική Επιτροπή για την Επικύρωση Εναλλακτικών Μεθόδων (ICCVAM) και το Διυπηρεσιακό Κέντρο για την Αξιολόγηση Εναλλακτικών Τοξικολογικών Μεθόδων (NICEATM) του Εθνικού Προγράμματος Τοξικολογίας (NTP) των ΗΠΑ (12). Η παρούσα μέθοδος δοκιμών περιλαμβάνει τη συνιστώμενη χρήση και τους περιορισμούς του προσδιορισμού comet και βασίζεται στο τελικό πρωτόκολλο (12) που χρησιμοποιήθηκε στη μελέτη επικύρωσης, καθώς και σε συμπληρωματικά δεδομένα, δημοσιευμένα και μη (ιδιοκτησίας των εργαστηρίων). Οι ορισμοί των βασικών όρων παρατίθενται στο προσάρτημα 1. Σημειώνεται ότι για τον παρόντα προσδιορισμό μπορούν να χρησιμοποιηθούν πολλά διαφορετικά υποθέματα (αντικειμενοφόρες πλάκες μικροσκοπίου, κουκκίδες πηκτώματος, πλάκες 96 μικροκοιλοτήτων κ.λπ.). Χάριν ευκολίας, στο υπόλοιπο κείμενο του παρόντος εγγράφου χρησιμοποιείται ο όρος «αντικειμενοφόρος πλάκα», αλλά αυτός ο όρος καλύπτει και όλα τα άλλα υποθέματα. ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ Ο προσδιορισμός comet είναι μέθοδος μέτρησης των ρήξεων κλώνων του DNA σε ευκαρυωτικά κύτταρα. Μεμονωμένα κύτταρα/πυρήνες, εγκλεισμένα σε αγαρόζη πάνω σε αντικειμενοφόρο πλάκα, υφίστανται λύση με απορρυπαντικό και υψηλής συγκέντρωσης διάλυμα άλατος. Με το στάδιο της λύσης επιτυγχάνεται η πέψη των κυτταρικών και πυρηνικών μεμβρανών και η ελευθέρωση βρόχων περιελιγμένου DNA, που ονομάζονται γενικά νουκλεοειδή, και θραυσμάτων DNA. Η ηλεκτροφόρηση σε υψηλό pH έχει ως αποτέλεσμα να εμφανίζονται δομές που μοιάζουν με κομήτες και οι οποίες, με κατάλληλη φθορίζουσα χρώση, μπορούν να παρατηρηθούν με μικροσκοπία φθορισμού. Τα θραύσματα DNA μεταναστεύουν από την «κεφαλή» προς την «ουρά» του κομήτη ανάλογα με το μέγεθός τους, ενώ η ένταση της ουράς σε σχέση με τη συνολική ένταση (κεφαλής και ουράς) αντικατοπτρίζει την έκταση των ρήξεων του DNA (13) (14) (15). Ο προσδιορισμός comet in vivo σε αλκαλικές συνθήκες προσφέρεται ιδίως για την αξιολόγηση των κινδύνων γονιδιοτοξικότητας, δεδομένου ότι οι αποκρίσεις που ανιχνεύονται με αυτόν εξαρτώνται από την ADME (απορρόφηση, κατανομή, μεταβολισμός, απέκκριση) in vivo, καθώς και από τις διεργασίες επιδιόρθωσης του DNA. Οι παράγοντες αυτοί μπορεί να διαφέρουν μεταξύ των ζωικών ειδών, των ιστών και των τύπων βλάβης του DNA. Για την ικανοποίηση των απαιτήσεων που αφορούν την καλή μεταχείριση των ζώων και, ειδικότερα, τον περιορισμό της χρήσης πειραματόζωων (η αρχή 3R — Replacement, Reduction, Refinement/αντικατάσταση, μείωση, βελτίωση), ο προσδιορισμός μπορεί να ενσωματωθεί σε άλλες τοξικολογικές μελέτες, π.χ. μελέτες τοξικότητας επαναλαμβανόμενης δόσης (10) (16) (17), ή να συνδυαστεί το τελικό σημείο με άλλα τελικά σημεία γονιδιοτοξικότητας, όπως ο προσδιορισμός μικροπυρήνων σε ερυθροκύτταρα θηλαστικών (18) (19) (20). Ο προσδιορισμός comet εκτελείται ως επί το πλείστον σε τρωκτικά, παρά το γεγονός ότι έχει εφαρμοστεί και σε άλλα είδη ζώων, θηλαστικών και μη. Η χρήση άλλων ειδών εκτός των τρωκτικών θα πρέπει να αιτιολογείται κατά περίπτωση από επιστημονικής και δεοντολογικής πλευράς και συνιστάται ένθερμα να εκτελείται προσδιορισμός comet σε άλλα είδη εκτός των τρωκτικών μόνον εφόσον αποτελεί μέρος άλλης μελέτης τοξικότητας και όχι ως αυτοτελής δοκιμή. Η επιλογή της οδού έκθεσης και των ιστών που πρόκειται να μελετηθούν θα πρέπει να βασίζεται σε όλες τις διαθέσιμες/υπάρχουσες γνώσεις για τις υπό δοκιμή χημικές ουσίες, π.χ. σκοπούμενη/αναμενόμενη οδός έκθεσης του ανθρώπου, μεταβολισμός και κατανομή, δυναμικό επιδράσεων στη θέση επαφής, προειδοποιητικές ενδείξεις από τη χημική δομή, άλλα δεδομένα γονιδιοτοξικότητας ή τοξικότητας, καθώς και στον σκοπό της μελέτης. Ως εκ τούτου, το γονιδιοτοξικό δυναμικό των υπό δοκιμή χημικών ουσιών μπορεί να προσδιοριστεί στους ιστούς-στόχους καρκινογόνων και/ή άλλων τοξικών επιδράσεων, εφόσον ενδείκνυται. Ο προσδιορισμός θεωρείται επίσης χρήσιμος για την περαιτέρω διερεύνηση της γονιδιοτοξικότητας που ανιχνεύεται με σύστημα δοκιμής in vitro. Η εκτέλεση του προσδιορισμού comet in vivo σε επιθυμητό ιστό ενδείκνυται όταν μπορεί εύλογα να αναμένεται ότι ο συγκεκριμένος ιστός θα εκτεθεί επαρκώς. Η πληρέστερη επικύρωση του προσδιορισμού αφορούσε σωματικούς ιστούς αρσενικών επιμύων στο πλαίσιο συλλογικών μελετών, όπως εκείνες του JaCVAM (12) και των Rothfuss και συν., 2010 (10). Στη διεθνή μελέτη επικύρωσης του JaCVAM χρησιμοποιήθηκαν ήπαρ και στόμαχος. Το ήπαρ χρησιμοποιήθηκε διότι αποτελεί το πιο δραστήριο όργανο στον μεταβολισμό των χημικών ουσιών και, επίσης, συχνά όργανο-στόχο στην καρκινογένεση. Ο στόμαχος χρησιμοποιήθηκε επειδή είναι συνήθως η πρώτη θέση επαφής με τις χημικές ουσίες κατόπιν έκθεσης από το στόμα, μολονότι και άλλες περιοχές του γαστρεντερικού σωλήνα, όπως το δωδεκαδάκτυλο και η νήστιδα, θα πρέπει επίσης να θεωρούνται ιστοί θέσης επαφής και ίσως θεωρούνται καταλληλότεροι για μελέτες που αφορούν τον άνθρωπο απ' ό,τι ο αδενώδης στόμαχος των τρωκτικών. Θα πρέπει να λαμβάνεται μέριμνα ώστε να μην εκτίθενται οι εν λόγω ιστοί σε υπερβολικά υψηλές συγκεντρώσεις της υπό δοκιμή χημικής ουσίας (21). Η τεχνική εφαρμόζεται καταρχήν σε κάθε ιστό από τον οποίο μπορούν να ληφθούν αναλύσιμα εναιωρήματα μεμονωμένων κυττάρων/πυρήνων. Ιδιόκτητα δεδομένα διαφόρων εργαστηρίων καταδεικνύουν την επιτυχή εφαρμογή της τεχνικής σε πολλούς διαφορετικούς ιστούς και υπάρχουν πολλές δημοσιεύσεις από τις οποίες προκύπτει η εφαρμοσιμότητά της σε άλλα όργανα και ιστούς εκτός από το ήπαρ και τον στόμαχο, π.χ. σε νήστιδα (22), νεφρούς (23) (24), δέρμα (25) (26), ουροδόχο κύστη (27) (28), κύτταρα πνευμόνων και βρογχοκυψελιδικού εκπλύματος (χρήσιμα σε μελέτες εισπνεόμενων χημικών ουσιών) (29) (30), ενώ έχουν επίσης διεξαχθεί δοκιμές σε πολλά όργανα συγχρόνως (31) (32). Παρά το πιθανό ενδιαφέρον για τις γονιδιοτοξικές επιδράσεις στα γεννητικά κύτταρα, θα πρέπει να σημειωθεί ότι ο τυποποιημένος προσδιορισμός comet σε αλκαλικές συνθήκες, που περιγράφεται στην παρούσα μέθοδο δοκιμών, δεν θεωρείται κατάλληλος για τη μέτρηση ρήξεων κλώνων του DNA σε ώριμα γεννητικά κύτταρα. Δεδομένου ότι, σε βιβλιογραφική επισκόπηση της χρήσης του προσδιορισμού comet για μελέτες γονιδιοτοξικότητας σε γεννητικά κύτταρα, αναφέρθηκαν υψηλά και μεταβλητά επίπεδα υποβάθρου όσον αφορά τις βλάβες του DΝΑ (33), θεωρείται αναγκαία η τροποποίηση του πρωτοκόλλου, σε συνδυασμό με βελτιωμένες μελέτες τυποποίησης και επικύρωσης, για να μπορεί να συμπεριληφθεί στη μέθοδο δοκιμών ο προσδιορισμός comet σε ώριμα γεννητικά κύτταρα (π.χ. σπερματοζωάρια). Επιπλέον, το προτεινόμενο σχήμα έκθεσης που περιγράφεται στην παρούσα μέθοδο δοκιμών δεν είναι το βέλτιστο και θα χρειάζονταν μεγαλύτεροι χρόνοι έκθεσης ή δειγματοληψίας για μια ουσιαστική ανάλυση των ρήξεων κλώνων του DNA σε ώριμα σπερματοζωάρια. Έχουν περιγραφεί στη βιβλιογραφία γονιδιοτοξικές επιδράσεις που μετρήθηκαν με τον προσδιορισμό comet σε ορχικά κύτταρα διαφόρων σταδίων διαφοροποίησης (34) (35). Ωστόσο, θα πρέπει να σημειωθεί ότι οι γονάδες περιέχουν μείγμα σωματικών και γεννητικών κυττάρων. Για τον λόγο αυτό, τα θετικά αποτελέσματα που αφορούν πλήρεις γονάδες (όρχεις) δεν αντικατοπτρίζουν κατ' ανάγκη βλάβες των γεννητικών κυττάρων· παρόλα αυτά, υποδηλώνουν ότι οι δοκιμασθείσες χημικές ουσίες και/ή οι μεταβολίτες τους φθάνουν στη γονάδα. Στις τυποποιημένες πειραματικές συνθήκες του προσδιορισμού comet δεν είναι δυνατή η αξιόπιστη ανίχνευση σταυροδεσμών. Υπό ορισμένες τροποποιημένες πειραματικές συνθήκες, θα μπορούσαν να ανιχνευθούν σταυροδεσμοί DNA-DNA και DNA-πρωτεϊνών, καθώς και άλλες μετατροπές βάσεων, όπως οι οξειδωμένες βάσεις (23) (36) (37) (38) (39). Θα χρειαστούν, όμως, περαιτέρω εργασίες για τον επαρκή χαρακτηρισμό των αναγκαίων τροποποιήσεων του πρωτοκόλλου. Ως εκ τούτου, η ανίχνευση παραγόντων σταυροσύνδεσης δεν είναι ο πρωταρχικός σκοπός του προσδιορισμού που περιγράφεται στο παρόν κεφάλαιο. Ο προσδιορισμός, ακόμη και τροποποιημένος, δεν ενδείκνυται για την ανίχνευση ανευπλοειδογόνων. Λόγω του τρέχοντος επιπέδου των γνώσεων, ο προσδιορισμός comet in vivo υπόκειται σε μια σειρά από πρόσθετους περιορισμούς (βλ. προσάρτημα 3). Αναμένεται ότι η μέθοδος δοκιμών θα επανεξεταστεί στο μέλλον και, εάν κριθεί απαραίτητο, θα αναθεωρηθεί βάσει της πείρας που θα έχει αποκομιστεί. Πριν από τη χρήση της μεθόδου δοκιμών σε μείγμα για την παραγωγή δεδομένων για συγκεκριμένο ρυθμιστικό σκοπό, θα πρέπει να εξετάζεται αν — και, εάν ναι, για ποιον λόγο — μπορεί να αποδώσει επαρκή αποτελέσματα για τον επιδιωκόμενο σκοπό. Οι εκτιμήσεις αυτές δεν είναι αναγκαίες όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος. ΑΡΧΗ ΤΗΣ ΜΕΘΟΔΟΥ Τα ζώα εκτίθενται στην υπό δοκιμή χημική ουσία μέσω κατάλληλης οδού. Λεπτομερής περιγραφή της δοσολογίας και της δειγματοληψίας παρέχεται στις παραγράφους 36-40. Κατά τους επιλεγμένους χρόνους δειγματοληψίας, ανατέμνονται οι ιστοί που ενδιαφέρουν και παρασκευάζονται εναιωρήματα μεμονωμένων κυττάρων/πυρήνων [επιτρέπεται η επιτόπια (in situ) διαπότιση, όταν κρίνεται χρήσιμο, π.χ. προκειμένου για ήπαρ], τα οποία εγκλείονται σε μαλακό άγαρ με σκοπό την ακινητοποίησή τους σε αντικειμενοφόρους πλάκες. Τα κύτταρα/πυρήνες υποβάλλονται σε κατεργασία με ρυθμιστικό διάλυμα λύσης για την απομάκρυνση της κυτταρικής και/ή πυρηνικής μεμβράνης και εκτίθενται σε ισχυρό άλκαλι, π.χ. pH ≥ 13, ώστε να καταστεί δυνατή η αποπεριέλιξη του DNA και η ελευθέρωση χαλαρωμένων βρόχων και θραυσμάτων DNA. Ακολουθεί ηλεκτροφόρηση του πυρηνικού DNA που βρίσκεται στο άγαρ. Τα φυσιολογικά, ακέραια μόρια DNA παραμένουν στη θέση του πυρηνικού DNA στο άγαρ, ενώ τα θραύσματα και οι χαλαρωμένοι βρόχοι DNA μεταναστεύουν προς την άνοδο. Μετά την ηλεκτροφόρηση, το DNA καθίσταται ορατό με τη χρήση κατάλληλης φθορίζουσας χρώσης. Τα παρασκευάσματα θα πρέπει να αναλύονται με μικροσκόπιο και πλήρως αυτόματα ή ημιαυτόματα συστήματα ανάλυσης εικόνων. Η έκταση της μετανάστευσης DNA κατά την ηλεκτροφόρηση και η απόσταση μετανάστευσης αντιστοιχούν στην ποσότητα και το μέγεθος των θραυσμάτων DNA. Υπάρχουν διάφορα τελικά σημεία για τον προσδιορισμό comet. Έχει διατυπωθεί η σύσταση να χρησιμοποιείται η περιεκτικότητα της ουράς σε DNA ( % DNA ουράς ή % έντασης ουράς) (12) (40) (41) για την αξιολόγηση της βλάβης του DNA (12) (40) (41) (42). Μετά από ανάλυση επαρκούς αριθμού πυρήνων, τα δεδομένα αναλύονται με κατάλληλες μεθόδους για να κριθούν τα αποτελέσματα του προσδιορισμού. Θα πρέπει να σημειωθεί ότι η τροποποίηση διαφόρων πτυχών της μεθοδολογίας, μεταξύ των οποίων συγκαταλέγονται η προετοιμασία των δειγμάτων, οι συνθήκες ηλεκτροφόρησης, οι παράμετροι της οπτικής ανάλυσης (π.χ. ένταση της χρώσης, φωτεινή ένταση του λαμπτήρα του μικροσκοπίου και χρήση φίλτρων μικροσκοπίου και συστημάτων λήψης εικόνων με δυναμικά στοιχεία) και οι συνθήκες του περιβάλλοντος (π.χ. φωτισμός υποβάθρου), έχει διερευνηθεί και μπορεί να επηρεάσει τη μετανάστευση του DNA (43) (44) (45) (46). ΕΛΕΓΧΟΣ ΤΗΣ ΤΕΧΝΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ ΤΟΥ ΕΡΓΑΣΤΗΡΙΟΥ Κάθε εργαστήριο θα πρέπει να τεκμηριώνει την πειραματική του επάρκεια όσον αφορά τον προσδιορισμό comet, αποδεικνύοντας την ικανότητά του να λαμβάνει επαρκούς ποιότητας εναιωρήματα μεμονωμένων κυττάρων ή πυρήνων από κάθε στοχευόμενο ιστό και για κάθε χρησιμοποιούμενο ζωικό είδος. Η ποιότητα των παρασκευασμάτων αξιολογείται πρώτα από την τιμή % DNA ουράς για τα ζώα που υποβάλλονται σε μεταχείριση με τον φορέα, η οποία πρέπει να βρίσκεται εντός αναπαραγώγιμου χαμηλού εύρους τιμών. Τα σημερινά δεδομένα δείχνουν ότι η ομαδική μέση τιμή % DNA ουράς για το ήπαρ επίμυος (με βάση τη μέση τιμή των διάμεσων τιμών — βλ. παράγραφο 57 για λεπτομέρειες σχετικά με τους όρους αυτούς) θα πρέπει, κατά προτίμηση, να μην υπερβαίνει το 6 %, ποσοστό που συμφωνεί με τις τιμές από τη μελέτη επικύρωσης του JaCVAM (12) και από άλλα δεδομένα, δημοσιευμένα ή ιδιοκτησίας εργαστηρίων. Δεν υπάρχουν προς το παρόν αρκετά δεδομένα για τη διατύπωση συστάσεων σχετικά με το βέλτιστο ή αποδεκτό εύρος τιμών για άλλους ιστούς, χωρίς αυτό να αποκλείει τη χρήση άλλων ιστών, εφόσον αιτιολογείται. Η έκθεση δοκιμής θα πρέπει να παρέχει κατάλληλη επισκόπηση των επιδόσεων του προσδιορισμού comet στους ιστούς αυτούς σε σχέση με τις επιστημονικές δημοσιεύσεις ή με δεδομένα ιδιοκτησίας εργαστηρίων. Πρώτον, καλό είναι να υπάρχει χαμηλό εύρος τιμών % DNA ουράς στους μάρτυρες για να εξασφαλίζεται επαρκής δυναμική περιοχή για την ανίχνευση θετικών επιδράσεων. Δεύτερον, κάθε εργαστήριο θα πρέπει να είναι ικανό να αναπαράγει τις αναμενόμενες αποκρίσεις σε άμεσα μεταλλαξιγόνα και προμεταλλαξιγόνα με διαφορετικούς τρόπους δράσης, όπως τα προτεινόμενα στον πίνακα 1 (παράγραφος 29). Θετικές ουσίες μπορούν να επιλεγούν, για παράδειγμα, από τη μελέτη επικύρωσης του JaCVAM (12) ή από άλλα δημοσιευμένα δεδομένα (βλ. παράγραφο 9), κατά περίπτωση, με αιτιολόγηση και εφόσον καταδεικνύονται σαφείς θετικές αποκρίσεις στους υπό μελέτη ιστούς. Θα πρέπει επίσης να καταδεικνύεται η ικανότητα ανίχνευσης ασθενών επιδράσεων γνωστών μεταλλαξιγόνων σε χαμηλές δόσεις, π.χ. του EMS (μεθανοσουλφονικός αιθυλεστέρας), λόγου χάριν με την απόδειξη σχέσεων δόσης-απόκρισης με κατάλληλο πλήθος δόσεων και τις ενδεδειγμένες αποστάσεις μεταξύ τους. Οι αρχικές προσπάθειες θα πρέπει να επικεντρώνονται στην απόδειξη τεχνικής ικανότητας ως προς τους ευρύτερα χρησιμοποιούμενους ιστούς, π.χ. ήπαρ τρωκτικών, στην περίπτωση των οποίων μπορεί να γίνει σύγκριση με τα υπάρχοντα δεδομένα και τα αναμενόμενα αποτελέσματα (12). Θα μπορούσαν να συλλέγονται συγχρόνως δεδομένα για άλλους ιστούς, π.χ. στόμαχο/δωδεκαδάκτυλο/νήστιδα, αίμα κ.λπ. Το εργαστήριο πρέπει να καταδεικνύει αφενός την τεχνική του ικανότητα ως προς κάθε επιμέρους ιστό κάθε ζωικού είδους που έχει προγραμματίσει να μελετήσει και, αφετέρου, τη δυνατότητα επίτευξης αποδεκτής θετικής απόκρισης με γνωστό μεταλλαξιγόνο (π.χ. EMS) στον εκάστοτε ιστό. Θα πρέπει να συλλέγονται δεδομένα για μάρτυρες με φορέα/αρνητικούς μάρτυρες, ώστε να καταδεικνύεται η αναπαραγωγιμότητα των αρνητικών αποκρίσεων και να διασφαλίζεται ο ενδεδειγμένος έλεγχος των τεχνικών πτυχών του προσδιορισμού ή, αντίθετα, να αναδεικνύεται η ανάγκη καθορισμού νέων πεδίων τιμών για τους ιστορικούς μάρτυρες (βλ. παράγραφο 22). Σημειωτέον ότι είναι μεν δυνατόν να συλλέγονται ταυτόχρονα πολλοί ιστοί κατά τη νεκροψία και να υποβάλλονται σε επεξεργασία για ανάλυση comet, αλλά το εργαστήριο πρέπει να διαθέτει την ικανότητα να συλλέγει διαφορετικούς ιστούς από το ίδιο ζώο, εξασφαλίζοντας κατ' αυτόν τον τρόπο ότι δεν παραβλέπεται καμία δυνητική βλάβη του DNA και δεν διακυβεύεται ο προσδιορισμός comet. Το χρονικό διάστημα που μεσολαβεί από την ευθανασία μέχρι την αφαίρεση ιστών για επεξεργασία ενδέχεται να είναι κρίσιμης σημασίας (βλ. παράγραφο 44). Κατά την ανάπτυξη τεχνικής ικανότητας όσον αφορά την παρούσα δοκιμή πρέπει να λαμβάνεται υπόψη η καλή μεταχείριση των ζώων και, ως εκ τούτου, μπορούν να αξιοποιούνται για την απόκτηση εμπειρίας στις διάφορες πτυχές της δοκιμής ιστοί προερχόμενοι από ζώα που έχουν χρησιμοποιηθεί σε άλλες δοκιμές. Επιπλέον, μπορεί να μην είναι απαραίτητο να διεξαχθεί πλήρης μελέτη κατά τα στάδια της εδραίωσης μιας νέας μεθόδου δοκιμών στο εργαστήριο και είναι δυνατόν να μειωθεί ο αριθμός των ζώων ή των συγκεντρώσεων δοκιμής που χρησιμοποιούνται κατά την ανάπτυξη των απαραίτητων δεξιοτήτων. Ιστορικά δεδομένα για μάρτυρες Κατά τη διάρκεια των ερευνών τεχνικής ικανότητας, το εργαστήριο θα πρέπει να δημιουργήσει ιστορική βάση δεδομένων που να καθορίζει πεδία και κατανομές τιμών στους θετικούς και αρνητικούς μάρτυρες για τους μελετώμενους ιστούς και ζωικά είδη. Συστάσεις για τον τρόπο δημιουργίας και χρήσης των ιστορικών δεδομένων (δηλ. κριτήρια προσθήκης στοιχείων στα ιστορικά δεδομένα και εξαίρεσης στοιχείων από αυτά, καθώς και κριτήρια αποδοχής συγκεκριμένου πειράματος) έχουν διατυπωθεί στη βιβλιογραφία (47). Οι τιμές % DNA ουράς που προκύπτουν για τους αρνητικούς μάρτυρες ενδέχεται να διαφέρουν ανάλογα με τον ιστό, το ζωικό είδος, τον φορέα και την οδό χορήγησης. Είναι, επομένως, σημαντικό να καθορίζονται πεδία τιμών αρνητικών μαρτύρων για κάθε ιστό και ζωικό είδος. Τα εργαστήρια θα πρέπει να χρησιμοποιούν μεθόδους ποιοτικού ελέγχου, όπως διαγράμματα ελέγχου [π.χ. διαγράμματα C ή X-bar (48)], για να προσδιορίζουν τη μεταβλητότητα των δεδομένων τους και να αποδεικνύουν ότι έχουν «υπό έλεγχο» τη μεθοδολογία. Μπορεί επίσης να χρειάζεται βελτιστοποίηση της επιλογής των κατάλληλων ουσιών ως θετικών μαρτύρων, καθώς και των κατάλληλων περιοχών δόσεων και πειραματικών συνθηκών (π.χ. συνθήκες ηλεκτροφόρησης) για την ανίχνευση ασθενών επιδράσεων (βλ. παράγραφο 17). Κάθε αλλαγή του πειραματικού πρωτοκόλλου θα πρέπει να μελετάται υπό το πρίσμα της συμφωνίας της με τις υφιστάμενες βάσεις ιστορικών δεδομένων του εργαστηρίου για μάρτυρες. Τυχόν σημαντικές ανακολουθίες θα πρέπει να έχουν ως αποτέλεσμα τη δημιουργία νέας βάσης ιστορικών δεδομένων για μάρτυρες. ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Προετοιμασίες Επιλογή ζωικού είδους Κατά κανόνα χρησιμοποιούνται υγιή νεαρά ενήλικα ζώα (ηλικίας 6-10 εβδομάδων κατά την έναρξη της μεταχείρισης, αν και είναι επίσης αποδεκτά ζώα λίγο μεγαλύτερης ηλικίας) που ανήκουν σε συνήθεις εργαστηριακές φυλές. Το είδος τρωκτικών θα πρέπει να επιλέγεται με τα εξής κριτήρια: i) τα είδη που χρησιμοποιούνται σε άλλες μελέτες τοξικότητας (ώστε να υπάρχει δυνατότητα συσχέτισης των δεδομένων και εκπόνησης ολοκληρωμένων μελετών), ii) τα είδη που ανέπτυξαν όγκους σε μελέτες καρκινογενετικότητας (εφόσον διερευνάται ο μηχανισμός καρκινογένεσης) και iii) τα είδη με μεταβολισμό που πλησιάζει περισσότερο στον ανθρώπινο, εάν είναι γνωστά. Στην παρούσα δοκιμή χρησιμοποιούνται συνήθως επίμυες. Ωστόσο, μπορούν να χρησιμοποιηθούν και άλλα είδη, εάν αυτό δικαιολογείται από δεοντολογικής και επιστημονικής πλευράς. Συνθήκες στέγασης και σίτισης των ζώων Για τα τρωκτικά, η θερμοκρασία της αίθουσας πειραματόζωων θα πρέπει, στην ιδανική περίπτωση, να είναι 22 °C (± 3 °C). Η σχετική υγρασία, η ιδανική τιμή της οποίας είναι 50-60 %, θα πρέπει να είναι τουλάχιστον 30 % και, κατά προτίμηση, να μην υπερβαίνει το 70 %, εκτός από τις περιόδους καθαρισμού της αίθουσας. Ο φωτισμός θα πρέπει να είναι τεχνητός, με φωτοπερίοδο 12 ωρών. Για τη διατροφή των ζώων μπορούν να χρησιμοποιούνται τα κλασικά εργαστηριακά σιτηρέσια, με απεριόριστη παροχή πόσιμου νερού. Όταν η υπό δοκιμή χημική ουσία χορηγείται με την τροφή, η ανάγκη επαρκούς ανάμειξης της ουσίας είναι δυνατόν να επηρεάσει την επιλογή σιτηρεσίου. Τα ζώα θα πρέπει να στεγάζονται σε μικρές ομάδες (όχι περισσότερα από πέντε) του ίδιου φύλου, εφόσον δεν αναμένεται επιθετική συμπεριφορά. Η ατομική στέγαση των ζώων επιτρέπεται, μόνον εάν αιτιολογείται επιστημονικά. Θα πρέπει να χρησιμοποιούνται κατά το δυνατόν συμπαγή δάπεδα, διότι τα δάπεδα από συρματόπλεγμα μπορούν να προκαλέσουν σοβαρούς τραυματισμούς (49). Πρέπει να προβλέπεται κατάλληλος εμπλουτισμός του περιβάλλοντος. Προετοιμασία των ζώων Τα ζώα κατανέμονται τυχαία στις ομάδες μαρτύρων και μεταχείρισης. Ταυτοποιούνται με αποκλειστικό αναγνωριστικό και εγκλιματίζονται στις εργαστηριακές συνθήκες τουλάχιστον για πέντε ημέρες πριν από την έναρξη της μεταχείρισης. Πρέπει να χρησιμοποιείται η λιγότερο επεμβατική μέθοδος αποκλειστικής ταυτοποίησης των ζώων. Κατάλληλες μέθοδοι είναι, μεταξύ άλλων, η δακτυλίωση, η σήμανση με ενώτιο, η τοποθέτηση μικροτσίπ και η βιομετρική ταυτοποίηση. Η αποκοπή τμήματος δακτύλου ή αυτιού δεν δικαιολογείται επιστημονικά στις συγκεκριμένες δοκιμές. Οι κλωβοί θα πρέπει να διατάσσονται με τρόπο ώστε να ελαχιστοποιούνται οι πιθανές επιδράσεις της θέσης τους. Στην αρχή της μελέτης, οι διαφορές βάρους μεταξύ των ζώων θα πρέπει να είναι ελάχιστες και να μην υπερβαίνουν το ± 20 %. Παρασκευή των δόσεων Οι στερεές υπό δοκιμή χημικές ουσίες θα πρέπει να διαλύονται ή να διασπείρονται (σχηματισμός εναιωρήματος) σε κατάλληλους φορείς ή να αναμειγνύονται με την τροφή ή το πόσιμο νερό, πριν χορηγηθούν στα ζώα. Οι υγρές υπό δοκιμή χημικές ουσίες μπορούν να χορηγούνται ως έχουν ή να αραιώνονται πριν από τη χορήγηση. Σε περίπτωση έκθεσης μέσω της εισπνοής, οι υπό δοκιμή χημικές ουσίες μπορούν να χορηγούνται ως αέριο, ατμοί ή αερόλυμα στερεού/υγρού, ανάλογα με τις φυσικοχημικές τους ιδιότητες (50) (51). Θα πρέπει να χρησιμοποιούνται πρόσφατα παρασκευάσματα της υπό δοκιμή χημικής ουσίας, εκτός αν τα στοιχεία σχετικά με τη σταθερότητά της καταδεικνύουν ότι είναι αποδεκτή η φύλαξή της και καθορίζουν τις κατάλληλες συνθήκες φύλαξης. Συνθήκες δοκιμής Φορέας Ο φορέας θα πρέπει να μην έχει τοξικές επιδράσεις στους χρησιμοποιούμενους όγκους δόσεων, ούτε να υπάρχουν υπόνοιες για πιθανή χημική αντίδρασή του με τις υπό δοκιμή χημικές ουσίες. Εάν χρησιμοποιείται άλλος φορέας εκτός των καθιερωμένων, η χρήση του θα πρέπει να τεκμηριώνεται με δεδομένα αναφοράς που αποδεικνύουν τη συμβατότητά του ως προς τα ζώα, την οδό χορήγησης και το τελικό σημείο της δοκιμής. Συνιστάται, εφόσον είναι δυνατό, να εξετάζεται πρώτα αν μπορεί να χρησιμοποιηθεί υδατικός διαλύτης/φορέας. Θα πρέπει να σημειωθεί ότι ορισμένοι φορείς (ιδίως οι παχύρρευστοι) μπορούν να προκαλέσουν φλεγμονή και αύξηση των επιπέδων υποβάθρου των ρήξεων κλώνων του DNA στη θέση επαφής, ιδίως σε περίπτωση πολλαπλής χορήγησης. Μάρτυρες Θετικοί μάρτυρες Επί του παρόντος, κάθε δοκιμή θα πρέπει κανονικά να περιλαμβάνει μία ομάδα αποτελούμενη από τουλάχιστον 3 αναλύσιμα ζώα του ίδιου φύλου ή, εάν χρησιμοποιούνται και τα δύο φύλα, από κάθε φύλο (βλ. παράγραφο 32), τα οποία υποβάλλονται σε μεταχείριση με ουσία που χρησιμεύει ως θετικός μάρτυρας. Στο μέλλον, θα είναι ίσως δυνατόν να καταδειχθεί επαρκής τεχνική ικανότητα που θα μειώνει την ανάγκη για θετικούς μάρτυρες. Εάν χρησιμοποιούνται περισσότεροι του ενός χρόνοι δειγματοληψίας (π.χ. με πρωτόκολλο εφάπαξ χορήγησης), αρκεί να περιλαμβάνονται θετικοί μάρτυρες μόνο σε έναν από τους χρόνους αυτούς, αλλά θα πρέπει να εξασφαλίζεται ισόρροπος σχεδιασμός (βλ. παράγραφο 48). Οι ουσίες που χρησιμεύουν ως παράλληλοι θετικοί μάρτυρες δεν είναι απαραίτητο να χορηγούνται από την ίδια οδό όπως η υπό δοκιμή χημική ουσία, αλλά είναι σημαντικό να χρησιμοποιείται η ίδια οδός όταν μετρώνται οι επιδράσεις στη θέση επαφής. Οι ουσίες που χρησιμεύουν ως θετικοί μάρτυρες θα πρέπει αποδεδειγμένα να επάγουν ρήξεις κλώνων του DNA σε όλους τους ιστούς που ενδιαφέρουν ως προς την υπό δοκιμή χημική ουσία και ο θετικός μάρτυρας επιλογής είναι πιθανότατα ο EMS, δεδομένου ότι έχει προκαλέσει ρήξεις κλώνων σε όλους τους ιστούς που έχουν μελετηθεί. Οι δόσεις των ουσιών που χρησιμεύουν ως θετικοί μάρτυρες θα πρέπει να επιλέγονται κατά τρόπο ώστε να έχουν μέτριες επιδράσεις, μέσω των οποίων κρίνονται ορθά οι επιδόσεις και η ευαισθησία του προσδιορισμού, η δε επιλογή τους θα μπορούσε να βασίζεται σε καμπύλες δόσης-απόκρισης που χάραξε το εργαστήριο στο πλαίσιο της απόδειξης τεχνικής ικανότητας. Το % DNA ουράς για τα ζώα που χρησιμεύουν ως παράλληλοι θετικοί μάρτυρες θα πρέπει να συμφωνεί με το προκαθορισμένο από το εργαστήριο εύρος τιμών σε κάθε ιστό και χρόνο δειγματοληψίας για το είδος των ζώων αυτών (βλ. παράγραφο 16). Παραδείγματα χημικών ουσιών που χρησιμεύουν ως θετικοί μάρτυρες και ορισμένοι από τους ιστούς-στόχους τους (στα τρωκτικά) περιλαμβάνονται στον πίνακα 1. Μπορούν να επιλεγούν ουσίες διαφορετικές από εκείνες που παρατίθενται στον πίνακα 1, εφόσον αιτιολογείται επιστημονικά. Πίνακας 1 Παραδείγματα χημικών ουσιών που χρησιμεύουν ως θετικοί μάρτυρες και ορισμένοι από τους ιστούς-στόχους τους Ουσίες και αριθ. CAS RN Μεθανοσουλφονικός αιθυλεστέρας (αριθ. CAS RN 62-50-0), όλοι οι ιστοί Αιθυλονιτροζουρία (αριθ. CAS RN 759-73-9), ήπαρ και στόμαχος, δωδεκαδάκτυλο ή νήστιδα Μεθανοσουλφονικός μεθυλεστέρας (αριθ. CAS RN 66-27-3), ήπαρ, στόμαχος, δωδεκαδάκτυλο ή νήστιδα, κύτταρα πνευμόνων και βρογχοκυψελιδικού εκπλύματος (BAL), νεφροί, ουροδόχος κύστη, πνεύμονες, όρχεις και μυελός των οστών/αίμα N-Μεθυλο-N′-νιτρο-N-νιτρωδογουανιδίνη (αριθ. CAS RN 70-25-7), στόμαχος, δωδεκαδάκτυλο ή νήστιδα Διυδροχλωρική 1,2-διμεθυλυδραζίνη (αριθ. CAS RN306-37-6), ήπαρ και έντερο N-Μεθυλο-N-νιτροζουρία (αριθ. CAS RN 684-93-5), ήπαρ, μυελός των οστών, αίμα, νεφροί, στόμαχος, νήστιδα και εγκέφαλος. Αρνητικοί μάρτυρες Κάθε δοκιμή θα πρέπει να περιλαμβάνει, σε κάθε χρόνο δειγματοληψίας και για κάθε ιστό, μία ομάδα ζώων που χρησιμεύουν ως αρνητικοί μάρτυρες, η οποία υποβάλλεται σε μεταχείριση μόνο με τον φορέα και, κατά τα άλλα, υφίσταται τους ίδιους χειρισμούς όπως οι ομάδες μεταχείρισης. Το % DNA ουράς στα ζώα που χρησιμεύουν ως αρνητικοί μάρτυρες θα πρέπει να βρίσκεται εντός του προκαθορισμένου από το εργαστήριο εύρους τιμών υποβάθρου για κάθε ιστό και χρόνο δειγματοληψίας και για το είδος των ζώων αυτών (βλ. παράγραφο 16). Εάν δεν υπάρχουν ιστορικά ή δημοσιευμένα δεδομένα για μάρτυρες που να δείχνουν ότι ο επιλεγμένος φορέας, ο αριθμός χορηγούμενων δόσεων και η οδός χορήγησης δεν επάγουν επιβλαβείς ή γονιδιοτοξικές επιδράσεις, θα πρέπει να διεξάγονται αρχικές μελέτες πριν από την πλήρη μελέτη για να διαπιστώνεται αν είναι αποδεκτοί οι μάρτυρες με φορέα. ΔΙΑΔΙΚΑΣΙΑ Αριθμός και φύλο των ζώων Αν και υπάρχουν ελάχιστα δεδομένα για θηλυκά ζώα, που να επιτρέπουν τη σύγκριση μεταξύ των φύλων όσον αφορά τον προσδιορισμό comet, άλλες αποκρίσεις γονιδιοτοξικότητας in vivo είναι γενικά παρόμοιες μεταξύ αρσενικών και θηλυκών ζώων και, ως εκ τούτου, οι περισσότερες μελέτες θα μπορούσαν να διεξαχθούν σε οποιοδήποτε φύλο. Δεδομένα που καταδεικνύουν σημαντικές διαφορές μεταξύ αρσενικών και θηλυκών ζώων (π.χ. διαφορές συστημικής τοξικότητας, μεταβολισμού, βιοδιαθεσιμότητας κ.λπ., συμπεριλαμβανομένων, π.χ., δεδομένων από μελέτη προσδιορισμού εύρους τιμών) ευνοούν τη χρησιμοποίηση ζώων και των δύο φύλων. Στην περίπτωση αυτή, ίσως είναι σκόπιμο να διεξάγεται μελέτη και στα δύο φύλα, π.χ. στο πλαίσιο μελέτης τοξικότητας επαναλαμβανόμενης δόσης. Σε περίπτωση χρήσης και των δύο φύλων, θα ήταν ενδεχομένως σκόπιμη η εφαρμογή παραγοντικού σχεδιασμού. Λεπτομέρειες σχετικά με τον τρόπο ανάλυσης των δεδομένων με τη χρήση αυτού του σχεδιασμού παρέχονται στο προσάρτημα 2. Το μέγεθος των ομάδων κατά την έναρξη της μελέτης (και κατά την απόδειξη τεχνικής ικανότητας) θα πρέπει να καθορίζεται με γνώμονα την εξασφάλιση, ανά ομάδα, τουλάχιστον 5 αναλύσιμων ζώων του ίδιου φύλου ή, εάν χρησιμοποιούνται ζώα και των δύο φύλων, από κάθε φύλο (μικρότερου αριθμού στην ομάδα που χρησιμεύει ως παράλληλος θετικός μάρτυρας — βλ. παράγραφο 29). Όταν η έκθεση του ανθρώπου σε μια χημική ουσία αφορά μόνο το ένα φύλο, όπως π.χ. στην περίπτωση ορισμένων φαρμακευτικών προϊόντων, η δοκιμή θα πρέπει να διεξάγεται σε ζώα του αντίστοιχου φύλου. Ενδεικτικά, όσον αφορά τις τυπικές απαιτήσεις για τον μέγιστο αριθμό ζώων, για τη διεξαγωγή μελέτης σύμφωνα με τις παραμέτρους που καθορίζονται στην παράγραφο 33, με τρεις ομάδες δόσης και παράλληλους αρνητικούς και θετικούς μάρτυρες (κάθε ομάδα αποτελούμενη από πέντε ζώα του ίδιου φύλου), θα απαιτούνταν 25 έως 35 ζώα. ΠΡΟΓΡΑΜΜΑ ΜΕΤΑΧΕΙΡΙΣΗΣ Τα ζώα θα πρέπει να υποβάλλονται σε μεταχείριση καθημερινά επί 2 ή περισσότερες ημέρες (δηλ. χορήγηση δύο ή περισσότερων δόσεων με μεσοδιαστήματα περίπου 24 ωρών) και τα δείγματα να συλλέγονται μία φορά 2-6 ώρες (ή κατά τον Tmax) μετά την τελευταία μεταχείριση (12). Είναι αποδεκτά δείγματα από παρατεταμένα δοσολογικά σχήματα (π.χ. καθημερινή δόση επί 28 ημέρες). Έχει αποδειχθεί ότι ο συνδυασμός του προσδιορισμού comet με τη δοκιμή μικροπυρήνων σε ερυθροκύτταρα είναι επιτυχής (10) (19). Ωστόσο, θα πρέπει να αποδίδεται ιδιαίτερη προσοχή στις οργανωτικές απαιτήσεις που επιβάλλει η δειγματοληψία ιστών για ανάλυση comet, παράλληλα με την ικανοποίηση των απαιτήσεων της δειγματοληψίας ιστών για άλλα είδη τοξικολογικών αξιολογήσεων. Στις περισσότερες περιπτώσεις, δεν ενδείκνυται η συλλογή 24 ώρες μετά τη χορήγηση της τελευταίας δόσης, όπως γίνεται συνήθως κατά τις μελέτες γενικής τοξικότητας (βλ. παράγραφο 40 σχετικά με τον χρόνο δειγματοληψίας). Η χρήση άλλων προγραμμάτων μεταχείρισης και δειγματοληψίας θα πρέπει να αιτιολογείται (βλ. προσάρτημα 3). Για παράδειγμα, θα μπορούσε να εφαρμοστεί εφάπαξ μεταχείριση με πολλαπλή δειγματοληψία, αλλά θα πρέπει να σημειωθεί ότι χρειάζονται περισσότερα ζώα για τις μελέτες με εφάπαξ χορήγηση, λόγω της ανάγκης για πολλούς χρόνους δειγματοληψίας. Ωστόσο, η επιλογή αυτή μπορεί να είναι προτιμότερη σε ορισμένες περιπτώσεις, π.χ. όταν η υπό δοκιμή χημική ουσία επάγει υπερβολική τοξικότητα μετά από επαναλαμβανόμενη χορήγηση. Όλοι οι τρόποι διεξαγωγής της δοκιμής είναι αποδεκτοί, υπό την προϋπόθεση ότι η υπό δοκιμή χημική ουσία παρέχει θετική απόκριση ή, σε περίπτωση μελέτης με αρνητικό αποτέλεσμα, τεκμηριώνεται με άμεσα ή έμμεσα στοιχεία η έκθεση των στοχευόμενων ιστών ή η τοξικότητα για τους ιστούς αυτούς ή εάν επιτυγχάνεται η οριακή δόση (βλ. παράγραφο 36). Οι υπό δοκιμή χημικές ουσίες μπορούν επίσης να χορηγούνται σε διαιρεμένες δόσεις, δηλ. δύο μεταχειρίσεις την ίδια ημέρα, χωρίς να μεσολαβούν μεταξύ τους περισσότερες από 2-3 ώρες, για να διευκολύνεται η χορήγηση μεγάλων όγκων. Υπό τις περιστάσεις αυτές, ο χρόνος δειγματοληψίας θα πρέπει να προγραμματίζεται με βάση τον χρόνο της τελευταίας χορήγησης δόσης (βλ. παράγραφο 40). Επίπεδα δόσης Εάν χρειάζεται προκαταρκτική μελέτη προσδιορισμού εύρους δόσεων, επειδή δεν υπάρχουν κατάλληλα δεδομένα από άλλες συναφείς μελέτες για να υποβοηθήσουν την επιλογή δόσεων, η εν λόγω μελέτη θα πρέπει να διεξάγεται στο ίδιο εργαστήριο, με τη χρήση του ίδιου είδους, φυλής, φύλου ζώων και σχήματος μεταχείρισης με αυτά που πρόκειται να χρησιμοποιηθούν στην κύρια μελέτη, σύμφωνα με τις τρέχουσες προσεγγίσεις για τη διεξαγωγή μελετών προσδιορισμού εύρους δόσεων. Η μελέτη θα πρέπει να αποσκοπεί στον προσδιορισμό της μέγιστης ανεκτής δόσης (ΜΑΔ), η οποία ορίζεται ως η δόση που επάγει ελαφρές τοξικές επιδράσεις σε σχέση με τη διάρκεια της μελέτης (π.χ. σαφή κλινικά σημεία, όπως ασυνήθης συμπεριφορά ή ασυνήθεις αντιδράσεις, μικρή μείωση του σωματικού βάρους ή κυτταροτοξικότητα στον στοχευόμενο ιστό), αλλά όχι θάνατο ή εκδήλωση πόνου, ταλαιπωρίας ή δυσφορίας που καθιστούν αναγκαία τη θανάτωση με ευθανασία. Για μη τοξικές υπό δοκιμή χημικές ουσίες, με περίοδο χορήγησης 14 ημερών και άνω, η μέγιστη (οριακή) δόση είναι 1 000 mg/kg σωματικού βάρους/ημέρα. Για περιόδους χορήγησης μικρότερες των 14 ημερών, η μέγιστη (οριακή) δόση είναι 2 000 mg/kg σωματικού βάρους/ημέρα. Για ορισμένα είδη υπό δοκιμή χημικών ουσιών (π.χ. φαρμακευτικά προϊόντα για τον άνθρωπο) που καλύπτονται από ειδικές κανονιστικές διατάξεις τα όρια αυτά μπορεί να διαφέρουν. Οι χημικές ουσίες που παρουσιάζουν κορεσμό τοξικοκινητικών ιδιοτήτων ή επάγουν διεργασίες αποτοξίνωσης που μπορεί να επιφέρουν μείωση της έκθεσης μετά από μακροχρόνια χορήγηση ίσως αποτελούν εξαιρέσεις από τα κριτήρια καθορισμού των δόσεων και θα πρέπει να αξιολογούνται κατά περίπτωση. Τόσο στην οξεία όσο και στην υποξεία παραλλαγή του προσδιορισμού comet, εκτός από τη μέγιστη δόση (ΜΑΔ, μέγιστη εφικτή δόση, μέγιστη έκθεση ή οριακή δόση) θα πρέπει να επιλέγεται, για κάθε χρόνο δειγματοληψίας, μια φθίνουσα σειρά από τουλάχιστον δύο επιπλέον επίπεδα δόσης με κατάλληλες αποστάσεις μεταξύ τους (κατά προτίμηση, με παράγοντα απόστασης μικρότερο από 10) για να καταδεικνύονται οι σχετιζόμενες με τη δόση αποκρίσεις. Ωστόσο, τα χρησιμοποιούμενα επίπεδα δόσης θα πρέπει επίσης να καλύπτουν, κατά προτίμηση, μια περιοχή από τη μέγιστη δόση μέχρι εκείνη που προκαλεί ελάχιστη ή μηδενική τοξικότητα. Όταν παρατηρείται τοξικότητα στον στοχευόμενο ιστό σε όλα τα επίπεδα δόσης που έχουν δοκιμαστεί, συνιστάται η διεξαγωγή περαιτέρω μελέτης με μη τοξικές δόσεις (βλ. παραγράφους 54-55). Οι μελέτες με τις οποίες επιδιώκεται η πληρέστερη διερεύνηση του σχήματος της καμπύλης δόσης-απόκρισης ενδέχεται να απαιτούν μία ή περισσότερες πρόσθετες ομάδες δόσης. Χορήγηση των δόσεων Κατά τον σχεδιασμό της δοκιμής θα πρέπει να λαμβάνεται υπόψη η προβλεπόμενη οδός έκθεσης του ανθρώπου. Επιτρέπεται επομένως η αιτιολογημένη επιλογή οδών έκθεσης, όπως μέσω της τροφής ή του πόσιμου νερού, με τοπική εφαρμογή, με υποδόρια ή ενδοφλέβια ένεση, από το στόμα (με στομαχικό καθετήρα), μέσω της εισπνοής, η ενδοτραχειακή οδός ή η εμφύτευση. Σε κάθε περίπτωση, η επιλεγόμενη οδός χορήγησης θα πρέπει να εξασφαλίζει επαρκή έκθεση των στοχευόμενων ιστών. Η ενδοπεριτοναϊκή ένεση γενικά δεν συνιστάται, επειδή δεν αποτελεί συνήθως συναφή οδό έκθεσης του ανθρώπου και θα πρέπει να χρησιμοποιείται μόνο με ειδική αιτιολόγηση (π.χ. για ορισμένες ουσίες που χρησιμεύουν ως θετικοί μάρτυρες, για διερεύνηση ή για ορισμένα φάρμακα που χορηγούνται ενδοπεριτοναϊκώς). Ο μέγιστος όγκος υγρού που μπορεί να χορηγηθεί με στομαχικό καθετήρα ή ένεση κάθε φορά εξαρτάται από το μέγεθος του πειραματόζωου. Ο όγκος δεν θα πρέπει να υπερβαίνει το 1 ml/100 g βάρους σώματος, εκτός στην περίπτωση υδατικών διαλυμάτων όπου μπορούν να χρησιμοποιούνται 2 ml/100 g βάρους σώματος. Η χρήση μεγαλύτερου όγκου (εφόσον το επιτρέπει η νομοθεσία για την καλή μεταχείριση των ζώων) θα πρέπει να αιτιολογείται. Στο μέτρο του δυνατού, τα διάφορα επίπεδα δόσης θα πρέπει να επιτυγχάνονται με ρύθμιση της συγκέντρωσης του δοσολογικού σκευάσματος, ώστε να εξασφαλίζεται σταθερός όγκος σε σχέση με το σωματικό βάρος σε όλα τα επίπεδα δόσης. Χρόνος δειγματοληψίας Ο χρόνος δειγματοληψίας αποτελεί κρίσιμη μεταβλητή, διότι καθορίζεται από το χρονικό διάστημα που απαιτείται για την επίτευξη της μέγιστης συγκέντρωσης των υπό δοκιμή χημικών ουσιών στον στοχευόμενο ιστό και για την επαγωγή ρήξεων κλώνων του DNA, πριν όμως προλάβουν οι τελευταίες να εξαλειφθούν, να επιδιορθωθούν ή να προκαλέσουν κυτταρικό θάνατο. Κάποιες από τις βλάβες που οδηγούν σε ρήξεις κλώνων του DNA, οι οποίες ανιχνεύονται με τον προσδιορισμό comet, μπορεί να παραμένουν για πολύ σύντομο χρονικό διάστημα, τουλάχιστον με ορισμένες χημικές ουσίες σε δοκιμές in vitro (52) (53). Εάν επομένως υπάρχουν υπόνοιες για τέτοιες παροδικές βλάβες στο DNA, θα πρέπει να λαμβάνονται μέτρα για τον μετριασμό της απώλειάς τους, με την εξασφάλιση αρκετά έγκαιρης δειγματοληψίας ιστών, ενδεχομένως νωρίτερα από τους προεπιλεγμένους χρόνους που υποδεικνύονται κατωτέρω. Οι βέλτιστοι χρόνοι δειγματοληψίας μπορεί να είναι ειδικοί για την εκάστοτε χημική ουσία ή οδό έκθεσης, με αποτέλεσμα, λόγου χάριν, την ταχεία έκθεση του ιστού κατόπιν ενδοφλέβιας χορήγησης ή μέσω της εισπνοής. Κατά συνέπεια, οι χρόνοι δειγματοληψίας θα πρέπει να καθορίζονται με βάση κινητικά δεδομένα, εφόσον είναι διαθέσιμα [π.χ. ο χρόνος (Tmax) κατά τον οποίο επιτυγχάνεται η συγκέντρωση αιχμής (Cmax) στο πλάσμα ή στον ιστό ή η σταθερή κατάσταση, προκειμένου για πολλαπλή χορήγηση]. Εάν δεν υπάρχουν κινητικά δεδομένα, μια ικανοποιητική συμβιβαστική λύση για τη μέτρηση της γονιδιοτοξικότητας είναι η δειγματοληψία 2-6 ώρες μετά την τελευταία μεταχείριση, προκειμένου για δύο ή περισσότερες μεταχειρίσεις, ή δύο δειγματοληψίες 2-6 και 16-26 ώρες μετά τη μεταχείριση στην περίπτωση της εφάπαξ χορήγησης, αν και θα πρέπει να λαμβάνεται μέριμνα ώστε να γίνεται νεκροψία όλων των ζώων κατά την ίδια χρονική στιγμή μετά την τελευταία (ή τη μοναδική) δόση. Για την επιλογή κατάλληλων χρόνων δειγματοληψίας μπορούν επίσης να χρησιμοποιούνται πληροφορίες που αφορούν την εμφάνιση των τοξικών επιδράσεων στα στοχευόμενα όργανα (εφόσον είναι διαθέσιμες). Παρατηρήσεις Τα ζώα θα πρέπει να υποβάλλονται σε γενική κλινική εξέταση και καταγραφή των κλινικών παρατηρήσεων που αφορούν την υγεία τους, τουλάχιστον μία φορά ημερησίως, κατά προτίμηση την ίδια ώρα και λαμβανομένου υπόψη του χρονικού διαστήματος κορύφωσης των αναμενόμενων επιδράσεων μετά τη χορήγηση των δόσεων (54). Όλα τα ζώα θα πρέπει να εξετάζονται τουλάχιστον δύο φορές ημερησίως για τη διαπίστωση νοσηρότητας και θνησιμότητας. Στις μελέτες μεγαλύτερης διάρκειας όλα τα ζώα θα πρέπει να ζυγίζονται τουλάχιστον σε εβδομαδιαία βάση, καθώς και κατά τη λήξη της περιόδου δοκιμής. Η κατανάλωση τροφής θα πρέπει να μετράται σε κάθε αλλαγή τροφής και τουλάχιστον σε εβδομαδιαία βάση. Εάν η υπό δοκιμή χημική ουσία χορηγείται με το πόσιμο νερό, η κατανάλωσή νερού θα πρέπει να μετράται σε κάθε αλλαγή νερού και, τουλάχιστον, εβδομαδιαίως. Τα ζώα που εμφανίζουν μη θανατηφόρους δείκτες υπερβολικής τοξικότητας θα πρέπει να υποβάλλονται σε ευθανασία πριν από τη λήξη της περιόδου δοκιμής και, γενικά, δεν χρησιμοποιούνται για ανάλυση comet. Συλλογή ιστών Δεδομένου ότι η επαγωγή ρήξεων κλώνων του DNA («κομητών») είναι δυνατόν να μελετηθεί σχεδόν σε οποιονδήποτε ιστό, η αιτιολογία της επιλογής ιστών προς συλλογή θα πρέπει να είναι σαφής και να βασίζεται στον λόγο διεξαγωγής της μελέτης, σε συνδυασμό με τυχόν υπάρχοντα δεδομένα ADME, γονιδιοτοξικότητας, καρκινογενετικότητας ή άλλα δεδομένα τοξικότητας για τις μελετώμενες με τη δοκιμή χημικές ουσίες. Σημαντικοί παράγοντες που θα πρέπει να λαμβάνονται υπόψη είναι, μεταξύ άλλων, η οδός χορήγησης (με βάση τις πιθανές οδούς έκθεσης του ανθρώπου), η προβλεπόμενη κατανομή και απορρόφηση στους ιστούς, ο ρόλος του μεταβολισμού και ο πιθανός μηχανισμός δράσης των υπό δοκιμή χημικών ουσιών. Το ήπαρ είναι ο ιστός που μελετάται συχνότερα και για τον οποίο έχουν συγκεντρωθεί τα περισσότερα δεδομένα. Ως εκ τούτου, ελλείψει προϋπαρχόντων στοιχείων και εάν δεν έχουν προσδιοριστεί συγκεκριμένοι ιστοί για μελέτη, η δειγματοληψία ήπατος θα είναι δικαιολογημένη, δεδομένου ότι το όργανο αυτό αποτελεί την πρωταρχική θέση ξενοβιοτικού μεταβολισμού και συχνά εκτίθεται σε μεγάλο βαθμό, τόσο στις μητρικές ουσίες όσο και στους μεταβολίτες τους. Σε ορισμένες περιπτώσεις η δοκιμή με τη μέγιστη καταλληλότητα μπορεί να συνίσταται στην εξέταση της θέσης απευθείας επαφής (όπως ο αδενώδης στόμαχος ή το δωδεκαδάκτυλο/η νήστιδα στην περίπτωση των χημικών ουσιών που χορηγούνται από το στόμα ή οι πνεύμονες, προκειμένου για εισπνεόμενες ουσίες). Η επιλογή επιπλέον ή εναλλακτικών ιστών θα πρέπει να βασίζεται στους ειδικούς λόγους που υπαγορεύουν τη διεξαγωγή της δοκιμής. Ωστόσο, μπορεί να είναι χρήσιμη η εξέταση διαφορετικών ιστών προερχόμενων από τα ίδια ζώα, υπό τον όρο ότι το εργαστήριο έχει αποδείξει την τεχνική του ικανότητα όσον αφορά τους συγκεκριμένους ιστούς και την επάρκειά του για τον ταυτόχρονο χειρισμό πολλών διαφορετικών ιστών. Παρασκευή των δοκιμίων Για τις διεργασίες που περιγράφονται στις επόμενες παραγράφους (44-49) είναι σημαντικό να χρησιμοποιούνται όλα τα διαλύματα ή σταθερά εναιωρήματα πριν από την ημερομηνία λήξης τους ή να παρασκευάζονται νέα, εάν είναι αναγκαίο. Στις επόμενες παραγράφους, επίσης, οι χρόνοι που χρειάζονται για i) την αφαίρεση κάθε ιστού μετά τη νεκροψία, ii) την επεξεργασία κάθε ιστού για να ληφθούν εναιωρήματα κυττάρων/πυρήνων και iii) την επεξεργασία των εναιωρημάτων και την επίστρωση σε αντικειμενοφόρες πλάκες θεωρούνται κρίσιμες μεταβλητές (βλ. ορισμούς στο προσάρτημα 1) και θα πρέπει να έχει καθοριστεί αποδεκτή χρονική διάρκεια για καθένα από αυτά τα στάδια κατά την εδραίωση της μεθόδου στο εργαστήριο και την απόδειξη της τεχνικής του ικανότητας. Τα ζώα υποβάλλονται σε ευθανασία, σύμφωνα με την εφαρμοζόμενη νομοθεσία για την καλή μεταχείριση των ζώων και την αρχή 3R, κατά τους κατάλληλους χρόνους μετά την τελευταία μεταχείριση με την υπό δοκιμή χημική ουσία. Οι επιλεγμένοι ιστοί αφαιρούνται, ανατέμνονται και ένα μέρος του καθενός συλλέγεται για τον προσδιορισμό comet, ενώ ταυτόχρονα θα πρέπει να λαμβάνεται μια τομή από το ίδιο μέρος του ιστού και να τοποθετείται σε διάλυμα φορμαλδεΰδης ή κατάλληλο μονιμοποιητικό για ενδεχόμενη ιστοπαθολογική εξέταση (βλ. παράγραφο 55) σύμφωνα με πρότυπες μεθόδους (12). Ο ιστός που προορίζεται για τον προσδιορισμό comet τοποθετείται σε ρυθμιστικό διάλυμα μικροτεμαχισμού, εκπλένεται επαρκώς με ψυχρό ρυθμιστικό διάλυμα μικροτεμαχισμού για την απομάκρυνση των υπολειμμάτων αίματος και φυλάσσεται σε παγωμένο ρυθμιστικό διάλυμα μικροτεμαχισμού, έως ότου υποβληθεί σε επεξεργασία. Επιτρέπεται επίσης η επιτόπια διαπότιση, π.χ. για το ήπαρ ή τους νεφρούς. Έχουν δημοσιευθεί πολλές μέθοδοι απομόνωσης κυττάρων/πυρήνων. Σε αυτές περιλαμβάνονται ο μικροτεμαχισμός ιστών, π.χ. ήπατος και νεφρών, η απόξεση επιφανειών του βλεννογόνου στην περίπτωση του γαστρεντερικού σωλήνα, η ομογενοποίηση και η ενζυμική πέψη. Η μελέτη επικύρωσης του JaCVAM αφορούσε μόνο απομονωμένα κύτταρα και, ως εκ τούτου, προτιμώνται τα απομονωμένα κύτταρα για την εδραίωση της μεθόδου στο εργαστήριο και για να είναι δυνατόν να αποδειχθεί η τεχνική ικανότητα με παραπομπή στα δεδομένα της μελέτης του JaCVAM. Ωστόσο, έχει αποδειχθεί ότι είτε χρησιμοποιηθούν απομονωμένα κύτταρα είτε απομονωμένοι πυρήνες, δεν υπάρχει ουσιώδης διαφορά στο αποτέλεσμα του προσδιορισμού (8). Ομοίως, οι διαφορετικές μέθοδοι απομόνωσης κυττάρων/πυρήνων (π.χ. ομογενοποίηση, μικροτεμαχισμός, ενζυμική πέψη και διήθηση με πλέγμα) παρέχουν συγκρίσιμα αποτελέσματα (55). Κατά συνέπεια μπορούν να χρησιμοποιούνται απομονωμένα κύτταρα ή απομονωμένοι πυρήνες. Το εργαστήριο θα πρέπει να αξιολογεί διεξοδικά και να επικυρώνει ειδικές για κάθε ιστό μεθόδους απομόνωσης μοναδιαίων κυττάρων/πυρήνων. Όπως εξηγείται στην παράγραφο 40, κάποιες από τις βλάβες που οδηγούν σε ρήξεις κλώνων του DNA, οι οποίες ανιχνεύονται με τον προσδιορισμό comet, μπορεί να είναι πολύ βραχύβιες (52) (53). Ως εκ τούτου, ανεξάρτητα από τη μέθοδο που χρησιμοποιείται για την παρασκευή των εναιωρημάτων μοναδικών κυττάρων/πυρήνων, είναι σημαντικό να υποβάλλονται οι ιστοί σε επεξεργασία το ταχύτερο δυνατόν μετά την ευθανασία των ζώων και να φέρονται σε συνθήκες που περιορίζουν την εξάλειψη βλαβών (π.χ. με τη διατήρηση των ιστών σε χαμηλές θερμοκρασίες). Τα εναιωρήματα κυττάρων θα πρέπει να διατηρούνται παγωμένα έως ότου είναι έτοιμα προς χρήση, ώστε να μπορούν να καταδειχθούν ελάχιστη διαδειγματική μεταβλητότητα και κατάλληλες αποκρίσεις στους θετικούς και αρνητικούς μάρτυρες. ΕΤΟΙΜΑΣΙΑ ΤΩΝ ΑΝΤΙΚΕΙΜΕΝΟΦΟΡΩΝ ΠΛΑΚΩΝ Οι αντικειμενοφόρες πλάκες θα πρέπει να ετοιμάζονται το ταχύτερο δυνατόν (στην ιδανική περίπτωση, εντός μίας ώρας) μετά την παρασκευή του εναιωρήματος μοναδικών κυττάρων/πυρήνων, αλλά η θερμοκρασία και ο χρόνος που μεσολαβεί μεταξύ του θανάτου των ζώων και της ετοιμασίας των αντικειμενοφόρων πλακών θα πρέπει να ελέγχονται αυστηρά και να επικυρώνονται στις συνθήκες του εργαστηρίου. Ο όγκος του εναιωρήματος κυττάρων που προστίθεται σε αγαρόζη χαμηλού σημείου τήξης (συνήθως 0,5-1,0 %) για την ετοιμασία των αντικειμενοφόρων πλακών δεν θα πρέπει να μειώνει την εκατοστιαία αναλογία αγαρόζης χαμηλού σημείου τήξης σε επίπεδα κάτω του 0,45 %. Η βέλτιστη πυκνότητα κυττάρων καθορίζεται από το σύστημα ανάλυσης εικόνων που χρησιμοποιείται για την καταμέτρηση των «κομητών». Λύση Οι συνθήκες λύσης αποτελούν επίσης κρίσιμη μεταβλητή και μπορεί να επηρεάσουν τις ρήξεις κλώνων που οφείλονται σε συγκεκριμένους τύπους τροποποίησης του DNA (ορισμένες αλκυλιώσεις του DNA και χημικές προσθήκες στις βάσεις του). Ως εκ τούτου, συνιστάται η διατήρηση όσο το δυνατόν σταθερότερων συνθηκών λύσης για όλες τις αντικειμενοφόρες πλάκες δεδομένου πειράματος. Μετά την ετοιμασία τους, οι αντικειμενοφόρες πλάκες θα πρέπει να εμβαπτίζονται σε διάλυμα λύσης υπό ψύξη τουλάχιστον για μία ώρα (ή όλη τη νύχτα), σε συνθήκες θερμοκρασίας περίπου 2-8°C και χαμηλού φωτισμού, π.χ. κίτρινο φως (ή φωτοστεγανό περιβάλλον), για να αποφεύγεται η έκθεση σε λευκό φως που μπορεί να περιέχει υπεριώδεις συνιστώσες. Μετά από αυτήν την περίοδο επώασης, οι αντικειμενοφόρες πλάκες θα πρέπει να εκπλένονται για την απομάκρυνση των υπολειμμάτων απορρυπαντικού και αλάτων πριν από το στάδιο της αποπεριέλιξης με άλκαλι. Για την έκπλυση αυτή μπορεί να χρησιμοποιηθεί νερό υψηλής καθαρότητας, ρυθμιστικό διάλυμα εξουδετέρωσης ή ρυθμιστικό διάλυμα φωσφορικών αλάτων, όπως επίσης και ρυθμιστικό διάλυμα ηλεκτροφόρησης. Κατ' αυτόν τον τρόπο διατηρούνται οι αλκαλικές συνθήκες στον θάλαμο ηλεκτροφόρησης. Αποπεριέλιξη και ηλεκτροφόρηση Οι αντικειμενοφόρες πλάκες θα πρέπει να τοποθετούνται τυχαία στην τράπεζα οριζόντιας (τύπου υποβρυχίου) μονάδας ηλεκτροφόρησης που περιέχει επαρκή ποσότητα διαλύματος ηλεκτροφόρησης, ώστε οι επιφάνειες των αντικειμενοφόρων πλακών να είναι πλήρως καλυμμένες (το βάθος βύθισης θα πρέπει επίσης να παραμένει σταθερό μεταξύ των ηλεκτροφορήσεων). Σε άλλου τύπου μονάδες ηλεκτροφόρησης που χρησιμοποιούνται για τον προσδιορισμό comet, δηλ. μονάδες με ενεργητικό σύστημα ψύξης, κυκλοφορία του ψυκτικού μέσου και υψηλής απόδοσης τροφοδοτικό ρεύματος, η ένταση του ηλεκτρικού ρεύματος αυξάνεται όταν αυξάνεται το ύψος του διαλύματος υπό σταθερή τάση. Θα πρέπει να χρησιμοποιείται ισόρροπος σχεδιασμός για την τοποθέτηση των αντικειμενοφόρων πλακών στη δεξαμενή ηλεκτροφόρησης, ώστε να μετριάζονται οι επιδράσεις τυχόν τάσεων μεταβολής ή του φαινομένου των άκρων (edge effect) στο εσωτερικό της δεξαμενής και να ελαχιστοποιείται η μεταβλητότητα μεταξύ των παρτίδων, δηλ. σε κάθε εκτέλεση ηλεκτροφόρησης θα πρέπει να τοποθετείται ο ίδιος αριθμός αντικειμενοφόρων πλακών από κάθε ζώο της μελέτης και να περιλαμβάνονται δείγματα από τις διαφορετικές δοσολογικές ομάδες, καθώς και από τους αρνητικούς και θετικούς μάρτυρες. Οι αντικειμενοφόρες πλάκες θα πρέπει να αφήνονται σε ηρεμία επί τουλάχιστον 20 λεπτά για να αποπεριελιχθεί το DNA και, στη συνέχεια, να υποβάλλονται σε ηλεκτροφόρηση υπό ελεγχόμενες συνθήκες που να μεγιστοποιούν την ευαισθησία και τη δυναμική περιοχή της δοκιμής (δηλ. να δίνουν αποδεκτά επίπεδα % DNA ουράς στους θετικούς και αρνητικούς μάρτυρες για μέγιστη ευαισθησία). Ο βαθμός μετανάστευσης του DNA συνδέεται γραμμικά με τη διάρκεια της ηλεκτροφόρησης, καθώς και με τo εφαρμοζόμενo ηλεκτρικό πεδίο (V/cm). Με βάση τη μελέτη του JaCVAM, το τελευταίο μπορεί να είναι 0,7 V/cm για τουλάχιστον 20 λεπτά. Η διάρκεια της ηλεκτροφόρησης θεωρείται κρίσιμη μεταβλητή και θα πρέπει να καθορίζεται με γνώμονα τη βελτιστοποίηση της δυναμικής περιοχής. Η αύξηση της διάρκειας της ηλεκτροφόρησης (π.χ. 30 ή 40 λεπτά για τη μεγιστοποίηση της ευαισθησίας) συνήθως οδηγεί σε ισχυρότερες θετικές αποκρίσεις σε γνωστά μεταλλαξιγόνα. Ωστόσο, μπορεί επίσης να έχει ως αποτέλεσμα υπερβολική μετανάστευση στα δείγματα μαρτύρων. Σε κάθε πείραμα η τάση θα πρέπει να διατηρείται σταθερή, ενώ η μεταβλητότητα των λοιπών παραμέτρων θα πρέπει να βρίσκεται εντός μικρού και καθορισμένου εύρους· για παράδειγμα, στη μελέτη του JaCVAM, η εφαρμογή ηλεκτρικού πεδίου 0,7 V/cm απέδωσε αρχική ένταση ρεύματος 300 mA. Το βάθος του ρυθμιστικού διαλύματος θα πρέπει να ρυθμίζεται κατά τρόπο ώστε να επιτυγχάνονται οι απαιτούμενες συνθήκες, και να διατηρείται σε όλη τη διάρκεια του πειράματος. Η ένταση του ρεύματος θα πρέπει να καταγράφεται στην αρχή και στο τέλος της ηλεκτροφόρησης. Κατά συνέπεια, οι βέλτιστες συνθήκες θα πρέπει να καθορίζονται από το εκάστοτε εργαστήριο κατά την αρχική απόδειξη τεχνικής ικανότητας για κάθε μελετώμενο ιστό. Η θερμοκρασία του διαλύματος ηλεκτροφόρησης θα πρέπει να διατηρείται σε χαμηλά επίπεδα, συνήθως 2-10 °C (10), σε όλη τη διάρκεια της αποπεριέλιξης και της ηλεκτροφόρησης και να καταγράφεται κατά την έναρξη της αποπεριέλιξης, καθώς και στην αρχή και στο τέλος της ηλεκτροφόρησης. Μετά την ολοκλήρωση της ηλεκτροφόρησης, οι αντικειμενοφόρες πλάκες θα πρέπει να εμβαπτίζονται στο ρυθμιστικό διάλυμα εξουδετέρωσης ή εκπλένονται με αυτό για 5 λεπτά τουλάχιστον. Η χρώση και η ανάλυση των πηκτωμάτων μπορούν να πραγματοποιούνται όταν αυτά είναι νωπά (π.χ. εντός 1-2 ημερών) ή μετά από αφυδάτωση για μεταγενέστερη μέτρηση (π.χ. εντός 1-2 εβδομάδων μετά τη χρώση) (56). Ωστόσο, οι συνθήκες θα πρέπει να επικυρώνονται κατά την απόδειξη τεχνικής ικανότητας και θα πρέπει να συγκεντρώνονται και να διατηρούνται χωριστά ιστορικά δεδομένα για κάθε συνθήκη. Στη δεύτερη περίπτωση, οι αντικειμενοφόρες πλάκες θα πρέπει να αφυδατώνονται με εμβάπτιση σε απόλυτη αιθανόλη για τουλάχιστον 5 λεπτά, να αφήνονται να ξηρανθούν στον αέρα και, στη συνέχεια, να φυλάσσονται σε θερμοκρασία δωματίου ή σε δοχείο στο ψυγείο μέχρι την ανάλυση. Μέθοδοι μέτρησης Οι «κομήτες» θα πρέπει να ποσοτικοποιούνται με αυτόματο ή ημιαυτόματο σύστημα ανάλυσης εικόνων. Για τη χρώση των αντικειμενοφόρων πλακών χρησιμοποιείται κατάλληλη φθορίζουσα χρωστική, π.χ. SYBR Gold, Green I, ιωδιούχο προπίδιο ή βρωμιούχο αιθίδιο, και για τη μέτρηση μικροσκόπιο επιφθορισμού με κατάλληλη μεγέθυνση (π.χ. 200x), εφοδιασμένο με τους ενδεδειγμένους ανιχνευτές ή με ψηφιακή συσκευή λήψης εικόνων (π.χ. με αισθητήρα CCD). Τα κύτταρα μπορούν να καταταχθούν σε τρεις κατηγορίες, όπως περιγράφεται στον άτλαντα εικόνων κομητών (57), ήτοι μετρήσιμα, μη μετρήσιμα και σκιώδη κύτταρα (βλ. παράγραφο 56 για επεξήγηση). Για την αποφυγή τεχνητών αποτελεσμάτων, μόνο τα μετρήσιμα κύτταρα (με σαφές περίγραμμα κεφαλής και ουράς, χωρίς παρεμβολές από γειτονικά κύτταρα) θα πρέπει να λαμβάνονται υπόψη στον προσδιορισμό του % DNA ουράς. Δεν είναι αναγκαίο να αναφέρεται η συχνότητα των μη μετρήσιμων κυττάρων. Η συχνότητα των σκιωδών κυττάρων θα πρέπει να προσδιορίζεται με βάση οπτική εξέταση (δεδομένου ότι η απουσία κεφαλής με σαφές περίγραμμα συνεπάγεται ότι δεν είναι εύκολο να ανιχνευθούν με ανάλυση εικόνων) τουλάχιστον 150 κυττάρων ανά δείγμα (βλ. παράγραφο 56 για επεξήγηση) και να τεκμηριώνεται χωριστά. Όλες οι προς ανάλυση αντικειμενοφόρες πλάκες, συμπεριλαμβανομένων των πλακών των θετικών και αρνητικών μαρτύρων, θα πρέπει να κωδικοποιούνται χωριστά και να εξετάζονται τυφλά, ώστε ο εξεταστής να μη γνωρίζει τη συνθήκη μεταχείρισης. Για κάθε δείγμα (ανά ιστό και ανά ζώο), θα πρέπει να αναλύονται τουλάχιστον 150 κύτταρα (χωρίς τα σκιώδη, βλ. παράγραφο 56). Η καταμέτρηση 150 κυττάρων ανά ζώο με τουλάχιστον 5 ζώα ανά δόση (λιγότερα στην ομάδα που χρησιμεύει ως παράλληλος θετικός μάρτυρας, βλ. παράγραφο 29) παρέχει επαρκή στατιστική ισχύ σύμφωνα με την ανάλυση των Smith και συν., 2008 (5). Εάν χρησιμοποιούνται αντικειμενοφόρες πλάκες, ο αριθμός αυτός θα μπορούσε να εξασφαλιστεί με την ανάλυση 2 ή 3 πλακών ανά δείγμα, όταν χρησιμοποιούνται ομάδες πέντε ζώων. Θα πρέπει να παρατηρούνται πολλές περιοχές των αντικειμενοφόρων πλακών με πυκνότητα που να αποκλείει την αλληλεπικάλυψη των ουρών. Η καταμέτρηση στα άκρα των αντικειμενοφόρων πλακών θα πρέπει να αποφεύγεται. Οι ρήξεις κλώνων του DNA μπορούν να μετρηθούν στον προσδιορισμό comet με ανεξάρτητα τελικά σημεία, όπως το % DNA ουράς, το μήκος της ουράς και η ορμή της. Όλες αυτές οι μετρήσεις μπορούν να εκτελούνται, εάν χρησιμοποιείται το κατάλληλο λογισμικό ανάλυσης εικόνων. Ωστόσο, για την αξιολόγηση και την ερμηνεία των αποτελεσμάτων, συνιστάται η χρήση του % DNA ουράς (γνωστό και ως % έντασης ουράς) (12) (40) (41) (42), το οποίο προσδιορίζεται από την ένταση φθορισμού των θραυσμάτων DNA της ουράς, εκφραζόμενη ως επί τοις εκατό ποσοστό της συνολικής έντασης φθορισμού του κυττάρου (13). Βλάβες των ιστών και κυτταροτοξικότητα Τα θετικά ευρήματα στον προσδιορισμό comet μπορεί να μην οφείλονται αποκλειστικά σε γονιδιοτοξικότητα, καθώς η τοξικότητα για τον στοχευόμενο ιστό ενδέχεται επίσης να επιφέρει αύξηση της μετανάστευσης του DNA (12) (41). Αντιστρόφως, παρατηρείται συχνά χαμηλή ή μέτρια κυτταροτοξικότητα με γνωστές γονιδιοτοξίνες (12), γεγονός που δείχνει ότι, μόνο με τον προσδιορισμό comet, δεν είναι δυνατόν να γίνει διάκριση μεταξύ της μετανάστευσης του DNA που επάγεται από γονιδιοτοξικότητα και εκείνης που επάγεται από κυτταροτοξικότητα. Ωστόσο, όταν παρατηρούνται αυξήσεις της μετανάστευσης του DNA, συνιστάται η εξέταση ενός ή περισσότερων δεικτών κυτταροτοξικότητας, δεδομένου ότι αυτή μπορεί να υποβοηθήσει την ερμηνεία των ευρημάτων. Η αύξηση της μετανάστευσης του DNA που συνοδεύεται από σαφή εκδήλωση κυτταροτοξικότητας θα πρέπει να ερμηνεύεται με προσοχή. Έχουν προταθεί πολλά μέσα μέτρησης της κυτταροτοξικότητας και, μεταξύ αυτών, οι ιστοπαθολογικές αλλαγές θεωρούνται κατάλληλη παράμετρος τοξικότητας για τους ιστούς. Μολονότι παρατηρήσεις όπως φλεγμονές, κυτταρική διήθηση και αποπτωτικές ή νεκρωτικές αλλαγές έχουν συσχετιστεί με αύξηση της μετανάστευσης του DNA, εν τούτοις, όπως κατέδειξε η μελέτη επικύρωσης του JaCVAM (12), δεν υπάρχει οριστικός κατάλογος ιστοπαθολογικών αλλαγών που να συνδέονται πάντοτε με την αύξηση της μετανάστευσης του DNA. Οι μεταβολές παραμέτρων κλινικής χημείας (π.χ. ηπατικά ένζυμα AST και ALT) μπορούν επίσης να προσφέρουν χρήσιμες πληροφορίες σχετικά με βλάβες ιστών, ενώ μπορούν επίσης να λαμβάνονται υπόψη επιπλέον δείκτες, όπως η ενεργοποίηση κασπασών, η χρώση TUNEL ή με αννεξίνη V κ.λπ. Ωστόσο, τα δημοσιευμένα δεδομένα σχετικά με περιπτώσεις χρήσης των τελευταίων σε μελέτες in vivo είναι περιορισμένα και άνισης αξιοπιστίας. Τα σκιώδη κύτταρα (ή κύτταρα-φαντάσματα/ghost cells) είναι κύτταρα των οποίων η μικροσκοπική εικόνα συνίσταται σε μικρή ή ανύπαρκτη κεφαλή και πλατιά διάχυτη ουρά και τα οποία θεωρείται ότι έχουν υποστεί σοβαρή βλάβη, αν και η αιτιολογία της παρουσίας τους είναι αβέβαιη (βλ. προσάρτημα 3). Λόγω της όψης τους, οι μετρήσεις του % DNA ουράς με ανάλυση εικόνων δεν είναι αξιόπιστες και, ως εκ τούτου, τα σκιώδη κύτταρα θα πρέπει να αξιολογούνται χωριστά. Η εμφάνιση σκιωδών κυττάρων θα πρέπει να σημειώνεται και να αναφέρεται, ενώ κάθε σχετική αύξηση που πιστεύεται ότι οφείλεται στην υπό δοκιμή χημική ουσία θα πρέπει να διερευνάται και να ερμηνεύεται με προσοχή. Η γνώση του δυνητικού τρόπου δράσης της υπό δοκιμή χημικής ουσίας μπορεί να συμβάλει στις εν λόγω εκτιμήσεις. ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Επεξεργασία των αποτελεσμάτων Η πειραματική μονάδα είναι το ζώο και, ως εκ τούτου, θα πρέπει να παρουσιάζονται σε μορφή πίνακα τόσο τα δεδομένα για κάθε ζώο όσο και σύνοψη των αποτελεσμάτων. Λόγω του ιεραρχικού χαρακτήρα των δεδομένων, συνιστάται να προσδιορίζεται η διάμεση τιμή % DNA ουράς για κάθε αντικειμενοφόρο πλάκα και να υπολογίζεται η μέση τιμή των διάμεσων τιμών για κάθε ζώο (12). Στη συνέχεια, προσδιορίζεται ο μέσος όρος των μέσων τιμών των επιμέρους ζώων για να προκύψει ομαδική μέση τιμή. Όλες αυτές οι τιμές θα πρέπει να περιλαμβάνονται στην έκθεση. Μπορούν να εφαρμοστούν εναλλακτικές προσεγγίσεις (βλ. παράγραφο 53), εφόσον δικαιολογούνται από επιστημονικής και στατιστικής πλευράς. Η στατιστική ανάλυση μπορεί να διενεργηθεί με την εφαρμογή διαφόρων προσεγγίσεων (58) (59) (60) (61). Κατά την επιλογή των στατιστικών μεθόδων που θα χρησιμοποιηθούν, θα πρέπει να λαμβάνεται υπόψη η ανάγκη μετασχηματισμού (π.χ. λογαριθμικού ή τετραγωνικού) των δεδομένων και/ή προσθήκης ενός μικρού αριθμού (π.χ. 0,001) σε όλες τις τιμές (ακόμη και στις μη μηδενικές) για τον μετριασμό των επιπτώσεων των μηδενικών τιμών κυττάρων, όπως εξηγείται στις ανωτέρω βιβλιογραφικές παραπομπές. Λεπτομέρειες για την ανάλυση των αλληλεπιδράσεων μεταχείρισης-φύλου, όταν χρησιμοποιούνται και τα δύο φύλα, και για την επακόλουθη ανάλυση των δεδομένων, αναλόγως του αν διαπιστώνονται διαφορές ή όχι, παρατίθενται στο προσάρτημα 2. Θα πρέπει επίσης να αναφέρονται δεδομένα για την τοξικότητα και τα κλινικά σημεία. Κριτήρια αποδοχής Η αποδοχή μιας δοκιμής βασίζεται στα ακόλουθα κριτήρια:
Αξιολόγηση και ερμηνεία των αποτελεσμάτων Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς θετική εάν:
Όταν πληρούνται όλα αυτά τα κριτήρια, η υπό δοκιμή χημική ουσία θεωρείται ικανή να επάγει ρήξη κλώνων του DNA στους ιστούς που μελετώνται με το παρόν σύστημα δοκιμής. Εάν πληρούνται μόνο ένα ή δύο από αυτά τα κριτήρια, βλ. παράγραφο 62. Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς αρνητική εάν:
Η υπό δοκιμή χημική ουσία θεωρείται τότε ότι δεν μπορεί να επαγάγει ρήξη κλώνων του DNA στους ιστούς που μελετώνται με το παρόν σύστημα δοκιμής. Δεν απαιτείται επαλήθευση των σαφώς θετικών ή αρνητικών αποκρίσεων. Σε περίπτωση που η απόκριση δεν είναι σαφώς θετική ούτε σαφώς αρνητική (δηλ. δεν πληρούνται όλα τα κριτήρια της παραγράφου 59 ή 60) και για να διαπιστωθεί η βιολογική σημασία ενός αποτελέσματος, τα δεδομένα θα πρέπει να αξιολογούνται κατά την κρίση των ειδικών και/ή με περαιτέρω διερεύνηση, εφόσον δικαιολογείται επιστημονικά. Η καταμέτρηση επιπλέον κυττάρων (κατά περίπτωση) ή η επανάληψη του πειράματος, ενδεχομένως με τη χρήση βελτιστοποιημένων πειραματικών συνθηκών (π.χ. αποστάσεις μεταξύ των δόσεων, άλλες οδοί χορήγησης, άλλοι χρόνοι δειγματοληψίας ή άλλοι ιστοί) θα μπορούσε να είναι χρήσιμη. Σε σπάνιες περιπτώσεις, ακόμη και μετά από περαιτέρω διερεύνηση, το σύνολο δεδομένων δεν επιτρέπει την εξαγωγή συμπεράσματος για θετικά ή αρνητικά αποτελέσματα και, κατά συνέπεια, η έκβαση κρίνεται διφορούμενη. Για την αξιολόγηση της βιολογικής σημασίας θετικού ή διφορούμενου αποτελέσματος, απαιτούνται στοιχεία σχετικά με την κυτταροτοξικότητα στον στοχευόμενο ιστό (βλ. παραγράφους 54-55). Όταν υπάρχουν θετικά ή διφορούμενα ευρήματα μόνο παράλληλα με σαφείς ενδείξεις κυτταροτοξικότητας, η μελέτη θα κρίνεται διφορούμενη ως προς τη γονιδιοτοξικότητα, εκτός εάν υπάρχουν επαρκή στοιχεία που να στηρίζουν τη συναγωγή οριστικού συμπεράσματος. Σε περίπτωση αρνητικής έκβασης της μελέτης, η οποία συνοδεύεται από σημεία τοξικότητας σε όλες τις δοκιμασθείσες δόσεις, μπορεί να είναι σκόπιμη η περαιτέρω μελέτη με μη τοξικές δόσεις. Έκθεση δοκιμής Στην έκθεση δοκιμής θα πρέπει να περιλαμβάνονται τα ακόλουθα στοιχεία:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Ηλεκτροφόρηση μοναδικών κυττάρων σε πήκτωμα σε αλκαλικές συνθήκες : ευαίσθητη τεχνική για την ανίχνευση πρωτογενών βλαβών του DNA σε επίπεδο μεμονωμένων κυττάρων/πυρήνων. Χημικό προϊόν : μια ουσία ή ένα μείγμα. Comet (κομήτης) : το σχήμα που παίρνουν τα νουκλεοειδή υπό την επίδραση ηλεκτροφορητικού πεδίου και το οποίο μοιάζει με κομήτη: η κεφαλή του είναι ο πυρήνας και η ουρά του αποτελείται από DNA που μεταναστεύει από τον πυρήνα εντός του ηλεκτρικού πεδίου. Κρίσιμη μεταβλητή/παράμετρος : πρόκειται για μεταβλητή του πρωτοκόλλου, μια μικρή αλλαγή της οποίας μπορεί να έχει μεγάλο αντίκτυπο στο συμπέρασμα του προσδιορισμού. Οι κρίσιμες μεταβλητές μπορεί να είναι ειδικές για κάθε ιστό. Δεν θα πρέπει να τροποποιούνται, ιδίως κατά τη διάρκεια μιας δοκιμής, χωρίς να λαμβάνεται υπόψη ο τρόπος με τον οποίο η τροποποίηση θα μεταβάλει την απόκριση στον προσδιορισμό, όπως προκύπτει, για παράδειγμα, από το μέγεθος και τη μεταβλητότητα της απόκρισης των θετικών και αρνητικών μαρτύρων. Στην έκθεση δοκιμής θα πρέπει να απαριθμούνται οι τροποποιήσεις κρίσιμων μεταβλητών που έγιναν κατά τη διάρκεια της δοκιμής ή σε σύγκριση με το τυποποιημένο πρωτόκολλο του εργαστηρίου και να αιτιολογείται κάθε τροποποίηση. Ένταση ουράς ή % DNA ουράς : αντιστοιχεί στην ένταση φθορισμού της ουράς του κομήτη σε σχέση με τη συνολική ένταση (κεφαλής και ουράς) και αντικατοπτρίζει την έκταση της ρήξης του DNA, εκφραζόμενη ως εκατοστιαία αναλογία. Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. UVCB : Ουσίες άγνωστης ή μεταβλητής σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά. Προσάρτημα 2 ΠΑΡΑΓΟΝΤΙΚΟΣ ΣΧΕΔΙΑΣΜΟΣ ΓΙΑ ΤΟΝ ΠΡΟΣΔΙΟΡΙΣΜΟ ΤΩΝ ΔΙΑΦΟΡΩΝ ΜΕΤΑΞΥ ΤΩΝ ΦΥΛΩΝ ΣΤΟΝ ΠΡΟΣΔΙΟΡΙΣΜΟ COMET IN VIVO Ο παραγοντικός σχεδιασμός και η σχετική ανάλυση Σύμφωνα με τον παρόντα σχεδιασμό, υποβάλλονται σε δοκιμή τουλάχιστον 5 αρσενικά και 5 θηλυκά άτομα σε κάθε επίπεδο συγκέντρωσης, με αποτέλεσμα τη χρήση τουλάχιστον 40 ζώων (20 αρσενικών και 20 θηλυκών, συν τους αντίστοιχους θετικούς μάρτυρες.) Πρόκειται για έναν από τους απλούστερους παραγοντικούς σχεδιασμούς, που ισοδυναμεί με αμφίδρομη ανάλυση διασποράς στην οποία ως κύριες επιδράσεις θεωρούνται το φύλο και το επίπεδο συγκέντρωσης. Τα δεδομένα μπορούν να αναλυθούν με πολλά τυποποιημένα στατιστικά πακέτα λογισμικού, όπως τα SPSS, SAS, STATA, Genstat, καθώς και με τη χρήση του συστήματος R. Κατά την ανάλυση διαχωρίζεται η μεταβλητότητα στο σύνολο δεδομένων σε μεταβλητότητα μεταξύ των φύλων, μεταβλητότητα μεταξύ των συγκεντρώσεων και μεταβλητότητα σχετιζόμενη με την αλληλεπίδραση μεταξύ των φύλων και των συγκεντρώσεων. Καθένας από τους όρους αυτούς συγκρίνεται με την εκτίμηση της μεταβλητότητας μεταξύ των ζώων επανάληψης (replicates) που απαρτίζουν τις ομάδες ζώων του ίδιου φύλου στις οποίες χορηγείται η ίδια συγκέντρωση. Περισσότερες λεπτομέρειες σχετικά με την υποκείμενη μεθοδολογία είναι διαθέσιμες σε πολλά κλασικά εγχειρίδια στατιστικής (βλ. βιβλιογραφία) και στις λειτουργίες βοήθειας (Help) που παρέχονται με τα στατιστικά πακέτα λογισμικού. Στο επόμενο στάδιο της ανάλυσης εξετάζεται ο όρος αλληλεπίδρασης φύλο x συγκέντρωση σε πίνακα ANOVA (35). Ελλείψει σημαντικού όρου αλληλεπίδρασης, οι συνδυασμένες τιμές στα φύλα ή στα επίπεδα συγκέντρωσης τροφοδοτούν έγκυρους στατιστικούς ελέγχους μεταξύ των επιπέδων με βάση τη συγχωνευμένη ενδοομαδική μεταβλητότητα (pooled within-group variability), όρο που παρέχεται από την ANOVA. Η ανάλυση συνεχίζεται με τον διαχωρισμό της εκτίμησης της μεταβλητότητας μεταξύ των συγκεντρώσεων σε αντιθέσεις που τροφοδοτούν έλεγχο για τις γραμμικές και τετραγωνικές αντιθέσεις των αποκρίσεων σε όλα τα επίπεδα συγκέντρωσης. Όταν υπάρχει σημαντική αλληλεπίδραση φύλου x συγκέντρωση, ο όρος αυτός μπορεί επίσης να διαχωριστεί σε αντιθέσεις γραμμικής x φύλο και τετραγωνικής x φύλο αλληλεπίδρασης. Οι εν λόγω όροι τροφοδοτούν ελέγχους με σκοπό να εξακριβωθεί αν οι αποκρίσεις στη συγκέντρωση είναι παράλληλες για τα δύο φύλα ή διαφοροποιούνται ανάλογα με το φύλο. Η εκτίμηση της συγχωνευμένης ενδοομαδικής μεταβλητότητας μπορεί να χρησιμοποιηθεί για κατά ζεύγη ελέγχους της διαφοράς μεταξύ των μέσων τιμών. Οι έλεγχοι αυτοί μπορούν να αφορούν συγκρίσεις μεταξύ των μέσων τιμών στα δύο φύλα και μεταξύ των μέσων τιμών στα διάφορα επίπεδα συγκέντρωσης, όπως π.χ. οι συγκρίσεις με τα επίπεδα των αρνητικών μαρτύρων. Στις περιπτώσεις σημαντικής αλληλεπίδρασης, μπορούν να γίνουν συγκρίσεις μεταξύ των μέσων τιμών των διαφόρων συγκεντρώσεων στο ίδιο φύλο ή μεταξύ των μέσων τιμών των φύλων στην ίδια συγκέντρωση. Βιβλιογραφία Υπάρχουν πολλά εγχειρίδια στατιστικής που πραγματεύονται τη θεωρία, τον σχεδιασμό, τη μεθοδολογία, την ανάλυση και την ερμηνεία παραγοντικών σχεδιασμών οι οποίοι εκτείνονται από τις απλούστερες αναλύσεις δύο παραγόντων έως τις πλέον περίπλοκες μορφές που χρησιμοποιούνται στη μεθοδολογία σχεδιασμού πειραμάτων. Ο κατάλογος που ακολουθεί δεν είναι πλήρης. Ορισμένα βιβλία παρέχουν πρακτικά παραδείγματα εφαρμογής συγκρίσιμων σχεδιασμών, συνοδευόμενα σε ορισμένες περιπτώσεις από κώδικα για τη διενέργεια των αναλύσεων με τη χρήση διαφόρων πακέτων λογισμικού.
Προσάρτημα 3 ΤΡΕΧΟΝΤΕΣ ΠΕΡΙΟΡΙΣΜΟΙ ΤΟΥ ΠΡΟΣΔΙΟΡΙΣΜΟΥ Λόγω του σημερινού επιπέδου γνώσεων, ο προσδιορισμός comet in vivo υπόκειται σε διάφορους περιορισμούς. Αναμένεται ότι οι περιορισμοί αυτοί θα μειωθούν ή θα καθοριστούν με ακριβέστερες λεπτομέρειες, όταν θα έχει αποκομιστεί μεγαλύτερη πείρα στην εφαρμογή του εν λόγω προσδιορισμού για την αντιμετώπιση ζητημάτων ασφάλειας εντός ρυθμιστικού πλαισίου.
Βιβλιογραφία
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(16) |
Στο μέρος Γ, το Κεφάλαιο Γ.13 αντικαθίσταται από το ακόλουθο κείμενο: «Γ.13 Βιοσυσσώρευση σε ψάρια: Υδατική και διατροφική έκθεση ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 305 του ΟΟΣΑ (2012). Ο βασικός στόχος της παρούσας αναθεώρησης της μεθόδου δοκιμών είναι διττός. Πρώτον, επιδιώκεται να ενσωματωθεί στη μέθοδο μια δοκιμή διατροφικής βιοσυσσώρευσης (36) κατάλληλη για τον προσδιορισμό του δυναμικού βιοσυσσώρευσης ουσιών με πολύ χαμηλή υδατοδιαλυτότητα. Δεύτερον, επιδιώκεται να καταρτιστεί μια μέθοδος δοκιμών που, για λόγους καλής μεταχείρισης των ζώων, απαιτεί τη χρήση μικρότερου αριθμού ψαριών, κατά περίπτωση, και είναι οικονομικά αποδοτικότερη. Στο διάστημα που μεσολάβησε από τη θέσπιση της κωδικοποιημένης μεθόδου δοκιμών Γ.13 (1), υποβλήθηκαν σε δοκιμές πολυάριθμες ουσίες και τόσο τα εργαστήρια όσο και οι ρυθμιστικές αρχές απόκτησαν σημαντική πείρα. Κατόπιν τούτου, διαμορφώθηκε η πεποίθηση ότι η πολυπλοκότητα της δοκιμής μπορεί να μειωθεί, εάν πληρούνται συγκεκριμένα κριτήρια (βλ. παράγραφο 88), και ότι είναι δυνατή η εφαρμογή κλιμακωτής προσέγγισης. Η πείρα έχει επίσης δείξει ότι βιολογικοί παράγοντες όπως η ανάπτυξη και το λιπιδικό περιεχόμενο των ψαριών μπορούν να επηρεάσουν σημαντικά τα αποτελέσματα και θα πρέπει ενδεχομένως να λαμβάνονται υπόψη. Επιπλέον, αναγνωρίζεται πλέον ότι η δοκιμή πολύ δυσδιάλυτων στο νερό ουσιών μπορεί να μην είναι τεχνικά εφικτή. Επιπλέον, για τις ουσίες πολύ χαμηλής υδατοδιαλυτότητας στο υδάτινο περιβάλλον, η έκθεση μέσω του νερού ενδέχεται να έχει περιορισμένη σημασία σε σχέση με τη διατροφική οδό. Για τους λόγους αυτούς, αναπτύχθηκε μέθοδος δοκιμών σύμφωνα με την οποία τα ψάρια εκτίθενται μέσω της διατροφής τους (βλ. παραγράφους 7-14 και 97 και επόμενες). Η επικύρωση [διεργαστηριακή δοκιμή τεχνικής ικανότητας (ring test)] της δοκιμής διατροφικής έκθεσης πραγματοποιήθηκε το 2010 (51). Στις βασικές αλλαγές συγκαταλέγονται οι ακόλουθες:
Πριν από τη διεξαγωγή οποιασδήποτε από τις δοκιμές βιοσυσσώρευσης, θα πρέπει να είναι γνωστά τα ακόλουθα στοιχεία σχετικά με την υπό δοκιμή χημική ουσία:
Ανεξάρτητα από τη μέθοδο έκθεσης ή το σχήμα δειγματοληψίας που επιλέγεται, στην παρούσα μέθοδο δοκιμών περιγράφεται διαδικασία για τον χαρακτηρισμό του δυναμικού βιοσυσσώρευσης ουσιών σε ψάρια. Αν και τα συστήματα δοκιμής με συνεχή ροή είναι κατά πολύ προτιμότερα, επιτρέπεται η χρήση ημιστατικών συστημάτων υπό την προϋπόθεση ότι πληρούνται τα κριτήρια εγκυρότητας (βλ. παραγράφους 24 και 113). Στην έκθεση μέσω της διατροφικής οδού, το σύστημα συνεχούς ροής δεν είναι απαραίτητο για τη διατήρηση των συγκεντρώσεων της υπό δοκιμή ουσίας στο νερό, αλλά διευκολύνει τη διατήρηση επαρκών συγκεντρώσεων διαλυμένου οξυγόνου και συμβάλλει στην εξασφάλιση καθαρού νερού και στην εξάλειψη των επιδράσεων, λόγου χάριν, των προϊόντων απέκκρισης. Ανεξάρτητα από την επιλεγόμενη δοκιμή, στην παρούσα μέθοδο δοκιμών παρέχονται επαρκείς λεπτομέρειες για τη διεξαγωγή της δοκιμής, ενώ παράλληλα παρέχεται ελευθερία για την προσαρμογή του σχεδιασμού του πειράματος στις συνθήκες του εκάστοτε εργαστηρίου και στα ποικίλα χαρακτηριστικά των υπό δοκιμή ουσιών. Η δοκιμή υδατικής έκθεσης εφαρμόζεται κατά προτίμηση σε σταθερές οργανικές ουσίες με τιμές log K OW που κυμαίνονται μεταξύ 1,5 και 6,0 (13), αλλά μπορεί να εφαρμοστεί και σε έντονα υδρόφοβες ουσίες (με log K OW > 6,0), εάν μπορεί να αποδειχθεί ότι η υπό δοκιμή ουσία διαλύεται πλήρως στο νερό και διατηρεί σταθερή τη συγκέντρωσή της. Εάν δεν είναι δυνατόν να αποδειχθεί η σταθερότητα της συγκέντρωσης της υπό δοκιμή ουσίας στο νερό, η μελέτη υδατικής έκθεσης δεν θα είναι κατάλληλη και, συνεπώς, θα απαιτείται η διατροφική προσέγγιση για τη δοκιμή της ουσίας σε ψάρια (αν και η ερμηνεία και η χρήση των αποτελεσμάτων της διατροφικής δοκιμής μπορεί να εξαρτώνται από το ρυθμιστικό πλαίσιο). Προεκτιμήσεις του συντελεστή βιοσυγκέντρωσης (BCF, συμβολίζεται ενίοτε και ως K B) για οργανικές ουσίες με τιμές log K OW περίπου έως 9,0 μπορούν να ληφθούν με τη χρήση της εξίσωσης των Bintein και συν. (14). Η προεκτίμηση του συντελεστή βιοσυγκέντρωσης για τέτοιου είδους έντονα υδρόφοβες ουσίες ενδέχεται να είναι υψηλότερη από την τιμή του συντελεστή βιοσυγκέντρωσης σε σταθερή κατάσταση (BCFSS) που αναμένεται να προκύψει από εργαστηριακά πειράματα, ιδίως όταν χρησιμοποιείται απλό γραμμικό μοντέλο για την προεκτίμηση. Οι παράμετροι που χαρακτηρίζουν το δυναμικό βιοσυσσώρευσης περιλαμβάνουν τη σταθερά ρυθμού πρόσληψης (k 1), τις σταθερές ρυθμού απώλειας που περιλαμβάνουν τη σταθερά ρυθμού αποβολής (k 2), τον συντελεστή βιοσυγκέντρωσης σε σταθερή κατάσταση (BCFSS), τον κινητικό συντελεστή βιοσυγκέντρωσης (BCFK) και τον διατροφικό συντελεστή βιομεγέθυνσης (BMF) (38). Οι ραδιοσημασμένες υπό δοκιμή ουσίες μπορούν να διευκολύνουν την ανάλυση δειγμάτων νερού, τροφής και ψαριών και επιτρέπεται να χρησιμοποιούνται για να διαπιστώνεται αν είναι αναγκαίο να γίνει ταυτοποίηση και ποσοτικοποίηση μεταβολιτών. Εάν μετρώνται μόνο τα ολικά ραδιενεργά κατάλοιπα (π.χ. με καύση ή με διαλυτοποίηση ιστών), ο BCF ή ο BMF βασίζεται στο σύνολο της μητρικής ουσίας, τυχόν κατακρατούμενων μεταβολιτών και του αφομοιωμένου άνθρακα. Οι τιμές BCF ή BMF που βασίζονται στα ολικά ραδιενεργά κατάλοιπα ενδέχεται να μην είναι, συνεπώς, ευθέως συγκρίσιμες με τις τιμές του BCF ή του BMF που προκύπτουν από ειδική χημική ανάλυση μόνο της μητρικής ουσίας. Στις μελέτες με ραδιοσήμανση μπορούν να χρησιμοποιούνται, πριν από την ανάλυση, διαδικασίες διαχωρισμού, όπως οι TLC, HPLC ή GC (39), με σκοπό τον προσδιορισμό του BCF ή του BMF με βάση τη μητρική ουσία. Όταν εφαρμόζονται τεχνικές διαχωρισμού, θα πρέπει να γίνεται ταυτοποίηση και ποσοτικοποίηση της μητρικής ουσίας και των σχετικών μεταβολιτών (40) (βλ. παράγραφο 65), εάν ο BCF ή ο BMF πρόκειται να βασίζεται στη συγκέντρωση της μητρικής ουσίας στα ψάρια και όχι στα ολικά ραδιοσημασμένα κατάλοιπα. Είναι επίσης δυνατόν να συνδυαστεί μια μελέτη μεταβολισμού σε ψάρια ή κατανομής in vivo με μελέτη βιοσυσσώρευσης με ανάλυση και ταυτοποίηση των καταλοίπων σε ιστούς. Η πιθανότητα μεταβολισμού μπορεί να προβλεφθεί με κατάλληλα εργαλεία [π.χ. εργαλειοθήκη QSAR του ΟΟΣΑ (15) ή ιδιόκτητα προγράμματα QSAR]. Η απόφαση για το αν θα διεξαχθεί δοκιμή υδατικής ή διατροφικής έκθεσης και με ποιο σχεδιασμό θα πρέπει να βασίζεται σε συνεκτίμηση των παραγόντων της παραγράφου 3 και του σχετικού ρυθμιστικού πλαισίου. Για παράδειγμα, για ουσίες με υψηλό K OW που παρουσιάζουν, όμως, ικανοποιητική υδατοδιαλυτότητα σε σχέση με την ευαισθησία των διαθέσιμων αναλυτικών τεχνικών, θα πρέπει να εξετάζεται πρώτα η δυνατότητα διεξαγωγής δοκιμής υδατικής έκθεσης. Επειδή, ωστόσο, είναι πιθανόν τα στοιχεία για την υδατοδιαλυτότητα να μην είναι οριστικά γι' αυτά τα είδη υδρόφοβων ουσιών, θα πρέπει να εξετάζεται η δυνατότητα επίτευξης σταθερών, μετρήσιμων συγκεντρώσεων διαλυμένης ουσίας στο νερό (δεν επιτρέπονται τα σταθερά γαλακτώματα) που να μπορούν να χρησιμοποιηθούν σε μελέτη υδατικής έκθεσης, πριν από τη λήψη απόφασης για τη μέθοδο δοκιμών που θα χρησιμοποιηθεί (16). Δεν είναι δυνατόν να δοθούν ακριβείς αναλυτικές οδηγίες σχετικά με τη μέθοδο που πρέπει να χρησιμοποιείται με βάση κριτήρια αποκλεισμού σχετικά με την υδατοδιαλυτότητα και τον συντελεστή κατανομής σε μείγμα οκτανόλης-νερού, διότι και άλλοι παράγοντες (αναλυτικές τεχνικές, αποδόμηση, προσρόφηση κ.λπ.) μπορούν να έχουν σημαντική επίδραση στην εφαρμοσιμότητα της μεθόδου για τους προαναφερθέντες λόγους. Ωστόσο, τιμές log K OW υψηλότερες από 5 και υδατοδιαλυτότητας χαμηλότερες από ~0,01-0,1 mg/l οριοθετούν το φάσμα ουσιών για τις οποίες η διεξαγωγή δοκιμών υδατικής έκθεσης ενδεχομένως καθίσταται πιο δύσκολη. Θα πρέπει να λαμβάνονται υπόψη και άλλοι παράγοντες που μπορούν να επηρεάσουν την επιλογή δοκιμής, όπως το δυναμικό προσρόφησης της ουσίας στα δοχεία και τα όργανα της δοκιμής, η σταθερότητά της σε υδατικό διάλυμα σε σχέση με τη σταθερότητά της στην ιχθυοτροφή (17) (18) κ.λπ. Πληροφορίες σχετικά με αυτές τις πρακτικές πτυχές μπορεί να είναι διαθέσιμες από άλλες ολοκληρωμένες μελέτες υδατικής έκθεσης. Πρόσθετες πληροφορίες για την αξιολόγηση των πτυχών που αφορούν τη διεξαγωγή μελετών βιοσυσσώρευσης είναι διαθέσιμες στη βιβλιογραφία [π.χ. (19)]. Όσον αφορά τις ουσίες για τις οποίες η διαλυτότητα ή η διατήρηση των συγκεντρώσεων στο νερό, καθώς και η ανάλυση των συγκεντρώσεων αυτών δεν θέτουν περιορισμούς στην εφαρμογή μεθόδου υδατικής έκθεσης, αυτή είναι η προτιμώμενη μέθοδος για τον προσδιορισμό του δυναμικού βιοσυγκέντρωσης της ουσίας. Σε κάθε περίπτωση, θα πρέπει να επαληθεύεται ότι οι συγκεντρώσεις υδατικής έκθεσης που θα εφαρμοστούν είναι εντός της υδατοδιαλυτότητας στα μέσα δοκιμής. Μπορούν να χρησιμοποιούνται διάφορες μέθοδοι για τη διατήρηση σταθερών συγκεντρώσεων της διαλυμένης υπό δοκιμή ουσίας, όπως η χρήση διαλυμάτων παρακαταθήκης ή παθητικών δοσιμετρικών συστημάτων (π.χ. μέθοδος έκλουσης στήλης), εφόσον είναι δυνατόν να αποδειχθεί ότι οι συγκεντρώσεις διατηρούνται σταθερές και τα μέσα της δοκιμής δεν διαφέρουν από τα συνιστώμενα στην παράγραφο 27. Για εξαιρετικά υδρόφοβες ουσίες (με log K OW > 5 και διαλυτότητα μικρότερη από ~ 0,01-0,1 mg/l), η δοκιμή μέσω υδατικής έκθεσης μπορεί να γίνεται σταδιακά δυσκολότερη. Οι λόγοι που επιβάλλουν περιορισμούς μπορεί να είναι το ότι η συγκέντρωση στο νερό δεν μπορεί να διατηρηθεί σε επίπεδο που θεωρείται επαρκώς σταθερό (π.χ. εξαιτίας ρόφησης στο γυαλί των δοχείων έκθεσης ή ταχείας πρόσληψης από τα ψάρια) ή το ότι πρόκειται να χρησιμοποιηθούν τόσο χαμηλές συγκεντρώσεις στο νερό, ώστε να είναι της ίδιας τάξης μεγέθους με το όριο ποσοτικοποίησης ή και χαμηλότερες (41). Για τις εν λόγω εξαιρετικά υδρόφοβες ουσίες, συνιστάται η δοκιμή διατροφικής έκθεσης, υπό την προϋπόθεση ότι είναι σύμφωνη με το σχετικό ρυθμιστικό πλαίσιο και τις απαιτήσεις εκτίμησης κινδύνου. Για τις επιφανειοδραστικές (τασιενεργές) ουσίες θα πρέπει να εξετάζεται κατά πόσον είναι εφικτή η δοκιμή βιοσυγκέντρωσης με υδατική έκθεση, λαμβανομένων υπόψη των ιδιοτήτων της ουσίας· διαφορετικά, η μελέτη διατροφικής έκθεσης είναι μάλλον καταλληλότερη. Οι επιφανειοδραστικές ουσίες είναι μέσα επιφανειακής δράσης που μειώνουν την τάση στη μεσεπιφάνεια μεταξύ δύο υγρών. Ο αμφίφιλος χαρακτήρας τους (δηλ. περιέχουν και υδρόφιλο και υδρόφοβο μέρος) προκαλεί τη συσσώρευσή τους σε μεσεπιφάνειες, όπως οι μεσεπιφάνειες νερού-αέρα και νερού-τροφής, καθώς και στα γυάλινα τοιχώματα, φαινόμενο που δυσχεραίνει τον προσδιορισμό της συγκέντρωσής τους στο νερό. Με τη δοκιμή διατροφικής έκθεσης μπορούν να παρακαμφθούν ορισμένες πτυχές της έκθεσης σε πολύπλοκα μείγματα με συστατικά που παρουσιάζουν διαφορετικά όρια υδατοδιαλυτότητας, υπό την έννοια ότι η συγκρίσιμη έκθεση σε όλα τα συστατικά του μείγματος είναι πιο πιθανή από ό,τι στη μέθοδο υδατικής έκθεσης [βλ. (20)]. Πρέπει να σημειωθεί ότι με τη διατροφική προσέγγιση λαμβάνεται συντελεστής διατροφικής βιομεγέθυνσης (BMF) και όχι συντελεστής βιοσυγκέντρωσης (BCF) (42). Υπάρχουν προσεγγίσεις για την εκτίμηση του κινητικού συντελεστή βιοσυγκέντρωσης (BCFK) από δεδομένα που παράγονται με τη μελέτη διατροφικής έκθεσης (όπως εξηγείται στο προσάρτημα 8), αλλά θα πρέπει να εφαρμόζονται με προσοχή. Οι προσεγγίσεις αυτές βασίζονται σε παραδοχή κινητικής πρώτης τάξης και μπορούν να εφαρμοστούν μόνο σε ορισμένες ομάδες ενώσεων. Είναι μάλλον απίθανο να μπορούν να εφαρμοστούν στις επιφανειοδραστικές ουσίες (βλ. παράγραφο 12). Ο σχεδιασμός ελαχιστοποιημένης δοκιμής υδατικής έκθεσης με λιγότερα χρονικά σημεία δειγματοληψίας, που αποσκοπεί στην εξοικονόμηση ζώων και/ή πόρων (βλ. παράγραφο 83 και επόμενες), θα πρέπει να εφαρμόζεται μόνο σε ουσίες για τις οποίες αναμένεται εύλογα ότι η πρόσληψη και η αποβολή ακολουθούν κατά προσέγγιση κινητική πρώτης τάξης (δηλ., γενικά, σε μη ιονισμένες οργανικές ουσίες, βλ. παράγραφο 88). Γ.13 — Ι: Δοκιμή βιοσυγκέντρωσης σε ψάρια με υδατική έκθεση ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ Η δοκιμή αποτελείται από δύο φάσεις: τη φάση της έκθεσης (πρόσληψη) και τη φάση μετά την έκθεση (αποβολή). Κατά τη διάρκεια της φάσης πρόσληψης, μια ομάδα ψαριών ενός είδους εκτίθεται στην υπό δοκιμή ουσία σε μία ή περισσότερες επιλεγμένες συγκεντρώσεις, ανάλογα με τις ιδιότητες της ουσίας (βλ. παράγραφο 49). Στη συνέχεια, τα ψάρια μεταφέρονται σε μέσο χωρίς την υπό δοκιμή ουσία για τη φάση αποβολής. Η φάση αποβολής είναι πάντα απαραίτητη, εκτός εάν η πρόσληψη της υπό δοκιμή ουσίας κατά τη διάρκεια της φάσης πρόσληψης είναι ασήμαντη. Καθ' όλη τη διάρκεια και των δύο φάσεων της δοκιμής παρακολουθείται η συγκέντρωση της υπό δοκιμή ουσίας στη μάζα/επιφάνεια των ψαριών (ή σε συγκεκριμένους ιστούς τους). Επιπλέον της εκτιθέμενης ομάδας, μία ομάδα ψαριών διατηρείται ως μάρτυρας υπό τις ίδιες ακριβώς συνθήκες με μόνη διαφορά την απουσία της υπό δοκιμή ουσίας, με σκοπό τη σύγκριση των πιθανών δυσμενών επιδράσεων που παρατηρούνται κατά τη δοκιμή βιοσυγκέντρωσης με μία αντίστοιχη ομάδα-μάρτυρα και τη διαπίστωση των συγκεντρώσεων υποβάθρου της υπό δοκιμή ουσίας (43). Κατά τη δοκιμή υδατικής έκθεσης, η φάση πρόσληψης διαρκεί συνήθως 28 ημέρες. Η διάρκεια μπορεί να παραταθεί, εάν είναι αναγκαίο (βλ. παράγραφο 18), ή να συντομευθεί, εφόσον αποδειχθεί ότι επιτυγχάνεται νωρίτερα σταθερή κατάσταση (βλ. προσάρτημα 1 «Ορισμοί και μονάδες»). Η διάρκεια της φάσης πρόσληψης και ο χρόνος που χρειάζεται για την επίτευξη σταθερής κατάστασης μπορούν να προβλεφθούν με τις εξισώσεις του προσαρτήματος 5. Στη συνέχεια αρχίζει η περίοδος αποβολής, όταν τα ψάρια δεν εκτίθενται πλέον στην υπό δοκιμή ουσία, με τη μεταφορά τους στο ίδιο μέσο, αλλά χωρίς την υπό δοκιμή ουσία, σε καθαρό δοχείο. Εφόσον είναι δυνατόν, ο συντελεστής βιοσυγκέντρωσης υπολογίζεται κατά προτίμηση τόσο ως ο λόγος της συγκέντρωσης στα ψάρια (C f) προς τη συγκέντρωση στο νερό (C w) σε σταθερή κατάσταση (BCFSS, βλ. ορισμό στο προσάρτημα 1), όσο και ως κινητικός συντελεστής βιοσυγκέντρωσης (BCFK· βλ. προσάρτημα 1 «Ορισμοί και μονάδες»), που υπολογίζεται ως ο λόγος των σταθερών ρυθμού πρόσληψης (k 1) και αποβολής (k 2) με την παραδοχή ότι η κινητική είναι πρώτης τάξεως (44). Εάν δεν επιτυγχάνεται σταθερή κατάσταση εντός 28 ημερών, είτε υπολογίζεται ο BCF με την κινητική προσέγγιση (βλ. παράγραφο 38) είτε μπορεί να παραταθεί η φάση πρόσληψης. Εάν η παράταση αυτή έχει ως αποτέλεσμα πρακτικά ανέφικτη διάρκεια της φάσης πρόσληψης για την επίτευξη σταθερής κατάστασης (βλ. παραγράφους 37 και 38 και προσάρτημα 5), προτιμάται η κινητική προσέγγιση. Εναλλακτικά, όταν πρόκειται για εξαιρετικά υδρόφοβες ουσίες, θα πρέπει να εξετάζεται το ενδεχόμενο διεξαγωγής δοκιμής διατροφικής έκθεσης (45), υπό την προϋπόθεση ότι η διατροφική δοκιμή είναι σύμφωνη με το σχετικό κανονιστικό πλαίσιο. Η σταθερά ρυθμού πρόσληψης, η σταθερά ρυθμού αποβολής (απώλειας) — ή οι σταθερές, αν χρησιμοποιούνται πιο σύνθετα μοντέλα –, ο συντελεστής βιοσυγκέντρωσης (σε σταθερή κατάσταση και/ή κινητικός) και, όπου είναι δυνατόν, τα όρια εμπιστοσύνης καθεμίας από τις παραμέτρους αυτές υπολογίζονται από το μοντέλο που περιγράφει ακριβέστερα τις μετρούμενες συγκεντρώσεις της υπό δοκιμή ουσίας στα ψάρια και το νερό (βλ. προσάρτημα 5). Η αύξηση της μάζας των ψαριών κατά τη διάρκεια της δοκιμής θα έχει ως αποτέλεσμα μείωση της συγκέντρωσης της υπό δοκιμή ουσίας στα αναπτυσσόμενα ψάρια (καλούμενη αναπτυξιακή αραίωση) και, ως εκ τούτου, ο κινητικός BCF θα είναι υποεκτιμημένος, εάν δεν διορθωθεί για να ληφθεί υπόψη η ανάπτυξη (βλ. παραγράφους 72 και 73). Ο BCF βασίζεται στη συνολική συγκέντρωση στα ψάρια (δηλ. ανά μονάδα συνολικού νωπού βάρους των ψαριών). Εντούτοις, για ειδικούς λόγους, επιτρέπεται να χρησιμοποιούνται συγκεκριμένοι ιστοί ή όργανα (π.χ. μύες, ήπαρ), εάν τα ψάρια είναι αρκετά μεγάλα, ή να χωρίζονται αυτά σε βρώσιμα (φιλέτα) και μη βρώσιμα (εντόσθια) τμήματα. Δεδομένου ότι στην περίπτωση πολλών οργανικών ουσιών υπάρχει σαφής σχέση μεταξύ του δυναμικού βιοσυγκέντρωσης και της υδροφοβικότητας, υπάρχει και αντίστοιχη σχέση μεταξύ της περιεκτικότητας των υπό δοκιμή ψαριών σε λιπίδια και της παρατηρούμενης βιοσυγκέντρωσης των ουσιών αυτών. Συνεπώς, για να περιοριστεί αυτή η πηγή μεταβλητότητας των αποτελεσμάτων της δοκιμής για τις ουσίες με υψηλή λιποφιλικότητα (δηλ. με log K OW > 3), η βιοσυγκέντρωση θα πρέπει να εκφράζεται κανονικοποιημένη σε ψάρι με περιεκτικότητα 5 % σε λιπίδια (με βάση το νωπό βάρος ολόκληρου του σώματος) επιπλέον της τιμής που προκύπτει απευθείας από τη μελέτη. Αυτό είναι απαραίτητο για να υπάρχει βάση σύγκρισης μεταξύ των αποτελεσμάτων για διαφορετικές ουσίες και/ή εξεταζόμενα είδη ψαριών. Η περιεκτικότητα 5 % σε λιπίδια χρησιμοποιείται ευρέως διότι αντιπροσωπεύει τη μέση περιεκτικότητα των ψαριών που συνήθως χρησιμοποιούνται στην παρούσα μέθοδο δοκιμών (21). ΣΤΟΙΧΕΙΑ ΓΙΑ ΤΗΝ ΥΠΟ ΔΟΚΙΜΗ ΟΥΣΙΑ Εκτός από τις ιδιότητες της υπό δοκιμή ουσίας που αναφέρονται στην εισαγωγή (παράγραφος 3), άλλα στοιχεία που απαιτούνται είναι η τοξικότητα για το είδος ψαριών που πρόκειται να χρησιμοποιηθεί στη δοκιμή, κατά προτίμηση η ασυμπτωτική (δηλ. ανεξάρτητη από τον χρόνο) LC50 και/ή η τοξικότητα που εκτιμάται με μακροχρόνιες δοκιμές σε ψάρια [π.χ. μέθοδοι δοκιμών Γ.47 (22), Γ.15 (23), Γ.14 (24)]. Θα πρέπει να είναι διαθέσιμη κατάλληλη αναλυτική μέθοδος, γνωστής ορθότητας, ακρίβειας και ευαισθησίας, για την ποσοτικοποίηση της ουσίας στα διαλύματα δοκιμής και σε βιολογικά υλικά, με λεπτομερείς οδηγίες για την προετοιμασία και τη φύλαξη των δειγμάτων. Θα πρέπει επίσης να είναι γνωστό το όριο ποσοτικοποίησης της υπό δοκιμή ουσίας, τόσο στο νερό όσο και στους ιστούς των ψαριών. Όταν χρησιμοποιείται ραδιοσημασμένη υπό δοκιμή ουσία, θα πρέπει να έχει την ανώτατη καθαρότητα (π.χ. κατά προτίμηση > 98 %) και να είναι γνωστό το ποσοστό ραδιενέργειας που αντιστοιχεί σε ξένες προσμείξεις. ΕΓΚΥΡΟΤΗΤΑ ΤΗΣ ΔΟΚΙΜΗΣ Οι προϋποθέσεις εγκυρότητας της δοκιμής είναι οι ακόλουθες:
ΟΥΣΙΕΣ ΑΝΑΦΟΡΑΣ Η χρησιμοποίηση ουσιών αναφοράς γνωστού δυναμικού βιοσυγκέντρωσης και χαμηλού μεταβολισμού είναι χρήσιμη για τον έλεγχο της πειραματικής διαδικασίας, εφόσον απαιτείται (π.χ. όταν ένα εργαστήριο δεν έχει προηγούμενη πείρα στη δοκιμή ή τροποποιούνται οι πειραματικές συνθήκες). ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Εργαστηριακός εξοπλισμός Θα πρέπει να λαμβάνεται μέριμνα ώστε να αποφεύγεται η χρήση υλικών, για οποιοδήποτε τμήμα του εξοπλισμού, τα οποία μπορεί να διαλυθούν, να ροφηθούν ή να εκπλυθούν και να έχουν δυσμενή επίδραση στα ψάρια. Μπορούν να χρησιμοποιούνται συνήθεις ορθογώνιες ή κυλινδρικές δεξαμενές, κατασκευασμένες από χημικώς αδρανές υλικό και με κατάλληλη χωρητικότητα ανάλογα με τον πληθυσμιακό φόρτο (βλ. παράγραφο 43). Θα πρέπει να ελαχιστοποιείται η χρήση εύκαμπτων πλαστικών σωλήνων. Θα πρέπει να χρησιμοποιούνται σωλήνες από πολυτετραφθοροαιθυλένιο (PTFE), ανοξείδωτο χάλυβα ή/και γυαλί. Η εμπειρία έχει δείξει ότι για υπό δοκιμή ουσίες με υψηλό συντελεστή προσρόφησης. όπως τα συνθετικά πυρεθροειδή, μπορεί να απαιτείται η χρήση σιλανιωμένου γυαλιού. Στις περιπτώσεις αυτές, ο εξοπλισμός θα πρέπει να απορρίπτεται μετά τη χρήση. Είναι προτιμότερο να εκτίθενται τα συστήματα της δοκιμής στις συγκεντρώσεις της υπό δοκιμή ουσίας που πρόκειται να χρησιμοποιηθούν στη μελέτη, για όσο χρονικό διάστημα απαιτείται για να αποδειχθεί η διατήρηση σταθερών συγκεντρώσεων έκθεσης, πριν από την εισαγωγή των υπό δοκιμή οργανισμών. Νερό Στη δοκιμή χρησιμοποιείται γενικά φυσικό νερό, το οποίο θα πρέπει να λαμβάνεται από μη μολυσμένες πηγές που παρέχουν νερό ομοιόμορφης ποιότητας. Ωστόσο, το ανασυσταθέν νερό (δηλ. απιονισμένο νερό με συγκεκριμένα θρεπτικά στοιχεία που προστίθενται σε γνωστές ποσότητες) μπορεί να είναι καταλληλότερο για τη διασφάλιση ομοιόμορφης ποιότητας με την πάροδο του χρόνου. Η ποιότητα του νερού αραίωσης, δηλαδή του νερού που αναμειγνύεται με την υπό δοκιμή ουσία πριν από την εισαγωγή στο δοχείο δοκιμής (βλ. παράγραφο 30), θα πρέπει να επιτρέπει την επιβίωση του επιλεγμένου είδους ψαριών κατά τη διάρκεια των περιόδων εγκλιματισμού και δοκιμής χωρίς αυτά να παρουσιάζουν ανωμαλίες στην εμφάνιση ή τη συμπεριφορά. Στην ιδανική περίπτωση, θα πρέπει να καταδεικνύεται ότι το υπό δοκιμή είδος ψαριών μπορεί να επιζήσει, να αναπτυχθεί και να αναπαραχθεί στο νερό αραίωσης (π.χ. με καλλιέργεια στο εργαστήριο ή με δοκιμή τοξικότητας κύκλου ζωής). Το νερό θα πρέπει να χαρακτηρίζεται τουλάχιστον με το pH, τη σκληρότητα, τα ολικά στερεά, τον ολικό οργανικό άνθρακα (TOC (47)) και, κατά προτίμηση, με την περιεκτικότητά του σε αμμώνιο και νιτρώδη άλατα, την αλκαλικότητα και, για τα θαλάσσια είδη ψαριών, την αλατότητά του. Οι παράμετροι που διαδραματίζουν σημαντικό ρόλο στην άριστη διαβίωση των ψαριών δεν είναι πλήρως γνωστές, αλλά στο παράρτημα 2 συνιστώνται μέγιστες συγκεντρώσεις για ορισμένες παραμέτρους γλυκού και θαλάσσιου νερού δοκιμής. Κατά τη διάρκεια της δοκιμής, το νερό αραίωσης θα πρέπει να είναι σταθερής ποιότητας. Η τιμή του pH θα πρέπει να κυμαίνεται από 6,0 έως 8,5 κατά την έναρξη δεδομένης δοκιμής, αλλά κατά τη διάρκειά της θα πρέπει να παραμένει εντός εύρους ± 0,5 μονάδων pH. Για να διασφαλίζεται ότι το νερό αραίωσης δεν επηρεάζει αδικαιολόγητα το αποτέλεσμα της δοκιμής (π.χ. συμπλοκοποιώντας την υπό δοκιμή ουσία) ούτε έχει δυσμενή επίδραση στις επιδόσεις του αποθέματος ψαριών, θα πρέπει κατά διαστήματα να λαμβάνονται δείγματα για ανάλυση, τουλάχιστον στην αρχή και στο τέλος της δοκιμής. Όταν είναι γνωστό ότι το νερό αραίωσης είναι σχετικά σταθερής ποιότητας, θα πρέπει να προσδιορίζονται, π.χ. ανά τρίμηνο, τα βαρέα μέταλλα (π.χ. Cu, Pb, Zn, Hg, Cd, Ni), τα κυριότερα ανιόντα και κατιόντα (π.χ. Ca2+, Mg2+, Na+, K+, Cl- και SO4 2-), τα γεωργικά φάρμακα (π.χ. ολικά οργανοφωσφορικά και ολικά οργανοχλωριούχα γεωργικά φάρμακα), ο ολικός οργανικός άνθρακας και τα αιωρούμενα στερεά. Εάν έχει αποδειχθεί ότι η ποιότητα του νερού αραίωσης είναι σταθερή επί ένα τουλάχιστον έτος, η συχνότητα των προσδιορισμών μπορεί να περιοριστεί και τα μεσοδιαστήματα να αυξηθούν (π.χ. ανά εξάμηνο). Η φυσική περιεκτικότητα του νερού αραίωσης σε σωματίδια, καθώς και η περιεκτικότητά του σε ολικό οργανικό άνθρακα θα πρέπει να είναι όσο το δυνατόν χαμηλότερες για να αποφεύγεται η προσρόφηση της υπό δοκιμή ουσίας στην οργανική ύλη, η οποία μπορεί να μειώσει τη βιοδιαθεσιμότητά της και, κατά συνέπεια, να οδηγήσει σε υποεκτίμηση του BCF. Η μέγιστη αποδεκτή τιμή είναι 5 mg/l όσον αφορά τα σωματίδια (ξηρά ουσία, μη διερχόμενη από ηθμό των 0,45 μm) και 2 mg/l για τον ολικό οργανικό άνθρακα (βλ. προσάρτημα 2). Αν είναι αναγκαίο, το νερό αραίωσης θα πρέπει να διηθείται πριν χρησιμοποιηθεί. Η συνεισφορά των υπό δοκιμή ψαριών (περιττώματα) και των υπολειμμάτων τροφών στη συγκέντρωση οργανικού άνθρακα στο νερό δοκιμής θα πρέπει να είναι όσο το δυνατόν χαμηλότερη (βλ. παράγραφο 46). Διαλύματα δοκιμής Παρασκευάζεται διάλυμα παρακαταθήκης της υπό δοκιμή ουσίας σε κατάλληλη συγκέντρωση. Το διάλυμα παρακαταθήκης θα πρέπει κατά προτίμηση να παρασκευάζεται με απλή ανάμειξη ή ανάδευση της υπό δοκιμή ουσίας στο νερό αραίωσης. Μια εναλλακτική λύση, η οποία μπορεί να ενδείκνυται σε ορισμένες περιπτώσεις, είναι η χρήση δοσιμετρικού συστήματος εκρόφησης στερεάς φάσης. Δεν συνιστάται γενικά η χρήση διαλυτών και μέσων διασποράς (μέσων διαλυτοποίησης) [βλ. (25)]· ωστόσο, η χρήση αυτών των υλικών μπορεί να είναι αποδεκτή για την παρασκευή κατάλληλα πυκνού διαλύματος παρακαταθήκης, αλλά θα πρέπει να καταβάλλεται κάθε δυνατή προσπάθεια να περιορίζεται στο ελάχιστο, και επιπλέον να μη σημειώνεται υπέρβαση της κρίσιμης μικκυλιακής συγκέντρωσης (κατά περίπτωση). Οι διαλύτες που επιτρέπεται να χρησιμοποιούνται είναι η ακετόνη, η αιθανόλη, η μεθανόλη, το διμεθυλοφορμαμίδιο και η τριαιθυλενογλυκόλη· μέσα διασποράς που έχουν χρησιμοποιηθεί είναι το Tween 80, η μεθυλοκυτταρίνη 0,01 % και η HCO-40. Η συγκέντρωση του διαλύτη στο τελικό μέσο δοκιμής θα πρέπει να είναι η ίδια σε κάθε μεταχείριση (δηλ. ανεξαρτήτως της συγκέντρωσης της υπό δοκιμή ουσίας) και να μην υπερβαίνει τις αντίστοιχες τιμές κατωφλίου τοξικότητας που έχουν προσδιοριστεί για τον διαλύτη στις συνθήκες της δοκιμής. Το ανώτατο επίπεδο είναι συγκέντρωση 100 mg/l (ή 0,1 ml/l). Μια συγκέντρωση διαλύτη 100 mg/l είναι απίθανο να τροποποιεί σημαντικά τη μέγιστη διαλυμένη συγκέντρωση της υπό δοκιμή ουσίας που μπορεί να επιτευχθεί μεσοπρόθεσμα (25). Θα πρέπει να είναι γνωστή η συνεισφορά του διαλύτη (σε συνδυασμό με την υπό δοκιμή ουσία) στη συνολική περιεκτικότητα του νερού δοκιμής σε οργανικό άνθρακα. Καθ' όλη τη διάρκεια της δοκιμής, η συγκέντρωση ολικού οργανικού άνθρακα στα δοχεία δοκιμής δεν θα πρέπει να υπερβαίνει κατά περισσότερο από 10 mg/l (± 20 %) τη συγκέντρωση του οργανικού άνθρακα που προέρχεται από την υπό δοκιμή ουσία και από τον διαλύτη ή το μέσο διαλυτοποίησης (48), εφόσον χρησιμοποιείται. Η περιεκτικότητα σε οργανική ύλη μπορεί να έχει σημαντική επίδραση στην ποσότητα ελεύθερης διαλυμένης υπό δοκιμή ουσίας κατά τη διάρκεια των δοκιμών σε ψάρια με σύστημα συνεχούς ροής, ιδίως όταν πρόκειται για εξαιρετικά λιπόφιλες ουσίες. Η μικροεκχύλιση σε στερεή φάση (βλ. παράγραφο 60) μπορεί να προσφέρει σημαντικές πληροφορίες για την αναλογία μεταξύ δεσμευμένων και ελεύθερων διαλυμένων ενώσεων, όπου οι τελευταίες θεωρείται ότι αντιπροσωπεύουν το βιοδιαθέσιμο κλάσμα. Η συγκέντρωση της υπό δοκιμή ουσίας πρέπει να είναι μικρότερη από το όριο διαλυτότητάς της στο μέσο δοκιμής, παρά τη χρήση διαλύτη ή μέσου διαλυτοποίησης. Όταν χρησιμοποιούνται εύκολα βιοαποδομήσιμοι διαλύτες, θα πρέπει να λαμβάνονται προφυλάξεις γιατί αυτοί μπορούν να προκαλέσουν προβλήματα λόγω ανάπτυξης βακτηρίων στις δοκιμές με σύστημα συνεχούς ροής. Εάν δεν είναι δυνατή η παρασκευή διαλύματος παρακαταθήκης χωρίς τη χρήση μέσου διαλυτοποίησης, θα πρέπει να εξετάζεται η καταλληλότητα της διενέργειας μελέτης υδατικής έκθεσης σε αντιδιαστολή με μελέτη διατροφικής έκθεσης. Στις δοκιμές με σύστημα συνεχούς ροής, για την παροχή των συγκεντρώσεων δοκιμής στους θαλάμους δοκιμής απαιτείται σύστημα που διανέμει και αραιώνει συνεχώς ένα διάλυμα παρακαταθήκης της υπό δοκιμή ουσίας (π.χ. αντλία μέτρησης, αναλογικός αραιωτής, σύστημα κορεσμού) ή δοσιμετρικό σύστημα εκρόφησης στερεάς φάσης. Προβλέπονται, κατά προτίμηση, τουλάχιστον πέντε αντικαταστάσεις του όγκου του νερού σε κάθε θάλαμο δοκιμής ημερησίως. Η μέθοδος συνεχούς ροής προτιμάται, όταν όμως η εφαρμογή της δεν είναι εφικτή (π.χ. έχει δυσμενή επίδραση στους υπό δοκιμή οργανισμούς) μπορεί να χρησιμοποιηθεί ημιστατική τεχνική υπό την προϋπόθεση ότι πληρούνται τα κριτήρια εγκυρότητας (βλ. παράγραφο 24). Η ταχύτητα ροής των διαλυμάτων παρακαταθήκης και του νερού αραίωσης θα πρέπει να ελέγχεται 48 ώρες πριν από τη δοκιμή και, κατόπιν, τουλάχιστον ημερησίως κατά τη διάρκειά της. Στον έλεγχο αυτό συμπεριλαμβάνεται ο προσδιορισμός της ταχύτητας ροής διαμέσου κάθε θαλάμου δοκιμής και διασφαλίζεται ότι δεν μεταβάλλεται κατά περισσότερο από 20 % είτε στον ίδιο θάλαμο είτε μεταξύ των θαλάμων. Επιλογή ζωικού είδους Σημαντικά κριτήρια για την επιλογή είδους είναι η άμεση διαθεσιμότητα, η προσφορά σε κατάλληλα μεγέθη και η δυνατότητα ικανοποιητικής διατήρησης στις συνθήκες του εργαστηρίου. Άλλα κριτήρια για την επιλογή είδους ψαριών είναι η ψυχαγωγική, εμπορική και οικολογική σημασία, καθώς και η συγκρίσιμη ευαισθησία, η επιτυχής χρήση στο παρελθόν κ.λπ. Τα συνιστώμενα είδη παρατίθενται στο προσάρτημα 3. Επιτρέπεται να χρησιμοποιούνται και άλλα είδη, αλλά μπορεί να χρειάζεται προσαρμογή της διαδικασίας δοκιμής, ώστε να εξασφαλίζονται οι κατάλληλες συνθήκες δοκιμής. Στην περίπτωση αυτή θα πρέπει να αναφέρεται η αιτιολογία της επιλογής του υπό δοκιμή είδους και της πειραματικής μεθόδου. Η χρήση μικρότερων ειδών ψαριών συντομεύει γενικά τον χρόνο επίτευξης σταθερής κατάστασης, αλλά ενδέχεται να χρειάζονται περισσότερα ψάρια (δείγματα) για την επαρκή ανάλυση της περιεκτικότητας των ψαριών σε λιπίδια και των συγκεντρώσεων της υπό δοκιμή ουσίας στα ψάρια. Επιπλέον, οι διαφορές στον ρυθμό αναπνοής και τον μεταβολισμό μεταξύ των νεαρών και των μεγαλύτερης ηλικίας ψαριών ενδέχεται να παρεμποδίσουν τις συγκρίσεις μεταξύ των αποτελεσμάτων διαφορετικών δοκιμών και διαφορετικών υπό δοκιμή ειδών ψαριών. Επισημαίνεται ότι η διενέργεια δοκιμών σε στάδιο του κύκλου ζωής όπου πραγματοποιείται ταχεία ανάπτυξη (ιχθύδια) μπορεί να περιπλέξει την ερμηνεία των δεδομένων. Διατήρηση ψαριών (αφορά την υδατική και διατροφική έκθεση) Ο πληθυσμός του αποθέματος ψαριών θα πρέπει να εγκλιματίζεται για δύο τουλάχιστον εβδομάδες σε νερό (βλ. παράγραφο 28) στη θερμοκρασία δοκιμής και να τρέφεται επαρκώς κατά το διάστημα αυτό (βλ. παράγραφο 45). Τόσο το νερό όσο και η τροφή θα πρέπει να είναι του ίδιου τύπου με εκείνα που πρόκειται να χρησιμοποιηθούν κατά τη δοκιμή. Έπειτα από μια περίοδο εγκατάστασης 48 ωρών, καταγράφονται οι θνησιμότητες και εφαρμόζονται τα ακόλουθα κριτήρια:
Τα ψάρια που χρησιμοποιούνται στις δοκιμές θα πρέπει να μην εμφανίζουν παρατηρήσιμες νόσους και ανωμαλίες. Τα ασθενή ψάρια θα πρέπει να απορρίπτονται. Τα ψάρια δεν θα πρέπει να υποβάλλονται σε θεραπευτική αγωγή κατά τις δύο εβδομάδες που προηγούνται της δοκιμής ούτε κατά τη διάρκειά της. ΕΚΤΕΛΕΣΗ ΤΗΣ ΔΟΚΙΜΗΣ Προκαταρκτική δοκιμή Μπορεί να είναι χρήσιμο να διεξαχθεί προκαταρκτικό πείραμα για τη βελτιστοποίηση των συνθηκών της οριστικής δοκιμής, π.χ. επιλογή της ή των συγκεντρώσεων της υπό δοκιμή ουσίας, καθορισμός της διάρκειας των φάσεων πρόσληψης και αποβολής, ή για να κριθεί αν χρειάζεται πλήρης δοκιμή. Ο σχεδιασμός της προκαταρκτικής δοκιμής θα πρέπει να εξασφαλίζει τη συγκέντρωση των απαιτούμενων πληροφοριών. Μπορεί να εξετάζεται αν αρκεί μια ελαχιστοποιημένη δοκιμή για τη συναγωγή του BCF ή χρειάζεται πλήρης μελέτη (βλ. παραγράφους 83-95 σχετικά με την ελαχιστοποιημένη δοκιμή). Συνθήκες έκθεσης Διάρκεια της φάσης πρόσληψης Η διάρκεια της φάσης πρόσληψης μπορεί να προβλεφθεί από την πρακτική εμπειρία (π.χ. από προγενέστερη μελέτη ή μελέτη συσσώρευσης ουσιών ανάλογης δομής) ή από ορισμένες εμπειρικές σχέσεις στις οποίες χρησιμοποιείται είτε η γνωστή υδατοδιαλυτότητα είτε ο γνωστός συντελεστής κατανομής σε μείγμα οκτανόλης/νερού της υπό δοκιμή ουσίας (υπό την προϋπόθεση ότι η πρόσληψη ακολουθεί κινητική πρώτης τάξης, βλ. προσάρτημα 5). Η φάση πρόσληψης θα πρέπει να διαρκεί 28 ημέρες, εκτός εάν μπορεί να αποδειχθεί ότι επιτυγχάνεται σταθερή κατάσταση νωρίτερα (βλ. προσάρτημα 1 «Ορισμοί και μονάδες»). Σταθερή κατάσταση στο διάγραμμα της συγκέντρωσης της υπό δοκιμή ουσίας στα ψάρια (C f) σε συνάρτηση με τον χρόνο επιτυγχάνεται όταν η καμπύλη καθίσταται παράλληλη με τον άξονα του χρόνου και τρεις διαδοχικές αναλύσεις της C f σε δείγματα που λαμβάνονται ανά διαστήματα τουλάχιστον δύο ημερών δεν διαφέρουν μεταξύ τους κατά περισσότερο από ± 20 % και δεν παρατηρείται σημαντική αύξηση της C f στο διάστημα που μεσολαβεί μεταξύ της πρώτης και της τελευταίας διαδοχικής ανάλυσης. Όταν αναλύονται συγχωνευμένα δείγματα, απαιτούνται τουλάχιστον τέσσερις διαδοχικές αναλύσεις. Όταν οι υπό δοκιμή ουσίες προσλαμβάνονται με αργό ρυθμό, ενδείκνυνται περισσότερο τα μεσοδιαστήματα επτά ημερών. Εάν δεν έχει επιτευχθεί σταθερή κατάσταση εντός 28 ημερών, είτε υπολογίζεται ο BCF με τη χρήση μόνον της κινητικής προσέγγισης, η οποία δεν βασίζεται σε σταθερή κατάσταση, είτε μπορεί να παραταθεί η φάση πρόσληψης και να προστεθούν μετρήσεις, μέχρις ότου επιτευχθεί σταθερή κατάσταση ή για 60 ημέρες, ανάλογα με το ποιο διάστημα είναι συντομότερο. Επίσης, η συγκέντρωση της υπό δοκιμή ουσίας στα ψάρια στο τέλος της περιόδου πρόσληψης πρέπει να είναι επαρκώς υψηλή για να εξασφαλίζεται αξιόπιστη εκτίμηση της σταθεράς k 2 από τη φάση αποβολής. Εάν δεν διαπιστωθεί σημαντική πρόσληψη μετά από 28 ημέρες, η δοκιμή μπορεί να διακοπεί. Διάρκεια της φάσης αποβολής Για ουσίες που ακολουθούν κινητική πρώτης τάξης, ένα διάστημα ίσο με το ήμισυ της διάρκειας της φάσης πρόσληψης συνήθως επαρκεί για την ενδεδειγμένη (π.χ. κατά 95 %) μείωση της επιβάρυνσης του σώματος από την ουσία (βλ. επεξήγηση της εκτίμησης στο προσάρτημα 5). Εάν ο χρόνος που απαιτείται για να σημειωθεί απώλεια 95 % είναι υπερβολικά μεγάλος, π.χ. υπερβαίνει το διπλάσιο της κανονικής διάρκειας της φάσης πρόσληψης (δηλ. πάνω από 56 ημέρες), μπορεί να χρησιμοποιηθεί μικρότερο χρονικό διάστημα (π.χ. μέχρις ότου η συγκέντρωση της υπό δοκιμή ουσίας να είναι μικρότερη από το 10 % της συγκέντρωσης σε σταθερή κατάσταση). Εντούτοις, μπορεί να είναι απαραίτητες φάσεις αποβολής μεγαλύτερης διάρκειας για ουσίες με πιο σύνθετη τυπολογία πρόσληψης και αποβολής από εκείνη που προκύπτει από το μονοδιαμερισματικό μοντέλο ψαριού, το οποίο αποδίδει κινητική πρώτης τάξης. Εάν παρατηρείται και/ή προβλέπεται τέτοια σύνθετη τυπολογία, συνιστάται να ζητείται η γνώμη βιοστατιστικολόγου και/ή ειδικού στη φαρμακοκινητική για να εξασφαλιστεί ο κατάλληλος σχεδιασμός της δοκιμής. Όταν παρατείνεται η περίοδος αποβολής, οι αριθμοί ψαριών προς δειγματοληψία μπορεί να γίνουν περιοριστικοί παράγοντες και οι αναπτυξιακές διαφορές μεταξύ των ψαριών να επηρεάσουν τα αποτελέσματα. Η περίοδος θα καθορίζεται επίσης από το χρονικό διάστημα επί το οποίο η συγκέντρωση της υπό δοκιμή ουσίας στα ψάρια παραμένει υψηλότερη από το όριο ποσοτικοποίησης. Αριθμός των υπό δοκιμή ψαριών Ο αριθμός ψαριών ανά συγκέντρωση δοκιμής επιλέγεται κατά τρόπο ώστε σε κάθε χρονικό σημείο δειγματοληψίας να είναι διαθέσιμα τουλάχιστον τέσσερα ψάρια. Τα ψάρια θα πρέπει να εξετάζονται ομαδικά μόνο αν δεν είναι εφικτή η ανάλυση μεμονωμένων ψαριών. Εάν επιδιώκεται μεγαλύτερη ακρίβεια προσαρμογής των καμπυλών (και των παραμέτρων που προκύπτουν) ή αν απαιτούνται μελέτες μεταβολισμού (π.χ. για να γίνει διάκριση μεταξύ μεταβολιτών και μητρικής ουσίας, όταν χρησιμοποιούνται ραδιοσημασμένες υπό δοκιμή ουσίες), χρειάζεται μεγαλύτερος αριθμών ψαριών ανά χρονικό σημείο δειγματοληψίας. Η περιεκτικότητα σε λιπίδια θα πρέπει να προσδιορίζεται στο βιολογικό υλικό που χρησιμοποιείται για τον προσδιορισμό της συγκέντρωσης της υπό δοκιμή ουσίας. Εάν αυτό δεν είναι εφικτό, μπορεί να χρειαστούν επιπλέον ψάρια (βλ. παραγράφους 56 και 57). Εάν χρησιμοποιούνται ενήλικα ψάρια (δηλ. ώριμα για αναπαραγωγή), αυτά δεν πρέπει να βρίσκονται σε κατάσταση ωοτοκίας ούτε να έχουν προσφάτως αποθέσει αυγά είτε πριν από τη δοκιμή είτε κατά τη διάρκειά της. Θα πρέπει επίσης να αναφέρεται αν χρησιμοποιούνται στο πείραμα αρσενικά ή θηλυκά άτομα ή και τα δύο. Εάν χρησιμοποιούνται άτομα και των δύο φύλων, θα πρέπει να τεκμηριώνεται, πριν από την έναρξη της έκθεσης, ότι οι διαφορές στην ανάπτυξη και στην περιεκτικότητα σε λιπίδια μεταξύ των δύο φύλων δεν είναι σημαντικές, ιδίως εάν αναμένεται να χρειαστεί ομαδική εξέταση αρσενικών και θηλυκών ψαριών για να εξασφαλιστούν ανιχνεύσιμες συγκεντρώσεις της ουσίας και/ή περιεκτικότητα σε λιπίδια. Για κάθε δοκιμή επιλέγονται ψάρια παρόμοιου βάρους, κατά τρόπο ώστε το βάρος των μικρότερων ψαριών να μην είναι μικρότερο από τα δύο τρίτα του βάρους των μεγαλύτερων. Όλα τα ψάρια θα πρέπει να είναι της ίδιας ηλικιακής τάξης και να προέρχονται από την ίδια πηγή. Επειδή το βάρος και η ηλικία των ψαριών μπορεί να έχουν σημαντική επίδραση στις τιμές του BCF (12), τα στοιχεία αυτά θα πρέπει να καταγράφονται με ακρίβεια. Συνιστάται η ζύγιση μερικού δείγματος του αποθέματος ψαριών λίγο πριν από την έναρξη της δοκιμής, για την εκτίμηση του μέσου βάρους (βλ. παράγραφο 61). Πληθυσμιακός φόρτος Θα πρέπει να χρησιμοποιούνται υψηλές αναλογίες νερού-ψαριών, για να ελαχιστοποιείται η μείωση της συγκέντρωσης της υπό δοκιμή ένωσης στο νερό, που προκαλείται από την προσθήκη των ψαριών κατά την έναρξη της δοκιμής, και για να αποφεύγεται επίσης η ελάττωση της συγκέντρωσης διαλυμένου οξυγόνου. Είναι σημαντικό ο πληθυσμιακός φόρτος να είναι κατάλληλος για το χρησιμοποιούμενο είδος ψαριών. Σε κάθε περίπτωση, συνιστάται κατά κανόνα πληθυσμιακός φόρτος 0,1-1,0 g ψαριών (νωπό βάρος) ανά λίτρο νερού ανά ημέρα. Μπορεί να χρησιμοποιηθεί υψηλότερος πληθυσμιακός φόρτος εάν αποδεικνύεται ότι η απαιτούμενη συγκέντρωση της υπό δοκιμή ουσίας μπορεί να διατηρηθεί εντός ορίων ± 20 % και ότι η συγκέντρωση διαλυμένου οξυγόνου δεν μειώνεται σε επίπεδα χαμηλότερα από το 60 % της συγκέντρωσης κορεσμού (βλ. παράγραφο 24). Για την επιλογή του κατάλληλου φόρτου, λαμβάνεται υπόψη το φυσικό ενδιαίτημα του είδους ψαριών. Για παράδειγμα, τα βενθικά είδη μπορεί να χρειάζονται ενυδρείο με μεγαλύτερο εμβαδόν πυθμένα για τον ίδιο όγκο νερού σε σύγκριση με τα πελαγικά είδη. Σίτιση Κατά τη διάρκεια των περιόδων εγκλιματισμού και δοκιμής, χορηγείται στα ψάρια κατάλληλο σιτηρέσιο γνωστής περιεκτικότητας σε λιπίδια και ολικές πρωτεΐνες, σε ποσότητα επαρκή ώστε η υγεία τους να είναι σε καλή κατάσταση και να διατηρούν το σωματικό τους βάρος (επιτρέπεται η αύξηση ως έναν βαθμό). Χορηγείται καθημερινά τροφή καθ' όλη τη διάρκεια των περιόδων εγκλιματισμού και δοκιμής σε καθορισμένη ποσότητα, ανάλογα με το χρησιμοποιούμενο είδος ψαριών, τις πειραματικές συνθήκες και τη θερμιδική αξία της τροφής (για παράδειγμα, για την ιριδίζουσα πέστροφα, περίπου 1 έως 2 % του σωματικού τους βάρους ημερησίως). Ο ρυθμός σίτισης θα πρέπει να επιλέγεται κατά τρόπο ώστε να αποφεύγονται η ταχεία ανάπτυξη και η μεγάλη αύξηση της περιεκτικότητας σε λιπίδια. Για τη διατήρηση του ίδιου ρυθμού σίτισης, η ποσότητα της τροφής θα πρέπει να επανυπολογίζεται, π.χ. εβδομαδιαίως. Για τον υπολογισμό αυτό, το βάρος των ψαριών σε κάθε θάλαμο δοκιμής μπορεί να εκτιμηθεί από το βάρος των ψαριών του θαλάμου που ελήφθησαν πιο πρόσφατα ως δείγματα. Τα ψάρια που παραμένουν στον θάλαμο δεν ζυγίζονται. Τα περισσεύματα τροφής και τα περιττώματα θα πρέπει να απομακρύνονται καθημερινά από τους θαλάμους δοκιμής με σιφωνισμό σε σύντομο χρόνο μετά τη σίτιση (30 λεπτά έως 1 ώρα). Οι θάλαμοι θα πρέπει να διατηρούνται όσο το δυνατόν καθαρότεροι καθ' όλη τη διάρκεια της δοκιμής, ώστε η συγκέντρωση οργανικής ύλης να παραμένει σε όσο το δυνατόν χαμηλότερα επίπεδα (βλ. παράγραφο 29), δεδομένου ότι η παρουσία οργανικού άνθρακα μπορεί να περιορίσει τη βιοδιαθεσιμότητα της υπό δοκιμή ουσίας (12). Επειδή πολλές τροφές προέρχονται από ιχθυάλευρα, θα πρέπει να διασφαλίζεται ότι η ζωοτροφή δεν θα επηρεάσει τα αποτελέσματα της δοκιμής ούτε θα έχει δυσμενείς επιδράσεις, π.χ. επειδή περιέχει (ίχνη) γεωργικών φαρμάκων, βαρέων μετάλλων και/ή της ίδιας της υπό δοκιμή ουσίας. Φως και θερμοκρασία Συνιστάται φωτοπερίοδος 12 έως 16 ωρών, η δε θερμοκρασία (± 2 °C) θα πρέπει να είναι κατάλληλη για το είδος των ψαριών της δοκιμής (βλ. προσάρτημα 3). Ο τύπος και τα χαρακτηριστικά του φωτισμού θα πρέπει να είναι γνωστά. Θα πρέπει να αποδίδεται ιδιαίτερη προσοχή στην πιθανότητα φωτομετασχηματισμού της υπό δοκιμής ουσίας στις συνθήκες ακτινοβολίας της δοκιμής. Θα πρέπει να χρησιμοποιείται κατάλληλος φωτισμός για να αποφεύγεται η έκθεση των ψαριών σε μη φυσικά φωτοπροϊόντα. Σε ορισμένες περιπτώσεις, μπορεί να είναι σκόπιμη η χρήση φίλτρου για την αποκοπή των μηκών κύματος υπεριώδους ακτινοβολίας κάτω των 290 nm. Συγκεντρώσεις δοκιμής Η δοκιμή σχεδιάστηκε αρχικά για μη πολικές οργανικές ουσίες. Για ουσίες αυτού του είδους, η έκθεση των ψαριών σε μία μόνο συγκέντρωση αναμένεται ότι θα αρκεί, καθώς δεν αναμένονται επιδράσεις της συγκέντρωσης, αν και το σχετικό ρυθμιστικό πλαίσιο μπορεί να επιβάλλει δύο συγκεντρώσεις. Εάν εξετάζονται ουσίες που δεν εμπίπτουν σε αυτό το πεδίο εφαρμογής ή εάν είναι γνωστές άλλες ενδείξεις πιθανής εξάρτησης από τη συγκέντρωση, η δοκιμή θα πρέπει να εκτελείται με δύο ή περισσότερες συγκεντρώσεις. Όταν υποβάλλεται σε δοκιμή μία μόνο συγκέντρωση, πρέπει να αιτιολογείται η επιλογή αυτή (βλ. παράγραφο 79). Επίσης, η εξεταζόμενη συγκέντρωση θα πρέπει να είναι τόσο χαμηλή όσο είναι πρακτικά ή τεχνικά εφικτό (δηλ. να μην προσεγγίζει το όριο διαλυτότητας). Σε ορισμένες περιπτώσεις, μπορεί να προβλεφθεί ότι η βιοσυγκέντρωση της ουσίας θα εξαρτάται από τη συγκέντρωσή της στο νερό (π.χ. για τα μέταλλα, των οποίων η πρόσληψη από τα ψάρια μπορεί να υπόκειται σε ρύθμιση, τουλάχιστον εν μέρει). Σε αυτή την περίπτωση, είναι απαραίτητο να εξετάζονται τουλάχιστον δύο και κατά προτίμηση περισσότερες συγκεντρώσεις (βλ. παράγραφο 49) με περιβαλλοντική σημασία. Επίσης, όσον αφορά τις ουσίες για τις οποίες οι συγκεντρώσεις δοκιμής πρέπει να προσεγγίζουν το όριο διαλυτότητας για πρακτικούς λόγους, συνιστάται η διεξαγωγή της δοκιμής με δύο τουλάχιστον συγκεντρώσεις, διότι με τον τρόπο αυτό είναι δυνατόν να διαμορφωθεί αντίληψη σχετικά με την αξιοπιστία των συγκεντρώσεων έκθεσης. Στις επιλεγόμενες συγκεντρώσεις δοκιμής θα πρέπει να συμπεριλαμβάνονται η περιβαλλοντικά ρεαλιστική συγκέντρωση, καθώς και η συγκέντρωση που έχει σημασία για τους σκοπούς της συγκεκριμένης εκτίμησης. Οι συγκεντρώσεις της υπό δοκιμή ουσίας θα πρέπει να επιλέγονται κατά τρόπο ώστε να είναι χαμηλότερες από το επίπεδο στο οποίο αυτή έχει χρόνιες επιδράσεις ή από 1 % της οξείας ασυμπτωτικής της LC50, να βρίσκονται εντός εύρους τιμών που συναντάται στο περιβάλλον και να υπερβαίνουν τουλάχιστον κατά μία τάξη μεγέθους το όριο ποσοτικοποίησης της ουσίας στο νερό με τη χρησιμοποιούμενη αναλυτική μέθοδο. Η ανώτατη επιτρεπτή συγκέντρωση δοκιμής μπορεί επίσης να προσδιοριστεί με διαίρεση της οξείας LC50 96 ωρών διά του κατάλληλου λόγου οξείας προς χρόνια τοξικότητα (π.χ. οι κατάλληλοι λόγοι για ορισμένες χημικές ουσίες είναι περίπου 3, αλλά για ορισμένες υπερβαίνουν το 100). Εάν χρησιμοποιείται δεύτερη συγκέντρωση, αυτή θα πρέπει να διαφέρει από την προαναφερθείσα κατά παράγοντα ίσο με δέκα. Εάν αυτό δεν είναι εφικτό λόγω του κριτηρίου τοξικότητας (το οποίο θέτει όριο στην ανώτατη συγκέντρωση δοκιμής) και του αναλυτικού ορίου (το οποίο θέτει όριο στην κατώτατη συγκέντρωση δοκιμής), μπορεί να χρησιμοποιηθεί παράγοντας μικρότερος από δέκα και θα πρέπει να εξεταστεί το ενδεχόμενο χρησιμοποίησης ραδιοσημασμένης υπό δοκιμή ουσίας (με τη μέγιστη καθαρότητα, κατά προτίμηση > 98 %). Θα πρέπει να λαμβάνεται μέριμνα ώστε καμία από τις χρησιμοποιούμενες συγκεντρώσεις να μην υπερβαίνει το όριο διαλυτότητας της υπό δοκιμή ουσίας στα μέσα δοκιμής. Μάρτυρες Επιπλέον της σειράς δοκιμής, θα πρέπει να ελέγχεται ένας μάρτυρας με νερό αραίωσης ή, εάν χρησιμοποιείται διαλύτης (βλ. παραγράφους 30 και 31), ένας μάρτυρας με διαλύτη. Συχνότητα μετρήσεων της ποιότητας του νερού Κατά τη διάρκεια της δοκιμής, θα πρέπει να εκτελούνται μετρήσεις του διαλυμένου οξυγόνου, του TOC, του pH και της θερμοκρασίας σε όλα τα δοχεία δοκιμής και μαρτύρων. Η ολική σκληρότητα και η αλατότητα (κατά περίπτωση) θα πρέπει να μετριούνται στους μάρτυρες και σε ένα δοχείο. Εάν εξετάζονται δύο ή περισσότερες συγκεντρώσεις, οι παράμετροι αυτές μετρώνται στην υψηλότερη (ή την ανώτατη) συγκέντρωση. Το διαλυμένο οξυγόνο και η αλατότητα (κατά περίπτωση) θα πρέπει να μετριούνται τουλάχιστον τρεις φορές — στην αρχή, περί τα μέσα και στο τέλος της περιόδου πρόσληψης — και εβδομαδιαίως κατά την περίοδο αποβολής. Ο TOC θα πρέπει να μετριέται στην αρχή της δοκιμής (24 και 48 ώρες πριν από την έναρξη της φάσης πρόσληψης) πριν προστεθούν τα ψάρια και τουλάχιστον εβδομαδιαίως κατά τη διάρκεια των φάσεων πρόσληψης και αποβολής. Η θερμοκρασία θα πρέπει να μετριέται και να καταγράφεται κάθε ημέρα, το pH στην αρχή και στο τέλος κάθε περιόδου και η σκληρότητα μία φορά σε κάθε δοκιμή. Η θερμοκρασία θα πρέπει κατά προτίμηση να παρακολουθείται συνεχώς σε ένα τουλάχιστον δοχείο. Δειγματοληψία και ανάλυση ψαριών και νερού Πρόγραμμα δειγματοληψίας ψαριών και νερού Θα πρέπει να λαμβάνονται δείγματα νερού από τους θαλάμους δοκιμής για τον προσδιορισμό της συγκέντρωσης της υπό δοκιμής ουσίας, πριν από την προσθήκη των ψαριών και κατά τη διάρκεια των φάσεων πρόσληψης και αποβολής. Τα δείγματα νερού θα πρέπει να λαμβάνονται πριν από τη σίτιση, συγχρόνως με τη δειγματοληψία ψαριών. Μια αύξηση των συχνοτήτων δειγματοληψίας μπορεί να είναι χρήσιμη για να εξασφαλίζονται σταθερές συγκεντρώσεις μετά την εισαγωγή των ψαριών. Κατά τη φάση πρόσληψης, θα πρέπει να προσδιορίζονται οι συγκεντρώσεις της υπό δοκιμή ουσίας ώστε να ελέγχεται η συμμόρφωση με τα κριτήρια εγκυρότητας (παράγραφος 24). Εάν από αναλύσεις δειγμάτων νερού κατά την έναρξη της φάσης αποβολής προκύπτει ότι η υπό δοκιμή ουσία δεν ανιχνεύεται, αυτό μπορεί να χρησιμοποιηθεί ως αιτιολογία για την παράλειψη της μέτρησης της υπό δοκιμή ουσίας στο νερό των δοχείων δοκιμής και μαρτύρων για το υπόλοιπο της φάσης αποβολής. Θα πρέπει να λαμβάνονται δείγματα ψαριών τουλάχιστον πέντε φορές κατά τη φάση πρόσληψης και τουλάχιστον τέσσερις φορές κατά τη διάρκεια της φάσης αποβολής για τη μέτρηση της υπό δοκιμή ουσίας. Επειδή ορισμένες φορές είναι δύσκολο να υπολογιστεί μια εύλογα ακριβής τιμή του BCF με βάση τον εν λόγω αριθμό δειγμάτων (ιδίως όταν υπάρχουν ενδείξεις ότι η κινητική της πρόσληψης και της αποβολής δεν είναι απλή κινητική πρώτης τάξης), μπορεί να είναι σκόπιμο να λαμβάνονται δείγματα με υψηλότερες συχνότητες και τις δύο περιόδους (βλ. παράρτημα 4). Η περιεκτικότητα σε λιπίδια θα πρέπει να προσδιορίζεται στο βιολογικό υλικό που χρησιμοποιείται για τον προσδιορισμό της συγκέντρωσης της υπό δοκιμή ουσίας, τουλάχιστον στην αρχή και στο τέλος της φάσης πρόσληψης και στο τέλος της φάσης αποβολής. Εάν αυτό δεν είναι εφικτό, θα πρέπει να λαμβάνονται ως δείγματα τουλάχιστον τρία ανεξάρτητα ψάρια για τον προσδιορισμό της περιεκτικότητας σε λιπίδια σε καθεμία από αυτές τις τρεις χρονικές στιγμές. Ο αριθμός των ψαριών ανά δεξαμενή κατά την έναρξη του πειράματος θα πρέπει να προσαρμόζεται αναλόγως (49). Εναλλακτικά, εάν δεν ανιχνεύονται σημαντικές ποσότητες της υπό δοκιμή ουσίας στα ψάρια-μάρτυρες (δηλ. ψάρια από τον πληθυσμό του αποθέματος), μπορεί να προσδιορίζεται στα ψάρια-μάρτυρες της δοκιμής μόνο η περιεκτικότητα σε λιπίδια και να διορθώνεται το αποτέλεσμα της ανάλυσης της υπό δοκιμή ουσίας στις ομάδες δοκιμής (και οι σχετικές τιμές σταθεράς ρυθμού πρόσληψης, σταθεράς ρυθμού αποβολής και BCF) για να λαμβάνονται υπόψη οι μεταβολές ανάλογα με την περιεκτικότητα των ομάδων-μαρτύρων σε λιπίδια κατά τη διάρκεια της δοκιμής (50). Η συγκέντρωση της υπό δοκιμή ουσίας και των λιπιδίων δεν θα πρέπει να αναλύεται σε νεκρά ή ασθενή ψάρια. Παράδειγμα αποδεκτού προγράμματος δειγματοληψίας δίδεται στο προσάρτημα 4. Μπορούν εύκολα να καταρτιστούν και άλλα προγράμματα με τη χρήση άλλων κατά παραδοχή τιμών K OW για τον υπολογισμό του χρόνου έκθεσης για πρόσληψη 95 % (βλ. υπολογισμούς στο προσάρτημα 5). Η δειγματοληψία θα πρέπει να συνεχίζεται κατά τη φάση πρόσληψης μέχρις ότου αποκατασταθεί σταθερή κατάσταση (βλ. προσάρτημα 1 «Ορισμοί και μονάδες») ή τερματιστεί η εν λόγω φάση με άλλον τρόπο (μετά από 28 ή 60 ημέρες, βλ. παραγράφους 37 και 38). Πριν από την έναρξη της φάσης αποβολής, τα ψάρια θα πρέπει να μεταφέρονται σε καθαρά δοχεία. Δειγματοληψία και παρασκευή δείγματος Θα πρέπει να λαμβάνονται δείγματα νερού για ανάλυση, π.χ. με σιφωνισμό μέσω αδρανών σωληνώσεων από κεντρικό σημείο του θαλάμου δοκιμής. Ούτε η διήθηση ούτε η φυγοκέντρηση φαίνεται να διαχωρίζουν πάντοτε το μη βιοδιαθέσιμο κλάσμα της υπό δοκιμή ουσίας από το βιοδιαθέσιμο. Εάν εφαρμόζεται τεχνική διαχωρισμού, η έκθεση δοκιμής θα πρέπει πάντοτε να περιλαμβάνει αιτιολόγηση ή επικύρωση της τεχνικής διαχωρισμού, δεδομένων των δυσχερειών ως προς τη βιοδιαθεσιμότητα (25). Τα δείγματα δεν θα πρέπει να υποβάλλονται σε αυτές τις κατεργασίες, ιδίως προκειμένου για εξαιρετικά υδρόφοβες ουσίες (δηλ. ουσίες με log K OW > 5) (12) (26), στην περίπτωση των οποίων υπάρχει πιθανότητα προσρόφησης στον φορέα του ηθμού ή στους σωλήνες φυγοκέντρησης. Αντ' αυτού, θα πρέπει αφενός να λαμβάνονται μέτρα ώστε οι δεξαμενές να διατηρούνται όσο το δυνατόν καθαρότερες (βλ. παράγραφο 46) και, αφετέρου, να παρακολουθείται η περιεκτικότητα σε ολικό οργανικό άνθρακα κατά τη διάρκεια τόσο της φάσης πρόσληψης όσο και της φάσης αποβολής (βλ. παράγραφο 53). Για την αποφυγή τυχόν προβλημάτων μειωμένης βιοδιαθεσιμότητας, μπορεί να εφαρμοστεί δειγματοληψία με τεχνικές μικροεκχύλισης σε στερεά φάση για τις δυσδιάλυτες και εξαιρετικά υδρόφοβες ουσίες. Τα ψάρια των δειγμάτων θα πρέπει να υποβάλλονται σε ευθανασία αμέσως, με την πλέον ενδεδειγμένη και ανώδυνη μέθοδο [για μετρήσεις σε ολόκληρα ψάρια, δεν θα πρέπει να εφαρμόζονται άλλες διαδικασίες εκτός από έκπλυση με νερό (βλ. παράγραφο 28) και στέγνωμα των ψαριών με απορροφητικό χαρτί]. Κατόπιν μετριέται το βάρος και το ολικό μήκος των ψαριών (51). Για κάθε ψάρι, το μετρούμενο βάρος και μήκος θα πρέπει να αντιστοιχίζονται με τη συγκέντρωση της αναλυόμενης ουσίας (και την περιεκτικότητα σε λιπίδια, κατά περίπτωση) που προσδιορίζεται με την ανάλυση, για παράδειγμα με τη χρήση αποκλειστικού αναγνωριστικού κωδικού για κάθε ψάρι δείγματος. Είναι προτιμότερο η ανάλυση των ψαριών και του νερού να διενεργείται αμέσως μετά τη δειγματοληψία, για να αποτρέπονται τυχόν αποδόμηση ή άλλες απώλειες και να υπολογίζονται κατά προσέγγιση σταθερές ρυθμού πρόσληψης και αποβολής με την πρόοδο της δοκιμής. Με την άμεση ανάλυση αποφεύγονται επίσης καθυστερήσεις στον προσδιορισμό του χρόνου οριζοντίωσης της καμπύλης (επίτευξη σταθερής κατάστασης). Εάν δεν διενεργείται άμεση ανάλυση, τα δείγματα θα πρέπει να φυλάσσονται με κατάλληλη μέθοδο. Πριν από την έναρξη της μελέτης, θα πρέπει να συγκεντρώνονται πληροφορίες σχετικά με την κατάλληλη μέθοδο φύλαξης της συγκεκριμένης υπό δοκιμή ουσίας — π.χ. βαθιά κατάψυξη, διατήρηση στους 4 °C, εκχύλιση κ.λπ. Η διάρκεια φύλαξης θα πρέπει να επιλέγεται κατά τρόπο που να εξασφαλίζει ότι η ουσία δεν αποδομείται στο διάστημα αυτό. Ποιότητα της αναλυτικής μεθόδου Επειδή η όλη διαδικασία εξαρτάται ουσιαστικά από την ορθότητα, την ακρίβεια και την ευαισθησία της αναλυτικής μεθόδου που χρησιμοποιείται για την υπό δοκιμή ουσία, ελέγχεται πειραματικά αν η ορθότητα, η ακρίβεια και αναπαραγωγιμότητα της ανάλυσης της ουσίας, καθώς και η ανάκτησή της από το νερό και τα ψάρια είναι ικανοποιητικές για τη συγκεκριμένη μέθοδο. Ο εν λόγω πειραματικός έλεγχος θα πρέπει να αποτελεί μέρος των προκαταρκτικών δοκιμών. Εξακριβώνεται, επίσης, ότι η υπό δοκιμή ουσία δεν ανιχνεύεται στο χρησιμοποιούμενο νερό αραίωσης. Εάν είναι αναγκαίο, οι τιμές συγκέντρωσης της υπό δοκιμή ουσίας στο νερό και στα ψάρια, που προκύπτουν από τη δοκιμή, διορθώνονται για να ληφθούν υπόψη οι τιμές ανάκτησης και συγκεντρώσεων υποβάθρου στους μάρτυρες. Ο χειρισμός των δειγμάτων ψαριών και νερού θα πρέπει να ελαχιστοποιεί τις μολύνσεις και τις απώλειες (που οφείλονται, π.χ., σε προσρόφηση στη συσκευή δειγματοληψίας) σε όλη τη διάρκεια της δοκιμής. Ανάλυση του δείγματος ψαριών Εάν στη δοκιμή χρησιμοποιούνται ραδιοσημασμένα υλικά, είναι δυνατόν να προσδιοριστεί το σύνολο της ραδιοσήμανσης (δηλ. μητρική ουσία και μεταβολίτες) ή να καθαριστούν τα δείγματα ώστε να μπορεί να αναλυθεί χωριστά η μητρική ουσία. Εάν ο BCF πρόκειται να βασίζεται στη μητρική ουσία, θα πρέπει να χαρακτηρίζονται οι βασικοί μεταβολίτες, τουλάχιστον στο τέλος της φάσης πρόσληψης (βλ. παράγραφο 6). Σημαντικοί μεταβολίτες είναι όσοι αντιπροσωπεύουν ποσοστό ≥ 10 % των ολικών καταλοίπων στους ιστούς των ψαριών, όσοι αντιπροσωπεύουν ποσοστό ≥ 5 % σε δύο διαδοχικά χρονικά σημεία δειγματοληψίας, όσοι εμφανίζουν αυξανόμενα επίπεδα καθ' όλη τη διάρκεια της φάσης πρόσληψης και όσοι είναι γνωστό ότι προκαλούν ανησυχίες από τοξικολογικής πλευράς. Εάν ο BCF για ολόκληρο το ψάρι ως προς τα ολικά ραδιοσημασμένα κατάλοιπα είναι ≥ 500, ενδέχεται να είναι σκόπιμη — και για ορισμένες κατηγορίες ουσιών, όπως τα γεωργικά φάρμακα, συνιστάται ένθερμα — η ταυτοποίηση και η ποσοτικοποίηση των σημαντικών μεταβολιτών. Η ποσοτικοποίηση των εν λόγω μεταβολιτών ενδέχεται να απαιτείται από ορισμένες ρυθμιστικές αρχές. Εάν ταυτοποιούνται και ποσοτικοποιούνται προϊόντα αποδόμησης που αντιπροσωπεύουν ποσοστό ≥ 10 % των ολικών ραδιοσημασμένων καταλοίπων στους ιστούς των ψαριών, συνιστάται η ταυτοποίηση και ποσοτικοποίηση των προϊόντων αποδόμησης και στο νερό δοκιμής. Εάν αυτό δεν είναι εφικτό, αυτό θα πρέπει να εξηγείται στην έκθεση. Η συγκέντρωση της υπό δοκιμή ουσίας πρέπει συνήθως να προσδιορίζεται σε κάθε ζυγισμένο ψάρι χωριστά. Εάν αυτό δεν είναι εφικτό, επιτρέπεται η συγχώνευση δειγμάτων σε κάθε χρόνο δειγματοληψίας, η οποία, ωστόσο, περιορίζει τις στατιστικές διαδικασίες που μπορούν να εφαρμοστούν στα δεδομένα και, κατά συνέπεια, θα πρέπει να περιλαμβάνεται στη δοκιμή κατάλληλος αριθμός ψαριών που να εξυπηρετεί την επιθυμητή συγχώνευση, καθώς και τη στατιστική διαδικασία και ισχύ. Οι βιβλιογραφικές παραπομπές (27) και (28) μπορούν να χρησιμοποιηθούν ως εισαγωγή στις σχετικές διαδικασίες συγχώνευσης. Ο BCF θα πρέπει να εκφράζεται κανονικοποιημένος σε ψάρι με περιεκτικότητα 5 % σε λιπίδια (με βάση το νωπό βάρος), επιπλέον της τιμής που προκύπτει απευθείας από τη μελέτη (βλ. παράγραφο 21), εκτός εάν είναι δυνατόν να υποστηριχθεί ότι η υπό δοκιμή ουσία δεν συσσωρεύεται κατά κύριο λόγο σε λιπίδια. Εφόσον είναι δυνατόν, η περιεκτικότητα των ψαριών σε λιπίδια θα πρέπει να προσδιορίζεται σε κάθε χρόνο δειγματοληψίας, κατά προτίμηση στο εκχύλισμα που παρασκευάζεται για την ανάλυση της υπό δοκιμή ουσίας, δεδομένου ότι τα λιπίδια πρέπει συχνά να απομακρύνονται από το εκχύλισμα πριν αυτό υποβληθεί σε χρωματογραφική ανάλυση. Ωστόσο, η ανάλυση των υπό δοκιμή ουσιών απαιτεί συχνά ειδικές διαδικασίες εκχύλισης που ενδεχομένως δεν είναι σύμφωνες με τις μεθόδους δοκιμών για τον προσδιορισμό των λιπιδίων. Στην περίπτωση αυτή (έως ότου καταστούν διαθέσιμες κατάλληλες μη καταστροφικές μέθοδοι ενόργανης ανάλυσης), συνιστάται να ακολουθείται διαφορετική στρατηγική για τον προσδιορισμό της περιεκτικότητας των ψαριών σε λιπίδια (βλ. παράγραφο 56). Θα πρέπει να χρησιμοποιούνται κατάλληλες μέθοδοι για τον προσδιορισμό της εν λόγω περιεκτικότητας (20). Ενώ συνιστάται η τεχνική της εκχύλισης με χλωροφόρμιο/μεθανόλη (29) ως πρότυπη μέθοδος (30), συνιστάται επίσης η μέθοδος Smedes (31) ως εναλλακτική τεχνική. Η τελευταία χαρακτηρίζεται από συγκρίσιμη απόδοση εκχύλισης, υψηλή ορθότητα, χρήση λιγότερο τοξικών οργανικών διαλυτών και ευχρηστία. Μπορούν να χρησιμοποιούνται και άλλες μέθοδοι, η ορθότητα των οποίων είναι εφάμιλλη εκείνης των συνιστώμενων μεθόδων, εφόσον παρέχεται η δέουσα αιτιολόγηση. Είναι σημαντικό να παρέχονται λεπτομερή στοιχεία για τη χρησιμοποιούμενη μέθοδο. Μέτρηση της ανάπτυξης των ψαριών Κατά την έναρξη της δοκιμής, πρέπει να ζυγίζονται χωριστά πέντε έως δέκα ψάρια από τον πληθυσμό του αποθέματος ψαριών και να μετράται το ολικό τους μήκος. Τα ίδια ψάρια μπορούν να χρησιμοποιηθούν και για την ανάλυση των λιπιδίων (βλ. παράγραφο 56). Το βάρος και το μήκος των ψαριών που χρησιμοποιούνται για κάθε δειγματοληψία, τόσο από την ομάδα δοκιμής όσο και από την ομάδα μαρτύρων, θα πρέπει να μετράται πριν από την ανάλυση της χημικής ουσίας ή των λιπιδίων. Οι μετρήσεις σε αυτά τα δείγματα ψαριών μπορούν να χρησιμοποιούνται για την εκτίμηση του βάρους και του μήκους των ψαριών που απομένουν στις δεξαμενές δοκιμής και μαρτύρων (βλ. παράγραφο 45). ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Επεξεργασία αποτελεσμάτων Η καμπύλη πρόσληψης της υπό δοκιμή ουσίας θα πρέπει να λαμβάνεται με γραφική παράσταση της συγκέντρωσής της στη μάζα/επιφάνεια των ψαριών (ή συγκεκριμένων ιστών) κατά τη φάση πρόσληψης σε συνάρτηση με τον χρόνο σε αριθμητική κλίμακα. Εάν η καμπύλη έχει οριζοντιωθεί, αν δηλαδή τείνει ασυμπτωτικά προς τον άξονα του χρόνου, ο BCF σε σταθερή κατάσταση (BCFSS) θα πρέπει να υπολογίζεται από τον τύπο:
Η εξέλιξη της συγκέντρωσης C f μπορεί να επηρεαστεί από την ανάπτυξη των ψαριών (βλ. παραγράφους 72 και 73). Η μέση συγκέντρωση έκθεσης (Cw ) επηρεάζεται από τη μεταβολή με την πάροδο του χρόνου. Μπορεί να αναμένεται ότι η χρονοσταθμισμένη μέση συγκέντρωση είναι καταλληλότερη και ακριβέστερη για τις μελέτες βιοσυγκέντρωσης, ακόμη και αν η μεταβλητότητα βρίσκεται εντός της ενδεδειγμένης περιοχής εγκυρότητας (βλ. παράγραφο 24). Η χρονοσταθμισμένη μέση (TWA) συγκέντρωση στο νερό μπορεί να υπολογιστεί σύμφωνα με το προσάρτημα 5, τμήμα 1. Ο κινητικός συντελεστής βιοσυγκέντρωσης (BCFK) θα πρέπει να προσδιορίζεται ως ο λόγος k 1/k 2, ήτοι των δύο σταθερών ρυθμού της κινητικής πρώτης τάξης. Οι σταθερές ρυθμού k 1 και k 2 και BCFK μπορούν να ληφθούν με ταυτόχρονη προσαρμογή τόσο της φάσης πρόσληψης όσο και της φάσης αποβολής. Εναλλακτικά, η k 1 και η k 2 μπορούν να προσδιορίζονται διαδοχικά (βλ. παράρτημα 5 για περιγραφή και σύγκριση αυτών των μεθόδων). Η σταθερά ρυθμού αποβολής (k 2) μπορεί να χρειαστεί διόρθωση για να ληφθεί υπόψη η αναπτυξιακή αραίωση (βλ. παραγράφους 72 και 73). Εάν είναι προφανές ότι η καμπύλη πρόσληψης και/ή αποβολής δεν είναι πρώτης τάξης, θα πρέπει να χρησιμοποιούνται πιο σύνθετα μοντέλα (βλ. παραπομπές στο προσάρτημα 5) και να ζητούνται οδηγίες από βιοστατιστικολόγο και/ή ειδικό στη φαρμακοκινητική. Δεδομένα για το βάρος/μήκος των ψαριών Το νωπό βάρος και το ολικό μήκος κάθε ψαριού, σε κάθε χρόνο δειγματοληψίας, παρουσιάζονται σε πίνακα χωριστά για τις ομάδες δοκιμής και τις ομάδες μαρτύρων κατά τις φάσεις πρόσληψης και αποβολής (συμπεριλαμβανομένου του πληθυσμού του αποθέματος κατά την έναρξη της πρόσληψης. Το μετρούμενο βάρος και μήκος κάθε ψαριού θα πρέπει να αντιστοιχίζεται με τη συγκέντρωση της χημικής ουσίας που προκύπτει από την ανάλυση, για παράδειγμα με τη χρήση αποκλειστικού αναγνωριστικού κωδικού για κάθε δείγμα ψαριών. Το βάρος είναι η προτιμώμενη παράμετρος ανάπτυξης για τη διόρθωση των τιμών του BCF κινητικής προκειμένου να ληφθεί υπόψη η αναπτυξιακή αραίωση (βλ. μέθοδο που χρησιμοποιείται για την εν λόγω διόρθωση των δεδομένων στην παράγραφο 73 και στο προσάρτημα). Διόρθωση ως προς την αναπτυξιακή αραίωση και κανονικοποίηση ως προς τα λιπίδια Η ανάπτυξη των ψαριών κατά τη φάση αποβολής μπορεί να ελαττώσει τις μετρούμενες συγκεντρώσεις χημικών ουσιών στα ψάρια, με αποτέλεσμα η συνολική σταθερά ρυθμού αποβολής (k 2) να είναι μεγαλύτερη από αυτήν που θα προέκυπτε μόνο από διεργασίες απομάκρυνσης (π.χ. αναπνοή, μεταβολισμός, εκκένωση). Οι συντελεστές βιοσυγκέντρωσης κινητικής θα πρέπει να διορθώνονται ως προς την αναπτυξιακή αραίωση. Ο BCFSS επηρεάζεται επίσης από την ανάπτυξη, αλλά δεν έχει συμφωνηθεί διαδικασία για τη σχετική διόρθωση αυτού του παράγοντα. Σε περιπτώσεις σημαντικής ανάπτυξης, θα πρέπει επίσης να συνάγεται ο διορθωμένος ως προς την ανάπτυξη BCFK (BCFKg), καθώς μπορεί να είναι πιο κατάλληλη παράμετρος βιοσυγκέντρωσης. Η περιεκτικότητα των ψαριών της δοκιμής σε λιπίδια (που συνδέεται στενά με τη βιοσυσσώρευση των υδρόφοβων ουσιών) μπορεί να ποικίλλει στην πράξη, σε βαθμό ώστε να είναι αναγκαία η κανονικοποίηση σε καθορισμένη περιεκτικότητα των ψαριών σε λιπίδια [5 % (κ.β.)] για λήψη χρήσιμων παραγόντων βιοσυγκέντρωσης, τόσο σε σταθερή κατάσταση όσο και κινητικής, εκτός εάν είναι δυνατόν να υποστηριχθεί ότι η υπό δοκιμή ουσία δεν συσσωρεύεται κατά κύριο λόγο σε λιπίδια (π.χ. ορισμένες υπερφθοριωμένες ουσίες μπορεί να δεσμεύονται από πρωτεΐνες). Εξισώσεις και παραδείγματα για τους υπολογισμούς αυτούς παρατίθενται στο προσάρτημα 5. Για τη διόρθωση του κινητικού BCF ως προς την αναπτυξιακή αραίωση, η σταθερά ρυθμού αποβολής θα πρέπει να διορθώνεται ως προς την ανάπτυξη. Αυτή η διορθωμένη ως προς την ανάπτυξη σταθερά ρυθμού αποβολής (k 2g) υπολογίζεται με την αφαίρεση της σταθεράς ρυθμού ανάπτυξης (k g, όπως λαμβάνεται από τα στοιχεία του μετρούμενου βάρους) από τη συνολική σταθερά ρυθμού αποβολής (k 2). Στη συνέχεια, υπολογίζεται ο διορθωμένος ως προς την ανάπτυξη κινητικός συντελεστής βιοσυγκέντρωσης με διαίρεση της σταθεράς ρυθμού πρόσληψης (k 1) διά της διορθωμένης ως προς την ανάπτυξη σταθεράς ρυθμού αποβολής (k 2g) (βλ. προσάρτημα 5). Σε ορισμένες περιπτώσεις, η προσέγγιση αυτή υπονομεύεται: για παράδειγμα, για ουσίες με πολύ αργό ρυθμό αποβολής που εξετάζονται σε ταχέως αναπτυσσόμενα ψάρια, η προκύπτουσα τιμή k 2g μπορεί να είναι πολύ μικρή και, ως εκ τούτου, το σφάλμα στις δύο σταθερές ρυθμού που χρησιμοποιούνται για να ληφθεί αυτή η τιμή καθίσταται κρίσιμο και, σε ορισμένες περιπτώσεις, οι εκτιμήσεις της σταθεράς k g μπορεί να είναι μεγαλύτερες από την k 2. Μια εναλλακτική προσέγγιση, με την οποία παρακάμπτεται η ανάγκη διόρθωσης ως προς την αναπτυξιακή αραίωση, συνίσταται στη χρήση δεδομένων αποβολής που εκφράζονται σε μάζα της υπό δοκιμή ουσίας ανά ψάρι (για ολόκληρα ψάρια) αντί των συνήθων δεδομένων που εκφράζονται σε μάζα της υπό δοκιμή ουσίας ανά μονάδα μάζας ψαριού (συγκέντρωση). Αυτό μπορεί να επιτευχθεί εύκολα, δεδομένου ότι στις δοκιμές σύμφωνα με την παρούσα μέθοδο οι καταγραφόμενες συγκεντρώσεις σε ιστούς θα πρέπει να αντιστοιχίζονται με το βάρος των επιμέρους ψαριών. Η απλή διαδικασία που εφαρμόζεται για τον σκοπό αυτό περιγράφεται συνοπτικά στο προσάρτημα 5. Επισημαίνεται ότι η k 2 θα πρέπει να αναφέρεται ακόμη κι αν ακολουθείται αυτή η εναλλακτική προσέγγιση. Οι παράγοντες βιοσυγκέντρωσης, κινητικός και σε σταθερή κατάσταση, θα πρέπει επίσης να αναφέρονται σε σχέση με την προεπιλεγμένη περιεκτικότητα 5 % κ.β. των ψαριών σε λιπίδια, εκτός εάν είναι δυνατόν να υποστηριχθεί ότι η υπό δοκιμή ουσία δεν συσσωρεύεται κατά κύριο λόγο σε λιπίδια. Τα δεδομένα συγκέντρωσης στα ψάρια, ή ο BCF, κανονικοποιούνται σύμφωνα με τον λόγο της περιεκτικότητας 5 % προς την πραγματική (ατομική) μέση περιεκτικότητα σε λιπίδια (σε % του νωπού βάρους) (βλ. προσάρτημα 5). Εάν οι αναλύσεις της χημικής ουσίας και των λιπιδίων έχουν διεξαχθεί στο ίδιο ψάρι, τα κανονικοποιημένα δεδομένα για την περιεκτικότητα κάθε ψαριού σε λιπίδια θα πρέπει να χρησιμοποιούνται για τον υπολογισμό κανονικοποιημένου ως προς τα λιπίδια BCF. Εναλλακτικά, εάν η ανάπτυξη των ψαριών-μαρτύρων είναι παρόμοια με εκείνη των εκτιθέμενων ψαριών, μπορεί να χρησιμοποιείται για τη διόρθωση ως προς τα λιπίδια μόνο η περιεκτικότητα των ψαριών-μαρτύρων σε λιπίδια (βλ. παράγραφο 56). Μια μέθοδος για τον υπολογισμό κανονικοποιημένου ως προς τα λιπίδια BCF περιγράφεται στο προσάρτημα 5. Ερμηνεία των αποτελεσμάτων Τα αποτελέσματα θα πρέπει να ερμηνεύονται με προσοχή όταν οι μετρούμενες συγκεντρώσεις των διαλυμάτων δοκιμής βρίσκονται σε επίπεδα κοντά στο όριο ανίχνευσης της αναλυτικής μεθόδου. Η μέση ανάπτυξη στις ομάδες δοκιμής και στις ομάδες μαρτύρων θα πρέπει, κατ' αρχήν, να μην παρουσιάζει σημαντικές διαφορές, ώστε να αποκλείεται το ενδεχόμενο τοξικών επιδράσεων. Οι σταθερές ρυθμού ανάπτυξης ή οι καμπύλες ανάπτυξης των δύο ομάδων θα πρέπει να συγκρίνονται με κατάλληλη διαδικασία (52). Οι καλώς καθορισμένες καμπύλες πρόσληψης και αποβολής αποτελούν ένδειξη καλής ποιότητας των δεδομένων βιοσυγκέντρωσης. Για τις σταθερές ρυθμού, το αποτέλεσμα του ελέγχου ποιότητας προσαρμογής χ2 θα πρέπει να παρουσιάζει ικανοποιητική προσαρμογή [δηλ. μικρό ποσοστό σφάλματος μετρήσεων (32)] του μοντέλου βιοσυσσώρευσης, ώστε οι σταθερές ρυθμού να μπορούν να θεωρηθούν αξιόπιστες (βλ. προσάρτημα 5). Εάν χρησιμοποιούνται περισσότερες από μία συγκεντρώσεις δοκιμής, η μεταβολή των σταθερών πρόσληψης/αποβολής μεταξύ των συγκεντρώσεων δοκιμής θα πρέπει να είναι μικρότερη από 20 % (53). Σε διαφορετική περίπτωση, μπορεί να αποτελεί ένδειξη εξάρτησης από τη συγκέντρωση. Η παρατήρηση σημαντικών διαφορών μεταξύ των χρησιμοποιούμενων συγκεντρώσεων δοκιμής ως προς τις σταθερές ρυθμού πρόσληψης/αποβολής θα πρέπει να καταγράφεται και να διατυπώνονται πιθανές εξηγήσεις. Γενικά, το όριο εμπιστοσύνης 95 % των BCF που προέρχονται από καλοσχεδιασμένες μελέτες προσεγγίζει το ± 20 % του προκύπτοντος BCF. Εάν εξετάζονται δύο ή περισσότερες συγκεντρώσεις, τα αποτελέσματα και των δύο ή όλων των συγκεντρώσεων χρησιμοποιούνται για να διερευνηθεί αν τα αποτελέσματα είναι σταθερά και να διαπιστωθεί κατά πόσον υπάρχει εξάρτηση από τη συγκέντρωση. Εάν εξετάζεται μόνο μία συγκέντρωση, για να μειωθεί η χρήση ζώων και/ή πόρων, θα πρέπει να παρέχεται αιτιολόγηση της χρήσης μίας συγκέντρωσης. Η συναγόμενη τιμή BCFSS είναι αμφίβολη αν η τιμή BCFK είναι κατά πολύ μεγαλύτερη από την BCFSS, διότι αυτό μπορεί να αποτελεί ένδειξη ότι δεν επιτεύχθηκε σταθερή κατάσταση ή ότι δεν συνυπολογίστηκαν οι διεργασίες αναπτυξιακής αραίωσης και απώλειας. Όταν η τιμή BCFSS είναι κατά πολύ υψηλότερη από την BCFK, ο υπολογισμός των σταθερών ρυθμού πρόσληψης και αποβολής θα πρέπει να ελέγχεται για σφάλματα και να επαναξιολογείται. Μια διαφορετική διαδικασία προσαρμογής θα μπορούσε να βελτιώσει την εκτίμηση του BCFK (βλ. προσάρτημα 5). Έκθεση δοκιμής Εκτός από τα στοιχεία για την υπό δοκιμή ουσία που αναφέρονται στην παράγραφο 3, η έκθεση δοκιμής περιλαμβάνει τις ακόλουθες πληροφορίες:
Γ.13 — II: Ελαχιστοποιημένη δοκιμή υδατικής έκθεσης σε ψάρια ΕΙΣΑΓΩΓΗ Η πείρα που συσσωρεύουν τόσο τα εργαστήρια όσο και οι ρυθμιστικές αρχές από τη διεξαγωγή και την ερμηνεία των αποτελεσμάτων της πλήρους δοκιμής δείχνει ότι, πλην ορισμένων εξαιρέσεων, ισχύει κινητική πρώτης τάξης για την εκτίμηση των σταθερών ρυθμού πρόσληψης και αποβολής. Συνεπώς, μπορούν να εκτιμώνται οι σταθερές ρυθμού πρόσληψης και αποβολής και να συνάγεται ο κινητικός BCF με ελάχιστο αριθμό χρονικών σημείων δειγματοληψίας. Ο αρχικός σκοπός της εξέτασης εναλλακτικών σχεδιασμών για μελέτες του BCF ήταν αφενός η ανάπτυξη δοκιμής μικρής κλίμακας που να χρησιμοποιείται ως ενδιάμεσο στάδιο δοκιμών για την απόρριψη ή την επιβεβαίωση εκτιμήσεων του BCF με βάση τη σταθερά K OW και τα μοντέλα QSAR ώστε, με τον τρόπο αυτό, να εκλείψει η ανάγκη διεξαγωγής πλήρων μελετών για πολλές ουσίες και, αφετέρου, η ελαχιστοποίηση του κόστους και της χρήσης ζώων μέσω της μείωσης των δειγματοληψιών και του αριθμού των πραγματοποιούμενων διαδοχικών αναλύσεων. Στόχος ήταν να παρέχονται επαρκούς ορθότητας και ακρίβειας εκτιμήσεις του BCF για τις αποφάσεις εκτίμησης κινδύνου και, παράλληλα, να τηρείται ο βασικός σχεδιασμός της προγενέστερης μεθόδου δοκιμών ώστε να είναι δυνατή η ενσωμάτωση των αποτελεσμάτων των δοκιμών στα υφιστάμενα δεδομένα για τον BCF και να διευκολυνθεί η διεξαγωγή των δοκιμών και η ερμηνεία των δεδομένων. Ισχύουν πολλές από τις ίδιες εκτιμήσεις όπως για την πλήρη δοκιμή, π.χ. τα κριτήρια εγκυρότητας (βλ. παράγραφο 24) και η διακοπή της δοκιμής σε περίπτωση που ο βαθμός πρόσληψης στο τέλος της φάσης πρόσληψης είναι ασήμαντος (βλ. παραγράφους 16 και 38). Οι ουσίες που θα είναι επιλέξιμες για τον σχεδιασμό ελαχιστοποιημένης δοκιμής θα πρέπει να εμπίπτουν στο γενικό πεδίο εφαρμογής για το οποίο αναπτύχθηκε η παρούσα μέθοδος δοκιμών, δηλ. μη πολικές οργανικές ουσίες (βλ. παράγραφο 49). Εάν υπάρχει οποιαδήποτε ένδειξη ότι η προς δοκιμή ουσία θα μπορούσε να επιδείξει διαφορετική συμπεριφορά (π.χ. σαφή απόκλιση από την κινητική πρώτης τάξεως), θα πρέπει να πραγματοποιηθεί πλήρης δοκιμή για κανονιστικούς σκοπούς. Κατά κανόνα, η ελαχιστοποιημένη δοκιμή δεν διενεργείται σε λιγότερο χρόνο από την τυπική δοκιμή BCF, αλλά περιλαμβάνει δειγματοληψία λιγότερων ψαριών (βλ. προσάρτημα 6 για την αιτιολόγηση). Ωστόσο, η περίοδος αποβολής μπορεί να συντομευθεί για τις ταχέως αποβαλλόμενες ουσίες, ώστε να μη σημειώνονται στα ψάρια συγκεντρώσεις κάτω από το όριο ανίχνευσης/ποσοτικού προσδιορισμού πριν από το πέρας της δοκιμής. Είναι δυνατόν να χρησιμοποιηθεί δοκιμή ελαχιστοποιημένης έκθεσης ψαριών με μία μόνο συγκέντρωση για να κριθεί αν χρειάζεται πλήρης δοκιμή και, εφόσον τα προκύπτοντα δεδομένα που χρησιμοποιούνται για τον υπολογισμό των σταθερών ρυθμού και του BCF είναι αξιόπιστα (βλ. παράγραφο 93), μπορεί να παραλειφθεί η διεξαγωγή πλήρους δοκιμής, εάν ο λαμβανόμενος BCF απέχει πολύ από τις ανησυχητικές τιμές που έχουν υπαχθεί σε κανονιστικές ρυθμίσεις. Σε ορισμένες περιπτώσεις, μπορεί να παρουσιάζει πλεονεκτήματα η εφαρμογή του σχεδιασμού ελαχιστοποιημένης δοκιμής με περισσότερες από μία συγκεντρώσεις δοκιμής ως προκαταρκτική δοκιμή για να διαπιστωθεί κατά πόσον οι εκτιμήσεις του BCF για μια ουσία εξαρτώνται από τη συγκέντρωση. Εάν οι εκτιμήσεις του BCF με την ελαχιστοποιημένη δοκιμή δείχνουν εξάρτηση από τη συγκέντρωση, θα είναι απαραίτητη η διεξαγωγή πλήρους δοκιμής. Εάν, με βάση την εν λόγω ελαχιστοποιημένη δοκιμή, οι εκτιμήσεις του BCF δεν εξαρτώνται από τη συγκέντρωση, αλλά τα αποτελέσματα δεν θεωρούνται οριστικά, κάθε μεταγενέστερη πλήρης δοκιμή θα μπορούσε να διεξάγεται με μία μόνο συγκέντρωση και, με τον τρόπο αυτό, να περιοριστεί η χρήση ζώων σε σύγκριση με μια πλήρη δοκιμή με δύο (ή περισσότερες) συγκεντρώσεις. Οι εν δυνάμει επιλέξιμες ουσίες για την ελαχιστοποιημένη δοκιμή θα πρέπει:
ΠΡΟΓΡΑΜΜΑ ΔΕΙΓΜΑΤΟΛΗΨΙΑΣ ΓΙΑ ΜΕΛΕΤΕΣ ΣΥΜΦΩΝΑ ΜΕ ΤΟΝ ΣΧΕΔΙΑΣΜΟ ΕΛΑΧΙΣΤΟΠΟΙΗΜΕΝΗΣ ΔΟΚΙΜΗΣ Δειγματοληψία ψαριών Η δειγματοληψία ψαριών μειώνεται σε τέσσερα χρονικά σημεία δειγματοληψίας:
Δειγματοληψία νερού Σύμφωνα με τον σχεδιασμό ελαχιστοποιημένης δοκιμής, η δειγματοληψία νερού διενεργείται όπως στην πλήρη μελέτη (βλ. παράγραφο 54) ή, τουλάχιστον, σε πέντε ισοκατανεμημένα χρονικά σημεία κατά τη φάση πρόσληψης και ανά εβδομάδα κατά τη φάση αποβολής. Τροποποιήσεις σχεδιασμού Μπορούν να εξεταστούν ορισμένες τροποποιήσεις του σχεδιασμού της μελέτης, λαμβανομένων υπόψη των ιδιοτήτων της υπό δοκιμή ουσίας, έγκυρων προβλέψεων με μοντέλα QSAR και του ειδικού σκοπού της μελέτης:
Υπολογισμοί Η λογική αυτής της προσέγγισης έγκειται στο ότι ο συντελεστής βιοσυγκέντρωσης σε μια πλήρη δοκιμή μπορεί να προσδιοριστεί είτε ως συντελεστής βιοσυγκέντρωσης σε σταθερή κατάσταση (BCFSS), με υπολογισμό του λόγου της συγκέντρωσης της υπό δοκιμή ουσίας στον ιστό των ψαριών προς τη συγκέντρωσή της στο νερό, είτε με υπολογισμό του κινητικού συντελεστή βιοσυγκέντρωσης (BCFK), ως ο λόγος της σταθεράς ρυθμού πρόσληψης k 1 προς τη σταθερά ρυθμού αποβολής k 2. Ο BCFK είναι έγκυρος ακόμη και αν δεν επιτυγχάνεται συγκέντρωση σταθερής κατάστασης μιας ουσίας κατά την πρόσληψη, υπό την προϋπόθεση ότι η πρόσληψη και η αποβολή ακολουθούν διεργασίες κινητικής πρώτης τάξεως περίπου. Απαιτούνται τουλάχιστον δύο σημεία δεδομένων για την εκτίμηση των σταθερών ρυθμού πρόσληψης και αποβολής, ένα στο τέλος της φάσης πρόσληψης (δηλ. κατά την έναρξη της φάσης αποβολής) και ένα στο τέλος (ή αφού συμπληρωθεί σημαντικό μέρος) της φάσης αποβολής. Το ενδιάμεσο σημείο δειγματοληψίας συνιστάται για τον έλεγχο της κινητικής της πρόσληψης και της αποβολής (57). Για υπολογισμούς βλ. προσαρτήματα 5 και 6. Ερμηνεία των αποτελεσμάτων Για να αξιολογηθεί η εγκυρότητα και η διαφωτιστική αξία της δοκιμής, επαληθεύεται ότι η περίοδος αποβολής υπερβαίνει τον χρόνο υποδιπλασιασμού. Επίσης, ο BCFKm (κινητικός BCF που προέρχεται από ελαχιστοποιημένη δοκιμή) θα πρέπει να συγκρίνεται με την ελαχιστοποιημένη τιμή BCFSS (η οποία είναι ο BCFSS που υπολογίζεται στο τέλος της φάσης πρόσληψης, με την παραδοχή ότι έχει επιτευχθεί σταθερή κατάσταση — αυτό μπορεί μόνο να υποτεθεί, διότι ο αριθμός των χρονικών σημείων δειγματοληψίας δεν αρκεί για να αποδειχθεί). Εάν ισχύει ότι BCFKm < ελαχιστοποιημένο BCFSS, ο ελαχιστοποιημένος BCFSS θα πρέπει να είναι η προτιμώμενη αξία. Εάν ο BCFKm είναι μικρότερος από το 70 % του ελαχιστοποιημένου BCFSS, τα αποτελέσματα δεν είναι έγκυρα και θα πρέπει να πραγματοποιείται πλήρης δοκιμή. Εάν η ελαχιστοποιημένη δοκιμή παρέχει τιμή BCFKm της ίδιας τάξης με οποιαδήποτε τιμή κανονιστικού ενδιαφέροντος, θα πρέπει να διεξάγεται πλήρης δοκιμή. Εάν το αποτέλεσμα απέχει πολύ από κάθε τιμή κανονιστικού ενδιαφέροντος (είτε προς τα άνω είτε προς τα κάτω), μπορεί να μην είναι αναγκαία η διεξαγωγή πλήρους δοκιμής ή μπορεί να διεξαχθεί πλήρης δοκιμή με μία μόνο συγκέντρωση, εάν το επιβάλλει το σχετικό ρυθμιστικό πλαίσιο. Εάν μετά από ελαχιστοποιημένη δοκιμή με μία συγκέντρωση κριθεί αναγκαία η πλήρης δοκιμή, αυτή μπορεί να διεξαχθεί με μια δεύτερη συγκέντρωση. Εάν τα αποτελέσματα συμφωνούν μεταξύ τους, μπορεί να παραλειφθεί η διεξαγωγή άλλης πλήρους δοκιμής με διαφορετική συγκέντρωση, δεδομένου ότι η βιοσυγκέντρωση της ουσίας δεν αναμένεται να εξαρτάται από τη συγκέντρωση. Εάν η ελαχιστοποιημένη δοκιμή έχει διεξαχθεί με δύο συγκεντρώσεις και τα αποτελέσματα δεν δείχνουν εξάρτηση από τη συγκέντρωση, η πλήρης δοκιμή μπορεί να διεξαχθεί με μία μόνο συγκέντρωση (βλ. παράγραφο 87). Έκθεση δοκιμής Η έκθεση δοκιμής για την ελαχιστοποιημένη δοκιμή θα πρέπει να περιλαμβάνει όλα τα στοιχεία που απαιτούνται για την πλήρη δοκιμή (βλ. παράγραφο 81), πλην εκείνων που δεν είναι δυνατόν να εκπονηθούν (δηλ. καμπύλη που να απεικονίζει τον χρόνο επίτευξης σταθερής κατάστασης και τον συντελεστή βιοσυγκέντρωσης σε σταθερή κατάσταση· αντί του τελευταίου, θα πρέπει να αναφέρεται ο ελαχιστοποιημένος BCFss). Επιπλέον, θα πρέπει επίσης να περιλαμβάνει αιτιολόγηση της εφαρμογής της ελαχιστοποιημένης δοκιμής και αναφορά του συνακόλουθου BCFKm. Γ.13 — III Δοκιμή βιοσυσσώρευσης σε ψάρια με διατροφική έκθεση ΕΙΣΑΓΩΓΗ Η μέθοδος που περιγράφεται στο παρόν τμήμα θα πρέπει να χρησιμοποιείται για ουσίες στις οποίες δεν μπορεί να εφαρμοστεί πρακτικά η μεθοδολογία της υδατικής έκθεσης (π.χ. επειδή δεν είναι δυνατόν να διατηρηθούν σταθερές, μετρήσιμες συγκεντρώσεις στο νερό ή να επιτευχθεί επαρκής φόρτος στο σώμα εντός 60 ημερών έκθεσης· βλ. προηγούμενα τμήματα για τη μέθοδο υδατικής έκθεσης). Πρέπει ωστόσο να γίνει κατανοητό ότι το τελικό σημείο της παρούσας δοκιμής είναι ο διατροφικός συντελεστής βιομεγέθυνσης (BMF) και όχι ο συντελεστής βιοσυγκέντρωσης (BCF) (58). Τον Μάιο του 2001 παρουσιάστηκε στο συνέδριο της SETAC Europe, που πραγματοποιήθηκε στη Μαδρίτη, μια νέα μέθοδος δοκιμών βιοσυσσώρευσης για δυσδιάλυτες στο νερό οργανικές ουσίες (36). Η εργασία αυτή στηρίχθηκε σε διάφορες μελέτες βιοσυσσώρευσης που είχαν αναφερθεί στη βιβλιογραφία και στις οποίες χρησιμοποιήθηκε δοσιμετρική μέθοδος με εμβολιασμένη ζωοτροφή [π.χ. (37)]. Στις αρχές του 2004, υποβλήθηκε σε ομάδα εργασίας της ΕΕ για τις ουσίες ΑΒΤ σχέδιο πρωτοκόλλου (38) που ήταν σχεδιασμένο για τη μέτρηση του δυναμικού βιοσυσσώρευσης δυσδιάλυτων στο νερό οργανικών ουσιών στις οποίες ήταν πρακτικά ανέφικτη η εφαρμογή της τυποποιημένης μεθόδου βιοσυγκέντρωσης με υδατική έκθεση, συνοδευόμενο από βασικό έγγραφο τεκμηρίωσης (39). Ένα άλλο επιχείρημα που προβλήθηκε για την αιτιολόγηση της μεθόδου ήταν ότι η πιθανή περιβαλλοντική έκθεση σε αυτές τις δυσδιάλυτες ουσίες (δηλ. με log K OW > 5) μπορεί να συντελείται σε μεγάλο βαθμό μέσω της τροφής (βλ. (40) (41) (42) (43) (44)). Για τον λόγο αυτόν, υπάρχουν παραπομπές σε δοκιμές διατροφικής έκθεσης σε ορισμένους κανονισμούς που έχουν εκδοθεί σχετικά με τα χημικά προϊόντα (59). Ωστόσο, πρέπει να γίνει κατανοητό ότι, με τη μέθοδο που περιγράφεται στο παρόν τμήμα, η έκθεση μέσω της υδατικής φάσης αποφεύγεται επιμελώς και, συνεπώς, οι τιμές του BMF που προκύπτουν από την παρούσα μέθοδο δοκιμών δεν μπορούν να συγκριθούν ευθέως με τις τιμές του BMF από μελέτες πεδίου (όπου μπορεί να συνδυάζονται η υδατική και η διατροφική έκθεση). Το παρόν τμήμα της παρούσας μεθόδου δοκιμών βασίζεται στο εν λόγω πρωτόκολλο (38) και είναι νέα μέθοδος που δεν περιλαμβανόταν στην προηγούμενη έκδοση της μεθόδου δοκιμών Γ.13. Η εν λόγω εναλλακτική δοκιμή επιτρέπει την άμεση διερεύνηση της διατροφικής πορείας έκθεσης υπό ελεγχόμενες εργαστηριακές συνθήκες. Οι ενδιαφερόμενοι ερευνητές θα πρέπει να ανατρέχουν στις παραγράφους 1 έως 14 της παρούσας μεθόδου δοκιμών για πληροφορίες σχετικά με τις περιπτώσεις κατά τις οποίες η δοκιμή διατροφικής έκθεσης μπορεί να είναι προτιμότερη από τη δοκιμή υδατικής έκθεσης. Παρέχονται πληροφορίες σχετικά με τις διάφορες παραμέτρους των ουσιών, οι οποίες θα πρέπει να λαμβάνονται υπόψη πριν από τη διεξαγωγή της δοκιμής. Η χρήση ραδιοσημασμένων υπό δοκιμή ουσιών μπορεί να μελετάται με παρόμοιο σκεπτικό όπως στη μέθοδο υδατικής έκθεσης (βλ. παραγράφους 6 και 65). Η διατροφική μέθοδος μπορεί να χρησιμοποιείται για την εξέταση περισσότερων της μιας ουσιών σε μία μόνο δοκιμή, εφόσον πληρούνται ορισμένα κριτήρια, τα οποία αναλύονται διεξοδικότερα στην παράγραφο 112. Για λόγους απλοποίησης, στη μεθοδολογία που παρατίθεται στο παρόν τμήμα περιγράφεται δοκιμή με τη χρήση μόνο μίας υπό δοκιμή ουσίας. Η δοκιμή διατροφικής έκθεσης είναι παρόμοια με τη δοκιμή υδατικής έκθεσης από πολλές απόψεις, με προφανή εξαίρεση την οδό έκθεσης. Ως εκ τούτου, πολλές πτυχές της μεθόδου που περιγράφεται στο παρόν τμήμα αλληλεπικαλύπτονται με αυτές της μεθόδου υδατικής έκθεσης που περιγράφεται στο προηγούμενο. Γίνονται όσο το δυνατόν περισσότερες παραπομπές σε σχετικές παραγράφους του προηγούμενου τμήματος, αλλά για λόγους σαφήνειας και κατανόησης του κειμένου είναι αναπόφευκτες ορισμένες επαναλήψεις. ΑΡΧΗ ΤΗΣ ΜΕΘΟΔΟΥ ΔΟΚΙΜΩΝ Μπορούν να χρησιμοποιούνται συνθήκες συνεχούς ροής ή ημιστατικές (βλ. παράγραφο 4)· συνιστάται η χρήση συνθηκών συνεχούς ροής για τον περιορισμό της δυνητικής έκθεσης στην υπό δοκιμή ουσία μέσω του νερού λόγω εκρόφησης από εμβολιασμένη τροφή ή περιττώματα. Η δοκιμή αποτελείται από δύο φάσεις: τη φάση πρόσληψης (τροφή εμβολιασμένη με την υπό δοκιμή ουσία) και τη φάση αποβολής (καθαρή, ακατέργαστη τροφή) (βλ. παράγραφο 16). Κατά τη φάση πρόσληψης, μια «δοκιμαστική» ομάδα ψαριών τρέφεται καθημερινά με καθορισμένο σιτηρέσιο, αποτελούμενο από ιχθυοτροφή του εμπορίου γνωστής σύνθεσης, που έχει εμβολιαστεί με την ελεγχόμενη ουσία. Στην ιδανική περίπτωση, τα ψάρια θα πρέπει να καταναλώνουν όλη την προσφερόμενη τροφή (βλ. παράγραφο 141). Στη συνέχεια, τα ψάρια σιτίζονται με την καθαρή, ακατέργαστη ιχθυοτροφή του εμπορίου κατά τη διάρκεια της φάσης αποβολής. Όπως και στη μέθοδο υδατικής έκθεσης, μπορούν να χρησιμοποιηθούν περισσότερες από μία ομάδες δοκιμής με διαφορετικές συγκεντρώσεις της υπό δοκιμή ουσίας στην εμβολιασμένη τροφή, αν είναι απαραίτητο, αλλά για τις περισσότερες από τις εξαιρετικά υδρόφοβες υπό δοκιμή οργανικές ουσίες αρκεί μία ομάδα δοκιμής (βλ. παραγράφους 49 και 107). Εάν χρησιμοποιούνται ημιστατικές συνθήκες, τα ψάρια θα πρέπει να μεταφέρονται σε νέο μέσο και/ή νέο θάλαμο δοκιμής στο τέλος της φάσης πρόσληψης (καθώς υπάρχει περίπτωση το μέσο και/ή η συσκευή που χρησιμοποιείται κατά τη φάση πρόσληψης να έχει μολυνθεί από την ελεγχόμενη ουσία μέσω έκπλυσης). Οι συγκεντρώσεις της υπό δοκιμή ουσίας στα ψάρια μετρώνται κατά τη διάρκεια και των δύο φάσεων της δοκιμής. Εκτός από την ομάδα ψαριών που τρέφεται με το εμβολιασμένο σιτηρέσιο (ομάδα δοκιμής), μια ομάδα ψαριών διατηρείται ως μάρτυρας υπό τις ίδιες ακριβώς συνθήκες και λαμβάνει ακριβώς την ίδια τροφή, με τη διαφορά ότι το σιτηρέσιο από ιχθυοτροφή του εμπορίου δεν είναι εμβολιασμένο με την υπό δοκιμή ουσία. Αυτή η ομάδα-μάρτυρας επιτρέπει την ποσοτικοποίηση των επιπέδων υποβάθρου της υπό δοκιμή ουσίας σε ψάρια που δεν έχουν εκτεθεί και χρησιμεύει ως μέτρο σύγκρισης για τυχόν δυσμενείς επιδράσεις που συνδέονται με τη μεταχείριση και παρατηρούνται στην/στις ομάδα/-ες δοκιμής (60). Επιτρέπει, επίσης, τη σύγκριση των σταθερών ρυθμού αύξησης μεταξύ των ομάδων, για να ελέγχεται αν καταναλώνονται παρόμοιες ποσότητες του χορηγούμενου σιτηρεσίου (για την ερμηνεία τυχόν διαφορετικών σταθερών ρυθμού ανάπτυξης θα πρέπει επίσης να λαμβάνονται υπόψη ενδεχόμενες διαφορές γευστικότητας μεταξύ των σιτηρεσίων· βλ. παράγραφο 138). Είναι σημαντικό να χορηγούνται στις ομάδες δοκιμής και μαρτύρων σιτηρέσια ισοδύναμης διατροφικής αξίας, τόσο κατά τη φάση πρόσληψης όσο και κατά τη φάση αποβολής. Μια φάση πρόσληψης διάρκειας 7-14 ημερών κατά κανόνα επαρκεί, με βάση την εμπειρία των σχεδιαστών της μεθόδου (38) (39). Η διάρκεια αυτή θεωρητικά ελαχιστοποιεί το κόστος διεξαγωγής της δοκιμής, ενώ παράλληλα εξασφαλίζει επαρκή έκθεση για τις περισσότερες ουσίες. Ωστόσο, σε ορισμένες περιπτώσεις, η φάση πρόσληψης μπορεί να παραταθεί (βλ. παράγραφο 127). Κατά τη φάση πρόσληψης, η συγκέντρωση της ουσίας στα ψάρια ενδέχεται να μη φθάσει σε σταθερή κατάσταση, με συνέπεια η επεξεργασία των δεδομένων και τα αποτελέσματα της παρούσας μεθόδου να βασίζονται συνήθως σε κινητική ανάλυση των υπολειμμάτων στους ιστούς. (Σημείωση: Οι εξισώσεις για τον υπολογισμό του χρόνου επίτευξης σταθερής κατάστασης μπορεί να εφαρμοσθούν εδώ, όπως για την δοκιμή υδατικής έκθεσης — βλ. προσάρτημα 5). Η φάση αποβολής αρχίζει με την πρώτη χορήγηση μη εμβολιασμένου σιτηρεσίου στα ψάρια και συνήθως διαρκεί έως 28 ημέρες ή έως καταστεί αδύνατος ο ποσοτικός προσδιορισμός της υπό δοκιμή ουσίας σε ολόκληρα ψάρια, ανάλογα με το ποιο από τα δύο διαστήματα είναι συντομότερο. Η φάση αποβολής μπορεί να συντομευθεί ή να παραταθεί πέραν των 28 ημερών, ανάλογα με τη μεταβολή των μετρούμενων συγκεντρώσεων και του μεγέθους των ψαριών με την πάροδο του χρόνου. Η παρούσα μέθοδος επιτρέπει τον προσδιορισμό του χρόνου υποδιπλασιασμού της συγκεκριμένης ουσίας (t 1/2, από τη σταθερά του ρυθμού αποβολής, k 2), της απόδοσης της αφομοίωσης (απορρόφηση στο πεπτικό σύστημα· a), του κινητικού διατροφικού συντελεστή βιομεγέθυνσης (BMFK), του διορθωμένου ως προς την ανάπτυξη κινητικού διατροφικού συντελεστή βιομεγέθυνσης (BMFKg), και του διορθωμένου ως προς τα λιπίδια (61) κινητικού διατροφικού συντελεστή βιομεγέθυνσης (BMFKL) (και/ή του κινητικού διατροφικού συντελεστή βιομεγέθυνσης, διορθωμένου ως προς την ανάπτυξη και τα λιπίδια, BMFKgL) για την υπό δοκιμή ουσία στα ψάρια. Όπως και στη μέθοδο υδατικής έκθεσης, η αύξηση της μάζας των ψαριών κατά τη διάρκεια της δοκιμής θα έχει ως αποτέλεσμα την αραίωση της υπό δοκιμή ουσίας στα αναπτυσσόμενα ψάρια και, ως εκ τούτου, ο (κινητικός) BCF θα είναι υποεκτιμημένος, εάν δεν διορθωθεί για να ληφθεί υπόψη η ανάπτυξη (βλ. παραγράφους 162 και 163). Επιπλέον, εάν εκτιμάται ότι επιτεύχθηκε σταθερή κατάσταση κατά τη φάση πρόσληψης, μπορεί να υπολογιστεί ενδεικτικός BMF σε σταθερή κατάσταση. Είναι διαθέσιμες προσεγγίσεις που καθιστούν εφικτή την εκτίμηση κινητικού συντελεστή βιοσυγκέντρωσης (BCFK) από δεδομένα που παράγονται από τη μελέτη διατροφικής έκθεσης [π.χ. (44) (45) (46) (47) (48)]. Τα πλεονεκτήματα και τα μειονεκτήματα αυτών των προσεγγίσεων εξηγούνται στο προσάρτημα 8. Η δοκιμή σχεδιάστηκε πρωτίστως για δυσδιάλυτες μη πολικές οργανικές ουσίες, των οποίων η πρόσληψη και αποβολή από τα ψάρια ακολουθούν κατά προσέγγιση κινητική πρώτης τάξης. Όταν εξετάζεται μια ουσία της οποίας η πρόσληψη και η αποβολή δεν ακολουθούν κατά προσέγγιση κινητική πρώτης τάξης, θα πρέπει να χρησιμοποιούνται πιο σύνθετα μοντέλα (βλ. παραπομπές στο προσάρτημα 5) και να ζητείται η γνώμη βιοστατιστικολόγου και/ή ειδικού στη φαρμακοκινητική. Ο BMF κατά κανόνα προσδιορίζεται με ανάλυση της υπό δοκιμή ουσίας σε ολόκληρα ψάρια (επί νωπού βάρους). Εάν έχει σημασία για τους στόχους της μελέτης, μπορούν να λαμβάνονται δείγματα συγκεκριμένων ιστών (π.χ. μυών, ήπατος), εάν τα ψάρια χωριστούν σε βρώσιμο και μη βρώσιμο μέρος (βλ. παράγραφο 21). Επιπλέον, μπορεί να πραγματοποιηθεί αφαίρεση και χωριστή ανάλυση του γαστρεντερικού σωλήνα για τον προσδιορισμό της συνεισφοράς του στις συγκεντρώσεις σε ολόκληρα ψάρια, σε χρονικά σημεία δειγματοληψίας στο τέλος της φάσης πρόσληψης και προς την έναρξη της φάσης αποβολής, ή στο πλαίσιο προσέγγισης ισοζυγίου μάζας. Θα πρέπει να μετράται η περιεκτικότητα των ολόκληρων ψαριών του δείγματος σε λιπίδια, ώστε να είναι δυνατή η διόρθωση των συγκεντρώσεων ως προς τα λιπίδια, λαμβανομένης υπόψη της περιεκτικότητας τόσο της τροφής όσο και των ψαριών σε λιπίδια (βλ. παραγράφους 56 και 57 και προσάρτημα 7). Το βάρος κάθε ψαριού του δείγματος θα πρέπει να μετράται, να καταγράφεται και να αντιστοιχίζεται με τη συγκέντρωση της αναλυόμενης ουσίας στο εν λόγω άτομο (π.χ. με τη χρήση αποκλειστικού αναγνωριστικού κωδικού για κάθε ψάρι του δείγματος), με σκοπό τον υπολογισμό ενδεχόμενης ανάπτυξης κατά τη διάρκεια της δοκιμής. Θα πρέπει επίσης να μετράται το ολικό μήκος των ψαριών, όταν είναι δυνατόν (62). Τα δεδομένα βάρους είναι επίσης απαραίτητα για την εκτίμηση του BCF με τη χρήση των δεδομένων αποβολής από τη δοκιμή διατροφικής έκθεσης. ΣΤΟΙΧΕΙΑ ΓΙΑ ΤΗΝ ΥΠΟ ΔΟΚΙΜΗ ΟΥΣΙΑ Θα πρέπει να είναι διαθέσιμες οι πληροφορίες για την υπό δοκιμή ουσία που αναφέρονται στις παραγράφους 3 και 22. Δεν είναι συνήθως απαραίτητο να υπάρχει αναλυτική μέθοδος για τις συγκεντρώσεις της υπό δοκιμή ουσίας στο νερό· απαιτούνται μέθοδοι με κατάλληλη ευαισθησία για τη μέτρηση των συγκεντρώσεων σε ιχθυοτροφές και στους ιστούς των ψαριών. Η μέθοδος μπορεί να χρησιμοποιηθεί για την εξέταση περισσότερων της μίας ουσιών σε μία μόνο δοκιμή. Ωστόσο, οι υπό δοκιμή ουσίες θα πρέπει να είναι συμβατές μεταξύ τους, ώστε να μην αλληλεπιδρούν ούτε να αλλάζουν χημική ταυτότητα κατά τον εμβολιασμό των ιχθυοτροφών. Το ζητούμενο είναι τα μετρούμενα αποτελέσματα για κάθε ουσία που συνυποβάλλεται σε δοκιμή να μη διαφέρουν σε μεγάλο βαθμό από τα αποτελέσματα που θα προέκυπταν εάν είχαν διεξαχθεί μεμονωμένες δοκιμές για κάθε υπό δοκιμή ουσία. Με προκαταρκτικές αναλυτικές εργασίες θα πρέπει να αποδεικνύεται ότι κάθε ουσία μπορεί να ανακτηθεί από πολλαπλά εμβολιασμένη τροφή και από δείγμα ιστών ψαριών με i) υψηλά ποσοστά ανάκτησης (π.χ. > 85 % της ονομαστικής τιμής) και ii) την απαραίτητη για τη δοκιμή ευαισθησία. Η συνολική δόση των ουσιών που συνυποβάλλονται σε δοκιμή θα πρέπει να είναι κατώτερη από τη συνδυασμένη συγκέντρωση η οποία θα μπορούσε να έχει τοξικές επιδράσεις (βλ. παράγραφο 51). Επιπλέον, κατά τον σχεδιασμό του πειράματος θα πρέπει να λαμβάνονται υπόψη οι πιθανές δυσμενείς επιδράσεις στα ψάρια και το δυναμικό αλληλεπιδράσεων (π.χ. επιδράσεις στον μεταβολισμό) που συνδέονται με την ταυτόχρονη υποβολή πολλών ουσιών σε δοκιμή. Η ταυτόχρονη δοκιμή ιοντιζόμενων ουσιών θα πρέπει να αποφεύγεται. Όσον αφορά την έκθεση, η μέθοδος είναι επίσης κατάλληλη για πολύπλοκα μείγματα (βλ. παράγραφο 13, μολονότι η ανάλυση υπόκειται στους ίδιους περιορισμούς όπως σε κάθε άλλη μέθοδο). ΕΓΚΥΡΟΤΗΤΑ ΤΗΣ ΔΟΚΙΜΗΣ Οι προϋποθέσεις εγκυρότητας της δοκιμής είναι οι ακόλουθες (βλ. παράγραφο 24):
ΟΥΣΙΕΣ ΑΝΑΦΟΡΑΣ Εάν το εργαστήριο δεν έχει εκτελέσει τη δοκιμή στο παρελθόν ή έχουν επέλθει ουσιαστικές μεταβολές (π.χ. αλλαγή της φυλής ή του προμηθευτή των ψαριών, εξέταση διαφορετικού είδους ψαριών, σημαντική αλλαγή του μεγέθους των ψαριών, της ιχθυοτροφής ή της μεθόδου εμβολιασμού κ.λπ.), συνιστάται η διεξαγωγή μελέτης τεχνικής ικανότητας, με τη χρήση ουσίας αναφοράς. Η ουσία αναφοράς χρησιμοποιείται κυρίως για να διαπιστώνεται κατά πόσον η τεχνική εμβολιασμού της τροφής είναι επαρκής για την εξασφάλιση της μέγιστης δυνατής ομοιογένειας και βιοδιαθεσιμότητας των υπό δοκιμή ουσιών. Ένα παράδειγμα ουσίας που χρησιμοποιήθηκε στην περίπτωση των μη πολικών υδρόφοβων ουσιών είναι το εξαχλωροβενζόλιο (HCB) αλλά, λόγω των επικίνδυνων ιδιοτήτων του, θα πρέπει να εξετάζονται και άλλες ουσίες για τις οποίες υπάρχουν αξιόπιστα δεδομένα σχετικά με την πρόσληψη και τη βιομεγέθυνση (63). Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει βασικές πληροφορίες για την ουσία αναφοράς, εάν έχει χρησιμοποιηθεί, μεταξύ των οποίων την ονομασία, την καθαρότητα, τον αριθμό CAS, τη δομή, δεδομένα τοξικότητας (εάν είναι διαθέσιμα), όπως και για τις υπό δοκιμή ουσίες (βλ. παραγράφους 3 και 22). ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Εργαστηριακός εξοπλισμός Θα πρέπει να χρησιμοποιούνται τα υλικά και οι συσκευές που περιγράφονται στη μέθοδο υδατικής έκθεσης (βλ. παράγραφο 26). Θα πρέπει να χρησιμοποιείται ένα σύστημα δοκιμής συνεχούς ροής ή στατικής ανανέωσης που παρέχει επαρκή όγκο νερού αραίωσης στις δεξαμενές δοκιμής. Οι ρυθμοί παροχής θα πρέπει να καταγράφονται. Νερό Θα πρέπει να χρησιμοποιείται το νερό δοκιμής που περιγράφεται στη μέθοδο υδατικής έκθεσης (βλ. παραγράφους 27-29). Το μέσο δοκιμής θα πρέπει να διαθέτει τα περιγραφόμενα χαρακτηριστικά και η ποιότητά του θα πρέπει να παραμένει σταθερή στη διάρκεια της δοκιμής. Η φυσική περιεκτικότητα σε σωματίδια και σε ολικό οργανικό άνθρακα (TOC) θα πρέπει να είναι όσο το δυνατόν χαμηλότερη (σωματίδια ≤ 5 mg/l· ολικός οργανικός άνθρακας ≤ 2 mg/l) πριν από την έναρξη της δοκιμής. Ο TOC χρειάζεται να μετράται μόνο πριν από τη διεξαγωγή της δοκιμής, στο πλαίσιο του χαρακτηρισμού του νερού δοκιμής (βλ. παράγραφο 53). Σιτηρέσιο Συνιστάται η χορήγηση ιχθυοτροφής του εμπορίου (επιπλέουσα και/ή βραδείας βύθισης, σε μορφή εξωθημένων κόκκων) που έχει χαρακτηριστεί τουλάχιστον ως προς την περιεκτικότητά της σε πρωτεΐνες και λιπαρές ύλες. Η τροφή θα πρέπει να έχει ομοιόμορφο μέγεθος κόκκων για να αυξάνεται η απόδοση της έκθεσης σε αυτή, δηλ. τα ψάρια να καταναλώνουν μεγαλύτερη ποσότητα τροφής αντί να τρώνε τα μεγαλύτερα τεμάχια και να αφήνουν τα μικρότερα. Το μέγεθος των κόκκων θα πρέπει να είναι κατάλληλο για το μέγεθος των ψαριών κατά την έναρξη της δοκιμής (π.χ. μπορούν να χρησιμοποιούνται κόκκοι με διάμετρο περίπου 0,6-0,85 mm για ψάρια ολικού μήκους 3 έως 7 cm και 0,85-1,2 mm για ψάρια ολικού μήκους 6 έως 12 cm). Το μέγεθος των κόκκων μπορεί να προσαρμόζεται ανάλογα με την ανάπτυξη των ψαριών κατά την έναρξη της φάσης αποβολής. Παράδειγμα τροφής κατάλληλης σύνθεσης που διατίθεται στο εμπόριο παρέχεται στο προσάρτημα 7. Κατά την ανάπτυξη της παρούσας μεθόδου δοκιμών χρησιμοποιήθηκαν ευρέως σιτηρέσια δοκιμής με συνολική περιεκτικότητα σε λιπίδια μεταξύ 15 και 20 % (κ.β.). Ιχθυοτροφές με τόσο υψηλή περιεκτικότητα σε λιπίδια ενδέχεται να μην είναι διαθέσιμες σε ορισμένες περιοχές. Στις περιπτώσεις αυτές, οι μελέτες θα μπορούσαν να διεξαχθούν με χαμηλότερη συγκέντρωση λιπιδίων στην τροφή και, εάν είναι απαραίτητο, κατάλληλη προσαρμογή του ρυθμού σίτισης για τη διατήρηση της υγείας των ψαριών (με βάση προκαταρκτικές δοκιμές). Η συνολική περιεκτικότητα σε λιπίδια των σιτηρεσίων της ομάδας δοκιμής και της ομάδας μαρτύρων πρέπει να μετράται και να καταγράφεται πριν από την έναρξη της δοκιμής και στο τέλος της φάσης πρόσληψης. Η έκθεση της μελέτης θα πρέπει να περιλαμβάνει λεπτομερή στοιχεία που παρέχονται από τον προμηθευτή των ζωοτροφών και αφορούν την ανάλυση θρεπτικών στοιχείων, υγρασίας, διαιτητικών ινών, τέφρας και, στο μέτρο του δυνατού, ανόργανων συστατικών και υπολειμμάτων γεωργικών φαρμάκων (π.χ. «τυπικοί» ρύποι προτεραιότητας. Κατά τον εμβολιασμό της τροφής με την υπό δοκιμή ουσία, θα πρέπει να καταβάλλεται κάθε δυνατή προσπάθεια ώστε να εξασφαλίζεται ομοιογένεια στο σύνολο της τροφής που χρησιμοποιείται στη δοκιμή. Για την επιλογή της συγκέντρωσης της υπό δοκιμή ουσίας στην τροφή της ομάδας δοκιμής θα πρέπει να λαμβάνονται υπόψη η ευαισθησία της αναλυτικής τεχνικής, η τοξικότητα της υπό δοκιμή ουσίας (η NOEC, εάν είναι γνωστή) και τα σχετικά φυσικοχημικά δεδομένα. Η ουσία αναφοράς, εάν χρησιμοποιείται, θα πρέπει κατά προτίμηση να ενσωματώνεται σε συγκέντρωση ίση περίπου με το 10 % της συγκέντρωσης της υπό δοκιμή ουσίας (ή, σε κάθε περίπτωση, σε όσο το δυνατόν χαμηλότερη συγκέντρωση), με την επιφύλαξη της ευαισθησίας της ανάλυσης [π.χ. για το εξαχλωροβενζόλιο έχει κριθεί αποδεκτή η συγκέντρωση 1-100 μg/g στην τροφή· βλ. (47) για περισσότερες πληροφορίες σχετικά με τις αποδόσεις αφομοίωσης του HCB]. Η υπό δοκιμή ουσία μπορεί να εμβολιάζεται στην ιχθυοτροφή με διάφορους τρόπους ανάλογα με τα φυσικά χαρακτηριστικά και τη διαλυτότητά της (για περισσότερες λεπτομέρειες σχετικά με τις μεθόδους εμβολιασμού, βλ. προσάρτημα 7):
Σε ορισμένες περιπτώσεις, π.χ. προκειμένου για λιγότερο υδρόφοβες υπό δοκιμή ουσίες που είναι πιθανότερο να εκροφηθούν από την τροφή, ενδέχεται να είναι απαραίτητη η επικάλυψη των κόκκων της παρασκευασμένης τροφής με μικρή ποσότητα αραβοσιτελαίου/ιχθυελαίου (βλ. παράγραφο 142). Στις περιπτώσεις αυτές, η τροφή των μαρτύρων θα πρέπει να υποβάλλεται σε παρόμοια κατεργασία και η τελική παρασκευασμένη ζωοτροφή να χρησιμοποιείται για τη μέτρηση των λιπιδίων. Τα αποτελέσματα που λαμβάνονται με την ουσία αναφοράς, εάν χρησιμοποιείται, θα πρέπει να είναι συγκρίσιμα με τα βιβλιογραφικά δεδομένα από μελέτες που έχουν διεξαχθεί υπό παρόμοιες συνθήκες με συγκρίσιμο ρυθμό σίτισης (βλ. παράγραφο 45) και οι ειδικές για την ουσία αναφοράς παράμετροι θα πρέπει να πληρούν τα σχετικά κριτήρια της παραγράφου 113 (τρίτη, τέταρτη και πέμπτη περίπτωση). Εάν χρησιμοποιείται έλαιο ή διαλύτης ως φορέας για την υπό δοκιμή ουσία, θα πρέπει να αναμειγνύεται με το σιτηρέσιο των μαρτύρων ισοδύναμη ποσότητα του ίδιου φορέα (χωρίς την υπό δοκιμή ουσία), για να διατηρείται η ισοδυναμία με την εμβολιασμένη τροφή. Είναι σημαντικό να χορηγούνται στις ομάδες δοκιμής και μαρτύρων σιτηρέσια ισοδύναμης διατροφικής αξίας, τόσο κατά τη φάση πρόσληψης όσο και κατά τη φάση αποβολής. Το εμβολιασμένο σιτηρέσιο θα πρέπει να αποθηκεύεται υπό συνθήκες που διατηρούν τη σταθερότητα της υπό δοκιμή ουσίας στο μείγμα της τροφής (π.χ. ψύξη) και οι συνθήκες αυτές να αναφέρονται. Επιλογή είδους ψαριών Μπορούν να χρησιμοποιούνται τα είδη ψαριών που ορίζονται για την υδατική έκθεση (βλ. παράγραφο 32 και προσάρτημα 3). Η ιριδίζουσα πέστροφα (Oncorhynchus mykiss), ο κυπρίνος (Cyprinus carpio) και ο χοντροκέφαλος φοξίνος (Pimephales promelas) έχουν χρησιμοποιηθεί ευρέως σε μελέτες διατροφικής βιοσυσσώρευσης με οργανικές ουσίες πριν από τη δημοσίευση της παρούσας μεθόδου δοκιμών. Η διατροφική συμπεριφορά του υπό δοκιμή είδους θα πρέπει να έχει ως αποτέλεσμα την ταχεία κατανάλωση της χορηγούμενης μερίδας τροφής ώστε να εξασφαλίζεται ότι κάθε παράγοντας που επηρεάζει τη συγκέντρωση της υπό δοκιμή ουσίας στην τροφή (π.χ. έκπλυση προς το νερό και πιθανότητα υδατικής έκθεσης) περιορίζεται στο ελάχιστο δυνατό επίπεδο. Θα πρέπει να χρησιμοποιούνται ψάρια με μέγεθος/βάρος εντός του συνιστώμενου εύρους τιμών (βλ. προσάρτημα 3). Το μέγεθος των ψαριών δεν θα πρέπει να είναι τόσο μικρό ώστε να παρεμποδίζει την ευχερή ανάλυση ανά άτομο. Η διενέργεια δοκιμών σε στάδιο του κύκλου ζωής όπου πραγματοποιείται ταχεία ανάπτυξη μπορεί να περιπλέξει την ερμηνεία των δεδομένων, ενώ οι υψηλοί ρυθμοί ανάπτυξης μπορούν να επηρεάσουν τον υπολογισμό της απόδοσης της αφομοίωσης (64). Διατήρηση των ψαριών Τα κριτήρια αποδοχής που αφορούν τον εγκλιματισμό, τη θνησιμότητα και τις ασθένειες είναι τα ίδια όπως για τη μέθοδο υδατικής έκθεσης πριν από τη διεξαγωγή της δοκιμής (βλ. παραγράφους 33-35). ΕΚΤΕΛΕΣΗ ΤΗΣ ΔΟΚΙΜΗΣ Εργασίες πριν από τη μελέτη και δοκιμή προσδιορισμού εύρους τιμών Απαιτείται αναλυτική εργασία πριν από τη μελέτη για να αποδειχθεί η ανάκτηση της ουσίας από την εμβολιασμένη τροφή/τον εμβολιασμένο ιστών ψαριών. Δεν είναι πάντοτε αναγκαία η διεξαγωγή δοκιμής προσδιορισμού εύρους τιμών για την επιλογή της κατάλληλης συγκέντρωσης στην τροφή. Για να αποδειχθεί ότι δεν παρατηρούνται δυσμενείς επιδράσεις και να αξιολογηθούν η γευστικότητα της εμβολιασμένης τροφής, η ευαισθησία της αναλυτικής μεθόδου για τους ιστούς των ψαριών και τις ιχθυοτροφές και η επιλογή κατάλληλου ρυθμού σίτισης και συχνότητας δειγματοληψίας κατά τη φάση αποβολής κ.λπ., μπορούν να διενεργηθούν προκαταρκτικά πειράματα διατροφής, αλλά αυτά δεν είναι υποχρεωτικά. Μια προκαταρκτική μελέτη μπορεί να είναι χρήσιμη για την εκτίμηση του αριθμού των ψαριών που απαιτούνται για τη δειγματοληψία κατά τη φάση αποβολής. Η εκτίμηση αυτή μπορεί να οδηγήσει σε σημαντική μείωση του αριθμού των χρησιμοποιούμενων ψαριών, ιδίως για τις υπό δοκιμή ουσίες που είναι ιδιαίτερα επιρρεπείς σε μεταβολισμό. Συνθήκες έκθεσης Διάρκεια της φάσης πρόσληψης Μια φάση πρόσληψης διάρκειας 7 έως 14 ημερών είναι κατά κανόνα επαρκής. Κατά τη διάρκειά της, σε μία ομάδα ψαριών χορηγείται καθημερινά το σιτηρέσιο-μάρτυρας και σε μια άλλη ομάδα το σιτηρέσιο δοκιμής, σε σταθερή ποσότητα που εξαρτάται από το εξεταζόμενο είδος ψαριών και τις πειραματικές συνθήκες, π.χ. 1-2 % του σωματικού βάρους (νωπό βάρος) στην περίπτωση της ιριδίζουσας πέστροφας. Ο ρυθμός σίτισης θα πρέπει να επιλέγεται κατά τρόπο ώστε να αποφεύγονται η ταχεία ανάπτυξη και η μεγάλη αύξηση της περιεκτικότητας σε λιπίδια. Εάν είναι απαραίτητο, η φάση πρόσληψης μπορεί να παραταθεί με βάση την πρακτική εμπειρία από προηγούμενες μελέτες ή τις γνώσεις σχετικά με την πρόσληψη/αποβολή της υπό δοκιμή ουσίας (ή ανάλογης) από τα ψάρια. Η έναρξη της δοκιμής ορίζεται ως ο χρόνος της πρώτης σίτισης με την εμβολιασμένη τροφή. Μια πειραματική ημέρα διαρκεί από την ώρα της σίτισης μέχρι λίγο πριν από την ώρα της επόμενης σίτισης (π.χ. μία ώρα). Επομένως, η πρώτη πειραματική ημέρα πρόσληψης αρχίζει την ώρα της πρώτης σίτισης με εμβολιασμένη τροφή και λήγει λίγο πριν από τη δεύτερη σίτιση με εμβολιασμένη τροφή. Στην πράξη, η φάση πρόσληψης λήγει λίγο πριν (π.χ. μία ώρα) από την πρώτη σίτιση με μη εμβολιασμένη με την υπό δοκιμή ουσία τροφή, δεδομένου ότι τα ψάρια θα συνεχίζουν να χωνεύουν την εμβολιασμένη τροφή και να απορροφούν την υπό δοκιμή ουσία κατά το ενδιάμεσο διάστημα των 24 ωρών. Είναι σημαντικό να διασφαλίζεται η επίτευξη αρκετά υψηλού (μη τοξικού) φόρτου της υπό δοκιμή ουσίας στο σώμα σε σχέση με την αναλυτική μέθοδο, ώστε να μπορεί να μετρηθεί μείωση τουλάχιστον κατά μία τάξη μεγέθους στη διάρκεια της φάσης αποβολής. Σε ειδικές περιπτώσεις, η φάση πρόσληψης μπορεί να παραταθεί (έως και σε 28 ημέρες), με πρόσθετη δειγματοληψία για να διαμορφωθεί αντίληψη σχετικά με την κινητική της πρόσληψης. Κατά τη φάση πρόσληψης η συγκέντρωση στα ψάρια ενδέχεται να μη φθάσει σε σταθερή κατάσταση. Μπορούν εν προκειμένω να εφαρμοστούν εξισώσεις για τον υπολογισμό του χρόνου που απαιτείται για την επίτευξη σταθερής κατάστασης, ως ένδειξης της πιθανής χρονικής περιόδου που απαιτείται για να επιτευχθούν σημαντικές συγκεντρώσεις στα ψάρια, όπως και στη δοκιμή υδατικής έκθεσης (βλ. προσάρτημα 5). Σε ορισμένες περιπτώσεις, ενδέχεται να είναι γνωστό ότι η πρόσληψη της ουσίας από τα ψάρια σε διάστημα 7-14 ημερών δεν επαρκεί ώστε η χρησιμοποιούμενη συγκέντρωση στην τροφή να έχει ως αποτέλεσμα αρκούντως υψηλή συγκέντρωση στα ψάρια για τη μέτρηση μείωσης τουλάχιστον κατά μια τάξη μεγέθους στη διάρκεια της φάσης αποβολής, είτε λόγω ανεπαρκούς ευαισθησίας της ανάλυσης είτε λόγω χαμηλής απόδοσης της αφομοίωσης. Σε αυτές τις περιπτώσεις, μπορεί να παρουσιάζει πλεονέκτημα η παράταση της αρχικής φάσης της σίτισης σε περισσότερο από 14 ημέρες ή, ιδίως για εξαιρετικά μεταβολίσιμες ουσίες, θα πρέπει να εξετάζεται το ενδεχόμενο υψηλότερης συγκέντρωσης στην τροφή. Ωστόσο, θα πρέπει να λαμβάνεται μέριμνα ώστε ο φόρτος του σώματος να διατηρείται κατά τη φάση πρόσληψης σε επίπεδο κατώτερο από την (εκτιμώμενη) χρόνια συγκέντρωση στην οποία δεν παρατηρείται επίδραση (NOEC) στους ιστούς των ψαριών (βλ. παράγραφο 138). Διάρκεια της φάσης αποβολής Η αποβολή συνήθως διαρκεί έως 28 ημέρες και αρχίζει από τη στιγμή που η ομάδα δοκιμής των ψαριών θα τραφεί με καθαρή ακατέργαστη τροφή μετά τη φάση πρόσληψης. Η αποβολή αρχίζει με την πρώτη χορήγηση «μη εμβολιασμένης» τροφής και όχι αμέσως μετά την τελευταία χορήγηση «εμβολιασμένης» τροφής, διότι τα ψάρια θα συνεχίζουν να χωνεύουν την τροφή και να απορροφούν την υπό δοκιμή ουσία κατά το ενδιάμεσο διάστημα των 24 ωρών, όπως επισημαίνεται στην παράγραφο 126. Ως εκ τούτου, το πρώτο δείγμα της φάσης αποβολής λαμβάνεται λίγο πριν από τη δεύτερη χορήγηση μη εμβολιασμένου σιτηρεσίου. Αυτή η φάση αποβολής έχει σχεδιαστεί με σκοπό να ανιχνεύονται οι ουσίες με πιθανό χρόνο υποδιπλασιασμού έως 14 ημερών, που χαρακτηρίζει τις βιοσυσσωρεύσιμες ουσίες (65) και, ως εκ τούτου, οι 28 ημέρες περιλαμβάνουν δύο χρόνους υποδιπλασιασμού τέτοιων ουσιών. Σε περιπτώσεις άκρως βιοσυσσωρευόμενων ουσιών, μπορεί να είναι χρήσιμη η παράταση της φάσης αποβολής (εάν το υποδεικνύουν οι προκαταρκτικές δοκιμές). Ακόμα κι αν μια ουσία αποβάλλεται με πολύ αργό ρυθμό, με αποτέλεσμα να μην είναι δυνατός ο προσδιορισμός του ακριβούς χρόνου υποδιπλασιασμού κατά τη φάση αποβολής, τα στοιχεία μπορεί να επαρκούν για τους σκοπούς της αξιολόγησης, ως ένδειξη υψηλού βαθμού βιοσυσσώρευσης. Αντιστρόφως, εάν μια ουσία αποβάλλεται με τόσο ταχύ ρυθμό ώστε να μην είναι εφικτή η συναγωγή αξιόπιστης συγκέντρωσης σε χρόνο 0 (συγκέντρωση κατά τη λήξη της πρόσληψης/έναρξη αποβολής, C 0,d) και σταθεράς k 2, μπορεί να γίνει συντηρητική εκτίμηση της k 2 (βλ. προσάρτημα 7). Εάν από τις αναλύσεις των ψαριών σε προηγούμενα χρονικά διαστήματα (π.χ. 7 ή 14 ημερών) προκύψει ότι η ουσία έχει αποβληθεί σε επίπεδα χαμηλότερα από το όριο ποσοτικού προσδιορισμού πριν από την πλήρη περίοδο των 28 ημερών, η δειγματοληψία μπορεί να διακοπεί και η δοκιμή να τερματιστεί. Σε ελάχιστες περιπτώσεις, η πρόσληψη της υπό δοκιμή ουσίας ενδέχεται να μην είναι μετρήσιμη στο τέλος της περιόδου πρόσληψης (ή στο δεύτερο δείγμα της φάσης αποβολής). Εάν μπορεί να καταδειχθεί ότι: i) πληρούνται τα κριτήρια εγκυρότητας της παραγράφου 113 και ii) η απουσία πρόσληψης δεν οφείλεται σε άλλη αδυναμία της δοκιμής (π.χ. ανεπαρκής διάρκεια πρόσληψης, ελαττώματα της τεχνικής εμβολιασμού τροφών που συνεπάγονται χαμηλή βιοδιαθεσιμότητα, έλλειψη ευαισθησίας της αναλυτικής μεθόδου, μη κατανάλωση τροφής από τα ψάρια κ.λπ.), είναι δυνατόν να τερματιστεί η μελέτη χωρίς να χρειάζεται να επαναληφθεί με μεγαλύτερη διάρκεια πρόσληψης. Εάν από τις προκαταρκτικές εργασίες συνάγεται ότι πρόκειται για τέτοια περίπτωση, μπορεί να είναι σκόπιμη η ανάλυση των περιττωμάτων, στο μέτρο του δυνατού, για την ανίχνευση της υπό δοκιμή ουσίας που δεν χωνεύθηκε, στο πλαίσιο προσέγγισης «ισοζυγίου μάζας». Αριθμός των υπό δοκιμή ψαριών Όπως και στη δοκιμή υδατικής έκθεσης, θα πρέπει να επιλέγονται ψάρια παρόμοιου βάρους και μήκους και το βάρος των μικρότερων ψαριών θα πρέπει να μην είναι μικρότερο από τα δύο τρίτα του βάρους των μεγαλύτερων (βλ. παραγράφους 40-42). Ο συνολικός αριθμός ψαριών για τη μελέτη θα πρέπει να επιλέγεται με βάση το πρόγραμμα δειγματοληψίας (τουλάχιστον ένα δείγμα στο τέλος της φάσης πρόσληψης και τέσσερα έως έξι δείγματα κατά τη φάση αποβολής, αλλά ανάλογα με τη διάρκεια των φάσεων), λαμβανομένων υπόψη της ευαισθησίας της αναλυτικής μεθόδου, της συγκέντρωσης που αναμένεται να επιτευχθεί στο τέλος της φάσης πρόσληψης (με βάση τη διαθέσιμη γνώση) και της διάρκειας της αποβολής (εάν μπορεί να εκτιμηθεί, από τη διαθέσιμη γνώση). Θα πρέπει κάθε φορά να λαμβάνονται ως δείγμα πέντε έως δέκα ψάρια και οι παράμετροι ανάπτυξης (βάρος και ολικό μήκος) να μετρώνται πριν από την ανάλυση της χημικής ουσίας ή των λιπιδίων. Λόγω της εγγενούς μεταβλητότητας του μεγέθους, του ρυθμού ανάπτυξης και της φυσιολογίας των ψαριών, καθώς και της πιθανής διακύμανσης της ποσότητας της χορηγούμενης τροφής που καταναλώνει κάθε ψάρι, θα πρέπει να λαμβάνονται ως δείγμα σε κάθε χρονικό διάστημα τουλάχιστον πέντε ψάρια από την ομάδα δοκιμής και πέντε από την ομάδα μαρτύρων, για τον ορθό προσδιορισμό της μέσης συγκέντρωσης και της μεταβλητότητάς της. Η μεταβλητότητα μεταξύ των χρησιμοποιούμενων ψαριών είναι πιθανό να συμβάλλει περισσότερο στη συνολική ανεξέλεγκτη μεταβλητότητα της δοκιμής απ' όσο η εγγενής μεταβλητότητα των χρησιμοποιούμενων αναλυτικών μεθόδων και, ως εκ τούτου, δικαιολογεί τη χρήση έως δέκα ψαριών ανά χρονικό σημείο δειγματοληψίας σε ορισμένες περιπτώσεις. Ωστόσο, εάν οι συγκεντρώσεις υποβάθρου της υπό δοκιμή ουσίας στα ψάρια-μάρτυρες δεν είναι μετρήσιμες κατά την έναρξη της αποβολής, μπορεί να αρκεί η ανάλυση της ουσίας σε δύο έως τρία ψάρια-μάρτυρες μόνο στο τελικό διάστημα δειγματοληψίας, εφόσον συνεχιστεί η λήψη δειγμάτων από τα υπόλοιπα ψάρια-μάρτυρες σε όλα τα χρονικά σημεία δειγματοληψίας για τη μέτρηση του βάρους και του ολικού μήκους (έτσι ώστε να λαμβάνεται ο ίδιος αριθμός δειγμάτων από τις ομάδες δοκιμής και τις ομάδες μαρτύρων για τον έλεγχο της ανάπτυξης). Τα ψάρια θα πρέπει να φυλάσσονται, να ζυγίζονται ατομικά (ακόμη και αν κριθεί αναγκαίο να συνδυαστούν αργότερα τα αποτελέσματα του δείγματος) και να μετράται το ολικό μήκος. Για μια τυπική δοκιμή, για παράδειγμα, με διάρκεια αποβολής 28 ημερών και πέντε δείγματα αποβολής, αυτό συνεπάγεται συνολικά 59-120 ψάρια από την ομάδα δοκιμής και 50-110 ψάρια από την ομάδα μαρτύρων, με την παραδοχή ότι η αναλυτική τεχνική για την ουσία επιτρέπει τον προσδιορισμό της περιεκτικότητας σε λιπίδια στα ίδια ψάρια. Εάν η ανάλυση των λιπιδίων δεν μπορεί να διενεργηθεί στα ίδια ψάρια στα οποία πραγματοποιείται η ανάλυση της χημικής ουσίας και δεν είναι εφικτή ούτε η χρήση μόνο των ψαριών-μαρτύρων για την ανάλυση των λιπιδίων (βλ. παράγραφο 56), θα απαιτούνται επιπλέον 15 ψάρια (τρία από τον πληθυσμό του αποθέματος κατά την έναρξη της δοκιμής, τρία από την ομάδα μαρτύρων και την ομάδα δοκιμής κατά την έναρξη της αποβολής και τρία από την ομάδα μαρτύρων και την ομάδα δοκιμής στο τέλος του πειράματος). Παράδειγμα προγράμματος δειγματοληψίας με αριθμούς ψαριών παρατίθεται στο προσάρτημα 4. Πληθυσμιακός φόρτος Θα πρέπει να χρησιμοποιούνται αναλογίες νερού-ψαριών παρόμοιου ύψους όπως στη μέθοδο υδατικής έκθεσης (βλ. παραγράφους 43 και 44). Μολονότι ο πληθυσμιακός φόρτος ψαριών δεν επηρεάζει τις συγκεντρώσεις έκθεσης στην παρούσα δοκιμή, συνιστάται πληθυσμιακός φόρτος 0,1-1,0 g ψαριών (νωπό βάρος) ανά λίτρο νερού ημερησίως για να διατηρούνται επαρκείς συγκεντρώσεις διαλυμένου οξυγόνου και να ελαχιστοποιείται η καταπόνηση των υπό δοκιμή οργανισμών. Σιτηρέσιο δοκιμής και σίτιση Κατά τη διάρκεια της περιόδου εγκλιματισμού, τα ψάρια θα πρέπει να τρέφονται με κατάλληλο σιτηρέσιο, όπως περιγράφεται ανωτέρω (παράγραφος 117). Εάν η δοκιμή διεξάγεται υπό συνθήκες συνεχούς ροής, η ροή θα πρέπει να διακόπτεται κατά τη σίτιση των ψαριών. Κατά τη διάρκεια της δοκιμής, το σιτηρέσιο της ομάδας δοκιμής θα πρέπει να ανταποκρίνεται στην ανωτέρω περιγραφή (παράγραφοι 116-121). Επιπλέον της συνεκτίμησης των ειδικών για την ουσία παραγόντων, της αναλυτικής ευαισθησίας, της αναμενόμενης συγκέντρωσης στην τροφή υπό τις περιβαλλοντικές συνθήκες και των επιπέδων χρόνιας τοξικότητας/φόρτου του σώματος, κατά την επιλογή της στοχευόμενης συγκέντρωσης εμβολιασμού θα πρέπει να λαμβάνεται υπόψη η γευστικότητα της τροφής (ώστε να μην απωθεί τα ψάρια). Η ονομαστική συγκέντρωση εμβολιασμού της υπό δοκιμή ουσίας πρέπει να τεκμηριώνεται στην έκθεση. Με βάση την αποκτηθείσα πείρα, οι συγκεντρώσεις εμβολιασμού στο φάσμα 1-1 000 μg/g παρέχουν ένα πρακτικό εύρος εργασίας για τις υπό δοκιμή ουσίες που δεν εμφανίζουν ειδικό τοξικό μηχανισμό. Για ουσίες που δρουν μέσω μη ειδικού μηχανισμού, τα επίπεδα των υπολειμμάτων στους ιστούς δεν θα πρέπει να υπερβαίνουν τα 5 μmol/g λιπιδίων, διότι σε ανώτερα επίπεδα είναι πιθανό να έχουν χρόνιες επιδράσεις (19) (48) (50) (66). Για άλλες ουσίες θα πρέπει να λαμβάνεται μέριμνα ώστε να μην επέρχονται δυσμενείς επιδράσεις από τη συσσωρευμένη έκθεση (βλ. παράγραφο 127). Αυτό ισχύει ιδίως εάν υποβάλλονται ταυτόχρονα σε δοκιμή περισσότερες από μία ουσίες (βλ. παράγραφο 112). Η κατάλληλη ποσότητα της υπό δοκιμή ουσίας μπορεί να εμβολιαστεί στην ιχθυοτροφή με έναν από τους τρεις τρόπους που περιγράφονται στην παράγραφο 119 και στο προσάρτημα 7. Οι μέθοδοι και οι διαδικασίες εμβολιασμού της ιχθυοτροφής θα πρέπει να τεκμηριώνονται στην έκθεση. Στα ψάρια-μάρτυρες χορηγείται τροφή χωρίς κατεργασία, που περιέχει ισοδύναμη ποσότητα μη εμβολιασμένου ελαίου, εάν αυτό χρησιμοποιήθηκε ως φορέας στην εμβολιασμένη ιχθυοτροφή για τη φάση πρόσληψης, ή που έχει υποστεί κατεργασία με «καθαρό» διαλύτη, εάν χρησιμοποιήθηκε διαλύτης ως φορέας για την παρασκευή του σιτηρεσίου της ομάδας δοκιμής. Τα σιτηρέσια, κατεργασμένα και μη, θα πρέπει να υποβάλλονται σε αναλυτική μέτρηση, τουλάχιστον εις τριπλούν, για τον προσδιορισμό της συγκέντρωσης της υπό δοκιμή ουσίας, πριν από την έναρξη και στο τέλος της φάσης πρόσληψης. Μετά την έκθεση στην κατεργασμένη ιχθυοτροφή (φάση πρόσληψης), τα ψάρια (και των δύο ομάδων) σιτίζονται με τροφή χωρίς κατεργασία (φάση αποβολής). Χορηγούνται στα ψάρια σταθερές μερίδες (ανάλογα με το είδος τους· π.χ. περίπου 1-2 % του νωπού σωματικού βάρους ημερησίως στην περίπτωση της ιριδίζουσας πέστροφας). Ο ρυθμός σίτισης θα πρέπει να επιλέγεται κατά τρόπο ώστε να αποφεύγονται η ταχεία ανάπτυξη και η μεγάλη αύξηση της περιεκτικότητας σε λιπίδια. Ο ακριβής ρυθμός σίτισης που καθορίζεται κατά τη διάρκεια του πειράματος θα πρέπει να καταγράφεται. Η αρχική σίτιση θα πρέπει να βασίζεται στις προγραμματισμένες μετρήσεις του βάρους του πληθυσμού του αποθέματος αμέσως πριν από την έναρξη της δοκιμής. Η ποσότητα της ιχθυοτροφής θα πρέπει να αναπροσαρμόζεται με βάση το νωπό βάρος των ψαριών των δειγμάτων σε κάθε χρόνο δειγματοληψίας για να λαμβάνεται υπόψη η ανάπτυξη κατά τη διάρκεια του πειράματος. Το βάρος και μήκος των ψαριών στις δεξαμενές των ομάδων δοκιμής και μαρτύρων μπορούν να υπολογίζονται κατ' εκτίμηση από το βάρος και το ολικό μήκος των ψαριών που χρησιμοποιούνται σε κάθε χρόνο δειγματοληψίας· τα ψάρια που παραμένουν στις δεξαμενές των ομάδων δοκιμής και μαρτύρων δεν ζυγίζονται ούτε μετράται το μήκος τους. Είναι σημαντικό να διατηρείται ο ίδιος καθορισμένος ρυθμός σίτισης σε όλη τη διάρκεια του πειράματος. Η σίτιση θα πρέπει να παρακολουθείται προσεκτικά για να είναι βέβαιο ότι τα ψάρια καταναλώνουν εμφανώς το σύνολο της χορηγούμενης τροφής, έτσι ώστε να διασφαλίζεται η χρήση των κατάλληλων ρυθμών λήψης τροφής για τους υπολογισμούς. Κατά την επιλογή του ρυθμού σίτισης που θα εξασφαλίζει την κατανάλωση του συνόλου της χορηγούμενης μία φορά ημερησίως τροφής, θα πρέπει να λαμβάνονται υπόψη τα προκαταρκτικά πειράματα διατροφής ή η προηγούμενη εμπειρία. Σε περίπτωση που απομένει συστηματικά άθικτη ποσότητα τροφής, ενδέχεται να είναι σκόπιμο να μοιραστεί η δόση σε μια επιπλέον περίοδο σίτισης κάθε πειραματική ημέρα (π.χ. αντί της χορήγησης τροφής μία φορά ημερησίως, χορήγηση της μισής ποσότητας τροφής δύο φορές ημερησίως). Εάν αυτό καταστεί αναγκαίο, ο χρόνος της δεύτερης σίτισης θα πρέπει να είναι ορισμένος και προγραμματισμένος κατά τρόπο ώστε να μεσολαβεί το μεγαλύτερο δυνατό χρονικό διάστημα μέχρι τη δειγματοληψία ψαριών (π.χ. δεύτερη σίτιση σε ορισμένο χρόνο εντός του πρώτου μισού της πειραματικής ημέρας). Αν και γενικά τα ψάρια καταναλώνουν με ταχύτητα την τροφή, είναι σημαντικό να εξασφαλίζεται ότι η ουσία παραμένει προσροφημένη στην τροφή. Θα πρέπει να καταβάλλεται προσπάθεια ώστε να αποφεύγεται η διασπορά της ουσίας από την τροφή στο νερό, η οποία θα εξέθετε τα ψάρια σε υδατικές συγκεντρώσεις της υπό δοκιμή ουσίας πέραν της έκθεσης μέσω της διατροφικής οδού. Αυτό μπορεί να επιτευχθεί με την απομάκρυνση της μη καταναλωθείσας τροφής (και των περιττωμάτων) από τις δεξαμενές των ομάδων δοκιμής και μαρτύρων εντός μίας ώρας από τη σίτιση, αλλά κατά προτίμηση εντός 30 λεπτών. Επιπλέον, μπορεί να χρησιμοποιηθεί ένα σύστημα συνεχούς καθαρισμού του νερού μέσω φίλτρου ενεργού άνθρακα για την απορρόφηση τυχόν «διαλυμένων» μολυντών. Τα συστήματα συνεχούς ροής μπορεί να διευκολύνουν την ταχεία απομάκρυνση των σωματιδίων τροφής και των διαλυμένων ουσιών (67). Σε ορισμένες περιπτώσεις, μια ελαφρώς τροποποιημένη τεχνική παρασκευής εμβολιασμένης τροφής μπορεί να συμβάλει στην άμβλυνση αυτού του προβλήματος (βλ. παράγραφο 119). Φως και θερμοκρασία Όπως και στη μέθοδο υδατικής έκθεσης (βλ. παράγραφο 48), συνιστάται φωτοπερίοδος 12 έως 16 ωρών και κατάλληλη θερμοκρασία (± 2 °C) για το χρησιμοποιούμενο είδος ψαριών (βλ. προσάρτημα 3). Ο τύπος και τα χαρακτηριστικά του φωτισμού θα πρέπει να είναι γνωστά και τεκμηριωμένα. Μάρτυρες Θα πρέπει να χρησιμοποιείται μία ομάδα μαρτύρων, αποτελούμενη από ψάρια στα οποία χορηγείται η ίδια μερίδα όπως στην ομάδα δοκιμής, χωρίς όμως την υπό δοκιμή ουσία. Εάν χρησιμοποιείται έλαιο ή διαλύτης ως φορέας για τον εμβολιασμό της ιχθυοτροφής που χορηγείται στην ομάδα δοκιμής, η τροφή της ομάδας μαρτύρων θα πρέπει να υποβάλλεται στην ίδια ακριβώς κατεργασία, αλλά χωρίς την υπό δοκιμή ουσία, κατά τρόπο ώστε τα σιτηρέσια των ομάδων δοκιμής και μαρτύρων να είναι ισοδύναμα (βλ. παραγράφους 121 και 139). Συχνότητα μετρήσεων της ποιότητας του νερού Οι συνθήκες που περιγράφονται στη μέθοδο υδατικής έκθεσης ισχύουν και στην προκειμένη περίπτωση, με τη διαφορά ότι ο TOC πρέπει να μετράται μόνο πριν από τη δοκιμή, στο πλαίσιο του χαρακτηρισμού του νερού δοκιμής (βλ. παράγραφο 53). Δειγματοληψία και ανάλυση ψαριών και σιτηρεσίου Ανάλυση δειγμάτων σιτηρεσίου Δείγματα των σιτηρεσίων των ομάδων δοκιμής και μαρτύρων θα πρέπει να αναλύονται τουλάχιστον εις τριπλούν για τον προσδιορισμό της υπό δοκιμή ουσίας και της περιεκτικότητας σε λιπίδια, τουλάχιστον πριν από την έναρξη και στο τέλος της φάσης πρόσληψης. Οι μέθοδοι ανάλυσης και οι διαδικασίες με τις οποίες εξασφαλίζεται η ομοιογένεια του σιτηρεσίου θα πρέπει να περιλαμβάνονται στην έκθεση. Τα δείγματα θα πρέπει να αναλύονται για τον προσδιορισμό της υπό δοκιμή ουσίας με την καθιερωμένη και επικυρωμένη μέθοδο. Θα πρέπει να διεξάγονται εργασίες πριν από τη μελέτη για να διαπιστώνονται το όριο ποσοτικοποίησης, η εκατοστιαία ανάκτηση, τυχόν παρεμβολές και η αναλυτική μεταβλητότητα στη σκοπούμενη μήτρα δείγματος. Εάν υποβάλλεται στη δοκιμή ραδιοσημασμένο υλικό, θα πρέπει να εξετάζονται παρόμοια ζητήματα με εκείνα της μεθόδου υδατικής έκθεσης, με αντικατάσταση της ανάλυσης του νερού από ανάλυση της ιχθυοτροφής (βλ. παράγραφο 65). Ανάλυση των ψαριών Σε κάθε χρόνο δειγματοληψίας ψαριών, λαμβάνονται ως δείγμα 5-10 άτομα από τις μεταχειρίσεις έκθεσης και μαρτύρων (σε ορισμένες περιπτώσεις οι αριθμοί των ψαριών-μαρτύρων μπορούν να μειωθούν· βλ. παράγραφο 134). Η δειγματοληψία θα πρέπει να διενεργείται την ίδια ώρα κάθε πειραματικής ημέρας (σε σχέση με τον χρόνο σίτισης) και να προγραμματίζεται κατά τρόπο που να ελαχιστοποιεί την πιθανότητα παραμονής τροφής στο πεπτικό σύστημα κατά τη διάρκεια της φάσης πρόσληψης και στις αρχές της φάσης αποβολής, ώστε να αποφεύγονται οι λανθασμένες προσθήκες στις συνολικές συγκεντρώσεις της υπό δοκιμή ουσίας (δηλ. τα ψάρια των δειγμάτων θα πρέπει να απομακρύνονται από τις δεξαμενές στο τέλος της πειραματικής ημέρας, ενώ υπενθυμίζεται ότι μια πειραματική ημέρα αρχίζει την ώρα σίτισης και λήγει την ώρα της επόμενης σίτισης, περίπου μετά από 24 ώρες.. Η αποβολή αρχίζει με την πρώτη χορήγηση μη εμβολιασμένης τροφής· βλ. παράγραφο 128). Το πρώτο δείγμα της φάσης αποβολής (που λαμβάνεται λίγο πριν από τη δεύτερη σίτιση με μη εμβολιασμένη τροφή) είναι σημαντικό, διότι η παρέκταση κατά μία ημέρα πριν από τη μέτρηση αυτή χρησιμοποιείται για την εκτίμηση της συγκέντρωσης σε χρόνο 0 (C 0,d, η συγκέντρωση στα ψάρια στο τέλος της πρόσληψης/στην αρχή της αποβολής). Προαιρετικά, μπορεί να αφαιρεθεί ο γαστρεντερικός σωλήνας των ψαριών και να αναλυθεί χωριστά στο τέλος της πρόσληψης, καθώς και τις ημέρες 1 και 3 της αποβολής. Σε κάθε χρόνο δειγματοληψίας θα πρέπει να λαμβάνονται ψάρια και από τα δύο δοκιμαστικά δοχεία και να υποβάλλονται στην ίδια μεταχείριση με αυτήν που περιγράφεται στη μέθοδο υδατικής έκθεσης (βλ. παραγράφους 61-63). Οι συγκεντρώσεις της υπό δοκιμή ουσίας σε ολόκληρα ψάρια (νωπό βάρος) μετρώνται τουλάχιστον στο τέλος της φάσης πρόσληψης και κατά τη διάρκεια της φάσης αποβολής, τόσο στην ομάδα μαρτύρων όσο και στην ομάδα δοκιμής. Κατά τη φάση αποβολής, συνιστώνται τέσσερα έως έξι χρονικά σημεία δειγματοληψίας (π.χ. 1, 3, 7, 14 και 28 ημέρες). Προαιρετικά, μπορεί να περιληφθεί ένα πρόσθετο σημείο δειγματοληψίας μετά από πρόσληψη 1-3 ημερών για να εκτιμηθεί η απόδοση της αφομοίωσης από τη γραμμική φάση πρόσληψης για τα ψάρια όταν ακόμη είναι κοντά η αρχή της περιόδου έκθεσης. Υπάρχουν δύο βασικές αποκλίσεις από το πρόγραμμα: i) εάν εφαρμοστεί παράταση της φάσης πρόσληψης με σκοπό τη διερεύνηση της κινητικής της πρόσληψης, θα απαιτηθούν πρόσθετα χρονικά σημεία δειγματοληψίας κατά τη φάση πρόσληψης και, συνεπώς, θα πρέπει να περιληφθούν επιπλέον ψάρια (βλ. παράγραφο 126)· ii) εάν η μελέτη τερματιστεί στο τέλος της φάσης πρόσληψης λόγω μη μετρήσιμης πρόσληψης (βλ. παράγραφο 131). Κάθε ψάρι που λαμβάνεται ως δείγμα θα πρέπει να ζυγίζεται (και να μετράται το συνολικό του μήκος), για να είναι δυνατός ο προσδιορισμός σταθερών ρυθμού ανάπτυξης. Μπορούν επίσης να μετρώνται οι συγκεντρώσεις της ουσίας σε συγκεκριμένους ιστούς των ψαριών (βρώσιμα και μη βρώσιμα μέρη) στο τέλος της πρόσληψης και σε επιλεγμένους χρόνους της φάσης αποβολής. Εάν υποβάλλεται στη δοκιμή ραδιοσημασμένο υλικό, θα πρέπει να εξετάζονται παρόμοια ζητήματα με εκείνα της μεθόδου υδατικής έκθεσης, με αντικατάσταση της ανάλυσης του νερού από ανάλυση της τροφής (βλ. παράγραφο 65). Όσον αφορά την περιοδική χρήση ουσίας αναφοράς (βλ. παράγραφο 25), είναι προτιμότερο να μετρώνται οι συγκεντρώσεις στην ομάδα δοκιμής στο τέλος της πρόσληψης και σε όλους τους χρόνους της φάσης αποβολής που καθορίζονται για την υπό δοκιμή ουσία (σε ολόκληρα ψάρια)· για την ομάδα μάρτυρα, αρκεί η ανάλυση των συγκεντρώσεων στο τέλος της φάσης πρόσληψης (σε ολόκληρα ψάρια). Σε ορισμένες περιπτώσεις (για παράδειγμα, εάν οι τεχνικές ανάλυσης της υπό δοκιμή ουσίας και της ουσίας αναφοράς είναι ασύμβατες, με αποτέλεσμα να χρειάζονται επιπλέον ψάρια για να τηρηθεί το πρόγραμμα δειγματοληψίας), μπορεί να υιοθετηθεί άλλη προσέγγιση για την ελαχιστοποίηση του αριθμού των απαιτούμενων επιπλέον ψαριών, ως εξής: οι συγκεντρώσεις της ουσίας αναφοράς μετρώνται κατά τη διάρκεια αποβολής μόνο τις ημέρες 1, 3 και σε δύο ακόμη χρονικά σημεία δειγματοληψίας, τα οποία επιλέγονται κατά τρόπο που να επιτρέπει αξιόπιστες εκτιμήσεις της συγκέντρωσης σε χρόνο 0 (C 0,d) και σταθεράς k 2 για την ουσία αναφοράς. Εάν είναι δυνατόν, η περιεκτικότητα κάθε ψαριού σε λιπίδια θα πρέπει να προσδιορίζεται σε κάθε χρόνο δειγματοληψίας ή τουλάχιστον στην αρχή και στο τέλος της φάσης πρόσληψης και στο τέλος της φάσης αποβολής (βλ. παραγράφους 56 και 67). Ανάλογα με την αναλυτική μέθοδο (βλ. παράγραφο 67 και προσάρτημα 4), μπορεί να είναι εφικτή η χρησιμοποίηση των ίδιων ψαριών για τον προσδιορισμό τόσο της περιεκτικότητας σε λιπίδια όσο και της συγκέντρωσης της υπό δοκιμή ουσίας. Αυτό προτιμάται για να περιορίζεται ο αριθμός των ψαριών στον ελάχιστο δυνατό. Εάν, ωστόσο, δεν είναι εφικτό, μπορεί να υιοθετηθεί η προσέγγιση που περιγράφεται στη μέθοδο υδατικής έκθεσης (βλ. εναλλακτικές επιλογές για τη μέτρηση των λιπιδίων στην παράγραφο 56 για αυτές τις εναλλακτικές επιλογές μέτρησης των λιπιδίων). Η μέθοδος που χρησιμοποιείται για την ποσοτικοποίηση της περιεκτικότητας σε λιπίδια θα πρέπει να τεκμηριώνεται στην έκθεση. Ποιότητα της αναλυτικής μεθόδου Θα πρέπει να διενεργούνται πειραματικοί έλεγχοι για να εξασφαλίζονται η ειδικότητα, η ορθότητα, η ακρίβεια και η αναπαραγωγιμότητα της ειδικής για την εκάστοτε ουσία αναλυτικής μεθόδου, καθώς και η ανάκτηση της υπό δοκιμή ουσίας, τόσο από την τροφή όσο και από τα ψάρια. Μέτρηση της ανάπτυξης των ψαριών Κατά την έναρξη της δοκιμής, πρέπει να ζυγίζεται ένα δείγμα ψαριών από τον πληθυσμό του αποθέματος (και να μετράται το ολικό μήκος των ψαριών). Αυτά τα δείγματα ψαριών θα πρέπει να λαμβάνονται λίγο πριν από την πρώτη χορήγηση εμβολιασμένης τροφής (π.χ. μία ώρα) και να αντιστοιχίζονται στην πειραματική ημέρα 0. Ο αριθμός των ψαριών για το εν λόγω δείγμα θα πρέπει να είναι τουλάχιστον ο ίδιος με εκείνον των δειγμάτων κατά τη διάρκεια της δοκιμής. Ορισμένα από αυτά τα ψάρια μπορεί να είναι εκείνα που χρησιμοποιήθηκαν για την ανάλυση των λιπιδίων πριν από την έναρξη της φάσης πρόσληψης (βλ. παράγραφο 153). Σε κάθε διάστημα δειγματοληψίας, πρώτα ζυγίζονται τα ψάρια και ύστερα μετράται το μήκος τους. Το μετρούμενο βάρος (και μήκος) κάθε ψαριού θα πρέπει να αντιστοιχίζεται με τη συγκέντρωση της υπό ανάλυση χημικής ουσίας (και την περιεκτικότητα σε λιπίδια, κατά περίπτωση), για παράδειγμα με τη χρήση αποκλειστικού αναγνωριστικού κωδικού για κάθε ψάρι του δείγματος. Οι μετρήσεις των ψαριών αυτών των δειγμάτων μπορούν να χρησιμοποιούνται για την εκτίμηση του βάρους (και του μήκους) των ψαριών που παραμένουν στις δεξαμενές δοκιμής και μαρτύρων. Πειραματική αξιολόγηση Θα πρέπει να ελέγχεται καθημερινά η θνησιμότητα και να καταγράφονται οι σχετικές παρατηρήσεις. Θα πρέπει να διενεργούνται και να καταγράφονται επιπλέον παρατηρήσεις για τον εντοπισμό δυσμενών επιδράσεων, για παράδειγμα αφύσικης συμπεριφοράς ή μελάγχρωσης. Τα ψάρια θεωρούνται νεκρά εάν δεν παρατηρείται αναπνευστική κίνηση και δεν διαπιστώνεται καμία αντίδραση σε ελαφρό μηχανικό ερέθισμα. Τα νεκρά ή εμφανώς ετοιμοθάνατα ψάρια θα πρέπει να απομακρύνονται. ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Επεξεργασία αποτελεσμάτων Τα αποτελέσματα των δοκιμών χρησιμοποιούνται για να προσδιοριστεί η σταθερά ρυθμού αποβολής (k 2) ως συνάρτηση του συνολικού νωπού βάρους των ψαριών. Η σταθερά ρυθμού ανάπτυξης, k g, που βασίζεται σε μέση αύξηση του βάρους των ψαριών, υπολογίζεται και χρησιμοποιείται για την παραγωγή της διορθωμένης ως προς την ανάπτυξη σταθεράς ρυθμού αποβολής, k 2g, κατά περίπτωση. Επιπλέον, θα πρέπει να αναφέρονται η απόδοση της αφομοίωσης (a· απορρόφηση στο πεπτικό σύστημα), ο κινητικός συντελεστής βιομεγέθυνσης (BMFK) (εάν είναι απαραίτητο διορθωμένος ως προς την ανάπτυξη, BMFKg), η διορθωμένη ως προς τα λιπίδια τιμή του (BMFKL ή BMFKgL, εάν είναι διορθωμένη ως προς την αναπτυξιακή αραίωση) και ο ρυθμός σίτισης. Επίσης, εάν είναι εφικτή μια εκτίμηση του χρόνου μέχρι να επιτευχθεί σταθερή κατάσταση (π.χ. σταθερή κατάσταση 95 % ή t 95 = 3,0/k 2), μπορεί να συναχθεί ο BMF σταθερής κατάστασης (BMFSS) (βλ. παραγράφους 105 και 106 και προσάρτημα 5) εάν η τιμή t 95 υποδηλώνει ότι μπορεί να έχουν επιτευχθεί συνθήκες σταθερής κατάστασης. Στον εν λόγω BMFSS θα πρέπει να εφαρμόζεται η ίδια διόρθωση ως προς τα λιπίδια όπως και στον κινητικό BMF (BMFK), ώστε να προκύψει μια τιμή διορθωμένη ως προς τα λιπίδια, ο BMFSSL (επισημαίνεται ότι δεν έχει συμφωνηθεί διαδικασία για τη διόρθωση ως προς την αναπτυξιακή αραίωση για τον BMF σε σταθερή κατάσταση). Μαθηματικοί τύποι και παράδειγμα υπολογισμών παρουσιάζονται στο προσάρτημα 7. Υπάρχουν προσεγγίσεις που καθιστούν εφικτή την εκτίμηση κινητικού συντελεστή βιοσυγκέντρωσης (BCFK) με βάση τα δεδομένα που προκύπτουν από τη μελέτη διατροφικής έκθεσης. Το θέμα αυτό εξετάζεται στο προσάρτημα 8. Δεδομένα για το βάρος/μήκος των ψαριών Οι τιμές νωπού βάρους και μήκους κάθε ψαριού για όλες τις χρονικές περιόδους παρουσιάζονται χωριστά σε πίνακα για τις ομάδες δοκιμής και μαρτύρων για όλες τις ημέρες δειγματοληψίας κατά τη διάρκεια της φάσης πρόσληψης [πληθυσμός του αποθέματος κατά την έναρξη της πρόσληψης· ομάδα μαρτύρων και ομάδα δοκιμής κατά τη λήξη της πρόσληψης και, εάν εκτελείται μέτρηση, κατά την αρχική φάση (π.χ. τις ημέρες 1-3 της πρόσληψης) και τη φάση αποβολής (π.χ. τις ημέρες 1, 2, 4, 7, 14, 28, για την ομάδα μαρτύρων και την ομάδα δοκιμής)]. Το βάρος είναι η προτιμώμενη παράμετρος ανάπτυξης για τους σκοπούς της διόρθωσης ως προς την αναπτυξιακή αραίωση. Βλ. κατωτέρω (παράγραφοι 162 και 163) και προσάρτημα 5 για τις μεθόδους που χρησιμοποιούνται για τη διόρθωση των δεδομένων ως προς την αναπτυξιακή αραίωση. Δεδομένα για τη συγκέντρωση της υπό δοκιμή ουσίας στα ψάρια Οι μετρήσεις υπολειμμάτων της υπό δοκιμή ουσίας σε κάθε ψάρι χωριστά (ή σε συγχωνευμένα δείγματα ψαριών, εάν δεν είναι εφικτές οι ατομικές μετρήσεις), εκφραζόμενες σε συγκέντρωση κατά νωπό βάρος (κ.β.), καταγράφονται σε πίνακα για τις ομάδες ψαριών δοκιμής και μαρτύρων ανά χρόνο δειγματοληψίας. Εάν έχει διενεργηθεί ανάλυση λιπιδίων σε κάθε ψάρι των δειγμάτων, μπορούν στη συνέχεια να συναχθούν και να παρουσιαστούν σε πίνακα οι ατομικές συγκεντρώσεις, διορθωμένες ως προς τα λιπίδια (κ.β. λιπιδίων).
Ρυθμός αποβολής και συντελεστής βιομεγέθυνσης Για τον υπολογισμό του συντελεστή βιομεγέθυνσης από τα δεδομένα, θα πρέπει να υπολογίζεται πρώτα η απόδοση αφομοίωσης (απορρόφηση της υπό δοκιμή ουσίας στο πεπτικό σύστημα, α). Για τον σκοπό αυτό, θα πρέπει να χρησιμοποιείται η εξίσωση A7.1 του προσαρτήματος 7, που απαιτεί να είναι γνωστές η παράγωγη συγκέντρωση στα ψάρια κατά τον χρόνο 0 της φάσης αποβολής (C 0,d), η (συνολική) σταθερά ρυθμού αποβολής (k 2), η συγκέντρωση στην τροφή (C food), η σταθερά ρυθμού λήψης τροφής (I) και η περίοδος πρόσληψης (t). Η κλίση και η τεταγμένη της καμπύλης της γραμμικής σχέσης μεταξύ ln(συγκέντρωση) και χρόνου αποβολής αναφέρονται ως συνολική σταθερά ρυθμού αποβολής (k 2 = κλίση) και συγκέντρωση χρόνου 0 (C 0,d = eτεταγμένη), όπως ανωτέρω. Θα πρέπει να ελέγχεται η βιολογική ευλογοφάνεια των παράγωγων τιμών (π.χ. η απόδοση αφομοίωσης, ως κλάσμα, δεν μπορεί να είναι μεγαλύτερη από 1). Η (I) υπολογίζεται με διαίρεση της μάζας της τροφής δια της μάζας των ψαριών που σιτίζονται κάθε ημέρα (εάν τους χορηγείται ποσότητα τροφής ίση με το 2 % του σωματικού τους βάρους, η (I) θα είναι 0,02). Ωστόσο, ο ρυθμός σίτισης που χρησιμοποιείται στον υπολογισμό μπορεί να χρειάζεται προσαρμογή για να ληφθεί υπόψη η ανάπτυξη των ψαριών (για την προσαρμογή αυτή μπορεί να χρησιμοποιηθεί η γνωστή σταθερά ρυθμού ανάπτυξης για να εκτιμηθεί το βάρος των ψαριών σε κάθε χρονικό σημείο κατά τη διάρκεια της φάσης πρόσληψης· βλ. προσάρτημα 7). Όταν δεν είναι δυνατό να ληφθούν οι τιμές k 2 και C 0,d επειδή, για παράδειγμα, οι συγκεντρώσεις είναι κατώτερες από το όριο ανίχνευσης στο δεύτερο δείγμα αποβολής, μπορεί να γίνει συντηρητική εκτίμηση της k 2, και να υπολογιστεί ένας «φραγμένος προς τα άνω» BMFk (βλ. προσάρτημα 7). Όταν ληφθεί η απόδοση αφομοίωσης (α), μπορεί να υπολογιστεί ο συντελεστής βιομεγέθυνσης με πολλαπλασιασμό της α επί τη σταθερά ρυθμού λήψης τροφής (I) και διαίρεση του γινομένου δια της (συνολικής) σταθεράς ρυθμού αποβολής (k 2). Ο διορθωμένος ως προς την ανάπτυξη συντελεστής βιομεγέθυνσης υπολογίζεται κατά τον ίδιο τρόπο, αλλά με τη χρήση της διορθωμένης ως προς την ανάπτυξη σταθεράς ρυθμού αποβολής (k 2g· βλ. παραγράφους 162 και 163. Μια εναλλακτική εκτίμηση της απόδοσης της αφομοίωσης μπορεί να προκύψει αν πραγματοποιήθηκε ιστολογική ανάλυση σε ψάρια που ελήφθησαν ως δείγματα κατά το αρχικό, γραμμικό στάδιο της φάσης πρόσληψης· βλ. παράγραφο 151 και προσάρτημα 7. Αυτή η τιμή αποτελεί μια ανεξάρτητη εκτίμηση της απόδοσης αφομοίωσης από έναν οργανισμό με ουσιαστικά μηδενική έκθεση (δηλαδή ένα ψάρι κοντά στην έναρξη της φάσης πρόσληψης). Η απόδοση της αφομοίωσης που εκτιμάται από τα δεδομένα αποβολής χρησιμοποιείται συνήθως για τον προσδιορισμό του BMF. Διόρθωση ως προς τα λιπίδια και την αναπτυξιακή αραίωση Η ανάπτυξη των ψαριών κατά τη φάση αποβολής μπορεί να μειώσει τις μετρούμενες συγκεντρώσεις χημικών ουσιών στα ψάρια, με αποτέλεσμα η συνολική σταθερά ρυθμού αποβολής, k2 , να είναι μεγαλύτερη από αυτήν που θα προέκυπτε μόνο από διεργασίες απομάκρυνσης (π.χ. μεταβολισμός, απεκκρίσεις) (βλ. παράγραφο 72). Η περιεκτικότητα των ψαριών δοκιμής σε λιπίδια (που είναι στενά συνδεδεμένη με τη βιοσυσσώρευση υδρόφοβων ουσιών) και η περιεκτικότητα των τροφών σε λιπίδια μπορεί να ποικίλλουν αρκετά στην πράξη, σε βαθμό που η διόρθωσή τους να είναι απαραίτητη για την παρουσίαση χρήσιμων συντελεστών βιομεγέθυνσης. Ο συντελεστής βιομεγέθυνσης θα πρέπει να διορθώνεται ως προς την αναπτυξιακή αραίωση (όπως και ο κινητικός BCF στη μέθοδο υδατικής έκθεσης) και ως προς την περιεκτικότητα της τροφής σε λιπίδια σε σχέση με την αντίστοιχη των ψαριών (συντελεστής διόρθωσης ως προς τα λιπίδια). Οι εξισώσεις και παραδείγματα των υπολογισμών αυτών παρατίθενται στα προσαρτήματα 5 και 7 αντίστοιχα. Για να γίνει διόρθωση ως προς την αναπτυξιακή αραίωση, θα πρέπει να υπολογιστεί η σταθερά ρυθμού αποβολής διορθωμένη ως προς την ανάπτυξη (k 2g) (βλ. προσάρτημα 5 για εξισώσεις). Η σταθερά ρυθμού αποβολής διορθωμένη ως προς την ανάπτυξη (k 2g) χρησιμοποιείται κατόπιν για τον υπολογισμό του συντελεστή βιομεγέθυνσης, διορθωμένο ως προς την ανάπτυξη, σύμφωνα με την παράγραφο 73. Σε ορισμένες περιπτώσεις, η προσέγγιση αυτή δεν είναι εφικτή. Μια εναλλακτική προσέγγιση, με την οποία παρακάμπτεται η ανάγκη διόρθωσης ως προς την αναπτυξιακή αραίωση, συνίσταται στη χρήση δεδομένων αποβολής που εκφράζονται σε μάζα της υπό δοκιμή ουσίας ανά ψάρι (για ολόκληρα ψάρια) αντί των συνήθων δεδομένων που εκφράζονται σε μάζα της υπό δοκιμή ουσίας ανά μονάδα μάζας ψαριού (συγκέντρωση). Αυτό μπορεί να επιτευχθεί εύκολα, καθώς οι δοκιμές σύμφωνα με την παρούσα μέθοδο θα πρέπει να συνδέουν τις καταγραφόμενες συγκεντρώσεις ιστών με το βάρος του κάθε ψαριού. Η απλή διαδικασία που εφαρμόζεται για τον σκοπό αυτό περιγράφεται συνοπτικά στο προσάρτημα 5. Επισημαίνεται ότι η k 2 θα πρέπει να υπολογίζεται και να αναφέρεται, ακόμη κι αν χρησιμοποιείται αυτή η εναλλακτική προσέγγιση. Για να γίνει διόρθωση ως προς την περιεκτικότητα της τροφής και των ψαριών σε λιπίδια, όταν δεν έχει γίνει ανάλυση των λιπιδίων σε όλα τα ψάρια του δείγματος, λαμβάνονται τα μέσα λιπιδικά κλάσματα (κ.β.) στα ψάρια και στην τροφή (68). Στη συνέχεια, υπολογίζεται ο συντελεστής διόρθωσης ως προς τα λιπίδια (Lc ) με διαίρεση του μέσου λιπιδικού κλάσματος στα ψάρια διά του μέσου λιπιδικού κλάσματος στην τροφή. Ο συντελεστής βιομεγέθυνσης –είτε διορθωμένος ως προς την ανάπτυξη είτε όχι– διαιρείται διά του συντελεστή διόρθωσης ως προς τα λιπίδια για να υπολογιστεί ο διορθωμένος ως προς τα λιπίδια συντελεστής βιομεγέθυνσης. Εάν διεξάγονται αναλύσεις της χημικής ουσίας και των λιπιδίων στα ίδια ψάρια σε κάθε χρονικό σημείο δειγματοληψίας, τα διορθωμένα ως προς τα λιπίδια δεδομένα ιστών για μεμονωμένα ψάρια μπορούν να χρησιμοποιηθούν για τον απευθείας υπολογισμό του διορθωμένου ως προς τα λιπίδια BMF [βλ. (37)]. Η γραφική παράσταση των διορθωμένων ως προς τα λιπίδια δεδομένων συγκέντρωσης παρέχει τις τιμές C 0,d βάσει των λιπιδίων και k 2. Στη συνέχεια μπορεί να γίνει μαθηματική ανάλυση με τη χρήση των εξισώσεων του προσαρτήματος 7, αλλά η απόδοση αφομοίωσης (a) υπολογίζεται με τη χρήση της κανονικοποιημένης ως προς τα λιπίδια σταθεράς ρυθμού λήψης τροφής (I lipid) και της συγκέντρωσης των λιπιδίων στην τροφή (C food-lipid). Οι διορθωμένες ως προς τα λιπίδια παράμετροι χρησιμοποιούνται στη συνέχεια με παρόμοιο τρόπο για τον υπολογισμό του BMF (σημειωτέον ότι η σταθερά ρυθμού ανάπτυξης θα πρέπει επίσης να εφαρμόζεται στο λιπιδικό κλάσμα και όχι στο νωπό βάρος των ψαριών για τον υπολογισμό του διορθωμένου ως προς τα λιπίδια και την ανάπτυξη BMFKgL). Ερμηνεία των αποτελεσμάτων Η μέση ανάπτυξη στις ομάδες δοκιμής και στις ομάδες μαρτύρων θα πρέπει, κατ' αρχήν, να μην παρουσιάζει σημαντικές διαφορές, ώστε να αποκλείεται το ενδεχόμενο τοξικών επιδράσεων. Οι σταθερές ρυθμού ανάπτυξης ή οι καμπύλες ανάπτυξης των δύο ομάδων θα πρέπει να συγκρίνονται με κατάλληλη διαδικασία (69). Έκθεση δοκιμής Μετά τον τερματισμό της μελέτης, συντάσσεται τελική έκθεση που περιέχει τις πληροφορίες σχετικά με την υπό δοκιμή ουσία, το είδος και τις συνθήκες δοκιμής, όπως παρατίθενται στην παράγραφο 81 (όπως και για τη μέθοδο υδατικής έκθεσης). Επιπλέον, απαιτούνται τα ακόλουθα στοιχεία:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ ΚΑΙ ΜΟΝΑΔΕΣ
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 2 ΟΡΙΣΜΕΝΑ ΧΗΜΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΕΝΟΣ ΑΠΟΔΕΚΤΟΥ ΝΕΡΟΥ ΑΡΑΙΩΣΗΣ
Προσάρτημα 3 ΕΙΔΗ ΨΑΡΙΩΝ ΠΟΥ ΣΥΝΙΣΤΩΝΤΑΙ ΓΙΑ ΤΗ ΔΟΚΙΜΗ
Διάφορα είδη που διαβιούν στις εκβολές ποταμών ή θαλάσσια είδη χρησιμοποιούνται λιγότερο, για παράδειγμα:
Τα ψάρια των γλυκών νερών που παρατίθενται στον παραπάνω πίνακα είναι εύκολο να εκτραφούν ή/και βρίσκονται εύκολα καθ' όλη τη διάρκεια του χρόνου, ενώ τα θαλασσινά είδη και τα είδη που διαβιούν στις εκβολές ποταμών περιορίζονται εν μέρει στις αντίστοιχες χώρες. Μπορούν να εκτραφούν και να καλλιεργηθούν είτε σε ιχθυοτροφεία είτε στο εργαστήριο, υπό ελεγχόμενες από πλευράς ασθενειών και παρασίτων συνθήκες, έτσι ώστε τα υπό δοκιμή ζώα να είναι υγιή και γνωστής καταγωγής. Τα ψάρια αυτά βρίσκονται σε πολλά μέρη του κόσμου. ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 4 ΠΡΟΓΡΑΜΜΑΤΑ ΔΕΙΓΜΑΤΟΛΗΨΙΑΣ ΓΙΑ ΤΙΣ ΔΟΚΙΜΕΣ ΥΔΑΤΙΚΗΣ ΚΑΙ ΔΙΑΤΡΟΦΙΚΗΣ ΕΚΘΕΣΗΣ 1. Θεωρητικό παράδειγμα προγράμματος δειγματοληψίας για μια πλήρη δοκιμή βιοσυγκέντρωσης με υδατική έκθεση μιας ουσίας με log KOW = 4.
2. Θεωρητικό παράδειγμα προγράμματος δειγματοληψίας για δοκιμή βιοσυσσώρευσης με διατροφική έκθεση στην ουσία μετά από φάση πρόσληψης 10 ημερών και φάση αποβολής 42 ημερών.
Σημείωση σχετικά με τη φάση και τα χρονοδιαγράμματα δειγματοληψίας: Η φάση της πρόσληψης ξεκινά με την πρώτη χρήση της εμβολιασμένης τροφής. Μία πειραματική ημέρα διαρκεί από τη στιγμή της σίτισης μέχρι λίγο πριν την ώρα της επόμενης σίτισης, 24 ώρες αργότερα. Η πρώτη δειγματοληψία (1 στον πίνακα) θα πρέπει να λαμβάνεται λίγο πριν από την πρώτη (π.χ. μία ώρα). Η δειγματοληψία κατά τη διάρκεια μιας μελέτης θα πρέπει, στην ιδανική περίπτωση, να διεξάγεται λίγο πριν από τη σίτιση της επόμενης ημέρας (δηλ. περίπου 23 ώρες μετά από τη σίτιση την ημέρα της δειγματοληψίας). Η φάση της πρόσληψης λήγει λίγο πριν από την πρώτη σίτιση με μη εμβολιασμένη τροφή, όταν αρχίζει η φάση αποβολής (τα ψάρια της ομάδας δοκιμής πιθανότατα θα αφομοιώνουν ακόμη την εμβολιασμένη τροφή κατά το ενδιάμεσο διάστημα των 24 ωρών μετά την τελευταία σίτιση με την εμβολιασμένη τροφή). Αυτό σημαίνει ότι το δείγμα για το τέλος της πρόσληψης θα πρέπει να λαμβάνεται λίγο πριν από την πρώτη σίτιση με μη εμβολιασμένη τροφή και το πρώτο δείγμα της φάσης αποβολής θα πρέπει να λαμβάνεται περίπου 23 ώρες μετά την πρώτη σίτιση με μη εμβολιασμένη τροφή. Προσάρτημα 5 ΓΕΝΙΚΟΙ ΥΠΟΛΟΓΙΣΜΟΙ
1. ΕΙΣΑΓΩΓΗ Το γενικό μοντέλο υδατικής βιοσυσσώρευσης σε ιχθύες μπορεί να περιγραφεί από την άποψη των διεργασιών πρόσληψης και απώλειας, αγνοώντας την πρόσληψη με την τροφή. Η διαφορική εξίσωση (dC f/dt) που περιγράφει τον ρυθμό μεταβολής της συγκέντρωσης στα ψάρια (mg·kg– 1·ημέρα– 1) δίδεται από την εξίσωση (1):
όπου:
Για βιοσυσσωρεύσιμες ουσίες, μπορεί να αναμένεται ότι η χρονικά σταθμισμένη μέση τιμή (TWA) είναι η καταλληλότερη συγκέντρωση έκθεσης στο νερό (Cw ) εντός των επιτρεπόμενων ορίων διακύμανσης (βλ. παράγραφο 24). Συνιστάται να υπολογίζεται μια TWA συγκέντρωσης στο νερό σύμφωνα με τη διαδικασία που ορίζεται στο προσάρτημα 6 της μεθόδου δοκιμών Γ.20 (2). Θα πρέπει να επισημανθεί ότι ο λογαριθμικός μετασχηματισμός της συγκέντρωσης στο νερό είναι κατάλληλος όταν αναμένεται εκθετική πορεία μείωσης μεταξύ των περιόδων ανανέωσης, π.χ. σχεδιασμός ημιστατικής δοκιμής. Σε ένα σύστημα συνεχούς ροής, μπορεί να μην είναι αναγκαίος ο λογαριθμικός μετασχηματισμός των συγκεντρώσεων έκθεσης. Εάν παράγονται τιμές TWA συγκεντρώσεων νερού, αυτές θα πρέπει να αναφέρονται και να χρησιμοποιούνται σε μετέπειτα υπολογισμούς. Σε μια τυποποιημένη δοκιμή BCF σε ψάρια, η πρόσληψη και αποβολή μπορεί να περιγραφούν σε σχέση με δύο κινητικές διεργασίες πρώτης τάξης.
Σε σταθερή κατάσταση, με την παραδοχή ότι η ανάπτυξη και ο μεταβολισμός είναι αμελητέα (δηλ. οι τιμές της k g και της k m δεν μπορούν να διακριθούν από το μηδέν), ο ρυθμός πρόσληψης ισοδυναμεί με τον ρυθμό αποβολής και, συνεπώς, ο συνδυασμός της εξίσωσης Α5.2 με την εξίσωση Α5.3 παράγει την ακόλουθη σχέση:
όπου:
Ο λόγος k 1/k 2 είναι γνωστός ως κινητικός BCF (BCFK) και θα πρέπει να ισούται με τον BCF σε σταθερή κατάσταση (BCFSS) που λαμβάνεται από τον λόγο της συγκέντρωσης σε σταθερή κατάσταση στα ψάρια προς τη συγκέντρωση στο νερό, αλλά ενδέχεται να υπάρξουν αποκλίσεις, εάν η σταθερή κατάσταση ήταν αβέβαιη ή εάν οι διορθώσεις για την ανάπτυξη έχουν εφαρμοστεί στον κινητικό BCF. Επειδή, ωστόσο, η k 1 και η k 2 είναι σταθερές, δεν είναι απαραίτητο να επιτευχθεί σταθερή κατάσταση για να ληφθεί ένας BCFK. Με βάση αυτές τις εξισώσεις πρώτης τάξης, το παρόν προσάρτημα 5 περιλαμβάνει τους γενικούς υπολογισμούς που είναι αναγκαίοι για τις μεθόδους βιοσυσσώρευσης τόσο με υδατική και όσο και με διατροφική έκθεση. Ωστόσο, τα τμήματα 5, 6 και 8 αφορούν μόνο τη μέθοδο της υδατικής έκθεσης, αλλά περιλαμβάνονται εδώ, διότι αποτελούν «γενικές» τεχνικές. Οι μέθοδοι διαδοχικών (τμήματα 4 και 5) και ταυτόχρονων (τμήμα 6) δοκιμών επιτρέπουν τον υπολογισμό των σταθερών πρόσληψης και αποβολής που χρησιμοποιούνται για τη λήψη του κινητικού BCF. Η μέθοδος διαδοχικών δοκιμών για τον προσδιορισμό της k 2 (τμήμα 4) είναι σημαντική για τη μέθοδο της διατροφικής έκθεσης, διότι είναι αναγκαία για τον υπολογισμό τόσο της απόδοσης αφομοίωσης όσο και του BMF. Το προσάρτημα 7 περιγράφει τους υπολογισμούς που αφορούν ειδικά τη διατροφική μέθοδο. 2. ΠΡΟΒΛΕΨΗ ΤΗΣ ΔΙΑΡΚΕΙΑΣ ΤΗΣ ΦΑΣΗΣ ΠΡΟΣΛΗΨΗΣ Πριν από την εκτέλεση της δοκιμής, μπορεί να εκτιμηθεί η k 2 και, ως εκ τούτου, κάποιο ποσοστό του χρόνου που απαιτείται για την επίτευξη σταθερής κατάστασης από την εμπειρική σχέση μεταξύ της k 2 και του συντελεστή κατανομής n-οκτανόλη/νερό (K OW) ή της k 1 και του BCF. Πρέπει, ωστόσο, να γίνει κατανοητό ότι οι εξισώσεις του παρόντος τμήματος εφαρμόζονται μόνο όταν η πρόσληψη και η αποβολή ακολουθούν κινητική πρώτης τάξης. Εάν είναι σαφές ότι αυτό δεν συμβαίνει, συνιστάται να ζητηθεί η γνώμη ειδικού βιοστατιστικολόγου και/ή ειδικού στη φαρμακοκινητική, εάν ζητούνται προβλέψεις της φάσης πρόσληψης. Μία εκτίμηση της k 2 (ημέρα– 1) μπορεί να ληφθεί με διάφορες μεθόδους. Για παράδειγμα, θα μπορούσαν να χρησιμοποιηθούν σε πρώτο στάδιο οι ακόλουθες εμπειρικές σχέσεις (87):
ή
W = μέσο βάρος ψαριών της δοκιμής (γραμμάρια νωπού βάρους) στο τέλος της πρόσληψης/έναρξη της αποβολής (88) Για άλλες συναφείς σχέσεις βλ. (6). Είναι ενδεχομένως χρήσιμο να χρησιμοποιούνται πιο σύνθετα μοντέλα για την εκτίμηση της k2 εάν, για παράδειγμα, είναι πιθανό να υπάρξει σημαντικός μεταβολισμός (7) (8). Όσο, όμως, το μοντέλο γίνεται πιο σύνθετο, χρειάζεται μεγαλύτερη προσοχή κατά την ερμηνεία των προβλέψεων. Για παράδειγμα, η παρουσία νιτροομάδων θα μπορούσε να υποδηλώνει ταχύ μεταβολισμό, αλλά αυτό δεν συμβαίνει πάντοτε. Ως εκ τούτου, ο χρήστης θα πρέπει να συνεκτιμά τα αποτελέσματα της μεθόδου πρόβλεψης με τη χημική δομή και κάθε άλλη σχετική πληροφορία (π.χ. από προκαταρκτικές μελέτες) κατά τον προγραμματισμό μιας μελέτης. Ο χρόνος για την επίτευξη ενός ποσοστού σταθερής κατάστασης μπορεί να υπολογιστεί με χρήση της εκτιμώμενης τιμής της k 2, από τη γενική κινητική εξίσωση που περιγράφει την πρόσληψη και αποβολή (κινητική πρώτης τάξης), με την παραδοχή ότι η ανάπτυξη και ο μεταβολισμός είναι αμελητέα. Εάν κατά τη διάρκεια της μελέτης σημειωθεί σημαντική ανάπτυξη, οι εκτιμήσεις που περιγράφονται κατωτέρω δεν θα είναι αξιόπιστες. Στις περιπτώσεις αυτές, είναι καλύτερο να χρησιμοποιηθεί η k 2g διορθωμένη ως προς την ανάπτυξη, όπως περιγράφεται κατωτέρω (βλ. τμήμα 7 του παρόντος προσαρτήματος):
ή, εάν η C w είναι σταθερά:
Όταν προσεγγίζεται η σταθερή κατάσταση (t → ∞), η εξίσωση A5.10 μπορεί να αναχθεί (βλ. (9) (10)) σε:
ή
Ο όρος BCF × C w είναι τότε μια κατά προσέγγιση τιμή της συγκέντρωσης στα ψάρια σε σταθερή κατάσταση (C f-SS). [Σημείωση: η ίδια προσέγγιση μπορεί να χρησιμοποιηθεί κατά την εκτίμηση του BMF σε σταθερή κατάσταση με τη μέθοδο της διατροφικής έκθεσης. Στην περίπτωση αυτή, ο BCF αντικαθίσταται από τον BMF και η C w από τη C food, συγκέντρωση στην τροφή, στις εξισώσεις ανωτέρω] Η εξίσωση A5.10 μπορεί να γραφεί ως:
ή
Με την εφαρμογή της εξίσωσης Α5.14, ο χρόνος για την επίτευξη ενός ποσοστού σταθερής κατάστασης μπορεί να προβλεφθεί όταν έχει υπολογιστεί εκ των προτέρων η k 2 με τη χρήση της εξίσωσης Α5.5 ή της εξίσωσης Α5.6. Κατά κανόνα, η στατιστικώς άριστη διάρκεια της φάσης πρόσληψης για να συναχθούν στατιστικώς αποδεκτά δεδομένα (BCFK) είναι το διάστημα που απαιτείται ώστε η καμπύλη του λογαρίθμου της συγκέντρωσης της υπό δοκιμή ουσίας στα ψάρια, που χαράσσεται σε συνάρτηση με τον γραμμικό χρόνο, να φθάσει τουλάχιστον στο 50 % της σταθερής κατάστασης (δηλ. 0,69/k 2) αλλά όχι περισσότερο από το 95 % (δηλ. 3,0/k 2) της σταθερής κατάστασης (11). Σε περίπτωση που η συσσώρευση υπερβαίνει το 95 % της σταθερής κατάστασης. ο υπολογισμός ενός BCFSS καθίσταται εφικτός. Ο χρόνος για την επίτευξη ποσοστού 80 % της σταθερής κατάστασης είναι (με τη χρήση της εξίσωσης Α5.14):
ή
Παρομοίως, ο χρόνος για την επίτευξη ποσοστού σταθερής κατάστασης 95 % είναι:
Για παράδειγμα, η διάρκεια της φάσης πρόσληψης (δηλ. ο χρόνος για την επίτευξη ενός συγκεκριμένου ποσοστού σταθερής κατάστασης, π.χ. t 80 ή t 95) για μια υπό δοκιμή ουσία με log K OW = 4 θα ήταν (με τη χρήση της εξίσωσης Α5.5, της εξίσωσης Α5.16 και της εξίσωσης Α.5.17): logk2 = 1,47 – 0,414 · 4 k 2 = 0,652 ημέρα-1
ή Εναλλακτικά, μπορεί να χρησιμοποιηθεί η έκφραση:
για τον υπολογισμό του χρόνου για την επίτευξη πραγματικής σταθερής κατάστασης (t eSS) (12). Για μία υπό δοκιμή ουσία με log K OW = 4, αυτό δίνει: teSS = 6,54 · 10 – 3 · 104 + 55,31 = 121 ώρες 3. ΠΡΟΒΛΕΨΗ ΤΗΣ ΔΙΑΡΚΕΙΑΣ ΤΗΣ ΦΑΣΗΣ ΑΠΟΒΟΛΗΣ Μία πρόβλεψη του χρόνου που απαιτείται για να μειωθεί ο φόρτος στο σώμα σε ένα ορισμένο ποσοστό της αρχικής συγκέντρωσης μπορεί επίσης να ληφθεί και από τη γενική εξίσωση που περιγράφει την πρόσληψη και την αποβολή [με την παραδοχή κινητικής πρώτης τάξεως, βλ. εξίσωση A 5.9 (1) (13)]. Για τη φάση αποβολής, ο C w (ή C food για τη δοκιμή διατροφικής έκθεσης) θεωρείται μηδενικός. Η εξίσωση μπορεί να αναχθεί σε:
ή
όπου C f,0 είναι η συγκέντρωση στην αρχή της περιόδου αποβολής. Ποσοστό αποβολής 50 % επιτυγχάνεται κατά τη χρονική στιγμή (t 50):
ή
Ομοίως, ποσοστό αποβολής 95 % επιτυγχάνεται:
Εάν για την πρώτη περίοδο εφαρμόζεται ποσοστό πρόσληψης 80 % (1,6/k 2) και 95 % απώλεια κατά τη φάση αποβολής (3,0/k 2), τότε η διάρκεια της φάσης αποβολής είναι περίπου διπλάσια από τη διάρκεια της φάσης πρόσληψης. Επισημαίνεται ότι οι εκτιμήσεις βασίζονται στην παραδοχή ότι οι τάσεις πρόσληψης και αποβολής θα ακολουθούν κινητική πρώτης τάξεως. Εάν είναι προφανές ότι δεν τηρείται κινητική πρώτης τάξεως, οι εκτιμήσεις αυτές δεν είναι έγκυρες. 4. ΜΕΘΟΔΟΣ ΔΙΑΔΟΧΙΚΩΝ ΔΟΚΙΜΩΝ: ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΣΤΑΘΕΡΑΣ ΡΥΘΜΟΥ ΑΠΟΒΟΛΗΣ (ΑΠΩΛΕΙΑΣ) K 2 Τα περισσότερα δεδομένα βιοσυγκέντρωσης βασίζονται στην παραδοχή ότι περιγράφονται «εύλογα» με ένα απλό μοντέλο δύο διαμερισμάτων/δύο παραμέτρων, όπως φαίνεται από την ευθύγραμμη καμπύλη που προσεγγίζει τα σημεία των συγκεντρώσεων στα ψάρια (σε κλίμακα ln) κατά τη διάρκεια της φάσης αποβολής.
Επισημαίνεται ότι οι αποκλίσεις από την ευθεία γραμμή ενδέχεται να υποδηλώνουν πολυπλοκότερο σχήμα αποβολής από την κινητική πρώτης τάξεως. Για την επίλυση μορφών αποβολής που αποκλίνουν από την κινητική πρώτης τάξεως μπορεί να εφαρμοστεί η γραφική μέθοδος. Για τον υπολογισμό της k 2 για πολλαπλά χρονικά σημεία (δειγματοληψίας), εκτελείται γραμμική παλινδρόμηση της ln(συγκέντρωση) σε συνάρτηση με τον χρόνο. Η κλίση της γραμμής παλινδρόμησης είναι μια εκτίμηση της σταθεράς ρυθμού αποβολής k 2 (89). Από την τεταγμένη μπορεί να υπολογιστεί εύκολα η μέση συγκέντρωση στα ψάρια κατά την έναρξη της φάσης αποβολής (C 0,d, που ισοδυναμεί με τη μέση συγκέντρωση στα ψάρια στο τέλος της φάσης πρόσληψης) (συμπεριλαμβανομένων των περιθωρίων σφάλματος) (89):
Για τον υπολογισμό της k 2 όταν είναι διαθέσιμα δύο μόνον σημεία (δειγματοληψίας) (όπως στον ελαχιστοποιημένο σχεδιασμό), υποκαθίστανται οι δύο μέσες συγκεντρώσεις στην ακόλουθη εξίσωση
όπου ln(C f1) και ln(C f2) είναι οι φυσικοί λογάριθμοι των συγκεντρώσεων στους χρόνους t 1 και t 2, αντίστοιχα, και t 2 και t 1 είναι οι χρόνοι συλλογής των δύο δειγμάτων σε σχέση με την έναρξη της αποβολής (90). 5. ΜΕΘΟΔΟΣ ΔΙΑΔΟΧΙΚΩΝ ΔΟΚΙΜΩΝ: ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΣΤΑΘΕΡΑΣ ΡΥΘΜΟΥ ΠΡΟΣΛΗΨΗΣ K 1 (ΜΕΘΟΔΟΣ ΥΔΑΤΙΚΗΣ ΕΚΘΕΣΗΣ ΜΟΝΟ) Για να ληφθεί μια τιμή για την k1 εφόσον υπάρχει μία σειρά διαδοχικών χρονικών δεδομένων συγκέντρωσης για τη φάση πρόσληψης, γίνεται χρήση προγράμματος ηλεκτρονικού υπολογιστή για την προσαρμογή στο ακόλουθο μοντέλο:
Όταν η k 2 λαμβάνεται με τον προηγούμενο υπολογισμό, οι C f(t) και C w(t) είναι οι συγκεντρώσεις στα ψάρια και το νερό, αντίστοιχα, σε χρόνο t. Για τον υπολογισμό της k 1, όταν είναι διαθέσιμα δύο μόνον σημεία (δειγματοληψίας) (όπως στον ελαχιστοποιημένο σχεδιασμό), χρησιμοποιείται ο ακόλουθος τύπος:
Όταν η k 2 λαμβάνεται με τον προηγούμενο υπολογισμό, η C f είναι η συγκέντρωση στα ψάρια στην έναρξη της φάσης αποβολής και η C w είναι η μέση συγκέντρωση στο νερό κατά τη φάση πρόσληψης (91). Μπορεί να χρησιμοποιηθεί οπτική εξέταση των κλίσεων της k 1 και της k 2 όταν παρίστανται γραφικά σε συνάρτηση με τα μετρούμενα δεδομένα της δειγματοληψίας για την αξιολόγηση της καταλληλότητας της προσαρμογής. Εάν διαπιστωθεί ότι η μέθοδος διαδοχικών δοκιμών παρέσχε μη αξιόπιστη εκτίμηση της k 1, τότε θα πρέπει να εφαρμόζεται η ταυτόχρονη προσέγγιση για τον υπολογισμό της k 1 και της k 2 (βλ. επόμενο τμήμα 6). Και σε αυτή την περίπτωση, οι συναγόμενες κλίσεις θα πρέπει να συγκριθούν με τα μετρούμενα δεδομένα της γραφικής παράστασης για οπτική εξέταση της καταλληλότητας της προσαρμογής. Εάν η ορθότητα της προσαρμογής εξακολουθεί να είναι αμφίβολη, αυτό θα μπορούσε να είναι ένδειξη ότι δεν ισχύει κινητική πρώτης τάξεως και ότι θα πρέπει να χρησιμοποιηθούν άλλα πιο περίπλοκα μοντέλα. 6. ΤΑΥΤΟΧΡΟΝΗ ΜΕΘΟΔΟΣ ΓΙΑ ΤΟΝ ΥΠΟΛΟΓΙΣΜΟ ΤΩΝ ΣΤΑΘΕΡΩΝ ΡΥΘΜΟΥ ΠΡΟΣΛΗΨΗΣ ΚΑΙ ΑΠΟΒΟΛΗΣ (ΑΠΩΛΕΙΑΣ) (ΜΕΘΟΔΟΣ ΥΔΑΤΙΚΗΣ ΕΚΘΕΣΗΣ ΜΟΝΟ) Προγράμματα ηλεκτρονικών υπολογιστών μπορούν να χρησιμοποιηθούν για τον υπολογισμό των τιμών k 1 και k 2 εφόσον υπάρχει ένα σύνολο διαδοχικών δεδομένων χρονικής συγκέντρωσης και το μοντέλο:
όπου
Η προσέγγιση αυτή παρέχει απευθείας τυπικά σφάλματα για τις εκτιμήσεις της k 1 και της k 2. Όταν το k 1/k 2 υποκαθίσταται από τον BCF (βλ. εξίσωση A5.4) στην εξίσωση A5.25 και στην εξίσωση A5.26, μπορούν επίσης να υπολογιστούν το τυπικό σφάλμα και η τιμή 95 % CI του BCF. Αυτό είναι ιδιαίτερα χρήσιμο κατά τη σύγκριση διαφορετικών εκτιμήσεων, λόγω μετασχηματισμού των δεδομένων. Η εξαρτημένη μεταβλητή (συγκέντρωση στα ψάρια) μπορεί να προσαρμοστεί με ή χωρίς λογαριθμικό μετασχηματισμό και η συνακόλουθη αβεβαιότητα για τον BCF μπορεί να αξιολογηθεί. Δεδομένου ότι υπάρχει ισχυρή συσχέτιση μεταξύ των δύο παραμέτρων k 1 και k 2 εάν υπολογιστούν ταυτόχρονα, θα ήταν σκόπιμο να υπολογίζεται πρώτα η k 2 μόνο βάσει των δεδομένων αποβολής (βλ. ανωτέρω)·η k 2 στις περισσότερες περιπτώσεις μπορεί να εκτιμηθεί από την καμπύλη αποβολής με σχετικά μεγάλη ακρίβεια. Η k 1 μπορεί στη συνέχεια να υπολογιστεί από τα δεδομένα πρόσληψης με τη χρήση μη γραμμικής παλινδρόμησης (92). Συνιστάται η χρήση του ίδιου μετασχηματισμό των δεδομένων σε περίπτωση διαδοχικής προσαρμογής. Για την αξιολόγηση της ορθότητας της προσαρμογής μπορεί να χρησιμοποιηθεί η οπτική εξέταση των κλίσεων που λαμβάνονται όταν παρίστανται γραφικώς σε συνάρτηση με τα μετρούμενα σημεία δεδομένων δειγματοληψίας. Εάν διαπιστωθεί ότι αυτή η μέθοδος παρέσχε μη αξιόπιστη εκτίμηση της k1 , τότε για τον υπολογισμό της k 1 και της k 2 μπορεί να εφαρμοστεί η ταυτόχρονη προσέγγιση. Και σε αυτή την περίπτωση, το προσαρμοσμένο μοντέλο θα πρέπει να συγκρίνεται με τα μετρούμενα δεδομένα της γραφικής παράστασης για οπτική εξέταση της ορθότητας της προσαρμογής και των συνακόλουθων εκτιμήσεων των παραμέτρων για τις k 1, k 2 και τον συναγόμενο BCF, και τα τυπικά τους σφάλματα και/ή τα διαστήματα εμπιστοσύνης θα πρέπει να συγκρίνονται μεταξύ των διαφόρων τύπων προσαρμογής. Εάν η ορθότητα της προσαρμογής είναι αμφίβολη, αυτό θα μπορούσε να είναι ένδειξη ότι δεν ισχύει κινητική πρώτης τάξης και ότι θα πρέπει να χρησιμοποιηθούν άλλα πιο σύνθετα μοντέλα. Μία από τις συνηθέστερες δυσκολίες είναι η ανάπτυξη των ψαριών κατά τη διάρκεια της δοκιμής. 7. ΔΙΟΡΘΩΣΗ ΤΗΣ ΑΝΑΠΤΥΞΙΑΚΗΣ ΑΡΑΙΩΣΗΣ ΓΙΑ ΤΟΝ ΚΙΝΗΤΙΚΟ BCF ΚΑΙ ΤΟΝ BMF Η παρούσα ενότητα περιγράφει μια τυποποιημένη μέθοδο για διόρθωση λόγω της ανάπτυξης των ψαριών κατά τη διάρκεια της δοκιμής (με την ονομασία «αναπτυξιακή αραίωση»), η οποία είναι έγκυρη μόνο όταν εφαρμόζεται κινητική πρώτης τάξης. Εάν υπάρχουν ενδείξεις ότι δεν ισχύει κινητική πρώτης τάξης, συνιστάται να ζητείται η γνώμη βιοστατιστικολόγου για την ορθή διόρθωση της αραίωσης ανάπτυξης ή να χρησιμοποιείται η προσέγγιση βάσει μάζας που περιγράφεται κατωτέρω. Σε ορισμένες περιπτώσεις, η μέθοδος αυτή για τη διόρθωση της αναπτυξιακής αραίωσης χαρακτηρίζεται από έλλειψη ακρίβειας ή, ενίοτε, δεν αποδίδει (για παράδειγμα, σε ουσίες εξαιρετικά βραδείας αποβολής που υποβάλλονται σε δοκιμή σε ψάρια ταχείας ανάπτυξης, η παράγωγη σταθερά ρυθμού αποβολής διορθωμένη ως προς την αναπτυξιακή αραίωση, k 2g, μπορεί να είναι πολύ μικρή και, ως εκ τούτου, το σφάλμα στις σταθερές των δύο ρυθμών που χρησιμοποιούνται για τον υπολογισμό της καθίσταται κρίσιμο και οι εκτιμώμενες k g μπορεί, σε ορισμένες περιπτώσεις, να είναι μεγαλύτερες από την k 2). Σε αυτές τις περιπτώσεις, μπορεί να χρησιμοποιηθεί μια εναλλακτική προσέγγιση (δηλ. η προσέγγιση της μάζας), η οποία είναι επίσης αποτελεσματική όταν δεν τηρείται κινητική ανάπτυξης πρώτης τάξης, ώστε να αποφεύγεται η ανάγκη διόρθωσης. Η προσέγγιση αυτή περιγράφεται στο τέλος του παρόντος τμήματος. Μέθοδος αφαίρεσης σταθεράς ρυθμού ανάπτυξης για τη διόρθωση ως προς την ανάπτυξη Για την τυποποιημένη μέθοδο, όλα τα δεδομένα ατομικού βάρους και μήκους μετατρέπονται σε φυσικούς λογάριθμους και η ln(βάρος) ή ln(1/βάρος) αναπαριστάται γραφικά σε συνάρτηση με τον χρόνο (ημέρες), χωριστά για τις ομάδες μεταχείρισης και τις ομάδες μαρτύρων. Η ίδια διεργασία εφαρμόζεται για τα δεδομένα των φάσεων πρόσληψης και αποβολής χωριστά. Γενικά, για τη διόρθωση της αναπτυξιακής αραίωσης, είναι ορθότερο να χρησιμοποιούνται τα δεδομένα βάρους από ολόκληρη τη μελέτη για τον προσδιορισμό της σταθεράς ρυθμού ανάπτυξης (k g), αλλά στατιστικά σημαντικές διαφορές μεταξύ των σταθερών ρυθμού ανάπτυξης που συνάγονται για τη φάση πρόσληψης και τη φάση αποβολής μπορεί να αποτελούν ένδειξη ότι θα πρέπει να χρησιμοποιηθεί η σταθερά ρυθμού αποβολής. Μπορούν να χρησιμοποιηθούν ολικοί ρυθμοί ανάπτυξης από μελέτες υδατικής έκθεσης για ομάδες δοκιμής και μαρτύρων για τον έλεγχο των επιδράσεων που σχετίζονται με τη μεταχείριση. Υπολογίζεται μια γραμμική συσχέτιση ελαχίστων τετραγώνων για τα δεδομένα ln(βάρος ψαριών) σε συνάρτηση με την ημέρα [και για ln(1/βάρος) σε συνάρτηση με την ημέρα] για κάθε ομάδα (ομάδες δοκιμής και ομάδες μαρτύρων, ατομικά δεδομένα, όχι ημερήσιες μέσες τιμές), για το σύνολο της μελέτης και τις φάσεις πρόσληψης και αποβολής, με τη χρήση τυποποιημένων στατιστικών διαδικασιών. Υπολογίζονται οι διακυμάνσεις των κλίσεων των καμπυλών και χρησιμοποιούνται για την αξιολόγηση της στατιστικής σημαντικότητας (p = 0,05) της διαφοράς των κλίσεων (σταθερές ρυθμού ανάπτυξης) με τη χρήση του ελέγχου t του Student (ή ANOVA, εάν υποβάλλονται σε δοκιμή περισσότερες από μία συγκεντρώσεις). Τα δεδομένα για το βάρος, κατά κανόνα, προτιμώνται για τη διόρθωση ως προς την ανάπτυξη. Τα δεδομένα για το μήκος, με τους ίδιους χειρισμούς, μπορεί να είναι χρήσιμα για τη σύγκριση μεταξύ των ομάδων μαρτύρων και δοκιμής ως προς τις επιδράσεις που σχετίζονται με τη μεταχείριση. Εάν δεν υπάρχει στατιστικά σημαντική διαφορά στην ανάλυση των δεδομένων για το βάρος, τα δεδομένα για τις ομάδες δοκιμής και μαρτύρων μπορούν να ομαδοποιηθούν και να υπολογιστεί μια συνολική σταθερά ρυθμού ανάπτυξης των ψαριών (k g) ως η συνολική κλίση της γραμμικής συσχέτισης. Εάν παρατηρηθούν στατιστικά σημαντικές διαφορές, οι σταθερές ρυθμού ανάπτυξης για κάθε ομάδα ψαριών, και/ή φάση μελέτης, αναφέρονται χωριστά. Η σταθερά ρυθμού από κάθε ομάδα που υποβάλλεται σε μεταχείριση θα πρέπει στη συνέχεια να χρησιμοποιείται για τη διόρθωση της αναπτυξιακής αραίωσης της εν λόγω ομάδας. Εάν παρατηρηθούν στατιστικές διαφορές μεταξύ των σταθερών ρυθμού πρόσληψης και αποβολής, θα πρέπει να χρησιμοποιούνται οι παράγωγες σταθερές ρυθμού της φάσης αποβολής. Η υπολογισθείσα σταθερά ρυθμού ανάπτυξης (k g εκφρασμένη σε ημέρες– 1) μπορεί να αφαιρεθεί από τη συνολική σταθερά ρυθμού αποβολής (k 2) για να ληφθεί η σταθερά ρυθμού αποβολής k 2g.
Η σταθερά ρυθμού πρόσληψης διαιρείται δια της διορθωμένης ως προς την ανάπτυξη σταθεράς ρυθμού αποβολής για να ληφθεί ο διορθωμένος ως προς την ανάπτυξη κινητικός BCF, που συμβολίζεται BCFKg (ή BMFKg).
Η σταθερά ρυθμού ανάπτυξης που λαμβάνεται για μια διατροφική μελέτη χρησιμοποιείται στην εξίσωση A7.5 για τον υπολογισμό του διορθωμένου ως προς την ανάπτυξη BMFKg (βλ. προσάρτημα 7). Μέθοδος που βασίζεται στη μάζα για τη διόρθωση ως προς την ανάπτυξη Μπορεί να χρησιμοποιηθεί η ακόλουθη εναλλακτική επιλογή αντί της ανωτέρω «μεθόδου αφαίρεσης της σταθεράς ρυθμού ανάπτυξης» που αποφεύγει την ανάγκη διόρθωσης ως προς την ανάπτυξη. Βασίζεται στην αρχή της χρησιμοποίησης δεδομένων αποβολής βάσει της μάζας ανά ολόκληρο ψάρι και όχι βάσει συγκέντρωσης. Οι συγκεντρώσεις στους ιστούς στη φάση αποβολής (μάζα της υπό δοκιμή ουσίας/μοναδιαία μάζα ψαριού) μετατρέπονται σε μάζα της υπό δοκιμή ουσίας/ψάρι: γίνεται αντιστοίχιση των συγκεντρώσεων και του βάρους του κάθε ψαριού σε μορφή πίνακα (π.χ. με τη χρήση ηλεκτρονικού λογιστικού φύλλου) και πολλαπλασιάζεται κάθε συγκέντρωση επί το συνολικό βάρος των ψαριών για την εν λόγω μέτρηση με σκοπό να ληφθεί ένα σύνολο τιμών μάζας της υπό δοκιμή ουσίας ανά ψάρι για όλα τα δείγματα της φάσης αποβολής. Απεικονίζεται σε γραφική παράσταση ο φυσικός λογάριθμος των δεδομένων της μάζας της ουσίας σε συνάρτηση με τον χρόνο για το πείραμα (φάση αποβολής), όπως θα γινόταν κανονικά. Για τη μέθοδο της υδατικής έκθεσης, συνάγεται συνήθως η σταθερά ρυθμού πρόσληψης (βλ. ενότητες 4 και 6 — σημειωτέον ότι η «κανονική» τιμή k 2 θα πρέπει να χρησιμοποιείται στις εξισώσεις προσαρμογής της καμπύλης για την k 1), και συνάγεται η σταθερά ρυθμού αποβολής από τα ανωτέρω στοιχεία. Επειδή η τιμή που προκύπτει για τη σταθερά ρυθμού αποβολής είναι ανεξάρτητη από την ανάπτυξη όπως έχει υπολογιστεί βάσει της μάζας ανά ολόκληρο ψάρι, θα πρέπει να συμβολίζεται k 2g και όχι k 2. 8. ΚΑΝΟΝΙΚΟΠΟΙΗΣΗ ΤΩΝ ΛΙΠΙΔΙΩΝ ΣΕ ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ 5 % ΣΕ ΛΙΠΙΔΙΑ (ΜΕΘΟΔΟΣ ΥΔΑΤΙΚΗΣ ΕΚΘΕΣΗΣ ΜΟΝΟ) Τα αποτελέσματα για τον BCF (κινητικό και σε σταθερή κατάσταση) από τις δοκιμές υδατικής έκθεσης θα πρέπει επίσης να αναφέρονται σε σχέση με την προκαθορισμένη περιεκτικότητα 5 % σε λιπίδια επί νωπού βάρους, εκτός εάν μπορεί να υποστηριχθεί ότι η υπό δοκιμή ουσία δεν συσσωρεύεται κατά κύριο λόγο στα λιπίδια (π.χ. ορισμένες υπερφθοριωμένες ουσίες μπορεί να δεσμεύονται από πρωτεΐνες). Τα δεδομένα για τη συγκέντρωση στα ψάρια, ή ο BCF, πρέπει να μετατρέπονται σε περιεκτικότητα 5 % σε λιπίδια επί νωπού βάρους. Εάν τα ίδια ψάρια χρησιμοποιήθηκαν για τη μέτρηση των συγκεντρώσεων της ουσίας και της περιεκτικότητας σε λιπίδια σε όλα τα χρονικά σημεία δειγματοληψίας, απαιτείται διόρθωση της μετρούμενης συγκέντρωσης σε κάθε ψάρι ως προς την περιεκτικότητά του σε λιπίδια.
όπου
Εάν δεν πραγματοποιήθηκε ανάλυση των λιπιδίων σε όλα τα ψάρια του δείγματος, χρησιμοποιείται μια μέση τιμή λιπιδίων για την κανονικοποίηση του BCF. Για τον BCF σε σταθερή κατάσταση, θα πρέπει να χρησιμοποιείται η μέση τιμή που καταγράφηκε στο τέλος της φάσης πρόσληψης στην ομάδα μεταχείρισης. Για την κανονικοποίηση του κινητικού BCF, ενδέχεται να υπάρχουν περιπτώσεις στις οποίες δικαιολογείται διαφορετική προσέγγιση, π.χ. σε περίπτωση σημαντικής μεταβολής της περιεκτικότητας σε λιπίδια κατά τη διάρκεια της φάσης πρόσληψης ή αποβολής. Ούτως ή άλλως, θα πρέπει να χρησιμοποιείται συστηματικά ένας ρυθμός σίτισης που ελαχιστοποιεί τις σημαντικές μεταβολές του λιπιδικού περιεχομένου.
όπου
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 6 ΕΝΟΤΗΤΑ ΕΞΙΣΩΣΕΩΝ ΓΙΑ ΤΗ ΔΟΚΙΜΗ ΥΔΑΤΙΚΗΣ ΕΚΘΕΣΗΣ: ΕΛΑΧΙΣΤΟΠΟΙΗΜΕΝΟΣ ΣΧΕΔΙΑΣΜΟΣ ΔΟΚΙΜΗΣ Η λογική αυτής της προσέγγισης έγκειται στο ότι ο συντελεστής βιοσυγκέντρωσης σε μια πλήρη δοκιμή μπορεί να προσδιοριστεί είτε ως συντελεστής βιοσυγκέντρωσης σε σταθερή κατάσταση (BCFSS), με υπολογισμό του λόγου της συγκέντρωσης της υπό δοκιμή ουσίας στον ιστό των ψαριών προς τη συγκέντρωσή της στο νερό, είτε μέσω του υπολογισμού του κινητικού συντελεστή βιοσυγκέντρωσης (BCFK), ως ο λόγος της σταθεράς ρυθμού πρόσληψης k 1 προς τη σταθερά ρυθμού αποβολής k 2. Ο BCFK είναι έγκυρος ακόμη και αν δεν επιτυγχάνεται σε σταθερή κατάσταση συγκέντρωση μιας ουσίας κατά την πρόσληψη, υπό την προϋπόθεση ότι οι φάσεις πρόσληψης και αποβολής ακολουθούν κατά προσέγγιση κινητικές διαδικασίες πρώτης τάξεως. Εάν γίνει μέτρηση της συγκέντρωσης της ουσίας σε ιστούς (C f1) κατά τον χρόνο λήξης της έκθεσης (t 1) και η συγκέντρωση στους ιστούς (C f2) μετρηθεί εκ νέου μετά από την παρέλευση ενός χρονικού διαστήματος (t 2), η σταθερά ρυθμού αποβολής (k 2) μπορεί να υπολογιστεί με τη χρήση της εξίσωσης A5.22 από το προσάρτημα 5. Η σταθερά ρυθμού πρόσληψης, k 1, μπορεί στη συνέχεια να καθοριστεί αλγεβρικά με την εφαρμογή της εξίσωσης A5.23 από το προσάρτημα 5 (όπου ο C f ισούται με τον C f1 και ο t ισούται με τον t 1) (1). Ο κινητικός συντελεστής βιοσυγκέντρωσης για τον ελαχιστοποιημένο σχεδιασμό (που συμβολίζεται BCFKm για να διακρίνεται από τους κινητικούς συντελεστές βιοσυγκέντρωσης που προσδιορίζονται με τη χρήση άλλων μεθόδων) έχει ως εξής:
Οι συγκεντρώσεις ή τα αποτελέσματα θα πρέπει να διορθώνονται ως προς την αναπτυξιακή αραίωση και να κανονικοποιούνται σε μια λιπιδική περιεκτικότητα ίση με 5 % στα ψάρια, όπως περιγράφεται στο προσάρτημα 5. Ο ελαχιστοποιημένος BCFSS είναι ο BCF που υπολογίζεται στο τέλος της φάσης πρόσληψης, με την παραδοχή ότι έχει επιτευχθεί σταθερή κατάσταση. Αυτό μπορεί να ληφθεί μόνο ως υπόθεση, διότι ο αριθμός των σημείων δειγματοληψίας δεν αρκεί για να αποδειχθεί αυτό.
όπου: C f-minSS = συγκέντρωση στα ψάρια με την παραδοχή σταθερής κατάστασης στο τέλος της πρόσληψης (mg kg– 1 νωπού βάρους). C w-minSS = συγκέντρωση στο νερό με την παραδοχή σταθερής κατάστασης στο τέλος της πρόσληψης (mg l– 1). ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 7 ΕΝΟΤΗΤΑ ΕΞΙΣΩΣΕΩΝ ΓΙΑ ΤΗ ΔΟΚΙΜΗ ΔΙΑΤΡΟΦΙΚΗΣ ΕΚΘΕΣΗΣ
1. ΠΑΡΑΔΕΙΓΜΑ ΠΟΣΟΤΗΤΩΝ ΤΩΝ ΣΥΣΤΑΤΙΚΩΝ ΚΑΤΑΛΛΗΛΗΣ ΙΧΘΥΟΤΡΟΦΗΣ ΤΟΥ ΕΜΠΟΡΙΟΥ
2. ΠΑΡΑΔΕΙΓΜΑΤΑ ΤΕΧΝΙΚΗΣ ΕΜΒΟΛΙΑΣΜΟΥ ΤΡΟΦΙΜΩΝ Γενικές παρατηρήσεις Το σιτηρέσιο των μαρτύρων θα πρέπει να παρασκευάζεται με τον ίδιο ακριβώς τρόπο όπως η εμβολιασμένη τροφή, αλλά χωρίς την υπό δοκιμή ουσία. Για να ελέγχεται η συγκέντρωση του κατεργασμένου σιτηρεσίου, θα πρέπει να εκχυλίζονται τριπλά δείγματα χορηγούμενης τροφής με κατάλληλη μέθοδο εκχύλισης και να μετράται η συγκέντρωση ή η ραδιενέργεια της υπό δοκιμή ουσίας στα εκχυλίσματα. Θα πρέπει να καταδεικνύονται υψηλά ποσοστά αναλυτικής ανάκτησης (> 85 %) με χαμηλή μεταβλητότητα μεταξύ των δειγμάτων (τρεις συγκεντρώσεις της ουσίας σε δείγματα που λαμβάνονται κατά την έναρξη της δοκιμής δεν θα πρέπει να διαφέρουν κατά περισσότερο από ± 15 % από τη μέση τιμή). Κατά τη διάρκεια της διατροφικής δοκιμής, θα πρέπει να συλλέγονται τρία δείγματα σιτηρεσίου για ανάλυση κατά την ημέρα 0 και στο τέλος της φάσης πρόσληψης για τον προσδιορισμό της υπό δοκιμή ουσίας στο σιτηρέσιο. Παρασκευάσματα ιχθυοτροφής με υγρό υλικό δοκιμής (αμιγές) Ορίζεται στοχευόμενη, ονομαστική συγκέντρωση δοκιμής στην κατεργασμένη ιχθυοτροφή, για παράδειγμα 500 μg/g της υπό δοκιμή ουσίας/g τροφής. Η κατάλληλη ποσότητα (βάσει γραμμομοριακής μάζας ή ειδικής ραδιενέργειας) αμιγούς υπό δοκιμή ουσίας προστίθεται σε γνωστή μάζα ιχθυοτροφής σε γυάλινο δοχείο ή στη φιάλη περιστροφικού εξατμιστήρα. Η μάζα της ιχθυοτροφής θα πρέπει να είναι επαρκής για τη διάρκεια της φάσης πρόσληψης (λαμβανομένης υπόψη της ανάγκης αύξησης των ποσοτήτων σε κάθε ιχθυοτροφή λόγω ανάπτυξης των ψαριών). Το σύνολο ιχθυοτροφής/υπό δοκιμή ουσίας θα πρέπει να αναμειγνύεται κατά τη διάρκεια της νύχτας με αργή ανατροπή (π.χ. με τη βοήθεια αναμικτήρα roto-rack ή με περιστροφή εάν χρησιμοποιείται φιάλη περιστροφικού εξατμιστήρα). Η εμβολιασμένη τροφή πρέπει να αποθηκεύεται υπό συνθήκες που διατηρούν τη σταθερότητα της υπό δοκιμή ουσίας στο μείγμα ζωοτροφής (π.χ. ψύξη). Παρασκευάσματα ιχθυοτροφής με αραβοσιτέλαιο ή ιχθυέλαιο ως φορέα Οι στερεές υπό δοκιμή ουσίες θα πρέπει να λειοτριβούνται σε ιγδίο σε λεπτή σκόνη. Οι υγρές ουσίες μπορούν να προστίθενται απευθείας στο αραβοσιτέλαιο ή το ιχθυέλαιο. Η υπό δοκιμή ουσία διαλύεται σε δεδομένη ποσότητα αραβοσιτελαίου ή ιχθυελαίου (π.χ. 5-15 ml). Το χορηγούμενο έλαιο μεταφέρεται ποσοτικώς σε περιστροφικό εξατμιστήρα κατάλληλου μεγέθους. Η φιάλη που χρησιμοποιείται για την παρασκευή του χορηγούμενου ελαίου θα πρέπει να ξεπλένεται με δύο μικρές ποσότητες ελαίου και αυτές να προστίθενται στη συσκευή για να εξασφαλιστεί η μεταφορά του συνόλου της διαλυμένης υπό δοκιμή ουσίας. Για να εξασφαλιστεί πλήρης διάλυση/διασπορά στο έλαιο (ή εάν χρησιμοποιούνται στη μελέτη περισσότερες από μία υπό δοκιμή ουσίες), προστίθεται ένας μικροαναδευτήρας, η φιάλη πωματίζεται και το μείγμα αναδεύεται σε υψηλή ταχύτητα κατά τη διάρκεια της νύχτας. Κατάλληλη για τη δοκιμή ποσότητα ιχθυοτροφής (συνήθως σε μορφή εξωθημένων κόκκων) προστίθεται στο εσωτερικό της βολβοειδούς φιάλης, και το περιεχόμενο της φιάλης αναμειγνύεται ομοιογενώς με διαρκή περιστροφή της γυάλινης φιάλης για τουλάχιστον 30 λεπτά, αλλά κατά προτίμηση κατά τη διάρκεια της νύχτας. Ύστερα, η εμβολιασμένη τροφή αποθηκεύεται κατάλληλα (π.χ. σε ψύξη) για να εξασφαλιστεί η σταθερότητα της ελεγχόμενης ουσίας στην τροφή μέχρι να καταναλωθεί. Παρασκευάσματα ιχθυοτροφής με οργανικό διαλύτη Κατάλληλη ποσότητα της υπό δοκιμή ουσίας (βάσει γραμμομοριακής μάζας ή ειδικής ραδιενέργειας), επαρκής για την επίτευξη της επιθυμητής δόσης, διαλύεται σε κατάλληλο οργανικό διαλύτη (π.χ. κυκλοεξάνιο ή ακετόνη, 10-40 ml ή μεγαλύτερο όγκο, εάν είναι αναγκαίο, ανάλογα με την ποσότητα της τροφής προς εμβολιασμό). Είτε ένα κλάσμα είτε ολόκληρη η ποσότητα (προστιθέμενη τμηματικά) αυτού του διαλύματος αναμειγνύεται με την κατάλληλη μάζα ιχθυοτροφής, επαρκή για να επιτευχθεί το απαιτούμενο επίπεδο ονομαστικής δόσης της δοκιμής. Το σύνολο τροφής/υπό δοκιμή ουσίας μπορεί να αναμιχθεί σε λεκάνη από ανοξείδωτο χάλυβα και η ιχθυοτροφή με την πρόσφατα προστεθείσα δόση να αφεθεί σε ηρεμία, μέσα στη λεκάνη, σε απαγωγό του εργαστηρίου για δύο ημέρες (αναδευόμενη κατά διαστήματα), ώστε να εξατμιστεί η περίσσεια διαλύτη, ή μπορεί να αναμιχθεί σε φιάλη περιστροφικού εξατμιστήρα με συνεχή περιστροφή. Η περίσσεια του διαλύτη μπορεί να «εκδιωχθεί» με ρεύμα αέρα ή αζώτου, εάν αυτό είναι αναγκαίο. Θα πρέπει να λαμβάνεται μέριμνα ώστε να εξασφαλίζεται ότι η υπό δοκιμή ουσία δεν κρυσταλλώνεται κατά την απομάκρυνση του διαλύτη. Η εμβολιασμένη τροφή πρέπει να αποθηκεύεται υπό συνθήκες (π.χ. σε ψύξη) που διατηρούν τη σταθερότητα της υπό δοκιμή ουσίας στο μείγμα ζωοτροφής μέχρι να καταναλωθεί. 3. ΥΠΟΛΟΓΙΣΜΟΣ ΤΗΣ ΑΠΟΔΟΣΗΣ ΤΗΣ ΑΦΟΜΟΙΩΣΗΣ ΚΑΙ ΤΟΥ ΣΥΝΤΕΛΕΣΤΗ ΒΙΟΜΕΓΕΘΥΝΣΗΣ Για τον υπολογισμό της απόδοσης της αφομοίωσης, η συνολική σταθερά ρυθμού αποβολής θα πρέπει πρώτα να υπολογίζεται σύμφωνα με το τμήμα 4 του προσαρτήματος 5 (με τη χρήση της «μεθόδου διαδοχικών δοκιμών», δηλ. τυπικής γραμμικής παλινδρόμησης) χρησιμοποιώντας τις μέσες συγκεντρώσεις δείγματος από τη φάση αποβολής. Η σταθερά ρυθμού σίτισης, I, και η διάρκεια πρόσληψης, t, είναι γνωστές παράμετροι της μελέτης. Η C food, η μέση μετρούμενη συγκέντρωση της υπό δοκιμή ουσίας στην τροφή, είναι μετρούμενη μεταβλητή στη μελέτη. Η C 0,d, η συγκέντρωση της υπό δοκιμή ουσίας στα ψάρια στο τέλος της φάσης πρόσληψης, συνάγεται συνήθως από την τεταγμένη της γραφικής παράστασης του ln(συγκέντρωση) σε συνάρτηση με την ημέρα αποβολής. Η απόδοση της αφομοίωσης της ουσίας (a, απορρόφηση της υπό δοκιμή ουσίας στο πεπτικό σύστημα) υπολογίζεται ως:
όπου: C 0,d = παράγωγη συγκέντρωση στα ψάρια στον χρόνο 0 της φάσης αποβολής (mg kg-1)· k 2 = συνολική (χωρίς διόρθωση ως προς την ανάπτυξη) σταθερά ρυθμού αποβολής (ημέρα-1), υπολογιζόμενη σύμφωνα με τις εξισώσεις στο προσάρτημα 5, τμήμα 3· I = σταθερά ρυθμού λήψης τροφής (g τροφής g-1 ψαριών ημέρα-1)· C food = συγκέντρωση στην τροφή (mg kg-1 τροφής)· t= διάρκεια της περιόδου σίτισης (ημέρες) Ο ρυθμός σίτισης, ωστόσο, I, που χρησιμοποιείται στον υπολογισμό ενδέχεται να χρειαστεί να προσαρμοστεί για να ληφθεί υπόψη η ανάπτυξη των ψαριών, ώστε να υπολογιστεί ορθά η απόδοση της αφομοίωσης, a. Σε μια δοκιμή κατά την οποία τα ψάρια αναπτύσσονται σημαντικά κατά τη διάρκεια της φάσης πρόσληψης (στην οποία δεν γίνεται καμία διόρθωση των ποσοτήτων ζωοτροφών για τη διατήρηση του καθορισμένου ρυθμού σίτισης), ο πραγματικός ρυθμός σίτισης κατά την εξέλιξη της φάσης πρόσληψης θα είναι χαμηλότερος από αυτόν που έχει καθοριστεί, με αποτέλεσμα η «πραγματική» απόδοση της αφομοίωσης να είναι υψηλότερη. Επισημαίνεται ότι αυτό δεν είναι σημαντικό για τον συνολικό υπολογισμό του BMF, αφού οι όροι της I αλληλοεξουδετερώνονται μεταξύ της εξίσωσης A7.1 και της εξίσωσης A7.4. Ο μέσος ρυθμός σίτισης διορθωμένος ως προς την αναπτυξιακή αραίωση, I g, μπορεί να ληφθεί με διάφορους τρόπους, αλλά ένας πρακτικός και αξιόπιστος τρόπος είναι να χρησιμοποιηθεί η γνωστή σταθερά ρυθμού ανάπτυξης (k g) για την εκτίμηση του βάρους των υπό δοκιμή ψαριών σε χρονικά σημεία κατά τη φάση πρόσληψης, δηλ.:
όπου W f(t)= το μέσο βάρος ψαριών την ημέρα πρόσληψης t W f,0 = το μέσο βάρος ψαριών στην έναρξη του πειράματος Με αυτό τον τρόπο, μπορεί να εκτιμηθεί (τουλάχιστον) το μέσο βάρος των ψαριών την τελευταία ημέρα έκθεσης (W f,end-of-uptake). Δεδομένου ότι ο ρυθμός σίτισης καθορίστηκε με βάση την τιμή W f,0, ο πραγματικός ρυθμός σίτισης για κάθε ημέρα πρόσληψης μπορεί να υπολογιστεί με τη χρήση αυτών των δύο τιμών βάρους. Ακολούθως, μπορεί να υπολογιστεί ο διορθωμένος ως προς την ανάπτυξη ρυθμός σίτισης, I g (g τροφής g– 1 ψαριών ημέρα-1), για να χρησιμοποιηθεί αντί της I σε περιπτώσεις ταχείας ανάπτυξης κατά τη διάρκεια της φάσης πρόσληψης, ως
Όταν έχει συναχθεί η απόδοση της αφομοίωσης, ο BMF μπορεί να υπολογιστεί πολλαπλασιαζόμενος επί τη σταθερά ρυθμού σίτισης I (ή I g, εάν χρησιμοποιείται για τον υπολογισμό του α) και διαιρώντας το αποτέλεσμα διά της συνολικής σταθεράς ρυθμού αποβολής k 2:
Ο διορθωμένος κατά την ανάπτυξη συντελεστής βιομεγέθυνσης θα πρέπει επίσης να υπολογίζεται κατά τον ίδιο τρόπο, χρησιμοποιώντας τη διορθωμένη ως προς την ανάπτυξη σταθερά ρυθμού αποβολής (όπως συνάγεται σύμφωνα με το τμήμα 7 στο προσάρτημα 5). Και σε αυτή την περίπτωση, εάν η I g έχει χρησιμοποιηθεί για τον υπολογισμό της α, θα πρέπει επίσης να χρησιμοποιηθεί εδώ αντί της I:
όπου: α = απόδοση της αφομοίωσης (απορρόφηση της υπό δοκιμή ουσίας στο πεπτικό σύστημα)· k 2 = συνολική (χωρίς διόρθωση ως προς την ανάπτυξη) σταθερά ρυθμού αποβολής (ημέρα– 1), υπολογιζόμενη σύμφωνα με τις εξισώσεις στο προσάρτημα 5, τμήμα 3· k 2g = διορθωμένη ως προς την ανάπτυξη σταθερά ρυθμού αποβολής (ημέρα– 1)· I = σταθερά ρυθμού λήψης τροφής (g τροφής g– 1 ψαριών ημέρα– 1)· Ο διορθωμένος ως προς την ανάπτυξη χρόνος υποδιπλασιασμού ((t 1/2) υπολογίζεται ως εξής.
Η απόδοση της αφομοίωσης της ουσίας από την τροφή μπορεί επίσης να εκτιμηθεί εάν προσδιοριστούν τα υπολείμματα στους ιστούς κατά το γραμμικό στάδιο της φάσης πρόσληψης (μεταξύ των ημερών 1 και 3). Στην περίπτωση αυτή, η απόδοση της αφομοίωσης της ουσίας (α) μπορεί να προσδιοριστεί ως εξής
όπου: C fish (t) = η συγκέντρωση της υπό δοκιμή ουσίας στα ψάρια στον χρόνο t (mg kg– 1 νωπού βάρους). 4. ΔΙΟΡΘΩΣΗ ΩΣ ΠΡΟΣ ΤΑ ΛΙΠΙΔΙΑ Εάν το λιπιδικό περιεχόμενο μετρηθεί στα ίδια ψάρια στα οποία γίνεται χημική ανάλυση, για όλα τα διαστήματα δειγματοληψίας, οι ατομικές συγκεντρώσεις θα πρέπει να διορθώνονται με βάση την περιεκτικότητα σε λιπίδια και να χαράσσεται η καμπύλη του ln(συγκέντρωση διορθωμένη ως προς τα λιπίδια) σε συνάρτηση με την αποβολή (ημέρα) για να συναχθούν οι C 0,d και k 2. Τότε μπορεί να υπολογιστεί η απόδοση της αφομοίωσης (εξίσωση Α7.1) βάσει των λιπιδίων, με τη χρήση της C food βάσει των λιπιδίων (δηλ. η C food πολλαπλασιάζεται επί το μέσο λιπιδικό κλάσμα της τροφής). Ο συνακόλουθος υπολογισμός με τη χρήση των εξισώσεων A7.4 και A 7.5 θα δώσει απευθείας τον διορθωμένο ως προς τα λιπίδια (και διορθωμένο ως προς την αναπτυξιακή αραίωση) BMF. Διαφορετικά, το μέσο λιπιδικό κλάσμα (κ.β.) στα ψάρια και στην τροφή συνάγονται και για τις ομάδες μεταχείρισης και τις ομάδες μαρτύρων (για την τροφή και τα ψάρια της ομάδας μαρτύρων συνάγονται, συνήθως, από τα στοιχεία που μετρώνται στην έναρξη και τη λήξη της έκθεσης· για τα ψάρια της ομάδας μεταχείρισης, συνάγονται συνήθως από τα δεδομένα που μετρώνται μόνο στο τέλος της έκθεσης). Σε ορισμένες μελέτες, η περιεκτικότητα σε λιπίδια των ψαριών μπορεί να αυξηθεί αισθητά· στις περιπτώσεις αυτές, είναι ορθότερο να χρησιμοποιείται μια μέση συγκέντρωση λιπιδίων στα ψάρια, που υπολογίζεται από τις τιμές που μετρήθηκαν στο τέλος της έκθεσης και στο τέλος της αποβολής. Σε γενικές γραμμές, μόνο τα δεδομένα από την ομάδα μεταχείρισης θα πρέπει να χρησιμοποιούνται για τον υπολογισμό και των δύο λιπιδικών κλασμάτων. Ο συντελεστής διόρθωσης ως προς τα λιπίδια (Lc ) υπολογίζεται ως εξής:
όπου οι L fish και L food είναι ο μέσος όρος των λιπιδικών κλασμάτων στα ψάρια και την τροφή, αντίστοιχα. Ο συντελεστής λιπιδικής διόρθωσης χρησιμοποιείται για τον υπολογισμό του συντελεστή βιομεγέθυνσης διορθωμένου ως προς τα λιπίδια (BMFL):
5. ΑΞΙΟΛΟΓΗΣΗ ΤΩΝ ΔΙΑΦΟΡΩΝ ΜΕΤΑΞΥ ΤΗΣ ΜΕΤΡΟΥΜΕΝΗΣ ΣΥΓΚΕΝΤΡΩΣΗΣ ΣΕ ΧΡΟΝΟ ΜΗΔΕΝ (C 0,M) ΚΑΙ ΤΗΣ ΠΑΡΑΓΩΓΗΣ ΣΥΓΚΕΝΤΡΩΣΗΣ ΣΕ ΧΡΟΝΟ ΜΗΔΕΝ (C 0,D) Η μετρούμενη συγκέντρωση σε χρόνο 0 (C 0,m) και η παράγωγη συγκέντρωση σε χρόνο 0 (C 0,d) θα πρέπει να συγκρίνονται. Εάν είναι πολύ παρόμοιες, αυτό συνηγορεί υπέρ του μοντέλου πρώτης τάξης που χρησιμοποιήθηκε για τον υπολογισμό των παραμέτρων της αποβολής. Σε ορισμένες μελέτες ενδέχεται να υπάρχει σημαντική διαφορά μεταξύ της παράγωγης τιμής σε χρόνο 0, C 0,d, και της μέσης μετρηθείσας συγκέντρωσης σε χρόνο 0. C 0,m (βλ. τελευταίο σημείο της παραγράφου 159 της παρούσας μεθόδου δοκιμών). Εάν η C 0,d είναι υπερβολικά χαμηλότερη από τη C 0,m (C 0,d << C 0,m), η διαφορά μπορεί να υποδηλώνει την παρουσία άπεπτης εμβολιασμένης τροφής στο πεπτικό σύστημα. Αυτό μπορεί να ελεγχθεί πειραματικά με τη διενέργεια χωριστής ανάλυσης στον εκτμηθέντα γαστρεντερικό σωλήνα, εάν ελήφθησαν και φυλάχθηκαν πρόσθετα δείγματα (ολόκληρα ψάρια) στο τέλος της φάσης πρόσληψης. Διαφορετικά, εάν η εφαρμογή στατιστικά έγκυρου ελέγχου έκτοπων τιμών στη γραμμική παλινδρόμηση της φάσης αποβολής δείχνει ότι το πρώτο δειγματικό σημείο της αποβολής είναι εσφαλμένα υψηλό, μπορεί να ενδείκνυται η συναγωγή της k 2 από τη γραμμική παλινδρόμηση, εξαιρουμένου όμως του πρώτου σημείου συγκέντρωσης αποβολής. Σε τέτοιες περιπτώσεις, εάν η αβεβαιότητα της γραμμικής παλινδρόμησης μειώνεται σημαντικά και είναι σαφές ότι η αποβολή ακολουθεί κατά προσέγγιση κινητική πρώτης τάξης, μπορεί να είναι σκόπιμο να χρησιμοποιηθούν οι προκύπτουσες τιμές C 0,d και k 2 για τον υπολογισμό της απόδοσης αφομοίωσης. Αυτό θα πρέπει να αιτιολογείται διεξοδικά στην έκθεση. Είναι επίσης δυνατόν να μην ακολουθείται κινητική πρώτης τάξης κατά τη φάση αποβολής. Εάν υπάρχει τέτοια πιθανότητα (δηλ. το διάγραμμα των λογαριθμικά μετασχηματισμένων δεδομένων φαίνεται να είναι κυρτό σε σύγκριση με το ευθύγραμμο διάγραμμα της γραμμικής παλινδρόμησης), οι υπολογισμοί των τιμών κατά πάσα πιθανότητα δεν είναι έγκυροι και θα πρέπει να ζητείται η γνώμη βιοστατιστικολόγου. Εάν η C 0,d είναι πολύ μεγαλύτερη από τη μετρηθείσα τιμή (C 0,d >> C 0,m), αυτό μπορεί να δείχνει ότι η ουσία αποβλήθηκε με ταχύτατο ρυθμό (δηλ. τα χρονικά σημεία δειγματοληψίας προσέγγισαν το όριο ποσοτικοποίησης της αναλυτικής μεθόδου πολύ νωρίς κατά τη φάση αποβολής, βλ. τμήμα 6 κατωτέρω)· η αποβολή αποκλίνει από την κινητική πρώτης τάξης· η γραμμική παλινδρόμηση για τον υπολογισμό της k 2 και της C 0,d είναι εσφαλμένη· ή υπήρξε πρόβλημα με τις μετρήσεις των συγκεντρώσεων στη μελέτη σε ορισμένα χρονικά σημεία δειγματοληψίας. Στις περιπτώσεις αυτές, το διάγραμμα της γραμμικής παλινδρόμησης θα πρέπει να ελέγχεται σχολαστικά για τον εντοπισμό δειγμάτων που φθάνουν ή προσεγγίζουν το όριο ποσοτικοποίησης, έκτοπων τιμών και εμφανούς κυρτότητας (ενδεικτική κινητικής που δεν είναι πρώτης τάξης) και αυτό να επισημαίνεται στην έκθεση. Κάθε μεταγενέστερη επαναξιολόγηση της γραμμικής παλινδρόμησης για τη βελτίωση των εκτιμώμενων τιμών θα πρέπει να περιγράφεται και να αιτιολογείται. Εάν παρατηρείται σημαντική απόκλιση από την κινητική πρώτης τάξης, οι υπολογισμοί των τιμών k 2 και C 0,d κατά πάσα πιθανότητα δεν είναι έγκυροι και θα πρέπει να ζητείται η γνώμη βιοστατιστικολόγου. 6. ΚΑΘΟΔΗΓΗΣΗ ΓΙΑ ΤΙΣ ΥΠΟ ΔΟΚΙΜΗ ΟΥΣΙΕΣ ΜΕ ΤΑΧΥΤΑΤΟ ΡΥΘΜΟ ΑΠΟΒΟΛΗΣ Όπως εξηγείται στην παράγραφο 129 της μεθόδου δοκιμών, ορισμένες ουσίες ενδέχεται να αποβάλλονται με τόσο ταχύ ρυθμό, ώστε να μην μπορούν να υπολογιστούν αξιόπιστες τιμές συγκέντρωσης σε χρόνο 0, C 0,d, και σταθεράς k 2, επειδή η ουσία δεν μετράται πλέον αποτελεσματικά (αναφέρονται συγκεντρώσεις στο όριο ποσοτικοποίησης) στα δείγματα που λαμβάνονται πολύ νωρίς κατά τη φάση αποβολής (δηλ. από το δεύτερο δείγμα αποβολής και τα επόμενα). Η περίπτωση αυτή παρατηρήθηκε στη διεργαστηριακή δοκιμή τεχνικής ικανότητας, που διεξήχθη με βενζο[a]πυρένιο για την υποστήριξη της παρούσας μεθόδου δοκιμών, και έχει καταγραφεί στην έκθεση επικύρωσης της μεθόδου. Στις περιπτώσεις αυτές δεν μπορεί να πραγματοποιηθεί αξιόπιστη γραμμική παλινδρόμηση και είναι πιθανό να προκύψει εξωπραγματικά υψηλή εκτίμηση της C 0,d, με αποτέλεσμα απόδοση αφομοίωσης πολύ μεγαλύτερη από 1. Είναι δυνατόν να γίνει συντηρητική εκτίμηση της k 2 και να υπολογιστεί BMF φραγμένος προς τα άνω στις περιπτώσεις αυτές. Με την εφαρμογή γραμμικής παλινδρόμησης (λογαριθμικά μετασχηματισμένη συγκέντρωση σε συνάρτηση με το χρόνο) στα σημεία δεδομένων από τη φάση αποβολής στα οποία μετρήθηκε η συγκέντρωση, μέχρι και την πρώτη συγκέντρωση στην οποία δεν ανιχνεύεται η ουσία (συγκέντρωση στο όριο ποσοτικού προσδιορισμού), λαμβάνεται εκτίμηση της k 2. Στις συγκεκριμένες περιπτώσεις θα πρόκειται πιθανότατα για δύο μόνο σημεία δεδομένων (π.χ. ημέρες 1 και 2 της φάσης αποβολής), οπότε η k 2 μπορεί να εκτιμηθεί σύμφωνα με την εξίσωση A 5.22 του προσαρτήματος 5. Η εν λόγω εκτίμηση της k 2 μπορεί να χρησιμοποιηθεί για να εκτιμηθεί η απόδοση αφομοίωσης σύμφωνα με την εξίσωση A7.1, με αντικατάσταση της τιμής C0,d στην εξίσωση με τη μετρηθείσα συγκέντρωση σε χρόνο 0 (C0,m), όταν εκτιμάται με βεβαιότητα ότι η C0,d είναι πολύ υψηλότερη από εκείνη που θα μπορούσε να έχει επιτευχθεί στη δοκιμή. Εάν η C0,m δεν είναι μετρήσιμη, θα πρέπει να χρησιμοποιείται το όριο ανίχνευσης στους ιστούς των ψαριών. Εάν, σε ορισμένες περιπτώσεις, αυτό συνεπάγεται τιμή α > 1, τεκμαίρεται απόδοση αφομοίωσης ίση με 1 ως «χειρότερη περίπτωση». Μπορεί κατόπιν να εκτιμηθεί ο μέγιστος BMFK με τη χρήση της εξίσωσης Α7.4, ο οποίος θα πρέπει να αναφέρεται ως τιμή «πολύ μικρότερη από» (<<). Για παράδειγμα, σε μελέτη με ρυθμό σίτισης 3 %, χρόνο υποδιπλασιασμού κατά την αποβολή μικρότερο από 3 ημέρες και α «χειρότερης περίπτωσης» ίση με 1, ο BMFK θα είναι πιθανότατα χαμηλότερος από 0,13 περίπου. Λαμβανομένων υπόψη του στόχου της εκτίμησης και του γεγονότος ότι οι τιμές θα είναι συντηρητικές, δεν είναι απαραίτητο να διορθώνονται ως προς την αναπτυξιακή αραίωση ή την περιεκτικότητα των ψαριών και της τροφής σε λιπίδια. Προσάρτημα 8 ΠΡΟΣΕΓΓΙΣΕΙΣ ΓΙΑ ΤΗΝ ΕΚΤΙΜΗΣΗ ΠΡΟΣΩΡΙΝΩΝ BCF ΑΠΟ ΔΕΔΟΜΕΝΑ ΠΟΥ ΣΥΓΚΕΝΤΡΩΝΟΝΤΑΙ ΣΤΟ ΠΛΑΙΣΙΟ ΤΗΣ ΜΕΛΕΤΗΣ ΔΙΑΤΡΟΦΙΚΗΣ ΕΚΘΕΣΗΣ Η μέθοδος διατροφικής έκθεσης περιλαμβάνεται στην παρούσα μέθοδο δοκιμών με σκοπό τον έλεγχο της βιοσυσσώρευσης ουσιών που δεν μπορούν, στην πράξη, να υποβληθούν σε δοκιμές με χρήση της μεθόδου υδατικής έκθεσης. Η μέθοδος υδατικής έκθεσης παρέχει συντελεστή βιοσυγκέντρωσης, ενώ η μέθοδος διατροφικής έκθεσης δίνει άμεσα πληροφορίες σχετικά με το δυναμικό βιομεγέθυνσης της διατροφής. Σε πολλά συστήματα ασφάλειας χημικών προϊόντων απαιτούνται πληροφορίες σχετικά με τη βιοσυγκέντρωση στο υδάτινο περιβάλλον (π.χ. για την εκτίμηση κινδύνου, καθώς και στο Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης GHS). Ως εκ τούτου, είναι αναγκαίο να χρησιμοποιούνται τα δεδομένα που προκύπτουν από μελέτες διατροφικής έκθεσης για την εκτίμηση συντελεστή βιοσυγκέντρωσης που να είναι συγκρίσιμος με εκείνον που προκύπτει από δοκιμές με τη μέθοδο της υδατικής έκθεσης (94). Στο παρόν τμήμα εξετάζονται προσεγγίσεις που μπορούν να εφαρμοστούν για τον σκοπό αυτό, μολονότι αναγνωρίζονται οι εγγενείς αδυναμίες των εκτιμήσεων. Στη μελέτη διατροφικής έκθεσης μετράται η αποβολή για να ληφθεί η σταθερά ρυθμού αποβολής k 2. Εάν η σταθερά ρυθμού πρόσληψης μπορεί να εκτιμηθεί με τα διαθέσιμα δεδομένα για την περίπτωση κατά την οποία τα ψάρια έχουν εκτεθεί στην υπό δοκιμή ουσία μέσω του νερού, είναι δυνατόν να εκτιμηθεί κινητικός BCF. Η εκτίμηση της σταθεράς ρυθμού πρόσληψης μιας υπό δοκιμή ουσίας μέσω υδατικής έκθεσης εξαρτάται από πολλές παραδοχές, οι οποίες συνολικά συντελούν στην αβεβαιότητα της εκτίμησης. Επιπλέον, αυτή η προσέγγιση για την εκτίμηση του BCF υποθέτει ότι ο συνολικός ρυθμός αποβολής (συμπεριλαμβανομένων συντελεστικών παραγόντων όπως η κατανομή στο σώμα και οι ατομικές διεργασίες αποβολής) είναι ανεξάρτητος από την τεχνική έκθεσης που χρησιμοποιείται για την παραγωγή φόρτου της υπό δοκιμή ουσίας στο σώμα. Οι βασικές εγγενείς παραδοχές της εκτιμητικής προσέγγισης μπορούν να συνοψιστούν ως εξής. Η αποβολή κατόπιν διατροφικής πρόσληψης είναι η ίδια με την αποβολή κατόπιν υδατικής έκθεσης για δεδομένη ουσία Η πρόσληψη από το νερό ακολουθεί κινητική πρώτης τάξης Ανάλογα με τη μέθοδο που χρησιμοποιείται για την εκτίμηση της πρόσληψης:
Η βάση δεδομένων («εκπαιδευτικό σύνολο δεδομένων») που χρησιμοποιείται για την ανάπτυξη της μεθόδου εκτίμησης της πρόσληψης είναι αντιπροσωπευτική της εξεταζόμενης ουσίας Σε διάφορες δημοσιεύσεις στη βιβλιογραφία ελεύθερης πρόσβασης έχουν διατυπωθεί εξισώσεις που συνδέουν την πρόσληψη από το νερό στα ψάρια μέσω των βραγχίων με τον συντελεστή κατανομής των ουσιών σε οκτανόλη-νερό, το βάρος των ψαριών (1) (2) (3) (4), τον όγκο και/ή την περιεκτικότητα σε λιπίδια, τη διαπερατότητα/διάχυση διαμέσου μεμβρανών (5) (6), τον αναπνευστικό όγκο των ψαριών (7), καθώς και με προσέγγιση τάσης διαφυγής/ισοζυγίου μάζας (8) (9) (10). Λεπτομερής αξιολόγηση των σχετικών μεθόδων στο πλαίσιο αυτό παρέχεται στην εργασία των Crookes & Brooke (11). Μια δημοσίευση του Barber (12), εστιασμένη στη μοντελοποίηση της βιοσυσσώρευσης μέσω διατροφικής πρόσληψης, είναι επίσης χρήσιμη εν προκειμένω, καθώς περιλαμβάνει συνεισφορές από μοντέλα ρυθμού πρόσληψης μέσω των βραγχίων. Στο ίδιο θέμα ήταν επίσης αφιερωμένο ένα τμήμα του εγγράφου τεκμηρίωσης που συνόδευε το πρωτόκολλο του 2004 για τη διατροφική έκθεση. Τα περισσότερα από τα μοντέλα αυτά φαίνεται να έχουν προκύψει από περιορισμένες βάσεις δεδομένων. Όσον αφορά τα μοντέλα, στην περίπτωση των οποίων είναι διαθέσιμα τα στοιχεία της βάσης δεδομένων που χρησιμοποιήθηκε για τον σχεδιασμό τους, φαίνεται ότι τα είδη ουσιών που χρησιμοποιούνται είναι συχνά ανάλογης δομής ή χημικής τάξης (από την άποψη της λειτουργίας, π.χ. οργανοχλωριούχες ενώσεις). Αυτό επαυξάνει την αβεβαιότητα της χρήσης ενός μοντέλου για την πρόβλεψη σταθεράς ρυθμού πρόσληψης για διαφορετικό είδος ουσιών, επιπλέον ζητημάτων που αφορούν ειδικά στη δοκιμή, όπως το ζωικό είδος, η θερμοκρασία κ.λπ. Σε επισκόπηση των διαθέσιμων τεχνικών (11) τονίζεται ότι καμία μέθοδος δεν είναι «ορθότερη» από τις υπόλοιπες. Ως εκ τούτου, θα πρέπει να αιτιολογείται με σαφήνεια η επιλογή του χρησιμοποιούμενου μοντέλου. Εάν είναι διαθέσιμες περισσότερες της μίας μέθοδοι που μπορούν να χρησιμοποιηθούν δικαιολογημένα, θα ήταν συνετό να παρουσιάζονται περισσότερες της μίας εκτιμήσεις της k 1 (και, κατ' επέκταση, του BCF) ή ένα εύρος τιμών k 1 (και BCF), σύμφωνα με διάφορες μεθόδους εκτίμησης της πρόσληψης. Ωστόσο, δεδομένων των διαφορών ανάμεσα στους τύπους μοντέλων και στα σύνολα δεδομένων που χρησιμοποιούνται για την ανάπτυξή τους, η λήψη μέσης τιμής από εκτιμήσεις που έχουν προκύψει με διαφορετικούς τρόπους δεν θα ήταν ενδεδειγμένη. Ορισμένοι ερευνητές κρίνουν ότι αυτού του είδους οι εκτιμήσεις BCF χρειάζονται διόρθωση ως προς τη βιοδιαθεσιμότητα για να λαμβάνεται υπόψη η προσρόφηση των ουσιών σε διαλυμένο οργανικό άνθρακα (DOC) σε συνθήκες υδατικής έκθεσης, ώστε να συμφωνεί η εκτίμηση με τα αποτελέσματα των μελετών υδατικής έκθεσης [π.χ. (13) (14)]. Ωστόσο, η διόρθωση αυτή μπορεί να μην είναι κατάλληλη, δεδομένων των χαμηλών επιπέδων DOC που απαιτούνται στις μελέτες υδατικής έκθεσης για την εκτίμηση «χειρότερης περίπτωσης» (δηλ. λόγος της βιοδιαθέσιμης ουσίας προς την ουσία που μετριέται στο διάλυμα). Για εξαιρετικά υδρόφοβες ουσίες, η πρόσληψη από τα βράγχια μπορεί να περιορίζεται από τον ρυθμό παθητικής διάχυσης κοντά στην επιφάνεια των βραγχίων· στην περίπτωση αυτή, η διόρθωση ενδέχεται να αντισταθμίζει αυτό το φαινόμενο, αντί για το επιθυμητό. Συνιστάται να επικεντρωθεί το ενδιαφέρον σε μεθόδους που απαιτούν παραμέτρους για τις οποίες υπάρχουν διαθέσιμα δεδομένα για ουσίες που δοκιμάζονται με τη μελέτη διατροφικής έκθεσης η οποία περιγράφεται στο παρόν κεφάλαιο (δηλ. log K OW, βάρος ψαριών). Άλλες μέθοδοι που προϋποθέτουν πιο πολύπλοκα δεδομένα εισαγωγής μπορούν να εφαρμόζονται, αλλά ενδέχεται να απαιτούν πρόσθετες μετρήσεις κατά τη διάρκεια της δοκιμής ή λεπτομερείς γνώσεις σχετικά με τις υπό δοκιμή ουσίες ή τα είδη ψαριών, που μπορεί να μην είναι ευρέως διαθέσιμες. Επιπλέον, η επιλογή του μοντέλου μπορεί να επηρεαστεί από το επίπεδο της επικύρωσης και το πεδίο εφαρμογής [βλ. (11) για επισκόπηση και σύγκριση των διαφόρων μεθόδων]. Υπενθυμίζεται ότι η προκύπτουσα εκτίμηση της k 1 και ο κατ' εκτίμηση BCF είναι αβέβαιες τιμές και μπορεί να χρειάζονται επεξεργασία με προσέγγιση ανάλυσης του βάρους της απόδειξης, παράλληλα με τον παράγωγο BMF και τις παραμέτρους της ουσίας (π.χ. μοριακό μέγεθος) για να διαμορφωθεί συνολική εικόνα του δυναμικού βιοσυσσώρευσης της ουσίας. Η ερμηνεία και η χρήση των παραμέτρων αυτών μπορεί να εξαρτάται από το ρυθμιστικό πλαίσιο. ΒΙΒΛΙΟΓΡΑΦΙΑ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(17) |
Στο μέρος Γ, το Κεφάλαιο Γ.20 αντικαθίσταται από το ακόλουθο κείμενο: «Γ.20 Δοκιμή αναπαραγωγής σε Daphnia magna ΕΙΣΑΓΩΓΗ Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 211 του ΟΟΣΑ (2012). Οι κατευθυντήριες γραμμές δοκιμών του ΟΟΣΑ επανεξετάζονται κατά περιόδους με βάση την επιστημονική πρόοδο. Η κατευθυντήρια γραμμή δοκιμών αναπαραγωγής 211 προέρχεται από την κατευθυντήρια γραμμή δοκιμών 202, μέρος II, Δοκιμή αναπαραγωγής σε Daphnia sp. (1984). Αναγνωρίζεται γενικά ότι τα δεδομένα από δοκιμές που διεξάγονται σύμφωνα με την εν λόγω TG 202 μπορεί να είναι μεταβλητά. Η διαπίστωση αυτή οδήγησε σε σημαντικές προσπάθειες για τον προσδιορισμό των λόγων στους οποίους οφείλεται η εν λόγω μεταβλητότητα, με σκοπό την κατάρτιση καλύτερης μεθόδου δοκιμών. Η κατευθυντήρια γραμμή δοκιμών 211 βασίζεται στα αποτελέσματα των σχετικών ερευνητικών δραστηριοτήτων, διεργαστηριακών δοκιμών τεχνικής ικανότητας (ring-test) και μελετών επικύρωσης που πραγματοποιήθηκαν το 1992 (1), το 1994 (2) και το 2008 (3). Οι βασικές διαφορές μεταξύ του αρχικού κειμένου (TG 202, 1984) και της δεύτερης έκδοσης (TG211, 1998) της κατευθυντήριας γραμμής δοκιμών αναπαραγωγής είναι οι εξής:
Οι ορισμοί που χρησιμοποιούνται παρατίθενται στο προσάρτημα 1. ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ Πρωταρχικός στόχος της δοκιμής είναι να εκτιμηθούν οι επιδράσεις των χημικών ουσιών στην αναπαραγωγική απόδοση των καρκινοειδών του είδους Daphnia magna. Για τον σκοπό αυτό, νεαρές θηλυκές δαφνίες (οι γεννήτορες), ηλικίας μικρότερης των 24 ωρών κατά την έναρξη της δοκιμής, εκτίθενται σε μια σειρά υδατικών διαλυμάτων της υπό δοκιμή χημικής ουσίας σε διαφορετικές συγκεντρώσεις. Η διάρκεια της δοκιμής είναι 21 ημέρες. Στο τέλος της δοκιμής, υπολογίζεται ο συνολικός αριθμός ζωντανών απογόνων. Η αναπαραγωγική απόδοση των γεννητόρων μπορεί να εκφραστεί και με άλλους τρόπους (π.χ. αριθμός ζωντανών απογόνων ανά ζώο ανά ημέρα, με αφετηρία την πρώτη ημέρα κατά την οποία παρατηρούνται απόγονοι), τα δεδομένα όμως αυτά θα πρέπει να αναφέρονται επιπλέον του συνολικού αριθμού ζωντανών απογόνων στο τέλος της δοκιμής. Λόγω του ιδιαίτερου σχεδιασμού της ημιστατικής δοκιμής σε σύγκριση με άλλες μεθόδους δοκιμών αναπαραγωγής με ασπόνδυλα, είναι επίσης δυνατόν να καταμετρώνται οι ζωντανοί απόγονοι κάθε επιμέρους γεννήτορα. Με τον τρόπο αυτό, σε αντίθεση με άλλες μεθόδους δοκιμών αναπαραγωγής με ασπόνδυλα, σε περίπτωση τυχαίου/απροσδόκητου θανάτου του γεννήτορα κατά τη διάρκεια της περιόδου δοκιμής, οι απόγονοί του μπορούν να εξαιρεθούν από την αξιολόγηση των δεδομένων. Ως εκ τούτου, σε περίπτωση γονικής θνησιμότητας στις εκτεθείσες επαναλήψεις (replicates), θα πρέπει να εξετάζεται αν η θνησιμότητα ακολουθεί μοντέλο σχέσης συγκέντρωσης-απόκρισης ή όχι, π.χ. αν παρατηρείται σημαντική παλινδρόμηση της απόκρισης συναρτήσει της συγκέντρωσης της υπό δοκιμή χημικής ουσίας, με θετική κλίση (προς τούτο μπορεί να χρησιμοποιηθεί στατιστικός έλεγχος, όπως ο έλεγχος τάσης Cochran-Armitage). Εάν η θνησιμότητα δεν ακολουθεί μοντέλο σχέσης συγκέντρωσης-απόκρισης, οι επαναλήψεις με γονική θνησιμότητα θα πρέπει να εξαιρούνται από την ανάλυση του αποτελέσματος της δοκιμής. Εάν η θνησιμότητα ακολουθεί μοντέλο σχέσης συγκέντρωσης-απόκρισης, η γονική θνησιμότητα θα πρέπει να χαρακτηρίζεται επίδραση της υπό δοκιμή χημικής ουσίας και οι επαναλήψεις δεν θα πρέπει να εξαιρούνται από την ανάλυση. Σε περίπτωση θανάτου του γεννήτορα κατά τη διάρκεια της δοκιμής — τυχαίου, εξαιτίας εσφαλμένου χειρισμού του ζώου ή ατυχήματος, ή απροσδόκητου, λόγω ανεξήγητου περιστατικού που δεν συνδέεται με την επίδραση της υπό δοκιμή χημικής ουσίας — ή εάν αποδειχθεί ότι ο γεννήτορας είναι αρσενικό άτομο, η αντίστοιχη επανάληψη εξαιρείται από την ανάλυση (βλ. περισσότερες λεπτομέρειες στην παράγραφο 51). Η τοξική επίδραση της υπό δοκιμή χημικής ουσίας στην αναπαραγωγική απόδοση εκφράζεται ως ECx, με προσαρμογή των δεδομένων σε κατάλληλο μοντέλο με μη γραμμική παλινδρόμηση για την εκτίμηση της συγκέντρωσης που θα προκαλούσε x % μείωση της αναπαραγωγικής απόδοσης, ή εναλλακτικά ως τιμή NOEC/LOEC (4). Οι συγκεντρώσεις δοκιμής θα πρέπει κατά προτίμηση να περικλείουν τη χαμηλότερη από τις χρησιμοποιούμενες συγκεντρώσεις στις οποίες παρατηρείται επίδραση (π.χ. την EC10), που σημαίνει ότι η τιμή αυτή θα υπολογίζεται με παρεμβολή και όχι με παρέκταση. Θα πρέπει επίσης να αναφέρονται η επιβίωση των γεννητόρων και ο χρόνος μέχρι την εμφάνιση της πρώτης γενεάς απογόνων. Μπορούν επίσης να εξετάζονται και άλλες σχετιζόμενες με τη χημική ουσία επιδράσεις σε παραμέτρους όπως η ανάπτυξη (π.χ. μήκος) και, ενδεχομένως, ο ενδογενής ρυθμός αύξησης του πληθυσμού (βλ. παράγραφο 44). ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΗΝ ΥΠΟ ΔΟΚΙΜΗ ΧΗΜΙΚΗ ΟΥΣΙΑ Τα αποτελέσματα δοκιμής οξείας τοξικότητας (βλ. κεφάλαιο Γ. 2 του παρόντος παραρτήματος: Δοκιμή οξείας ακινητοποίησης σε δαφνία), που διεξήχθη με το είδος καρκινοειδών Daphnia magna, μπορεί να είναι χρήσιμα για την επιλογή κατάλληλου εύρους συγκεντρώσεων δοκιμής για τις δοκιμές αναπαραγωγής. Θα πρέπει να είναι γνωστές η υδατοδιαλυτότητα και η τάση ατμών της υπό δοκιμή ουσίας και να υπάρχει αξιόπιστη αναλυτική μέθοδος για την ποσοτικοποίηση της χημικής ουσίας στα διαλύματα δοκιμής, μέθοδος της οποίας έχουν αναφερθεί η απόδοση ανάκτησης και το όριο προσδιορισμού. Στις πληροφορίες σχετικά με την υπό δοκιμή χημική ουσία που μπορεί να είναι χρήσιμες για τον καθορισμό των συνθηκών δοκιμής περιλαμβάνονται ο συντακτικός τύπος, η καθαρότητα της ουσίας, η σταθερότητα στο φως, η σταθερότητα στις συνθήκες της δοκιμής, οι τιμές pKa και Pow, καθώς και τα αποτελέσματα δοκιμών άμεσης βιοαποικοδομησιμότητας [βλ. κεφάλαια Γ.4 (προσδιορισμός «άμεσης» βιοαποικοδομησιμότητας) και Γ.29 (άμεση βιοαποικοδομησιμότητα — CO2 σε σφραγισμένα δοχεία) του παρόντος παραρτήματος]. ΕΓΚΥΡΟΤΗΤΑ ΤΗΣ ΔΟΚΙΜΗΣ Η δοκιμή είναι έγκυρη, εφόσον οι μάρτυρες πληρούν τα ακόλουθα κριτήρια επιδόσεων:
Σημείωση: Το ίδιο κριτήριο εγκυρότητας (20 %) μπορεί να χρησιμοποιείται για την τυχαία και την απροσδόκητη γονική θνησιμότητα στους μάρτυρες και σε καθεμία από τις συγκεντρώσεις δοκιμής. ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Εργαστηριακός εξοπλισμός Τα δοχεία δοκιμής και ο λοιπός εξοπλισμός που έρχονται σε επαφή με τα διαλύματα δοκιμής θα πρέπει να αποτελούνται εξ ολοκλήρου από γυαλί ή άλλο χημικώς αδρανές υλικό. Τα δοχεία δοκιμής είναι κατά κανόνα γυάλινα ποτήρια ζέσεως. Επιπλέον, απαιτούνται ορισμένα από τα ακόλουθα όργανα ή και όλα:
Οργανισμός δοκιμής Το είδος που πρέπει να χρησιμοποιείται στη δοκιμή είναι το Daphnia magna Straus (95). Ο κλώνος θα πρέπει κατά προτίμηση να έχει ταυτοποιηθεί με γονοτύπηση. Η έρευνα (1) έδειξε ότι η αναπαραγωγική απόδοση του κλώνου Α (ο οποίος προέρχεται από το ερευνητικό ινστιτούτο IRCHA της Γαλλίας) (5) ανταποκρίνεται σταθερά στο κριτήριο εγκυρότητας που απαιτεί να είναι ≥ 60 ο μέσος όρος των ζωντανών απογόνων ανά επιζώντα γεννήτορα, όταν καλλιεργούνται στις συνθήκες που περιγράφονται στην παρούσα μέθοδο δοκιμών. Είναι όμως αποδεκτοί και άλλοι κλώνοι, αρκεί να αποδεικνύεται ότι η καλλιέργεια δαφνιών ανταποκρίνεται στα κριτήρια εγκυρότητας της δοκιμής. Κατά την έναρξη της δοκιμής, τα ζώα θα πρέπει να είναι ηλικίας μικρότερης των 24 ωρών και να μην είναι απόγονοι πρώτης γέννας. Θα πρέπει επίσης να προέρχονται από υγιές απόθεμα (να μην εμφανίζουν δηλαδή σημεία καταπόνησης, όπως υψηλή θνησιμότητα, παρουσία αρσενικών και εφιππίων, καθυστέρηση στη γέννηση της πρώτης γέννας, αποχρωματισμένα ζώα κ.λπ.). Τα ζώα του αποθέματος θα πρέπει να διατηρούνται σε συνθήκες καλλιέργειας (φωτισμός, θερμοκρασία, θρεπτικό μέσο, διατροφή και αριθμός ζώων ανά μονάδα όγκου) παρόμοιες με εκείνες υπό τις οποίες θα διεξαχθεί η δοκιμή. Εάν το θρεπτικό μέσο καλλιέργειας δαφνιών που πρόκειται να χρησιμοποιηθεί στη δοκιμή διαφέρει από το χρησιμοποιούμενο για τις συνήθεις καλλιέργειες δαφνιών, η ορθή πρακτική υπαγορεύει να προηγείται της δοκιμής ένα χρονικό διάστημα εγκλιματισμού τριών συνήθως εβδομάδων (δηλ. μιας γενεάς), ώστε να αποφεύγεται η καταπόνηση των γεννητόρων. Θρεπτικό μέσο δοκιμής Συνιστάται η χρησιμοποίηση επακριβώς καθορισμένου θρεπτικού μέσου στην παρούσα δοκιμή. Αποφεύγεται με τον τρόπο αυτόν η χρήση προσθέτων (π.χ. φύκη, εκχυλίσματα εδάφους κ.λπ.), που χαρακτηρίζονται δύσκολα, με αποτέλεσμα να βελτιώνονται οι δυνατότητες τυποποίησης μεταξύ εργαστηρίων. Μέσα κατάλληλα προς τούτο θεωρούνται τα Elendt Μ4 (6) και Μ7 (βλέπε προσάρτημα 2). Αποδεκτά είναι όμως κι άλλα μέσα [π.χ. (7) (8)], αρκεί οι επιδόσεις της καλλιέργειας δαφνιών να ανταποκρίνονται αποδεδειγμένα στα κριτήρια εγκυρότητας της δοκιμής. Εάν χρησιμοποιούνται θρεπτικά μέσα που περιέχουν ακαθόριστα πρόσθετα, τα τελευταία θα πρέπει να προσδιορίζονται επακριβώς και στην έκθεση της δοκιμής, να παρέχονται πληροφορίες για τη σύνθεσή τους, αναφορικά κυρίως με την περιεκτικότητα σε άνθρακα, δεδομένου ότι αυτή μπορεί να συνεισφέρει στο χορηγούμενο σιτηρέσιο. Συνιστάται να προσδιορίζεται ο ολικός οργανικός άνθρακας (TOC) και/ή το χημικώς απαιτούμενο οξυγόνο (COD) του παρασκευάσματος παρακαταθήκης του οργανικού προσθέτου και να εκτιμάται η συνακόλουθη συνεισφορά του στην περιεκτικότητα του θρεπτικού μέσου δοκιμής σε TOC/COD. Συνιστάται επιπλέον να μην υπερβαίνουν τα επίπεδα TOC στο θρεπτικό μέσο (προτού προστεθούν τα φύκη) τα 2 mg/l (9). Όταν οι υπό δοκιμή χημικές ουσίες περιέχουν μέταλλα, είναι σημαντικό να λαμβάνεται υπόψη ότι οι ιδιότητες του θρεπτικού μέσου δοκιμής (π.χ. σκληρότητα, ικανότητα χηλίωσης) μπορεί να έχουν επίπτωση στην τοξικότητα της υπό δοκιμή ουσίας. Για τον λόγο αυτό, είναι σκόπιμο να χρησιμοποιείται πλήρως καθορισμένο θρεπτικό μέσο. Τα μόνα όμως πλήρως καθορισμένα θρεπτικά μέσα που είναι γνωστό ότι ενδείκνυνται για μακροχρόνιες καλλιέργειες Daphnia magna είναι επί του παρόντος τα Elendt Μ4 και Μ7. Περιέχουν και τα δύο το χηλικό αντιδραστήριο EDTA. Έχει προκύψει από εργασίες (2) ότι η «φαινόμενη τοξικότητα» του καδμίου είναι κατά κανόνα χαμηλότερη όταν για τη δοκιμή αναπαραγωγής χρησιμοποιούνται τα μέσα Μ4 και Μ7 σε σύγκριση με τη χρήση μέσων που δεν περιέχουν EDTA. Συνεπώς, τα μέσα Μ4 και Μ7 δεν συνιστώνται για τις δοκιμές χημικών ουσιών που περιέχουν μέταλλα, θα πρέπει δε να αποφεύγονται και άλλα μέσα που περιέχουν γνωστά χηλικά αντιδραστήρια. Για τις χημικές ουσίες που περιέχουν μέταλλα, είναι ίσως σκόπιμο να χρησιμοποιείται εναλλακτικό θρεπτικό μέσο όπως, π.χ. το σκληρό γλυκό ανασυσταθέν ύδωρ κατά ASTM (9), που δεν περιέχει EDTA. Ο συνδυασμός του σκληρού γλυκού ανασυσταθέντος ύδατος κατά ASTM με εκχύλισμα φυκών (10) είναι κατάλληλος για τη μακροχρόνια καλλιέργεια Daphnia magna (2). Η συγκέντρωση διαλυμένου οξυγόνου θα πρέπει να είναι μεγαλύτερη από 3 mg/l στην αρχή και κατά τη διάρκεια της δοκιμής. To pΗ θα πρέπει να βρίσκεται στην περιοχή 6-9 και, κανονικά, να μην μεταβάλλεται κατά περισσότερο από 1,5 μονάδες στη διάρκεια της δοκιμής. Η σκληρότητα (εκφρασμένη ως CaCO3) συνιστάται να είναι μεγαλύτερη από 140 mg/l. Δοκιμές που διεξήχθησαν με την τιμή αυτή ή και μεγαλύτερες έδειξαν αναπαραγωγικές επιδόσεις ανταποκρινόμενες στα κριτήρια εγκυρότητας (11) (12). Διαλύματα δοκιμής Τα διαλύματα δοκιμής των επιλεγμένων συγκεντρώσεων παρασκευάζονται συνήθως με αραίωση διαλύματος παρακαταθήκης. Τα διαλύματα παρακαταθήκης θα πρέπει να παρασκευάζονται, κατά προτίμηση, χωρίς τη χρήση διαλυτών ή μέσων διασποράς, στο μέτρο του δυνατού, με ανάμειξη ή ανάδευση της υπό δοκιμή χημικής ουσίας στο θρεπτικό μέσο δοκιμής με τη βοήθεια μηχανικών μέσων, όπως η ανακίνηση, η ανάδευση ή η έκθεση σε υπερήχους, ή με άλλες κατάλληλες μεθόδους. Είναι προτιμότερο να εκτίθενται τα συστήματα δοκιμής στις συγκεντρώσεις της υπό δοκιμή ουσίας που πρόκειται να χρησιμοποιηθούν στη μελέτη, για όσο χρονικό διάστημα απαιτείται για να αποδειχθεί η διατήρηση σταθερών συγκεντρώσεων έκθεσης, πριν από την εισαγωγή των υπό δοκιμή οργανισμών. Εάν η υπό δοκιμή χημική ουσία είναι δυσδιάλυτη στο νερό, θα πρέπει να ακολουθούνται οι διαδικασίες που προβλέπονται στο έγγραφο καθοδήγησης του ΟΟΣΑ σχετικά με τον χειρισμό δύσκολων ουσιών (13). Η χρήση διαλυτών ή μέσων διασποράς θα πρέπει να αποφεύγεται, αλλά μπορεί να είναι απαραίτητη σε ορισμένες περιπτώσεις, προκειμένου να παρασκευασθεί ένα κατάλληλα πυκνό διάλυμα παρακαταθήκης. Εκτός από τις συγκεντρώσεις δοκιμής θα πρέπει να περιλαμβάνεται στη δοκιμή μάρτυρας με νερό αραίωσης και, εάν είναι αναπόφευκτο, μάρτυρας με διαλύτη, με επαρκή αριθμό επαναλήψεων και στις δύο περιπτώσεις. Για τη δοκιμή θα πρέπει να χρησιμοποιούνται μόνο διαλύτες ή μέσα διασποράς που, σύμφωνα με τα αποτελέσματα ερευνών, έχουν ασήμαντες ή ελάχιστες επιπτώσεις στην μεταβλητή απόκρισης Παραδείγματα κατάλληλων διαλυτών (π.χ. ακετόνη, αιθανόλη, μεθανόλη, διμεθυλοφορμαμίδιο και τριαιθυλενογλυκόλη) και μέσων διασποράς (π.χ. Cremophor RH 40, μεθυλοκυτταρίνη 0,01 % και HCO-40) παρέχονται στη βιβλιογραφική παραπομπή (13). Όταν χρησιμοποιείται διαλύτης ή μέσο διασποράς, η τελική του συγκέντρωση θα πρέπει να μην υπερβαίνει το 0,1 ml/l (13) και να είναι η ίδια σε όλα τα δοχεία δοκιμής, εκτός από εκείνο που περιέχει τον μάρτυρα με νερό αραίωσης. Ωστόσο, θα πρέπει να καταβάλλεται κάθε δυνατή προσπάθεια για να διατηρείται η συγκέντρωση του διαλύτη στα κατώτατα δυνατά επίπεδα. ΔΙΑΔΙΚΑΣΙΑ Συνθήκες έκθεσης Διάρκεια Η διάρκεια της δοκιμής είναι 21 ημέρες. Πληθυσμιακός φόρτος Οι γεννήτορες διατηρούνται σε ατομικά δοχεία δοκιμής που περιέχουν συνήθως 50-100 ml θρεπτικού μέσου (για το είδος Daphnia magna, ενώ είναι δυνατόν να απαιτούνται μικρότεροι όγκοι, ιδίως για μικρότερες δαφνιίδες, π.χ. του είδους Ceriodaphnia dubia), εκτός εάν απαιτείται σχεδιασμός δοκιμής συνεχούς ροής. Ενδέχεται να χρειαστούν σε ορισμένες περιπτώσεις μεγαλύτεροι όγκοι για την ικανοποίηση των απαιτήσεων της ακολουθούμενης αναλυτικής διαδικασίας για τον προσδιορισμό της συγκέντρωσης της υπό δοκιμή χημικής ουσίας, μολονότι επιτρέπεται η συγχώνευση επαναλήψεων για τη χημική ανάλυση. Εάν χρησιμοποιηθούν όγκοι μεγαλύτεροι από 100 ml, ενδέχεται να χρειαστεί να αυξηθεί η μερίδα που χορηγείται στις δαφνίες, για να διασφαλιστεί αφθονία τροφής και να πληρούνται τα κριτήρια εγκυρότητας. Πειραματόζωα Για τις ημιστατικές δοκιμές απαιτούνται 10 τουλάχιστον ζώα, το καθένα από τα οποία εκτίθεται σε κάθε συγκέντρωση δοκιμής, και 10 τουλάχιστον ζώα για τη σειρά των μαρτύρων. Για τις δοκιμές συνεχούς ροής, έχει αποδειχθεί ότι κατάλληλος αριθμός είναι 40 ζώα σε τέσσερις ομάδες των 10 για κάθε συγκέντρωση δοκιμής (1). Μπορεί να χρησιμοποιηθεί μικρότερος αριθμός οργανισμών δοκιμής, συνιστώνται όμως τουλάχιστον 20 ζώα ανά συγκέντρωση κατανεμημένα σε δύο ή περισσότερες ομάδες επανάληψης με τον ίδιο αριθμό ζώων (π.χ. τέσσερις ομάδες επανάληψης των πέντε δαφνιίδων). Να σημειωθεί ότι, σε δοκιμές όπου τα ζώα διατηρούνται ομαδικά, δεν είναι δυνατόν να εξαιρεθούν απόγονοι από τη στατιστική ανάλυση σε περίπτωση απροσδόκητης/τυχαίας γονικής θνησιμότητας αφού έχει αρχίσει η αναπαραγωγή και, ως εκ τούτου, στις περιπτώσεις αυτές, η αναπαραγωγική απόδοση θα πρέπει να εκφράζεται ως συνολικός αριθμός ζωντανών απογόνων ανά παρόντα στην αρχή της δοκιμής γεννήτορα. Η κατανομή των μεταχειρίσεων μεταξύ των δοχείων δοκιμής και όλοι οι μετέπειτα χειρισμοί τους θα πρέπει να γίνονται κατά τρόπο τυχαίο. Σε αντίθετη περίπτωση, ενδέχεται να προκύψει μεροληψία που θα μπορούσε να ερμηνευθεί ως επίδραση της συγκέντρωσης. Πιο συγκεκριμένα, εάν ο χειρισμός των πειραματικών μονάδων γίνεται κατά σειρά μεταχείρισης ή συγκέντρωσης, τότε κάποιο φαινόμενο συνδεόμενο με τον χρόνο, π.χ. κόπωση του τεχνικού ή άλλο σφάλμα, θα μπορούσε να πολλαπλασιάσει τις επιδράσεις των υψηλότερων συγκεντρώσεων. Επιπλέον, εάν υπάρχει πιθανότητα επηρεασμού των αποτελεσμάτων της δοκιμής από μια αρχική ή περιβαλλοντική συνθήκη της δοκιμής, όπως π.χ. η θέση στο εργαστήριο, θα πρέπει να εξετάζεται το ενδεχόμενο εκτέλεσης της δοκιμής σε παρτίδες (μπλοκ). Σίτιση Στις ημιστατικές δοκιμές, η τροφή θα πρέπει κατά προτίμηση να χορηγείται καθημερινά, και πάντως τουλάχιστον τρεις φορές εβδομαδιαίως (δηλ. παράλληλα με κάθε αλλαγή θρεπτικού μέσου). Η ενδεχόμενη αραίωση των συγκεντρώσεων έκθεσης λόγω της προσθήκης της τροφής θα πρέπει να λαμβάνεται υπόψη και να αποφεύγεται όσο το δυνατόν περισσότερο, με επαρκώς πυκνά εναιωρήματα φυκών. Τυχόν διαφοροποιήσεις (π.χ. σε δοκιμές συνεχούς ροής) θα πρέπει να αναφέρονται. Κατά τη διάρκεια της δοκιμής, το σιτηρέσιο των γεννητόρων θα πρέπει κατά προτίμηση να συνίσταται σε ζωντανά μονοκύτταρα φύκη ενός ή περισσοτέρων από τα ακόλουθα είδη: Chlorella sp., Pseudokirchneriella subcapitata (πρώην Selenastrum capricornutum) και Desmodesmus subspicatus (πρώην Scenedesmus subspicatus). Το χορηγούμενο σιτηρέσιο θα πρέπει να βασίζεται στην ποσότητα οργανικού άνθρακα (C) που παρέχεται σε κάθε γεννήτορα. Η έρευνα (14) έχει δείξει ότι, για το είδος Daphnia magna, μερίδες μεταξύ 0,1 και 0,2 mg C/δαφνία/ημέρα αρκούν για να επιτευχθεί ο απαιτούμενος αριθμός ζωντανών απογόνων ώστε να πληρούνται τα κριτήρια εγκυρότητας της δοκιμής. Η μερίδα μπορεί να χορηγείται είτε με σταθερό ρυθμό καθ' όλη τη διάρκεια της δοκιμής είτε, εάν κριθεί σκόπιμο, με βραδύτερο ρυθμό στην αρχή, που θα αυξάνεται στη συνέχεια για να λαμβάνεται υπόψη η ανάπτυξη των γεννητόρων. Στην περίπτωση αυτή, ωστόσο, η μερίδα πρέπει πάντοτε να παραμένει στη συνιστώμενη περιοχή των 0,1 έως 0,2 mg C/δαφνία/ημέρα. Εάν πρόκειται να χρησιμοποιηθούν εναλλακτικές παράμετροι για τον υπολογισμό της απαιτούμενης μερίδας, όπως π.χ. ο αριθμός κυττάρων φυκών ή η απορρόφηση του φωτός (για πρακτικούς λόγους, δεδομένου ότι η μέτρηση της περιεκτικότητας σε άνθρακα είναι χρονοβόρος), κάθε εργαστήριο θα πρέπει να εκπονεί το δικό του νομογράφημα που να συνδέει την εναλλακτική παράμετρο με την περιεκτικότητα της καλλιέργειας φυκών σε άνθρακα (βλ. συστάσεις για την εκπόνηση νομογραφήματος στο παράρτημα 3). Τα νομογραφήματα θα πρέπει να ελέγχονται τουλάχιστον σε ετήσια βάση, συχνότερα δε εάν μεταβληθούν στο μεταξύ οι συνθήκες της καλλιέργειας φυκών. Έχει διαπιστωθεί ότι η απορρόφηση του φωτός υπερτερεί του αριθμού κυττάρων ως υποκατάστατο της περιεκτικότητας σε άνθρακα (15). Οι δαφνίες θα πρέπει να σιτίζονται με πυκνό εναιώρημα φυκών, ώστε ο όγκος θρεπτικού μέσου της καλλιέργειας φυκών που μεταγγίζεται στα δοχεία δοκιμής να είναι ο ελάχιστος δυνατός. Συμπύκνωση των φυκών μπορεί να επιτευχθεί με φυγοκέντρηση και σχηματισμό νέου εναιωρήματος σε θρεπτικό μέσο καλλιέργειας δαφνιών. Φως Δεκαέξι ώρες φωτός, με ένταση που δεν υπερβαίνει τα 15-20 μE · m– 2 · s– 1 μετρούμενη στην επιφάνεια του νερού των δοχείων. Στην περίπτωση των φωτομέτρων που είναι βαθμονομημένα σε lux, το πεδίο τιμών 1 000-1 500 lux, προκειμένου για ψυχρό λευκό φως, αντιστοιχεί περίπου στη συνιστώμενη φωτεινή ένταση των 15-20 μE · m– 2 · s– 1. Θερμοκρασία Η θερμοκρασία των θρεπτικών μέσων δοκιμής θα πρέπει να είναι 18-22 °C. Ωστόσο, στη διάρκεια κάθε δοκιμής, θα πρέπει κατά το δυνατόν να μην αποκλίνει από τα όρια αυτά κατά περισσότερο από 2 °C (π.χ. 18-20, 19-21 ή 20-22 °C) ως ημερήσιο εύρος τιμών. Για τις ανάγκες παρακολούθησης της θερμοκρασίας, ενδείκνυται ίσως η χρήση ενός επιπλέον δοχείου δοκιμής. Αερισμός Τα δοχεία δεν θα πρέπει να αερίζονται κατά τη διάρκεια της δοκιμής. Σχεδιασμός της δοκιμής Δοκιμή προσδιορισμού εύρους δόσεων Όταν είναι αναγκαίο, διεξάγεται δοκιμή προσδιορισμού εύρους δόσεων, για παράδειγμα με πέντε συγκεντρώσεις της υπό δοκιμή χημικής ουσίας και δύο επαναλήψεις για κάθε μεταχείριση και μάρτυρα. Πρόσθετες πληροφορίες σχετικά με την οξεία τοξικότητα για τη δαφνία και/ή άλλους υδρόβιους οργανισμούς, προερχόμενες από δοκιμές με παρόμοιες χημικές ουσίες ή από τη βιβλιογραφία, μπορεί επίσης να είναι χρήσιμες για να αποφασιστεί το εύρος συγκεντρώσεων που θα χρησιμοποιηθεί στη δοκιμή προσδιορισμού εύρους δόσεων. Η διάρκεια της δοκιμής προσδιορισμού εύρους δόσεων είναι 21 ημέρες ή επαρκές χρονικό διάστημα για την αξιόπιστη πρόβλεψη των επιπέδων επίδρασης. Στο τέλος της δοκιμής, αξιολογείται η αναπαραγωγή των δαφνιών. Θα πρέπει να καταγράφονται ο αριθμός των γεννητόρων και η εμφάνιση απογόνων. Οριστική δοκιμή Κανονικά, η δοκιμή θα πρέπει να διεξάγεται με πέντε τουλάχιστον συγκεντρώσεις που να περικλείουν την αποτελεσματική συγκέντρωση (π.χ. ECx) και να είναι διατεταγμένες σε γεωμετρική πρόοδο, με λόγο προόδου που να μην υπερβαίνει, κατά προτίμηση, το 3,2. Για κάθε συγκέντρωση δοκιμής θα πρέπει να χρησιμοποιείται κατάλληλος αριθμός επαναλήψεων (βλ. παραγράφους 24-25). Εάν χρησιμοποιούνται λιγότερες από πέντε συγκεντρώσεις, η επιλογή αυτή θα πρέπει να αιτιολογείται. Οι χημικές ουσίες δεν θα πρέπει να ελέγχονται σε συγκεντρώσεις υψηλότερες από το όριο διαλυτότητάς τους στο θρεπτικό μέσο της δοκιμής. Πριν από την εκτέλεση του πειράματος είναι σκόπιμο να εξετάζεται η στατιστική ισχύς του σχεδιασμού της δοκιμής με τη χρήση κατάλληλων στατιστικών μεθόδων (4). Κατά τον καθορισμό του εύρους συγκεντρώσεων θα πρέπει να λαμβάνονται υπόψη τα ακόλουθα:
Εάν δεν παρατηρηθεί καμία επίδραση στην υψηλότερη συγκέντρωση κατά τη δοκιμή προσδιορισμού εύρους δόσεων (π.χ. σε 10 mg/l) ή όταν η υπό δοκιμή χημική ουσία είναι πολύ πιθανό να είναι χαμηλής/μηδενικής τοξικότητας με βάση την απουσία τοξικότητας για άλλους οργανισμούς και/ή τη μικρή/μηδενική πρόσληψη, η δοκιμή αναπαραγωγής μπορεί να διεξαχθεί ως οριακή δοκιμή, με τη χρήση συγκέντρωσης δοκιμής της τάξης των 10 mg/l και ενός μάρτυρα. Θα πρέπει να χρησιμοποιούνται δέκα επαναλήψεις, τόσο για τις ομάδες μεταχείρισης όσο και για τις ομάδες μαρτύρων. Όταν είναι ενδεχομένως αναγκαίο να διεξαχθεί οριακή δοκιμή με σύστημα συνεχούς ροής, επαρκούν λιγότερες επαναλήψεις. Η οριακή δοκιμή προσφέρει την ευκαιρία να καταδειχθεί ότι δεν υπάρχουν στατιστικά σημαντικές επιδράσεις στην οριακή συγκέντρωση, αλλά εάν καταγραφούν επιδράσεις, απαιτείται κατά κανόνα πλήρης δοκιμή. Μάρτυρες Επιπλέον της σειράς των συγκεντρώσεων δοκιμής, θα πρέπει να περιλαμβάνονται στη δοκιμή μια σειρά μαρτύρων του θρεπτικού μέσου δοκιμής και, κατά περίπτωση, μια σειρά μαρτύρων που να περιέχουν τον διαλύτη ή το μέσο διασποράς. Όταν χρησιμοποιείται διαλύτης ή μέσο διασποράς, η συγκέντρωσή του θα πρέπει να είναι η ίδια με την χρησιμοποιούμενη στα δοχεία που περιέχουν την υπό δοκιμή ουσία. Επιπλέον, απαιτείται κατάλληλος αριθμός επαναλήψεων (βλ. παραγράφους 23-24). Γενικότερα, εάν η δοκιμή εκτελεστεί σωστά, ο συντελεστής μεταβλητότητας του μέσου αριθμού ζωντανών απογόνων ανά γεννήτορα στους μάρτυρες θα πρέπει να είναι ≤ 25 % και το στοιχείο αυτό θα πρέπει να αναφέρεται όταν πρόκειται για σχεδιασμούς δοκιμών κατά τις οποίες τα ζώα διατηρούνται σε ατομικά δοχεία. Ανανέωση του θρεπτικού μέσου Η συχνότητα ανανέωσης του θρεπτικού μέσου εξαρτάται από τη σταθερότητα της υπό δοκιμή χημικής ουσίας, θα πρέπει πάντως να είναι τουλάχιστον τρεις φορές εβδομαδιαίως. Εάν σε προκαταρκτικές δοκιμές σταθερότητας (βλ. παράγραφο 7) έχει διαπιστωθεί ότι η συγκέντρωση της υπό δοκιμή χημικής ουσίας δεν είναι σταθερή (βρίσκεται δηλαδή εκτός των ορίων 80-120 % της ονομαστικής συγκέντρωσης ή μειώνεται σε επίπεδα κάτω του 80 % της μετρηθείσας αρχικής συγκέντρωσης) κατά τη μέγιστη περίοδο ανανέωσης (3 ημέρες), θα πρέπει να εξετάζεται το ενδεχόμενο να ανανεώνεται συχνότερα το θρεπτικό μέσο ή να διεξαχθεί δοκιμή συνεχούς ροής. Κατά την ανανέωση του θρεπτικού μέσου σε ημιστατικές δοκιμές, ετοιμάζεται μια δεύτερη σειρά δοχείων δοκιμής, όπου μεταφέρονται οι γεννήτορες, π.χ. με γυάλινο σιφώνιο κατάλληλης διαμέτρου. Ο όγκος του θρεπτικού μέσου που μεταγγίζεται μαζί με τις δαφνίες θα πρέπει να είναι ο ελάχιστος δυνατός. Παρατηρήσεις Τα αποτελέσματα των παρατηρήσεων κατά τη δοκιμή θα πρέπει να καταγράφονται σε πίνακες (βλ. παραδείγματα στα προσαρτήματα 4 και 5). Αν χρειαστεί να γίνουν κι άλλες μετρήσεις (βλ. παράγραφο 44), θα υπάρξουν ενδεχομένως κι άλλες παρατηρήσεις. Απόγονοι Οι απόγονοι κάθε γεννήτορα είναι προτιμότερο να απομακρύνονται από τα δοχεία και να καταμετρώνται σε ημερήσια βάση, αφότου εμφανιστεί η πρώτη γέννα, ώστε να μην καταναλώνουν τροφή προοριζόμενη για τους γεννήτορες. Για τους σκοπούς της παρούσας μεθόδου δοκιμών, είναι αναγκαίο να καταμετρώνται μόνο οι ζωντανοί απόγονοι, θα πρέπει όμως να καταγράφονται τα αβγά που δεν εκκολάφθηκαν, καθώς και οι νεκροί απόγονοι. Θνησιμότητα Η θνησιμότητα των γεννητόρων θα πρέπει να καταγράφεται σε ημερήσια κατά προτίμηση βάση και, τουλάχιστον, κάθε φορά που καταμετρώνται οι απόγονοι. Άλλες παράμετροι Μολονότι η παρούσα μέθοδος δοκιμών αποβλέπει κατά κύριο λόγο στην αξιολόγηση των επιδράσεων στην αναπαραγωγική απόδοση, ενδέχεται να παρατηρηθούν και άλλες επιδράσεις, επαρκώς ποσοτικοποιημένες ώστε να είναι εφικτή η στατιστική τους ανάλυση. Μπορεί να καταγράφεται η αναπαραγωγική απόδοση ανά επιζώντα γεννήτορα, δηλ. ο αριθμός ζωντανών απογόνων που γεννήθηκαν κατά τη διάρκεια της δοκιμής ανά επιζώντα γεννήτορα. Ο αριθμός αυτός μπορεί να συγκρίνεται με την κύρια μεταβλητή απόκρισης (αναπαραγωγική απόδοση ανά γεννήτορα παρόντα στην αρχή της δοκιμής που δεν πέθανε τυχαία ή απροσδόκητα κατά τη διάρκεια της δοκιμής). Σε περίπτωση γονικής θνησιμότητας σε εκτεθείσες επαναλήψεις, θα πρέπει να εξετάζεται αν η θνησιμότητα ακολουθεί μοντέλο σχέσης συγκέντρωσης-απόκρισης ή όχι, π.χ. αν παρατηρείται σημαντική παλινδρόμηση της απόκρισης συναρτήσει της συγκέντρωσης της υπό δοκιμή χημικής ουσίας, με θετική κλίση (προς τούτο μπορεί να χρησιμοποιηθεί στατιστικός έλεγχος, όπως ο έλεγχος τάσης Cochran-Armitage). Εάν η θνησιμότητα δεν ακολουθεί μοντέλο σχέσης συγκέντρωσης-απόκρισης, οι επαναλήψεις με γονική θνησιμότητα θα πρέπει να εξαιρούνται από την ανάλυση του αποτελέσματος της δοκιμής. Εάν η θνησιμότητα ακολουθεί μοντέλο σχέσης συγκέντρωσης-απόκρισης, η γονική θνησιμότητα θα πρέπει να χαρακτηρίζεται επίδραση της υπό δοκιμή χημικής ουσίας και οι επαναλήψεις δεν θα πρέπει να εξαιρούνται από την ανάλυση του αποτελέσματος της δοκιμής. Οι μετρήσεις της ανάπτυξης είναι ιδιαίτερα επιθυμητές, διότι παρέχουν πληροφορίες για πιθανές υποθανατηφόρες επιδράσεις, οι οποίες ενδέχεται να είναι χρήσιμες συμπληρωματικά στις παραμέτρους αναπαραγωγής. Συνιστάται η μέτρηση του μήκους των γεννητόρων (μήκος του σώματος χωρίς την εδρική άκανθα) στο τέλος της δοκιμής. Άλλες παράμετροι που μπορούν να μετρηθούν ή να υπολογιστούν είναι ο χρόνος μέχρι την εμφάνιση της πρώτης γέννας (και των επόμενων), ο αριθμός και το μέγεθος των γεννών ανά ζώο, ο αριθμός των αυγών που δεν εκκολάφθηκαν, η παρουσία αρσενικών νεογνών (ΟΟΣΑ, 2008) ή εφιππίων και, ενδεχομένως, ο ενδογενής ρυθμός αύξησης του πληθυσμού (βλ. ορισμό στο προσάρτημα 1 και αναγνώριση του φύλου των νεογνών στο προσάρτημα 7). Συχνότητα αναλυτικών προσδιορισμών και μετρήσεων Η συγκέντρωση του οξυγόνου, η θερμοκρασία, η σκληρότητα και το pΗ θα πρέπει να μετρώνται τουλάχιστον μία φορά εβδομαδιαίως, πριν και μετά την ανανέωση του θρεπτικού μέσου, στους μάρτυρες και στην υψηλότερη συγκέντρωση της υπό δοκιμή χημικής ουσίας. Κατά τη διάρκεια της δοκιμής, οι συγκεντρώσεις της δοκιμαζόμενης ουσίας προσδιορίζονται σε τακτά διαστήματα. Στις ημιστατικές δοκιμές όπου η συγκέντρωση της υπό δοκιμή χημικής ουσίας αναμένεται να παραμένει εντός ορίων ± 20 % της ονομαστικής τιμής (να βρίσκεται δηλαδή εντός του εύρους 80-120 % — βλ. παραγράφους 6, 7 και 39), συνιστάται να προσδιορίζονται τουλάχιστον η υψηλότερη και η χαμηλότερη συγκέντρωση αμέσως μόλις παρασκευαστούν τα διαλύματα και κατά τον χρόνο ανανέωσης, μία φορά κατά τη διάρκεια της πρώτης εβδομάδας της δοκιμής (δηλ. θα πρέπει να υποβάλλονται σε ανάλυση δείγματα του ίδιου διαλύματος, μία φορά μόλις παρασκευαστεί και μια δεύτερη όταν ανανεωθεί). Στη συνέχεια, οι προσδιορισμοί αυτοί θα πρέπει να επαναλαμβάνονται σε εβδομαδιαία τουλάχιστον βάση. Στις δοκιμές όπου η συγκέντρωση της υπό δοκιμή χημικής ουσίας αναμένεται να μην παραμένει εντός των ορίων ± 20 % της ονομαστικής της τιμής, είναι απαραίτητο να προσδιορίζονται όλες οι συγκεντρώσεις, αμέσως μόλις παρασκευαστούν τα διαλύματα και κατά την ανανέωση. Εντούτοις, σε δοκιμές όπου η μετρηθείσα αρχική συγκέντρωση της υπό δοκιμή χημικής ουσίας δεν βρίσκεται εντός ορίων ± 20 % της ονομαστικής της τιμής, αλλά μπορεί να αποδειχθεί ότι οι αρχικές συγκεντρώσεις είναι επαναλήψιμες και σταθερές (δηλ. εντός εύρους 80-120 % των αρχικών συγκεντρώσεων), οι χημικές αναλύσεις κατά τη διάρκεια της δεύτερης και της τρίτης εβδομάδας της δοκιμής μπορούν να περιορίζονται στην υψηλότερη και τη χαμηλότερη συγκέντρωση. Σε όλες τις περιπτώσεις, ο προσδιορισμός των συγκεντρώσεων της υπό δοκιμή χημικής ουσίας πριν την ανανέωση αρκεί να εκτελείται μόνο σε ένα δοχείο επανάληψης για κάθε επίπεδο συγκέντρωσης. Σε δοκιμή συνεχούς ροής, ενδείκνυται καθεστώς δειγματοληψίας ανάλογο με το περιγραφόμενο για ημιστατικές δοκιμές (στην περίπτωση όμως αυτή δεν ισχύουν οι μετρήσεις «παλαιών» διαλυμάτων). Εντούτοις, μπορεί να είναι σκόπιμο να αυξηθεί ο αριθμός των δειγματοληψιών στη διάρκεια της πρώτης εβδομάδας (π.χ. τρεις σειρές μετρήσεων) ώστε να είναι βέβαιο ότι οι συγκεντρώσεις δοκιμής παραμένουν σταθερές. Στις δοκιμές αυτού του τύπου, η ταχύτητα ροής του μέσου αραίωσης και της υπό δοκιμή χημικής ουσίας θα πρέπει να ελέγχονται καθημερινά. Εάν μπορεί να αποδειχθεί ότι η συγκέντρωση της υπό δοκιμή χημικής ουσίας παρέμεινε σε ικανοποιητικό βαθμό εντός ορίων ± 20 % της ονομαστικής ή της μετρηθείσας αρχικής συγκέντρωσης σε όλη τη διάρκεια της δοκιμής, τα αποτελέσματα μπορούν να βασίζονται στις ονομαστικές ή τις μετρηθείσες αρχικές τιμές. Εάν η απόκλιση από την ονομαστική ή την μετρηθείσα αρχική συγκέντρωση είναι μεγαλύτερη από ± 20 %, τα αποτελέσματα θα πρέπει να εκφράζονται ως χρονοσταθμισμένη μέση τιμή (βλ. καθοδήγηση για τον υπολογισμό στο προσάρτημα 6). ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Επεξεργασία αποτελεσμάτων Σκοπός της δοκιμής είναι να προσδιοριστούν οι επιδράσεις της υπό δοκιμή χημικής ουσίας στην αναπαραγωγική απόδοση. Ο συνολικός αριθμός ζώντων απογόνων ανά ζώντα γεννήτορα πρέπει να υπολογίζεται για κάθε δοχείο (επανάληψη). Η αναπαραγωγική απόδοση μπορεί επίσης να υπολογιστεί από την παραγωγή ζώντων απογόνων από τους επιζήσαντες γεννήτορες. Ωστόσο, η σημαντικότερη από οικολογικής πλευράς μεταβλητή απόκρισης είναι ο συνολικός αριθμός ζωντανών απογόνων ανά γεννήτορα που δεν πεθαίνει τυχαία (96) ή απροσδόκητα (97) κατά τη διάρκεια της δοκιμής. Σε περίπτωση τυχαίου ή απροσδόκητου θανάτου του γεννήτορα κατά τη διάρκεια της δοκιμής ή εάν αυτός αποδειχθεί αρσενικό άτομο, η επανάληψη εξαιρείται από την ανάλυση. Η ανάλυση θα βασίζεται τότε σε μειωμένο αριθμό επαναλήψεων. Σε περίπτωση γονικής θνησιμότητας σε εκτεθείσες επαναλήψεις, θα πρέπει να εξετάζεται αν η θνησιμότητα ακολουθεί μοντέλο σχέσης συγκέντρωσης-απόκρισης ή όχι, π.χ. αν παρατηρείται σημαντική παλινδρόμηση της απόκρισης συναρτήσει της συγκέντρωσης της υπό δοκιμή χημικής ουσίας, με θετική κλίση (προς τούτο μπορεί να χρησιμοποιηθεί στατιστικός έλεγχος, όπως ο έλεγχος τάσης Cochran-Armitage). Εάν η θνησιμότητα δεν ακολουθεί μοντέλο σχέσης συγκέντρωσης-απόκρισης, οι επαναλήψεις με γονική θνησιμότητα θα πρέπει να εξαιρούνται από την ανάλυση του αποτελέσματος της δοκιμής. Εάν η θνησιμότητα ακολουθεί μοντέλο σχέσης συγκέντρωσης-απόκρισης, η γονική θνησιμότητα θα πρέπει να χαρακτηρίζεται επίδραση της υπό δοκιμή χημικής ουσίας και οι επαναλήψεις δεν θα πρέπει να εξαιρούνται από την ανάλυση του αποτελέσματος της δοκιμής. Συνοπτικά, όταν χρησιμοποιούνται οι τιμές LOEC και NOEC ή ECx για την έκφραση των επιδράσεων, συνιστάται να υπολογίζεται η επίδραση στην αναπαραγωγή με τη χρήση και των δύο μεταβλητών απόκρισης που αναφέρονται ανωτέρω, δηλαδή
και, στη συνέχεια, να χρησιμοποιείται ως τελικό αποτέλεσμα η χαμηλότερη από τις τιμές LOEC και NOEC ή ECx που υπολογίζονται με τη χρήση αυτών των δύο μεταβλητών απόκρισης. Πριν από τη στατιστική ανάλυση, π.χ. εφαρμογή διαδικασιών ANOVA, σύγκριση των μεταχειρίσεων με τους μάρτυρες με ελέγχους t του Student, Dunnett Williams ή με έλεγχο Jonckheere-Terpstra με αποκλιμάκωση (stepdown), συνιστάται να εξετάζεται το ενδεχόμενο μετασχηματισμού των δεδομένων, εφόσον είναι αναγκαίο για την εκπλήρωση των απαιτήσεων του συγκεκριμένου στατιστικού ελέγχου. Πιθανές μη παραμετρικές εναλλακτικές λύσεις είναι οι έλεγχοι των Dunn ή Mann-Whitney. Υπολογίζονται τα διαστήματα εμπιστοσύνης 95 % για τις μέσες τιμές των μεμονωμένων αγωγών. Ο αριθμός επιζώντων γεννητόρων στους μάρτυρες χωρίς μεταχείριση αποτελεί κριτήριο εγκυρότητας και θα πρέπει να τεκμηριώνεται και να αναφέρεται. Στην τελική έκθεση θα πρέπει να αναφέρεται και κάθε άλλη επιβλαβής επίδραση, όπως π.χ. αφύσικη συμπεριφορά και σημαντικά τοξικολογικά ευρήματα. ECx Οι τιμές ECx, συμπεριλαμβανομένων των αντίστοιχων κατώτατων και ανώτατων ορίων εμπιστοσύνης, υπολογίζονται με τη χρήση κατάλληλων στατιστικών μεθόδων (π.χ. λογιστική συνάρτηση ή συνάρτηση Weibull, απλοποιημένη μέθοδος Spearman-Karber ή απλή παρεμβολή). Για να υπολογιστούν οι τιμές EC10, EC50 ή οποιαδήποτε άλλη τιμή ECx, θα πρέπει να υποβάλλεται σε ανάλυση παλινδρόμησης το πλήρες σύνολο δεδομένων. NOEC/LOEC Εάν η στατιστική ανάλυση αποσκοπεί στον προσδιορισμό της NOEC/LOEC, θα πρέπει να χρησιμοποιούνται κατάλληλες στατιστικές μέθοδοι σύμφωνα με το έγγραφο αριθ. 54 του ΟΟΣΑ«Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application» (4). Σε γενικές γραμμές, οι δυσμενείς επιδράσεις της ελεγχόμενης χημικής ουσίας σε σύγκριση με τον μάρτυρα διερευνώνται με χρήση του μονόπλευρου ελέγχου υποθέσεων με p ≤ 0,05. Η κανονική κατανομή και η ομοιογένεια της διασποράς μπορούν να εξακριβωθούν με κατάλληλο στατιστικό έλεγχο, π.χ. έλεγχος Shapiro-Wilk και έλεγχος Levene αντίστοιχα (p ≤ 0,05). Μπορεί να διενεργηθεί μονόδρομος έλεγχος διασποράς (ANOVA) και να επακολουθήσουν έλεγχοι πολλαπλών συγκρίσεων. Οι έλεγχοι πολλαπλών συγκρίσεων (π.χ. έλεγχος Dunnett) ή τάσης με αποκλιμάκωση (π.χ. έλεγχος Williams ή έλεγχος Jonckheere-Terpstra με αποκλιμάκωση) μπορούν να χρησιμοποιούνται για τον υπολογισμό της σημαντικότητας των διαφορών (p ≤ 0,05) ανάμεσα στους μάρτυρες και στις διάφορες συγκεντρώσεις της υπό δοκιμή χημικής ουσίας [επιλογή συνιστώμενου ελέγχου σύμφωνα με το έγγραφο καθοδήγησης αριθ. 54 του ΟΟΣΑ (4)]. Διαφορετικά, μπορούν να χρησιμοποιηθούν μη παραμετρικές μέθοδοι (π.χ. έλεγχος Bonferroni-U κατά Holm ή έλεγχος τάσεων Jonckheere-Terpstra) για να προσδιοριστούν οι τιμές NOEC και LOEC. Οριακή δοκιμή Εάν έχει διεξαχθεί οριακή δοκιμή (σύγκριση μεταξύ του μάρτυρα και μίας μόνο μεταχείρισης) και πληρούνται οι προϋποθέσεις των διαδικασιών παραμετρικού ελέγχου (κανονικότητα, ομοιογένεια), οι μετρικές αποκρίσεις μπορούν να αξιολογούνται με έλεγχο Student (t-test). Εάν δεν πληρούνται οι απαιτήσεις αυτές, μπορεί να χρησιμοποιηθεί ο έλεγχος t άνισης διασποράς (Welch-t) ή ένας μη παραμετρικός έλεγχος, όπως ο Mann-Whitney-U. Για τον προσδιορισμό σημαντικών διαφορών μεταξύ των μαρτύρων (μάρτυρας και μάρτυρας με διαλύτη ή μέσο διασποράς), οι επαναλήψεις κάθε μάρτυρα μπορούν να ελέγχονται με τον τρόπο που περιγράφεται για την οριακή δοκιμή. Εάν με τους ελέγχους αυτούς δεν εντοπίζονται σημαντικές διαφορές, μπορεί να γίνει συγχώνευση όλων των επαναλήψεων του μάρτυρα και του μάρτυρα με διαλύτη. Διαφορετικά, όλες οι κατεργασίες θα πρέπει να συγκρίνονται με τον μάρτυρα με διαλύτη. Έκθεση δοκιμής Η έκθεση δοκιμής πρέπει να περιλαμβάνει τις ακόλουθες πληροφορίες:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Για τους σκοπούς της παρούσας μεθόδου δοκιμών χρησιμοποιούνται οι ακόλουθοι ορισμοί: Τυχαία θνησιμότητα : θνησιμότητα που δεν σχετίζεται με χημική ουσία και οφείλεται σε τυχαία επίπτωση (δηλαδή γνωστής αιτιολογίας). Χημικό προϊόν : μια ουσία ή ένα μείγμα. ECx : η συγκέντρωση της υπό δοκιμή χημικής ουσίας, διαλυμένης σε νερό, που έχει ως αποτέλεσμα να μειώνεται κατά x % η αναπαραγωγή των δαφνιών σε συγκεκριμένη περίοδο έκθεσης. Απροσδόκητη θνησιμότητα : θνησιμότητα άγνωστης αιτιολογίας που δεν σχετίζεται με χημική ουσία. Ενδογενής ρυθμός αύξησης του πληθυσμού : μέτρο της αύξησης του πληθυσμού, στο οποίο έχουν ενσωματωθεί η αναπαραγωγική απόδοση και η ειδική κατά ηλικία θνησιμότητα (1) (2) (3). Σε πληθυσμούς σε σταθερή κατάσταση είναι μηδενικός. Σε αυξανόμενους πληθυσμούς είναι θετικός και σε πληθυσμούς που συρρικνώνονται αρνητικός. Στην τελευταία περίπτωση, οι πληθυσμοί προφανώς δεν είναι βιώσιμοι και τελικώς θα εξαφανιστούν. Όριο ανίχνευσης : η χαμηλότερη ανιχνεύσιμη, όχι όμως και ποσοτικοποιημένη συγκέντρωση. Όριο προσδιορισμού : η χαμηλότερη ποσοτικά μετρήσιμη συγκέντρωση. Ελάχιστη συγκέντρωση στην οποία παρατηρείται επίδραση (Lowest Observed Effect Concentration/LOEC) : η χαμηλότερη δοκιμασθείσα συγκέντρωση στην οποία παρατηρείται ότι η χημική ουσία έχει στατιστικά σημαντική επίδραση (με p < 0,05) στην αναπαραγωγή και στη γονική θνησιμότητα, συγκριτικά με τους μάρτυρες, σε συγκεκριμένη περίοδο έκθεσης. Ωστόσο, όλες οι συγκεντρώσεις δοκιμής που υπερβαίνουν τη LOEC θα πρέπει να έχουν επιβλαβή επίδραση ίση με εκείνη που παρατηρείται στη LOEC ή μεγαλύτερη. Σε περίπτωση που δεν είναι δυνατόν να τηρηθούν οι δύο αυτοί όροι, θα πρέπει να εξηγείται πλήρως ο τρόπος επιλογής της LOEC (και, κατ' επέκταση, της NOEC). Θνησιμότητα : ένα ζώο καταγράφεται ως νεκρό εάν παραμένει ακίνητο, δηλαδή όταν δεν μπορεί να κολυμπήσει, ή εάν δεν παρατηρηθεί κίνηση των αποφύσεων ή της μετακοιλιακής περιοχής 15 δευτερόλεπτα μετά από ήπια ανατάραξη του δοχείου δοκιμής. (Εάν χρησιμοποιείται άλλος ορισμός, θα πρέπει να αναφέρεται, συνοδευόμενος από τη σχετική παραπομπή). Συγκέντρωση στην οποία δεν παρατηρείται επίδραση (No Observed Effect Concentration/NOEC) : η αμέσως χαμηλότερη της LOEC συγκέντρωση, η οποία, συγκριτικά με τους μάρτυρες, δεν έχει στατιστικά σημαντική επίδραση (p < 0,05) σε συγκεκριμένη περίοδο έκθεσης. Απόγονοι : οι νεαρές δαφνίες που γεννιούνται από τους γεννήτορες κατά τη διάρκεια της δοκιμής. Γεννήτορες : οι θηλυκές δαφνίες που είναι παρούσες κατά την έναρξη της δοκιμής και των οποίων η αναπαραγωγική απόδοση αποτελεί το αντικείμενο της μελέτης. Αναπαραγωγική απόδοση : ο αριθμός ζωντανών απογόνων των γεννητόρων, που γεννιούνται κατά τη διάρκεια της δοκιμής. Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Βιβλιογραφία
Προσάρτημα 2 ΠΑΡΑΣΚΕΥΗ ΕΠΑΚΡΙΒΩΣ ΚΑΘΟΡΙΣΜΕΝΩΝ ΘΡΕΠΤΙΚΩΝ ΜΕΣΩΝ ΕLΕΝDΤ Μ7 ΚΑΙ Μ4 Εγκλιματισμός στα θρεπτικά μέσα Elendt Μ7 και M4 Ορισμένα εργαστήρια έχουν συναντήσει δυσκολίες στη μεταφορά των δαφνιών κατευθείαν στα θρεπτικά μέσα M4 και M7. Ωστόσο, αυτές υπερνικήθηκαν ως ένα βαθμό με σταδιακό εγκλιματισμό, δηλαδή μεταφορά από το θρεπτικό μέσο του εργαστηρίου σε Elendt 30 %, κατόπιν σε Elendt 60 % και τέλος σε Elendt 100 %. Η διάρκεια των περιόδων εγκλιματισμού ενδέχεται να χρειαστεί να φθάσει τον ένα μήνα. Προετοιμασία Ιχνοστοιχεία Πρώτα παρασκευάζονται χωριστά διαλύματα παρακαταθήκης (I) των επιμέρους ιχνοστοιχείων σε νερό κατάλληλης καθαρότητας, π.χ. απιονισμένο, απεσταγμένο ή καθαρισμένο με αντίστροφη όσμωση. Από τα εν λόγω διαλύματα παρακαταθήκης (I) παρασκευάζεται ένα δεύτερο, ενιαίο διάλυμα παρακαταθήκης (II), το οποίο περιέχει όλα τα ιχνοστοιχεία (συνδυασμένο διάλυμα), δηλαδή:
Θρεπτικά μέσα Μ4 και Μ7 Παρασκευάζονται με διάλυμα παρακαταθήκης II, μακροθρεπτικά στοιχεία και βιταμίνες ως εξής:
Το διάλυμα παρακαταθήκης συνδυασμού βιταμινών φυλάσσεται στην κατάψυξη, χωρισμένο σε μερίδες. Οι βιταμίνες προστίθενται στα θρεπτικά μέσα λίγο πριν από τη χρήση.
Προσάρτημα 3 ΑΝΑΛΥΣΗ ΟΛΙΚΟΥ ΟΡΓΑΝΙΚΟΥ ΑΝΘΡΑΚΑ (TOC) ΚΑΙ ΕΚΠΟΝΗΣΗ ΝΟΜΟΓΡΑΦΗΜΑΤΟΣ ΤΗΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΑΣ ΤΩΝ ΖΩΟΤΡΟΦΩΝ ΑΠΟ ΦΥΚΗ ΣΕ TOC Αναγνωρίζεται ότι η περιεκτικότητα των ζωοτροφών από φύκη σε άνθρακα δεν μετράται κατά κανόνα άμεσα αλλά συνάγεται έμμεσα με τη βοήθεια συσχετισμών (δηλ. νομογραφημάτων), για τους οποίους χρησιμοποιούνται υποκατάστατες παράμετροι, όπως ο αριθμός κυττάρων φυκών ή η απορρόφηση του φωτός. Για τη μέτρηση του TOC θα πρέπει να προτιμάται η οξείδωση σε υψηλή θερμοκρασία έναντι άλλων μεθόδων, όπως η μέθοδος υπεριώδους ακτινοβολίας ή η μέθοδος υπερθειικού άλατος. (Για συμβουλές βλ.: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB). Για την εκπόνηση του νομογραφήματος, τα φύκη διαχωρίζονται από το θρεπτικό μέσο με φυγοκέντρηση και εν συνεχεία επανεναιωρούνται σε απεσταγμένο νερό. Μετράται η υποκατάστατη παράμετρος και η συγκέντρωση TOC σε κάθε δείγμα εις τριπλούν. Αναλύονται τυφλά δείγματα που περιέχουν απεσταγμένο νερό και η συγκέντρωση TOC σε αυτά αφαιρείται από εκείνη του δείγματος φυκών. Τα νομογραφήματα θα πρέπει να είναι γραμμικά στην περιοχή συγκεντρώσεων άνθρακα που ενδιαφέρει. Σχετικά παραδείγματα εμφαίνονται κατωτέρω.
Chlorella vulgaris, ποικιλία viridis (CCAP 211/12). Παλινδρόμηση mg/l ξηρού βάρους σε mg C/l. Δεδομένα από πυκνά εναιωρήματα κυττάρων καλλιεργειών ημισυνεχούς ροής, μετά από επανεναιώρηση σε απεσταγμένο νερό. άξονας x: mg C/l συμπυκνωμένης ζωοτροφής από φύκη άξονας y: mg/1 ξηρό βάρος συμπυκνωμένης ζωοτροφής από φύκη Διορθωτικός συντελεστής -0,980 
Chlorella vulgaris, ποικιλία viridis (CCAP 211/12). Παλινδρόμηση αριθμού κυττάρων σε mg C/l. Δεδομένα από πυκνά εναιωρήματα κυττάρων καλλιεργειών ημισυνεχούς ροής, μετά από επανεναιώρηση σε απεσταγμένο νερό. άξονας x: mg C/l συμπυκνωμένης ζωοτροφής από φύκη άξονας y: αριθ. κυττάρων/1 συμπυκνωμένης ζωοτροφής από φύκη Διορθωτικός συντελεστής -0,926 
Chlorella vulgaris, ποικιλία viridis (CCAP 211/12). Παλινδρόμηση απορρόφησης σε mg C/l (μήκος διαδρομής 1 cm). Δεδομένα από πυκνά εναιωρήματα κυττάρων καλλιεργειών ημισυνεχούς ροής, μετά από επανεναιώρηση σε απεσταγμένο νερό. άξονας x: mg C/l συμπυκνωμένης ζωοτροφής από φύκη άξονας y: Απορρόφηση στα 440 nm συμπυκνωμένης ζωοτροφής από φύκη, μετά από αραίωση 1/10 Διορθωτικός συντελεστής -0,998 Προσάρτημα 4 ΠΑΡΑΔΕΙΓΜΑ ΦΥΛΛΟΥ ΔΕΔΟΜΕΝΩΝ ΟΠΟΥ ΚΑΤΑΓΡΑΦΟΝΤΑΙ Η ΑΝΑΝΕΩΣΗ ΤΟΥ ΜΕΣΟΥ, ΦΥΣΙΚΟΧΗΜΙΚΑ ΔΕΔΟΜΕΝΑ ΠΑΡΑΚΟΛΟΥΘΗΣΗΣ, Η ΔΙΑΤΡΟΦΗ, Η ΑΝΑΠΑΡΑΓΩΓΗ ΤΩΝ ΔΑΦΝΙΩΝ ΚΑΙ Η ΓΟΝΙΚΗ ΘΝΗΣΙΜΟΤΗΤΑ
Προσάρτημα 5 ΠΑΡΑΔΕΙΓΜΑ ΦΥΛΛΟΥ ΔΕΔΟΜΕΝΩΝ ΓΙΑ ΤΗΝ ΚΑΤΑΓΡΑΦΗ ΤΩΝ ΑΠΟΤΕΛΕΣΜΑΤΩΝ ΤΩΝ ΧΗΜΙΚΩΝ ΑΝΑΛΥΣΕΩΝ α) Μετρηθείσες συγκεντρώσεις
β) Μετρηθείσες συγκεντρώσεις ως επί τοις εκατό ποσοστό της ονομαστικής τιμής
Προσάρτημα 6 ΥΠΟΛΟΓΙΣΜΟΣ ΧΡΟΝΟΣΤΑΘΜΙΣΜΕΝΗΣ ΜΕΣΗΣ ΤΙΜΗΣ Χρονοσταθμισμένη μέση τιμή Δεδομένου ότι η συγκέντρωση της υπό δοκιμή ουσίας μπορεί να μειωθεί κατά το χρονικό διάστημα ανάμεσα σε δύο ανανεώσεις του θρεπτικού μέσου, είναι απαραίτητο να εξετάζεται ποια συγκέντρωση θα πρέπει να επιλεγεί ως αντιπροσωπευτική του εύρους συγκεντρώσεων στις οποίες εκτίθενται οι γονικές δαφνίες. Η επιλογή θα πρέπει να βασίζεται τόσο σε βιολογικά όσο και σε στατιστικά κριτήρια. Εάν για παράδειγμα θεωρείται ότι η αναπαραγωγή επηρεάζεται περισσότερο από τη μέγιστη συγκέντρωση, τότε χρησιμοποιείται η μέγιστη συγκέντρωση. Εάν όμως θεωρείται ότι υπερισχύει η αθροιστική ή η μακροχρόνια επίδραση της τοξικής χημικής ουσίας, καταλληλότερος είναι ο μέσος όρος των συγκεντρώσεων. Στην περίπτωση αυτή, ενδείκνυται να χρησιμοποιείται ως μέσος όρος η χρονοσταθμισμένη μέση τιμή συγκέντρωσης, δεδομένου ότι σε αυτήν συνυπολογίζεται η μεταβολή της στιγμιαίας συγκέντρωσης με την πάροδο του χρόνου. Σχήμα 1: Παράδειγμα χρονοσταθμισμένης μέσης τιμής 
Στο σχήμα 1 εμφαίνεται παράδειγμα (απλοποιημένης) δοκιμής διάρκειας 7 ημερών με ανανέωση του θρεπτικού μέσου τις ημέρες 0, 2 και 4.
Η χρονοσταθμισμένη μέση τιμή υπολογίζεται κατά τρόπο ώστε το εμβαδόν κάτω από τη γραμμή της να ισούται με το εμβαδόν κάτω από την καμπύλη της συγκέντρωσης. Ο υπολογισμός για το ανωτέρω παράδειγμα επεξηγείται στον πίνακα 1. Πίνακας 1 Υπολογισμός χρονοσταθμισμένης μέσης τιμής
Εμβαδόν είναι το εμβαδόν κάτω από την εκθετική καμπύλη για κάθε περίοδο ανανέωσης, υπολογιζόμενο βάσει του τύπου:
Η χρονοσταθμισμένη μέση τιμή (μέση τιμή TW) είναι το πηλίκο του συνολικού εμβαδού δια του συνολικού αριθμού ημερών. Εξυπακούεται ότι για τη δοκιμή αναπαραγωγής με δαφνίες ο πίνακας θα πρέπει να επεκταθεί για να καλύψει 21 ημέρες. Είναι σαφές ότι όταν γίνεται παρατήρηση μόνο στην αρχή και στο τέλος κάθε περιόδου ανανέωσης, δεν υπάρχει δυνατότητα να επιβεβαιωθεί ότι η μείωση ακολουθεί όντως εκθετική πορεία. Διαφορετική καμπύλη θα οδηγούσε σε διαφορετικό υπολογισμό του εμβαδού. Εντούτοις, η εκθετική μείωση δεν αποκλείεται, είναι μάλιστα η προσφορότερη καμπύλη αν δεν υπάρχουν άλλες πληροφορίες. Χρειάζεται πάντως προσοχή σε περίπτωση κατά την οποία δεν ανιχνεύεται η ουσία με τη χημική ανάλυση στο τέλος της περιόδου ανανέωσης. Εάν δεν υπάρχει τρόπος να εκτιμηθεί η ταχύτητα με την οποία εξαφανίζεται η χημική ουσία από το διάλυμα, είναι αδύνατον να προκύψει ρεαλιστικό εμβαδόν κάτω από την καμπύλη και, κατ' επέκταση, εύλογη χρονοσταθμισμένη μέση τιμή. Προσάρτημα 7 ΚΑΘΟΔΗΓΗΣΗ ΓΙΑ ΤΗΝ ΑΝΑΓΝΩΡΙΣΗ ΤΟΥ ΦΥΛΟΥ ΤΩΝ ΝΕΟΓΝΩΝ Είναι δυνατόν να γεννηθούν αρσενικά νεογνά υπό μεταβαλλόμενες περιβαλλοντικές συνθήκες, όπως η συντόμευση της φωτοπεριόδου, η αλλαγή της θερμοκρασίας, η μείωση της συγκέντρωσης της τροφής και η αύξηση της πυκνότητας του πληθυσμού (Hobaek και Larson, 1990· Kleiven και συν., 1992). Η γέννηση αρσενικών απογόνων είναι επίσης γνωστή απόκριση σε ορισμένους ρυθμιστές ανάπτυξης εντόμων (Oda και συν., 2005). Υπό συνθήκες όπου χημικοί στρεσογόνοι παράγοντες προκαλούν μείωση των αναπαραγωγικών παρθενογενετικών θηλυκών ατόμων, μπορεί να αναμένεται αυξημένος αριθμός αρσενικών (ΟΟΣΑ, 2008). Με βάση τις διαθέσιμες πληροφορίες, δεν είναι δυνατόν να προβλεφθεί ποιο από τα δύο τελικά σημεία — αναλογία των φύλων ή αναπαραγωγή — θα είναι πιο ευαίσθητο· ωστόσο, υπάρχουν ενδείξεις (βλ. «Έκθεση επικύρωσης», μέρος 1) ότι αυτή η αύξηση του αριθμού των αρσενικών ατόμων μπορεί να είναι λιγότερο ευαίσθητη από την μείωση των απογόνων. Δεδομένου ότι ο πρωταρχικός σκοπός της μεθόδου δοκιμών είναι η εκτίμηση του αριθμού των απογόνων, η εμφάνιση αρσενικών ατόμων είναι προαιρετική παρατήρηση. Εάν σε μια μελέτη αξιολογείται αυτό το προαιρετικό τελικό σημείο, θα πρέπει να εφαρμόζεται ένα πρόσθετο κριτήριο εγκυρότητας της δοκιμής, συγκεκριμένα να μην υπερβαίνει το ποσοστό των αρσενικών ατόμων στους μάρτυρες το 5 %. Ο πιο πρακτικός και εύκολος τρόπος διάκρισης του φύλου της δαφνίας είναι να χρησιμοποιούνται τα φαινοτυπικά χαρακτηριστικά, δεδομένου ότι τα αρσενικά και τα θηλυκά άτομα είναι γενετικά πανομοιότυπα και το φύλο καθορίζεται από το περιβάλλον. Τα αρσενικά άτομα διαφέρουν από τα θηλυκά ως προς το μήκος και τη μορφολογία των πρώτων κεραιών, οι οποίες είναι μακρύτερες στα αρσενικά απ' ό,τι στα θηλυκά (εικόνα 1). Η διαφορά αυτή είναι αναγνωρίσιμη αμέσως μετά τη γέννηση, ενώ άλλα δευτερογενή χαρακτηριστικά του φύλου αναπτύσσονται με την πρόοδο της ηλικίας (ενδεικτικά, βλ. εικόνα 2 στη δημοσίευση των Olmstead και LeBlanc, 2000). Για την παρατήρηση του μορφολογικού φύλου, τα νεογνά κάθε ζώου δοκιμής θα πρέπει να μεταφέρονται με πιπέτα σε τρυβλίο Petri με θρεπτικό μέσο δοκιμής. Το θρεπτικό μέσο περιορίζεται στο ελάχιστο για τον περιορισμό της κίνησης των ζώων. Οι πρώτες κεραίες μπορούν να παρατηρηθούν με στερεοσκόπιο (μεγέθυνση (× 10-60). Εικόνα 1 Αρσενικό (αριστερά) και θηλυκό (δεξιά) άτομο ηλικίας 24 ωρών, του είδους D. magna. Τα αρσενικά άτομα διακρίνονται από τα θηλυκά από το μήκος και τη μορφολογία των πρώτων κεραιών, όπως φαίνεται στους κύκλους (Tatarazako και συν., 2004). 
ΒΙΒΛΙΟΓΡΑΦΙΑ Hobaek A and Larson P. 1990. Sex determination in Daphnia magna. Ecology 71: 2255-2268. Kleiven O.T., Larsson P., Hobaek A. 1992. Sexual reproduction in Daphnia magna requires three stimuli. Oikos 65, 197-206. Oda S., Tatarazako N, Watanabe H., Morita M., and Iguchi T. 2005. Production of male neonates in Daphnia magna (Cladocera, Crustacea) exposed to juvenile hormones and their analogs. Chemosphere 61:1168-1174. OECD, 2008. Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. OECD Series on Testing and Assessment, Number 88. Οργανισμός Οικονομικής Συνεργασίας και Ανάπτυξης, Παρίσι. Olmstead, A.W., LeBlanc, G.A., 2000. Effects of endocrine-active chemicals on the development characteristics of Daphnia magna. Environmental Toxicology and Chemistry 19:2107-2113. Tatarazako, N., Oda, S., Abe, R., Morita M. and Iguchi T., 2004. Development of a screening method for endocrine disruptors in crustaceans using Daphnia magna (Cladocera, Crustacea). Environmental Science 17, 439-449. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(18) |
Στο μέρος Γ και στο κεφάλαιο Γ.29, η παράγραφος 66 αντικαθίσταται από το ακόλουθο κείμενο:
|
|
(19) |
Στο μέρος Γ προστίθενται τα ακόλουθα κεφάλαια: «Γ.47 Δοκιμή τοξικότητας στα αρχικά στάδια ζωής των ψαριών ΕΙΣΑΓΩΓΗ
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΗΝ ΥΠΟ ΔΟΚΙΜΗ ΧΗΜΙΚΗ ΟΥΣΙΑ
ΕΓΚΥΡΟΤΗΤΑ ΤΗΣ ΔΟΚΙΜΗΣ
ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Δοκιμαστικοί θάλαμοι
Επιλογή είδους
Διατήρηση των γεννητόρων
Χειρισμός των γονιμοποιημένων αυγών, των εμβρύων και προνυμφών
Νερό
Διαλύματα της δοκιμής
ΔΙΑΔΙΚΑΣΙΑ Συνθήκες έκθεσης Διάρκεια
Φόρτωση
Φως και θερμοκρασία
Σίτιση
Συγκεντρώσεις της δοκιμής
Μάρτυρες
Συχνότητα αναλυτικών προσδιορισμών και μετρήσεων
Παρατηρήσεις 26. Στάδιο εμβρυϊκής ανάπτυξης : Το εμβρυϊκό στάδιο κατά την έναρξη της έκθεσης στην υπό δοκιμή χημική ουσία θα πρέπει να επαληθεύεται με όσο το δυνατόν μεγαλύτερη ακρίβεια. Η επαλήθευση μπορεί να γίνει σε αντιπροσωπευτικό δείγμα αυγών τα οποία έχουν διατηρηθεί και καθαριστεί καταλλήλως. 27. Εκκόλαψη και επιβίωση : η εκκόλαψη και η επιβίωση θα πρέπει να παρατηρούνται τουλάχιστον μία φορά ημερησίως και να καταγράφονται τα αριθμητικά δεδομένα. Εάν παρατηρηθούν μύκητες στα αυγά στα αρχικά στάδια της εμβρυϊκής ανάπτυξης (π.χ. κατά την πρώτη ή τη δεύτερη ημέρα της δοκιμής), αυτά τα αυγά θα πρέπει να καταμετρούνται και να αφαιρούνται. Τα νεκρά έμβρυα, προνύμφες και νεαρά ψάρια θα πρέπει να απομακρύνονται αμέσως μόλις γίνονται αντιληπτά, καθώς μπορεί να αποσυντεθούν ταχέως και να διαλυθούν από τις ενέργειες των άλλων ψαριών. Η απομάκρυνση των νεκρών ατόμων πρέπει να γίνεται με σχολαστική προσοχή για να μην υποστούν φυσική βλάβη τα παρακείμενα αυγά/προνύμφες. Οι ενδείξεις θανάτου διαφέρουν ανάλογα με το είδος και στάδιο του κύκλου ζωής. Για παράδειγμα:
28. Μη φυσιολογική εμφάνιση : ο αριθμός των προνυμφών ή νεαρών ψαριών που εμφανίζουν αφύσικο σχήμα σώματος θα πρέπει να καταγράφεται σε κατάλληλα χρονικά διαστήματα ανάλογα με τη διάρκεια της δοκιμής και το είδος της παρατηρούμενης ανωμαλίας. Θα πρέπει να σημειωθεί ότι είναι φυσικό να εμφανίζονται ανώμαλες προνύμφες και νεαρά ψάρια, που μπορεί να αντιπροσωπεύουν σημαντικό ποσοστό των μαρτύρων σε ορισμένα είδη. Όταν οι δυσμορφίες και η συνακόλουθη μη φυσιολογική συμπεριφορά θεωρείται ότι είναι τόσο σοβαρά ώστε να προκαλείται σημαντική ταλαιπωρία στον οργανισμό, ο οποίος έχει φθάσει σε σημείο πέραν του οποίου δεν υπάρχει δυνατότητα ανάρρωσης, ο οργανισμός επιτρέπεται να αφαιρείται από τη δοκιμή. Τα ζώα αυτά θα πρέπει να υποβάλλονται σε ευθανασία και να συνυπολογίζονται στη θνησιμότητα στη μετέπειτα ανάλυση των δεδομένων. Έχει τεκμηριωθεί φυσιολογική εμβρυϊκή ανάπτυξη για τα περισσότερα από τα είδη που συνιστώνται στην παρούσα μέθοδο δοκιμών (9) (10) (11) (12). 29. Αφύσικη συμπεριφορά : ανωμαλίες όπως ο υπεραερισμός, η μη συντονισμένη κολύμβηση, η άτυπη ηρεμία και η άτυπη συμπεριφορά σίτισης θα πρέπει να καταγράφονται σε κατάλληλα χρονικά διαστήματα ανάλογα με τη διάρκεια της δοκιμής (π.χ. μία φορά ημερησίως για τα είδη θερμών υδάτων). Αυτές οι επιδράσεις, αν και είναι δύσκολο να προσδιοριστούν ποσοτικά, μπορούν, όταν παρατηρούνται, να βοηθήσουν στην ερμηνεία των δεδομένων θνησιμότητας. 30. Βάρος : στο τέλος της δοκιμής ζυγίζονται όλα τα επιζώντα ψάρια τουλάχιστον σε μία από τις επαναλήψεις (αναφορά του αριθμού των ζώων στην επανάληψη και του μέσου βάρους ανά ζώο): αν και προτιμάται το νωπό βάρος (στέγνωμα με απορροφητικό χαρτί), μπορεί επίσης να αναφέρονται δεδομένα για το ξηρό βάρος (13). 31. Μήκος : στο τέλος της δοκιμής, μετράται το μήκος κάθε ψαριού. Συνιστάται το ολικό μήκος, αλλά αν παρουσιαστεί αποσύνθεση του ουραίου πτερυγίου ή διάβρωση πτερυγίου, μπορεί να χρησιμοποιηθεί το κανονικό μήκος. Η ίδια μέθοδος θα πρέπει να χρησιμοποιείται σε όλα τα ψάρια δεδομένης δοκιμής. Το ατομικό μήκος μπορεί να μετρηθεί με παχύμετρο, ψηφιακή φωτογραφική μηχανή ή βαθμονομημένο οπτικό μικρόμετρο. Τα συνήθη ελάχιστα μήκη καθορίζονται στο προσάρτημα 2. ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Επεξεργασία των αποτελεσμάτων
Έκθεση δοκιμής
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ
Προσάρτημα 2 ΣΥΝΘΗΚΕΣ ΔΟΚΙΜΗΣ, ΔΙΑΡΚΕΙΑ ΚΑΙ ΚΡΙΤΗΡΙΑ ΕΠΙΒΙΩΣΗΣ ΓΙΑ ΤΑ ΣΥΝΙΣΤΩΜΕΝΑ ΕΙΔΗ
Προσάρτημα 3 ΟΔΗΓΙΕΣ ΣΙΤΙΣΗΣ ΚΑΙ ΧΕΙΡΙΣΜΟΥ ΓΕΝΝΗΤΟΡΩΝ ΚΑΙ ΠΕΙΡΑΜΑΤΟΖΩΩΝ ΤΩΝ ΣΥΝΙΣΤΩΜΕΝΩΝ ΕΙΔΩΝ
Προσάρτημα 4 ΟΡΙΣΜΕΝΑ ΧΗΜΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΑΠΟΔΕΚΤΟΥ ΝΕΡΟΥ ΑΡΑΙΩΣΗΣ
Προσάρτημα 5 ΣΤΑΤΙΣΤΙΚΗ ΚΑΘΟΔΗΓΗΣΗ ΓΙΑ ΤΟΝ ΠΡΟΣΔΙΟΡΙΣΜΟ ΤΗΣ NOEC Γενικές παρατηρήσεις Η δεξαμενή επανάληψης είναι η μονάδα ανάλυσης. Συνεπώς, για συνεχείς παραμέτρους, όπως το μέγεθος, θα πρέπει να υπολογίζεται η μέση ή διάμεση τιμή των επαναλήψεων και οι εν λόγω τιμές επαναλήψεων είναι τα δεδομένα για ανάλυση. Θα πρέπει να καταδεικνύεται η ισχύς των δοκιμών που χρησιμοποιούνται, κατά προτίμηση βάσει επαρκών ιστορικών δεδομένων για κάθε εργαστήριο. Για κάθε τελικό σημείο θα πρέπει να παρέχεται, μαζί με τον στατιστικό έλεγχο που πρόκειται να χρησιμοποιηθεί, η επίδραση μεγέθους που μπορεί να ανιχνευθεί με ισχύ 75-80 %. Οι βάσεις δεδομένων που ήταν διαθέσιμες κατά την εκπόνηση της παρούσας μεθόδου δοκιμών καθορίζουν την ισχύ που επιτυγχάνουν οι συνιστώμενες στατιστικές διαδικασίες. Κάθε εργαστήριο θα πρέπει να αποδεικνύει την ικανότητά του να ανταποκρίνεται στην εν λόγω απαίτηση ισχύος, είτε διεξάγοντας ανάλυση ισχύος είτε καταδεικνύοντας ότι ο συντελεστής μεταβλητότητας (CV) για κάθε απόκριση δεν υπερβαίνει το 90ό εκατοστημόριο των CV που χρησιμοποιήθηκαν στην εκπόνηση της κατευθυντήριας γραμμής. Οι σχετικοί CV παρατίθενται στον πίνακα 1. Εάν είναι διαθέσιμες μόνο μέσες ή διάμεσες τιμές των επαναλήψεων, ο CV εντός κάθε επανάληψης μπορεί να αγνοηθεί. Πίνακας 1 CV 90ού εκατοστημορίου για επιλεγμένα είδη γλυκού νερού
Για όλες σχεδόν τις στατιστικές μεθόδους που χρησιμοποιούνται για την αξιολόγηση εργαστηριακών τοξικολογικών μελετών, οι συγκρίσεις που ενδιαφέρουν είναι εκείνες που γίνονται μεταξύ των ομάδων μεταχείρισης και των μαρτύρων. Για τον λόγο αυτό, δεν ενδείκνυται να απαιτείται έλεγχος F ANOVA με σημαντικό αποτέλεσμα πριν από τη χρήση του ελέγχου Dunnett ή Williams ούτε έλεγχος Kruskal-Wallis με σημαντικό αποτέλεσμα πριν από τη χρήση του ελέγχου Jonckheere-Terpstra, Mann-Whitney ή Dunn (Hochberg και Tamhane 1987, Hsu 1996, Dunnett 1955, 1964, Williams 1971, 1972, 1975, 1977, Robertson και συν. 1988, Jonckheere 1954, Dunn 1964). Καθώς ο έλεγχος Dunnett διαθέτει ενσωματωμένη διόρθωση ως προς την πολλαπλότητα, τα ψευδοθετικά και ψευδοαρνητικά ποσοστά του επηρεάζονται δυσμενώς από τη χρησιμοποίηση του ελέγχου F ως θυροφύλακα (gatekeeper). Ομοίως, οι εφαρμοζόμενοι με αποκλιμάκωση έλεγχοι Williams και Jonckheere-Terpstra με τη χρήση επιπέδου σημαντικότητας 0,05 σε κάθε στάδιο διατηρούν συνολικό ψευδοθετικό ποσοστό 5 %, τόσο δε το ποσοστό αυτό όσο και η ισχύς των ελέγχων επηρεάζονται δυσμενώς από τη χρησιμοποίηση του ελέγχου F ή Kruskal-Wallis ως θυροφύλακα. Οι έλεγχοι Mann-Whitney και Dunn πρέπει να διορθώνονται ως προς την πολλαπλότητα, συνιστάται δε η διόρθωση κατά Bonferroni-Holm. Διεξοδική ανάλυση των περισσότερων συστάσεων για τους ελέγχους υποθέσεων και την επαλήθευση των παραδοχών στις οποίες βασίζονται οι εν λόγω έλεγχοι παρέχεται σε έγγραφο του ΟΟΣΑ (2006), το οποίο περιλαμβάνει επίσης εκτενή βιβλιογραφία. Αντιμετώπιση των μαρτύρων όταν χρησιμοποιείται διαλύτης Εάν χρησιμοποιείται διαλύτης, θα πρέπει να περιλαμβάνονται δύο μάρτυρες: ένας με νερό αραίωσης και ένας με διαλύτη. Οι δύο μάρτυρες θα πρέπει να συγκρίνονται για κάθε απόκριση και να συνδυάζονται για στατιστική ανάλυση, εάν δεν διαπιστωθεί σημαντική διαφορά μεταξύ τους. Διαφορετικά, ο μάρτυρας με διαλύτη θα πρέπει να χρησιμοποιείται για τον προσδιορισμό της NOEC ή την εκτίμηση της ECx, ενώ ο μάρτυρας με νερό δεν χρησιμοποιείται. Βλ. περιορισμό στα κριτήρια εγκυρότητας (παράγραφος 7). Για το μήκος, το βάρος, την αναλογία εκκολαπτόμενων αυγών ή θνησιμότητας των προνυμφών ή μη φυσιολογικών προνυμφών, καθώς και για την πρώτη ή την τελευταία ημέρα επώασης ή ανάπλευσης, θα πρέπει να χρησιμοποιείται έλεγχος T ή Mann-Whitney για τη σύγκριση μεταξύ μάρτυρα με νερό αραίωσης και μάρτυρα με διαλύτη σε επίπεδο σημαντικότητας 0,05, κατά την οποία αγνοούνται όλες οι ομάδες μεταχείρισης. Τα αποτελέσματα αυτών των ελέγχων θα πρέπει να αναφέρονται. Μετρήσεις μεγέθους (μήκους και βάρους) Οι τιμές μήκους και βάρους κάθε ψαριού μπορούν να είναι κανονικά ή λογαριθμοκανονικά κατανεμημένες. Σε κάθε περίπτωση, οι μέσες τιμές των επαναλήψεων τείνουν να είναι κανονικά κατανεμημένες βάσει του κεντρικού οριακού θεωρήματος και να επιβεβαιώνονται από τα δεδομένα περισσότερων από 100 μελετών αρχικών σταδίων της ζωής με τρία ζωικά είδη του γλυκού νερού. Εναλλακτικά, όταν τα δεδομένα ή οι ιστορικές βάσεις δεδομένων υποδηλώνουν λογαριθμοκανονική κατανομή των μεμονωμένων τιμών μεγέθους των ψαριών, μπορεί να υπολογιστεί ο λογάριθμος των μέσων τιμών μεγέθους ανά επανάληψη, οπότε τα δεδομένα για ανάλυση θα είναι οι αντιλογάριθμοι των εν λόγω λογαρίθμων των μέσων τιμών των επαναλήψεων. Θα πρέπει να αξιολογείται η συμφωνία των δεδομένων με την κανονική κατανομή και την ομοιογένεια της διασποράς. Για τον σκοπό αυτό, θα πρέπει να χρησιμοποιούνται τα υπόλοιπα από μοντέλο ANOVA, με τη συγκέντρωση ως μόνη ερμηνευτική μεταβλητή ανά κατηγορία. Επιτρέπεται ο οπτικός προσδιορισμός από διαγράμματα διασποράς και ιστογράμματα ή διαγράμματα μίσχου-φύλλου. Εναλλακτικά, μπορεί να χρησιμοποιηθεί κάποιος επίσημος έλεγχος, όπως οι Shapiro-Wilk ή Anderson-Darling. Η συνέπεια με την ομοιογένεια της διασποράς μπορεί να αξιολογηθεί με οπτική εξέταση του ίδιου διαγράμματος διασποράς ή επίσημα με τον έλεγχο Levene. Η αξιολόγηση της κανονικότητας και της ομοιογένειας της διασποράς είναι αναγκαία μόνο στην περίπτωση των παραμετρικών ελέγχων (π.χ. έλεγχοι Williams, Dunnett). Πρέπει να δίνεται προσοχή στις πιθανές έκτοπες τιμές και την επίδρασή τους στην ανάλυση. Μπορεί να χρησιμοποιείται ο έλεγχος έκτοπων τιμών Tukey και ο οπτικός έλεγχος των διαγραμμάτων υπολοίπων που περιγράφονται ανωτέρω. Υπενθυμίζεται ότι οι παρατηρήσεις είναι πλήρεις επαναλήψεις και, ως εκ τούτου, οι έκτοπες τιμές θα πρέπει να παραλείπονται από την ανάλυση μόνο μετά από προσεκτική εξέταση. Οι στατιστικοί έλεγχοι που αξιοποιούν τα χαρακτηριστικά του πειραματικού σχεδιασμού και της βιολογικής προσδοκίας είναι έλεγχοι τάσης με διαδικασία αποκλιμάκωσης, όπως οι έλεγχοι Williams και Jonckheere-Terpstra. Οι έλεγχοι αυτοί λαμβάνουν ως παραδοχή μονοτονική σχέση συγκέντρωσης-απόκρισης και θα πρέπει να αξιολογείται η συμφωνία των δεδομένων με την παραδοχή αυτή. Η αξιολόγηση μπορεί να είναι οπτική από το διάγραμμα διασποράς των μέσων τιμών των επαναλήψεων συναρτήσει της συγκέντρωσης της δοκιμής. Είναι χρήσιμη η υπέρθεση του εν λόγω διαγράμματος διασποράς με μια τμηματικά γραμμική καμπύλη που συνδέει τις μέσες τιμές συγκέντρωσης, σταθμισμένες κατά το μέγεθος του δείγματος επανάληψης. Μια μεγάλη απόκλιση της τμηματικά γραμμικής καμπύλης από τη μονοτονικότητα θα αποτελούσε ένδειξη πιθανής ανάγκης να χρησιμοποιηθούν άλλοι έλεγχοι πλην των ελέγχων τάσης. Εναλλακτικά, είναι δυνατόν να χρησιμοποιηθούν επίσημοι έλεγχοι. Ένας απλός επίσημος έλεγχος συνίσταται στον υπολογισμό των γραμμικών και τετραγωνικών αντιθέσεων των μέσων τιμών συγκέντρωσης. Εάν η τετραγωνική αντίθεση είναι σημαντική, ενώ η γραμμική δεν είναι, αυτό αποτελεί ένδειξη πιθανού προβλήματος μονοτονικότητας, το οποίο θα πρέπει να αξιολογείται περαιτέρω από τα διαγράμματα. Όταν τίθεται ζήτημα κανονικότητας ή ομοιογένειας της διασποράς, οι αντιθέσεις αυτές μπορούν να υπολογιστούν από δεδομένα που έχουν μετασχηματιστεί με βάση τη σειρά κατάταξης. Είναι δυνατόν να χρησιμοποιηθούν εναλλακτικές διαδικασίες, όπως ο έλεγχος Bartholomew για τη μονοτονικότητα, αλλά περιπλέκουν την εργασία. Εικόνα 2 Διάγραμμα ροής NOEC για τις μετρήσεις μεγέθους (μήκους και βάρους). 
Εάν τα δεδομένα δεν είναι σύμφωνα με τις απαιτήσεις αυτών των ελέγχων, η NOEC προσδιορίζεται με αποκλιμακωμένη εφαρμογή του ελέγχου Williams ή Jonckheere-Terpstra. Το έγγραφο του ΟΟΣΑ (2006) παρέχει λεπτομερείς πληροφορίες για τις διαδικασίες αυτές. Για τα δεδομένα που δεν είναι σύμφωνα με τις απαιτήσεις για τους ελέγχους τάσης με αποκλιμάκωση, μπορεί να χρησιμοποιηθεί ο έλεγχος Dunnett ή Tamhane-Dunnett (T3), οι οποίοι διαθέτουν ενσωματωμένες διορθώσεις ως προς την πολλαπλότητα. Οι έλεγχοι λαμβάνουν ως παραδοχή την κανονικότητα και, στην περίπτωση του ελέγχου Dunnett, την ομοιογένεια της διασποράς. Εάν δεν πληρούνται οι προϋποθέσεις αυτές, μπορεί να χρησιμοποιηθεί ο μη παραμετρικός έλεγχος Dunn. Το έγγραφο του ΟΟΣΑ (2006) παρέχει λεπτομερείς πληροφορίες για όλες αυτές τις μεθόδους. Η εικόνα 2 παρέχει μια επισκόπηση για την εξεύρεση της προτιμητέας μεθόδου. Εκκόλαψη αυγών και επιβίωση προνυμφών Τα δεδομένα είναι οι αναλογίες εκκολαπτόμενων αυγών ή προνυμφών που επιβιώνουν στην κάθε επανάληψη. Θα πρέπει να αξιολογείται η εξωδιωνυμική διασπορά αυτών των αναλογιών, η οποία είναι συνήθης αλλά όχι καθολική σε τέτοιες μετρήσεις. Το διάγραμμα ροής στην εικόνα 3 καθοδηγεί την αναζήτηση της προτιμητέας μεθόδου· βλ. κείμενο για αναλυτικές περιγραφές. Χρησιμοποιούνται συνήθως δύο έλεγχοι. Πρόκειται για τον έλεγχο C(α) του Tarone (Tarone, 1979) και τον έλεγχο «χι τετράγωνο» (χ2), καθένας από τους οποίους εφαρμόζεται χωριστά σε κάθε συγκέντρωση της δοκιμής. Εάν διαπιστωθεί εξωδιωνυμική διασπορά έστω και σε μία συγκέντρωση της δοκιμής, θα πρέπει να χρησιμοποιηθούν υποστηρικτικές (accommodating) μέθοδοι. Τύπος 1. Έλεγχος C(α) κατά Tarone (Tarone 1979)
όπου ̂ είναι η μέση αναλογία για δεδομένη συγκέντρωση, m ο αριθμός δεξαμενών επανάληψης, nj ο αριθμός των υποκειμένων της επανάληψης j και xj ο αριθμός υποκειμένων της εν λόγω επανάληψης που αποκρίθηκαν, π.χ. δεν εκκολάφθηκαν ή ήταν νεκρά. Ο έλεγχος αυτός εφαρμόζεται σε κάθε συγκέντρωση χωριστά. Μολονότι μπορεί να θεωρηθεί ένα είδος τροποποιημένου ελέγχου χ2, οι περιορισμένες προσομοιώσεις ισχύος του Tarone έδειξαν ότι είναι ισχυρότερος από τους ελέγχους χ2. Εικόνα 3 Διάγραμμα ροής NOEC για την εκκόλαψη αυγών και τη θνησιμότητα προνυμφών 
Όταν δεν υπάρχουν σημαντικές ενδείξεις εξωδιωνυμικής διασποράς, μπορεί να χρησιμοποιηθεί ο έλεγχος Cochran-Armitage με αποκλιμάκωση. Καθώς ο έλεγχος αυτός αγνοεί τις επαναλήψεις, όταν υπάρχουν τέτοιες ενδείξεις, η διόρθωση κατά Rao-Scott του ελέγχου Cochran-Armitage (RSCA) λαμβάνει υπόψη τις επαναλήψεις, τα μεγέθη των επαναλήψεων και την εξωδιωνυμική διασπορά και συνιστάται. Εναλλακτικοί έλεγχοι είναι, μεταξύ άλλων, οι έλεγχοι Williams και Jonckheere-Terpstra με αποκλιμάκωση, καθώς και ο έλεγχος Dunnett, όπως περιγράφεται για τις μετρήσεις μεγέθους. Οι έλεγχοι αυτοί εφαρμόζονται ανεξάρτητα από την ύπαρξη εξωδιωνυμικής διασποράς, η ισχύς τους όμως είναι σχετικά μικρότερη (Agresti 2002, Morgan 1992, Rao και Scott 1992, 1999, Fung και συν. 1994, 1996). Πρώτη ή τελευταία ημέρα επώασης ή ανάπλευσης Η απόκριση είναι ακέραιος αριθμός που δηλώνει την ημέρα της δοκιμής κατά την οποία έγινε η αναφερόμενη παρατήρηση για δεδομένη δεξαμενή επανάληψης. Το εύρος τιμών είναι γενικά πολύ περιορισμένο και υπάρχει συχνά υψηλό ποσοστό όμοιων τιμών, π.χ. η ίδια πρώτη ημέρα εκκόλαψης παρατηρείται σε όλες τις επαναλήψεις των μαρτύρων και, ίσως, σε μία ή δύο χαμηλές συγκεντρώσεις της δοκιμής. Οι παραμετρικοί έλεγχοι, όπως των Williams και Dunnett, δεν είναι κατάλληλοι για τα εν λόγω δεδομένα. Ο έλεγχος Jonckheere-Terpstra με αποκλιμάκωση είναι πολύ ισχυρός για την ανίχνευση των επιδράσεων της υπό δοκιμή χημικής ουσίας, εφόσον δεν υπάρχουν στοιχεία σοβαρής έλλειψης μονοτονικότητας. Διαφορετικά, μπορεί να χρησιμοποιηθεί ο έλεγχος Dunn. Ανωμαλίες προνυμφών Η απόκριση είναι ο αριθμός των προνυμφών που διαπιστώνεται ότι για κάποιο λόγο δεν είναι φυσιολογικές. Η απόκριση αυτή είναι συνήθως χαμηλής επίπτωσης και παρουσιάζει ορισμένα από τα ίδια προβλήματα όπως η πρώτη ημέρα εκκόλαψης, επιπλέον δε, σε ορισμένες περιπτώσεις, ακανόνιστη σχέση συγκέντρωσης-απόκρισης. Εάν τα δεδομένα ακολουθούν τουλάχιστον σε γενικές γραμμές ένα μονοτονικό σχήμα συγκέντρωσης, ο έλεγχος Jonckheere-Terpstra με αποκλιμάκωση είναι ισχυρός για την ανίχνευση των επιδράσεων. Διαφορετικά, μπορεί να χρησιμοποιηθεί ο έλεγχος Dunn. ΒΙΒΛΙΟΓΡΑΦΙΑ Agresti, A. (2002); Categorical Data Analysis, second edition, Wiley, Hoboken. Dunnett C. W. (1955); A multiple comparison procedure for comparing several treatments with a control, J. American Statistical Association 50, 1096-1121. Dunn O. J. (1964 ); Multiple Comparisons Using Rank Sums, Technometrics 6, 241-252. Dunnett C. W. (1964); New tables for multiple comparisons with a control, Biometrics 20, 482-491. Fung, K.Y., D. Krewski, J.N.K. Rao, A.J. Scott (1994); Tests for Trend in Developmental Toxicity Experiments with Correlated Binary Data, Risk Analysis 14, 639-648. Fung, K.Y, D. Krewski, R.T. Smythe (1996); A comparison of tests for trend with historical controls in carcinogen bioassay, Canadian Journal of Statistics 24, 431-454. Hochberg, Y. and A. C. Tamhane (1987); Multiple Comparison Procedures, Wiley, New York. Hsu, J.C. (1996); Multiple Comparisons: Theory and Methods; Chapman and Hall/CRC Press, Boca Raton. Jonckheere, A. R. (1954); A distribution-free k-sample test against ordered alternatives, Biometrika 41, 133. Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London. OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series on Testing and Assessment, Αρ. 54. Organisation for Economic Co-operation and Development, OECD, Paris.. Rao J.N.K. and Scott A.J. (1992) — A simple method for the analysis of clustered binary data, Biometrics 48, 577-585. Rao J.N.K. and Scott A.J. (1999) — A simple method for analyzing overdispersion in clustered Poisson data, Statistics in Medicine 18, 1373-1385. Robertson, T., Wright F.T. and Dykstra R.L. (1988); Order restricted statistical inference, Wiley. Tarone, R.E. (1979); Testing the goodness of fit of the Binomial distribution, Biometrika 66, 585-590. Williams D.A. (1971); A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics 27, 103-117. Williams D.A. (1972); The comparison of several dose levels with a zero dose control, Biometrics 28, 519-531. Williams D. A. (1975); The Analysis of Binary Responses from Toxicological Experiments Involving Reproduction and Teratotlogy, Biometrics 31, 949-952. Williams D.A. (1977); Some inference procedures for monotonically ordered normal means, Biometrika 64, 9-14. Προσάρτημα 6 ΣΤΑΤΙΣΤΙΚΗ ΚΑΘΟΔΗΓΗΣΗ ΓΙΑ ΤΙΣ ΕΚΤΙΜΗΣΕΙΣ ΠΑΛΙΝΔΡΟΜΗΣΗΣ Γενικές παρατηρήσεις Οι παρατηρήσεις που χρησιμοποιούνται για την προσαρμογή μοντέλων είναι οι μέσες τιμές των επαναλήψεων (μήκους και βάρους) ή οι αναλογίες των επαναλήψεων (εκκόλαψης αυγών και θνησιμότητας προνυμφών) (ΟΟΣΑ 2006). Συνιστάται γενικά η σταθμισμένη παλινδρόμηση με τη χρήση του μεγέθους δείγματος επανάληψης ως συντελεστή στάθμισης. Μπορεί να χρησιμοποιηθούν και άλλα συστήματα στάθμισης, όπως η στάθμιση με την προβλεπόμενη μέση απόκριση ή ένας συνδυασμός αυτής και του μεγέθους δείγματος επανάληψης. Δεν συνιστάται στάθμιση με την αντίστροφη δειγματική διασπορά εντός συγκέντρωσης (Bunke και συν. 1999, Seber και Wild, 2003, Motulsky και Christopoulos 2004, Huet και συν. 2003). Κάθε μετασχηματισμός αποκρίσεων πριν από την ανάλυση θα πρέπει να διατηρεί την ανεξαρτησία των παρατηρήσεων, η δε ECx και τα όρια εμπιστοσύνης θα πρέπει να εκφράζονται στις αρχικές μονάδες μέτρησης και όχι σε μετασχηματισμένες μονάδες. Για παράδειγμα, μια μεταβολή κατά 20 % στον λογάριθμο του μήκους δεν ισοδυναμεί με μεταβολή του μήκους κατά 20 % (Lyles και συν. 2008, Draper και Smith 1999). Το διάγραμμα ροής στην εικόνα 4 παρέχει μια επισκόπηση των εκτιμήσεων της ECx. Οι λεπτομέρειες περιγράφονται στο κείμενο που ακολουθεί. Εικόνα 4: Διάγραμμα ροής για την εκτίμηση της ECx βάσει του μέσου μήκους ή βάρους των επαναλήψεων ή της αναλογίας εκκολαπτόμενων αυγών ή θνησιμότητας προνυμφών των επαναλήψεων· για περισσότερες λεπτομέρειες, βλ. κείμενο 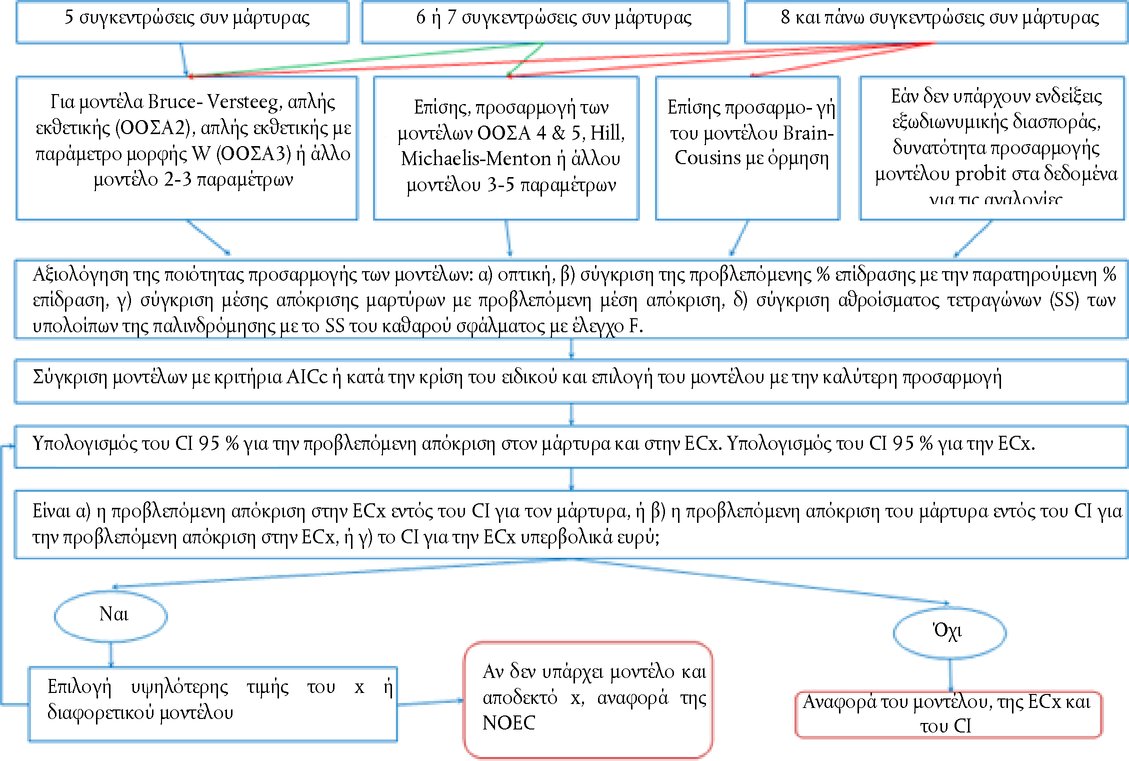
Εκτιμήσεις για την εκκόλαψη αυγών και τη θνησιμότητα προνυμφών Όσον αφορά την εκκόλαψη αυγών και τη θνησιμότητα προνυμφών, κατά κανόνα το καλύτερο είναι να προσαρμόζεται ένα φθίνον μοντέλο, εκτός αν προσαρμόζεται μοντέλο probit, όπως περιγράφεται κατωτέρω. Δηλαδή, πρέπει να μοντελοποιείται η αναλογία μη εκκολαπτόμενων αυγών ή νεκρών προνυμφών. Αυτό οφείλεται στο ότι η ECx αναφέρεται σε μια συγκέντρωση στην οποία επέρχεται μεταβολή ίση με x % της μέσης απόκρισης των μαρτύρων. Για παράδειγμα, αν το ποσοστό της αποτυχίας εκκόλαψης στον μάρτυρα είναι 5 % και μοντελοποιηθεί η αποτυχία εκκόλαψης, η τιμή EC20 αναφέρεται στη συγκέντρωση στην οποία επέρχεται μεταβολή ίση με 20 % του ποσοστού αποτυχίας εκκόλαψης 5 %, το οποίο σημαίνει μεταβολή 0,2 * 0,05 = 0,01 ή κατά 1 ποσοστιαία μονάδα, με αποτέλεσμα ποσοστό αποτυχίας εκκόλαψης 6 %. Μια τόσο μικρή μεταβολή δεν είναι δυνατόν να εκτιμηθεί από τα διαθέσιμα δεδομένα κατά τρόπο που να έχει σημασία και δεν είναι σημαντική από βιολογική άποψη. Εάν όμως μοντελοποιηθεί η αναλογία εκκολαπτόμενων αυγών, η αναλογία στους μάρτυρες θα είναι 95 % στο παράδειγμα αυτό και μια μείωση της μέσης τιμής των μαρτύρων κατά 20 % θα ισοδυναμεί με μεταβολή 0,95 * 0,2 = 0,18, δηλ. ποσοστό επιτυχίας εκκόλαψης από 95 % σε 77 % (= 95 – 18) και αυτή η συγκέντρωση επίδρασης μπορεί να εκτιμηθεί και είναι κατά τεκμήριο σημαντικότερη. Δεν τίθεται τέτοιο ζήτημα με τις μετρήσεις μεγέθους, αν και δυσμενείς επιδράσεις στο μέγεθος συνεπάγονται κατά κανόνα μείωση μεγέθους. Μοντέλα για το μέγεθος (μήκος ή βάρος) και την επιτυχία εκκόλαψης αυγών ή την επιβίωση προνυμφών Εκτός από το μοντέλο Brain-Cousens με όρμηση, όλα αυτά τα μοντέλα περιγράφονται και συνιστώνται στο έγγραφο του ΟΟΣΑ (2006). Τα επονομαζόμενα μοντέλα ΟΟΣΑ 2-5 εξετάζονται επίσης για πειράματα οικοτοξικότητας στη δημοσίευση Slob (2002). Πολλά άλλα διαθέσιμα μοντέλα θα ήταν, ασφαλώς, χρήσιμα. Οι Bunke και συν. (1999) παραθέτουν πολυάριθμα μοντέλα που δεν περιλαμβάνονται στο παρόν προσάρτημα, ενώ υπάρχουν πολλές βιβλιογραφικές παραπομπές σε άλλα μοντέλα. Αυτά που απαριθμούνται στη συνέχεια προτείνονται ως κατ' εξοχήν κατάλληλα για πειράματα οικοτοξικότητας και χρησιμοποιούνται ευρέως. Με 5 συγκεντρώσεις δοκιμής συν μάρτυρα
Με 6 ή περισσότερες συγκεντρώσεις δοκιμής συν μάρτυρα
Όταν υπάρχουν οπτικές ενδείξεις όρμησης (απίθανο στην περίπτωση της επιτυχίας εκκόλαψης αυγών ή της επιβίωσης προνυμφών, αλλά ενίοτε διακρίνονται στις παρατηρήσεις μεγέθους)
Εναλλακτικά μοντέλα για την αποτυχία εκκόλαψης αυγών και τη θνησιμότητα προνυμφών
Ποιότητα προσαρμογής μεμονωμένου μοντέλου
Σύγκριση μοντέλων
Ποιότητα της εκτίμησης της ECx Το διάστημα εμπιστοσύνης (CI) για την ECx δεν θα πρέπει να είναι υπερβολικά ευρύ. Απαιτείται στατιστική κρίση για τον καθορισμό του εύρους του διαστήματος εμπιστοσύνης που εξακολουθεί να δίνει χρήσιμη ECx. Οι προσομοιώσεις της προσαρμογής μοντέλων παλινδρόμησης σε δεδομένα για την εκκόλαψη αυγών και για το μέγεθος δείχνουν ότι περίπου το 75 % των διαστημάτων εμπιστοσύνης για την ECx (x = 10, 20 ή 30) καλύπτουν το πολύ δύο συγκεντρώσεις δοκιμής. Αυτό παρέχει μια γενική κατεύθυνση για το τι είναι αποδεκτό και αποτελεί πρακτικό οδηγό για το τι είναι εφικτό. Πολλοί συγγραφείς υποστηρίζουν ότι είναι αναγκαία η αναφορά των διαστημάτων εμπιστοσύνης για όλες τις παραμέτρους τoυ μοντέλου και ότι διαστήματα εμπιστοσύνης με μεγάλο εύρος δηλώνουν μη αποδεκτά μοντέλα (Ott και Longnecker 2008, Alvord και Rossio 1993, Motulsky και Christopoulos 2004, Lyles και συν. 2008, Seber και Wild 2003, Bunke και συν 1999, Environment Canada 2005). Το διάστημα εμπιστοσύνης (CI) για την ECx (ή οποιαδήποτε άλλη παράμετρο του μοντέλου) δεν θα πρέπει να περιέχει το μηδέν (Motulsky και Christopoulos 2004). Είναι η παλινδρόμηση που ισοδυναμεί με την ελάχιστη σημαντική διαφορά η οποία αναφέρεται συχνά στις προσεγγίσεις ελέγχου υποθέσεων (π.χ. Wang και συν. 2000). Επίσης, αντιστοιχεί στο διάστημα εμπιστοσύνης ώστε οι μέσες αποκρίσεις στη LOEC να μην περιέχουν τη μέση τιμή των μαρτύρων. Θα πρέπει να τίθεται το ερώτημα αν οι εκτιμήσεις των παραμέτρων είναι επιστημονικά ευλογοφανείς. Για παράδειγμα, εάν το διάστημα εμπιστοσύνης για τη μεταβλητή y0 είναι ± 20 %, καμία εκτίμηση της EC10 δεν είναι ευλογοφανής. Εάν το μοντέλο προβλέπει επίδραση 20 % σε μια συγκέντρωση C και η μέγιστη παρατηρούμενη επίδραση στη C και στις χαμηλότερες συγκεντρώσεις είναι 10 %, η EC20 δεν είναι ευλογοφανής (Motulsky και Christopoulos 2004, Wang και συν. 2000, Environment Canada 2005). Για την ECx δεν θα πρέπει να χρειάζεται παρέκταση εκτός του εύρους των θετικών συγκεντρώσεων (Draper και Smith 1999, ΟΟΣΑ 2006). Για παράδειγμα, μια πιθανή γενική κατεύθυνση θα μπορούσε να ορίζει ότι η ECx δεν πρέπει να είναι χαμηλότερη από την κατώτατη συγκέντρωση της δοκιμής ή υψηλότερη από την ανώτατη κατά περισσότερο από 25 % περίπου. ΒΙΒΛΙΟΓΡΑΦΙΑ Alvord, W.G., Rossio, J.L. (1993); Determining confidence limits for drug potency in immunoassay, Journal of Immunological Methods 157, 155-163. Brain P. and Cousens R. (1989); An equation to describe dose responses where there is stimulation of growth at low doses. Weed res. 29: 93-96. Bunke, O., Droge, B. and Polzehl, J. (1999). Model selection, transformations and variance estimation in nonlinear regression. Statistics 33, 197-240. Collett, D. (2002); Modelling Binary Data, second edition, Chapman and Hall, London. Collett, D. (2003); Modelling Survival Data in Medical Research, second edition, Chapman and Hall, London. Draper, N.R. and Smith, H. (1999); Applied Regression Analysis, third edition. New York: John Wiley & Sons. Environment Canada (2005). Guidance Document on Statistical Methods for Environmental Toxicity Tests, Report EPS 1/RM/46 Huet, S., A. Bouvier, M.-A. Poursat, E. Jolivet (2003); Statistical Tools for Nonlinear Regression: A Practical Guide with S-PLUS and R Examples, Springer Series in Statistics, New York. Lyles, R. H., C. Poindexter, A. Evans, M. Brown, and C.R. Cooper (2008); Nonlinear Model-Based Estimates of IC50 for Studies Involving Continuous Therapeutic Dose-Response Data, Contemp Clin Trials. 2008 November; 29(6): 878-886. Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London. Motulsky, H., A. Christopoulos (2004); Fitting Models to Biological Data Using Linear and Nonlinear Regression: A Practical Guide to Curve Fitting, Oxford University Press, USA. O'Hara Hines, R. J. and J. F. Lawless (1993); Modelling Overdispersion in Toxicological Mortality Data Grouped over Time, Biometrics Vol. 49, pp. 107-121 OECD (2006); Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series Testing and Assessment, No. 54, Organisation for Economic Co-operation and Development, OECD, Paris. Ott, R.L., M.T. Longnecker, An Introduction to Statistical Methods and Data Analysis, sixth edition, 2008, Brooks-Cole, Belmont, CA Ratkowsky, D.A. (1993); Principles of nonlinear regression, Journal of Industrial Microbiology 12, 195-199. Seber, G.A.F., C.J. Wild, Nonlinear Regression, Wiley, 2003 Slob W. (2002); Dose-response modelling of continuous endpoints. Toxicol. Sci., 66, 298-312 Wang, Q., D.L. Denton, and R. Shukla (2000); Applications and Statistical Properties Of Minimum Significant Difference-Based Criterion Testing In a Toxicity Testing Program, Environmental Toxicology and Chemistry, Vol. 19, pp. 113–117, 2000. Γ.48 Βραχυπρόθεσμη δοκιμή αναπαραγωγής σε ψάρια ΕΙΣΑΓΩΓΗ
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
ΚΡΙΤΗΡΙΑ ΑΠΟΔΟΧΗΣ ΤΗΣ ΔΟΚΙΜΗΣ
ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Εργαστηριακός εξοπλισμός
Νερό
Διαλύματα της δοκιμής
Διατήρηση των ψαριών
Προέκθεση και επιλογή των ψαριών
ΣΧΕΔΙΑΣΜΟΣ ΤΗΣ ΔΟΚΙΜΗΣ
Επιλογή των συγκεντρώσεων δοκιμής
ΔΙΑΔΙΚΑΣΙΑ Επιλογή και ζύγιση των υπό δοκιμή ψαριών
Συνθήκες έκθεσης Διάρκεια
Σίτιση
Φως και θερμοκρασία
Συχνότητα αναλυτικών προσδιορισμών και μετρήσεων
Παρατηρήσεις
Επιβίωση
Συμπεριφορά και εμφάνιση
Γονιμότητα
Ανώδυνη θανάτωση των ψαριών
Παρατήρηση των δευτερογενών χαρακτηριστικών του φύλου
Βιτελογενίνη (VTG)
Αξιολόγηση της ιστοπαθολογικής εικόνας των γονάδων
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Αξιολόγηση των αποκρίσεων βιοδεικτών με ανάλυση διασποράς (ANOVA)
Αναφορά των αποτελεσμάτων των δοκιμών
ΚΑΘΟΔΗΓΗΣΗ ΓΙΑ ΤΗΝ ΕΡΜΗΝΕΙΑ ΚΑΙ ΤΗΝ ΑΠΟΔΟΧΗ ΤΩΝ ΑΠΟΤΕΛΕΣΜΑΤΩΝ ΤΗΣ ΔΟΚΙΜΗΣ
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΣΥΝΤΜΗΣΕΙΣ ΚΑΙ ΟΡΙΣΜΟΙ Άξονας HPG : ο άξονας υποθαλάμου-υπόφυσης-γονάδων. ΜΑΣ : Μέγιστη Ανεκτή Συγκέντρωση, που αντιπροσωπεύει περίπου 10 % της LC50. Πληθυσμιακή πυκνότητα : ο αριθμός ψαριών κατ' όγκο νερού. Πληθυσμιακός φόρτος : το νωπό βάρος των ψαριών κατ' όγκο νερού. Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Χημική ουσία : μια ουσία ή ένα μείγμα. CV : Συντελεστής μεταβλητότητας ELISA : ενζυμικός ανοσοπροσροφητικός προσδιορισμός VTG : η βιτελογενίνη — φωσφολιπογλυκοπρωτεΐνη που αποτελεί πρόδρομη ένωση των πρωτεϊνών της λεκίθου του αυγού και συναντάται κανονικά σε σεξουαλικά ενεργά θηλυκά άτομα όλων των ωοτόκων ειδών. Προσάρτημα 2 ΠΕΙΡΑΜΑΤΙΚΕΣ ΣΥΝΘΗΚΕΣ ΓΙΑ ΤΗ ΔΟΚΙΜΗ ΕΝΔΟΚΡΙΝΙΚΗΣ ΔΙΑΛΟΓΗΣ ΣΕ ΨΑΡΙΑ
Προσάρτημα 3 ΟΡΙΣΜΕΝΑ ΧΗΜΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΑΠΟΔΕΚΤΟΥ ΝΕΡΟΥ ΑΡΑΙΩΣΗΣ
Προσάρτημα 4A ΥΠΟΣΤΡΩΜΑ ΩΟΤΟΚΙΑΣ ΓΙΑ ΖΕΒΡΟΨΑΡΑ Δίσκος ωοτοκίας : δίσκος εργαστηριακών σκευών, εξ ολοκλήρου από γυαλί, για παράδειγμα διαστάσεων 22 × 15 × 5,5 cm (μήκος x× πλάτος × ύψος), καλυμμένος με αποσπώμενο συρμάτινο πλέγμα από ανοξείδωτο χάλυβα (με οπές πλάτους 2mm). Το πλέγμα θα πρέπει να καλύπτει το άνοιγμα του δίσκου εργαστηριακών σκευών σε επίπεδο χαμηλότερο από το χείλος. 
Πάνω στο πλέγμα θα πρέπει να στερεωθεί υπόστρωμα ωοτοκίας, το οποίο θα πρέπει να αποτελεί μια κατασκευή που επιτρέπει στα ψάρια να εισχωρούν σε αυτή. Για παράδειγμα, κατάλληλα είναι τα τεχνητά φυτά ενυδρείου, κατασκευασμένα από πράσινο πλαστικό υλικό (Σημ.: θα πρέπει να λαμβάνεται υπόψη το ενδεχόμενο προσρόφησης της υπό δοκιμή χημικής ουσίας στο πλαστικό υλικό). Το πλαστικό υλικό θα πρέπει να εκπλένεται σχολαστικά με επαρκή ποσότητα θερμού νερού για επαρκές χρονικό διάστημα, ώστε να διασφαλίζεται ότι δεν πρόκειται να ελευθερωθούν χημικές ουσίες στο νερό της δοκιμής. Όταν χρησιμοποιούνται γυάλινα υλικά, θα πρέπει να διασφαλίζεται ότι τα ψάρια δεν θα τραυματιστούν ούτε θα συνωθούνται κατά τη διάρκεια ζωηρών κινήσεων. Η απόσταση μεταξύ του δίσκου και των γυάλινων τοιχωμάτων θα πρέπει να είναι τουλάχιστον 3 cm για να εξασφαλίζεται ότι δεν αποτίθενται αυγά εκτός του δίσκου. Τα αυγά που αποτίθενται πάνω στον δίσκο πέφτουν μέσα από το πλέγμα και μπορούν να συλλεχθούν 45-60 λεπτά μετά την έναρξη του φωτισμού. Τα διαφανή αυγά δεν προσκολλώνται και μπορούν εύκολα να καταμετρηθούν με τη χρήση εγκάρσιου φωτός. Όταν χρησιμοποιούνται πέντε θηλυκά άτομα ανά δοχείο, μέχρι 20 αυγά ημερησίως μπορούν να θεωρηθούν χαμηλός αριθμός, μέχρι 100 μέτριος και πάνω από 100 υψηλός αριθμός. Ο δίσκος ωοτοκίας αφαιρείται, συλλέγονται τα αυγά και ο δίσκος επανεισάγεται στο δοκιμαστικό δοχείο, είτε όσο το δυνατόν αργότερα το βράδυ είτε πολύ νωρίς το πρωί. Ο δίσκος θα πρέπει να επανεισάγεται το αργότερο ύστερα από μία ώρα, διαφορετικά το σήμα από το υπόστρωμα ωοτοκίας μπορεί να επαγάγει μεμονωμένα ζευγαρώματα και ωοτοκία σε ασυνήθη χρόνο. Εάν μια κατάσταση επιβάλλει να εισαχθεί αργότερα ο δίσκος ωοτοκίας, αυτό θα πρέπει να γίνει τουλάχιστον 9 ώρες μετά την έναρξη του φωτισμού. Την προχωρημένη αυτή ώρα της ημέρας δεν επάγεται πλέον ωοτοκία. Προσάρτημα 4B ΥΠΟΣΤΩΜΑ ΩΟΤΟΚΙΑΣ ΓΙΑ ΧΟΝΤΡΟΚΕΦΑΛΟΥΣ ΦΟΞΙΝΟΥΣ Σε κάθε δοκιμαστικό θάλαμο τοποθετούνται δύο ή τρία συνδυασμένα πλαστικά/κεραμικά/γυάλινα ή από ανοξείδωτο χάλυβα πλακίδια και δίσκοι ωοτοκίας (π.χ. τεμάχιο ημικυκλικής υδρορροής χρώματος γκρι, μήκους 80 mm, στερεωμένο επάνω σε δίσκο με ανυψωμένα άκρα μήκους 130 mm) (βλ. εικόνα). Καταλλήλως πατιναρισμένα πλακίδια από PVC ή κεραμικό υλικό έχει αποδειχθεί ότι ενδείκνυνται ως υπόστρωμα ωοτοκίας (Thorpe και συν., 2007). Συνιστάται τράχυνση των πλακιδίων για να βελτιώνεται η πρόσφυση. Ο δίσκος θα πρέπει επίσης να διαθέτει διαχωριστικό ώστε να μην έχουν τα ψάρια πρόσβαση στα πεσμένα αυγά, εκτός εάν έχει αποδειχθεί η απόδοση πρόσφυσης των αυγών για το χρησιμοποιούμενο υπόστρωμα ωοτοκίας. 
Η βάση είναι σχεδιασμένη έτσι ώστε να συγκρατεί τα αυγά που ενδεχομένως δεν προσκολλώνται στην επιφάνεια των πλακιδίων και, ως εκ τούτου, θα μπορούσαν να πέσουν στον πυθμένα της δεξαμενής (ή εκείνα που αποτίθενται απευθείας επάνω στην επίπεδη πλαστική βάση). Όλα τα υποστρώματα ωοτοκίας θα πρέπει να εκπλένονται τουλάχιστον για 12 ώρες, με νερό αραίωσης, πριν από τη χρήση. Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98. Προσάρτημα 5A ΑΞΙΟΛΟΓΗΣΗ ΤΩΝ ΔΕΥΤΕΡΟΓΕΝΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΦΥΛΟΥ ΣΤΟΝ ΧΟΝΤΡΟΚΕΦΑΛΟ ΦΟΞΙΝΟ ΓΙΑ ΤΗΝ ΑΝΙΧΝΕΥΣΗ ΟΡΙΣΜΕΝΩΝ ΕΝΔΟΚΡΙΝΙΚΑ ΔΡΑΣΤΙΚΩΝ ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ Επισκόπηση Τα δυνητικά σημαντικά χαρακτηριστικά της φυσικής εμφάνισης των ενηλίκων χοντροκέφαλων φοξίνων σε δοκιμές ενδοκρινικών διαταρακτών περιλαμβάνουν το χρώμα του σώματος (ανοικτό/σκούρο), τα μοτίβα χρωματισμού (παρουσία ή απουσία κάθετων λωρίδων), το σχήμα του σώματος (σχήμα κεφαλής και θωρακικής περιοχής, διάταση κοιλίας) και εξειδικευμένα δευτερογενή χαρακτηριστικά του φύλου (αριθμός και μέγεθος των γαμήλιων φυματίων, μέγεθος του ραχιαίου σπογγώδους εξογκώματος και του ωοθέτη). Τα γαμήλια φυμάτια βρίσκονται στην κεφαλή (ραχιαίο σπογγώδες εξόγκωμα) του αναπαραγωγικά ενεργού αρσενικού χοντροκέφαλου φοξίνου και είναι συνήθως διατεταγμένα με αμφίπλευρη συμμετρία (Jensen και συν. 2001). Οι θηλυκοί μάρτυρες και οι νεαροί αρσενικοί και θηλυκοί φοξίνοι δεν παρουσιάζουν ανάπτυξη φυματίων (Jensen και συν. 2001). Έως και οκτώ μεμονωμένα φυμάτια μπορούν να υπάρχουν γύρω από τα μάτια και μεταξύ των ρωθώνων των αρσενικών ατόμων. Τα περισσότερα και μεγαλύτερα φυμάτια βρίσκονται σε δύο παράλληλες γραμμές ακριβώς κάτω από τους ρώθωνες και πάνω από το στόμα. Σε πολλά ψάρια υπάρχουν ομάδες φυματίων κάτω από την κάτω γνάθο· τα εγγύτερα στο στόμα απαντώνται γενικά ως ένα και μοναδικό ζεύγος, ενώ η ομάδα που βρίσκεται προς την κοιλιά μπορεί να αποτελείται από έως και τέσσερα φυμάτια. Οι πραγματικοί αριθμοί φυματίων σπάνια υπερβαίνουν τα 30 (εύρος 18-28· Jensen και συν. 2001). Τα πιο κοινά φυμάτια (από άποψη αριθμού) απαντώνται ως χωριστή, σχετικά στρογγυλή δομή, με ύψος περίπου ίσο με την ακτίνα. Τα περισσότερα αναπαραγωγικά ενεργά αρσενικά άτομα διαθέτουν επίσης ορισμένα, τουλάχιστον, φυμάτια που είναι τόσο διευρυμένα και πρόδηλα ώστε να μην είναι διακριτά ως μεμονωμένες δομές. Ορισμένα είδη ενδοκρινοδιαταρακτικών χημικών ουσιών μπορούν να προκαλέσουν ανώμαλη εμφάνιση ορισμένων δευτερογενών χαρακτηριστικών του φύλου στο αντίθετο φύλο· για παράδειγμα, αγωνιστές των υποδοχέων ανδρογόνων, όπως η 17α-μεθυλοτεστοστερόνη ή η 17β-τρενβολόνη, μπορούν να προκαλέσουν την ανάπτυξη γαμήλιων φυματίων σε θηλυκούς χοντροκέφαλους φοξίνους (Smith 1974· Ankley και συν 2001, 2003), ενώ αγωνιστές των υποδοχέων οιστρογόνων ενδέχεται να μειώσουν τον αριθμό ή το μέγεθος των γαμήλιων φυματίων στα αρσενικά άτομα (Miles-Richardson και συν. 1999· Harries και συν. 2000). Ακολουθεί περιγραφή του χαρακτηρισμού των γαμήλιων φυματίων σε χοντροκέφαλους φοξίνους βάσει των διαδικασιών που χρησιμοποιούνται στο εργαστήριο της Υπηρεσίας Προστασίας του Περιβάλλοντος των ΗΠΑ, στο Duluth της Mινεσότα. Τα διάφορα προϊόντα και/ή ο εξοπλισμός μπορούν να αντικατασταθούν με συγκρίσιμα διαθέσιμα υλικά. Η παρατήρηση επιτυγχάνεται καλύτερα με τη χρήση μεγεθυντικού φακού με φωτισμό ή στερεοσκοπίου με φωτισμό και μεγέθυνση 3x. Εξετάζονται τα ψάρια νωτιαίως και με την πρόσθια πλευρά προς τα εμπρός (η κεφαλή προς την πλευρά του εξεταστή).
Καταμέτρηση και αξιολόγηση των φυματίων Έχουν προσδιοριστεί έξι συγκεκριμένες περιοχές για την αξιολόγηση της παρουσίας και της ανάπτυξης φυματίων στους ενήλικους χοντροκέφαλους φοξίνους. Εκπονήθηκε υπόδειγμα για τη χαρτογράφηση της θέσης και της ποσότητας των υπαρχόντων φυματίων (βλ. τέλος του παρόντος προσαρτήματος). Ο αριθμός φυματίων καταγράφεται και το μέγεθός τους μπορεί να ταξινομηθεί ποσοτικά ως εξής: 0-απουσία, 1-παρόν, 2-διευρυμένο και 3-πρόδηλο για κάθε οργανισμό (εικόνα 1). Κλάση 0- απουσία φυματίων. Κλάση 1-παρόν φυμάτιο, χαρακτηριζόμενο ως κάθε φυμάτιο που έχει ένα μόνο σημείο του οποίου το ύψος είναι σχεδόν ίσο με την ακτίνα του. Κλάση 2-διευρυμένο φυμάτιο, χαρακτηριζόμενο από ιστό που μοιάζει με αστερίσκο στην όψη και διαθέτει συνήθως μεγάλη ακτινωτή βάση με ραβδώσεις ή αύλακες που ξεκινούν από το κέντρο. Η κορυφή του φυματίου είναι συχνά πιο οδοντωτή αλλά μπορεί να είναι ελαφρώς στρογγυλεμένη σε μερικές περιπτώσεις. Κλάση 3-πρόδηλο φυμάτιο, συνήθως πολύ μεγάλο και στρογγυλεμένο με λιγότερο σαφή δομή. Σε μερικές περιπτώσεις τα εν λόγω φυμάτια συρρέουν σχηματίζοντας ενιαία μάζα κατά μήκος μιας μεμονωμένης περιοχής ή ενός συνδυασμού περιοχών (Β, Γ και Δ, όπως περιγράφεται παρακάτω). Ο χρωματισμός και το σχέδιο είναι παρόμοια με εκείνα της κλάσης 2, αλλά σε μερικές περιπτώσεις αρκετά απροσδιόριστα. Η χρήση του εν λόγω συστήματος κατάταξης οδηγεί κατά κανόνα σε συνολική βαθμολογία φυματίων < 50 σε έναν φυσιολογικό αρσενικό μάρτυρα που διαθέτει από 18 έως 20 φυμάτια (Jensen και συν. 2001). Εικόνα 1 
Ο πραγματικός αριθμός φυματίων σε ορισμένα ψάρια μπορεί να είναι μεγαλύτερος από τα διαθέσιμα τετραγωνίδια του υποδείγματος για δεδομένη περιοχή κατάταξης. Στην περίπτωση αυτή, επιτρέπεται να σημειωθούν επιπλέον αριθμοί κλάσεων εντός, στα δεξιά ή στα αριστερά του τετραγωνιδίου. Ως εκ τούτου, το υπόδειγμα δεν χρειάζεται να εμφανίζει συμμετρία. Ως πρόσθετη τεχνική για τη χαρτογράφηση φυματίων που είναι σε ζεύγη ή συνδέονται κάθετα κατά μήκος του οριζόντιου επιπέδου του στόματος μπορούν να σημειωθούν δύο κλάσεις φυματίων στο ίδιο τετραγωνίδιο. Περιοχές χαρτογράφησης:
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 5Β ΑΞΙΟΛΟΓΗΣΗ ΤΩΝ ΔΕΥΤΕΡΟΓΕΝΩΝ ΧΑΡΑΚΤΗΡΙΣΤΙΚΩΝ ΤΟΥ ΦΥΛΟΥ ΣΤΟ ΡΥΖΟΨΑΡΟ ΓΙΑ ΤΗΝ ΑΝΙΧΝΕΥΣΗ ΟΡΙΣΜΕΝΩΝ ΕΝΔΟΚΡΙΝΙΚΑ ΔΡΑΣΤΙΚΩΝ ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ Ακολουθεί περιγραφή της μέτρησης των θηλοειδών αποφύσεων (*10), που είναι τα δευτερογενή χαρακτηριστικά του φύλου στο ρυζόψαρο (Oryzias latipes).
Μέτρηση
Εικόνα 1. Διάγραμμα που απεικονίζει τη διαφορά των φύλων ως προς το σχήμα και το μέγεθος του εδρικού πτερυγίου. Α, αρσενικό· B, θηλυκό. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218. 
Εικόνα 2. A, Αποφύσεις σε αρθρικές πλάκες ακτίνας εδρικού πτερυγίου. J.P., αρθρική πλάκα· A.S., αξονικός χώρος· P., απόφυση. B, άπω άκρο της ακτίνας του πτερυγίου. Τα ακτινοτρίχια (Act.) βρίσκονται στην άκρη. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218. 
Εικόνα 3. Φωτογραφία του σώματος του ψαριού που δείχνει το σημείο τομής όταν η γονάδα πρόκειται να μονιμοποιηθεί σε διάλυμα μονιμοποίησης διαφορετικό του ουδέτερου διαλύματος φορμαλδεΰδης 10 % (φορμόλη) στο οποίο έχει προστεθεί ρυθμιστικό διάλυμα. Σε αυτή την περίπτωση, το υπόλοιπο σώμα αποκόπτεται μεταξύ της πρόσθιας περιοχής του εδρικού πτερυγίου και του πρωκτού με ξυριστική λεπίδα (κόκκινη γραμμή) και το τμήμα του σώματος του ψαριού με την κεφαλή τοποθετείται στο μονιμοποιητικό διάλυμα για τη γονάδα, ενώ το ουραίο τμήμα του σώματος του ψαριού τοποθετείται σε ουδέτερο διάλυμα φορμαλδεΰδης 10 % στο οποίο έχει προστεθεί ρυθμιστικό διάλυμα. 
Προσάρτημα 6 ΣΥΝΙΣΤΩΜΕΝΕΣ ΔΙΑΔΙΚΑΣΙΕΣ ΣΥΛΛΟΓΗΣ ΔΕΙΓΜΑΤΩΝ ΓΙΑ ΤΗΝ ΑΝΑΛΥΣΗ ΒΙΤΕΛΟΓΕΝΙΝΗΣ Θα πρέπει να λαμβάνεται μέριμνα ώστε να αποτρέπεται η διασταυρούμενη μόλυνση μεταξύ των δειγμάτων VTG αρσενικών και θηλυκών ατόμων. Διαδικασία 1A: Χοντροκέφαλος φοξίνος, αιμοληψία από την ουραία φλέβα/αρτηρία Μετά την αναισθητοποίηση, αποκόπτεται μερικώς ο ουραίος μίσχος με λεπίδα νυστεριού και συλλέγεται αίμα από την ουραία φλέβα/αρτηρία με ηπαρινισμένο τριχοειδή σωλήνα μικροαιματοκρίτη. Αφού συλλεχθεί το αίμα, απομονώνεται γρήγορα το πλάσμα με φυγοκέντρηση για 3 λεπτά σε 15 000 g (ή εναλλακτικά για 10 λεπτά σε 15 000 g στους 4 °C). Εάν κριθεί σκόπιμο, μπορεί να προσδιοριστεί ο αιματοκρίτης μετά τη φυγοκέντρηση. Στη συνέχεια, το κλάσμα πλάσματος απομακρύνεται από τον σωλήνα μικροαιματοκρίτη και φυλάσσεται σε σωλήνα φυγοκέντρου με 0,13 μονάδες απροτινίνης (αναστολέας πρωτεάσης) στους – 80 °C μέχρι τον προσδιορισμό της VTG. Ανάλογα με το μέγεθος του χοντροκέφαλου φοξίνου (το οποίο εξαρτάται από το φύλο), οι όγκοι πλάσματος που μπορούν να συλλεχθούν κυμαίνονται γενικά ανάμεσα σε 5 και 60 μικρόλιτρα ανά ψάρι (Jensen και συν. 2001). Διαδικασία 1B: Χοντροκέφαλος φοξίνος, αιμοληψία από την καρδιά Εναλλακτικά, είναι επίσης δυνατόν να συλλεχθεί αίμα με καρδιακή παρακέντηση με χρήση ηπαρινισμένης σύριγγας (1 000 μονάδες ηπαρίνης ανά ml). Το αίμα μεταγγίζεται σε σωλήνες Eppendorf (που διατηρούνται σε πάγο) και στη συνέχεια φυγοκεντρείται (5 λεπτά, 7 000 g, θερμοκρασία δωματίου). Το πλάσμα θα πρέπει να μεταγγίζεται σε καθαρούς σωλήνες Eppendorf (σε κλάσματα εφόσον ο όγκος του πλάσματος το καθιστά εφικτό) και να καταψύχεται αμέσως στους – 80 °C μέχρι την ανάλυση (Panter και συν., 1998). Διαδικασία 2A: Ρυζόψαρο, εκτομή του ήπατος Απομάκρυνση των υπό δοκιμή ψαριών από τον δοκιμαστικό θάλαμο
Εκτομή του ήπατος
Μετά την εκτομή του ήπατος, το νεκρό σώμα του ψαριού είναι διαθέσιμο για ιστολογική εξέταση των γονάδων και μέτρηση των δευτερογενών χαρακτηριστικών του φύλου. Δείγμα Τα δείγματα ήπατος που λαμβάνονται από τα υπό δοκιμή ψάρια φυλάσσονται στους ≤ -70 °C εάν δεν πρόκειται να χρησιμοποιηθούν για προκατεργασία αμέσως μετά την εκτομή. Εικόνα 1 Πραγματοποιείται τομή με ψαλίδι ακριβώς μπροστά από τα θωρακικά πτερύγια. 
Εικόνα 2 Τέμνεται η κοιλία κατά μήκος του άξονα συμμετρίας της με ψαλίδι μέχρι περίπου 2 mm από την κρανιακή πλευρά του πρωκτού. 
Εικόνα 3 Τα κοιλιακά τοιχώματα ανοίγονται με λαβίδα ώστε να αποκαλυφθούν το ήπαρ και τα άλλα εσωτερικά όργανα. (Εναλλακτικά, επιτρέπεται να καρφιτσωθούν τα κοιλιακά τοιχώματα στα πλάγια). Το βέλος δείχνει το ήπαρ. 
Εικόνα 4 Το ήπαρ ανατέμνεται με αμβλύ όργανο και εκτέμνεται με λαβίδα. 
Εικόνα 5 Τα έντερα ανασύρονται με απαλές κινήσεις με τη βοήθεια λαβίδας. 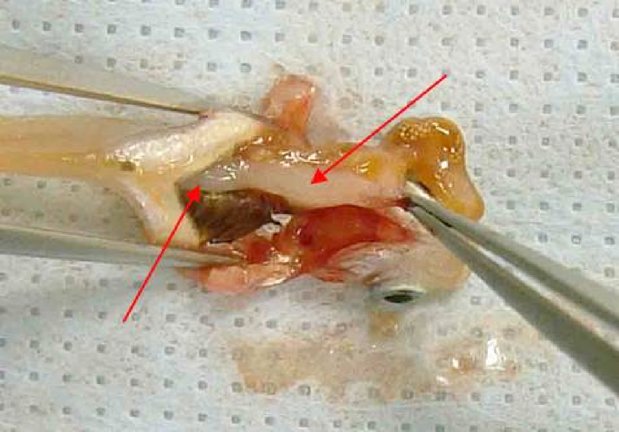
Εικόνα-6 Τα δύο άκρα των εντέρων και τα σημεία πρόσφυσης του μεσεντερίου αποκόπτονται με ψαλίδι. 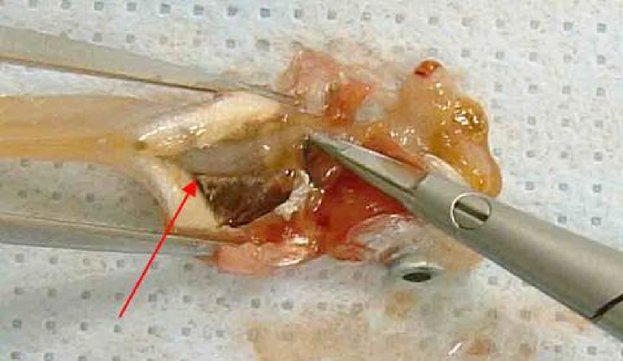
Εικόνα 7 (θηλυκό) Η διαδικασία είναι πανομοιότυπη για τα θηλυκά άτομα. 
Εικόνα 8 Η ολοκληρωμένη διαδικασία. 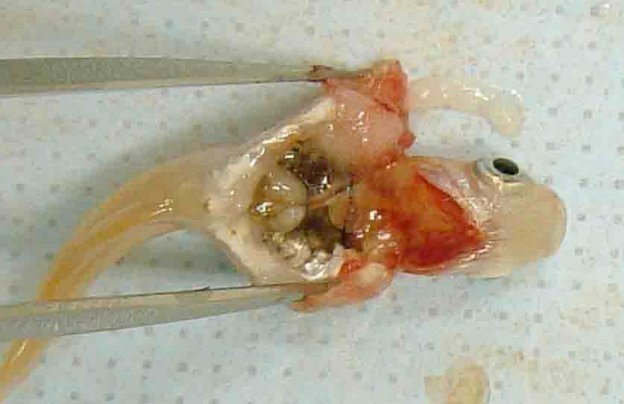
Διαδικασία 2B: Ρυζόψαρο (Oryzias latipes), προκατεργασία ήπατος για ανάλυση βιτελογενίνης Λαμβάνεται η φιάλη με το ρυθμιστικό διάλυμα ομογενοποίησης από το κιτ ELISA και ψύχεται με θρυμματισμένο πάγο (θερμοκρασία του διαλύματος: ≤ 4 °C). Αν χρησιμοποιείται ρυθμιστικό διάλυμα ομογενοποίησης από σύστημα EnBio ELISA, αποψύχεται σε θερμοκρασία δωματίου και, στη συνέχεια, η φιάλη ψύχεται με θρυμματισμένο πάγο. Υπολογίζεται ο όγκος του ρυθμιστικού διαλύματος ομογενοποίησης για το ήπαρ βάσει του βάρους του (50 μl ρυθμιστικού διαλύματος ομογενοποίησης ανά mg βάρους ήπατος). Για παράδειγμα, εάν το βάρος του ήπατος είναι 4,5 mg, ο όγκος του ρυθμιστικού διαλύματος ομογενοποίησης για το ήπαρ θα είναι 225 μl. Καταρτίζεται κατάλογος με τον όγκο ρυθμιστικού διαλύματος ομογενοποίησης για όλα τα ήπατα. Προετοιμασία του ήπατος για την προκατεργασία
Εκτέλεση της προκατεργασίας 1) Προσθήκη του ρυθμιστικού διαλύματος ομογενοποίησης Εξακριβώνεται από τον κατάλογο ο όγκος ρυθμιστικού διαλύματος ομογενοποίησης που πρέπει να χρησιμοποιηθεί για το εκάστοτε δείγμα ήπατος και ρυθμίζεται μικροπιπέτα (εύρος όγκου: 100-1 000 μl) στον κατάλληλο όγκο. Εφαρμόζεται καθαρό ρύγχος στη μικροπιπέτα. Το ρυθμιστικό διάλυμα ομογενοποίησης λαμβάνεται από τη φιάλη αντιδραστηρίου και προστίθεται στο μικροσωληνάριο των 1,5 ml που περιέχει το ήπαρ. Προστίθεται ρυθμιστικό διάλυμα ομογενοποίησης σε όλα τα μικροσωληνάρια των 1,5 ml που περιέχουν ήπαρ, σύμφωνα με τη διαδικασία που περιγράφεται παραπάνω. Δεν υπάρχει λόγος να αλλάζεται το ρύγχος της μικροπιπέτας. Ωστόσο, εάν το ρύγχος μολυνθεί ή υπάρχει υπόνοια ότι έχει μολυνθεί, θα πρέπει να αντικαθίσταται. 2) Ομογενοποίηση του ήπατος
3) Φυγοκέντρηση του εναιωρήματος ομογενοποιημένου ήπατος
4) Συλλογή του υπερκείμενου υγρού
Φύλαξη του δείγματος Τα μικροσωληνάρια των 0,5 ml που περιέχουν το υπερκείμενο υγρό του ομογενοποιημένου ήπατος φυλάσσονται στους ≤ – 70 °C έως ότου χρησιμοποιηθούν στον προσδιορισμό ELISA. Διαδικασία 3A: Ρυζόψαρο, αιμοληψία από την ουραία φλέβα/αρτηρία Αμέσως μετά την αναισθητοποίηση, αποκόπτεται εγκαρσίως ο ουραίος μίσχος και αφαιρείται το αίμα από την ουραία αρτηρία/φλέβα με ηπαρινισμένο τριχοειδή σωλήνα μικροαιματοκρίτη. Ο όγκος του αίματος κυμαίνεται μεταξύ 5 και 15 μικρόλιτρων ανάλογα με το μέγεθος του ψαριού. Στον μικροτριχοειδή σωλήνα προστίθεται ίσος όγκος ρυθμιστικού διαλύματος απροτινίνης (6 μικρογραμμάρια/ml σε PBS) και διαχωρίζεται το πλάσμα από το αίμα με φυγοκέντρηση (5 λεπτά στα 600 g). Το πλάσμα συλλέγεται σε δοκιμαστικούς σωλήνες και φυλάσσεται στους – 20 °C έως ότου διεξαχθεί ανάλυση για VTG ή άλλες πρωτεΐνες που αποτελούν αντικείμενο ενδιαφέροντος. Διαδικασία 3B: Ζεβρόψαρο, αιμοληψία μέσω καρδιακής παρακέντησης Για να αποφευχθεί η πήξη του αίματος και η αποδόμηση των πρωτεϊνών, τα δείγματα συλλέγονται μέσα σε φυσιολογικό ορό με ρυθμιστικό διάλυμα φωσφορικών αλάτων (phosphate-buffered saline, PBS), που περιέχει ηπαρίνη (1 000 μονάδες/ml) και τον αναστολέα πρωτεάσης απροτινίνη (2 TIU/ml). Ως συστατικά για το ρυθμιστικό διάλυμα συνιστώνται το μετ' αμμωνίου άλας της ηπαρίνης και η λυοφιλιωμένη απροτινίνη. Για την αιμοληψία συνιστάται σύριγγα (1 ml) με σταθερή λεπτή βελόνα (π.χ. Braun Omnikan-F). Η σύριγγα θα πρέπει να είναι προπληρωμένη με ρυθμιστικό διάλυμα (περίπου 100 μικρόλιτρα) για να εκλούονται πλήρως οι μικροί όγκοι αίματος από κάθε ψάρι. Τα δείγματα αίματος λαμβάνονται με καρδιακή παρακέντηση. Αρχικά, τα ψάρια θα πρέπει να αναισθητοποιούνται με MS-222 (100 mg/l). Το κατάλληλο επίπεδο αναισθησίας επιτρέπει στον χρήστη να διακρίνει τον καρδιακό παλμό του ζεβρόψαρου. Κατά την καρδιακή παρακέντηση το έμβολο της σύριγγας διατηρείται υπό ελαφρά έλξη. Οι συλλέξιμοι όγκοι αίματος κυμαίνονται ανάμεσα σε 20 και 40 μικρόλιτρα. Μετά την καρδιακή παρακέντηση, το μείγμα αίματος/ρυθμιστικού διαλύματος εισάγεται στον δοκιμαστικό σωλήνα. Το πλάσμα διαχωρίζεται από το αίμα με φυγοκέντρηση (20 λεπτά· 5 000g) και θα πρέπει να φυλάσσεται στους – 80 °C έως ότου χρησιμοποιηθεί για ανάλυση. Διαδικασία 3Γ: Τυποποιημένη διαδικασία (SOP): Ζεβρόψαρο, ομογενοποίηση κεφαλής και ουράς
Προσάρτημα 7 ΔΕΙΓΜΑΤΑ ΕΜΠΛΟΥΤΙΣΜΕΝΑΜΕ ΒΙΤΕΛΟΓΕΝΙΝΗ ΚΑΙ ΠΡΟΤΥΠΟ ΑΝΑΦΟΡΑΣ ΜΕΤΑΞΥ ΔΟΚΙΜΩΝ Κάθε ημέρα κατά την οποία εκτελούνται δοκιμές VTG, αναλύεται ένα εμπλουτισμένο δείγμα που παρασκευάζεται με χρήση προτύπου αναφοράς μεταξύ δοκιμών. Η VTG που χρησιμοποιείται για την παρασκευή του προτύπου αναφοράς μεταξύ δοκιμών προέρχεται από διαφορετική παρτίδα από εκείνη που χρησιμοποιείται για την παρασκευή των προτύπων βαθμονόμησης για την εκτελούμενη δοκιμή. Το εμπλουτισμένο δείγμα παρασκευάζεται με την προσθήκη γνωστής ποσότητας του προτύπου αναφοράς μεταξύ δοκιμών σε δείγμα πλάσματος αρσενικού μάρτυρα. Το δείγμα εμπλουτίζεται ώστε να επιτευχθεί συγκέντρωση VTG 10πλάσια έως 100πλάσια της αναμενόμενης συγκέντρωσης βιτελογενίνης στα αρσενικά ψάρια-μάρτυρες. Το δείγμα πλάσματος αρσενικού μάρτυρα που εμπλουτίζεται μπορεί να προέρχεται από μεμονωμένο ψάρι ή να είναι σύνθετο, προερχόμενο από περισσότερα ψάρια. Υποβάλλεται σε ανάλυση ένα μερικό δείγμα μη εμπλουτισμένου πλάσματος αρσενικού μάρτυρα σε δύο τουλάχιστον διπλές μικροκοιλότητες πλάκας. Το εμπλουτισμένο δείγμα αναλύεται και αυτό σε δύο τουλάχιστον διπλές μικροκοιλότητες πλάκας. Η μέση ποσότητα βιτελογενίνης στα δύο μη εμπλουτισμένα δείγματα πλάσματος αρσενικού μάρτυρα προστίθεται στην υπολογιζόμενη ποσότητα VTG που έχει προστεθεί στα εμπλουτισμένα δείγματα, ώστε να προκύψει η αναμενόμενη συγκέντρωση. Ο λόγος της εν λόγω αναμενόμενης συγκέντρωσης προς τη μετρούμενη συγκέντρωση θα πρέπει να αναφέρεται μαζί με τα αποτελέσματα κάθε σειράς δοκιμών που διενεργούνται τη συγκεκριμένη ημέρα. Προσάρτημα 8 ΔΙΑΓΡΑΜΜΑ ΛΗΨΗΣ ΑΠΟΦΑΣΕΩΝ ΓΙΑ ΤΗ ΣΤΑΤΙΣΤΙΚΗ ΑΝΑΛΥΣΗ 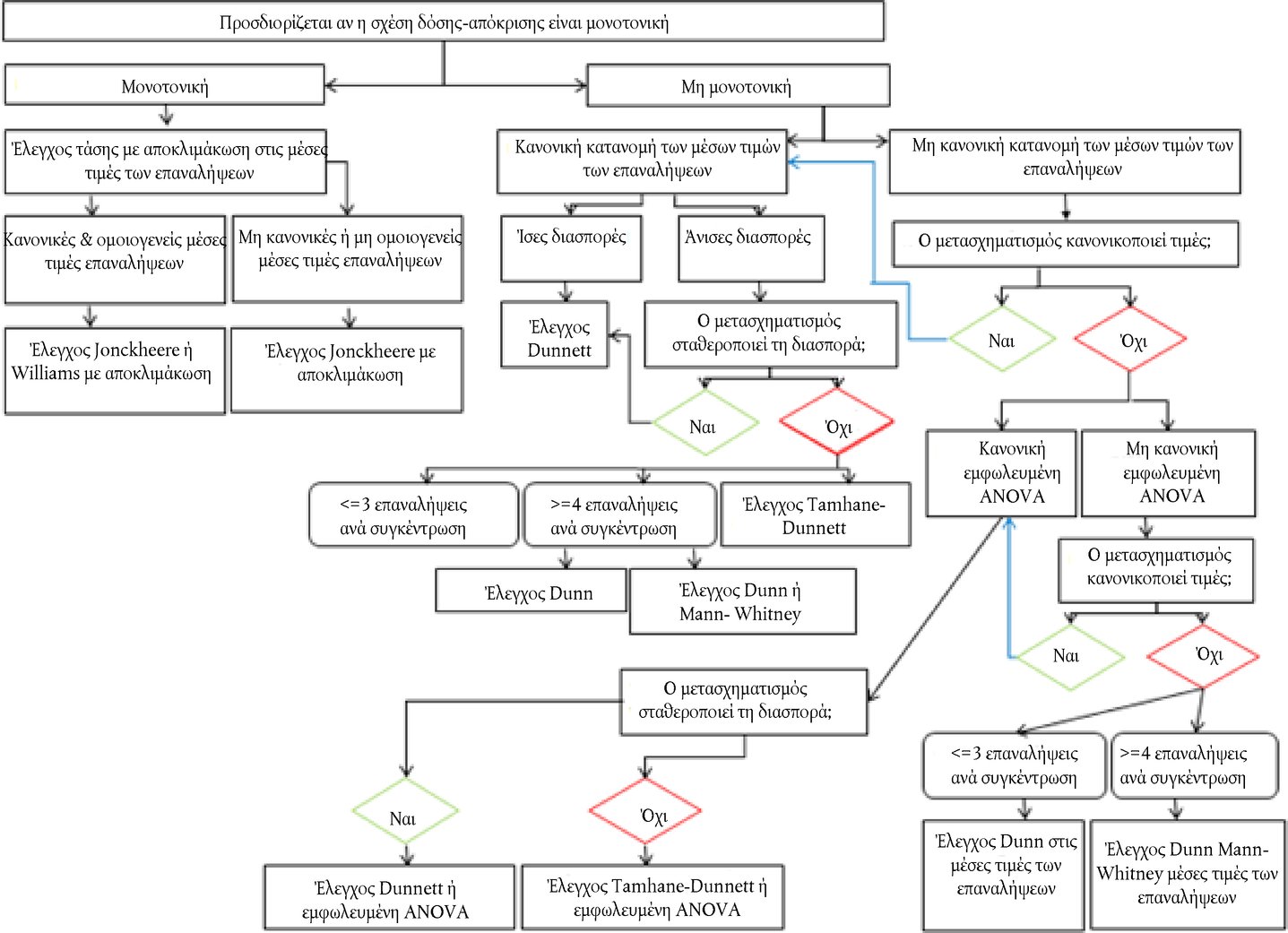
Γ.49 Δοκιμή οξείας τοξικότητας σε έμβρυα ψαριών (FET) ΕΙΣΑΓΩΓΗ
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ
ΕΓΚΥΡΟΤΗΤΑ ΤΗΣ ΔΟΚΙΜΗΣ
ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ
Εργαστηριακός εξοπλισμός
Δοκιμαστικοί θάλαμοι
Νερό και συνθήκες δοκιμής
Διαλύματα δοκιμής
Διατήρηση των γεννητόρων
Δοκιμή τεχνικής ικανότητας
Παραγωγή αυγών
Διαφοροποίηση των αυγών
ΔΙΑΔΙΚΑΣΙΑ Συνθήκες έκθεσης
Συγκεντρώσεις δοκιμής
Μάρτυρες
Έναρξη της έκθεσης και διάρκεια της δοκιμής
Κατανομή των αυγών στις πλάκες 24 μικροκοιλοτήτων
Παρατηρήσεις
Αναλυτικές μετρήσεις
ΟΡΙΑΚΗ ΔΟΚΙΜΗ
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Επεξεργασία των αποτελεσμάτων
Έκθεση δοκιμής
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Βλαστίδιο : κυτταρικός σχηματισμός γύρω από τον ζωικό πόλο που καλύπτει ένα μέρος της λεκίθου. Δοκιμή συνεχούς ροής : δοκιμή με συνεχή ροή των διαλυμάτων δοκιμής μέσω του συστήματος δοκιμής κατά τη διάρκεια της έκθεσης. Επιβολή : ο μαζικός πολλαπλασιασμός κυρίως επιδερμικών κυττάρων στη φάση της γαστριδίωσης του εμβρύου και η μετακίνησή τους από τη νωτιαία στην κοιλιακή πλευρά, με την οποία ενδοδερμικές κυτταρικές στιβάδες εσωτερικεύονται με μια διαδικασία που προσομοιάζει με εγκόλπωση και η λέκιθος ενσωματώνεται στο έμβρυο. Εσωτερικός μάρτυρας πλάκας : εσωτερικός μάρτυρας αποτελούμενος από 4 μικροκοιλότητες ανά πλάκα 24 μικροκοιλοτήτων, πληρούμενες με νερό αραίωσης, για τον εντοπισμό πιθανής μόλυνσης των πλακών από τον κατασκευαστή ή από τον ερευνητή κατά τη διάρκεια της διαδικασίας, καθώς και τυχόν επίδρασης πλάκας που ενδεχομένως επηρεάζει το αποτέλεσμα της δοκιμής (π.χ. βαθμίδωση θερμοκρασίας). Ημιστατική δοκιμή με ανανέωση : δοκιμή με τακτική ανανέωση των διαλυμάτων δοκιμής μετά από καθορισμένες περιόδους (π.χ. κάθε 24 ώρες). Κορυφαίο τελικό σημείο : που έχει επίδραση σε επίπεδο πληθυσμού. Μέση θανατηφόρος συγκέντρωση (LC50) : η συγκέντρωση της υπό δοκιμή χημικής ουσίας που εκτιμάται ότι είναι θανατηφόρος για το 50 % των υπό δοκιμή οργανισμών κατά τη διάρκεια της δοκιμής. Νερό διατήρησης : νερό στο οποίο εκτρέφονται τα ενήλικα ψάρια. Στατική δοκιμή : δοκιμή στην οποία τα διαλύματα δοκιμής παραμένουν αμετάβλητα καθ' όλη τη διάρκεια της δοκιμής. Σωμίτης : στα αναπτυσσόμενα έμβρυα σπονδυλωτών, οι σωμίτες είναι μάζες μεσοδέρματος κατανεμημένες στα πλάγια του νευρικού σωλήνα, που τελικά θα αναπτύξουν το χόριο (δερμοτόμιο), τους σκελετικούς μύες (μυοτόμιο) και τους σπονδύλους (σκληροτόμιο). Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών Χημική ουσία : μια ουσία ή ένα μείγμα IUPAC : Διεθνής Ένωση Καθαρής και Εφαρμοσμένης Χημείας. SMILES : Simplified Molecular Input Line Entry Specification (Προδιαγραφή Απλοποιημένης Μοριακής Γραμμικής Γραφής) UVCB : ουσίες άγνωστης ή μεταβλητής σύνθεσης, σύμπλοκα προϊόντα αντίδρασης ή βιολογικά υλικά Προσάρτημα 2 ΔΙΑΤΗΡΗΣΗ, ΑΝΑΠΑΡΑΓΩΓΗ ΚΑΙ ΤΥΠΙΚΕΣ ΣΥΝΘΗΚΕΣ ΣΤΙΣ ΔΟΚΙΜΕΣ ΟΞΕΙΑΣ ΤΟΞΙΚΟΤΗΤΑΣ ΣΕ ΕΜΒΡΥΑ ΖΕΒΡΟΨΑΡΟΥ
Προσάρτημα 3 ΦΥΣΙΟΛΟΓΙΚΗ ΑΝΑΠΤΥΞΗ ΖΕΒΡΟΨΑΡΩΝ ΣΤΟΥΣ 26 °C 
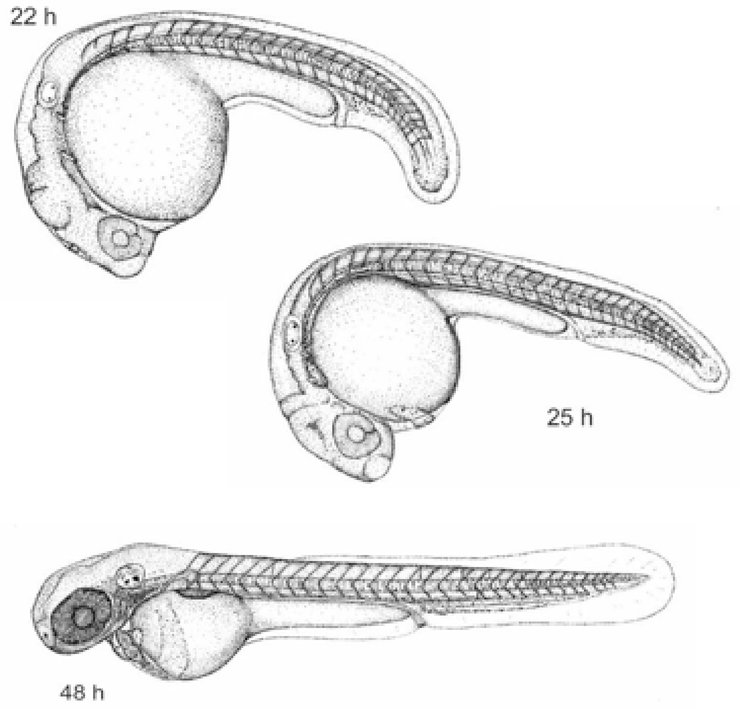
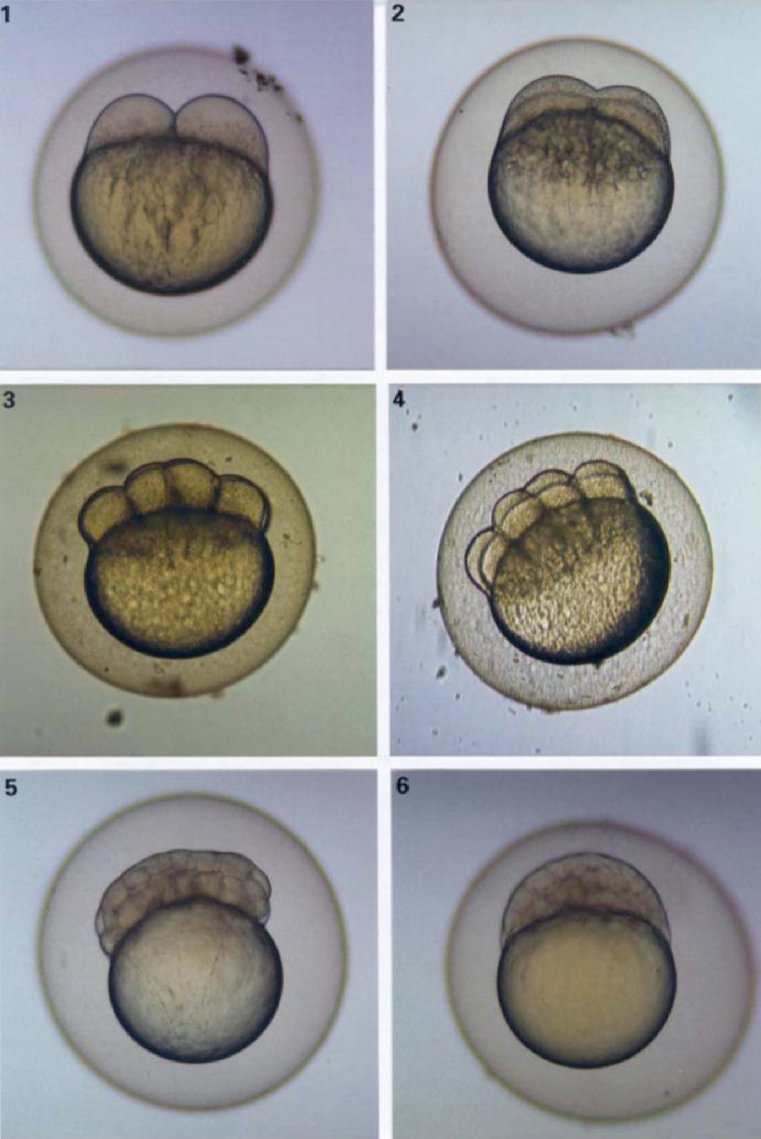
Προσάρτημα 4 Εικόνα 1 Σχεδιάγραμμα των πλακών των 24 μικροκοιλοτήτων 
Εικόνα 2 Διάγραμμα της διαδικασίας δοκιμής οξείας τοξικότητας σε έμβρυα ζεβρόψαρου (από αριστερά προς τα δεξιά): παραγωγή αυγών, συλλογή των αυγών, προέκθεση αμέσως μετά τη γονιμοποίηση σε γυάλινα δοχεία, επιλογή των γονιμοποιημένων αυγών με ανεστραμμένο ή διοφθάλμιο μικροσκόπιο και κατανομή των γονιμοποιημένων αυγών σε πλάκες 24 μικροκοιλοτήτων που έχουν προετοιμαστεί με τις αντίστοιχες συγκεντρώσεις δοκιμής/μάρτυρες, n = αριθμός αυγών που απαιτούνται ανά συγκέντρωση δοκιμής/μάρτυρα (εν προκειμένω 20), hpf = ώρες μετά τη γονιμοποίηση. 
Προσάρτημα 5 ΑΤΛΑΣ ΘΑΝΑΤΗΦΟΡΩΝ ΤΕΛΙΚΩΝ ΣΗΜΕΙΩΝ ΓΙΑ ΤΗ ΔΟΚΙΜΗ ΟΞΕΙΑΣ ΤΟΞΙΚΟΤΗΤΑΣ ΣΕ ΕΜΒΡΥΑ ΖΕΒΡΟΨΑΡΟΥ Τα ακόλουθα κορυφαία τελικά σημεία υποδηλώνουν οξεία τοξικότητα και, κατά συνέπεια, τον θάνατο των εμβρύων: πήξη του εμβρύου, απουσία απόσπασης της ουράς, απουσία σχηματισμού σωμιτών και απουσία καρδιακού παλμού. Οι ακόλουθες φωτομικρογραφίες έχουν επιλεγεί για να επεξηγήσουν αυτά τα τελικά σημεία. Εικόνα 1 Πήξη του εμβρύου: 
Με φωτισμό φωτεινού πεδίου, τα πηγμένα έμβρυα ζεβρόψαρου παρουσιάζουν ποικίλα αδιαφανή έγκλειστα. Εικόνα 2 Απουσία σχηματισμού σωμιτών: 
Αν και με περίπου 10ωρη καθυστέρηση ανάπτυξης, το έμβρυο ζεβρόψαρου 24 ωρών στην εικόνα α) παρουσιάζει καλώς ανεπτυγμένους σωμίτες (→), ενώ στην εικόνα β) δεν παρουσιάζει σημεία σχηματισμού σωμιτών (→). Αν και εμφανίζει έντονο οίδημα λεκιθικού σάκου (*), το έμβρυο ζεβρόψαρου 48 ωρών στην εικόνα γ) παρουσιάζει σαφή σχηματισμό σωμιτών (→), ενώ το έμβρυο ζεβρόψαρου 96 ωρών στην εικόνα δ) δεν παρουσιάζει σημεία σχηματισμού σωμιτών (→). Επισημαίνεται επίσης το κύρτωμα της σπονδυλικής στήλης (σκολίωση) και το περικαρδιακό οίδημα (*) του εμβρύου που εμφαίνεται στην εικόνα δ). Εικόνα 3 Απουσία απόσπασης της ουραίας καταβολής, πλάγια όψη 
Εικόνα 4 Απουσία καρδιακού παλμού 
Η απουσία καρδιακού παλμού είναι εξ ορισμού δύσκολο να απεικονιστεί σε φωτομικρογραφία. Η απουσία καρδιακού παλμού δηλώνεται με την απουσία σπασμού της καρδιάς (διπλό βέλος). Η ακινησία αιμοκυττάρων, π.χ. στην κοιλιακή αορτή (→ στο ένθετο) δεν είναι δείκτης απουσίας καρδιακού παλμού. Επισημαίνεται επίσης η απουσία σχηματισμού σωμιτών σε αυτό το έμβρυο (*, ομοιογενής και όχι κατατμημένη όψη των μυϊκών ιστών). Ο χρόνος παρατήρησης για την καταγραφή απουσίας καρδιακού παλμού θα πρέπει να είναι τουλάχιστον ένα λεπτό με ελάχιστη μεγέθυνση 80×. Γ. 50 Δοκιμή τοξικότητας σε Myriophyllum spicatum με σύστημα χωρίς ίζημα ΕΙΣΑΓΩΓΗ
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΗΝ ΥΠΟ ΔΟΚΙΜΗ ΧΗΜΙΚΗ ΟΥΣΙΑ
ΕΓΚΥΡΟΤΗΤΑ ΤΗΣ ΔΟΚΙΜΗΣ
ΧΗΜΙΚΗ ΟΥΣΙΑ ΑΝΑΦΟΡΑΣ
ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Εργαστηριακός εξοπλισμός
Υπό δοκιμή οργανισμός
Καλλιέργεια
Θρεπτικό μέσο δοκιμής
Διαλύματα δοκιμής
Ομάδες δοκιμής και ομάδες μάρτυρες
Έκθεση
Συνθήκες δοκιμής
Διάρκεια
Μετρήσεις και αναλυτικοί προσδιορισμοί
Συχνότητα των μετρήσεων και των αναλυτικών προσδιορισμών
Οριακή δοκιμή
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ Μεταβλητές απόκρισης
Μέσος ειδικός ρυθμός αύξησης
Απόδοση
Χρόνος διπλασιασμού
Χάραξη των καμπυλών συγκέντρωσης-απόκρισης
Εκτίμηση της ECx
Στατιστικές διαδικασίες
Αναφορά αποτελεσμάτων
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΟΡΙΣΜΟΙ Απόδοση : τιμή μετρούμενης μεταβλητής που εκφράζει τη βιομάζα στο τέλος της περιόδου έκθεσης μείον την τιμή της ίδιας μεταβλητής στην αρχή της περιόδου έκθεσης. Σημείωση: Όταν ο τύπος ανάπτυξης των οργανισμών που δεν έχουν εκτεθεί είναι εκθετικός, οι μεταβλητές απόκρισης που βασίζονται στην απόδοση μειώνονται όσο αυξάνεται η διάρκεια της δοκιμής. Αύξηση : αύξηση της μετρούμενης μεταβλητής, π.χ. μήκος του κύριου βλαστού, συνολικό μήκος πλευρικών κλάδων, συνολικό μήκος βλαστών, συνολικό μήκος ριζών, νωπό βάρος, ξηρό βάρος ή αριθμός σπονδύλων, κατά τη διάρκεια της δοκιμής. Βιομάζα : το νωπό και/ή ξηρό βάρος της ζώσας ύλης την οποία περιέχει ένας πληθυσμός. Στην παρούσα δοκιμή η βιομάζα είναι το άθροισμα του κύριου βλαστού, όλων των πλευρικών κλάδων και όλων των ριζών. Ημιστατική δοκιμή (με ανανέωση) : δοκιμή στη διάρκεια της οποίας το διάλυμα δοκιμής αντικαθίσταται περιοδικά σε συγκεκριμένα χρονικά διαστήματα. Θρεπτικό μέσο δοκιμής : το πλήρες συνθετικό θρεπτικό μέσο, στο οποίο αναπτύσσονται τα υπό δοκιμή φυτά όταν εκτίθενται στην υπό δοκιμή χημική ουσία. Η υπό δοκιμή χημική ουσία διαλύεται, κατά κανόνα, στο θρεπτικό μέσο δοκιμής. Κατώτατη συγκέντρωση στην οποία παρατηρούνται επιπτώσεις (LOEC) : η χαμηλότερη ελεγχθείσα συγκέντρωση στην οποία παρατηρήθηκε στατιστικά σημαντική μείωση της ανάπτυξης (με p < 0,05) υπό την επίδραση της ουσίας, σε σύγκριση με τον μάρτυρα, εντός δεδομένου χρόνου έκθεσης. Ωστόσο, όλες οι συγκεντρώσεις δοκιμής που υπερβαίνουν τη LOEC αναμένεται να έχουν βλαβερή επίδραση ίση ή μεγαλύτερη από εκείνη που παρατηρείται στη LOEC. Σε περίπτωση που δεν είναι δυνατόν να πληρούνται οι δύο αυτοί όροι, θα πρέπει να εξηγείται πλήρως ο τρόπος επιλογής της LOEC (και, κατ' επέκταση, της NOEC). Μεταβλητή απόκρισης : μεταβλητή για την εκτίμηση της τοξικότητας, η οποία προκύπτει, με διάφορες μεθόδους υπολογισμού, από τις μετρούμενες μεταβλητές που περιγράφουν τη βιομάζα. Στην παρούσα μέθοδο δοκιμών, ο ρυθμός αύξησης και η απόδοση είναι μεταβλητές απόκρισης που προκύπτουν από μετρούμενες μεταβλητές, όπως το μήκος του κύριου βλαστού, το συνολικό μήκος των βλαστών, το νωπό βάρος, το ξηρό βάρος και ο αριθμός σπονδύλων. Μετρούμενες μεταβλητές : κάθε είδους μεταβλητή που μετράται προκειμένου να εκφραστεί το τελικό σημείο της δοκιμής με χρήση μίας ή περισσότερων διαφορετικών μεταβλητών απόκρισης. Στην παρούσα μέθοδο δοκιμών, το μήκος του κύριου βλαστού, το συνολικό μήκος των πλευρικών κλάδων· το συνολικό μήκος των βλαστών, το συνολικό μήκος των ριζών, το νωπό βάρος, το ξηρό βάρος και ο αριθμός σπονδύλων είναι μετρούμενες μεταβλητές. Μονοκαλλιέργεια : καλλιέργεια με ένα μόνο είδος φυτού. Νέκρωση : νεκρός (δηλ. λευκός ή βαθυκάστανος) ιστός του υπό δοκιμή οργανισμού. Ρυθμός αύξησης (μέσος ειδικός ρυθμός αύξησης): η λογαριθμική αύξηση της μετρούμενης μεταβλητής κατά την περίοδο έκθεσης. Σημείωση: Οι μεταβλητές απόκρισης που συνδέονται με τον ρυθμό αύξησης είναι ανεξάρτητες από τη διάρκεια της δοκιμής, εφόσον ο τύπος ανάπτυξης των οργανισμών μαρτύρων που δεν έχουν εκτεθεί είναι εκθετικός. Στατική δοκιμή : μέθοδος δοκιμών χωρίς ανανέωση του διαλύματος δοκιμής στη διάρκεια της δοκιμής. Συγκέντρωση μη παρατηρούμενης επίδρασης (NOEC) : η αμέσως μικρότερη από τη LOEC συγκέντρωση δοκιμής. Τελικό σημείο της δοκιμής : περιγράφει, ως στόχο της δοκιμής, τον γενικό παράγοντα που θα μεταβληθεί υπό την επίδραση της υπό δοκιμή χημικής ουσίας σε σχέση με τον μάρτυρα. Στην παρούσα μέθοδο δοκιμών, το τελικό σημείο της δοκιμής είναι η αναστολή της ανάπτυξης, η οποία μπορεί να εκφραστεί με διάφορες μεταβλητές απόκρισης που βασίζονται σε μία ή περισσότερες μετρούμενες μεταβλητές. Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Χημική ουσία : ουσία ή μείγμα. Χλώρωση : η αλλαγή του χρώματος του υπό δοκιμή οργανισμού, ιδίως των σπονδύλων, από πράσινο σε κίτρινο. ECx : συγκέντρωση της υπό δοκιμή χημικής ουσίας, διαλυμένης στο θρεπτικό μέσο δοκιμής, η οποία προκαλεί μείωση της ανάπτυξης κατά x % (π.χ. 50 %) του Myriophyllum spicatum εντός της δηλούμενης περιόδου έκθεσης (πρέπει να αναφέρεται επακριβώς, εάν διαφέρει από την πλήρη ή την κανονική διάρκεια της δοκιμής). Για να δηλώνεται σαφώς αν η τιμή EC προκύπτει από τον ρυθμό αύξησης ή από την απόδοση, χρησιμοποιούνται τα σύμβολα «ErC» για τον ρυθμό αύξησης και «EyC» για την απόδοση, ακολουθούμενα από τη χρησιμοποιηθείσα μετρούμενη μεταβλητή, π.χ. ErC (μήκος κύριου βλαστού). UVCB : ουσία άγνωστης ή ασταθούς σύνθεσης, σύμπλοκο προϊόν αντίδρασης ή βιολογικό υλικό. Προσάρτημα 2 ΤΡΟΠΟΠΟΙΗΜΕΝΟ ΘΡΕΠΤΙΚΟ ΜΕΣΟ ΤΟΥ ANDREWS ΓΙΑ ΑΠΟΘΕΜΑΤΙΚΕΣ ΚΑΛΛΙΕΡΓΕΙΕΣ ΚΑΙ ΠΡΟΚΑΛΛΙΕΡΓΕΙΕΣ Το τροποποιημένο θρεπτικό μέσο του Andrews που απαιτείται για τις αποθεματικές καλλιέργειες και τις προκαλλιέργειες παρασκευάζεται από πέντε χωριστά παρασκευασμένα θρεπτικά διαλύματα παρακαταθήκης, με προσθήκη 3 % σακχαρόζης. Πίνακας 1 Σύνθεση του θρεπτικού διαλύματος του Andrews: (Πρότυπο ASTM E 1913-04)
Τα διαλύματα παρακαταθήκης μπορούν να διατηρηθούν σε ψυγείο για 6 μήνες (στους 5-10 °C). Μόνο το διάλυμα παρακαταθήκης αριθ. 5 έχει μικρότερη διάρκεια διατήρησης (δύο μήνες). Πίνακας 2 Παρασκευή του διαλύματος παρακαταθήκης 3.1 για την παρασκευή του διαλύματος παρακαταθήκης 3
Μετά την παρασκευή του διαλύματος παρακαταθήκης 3.1 (πίνακας 2), το διάλυμα αυτό καταψύχεται χωρισμένο σε κλάσματα όγκου περίπου 11 ml (στους – 18 °C τουλάχιστον). Τα κατεψυγμένα κλάσματα έχουν πενταετή διάρκεια διατήρησης. Για να παρασκευαστεί το διάλυμα παρακαταθήκης 3, αποψύχεται το διάλυμα παρακαταθήκης 3.1, φέρονται 10 ml αυτού σε ογκομετρική φιάλη του 1 λίτρου και συμπληρώνεται ο όγκος της φιάλης μέχρι τη χαραγή με υπερκάθαρο νερό. Για να ληφθεί το τροποποιημένο θρεπτικό μέσο του Andrews, φέρονται περίπου 2 500 ml υπερκάθαρου νερού σε ογκομετρική φιάλη των 5 λίτρων. Μετά την προσθήκη 50 ml από κάθε διάλυμα παρακαταθήκης, πληρούται κατά 90 % η ογκομετρική φιάλη με υπερκάθαρο νερό και ρυθμίζεται το pH στο 5,8. Στη συνέχεια, προστίθενται 150 g διαλυμένης σακχαρόζης (3 % ανά 5 λίτρα) και, κατόπιν, συμπληρώνεται ο όγκος της ογκομετρικής φιάλης μέχρι τη χαραγή με υπερκάθαρο νερό. Τέλος, το θρεπτικό διάλυμα τοποθετείται σε φιάλες Schott του 1 λίτρου και αποστειρώνεται σε αυτόκαυστο στους 121 °C για 20 λεπτά. Το θρεπτικό διάλυμα που προκύπτει με τον τρόπο αυτό μπορεί να διατηρηθεί στείρο σε ψυγείο (στους 5-10 °C) για τρεις μήνες. Τροποποιημένο θρεπτικό μέσο του Andrews για δοκιμή τοξικότητας σε σύστημα χωρίς ίζημα Από τα πέντε θρεπτικά διαλύματα παρακαταθήκης που έχουν ήδη αναφερθεί στους πίνακες 1 και 2, παρασκευάζεται τροποποιημένο θρεπτικό μέσο του Andrews δεκαπλάσιας συγκέντρωσης, που είναι αναγκαίο για τη λήψη των διαλυμάτων δοκιμής, με την προσθήκη 30 % σακχαρόζης. Για τον σκοπό αυτό, φέρονται περίπου 100 ml υπερκάθαρου νερού σε ογκομετρική φιάλη του 1 λίτρου. Μετά την προσθήκη 100 ml από κάθε διάλυμα παρακαταθήκης, ρυθμίζεται το pH στο 5,8. Στη συνέχεια, προστίθεται 30 % διαλυμένης σακχαρόζης (300 g ανά 1 000 ml) και, κατόπιν, συμπληρώνεται ο όγκος της ογκομετρικής φιάλης μέχρι τη χαραγή με υπερκάθαρο νερό. Τέλος, το θρεπτικό διάλυμα τοποθετείται σε φιάλες Schott του 0,5 λίτρου και αποστειρώνεται σε αυτόκαυστο στους 121 °C για 20 λεπτά. Το δεκαπλάσιας συγκέντρωσης τροποποιημένο θρεπτικό διάλυμα που προκύπτει με τον τρόπο αυτό μπορεί να διατηρηθεί στείρο σε ψυγείο (στους 5-10 °C) για τρεις μήνες. Προσάρτημα 3 ΔΙΑΤΗΡΗΣΗ ΑΠΟΘΕΜΑΤΙΚΗΣ ΚΑΛΛΙΕΡΓΕΙΑΣ Στο παρόν προσάρτημα 3, περιγράφεται η αποθεματική καλλιέργεια Myriophyllum spicatum L (103), υφυδατικού υδρόβιου δικοτυλήδονου φυτού της οικογένειας των μυριόφυλλων. Μεταξύ Ιουνίου και Αυγούστου, δυσδιάκριτα λευκορόδινα άνθη αναδύονται από την επιφάνεια του νερού. Τα φυτά ριζώνουν στο έδαφος με ένα σύστημα ισχυρών ριζωμάτων και συναντώνται σε ολόκληρο το βόρειο ημισφαίριο σε ευτροφικά, αλλά μη ρυπασμένα και περισσότερο ασβεστοφόρα λιμνάζοντα ύδατα με λασπώδες υπόστρωμα. Το Myriophyllum spicatum προτιμά τα γλυκά ύδατα, αλλά συναντάται και σε υφάλμυρα. Για αποθεματικές καλλιέργειες χωρίς ίζημα υπό εργαστηριακές συνθήκες, απαιτούνται στείρα φυτά. Στείρα φυτά διατίθενται από το εργαστήριο οικοτοξικολογίας της γερμανικής Umweltbundesamt (Ομοσπονδιακή Υπηρεσία Περιβάλλοντος της Γερμανίας). Εναλλακτικά, οι υπό δοκιμή οργανισμοί μπορούν να δημιουργηθούν από μη στείρα φυτά σύμφωνα με το πρότυπο ASTM E 1913-04. Στην επόμενη παράγραφο –απόσπασμα από τον οδηγό ASTM Standard Guide– περιγράφεται η διαδικασία καλλιέργειας Myriophyllum sibiricum που έχει συλλεγεί από τη φύση: «Εάν το αρχικό υλικό πρόκειται να είναι μη στείρα φυτά από τη φύση, συλλέγονται φύτρα (turion) του φυτού M. sibiricum το φθινόπωρο. Τα φύτρα τοποθετούνται σε ενυδρείο χωρητικότητας 20 λίτρων που περιέχει στείρο ίζημα πάχους 5 cm, καλυμμένο με πυριτική άμμο ή, για παράδειγμα, Turface® και 18 λίτρα νερού ποιότητας χημικού αντιδραστηρίου. Το ενυδρείο αερίζεται και διατηρείται σε θερμοκρασία 15 °C και πυκνότητα ροής 200 έως 300 μmol m– 2 s– 1 για 16 ώρες ημερησίως. Η φυτοκαλλιέργεια στο ενυδρείο μπορεί να διατηρηθεί ως εφεδρική πηγή φυτών σε περίπτωση καταστροφής των στείρων φυτοκαλλιεργειών λόγω μηχανικής δυσλειτουργίας στον θάλαμο ανάπτυξης, μόλυνσης ή άλλης αιτίας. Τα φυτά που καλλιεργούνται στο ενυδρείο δεν είναι στείρα και δεν είναι δυνατόν να διατηρηθούν στείρες καλλιέργειες σε σύστημα ασυνεχούς καλλιέργειας. Για την αποστείρωση της καλλιέργειας, τα φυτά απομακρύνονται από το ενυδρείο και εκπλένονται με ρέον απιονισμένο νερό για περίπου μισή ώρα. Απολυμαίνονται υπό άσηπτες συνθήκες σε απαγωγό στρωτής ροής αέρα για λιγότερο από 20 λεπτά (έως ότου λευκανθεί το μεγαλύτερο μέρος των φυτικών ιστών και παραμένει πράσινη μόνο η αναπτυσσόμενη κορυφή) σε διάλυμα υποχλωριώδους νατρίου 3 % (κ.β.) που περιέχει 0,01 % κατάλληλης επιφανειοδραστικής ουσίας. Ανακινείται το απολυμαντικό και το φυτικό υλικό. Τμήματα με αρκετά γόνατα μεταφέρονται σε στείρους σωλήνες καλλιέργειας που περιέχουν 45 ml αποστειρωμένου τροποποιημένου θρεπτικού μέσου του Andrews και πωματίζονται με απλά πώματα σωλήνων καλλιέργειας. Σε κάθε δοκιμαστικό θάλαμο τοποθετείται μόνο ένα τμήμα φυτού. Χρησιμοποιείται εργαστηριακή πλαστική μεμβράνη (παραφίλμ) για τη σφράγιση του δοχείου καλλιέργειας. Μετά την εγκατάσταση της στείρας καλλιέργειας, τμήματα φυτού με αρκετά γόνατα θα πρέπει να μεταφέρονται σε νέους δοκιμαστικούς θαλάμους, που περιέχουν πρόσφατα παρασκευασμένο υγρό θρεπτικό μέσο, κάθε δέκα έως δώδεκα ημέρες. Τα φυτά πρέπει να είναι στείρα, γεγονός που να αποδεικνύεται με καλλιέργεια σε τρυβλία με άγαρ, και να παραμένουν στείρα επί οκτώ εβδομάδες πριν από την έναρξη της δοκιμής.» Δεδομένου ότι το τροποποιημένο θρεπτικό μέσο του Andrews περιέχει σακχαρόζη (η οποία προάγει την ανάπτυξη μυκήτων και βακτηρίων), ο χειρισμός όλων των υλικών, διαλυμάτων και καλλιεργειών πρέπει να πραγματοποιείται υπό στείρες συνθήκες. Όλα τα υγρά καθώς και ο εξοπλισμός αποστειρώνονται πριν από τη χρήση. Η αποστείρωση επιτυγχάνεται με κατεργασία με θερμό αέρα (στους 210 °C) επί 4 ώρες ή σε αυτόκαυστο επί 20 λεπτά στους 121 °C. Επιπλέον, όλες οι φιάλες, τα τρυβλία, τα κύπελλα κ.λπ. και ο λοιπός εξοπλισμός υποβάλλονται σε κατεργασία με φλόγα στη στείρα επιφάνεια εργασίας αμέσως πριν από τη χρήση τους. Οι αποθεματικές καλλιέργειες μπορούν να διατηρούνται σε ελαττωμένο φωτισμό και θερμοκρασία (50 μE m– 2 s– 1, 20 ± 2 °C) για μεγαλύτερα διαστήματα, χωρίς να είναι αναγκαία η εκ νέου εγκατάσταση. Το θρεπτικό μέσο για το μυριόφυλλο θα πρέπει να είναι ίδιο με εκείνο που χρησιμοποιείται στη δοκιμή, αλλά για τις αποθεματικές καλλιέργειες μπορούν να χρησιμοποιούνται άλλα πλούσια σε θρεπτικά στοιχεία μέσα. Τα τμήματα φυτών κατανέμονται αξενικά σε πολλές φιάλες Erlenmeyer των 500 ml και/ή Fernbach των 2 000 ml, καθεμία από τις οποίες πληρούται, αντίστοιχα, με περίπου 450 και 1 000 ml τροποποιημένου θρεπτικού μέσου του Andrews. Στη συνέχεια, οι φιάλες πωματίζονται αξενικά με πώματα κυτταρίνης. Επιπλέον, είναι απολύτως αναγκαία η κατεργασία του εξοπλισμού με φλόγα στη στείρα επιφάνεια εργασίας αμέσως πριν από τη χρήση. Ανάλογα με τον αριθμό και το μέγεθος, τα φυτά πρέπει να μεταφέρονται σε πρόσφατα παρασκευασμένο θρεπτικό διάλυμα περίπου κάθε τρεις εβδομάδες. Για αυτή την ανακαλλιέργεια μπορούν να χρησιμοποιούνται οι κορυφές, καθώς και τμήματα του μεσαίου μέρους του στελέχους. Ο αριθμός και το μέγεθος των μεταφερόμενων φυτών (ή τμημάτων φυτών) εξαρτώνται από τον αναγκαίο αριθμό φυτών. Ενδεικτικά, μπορούν να μεταφερθούν πέντε τμήματα βλαστού σε μία φιάλη Fernbach και τρία τμήματα βλαστού σε μία φιάλη Erlenmeyer, το καθένα μήκους 5 cm. Απορρίπτονται τα μέρη που φέρουν ρίζες ή άνθη, είναι νεκρά ή ξεχωρίζουν με άλλον τρόπο. Εικόνα 1 Κοπή φυτών για την αποθεματική καλλιέργεια και την προκαλλιέργεια μετά από 3 εβδομάδες καλλιέργειας. 
Τα φυτά πρέπει να καλλιεργούνται σε φιάλες Erlenmeyer των 500 ml και Fernbach των 2 000 ml σε ψυκτικό επωαστήρα στους 20 ± 2 °C με συνεχές φως περίπου 100-150 μE m– 2 s– 1 ή 6 000-9 000 Lux (που εκπέμπεται από φωτισμό θαλάμου με θερμοκρασία χρώματος «θερμό λευκό φως»). Εικόνα 2 Καλλιέργεια φυτών σε ψυκτικό επωαστήρα με φωτισμό θαλάμου. 
Θα πρέπει να χρησιμοποιούνται χημικώς καθαρά (εκπλυμένα με οξύ) και στείρα γυάλινα δοχεία καλλιέργειας και να εφαρμόζονται άσηπτες τεχνικές για τους χειρισμούς. Σε περίπτωση μόλυνσης της αποθεματικής καλλιέργειας, π.χ. από φύκη, μύκητες και/ή βακτήρια, αυτή θα πρέπει να αντικαθίσταται με νέα καλλιέργεια ή με αποθεματική καλλιέργεια από άλλο εργαστήριο. Προσάρτημα 4 ΔΙΑΤΗΡΗΣΗ ΠΡΟΚΑΛΛΙΕΡΓΕΙΑΣ ΚΑΙ ΠΡΟΕΤΟΙΜΑΣΙΑ ΤΟΥ ΥΠΟ ΔΟΚΙΜΗ ΟΡΓΑΝΙΣΜΟΥ ΓΙΑ ΤΗ ΔΟΚΙΜΗ Για τη λήψη προκαλλιέργειας, κόβονται βλαστοί από την αποθεματική καλλιέργεια σε τμήματα με δύο σπονδύλους το καθένα. Τα τμήματα τοποθετούνται σε φιάλες Fernbach που έχουν πληρωθεί με τροποποιημένο θρεπτικό μέσο του Andrews (με 3 % σακχαρόζη). Κάθε φιάλη μπορεί να περιέχει μέχρι 50 τμήματα βλαστών. Πρέπει, ωστόσο, να υπάρχει μέριμνα ώστε τα τμήματα να είναι σφριγηλά και να μην έχουν ρίζες και πλευρικούς κλάδους ούτε τις καταβολές αυτών (βλ. εικόνα 1 στο προσάρτημα 3). Οι οργανισμοί προκαλλιέργειας καλλιεργούνται επί 14 έως 21 ημέρες υπό στείρες συνθήκες σε θάλαμο ελεγχόμενου περιβάλλοντος με εναλλασσόμενες φάσεις φωτός/σκότους 16:8 ωρών. Η φωτεινή ένταση επιλέγεται από το εύρος 100-150 μE m– 2 s– 1. Η θερμοκρασία στα δοκιμαστικά δοχεία θα πρέπει να είναι 23 ± 2 °C. Δεδομένου ότι το τροποποιημένο θρεπτικό μέσο του Andrews περιέχει σακχαρόζη (η οποία προάγει την ανάπτυξη φυκών, μυκήτων και βακτηρίων), η παρασκευή των διαλυμάτων της υπό δοκιμή χημικής ουσίας και η καλλιέργεια θα πρέπει να διεξάγονται σε στείρες συνθήκες. Όλα τα υγρά καθώς και ο εξοπλισμός αποστειρώνονται πριν από τη χρήση. Η αποστείρωση επιτυγχάνεται με κατεργασία με θερμό αέρα (στους 210 °C) επί 4 ώρες ή σε αυτόκαυστο επί 20 λεπτά στους 121 °C. Επιπλέον, όλες οι φιάλες, τα τρυβλία, τα κύπελλα κ.λπ. και ο λοιπός εξοπλισμός υποβάλλονται σε κατεργασία με φλόγα στη στείρα επιφάνεια εργασίας αμέσως πριν από τη χρήση τους. Οι βλαστοί απομακρύνονται αξενικά από τις φιάλες προκαλλιέργειας, ενώ επιλέγεται όσο το δυνατόν περισσότερο ομοιογενές υλικό. Για κάθε δοκιμή απαιτούνται τουλάχιστον 60 οργανισμοί (δοκιμή με οκτώ συγκεντρώσεις της υπό δοκιμή χημικής ουσίας). Για τη διεξαγωγή της δοκιμής λαμβάνονται νέοι πλευρικοί κλάδοι από προκαλλιέργειες, κόβονται σε μήκος 2,5 cm από τη βάση (μέτρηση με κανόνα) και μεταφέρονται σε ποτήρι ζέσεως που περιέχει στείρο τροποποιημένο θρεπτικό μέσο του Andrews. Αυτοί οι νέοι πλευρικοί κλάδοι μπορούν να χρησιμοποιηθούν για τη δοκιμή τοξικότητας σε Myriophyllum spicatum με σύστημα χωρίς ίζημα. Εικόνα 2 Κοπή φυτών από την προκαλλιέργεια για τη δοκιμή τοξικότητας σε Myriophyllum spicatum με σύστημα χωρίς ίζημα. 
Γ. 51 Δοκιμή τοξικότητας σε Myriophyllum spicatum με σύστημα νερού-ιζήματος ΕΙΣΑΓΩΓΗ
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΗΝ ΥΠΟ ΔΟΚΙΜΗ ΧΗΜΙΚΗ ΟΥΣΙΑ
ΕΓΚΥΡΟΤΗΤΑ ΤΗΣ ΔΟΚΙΜΗΣ
ΧΗΜΙΚΗ ΟΥΣΙΑ ΑΝΑΦΟΡΑΣ
ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ Εξοπλισμός δοκιμής
Υπό δοκιμή οργανισμός
Καλλιέργεια του υπό δοκιμή οργανισμού
Ίζημα
Θρεπτικό μέσο δοκιμής
Σχεδιασμός του πειράματος
Συγκεντρώσεις της υπό δοκιμή χημικής ουσίας και ομάδες μαρτύρων
Οριακή δοκιμή
Διαλύματα δοκιμής
ΔΙΑΔΙΚΑΣΙΑ ΔΟΚΙΜΗΣ
Φάση εγκατάστασης
Επιλογή ομοιόμορφου φυτικού υλικού
Έκθεση μέσω της υδατικής φάσης
Έκθεση μέσω ιζήματος
Διατήρηση της στάθμης του νερού κατά τη διάρκεια της δοκιμής
Συνθήκες δοκιμής
Διάρκεια της δοκιμής
Μετρήσεις και αναλυτικοί προσδιορισμοί
Συχνότητα των μετρήσεων και των αναλυτικών προσδιορισμών
Αναλυτικές μετρήσεις της υπό δοκιμή χημικής ουσίας
ΑΞΙΟΛΟΓΗΣΗ ΔΕΔΟΜΕΝΩΝ
Μεταβλητές απόκρισης
Μέσος ειδικός ρυθμός αύξησης
Απόδοση
Χάραξη των καμπυλών συγκέντρωσης-απόκρισης
Εκτίμηση της ECx
Στατιστικές διαδικασίες
ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ
ΒΙΒΛΙΟΓΡΑΦΙΑ
Προσάρτημα 1 ΣΥΝΘΕΣΗ ΤΟΥ ΘΡΕΠΤΙΚΟΥ ΜΕΣΟΥ SMART AND ΒARKO
Προσάρτημα 2 ΟΡΙΣΜΟΙ Απόδοση : τιμή μετρούμενης μεταβλητής που εκφράζει τη βιομάζα στο τέλος της περιόδου έκθεσης μείον την τιμή της ίδιας μεταβλητής στην αρχή της περιόδου έκθεσης. Σημείωση: Όταν ο τύπος ανάπτυξης των οργανισμών που δεν έχουν εκτεθεί είναι εκθετικός, οι μεταβλητές απόκρισης που βασίζονται στην απόδοση μειώνονται όσο αυξάνεται η διάρκεια της δοκιμής. Αύξηση : αύξηση της μετρούμενης μεταβλητής, π.χ. μήκος του κύριου βλαστού, συνολικό μήκος πλευρικών κλάδων, συνολικό μήκος βλαστών, συνολικό μήκος ριζών, νωπό βάρος, ξηρό βάρος ή αριθμός σπονδύλων, κατά τη διάρκεια της δοκιμής. Βιομάζα : το νωπό και/ή ξηρό βάρος της ζώσας ύλης την οποία περιέχει ένας πληθυσμός. Στην παρούσα δοκιμή η βιομάζα είναι το άθροισμα του κύριου βλαστού, όλων των πλευρικών κλάδων και όλων των ριζών. Ημιστατική δοκιμή (με ανανέωση) : δοκιμή στη διάρκεια της οποίας το διάλυμα δοκιμής αντικαθίσταται περιοδικά σε συγκεκριμένα χρονικά διαστήματα. Θρεπτικό μέσο δοκιμής : το πλήρες συνθετικό θρεπτικό μέσο, στο οποίο αναπτύσσονται τα υπό δοκιμή φυτά όταν εκτίθενται στην υπό δοκιμή χημική ουσία. Η υπό δοκιμή χημική ουσία διαλύεται, κατά κανόνα, στο θρεπτικό μέσο δοκιμής. Κατώτατη συγκέντρωση στην οποία παρατηρούνται επιπτώσεις (LOEC) : η χαμηλότερη ελεγχθείσα συγκέντρωση στην οποία παρατηρήθηκε στατιστικά σημαντική μείωση της ανάπτυξης (με p < 0,05) υπό την επίδραση της χημικής ουσίας, σε σύγκριση με τον μάρτυρα, εντός δεδομένου χρόνου έκθεσης. Ωστόσο, όλες οι συγκεντρώσεις δοκιμής που υπερβαίνουν τη LOEC αναμένεται να έχουν βλαβερή επίδραση ίση ή μεγαλύτερη από εκείνη που παρατηρείται στη LOEC. Σε περίπτωση που δεν είναι δυνατόν να πληρούνται οι δύο αυτοί όροι, θα πρέπει να εξηγείται πλήρως ο τρόπος επιλογής της LOEC (και, κατ' επέκταση, της NOEC). Μεταβλητή απόκρισης : μεταβλητή για την εκτίμηση της τοξικότητας, η οποία προκύπτει, με διάφορες μεθόδους υπολογισμού, από τις μετρούμενες μεταβλητές που περιγράφουν τη βιομάζα. Στην παρούσα μέθοδο δοκιμών, ο ρυθμός αύξησης και η απόδοση είναι μεταβλητές απόκρισης που προκύπτουν από μετρούμενες μεταβλητές, όπως το μήκος του κύριου βλαστού, το συνολικό μήκος των βλαστών, το νωπό βάρος, το ξηρό βάρος και ο αριθμός σπονδύλων. Μετρούμενες μεταβλητές : κάθε είδους μεταβλητή που μετράται προκειμένου να εκφραστεί το τελικό σημείο της δοκιμής με χρήση μίας ή περισσότερων διαφορετικών μεταβλητών απόκρισης. Στην παρούσα μέθοδο δοκιμών, το μήκος του κύριου βλαστού, το συνολικό μήκος των πλευρικών κλάδων· το συνολικό μήκος των βλαστών, το συνολικό μήκος των ριζών, το νωπό βάρος, το ξηρό βάρος και ο αριθμός σπονδύλων είναι μετρούμενες μεταβλητές. Μονοκαλλιέργεια : καλλιέργεια με ένα μόνο είδος φυτού. Νέκρωση : νεκρός (δηλ. λευκός ή βαθυκάστανος) ιστός του υπό δοκιμή οργανισμού. Ρυθμός αύξησης (μέσος ειδικός ρυθμός αύξησης): η λογαριθμική αύξηση της μετρούμενης μεταβλητής κατά την περίοδο έκθεσης. Σημείωση: Οι μεταβλητές απόκρισης που συνδέονται με τον ρυθμό αύξησης είναι ανεξάρτητες από τη διάρκεια της δοκιμής, εφόσον ο τύπος ανάπτυξης των οργανισμών μαρτύρων που δεν έχουν εκτεθεί είναι εκθετικός. Στατική δοκιμή : μέθοδος δοκιμών χωρίς ανανέωση του διαλύματος δοκιμής στη διάρκεια της δοκιμής. Συγκέντρωση μη παρατηρούμενης επίδρασης (NOEC) : η αμέσως μικρότερη από τη LOEC συγκέντρωση δοκιμής. Τελικό σημείο της δοκιμής : περιγράφει, ως στόχο της δοκιμής, τον γενικό παράγοντα που θα μεταβληθεί υπό την επίδραση της υπό δοκιμή χημικής ουσίας σε σχέση με τον μάρτυρα. Στην παρούσα μέθοδο δοκιμών, το τελικό σημείο της δοκιμής είναι η αναστολή της ανάπτυξης, η οποία μπορεί να εκφραστεί με διάφορες μεταβλητές απόκρισης που βασίζονται σε μία ή περισσότερες μετρούμενες μεταβλητές. Υπό δοκιμή χημική ουσία : κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών. Χημική ουσία : ουσία ή μείγμα. Χλώρωση : η αλλαγή του χρώματος του υπό δοκιμή οργανισμού και ιδίως των σπονδύλων από πράσινο σε κίτρινο. ECx : συγκέντρωση της υπό δοκιμή χημικής ουσίας, διαλυμένης στο θρεπτικό μέσο δοκιμής, η οποία προκαλεί μείωση της ανάπτυξης κατά x % (π.χ. 50 %) του Myriophyllum spicatum εντός της δηλούμενης περιόδου έκθεσης (πρέπει να αναφέρεται επακριβώς, εάν διαφέρει από την πλήρη ή την κανονική διάρκεια της δοκιμής). Για να δηλώνεται σαφώς αν η τιμή EC προκύπτει από τον ρυθμό αύξησης ή από την απόδοση, χρησιμοποιούνται τα σύμβολα «ErC» για τον ρυθμό αύξησης και «EyC» για την απόδοση, ακολουθούμενα από τη χρησιμοποιηθείσα μετρούμενη μεταβλητή, π.χ. ErC (μήκος κύριου βλαστού). UVCB : ουσία άγνωστης ή ασταθούς σύνθεσης, σύμπλοκο προϊόν αντίδρασης ή βιολογικό υλικό. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(1) Δεν υπάρχει διαθέσιμη τιμή για τους 20 °C, τεκμαίρεται, ωστόσο, ότι η μεταβλητότητα των αποτελεσμάτων των μετρήσεων είναι υψηλότερη από την αναμενόμενη θερμοκρασιακή εξάρτηση
(2) Κανονισμός (ΕΚ) αριθ. 1907/2006 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 18ης Δεκεμβρίου 2006, για την καταχώριση, την αξιολόγηση, την αδειοδότηση και τους περιορισμούς των χημικών προϊόντων (REACH) και για την ίδρυση του Ευρωπαϊκού Οργανισμού Χημικών Προϊόντων καθώς και για την τροποποίηση της οδηγίας 1999/45/EΚ και για την κατάργηση του κανονισμού (ΕΟΚ) αριθ. 793/93 του Συμβουλίου και του κανονισμού (ΕΚ) αριθ. 1488/94 της Επιτροπής καθώς και της οδηγίας 76/769/ΕΟΚ του Συμβουλίου και των οδηγιών της Επιτροπής 91/155/ΕΟΚ, 93/67/ΕΟΚ, 93/105/ΕΚ και 2000/21/ΕΚ. ΕΕ L 304 της 22.11.2007, σ. 1.
(3) Interagency Coordinating Committee on the Validation of Alternative Methods (Διυπηρεσιακή Συντονιστική Επιτροπή για την Επικύρωση Εναλλακτικών Μεθόδων, των Ηνωμένων Πολιτειών)
(*1) Θα πρέπει να σημειώνεται η έκταση της αδιαφανούς περιοχής
(4) Για τη χρήση στρατηγικής ολοκληρωμένων δοκιμών για τον ερεθισμό των οφθαλμών στο πλαίσιο του κανονισμού REACH, βλ. επίσης έγγραφο καθοδήγησης του ECHA σχετικά με τις απαιτούμενες πληροφορίες και την εκτίμηση χημικής ασφάλειας, κεφάλαιο R.7a: Endpoint specific guidance http://echa.europa.eu/documents/10162/13632/information_requirements_r7a_en.pdf
(5) Οι στατιστικολόγοι που υιοθετούν προσέγγιση μοντελοποίησης, όπως η χρήση γενικών γραμμικών μοντέλων (General Linear Models/GLM), μπορεί να προσεγγίζουν την ανάλυση με διαφορετικό αλλά συγκρίσιμο τρόπο, χωρίς ωστόσο να συνάγουν αναγκαστικά τον παραδοσιακό πίνακα ANOVA, που ανάγεται στις αλγοριθμικές προσεγγίσεις για τον υπολογισμό των στατιστικών στοιχείων οι οποίες αναπτύχθηκαν πριν από την εποχή των υπολογιστών.
(6) Οι στατιστικολόγοι που υιοθετούν προσέγγιση μοντελοποίησης, όπως η χρήση γενικών γραμμικών μοντέλων (General Linear Models/GLM), μπορεί να διενεργούν την ανάλυση με διαφορετικό αλλά συγκρίσιμο τρόπο, χωρίς ωστόσο να συνάγουν αναγκαστικά τον παραδοσιακό πίνακα ANOVA, που ανάγεται στις αλγοριθμικές προσεγγίσεις για τον υπολογισμό των στατιστικών στοιχείων οι οποίες αναπτύχθηκαν πριν από την εποχή των υπολογιστών.
(7) Κανονισμός (ΕΚ) αριθ. 1272/2008 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 16ης Δεκεμβρίου 2008, για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων, την τροποποίηση και την κατάργηση των οδηγιών 67/548/EΟΚ και 1999/45/EΚ και την τροποποίηση του κανονισμού (EΚ) αριθ. 1907/2006, ΕΕ L 353 της 31.12.2008, σ. 1.
(8) Κάθε υπό δοκιμή χημική ουσία κατατάχθηκε σε χημική κατηγορία σύμφωνα με πρότυπο σύστημα ταξινόμησης, το οποίο βασίζεται στο σύστημα ταξινόμησης Medical Subject Headings (MeSH) της National Library of Medicine (θεματικές επικεφαλίδες ιατρικού περιεχομένου της Εθνικής Ιατρικής Βιβλιοθήκης, διατίθεται στη διαδικτυακή διεύθυνση https://www.nlm.nih.gov/mesh/).
(9) Βάσει των αποτελεσμάτων της οφθαλμικής δοκιμής in vivo σε κουνέλια (OECD TG 405) (17) και σύμφωνα με το GHS των Ηνωμένων Εθνών (4).
(10) Η ταξινόμηση ως κατηγορίας 2Α ή 2Β εξαρτάται από την ερμηνεία του κριτηρίου του GHS των Ηνωμένων Εθνών για τη διάκριση μεταξύ αυτών των δύο κατηγοριών, δηλ. για την κατάταξη στην κατηγορία 2Α είναι απαραίτητο να εμφανίζει επιδράσεις την 7η ημέρα 1 από τα 3 ζώα έναντι 2 από τα 3 ζώα. Η μελέτη in vivo περιελάμβανε 3 ζώα. Όλα τα τελικά σημεία, εκτός από το ερύθημα του επιπεφυκότος σε ένα ζώο, επανήλθαν σε μηδενική βαθμολογία την ημέρα 7 ή νωρίτερα. Το ένα ζώο που δεν είχε αναρρώσει πλήρως έως την ημέρα 7 παρουσίαζε ερύθημα επιπεφυκότος βαθμού 1 (την ημέρα 7) που εξαφανίστηκε την ημέρα 10.
(11) Οι αναφερόμενες διαστάσεις βασίζονται σε διάταξη συγκράτησης κερατοειδούς που χρησιμοποιείται για αγελάδες ηλικίας 12 έως 60 μηνών. Εάν χρησιμοποιούνται ζώα ηλικίας 6 έως 12 μηνών, η διάταξη συγκράτησης πρέπει να είναι σχεδιασμένη κατά τρόπο ώστε κάθε θάλαμος να έχει χωρητικότητα 4 mL και κάθε εσωτερικός θάλαμος να έχει διάμετρο 1,5 cm και βάθος 2,2 cm. Σε κάθε διάταξη συγκράτησης νέας κατασκευής είναι πολύ σημαντικό η αναλογία της εκτεθειμένης επιφάνειας του κερατοειδούς προς τη χωρητικότητα του οπίσθιου θαλάμου να είναι η ίδια όπως στη συμβατική διάταξη συγκράτησης κερατοειδούς. Αυτό είναι απαραίτητο ούτως ώστε να διασφαλίζεται ο ορθός προσδιορισμός των τιμών διαπερατότητας για τον υπολογισμό της IVIS με τη βοήθεια του προτεινόμενου τύπου.
(12) Κανονισμός (ΕΚ) αριθ. 1272/2008 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 16ης Δεκεμβρίου 2008, για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων, την τροποποίηση και την κατάργηση των οδηγιών 67/548/EΟΚ και 1999/45/EΚ και την τροποποίηση του κανονισμού (EΚ) αριθ. 1907/2006, ΕΕ L 353 της 31.12.2008, σ. 1.
(*2) Υψηλότερη μέση βαθμολογία για που παρατηρείται σε οποιαδήποτε χρονική στιγμή
(*3) Μέγιστη μέση βαθμολογία που παρατηρείται σε οποιαδήποτε χρονική στιγμή (με βάση τη βαθμολογία αδιαφάνειας όπως ορίζεται στον πίνακα 1).
(*4) Με βάση βαθμολογία όπως ορίζεται στον πίνακα 2.
(*5) Λιγότερο πιθανοί συνδυασμοί.
(13) Κάθε υπό δοκιμή χημική ουσία κατατάχθηκε σε χημική κατηγορία σύμφωνα με πρότυπο σύστημα ταξινόμησης, το οποίο βασίζεται στο σύστημα ταξινόμησης Medical Subject Headings (MeSH) της National Library of Medicine (θεματικές επικεφαλίδες ιατρικού περιεχομένου της Εθνικής Ιατρικής Βιβλιοθήκης, διατίθεται στη διαδικτυακή διεύθυνση https://www.nlm.nih.gov/mesh/).
(14) Βάσει των αποτελεσμάτων της οφθαλμικής δοκιμής in vivo σε κουνέλια (OECD TG 405) και σύμφωνα με το GHS των Ηνωμένων Εθνών (4)(6).
(15) Βάσει των αποτελεσμάτων στη μέθοδο ICE, όπως περιγράφεται στον πίνακα 6.
(16) Συνδυασμός των βαθμολογιών στη μέθοδο ICE, εκτός από εκείνες που περιγράφονται στον πίνακα 6 για τον προσδιορισμό των ουσιών «Καμίας κατηγορίας» του GHS και κατηγορίας 1 του GHS (βλ. πίνακα 6)
(17) Η ταξινόμηση ως κατηγορίας 2Α ή 2Β εξαρτάται από την ερμηνεία του κριτηρίου του GHS των Ηνωμένων Εθνών για τη διάκριση μεταξύ αυτών των δύο κατηγοριών, δηλ. για την κατάταξη στην κατηγορία 2Α είναι απαραίτητο να εμφανίζει επιδράσεις την 7η ημέρα 1 από τα 3 ζώα έναντι 2 από τα 3 ζώα. Η μελέτη in vivo περιελάμβανε 3 ζώα. Όλα τα τελικά σημεία, εκτός από το ερύθημα του επιπεφυκότος σε ένα ζώο, επανήλθαν σε μηδενική βαθμολογία την ημέρα 7 ή νωρίτερα. Το ένα ζώο που δεν είχε αναρρώσει πλήρως έως την ημέρα 7 παρουσίαζε ερύθημα επιπεφυκότος βαθμού 1 (την ημέρα 7) το οποίο εξαφανίστηκε την ημέρα 10.
(18) Κανονισμός (ΕΚ) αριθ. 1272/2008 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 16ης Δεκεμβρίου 2008, για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων, την τροποποίηση και την κατάργηση των οδηγιών 67/548/EΟΚ και 1999/45/EΚ και την τροποποίηση του κανονισμού (EΚ) αριθ. 1907/2006, ΕΕ L 353 της 31.12.2008, σ. 1.
(19) Σε ολόκληρο το κείμενο, ως «μέσος» ή «μέση τιμή» νοείται ο αριθμητικός μέσος.
(20) Οι αριθμοί παραπέμπουν σε στατιστικά παραγόμενες τιμές κατωφλίου και δεν σχετίζονται με την ακρίβεια της μέτρησης.
(21) Οι προβλέψεις βάσει DPRA θα πρέπει να συνεκτιμώνται στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις διατάξεις των παραγράφων 9 και 12.
(22) Οι αριθμοί παραπέμπουν σε στατιστικά παραγόμενες τιμές κατωφλίου και δεν σχετίζονται με την ακρίβεια της μέτρησης.
(23) Οι προβλέψεις βάσει DPRA θα πρέπει να συνεκτιμώνται στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις διατάξεις των παραγράφων 9 και 12.
(24) Οι προβλέψεις για τον κίνδυνο (και την ισχύ) in vivo βασίζονται σε δεδομένα από LLNA (19). Η ευαισθητοποιητική ισχύς in vivo συνάγεται με την εφαρμογή των κριτηρίων που έχει προτείνει το ECETOC (23).
(25) Η πρόβλεψη βάσει DPRA θα πρέπει να συνεκτιμάται στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις διατάξεις των παραγράφων 9 και 11.
(26) Πεδία τιμών προσδιορισμένα με βάση τουλάχιστον 10 τιμές ελάττωσης που προέκυψαν από 6 ανεξάρτητα εργαστήρια.
(27) Κανονισμός (ΕΚ) αριθ. 1272/2008 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 16ης Δεκεμβρίου 2008, για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων, την τροποποίηση και την κατάργηση των οδηγιών 67/548/EΟΚ και 1999/45/EΚ και την τροποποίηση του κανονισμού (EΚ) αριθ. 1907/2006, ΕΕ L 353 της 31.12.2008, σ. 1.
(28) Η πρόβλεψη in vivo για τον κίνδυνο (και την ισχύ) βασίζεται σε δεδομένα από LLNA (13). Η ισχύς in vivo συνάγεται με την εφαρμογή των κριτηρίων που έχει προτείνει το ECETOC (24).
(29) Οι προβλέψεις βάσει ανάλυσης KeratinoSensTM θα πρέπει να εξετάζονται στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις διατάξεις των παραγράφων 9 και 11 της παρούσας μεθόδου δοκιμών.
(30) Βάσει των ιστορικώς παρατηρούμενων τιμών (12).
(31) Κανονισμός (ΕΚ) αριθ. 1272/2008 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 16ης Δεκεμβρίου 2008, για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων, την τροποποίηση και την κατάργηση των οδηγιών 67/548/EΟΚ και 1999/45/EΚ και την τροποποίηση του κανονισμού (EΚ) αριθ. 1907/2006, ΕΕ L 353 της 31.12.2008, σ. 1.
(32) Κάθε υπό δοκιμή χημική ουσία κατατάχθηκε σε χημική κατηγορία σύμφωνα με πρότυπο σύστημα ταξινόμησης, το οποίο βασίζεται στο σύστημα ταξινόμησης Medical Subject Headings (MeSH) της National Library of Medicine (θεματικές επικεφαλίδες ιατρικού περιεχομένου της Εθνικής Ιατρικής Βιβλιοθήκης, διατίθεται στη διαδικτυακή διεύθυνση https://www.nlm.nih.gov/mesh/).
(33) Βάσει αποτελεσμάτων της οφθαλμικής δοκιμής in vivo σε κουνέλια (TG 405 του ΟΟΣΑ, μέθοδος δοκιμών Β.5) και σύμφωνα με το GHS των Ηνωμένων Εθνών και τον κανονισμό CLP της ΕΕ.
(34) Βάσει αποτελεσμάτων που προέκυψαν με τη μέθοδο FL [πρωτόκολλο INVITTOX αριθ. 71 (6)]
(35) Οι στατιστικολόγοι που υιοθετούν προσέγγιση μοντελοποίησης, όπως η χρήση γενικών γραμμικών μοντέλων (General Linear Models/GLM), μπορεί να προσεγγίζουν την ανάλυση με διαφορετικό αλλά συγκρίσιμο τρόπο, χωρίς ωστόσο να συνάγουν αναγκαστικά τον παραδοσιακό πίνακα ANOVA, που ανάγεται στις αλγοριθμικές προσεγγίσεις για τον υπολογισμό των στατιστικών στοιχείων οι οποίες αναπτύχθηκαν πριν από την εποχή των υπολογιστών.
(36) Βλ. προσάρτημα 1 για τους ορισμούς και τις μονάδες
(37) Ορισμένες φορές δηλώνεται με το σύμβολο P OW· προσδιορίζεται με μέθοδο ανακινούμενης φιάλης κατά τη μέθοδο δοκιμών Α.8 (3), με HPLC κατά τη μέθοδο δοκιμών Α.24 (4) και με μέθοδο αργής ανάδευσης κατά τη μέθοδο δοκιμών A.23 (5). Για τον προσδιορισμό του log KOW χρησιμοποιείται περιστασιακά η τεχνική της κατανομής σε στήλη (generator column). Ο αριθμός των διαθέσιμων μελετών στις οποίες έχει χρησιμοποιηθεί η τεχνική αυτή, κυρίως για τα χλωριωμένα διφαινύλια και τις διβενζοδιοξίνες, είναι περιορισμένος (π.χ. Li και Doucette, 1993) (3). Για ουσίες που είναι πιθανόν να ιοντίζονται, ο log K OW θα πρέπει να αναφέρεται στη μη ιοντισμένη μορφή.
(38) Βλ. ορισμούς και μονάδες στο προσάρτημα 1
(39) TLC: Χρωματογραφία λεπτής στιβάδας· HPLC: υγροχρωματογραφία υψηλής πίεσης (απόδοσης)· GC: αεριοχρωματογραφία,
(40) Βάσει ορισμένων ρυθμιστικών πλαισίων, η ανάλυση των μεταβολιτών ενδέχεται να είναι υποχρεωτική υπό ορισμένες προϋποθέσεις (βλ. παράγραφο 65).
(41) Οι μετρούμενες συγκεντρώσεις στο νερό κατά τη φάση πρόσληψης θα πρέπει γενικά να υπερβαίνουν τουλάχιστον κατά μία τάξη μεγέθους το όριο ποσοτικοποίησης, ώστε να είναι δυνατή η μέτρηση περισσότερων του ενός υποδιπλασιασμών της επιβάρυνσης του σώματος κατά τη φάση αποβολής της μελέτης.
(42) Βλ. ορισμούς και μονάδες στο προσάρτημα 1
(43) Για τις περισσότερες υπό δοκιμή ουσίες, δεν θα πρέπει, στην ιδανική περίπτωση, να ανιχνεύονται συγκεντρώσεις στο νερό των μαρτύρων. Οι συγκεντρώσεις υποβάθρου αφορούν μόνο υλικά που συναντώνται στη φύση (π.χ. ορισμένα μέταλλα) και ουσίες που είναι πανταχού παρούσες στο περιβάλλον.
(44) Εάν είναι προφανές ότι δεν ακολουθείται κινητική πρώτης τάξης, θα πρέπει να χρησιμοποιούνται πιο σύνθετα μοντέλα (βλ. παραπομπές στο προσάρτημα 5) και να ζητείται η γνώμη βιοστατιστικολόγου.
(45) Η πρόσληψη μπορεί να περιοριστεί από χαμηλές συγκεντρώσεις έκθεσης, λόγω της χαμηλής υδατοδιαλυτότητας στη δοκιμή βιοσυγκέντρωσης, ενώ με τη δοκιμή διατροφικής έκθεσης είναι δυνατόν να επιτευχθούν πολύ υψηλότερες συγκεντρώσεις έκθεσης.
(46) Για τις πολυσυστατικές ουσίες, τις UVCB και τα μείγματα, θα πρέπει να λαμβάνεται υπόψη η υδατοδιαλυτότητα κάθε ουσιώδους συστατικού για τον καθορισμό των κατάλληλων συγκεντρώσεων έκθεσης.
(47) Ο TOC περιλαμβάνει τα σωματίδια οργανικού άνθρακα και τον διαλυμένο οργανικό άνθρακα, δηλ. TOC = POC + DOC.
(48) Σε περίπτωση χρήσης διαλύτη ή μέσου διαλυτοποίησης, αν και γενικά δεν συνιστάται, ο οργανικός άνθρακας που προέρχεται από το εν λόγω μέσο θα πρέπει να προστίθεται στον οργανικό άνθρακα από την υπό δοκιμή ουσία για την αξιολόγηση της συγκέντρωσης οργανικού άνθρακα στα δοχεία δοκιμής.
(49) Εάν η περιεκτικότητα σε λιπίδια δεν αναλύεται στα ίδια ψάρια με την υπό δοκιμή ουσία, τα ψάρια θα πρέπει τουλάχιστον να έχουν παρόμοιο βάρος και (κατά περίπτωση) να είναι του ίδιου φύλου.
(50) Η εναλλακτική αυτή λύση είναι έγκυρη μόνο εάν τα ψάρια όλων των ομάδων δοκιμής διατηρούνται σε ομάδες παρόμοιου μεγέθους, απομακρύνονται από τα δοχεία σύμφωνα με το ίδιο μοντέλο και σιτίζονται με τον ίδιο τρόπο. Με τον τρόπο αυτό διασφαλίζεται παρόμοια ανάπτυξη των ψαριών όλων των ομάδων δοκιμής, εάν η εξεταζόμενη συγκέντρωση είναι μικρότερη από το τοξικό εύρος. Εάν η ανάπτυξη είναι παρόμοια, αναμένεται να είναι παρόμοια και η περιεκτικότητα σε λιπίδια. Οι αναπτυξιακές διαφορές στην ομάδα μάρτυρα θα υποδηλώνουν επίδραση ουσίας και θα ακυρώνουν τη μελέτη.
(51) Εκτός από το βάρος, θα πρέπει να καταγράφεται και το ολικό μήκος, διότι η σύγκριση των αυξήσεων του μήκους κατά τη διάρκεια της δοκιμής αποτελεί καλό δείκτη της επέλευσης δυσμενών επιδράσεων.
(52) Οι σταθερές ρυθμού ανάπτυξης μπορούν να υποβληθούν σε στατιστικό έλεγχο t, για να διαπιστωθεί αν υπάρχει διαφορά ανάπτυξης μεταξύ των ομάδων δοκιμής και των ομάδων μαρτύρων, ή σε έλεγχο F σε περίπτωση ανάλυσης διασποράς. Σε περίπτωση ανάγκης, μπορεί να διενεργηθεί έλεγχος F ή έλεγχος λόγου πιθανοφανειών για να υποβοηθήσει την επιλογή του κατάλληλου αναπτυξιακού μοντέλου [μονογραφία αριθ. 54 του ΟΟΣΑ, (32)].
(53) Τα ποσοστά αυτά προϋποθέτουν ότι οι αναλυτικές μέθοδοι είναι αξιόπιστες και ο χρόνος υποδιπλασιασμού είναι < 14 ημέρες. Εάν οι αναλυτικές μέθοδοι είναι λιγότερο αξιόπιστες ή ο χρόνος υποδιπλασιασμού είναι (κατά πολύ) μεγαλύτερος, οι αριθμοί αυτοί θα είναι μεγαλύτεροι.
CI: διάστημα εμπιστοσύνης (όταν είναι δυνατός ο υπολογισμός)
SD: τυπική απόκλιση (όταν είναι δυνατός ο υπολογισμός)
(56) Η ελαχιστοποιημένη δοκιμή μπορεί στην πράξη να χρησιμοποιηθεί για να αποδειχθεί ο ταχύς μεταβολισμός, όταν είναι γνωστό ότι είναι πιθανό ο μεταβολισμός να είναι ταχύς.
(57) Όταν μετρώνται μόνο δύο σημεία δεδομένων, εκτιμήσεις των ορίων εμπιστοσύνης για BCFKm μπορούν να εκτιμηθούν με μεθόδους bootstrap. Όταν είναι επίσης διαθέσιμα ενδιάμεσα σημεία δεδομένων, μπορούν να υπολογιστούν επίσης όρια εμπιστοσύνης για BCFKm όπως και στην πλήρη δοκιμή.
(58) Βλ. ορισμούς και μονάδες στο προσάρτημα 1
(59) Για τους σκοπούς του κανονισμού (ΕΚ) αριθ. 1907/2006 για την καταχώριση, την αξιολόγηση, την αδειοδότηση και τους περιορισμούς των χημικών προϊόντων (REACH) (ΕΕ L 396 της 30.12.2006, σ. 1), το θέμα αυτό καλύπτεται από το έγγραφο «Καθοδήγηση σχετικά με τις απαιτήσεις πληροφοριών και την αξιολόγηση χημικής ασφάλειας», κεφάλαιο R.7c, σημεία R.7.10.3.1, σ. 13, R.7.10.4.1, σ. 31-32 και στο διάγραμμα R 7.10-2, σ. 50.
(60) Για τις περισσότερες υπό δοκιμή ουσίες, δεν θα πρέπει, στην ιδανική περίπτωση, να ανιχνεύονται συγκεντρώσεις στο νερό των μαρτύρων. Οι συγκεντρώσεις υποβάθρου αφορούν μόνο υλικά που συναντώνται στη φύση (π.χ. ορισμένα μέταλλα) και ουσίες που είναι πανταχού παρούσες στο περιβάλλον.
(61) Εφόσον ο BMF ορίζεται ως ο λόγος της συγκέντρωσης μιας ουσίας σε έναν οργανισμό προς τη συγκέντρωση στην τροφή του οργανισμού σε σταθερή κατάσταση, τα λιπίδια λαμβάνονται υπόψη με διόρθωση ως προς την περιεκτικότητα του οργανισμού και της τροφής σε λιπίδια και, ως εκ τούτου, η εν λόγω διαδικασία περιγράφεται ακριβέστερα με τον όρο «διόρθωση». Η προσέγγιση αυτή διαφέρει από την «κανονικοποίηση» σε καθορισμένη περιεκτικότητα του οργανισμού σε λιπίδια, όπως στη δοκιμή βιοσυγκέντρωσης με υδατική έκθεση.
(62) Το ολικό μήκος θα πρέπει επίσης να καταγράφεται κατά τη διάρκεια της δοκιμής, διότι αποτελεί καλό δείκτη πρόκλησης δυσμενών επιδράσεων.
(63) Το HCB περιλαμβάνεται στα παραρτήματα Α και Γ της Σύμβασης της Στοκχόλμης και στα παραρτήματα I και III του κανονισμού (ΕΚ) αριθ. 850/2004 για τους έμμονους οργανικούς ρύπους (ΕΕ L 158 της 30.4.2004, σ. 7)
(64) Η ταχεία ανάπτυξη κατά τη φάση πρόσληψης συνεπάγεται ότι ο πραγματικός ρυθμός σίτισης θα μειωθεί σε επίπεδο χαμηλότερο από εκείνο που καθορίστηκε κατά την έναρξη της έκθεσης.
(65) Σε μελέτη υδατικής έκθεσης, ο χρόνος υποδιπλασιασμού 14 ημερών θα αντιστοιχούσε σε BCF περίπου 10 000 L/kg με τη χρήση ψαριών βάρους 1 g με ρυθμό πρόσληψης περίπου 500 L/kg/d (σύμφωνα με την εξίσωση των Sijm και συν. (46)).
(66) Δεδομένου ότι οι πραγματικές εσωτερικές συγκεντρώσεις μπορούν να προσδιοριστούν μόνο μετά τη διεξαγωγή της δοκιμής, απαιτείται εκτίμηση της αναμενόμενης εσωτερικής συγκέντρωσης (π.χ. με βάση τον αναμενόμενο BMF και τη συγκέντρωση στην τροφή· βλ. εξίσωση Α5.8 στο προσάρτημα 5).
(67) Η παρουσία της υπό δοκιμή ουσίας στο μέσο δοκιμής ως αποτέλεσμα απέκκρισης από τα ψάρια ή έκπλυσης από την τροφή ίσως είναι αδύνατο να αποφευχθεί πλήρως. Ως εκ τούτου, μια επιλογή είναι να μετράται η συγκέντρωση της ουσίας στο νερό στο τέλος της περιόδου πρόσληψης, ιδίως εάν χρησιμοποιείται ημιστατική διάταξη, για να διαπιστώνεται κατά πόσον έχει σημειωθεί υδατική έκθεση.
(68) Η προσέγγιση αυτή εφαρμόζεται ειδικά στη διατροφική μελέτη και διαφέρει από τη διαδικασία που ακολουθείται στη μέθοδο της υδατικής έκθεσης και, για τον λόγο αυτόν, χρησιμοποιείται η λέξη «διόρθωση» αντί της «κανονικοποίησης» για να αποφεύγεται η σύγχυση — βλ. επίσης υποσημείωση (34).
(69) Μπορεί να διενεργηθεί έλεγχος t των σταθερών ρυθμού αύξησης, για να εξακριβωθεί αν υπάρχει διαφορά στην ανάπτυξη μεταξύ των ομάδων δοκιμής και των ομάδων μαρτύρων, ή έλεγχος F σε περίπτωση ανάλυσης διασποράς. Εάν χρειάζεται, μπορεί να διενεργηθεί έλεγχος F ή έλεγχος λόγου πιθανοφανειών για να υποβοηθήσει την επιλογή του κατάλληλου αναπτυξιακού μοντέλου [μονογραφία αριθ. 54 του ΟΟΣΑ (32)].
(70) Τεχνική ανάλυσης της περιεκτικότητας των τροφών σε πρωτεΐνες, λιπίδια, ολικές διαιτητικές ίνες και τέφρα· οι πληροφορίες αυτές παρέχονται συνήθως από τον προμηθευτή των ζωοτροφών.
CI: διάστημα εμπιστοσύνης (όταν είναι δυνατός ο υπολογισμός)
SD: τυπική απόκλιση (όταν είναι δυνατός ο υπολογισμός)
(73) Meyer et al. (1)
(74) Πρέπει να επισημανθεί ότι σε αυτή τη δοκιμή καθαυτή, το βάρος είναι το προτιμώμενο μέτρο για τον υπολογισμό του μεγέθους και της σταθεράς ρυθμού ανάπτυξης. Αναγνωρίζεται, ωστόσο, ότι το μήκος αποτελεί πιο πρακτικό μέτρο, εάν τα ψάρια πρέπει να επιλέγονται μακροσκοπικά κατά την έναρξη του πειράματος (δηλ. από τον αρχικό πληθυσμό).
(75) Αυτό το εύρος τιμών μήκους αναφέρεται στις μεθόδους δοκιμών για νέες χημικές ουσίες με βάση τον ιαπωνικό νόμο για τον έλεγχο των χημικών ουσιών (CSCL).
(76) Οι τιμές σε παρενθέσεις είναι αριθμοί δειγμάτων (νερού, ψαριών) που πρέπει να λαμβάνονται, εάν πρόκειται να διενεργηθεί πρόσθετη δειγματοληψία.
(77) Η εκτίμηση πριν από τη δοκιμή της k 2 για log K OW 4,0 είναι 0,652 ημέρες-1. Η συνολική διάρκεια του πειράματος ορίζεται σε 3 × t SS = 3 × 4,6 ημέρες, δηλ. 14 ημέρες. Για την εκτίμηση της t SS βλ. προσάρτημα 5.
(78) Δειγματοληψία νερού μετά από παροχή νερού όγκου τουλάχιστον τριών θαλάμων.
(79) Τα ψάρια αυτά μπορούν να λαμβάνονται από τον αποθεματικό πληθυσμό.
(80) Εάν πρέπει να διεξαχθούν ακριβέστερος προσδιορισμός ή μελέτες μεταβολισμού που απαιτούν περισσότερα ψάρια, αυτά θα πρέπει να υποβάλλονται σε δειγματοληψία, ιδίως στο τέλος των φάσεων πρόσληψης και αποβολής (βλ. παράγραφο 40).
(81) Ενδέχεται να απαιτούνται τουλάχιστον 3 επιπλέον ψάρια για την ανάλυση της περιεκτικότητας σε λιπίδια, εάν δεν είναι δυνατόν να χρησιμοποιηθεί το ίδιο δείγμα στο οποίο μετρούνται οι συγκεντρώσεις της ουσίας, κατά την έναρξη της δοκιμής, στο τέλος της φάσης πρόσληψης και στο τέλος της φάσης αποβολής. Σημείωση: σε πολλές περιπτώσεις, θα πρέπει να είναι εφικτή η χρήση τριών ψαριών-μαρτύρων μόνο (βλ. παράγραφο 56).
(82) 3 δείγματα ιχθυοτροφής τόσο από την ομάδα μαρτύρων όσο και από την ομάδα δοκιμής αναλύονται για να μετρηθούν οι συγκεντρώσεις της υπό δοκιμή ουσίας και η περιεκτικότητα σε λιπίδια.
(83) Λαμβάνονται δείγματα ψαριών από τον αποθεματικό πληθυσμό σε όσο το δυνατόν πλησιέστερο χρόνο προς την έναρξη της μελέτης· τουλάχιστον 3 ψάρια από τον αποθεματικό πληθυσμό κατά την έναρξη της δοκιμής θα πρέπει να περιλαμβάνονται στο δείγμα για την περιεκτικότητα σε λιπίδια.
(84) Μια (προαιρετική) δειγματοληψία κοντά στην έναρξη της φάσης πρόσληψης παρέχει στοιχεία για τον υπολογισμό της διατροφικής αφομοίωσης της υπό δοκιμή ουσίας που μπορεί να συγκριθεί με την απόδοση της αφομοίωσης που υπολογίζεται με βάση τα δεδομένα της φάσης αποβολής.
(85) Μπορούν να ληφθούν ως δείγματα 5 επιπλέον ψάρια για ειδική ιστολογική ανάλυση.
(86) Ενδέχεται να απαιτούνται τουλάχιστον 3 επιπλέον ψάρια για την ανάλυση της περιεκτικότητας σε λιπίδια, εάν δεν είναι δυνατόν να χρησιμοποιηθεί το ίδιο δείγμα στο οποίο μετρούνται οι συγκεντρώσεις της ουσίας κατά την έναρξη της δοκιμής, στο τέλος της φάσης πρόσληψης και στο τέλος της φάσης αποβολής. Σημείωση: σε πολλές περιπτώσεις, θα πρέπει να είναι εφικτή η χρήση τριών ψαριών-μαρτύρων μόνο (βλ. παραγράφους 56 και 153).
(87) Όπως συμβαίνει με κάθε εμπειρική σχέση, θα πρέπει να εξακριβώνεται ότι η υπό δοκιμή ουσία εμπίπτει στο πεδίο εφαρμογής της σχέσης.
(88) Το βάρος του ψαριού στο τέλος της φάσης πρόσληψης μπορεί να εκτιμηθεί βάσει δεδομένων προηγούμενης μελέτης ή τη γνώση ότι το μέγεθος του υπό δοκιμή είδους είναι πιθανό να αυξηθεί από το σύνηθες αρχικό βάρος κατά την έναρξη σε μια συνήθη διάρκεια πρόσληψης (π.χ. 28 ημερών).
(89) Στα περισσότερα προγράμματα που επιτρέπουν τη γραμμική παλινδρόμηση, παρέχονται επίσης τυπικά σφάλματα και διάστημα εμπιστοσύνης (CI) των εκτιμήσεων, π.χ. στο Microsoft Excel με τη χρήση της εργαλειοθήκης ανάλυσης δεδομένων.
(90) Σε αντίθεση με τη μέθοδο γραμμικής παλινδρόμησης, η χρησιμοποίηση αυτού του μαθηματικού τύπου δεν θα αποδώσει τυπικό σφάλμα για την k2.
(91) Σε αντίθεση με μια γραμμική διαδικασία προσαρμογής, η παρούσα μέθοδος συνήθως δεν παρέχει τυπικό σφάλμα ή διάστημα εμπιστοσύνης για τις εκτιμήσεις της k1.
(92) Πρέπει να γίνει αντιληπτό ότι η αβεβαιότητα όσον αφορά την εκτίμηση της K2 δεν χρησιμοποιείται ορθά στο μοντέλο βιοσυσσώρευσης, όταν αυτό στην ουσία εκλαμβάνεται ως σταθερά κατά την προσαρμογή της Κ1 στη μέθοδο διαδοχικής προσαρμογής. Η συνακόλουθη αβεβαιότητα ως προς τον BCF θα είναι, συνεπώς, διαφορετική ανάμεσα στις μεθόδους ταυτόχρονης και διαδοχικής προσαρμογής.
(93) Σε ορισμένες περιοχές, μπορεί να είναι δυνατή μόνον η προμήθεια ιχθυοτροφής με συγκέντρωση λιπιδίων που υπολείπεται κατά πολύ του εν λόγω ανωτάτου ορίου. Στις περιπτώσεις αυτές, οι μελέτες θα πρέπει να διεξάγονται με τη χαμηλότερη συγκέντρωση λιπιδίων στις τροφές, ανάλογα με την προμήθεια, και ο ρυθμός σίτισης να προσαρμόζεται κατάλληλα για τη διατήρηση της υγείας των ψαριών. Τα λιπίδια των σιτηρεσίων δεν θα πρέπει να αυξάνονται τεχνητά με την προσθήκη περίσσειας ελαίου.
(94) Στη φύση, η οδός που οδηγεί στη μεγαλύτερη έκθεση σε πολύ υδρόφοβες ουσίες στο υδάτινο περιβάλλον είναι πιθανότατα η πρόσληψη τροφής και, επομένως, οι κατ' εκτίμηση BCF δεν είναι απόλυτα αντιπροσωπευτικοί του δυναμικού βιοσυσσώρευσης των εν λόγω ουσιών.
(95) Μπορούν να χρησιμοποιηθούν και άλλες δαφνιίδες, υπό τον όρο ότι ανταποκρίνονται στα κριτήρια εγκυρότητας, κατά περίπτωση (το κριτήριο εγκυρότητας που αφορά την αναπαραγωγική απόδοση των μαρτύρων θα πρέπει κανονικά να αφορά όλα τα είδη). Εάν χρησιμοποιούνται άλλες δαφνιίδες θα πρέπει να ταυτοποιούνται επακριβώς και να αιτιολογείται η χρήση τους.
(96) Τυχαία θνησιμότητα: θνησιμότητα που δεν σχετίζεται με χημική ουσία και οφείλεται σε τυχαίο συμβάν(δηλαδή γνωστής αιτιολογίας)
(97) Απροσδόκητη θνησιμότητα: θνησιμότητα άγνωστης αιτιολογίας που δεν σχετίζεται με τη χημική ουσία
(*6) Σημειώνεται ποιο δοχείο χρησιμοποιήθηκε για τα πείραμα.
(*7) Τα αυγά που δεν εκκολάφθηκαν καταγράφονται με την ένδειξη «AB» (aborted) στο αντίστοιχο τετραγωνίδιο.
(*8) Η θνησιμότητα των γεννητόρων καταγράφεται με την ένδειξη «Μ» (mortality) στο αντίστοιχο τετραγωνίδιο.
(98) Το σύνηθες ελάχιστο μέσο ολικό μήκος δεν αποτελεί κριτήριο εγκυρότητας, αλλά οι αποκλίσεις κάτω από τον αναφερόμενο αριθμό θα πρέπει να εξετάζονται προσεκτικά σε σχέση με την ευαισθησία της δοκιμής. Το ελάχιστο μέσο ολικό μήκος συνάγεται από επιλογή των δεδομένων που είναι επί του παρόντος διαθέσιμα.
(99) Το υπό δοκιμή συγκεκριμένο στέλεχος ιριδίζουσας πέστροφας μπορεί να απαιτεί τη χρήση άλλων θερμοκρασιών. Οι γεννήτορες πρέπει να διατηρούνται στην ίδια θερμοκρασία με εκείνη που χρησιμοποιείται για τα αυγά. Μετά την παραλαβή των αυγών από εμπορικό εκτροφέα, είναι απαραίτητη μια σύντομης διάρκειας προσαρμογή (π.χ. 1-2 ωρών) στη θερμοκρασία της δοκιμής μετά την άφιξη.
(100) Σκοτάδι για τις προνύμφες έως μία εβδομάδα μετά την εκκόλαψη, εκτός από τον χρόνο κατά τον οποίο επιθεωρούνται, και στη συνέχεια χαμηλός φωτισμός καθ' όλη τη διάρκεια της δοκιμής (φωτοπερίοδος 12-16 ωρών) (4).
(101) Για δεδομένες συνθήκες δοκιμής, το πρόγραμμα φωτισμού πρέπει να είναι σταθερός.
(102) Για δεδομένη δοκιμή, η τιμή πρέπει να επιτυγχάνεται με ακρίβεια ± 2 0/00.
(*9) Η τροφή θα πρέπει να παρέχεται μέχρι κορεσμού. Η πλεονάζουσα τροφή και τα περιττώματα θα πρέπει να απομακρύνονται, στο μέτρο του αναγκαίου για την αποφυγή της συσσώρευσης αποβλήτων.
|
FBS |
Κατεψυγμένες γαρίδες της άλμης, ενήλικες Artemia sp |
|
BSN |
Ναύπλιοι γαρίδας της άλμης, νεοεκκολαφθέντες |
|
BSN48 |
Ναύπλιοι γαρίδας της άλμης, ηλικίας 48 ωρών |
(1) οι λεκιθοφόρες προνύμφες δεν χρειάζονται τροφή
(2) διηθημένα από μεικτή καλλιέργεια
(3) κόκκοι από διεργασία ζύμωσης
(*10) Oι θηλοειδείς αποφύσεις κανονικά εμφανίζονται μόνο σε ενήλικα αρσενικά άτομα και απαντώνται στις ακτίνες του εδρικού πτερυγίου, από τη δεύτερη έως την έβδομη ή όγδοη, αριθμώντας από το οπίσθιο άκρο του (εικόνες 1 και 2). Ωστόσο, σπάνια εμφανίζονται αποφύσεις στην πρώτη ακτίνα του εδρικού πτερυγίου, αριθμώντας από το οπίσθιο άκρο του. Η παρούσα τυποποιημένη διαδικασία (SOP) καλύπτει τη μέτρηση των αποφύσεων στην πρώτη ακτίνα του πτερυγίου (ο αριθμός ακτίνας πτερυγίου παραπέμπει στη σειρά αρίθμησης από το οπίσθιο άκρο του εδρικού πτερυγίου στην παρούσα SOP).
(*11) Ρυθμιστικό διάλυμα ομογενοποίησης:
|
— |
(50 mM Tris-HCl pH 7,4· μείγμα αναστολέων πρωτεάσης 1 % (Sigma)): 12 ml Tris-HCl pH 7,4 + 120 μl μείγματος αναστολέων πρωτεάσης. |
|
— |
TRIS: TRIS-ULTRA PURE (ICN) π.χ. της Bie & Berntsen, Δανία. |
|
— |
Μείγμα αναστολέων πρωτεάσης: της Sigma (για ιστούς θηλαστικών). Κωδικός προϊόντος P 8340. |
ΣΗΜΕΙΩΣΗ: Το ρυθμιστικό διάλυμα ομογενοποίησης θα πρέπει να χρησιμοποιείται την ημέρα παρασκευής του. Κατά τη διάρκεια της χρήσης να τοποθετείται σε πάγο.
(103) Carl von Linné/Κάρολος Λινναίος (* 23 Μαΐου 1707 στο Råshult /Älmhult, † Ουψάλα, 10 Ιανουαρίου 1778).
(*12) απιονισμένο ή απεσταγμένο νερό




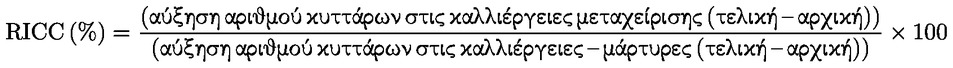

 , που ισούται με 0,095 mm. Οι χρήστες θα πρέπει να γνωρίζουν ότι η ένδειξη της σχισμοειδούς λυχνίας για το πάχος του κερατοειδούς μπορεί να διαφέρει ανάλογα με τη ρύθμιση του πλάτους της σχισμής.
, που ισούται με 0,095 mm. Οι χρήστες θα πρέπει να γνωρίζουν ότι η ένδειξη της σχισμοειδούς λυχνίας για το πάχος του κερατοειδούς μπορεί να διαφέρει ανάλογα με τη ρύθμιση του πλάτους της σχισμής.