EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32013R0294
Commission Regulation (EU) No 294/2013 of 14 March 2013 amending and correcting Regulation (EU) No 142/2011 implementing Regulation (EC) No 1069/2009 of the European Parliament and of the Council laying down health rules as regards animal by-products and derived products not intended for human consumption and implementing Council Directive 97/78/EC as regards certain samples and items exempt from veterinary checks at the border under that Directive Text with EEA relevance
Verordnung (EU) Nr. 294/2013 der Kommission vom 14. März 2013 zur Änderung und Berichtigung der Verordnung (EU) Nr. 142/2011 zur Durchführung der Verordnung (EG) Nr. 1069/2009 des Europäischen Parlaments und des Rates mit Hygienevorschriften für nicht für den menschlichen Verzehr bestimmte tierische Nebenprodukte sowie zur Durchführung der Richtlinie 97/78/EG des Rates hinsichtlich bestimmter gemäß der genannten Richtlinie von Veterinärkontrollen an der Grenze befreiter Proben und Waren Text von Bedeutung für den EWR
Verordnung (EU) Nr. 294/2013 der Kommission vom 14. März 2013 zur Änderung und Berichtigung der Verordnung (EU) Nr. 142/2011 zur Durchführung der Verordnung (EG) Nr. 1069/2009 des Europäischen Parlaments und des Rates mit Hygienevorschriften für nicht für den menschlichen Verzehr bestimmte tierische Nebenprodukte sowie zur Durchführung der Richtlinie 97/78/EG des Rates hinsichtlich bestimmter gemäß der genannten Richtlinie von Veterinärkontrollen an der Grenze befreiter Proben und Waren Text von Bedeutung für den EWR
OJ L 98, 6.4.2013, p. 1–57
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
Special edition in Croatian: Chapter 03 Volume 072 P. 11 - 67
 In force: This act has been changed. Current consolidated version: 15/03/2013
In force: This act has been changed. Current consolidated version: 15/03/2013
|
6.4.2013 |
DE |
Amtsblatt der Europäischen Union |
L 98/1 |
VERORDNUNG (EU) Nr. 294/2013 DER KOMMISSION
vom 14. März 2013
zur Änderung und Berichtigung der Verordnung (EU) Nr. 142/2011 zur Durchführung der Verordnung (EG) Nr. 1069/2009 des Europäischen Parlaments und des Rates mit Hygienevorschriften für nicht für den menschlichen Verzehr bestimmte tierische Nebenprodukte sowie zur Durchführung der Richtlinie 97/78/EG des Rates hinsichtlich bestimmter gemäß der genannten Richtlinie von Veterinärkontrollen an der Grenze befreiter Proben und Waren
(Text von Bedeutung für den EWR)
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 1069/2009 des Europäischen Parlaments und des Rates vom 21. Oktober 2009 mit Hygienevorschriften für nicht für den menschlichen Verzehr bestimmte tierische Nebenprodukte und zur Aufhebung der Verordnung (EG) Nr. 1774/2002 (1), insbesondere auf Artikel 5 Absatz 2, Artikel 15 Absatz 1 Unterabsatz 1 Buchstaben b und c, Artikel 15 Absatz 1 Unterabsatz 2, Artikel 18 Absatz 3, Artikel 19 Absatz 4 Unterabsatz 1 Buchstaben a, b und c, Artikel 19 Absatz 4 Unterabsatz 2, Artikel 21 Absatz 6 Buchstabe c, Artikel 32 Absatz 3 Buchstabe a, Artikel 40 Unterabsatz 1 Buchstabe d und Artikel 41 Absatz 3 Unterabsätze 1 und 3, Artikel 42 Absatz 2 und Artikel 45 Absatz 4,
in Erwägung nachstehender Gründe:
|
(1) |
Die Verordnung (EG) Nr. 1069/2009 enthält Hygiene- und Veterinärvorschriften für tierische Nebenprodukte und ihre Folgeprodukte, mit denen von diesen Produkten ausgehende Risiken für die Gesundheit von Mensch und Tier vermieden bzw. minimiert werden sollen. Auch ist dort für bestimmte Folgeprodukte die Festlegung eines Endpunkts in der Produktionskette vorgesehen, ab dem diese Produkte nicht mehr den Anforderungen der genannten Verordnung entsprechen müssen. |
|
(2) |
Mit der Verordnung (EU) Nr. 142/2011 der Kommission vom 25. Februar 2011 zur Durchführung der Verordnung (EG) Nr. 1069/2009 des Europäischen Parlaments und des Rates mit Hygienevorschriften für nicht für den menschlichen Verzehr bestimmte tierische Nebenprodukte sowie zur Durchführung der Richtlinie 97/78/EG des Rates hinsichtlich bestimmter gemäß der genannten Richtlinie von Veterinärkontrollen an der Grenze befreiter Proben und Waren (2) wurden Durchführungsvorschriften für die Verordnung (EG) Nr. 1069/2009 eingeführt, darunter Regeln über die Bestimmung von Endpunkten für bestimmte Folgeprodukte. |
|
(3) |
In ihrer Stellungnahme vom 7. Februar 2011 über die Fähigkeit oleochemischer Prozesse, TSE-bezogene Risiken in tierischen Nebenprodukten der Kategorie 1 zu minimieren (3), kam die Europäische Behörde für Lebensmittelsicherheit (EFSA) zu dem Schluss, dass sich das Risiko einer Verbreitung der transmissiblen spongiformen Enzephalopathie (TSE) nach einer Behandlung von Material der Kategorie 1 mit hydrolytischer Fettspaltung und Hydrierung erheblich verringert. Allerdings besteht Unsicherheit in Bezug auf die Verringerung der TSE-Infektiosität in oleochemischen Produkten, die aus Material der Kategorie 1 hergestellt wurden. Aus diesem Grund kann nicht mit Sicherheit angenommen werden, dass diese Produkte frei von Infektiosität sind; daher können sie ein Risiko darstellen, wenn sie in die Lebens- oder Futtermittelkette gelangen. Artikel 3 der Verordnung (EU) Nr. 142/2011 und ihre Anhänge XIV und XV sollten daher entsprechend geändert werden. |
|
(4) |
In Artikel 18 Absatz 1 der Verordnung (EG) Nr. 1069/2009 sind Ausnahmeregelungen für die Verwendung von Material der Kategorien 2 und 3 für die Fütterung bestimmter Tiere vorgesehen, die nicht in die Lebensmittelkette gelangen, einschließlich Zirkustieren. Da bestimmte Zirkustiere zu Arten gehören, die normalerweise für die Lebensmittelproduktion verwendet werden, sollte die Verfütterung dieses Materials an Zirkustiere den Bestimmungen des Artikels 13 der Verordnung (EU) Nr. 142/2011 unterworfen werden. |
|
(5) |
In Artikel 19 Absatz 1 Buchstabe f der Verordnung (EG) Nr. 1069/2009 ist eine Ausnahmeregelung für die Beseitigung von Bienen und Imkerei-Nebenprodukten durch Verbrennung oder Vergraben an Ort und Stelle unter Bedingungen vorgesehen, mit deren Hilfe die Übertragung von Gefahren für die Gesundheit von Mensch und Tier verhindert wird. In Artikel 15 Buchstabe c der Verordnung (EU) Nr. 142/2011 wird auf Sondervorschriften für die Sammlung und Beseitigung von Bienen und Imkerei-Nebenprodukten verwiesen. Der einleitende Satz des genannten Artikels sollte daher dahingehend korrigiert werden, dass auch auf Sondervorschriften für die Sammlung und Beseitigung von Bienen und Imkerei-Nebenprodukten Bezug genommen wird. |
|
(6) |
Artikel 36 Absatz 3 der Verordnung (EU) Nr. 142/2011 sieht für die Beseitigung geringer Mengen von Material der Kategorie 3 gemäß Artikel 10 Buchstabe f der Verordnung (EG) Nr. 1069/2009 eine Übergangsfrist bis zum 31. Dezember 2012 vor. Diese Übergangsfrist sollte um zwei Jahre verlängert werden, in denen weitere Daten über Sammlung, Transport und Beseitigung des betreffenden Materials der Kategorie 3 erhoben werden sollten. |
|
(7) |
Verarbeitetes tierisches Protein aus tierischen Nebenprodukten, mit Ausnahme von Material der Kategorie 3 gemäß Artikel 10 Buchstaben n, o und p der Verordnung (EG) Nr. 1069/2009 darf als Zutat für die Herstellung verarbeiteten Heimtierfutters verwendet werden. Verarbeitetes tierisches Protein sollte nur als Heimtierfutter deklariert werden, wenn es in einem angemessenen Verhältnis mit anderen Futtermittelstoffen gemischt wird, die normalerweise zur Nahrung für Heimtiere der betreffenden Art gehören. Hersteller verarbeiteten tierischen Proteins dürfen dieses Produkt jedoch an Betreiber anerkannter Hundezwinger oder Hundemeuten sowie für die Ernährung von Hunden und Katzen in Tierheimen zum Zweck der Produktion von Mischfutter für Hunde und Katzen vertreiben. In diesem Fall ist das Produkt als verarbeitetes tierisches Protein zu deklarieren und zu kennzeichnen. Für die Ausfuhr verarbeiteten tierischen Proteins gelten neben den Rechtsvorschriften für tierische Nebenprodukte auch die Bestimmungen der Verordnung (EG) Nr. 999/2001 des Europäischen Parlaments und des Rates (4). Gemäß Anhang IV Teil III Abschnitt E Nummer 2 der genannten Verordnung unterliegt die Ausfuhr verarbeiteten tierischen Proteins einer schriftlichen Vereinbarung zwischen dem Ursprungsmitgliedstaat des verarbeiteten tierischen Proteins und dem Bestimmungsdrittland. Für die Ausfuhr von Heimtierfutter besteht eine solche Verpflichtung nicht. Angesichts des festgestellten Risikos einer unangemessenen Anwendung dieser Bestimmungen auf die Ausfuhr verarbeiteten tierischen Proteins ist eine präzisere Definition von Heimtierfutter erforderlich. |
|
(8) |
Die Umwandlung tierischer Nebenprodukte und Folgeprodukte in Biogas ist gemäß der Verordnung (EG) Nr. 1069/2009 zulässig. Die Produktion von Biogas führt zur Erzeugung fester oder flüssiger Fraktionen. Es sollte klargestellt werden, dass die Anforderungen bezüglich der Beseitigung dieser Rückstände für beide Fraktionen gelten. |
|
(9) |
In ihrer Stellungnahme vom 30. November 2010 zu den abiotischen Risiken von Glycerin als Beiprodukt der Biodieselproduktion aus tierischen Nebenprodukten der Kategorie 1 und Pflanzenölen für die Gesundheit von Mensch und Tier (5) erkennt die EFSA an, dass Glycerin, das nach der Methode 1 gemäß Anhang IV Kapitel III der Verordnung (EU) Nr. 142/2011 für die Produktion von Biodiesel behandelt wurde, ein in Bezug auf das TSE-Risiko sicheres Material ist. Glycerin als Beiprodukt aus der Biodieselproduktion kann nach der Biogasproduktion in Biogas und Fermentationsrückstände umgewandelt und auf dem Hoheitsgebiet des Produktionsmitgliedstaats ohne Risiko für die Gesundheit von Mensch und Tier auf landwirtschaftlichen Flächen ausgebracht werden, vorbehaltlich der Entscheidung der zuständigen Behörde. |
|
(10) |
Tierische Nebenprodukte gemäß Artikel 13 Buchstabe f der Verordnung (EG) Nr. 1069/2009 dürfen ohne Verarbeitung auf landwirtschaftlichen Flächen ausgebracht werden, sofern die zuständige Behörde der Ansicht ist, dass sie kein Risiko für die Ausbreitung einer ernsten übertragbaren Krankheit darstellen. Diese Produkte dürfen ebenfalls ohne vorherige Verarbeitung kompostiert oder in Biogas umgewandelt werden. |
|
(11) |
Der Standardwortlaut für die Beschreibung tierischer Nebenprodukte und von Folgeprodukten im Handel zwischen den Mitgliedstaaten gemäß Anhang VIII der Verordnung (EU) Nr. 142/2011 muss während Transport und Lagerung auf der Verpackung, dem Behälter oder dem Fahrzeug deutlich sichtbar und gut lesbar angebracht sein. Die Liste der Standardformulierungen sollte zur Berücksichtigung des Handels mit verarbeiteter Gülle erweitert werden. |
|
(12) |
Artikel 48 der Verordnung (EG) Nr. 1069/2009 verpflichtet Unternehmer, die zuständige Behörde des Bestimmungsmitgliedstaats zu informieren, wenn sie beabsichtigen, Sendungen mit Material der Kategorien 1 oder 2 zu versenden. Mitgliedstaaten dürfen bilaterale Vereinbarungen darüber schließen, ihre Einrichtungen für die Verbrennung von Heimtieren aus anderen Mitgliedstaaten, mit denen sie eine gemeinsame Grenze haben, bereitzustellen. In solchen Fällen stellen die Anforderungen des Artikels 48 Absätze 1 bis 3 der Verordnung (EG) Nr. 1069/2009 eine unnötige administrative Belastung dar. |
|
(13) |
Anhang X Kapitel II der Verordnung (EU) Nr. 142/2011 enthält spezielle Anforderungen an Folgeprodukte, die für die Produktion von Futtermitteln bestimmt sind. Der Wortlaut der Ausnahmeregelung für das Inverkehrbringen von nach nationalen Normen verarbeiteter Milch sollte so angepasst werden, dass er sich auch auf Erzeugnisse auf Milchbasis und aus Milch gewonnene Erzeugnisse bezieht, so dass Abschnitt 4 Teil II des genannten Kapitels an die Bestimmungen in Artikel 10 der Verordnung (EG) Nr. 1069/2009 und insbesondere an den Buchstaben f in Bezug auf die Genehmigung der Umwandlung gewisser nicht mehr zum menschlichen Verzehr bestimmter Lebensmittel in Material zur Verfütterung an Nutztiere außer Pelztieren, angeglichen wird. |
|
(14) |
Wenn ehemalige Lebensmittel, die Bestandteile tierischen Ursprungs enthalten, als Ausgangsmaterial für die Herstellung von Futtermitteln für Nutztiere verwendet werden, gelten besondere Anforderungen zur Verhütung des Risikos der Übertragung von Krankheiten auf Tiere. Sofern die ehemaligen Lebensmittel jedoch weder Fleisch, noch Fisch noch daraus gewonnene Produkte enthalten, sollte ihre Verwendung für die Produktion von Futtermitteln für Nutztiere erlaubt sein, soweit sie kein Risiko der Übertragung von auf Mensch oder Tier übertragbaren Krankheiten darstellen. |
|
(15) |
Artikel 32 der Verordnung (EG) Nr. 1069/2009 enthält Bedingungen für das Inverkehrbringen und die Verwendung organischer Düngemittel und Bodenverbesserungsmittel. Diese Produkte dürfen unter Beachtung der Anforderungen in Anhang XI der Verordnung (EU) Nr. 142/2011 aus Material der Kategorien 2 und 3 hergestellt werden. Im Fall verarbeiteten tierischen Proteins aus Material der Kategorie 3 sind die in Anhang X Kapitel II der Verordnung (EU) Nr. 142/2011 festgelegten spezifischen Produktionsanforderungen einzuhalten, auch in Bezug auf verarbeitetes tierisches Protein, das ausschließlich für die Verwendung in Heimtierfutter bestimmt ist. Der größeren Klarheit wegen sollte Anhang XI der Verordnung (EU) Nr. 142/2011 geändert werden, indem Verweise auf Verarbeitungsnormen für verarbeitetes tierisches Protein aufgenommen werden. |
|
(16) |
Zwecks Förderung wissenschaftlicher Forschung und insbesondere der Forschung zur biologischen Vielfalt sollte für Referenzarchive, wissenschaftliche Organisationen und Museen in Bezug auf Sammlung, Transport und Verwendung von in Medien konservierten, in Mikroskopträgern komplett eingeschlossenen oder als verarbeitete genetische Proben verwendeten Tieren oder Teilen von Tieren eine Ausnahmeregelung gelten. Die Anforderungen an Jagdtrophäen und andere Tierpräparate in Anhang XIII Kapitel VI der Verordnung (EU) Nr. 142/2011 sollten entsprechend geändert werden. |
|
(17) |
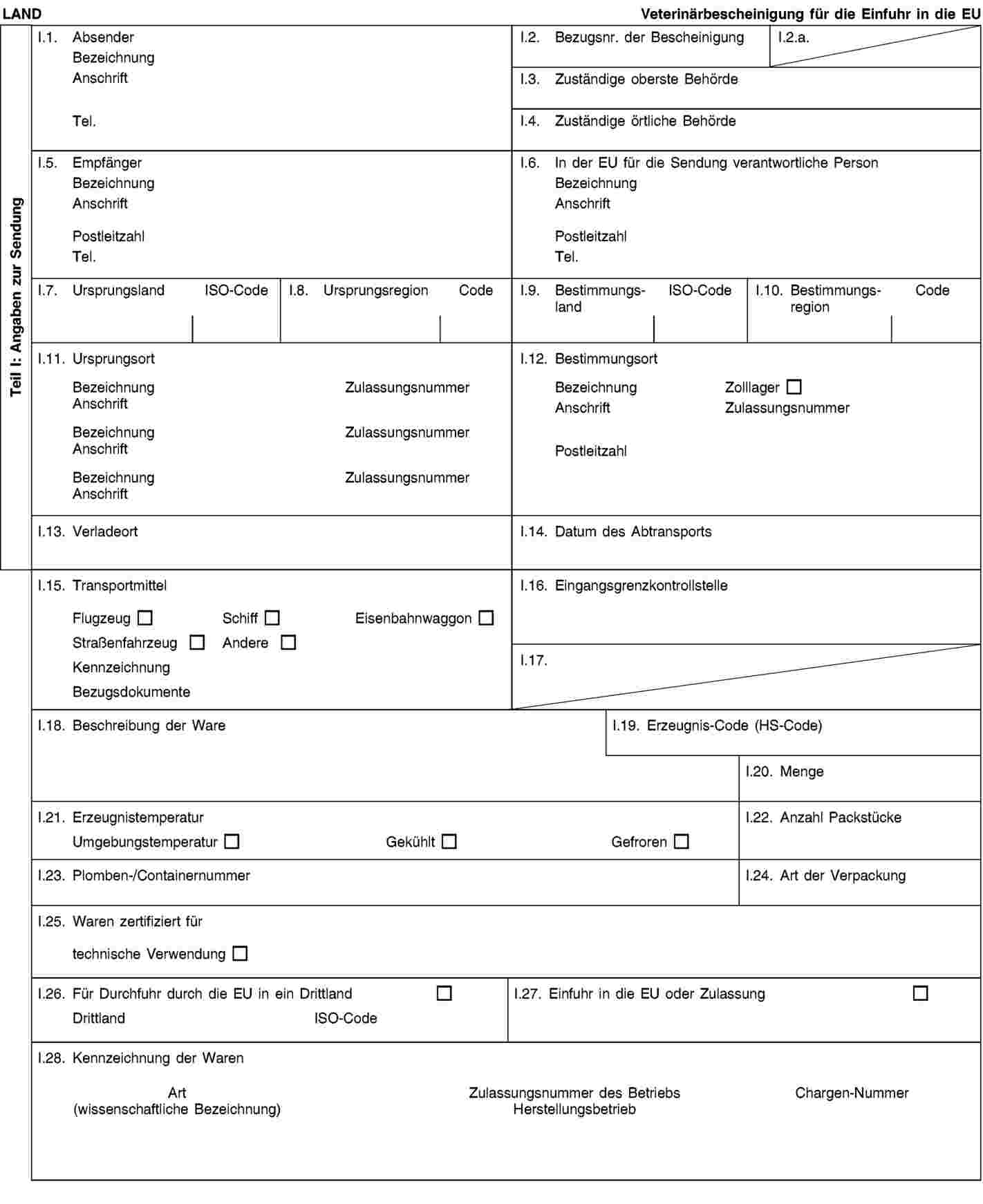
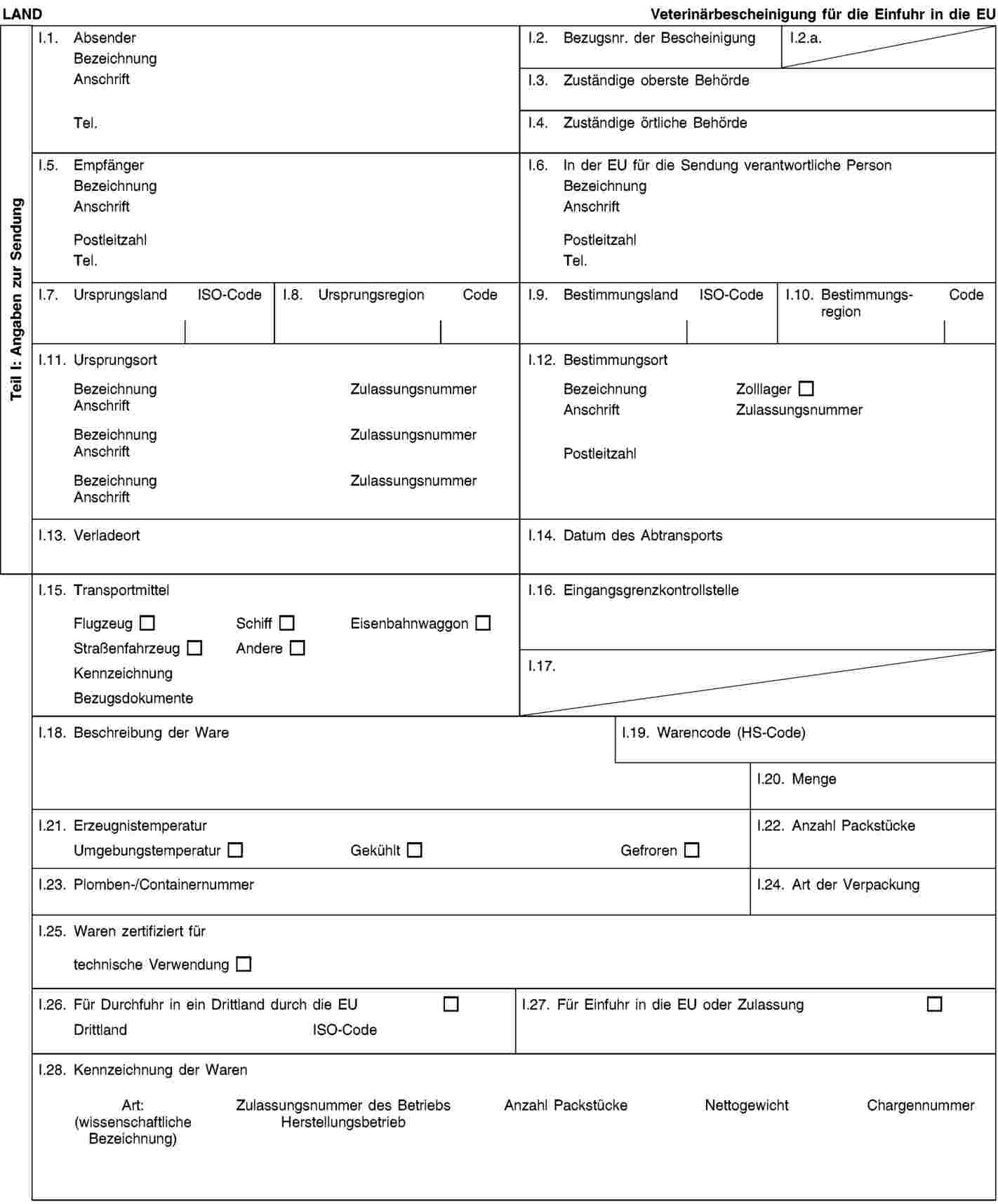
Tabelle 2 in Anhang XIV Kapitel II Abschnitt 1 der Verordnung (EU) Nr. 142/2011 enthält Anforderungen für die Einfuhr tierischer Nebenprodukte in die Union. Der Wortlaut bestimmter Teile der Tabelle 2 sollte klarer formuliert werden. In Bezug auf bestimmte Waren, die aus tierischen Nebenprodukten verschiedener Tiere bestehen können, sollte die Liste der Drittländer, aus denen tierische Nebenprodukte der einschlägigen Tierarten eingeführt werden dürfen, in Tabelle 2 entsprechend geändert werden. Die Änderungen sollten sich auch in den entsprechenden Bescheinigungen in Anhang XV der genannten Verordnung niederschlagen. |
|
(18) |
Heimtierfutter darf aus Material der Kategorie 3 ausgenommen Material der Kategorie 3 gemäß Artikel 10 Buchstaben n, o und p der Verordnung (EG) Nr. 1069/2009 hergestellt werden. Die Bestimmungen, die für das Inverkehrbringen von Heimtierfutter innerhalb der EU gelten, sollten auch für die Einfuhr aus Drittländern gelten. In die Bescheinigung in Anhang XV Kapitel 3(B) der Verordnung (EU) Nr. 142/2011 sollte ein Verweis auf Artikel 10 Buchstabe c der Verordnung (EG) Nr. 1069/2009 aufgenommen werden. |
|
(19) |
Bestimmte Anforderungen für die Einfuhr von Blut und Blutprodukten sollten klarer gefasst werden, insbesondere diejenigen, die sich auf den Ursprungs des Bluts beziehen. Blut muss aus sicheren Quellen stammen; dies können ein gemäß EU-Recht oder ein gemäß dem nationalen Recht eines Drittlands zugelassener Schlachthof oder für diesen Zweck gehaltene lebende Tiere sein. Blut aus solchen sicheren Quellen darf auch gemischt werden. Es ist notwendig, den Wortlaut der einschlägigen Bescheinigungen entsprechend zu ändern. Daher sollten Anhang XIV und die Musterveterinärbescheinigungen in Anhang XV Kapitel 4(A), 4(C) und 4(D) der Verordnung (EU) Nr. 142/2011 entsprechend geändert werden. |
|
(20) |
Anhang XVI der Verordnung (EU) Nr. 142/2011 enthält Bestimmungen für amtliche Kontrollen bezüglich der Fütterung aasfressender Vögel mit Material der Kategorie 1. Gemäß Artikel 18 der Verordnung (EG) Nr. 1069/2009 kann die zuständige Behörde die Verfütterung von Material der Kategorie 1 an gefährdete oder geschützte Arten aasfressender Vögel und andere Arten, die in ihrem natürlichen Lebensraum leben, zulassen. Die bestehenden Bestimmungen für amtliche Kontrollen bezüglich der Fütterung aasfressender Vögel sollten daher auf alle Tierarten ausgeweitet werden, für die die Fütterung mit Material der Kategorie 1 gemäß Anhang VI der Verordnung (EU) Nr. 142/2011 zugelassen werden kann. |
|
(21) |
Die Verordnung (EU) Nr. 142/2011 sollte daher entsprechend geändert werden. |
|
(22) |
Um Handelsstörungen zu vermeiden, sollte eine Übergangsfrist festgelegt werden, während der die Einfuhr von Waren, für die die Bestimmungen der Verordnung (EU) Nr. 142/2011 in der durch die vorliegende Verordnung geänderten Fassung gelten, von den Mitgliedstaaten gemäß den Bestimmungen, die vor dem Inkrafttreten/Geltungsdatum der vorliegenden Verordnung in Kraft waren, akzeptiert werden sollte. |
|
(23) |
Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit, und weder das Europäische Parlament noch der Rat haben ihnen widersprochen — |
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Die Verordnung (EU) Nr. 142/2011 wird wie folgt geändert:
|
1. |
Artikel 3 Buchstabe i wird durch Folgendes ersetzt:
|
|
2. |
Artikel 13 wird wie folgt geändert:
|
|
3. |
In Artikel 15 erhält der einleitende Satz folgende Fassung: „Gestatten die zuständigen Behörden die Beseitigung tierischer Nebenprodukte gemäß der in Artikel 19 Absatz 1 Buchstaben a, b, c, e und f der Verordnung (EG) Nr. 1069/2009 vorgesehenen Ausnahmeregelung, sind bei der Beseitigung folgende in Anhang VI Kapitel III festgelegten Sondervorschriften zu beachten:“. |
|
4. |
In Artikel 36 Absatz 3 wird das Datum „31. Dezember 2012“ durch das Datum „31. Dezember 2014“ ersetzt. |
|
5. |
Die Anhänge I, IV, V, VI, VIII, X und XI sowie XIII bis XVI werden gemäß dem Anhang dieser Verordnung geändert. |
Artikel 2
Während einer Übergangsfrist bis zum 26. Dezember 2013 werden Sendungen mit tierischen Nebenprodukten und Folgeprodukten, denen eine ausgefüllte und unterschriebene Veterinärbescheinigung nach einem der Muster in Anhang XV Kapitel 3(B), 3(D), 4(A), 4(C), 4(D), 6(A), 8, 10(B), 11, 14(A) und 15 der Verordnung (EU) Nr. 142/2011 in der Fassung vor dem Inkrafttreten der vorliegenden Verordnung beiliegt, weiter zur Einfuhr in die EU akzeptiert, sofern die entsprechende Bescheinigung vor dem 26. Oktober 2013 ausgefüllt und unterzeichnet wurde.
Artikel 3
Diese Verordnung tritt am zwanzigsten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Sie gilt ab dem 15. März 2013.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 14. März 2013
Für die Kommission
Der Präsident
José Manuel BARROSO
(1) ABl. L 300 vom 14.11.2009, S. 1.
(2) ABl. L 54 vom 26.2.2011, S. 1.
(3) EFSA Journal (2011); 9(2):1976.
(4) ABl. L 147 vom 31.5.2001, S. 1.
(5) EFSA Journal 2010;8(12):1934.
ANHANG
Die Anhänge der Verordnung (EU) Nr. 142/2011 werden wie folgt geändert:
|
1. |
Anhang I wird wie folgt geändert:
|
|
2. |
Anhang IV Kapitel IV Abschnitt 3 wird wie folgt geändert:
|
|
3. |
Anhang V Kapitel I Abschnitt 1 Nummer 2 Buchstabe d erhält folgende Fassung:
|
|
4. |
In Anhang VI Kapitel II Abschnitt 1 erhält der einleitende Satz folgende Fassung: „Material der Kategorien 2 und 3 gemäß Artikel 18 Absatz 1 der Verordnung (EG) Nr. 1069/2009 darf an Tiere gemäß Absatz 1 Buchstaben a, b, d, f, g und h des genannten Artikels unter der Voraussetzung verfüttert werden, dass zusätzlich zu etwaigen Bedingungen, die von der zuständigen Behörde gemäß Artikel 18 Absatz 1 der genannten Verordnung festgelegt wurden, mindestens folgende Bedingungen erfüllt sind:“. |
|
5. |
Anhang VIII wird wie folgt geändert:
|
|
6. |
Anhang X Kapitel II wird wie folgt geändert:
|
|
7. |
Anhang XI Kapitel II Abschnitt 1 Nummer 1 Buchstabe b erhält folgende Fassung:
|
|
8. |
Anhang XIII wird wie folgt geändert:
|
|
9. |
Anhang XIV wird wie folgt geändert:
|
|
10. |
Anhang XV wird wie folgt geändert:
|
|
11. |
Anhang XVI Kapitel III Abschnitt 6 erhält folgende Fassung: „Abschnitt 6 Amtliche Kontrollen der Verfütterung von Material der Kategorie 1 an wildlebende Tiere und bestimmte Zootiere Die zuständige Behörde überwacht den Gesundheitszustand der Nutztiere in der Region, in der gemäß Anhang VI Kapitel II Abschnitte 2, 3 und 4 gefüttert wird, und führt eine angemessene TSE-Überwachung einschließlich regelmäßiger Entnahme von Proben und deren Untersuchung auf TSE durch. Diese Proben müssen Proben von verdächtigen Tieren umfassen sowie solche von älteren Zuchttieren.“ |