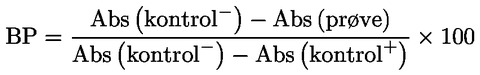EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32016D1840
Commission Implementing Decision (EU) 2016/1840 of 14 October 2016 amending Annex IV to Council Directive 2009/156/EC as regards methods for African horse sickness diagnosis (notified under document C(2016) 6509) (Text with EEA relevance)
Kommissionens gennemførelsesafgørelse (EU) 2016/1840 af 14. oktober 2016 om ændring af bilag IV til Rådets direktiv 2009/156/EF for så vidt angår metoder til diagnosticering af afrikansk hestepest (meddelt under nummer C(2016) 6509) (EØS-relevant tekst)
Kommissionens gennemførelsesafgørelse (EU) 2016/1840 af 14. oktober 2016 om ændring af bilag IV til Rådets direktiv 2009/156/EF for så vidt angår metoder til diagnosticering af afrikansk hestepest (meddelt under nummer C(2016) 6509) (EØS-relevant tekst)
C/2016/6509
OJ L 280, 18.10.2016, p. 33–40
(BG, ES, CS, DA, DE, ET, EL, EN, FR, HR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 No longer in force, Date of end of validity: 20/04/2021; stiltiende ophævelse ved 32016R0429
No longer in force, Date of end of validity: 20/04/2021; stiltiende ophævelse ved 32016R0429
|
18.10.2016 |
DA |
Den Europæiske Unions Tidende |
L 280/33 |
KOMMISSIONENS GENNEMFØRELSESAFGØRELSE (EU) 2016/1840
af 14. oktober 2016
om ændring af bilag IV til Rådets direktiv 2009/156/EF for så vidt angår metoder til diagnosticering af afrikansk hestepest
(meddelt under nummer C(2016) 6509)
(EØS-relevant tekst)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Rådets direktiv 2009/156/EF af 30. november 2009 om dyresundhedsmæssige betingelser for enhovede dyrs bevægelser og indførsel af enhovede dyr fra tredjelande (1), særlig artikel 20, og
ud fra følgende betragtninger:
|
(1) |
Ved bilag IV til direktiv 2009/156/EF er det beskrevet, hvilke diagnosticeringsmetoder der skal anvendes i det fornødne omfang til testning af dyr af hestefamilien for afrikansk hestepest forud for flytning af dem inden for Unionen eller import af dem fra tredjelande. |
|
(2) |
Siden vedtagelsen af direktiv 2009/156/EF er der udviklet laboratoriekapacitet til udførelse af avancerede, særdeles følsomme og effektive test til diagnosticering af afrikansk hestepest. Parallelt hermed er kapitlet vedrørende diagnosticering af afrikansk hestepest i Manual of Diagnostic Tests and Vaccines for Terrestrial Animals fra Verdensorganisationen for Dyresundhed (OIE) (2) blevet ændret for at afspejle denne udvikling. |
|
(3) |
Som en del af deres arbejdsprogram for 2014 udarbejdede EU-referencelaboratoriet for afrikansk hestepest (3) en rapport om den tekniske evaluering af de diagnosticeringsmetoder, der er beskrevet i bilag IV til direktiv 2009/156/EF. I evalueringen, som blev fremlagt for Kommissionen i maj 2015, konkluderedes det, at det kompetitive enzymbundne immunosorbente assay (ELISA) ikke længere er til rådighed, at den indirekte ELISA ikke finder almindelig anvendelse, men kan tilvejebringes 4-6 måneder efter anmodning herom, og at den blokerende ELISA er kommercielt tilgængelig og finder almindelig anvendelse til analyse af prøver i forbindelse med de præstationsprøvninger, der organiseres af EU-referencelaboratoriet for afrikansk hestepest. |
|
(4) |
Det påpeges i rapporten tillige, at metoderne til nukleinsyreidentifikation ved revers transkriptase-polymerasekædereaktion (RT-PCR) frembyder fordele i forhold til serologiske diagnosticeringsmetoder, fordi de gør det muligt at opdage sygdommen i en tidlig infektionsfase. Dertil kommer, at de fleste af de nationale referencelaboratorier i EU's medlemsstater anvender realtids-RT-PCR-metoder, også til diagnosticering af afrikansk hestepest, som har vist sig at være egnede til formålet i de årlige præstationsprøvninger, der er gennemført fra 2009 til 2014. Ydermere peges der i rapporten på, at en række OIE-referencelaboratorier og andre laboratorier uden for Unionen med særlig ekspertise i afrikansk hestepest har bragt mindst én af realtids-RT-PCR-metoderne til påvisning af afrikansk hestepest-genomet i anvendelse. |
|
(5) |
Den 24.-25. november 2015 anbefalede man på den fælles workshop for EU-referencelaboratorierne for afrikansk hestepest/bluetongue og nationale referencelaboratorier, som blev afholdt i Ascot i Det Forenede Kongerige, at optage realtids-revers transkriptase (RRT)-polymerasekædereaktion (PCR)-metoder til påvisning af afrikansk hestepest-virus i bilag IV til direktiv 2009/156/EF. |
|
(6) |
De realtids-RT-PCR-metoder til påvisning af afrikansk hestepest-genomet, der er til rådighed, er alle tilstrækkeligt følsomme, men den procedure, der er beskrevet af Agüero et al. (2008) (4), er den, der anvendes mest af laboratorierne. Den metode, der er beskrevet af Guthrie et al. (2013) (5), er specifikt udviklet med henblik på at sikre, at heste fra områder, der er risikozoner med hensyn til afrikansk hestepest, kan transporteres sikkert efter udløbet af den minimumskarantæneperiode, der er nødvendig i henhold til OIE's sundhedskodeks for terrestriske dyr (6). |
|
(7) |
Agensidentifikationsmetoder og metoder til påvisning af antistof bør derfor optages i bilag IV til direktiv 2009/156/EF som komplementære metoder til hurtig diagnosticering af afrikansk hestepest. |
|
(8) |
Bilag IV til direktiv 2009/156/EF bør derfor ændres, således at den kompetitive ELISA udgår, og procedurerne for indirekte og for blokerende ELISE ajourføres i overensstemmelse med kapitel 2.5.1 i OIE's Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2016-udgaven, baseret på den version, der blev vedtaget af OIE's World Assembly of Delegates i maj 2012 (7). Samtidig bør realtids-RT-PCR-procedurer som beskrevet af Agüero et al. (2008) og af Guthrie et al. (2013) inkluderes i nævnte bilag, således at de pågældende agensidentifikationstest kan anvendes til testning forud for flytning. |
|
(9) |
Direktiv 2009/156/EF bør derfor ændres. |
|
(10) |
Foranstaltningerne i denne afgørelse er i overensstemmelse med udtalelse fra Den Stående Komité for Planter, Dyr, Fødevarer og Foder — |
VEDTAGET DENNE AFGØRELSE:
Artikel 1
Bilag IV til direktiv 2009/156/EF erstattes af teksten i bilaget til denne afgørelse.
Artikel 2
Denne afgørelse er rettet til medlemsstaterne.
Udfærdiget i Bruxelles, den 14. oktober 2016.
På Kommissionens vegne
Vytenis ANDRIUKAITIS
Medlem af Kommissionen
(1) EUT L 192 af 23.7.2010, s. 1.
(2) http://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/2.05.01_AHS.pdf
(3) Rådets direktiv 92/35/EØF af 29. april 1992 om fastsættelse af regler for kontrol med og foranstaltninger til bekæmpelse af hestepest (EFT L 157 af 10.6.1992, s. 19).
(4) M. Agüero, C. Gomez-Tejedor, M. Angeles Cubillo, C. Rubio, E. Romero og A. Jimenez-Clavero, (2008). Real-time fluorogenic reverse transcription polymerase chain reaction assay for detection of African horse sickness virus. J. Vet. Diagn. Invest., 20, s. 325-328.
(5) A.J. Guthrie, N.J. MacLachlan, C. Joone, L.C. W.ourens, C.T. Weyer, M. Quan, M.S. Monyai, I.A. Gardner,. Diagnostic accuracy of a duplex real-time reverse transcription quantitative PCR assay for detection of African horse sickness virus. Journal of Virological Methods. 2013;189(1), s. 30-35.
(6) http://www.oie.int/fileadmin/Home/eng/Health_standards/tahc/current/chapitre_ahs.pdf
(7) Se fodnote 2.
BILAG
»BILAG IV
AFRIKANSK HESTEPEST
DIAGNOSE
DEL A
Serologiske test
Den serologiske metode, der er beskrevet nedenfor, er enzymbundne immunosorbente assays (ELISA), baseret på kapitel 2.5.1, afsnit B, punkt 2, i Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2016-udgaven, som vedtaget af OIE's World Assembly of Delegates i maj 2012.
VP7-virusproteinet er et betydende immundominant antigen af afrikansk hestepest-virus (AHSV) og er bevaret i alle de ni AHSV-serotyper. Rekombinante AHSV-VP7-proteiner har vist sig at være stabile og uskadelige og egnede til at blive anvendt som antigen i ELISA-procedurer til bestemmelse af AHSV-antistoffer med en høj grad af følsomhed og specificitet (Laviada et al., 1992b (1); Maree og Paweska, 2005). Den indirekte ELISA og den blokerende ELISA er de to AHS-VP7-ELISA-test, der egner sig til serologisk diagnosticering af afrikansk hestepest (AHS).
1. Indirekte ELISA til påvisning af antistoffer mod afrikansk hestepest-virus (AHSV)
Det konjugat, der anvendes med denne metode, er en horseradishperoxidase-antihestegammaglobulin, som reagerer med serum fra heste, muldyr og æsler. Med den af Maree & Paweska (2005) beskrevne metode (2) anvendes protein G som konjugat, der også reagerer med zebraserum.
Antigenet kan efter anmodning leveres af Centro de Investigación en Sanidad Animal (CISA) i Spanien inden for 4-6 måneder.
1.1. Testprocedure
1.1.1. Fast fase
|
1.1.1.1. |
ELISA-plader påføres rekombinant AHSV-4 VP7 fortyndet med carbonat/bicarbonatbuffer, pH-værdi 9,6. Pladerne inkuberes natten over ved 4 °C. |
|
1.1.1.2. |
Pladerne skylles fem gange med destilleret vand indeholdende 0,01 % (v/v) Tween 20 (skylleopløsning). Pladerne bankes forsigtigt mod absorberende materiale, så eventuel resterende skylleopløsning fjernes. |
|
1.1.1.3. |
Pladerne blokeres med phosphatbufferet saltopløsning (PBS), pH-værdi 7,2, + 5 % (w/v) skummetmælk (Nestlé Dry Skim MilkTM), 200 μl/brønd, i 1 time ved 37 °C. |
|
1.1.1.4. |
Den blokerende opløsning fjernes, og pladerne bankes forsigtigt mod absorberende materiale. |
1.1.2. Testprøver
|
1.1.2.1. |
De serumprøver, der skal testes, og positive og negative kontrolsera fortyndes 1:25 med PBS + 5 % (w/v) skummetmælk + 0,05 % (v/v) Tween 20, 100 μl pr. brønd. Der inkuberes i 1 time ved 37 °C. Ved titrering tilberedes en tofolds fortyndingsrække fra 1:25 (100 μl/brønd), ét serum pr. pladekolonne, og det samme gøres med de positive og negative kontroller. Der inkuberes i 1 time ved 37 °C. |
|
1.1.2.2. |
Pladerne skylles fem gange med destilleret vand indeholdende 0,01 % (v/v) Tween 20 (skylleopløsning). Pladerne bankes forsigtigt mod absorberende materiale, så eventuel resterende skylleopløsning fjernes. |
1.1.3. Konjugat
|
1.1.3.1. |
Der overføres 100 μl/brønd horseradishperoxidasekonjugeret (HRP) antihestegammaglobulin fortyndet med PBS + 5 % mælk + 0,05 % Tween 20, pH-værdi 7,2. Der inkuberes i 1 time ved 37 °C. |
|
1.1.3.2. |
Pladerne skylles fem gange med destilleret vand indeholdende 0,01 % (v/v) Tween 20 (skylleopløsning). Pladerne bankes forsigtigt mod absorberende materiale, så eventuel resterende skylleopløsning fjernes. |
1.1.4. Kromogen/substrat
|
1.1.4.1. |
Der tilsættes 200 μl/brønd kromogen-/substratopløsning (10 ml 80,6 mM DMAB (dimethylaminobenzaldehyd) + 10 ml 1,56 mM MBTH (3-methyl-2-benzothiazolinhydrazonhydrochlorid) + 5 μl H2O2). Farveudviklingen standses ved tilsætning af 50 μl 3N H2SO4 efter ca. 5-10 minutter (inden den negative kontrol begynder at antage farve). Andre kromogener såsom ABTS (2,2′-azino-bis-[3-ethylbenzothiazolin-6-sulfonsyre]), TMB (tetramethylbenzidin) eller OPD (orthophenyldiamin) kan også benyttes. |
|
1.1.4.2. |
Pladerne aflæses ved 600 nm (eller 620 nm). |
1.2. Fortolkning af resultater
|
1.2.1. |
Cut-off-værdien beregnes, ved at der lægges 0,06 til værdien af den negative kontrol (0,06 er den afledte standardafvigelse for en gruppe på 30 negative sera). |
|
1.2.2. |
Testprøver, der giver absorbansværdier, som ligger under cut-off, betragtes som negative. |
|
1.2.3. |
Testprøver, der giver absorbansværdier, som ligger over cut-off + 0,15, betragtes som positive. |
|
1.2.4. |
Testprøver, der giver mellemliggende absorbansværdier, betragtes som inkonklusive, og resultatet skal bekræftes ved en anden metode. |
2. Blokerende ELISA til påvisning af antistoffer mod afrikansk hestepestvirus (AHSV)
Den kompetitive blokerende ELISA er udformet med henblik på påvisning af specifikke AHSV-antistoffer i sera fra ethvert dyr af hestefamilien, dvs. heste, æsler, zebraer og krydsninger heraf, med det formål at forebygge problemet med specificitet, som til tider gør sig gældende ved brug af indirekte ELISA'er.
Testprincippet er at blokere reaktionen mellem det rekombinante VP7-protein, der er absorberet til ELISA-pladen, og et konjugeret AHS-VP7-specifikt monoklonalt antistof (Mab). Antistoffet i testseraene vil blokere reaktionen mellem antigenet og Mab, hvilket medfører, at farven bliver mindre kraftig. Da Mab er rettet mod VP7, vil testen udvise stor følsomhed og specificitet.
Den kompetitive blokerende ELISA er kommercielt tilgængelig.
2.1. Testprocedure
2.1.1. Fast fase
|
2.1.1.1. |
Pladerne påføres 50-100 ng rekombinant AHSV-4 VP7 fortyndet med carbonat/bicarbonatbuffer, pH-værdi 9,6. Der inkuberes natten over ved 4 °C. |
|
2.1.1.2. |
Pladerne skylles 3 gange med phosphatbufferet saltopløsning (PBS) 0,1x indeholdende 0,135 M NaCl og 0,05 % (v/v) Tween 20 (PBST). Pladerne bankes forsigtigt mod absorberende materiale, så eventuel resterende skylleopløsning fjernes. |
2.1.2. Testprøver og kontroller
|
2.1.2.1. |
De serumprøver, der skal testes, og positive og negative kontrolsera fortyndes 1:5 med fortyndingsmiddel indeholdende 0,35 M NaCl, 0,05 % (v/v) Tween 20 + 0,1 % Kathon, 100 μl pr. brønd. Der inkuberes i 1 time ved 37 °C. Ved titrering tilberedes en tofolds fortyndingsrække af testseraene fra 1:10 til 1:280 over 8 brønde (100 μl/brønd), ét serum pr. pladekolonne, og det samme gøres med de positive og negative kontroller. Der inkuberes i 1 time ved 37 °C. |
|
2.1.2.2. |
Pladerne skylles 5 gange med phosphatbufferet saltopløsning (PBS) 0,1× indeholdende 0,135 M NaCl og 0,05 % (v/v) Tween 20 (PBST). Pladerne bankes forsigtigt mod absorberende materiale, så eventuel resterende skylleopløsning fjernes. |
2.1.3. Konjugat
|
2.1.3.1. |
Der overføres 100 μl/brønd horseradishperoxidasekonjugeret anti-VP7-Mab. Dette Mab er forinden fortyndet 1:5 000-1:15 000 i en 1:1 opløsning af StabiliZyme Select® Stabilizer (SurModics. Reference: SZ03) i destilleret vand. Der inkuberes i 30 minutter ved 37 °C. |
|
2.1.3.2. |
Pladerne skylles 5 gange med phosphatbufferet saltopløsning (PBS) 0,1× indeholdende 0,135 M NaCl og 0,05 % (v/v) Tween 20 (PBST). Pladerne bankes forsigtigt mod absorberende materiale, så eventuel resterende skylleopløsning fjernes. |
2.1.4. Kromogen/substrat
Der tilsættes 100 μl/brønd kromogen-/substratopløsning, dvs. 1 ml ABTS (2,2′-azino-bis-[3-ethylbenzothiazolin-6-sulfonsyre] 5 mg/ml + 9 ml substratbuffer (0,1 M phosphat-citratbuffer med en pH-værdi på 4 indeholdende 0,03 % H2O2), og inkuberes i 10 minutter ved stuetemperatur. Farveudviklingen standses ved tilsætning af 100 μl/brønd 2 % (w/v) SDS (natriumdodecylsulfat).
2.1.5. Aflæsning
Der aflæses ved 405 nm i en ELISA-læser.
2.2. Fortolkning af resultater
|
2.2.1. |
Blokeringsprocenten (BP) bestemmes for hver prøve ved anvendelse af følgende formel, hvor »Abs« står for antistoffer:
|
|
2.2.2. |
Prøver, der giver en BP-værdi på over 50 %, betragtes som positive for AHSV-antistoffer. |
|
2.2.3. |
Prøver, der giver en BP-værdi på under 45 %, betragtes som negative for AHSV-antistoffer. |
|
2.2.4. |
Prøver, der giver en BP-værdi på mellem 45 % og 50 %, betragtes som inkonklusive og underkastes fornyet testning. Er resultatet igen inkonklusivt, underkastes dyrene fornyet testning på prøver udtaget tidligst to uger efter udtagelsen af den prøve, der blev betragtet som inkonklusiv. |
DEL B
Bestemmelse af agenset
Realtids-revers transkriptase-polymerasekædereaktion (rRT-PCR)
Agensidentifikationstest baseret på nukleinsyremetoder skal kunne påvise referencestammer fra de ni AHSV-virusserotyper.
Den metode, der er beskrevet i punkt 2.1, er baseret på kapitel 2.5.1, afsnit B, punkt 1,2, i Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2016-udgaven, som vedtaget af OIE's World Assembly of Delegates i maj 2012.
Enhver RT-PCR-påvisningsmetode, der anvendes til testning af prøver — enten blod eller milt — inden for rammerne af direktiv 2009/156/EF, skal være lige så eller mere følsom end de i punkt 2 beskrevne metoders.
Inaktiverede virus af referencestammer af serotype 1-9 kan fås fra EU-referencelaboratoriet eller OIE-referencelaboratoriet for afrikansk hestepest i Algete i Spanien.
1. Ekstraktion af viralt RNA
For at sikre en god reaktion er det nødvendigt at ekstrahere AHSV-RNA af høj kvalitet fra prøven. Ekstraktion af nukleinsyrer fra kliniske prøver kan udføres efter flere forskellige interne og kommercielt tilgængelige metoder.
De forskellige kommercielle kit indebærer forskellige tilgange til RNA-isolering. De fleste er baseret på én af følgende procedurer:
|
— |
phenol-chloroform-ekstraktion af nukleinsyrer |
|
— |
adsorption af nukleinsyrer til filter |
|
— |
adsorption af nukleinsyrer til magnetiske kugler. |
Nedenfor beskrives et eksempel på intern RNA-ekstraktion:
|
1.1. |
1 g vævsprøve homogeniseres i 1 ml denatureringsopløsning (4 M guanidiniumthiocyanat, 25 mM natriumcitrat, 0,1 M 2-mercaptoethanol og 0,5 % sarcosyl). |
|
1.2. |
Efter centrifugering tilsættes 1 μg gær-RNA, 0,1 ml 2 M natriumacetat, pH-værdi 4, 1 ml phenol og 0,2 ml chloroform/isoamylalkohol-blanding (49:1), til supernatanten. |
|
1.3. |
Opløsningen omrystes kraftigt og afkøles på is i 15 minutter. |
|
1.4. |
Efter centrifugering phenolekstraheres RNA'et, som er til stede i den vandige fase, hvorefter det udfældes med ethanol og resuspenderes i sterilt vand. |
2. Realtids-RT-PCR-procedure
2.1. Gruppespecifik realtids-RT-PCR efter Agüero et al., 2008 (3)
Denne gruppespecifikke realtids-RT-PCR er rettet mod VP7 i AHSV og gør det muligt at påvise alle kendte AHSV-serotyper og -stammer, der er i omløb i dag. Den er blevet anvendt med rigtig gode resultater af de nationale referencelaboratorier fra EU's medlemsstater, der har deltaget i de præstationsprøvninger, der er blevet arrangeret årligt af EU-referencelaboratoriet i perioden 2009-2015. I en international ringtest, som blev arrangeret i 2015 inden for rammerne af OIE-referencelaboratoriernes netværk, opnåede denne protokol en meget høj placering blandt de øvrige protokoller.
Primer- og probesekvenser til påvisning af AHSV-artsvirus:
|
— |
forward primer |
5′-CCA-GTA-GGC-CAG-ATC-AAC-AG-3′ |
|
— |
revers primer |
5′-CTA-ATG-AAA-GCG-GTG-ACC-GT-3′ |
|
— |
MGB-TaqMan-probe |
5′-FAM-GCT-AGC-AGC-CTA-CCA-CTA-MGB-3′ |
|
2.1.1. |
Primer-stamopløsningen fortyndes til en arbejdskoncentration på 8 μM (»primer-arbejdsopløsning 8 μM«), mens proben fortyndes til en arbejdskoncentration på 50 μM (»probe-arbejdsopløsning 50 μM«). Der frembringes et testpladelayout, som indlæses i realtids-PCR-maskinens software. Med dette layout som rettesnor tilsættes 2,5 μl af hver primer-arbejdsopløsning 8 μM til hver brønd, der er bestemt til at indeholde RNA-prøver/positive og/eller negative kontroller (slutkoncentrationen af primeren vil være på 1 μM i de 20 μl RT-PCR-mix). Pladen holdes på is. |
|
2.1.2. |
2 μl af det isolerede RNA (testprøver og den positive kontrol), eller 2 μl RNAse-frit vand i negative reaktionskontroller, blandes med forward- og revers-primere. Denne blanding denatureres ved opvarmning ved 95 °C i 5 minutter, efterfulgt af hurtig afkøling på is i mindst 5 minutter. |
|
2.1.3. |
Der tilberedes en passende mængde realtids-one-step-RT-PCR-mastermix til det antal prøver, der skal testes, efter fabrikantens anvisninger. Der tilsættes 0,1 μl probe-arbejdsopløsning 50 μM til hver brønd indeholdende RNA-prøver (slutkoncentrationen af proben vil være på 0,25 μM i hver brønd indeholdende RNA-prøver). 13 μl realtids-one-step-RT-PCR-mastermix fordeles i hver brønd på PCR-pladen indeholdende de(t) denaturerede primere/RNA. |
|
2.1.4. |
Pladen anbringes i en realtidstermocykler, som er programmeret til revers transkriptase og cDNA-amplifikation/fluorescensdetektion. Amplifikationsbetingelserne består af et første revers transkriptase-trin ved 48 °C i 25 minutter, efterfulgt af 10 minutter ved 95 °C (»varmstart«) og 40 cykler a 15 sekunder ved 95 °C, 35 sekunder ved 55 °C og 30 sekunder ved 72 °C (eller 40 cykler ved 97 °C i 2 sekunder og 55 °C i 30 sekunder, såfremt der anvendes reagenser og thermocycler, der muliggør hurtige reaktioner). Fluorescensdata opnås ved afslutningen af 55 °C-trinnet. |
|
2.1.5. |
Assayet betragtes som værende ikke validt, hvis der fås atypiske amplifikationskurver, og skal da gentages. Prøver betragtes som positive, hvis Ct-værdien (cyklusnummer, ved hvilken den fluorescens, der er genereret i en reaktion, krydser fluorescenstærskelværdien) er lavere end eller lig med den definerede Ct-tærskelværdi (35) inden for 40 PCR-cykler (Ct ≤ 35). Prøver betragtes som inkonklusive, hvis Ct-værdien er højere end den definerede Ct-tærskelværdi (35) inden for 40 PCR-cykler (CT ≥ 35). Prøver betragtes som negative, hvis der fås en horisontal amplifikationskurve, som ikke krydser tærskelværdien inden for 40 PCR-cykler. |
2.2. Gruppespecifik realtids-RT-PCR efter Guthrie et al., 2013 (4)
Realtids-RT-PCR med anvendelse af fluorescensresonansenergioverførsel (FRET)-prober til påvisning af AHSV-nukleinsyre.
Det beskrevne AHSV-RT-PCR-assay blev udformet med brug af sekvenser fra en bred vifte af AHSV-feltstammer, der er i omløb i dag (Quan et al., 2010 (5)). Det omfatter også et ejendomsretligt beskyttet syntetisk ekstern kontrol-assay til verifikation af, at assayets komponenter fungerer på tilfredsstillende vis.
Kit til realtids-one-step-PCR er kommercielt tilgængelige. Nedenstående grundlæggende trin, som er beskrevet af Guthrie et al. (2013), kan tilpasses i overensstemmelse med lokale/sagsspecifikke krav og de(t) anvendte kit/udstyr.
Primer- og probesekvenser til påvisning af AHSV-artsvirus:
|
— |
forward primer |
5′-AGA-GCT-CTT-GTG-CTA-GCA-GCC-T-3′ |
|
— |
revers primer |
5′-GAA-CCG-ACG-CGA-CAC-TAA-TGA-3′ |
|
— |
MGB-TaqMan-probe |
5′-FAM-TGC-ACG-GTC-ACC-GCT-MGB-3′ |
|
2.2.1. |
5 μΜ forward- og revers-primere og 3 μΜ probe blandes til primer- og probemixstamopløsninger i en koncentration på 25×. Der frembringes et testpladelayout, som indlæses i realtids-PCR-maskinens software. Med dette layout som rettesnor tilsættes 5 μl RNA-prøver, herunder testprøver og positive og negative kontroller, til de relevante brønde på pladen i overensstemmelse med layoutet. |
|
2.2.2. |
RNA'et denatureres ved opvarmning ved 95 °C i 5 minutter, efterfulgt af hurtig afkøling på is i mindst 3 minutter. |
|
2.2.3. |
Der tilberedes en passende mængde realtids-one-step-RT-PCR-mastermix til det antal prøver, der skal testes, efter fabrikantens anvisninger. 1 μl 25× primersondemixstamopløsning (se punkt 2.2.1 ovenfor) tilsættes til mastermixet, så der opnås en slutkoncentration i hver brønd på 200 nM for hver primer og 120 nM for proben. 20 μl mastermix fordeles i hver brønd på PCR-pladen, der indeholder det denaturerede RNA. |
|
2.2.4. |
Pladen anbringes i en realtidstermocykler, som er programmeret til revers transkriptase og cDNA-amplifikation/fluorescensdetektion, efter fabrikantens anvisninger. Amplifikationsbetingelserne er f.eks. et første revers transkriptase-trin ved 48 °C i 10 minutter, efterfulgt af 10 minutter ved 95 °C og 40 cykler a 15 sekunder ved 95 °C og 45 sekunder ved 60 °C. |
|
2.2.5. |
Prøver betragtes som positive, hvis den normaliserede fluorescens for AHSV-RT-PCR-assayet overstiger en tærskelværdi på 0,1 inden for 36 PCR-cykler i alle replikater af en prøve. Prøver betragtes som inkonklusive, hvis den normaliserede fluorescens for AHSV-RT-PCR-assayet overstiger en tærskelværdi på 0,1 mellem 36 og 40 PCR-cykler i et eller flere replikater af en prøve. Prøver betragtes som negative, hvis den normaliserede fluorescens for AHSV-RT-PCR-assayet ikke oversteg en tærskelværdi på 0,1 inden for 40 PCR-cykler i alle replikater af en prøve, og hvis den normaliserede fluorescens for det ejendomsretligt beskyttede syntetiske eksterne kontrolassay oversteg en tærskelværdi på 0,1 inden for 33 PCR-cykler.« |
(1) M. D. Laviada, P. Roy, og J. M. Sanchez-Vizcaino (1992b). Adaptation and Evaluation of an Indirect ELISA and Immuno-Blotting Test for African Horse Sickness Antibody Detection. Findes i: Bluetongue, African Horse Sickness and Related Orbiviruses: Proceedings of the Second International Symposium. T. E. Walton & B. I. Osburn, Eds. CRC Press, Boca Raton, Florida, USA, s. 646-650.
(2) S. Maree og J. T. Paweska (2005). Preparation of recombinant African horse sickness virus VP7 antigen via a simple method and validation of a VP7-based indirect ELISA for the detection of group-specific IgG antibodies in horse sera. J. Virol. Methods, 125 (1), s. 55-65.
(3) M. Agüero, C. Gomez-Tejedor, M. Angeles Cubillo, C. Rubio, E. Romero og A. Jimenez-Clavero, (2008). Real-time fluorogenic reverse transcription polymerase chain reaction assay for detection of African horse sickness virus. J. Vet. Diagn. Invest., 20, s. 325-328.
(4) A. J. Guthrie, N. J. MacLachlan, C. Joone, C. W. Lourens, C. T. Weyer, M. Quan, M. S. Monyai, I. A. Gardner, Diagnostic accuracy of a duplex real-time reverse transcription quantitative PCR assay for detection of African horse sickness virus. Journal of Virological Methods. 2013;189(1):30-5.
(5) M. Quan, C. W. Lourens, N. J. MacLachlan, I. A. Gardner, A. J. Guthrie, 2010. Development and optimisation of a duplex real-time reverse transcription quantitative PCR assay targeting the VP7 and NS2 genes of African horse sickness virus. J. Virol. Methods, 167, s. 45-52.