|
12.6.2008
|
CS
|
Úřední věstník Evropské unie
|
L 153/23
|
NAŘÍZENÍ KOMISE (ES) č. 523/2008
ze dne 11. června 2008,
kterým se mění přílohy VIII, X a XI nařízení Evropského parlamentu a Rady (ES) č. 1774/2002, pokud jde o dovoz krevních výrobků pro výrobu technických výrobků
(Text s významem pro EHP)
KOMISE EVROPSKÝCH SPOLEČENSTVÍ,
s ohledem na Smlouvu o založení Evropského společenství,
s ohledem na nařízení Evropského parlamentu a Rady (ES) č. 1774/2002 ze dne 3. října 2002 o hygienických pravidlech pro vedlejší produkty živočišného původu, které nejsou určeny pro lidskou spotřebu (1), a zejména na čl. 4 odst. 4, čl. 28 druhý pododstavec, čl. 29 odst. 3 první pododstavec a čl. 32 odst. 1 uvedeného nařízení,
vzhledem k těmto důvodům:
|
(1)
|
Nařízení (ES) č. 1774/2002 stanoví veterinární a hygienické požadavky na dovoz krevních výrobků určených pro technické účely do Společenství a jejich tranzit přes území Společenství včetně vzorových veterinárních osvědčení a seznamu zemí, ze kterých je dovoz povolen.
|
|
(2)
|
Nařízení (ES) č. 1774/2002 stanoví, že vedlejší produkty živočišného původu pocházející ze zvířat, která byla ošetřena některými látkami zakázanými podle směrnice Rady 96/22/ES ze dne 29. dubna 1996 o zákazu používání některých látek s hormonálním nebo tyreostatickým účinkem a beta-sympatomimetik v chovech zvířat a o zrušení směrnic 81/602/EHS, 88/146/EHS a 88/299/EHS (2), smí být dovezeny do Společenství pouze v souladu s nařízením (ES) č. 1774/2002 nebo zvláštními pravidly, která budou stanovena.
|
|
(3)
|
Možnost dovozu těchto krevních výrobků je nezbytná pro biotechnologický průmysl pro výrobu různých technických výrobků využívaných zejména v rámci farmaceutické a výzkumné obce. Protože tyto výrobky nejsou určeny pro lidskou spotřebu ani ke krmení zvířat a protože skutečnost, že pochází ze zvířat, která byla ošetřena některými látkami zakázanými podle směrnice 96/22/ES, nepředstavuje při zpracování a technickém využití těchto výrobků riziko pro zdraví zvířat nebo lidí, je vhodné dovoz těchto krevních výrobků do Společenství povolit.
|
|
(4)
|
Nařízení (ES) č. 1774/2002 stanoví, že krevní výrobky používané pro výrobu technických výrobků musí být speciálně ošetřeny nebo země nebo oblast původu výrobků musí být prosté určitých chorob bez očkování. Některé země nebo určité oblasti jsou však způsobilé dodávat čerstvé maso přežvýkavců do Společenství s ohledem na to, že jsou prosté slintavky a kulhavky s očkováním, jestliže je riziko případného výskytu viru zmírněno. Je rovněž vhodné povolit dovoz neošetřených krevních výrobků z přežvýkavců z těchto zemí nebo oblastí, jestliže tyto výrobky směřují do místa určení k dalšímu zpracování za bezpečných podmínek.
|
|
(5)
|
Nařízení (ES) č. 1774/2002 rovněž stanoví, že v případě krevních výrobků z přežvýkavců musí být oblast původu způsobilá pro dovoz živých zvířat téhož druhu do Společenství. Podle mezinárodních norem je pravděpodobnost přenosu příslušných chorob u krevních výrobků menší než u živých zvířat. Je proto vhodné tuto podmínku z příslušných požadavků odstranit.
|
|
(6)
|
Část VI oddíl A přílohy XI nařízení (ES) č. 1774/2002 stanoví seznamy třetích zemí, ze kterých mohou členské státy povolit dovoz krevních výrobků určených k technickým účelům. Tyto seznamy jsou v současné době omezeny na země, ze kterých je povolen dovoz všech kategorií čerstvého masa příslušných druhů pro lidskou spotřebu.
|
|
(7)
|
Protože v rámci platných požadavků je povoleno ošetření krevních výrobků, měly by být tyto seznamy rozšířeny tak, aby zahrnovaly i země, které nemají povolení vyvážet čerstvé maso příslušných druhů do Společenství, ale jsou schopny splnit požadavky na ošetření. V zájmu přehlednosti by však měla být stanovena samostatná veterinární osvědčení pro ošetřené a neošetřené krevní výrobky.
|
|
(8)
|
Je vhodné aktualizovat požadavky vztahující se na dovoz krevních výrobků z drůbeže a jiných druhů ptáků odkazem na mezinárodní normy stanovené v Kodexu zdraví suchozemských živočichů Světové organizace pro zdraví zvířat (OIE).
|
|
(9)
|
Přílohy VIII, X a XI nařízení (ES) č. 1774/2002 by proto měly být odpovídajícím způsobem změněny.
|
|
(10)
|
Po vstupu tohoto nařízení v platnost by mělo být stanoveno přechodné období s cílem poskytnout zúčastněným stranám čas potřebný k zajištění souladu s novými pravidly a umožnit nadále dovážet do Společenství krevní výrobky, na něž se v současné době vztahuje nařízení (ES) č. 1774/2002.
|
|
(11)
|
Opatření stanovená tímto nařízením jsou v souladu se stanoviskem Stálého výboru pro potravinový řetězec a zdraví zvířat,
|
PŘIJALA TOTO NAŘÍZENÍ:
Článek 1
Přílohy VIII, X a XI nařízení (ES) č. 1774/2002 se mění v souladu s přílohou tohoto nařízení.
Článek 2
Dovoz zásilek krevních výrobků, k nimž je připojeno veterinární osvědčení vyplněné a podepsané v souladu s ustanoveními nařízení (ES) č. 1774/2002 platnými před datem vstupu tohoto nařízení v platnost, do Společenství se povoluje nejpozději do 12. prosince 2008.
Tyto zásilky se rovněž přijmou nejpozději do 12. února 2009, pokud byla připojená veterinární osvědčení vyplněna a podepsána nejpozději do 12. prosince 2008.
Článek 3
Toto nařízení vstupuje v platnost třetím dnem po vyhlášení v Úředním věstníku Evropské unie a použije se od téhož dne.
Toto nařízení je závazné v celém rozsahu a přímo použitelné ve všech členských státech.
V Bruselu dne 11. června 2008.
Za Komisi
Androulla VASSILIOU
členka Komise
(1) Úř. věst. L 273, 10.10.2002, s. 1. Nařízení naposledy pozměněné nařízením Komise (ES) č. 437/2008 (Úř. věst. L 132, 22.5.2008, s. 7).
(2) Úř. věst. L 125, 23.5.1996, s. 3. Směrnice ve znění směrnice Evropského parlamentu a Rady 2003/74/ES (Úř. věst. L 262, 14.10.2003, s. 17).
PŘÍLOHA
Přílohy nařízení (ES) č. 1774/2002 se mění takto:
|
1)
|
V příloze VIII se kapitola IV nahrazuje tímto:
„KAPITOLA IV
Požadavky na krev a krevní výrobky, kromě krve a krevních výrobků z koňovitých, pro výrobu technických výrobků
A. Dovoz
|
1.
|
Dovoz krve podléhá požadavkům stanoveným v kapitole XI.
|
|
2.
|
Členské státy musí dovoz krevních výrobků pro výrobu technických výrobků včetně materiálu pocházejícího ze zvířat, kterým byly podány látky zakázané podle směrnice 96/22/ES, povolit, pokud:
|
a)
|
pocházejí ze třetích zemí, které jsou uvedeny na příslušném seznamu v části VI oddílu A přílohy XI;
|
|
b)
|
pocházejí z technického zařízení, které splňuje zvláštní podmínky stanovené v tomto nařízení, nebo ze zařízení odběru;
|
|
c)
|
jsou provázeny veterinárním osvědčením podle vzoru uvedeného v kapitole 4 oddílu C přílohy X nebo případně v kapitole 4 oddílu D přílohy X.
|
|
|
3.
|
Krev, ze které jsou krevní výrobky pro výrobu technických výrobků vyráběny, musí být odebrána:
|
a)
|
na jatkách schválených v souladu s právními předpisy Společenství;
|
|
b)
|
na jatkách schválených a dozorovaných příslušným orgánem třetí země nebo
|
|
c)
|
od živých zvířat v zařízeních schválených a dozorovaných příslušným orgánem třetí země.
|
|
|
4.
|
Krevní výrobky pro výrobu technických výrobků, které byly získány ze zvířat řádů Artiodactyla, Perissodactyla a Proboscidea včetně jejich kříženců, musí splňovat buď podmínky uvedené pod písmenem a) nebo podmínky uvedené pod písmenem b):
|
a)
|
výrobky prošly jedním z následujících ošetření zaručujících nepřítomnost patogenních původců chorob uvedených pod písmenem b):
|
i)
|
tepelným ošetřením při teplotě 65 oC po dobu nejméně tří hodin s následnou kontrolou účinnosti,
|
|
ii)
|
ozářením paprsky gama s intenzitou 25 kGy s následnou kontrolou účinnosti,
|
|
iii)
|
tepelným ošetřením při teplotě nejméně 80 oC v celé hmotě s následnou kontrolou účinnosti,
|
|
iv)
|
pouze v případě zvířat jiných než čeledí Suidae a Tayassuidae: změnou pH na hodnotu pH 5 po dobu dvou hodin s následnou kontrolou účinnosti;
|
|
|
b)
|
v případě krevních výrobků neošetřených v souladu s písmenem a) pocházejí výrobky ze země nebo oblasti:
|
i)
|
ve které nebyl v období 12 měsíců zaznamenán žádný případ výskytu moru skotu, moru malých přežvýkavců a horečky Údolí Rift a ve které nebylo provedeno očkování proti těmto chorobám po dobu nejméně 12 měsíců,
|
|
ii)
|
ve které nebyl v období 12 měsíců zaznamenán žádný případ výskytu slintavky a kulhavky a ve které nebylo provedeno očkování proti této chorobě po dobu nejméně 12 měsíců nebo
ve které nebyl za období 12 měsíců zaznamenán žádný případ výskytu slintavky a kulhavky a ve které jsou u domácích přežvýkavců úředně prováděny a kontrolovány programy očkování proti slintavce a kulhavce po dobu nejméně 12 měsíců; v takovém případě musí být výrobky po provedení hraniční kontroly podle směrnice 97/78/ES a v souladu s podmínkami stanovenými v čl. 8 odst. 4 uvedené směrnice přepraveny přímo do technického zařízení určení a musí být přijata veškerá preventivní opatření včetně bezpečné likvidace odpadu, nepoužitého nebo přebytečného materiálu, aby se předešlo rizikům rozšíření chorob na zvířata či lidi.
|
Kromě ustanovení bodů i) a ii) musí být v případě zvířat jiných než čeledí Suidae a Tayassuidae splněna jedna z těchto podmínek:
|
—
|
v zemi nebo oblasti původu nebyl za období 12 měsíců zaznamenán žádný případ výskytu vezikulární stomatitidy a katarální horečky ovcí (včetně výskytu séropozitivních zvířat) a u vnímavých druhů nebylo provedeno očkování proti těmto chorobám po dobu nejméně 12 měsíců,
|
|
—
|
po provedení hraniční kontroly podle směrnice 97/78/ES a v souladu s podmínkami stanovenými v čl. 8 odst. 4 uvedené směrnice musí být výrobky přepraveny přímo do technického zařízení určení a musí být přijata veškerá preventivní opatření včetně bezpečné likvidace odpadu, nepoužitého nebo přebytečného materiálu, aby se předešlo rizikům rozšíření chorob na zvířata či lidi.
|
Kromě ustanovení bodů i) a ii) nebyl v případě zvířat čeledí Suidae a Tayassuidae v zemi nebo oblasti původu za období nejméně 12 měsíců zaznamenán žádný případ výskytu vezikulární choroby prasat, klasického moru prasat a afrického moru prasat, nebylo provedeno očkování proti těmto chorobám po dobu nejméně 12 měsíců a je splněna jedna z těchto podmínek:
|
—
|
v zemi nebo oblasti původu nebyl za období 12 měsíců zaznamenán žádný případ výskytu vezikulární stomatitidy (včetně výskytu séropozitivních zvířat) a u vnímavých druhů nebylo provedeno očkování proti této chorobě po dobu nejméně 12 měsíců,
|
|
—
|
po provedení hraniční kontroly podle směrnice 97/78/ES a v souladu s podmínkami stanovenými v čl. 8 odst. 4 uvedené směrnice musí být výrobky přepraveny přímo do technického zařízení určení a musí být přijata veškerá preventivní opatření včetně bezpečné likvidace odpadu, nepoužitého nebo přebytečného materiálu, aby se předešlo rizikům rozšíření chorob na zvířata či lidi.
|
|
|
|
5.
|
Krevní výrobky pro výrobu technických výrobků, které byly získány z drůbeže a jiných druhů ptáků, musí splňovat buď podmínky uvedené pod písmenem a) nebo podmínky uvedené pod písmenem b):
|
a)
|
výrobky prošly jedním z následujících ošetření zaručujících nepřítomnost patogenních původců chorob uvedených pod písmenem b):
|
i)
|
tepelným ošetřením při teplotě 65 oC po dobu nejméně tří hodin s následnou kontrolou účinnosti,
|
|
ii)
|
ozářením paprsky gama s intenzitou 25 kGy s následnou kontrolou účinnosti,
|
|
iii)
|
tepelným ošetřením při teplotě nejméně 70 oC v celé hmotě s následnou kontrolou účinnosti;
|
|
|
b)
|
v případě krevních výrobků neošetřených v souladu s písmenem a) pocházejí výrobky ze země nebo oblasti:
|
i)
|
která byla prostá newcastleské choroby a vysoce patogenní influenzy ptáků podle definice v Kodexu zdraví suchozemských živočichů OIE,
|
|
ii)
|
ve které nebylo během posledních 12 měsíců provedeno očkování proti influenze ptáků,
|
|
iii)
|
ve které drůbež nebo jiné druhy ptáků, z nichž výrobky pocházejí, nebyly očkovány proti newcastleské chorobě očkovacími látkami připravenými z matečného kmene newcastleské choroby vykazujícího vyšší patogenitu než lentogenní kmeny viru.“
|
|
|
|
|
2)
|
Příloha X se mění takto:
|
a)
|
Kapitola 4 (C) se nahrazuje tímto:
„KAPITOLA 4 (C)
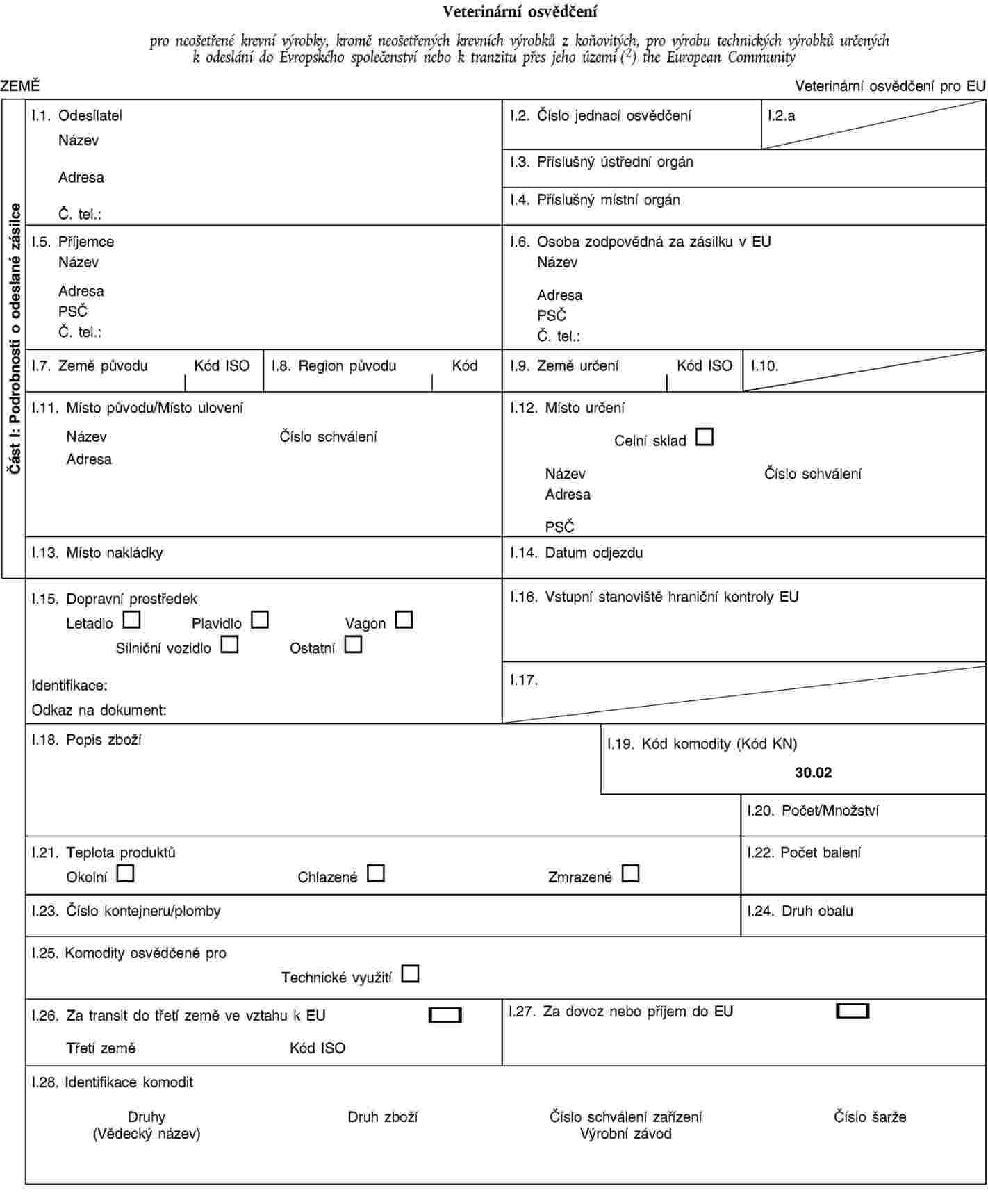


|
|
b)
|
Doplňuje se nová kapitola 4 (D), která zní:
„KAPITOLA 4 (D)



|
|
|
3)
|
V příloze XI se část VI oddíl A nahrazuje tímto:
|
„A.
|
Krevní výrobky:
|
1.
|
Neošetřené krevní výrobky z kopytníků:
Třetí země nebo části třetích zemí uvedené v části 1 přílohy II rozhodnutí 79/542/EHS, ze kterých je povolen dovoz čerstvého masa jakýchkoli druhů domácích kopytníků, a to pouze pro období uvedené ve sloupcích 7 a 8 uvedené části,
Japonsko.
|
|
2.
|
Neošetřené krevní výrobky z drůbeže a jiných druhů ptáků:
Třetí země nebo části třetích zemí uvedené v části 1 přílohy II rozhodnutí 2006/696/ES
Japonsko.
|
|
3.
|
Neošetřené krevní výrobky z jiných zvířat:
Třetí země uvedené buď v části 1 přílohy II rozhodnutí 79/542/EHS, v části 1 přílohy II rozhodnutí Komise 2006/696/ES nebo v příloze I rozhodnutí Komise 2000/585/ES
Japonsko.
|
|
4.
|
Ošetřené krevní výrobky jakýchkoli druhů:
Třetí země uvedené v části 1 přílohy II rozhodnutí 79/542/EHS, v části 1 přílohy II rozhodnutí 2006/696/ES nebo v příloze I rozhodnutí 2000/585/ES
Japonsko.“
|
|
|





