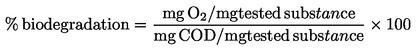|
6)
|
Добавят се следните глави от В.31 до В.46: „В.31. ИЗПИТВАНЕ НА СУХОЗЕМНИ РАСТЕНИЯ: ИЗПИТВАНЕ ЗА ПОНИКВАНЕ И РАСТЕЖ НА ПОНИЦИ
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 208 (2006). Методите за изпитване периодично се преразглеждат с оглед на научния прогрес и приложимостта за регулаторно използване. Настоящият актуализиран метод за изпитване е предназначен за оценка на потенциалните въздействия на химикалите върху поникването и растежа на поници. Като такъв той не обхваща хроничните въздействия или въздействията върху размножаването (напр. завръз, образуване на цветове, зреене на плода). Условията на експозиция и свойствата на химикала за изпитване трябва да се вземат под внимание по такъв начин, че да се гарантира, че се използват подходящи методи за изпитване (например при изпитване на метали/метални съединения трябва да се вземе под внимание въздействието на pH и свързаните с него противоположно натоварени йони) (1). Настоящият метод за изпитване не се отнася до растения, изложени на изпарения на химикали. Този метод на изпитване е приложим за проверката на общи химикали, биоциди и продукти за растителна защита (известни също като пестициди). Той е разработен въз основа на съществуващите методи (2) (3) (4) (5) (6) (7). Взети са предвид и други позовавания, отнасящи се до изпитвания на растения (8) (9) (10). Определенията, които са използвани, са дадени в допълнение 1.
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
2.
|
С изпитването се оценява въздействието върху поникването и началото на растежа на поници при висши растения след експозиция на изпитвания химикал в почвата (или друга подходяща почвена матрица). Семената се поставят в контакт с почва, третирана с изпитвания химикал и се прави оценка на въздействията, появяващи се обикновено от 14 до 21 дни след 50 % поникване на пониците в контролната група. Измерените крайни точки са визуална оценка на поникването на пониците, сухо тегло на поника (като алтернатива, свежо тегло на поника) и, в определени случаи, височина на поника, както и оценка на видимите неблагоприятни въздействия върху различни части на растението. Посочените измервания и наблюдения се сравняват с тези при нетретирани контролни растения.
|
|
3.
|
В зависимост от очаквания път на експозиция, изпитваният химикал или се внася в почвата (или евентуално в изкуствена почвена матрица), или се прилага към почвената повърхност, което представя по подходящ начин потенциалния път за експозиция на химикала. Внасянето в почвата се извършва чрез третиране на почвата в насипно състояние. След прилагането почвата се прехвърля в саксии и след това семената от дадения растителен вид се засаждат в почвата. Прилагането към почвената повърхност се извършва върху почва, която вече е била поставена в саксии и в която семената вече са били засадени. След това изпитваните обекти (контроли и третирани почви плюс семена) се поставят при подходящи условия за подпомагане на покълването/растежа на растенията.
|
|
4.
|
Изпитването може да се проведе за определяне на кривата доза-отклик, или при единична концентрация/доза като гранично изпитване в зависимост от целта на изследването. Ако резултатите от изпитването на единична концентрация/доза надвишават определено равнище на токсичност (например когато се наблюдават въздействия, по-големи от x %), се извършва изпитване за определяне на обхвата, за да се определят горни и долни граници за токсичност, последвано от изпитване с множество концентрации/дози, за да се генерира крива доза-отклик. Използва се подходящ статистически анализ за получаване на ефективна концентрация ECx или ефективна доза на прилагане ERx (например EC25, ER25, EC50, ER50) за най-чувствителния(те) параметър(ри), които представляват интерес. Също така, при това изпитване могат да бъдат изчислени концентрацията без наблюдавано въздействие (NOEC) и най-ниската концентрация, при която се наблюдава ефект (LOEC).
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНИЯ ХИМИКАЛ
|
5.
|
Следната информация е полезна за идентифициране на очаквания път на експозиция на химикала и за планирането на изпитването: структурната формула, чистотата, разтворимостта във вода, разтворимостта в органични разтворители, коефициентът на разпределение 1-октанол/вода, поведението при сорбция в почвата, парното налягане, стабилността на химикала във вода и на светлина, и биоразградимостта.
|
ВАЛИДНОСТ НА ИЗПИТВАНЕТО
|
6.
|
За да бъде считано за валидно изпитването, за контролите следва да се изпълнят следните критерии:
|
—
|
поникването е най-малко 70 %;
|
|
—
|
пониците не проявяват видими признаци на фитотоксично въздействие (напр. хлороза, некроза, увяхване, деформации на листата и стъблото) и растенията показват само нормалното вариране по отношение на растежа и морфологията за този конкретен растителен вид;
|
|
—
|
средната стойност на преживелите поникнали поници в контролите е поне 90 % за периода на проучването;
|
|
—
|
условията на околната среда за конкретния растителен вид са идентични и средата на растеж съдържа еднакво количество от почвената матрица, поддържащата среда, или субстрата от един и същ източник.
|
|
РЕФЕРЕНТЕН ХИМИКАЛ
|
7.
|
Референтният химикал може да бъде изпитван на редовни интервали от време, за да се провери дали провеждането на изпитването, откликът при конкретните изпитвани растения и условията на изпитването не са се променили значително с течение на времето. Като алтернатива, данните за минали периоди за биомасата или за измервания на растежа в контролите могат да бъдат използвани за оценка на параметрите на системата за изпитване в конкретни лаборатории, и могат да послужат като вътрешнолабораторна мярка за контрол на качеството.
|
ОПИСАНИЕ НА МЕТОДА
Естествена почва — изкуствен субстрат
|
8.
|
Растенията могат да се отглеждат в саксии, с използване на праховито-песъклива, песъклива (свързан пясък) или глинесто-песъклива почва, която съдържа до 1,5 процента органичен въглерод (около 3 процента органична материя). Могат да се използват също почви за саксийни растения или синтетични почвени смеси, които са на разположение в търговската мрежа и които съдържат до 1,5 процента органичен въглерод. Глинести почви не бива да се използват, ако за изпитвания химикал е известно, че е с висок афинитет към глина. Естествената почва следва да се пресее до частици с размер 2 mm, за да се хомогенизира и да се отстранят едрите частици. Типът и текстурата, %-ното съдържание на органичен въглерод, рН и съдържанието на соли, както и електропроводимостта на окончателната приготвена почва следва да бъдат протоколирани. Почвата следва да бъде класифицирана съгласно стандартна схема за класификация (11). Почвата може да бъде пастьоризирана или термично обработена, за да се намали въздействието на почвените патогени.
|
|
9.
|
Естествената почва може да усложни тълкуването на резултатите и да повиши варирането поради различни физични/химични свойства и микробни популации. Тези променливи на свой ред променят капацитета за задържане на влага, капацитета за свързване на химикала, аерирането и съдържанието на хранителни вещества и микроелементи. В допълнение към варирането на тези физически фактори ще има и различия по отношение на химическите свойства, като например pH и редокси потенциала, което може да повлияе на бионаличността на изпитвания химикал (12) (13) (14).
|
|
10.
|
Обикновено не се използват изкуствени субстрати за изпитване на препарати за растителна защита, но те могат да бъдат от полза за изпитване на общи химикали или когато е необходимо свеждане до минимум на варирането в естествените почви и увеличаване на съпоставимостта на резултатите от изпитването. Използваните субстрати следва да се състоят от инертни материали, които намаляват до минимум взаимодействието с изпитвания химикал, с разтворителя, използван като носител, или и с двете. За кварцовия пясък, промит с киселина, минералната вата и стъклените перли (напр. от 0.35 до 0,85 mm в диаметър) е установено, че са подходящи инертни материали, които абсорбират изпитвания химикал в минимална степен (15), като се гарантира, че химикалът ще е максимално достъпен за усвояване от пониците чрез корените. Неподходящи субстрати включват вермикулит, перлит и други силно абсорбиращи материали. Следва да се предоставят хранителни вещества за растежа на растенията, за да се гарантира, че растенията не са подложени на стрес от недостатъчно хранителни вещества, и когато е възможно, това следва да бъде оценено чрез химичен анализ или чрез визуална оценка на растенията в контролите.
|
Критерии за подбор на изпитваните растителни видове
|
11.
|
Изборът на растителни видове следва да бъде в разумно широки граници, напр. като се има предвид тяхното таксономично разнообразие в растителното царство, тяхното разпределение, изобилие, специфични за различните видове характеристики на жизнения цикъл и района на естествено срещане, с оглед получаване на диапазон от отклици (8) (10) (16) (17) (18) (19) (20). При подбор следва да бъдат взети предвид следните характеристики на евентуалните видове за изпитването:
|
—
|
видовете имат еднакви семена, които са леснодостъпни от надежден(ни) източник(ци) на посевен материал и които са с последователна, надеждна и равномерна кълняемост, както и еднакъв растеж на пониците;
|
|
—
|
растението може да бъде предмет на изпитвания в лабораторни условия, и може да дава надеждни и възпроизводими резултати във или извън рамките на изпитвателните съоръжения;
|
|
—
|
чувствителността на изпитваните видове следва да съответства на отклиците на растения в околната среда, експонирана на химикала;
|
|
—
|
те са били използвани до известна степен в предходни изпитвания за токсичност и тяхното използване, например при биологични изследвания на хербициди, скрининг на тежки метали, тестове за устойчивост към соленост или минерализация или проучвания за алелопатия, показва чувствителност спрямо голямо разнообразие от стресови фактори;
|
|
—
|
те са съвместими с условията на растеж на метода за изпитване;
|
|
—
|
те отговарят на критериите за валидност на изпитването.
|
Някои от най-често използваните изпитвани видове през предходни периоди са включени в допълнение 2, а потенциални неземеделските видове — в допълнение 3.
|
|
12.
|
Броят на видовете за изпитване зависи от съответните регулаторни изисквания, поради това не е посочен в настоящия метод за изпитване.
|
Прилагане на изпитвания химикал
|
13.
|
Химикалът трябва да бъде приложен в подходящ носител (напр. вода, ацетон, етанол, полиетиленгликол, арабска гума, пясък). Смеси (формулирани продукти или формулировки), които съдържат активни съставки и различни адюванти също могат да бъдат изпитвани.
|
Внасяне в почва/изкуствен субстрат
|
14.
|
Химикали, които са разтворими във вода или суспендират във вода, могат да бъдат добавени към вода, след което разтворът се смесва с почвата с подходящо смесително устройство. Този тип изпитване може да бъде подходящ, ако експозицията на химикала е чрез почвата или чрез водата между почвените частици, и усвояването чрез корените е източник на загриженост. Капацитетът на почвата за задържане на вода не трябва да бъде надхвърлян чрез добавянето на изпитвания химикал. Обемът на добавената вода трябва да е еднакъв за всяка изпитвана концентрация, но следва да бъде ограничен, за да се предотврати слепване на почвени агломерати.
|
|
15.
|
Химикали с ниска водоразтворимост трябва да се разтворят в подходящ летлив разтворител (напр. ацетон, етанол) и да се смесят с пясък. След това разтворителят може да бъде отстранен от пясъка, с използване на струя въздух при непрекъснато разбъркване на пясъка. Третираният пясък се смесва с опитната почва. Установява се втора контрола, която получава само пясък и разтворител. Равни количества пясък, смесен с разтворител, който след това е отстранен, се добавят към всички равнища на третиране и към втората контрола. За твърди, неразтворими изпитвани химикали, суха почва и химикалът се смесват в подходящо смесително устройство. След това почвата се добавя към саксиите и семената са засяват веднага.
|
|
16.
|
Когато вместо почва се използва изкуствен субстрат, химикалите, които са разтворими във вода, могат да бъдат разтворени в хранителния разтвор непосредствено преди началото на изпитването. Химикали, които са неразтворими във вода, но които могат да бъдат суспендирани във вода с използвани като носител разтворители, следва да бъдат добавени с носителя към хранителния разтвор. Неразтворимите във вода химикали, за които няма нетоксичен водоразтворим носител, следва да се разтворят в подходящ летлив разтворител. Разтворът се разбърква с пясък или стъклени перли, поставя се в ротационен вакуумен изпарител, и се изпарява, в резултат на което равномерен слой от химикала остава върху пясъка или перлите. Претеглена част от перлите трябва да се подложи на екстракция със същия органичен разтворител и химикалът се анализира преди поставянето в саксиите.
|
Прилагане към почвената повърхност
|
17.
|
При продуктите за растителна защита разпръскването по повърхността на почвата на изпитвания разтвор се използва често за прилагане на изпитвания химикал. Всяко оборудване, използвано при провеждане на изпитванията, включително оборудване, което се използва за подготовка и прилагане на изпитвания химикал, следва да бъде с такъв дизайн и капацитет, че изпитванията с това оборудване да могат да се провеждат с точност и то да дава възпроизводимо покритие. Покритието следва да е еднакво по цялата почвена повърхност. Следва да се положат грижи за избягване на възможността химикалите да бъдат адсорбирани в оборудването или да реагират с него (напр. пластмасови епруветки и липофилни химикали, или стоманени части и елементи). Изпитваният химикал се разпръсква върху повърхността на почвата, като се симулира типично прилагане с устройство за разпръскване. Като цяло, разпръскваните обеми следва да съответстват на обичайната земеделска практика и обеми (количеството вода и т.н., следва да бъдат протоколирани). Типът на дюзите трябва да е избран така, че да се осигурява еднакво покритие на повърхността на почвата. Ако се прилагат разтворители и носители, следва да бъде създадена втора група от контролни растения, които да получат само разтворител/носител. Това не е необходимо за продукти за растителна защита, изпитвани като формулировки.
|
Проверка на концентрацията/дозата на изпитвания химикал
|
18.
|
Концентрациите/дозите трябва да бъдат потвърдени с подходяща аналитична проверка. За разтворими химикали проверката на всички изпитвани концентрации/дози може да бъде потвърдена чрез анализ на изпитвания разтвор с най-високата концентрация, използван за изпитването, с документиране относно последващото разреждане и използването на калибрирано оборудване за прилагането (напр. калибрирана лабораторна стъклария, калибриране на оборудването за пръскане). За неразтворимите химикали трябва да се направи проверка на съставния материал с теглата на изпитвания химикал, добавен към почвата. Ако се изисква доказване на хомогенност, може да бъде необходим анализ на почвата.
|
ПРОЦЕДУРА
ПЛАНИРАНЕ НА ИЗПИТВАНЕТО
|
19.
|
Семена от един и същ вид се засаждат в саксии. Броят на засадените във всяка саксия семена зависи от растителния вид, размера на саксията и продължителността на изпитването. Чрез броя на засадените във всяка саксия растения следва да се предоставят подходящи условия за растеж и да се избягва прекомерно струпване по време на изпитването. Максималната плътност на растенията следва да е 3—10 семена на 100 cm2 в зависимост от големината на семената. Като пример се препоръчват от едно до две растения царевица, соя, домати, краставици или захарно цвекло за контейнер с размер 15 cm; три растения рапица или грах за контейнер с размер 15 cm; и 5—10 растения лук, пшеница или други малки семена за контейнер с размер 15 cm. Броят на семената и на саксиите за повторения (повторението се определя като саксия и следователно растенията в рамките на една и съща саксия не представляват повторение) следва да бъде достатъчен за оптимален статистически анализ (21). Следва да се отбележи, че варирането ще бъде по-голямо при изпитването на растителни видове, при които на саксия (повторение) се използват по-малко на брой големи по размер семена, в сравнение с изпитвани растителни видове, при които на саксия могат да се използват повече на брой малки по размер семена. Чрез засаждане на равен брой семена във всяка саксия това вариране може да бъде сведено до минимум.
|
|
20.
|
Контролните групи се използват, за да се гарантира, че наблюдаваните въздействия са свързани с експозиция на изпитвания химикал, или са резултат само от такава. Подходящата контролна група трябва да е еднаква във всяко едно отношение с изпитваната група, с изключение на експозицията на изпитвания химикал. В рамките на дадено изпитване всички изпитвани растения, включително контролите, трябва да са от един и същ източник. Изисква се случайно определяне на изпитваните и контролните саксии, с цел да се предотврати изместването.
|
|
21.
|
Семената, покрити с инсектицид, фунгицид (т.е. „обработени“ семена), следва да бъдат избягвани. Независимо от това използването на някои несистемни фунгициди с контактно действие (например каптан, тирам) е разрешено от някои регулаторни органи (22). Ако семепреносимите патогени са повод за загриженост, семената може да се напоят за кратко в слаб 5 % разтвор на хипохлорит, след това да се изплакнат многократно в течаща вода и да се изсушат. Не се разрешава лечебно третиране с други продукти за растителна защита.
|
Условия на изпитването
|
22.
|
Условията на изпитването следва да се доближават до условията, необходими за нормалния растеж на изпитваните видове и сортове (в допълнение 4 се съдържат примери за условия на изпитването). Нововъзникващите растения следва да се съхраняват с използването на добри градинарски практики в климатични камери, вегетационни къщи или оранжерии. Когато се използват съоръжения за регулиране на растежа, тези практики обикновено включват контрол и достатъчно често (например ежедневно) записване на температурата, влажността, концентрацията на въглероден диоксид, осветлението (интензитет, дължина на вълната, фотосинтетично активно излъчване) и времетраенето му, средства за напояване и др., за осигуряване на добро развитие на растенията, в сравнение с контролните растения от избрания растителен вид. Температурите в оранжериите трябва да се контролират чрез вентилиране, отоплителни и/или охладителни системи. За изпитване в оранжерии обикновено се препоръчват следните условия:
|
—
|
температура: 22 °C ± 10 °C;
|
|
—
|
времетраене на осветлението: минимум 16 часа светлина;
|
|
—
|
светлинен интензитет: 350 ± 50 μE/m2/s. Може да необходимо допълнително осветление, ако интензитетът намалее под 200 μE/m2/s при дължина на вълната 400—700 nm, с изключение на някои растителни видове, при които изискванията към осветлението са по-ниски.
|
Условията на околната среда следва да бъдат наблюдавани и протоколирани по време на изследването. Растенията трябва да се отглеждат в непорести пластмасови или глазирани саксии с табли или чинийки под саксиите. Саксиите могат да бъдат премествани периодично, за да се сведе до минимум варирането в растежа на растенията (дължащо се на разлики в условията на изпитване в рамките на съоръженията за регулиране на растежа). Саксиите следва да бъдат достатъчно широки, за да позволяват нормален растеж.
|
|
23.
|
Хранителните вещества в почвата могат да бъдат допълнени според необходимостта, за да се поддържа добра жизненост на растенията. Необходимостта от допълнителни хранителни вещества и и моментът на подаването им могат да се преценят чрез наблюдение на контролните растения. Препоръчва се дънно напояване на изпитвателните съдове (например чрез използване на фитили от стъклена вата). Независимо от това, първоначалното напояване отгоре може да се използва за стимулиране на покълването на семената, а при прилагане на повърхността на почвата то улеснява навлизането на химикала в почвата.
|
|
24.
|
Специфичните условия за отглеждане следва да са подходящи за изпитваните растителни видове и за изпитвания химикал, предмет на проучването. Контролните и третираните растения трябва да се съхраняват при същите условия на околната среда, като обаче следва да бъдат взети подходящи мерки, за да не се допусне кръстосана експозиция на изпитвания химикал (напр. при летливи химикали) между различни третирани и контролни растения.
|
Изпитване при единична концентрация/доза
|
25.
|
За да се определи подходящата концентрация/доза на даден химикал за провеждане на изпитване при единична концентрация или доза (предизвикваща/гранична следва да бъдат взети предвид редица фактори. За общите химикали те включват физичните/химичните свойства на химикала. При продуктите за растителна защита трябва да бъдат взети предвид физичните/химичните свойства и начинът на употреба на изпитвания химикал, неговата максимална концентрация или приложена доза, броят прилагания на сезон и/или устойчивостта му. За да се определи дали един общ химикал притежава фитотоксични свойства, може да е целесъобразно той да се изпита при максимално равнище от 1 000 mg/kg суха почва.
|
Изпитване за определяне на обхвата
|
26.
|
Когато е необходимо, може да се извърши изпитване за определяне на обхвата, за да се предоставят насоки относно концентрациите/дозите, които да бъдат изпитвани в окончателно изследване на зависимостта доза-отклик. За изпитването за определяне на обхвата изпитваните концентрации/дози следва да бъдат широко раздалечени (напр. 0,1, 1,0, 10, 100 и 1 000 mg/kg суха почва). При продуктите за растителна защита концентрациите/дозите могат да се основават на препоръчаната или максимално допустимата концентрация или доза, напр. 1/100, 1/10, 1/1 от препоръчаната/максимално допустимата концентрация или доза на прилагане.
|
Изпитване при множество концентрации/дози
|
27.
|
Целта на изпитването при множество концентрации/дози е да се установи зависимостта доза-отклик и да се определи стойност на ECx или ERx за въздействия върху поникването, биомасата и/или видимите белези в сравнение с неекспонираните контроли, както се изисква от регулаторните органи.
|
|
28.
|
Броят и раздалечеността на концентрациите или дозите следва да бъде достатъчен, за да осигури надеждна зависимост доза-отклик и регресионно уравнение и да даде оценка за стойностите на ECx. или ERx.. Избраните концентрации/дози следва да обхващат стойностите на ECx или ERx, които трябва да бъдат определени. Например, ако е необходима стойност на ЕС50, би било желателно да се проведе изпитване с дози, които предизвикват въздействие от 20 до 80 %. Препоръчаният в изпитването брой концентрации/дози за постигането на тази цел, е най-малко пет в геометрична прогресия плюс нетретирана контролна група, раздалечени една от друга с кратност, която не надвишава три. За всяка третирана и контролна група броят на отделните повторения следва да е най-малко четири и общият брой на семената следва да бъде най-малко 20. При някои растения с ниска кълняемост или вариращ растеж може да са необходими повече повторения за увеличаване на статистическата мощност на изпитването. Ако са използвани по-голям брой изпитвани концентрации/дози, броят на повторенията може да бъде намален. Ако трябва да се оценя NOEC, може да са необходими повече повторения, за да се получи желаната статистическа мощност (23).
|
Наблюдения
|
29.
|
По време на периода на наблюдение, а именно от 14 до 21 дни след поникването на 50 % от контролните растения (също и при контролите на разтворител, ако е приложимо), растенията се наблюдават често (най-малко веднъж седмично и, ако е възможно, ежедневно) за поникване, визуални признаци на фитотоксичност и смъртност. В края на изпитването следва да се запишат измереният процент на поникване и биомасата на преживелите растения, както и видимите неблагоприятни въздействия върху различните части на растението. Последните включват аномалии във външния вид на поникналите поници, забавен растеж, хлороза, обезцветяване, смъртност и въздействия върху развитието на растенията. Крайната биомаса може да бъде измерена чрез крайната средна стойност на теглото на пониците на преживелите растения, като поникът се взема от повърхността на почвата нагоре и се изсушава до постоянно тегло при температура от 60 °С. Като алтернатива, крайната биомаса може да бъде измерена с използване на свежото тегло на пониците. Височината на пониците може да бъде друга крайна точка, ако това се изисква от регулаторните органи. За оценка на наблюдаемия токсичен отклик следва да се използва единна скала по отношение на видимите увреждания. Примери за извършването на качествена и количествена визуална оценка по скала са дадени в (23) (24).
|
ДАННИ И ПРОТОКОЛИРАНЕ
Статистически анализ
Изпитване при единична концентрация/доза
|
30.
|
Данните за всеки растителен вид следва да се анализират чрез използване на подходящ статистически метод (21). Следва да се протоколира както степента на въздействие при изпитваната концентрация/доза, така и невъзможността да се постигне дадено въздействие при изпитваната концентрация/доза (напр. < x % наблюдавано въздействие при y концентрация или доза).
|
Изпитване при множество концентрации/дози
|
31.
|
Установява се зависимост доза-отклик под формата на регресионно уравнение. Могат да се използват различни модели: Така например при поникването, за оценка на стойностите на ECx или ERx (напр. EC25, ER25, EC50, ER50) и техните доверителни граници като двоични данни могат да бъдат подходящи методите логит, пробит, на Вейбул, на Спирмън-Карбър, на Спирмън-Карбър с изключване на данни и други. При растежа на пониците (тегло и височина) крайните точки ECx или ERx и техните доверителни граници като непрекъснати величини могат да се оценят с използване на подходящ регресионен анализ (напр. нелинеен регресионен анализ на Брус-Верстийг (25)). Където е възможно, R2 следва да бъде 0,7 или по-висок за най-чувствителните растителни видове и използваните изпитвани концентрации/дози следва да обхващат 20 % до 80 % въздействия. Ако трябва да се оценя NOEC, следва да се предпочете прилагането на мощни статистически тестове и те трябва да се избират въз основа на разпределението на данните (21) (26).
|
Протокол от изпитването
|
32.
|
Протоколът от изпитването следва да представя резултатите от изследванията, както и подробно описание на условията на изпитване, задълбочено обсъждане на резултатите, анализ на данните и направените заключения от анализа. Трябва да бъда представени в табличен вид обобщение и резюмирана информация за резултатите. Протоколът трябва да включва следното:
|
|
Изпитван химикал:
|
—
|
данни за идентификацията на химикала, относими свойства на изпитвания химикал (например log Pow, разтворимост във вода, парното налягане и информация за съдбата и поведението му в околната среда, ако са налични);
|
|
—
|
подробни данни относно приготвянето на разтвора за изпитване и проверката на изпитваните концентрации, както е посочено в точка 18.
|
|
|
|
Изпитван растителен вид:
|
—
|
подробни данни относно изпитвания организъм: растителен вид/сорт, семейство, научни и общоприети наименования, източник и история на семената възможно най-подробно (т.е., име на доставчика, процент на кълняемост, клас по размер на семената, номер на партида или на пратка, година за семената или вегетативен период, през който са събрани, дата за кълняемостта), жизнеспособност и т.н.;
|
|
—
|
брой на изпитаните едносемеделни и двусемеделни видове;
|
|
—
|
обосновка за избора на растителните видове;
|
|
—
|
описание на съхранението, третирането и поддръжката на семената.
|
|
|
|
Условия на изпитване:
|
—
|
съоръжение за изпитване (напр. климатична камера, вегетационна къща и оранжерия);
|
|
—
|
описание на системата за изпитване (например, размери и материал, от който е направена саксията и количества почва);
|
|
—
|
характеристики на почвата (текстура или тип на почвата: разпределение и класификация на почвените частици, физични и химични свойства, включително % органична материя, % съдържание на органичен въглерод и рН);
|
|
—
|
приготвяне на почвата/субстрата (напр. почва, изкуствена почва, пясък и др.) преди изпитването;
|
|
—
|
описание на хранителната среда, ако е използвана такава;
|
|
—
|
прилагане на изпитвания химикал: описание на метода на прилагане, описание на оборудването, дозите на експозиция и обемите, включително проверка на химикала, описание на метода за калибриране иописание на условията на околната среда по време на прилагането;
|
|
—
|
условия на растеж: светлинен интензитет (напр. фотосинтетично активно излъчване), времетраене на осветлението, максимални/минимални температури, график и метод за напояването, торене;
|
|
—
|
брой семена в саксия, брой растения на доза, брой повторения (саксии) на доза на експозиция;
|
|
—
|
тип и брой на контролите (негативни и/или положителни контроли, контроли на разтворител, ако се използват);
|
|
—
|
продължителност на изпитването.
|
|
|
|
Резултати:
|
—
|
таблица с всички крайни точки за всяко повторение, изпитвана концентрация/доза и растителен вид;
|
|
—
|
броят и процентът на поникване в сравнение с контролите;
|
|
—
|
измервания на биомасата на растенията (сухо или свежо тегло на пониците) като процент от стойността при контролите;
|
|
—
|
височина на пониците на растенията като процент от стойността при контролите, ако се измерва;
|
|
—
|
процент видими увреждания и количествено и качествено описание на видимите увреждания (хлороза, некроза, увяхване, деформация на листата и стъблото, както и всякаква липса на въздействие) в резултат от изпитвания химикал в сравнение с контролните растения;
|
|
—
|
описание на скалата, използвана за преценка на видимите увреждания, ако е правена визуална преценка;
|
|
—
|
за проучвания с една доза следва да се протоколира процентът на уврежданията;
|
|
—
|
Стойностите на ECx или ERx (напр. EC50, ER50, EC25, ER25) и свързаните с тях доверителни граници. Където е извършен регресионен анализ, се предоставят стандартната грешка за регресионното уравнение, както и стандартна грешка на оценката на отделния параметър (напр. наклон, отсечка);
|
|
—
|
стойностите на NOEC (и LOEC), ако са изчислени;
|
|
—
|
описание на статистическите процедури и направените допускания;
|
|
—
|
графично представяне на тези данни и на зависимостта доза-отклик при изпитвания растителен вид.
|
|
Отклонения от процедурите, описани в настоящия метод за изпитване, и всички необичайни обстоятелства по време на изпитването.
|
ЛИТЕРАТУРА
|
(1)
|
Schrader G., Metge K., and Bahadir M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189-193.
|
|
(2)
|
International Organisation of Standards. (1993). ISO 11269-1. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora — Part 1: Method for the Measurement of Inhibition of Root Growth.
|
|
(3)
|
International Organisation of Standards. (1995). ISO 11269-2. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora — Part 2: Effects of Chemicals on the Emergence and Growth of Higher Plants.
|
|
(4)
|
American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
U.S. EPA. (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
|
|
(6)
|
US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background — Non-target Plant Testing;
|
|
—
|
850.4025: Target Area Phytotoxicity;
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850.4225: Seedling Emergence, Tier II;
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR, X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1. (1993) Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K.E. and Keddy, C.J. (1993). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No.145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Canada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C., and Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms — A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. No 48.
|
|
(10)
|
Hale, B., Hall, J.C., Solomon, K., and Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario Canada.
|
|
(11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sc. Soc. Amer. Proc. 26:305 (1962).
|
|
(12)
|
Audus, L.J. (1964). Herbicide behaviour in the soil. In: Audus, L.J. ed. The Physiology and biochemistry of Herbicides, London, New York, Academic Press, NY, Chapter 5, pp. 163-206.
|
|
(13)
|
Beall, M.L., Jr. and Nash, R.G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571-575.
|
|
(14)
|
Beetsman, G.D., Kenney, D.R. and Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247-250.
|
|
(15)
|
U.S. Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 pp., FDA, Washington, DC.
|
|
(16)
|
McKelvey, R.A., Wright, J.P., Honegger, J.L. and Warren, L.W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161-1174
|
|
(17)
|
Boutin, C.; Elmegaard, N. and Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349-369.
|
|
(18)
|
Boutin, C., and Rogers, C.A. (2000). Patterns of sensitivity of plant species to various herbicides — An analysis with two databases. Ecotoxicology vol.9(4):255-271.
|
|
(19)
|
Boutin, C. and Harper, J.L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155-271.
|
|
(20)
|
Boutin, C., Lee, H.-B., Peart, T.E., Batchelor, S.P. and Maguire, R.J.. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532-2541.
|
|
(21)
|
OECD (2006). Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment No 54, Organisation for Economic Co-operation and Development, Paris.
|
|
(22)
|
Hatzios, K.K. and Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1-63.
|
|
(23)
|
Hamill, P.B., Marriage, P.B. and G. Friesen. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386-389.
|
|
(24)
|
Frans, R.E. and Talbert, R.E. (1992). Design of field experiments and the measurement and analysis of plant response. In: B. Truelove (Ed.) Research Methods in Weed Science, 2nd ed. Southern weed Science Society, Auburn, 15-23.
|
|
(25)
|
Bruce, R.D. and Versteeg, D. J.(1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485-1492.
|
|
(26)
|
Глава В.33 от настоящото приложение: Изпитване за размножаване на земни червеи (Eisenia fetida/Eisenia andrei).
|
Допълнение 1
Определения
|
|
Активна съставка (a.i.) (или активно вещество (a.s.)) е материал, предназначен за предизвикване на специфично биологично въздействие (напр. контрол на насекоми, борба с болести по растенията, борба с плевели в третираната площ), известно също като активна съставка или активно вещество с квалификация „технически чист“.
|
|
|
Химикал означава вещество или смес.
|
|
|
Продукти за растителна защита или пестициди са материали със специфична биологична активност, целенасочено използвани за растителна защита от вредители (например гъбични болести, насекоми и конкурентни растения).
|
|
|
ECx. концентрация с въздействие x % или ERx. доза с въздействие x % е концентрацията или дозата, в резултат от която се получава нежелано изменение или промяна от х % в изпитваната крайна точка, която се измерва, по отношение на контролата (напр. 25 % или 50 % намаляване на поникването на пониците, тегло на пониците, краен брой налични растения или увеличение на видимите увреждания би представлявало съответно EC25/ER25 или EC50/ER50).
|
|
|
Поникване е появата на колеоптила или на котиледон над повърхността на почвата.
|
|
|
Формулировка е наличният в търговската мрежа формулиран продукт, съдържащ активното вещество (активната съставка), известен също като краен продукт (8) или типичен продукт за крайно потребление.
|
|
|
LOEC (най-ниската концентрация, при която се наблюдава ефект) е най-ниската концентрация на изпитвания химикал, при която е наблюдавано въздействие. В настоящото изпитване концентрацията, съответстваща на LOEC, има статистически значимо (р < 0,05) въздействие в рамките на даден период на експозиция, при сравнение с контролата, и е по-висока от NOEC.
|
|
|
Неприцелни растения: Тези растения, които са извън прицелната растителна площ. При продуктите за растителна защита това обикновено се отнася за растения извън третираната площ.
|
|
|
NOEC (концентрация без наблюдавано въздействие) е най-високата концентрация на изпитвания химикал, при която не е наблюдавано въздействие. В настоящото изпитване концентрацията, съответстваща на NOEC, няма статистически значимо (р < 0,05) въздействие в рамките на даден период на експозиция, при сравнение с контролата.
|
|
|
Фитотоксичност: Неблагоприятни отклонения (от оценки от измервания и от визуални оценки) от обичайния външен вид и растеж на растения като отклик на даден химикал.
|
|
|
Повторение е опитната единица, която представлява контролната група и/или третираната група. В разглежданите изследвания за повторение е определена саксията.
|
|
|
Визуална оценка: преценка за видимо увреждане, основавана на наблюдение на стъблостой, жизненост, малформация, хлороза, некроза и цялостен изглед в сравнение с контрола.
|
|
|
Изпитван химикал: всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
|
Допълнение 2
Списък на растителните видове, за които съществуват данни за използването им за изпитване на растения през предходни периоди
|
Семейство
|
Вид
|
Общоприети наименования
|
|
DICOTYLEDONAE
|
|
Apiaceae (Umbelliferae)
|
Daucus carota
|
Морков
|
|
Asteraceae (Сложноцветни)
|
Helianthus annuus
|
Слънчоглед
|
|
Asteraceae (Сложноцветни)
|
Lactuca sativa
|
Марули
|
|
Brassicaceae (Cruciferae)
|
Sinapis alba
|
Бял синап
|
|
Brassicaceae (Cruciferae)
|
Brassica campestris var. chinensis
|
Китайско зеле
|
|
Brassicaceae (Cruciferae)
|
Brassica napus
|
Рапица
|
|
Brassicaceae (Cruciferae)
|
Brassica oleracea var. capitata
|
Бяло зеле
|
|
Brassicaceae (Cruciferae)
|
Brassica rapa
|
Ряпа
|
|
Brassicaceae (Cruciferae)
|
Lepidium sativum
|
Градински кресон
|
|
Brassicaceae (Cruciferae)
|
Raphanus sativus
|
Репички
|
|
Chenopodiaceae
|
Beta vulgaris
|
Захарно цвекло
|
|
Cucurbitaceae
|
Cucumis sativus
|
Краставици
|
|
Fabaceae (Leguminosae)
|
Glycine max (G. soja)
|
Соя
|
|
Fabaceae (Leguminosae)
|
Phaseolus aureus
|
Боб мунг
|
|
Fabaceae (Leguminosae)
|
Phaseolus vulgaris
|
Фасул пешак, нисък френски фасул, градински фасул
|
|
Fabaceae (Leguminosae)
|
Pisum sativum
|
Грах
|
|
Fabaceae (Leguminosae)
|
Trigonella foenum-graecum
|
Сминдух
|
|
Fabaceae (Leguminosae)
|
Lotus corniculatus
|
Звездан обикновен
|
|
Fabaceae (Leguminosae)
|
Trifolium pratense
|
Детелина червена
|
|
Fabaceae (Leguminosae)
|
Vicia sativa
|
Фий
|
|
Linaceae
|
Linum usitatissimum
|
Лен
|
|
Polygonaceae
|
Fagopyrum esculentum
|
Елда
|
|
Solanaceae
|
Solanum lycopersicon
|
Домат
|
|
MONOCOTYLEDONAE
|
|
Liliaceae (Amarylladaceae)
|
Allium cepa
|
Лук
|
|
Poaceae (Gramineae)
|
Avena sativa
|
Овес
|
|
Poaceae (Gramineae)
|
Hordeum vulgare
|
Ечемик
|
|
Poaceae (Gramineae)
|
Lolium perenne 0·3
|
Английски райграс
|
|
Poaceae (Gramineae)
|
Oryza sativa
|
Ориз
|
|
Poaceae (Gramineae)
|
Secale cereale
|
Ръж
|
|
Poaceae (Gramineae)
|
Sorghum bicolor
|
Сорго на зърна, сорго
|
|
Poaceae (Gramineae)
|
Triticum aestivum
|
Пшеница
|
|
Poaceae (Gramineae)
|
Zea mays
|
Царевица
|
Допълнение 3
Списък на възможните неземеделски растителни видове
Възможни растителни видове на ОИСР за изпитване за токсичност.
Бележка: В таблицата по-долу се предоставя информация за 52 неземеделски растителни вида (за всяко вписване в скоби е посочена референтна информация). Предоставената информация за кълняемостта е от публикуваната литература и служи само като общи насоки. Индивидуалният опит може да варира в зависимост от източника на семената и други фактори.
|
СЕМЕЙСТВО Вид Ботаническо наименование
(Общоприето наименование на български език)
|
Продължителност на живота (9) и местообитание
|
Тегло на семето
(mg)
|
Времетраене на осветлението за покълване и растеж (10)
|
Дълбочина на засаждане
(mm) (11)
|
Време до покълване
(дни) (12)
|
Специален режим на третиране (13)
|
Изпитване за токсичност (14)
|
Доставчици на семената (15)
|
Друга референтна информация (16)
|
|
APIACEAE
Torilis japonica
(японски торилис)
|
А, В нарушени терени, живи плетове, пасища (16, 19)
|
1,7 — 1,9 (14, 19)
|
L = D (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
студена стратификация (7, 14, 18, 19) може да е необходимо зреене (19) покълването се потиска от тъмнина (1, 19) няма специални третирания (5)
|
POST (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(многогодишна паричка)
|
Ρ
пасища, обработваеми земи, торф (16, 19)
|
0,09-0,17 (4, 19)
|
L = D (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
покълването не е засегнато от лъчение (18, 19) няма специални третирания (4, 14)
|
POST (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(Обикновена метличина)
|
A
полета, крайпътни пространства и открити местообитания (16)
|
4,1-4,9 (4, 14)
|
L = D (14)
|
0-3 (2, 4, 14)
|
14-21 (100 %) (14)
|
няма специални третирания (2, 4)
|
POST (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(вид червена метличина)
|
Ρ
полета, крайпътни пространства и открити местообитания (16, 19)
|
2,4-2,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
може да е необходимо зреене (18, 19) покълването се потиска от тъмнина (19) няма специални третирания (5, 14, 26)
|
POST (5, 22, 26)
|
A
|
|
|
Inula helenium
(бял оман)
|
Ρ
влажни, нарушени терени
(16)
|
1 — 1,3 (4, 14, 29)
|
|
0
(4, 29)
|
|
няма специални третирания (4)
|
POST (4)
|
A, F
|
|
|
Leontodon hispidus
(космата жълтица)
|
Ρ
полета, крайпътни пространства, нарушени терени (16, 19)
|
0,85 -1,2 (14, 19)
|
L = D (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
покълването се потиска от тъмнина (17, 18, 19) няма специални третирания (5, 23)
|
POST (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(влакнеста рудбекия)
|
Β, Ρ нарушени
16)
|
0,3 (4, 14)
|
L = D (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
няма специални третирания
(4, 14, 33)
|
POST (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(канадски енчец)
|
Ρ
пасища, открити терени (16)
|
0,06-0,08 (4, 14)
|
L = D (11)
|
0
(4)
|
14-21
(11)
|
разбърква се с равна част пясък и се напоява в 500 ppm GA в течение на 24 часа (11) няма специални третирания (4)
|
POST (4)
|
E, F
|
|
|
Xanthium pensylvanicu
(влакнест казашки бодил, разновидност canadense)
|
A
полета, открити местообитания (16)
|
25-61 (14, 29)
|
|
0(1)
5(29)
|
|
покълването може да се потиска от тъмнина (1) потапяне в топла вода в течение на 12 часа (29)
|
PRE & POST (31)
|
A
|
|
|
Xanthium spinosum
(влакнест казашки бодил)
|
A
открити местообитания (16)
|
200 (14)
|
L = D (14)
L > D (6)
|
10
6)
|
|
скарификация (14) няма специални третирания (6)
|
PRE & POST (6)
|
A
|
|
|
Xanthium strumarium
(влакнест казашки бодил)
|
A
полета, открити местообитания (16)
|
67,4 (14)
|
L = D (14)
|
10-20 (6, 21)
|
|
няма специални третирания
(6, 14, 21)
|
PRE & POST (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Card amine pratensis
(ливадна горва)
|
Ρ
полета, крайпътни пространства, торф (6, 19)
|
0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
покълването се потиска от тъмнина (18, 19) няма специални третирания (5, 14, 22)
|
POST (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
(румянка)
|
Ρ
(16)
|
0,21 (14)
|
L = D (14)
|
|
< 14 (100 %) (14, 25)
|
може да е необходимо зреене (18) няма специални третирания (5, 14, 15, 22-26)
|
POST (5, 15, 22-26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(бяла куча лобода)
|
A
синорни ивици, нарушени терени (16, 19)
|
0,7 — 1,5 (14, 19, 34)
|
L = D (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
третирането е различно в зависимост от цвета на семената (19) покой на семето при съхранение на сухо (19) покълването се потиска от тъмнина (1, 18, 19) студена стратификация (18) няма специални третирания (14, 34)
|
PRE & POST (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(жълт кантарион)
|
Ρ
полета, обработваеми земи, открити местообитания (16, 19)
|
0,1-0,23
(14, 19)
|
L = D
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
покълването се потиска от тъмнина (1, 18, 19)
няма специални третирания (5, 14, 15, 25, 27)
|
POST
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
(бръшляноподобна ипомея)
|
A
полета, открити местообитания, ниви (16)
|
28,2
(14)
|
L > D
(6, 10)
|
10-20
(6, 10, 21)
|
4 (100 %)
(10)
|
покълването не е засегнато от лъчение (1)
няма специални третирания (6, 21)
|
PRE & POST
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
(лилава острица)
|
Ρ
обработваеми земи, пасища, крайпътни пространства (16, 30)
|
0,2
(14)
|
L = D
(14)
|
0 (1)
10-20 (6, 10)
|
12 (91 %)
(10)
|
покълването се потиска от тъмнина (1)
няма специални третирания (6, 10, 14)
|
PRE & POST
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
(обикновен звездан)
|
Ρ
тревисти райони, крайпътни пространства, открити местообитания (16, 19)
|
1-1,67
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
скарификация (14, 19)
покълването не е засегнато от лъчение (18, 19) няма специални третирания (23, 25)
|
POST
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(китайска сена, тъполистна касия)
|
A
влажни гори (16)
|
23-28
(9)
|
L = D (14)
L > D (9)
|
10-20
(6,9)
|
|
потапяне на семената във вода в продължение на 24 часа (9)
скарификация (14) жизнеспособността на семената се различава в зависимост от цвета (1) няма специални третирания (6)
|
POST
(6,9)
|
A
|
|
|
Sesbania exaltata
(Сесбания екзалтата)
|
A
алувиални почви (16)
|
11 — 13
(9, 14)
|
L > D (9)
|
10-20
(9, 21)
|
|
потапяне на семената във вода в продължение на 24 часа (9)
покълването не е засегнато от лъчение (1) няма специални третирания (21)
|
PRE & POST
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
ливадна детелина
|
Ρ
полета, крайпътни пространства, обработваеми земи (16, 19)
|
1,4 — 1,7
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
скарификация (14, 18)
може да е необходимо зреене (19), покълването не е засегнато от лъчение (1, 19) няма специални третирания (5)
|
POST
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(дяволска уста)
|
Ρ
открити местообитания (16)
|
0,75-1,0
(4, 14)
|
L = D (14)
|
0
(4)
|
|
няма специални третирания
(4, 14)
|
POST
(4)
|
F
|
|
|
Mentha spicata
(обикновена мента)
|
Ρ
влажни зони (16)
|
2,21
(4)
|
|
0
(4)
|
|
няма специални третирания
(4)
|
POST
(4)
|
F
|
|
|
Nepeta cataria
(коча билка обикновена)
|
Ρ
нарушени терени (16)
|
0,54
(4, 14)
|
L = D (14)
|
0
(4)
|
|
няма специални третирания
(2, 4, 14)
|
POST
(2,4)
|
F
|
|
|
Prunella vulgaris
(обикновена пришница)
|
Ρ
обработваеми полета, тревисти площи, нарушени терени (16, 19)
|
0,58-1,2
(4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
5 (50 %) (19)
7 (91 %) (18)
|
покълването се потиска от тъмнина (18, 19)
покълването е по-голямо при по-големи семена (1,) няма специални третирания (4, 14, 22)
|
POST
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(лечебен ранилист)
|
Ρ
тревни съобщества, синорни ивици (19)
|
14-18
(14, 19)
|
L = D (14)
|
|
7 (50 %)
(19)
|
няма специални третирания
(5, 14, 22)
|
POST
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilon theophrasti
(просфорник)
|
A
полета, открити местообитания (16)
|
8,8
(14)
|
L = D (14)
|
10-20
(6, 10, 21)
|
4 (84 %)
(10)
|
скарификация (14)
няма специални третирания (5, 10, 21)
|
PRE & POST
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(Сида спиноза)
|
A
полета, крайпътни пространства (6, 19)
|
3,8
(14)
|
L = D (14)
|
10-20
(6, 21)
|
|
скарификация (14)
покълването не е засегнато от лъчение (1) няма специални третирания (6, 21)
|
PRE & POST
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(полски мак)
|
A
полета, обработваеми земи, нарушени терени (16, 19)
|
0,1-0,3
(4, 14, 19, 29)
|
L = D (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
студена стратификация и скарификация (1, 19, 32)
няма специални третирания (4, 14, 29)
|
POST
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis
(обикновена полевица)
|
тревни площи, пасища (16)
|
0,07 (14)
|
L > D (Ю)
|
20 (10)
|
10 (62 %) (10)
|
покълването се потиска от тъмнина (1, 17-19) няма специални третирания (10)
|
POST (10)
|
A, E
|
|
|
Alopecurus myosuroides
(полска класица)
|
A
полета, открити местообитания (16)
|
0,9-1,6
(29, 34)
|
L = D (14)
|
2
(29)
|
< 24 (30 %) (34)
|
скарификация (14) третира се със 101 mg/l KNO3 (14) топла стратификация (1) покълването се потиска от тъмнина (1) няма специални третирания (34)
|
PRE & POST
(28, 34)
|
A
|
32
|
|
Avena fatua
(див овес)
|
A
обработваеми площи, открити местообитания (16)
|
7-37,5 (14, 30)
|
L = D (14)
L > D (6)
|
10-20 (6, 10)
|
3 (70 %) (18)
|
скарификация (7, 32) покълването се потиска от тъмнина (1)
студена стратификация (1, 18) няма специални третирания (6, 10, 14)
|
PRE & POST (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(покривна овсига)
|
A
полета, крайпътни пространства, обработваеми земи (16)
|
0,45-2,28 (14, 29)
|
L = D (14)
|
3 (29)
|
|
период на зреене (1, 7, 32) покълването се потиска от светлина (1) няма специални третирания (14)
|
PRE & POST (28, 31)
|
A
|
|
|
Cynosurus cristatus
(обикновен сеноклас)
|
P
полета, крайпътни пространства, открити местообитания (16, 19)
|
0,5-0,7 (14, 19, 29)
|
L = D (14)
|
0 (29)
|
3 (50 %) (19)
|
покълването не е засегнато от лъчение (19) няма специални третирания (14, 29)
|
POST (5)
|
A
|
|
|
Digitaria sanguinalis
(кървава росичка)
|
A
полета, торф, открити местообитания (16)
|
0,52-0,6 (14, 30)
|
L = D (14)
|
10-20 (21)
|
7 (75 %)
14 (94 %) (7)
|
скарификация, студена стратификация (1, 7, 14, 32) третира се със 101 mg/l KNO3 (14) покълването се потиска от тъмнина (1) няма специални третирания (21)
|
PRE & POST (18, 25, 31)
|
A
|
|
|
Echinochloa crus-galli
(дараджан)
|
A
(16)
|
1,5 (14)
|
L = D (14)
L > D (3)
|
10-20 (7, 21)
|
|
скарификация (7, 32) покълването не е засегнато от лъчение (1) няма специални третирания (3, 14, 21)
|
PRE & POST (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(Елимус канаденсис)
|
P
крайречни зони, нарушени терени (16)
|
4-5 (14, 30)
|
L = D (11)
|
1
(11)
|
14-28
(11)
|
няма специални третирания
(2, 11)
|
POST (2)
|
C, D, E
|
|
|
Festuca pratensis
(ливадна власатка)
|
P
полета, влажни зони (16, 19)
|
1,53-2,2 (16, 19)
|
L = D (14)
L > D (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
няма специални третирания
(10, 19)
|
POST (10)
|
A
|
7
|
|
Hordeum pusillum
(вид дребен ечемик)
|
A
пасища, крайпътни пространства, открити местообитания (16)
|
3,28 (14)
|
|
|
|
топла стратификация (1) покълването не е засегнато от лъчение (1)
|
PRE (31)
|
|
7
|
|
Phleum pratense
(ливадна тимотейка)
|
P
пасища, обработваеми полета, нарушени терени (16, 19)
|
0,45 (14, 19)
|
L > D (10, 14)
|
0-10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
покълването се потиска от тъмнина (19) покълването не е засегнато от лъчение (17) няма специални третирания (10, 14, 17, 19)
|
POST (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(поветицово пипериче)
|
A
открити местообитания, крайпътни пространства (16)
|
5-8 (4, 14, 29)
|
L = D (20)
|
0-2 (4, 29)
|
|
студена стратификация в продължение на 4-8 седмици (1, 2, 4, 20, 29) покълването не е засегнато от лъчение (1)
|
PRE & POST 1, 2, 20, 28, 31
|
A
|
32
|
|
Polygonum lapathifolium
(лападоволистно пипериче)
|
A
влажни почви (16)
|
1,8-2,5 (14)
|
L > D (6)
|
|
5 (94 %) (18)
|
покълването не е засегнато от излъчване (1) покълването се потиска от тъмнина (18) студена стратификация (1) няма специални третирания (5)
|
PRE & POST (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
(пенсилванско пипериче)
|
A
полета, открити местообитания (16)
|
3,6-7 (14, 29)
|
|
2 (29)
|
|
студена стратификация в продължение на 4 седмици при 0-5 °C (1, 29), покълването се потиска от тъмнина (1)
|
PRE (31)
|
A, E
|
|
|
Polygonum periscaria
(обикновено пипериче)
|
A
нарушени терени, обработваеми земи (16, 19)
|
2,1 -2,3 (14, 19)
|
L > D (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
скарификация, студена стратификация (14) третира се с GA (17-19) покълването се потиска от тъмнина (19) няма специални третирания (13)
|
POST (13)
|
A
|
32
|
|
Rumex crispus
(къдрав лапад)
|
P
обработваеми полета, крайпътни пространства, открити зони (16, 19)
|
1,3-1,5 (4, 14, 19)
|
L = D (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
покълването се потиска от тъмнина (18, 19) може да е необходимо зреене (18) няма специални третирания (4, 14, 33)
|
POST (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
(полско огнивче)
|
A
обработваеми полета, открити терени, нарушени терени (16, 19)
|
0,4-0,5 (4, 14, 19)
|
L = D (14)
|
|
1 (50 %) (19)
|
студена стратификация, третиране с GA (1,14, 18, 19, 32), за покълване е необходима светлина (1) няма специални третирания (2, 4)
|
POST (2,4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(лютиче обикновено)
|
Ρ
обработваеми полета, крайпътни пространства, открити зони (16, 19)
|
1,5-2 (14, 19, 29)
|
L = D (14)
|
1
(29)
|
41 -56 (19, 29)
|
няма специални третирания
(5, 14, 22, 24-26)
|
POST (5, 22, 24-26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(градско омайниче)
|
Ρ
живи плетове, влажни зони
(16, 19)
|
0,8 — 1,5 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
покълването се потиска от тъмнина (18, 19) топла стратификация (1) няма специални третирания (5, 14, 22, 25, 26)
|
POST (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(лепка)
|
A
обработваеми полета, влажни зони, нарушени терени (16, 19)
|
7-9 (14, 19)
|
L = D (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
студена стратификация (1, 18, 19), покълването не е засегнато от лъчение (18, 19) покълването се потиска от светлина (1) няма специални третирания (6, 14)
|
PRE & POST (6, 28)
|
A
|
32
|
|
Galium mollugo
(меко еньовче)
|
Ρ
насипи, открити райони (8)
|
7
(29)
|
L = D (14)
|
2
(29)
|
|
няма специални третирания
(5, 14, 22, 24, 26, 29)
|
POST (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(червен напръстник)
|
Β, Ρ живи плетове, открити райони (16, 19)
|
0,1-0,6 (4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
6 (50 %) (19)
8 (99 %) (18)
|
покълването се потиска от тъмнина (1, 17-19) няма специални третирания (4, 22-26)
|
POST (4, 22 — 26)
|
D, G, F
|
|
|
Veronica persica
(персийско великденче)
|
A
обработваеми полета, открити терени, нарушени терени (16, 19)
|
0,5-0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3(19)
5 (96 %) (18)
|
покълването се потиска от тъмнина (18, 19) студена стратификация (18) няма специални третирания (14)
|
PRE & POST (28)
|
A
|
32
|
Цитирани доставчици на семена
|
Идентификатор на доставчика
|
Информация за доставчика
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ ENGLAND +44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 USA
|
|
(727) 344 — 4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla — Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 CANADA (519) 586 — 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 USA (303) 431 – 7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 USA
|
|
(800) 873 — 3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB ENGLAND
|
|
+44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 CANADA (800) 274 - 7333
|
|
www.thompson-morgan.com
|
|
ЦИТИРАНИ ПОЗОВАВАНИЯ
|
(1)
|
Baskin, C.C. & Baskin, J.M. 1998. Seeds. Academic Press, Toronto
|
|
(2)
|
Blackburn, L.G. & Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271-285.
|
|
(3)
|
Boutin, C., Lee, H-B., Peart, T., Batchelor, P.S., & Maguire, R.J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
|
|
(4)
|
Boutin, C., Elmegaard, N., & Kjaer, C. 2004. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349-369.
|
|
(5)
|
Breeze, V., Thomas, G., & Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669-677.
|
|
(6)
|
Brown, R.A., & Farmer, D. 1991. Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. In: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J.W. Gorsuch, W.R. Lower, W.Wang, & M.A. Lewis, eds. American Society for Testing & Materials, Philadelphia. pp 197 — 208.
|
|
(7)
|
Buhler, D.D. & Hoffman, M.L. 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
(8)
|
Clapham, A.R., Tutin, T.G., & Warburg, E.F. 1981. Excursion flora of the British Isles, 3rd ed. Cambridge University Press, Cambridge
|
|
(9)
|
Clay, P.A. & Griffin, J.L. 2000. Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481-486.
|
|
(10)
|
Cole, J.F.H. & Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC — Weeds. pp. 151 — 156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds). 2004. Personal communication. (www.ernstseed.com)
|
|
(12)
|
Fletcher, J.S., Johnson, F.L., & McFarlane, J.C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769-776.
|
|
(13)
|
Fletcher, J.S., Pfleeger, T.G., Ratsch, H.C., & Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189-1196.
|
|
(14)
|
Flynn, S., Turner, R.M., and Dickie, J.B. 2004. Seed Information Database (release 6.0, Oct 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid)
|
|
(15)
|
Franzaring, J., Kempenaar, C., & van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21-28.
|
|
(16)
|
Gleason, H.A. & Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2nd ed. New York Botanical Garden, Bronx, NY
|
|
(17)
|
Grime, J.P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555-558.
|
|
(18)
|
Grime, J.P., Mason, G., Curtis, A.V., Rodman, J., Band, S.R., Mowforth, M.A.G., Neal, A.M., & Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017-1059.
|
|
(19)
|
Grime, J.P., Hodgson, J.G., & Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London
|
|
(20)
|
Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453-459.
|
|
(21)
|
Klingaman, T.E., King, C.A., & Oliver, L.R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227-232.
|
|
(22)
|
Marrs, R.H., Williams, C.T., Frost, A.J., & Plant, R.A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71-86.
|
|
(23)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223-235.
|
|
(24)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25-42.
|
|
(25)
|
Marrs, R.H., Frost, A.J., Plant, R.A., & Lunnis, P. 1993. Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283-293.
|
|
(26)
|
Marrs, R.H. & Frost, A.J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369-388.
|
|
(27)
|
Marshall, E.J.P. & Bernie, J.E. 1985. Herbicide effects on field margin flora. BCPC — Weeds. pp. 1021-1028.
|
|
(28)
|
McKelvey, R.A., Wright, J.P., & Honegger, J.L. 2002. A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161-1174.
|
|
(29)
|
Morton, S. (Herbiseed). 2004. Personal communication. (http://www.herbiseed.com)
|
|
(30)
|
USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA
|
|
(31)
|
USEPA. 1999. One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
(32)
|
Webster, R.H. 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L. & Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Personal communication.
|
|
(34)
|
Zwerger, P. & Pestemer, W. 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711-718.
|
Допълнение 4
Примери за подходящи условия за растеж за някои растителни видове
Следните условия са възприети като подходящи за 10 растителни вида и могат да бъдат използвани като насоки за изпитвания в климатични камери, също така при някои други растителни видове:
|
|
Концентрация на въглероден диоксид: 350 ± 50 ppm;
|
|
|
Относителна влажност: 70 ± 5 % през светлите периоди и 90 ± 5 % през тъмните периоди;
|
|
|
Температура: 25 ± 3 °C през деня, 20 ± 3 °C през нощта;
|
|
|
Времетраене на осветлението: 16 часа светлина/8 часа тъмнина при средна дължина на вълната от 400 до 700 nm;
|
|
|
Светлина: яркост 350 ± 50 μE/m2/s, измерена непосредствено над листата.
|
Растителните видове са:
|
—
|
домат (Solanum lycopersicon);
|
|
—
|
краставици (Cucumis sativus);
|
|
—
|
марули (Lactuca sativa);
|
|
—
|
зеле (Brassica oleracea var. capitata);
|
|
—
|
моркови (Daucus carota);
|
|
—
|
английски райграс (Lolium perenne);
|
В.32. ИЗПИТВАНЕ ЗА РАЗМНОЖАВАНЕ НА ПРЕДСТАВИТЕЛИ НА СЕМ. ENCHYTRAEIDAE
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 220 (2004). Той е предназначен да бъде използван за оценяване на въздействието на химикали върху репродуктивната способност в почвата на червеи от вида Enchytraeus albidus Henle 1873. Той се основава главно на метод, разработен от Агенцията по околна среда, Германия (1), който е бил предмет на кръгово изпитване (2). Други методи за изпитване на токсичността на химикали към представители на сем. Enchytraeidae и земни червеи също са взети предвид (3) (4) (5) (6) (7) (8).
|
ПЪРВОНАЧАЛНИ СЪОБРАЖЕНИЯ
|
2.
|
Обитаващите почвата прешленести червеи от род Enchytraeus са екологично значими видове по отношение на екотоксикологичните изпитвания. Докато представителите на сем. Enchytraeidae се срещат често в почвите, обитавани от земни червеи, вярно е също така, че те често са в изобилие в много почви, които не са обитавани от земни червеи. Представителите на сем. Enchytraeidae могат да се използват при лабораторни изпитвания, както и в полуполеви и полеви изследвания. От практическа гледна точка много видове от род Enchytraeus са лесни за боравене и отглеждане и тяхното време за създаване на поколение е значително по-кратко от това на земните червеи. Продължителността на едно изпитване за размножаване на представители на сем. Enchytraeidae следователно трае само 4-6 седмици, докато при земните червеи (Eisenia fetida) то е 8 седмици.
|
|
3.
|
Основна информация относно екологията и екотоксикологията на представителите на сем. Enchytraeidae в сухоземни условия могат да бъдат намерени в (9) (10) (11) (12).
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
4.
|
Възрастни (полово зрели) представители на сем. Enchytraeidae се експонират на диапазон от концентрации на изпитвания химикал, примесен с изкуствена почва. Изпитването може да бъде разделено на две стъпки: а) изпитване за определяне на обхвата, в случай че не е налице достатъчно информация, при която смъртността е основната крайна точка, оценена след две седмици експозиция, и б) окончателното изпитване за размножаване, в което се оценяват общият брой на ювенилните екземпляри, произлезли от родител, и преживяването на родителите. Продължителността на окончателното изпитване е шест седмици. След първите три седмици полово зрелите червеи се отстраняват и морфологичните промени се записват. След още три седмици се отчита броят на новоизлюпените от пашкулчетата червеи, произлезли от полово зрели индивиди. Репродуктивната способност на животните, експонирани на изпитвания химикал, се сравнява с тази на контролата(ите), за да се определи (i) концентрацията без наблюдавано въздействие (NOEC) и/или (ii) ECx (напр. EC10, EC50), като се използва регресионен модел, за да се оцени концентрацията, която би причинила х % намаляване в репродуктивната способност. Изпитваните концентрации трябва да обхващат ECx (напр. EC10, EC50), така че ЕСх впоследствие да се получи след интерполация, вместо след екстраполация.
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНИЯ ХИМИКАЛ
|
5.
|
Разтворимостта във вода, log Kow, коефициентът на разпределение почва-вода (вж. напр. глава В.18 или В.19 от настоящото приложение) и парното налягане на изпитвания химикал следва да са известни. Желателно е да е налична допълнителна информация относно съдбата на изпитвания химикал в почвата, като например скоростите на фотолиза и хидролиза.
|
|
6.
|
Този метод за изпитване може да се използва за разтворими във вода и неразтворими химикали. Начините на прилагане на изпитвания химикал обаче съответно ще се различават. Методът за изпитване е неприложим за летливи химикали, т.е., химикали, за които константата на Хенри или коефициентът на разпределение въздух-вода е по-голям от единица, или за химикали, при които парното налягане превишава 0,0133 Pa при 25 °С.
|
ВАЛИДНОСТ НА ИЗПИТВАНЕТО
|
7.
|
За да бъде изпитването валидно, при контролите следва да се изпълнят следните критерии:
|
—
|
Смъртността при възрастните индивиди не трябва да превишава 20 % в края на изпитването за определяне на обхвата и след първите три седмици от изпитването за размножаване.
|
|
—
|
Ако се предположи, че са били използвани 10 възрастни индивиди на съд при подготвянето на изпитването, в края му трябва да са получени средно най-малко 25 ювенилни индивиди на съд.
|
|
—
|
Коефициентът на вариация около средната величина на ювенилните индивиди не трябва да е по-голям от 50 % в края на изпитването за размножаване.
|
Когато дадено изпитване не отговаря на посочените по-горе критерии, то следва да бъде прекратено, освен ако не може да бъде предоставена обосновка за продължаването му. Обосновката следва да се включи в протокола от изпитването.
|
РЕФЕРЕНТЕН ХИМИКАЛ
|
8.
|
Референтният химикал или трябва да се изпитва редовно, или евентуално да бъде включен във всяко изпитване, за да се провери дали откликът на изпитваните организми не се е променил значително с течение на времето. Подходящ референтен химикал е карбендазим, за когото е било доказано, че оказва въздействие върху преживяването и размножаването на представителите на сем. Enchytraeidae (13) (14), като също могат да бъдат използвани и други химикали, при които данните за токсичността са добре известни. В кръгово изпитване е използвана формулировка на карбендазим, известна с търговското наименование Derosal™, доставена от AgrEvo Company (Франкфурт, Германия) и съдържаща 360 g/l (32,18 %) активна съставка (2). Стойността на EC50 за размножаването, определена в кръговото изпитване, е в интервала 1,2 ± 0,8 mg активна съставка (a.i.) на kg суха маса (2). Ако в поредицата изпитвания е включена положителна стандартна проба за токсичност, използва се една концентрация, като броят на отделните повторения следва да е същият като този при контролите. По отношение на карбендазим се препоръчва изпитване с 1,2 mg a.i./kg сухо тегло (изпитва се във вид на течна формулировка).
|
ОПИСАНИЕ НА ИЗПИТВАНЕТО
Оборудване
|
9.
|
Съдовете за изпитване следва да са направени от стъкло или друг химически инертен материал. Подходящи са стъклени буркани (напр. с обем: 0,20—0,25 литра; диаметър: ≈ 6 cm). Съдовете следва да са с прозрачни капаци (напр. стъкло или полиетилен), които са разработени така, че да намаляват изпаряването на водата, като същевременно дават възможност за газообмен между почвата и атмосферата. Капаците следва да бъдат прозрачни, за да се позволи пропускането на светлина.
|
|
10.
|
Необходимо е обикновено лабораторно оборудване, по-специално следното:
|
—
|
подходящо оборудване за контрол на температурата;
|
|
—
|
подходящо оборудване за контрол на влажността (не е от съществено значение, ако съдовете за експозицията са снабдени с капаци);
|
|
—
|
инкубатор или малко помещение с климатик;
|
|
—
|
пинсети, куки или примки;
|
|
Приготвяне на изкуствената почва
|
11.
|
В настоящото изпитване се използва изкуствена почва (5)(7) със следния състав (на базата на сухо тегло след изсушаване до постоянно тегло при температура от 105 °C):
|
—
|
10 % торфен мъх, изсушен на въздух и фино смлян (приема се размер на частиците от 2 ± 1 mm); препоръчва се да се провери дали преди използване в изпитването дадена почва, приготвена с прясна партида торф, е подходяща за отглеждане на червеите;
|
|
—
|
20 % каолин (за предпочитане съдържанието на каолинит да е над 30 %);
|
|
—
|
приблизително от 0,3 до 1,0 % калциев карбонат (CaCO3 на прах, с квалификация „чист“) за получаване на pH, равно на 6,0 ± 0,5; количеството на калциевия карбонат за добавяне може да зависи основно от качеството/естеството на торфа;
|
|
—
|
приблизително 70 % кварцов пясък, изсушен на въздух (в зависимост от количеството на необходимия CaCO3), предимно фин пясък с над 50 % от частиците между 50 и 200 микрона.
|
Преди използването на почвата в окончателното изпитване е препоръчително да се демонстрира пригодността на изкуствената почва за отглеждането на червеите и за постигането на критериите за валидност на изпитването. Особено е препоръчително да се направи такава проверка, за да се гарантира, че ефективността на изпитването не е изложена на риск, ако съдържанието на органичен въглерод в изкуствената почва се намали, например чрез понижаване на съдържанието на торф до 4 — 5 % и съответно повишаване на съдържанието на пясък. С подобно намаляване на съдържанието на органичен въглерод може да се намали и способността за адсорбция на изпитвания химикал в почвата (органичен въглерод) и да се увеличи наличният изпитван химикал за червеите. Беше показано, че Enchytraeus albidus може да изпълни критериите за валидност по отношение на размножаването, когато се изпитва в естествени почви с по-ниско съдържание на органичен въглерод от упоменатото по-горе (напр. 2,7 %) (15), като е експериментално установено, макар и в ограничен мащаб, че това може да се постигне и в изкуствена почва със съдържание на торф 5 %.
Забележка: Когато се използва естествена почва в допълнително изпитване (напр. изпитване на по-високо стъпало), следва също да бъдат доказани пригодността на почвата и постигането на критериите за валидност на изпитването.
|
|
12.
|
Сухите съставки на почвата се смесват старателно (напр. в голямо лабораторно устройство за смесване). Това следва да се извърши най-малко една седмица преди началото на изпитването. Смесената почва следва да се съхранява в продължение на два дни, за да се достигне равновесие при киселинността/да се стабилизира киселинността. За определянето на рН се използва смес от почва и разтвор на 1 М калиев хлорид (KCl) или 0,01 M калциев хлорид (CaCl2) в съотношение 1:5 (вж. (16) и Допълнение 3). Ако почвата е по-киселинна от изисквания диапазон (вж. точка 11), може да бъде коригирана чрез добавяне на подходящо количество CaCO3. Ако почвата е твърде алкална, може да се коригира чрез добавяне на повече от сместа, посочена в параграф 11, но без съдържание на CaCO3.
|
|
13.
|
Максималната способност за задържане на вода (СЗВ) на изкуствената почва се определя в съответствие с процедурите, описани в допълнение 2. Един или два дни преди началото на изпитването сухата изкуствена почва предварително се навлажнява чрез добавяне на дейонизирана вода, до получаване на приблизително половината от крайното съдържание на вода, което представлява 40 до 60 % от максималната способност за задържане на вода. В началото на изпитването предварително навлажнената почва се разделя на части, съответстващи на броя изпитвани концентрации (и референтен химикал, когато е целесъобразно) и контроли. Влажността се коригира до 40—60 % от максималната СЗВ чрез добавяне на разтвор на изпитвания химикал и/или като се добавя дестилирана или дейонизирана вода (вж. точки 19—21). Съдържанието на влага се измерва в началото и в края на изпитването (чрез изсушаване до постоянно тегло при 105 °С) и следва да бъде в оптимални граници за преживяването на червеите. Приблизителна проверка на съдържанието на влага в почвата може да се извърши чрез леко стискане в ръка на почвата — ако съдържанието на влага е коректно, трябва между пръстите да се появят малки капки вода.
|
Избор и подготвяне на изпитваните животински видове
|
14.
|
Препоръчаният за изпитването вид е Enchytraeus albidus Henle 1837 (бял червей), представител на семейство Enchytraeidae (клас Oligochaeta, тип Annelida). E. albidus е един от най-големите видове измежду представителите на семейство Enchytraeidae, като е съобщавано за екземпляри, достигащи дължина до 35 mm (17) (18). Enchytraeus albidus се среща по целия свят в морски, сладководни и сухоземни местообитания, главно в разлагаща се органична материя (водорасли, компост) и рядко по ливади (9). Неговата широка екологична толерантност и някои морфологични изменения може да показват, че съществуват различни подвидове.
|
|
15.
|
Enchytraeus albidus е достъпен в търговската мрежа като храна за риби. Следва да се провери дали отгледаните екземпляри не са замърсени от други, обикновено по-дребни видове (1) (19). Ако е налице замърсяване, всички червеи следва да се измият с вода в стъкло на Петри. След това следва да се изберат едри полово зрели екземпляри от E. albidus (с използване на стереомикроскоп) за започване на нова култура, като всички други червеи се отстраняват. E. albidus може да се отглежда лесно в широка гама от органични материали (виж допълнение 4). Жизненият цикъл при E. albidus е къс, тъй като той достига до зрелост между 33 дни (при 18 °C) и 74 (при 12 °С). В изпитвания следва да се използват само култури, които са били държани безпроблемно в лаборатория в продължение на най-малко 5 седмици (едно поколение).
|
|
16.
|
Други видове от род Enchytraeus също са подходящи, напр. E. buchholzi Vejdovsky 1879 или E. crypticus Westheide & Graefe 1992 (вж. допълнение 5). Ако се използват други видове от род Enchytraeus, те следва да бъдат ясно определени и да се отчетат причините за избора им.
|
|
17.
|
При изпитванията се използват полово зрели червеи. Те следва да имат яйца (бели точки) в областта на клителума и да са с приблизително еднакъв размер (около 1 см в дължина). Синхронизиране при отглеждането им не е необходимо.
|
|
18.
|
Ако представителите на семейство Enchytraeidae не са отгледани в същия тип почва и при условията (включително хранене), използвани при крайното изпитване, те трябва да бъде аклиматизирани в продължение на най-малко 24 часа и най-много до три дни. Първоначално следва да бъде аклиматизиран по-голям брой полово зрели индивиди в сравнение с необходимите за извършване на изпитването, за да се остави възможност за отстраняване на увредени или други неподходящи екземпляри. В края на периода на аклиматизация единствено червеите, които са с яйца и не проявяват поведенчески отклонения (например, опити да избягат от почвата) се избират за изпитването. Червеите внимателно се отстраняват, като се използват мека златарска пинсета, куки или примки, и се поставят в блюдо на Петри, съдържащо малко количество прясна вода. Възстановената сладка вода, както е предложено в глава В.20 от настоящото приложение („тест за възпроизвеждане на гигантска водна бълха“) се предпочита за целта, тъй като дейонизираната, деминерализираната или чешмяната вода биха могли да навредят на червеите. Червеите се проверяват под стереомикроскоп и всички, които не съдържат яйца, се отстраняват. Вземат се мерки за отстраняване и изхвърляне на всички акари или колемболи, които може да са заразили културите. Здравите червеи, които не се използват за изпитването, се връщат в изходната култура.
|
Приготвяне на концентрации за изпитване
Разтворим във вода изпитван химикал
|
19.
|
Разтвор на изпитвания химикал се приготвя в дейонизирана вода в количество, достатъчно за всички повторения на една концентрация за изпитване. Препоръчително е да се използва подходящо количество вода до достигане на изискуемото съдържание на влага, т.е., 40—60 % от максималната СЗВ (вж. точка 13). Всеки разтвор на изпитвания химикал се смесва старателно с една партида от предварително навлажнена почва, преди да бъде внесен в съда за изпитване.
|
Неразтворим във вода изпитван химикал
|
20.
|
За химикалите, които са неразтворими във вода, но разтворими в органични разтворители, изпитваният химикал може да бъде разтворен във възможно най-малък обем подходящ носител (напр. ацетон). Следва да се използват само летливи разтворители. Носителят се разпръсква върху малко количество фин кварцов пясък, например 2,5 g, или се смесва с него., Носителят се отстранява чрез изпаряване в лабораторна камина в продължение най-малко на един час. Сместа от кварцов пясък и изпитван химикал се добавя в предварително навлажнената почва и старателно се смесва, след добавяне на подходящо количество дейонизирана вода, за да се получи необходимото съдържание на влага. Крайната смес се въвежда в съдовете за изпитване.
|
|
21.
|
За малко разтворимите във вода и в органични разтворители химикали, еквивалентът на 2,0—2,5 g фино стрит кварцов пясък на изпитвателен съд се смесва с количеството изпитван химикал, така че да се получи желаната концентрация за изпитването. Сместа от кварцов пясък и изпитван химикал се добавя в предварително навлажнената почва и старателно се смесва, след добавяне на подходящо количество дейонизирана вода, за да се получи необходимото съдържание на влага. Крайната смес се разпределя между съдовете за изпитване. Процедурата се повтаря за всяка концентрация за изпитване, като се приготвя и подходяща контролна проба.
|
|
22.
|
Химикали обикновено не следва да се изпитват в концентрации, по-високи от 1 000 mg/kg суха маса почва. Изпитването при по-високи концентрации обаче може да се изисква в съответствие с целите на определено изпитване.
|
ПРОВЕЖДАНЕ НА ИЗПИТВАНЕТО
Групи на изпитване и контроли
|
23.
|
За всяка концентрация за изпитване в съда за изпитване (вж. точки 19-21) се поставя количество почва за изпитване, съответстващо на 20 g сухо тегло. Приготвят се и контролите без изпитвания химикал. Към всеки съд се добавя храна в съответствие с процедурите, описани в точка 29. Десет червея се разпределят на случаен принцип във всеки съд за изпитване. Червеите внимателно се прехвърлят във всеки съд за изпитване и се поставят върху повърхността на почвата, например чрез използване на мека златарска пинсета, куки или примки. Броят на повторенията за концентрациите за изпитване и за контролите зависи от използвания план за изпитването (вж. точка 34). Съдовете за изпитване се поставят в инкубатор за изпитване на случаен принцип и тези позиции се разместват веднъж седмично, също на случаен принцип.
|
|
24.
|
Ако за прилагане на изпитвания химикал се използва носител, една поредица контроли, съдържащи кварцов пясък, напръскани или смесени с разтворител, следва да бъдат включени допълнително към изпитваните поредици. Концентрацията на разтворителя или на диспергиращото средство следва да е същата, като използваната в съдовете за изпитване, съдържащи изпитвания химикал. Една поредица контроли, съдържаща допълнително кварцов пясък (2,5 g за всеки съд) следва да бъде приготвена за химикали, които изискват прилагане в съответствие с процедурите, описани в точка 21.
|
Условия на изпитването
|
25.
|
Температурата на изпитването е 20 ± 2 °C. С цел да не се насърчава избягването на червеи от почвата, изпитването се провежда при контролирани цикли светлина-тъмнина (за предпочитане 16 часа светлина и 8 часа тъмнина) с осветление от 400 до 800 lux в зоната на съдовете за изпитване.
|
|
26.
|
С цел проверка на влажността на почвата, съдовете се претеглят в началото на изпитването и един път седмично след това. Загубата на тегло се запълва чрез добавяне на подходящо количество дейонизирана вода. Следва да се отбележи, че загубата на вода може да се намали чрез поддържане на висока влажност на въздуха в инкубатора за изпитване (> 80 %).
|
|
27.
|
Съдържанието на влага и стойността на pH трябва да се измерят в началото и в края както на изпитването за определяне на обхвата, така и на окончателното изпитване. Измерванията трябва да се извършват в контролните и третираните почвени проби (всички концентрации), подготвени и поддържани по същия начин като изпитваните култури, но несъдържащи червеи. Храна следва да се добавя само към тези почвени проби в началото на изпитването за улесняване на микробната активност. Количеството на храната следва да бъде същото като добавеното към изпитваните култури. Не е необходимо да се добавя допълнително храна към тези съдове по време на изпитването.
|
Хранене
|
28.
|
Може да се използва храна, която е в състояние да поддържа популацията от представители на сем. Enchytraeidae. Сплескани овесени ядки, за предпочитане обработени в автоклав преди употреба, за да се избегне микробно замърсяване (загряване също е целесъобразно), се считат за подходящ материал за храненето.
|
|
29.
|
Храната се предоставя най-напред чрез смесване на 50 mg смлени сплескани овесени ядки с почвата във всеки съд, преди въвеждането на червеите. След това храна се доставя седмично до ден 21. Хранене не се извършва в ден 28, тъй като на този етап полово зрелите индивиди се отстраняват, а ювенилните червеи се нуждаят от сравнително малко допълнителна храна след този ден. Храненето по време на изпитването се състои от 25 mg смлени сплескани овесени ядки на съд, поставени внимателно върху повърхността на почвата, така че да се избегне нараняването на червеите. С цел да се намали растежът на гъбички, овесените ядки трябва да се заровят в почвата, като се покриват с малки количества от почвата. Ако храната остава неизядена, дажбата трябва да бъде намалена.
|
План за изпитването за определяне на обхвата
|
30.
|
Когато е необходимо, се провежда изпитване за определяне на обхвата, например за пет концентрации на изпитвания химикал от 0,1, 1,0, 10, 100 и 1 000 mg/kg (сухо тегло на почвата). За всяка третирана и контролна проба е достатъчно едно повторение.
|
|
31.
|
Продължителността на изпитването за определяне на обхвата е две седмици. В края на изпитването се оценява смъртността на червеите. Червеят се отчита като мъртъв, когато не реагира на механичен стимул в предния край. Допълнителна информация за смъртността може също да бъде полезна при вземането на решение за диапазона на концентрациите, които да се използват в окончателното изпитване. Промени в поведението (напр. не е способен да копае в почвата; лежи неподвижно срещу стъклената стена на съда за изпитване) и морфологията (напр. наличие на открити рани) на полово зрелите индивиди също следва да бъдат записвани заедно с наличието на ювенилни екземпляри. Последното може да се определи с помощта на метода с оцветяване, описан в допълнение 6.
|
|
32.
|
Стойността на LC50 може да бъде приблизително определена чрез изчисляване на геометричната средна стойност от данните за смъртността. При определяне на диапазона на концентрациите за окончателното изпитване, въздействието върху размножаването се приемат с по-ниска стойност от стойността на LC50 с коефициент в размер до 10. Това обаче е емпирична зависимост и във всеки конкретен случай би могла да бъде различна. Допълнителните наблюдения при изпитването за определяне на обхвата, като срещането на ювенилни екземпляри, могат да допринесат за по-точно определяне на диапазона на концентрациите на изпитвания химикал, които да се използват за окончателното изпитване.
|
|
33.
|
С цел точно определяне на LC50 се препоръчва изпитване с използване най-малко на четири повторения за всяка от концентрациите на изпитвания химикал, и достатъчен брой концентрации за получаване на най-малко четири статистически значими различни средни отклика при тези концентрации. Когато се прилагат контроли, за тях се използва подобен брой концентрации и повторения.
|
План за окончателното изпитване за размножаване
|
34.
|
Въз основа на препоръките от кръгово изпитване се предлагат три вида планове (2)
|
—
|
За определяне на NOEC следва да се изпитат най-малко пет концентрации в геометрична прогресия. Препоръчват се четири повторения за всяка концентрация за изпитване, плюс осем контроли. Концентрациите трябва да бъдат разделени една от друга с кратност, която не превишава 1,8.
|
|
—
|
За определяне на ECx (напр. EC10, EC50) следва да се изпитат поне пет концентрации, като те трябва да обхващат ECx, за да се даде възможност за определяне на ECx чрез интерполация, а не чрез екстраполация. Препоръчват се най-малко по четири повторения за всяка изпитвана концентрация и четири контролни повторения. Кратността на разделянето може да варира, т.е., да е по-малка или равна на 1,8 в диапазона на очакваното въздействие и над 1,8 при по-високите и по-ниските концентрации.
|
|
—
|
Комбиниран подход дава възможност за едновременно определяне на NOEC и ЕСх. Следва да бъдат използвани осем концентрации на третиране в геометрична прогресия. Препоръчват се четири повторения за всяко третиране, плюс осем контроли. Концентрациите трябва да бъдат разделени една от друга с кратност, която не превишава 1,8.
|
|
|
35.
|
Трябва да бъдат използвани по десет полово зрели червея на съд за изпитване (вж. точка 23). Храната се добавя в стъклените съдове за изпитване в началото на теста, след това веднъж седмично (вж. точка 29) включително до ден 21. В ден 21 почвените проби се подлагат на внимателно ръчно претърсване и живите полово зрели червеи се наблюдават и отчитат и се записват промените в поведението (напр. неспособност да се копае в почвата; лежане неподвижно срещу стъклената стена на съда за изпитване) и морфологията (напр. наличие на открити рани). След това всички полово зрели червеи се отстраняват от съдовете за изпитване и от изпитваната почва. Използваната при изпитването почва и всички получени пашкулчета, съдържащи се в нея, се инкубират в продължение на три допълнителни седмици при същите условия на изпитване, с изключение на това, че храненето се извършва само в ден 35 (т.е. 25 mg смлени сплескани овесени ядки, за всеки съд).
|
|
36.
|
След шест седмици новоизлюпените червеи се преброяват. Методът, основан на оцветяване в бенгалско червено (вж. допълнение 6), се препоръчва, въпреки че други техники, като извличане с вода (но не с топлина) и флотация (вж. допълнение 6), също са се оказали подходящи (4) (10) (11) (20). Оцветяването в бенгалско червено се препоръчва, тъй като извличането с вода от почвата може да се възпрепятства от мътност, причинена от суспендирани частици глина.
|
Гранично изпитване
|
37.
|
Ако при изпитването за определяне на обхвата не се наблюдават въздействия при най-високата концентрация (т.е. 1 000 mg/kg), изпитването за размножаването може да бъде проведено като гранично изпитване, като се използва 1 000 mg/kg, за да се покаже, че NOEC за размножаването е по-висока от тази стойност.
|
Обобщение и график за провеждане на изпитването
|
38.
|
Етапите на изпитването могат да бъдат обобщени както следва:
|
Време
|
Изпитване за определяне на обхвата
|
Окончателно изпитване
|
|
Ден – 7 или по-рано
|
|
—
|
приготвяне на изкуствена почва (смесване на сухи съставки)
|
|
|
—
|
приготвяне на изкуствена почва (смесване на сухи съставки)
|
|
|
Ден – 5
|
|
—
|
проверява се pH на изкуствената почва
|
|
—
|
измерва се максималната СЗВ на почвата
|
|
|
—
|
проверява се pH на изкуствената почва
|
|
—
|
измерва се максималната СЗВ на почвата
|
|
|
Ден – 5 до – 3
|
|
—
|
сортиране на червеите с оглед на аклиматизацията
|
|
|
—
|
сортиране на червеите с оглед на аклиматизацията
|
|
|
Ден – 3 to 0
|
|
—
|
червеите се аклиматизират в продължение на поне 24 часа
|
|
|
—
|
червеите се аклиматизират в продължение на поне 24 часа
|
|
|
Ден – 1
|
|
—
|
предварително намокряне на изкуствената почва и разделяне на партиди
|
|
|
—
|
предварително намокряне на изкуствената почва и разделяне на партиди
|
|
|
Ден 0
|
|
—
|
приготвят се изходни разтвори
|
|
—
|
прилага се изпитваният химикал
|
|
—
|
претегляне на изпитвания субстрат в съдовете за изпитване
|
|
—
|
измерване на рН и съдържанието на влага на почвата
|
|
|
—
|
приготвят се изходни разтвори
|
|
—
|
прилага се изпитваният химикал
|
|
—
|
претегляне на изпитвания субстрат в съдовете за изпитване
|
|
—
|
измерване на рН и съдържанието на влага на почвата
|
|
|
Ден 7
|
|
—
|
проверка на съдържанието на влага на почвата
|
|
|
—
|
проверка на съдържанието на влага на почвата
|
|
|
Ден 14
|
|
—
|
определяне на смъртността при полово зрелите индивиди
|
|
—
|
оценка на броя ювенилни индивиди
|
|
—
|
измерване на рН и съдържанието на влага на почвата
|
|
|
—
|
проверка на съдържанието на влага на почвата
|
|
|
Ден 21
|
|
|
—
|
наблюдение на поведението на полово зрелите индивиди
|
|
—
|
отстраняване на полово зрелите индивиди
|
|
—
|
определяне на смъртността при полово зрелите индивиди
|
|
—
|
проверка на съдържанието на влага на почвата
|
|
|
Ден 28
|
|
|
—
|
проверка на съдържанието на влага на почвата
|
|
|
Ден 35
|
|
|
—
|
проверка на съдържанието на влага на почвата
|
|
|
Ден 42
|
|
|
—
|
преброяване на ювенилните червеи
|
|
—
|
измерване на рН и съдържанието на влага на почвата
|
|
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
39.
|
Въпреки че в допълнение 7 е направен общ преглед, в настоящия метод за изпитване не се дават окончателни насоки за статистически анализ на резултатите от изпитването.
|
|
40.
|
В изпитването за определяне на обхвата основната крайна точка е смъртността. Промени в поведението (напр. неспособност за копаене в почвата; лежане неподвижно срещу стъклената стена на съда за изпитване) и морфологията (напр. открити рани) на полово зрелите индивиди следва обаче също да бъдат записвани, заедно с наличието на ювенилни екземпляри. Обичайно за определяне на LC50 следва да се прилагат пробит-анализ (21) или логистична регресия. Независимо от това в случаите, когато този метод за анализ е неподходящ (например, ако на разположение са по-малко от три концентрации с частично проявена смъртност), могат да се използват алтернативни методи. Тези методи могат да включват хлъзгащи средни (22), метод на Спирмън-Карбър с изключване на данни (23) или обикновена интерполация (напр. геометрична средна стойност на LC0 и LC100, изчислена чрез корен квадратен на LC0, умножена по LC100).
|
|
41.
|
При окончателното изпитване крайна точка на изпитване е плодовитостта (т.е. брой на получените ювенилни индивиди). Независимо от това, също както и при изпитването за определяне на обхвата, всички други признаци за неблагоприятно въздействие трябва да бъдат записани в окончателния протокол. За изчисляване на размножаването статистическият анализ изисква средноаритметичната стойност и стандартното отклонение за всяко отделно третиране и за контролата.
|
|
42.
|
Ако е направен дисперсионен анализ, стандартното отклонение s и степените на свобода df могат да бъдат заменени съответно с обединената оценка на дисперсията, получена от ANOVA, и от нейните степени на свобода, при условие че дисперсията не зависи от концентрацията. В такъв случай се използват единичните дисперсии на контролната и на третираните проби. Тези стойности обикновено се изчисляват с търговски статистически софтуер, с използване на резултатите по съдове като повторения. Ако обединяването на данни за негативните контроли и контролите на разтворител изглежда по-разумно, отколкото изпитването само на една от тях, те трябва да бъдат тествани дали не са значимо различни (за подходящи тестове вж. точка 45 и допълнение 7).
|
|
43.
|
Допълнителното статистическо тестване и статистическите изводи и заключения зависят от това дали стойностите на повторенията са нормално разпределени и са с хомогенна дисперсия.
|
Оценка на NOEC
|
44.
|
Следва да се предпочита прилагането на мощни тестове. За това дали данните са приблизително нормално разпределени следва да се използва информация, например от предходен опит с кръгови изпитвания или от други данни за предходни периоди. Хомогенността на дисперсията (хомоскедастичността) е по-важна. Опитът показва, че дисперсията често се увеличава с увеличаването на средната стойност. В тези случаи преобразуване на данните би могло да доведе до хомоскедастичност. Такава трансформация обаче следва да се основава на опита, натрупан с данните за предходни периоди, вместо с данните, които са предмет на проучването. При хомогенни данни следва да се използват множествени t-тестове като тестът на Уйлямс (α = 0,05, едностранен) (24) (25) или, в някои случаи, тестът на Дънет (26) (27). Следва да се отбележи, че в случай на неравни повторения табличните t-стойности трябва да се коригират, както се предлага от Дънет и Уйлямс. В някои случаи, поради наличието на големи колебания, отклиците не се увеличават/намаляват регулярно. В този случай на голямо отклонение от монотонността тестът на Дънет е по-подходящ. Ако са налице отклонения от хомоскедастичността, може да е уместно да се проучат по-подробно възможните въздействия върху дисперсията, за да се вземе решение дали могат да бъдат прилагани t-тестове без да се губи много мощност (28). Множествен U-тест като например U-тестът на Бонферони по Holm (29) или — когато тези данни показват хетероскедастичност, но иначе са съобразени с базисната монотонна зависимост доза-отклик — друг непараметричен тест [напр. на Йонкхере-Терпстра (30) (31) или на Шърли (32) (33)] могат да бъдат прилагани като алтернатива и като цяло се предпочитат пред t-тестовете при неравна дисперсия. (виж също и схемата в допълнение 7).
|
|
45.
|
Ако e извършено гранично изпитване и критериите за използване на параметрични тестови процедури (нормалност, хомогенност) са изпълнени, може да се използва на t-тестът на Стюдънт за сравнения по двойки, или в противен случай — процедурата на U-теста на Ман-Уитни (29).
|
Оценка на ECx
|
46.
|
За да се изчисли стойността на ECx средните стойности от всяко третиране се използват за извършване на регресионен анализ (линеен или нелинеен), след като е получена подходяща функция доза-отклик. За растежа на червеите като непрекъснат отклик стойностите на ECx могат да се оценят с използване на подходящ регресионен анализ (35). Сред подходящите функции за двоични данни (смъртност/преживяване и брой получени новородени индивиди) са нормалната сигмоидна, логистичната функция или функцията на Вейбул, съдържащи от два до четири параметъра, като някои от тях могат също така да моделират хорметични отклици. Ако функция доза-отклик е била изгладена с линеен регресионен анализ, при този анализ трябва да е получен значим r2 (коефициент на детерминация) и/или наклон преди изчисляване на ЕСх чрез добавяне на стойност, съответстваща на х % от средната стойност на контролна проба, в полученото чрез регресионен анализ уравнение. 95 %-ните доверителни граници се изчисляват по Fieller (цитиран във Finney (21)) или с други подходящи съвременни методи.
|
|
47.
|
Като алтернативна възможност откликът се моделира като процент или пропорция от параметър на модел, който се тълкува като средна стойност на отклика на контролната проба. В тези случаи нормалната (логистична, на Вейбул) сигмоидна крива може често да бъде лесно изгладена по отношение на резултатите, като се използва пробит-регресия (21). В тези случаи функцията на претеглянето трябва да бъде коригирана за метрични отклици, както е по Christensen (36). Въпреки това, ако е наблюдаван хормезис, пробит-анализът следва да бъде заменен с логистична функция с четири параметъра, или функция на Вейбул, изгладена чрез нелинейна регресия (36). Ако подходяща функция доза-отклик функция не може да се съгласува с данните, може да се използват алтернативни методи за оценяване на ECx и нейните доверителни граници, като хлъзгащи средни по Томпсън (22) и метод на Спирмън-Карбър с изключване на данни (23).
|
ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
|
48.
|
Протоколът от изпитването трябва да съдържа следната информация:
|
|
Изпитван химикал:
|
—
|
физична природа и, където е уместно, съответните физични и химични свойства (например водоразтворимост, парно налягане);
|
|
—
|
химична идентификация на изпитвания химикал според номенклатурата на IUPAC, номер по CAS, партида, пратка, структурна формула и чистота;
|
|
—
|
дата на валидност на пробата:
|
|
|
|
Изпитван вид:
|
—
|
използвани в изпитването животни: вид, научно наименование, източник на организмите и условия на отглеждане;
|
|
|
|
Условия на изпитване:
|
—
|
съставки и приготвяне на изкуствената почва;
|
|
—
|
метод за прилагане на изпитвания химикал:
|
|
—
|
описание на условията на изпитване, включително температура, съдържание на влага, pH и др.;
|
|
—
|
пълно описание на плана на проучването и на процедурите.
|
|
|
|
Резултати от изпитването:
|
—
|
смъртност при полово зрели червеи след две седмици и брой на ювенилните екземпляри в края на изпитването за определяне на обхвата;
|
|
—
|
смъртност при полово зрели червеи след експозиция от три седмици и пълно описание на ювенилните екземпляри в края на окончателното изпитване;
|
|
—
|
всички наблюдавани физиологични или патологични симптоми и промени в поведението на изпитваните организми;
|
|
—
|
стойностите на LC50, NOEC и/или ECx (напр. EC50, EC10) за размножаването, ако някои от тях са приложими с доверителни интервали, и графика на изгладения модел, използвана за изчисляването им, цялата информация и полезни наблюдения за тълкуване на резултатите;
|
|
Отклонения от процедурите, описани в настоящия метод за изпитване, и всички необичайни обстоятелства по време на изпитването.
|
ЛИТЕРАТУРА
|
(1)
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen — Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke, J. and Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 pp.
|
|
(3)
|
Westheide, W. and Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, In: Modern Ecology: Basic and Applied Aspects. Ed. by Esser, G. and Overdieck, D. pp 497-508. Elsevier, Amsterdam,
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(5)
|
Глава В.8 от настоящото приложение „Токсичност за земни червеи“
|
|
(6)
|
ISO (International Organization for Standardization) (1993). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using Artificial Soil substrate, No. 11268-1. ISO, Geneve.
|
|
(7)
|
ISO (International Organization for Standardization) (1996). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(8)
|
Rundgren, S. and A.K. Augustsson (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). In: Løkke, H. and C.A.M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73-94.
|
|
(9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217-232.
|
|
(10)
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF — Z. Umweltchem. Ökotox. 7, 246-249.
|
|
(11)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
(12)
|
Didden, W.A.M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2-29.
|
|
(13)
|
Becker, H. (1991). Bodenorganismen — Prüfungskategorien der Forschung. UWSF — Z. Umweltchem. Ökotox. 3, 19-24.
|
|
(14)
|
Römbke, J. and Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79-96.
|
|
(15)
|
Römbke, J., Riepert, F. & Achazi R. (2000): Enchytraeen als Testorganismen. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(16)
|
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
|
(17)
|
Bell, A.W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1-13.
|
|
(18)
|
Nielsen, C.O. and Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1-160.
|
|
(19)
|
Bouguenec, V. and Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9-22.
|
|
(20)
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(21)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(22)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. — Charles Griffin & Company Ltd, London.
|
|
(23)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(24)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(25)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(26)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(27)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(28)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(29)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(30)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(31)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(32)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(33)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(34)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(35)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(36)
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Допълнение 1
Определения
За целите на настоящия метод за изпитване са използвани следните определения:
|
|
Химикал означава вещество или смес.
|
|
|
ЕСх (ефективна концентрация, при която се наблюдава х % от въздействието) е концентрацията, която причинява х % от дадено въздействие на изпитвани организми в рамките на даден период на експозиция, при сравнение с контрола. В настоящото изпитване ефективните концентрации се изразяват като масата на изпитвания химикал към сухата маса на почвата за изпитване.
|
|
|
LC0
(нелетална концентрация) е концентрацията на изпитвания химикал, която не води до летален изход при никой от експонираните изпитвани организми в рамките на даден период от време. В настоящото изпитване LC0 се изразява като масата на изпитвания химикал към сухата маса на почвата за изпитване.
|
|
|
LC50
(медианна летална концентрация) е концентрацията на изпитвания химикал, която води до летален изход при 50 % от експонираните изпитвани организми в рамките на даден период от време. В настоящото изпитване LC50 се изразява като масата на изпитвания химикал към сухата маса на почвата за изпитване.
|
|
|
LC100
(напълно летална концентрация) е концентрацията на изпитвания химикал, която води до летален изход при 100 % от експонираните изпитвани организми в рамките на даден период от време. В настоящото изпитване LC100 се изразява като масата на изпитвания химикал към сухата маса на почвата за изпитване.
|
|
|
LOEC (най-ниската концентрация, при която се наблюдава ефект) е най-ниската концентрация на изпитвания химикал, при която е наблюдавано статистически значимо въздействие (р < 0,05). В настоящото изпитване LOEC се изразява като масата на изпитвания химикал към сухата маса на почвата за изпитване. Всички концентрации на изпитване, по-големи от LOEC, следва по принцип да показват въздействие, което в статистическо отношение е различно от това на контролата. Всички отклонения от посоченото по-горе по отношение на идентифицирането на LOEC трябва да бъдат обосновани в протокола от изпитването.
|
|
|
NOEC (концентрация без наблюдавано въздействие) е най-високата концентрация на изпитвания химикал непосредствено под LOEC, при която не се наблюдава въздействие. В настоящото изпитване концентрацията, съответстваща на NOEC, няма статистически значимо (р < 0,05) въздействие в рамките на даден период на експозиция, при сравнение с контролата.
|
|
|
Скорост на размножаването е средният брой ювенилни червеи, получени от определен брой полово зрели индивиди за времето на изпитването.
|
|
|
Изпитван химикал е всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
|
Допълнение 2
Определяне на максималната способност за задържане на вода
Определяне на способността за задържане на вода на изкуствената почва
Описаният по-долу метод се счита за подходящ. Той е описан в приложение С към стандарта ISO DIS 11268-2.
Взема се определено количество (например 5 g) изпитвана почва субстрат с помощта на подходящо устройство (шнекова сонда и т.н.). Дъното на сондата се покрива с парче филтърна хартия и след напълване с вода сондата се поставя на стойка на водна баня. Сондата следва постепенно да се потапя във водата, докато водното ниво стане над повърхността на почвата. След това тя се оставя във водата за около три часа. Тъй като не цялото количество вода, абсорбирано от почвените капиляри, може да бъде задържано, почвената проба следва да се остави да се отцеди в продължение на два часа чрез поставяне на сондата върху легло от много влажен фино смлян кварцов пясък, намиращо се в затворен съд (за да се предотврати изсушаването). След това тази проба трябва да бъде претеглена и изсушена до постоянна маса при 105 °C. Способността за задържане на вода (СЗВ) може да се изчисли, както следва:

където:
|
S
|
=
|
водонаситен субстрат + маса на сондата + маса на филтърната хартия
|
|
T
|
=
|
тара (маса на сондата + маса на филтърната хартия)
|
|
D
|
=
|
сухата маса на субстрата
|
ПОЗОВАВАНИЯ:
ISO (International Organization for Standardization) (1996). Soil Quality -Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
Допълнение 3
Определяне на стойността на рН на почвата
Следният метод за определяне на pH на почвени проби се основава на описанието в ISO 10390 (Качество на почви. Определяне на pH).
Определено количество почва се изсушава при стайна температура в продължение на най-малко 12 часа. След това се приготвя суспензия от почвата, (съдържаща най-малко 5 грама почва) в нейния петкратен обем или в 1 M разтвор на калиев хлорид (KCl) с квалификация „чист“, или в 0,01 M разтвор на калциев хлорид (CaCl2) с квалификация „чист“. След това суспензията се разклаща добре в продължение на пет минути. След разклащането суспензията се оставя да се утаи в продължение на най-малко 2 часа, но не повече от 24 часа. След това се измерва стойността на pH на течната фаза с помощта на рН-метър, който е бил калибриран преди всяко измерване чрез подходящ набор от буферни разтвори (напр. pH 4,0 и 7,0).
ПОЗОВАВАНИЯ:
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
Допълнение 4
Условия за отглеждане на Enchytraeus sp.
Представителите на вида Enchytraeus albidus от семейство Enchytraeidae (както и други видове от род Enchytraeus) могат да бъдат отглеждани в големи пластмасови кутии (напр. 30 × 60 × 10 cm), запълнени със смес от изкуствена почва и естествена, незамърсена градинска почва, в съотношение 1:1. Употребата на компост следва да се избягва, тъй като той може да съдържа токсични химикали, като тежки метали. Преди употреба фауната следва да бъде отстранена от почвата (например чрез дълбоко замразяване). Може също да се използва субстрат, състоящ се само от изкуствена почва, но скоростта на размножаване може да е по-ниска от скоростта, получена при смесен почвен субстрат. Използваният за отглеждането субстрат трябва да има рН от 6,0 ± 0,5.
Отглеждането става на тъмно при температура от 15 до 20 °C ± 2 °C. Температура, по-висока от 23 °C, трябва да се избягва. Почвата трябва да се съхранява влажна, но не мокра. Точното съдържание на влага в почвата се определя по появата на малки капки вода между пръстите при леко стискане на почвата. Създаването на безкислородни условия трябва да се избягва, като се гарантира, че капаците на съдовете за отглеждане позволяват достатъчен газообмен с атмосферата. Почвата трябва да бъде внимателно разрохквана всяка седмица, за да се улесни аерирането.
Червеите могат да се захранват със сплескани овесени ядки. Овесените ядки трябва да се съхраняват в херметично затворени съдове, да се автоклавират или нагреят преди употреба с цел да се избегнат инфекции с брашнени акари (напр. Glyzyphagus sp., Astigmata, Acarina) или хищни акари [напр. Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina]. След термична обработка храната се смила така, че да може да бъде лесно разпръсната по повърхността на почвата. От време на време сплесканите овесени ядки могат да бъдат допълвани с добавяне на витамини, мляко и масло от черен дроб на риба треска. Друг подходящ източник на храна са мая за хляб и храна за риби „Tetramin“.
Храненето се извършва приблизително два пъти седмично. Подходящо количество сплескани овесени ядки се разпръсва по повърхността на почвата или внимателно се смесва в субстрата при разрохкването на почвата за улесняване на аерирането. Абсолютното количество въведена храна зависи от броя на червеите, присъстващи в субстрата. Като насока, количеството храна трябва да бъде увеличено, ако цялото въведено количество бъде консумирано в рамките на един ден от момента на въвеждането. Обратно, ако все още има останала храна на повърхността по време на второто хранене (една седмица по-късно), това количество следва да бъде намалено. Храната, заразена с гъбички, следва да бъде отстранена и заменена. След три месеца червеите следва да бъдат прехвърлени в прясно приготвен субстрат.
Условията за отглеждане се считат за задоволителни, ако червеите: а) не се опитват да напуснат субстрата, б) се движат бързо в почвата, в) имат лъскава външна повърхност без частици почва, прилепнали към нея, г) имат повече или по-малко изявен белезникав цвят, д) показват различия в наблюдаваните възрасти, е) се размножават непрекъснато.
Допълнение 5
Резултати от изпитванията с други видове от род Enchytraeus
Избор на видове
Могат да се използват видове, различни от E. albidus, но процедурата за изпитване и критериите за валидност следва да бъдат съответно адаптирани. Тъй като много видове от род Enchytraeus са лесно достъпни и да могат по задоволителен начин да се отглеждат в лабораторни условия, най-важният критерий за избора на видове, различни от E. albidus, е екологичната значимост и, в допълнение, сравнимата чувствителност. Също така може да има формални причини за промяна на вида. Например, в държави, където E. albidus не се среща и не може да бъде внасян (напр. поради карантинни ограничения), ще бъде необходимо да се използва друг вид от род Enchytraeus.
Примери за подходящи алтернативни видове
|
—
|
Enchytraeus crypticus (Westheide & Graefe 1992): През последните години този вид често е бил използван в изследванията за екотоксичност поради това, че лесно се поддава на отглеждане и изпитване. Независимо от това, видът е дребен и това прави боравенето с него по-сложно, отколкото с E. albidus (особено на етапите преди използване на метод за оцветяване). Съществуването на E. crypticus в природата не е установено със сигурност, видът е бил описан само в култури на червеи. Поради това изискванията му по отношение на околната среда не са известни.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky 1879): Това название може би обхваща група от тясно свързани видове, които са трудно различими в морфологично отношение. Използването му за изпитване не се препоръчва докато индивидите, използвани при изпитване, не бъдат идентифицирани като видове. Enchytraeus buchholzi се намира обикновено в ливади и нарушени терени, като крайпътни пространства.
|
|
—
|
Enchytraeus luxuriosus: Този вид е бил първоначално познат като E.„minutus“, но неотдавна беше описан (1). Първоначално е установен от U. Graefe (Хамбург) в ливада близост до St. Peter-Ording (Шлезвиг-Холщайн, Германия). E. luxuriosus е с размер приблизително половината от този на E. albidus, но е по-голям от другите видове, обсъдени тук; това би могло да го направи добра алтернатива на E. albidus.
|
|
—
|
Enchytraeus bulbosus (Nielsen & Christensen 1963): Този вид до момента се съобщава в минерални почви от Германия и Испания, където срещането му е обичайно, но обикновено не е много разпространен. В сравнение с други малки видове от този род, той е относително лесен за разпознаване. Нищо не е известно за поведението му при лабораторни изпитвания, нито за чувствителността му към химикали. Установено е обаче, че е лесен за отглеждане (E. Belotti, лично съобщение).
|
Условия на отглеждане
Всички упоменати по-горе видове от род Enchytraeus могат да бъдат отглеждани в същите субстрати, които се използват за E. albidus. По-малкият им размер означава, че съдовете за отглеждане могат да са по-малки и че въпреки възможността да се използва същата храна, размерът на дажбата трябва да се коригира. Жизненият цикъл на тези видове е по-кратък от този на E. albidus и храненето следва да се провежда по-често.
Условия на изпитването
Условията на изпитването като цяло са същите като онези, които се прилагат за E. albidus, с изключение на това, че:
|
—
|
размерът на съда за изпитването може (но не е задължително) да е по-малък;
|
|
—
|
продължителността на изпитването за размножаване може (но не е задължително) да е по-малка, т.е., четири вместо шест седмици; независимо от това, продължителността на изпитването за определяне на обхвата не следва да се променя;
|
|
—
|
с оглед на малкия размер на ювенилните червеи използването на метода на оцветяването за отчитането настоятелно се препоръчва;
|
|
—
|
критерият за валидност по отношение на „брой ювенилни индивиди за един съд за изпитване в контролата“ следва да се промени на „50“.
|
ПОЗОВАВАНИЯ
|
(1)
|
Schmelz, R.M. and Collado, R. (1999). Enchytraeus luxuriosus sp.nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93-100.
|
Допълнение 6
Подробно описание на техниките за извличане
Оцветяване с бенгалско червено
Този метод първоначално е разработен в областта на екологията на езерата и течащите води (1) и за първи път е предложен за преброяване на ювенилните представители на семейство Enchytraeidae, в изпитвания за размножаването на представители на това семейство, от W. de Coen (Университет на Гент, Белгия). По независим път от RIVM Bilthoven е разработен модифициран вариант (бенгалско червено, смесено с формалдехид вместо етанол) (2)(3).
В края на окончателното изпитване (т.е., след шест седмици) почвата в съдовете за изпитване се прехвърля в плитък съд. Полезни за тази цел са съд Bellaplast или фотографска вана с оребрено дъно, тъй като „ребрата“ ограничават движението на червеите в рамките на полето на наблюдение. Ювенилните екземпляри се фиксират с етанол (приблизително 5 ml на повторение). След това съдовете се запълват с вода до слой от 1 до 2 cm. Добавят се няколко капки (200 до 300 μl) бенгалско червено (1 % разтвор в етанол) (0,5 % еозин като алтернатива) и двете съставки се размесват внимателно. След 12 часа червеите следва да бъдат оцветени в червеникав цвят преброяването им следва да е лесно, тъй като те ще лежат върху повърхността на субстрата. Като алтернатива, преди преброяването на червеите сместа субстрат/алкохол може да се промие през сито (размер на отвора: 0,250 mm). При използването на тази процедура каолинитът, торфът и част от пясъка ще се отмият и забелязването и преброяването на оцветените в червеникав цвят червеи ще бъде по-лесно. Използването на осветени увеличителни лупи (размер на лупата най-малко 100 × 75 mm с увеличение 2× до 3×) също улеснява броенето.
Техниката с оцветяване намалява времето за преброяване до няколко минути за съд и, като насочваща информация, следва да бъде възможно едно лице да оцени всички съдове от дадено изпитване най-много за два дни.
Извличане с вода
Извличането с вода следва да започне незабавно след приключване на изпитването. Почвата от всеки съд за изпитване се поставя в пластмасови сита с размер на отвора около 1 mm. След това ситата се окачват в пластмасови купи без да се допират до дъното. Купите се напълват внимателно с вода дотогава, докато пробите в ситата са напълно под повърхността на водата. За да се осигури аналитичен добив в размер на повече от 90 % от червеите следва да се приложи извличане с продължителност от 3 дни при температура 20 ± 2 °С. В края на периода на извличането ситата се отстраняват и водата (с изключение на малко количество) бавно се декантира, като се внимава да не се засяга утайката на дъното на купите. След това пластмасовите купи леко се разклащат за суспендиране на утайката в надутаечната вода. Водата се прехвърля в стъкло на Петри и след утаяването на почвените частици представителите на семейство Enchytraeidae могат да бъдат идентифицирани, отстранени и преброени, като се използват стереомикроскоп и меки стоманени пинсети.
Флотация
Метод, основан на флотация, е описан в бележка от R. Kuperman (4). След фиксирането на съдържанието на съда за изпитване с етанол, почвата се напоява с Ludox (AM-30 колоиден силициев диоксид, 30 тегл. % суспензия във вода) до 10—15 mm над повърхността на почвата. След като почвата бъде добре размесена с флотационното средство в продължение на 2-3 минути, ювенилните червеи, плаващи на повърхността, могат лесно да се преброят.
ПОЗОВАВАНИЯ
|
(1)
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R.P.M. and Dirven-Van Breemen, E.M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108-121.
|
|
(4)
|
Phillips, C.T., Checkai, R.T. and Kuperman, R.G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, USA. Abstract Book No. PMP069, p. 157.
|
Допълнение 7
Преглед на статистическата оценка на данните (определяне на NOEC)
В.33. ИЗПИТВАНЕ ЗА РАЗМНОЖАВАНЕ НА ЗЕМНИ ЧЕРВЕИ (EISENIA FETIDA/ EISENIA ANDREI)
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 222 (2004). Той е предназначен да бъде използван за оценка на въздействието на химикали в почвата върху репродуктивната способност (и други сублетални крайни точки) на земни червеи от видове Eisenia fetida (Savigny 1826) или Eisenia andrei (Andre 1963) (1)(2). Методът е бил обект на кръгово изпитване (3). Съществува метод за изпитване на остра токсичност при земни червеи (4). Публикувани са редица други международни и национални насоки за изпитване на остра и хронична токсичност при земни червеи (5) (6) (7) (8).
|
|
2.
|
Eisenia fetida/Eisenia andrei се смятат за представители на почвената фауна и в частност на земните червеи. На разположение е обща информация за екологията на земните червеи и за използването им в екотоксикологични изпитвания (7) (9) (10) (11) (12).
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
3.
|
Полово зрели червеи се експонират на диапазон от концентрации на изпитвания химикал или смесен в почвата, или — в случай на пестициди — прилаган във или върху почвата, при използване на процедури в съответствие с начина на употреба на химикала. Методът на прилагане е специфичен за целите на изпитването. Диапазонът от изпитвани концентрации се избира така, че да обхване концентрациите, за които е вероятно да причинят както сублетални, така и летални последици в рамките на период от осем седмици. Въздействията върху смъртността и растежа на полово зрелите червеи се определят след 4 седмици на експозиция. След това полово зрелите индивиди се отстраняват от почвата и въздействието върху размножаването се оценява след още 4 седмици, чрез преброяване на новоизлюпените индивиди, налични в почвата. Репродуктивната способност на червеите, експонирани на изпитвания химикал, се сравнява с тази на контролата(ите), за да се определи (i) концентрацията без наблюдавано въздействие (NOEC) и/или (ii) ECx (напр. EC10, EC50), като се използва регресионен модел, за да се оцени концентрацията, която би причинила х % намаляване в репродуктивната способност. Изпитваните концентрации трябва да обхващат ECx (напр. EC10, EC50), така че ЕСх впоследствие да се получи след интерполация, вместо след екстраполация (вж. допълнение 1 за определения).
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНИЯ ХИМИКАЛ
|
4.
|
Следната информация, свързана с изпитвания химикал, следва да бъде на разположение, за да се подпомогне разработването на подходящи процедури за изпитване:
|
—
|
и информация за съдбата и поведението в околната среда, когато е възможно (напр. скорости на фотолиза и хидролиза, когато е приложимо към начините за прилагане).
|
|
|
5.
|
Настоящият метод за изпитване е приложим за всички химикали, независимо от тяхната разтворимост във вода. Методът за изпитване е неприложим за летливи химикали, определени тук като химикали, за които константата на Хенри или коефициентът на разпределение въздух-вода е по-голям от единица, или за химикали, при които парното налягане превишава 0,0133 Pa при 25 °С.
|
|
6.
|
При този метод за изпитване не се взема под внимание възможно разграждане на изпитвания химикал през периода на изпитването. Следователно не може да се допуска, че началните стойности на концентрациите на експозиция ще бъдат поддържани през цялото време на изпитването. В този случай се препоръчва химичен анализ на изпитвания химикал в началото и в края на изпитването.
|
РЕФЕРЕНТЕН ХИМИКАЛ
|
7.
|
NOEC и/или ECx на референтния химикал трябва да бъдат определени, за да се гарантира, че условията на лабораторното изпитване са адекватни, и да се провери дали откликът на изпитваните организми не се променя в статистическо отношение с течение на времето. Желателно е референтният химикал да се изпитва най-малко веднъж годишно или, когато изпитването се извършва по-рядко, да се извършва едновременно с определянето на токсичността на изпитвания химикал. Подходящи референтни химикали са карбендазим или беномил, за коиото е било доказано, че оказват въздействие върху размножаването (3). Значими въздействия следва да се наблюдават между а) 1 и 5 mg активни съставки (a.i.)/kg суха маса или б) 250-500 g/ha или 25-50 mg/m2. Ако в поредицата изпитвания е включена положителна стандартна проба за токсичност, използва се една концентрация, като броят на отделните повторения следва да е същият като този при контролите.
|
ВАЛИДНОСТ НА ИЗПИТВАНЕТО
|
8.
|
Следните критерии трябва да бъдат изпълнени при контролите, за да се счита за валиден даден резултат от изпитването:
|
—
|
към края на изпитването от всяко повторение (съдържащо 10 полово зрели индивиди) да са получени ≥ 30 ювенилни индивиди;
|
|
—
|
коефициентът на вариация на размножаването да бъде ≤ 30 %;
|
|
—
|
смъртността при полово зрелите индивиди през първите 4 седмици от изпитването да бъде ≤ 10 %.
|
Когато дадено изпитване не отговаря на посочените по-горе критерии, то следва да бъде прекратено, освен ако не може да бъде предоставена обосновка за продължаването му. Обосновката следва да се включи в протокола.
|
ОПИСАНИЕ НА ИЗПИТВАНЕТО
Оборудване
|
9.
|
Следва да се използват съдове за изпитване, изработени от стъкло или друг химически инертен материал, с обем от около един до два литра. Контейнерите трябва да са с площ на напречното сечение от около 200 cm2, така че дълбочина на влажен субстрат от около 5-6 cm да се постига при добавяне на 500 до 600 g суха маса на субстрата. Видът на капака на съда трябва да позволява газообмен между субстрата и атмосферата, и достъп до светлина (напр. при използване на перфориран прозрачен капак), като в същото време предотвратява избягването на червеи. Ако количеството на използвания изпитван субстрат е значително повече от 500 до 600 g за съд за изпитване, броят на червеите следва да бъде увеличен пропорционално.
|
|
10.
|
Необходимо е обикновено лабораторно оборудване, по-специално следното:
|
—
|
подходящо оборудване за контрол на температурата;
|
|
—
|
подходящо оборудване за контрол на влажността (не е от съществено значение, ако съдовете за експозицията са снабдени с капаци);
|
|
—
|
инкубатор или малко помещение с климатик;
|
|
—
|
пинсети, куки или примки;
|
|
Приготвяне на изкуствената почва
|
11.
|
В това изпитване се използва изкуствена почва (5)(7) със следния състав (на базата на сухо тегло след изсушаване до постоянно тегло при температура от 105 °C):
|
—
|
10 процента торфен мъх (с рН възможно най-близо до 5,5-6,0, без видими остатъци от растения, фино смлян, изсушен до измереното съдържание на влага);
|
|
—
|
20 процента каолин (за предпочитане съдържанието на каолинит да е над 30 процента);
|
|
—
|
от 0,3 до 1,0 % калциев карбонат (CaCO3 на прах, с квалификация „чист“) за получаване на първоначална стойност на pH, равна на 6,0 ± 0,5;
|
|
—
|
70 % кварцов пясък, изсушен на въздух (в зависимост от количеството на необходимия CaCO3), предимно фин пясък с над 50 % от частиците между 50 и 200 микрона.
|
Забележка 1: Изискваното количество CaCO3 ще зависи от съставките на почвения субстрат, включително храна, и следва да бъде определено чрез измерване на почвени подпроби непосредствено преди изпитването. Стойността на рН се измерва в смес от почва и разтвор на 1 М калиев хлорид (KCl) или 0,01 M калциев хлорид (CaCl2) (13).
Забележка 2: Възможно е също съдържанието на органичен въглерод на изкуствената почва да бъде намалено, напр. чрез понижаване на съдържанието на торф до 4—5 %, и съответно чрез повишаване на съдържанието на пясък. С подобно намаляване на съдържанието на органичен въглерод може да се намали и способността за адсорбция на изпитвания химикал в почвата (органичен въглерод) и да се увеличи наличният изпитван химикал за червеите. Беше показано, че Eisenia fetida може да изпълни критериите за валидност по отношение на размножаването, когато се изпитва в естествени почви с по-ниско съдържание на органичен въглерод, напр. 2,7 % (14), като беше експериментално установено, че това може да се постигне и в изкуствена почва със съдържание на торф 5 %. Поради това не е необходимо преди използването на такава почва в окончателно изпитване да се доказва, че изкуствената почва дава възможност за съответствие на изпитването с критериите за валидност, освен ако съдържанието на торф не е намалено повече от посоченото по-горе.
Забележка 3: Когато се използва естествена почва в допълнително изпитване (напр. изпитване на по-високо стъпало), следва също да бъдат доказани пригодността на почвата и постигането на критериите за валидност на изпитването.
|
|
12.
|
Сухите съставки на почвата се смесват старателно (напр. в голямо лабораторно устройство за смесване) на добре проветрено място. Преди началото на изпитването сухата изкуствена почва се навлажнява чрез добавяне на дейонизирана вода до получаване на приблизително половината от крайното съдържание на вода, което представлява 40 % до 60 % от максималната способност за задържане на вода (съответстващо на суха маса с 50 ± 10 % влажност). В резултат от това ще бъде получен субстрат, който при стискане в ръка не съдържа стояща вода или вода в свободно състояние. Максималната способност за задържане на вода (СЗВ) на изкуствената почва се определя в съответствие с процедурите, описани в допълнение 2, ISO 11274 (15) или еквивалентен стандарт на ЕС.
|
|
13.
|
Ако изпитваният химикал се прилага върху повърхността на почвата или се смесва с почвата без вода, окончателното количество вода може да се смеси с изкуствената почва по време на приготвянето на почвата. Ако изпитваният химикал се смесва с почвата заедно с малко вода, допълнителното количество вода може да бъде добавено заедно с изпитвания химикал (вж. точка 19).
|
|
14.
|
Съдържание на влага в почвата се определя в началото и в края на изпитването в съответствие с ISO 11465 (16) или еквивалентен стандарт на ЕС, рН на почвата — в съответствие с допълнение 3 или ISO 10390 (13), или еквивалентен стандарт на ЕС. Тези определяния следва да се извършват в почвена проба от контрола и в проба от почва с всяка от изпитваните концентрации. Когато се изпитват химикали с кисела или основна реакция, стойността на pH на почвата не трябва да се коригира. Съдържанието на влага трябва да се следи по време на изпитването посредством периодично претегляне на съдовете (вж. точки 26 и 30).
|
Избор и подготвяне на изпитваните животински видове
|
15.
|
Видовете, използвани в изпитването, са Eisenia fetida или Eisenia andrei (1)(2). За започване на изпитването са необходими притежаващи клителум полово зрели червеи на възраст между два месеца и една година. Червеите следва да бъдат избрани от синхронизирана култура с относително еднородна възрастова структура (допълнение 4). Индивидите в дадена изпитвана група не следва да се различават по възраст с повече от 4 седмици.
|
|
16.
|
Избраните червеи следва да се аклиматизират в продължение на поне един ден към типа изкуствен почвен субстрат, който ще бъде използван за изпитването. През този период червеите следва да бъдат хранени със същата храна, която ще се използва при изпитването (вж. точки 31—33).
|
|
17.
|
Групите от 10 червеи трябва да бъдат претеглени индивидуално, като в началото на изпитването групите се разпределят в съдове за изпитване на случаен принцип. Преди претегляне червеите се измиват (с дейонизирана вода) и излишната вода се отстранява чрез поставяне на червеите за кратко време върху филтърна хартия. Живата маса на отделните червеи, включително съдържащата се вода, следва да бъде между 250 и 600 mg.
|
Приготвяне на концентрации за изпитване
|
18.
|
Могат да се използват два метода за прилагане на изпитвания химикал: смесване на изпитвания химикал в почвата (вж. точки 19—21), или прилагане на повърхността на почвата (вж. точки 22—24). Изборът на подходящ метод зависи от целта на изпитването. Като цяло се препоръчва смесване на изпитвания химикал в почвата. Независимо от това, може да се изискват процедури на прилагане, които са в съответствие с обичайната селскостопанска практика (например пръскане на течна формулировка или употреба на специфични пестицидни формулировки, като например гранули или продукти за третиране на семена). Разтворителите, използвани за третиране на почвата с изпитвания химикал, следва да се подбират въз основа на тяхната ниска токсичност за земните червеи, като в плана за изпитването трябва да бъде включена и подходяща контрола на разтворител (вж. точка 27).
|
Смесване на изпитвания химикал в почвата
Разтворим във вода изпитван химикал
|
19.
|
Разтвор на изпитвания химикал в дейонизирана вода се приготвя непосредствено преди започване на изпитването, в количество, достатъчно за всички повторения на една концентрация. За улесняване на приготвянето на разтвора за изпитване може да е необходим съразтворител. Уместно е да се приготви количество разтвор, необходимо за достигане на окончателното съдържание на влага (40 до 60 % от максималната способност за задържане на вода). Разтворът се смесва добре с почвения субстрат, преди въвеждането му в съда за изпитване.
|
Неразтворим във вода изпитван химикал
|
20.
|
Изпитваният химикал се разтваря в малък обем подходящ органичен разтворител (например ацетон) и след това се разпръсква върху малко количество фин кварцов пясък, или се смесва с такъв. След това разтворителят се отстранява чрез изпаряване в лабораторна камина в продължение най-малко на няколко минути. След това третираният пясък се смесва добре с предварително овлажнената изкуствена почва. След това се добавя дейонизирана вода (количество, изисквано за постигане на окончателно съдържание на влага от 40 до 60 % от максималната способност за задържане на вода) и се смесва. След това почвата е готова за поставяне в съдовете за изпитване. Следва да се обърне внимание, че някои разтворители могат да бъдат токсични за земните червеи.
|
Изпитван химикал, неразтворим във вода и органични разтворители
|
21.
|
Приготвя се смес, състояща се от 10 г фино смлян промишлен кварцов пясък и определено количество от изпитвания химикал, необходимо за достигане на концентрацията за изпитване в почвата. След това сместа се смесва добре с предварително овлажнената изкуствена почва. След това се добавя дейонизирана вода в количество, изисквано за постигане на окончателно съдържание на влага от 40 до 60 % от максималната способност за задържане на вода, и се смесва. След това почвата е готова за поставяне в съдовете за изпитване.
|
Прилагане на изпитвания химикал на повърхността на почвата
|
22.
|
Почвата се третира след добавянето на червеите. Отначало изпитваните съдове се запълват с овлажнения почвен субстрат и след това претеглените червеи се поставят върху повърхността. Здравите червеи обикновено се заравят незабавно в субстрата и, следователно, всички останали на повърхността след 15 минути се определят като увредени и трябва да бъдат заменени. Ако се заменят червеи, новопоставените и заменяните червеи следва да бъдат претеглени, така че в началото на изпитването да са известни общото живо тегло на експонираната група от червеи и общото тегло на съда с червеите.
|
|
23.
|
Прилага се изпитваният химикал. Той не следва да се добавя в почвата в рамките на половин час след въвеждането на червеите (или, ако червеите се намират в почвата, на повърхността на почвата), за да се избегне всякаква пряка експозиция на изпитвания химикал чрез контакт с кожата. Когато изпитваният химикал е пестицид, може да е уместно същият да се прилага към повърхността на почвата чрез пръскане. Изпитваният химикал следва да се приложи към повърхността на почвата колкото се може по-равномерно, като се използва подходящо лабораторно устройство за пръскане с цел симулиране на прилагане чрез пръскане в полеви условия. Преди прилагането капакът на съда за изпитването следва да се отстрани и да се замени с изолация, предпазваща от пръскащото устройство страничните стени на съда. Изолацията може да бъде изработена от съд за изпитване с отстранена основа. Прилагането следва да се извършва при температура с вариране в рамките на 20 ± 2 °C и, за водни разтвори, емулсии или дисперсии, с количество прилагана вода между 600 и 800 μl/m2. Количеството следва да се проверява с използване на подходяща техника за калибриране. Специалните формулировки, като гранули или продукти за третиране на семена, следва да се прилагат по начин, съответстващ на използването им в селското стопанство.
|
|
24.
|
Съдовете за изпитване следва да бъдат оставени непокрити за срок от един час, за да може да се изпари всякакъв летлив разтворител, свързан с прилагането на изпитвания химикал. Следва да се вземат мерки през този период нито един червей да не напусне съдовете за изпитване.
|
ПРОЦЕДУРА
Групи на изпитване и контроли
|
25.
|
Препоръчва се въвеждане на 10 земни червея в 500—600 g суха маса от изкуствената почва (т.е. от 50 до 60 g почва на червей). Ако се използват по-големи количества почва, какъвто може да бъде случаят при изпитване на пестициди със специални режими на прилагане като например продукти за третиране на семена, отношението 50-60 g почва на червей следва да се запази чрез увеличаване на броя червеи. Десет червея се приготвят за всеки контролен съд и съд за третиране. Червеите се измиват с вода, подсушават се и се поставят върху абсорбираща хартия за кратък период от време, за отстраняване на излишното количество вода.
|
|
26.
|
За да се избегнат системни грешки при разпределение на червеите в съдовете за изпитвателните, хомогенността на изпитваната популация следва да бъде определена чрез индивидуално претегляне на 20 червея, взети на случаен принцип от популацията, от която следва да бъдат взети изпитваните червеи. След гарантирането на хомогенността партидите от червеи се избират, претеглят се и се разпределят по съдовете за изпитване, като се използва процедура за случаен подбор. След добавянето на изпитваните червеи, следва да се измери теглото на всеки съд за изпитване, за да се гарантира, че съществува първоначално тегло, което може да бъде използвано като основа за наблюдение на съдържанието на влага в почвата през цялото време на изпитването, както е описано в точка 30. Изпитваните съдове след това се покриват, както е описано в точка 9, и се поставят в изпитвателната камера.
|
|
27.
|
Изготвят се подходящи контроли за всеки от методите за прилагане на изпитвания химикал, описани в точки от 18 до 24. За изготвяне на контролите се следват описаните относими процедури, с изключение на това, че не се добавя изпитваният химикал. Следователно, при необходимост към контролите се прилагат органични разтворители, кварцов пясък или други носители, в концентрации/количества, съответстващи на използваните при третиранията. Когато за добавяне на изпитвания химикал се използва разтворител или друг носител, следва да се подготви и изпита допълнителна контрола без носителя или изпитвания химикал, за да се гарантира, че носителят не влияе върху резултата.
|
Условия на изпитването
|
28.
|
Температурата на изпитването е 20 ± 2 °C. Изпитването се провежда при контролирани цикли светлина-тъмнина (за предпочитане 16 часа светлина и 8 часа тъмнина) с осветление от 400 до 800 lux в зоната на съдовете за изпитване.
|
|
29.
|
Съдовете за изпитване не се аерират по време на изпитването, но конструкцията на капаците на съда за изпитване следва да дава възможност за газообмен, като същевременно ограничава изпаряването на влагата (вж. точка 9).
|
|
30.
|
Съдържанието на вода в почвения субстрат в изпитваните съдове се поддържа по време на цялото изпитване чрез периодично претегляне на съдовете за изпитване (без капаците им). При необходимост загубите се попълват с дейонизирана вода. Съдържанието на вода не трябва да се различава с повече от 10 % от това в началото на изпитването.
|
Хранене
|
31.
|
Всяка храна с качество, за което е демонстрирана пригодност най-малко за поддържане на теглото на червеите по време на изпитването, се счита за приемлива. Опитът показва, че овесеното брашно, говеждият или конският тор са подходяща храна. Трябва да се извършват проверки, за да се гарантира, че говедата или конете, от които се получава оборски тор, не са подложени на лекарствена терапия или лечение с химикали като стимулатори на растежа, нематоциди или подобни ветеринарни продукти, които биха могли да се отразят неблагоприятно на червеите по време на изпитването. Препоръчва се говеждият тор да бъде събиран самостоятелно, тъй като опитът показва, че наличният в търговската мрежа говежди тор, използван за наторяване на градини, може да има неблагоприятно въздействие върху червеите. Преди употреба оборският тор трябва да бъде изсушен на въздух, фино смлян и пастьоризиран.
|
|
32.
|
Преди използването на всяка нова партида храна в изпитването, с нея трябва да бъде захранена култура от неучастващи в изпитването червеи, за да се гарантира, че партидата е с необходимото качество. Растежът и получаването на пашкулчета не следва да намалява в сравнение с червеите, отглеждани в субстрат, който не съдържа новата партида храна (условията са както е описано в метод за изпитване В.8 (4)).
|
|
33.
|
Храната се дава първоначално един ден след въвежането на червеите и прилагането на изпитвания химикал към почвата. Приблизително 5 g храна се разпръсква по повърхността на почвата на всеки съд и се овлажнява с дейонизирана вода (около 5 ml до 6 ml на съд). След това храна се дава веднъж на седмица по време на 4-седмичния период на изпитване. Ако остане неконсумирана храна, дажбата следва да бъде намалена, за да се избегне развитието на гъбички или плесен. Полово зрелите индивиди се отстраняват от почвата в ден 28 от изпитването. Допълнително се поставя 5 g храна във всеки съд за изпитване. През останалите 4 седмици от изпитването не се извършва допълнително хранене.
|
Избор на концентрации на изпитване
|
34.
|
Предварителното познаване на токсичността на изпитвания химикал следва да помогне при избора на подходящи концентрации на изпитване, например от изпитване на остра токсичност (4) и/или от проучвания за определяне на обхвата. Когато е необходимо, се провежда изпитване за определяне на обхвата, например за пет концентрации на изпитване от 0,1, 1,0, 10, 100 и 1 000 mg/kg (суха маса на почвата). За всяка третирана и контролна проба е достатъчно едно повторение. Продължителността на изпитването за определяне на обхвата е две седмици и смъртността се оценява в края на изпитването.
|
План на проучването
|
35.
|
Тъй като не може да бъде определена само една обобщена статистика за изпитването, настоящият метод за изпитване се отнася за определяне на NOEC и ECx. Вероятно определянето на NOEC ще се изисква от регулаторните органи в обозримо бъдеще. В резултат от статистически и екологични съображения в близко бъдеще може да бъде възприето по-широко използване на ECx. Следователно, въз основа на препоръките от кръгово изпитване на метод за размножаване на представители на сем. Enchytraeidae се предлагат три вида планове (17).
|
|
36.
|
При определяне границите на концентрация се взема предвид следното:
|
—
|
За определяне на NOEC следва да се изпитат най-малко пет/дванадесет концентрации в геометрична прогресия. Препоръчват се четири повторения за всяка концентрация за изпитване, плюс осем контроли. Концентрациите трябва да бъдат разделени една от друга с кратност, която не превишава 2,0.
|
|
—
|
За определяне на ECx (например ЕС10, ЕС50) се препоръчва брой концентрации, достатъчен за получаване най-малко на четири средни стойности на отклиците при тези концентрации със статистически значими различия между тях. Препоръчват се най-малко две повторения за всяка концентрация на изпитване и шест контролни повторения. Кратността на разделянето може да варира, т.е., да е по-малка или равна на 1,8 в диапазона на очакваното въздействие и над 1,8 при по-високите и по-ниските концентрации.
|
|
—
|
Комбинираният подход, ако се използва такъв, дава възможност за едновременно определяне на NOEC и ЕСх. Следва да бъдат използвани осем концентрации на третиране в геометрична прогресия. Препоръчват се четири повторения за всяко третиране, плюс осем контроли. Концентрациите трябва да бъдат разделени една от друга с кратност, която не превишава 1,8.
|
|
Продължителност на изпитването и измервания
|
37.
|
В ден 28 оцелелите полово зрели червеи се наблюдават и преброяват. Всякакво необичайно поведение (напр. неспособност за копаене в почвата; лежане неподвижно) и морфология (напр. открити рани) също се записват. След това всички полово зрели червеи се отстраняват от съдовете за изпитване, преброяват се и се претеглят. Прехвърлянето на почвата, съдържаща червеите, в чиста табла преди оценката може да улесни търсенето на полово зрели индивиди. Преди претегляне червеите, извлечени от почвата, следва да се измият (с дейонизирана вода) и излишната вода следва да се отстрани чрез поставяне на червеите за кратко време върху филтърна хартия. Всички червеи, които не са намерени по това време, трябва да бъдат записани като мъртви, тъй като следва да се допусне, че такива червеи са умрели и са се разградили преди оценката.
|
|
38.
|
Ако почвата е отстранена от съдовете, след това тя се връща (без полово зрелите червеи, но съдържаща всички получени пашкулчета). След това почвата се инкубира за още четири седмици при същите условия на изпитване, с изключение на това, че храненето се извършва само веднъж в началото на тази фаза на изпитването (вж. точка 33).
|
|
39.
|
В края на втория 4-седмичния период се определят броят на излюпените от пашкулчетата ювенилни екземпляри в изпитваната почва и броят на пашкулчетата, като се използват процедурите, описани в допълнение 5. Всички признаци на увреждане или поражение по червеите трябва също да се записват по време на периода на изпитване.
|
Гранично изпитване
|
40.
|
Ако при изпитването за определяне на обхвата не се наблюдава въздействие при най-високата концентрация (т.е., 1 000 mg/kg), изпитването за размножаването следва да бъде проведено като гранично изпитване, като се използва концентрация на изпитване от 1 000 mg/kg. Граничното изпитване ще предостави възможност да се демонстрира, че стойността на NOEC за размножаването е по-висока от пределната концентрация, едновременно с намаляване до минимум на броя червеи, използвани в изпитването. Както за третираната почва, така и за контролата следва да се използват по осем повторения
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
41.
|
Въпреки че в допълнение 6 е направен общ преглед, в настоящия метод за изпитване не се дават окончателни насоки за статистически анализ на резултатите от изпитването.
|
|
42.
|
Една от крайните точки е смъртността. Промените в поведението (напр. неспособност за копаене в почвата; лежане неподвижно срещу стъклената стена на съда за изпитване) и морфологията (напр. открити рани) на полово зрелите индивиди следва обаче също да бъдат записвани, заедно с наличието на ювенилни екземпляри. Обичайно за определяне на LC50 следва да се прилагат пробит-анализ (18) или логистична регресия. Независимо от това в случаите, когато този метод за анализ е неподходящ (например, ако на разположение са по-малко от три концентрации с частично проявена смъртност), могат да се използват алтернативни методи. Тези методи могат да включват хлъзгащи средни (19), метод на Спирмън-Карбър с изключване на данни (20) или обикновена интерполация (напр. геометрична средна стойност на LC0 и LC100, изчислена чрез корен квадратен на LC0, умножена по LC100).
|
|
43.
|
Другата крайна точка е плодовитостта (т.е., броят на получените ювенилни индивиди). Независимо от това, също както и при изпитването за определяне на обхвата, всички други признаци за неблагоприятно въздействие трябва да бъдат записани в окончателния протокол. За изчисляване на размножаването статистическият анализ изисква средноаритметичната стожйност

и стандартното отклонение за всяко отделно третиране и за контролата. |
|
44.
|
Ако е направен дисперсионен анализ, стандартното отклонение s и степените на свобода (df) могат да бъдат заменени съответно от обединената оценка на дисперсията, получена от ANOVA, и от нейните степени на свобода, при условие че дисперсията не зависи от концентрацията. В такъв случай се използват единичните дисперсии на контролната и на третираните проби. Тези стойности обикновено се изчисляват с търговски статистически софтуер, с използване на резултатите по съдове като повторения. Ако обединяването на данни за негативните контроли и контролите на разтворител изглежда по-разумно, отколкото изпитването само на една от тях, те трябва да бъдат тествани дали не са значимо различни (за подходящия тест се вземат предвид точка 47 и допълнение 6).
|
|
45.
|
Допълнителното статистическо тестване и статистическите изводи и заключения зависят от това дали стойностите на повторенията са нормално разпределени и са с хомогенна дисперсия.
|
Оценка на NOEC
|
46.
|
Следва да се предпочита прилагането на мощни тестове. За това дали данните са приблизително нормално разпределени, следва да се използва информация, например от предходен опит с кръгови изпитвания или от други данни за предходни периоди. Хомогенноста на дисперсията (хомоскедастичността) е по-важна. Опитът показва, че дисперсията често се увеличава с увеличаването на средната стойност. В тези случаи преобразуване на данните би могло да доведе до хомоскедастичност. Такава трансформация обаче следва да се основава на опита, натрупан с данните за предходни периоди, вместо на данните, които са предмет на проучването. При хомогенни данни следва да се използват множествени t-тестове като тестът на Уйлямс (α = 0,05, едностранен) (21) (22) или, в някои случаи, тестът на Дънет (23) (24). Следва да се отбележи, че в случай на неравни повторения табличните t-стойности трябва да се коригират както се предлага от Дънет и Уйлямс. В някои случаи, поради наличието на големи колебания, отклиците не се увеличават/намаляват регулярно. В този случай на голямо отклонение от монотонността тестът на Дънет е по-подходящ. Ако са налице отклонения от хомоскедастичността, може да е уместно да се проучат по-подробно възможните въздействия върху дисперсията, за да се вземе решение дали могат да бъдат прилагани t-тестове без да се губи много мощност (25). Множествен U-тест като например U-тестът на Бонферони по Holm (26) или — когато тези данни показват хетероскедастичност, но иначе са съобразени с базисната монотонна зависимост доза-отклик — друг непараметричен тест (напр. на Йонкхере-Терпстра (27) (28) или на Шърли (29) (30)) могат да бъдат прилагани като алтернатива и като цяло се предпочитат пред t-тестовете при неравна дисперсия. (виж също и схемата в допълнение 6).
|
|
47.
|
Ако e извършено гранично изпитване и критериите за използване на параметрични тестови процедури (нормалност, хомогенност) са изпълнени, може да се използва t-тестът на Стюдънт за сравнения по двойки, или в противен случай — процедурата на U-теста на Ман-Уитни (31).
|
Оценка на ECx
|
48.
|
За да се изчисли стойността на ECx, средните стойности от всяко третиране се използват за извършване на регресионен анализ (линеен или нелинеен), след като е получена подходяща функция доза-отклик. За растежа на червеите като непрекъснат отклик стойностите на ECx могат да се оценят с използване на подходящ регресионен анализ (32). Сред подходящите функции за двоични данни (смъртност/преживяване) и брой на полученото потомство са обикновената сигмоидна, логистичната функция или функцията на Вейбул, с два до четири параметъра, някои от които могат също така да моделират хорметични отклици. Ако функция доза-отклик е била изгладена с линеен регресионен анализ, при този анализ трябва да е получен значим r2 (коефициент на детерминация) и/или наклон преди изчисляване на ЕСх чрез добавяне на стойност, съответстваща на х % от средната стойност на контролна проба, в полученото чрез регресионен анализ уравнение. 95 %-ните доверителни граници се изчисляват по Fieller (цитиран във Finney (18)) или с други подходящи съвременни методи.
|
|
49.
|
Като алтернативна възможност откликът се моделира като процент или пропорция от параметър на модел, който се тълкува като средна стойност на отклика на контролната проба. В тези случаи нормалната (логистична, на Вейбул) сигмоидна крива може често да бъде лесно изгладена по отношение на резултатите, като се използва пробит-регресия (18). В тези случаи функцията на претеглянето трябва да бъде коригирана за метрични отклици, както е по Christensen (33). Ако обаче се наблюдава хормезис, пробит-анализът следва да бъде заменен с логистична функция или функция на Вейбул с четири параметъра, изгладена с помощта на нелинейна регресия (34). Ако подходяща функция доза-отклик функция не може да се съгласува с данните, може да се използват алтернативни методи за оценяване на ECx и нейните доверителни граници, като хлъзгащи средни по Томпсън (19) и метод на Спирмън-Карбър с изключване на данни (20).
|
ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
|
50.
|
Протоколът от изпитването трябва да съдържа следната информация:
|
|
Изпитван химикал:
|
—
|
окончателно описание на изпитвания химикал, партида, пратка и номер по CAS, чистота;
|
|
—
|
свойства на изпитвания химикал (напр. log Kow, разтворимост във вода, парно налягане, константа на Хенри (H) и информация за съдбата и поведението в околната среда).
|
|
|
|
Изпитвани организми:
|
—
|
използвани в изпитването животни: вид, научно наименование, източник на организмите и условия на отглеждане;
|
|
—
|
възраст, диапазон от размери (маси) на изпитваните организми.
|
|
|
|
Условия на изпитването
|
—
|
подробни данни за почвата за изпитване;
|
|
—
|
максималната способност на почвата за задържане на вода;
|
|
—
|
описание на техниката, използвана за прилагане на изпитвания химикал към почвата;
|
|
—
|
подробни данни за спомагателните химикали, използвани за прилагането на изпитвания химикал;
|
|
—
|
подробни данни за калибриране на оборудването за пръскане, ако е приложимо;
|
|
—
|
описание на плана на проучването и на процедурата;
|
|
—
|
размер на съдовете за изпитване и обема на почвата за изпитване;
|
|
—
|
условия на изпитване: интензитет на светлината, продължителност на циклите светлина-тъмнина, температура;
|
|
—
|
описание на режима на хранене, вида и количество на храната, използвана при изпитването, дати на хранене;
|
|
—
|
стойност на рН и съдържание на вода в почвата в началото и в края на изпитването.
|
|
|
|
Резултати от изпитването:
|
—
|
смъртност при полово зрелите индивиди ( %) във всеки съд за изпитване в края на първите 4 седмици от изпитването;
|
|
—
|
общата маса на полово зрелите индивиди в началото на изпитването във всеки от съдовете за изпитване;
|
|
—
|
промени в телесното тегло на живите полово зрели индивиди ( % от първоначалното тегло) за всеки от съдовете за изпитване след първите четири седмици на изпитването;
|
|
—
|
броят на ювенилните екземпляри, получени във всеки от съдовете за изпитване в края на изпитването;
|
|
—
|
описание на видими или патологични симптоми, или явни промени в поведението;
|
|
—
|
резултатите, получени с референтния изпитван химикал;
|
|
—
|
стойностите на LC50, NOEC и/или ECx (напр. EC50, EC10) за размножаването, ако някои от тях са приложими с доверителни интервали, и графика на изгладения модел, използвана за изчисляването им, цялата информация и полезни наблюдения за тълкуване на резултатите;
|
|
—
|
графичното изобразяване на зависимостта доза-отклик;
|
|
—
|
резултатите, приложими за всеки съд за изпитване;
|
|
отклонения от процедурите, описани в настоящия метод за изпитване, и всички необичайни обстоятелства по време на изпитването.
|
ЛИТЕРАТУРА
|
(1)
|
Jaenicke, J. (1982). „Eisenia foetida“ is two biological species. Megadrilogica 4, 6-8.
|
|
(2)
|
Oien, N. and J. Stenerson (1984). Esterases of earthworm — III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277 — 282.
|
|
(3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei — comparison of two ringtests. In: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, p. 50-82.
|
|
(4)
|
Глава В.8 от настоящото приложение „Токсичност за земни червеи“
|
|
(5)
|
ISO (International Organization for Standardization) (1996). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
|
(6)
|
ISO (International Organization for Standardization) (1993). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using artificial soil substrate, No.11268-1. ISO, Geneve.
|
|
(7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S.C., Bembridge, J.D., Holmstrup, M., and L. Posthuma, (eds). SETAC Press, 456 pp.
|
|
(8)
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, April 1996.
|
|
(9)
|
Bouché, M.B. (1972). Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C.A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN, Commission of European Communities.
|
|
(11)
|
Greig-Smith, P.W., H. Becker, P.J. Edwards and F. Heimbach (eds.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C.A. and J. P. Bohlen, (1996). Biology and ecology of Earthworms, 3rd Edition. Chapman and Hall, London.
|
|
(13)
|
(ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
|
(14)
|
Hund-Rinke, K, Römbke, J., Riepert, F. & Achazi R. (2000): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(15)
|
ISO (International Organization for Standardization) (1992). Soil Quality –Determination of water retention characteristics –Laboratory methods, No. 11274. ISO, Geneve.
|
|
(16)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis — Gravimetric method, No. 11465. ISO, Geneve.
|
|
(17)
|
Römbke, J. and Th. Moser (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150+ 223 pp.
|
|
(18)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(19)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. — Charles Griffin & Company Ltd, London.
|
|
(20)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(21)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(22)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(23)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(24)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(25)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(26)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(27)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(28)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(29)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(30)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(31)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(32)
|
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485-1494
|
|
(33)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(34)
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Допълнение 1
Определения
В настоящия метод за изпитване са приложими следните определения:
|
|
Химикал означава вещество или смес.
|
|
|
ЕСх (ефективна концентрация, при която се наблюдава х % от въздействието) е концентрацията, която причинява х % от дадено въздействие на изпитвани организми в рамките на даден период на експозиция, при сравнение с контрола. Например EC50 е концентрация, за която е направена оценка, че предизвиква дадено въздействие върху изпитвана крайна точка в 50 % от експонираната популация в рамките на определен период на експозиция. В настоящото изпитване ефективните концентрации се изразяват като масата на изпитвания химикал към сухата маса на почвата за изпитване или като масата на изпитвания химикал към единица площ на почвата.
|
|
|
LC0
(нелетална концентрация) е концентрацията на изпитвания химикал, която не води до летален изход при никой от експонираните изпитвани организми в рамките на даден период от време. В настоящото изпитване LC0 се изразява като масата на изпитвания химикал към сухата маса на почвата за изпитване.
|
|
|
LC50
(медианна летална концентрация) е концентрацията на изпитвания химикал, която води до летален изход при 50 % от експонираните изпитвани организми в рамките на даден период от време. В настоящото изпитване LC50 се изразява като масата на изпитвания химикал към сухата маса на почвата за изпитване или като масата на изпитвания химикал към единица площ на почвата.
|
|
|
LC100
(напълно летална концентрация) е концентрацията на изпитвания химикал, която води до летален изход при 100 % от експонираните изпитвани организми в рамките на даден период от време. В настоящото изпитване LC100 се изразява като масата на изпитвания химикал към сухата маса на почвата за изпитване.
|
|
|
LOEC (най-ниската концентрация, при която се наблюдава ефект) е най-ниската концентрация на изпитвания химикал, при която е наблюдавано статистически значимо въздействие (р < 0,05). В настоящото изпитване LOEC се изразява като масата на изпитвания химикал към сухата маса на почвата за изпитване или като масата на изпитвания химикал към единица площ на почвата. Всички концентрации на изпитване, по-големи от LOEC, следва по принцип да показват въздействие, което в статистическо отношение е различно от това на контролата. Всички отклонения от посоченото по-горе по отношение трябва да бъдат обосновани в протокола от изпитването.
|
|
|
NOEC (концентрация без наблюдавано въздействие) е най-високата концентрация на изпитвания химикал непосредствено под LOEC, при която не се наблюдава въздействие. В настоящото изпитване концентрацията, съответстваща на NOEC, няма статистически значимо (р < 0,05) въздействие в рамките на даден период на експозиция, при сравнение с контролата.
|
|
|
Скорост на размножаването: средният брой ювенилни червеи, получени от определен брой полово зрели индивиди за времето на изпитването.
|
|
|
Изпитван химикал означава всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
|
Допълнение 2
Определяне на максималната способност на почвата за задържане на вода
За подходящ се смята следният метод за определяне на максималната способност на почвата за задържане на вода. Той е описан в приложение С към стандарта ISO DIS 11268-2 (1).
Взема се определено количество (например 5 g) изпитван почвен субстрат с помощта на подходящо устройство за пробовземане (шнекова сонда и т.н.). Дъното на сондата се покрива с парче филтърна хартия, сондата се напълва с вода и след това се поставя на стойка на водна баня. Сондата следва постепенно да се потапя във водата, докато нивото на водата стане над повърхността на почвата. След това тя се оставя във водата за около три часа. Тъй като не цялото количество вода, абсорбирано от почвените капиляри, може да бъде задържано, почвената проба следва да се остави да се отцеди в продължение на два часа чрез поставяне на сондата върху легло от много влажен фино смлян кварцов пясък, намиращо се в покрит съд (за да се предотврати изсушаването). Тази проба следва след това да бъде претеглена и изсушена до постоянна маса при температура 105 °C. Способността за задържане на вода (СЗВ) може след това да се изчисли, както следва:

където:
|
S
|
=
|
водонаситен субстрат + маса на сондата + маса на филтърната хартия
|
|
T
|
=
|
тара (маса на сондата + маса на филтърната хартия)
|
|
D
|
=
|
сухата маса на субстрата
|
ПОЗОВАВАНИЯ:
|
(1)
|
ISO (International Organization for Standardisation) (1996). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
Допълнение 3
Определяне на стойността на РН на почвата
Описаният по-долу метод за определяне на pH на почвата се основава на описанието в ISO DIS 10390: Качество на почвите — Определяне на pH (1).
Определено количество почва се изсушава при стайна температура в продължение на най-малко 12 часа. След това се приготвя суспензия от почвата, (съдържаща най-малко 5 грама почва) в нейния петкратен обем или в 1 M разтвор на калиев хлорид (KCl) с квалификация „чист“, или в 0,01 M разтвор на калциев хлорид (CaCl2) с квалификация „чист“. След това суспензията се разклаща добре в продължение на пет минути и се оставя да се утаи в продължение на най-малко 2 часа, но не повече от 24 часа. След това се измерва стойността на pH на течната фаза с помощта на рН-метър, който е бил калибриран преди всяко измерване чрез подходящ набор от буферни разтвори (напр. pH 4,0 и 7,0).
ПОЗОВАВАНИЯ:
|
(1)
|
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
Допълнение 4
Отглеждане на Eisenia fetida/Eisenia andrei
Предпочита се отглеждането да се извършва в климатична камера при 20 °C ± 2 °C. При тази температура и при осигуряването на достатъчно храна, червеите достигат полова зрялост след около 2 до 3 месеца.
И двата вида могат да бъдат отглеждани върху най-различни животински отпадъци. Препоръчваната среда за отглеждане е смес 50:50 от конски или говежди тор и торф. Трябва да се извършват проверки, за да се гарантира, че кравите или конете, от които се получава оборски тор, не са подложени на лекарствена терапия или лечение с химикали като стимулатори на растежа, нематоциди или подобни ветеринарни продукти, които биха могли да се отразят неблагоприятно на червеите по време на изпитването. Препоръчва се събиран самостоятелно органичен тор, тъй като опитът показва, че наличният в търговската мрежа тор, използван за наторяване на градини, може да има неблагоприятно въздействие върху червеите. Средата трябва да има стойност на рН от около 6 до 7 (коригирана с калциев карбонат) и ниска йонна проводимост (под 6 mS/cm или концентрация на соли от 0,5 %) и не бива да е прекомерно замърсена с амоняк или животинска урина. Субстратът трябва да бъде влажен, но не прекалено мокър. Подходящи са кутии за отглеждане с вместимост 10—50 литра.
За да се получат червеи със стандартна възраст и размери (маса), най-добре е отглеждането да се започне от пашкули. След въвеждането на културата тя се поддържа чрез поставяне на полово зрели червеи в кутия за размножаване с пресен субстрат за период от 14 дни до 28 дни, за да се даде възможност за получаване на допълнителни пашкули. След това полово зрелите индивиди се отстраняват и излюпените от пашкулите ювенилни индивиди се използват като основа за следващата култура. Червеите се захранват непрекъснато с животински отпадъци и от време на време се прехвърлят в пресен субстрат. Опитът показва, че изсушеният на въздух фино смлян говежди или конски тор, както и овесеното брашно, са подходяща храна. Трябва да се гарантира, че кравите или конете, от които се получава оборският тор, не са подложени на лекарствена терапия с химикали, като например стимулатори на растежа, които биха могли да се отразят неблагоприятно на червеите при продължително отглеждане. Излюпените от пашкулите червеи се използват за изпитване, когато са на възраст между 2 и 12 месеца и които се считат за полово зрели.
Червеите могат да се смятат за здрави, ако се движат в субстрата, не се опитват да го напускат и се размножават непрекъснато. При червеите много бавното движение и жълтият заден край са указание за изтощаване на субстрата. В този случай се препоръчва предоставяне на свеж субстрат и/или намаляване на гъстотата на отглеждане.
Допълнение 5
Техники за броене на излюпени от пашкули ювенилни червеи
Ръчното сортиране на червеите от почвения субстрат отнема много време. Във връзка с това се препоръчват два алтернативни метода:
|
а)
|
съдовете за изпитване се поставят на водна баня при първоначална температура 40 °С, която се увеличава до 60 °C. След период от около 20 минути ювенилните червеи следва да се появят на повърхността на почвата, откъдето те лесно да могат да бъдат отстранени и преброени.
|
|
б)
|
използваната при изпитването почва може да се промие през сито, като се използва методът, разработен от van Gestel et al. (1), при условие че торфът и оборският тор или овесеното брашно, добавени към почвата, са били стрити на фин прах. Две сита (с диаметър 30 cm) с размер на отвора 0,5 mm се поставят едно върху друго. Съдържанието на даден съд за изпитване се промива през ситата със силна струя чешмяна вода, при което новородените червеи и пашкулите се задържат главно върху горното сито. Важно е да се отбележи, че цялата повърхност на горното сито следва да се запази влажна по време на тази операция, така че ювенилните червеи да плават върху слой от вода, което по този начин ги възпрепятства да преминават през порите на ситото. Най-добри резултати се постигат, когато се използва глава за душ.
|
След като целият почвен субстрат е промит през ситото, ювенилните екземпляри и пашкулите могат да бъдат отмити от горното сито в купа. Съдържанието на купата след това се оставя да престои, което дава възможност празните пашкули да останат да плуват на водната повърхност, а пълните пашкули и новородените червеи — да потънат на дъното. След това престоялата вода може да се излее и новородените червеи и пашкулите да се прехвърлят в блюдо на Петри, съдържащо малко вода. Червеите могат да се отстранят за преброяване, като за целта се използва игла или пинсета.
Опитът показва, че метод а) е по-подходящ за извличане на ювенилни червеи, които могат да бъдат отмити дори и през сито с око 0,5 mm.
Ефикасността на метода, използван за отстраняване на червеите (и на пашкулите, ако е целесъобразно) от почвения субстрат, следва винаги да бъде определяна. Ако ювенилните индивиди са събрани чрез използване на ръчно сортиране, препоръчително е операцията да се извърши два пъти за всички проби.
ПОЗОВАВАНИЯ:
|
(1)
|
Van Gestel, C.A.M., W.A. van Dis, E.M. van Breemen, P.M. Sparenburg (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367-371.
|
Допълнение 6
Преглед на статистическата оценка на данните (Определяне на NOEC)
В.34. ОПРЕДЕЛЯНЕ НА ИНХИБИРАНЕТО НА АКТИВНОСТТА НА АНАЕРОБНИ БАКТЕРИИ — НАМАЛЯВАНЕ НА ПРОИЗВОДСТВОТО НА ГАЗ ОТ АНАЕРОБНО РАЗГРАЖДАЩИ СЕ (ОТПАДЪЧНИ) УТАЙКИ
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 224 (2007). Химикалите, зауствани във водна среда, преминават както през аеробни, така и през анаеробни зони, където те могат да се подложат на разграждане и/или могат да потиснат бактериалната активност; в някои случаи те могат да останат без външно въздействие в анаеробните зони в продължение на десетилетия или повече. При пречистването на отпадъчни води първата фаза, първичното утаяване, е аеробна в супернатантната течност, докато в намиращата се под течността утайка са налице анаеробни условия. Във втората фаза следват аеробна зона в резервоара за аериране с активна утайка и анаеробна зона в намиращата се под течността утайка в резервоара за вторично утаяване. Утайката от тези две фази обикновено се подлага на анаеробна обработка, в резултат от която се отделят метан и въглероден диоксид, които обикновено се използват за производството на електроенергия. В по-широк план в околната среда химикалите, достигащи до утайки в заливи, устия и морето вероятно ще останат в анаеробните зони за неограничен период от време, ако не са биоразградими. Физически свойства, като например малка разтворимост във вода, висока адсорбция към суспендирани твърди вещества, както и невъзможност за биоразграждане в аеробна среда, биха позволили на по-голям дял от някои химикали да достигнат до тези зони.
|
|
2.
|
Въпреки че е желателно химикалите, изпускани в околната среда, да са биоразградими както при аеробни, така и при анаеробни условия, важно е тези химикали да не потискат активността на микроорганизмите в никоя от зоните. В Обединеното кралство имаше няколко случая на цялостно потискане на получаването на метан, причинено, например, от пентахлорофенол в промишлени отпадъци, водещо до много скъпо транспортиране на инхибираните утайки от реакторите към „безопасни“ площадки и подаване на прясна разграждаща се утайка от съседни съоръжения. Но има и много случаи на не толкова сериозно прекъсване на разграждането от няколко други химикала, включително алифатни халогенирани въглеводороди (химическо чистене) и детергенти, довело до значително влошаване на ефикасността на разграждането.
|
|
3.
|
Само един метод за изпитване, В.11 (1), се занимава с потискането на бактериалната активност (Дишане на активна утайка), като с него се прави оценка на въздействието на изпитвани химикали върху скоростта на усвояването на кислород в присъствието на субстрат. Методът се използва широко за даване на ранно предупреждение за възможното вредно въздействие на химикалите върху аеробното пречистване на отпадъчните води, както и за посочване на концентрации на изпитваните химикали, които не водят до потискане, и които да се използват при различните изпитвания за биоразградимост. Метод за изпитване В.43 (2) дава ограничена възможност за определяне доколко даден изпитван химикал е токсичен за производство на газ от утайката в анаеробни условия, разредена до една десета от нормалната за нея концентрация на твърди вещества, за постигане на изискваната прецизност при оценката на процента на биоразграждане. Тъй като разредената утайка може да е по-чувствителна към потискащи химикали, групата по ISO реши да изготви метод чрез използване на неразредена утайка. Бяха разгледани най-малко три текста (от Дания, Германия и Обединеното кралство) и накрая бяха изготвени два ISO стандарта, единият от които с използване на неразредена утайка, ISO 13 641-1 (3), а другият — с използване на разредена до една стотна утайка, ISO 13 641-2 (4), за представляване на кал и утайки, имащи малки бактериални популации. И двата метода бяха подложени на кръгово изпитване (5); част 1 беше потвърдена като приемлив стандарт, но не беше постигнато съгласие по част 2. Органите на Обединеното кралство счетоха, че тъй като значителен дял от участниците посочват твърде слабо или никакво получаване на газ, отчасти защото делът на пространството на газа е бил твърде висок (75 %) за оптимална чувствителност, методът изисква допълнително разглеждане.
|
|
4.
|
В по-ранни разработки в Обединеното кралство (6)(7) е описан манометричен метод чрез използване на неразредена разграждаща утайка плюс сурова утайка от отпадъчни води като субстрат, в колби от 500 ml; апаратурата е била е неудобна и миризмата на суровата утайка е била неприятна. По-късно от Wilson et al. (10) е била приложена успешно по-компактната и удобна апаратура на Shelton and Tiedje (8), разработена от Battersby and Wilson (9). Kawahara et al (11) успешно са приготвили по-стандартни утайки в лабораторни условия за използване при изпитвания за анаеробна биоразградимост и потискане за редица химикали. Също така, за извършване на изпитване суровата утайка като субстрат е заменена с разредена до една стотна анаеробна утайка, или с кал, утайки и т.н. с ниска бактериална активност.
|
|
5.
|
Този метод може да предостави информация, която е полезна при прогнозирането на вероятните въздействия на даден изпитван химикал върху получаването на газ в анаеробни реактори. Независимо от това единствено по-дълги изпитвания, симулиращи по-добре реактори в работни условия, могат да покажат дали може да настъпи адаптиране на микроорганизмите към изпитвания химикал или дали химикалите, за които е вероятно да бъдат абсорбирани и адсорбирани от утайката, могат да се натрупат до токсични концентрации за период, по-дълъг от предвидения в настоящото изпитване.
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
6.
|
Аликвотни части от смес на анаеробно разграждащи се утайки (20 g/l — 40 g/l общо съдържание на твърди вещества) и разтвор на разградим субстрат се инкубират поотделно и едновременно с концентрации на изпитвания химикал в определен диапазон в херметично затворени съдове за период до 3 дни. Полученото количество газ (метан и въглероден диоксид) се измерва посредством увеличаването на налягането (Pa) в бутилките. Процентното потискане на получаването на газ, предизвикано при различните концентрации на изпитвания химикал, се изчислява от стойностите, получени при съответните изпитвани и контролни бутилки. Стойностите на ЕС50 и други ефективни концентрации се изчисляват от графиките на процентното потискане спрямо концентрацията на изпитваните химикали, или, по-често — от нейния логаритъм.
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНИЯ ХИМИКАЛ
|
7.
|
Изпитваните химикали следва да се използват по принцип в най-чистата форма, която е лесно достъпна, тъй като онечистванията в някои химикали, например хлорофеноли, могат да бъдат значително по-токсични от самия изпитван химикал. Независимо от това следва да бъдат взети предвид потребностите от изпитваните химикали във вида, в който са произведени/пуснати в търговската мрежа. Използването на формулирани продукти обикновено не се препоръчва, но при малко разтворими изпитвани химикали използването на формулирани материали може да бъде подходящо. Свойствата на изпитвания химикал, за които следва да има налична информация, включват разтворимост във вода и някои органични разтворители, парно налягане, коефициент на адсорбция, хидролиза и биоразградимост в анаеробни условия.
|
ПРИЛОЖИМОСТ НА МЕТОДА
|
8.
|
Изпитването се прилага за химикали, които са разтворими или неразтворими във вода, включително летливи химикали. Необходимо е обаче специално внимание при силно летливите материали с малка разтворимост във вода (виж позоваване (12)). Също така може да бъде използван инокулум от други анаеробни обекти, напр. кал, наситени почви, утайки. Анаеробните бактериални системи, които по-рано са били експонирани на токсични химикали, могат да бъдат адаптирани да поддържат активността си в присъствието на ксенобиотични химикали. Инокулумът от адаптирани бактериални системи може да има по-голяма толерантност към изпитваните химикали в сравнение с инокулума, получен от неадаптирани системи.
|
РЕФЕРЕНТНИ ХИМИКАЛИ
|
9.
|
За да се провери процедурата, се изпитва референтен химикал чрез паралелно приготвяне на подходящи съдове като част от нормалните провеждания на изпитването; за 3,5-дихлорофенол е доказано, че е последователен инхибитор на анаеробното получаване на газ, както и на потреблението на кислород от активната утайка и на други биохимични реакции. За два други химикала е показано, че са по-силни инхибитори на получаването на метан от 3,5-дихлорофенола, а именно метиленбистиоцианат и пентахлорофенол, но резултатите при тях не са били валидирани. Пентахлорофенолът не се препоръчва, тъй като не е лесно достъпен в чист вид.
|
ВЪЗПРОИЗВОДИМОСТ НА РЕЗУЛТАТИТЕ
|
10.
|
При международно кръгово изпитване за 3,5-дихлорофенол и 2-бромоетансулфонова киселина (5) е получена само задоволителна възпроизводимост в стойностите на EC50 между 10-те участващи лаборатории. (диапазонът за първия е бил от 32 mg/l до 502 mg/l, а за втория — от 220 mg/l до 2 190 mg/l).
|
Брой на лабораториите
|
като mg/l
|
като mg/g утайка
|
|
средно
|
s.d.
|
cv(%)
|
средно
|
s.d.
|
cv(%)
|
|
|
3,5-дихлорофенол
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
2-бромоетансулфонова киселина
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
данни за EC50 от кръговото изпитване — неразредена утайка
|
11.
|
Високите коефициенти на вариация между лабораториите до голяма степен отразяват разликите в чувствителността на микроорганизмите в утайката или поради предварителна експозиция, или поради липсата на предварителна експозиция на изпитвания химикал или на други химикали, които са химически свързани с него. Прецизността, с която е била определена стойността на ЕС50, основана на утайката, е била съвсем малко по-добра от „волуметричната“ стойност (mg/l). Трите лаборатории, които са протоколирали за прецизността на стойностите си за EC50 за 3,5-дихлорофенол, са показали много по-ниски коефициенти на вариация (22,9 и 18 % съответно за ЕС50 mg/g) от тези на средните за всички десет лаборатории. Индивидуалните средни за трите лаборатории са били съответно 3,1, 3,2 и 2,8 mg/g. По-ниските, допустимите вътрешнолабораторни коефициенти на вариация, в сравнение с много по-високите стойности на междулабораторните коефициенти, а именно срв. 9-22 % с 92 %, показват, че съществуват значими разлики в свойствата на отделните утайки.
|
ОПИСАНИЕ НА МЕТОДА
Апаратура
|
12.
|
Изисква се използване на стандартно лабораторно оборудване, както и на следното:
|
а)
|
Инкубатор — безискров и контролиран при 35 °С ± 2 °С;
|
|
б)
|
Устойчиви на налягане стъклени съдове за изпитване с подходящ номинален размер (17), всеки от които е снабден с газонепроницаема промазана септа, способна да издържи около 2 bar или 2 × 105 Pa (за промазване се използва напр. политетрафлуороетен = PTFE). Препоръчват се стъклени серумни бутилки с номинален обем 125 ml, с действителен обем от около 160 ml, херметично затворени със септи за серумни бутилки (18) и алуминиеви капачки във формата на пръстени; могат обаче да се използват успешно бутилки с общ обем между 0,1 и 1 литър;
|
|
в)
|
Прецизен манометър (19) с приложена игла
Общото количество получени газове (метан и въглероден диоксид) се измерва с помощта на манометър, приспособен за измерване и пропускане на получените газове. Пример за подходящ инструмент е ръчният прецизен манометър, свързан с игла от спринцовка; трипътен газонепроницаем клапан позволява изпускане на надналягането (допълнение 1). Необходимо е вътрешният обем в тръбите на преобразувателя на налягането и клапана да се запази колкото е възможно по-малък, така че грешките от пренебрегването на обема на оборудването да не са значими;
|
|
г)
|
изолирани съдове, за транспорт на разграждащата се утайка;
|
|
д)
|
трипътни изпускателни клапани;
|
|
е)
|
сито с квадратни отвори със страна 1 mm;
|
|
ж)
|
резервоар за разграждащата се утайка, бутилка от стъкло или полиетилен висока плътност, с вместимост около 5 l, снабдена с бъркалка и приспособления за преминаване на поток от азот (вж. точка 13) през парното пространство;
|
|
з)
|
мембранни филтри (0,2 μm) за стерилизиране на субстрата;
|
|
и)
|
микроспринцовки, за газонепроницаемо свързване на преобразувателя на налягането (вж. точка 12 в)) към парното пространство в бутилките (вж. точка 12 б)); също и за добавяне в бутилките на неразтворими течни изпитвани материали;
|
|
й)
|
защитна камера с ръкавици, с леко положително налягане на азота (незадължителна, но препоръчителна характеристика).
|
|
Реактиви
|
13.
|
Навсякъде се използват само реактиви с квалификация „чист“. Навсякъде следва да се използва газообразен азот с висока чистота, със съдържание на кислород по-малко от 5μl/l.
|
Вода
|
14.
|
При необходимост от разреждане на някакъв етап, се използва дейонизирана вода, от която въздухът е предварително отстранен. Не е необходим аналитичен контрол на тази вода, но следва да се гарантира, че апаратът за дейонизиране се поддържа редовно. Дейонизирана вода се използва също така за приготвянето на изходните разтвори. Преди добавянето на анаеробния инокулум към някой от разтворите или разредените разтвори на изпитван материал, следва да се гарантира, че същите не съдържат кислород. Това се постига или чрез продухване на азот чрез водата за разреждане (или чрез разредените разтвори) в продължение на 1 час преди добавянето на инокулума или, като алтернативен вариант, чрез нагряване на водата за разреждане до кипене и охлаждане до стайна температура в безкислородна среда.
|
Разградена утайка
|
15.
|
Взема се активно разграждаща се утайка от реактор в пречиствателна станция за отпадъчни води или, като алтернатива, от лабораторен реактор, третиращ утайки предимно от битови отпадъчни води. Практическа информация относно утайките от лабораторни реактори може да бъде намерена в друг източник (11). Ако съществува намерение за използване на адаптиран инокулум, може да бъде взета под внимание разграждаща се утайка от станция за пречистване на промишлени отпадъчни води. За вземане на утайката се използват бутилки с широко гърло, изработени от полиетилен висока плътност или подобен материал, с възможност за разширяване. Утайката се добавя в бутилките за проби до около 1 cm от върха на бутилката, бутилките се запечатат плътно, за предпочитане с предпазен клапан (точка 12, д)), и се поставят в изолирани съдове (точка 12, г)) с цел свеждане до минимум на температурния шок, до прехвърлянето им в инкубатор, в който се поддържа температура 35 °С ± 2 °C. При отварянето на бутилки се вземат мерки за освобождаване на газовото надналягане или чрез внимателно разхлабване на херметичното затваряне, или чрез трипътния изпускателен клапан (точка 12, д)). Препоръчва се използването на утайката в рамките на няколко часа след нейното вземане, в противен случай тя се съхранява до 3 дни при 35 °C ± 2 °C с парно пространство от азот, когато обичайно загубата на активност е малка.
Предупреждение — от разграждащата се утайка се получават запалими газове, които създават рискове от пожар и експлозия: тя също така съдържа потенциално патогенни организми и следователно при работата с утайката трябва да се вземат подходящи предпазни мерки. Поради причини, свързани с безопасността, за вземане на утайката не се използват стъклени съдове.
|
Инокулум
|
16.
|
Непосредствено преди употреба утайката се размесва чрез леко разбъркване и се пропуска през сито с размер на отворите 1 mm2 (точка 12, е)) в подходяща бутилка (точка 12, ж)) през парното пространство на която се пропуска поток от азот. Заделя се проба за измерване на концентрацията на общото количество сухо вещество (вж. например ISO 11923 (13) или еквивалентен стандарт на ЕС). По принцип се използване утайка без разреждане. Концентрацията на твърди вещества обикновено е между 2 % и 4 % (w/v). Определя се стойността на рН и, ако е необходимо, се коригира до 7 ± 0,5.
|
Субстрат за изпитването
|
17.
|
Разтварят се 10 g хранителен бульон (напр. Oxoid), 10 g екстракт от дрожди и 10 g D-глюкоза, в дейонизирана вода и се разреждат до 100 ml. Пробата се стерилизира чрез филтруване през мембранен филтър с 0,2 μm (точка 12, з)) и се използва незабавно, или се съхранява не повече от 1 ден при 4 °C.
|
Изпитван химикал
|
18.
|
Приготвя се отделен изходен разтвор за всеки от разтворимите във вода изпитвани химикали, съдържащ примерно 10 g/l от химикала във вода за разреждане без съдържание на кислород (точка 14). За приготвяне на реакционните смеси, съдържащи различните концентрации, се използват подходящи обеми от тези изходни разтвори. Като алтернатива, от всеки изходен разтвор се изготвя серия от разредени разтвори, така че обемът, добавен в бутилките за изпитването, да е един и същ за всяка изисквана крайна концентрация. Стойностите на pH на изходните разтвори трябва да се коригират до 7 ± 0,2, ако е необходимо.
|
|
19.
|
За изпитвани химикали, които не са достатъчно разтворими във вода, вж. ISO 10634 (12) или еквивалентен стандарт на ЕС. Ако е необходимо използването на органичен разтворител, се избягват разтворители като хлороформ и тетрахлорометан, за които е известно, че значително потискат получаването на метан. Приготвя се разтвор с подходяща концентрация на неразтворимия във вода химикал в подходящ летлив разтворител, като например ацетон, диетилов етер. Добавят се необходимите обеми от разтвор с разтворител в празни бутилки за изпитване (точка 12, б)) и разтворителят се изпарява преди добавянето на утайка. За други видове третиране се ползва стандарт ISO 10634 (12) или еквивалентен стандарт на ЕС, но следва да се има предвид, че всички повърхностноактивни вещества, използвани за получаване на емулсии, могат да имат потискащо въздействие върху получаването на газ в анаеробни условия. Ако се смята, че наличието на органични разтворители, емулгатори причинява артефакти, изпитваният химикал може да бъде добавен направо в изпитвателната смес като прах или течност. Летливи химикали и неразтворими във вода течни изпитвани химикали могат да бъдат инжектирани в инокулирани серумни бутилки, с използване на микроспринцовки (точка 12, и)).
|
|
20.
|
В бутилките се добавят изпитвани химикали до получаване на геометрична прогресия от концентрации, например 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l и 15,6 mg/l. Ако диапазонът на токсичността не е известен от сходни химикали, най-напред се извършва предварително изпитване за определяне на обхвата с концентрации от 1 000 mg/l, 100 mg/l и 10 mg/l, за да определи подходящият диапазон.
|
Референтен химикал
|
21.
|
Приготвя се воден разтвор на 3,5-дихлорофенол (10 g/l), като постепенно се прибавя минималното количество от 5 mol/l разтвор на натриев хидроксид към твърдото вещество, като се разбърква, докато се разтвори. След това се добавя вода за разреждане, от която е отстранен кислородът (точка 14) до необходимия обем; процесът на разтваряне може да се подпомогне със сонификация. Могат да се използват други референтни химикали, когато средният диапазон на ЕС50 е постигнат в най-малко три изпитвания с различен инокулум (различни източници или различно време на вземането).
|
ИНТЕРФЕРЕНЦИЯ/ГРЕШКИ
|
22.
|
Някои съставки на утайката вероятно биха могли да реагират с евентуални инхибитори, правейки ги недостъпни за микроорганизмите, като в резултат от това се получава по-ниско или никакво потискане. Също така, ако утайката вече съдържа химикал с потискащо действие, биха се получили погрешни резултати, когато този химикал бъде подложен на изпитването. Освен тези възможности съществуват редица идентифицирани фактори, които могат да доведат до погрешни резултати. Те са изброени в допълнение 3, заедно с методи за премахването, или поне за намаляването на грешките.
|
ПРОЦЕДУРА НА ИЗПИТВАНЕ
|
23.
|
Броят на необходимите повторения зависи от степента на прецизност, изисквана за показанията за потискането. Ако запушалките на бутилките са достатъчно газонепроницаеми през периода на изпитването, се приготвя само една партида (най-малко три повторения) бутилки за изпитване за всяка изисквана концентрация. По подобен начин се приготвя една партида бутилки с референтен химикал и един набор от контроли. Независимо от това, ако запушалките на бутилките са надеждни само за едно или малко на брой вкарвания на игли, се приготвя партида (напр. три повторения) на бутилките за изпитване за всеки интервал (t), за който са необходими резултати от изпитвания на всички концентрации на изпитвания химикал. По подобен начин се приготвят „t“ партиди бутилки за референтния химикал и за контролите.
|
|
24.
|
Използването на защитна камера с ръкавици (точка 12 й)) е препоръчително. Поне 30 минути преди началото на изпитването започва подаване на поток от азот през съдържащата цялото необходимо оборудване защитна камера с ръкавици. Трябва да се гарантира, че температурата на утайката се поддържа в границите на 35 °C ± 2 °C по време на обработката и херметичното затваряне на бутилките.
|
Предварително изпитване
|
25.
|
Ако активността на утайката е неизвестна, се препоръчва да се извърши предварително изпитване. Подготвят се контроли, които да дават концентрации на твърди вещества от 10 g/l, 20 g/l и 40 g/l плюс субстрат, но не се използва изпитван химикал. Освен това се използват различни обеми реакционна смес, за да се получат три или четири отношения на обема на парното пространство към обема на течността. От резултатите от получените обеми газ на различни интервали от време, най-подходящите условия, които позволяват две дневни измервания, при които се получават значими обеми газ и се извършва изпускане на налягането, при оптимална чувствителност (20) без риск от експлозии.
|
Добавяне на изпитвани химикали
|
26.
|
Разтворимите във вода изпитвани химикали се добавят в празни бутилки за изпитване (точка 12, б)) като водни разтвори (точка 18). Използват се набори бутилки с поне три повторения за всеки диапазон на концентрациите (точка 20). В случай на неразтворим и малко разтворим изпитван химикал, разтвор на този химикал в органичен разтворител се инжектира, с помощта на микроспринцовка, в празна бутилка за получаване на набори с повторения от всичките пет концентрации на изпитвания химикал. Разтворителят се изпарява чрез прекарване на струя азот над повърхността на разтвора в бутилката за изпитване. Като алтернатива, към бутилката за изпитване директно се добавя претеглено количество неразтворим химикал в твърдо състояние.
|
|
27.
|
Ако неразтворим или малко разтворим във вода течен изпитван химикал не е добавен с използването на разтворите, той се добавя директно към бутилката за изпитване чрез микроспринцовка след добавянето на инокулума и субстрата за изпитването (вж. точка 30). Летливите изпитвани химикали могат да се добавят по същия начин.
|
Добавяне на инокулум и субстрат
|
28.
|
Разбърква се подходящ обем от пресятата разграждаща се утайка (вж. точка 16) в бутилка от 5 литра (параграф 12, ж)), като едновременно с това се пропуска поток от азот през парното пространство. Бутилките за изпитване, съдържащи водни разтвори или разтвори с изпарен разтворител, се продухват с поток от азот за около две минути за отстраняване на въздуха. Аликвотни части, например 100 ml, от добре разбърканата утайка се поставят в бутилките за изпитване с помощта на пипета с широк връх или мерителен цилиндър. От съществено значение е пипетата да се напълни в една стъпка до точното изискуемо количество утайка, поради това че твърдите вещества в утайката се утаяват бързо. Ако е взето по-голямо количество, пипетата се изпразва и пълненето започва отначало.
|
|
29.
|
След това се добавя достатъчно количество разтвор на субстрат (точка 17) за получаване на концентрация в сместа от 2 g/l поотделно за хранителния бульон, екстракта от дрожди и D-глюкозата, като същевременно продължава подаването на азот. По-долу е даден пример за партиди за изпитване.
|
Крайна масова концентрация на изпитвания химикал в бутилките за изпитване
(mg/l)
|
Обем на изпитвания химикал
(ml)
|
Реактиви и среди
(ml)
|
|
Изходен разтвор а)10 g/lт. 18
|
Изходен разтвор б)1 g/lт. 18
|
Вода за разреждане
т. 14
|
Инокулум
т. 16
|
Субстрат
т. 17
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Общ обем на бутилката = 160 ml. Обем на течността = 103 ml
Газов обем = 57 ml, или 35,6 % от общия обем.
|
|
|
30.
|
По подобен начин се продухват с азот празни бутилки за изпитване в достатъчно количество за работа с всякакви летливи и неразтворими течни изпитвани химикали (вж. точка 27).
|
Контроли и референтен химикал
|
31.
|
Приготвят се набори бутилки с поне три повторения, съдържащи само утайки и субстрат, за да служат като контроли. Приготвят се бутилки за допълнителни повторения, съдържащи утайка и субстрат плюс достатъчно изходен разтвор на референтния химикал, 3,5-дихлорофенол (точка 21), до получаване на крайна концентрация от 150 mg/l. Тази концентрация следва да потисне получаването на газове с около 50 %. Като алтернатива се приготвя диапазон от концентрации на референтния химикал. Освен това се приготвят четири допълнителни бутилки за измерване на pH, които съдържат утайка, вода, от която е отстранен кислородът, и субстрат. Към двете бутилки за изпитване при най-високата концентрация се добавя изпитваният химикал, а към останалите две бутилки се добавя вода, от която е отстранен кислородът.
|
|
32.
|
Гарантира се, че всички бутилки — с изпитвания химикал, с референтния химикал и с контролите — съдържат един и същ обем (VR) течност; ако е необходимо, за постигане на желания обем се добавя дейонизирана вода, от която е отстранен кислородът (точка 14). Парното пространство трябва да е между 10 % и 40 % от обема на бутилката, като действителната стойност се избира от данните, получени при предварителното изпитване. След добавяне на всички съставки в бутилките иглата, през която се подава газ, се отстранява и всяка бутилка се затваря херметически с гумена запушалка и алуминиева капачка (точка 12 б)), като запушалката се овлажнява с капка дейонизирана вода за улесняване на запушването. Съдържанието на всяка бутилка се размесва чрез разклащане.
|
Инкубиране на бутилки
|
33.
|
Бутилките се прехвърлят в термостатично контролирания инкубатор, в който се поддържа температура 35 °C ± 2 °C, и който за предпочитане е оборудван с устройство за разклащане. Бутилките се инкубират на тъмно. След около 1 час налягането в бутилките се изравнява с атмосферното чрез вкарване на иглата от спринцовка, прикрепена към манометъра (точка 12, в)), през запушалката на всяка следваща бутилка, клапанът се отваря, докато манометърът покаже нула и накрая клапанът се затваря. Иглата следва да бъде вкарана под ъгъл от около 45°, за да се предотврати изтичане на газове от бутилката. Ако бутилките са инкубирани без устройство за разклащане, извършва се ръчно разклащане по два пъти всеки ден по време на целия период на инкубиране, за да достигне равновесие системата. Бутилките се инкубират и се обръщат, за да се предотврати всякаква загуба на газ през запушалката. Обръщането не е подходящо обаче когато неразтворимите изпитвани химикали могат да останат по дъното на бутилката.
|
Измерване на налягането
|
34.
|
Когато бутилките достигнат 35 °C ± 2 °C, стойността на рН на съдържимото в две от четирите бутилки, приготвени за целта, се измерва и записва, а съдържанието се изхвърля; продължава се с инкубирането на тъмно на оставащите бутилки. Налягането в бутилките се измерва и се записва два пъти дневно в продължение на следващите 48 до 72 часа, чрез вкарване на иглата на манометъра през запушалката на всяка следваща бутилка, като между измерванията иглата се подсушава. Всички части на бутилката се поддържат при температурата на инкубирането по време на измерването, което трябва да се извърши възможно най-бързо. Дава се възможност показанията за налягането да се стабилизират, след което същите се регистрират. След това клапанът се отваря за вентилиране и се затваря, когато налягането покаже нулева стойност. Изпитването сепродължава обикновено в продължение на 48 часа, считано от времето на първото изравняване на налягането, определено като „време 0“. Броят на показанията и вентилиранията за летливи химикали следва да бъде ограничен до едно (в края на инкубацията) или две, за да се избегне загуба на изпитвания химикал (10).
|
|
35.
|
Ако показанията за налягането са отрицателни, клапанът не следва да се отваря. Понякога в иглата от спринцовка и в тръбите се натрупва влага, което води до леко отрицателни показания за налягането. В този случай иглата се отстранява, тръбите се разклащат, подсушава се с тъкан и се поставя нова игла.
|
Измерване на pH
|
36.
|
След последното измерване на налягането стойността на рН на съдържимото във всяка бутилката се измерва и се записва.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Представяне на резултатите
|
37.
|
Изчислява се сумата и средната стойност на записаните налягания, получени при всеки интервал от време за всеки набор от бутилки с повторения, изчислява се средната кумулативна брутна стойност на налягането на газовете за всеки интервал от време за всеки набор от повторения. За контролите, бутилките за изпитване и референтните бутилки се начертават кривите на средните кумулативни стойности на получените газове (Pa) спрямо времето. Избира се време върху линейната част от кривата, обикновено 48 часа, и се изчислява процентното потискане (I) за всяка концентрация от уравнение [1]:
|
I = (1 – Pt/PC) × 100
|
[1],
|
където
|
I
|
=
|
процентно потискане в %;
|
|
Pt
|
=
|
налягане на газовете, получено с изпитвания материал в избрания момент (в Pа);
|
|
Pc
|
=
|
налягане на газовете, получено в контролата в същия избран момент (в Pа);
|
Би било уместно да се начертаят двете графики, т.е., графика I спрямо концентрацията и също така спрямо логаритъма на концентрацията, така че да може да бъде избрана кривата, която в по-голяма степен се доближава до линейна зависимост. Стойността на ЕС50 (mg/l) се оценява или визуално, или чрез регресионен анализ от кривата, която в по-голяма степен се доближава до линейна зависимост. За целите на сравнението може да се окаже по-полезно концентрацията на химикала да се изрази в mg химикал на g от общото количество сухо вещество. За получаване на тази концентрация обемната концентрация (mg/l) се разделя на обемната концентрация на твърдите вещества в изсушената утайка (g/l) (точка 16).
|
|
38.
|
Изчислява се процентното потискане, достигнато при единствената концентрация на използвания референтен химикал, или ЕС50, ако са били изследвани достатъчен брой концентрации.
|
|
39.
|
Средното налягане на газовете, получени в контролата Pc(Pa) се превръща в обем по калибрационната крива на манометъра (допълнение 2) и от това се изчислява добивът на газ, изразен като обем, получен за 48 часа от 100 ml неразредена утайка с концентрация на твърди вещества от 2 % (20 g/l) до 4 % (40 g/l).
|
Критерии за валидност
|
40.
|
Резултатите от междулабораторното изпитване на ISO (5) са показали, че референтният химикал (3,5-дихлорофенол) е довел до 50 % потискане на получаването на газове в диапазон от концентрации от 32 mg/l до 510 mg/l при средна стойност 153 mg/l (точка 10). Този диапазон е толкова широк, че като критерии за валидност не могат с необходимата доверителност да бъдат определени твърди гранични стойности на потискането; това следва да стане възможно, когато в нови разработки бъде показано как да се получи инокулум по по-последователен начин. Обемите на газовете, получените в контролните бутилки за 48 часа, са варирали от 21 ml на g сухо вещество в утайката до 149 ml/g (средно 72 ml/g). Не е била установена очевидна връзка между обема на получените газове и съответната стойност на EC50. Крайната стойност на pH е варирала между 6,1 и 7,5.
|
|
41.
|
Изпитването се счита за валидно ако в референтната контрола, съдържаща 150 mg/l 3,5-дихлорофенол, бъде получено потискане над 20 %, в празната контрола са получени повече от 50 ml газове на g сухо вещество и в края на изпитването стойността на pH е в диапазона от 6,2 до 7,5.
|
Протокол от изпитването
|
42.
|
Протоколът от изпитването трябва да съдържа следната информация:
|
|
Изпитван химикал
|
—
|
общоприето наименование, химично наименование, номер по CAS, структурна формула и съответни физични и химични свойства;
|
|
—
|
чистота (онечиствания) на изпитвания химикал.
|
|
|
|
Условия на изпитването
|
—
|
обеми на течността и на парното пространство в съдовете за изпитване;
|
|
—
|
описания на съдовете за изпитване и измерването на газовете (напр. тип на манометъра);
|
|
—
|
прилагане на изпитвания и референтния химикал в системата за изпитване, използвани концентрации на изпитване и използване на разтворители;
|
|
—
|
подробни данни за използвания инокулум: наименование на пречиствателната станция за отпадъчни води, описание на източника на пречистваните отпадъчни води (напр. работна температура, време на задържане на утайката, дали е представлява предимно битови отпадъчни води или промишлени отпадъци и др.), концентрация на твърди вещества, водеща до получаване на газове
|
|
—
|
активност в анаеробния реактор, предходна експозиция или предварително адаптиране към токсични химикали или място на вземане на кал, утайка и т.н.;
|
|
—
|
температура и температурен обхват на инкубирането;
|
|
|
|
брой на повторенията.
|
—
|
стойности на pH в края на изпитването;
|
|
—
|
всички измерени данни, събрани в съдовете за изпитване, празните проби и съдовете с контроли с референтен химикал, при необходимост (напр. налягане в Pa или милибари) в табличен вид;
|
|
—
|
процентно потискане в бутилките за изпитването и в референтните бутилки, и кривите концентрация-потискане;
|
|
—
|
изчисляване на стойностите на ЕС50, изразени в mg/l и mg/g;
|
|
—
|
получени газове за g утайка за 48 часа;
|
|
—
|
причини за всякакво отхвърляне на резултатите от изпитването, обсъждане на резултатите, включително всякакви отклонения от процедурите в настоящия метод за изпитване, и обсъждане на всякакви неочаквани отклонения в резултатите от изпитването, дължащи се на интерференция и грешки;
|
|
—
|
засягане и на въпроса дали целта на изпитването е била да се измери токсичността по отношение на микроорганизми, които са били, или не са били предварително експонирани.
|
|
|
ЛИТЕРАТУРА
|
(1)
|
Глава В.11 от настоящото приложение: Изпитване за потискане дишането на активна утайка.
|
|
(2)
|
Глава В.43 от настоящото приложение: Анаеробна биоразградимост на органични съединения в разградена утайка: метод чрез измерване на получаването на газ.
|
|
(3)
|
International Organisation for Standardisation (2003) ISO 13 641-1 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 1: General Test.
|
|
(4)
|
International Organisation for Standardisation (2003) ISO 13 641-2 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 2: Test for low biomass concentrations.
|
|
(5)
|
ISO (2000) Ring test of ISO 13 641-1 and ISO 13 641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
(6)
|
Swanwick JD, Foulkes M (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Pollut. Control, 70, 58-70.
|
|
(7)
|
HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, In: Methods for the Examination of Waters and Associated Materials UK.
|
|
(8)
|
Shelton DR, Tiedje JM (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47 850-857.
|
|
(9)
|
Battersby NS and Wilson V (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441-2460.
|
|
(10)
|
Wilson V, Painter HA and Battersby NS (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Germany (1990). Eds. Steinberg C and Kettrup A, pp 117-132 (1992).
|
|
(11)
|
Kawahara K, Yakabe Y, Chida T, and Kida K (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007-2018.
|
|
(12)
|
International Organization for Standardization (1995) ISO 10 634 Water Quality — Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(13)
|
International Organization for Standardization (1997) ISO 11 923 Water Quality — Determination of suspended solids by filtration through glass-fibre filters.
|
Допълнение 1
Пример за апаратура за измерване на получения биогаз чрез налягане на газовете
Легенда:
|
1
|
—
|
манометър
|
|
2
|
—
|
3-пътен газонепроницаем клапан
|
|
3
|
—
|
игла от спринцовка
|
|
4
|
—
|
газонепроницаема капсулирана запушалка (капачка за капсулиране и септа)
|
|
5
|
—
|
парно пространство
|
|
6
|
—
|
инокулум с разградена утайка
|
Съдове за изпитване в среда от 35 °C ± 2 °C
Допълнение 2
Преобразуване на показанията на манометъра
Показанията на манометъра могат да бъдат съотнесени с обемите газ чрез стандартна крива и оттам могат да се изчислят обемите газове, получени на g суха утайка за 48 часа. Този индекс на активността се използва като един от критериите, по които да се оцени валидността на резултатите от изпитването. Калибрационната крива се получава чрез инжектиране на известни обеми газ при температура 35 °C ± 2 °C в серумни бутилки, съдържащи обем вода, равен на този на реакционната смес, VR;
|
—
|
Аликвотни части от VR ml вода, съхранявана при температура 35 °C ± 2 °C, се поставят в пет серумни бутилки за изпитване. Бутилките се затварят херметически и се поставят на водна баня при температура 35 °C ± 2 °C за 1 час за достигане на равновесие;
|
|
—
|
Включва се манометърът, оставя се да се стабилизира и се коригира до нула;
|
|
—
|
Иглата от спринцовка се вкарва през капсулираната запушалка на една от бутилките, клапанът се отваря до отчитане на стойност нула от манометъра и след това се затваря;
|
|
—
|
Процедурата се повтаря с останалите бутилки;
|
|
—
|
Във всяка бутилка се инжектира 1 ml въздух при 35 °С ± 2 °С. Иглата (върху манометъра) се вкарва през херметично затворената запушалка на една от бутилките и се дава възможност за стабилизиране на показанията. Показанията за налягането се записват, клапанът се отваря до отчитане на стойност нула от манометъра и след това се затваря;
|
|
—
|
Процедурата се повтаря с останалите бутилки;
|
|
—
|
Цялата процедура се повтаря, като се използват 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml и 50 ml въздух;
|
|
—
|
Начертава се крива на преобразуване на налягането (Pa) спрямо инжектирания обем газ (ml). Откликът на инструмента е линеен в интервала от 0 до 70 000 Ра, и от 0 ml до 50 ml получен газ.
|
Допълнение 3
Идентифицирани фактори, които могат да доведат до погрешни резултати
а) Качество на капачките на бутилките
В търговската мрежа са налични различни видове септи за серумни бутилки; при условията на настоящото изпитване много от тях, включително направени от бутилов каучук, губят херметичността си след пробиване с игла. Понякога налягането се понижава много бавно след пробиването на септата с иглата от спринцовка. За преодоляване на изтичане се препоръчва използване на газонепроницаеми септи (точка 12 б)).
б) Влага в иглата от спринцовка
Понякога в иглата от спринцовка и в тръбите се натрупва влага и това дава леко отрицателни показания за налягането. За коригиране иглата се отстранява, тръбите се разклащат, подсушава се с тъкан и се поставя нова игла (точки 12 в) и 35).
в) Замърсяване с кислород
При анаеробните методи може да се получи грешка в резултат от замърсяване с кислород, което може да доведе до по-ниски стойности на произведените количества газ. В настоящия метод тази възможност следва да бъде сведена до минимум чрез използване на строго анаеробни техники, включително използване на защитна камера с ръкавици.
г) Груби субстрати в утайки
Анаеробното получаване на газ и чувствителността на утайката се влияят от субстрати, които се прехвърлят с инокулува в бутилките за изпитване. Разградената утайка от анаеробните реактори за битови отпадъчни води все още често съдържа видими материали като косми и растителни остатъци от целулоза, които по принцип затрудняват вземането на представителни проби. Чрез прекарване на утайката през сито грубите неразтворими материали могат да бъдат отстранени, което прави вземането на представителни проби по-вероятно (точка 16).
д) Летливи изпитвани химикали
Летливите изпитвани химикали ще бъдат освободени в парното пространство на бутилките за изпитване. Това може да доведе до загуба на част от изпитвания материал от системата по време на пропускането на газове след измерване на налягането, което да доведе до неверни високи стойности на EC50. Грешката може да се намали чрез подходящ избор на съотношението между обемите на течността и на парното пространство и чрез непропускане на газове след измерване на налягането (10).
е) Нелинейност при получаването на газове
Ако графиката на средните кумулативни стойности за получените газове спрямо периода на инкубирането не е приблизително линейна в 48-часовия период, точността на изпитването може да бъде занижена. За да се преодолее този проблем, може да е препоръчително да се използва разграждаща се утайка от друг източник и/или добавяне на по-висока концентрация на изпитван субстрат — хранителен бульон, екстракт от дрожди и глюкоза (точка 29).
Допълнение 4
Прилагане към проби от околната среда с ниска концентрация на биомаса — анаеробна кал, утайки т.н.
ВЪВЕДЕНИЕ
А.1 По принцип специфичната микробна активност (обемът получени газове за g сухо вещество) на срещаща се в природата анаеробна кал, утайки, почви и т.н., е много по-ниска от това на анаеробната утайка с произход от отпадъчни води. Поради това, когато трябва да бъде измерено потискащото въздействие на химикали върху тези по-слабо активни проби, някои от експерименталните условия трябва да бъдат изменени. За тези по-слабо активни проби съществуват два общи начина на действие:
|
а)
|
Извършване на модифицирано предварително изпитване (точка 25) с неразредената проба от кал, почва и т.н. при 35 °С ± 2 °С или при температурата на мястото на вземане на пробата, за постигането на по-точна симулация (като в част 1 от стандарта ISO 13641);
|
|
б)
|
Или извършване на изпитването с разредена (1 на 100) утайка от реактор, за симулиране на слабата активност, очаквана от взетата от околната среда проба, но с поддържане на температура 35 °C ± 2 °C (като в част 2 от стандарта ISO 13641).
|
А.2 Вариант а) може да бъде постигнат, като се следва описаният тук метод (еквивалентен на част 1 от ISO 13641), но е от съществено значение да се направи предварително изпитване (точка 25), за да се установят оптимални условия, освен ако те не са вече известни от предходни изпитвания. Пробата от кал или от утайка трябва да бъде много добре размесена, напр. в хомогенизатор и, ако е необходимо, разредена с малка част вода за разреждане, от която въздухът е предварително отстранен (точка 14), така че да е достатъчно мобилна, за да се прехвърли с помощта на пипета с широк връх или мерителен цилиндър. Ако се приеме, че хранителните съставки могат да са в недостатъчно количество, пробата от кал може да се центрофугира (при анаеробни условия) и повторно да се суспендира в минералната среда, съдържаща екстракт от дрожди (А.11)
А.3 Вариант б). Така ниската активност на пробите от околната среда се наподобява по приемлив начин, но липсва високата концентрация на суспендираните твърди вещества, присъстващи в тези проби. Ролята на тези твърди вещества при потискането не е известна, но е възможно евентуална реакция между изпитваните химикали и съставките на калта, както и адсорбция на изпитваните химикали върху твърдите вещества, да доведе до понижаване на токсичността на изпитвания химикал.
А.4 Температурата е друг важен фактор: за стриктна симулация изпитванията трябва да се правят при температурата на мястото на вземане на пробата, тъй като за различни групи произвеждащи метан консорциуми от бактерии се знае, че функционират в различни температурни обхвати, а именно термофили (~ 30-35 °C), мезофили (20-25 °C) и психрофили (< 20 °C), което може да доведе до проява на различни модели на потискане.
А.5 Продължителност. По време на кръговото изпитване, в част 1 от общото изпитване, чрез използване на неразредена утайка, получаването на газ в рамките на 2-4 дни е било винаги достатъчно, докато в част 2, с разредена едно към сто утайка, за този период получаването на газ е било недостатъчно, ако въобще е имало такова. При описанието на това изпитванеMadsen et al (1996) споменават, че трябва да бъдат дадени поне 7 дни.
Изпитване с ниска концентрация на биомасата (вариант б)
Следните изменения и допълнения следва да бъдат направени за добавяне или замяна на някои съществуващи точки и подточки от основния текст.
А.6 Към точка 6 се добавя: Принцип на изпитването;
„Тази техника може да се използва с разредена 1 към 100 анаеробна утайка, частично за симулиране на слабата активност на кал и утайки. Температурата на инкубиране може да бъде или 35 °С, или тази на мястото, от което е била взета пробата. Тъй като бактериалната активност е много по-ниска в сравнение с неразредената утайка, периодът на инкубирането следва да бъде удължен на най-малко 7 дни.“
А.7 Към точка 12 а) се добавя следното:
„инкубаторът следва да може да работи до температури с долна граница 15 °C.“
А.8 След точка 13 се добавя допълнителен реактив:
„фосфорна киселина (H3PO4), 85 масови % във вода.“
А.9 В края на точка 16 се добавя следното:
„При изпитването се използва крайна концентрация от 0,20 ± 0,05 g/l общо сухо вещество.“
А.10 Точка 17. Субстрат за изпитването
Този субстрат следва да не се използва, а да се замени с екстракт от дрожди (вж. точки 17; А.11, А.12, А.13).
А.11 За разтваряне на анаеробната утайка се изисква минерална среда, включително микроелементи,, като за улеснение към тази среда се добавя органичният субстрат, екстракт от дрожди.
След точка 17 се добавя следното:
|
„а)
|
Минерална среда за изпитване с екстракт от дрожди.
|
Тя се приготвя от 10-кратно концентрирана среда за изпитване (точка 17, б)); А.12) с разтвор на микроелементи (точка 17, в)); А.13). Използва се прясно доставен натриев сулфид нонахидрат (точка 17, б)); А.12) или се измива и изсушава преди използване, за да се гарантира, че разполага с достатъчна редукционна способност. Ако изпитването е проведено без използване на защитна камера с ръкавици (точка 12, й)), концентрацията на натриев сулфид в изходния разтвор следва да се увеличи до 2 g/l (от 1 g/l). Натриев сулфид може също да се добави, до получаване на крайна концентрация 0,2 g/l, от подходящ изходен разтвор през септата на затворените бутилки за изпитване, тъй като тази процедура ще доведе до намаляване на риска от окисление. Като алтернатива може да се използва титанов(III) цитрат (точка 17, б)). Добавя се през септата на затворените бутилки за изпитване, до получаване на концентрация от 0,8 mmol/l до 1,0 mmol/l. Титановият(III) цитрат е високо ефективен и ниско токсичен редуктор, който се изготвя, както следва: Разтварят се 2,94 g тринатриев цитрат дихидрат с 50 ml вода за разреждане, несъдържаща кислород, (точка 14) (което води до 200 mmol/l разтвор) и се добавят 5 ml разтвор на титанов(III) хлорид (15 g/100 ml вода за разреждане). Неутрализира се до pH 7 ± 0,5 с натриев карбонат и се поставя в подходяща серумна бутилка в струя от газообразен азот. Концентрацията на титановия(III) цитрат в този изходен разтвор е 164 mmol/l. Средата за изпитване се използва незабавно или се съхранява при 4 °C за не повече от 1 ден.
|
А.12
|
б)
|
Десетократно концентрирана среда за изпитване, приготвена със следното:
|
безводен калиев дихидрогенфосфат (KH2PO4)
|
2,7 g
|
|
динатриев хидрогенфосфат (Na2HPO4)
|
4,4 g
|
|
(или 11,2 g додекахидрат)
амониев хлорид (NH4Cl)
|
5,3 g
|
|
калциев хлорид дихидрат (CaCl2 · 2H2O)
|
0,75 g
|
|
магнезиев хлорид хексахидрат (MgCl2 · 6H2O)
|
1,0 g
|
|
железен(II) хлорид тетрахидрат (FeCl2 · 4H2O)
|
0,2 g
|
|
ресазурин (редокси индикатор)
|
0,01 g
|
|
натриев сулфид нонахидрат (Na2S · 9H2O)
|
1,0 g
|
|
(или титанов(III) цитрат) крайна концентрация
|
0,8 mmol/l до 1,0 mmol/l
|
|
разтвор на микроелементи (вж. точка 17, в)); А.13)
|
10,0 ml
|
|
екстракт от дрожди
|
100 g
|
|
Разтваря се във вода за разреждане (точка 14) и се долива до:
|
1 000 ml
|
|
|
А.13
|
в)
|
разтвор на микроелементи, приготвен със следното:
|
манганов(II) хлорид тетрахидрат (MnCl2 · 4H2O)
|
0,5 g
|
|
ортоборна киселина (H3BO3)
|
0,05 g
|
|
цинков хлорид (ZnCl2)
|
0,05 g
|
|
меден(II) хлорид (CuCl2)
|
0,03 g
|
|
натриев молибдат дихидрат (Na2MoO4 · 2H2O)
|
0,01 g
|
|
кобалтов(II) хлорид хексахидрат (CoCl2 · 6H2O)
|
1,0 g
|
|
никелов(II) хлорид хексахидрат (NiCl2 · 6H2O)
|
0,1 g
|
|
динатриев селенит (Na2SeO3)
|
0,05 g
|
|
Разтваря се във вода за разреждане (точка 14) и се долива до:
|
1 000 ml“
|
|
А.14 Точка 25: Предварително изпитване
От съществено значение е да се извърши предварително изпитване, както е описано в точка 24, с изключение на това, че концентрацията на твърдите вещества в утайката трябва да бъде една стотна от посочените, т.е., 0,1 g/l, 0,2 g/l и 0,4 g/l. Продължителността на инкубирането трябва да бъде поне 7 дни.
Бележка: В кръговото изпитване (5) парното пространство е било прекомерно високо, в размер на 75 % от общия обем; то следва да бъде в препоръчания обхват от 10 %- 40 %. Относимият критерий е, че обемът газове, получен при около 80 % потискане, следва да може да се измери с приемлива прецизност (например ± 5 % до ± 10 %).
А.15 Точки от 26 до 30: Добавяне на изпитван химикал, инокулум и субстрат.
Добавянията се извършват по същия начин, както е описано в тези точки, но разтворът на субстрата (точка 17) се заменя с изпитваната среда плюс среда от екстракт от дрожди (А.11).
Също така, крайната концентрация на твърдите вещества в утайката се намалява от 2 g/l—4 g/l до 0,2 g/l ± 0,05 g/l (А.9). Два примера за добавяне на съставки към сместа за изпитване са дадени в таблица A.1, която заменя таблицата в точка 29.
А.16 Точка 33: Инкубиране на бутилки
Поради очакваната по-малка скорост на получаване на газове инкубирането се извършва в продължение на най-малко 7 дни.
А.17 Точка 34: Измерване на налягането
Ако се изискват количествата в газовата фаза, прилага се същата процедура за измерване на налягането в парното пространство, както описаната в точка 34. Ако следва да се измерват общите количества на CO2 и CH4, рН на течната фаза се намалява до около pH 2 чрез инжектиране на H3PO4 във всяка съответна бутилка и налягането се измерва след 30 минути разклащне при температурата на изпитването. Независимо от това, повече информация относно качеството на инокулума може да бъде получена чрез измерване на налягането във всяка бутилка преди и след подкисляването. Например когато скоростта на получаване на CO2 е много по-висока от тази на метана, вероятно чувствителността на ферментативните бактерии се е променила и/или въздействието на изпитвания химикал е преференциално върху метаногенните бактерии.
А.18 Точка 36: измерване на pH
Ако следва да се използва H3PO4, особено за измерването на pH, следва да се приготвят няколко допълнителни бутилки, към които се добавя H3PO4.
ПОЗОВАВАНЕ:
Madsen, T, Rasmussen, HB; and Nilsson, L (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No.336, Water Quality Institute, Danish Environment Protection Agency, Copenhagen.
Таблица A.1.
Примери за подготовка на изпитването за партиди за изпитване
|
Съставки на реакционната смес
|
Пример 1
|
Пример 2
|
Нормална последователност на добавянето
|
|
Концентрация на приготвения инокулум (g/l)
|
0,42
|
2,1
|
—
|
|
Обем на добавения инокулум (ml)
|
45
|
9
|
4
|
|
Концентрация на инокулума в бутилките за изпитване (g/l)
|
0,20
|
0,20
|
—
|
|
Обем на добавената среда за изпитване (ml)
|
9
|
9
|
2
|
|
Обем на добавената вода за разреждане (ml)
|
36
|
72
|
3
|
|
Концентрация на екстракта от дрожди в бутилките за изпитване (g/l)
|
9,7
|
9,7
|
—
|
|
Обем на изходния разтвор на изпитвания химикал (ml)
|
3
|
3
|
1
|
|
Общ обем на течността (ml)
|
93
|
93
|
—
|
Допълнение 5
Определения
За целите на настоящия метод за изпитване са използвани следните определения:
|
|
Химикал означава вещество или смес.
|
|
|
Изпитван химикал означава всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
|
В.35 ИЗПИТВАНЕ ЗА ТОКСИЧНОСТ ЗА ВИДОВЕ ОТ РОД LUMBRICULUS С ИЗПОЛЗВАНЕ НА СЕДИМЕНТ С ДОБАВКА В СИСТЕМА СЕДИМЕНТ-ВОДА
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 225 (2007). Хранещият се със седименти ендобентос е с потенциално висока експозиция на свързани със седиментите химикали и следователно трябва да му се отдаде приоритетно внимание, напр. (1), (2), (3). Сред тези хранещи се със седименти водните олигохети играят важна роля в седиментите на водните системи. Чрез биотурбация на седиментите и като служат за жертви на други животни, тези животни могат да окажат силно влияние върху бионаличността на такива химикали за други организми, като рибите, хранещи се с бентос. За разлика от епибентосните организми, ендобентосните водни олигохети (напр. Lumbriculus variegatus) се заравят в седимента и поглъщат частици от него под повърхността му. Това гарантира експозиция на изпитваните организми на изпитвания химикал по всички възможни пътища (напр. контакт със замърсени частици от седимента, както и поглъщане на такива частици, а също и чрез водата между частиците на седимента и водата над седимента).
|
|
2.
|
Настоящият метод за изпитване е предназначен за оценка на въздействието на продължителната експозиция на ендобентосния олигохет Lumbriculus variegatus (Müller) към свързани със седимента химикали. Методът се основава на съществуващите протоколи за изпитване на токсичността на седименти и биоакумулацията, напр. (3), (4), (5), (6), (7), (8), (9), (10). Методът е описан за статични условия на изпитване. Сценарият за експозиция, който се използва в настоящия метод за изпитване, е добавяне на изпитвания химикал към седимента. Използването на седимент с добавка цели да симулира седимент, замърсен с изпитвания химикал.
|
|
3.
|
Химикалите, които трябва да бъдат изпитани с помощта на организми, живеещи в седимента, обикновено се задържат в тази естествена среда за дълги периоди от време. Живеещите в седимента организми могат да бъдат експонирани по различни пътища. Относителната важност на всеки път на експозиция и времето, необходимо за всеки от тях да способства за общото токсично въздействие, зависят от физичните и химичните свойства на съответния химикал и крайната му съдба в организма. За силно адсорбиращите химикали (напр. с log Kow > 5) или за химикали, които образуват ковалентна връзка със седимента, поглъщането на замърсена храна може да бъде значим път на експозиция. За да не се подцени токсичността на такива химикали, храната, необходима за размножаването и растежа на изпитваните организми се добавя към седимента, преди да бъде приложен изпитваният химикал (11). Описаният метод за изпитване е описан достатъчно подробно, така че изпитването да може да бъде проведено, като същевременно се дава възможност за адаптиране на плана на проучването в зависимост от условията в отделните лаборатории и различните характеристики на изпитваните химикали.
|
|
4.
|
Методът за изпитване е насочен към определяне на въздействието на изпитвания химикал върху размножаването и биомасата на изпитваните организми. Измервани биологични параметри са общият брой на преживелите червеи и биомасата (сухо тегло) в края на експозицията. Тези данни се анализират или като се използва регресионен модел, за да се оцени концентрацията, която би предизвикала въздействие от х % (напр. EC50, EC25 и EC10), или като се използва статистическо тестване на хипотези за определяне на концентрацията без наблюдавано въздействие (NOEC) и най-ниската концентрация, при която се наблюдава ефект (LOEC).
|
|
5.
|
Глава В.27 от настоящото приложение, „Изпитване за токсичност за хирономиди в система вода–седимент с използване на седимент с добавка“ (6), предоставя множество важни и полезни данни за прилагането на представения метод за изпитване за токсичност на седименти. Следователно посоченият документ служи като основа, в която са внесени изменения, необходими за провеждането на изпитвания за токсичност на седименти с Lumbriculus variegatus. Други документи, на които има позоваване, са напр. Ръководството на ASTM за определяне на биоакумулацията на свързани със седименти замърсители от бентосни безгръбначни (3), методите на EPA на САЩ за измерване на токсичност и биоакумулация на свързани със седименти замърсители със сладководни безгръбначни (7), и в Ръководството на ASTM за събиране, съхранение, характеризиране и манипулиране на седименти за токсикологични изпитвания и за избор на уреди за вземане на проби, използвани за събиране на бентосни безгръбначни (12). Освен това, практическият опит, получен при кръгово изпитване на метода за изпитване (13), протоколът от кръговото изпитване, както и информация от литературата са важни източници на информация за изготвянето на този документ.
|
ИНФОРМАЦИЯ ЗА НЕОБХОДИМИТЕ УСЛОВИЯ И НАСОКИ
|
6.
|
Информация за изпитвания химикал като напр. мерки за безопасност, правилни условия за съхранение и методи за анализ, следва да бъде получена преди започването на изследването. Насоки за изпитване на химикали с физични и химични свойства, които ги правят трудни за такова изпитване, са дадени в (14).
|
|
7.
|
Преди провеждане на изпитване трябва да бъде известна следната информация за изпитвания химикал:
|
—
|
общоприето наименование, химично наименование (за предпочитане по IUPAC) структурна формула, номер по CAS, чистота;
|
|
|
8.
|
Следната допълнителна информация се счита за полезна преди началото на изпитването:
|
—
|
коефициент на разпределение октанол-вода, Kow;
|
|
—
|
коефициент на разпределение органичен въглерод-вода, изразен като Koc;
|
|
—
|
фототрансформация във вода;
|
|
—
|
повърхностно напрежение.
|
|
|
9.
|
Преди започване на изпитването следва да е получена информация относно някои характеристики на седимента, който ще се използва (7). За подробности вж. точки 22—25;
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
10.
|
Червеи със сходен физиологичен статус (синхронизирани, както е описано в допълнение 5) се експонират на поредица от токсични концентрации, приложени към фазата на седимента от системата седимент—вода. Като среди следва да се използват изкуствен седимент и възстановена вода. Съдовете за изпитване без добавен изпитван химикал служат като контроли. Изпитваният химикал се добавя към седимента в насипно състояние за всяко равнище на концентрация, за да се сведе до минимум варирането между повторенията на всяко равнище на концентрация, и впоследствие изпитваните организми се въвеждат в съдовете за изпитване, в които концентрациите на водата и на седимента са достигнали равновесно състояние (вж. точка 29). Изпитваните животни се експонират на системите седимент—вода за период от 28 дни. С оглед на ниското съдържание на храна в изкуствения седимент, към същия трябва да бъде добавен източник на храна (вж. точки 22 и 23, и допълнение 4), за да се гарантира растежът и размножаването на червеите при контролираните условия. По този начин се гарантира, че изпитваните животни са експонирани както чрез водата и седиментите, така и чрез храната си.
|
|
11.
|
Предпочитаната крайна точка при този тип изследване е ECx (напр. EC50, EC25 и EC10; ефективна концентрация, при която се наблюдава въздействие върху х % от изпитваните организми) съответно за размножаването и биомасата, в сравнение с контролата. Следва обаче да се отбележи, че като се има предвид голямата неопределеност при ниски ECx (напр. EC10, EC25) с изключително високи 95 %-ни доверителни граници (напр. (15)) и статистическата мощност, изчислена по време на тестването на хипотези, ЕС50 се разглежда като най-устойчивата крайна точка. В допълнение, концентрацията без наблюдавано въздействие (NOEC) и най-ниската концентрация, при която се наблюдава ефект (LOEC) могат да се изчислят за биомасата и размножаването, ако планът на изпитването и данните са в подкрепа на тези изчисления (вж. точки 34—38). Целта на изследването, извеждането ECx или NOEC, определя плана на изпитването.
|
РЕФЕРЕНТНИ ИЗПИТВАНИЯ
|
12.
|
Резултатите при контролните организми се очаква да покажат в достатъчна степен капацитета на дадена лаборатория да извършва изпитването и, ако са налични данни за предходни периоди, повторяемостта на изпитването. Освен това референтните изпитвания за токсичност могат да се извършват на редовни интервали с използване на референтно токсично вещество за оценка на чувствителността на изпитваните организми. Референтни изпитвания за токсичност само във водата с продължителност 96 h могат да докажат в задоволителна степен чувствителността и състоянието на изпитваните животни (4) (7). Информация за токсичността на пентахлорофенол (PCP) в пълни изпитвания (28 дни експозиция на седимент с добавка) е включена в допълнение 6 и в протокола от кръговото изпитване на метода за изпитване (13). Острата токсичност на PCP само във вода е описана например в (16). Тази информация може да се използва за сравняване на чувствителността на изпитван организъм в референтни изпитвания с РСР като референтно токсично вещество. Калиев хлорид (KCl) и меден сулфат (CuSO4) се препоръчват като референтни токсични вещества при L. variegatus (4) (7). Към днешна дата установяването на критерии за качество въз основа на данни за токсичността за KCl е трудно поради липсата на данни за L. variegatus в литературата. Информация за токсичността на медта към L. variegatus може да бъде намерена в (17)—(21).
|
ВАЛИДНОСТ НА ИЗПИТВАНЕТО
|
13.
|
За да е валидно дадено изпитване, трябва да бъдат изпълнени следните изисквания:
|
—
|
Кръгово изпитване (13) е показало, че за Lumbriculus variegatus средният брой на живите червеи на повторение при контролите следва да се е увеличил с кратност от най-малко 1,8 в края на експозицията в сравнение с броя на червеите на повторение в началото на експозицията.
|
|
—
|
Стойността на рН на водата над седимента следва да бъде между 6 и 9 по време на изпитването.
|
|
—
|
Концентрацията на кислород във водата над седимента следва да не бъде под 30 % от стойността на насищането с разтворен въздух при температурата на изпитване по време на изпитването.
|
|
ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Система за изпитване
|
14.
|
Препоръчителни са статични системи без обновяване на водата над седимента. Ако отношението на седимента към водата (вж. точка 15) е подходящо, леко аериране обикновено ще е достатъчно за поддържане на качеството на водата на приемливи равнища за изпитваните организми (напр. увеличаване до максимум на стойностите на разтворения кислород, свеждане до минимум на натрупването на екскреторни продукти). Полустатични или проточни системи с периодично или непрекъснато обновяване на водата над седимента следва да се използват само в изключителни случаи, тъй като редовното обновяване на водата над седимента се очаква да засегне химичното равновесие (напр. загуба на изпитвания химикал от системата за изпитване).
|
Съдове и оборудване за изпитването
|
15.
|
Експозицията следва да се извършва в стъклени бехерови чаши с вместимост напр. от 250 ml с диаметър 6 cm. Могат да се използват други стъклени съдове, но те следва да осигуряват подходяща дълбочина на водата над седимента и на самия седимент. Във всеки съд следва бъде получен слой от около 1,5—3 cm формулиран седимент. Съотношението между дебелината на слоя седимент и тази на водата над него трябва да бъде 1:4. Съдовете трябва да бъдат с подходящ капацитет в съответствие със степента на зареждане, т.е., броя на червеите, добавени на единица тегло на седимента (вж. също точка 39).
|
|
16.
|
Съдовете за изпитване и другото оборудване, което ще влезе в контакт с изпитвания химикал, следва да бъдат изцяло стъклени или от друг химически инертен материал. Трябва внимателно да се избягва използването на материали за всички части от оборудването, които могат да разтворят или абсорбират изпитвани химикали, или да освободят други химикали и да окажат неблагоприятно въздействие върху изпитваните животни. За оборудването, което влиза в контакт с изпитвателната среда, следва да се използват политетрафлуороетилен, неръждаема стомана и/или стъкло. За органични химикали, за които е известно, че са адсорбируеми от стъкло, може да се наложи използването на силанизирани стъкла. В такива ситуации оборудването трябва да се изхвърли след употреба.
|
Животински видове за изпитването
|
17.
|
Използваният вид за този тип изследване е сладководният олигохет Lumbriculus variegatus (Müller). Този вид е толерантен към широка гама от типове седименти и широко се използва при изпитвания за за токсичност на седименти и за биоакумулация [напр. (3), (5), (7), (9), (13), (15), (16), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34), (35)]. Произходът на изпитваните животни, потвърждаването на видовата идентичност (напр. (36)), както и условията на отглеждането следва да се протоколират. Идентификацията на видовете не е задължителна преди всяко изпитване, ако организмите са получени при отглеждане в изпитващата лаборатория.
|
Отглеждане на изпитваните организми
|
18.
|
С цел да се разполага с достатъчен брой червеи за провеждане на изпитвания за токсичност на седименти е полезно да се поддържат условия на непрекъснато отглеждане на червеите в лаборатория. Насоки за методите на отглеждане в лаборатория за Lumbriculus variegatus и източници на стартерни култури са дадени в допълнение 5. За подробни данни относно отглеждането на този вид вж. (3), (7), (27).
|
|
19.
|
За да се гарантира, че изпитванията се извършват с животни от същия вид, създаването на едновидови култури се препоръчва настоятелно. Гарантира се, че културите и особено червеите, използвани при изпитванията, не страдат от видими заболявания и отклонения.
|
Вода
|
20.
|
За използване като вода над седимента в изпитванията се препоръчва възстановена вода съгласно глава В.1 от настоящото приложение (37); тя може да се използва и в лабораторните култури от червеи (за приготвянето виж допълнение 2). Ако е необходимо, може да се използва природна вода. Избраната вода трябва да е с качество, което да позволява растежа и размножаването на изпитваните видове за периодите на аклиматизация и изпитване, без същите да показват необичаен външен вид или поведение. Доказано е, че Lumbriculus variegatus преживява, нараства и се размножава в този вид вода (30), и е предоставено максимално стандартизиране на условията на изпитване и отглеждане. Ако се използва възстановена вода, нейният състав трябва да бъде протоколиран и преди употреба водата трябва да се охарактеризира поне чрез pH, съдържание на кислород и твърдост (изразена в mg CaCO3/l). Анализът на водата за микрозамърсители преди нейната употреба би могъл да предостави полезна информация (виж например допълнение 3).
|
|
21.
|
Стойността на рН на водата над седимента следва да бъде в интервала от 6,0 до 9,0 (вж. точка 13). Ако се очаква увеличаване на амоняка, счита се за полезно стойността на pH да се запази между 6,0 и 8,0. Например при изпитване на слаби органични киселини се препоръчва рН да се коригира чрез буфериране на водата, която ще се използва в изпитването, както е описано напр. в (16). При природната вода общата твърдост на водата, която ще се използва при изпитването, следва да бъде между 90 и 300 mg CaCO3 на литър. В допълнение 3 са обобщени допълнителните критерии за вода, приемлива за използване за разреждане в съответствие с насоки ОИСР № 210 (38).
|
Седимент
|
22.
|
Тъй като незамърсени естествени седименти от конкретен източник могат да не бъдат достъпни през цялата година, а местните организми, както и наличието на микрозамърсители, могат да повлияят на изпитването, за употреба се предпочита формулиран седимент (наричан още възстановен, изкуствен или синтетичен седимент). Използването на формулиран седимент свежда до минимум варирането в условията на изпитването, както и въвеждането на местната фауна. Следният формулиран седимент се основава на изкуствения седимент по (6), (39) и (40). Препоръчва се използването му при този тип изпитване ((6), (10), (30), (41), (42), (43)):
|
а)
|
4—5 % торфен мъх (сухо тегло); важно е да се използва торф под формата на прах, степен на разграждане: „средна“, ситно смлян (размер на частиците ≤ 0,5 mm) и изсушен само с въздух.
|
|
б)
|
20 ± 1 % каолин (сухо тегло) (за предпочитане съдържанието на каолинит да е повече от 30 %);
|
|
в)
|
75—76 % кварцов пясък (сухо тегло) (фин пясък, размер на зърната: ≤ 2 mm, но > 50 % от частиците следва да бъдат в интервала 50-200 μm).
|
|
г)
|
Дейонизирана вода, 30–50 % от сухото тегло на седимента, в допълнение към сухите съставки на седимента.
|
|
д)
|
добавя се химически чист калциев карбонат (CaCO3), за да се коригира рН на крайната смес на седимента.
|
|
е)
|
Общото съдържание на органичен въглерод в крайната смес следва да бъде 2 % (± 0,5 %) от сухото тегло на седимента и следва да бъде коригирано, като се използват подходящи количества торф и пясък, в съответствие с букви а) и в).
|
|
ж)
|
Храната, като например стрити на прах листа от коприва (Urtica sp., в съответствие с аптечните стандарти, за консумация от човека) или смес от стрити на прах листа от Urtica sp. с алфа-целулоза, параграф (1:1), представляващо 0,4—0,5 % от сухото тегло на седимента, в допълнение към сухите съставки на седимента; за подробно обяснение вж. допълнение 4.
|
|
|
23.
|
Източниците на торф, каолин, храна и пясък трябва да са известни. В допълнение към буква ж), в глава В.27 от настоящото приложение (6) се изброяват алтернативни растителни материали за използване като източник на храна: обезводнени листа от черница (Morus alba), бяла детелина (Trifolium repens), спанак (Spinacia oleracea) или житни треви.
|
|
24.
|
Избраният източник на храна следва да се добави преди или по време на добавянето на изпитвания химикал към седимента. На избрания източник на храна следва да се даде възможност най-малко за приемливо размножаване в контролите. Полезна информация преди използването на изкуствения седимент може да се получи от анализа на изкуствения седимент или на компонентите му за микрозамърсители. Пример за приготвянето на формулирания седимент е даден в допълнение 4. Допустимо е също и смесването на сухи съставки, ако се докаже, че след добавянето на водата над седимента не настъпва разделяне на съставките (напр. изплуване на торфени частици), и че торфът или седиментът е подготвен в необходимата степен (виж също точка 25 и допълнение 4). Изкуственият седимент следва да бъде характеризиран най-малко по отношение на произход на съставките, механичен състав (процент на пясък, прах и глина), общо съдържание на органичен въглерод (ТОС), съдържание на вода и pH. Измерването на редокси потенциалане е задължително.
|
|
25.
|
Ако се изисква, например за конкретни цели на изпитвания, естествените седименти от незамърсени източници също могат да бъдат използвани като седимент за изпитванията или за отглеждане (3). Ако обаче се използва естествен седимент, той следва да бъде характеризиран най-малко по отношение на произход (място, от което е взет), рН и амоняк във водата между частиците на седимента, общо съдържание на органичен въглерод и съдържание на азот, зърнометричен състав (процент на пясък, прах и глина) и процент на съдържание на вода (7), и той трябва да не съдържа никакво замърсяване и други организми, които биха могли да се конкурират с изпитваните организми или за които изпитваните организми да са жертви. Измерването на редокси потенциала и на катионообменния капацитет не е задължително. Препоръчва се също така преди добавянето на изпитвания химикал естественият седимент да бъде аклиматизиран в продължение на седем дни при същите условия, които ще преобладават при последващото провеждане на изпитване. В края на този период за аклиматизация водата над седимента следва да се отстрани и изхвърли.
|
|
26.
|
Седиментът, който ще се използва, трябва да е с качество, което да позволява преживяването и размножаването на контролните видове за периода на експозицията, без същите да показват необичаен външен вид или поведение. Червеите от контролните групи трябва да могат да се заравят в седимента и да поглъщат седимент. Размножаването в контролите трябва да е в съответствие най-малко с критериите за валидност, както са описани в точка 13. Наличието или отсъствието на фекални пелети по повърхността на седимента, които показват поглъщане на седимент от червеите, следва да бъдат записвани и могат да бъдат от полза при интерпретирането на резултатите от изпитването по отношение на начините на експозиция. Допълнителна информация за поглъщане на седимент може да бъде получена чрез използването на методи, описани в (24), (25), (44) и (45), в които се уточняват поглъщането на седимент или изборът на частици при изпитваните организми.
|
|
27.
|
Процедурите по боравене с естествени седименти преди употреба в лабораториите са описани в (3), (7) и (12). Приготвянето и съхранение на изкуствения седимент, препоръчан за използване в изпитването с Lumbriculus, е описан в допълнение 4.
|
Прилагане на изпитвания химикал
|
28.
|
Изпитваният химикал следва да се добави към седимента. Тъй като се очаква повечето изпитвани химикали да имат малка разтворимост във вода, те следва да се разтворят в подходящ органичен разтворител (например ацетон, n-хексан, циклохексан) в обеми, които са възможно най-малки, с цел подготовка на изходния разтвор. Изходният разтвор следва да се разреди със същия разтворител за приготвяне на разтворите за изпитване. Токсичността и летливостта на разтворителя, а също и разтворимостта на изпитвания химикал в избрания разтворител следва да са главните критерии за избор на подходящо средство за повишаване на разтворимостта. За всяко равнище на концентрация трябва да бъде използван същият обем на съответстващия разтвор. Седиментът трябва да се добави изцяло за всяко равнище на концентрация, за да се сведе до минимум варирането на концентрацията на изпитвания химикал между повторенията. След това всеки от изпитваните разтвори се смесва с кварцов пясък, както е описано в точка 22 (напр. 10 g кварцов пясък за всеки съд за изпитване). За пълното потапяне на кварцовия пясък за достатъчен се счита обем от 0,20—0,25 ml на g пясък. След това разтворителят се изпарява до сухо. С цел да се сведат до минимум загубите чрез съизпарение на изпитвания химикал (напр. в зависимост от парното налягане на химикала) пясъкът с покритието следва да бъде използван незабавно след сушенето. Сухият пясък се смесва с необходимото количество формулиран седимент от съответното равнище на концентрация. Количеството пясък, добавен чрез сместа изпитван химикал—пясък, трябва да се вземе предвид при приготвянето на седимента (т.е., седиментът трябва следователно да се приготвя с по-малко количество пясък). Основното предимство на тази процедура е, че почти не се въвежда разтворител в седимента (7). Като алтернатива, например за събран в полеви условия седимент, изпитваният химикал може да се прибави чрез добавяне в част от седимента, изсушена и фино стрита, както е описано по-горе за кварцовия пясък, или чрез размесване на изпитвания химикал с влажния седимент с последващо изпаряване на евентуалното средство за повишаване на разтворимостта. Трябва да се внимава изпитваният химикал, добавен към седимента, да бъде старателно и равномерно разпределен в целия му обем. Ако е необходимо, може да се анализират подпроби за потвърждаване на целевите концентрации в седимента и за определяне степента на хомогенност. Също така може да бъде полезно да се анализират подпроби от изпитваните разтвори за потвърждаване на целевите концентрации в седимента. Тъй като се използва разтворител за нанасяне на покритие от изпитвания химикал върху кварцов пясък, следва да бъде използвана контрола на разтворител, която се приготвя със същото количество разтворител като изпитваните седименти. Методът, използван за добавяне на химикала, и аргументите за избор на конкретна процедура за добавяне, ако са различни от описаните по-горе, следва да бъдат протоколирани. Методът за добавяне може да бъде адаптиран към физичните и химичните свойства на изпитвания химикал, например за избягване на дължащи се на летливост загуби при добавяне или достигане на равновесие. Допълнителни насоки относно процедурите за добавяне се съдържат в „Environment Canada (1995)“ (46).
|
|
29.
|
След като седиментът с добавка е приготвен, разпределен по съдовете за повторенията и залят с водата за изпитването, желателно е да се даде възможност за разпределение на изпитвания химикал от седимента във водната фаза (напр. (3) (7) (9)). За препоръчване е това да стане при температурата и аерирането, използвани при изпитването. Подходящото време за установяване на равновесие зависи от седимента и химикалите и може да варира от няколко часа до дни, дори до няколко (4—5) седмици в редки случаи (напр. (27)(47)). В това изпитване не се чака до достигане на равновесие, но се препоръчва период за достигане на равновесие от 48 часа до 7 дни. По този начин времето за разграждане на изпитвания химикал ще бъде сведено до минимум. В зависимост от целта на изследването, например когато трябва да се симулират условията в околната среда, седиментът с добавката може да се остави за по-дълъг период с оглед достигане на равновесие или зреене.
|
|
30.
|
В края на този период за достигане на равновесие трябва да се вземат проби поне от водата над седимента, както и цялостно от седимента, най-малко при най-високата и при една по-ниска концентрация, за анализ на концентрацията на изпитвания химикал. Посочените аналитични определяния на изпитвания химикал следва да дадат възможност за изчисляване на масовия баланс и за изразяване на резултатите въз основа на измерените начални концентрации. Като цяло вземането на проби нарушава или разрушава системата седимент-вода. Следователно обикновено не е възможно да се използват същите повторения за вземане на проби от седимента и за червеи. Трябва да бъдат приготвени допълнителни „аналитични“ съдове с подходящи размери, които да бъдат третирани по същия начин (включително наличието на организми за изпитването), но които не се използват за биологични наблюдения. Размерите на съда следва да бъдат избрани така, че да се получат количествата от проби, изисквани от метода за анализ. Подробности за пробовземането са дадени в точка 53.
|
ПРОВЕЖДАНЕ НА ИЗПИТВАНЕТО
Предварително изпитване
|
31.
|
Ако няма налична информация за токсичността на изпитвания химикал за Lumbriculus variegatus, може да е полезно да се извърши предварителен опит с цел определяне на диапазона от концентрации, които да се изпитат в окончателното изпитване, и оптимизирне на условията на изпитването при окончателното изпитване. За тази цел се използва поредица от концентрации на изпитвания химикал, в която те са много раздалечени една от друга. Червеите се експонират на всяка една концентрация на изпитвания химикал за даден период от време (например 28 дни, както при окончателното изпитване), което позволява оценяване на подходящите концентрации за изпитването; не са необходими повторения. Поведението на червеите, например избягването на седимента, което може да се дължи на изпитвания химикал и/или на седимента, следва да се наблюдава и записват по време на предварителното изпитване. Концентрации над 1 000 mg/kg сухо тегло на седимента следва да не се изпитват при предварителните изпитвания.
|
Окончателно изпитване
|
32.
|
При окончателното изпитване следва да се използват най-малко пет концентрации, които следва да се изберат въз основа на резултатите от предварителното изпитване за определяне на обхвата (точка 31) и както е описано в параграфи 35, 36, 37 и 38.
|
|
33.
|
В допълнение към изпитваната поредица се изпитва и контрола (за повторенията вж. точки 36, 37 и 38), съдържаща всички съставки, с изключение на изпитвания химикал. Ако за прилагане на изпитвания химикал е използвано средство за повишаване на разтворимостта, то следва да не оказва значително въздействие върху изпитваните организми, което се изяснява от допълнителна контрола само с разтворител.
|
Планиране на изпитването
|
34.
|
Планирането на изпитването се изразява в избор на броя на стойностите на концентрацията на изпитване и интервалите между тези стойности, броя на съдовете за всяка концентрация и броя на червеите, добавени във всеки съд. В точки 35, 36, 37 и 38 са описани планове на изпитване за оценка на ECx, за оценка на NOEC и за провеждане на гранично изпитване.
|
|
35.
|
Концентрацията, при която се проявява въздействие (напр. EC50, EC25, EC10), и диапазонът от концентрации, над който въздействието на изпитвания химикал е от значение, следва да бъдат обхванати от концентрациите, включени в изпитването. Следва да се избягват екстраполации за стойности, много по-ниски от най-ниската концентрация на въздействие или по-високи от най-високата концентрация на изпитване. Ако в изключителни случаи се прави подобна екстраполация, трябва да се даде пълно обяснение в протокола.
|
|
36.
|
Ако трябва да се направи оценка на ECx, следва да се направи изпитване при най-малко пет концентрации и минимум по три повторения за всяка концентрация; препоръчват се шест повторения за контролата или, ако се използва, за контролата на разтворител, за да се подобри оценката на варирането на контролата. Във всички случаи, препоръчва се да се използват достатъчно стойности на концентрациите на изпитване, за да е възможна удовлетворителна оценка чрез модела. Кратността между концентрациите не бива да бъде по-голяма от две (може да се направи изключение в случаите, в които кривата на зависимостта концентрация-отклик има твърде слаб наклон). Броят на повторенията за всяко третиране може да се намали, ако се увеличи броят на изпитваните концентрации с отклик в интервала от 5 – 95 %. Увеличаването на броя на повторенията или съкращаването на интервала между концентрациите обикновено води до стесняване на доверителния интервал на изпитването.
|
|
37.
|
Ако се прави оценка на стойностите на NOEC/LOEC, препоръчват се най-малко пет концентрации на изпитване с най-малко четири повторения (препоръчват се шест повторения за контролата или, ако се използва, за контролата на разтворител, за да се подобри оценката на варирането на контролата), като кратността между стойностите на концентрациите не бива да е по-голяма от две. Известна информация за статистическата мощност, установена по време на тестването на хипотезите в кръговото изпитване на метода за изпитване, е дадена в допълнение 6.
|
|
38.
|
Може да се предприеме гранично изпитване (с една концентрация за изпитване и контроли), ако не се очаква наблюдаване на въздействие нагоре до 1 000 mg/kg сухо тегло на седимент (напр. от предварително изпитване за определяне на обхвата), или ако изпитване при една концентрация ще бъде достатъчно, за да се потвърди представляваща интерес стойност на NOEC. В последния случай в протокола от изпитването трябва да бъде включена подробна обосновка за избора на пределна концентрация. Предназначението на граничното изпитване е да се извърши изпитване при достатъчно висока концентрация, така че да се позволи на лицата, взимащи решения, да отхвърлят възможно токсично въздействие на изпитвания химикал, като за прагова стойност се избира концентрация, каквато не се очаква да се прояви при каквато и да било ситуация. Препоръчва се 1 000 mg/kg (сухо тегло). Обикновено са необходими най-малко шест повторения както на третираните проби, така и на контролите. Известна информация за статистическата мощност, установена по време на тестването на хипотезите в кръговото изпитване на метода за изпитване, е дадена в допълнение 6.
|
Условия на експозиция
Изпитвани организми
|
39.
|
Изпитването се извършва с най-малко 10 червея за всяко повторение, използвано за определяне на биологичните параметри. Броят на червеите съответства приблизително на 50—100 mg влажна биомаса. При допускане за сухо съдържание от 17,1 % (48), това води до приблизително 9—17 mg суха биомаса за съд. EPA на САЩ (2000 (7)) препоръчва на степен на зареждане не по-голяма от 1: 50 (суха биомаса: TOC). За формулирания седимент, описан в точка 22, това съответства на около 43 g седимент (сухо тегло) на 10 червея при съдържание на ТОС от 2,0 % от сухия седимент. В случаите, в които се използват повече от 10 червея на съд, количеството на седимента и на водата над седимента следва да бъде съответно коригирано.
|
|
40.
|
Всички червеи, използвани в дадено изпитване, следва да идват от един и същ източник, и да бъдат индивиди със сходен физиологичен статус (вж. допълнение 5). Следва да бъдат избрани червеи със сходен размер (вж. точка 39). Препоръчва се преди изпитването да се претегли подпроба от партидата или запаса от червеи, за да се оцени средното тегло.
|
|
41.
|
Червеите, които трябва да се използват при дадено изпитване, се отстраняват от културата (вж. допълнение 5 за повече подробности). Големите (полово зрели) животни, които не показват признаци на неотдавнашно разкъсване, се прехвърлят в стъклени блюда (напр. блюда на Петри), съдържащи чиста вода. Впоследствие те се синхронизират, както е описано в допълнение 5. След регенериране за период от 10 до 14 дни за изпитването следва да се използват интактните цели червеи със сходен размер, които активно плават или пълзят след лек механичен стимул. Ако условията на изпитването се различават от условията на отглеждането (например температура, режим на осветление и вода над седимента), фаза от напр. 24 h при същите като изпитването температура, режим на осветление и вода над седимента следва да е достатъчна за адаптирането на червеите към условията на изпитване. Адаптираните олигохети следва да се разпределят на случаен принцип в съдовете за изпитване.
|
Хранене
|
42.
|
Тъй като храна се добавя към седимента преди (или по време на) прилагането на изпитвания химикал, червеите не се захранват допълнително по време на изпитването.
|
Светлина и температура
|
43.
|
Продължителността на излагане на светлина в културата и при изпитването обикновено е 16 часа (3), (7). Интензитетът на светлината трябва да бъде поддържан нисък (напр. 100-500 lx), за да се симулират естествените условия на повърхността на седимента, и се измерва поне веднъж по време на периода на експозиция. Температурата трябва да бъде 20 °C ± 2 °C по време на цялото изпитване. Разликата в температурите между съдовете за изпитване, измерена на зададена дата, трябва да не е по-висока от ± 1 °C. Съдовете за изпитване следва да се поставят в инкубатора за изпитване или в зоната за изпитване на случаен принцип, например с цел да се сведе до минимум изместването на стойностите на размножаването, дължащо се на местоположението на съда.
|
Аериране
|
44.
|
Водата над седимента в съдовете за изпитване следва леко да се аерира (напр. 2-4 мехурчета в секунда) с помощта на пипета „Пастьор“, разположена на приблизително 2 cm над повърхността на седимента, за да се ограничи максимално нарушаването на седимента. Следва да се вземат мерки концентрацията на разтворения кислород да не се понижава под 30 % от стойността на насищането с разтворен въздух (ASV). Снабдяването с въздух следва да се контролира и, ако е необходимо, да се коригира поне веднъж на ден в работните дни.
|
Измерване на качеството на водата
|
45.
|
Във водата над седимента трябва да се измерват следните параметри за качество на водата:
|
Температура:
|
поне в един съд за изпитване на всяко равнище на концентрация и в един съд за изпитване от контролите веднъж седмично и в началото и в края на периода на експозиция; Ако е възможно, температурата в заобикалящата среда (въздух от околната среда или водна баня) може да се записва допълнително, напр. на всеки час;
|
|
Съдържание на разтворения кислород:
|
поне в един съд за изпитване на всяко равнище на концентрация и в един съд за изпитване от контролите веднъж седмично и в началото и в края на периода на експозиция; изразено като mg/l и стойността на ASV (%);
|
|
Снабдяване с въздух:
|
следва да бъде контролирано поне веднъж на ден в работните дни и, ако е необходимо, коригирано;
|
|
pH:
|
поне в един съд за изпитване на всяко равнище на концентрация и в един съд за изпитване от контролите веднъж седмично и в началото и в края на периода на експозиция;
|
|
Обща твърдост на водата:
|
най-малко в едно повторение на контролите и в един съд за изпитване при най-високата концентрация в началото и в края на периода на експозиция; изразена като mg/l CaCO3;
|
|
Общо съдържание на амоняк:
|
най-малко в едно повторение на контролите и в един съд за изпитване за всяка концентрация в началото на периода на експозиция, и впоследствие 3 пъти в седмицата; изразено като mg/l NH4
+ или NH3 или общо азот от амоняк.
|
Ако измерването на параметри за качество на водата изисква отстраняване на значителни водни проби от съдовете, може да е препоръчително да се приготвят отделни съдове за измерванията на качеството на водата, така че да не се променя обемното съотношение на водата към седимента.
|
Биологични наблюдения
|
46.
|
По време на експозицията съдовете за изпитване следва да бъдат наблюдавани, за да се оценят визуално всякакви разлики в поведението при червеите (напр. избягване на седимента, фекални пелети, видими върху повърхността на седимента) в сравнение с контролите. Наблюденията следва да се записват.
|
|
47.
|
В края на изпитването всяко повторение се изследва (допълнителните съдове, определени за химични анализи, могат да бъдат изключени от разглеждането). Трябва да се използва подходящ метод за обратно извличане на всички червеи от съда за изпитване. Следва да се вземат мерки всички червеи да бъдат извлечени без наранявания. Един от възможните методи е пресяване на червеите от седимента. Може да се използва мрежа от неръждаема стомана с подходящ размер на отворите. По-голямата част от водата над седимента се отдекантира внимателно, а оставащите седимент и вода се разбъркват до каша, която може да премине през ситото. При използване на отвори с размер 500 μm повечето от частиците на седимента преминават много бързо през ситото; независимо от това, пресяването следва да се извърши бързо, за да се не се допусне пълзене на червеите в ситото или през него. При използване на отвори с размер 250 μm се предотвратява пълзенето на червеите в ситото или през него; Независимо от това следва да се внимава колкото е възможно по-малко частици от седимента да се задържат върху мрежата. Пресятата каша от всеки съд с повторение може да бъде прекарана през сито за втори път, за да се гарантира, че са извлечени всички червеи. Алтернативен метод би могъл да бъде затоплянето на седимента чрез поставяне на съдовете за изпитване във водна баня при температура 50—60 °C; червеите напускат седимента и могат да бъдат събрани от повърхността на седимента с използване на пипета с широк отвор с огнева полировка. Друг алтернативен метод би могъл да бъде изготвянето на каша от седимент и поставянето на тази каша в плитко блюдо с подходящ размер. От плиткия слой на кашата червеите могат да бъдат взети със стоманена игла или часовникарска пинсета (която следва да се използва по-скоро като вилица, отколкото като щипци, за да се избегне нараняването на червеите) и прехвърлени в чиста вода. След отделяне на червеите от кашата от седимент, те се измиват в средата за изпитване и се преброяват.
|
|
48.
|
Независимо от използвания метод, лабораториите следва да докажат, че техният персонал е в състояние да извлече обратно най-малко средно 90 % от организмите от цялото количество седимент. Например, определен брой от изпитвани организми може да се добави към седимент в контрола или към изпитван седименти, и извличането би могло да се определи след 1 час (7).
|
|
49.
|
Общият брой на живите и мъртви индивиди на повторение трябва да бъде записан и оценен. Следните групи от червеи се смятат за мъртви:
|
а)
|
няма реакция след лек механичен стимул
|
|
б)
|
има признаци за разлагане (в съчетание с „а“)
|
|
в)
|
брой на липсващите червеи
|
Освен това, живите червеи могат да бъдат причислени към една от следните три групи:
|
а)
|
големи цели червеи (полово зрели) без регенерирани части на тялото
|
|
б)
|
цели червеи с регенерирани, по-светло оцветени телесни зони (т.е. с нова задна част, с нова предна част, или с нови и задна, и предна част)
|
|
в)
|
разкъсани червеи (т.е. наскоро разкъсани червеи с нерегенерирани телесни зони)
|
Тези допълнителни наблюдения не са задължителни, но могат да бъдат използвани за допълнително тълкуване на биологичните резултати (например, голям брой червеи, причислени към група „C“, може да означава забавяне на размножаването или регенерация при дадено третиране). Освен това, ако се наблюдават разлики във външния вид (напр. увреждания на външната обвивка, едематозни участъци от тялото) между третираните и контролните червеи, те следва да бъдат записани.
|
|
50.
|
Незабавно след преброяването/оценката, живите червеи, открити във всяко повторение, се прехвърлят върху изсушени, предварително претеглени и етикетирани блюда за теглене (по едно за всяко повторение), и се умъртвяват с помощта на една капка етанол на блюдо за теглене. Блюдата за теглене се поставят в пещ за сушене при 100 ± 5 °C, за изсушаване през нощта, след което се претеглят след охлаждане в сушилня, и се определя сухото тегло на червеите (за предпочитане в g, с точност май-малко 4 знака след десетичната запетая).
|
|
51.
|
В допълнение към общото сухо тегло, сухото тегло без пепел може да бъде определено както е описано в (49), за да се отчетат произхождащите от погълнатия седимент неорганични съставки, налични в храносмилателния тракт на червеите.
|
|
52.
|
Биомасата се определя като обща биомаса за повторение, включително полово зрелите и новородените червеи. Мъртвите червеи не следва да се вземат предвид за определяне на биомасата в едно повторение.
|
Проверка на концентрацията на изпитвания химикал
Пробовземане
|
53.
|
Проби за химичен анализ на изпитвания химикал следва да се вземат като минимум при най-високата и при една по-ниска концентрация, най-малко в края на фаза на достигане на равновесие (преди добавянето на изпитваните организми) и в края на изпитването. Трябва да се вземат проби за анализ най-малко от самия седимент и от водата над него. На всяка дата на вземане на пробата следва да се вземат най-малко по две проби от всяка матрица и от всяко третиране. Една от пробите от повторението може да се съхранява като резервна (за анализ например в случай, че първоначалният анализ попадне извън диапазона ± 20 % от номиналната концентрация). В случай на специфични химически свойства, например ако се очаква бързо разграждане на изпитвания химикал, графикът за анализа може да се прецизира (напр. по-често вземане на проби, анализ на повече равнища на концентрация) въз основа на експертна преценка. В такъв случай пробите могат да се вземат на междинни дати за вземане на проби (напр. на ден седми след началото на експозицията).
|
|
54.
|
Проби от водата над седимента следва да се вземат чрез внимателно декантиране или източване със сифон на водата над седимента, така че да се сведе до минимум нарушаването на седимента. Записват се обемите на взетите проби.
|
|
55.
|
След като водата над седимента е отстранена, седиментът се хомогенизира и се прехвърля в подходящ съд. Теглото на пробата от влажния седимент се записва.
|
|
56.
|
Ако в допълнение се изисква анализ на изпитвания химикал във водата между частиците на седимента, хомогенизираните и претеглени проби от седимента трябва да се центрофугират за получаване на водата между частиците на седимента. Например, около 200 ml влажен седимент може да се напълни в 250 ml бехерови чаши за центрофугиране. След това пробите следва да се центрофугират без филтруване, за да се изолира водата между частиците на седимента, например на 10 000 ± 600 × g за 30—60 min. при температура, не по-висока от температурата, при която се провежда изпитването. След центрофугирането супернатантната течност се декантира или се отстранява с пипета, като се внимава да не се въвеждат частици седимент, и обемът се записва. Теглото на оставащия седимент се записва. Определянето на сухото тегло на седимента на всяка дата на пробовземане може да улесни оценката на масовия баланс или аналитичния добив на изпитвания химикал в системата вода-седимент. В някои случаи може да не е възможно да се анализират концентрациите във водата между частиците на седимента, тъй като пробата е с много малък размер.
|
|
57.
|
Ако не се извършват незабавни анализи, пробите следва да се съхраняват с помощта на подходящ метод, напр. при условията за съхранение, препоръчани за минимално разграждане на конкретния изпитван химикал (напр. пробите от околната среда обикновено се съхраняват при – 18 °С на тъмно). Информация за правилните условия за съхранение на конкретния изпитван химикал — например продължителност и температура на съхранение, процедури за екстракция и др. — следва да бъде получена преди започването на изследването.
|
Метод за анализ
|
58.
|
Понеже цялата процедура се обуславя по същество от точността, прецизността и чувствителността на метода за анализ, използван за изпитвания химикал, проверява се експериментално дали прецизността и възпроизводимостта на химичния анализ, а също и аналитичният добив на изпитвания химикал от водата и седимента, са задоволителни за конкретния метод най-малко при най-ниската и при най-високата концентрация на изпитване. Следва да се провери също така дали изпитваният химикал не е откриваем в контролните камери в концентрации, които са по-високи от границата за количествено определяне. Ако е необходимо, номиналните концентрации за аналитичния добив в пробите за качествен контрол с добавка (напр. в случаите, в които аналитичният добив е извън 80-120 % от добавеното количество) се коригират. По време на изпитването с всички проби следва да се борави по начин, който намалява до минимум замърсяването и загубите (които напр. могат да се получат при адсорбция на изпитвания химикал от устройството за вземане на проба).
|
|
59.
|
Аналитичният добив на изпитвания химикал, границата на количествено определяне и границата на откриване в седимента и водата следва да се записват и протоколират.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
60.
|
Основните задължителни зависими величини при изпитването, които трябва да бъде оценени от статистическа гледна точка, са биомасата и общият брой червеи на повторение. По избор могат също да бъдат оценени размножаването (като увеличение на броя на червеите) и растежът (като увеличение на сухата биомаса). В този случай следва да се получи оценка на сухото тегло на червеите в началото на експозицията, например, чрез измерване на сухото тегло на представителна подпроба от партидата на синхронизирани червеи, които ще се използват за изпитването.
|
|
61.
|
Въпреки че смъртността не представлява крайна точка на това изпитване, тя следва да се оцени в максималната възможна степен. С цел да се изчисли смъртността, броят на червеите, които не реагират на лек механичен стимул или показват признаци на разграждане, както и липсващите червеи, следва да се смятат за мъртви. Смъртността трябва като минимум поне да се записва и да се взема под внимание, когато се интерпретират резултатите от изпитването.
|
|
62.
|
Концентрациите, оказващи въздействие, следва да бъдат изразени в mg/kg сухо тегло на седимента. Ако аналитичният добив на изпитвания химикал, измерен в седимента, или в седимента и водата над седимента в началото на експозицията, е между 80 и 120 % от номиналните концентрации, концентрациите, оказващи въздействие (ECx, NOEC, LOEC), могат да бъдат изразени въз основа на номиналните концентрации. Ако аналитичният добив се отклонява от номиналните концентрации с повече от ± 20 % от тях, концентрациите, оказващи въздействие (ECx, NOEC, LOEC) следва да се основават на първоначално измерените концентрации в началото на експозицията, например като се отчита масовият баланс на изпитвания химикал в системата за изпитване (вж. точка 30). В тези случаи допълнителна информация може да се получи от анализа на изходните и/или прилаганите разтвори, за да се потвърди дали изпитваните седименти са приготвени правилно.
|
ECx
|
63.
|
Стойностите на ECx за описаните в точка 60 параметри се изчисляват с помощта на подходящи статистически методи (например пробит-анализ, логистична функция или функция на Вейбул, метод на Спирмън-Карбър с изключване на данни, или обикновена интерполация). Указания за статистическото оценяване са дадени в (15) и (50). Стойност на ECx се получава чрез добавяне на стойност, съответстваща на x % от средната стойност на контролна проба в уравнението. За изчисляване на EC50 или всяка друга стойност ECx, средните стойности от всяко третиране (

) следва да бъдат подложени на регресионен анализ. |
NOEC/LOEC
|
64.
|
Ако със статистическия анализ се цели определяне на NOEC/LOEC, необходими са статистики за всеки отделен съд (индивидуалните съдове се разглеждат като повторения). Следва да се приложат подходящи статистически методи. По принцип неблагоприятните въздействия на изпитвания обект в сравнение с контролата се проучват чрез проверяване на (по-малката) едностранна хипотеза при p ≤ 0,05. Примери са дадени в следващите точки. Указания за избора на подходящи статистически методи са дадени в (15) и (50).
|
|
65.
|
Нормалността на разпределението на данните може да се тества например с тест на Колмогоров-Смирнов за качество на апроксимацията, тест с тестова статистика отношението на размаха към стандартното отклонение (R/s-тест) или тест на Шапиро-Уилк (двустранен, p ≤ 0,05). За тестване на хомогенността на дисперсията могат да се използват тест на Кокрън, тест на Левин или тест на Бартлет, (двустранен, p ≤ 0,05). Ако са изпълнени критериите за използване на параметрични тестови процедури (нормалност, хомогенност на дисперсията), могат да се извършат еднофакторен дисперсионен анализ (ANOVA) и последващи множествени сравнения. За изчисляване дали са налице статистически значими разлики (p ≤ 0,05) между контролите и различните концентрации на изпитваните обекти могат да се използват сравнения по двойки (например t-тест на Дънет) или трендови тестове със стъпка назад (напр. тест на Уйлямс). В противен случай за определяне на NOEC и LOEC следва да се използват непараметрични методи (напр. U-тест на Бонферони по Holm или трендов тест на Йонкхере-Терпстра).
|
Гранично изпитване
|
66.
|
Ако е извършено гранично изпитване (сравнение на контрола и само на едно третиране) и са изпълнени критериите за използване на параметрични тестови процедури (нормалност, хомогенност), метричните отклици (общ брой червеи и биомаса, изразена като сухо тегло на червеите) могат да бъдат оценени чрез тест на Стюдънт (t-тест). Ако тези критерии не са изпълнени, може да се използва t-тест за нееднаква дисперсия (t-тест на Уелч) или непараметричен тест, напр. U-тест на Ман-Уитни. Известна информация за статистическата мощност, установена по време на тестването на хипотезите в кръговото изпитване на метода, е дадена в допълнение 6.
|
|
67.
|
За установяване на значими разлики между контролите (контрола и контрола на разтворител), повторенията на всяка контрола могат да се изпитват както е описано при граничното изпитване. Ако при тези изпитвания не бъдат установени значими разлики, всички повторения на контроли и контроли на разтворител могат да бъдат обединени. В противен случай всички третирания следва да бъдат сравнявани с контролата на разтворител.
|
Интерпретиране на резултатите
|
68.
|
Резултатите трябва да се интерпретират с внимание, ако са налице отклонения от настоящия метод за изпитване и когато измерените концентрации на изпитване са на равнища, близки до границата на откриване на метода за анализ. Всички отклонения от настоящия метод за изпитване трябва да се отбележат.
|
Протокол от изпитването
|
69.
|
Протоколът от изпитването следва да включва най-малко следната информация.
|
—
|
Изпитван химикал:
|
—
|
данни за идентичността на химикала (общоприето наименование, химично наименование, номер по CAS и т.н.), включително чистота и метод за анализ за количествено определяне на изпитвания химикал. източник на изпитвания химикал, идентичност и концентрация на използвания разтворител, ако има такъв;
|
|
—
|
всяка налична информация относно физичната природа и физичните и химичните свойства, получена преди започване на изпитването (напр. разтворимост във вода, парно налягане, коефициент на разпределение в почвата (или в седимент, ако такава информация е налице), log Kow, стабилност във вода и др.);
|
|
|
—
|
Изпитван вид:
|
—
|
научно наименование, източник и всякакво предварително третиране, аклиматизация, условия на отглеждане и т.н.
|
|
|
—
|
Условия на изпитване:
|
—
|
използвана процедура на изпитване (напр. статична, полустатична или проточна);
|
|
—
|
планиране на изпитването (например брой, материал и размер на камерите за изпитване, обем на водата на съд, маса и обем на седимента на съд, (за проточна или полустатична процедури: скорост на подмяна на обема вода), всякакво аериране, използвано преди и по време на изпитването, брой на повторенията, брой червеи на повторение в началото на експозицията, брой на концентрациите на изпитване, продължителност на кондиционирането, времена на достигане на равновесие и на експозиция, честота на пробовземането);
|
|
—
|
дълбочина на седимента и на водата над седимента;
|
|
—
|
Метод за предварителна обработка и добавяне/прилагане на изпитвания химикал;
|
|
—
|
номиналните концентрации на изпитване, подробности относно вземане на проби за химичен анализ, както и методите за анализ, чрез които са получени концентрациите на изпитвания химикал;
|
|
—
|
характеристики на седиментите, както е описано в точки 24—25, и всички други направени измервания; приготвяне на формулиран седимент;
|
|
—
|
приготвяне на водата за изпитването (ако се използва възстановена вода) и характеристики на водата (концентрация на кислород, рН, проводимост, твърдост и всички други направени измервания) преди началото на изпитването;
|
|
—
|
подробна информация за храненето, включително вида на храната, приготвянето, количеството и режима на хранене;
|
|
—
|
Интензитет на светлината и времетраене на осветлението;
|
|
—
|
методите, използвани за определяне на всички биологични параметри (например вземане на проби, проверка, измерване теглото на изпитваните организми) и всички абиотични параметри (напр. параметри на качеството на водата и седимента);
|
|
—
|
обеми и/или тегла на всички проби за химичен анализ;
|
|
—
|
подробна информация за третирането на всички проби за химичен анализ, включително подробности за изготвяне, съхранение, процедури на добавяне, екстракция и процедури за анализ (и прецизност) за изпитвания химикал, както и аналитичен добив на изпитвания химикал.
|
|
|
—
|
Резултати:
|
—
|
качество на водата в съдовете за тестване (pH, температура, концентрация на разтворен кислород, твърдост, концентрации на амоняк и всякакви други направени измервания);
|
|
—
|
общ органичен въглерод (ТОС), отношението на сухото тегло към влажното тегло, pH на седимента, и всякакви други направени измервания;
|
|
—
|
общ брой и, ако е определен, брой цели и разкъсани червеи във всяка камера за изпитване в края на изпитването;
|
|
—
|
сухо тегло на червеите във всяка камера за изпитване в края на изпитването и, ако е измерено, сухо тегло на подпроба от червеите в началото на изпитването;
|
|
—
|
всякакво наблюдавано анормално поведение в сравнение с контролите (напр. избягване на седимента, наличие или отсъствие на фекални пелети);
|
|
—
|
всякаква наблюдавана смъртност;
|
|
—
|
оценки на стойностите на крайни точки за токсичността (напр. ECx, LOEC и/или NOEC), както и статистическите методи, използвани за тяхното определяне;
|
|
—
|
номиналните концентрации на изпитване, измерените концентрации на изпитване и резултатите от всички анализи за определяне на концентрацията на изпитвания химикал в съдовете за изпитване;
|
|
—
|
всякакви отклонения от критериите за валидност.
|
|
|
—
|
Оценка на резултатите:
|
—
|
съответствие на резултатите с критериите за валидност, изброени в точка 13,
|
|
—
|
обсъждане на резултатите, включително всякакво влияние върху резултата от изпитването, вследствие на отклонения от настоящия метод за изпитване.
|
|
|
ЛИТЕРАТУРА
|
(1)
|
EC (2003). Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I — IV. Office for Official Publications of the EC (European Commission), Luxembourg.
|
|
(2)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(6)
|
Глава В.27 от настоящото приложение, „Изпитване за токсичност за хирономиди в система вода–седимент с използване на седимент с добавка“.
|
|
(7)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(8)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
(9)
|
Hill, I.R., Matthiessen, P., Heimbach, F. (eds), 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8-10 November 1993, Renesse (NL).
|
|
(10)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H.Köpp. Berlin 1995.
|
|
(11)
|
Riedhammer C. & B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105-110.
|
|
(12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(14)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(15)
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests; fifth draft, March 2003; Report EPS 1/RM/
|
|
(16)
|
Nikkilä A., Halme A., Kukkonen J.V.K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35-46.
|
|
(17)
|
Baily H.C., & Liu D.H.W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. p. 205-215. In J.C. Eaton, P.R. Parrish, and A.C. Hendricks (eds). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
(18)
|
Chapman K. K., Benton M. J., Brinkhurst R. O. & Scheuerman P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271-278.
|
|
(19)
|
Meyer J.S., Boese C.J. & Collyard S.A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Part C 133:99-109.
|
|
(20)
|
Schubauer-Berigan M.K., Dierkes J.R., Monson P.D. & Ankley G.T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxciol. Chem. 12(7):1261-1266.
|
|
(21)
|
West, C.W., V.R. Mattson, E.N. Leonard, G.L. Phipps & G.T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57-63.
|
|
(22)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(23)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(24)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(25)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(26)
|
Landrum, P.F., Gedeon, M.L., Burton, G.A., Greenberg. M.S., & Rowland, C.D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42: 292-302.
|
|
(27)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(28)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(29)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph. Oehlmann, J., & Knacker, Th. (2005). Bioaccumulation of 14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271-280.
|
|
(31)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
(32)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(33)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
(34)
|
Dermott R. & Munawar M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407-414.
|
|
(35)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(36)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(37)
|
Глава В.1 от настоящото приложение, Изпитване за остра токсичност при риби
|
|
(38)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(40)
|
Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel and B. Streit. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10-20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on „Bioaccumulation: Sediment test using benthic oligochaetes“, 26.-27.4.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(42)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
(43)
|
Naylor, C. and C. Rodrigues. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
|
|
(44)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(46)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(47)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588-595.
|
|
(48)
|
Brooke, L.T., Ankley, G.T., Call, D.J. & Cook, P.M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223-228.
|
|
(49)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
(50)
|
OECD 2006. Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment No. 54, OECD, Paris, France.
|
|
(51)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten — Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. pp. 107-119.
|
Допълнителна литература по статистическите процедури:
Dunnett, C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
Finney, D.J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction: Environ. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
Sokal, R.R. and F.J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
Miller, R.G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro S.S. & Wilk M.B (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591-611.
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519 531.
Допълнение 1
Определения
За целите на настоящия метод за изпитване са използвани следните определения:
|
|
Химикал означава вещество или смес.
|
|
|
Периодът на кондициониране се използва за стабилизиране на микробния компонент на седимента и за отстраняване, например, на амоняка с произход от съставки на седимента; той е преди добавянето на изпитвания химикал към седимента. Обикновено след кондиционирането водата над седимента се изхвърля.
|
|
|
ЕСх
е концентрацията на изпитвания химикал в седимента, която води до въздействие от x % (например 50 %) върху биологичен параметър в рамките на определен период на експозиция.
|
|
|
Периодът за достигане на равновесие се използва, за да се даде възможност за разпределение на изпитвания химикал между твърдата фаза, водата между частиците на седимента и водата над седимента; той е след добавянето на изпитвания химикал към седимента и преди добавянето на изпитваните организми.
|
|
|
Фазата на експозиция е времето, през което изпитваните организми са експонирани на изпитвания химикал.
|
|
|
Формулиран седимент или възстановен, изкуствен или синтетичен седимент, е смес от материали, използвани за симулиране на физичните съставки на естествения седимент.
|
|
|
Най-ниска концентрация, при която се наблюдава ефект (LOEC) е най-ниската изпитвана концентрация на изпитван химикал, при която за химикала се наблюдава значимо токсично въздействие (при p ≤ 0,05) в сравнение с контролата. Независимо от това, всички изпитвани концентрации над LOEC трябва да имат вредно въздействие, равно или по-голямо от наблюдаваното при LOEC. Ако тези две условия не могат да бъдат удовлетворени, трябва да се даде пълно обяснение за това как е била избрана LOEC (и следователно NOEC).
|
|
|
Концентрацията без наблюдавано въздействие (NOEC) е изпитваната концентрация непосредствено под LOEC, която при сравнение с контролната няма статистически значимо въздействие (р ≤ 0,05) в рамките на даден период на експозиция.
|
|
|
Коефициент на разпределение октанол-вода, Kow, понякога изразяван също и като Pow), е отношението на разтворимостите на химикала в n-октанол и във вода при достигнато равновесие и представлява липофилността на даден химикал (глава A.24 от настоящото приложение). Kow или логаритъмът от Kow (log Kow) се използва като указание за потенциала на химикала за биоакумулация във водни организми.
|
|
|
Коефициент на разпределение органичен въглерод-вода (Koc) е съотношението между концентрацията на химикала в/върху съдържащата органичен въглерод част от седимента и концентрацията на химикала във вода при достигнато равновесие.
|
|
|
Вода над седимента е водата, която покрива седимента в съда за изпитване.
|
|
|
Вода между частиците на седимента или интерстициална вода е водата, която заема пространството между частиците на седимента или на почвата.
|
|
|
Седимент с добавка е седимент, към който е добавен изпитван химикал.
|
|
|
Изпитван химикал означава всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
|
Допълнение 2
Състав на препоръчаната възстановена вода
(възприет от глава В.1 от настоящото приложение (1))
|
а)
|
Разтвор на калциев хлорид
В дейонизирана вода се разтварят 11,76 g CaCl2 · 2H2O; допълва се до 1 l с дейонизирана вода
|
|
б)
|
Разтвор на магнезиев сулфат
В дейонизирана вода се разтварят 4.93 g MgSO4 · 7H2O; допълва се до 1 l с дейонизирана вода
|
|
в)
|
Разтвор на натриев бикарбонат
В дейонизирана вода се разтварят 2,59 g NaHCO3; допълва се до 1 l с дейонизирана вода
|
|
г)
|
Разтвор на калиев хлорид
В дейонизирана вода се разтварят 0,23 g KCl; допълва се до 1 l с дейонизирана вода
|
Всички химикали следва да са с квалификация „чист“.
Проводимостта на дестилираната или дейонизираната вода не следва да надвишава 10 μScm– 1.
25 ml от всеки от разтвори а)—г) се смесват и общият обем се допълва до 1 литър с дейонизирана вода. Сборът от калциевите и магнезиевите йони в тези разтвори е 2,5 mmol/l.
Съотношението на Ca:Mg йони е 4:1, а на Na:K йони — 10:1. Алкалността на този разтвор до достигане на pH 4,3 (KS4.3) е 0,8 mmol/l.
Водата за разреждане се аерира до насищане с кислород, след това се съхранява около два дни без допълнително аериране преди употреба.
ПОЗОВАВАНЕ
|
(1)
|
Глава В.1 от настоящото приложение, Изпитване за остра токсичност при риби.
|
Допълнение 3
Физични и химични характеристики на приемлива вода за разреждане
|
Съставка
|
Концентрации
|
|
Твърди частици
|
< 20 mg/l
|
|
Общ органичен въглерод
|
< 2 μg/l
|
|
Нейонизиран амоняк
|
< 1 μg/l
|
|
Остатъчен хлор
|
< 10 μg/l
|
|
Общо органофосфорни пестициди
|
< 50 ng/l
|
|
Общо органохлорни пестициди плюс полихлорирани бифенили
|
< 50 ng/l
|
|
Общ органичен хлор
|
< 25 ng/l
|
|
(възприет от ОИСР (1992) (1))
|
ПОЗОВАВАНЕ
|
(1)
|
OECD (1992). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
Допълнение 4
Препоръчан изкуствен седимент — указания за приготвяне и съхранение
Съставки на седимента
|
Съставка
|
Характеристики
|
% седимент сухо тегло
|
|
Торф
|
Торф от торфен мъх, степен на разграждане: „средно“, изсушен на въздух, без видими остатъци от растения, фино смлян (размер на частиците ≤ 0,5 mm)
|
5 ± 0,5
|
|
Кварцов пясък
|
Размер на зърната: ≤ 2 mm, но > 50 % от частиците следва да бъдат в диапазон 50—200 μm
|
75 — 76
|
|
Каолин
|
Съдържание на каолинит ≥ 30 %
|
20 ± 1
|
|
Източник на храна
|
напр. прах от Urtica (Folia urticae), листа от коприва (Urtica dioica), фино смляни (размер на частиците ≤ 0,5 mm); в съответствие с аптечните стандарти, за консумация от човека в допълнение към сухия седимент
|
0,4 — 0,5 %
|
|
Органичен въглерод
|
Коригира се чрез добавяне на торф и пясък
|
2 ± 0,5
|
|
Калциев карбонат
|
CaCO3, на прах, химически чист, в допълнение към сухия седимент
|
0,05 — 1
|
|
Дейонизирана вода
|
Проводимост ≤ 10 μS/cm, в допълнение към сухия седимент
|
30—50
|
Бележка: Ако се очакват повишени концентрации на амоняк, например ако за изпитвания химикал е известно, че потиска нитрификацията, може да се окаже полезно 50 % от богатия на азот прах от Urtica да се заменят с целулоза (напр. α-целулоза на прах, химически чиста, размер на частиците ≤ 0,5 mm; (1) (2)).
Приготвяне
Торфът се изсушава с въздух и се смила на фин прах. Приготвя се суспензия от желаното количество торф на прах в дейонизирана вода, като се използва високопроизводително хомогенизиращо устройство. Стойността на рН на тази суспензия се коригира до 5,5 ± 0,5 с CaCO3. Суспензията се аклиматизира най-малко два дни при 20 ± 2 °C, като се разбърква леко, за да се стабилизира рН и да се установи стабилна микробна съставка. Отново се измерва рН, което трябва да бъде 6,0 ± 0,5. След това торфената суспензия се смесва с другите съставки (пясък и каолин) и дейонизирана вода, за да се получи хомогенен седимент със съдържание на вода в интервала 30–50 % от сухото тегло на седимента. Измерва се отново рН на крайната смес и, ако е необходимо, се коригира до 6,5—7,5 с CaCO3. Независимо от това, ако се очаква изменение в стойностите на амоняка, може да бъде полезно рН на седимента да се поддържа под 7,0 (например между 6,0 и 6,5). Вземат се проби от седимента, за да се определи сухото тегло и съдържанието на органичен въглерод. Ако се очаква изменение в стойностите на амоняка, формулираният седимент може да бъде кондициониран в продължение на седем дни при същите условия, които преобладават в последващото изпитване (напр. съотношение седимент—вода от 1: 4, височина на слоя седимент както в съдовете за изпитване), преди към него да бъде добавен изпитваният химикал, т.е. следва към него да бъде добавена вода, която трябва да е аерирана. В края на периода за кондициониране водата над седимента следва да се отстрани и изхвърли. След това кварцовият пясък с добавка се смесва със седимента за всяко равнище на третиране, седиментът се разпределя по съдовете за повторенията и се залива с водата за изпитването. След дова съдовете се инкубират при същите условия, които преобладават в последващото изпитване. Оттук започва периодът на достигане на равновесие. Водата над седимента следва да бъде аерирана.
Избраният източник на храна следва да се добави преди или по време на добавянето на изпитвания химикал към седимента. Тя може първоначално да се смеси с торфената суспензия (вж. по-горе). Независимо от това, прекомерното разграждане на източника на храна преди да бъдат добавени изпитваните организми — например в случай на дълго време за достигане на равновесие — може да се избегне чрез поддържане на максимално кратък времеви интервал между добавянето на храната и началото на експозицията. За да се гарантира, че храната е с добавен изпитван химикал, източникът на храна следва да бъде смесен със седимента не по-късно от деня, в който изпитвания химикал се добавя към седимента.
Съхранение
Сухите съставки на изкуствения седимент могат да се съхраняват в сухо и хладно място, или при стайна температура. Приготвеният седимент с добавен изпитван химикал следва да се използва незабавно в изпитването. До анализа пробите от седимент с добавен химикал могат да се съхраняват при условията, препоръчани за конкретния изпитван химикал.
ПОЗОВАВАНИЯ
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(2)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten — Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. pp. 107-119.
|
Допълнение 5
Методи за отглеждане на Lumbriculus variegatus
Lumbriculus variegatus (Müller), Lumbriculidae, Oligochaeta обитава сладководни седименти и широко се използва при екотоксикологични изпитвания. Той може лесно да се отглежда в лабораторни условия. Кратко описание на методите за отглеждане е дадено по-долу.
Методи за отглеждане
Условията на отглеждане на Lumbriculus variegatus са подробно описани във Phipps et al. (1993) (1), Brunson et al. (1998) (2), ASTM (2000) (3), U.S. EPA (2000) (4). По-долу е дадено кратко резюме на тези условия. Основно предимство на L. variegatus е бързото му размножаване, водещо до бързо увеличаване на биомасата в отглеждани в лабораторни условия популации(напр. (1), (3), (4), (5)).
Червеите могат да бъдат отглеждани в големи аквариуми (57—80 l) при 23 °С, с времетраене на осветлението 16 L:8 D (100—1 000 lx), като се използва ежедневно подновявана природна вода (45—50 l на аквариум). Субстратът се приготвя чрез нарязване на ленти на салфетки от неизбелена кафява хартия, които могат впоследствие да бъдат смесени с вода за отглеждането за няколко секунди, за получаване на малки парчета хартиен субстрат. След това субстратът може да бъде пряко използван в аквариумите за отглеждане на Lumbriculus чрез покриване на дънната област на съда, или да се съхранява замразен в дейонизирана вода за по-късна употреба. Новият субстрат в съда обикновено е с трайност около два месеца.
Всяко отглеждане на червеи започва с 500—1 000 червея и се захранва с 10 ml суспензия, съдържаща 6 g стартерни фуражи за пъстърва 3 пъти седмично в условия на прилагане на полустатичен или проточен метод. Скоростта на подаване на храната за статичните или полустатичните култури следва да бъдат по-малка, за да се предотврати развитието на бактерии и патогенни гъбички. .
При тези условия броят на индивидите в културата по принцип се удвоява приблизително за 10 до 14 дни.
Като алтернатива, Lumbriculus variegatus също може да се отглежда в система, състояща се от слой от кварцов пясък, като използвания за изкуствения седимент (1—2 см дълбочина), и възстановена вода. Като съдове за отглеждане могат да се използват контейнери от стъкло или неръждаема стомана, с височина от 12 до 20 cm. Водното тяло следва леко да се аерира (напр. 2 мехурчета в секунда) с помощта на пипета „Пастьор“, разположена на приблизително 2 cm над повърхността на седимента. За да се избегне натрупване, например на амоняк, водата над седимента следва да се обменя, като се използва проточна система, или ръчно поне веднъж седмично. Олигохетите могат да се държат при стайна температура със светъл период от 16 часа (интензитет 100-1 000 lx) и 8 часа тъмнина. При полустатичните култури (сменяне на водата веднъж седмично) червеите се хранят с TetraMin два пъти седмично (например 0,6-0,8 mg на cm2 от площта на седимента), който може да се прилага като суспензия 50 mg TetraMin на ml дейонизирана вода.
Lumbriculus variegatus може да бъде отстранен от културите в отделна бехерова чаша, например чрез прехвърляне на субстрат с фина мрежа, или на организми с помощта на стъклена пипета с широк отвор с огнева полировка (приблизително 5 mm в диаметър). Ако заедно с това в тази бехерова чаша бъде прехвърлен субстрат, бехеровата чаша, съдържаща червеите и субстрата, се оставя за една нощ при проточни условия, което ще отстрани субстрата от бехеровата чаша, а червеите ще останат на дъното на съда. След това те могат да бъдат въведени в наскоро приготвени съдове за отглеждане, или да бъдат допълнително обработени за изпитването, както е посочено в (3) и (4), или по-долу.
Един въпрос, който следва да бъде разгледан критично при използването на L. variegatus в изпитвания със седимент, е начинът му на размножаване (архитомия или морфалаксис, напр. (6)). В резултат от това безполово размножаване се получават два фрагмента, които не се хранят в продължение на определен период от време, докато не регенерира частта откъм главата или опашката (напр. (7), (8)). Това означава, че при L. variegatus експозицията чрез поглъщане на замърсени седимент не е непрекъснат процес.
Поради това следва да се извърши синхронизация с цел свеждане до минимум на неконтролираното размножение и регенерация и следващото от това голямо вариране на резултатите от изпитването. Известно вариране може да се получи, когато някои от индивидите, които са се разделили на фрагменти и поради това не се хранят в продължение на определен период, са по-малко експонирани на изпитвания химикал в сравнение с другите индивиди, които не се разделят на фрагменти по време на изпитването (9), (10), (11). От 10 до 14 дни преди началото на експозицията червеите следва да бъдат изкуствено разделени на сегменти (синхронизация). За синхронизация следва да бъдат избрани големи (полово зрели) червеи, които, за предпочитане, не показват признаци на неотдавнашен морфалаксис. Тези червеи могат да бъдат поставени върху предметно стъкло в капка вода за отглеждане и им се извършва дисекция със скалпел в средната част на тялото. Следва да се вземат мерки задните краища да са със сходен размер. След това задните краища се оставят, до началото на експозицията, за регенерация на нови глави в съд за отглеждане, съдържащ същия субстрат, като използвания при отглеждането, и възстановена вода. Има показания за регенерация на нови глави, когато синхронизираните червеи се заравят в субстрата (наличието на регенерирани глави може да бъде потвърдено чрез инспектиране на представителна подпроба с бинокулярен микроскоп). След това се очаква изпитваните организми да са със сходен физиологичен статус. Това означава, че когато по време на изпитването се извърши размножаване чрез морфалаксис в синхронизирани червеи, почти всички животни се очаква да бъдат еднакво експонирани на седимента с добавка. Храненето на синхронизираните червеи следва да се извърши веднага след като червеите започнат да се заравят в субстрата, или 7 дни след дисекцията. Режимът на хранене следва да бъде съпоставим с този при редовните култури, но може да е препоръчително синхронизираните червеи да се хранят със същия източник на храна, който ще се използва по време на изпитването. Червеите следва да се държат при температурата на изпитването, на 20 ± 2 °C. След регенерацията, за изпитването следва да се използват интактни цели червеи, които активно плават или пълзят след лек механичен стимул. Следва да се избягват наранявания или автотомия при червеите, напр. чрез обработка на тези червеи с използване на пипети с ръбове, полирани с огнева полировка, или с направени от неръждаема стомана клечки за зъби.
Източници на стартерни култури за Lumbriculus variegatus (адреси в САЩ, взети от (4))
|
Европа
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Germany
|
|
|
Bayer Crop Science AG
|
|
Development — Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Germany
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Box 111
|
|
FIN-80101 Joensuu
|
|
Finland
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Germany
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
САЩ
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
ПОЗОВАВАНИЯ
|
(1)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(2)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(5)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(6)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(7)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(8)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(9)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
(10)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(11)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
Допълнение 6
Обобщение на резултатите от кръговото изпитване
„Изпитване за токсичност на седименти с Lumbriculus variegatus“
Таблица 1
Резултати от отделните провеждания на кръговото изпитване: Среден брой червеи в контролите и в контролите на разтворител в края на изпитването; SD = стандартно отклонение; CV = коефициент на вариация.
|
|
среден брой червеи в контролите
|
SD
|
CV (%)
|
n
|
среден брой червеи в контролите на разтворител
|
SD
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
междулабораторна средна стойност
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min
|
16,3
|
|
|
|
15,0
|
|
|
|
|
max
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Таблица 2
Резултати от отделните провеждания на кръговото изпитване: Средно общо сухо тегло на червеите на повторение в контролите и в контролите на разтворител в края на изпитването; SD = стандартно отклонение; CV = коефициент на вариация.
|
|
Общо сухо тегло на червеите на повторение (контроли)
|
SD
|
CV (%)
|
n
|
Общо сухо тегло на червеите на повторение (контроли на разтворител)
|
SD
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
междулабораторна средна стойност
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min
|
12,9
|
|
|
|
10,5
|
|
|
|
|
max
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Таблица 3
Токсичност на PCP: Обобщение на крайните точки в кръговото изпитване; междулабораторни средни стойности за ЕС50, NOEC и LOEC; SD = стандартно отклонение; CV = коефициент на вариация.
|
биологичен параметър
|
|
междулабораторна средна стойност (mg/kg)
|
min
|
max
|
междулабораторен фактор
|
SD
|
CV (%)
|
геометр. средна стойност (mg/kg)
|
|
общ брой червеи
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
MDD (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
Общо сухо тегло на червеите
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
MDD (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
смъртност/преживяване
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
размножаване (увеличаване на броя на червеите на повторение)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
MDD (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
растеж (увеличаване на биомасата на повторение)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
MDD (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
MDD: минимална откриваема разлика от контролните стойности по време на тестването на хипотези; използва се като мярка за статистическа мощност
|
ПОЗОВАВАНЕ
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
В.36 ИЗПИТВАНЕ ЗА РАЗМНОЖАВАНЕ НА ХИЩЕН АКАР (HYPOASPIS (GEOLAELAPS) ACULEIFER) В ПОЧВАТА
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 226 (2008). Настоящият метод за изпитване е предназначен да се използва за оценка на въздействията от химикали в почвата върху репродуктивната способност на почвени акари от вид Hypoaspis (Geolaelaps) aculeifer Canestrini (Acari: Laelapidae), като по този начин се предоставя възможност за оценка на потискането на специфична скорост на растеж на популацията (1,2). Репродуктивната способност тук означава броя на ювенилните индивиди в края на периода на изпитване. H. aculeifer представлява допълнително трофично равнище за видовете, за които вече са на разположение методи за изпитване. За целите на настоящия метод за изпитване се счита за достатъчно изпитването за размножаване без разграничаване и количествено определяне на различните етапи от цикъла на размножаване. За химични вещества със сценарий на експозиция, различен от този чрез почвата, биха могли да бъдат по-подходящи други подходи (3).
|
|
2.
|
Hypoaspis (Geolaelaps) aculeifer се приема за относим представител на почвената фауна, и в частност на хищните акари. Той е повсевместно разпространен (5) и може лесно да се събран и отгледан в лаборатория. Обобщение на биологичните характеристики на H. aculeifer се предоставя в допълнение 7. На разположение е обща информация за екологията на вида акари и за използването му в екотоксикологични изпитвания (4), (5), (6), (7), (8), (9), (10), (11), (12).
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
3.
|
Полово зрели женски индивиди се експонират на диапазон от концентрации на изпитвания химикал, примесен с почва. Изпитването се започва с 10 полово зрели женски индивида на съд за повторение. Мъжките индивиди не се въвеждат в изпитването, тъй като опитът показва, че при наличие на мъжки женските копулират незабавно или малко след преминаване на стадия дейтонимфа. Освен това включването на мъжките индивиди може да удължи срока на изпитване с това, че би станало необходимо трудоемкото разграничаване на стадиите от жизнения цикъл. По този начин чифтосването само по себе си не е част от изпитването. Женските се въвеждат в изпитването 28—35 дни след началото на периода на снасяне на яйца в синхронизацията (вж. допълнение 4), като тогава женските могат да се смятат вече за копулирали и преминали етапа преди яйцеотлагането. При 20 °C изпитването завършва в ден 14 след въвеждането на женските (ден 0), което позволява на първото контролно поколение да достигне до стадия дейтонимфа (вж. допълнение 4). Като основна измервана променлива се определя броят на ювенилните индивиди на съд за изпитване и, допълнително, броят на преживелите женски. Репродуктивната способност на акарите, експонирани на изпитвания химикал, се сравнява с тази на контролите, за да се определи ЕСх (например ЕС10, ЕС50 или концентрацията без наблюдавано въздействие (NOEC) (вж. допълнение 1 за определенията), в зависимост от плана на проучването (вж. точка 29). Преглед на графика на изпитването е даден в допълнение 8.
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНИЯ ХИМИКАЛ
|
4.
|
Предпочита се разтворимостта във вода, log Kow, коефициентът на разпределение почва-вода и парното налягане на изпитвания химикал да са известни. Желателно е да е налична допълнителна информация относно съдбата на изпитвания химикал в почвата, като например скоростите на биотично и абиотично разграждане.
|
|
5.
|
Този метод за изпитване може да се използва за разтворими във вода и неразтворими химикали. Начините на прилагане на изпитвания химикал обаче съответно ще се различават. Методът за изпитване е неприложим за летливи химикали, т.е., химикали, за които константата на Хенри или коефициентът на разпределение въздух-вода е по-голям от единица, или за химикали, при които парното налягане превишава 0,0133 Pa при 25 °С.
|
ВАЛИДНОСТ НА ИЗПИТВАНЕТО
|
6.
|
Следните критерии трябва да бъдат изпълнени при нетретираните контроли, за да се счита за валиден даден резултат от изпитването:
|
—
|
Средна смъртност сред полово зрелите женски индивиди не трябва да надвишава 20 % в края на изпитването;
|
|
—
|
Средният брой на ювенилните индивиди на повторение (при въведени 10 полово зрели женски) следва да бъде най-малко 50 в края на изпитването;
|
|
—
|
Коефициентът на вариация, изчислен за броя на ювенилните акари не трябва да е по-голям от 30 % в края на окончателното изпитване.
|
|
РЕФЕРЕНТЕН ХИМИКАЛ
|
7.
|
Стойностите на ECx и/или NOEC на референтния химикал трябва да бъдат определени, за да се гарантира, че условията на лабораторното изпитване са адекватни, и да се провери дали откликът на изпитваните организми не се е променил с течение на времето. Диметоатът (CAS 60-51-5) е подходящ референтен химикал, за който има показания, че оказва въздействие върху размера на популацията (4). Борната киселина (CAS 10043-35-3) може да се използва като алтернативен референтен химикал. С този химикал е натрупан по-малко опит. При планирането са възможни два варианта:
|
—
|
Референтните химикали могат да се изпитват едновременно с определянето на токсичността на всеки изпитван химикал в една концентрация, което е необходимо да се демонстрира предварително в проучване на зависимостта доза-отклик, която да води до въздействие от > 50 % намаление на потомството. В този случай броят на повторенията следва да е същият като този в контролите (вж. точка 29).
|
|
—
|
Като алтернатива, референтният химикал се изпитва 1—2 пъти годишно в изпитване „доза-отклик“. В зависимост от избрания план, броят на концентрациите и повторенията и кратността между концентрациите се различават (вж. точка 29), но като отклик следва да се постигне въздействие от 10—90 % (при кратност 1,8). Стойността на EC50 за диметоат въз основа на броя на ювенилните индивиди следва да попада в интервала между 3,0 и 7,0 mg активно вещество/кг почва (сухо тегло). Въз основа на резултатите, получени с борна киселина до момента, EC50, получена въз основа на броя на ювенилните индивиди, следва да попада в интервала между 100 и 500 mg/kg почва сухо тегло.
|
|
ОПИСАНИЕ НА ИЗПИТВАНЕТО
Съдове и оборудване за изпитването
|
8.
|
Следва да бъдат използвани съдове за изпитване с диаметър 3-5 cm (височина на почвата ≥ 1,5 cm), изработени от стъкло или друг химически инертен материал и разполагащи с плътно прилягащо покритие. Винтовите капачки са за предпочитане, като в този случай съдовете могат да се аерират два пъти седмично. Като алтернатива могат да бъдат използвани, покрития, които позволяват пряк газообмен между субстрата и атмосферата (напр. марля). Тъй като съдържанието на влага трябва да се поддържа достатъчно високо по време на изпитването, от съществено значение е контролът на теглото на всеки съд за изпитване по време на изпитването и добавянето на вода при необходимост. Това може да е от особено голямо значение, ако не са налице винтови капачки. Ако се използва непрозрачен съд за изпитване покритието трябва да е изработено от материал, позволяващ достъп до светлина (напр. чрез перфорирано прозрачно покритие) и в същото време да предотвратява избягването на акарите. Размерът и видът на съда за изпитването зависят от метода за извличане (виж допълнение 5 за повече подробности). Ако се прилага извличане чрез топлина директно към съда за изпитване, тогава може да бъде добавена дънна мрежа с подходящ размер на отвора (запечатана до извличането) и дълбочината на почвата следва да бъде достатъчна, за да се даде възможност за градиент на температурата и влажността.
|
|
9.
|
Необходимо е стандартно лабораторно оборудване, по-специално следното:
|
—
|
за предпочитане стъклени съдове с винтови капачки;
|
|
—
|
четки за прехвърляне на акари
|
|
—
|
подходящо оборудване за контрол на температурата;
|
|
—
|
подходящо оборудване за контрол на влажността на въздуха (не е от съществено значение, ако съдовете за експозицията са покрити с капаци);
|
|
—
|
инкубаторс контролирана температура или малко помещение;
|
|
—
|
оборудване за извличане (вж. допълнение 5) (13)
|
|
—
|
панел с таванно осветление със светлинен контрол
|
|
—
|
буркани за събиране на извлечените акари.
|
|
Приготвяне на изкуствената почва
|
10.
|
За това изпитване се използва изкуствена почва. Изкуствената почва се състои от следните съставки (всички стойности се основават на суха маса):
|
—
|
5 % торфен мъх, изсушен на въздух и фино смлян (приема се размер на частиците от 2 ± 1 mm);
|
|
—
|
20 % каолин (за предпочитане съдържанието на каолинит да е над 30 %);
|
|
—
|
приблизително 74 % промишлен пясък, изсушен на въздух (в зависимост от количеството на необходимия CaCO3), предимно фин пясък с над 50 % от частиците между 50 и 200 микрона. Точното количество пясък зависи от количеството на CaCO3 (вж. по-долу), заедно те следва да доведат до 75 %.
|
|
—
|
< 1,0 % калциев карбонат (CaCO3 на прах, с квалификация „чист“) за получаване на pH, равно на 6,0 ± 0,5; количеството на калциевия карбонат за добавяне може да зависи основно от качеството/естеството на торфа (вж. Забележка 1).
|
Забележка 1: Изискваното количество CaCO3 ще зависи от съставките на почвения субстрат и следва да бъде определено чрез измерване на pH на почвени подпроби непосредствено преди изпитването (14).
Забележка 2: съдържанието на торф l изкуствената почва се отклонява от други методи за изпитване върху живеещите в почвата организми, при които в повечето случаи се използва 10 % торф (напр. (15)). Независимо от това, според EPPO (16) типичната земеделска почва съдържа не повече от 5 % органична материя, като по този начин намаляването на съдържанието на торф отразява намалените възможности на естествената почва за сорбция на изпитвания химикал от органичен въглерод.
Забележка 3: Ако се изисква, например за конкретни цели на изпитвания, естествените почви от незамърсени източници също могат да бъдат използвани като субстрат за изпитванията и/или за отглеждане. Независимо от това, ако се използва естествена почва, тя следва да бъде характеризирана най-малко по отношение на произхода (място, от което е взета), рН, текстура (зърнометричен състав) и съдържание на органична материя. Ако са налични, следва да бъдат включени типът и наименованието на почвата съгласно почвена класификация, и почвата трябва да не съдържа никакви замърсявания. В случай че изпитваният химикал е метал или органометално съединение, също трябва да се определи и катионообменният капацитет на естествената почва. Специално внимание следва да се обърне на съответствието на критериите за валидност, тъй като общата информация за естествените почви обикновено се среща рядко.
|
|
11.
|
Сухите съставки на почвата се смесват старателно (напр. в голямо лабораторно устройство за смесване). За определянето на рН се използва смес от почва и разтвор на 1 М калиев хлорид (KCl) или 0,01 M калциев хлорид (CaCl2) в съотношение 1:5 (вж. (14) и Допълнение 3). Ако почвата е по-киселинна от изисквания диапазон (вж. точка 10), може да бъде коригирана чрез добавяне на подходящо количество CaCO3. Ако почвата е твърде алкална, може да се коригира чрез добавяне на повече от сместа, състояща се от първите три съставки, описани в точка 10, но без съдържание на CaCO3.
|
|
12.
|
Максималната способност за задържане на вода (СЗВ) на изкуствената почва се определя в съответствие с процедурите, описани в допълнение 2. От два до седем дни преди началото на изпитването сухата изкуствена почва предварително се навлажнява чрез добавяне на достатъчно количество дестилирана или дейонизирана вода, до получаване на приблизително половината от крайното съдържание на вода, което представлява 40 до 60 % от максималната СЗВ. Влажността се коригира до 40-60 % от максималната СЗВ чрез добавяне на разтвор на изпитвания химикал и/или като се добавя дестилирана или дейонизирана вода (вж. точки 16—18). Следва да се извърши допълнителна приблизителна проверка на съдържанието на влага в почвата чрез леко стискане в ръка на почвата — ако съдържанието на влага е коректно, трябва между пръстите да се появят малки капки вода.
|
|
13.
|
Съдържание на влага в почвата се определя в началото и в края на изпитването чрез изсушаване до постоянно тегло при 105 °С в съответствие с ISO 11465 (17), а рН на почвата — в съответствие с допълнение 3 или ISO 10390 (14). Тези измервания трябва да бъдат извършвани в допълнителни проби без акари, както от контролната почва, така и от почва с всяка една изпитвана концентрация. Когато се изпитват химикали с кисела или основна реакция, стойността на pH на почвата не трябва да се коригира. Съдържанието на влага трябва да се следи по време на изпитването посредством периодично претегляне на съдовете (вж. точки 20 и 24).
|
Избор и приготвяне на изпитваните животински видове
|
14.
|
Използваният в изпитването вид е Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). За започване на изпитването се изискват полово зрели женски акари, получени от синхронизирана кохорта. Акарите следва да бъдат въведени около 7—14 дни след като са станали полово зрели, 28—35 дни след началото на периода на снасяне на яйца в синхронизацията (вж. точка 3 и допълнение 4). Източникът или доставчикът на акари, и поддръжката на лабораторната култура следва да бъдат записани. Ако дадена лабораторна култура се съхранява, препоръчително е идентичността на видовете да се потвърждава най-малко веднъж годишно. Идентификационен формуляр е включен в допълнение 6.
|
Приготвяне на концентрации за изпитване
|
15.
|
Изпитваният химикал се смесва с почвата. Органичните разтворители, използвани за третиране на почвата с изпитвания химикал, следва да се подбират въз основа на тяхната ниска токсичност за акари, като в плана за изпитването трябва да бъде включена и подходяща контрола на разтворител (вж. точка 29).
|
Разтворим във вода изпитван химикал
|
16.
|
Разтвор на изпитвания химикал се приготвя в дейонизирана вода в количество, достатъчно за всички повторения на една концентрация за изпитване. Препоръчително е да се използва подходящо количество вода до достигане на изискуемото съдържание на влага, т.е. 40—60 % от максималната СЗВ (вж. точка 12). Всеки разтвор на изпитвания химикал се смесва старателно с една партида от предварително навлажнена почва преди да бъде внесен в съда за изпитване.
|
Неразтворим във вода изпитван химикал
|
17.
|
За химикалите, които са неразтворими във вода, но разтворими в органични разтворители, изпитваният химикал може да бъде разтворен във възможно най-малък обем подходящ носител (напр. ацетон). Следва да се използват само летливи разтворители. Когато се използват такива носители, всички изпитвани концентрации и контролата трябва да съдържат еднакво минимално количество от носителя. Носителят се разпръсква върху (или се смесва с) малко количество фин кварцов пясък, например 10 g. Общото съдържание на пясък в субстрата трябва да се коригира за това количество. Носителят се отстранява чрез изпаряване в лабораторна камина в продължение най-малко на един час. Сместа от кварцов пясък и изпитван химикал се добавя в предварително навлажнената почва и старателно се смесва, чрез добавяне на подходящо количество дейонизирана вода, за да се получи необходимото съдържание на влага. Крайната смес се въвежда в съдовете за изпитване. Следва да се отбележи, че някои разтворители могат да бъдат токсични за акари. Следователно се препоръчва използване допълнителна контрола на вода без носител, ако токсичността на разтворителя за акари не е известна. Ако е доказано в достатъчна степен, че разтворителят (в концентрациите, които ще се прилагат) не оказва въздействие, контролата на вода може да бъде изключена.
|
Изпитван химикал, малко разтворим във вода и органични разтворители
|
18.
|
За малко разтворимите във вода и в органични разтворители химикали, еквивалентът на 2,5 g фино стрит кварцов пясък на изпитвателен съд (например 10 g фин кварцов пясък за четири повторения) се смесва с количеството изпитван химикал, така че да се получи желаната концентрация за изпитването. Общото съдържание на пясък в субстрата трябва да се коригира за това количество. Сместа от кварцов пясък и изпитван химикал се добавя в предварително навлажнената почва и старателно се смесва, след добавяне на подходящо количество дейонизирана вода, за да се получи необходимото съдържание на влага. Крайната смес се разпределя между съдовете за изпитване. Процедурата се повтаря за всяка концентрация за изпитване, като се приготвя и подходяща контрола.
|
ПРОЦЕДУРА
Групи на изпитване и контроли
|
19.
|
Препоръчват се десет полово зрели женски индивида в 20 g суха маса изкуствена почва, за всеки отделен съд с контролни проби и с третирани проби. Изпитваните организми трябва да бъдат добавени в рамките на два часа след приготвянето на крайния субстрат за изпитването (т.е., след прилагането на изпитвания обект). В някои специфични случаи (напр. когато фазата от жизнения цикъл се счита за определящ фактор), времето между приготвянето на крайния субстрат за изпитването и добавянето на акарите може да бъде удължено (за подробна информация, свързана с тази фаза от жизнения цикъл, вж. (18). Независимо от това, в такива случаи трябва да се представи научна обосновка.
|
|
20.
|
След добавянето на акарите в почвата, на същите се предоставя храна, като следва да се измери първоначалното тегло на всеки съд за изпитване, за да се използва като референтна информация за наблюдение на съдържанието на влага в почвата през цялото време на изпитването, както е описано в точка 24. След това изпитваните съдове се покриват, както е описано в точка 8, и се поставят в изпитвателната камера.
|
|
21.
|
Изготвят се подходящи контроли за всеки от методите за прилагане на изпитвания химикал, описани в точки от 15 до 18. За приготвяне на контролите се следват описаните относими процедури, с изключение на това, че не се добавя изпитваният химикал. Следователно, при необходимост към контролите се прилагат органични разтворители, кварцов пясък или други носители, в концентрации/количества като тези при третиранията. Когато за добавяне на изпитвания химикал се използва разтворител или друг носител, следва да се подготви и изпита допълнителна контрола без носителя или изпитвания химикал, в случай че токсичността на разтворителя не е известна (вж. точка 17).
|
Условия на изпитването
|
22.
|
Температурата на изпитването трябва да бъде 20 ± 2 °C. Температурата трябва да се записва най-малко веднъж дневно и да се регулира, ако е необходимо. Изпитването се провежда при контролирани цикли светлина-тъмнина (за предпочитане 16 часа светлина и 8 часа тъмнина) с осветление от 400 до 800 lux в зоната на съдовете за изпитване. По съображения за сравнимост, тези условия са същите, както и при други екотоксикологични изпитвания на почвата (напр. (15)).
|
|
23.
|
Газообменът следва да бъде гарантиран чрез аериране на съдовете за изпитване поне два пъти седмично, в случай че се използват винтови капачки. Ако се използват покрития от марля, специално внимание следва да се отдели на поддържането на съдържанието на влага в почвата (вж. точки 8 и 24).
|
|
24.
|
Съдържанието на вода в почвения субстрат в изпитваните съдове се поддържа по време на цялото изпитване чрез претегляне на съдовете за изпитване и, при необходимост, добавяне на вода в тях (например веднъж седмично). При необходимост загубите се попълват с дейонизирана вода. Съдържанието на влага по време на изпитването не трябва да се отклонява с повече от 10 % от началната стойност.
|
Хранене
|
25.
|
Доказано е, че акарите от вида Tyrophagus putrescentiae (Schrank, 1781) са подходящ източник на храна. Малки колемболи (напр. ювенилни Folsomia candida Willem, 1902 или Onychiurus fimatus (19), (20), представители на семейство Enchytraeidae (напр. Enchytraeus crypticus Westheide & Graefe, 1992) или нематоди (напр. Turbatrix silusiae de Man, 1913)) могат да бъдат също подходящи (21). Препоръчва се проверка на храните преди използването им в изпитване. Видът и количеството на храната следва да осигуряват достатъчен брой ювенилни екземпляри, за да бъдат изпълнени критериите за валидност (точка 6). По отношение на жертвите следва следва да се вземе предвид начинът на действие на изпитвания обект (напр. акарицид може да бъде токсичен и за акарите в храните, вж. точка 26).
|
|
26.
|
Храната трябва да се предоставя ad libitum (т.е. малки количества всеки път (на върха на шпатулата)). За тази цел могат също да се използват и смукателен вентилатор със слаба тяга, както е предложено в изпитването с колемболи, или фина бояджийска четка. Даването на храна в началото на изпитването и два до три пъти в седмицата обикновено е достатъчно. Когато изглежда, че изпитваният обект е токсичен за жертвите, следва да бъде взета предвид увеличена скорост на храненето и/или алтернативен източник на храна.
|
Избор на концентрации на изпитване
|
27.
|
Предварителното познаване на токсичността на изпитвания химикал следва да помогне при избора на подходящи концентрации на изпитване, например от проучвания за определяне на обхвата. Когато е необходимо, се извършва изпитване за определяне на обхвата с пет концентрации на изпитвания химикал в диапазон от 0,1—1 000 mg/kg суха почва, с поне едно повторение за третираните проби и контролите. Продължителността на изпитването за определяне на обхвата е 14 дни, след което се определят смъртността на полово зрелите акари и броят на ювенилните екземпляри. Диапазонът на концентрациите при окончателното изпитване трябва за предпочитане да бъде избран така, че да включва концентрации, при които има въздействие върху броя ювенилни индивиди, но няма въздействие върху преживяването на родителското поколение. Това обаче може да не е възможно при химикали, които причиняват летално и сублетално въздействие в почти сходни концентрации. Концентрацията, при която се проявява въздействие (напр. EC50, EC25, EC10), и диапазонът от концентрации, над който въздействието на изпитвания химикал е от значение, следва да бъдат обхванати от концентрациите, включени в изпитването. Екстраполации за стойности, много по-ниски от най-ниската концентрация на въздействие върху изпитваните организми, или по-високи от най-високата концентрация на изпитване, следва да се правят само в изключителни случаи, като в протокола следва да се даде пълно обяснение.
|
План на проучването
Изпитвания доза-отклик
|
28.
|
Въз основа на препоръките от друго кръгово изпитване (изпитване на метод за размножаване на представители на сем. Enchytraeidae) се предлагат три вида планове за изпитване (22). Общата пригодност на всички тези планове е била потвърдена с резултатите от валидирането за H. aculeifer.
|
|
29.
|
При определяне границите на концентрация се взема предвид следното:
|
—
|
За определяне на ECx (напр. EC10, EC50) следва да се изпитат дванадесет концентрации. Препоръчват се най-малко две повторения за всяка концентрация на изпитване и шест контролни повторения. Кратността на разделянето може да варира, т.е., да е по-малка или равна на 1,8 в диапазона на очакваното въздействие и над 1,8 при по-високите и по-ниските концентрации.
|
|
—
|
За определяне на NOEC следва да се изпитат най-малко пет концентрации в геометрична прогресия. Препоръчват се четири повторения за всяка концентрация за изпитване, плюс осем контроли. Концентрациите трябва да бъдат разделени една от друга с кратност, която не превишава 2,0.
|
|
—
|
Комбинираният подход дава възможност за едновременно определяне на NOEC и ЕСх. Следва да бъдат използвани осем концентрации на третиране в геометрична прогресия. Препоръчват се четири повторения за всяко третиране, плюс осем контроли. Концентрациите трябва да бъдат разделени една от друга с кратност, която не превишава 1,8.
|
|
Гранично изпитване
|
30.
|
Ако при изпитването за определяне на обхвата не се наблюдават въздействия при най-високата концентрация (т.е. 1 000 mg/kg сухо тегло на почвата), окончателното изпитване за размножаването може да бъде проведено като гранично изпитване, като се използва концентрация на изпитване от 1 000 mg/kg сухо тегло на почвата. Граничното изпитване ще предостави възможност да се демонстрира, че стойността на NOEC или EC10 за размножаването е по-висока от пределната концентрация, едновременно с намаляване до минимум на броя акари, използвани в изпитването. По осем повторения следва да се използват както за третираната почва, така и за контролата.
|
Продължителност на изпитването и измервания
|
31.
|
Всички установени разлики между поведението и морфологията на акарите в контролите и третираните съдове следва да бъдат записвани.
|
|
32.
|
На ден 14 преживелите акари се извличат от почвата чрез топлина/светлина, или чрез друг подходящ метод (вж. допълнение 5). Броенето на ювенилните (т.е. ларва, протонимфа, дейтонимфа) и полово зрелите екземпляри се извършва отделно. Всички полово зрели акари, които не са намерени по това време, трябва да бъдат записани като мъртви, като се допуска, че такива акари са умрели и са се разградили преди оценката. Ефикасността на извличането трябва да бъде валидирана веднъж или два пъти в годината в контроли с известен полово зрели и ювенилни екземпляри. Ефикасността следва да бъде над 90 % средно, комбинирана за всички стадии на развитие (вж. допълнение 5). Преброяване на полово зрелите и ювенилните екземпляри не се коригира с оглед на ефикасността.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
33.
|
Информация относно статистическите методи, които могат да бъдат използвани за анализ на резултатите от изпитването, е представена в точки 36—41. В допълнение следва да бъде консултиран Документ № 54 на ОИСР относно „Съвременни подходи за статистически анализ на данни за екотоксичност: насоки за прилагане“ (31).
|
|
34.
|
Основната крайна точка на изпитването е репродуктивната способност, в случая броят на ювенилните индивиди, получени на съд за изпитване с повторение (с въведени 10 полово зрели женски). За статистическия анализ се изисква средно аритметичната стойност (Х) и дисперсията (s2) за репродуктивната способност да бъдат изчислени на третирана проба и на контрола. X и s2 се използват за процедурите на ANOVA, като t-тест на Стюдънт, тест на Дънет или тест на Уйлямс, както и за изчисляването на 95 %-ните доверителни интервали.
Забележка: Тази основна крайна точка е равностойна на плодовитост, измерена чрез броя на живите ювенилни екземпляри, получени по време на изпитването, разделен на броя на родителските женски, въведени в началото на изпитването.
|
|
35.
|
Броят на преживелите женски индивиди в нетретираните контроли е основен критерий за валидност и трябва да бъде документиран. Също както и при изпитването за определяне на обхвата, всички други признаци за неблагоприятно въздействие трябва да бъдат записани и в окончателния протокол.
|
ECx
|
36.
|
Стойностите на ECx, включително свързаните с тях долни и горни 95 %-ни доверителни граници за описания в точка 34 параметър, се изчисляват с помощта на подходящи статистически методи (например пробит-анализ, логистична функция или функция на Вейбул, метод на Спирмън-Карбър с изключване на данни, или обикновена интерполация). Стойност на ECx се получава чрез добавяне на стойност, съответстваща на x % от средната стойност на контролна проба в уравнението. За изчисляване на EC50 или всяка друга стойност ECx, средните стойности от всяко третиране (X) следва да бъдат подложени на регресионен анализ.
|
NOEC/LOEC
|
37.
|
Ако със статистическия анализ се цели определяне на NOEC/LOEC, необходими са статистики за всеки отделен съд (индивидуалните съдове се разглеждат като повторения). Трябва да се използват подходящи статистически методи (съгласно документ на ОИСР № 54 „Съвременни подходи за статистически анализ на данни за екотоксичност: насоки за прилагане“ (Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application). По принцип неблагоприятните въздействия на изпитвания обект в сравнение с контролата се проучват чрез проверяване на (по-малката) едностранна хипотеза при p ≤ 0,05. Примери са дадени в следващите точки.
|
|
38.
|
Нормалността на разпределението на данните може да се тества например с тест на Колмогоров-Смирнов за качество на апроксимацията, тест с тестова статистика отношението на размаха към стандартното отклонение (R/s-тест) или тест на Шапиро-Уилк (двустранен, p ≤ 0,05). За тестване на хомогенността на дисперсията могат да се използват тест на Кокрън, тест на Левин или тест на Бартлет, (двустранен, p ≤ 0,05). Ако са изпълнени критериите за използване на параметрични тестови процедури (нормалност, хомогенност на дисперсията), могат да се извършат еднофакторен дисперсионен анализ (ANOVA) и последващи множествени сравнения. Множествени сравнения (например t-тест на Дънет) или трендови тестове със стъпка назад (напр. тест на Уйлямс при монотонна зависимост доза-отклик) могат да се използват за изчисляване дали са налице статистически значими разлики (p ≤ 0,05) между контролите и различните концентрации на изпитвания обект (избор на препоръчителния тест в съответствие с документ № 54 на ОИСР „Съвременни подходи за статистически анализ на данни за екотоксичност: насоки за прилагане“ (Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application). В противен случай за определяне на NOEC и LOEC следва да се използват непараметрични методи (напр. U-тест на Бонферони по Holm или трендов тест на Йонкхере-Терпстра).
|
Гранично изпитване
|
39.
|
Ако е извършено гранично изпитване (сравнение на контрола и само на едно третиране) и са изпълнени критериите за използване на параметрични тестови процедури (нормалност, хомогенност), метричните отклици могат да бъдат оценени чрез тест на Стюдънт (t-тест). Ако тези критерии не са изпълнени, може да се използва t-тест за нееднаква дисперсия (t-тест на Уелч) или непараметричен тест, напр. U-тест на Ман-Уитни.
|
|
40.
|
За установяване на значими разлики между контролите (контрола и контрола на разтворител), повторенията на всяка контрола могат да се изпитват както е описано при граничното изпитване. Ако при тези изпитвания не бъдат установени значими разлики, всички повторения на контроли и контроли на разтворител могат да бъдат обединени. В противен случай всички третирания следва да бъдат сравнявани с контролата на разтворител.
|
Протокол от изпитването
|
41.
|
Протоколът от изпитването следва да включва най-малко следната информация:
|
—
|
Изпитван химикал
|
—
|
идентичността на изпитвания химикал, наименование, партида, пратка и номер по CAS, чистота;
|
|
—
|
физични и химични свойства на изпитвания химикал (напр. log Kow, разтворимост във вода, парно налягане, константа на Хенри (H) и, за предпочитане, информация относно съдбата на изпитвания химикал в почвата);
|
|
|
—
|
Изпитвани организми
|
—
|
Идентификация и доставчик на изпитваните организми, описание на условията за отглеждане;
|
|
—
|
възрастов диапазон на изпитваните организми.
|
|
|
—
|
Условия на изпитването
|
—
|
описание на плана на проучването и на процедурата;
|
|
—
|
подробни данни за приготвянето на почвата за изпитване; подробна спецификация, ако се използва естествена почва (произход, история, зърнометричен състав, pH, съдържание на органична материя, и класификация на почвата, ако има налична)
|
|
—
|
максималната способност на почвата за задържане на вода;
|
|
—
|
описание на техниката, използвана за прилагане на изпитвания химикал към почвата;
|
|
—
|
подробни данни за спомагателните химикали, използвани за прилагането на изпитвания химикал;
|
|
—
|
размер на съдовете за изпитване и суха маса на почвата за изпитването на съд за изпитване;
|
|
—
|
условия на изпитване: интензитет на светлината, продължителност на циклите светлина-тъмнина, температура;
|
|
—
|
описание на режима на хранене, вида и количество на храната, използвана при изпитването, дати на хранене;
|
|
—
|
стойност на рН и съдържание на вода в почвата в началото и по време на изпитването (контрола и всяко третиране)
|
|
—
|
подробно описание на метода на извличане и на ефикасността на извличането.
|
|
|
—
|
Резултати от изпитванията
|
—
|
броят на ювенилните екземпляри, определени във всеки от съдовете за изпитване в края на изпитването;
|
|
—
|
броят на полово зрелите женски екземпляри и смъртността при полово зрелите екземпляри ( %), във всеки от съдовете за изпитване в края на изпитването
|
|
—
|
описание на видими симптоми, или явни промени в поведението;
|
|
—
|
резултатите, получени с референтния изпитван химикал;
|
|
—
|
обобщени статистики (ECx и/или NOEC) включително 95 %-ни доверителни граници и описание на метода на изчисление;
|
|
—
|
графично изобразяване на зависимостта концентрация-отклик;
|
|
—
|
отклонения от процедурите, описани в настоящия метод за изпитване, и всички необичайни обстоятелства по време на изпитването.
|
|
|
ЛИТЕРАТУРА
|
(1)
|
Casanueva, M.E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21-46.
|
|
(2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259-274.
|
|
(3)
|
Bakker, F.M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. and van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS — Journal of Soils and Sediments 3, 73-77.
|
|
(4)
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. 2nd edition In: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 pp.
|
|
(5)
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the popualation development of Hypoaspis aculeifer (Acari: Parasitiformes). In: F. Dusbabek & V. Bukva (eds.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487-492
|
|
(6)
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: p 241-249.
|
|
(7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: p 621-628.
|
|
(8)
|
Krogh, P.H. and Axelsen, J.A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. In: Lokke, H. and van Gestel, C.A.M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, p 239-251.
|
|
(9)
|
Løkke, H., Janssen, C.R., Lanno, R.P., Römbke, J., Rundgren, S. and Van Straalen, N.M. (2002). Soil Toxicity Tests — Invertebrates. In: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P.W., Van Straalen, N.M. and Tarazona, J.V. (eds.). SETAC Press, Pensacola, USA. 128 pp.
|
|
(10)
|
Schlosser, H.-J. and Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395-433.
|
|
(11)
|
Schlosser, H.-J. and Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413-433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K. and Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154-7157.
|
|
(13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95-122.
|
|
(14)
|
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
|
(15)
|
Глава В.8 от настоящото приложение — „Токсичност за земни червеи“.
|
|
(16)
|
EPPO (2003): EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195-209.
|
|
(17)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis — Gravimetric method, No. 11465. ISO, Geneve.
|
|
(18)
|
Fairbrother, A., Glazebrock, P.W., Van Straalen, N.M. and Tarazona, J.V. 2002. Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, USA.
|
|
(19)
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges.allg..angew. Ent. 3:122-125.
|
|
(20)
|
Schlosser, H.J., und Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool.Beitr. N.F. 34(3):395-433.
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. and Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130-135.
|
|
(22)
|
Глава В.32 от настоящото приложение- Изпитване за размножаване на представители на сем. Enchytraeidae.
|
|
(23)
|
ISO (International Organization for Standardization) (1994). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(24)
|
Southwood, T.R.E. (1991). Ecological methods. With particular reference to the study of insect populations. (2nd ed.). Chapman & Hall, London, 524 pp.
|
|
(25)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie (2nd ed.). G. Fischer, Jena, 539 pp.
|
|
(26)
|
Lesna, I. and Sabelis, M.W. (1999). Diet-dependent female choice for males with „good genes“ in a soil predatory mite. Nature 401, 581-583.
|
|
(27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103-107.
|
|
(28)
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
(29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11-59.
|
|
(30)
|
Kevan, D.K. McE. and Sharma, G.D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647-658.
|
|
(31)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
Допълнение 1
Определения
В настоящия метод за изпитване са приложими следните определения (в настоящото изпитване всички ефективни концентрации се изразяват като масата на изпитвания химикал към сухата маса на почвата за изпитване):
|
|
Химикал означава вещество или смес.
|
|
|
NOEC (концентрация без наблюдавано въздействие) е концентрацията на изпитвания химикал, при която не се наблюдава въздействие. В настоящото изпитване концентрацията, съответстваща на NOEC, няма статистически значимо (р < 0,05) въздействие в рамките на даден период на експозиция, при сравнение с контролата.
|
|
|
LOEC (най-ниската концентрация, при която се наблюдава ефект) е най-ниската концентрация на изпитвания химикал, при която е наблюдавано статистически значимо въздействие (р < 0,05) в рамките на даден период на експозиция, при сравнение с контролата.
|
|
|
ЕСх (ефективна концентрация, при която се наблюдава х % от въздействието) е концентрацията, която причинява х % от дадено въздействие на изпитвани организми в рамките на даден период на експозиция, при сравнение с контрола. Например EC50 е концентрация, за която е направена оценка, че предизвиква дадено въздействие върху изпитвана крайна точка в 50 % от експонираната популация в рамките на определен период на експозиция.
|
|
|
Изпитван химикал е всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
|
Допълнение 2
Определяне на максималната способност на почвата за задържане на вода
Следният метод за определяне на максималната способност на почвата за задържане на вода се счита за подходящ. Той е описан в приложение В към ISO DIS 11268-2 (Качество на почвите — въздействия на замърсители върху земни червеи (Eisenia fetida). Част 2: Определяне на въздействията върху размножаването (23)).
Взема се определено количество (например 5 г) изпитван почвен субстрат с помощта на подходящо устройство за пробовземане (шнекова сонда и т.н.). Дъното на сондата се покрива с парче филтърна хартия, напоено с вода, и след това се поставя на стойка на водна баня. Сондата следва постепенно да се потапя във водата, докато водното ниво стане над повърхността на почвата. След това тя се оставя във водата за около три часа. Тъй като не цялото количество вода, абсорбирано от почвените капиляри, може да бъде задържано, почвената проба следва да се остави да се отцеди в продължение на два часа чрез поставяне на сондата върху легло от много влажен фино смлян кварцов пясък, намиращо се в покрит съд (за да се предотврати изсушаването). След това тази проба трябва да бъде претеглена и изсушена до постоянна маса при 105 °C. Способността за задържане на вода (СЗВ) може да се изчисли, както следва:

където:
S= водонаситен субстрат + маса на сондата + маса на филтърната хартия
T= тара (маса на сондата + маса на филтърната хартия)
D= сухата маса на субстрата
Допълнение 3
Определяне на стойността на рн на почвата
Описаният по-долу метод за определяне на pH на почвата се основава на описанието в ISO DIS 10390: Качество на почвите — Определяне на pH (16).
Определено количество почва се изсушава при стайна температура в продължение на най-малко 12 часа. След това се приготвя суспензия от почвата, (съдържаща най-малко 5 грама почва) в нейния петкратен обем или в 1 M разтвор на калиев хлорид (KCl) с квалификация „чист“, или в 0,01 M разтвор на калциев хлорид (CaCl2) с квалификация„чист“. След това суспензията се разклаща добре в продължение на пет минути и се оставя да се утаи в продължение на най-малко 2 часа, но не повече от 24 часа. След това се измерва стойността на pH на течната фаза с помощта на рН-метър, който е бил калибриран преди всяко измерване чрез подходящ набор от буферни разтвори (напр. pH 4,0 и 7,0).
Допълнение 4
Отглеждане на Hypoaspis (Geolaelaps) aculeifer, акари в храните и синхронизиране на културата
Отглеждане на Hypoaspis (Geolaelaps) aculeifer:
Културите могат да бъдат поддържани в пластмасови съдове или стъклени буркани, напълнени със смес от парижки гипс/въглен на прах (9:1). Гипсът може да се поддържа влажен чрез добавяне на няколко капки дестилирана или дейонизирана вода, ако е необходимо. Оптималната температура на отглеждането е 20 ± 2 °C, режимът светлина/тъмнина не е от значение за този вид. Жертвите могат да бъдат акари от видовете Typrophagus putrescentiae или Caloglyphus sp. (акарите в храните трябва да бъдат третирани внимателно, тъй като те биха могли да предизвикат алергии при хората), но нематодите, представителите на семейство Enchytraeidae и колемболите също са подходящи като обекти, представляващи жертва. Техният източник следва да бъде записан. Развитието на популацията може да започне с една женска, тъй като мъжките се развиват в неоплодени яйца. Поколенията до голяма степен се припокриват. Женският индивид може да живее най-малко 100 дни, като през този период може да снесе приблизително 100 яйца. Максималната скорост на снасяне на яйца се достига между 10 и 40 дни (след достигането на полова зрялост) и възлиза на 2,2 яйца женска– 1 ден– 1. Времето за развитие от яйцето до полово зрелия женски индивид е около 20 дни при 20 °C. Предварително следва да се отглежда и съхранява повече от една култура.
Отглеждане на Typrophagus putrescentiae:
Акарите се съхраняват в стъклен съд, запълнен с бирена мая на фин прах, която е поставена в пластмасов контейнер, напълнен с разтвор на KNO3 с цел да се предотврати избягване. Акарите в храните се поставят в горната част на този прах. След това те внимателно се разбъркват с праха (който трябва да се сменя два пъти седмично) с помощта на шпатула.
Синхронизиране на културата:
Екземплярите, използвани при изпитването, трябва да бъдат на сходна възраст (около 7 дни след достигане на полова зрялост). При отглеждане на температура от 20 °C това се постига чрез
прехвърляне на женските в чист съд за отглеждане и добавяне на достатъчно количество храна
|
—
|
даване на възможност за снасяне на яйца от два до три дни, отстраняване на женските
|
|
—
|
вземане на полово зрелите женски индивиди между 28-ия и 35-ия ден след поставянето на женските в чисти съдове за отглеждане.
|
Полово зрелите женски индивиди могат лесно да бъдат различени от мъжките и от индивидите на други етапи от развитие по по-големите си размери, подутата си форма и кафяфия дорзален щит (мъжките са по-тънки и плоски), индивидите, които не са достигнали полова зрялост, са с бял до кремав цвят. Развитието на акари следва приблизително модела, описан по-долу при 20 °C (фигура): яйце 5 дни, ларва 2 дни, протонимфа 5 дни, дейтонимфа 7 дни, етап преди яйцеотлагането при женските 2 дни. След това акарите са полово зрели.
Фигура:
Развитие на Hypoaspis (Geolaelaps) aculeifer при 20 °C. (отстраняване = женски индивиди, използвани за изпитването)

Полово зрелите изпитвани екземпляри се отстраняват от синхронизираната култура и се въвеждат в съдовете за изпитване между 28-ия и 35-ия ден след като родителските женски индивиди са започнали снасянето на яйца (т.е., 7—14 дни след като са достигнали полова зрялост). По този начин се гарантира, че изпитваните екземпляри вече са преминали етапа преди яйцеотлагането и са копулирали с мъжки, които също се намират в съда за отглеждане. Наблюденията върху култури в лабораторни условия показват, че при наличие на мъжки женските копулират незабавно или малко след достигане на полова зрялост (Ruf, Vaninnen, лич. набл). Периодът от седем дни е избран така, че да се улесни интегрирането към условията на лабораторната работа и да се ограничи варирането в индивидуалното развитие сред акарите. Снасянето на яйца следва да започне най-малко със същия брой женски индивиди, който евентуално е необходим за изпитването (например ако в изпитването са необходими 400 женски, поне на 400 женски следва да се даде възможност за снасяне на яйца от два до три дни. Минимум 1 200 яйца следва да бъдат началната точка за синхронизираната популация (съотношение между половете около 0,5, смъртност около 0,2). За да се избегне канибализмът е по-практично в един съд да се държат не повече от 20-30 снасящи яйца женски.
Допълнение 5
Методи за извличане
Извличането чрез топлина е подходящ за микроартроподи метод за отделяне на индивидите от почвата/субстрата (вж. фигурата по-долу). Методът се основава на активността на организмите, следователно ще могат да бъдат регистрирани само мобилни екземпляри. Принципът на извличането чрез топлина е постепенното влошаване на условията за организмите в пробата по такъв начин, че те да напуснат напуснат субстрата и да попадат в течност за фиксиране (напр. етанол). Ключови точки са продължителността на извличането и градиентът от добри през умерени до лоши условия за организмите. Продължителността на извличането за екотоксикологични изпитвания трябва да бъде възможно най-малка, защото всяко нарастване на популацията по време на извличането би довело до неверни резултати. От друга страна температурата и влажността като условията в пробата трябва да бъдат винаги в обхват, който позволява на акарите да се движат. Затоплянето на почвената проба води до изсушаване на субстрата. В случай че изсушаването е твърде бързо, някои акари биха могли също да бъдат изсушени преди да успеят да напуснат.
Следователно се предлага следната процедура (24) (25):
|
|
Апаратура: Фуния на Тулгрен или сравними методи, като например на Макфадиен (затопляне отгоре, пробата се поставя върху фуния)
|
|
|
Режим на затоплянето: 25 °C в продължение на 12 часа, 35 °C в продължение на 12 часа, 45 °C в продължение на 24 часа (общо 48 часа). Температурата трябва да се измерва в субстрата.
|
|
|
Течност за фиксиране: 70 % етанол
|
|
|
Подробни данни: Взема се стъклен флакон, който е използван за изпитването. Отстранява се капачката и около отвора се увива парче от мрежа или тъкан. Тъканта трябва да е с размер на отвора от 1,0 до 1,5 mm. Тъканта се фиксира с еластична лента. Флаконът се обръща внимателно с дъното нагоре и се поставя в апаратурата за извличане. Тъканта предотвратява процеждането на субстрат в течността за фиксиране, но дава възможност на акарите да напуснат пробата. Режимът на затопляне започва след поставянето на всички флакони. Извличането се прекратява след 48 часа. Флаконите за фиксиране се отстраняват и акарите се преброяват чрез стереомикроскоп.
|
Ефикасността на извличането на избрания метод трябва да се доказва веднъж или два пъти годишно, като се използват съдове, които съдържат предварително известен брой ювенилни и полово зрели акари, държани в нетретиран субстрат за изпитване. Ефикасността следва да бъде ≥ 90 % средно, комбинирана за всички стадии на развитие.
Устройство за извличане от тип Тулгрен
Как да се приготви флаконът за изпитване след приключване на изпитването, преди извличането

Допълнение 6
Идентификация на Hypoaspis (Geolaelaps) aculeifer
|
Подклас/разред/подразред:
|
|
Семейство:
|
|
Род/подрод/вид:
|
|
Acari/Parasitiformes/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Автор и дата:
|
F. Faraji, Ph.D. (MITOX), 23 January 2007
|
|
Използвана литература:
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, 2nd revised edition: 1-523.
Hughes, A.M. (1976). The mites of stored food and houses. Ministry of Agriculture, Fisheries and Food, Technical Bulletin 9: 400pp.
Krantz, G.W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 pp.
|
|
Характеристики за определяне:
|
тектумът със закръглен назъбен край; хипостомалните бразди с повече от 6 зъбци; опашните дорзални четинки от Z4 не много дълги; дорзалните четинки четинковидни; гениталният щит нормален, не много разширен и не достигащ до аналния щит; Задната половина от дорзалния щит без нечифтни четинки; крака II и IV с няколко дебели големи четинки; дорзална четинка Z5 около два пъти по-дълга от J5; неподвижният палец на хелицерата с 12-14 зъбци, а подвижният палец с 2 зъбци; Дължина на идиосомата 520-685 микрона.
Hypoaspis miles също се използва за биологичен контрол и може да се обърка с H. aculeifer. Основната разлика е:
H. miles принадлежи към подрод Cosmolaelaps и е с подобни на нож дорзални четинки, докато H. aculeifer принадлежи към подрод Geolaelaps и е с четинковидни дорзални четинки.
|

Допълнение 7
Основна информация за биологичните характеристики на Hypoaspis (Geolaelaps) aculeifer
Hypoaspis aculeifer принадлежи към семейство Lealapidae, разред Acari (акари), клас Arachnida, тип Arthropoda. Живеят във всички видове почви и се хранят с други акари, нематоди, енхитреиди и колемболи (26). В случай на недостиг на храна преминат към канибализъм (27). Тялото на хищните акари се дели на идиосома и гнатосома. Липсва ясно разграничение на идиосомата на просома (глава) и опистосома (коремче). Гнатосомата (главогръден щит) съдържа средствата за хранене като педипалпите и хелицерите. Хелицерите са разтроени и имат зъбци с различна форма. Освен за поглъщане мъжките използват хелицерите си главно за прехвърляне на сперматофорите към женските. Идиосомата е покрита почти изцяло от дорзален щит. Голяма част от идиосомата на женския индивид е заета от органите за размножение, които са особено различими малко преди яйцеполагането. Вентрално могат да бъдат намерени два щита — гръден и генитален. Всички крака имат четинки и шипове. Четинките на краката се използват за опора при движение във и по повърхността на почвата. Първата двойка крака се използва главно като антени. Втора двойка крака се използва не само за придвижване, но също така за захващане на жертвата. Шиповете на четвъртата двойка крака могат да служат за защита, както и като „двигател“ (28). Мъжките са с дължина от 0,55 до 0,65 mm и с тегло от 10—15 μg. Женските са с дължина от 0,8 до 0,9 mm и с тегло от 50—60 μg (8) (28) (фиг. 1).
Фигура 1:
Женски индивид, мъжки индивид, протонимфа и ларви на H. aculeifer.

При 23 °C акарите достигат полова зрялост съответно след 16 дни (при женските) и 18 дни (при мъжките) (6). Женският индивид прехвърля сперматофора през гениталния отвор, откъдето той достига до семеприемника. В семеприемника сперматозоидите узряват и се съхраняват. Оплождането се извършва едва след узряването на сперматозоидите в семеприемника. Оплодените или неоплодените яйца се полагат от женските слепени или отделно, за предпочитане в пукнатини или дупки. От копулиралите женски се раждат ювенилни индивиди и от двата пола, докато от яйцата от некопулиралите женски се излюпват само мъжки ювенилни индивиди. За достигането до етапа на полова зрялост индивидът преминава през четири фази на развитие (яйца — ларви, ларви — протонимфа, протонимфа — дейтонимфа, дейтонимфа — полово зрял индивид).
Яйцето е млечнобяло, прозрачно, елипсовидно и с дължина приблизително 0,37 mm, с твърда обвивка. Според (8) ларвите са с размер между 0,42 и 0,45 mm. Те имат само три двойки крака. В областта на главата са развити педипалпите и хелицерите. Хелицерите се използват за излюпване от яйцето, тъй като разполагат с няколко малки зъбци. Протонимфите се развиват след първото линеене, 1-2 дни след излюпването. Те също така са с бял цвят, с размери 0,45-0,62 mm (8) и имат четири двойки крака. Зъбците са изцяло налични върху хелицерите. От горепосочения стадий акарите започват да търсят храна. За тази цел кутикулата на жертвата се пробива с хелицерите и в жертвата се изпуска секреция за извънтелесно смилане. След това хранителната каша може да бъде всмукана от акара. хелицерите могат също да се използват за откъсване на по-големи частици от късовете храна (28). След още едно линеене се развиват дейтонимфи. Те са с размери 0,60-0,80 mm (8) и с жълт до светлокафяв цвят. Със започването на тази фаза те могат да бъдат разделени на женски и мъжки. След още едно линеене, през времето на което индивидите са неактивни и се развива кафявият щит (приблизително след 14 дни) акарите стават полово зрели (възрастни) индивиди (28) (29) (30). Техният жизнен цикъл е между 48 и 100 дни при 25 °C (27).
Допълнение 8
Обобщение и времеви график за основните действия, които трябва да бъдат предприети с оглед извършване на изпитването с Hypoaspis
|
Време (дни)
начало на изпитването = ден 0
|
Дейност/Задача
|
|
Ден – 35
до – 28
|
Прехвърляне на женските индивиди от изходната култура в чисти съдове за започване на синхронизацията
2 дни по-късно: отстраняване на женските
два или три пъти в седмицата: даване на достатъчни количества храна
|
|
Ден – 5 (+/– 2)
|
Подготовка на изкуствена почва
|
|
Ден – 4 (+/– 2)
|
Определяне на СЗВ на изкуствената почва
Изсушаване през нощта
На следващия ден: претегляне на пробите и изчисляване на СЗВ
|
|
Ден – 4 (+/– 2)
|
Предварително навлажняване на изкуствената почва за постигане на 20-30 % от СЗВ
|
|
Ден 0
|
Начало на изпитването: изпитваният химикал се добавя към изкуствената почва
Във всяко повторение се въвеждат 10 женски
Всяко повторение се претегля
Приготвят се абиотични контроли за съдържание на влага и pH, 2 повторения за всяко третиране
Контролите за съдържание на влага се изсушават през нощта
На следващия ден: контролите за съдържание на влага се претеглят
На следващия ден: измерва се рН на изсушените абиотични контроли
|
|
Ден 3, 6, 9, 12 (приблизително)
|
Във всяко повторение се осигуряват достатъчно организми, представляващи жертви
Всяко повторение се претегля и евентуално се добавя вода за компенсиране на изпарената
|
|
Ден 14
|
Изпитването се приключва, подготвя се извличането, с всички повторения плюс контролите за ефикасността на извличането
Контролите за съдържание на влага се изсушават през нощта
На следващия ден: Контролите за съдържание на влага се претеглят
На следващия ден: измерва се рН на изсушените контроли
|
|
Ден 16
|
Приключва се извличането
|
|
Ден 16 +
|
Записва се броят на полово зрелите и ювенилните екземпляри в извлечения материал
Резултатите се протоколират в таблици по образец
Процедурата на изпитването се протоколира в листовете за протоколиране на изпитването
|
В.37. 21-ДНЕВНО ИЗСЛЕДВАНЕ НА РИБИ: КРАТКОСРОЧЕН СКРИНИНГ ЗА ЕСТРОГЕННА АКТИВНОСТ, АНДРОГЕННА АКТИВНОСТ И ПОТИСКАНЕ НА АРОМАТАЗАТА
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 230 (2009). Необходимостта от разработване и валидиране на изследване, позволяващо откриване на някои ендокринно активни химикали, произлиза от загрижеността, че нивата на химикали в околната среда могат да причинят неблагоприятни въздействия както за хората, така и за дивата флора и фауна, поради взаимодействието на тези химикали с ендокринната система. През 1998 г. ОИСР стартира с висок приоритет дейност по преразглеждане на съществуващите Насоки за изпитване и по разработване на нови Насоки за изпитване за скрининг и изпитвания за потенциални нарушители на функциите на ендокринната система. Един от елементите на дейността бе да се разработи насока за изпитване за скрининг на химикали, активни в ендокринната система на риби. 21-дневното скринингово изследване на ендокринната система на риби премина на обширна програма за валидиране, състояща се от междулабораторни изследвания с подбрани химикали, за доказване уместността и надеждността на анализа за откриване на химикали, потискащи естрогенната активност и ароматазата (1, 2, 3, 4, 5) в трите изследвани вида риби (Pimephales promelas, японска оризия и зеброво данио); откриването на андрогенна активност е възможно при Pimephales promelas и японска оризия, но не при зеброво данио. Настоящият метод за изпитване не позволява откриването на антиандрогенни химикали. Работата по валидирането е преминала през партньорска проверка от група от експерти, назначени от националните координатори на Програмата за насоки за изпитване (6). Изследването не е предназначено за идентифициране на специфични механизми на хормонални нарушения, тъй като изпитваните животни имат интактна хипоталамус-хипофиза-гонадна ос (ХХГ ос), която може да реагира на химикали, оказващи въздействие върху ХХГ оста на различни равнища. Краткосрочно изследване на размножаването при риби (ОИСР TG 229) включва плодовитостта и, по целесъобразност, хистопатологията на гонадите за Pimephales promelas, както и всички крайни точки, включени в настоящия метод за изпитване. Насоки за изпитване № 229 на ОИСР предоставят скрининг на химикали, които въздействат върху размножаването чрез различни механизми, в това число ендокринни механизми. Това следва да бъде взето предвид преди избора на най-подходящия метод за изпитване.
|
|
2.
|
Настоящият метод за изпитване описва скринингово изследване in vivo, при което полово зрели мъжки и хвърлящи хайвер женски индивиди се държат заедно и се експонират на даден химикал през ограничена част от жизнения им цикъл (21 дни). При приключване на 21-дневния период на експозиция в зависимост от използвания биологичен вид като крайни точки се измерват един или два биомаркера в мъжки и женски индивиди, в качеството им на показатели за естрогенна активност, потискане на ароматазата или андрогенна активност на изпитвания химикал; тези крайни точки са вителогенин и вторични полови белези. Вителогенин се измерва в Pimephales promelas, японска оризия и зеброво данио, докато вторични полови белези се измерват само в Pimephales promelas и японска оризия.
|
|
3.
|
Настоящото биологично изследване служи като скринингово изследване in vivo за някои ендокринни механизми на действие и неговото прилагане следва да се разглежда в контекста на „Концептуалната рамка на ОИСР за изпитване и оценка на химикали, нарушаващи функциите на ендокринната система“ (28).
|
ПЪРВОНАЧАЛНИ СЪОБРАЖЕНИЯ И ОГРАНИЧЕНИЯ
|
4.
|
Вителогенинът (VTG) обикновено се произвежда от черния дроб на женски яйценосни гръбначни животни в отговор на циркулиращия ендогенен естроген. Той е прекурсор на белтъците в яйчния жълтък и след образуването си в черния дроб преминава в кръвообращението, откъдето стига до яйчника и там се модифицира в образуващия се хайвер. Вителогенинът е почти неоткриваем в плазмата на незрели женски и мъжки риби поради липса на достатъчно циркулиращ естроген; черният дроб обаче може да синтезира и секретира VTG в отговор на външно естрогенно стимулиране.
|
|
5.
|
Измерването на VTG служи за откриване на химикали с различни естрогенни механизми на действие. Откриването на химикали с естрогенно действие е възможно чрез измерване на индуцирането на VTG в мъжки риби, и е много добре документирано в научната литература, преминала през партньорска проверка (напр. (7)). Индуцирането на VTG е доказано и след експозиция на андрогени, които могат да се ароматизират (8, 9). Намаляването на равнището на циркулиращ естроген в женските животни, например посредством инхибиране на ароматазата, превръщаща ендогенния андроген в природния естроген 17β-естрадиол, води до намаляване на нивото на VTG, което се използва за откриване на химикали, притежаващи свойства на инхибитори по отношение на ароматазата (10, 11). Биологичната значимост на отговора с VTG след естрогенно/ароматазно инхибиране е установена и е широко документирана. Възможно е обаче образуването на VTG в женски животни да е също така повлияно от обща токсичност и начини на токсично действие, различни от ендокринните, напр. хепатотоксичност.
|
|
6.
|
Успешно са разработени и стандартизирани за рутинна употреба няколко метода за измерване. Такъв е случаят със специфичните за отделните видове ензимно-свързани имуносорбентни анализи (ELISA), използващи имунохимия за количествено определяне на получавания VTG в малки проби от кръв или черен дроб, взети от отделните риби (12, 13, 14, 15, 16, 17, 18). Проби за измерване на VTG се вземат от кръв от Pimephales promelas, кръв или хомогенат глава/опашка от зеброво данио и черен дроб от японска оризия. При японската оризия е налице добра корелация между VTG, измерен от кръв и от черен дроб (19). В допълнение 6 са дадени препоръчителните процедури за събирането на проби за анализ на VTG. Комплектите за измерване на VTG са широко разпространени; такива комплекти следва да се основават на валидиран специфичен за отделните видове ELISA метод.
|
|
7.
|
Вторичните полови белези в мъжки екземпляри от някои видове риби са видими външно, количествено определяеми и чувствителни към нивата на циркулиращите ендогенни андрогени; такъв е случаят с Pimephales promelas и японската оризия, но не и със зебровото данио, което не притежава количествено определяеми вторични полови белези. Женските запазват способността си за развиване на мъжки вторични полови белези, когато са експонирани на андрогенни химикали във вода. В научната литература са на разположение няколко проучвания, документиращи този тип отговор в Pimephales promelas (20) и японската оризия (21). Намаляването при вторични полови белези у мъжките индивиди следва да се тълкува внимателно поради неголямата статистическата мощност, и следва да се основава на експертна оценка и определяне на значимостта на доказателствения материал. Съществуват ограничения за използването на зебровото данио в настоящото изследване поради липсата на количествено определяеми вторични полови белези, реагиращи на андрогенно активни химикали.
|
|
8.
|
При Pimephales promelas основният показател за външна андрогенна експозиция е броят на размножителните туберкули, разположени по муцуната на женския индивид. При оризията броят на папиларните израстъци представлява основният маркер на екзогенна експозиция на андрогенни химикали при женските риби. Допълнение 5А и допълнение 5Б посочват препоръчваните процедури, които трябва да се спазват при оценката на половите белези съответно при Pimephales promelas и оризията.
|
|
9.
|
Определенията, използвани за този метод за изпитване, са дадени в Допълнение 1.
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
10.
|
В рамките на изследването мъжки и женски риби, способни на размножаване, се експонират заедно в съдове за изпитване. Техният статус на полово зрели и способни на размножаване индивиди позволява ясното разграничаване на половете и следователно дава възможност за свързан с пола анализ на всяка крайна точка, и гарантира тяхната чувствителност към външни химикали. При завършване на изпитването полът се потвърждава с макроскопско изследване на гонадите след отваряне на корема с ножици. Преглед на съответните условия на биологичното изследване е даден в допълнение 2. Изследването обикновено започва с риби, пробовзети от популация, която е в състояние на хвърляне на хайвер; застаряващи индивиди не следва да се използват. Указания относно възрастта на рибите и репродуктивния им статус са дадени в раздела за подбора на риби. Изпитването се провежда, като се използват три концентрации на експозиция на химикал, както и контрола на вода и, ако е необходимо, контрола на разтворител. При оризията и зебровото данио се използват два съда или повторения на третиране (всеки съд съдържа 5 мъжки и 5 женски), а при Pimephales promelas се използват четири съда или повторения на третиране (всеки съд съдържащ 2 мъжки и 4 женски). Това е така с цел приспособяване към териториалното поведение на мъжките при Pimephales promelas, като се поддържа достатъчна мощност на изследването. Експозицията се провежда в продължение на 21 дни и вземане на проби от риби се извършва на 21-ия ден от експозицията.
|
|
11.
|
При вземането на проби на 21-ия ден от експозицията животните се умъртвяват по хуманен начин. Вторичните полови белези се измерват при Pimephales promelas и японската оризия (виж допълнение 5А и допълнение 5Б); кръвни проби за определяне на VTG се вземат от зебровото данио и Pimephales promelas, като алтернатива хомогенат глава/опашка може да се вземе от зебровото данио за определяне на VTG (допълнение 6); черен дроб за анализа на VTG се взема от оризията (допълнение 6).
|
КРИТЕРИИ ЗА ПРИЕМАНЕ НА ИЗПИТВАНЕТО
|
12.
|
За да са приемлими резултатите от изпитването, се прилагат следните условия:
|
—
|
Смъртността в контролите на вода (или на разтворител) не трябва да надвишава 10 % в края на периода на експозиция;
|
|
—
|
концентрацията на разтворен кислород трябва да бъде най-малко 60 % от стойността на насищане при равновесие с атмосферния въздух (ASV) по време на периода на експозиция;
|
|
—
|
температурата на водата трябва да се различава с не повече от ± 1,5 °C между съдовете за изпитване по всяко време на периода на експозиция, и се поддържа в диапазон от 2 °C в рамките на температурните диапазони, посочени за изпитваните видове (допълнение 2).
|
|
—
|
следва да бъдат на разположение доказателства, че концентрацията на изпитвания химикал в разтвора е била задоволително поддържана в рамките на ± 20 % от усреднените измерени стойности. chemical
|
|
ОПИСАНИЕ НА МЕТОДА
Апаратура
|
13.
|
Обикновено лабораторно оборудване и специално следното:
|
а)
|
устройства за измерване на съдържанието на кислород и рН-метри;
|
|
б)
|
оборудване за определяне твърдост и алкалност на водата;
|
|
в)
|
подходяща апаратура за контрол на температурата и за предпочитане продължителен мониторинг;
|
|
г)
|
съдове, направени от химични инертни материали и с подходящ капацитет по отношение на препоръчителната гъстота на зареждане и отглеждане (вж. допълнение 2);
|
|
д)
|
субстрат за хвърляне на хайвер за Pimephales promelas и зебровото данио, допълнение 4 съдържа необходимите подробности;
|
|
е)
|
подходящи точни везни (т.е. точност до ± 0,5 mg).
|
|
Вода
|
14.
|
Всяка вода, в която изпитваният вид показва съответните признаци за дългосрочно преживяване и растеж, може да се използва като вода за изпитването. Необходимо е постоянно качество на водата по време на изпитването. Стойността на рН на водата следва да е от 6,5 до 8,5, но по време на дадено изпитване трябва да е в диапазон ± 0,5 рН единици. За да се гарантира, че водата за разреждане няма да повлияе неправилно върху резултата от изпитването (например чрез образуване на комплекс с изпитвания химикал), пробите за анализ следва да се вземат на интервали. Правят се измервания на тежки метали (например Cu, Pb, Zn, Hg, Cd и Ni), основни аниони и катиони (например Ca2+, Mg2+, Na+, K+, Cl–, и SO4
2–), пестициди (например общо органофосфорни и общо органохлорни пестициди), общ органичен въглерод и суспендирани твърди частици, например на всеки три месеца, когато се знае, че водата за разреждане има относително постоянно качество. Ако е показано, че качеството на водата е постоянно поне за период, по-голям от една година, определянията могат да се правят по-рядко и да се увеличат интервалите (например на всеки шест месеца). Някои от химичните характеристики на водата за разреждане са изброени в допълнение 3.
|
Разтвори за изпитване
|
15.
|
Разтворите за изпитване при избраните концентрации се приготвят чрез разреждане на изходен разтвор. Изходният разтвор се приготвя за предпочитане чрез просто смесване и разбъркване на изпитвания химикал във водата за разреждане с помощта на механични средства (например разклащане или ултрасонификация). За постигане на подходящо концентриран изходен разтвор могат да се използват колони за насищане (колони за разтворимост). Използването на разтворител за носител не е препоръчително. Независимо от това, в случай че е необходим разтворител, успоредно следва да се проведе изпитване на контрола на разтворител, при същата концентрация на разтворител, като тази при третиранията с химикала. За трудно разтворими изпитвани химикали е възможно разтворителят да бъде технически най-доброто решение; Следва да се консултира Ръководството на ОИСР с насоки за изпитване за токсичност във водна среда на трудни вещества и смеси (22). Изборът на разтворител се определя в зависимост от химичните свойства на химикала. Ръководството на ОИСР препоръчва максимум от 100μl/l, което следва да се спазва; Независимо от това неотдавнашен преглед (23) подчерта допълнителни проблеми при използването на разтворители за изпитване на ендокринна активност. Поради това се препоръчва концентрацията на разтворителя, ако е необходим, да бъде сведена до минимум, когато това е технически осъществимо (в зависимост от физичните и химичните свойства на изпитвания химикал).
|
|
16.
|
Използва се проточна система за изпитване. Такава система постоянно подава и разрежда изходен разтвор на изпитвания химикал (например система с измерваща помпа, пропорционално разреждащо устройство, сатуратор), за да се подават серии от концентрации към камерите за изпитване. Параметрите на потока на изходния разтвор и водата за разреждане следва да се проверяват на интервали, за предпочитане всеки ден по време на извършването на изпитването, и през това време не следва да се променят с повече от 10 %. Трябва внимателно да се избягва използването на нискокачествени пластмасови тръби или други материали, които могат да съдържат биологично активни химикали. При избора на материали за проточната система трябва да бъде взета под внимание възможна адсорбция на изпитвания химикал в този материал.
|
Отглеждане на рибата
|
17.
|
Рибата за изпитването следва да се избира от лабораторна популация, за предпочитане от едно и също потомство, която е била аклиматизирана в продължение на поне две седмици преди изпитването, при условия, свързани с качеството на водата и осветлението, подобни на тези, използвани при изпитването. Важно е скоростта на зареждане и гъстотата на отглеждане (за определения, виж допълнение 1) да са подходящи за използваните за изпитването видове (вж. допълнение 2).
|
|
18.
|
След 48-часов период на свикване се отчита смъртността и се прилагат следните критерии:
|
—
|
при смъртност, по-голяма от 10 % от популацията за седем дни: отхвърля се цялата партида;
|
|
—
|
при смъртност между 5 % и 10 % от популацията: аклиматизация за нови седем дни; ако смъртността е повече от 5 % през вторите седем дни, се отхвърля цялата партида;
|
|
—
|
при смъртност по-малко от 5 % от популацията за седем дни: партидата се приема
|
|
|
19.
|
По време на аклиматизационния период, в периода преди експозицията или по време на периода на експозиция рибата не следва да бъде лекувана от заболявания.
|
Период преди експозицията и подбор на риби
|
20.
|
Препоръчва се едноседмичен период преди експозицията, в който животните се поставят в съдове, подобни на съдовете при действителното изпитване. Рибите следва да бъдат хранени ad libitum през време на периода на отглеждане и по време на фазата на експозиция. Фазата на експозиция започва с полово диморфни възрастни риби от лабораторна доставка на зрели животни, способни на размножение (напр. с ясно видими вторични полови белези що се отнася до Pimephales promelas и японската оризия) и активно хвърлящи хайвер. Само за общ ориентир (и без да се разглежда изолирано от наблюдаването на настоящия репродуктивен статус на дадена партида от риби), Pimephales promelas трябва да бъде на възраст приблизително 20 (± 2) седмици, като се приема, че рибите от този вид са били отглеждани при 25 ± 2 °C през жизнения им цикъл. Японската оризия трябва да бъде на възраст приблизително 16 (± 2) седмици, като се приема, че рибите от този вид са били отглеждани при 25 ± 2 °C през жизнения им цикъл. Зебровото данио трябва да бъде на възраст приблизително 16 (± 2) седмици, като се приема, че рибите от този вид са били отглеждани при 26 ± 2 °C през жизнения им цикъл.
|
ПЛАНИРАНЕ НА ИЗПИТВАНЕТО
|
21.
|
Използват се три концентрации на изпитвания химикал, една контрола (вода) и, ако е необходимо, една контрола на разтворител. Данните могат да бъдат анализирани, за да се определят статистически значими разлики между отклиците в третиранията и контролите. Тези анализи ще дадат информация дали, вместо за употреба при оценка на риска, не се изисква по-нататъшно по-дългосрочно изпитване за неблагоприятни последици (а именно преживяване, развитие, растеж и размножение) (24).
|
|
22.
|
За зебровото данио и оризията, в ден 21 на опита се пробовземат мъжки и женски животни от всяко ниво на третиране (5 мъжки и 5 женски животни във всяко от двете повторения) и от контролата(ите), за измерване на VTG и вторични полови белези, където е приложимо. За Pimephales promelas в ден 21 на опита се пробовземат мъжки и женски животни (2 мъжки и 4 женски животни във всяко от четирите повторения) и от контролата(ите), за измерване на VTG и вторични полови белези.
|
Избор на концентрации на изпитване
|
23.
|
За целите на това изпитване най-високата изпитвана концентрация трябва да се определя от максимално поносимата концентрация (МПК), определена при изпитване за определяне на обхвата, или от други данни за токсичност, или 10 mg/l, или максималната разтворимост във вода, в зависимост от това коя е най-ниска. МПК се определя като най-високата изпитвана концентрация на химикала, която води до по-малко от 10 % смъртност. При използването на този подход се допуска, че са налице емпирични данни за смъртността от остра и друга токсичност, от които може да се оцени МПК. Оценката на МПК може да бъде неточна и обикновено се изисква определена професионална преценка.
|
|
24.
|
Изискват се три изпитвани концентрации, раздалечени на равни интервали една от друга с кратност, която не надвишава 10, и контрола на вода за разреждане (както и контрола на разтворител, ако е необходимо). Препоръчва се раздалечаване с кратност между 3,2 и 10.
|
ПРОЦЕДУРА
Подбор и измерване теглото на изпитваните риби
|
25.
|
Важно е варирането в теглото на рибите в началото на изпитването да се сведе до минимум. Подходящи диапазони на размерите за различните видове, които се препоръчват за използване в настоящото изпитване, са дадени в допълнение 2. За цялата партида от риби, използвани в изпитването, стойностите на индивидуалните тегла в началото на изпитването следва да се запазят в ± 20 % от средноаритметичното тегло на рибите от същия пол. Препоръчва се да се измерва и теглото на подпроба от рибното потомство преди изпитването с цел да се оцени средното тегло.
|
Условия на експозиция
Продължителност
|
26.
|
Продължителността на теста е 21 дни, след период преди експозицията. Препоръчаният период преди експозицията е една седмица.
|
Хранене
|
27.
|
Рибите следва да бъдат хранени ad libitum с подходяща храна (приложение 2) в достатъчно количество за поддържане на телесното състояние. Следва да се полагат грижи за избягване на развитието на микроби и на мътност на водата. Като обща насока дневната порция може да бъде разделена на две или три равни части за многократно ежедневно хранене, с поне три часа между всяко хранене. Еднократна по-голяма порция е приемлива, особено за съботите и неделите. Даването на храна се прекратява 12 часа преди пробовземането/аутопсията.
|
|
28.
|
Храната за риби следва да бъдат оценявана за наличието на замърсители, като например органохлорни пестициди, полициклични ароматни въглеводороди (PAH), полихлорирани бифенили (PCB). Храна с повишени нива на фитоестрогени, които биха нарушили отклика при изследването с познати естрогенни агонисти (напр. 17-бета-естрадиол) следва да се избягва.
|
|
29.
|
Неконсумираната храна и фекалните отпадъци следва да се отстраняват от съдовете за изпитване най-малко два пъти седмично, напр. чрез внимателно почистване на дъното на всеки съд, с използване на сифон.
|
Светлина и температура
|
30.
|
Продължителността на излагане на светлина и температурата на водата следва да са подходящи за изпитваните видове (допълнение 2).
|
Честота на аналитичните определяния и измервания
|
31.
|
Преди започване на периода на експозиция следва да бъде гарантирано правилното функциониране на системата за доставяне на химикала. Всички необходими методи за анализ следва да бъдат установени, включително с достатъчно информация за стабилността на химикала в системата за изпитване. По време на изпитването концентрациите на изпитвания химикал се определят през постоянни интервали, както следва: дебитът на изходните разтвори на водата за разреждане и на токсичния химикал следва да се проверяват, за предпочитане ежедневно, но като минимум два пъти седмично и през време на изпитването не следва да се променят с повече от 10 %. Препоръчва се действителните концентрации на изпитвания химикал да се измерват във всички съдове в началото на изпитването и след това на интервали от една седмица.
|
|
32.
|
Препоръчва се резултатите да се основават на измерени концентрации. Обаче ако концентрацията на изпитвания химикал в разтвора е поддържана на задоволително ниво в рамките на ± 20 % от номиналната концентрация по време на изпитването, тогава резултатите могат да се основават или на номиналната, или на измерената стойност.
|
|
33.
|
Възможно е да се наложи филтруване (напр. с използване на отвори с размер 0,45 μm) или центрофугиране на пробите. Ако е необходимо, центрофугирането се препоръчва като процедура. Обаче в случай че изпитваният материал не се адсорбира от филтрите, филтруването също може да е приемливо.
|
|
34.
|
По време на изпитването разтвореният кислород, температурата и рН следва да бъдат измервани във всеки съд за изпитване най-малко веднъж седмично. Общата твърдост и алкалността следва да се измерват в контролите и в един съд с най-висока концентрация най-малко веднъж седмично. За предпочитане е температурата да се наблюдава непрекъснато най-малко в един съд за изпитване.
|
Наблюдения
|
35.
|
По време на изследването или при приключването му се оценяват редица общи (напр. преживяване) или ключови биологични отклици (напр. нива на VTG). Измерването и оценката на тези крайни точки и ползата от тях са описани по-долу.
|
Преживяване
|
36.
|
Рибите следва да се преглеждат всеки ден през периода на изпитването и всякаква смъртност следва да се записва, а мъртвите екземпляри се отстраняват колкото е възможно по-бързо. Мъртвите риби не следва да се заменят нито в съдовете с контроли, нито в съдове за третиране. Полът на рибите, които умират по време на изпитването, трябва да се определи чрез макроскопска оценка на гонадите.
|
Поведение и външен вид
|
37.
|
Всяко необичайно поведение (в сравнение с контролите) трябва да бъде отбелязвано; това може да включва признаци на обща токсичност, включително хипервентилация, некоординирано плуване, загуба на равновесие, и нетипично състояние на покой или нетипично поведение при хранене. Освен това следва да бъдат отбелязвани и външните аномалии (като кръвоизлив, обезцветяване). Такива признаци на токсичност следва да се разглеждат внимателно при интерпретирането на данните, тъй като те могат да сочат концентрации, при които биомаркерите за ендокринна активност не са надеждни. Такива наблюдения на поведението могат също да предоставят полезна качествена информация за потенциалните бъдещи изисквания за изпитвания на риби. Така например териториалната агресивност при нормални мъжки или при женски, придобили мъжки вторични полови белези, е наблюдавана при Pimephales promelas при андрогенна експозиция; При зебровото данио характерното поведение при чифтосване и хвърляне на хайвера, проявяващо се непосредствено след изгрев, се ограничава или се възпрепятства от естрогенна или антиандрогенна експозиция.
|
|
38.
|
Тъй като някои аспекти на външния вид (предимно цветът) могат да се променят бързо при боравенето, важно е качествените наблюдения да бъдат извършени преди отстраняването на животните от системата за изпитване. От досегашния опит с Pimephales promelas се предполага, че някои ендокринно активни химикали може първоначално да предизвикат промени в следните външни характеристики: оцветяване на тялото (светло или тъмно), начини на оцветяване (наличие на вертикални ленти) и форма на тялото (главата и гръдната област). Поради това наблюденията на външния вид на рибите следва да бъдат правени по време на изпитването и при приключване на изследването
|
Умъртвяване на риби по хуманен начин
|
39.
|
На ден 21, т.е. при приключване на експозицията, рибите следва да бъдат подложени на евтаназия с подходящи количества трикаин (трикаинов метансулфонат, метакаин, MS-222 (CAS 886-86-2), 100-500 mg/l буфериран с 300 mg/l NaHCO3 (натриев хидрогенкарбонат, CAS 144-55-8), за да се намали дразненето на мукозните мембрани; след това се вземат проби от кръв или тъкани за определяне на вителогенин, както е обяснено в раздела за витогенин.
|
Наблюдение на вторични полови белези
|
40.
|
Някои химикали с активно действие върху ендокринната система могат да предизвикат промени в специализирани вторични полови белези (брой размножителни туберкули при мъжки Pimephales promelas, броят на папиларните израстъци при оризията от мъжки пол). Следва да се отбележи, че химикали с известни начини на действие могат да са причина за анормална проява на вторични полови белези при животни от противоположния пол; например агонисти на андрогенните рецептори като например тренболон, метилтестостерон и дихидротестостерон, могат да предизвикат поява на подчертано развити размножителни туберкули у женски Pimephales promelas, или развитие на папиларни израстъци при оризията от женски пол (11, 20, 21). Протоколирано е също, че агонисти на естрогенните рецептори могат да намалят броя на размножителните туберкули и размера на дорзалните отлагания на колаген при полово зрели мъжки индивиди (25, 26). Такива макроскопски наблюдения на морфологията могат да предоставят полезна качествена информация за потенциалните бъдещи изисквания за изпитвания на риби. Броят и размерът на размножителните туберкули при Pimephales promelas и папиларните израстъци при оризията могат да бъдат количествено определени директно или, по-практично, в консервирани екземпляри. Препоръчваните процедури за оценка на вторични полови белези при Pimephales promelas и при оризията са на разположение съответно в допълнение 5А и допълнение 5Б.
|
Вителогенин (VTG)
|
41.
|
Пробовземането на кръв се извършва от опашната артерия/вена с хепаринизирана микрокапилярка за хематокрит или, като алтернативен вариант, чрез сърдечна пункция със спринцовка. В зависимост от размера на рибата обемът на кръвта за пробовземане обикновено варира между 5 и 60 μl на индивид за Pimephales promelas и 5-15 μl на индивид за зеброво данио. Плазмата се отделя от кръвта чрез центрофугиране и се съхранява с протеазни инхибитори при – 80 °C до анализа за вителогенин. Като алтернатива, при оризията се използва черният дроб, а при зебровото данио като източник на тъкан за определяне на VTG може да се използва хомогенат глава/опашка (допълнение 6). Измерването на VTG следва да се основава на валидиран хомоложен ELISA метод, като се използва хомоложен VTG стандарт и хомоложни антитела. Препоръчва се използването на метод, който позволява да се открият нива VTG от порядъка на няколко ng/ml плазма (или ng/mg тъкан), което е фоновото ниво при неекспонирани мъжки риби.
|
|
42.
|
Контролът на качеството на анализа на VTG се извършва чрез използването на еталони, празни проби и анализи с най-малко две повторения. За всеки ELISA метод следва да се проведе изпитване за матричен ефект (ефект на разреждане на пробата), за да се определи минималният коефициент на разреждане на пробата. Всяка ELISA плака, използвана за изследвания на VTG, следва да включва следните проби за контрол на качеството: най-малко 6 еталона за калибриране, покриващи диапазона от очаквани концентрации на VTG, и поне една празна проба за изследване за неспецифично свързване (анализ в две повторения). Абсорбцията при тези празни проби следва да е по-малко от 5 % от максималната абсорбция на еталона за калибриране. Следва да се анализират най-малко две аликвотни части (две повторения в отделни гнезда) от всяко разреждане на проба. Повторенията в отделни гнезда, които се различават с повече от 20 %, следва да бъдат анализирани повторно.
|
|
43.
|
Коефициентът на корелация (R2) за калибрационните криви трябва да бъде по-голям от 0,99. Независимо от това, високата корелация не е достатъчна, за да гарантира достатъчно прогнозиране на концентрацията във всички диапазони. В допълнение към достатъчно високата степен на корелация за калибрационната крива, концентрацията на всеки еталон, както е изчислена от калибрационната крива, следва да попада между 70 и 120 % от неговата номинална концентрация. В случай, че трендът на номиналните концентрации се отдалечава от тренда на регресионната линия (напр. при по-ниски концентрации), може да е необходимо калибрационната крива да се раздели на ниски и високи диапазони, или да се използва нелинеен модел за подходящо изглаждане на данните от абсорбцията. Ако кривата е раздвоена, и двата линейни участъка следва да са с R2 > 0,99.
|
|
44.
|
Границата на откриване (LOD) се определя като границата, под която концентрацията е твърде ниска за откриване на веществото, а границата на количествено определяне (LOQ) се определя като границата, под която концентрацията е твърде ниска за откриване на веществото, умножена по най-ниския коефициент на разреждане.
|
|
45.
|
Всеки ден, в който се извършват изпитвания за VTG, се анализира проба с внесена добавка с използване на еталон, който е референтен между различни изследвания (допълнение 7). Отношението на очакваната концентрация към измерената концентрация се протоколира заедно с резултатите от всеки набор от изследвания от този ден.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Оценка на отклиците на биомаркерите чрез дисперсионен анализ (ANOVA)
|
46.
|
За идентифициране на потенциална ендокринна активност на даден химикал се сравняват отклиците между третираните и контролните групи с помощта на дисперсионен анализ (ANOVA). Когато се използва контрола на разтворител, за всяка крайна точка следва да се приложи подходящ статистически тест между контролите на вода за разреждане и на разтворител. Насоки за работата с данните за контролите на вода за разреждане и на разтворител при последващия статистически анализ могат да се намерят в източник OECD, 2006c (27). Всички биологични данни, свързани с отклици, следва да се анализират и протоколират отделно по пол. Ако изискваните допускания за използване на параметричен метод не са изпълнени — не е налице нормалност на разпределението (например тест на Шапиро-Уилк) или дисперсията е хетерогенна (тест на Бартлет или тест на Левин), преди извършването на ANOVA следва да се разгледа трансформиране на данните с оглед хомогенизиране на дисперсията, или извършване на ANOVA с претеглени средни. За немонотонна зависимост доза-отклик могат да се използват тестът на Дънет (параметричен) върху множествени сравнения по двойки, или тестът на Ман-Уитни с корекция на Бонферони (непараметричен). Ако зависимостта е приблизително монотонна, могат да се използват други статистически тестове (напр. тестът на Йонкхере-Терпстра или тестът на Уйлямс). За подпомагане при вземането на решение относно използването на най-подходящия статистически тест в допълнение 8 е представена статистическа блокова схема. Допълнителна информация може да бъде получена също и от документа на ОИСР „Съвременни подходи за статистически анализ на данни за екотоксичност“ (27).
|
Протоколиране на резултатите от изпитването
|
47.
|
Данните от изследването следва да включват:
|
|
Извършваща изпитвания лаборатория:
|
—
|
Отговорен персонал и неговите отговорности, свързани с изследването
|
|
—
|
Всяка лаборатория трябва да е показала компетентността си чрез използване на набор от представителни химикали
|
|
|
|
Изпитван химикал:
|
—
|
Характеризиране на изпитвания химикал (chemical)
|
|
—
|
Физична природа и относими физични и химични свойства
|
|
—
|
Метод и честота на приготвяне на изпитваните концентрации
|
|
—
|
Информация за стабилността и биоразградимостта
|
|
|
|
Разтворител:
|
—
|
Характеристика на разтворителя (естество, използвана концентрация)
|
|
—
|
Обосновка за избора на разтворителя (когато разтворителят е различен от вода)
|
|
|
|
Изпитвани животни:
|
—
|
Биологични видове и щам
|
|
—
|
Доставчик и специални съоръжения на доставчика
|
|
—
|
Възрастта на рибите в началото на изпитването и репродуктивен статус/статус по отношение на хвърляне на хайвера
|
|
—
|
Подробни данни за процедурата за аклиматизация на животните
|
|
—
|
Телесно тегло на рибите в началото на експозицията (от подпроба от рибното потомство)
|
|
|
|
Условия на изпитване:
|
—
|
Използвана процедура на изпитване (тип изпитване, скорост на зареждане, гъстота на отглеждане и т.н.);
|
|
—
|
Метод за приготвяне на изходни разтвори и скорост на потока;
|
|
—
|
Номиналните концентрации на изпитване, измерваните седмично концентрации на разтворите за изпитването и използвания аналитичен метод, средни величини на измерените стойности и стандартни отклонения в съдовете за изпитване, и доказателство, че измерванията се отнасят за концентрациите на изпитвания химикал ( test chemical ) в истински разтвор;
|
|
—
|
Характеристиките на водата за разреждане (включително рН, твърдост, алкалност, температура, концентрация на разтворен кислород, нива на остатъци от хлор, общо съдържание на органичен въглерод, суспендирани твърди частици и всякакви други направени измервания)
|
|
—
|
Качество на водата в съдовете за изпитване: рН, твърдост, температура и концентрация на разтворен кислород;
|
|
—
|
Подробна информация за храненето (например вид на храната(ите), източник, дадено количество и честота, и анализи за съдържание на относими замърсители, ако са на разположение (напр. полихлорирани бифенили, полициклични ароматни въглеводороди и органохлорни пестициди).
|
|
|
|
Резултати
|
—
|
Доказателство, че контролите отговарят на критериите за приемане на изпитването;
|
|
—
|
Данни за смъртността при всички нива на концентрацията на изпитване и в контролите;
|
|
—
|
Използваните техники за статистически анализ, обработка на данните и обосновка за използваните техники;
|
|
—
|
Данни за макроскопски биологични наблюдения на морфологията, включително вторични полови белези и вителогенин;
|
|
—
|
Резултати от анализите на данните, за предпочитане в таблична и графична форма;
|
|
—
|
Проява на необичайни реакции от страна на рибите и всякакви видими въздействия, причинени от изпитвания химикал ( chemical )
|
|
|
НАСОКИ ЗА ИНТЕРПРЕТИРАНЕТО И ПРИЕМАНЕТО НА РЕЗУЛТАТИТЕ ОТ ИЗПИТВАНЕТО
|
48.
|
Този раздел съдържа някои съображения, които трябва да се вземат предвид при тълкуването на резултатите от изпитването за различните измерени крайни точки. Резултатите трябва да се интерпретират внимателно, когато изглежда, че изпитваният химикал предизвиква ясно изразено токсично действие или оказва въздействие върху общото състояние на животното.
|
|
49.
|
При задаването на диапазона на изпитваните концентрации трябва да се внимава да не се превишава максималната поносима концентрация, за да се даде възможност за съдържателно интерпретиране на данните. Важно е да има поне едно третиране, при което не са налице признаци на токсично въздействие. Признаците на заболяване или на токсично въздействие следва да бъдат подробно оценявани и протоколирани. Например, възможно е образуването на VTG в женски животни да е също така повлияно от обща токсичност и начини на токсично действие, различни от ендокринните, напр. хепатотоксичност. Независимо от това, тълкуването на въздействията може да бъде подкрепено чрез други нива на третиране, които да не водят до невъзможност за разграничаване поради системна токсичност.
|
|
50.
|
Има няколко аспекта, които трябва да бъдат взети предвид при приемането на резултатите от изпитването. Като насока, нивата на VTG в контролните групи мъжки и женски животни следва да бъдат разграничени и разделени от около три порядъка при Pimephales promelas и зебровото данио, и от около един порядък при оризията. Примери за диапазона на стойностите, които се срещат в контролните групи и в групите на третиране, могат да бъдат намерени в протоколите за валидиране (1, 2, 3, 4). Високите стойности на VTG в контролни мъжки екземпляри могат да поставят под съмнение реагирането на биологичното изследване и способността му да открива слаби естрогенни агонисти. Ниските стойности на VTG в контролни женски екземпляри могат да поставят под съмнение реагирането на биологичното изследване и способността му да открива инхибитори на ароматазата и естрогенни антагонисти. Изследванията за валидиране са били използвани за изготвянето на тези насоки.
|
|
51.
|
Ако дадена лаборатория не е извършвала изследването преди това, или са направени съществени промени (например промяна на щама на рибите или доставчика), е целесъобразно да се проведе проучване на техническата компетентност. Препоръчва се да се използват химикали, които обхващат широк спектър от механизми на действие или въздействия върху някои от крайните точки от изпитването. На практика всяка лаборатория се насърчава да изгради собствени контролни данни за минали периоди за мъжките и женските индивиди, както и да извърши изпитване на химикал, представляващ положителна контрола за естрогенна активност (напр. 17β-естрадиол при 100 ng/l, или известен слаб агонист), в резултат на което се увеличава VTG в мъжките риби, на химикал, представляващ положителна контрола за потискане на ароматазата (напр. фадрозол или прохлораз при 300 μg/l), в резултат на което се намалява VTG в женския индивид, и на химикал, представляващ положителна контрола за андрогенна активност (напр. 17β-тренболон при 5 μg/l), в резултат на което се индуцират вторични полови белези в женски Pimephales promelas и японска оризия. Всички тези данни могат да бъдат сравнявани с наличните данни от изследванията за валидиране (1, 2, 3), за да се гарантира компетентността на лабораторията.
|
|
52.
|
Като цяло, измерванията на VTG следва да се считат за положителни, ако се наблюдава статистически значимо увеличаване на VTG при мъжките индивиди (p < 0,05), или статистически значимо намаление при женските индивиди (p < 0,05) най-малко при най-високата доза на изпитване, в сравнение с контролната група, и при липса на признаци за обща токсичност. Положителният резултат се подкрепя допълнително от доказване на биологически реалистична връзка между дозата и кривата на отклика. Както беше споменато по-горе, намалението на вителогенина може да не е изцяло с ендокринен произход; независимо от това положителният резултат по принцип следва да се тълкува като доказателство за ендокринна активност in vivo и обичайно следва да води до предприемане на действия за допълнително изясняване.
|
ЛИТЕРАТУРА
|
(1)
|
OECD (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006)27.
|
|
(2)
|
OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006)29.
|
|
(3)
|
OECD (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007)25.
|
|
(4)
|
Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (accessed 18/09/08).
|
|
(5)
|
US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Unpublished report dated 15 December 2007. US Environmental Protection Agency, Washington, DC. 104 pp.
|
|
(6)
|
OECD, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008)21.
|
|
(7)
|
Sumpter and Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7:173-8 Review.
|
|
(8)
|
Pawlowski S, Sauer A, Shears JA, Tyler CR, Braunbeck T (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277-91.
|
|
(9)
|
Andersen L, Goto-Kazato R, Trant JM, Nash JP, Korsgaard B, Bjerregaard P (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4):343-52.
|
|
(10)
|
Ankley GT, Kahl MD, Jensen KM, Hornung MW, Korte JJ, Makynen EA, Leino RL (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences;67(1):121-30.
|
|
(11)
|
Panter GH, Hutchinson TH, Hurd KS, Sherren A, Stanley RD, Tyler CR (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11-21.
|
|
(12)
|
Parks LG, Cheek AO, Denslow ND, Heppell SA, McLachlan JA, LeBlanc GA, Sullivan CV (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2):113-25.
|
|
(13)
|
Panter GH, Tyler CR, Maddix S, Campbell PM, Hutchinson TH, Länge R, Lye C, Sumpter JP, 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Brussels, Belgium.
|
|
(14)
|
Fenske M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217-232.
|
|
(15)
|
Holbech H, Andersen L, Petersen GI, Korsgaard B, Pedersen KL, Bjerregaard P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119-131
|
|
(16)
|
Rose J, Holbech H, Lindholst C, Noerum U, Povlsen A, Korsgaard B, Bjerregaard P. 2002. Vitellogenin induction by 17ß-estradiol and 17ß-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131: 531-539.
|
|
(17)
|
Brion F, Nilsen BM, Eidem JK, Goksoyr A, Porcher JM, Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699-1708.
|
|
(18)
|
Yokota H, Morita H, Nakano N, Kang IJ, Tadokoro H, Oshima Y, Honjo T, Kobayashi K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87–98.
|
|
(19)
|
Tatarazako N, Koshio M, Hori H, Morita M and Iguchi T., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50:301-308.
|
|
(20)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray LE (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350-60.
|
|
(21)
|
Seki M, Yokota H, Matsubara H, Maeda M, Tadokoro H, Kobayashi K (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3):774-81.
|
|
(22)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris
|
|
(23)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp.69–92.
|
|
(24)
|
Hutchinson TH, Ankley GT, Segner H, Tyler CR, 2006b. Screening and testing for endocrine disruption in fish-biomarkers as „signposts“, not „traffic lights“, in risk assessment. Environmental Health Perspectives;114 Suppl 1:106-14.
|
|
(25)
|
Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure to 17B-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129-145.
|
|
(26)
|
Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve and G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478-488.
|
|
(27)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
|
(28)
|
OECD (2012) OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No 150. ENV/JM/MONO(2012)22
|
Допълнение 1
Съкращения и определения
Химикал
: Вещество или смес
CV
: Коефициент на вариация.
ELISA
: Ензимно-свързан имуносорбентен анализ.
Скорост на зареждане
: Мокро тегло на рибите на обем вода.
Гъстота на отглеждане
: Брой на рибите на обем вода.
VTG (вителогенин)
: Фосфогликопротеин, който е прекурсор на белтъците в яйчния жълтък и обикновено се среща в полово активните женски индивиди от всички яйценосни видове.
ХХГ ос
: хипоталамус-хипофиза-гонадна ос.
МПК
: Максимално поносима концентрация, която представлява около 10 % от LC50.
Изпитван химикал
: Всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
Допълнение 2
Опитни условия за скрининговото изследване на ендокринната система при риби
|
|
Pimephales promelas
|
Японска оризия
(Oryzias latipes)
|
Зеброво данио
(Danio rerio)
|
|
|
Проточно
|
Проточно
|
Проточно
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
4.
|
Качеството на осветлението
|
|
Луминесцентни крушки (широк спектър)
|
Луминесцентни крушки (широк спектър)
|
Луминесцентни крушки (широк спектър)
|
|
|
10-20 μE/m2/s, 540-1 000 lux, или 50-100 ft-c (заобикалящи равнища на осветеност в лабораторията)
|
10-20 μE/m2/s, 540-1 000 lux, или 50-100 ft-c (заобикалящи равнища на осветеност в лабораторията)
|
10-20 μE/m2/s, 540-1 000 lux, или 50-100 ft-c (заобикалящи равнища на осветеност в лабораторията)
|
|
6.
|
Фотопериод (преходните фази на разсъмване и здрач са по избор, но не се считат за необходими)
|
|
16 h светлина, 8 h тъмнина
|
12-16 h светлина, 12-8 h тъмнина
|
12-16 h светлина, 12-8 h тъмнина
|
|
|
< 5 g на l
|
< 5 g на l
|
< 5 g на l
|
|
8.
|
Размер на камерата за изпитване
|
|
10 l (най-малко)
|
2 l (най-малко)
|
5 l (най-малко)
|
|
9.
|
Обем на изпитвания разтвор
|
|
8 l (най-малко)
|
1,5 l (най-малко)
|
4 l (най-малко)
|
|
10.
|
Обменени обеми на изпитвани разтвори
|
|
Най-малко 6 дневно
|
Най-малко 5 дневно
|
Най-малко 5 дневно
|
|
11.
|
Възраст на изпитваните организми
|
|
Вж. точка 20
|
Вж. точка 20
|
Вж. точка 20
|
|
12.
|
Приблизително мокро тегло на полово зряла риба (g)
|
|
Женски: 1,5 ± 20 %
Мъжки: 2,5 ± 20 %
|
Женски: 0,35 ± 20 %
Мъжки: 0,35 ± 20 %
|
Женски: 0,65 ± 20 %
Мъжки: 0,4 ± 20 %
|
|
13.
|
Брой на рибите на съд за изпитване
|
|
6 (2 мъжки и 4 женски)
|
10 (5 мъжки и 5 женски)
|
10 (5 мъжки и 5 женски)
|
|
|
= 3 (плюс подходящи контроли)
|
= 3 (плюс подходящи контроли)
|
= 3 (плюс подходящи контроли)
|
|
15.
|
Брой съдове на третиране
|
|
най-малко 4
|
най-малко 2
|
най-малко 2
|
|
16.
|
Брой на рибите на концентрация на изпитване
|
|
16 полово зрели женски и 8 мъжки (4 женски и 2 мъжки във всеки един съд с повторение)
|
10 полово зрели женски и 10 мъжки (5 женски и 5 мъжки във всеки един съд с повторение)
|
10 полово зрели женски и 10 мъжки (5 женски и 5 мъжки във всеки един съд с повторение)
|
|
|
Живи или замразени полово зрели артемии или науплии от артемии два или три пъти дневно (ad libitum), налични в търговската мрежа храни или комбинация от горепосочените
|
Науплии от артемии два или три пъти дневно (ad libitum), налични в търговската мрежа храни или комбинация от горепосочените
|
Науплии от артемии два или три пъти дневно (ad libitum), налични в търговската мрежа храни или комбинация от горепосочените
|
|
|
Няма, освен в случаите, когато концентрацията на разтворения кислород падне под 60 % от стойността на насищане при равновесие с атмосферния въздух
|
Няма, освен в случаите, когато концентрацията на разтворения кислород падне под 60 % от стойността на насищане при равновесие с атмосферния въздух
|
Няма, освен в случаите, когато концентрацията на разтворения кислород падне под 60 % от стойността на насищане при равновесие с атмосферния въздух
|
|
|
Вода с чиста повърхност, кладенчова или възстановена вода или дехлорирана чешмяна вода
|
Вода с чиста повърхност, кладенчова или възстановена вода или дехлорирана чешмяна вода
|
Вода с чиста повърхност, кладенчова или възстановена вода или дехлорирана чешмяна вода
|
|
20.
|
Период преди експозицията
|
|
препоръчват се 7 дни
|
препоръчват се 7 дни
|
препоръчват се 7 дни
|
|
21.
|
Продължителност на експозицията на химикала
|
|
21 d
|
21 d
|
21 d
|
|
22.
|
Биологични крайни точки
|
|
— преживяване
- поведение
- 2-ни полови белези
- VTG
|
- преживяване
- поведение
- 2-ни полови белези
- VTG
|
- преживяване
- поведение
- VTG
|
|
23.
|
Приемливост на изпитването
|
|
Разтворен кислород > 60 % от стойността на насищане; средна температурата 25 ± 2 °C; 90 % преживели риби в контролите; измерени концентрации на изпитване в рамките на 20 % от средните измерени стойности на ниво на третиране.
|
Разтворен кислород > 60 % от стойността на насищане; средна температурата 24 ± 2 °C; 90 % преживели риби в контролите; измерени концентрации на изпитване в рамките на 20 % от средните измерени стойности на ниво на третиране.
|
Разтворен кислород > 60 % от стойността на насищане; средна температурата 26 ± 2 °C; 90 % преживели риби в контролите; измерени концентрации на изпитване в рамките на 20 % от средните измерени стойности на ниво на третиране.
|
Допълнение 3
Някои химични характеристики на приемлива вода за разреждане
|
Съставка
|
Концентрации
|
|
Твърди частици
|
< 20 mg/l
|
|
Общ органичен въглерод
|
< 2 mg/l
|
|
Нейонизиран амоняк
|
< 1 μg/l
|
|
Остатъчен хлор
|
< 10 μg/l
|
|
Общо органофосфорни пестициди
|
< 50 ng/l
|
|
Общо органохлорни пестициди плюс полихлорирани бифенили
|
< 50 ng/l
|
|
Общ органичен хлор
|
< 25 ng/l
|
Допълнение 4А
Субстрат за хвърляне на хайвер за зеброво данио
Вана за хвърляне на хайвера
: всякакви стъклени съдове за инструменти с примерни дължина 22 cm × широчина 15 cm × дълбочина 5,5 cm, покрити с отстранима телена решетка от неръждаема стомана (с ширина на отворите 2 mm). Решетката следва да покрива отвора на съда за инструменти на равнище, по-ниско от върха на съда.

Върху решетката следва да бъде фиксиран субстрат за хвърляне на хайвер. Той следва да представлява структура, в която рибите да могат да проникнат. Например, подходяща е изкуствена аквариумна растителност, изработена от зелен пластмасов материал (NB: следва да се обърне внимание на възможна адсорбция на изпитвания химикал върху пластмасовия материал). Пластмасата следва да бъде промита в достатъчно количество топла вода за период, достатъчен, за да се гарантира, че няма да преминат химикали във водата за изпитването. Когато се използват стъклени материали, следва да се гарантира, че при извършване на енергични движения рибите не се увреждат и не се притискат.
Разстоянието между ваната и стъклените стени трябва да бъде най-малко 3 cm, за да се гарантира, че хвърлянето на хайвер не се извършва извън ваната. Хвърленият във ваната хайвер попада през решетката и може да бъде пробовзет 45-60 min след началото на периода на осветление. Прозачните хайверни зърна не се слепват и могат лесно да бъдат преброени, като се използва напречно осветление. Когато се използват пет женски животни на съд, брой на хайверните зърна до 20 на ден може да се счита за нисък, до 100 за среден и над 100 за висок. Ваната за хвърляне на хайвер се отстранява, хайверните зърна се събират и ваната се поставя отново в съда за изпитване или възможно най-късно вечерта, или много рано сутринта. Времето до повторното поставяне не следва да надвишава един час, защото в противен случай е възможно сигналът от субстрата за хвърляне на хайвер да предизвика чифтосване и хвърляне на хайвер по необичайно време. Ако в дадена ситуация се изисква по-късно въвеждане на ваната за хвърляне на хайвер, това следва да бъде направено поне 9 часа след началото на периода на осветление. През тази късна част от деня вече не се предизвиква хвърляне на хайвер.
Допълнение 4Б
Субстрат за хвърляне на хайвер за Pimephales promelas
Две или три комбинирани пластмасови/керамични/от неръждаема стомана къщички с форма на керемида и вани за хвърляне на хайвер се поставят във всяка камера за изпитване (напр. сив полукръгъл улук с дължина 80 mm, поставен върху вана с дължина 130 mm, с опорен издатък) (вж. изображението). За аклиматизирани по подходящ начин керемиди от поливинилхлорид или керамичен материал е доказано, че са подходящи като субстрат за хвърляне на хайвер (Thorpe et al., 2007).
Препоръчително е керемидите да са шлайфани за подобряване на прилепването. Ваната също така следва да бъде преградена, за да се предотврати достъпът на рибите до падналите хайверни зърна, освен ако ефикасността на прилепването на хайверните зърна не е доказана за използвания субстрат за хвърляне на хайвер.

Основата е проектирана да побира всички хайверни зърна, които не са прилепнали към повърхността на керемидата, и следователно биха паднали на дъното на контейнера (или хайверни зърна, положени направо върху плоската пластмасова основа). Преди употреба всички субстрати за хвърляне на хайвер трябва да се промият в продължение на минимум 12 часа във вода за разреждане.
ПОЗОВАВАНИЯ
Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98.
Допълнение 5А
Оценка на вторични полови белези у Pimephales promelas за откриване на определени химикали с активно действие върху ендокринната система
Общ преглед
При изпитвания за нарушители на функциите на ендокринната система потенциално важните характеристики на външния вид на полово зрели Pimephales promelas включват цвят на тялото (т.е. светло/тъмно оцветяване), начини на оцветяване (т.е. наличието или отсъствието на вертикални ленти), форма на тялото (т.е., форма на главата и гръдната област, разширяване на коремната кухина), както и специализирани вторични полови белези (т.е., брой и размер на размножителните туберкули, размери на дорзалните отлагания на колаген и яйцеполагалото).
Размножителните туберкули са разположени върху главата (дорзалните отлагания) на репродуктивно активните мъжки Pimephales promelas и обикновено са подредени двустранно симетрично (Jensen et al. 2001). При контролните женски и ювенилните животни от мъжки и женски пол не се наблюдава развитие на туберкули (Jensen et al. 2001). Възможни са до осем отделни туберкули около очите и между ноздрите на мъжките екземпляри. Най-голям брой и най-големи туберкули са разположени в два успоредни реда, непосредствено под ноздрите и над устата. При много риби съществуват групи от туберкули под долната челюст; тези, които са най-близо до устата, обикновено са един чифт, докато разположените вентрално от тях могат да се състоят от до четири туберкули. Действителният брой на туберкулите рядко е повече от 30 (обхват от 18—28; Jensen et al. 2001). Преобладаващите туберкули (по отношение на броя) представляват единични, относително заоблени структури, с височина приблизително равна на радиуса. Повечето репродуктивно активни мъжки животни също имат поне няколко туберкули, които са разширени и подчертано развити по такъв начин, че не могат да бъдат разграничени като отделни структури.
Някои типове химикали, нарушаващи функциите на ендокринната система, могат да причинят необичайната поява на някои вторични полови белези в другия пол; например на агонисти на андрогенните рецептори, като 17β-метилтестостерон или 17β-тренболон, могат да предизвикат развитие на размножителни туберкули у женски Pimephales promelas (Smith 1974; Ankley et al. 2001; 2003), докато агонисти на естрогенните рецептори могат да предизвикат намаляване на размножителните туберкули у мъжки индивиди (Miles-Richardson et al. 1999; Harries et al. 2000).
По-долу е представено описание на характеризирането на размножителни туберкули у Pimephales promelas въз основа на процедурите, използвани в лабораторията на Американската агенция за защита на околната среда в Duluth, MN. Специфичните продукти и/или оборудване може да бъдат заменени с налични равностойни материали.
Наблюдението се извършва най-добре с помощта на увеличително стъкло с осветително тяло или със стереомикроскоп с осветително тяло и увеличение 3X. Рибата се наблюдава дорзално с предната част в посока напред (глава към наблюдателя).
|
а)
|
Рибата се поставя в малко блюдо на Петри (напр. 100 mm в диаметър), с предната част в посока напред, с коремния дял надолу. Визьорът се фокусира, за да се даде възможност за идентифициране на туберкулите. Рибата се обръща леко и бавно от една страна на друга, за да се идентифицират областите с туберкули. Туберкулите се преброяват и ранжират.
|
|
б)
|
Наблюдението се повтаря по отношение на предната част на коремния дял, чрез поставяне на рибата дорзално с предната част в посока напред в блюдото на Петри.
|
|
в)
|
Наблюденията трябва да бъдат извършени в рамките на 2 минути за всяка риба.
|
Броене и ранжиране на туберкулите
Определени шест конкретни области за оценка на наличието и развитието на туберкули в полово зрели Pimephales promelas. Разработен е образец за отбелязване на местоположението и количеството на налични туберкули (вж. в края на настоящото допълнение). Броят на туберкулите се записва и техните размери могат да бъдат количествено ранжирани като: 0- липсва, 1-наличен, 2-уголемен и 3-подчертано развит (фиг. 1).
Ранг 0 — липса на туберкули. Ранг 1 — наличен се определя за всеки туберкул, който има точка, чиято височина е почти равна на радиуса му (диаметъра). Ранг 2 — уголемен се определя при тъкан с външен вид, наподобяващ звездичка, обикновено с голяма радиална база с вдлъбнатини или бразди, излизащи от центъра. Височината на туберкула често е по-неравна, но понякога може до известна степен да е закръглена. Ранг 3 — подчертано развит обикновено е доста голям и закръглени, с по-неопределена структура. Понякога тези туберкули са разположени заедно, образувайки обща маса по протежение на отделна област или съчетание от области (B, C и D, описани по-долу). Оцветяването и формата са сходни с ранг 2, но понякога са твърде произволни. Използването на тази рангова система най-общо води като цяло резултати от ранжирането < 50 в нормален контролен мъжки индивид, притежаващ 18 до 20 броя туберкули (Jensen et al. 2001).
Фигура 1

Действителният брой на туберкулите при някои риби може да е по-голям от полетата в образеца (допълнение A) за определена област. В такъв случай вътре могат да бъдат отбелязани допълнителни числа, вдясно или вляво от полето. Следователно не е необходимо образецът да показва симетрия. Допълнителен метод за отбелязване на местоположението на туберкули, които са чифтни или съединени вертикално по протежение на хоризонталната равнина на устата, може да се осъществи чрез двойно отбелязване на два ранга на туберкули в едно поле.
Области за отбелязване на местоположението:
A— туберкули, разположени около окото. Положението се отбелязва дорзално към вентрално около предния край на окото. Обичайно са много при полово зрели мъжки от контроли, не са налични при женски, като цяло чифтни (един в близост до всяко око) или единични при женски животни, експонирани на андрогени.
B— туберкули, разположени между ноздрите (сензорни канали). Обикновено чифтни при мъжките в контролите с по-висок ранг за развитие (2- уголемен или 3- подчертано развит). Не са налични при женски от контролите, с известно срещане и развитие при женски животни, експонирани на андрогени.
C— туберкули, разположени непосредствено задно от ноздрите, успоредно на устата. Обикновено уголемени или подчертано развити при полово зрели мъжки от контроли. С ранг налични или уголемени при по-слабо развитите мъжки или при женски животни, експонирани на андрогени.
D— туберкули, разположени успоредно по линията на устата. Като цяло се класифицират като развити в контролните животни от мъжки пол. С ранг липсващи в контролните животни от женски пол, но с ранг налични при женски животни, експонирани на андрогени.
E— туберкули, разположени по долната челюст, близо до устата, обикновено малки и обичайно чифтни. Варират при контролните или третираните мъжки, и третираните женски индивиди.
F— туберкули, разположени вентрално от E. Обикновено малки и чифтни. Налични в контролните животни от мъжки пол и при женски животни, експонирани на андрогени.
ПОЗОВАВАНИЯ
|
(1)
|
Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276-1290.
|
|
(2)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Hornung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray EL. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22:1350-1360.
|
|
(3)
|
Harries JE, Runnalls T, Hill E, Harris CA,Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003-3011.
|
|
(4)
|
Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128:127-141.
|
|
(5)
|
Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515-523.
|
|
(6)
|
Miles-Richardson SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47:129-145.
|
|
(7)
|
Smith RJF. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52:1031-1038.
|
|
Образец за туберкули
|
Ранжиране с числови стойности на ранга
|
|
ID
|
1-наличен
|
|
Дата
|
2-уголемен
|
|
Общ резултат развит
|
3-подчертано
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Допълнение 5Б
Оценка на вторични полови белези у японската оризия за откриване на определени химикали с активно действие върху ендокринната система
По-долу е представено описание на измерването на папиларните израстъци (21), които са вторични полови белези при японската оризия (Oryzias latipes).
|
1)
|
След изрязване на черния дроб (допълнение 6), трупът се поставя в конична епруветка, съдържаща около 10 ml 10 % неутрален буфериран формалин (горна страна: глава, долна страна: опашка). Ако гонадата е фиксирана в разтвор, различен от 10 % неутрален буфериран формалин, прави се напречен разрез през трупа между предната област на аналната перка и ануса, с използване на бръснач, като се внимава да не се увреди половият отвор и самата гонада (фиг. 3). Краниалната част от тялото на рибата се поставя в разтвора на фиксатора за запазване на гонадата, а опашната част от тялото на рибата се поставя в 10 % неутрален буфериран формалин, както е описано по-горе.
|
|
2)
|
След поставянето на тялото на рибата в 10 % неутрален буфериран формалин задният край на аналната перка се захваща с пинцети и се разтваря за около 30 секунди, за да се запази аналната перка отворена. При захващането на аналната перка с пинцети се захващат няколко лъча на перката в предната област, като се внимава да не се надраскат папиларните израстъци.
|
|
3)
|
След държането на аналната перка отворена в продължение на около 30 секунди, тялото на рибата се съхранява в 10 % неутрален буфериран формалин при стайна температура до измерването на папиларните израстъци (измерването следва да се проведе след фиксиране в продължение най-малко на 24 часа).
|
Измерване
|
1)
|
След фиксиране на тялото на рибата в 10 % неутрален буфериран формалин в продължение най-малко на 24 часа, трупът на рибата се взема от коничната епруветка и формалинът се избърсва върху филтърна хартия (или хартиена кърпа).
|
|
2)
|
Рибата се поставя с корема нагоре. След това аналната перка се изрязва внимателно с малки ножици за дисекция (за предпочитане е да се изреже аналната перка с малко количество птеригиофор).
|
|
3)
|
С пинцети се захваща предната област от отрязаната анална перка и тя се поставя върху предметно стъкло с няколко капки вода. След това аналната перка се покрива с покривно стъкло. При захващането на аналната перка с пинцети се внимава да не се надраскат папиларните израстъци.
|
|
4)
|
Отчита се броят членчета с папиларни израстъци, като се използва брояч под биологичен микроскоп (изправен или инвертен микроскоп). Папиларните израстъци се познават, когато в задната част на членчетата се вижда малко образувание от израстъци. В работната таблица се записва броят на членчетата с папиларни израстъци във всеки лъч на перка (напр. първи лъч на перка: 0, втори лъч на перка: 10, трети лъч на перка: 12 и т.н.) и се вписва сумата им в таблицата в Excel за всеки отделен екземпляр. Ако е необходимо, аналната перка се фотографира и върху снимката се отчита броят на членчетата с папиларни израстъци.
|
|
5)
|
След измерването аналната перка се поставя в коничната епруветка, описана в 1) и се съхранява.
|
Фиг. 1.
Схема, показваща разликата при половете по отношение на формата и размера на аналната перка. A, мъжка; B, женска. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

Фиг. 2.
А, папиларни израстъци върху членчета от лъч на анална перка. J.P., членче; A.S., аксиално пространство; P., израстък. B, дистален край на лъч на перка. Дистално в края на лъча са разположени колагенни фибри (Actinotrichia) (Act.). Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

Фиг. 3.
Снимка на тяло на риба, показваща мястото на срязване, когато гонадата се фиксира в разтвор на фиксатор, различен от 10 % неутрален буфериран формалин. В този случай останалата част от тялото се разрязва между предната област на аналната перка и ануса с помощта на бръснач (червена лента), и предната част от тялото на рибата се поставя в разтвора на фиксатор за гонади, а опашната част от тялото на рибата се поставя в 10 % неутрален буфериран формалин.
Допълнение 6
Препоръчителни процедури за пробовземане за анализ на вителогенин
Трябва да се вземат мерки за избягване на кръстосано замърсяване между пробите с VTG от мъжки и от женски животни.
Процедура 1А: Вземане на кръвна проба от опашна вена/артерия от Pimephales promelas
След подлагане на анестезия, опашното стъбло частично се отрязва със скалпел и се взема кръв от опашната вена/артерия с хепаринизирана микрокапилярка за хематокрит. След вземането на кръвната проба плазмата бързо се отделя чрез центрофугиране при 15 000 g за 3 минути (или алтернативно при 15 000 g за 10 минути при 4 °C). По избор, процентът хематокрит може да се определи след центрофугирането. Частта плазма се отстранява от микрокапилярката за хематокрит и се съхранява в центрофужна епруветка с 0,13 единици апротинин (протеазен инхибитор) при – 80 °C докато може да бъде извършено определяне на вителогенин. В зависимост от размера на Pimephales promelas (който зависи от пола) събираемият обем плазма обикновено се намира в интервала от 5 до 60 микролитра на риба (Jensen et al. 2001).
Процедура 1Б: Вземане на кръвна проба от сърце от Pimephales promelas
Като алтернатива, кръвна проба може също така да се вземе чрез сърдечна пункция с помощта на хепаризирана спринцовка (1 000 единици хепарин/ml). Кръвта се прехвърля в епендорфови епруветки (държани върху лед) и се центрофугира (5 минути, 7 000 g, стайна температура). Плазмата следва да се прехвърли в чисти епендорфови епруветки (в аликвотни части, ако обемът на плазмата позволява това) и бързо да се замрази при температура – 80 °C до нейното анализиране (Panter et al., 1998).
Процедура 2А: Изрязване на черен дроб от японска оризия
Отстраняване на изпитваната риба от камерата за изпитване
|
(1)
|
Изпитваната риба следва да се отстрани от изпитвателната камера с помощта на малко кепче. Следва да се внимава изпитваната риба да не попадне в други камери за изпитване.
|
|
(2)
|
По принцип изпитваните риби следва да бъдат отстранявани в следния ред: контрола, контрола на разтворител (където е приложимо), най-ниска концентрация, средна концентрация, най-висока концентрация и положителна контрола. В допълнение, всички мъжки животни следва да бъдат отстранени от дадена камера за изпитване преди да бъдат отстранени оставащите женски.
|
|
(3)
|
Полът на всяка изпитвана риба се определя въз основа на външни вторични полови белези (напр. формата на аналната перка).
|
|
(4)
|
Опитната риба се поставя в контейнер за пренасяне и се пренася до работното място за изрязване на черния дроб. За точност и за потвърждаване, че броят на рибите, които са отстранени от камерата за изпитване и броят на рибите, останали в камерата за изпитване, са в съответствие с очакванията, се проверяват етикетите на камерата за изпитване и на контейнера за пренасяне.
|
|
(5)
|
Ако полът не може да бъде определен по външния вид на рибата, от камерата за изпитване се отстраняват всички риби. В този случай полът следва да бъде определен чрез наблюдение на гонадата или на вторични полови белези под стереомикроскоп.
|
Изрязване на черния дроб
|
(1)
|
Изпитваните риби се прехвърлят от контейнера за пренасяне в разтвор за подлагане на анестезия с помощта на малкото кепче.
|
|
(2)
|
След анестезирането изпитваните риби се прехвърлят върху филтърната хартия (или хартиена кърпа) с пинсети (разпространени в търговската мрежа). При захващането на изпитваните риби пинцетите се прилагат отстрани на главата, за да се предотврати счупването на опашката.
|
|
(3)
|
Водата се избърсва от повърхността на изпитваните риби върху филтърната хартия (или хартиената кърпа).
|
|
(4)
|
Рибата се поставя с корема нагоре. След това се прави малък напречен разрез между областта на врата вентрално и областта в средата на корема с помощта на ножици за дисекция.
|
|
(5)
|
Ножиците за дисекция се вкарват в малката инцизия и се разрязва коремът от определена точка каудално от бранхиалната мантия до краниално от ануса по средната линия на корема. Внимава се ножиците за дисекция да не се вкарват прекомерно дълбоко, за да се избегне увреждане на черния дроб и гонадата.
|
|
(6)
|
Под стереомикроскоп се извършват следните операции.
|
|
(7)
|
Изпитваната риба се поставя с корема нагоре върху хартиената кърпа (стъклено блюдо на Петри или предметно стъкло също така са на разположение).
|
|
(8)
|
Стените на коремната кухина се разширяват с прецизни пинсети и вътрешните органи се екстериоризират. Също така, приемливо е екстериоризирането на външните органи да се извърши чрез отстраняване на едната страна от стената на коремната кухина, ако е необходимо.
|
|
(9)
|
С помощта на друг чифт прецизни пинцети се разкрива свързаната част на черния дроб и жлъчния мехур. След това се захваща жлъчният канал и се прекъсва жлъчният мехур. Внимава се да не се пробие жлъчният мехур.
|
|
(10)
|
Захваща се хранопроводът и по същия начин стомашно-чревният тракт се изрязва от черния дроб. Внимава се да не се допусне изтичане на съдържанието на стомашно-чревния тракт. Стомашно-чревният тракт се изрязва каудално от ануса и се отстранява от коремната кухина.
|
|
(11)
|
Отстранява се масата от мазнини и други тъкани от периферията на черния дроб. Внимава се да не се надраска черният дроб.
|
|
(12)
|
С помощта на прецизните пинцети се захваща областта на вратата на черния дроб и черният дроб се отстранява от коремната кухина.
|
|
(13)
|
Черният дроб се поставя върху предметното стъкло. С помощта на прецизните пинцети от повърхността на черния дроб се отстраняват всякакви допълнителни мазнини и чужди тъкани (напр. перитонеумът), ако е необходимо.
|
|
(14)
|
Теглото на черния дроб се измерва като тара с 1,5 ml микроепруветка, с помощта на електронна аналитична везна. Стойността се вписва в работния лист (точност: 0,1 mg). Потвърждава се информацията за идентифициране, намираща се върху етикета на микроепруветката.
|
|
(15)
|
Капачката на микроепруветката, съдържаща черния дроб, се затваря. Тя се съхранява в охладителен статив (или охладителен статив с лед).
|
|
(16)
|
След изрязването на всеки черен дроб инструментите за дисекцията се почистват или се заменят с чисти.
|
|
(17)
|
Отстранява се черният дроб от всички риби, намиращи се в контейнера за пренасяне, както е описано по-горе.
|
|
(18)
|
След като черен дроб е изрязан от всички риби в контейнера за пренасяне (т.е. от всички мъжки или женски в дадена изпитвателна камера) всички екземпляри от черен дроб се поставят на статив за епруветки с етикет за идентификация и слагат за съхранение във фризер. Когато черният дроб се дава за предварителна обработка непосредствено след изрязването, екземплярите се пренасят до следващото работно място в охладителен статив (или охладителен статив с лед).
|
След изрязването на черния дроб трупът на рибата е на разположение за измерване на вторични полови белези.
Екземпляри
Ако не се използват за предварителна обработка непосредствено след изрязването, екземплярите от черен дроб, взети от изпитваните риби, се съхраняват при ≤ – 70 °C.
Фиг-1
Прави се разрез с ножици точно пред гръдните перки.

Фиг-2
Средната линия на корема се разрязва с ножица до точка, разположена приблизително 2 mm краниално от ануса.

Фиг-3
Коремните стени се разтварят с пинцети за разкриване на черния дроб и други вътрешни органи. (като алтернатива, коремните стени могат да се забодат латерално).

Фиг-4
С помощта на пинцети се прави дисекция на черния дроб и същият се изрязва.

Фиг-5
Червата леко се издърпват с помощта на пинцети.
Фиг-6
Двата края на червата и мезентериалните връзки се отрязват с ножици.
Фиг-7 (женски)
Процедурата е идентична като тази при мъжките.

Фиг-8
Завършената процедура.

Процедура 2Б: Японска оризия (Oryzias latipes), предварителна обработка на черен дроб за анализ на вителогенин
взема се бутилката с буфера за хомогенат от комплекта за ELISA и се охлажда с натрошен лед (температура на разтвора: ≤ 4 °C). Ако се използва буфер за хомогенат от EnBio система за ELISA система се използва, разтворът се размразява при стайна температура и след това бутилката се охлажда с натрошен лед.
Изчислява се обемът на буфера за хомогенат за черния дроб въз основа на теглото му (добавят се 50 μl буфер за хомогенат на mg тегло на черен дроб за хомогенат). Например, ако теглото на черния дроб е 4,5 mg, обемът на буфера за хомогенат за черния дроб е 225 μl. Изготвя се списък с обемите на буфера за хомогенат за всички екземпляри черен дроб.
Подготовка на черния дроб за предварителната обработка
|
(1)
|
Непосредствено преди предварителната обработка микроепруветката от 1,5 ml, съдържаща черния дроб, се взема от фризера.
|
|
(2)
|
Предварителна обработка на черния дроб от животни от мъжки пол следва да се извършва преди тази при женските животни, за да се предотврати замърсяване с вителогенин. Освен това, предварителната обработка за изпитваните риби следва да се извършва в следния ред: контрола, контрола на разтворител (където е приложимо), най-ниска концентрация, средна концентрация, най-висока концентрация и положителна контрола.
|
|
(3)
|
Броят на взетите от фризера в даден момент микроепруветки от 1,5 ml, съдържащи проби черен дроб, не следва да надвишава броя, който може да се центрофугира по това време.
|
|
(4)
|
Микроепруветките от 1,5 ml, съдържащи проби черен дроб, се подреждат на охладителния статив с лед по реда на екземпляра (няма нужда от размразяване на черния дроб).
|
Извършване на предварителната обработка
1. Добавяне на буфера за хомогенизиране
|
(1)
|
Проверява се списъкът за обема на буфера за хомогенат, който да се използва за определена проба черен дроб и микропипетата се настройва (диапазон на обемите: 100-1 000 μl) към подходящия обем. Поставя се чист връх на микропипетата.
|
|
(2)
|
Буферът за хомогенат се взема от бутилката с реактива и се добавя в микроепруветката от 1,5 ml, съдържаща проба черен дроб.
|
|
(3)
|
Буферът за хомогенат се добавя във всички микроепруветки от 1,5 ml, съдържащи проба черен дроб, в съответствие с гореописаната процедура. Не е необходимо да се сменя върхът на микропипетата с нов. Независимо от това, ако върхът е замърсен или се предполага, че е замърсен, той следва да бъде сменен.
|
2. Хомогенизиране на черния дроб
|
(1)
|
Поставя се нов пестик за хомогенизиране в хомогенизатора за микроепруветката.
|
|
(2)
|
Пестикът се въвежда в микроепруветката от 1,5 ml. Хомогенизаторът се държи за натиск върху черния дроб между повърхността на пестика и вътрешната стена на микроепруветката от 1,5 ml.
|
|
(3)
|
Хомогенизаторът за микроепруветката се оставя да функционира в продължение на 10 до 20 секунди. Микроепруветката от 1,5 ml се охлажда с натрошен лед по време на функционирането.
|
|
(4)
|
Пестикът се изважда от микроепруветката от 1,5 ml и се оставя в покой в продължение на около 10 секунди. След това се извършва визуална проверка на състоянието на суспензията.
|
|
(5)
|
Ако в суспензията се наблюдават парченца от черен дроб, операции 3) и 4) се повтарят, за да се приготви задоволителен хомогенат.
|
|
(6)
|
Суспендираният хомогенат от черен дроб се охлажда на охладителен статив с лед до центрофугирането.
|
|
(7)
|
Пестикът се сменя с нов за всеки хомогенат.
|
|
(8)
|
Всички екземпляри от черен дроб се хомогенизират с буфер за хомогенат в съответствие с гореописаната процедура.
|
3. Центрофугиране на суспендирания хомогенат от черен дроб
|
(1)
|
Потвърждава се температурата на охладителната центрофуга на ≤ 5 °C.
|
|
(2)
|
Микроепруветките от 1,5 ml, съдържащи суспендирания хомогенат от черен дроб, се поставят в охладената центрофуга (коригира се балансът, ако е необходимо).
|
|
(3)
|
Суспендираният хомогенат от черен дроб се центрофугира при 13 000 g за 10 минути при ≤ 5 °C. Ако супернатантът е разделен по подходящ начин обаче, центробежната сила и времето могат да бъдат коригирани според необходимостта.
|
|
(4)
|
След центрофугирането се проверява дали супернатантът е разделен по подходящ начин (повърхностен слой: липиди, среден слой: супернатант, дънен слой: чернодробна тъкан). Ако разделянето не е достатъчно, суспензията се центрофугира отново при същите условия.
|
|
(5)
|
Всички екземпляри се отстраняват от охладената центрофуга и се подреждат на охладителния статив с лед по реда на екземпляра. Внимава се да не се суспендира повторно някой от разделените след центрофугирането слоеве.
|
4. Вземане на супернатанта
|
(1)
|
На статива за епруветки се поставят четири микроепруветки от 0,5 ml за съхранение на супернатанта.
|
|
(2)
|
От всеки супернатант (разделен като междинен слой) с микропипетата се вземат по 30 μl и се поставят в една микроепруветка от 0,5 ml. Внимава се да не се вземе от липидите върху повърхността, или от дънния слой с чернодробната тъкан.
|
|
(3)
|
Супернатантът се взема и се поставя в други микроепруветки от 0,5 ml по същия начин, както е описано по-горе.
|
|
(4)
|
Останалата част от супернатанта се взема с микропипетата (ако е осъществимо: ≥ 100 μl). След това супернатантът се поставя в оставащата микроепруветка от 0,5 ml. Внимава се да не се вземе от липидите върху повърхността, или от дънния слой с чернодробната тъкан.
|
|
(5)
|
Капачката на микроепруветката от 0,5 ml се затваря и върху етикета се отбелязва обемът на супернатанта. След това микроепруветките се охлаждат незабавно върху охладителния статив с лед.
|
|
(6)
|
Върхът на пипетата се сменя с нов за всеки супернатант. Ако към върха остава прикрепено голямо количество липиди, той се сменя незабавно с нов, за да се избегне замърсяване на екстракта от черен дроб с мазнини.
|
|
(7)
|
Цялото количество центрофугиран супернатант се поставя в четири микроепруветки от 0,5 ml съгласно процедурата, описана по-горе.
|
|
(8)
|
След поставянето на супернатантата в микроепруветките от 0,5 ml, всички те се поставят на статива за епруветки с етикет за идентификация, след което се замразяват незабавно във фризера. Ако концентрациите на VTG се измерват непосредствено след предварителната обработка, една микроепруветка от 0,5 ml (съдържаща 30 μl супернатант) се съхранява на хладно на статива за епруветки и се прехвърля на работното място, където се провежда изпитването с ELISA. В такъв случай оставащите микроепруветки се поставят на стативите за епруветки и се замразяват във фризера.
|
|
(9)
|
След вземането на супернатанта остатъкът се изхвърля по подходящ начин.
|
Съхранение на пробите
Микроепруветките от 0,5 ml, съдържащи супернатанта от хомогената от черен дроб, се съхраняват при ≤ – 70 °C до използването им за ELISA.
Процедура 3А: Вземане на кръвна проба от опашна вена/артерия от зеброво данио
Непосредствено след анестезията опашното стъбло се разрязва напречно и кръвта се отстранява от опашната артерия/вена с хепаринизирана микрокапилярка за хематокрит. Обемът на кръвта варира от 5 до 15 μl в зависимост от размера на рибата. Равен обем буфер с апротинин (6 μg/ml в PBS) се добавя към микрокапилярката и плазмата се разделя от кръвта чрез центрофугиране (5 минути при 600 g). Плазмата се събира в епруветките за изпитването и се съхранява при температура – 20 °C до анализа за вителогенин или за други представляващи интерес белтъци.
Процедура 3Б: Кръвна проба чрез сърдечна пункция при зеброво данио
За да се избегне съсирването на кръвта и разграждането на белтъците, пробите се вземат във фосфатно буфериран физиологичен разтвор (PBS), съдържащ хепарин (1 000 единици/ml) и протеазен инхибитор апротинин (2 TIU/ml). Като съставки за буфера са препоръчителни хепарин (амониева сол) и лиофилизиран апротинин. За вземане на кръв се препоръчва спринцовка (1 ml) с фиксирана тънка игла (напр. Braun Omnikan-F). Спринцовката трябва да се запълни с буфер (около 100 μl) за пълно елуиране на малките обеми кръв от всяка риба. Кръвните проби се вземат чрез сърдечна пункция. Първоначално рибата трябва да бъде анестезирана с MS-222 (100 mg/l). Правилното извършване на анестезията позволява на ползвателя да различава пулсирането на сърцето на зебровото данио. При извършването на сърдечната пункция буталото на спринцовката се държи под слаб натиск. Обемът на кръвната проба, който може да бъде взет, варира между 20 и 40 микролитра. След сърдечната пункция сместа от кръвта и буфера следва да бъде поставена в епруветката за изпитване. Плазмата се отделя от кръвта чрез центрофугиране (20 мин.; 5 000 g) и следва да се съхранява при – 80 °C докато стане необходима за анализ.
Процедура 3В: СОП: Зеброво данио, хомогенизиране на главата и опашката
|
(1)
|
Рибите се подлагат на анестезия и евтаназия в съответствие с описанието на изпитването.
|
|
(2)
|
Главата и опашката се изрязват от рибата в съответствие с фигура 1.
|
Важно: Всички инструменти за дисекция и плоскостта за разрязване трябва да се промият и почистят по подходящ начин (например с 96 % етанол) между обработването на всяка отделна риба, за да се предотврати „замърсяване с вителогенин“ от женски или индуцирани мъжки към неиндуцирани мъжки.
Фигура 1

|
(3)
|
Теглото на обединените глава и опашка от всяка риба се измерва с точност до един mg.
|
|
(4)
|
След като се претеглят, частите се поставят в подходящи епруветки (напр. 1,5 ml епендорфова епруветка) и се замразяват при – 80 °С до хомогенизирането, или направо се хомогенизират върху лед с два пластмасови пестика. (Могат да се използват други методи, ако те се извършват върху лед и резултатът е хомогенна маса). Важно: Епруветките следва да бъдат номерирани по подходящ начин, така че главата и опашката от рибата да могат да бъдат свързани с частта от тялото, останала след изрязването им и използвана за хистология на гонадите.
|
|
(5)
|
Когато се достигне до хомогенна маса, се добавя леденостуден буфер за хомогенизиране (22) в количество, равно на 4 пъти теглото на тъканта. Продължава се работата с пестиците, докато сместа стане хомогенна. Важна забележка: За всяка риба се използват нови пестици.
|
|
(6)
|
Пробите се поставят върху лед до центрофугирането при 4 °C на 50 000 × g за 30 min.
|
|
(7)
|
Използва се пипета за поставяне на порции от 20 μl супернатант в поне две епруветки, чрез потапяне на върха на пипетата под слоя мазнини на повърхността, и внимателно изсмукване на супернатанта, без фракции от мазнини или пелети.
|
|
(8)
|
Епруветките се съхраняват при – 80 °C до момента на употребата.
|
Допълнение 7
Проби с внесена добавка вителогенин и еталон, който е референтен между различни изследвания
Всеки ден, в който се извършват изпитвания за VTG, се анализира проба с внесена добавка с използване на еталон, който е референтен между различни изследвания. Вителогенинът, използван за получаването на еталон, който е референтен между различни изследвания, ще е от партида, различна от използваната за приготвяне на еталони за калибриране за извършваното изследване.
Пробата с внесена добавка се приготвя чрез добавяне на предварително известно количество от еталона, който е референтен между различни изследвания, в проба от плазма от контролен мъжки екземпляр. В пробата се внася добавка с цел постигане на концентрация на вителогенин между 10 и 100 пъти по-висока от очакваната концентрация на вителогенин в контролен мъжки екземпляр. Пробата от плазма от контролен мъжки екземпляр, в която се внася добавка, може да бъде от отделна риба, или може да бъде съставена от няколко риби.
Подпроба от плазма от контролен мъжки екземпляр, в която не е внесена добавка, се анализира най-малко в две гнезда с повторения. Пробата с внесена добавка също се анализира най-малко в две гнезда с повторения. Средното количество вителогенин в двете проби от плазма от контролен мъжки екземпляр, в които не е внесена добавка, се добавя към изчисленото количество вителогенин, внесено като добавка в пробите, за да се определи очаквана концентрация. Отношението на тази очаквана концентрация към измерената концентрация се протоколира заедно с резултатите от всеки набор от изследвания от този ден.
Допълнение 8
Блокова схема за статистическия анализ

В.38. ИЗСЛЕДВАНЕ ЗА МЕТАМОРФОЗА НА ЗЕМНОВОДНИ
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 231 (2009). Необходимостта от разработване и валидиране на изследване, позволяващо откриване на химикали, активни в системата на щитовидната жлеза на гръбначни животни, произлиза от загрижеността, че нивата на химикали в околната среда могат да причинят неблагоприятни въздействия както за хората, така и за дивата флора и фауна. През 1998 г. ОИСР стартира с висок приоритет дейност по преразглеждане на съществуващите Насоки за изпитване и по разработване на нови Насоки за изпитване за скрининг и изпитвания за потенциални нарушители на функциите на ендокринната система (8). Един от елементите на дейността бе да се разработи насока за изпитване за скрининг на химикали, активни в системата на щитовидната жлеза на гръбначни животни. Бяха предложени както подобряване на „28-дневно изследване на оралната токсичност при гризачи с повтаряща се доза“ (глава Б.7 от настоящото приложение), така и изследване за метаморфоза на земноводни (ИМЗ). Подобреният метод за изпитване Б.7 премина през валидиране и беше издаден преработен метод за изпитване. Изследването за метаморфоза на земноводни (ИМЗ) премина през обширна програма за валидиране, които включваше вътрешно- и междулабораторни изследвания, които доказват уместността и надеждността на изследването (1, 2). Впоследствие, валидирането на изследването бе подложено на партньорска оценка от група от независими експерти (3). Настоящият метод за изпитване е резултат от опита, придобит по време на изследванията за валидиране за откриване на химикали, активни по отношение на щитовидната жлеза, както и от работата на други места в държавите — членки на ОИСР.
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
2.
|
Изследването за метаморфоза на земноводни (ИМЗ) е скринингово изследване, целящо емпирично определяне на химикали, които могат да пречат на нормалното функциониране на хипоталамус-хипофиза-гонадната (ХХГ) ос. ИМЗ представлява обобщен модел за гръбначни, доколкото се основава на съхранените структури и функции на ХХГ ос. Това изследване е важно, тъй като метаморфозата на земноводните предоставя добре проучен тиреоидно зависим процес, който е отклик на химикали, активни в рамките на ХХГ ос, и е единственото съществуващо изследване, което открива тиреоидна активност при животни, преминаващи през морфологично развитие.
|
|
3.
|
Общият план за опита включва експониране на попови лъжички от Xenopus laevis на етап 51 най-малко на три различни концентрации на изпитван химикал и контрола на вода за разреждане в продължение на 21 дни. В изпитването за всяко третиране се правят по четири повторения. За всички групи за третиране при началото на изпитването гъстотата на ларвите е 20 попови лъжички на съд за изпитване. Наблюдаваните крайни точки са дължина на задни крайници (HLL), дължина от върха на муцуната до клоачния отвор (SVL), етап на развитие, мокро тегло, тиреоидна хистология и ежедневни наблюдения на смъртността.
|
ОПИСАНИЕ НА МЕТОДА
Животински вид за изпитването
|
4.
|
Xenopus laevis се отглежда обичайно и повсевместно в лабораторни условия и лесно може да бъде доставен от доставчици в търговската мрежа. При този животински вид размножаването може лесно да бъде индуцирано през цялата година с използване на инжекции с човешки хорионен гонадотропин (hCG), като получените ларви могат да бъдат отглеждани по обичаен начин и в големи количества до избрани стадии на развитие, за да даде възможност за използване на протоколи за изпитване, специфични за съответния стадий. Предпочита се ларвите, използвани за изследването, да са от полово зрели индивиди, отгледани в изпитващата лаборатория. Като алтернатива, въпреки че това не е предпочитаната процедура, на лабораторията, провеждаща изпитването, могат да бъдат доставени яйца и ембриони, като те се оставят да се аклиматизират; доставянето на ларви за използване при изпитването е неприемливо.
|
Оборудване и материали
|
5.
|
За провеждането на това изследване са нужни следното оборудване и материали:
|
а)
|
система за експозицията (вж. описанието по-долу);
|
|
б)
|
аквариуми от стъкло или от неръждаема стомана (вж. описанието по-долу);
|
|
в)
|
съдове за размножаване;
|
|
г)
|
апарати за контролиране на температурата (напр. от нагреватели или охладители (регулируеми до 22° ± 1 °C));
|
|
е)
|
бинокулярен стереомикроскоп;
|
|
ж)
|
цифров фотоапарат с разделителна способност най-малко 4 мегапиксела и функция за микрофотография;
|
|
з)
|
софтуер за дигитализиране на изображения;
|
|
и)
|
блюдо на Петри (напр. 100 × 15 mm.) или прозрачна пластмасова камера със сравними размери;
|
|
й)
|
аналитични везни, с които се измерва до 3-я знак след десетичната запетая (mg).
|
|
к)
|
устройство за измерване на съдържанието на разтворения кислород:
|
|
м)
|
измервателен уред за интензитет на светлината с възможности за измерване в lux;
|
|
н)
|
лабораторна стъклария и инструменти;
|
|
о)
|
регулируеми пипети (от 10 до 5 000 μl) или комплекти пипети с еквивалентни размери;
|
|
п)
|
изпитван химикал в количество, достатъчно за провеждане на изследването, за предпочитане от една партида;
|
|
р)
|
Аналитична апаратура, подходяща за химикала за изпитвания химикал, или договорени услуги по анализ.
|
|
Изпитваемост на химикала
|
6.
|
ИМЗ се основава на протокол за експозиция във вода, при който изпитваният химикал се въвежда в камерите за изпитване чрез проточна система. Проточните методи обаче налагат ограничения по отношение на вида на химикалите, които могат да бъдат изпитвани, определени от физичните и химичните свойства на химикала. Следователно, преди да се използва настоящият протокол, следва да бъде получена базова информация за химикала, която е от значение за определяне на изпитваемостта, и следва да бъде консултиран и документът на ОИСР с насоки за изпитване за токсичност във водна среда на трудни вещества и смеси (4). Характеристиките, които показват, че изпитването на химикала във водни системи може да е трудно, включват: високи коефициенти на разпределение октанол/вода (log Kow), висока летливост, склонност към хидролиза и склонност към фотолиза при заобикалящите условия на осветеност в лабораторията. Други фактори също могат да бъдат относими за определянето на изпитваемостта и следва да бъдат определяни за всеки отделен случай. Ако за химикала не е възможно успешно изпитване с използване на проточна система, може да се използва статична система с обновяване. Ако нито една от тези системи не е в състояние да бъде адаптирана за изпитвания химикал, тогава по подразбиране той не следва да бъде изпитван по настоящия протокол.
|
Система на експозиция
|
7.
|
Системата с проточно разреждащо устройство, когато е възможно нейното използване, се предпочита пред статичната система с обновяване. Ако физическите и/или химическите свойства на някой от изпитваните химикали не позволяват използване на системата с проточно разреждащо устройство, може като алтернатива да се използва друга система (например статична система с обновяване). Компонентите на системата трябва да имат компоненти за контакт с водата, изготвени от стъкло, неръждаема стомана и/или политетрафлуороетилен. Независимо от това, може да бъде използвана подходяща пластмаса, ако не излага на риск изследването. Съдовете за експозицията трябва да са аквариуми от стъкло или неръждаема стомана, оборудвани с вертикални тръби, в резултат на което съдът е с приблизителен обем между 4,0 и 10,0 l и с минимална дълбочина на водата от 10 до 15 cm. Системата следва да бъде в състояние да поддържа всички концентрации на експозиция и контрола, с четири повторения на третиране. Дебитът на потока към всеки съд трябва да бъде постоянен по отношение както на поддържането на биологичните условия, така и на експозицията на химикала (напр. 25 ml/min). Местоположението на съдовете за третирането трябва да бъде определено на случаен принцип в рамките на системата за изпитването, с цел намаляване на потенциалните въздействия на местоположението, включително леките колебания в температурата, светлинния интензитет и др. Следва да се използва флуоресцентно осветление за осигуряване на период на осветеност от 12 часа светлина: 12 часа тъмнина при интензитет от 600 до 2 000 лукса (lumen/m2) на повърхността на водата. Температурата на водата трябва да се поддържа на 22° ± 1 °C, рН се поддържа между 6,5 и 8,5, а концентрацията на разтворения кислород (DO) > 3,5 mg/l (> 40 % от стойността на насищане при равновесие с атмосферния въздух) във всеки съд за изпитване. Като минимум температурата на водата, рН и разтвореният кислород трябва да се измерват всяка седмица; за предпочитане е температурата да се измерва непрекъснато поне в един от съдовете за изпитване. В допълнение 1 се описват накратко условията на опита, при които следва да бъде изпълнен протоколът. За допълнителна информация относно проточната система за експозиция, или статичната система с обновяване се използват Ръководството на ASTM за извършване на изпитвания за остра токсичност за материали с риби, макробезгръбначни и земноводни (5), както и общи изследвания за токсичност във водна среда.
|
Качество на водата
|
8.
|
Може да се използва всякаква вода, която се предлага на местно равнище (напр. изворна вода или филтрувана с въглен чешмяна вода) и позволява нормален растеж и развитие на поповите лъжички на X. laevis. Тъй като качеството на водата на местно равнище може да се различава значително от едно място на друго, следва да се извърши анализ на качеството на водата, по-специално ако няма на разположение данни за предходни периоди относно полезността на водата за отглеждане на Xenopus. Следва да се обърне специално внимание водата да не съдържа мед, хлор и хлорамини, всички от които са токсични за жабите и поповите лъжички. Освен това се препоръчва да се анализира водата за фонови нива на флуорид, перхлорат и хлорат (странични продукти от дезинфекцията на водата за пиене), тъй като всички тези аниони са субстрати за транспортирането на йод за щитовидната жлеза и повишени нива на всеки от тези аниони може да доведат до невъзможност за разграничаване на резултатите от изследването. Анализът следва да се извърши преди да започне изпитването и водата за изпитване по принцип трябва да не съдържа тези аниони.
|
Концентрация на йодид във водата за изпитване
|
9.
|
За да може щитовидната жлеза да синтезира хормони, на разположение на ларвите трябва да има достатъчно йодид, чрез съчетание от източници на вода и на храна. Понастоящем не съществуват емпирично изведени насоки за минималните концентрации на йодид. Независимо от това наличността на йодид може да засегне способността на тиреоидната система да реагира на средства, активни по отношение на щитовидната жлеза, и за тази наличност е известно, че променя основната дейност на щитовидната жлеза — аспект, който заслужава внимание при интерпретиране на резултатите от тиреоидната хистопатология. Следователно, измерената концентрация на йодид във водата за изпитване следва да бъде протоколирана. Въз основа на наличните данни от проучванията за валидиране е доказано, че протоколът функционира добре, когато концентрацията на йодид (I–) във водата за изпитване е била между 0,5 и 10 μg/l. В идеалния случай минималната концентрация на йодид във водата за изпитване трябва да бъде 0,5μg/l. Ако водата за изпитване е възстановена от дейонизирана вода, йодът следва да се добави при минимална концентрация от 0,5μg/l. Всяко допълнително добавяне на вода за изпитване с йод или други соли следва да се отбележи в протокола.
|
Отглеждане на животни
Грижи за полово зрелите индивиди и за размножаването
|
10.
|
Грижите за полово зрелите индивиди и за размножаването се полагат в съответствие със стандартните насоки и за по-подробна информация читателят се насочва към стандартното ръководство за изследване на тератогенезата при жабешки ембриони (FETAX) (6). Такива стандартни насоки предоставят пример за подходящи грижи и методи на размножаване, но не се изисква строго спазване. За предизвикване на размножаването двойки (3-5) от полово зрели женски и мъжки индивиди се инжектират с човешки хорионен гонадотропин (hCG). Женски и мъжки екземпляри се инжектират съответно с около 800 IU-1 000 IU и 600 IU-800 IU hCG, разтворен в 0,6-0,9 % физиологичен разтвор. Двойките за размножаване се държат в големи съдове, без външно въздействие и при статични условия, за да се насърчи репродуктивното поведение. На дъното на всеки съд за размножаване следва да има лъжливо дъно от мрежа от неръждаема стомана или пластмаса, което да позволява на яйцата да изпаднат на дъното на съда. Жаби, инжектирани в късния следобед, обикновено полагат повечето от яйцата си до средата на сутринта на следващия ден. След получаването и оплождането на достатъчно количество яйца, полово зрелите индивиди следва да бъдат отстранени от съдовете за размножаване.
|
Грижи за ларвите и подбор
|
11.
|
След като полово зрелите индивиди бъдат отстранени от съдовете за размножение, яйцата се събират и се оценявани за жизнеспособност, с използване на представителна извадка от ембриони, взета от всички съдове за размножение. Най-доброто отделно снасяне (или снасяния) на яйца (препоръчват се 2-3 за оценяване на качеството на яйцата) следва да бъде запазено, на база на жизнеспособността на ембрионите и наличието на достатъчен брой ембриони (минимум 1 500). Всички организми, които се използват в изследването, следва да произхождат само от едно снасяне на яйца (т.е. не следва да се смесват снасяния на яйца). Ембрионите се прехвърлят в голямо, плоско блюдо или чиния и всички очевидно мъртви или необичайни яйца (виж определението в (5)) се отстраняват с помощта на пипета или капкомер за очи. Здравите ембриони от всяко от трите снасяния на яйца се прехвърлят в три отделни съда за излюпване. Четири дни след поставянето в съдовете за излюпване най-доброто снасяне на яйца, въз основа на жизнеспособността и успешното излюпване, се избира и ларвите се прехвърлят в подходящ брой съдове за отглеждане при 22° ± 1 °C. Освен това, някои допълнителни ларви се преместват в допълнителни съдове за употреба за замяна в случай че се появи смъртност в съдовете за отглеждане през първата седмица. Тази процедура поддържа последователна гъстота на организмите и по този начин намалява различията в рамките на кохортата от отделното снасяне на яйца. Всички съдове за отглеждане следва да се източват ежедневно. Като предпазна мярка, виниловите или нитрилните ръкавици са за предпочитане пред латексовите ръкавици. При смъртност през първата седмица, умрелите екземпляри следва да се отстраняват ежедневно и следва да се добавят от приготвените за замяна ларви, за да се поддържа гъстотата на организмите. Храненето следва да е поне два пъти на ден.
|
|
12.
|
По време на фазата преди експозицията поповите лъжички се аклиматизират към условията на действителната фаза на експозиция, включително вида на храната, температурата, цикъла светлина-тъмнина и средата за отглеждането. Ето защо се препоръчва по време на фазата преди експозицията и на фазата на експозиция да се използва една и съща вода за отглеждането/разреждането. Ако се използва статична система за отглеждане за поддържането на поповите лъжички по време на фазата преди експозицията, средата за отглеждане следва да се заменя изцяло поне два пъти седмично. Следва да се избягват струпвания, предизвикани от голямата гъстота на ларвите по време на фазата преди експозицията, тъй като такива ефекти могат да засегнат чувствително развитието на поповите лъжички по време на следващата след това фаза на изпитването. Поради това гъстотата на отглеждането не трябва да надвишава приблизително четири попови лъжички на литър среда за отглеждане (статична система на експозиция) или 10 попови лъжички на литър среда за отглеждане (напр. с дебит 50 ml/min във системата преди експозицията или системата за отглеждане). При тези условия поповите лъжички следва да се развият от етапи 45/46 към етап 51 в рамките на дванадесет дни. Поповите лъжички, които са представителни екземпляри за тази изходна популация, следва да бъдат проверявани ежедневно за етапа на развитие, с цел да се определи подходящият момент за започване на експозицията. Следва да се положат грижи за свеждане до минимум на стреса и травмирането на поповите лъжички, особено по време на преместване, почистване на аквариумите и манипулиране на ларвите. Следва да бъдат избягвани стресиращите условия/действия, като например висок и/или непрекъснат шум, почукване по аквариума, вибрации в аквариума, прекомерна активност в лабораторията и резки промени в компонентите на околната среда (наличие на светлина, температура, pH, DO, дебит на водния поток и т.н.). Ако поповите лъжички не се развият до етап 51 в срок от 17 дни след оплождането, за потенциална причина следва да бъде считан прекомерният стрес.
|
Отглеждане и хранене на ларвите
|
13.
|
Поповите лъжички биват хранени напр. с достъпните в търговската мрежа храни за попови лъжички, използвани в изследванията за валидиране (вж. също допълнение 1) през целия период преди експозицията (по Nieuwkoop и Faber (NF) етап 45/46 (8)) и през целия период на изпитването от 21 дни, или са на друг хранителен режим, за който е доказано, че дава резултати, еквивалентни на тези в изследването за метаморфоза на земноводни. Хранителният режим през целия период преди експозицията следва внимателно да се регулира така, че да отговаря на нуждите на развиващите се попови лъжички. Това означава, че на новоизлюпените малки попови лъжички следва да бъдат давани малки порции храна няколко пъти на ден (поне два пъти). Следва да се избягва прекомерното количество с цел i) да се запази качеството на водата и ii) да се предотврати задръстването на хрилните филтри с частици храна и детрит. За храните за попови лъжички, използвани в изследванията за валидиране, дневните хранителни дажби следва да бъдат увеличавани с растежа на поповите лъжички до около 30 mg на индивид на ден малко преди започването на изпитването. При проучванията за валидиране е доказано, че тази достъпна в търговската мрежа храна допринася за нормалния растеж и развитие на поповите лъжички на Х. laevis и същата представлява фини частици, суспендирани във водния стълб за дълъг период от време и подлежи на отмиване с оттока. Следователно общото дневно количество храна следва да се разделя на по-малки порции и да се дава поне два пъти дневно. Хранителният режим за тази храна е посочен в таблица 1. Скоростите на подаване на храната трябва да бъдат записвани. Тя може да се дава в сухо състояние или като изходен разтвор, приготвен във вода за разреждане. Този изходен разтвор трябва да се приготвя прясно през ден и да се съхранява при температура 4 °C, когато не се използва.
Таблица 1
Режим на хранене с храна за попови лъжички от търговската мрежа, използван в изследванията за валидиране за попови лъжички на Х. laevis по време на интравиталната част от ИМЗ в проточни условия
|
Ден от проучването
|
Хранителната дажба (mg храна на индивид на ден)
|
|
0-4
|
30
|
|
5-7
|
40
|
|
8-10
|
50
|
|
11-14
|
70
|
|
15-21
|
80
|
|
Аналитична химия
|
14.
|
Преди провеждането на проучването следва да бъде оценена стабилността на изпитвания химикал, като се използва съществуващата информация за неговата разтворимост, разграждане и летливост. От разтворите за изпитване от всяко повторение при всяка концентрация следва да бъде взета проба за химични анализи в началото на изпитването (ден 0) и един път седмично по време на изпитването за минимум четири проби. Препоръчва се, също така, всяка една изпитвана концентрация да бъде анализирана по време на подготовката на системата, преди започването на изпитването, за да се провери действието на системата. Освен това се препоръчва изходните разтвори да се анализират когато се изменят, особено ако обемът на изходния разтвор не предоставя достатъчно количество химикал така, че да обхваща продължителността на рутинните периоди на вземане на проби. В случай на химикали, които не могат да бъдат открити при някои или при всички концентрации, използвани при изпитването, следва да се измерят изходните разтвори и да се запише дебитът на системата, за да се изчислят номиналните концентрации.
|
Доставка на химикал
|
15.
|
Методът, използван за въвеждане на изпитвания химикал в системата, може да варира в зависимост от неговите физични и химични свойства. Разтворимите във вода химикали могат да бъдат разтворени в аликвотни части вода за изпитване при концентрация, която позволява доставка при целевата концентрация на изпитване при проточна система. Химикали, които са в течно състояние при стайна температура и умерено разтворими във вода, могат да бъдат въвеждани с методи със сатуратор течност-течност. Химикали, които са в твърдо състояние при стайна температура и умерено разтворими във вода, могат да бъдат въвеждани със сатуратор с колона със стъклена вата (7). За предпочитане е да се използва система за изпитване без носител, но отделните изпитвани химикали имат различни физични и химични свойства, които вероятно ще изискват различни подходи за подготвяне на водата за експозиция на химикала. За препоръчване е да бъдат положени усилия за избягване на разтворители или носители, защото: i) някои разтворители сами по себе си могат да доведат до токсичност и/или нежелан или непредвиден ендокринен отговор, ii) изпитването на химикали на равнища над разтворимостта им във вода (както може често да се случи при използването на разтворители) може да доведе до неточно определяне на ефективните концентрации, и iii) употребата на разтворители в по-дългосрочните изпитвания може да доведе до значително „образуване на биофилм“, свързано с микробната активност. За трудни за изпитване химикали могат да се използват разтворители в краен случай, и за определяне на най-добрия метод следва да бъде консултиран документът на ОИСР с насоки за изпитване за токсичност във водна среда на трудни вещества и смеси (4). Изборът на разтворител се определя в зависимост от химичните свойства на химикала. Разтворители, за които е установено, че са ефективни за изпитване за водна токсичност, включват ацетон, етанол, метанол, диметилформамид и триетиленгликол. В случай, че се използва разтворител за носител, концентрациите на разтворителя трябва да бъдат под хроничната концентрация без наблюдавано въздействие (NOEC); Документът на ОИСР с насоки препоръчва максимум от 100μl/l; в неотдавнашен преглед се препоръчва използване на разтворител с концентрация само 20μl на литър вода за разреждане (12). Ако се използва разтворител за носител, следва да се оценят подходящи контроли на разтворител в допълнение към контролите без разтворител (чиста вода). Ако прилагането на химикала чрез водата не е възможно — поради физични или химични характеристики (малка разтворимост) или поради ограничена наличност на химикала — може да бъде взето предвид въвеждането чрез хранителния режим. Върху експозицията чрез хранителен режим има извършена предварителна работа; независимо от това, използването на този път на експозиция не е обичайно. Изборът на метод следва да бъде документирано и проверено по аналитичен път.
|
Избор на концентрации на изпитване
Определяне на висока концентрация на изпитване
|
16.
|
За целите на това изпитване високата изпитвана концентрация трябва да се определи от прага на разтворимост на изпитвания химикал; максимално поносимата концентрация (МПК) за остро токсични химикали; или 100 mg/l, в зависимост от това коя е най-ниска.
|
|
17.
|
МПК се определя като най-високата изпитвана концентрация на химикала, която води до по-малко от 10 % смъртност в резултат от остра токсичност. При използването на този подход се допуска, че са налице емпирични данни за смъртността от остра токсичност, от които може да се оцени МПК. Оценката на МПК може да бъде неточна и обикновено се изисква определена професионална преценка. Въпреки че използването на регресионни модели може да е най-издържаният в техническо отношение подход за оценяване на МПК, полезна апроксимация на МПК може да бъде изведена от съществуващите данни за остра токсичност, като се използва 1/3 от стойността на LC50 за остра токсичност. Въпреки това, възможно е да липсват данни за остра токсичност за изпитваните животински видове. Ако липсват специфични за съответния животински вид данни за остра токсичност, може да бъде извършено 96-часово изпитване за определяне на LC50 с попови лъжички, които са представителни за изпитваните в ИМЗ (т.е., са на същия етап на развитие). Като вариант, ако са налични данни за други водни видове (напр. изследвания за LC50 за риби, или за други земноводни видове), тогава може да се използва професионална преценка за оценка на вероятната МПК въз основа на екстраполация между отделните видове.
|
|
18.
|
Като алтернатива, ако химикалът не предизвиква остра токсичност и разтворимостта му е над 100 mg/l, тогава следва 100 mg/l да се приеме за най-високата изпитвана концентрация, тъй като тази концентрация обикновено се счита за „практически нетоксична“.
|
|
19.
|
Въпреки че не се препоръчват като процедура, статичните методи с обновяване могат да бъдат използвани, когато проточните методи са неподходящи за постигането на МПК. Ако се използват статични методи с обновяване, стабилността на концентрацията на изпитвания химикал следва да бъде документирана и да остава в границите на критериите за параметрите. Препоръчват се двадесет и четири периода на обновяване. Периоди на обновяване, надвишаващи 72 часа, са неприемливи. Освен това параметрите за качество на водата (например DO, температура, рН и т.н.) следва да се измерват в края на всеки период на обновяване, непосредствено преди обновяването.
|
Диапазон от концентрации на изпитване
|
20.
|
Изискват се най-малко три концентрации на изпитване и контрола с чиста вода (и контрола на носител, ако е необходимо). Минималната разлика между най-високата и най-ниската концентрация на изпитване следва да бъде около един порядък. Максималното разделяне на дозите е 0,1, а минималното е 0,33.
|
ПРОЦЕДУРА
Започване и провеждане на изпитването
Ден 0
|
21.
|
Експозицията следва да започне, когато достатъчно на брой попови лъжички в изходната популация преди експозицията са достигнали етап на развитие 51 по Nieuwkoop и Faber (8), и когато същите са на възраст по-малко или равна на 17 дни след оплождането. За подбор на екземпляри за изпитването, в единичен съд, съдържащ подходящ обем вода за разреждане, следва да се обединят здрави попови лъжички изходната популация, с нормален външен вид. За определяне на етапа на развитие поповите лъжички следва да бъдат отстранени с малка мрежа или сито от съда, в който са били обединени, и прехвърлени в прозрачна измервателна камера (например 100 mm блюдо на Петри), съдържаща вода за разреждане. Предпочита се за определяне на етапа да не се използва анестезия, но може да се използва индивидуална анестезия на поповите лъжички с 100 mg/l трикаинметансулфонат (напр. MS-222), подходящо буфериран с натриев бикарбонат (рН 7,0) преди обработката. Ако се използва, следва от опитни лаборатории да се получи методология за използване, напр. на MS-222, по подходящ начин, и да се протоколира заедно с резултатите от изпитването. По време на това прехвърляне с животните трябва да се борави внимателно, за да се сведе до минимум стресът от боравенето, както и да се избегне каквото и да е увреждане.
|
|
22.
|
Етапът на развитие на животните се определя като се използва бинокулярен стереомикроскоп. За намаляване на крайното вариране в етапа на развитие, важно е това определяне на етапа да се провежда колкото е възможно по-точно. Според Nieuwkoop и Faber (8) основният ориентир за развитието при подбор на организми на етап 51 е морфологията на задните крайници. Морфологичните характеристики на задните части следва да бъдат изучени под микроскоп. Въпреки че за изчерпателна информация относно определянето на етапа на развитие при поповите лъжички следва да бъде консултирано ръководството по Nieuwkoop и Faber (8), може надеждно да се определи етапът, като се използват видими морфологични ориентири. Следната таблица може да бъде използвана за опростяване и стандартизиране на процедурата за определяне на етапа чрез определяне на видими морфологични ориентири, свързани с различни етапи, като се допуска нормално развитие.
Таблица 2
Видими морфологични ориентири за определяне на етапа съгласно насоките на Neuwkoop и Faber.
|
Видими морфологични ориентири
|
Етап на развитие
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Задни крайници
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Предни крайници
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Черепно-лицева структура
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Морфология на обонятелен нерв
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Дължина на опашката
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
За започване на изпитването всички попови лъжички трябва да са на етап 51. Най-видимият морфологичен ориентир за определяне на посочения етап е морфологията на задните крайници, която е показана на фигура 1.
Фигура 1.
Морфология на задните крайници на попова лъжичка на Х. laevis на етап 51.

|
|
24.
|
В допълнение към избора на етапа на развитие може да се използва незадъжителен подбор по размера на екземплярите за изпитване. За тази цел цялата дължина на тялото (не SVL) следва да се измери в ден 0 за подпроба от приблизително 20 попови лъжички на етап 51 по NF. След изчисляване на средната цялостна дължина на тялото за тази група животни, минималните и максималните граници за цялостната дължина на тялото на опитните животни може да се определи, като се даде интервал около средната стойност ± 3 mm (средните стойности на цялостната дължина на тялото са в диапазон от 24,0 до 28,1 mm за попови лъжички на етап 51). Независимо от това, определянето на етапа е първичният параметър при определяне на готовността на всеки екземпляр за изпитване. Поповите лъжички, показващи видими макроскопски дефекти или увреждания, следва да бъдат изключени от изследването.
|
|
25.
|
Поповите лъжички, които отговарят на критериите за етапа, описани по-горе, се държат в съд с чиста вода за отглеждане до приключване на процеса на определяне на етапа. След приключване на определянето на етапа ларвите се разпределят на случаен принцип към съдове за третиране с експозиция до запълване на всеки такъв съд с 20 ларви. Сред това всеки съд за третиране се проверява за животни с анормален външен вид (напр. увреждания, необичаен начин на плуване и т.н.). Поповите лъжички с явно нездрав външен вид следва да бъдат отстранявани от съдовете за третиране и заменяни с новоизбрани ларви от съда, в който са били обединени.
|
Наблюдения
|
26.
|
За по-подробна информация относно процедурите за приключване на изпитването и обработката на поповите лъжички вж. Ръководството на ОИСР за тиреоидна хистология на земноводни (9).
|
Измервания на Ден 7
|
27.
|
В ден 7 пет случайно избрани попови лъжички от всяко повторение се отстраняват от всеки съд за изпитване. Използваната процедура с избор на случаен принцип следва да предоставя равен шанс за избиране на всеки изпитван организъм. Това може да се постигне чрез използване на произволен метод за рандомизация, но се изисква всяка попова лъжичка да бъде уловена с мрежа. Поповите лъжички, които не са избрани, се връщат в първоначалния съд, избраните попови лъжички се подлагат на евтаназия по хуманен начин в 150 до 200 mg/l, напр. MS-222, подходящо буфериран с натриев бикарбонат за постигане на рН 7,0. Подложените на евтаназия попови лъжички се промиват с вода и водата се попива, след което се определя телесното тегло с точност до милиграм. За всяка попова лъжичка се определят дължината на задните крайници, дължината от върха на муцуната до клоачния отвор и етапът на развитие (като се използва бинокулярен стереомикроскоп).
|
Ден 21 Измервания (Приключване на изпитването)
|
28.
|
При приключването на изпитването (ден 21) останалите попови лъжички се отстраняват от съдовете за изпитване и се подлагат на евтаназия по хуманен начин в 150 до 200 mg/l, напр. MS-222, подходящо буфериран с натриев бикарбонат, както е посочено по-горе. Поповите лъжички се промиват с вода и водата се попива, след което се определя телесното тегло с точност до милиграм. За всяка попова лъжичка се измерват етапът на развитие, дължината от върха на муцуната до клоачния отвор и дължината на задните крайници.
|
|
29.
|
Всички ларви се поставят във фиксатор на Davidson за 48 до 72 часа или като проби с цяло тяло, или като проби от тъкан с почистена глава, съдържащи долната челюст за хистологична оценка. Като проби за хистопатологията се вземат общо пет попови лъжички от всеки съд с повторение. Тъй като височината на фоликуларната клетка зависи от етапа (10), най-подходящият подход за вземане на проби за хистологични анализи е да се използват индивиди със съвпадащ етап, когато това е възможно. С цел да се подберат индивиди със съвпадащ етап следва етапът на ларвите да бъде определен преди подбора и последващата обработка за събиране на данни и съхранение. Това е необходимо, тъй като обичайните различия в развитието ще доведат до различни разпределения по етапи в рамките на всеки съд с повторение.
|
|
30.
|
Животните, избрани за хистопатология (n=5 от всяко повторение) следва да са еднакви с медианната стойност на етапа от контролите (обединени повторения), когато това е възможно. Ако са налице съдове с повторение с повече от пет ларви на подходящ етап, тогава се избират пет ларви на случаен принцип.
|
|
31.
|
Ако са налице съдове с повторение с по-малко от пет ларви на подходящ етап, тогава като извадка следва да бъдат взети на случаен принцип индивиди от следващия надолу или нагоре етап на развитие, до достигане на общ размер на извадката от пет ларви на повторение. За предпочитане е решението за подбор на извадка от допълнителни ларви или от следващия надолу, или от следващия нагоре етап на развитие, да се прави въз основа на цялостна оценка на разпределението на етапите в контролата и при третиранията с химикала. Това означава, че ако третирането с химикала е свързано със забавяне на развитието, тогава извадката от допълнителните ларви следва да бъде взета от следващия надолу етап. Обратно, ако третирането с химикала е свързано с ускоряване на развитието, тогава извадката от допълнителните ларви следва да бъде взета от следващия нагоре етап.
|
|
32.
|
В случаи на тежки изменения в развитието на поповите лъжички, дължащи се на третирането с изпитвания химикал, може да не е налице припокриване на разпределението на етапите в третиранията с изчислената медианна стойност на етапа на развитие от контролите. Само в тези случаи процесът на подбор следва да бъде модифициран чрез използване на етап, различен от медианната стойност на етапа от контролите, за постигане на извадки от ларви със съвпадащ етап за тиреоидната хистопатология. Освен това, ако етапите са неопределени (т.е., асинхронност), тогава за хистологичен анализ следва на случаен принцип да се изберат 5 попови лъжички от всяко повторение. Обосновката за извадка от ларви, които не са на етап, равностоен на медианната стойност на етапа на развитие от контролите, следва да бъде протоколирана.
|
Определяне на биологични крайни точки
|
33.
|
По време на 21-дневната фаза на експозиция измерването на първичните крайни точки се извършва в дни 7 и 21, но е необходимо ежедневно наблюдение на изпитваните индивиди. В таблица 3 е даден преглед на крайните точки на измерване, както и на съответните моменти на извършване на наблюдение. По-подробна информация за техническите процедури за измерване на апикални крайни точки и за хистологични оценки може да се намери в документите с насоки на ОИСР (9).
Таблица 3.
Моменти на извършване на наблюдение за първични крайни точки в ИМЗ.
|
Апикални крайни точки
|
Ежедневно
|
Ден 7
|
Ден 21
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Дължина на задни крайници
|
|
|
ߦ
|
ߦ
|
|
—
|
Дължина от върха на муцуната до клоачния отвор
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Хистология на щитовидна жлеза
|
|
|
|
ߦ
|
|
Апикални крайни точки
|
34.
|
Етап на развитие, дължина на задни крайници, SVL и мокро тегло са апикалните крайни точки на ИМЗ, като всяка от тях е обсъдена накратко по-долу. По-нататъшна техническа информация за събирането на тези данни е на разположение в документите с насоки, към които е оваване, включително процедури за анализ с компютърни програми, които се препоръчват за използване.
|
Етап на развитие
|
35.
|
Етапът на развитие на попови лъжички на Х. laevis се определя с използване на критериите за определяне на етапи по Nieuwkoop и Faber (8). Данните за етапа на развитие се използват, за да се определи дали развитието е ускорено, асинхронно, забавено или незасегнато. Ускорението или забавянето на развитието се определят чрез сравнение на средната стойност на етапа, достигнат от контролата и третираните групи. Асинхронно развитие се протоколира, когато изследваните тъкани не са деформирани или анормални, но относителното разпределяне на морфогенезата или развитието на различни тъкани във времето е нарушено в рамките на отделна попова лъжичка.
|
Дължина на задни крайници
|
36.
|
Диференциацията и растежът на задните крайници се контролират от тиреоидни хормони и са основни ориентири за развитието, вече използвани при определянето на етапа на развитие. Развитието на задните крайници се използва в качествено отношение при определяне на етапа на развитие, но тук се разглежда като количествена крайна точка. Поради това дължината на задните крайници се измерва като крайна точка за откриване на въздействия върху тиреоидната ос (фигура 2). С оглед на последователността дължината на задните крайници се измерва по левия заден крайник. Дължината на задните крайници се оценява както на ден 7, така и на ден 21 от изпитването. На ден 7 измерването на дължината на задните крайници е просто, както се вижда на фигура 2. Измерването на дължината на задните крайници в ден 21 обаче е по-сложно поради извивките на крайника. Следователно измерванията на дължината на задните крайници в ден 21 трябва да започват от телесната стена и да следват средната линия на крайника по всички ъглови отклонения. Измененията в дължината на задните крайници в ден 7, макар и това да не е очевидно на ден 21, все още се считат за значими за потенциална тиреоидна активност. Измерванията на дължината се правят от цифрови снимки, с използване на софтуер за анализ на изображения, както е описано в Ръководството на ОИСР за тиреоидна хистология на земноводни (9).
|
Дължина на тялото и мокро тегло
|
37.
|
Определянето на дължината от върха на муцуната до клоачния отвор (SVL) (фигура 2) и мокрото тегло са включени в протокола от изпитването за оценка на възможните въздействия на изпитваните химикали върху растежа на поповите лъжички в сравнение с контролата и са полезни за откриването на обща токсичност на изпитвания химикал. Тъй като отстраняването на прилежащата вода за определяне на теглото може да предизвика стресиращи условия за поповите лъжички и може да причини увреждания на кожата, измерванията се извършват на ден 7 върху поповите лъжички от подпробата, а върху всички останали попови лъжички — при приключване на изпитването (ден 21). С оглед на последователността при измерването краниалният аспект на клоачния отвор се използва като каудален край.
|
|
38.
|
Дължината от върха на муцуната до клоачния отвор (SVL) се използва, за да се оцени растежът на поповите лъжички, както е показано на фигура 2.
Фигура 2.
(А) Видове измервания на дължината на тялото и (Б) Измерване на дължината на задните крайници на попови лъжички на Х. laevis (1).
|
Хистология на щитовидна жлеза
|
39.
|
Независимо от това, че дължината от върха на муцуната до клоачния отвор и дължината на задните крайници са важни крайни точки за оценка на измененията в развитието, само по себе си забавянето на развитието не може да се счита за диагностичен показател за анти-тиреоидна активност. Някои изменения могат да се наблюдават само при рутинен хистопатологичен анализ. Диагностични критерии включват хипертрофия/атрофия на щитовидната жлеза, хипертрофия на фоликуларни клетки, хиперплазия на фоликуларни клетки и, като допълнителни качествени критерии: област на фоликуларния лумен, качеството на колоидите и височина/форма на фоликуларните клетки. Скалата на степените на тежест на измененията (4 степени) следва да се протоколира. Информация за получаване и обработка на проби за хистологичен анализ и за извършване на хистологични анализи на тъканни проби е на разположение в „Amphibian Metamorphosis Assay: Part 1 — Technical guidance for morphologic sampling and histological preparation“ и „Amphibian Metamorphosis Assay: Part 2 — Approach to reading studies, diagnostic criteria, severity grading and atlas“ (9). Лаборатории, извършващи изследването за първи път, следва да търсят съвети от опитни патолози за обучение преди извършване на хистологичен анализ и оценка на щитовидната жлеза. Явни и значими промени в апикалните крайни точки, показващи ускорение или асинхронност на развитието, могат да изключат необходимостта от извършване на хистопатологичен анализ на щитовидната жлеза. Липсата на ясно изразени морфологични изменения или доказателства за забавяне на развитието обаче налагат хистологичен анализ.
|
Смъртност
|
40.
|
Всички съдове за изпитване следва да се проверяват ежедневно за мъртви попови лъжички, а броят се записва за всеки съд. Следва да се записват датата, концентрацията и номерът на всеки съд за всяко наблюдение на смъртност. Мъртвите екземпляри следва да се отстраняват от съда за изпитването незабавно след забелязването им. Смъртност, превишаваща 10 %, може да показва неподходящи условия на изпитването или токсични въздействия, предизвикани от изпитвания химикал.
|
Допълнителни наблюдения
|
41.
|
Случаите на анормално поведение и макроскопски видими малформации и увреждания следва да бъдат записани. Следва да се записват датата, концентрацията и номерът на всеки съд при анормално поведение и макроскопски видими малформации и увреждания. Нормалното поведение се характеризира с попови лъжички, суспендирани във водната колона, с опашка, повдигната над главата, редовни ритмични движения на опашния плавник, периодично излизане на повърхността, подвижен оперкулум и реагиране на стимули. Необичайно поведение може да включва например плаване на повърхността, лежане на дъното на съда, обърнато или неправилно плуване, липса на активност по излизане на повърхността и нереагиране на стимули. В допълнение, брутните разлики в потреблението на храна между третиранията следва да се записват. Макроскопските малформации и увреждания могат да включват морфологични аномалии (напр. деформации на крайници), хеморагични увреждания, бактериални или гъбични инфекции, както и много други. Тези определяния са качествени и следва да се считат за близки до клиничните признаци за заболяване/стрес и да се правят в сравнение с индивидите в контролите. Ако появата или честота на поява е по-голяма в експонираните съдове, отколкото в контролите, тогава те следва да се разглеждат като доказателство за ясно изразена токсичност.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Събиране на данни
|
42.
|
Всички данни следва да бъдат събирани чрез електронни системи или системи за ръчно събиране, които отговарят на изискванията за добри лабораторни практики (ДЛП). Данните от изследването следва да включват:
|
|
Изпитван химикал:
|
—
|
Характеризиране на изпитвания химикал: физични и химични свойства; информация за стабилността и биоразградимостта;
|
|
—
|
Информация и данни за химикала: метод и честота на изготвяне на разрежданията Информацията за изпитвания химикал включва действителни и номинални концентрации на изпитвания химикал и, в някои случаи, неизходен химикал, когато е необходимо. За изходните разтвори, както и за изпитваните разтвори, може да се изискват измервания на изпитвания химикал;
|
|
—
|
Разтворител (ако е различен от вода): обосновка на избора на разтворител и характеризиране на разтворителя (природа, използвана концентрация);
|
|
|
|
Условия на изпитването:
|
—
|
Работни записи: те се състоят от наблюдения, свързани с функционирането на системата за изпитване и поддържащата среда и инфраструктура. Типичните записи включват: температура на околната среда, температура на изпитването, период на осветеност, състояние на критичните компоненти на системата за експозиция (например помпи, броячи на цикли, налягане), дебит, нива на водата, изменения при съдовете с изходните разтвори и записи за храненето. Общите параметри за качество на водата включват: pH, DO, проводимост, общ йод, алкалност и твърдост;
|
|
—
|
Отклонения от метода на изпитването: тази информация следва да включва информация или текстово описание на отклоненията от метода за изпитване;
|
|
|
|
Резултати:
|
—
|
Биологични наблюдения и данни: те включват ежедневни наблюдения на смъртност, консумация на храна, необичаен начин на плуване, летаргия, загуба на равновесие, деформации, увреждания и други. Наблюденията и данните, събирани на предварително определени интервали, включват: етап на развитие, дължина на задни крайници, дължина от върха на муцуната до клоачния отвор и мокро тегло;
|
|
—
|
Статистически техники за анализ и обосноваване на използването на тези техники; резултати от статистическия анализ, за предпочитане в таблична форма;
|
|
—
|
Хистологични данни: те включват текстово описание, както и степенувана тежест на уврежданията и поява на специалните наблюдения, както е описано подробно в документа с ръководството по хистопатология;
|
|
—
|
Наблюдения ad hoc: тези наблюдения следва да включват текстови описания на изследването, които не попадат в описаните по-горе категории.
|
|
|
Протоколиране на данни
|
43.
|
В допълнение 2 се съдържат формуляри за ежедневно събиране на данни, които могат да бъдат използвани като насоки за въвеждане на необработени данни и за изчисляване на обобщени статистически данни. Освен това са представени таблици за протоколиране, които са удобни за съобщаване на обобщения на данните за крайните точки. Таблиците за протоколиране за хистологичните оценки могат да бъдат намерени в допълнение 2.
|
Критерии за параметрите и приемливост/валидност на изпитването
|
44.
|
Като правило, големите отклонения от метода за изпитването ще доведат до неприемливи данни за интерпретиране или протоколиране. Следователно, следните критерии в таблица 4 са разработени като насоки за определяне на качеството на извършеното изпитване и общите параметри на контролните организми.
Таблица 4
Критерии за параметрите на ИМЗ
|
Критерий
|
Допустими граници
|
|
Концентрации на изпитване
|
Поддържа се при ≤ 20 % CV (вариация на измерената концентрация на изпитване) по време на 21-дневното изпитване.
|
|
Смъртност при контролите
|
≤ 10 % — смъртността във всяко едно повторение при контролите не трябва да превишава 2 попови лъжички
|
|
Минимална медианна стойност на етапа на развитие от контролите в края на изпитването
|
57
|
|
Размах на етапа на развитие в контролна група
|
Стойностите на 10-я и 90-я процентил от разпределението на етапите на развитие следва да се различават с не повече от 4 етапа
|
|
Разтворен кислород
|
≥ 40 % стойност на насищане при равновесие с атмосферния въздух (23)
|
|
pH
|
pH трябва да бъде между 6,5 и 8,5. Разликите в стойностите между повторенията/между третиранията не трябва да превишават 0,5.
|
|
Температура на водата
|
22° ± 1 °C — разликите в стойностите между повторенията/между третиранията не трябва да превишават 0,5 °C
|
|
Концентрации на изпитване без ясно изразена токсичност
|
≥ 2
|
|
Параметри на повторенията
|
≤ 2 повторения могат да бъдат изложени на риск по време на изпитването
|
|
Специални условия за употреба на разтворител
|
Ако се използва разтворител за носител, следва да се използват както контрола на разтворител, така и контрола на чиста вода, и резултатите следва да се протоколират
|
|
Статистически значими разлики между групите от контролата на разтворител и от контролата на вода се третират специално. За повече информация вж. по-долу
|
|
Специални условия за статичната система с обновяване
|
Представителните химични анализи преди и след обновяване следва да се протоколират
|
|
Равнищата на амоняк трябва да се измерват непосредствено преди обновяване
|
|
Всички параметри за качество на водата, изброени в таблица 1 от допълнение 1, следва да се измерват непосредствено преди обновяване
|
|
Периодът за обновяване не следва да надвишава 72 часа
|
|
Подходящ график на хранене (50 % от дневната дажба храна за попови лъжички от търговската мрежа)
|
|
Валидност на изпитването
|
45.
|
Следните изисквания трябва да бъдат изпълнени, за да се приеме дадено изпитване за приемливо/валидно:
|
|
При валиден опит от изпитване е получен отрицателен резултат за тиреоидна активност:
|
(1)
|
За всяко дадено третиране (включително и контролите) смъртността не може да надхвърля 10 %. За всяко отделно повторение смъртността не може да надхвърля три попови лъжички, в противен случай повторението се смята за изложено на риск
|
|
(2)
|
Най-малко две равнища на третиране, като и всичките четири неизложени на риск повторения, следва да са налични за анализ
|
|
(3)
|
Най-малко две равнища на третиране без ясно изразена токсичност следва да са налични за анализ
|
|
|
|
При валиден опит от изпитване е получен положителен резултат за тиреоидна активност:
|
(1)
|
В контролната група може да бъде получена смъртност от не повече от две попови лъжички/повторение
|
|
|
Схема за вземане на решения за провеждането на ИМЗ
|
46.
|
За провеждането на ИМЗ беше разработена схема за вземане на решения, за предоставяне на логическа помощ в провеждането на изпитването и интерпретирането на резултатите от биологичното изследване (вж. диаграмата на фигура 3). Схемата за вземане на решения по същество претегля крайните точки, като дава голяма тежест на ускореното и асинхронното развитие и тиреоидната хистопатология, и по-малка тежест на забавеното развитие, дължината от върха на муцуната до клоачния отвор и мокрото тегло — параметри, които потенциално могат да бъдат повлияни от обща токсичност.
Фигура 3.
Схема за вземане на решения за провеждането на ИМЗ.

|
Ускорено развитие (определено с помощта на етапа на развитие, SVL и HLL)
|
47.
|
Известно е, че ускореното развитие се наблюдава само при въздействия, свързани с тиреоидни хормони. Това могат да бъдат въздействия върху периферна тъкан, като например прякото взаимодействие с рецептора за тиреоидния хормон (като например с T4) или въздействия, които изменят равнищата на циркулиращите тиреоидни хормони. И в двата случая това се счита за достатъчно доказателство, за да се покаже, че химикалът притежава тиреоидна активност. Ускореното развитие се оценява по един от следните два начина. Първо, общият етап на развитие може да бъде оценен с помощта на стандартизирания подход, посочен в Nieuwkoop и Faber (8). На второ място, специфичните морфологични характеристики могат да бъдат определени количествено, като например дължина на задни крайници както през ден 7, така и през ден 21, което се свързва положително с агонистични въздействия върху рецептора за тиреоидния хормон. Ако бъде получено статистически значимо ускоряване в развитието, или в дължината на задните крайници, тогава изпитването показва, че химикалът притежава тиреоидна активност.
|
|
48.
|
Оценката на изпитваните индивиди за наличие на ускорено развитие, сравнено с популацията в контролата, се основава на резултатите от статистическите анализи, извършени за следните четири крайни точки:
|
—
|
дължина на задните крайници (нормализирана чрез SVL) на ден 7 от изследването
|
|
—
|
дължина на задните крайници (нормализирана чрез SVL) на ден 21 от изследването
|
|
—
|
етап на развитие на ден 7 от изследването
|
|
—
|
етап на развитие на ден 21 от изследването.
|
|
|
49.
|
Статистическите анализи на дължината на задните крайници следва да се извършват въз основа на измерванията на дължината на левия заден крайник. Дължината на задните крайници се нормализира, като се вземе съотношението дължина на задните крайници към дължина от върха на муцуната до клоачния отвор на дадения индивид. След това средната стойност на нормализираните стойности за всяко ниво на третиране се сравняват. Тогава показател за ускоряване на развитието е значителното увеличение на средната дължина на задните крайници (нормализирана) в дадена третирана с химикал група в сравнение с контролната група на ден 7 и/или ден 21 от изследването (вж. допълнение 3).
|
|
50.
|
Статистическите анализи на етапа на развитие следва да се извършват въз основа на определяне на етапите на развитие въз основа на морфологичните критерии, описани от Nieuwkoop и Faber (8). Показател за ускоряване на развитието е когато посредством анализ на данни с полиномно разпределение е установено значимо увеличение на средната дължина на задните крайници (нормализирана) в дадена третирана с химикал група в сравнение с контролната група в ден 7 и/или ден 21 от изследването (вж. допълнение 3).
|
|
51.
|
В метода за изпитване ИМЗ значимото въздействие върху някоя от четирите крайни точки, посочени по-горе, се приема за достатъчно за положителен резултат за откриване на ускорено развитие. Това означава, че при съществени въздействия върху дължината на задните крайници в определена времева точка не се изисква потвърждаване от значително въздействие върху дължината на задните крайници в алтернативната времева точка, нито от значими въздействия върху етапа на развитие в тази конкретна времева точка. Обратно, при значими въздействия върху етапа на развитие в определена времева точка не се изисква потвърждаване от значими въздействия върху етапа на развитие в алтернативната времева точка, нито от значими въздействия върху дължината на задните крайници в тази конкретна времева точка. Тежестта на доказателствата за ускорено развитие все пак ще се увеличи, ако бъдат открити значими въздействия за повече от една крайна точка.
|
Асинхронно развитие (определено с помощта на критерии за етапа на развитие)
|
52.
|
Асинхронното развитие се характеризира с това, че относителното разпределяне на морфогенезата или развитието на различни тъкани във времето е нарушено в рамките на отделна попова лъжичка. Невъзможността за ясно установяване на етапа на развитие на един организъм, при използване на набора от морфологични крайни точки, смятан за типичен за всеки отделен етап, показва, че тъканите се развиват асинхронно по време на метаморфозата. Асинхронното развитие е показател за тиреоидна активност. Единствените известни действия, водещи до асинхронно развитие, са чрез въздействия на химикали върху дейността на периферните тиреоидни хормон и/или метаболизма на тиреоидните хормони при развитието на тъкани, каквито се наблюдават и при инхибитори на дейодиназата.
|
|
53.
|
Оценката на изпитваните индивиди за наличие на асинхронно развитие в сравнение с популацията в контролата се основава на макроскопска морфологична оценка на изпитваните индивиди в ден 7 и ден 21 от изследването.
|
|
54.
|
Описанието на нормалното развитие на Xenopus laevis от Nieuwkoop и Faber (8) дава рамката за определяне на последователността на настъпването на промените в тъканите при нормално развитие. Терминът „асинхронно развитие“ се отнася специално за тези отклонения в макроскопското морфологично развитие на поповите лъжички, които не дават възможност за окончателно определяне на етапа на развитие в съответствие с критериите на Nieuwkoop и Faber (8), тъй като ключови морфологични ориентири сочат характеристики на различни етапи.
|
|
55.
|
Следва да се разглеждат само случаи, показващи отклонения в хода на настъпването на промените в специфични тъкани, в сравнение с хода на настъпването на промените в други тъкани, каквото е и съдържанието на термина „асинхронно развитие“. Някои класически фенотипове включват забавяне или липса на поява на предни крайници, независимо от нормалното или ускорено развитие на задните крайници и опашните тъкани, или преждевременна резорбция на хрилете по отношение на етапа на морфогенезата на задните крайници и резорбцията на опашката. Индивидът се записва като показващ асинхронно развитие, ако не може да му бъде определен етап, тъй като той не отговаря на повечето от служещите като ориентир критерии за развитието за даден Niewkoop и Faber етап (8), или ако има изключително забавяне или ускоряване на една или повече ключови характеристики (напр. пълна резорбция на опашката без да са се появили предни крайници). Тази оценка се извършва в качествено отношение и следва да включва разглеждане на пълния набор от ориентири, посочени от Nieuwkoop и Faber (8). Независимо от това не е необходимо да се записва развитието на различните ориентири на наблюдаваните индивиди. За индивидите, записани като показващи асинхронно развитие, не се определя етап на развитие по Nieuwkoop и Faber (8).
|
|
56.
|
По този начин основен критерий за определяне на случаите на необичайно морфологично развитие като „асинхронно развитие“ е, че относителното разпределяне на промените в тъканите и на морфогенезата на тъканите във времето е нарушено, докато морфологията на повлияните тъкани не е видимо необичайна. Един пример, който илюстрира това тълкуване на макроскопски морфологични аномалии, е че забавена морфогенеза на задните крайници спрямо развитието на други тъкани отговаря на критерия за „асинхронно развитие“, докато случаи, показващи липсващи задни крайници, необичайни пръсти (напр. ектродактилия, полидактилия) или други явни малформации по краката не следва да се разглеждат като „асинхронно развитие“.
|
|
57.
|
В този контекст, основните морфологични ориентири, които следва да бъдат оценени за тяхната координирана метаморфоза, следва да включват морфогенеза на задните крайници, морфогенеза на предните крайници, поява на предните крайници, етап на резорбция на опашката (по-специално резорбция на опашния плавник), и морфология на главата (напр. размер на хрилете и етап на резорбция на хрилете, морфология на долната челюст, изпъкване на Мекелов хрущял).
|
|
58.
|
В зависимост от начина на действие на химикала могат да се проявят различни макроскопски морфологични фенотипове. Някои класически фенотипове включват забавяне или липса на поява на предни крайници, независимо от нормалното или ускорено развитие на задните крайници и опашните тъкани, преждевременна резорбция на хрилете по отношение на промените в развитието на задните крайници и опашката.
|
Хистопатология
|
59.
|
Ако химикалът не предизвиква ясно изразена токсичност и не ускорява развитието, нито предизвиква асинхронно развитие, хистопатологията на щитовидните жлези се оценява чрез използване на подходящия документ с ръководство (9). Изоставането в развитието при отсъствие на токсичност е ясен показател за анти-тиреоидна дейност, но анализът на етапа на развитието е по-малко чувствителен и с по-малка диагностична стойност от хистопатологичния анализ на щитовидната жлеза. Следователно, в този случай е необходимо провеждане на хистопатологични анализи на щитовидните жлези. Въздействия върху хистологията на щитовидната жлеза са доказани при отсъствие на въздействия върху развитието. Ако настъпят изменения в тиреоидната хистопатология, тогава се смята, че химикалът показва тиреоидна активност. Ако не се наблюдават забавено развитие или хистологични увреждания в щитовидна жлеза, тогава се смята, че химикалът не показва тиреоидна активност. Обосновката за това решение е, че щитовидната жлеза е под влиянието на TSH и всеки химикал, който променя циркулиращия тиреоиден хормон достатъчно, за да се промени секрецията на TSH, ще доведе до хистопатологични изменения в щитовидните жлези. Циркулиращият тиреоиден хормон може да бъде променен по различни начини и механизми на действие. По този начин независимо от това, че равнището на тиреоиден хормон е показателно за въздействие, свързано с щитовидната жлеза, то е недостатъчно, за да се определи кой начин или механизъм на действие е свързан с отговора.
|
|
60.
|
Поради това, че тази крайна точка не се свежда до използване на основни статистически подходи, определянето на въздействието, свързано с експозиция на химикал, се извършва с помощта на експертно становище от патолог.
|
Забавено развитие (определено с помощта на етапа на развитие, HLL, телесното тегло, SVL)
|
61.
|
Забавено развитие може да се прояви чрез анти-тиреоидни механизми и чрез непряка токсичност. Леко забавяне на развитието, в съчетание с явни признаци на токсичност, вероятно са показател за неспецифичен токсичен ефект. Оценката на токсичността, различна от тиреоидната, е съществен елемент на изпитването, с оглед намаляване на вероятността от неверни положителни резултати. Прекомерната смъртност е явен признак, че се проявяват други механизми на токсичност. Аналогично, слабото намаление на растежа, определено чрез мокрото тегло и/или SVL, също предполагат токсичност, различна от тиреоидната. Видимото увеличение на растежа обикновено се наблюдава при химикали, които оказват отрицателно въздействие върху нормалното развитие. Следователно присъствието на по-големи индивиди не означава непременно токсичност, различна от тиреоидната. Растежът обаче никога не следва да бъде единствената надеждна основа за определяне на тиреоидната токсичност. За да се определи тиреоидната активност, следва да се използва по-скоро растежът в съчетание с етапа на развитие и тиреоидната хистопатология. Други крайни точки следва също да бъдат взети предвид при определяне на ясно изразената токсичност, включително оток, хеморагични увреждания, летаргия, намалена консумация на храна, изменчив/изменен начин на плуване и други. Ако при всички изпитвани концентрации се проявяват признаци на явна токсичност, изпитваният химикал трябва да бъде повторно оценен при по-ниски концентрации на изпитване, преди да се определи дали химикалът показва или не показва тиреоидна активност.
|
|
62.
|
Статистически значимото забавеното развитие, при отсъствие на други признаци на ясно изразена токсичност, показва, че химикалът притежава тиреоидна активност (антагонистичен). В отсъствието на голям статистически отклик този резултат може да бъде подсилен с резултатите от тиреоидната хистопатология.
|
Статистически анализи
|
63.
|
Предпочита се статистическите анализи на данните да следват процедурите, описани в документа „Съвременни подходи за статистически анализ на данни за екотоксичност: ръководство за прилагане“ (Current Approaches in the Statistical Analysis of Ecotoxicity Data:A Guidance to Application) (11). За всички непрекъснати количествени крайни точки (HLL, SVL, мокро тегло), съответстващи на монотонна зависимост доза-отклик, следва да се прилага тестът на Йонкхере-Терпстра със стъпка назад, за да се установи значимо въздействие от третирането.
|
|
64.
|
За непрекъснати крайни точки, които не са съответстващи на монотонна зависимост доза-отклик, данните трябва да бъдат оценени за нормалност (за предпочитане с използване на теста на Шапиро-Уилк или Андерсън-Дарлинг) и за хомогенност на дисперсията (за предпочитане с използване на тест на Левин). И двата теста се извършват с остатъците от ANOVA. Вместо тези формализирани тестове за нормалност и хомогенност на дисперсията може да се използва експертна преценка, въпреки че формализираните тестове са за предпочитане. Когато не е установена нормалност, или е установена хетерогенност на дисперсията, следва да се търси трансформация за нормализиране, стабилизиране на дисперсията. Ако данните (може би след трансформация) са с нормално разпределение и хомогенна дисперсия, значимо въздействие от третирането се определя от теста на Дънет. Ако данните (може би след трансформация) са с нормално разпределение и хетерогенна дисперсия, значимо въздействие от третирането се определя от теста на Тамхане-Дънет (или T3 тест) или от U-теста на Ман-Уитни-Уилкоксон. Когато не може да бъде намерена нормализираща трансформация, значимо въздействие от третирането се определя от U-теста на Ман-Уитни-Уилкоксон с използване на корекция на Бонферони-Холм на р-стойностите. Тестът на Дънет се прилага независимо от всеки ANOVA с използване на F-отношения, а тестът на Ман-Уитни се прилага независимо от всеки общ тест на Кръскал-Уолис.
|
|
65.
|
Значима смъртност не се очаква, но тя следва да бъде оценена с теста на Кокрън-Армитидж със стъпка назад, когато данните са съгласувани с монотонността на зависимостта доза-отклик, а в други случаи — с точен тест на Фишер с корекция на Бонферони-Холм.
|
|
66.
|
Значимото въздействие от третирането за етапа на развитие се определя с прилагане на теста на Йонкхере-Терпстра със стъпка назад, който се прилага за медианите в повторенията. Като алтернативна възможност, и за предпочитане, за определянето на въздействието следва да се използва тест за данни с полиномно разпределение на Йонкхере от 20-я to the 80-я процентил, тъй като с него се вземат предвид промените в профила на разпределението.
|
|
67.
|
Подходящият обект за анализ е повторението, поради което данните се състоят от медиани в повторенията, ако се използва тестът на Йонкхере-Терпстра или U-тестът на Ман-Уитни, или от средни в повторенията, ако се използва тестът на Дънет. Монотонната зависимост доза-отклик може да бъде оценена визуално от средните или медианите в контролите и третираните групи, или от формализирани тестове като описаните по-горе (11). При по-малко от пет повторения на третиране или на контрола следва да се използват точните версии на тестовете на Йонкхере-Терпстра и на Ман-Уитни, ако са налични. Статистическата значимост на всички посочени тестове се преценява на 0,05 ниво на значимост.
|
|
68.
|
Фигура 4 представлява схема за извършване на статистически тестове на непрекъснати данни.
Фигура 4.
Схема за статистически подходи при отклик с непрекъснати данни.

|
Специални съображения, свързани с анализ на данните
Използване на изложени на риск нива на третиране
|
69.
|
При определяне дали дадено повторение или цяло третиране показва ясно изразена токсичност и следва да бъде отстранено от анализа, са взети предвид няколко фактора. Ясно изразената токсичност се определя като > 2 случая на смъртност в някое от повторенията, които могат да се обяснят само с токсичност вместо с техническа грешка. Други признаци на ясно изразена токсичност включват кръвоизлив, необичайно поведение, необичайни начини на плуване, анорексия и други клинични признаци на заболяване. За сублетални признаци на токсичност могат да бъдат необходими качествени оценки, при които винаги трябва да се прави позоваване на контролната група на чиста вода.
|
Контроли на разтворител
|
70.
|
Използването на разтворител следва да се разглежда само като крайна мярка, след като са разгледани всички други възможности за прилагане на химикала. Ако се използва разтворител, тогава съгласувано с това се провежда изпитване на контрола на чиста вода. При приключване на изпитването следва да се направи оценка на възможното въздействие на разтворителя. Това се прави чрез статистическо сравнение на контролната група на разтворител с контролната група на чиста вода. Най-важните крайни точки за разглеждане в посочения анализ са етапът на развитие, SVL и мокрото тегло, тъй като те могат да бъдат засегнати чрез токсичност, различна от тиреоидната. Ако са открити значими от статистическа гледна точка разлики между контролните групи на чиста вода и на разтворител, крайните точки на изследването за измерване на отклика се определят с използване на контролата на чиста вода. Ако няма значими от статистическа гледна точка разлики между контролните групи на чиста вода и на разтворител по отношение на никоя от измерваните зависими променливи, крайните точки на изследването за измерване на отклика се определят с използване на обединените контроли на вода за разреждане и на разтворител.
|
Третирани групи, достигнали етап на развитие 60 и повече
|
71.
|
След етап на развитие 60 поповите лъжички показват намаление в размера и теглото поради резорбция на тъканта и поради намаляване на абсолютното съдържание на вода. По този начин измерванията на мокро тегло и SVL не могат да бъдат използвани по подходящ начин в статистически анализи за различия в скоростите на растеж. Следователно, данните за мокро тегло и дължинаот организми > NF 60 следва да бъдат цензурирани и не могат да се използват при анализи на средни стойности за повторение или медианни стойности за повторение. В анализа на тези свързани с растежа параметри биха могли да се използват два различни подхода.
|
|
72.
|
Един възможен подход е за статистически анализ на мокро тегло и/или SVL да се разглеждат само поповите лъжижки на етап на развитие по-малък или равен на етап 60. Смята се, че този подход предоставя достатъчно устойчива информация относно тежестта на евентуалните въздействия върху растежа, тъй като само малка част от изпитваните индивиди се отстраняват от анализите (≤ 20 %). Ако увеличен брой попови лъжички показва развитие след етап 60 (≥ 20 %) в една или повече от една номинална концентрация, тогава към всички попови лъжички следва да се приложи двуфакторен ANOVA с вложен дизайн за оценка на въздействията върху растежа, дължащи се на третирания с химикала, с едновременно отчитане на напредналия етап на развитие върху растежа. В допълнение 3 са дадени насоки относно двуфакторния ANOVA на теглото и дължината..
|
ЛИТЕРАТУРА
|
(1)
|
OECD (2004) Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 — Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 77, Paris.
|
|
(2)
|
OECD (2007) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 — Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 76. Paris
|
|
(3)
|
OECD (2008) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 92. Paris
|
|
(4)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris
|
|
(5)
|
ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729-96(2002), Philadelpia, PA
|
|
(6)
|
ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay — Xenopus (FETAX). E 1439-98
|
|
(7)
|
Kahl,M.D., Russom,C.L., DeFoe,D.L. & Hammermeister,D.E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, pp. 539-551
|
|
(8)
|
Nieuwkoop,P.D. & Faber,J. (1994) Normal Table of Xenopus laevis. Garland Publishing, New York
|
|
(9)
|
OECD (2007) Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 82. Paris
|
|
(10)
|
Dodd,M.H.I. & Dodd,J.M. (1976) Physiology of Amphibia. Lofts,B. (ed.), Academic Press, New York, pp. 467-599
|
|
(11)
|
OECD (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 54. Paris
|
|
(12)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp.69–92.
|
Допълнение 1
Таблица 1
Условията на опита за 21-дневното изследване за метаморфоза на земноводни
|
Изпитван индивид
|
Ларви на Xenopus laevis
|
|
Първоначален етап на ларвите
|
Етап 51 на Nieuwkoop и Faber
|
|
Период на експозиция:
|
21 дни
|
|
Критерии за подбор на ларви
|
Етап на развитие и обща дължина (по избор)
|
|
Концентрации на изпитване
|
Най-малко 3 концентрации, с диапазон от приблизително един порядък
|
|
Режим на експозиция
|
Проточен (за предпочитане) и/или статичен с обновяване
|
|
Дебит на системата за изпитване
|
25 ml/min (пълна замяна на обема приблизително на всеки 2,7 h)
|
|
Първични крайни точки/ дни на определяне
|
Смъртност
|
Ежедневно
|
|
Етап на развитие
|
D 7 и 21
|
|
Дължина на задни крайници
|
D 7 и 21
|
|
Дължина от върха на муцуната до клоачния отвор
|
D 7 и 21
|
|
Мокро телесно тегло
|
D 7 и 21
|
|
Тиреоидна хистология
|
D 21
|
|
Вода за разреждане/лабораторен контрол
|
Дехлорирана чешмяна вода (филтрувана с въглен) или еквивалентен лабораторен източник
|
|
Гъстота на ларвите
|
20 ларви/съд за изпитване (5 на литър)
|
|
Разтвор за изпитване/съд за изпитване
|
4-10 l (минимум 10-15 cm вода) /съдове от стъкло или от неръждаема стомана (напр. 22,5 cm × 14 cm × 16,5 cm)
|
|
Повторения
|
4 съда за изпитване с повторения/концентрация на изпитване и контрола
|
|
Приемлив процент на смъртност при контролите
|
≤ 10 % на съд за изпитване с повторение
|
|
Фиксиране на щитовидната жлеза
|
Брой фиксирани
|
Всички попови лъжички (първоначално се оценяват 5/повторение)
|
|
Област
|
Главата или цялото тяло
|
|
Течност за фиксиране
|
Фиксатор на Davidson
|
|
Хранене
|
Храни
|
Sera Micron® или равностойна
|
|
Количество/честота
|
Вж. таблица 1 за режима на хранене с използване на Sera Micron®
|
|
Осветление
|
Период на осветеност:
|
12 часа светлина: 12 часа тъмнина
|
|
Интензитет
|
600 до 2 000 lux (измерен на повърхността на водата)
|
|
Температура на водата
|
22° ± 1 °C
|
|
pH
|
6,5—8,5.
|
|
Концентрация на разтворения кислород (DO)
|
> 3,5 mg/l (> 40 % стойността на насищане при равновесие с атмосферния въздух)
|
|
График за пробовземане за химични анализи
|
Веднъж седмично (4 пробовземания/изпитване)
|
Допълнение 2
Таблици за протоколиране за необработени данни и обобщени данни
Таблица 1
Обща информация за изпитвания химикал
|
Информация за изпитвания химикал
|
|
|
Въвеждат се изпитван химикал, мерни единици за концентрацията и третирания
|
|
|
Изпитван химикал:
|
|
|
|
|
Мерни единици за концентрацията:
|
|
|
|
|
Третиране 1
|
|
|
|
|
Третиране 2
|
|
|
|
|
Третиране 3
|
|
|
|
|
Третиране 4
|
|
|
|
|
|
|
|
|
|
Дата (ден 0)
|
|
Въведете дата (мм/дд/гг)
|
|
|
Дата (ден 7)
|
|
Въведете дата (мм/дд/гг)
|
|
|
Дата (ден 21)
|
|
Въведете дата (мм/дд/гг)
|
Таблица 2
Листове за събиране на необработени данни за дни 7 и 21
|
ДЕН X
ДАТА 00/00/00
|
|
|
Концентрация
|
Номер на третирането
|
Номер на повторението
|
Индивидуален номер
|
Индивидуален идентификатор
|
Етап на развитие
|
SVL (дължина в mm)
|
Дължина на задни крайници (mm)
|
Мокро тегло на целия организъм (mg)
|
|
ROW
|
TRT
|
TRT#
|
REP
|
IND
|
ID#
|
STAGE
|
BL
|
HLL
|
WEIGHT
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Таблица 3
Изчислени обобщения на данни за крайни точки от дни 7 и 21
|
|
|
Етап на развитие
|
SVL (mm)
|
Дължина на задни крайници (mm)
|
Тегло (mg)
|
|
ТРЕТ
|
ПОВТ
|
МИН
|
МЕДИАН
|
МАКС
|
СРЕД
|
СТД ОТКЛ
|
СРЕД
|
СТД ОТКЛ
|
СРЕД
|
СТД ОТКЛ
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Забележка: Изчисленията в клетките са свързани с данните, въведени в таблица 2.
|
Таблица 4
Ежедневни данни за смъртността
|
Ден от изпитването
|
Дата
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Брой в повторения
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Брой в третирания
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Забележка: Изчисленията в клетките са свързани с данните, въведени в таблица 1.
|
Таблица 5
Критерии за качеството на водата
Система на експозиция (проточна/статична с обновяване):
Температура:
Светлинен интензитет:
Цикъл светлина-тъмнина:
Храни:
Скорост на храненето:
pH на водата:
Концентрация на йод във водата за изпитване:
Таблица 6:
Обобщени химични данни
|
Химично наименование:
|
|
CAS №:
|
|
Ден от изпитването
|
Дата
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Забележка: Изчисленията в клетките са свързани с данните, въведени в таблица 1.
|
Таблица 7
Таблици за протоколиране за основните критерии за хистопатологията
|
Дата:
|
Химикал:
|
|
|
Патолог:
|
|
|
Хипертрофия на щитовидната жлеза
|
Атрофия на щитовидната жлеза
|
Хипертрофия на фоликуларна клетка
|
Хиперплазия на фоликуларна клетка
|
|
Хипертрофия на щитовидната жлеза
|
Атрофия на щитовидната жлеза
|
Хипертрофия на фоликуларна клетка
|
Хиперплазия на фоликуларна клетка
|
|
Контролен индивид ID — повторение 1
|
|
|
|
|
|
Дозиран индивид ID — повторение 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Контролен индивид ID — повторение 2
|
|
|
|
|
|
Дозиран индивид ID — повторение 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Общо:
|
|
|
|
|
Общо:
|
|
|
|
|
|
|
Хипертрофия на щитовидната жлеза
|
Атрофия на щитовидната жлеза
|
Хипертрофия на фоликуларна клетка
|
Хиперплазия на фоликуларна клетка
|
|
|
Хипертрофия на щитовидната жлеза
|
Атрофия на щитовидната жлеза
|
Хипертрофия на фоликуларна клетка
|
Хиперплазия на фоликуларна клетка
|
|
Дозиран индивид ID — повторение 1
|
|
|
|
|
|
Дозиран индивид ID — повторение 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дозиран индивид ID — повторение 2
|
|
|
|
|
|
Дозиран индивид ID — повторение 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Общо:
|
|
|
|
|
Общо:
|
|
|
|
|
Таблица 8:
Допълнителни критерии за хистопатологията
|
Дата:
|
Химикал:
|
|
|
Патолог:
|
|
|
|
|
|
|
|
|
Увеличаване на областта на фоликуларния лумен
|
Намаляване на областта на фоликуларния лумен
|
Увеличаване на областта на фоликуларния лумен
|
Намаляване на областта на фоликуларния лумен
|
|
Контролен индивид ID — повторение 1
|
|
|
|
Дозиран индивид ID — повторение 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Контролен индивид ID — повторение 2
|
|
|
|
Дозиран индивид ID — повторение 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Общо:
|
|
|
Общо:
|
|
|
|
|
Увеличаване на областта на фоликуларния лумен
|
Намаляване на областта на фоликуларния лумен
|
|
|
Увеличаване на областта на фоликуларния лумен
|
Намаляване на областта на фоликуларния лумен
|
|
Дозиран индивид ID — повторение 1
|
|
|
|
Дозиран индивид ID — повторение 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дозиран индивид ID — повторение 2
|
|
|
|
Дозиран индивид ID — повторение 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Общо:
|
|
|
Общо:
|
|
|
Таблица 9
Текстово описание на хистопатологичните находки
|
Дата:
|
|
Химикал:
|
|
Патолог:
|
|
|
Подробно описание
|
|
Контролен индивид ID — повторение 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Контролен индивид ID — повторение 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дозиран индивид ID — повторение 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дозиран индивид ID — повторение 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дозиран индивид ID — повторение 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дозиран индивид ID — повторение 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дозиран индивид ID — повторение 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дозиран индивид ID — повторение 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 10
Образец на таблица за протоколиране на обобщени данни за ден × (7 или 21) от ИМЗ
|
|
|
Контрола
|
Доза 1
|
Доза 2
|
Доза 3
|
|
Крайна точка
|
Повторение
|
Средна
|
SD
|
CV
|
N
|
Средна
|
SD
|
CV
|
N
|
p-стойност
|
Средна
|
SD
|
CV
|
N
|
p-стойност
|
Средна
|
SD
|
CV
|
N
|
p-стойност
|
|
Дължина на задни крайници Дължина
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Средна:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SVL
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Средна:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мокро тегло
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Средна:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 11
Образец на таблица за протоколиране на обобщени данни за ден x (7 или 21) данни от ИМЗ за етапа на развитие
|
|
|
Контрола
|
Доза 1
|
Доза 2
|
Доза 3
|
|
|
Повторение
|
Медиана
|
Мин.
|
Макс.
|
N
|
Медиана
|
Минимална
|
Макс.
|
N
|
p-стойност
|
Медиана
|
Мин.
|
Макс.
|
N
|
p-стойност
|
Медиана
|
Мин.
|
Макс.
|
Медиана
|
p-стойност
|
|
Етап на развитие
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Средна:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Допълнение 3
Алтернативен Анализ на тегло и дължина в случай на напреднал етап на развитие при над 20 % от поповите лъжички при една или повече от една концентрация
Ако увеличен брой попови лъжички показват развитие след етап 60 (≥ 20 %) в една или повече от една номинална концентрация, тогава към всички попови лъжички следва да се приложи двуфакторен ANOVA с вложен дизайн за оценка на въздействията върху растежа, дължащи се на третирания с химикала, с едновременно отчитане на напредналия етап на развитие върху растежа.
Предложението е да се използват всички данни, но да се вземе предвид въздействието на напредналия етап на развитие. Това може да се постигне с помощта на двуфакторен ANOVA с вложен дизайн. За даден индивид се определя НапрЕтап = „Да“, ако неговият етап на развитие е равен на 61 или е по-голям. В противен случай се определя НапрЕтап = „Не“. След това може да бъде извършен двуфакторен ANOVA с концентрация и НапрЕтап и тяхното взаимодействие, с Повт(Конц) случаен фактор и Поповалъжичка(Повт) друго случайно въздействие. Това все още третира Повт като обект за анализ и дава по същество същите резултати като претегления анализ на средните на Повт*НапрЕтап, с тегло броят на животните в една средна. Ако данните не съответстват на изискванията на ANOVA за нормалност или хомогенност на дисперсията, тогава може да бъде направено преобразование за нормализация чрез подреждане по рангова скала за отстраняване на тази пречка.
В допълнение към стандартните ANOVA с използване на F-отношения за въздействието на Конц, НапрЕтап и техните взаимодействия, тестът с F-отношения за взаимодействието може да бъде „разделен“ на два допълнителни ANOVA с използване на F-отношения, единият третиращ средните стойности на отклиците при концентрациите за НапрЕтап = „Не“, а другият третиращ средните стойности на отклиците при концентрациите за НапрЕтап = „Да“. Последващите сравнения на средните при третиранията с тези при контролата се извършват в рамките на всяко ниво на НапрЕтап. Може да се извърши трендов анализ с използване на подходящи контрасти или обикновени сравнения по двойки, ако има доказателства за немонотонна зависимост доза-отклик в рамките на ниво на променлива от НапрЕтап. Корекция на Бонферони-Холм на р-стойностите се прави само ако съответният от двата „разделени“ допълнителни ANOVA F-теста не е значим. Това може да бъде извършено с помощта на SAS и, вероятно, на други статистически софтуерни пакети. Усложнения могат да възникнат, когато при някои концентрации няма индивиди в напреднал етап на развитие, но тези ситуации могат да бъдат третирани по ясен начин.
Допълнение 4
Определения
Химикал
: Вещество или смес
Изпитван химикал: Всяко вещество или смес, изпитвано(а) чрез използването на настоящия метод за изпитване.
В.39. ИЗПИТВАНЕ ЗА РАЗМНОЖАВАНЕ НА КОЛЕМБОЛИ В ПОЧВАТА
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 232 (2009). Настоящият метод за изпитване е предназначен за оценка на въздействието на химикали върху репродуктивната способност на колемболи в почвата. Той се основава на съществуващи процедури (1) (2). Видът Folsomia candida с партеногенетично размножаване и видът Folsomia fimetaria с полово размножаване са два от най-достъпните видове от разред Collembola, те също така могат да бъдат отглеждани и са достъпни в търговската мрежа. Когато трябва да бъдат оценявани определени местообитания, в които двата вида не се срещат, процедурата може да се разшири и към други видове от разред Collembola, ако с тях могат да бъдат изпълнени критериите за валидност на теста.
|
|
2.
|
Обитаващите почвата колемболи са екологично значими видове за екотоксикологични изпитвания. Колемболите са шестокраки, с тънък екзоскелет, силно пропусклив по отношение на въздух и вода, и представляват видове от тип Членестоноги с начин и дози на експозиция, различни от тези на земните червеи и енхитреидите.
|
|
3.
|
Гъстотата на популацията на Collembola обикновено достига до 105 m– 2 в почвата и падналата листна маса в много сухоземни екосистеми (3) (4). Полово зрелите индивиди обикновено са с размери 0,5-5 mm, техният дял от общата биомаса и дишането на почвената фауна е малък, оценява се между 1 % и 5 % (5). Следователно тяхната най-важна роля може да бъде като потенциални регулатори на процесите чрез хранене с микроорганизми и хищничество по отношение на микрофауната. Колемболите са жертви за широк спектър от безгръбначни, живеещи под земята и по повърхността на земята, като например акари, стоножки, паяци, бръмбари от сем. Бегачи и късокрили бръмбари. Колемболите допринасят за процесите на разграждане в кисели почви, в които те могат да бъдат най-важните почвени безгръбначни освен енхитреидите, тъй като земни червеи и стоножки обикновено липсват.
|
|
4.
|
F. fimetaria е разпространен в целия свят и се среща често в няколко вида почви, които варират от песъкливи (рохкав пясък) до глинесто-песъкливо-праховити и от алкални до кисели почви. Този вид колембола е непигментиран и без очи. Споменава се в селскостопански почви в цяла Европа (6). Всеяден е, като включва в храната си и гъбни хифи, бактерии, протозоа и детрит. Чрез паша взаимодейства с инфекции на патогенни гъбички по растенията (7) и може да влияе на микоризата, както е известно за F. candida. Като повечето видове колемболи се размножава полово, изисквайки постоянно присъствие на мъжки за оплождането на яйцата.
|
|
5.
|
F. candida също е разпространен в целия свят. Въпреки че не е обичаен за повечето естествени почви, той често е с много висока численост в богати на хумус почви. Този вид колембола е непигментиран и без очи. Има добре развита скакателна вилка (орган за скачане) и активни движения, свързани с бягане, и скача лесно, ако бъде обезпокоен. Екологичната роля на F. candida е сходна с ролята на F. fimetaria, но местообитанията са по-богати на органична материя почви. Тя възпроизвежда партеногенетично. Мъжките могат да се срещат в съотношение, по-малко от 1 на хиляда.
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
6.
|
Синхронни полово зрели (F. fimetaria) или ювенилни (F. candida) колемболи се експонират на диапазон от концентрации на изпитвания химикал, размесен в модифицирана изкуствена почва (8), с използване на 5 % съдържание на органична материя (или алтернативна почва). Сценарият на изпитването може да бъде разделен на две стъпки:
|
—
|
изпитване за определяне на обхвата, в случай че не е налична достатъчно информация относно токсичността, като в него смъртността и размножението са основните крайни точки, които се оценят след 2 седмици за F. fimetaria и 3 седмици за F. candida.
|
|
—
|
Окончателно изпитване за размножаването, в което се оценяват общият брой на ювенилните индивиди, получени от родителски индивиди, и преживяването на родителските животни. Продължителността на това окончателно изпитване е 3 седмици за F. fimetaria или 4 седмици за F. candida.
|
Токсичното въздействие на изпитвания химикал върху смъртността при полово зрелите индивиди и върху репродуктивната способност се изразява като LCx и ECx чрез изглаждането на данните към подходящ модел на данните чрез нелинейна регресия, за да се оцени концентрацията, която би причинила съответно х % смъртност или намаляване на репродуктивната способност, или алтернативно като NOEC/LOEC стойност (9).
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНИЯ ХИМИКАЛ
|
7.
|
Предпочита се да са известни физичните свойства, разтворимостта във вода, log Kow, коефициентът на разпределение почва-вода и парното налягане на изпитвания химикал. Желателно е да е налична допълнителна информация относно съдбата на изпитвания химикал в почвата, като например скоростите на фотолизата, хидролизата и биотичното разграждане. Химичната идентификация на изпитвания химикал според номенклатурата на IUPAC, номер по CAS, партида, пратка, структурна формула и чистота следва да бъдат документирани, когато са налични.
|
|
8.
|
Този метод за изпитване може да се използва за разтворими във вода и неразтворими химикали. Начините на прилагане на изпитвания химикал обаче съответно ще се различават. Методът за изпитване е неприложим за летливи химикали, т.е., химикали, за които константата на Хенри или коефициентът на разпределение въздух-вода е по-голям от единица, или за химикали, при които парното налягане превишава 0,0133 Pa при 25 °С.
|
ВАЛИДНОСТ НА ИЗПИТВАНЕТО
|
9.
|
Следните критерии трябва да бъдат изпълнени при нетретираните контроли, за да се счита за валиден даден резултат от изпитването:
|
—
|
Средна смъртност сред полово зрелите индивиди не трябва да надвишава 20 % в края на изпитването;
|
|
—
|
Средният брой на ювенилните индивиди на съд следва да бъде най-малко 100 в края на изпитването;
|
|
—
|
Коефициентът на вариация, изчислен за броя на ювенилните индивиди, не трябва да е по-малък от 30 % в края на окончателното изпитване.
|
|
РЕФЕРЕНТЕН ХИМИКАЛ
|
10.
|
Референтният химикал трябва да бъде изпитан при своята ЕС50 концентрация за избрания тип почва за изпитване — или на редовни интервали от време, или евентуално да бъде включен във всяко отделно провеждане на изпитване, за да се провери дали откликът на изпитваните организми в системата за изпитване е в рамките на нормалното равнище. Подходящ референтен химикал е борната киселина, която следва да намали размножаването с 50 % (10) (11) при около 100 mg/kg сухо тегло почва и за двата вида.
|
ОПИСАНИЕ НА ИЗПИТВАНЕТО
Съдове и оборудване за изпитването
|
11.
|
Контейнери, в които може да бъде поставена 30 g влажна почва, са подходящи съдове за провеждане на изпитването. Материалът следва да бъде стъкло или инертна пластмаса (нетоксична). Независимо от това, използването на пластмасови контейнери следва да се избягва, ако експозицията на изпитвания химикал намалява поради сорбция. Съдовете за изпитването трябва да имат минимална площ на напречното сечение, позволяваща действителната дълбочина на почвата в съдовете за изпитване да бъде 2-4 cm. Съдовете следва да са с прозрачни капаци (напр. стъкло или полиетилен), които са разработени така, че да намаляват изпаряването на водата, като същевременно дават възможност за газообмен между почвата и атмосферата. Контейнерът следва да бъде най-малко частично прозрачен, за да се позволи пропускането на светлина.
|
|
12.
|
Необходимо е обикновено лабораторно оборудване, по-специално следното:
|
—
|
подходящо оборудване за контрол на температурата;
|
|
—
|
подходящо оборудване за контрол на влажността на въздуха (не е от съществено значение, ако съдовете за експозицията са покрити с капачки);
|
|
—
|
инкубатор с контролирана температура или малко помещение;
|
|
—
|
щипци или смукателно устройство със слаба тяга.
|
|
Приготвяне на почвата за изпитването
|
13.
|
Използва се модифицирана изкуствена почва (8), с 5 % съдържание на органична материя. Като алтернатива може да се използва естествена почва, тъй като изкуствената почва не наподобява естествените почви. Препоръчителният състав на изкуствената почва е, както следва (на базата на сухо тегло, изсушена до постоянно тегло при температура 105 °C):
|
—
|
5 % торфен мъх, изсушен на въздух и фино смлян (размер на частиците от 2 ± 1 mm е приемливо);
|
|
—
|
20 % каолин (за предпочитане съдържанието на каолинит да е над 30 %);
|
|
—
|
приблизително 74 % промишлен пясък, изсушен на въздух (в зависимост от количеството на необходимия CaCO3), предимно фин пясък с над 50 % от частиците между 50 и 200 микрона. Точното количество пясък зависи от количеството на CaCO3 (вж. по-долу), заедно те следва да доведат до 75 %.
|
|
—
|
1,0 % калциев карбонат (CaCO3 на прах, с квалификация „чист“) за получаване на pH, равно на 6,0 ± 0,5; количеството на калциевия карбонат за добавяне може да зависи основно от качеството/естеството на торфа (вж. Забележка 1).
|
Забележка 1: Изискваното количество CaCO3 ще зависи от съставките на почвения субстрат и следва да бъде определено чрез измерване на pH на предварително инкубирани влажни почвени подпроби непосредствено преди изпитването (14).
Забележка 2: Препоръчва се да се измерва pH и, по избор, съотношението C/N, катионообменният капацитет (CEC) и съдържанието на органична материя в почвата, за да се даде възможност за нормализация на по-късен етап и за по-добро тълкуване на резултатите.
Забележка 3: Ако се изисква, например за конкретни цели на изпитвания, естествените почви от незамърсени източници също могат да бъдат използвани като субстрат за изпитванията и/или за отглеждане. Независимо от това, ако се използва естествена почва, тя следва да бъде характеризирана най-малко по отношение на произхода (място, от което е взета), рН, текстура (зърнометричен състав), CEC и съдържание на органична материя и трябва да не съдържа никакво замърсяване. За естествените почви е препоръчително да се докаже тяхната годност за изпитване и за постигане на критериите за валидност на изпитването, преди използването на почвата в окончателно изпитване.
|
|
14.
|
Сухите съставки на почвата се смесват старателно (напр. в голямо лабораторно устройство за смесване). Максималната способност за задържане на вода (СЗВ) на изкуствената почва се определя в съответствие с процедурите, описани в допълнение 5. Съдържанието на влага на почвата за изпитване следва да бъде оптимизирано, за да се постигнат сипкава пореста почвена структура, която дава възможност за навлизане на колемболите в порите. Това обикновено е между 40 и 60 % от максималната СЗВ.
|
|
15.
|
Сухата изкуствена почва е предварително навлажнена в достатъчна степен чрез добавяне на дейонизирана вода, за получаване на приблизително половината от крайното съдържание на вода 2-7 дни преди започване на изпитването, за да се достигне равновесие при киселинността/да се стабилизира киселинността. За определянето на рН се използва смес от почва и разтвор на 1 М калиев хлорид (KCl) или 0,01 M калциев хлорид (CaCl2) в съотношение 1:5 (съгласно допълнение 6). Ако почвата е по-киселинна от изисквания диапазон, може да бъде коригирана чрез добавяне на подходящо количество CaCO3. Ако почвата е твърде алкална, може да се коригира чрез добавяне на неорганична киселина, която е безвредна за колемболите.
|
|
16.
|
Предварително навлажнената почва се разделя на части, съответстващи на броя изпитвани концентрации (и референтен химикал, когато е целесъобразно) и контроли. Изпитваните химикали се добавят и съдържанието на вода се регулира съгласно точка 24.
|
Избор и приготвяне на изпитваните животински видове
|
17.
|
Видът Folsomia candida с партеногенетично размножаване се препоръчва, тъй като по време на кръговото изпитване на метода за изпитване (11) при този вид критериите за валидност за преживяване са били изпълнени по-често, отколкото при F. fimetaria. Ако се използва друг вид, той следва да отговаря на критериите за валидност, посочени в точка 9. В началото на изпитването животните следва да бъдат добре нахранени и на възраст между 23-26 дни за F. fimetaria и 9-12 дни за F. candida. За всяко повторение броят на F. fimetaria следва да бъде 10 мъжки и 10 женски индивида, а за F. candida трябва да бъдат използвани 10 женски (вж. допълнение 2 и допълнение 3). Синхронните индивиди се избират на случаен принцип от блюдата и тяхното здраве и физическо състояние се проверяват за всяка партида, която се добавя към повторение. Всяка група от 10/20 индивида се добавя към случайно подбран съд за изпитване и се избират големите женски от F. fimetaria, така че да гарантират правилното разграничаване от мъжките от F. fimetaria.
|
Приготвяне на концентрации за изпитване
|
18.
|
Могат да се използват четири метода за прилагане на изпитвания химикал: 1) смесване на изпитвания химикал в почвата с вода като носител, 2) смесване на изпитвания химикал в почвата с органичен разтворител като носител, 3) смесване на изпитвания химикал в почвата с пясък като носител, или 4) прилагане на изпитвания химикал върху повърхността на почвата. Изборът на подходящ метод зависи от характеристиките на химикала и от целта на изпитването. Като цяло се препоръчва смесване на изпитвания химикал в почвата. Независимо от това, може да се изискват процедури на прилагане, които са в съответствие с практическата употреба на изпитвания химикал (например пръскане на течна формулировка или употреба на специфични пестицидни формулировки, като например гранули или продукти за третиране на семена). Почвата се третира преди добавянето на колемболите, дава се възможност на колемболите да навлезат в почвата, освен когато изпитваният химикал се добавя към повърхността на почвата.
|
Разтворим във вода изпитван химикал
|
19.
|
Разтвор на изпитвания химикал се приготвя в дейонизирана вода в количество, достатъчно за всички повторения на една концентрация за изпитване. Всеки разтвор на изпитвания химикал се смесва грижливо с една партида предварително навлажнена почва, преди да бъде внесен в съда за изпитване.
|
Неразтворим във вода изпитван химикал
|
20.
|
За неразтворимите във вода, но разтворими в органични разтворители химикали, изпитваният химикал може да бъде разтворен във възможно най-малкия обем подходящ носител (напр. ацетон), който все още гарантира доброто размесване на химикала с почвата, и да бъде смесен с част от необходимия кварцов пясък. Следва да се използват само летливи разтворители. Когато се използва органичен разтворител, всички изпитвани концентрации и допълнителната отрицателна контрола на разтворител трябва да съдържат еднакво минимално количество от разтворителя. Контейнерите за прилагането трябва да се оставят непокрити за определен период от време, за да се даде възможност на разтворителя, свързан с прилагането на изпитвания химикал, да се изпари, като се гарантира неразпръскване на токсичния химикал през този период.
|
Изпитван химикал, малко разтворим във вода и органични разтворители
|
21.
|
За малко разтворимите във вода и в органични разтворители химикали, кварцов пясък, който следва да е част от общото добавено в почвата количество пясък, се смесва с количеството изпитван химикал, така че да се получи желаната концентрация за изпитването. Сместа от кварцов пясък и изпитван химикал се добавя в предварително навлажнената почва и старателно се смесва, след добавяне на подходящо количество дейонизирана вода, за да се получи необходимото съдържание на влага. Крайната смес се разпределя между съдовете за изпитване. Процедурата се повтаря за всяка концентрация за изпитване, като се приготвя и подходяща контрола.
|
Прилагане на изпитвания химикал към повърхността на почвата
|
22.
|
Когато изпитваният химикал е пестицид, може да е уместно същият да се прилага към повърхността на почвата чрез пръскане. Почвата се третира след добавянето на колемболите. Отначало изпитваните съдове се запълват с овлажнения почвен субстрат, след това се добавят индивидите, след което се претеглят изпитваните съдове. С цел да се избегне всякаква директна експозиция на индивидите на изпитвания химикал чрез пряк контакт, изпитваният химикал се прилага най-малко половин час след въвеждането на колемболите. Изпитваният химикал следва да се приложи към повърхността на почвата колкото се може по-равномерно, като се използва подходящо лабораторно устройство за пръскане с цел симулиране на прилагане чрез пръскане в полеви условия. Прилагането следва да се извършва при температура с вариране в рамките на ± 2 °C и, за водни разтвори, емулсии или дисперсии, с количество прилагана вода между 600 и 800 l/m2 според препоръките от оценката на риска. Количеството следва да се проверява с използване на подходяща техника за калибриране. Специалните формулировки, като гранули или продукти за третиране на семена, могат да се прилагат по начин, съответстващ на използването им в селското стопанство. Храната се добавя след пръскането.
|
ПРОЦЕДУРА
Условия на изпитването
|
23.
|
Средната температурата на изпитването следва да е 20 ± 1 °C с температурен диапазон 20 ± 2 °C. Изпитването се провежда при контролирани цикли светлина-тъмнина (за предпочитане 12 часа светлина и 12 часа тъмнина) с осветление от 400 до 800 lux в зоната на съдовете за изпитване.
|
|
24.
|
С цел проверка на влажността на почвата, съдовете се претеглят в началото, в средата и в края на изпитването. Загуба на тегло > 2 % се компенсира чрез добавяне на дейонизирана вода. Следва да се отбележи, че загубата на вода може да се намали чрез поддържане на висока влажност на въздуха в инкубатора за изпитване (> 80 %).
|
|
25.
|
Стойността на pH трябва да се измери в началото и в края както на изпитването за определяне на обхвата, така и на окончателното изпитване. Измерванията трябва да се извършват в една допълнителна контролна проба и една допълнителна проба от третираните почвени проби (всички концентрации), подготвени и поддържани по същия начин като изпитваните култури, но несъдържащи колемболи.
|
Процедура на изпитването и измервания
|
26.
|
За всяка тествана концентрация за изпитване количество почва за изпитване, съответстващо на 30 g мокро тегло, се поставя в съда за изпитване. Приготвят се и контролите на вода, без изпитвания химикал. Ако за прилагане на изпитвания химикал се използва носител, една поредица контроли, съдържащи само носителя, следва да бъдат включени допълнително към изпитваните поредици. Концентрацията на разтворителя или на диспергиращото средство следва да е същата, като използваната в съдовете за изпитване, съдържащи изпитвания химикал.
|
|
27.
|
Отделните колемболи внимателно се прехвърлят във всеки съд за изпитване (разпределени по изпитвателните съдове на случаен принцип) и се поставят върху повърхността на почвата. За ефикасно прехвърляне на животните може да се използва смукателно устройство със слаба тяга. Броят на повторенията за концентрациите за изпитване и за контролите зависи от използвания план за изпитването. Съдовете за изпитване се поставят в инкубатор за изпитване на случаен принцип и тези позиции се разместват веднъж седмично, също на случаен принцип.
|
|
28.
|
За изпитване на F. fimetaria броят им на съд за изпитване следва да бъде 10 мъжки и 10 женски индивида на възраст 23-26 дена. В ден 21 колемболите се извличат от почвата и се преброяват. При F. fimetaria полът се разпознава по размера в партидата от синхронизирани индивиди, използвана при изпитването. Женските индивиди са значително по-големи от мъжките (вж. допълнение 3)
|
|
29.
|
За изпитване на F. candida следва на съд за изпитване да се използват десет ювенилни индивида на възраст 9-12 дни. В ден 28 колемболите се извличат от почвата и се преброяват.
|
|
30.
|
Като подходящ източник на храна към всеки съд се добавя, в началото на теста и след около 2 седмици, достатъчно количество, например 2-10 mg гранулирана изсушена хлебна мая, достъпна в търговската мрежа и предназначена за домашна употреба.
|
|
31.
|
В края на изпитването се оценяват смъртността и размножаването. След 3 седмици (F. fimetaria) или 4 седмици (F. candida) колемболите се извличат от почвата за изпитване (виж допълнение 4) и се преброяват (12). Дадена колембола се записва като мъртва, ако не е налична след извличането. Методът за извличане и преброяване следва да бъде валидиран. Валидността предполага по-голяма от 95 % ефикасност на извличането на ювенилни екземпляри,, определяна например чрез добавяне на точно известен брой в почвата.
|
|
32.
|
Практично обобщение и график за провеждането на процедурата за изпитване са описани в приложение 2.
|
Планиране на изпитването
Изпитване за определяне на обхвата
|
33.
|
Когато е необходимо, се провежда изпитване за определяне на обхвата, например за пет концентрации на изпитвания химикал от 0,1, 1,0, 10, 100 и 1 000 mg/kg сухо тегло на почвата и две повторения за всяко третиране и контрола. Допълнителна информация върху смъртността или размножаването на Collembola, получена от изпитвания с аналогични химикали или от литературата, може също да бъде полезна при вземането на решение за диапазона на концентрациите, които да се използват при изпитването за определяне на обхвата.
|
|
34.
|
Продължителността на изпитването за определяне на обхвата е две седмици за F. fimetaria и 3 седмици за F. candida, за да се гарантира, че са получени ювенилни екземпляри от едно люпило. В края на изпитването се оценяват смъртността и размножаването на Collembola. Броят на полово зрелите и срещането на ювенилни екземпляри трябва да бъдат записани.
|
Окончателно изпитване
|
35.
|
За определяне на ECx (напр. EC10, EC50) следва да се изпитат дванадесет концентрации. Препоръчват се най-малко две повторения за всяко третиране с концентрация на изпитване и шест контролни повторения. Кратността на разделянето може да варира в зависимост от зависимостта доза-отклик.
|
|
36.
|
За определяне на NOEC/LOEC следва да се изпитат най-малко пет концентрации в геометрична прогресия. Препоръчват се четири повторения за всяко третиране с концентрация на изпитване, плюс осем контроли. Концентрациите трябва да бъдат разделени една от друга с кратност, която не превишава 1,8.
|
|
37.
|
Комбиниран подход дава възможност за едновременно определяне на NOEC/LOEC и ЕСх. За този комбиниран подход следва да бъдат използвани осем концентрации на третиране в геометрична прогресия. Препоръчват се четири повторения за всяко третиране, плюс осем контроли. Концентрациите трябва да бъдат разделени една от друга с кратност, която не превишава 1,8.
|
|
38.
|
Ако при изпитването за определяне на обхвата не се наблюдават въздействия при най-високата концентрация (т.е. 1 000 mg/kg), изпитването за размножаването следва да бъде проведено като гранично изпитване, като се използват концентрация на изпитване от 1 000 mg/kg и контролата. Гранично изпитване ще предостави възможност да се демонстрира, че няма статистически значимо въздействие при пределната концентрация. По осем повторения следва да се използват както за третираната почва, така и за контролата.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
39.
|
Репродуктивната способност е основната крайна точка (напр. брой ювенилни екземпляри, получени на съд за изпитване). Статистическият анализ, напр. ANOVA процедури, сравнява третиранията с t-тест на Стюдънт, тест на Дънет или тест на Уйлямс. За индивидуалните средни от третиране се изчисляват доверителни интервали от 95 %.
|
|
40.
|
Броят на преживелите полово зрели индивиди в нетретираните контроли е основен критерий за валидност и трябва да бъде документиран. Също както и при изпитването за определяне на обхвата, всички други признаци за неблагоприятно въздействие трябва да бъдат протоколирани и в окончателния протокол.
|
LCx и ECx
|
41.
|
Стойностите на ECx, включително свързаните с тях долни и горни 95 %-ни доверителни граници за параметъра, се изчисляват с помощта на подходящи статистически методи (например логистична функция или функция на Вейбул, метод на Спирмън-Карбър с изключване на данни, или обикновена интерполация). Стойност на ECx се получава чрез добавяне на стойност, съответстваща на x % от средната стойност на контролна проба в уравнението. За изчисляване на EC50 или всяка друга стойност ECx, пълният набор от данни (x) следва да бъде подложен на регресионен анализ. LC50 обикновено се оценява с пробит-анализ или подобен анализ, който отчита биномно разпределените данни за смъртността.
|
NOEC/LOEC
|
42.
|
Ако със статистическия анализ се цели определяне на NOEC/LOEC, необходими са статистики за всеки отделен съд (индивидуалните съдове се разглеждат като повторения). Трябва да се използват подходящи статистически методи (съгласно документ на ОИСР № 54 „Съвременни подходи за статистически анализ на данни за екотоксичност: ръководство за прилагане“ (9). По принцип неблагоприятните въздействия на изпитвания химикал в сравнение с контролата се проучват чрез тестване на едностранна хипотеза при p ≤ 0,05.
|
|
43.
|
Нормалното разпределение и хомогенността на дисперсията могат да бъдат тествани с помощта на подходящ статистически тест, напр. съответно тест на Шапиро-Уилк и тест на Левин (p ≤ 0,05). Може да бъде извършен еднофакторен дисперсионен анализ (ANOVA) с последващи множествени сравнения. За изчисляване дали са налице статистически значими разлики (p ≤ 0,05) между контролите и различните концентрации на изпитвания химикал могат да се използват множествени сравнения (например тест на Дънет) или трендови тестове със стъпка назад (напр. тест на Уйлямс) ( (избор на препоръчителния тест в съответствие с документ № 54 на ОИСР (9)). В противен случай за определяне на NOEC и LOEC могат да се използват непараметрични методи (напр. U-тест на Бонферони по Holm или трендов тест на Йонкхере-Терпстра).
|
Гранично изпитване
|
44.
|
Ако е извършено гранично изпитване (сравнение на контрола и само на едно третиране) и са изпълнени критериите за използване на параметрични тестови процедури (нормалност, хомогенност), метричните отклици могат да бъдат оценени чрез тест на Стюдънт (t-тест). Ако тези критерии не са изпълнени, може да се използва t-тест за нееднаква дисперсия (t-тест на Уелч) или непараметричен тест, напр. U-тест на Ман-Уитни.
|
|
45.
|
За установяване на значими разлики между контролите (контрола и контрола на разтворител), повторенията на всяка контрола могат да се изпитват както е описано при граничното изпитване. Ако при тези изпитвания не бъдат установени значими разлики, всички повторения на контроли и контроли на разтворител могат да бъдат обединени. В противен случай всички третирания следва да бъдат сравнявани с контролата на разтворител.
|
Протокол от изпитването
|
46.
|
Протоколът от изпитването следва да включва най-малко следната информация:
|
|
Изпитван химикал
|
—
|
идентичността на изпитвания химикал, партида, пратка и номер по CAS, чистота;
|
|
—
|
физични и химични свойства на изпитвания химикал (напр. log Kow, разтворимост във вода, парно налягане, константа на Хенри (H) и, за предпочитане, информация относно съдбата на изпитвания химикал в почвата), ако са налични;
|
|
—
|
формулирането на изпитвания химикал и добавките следва да бъде уточнено, ако не се изпитва чистият химикал;
|
|
|
|
Изпитвани организми
|
—
|
идентификация на животинския вид и доставчика на изпитваните организми, описание на условията за размножаване и възрастовия диапазон на изпитваните организми;
|
|
|
|
Условия на изпитването
|
—
|
описание на плана на проучването и на процедурата;
|
|
—
|
подробни данни за приготвянето на почвата за изпитване; подробна спецификация, ако се използва естествена почва (произход, история, зърнометричен състав, pH, съдържание на органична материя)
|
|
—
|
способност на почвата за задържане на вода;
|
|
—
|
описание на техниката, използвана за прилагане на изпитвания химикал към почвата;
|
|
—
|
условия на изпитване: интензитет на светлината, продължителност на циклите светлина-тъмнина, температура;
|
|
—
|
описание на режима на хранене, вида и количество на храната, използвана при изпитването, дати на хранене;
|
|
—
|
стойност на рН и съдържание на вода в почвата в началото и в края на изпитването (контрола и всяко третиране);
|
|
—
|
подробно описание на метода на извличане и на ефикасността на извличането;
|
|
|
|
Резултати от изпитването
|
—
|
броят на ювенилните екземпляри, определени във всеки от съдовете за изпитване в края на изпитването;
|
|
—
|
броят на полово зрелите екземпляри и тяхната смъртност ( %), във всеки от съдовете за изпитване в края на изпитването;
|
|
—
|
описание на видими физиологични или патологични симптоми, или явни промени в поведението;
|
|
—
|
резултатите, получени с референтния изпитван химикал;
|
|
—
|
стойностите на NOEC/LOEC, LCx за смъртността и ECx за размножаването (най-вече за LC50, LC10, ЕС50, и ЕС10) заедно с доверителни интервали от 95 %. Графика на изгладения модел, използван за изчисляване, неговите функция и параметри (вж. (9));
|
|
—
|
цялата информация и наблюдения, подпомагащи интерпретирането на резултатите;
|
|
—
|
мощност на действителния тест, ако се използва проверка на хипотеза (9);
|
|
—
|
отклонения от процедурите, описани в настоящия метод за изпитване, и всички необичайни обстоятелства по време на изпитването;
|
|
—
|
валидност на изпитването;
|
|
—
|
за NOEC — когато се изчислява — минималната откриваема разлика.
|
|
|
ЛИТЕРАТУРА
|
(1)
|
Wiles JA and Krogh PH (1998) Testing with the collembolans I. viridis, F. candida and F. fimetaria. In Handbook of soil invertebrate toxicity tests (ed. H Løkke and CAM Van Gestel), pp. 131-156. John Wiley & Sons, Ltd., Chichester
|
|
(2)
|
ISO (1999) Soil Quality — Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. No. 11267. International Organisation for Standardisation, Geneve
|
|
(3)
|
Burges A and Raw F (Eds) (1967) Soil Biology. Academic Press. London
|
|
(4)
|
Petersen H and Luxton M (1982) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287-388
|
|
(5)
|
Petersen H (1994) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111-118
|
|
(6)
|
Hopkin SP (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330pp (ISBN 0-19-854084-1)
|
|
(7)
|
Ulber B (1983) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In New trends in soil Biology (Lebrun Ph, André HM, De Medts A, Grégoire-Wibo, Wauthy G (Eds), Proceedings of the VI. international colloquium on soil zoology, Louvain-la-neuve (Belgium), 30 August-2 September 1982, I Dieu-Brichart, Ottignies-Louvain-la-Neuve, pp. 261-268
|
|
(8)
|
Глава В.36 от настоящото приложение:, Изпитване за размножаване на хищен акар (Hypoaspis (Geolaelaps) aculeifer) в почвата.
|
|
(9)
|
OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006)18, OECD Paris
|
|
(10)
|
Scott-Fordsmand JJ and Krogh PH (2005) Background report on prevalidation of an OECD springtail test guideline. Environmental Project Nr. 986. Miljøstyrelsen 61 pp. Danish Ministry for the Environment.
|
|
(11)
|
Krogh, P.H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danish Environmental Protection Agency, Environmental Project No. 1256, pp. 66.
|
|
(12)
|
Krogh PH, Johansen K and Holmstrup M (1998) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201-205
|
|
(13)
|
Fjellberg A (1980) Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
(14)
|
Edwards C.A. (1955) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan D.K. McE., Ed). Butterworths, London, pp. 412-416
|
|
(15)
|
Goto HE (1960) Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96:138-140.
|
Допълнение 1
Определения
В настоящия метод за изпитване са приложими следните определения (в настоящото изпитване всички ефективни концентрации се изразяват като масата на изпитвания химикал към сухата маса на почвата за изпитване):
|
|
Химикал означава вещество или смес.
|
|
|
Концентрация без наблюдавано въздействие (NOEC) е концентрацията на изпитвания химикал, при която не се наблюдава въздействие. В настоящото изпитване концентрацията, съответстваща на NOEC, няма статистически значимо (р < 0,05) въздействие в рамките на даден период на експозиция, при сравнение с контролата.
|
|
|
LOEC (най-ниската концентрация, при която се наблюдава ефект) е най-ниската концентрация на изпитвания химикал, при която е наблюдавано статистически значимо въздействие (р < 0,05) в рамките на даден период на експозиция, при сравнение с контролата.
|
|
|
ЕСх (ефективна концентрация, при която се наблюдава х % от въздействието) е концентрацията, която причинява х % от дадено въздействие на изпитвани организми в рамките на даден период на експозиция, при сравнение с контрола. Например EC50 е концентрация, за която е направена оценка, че предизвиква дадено въздействие върху изпитвана крайна точка в 50 % от експонираната популация в рамките на определен период на експозиция.
|
|
|
Изпитван химикал е всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
|
Допълнение 2
Основни действия и график за извършване на изпитването на колемболи
Етапите на изпитването могат да бъдат обобщени както следва:
|
Време (ден)
|
Действие
|
|
– 23 до – 26
|
Приготвяне на синхронна култура от F. fimetaria
|
|
– 14
|
Приготвяне на изкуствена почва (смесване на сухи съставки)
Проверка на pH на изкуствена почва и съответно коригиране
Измерване на максималната СЗВ на почвата
|
|
– 9 до – 12
|
Приготвяне на синхронна култура от F. candida
|
|
– 2 до – 7
|
Предварително навлажнена почва
|
|
– 1
|
Разпределяне на ювенилните екземпляри в партиди
Приготвяне на изходни разтвори и прилагане на изпитвания химикал, ако се изисква разтворител
|
|
0
|
Приготвяне на изходни разтвори и прилагане на изпитвания химикал, ако се изисква прилагане на химикал в твърдо състояние, разтворим във вода или прилагане на повърхността.
Измерване на рН на почвата и претегляне на контейнерите.
Добавяне на храна. Въвеждане на колемболите.
|
|
14
|
Изпитване за определяне обхвата за F. fimetaria: Приключване на изпитването, извличане на животните, измерване на pH на почвата и на загубата на вода (тегло)
Окончателни изпитвания: Измерване на съдържанието на влага и допълване на вода, и добавяне на 2-10 mg мая
|
|
21
|
Окончателно изпитване за F. fimetaria: Приключване на изпитването, извличане на животните, измерване на pH на почвата и на загубата на вода (тегло)
Изпитване за определяне обхвата за F. candida: Приключване на изпитването, извличане на животните, измерване на pH на почвата и на загубата на вода (тегло)
|
|
28
|
Окончателно изпитване за F. candida: Приключване на изпитването, извличане на животните, измерване на pH на почвата и на загубата на вода (тегло)
|
Допълнение 3
Насоки за отглеждане и синхронизиране на F. fimetaria и F. candida
Времето и продължителността, дадени в това ръководство, следва да се проверяват за всеки конкретен щам, за да се гарантира, че графикът ще даде възможност за достатъчно на брой синхронизирани ювенилни екземпляри. По принцип яйцеполагането, след прехвърлянето на полово зрелите индивиди на пресен субстрат, и излюпването на яйцата определят подходящия ден за събиране на яйца и за събиране на синхронни ювенилни екземпляри.
За препоръчване е да има постоянна изходна култура, състояща се например от 50 контейнера/блюда на Петри. Изходната култура следва да се захранва добре чрез ежеседмично хранене, добавяне на вода и отстраняване на хранителните остатъци и умрелите индивиди. Ако върху субстрата има прекалено малко колемболи, това може да доведе до потискане поради увеличено развитие на гъбички. Ако изходната култура се използва прекомерно често за получаване на яйца, в нея може да настъпи умора. Признаци на умора са мъртви възрастни индивиди и плесен върху субстрата. Яйцата, останали от получаването на синхронни индивиди, могат да се използват за подмладяване на културата.
В една синхронизирана култура на F. fimetaria мъжките индивиди се разграничават от женските предимно по размер. Мъжките са отчетливо по-малки от женските, и ходът на мъжките е по-бърз от този на женските. Правилният подбор на пола изисква малко практика и може да бъде потвърден с микроскопска инспекция на гениталната област (13).
1. Отглеждане
1.а. Приготвяне на субстрата за отглеждане
Субстратът за отглеждане е парижки гипс (калциев сулфат) с активен въглен. Това осигурява влажен субстрат, като функцията на активния въглен е да абсорбира отпадъчните газове и екскрети (14) (15). За да се улеснят наблюденията над Collembola могат да се използват различни видове въглен. Например при F. candida и F. fimetaria се използва въглен на прах (получава се черен/сив парижки гипс):
Съставки на субстрата:
|
—
|
200 ml дестилирана вода
|
или
|
—
|
50 g активен въглен на прах
|
|
—
|
260-300 ml дестилирана вода
|
Сместа на субстрата се оставя да отлежи преди употреба.
1.б. Размножение
Колемболите се държат в контейнери, като например блюда на Петри (90 mm × 13 mm), с дъно, покрито със слой с дебелина 0,5 cm от субстрат гипс/въглен. Те се отглеждат при 20 ± 1 °C на цикъл светлина-тъмнина 12 на 12 часа (400-800 lux). Контейнерите се съхраняват влажни във всеки един момент, като така се гарантира, че относителната влажност на въздуха в контейнерите е 100 %. Това може да се гарантира от наличието на свободна вода в порестия гипс, но като се избягва получаването на воден слой върху повърхността на гипса. Загубата на вода може да бъде предотвратена чрез осигуряване на влажен въздух от околната среда. Всички мъртви екземпляри трябва да се отстраняват от контейнерите, както и плесенясалата храна. За стимулиране на получаването на яйца е необходимо полово зрелите животни да бъдат прехвърлени в блюда на Петри с новоприготвен субстрат парижки гипс/въглен.
1.в. Източник на храна
Гранулираната сушена хлебна мая се използва като единствен източник на храна както за F. candida, така и за F. fimetaria. Прясна храна се предоставя веднъж или два пъти седмично, за да се избегне плесенясването. Поставя се на купчинка непосредствено върху парижкия гипс. Масата на добавената хлебна мая следва да се регулира според размера на популацията от колемболи, но като общо правило са достатъчни 2-15 mg.
2. Синхронизиране
Изпитването трябва да се провежда със синхронизирани индивиди до получаване на хомогенни изпитвани животни от един и същ стадий и с еднакъв размер. Освен това, синхронизирането позволява разграничаването на мъжките от женските F. fimetaria от възраст 3 седмици и след това, въз основа на половия диморфизъм, т.е., разликите в размера. Процедурата по-долу е предложение за това как да бъдат получени синхронизирани индивиди (практическите стъпки са по избор).
2.а. Синхронизиране.
|
—
|
Подготовка на контейнери с 0,5 cm слой субстрат парижки гипс/въглен.
|
|
—
|
За излюпването на яйцата 150-200 полово зрели F. fimetaria и 50-100 F. candida се прехвърлят от най-добрите 15-20 контейнера с изходната култура със субстрат на възраст 4-8 седмици в контейнерите и се захранват с 15 mg хлебна мая. Избягва се поставянето на ювенилни екземпляри заедно с полово зрелите, тъй като присъствието на ювенилни екземпляри може да потисне получаването на яйца.
|
|
—
|
Културата се държи при 20 ± 1 °C (средната стойност следва да е 20 °C) на цикъл светлина-тъмнина 12 на 12 часа (400-800 lux). Гарантира се, че има прясна храна на разположение и че въздухът е наситен с вода. Липсата на храна може да доведе до дефекация на животните върху яйцата, което води до развитие на гъбички върху яйцата, или F. candida може да изяде собствените си яйца. След 10 дни яйцата внимателно се събират с игла и шпатула и прехвърлят в „хартия за яйца“ (малки парчета филтърна хартия, накисната в каша от парижки гипс/въглен), която се поставя в контейнер с пресен субстрат гипс/въглен. В субстрата се добавят няколко зрънца мая за привличане на ювенилните екземпляри, за да напуснат хартията за яйца. Важно е хартията за яйца и субстратът да са влажни, защото в противен случай яйцата се обезводняват. Като алтернатива, полово зрелите животни могат да бъдат отстранени от кутиите за синхронизиране на културата след получаването на яйца за 2 или 3 дни.
|
|
—
|
След три дни повечето от яйцата върху хартията за яйца ще са излюпени, и някои ювенилни екземпляри могат да бъдат намерени под хартията за яйца.
|
|
—
|
За да се получат ювенилни екземпляри с еднаква възраст, хартията за яйца с неизлюпените яйца се отстранява от блюдото на Петри с пинцети. Ювенилните екземпляри, към този момент на 0-3 дни, се оставят в блюдото и се захранват с хлебна мая. Неизлюпените яйца се изхвърлят.
|
|
—
|
Яйцата и излюпените ювенилни екземпляри се отглеждат по същия начин, както полово зрелите индивиди. По-специално за F. fimetaria следва да се вземат следните мерки: осигуряване на достатъчно количество прясна храна, отстраняване на плесенясалата храна, след 1 седмица ювенилните екземпляри се разделят в нови блюда на Петри, при условие че гъстотата е над 200.
|
2.б. Боравене с колемболите при започването на изпитването
|
—
|
Екземплярите от F. candida на възраст 9-12 дни или от F. fimetaria на възраст 23-26 дни се събират, напр. чрез засмукване, и се поставят в малък контейнер с влажен субстрат гипс/въглен и тяхното физическо състояние се проверява с микроскоп (наранените и увредени екземпляри се премахват). Всички стъпки следва да се правят като същевременно атмосферата на колемболите се поддържа влажна, за да се избегне стрес от изсушаване, например чрез използване на навлажнени повърхности и т.н.
|
|
—
|
Контейнерът се обръща с дъното нагоре и се почуква по него, за да се прехвърлят колемболите в почвата. Статичното електричество трябва да бъде неутрализирано, защото в противен случай е възможно животните само да летят във въздуха, или да се прилепят странично към контейнера за изпитването и да изсъхнат. За неутрализирането може да бъде използван йонизатор или влажна кърпа под контейнера.
|
|
—
|
Храната следва да бъдат разпръсната по цялата повърхност на почвата, а не само в една бучка.
|
|
—
|
По време на прехвърлянето и по време на периода на изпитване следва да се избягват почуквания или други действия, физически засягащи контейнерите за изпитване, тъй като това може да повиши уплътняването на почвата и да възпрепятства взаимодействието между колемболите.
|
3. Алтернативни видове колемболи
За изпитване в съответствие с настоящия метод за изпитване могат да бъдат избрани други видове колемболи, като например Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi, Mesaphorura macrochaeta. Преди използването на алтернативни видове следва предварително да бъдат изпълнени редица предпоставки:
|
—
|
Те следва да бъдат идентифицирани по категоричен начин;
|
|
—
|
Следва да се направи обосновка на избора на вида.
|
|
—
|
Следва да се гарантира, че репродуктивната биология е включена във фазата на изпитването, така че да бъде потенциален прицелен обект по време на експозицията;
|
|
—
|
Следва да е известен жизненият цикъл: възраст при достигане на полова зрялост, продължителност на съзряване на яйцата и стадии, подлежащи на експозиция;
|
|
—
|
Субстратът за изпитването и даването на храна трябва да предоставят оптимални условия за растежа и размножаването;
|
|
—
|
Стойността на варирането следва да бъде достатъчно ниска за прецизна и точна оценка на токсичността.
|
Допълнение 4
Извличане и броене на индивидите
1. Могат да бъдат използвани два метода на извличане.
|
1.а.
|
Първи метод: Може да се използва екстрактор с контролиран температурен градиент, основан на принципите на MacFadyen (1). Топлината идва от нагревателен елемент в горната част на клетката за извличане (регулиран чрез термистор, поставен върху повърхността на почвената проба). Температурата в охладената течност, заобикаляща съда за събирането, се регулира чрез термистор, разположен на повърхността на клетката за събиране (поставена под почвената среда). Термисторите са свързани към програмируем блок за управление, който повишава температурата съгласно предварително програмиран график. Екземплярите се събират в охладената клетка за събиране (2 °C) с дънен слой от парижки гипс/въглен. Извличането е с обща продължителност от 48 h, започва при 25 °C и температурата се увеличава автоматично с 5 °C на всеки 12 h. След 12 h при 40 °C извличането приключва.
|
|
1.б.
|
Втори метод: След опитния инкубационен период броят на ювенилните екземпляри от Collembola се оценява чрез флотация. За тази цел изпитването се извършва в съдове с обем приблизително 250 ml. В края на изпитването се добавят около 200 ml дестилирана вода. Почвата се разбърква леко с фина четка, за да се позволи на колемболите да изплуват върху повърхността на водата. Малко количество, приблизително 0,5 ml черно фотографско багрило Kentmere, може да се добави към водата за подпомагане на броенето чрез увеличаване на контраста между водата и белите колемболи. Багрилото не е токсично за колемболи.
|
2. Преброяване:
Преброяването може да се извършва на око или под светлинен микроскоп, който използва мрежа, която се поставя върху съда за флотацията, или чрез фотографиране на повърхността на всеки съд и след това преброяване на колемболите върху увеличени разпечатани или прожектирани изображения. Преброяването може да се извършва също чрез използване на техники за цифрова обработка на изображения (12). Всички техники следва да са валидирани.
Допълнение 5
Определяне на максималната способност на почвата за задържане на вода
Следният метод за определяне на максималната способност на почвата за задържане на вода (СЗВ) се счита за подходящ. Той е описан в приложение В към ISO DIS 11268-2 (Качество на почвите — въздействия на замърсители върху земни червеи (Eisenia fetida). Част 2: Определяне на въздействията върху размножаването).
Взема се определено количество (например 5 g) изпитван почвен субстрат с помощта на подходящо устройство за пробовземане (шнекова сонда и т.н.). Дъното на сондата се покрива с парче влажна филтърна хартия и след това се поставя на стойка на водна баня. Сондата следва постепенно да се потапя във водата, докато водното ниво се издигне над повърхността на почвата. След това тя се оставя във водата за около три часа. Тъй като не цялото количество вода, абсорбирано от почвените капиляри, може да бъде задържано, почвената проба следва да се остави да се отцеди в продължение на два часа чрез поставяне на сондата върху легло от много влажен фино смлян кварцов пясък, намиращо се в покрит съд (за да се предотврати изсушаването). След това тази проба трябва да бъде претеглена и изсушена до постоянна маса при 105 °C. Способността за задържане на вода (СЗВ) трябва да се изчислява както следва:

където:
|
S
|
=
|
водонаситен субстрат + маса на сондата + маса на филтърната хартия
|
|
T
|
=
|
тара (маса на сондата + маса на филтърната хартия)
|
|
D
|
=
|
сухата маса на субстрата
|
Допълнение 6
Определяне на стойността на рн на почвата
Описаният по-долу метод за определяне на pH на почвата се основава на описанието в ISO DIS 10390: Качество на почвите — Определяне на pH.
Определено количество почва се изсушава при стайна температура в продължение на най-малко 12 часа. След това се приготвя суспензия от почвата, (съдържаща най-малко 5 грама почва) в нейния петкратен обем или в 1 M разтвор на калиев хлорид (KCl) с квалификация „чист“, или в 0,01 M разтвор на калциев хлорид (CaCl2) с квалификация „чист“. След това суспензията се разклаща добре в продължение на пет минути и се оставя да се утаи в продължение на най-малко 2 часа, но не повече от 24 часа. След това се измерва стойността на pH на течната фаза с помощта на рН-метър, който е бил калибриран преди всяко измерване чрез подходящ набор от буферни разтвори (напр. pH 4,0 и 7,0).
В.40. ИЗПИТВАНЕ ЗА ТОКСИЧНОСТ ПРЕЗ ЦЕЛИЯ ЖИЗНЕН ЦИКЪЛ НА ХИРОНОМИДИ В СИСТЕМА ВОДА-СЕДИМЕНТ С ИЗПОЛЗВАНЕ НА ВОДА С ДОБАВКА ИЛИ СЕДИМЕНТ С ДОБАВКА
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 233 (2010). Той е предназначен за оценка на въздействието на химикали от експозицията през целия жизнен цикъл на сладководното двукрило Chironomus sp. и обхваща изцяло 1-вото поколение (поколение Р) и началото на 2-то поколение (поколение F1). Той представлява продължение на съществуващите методи за изпитване В.28 (1) и В.27 (15), като се използва сценарий на експозиция съответно на вода с добавка или на седимент с добавка. Методът също така взима под внимание съществуващите протоколи за изпитвания на токсичността за Chironomus riparius и Chironomus dilutus (с предходно наименование C. tentans (2)), разработени в Европа и Северна Америка (3)(4)(5)(6)(7)(8)(9) и впоследствие преминали през кръгово изпитване (1) (7) (10) (11) (12). Могат да се използват и други добре документирани видове хирономиди, напр. Chironomus yoshimatsui (13)(14). Цялостната продължителност на експозицията е около 44 дни за C. riparius и C. yoshimatsui и около 100 дни за C. dilutus.
|
|
2.
|
В настоящия метод за изпитване са описани и двата сценария на експозиция — на вода и на седимент. Изборът на подходящ сценарий за експозиция зависи от предвиденото приложение на изпитването. Със сценария с експозиция чрез водата, при който добавката е към водата над седимента, се цели да се симулира разнасяне на пестицид, и същият обхваща началната пикова стойност на концентрацията в повърхностните води. Сценарият с вода с добавка е полезен също и за други типове експозиция (в това число разливане на химикали), но не за процесите на натрупване в рамките на седимента, които продължават по-дълго от времетраенето на изпитването. В този случай, а също и когато оттичането е основен път за навлизането на пестициди във водни обекти, постановката със седимент с добавка може да е по-подходяща. Ако интерес представляват други сценарии на експозиция, планът на изпитването може да бъде лесно адаптиран. Например, ако разпределението на изпитвания химикал между водната фаза и слоя от седимент не представлява интерес и адсорбцията в седимента трябва да бъде сведена до минимум, може да бъде взето под внимание използването на сурогатен изкуствен седимент (напр. кварцов пясък).
|
|
3.
|
Химикали, които изискват изпитване на обитаващите седимента организми, могат да се задържат в седимента в продължение на дълги периоди от време. Обитаващите седимента организми могат да бъдат експонирани по различни пътища. Относителната важност на всеки път на експозиция и времето, необходимо за всеки от тях да способства за общото токсично въздействие, зависят от физичните и химичните свойства на химикала. За силно адсорбиращите химикали или за химикали, които образуват ковалентна връзка със седимента, поглъщането на замърсена храна може да бъде значим път на експозиция. За да не се подцени токсичността на силно липофилните химикали, може да се разгледа възможността за добавяне на храна в седимента, преди да бъде приложен изпитваният химикал (вж. точка 31). Поради това е възможно да се включат всички пътища на експозиция и всички етапи от жизнения цикъл.
|
|
4.
|
Измерваните крайни точки са общият брой на имагиниралите полово зрели индивиди (както за 1-во, така и за 2-ро поколение), скоростта на развитие (както за 1-во, така и за 2-ро поколение), съотношението между половете на имагиниралите и живите полово зрели индивиди (както за 1-во, така и за 2-ро поколение), броят на яйчните маси на женски индивид (само от 1-во поколение) и оплождането на яйчните маси (само от 1-во поколение).
|
|
5.
|
Настоятелно се препоръчва формулиран седимент. Формулираният седимент има някои преимущества пред естествените седименти:
|
—
|
намалява се варирането при опитите, тъй като формулираният седимент играе ролята на възпроизводима „стандартна матрица“ и отпада необходимостта да се намират източници на незамърсен и чист седимент;
|
|
—
|
изпитванията могат да започнат по всяко време, без да се влияят от сезонното вариране на включения в изпитването седимент, и без да се налага седиментът да се подлага на предварителна подготовка за отстраняване на собствената му фауна;
|
|
—
|
по-ниски разходи в сравнение с тези за събирането в полеви условия на достатъчно количество седимент за рутинните изпитвания;
|
|
—
|
формулираният седимент позволява сравняване на токсичността между изследванията и съответно ранжиране на химикалите (3).
|
|
|
6.
|
Определенията, които са използвани, са дадени в допълнение 1.
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
7.
|
Ларви на хирономиди в първи ларвен стадий се експонират на диапазон от концентрации на изпитвания химикал в система седимент — вода. Изпитването започва с въвеждането на ларви в първи ларвен стадий (1-во поколение) в бехеровите чаши за изпитването, съдържащи седимент с добавка, или алтернативно, изпитваният химикал се добавя във водата след добавянето на ларвите. Оценяват се имагинирането на хирономидите, времето до имагинирането и съотношението между половете на напълно имагиниралите живи организми. Имагиниралите възрастни се прехвърлят в клетки за размножение, за улесняване на роенето, чифтосването и яйцеполагането. Оценяват се броят на получените яйчни маси и тяхното оплождане. От тези яйчни маси се получават ларвите в първи ларвен стадий от 2-ро поколение. Тези ларви се поставят в наскоро приготвени изпитвателни бехерови чаши (процедура за добавяне както за 1-то поколение), за да се определи жизнеспособността на 2-рото поколение чрез оценка на имагинирането на хирономидите, времето до имагинирането и съотношението между половете на напълно имагиниралите живи организми (схематично представяне на изпитването за жизнения цикъл е дадено в допълнение 5). Всички данни се анализират или чрез регресионен модел, за да се оцени концентрацията, която би причинила х % намаляване в съответната крайна точка, или като се използва проверка на хипотези, за да се определи дадена концентрация без наблюдавано въздействие (NOEC). Последното изисква сравнение на стойностите на отклиците от третирането с подходящите отклици при контролите, като се използват статистически тестове. Следва да се отбележи, че в сценария с вода с добавка, в случай на бързо разградими химикали, по-късните етапи от живота на всеки етап на всяко поколение (напр. фаза на какавида) могат да бъдат експонирани на значително по-ниско равнище на концентрация във водата над седимента от ларвите от 1-ви ларвен стадий. Ако това е повод за загриженост, и е необходимо сравнимо ниво на експозиция за всеки от етапите на жизнения им цикъл, могат да се разгледат следните изменения на метода на изпитване:
|
—
|
успоредни провеждания с добавяне при различни етапи на жизнения цикъл, или
|
|
—
|
повторно добавяне (или обновяване на водата над седимента) на системата за изпитване по време на двете фази на изпитването (1-во и 2-ро поколение), при което интервалите на добавяне (обновяване) следва да бъдат съобразени с характеристиките на съдбата на изпитвания химикал.
|
Такива промени са осъществими само в рамките на сценария с вода с добавка, но не и в сценария със седимент с добавка.
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНИЯ ХИМИКАЛ
|
8.
|
Разтворимостта във вода на изпитвания химикал, неговото парно налягане и log K
ow, измереното или изчисленото му разпределение в седимента и стабилността му във вода следва да са известни. Следва да е на разположение и надежден метод за анализ за количествено определяне на изпитвания химикал във водата над седимента, във водата между частиците на седимента и в седимента, с известни и протоколирани точност и граница на откриване. Полезната информация включва структурната формула и чистотата на изпитвания химикал. Информацията за химичната съдба на изпитвания химикал (напр. разсейване, абиотично и биотично разграждане и т.н.) също е полезна. Допълнителни насоки за изпитване на химикали с физични и химични свойства, които ги правят трудни за изпитване, са дадени в (16).
|
РЕФЕРЕНТНИ ХИМИКАЛИ
|
9.
|
Референтните химикали може да се изпитват периодично като средство за потвърждение, че чувствителността на популацията в лабораторията не е изменена. Както при водните бълхи, би било достатъчно да се извърши изпитване за 48-часова остра токсичност (по 17). Независимо от това, докато няма налична валидирана насока за остра токсичност, може да бъде взета предвид Глава В.28 от настоящото приложение. Могат да се посочат като пример следните референтни токсични вещества, използвани успешно в кръгови изпитвания и в изследвания за валидиране: линдан, трифлуралин, пентахлорофенол, кадмиев хлорид и калиев хлорид (1) (3) (6) (7) (18).
|
ВАЛИДНОСТ НА ИЗПИТВАНЕТО
|
10.
|
За да е валиден тестът, прилагат се следните условия:
|
—
|
в края на експозицията и за двете поколения средното имагиниране в контролните третирания трябва да бъде поне 70 % (1)(7);
|
|
—
|
за C. riparius и C. yoshimatsui 85 % от общия брой на имагиниралите полово зрели индивиди от контролното третиране при двете поколения трябва да се появяват между 12 и 23 дни след въвеждането на ларвите в първи ларвен стадий в съдовете; за C. dilutus е приемлив период от 20 до 65 дни;
|
|
—
|
средното съотношението между половете на имагиниралите и живи полово зрели индивиди (като дял женски или дял мъжки индивиди) в контролното третиране на двете поколения, следва да бъде най-малко 0,4, но не може да надвишава 0,6;
|
|
—
|
за всяка клетка за размножаване броят на яйчните маси в контролите от 1-вото поколение следва да бъде най-малко 0,6 на женски индивид, добавен към клетка за размножение;
|
|
—
|
делът на оплодените яйчни маси във всяка клетка за размножаване от контролите от 1-то поколение следва да бъде най-малко 0,6;
|
|
—
|
в края на периода на експозиция за двете поколения следва да се измери рН и концентрацията на разтворения кислород във всеки от съдовете. Концентрацията на разтворен кислород трябва да бъде поне 60 % от стойността на насищане при равновесие с атмосферния въздух (ASV (24)), а рН на водата над седимента следва да бъде в обхвата 6—9 във всички съдове за изпитване,
|
|
—
|
температурата на водата не трябва да варира с повече от ± 1 °С.
|
|
ОПИСАНИЕ НА МЕТОДА
Съдове за изпитване и клетки за размножение
|
11.
|
Ларвите се експонират в 600 ml стъклени бехерови чаши с диаметър около 8,5 cm (виж допълнение 5). Подходящи са и други съдове, но те следва да осигуряват подходяща дълбочина на водата над седимента и на самия седимент. Площта на седимента трябва да бъде достатъчна, за да осигурява 2 до 3 cm2 на ларва. Съотношението между дебелината на слоя седимент и тази на водата над него трябва да бъде около 1:4. Следва да бъдат използвани клетки за размножаване (най-малко по 30 см във всяко от трите измерения) с марля (размер на отвора приблизително 1 mm) в горната част и една странична част на клетката като минимум (вж. допълнение 5). Във всяка клетка се поставя за яйцеполагане блюдо кристализатор от 2 l, със съдържание на вода за изпитване и на седимент. Също така, за блюдото кристализатор съотношението между дебелината на слоя седимент и тази на водата над него трябва да бъде около 1:4. След като яйчните маси бъдат събрани от блюдото кристализатор, те се поставят в тигел на 12-гнездна микротитърна плака (една яйчна маса в гнездо, съдържаща минимум 2,5 ml вода от блюдото кристализатор с добавка), след което плаките се покриват с капак, за да се предотврати значимо изпаряване. Могат да се използват и други съдове, подходящи за съхранение на яйчните маси. С изключение на микротитърните плаки, всички съдове за изпитване и другото оборудване, което ще влезе в контакт с изпитваната система, следва да бъдат изцяло от стъкло или от друг химически инертен материал (напр. политетрафлуороетилен).
|
Избор на видове
|
12.
|
За предпочитане е видът, който се използва за изпитването, да е Chironomus riparius. C. yoshimatsui също може да бъде използван. C. dilutus също е подходящ, но с него се борави по-трудно и е необходим по-дълъг период на изпитване. Подробности за методите на отглеждане на Chironomus riparius са дадени в допълнение 2. Информация за условията на отглеждане е на разположение също и за C. dilutus (5) и C. yoshimatsui (14). Идентичността на видовете трябва да се потвърждава преди изпитването, но не е задължителна преди всяко изпитване, ако организмите са получени при отглеждане в изпитващата лаборатория.
|
Седимент
|
13.
|
За предпочитане е да се използва формулиран седимент (наричан още възстановен, изкуствен или синтетичен седимент). Ако обаче се използва естествен седимент, трябва да се определят характеристиките му (най-малко рН и съдържание на органичен въглерод, а определянето на други параметри, напр. на съотношението C/N и зърнометричния състав, също се препоръчва), той следва да бъде незамърсен и в него да няма други организми, които да се конкурират с ларвите на хирономидите, или да се хранят с тях. Също така се препоръчва преди изпитването седиментите да бъдат аклиматизиран в продължение на седем дни при условията на изпитването. Препоръчва се следният описан в (1) формулиран седимент (1) (20) (21):
|
а.
|
4—5 % торф (сухо тегло); с рН възможно най-близко до обхвата 5,5—6,0; важно е да се използва торф под формата на прах, ситно смлян (размер на частиците ≤ 1 mm) и изсушен само с въздух.
|
|
б.
|
20 % каолин (сухо тегло) (за предпочитане съдържанието на каолинит да е повече от 30 %);
|
|
в.
|
75—76 % кварцов пясък (сухо тегло) (трябва да преобладава финият пясък с размер на над 50 % от частиците между 50 и 200 μm);
|
|
г.
|
добавя се дейонизирана вода, така че влажността на крайната смес да бъде в обхвата 30–50 %;
|
|
д.
|
добавя се химически чист калциев карбонат (CaCO3), за да се коригира рН на крайната смес на седимента до 7,0 ± 0,5;
|
|
е.
|
съдържанието на органичен въглерод в крайната смес следва да бъде 2 % (± 0,5 %) и да бъде коригирано, като се използват подходящи количества торф и пясък, в съответствие с а) и в).
|
|
|
14.
|
Източниците на торф, каолин и пясък трябва да са известни. Съставките на седимента следва да се проверят за липса на замърсяване с химикал (напр. тежки метали, органохлорни съединения, органофосфорни съединения и т.н.). Пример за приготвянето на формулирания седимент е даден в допълнение 3. Допустимо е също и смесването на сухи съставки, ако се докаже, че след добавянето на надседиментната вода не настъпва разделяне на съставките (напр. изплуване на торфените частици), и че торфът или седиментът е аклиматизиран в необходимата степен.
|
Вода
|
15.
|
Всяка вода, която отговаря на изброените в допълнение 2 и 4 химични характеристики за вода, приемлива за използване за разреждане, е подходяща за използване като вода за изпитването. Всяка подходяща вода, природна вода (от повърхностни или подпочвени води), възстановена вода (вж. допълнение 2) или дехлорирана чешмяна вода може да се използва за отглеждане и за изпитване, ако хирономидите преживяват в нея за времето на отглеждане и изпитване, без да показват признаци на стрес. В началото на изпитването рН на водата за изпитване трябва да бъде между 6 и 9, а общата ѝ твърдост — не по-висока от 400 mg/l, изразена като CaCO3. Ако обаче се предполага взаимодействие между отговорните за твърдостта йони и изпитвания химикал, следва да се използва вода с по-ниска твърдост (и затова в този случай не трябва да се използва среда „Elendt M4“). По време на цялото изпитване трябва да се използва един и същи тип вода. Качествените параметри на водата, изброени в допълнение 4, следва да се измерват поне два пъти годишно или всеки път когато има подозрение, че тези характеристики може да са се променили значително.
|
Изходни разтвори — вода с добавка
|
16.а.
|
Концентрациите, при които се прави изпитването, се изчисляват въз основа на концентрациите в обема на водата, т.е., водата над седимента. Разтворите с избраните концентрации, които ще се ползват в изпитването, обикновено се приготвят чрез разреждане на изходен разтвор. Изходните разтвори се приготвят за предпочитане чрез разтваряне на изпитвания химикал във водата за изпитване. В някои случаи може да се наложи да се използват разтворители или диспергиращи средства, с цел да се получи изходен разтвор с подходяща концентрация. Като подходящи разтворители могат да се посочат: ацетон, етанол, метанол, моноетилов етер на етиленгликола, диметилов етер на етиленгликола, диметилформамид и триетиленгликол. Като диспергиращи средства могат да се използват Cremophor RH40, Tween 80, метилцелулоза 0,01 % и НСО-40. Концентрацията на средството за повишаване на разтворимостта в окончателната среда за изпитване следва да е минимална (т.е. ≤ 0,1 ml/l и трябва да бъде една и съща във всички третирания. Когато се използва средство за повишаване на разтворимостта, то не трябва да оказва значимо въздействие върху преживяването, което се вижда от контрола на разтворител в сравнение с отрицателна контрола (вода). Въпреки това, следва да се положат всички усилия, за да се избегне употребата на такива материали.
|
Изходни разтвори — седименти с добавка
|
16.б.
|
Обикновено седиментите с добавка с избрана концентрация се приготвят чрез добавяне на разтвор на изпитвания химикал директно към седимента. Изходен разтвор на изпитвания химикал, разтворен в дейонизирана вода, се смесва с формулирания седимент с помощта на валцова мелница, смесител за фураж, или смесване с ръка. Ако е малко разтворим във вода, изпитваният химикал може да бъде разтворено във възможно най-малък обем подходящ органичен разтворител (например хексан, ацетон или хлороформ). След това този разтвор се смесва с 10 g фин кварцов пясък за всеки съд за изпитване. Оставя се разтворителят да се изпари и същият следва да бъде напълно елиминиран от пясъка; тогава пясъкът се смесва с необходимото количество седимент. За разтваряне, диспергиране или емулгиране на изпитвания химикал могат да се използват само средства, които лесно се изпаряват. Трябва да се помни, че пясъкът, добавен заедно с изпитвания химикал, и пясъчната смес трябва да се вземат предвид при приготвянето на седимента (т.е., седиментът трябва следователно да се приготвя с по-малко количество пясък). Трябва да се внимава изпитваният химикал, добавен към седимента, да бъде старателно и равномерно разпределен в целия му обем. Ако е необходимо, може да се анализират подпроби, за да се определи степента на хомогенност.
|
ПЛАНИРАНЕ НА ИЗПИТВАНЕТО
|
17.
|
Планирането на изпитването е свързано с избор на броя на стойностите на концентрацията на изпитване и интервалите между тези стойности, броя на съдовете за всяка концентрация, броя на ларвите във всеки съд, броя на блюдата кристализатори и клетките за размножение. По-долу са описани планове за ECx, за NOEC и за провеждане на гранично изпитване.
|
Планиране на регресионния анализ
|
18.
|
Ефективната концентрация (ECx) и диапазонът от концентрации, над който въздействието на изпитвания химикал представлява интерес, следва да бъдат обхванати от изпитването, така че крайната точка да не се екстраполира извън обхвата на генерираните данни. Следва да се избягват екстраполации за стойности, много по-ниски от най-ниската концентрация или по-високи от най-високата концентрация. Предварително изпитване за определяне на обхвата в съответствие с методи за изпитване В.27 или В.28 може да е полезно при избора на подходящ диапазон от концентрации на изпитването.
|
|
19.
|
За подход за ECx следва да се извърши изпитване при най-малко пет концентрации и осем повторения за всяка концентрация. За всяка концентрация следва да се използват две клетки за размножаване (А и Б). Осемте повторения се разделят на две групи с по четири повторения за всяка клетка за размножаване. Това сливане на повторения е необходимо поради броя на индивидите, необходим в клетката, за надеждна оценка на размножаването. Независимо от това, за 2-то поколение отново има осем повторения, които започват от експонираните популации в клетките за размножаване. Кратността, с чиято помощ се получава следващата концентрация, не бива да бъде по-голяма от две (може да се направи изключение в случаите, в които графиката на зависимостта доза-отклик има твърде слаб наклон). Броят на повторенията за всяко третиране може да се намали до шест (три повторения за всяка клетка за размножение), ако се увеличи броят на изпитваните концентрации, които предизвикват различни отклици. Увеличаването на броя на повторенията или намаляването на кратността на интервалите между изпитваните концентрации обикновено води до стесняване на доверителния интервал около ECX.
|
Планиране на изпитване за оценка на NOEC
|
20.
|
За подход за NOEC следва да се извърши изпитване при пет концентрации и най-малко осем повторения (4 за всяка клетка за размножение, А и Б), а кратността между стойностите на концентрациите не бива да е по-голяма от две. Броят на отделните повторения следва да е достатъчен за осигуряване на достатъчно статистическа мощност за откриване на разлика от 20 % по отношение на контролата при равнище на значимост от 5 % (α = 0,05). По отношение на скоростта на развитие, плодовитостта и оплождането обикновено е подходящ дисперсионен анализ (ANOVA), последван тест на Дънет или тест на Уйлямс (22-25). За съотношението на имагиниране и съотношението между половете може да са подходящи тестът на Кокрън-Армитидж, точният тест на Фишер (с корекция на Бонферони) или тестът на Мантел-Хенцал.
|
Гранично изпитване
|
21.
|
Може да се предприеме гранично изпитване (с една концентрация за изпитване и контрола(контроли)), ако не е наблюдавано въздействие в предварителното изпитване по избор за определяне на обхвата до максимална концентрация. Предназначението на граничното изпитване е да се покаже, че всякакво токсично въздействие на изпитвания химикал се открива на равнища, които са по-високи от изпитваната пределна концентрация. За вода се предлагат 100 mg/l, а за седимент — 1 000 mg/kg (сухо тегло). Обикновено са необходими най-малко осем повторения както на третираните проби, така и на контролите. Следва да се докаже достатъчна статистическа мощност за откриване на разлика от 20 % по отношение на контролата при равнище на значимост от 5 % (α = 0,05). По отношение на метричния отклик (например скорост на развитие), t-тестът е подходящ статистически метод, ако данните отговарят на изискванията на посочения тест (нормалност, хомогенни дисперсии). Ако посочените изисквания не са изпълнени, може да се използва t-тест за нееднаква дисперсия или непараметричен тест, напр. тест на Уилкоксън-Ман-Уитни. По отношение на съотношението на имагиниране е подходящ точният тест на Фишер.
|
ПРОЦЕДУРА
Условия на експозиция
Приготвяне на системата вода-седимент (вода с добавка)
|
22.а.
|
Подходящи количества формулиран седимент (вж. точки 13—14 и допълнение 3) се слагат във всеки съдове за изпитване и блюдо кристализатор, така че да се образува слой от най-малко 1,5 cm (за блюдото кристализатор може да е малко по-малко), но не повече от 3 cm. Добавя се вода (вж. точка 15) така, че съотношението между дебелината на слоя седимент и тази на водата да не надвишава 1:4. След подготовката на съдовете за изпитване системата седимент-вода трябва да се остави, при леко аериране, за около седем дни, преди да бъдат добавени ларвите в първи ларвен стадий от 1-вото или от 2-то поколение (вж. точка 14 и допълнение 3). Системата седимент-вода в блюдата кристализатори не се аерира по време на изпитването, тъй като не е необходимо тя да осигурява преживяване на ларви (преди излюпването яйчните маси вече са събрани). За да се избегне разделяне на съставките на седимента и повторно суспендиране на фините частици по време на добавянето на водата за изпитването във водата над седимента, седиментът може да се покрие с пластмасов диск, докато се налива водата. Дискът се отстранява незабавно след това. Могат да бъдат подходящи и други устройства.
|
Приготвяне на системата вода-седимент (седимент с добавка)
|
22.б.
|
Седиментите с добавка, приготвени в съответствие с точка 16б, се поставят в съдовете и блюдото кристализатор и се добавя вода над седимента до получаване на обемно съотношение седимент-вода от 1:4. Дълбочината на слоя седимент трябва да бъде в интервала от 1,5 до 3 cm (тя може да бъде малко по-малка за блюдото кристализатор). За да се избегне разделяне на съставките на седимента и повторно суспендиране на фините частици по време на добавянето на водата за изпитването във водата над седимента, седиментът може да се покрие с пластмасов диск, докато се налива водата, веднага след което дискът трябва да се извади. Могат да бъдат подходящи и други устройства. След като е приготвен седиментът с добавка, заедно с водата над седимента, желателно е да се даде възможност изпитваният химикал от седимента да се разпредели в течната фаза (4)(5)(7)(18). За препоръчване е това да стане при температурата и аерирането, използвани при изпитването. Подходящото време за достигане на равновесие зависи от седимента и химикала и може да варира от няколко часа до дни, в редки случаи дори до пет седмици. Тъй като това би довело до разграждането на много химикали, не се чака достигане на равновесие, а се препоръчва период за уравновесяване, равен на 48 часа. Въпреки това, когато е известно, че времето на полуразграждане на химикала в седимента е дълго (вж. точка 8), времето за достигане на равновесие може да бъде удължено. В края на този допълнителен период за достигане на равновесие следва да се измери концентрацията на изпитвания химикал във водата над седимента, във водата между частиците на седимента и в седимента, най-малкото при най-високата и при по-ниска концентрация (вж. точка 38). Посочените аналитични определяния на изпитвания химикал дават възможност за изчисляване на масовия баланс и изразяване на резултати въз основа на измерените концентрации.
|
|
23.
|
Съдовете за изпитването следва да бъдат покрити (напр. със стъклени пластинки). Ако е необходимо, по време на изследването съдовете могат да се допълват до първоначалния обем, за да се компенсира изпаряването. Това следва да се извърши, като се използва дестилирана или дейонизирана вода, за да се избегне всякакво образуване на соли. Блюдата кристализатори в клетките за размножаване не се покриват и при тях може, но не е задължително, да се извършва компенсация за загубата на вода по време на периода на изпитването, тъй като яйчните маси са в контакт с водата само за около един ден и блюдата за кристализиране се използват само в кратък етап от изпитването.
|
Добавяне на изпитваните организми
|
24.
|
Четири до пет дни преди да бъдат добавени ларвите в първи ларвен стадий от 1-вото поколение, яйчните маси следва да се извадят от културата и да се сложат в малки съдове в среда за отглеждане. Може да се използва зряла среда от онази, в която е отглеждана изходната култура, или прясно приготвена среда. Във всеки случай към средата за отглеждане се добавя малко количество храна, напр. няколко капки филтрат от суспензия от фино смляна храна за риби (вж. допълнение 2). Следва да се използват само прясно снесени яйчни маси. Като правило, ларвите започват да се излюпват няколко дни след снасянето на яйцата (2 до 3 дни за Chironomus riparius при 20 °C, 1 до 4 дни за C. dilutus при 23 °C и C. yoshimatsui при 25 °C), а растежът на ларвите преминава през четири стадия, всеки от които трае от 4 до 8 дни. В изпитването следва да се използват ларви в първи стадий на развитие (максимум 48 h след излюпването). Стадият на развитие на ларвите може да се провери чрез проверка на широчината на капсулата на главата (7).
|
|
25.
|
Двадесет ларви в първи ларвен стадий от 1-во поколение се разпределят на случаен принцип във всеки съд за изпитване, който съдържа система седимент-вода, като се използва пипета с тъп край. Аерирането на водата се спира при добавянето на ларвите в съдовете за изпитване и не се подновява преди изтичането на 24 часа след добавянето на ларвите (вж. точка 32). В зависимост от използвания план за изпитване (вж. точки 19 и 20) броят на ларвите, използвани за всяка концентрация, е най-малко 120 (6 повторения на концентрация) за подхода за ECX и 160 за подхода за NOEC (8 повторения на концентрация). При постановката със седимент с добавка експозицията започва с поставянето на ларвите.
|
Добавяне към водата над седимента
|
26.
|
Двадесет и четири часа след добавянето на ларвите в първи ларвен стадий от 1-во поколение, изпитваният химикал се добавя във водата над седимента и отново се прилага леко аериране (за възможни изменения на планирането на изпитването вж. точка 7). Малки обеми от изходните разтвори на изпитвания химикал се въвеждат под повърхността на водата, като се използва пипета. След това водата над седимента се разбърква леко, като се внимава седиментът да остане незасегнат. В постановката с вода с добавка експозицията започва с добавянето на добавката към водата (т.е., един ден след добавянето на ларвите).
|
Събиране на имагиниралите полово зрели индивиди
|
27.
|
Имагиниралите индивиди от 1-то поколение се събират поне веднъж, но за предпочитане два пъти дневно (вж. точка 36) от съдовете за изпитване с аспиратор, всмукателен вентилатор или подобно устройство (вж. допълнение 5). Трябва особено да се внимава полово зрелите индивиди да не бъдат увредени. Събраните индивиди от четири съда за изпитване в рамките на едно третиране се пускат в клетката за размножаване, към която те са били разпределени преди това. В деня на имагинирането на първия (мъжки) индивид в блюдата кристализатори се слага добавка чрез поставяне с пипета под водната повърхност на малък обем изходен разтвор на изпитвания химикал (постановка с вода с добавка). След това водата над седимента се разбърква леко, като се внимава седиментът да остане незасегнат. Концентрацията на изпитвания химикал в блюдото кристализатор номинално е същата, както в съдовете за третиране, които са разпределени за тази конкретна клетка за размножаване. За постановката със седимент с добавка блюдата кристализатори се приготвят около ден 11 след началото на експозицията (т.е. въвеждането на ларвите от 1-то поколение), така че в тях да може да се достигне равновесие около 48 часа преди получаването на първите яйчни маси.
|
|
28.
|
Яйчните маси се събират от блюдото кристализатор в клетката за размножаване с пинсета или пипета с тъп край. Всяка яйчна маса се поставя в съд, съдържащ среда за отглеждане от клетката за размножаване, от която тази яйчна маса е била събрана (напр. гнездо от 12-гнездна микроплака, заедно с най-малко 2,5 ml среда). Съдовете с яйчна маса се покриват с капак, за да се предотврати значимо изпаряване. Яйчните маси се държат за наблюдение в продължение на най-малко шест дни след като са били получени, така че да могат да се класифицират като оплодени или неоплодени.
За започване на 2-ро поколение от всяка клетка за размножаване се избират най-малко три, а за предпочитане шест оплодени яйчни маси, и заедно с малко храна им се дава възможност за излюпване. Тези яйчни маси трябва да са произведени по време на пиковата стойност на яйцеполагането, която обикновено е около ден 19 от изпитването в контролите. В идеалния случай 2-рото поколение от всички третирания се започва на същия ден, но поради свързаните с химикала въздействия върху развитието на ларвите това може да не е винаги възможно. В такъв случай по-високата концентрация може да бъде започната по-късно от третиранията на по-ниски концентрации и контролата (на разтворител).
|
|
29.а.
|
При постановката с вода с добавка системата седимент-вода за 2-то поколение се приготвя чрез добавяне на изпитвания химикал във водата над седимента около 1 час преди добавянето на ларвите в първи ларвен стадий в съдовете за изпитване. Малки обеми от разтворите на изпитвания химикал се въвеждат под повърхността на водата, като се използва пипета. След това водата над седимента се разбърква леко, като се внимава седиментът да остане незасегнат. След добавянето се прилага леко аериране.
|
|
29.б.
|
При постановката със седимент с добавка съдовете за изпитване, съдържащи системата седимент-вода за 2-то поколение се приготвят по същия начин, както за 1-то поколение.
|
|
30.
|
Двадесет ларви в първи ларвен стадий (максимум 48 h след излюпването) от 2-ро поколение се разпределят на случаен принцип във всеки съд за изпитване, който съдържа системата седимент-вода с добавка, като се използва пипета с тъп край. Аерирането на водата трябва да се спре, когато ларвите в първи ларвен стадий се добавят в съдовете за изпитване, и да не се подновява преди изтичането на 24 часа след добавянето на ларвите. В зависимост от използвания план за изпитване (вж. точки 19 и 20) броят на ларвите, използвани за всяка концентрация, е най-малко 120 (6 повторения на концентрация) за подхода за ECX и 160 за подхода за NOEC (8 повторения на концентрация).
|
Храна
|
31.
|
Необходимо е да се хранят ларвите в съдовете за изпитване, за предпочитане всеки ден или най-малко три пъти седмично. Храна за риби (суспензия във вода или фино смляна храна, напр. Tetra-Min или Tetra-Phyll; вж. подробности в допълнение 2) от 0,25-0,5 mg (0,35-0,5 mg за C. yoshimatsui) на ларва на ден е достатъчно количество храна за млади ларви в първите 10 дни от тяхното развитие. За по-възрастни ларви може да е необходима малко повече храна: 0,5—1,0 mg на ларва на ден трябва да е достатъчно за оставащото време на изпитването. Дажбата храна във всички третирания и контролата следва да се намали, ако е забелязано развитие на гъбички, или ако в контролата има смъртност. Ако е невъзможно да се спре развитието на гъбички, изпитването трябва да се повтори.
Токсикологичната значимост на експозицията чрез поглъщане обикновено е по-висока при химикали с висок афинитет към органичен въглерод или при химикали, образуващи ковалентна връзка със седимента. Следователно, когато се изпитват химикали с такива свойства, количеството храна, необходимо за гарантиране на преживяването и нормалното развитите на ларвите, може да се добави към формулирания седимент преди периода на стабилизация, в зависимост от регулаторните нужди. За да се предотврати влошаването на качеството на водата, вместо храна за риби трябва да се използва растителна материя, например да се добавят 0,5 % (сухо тегло) фино смлени листа от коприва (Urtica dioica), черница (Morus alba), бяла детелина (Trifolium repens), спанак (Spinacia oleracea) или друг растителен материал (Cerophyl или алфа-целулоза). Добавянето в седимента на цялата дажба от даден органичен източник на храна преди поставянето на добавката нито е обичайно, предвид качеството на водата и биологичните показатели (21), нито е стандартизиран метод, но нови изследвания сочат, че този метод функционира (19) (26). Полово зрелите индивиди в клетката за размножаване обикновено не се нуждаят от храна, но плодовитостта и оплождането се подобряват, когато на имагиниралите полово зрели индивиди бъде предложен като храна наситен разтвор на захароза, напоен в тампон от памук (34).
|
Условия за инкубиране
|
32.
|
Водата над седимента в съдовете за изпитване леко се аерира 24 часа след добавянето на ларвите в първи ларвен стадий от двете поколения, като аерирането продължава през цялото време на изпитването (следва да се вземат мерки концентрацията на разтворения кислород да не пада под 60 % от стойността на насищане във въздух). Аерирането се осъществява с помощта на стъклена пипета „Пастьор“, чийто отвор е закрепен на 2—3 cm над слоя седимент, с няколко мехурчета в секунда. Когато се изпитват летливи химикали, следва да се разгледа възможността да не се аерира системата седимент-вода, като същевременно критериите за валидност за минимум 60 % от ASV (точка 10) трябва да бъдат изпълнени. Повече подробна информация е предоставена в (16).
|
|
33.
|
Изпитването с C. riparius се провежда при постоянна температура 20 °С (± 2 °С). Препоръчваните за C. dilutus и C. yoshimatsui температури са съответно 23 °C и 25 °C (± 2 °С). Продължителността на излагане на светлина е 16 часа, а интензитетът на светлината трябва да бъде между 500 и 1 000 lux. По отношение на клетките за размножаване може да бъде включена допълнителна фаза от един час разсъмване и здрач.
|
Продължителност на експозицията
|
34.
|
Постановка с вода с добавка: периодът на експозиция на 1-то поколение започва, когато изпитваният химикал се добавя във водата над седимента в съдовете за изпитване (което е един ден след въвеждането на ларвите — за възможни изменения на плана за експозицията вж. точка 7). Експозицията на 2-рото поколение ларви започва незабавно, тъй като те са въведени в система седимент-вода, в която вече има добавка. Максималната продължителност на експозицията за 1-то поколение е 27 дни и 28 дни за 2-то поколение (1-вото поколение ларви прекарва един ден в съдовете без експозиция) за C. riparius и C. yoshimatsui. Като се има предвид припокриването, пълната продължителност на изпитването е около 44 дни. За C. dilutus максималните продължителности на експозицията са 64 и 65 дни, съответно за 1-вото и за 2-рото поколение. Общата продължителност е около 100 дни.
Постановка със седимент с добавка: експозицията започва с поставянето на ларвите и е максимум 28 дни за двете поколения за C. riparius и C. yoshimatsui и максимум 65 дни за двете поколения за C. dilutus.
|
Наблюдения
Имагиниране
|
35.
|
За двете поколения се определя времето на развитие и общият брой на напълно имагинирали и живи мъжки и женски индивиди. Мъжките лесно се разпознават по перестите си антени и слабото телосложение.
|
|
36.
|
Съдовете за изпитване с двете поколения се наблюдават най-малко три пъти седмично, за да се оцени визуално дали не е налично ненормално по отношение на контролите поведение на ларвите (напр. напускане на седимента, необичайно плуване). По време на периода на имагиниране, който започва около 12 дни след въвеждането на ларвите за C. riparius и C. yoshimatsui (20 дни за C. dilutus), имагиниралите индивиди се броят и и определят по пол поне веднъж, но за предпочитане два пъти дневно (рано сутринта и късно следобед). След разпознаването индивидите от 1-то поколение внимателно се отстраняват от съдовете и се прехвърлят в клетка за размножаване. След разпознаването на индивидите от 2-то поколение, същите се отстраняват и умъртвяват. Всички яйчни маси, положени в съдовете за изпитване от 1-то поколение, следва да бъдат събирани индивидуално и прехвърляни с най-малко 2,5 ml от водата, от която са събрани, върху 12-гнездови микроплаки (или други подходящи съдове), които са покрити с капак, за да се предотврати значимо изпаряване. Броят на умрелите ларви и видимите какавиди, които не са успели да имагинират, също следва да се записва. Примери за клетка за размножение, съд за изпитване и всмукателен вентилатор са дадени в допълнение 5.
|
Размножаване
|
37.
|
Въздействията върху размножаването се оценяват чрез броя на яйчните маси, получени от 1-то поколение индивиди, и от оплождането на тези яйчни маси. Веднъж дневно яйчните маси се събират от блюдото кристализатор, което е поставено във всяка клетка за размножаване. Яйчните маси следва да се събират и прехвърлят с най-малко 2,5 ml от водата, от която са събрани, в 12-гнездова микроплака (една яйчна маса във всяко гнездо) или в други подходящи съдове, които са покрити с капак, за да се предотврати значимо изпаряване. За всяка яйчна маса се документират следните характеристики: дата на получаване, размер (нормална, т.е. 1,0 ± 0,3 cm, или малка; обикновено ≤ 0,5 cm), структура (нормална = във форма на банан със спираловидни низове от яйца, или необичайна, напр. низ от яйца, който не е със спираловидна форма) и оплождане (оплодена или неоплодена). Оплождането на яйчната маса се оценява в рамките на шест дни след като е била получена. Яйчната маса се счита за оплодена, когато най-малко една трета от яйцата се излюпят. Общият брой на женските индивиди, добавени към клетката за размножение, се използва, за да се изчислят броят на яйчните маси на женски индивид и броят на оплодените яйчни маси на женски индивид. Ако се изисква, броят на яйцата в яйчната маса може да бъде оценен, без да се нарушава целостта им, с използване на метод с пръстени (подробно описан в 32 и 33).
|
Аналитични измервания
Концентрация на изпитвания химикал
|
38.
|
Като минимум следва да се анализират проби от водата над седимента, от водата между частиците на седимента и от седимента в началото на експозицията (при вода с добавка за предпочитане е един час след прилагането) и в края на изпитването при най-високата концентрация и при по-ниска такава. Това се прилага за съдове както с едното, така и с другото поколение. От блюдата кристализатори в клетката за размножаване се анализира само водата над седимента, тъй като именно тя влиза в контакт с яйчните маси (за постановката със седимент с добавка може да бъде взето предвид аналитично потвърждаване на седиментната концентрация). Ако се сметне за необходимо, по време на изпитването могат да се проведат допълнителни измервания на седимента, водата между частиците на седимента и водата над седимента. Посочените определяния на концентрацията на изпитвания химикал дават информация за поведението/разпределението на изпитвания химикал в системата вода-седимент. За вземането на проби от седимента и водата между частиците на седимента при започване и по време на изпитването (вж. точка 39) се изискват допълнителни съдове за изпитване за извършване на аналитичното определяне. Измерванията в седимента при постановка с вода с добавка може да не са необходими, ако разпределението на изпитвания химикал между водата и седимента е ясно определено с изследване вода/седимент при сходни условия (напр. съотношение на седимента към водата, вид на прилагането, съдържание на органичен въглерод на седимента), или ако измерените концентрации във водата над седимента остават със стойности от 80 до 120 % от номиналната или измерената начална концентрация.
|
|
39.
|
Когато се правят междинни измервания (напр. на 7-ия и/или 14-ия ден) и ако анализът изисква големи проби, които не могат да се вземат от лабораторните съдове, без да се повлияе върху системата за изпитване, аналитичните определяния следва да се извършват върху проби от допълнителните съдове за изпитване, които са третирани по същия начин (включително присъствието на организми за изпитването), но които не се използват за биологични наблюдения.
|
|
40.
|
За изолиране на интерстициалната вода (= водата между частиците на седимента) се препоръчва центрофугиране при 10 000 g и 4 °C за 30 min. Ако обаче се покаже, че изпитваният химикал не се адсорбира от филтрите, филтруването също е приемливо. В някои случаи може да не е възможно да се анализират концентрациите във водата между частиците на седимента, тъй като пробата може да е с много малък размер.
|
Физични и химични параметри
|
41.
|
Стойността на рН, концентрацията на разтворения кислород във водата за изпитване и температурата на водата в съдовете за изпитване и блюдата кристализатори следва да се измерват по подходящ начин (вж. точка 10). Твърдостта и амонякът се измерват в контролните съдове и в един съд за изпитване и едно блюдо кристализатор при най-високата концентрация в началото и в края на изпитването.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
42.
|
Целта на настоящото изпитване за целия жизнен цикъл е да се определи въздействието на изпитвания химикал върху размножаването и, за две поколения, върху скоростта на развитие и общия брой на напълно имагиниралите и живи мъжки и женски индивиди. Данните за съотношението на имагиниране на мъжките и женските индивиди следва да бъдат обединени. Ако не съществуват статистически значими разлики между чувствителността в скоростта на развитие на различните полове, резултатите за мъжките и женските индивиди могат да се обединят за целите на статистическия анализ.
|
|
43.
|
Концентрациите, оказващи въздействие, изразени като концентрации във водата над седимента (за вода с добавка), обикновено се изчисляват въз основа на измерените концентрации в началото на експозицията (вж. точка 38). Поради това за водата с добавка концентрациите, обикновено измервани в началото на периода на експозиция във водата над седимента в съдовете и за двете поколения, и концентрациите в блюдата кристализатори, се осредняват за всяко третиране. За седимента с добавка концентрациите, обикновено измервани в началото на периода на експозиция в съдовете и за двете поколения (и по избор концентрациите в блюдата кристализатори), се осредняват за всяко третиране.
|
|
44.
|
За да се изчисли точкова оценка, т.е., ECx, статистиките на съд и на клетка за размножаване могат да се използват като истински повторения. При изчисляването на доверителния интервал за всяка стойност на ECx трябва да се вземе предвид варирането между съдовете, или трябва да се покаже, че то е толкова малко, че може да се пренебрегне. Когато моделът е изгладен с помощта на метода на най-малките квадрати, трябва да се приложи трансформация към статистическите данни за съд, за да се подобри хомогенността на дисперсията. Стойностите на ЕСх обаче следва да се изчисляват след като откликът е обратно трансформиран към оригиналната стойност (31).
|
|
45.
|
Когато със статистическия анализ се цели определяне на NOEC чрез проверка на хипотези, варирането между съдовете трябва да се взема под внимание, което се гарантира чрез използване на ANOVA методи (примерно процедури на теста на Уйлямс или теста на Дънет). Използването на теста на Уйлямс би било целесъобразно, когато теоретично се очаква монотонна зависимост доза-отклик, докато тестът на Дънет би бил целесъобразен там, където не се потвърждава хипотезата за монотонността. Като алтернатива, при ситуации, в които са налице нарушения на обичайните допускания на ANOVA, може да се окажат полезни по-устойчиви тестове (27).
|
Съотношение на имагиниране
|
46.
|
Стойностите на съотношението на имагиниране (ER) са двоични данни и могат да се анализират с теста на Кокрън-Армитидж, който се прилага със стъпка назад, когато се очаква монотонна зависимост доза-отклик, а тези данни потвърждават очакванията. В противен случай може да се използва точният тест на Фишер или тестът на Мантел-Хенцал с коригирани по Бонферони-Холм р-стойности. Ако между повторения при една и съща концентрация са налице данни за по-голямо вариране, отколкото би показало биномно разпределение (често наричано „екстра биномна“ вариация), следва да се прилага устойчив тест на Кокрън-Армитидж или точен тест на Фишер, както се предлага в (27).
Сборът от имагиниралите индивиди (мъжки плюс женски) на съд, ne
, се определя и се разделя на броя на въведените ларви, nа
:

където:
|
ER
|
=
|
съотношение на имагиниране
|
|
ne
|
=
|
брой на имагиниралите индивиди на съд
|
|
na
|
=
|
брой на въведените ларви на съд (обикновено 20)
|
Когато ne
е по-голям от na
(т.е. когато непреднамерено е въведен повече от предвидения брой ларви) na
следва да бъде приравнен към ne
.
|
|
47.
|
Алтернативен подход, който е най-пригоден за големи извадки, когато е налице екстра биномна дисперсия, е да се третира съотношението на имагиниране като непрекъснат отклик и да се използват процедури, съответстващи на тези данни за ER. Като голяма извадка тук се определя такава, при която броят както на имагиниралите, така и на неимагиниралите индивиди, надвишава пет за всяко повторение (съд).
|
|
48.
|
За да се приложат методите на ANOVA, стойностите на ER трябва първо да се преобразуват с трансформация „аркуссинус от корен квадратен“ или с трансформация на Тюки-Фрийман, за да се получи приблизително нормално разпределение и да се изравнят дисперсиите. При използване на абсолютни честоти може да се приложи тестът на Кокрън-Армитидж, точният тест на Фишер (Бонферони), или тестът на Мантел-Хенцал. Трансформацията „аркуссинус от корен квадратен“ се прилага, като се вземе реципрочната стойност на синус (sin– 1) от квадратния корен на ER.
|
|
49.
|
Стойностите ECx за съотношението на имагиниране се изчисляват с помощта на регресионен анализ (напр. пробит-модел, логит-модел или модел на Вейбул (28)). Ако регресионният анализ е неуспешен (напр. ако има по-малко от два частични отклика), могат да се използват други непараметрични методи, напр. хлъзгащи се средни или обикновена интерполация.
|
Скорост на развитие
|
50.
|
Средното време на развитие е средният период между въвеждането на ларвите (ден 0 на изпитването) и имагинирането на опитната кохорта от индивиди (за изчисляването на действителното време за развитие следва да бъде взета предвид възрастта на ларвите в момента на въвеждането). Скоростта на развитие (единица: 1/ден) е реципрочна на времето на развитие и отговаря на частта от развитието на ларвите, която се извършва за един ден. Скоростта на развитие се предпочита за оценката на изследванията на токсичността на седимента, тъй като нейната дисперсия е по-ниска, и тя е по-хомогенна и по-близка до нормалното разпределение, отколкото средното време на развитие. Поради това могат да се използват по-мощни параметрични тестови процедури, в които се използва скоростта на развитие, за разлика от времето за развитие. По отношение на скоростта на развитие като непрекъснат отклик, стойностите на ECx могат да се оценят с използване на регресионен анализ (напр. (29) (30)). NOEC за средна скорост на развитие може да се определи чрез ANOVA методи, напр. тестове на Уйлямс или на Дънет. Тъй като мъжките имагинират по-рано от женските, т.е. имат по-висока скорост на развитие, има смисъл да се изчислява скоростта на развитие за всеки пол поотделно, в допълнение към общата стойност за всички индивиди.
|
|
51.
|
За статистическото тестване се допуска, че наблюдаваният в ден „x“ за инспекция брой индивиди са имагинирали в средата на интервала между ден х и ден x – l (l = дължина на периода на инспекция, обикновено 1 ден). Средната скорост на развитие за съд (

) се изчислява по формулата:

където:
|

|
:
|
средна скорост на развитие за съд
|
|
i
|
:
|
индекс на периода на инспекция
|
|
m
|
:
|
максимален брой интервали на инспекция
|
|
fi
|
:
|
брой на имагиниралите индивиди през периода на инспекция i
|
|
ne
|
:
|
общ брой на имагиниралите индивиди в края на експеримента (= Σfi
)
|
|
xi
|
:
|
скорост на развитие на имагиниралите индивиди в интервала на инспекция i
|
където:
|
денi
|
:
|
ден на инспекция (дни след въвеждането на ларвите)
|
|
li
|
:
|
продължителност на интервала i (дни, обикновено 1 ден)
|
|
Съотношение между половете;
|
52.
|
Съотношенията между половете са двоични данни и следва да бъдат оценени с помощта на точен тест на Фишер или други подходящи методи. Естественото съотношение между половете при C. riparius е единица, т.е. мъжките и женските са с еднакво обилие. Данните за съотношението между половете следва да бъдат третирани по един и същ начин и за двете поколения. Тъй като максималният брой индивиди за съд (т.е. 20) е твърде нисък за съдържателен статистически анализ, общият брой на напълно имагинирали и живи индивиди за всеки пол се сумира за всички съдове на едно третиране. Тези нетрансформирани данни се тестват по отношение на контролата (на разтворител) или на обединените данни от контролите в таблица на спрегнатост 2 × 2.
|
Размножение
|
53.
|
Размножението се изчислява като плодовитост чрез броя на яйчните маси на женски индивид. По-конкретно, общият брой на яйчните маси, получени в дадена клетка за размножение, се разделя на общия брой на живи и неувредени женски индивиди, добавени в тази клетка. NOEC за плодовитостта може да се определи чрез ANOVA методи, напр. тестове на Уйлямс или на Дънет.
|
|
54.
|
Оплождането на яйчните маси се използва за количествено определяне на оплодените яйчни маси на женски индивид. Общият брой на оплодените яйчни маси, получени в дадена клетка за размножение, се разделя на общия брой на живи и неувредени женски индивиди, добавени в тази клетка. NOEC за оплождането може да се определи чрез ANOVA методи, напр. тестове на Уйлямс или на Дънет.
|
Протокол от изпитването
|
55.
|
Докладът от изпитването следва да предоставя следната информация:
|
|
Изпитван химикал:
|
—
|
физична природа, физични и химични свойства (разтворимост във вода, парно налягане, log K
ow, коефициент на разпределение в почва (или в седимент, ако такава информация е налице), стабилност във вода, в седимент и т.н.);
|
|
—
|
данни за идентичността на химикала (общоприето наименование, химично наименование, номер по CAS и т.н.), включително чистота и метод за анализ за количествено определяне на изпитвания химикал.
|
|
|
|
Изпитвани видове:
|
—
|
използвани в изпитването организми: вид, научно наименование, източник на организмите и условия на отглеждане;
|
|
—
|
информация за начина на боравене с яйчните маси и ларвите;
|
|
—
|
Информация относно обработката на имагиниралите полово зрели индивиди от 1-то поколение с помощта на всмукателен вентилатор и др. (вж. допълнение 5)
|
|
—
|
възраст на изпитваните организми по време на въвеждането на 1-то и 2-то поколение в съдовете за изпитване.
|
|
|
|
Условия на изпитването:
|
—
|
използван седимент, т.е., естествен или формулиран (изкуствен) седимент;
|
|
—
|
естествен седимент: местоположение и описание на мястото на вземане на седимента, включително (ако е възможно) история на замърсяване; характеристики на седимента: рН, съдържание на органичен въглерод, съотношение C/N и зърнометричен състав (ако е подходящо).
|
|
—
|
формулиран седимент: приготвяне, съставки и характеристики (съдържание на органичен въглерод, рН, влажност, и т.н., измерени в началото на изпитването);
|
|
—
|
подготовка на водата за изпитването (ако се използва възстановена вода) и характеристики на водата (концентрация на кислород, рН, твърдост и т.н., измерени в началото на изпитването);
|
|
—
|
дълбочина на седимента и на водата над седимента в съдовете за изпитване и блюдата кристализатори;
|
|
—
|
обем на водата над седимента и на водата между частиците на седимента; тегло на мокър седимент със и без водата между частиците на седимента за съдовете за изпитване и блюдата кристализатори;
|
|
—
|
съдове за изпитване (материал и размери);
|
|
—
|
блюда кристализатори (материал и размери);
|
|
—
|
клетки за размножаване (материал и размери)
|
|
—
|
метод за приготвяне на изходни разтвори и на концентрации за изпитване за съдовете за изпитване и за блюдата кристализатори;
|
|
—
|
прилагане на изпитвания химикал в съдовете за изпитване и блюдата кристализатори: концентрации за изпитване, брой на повторенията и разтворители, ако са необходими;
|
|
—
|
условия за инкубация за съдовете за изпитване: температура, редуване на светлина и тъмнина, светлинен интензитет, аериране (мехурчета в секунда);
|
|
—
|
условия за инкубация за клетките за размножаване и за блюдата кристализатори: температура, редуване на светлина и тъмнина, светлинен интензитет;
|
|
—
|
условия за инкубация за яйчните маси в микроплаките (или други съдове): температура, редуване на светлина и тъмнина, светлинен интензитет:
|
|
—
|
подробна информация за храненето, включително вида на храната, приготвянето и режима на хранене.
|
|
|
|
Резултати:
|
—
|
номинални концентрации на изпитване, измерени концентрации на изпитване, резултати от всички анализи за определяне на концентрацията на изпитвания химикал в съдовете за изпитване;
|
|
—
|
качество на водата в съдовете за изпитване и блюдата кристализатори, т.е., рН, температура, разтворен кислород, твърдост и амоняк;
|
|
—
|
замяна на изпарилата се вода от изпитването за съдовете за изпитване, ако има такава;
|
|
—
|
брой на имагиниралите мъжки и женски индивиди за съд и за ден от 1-вото и от 2-то поколение;
|
|
—
|
съотношение между половете на напълно имагиниралите и живи индивиди на третиране за 1-вото и 2-то поколение
|
|
—
|
брой ларви, недостигнали до стадий на имаго за съд за 1-вото и 2-то поколение;
|
|
—
|
процент/дял на имагиниране на повторение и на концентрация за изпитване (обединени мъжки и женски индивиди) за 1-вото и 2-то поколение;
|
|
—
|
средна скорост на развитие на напълно имагиниралите и живи индивиди на повторение и на концентрация на третиране (мъжки и женски индивиди както поотделно, така и обединени) за 1-вото и 2-то поколение;
|
|
—
|
брой на яйчните маси, положени в блюдата кристализатори на клетка за съответните клетка за размножаване и ден;
|
|
—
|
характеристики на всяка яйчна маса (размер, форма и оплождане);
|
|
—
|
Плодовитост — общ брой на яйчните маси спрямо общия брой женски индивиди, добавени към клетката за размножение;
|
|
—
|
Оплождане — общ брой на оплодените яйчни маси спрямо общия брой женски индивиди, добавени към клетката за размножение;
|
|
—
|
оценки на стойностите на крайни точки за токсичността, напр. ECx (и свързаните с тях доверителни интервали), NOEC, както и статистическите методи, използвани за тяхното определяне;
|
|
—
|
обсъждане на резултатите, включително всякакво влияние върху резултата от изпитването, вследствие на отклонения от настоящия метод за изпитване.
|
|
|
ЛИТЕРАТУРА
|
(1)
|
Глава В.28 от настоящото приложение, Изпитване за токсичност на хирономиди в система вода-седимент с използване на вода с добавка.
|
|
(2)
|
Shobanov, N.A., Kiknadze, I.I. and M.G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311–322.
|
|
(3)
|
Fleming, R. et al. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. August 1994. WRc, UK.
|
|
(4)
|
SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, From the WOSTA Workshop held in the Netherlands.
|
|
(5)
|
ASTM International (2009), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
(6)
|
Environment Canada (1997), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, December 1997.
|
|
(7)
|
US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, Second edition, EPA 600/R-99/064, March 2000, Revision to the first edition dated June 1994.
|
|
(8)
|
US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates.
|
|
(9)
|
US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment toxicity Test.
|
|
(10)
|
Milani, D., Day, K.E., McLeay, D.J. and R.S. Kirby (1996), Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canada.
|
|
(11)
|
Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R. and C.D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662-2674.
|
|
(12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. and L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221-230.
|
|
(13)
|
Sugaya, Y. (1997), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345-350.
|
|
(14)
|
Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47-57.
|
|
(15)
|
Глава В.27 от настоящото приложение, Изпитване за токсичност на хирономиди в система вода-седимент с използване на седимент с добавка.
|
|
(16)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000)6, OECD, Paris.
|
|
(17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. and M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
(18)
|
Environment Canada. (1995), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, September 1995.
|
|
(19)
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. and J. Oehlmann (2005), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: 353-361.
|
|
(20)
|
Suedel, B.C. and J.H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163-1175.
|
|
(21)
|
Naylor, C. and C. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291-3303.
|
|
(22)
|
Dunnett, C.W. (1964), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096-1121.
|
|
(23)
|
Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: 482-491.
|
|
(24)
|
Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117.
|
|
(25)
|
Williams, D.A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28: 510-531.
|
|
(26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L. and H.M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94-102.
|
|
(27)
|
Rao, J.N.K. and A.J. Scott (1992), A simple method for the analysis of clustered binary data. Biometrics, 48: 577-585.
|
|
(28)
|
Christensen, E.R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213-221.
|
|
(29)
|
Bruce, R.D. and D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485-1494.
|
|
(30)
|
Slob, W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298-312.
|
|
(31)
|
OECD (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No. 54, 146 pp., ENV/JM/MONO(2006)18, OECD, Paris.
|
|
(32)
|
Benoit, D.A., Sibley, P.K., Juenemann, J.L. and G.T. Ankley (1997), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165-1176.
|
|
(33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. and J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) — baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: 1-9.
|
|
(34)
|
OECD (2010), Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OECD, Paris.
|
Допълнение 1
Определения
За целите на настоящия метод за изпитване са използвани следните определения:
|
|
Химикал означава вещество или смес.
|
|
|
Формулиран седимент или възстановен, изкуствен или синтетичен седимент, е смес от материали, използвани за симулиране на физичните съставки на естествен седимент.
|
|
|
Вода над седимента е водата, която се намира над седимента в съда за изпитване.
|
|
|
Интерстициална вода, или вода между частиците на седимента е водата, която заема пространството между седимента и частиците на почвата.
|
|
|
Вода с добавка е вода, към която е добавен изпитваният химикал.
|
|
|
Изпитван химикал е всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
|
Допълнение 2
Препоръки за отглеждане на Chironomus riparius
|
1.
|
Ларвите на Chironomus могат да се отглеждат в блюда кристализатори или в по-големи контейнери. На дъното на контейнера се разпръсква фин кварцов пясък на тънък слой с дебелина 5 до 10 mm. Беше посочено, че кизелгурът (напр. арт. 8117 на Merck) също е подходящ субстрат (по-тънък слой от само няколко mm е достатъчен). След това се добавя подходяща вода до достигане на дълбочина от няколко сm. Долива се вода, ако е необходимо, за да се компенсира загубата от изпаряване и за да се предотврати изсушаването. Водата може да се сменя, ако е необходимо. Следва да се осигури умерено аериране. Съдовете за отглеждане на ларвите следва да се поставят в подходяща клетка, с която да се предотврати напускането на имагиниращите полово зрели индивиди. Клетката следва да бъде с достатъчни размери, за да се даде възможност за оформяне на рой от имагиниралите полово зрели индивиди, защото в противен случай може да не се стигне до копулация (най-малко около 30 × 30 × 30 сm).
|
|
2.
|
Клетките следва да се държат при стайна температура или в помещение с постоянни характеристики на средата при 20 ± 2 °С със светъл период от 16 часа (интензитет около 1 000 lux) и 8 часа тъмнина. Докладвано е, че относителна влажност на въздуха, по-ниска от 60 %, може да възпрепятства размножаването.
|
Вода за разреждане
|
3.
|
Може да се използва всяка естествена или синтетична вода. Практиката е да се използва вода от кладенец, дехлорирана чешмяна вода и изкуствена среда (напр. среда Elendt „M4“ или „M7“). Преди употреба водата трябва да бъде аерирана. Ако е необходимо, водата за отглеждане може да се обновява, като се внимателно се излива или изсмуква използваната вода от съдовете за отглеждане, без да се унищожават тръбичките на ларвите.
|
Хранене на ларвите
|
4.
|
Ларвите на Chironomus трябва да се хранят с храна за риба на люспи (Tetra Min®, Tetra Phyll® или друга подобна търговска марка храна за риба) по около 250 mg на съд на ден. Храната може да се дава като сух смлян прах или като суспензия във вода: 1,0 g храна във вид на люспи се добавя към 20 ml вода за разреждане и се разбърква, за да се образува хомогенна смес. Така получената смес може да се дава в количество от около 5 ml на съд дневно. (разбърква се преди употреба). По-старите ларви могат да получават повече храна.
|
|
5.
|
Храненето се коригира съобразно качеството на водата. Ако средата за отглеждане стане мътна, количеството храна трябва да се намали. Добавянето на храна се следи внимателно. Даването на прекалено малко храна ще предизвика миграция на ларвите във водата над седимента, а твърде много храна ще предизвика увеличаване на дейността на микробите и по-ниски нива на кислорода. И двете обстоятелства могат да доведат до по-ниска скорост на развитие.
|
|
6.
|
Могат също да се добавят и клетки от някои зелени водорасли (напр. Scenedesmus subspicatus, Chlorella vulgaris), когато се подготвят нови съдове за отглеждане.
|
Хранене на имагиниралите възрастни
|
7.
|
Някои експериментатори изказват идеята, че тампон от памук, напоен с наситен разтвор на захароза, може да се използва за хранене на имагиниралите възрастни.
|
Имагиниране
|
8.
|
При температура от 20 °С ± 2 °С след приблизително 13—15 дни от съдовете за отглеждане на ларви ще започнат да имагинират полово зрелите индивиди. Мъжките лесно се разпознават по перестите си антени и слабото телосложение.
|
Яйчни маси
|
9.
|
Щом в клетката за размножаване се поставят полово зрели индивиди, всички съдове за отглеждане трябва да се проверяват три пъти седмично за полагане на пихтиести яйчни маси. Ако са налице, яйчните маси следва да бъдат внимателно отстранени. Те следва да се преместят в малко блюдо, съдържащо проба от водата за размножаване. Яйчните маси се използват за започване на отглеждане в нов съд за отглеждане (напр. 2—4 яйчни маси/съд) или се използват в изпитванията за токсичност.
|
|
10.
|
След 2—3 дни следва да се излюпят ларви от първи стадий.
|
Създаване на нови съдове за отглеждане
|
11.
|
След като е сложено началото на отглеждането, следва да е възможно да се създава нов съд за отглеждане на ларви всяка седмица или по-рядко, в зависимост от изискванията на изпитването, като старите съдове се отстраняват от изпитването, след като имагинирането на полово зрелите индивиди е завършило. Използването на тази система позволява редовно получаване на полово зрели индивиди с минимална организация.
|
Приготвяне на разтвори за изпитване „М4“ и „М7“
|
12.
|
В Elendt (1990) е описана среда „М4“. Среда „М7“ се приготвя като „М4“, освен по отношение на указаните в таблица 1 вещества, при които за „М7“ се използват концентрации, четири пъти по-ниски, отколкото използваните в „М4“. Разтворът за изпитване не трябва да се приготвя според Elendt and Bias (1990), тъй като концентрациите на NaSiO3 · 5H2O, NaNO3, KH2PO4 and K2HPO4, посочени за приготвянето на изходния разтвор, не са подходящи.
|
Приготвяне на среда „М7“
|
13.
|
Всеки изходен разтвор (I) се приготвя отделно и с изходните разтвори (I) се приготвя комбиниран изходен разтвор (II) (вж. таблица 1). За получаване на среда „М7“ петдесет ml от комбинирания изходен разтвор (II) и посочените в таблица 2 количества от изходните разтвори на макро храни се допълват до 1 литър с дейонизирана вода. Приготвя се изходен разтвор на витамини, като се добавят трите витамина, както е посочено в таблица 3, към дейонизирана вода, и 0,1 ml от комбинирания изходен разтвор на витамини се добавя към крайната среда „М7“ малко преди употреба. Изходният разтвор на витамини се съхранява замразен на малки аликвотни части. Средата се аерира и стабилизира.
|
Таблица 1
Изходни разтвори на микроелементи за среди М4 и М7
|
Изходни разтвори (I)
|
Количество (mg), разреждано до 1 l с дейонизирана вода
|
За приготвянето на комбинирания изходен разтвор (II): смесват се следните количества (ml) от всеки от изходните разтвори (I) и се долива до 1 литър дейонизирана вода.
|
Крайни концентрации в разтворите за изпитване (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7H2O (25)
(26)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Таблица 2
Изходни разтвори на макрохранителни вещества за среди М4 и М7
|
|
Количество, разреждано до 1 l с дейонизирана вода
(mg)
|
Изходни разтвори на макрохранителни вещества, добавяни за приготвяне на среди М4 и М7
(mg/l)
|
Крайни концентрации в разтвори за изпитване М4 и М7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Таблица 3
Изходни разтвори на витамини за среди М4 и М7
Събират се всички три разтвора на витамини, за да се приготви един общ изходен разтвор на витамини
|
|
Количество, разреждано до 1 l с дейонизирана вода
(mg)
|
Количество изходен разтвор на витамини, добавяно за приготвяне на среди М4 и М7
(mg/l)
|
Крайни концентрации в разтвори за изпитване М4 и М7
(mg/l)
|
|
Тиаминхидрохлорид
|
750
|
0,1
|
0,075
|
|
Цианокобаламин (B12)
|
10
|
0,1
|
0,0010
|
|
Биотин
|
7,5
|
0,1
|
0,00075
|
ПОЗОВАВАНИЯ
BBA (1995), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, Edited by M. Streloke and H. Köpp. Berlin.
Elendt, B.P. (1990), Selenium deficiency in Crustacea, Protoplasma, 154: 25-33.
Elendt, B.P. and W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157-1167.
Допълнение 3
Приготвяне на формулиран седимент
СЪСТАВ НА СЕДИМЕНТА
Съставът на формулирания седимент е, както следва:
|
Съставка
|
Характеристики
|
% седимент сухо тегло
|
|
Торф
|
Торф от торфен мъх, с рН възможно най-близо до 5,5—6,0, без видими остатъци от растения и фино смлян (размер на частиците ≤ 1 mm) и изсушен на въздух
|
4 — 5
|
|
Кварцов пясък
|
Размер на зърната: > 50 % от частиците следва да бъдат в интервала 50-200 μm
|
75 — 76
|
|
Каолин
|
Съдържание на каолинит ≥ 30 %
|
20
|
|
Органичен въглерод
|
Коригира се чрез добавяне на торф и пясък
|
2 (± 0,5)
|
|
Калциев карбонат
|
CaCO3, на прах, химически чист
|
0,05 — 0,1
|
|
Вода
|
Проводимост ≤ 10 μS/cm
|
30 — 50
|
ПРИГОТВЯНЕ
Торфът се изсушава с въздух и се смила на фин прах. Приготвя се суспензия от изискваното количество торф на прах в дейонизирана вода, като се използва високопроизводително хомогенизиращо устройство. Стойността на рН на тази суспензия се коригира до 5,5 ± 0,5 с CaCO3. Суспензията се аклиматизира най-малко два дни при 20 ± 2 °C, като се разбърква леко, за да се стабилизира рН и да се създаде стабилна микробна среда. Отново се измерва рН, което трябва да бъде 6,0 ± 0,5. След това торфената суспензия се смесва с другите съставки (пясък и каолин) и дейонизирана вода, за да се получи хомогенен седимент със съдържание на вода в интервала 30–50 % от сухото тегло на седимента. Измерва се отново рН на крайната смес и, ако е необходимо, се коригира до 6,5—7,5 с CaCO3. Вземат се проби от седимента, за да се определи сухото тегло и съдържанието на органичен въглерод. Освен това, препоръчва се преди използването му в изпитване за токсичност за хирономиди, изкуственият седимент да бъде аклиматизиран в продължение на седем дни при същите условия, при които ще се провежда изпитването.
СЪХРАНЕНИЕ
Сухите съставки за приготвянето на изкуствения седимент могат да се съхраняват в сухо и хладно място при стайна температура. Формулираният (влажен) седимент не трябва да се съхранява преди употребата му в изпитването. Той следва да се употребява незабавно след 7-дневния период за аклиматизация, с който завършва приготвянето му.
ПОЗОВАВАНИЯ
OECD (1984), Earthworm, Acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OECD, Paris.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. and B. Streit (1998), Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10-20.
Допълнение 4
Химични характеристики на приемлива вода за разреждане
|
СЪСТАВКА
|
КОНЦЕНТРАЦИИ
|
|
Твърди частици
|
< 20 mg/l
|
|
Общ органичен въглерод
|
< 2 mg/l
|
|
Нейонизиран амоняк
|
< 1 μg/l
|
|
Твърдост, изразена като CaCO3
|
< 400 mg/l (27)
|
|
Остатъчен хлор
|
< 10 μg/l
|
|
Общо органофосфорни пестициди
|
< 50 ng/l
|
|
Общо органохлорни пестициди плюс полихлорирани бифенили
|
< 50 ng/l
|
|
Общ органичен хлор
|
< 25 ng/l
|
Допълнение 5
Насоки за параметрите на изпитването
Пример за клетка за размножение:

|
A
|
:
|
марля (с размер на отвора приблизително 1 mm) в горната част и една странична част на клетката като минимум
|
|
B
|
:
|
отвор за поставяне на имагиниралите възрастни в клетката за размножение, както и за отстраняване на положените яйчни маси от блюдата кристализатори (не е показан на тази графика)
|
|
C
|
:
|
клетка за размножаване с минимални размери 30 cm дължина, 30 cm ширина и 30 cm височина
|
Пример за съд за изпитване:

|
A
|
:
|
пипета „Пастьор“ за подаване на въздух във водата над седимента
|
|
B
|
:
|
стъклен капак за предотвратяване на напускането на имагиниралите индивиди
|
|
C
|
:
|
воден слой
|
|
D
|
:
|
съд за изпитване (стъклена бехерова чаша с минимална вместимост 600 ml)
|
|
E
|
:
|
слой на седимента
|
Пример за всмукателен вентилатор за улавяне на полово зрелите индивиди (стрелките указват посоката на въздушния поток):
|
A
|
:
|
стъклена тръба (вътрешен диаметър приблизително 5 mm), свързана със самозасмукваща помпа
|
|
B
|
:
|
запушалка от вулканизиран каучук, перфорирана със стъклена тръба (А). от вътрешната страна отворът на стъклената тръба (А) е покрит с малко памук и марля (размер на отворите около 1 mm), за да се избегне увреждане на индивидите при засмукването им във всмукателния вентилатор
|
|
C
|
:
|
прозрачен контейнер (пластмасов или стъклен, дължина около 15 cm) за уловените индивиди
|
|
D
|
:
|
корк от вулканизиран каучук, перфориран с тръба (Д). За освобождаване на индивидите в клетката за размножаване, коркът Г се освобождава от контейвера В
|
|
E
|
:
|
тръба (пластмаса или стъкло, вътрешен диаметър приблизително 8 mm) за събиране на полово зрелите индивиди от съда
|
Схематично представяне на изпитване за целия жизнен цикъл:

|
А
|
:
|
1-во поколение — съдове за изпитване, съдържащи система седимент-вода, осем повторения, 20 ларви в първи ларвен стадий на съд
|
|
Б
|
:
|
четири съда за изпитване за всяка клетка за размножаване, А и Б
|
|
В
|
:
|
клетки за размножаване (А и Б) за роене, чифтосване и яйцеполагане
|
|
Г
|
:
|
блюда кристализатори за полагане на яйчни маси
|
|
Д
|
:
|
микроплаки, по едно гнездо за всяка яйчна маса
|
|
Е
|
:
|
2-ро поколение — съдове за изпитване, съдържащи система седимент-вода, осем повторения, 20 ларви в първи ларвен стадий на съд
|
В.41. ИЗПИТВАНЕ ЗА РАЗВИТИЕ НА ПОЛА ПРИ РИБИТЕ
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 234 (2011). Той се основава на решение от 1998 г. за разработване на нови или актуализиране на съществуващи методи за изпитване за скрининг и изпитвания за потенциални нарушители на функциите на ендокринната система. Изпитването за развитие на пола при рибите (ИРПР) бе идентифицирано като многообещаващ метод за изпитване, обхващащ чувствителен стадий от жизнения цикъл на рибите, с отклик на химикали, подобни както на естроген, така и на андроген. Методът за изпитване е преминал през междулабораторно валидиране, извършено от 2006 до 2010 г., при което японската оризия (Oryzias latipes), зебровото данио (Danio rerio) и трииглата бодливка (Gasterosteus aculeatus) са били валидирани, а Pimephales promelas е била частично валидирана (41) (42) (43). Настоящият протокол включва японската оризия, трииглата бодливка и зебровото данио. Протоколът по принцип е усъвършенстван вариант на Насоки на ОИСР 210 „Риби, изследване на токсичността в ранния жизнен стадий“ (1), при който експозицията продължава докато полът на рибите се диференцира, т.е. около 60 дни след излюпването (dph) за японската оризия, трииглата бодливка и зебровото данио (периодът на експозиция може да е по-кратък или по-дълъг за други видове, валидирани в бъдеще), и се добавят чувствителни за функциите на ендокринната система крайни точки. Чрез ИРПР се оценява въздействието в ранните етапи от жизнения цикъл, както и потенциалните неблагоприятни последици за развитието на пола от химикали, за които се предполага, че нарушават функциите на ендокринната система (напр. естрогени, андрогени и инхибитори на стероидогенезата). Комбинацията от двете основни крайни точки за ендокринната система — концентрацията на вителогенин (VTG) и фенотипното съотношение между половете позволява на изпитването да посочи начина на действие на изпитвания химикал. Поради значими за популацията изменения на фенотипното съотношение между половете, ИРПР може да се използва за оценка на опасността и риска. Независимо от това, ако изпитването се използва за оценка на опасността или риска, не следва да се използва бодливката, тъй като наличните до момента данни от валидирането са показали, че при този вид не са обичайни предизвиканите от изпитвания химикал изменения на съотношението между фенотипните полове.
|
|
2.
|
Протоколът се основава на риби, експонирани на въздействието на химикали чрез водата по време на периода между диференцирането на гонадите и образуването на първите гамети, през който рибите се очаква да бъдат по-чувствителни към въздействията от химикали, нарушаващи функциите на ендокринната система, които пречат на развитието на пола. Две основни крайни точки се измерват като показатели за свързани с ендокринната система отклонения в развитието — концентрациите на VTG и съотношенията между половете (дялове на съответните полове), определяни чрез хистология на гонадите. Хистопатологията на гонадите (оценка и определяне на етапите при овоцитите и сперматогенните клетки) е по избор. Освен това, когато е възможно, се определя генетичният пол (напр. при японската оризия и трииглата бодливка). Присъствието на маркер за генетичния пол е значително предимство, защото увеличава мощността на статистиките за съотношението между половете и дава възможност за откриване на индивидуална инверсия на фенотипния пол. Други апикални крайни точки, които трябва да бъдат измерени, включват процент на излюпване, преживяване, дължина и телесно тегло. Този метод за изпитване може да се приспособява към видове, различни от посочените по-горе, при условие че другите видове бъдат подложени на валидиране, еквивалентно на извършеното за японската оризия, трииглата бодливка и зебровото данио, че рибите в контролите са полово диференцирани в края на изпитването, че нивата на VTG са достатъчно високи за откриване на значимо вариране, свързано с химикалите, и че чувствителността на системата за изпитване се определя с използване на ендокринно активни референтни химикали ((анти)-естрогени, (анти)-андрогени, инхибитори на ароматазата и др.). В допълнение, всеки протокол (или протоколи) за валидиране, позоваващ се на данни от ИРПР с използване на други видове, следва да бъде проверен от ОИСР и резултатът от валидирането следва да се смята за задоволителен.
|
Първоначални съображения и ограничения
|
3.
|
VTG обикновено се произвежда от черния дроб на женски яйценосни гръбначни животни в отговор на циркулиращия ендогенен естроген (2). Той е прекурсор на белтъците в яйчния жълтък и след образуването си в черния дроб преминава в кръвообращението, откъдето стига до яйчника и там се модифицира в образуващия се хайвер. Синтезът на VTG е много ограничен, макар и забележим, в недостигнали полова зрялост риби и в полово зрели мъжки риби, поради липса у тях на достатъчно количество циркулиращ естроген. Черният дроб обаче може да синтезира и секретира VTG в отговор на външно естрогенно стимулиране (3) (4) (5).
|
|
4.
|
Измерването на VTG служи за откриване на химикали с естрогенен, анти-естрогенен и андрогенен начин на действие, и на химикали, които пречат на стероидогенезата, например като инхибитори на ароматазата. Откриването на химикали с естрогенно действие е възможно чрез измерване на индуцирането на VTG в мъжки риби, и е много добре документирано в научната литература, преминала през партньорска проверка. Индуциране на VTG е доказано и след експозиция на андрогени, които могат да се ароматизират (6) (7). Намаляването на равнището на циркулиращ естроген в женските животни, например посредством инхибиране на ароматазата, превръщаща ендогенния андроген в природния естроген 17β-естрадиол, води до намаляване на концентрацията на VTG, което се използва за откриване на химикали, притежаващи свойства на инхибитори по отношение на ароматазата или, по-общо, на инхибитори на стероидогенезата (33). Биологичната значимост на отговора с VTG след естрогенно/ароматазно инхибиране е установена и е широко документирана (8) (9). Възможно е обаче образуването на VTG в женски животни да е също така повлияно от обща токсичност и начини на токсично действие, различни от ендокринните.
|
|
5.
|
Няколко методи за измерване са успешно разработени и стандартизирани за рутинна употреба, за количествено определяне на VTG във взети от отделни риби проби в кръвта, в черния дроб, в цялото тяло или в хомогенат глава/опашка. Такъв е случаят със зебровото данио, трииглата бодливка и японската оризия, както и с частично валидирания вид Pimephales promelas; На разположение са специфични за отделните видове ензимно-свързани имуносорбентни анализи (ELISA), използващи имунохимия за количествено определяне на VTG (5) (10) (11) (12) (13) (14) (15) (16). При японската оризия и зебровото данио съществува добра корелация между VTG, измерен в проби от кръвна плазма, черен дроб и хомогенат, въпреки че при хомогенати като цяло се получават малко по-ниски стойности, отколкото от плазма (17) (18) (19). В допълнение 5 са дадени препоръчителните процедури за събирането на проби за анализ на VTG.
|
|
6.
|
Промяна в съотношението между фенотипните полове на (дялове на съответните полове) е крайна точка, отразяваща инверсията на пола. По принцип естрогените, анти-естрогените, андрогените, анти-андрогените и химикалите, потискащи стероидогенезата, могат да повлияят на съотношението между половете при развиващи се риби (20). Доказано е, че тази инверсия на пола е отчасти обратима при зебровото данио (21) след експозиция на химикал, сходен с естроген, докато инверсията на пола след експозиция на химикал, сходен с андроген, е окончателна (30). Полът се дефинира като женски, мъжки, междинен (в една гонада има както овоцити, така и сперматогенни клетки) или недиференциран, и се определя в отделните риби чрез хистологично изследване на гонадите. Указания са дадени в допълнение 7 и в Ръководството на ОИСР за диагностициране на свързана с ендокринната система хистопатология на гонадите при риби (22).
|
|
7.
|
Генетичният пол се проверява чрез генетични маркери, когато има такива в даден вид риби. При японската оризия женските ХХ или мъжките XY гени могат да бъдат открити чрез полимеразна верижна реакция (PCR), или свързаният с Y ген от домен DM (DMY) може да бъде анализиран (DMY-отрицателен или положителен), както е описано в (23) (24). При трииглата бодливка има еквивалентен PCR метод за определяне на генетичния пол, описан в допълнение 10. Когато генетичният пол може да бъде индивидуално свързан с фенотипния пол, мощта на теста се подобрява и следователно генетичният пол следва да бъде определян във видовете с документирани маркери за генетичния пол.
|
|
8.
|
Двете основни ендокринни крайни точки, VTG и съотношението между половете, могат в съчетание да докажат ендокринния начин на действие (НД) на химикала (таблица 1). Съотношението между половете е значим за популацията биомаркер (25) (26) и за някои ясно определени начини на действие резултатите от ИРПР могат да бъдат използвани за целите на оценката на опасността и риска, когато това се счита за целесъобразно от регулаторния орган. Тези начини на действие са понастоящем естрогените, андрогените и инхибиторите на стероидогенезата.
Таблица 1
Реакция на ендокринните крайни точки за различни начини на действие на химикали:
↑= нараства, ↓= намалява, — = не е изследвано
|
НД
|
VTG ♂
|
VTG ♀
|
Съотношение между половете;
|
Позовавания
|
|
Слаб естрогенен агонист
|
↑
|
↑
|
↑ ♀ или ↑Недифер
|
(27) (40)
|
|
Силен естрогенен агонист
|
↑
|
↑
|
↑ ♀ или ↑Недифер, няма ♂
|
(28) (40)
|
|
Естрогенен антагонист
|
—
|
—
|
↓♀, ↑Недифер.
|
(29)
|
|
Андрогенен агонист
|
↓ или —
|
↓ или —
|
↑ ♂, няма ♀
|
(28) (30)
|
|
Андрогенен антагонист
|
—
|
—
|
↑♀
↑Междинен пол
|
(31)
|
|
Инхибитор на ароматазата
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
ИРПР не обхваща стадия на размножаване на рибите и следователно химикалите, за които се предполага, че влияят върху размножаването при концентрации, по-ниски тези за развитието на пола, следва да бъдат проучени в изпитване, обхващащо размножаването.
|
|
10.
|
Определенията, използвани за целите на настоящия метод за изпитване, са дадени в допълнение 1.
|
|
11.
|
ИРПР in vivo е предназначен за откриване на химикали с андрогенни и естрогенни свойства, както и анти-андрогенни, анти-естрогенни и потискащи стероидогенезата свойства. Фазите на валидирането на ИРПР (1 и 2) не обхващат естрогенни, андрогенни и потискащи стероидогенезата химикали. Въздействията в ИРПР на естрогенни и андрогенни антагонисти може да се види в таблица 1, но тези ЕНД са по-слабо документирани към момента.
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
12.
|
При изпитването рибите се експонират от новооплодения хайвер до завършването на половата диференциация, най-малко на три концентрации на изпитвания химикал, разтворен във вода. Изпитването трябва да е при проточни условия, освен ако това не е възможно поради наличието или природата (напр. ограничена разтворимост) на изпитвания химикал. Изпитването започва с поставянето на новооплодени хайверни зърна (преди дробенето на бластодиска) в камерите за изпитване. Зареждането на камерите е описано за всеки вид в точка 27. За валидираните рибни видове (японската оризия, трииглата бодливка и зебровото данио) изпитването приключва на 60 dph. При приключването на изпитването всички риби се умъртвяват по хуманен начин. От всяка риба се взема биологична проба (кръвна плазма, черен дроб или хомогенат глава/опашка) за анализ на VTG, а останалата част се фиксира за хистологична оценка на гонадите с цел определяне на фенотипния пол; по избор може да бъде извършвана хистопатология (например определяне на етапите при гонадите, степен на проява на междинния пол). Биологична проба (аналната или гръбната перка) за определяне на генетичния пол се взема от видовете, притежава подходящите маркери (допълнения 9 и 10).
|
|
13.
|
Преглед на съответните условия на изпитване, специфични за валидираните видове: японската оризия, трииглата бодливка и зебровото данио) е даден в допълнение 2.
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНИЯ ХИМИКАЛ
|
14.
|
На разположение следва да са резултати от изпитване за остра токсичност или друго краткосрочно изследване за токсичност [напр. метод за изпитване В.14 (34), и насоки на ОИСР 210 (1)], за предпочитане извършено с видовете, избрани за настоящото изпитване. Това предполага, че разтворимостта във вода и парното налягане на изпитвания химикал са известни и е налице надежден аналитичен метод за количествено определяне на химикала в камерите за изпитване с позната и протоколирана точност и граница на откриване.
|
|
15.
|
Друга полезна информация включва структурната формула, чистотата на химикала, стабилността му във вода или на светлина, pKa, Pow и резултатите от изпитване за пълна биоразградимост (вж. метод В.4) (35).
|
Критерии за приемане на изпитването
|
16.
|
За да са приемливи резултатите от изпитването, се прилагат следните условия:
|
—
|
концентрацията на разтворен кислород трябва да бъде най-малко 60 от стойността на насищане при равновесие с атмосферния въздух (ASV) по време на извършването на изпитването;
|
|
—
|
температурата на водата трябва да се различава с не повече от ± 1,5 °C между камерите за изпитване по всяко време на провеждането на изпитването, и се поддържа в рамките на температурните диапазони, посочени за изпитваните видове (допълнение 2).
|
|
—
|
Следва да е на разположение валидиран метод за анализ на химикала за експозицията, като границата на откриване на този метод следва да е доста под най-ниската номинална концентрация, и следва да се съберат доказателства, доказващи, че концентрацията на изпитвания химикал в разтвор е била задоволително поддържана в рамките на ± 20 % от средните измерени стойности;
|
|
—
|
цялостното преживяване на оплодените хайверни зърна в контролите и, където е относимо, в контролите на разтворител, трябва да бъде по-голямо или равно на границите, определени в допълнение 2;
|
|
—
|
Критерии за приемане, свързани с растежа и дяловете на половете при приключването на изпитването се основават на данни от контролните групи (обединени контроли на разтворител и на вода, освен ако те се различават значимо, като в последния случай само на разтворител):
|
|
японска оризия
|
зеброво данио
|
триигла бодливка
|
|
Растеж
|
Риба, мокро тегло, след попиване
|
> 150 mg
|
> 75 mg
|
> 120 mg
|
|
Дължина (стандартна дължина)
|
> 20mm
|
> 14 mm
|
> 20 mm
|
|
Съотношение между половете (% мъжки или женски)
|
30-70 %
|
30-70 %
|
30-70 %
|
|
|
—
|
Когато се използва разтворител, той следва да няма статистически значимо въздействие върху преживяването и трябва да не предизвиква никакво нарушаване на функциите на ендокринната система или други вредни въздействия на ранните стадии от жизнения цикъл, което се вижда при контрола на разтворител.
|
Ако се наблюдава отклонение от критериите за приемане на изпитването, последиците следва да се съобразят с надеждността на данните от изпитването и тези съображения следва да бъдат включени в протоколирането.
|
ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
Камери за изпитване
|
17.
|
Могат да се използват всякакви камери от стъкло, неръждаема стомана или други химически неутрални материали. Камерите следва да са достатъчно широки, за да съответстват на критериите за степен на зареждане, посочени по-долу. Препоръчва се камерите за изпитване да са разположени на случаен принцип в зоната на извършване на изпитването. Рандомизираният блоков план, при който всяка концентрация е налична във всеки блок, се предпочита пред напълно рандомизирания. Камерите за изпитване следва да са защитени от нежелани смущения.
|
Избор на видове
|
18.
|
Препоръчваните видове риби са дадени в допълнение 2. Процедурите за включване на нови видове са дадени в точка 2.
|
Отглеждане на родителски индивиди
|
19.
|
Подробности относно съхраняването на родителските риби при задоволителни условия могат да се намерят в насоки на ОИСР 210 (1). Родителските риби следва да бъдат хранени веднъж или два пъти дневно с подходяща храна.
|
Третиране на ембрионите и ларвите
|
20.
|
Първоначално ембрионите и ларвите могат да се експонират, в рамките на основната камера, в по-малки камери от стъкло или неръждаема стомана, снабдени със страни или краища с отвори, за да се позволи потокът на изпитвания химикал през камерата. Може да се предизвика слаб поток през тези малки камери чрез поставянето им на ръчка, монтирана да премества съда нагоре и надолу, но като запазва винаги организмите във водата.
|
|
21.
|
Когато за задържане на хайвера в основната камера за изпитване са били използвани контейнери с хайвер, решетки и сита, тези ограничители се отстраняват след излюпването на ларвите, c изключение на ситата, които следва да се задържат, за да се предотврати изпускането на рибите. Ако има нужда от прехвърляне на ларвите, те следва да не се излагат на въздух и не следва да се използват мрежи, да за се освободи рибата от контейнерите с хайвера. Графикът за това прехвърляне е различен за различните видове, и прехвърлянето не винаги е необходимо.
|
Вода
|
22.
|
Всяка вода, в която изпитваният вид показва преживяване в контролата най-малко такова, каквото и във водата, описана в допълнение 3, е подходяща да се използва като вода за изпитването. Необходимо е постоянно качество на водата по време на изпитването. За да се гарантира, че водата за разреждане няма да повлияе неправилно върху резултата от изпитването (например чрез реагиране с изпитвания химикал) или да навреди на родителите, пробите за анализ следва да се вземат на интервали. Общият органичен въглерод, проводимостта, рН и суспендираните твърди вещества следва да се измерват, например на всеки три месеца, когато се знае, че водата за разреждане има относително постоянно качество. Ако качеството на водата не е сигурно, следва да се правят измервания за тежки метали (например Cu, Pb, Zn, Hg, Cd, Ni), основни аниони и катиони (например Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) и пестициди. Подробности относно химичния анализ и събирането на водата могат да бъдат намерени в точка 34.
|
Разтвори за изпитване
|
23.
|
Следва да се използва проточна система, ако е практически възможно. За изпитванията с проточна система се изисква система, която постоянно подава и разрежда изходен разтвор на изпитвания химикал (например система с измерваща помпа, пропорционално разреждащо устройство и сатуратор), за да се подават серии от концентрации към камерите за изпитване. Дебитът на изходните разтвори и този на водата за разреждане следва да се проверяват на интервали по време на изпитването и през това време не следва да се променят с повече от 10 %. За подходящ се счита дебит, равен на поне пет обема на камера за изпитване за 24 часа (1). Трябва внимателно да се избягва използването на пластмасови тръби или други материали, някои от които могат да съдържат биологично активни химикали или могат да адсорбират изпитвания химикал.
|
|
24.
|
Изходният разтвор се приготвя за предпочитане без използване на разтворители, чрез просто смесване и разбъркване на изпитвания химикал във водата за разреждане, като се използват механични средства (например разклащане или ултрасонификация). Ако разтварянето на изпитвания химикал във вода е е трудно, трябва да бъдат следвани процедурите, описани в ръководството на ОИСР с насоки за изпитване за токсичност във водна среда на трудни вещества и смеси (36). Използването на разтворители следва да се избягва, но в някои случаи може да се наложи, с цел да се получи изходен разтвор с подходяща концентрация. Примери за подходящи разтворители са дадени в (36).
|
|
25.
|
Условията на полустатично изпитване следва да се избягват, освен в случаите, когато е представена обосновка за наложителни причини, свързани с изпитвания химикал (например стабилност, ограничена наличност, високи разходи или опасност). При полустатичните техники могат да се следват две различни процедури за обновяване — или се приготвят нови разтвори за изпитване в чисти камери и преживелите хайверни зърна и ларви внимателно се пренасят в новите камери, или изпитваните организми се запазват в камерите за изпитване, като известен дял (поне две трети) от водата за изпитване се сменя ежедневно.
|
ПРОЦЕДУРА
Условия на експозиция
Събиране на хайвер и продължителност
|
26.
|
За да се избегне отклонение в генетично отношение, хайверът се събира от минимум три на брой двойки за размножаване или групи, смесени и избрани на случаен принцип за започване на изпитването. За трииглата бодливка, вж. описанието за изкуствено оплождане в допълнение 11. Изпитването трябва да започне възможно най-бързо след оплождането на хайвера, като е за предпочитане ембрионите да са потопени в разтворите за изпитване преди започването на дробенето на бластодиска или колкото е възможно по-скоро след този етап, и не по-късно от 12 часа след оплождането. Изпитването трябва да продължи до приключването на половата диференциация в контролната група (60 dph за японската оризия, трииглата бодливка и зебровото данио).
|
Зареждане
|
27.
|
Броят на оплодените хайверни зърна в началото на изпитването следва да е поне 120 на концентрация, разделени между минимум 4 повторения (допустимо е разпределяне към контролата с използване на корен квадратен). Хайверните зърна следва да са разпределени на случаен принцип (с помощта на статистически таблици за рандомизация) сред третиранията. Скоростта на зареждане (за определение вж. допълнение 1) следва да е достатъчно ниска с цел да се поддържа концентрация на разтворения кислород от поне 60 % от ASV без директно аериране на камерите. За изпитванията с проточна система се препоръчва скорост на зареждане не по-голяма от 0,5 g/1 за 24 часа и не повече от 5 g/1 от разтвора по всяко време. Не по-късно от 28 дни след оплождането броят на рибите на повторение следва да бъде преразпределен така, че броят на рибите във всяко повторение да бъде колкото е възможно по-близък до равния. Ако се появи смъртност, свързани с експозицията, броят на отделните повторения следва да бъде намален до подходящ размер, така че гъстотата на рибите между нивата на третиране да се поддържа със стойности колкото е възможно по-близо до равните.
|
Светлина и температура
|
28.
|
Периодът на осветеност и температурата на водата следва да са подходящи за изпитваните видове (вж. допълнение 1 за опитните условия за ИРПР).
|
Хранене
|
29.
|
Храната и храненето са изключително важни и е от съществено значение да се предоставя подходящата храна за всеки етап, на подходящи времеви интервали и в количества, които са достатъчни за поддържане на нормален растеж. Храненето следва да бъде ad libitum при същевременно свеждане до минимум на излишъка. За осигуряване на достатъчна скорост на растеж рибите следва да бъдат хранени поне два пъти на ден (допустимо е веднъж на ден в събота и неделя), на интервал от поне три часа между всяко хранене. Излишната храна и изпражненията трябва да бъдат отстранявани, когато е необходимо, за да се избегне натрупване на отпадъци. С натрупването на опит храната и хранителните режими непрекъснато се усъвършенстват с оглед подобряване на преживяемостта и оптимизиране на растежа. Следователно трябва да се положат усилия да се потвърди предлаганият режим с признати експерти. Храна не следва да се предоставя 24 часа преди приключването на изпитването. Примери за подходящи хранителни продукти са изброени в допълнение 2 (Вж. също рамката на ОИСР за изпитвания върху риб (39).
|
Концентрации на изпитване
|
30.
|
Концентрациите на изпитваните химикали следва да бъдат разположени както е описано в допълнение 4. Следва да бъдат използвани минимум три концентрации за изпитването, с най-малко по четири повторения. Когато се избира диапазонът на концентрациите на изпитване следва да се има предвид кривата, свързваща LC50 и периода на експозиция при наличните проучвания за остра токсичност. Ако данните ще бъдат използвани за оценка на риска, препоръчителни са пет концентрации на изпитване.
|
|
31.
|
Не е нужно да се изпитват концентрации на химикала, по-високи от 10 % от LC50 за остра токсичност при полово зрели индивиди, или 10 mg/1, според това коя от двете е по-ниска. Максималната концентрация на изпитване следва да е 10 % от стойността на LC50 за стадий ларви/ювенилни екземпляри.
|
Контроли
|
32.
|
Една контрола на вода за разреждане (≥ 4 повторения) и, ако е относимо, контрола на разтворител (≥ 4 повторения), следва да бъдат включени допълнително към концентрациите на изпитване. По време на изпитването следва да се използват само разтворители, за които е проучено, че нямат статистически значимо влияние върху крайните точки от изпитването.
|
|
33.
|
Когато се използва разтворител, неговата крайна концентрация не следва да е по-висока от 0,1 ml/l (36) и концентрацията следва да бъде една и съща във всички камери за изпитване, с изключение на контролата на вода за разреждане. Въпреки това, следва да се положат всички усилия, за да се избегне употребата на такъв разтворител, или неговите концентрации следва да бъдат поддържани на минимално равнище.
|
Честота на аналитичните определяния и измервания
|
34.
|
Преди започване на изпитването следва да бъде извършен химичен анализ на концентрацията на изпитвания химикал, за да се провери съответствието с критериите за приемане. Всички повторения трябва да бъдат анализирани поотделно в началото и в края на изпитването. Едно повторение за всяка концентрация на изпитване трябва да се анализира поне веднъж на седмица по време на изпитването, като повторенията се сменят системно (1,2,3,4,1,2...). Ако се съхраняват проби, за да бъдат анализирани по-късно, методът за съхранение на пробите следва да бъде предварително валидиран. Пробите следва да бъдат филтрувани (например с използване на размер на порите 0,45 μm) или центрофугирани, за да се гарантира, че определянията на химикала се правят в истински разтвор.
|
|
35.
|
По време на теста следва да бъдат измервани разтвореният кислород, рН, общата твърдост, проводимостта, солеността (ако е относима) и температурата във всяка камера за изпитване. Като минимум разтвореният кислород, солеността (ако е относима) и температурата трябва да се измерват всяка седмица, а рН, проводимостта и твърдостта — в началото и в края на изпитването. За предпочитане е температурата да се наблюдава непрекъснато най-малко в една камера за изпитване.
|
|
36.
|
Резултатите следва да се основават върху измерените концентрации. Обаче ако концентрацията на изпитвания химикал в разтвора е поддържана на задоволително ниво в рамките на ± 20 % от номиналната концентрация по време на изпитването, тогава резултатите могат да се основават или на номиналната, или на измерената стойност.
|
Наблюдения и измервания
Стадий на ембрионално развитие
|
37.
|
Експозицията следва да започне колкото е възможно по-скоро след оплождането и преди започването на дробенето на бластодиска, и не по-късно от 12 часа след оплождането, за да се гарантира експозиция по време на ранното ембрионално развитие.
|
Излюпване u преживяване
|
38.
|
Наблюденията върху излюпването и преживяването се правят поне веднъж на ден и се записва броят. Мъртвите ембриони, ларви и ювенилни екземпляри следва да се отстраняват веднага след като са забелязани, тъй като могат да се разложат бързо и да бъдат разкъсани от действията на другите риби. При отстраняването на мъртвите индивиди се полага изключителна грижа да не се ударят и да не се наранят физически близкостоящите хайверни зърна/ларви, които са изключително деликатни и чувствителни. Критериите за смърт варират в зависимост от етапа от жизнения цикъл:
|
—
|
за хайверни зърна: по специално в ранните етапи това са: явна загуба на прозрачност и изменение в оцветяването, причинени от коагулация и/или утаяване на белтъци, водещи до бял непрозрачен вид,
|
|
—
|
за ларвите и ювенилните екземпляри: неподвижност и/или липса на дихателни движения и/или липса на сърдечен ритъм и/или бяло непрозрачно оцветяване на централната нервна система и/или липса на реакция при механично стимулиране.
|
|
Необичаен външен вид
|
39.
|
Броя на ларвите, които показват необичайна форма на тялото, следва да се запише, а външният вид и природата на необичайността във външния вид следва да се опише. Следва да се отбележи, че ембрионите и ларвите с необичаен външен вид се появяват по нормален начин и могат да бъдат от порядъка на няколко процента от контролата(ите) при някои видове. Индивидите с необичаен външен вид следва да се отстраняват от камерите за изпитване само при смърт. В съответствие с Директива 2010/63/ЕС на Европейския парламент и на Съвета от 22 септември 2010 г. относно защитата на животните, използвани за научни цели обаче, ако аномалии водят до болка, страдание и дистрес или трайно увреждане, и леталният изход може да бъде предвиден по надежден начин, животните следва да бъдат подложени на анестезия и евтаназия съгласно описанието в точка 44, и да се третират като смъртност при анализа на данните.
|
Необичайно поведение
|
40.
|
Аномалните състояния, като хипервентилация, некоординирано плуване, нетипично състояние на покой и нетипично поведение при хранене, следва да се записват при появяването им.
|
Тегло
|
41.
|
В края на изпитването всички преживели риби следва да бъдат подложени на евтаназия (на анестезия, ако следва да се вземат кръвни проби) и следва да бъде измерено индивидуалното им мокро тегло (след попиване на водата).
|
Дължина
|
42.
|
В края на изпитването следва да се измери индивидуалната дължина (стандартната дължина).
|
|
43.
|
В резултат от тези наблюдения, за протоколирането ще бъдат налични някои или всички от следните данни:
|
—
|
брой на здравите риби в края на изпитването;
|
|
—
|
време за започване на излюпването и приключване на излюпването;
|
|
—
|
дължина и тегло на преживелите индивиди;
|
|
—
|
брой на деформираните ларви;
|
|
—
|
брой на рибите, проявили необичайно поведение.
|
|
Вземане на проби от риби
|
44.
|
Пробовземането от рибите се извършва при приключване на изпитването. Рибите, от които се вземат проби, следва да бъдат подложени на евтаназия, напр. с MS-222 (100-500 mg на l, буфериран с 200 mg NaHCO3 на l) или FA-100 (4-алил-2-метоксифенол: евгенол) и да бъдат индивидуално измерени и претеглени като мокро тегло (след попиване на водата) или да бъдат подложени на анестезия, ако следва да се взема кръвна проба (вж. точка 49).
|
Вземане на проби за анализ на VTG и определяне на пола чрез хистологична оценка
|
45.
|
Трябва да се извърши пробовземане на всички риби и същите да се подготвят за анализ на пола и на VTG. Всички риби трябва да се анализират хистологично за определяне на пола. За измерванията на VTG се допуска вземане на подпроба от най-малко 16 риби от всяко повторение. Ако резултатите от подпробата се окажат неясни, следва повече риби да бъдат анализирани за VTG.
|
|
46.
|
Процедурата за вземане на проби за определяне на пола и VTG зависи от метода за анализ на VTG:
|
Метод за анализ на VTG с хомогенат глава/опашка
|
47.
|
Рибата се подлага на евтаназия. Главата и опашката на всяка риба се отделят от тялото на рибата чрез направени със скалпел разрези точно зад коремните перки и точно зад гръбната перка (вж. фигура 1). Частите от всяка риба, представляващи главата и опашката, се обединяват, претеглят се и индивидуално се номерират, замразяват се в течен азот и се съхраняват при температура – 70 °C или по-ниска, за анализ на VTG. Частта от рибата, представляваща тялото, се номерира и фиксира в подходящ фиксатор, за хистологична оценка (22). С използването на този метод VTG и хистопатологията се оценяват за всеки индивид и по този начин евентуална промяна в нивото на VTG може да бъде свързана с фенотипния пол на рибата, или с генетичния пол (японската оризия и трииглата бодливка) на рибата. За повече информация вж. насоки за хомогенизиране (допълнение 5) и насоки за количествено определяне на VTG (допълнение 6).
|
Метод за анализ на VTG с хомогенат черен дроб
|
48.
|
Рибата се подлага на евтаназия. Извършва се дисекция на черния дроб и същият се съхранява при температура – 70 °C или по-ниска. Препоръчителни процедури за отрязването и предварителното обработване на черния дроб са дадени в насоки на ОИСР 229 (37) или в глава В.37 от настоящото приложение (38). Черният дроб се хомогенизира индивидуално, както е описано в насоки на ОИСР 229 или глава В.37 от настоящото приложение. Супернатантатът се събира и се използва за измерване с VTG хомоложна ELISA техника (вж. допълнение 6 за пример за количествено определяне при зебровото данио, или насоки на ОИСР 229 (37) за японската оризия). При следване на този подход също така е възможно получаването на индивидуални данни за рибите както по отношение на VTG, така и на хистологията на гонадите.
|
Метод за анализ на VTG с кръвна плазма
|
49.
|
Кръв се взема от подложена на анестезия риба чрез сърдечна пункция, от опашната вена или чрез разрез на опашката, и се центрофугира при 4 °С за събиране на плазма. Плазмата се съхранява при – 70 °С или още по-ниска температура, докато не бъде използвана. Цялата риба се подлага на евтаназия и се фиксира за хистологията. Пробата от плазма, както и рибата, се номерират индивидуално, за да се свържат нивата на VTG с пола на рибата.
Фигура 1:
Как да се направи разрез на риба за измерване на VTG в хомогенат глава/опашка и за хистологична оценка на средната част

|
Определяне на генетичния пол
|
50.
|
Биологична проба за определяне на генетичния пол се взема от всяка риба, която е от биологичен вид, притежаващ подходящите маркери. За японската оризия се взема аналната перка или гръбната перка. Подробно описание е дадено в допълнение 9, включително вземане на тъканни проби и определяне на пола чрез метод с PCR. Аналогично, в допълнение 10 е дадено описание на вземане на тъканни проби и определяне на пола чрез метод с PCR за трииглата бодливка.
|
Измерване на VTG
|
51.
|
Измерването на VTG следва да се основава на валидиран за анализ количествен метод. Следва да бъде на разположение информация за варирането на метода, използван от дадена лаборатория — в рамките на дадено изследване, както и между изследванията. Източникът на между- и вътрешнолабораторното вариране (най-вероятно) се основава на различните стадии от развитието на рибната популация. Като се има предвид варирането на измерването на VTG, стойностите на NOEC въз основа единствено на тази крайна точка следва да бъдат третирани много внимателно. За рибните видове, разглеждани в настоящото изследване, съществуват различни методи за оценка на образуването на VTG. Техника за измерване, която е едновременно относително чувствителна и специфична, е определянето на концентрациите на белтъци чрез ензимно-свързан имуносорбентен анализ (ELISA). Следва да се използват хомоложни антитела (срещу VTG от същия биологичен вид) и най-важните хомоложни стандарти.
|
Определяне на пола
|
52.
|
В зависимост от процедурата за вземане на проби за VTG, цяла риба или оставащата средна част от всяка риба се поставя в предварително етикетирана касета за обработка и се фиксира с подходящ фиксатор за хистологично определяне на пола (по избор и за оценка на етапите при гонадите). Насоки за фиксирането и включването са дадени в допълнение 7 и в Ръководството на ОИСР за диагностициране на свързана с ендокринната система хистопатология на гонадите при риби (22). След обработката рибите се включват в парафинови блокчета. Индивидите следва да бъдат поставени надлъжно в парафиновите блокчета. От всеки индивид се вземат най-малко шест надлъжни среза (с дебелина 3-5 μm) във фронтална равнина, включително гонадна тъкан от двете гонади. Разстоянието между тези срезове следва да бъде приблизително 50 μm за мъжките и 250 μm за женските индивиди. Независимо от това, тъй като всяко блокче често съдържа и мъжки, и женски (ако във всяко блокче е включен повече от един индивид), разстоянието между срезовете от тези блокчета трябва да е около 50 μm, докато бъдат получени поне шест среза от гонадите от всеки мъжки индивид. След това разстоянието между срезовете може да бъде увеличено до 250 μm за женските. Срезовете се оцветяват с хематоксилин и еозин и се изследват с оптическа микроскопия с фокусиране върху пола (мъжки, женски, междинен или недиференциран). Междинният пол се определя като наличие на повече от един овоцит в тестисите за шест анализирани среза, или сперматогенни клетки (да/не) в яйчниците. Хистопатологията и определянето на етапите на яйчниците и тестисите са по избор, но ако се изследват, трябва да се извърши статистически анализ на резултатите и те следва да се протоколират. Следва да се отбележи, че някои видове риби не разполагат по естествен път с напълно развит чифт гонади и може да е налице само една гонада (напр. японската оризия и, понякога, зебровото данио). Всички подобни наблюдения трябва да бъдат записани.
|
|
53.
|
Определянето на генетичния пол в отделния индивид японска оризия се основава на наличието или отсъствието на определящия мъжкия пол на оризията ген DMY, разположен в Y хромозомата. Генотипният пол на оризията може да бъде идентифициран чрез определяне на първичната структура на гена DMY от ДНК, извлечена например от парче анална перка или гръбна перка. Наличието на DMY показва XY (мъжки) индивид, независимо от фенотипа, докато липсата на DMY показва XX (женски) индивид, независимо от фенотипа (23). Насоки за приготвяне на тъканите и за метода с PCR са дадени в допълнение 9. Определянето на генетичния пол при трииглата бодливка също се извършва чрез метод с PCR, описан в допълнение 10.
|
|
54.
|
Проявата на междинен пол (за определение, вж. допълнение 1) следва да бъде протоколирана.
|
Вторични полови белези
|
55.
|
При видове риби като японската оризия вторичните полови белези са под контрола на ендокринната система; поради това, ако е възможно, в края на експозицията следва да бъдат извършени наблюдения върху външния вид на рибата. При японската оризия образуването на гениталната папила в задната част на аналната перка при женските е чувствително към андрогени. В глава В.37 от настоящото приложение (38) са предоставени съответни снимки на мъжки вторични полови белези и на андрогенизирани женски индивиди.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
56.
|
Важно е крайната точка да се определя с най-силния валиден статистически тест. Опитната единица е повторението, но варирането вътре в повторението трябва да бъде включено в статистическото тестване. Блокова схема на процедурата по вземане на решения е на разположение в допълнение 8, за подпомагане при избора на най-подходящия статистически тест за използване, въз основа на характеристиките на данните, получени от изпитването. Статистическото ниво на значимост е 0,05 за всички включени крайни точки.
|
Съотношения между половете и генетичен пол
|
57.
|
Ако съществува монотонна зависимост доза-отклик, съотношенията между половете следва да бъдат анализирани за значимо въздействие (подход NOEC/LOEC) на експозицията с трендов тест на Йонкхере-Терпстра. Ако се установи, че зависимостта не е монотонна, следва да бъде приложен тест за сравнения по двойки: Ако могат да бъдат получени нормалност и хомогенна дисперсия, използва се тестът на Дънет. Ако дисперсията е хетерогенна, използва се тестът на Тамхане-Дънет. В другите случаи се използва точният тест на Ман-Уитни с корекция на Бонферони-Холм. Блокова схема с описание на статистиките на съотношенията между половете е дадена в допълнение 8. Съотношенията между половете следва да бъдат представени в таблици като концентрационни отношения ± SD за мъжки, женски, междинен и недиференциран пол. Статистическата значимост следва да бъде подчертана. Примери са представени в доклада за валидиране на фаза 2 от ИРПР (42). Генетичният пол следва да се протоколира като процент на инверсия на фенотипния пол на индивидите от мъжки, женски, междинен и недиференциран пол.
|
Концентрации на VTG
|
58.
|
Концентрациите на VTG следва да бъдат анализирани за значимо въздействие (подход NOEC/LOEC) на експозицията. Тестът на Дънет се предпочита пред t-теста с корекция на Бонферони. Когато се използва корекция на Бонферони, предпочита се корекция на Бонферони-Холм. Необходимо е да се предвиди лог-трансформация на VTG за постигане на нормалност и хомогенност на дисперсията. На следващо място, ако зависимостта концентрация-отклик е в съответствие с монотонността, тогава тестът на Йонкхере-Терпстра е за предпочитане пред всички горепосочени. Ако се използват t-тестове или тестът на Дънет, за продължаване на работата не е необходим F-тест за значимост при ANOVA. За подробности виж диаграмата в допълнение 8. Резултатите следва да бъдат протоколирани в таблици като средни стойности на концентрациите ± SD отделно за мъжки, женски, междинен и недиференциран пол. Статистическата значимост на фенотипните женски и фенотипните мъжки индивиди трябва да бъде ясно обозначена. Примери са представени в доклада за валидиране на фаза 2 от ИРПР (42).
|
Действителни концентрации на изпитвания химикал
|
59.
|
Действителните концентрации на изпитвания химикал в камерите трябва да бъдат анализирани в честоти, описани в точка 34. Резултатите следва да се протоколират в таблици, като средна стойност на концентрацията ± SD на база повторение, както и на база концентрация с ясно обозначени информация за броя на пробите и стойностите, силно различаващи се от нормалните за средната концентрация на третиране ± 20 %. Примери могат да бъдат намерени в доклада за валидиране на фаза 2 от ИРПР (42).
|
Интерпретиране на резултатите
|
60.
|
Резултатите от изпитването следва да се тълкуват внимателно, когато измерените концентрации на изпитвания химикал в разтворите за изпитване са на нива, които са близки до границата на откриване на метода за анализ.
|
Протокол от изпитването
|
61.
|
Протоколът от изпитването следва да включва следната информация:
|
|
Изпитван химикал
|
—
|
Относими физични и химични свойства; данни за идентификация на химикала, включително чистота и аналитичен метод за количествено определяне на изпитвания химикал.
|
|
|
|
Условия на изпитването
|
—
|
Използвана процедура за изпитване (например проточна или полустатична/с обновяване); планът на изпитването, включително концентрации на изпитване, метод на подготовка на изходните разтвори, честота на обновяване (трябва да са посочени средството за повишаване на разтворимостта и неговата концентрация, когато се използва такова);
|
|
—
|
номиналната концентрация на изпитване, средните стойности на измерените величини и техните стандартни отклонения в камерите за изпитването, и методът, чрез който са получени (използваният метод за анализ трябва да бъде представен в приложение); доказателство, че измерванията се отнасят за концентрациите на изпитвания химикал в истински разтвор;
|
|
—
|
качество на водата в камерите за изпитване: рН, твърдост, температура и концентрация на разтворен кислород;
|
|
—
|
подробна информация за храненето (например вид на храната(ите), дадено количество и честота, и анализи за съдържание на замърсители, напр. полихлорирани бифенили, полициклични ароматни въглеводороди и органохлорни пестициди), ако е относимо.
|
|
|
|
Резултати
|
—
|
Доказателство, че контролите съответстват на критериите за валидност: в таблиците данните за процента на излюпване следва да бъдат представени като процент на повторение и на концентрация. Стойностите, силно различаващи се от критериите за признаване (при контролите), следва да бъдат ясно посочени. Преживяването следва да бъде представено като процент на повторение и на концентрация. Стойностите, силно различаващи се от критериите за валидност (при контролите), следва да бъдат ясно посочени;
|
|
—
|
Ясно посочване на резултатите, получени за различните наблюдавани крайни точки: преживяване на ембриони и процент на излюпване; необичаен външен вид; дължина и тегло; измервания на VTG (ng/g хомогенат, ng/ml плазма или ng/mg черен дроб); хистология на гонадите, съотношение между половете, данни за генетичния пол; проява на необичайни реакции от страна на рибите и всякакви видими въздействия, причинени от изпитвания химикал.
|
|
|
|
62.
|
Резултатите трябва да бъдат представени като средни стойности ± стандартно отклонение (SD) или стандартна грешка (SE). Статистиките следва да бъдат протоколирани най-малко като NOEC и LOEC и доверителни интервали. Следва да се спазва статистическата блокова схема (допълнение 8).
|
ЛИТЕРАТУРА
|
(1)
|
OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(2)
|
Jobling, S., D. Sheahan, J.A. Osborne, P. Matthiessen, and J.P. Sumpter, 1996, „Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals“, Environmental Toxicology and Chemistry 15, pp. 194-202.
|
|
(3)
|
Sumpter, J.P. and S. Jobling, 1995, „Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment“, Environmental Health Perspectives 103, pp. 173-178.
|
|
(4)
|
Tyler, C.R., R.van Aerle, T.H. Hutchinson, S. Maddix, and H. Trip (1999), „An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin“, Environmental Toxicology and Chemistry 18, pp. 337-347.
|
|
(5)
|
Holbech, H., L. Andersen, G.I. Petersen, B. Korsgaard, K.L. Pedersen, and P. Bjerregaard (2001a), „Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)“, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, pp. 119-131.
|
|
(6)
|
Andersen, L., P. Bjerregaard, and B. Korsgaard ( 2003), „Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters“, Fish Physiology and Biochemistry 28, pp. 319-321.
|
|
(7)
|
Orn, S., H. Holbech, T.H. Madsen, L. Norrgren, and G.I. Petersen (2003), „Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone“, Aquatic Toxicology 65, pp. 397-411.
|
|
(8)
|
Panter, G.H., T.H. Hutchinson, R. Lange, C.M. Lye, J.P. Sumpter, M. Zerulla, and C.R. Tyler (2002), „Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances“, Environmental Toxicology and Chemistry 21, pp. 319-326.
|
|
(9)
|
Sun, L.W., J.M. Zha, P.A. Spear, and Z.J. Wang (2007), „Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults“, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 533-541.
|
|
(10)
|
Parks, L.G., A.O. Cheek, N.D. Denslow, S.A. Heppell, J.A. McLachlan, G.A. LeBlanc, and C.V.Sullivan (1999), „Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds“, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, pp. 113-125.
|
|
(11)
|
Brion, F., B.M. Nilsen, J.K. Eidem, A. Goksoyr, and J.M. Porcher (2002), „Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)“, Environmental Toxicology and Chemistry 21, pp. 1699-1708.
|
|
(12)
|
Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara, and E. Tamiya (2002), „Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin“, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, pp. 161-169.
|
|
(13)
|
Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James, and B.E. Bengtsson (2004), „The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption — II — kidney hypertrophy, vitellogenin and spiggin induction“, Aquatic Toxicology 70, pp. 311-326.
|
|
(14)
|
Tatarazako, N., M. Koshio, H. Hori, M. Morita, and T. Iguchi (2004), „Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka“, Journal of Health Science 50, pp. 301-308.
|
|
(15)
|
Eidem, J.K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Panter, T. Hutchinson, and A. Goksoyr (2006), „Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology“, 78, pp. 202-206.
|
|
(16)
|
Jensen, K.M. and G.T. Ankley (2006), „Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)“, Ecotoxicology and Environmental Safety 64, pp. 101-105.
|
|
(17)
|
Holbech, H., Petersen, G. I., Norman, A., Örn, S, Norrgren, L., and Bjerregaard, P (2001b), „Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)“, Nordic Council of Ministers, TemaNord 2001:597, pp. 48-51.
|
|
(18)
|
Nilsen, B.M., K. Berg, J.K. Eidem, S.I. Kristiansen, F. Brion, J.M. Porcher, and A. Goksoyr (2004), „Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening“, Analytical and Bioanalytical Chemistry 378, pp. 621-633.
|
|
(19)
|
Orn, S., S. Yamani, and L. Norrgren (2006), „Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone“, Archives of Environmental Contamination and Toxicology 51, pp. 237-243.
|
|
(20)
|
Scholz, S. and N. Kluver (2009), Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish, Sexual Development 3, pp. 136-151.
|
|
(21)
|
Fenske, M., G. Maack, C. Schafers, and H. Segner (2005), „An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio“, Environmental Toxicology and Chemistry 24, pp. 1088-1098.
|
|
(22)
|
OECD (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Paris.
|
|
(23)
|
Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi, A. Suzuki, N. Saito, M. Nakamoto, N. Shibata, and Y. Nagahama (2004), „Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes“, Developmental Dynamics 231, pp. 518-526.
|
|
(24)
|
Shinomiya, A., H. Otake, K. Togashi, S. Hamaguchi, and M. Sakaizumi (2004), „Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations“, Zoological Science 21, pp. 613-619.
|
|
(25)
|
Kidd, K.A., P.J. Blanchfield, K.H. Mills, V.P. Palace, R.E. Evans, J.M. Lazorchak, and R.W. Flick (2007), „Collapse of a fish population after exposure to a synthetic estrogen“, Proceedings of the National Academy of Sciences of the United States of America 104, pp. 8897-8901.
|
|
(26)
|
Palace,V.P., R.E. Evans, K.G. Wautier, K.H. Mills, P.J. Blanchfield, B.J. Park, C.L. Baron, and K.A. Kidd (2009), „Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake“, Canadian Journal of Fisheries and Aquatic Sciences 66, pp. 1920-1935.
|
|
(27)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, J. Bamforth, R.D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno, and C.R. Tyler (2006), „Development of chronic tests for endocrine active chemicals — Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)“, Aquatic Toxicology 77, pp. 279-290.
|
|
(28)
|
Holbech, H., K. Kinnberg, G.I. Petersen, P. Jackson, K. Hylland, L. Norrgren, and P. Bjerregaard (2006), „Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)“, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, pp. 57-66.
|
|
(29)
|
Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard, and P. Bjerregaard (2004), „Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)“, Fish Physiology and Biochemistry 30, pp. 257-266.
|
|
(30)
|
Morthorst, J.E., H. Holbech, and P. Bjerregaard (2010), „Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations“, Aquatic Toxicology 98, pp. 336-343.
|
|
(31)
|
Kiparissis,Y., T.L. Metcalfe, G.C. Balch, and C.D. Metcalf (2003), „Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)“, Aquatic Toxicology 63, pp. 391-403.
|
|
(32)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, A. Sherren, R.D. Stanley, and C.R. Tyler (2004), „Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development“, Aquatic Toxicology 70, pp. 11-21.
|
|
(33)
|
Kinnberg, K., H. Holbech, G.I. Petersen, and P. Bjerregaard (2007), „Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)“, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 165-170.
|
|
(34)
|
Глава В.14 от настоящото приложение, Изпитване за растеж на ювенилни (полово незрели) риби.
|
|
(35)
|
Глава В.5 от настоящото приложение, Пълна биоразградимост.
|
|
(36)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OECD, Paris.
|
|
(37)
|
OECD (2009), Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(38)
|
Глава В.37 от настоящото приложение, 21-дневно изследване на риби: Краткосрочен скрининг за естрогенна активност, андрогенна активност и потискане на ароматазата.
|
|
(39)
|
OECD (2012), Fish Toxicity Testing Framework, Series on Testing and Assessment No. 171, OECD, Paris
|
|
(40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H (2007), „Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio“ Journal of Toxicology and Environmental Health-Part A, 70, 9-10 pp 768-779.
|
|
(41)
|
OECD (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Paris.
|
|
(42)
|
OECD (2011), Validation Report ( Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Paris.
|
|
(43)
|
OECD (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Paris.
|
|
(44)
|
Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. OJ L 276, 20.10.2010, p. 33.
|
Допълнение 1
Съкращения и определения
Апикална крайна точка
: Причиняване на въздействие на равнище популация
ASV
: Стойност на насищане при равновесие с атмосферния въздух
Биомаркер
: Причиняване на въздействие на равнище индивид
Химикал
: Вещество или смес.
Dph
: Дни след излюпването
DMY
: свързан с Y ген от домен DM, необходим за развитие на мъжки индивиди при оризията
ELISA
: Ензимно-свързан имуносорбентен анализ
Тегло на риба
: Мокро тегло на риба (след попиване)
ИРПР
: Изпитване за развитие на пола при рибите
ос ХХГ
: хипоталамус-хипофиза-гонадна ос
риба с междинен пол
: Риба с наличие на повече от един овоцит в тестисите за 6 анализирани среза, или сперматогенни клетки в яйчниците (да/не)
Скорост на зареждане
: Мокро тегло на рибите на обем вода
НД
: Начин на действие
RT-PCR
: Полимеразна верижна реакция с използване на обратна транскриптаза
Изпитван химикал
: Всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
риба с недиференциран пол
: Риба с гонади, не проявяващи видими зародишни клетки.
VTG
: Вителогенин
Допълнение 2
Опитни условия за ИРПР (сладководни видове)
|
|
Японска оризия (Oryzias latipes)
|
Зеброво данио (Danio rerio)
|
Триигла бодливка (Gasterostreus aculeatus)
|
|
|
Проточно или полустатично
|
Проточно или полустатично
|
Проточно или полустатично
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
4.
|
Качеството на осветлението
|
|
Луминесцентни крушки (широк спектър)
|
Луминесцентни крушки (широк спектър)
|
Луминесцентни крушки (широк спектър)
|
|
|
10-20 μE/m2/s, 540-1 080 lux, или 50-100 ft-c (заобикалящи равнища на осветеност в лабораторията)
|
10-20 μE/m2/s, 540-1 080 lux, или 50-100 ft-c (заобикалящи равнища на осветеност в лабораторията)
|
10-20 μE/m2/s, 540-1 080 lux, или 50-100 ft-c (заобикалящи равнища на осветеност в лабораторията)
|
|
|
12-16 h светлина, 8-12 h тъмнина
|
12-16 h светлина, 8-12 h тъмнина
|
16 h светлина, 8 h тъмнина
|
|
7.
|
Минимални размери на камерата
|
|
Отделните камери следва да съдържат обем вода минимум 7 l
|
Отделните камери следва да съдържат обем вода минимум 7 l
|
Отделните камери следва да съдържат обем вода минимум 7 l
|
|
8.
|
Обменени обеми на изпитвани разтвори
|
|
Най-малко 5 дневно
|
Най-малко 5 дневно
|
Най-малко 5 дневно
|
|
9.
|
Възраст на изпитваните организми в началото на експозицията
|
|
Новооплодени хайверни зърна (стадий ранна бластула)
|
Новооплодени хайверни зърна (стадий ранна бластула)
|
Новооплодени хайверни зърна
|
|
10.
|
Брой хайверни зърна на третиране
|
|
Минимум 120
|
Минимум 120
|
Минимум 120
|
|
|
Минимум 3 (плюс подходящи контроли)
|
Минимум 3 (плюс подходящи контроли)
|
Минимум 3 (плюс подходящи контроли)
|
|
12.
|
Брой повторения на третиране
|
|
Минимум 4 (освен при разпределяне към контролите с използване на корен квадратен)
|
Минимум 4 (освен при разпределяне към контролите с използване на корен квадратен)
|
Минимум 4 (освен при разпределяне към контролите с използване на корен квадратен)
|
|
|
Живи Artemia, замразени възрастни морски скариди, храна във вид на люспи и т.н. Препоръчително е храната да се дава два пъти дневно
|
Специална пържена храна, живи Artemia, замразени възрастни морски скариди, храна във вид на люспи и т.н. Препоръчително е храната да се дава два пъти дневно
|
Живи Artemia, замразени възрастни морски скариди, храна във вид на люспи и т.н. Препоръчително е храната да се дава два пъти дневно
|
|
|
Няма, освен в случаите, когато концентрацията на разтворения кислород падне под 60 % насищане
|
Няма, освен в случаите, когато концентрацията на разтворения кислород падне под 60 % насищане
|
Няма, освен в случаите, когато концентрацията на разтворения кислород падне под 70 % насищане
|
|
|
Чиста вода от повърхностни води, от кладенец или възстановена
|
Чиста вода от повърхностни води, от кладенец или възстановена
|
Чиста вода от повърхностни води, от кладенец или възстановена
|
|
16.
|
Продължителност на експозицията на изпитвания химикал
|
|
60-dph
|
60-dph
|
60-dph
|
|
17.
|
Биологични крайни точки
|
|
Процент на излюпване, преживяване, макроскопска морфология, VTG, хистология на гонадите, генетичен пол, съотношение между половете
|
Процент на излюпване, преживяване, макроскопска морфология, VTG, хистология на гонадите, съотношение между половете
|
Процент на излюпване, преживяване, макроскопска морфология, VTG, хистология на гонадите, съотношение между половете
|
|
18.
|
Критерии за приемливост на изпитването за обединени повторения на контроли
|
|
Процент на излюпване > 80 %
|
Процент на излюпване > 80 %
|
Процент на излюпване > 80 %
|
|
Преживяване след излюпването ≥ 70 %
|
Преживяване след излюпването ≥ 70 %
|
Преживяване след излюпването ≥ 70 %
|
|
растеж (мокро тегло на риба, след попиване) > 150 mg
|
растеж (мокро тегло на риба, след попиване) > 75 mg
|
растеж (мокро тегло на риба, след попиване) > 120 mg
|
|
Дължина (стандартна дължина) > 20mm
|
Дължина (стандартна дължина) > 14 mm
|
Дължина (стандартна дължина) > 20 mm
|
|
Съотношение между половете (% мъжки или женски)
30 %-70 %
|
Съотношение между половете (% мъжки или женски) 30 %-70 %
|
Съотношение между половете (% мъжки или женски) 30 %-70 %
|
Допълнение 3
Химични характеристики на приемлива вода за разреждане
|
СЪСТАВКА
|
КОНЦЕНТРАЦИЯ
|
|
Твърди частици
|
< 20 mg/l
|
|
Общ органичен въглерод
|
< 2 mg/l
|
|
Нейонизиран амоняк
|
< 1 μg/l
|
|
Остатъчен хлор
|
< 10 μg/l
|
|
Общо органофосфорни пестициди
|
< 50 ng/l
|
|
Общо органохлорни пестициди плюс полихлорирани бифенили
|
< 50 ng/l
|
|
Общ органичен хлор
|
< 25 ng/l
|
Допълнение 4
От метода на изпитване В.14/Насоки относно концентрации на изпитване
|
Колона (брой на концентраците между 100 и 10, или между 10 и 1) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
Допълнение 5
Насоки за хомогенизиране на главата и опашката от ювенилни екземпляри от зеброво данио, Pimephales promelas, триигла бодливка и японска оризия
Целта на настоящия раздел е да се опишат процедурите преди количественото определяне на концентрацията на VTG. Могат да се използват други процедури, които водят до сравнимо количествено определяне на VTG. Като опция концентрацията на VTG може да се определи в кръвна плазма или черен дроб, вместо в хомогенат глава/опашка.
Процедура
|
1.
|
Рибите се подлагат на анестезия и евтаназия в съответствие с описанието на изпитването.
|
|
2.
|
Главата и опашката си изрязват от рибата в съответствие с описанието на изпитването. Важно: Всички инструменти за дисекция и плоскостта за разрязване трябва да се промият и почистят по подходящ начин (например с 96 % етанол) между обработването на всяка отделна риба, за да се предотврати „замърсяване с VTG“ от женски или индуцирани мъжки към неиндуцирани мъжки.
|
|
3.
|
Теглото на обединените глава и опашка от всяка риба се измерва с точност до един mg.
|
|
4.
|
След като се претеглят, частите се поставят в подходящи епруветки (напр. 1,5 ml епендорфова епруветка) и се замразяват при – 80 °С до хомогенизирането, или направо се хомогенизират върху лед с два пластмасови пестика. (Могат да се използват други методи, ако те се извършват върху лед и резултатът е хомогенна маса). Важно: Епруветките следва да бъдат номерирани по подходящ начин, така че главата и опашката от рибата да могат да бъдат свързани с частта от тялото, останала след изрязването им и използвана за хистология на гонадите.
|
|
5.
|
Когато се достигне до хомогенна маса, се добавя леденостуден буфер за хомогенизиране
(29) в количество, равно на 4-10 пъти теглото на тъканта (отбелязва се разреждането). Продължава се работата с пестиците, докато сместа стане хомогенна. Важна забележка: За всяка риба се използват нови пестици.
|
|
6.
|
Пробите се поставят върху лед до центрофугирането при 4 °C на 50 000 g за 30 min..
|
|
7.
|
Използва се пипета за поставяне на порции от 20 до 50 μl супернатант (отбелязва се количеството) в поне две епруветки, чрез потапяне на върха на пипетата под слоя мазнини на повърхността, и внимателно изсмукване на супернатантата, без фракции от мазнини или пелети.
|
|
8.
|
Епруветките се съхраняват при – 80 °C до момента на употребата.
|
Бележка: Буферът за хомогенизирането следва да се използва на същия ден, в който е приготвен. По време на употреба се поставя върху лед
Допълнение 6
Насоки за количествено определяне на вителогенин в хомогенат глава/опашка при зеброво данио (Danio rerio) (с изменение от Holbech et al., 2001). могат да бъдат използвани други процедури, използващи хомоложни антитела и стандарти
|
1.
|
Микротитърни плаки (сертифицирани Maxisorp F96, Nunc, Roskilde Denmark), предварително покрити с 5 μg/ml IgG срещу липовителин от зеброво данио се размразяват и се промиват 3 пъти с буфер за промиване (*).
|
|
2.
|
Пречистен стандарт от вителогенин от зеброво данио (30) се разрежда в поредица до 0,2, 0,5, 1, 2, 5, 10 и 20 ng/ml в буфер за разреждане (**) и проби се разреждат поне 200 кратно (за предотвратяване на матричния ефект) в буфер за разреждане и се поставят на плаките. Контрола за изследването се извършва в две повторения. Към всяко гнездо се прилагат 150 μl. Стандартите се прилагат в две повторения, а пробите — в три повторения. Инкубирането се извършва през нощта при 4 °C на клатачна машина.
|
|
3.
|
Плаките се промиват 5 пъти с буфер за промиван (*)
|
|
4.
|
HRP, свързан към верига от декстран (напр. AMDEX A/S, Denmark) и конюгираните антитела се разреждат в буфер за промиване; Действителното разреждане се различава в зависимост от партидата и възрастта. Към всяко гнездо се прилагат 150 μl и плаките се инкубират в продължение на 1 час при стайна температура върху клатачна машина.
|
|
5.
|
Плаките се промиват 5 пъти с буфер за промиване (*) и дъното им се почиства внимателно с етанол.
|
|
6.
|
Към всяко гнездо се прилагат 150 μl TMB plus (***). Плаките се защитават от светлина с калаено фолио плаката и се следи за промяна на оцветяването върху клатачна машина.
|
|
7.
|
Когато стандартната крива е напълно оформена, ензимната активност се прекратява с добавяне на 150 μl 0,2 M H2SO4 към всяко гнездо.
|
|
8.
|
Абсорбцията се измерва при 450 nm (напр. с четец за плаки Thermomax на Molecular Devices. Данните се анализират със съответния софтуер (напр. Softmax).
|
|
(*)
|
Буфер за промиване:
|
PBS-изходен (****)
|
500,0
|
ml
|
|
BSA
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
Стойността на рН се коригира до 7,3 и се допълва до 5 l с H2O, филтрувана през микропорест филтър. Съхранява се при 4 °C.
|
|
|
(**)
|
Буфер за разреждане:
|
PBS-Изходен (****)
|
100,0
|
ml
|
|
BSA
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
Стойността на рН се коригира до 7,3 и се допълва до 1 l с H2O, филтрувана през микропорест филтър. Съхранява се при 4 °C.
|
|
|
(***)
|
TMB Plus е „готов за употреба“ субстрат, произведен от KemEnTec (Дания). Той е чувствителен към светлина. Съхранява се при 4 °C.
|
|
(****)
|
PBS изходен
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4
.2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
Стойността на рН се коригира до 6,8 и се допълва до 2 l с H2O, филтрувана през микропорест филтър. Съхранява се при стайна температура.
|
|
Допълнение 7
Насоки за приготвяне на тъканни срезове за определяне на пола и на етапите при гонадите
Целта на настоящия раздел е да се опишат процедурите преди оценката на хистологичните срезове. Могат да бъдат използвани други процедури, които водят до подобно определяне на пола и на етапите при гонадите.
С няколко изключения, тези процедури са сходни за японската оризия и зебровото данио.
Евтаназия, аутопсия и фиксиране на тъкани
Цели:
|
1.
|
Гарантиране на умъртвяването на рибите по хуманен начин.
|
|
2.
|
Получаване на необходимите телесно тегло и измервания.
|
|
3.
|
Оценка на вторичните полови белези.
|
|
4.
|
Извършване на дисекция на тъкани за анализ на VTG.
|
|
5.
|
Фиксиране на гонадите.
|
Процедури:
|
1.
|
Умъртвяването на рибите трябва да се извършва непосредствено преди аутопсията. Поради тази причина не трябва да се умъртвяват множество риби едновременно, освен ако не са налице множество просектори.
|
|
2.
|
С използване на кепче рибата се отстранява от камерата за изпитване и се пренася до зоната за аутопсия в съд за транспорт.
|
|
3.
|
Рибата се поставя в разтвора за евтаназия. Рибата се отстранява от разтвора когато се преустанови дишането и тя не реагира на външни дразнители.
|
|
4.
|
Установява се мокрото тегло на рибата.
|
|
5.
|
За приготвянето на тъканите за анализ на VTG рибата може да бъде поставена на коркова плоскост върху поставката на стереомикроскоп.
|
а.
|
при зебровото данио главата се разрязва непосредствено зад коремната перка, а опашката се разрязва непосредствено зад гръбната перка.
|
|
б.
|
при японската оризия коремът се отваря чрез направена внимателно инцизия, която се простира по коремната средна линия от гръдния пояс до точка, разположена точно краниално от ануса. Черният дроб се отстранява внимателно, като се използват малки пинсети и малка ножичка.
|
|
|
6.
|
Екземплярите за анализ на VTG се поставят в епендорфови епруветки и незабавно се замразяват в течен азот.
|
|
7.
|
Трупът, включително гонадите, се поставя в предварително етикетирана пластмасова касета за тъкани, която се прехвърля във фиксатор на Davidson или на Bouin. Обемът на фиксатора следва да бъде най-малко 10 пъти по-голям от приблизителния обем на тъканите. Съдът с фиксатора леко се разклаща в продължение на пет секунди за отстраняване на мехурчетата въздух от касетата.
|
|
8.
|
|
а.
|
Всички тъкани престояват във фиксатора на Davidson през нощта, след което на следващия ден се прехвърлят в отделни съдове с 10 %-ен неутрален буфериран формалин. Съдовете с касетите се разклащат леко за 5 сек, за да се осигури достатъчно проникване на формалина в касетите.
|
|
б.
|
Тъканите престояват във фиксатора на Bouin в продължение на 24 часа, след което се прехвърлят в 70 % етанол.
|
|
Обработка на тъканите
Цели:
|
1.
|
Тъканите се дехидратират с цел достатъчно проникване на парафин.
|
|
2.
|
Тъканта се пропива с парафин за запазване на нейната цялост и за образуване на здрава повърхност за микротомия.
|
Процедури:
|
3.
|
Етикетираните касети с тъкани се изваждат от съхранението във формалин/етанол и се поставят в кошница(и) за обработка. Кошницата за обработка се зарежда в тъканния процесор.
|
|
4.
|
Избира се график за обработката.
|
|
5.
|
След приключването на цикъла на обработка от тъканния процесор тъканта обработващият лични данни е завършил цикъл за обработка, кошницата (или кошниците) може да се прехвърли към станцията за включване в парафин.
|
Включване
Цел:
Екземплярът се ориентира правилно във втвърдения парафин за микротомия.
Процедури:
|
1.
|
Кошницата (или кошниците) с касети се изважда от процесора и се потапя в напълнената с парафин предна камера на термичната конзола на станцията за включване в парафин или касетите се преместват в отделен апарат за подгряване за парафин.
|
|
2.
|
Първата касета, която трябва да бъде включена, се отстранява от предната камера на термичната конзола или от апарата за подгряване за парафин. Капакът на касетата се отстранява и изхвърля, и етикетът на касетата се проверява насрещно със записите за животинския екземпляр, за разрешаване на евентуални несъответствия преди включването.
|
|
3.
|
Избира се матрица с подходящ размер за включването.
|
|
4.
|
След това матрицата се поставя под мястото на подаване на дозиращата конзола и се запълва с разтопен парафин.
|
|
5.
|
Екземплярът се отстранява от касетата и се поставя в разтопения парафин в матрицата. Това се повтаря с 4-8 екземпляра за всяка парафинова матрица. Позициите на отделните риби се маркират чрез поставянето на риба № 1 на 180 градуса от риби 2-4/8.
|
|
6.
|
Добавя се допълнително парафин за покриване на екземпляра.
|
|
7.
|
Матрицата с основата на касетата се поставя върху охлаждащата плоча на крио конзолата.
|
|
8.
|
След втвърдяването на парафина блокчето (т.е. втвърденият парафин, съдържащ тъканите и основата на касетата) се отстранява от матрицата.
|
Микротомия
Цел:
Да се разрежат и приготвят хистологични срезове за оцветяване.
Процедури:
|
1.
|
Началната фаза на микротомията, наречена „facing“ се извършва, както следва:
|
а.
|
Парафиновото блокче се поставя в държача за образци на микротома.
|
|
б.
|
Държачът за образци се придвижва чрез въртене на колелото на микротома и от парафиновата повърхност на блока се изрязват дебели срезове докато ножът достигне включените тъкани.
|
|
в.
|
Дебелината на среза на микротома се настройва между 3-5 микрона. Държачът за образци се придвижва и от блокчето се отрязват множество срезове, за да се отстранят всички артефакти, създадени върху срязаната повърхност на тъканта по време на грубото обрязване.
|
|
г.
|
Блокчето може да бъде отстранено от държача за образци и поставено върху лед с лицето надолу за намокряне на тъканта.
|
|
|
2.
|
Следващата фаза на микротомията е окончателното срязване и поставянето на тъканните срезове върху предметни стъкла. Тези процедури се извършват, както следва:
|
а.
|
Ако блокчето е било поставено върху лед, то се отстранява от леда и се поставя обратно в държача за образци на микротома.
|
|
б.
|
С дебелина на среза на микротома, настроена на 3-5 микрона, държачът за образци се придвижва чрез въртене на колелото на микротома. Правят се срезове от блока до получаването на „лента“, съдържаща поне един приемлив срез, включващ гонадите. (При необходимост, по време на срязването блокчето може да бъде отстранено от държача за образци и поставено върху лед за намокряне на тъканта, и после поставено обратно в държача за образци.)
|
|
в.
|
Срезовете се оставят за изправяне да плуват върху водната повърхност във водната баня. Прави се опит да се получи най-малко един срез, който не съдържа гънки и няма въздушни мехурчета, попаднали под него.
|
|
г.
|
Предметно стъкло за микроскоп се потапя под най-добрия срез, който се изважда от водата чрез повдигане нагоре с предметното стъкло. Този процес се нарича „монтиране“ на среза върху предметното стъкло.
|
|
д.
|
Приготвят се три среза за набор от риби. Вторият и третият срез се правят на интервали 50 микрона след първия. Ако рибите не са включени с техните гонади на същото ниво на срязването, трябва да се направят повече срезове, за да се гарантира, че от всяка риба са получени най-малко шест среза, включващи гонадите.
|
|
е.
|
Със средство за надписване на преметни стъкла номерът на блокчето, от който е било приготвено предметното стъкло, се записва върху предметното стъкло.
|
|
ж.
|
Предметното стъкло се поставя на поставка за оцветяване.
|
|
з.
|
Блокчето се отстранява от държача за образци и се поставя с лицето надолу за съхранение.
|
|
Оцветяване, поставяне на покривно стъкло и етикетиране на предметното стъкло
Цели:
|
—
|
Оцветяват се срезовете за хистопатологично изследване
|
|
—
|
Постоянно се запечатват монтираните и оцветени тъкани.
|
|
—
|
Постоянно се идентифицират оцветените срезове раздели по начин, който позволява пълна проследимост.
|
Процедури:
|
1.
|
Оцветяване
|
а.
|
Предметните стъкла се изсушават на въздух през нощта преди оцветяването.
|
|
б.
|
Срезовете се оцветяват с хематоксилин-еозин.
|
|
|
2.
|
Поставяне на покривно стъкло
|
а.
|
Покривното стъкло може да се поставя ръчно или автоматично.
|
|
б.
|
Предметното стъкло се потапя в ксилен или TissueClear и излишъкът от ксилен/TissueClear леко се изхвърля от предметното стъкло.
|
|
в.
|
Приблизително 0,1 ml от средата за монтиране се прилага в близост до края на предметното стъкло, противоположен на матирания край, или на покривното стъкло.
|
|
г.
|
Покривното стъкло се слага под малък ъгъл при поставянето му върху предметното стъкло.
|
|
|
3.
|
Етикетиране
|
a.
|
Всеки етикет на предметно стъкло следва да включва следната информация.
|
i.
|
Наименование на лабораторията
|
|
iii.
|
Екземпляр №/предметно стъкло №
|
|
iv.
|
Химикал/Третирана група
|
|
|
Допълнение 8
Статистическа блокова схема при анализ на вителогенин

Статистическа блокова схема при анализ на съотношението между половете
Допълнение 9
Насоки за вземане на тъканни проби за определяне на генетичния пол и за определяне на генетичния пол чрез метод с PCR
Вземане на тъканни проби, приготвяне и съхранение преди определяне на генетичния пол чрез метод с PCR при оризия (изготвено от Лабораторията по водни организми на Bayer CropScience AG)
|
1.
|
От всяка отделна риба с тънка ножица се отрязва аналната или гръбната перка и се поставя в епруветка, напълнена с 100 μl буфер за извличане 1 (подробности за приготвянето на буфера са дадени по-долу). Ножиците се почистват след всяка отделна риба в бехерова чаша, напълнена с дестилирана H2О, и се изсушават с абсорбираща хартия.
|
|
2.
|
Тъканта на перката се хомогенизира с тефлонов пестик за микроепруветки за лизис на клетките. За всяка епруветка се използва нов пестик за предотвратяване на всякакво замърсяване. Пестиците се поставят за престояване до следващия ден в 0,5 M NaOH, изплакват се в продължение на 5 минути в дестилирана H2O и до използването се съхраняват в етанол или в стерилна среда след автоклавиране.
|
|
3.
|
Възможно е също така тъканта от перка да се съхранява без буфер за извличане 1, поставена върху сух лед и след това в хладилник при – 80 °C, за да се предотврати всякакво разграждане на ДНК. Но извличането функционира по-добре, ако извличането на ДНК е по същото време (за обработка вж. по-горе; пробите трябва да се размразят върху лед след съхранение при температура – 80 °C преди поставянето на буфера в епруветките).
|
|
4.
|
След хомогенизирането всички епруветки се поставят на водна баня и се загряват в продължение на 15 минути при 100 °C.
|
|
5.
|
След това 100 μl от буфер за извличане 2 (подробности за приготвянето на буфера са дадени по-долу) се добавят с пипета във всяка епруветка. Пробите се съхраняват на стайна температура в продължение на 15 минути, като от време време леко се разклащат с ръка.
|
|
6.
|
След това всички епруветки се поставят отново на водна баня и отново се загряват в продължение на 15 минути при 100 °C.
|
|
7.
|
До последващия анализ епруветките се замразяват при – 20 °C.
|
Подготовка на буфер
буфер 1 за PCR:
|
|
500 mg N-лауроилсаркозин (напр. Merck KGaA, Darmstadt, GE)
|
|
|
добавя се 100 ml дест. H2O
|
буфер 2 за PCR:
|
|
20 g Chelex (напр. Biorad, Munich, GE)
|
|
|
обемът се увеличава в 100 ml дест. H2O
|
Определяне на генетичния пол (чрез метод с PCR) при оризия (изготвено от Лабораторията по водни организми на Bayer CropScience AG и Universität Würzburg Biozentrum)
Приготвените и замразени епруветки (описани в горния раздел) се размразяват върху лед. След това те се центрофугират с помощта на центрофуга Епендорф (30 секунди на максимална скорост, при стайна температура). За PCR се използва чистият супернатант, отделен от утайката. Следва абсолютно да се избягва прехвърлянето в PCR на всякакви следи от Chelex (локализиран в утайката), тъй като това ще пречи на активността на Taq полимеразата. Супернатантът се използва пряко или може да се съхранява замразяван (при – 20 °C) и след това размразяван отново в няколко цикъла без отрицателно въздействие върху ДНК за последващи анализи.
1. Приготвяне на „реакционна смес“ (25 μl на проба):
|
|
Обем
|
Крайна концентрация
|
|
Изходна ДНК
|
0,5 μl-2 μl
|
|
|
10x буфер за PCR с MgCl2
|
2,5 μl
|
1 x
|
|
Нуклеотиди (всеки от dATP, dCTP, dGTP, dTTP)
|
4 μl (5 mM)
|
200 μM
|
|
Начален праймер (10 μm) (вж. по-долу 3-5)
|
0,5 μl
|
200 nM
|
|
Обратен праймер (10μM) (вж. по-долу 3-5)
|
0,5 μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Вода (с чистота за PCR)
|
до 25 μl
|
|
|
Taq E полимераза
|
0,3 μl
|
1,5 U
|
|
10x буфер за PCR с MgCl2: 670 mM TRIS хидрохлорид (pH 8,8 при 25 °C), 160 mM (NH4)2SO4, 25 mM MgCl2, 0,1 % Tween 20
|
За всяка PCR (вж. по-долу 3-5) са необходими специалният праймер като нова комбинация от „реакционна смес“ и достатъчно необходимо количество изходна ДНК за всяка проба (вж. по-горе). Съответните количества се прехвърлят в нови епруветки чрез пипети. След това всички епруветки се затварят, разбъркват (приблизително 10 секунди) и центрофугират (10 секунди, на стайна температура). В този момент могат да бъдат започнати съответните PCR програми. Допълнително във всяка PCR програма се използват положителна контрола (примерна проба ДНК с известна активност и ясни резултати) и отрицателна контрола (1 μl дест. H2O)
2. Приготвяне на гела от агароза (1 %) — по време на изпълняващи се PCR програми:
|
—
|
Разтварят се 3 g агароза в 300 ml 1 × TAE буфер (1 % агарозен гел)
|
|
—
|
Този разтвор трябва да се изварява с използване на микровълнова фурна (около 2-3 мин.)
|
|
—
|
Горещият разтвор се прехвърля, като се налива в специална поставка, която се намира върху лед.
|
|
—
|
След около 20 минути агарозният гел е готов за ползване
|
|
—
|
Агарозният гел се съхранява в 1x TAE буфер до края на PCR програмите
|
3. PCR програма за актин:
Тази PCR цели да се покаже, че ДНК в пробата не е увредена.
|
—
|
Специален праймер:
|
—
|
„Mact1(upper/forward)“ → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
„Mact2(lower/reverse)“ → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Програма:
|
—
|
Цикъл (35 пъти):
|
Денатуриране
|
→ 45 sec при 95 °C
|
|
Хибридизация
|
→ 45 sec при 56 °C
|
|
Удължаване
|
→ 1 min при 68 °C
|
|
|
4. PCR програма за X- и Y-гени:
Пробите с интактна ДНК се използват при тази PCR програма за откриване на X- и Y-гени. Мъжката ДНК следва да показва една двойна лента, а женската ДНК следва да показва една единична лента (след оцветяване и гелна електрофореза). В изпълнението на тази програма следва да се включат една положителна контрола за мъжки (XY проба) и една за женски (XX проба).
|
—
|
Специален праймер:
|
—
|
„PG 17.5“ (upper/forward) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
„PG 17.6“ (lower/reverse) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Програма:
|
—
|
Цикъл (40 пъти):
|
Денатуриране
|
→ 45 sec при 95 °C
|
|
Хибридизация
|
→ 45 sec при 55 °C
|
|
Удължаване
|
→ 1 min 30 sec при 68 °C
|
|
|
5. PCR програма за Y-ген като „контрола“ за PCR програмата за X- и Y-ген:
Тази PCR програма проверява резултатите от „PCR програмата за X- и Y-ген“. „Мъжките проби“ следва да показват една лента, а „женските проби“ не трябва да показват никаква лента (след оцветяване и гелна електрофореза).
|
—
|
Специален праймер:
|
—
|
„DMTYa (upper/forward)“ → GGC CGG GTC CCC GGG TG
|
|
—
|
„DMTYd (lower/reverse)“ → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Програма:
|
—
|
Цикъл (40 пъти):
|
Денатуриране
|
→ 45 sec при 95 °C
|
|
Хибридизация
|
→ 45 sec при 56 °C
|
|
Удължаване
|
→ 1 min при 68 °C
|
|
|
6. Оцветяване на PCR проби:
Оцветяващ разтвор:
|
|
0,25 % Бромофенолово синьо
|
Отмерва се с пипета 1 μl от оцветяващия разтвор във всяка отделна епруветка
7. Начало на гелната електрофореза:
|
—
|
Приготвеният 1 %-ен агарозен гел се прехвърля в контейнер за гелна електрофореза, напълнен с 1 × TAE буфер.
|
|
—
|
Обем от 10 — 15 μl от всяка оцветена PCR проба се добавя с пипета в улей за агарозния гел
|
|
—
|
Също така, 5 — 15 μl от 1kb-„Ladder“(Invitrogen) се добавя с пипета в отделен улей
|
|
—
|
Начало на електрофорезата с 200 V
|
|
—
|
Прекратяване след 30-45 min
|
8. Определяне на лентите:
|
—
|
Агарозният гел се почиства в дестилирана H2O
|
|
—
|
След това агарозният гел се прехвърля в етидиев бромид за 15-30 min
|
|
—
|
След това следва да се заснеме изображение на агарозния гел в UV кутия
|
|
—
|
Накрая пробите се анализират в сравнение с лентата с положителна контрола (или ленти) и маркера.
|
Допълнение 10
Насоки за вземане на тъканни проби от триигла бодливка за определяне на генетичния пол чрез метод с PCR
Вземане на тъканни проби и извличане на ДНК
ДНК може да бъде извлечена посредством различни достъпни в търговската мрежа реактиви и както с ръчни, така и с автоматични системи за извличане. Протоколът, използван в Cefas Weymouth Laboratory е изложен по-долу, а където е уместно, са добавени алтернативните подходи.
|
1.
|
От всяка отделна риба с тънка ножица се отстранява малка част от тъкан (10-20 mg) от дорзолатералната област (след отстраняване на главата и опашката за анализ на VTG). Тъканта се слага в епруветка, след което или се поставя директно в течен азот (за съхранение при – 80 °C), или се напълва с 70 % етанол (за транспортиране и последващо съхраняване при 4 °C). Ножицата се почиства след всяка отделна риба в 70 % етанол, след това в дестилирана вода, и се изсушава с абсорбираща хартия.
|
|
2.
|
Етанолът (ако е наличен) се отстранява чрез аспирация и тъканта се разгражда до следващия ден с протеиназа K в 400 μl ATL буфер (Qiagen). Една аликвотна част (200 μl) от разградената тъкан се прехвърля В 96-гнездов S-блок (Qiagen) и ДНК, извлечена в 96-гнездови формат с Qiagen Universal BioRobot и комплект QIamp Investigator BioRobot. ДНК се елуира в 50 μl вода, несъдържаща дезоксирибонуклеази и рибонуклеази. Ако се използват твърди тъкани за извличане на ДНК (например гръбнак или гръдна перка), може да се окаже необходимо да се хомогенизира пробата в лизиращ буфер, като се използва устройство за лизис на тъкани FastPrep® или еквивалентна система за разрушаване на тъканната структура.
Алтернативно,
|
а)
|
а) тъканта се разгражда до следващия ден с протеиназа K в 400 μl G2 лизиращ буфер (Qiagen) и ДНК се извлича от 200 μl от разградения материал се подлага на преглед чрез използването на комплект EZ-1 DNA easy tissue и EZ-1 biorobot, или миникомплект DNA easy tissue. ДНК се елуира в 50 μl обем.
|
|
б)
|
Тъканите се обработват с помощта на реактив DNAzol. За кратко време тъканните проби се лизират в 1 ml DNAzol в продължение на 10 min в микроцентрофужна епруветка от 1,5 ml и след това се центрофугират при 13 000 rpm в продължение на 5 минути, за да се отстранят всякакви твърди частици. След това лизираната проба се прехвърля в нова микроцентрофужна епруветка от 1,5 ml, съдържаща 500 μl 100 % етанол с чистота „за молекулярна биология“ и след това се центрофугира при 13 000 rpm в продължение на 10 минути, за да се утаи ДНК. Етанолът се отстранява и се заменя с 400 μl 70 % етанол, центрофугира се при 13 000 оборота в минута в продължение на 5 минути и ДНК пелетата се разтваря в 50 μl вода с чистота „за молекулярна биология“, несъдържаща дезоксирибонуклеази и рибонуклеази. Отново, при използване на твърди тъкани (гръдна перка), преди извличане на ДНК може да се окаже необходимо да се хомогенизира пробата в лизиращ буфер, като се използва устройство за лизис на тъкани FastPrep® или еквивалентна система за разрушаване на тъканната структура.
|
|
|
3.
|
ДНК се съхранява при – 20 °С, докато стане необходима.
|
Важна забележка: по време на процедурите трябва да бъдат носени ръкавици.
Анализ с полимеразна верижна реакция (PCR)
Извършени са амплификации с използване на 2,5 μl ДНК екстракт в 50 μl реакционен обем чрез използване на Idh локус-специфични праймери (както е описано от Peichel et al., 2004. Current Biology 1:1416-1424):
|
Начален праймер
|
5' GGG ACG AGC AAG ATT TAT TGG 3'
|
|
Обратен праймер
|
5' TAT AGT TAG CCA GGA GAT GG 3'
|
Съществуват множество доставчици на подходящи PCR реактиви. Методът, изложен по-долу, е използваният понастоящем в Cefas Weymouth Laboratory.
1. Приготвяне на „реакционна смес“ (50 μl на проба):
Mastermix се приготвя, както следва. Тя може да бъде приготвена предварително и да се съхраняваа замразена при – 20 °С, докато стане необходима. Приготвя се достатъчно Mastermix за отрицателна контрола (само вода с чистота „за молекулярна биология“).
|
|
Обем (изходна конц.)/проба)
|
Крайна концентрация
|
|
5xGoTaq® реакционен буфер
|
10 μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Нуклеотиди (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (25 mM всеки)
|
250 μM всеки
|
|
Начален праймер
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Обратен праймер
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
вода с чистота „за молекулярна биология“
|
30,75 μl
|
|
|
GoTaq полимераза
|
0,25 μl
|
1,25 U
|
|
—
|
Поставят се 47,5 μl в етикетирана тънкостенна епруветка за PCR от 0,5 ml.
|
|
—
|
Добавят се 2,5 μl от пречистената ДНК към подходящо етикетираната епруветка. Повтаря се за всички проби и за отрицателната контрола.
|
|
—
|
Покрива се с 2 капки минерално масло. Като алтернатива се използва термоциклер със загрят капак.
|
|
—
|
Пробите са били денатурирани в термоциклер Peltier PTC-225 при 94 ± 2 °C в продължение на 5 минути, последвани от 39 цикъла на 94 ± 2 °C в продължение на 1 минута, при 55 ± 2 °C в продължение на 1 минута, при 72 ± 2 °C в продължение на 1 минута, и окончателно удължаване при 72 ± 2 °C в продължение на 10 минути.
|
2. Приготвяне на агарозния гел (2 %):
Традиционно PCR продуктите се разделят върху 20 % агарозен гел, съдържащ етидиев бромид.
Могат също да се използват капилярни системи за електрофореза.
|
—
|
Претеглят се 2 g агароза в 100 ml 1 × TAE буфер
|
|
—
|
Загрява се в микровълнова фурна (прибл. 2-3 мин.) за разтваряне на агарозата.
|
|
—
|
Добавят се 2 капки етидиев бромид с крайна концентрация 0,5μg/ml
|
|
—
|
Горещият разтвор се прехвърля в оборудване за наливане на гел.
|
|
—
|
Дава се възможност за втвърдяване на гела
|
3. Гелна електрофореза:
|
—
|
Агарозният гел се прехвърля в уреда за електрофореза и се потапя в 1 × TAE буфер
|
|
—
|
Поставят се 20 μl от всяка проба в отделно гнездо, като се добавя маркер за молекулно тегло (100bp DNA ladder, Promega) в свободно гнездо.
|
|
—
|
Електрофорезата се провежда при 120 V за 30-45 минути.
|
4. Визуализиране на продуктите от амплификацията
Ако, както е описано по-горе, в агарозния гел е бил включен етидиев бромид, продуктите от ДНК стават видими под източник на ултравиолетови лъчи. Като алтернатива агарозният гел се оцветяват чрез покриване на гела в разреден разтвор на етидиев бромид (0,5 μg/ml във вода) за 30 минути преди визуализацията.
Допълнение 11
Насоки за процедура за изкуствено оплождане за триигла бодливка
Целта на настоящия раздел е да се опишат процедурите за получаване на оплоден хайвер от триигла бодливка с оглед на използването му в ИРПР.
Процедури
Получаване на сперма от мъжки индивиди
|
1.
|
Подлага се на евтаназия добре оцветен мъжки индивид от желаната популация.
|
|
2.
|
Извършва се дисекция на тестисите от всяка страна на рибата. Тестисите по принцип са силно пигментирани пръчковидни структури, които са лесно забележими на страничната линия на тялото. Използва се един от следните методи:
|
|
3.
|
С използване на чифт тънки ножици се започва от клоаката и се прави 1-1,5 cm инцизия с едно срязване под ъгъл от около 45 градуса.
|
|
4.
|
Използва се скалпел за извършване на малка инцизия странично на рибата, леко задно от таза и точно вентрално на костните пластинки.
|
|
5.
|
Тестисите се отстраняват чрез тънки пинсети и се поставят в блюдо на Петри.
|
|
6.
|
Всеки тестис се покрива със 100 μl прясно приготвен краен разтвор на Hank
(31).
|
|
7.
|
Тестисите се нарязват на фини кубчета с помощта на бръснарско ножче или скалпел. Това освобождава сперматозоиди и придава на разтвора на Hank вид на мляко.
|
|
8.
|
Течността, съдържаща спермата, се добавя в епруветка, като същевременно се внимава да не се включват никакви парчета тъкан от тестиси при пипетирането.
|
|
9.
|
Обем от 800 μl краен разтвор на Hank се добавят в епруветката и се смесват добре.
|
|
10.
|
Ако е необходимо, мъжкият екземпляр може да бъде съхранен чрез фиксиране в 100 % етанол или друг желан фиксатор. Това е особено важно, ако при проучването се определят родителите на поколението.
|
Важна забележка: Въпреки че повечето от изискваните изходни разтвори могат да бъдат приготвени предварително,
изходен разтвор 5
и впоследствие
крайният разтвор
следва да бъдат приготвени свежи в деня на употребата.
|
Изходен разтвор 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Дестилирана вода (дест.в.)
|
100 ml
|
|
Изходен разтвор 2
|
|
Na2HPO4 (безводен)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
дест.в.
|
100 ml
|
|
Изходен разтвор 3
|
|
CaCl2
|
0,72 g
|
|
дест.в.
|
50 ml
|
|
Изходен разтвор 4
|
|
MgSO4 · 7H2O
|
1,23 g
|
|
дест.в.
|
50 ml
|
|
Изходен разтвор 5 (прясно приготвен)
|
|
NaHCO3
|
0,35 g
|
|
дест.в.
|
10 ml
|
Забележка: Ако някои от горните соли са налични, но са с различно съдържание на вода (т.е., 2H2O вместо безводен), те все пак могат да се използват, но първо се коригира теглото въз основа на молекулното тегло).
За крайния разтвор на Hank се комбинират в следния ред:
|
Изходен разтвор 1
|
1,0 ml
|
|
Изходен разтвор 2
|
0,1 ml
|
|
Изходен разтвор 3
|
0,1 ml
|
|
дест.в.
|
8,6 ml
|
|
Изходен разтвор 4
|
0,1 ml
|
|
Изходен разтвор 5
|
0,1 ml
|
Разбърква се добре преди използване.
Оплождане
|
1.
|
В желаната популация се идентифицират едри женски екземпляри със зрял хайвер; Женските индивиди са готови за манипулация с цел хвърляне на хайвер само когато се виждат хайверни зърна, издадени от клоаката. Женските индивиди имат характерна поза „с главата нагоре“.
|
|
2.
|
Леко се прокарва пръст или палец от едната страна на рибата по продължение на тялото към опашката, за стимулиране на хвърлянето на хайвер в новоприготвено блюдо на Петри. Същото се повтаря от другата страна на рибата и тя се връща откъдето е взета.
|
|
3.
|
Хайверът може да бъде разпръснат (така, че да образува монослой) с използване на фина четка. Важно е да се направи опит за излагане на максимален брой хайверни зърна на спермата, поради което максималното увеличаване на площта им е от полза. Важна забележка: Хайверът се съхранява във влажно състояние чрез поставяне на влажна тъкан около него (важно е хайверът да не докосва водата пряко, тъй като това може да доведе до преждевременно втвърдяване на хориона и да попречи на оплождането). Съществува голямо вариране в броя на хайверните зърна, които могат да бъдат получени от всяка женска, но като средна стойност следва да бъде лесно от един единствен женски индивид със зрял хайвер да се получат около 150 хайверни зърна.
|
|
4.
|
25μl сперма в смес на Hank се разпределя равномерно по цялата повърхност на хайвера с използване на четката. Хайверните зърна бързо се втвърдяват и променят цвета си (в рамките на една минута) след започване на оплождането. Ако очакваният брой на хайверните зърна е над 150, процедурата се повтаря. По подобен начин, ако хайверните зърна не се втвърдяват в рамките на една минута, добавя се малко повече сперма. Важна забележка: Добавянето на повече сперма не подобрява непременно процента на оплождане.
|
|
5.
|
Хайверните зърна и спермата следва да бъдат оставени да „взаимодействат“ в продължение най-малко на 15 минути и оплодените хайверни зърна следва да бъдат поставени в аквариумите за експозиция в рамките на 1,5 часа след оплождането.
|
|
6.
|
Процедурата се повтаря, като се използва друга женска, до събирането на желания брой хайверни зърна.
|
|
7.
|
Няколко хайверни зърна от последната партида се отделят и се фиксират в 10 % оцетна киселина.
|
Преброяване и разпределяне на хайверните зърна в аквариумите за изпитване
|
1.
|
Хайверните зърна трябва да бъдат равномерно разпределени между всяко ниво на третиране, за да се избегне отклонение в генетично отношение. Всяка партида от оплодени хайверни зърна следва да се раздели на равни по численост групи (на брой колкото нивата на третиране) с помощта на тъп инструмент (т.е., ентомологични пинсети с широк край или с използването на примка за инокулиране). Ако целта е 4 повторения на третиране, с 20 хайверни зърна във всяко, трябва да се разпределят 80 хайверни зърна в аквариум за експозиция. Важна забележка: Препоръчително е да се добавят допълнителни 20 % (т.е., 96 хайверни зърна при всяко ниво на третиране), за да е сигурно, че е получено 100 % оплождане.
|
|
2.
|
Хайверът на бодливката е много податлив на гъбични инфекции извън пазеното от мъжкия гнездо. Във връзка с това обработката на всички хайверни зърна с метиленово синьо през първите 5 дни на изпитването е от решаващо значение. Изходен разтвор на метиленово синьо се приготвя при 1 mg/ml и се добавя към аквариумите за експозиция, за достигане на максимална крайна концентрация от 2,125 mg/l. Важна забележка: Бодливките не следва да бъдат обработвани с метиленово синьо след излюпването, така че системата следва да не съдържа метиленово синьо в ден 6.
|
|
3.
|
Хайверните зърна се проверяват ежедневно и всички мъртви или неоплодени хайверни зърна се записват като такива. Важна забележка: Хайверните зърна не трябва никога да бъдат извън водата до излюпването си, дори да се отнася за много кратки периоди.
|
В.42 БИОРАЗГРАДИМОСТ В МОРСКА ВОДА
ОБЩО ВЪВЕДЕНИЕ
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 306 (1992). Когато са разработвани първоначалните методи за изпитване, не е било известно до каква степен резултатите от скрининговите изпитвания за пълна биоразградимост с помощта на сладки води и отпадъчни води води или активирана утайка като инокулум биха могли да се прилагат за морската среда. По тази точка са били протоколирани променливи резултати (напр. (1)).
|
|
2.
|
Много промишлени отпадъчни води, съдържащи различни химикали, достигат морето или чрез директно изхвърляне, или чрез устията на реките и реките, в които времената на престой са малки в сравнение с периода от време, необходим за пълно биоразграждане на много от съдържащите се химикали. Поради нарастващото осъзнаване на необходимостта от защита на морската среда от увеличаващо се изхвърляне на химикали и необходимостта да се направи оценка на вероятната концентрация на химикали в морето са разработени методи за изпитване за биоразграждане в морска вода.
|
|
3.
|
Описаните тук методи използват естествената морска вода както като водна фаза и като източник на микроорганизми. В стремежа си да съответстват на методите за установяване на пълна биоразградимост в сладки води са били проучени използването на ултрафилтрувана морска вода, както и използването на морски седименти като инокулум. Тези проучвания са били неуспешни. Поради това средата за изпитване е морска вода, предварително обработена с цел отстраняване на грубите частици.
|
|
4.
|
За оценяване на крайната биоразградимост по метода „разклащане в стъкленица“ трябва да бъдат използвани относително високи концентрации на изпитваното вещество, поради слабата чувствителност на метода за анализ на разтворения органичен въглерод (DOC). Това на свой ред налага добавяне към морската вода на неорганични хранителни вещества (N и P), ниските концентрации на които в противен случай биха ограничили отстраняването на DOC. Освен това в метода на изолираните проби е необходимо да се добавят хранителни съставки поради концентрацията на добавеното изпитвано вещество.
|
|
5.
|
Следователно методите не са изпитвания за пълна биоразградимост, тъй като не се прибавя инокулум в допълнение към микроорганизмите, които вече присъстват в морската вода. Също така, при изпитванията не се симулира морската среда, тъй като се добавят хранителни съставки и концентрацията на изпитваното вещество е много по-голяма от евентуалната концентрация в морето. Поради тези причини методите са предложени в нов подраздел „Биоразградимост в морска вода“.
|
ПРИЛАГАНЕ
|
6.
|
Резултатите от изпитванията, които следва да се приложат поради това, че начинът на използване и извеждане от употреба на въпросното вещество е посочил насочване към морето, оставят първоначално впечатление за биоразграждане в морска вода. Ако резултатът е положителен (> 70 % отстраняване на РОВ; > 60 % ThOD — теоретична потребност от кислород), може да се заключи, че е налице потенциал за биоразграждане в морска среда. Въпреки това, евентуален отрицателен резултат не изключва такъв потенциал, но показва, че е необходимо допълнително проучване, например, като се използва максимално ниска концентрация на изпитваното вещество.
|
|
7.
|
Във всеки случай, ако се изисква по-определена стойност за скоростта или степента на биоразграждане в морска вода в съответния обект, би трябвало да се прилагат други по-комплексни и по-сложни, и следователно, по-скъпи методи. Например, изпитването за симулиране може да се прилага, като се използва концентрация на изпитваното вещество, разположена по-близо до вероятната концентрация в околната среда. Също така, възможно е да се използва вода, взета от представляващото интерес място, която не е подсилена, нито предварително обработена, а може също първичното биоразграждане да бъде последвано от специфичен химичен анализ. За крайната биоразградимост биха били необходими белязани с 14C вещества, за да могат да бъдат измерени скоростите на отстраняване на разтворимия органичен 14C и на образуване на 14CO2 в концентрации, близки до условията на околната среда.
|
ИЗБОР НА МЕТОДИ
|
8.
|
Изборът на метода за използване зависи от редица фактори; Следната таблица е дадена в помощ на избора. Веществата с разтворимост във вода под еквивалента на около 5 mg С/l не могат да се изпитват по метода на разклащането в стъкленица, но, поне по принцип, малко разтворимите вещества могат да се изпитват по метода на изолираните проби.
Таблица
Предимства и недостатъци на изпитванията с разклащане в стъкленица и с изолирани проби
|
МЕТОД
|
ПРЕДИМСТВА
|
НЕДОСТАТЪЦИ
|
|
РАЗКЛАЩАНЕ В СТЪКЛЕНИЦА
|
|
—
|
просто устроен апарат с изключение на анализатора на C
|
|
—
|
продължителност от 60 дни не е проблем
|
|
—
|
няма пречения от нитрификация
|
|
—
|
може да бъде адаптиран за летливи вещества
|
|
|
—
|
необходим е анализатор на C
|
|
—
|
използва 5-40 mg DOC/1, може да има потискащо въздействие
|
|
—
|
определянето на DOC е трудно при ниски концентрации в морската вода (ефект на хлоридите)
|
|
—
|
понякога DOC е висок в морска вода
|
|
|
МЕТОД НА ИЗОЛИРАНИТЕ ПРОБИ
|
|
—
|
просто крайно определяне
|
|
—
|
използва ниска концентрация от изпитваното вещество (2 mg/l), като по този начин намалява вероятността от инхибиране
|
|
—
|
лесно се адаптира за летливи вещества
|
|
|
—
|
може да е трудно да се поддържа херметичността на бутилките
|
|
—
|
развитието на бактерии по стените може да доведе до неверни стойности
|
|
—
|
усвояването на O2 в празните проби може да е високо, особено след 28 дни; — може да се преодолее с оставянето на морската вода да престои
|
|
—
|
възможно пречене от усвояването на O2 в резултат от нитрификацията
|
|
|
МЕТОД „РАЗКЛАЩАНЕ В СТЪКЛЕНИЦА“
УВОД
|
1.
|
Настоящият метод е вариант за морска вода на Модифицирания скрининг на ОИСР, описан в глава В.4-Б от настоящото приложение (2). Той е финализиран в резултат на кръгови изпитвания, организирани за Европейската комисия (ЕК) от Датския институт по качество на водите (3).
|
|
2.
|
Също като другия метод за морска вода (метод на изолираните проби), резултатите от това изпитване не следва да се считат като показатели за пълна биоразградимост, но следва да се използват по-специално за получаване на информация относно биоразградимостта на вещества в морската среда.
|
ПРИНЦИП НА МЕТОДА
|
3.
|
Предварително определено количество от изпитваното вещество се разтваря в средата за изпитване до концентрация 5-40 mg разтворен органичен въглерод (DOC)/l. Ако границите на чувствителност на анализите на органичния въглерод са подобрени, използването на по-ниски концентрации от изпитваното вещество може да е полезно, особено за вещества с потискащо действие. Разтворът на изпитваното вещество в изпитвателната среда се инкубира с разбъркване на тъмно или на разсеяна светлина при аеробни условия и определена температура (регулирана до ± 2 °C), която обикновено е в диапазона 15-20 °C. В случаите, когато целта на проучването е симулиране на екологични ситуации, изпитванията могат да се провеждат извън този нормален температурен диапазон. Препоръчителната максимална продължителност на изпитването е около 60 дни. Разграждането се следи чрез измервания на DOC (крайно разграждане) и, в някои случаи, чрез специфичен анализ (първично разграждане).
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНОТО ВЕЩЕСТВО
|
4.
|
За да се разбере дали изпитването може да се приложи към определено вещество, част от свойствата му трябва да са известни. Съдържанието на органичен въглерод във веществото трябва да бъде установен, неговата летливост трябва да бъде такава, че да не възникват значими загуби по време на процеса на изпитване и разтворимостта му във вода следва да бъде по-голяма от еквивалента на 25-40 mg С/l. Също така, не трябва да има значима адсорбция на изпитваното вещество върху стъклени повърхности. За тълкуването на получените резултати следва да има информация за чистотата или относителните дялове на основните компоненти на изпитваното вещество, особено когато резултатът е близък до „праговото“ ниво.
|
|
5.
|
Информацията за токсичността на изпитваното вещество спрямо бактерии, както например е измерена в краткосрочни изпитвания на скоростта на дишане (4) може да бъде полезна при избирането на подходящи концентрации за изпитване и може да бъде особено важна за правилното тълкуване при ниски стойности на биоразграждането. Въпреки това, такава информация не винаги е достатъчна за тълкуването на резултатите, получени при изпитването за биоразграждане, и процедурата, описана в точка 18, е по-подходяща.
|
РЕФЕРЕНТНИ ВЕЩЕСТВА
|
6.
|
За проверка на микробната активност на пробата от морска вода трябва да се използват подходящи референтни вещества. Примери за вещества, които могат да бъдат използвани за тази цел, са натриевият бензоат, натриевият ацетат и анилинът. Референтните вещества трябва да се разграждат в рамките на разумно кратък период от време, в противен случай се препоръчва това изпитване да се повтори, като се използва друга проба от морска вода.
|
|
7.
|
В кръговото изпитване на ЕК, при което пробите от морска вода са взети на различни места и в различно време от годината (3), латентната фаза (tL) и времето за достигане на 50 процента разграждане (t50) за натриевия бензоат, с изключение на латентната фаза, са съответно 1 до 4 дни и 1 до 7 дни. За анилина tL е варирало от 0 до 10 дни, като в същото време t50 е варирало от 1 до 10 дни.
|
ВЪЗПРОИЗВОДИМОСТ И ЧУВСТВИТЕЛНОСТ НА МЕТОДА
|
8.
|
Възпроизводимостта на метода е установена в кръговото изпитване (3). Най-ниската концентрация на изпитваното вещество, за която този метод може да бъде използван с анализ на DOC, до голяма степен се определя от границата на откриване при анализа на органичен въглерод (понастоящем около 0,5 mg С/l) и от концентрацията на разтворения органичен въглерод в използваната морска вода (обикновено от порядъка на 3-5 mg/l за вода от открито море). Фоновата концентрация на DOC не трябва да е надвишава приблизително 20 % от общата концентрация на DOC след добавянето на изпитваното вещество. Ако това не е осъществимо, фоновата концентрация на DOC понякога може да бъде намалена с оставянето на морската вода да престои преди изпитването. Ако методът се използва само със специфичен химичен анализ (чрез който се измерва първичното разграждане), изследователят трябва да документира, като предостави допълнителна информация, дали може да се очаква крайна биоразградимост. Тази допълнителна информация може да се състои от резултатите от други изпитвания за пълна или присъща биоразградимост.
|
ОПИСАНИЕ НА МЕТОДА
Апаратура
|
9.
|
Стандартна лабораторна апаратура, както и:
|
а.
|
Клатачна машина за разполагане на ерленмайерови колби от 0,5-2 l или с автоматично регулиране на температурата, или използвана в пространство с постоянна температура 15-20 °C контролирана до ± 2 °C;
|
|
б.
|
Ерленмайерови колби от 0,5-2 l с тясно гърло;
|
|
в.
|
Апарат за мембранно филтруване или центрофуга;
|
|
г.
|
Мембранни филтри, 0,2-0,45μm;
|
|
д.
|
Анализатор на въглерод;
|
|
е.
|
Оборудване за специфичен анализ (по избор).
|
|
Морска вода
|
10.
|
Взема се проба от морска вода в добре почистен контейнер и се транспортира до лабораторията, за предпочитане в рамките на един или два дни от вземането. По време на транспортирането не се позволява температурата на пробата да надвишава значително температурата, която ще се използва в изпитването. Мястото на пробовземането се определя точно и се описва статусът му по отношение на замърсяванията и хранителните съставки. Особено по отношение на крайбрежните води в тази характеристика следва да се включат брой хетеротрофни микробни колонии и определяне на концентрациите на разтворени нитрати, амониеви йони и фосфати.
|
|
11.
|
Посочва се следната информация за самата проба морска вода:
|
—
|
дълбочина на вземане на пробата;
|
|
—
|
външен вид на пробата — мътност, и т.н.;
|
|
—
|
температура по време на вземането;
|
|
—
|
период между вземането на пробата и използването ѝ за изпитване.
|
|
|
12.
|
Ако съдържанието на DOC в пробата морска вода е високо (точка 8), препоръчва се морската вода да се остави да престои в продължение на около една седмица преди употреба. Пробата престоява в аеробни условия при температурата на изпитването и на тъмно или при разсеяна светлина. Ако е необходимо аеробните условия се поддържат с леко аериране. По време на престояването съдържанието на напълно разградима органична материя намалява. При кръговото изпитване (3) не е установена разлика между потенциала за разграждане на престоялата и прясно взетата проба морска вода. Преди употреба морската вода се обработва предварително с цел отстраняване на грубите частици, например чрез филтруване през найлонов филтър или груба филтърна хартия (не мембрана или GF-C филтри), или пък чрез утаяване и декантиране. Процедурата трябва да бъде протоколирана. Ако се прилага предварителна обработка, тя трябва да се извърши след престояването.
|
Изходни разтвори за неорганични хранителни вещества
|
13.
|
Приготвят се следните изходни разтвори, като се използват реактиви с квалификация „чист“:
|
а)
|
калиев дихидрогенортофосфат, KH2PO4
|
8,50 g
|
|
дикалиев хидрогенортофосфат, K2HPO4
|
21,75 g
|
|
динатриев хидрогенортофосфат дихидрат Na2HPO4 · 2H2O
|
33,30 g
|
|
амониев хлорид (NH4Cl)
|
0,50 g
|
|
Разтваря се в дестилирана вода и се долива до 1 литър.
|
|
|
б)
|
Калциев хлорид (CaCl2).
|
27,50 g
|
|
Разтваря се в дестилирана вода и се долива до 1 литър.
|
|
|
в)
|
Магнезиев сулфат хептахидрат, MgSO4 · 7H2O
|
22,50 g
|
|
Разтваря се в дестилирана вода и се долива до 1 литър.
|
|
|
г)
|
железен(III) хлорид хексахидрат, FeCl3 · 6H2O
|
0,25 g
|
|
Разтваря се в дестилирана вода и се долива до 1 литър.
|
|
Утаяването в разтвор г) може да бъде предотвратено чрез добавяне на една капка концентрирана HCl или 0,4 g динатриева сол на етилендиаминтетраоцетна киселина (EDTA) на литър. Ако се образува утайка в изходния разтвор, той се заменя с прясно приготвен разтвор.
|
Приготвяне на средата за изпитване
|
14.
|
Добавя се 1 ml от всеки от тези изходни разтвори на литър от предварително обработена морска вода.
|
Инокулум
|
15.
|
Не се добавя специфичен инокулум в допълнение към микроорганизмите, които вече присъстват в морска вода. Определя се (по избор) броят образуващи колонии хетеротрофи в средата от морска вода за изпитване (и за предпочитане също и в първоначалните проби морска вода), например чрез броене върху плаки, с използване на морски агар. Това е особено желателно за проби от крайбрежни или замърсени обекти. Проверява се хетеротрофната микробна активност в морска вода чрез провеждане на изпитване с референтно вещество.
|
Приготвяне на стъклениците
|
16.
|
Гарантира се, че всички изделия от стъкло са безупречно чисти, без да е необходимо да са стерилни, (например чрез използване на алкохолен разтвор на хлороводород), промити и подсушени преди употреба, за да се избегне замърсяването им с остатъци от предишни изпитвания. Стъклениците трябва също така да бъдат почистени преди първото използване.
|
|
17.
|
Оценката на изпитваните вещества се извършва в две стъкленици с повторения едновременно, заедно с една стъкленица за референтното вещество. За аналитично определяне на празни проби се извършва изпитване на празна проба, в две повторения, като в нея не се съдържа нито изпитваното, нито референтното вещество. Изпитваните вещества се разтварят в средата за изпитване — те могат да бъдат добавени по подходящ начин чрез концентриран изходен разтвор — за постигане на желаните начални концентрации, обикновено от 5-40 mg DOC/l. Референтното вещество обикновено се изпитва при начални концентрации, съответстващи на 20 mg DOC/l. Ако се използват изходни разтвори на изпитвано и/или референтно вещества, се гарантира, че солеността на средата от морска вода не е значително променена.
|
|
18.
|
Ако могат да се очакват или не могат да бъдат изключени токсични въздействия, може да е препоръчително в планирането на изпитването да се включи опит за потискане, в две повторения. Изпитваното и референтното вещества се добавят в същия съд, като концентрацията на референтното вещество обикновено е същата, както при изпитването на контролата (т.е., 20 mg DOC/l), за да се даде възможност за сравнение.
|
|
19.
|
В ерленмайеровите колби се поставят достатъчни количества от изпитваните разтвори (подходящо количество е до около половината от обема на колбите), и впоследствие всяка колба се снабдява с нехерметично покритие (например алуминиево фолио), което дава възможност за газообмен между колбата и околния въздух. (памучните тапи са неподходящи, ако се използва анализ на DOC). Съдовете се поставят на клатачната машина и се разклащат непрекъснато и леко (напр. при 100 rpm) през цялото време на изпитването. Температурата се контролира (15-20 °C и в рамките на ± 2 °C) и съдовете се защитават срещу попадане на светлина, за да се избегне растеж на водорасли. Гарантира се, че въздухът не съдържа токсични материали.
|
Контролно изпитване за физични и химични свойства
|
20.
|
Ако се подозират механизми на абиотично разграждане, като например хидролиза (проблематична само при специфичен анализ), изпарение или адсорбция, се препоръчва да се извърши контролно изпитване за физични и химични свойства. Това може да бъде постигнато чрез добавяне на живачен(II) хлорид (HgCl2) (32) (50-100 mg/l) в съдове с изпитваното вещество с цел спиране на микробната активност. Значимо намаляване на DOC или на концентрацията на друго специфично вещество в контролното изпитване за физични/химични свойства показва механизми на абиотично отстраняване. (ако се използва живачен хлорид, следва да бъде обърнато внимание на пречения или на каталитично отравяне при анализа на DOC.)
|
Брой на колбите
|
21.
|
В едно типично провеждане се използват следните колби:
|
Колби 1 и 2
|
—
|
съдържат изпитваното вещество (изпитваната суспензия).
|
|
Колби 3 и 4
|
—
|
съдържат само морска вода (празна проба);
|
|
Колба 5
|
—
|
съдържа сравнително вещество (контрола за процедурата).
|
|
Колба 6
|
—
|
съдържа изпитвано и референтно вещества (контрола за токсичност) — по избор;
|
|
Колба 7
|
—
|
съдържа изпитвано вещество и средство за стерилизиране (абиотична стерилна контрола) — по избор.
|
|
Анализ на DOC
|
22.
|
В хода на изпитването през подходящи интервали от време се вземат проби за анализ на DOC (допълнение 1). Пробовземането винаги е при започване на изпитването (ден 0) и на ден 60. За описване на разграждането във времето общо се изискват най-малко пет проби. Не може да се посочи фиксиран времеви график за вземане на проби, тъй като скоростта на биоразграждането варира. Извършва се определяне на DOC в две повторения за всяка проба.
|
Пробовземане
|
23.
|
Изискваният обем на пробите зависи от метода за анализ (специфичен анализ), от използвания апарат за анализ на въглерод, и от процедурата (мембранно филтруване или центрофугиране), избрана за обработка на пробите преди определянето на въглерода (точки 25 и 26). Преди вземането на проби се гарантира, че средата за изпитването е добре размесена и че всички материали, полепнали по стените на колбата, са разтворени или суспендирани.
|
|
24.
|
Веднага след пробовземането се извършва мембранно филтруване или центрофугиране. Ако е необходимо, филтруваните или центрофугираните проби се съхраняват при 2-4 °C за максимум 48 часа, или под – 18 °C за по-дълги периоди (ако е известно, че веществото ще остане незасегнато, преди съхранението се извършва ацидификация до рН 2).
|
|
25.
|
Мембранните филтри (0,2-0,45 μm), като например поликарбонатни мембранни филтри, са подходящи, ако е гарантирано, че нито освобождават въглерод, нито адсорбират веществото по време на филтруването. Някои мембранни филтри са импрегнирани с повърхностноактивни вещества за хидрофилизация и могат да отделят значителни количества разтворен въглерод. Такива филтри се подготвят чрез изваряване в дейонизирана вода три пъти последователно, всеки път по един час. След изваряването филтрите се съхраняват в дейонизирана вода. Отстраняват се началните 20 ml от филтрата.
|
|
26.
|
Като алтернатива на мембранно филтруване може да бъде избрано центрофугиране на пробите. Центрофугирането се извършва при 40 000 m.s– 2 (~ 4 000 g) в продължение на 15 минути, за предпочитане в центрофуга с охлаждане.
Забележка: Както изглежда, разграничаването на общия органичен въглерод (TOC) и DOC (TOC/DOC) при центрофугиране не функционира при много ниски концентрации, тъй като или не са отстранени всички бактерии, или въглеродът като част от бактериалната плазма се е разтворил повторно. При по-високи концентрации на изпитване (> 10 mg С/l) грешката при центрофугирането изглежда сравнително малка.
|
Честота на вземане на пробите
|
27.
|
Ако анализите се извършват веднага след вземане на проби, оценката на следващото време за пробовземане се прави, като се вземе предвид резултатът от аналитичното определяне.
|
|
28.
|
Ако пробите се съхраняват (точка 24) за анализ на по-късен етап, взема се по-голям от изисквания минимален брой от пет проби. Последните проби се анализират най-напред, и чрез избор „със стъпка назад“ на подходящите проби за анализ е възможно да се получи добро описание на кривата на биоразграждане с относително малък брой аналитични определяния. Ако до края на изпитването не е протекло разграждане, не е необходимо да бъдат анализирани допълнителни проби, и при това положение стратегията „със стъпка назад“ може да спести значителни разходи за анализ.
|
|
29.
|
Ако се наблюдава плато на кривата на разграждане преди 60-ия ден, изпитването се прекратява. Ако протичането на разграждане очевидно е започнало към ден 60, но още не е достигнато плато, опитът се удължава за по-нататъшен период.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
30.
|
Резултатите от анализа се записват върху приложените таблици с данни (допълнение 2) и стойностите на биоразграждането както за изпитваното, така и за референтното вещество, се изчисляват от уравнението:

където:
|
Dt
|
=
|
разграждане в процент DOC или отстраняване на специфично вещество в момент t,
|
|
Co
|
=
|
начална концентрация на DOC или на специфично вещество в средата за изпитване,
|
|
Ct
|
=
|
концентрация на DOC или на специфично вещество в средата за изпитване в момент t,
|
|
Cbl(0)
|
=
|
начална концентрация на DOC или на специфично вещество в празната проба,
|
|
Cbl(t)
|
=
|
концентрация на DOC или на специфично вещество в празната проба в момент t,
|
|
|
31.
|
Разграждането се посочва като процентно отстраняване на DOC (крайно разграждане) или отстраняване на специфично вещество (първично разграждане) в момент t. Концентрациите на DOC се изчисляват с точност до 0,1 mg на литър, а средните стойности на Dt се закръглят до най-близкия цял процент.
|
|
32.
|
Процесът на разграждане се илюстрира в графичен вид на диаграма, както е показано на фигурата във „Валидност и интерпретиране на резултатите“. Ако са налице достатъчно данни, от кривата се изчисляват латентната фаза (tL) и времето за достигане на 50 процента отстраняване от края на латентната фаза (t50).
|
Протокол от изпитването
|
33.
|
Протоколът от изпитването трябва да включва следната информация:
|
|
Изпитвано вещество:
|
—
|
физична природа и, където е относимо, физични и химични свойства;
|
|
—
|
данни за идентичността.
|
|
|
|
Условия на изпитването:
|
—
|
местоположение и описание на мястото на пробовземане; статусът му по отношение на замърсяванията и хранителните съставки (брой на колониите, нитрати, амониеви йони, фосфати, ако е приложимо);
|
|
—
|
характеристики на пробата (дата на пробовземане, дълбочина, външен вид, температура, соленост, DOC (по избор), период между вземането на пробата и използването ѝ за изпитването;
|
|
—
|
използван метод за оставяне за престояване на морска вода (ако има такъв);
|
|
—
|
използван метод за предварителна обработка (филтруване/утаяване) на морската вода;
|
|
—
|
метод, използван за определяне на DOC;
|
|
—
|
метод, използван за специфичен анализ (по избор).
|
|
—
|
метод, използван за определянето на броя на хетеротрофите в морската вода (метод чрез броене върху плаки или алтернативна процедура) (по избор);
|
|
—
|
други методи (по избор), използвани за характеризиране на морската вода (измервания на АТФ и др.).
|
|
|
|
Резултати:
|
—
|
аналитичните данни се протоколират в таблица с данни (допълнение 2);
|
|
—
|
Протичането на изпитването за разграждане се представя графично на диаграма, показваща латентната фаза (tL), наклонът и времето (от края на латентната фаза) за достигане на 50 процента отстраняване (t50). Латентната фаза може да се оцени графично, както е показано на фигурата в раздел „Валидност и интерпретиране на резултатите“, или за удобство може да бъде взета като времето, необходимо за 10 процента разграждане;
|
|
—
|
процент на разграждане, измерен след 60 дни, или в края на изпитването.
|
|
|
|
Обсъждане на резултатите.
|
|
Валидност и интерпретиране на резултатите
|
34.
|
Резултатите, получени с референтни вещества, например натриев бензоат, натриев ацетат или анилин, следва да бъдат сравними с резултатите, получени при кръговото изпитване (3) (виж раздел „Референтни вещества“, точка 7). Ако резултатите, получени с референтни вещества, са нетипични, изпитването трябва да се повтори, като се използва друга проба морска вода. Въпреки че резултатите от изпитванията за потискане не винаги са лесни за интерпретиране поради приноса на DOC от изпитваното вещество, значително намаляване на общия процент на отстраняване на DOC в сравнение с този на контролата е положителен знак за токсични въздействия.
|
|
35.
|
Поради използваните относително високи концентрации на изпитване в сравнение с повечето природни системи (и оттам — неблагоприятното съотношение между концентрациите на изпитваните вещества и други източници на въглерод) методът следва да се разглежда като предварителен тест, който може да се използва, за да се посочи дали веществото е напълно биоразградимо. Съответно ниският резултат не винаги означава, че изпитваното вещество не е биоразградимо в морска среда, но показва, че е необходима повече работа, за да може да се установи това.
На фигурата по-долу е даден примерен опит за теоретично разграждане, илюстриращ осъществим начин на оценка на стойностите на tL (продължителност на „латентната фаза“) и t50 (времеви интервал, започващ от tL), необходими за достигане на 50 процента отстраняване.
|
МЕТОД НА ИЗОЛИРАНИТЕ ПРОБИ
УВОД
|
1.
|
Този метод е вариант с морска вода на изпитването с изолирани проби (5) и е финализиран в резултат на кръгово изпитване, организирано за Европейската комисия (ЕК) от Датския институт по качество на водите (3).
|
|
2.
|
Също като другия метод „разклащане в стъкленица“ за морска вода, резултатите от това изпитване не следва да се считат като показания за пълна биоразградимост, но следва да се използват за специално за получаване на информация относно биоразградимостта на вещества в морска среда.
|
ПРИНЦИП НА МЕТОДА
|
3.
|
Предварително определено количество от изпитваното вещество се разтваря в средата за изпитване, обикновено в концентрация 2-10 mg изпитвано вещество на литър (могат да бъдат използвани една или повече концентрации). Разтворът се съхранява в пълна затворена бутилка на тъмно в термостатирана вана при постоянна температура или в затворено пространство при постоянна температура, регулирана с точност ± 1 °C в интервала от 15-20 °C. В случаите, когато целта на проучването е симулиране на екологични ситуации, изпитванията могат да се провеждат извън този нормален температурен диапазон, ако са направени подходящи корекции за регулиране на температурата. Разграждането се следи чрез анализ на кислорода в течение на 28-дневен период.
|
|
4.
|
Кръговото изпитване е показало, че ако изпитването се удължава след 28 дни, в повечето случаи не може да бъде събрана полезна информация, поради сериозни пречения. Стойностите на биологичната потребност от кислород (БПК) в празната проба са били прекомерно високи, което вероятно се дължи на развитието по стените, причинено от липса на разбъркване, и на нитрификацията. Следователно препоръчителната продължителност е 28 дни, но ако стойностите на БПК в празната проба остават в рамките на 30-процентната граница (точки 15 и 40), изпитването може да се удължи.
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНОТО ВЕЩЕСТВО
|
5.
|
За да се разбере дали изпитването може да се приложи към определено вещество, част от свойствата му трябва да са известни. Изисква се емпиричната формула, за да може да бъде изчислена теоретичната потребност от кислород (ТПК) (вж. допълнение 3); в противен случай трябва да бъде определена химичната потребност от кислород (ХПК) на веществото, която да служи като референтна стойност. Използването на ХПК е по-малко задоволително, тъй като някои вещества не се окисляват напълно при изпитване за ХПК.
|
|
6.
|
Разтворимостта на веществото трябва да бъде поне 2 mg/l, макар че по принцип могат да бъдат изпитвани по-малко разтворими вещества (напр. чрез разбъркване с ултразвук), както и летливи вещества. За тълкуването на получените резултати следва да има информация за чистотата или относителните дялове на основните компоненти на изпитваното вещество, особено когато резултатът е близък до „праговото“ ниво.
|
|
7.
|
Информацията за токсичността на веществото спрямо бактерии, както например е измерена в краткосрочни изпитвания на дишането (4) може да бъде много полезна при избирането на подходящи концентрации за изпитване и може да бъде особено важна за правилното тълкуване при ниски стойности на биоразграждането. Въпреки това, такава информация не винаги е достатъчна за тълкуването на резултатите, получени при изпитването за биоразграждане, и процедурата, описана в точка 27, е по-подходяща.
|
РЕФЕРЕНТНИ ВЕЩЕСТВА
|
8.
|
За проверка на микробната активност на пробата от морска вода трябва да се използват подходящи референтни вещества. За тази цел могат да бъдат използвани (например) анилин, натриев ацетат или натриев бензоат. Разграждане на тези вещества от най-малко 60 процента (от тяхната ТПК) трябва да се получава в рамките на разумно кратък период от време, в противен случай се препоръчва изпитването да се повтори, като се използва друга проба от морска вода.
|
|
9.
|
В кръговото изпитване на ЕК, при което пробите от морска вода са взети на различни места и в различно време от годината, латентната фаза (tL) и времето за достигане на 50 процента разграждане (t50) за натриевия бензоат, с изключение на латентната фаза, са съответно 0 до 2 дни и 1 до 4 дни. По отношение на анилина стойностите на tL и t50 са били съответно от 0 до 7 и от 2 до 12 дни.
|
ВЪЗПРОИЗВОДИМОСТ
|
10.
|
Възпроизводимостта на методите е установена в кръговото изпитване (3).
|
ОПИСАНИЕ НА МЕТОДА
Апаратура
|
11.
|
Стандартно лабораторно оборудване и:
|
а)
|
могат да се използват бутилки за БПК с вместимост 250-300 ml със стъклени запушалки или бутилки с вместимост 250-300 ml с тясно гърло и стъклени запушалки;
|
|
б)
|
няколко 2-, 3- и 4-литрови бутилки с отметки за литрите за подготовката на опита и за пълненето на бутилките за БПК;
|
|
в)
|
Водна баня или пространство с постоянна температура за съхранение на бутилките при постоянна температура (± 1 °C), защитени от светлина.
|
|
г)
|
Оборудване за анализ на разтворения кислород;
|
|
д)
|
Мембранни филтри, 0,2-0,45μm (по избор);
|
|
е)
|
Оборудване за специфичен анализ (по избор).
|
|
Морска вода
|
12.
|
Взема се проба от морска вода в добре почистен контейнер и се транспортира до лабораторията, за предпочитане в рамките на един или два дни от вземането. По време на транспортирането не се позволява температурата на пробата да надвишава значително температурата, която ще се използва в изпитването.
|
|
13.
|
Мястото на пробовземането се определя точно и се описва статусът му по отношение на замърсяванията и хранителните съставки. Особено по отношение на крайбрежните и замърсените води в тази характеристика следва да се включат брой хетеротрофни микробни колонии и определяне на концентрациите на разтворени нитрати, амониеви йони и фосфати.
|
|
14.
|
Посочва се следната информация за самата проба морска вода:
|
—
|
дълбочина на вземане на пробата;
|
|
—
|
външен вид на пробата — мътност, и т.н.;
|
|
—
|
температура по време на вземането;
|
|
—
|
разтворен органичен въглерод (DOC):
|
|
—
|
период между вземането на пробата и използването ѝ за изпитване.
|
|
|
15.
|
Ако съдържанието на DOC в пробата морска вода е високо (точка 8), препоръчва се морската вода да се остави да престои в продължение на около една седмица преди употреба.
|
|
16.
|
Престояването на пробата е чрез съхраняване в аеробни условия при температурата на изпитването и на тъмно или при разсеяна светлина. Ако е необходимо, се поддържат аеробни условия с леко аериране. По време на престояването съдържанието на напълно разградима органична материя намалява. При кръговото изпитване (3) не е установена разлика между потенциала за разграждане на престоялата и прясно взетата проба морска вода.
|
|
17.
|
Преди употреба морската вода се обработва предварително с цел отстраняване на грубите частици, например чрез филтруване през найлонов филтър или груба филтърна хартия (не мембрана или GF-C филтри), или пък чрез утаяване и декантиране. Използваната процедура се протоколира. Ако се прилага предварителна обработка, тя трябва да се извърши след престояването.
|
Изходни разтвори за неорганични хранителни вещества
|
18.
|
Приготвят се следните изходни разтвори, като се използват реактиви с квалификация „чист“:
|
а)
|
калиев дихидрогенортофосфат, KH2PO4
|
8,50 g
|
|
дикалиев хидрогенортофосфат, K2HPO4
|
21,75 g
|
|
динатриев хидрогенортофосфат дихидрат Na2HPO4 · 2H2O
|
33,30 g
|
|
амониев хлорид (NH4Cl)
|
0,50 g
|
|
Разтваря се в дестилирана вода и се долива до 1 литър.
|
|
|
б)
|
Калциев хлорид (CaCl2).
|
27,50 g
|
|
Разтваря се в дестилирана вода и се долива до 1 литър.
|
|
|
в)
|
Магнезиев сулфат хептахидрат, MgSO4 · 7H2O
|
22,50 g
|
|
Разтваря се в дестилирана вода и се долива до 1 литър.
|
|
|
г)
|
железен(III) хлорид хексахидрат, FeCl3 · 6H2O
|
0,25 g
|
|
Разтваря се в дестилирана вода и се долива до 1 литър.
|
|
Утаяването в разтвор г) може да бъде предотвратено чрез добавяне на една капка концентрирана HCl или 0,4 g динатриева сол на етилендиаминтетраоцетна киселина (EDTA) на литър. Ако се образува утайка в изходния разтвор, той се заменя с прясно приготвен разтвор.
|
Приготвяне на средата за изпитване
|
19.
|
На един литър предварително обработена морска вода се добавя 1 ml от всеки от горепосочените изходни разтвори. Изпитваната среда се насища с въздух при температурата на изпитването, чрез аериране с чист сгъстен въздух за около 20 минути. Определя се концентрацията на разтворения кислород с контролна цел, Концентрацията на разтворения кислород при насищане, като функция на солеността и температурата, могат да бъдат прочетени от номограмата, приложена към настоящия метод за изпитване (допълнение 4).
|
Инокулум
|
20.
|
Не се добавя специфичен инокулум в допълнение към микроорганизмите, които вече присъстват в морска вода. Определя се (по избор) броят образуващи колонии хетеротрофи в средата от морска вода за изпитване (и за предпочитане също и в първоначалната проба морска вода), например чрез броене върху плаки, с използване на морски агар. Това е особено желателно за проби от крайбрежни или замърсени обекти. Проверява се хетеротрофната микробна активност в морска вода чрез провеждане на изпитване с референтно вещество.
|
Приготвяне на бутилките за изпитване
|
21.
|
Изпълняват се всички необходими манипулации, включително престояването и предварителната обработка на морската вода при избраната температура на изпитване от 15 до 20 °C, като се гарантира чистота, но не стерилност, на всички изделия от стъкло.
|
|
22.
|
Приготвят се групи от бутилки за БПК за определяне на БПК на изпитваното и референтното вещество в едновременни серии от опити. Извършват се всички анализи на двукратните повторения (празни проби, референтно и изпитвано вещества), т.е. приготвят се по две бутилки за всяко определяне. Извършват се анализи най-малко през дни 0, 5, 15 и 28 (четири определяния). Четири определяния за анализите на кислорода изискват общо 3 × 2 × 4 = 24 бутилки (празна проба, референтно и изпитвано вещества) и, следователно, около 8 литра от средата за изпитване (за една концентрация от изпитваното вещество).
|
|
23.
|
Разтвори на референтното и изпитваното вещества се приготвят отделно в големи бутилки с достатъчен обем (точка 11), като първо се добавят референтното и изпитваното вещества или пряко, или, чрез използване на концентриран изходен разтвор, към частично напълнените големи бутилки. Добавя се допълнително среда за изпитване, за получаване на желаните крайни концентрации. Ако се използват изходни разтвори на изпитвани и/или референтни вещества, се гарантира, че солеността на средата от морска вода не е значително променена.
|
|
24.
|
Концентрациите на референтното и изпитваното вещества се избират, като се вземат предвид:
|
а)
|
разтворимостта на разтворения кислород в морска вода при преобладаващите температура на изпитването и соленост (вж. приложената номограма — допълнение 4);
|
|
б)
|
БПК на празната проба морска вода; както и
|
|
в)
|
очакваната биоразградимост на изпитваното вещество.
|
|
|
25.
|
При 15 °C и 20 °C и 32 промила соленост (океанска вода), разтворимостта на разтворения кислород е съответно около 8,1 и 7,4 mg/l. Потреблението на кислород на самата морска вода (дишане в празната проба) може да бъде 2 mg O2/l или повече, ако морската вода не е оставена да престои. Поради това, с цел да се гарантира значима концентрация на кислород, оставаща след окисляване на изпитваното вещество, се използва начална концентрация на изпитваното вещество от около 2-3 mg/l (в зависимост от ТПК) за веществата, при които се очаква пълно разграждане при условията на изпитването (като например референтните вещества). По-малко разградимите вещества се изпитват при по-високи концентрации, до около 10 mg/l, ако не се получават токсични въздействия. Може да бъде полезно да се проведат успоредни изпитвания с ниска (около 2 mg/l) и висока (около 10 mg/l) концентрация на изпитваното вещество.
|
|
26.
|
Трябва успоредно да се определят стойностите на кислорода в празната проба в бутилките, които не съдържат нито изпитваното, нито референтното вещество.
|
|
27.
|
Ако трябва да се определят въздействия за потискане, се приготвят следните серии от разтвори в отделни големи бутилки (точка 13):
|
а)
|
2 mg напълно разградимо вещество на литър, напр. всяко от посочените референтни вещества;
|
|
б)
|
x mg от изпитваното вещество/l (x обикновено е 2);
|
|
в)
|
2 mg напълно разградимо вещество на литър плюс x mg от изпитваното вещество/l.
|
|
Контролно изпитване за физични и химични свойства
|
28.
|
Ако се използва възможността за провеждане на специфични анализи, може да се извърши контролно изпитване за физични и химични свойства с цел да се провери дали изпитваното вещество се отстранява чрез абиотични механизми, като хидролиза или адсорбция. Контролно изпитване за физични и химични свойства може да бъде извършено чрез добавяне на живачен(II) хлорид (HgCl2) (33) (50-100 mg/l) в колби с двукратни повторения с изпитвано вещество, с цел спиране на микробната активност. Значимо намаляване на концентрацията на специфично вещество в по време на изпитването показва механизми на абиотично отстраняване.
|
Брой на бутилките за БПК при типично провеждане
|
29.
|
В типичното провеждане се използват следните бутилки:
|
—
|
най-малко 8, съдържащи изпитвано вещество;
|
|
—
|
най-малко 8, съдържащи само подсилена с хранителни съставки морска вода;
|
|
—
|
най-малко 8, съдържащи референтно вещество и, ако е необходимо
|
|
—
|
6 бутилки, съдържащи изпитвано и референтно вещества (контрола за токсичност).
|
|
ПРОЦЕДУРА
|
30.
|
Незабавно след приготвянето, от долната четвърт (не от дъното) на съответната голяма бутилка се източва всеки разтвор, и се запълват съответната група от бутилки за БПК. Незабавно се анализират нулевите контроли (във време нула) за разтворен кислород (точка 33) или същите се съхраняват за последващ химичен анализ чрез утаяване с MnCl2 (манганов(II) хлорид) и NaOH (натриев хидроксид).
|
|
31.
|
Оставащите успоредни бутилки за БПК се инкубират при температурата на изпитването (15-20 °C), съхраняват се на тъмно, и се отстраняват от зоната за инкубация през подходящи интервали от време (например след 5, 15 и 28 дни, като минимум) и се извършва анализ за разтворен кислород (точка 33).
|
|
32.
|
Пробите за специфични анализи (по избор) се филтруват през мембрана (0,45-0,2 μm) или се центрофугират в продължение на 15 минути. Съхраняват се в продължение на най-много 48 часа при 2-4 °C, или за по-дълъг период при – 18 °C, ако не се анализират незабавно (ако е известно, че веществото ще остане незасегнато, преди съхранението се извършва ацидификация до рН 2).
|
Определяне на разтворения кислород
|
33.
|
Определя се концентрацията на разтворения кислород с използване на химически или електрохимически метод, който е признат на национално или международно равнище.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
34.
|
Резултатите от анализа се записват върху приложените таблици с данни (допълнение 5)
|
|
35.
|
БПК се изчислява като разликата в намаляването на кислорода между празна проба и разтвор на изпитваното вещество при условията на изпитването. Нетното намаляване на кислорода се разделя на концентрацията (w/v) на веществото, за да се изрази БПК като mg БПК/mg изпитвано вещество. Разграждането се определя като отношението на биохимичната потребност от кислород или (за предпочитане) към теоретичната потребност от кислород (ТПК), или към химичната потребност от кислород (ХПК), и се изразява като процент (вж. точка 36).
|
|
36.
|
Стойностите на биоразграждането се изчисляват за всяка времева точка на пробовземане както за изпитваното, така и за референтното вещества, с използване на едното или другото от посочените уравнения:
където:
|
ThOD
|
=
|
теоретична потребност от кислород (изчисляване, допълнение 3)
|
|
COD
|
=
|
химична потребност от кислород, определена опитно.
|
Забележка: Понякога двата начина на изчисляване (процент от ТПК или процент от ХПК) не дават еднакви резултати; използването на ТПК е за предпочитане, тъй като някои вещества не се окисляват напълно при изпитване за ХПК.
|
|
37.
|
Процесът на изпитването за разграждане се илюстрира в графичен вид на диаграма (вж. пример в раздела „Валидност и интерпретиране на резултатите“. Ако са налице достатъчно данни, от кривата за биоразграждането се изчисляват латентната фаза (tL) и времето (t50) за достигане на 50 процента отстраняване от края на латентната фаза.
|
|
38.
|
Ако се използва специфичен анализ (по избор), се посочва процентът на първично разграждане като процент на отстраняване на специфичното вещество в рамките на периода на изпитването (коригиран със стойността, получена в аналитичните празни проби).
|
Протокол от изпитването
|
39.
|
Протоколът от изпитването трябва да включва следната информация:
|
|
Изпитвано вещество:
|
—
|
физична природа и, където е относимо, физични и химични свойства;
|
|
—
|
данни за идентичността.
|
|
|
|
Условия на изпитването:
|
—
|
местоположение и описание на мястото на пробовземане; статусът му по отношение на замърсяванията и хранителните съставки (брой на колониите, нитрати, амониеви йони, фосфати, ако е приложимо);
|
|
—
|
характеристики на пробата (дата на пробовземане, дълбочина, външен вид, температура, соленост, DOC (по избор), период между вземането на пробата и използването ѝ за изпитването;
|
|
—
|
използван метод за оставяне за престояване на морска вода (ако има такъв);
|
|
—
|
използван метод за предварителна обработка (филтруване/утаяване) на морската вода;
|
|
—
|
метод, използван за определянето на ХПК (ако е извършено);
|
|
—
|
метод, използван за измерването на кислорода;
|
|
—
|
процедура за диспергиране на вещества, които са малко разтворими при условията на изпитване;
|
|
—
|
метод, използван за определянето на броя на хетеротрофите в морската вода (метод чрез броене върху плаки или алтернативна процедура);
|
|
—
|
метод, използван за определяне на DOC в морска вода (по избор);
|
|
—
|
метод, използван за специфичен анализ (по избор);
|
|
—
|
други методи по избор, използвани за характеризиране на морската вода (измервания на АТФ и др.).
|
|
|
|
Резултати:
|
—
|
аналитичните данни се протоколират в таблица с данни (приложена, допълнение 5);
|
|
—
|
протичането на изпитването за разграждане се представя графично на диаграма, показваща латентната фаза (tL), наклонът и времето (от края на латентната фаза) за достигане на 50 процента от крайното усвояване на кислород, причинено от окисление на изпитваното вещество (t50). Латентната фаза може да се оцени графично, както е показано на приложената фигура, или за удобство може да бъде взета като времето, необходимо за 10 процента разграждане;
|
|
—
|
процент на разграждане, измерен след 28 дни.
|
|
|
|
Обсъждане на резултатите.
|
|
Валидност и интерпретиране на резултатите
|
40.
|
Дишането в празната проба не трябва да надхвърля 30 процента от кислорода в бутилката за изпитване. Ако не е възможно да се изпълни този критерий с прясно взета морска вода, морската вода трябва да се остави да престои (да се стабилизира) преди употреба.
|
|
41.
|
Следва да се вземе под внимание възможността азотсъдържащи вещества да повлияят на резултатите.
|
|
42.
|
Резултатите, получени с референтните вещества, натриев бензоат и анилин следва да бъдат сравними с резултатите, получени по време на кръговото изпитване (3) (точка 9). Ако резултатите, получени с референтни вещества, са нетипични, изпитването трябва да се повтори, като се използва друга проба морска вода.
|
|
43.
|
Изпитваното вещество може да се счита за потискащо за бактерии (при използваната концентрация) ако БПК на сместа от референтното и изпитваното вещество е по-малка от сбора на БПК на отделните разтвори на двете вещества.
|
|
44.
|
Поради относително високите концентрации на изпитване в сравнение с повечето природни системи и оттам — неблагоприятното съотношение между концентрациите на изпитваното вещество и други източници на въглерод, методът следва да се разглежда като предварителен тест, който може да се използва, за да се посочи дали веществото е напълно биоразградимо. Съответно ниският резултат не винаги означава, че изпитваното вещество не е биоразградимо в морска среда, но показва, че е необходима повече работа, за да може да се установи това.
По-долу е даден примерен опит за теоретично разграждане, илюстриращ осъществим начин на оценка на стойностите на tL (продължителност на „латентната фаза“) и t50, времеви интервал (започващ от tL), необходим за достигане на 50 процента от крайното усвояване на кислород, причинено от окисление на изпитваното вещество:
|
ЛИТЕРАТУРА
|
(1)
|
de Kreuk J.F. and Hanstveit A.O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561-573.
|
|
(2)
|
Глава В.4-Б от настоящото приложение: „Определяне на пряката биологична разградимост“ част III Модифициран скрининг на ОИСР
|
|
(3)
|
Nyholm N. and Kristensen P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984-1985, March 1987, Commission of the European Communities.
|
|
(4)
|
Глава В.11 от настоящото приложение: Биоразграждане — изпитване за потискане дишането на активирана утайка.
|
|
(5)
|
Глава В.4-Д от настоящото приложение: Определяне на пълната биоразградимост, част VI. Изпитване с изолирани проби
|
Допълнение 1
Определяне на органичен въглерод в морска вода
МЕТОД „РАЗКЛАЩАНЕ В СТЪКЛЕНИЦА“
За определяне на съдържанието на органичен въглерод във водна проба, органичните съединения в пробата се окисляват до въглероден диоксид, като за тази цел обикновено се използва една от следните три техники:
|
—
|
окисляване във воден разтвор с персулфат/ултравиолетови лъчи;
|
|
—
|
окисляване във воден разтвор с персулфат/висока температура (116-130 °C);
|
Участващият CO2 се определя количествено, с използване инфрачервена спектроскопия или титриметрия. Като алтернатива, CO2 се редуцира до метан, който се определя количествено с пламъчно-йонизационен детектор (FID).
Методът с персулфат/ултравиолетови лъчи обикновено се използва за анализ на „чиста“ вода с ниско съдържание на твърди частици. Последните два метода могат да се прилагат за повечето видове водни проби, като окисляването с персулфат/висока температура е най-подходящо за проби с ниско съдържание, а техниката с изгарянето е приложима за проби със съдържание на нелетлив органичен въглерод много над 1 mg С/l.
Пречения
И трите метода са зависими от отстраняването на съдържащия се в пробата неорганичен въглерод (IC), или от компенсирането му. Прочистване подкислената проба от CO2 е най-често използваният метод за отстраняване на неорганичен въглерод, въпреки че това също води до загуба на летливи органични съединения (1). Пълното отстраняване или компенсиране на неорганичния въглерод трябва да се гарантира за всяка матрица на пробата, и летливият органичен въглерод трябва да бъде определен в допълнение към нелетливия органичен въглерод в зависимост от вид на пробата.
Високите концентрации на хлориди водят до намалена ефикасност на окисляването при използването на метода с персулфат/ултравиолетови лъчи (2). Прилагане на окисляващ реактив, модифициран чрез добавяне на живачен(II) нитрат може обаче да отстрани това пречене. Препоръчва се за оценка на всеки тип съдържаща хлориди проба да се използва максимално допустимият обем на пробата. Високи концентрации на сол в проба, анализирана с използване на метода на изгарянето, може да причини покриване на катализатора със сол и прекомерна корозия на горивната тръба. Следва да се вземат предпазни мерки в съответствие с ръководството на производителя.
Много мътни проби, както и проби, съдържащи твърди частици, може да не се окислят напълно бъде ненапълно окислени при използването на метода с персулфат/ултравиолетови лъчи.
Пример за подходящ метод
Нелетливият органичен въглерод се определя чрез окисляване с персулфат/ултравиолетови лъчи и последващо количествено определяне на отделения CO2 с използване на недисперсионна инфрачервена спектрометрия.
Окисляващият реактив се модифицира в съответствие с препоръките, дадени в (2), както е описано в ръководството на производителя:
|
а)
|
8,2 g HgCl2 и 9,6 g Hg(NO3)2 · H2O се разтварят в няколко стотици милилитра вода с квалификация „чист“ и ниска концентрация на въглерод.
|
|
б)
|
20 g K2S2O8 се разтварят в разтвора на живачни соли.
|
|
б)
|
5 ml HNO3 (конц.) се добавят към сместа.
|
|
г)
|
реактивът се разрежда до 1 000 ml.
|
Преченията от хлориди се отстраняват с използване на проба с обем 40 μl за 10 процента хлориди и проба с обем 200 μl за 1,9 процента хлориди. Пробите с високи концентрации на хлориди и/или по-големи обеми проби могат да бъдат анализирани в съответствие с този метод, при условие че се предотврати увеличаването на хлоридите в съда за окисление. впоследствие може да бъде извършено определяне на летливия органичен въглерод за въпросния тип проба, ако е относимо.
ЛИТЕРАТУРА
|
(1)
|
ISO, Water quality — determination of total organic carbon. Draft International Standard ISO/DIS 8245, January 16, 1986.
|
|
(2)
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16th edition, 1985.
Също така представлява интерес (дава описание на система за автоматизиран анализ):
|
|
(3)
|
Schreurs W. (1978). An automated colorimetric method for the determination of dissolvedorganic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137-142.
|
Допълнение 2
Биоразграждане в морска вода
МЕТОД „РАЗКЛАЩАНЕ В СТЪКЛЕНИЦА“
ТАБЛИЦА С ДАННИ
|
2.
|
ДАТА НА ЗАПОЧВАНЕ НА ИЗПИТВАНЕТО:
|
|
3.
|
ИЗПИТВАНО ВЕЩЕСТВО:
Наименование:
|
Концентрация на изходния разтвор:
|
mg/l като вещество
|
|
Начална концентрация в средата, to:
|
mg/l като вещество
|
|
:
|
mg DOC/l
|
|
|
4.
|
МОРСКА ВОДА:
Източник:
Дата на вземане:
Дълбочина на вземане на пробата;
Външен вид в момента на вземане (напр. мътна и т.н.):
|
Соленост при вземането:
|
‰
|
|
Температура при вземането:
|
°C
|
|
DOC „x“ часа след вземането:
|
mg/l
|
Предварителна обработка преди третирането (напр. филтруване, утаяване, престояване и т.н.):
|
Брой микробни колонии
|
|
колонии/ml
|
|
|
|
—
|
в началото на изпитването
|
|
колонии/ml
|
|
Други характеристики:
|
|
|
|
|
5.
|
ОПРЕДЕЛЯНИЯ НА ВЪГЛЕРОД:
Анализатор на въглерод
|
|
Колба №
|
|
DOC след n дни (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Изпитване: подсилена с хранителни съставки морска вода с изпитвано вещество
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
средна стойност, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
средна стойност, Cb(t)
|
|
|
|
|
|
|
Празна проба: подсилена с хранителни съставки морска вода без изпитвано вещество
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
средна стойност, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
средна стойност, Cd(t)
|
|
|
|
|
|
| средна стойност,

|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
ОЦЕНЯВАНЕ НА НЕОБРАБОТЕНИТЕ ДАННИ
|
Колба №
|
Изчисляване на резултатите
|
% на разграждане след n дни
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|

|
0
|
|
|
|
|
|
Средна стойност (34)
|

|
0
|
|
|
|
|
|
Забележка:
|
Подобни формати могат да се използват когато след разграждането следва специфичен анализ, както и за референтното вещество и за контролите за токсичност.
|
|
|
7.
|
АБИОТИЧНО РАЗГРАЖДАНЕ (по избор)
|
|
Време (дни)
|
|
0
|
t
|
|
концентрация на DOC (mg/l) в стерилна контрола
|
Cs(o)
|
Cs(t)
|

|
Допълнение 3
Изчисляване на теоретичната биохимична потребност от кислород
МЕТОД НА ИЗОЛИРАНИТЕ ПРОБИ
ТПК на веществото CcHhClclNnNanaOoPpSs с молекулно тегло MW се изчислява според:
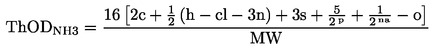
Това изчисление предполага, че C се минерализира в CO2, H в H2O, P в P2O5 и Na в Na2O. Халогенът се отстранява като водороден халогенид, а азотът — като амоняк.
Пример:
Глюкоза C6H12O6, MW = 180
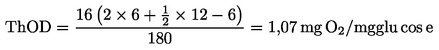
Молекулните тегла на солите, различни от тези на алкалните метали, се изчислява въз основа на допускането, че солите са хидролизирани.
За сярата се допуска, че се окислява до степен на окисление + 6.
Пример:
Натриев n-додецилбензенсулфонат C18H29SO3Na, MW = 348

В случай на азотсъдържащи вещества азотът може да бъде отстранен като амоняк, нитрити или нитрати, съответстващи на различни теоретични биохимични потребности от кислород.

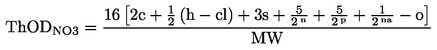
Да предположим, че в случая с вторичен амин при анализа е наблюдавано образуване изцяло на нитрати:
(C12H25)2 NH, MW = 353

Допълнение 4

Допълнение 5
Биоразграждане в морска вода
МЕТОД НА ИЗОЛИРАНИТЕ ПРОБИ
ТАБЛИЦА С ДАННИ
|
2.
|
ДАТА НА ЗАПОЧВАНЕ НА ИЗПИТВАНЕТО:
|
|
3.
|
ИЗПИТВАНО ВЕЩЕСТВО:
Наименование:
|
Концентрация на изходния разтвор:
|
mg/l
|
|
Начална концентрация в средата от морска вода:
|
mg/l
|
|
ТПК или ХПК:
|
mg О2/mg изпитвано вещество
|
|
|
4.
|
МОРСКА ВОДА:
Източник:
Дата на вземане:
Дълбочина на вземане на пробата;
Външен вид в момента на вземане (напр. мътна и т.н.):
|
Соленост при вземането:
|
‰
|
|
Температура при вземането:
|
°C
|
|
DOC „x“ часа след вземането:
|
mg/l
|
Предварителна обработка преди третирането (напр. филтруване, утаяване, престояване и т.н.):
|
Брой микробни колонии
|
|
колонии/ml
|
|
|
|
—
|
началото на изпитването
|
|
в колонии/ml
|
|
Други характеристики:
|
|
|
|
|
5.
|
СРЕДА ЗА ИЗПИТВАНЕ:
|
Температура след аерирането:
|
°C
|
|
Концентрация на O2 след аериране и преди започване на изпитването:
|
mg O2/l
|
|
|
6.
|
ОПРЕДЕЛЯНЕ НА РАЗТВОРЕНИЯ КИСЛОРОД:
Метод: по Winkler/електрод
|
|
Колба №
|
|
mg O2/l след n дни
|
|
0
|
5
|
15
|
28
|
|
Изпитване: подсилена с хранителни съставки морска вода с изпитвано вещество
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Средна стойност от празна проба
|

|
|
|
|
|
|
Празна проба: подсилена с хранителни съставки морска вода, но без изпитвано вещество
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Средна стойност от изпитването
|

|
|
|
|
|
Забележка: Подобни формати могат да се използват за референтното вещество и за контролите за токсичност.
|
|
7.
|
НАМАЛЯВАНЕ НА РАЗТВОРЕНИЯ КИСЛОРОД: % РАЗГРАЖДАНЕ (%D):
|
|
Намаляване на разтворения кислород след n дни
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|

|
|
|
|
|
В.43. АНАЕРОБНА БИОРАЗГРАДИМОСТ НА ОРГАНИЧНИ ВЕЩЕСТВА В РАЗГРАДЕНА УТАЙКА: ЧРЕЗ ИЗМЕРВАНЕ НА ПОЛУЧАВАНЕТО НА ГАЗ
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 311 (2006). Съществуват редица скринингови тестове за оценка на аеробната биоразградимост на органични вещества (методи за изпитване В.4, В.9, В.10 и В.11 (1), и насоки на ОИСР TG 302C (2)) и резултатите от прилагането на същите са били успешно използвани за прогнозиране на съдбата на вещества в аеробна среда, особено в аеробните етапи на пречистване на отпадъчните води. Различни пропорции неразтворими във вода вещества, както и такива, които се адсорбират върху твърди вещества от отпадъчните води, също се пречистват в аеробна среда, тъй като те присъстват в утаени отпадъчни води. Независимо от това, по-големите части от тези вещества са свързани с първичната утаена утайка, която е отделена от непречистените отпадъчни води в резервоари за утаяване преди утаените отпадъчни води или супернатантът да бъдат пречистени в аеробна среда. След това утайката, съдържаща някои от разтворимите вещества в интерстициалната течност, след това се пропуска в нагряти реактори за анаеробно разграждане. Все още не съществуват изпитвания в тази серия за оценка на биоразградимостта в анаеробни условия в анаеробни реактори и с това изпитване се цели да бъде запълнена тази празнина; то не е задължително приложимо по отношение на други безкислородни компоненти на околната среда.
|
|
2.
|
Респирометричните техники за измерване на получени количества газ при анаеробни условия, предимно метан (CH4) и въглероден диоксид (CO2), са успешно използвани за оценка на биоразградимостта в анаеробни условия. Birch et al (3) преразгледаха тези процедури и стигнаха до заключение, че работата на Shelton and Tiedje (4), основана на по-ранни проучвания (5)(6)(7), е най-всеобхватна. Този метод (4), който бе доразвит от други (8) и стана част от стандартите на САЩ (9) (10), не реши проблемите, свързани с различната разтворимост на CO2 и CH4 в средата за изпитване, и с изчисляването на теоретичното получаване на газ на дадено изпитвано вещество. Докладът ECETOC (3) препоръча допълнително измерване на съдържанието на разтворен неорганичен въглерод (DIC) в супернатантната течност, което направи техниката по-широко приложима. Методът ECETOC беше обект на международни действия по калибриране (или кръгово изпитване) и се превърна в ISO стандарт 11734 (11).
|
|
3.
|
Настоящият метод за изпитване, основаващ се на ISO 11734 (11), описва скринингов метод за оценка на потенциалната анаеробна биоразградимост на органични вещества при специфично условие (т.е. в анаеробен реактор в даден момент и диапазон от концентрации на микроорганизми). Тъй като се използва разредена утайка със сравнително висока концентрация на изпитваното вещество и продължителността на изпитването обикновено е по-голяма от времето на задържане на утайката в анаеробните реактори, условията на изпитването не отговарят непременно на условията в анаеробните реактори, нито пък това изпитване е приложимо за оценката на анаеробната биоразградимост на органични вещества при различни условия на околната среда. Утайката се експонира на изпитваното вещество за период до 60 дни, който е по-дълъг от нормалното време на задържане на утайката (25 до 30 дни) в анаеробните реактори, макар че в промишлени обекти времена на задържане могат да бъдат много по-дълги. Прогнозите от резултатите от това изпитване не могат да бъдат направени толкова убедително, както при биоразграждане в аеробни условия, тъй като са натрупани много доказателства за поведението на изпитвани вещества в „готови“ изпитвания в аеробни условия и в изпитвания за симулиране, и аеробната среда е достатъчна за увереността, че съществува връзка; съществуват малко подобни доказателства за анаеробната среда. Може да се допусне, че е налице пълно анаеробно биоразграждане, ако се постигне 75—80 % от теоретичното получаване на газ. Високите съотношения на вещество към биомаса, използвани при тези изпитвания, означават, че за вещество, което премине, е по-вероятно да се разгражда в анаеробен реактор. Освен това веществата, които не могат да бъдат преобразувани в газ при изпитването, не са непременно устойчиви при съотношения на вещество към биомаса, които са по-близки до действителните в околната среда. Също така, протичат други анаеробни реакции, чрез които веществата могат да бъдат най-малко частично разградени, напр. дехлориране, но това изпитване не открива такива реакции. Независимо от това, чрез прилагане на специални аналитични методи за определяне на изпитваното вещество, неговото отстраняване може да се следи (вж. точки 6, 30, 44 и 53).
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
4.
|
Промита разградена утайка (36), съдържаща ниски (< 10 mg/l) концентрации на неорганичен въглерод (IC), се разрежда приблизително десетократно до обща концентрация на твърди вещества от 1 g/l до 3 g/l и се инкубира при 35 °C ± 2 °C в херметично затворени съдове с изпитваното вещество с 20 до 100 mg С/l за период до 60 дни. Дава се възможност за измерване активността на утайката чрез изпитване на паралелни празни контроли с инокулум от утайка в средата, но без изпитвано вещество.
|
|
5.
|
Измерва се увеличението на налягането в парното пространство в съдовете, произтичащо от получаването на въглероден диоксид и метан. При условията на изпитването голяма част от получения CO2 ще бъде разтворен в течната фаза или преработен в карбонат или хидрогенкарбонат. Този неорганичен въглерод се измерва в края на изпитването.
|
|
6.
|
Количеството въглерод (неорганичен, плюс метан), получено в резултат на биоразграждането на изпитваното вещество, се изчислява от нетното количество получен газ и нетното образуване на неорганичен въглерод в течната фаза, превишаващи стойностите на празните контроли. Степента на биоразграждане се изчислява от получения общия неорганичен въглерод и въглерода в метана като процент от измереното или изчислено количество въглерод, добавен като изпитвано вещество. Процесът на биоразграждане може да бъде следен чрез извършване на междинни измервания само на получаването на газ. Освен това първичното биоразграждане може да се определи чрез специфични анализи в началото и в края на изпитването.
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНОТО ВЕЩЕСТВО
|
7.
|
Необходимо е да са известни чистотата, водоразтворимостта, летливостта и адсорбционните характеристики на изпитваното вещество, за да е възможно да се извърши правилно тълкуване на резултатите. Трябва да се установи — от химичната структура или от измерване — съдържанието на органичен въглерод ( % w/w) на изпитваното вещество. За летливите изпитвани вещества измерената или изчислената стойност на константата от закона на Хенри може да е от полза при вземане на решение дали изпитването е приложимо. За избора на подходяща концентрация на изпитване и за тълкуването на резултатите, показващи слаба биоразградимост, е полезно да се разполага с информация за токсичността на изпитваното вещество за анаеробните бактерии. Препоръчва се да се включи контрола за потискането, освен ако не е известно, че изпитваното вещество не потиска активността на анаеробните микроорганизми (вж. точка 21 и ISO 13641-1 (12)).
|
ПРИЛОЖИМОСТ НА МЕТОДА ЗА ИЗПИТВАНЕ
|
8.
|
Методът за изпитване може да се прилага за водоразтворими вещества; той може да се прилага също така за малко разтворими и неразтворими вещества, при условие че се използва метод за точно дозиране, вж. напр. ISO 10634 (13). За летливи вещества като цяло е необходимо решение за всеки конкретен случай. Може да е необходимо да бъдат предприети специални мерки, например с цел да не се отделя газ по време на изпитването.
|
РЕФЕРЕНТНИ ВЕЩЕСТВА
|
9.
|
За да се провери процедурата се изпитва референтно вещество чрез паралелно приготвяне на подходящи съдове като част от нормалните провеждания изпитването; Като пример могат да бъдат дадени фенол, натриев бензоат и полиетиленгликол 400, от които би се очаквало да се разградят с повече от 60 % от теоретичното получаване на газ (т.е. метан и неорганичен въглерод) в рамките на 60 дни (3)(14).
|
ВЪЗПРОИЗВОДИМОСТ НА РЕЗУЛТАТИТЕ ОТ ИЗПИТВАНЕТО
|
10.
|
В международно кръгово изпитване (14) е имало добра възпроизводимост при измерванията на налягането на газ между съдове с трикратни повторения. Относителното стандартно отклонение (коефициент на вариация, COV) като цяло е било под 20 %, въпреки че тази стойност често се е увеличавала > 20 % в присъствието на токсични вещества или към края на 60-дневния период на инкубация. Установени са също така и по-високи отклонения в съдове с обем < 150 ml. Крайните стойности на pH за изпитваните среди са били в диапазона 6,5-7,0.
|
|
11.
|
При кръговото изпитване са получени следните резултати.
|
Изпитвано вещество
|
Общи данни
n1
|
Средно разграждане
(от общите данни)
(%)
|
Относително стандартно отклонение
(от общите данни)
(%)
|
Валидни данни
n2
|
Средно разграждане
(от валидните данни)
(%)
|
Относително стандартно отклонение
(от валидните данни)
(%)
|
Данни > 60 % разграждане във валидни изпитвания
n3
|
|
Палмитинова киселина
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (37)
|
|
Полиетиленгликол 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Коефициентите на вариация на средната за всички стойности, получени при палмитинова киселина и полиетиленгликол 400, са били 45 % (n = 36) и 35 % (n = 38). При игнориране на стойностите < 40 % и > 100 % (за първите се допуска, че се дължат на неоптимални условия, а последните — на неизвестни причини) COV са били намалени съответно на 26 % и 23 %. Делът на „валидните“ стойности, при които се достига минимум 60 % разграждане, е бил 70 % за палмитинова киселина и 83 % за полиетиленгликол 400. Съотношенията на процента на биоразграждане, получени от измервания на DIC, са били относително ниски, но са варирали. За палмитинова киселина интервалът е бил 0-35 % със средна стойност 12 % и COV 92 %, а за полиетиленгликол 400 интервалът е бил 0-40 %, средно 24 % и COV 54 %.
|
ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
Апаратура
|
13.
|
Изисква се използване на стандартно лабораторно оборудване, както и на следното:
|
а.
|
Инкубатор — безискров и контролиран при 35 °C ± 2 °C;
|
|
б.
|
Устойчиви на високо налягане стъклени съдове за изпитване с подходящ номинален размер (38), всеки от които снабден със септа с газонепроницаемо покритие, издържаща около 2 bar. Парното пространство трябва да е между 10 % и 30 % от общия обем. Ако биогазът се освобождава редовно, подходящата стойност е около 10 % обем на парното пространство, но ако освобождаването на газ се извършва само в края на изпитването, подходящата стойност е 30 %. Когато налягането се освобождава при всяко време на пробовземане, препоръчват се стъклени серумни бутилки с номинален обем 125 ml, с действителен обем от около 160 ml, херметично затворени със септи (39) за серумни бутилки и алуминиеви капачки във формата на пръстени;
|
|
в.
|
Уред за измерване на налягане (40), приспособен за измерване и пропускане на получените газове, например ръчен прецизен манометър, свързан с подходяща игла от спринцовка; 3-пътен газонепроницаем клапан позволява изпускане на надналягането (допълнение 1). Необходимо е вътрешният обем в тръбите на преобразувателя на налягането и клапана да се запази колкото е възможно по-малък, така че грешките от пренебрегването на обема на оборудването да не са значими;
Забележка — показанията за налягането се използват директно за изчисляване на количеството въглерод, получен в парното пространство (точки 42-44). Като алтернатива, показанията за налягането могат да бъдат превърнати в обеми (при температура 35 °C, атмосферно налягане) получен газ, чрез графика за преобразуване. Тази графика се построява въз основа на данни, получени чрез инжектиране на предварително известни количества азот в серия от съдове за изпитване (напр. серумни бутилки) при 35° ± 2 °C и записване на получените стабилизирани показания за налягането (виж допълнение 2). Изчислението е показано в бележката в точка 44.
Предупреждение — следва да се обърне внимание с оглед избягване на убождане с игли при използването на микроспринцовки.
|
|
г.
|
Анализатор на въглерод, подходящ за директно определяне на неорганичен въглерод в интервала от 1 mg/l до 200 mg/l;
|
|
д.
|
високоточни спринцовки за пробите от газове и течности;
|
|
е.
|
Магнитни бъркалки и магнитни пръчици за разбъркване (по избор);
|
|
ж.
|
Защитна камера с ръкавици (препоръчително).
|
|
Реактиви
|
14.
|
Навсякъде се използват само реактиви с квалификация „чист“.
|
Вода
|
15.
|
Дестилирана или дейонизирана вода (от която кислородът е отстранен чрез барботиране с азот, съдържащ по-малко от 5 μl/l кислород), съдържаща по-малко от 2 mg/l разтворен органичен въглерод (DOC).
|
Среда за изпитване
|
16.
|
Средата за разреждане трябва да бъде изготвена така, че да съдържа следните съставки в посочените количества:
|
безводен калиев дихидрогенфосфат (KH2PO4)
|
0,27 g
|
|
динатриев хидрогенфосфат додекахидрат (Na2HPO4 · 12H2O))
|
1,12 g
|
|
амониев хлорид (NH4Cl)
|
0,53 g
|
|
калциев хлорид дихидрат (CaCl2 · 2H2O)
|
0,075 g
|
|
магнезиев хлорид хексахидрат (MgCl2 · 6H2O)
|
0,10 g
|
|
железен(II) хлорид тетрахидрат (FeCl2 · 4H2O)
|
0,02 g
|
|
ресазурин (индикатор за кислород)
|
0,001 g
|
|
натриев сулфид нонахидрат (Na2S · 9H2O)
|
0,10 g
|
|
изходен разтвор на микроелементи (по избор, точка 18)
|
10 ml
|
|
Добавя се вода, от която е отстранен кислородът (точка 15)
|
до 1 литър
|
Забележка: Следва да бъде използван прясно доставен натриев сулфид, или същият следва да бъде промит и изсушен преди употреба, с цел да се осигури достатъчна редукционна способност. Изпитването може да се извърши без използването на защитна камера с ръкавици (вж. точка 26). В този случай крайната концентрация на натриев сулфид в средата следва да се увеличи до 0,20 g Na2S · 9H2O на литър. Натриев сулфид може също да се добави от подходящ анаеробен изходен разтвор през септата на затворените бутилки за изпитване, тъй като тази процедура ще доведе до намаляване на риска от окисление. Натриевият сулфид може да се замени с титанов(III) цитрат, който се добавя през септата на затворените съдове за изпитване при крайна концентрация от 0,8 до 1,0 mmol/l. Титановият(III) цитрат е високо ефективен и ниско токсичен редуктор, който се изготвя, както следва: Разтварят се 2,94 g тринатриев цитрат дихидрат в 50 ml вода без съдържание на кислород (което води до 200 mmol/l разтвор) и се добавят 5 ml 15 % (w/v) разтвор на титанов(III) хлорид. Неутрализира се до pH 7 ± 0,2 с неорганични вещества с алкален характер и се поставя в подходящ съд под струя от газообразен азот. Концентрацията на титановия(III) цитрат в този изходен разтвор е 164 mmol/l.
|
|
17.
|
Смесват се компонентите на средата за изпитване, с изключение на редуктора (натриев сулфид, титанов цитрат) и в разтвора се барботира азот за около 20 минути непосредствено преди употреба, за да се отстрани кислородът. След това се добавя подходящият обем от прясно приготвен разтвор на редуктора (приготвен във вода, от която е отстранен кислородът) непосредствено преди използването на средата. Коригира се pH на средата на 7 ± 0,2, при необходимост с разредена неорганична киселина или вещество с алкален характер.
|
Изходен разтвор на микроелементи (по избор)
|
18.
|
Препоръчва се средата за изпитване да съдържа следните микроелементи за подобряване на процесите на разграждане в анаеробни условия, особено при използване на ниски концентрации (напр. 1 g/l) на инокулума (11).
|
Манганов хлорид тетрахидрат (MnCl2 · 4H2O)
|
50 mg
|
|
Борна киселина (H3BO3)
|
5 mg
|
|
Цинков хлорид (ZnCl2)
|
5 mg
|
|
Меден(II) хлорид (CuCl2)
|
3 mg
|
|
Динатриев молибдат дихидрат ((MnCl2 · 4H2O))
|
1 mg
|
|
Кобалтов хлорид хексахидрат (CoCl2 · 6H2O)
|
100 mg
|
|
Никелов хлорид хексахидрат (NiCl2 · 6H2O)
|
10 mg
|
|
Динатриев селенит (Na2SeO3)
|
5 mg
|
|
Добавя се вода, от която е отстранен кислородът (точка 15)
|
до 1 литър
|
|
Изпитвано вещество
|
19.
|
Добавя се изпитваното вещество като изходен разтвор, суспензия, емулсия или пряко в твърдо или течно състояние, или абсорбирано върху филтър от стъклено влакно, за да се получи концентрация не повече от 100 mg/l органичен въглерод. Ако са използвани изходни разтвори се приготвя подходящ разтвор с вода (от която кислородът е предварително отстранен чрез барботиране с азот) (точка 15) с такова съдържание, че добавеният обем да е по-малко от 5 % от общия обем на реакционната смес. Стойността на pH на изходния разтвор се коригира до 7 ± 0,2 ако е необходимо. За изпитвани вещества, които не са достатъчно разтворими във вода, вж. ISO 10634 (13). Ако се използва разтворител, приготвя се допълнителна контрола, само с добавен в инокулираната среда разтворител. Органичните разтворители, за които се знае, че потискат получаването на метан, като хлороформът и тетрахлорометанът, следва да се избягват.
Предупреждение — с токсичните изпитвани вещества и с тези, чиито свойства не са известни, следва да се борави внимателно.
|
Референтни вещества
|
20.
|
Референтни вещества, като например натриев бензоат, фенол и полиетиленгликол 400, са били успешно използвани за проверка на процедурата, като са показали биоразграждане над 60 % в рамките на 60 дни. Приготвя се изходен разтвор (във вода, от която е отстранен кислородът) от избраното референтно вещество, по същия начин, както за изпитваното вещество и, ако е необходимо, се коригира до pH 7 ± 0,2.
|
Контрола за потискане (при условие)
|
21.
|
За да се получи информация за токсичността на изпитваното вещество към анаеробни микроорганизми за напиране на най-подходящата изпитвана концентрация, се добавя изпитваното вещество и референтно вещество в съд със средата за изпитване (вж. точка 16), всяко съответно в концентрациите, в които е било добавено в средата за изпитване при изпитването (вж. точки 19 и 20 и вж. също ISO 13641-1 (12)).
|
Разградена утайка
|
22.
|
Взема се разградена утайка от реактор в пречиствателна станция, която пречиства главно битови отпадъчни води. Утайката трябва да бъде напълно охарактеризирана и нейната основна информация следва да бъде протоколирана (вж. точка 54). Ако съществува намерение за използване на адаптиран инокулум, може да бъде взета под внимание разградена утайка от станция за пречистване на промишлени отпадъчни води. За вземане на разградената утайка се използват бутилки с широко гърло, изработени от полиетилен висока плътност или подобен материал, с възможност за разширяване. Добавя се утайка до около 1 cm от горната част на бутилките и същите се затварят херметично, за предпочитане с предпазен клапан. След транспортиране до лабораторията взетата утайка може да се използва директно или да се постави в лабораторен реактор. Прекомерното количество биогаз се освобождава чрез внимателно отваряне на бутилките с утайката. Алтернативно, като източник на инокулум може да се използва получена в лабораторни условия анаеробна утайка, но нейният спектър на действие може да е намален.
Предупреждение — от разградената утайка се получават запалими газове, които създават рискове от пожар и експлозия: тя също така съдържа потенциално патогенни организми и следователно при работата с утайката трябва да се вземат подходящи предпазни мерки. Поради причини, свързани с безопасността, за вземане на утайката не се използват стъклени съдове.
|
|
23.
|
С цел да се намали фоновото получаване на газ и за намаляване на влиянието на празните контроли може да бъде взето под внимание предварително разграждане на утайката. Ако се изисква предварително разграждане, утайката трябва да бъде оставена до 7 дни да се разгради без добавяне на никакви хранителни вещества или субстрати, при 35 °C ± 2 °C. За няколко изпитвани вещества е установено, че предварително разграждане за около 5 дни обикновено осигурява оптимален спад в получаването на газ в празната проба без неприемливо увеличаване на латентния или инкубационния период по време на етапа на изпитване, и без загуба на активност.
|
|
24.
|
За идпитвани вещества, които са, или се очаква да бъдат слабо биоразградими, се разглежда евентуална предварителна експозиция на утайката на изпитваното вещество, за да се получи инокулум, който да е по-добре приспособен. В такъв случай изпитваното вещество се добавя с концентрация на органичен въглерод от 5 mg/l до 20 mg/l към разградената утайка и се инкубира за максимум 2 седмици. Предварително експонираната утайка се промива внимателно преди употреба (вж. точка 25) и в протокола от изпитването се посочват условията на предварителната експозиция.
|
Инокулум
|
25.
|
Утайката се промива (вж. точки 22-24) непосредствено преди употреба, за намаляване на концентрация на неорганичен въглерод на по-малко от 10 mg/l в крайната изпитвана суспензия. Утайката се центрофугира в херметично затворени епруветки (напр. 3 000 g за 5 минути) и супернатантът се отстранява. Получената пелета се суспендира повторно в среда, от която е отстранен кислородът (точки 16 и 17), суспензията се центрофугира повторно и течният супернатант се отстранява. Ако неорганичният въглерод не е бил достатъчно намален, процедурата по промиване на утайката може да се повтори още само до два пъти. Това, както изглежда, не засяга неблагоприятно микроорганизмите. Накрая, пелетата се суспендира в необходимия обем от среда за изпитване и се определя общата концентрация на твърди вещества [напр. ISO 11923 (15)]. Общо крайната концентрация на твърди вещества в съдовете за изпитване трябва да бъде в интервала от 1 g/l до 3 g/l (или около 10 % от тази в неразредена разградена утайка). Гореописаните операции се провеждат по такъв начин, че утайката да има минимален контакт с кислород (напр. с използване на азотна атмосфера).
|
ПРОЦЕДУРА НА ИЗПИТВАНЕ
|
26.
|
Изпълняват се следните първоначални процедури, с използване техники за поддържане на възможно най-малък контакт между разградената утайка и кислорода; например, може да е наложително да се работи в защитна камера с ръкавици в азотна атмосфера и/или бутилките да се прочистят с азот (4).
|
Приготвяне на съдовете за изпитване и на контролите
|
27.
|
Приготвят се съдове за изпитване в най-малко три повторения (вж. точка 13, б) за изпитваното вещество, празните контроли, референтното вещество, контролите за потискане (при условие) и камерите за регулиране на налягането (процедура по избор) (вж. точки 7 и 19-21). Могат също така да се приготвят допълнителни съдове за оценка на първичното биоразграждане, като се използват специфични анализи за изпитваното вещество. Един и същ набор от празни контроли може да се използва за множество изпитвани вещества по време на едно и също изпитване, при условие че парното пространство е в съответствие с условията.
|
|
28.
|
Разреденият инокулум се приготвя преди да бъде добавен към съдовете, например с помощта на пипета с широк отвор. Аликвотни части от добре разбъркан инокулум (точка 25) се добавят така, че общата концентрация на твърди вещества да е една и съща във всички съдове (между 1 g/l и 3 g/l). Добавят се изходни разтвори на изпитваното и референтното вещества, след корекция до стойност на pH 7 ± 0,2, ако е необходима. Изпитваното вещество и референтното вещество следва да бъдат добавени, като се използва най-подходящият път на прилагане (точка 19).
|
|
29.
|
Изпитваната концентрация на органичния въглерод, обикновено следва да бъде между 20 и 100 mg/l (точка 4). Ако изпитваното вещество е токсично, изпитваната концентрация трябва да се намали до 20 mg С/l или дори по-малко, ако се измерва само първичната биоразградимост чрез специфични анализи. Следва да се отбележи, че варирането на резултатите от изпитването се увеличава при по-ниски концентрации на изпитване.
|
|
30.
|
В съдовете с празни проби се добавя еквивалентно количество от носителя, използван за дозиране на изпитваното вещество вместо изходен разтвор, суспензия или емулсия. Ако изпитваното вещество се прилага с използването на филтри от стъклено влакно или органични разтворители, към празните проби се добавя филтър или обем разтворител, еквивалентен на изпарилия се. Приготвя се допълнително повторение с изпитваното вещество за измерването на стойността на pH. Ако е необходимо, стойността на рН се коригира до 7 ± 0,2, като се разрежда с малки количества разредена неорганична киселина или вещество с алкален характер. Същите количества неутрализиращи вещества следва да се добавят към всички съдове за изпитване. Не би следвало да се налага да се правят такива добавки, тъй като стойностите на рН на изходните разтвори на изпитваното вещество и на референтното вещество вече са били коригирани (вж. точки 19 и 20). Ако следва да се измерва първичното биоразграждане, трябва да се вземе подходяща проба от съда с контролата за pH, или от допълнителен съд за изпитване, и концентрацията на изпитваното вещество следва да се измерва с използване на специфични анализи. Към всички съдове могат да се добавят магнити с покритие, ако реакционните смеси трябва да се разбъркват (по избор).
|
|
31.
|
Следва да се гарантира, че общият обем течност V1 и обемът на парното пространство VH са едни и същи във всички съдове; Стойностите на V1 and Vh се отбелязват и записват. Всеки съд следва да бъде херметично затворени със септа с газонепроницаемо покритие и прехвърлен от защитната камера с ръкавици (вж. точка 26) в инкубатора (вж. точка 13, а)).
|
Неразтворими изпитвани вещества
|
32.
|
Претеглени количества от вещества, които са малко разтворими във вода, се добавят направо в приготвените съдове. Когато е необходимо използването на разтворител (вж. точка 19), разтворът или суспензията на изпитваното вещество се прехвърля в празните съдове. Когато е възможно, разтворителят се изпарява чрез прекарване на газообразен азот през съдовете, и след това се добавят останалите съставки, а именно разредена утайка (точка 25) и вода, от която е отстранен кислородът, съгласно изискванията. Следва също така да бъде подготвена допълнителна контрола на разтворител (вж. точка 19). За други методи за добавяне на неразтворими вещества може да се направи справка с ISO 10634 (13). Течните изпитвани вещества могат да се дозират със спринцовка в напълно приготвени херметично затворени съдове, ако се очаква, че първоначалната стойност на pH не надвишава 7 ± 1 — в противен случай дозирането се извършва както е описано по-горе (вж. точка 19).
|
Инкубиране и измервания на налягането на газовете
|
33.
|
Приготвените съдове се инкубират при 35 °C ± 2 °C за около 1 час, за да се позволи достигане на равновесие и излишъкът от газове да бъде освободен в атмосферата, например чрез разклащане на всички съдове един след друг, вкарване на иглата на манометъра (точка 13, в)) през запушалката и отваряне на клапана, докато манометърът отчете нулева стойност. Ако на този етап, или когато се правят междинни измервания, налягането в парното пространство е по-ниско от атмосферното, следва да се подаде газообразен азот, за да се възстанови атмосферното налягане. Клапанът се затваря (вж. точка 13, в)) и се продължава с инкубирането на тъмно, като се гарантира, че всички части на съдовете се поддържат при температурата на разграждането. Съдовете се наблюдават след инкубирането в продължение на 24 до 48 часа. Съдовете се отхвърлят, ако съдържанието на съдовете показва ясно розово оцветяване в супернатанта, т.е. ако ресазуринът (вж. точка 16) е променил цвета си, показвайки наличие на кислород (вж. точка 50). Въпреки че малки количества кислород могат да бъдат толерирани от системата, по-високи концентрации могат сериозно да потиснат хода на биоразграждането в анаеробни условия. Отхвърлянето на случаен отделен съд от набора от три повторения може да бъде прието, но по-голяма честота на неуспехите трябва да води до проучване на опитните процедури, както и до повтаряне на изпитването.
|
|
34.
|
Съдържанието на всеки съд се смесва внимателно чрез бъркане или чрез разклащане в продължение на няколко минути поне 2 или 3 пъти седмично и малко преди всяко измерване на налягането. Разклащането суспендира повторно инокулума и гарантира равновесието в газовата фаза. Всички измервания на налягането следва да бъдат извършвани бързо, тъй като в съдовете за изпитване може да настъпи понижаване на температурата, водещо до неверни показания. При измерването на налягането целият съд за изпитване, включително парното пространство, следва да бъде поддържан при температурата на разграждането. Налягането на газа се измерва, например, чрез вкарване през септата на иглата от спринцовка, прикрепена към манометъра (точка 12, в)). Следва да се вземат мерки за предотвратяване на навлизането на вода в иглата от спринцовка; ако това се случи, трябва мокрите части да бъдат подсушени и да се постави нова игла. Налягането трябва да се измерва в mbar (вж. точка 42). Налягането на газовата фаза в съдовете може да се измерва периодично, например седмично и, по избор, излишъкът от газове се освобождава в атмосферата. Като алтернатива, налягането се измерва само в края на изпитването, за да се определи количеството на получения биогаз.
|
|
35.
|
Препоръчва се да се извършват междинни замервания на налягането на газовата фаза, тъй като повишаването на налягането предоставя насоки кога може да бъде приключено изпитването и позволява наблюдаването на кинетиката (вж. точка 6).
|
|
36.
|
Изпитването обикновено се прекратява след инкубационен период от 60 дни, освен в случаите когато кривата на биоразграждането, получена от измерването на налягането, е достигнала фазата на плато преди това; това е фазата, в която е достигнато максимално разграждане и кривата на биоразграждане е изравнена. Ако стойността във фазата на плато е по-малка от 60 %, интерпретирането е проблематично, тъй като тази стойност сочи, че само част от молекулата е минерализирана, или че е направена грешка. Ако в края на нормалния период на инкубация се получават газове, но очевидно не е достигната фаза на плато, следва да се разгледа удължаване на срока на изпитването, за да се провери дали фазата на плато (> 60 %) ще бъде достигната.
|
Измерване на неорганичен въглерод
|
37.
|
В края на изпитването, след последното измерване на налягането на газовете, утайката се оставя да се утаи. Всички съдове се отварят един след друг и незабавно се взема проба за определяне на концентрацията (mg/l) на неорганичен въглерод в течния супернатант. Към течния супернатант не трябва да се прилага нито центрофугиране, нито филтруване, тъй като това би довело до неприемлива загуба на разтворен въглероден диоксид. Ако течността не може да бъде анализирана в момента, в който е взета проба от нея, тя се съхранява до 2 дни в херметично затворен флакон без парно пространство и охладена до температура от около 4 °C. След измерването на неорганичния въглерод се измерва и се записва стойността на pH.
|
|
38.
|
Като алтернатива, неорганичният въглерод в супернатанта може да се определи косвено чрез отделянето на разтворения неорганичен въглерод под формата на въглероден диоксид, който може да бъде измерен в парното пространство. След последното измерване на налягането на газовете, налягането във всички съдове за изпитване се коригира до изравняване с атмосферното налягане. Съдържанието на всеки съд се подкиселява приблизително до рН 1 чрез добавяне на концентрирана неорганична киселина (напр. H2SO4) през септата на херметично затворените съдове. Разклатените съдове се инкубират при 35 °C ± 2 °C в продължение на приблизително 24 часа и се измерва с манометър налягането на газовете, получено в резултат на отделения въглероден диоксид.
|
|
39.
|
Сходни замервания се извършват за съответните празни проби, референтни вещества и, ако са включени, съдовете с контроли за потискане (вж. точка 21).
|
|
40.
|
В някои случаи, особено когато същите съдове с контроли се използват за изпитване на няколко изпитвани вещества, трябва да бъдат взимани предвид измервания на междинните концентрации на неорганичен въглерод в съдовете за изпитване и в съдовете с контроли, когато това е подходящо. В този случай трябва да бъде приготвен достатъчен брой съдове за всички междинни измервания. Настоящата процедура е за предпочитане пред вземането на всички проби само от един съд. Последното може да се извършва само при условие, че обемът, необходим за анализ на DIC, не се счита за прекомерно голям. Измерването на DIC трябва да бъде направено след измерването на налягането на газовете без освобождаване на излишъка от газове, както е описано по-долу:
|
—
|
вземат се проби от супернатанта с възможно най-малък обем, с помощта на спринцовка през септата и без отваряне на съдовете, и се определя неорганичният въглерод в пробата;
|
|
—
|
след вземането на пробата излишъкът от газове се освобождава, или не;
|
|
—
|
следва да се има предвид, че дори малко намаление в обема на супернатанта (напр. около 1 %) може да доведе до значително увеличение на обема на газовете в парното пространство (Vh);
|
|
—
|
уравненията (вж. точка 44) се коригират чрез увеличаване на Vh в уравнение 3, когато е необходимо.
|
|
Специфични анализи
|
41.
|
Ако трябва да се определи първичното разграждане при анаеробни условия (виж точка 30), от съдовете, съдържащи изпитваното вещество, в началото и в края на изпитването се взема проба с подходящ обем за специфични анализи. Ако бъде извършено това, се отбелязва, че обемите на парното пространство (Vh) и на течността (Vl) ще се променят, и това се взема под внимание при изчисляването на резултатите от получаването на газове. Като алтернатива могат да се вземат проби за специфични анализи от допълнителни смеси, които преди това са приготвени за тази цел (точка 30).
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
42.
|
По практически причини, налягането на газовете се измерва в милибари (1 mbar = 1h Pa = 102 Pa; 1 Pa = 1 N/m2), обемът — в литри, а температурата — в градуси по Целзий.
|
Въглерод в парното пространство
|
43.
|
Тъй като както в 1 mol метан, така и в 1 mol въглероден диоксид, се съдържат по 12 g въглерод, масата на въглерода в даден обем на отделените газове може да бъде изразена като:
|
m= 12 × 103×n
|
Уравнение [1]
|
където:
|
m
|
=
|
маса на въглерода (mg) в даден обем на отделения газ;
|
|
12
|
=
|
относителна атомна маса на въглерода;
|
|
n
|
=
|
брой молове газ в дадения обем.
|
Ако в значителни количества се получава газ, различен от метан или въглероден диоксид (напр. N2O), формулата [1] следва да бъде изменена, за да се опише възможността за въздействия от получените газовете.
|
|
44.
|
От законите за газовете n може да бъде изразено като:
|

|
Уравнение [2]
|
където:
|
p
|
=
|
налягане на газовете (Pa);
|
|
V
|
=
|
обема на газовете (m3);
|
|
R
|
=
|
моларна газова константа [8,314J/(mol.K)];
|
|
T
|
=
|
температура на инкубирането (K).
|
Чрез комбинация от уравнение [1] и [2] и рационализиране, за да се даде възможност за получаване на газ в празните контроли:
|

|
Уравнение [3]
|
където:
|
mh
|
=
|
маса на нетния въглерод, получен като газове в парното пространство (mg);
|
|
Δp
|
=
|
средна стойност на разликата между началното и крайното налягане в съдовете за изпитване, минус съответстващата средна стойност в съдовете с празни проби (mbar);
|
|
Vh
|
=
|
обем на парното пространство в съда (l);
|
|
0,1
|
=
|
преобразуване както на N/m2 в mbar, така и на m3 в литри.
|
Уравнение [4] следва да бъде използвано за нормалната температура на инкубиране от 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
Уравнение [4]
|
Забележка: Алтернативно изчисляване на обема. Показанията на манометъра трябва да се преобразуват в ml газове, получени при използване на стандартната крива, генерирана чрез начертаване на инжектирания обем (ml) спрямо показанията на манометъра (допълнение 2). Броят молове (n) газове в парното пространство на всеки съд се изчислява като се раздели кумулативното получаване на газове (ml) на 25 286 ml/mol, което е обемът, заеман от един mol газове при 35 °C и стандартно атмосферно налягане. Тъй като както в 1 mol CH4, така и в 1 mol CO2, се съдържат по 12 g въглерод, количеството на въглерода (m, mg) в парното пространство (mh
) се дава от уравнение [5]:
|
mh
= 12 × 103×n
|
Уравнение [5]
|
Рационализиране, за да се даде възможност за получаване на газ в празните контроли:
|

|
Уравнение [6]
|
където:
|
mh
|
=
|
маса на нетния въглерод, получен като газове в парното пространство (mg);
|
|
ΔV
|
=
|
средна стойност на разликата между обема получени газове в парното пространство в съдовете за изпитване и в съдовете с празна проба;
|
|
25 286
|
=
|
обем, заеман от 1 mol газ при 35 °C, 1 атмосфера.
|
|
|
45.
|
Процесът на биоразграждането може да бъде последван от начертаване на кумулативното нарастване на налягането Δp (mbar) спрямо времето, ако това е целесъобразно. От тази крива се идентифицира и се записва латентната фаза (дни). Латентната фаза е периодът от началото на изпитването до започването на значимо разграждане (вж. напр. допълнение 3). Ако са взети и анализирани междинни проби от супернатант (виж точки 40, 46 и 47), тогава вместо единствено кумулативното налягане може да бъде начертан общият получен въглерод (в газовата фаза плюс този в течната фаза).
|
Въглерод в течността
|
46.
|
Количеството метан в течността се пренебрегва, тъй като е известно, че разтворимостта му във вода е много малка. Масата на неорганичния въглерод в течността в съдовете за изпитване се изчислява, като се използва уравнение [7]:
|
ml
=Cnet
×Vl
|
Уравнение [7]
|
където:
|
ml
|
=
|
маса на неорганичния въглерод в течността (mg);
|
|
Cnet
|
=
|
концентрация на неорганичния въглерод в съдовете за изпитване, минус тази в съдовете с контролите в края на изпитването (mg/l);
|
|
Vl
|
=
|
обем на течността в съда (l);
|
|
Общ въглерод в газове
|
47.
|
Общата маса на въглерода в газовете в съда се изчислява, като се използва уравнение [8]:
където:
|
|
mt
= обща маса на въглерода в газовете (mg);
|
|
|
mh
и ml
са както са определени по-горе.
|
|
Въглерод от изпитваното вещество
|
48.
|
Масата на въглерода в съдовете за изпитване, получена от добавеното изпитвано вещество, се изчислява, като се използва уравнение [9]:
където:
|
mv
|
=
|
маса на въглерода от изпитваното вещество (mg)
|
|
Cc
|
=
|
концентрация на въглерода от изпитваното вещество в съдовете за изпитване (mg/l)
|
|
Vl
|
=
|
обем на течността в съда за изпитване (l).
|
|
Степен на биоразграждане
|
49.
|
Процентът на биоразграждане се изчислява от газовете в парното пространство, като се използва уравнение [10], а общият процент на биоразграждане — като се използва уравнение [11]:
|
Dh
= (mh
/mv
) × 100
|
Уравнение [10]
|
|
Dt
= (mt
/mv
) × 100
|
Уравнение [11]
|
където:
|
|
Dh
= биоразграждане от газовете в парното пространство ( %);
|
|
|
Dt
= общо биоразграждане (%);
|
|
|
mh
, mv
и mt
са както са определени по-горе.
|
Степента на първичното биоразграждане се изчислява от измерванията (по избор) на концентрацията на изпитваното вещество в началото и в края на инкубацията, с използване на уравнение [12]:
|
Dp
= (1 –Se
/Si
) × 100
|
Уравнение [12]
|
където:
|
Dp
|
=
|
първично биоразграждане на изпитваното вещество (%);
|
|
Si
|
=
|
крайна концентрация на изпитваното вещество (mg/l);
|
|
Se
|
=
|
концентрация на изпитваното вещество в края (mg/l).
|
Ако методът за анализ показва значими концентрации на изпитваното вещество в неизменения инокулум с анаеробна утайка, се използва уравнение [13]:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
Уравнение [13]
|
където:
|
Dp
1
|
=
|
коригирано първично биоразграждане на изпитваното вещество (%);
|
|
Sib
|
=
|
първоначална „привидна“ концентрация на изпитваното вещество в празни контроли (mg/l);
|
|
Seb
|
=
|
„привидна“ концентрация на изпитваното вещество в празни контроли в края (mg/l).
|
|
Валидност на резултатите
|
50.
|
Показанията за налягането следва да се използват само от съдове, които не показват розово оцветяване (вж. точка 33). Замърсяването с кислород се свежда до минимум чрез използване на подходящи техники за обработка в анаеробни условия.
|
|
51.
|
Следва да се има предвид, че тестът е валиден, ако референтното вещество достигне плато, което представлява повече от 60 % биоразграждане (41).
|
|
52.
|
Ако pH в края на изпитването е превишила обхвата 7 ± 1 и протеклото биоразграждане е било недостатъчно, изпитването се повтаря с увеличен буферен капацитет на средата.
|
Потискане на разграждането
|
53.
|
Получаването на газове в съдове, съдържащи изпитваното вещество и референтно вещество, трябва да бъде най-малко равно на това в съдовете, съдържащи само референтно вещество; в противен случай има показания за потискане на получаването на газове. В някои случаи получаването на газове в съдове, съдържащи изпитваното вещество, но без референтно вещество, ще бъде по-ниско, отколкото това в празните контроли, което сочи, че изпитваното вещество има потискащо въздействие.
|
Протокол от изпитването
|
54.
|
Докладът от изпитването трябва да съдържа следната информация:
|
|
Изпитвано вещество:
|
—
|
общоприето наименование, химично наименование, номер по CAS, структурна формула и съответни физични и химични свойства,
|
|
—
|
чистота (онечиствания) на изпитваното вещество,
|
|
|
|
Условия на изпитването:
|
—
|
обеми на разредената течност от реактора (Vl
) и на парното пространство (Vh
) в съда;
|
|
—
|
описание на съдовете за изпитване, основните характеристики на измерването на биогаза (например вида манометър) и на анализатора на неорганичен въглерод;
|
|
—
|
прилагане на изпитваното и референтното вещество в системата за изпитване: използвана концентрация на изпитване и използване на разтворители;
|
|
—
|
подробни данни за използвания инокулум: име на пречиствателната станция за отпадъчни води, описание на източника на пречистените отпадъчни води (напр. работна температура, време на задържане на утайката, предимно битови и др.), концентрация, цялата необходима информация за обосновка на посоченото, и информация за всяко предварително третиране на инокулума (например преди разграждането, преди експозицията);
|
|
—
|
температура на инкубиране,
|
|
|
|
Резултати:
|
—
|
стойностите на pH и неорганичния въглерод в края на изпитването;
|
|
—
|
концентрация на изпитваното вещество в началото и в края на изпитването, ако е извършено специфично измерване;
|
|
—
|
всички измерени данни, събрани по време на изпитването, съдове с празна проба, референтно вещество и контроли за потискане, където е подходящо (напр. налягане в mbar, концентрация на неорганичен въглерод в mg/l) в таблична форма (данните от измервания за парното пространство и за течността следва да се протоколират отделно);
|
|
—
|
статистическа обработка на данни, продължителност на изпитването и диаграма на биоразграждането на изпитваното вещество, референтното вещество и контролата за потискане;
|
|
—
|
процент на биоразграждане на изпитваното вещество и на референтно вещество;
|
|
—
|
причини за всякакво отхвърляне на резултати от изпитването;
|
|
—
|
обсъждане на резултатите.
|
|
|
ЛИТЕРАТУРА
|
(1)
|
Следните части от настоящото приложение:
|
|
C.4,Determination of Ready Biodegradability;
|
|
|
C.9, Biodegradation — Zahn-Wellens Test;
|
|
|
C.10, Simulation Test — Aerobic Sewage Treatment:
A: Activated Sludge Units, B: Biofilms
|
|
|
C.11, Biodegradation — Activated sludge respiration inhibition
|
|
|
(2)
|
OECD (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OECD, Paris
|
|
(3)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W.E., Pagga,U., Steber, J., Reust, H. and Bontinck, W.J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550. (Also published as ECETOC Technical Report No. 28, June 1988).
|
|
(4)
|
Shelton D.R. and Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. Appl. Environ. Mircobiology, 47, 850-857.
|
|
(5)
|
Owen, W.F., Stuckey, DC., Healy J.B., Jr, Young L.Y. and McCarty, P.L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485-492.
|
|
(6)
|
Healy, J.B.Jr. and Young, L.Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84-89.
|
|
(7)
|
Gledhill, W.E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Philadelphia.
|
|
(8)
|
Battersby, N.S. and Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441-2460.
|
|
(9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
|
|
(10)
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
(11)
|
International Organization for Standardization (1995) ISO 11 734 Water Quality — Evaluation of the ultimate anaerobic biodegradation of organic compounds in digested sludge — Method by measurement of the biogas production.
|
|
(12)
|
International Organization for Standardization (2003) ISO 13 641-1 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 1 General Test.
|
|
(13)
|
International Organization for Standardization (1995) ISO 10 634 Water Quality — Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(14)
|
Pagga, U. and Beimborn, D.B., (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499-1509.
|
|
(15)
|
International Organization for Standardization (1997) ISO 11 923 Water Quality — Determination of suspended solids by filtration through glass-fibre filters.
|
Допълнение 1
Пример за апаратура за измерване на получения биогаз чрез налягане на газовете

Легенда:
|
1
|
—
|
Манометър
|
|
2
|
—
|
3-пътен газонепроницаем клапан
|
|
3
|
—
|
игла от спринцовка
|
|
4
|
—
|
газонепроницаема капсулирана запушалка (капачка за капсулиране и септа)
|
|
5
|
—
|
парно пространство (Vh
)
|
|
6
|
—
|
инокулум с разградена утайка (Vl
)
|
Съдове за изпитване в среда от 35 °C ± 2 °C
Допълнение 2
Преобразуване на показанията на манометъра
Показанията на манометъра могат да бъдат свързани с обемите на газовете чрез стандартна крива, получена чрез инжектиране на известни количества въздух при температура 35 °C ± 2 °C в серумни бутилки, съдържащи обем вода, равен на този на реакционната смес, VR
:
|
—
|
Аликвотни части от VR
ml вода, съхранявана при температура 35 °C ± 2 °C, се поставят в пет серумни бутилки. Бутилките се затварят херметически и се поставят на водна баня при температура 35 °C за 1 час за достигане на равновесие;
|
|
—
|
Включва се манометърът, оставя се да се стабилизира и се коригира до нула;
|
|
—
|
Иглата от спринцовка се вкарва през капсулираната запушалка на една от бутилките, клапанът се отваря до отчитане на стойност нула от манометъра и след това се затваря;
|
|
—
|
Процедурата се повтаря с останалите бутилки;
|
|
—
|
Във всяка бутилка се инжектира 1 ml въздух при 35 °С ± 2 °С. Иглата (върху манометъра) се вкарва през капсулираната запушалка на една от бутилките и се дава възможност за стабилизиране на показанията. Показанията за налягането се записват, клапанът се отваря до отчитане на стойност нула от манометъра и след това се затваря;
|
|
—
|
Процедурата се повтаря с останалите бутилки;
|
|
—
|
Цялата горепосочена процедура се повтаря, като се използват 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml и 50 ml въздух;
|
|
—
|
Начертава се крива на преобразуване на налягането (Pa) спрямо инжектирания обем газ Vb (ml). Откликът на инструмента е линеен в интервала от 0 Pa до 70 000 Ра, и от 0 ml до 50 ml получен газ.
|
Допълнение 3
Пример за крива на разграждане (кумулативното нетно увеличение на налягането)

Допълнение 4
Пример за таблици с данни за изпитването за анаеробно биоразграждане — Таблица с данни за изпитваното вещество
|
Лаборатория: …
|
Изпитвано вещество: …
|
Изпитване №: …
|
|
Температура на изпитването (°C): …
|
Обем на парното пространство (Vh
): …(l)
|
Обем на течността (Vl
): …(l)
|
|
Въглерод в изпитваното вещество Cc,v
: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Ден
|
p
1 (изпитване)
(mbar)
|
p
2 (изпитване)
(mbar)
|
p
3 (изпитване)
(mbar)
|
p (изпитване)
средно
(mbar)
|
p
4 (изпитване)
(mbar)
|
p
5 (изпитване)
(mbar)
|
p
6 (изпитване)
(mbar)
|
p (празна проба)
средно
(mbar)
|
p (нетно)
изпитване — празна проба
средно (mbar)
|
Δ
p (нетно)
Кумулативно
(mbar)
|
m
h
Въглерод в парното пространство (43)
(mg)
|
D
h
Биоразграждане (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
изпитване
(mg)
|
C
IC, 2
изпитване
(mg)
|
C
IC, 3
изпитване
(mg)
|
C
IC
средна от изпитване
(mg)
|
C
IC, 4
празна проба
(mg)
|
C
IC, 5
празна проба
(mg)
|
C
IC, 6
празна проба
(mg)
|
C
IC
средна от празната проба
(mg)
|
C
IC, net
изпитване — празна проба
средно
(mg)
|
m
l
въглерод в течността (45)
(mg)
|
m
t
Общ въглерод (46)
(mg)
|
D
t
Биоразграждане (47)
(%)
|
|
Неорганичен въглерод (IC) (край)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (край)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лаборатория: …
|
Референтно в: …
|
Изпитване №: …
|
|
Температура на изпитването (°C): …
|
Обем на парното пространство (Vh): …(l)
|
Обем на течността (Vl) (литри): …
|
|
Въглерод в референтното вещество Cc,v (mg/l): …
|
mv
(48) (mg):
|
|
|
Ден
|
p
1 (реф.)
(mbar)
|
p
2 (реф.)
(mbar)
|
p
3 (реф.)
(mbar)
|
p (реф.)
средно
(mbar)
|
p
4 (потиск.)
(mbar)
|
p
5 (потиск.)
(mbar)
|
p
6 (потиск.)
(mbar)
|
p (потиск.)
средно
(mbar)
|
p (реф.)
реф. — празна проба
(mbar)
|
Δ
p (ref.)
натрупване
(mbar)
|
m
h
Въглерод в парното пространство (49)
(mg)
|
D
h
Биоразграждане (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
реф.
(mg)
|
C
IC, 2
реф.
(mg)
|
C
IC, 3
реф.
(mg)
|
C
IC
средна реф.
(mg)
|
C
IC, 4
потиск.
(mg)
|
C
IC, 5
потиск.
(mg)
|
C
IC, 6
потиск.
(mg)
|
C
IC
средна потиск.
(mg)
|
C
IC, net
реф. — потиск.
(mg)
|
m
l
въглерод в течността (51)
(mg)
|
m
t
Общ въглерод (52)
(mg)
|
D
t
Биоразграждане (53)
(%)
|
|
Неорганичен въглерод (IC) (край)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (край)
|
|
|
|
|
|
|
|
|
|
|
|
|
В. 44. ПРОСМУКВАНЕ В ПОЧВЕНИ КОЛОНИ
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 312 (2004). Синтетични химикали могат да достигнат до почвата пряко чрез преднамерено използване (напр. агрохимикали) или чрез непреки пътища (напр. чрез отпадъчни води → утайки от отпадъчни води → почва или въздух → мокри/сухи утайки). За оценката на риска по отношение на тези химикали е важно да се прецени техният потенциал за трансформация в почвата и за движение (просмукване) към по-дълбоки почвени слоеве и евентуално в подпочвени води.
|
|
2.
|
Съществуват няколко метода за измерване на потенциала за просмукване на химикалите в почвата в контролирани лабораторни условия, т.е. тънкослойна хроматография с почва, хроматография с дебел слой почва, колонна хроматография с почва и измервания на адсорбция — десорбция (1) (2). За нейонизираните химикали, коефициентът на разпределение n-октанол-вода (Pow) позволява ранна оценка на тяхната адсорбция и потенциала им за просмукване в почвата (3) (4) (5).
|
|
3.
|
Методът, описан в настоящия метод за изпитване, е основан на колонна хроматография с почва, за обработени почви (вж. допълнение 1 за определение). Два вида опити сe провеждат, за да се определи (i) потенциалът за просмукване на изпитвания химикал, и (ii) на потенциалът за просмукване на продуктите от трансформацията (проучване със стари остатъци) в почвите при контролирани лабораторни условия (54). Методът за изпитване се основава на съществуващи методи (6)(7)(8)(9)(10)(11).
|
|
4.
|
Семинарът на ОИСР за избор на почви/седименти, проведен в Belgirate, Италия, през 1995 г. (12), приема броя и вида на почвите, използвани при този метод за изпитване. На него също така са направени препоръки по отношение на вземането, обработването и съхранението на почвени проби за опити за просмукване.
|
ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
|
5.
|
Колони, направени от подходящ инертен материал (например стъкло, неръждаема стомана, алуминий, тефлон, PVC и др.) се пълнят с почва, и след това се насищат и уравновесяват с разтвор „изкуствен дъжд“ (за определение виж допълнение 1) и се оставят да се отцеждат. След това повърхността на всяка колона с почва се третира с изпитвания химикал и/или със стари остатъци от изпитвания химикал. След това се прилага изкуствен дъжд към почвените колони и отцедената вода се събира. След процеса на просмукване почвата се отстранява от колоните и се разделя на подходящ брой сегменти в зависимост от информацията, която се изисква от проучването. Всеки сегмент на почвата и отцедената вода се анализират за изпитвания химикал и, ако е подходящо, за продукти от трансформацията или други химикали, представляващи интерес.
|
ПРИЛОЖИМОСТ НА МЕТОДА ЗА ИЗПИТВАНЕ
|
6.
|
Този метод на изпитване е приложим по отношение на изпитвани химикали (небелязани или изотопно белязани: напр. 14C), за които има метод за анализ с достатъчна точност и чувствителност. Методът за изпитване не трябва да се прилага при химикали, които са летливи при прилагане върху почвата и водата и по този начин не остават в почвата и/или отцедената вода при условията на изпитване на настоящия метод за изпитване.
|
ИНФОРМАЦИЯ ЗА ИЗПИТВАНИЯ ХИМИКАЛ
|
7.
|
За измерване на просмукването в почвените колони могат да бъдат използвани небелязани или изотопно белязани изпитвани химикали. Изотопно белязаният материал се изисква за изучаване на просмукването на продуктите от трансформацията (стари остатъци от изпитвания химикал) и за определяне на масовия баланс. Белязване с 13C се препоръчва, но могат да бъдат полезни и други изотопи, като 13C, 15N, 3H, 32P. Доколкото е възможно, белязването трябва да стане в най-стабилната(ите) част(и) на молекулата. Изпитваният химикал трябва да бъде със степен на чистота минимум 95 %.
|
|
8.
|
Повечето химикали следва да се прилагат като единствено вещество. Обаче за активни вещества в продукти за растителна защита могат да се използват формулирани продукти за изследване на просмукването на базовото изпитвано вещество, но тяхното изпитване се изиксва особено в случаите, когато е вероятно сместа да окаже влияние върху скоростта на освобождаване (напр. при гранулираните формулировки, или при формулировките с контролирано освобождаване). По отношение на специфичните за сместа изисквания за планирането на изпитването, може да се окаже полезно консултиране с регулаторния орган преди провеждането на изпитването. При изследванията за просмукване на стари остатъци следва да се използва чистото базово изпитвано вещество.
|
|
9.
|
Преди провеждане на изпитване за просмукване в почвени колони за предпочитане е да бъде налична следната информация за изпитвания химикал:
|
(1)
|
разтворимост във вода [метод за изпитване А.6] (13);
|
|
(2)
|
разтворимост в органични разтворители;
|
|
(3)
|
парно налягане [метод за изпитване A.24] (13) и константата от закона на Хенри;
|
|
(4)
|
коефициент на разпределение n-октанол/вода [методи за изпитване А.8 и А.24] (13);
|
|
(5)
|
коефициент на адсорбция (Kd, Kf или KOC) [методи за изпитване В.18 и/или В.19] (13);
|
|
(6)
|
хидролиза (метод за изпитване В.7] (13);
|
|
(7)
|
константа на дисоциация (рKа) [Насоки на ОИСР 112] (25);
|
|
(8)
|
аеробна и анаеробна трансформация в почва [метод за изпитване В. 23] (13)
|
Забележка: В съответните протоколи от изпитвания трябва да бъде протоколирана температурата, при която са направени тези измервания.
|
|
10.
|
Количеството от изпитвания химикал, приложено към почвените колони, следва да бъде достатъчно, за да позволи откриването на най-малко 0,5 % от приложената доза във всеки отделен сегмент. За активни химикали в продукти за растителна защита, приложеното количество от изпитвания химикал може да съответства на максималната препоръчителна доза (еднократно прилагане).
|
|
11.
|
Трябва да бъде на разположение подходящ метод за анализ с известни точност, прецизност и чувствителност при количественото определяне на изпитвания химикал и, когато това е приложимо, на неговите продукти от трансформацията в почвата и отцедената вода. Границата на аналитично откриване на изпитвания химикал и неговите значими продукти на трансформация (обикновено поне всички продукти от трансформацията ≥ 10 % от приложената доза, наблюдавани при проучванията за пътищата на трансформация, но за предпочитане всички относими продукти от трансформацията, представляващи интерес) трябва също да са известни (вж. точка 17).
|
РЕФЕРЕНТНИ ХИМИКАЛИ
|
12.
|
За оценка на относителната мобилност на изпитвания химикал в почвата следва да се използват референтни химикали с известно поведение при просмукване, като атразин или монурон, които могат да бъдат считани за умерено просмукващи се в полеви условия (1) (8) (11). Несорбиращ се и неразградим полярен референтен химикал (напр. тритиев бромид, флуоресцеин, еозин) за проследяване на движението на водата в колоната може също да бъде полезен с оглед потвърждаване на хидродинамичните свойства на почвената колона.
|
|
13.
|
Еталонни аналитични химикали също могат да бъдат полезни за охарактеризиране и/или идентифициране на продуктите от трансформацията, открити в почвените сегменти и в отцедената вода чрез хроматографски, спектроскопски, или други относими методи.
|
ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
КРИТЕРИИ ЗА КАЧЕСТВО
Аналитичен добив
|
15.
|
Сборът от процентите от изпитвания химикал, открити в почвените сегменти и в отцедената вода след просмукването, дава аналитичния добив за даден опит с просмукване. Аналитичните добиви трябва да бъдат в обхвата от 90 % до 110 % за изотопно белязани химикали (11) и от 70 % до 110 % за небелязани химикали (8).
|
Повторяемост и чувствителност на метода за анализ
|
16.
|
Повторяемостта на метода за анализ за количествено определяне на изпитвания химикал и продуктите от трансформацията може да бъде проверена чрез анализ на двукратни повторения от един и същ екстракт от почвен сегмент или от отцедената вода (вж. точка 11).
|
|
17.
|
Границата на откриване (LOD) на метода за анализ по отношение на изпитвания химикал и на продуктите от трансформацията му трябва да бъде поне 0,01 mg · kg– 1 във всеки почвен сегмент или в отцедената вода (като изпитван химикал), или 0,5 % от приложената доза във във всеки отделен сегмент, като се взема по-ниската стойност. Трябва да бъде определена също и границата за количествено определяне на метода (LOQ).
|
ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
Система за изпитване
|
18.
|
За изпитването се използват колони за просмукване (сегментируеми или не), направени от подходящ инертен материал (например стъкло, неръждаема стомана, алуминий, тефлон, PVC и др.) с вътрешен диаметър от поне 4 cm и минимална височина от 35 cm. Материалите за колоните следва да бъдат изпитани за потенциално взаимодействие с изпитвания химикал и/или продуктите от трансформацията му. Примери за подходящи сегментируеми и несегментируеми колони са дадени в допълнение 2.
|
|
19.
|
За пълнене и запълване на почвените колони се използват лъжица, бутало и апарат за вибрации.
|
|
20.
|
За прилагането на изкуствен дъжд към почвените колони могат да се използват бутални или перисталтични помпи, глави за душ, устройства за подаване на постоянен поток течност или обикновени делителни фунии.
|
Лабораторно оборудване и химикали
|
21.
|
Необходимо е стандартно лабораторно оборудване, по-специално следното:
|
(1)
|
инструменти за анализ, като оборудване за газо-течна, високоефективна течна и тънкослойна хроматография, включително подходящи детектори за анализиране на изотопно белязани и небелязани химикали или метод с обратно изотопно разреждане;
|
|
(2)
|
инструменти, използвани за целите на идентификацията (напр. масспектрометър, газова хроматография с масспектрометър, високоефективна течна хроматография с масспектрометър, ЯМР и др.);
|
|
(3)
|
течен сцинтилационен брояч за изотопно белязани изпитвани химикали;
|
|
(4)
|
апарат за окисление, за изгаряне на белязани материали;
|
|
(5)
|
апаратура за екстракция (например центрофужни епруветки за студена екстракция и апарат „Сокслет“ за продължителна екстракция с хладник);
|
|
(6)
|
оборудване за концентриране на разтвори и екстракти (напр. ротационен изпарител).
|
|
|
22.
|
Използваните химикали включват: органични разтворители с квалификация „чист“, като ацетон, метанол и др.; сцинтилационна течност; Разтвор 0,01 М CaCl2 в дестилирана или дейонизирана вода (= изкуствен дъжд).
|
Изпитван химикал
|
23.
|
За прилагане на изпитвания химикал в почвената колона той следва да бъде разтворен във вода (дейонизирана или дестилирана). Ако изпитваният химикал е малко разтворим във вода, той може да бъде приложен или като формулиран продукт (ако е необходимо, след суспендиране или емулгиране във вода) или във всякакъв органичен разтворител. В случай че се използва органичен разтворител, той следва да бъде сведен до минимум и следва да се изпари от повърхността на почвената колона преди да започне процедурата по просмукването. Твърдите формулировки, като например гранули, следва да се прилагат в твърда форма без вода; за да се даде възможност за по-добро разпределение по повърхността на почвената колона, формулираният продукт може да бъде смесен с малко количество кварцов пясък (напр. 1 g) преди прилагането.
|
|
24.
|
Количеството от изпитвания химикал, приложено към почвените колони, следва да бъде достатъчно, за да позволи откриването на най-малко 0,5 % от приложената доза във всеки отделен сегмент. За активни химикали в продукти за растителна защита, това може да се основава на максималната препоръчителна доза (еднократно прилагане) и, за просмукване както на стари остатъчни, така и на базови вещества, следва да бъде свързано с площта на почвената колона, която се използва (55).
|
Референтен химикал
|
25.
|
При опитите за просмукване следва да се използва референтен химикал (вж. точка 12). Той следва да се прилага към повърхността на почвата в колоната по начин, подобен на този за изпитвания химикал, и в подходящо количество, което да дава възможност за достатъчно откриване или като вътрешен стандарт, заедно с изпитвания химикал в същата почвена колона, или самостоятелно в отделна почвена колона. Предпочита се изпитването и с двата химикала да се провежда в същата колона, с изключение на случаите, когато тези два химикала са белязани по подобен начин.
|
Почви
Избор на почва
|
26.
|
При изследванията за просмукване с базовия изпитван химикал следва да се използват 3-4 почви с различни стойност на рН, съдържание на органичен въглерод и зърнометричен състав (12). Насоки за избор на почви при опити с просмукване са дадени в таблица 1 по-долу. За изпитвани химикали, които могат да се йонизират, избраните почви следва да покриват широк интервал от рН, с цел да се оцени мобилността на химикала в неговите йонизирана и нейонизирана форми; най-малко 3 почви трябва да имат рН, при което изпитваният химикал е в мобилната си форма.
Таблица 1
Насоки за избор на почви при изследвания за просмукване
|
№ на почвата
|
Стойност на pH
|
Органичен въглерод
%
|
Съдържание на глина
%
|
Зърнометричен състав (56)
|
|
1
|
> 7,5
|
3,5 — 5,0
|
20 — 40
|
песъкливо-глинесто-праховита
|
|
2
|
5,5 — 7,0
|
1,5 — 3,0
|
15 — 25
|
песъкливо-праховита
|
|
3
|
4,0 — 5,5
|
3,0 — 4,0
|
15 — 30
|
глинесто-песъкливо-праховита
|
|
4
|
< 4,0 — 6,0 (57)
|
< 0,5 — 1,5 (57)
(58)
|
< 10 — 15 (57)
|
песъклива (свързан пясък)
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
песъклива (свързан пясък)/песъклива (рохкав пясък)
|
|
|
27.
|
Понякога може да се наложи използване на други видове почви, които да са представителни за по-студени, умерени и тропически зони. Следователно, ако се предпочитат други видове почви, те следва да бъдат характеризирани със същите параметри и следва да имат подобни варирания в свойствата, като описаните в Насоките за избор на почви при изследвания за просмукване (вж. таблица 1 по-горе), дори и да не съответстват точно на критериите.
|
|
28.
|
При изследвания за просмукване със „стари остатъци“ следва да бъде използван един тип почва (12). Той трябва да има съдържание на пясък > 70 % и съдържание на органичен въглерод между 0,5-1,5 % (например почва № 4 в таблица 1). Използването на повече видове почви може да бъде необходимо, ако данните за продуктите от трансформацията са важни.
|
|
29.
|
Всички почви трябва да бъдат охарактеризирани, поне по отношение на зърнометричния им състав [ % песъклива, % праховита, % глинеста фракция съгласно класификационните системи на ФАО и на министерството на земеделието на САЩ (14)], рН, катионообменен капацитет, съдържание на органичен въглерод, обемно тегло (за обработени почви) и способност за задържане на вода. Измерването на микробната биомаса се изисква само за почвата, която се използва през периода на стареене/инкубация, който е преди опита с просмукване на стари остатъчни количества. Информацията относно допълнителни свойства на почвата (например класификация на почвите, минералогия на глината, специфична повърхност) може да бъде полезна за интерпретирането на резултатите от настоящото проучване. За определянето на характеристиките на почвата могат да бъдат използвани методите, препоръчани в позовавания (15) (16) (17) (18) (19).
|
Вземане и съхранение на почвени проби
|
30.
|
Почвените проби трябва да бъдат вземани от горния слой (хоризонт А) най-много до дълбочина 20 cm. Остатъците от растителност, макрофауна и камъни трябва да бъдат отстранени. Почвите (с изключение на използваните за стареене на изпитвания химикал) се изсушават на въздух при стайна температура (за предпочитане между 20-25 °C). Разрушаването на агрегатите следва да се извършва с минимална сила, така че оригиналната структура на почвата да се измени колкото е възможно по-малко. Почвите се пресяват през сито ≤ 2 mm. Препоръчва се внимателно хомогенизиране, тъй като това повишава възпроизводимостта на резултатите. Преди използване почвите могат да се съхраняват при температура на околната среда и да се държат изсушени на въздух (12). Не се препоръчва ограничаване на времето за съхраняване, но почви, които се съхраняват повече от 3 години, се анализират отново преди употребата с оглед на тяхното съдържание на органичен въглерод и рН.
|
|
31.
|
Трябва да има подробна информация за историята на мястото в полето, откъдето са били взети почвените проби за изпитване. Подробностите включват точно местоположение [точно определено чрез UTM (Универсална напречна цилиндрична проекция на Меркатор /Европейска хоризонтална координатна система (European Horizontal Datum) или географски координати], растителна покривка, обработване с химикали за растителна защита, третиране с органични и неорганични торове, прибавяне на биологични материали или случайни замърсявания (12). Ако почва е третирана с изпитвания химикал или с негови структурни аналози през предходните четири години, тя не трябва да бъде използвана за изследвания за просмукване.
|
Условия на изпитването
|
32.
|
По време на периода за провеждане на изпитването почвените колони за изпитване на просмукването следва да се съхраняват на тъмно при стайна температура, при условие, че тази температура се поддържа в границите на ± 2 °C. Препоръчват се температури между 18 и 25 °C.
|
|
33.
|
Към повърхността на почвената колона следва непрекъснато да се прилага изкуствен дъжд (0,01 М CaCl2) в количества от 200 mm за период от 48 часа (60); Тези прилагани количества са равностойни на прилагане на 251 ml за колона с вътрешен диаметър от 4 cm. Ако е необходимо за целите на изпитването, могат допълнително да бъдат използвани други прилагани количества изкуствен дъжд и по-голяма продължителност.
|
Провеждане на изпитването
Просмукване с базов изпитван химикал
|
34.
|
Колони за изпитване на просмукването в най-малко две повторения се запълват с нетретирана, изсушена на въздух и пресятата почва (сито < 2 mm) до височина приблизително 30 cm. За получаване на еднотипен пълнеж почвата се добавя към колоните на малки порции с лъжица и се притиска с бутало, като едновременно с това колоната се подлага на леки вибрации, докато горната част на почвата в колоната престане да потъва допълнително. Еднообразното запълване се изисква с оглед получаването на възпроизводими резултати от колоните за изпитване на просмукването. За подробни данни относно техниките за запълване на колоните вж. (20), (21) и (22). За контролиране на възпроизводимостта на процедурата по запълване се определя общото тегло на почвата, напълнена в колоните (61); теглата на двете повторения на колони следва да са сходни.
|
|
35.
|
След запълването се извършва предварително омокряне на колоните с почва с изкуствен дъжд (0,01 М CaCl2), от основата към върха, с цел въздухът в порите на почвата да се замести с вода. След това се дава възможност за достигане на равновесие в почвените колони и излишната вода се отцежда гравитационно. Преглед на методи за насищане на колоната е направен в позоваване (23).
|
|
36.
|
След това изпитваният и/или референтният химикал се прилагат към почвените колони (виж също точки 23-25). За получаване на хомогенно разпределение разтворите, суспензиите или емулсиите на изпитвания и/или референтния химикал следва да се прилагат равномерно над повърхността на почвените колони. Ако по отношение на прилагането на изпитван химикал се препоръчва внасяне в почвата, той следва да се смеси в малко количество (например 20 g) почва и да се добави към повърхността на почвата в колоната.
|
|
37.
|
След това повърхността на почвените колони се покрива с диск от синтеровано стъкло, стъклени перли, филтри от стъклено влакно или кръгла филтърна хартия, за разпределяне на изкуствения дъжд равномерно по цялата повърхност и за избягване нарушаването на повърхността на почвата от дъждовните капки. Колкото е по-голям диаметърът на колоната, толкова повече грижи са необходими за гарантиране на равномерно разпределение на изкуствения дъжд над повърхността на почвата при прилагането на изкуствен дъжд към почвените колони. След това изкуственият дъжд се добавя на капки към почвените колони с помощта на бутало или перисталтична помпа, или делителна фуния. За предпочитане е отцедената вода да се събира на фракции и техните съответни обеми да се записват (62).
|
|
38.
|
След просмукването и оставянето на водата в колоните да се оттече, почвените колони се сегментират на подходящ брой сегменти в зависимост от информацията, която се изисква от проучването, сегментите се екстрахират с подходящи разтворители или смеси от разтворители и се анализират за изпитвания химикал и, където е подходящо, за продукти от трансформацията, за обща радиоактивност и за референтния химикал. Отцедената вода или фракции от нея се анализират или директно, или след екстракция, за същите продукти. Когато се използва изотопно белязан изпитван химикал, всички части, съдържащи ≥ 10 % от приложената радиоактивност, следва да бъдат идентифицирани.
|
Просмукване със стари остатъци
|
39.
|
Прясната почва (която не е предварително изсушена на въздух) се третира със скорост, съответстваща на повърхността на почвените колони (вж. точка 24), с изотопно белязания изпитван химикал и се инкубира при аеробни условия съгласно метод за изпитване В.23 (13). Периодът на инкубация (стареене) трябва да бъде достатъчно дълъг, за да се получат значими количества продукти от трансформация; препоръчва се период на стареене, равен на периода на полуразграждане на изпитвания химикал (63), но този период не следва да надхвърля 120 дни. Преди просмукването преминалата през стареене почва се анализира за изпитвания химикал и за продуктите от трансформацията му.
|
|
40.
|
Колоните за изпитване на просмукването се пълнят до височина 28 cm със същата почва (но изсушена на въздух), която се използва при опита със стареенето, описан в точка 34, и също се определя общото тегло на запълнените почвени колони. След това се извършва предварително омокряне на колоните с почва, както е описано в точка 35.
|
|
41.
|
След това изпитваният химикал и продуктите от трансформацията му се прилагат към повърхността на почвените колони под формата на стари остатъци в почвата (вж. точка 39) като почвен сегмент от 2 cm. Предпочита се общата височина на почвените колони (нетретирана почва + преминала през стареене почва) да не надхвърля 30 cm (вж. точка 34).
|
|
42.
|
Просмукването се извършва така, както е описано в точка 37.
|
|
43.
|
След просмукването почвените сегменти и отцедената вода се анализират така, както е посочено в точка 38, за изпитвания химикал, продуктите от трансформацията му и неизвлечената радиоактивност. За да се определи каква част от старите остатъци се е задържала в горния слой от 2 cm след просмукването, този сегмент следва да се анализира отделно.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
44.
|
Количествата от изпитвания химикал, продуктите от трансформацията му, неекстрахируемите и, ако са включени, тази на референтния химикал, следва да бъдат изразени в процент от приложената първоначална доза за всеки почвен сегмент и фракция от отцедената вода. За всяка колона следва да се даде графично представяне, като установените проценти се начертаят като функция от дълбочините на почвата.
|
|
45.
|
Когато в тези изследвания за просмукване в колони е включен референтен химикал, просмукването на даден химикал може да бъде оценено с относителна скала, като се използват коефициенти на относителна мобилност (КОМ; за определение вж. допълнение 3) (1) (11), което позволява сравняване на данни за просмукването на различни химикали, получени с различни видове почви. Примери за стойности на КОМ за различни химикали за растителна защита са дадени в допълнение 3.
|
|
46.
|
Оценките на органичния въглерод Koc (нормализиран коефициент на адсорбция на органичния въглерод) и Kom (нормализиран коефициент на разпределение на органичната материя) могат също да бъдат получени от резултатите от просмукването в колоните, като се използва средното разстояние на просмукване или установените корелации между КОМ и съответно Kom и Koc (4), или чрез прилагане на обикновената хроматографска теория (24). Независимо от това, последният метод следва да се използва с предпазливост, особено като се има предвид, че процесът на просмукване включва не само отток в наситен режим, а по-скоро системи в ненаситен режим.
|
Интерпретиране на резултатите
|
47.
|
Изследванията за просмукване в колони, описани в настоящия метод, позволяват определянето на потенциала на изпитвания химикал за просмукване или за мобилност в почвата (в проучването за просмукване на базисния химикал) и/или продуктите от трансформацията му (в проучването за просмукване на стари остатъци). Тези изпитвания не прогнозират количествено поведението при просмукване в полеви условия, но те могат да се използват за съпоставяне на „способността за просмукване“ на даден химикал с други, чието поведение при просмукване може да бъде известно (24). По подобен начин, те не измерват количествено процента на приложения химикал, който може да достигне до подпочвените води (11). Независимо от това, резултатите от изследванията за просмукване в колони могат да помогнат при вземането на решение дали трябва да бъдат проведени допълнителни полуполеви или полеви изпитвания за химикали, които показват голям потенциал за мобилност в лабораторни изпитвания.
|
Протокол от изпитването
|
48.
|
Протоколът трябва да съдържа:
|
|
Изпитван и референтен химикал (когато се използва такъв):
|
—
|
общоприето наименование, химично наименование (номенклатури на IUPAC и на CAS), CAS номер, химична структура (показваща къде е белязан изотопно белязаният материал, когато се използва такъв) и относими физични и химични свойства;
|
|
—
|
чистота (онечиствания) на изпитвания химикал;
|
|
—
|
радиохимична чистота на белязания химикал и специфична активност (където е уместно).
|
|
|
|
Изпитвани почви:
|
—
|
подробности за мястото, от което са събирани;
|
|
—
|
свойства на почвите, такива като pH, съдържание на органичен въглерод и глинеста фракция, зърнометричен състав и обемно тегло (за обработени почви);
|
|
—
|
почвена микробна активност (само за почвите, използвани за стареене на изпитвания химикал);
|
|
—
|
продължителност на периода на съхраняване на почвата и условия на съхранение.
|
|
|
|
Условия на изпитването:
|
—
|
дати на извършване на изследванията;
|
|
—
|
дължина и диаметър на колоните за изпитване на просмукването;
|
|
—
|
общо тегло на почвата в почвените колони;
|
|
—
|
количество на приложения изпитван химикал и, ако е подходящо, на приложения референтен химикал;
|
|
—
|
количество, честота и продължителност на прилагането на изкуствен дъжд;
|
|
—
|
температура на опитната постановка;
|
|
—
|
брой повторения (най-малко две);
|
|
—
|
методи за анализ на изпитвания химикал, на продуктите от трансформацията и, където е приложимо, на референтния химикал в различните почвени сегменти и в отцедената вода;
|
|
—
|
методи за характеризиране и идентифициране на продуктите от трансформацията в почвените сегменти и в отцедената вода.
|
|
|
|
Резултати от изпитването:
|
—
|
таблици с резултати, изразени като концентрации и като процент от приложената доза за почвените сегменти и за отцедената вода;
|
|
—
|
масов баланс, ако е приложимо;
|
|
—
|
обеми на отцедената вода;
|
|
—
|
разстояния на просмукване и, където е приложимо, коефициенти на относителна мобилност;
|
|
—
|
графично изобразяване на процентите, установени в почвените сегменти, като футкция от дълбочината на почвения сегмент;
|
|
—
|
обсъждане и интерпретиране на резултатите.
|
|
|
ЛИТЕРАТУРА
|
(1)
|
Guth, J.A., Burkhard, N. and Eberle, D.O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
(2)
|
Russel, M.H. (1995). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals — T.R. Roberts and P.C. Kearney, Eds.). J. Wiley & Sons.
|
|
(3)
|
Briggs, G.G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J.Agric. Food Chem. 29, 1050-1059.
|
|
(4)
|
Chiou, C.T., Porter, P.E. and Schmedding, D.W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227-231.
|
|
(5)
|
Guth, J.A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26-33.
|
|
(6)
|
US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(7)
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
(8)
|
Annex I to Commission Directive 95/36/EC of 14 July 1995 amending Council Directive 91/414/EEC concerning the placing of plant protection products on the market, OJ L 172, 22.7.1995, p. 8.
|
|
(9)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
(11)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
(12)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995.
|
|
(13)
|
Следните глави от настоящото приложение:
|
|
Глава А.4, парно налягане
|
|
|
Глава А.6, разтворимост във вода
|
|
|
Глава А.8, коефициент на разпределение, метод „разклащане в стъкленица“
|
|
|
Глава А.24, коефициент на разпределение, метод ВЕТХ
|
|
|
Глава В.7, Разграждане — абиотично разграждане: хидролиза като функция от рН
|
|
|
Глава В.18, Адсорбция/десорбция чрез използване метода за равновесие в групата
|
|
|
Глава В.23, Аеробна и анаеробна трансформация в почва
|
|
|
(14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
|
|
(15)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods (A. Klute, Ed.). Agronomy Series No. 9, 2nd Edition.
|
|
(16)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A.L. Page, R.H. Miller and D.R. Kelney, Eds.). Agronomy Series No. 9, 2nd Edition.
|
|
(17)
|
ISO Standard Compendium Environment (1994). Soil Quality — General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
|
|
(18)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
(19)
|
Scheffer, F. and Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(20)
|
Weber, J.B. and Peeper, T.F. (1977). In Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, 73-78.
|
|
(21)
|
Weber, J.B., Swain, L.R., Strek, H.J. and Sartori, J.L. (1986). In Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, 190-200.
|
|
(22)
|
Oliveira, et al. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): 49-53.
|
|
(23)
|
Shackelford, C. D. (1991). Laboratory diffusion testing for waste disposal. — A review. J. Contam. Hydrol. 7, 177-217.
|
|
(24)
|
(Hamaker, J.W. (1975). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V.H. Freed, Eds), 115-133. Plenum Press, New York.
|
|
(25)
|
OECD (1981). Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112, OECD, Paris
|
Допълнение 1
Определения и мерни единици
Стари остатъци в почвата
: Изпитваният химикал и продуктите от трансформацията, налични в почвата след прилагането и след период, който е достатъчно продължителен за протичането на процесите по придвижването, адсорбцията, метаболизма и разсейването, за изменение на разпределението и химичната природа на част от приложения химикал (1).
Изкуствен дъжд
: Разтвор 0,01 М CaCl2 в дестилирана или дейонизирана вода.
Средно разстояние на просмукване
: Долната част на почвения сегмент, където кумулативната стойност на аналитичния добив от химикала = 50 % от общата стойност на аналитичния добив от изпитвания химикал [обичаен опит по просмукване], или; (долната част на почвения сегмент, където кумулативната стойност на аналитичния добив от химикала = 50 % от общата стойност на аналитичния добив от изпитвания химикал) — ((дебелина на слоя от стари остатъци)/2) [проучване за просмукване на стари остатъци]
Химикал
: Вещество или смес.
Отцедена вода
: Водна фаза, процедила се през почвен профил, или през почвена колона (1).
Просмукване
: Процес, при който даден химикал се движи надолу през почвения профил, или през почвена колона (1).
Разстояние на просмукване
: Най-дълбокият почвен сегмент, в който след процеса на просмукване е бил установен ≥ 0,5 % от приложения изпитван химикал или стари остатъци (равностойно на дълбочина на проникване).
Граница на откриване (LOD) и граница на количествено определяне (LOQ)
: Границата на откриване (LOD) представлява концентрацията на даден химикал, под която идентичността на химикала не може да бъде разграничена от аналитичните артефакти. Границата на количествено определяне (LOQ) представлява концентрацията на даден химикал, под която концентрацията не може да бъде установена с приемлива точност.
КОМ коефициент на относителна мобилност
: (разстояние на просмукване на изпитвания химикал (cm))/(разстояние на просмукване на референтния химикал (cm))
Изпитван химикал
: Всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
Продукт от трансформацията
: Всички химикали, получени в резултат на реакции по биотична и абиотична трансформация на изпитвания химикал, включително СО2 и продуктите, които са свързани в остатъци.
Почва
: Смес от неорганични и органични химични компоненти, последните от които съдържат съединения с високо съдържание на въглерод и азот и с високи молекулни тегла, обитавана от малки организми (предимно микроорганизми). Почвата може да бъде третирана в две състояния:
|
—
|
необработено, в каквото се е развивала с времето, в характерни пластове на различни типове почви;
|
|
—
|
обработено, в каквото тя се намира обикновено в обработваеми площи или когато пробите са взети чрез разкопаване и се използват в настоящия метод за изпитване (2).
|
|
(1)
|
Holland, P.T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, 1167-1193.
|
|
(2)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981).
|
Допълнение 2
Фигура 1
Пример за несегментируеми колони за изпитване на просмукването, изработени от стъкло
с дължина 35 cm и вътрешен диаметър 5 cm (1)

|
(1)
|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden — 70 Jahre Agrarforschung der BASF AG, 225-236. Verlag Wissenschaft und Politik, Köln.
|
Фигура 2
Пример за сегментируема метална колона с вътрешен диаметър 4 cm (1)

|
(1)
|
Burkhard, N., Eberle D.O. and Guth, J.A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203-213.
|
Допълнение 3
Примери за коефициенти на относителна мобилност
(64)
(КОМ) за различни химикали за растителна защита (1)(2) и съответните класове на мобилност
(66)
|
КОМ-обхват
|
Химикал (КОМ)
|
Клас на мобилност
|
|
≤ 0,15
|
Паратион (< 0,15), Флуродифен (0,15)
|
I
неподвижен
|
|
0,15 — 0,8
|
Профенофос (0,18), Пропиконазол (0,23), Диазинон (0,28), Диурон (0,38), Тербутилазин (0,52), Метидатион (0,56), Прометрин (0,59), Пропазин (0,64), Алахлор (0,66), Метолахлор (0,68)
|
II
слабо мобилен
|
|
0,8 — 1,3
|
Монурон (65) (1,00), Атразин (1,03), Симазин (1,04), Флуометурон (1,18)
|
III
умерено мобилен
|
|
1,3 — 2,5
|
Прометон (1,67), Цианазин (1,85), Бромацил (1,91), Карбутилат (1,98)
|
IV
сравнително мобилен
|
|
2,5 — 5,0
|
Карбофуран (3,00), Диоксакарб (4,33)
|
V
мобилен
|
|
> 5,0
|
Монокротофос (> 5,0), Дикротофос (> 5,0)
|
VI
много мобилен
|
|
(1)
|
Guth, J.A. (1985). Adsorption/desorption. In Joint International Symposium „Physicochemical Properties and their Role in Environmental Hazard Assessment.“ Canterbury, UK, 1-3 July 1985.
|
|
(2)
|
Guth, J.A. and Hörmann, W.D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91-106.
|
|
(3)
|
Harris, C.I. (1967). Movement of herbicides in soil. Weeds 15, 214-216.
|
|
(4)
|
Helling, C.S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, 743-748.
|
|
(5)
|
McCall, P.J., Laskowski, D.A., Swann, R.L. and Dishburger, H.J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
(6)
|
Hollis, J.M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, 165-174.
|
В.45. ОЦЕНКА НА ЕМИСИИТЕ В ОКОЛНАТА СРЕДА ОТ ДЪРВЕСИНА, ТРЕТИРАНА С КОНСЕРВАНТИ: ЛАБОРАТОРЕН МЕТОД ЗА СТОКИ ОТ ДЪРВЕСИНА, КОИТО НЕ СА ПОКРИТИ И СА В КОНТАКТ СЪС СЛАДКА ИЛИ МОРСКА ВОДА
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (ТG) 313 (2007). Емисиите в околната среда от дървесина, третирана с консерванти, трябва да бъдат количествено определени, за да се даде възможност за оценка на риска за околната среда за третирана дървесина. Този метод за изпитване описва лабораторен метод за оценка на емисиите от дървесина, третирана с консерванти, в две ситуации, при които емисиите биха могли да преминат в околната среда:
|
—
|
Емисии от третирана дървесина, намираща се в контакт със сладка вода. Емисии от повърхността на третираната дървесина могат да преминат във водата.
|
|
—
|
Емисии от третирана дървесина, намираща се в контакт с морска вода. Емисии от повърхността на третираната дървесина могат да преминат в морската вода.
|
|
|
2.
|
Настоящият метод за изпитване е предназначен за изпитване на емисиите от дървесина и стоки от дървесина, които не са покрити и са в контакт със сладка или морска вода. Класовете на употреба се използват в международен мащаб и категоризират биологичната опасност, която ще се отнася за третираната стока. Класовете на употреба също определят ситуацията, при която се използва третираната стока, и компонентите на околната среда (въздух, вода, почва), които са потенциално застрашени от дървесината, третирана с консерванти.
|
|
3.
|
Методът за изпитване представлява лабораторна процедура за вземане на проби (среда за емисии) от вода, използвана за накисване на третирана дървесина, на увеличаващи се времеви интервали след експозицията. Количеството на емисиите в средата за емисии е свързано с повърхността на дървесината и продължителността на експозицията, с оглед оценка на преминаването в mg/m2/ден. По този начин може да се оцени преминаването (скоростта на отмиване) след увеличаване на периодите на експозиция.
|
|
4.
|
Количеството на емисиите може да се използва при оценката на риска за околната среда от третираната дървесина.
|
ПЪРВОНАЧАЛНИ СЪОБРАЖЕНИЯ
|
5.
|
Механизмът на отмиването от повърхността на дървесината не е идентичен, по природа и като интензитет, при сладката вода и при морската вода. Поради това за продуктите и смесите за консервиране на дървесина, употребявани за третиране на дървесина, използвана в морска вода, е необходимо проучване за отмиването от дървесина за морска вода.
|
|
6.
|
Дървесината, в случая на дървесина, третирана с консервант за дървесина, следва да бъде представителна за дървесината, която се използва за търговски цели. Тя следва да се третира в съответствие с инструкциите на производителя на консерванта и в съответствие със съответните стандарти и спецификации. Параметрите за кондиционирането на дървесината след третиране, преди започване на изпитването, трябва да се посочат.
|
|
7.
|
Пробите от дървесината, които се използват, следва да бъдат представителни за стоките, които се използват (напр. по отношение на биологичен вид, плътност и други характеристики).
|
|
8.
|
Изпитването може да се прилага върху дървесина, като се използва процес на проникване или повърхностно приложение, или върху третирана дървесина, която е с допълнителна задължителна повърхностна обработка (например боя, който е поставена като изискване за използване за търговски цели).
|
|
9.
|
Съставът, количеството, pH и физичната форма на водата са важни при определяне на количеството, съдържанието и естеството на емисиите от дървесината.
|
ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
|
10.
|
Изпитваните образци от дървесина, третирана с консерванти, се накисват във вода. Водата (средата за емисии) се събира и се анализира химически множество пъти по време на периода на експозиция, достатъчни, за да се извършат статистически изчисления. Eмисионни потоци в mg/m2/ден се изчисляват от резултатите от анализите. Периодите на пробовземане следва да се записват. Изпитванията с нетретирани проби могат да бъдат прекратени, ако не се откриват фонови стойности в първите три точки от данни.
|
|
11.
|
Включването на образци от нетретирана дървесина дава възможност за определяне, в средите за емисии, на фонови нива за емисии от дървесина, различни от използвания консервант.
|
КРИТЕРИИ ЗА КАЧЕСТВО
Точност
|
12.
|
Точността на метода за изпитване за оценка на емисиите зависи от това дали образците за изпитване са представителни за третираната дървесина на пазара, от представителността на водата по отношение на водата в реални условия и как от представителността на режима на експозиция по отношение на природните условия.
|
|
13.
|
Точността, прецизността и повторяемостта на метода за анализ трябва да бъдат определени преди провеждането на изпитването.
|
Възпроизводимост
|
14.
|
Три водни проби се вземат и анализират и средната стойност се взема като стойност на емисиите. Възпроизводимостта на резултатите в рамките на една лаборатория и между различни лаборатории зависи от режима на накисване и от дървесината, използвана като образци за изпитване.
|
Приемлив диапазон на резултатите
|
15.
|
Диапазон от резултати от това изпитване, в който най-горните и най-долните стойности се различават с по-малко от един порядък, е приемлив.
|
УСЛОВИЯ НА ИЗПИТВАНЕ
Вода
|
16.
|
Сценарии на отмиване със сладка вода: дейонизирана вода (напр. ASTM D 1193 Type II) се препоръчва за употреба в изпитването за отмиване, когато трябва да бъде оценена дървесина, която е в контакт със сладка вода. Температурата на водата трябва да бъде 20 °C ± 2 °C и измерената стойност на pH и на температурата на водата следва да бъде включена в протокола от изпитването. Анализът на проби от водата, взети преди накисването на третираните образци, позволява оценка на анализираните химикали във водата. Това е контрола за определяне на фоновите нива на химикали, които след това се анализират химически.
|
|
17.
|
Сценарии на отмиване с морска вода: синтетична морска вода (напр. ASTM D 1141 Substitute Ocean Water, without Heavy Metals) се препоръчва за употреба в изпитването за отмиване, когато трябва да бъде оценена дървесина, която е в контакт с морска вода. Температурата на водата трябва да бъде 20 °C ± 2 °C и измерената стойност на pH и на температурата на водата следва да бъде включена в протокола от изпитването. Анализът на проби от водата, взети преди накисването на третираните образци, позволява оценка на анализираните химикали във водата. Това е контрола за анализа на фоновите нива за химикали, които са от значение.
|
Образци от дървесина за изпитване
|
18.
|
Дървесните видове следва да бъдат типични за дървесните видове, използвани за изпитването за ефикасност на консерванти за дървесина. Препоръчваните видове са Pinus sylvestris L. (бял бор), Pinus resinosa Ait. (вид северноамерикански червен бор) или Pinus spp. (бор). При допълнителни изпитвания могат да се използват други биологични видове.
|
|
19.
|
Следва да бъде използвана дървесина с прави влакна без чепове. Смолистите на външен вид материали следва да се избягват. Дървесината трябва да бъде типична за дървесината, достъпна в търговската мрежа. Източникът, плътността и броят на годишните пръстени на 10 mm следва да бъдат документирани.
|
|
20.
|
Препоръчва се образците от дървесина за изпитване да се определят в серии от по пет образеца съгласно размерите по EN 113 (размери 25 mm × 50 mm × 15 mm) с надлъжни страни, успоредни на влакното на дървесината, въпреки че могат да се използват и други размери, например 50 mm на 150 mm на 10 mm. Образецът за изпитване трябва да бъде напълно накиснат във водата. Образците за изпитване се състоят от 100 % беловина. Всеки образец се маркира по уникален начин, така че да може да бъде разпознаван през цялото време на изпитването.
|
|
21.
|
Всички изпитвани образци трябва да бъдат рендосани или надлъжно рязани и повърхностите не трябва да са шлифовани.
|
|
22.
|
Броят на сериите от образци от дървесина за изпитване, използван за анализа, е най-малко пет: три серии образци се третират с консерванти, една серия от образци не се третира и една серия от образци се използва за оценка на съдържанието на влага, след сушене в сушилна камера, в образците за изпитване преди третирането. Приготвят се достатъчно образци за изпитване, за да може да се извърши подбор на три серии от екземпляри, които са в рамките на 5 % от средната стойност на поемане на консерванта от обединените образци за изпитване.
|
|
23.
|
Краищата на всички образци за изпитване се запечатват с химикал, който не позволява проникване на консервант в края на влакната на образците, или не позволява отмиване от образците чрез краищата на влакната. При прилагането на химикал за запечатването е необходимо да се прави разграничение между образци, използвани за процеси по повърхностно прилагане и такива, използвани за процеси по проникване. Химикалът за запечатване трябва да се прилага преди третиране само в случай на повърхностно прилагане.
|
|
24.
|
Краищата на влакната не трябва да бъдат запечатвани при третиране чрез процеси по проникване. Поради това краищата на образците трябва да бъдат запечатвани в края на периода на кондициониране. Оценката на емисията трябва да се прави само за надлъжната повърхност. Химикалите за запечатване следва да бъдат проверени и, ако е необходимо, приложени отново преди започване на отмиването, но не трябва да бъдат прилагани отново след започването на отмиването.
|
Контейнер за накисване
|
25.
|
Контейнерът е направен от инертен материал и е достатъчно голям, за да побере 5 образеца от дървесина с размери по EN 113 в 500 ml вода, което води до отношение на повърхността към обема вода от 0,4 cm2/ml.
|
Установка за изпитване на образците
|
26.
|
Образците за изпитване се държат върху установка, която дава възможност всички експонирани повърхности на образеца да са в контакт с водата.
|
ПРОЦЕДУРА ЗА ТРЕТИРАНЕ С КОНСЕРВАНТ
Приготвяне на образци за изпитване, третирани с консервант
|
27.
|
Образецът за изпитване от дървесина, който следва да бъде третиран с изпитвания консервант, се третира по метода, определен за консерванта, който може да е с процес на третиране с проникване, или с процес по повърхностно прилагане, който от своя страна може да бъде с потапяне, с напръскване или с нанасяне с четка.
|
Консерванти, които се прилагат при процес на третиране с проникване
|
28.
|
Трябва да бъде приготвен разтвор на консерванта, с който, при прилагане чрез процеса на третиране с проникване, ще се постигне определеното поемане. Образецът за изпитване от дървесина се претегля и се определят размерите му. Процесът на третиране с проникване трябва да се извършва така, както е определено за прилагането на консервант за дървесина за използване в клас на употреба 4 или 5. Образецът се претегля отново след третирането и поемането на консерванта (kg/m3) се изчислява по уравнението:

|
|
29.
|
Следва да се отбележи, че в това изпитване може да се използва дървен материал, третиран в инсталация за промишлено третиране (напр. чрез импрегниране под налягане с използване на вакуум). Процедурите, които се използват, трябва да бъдат записани и поемането на материал, третиран по този начин, трябва да бъде анализирано и записано.
|
Консерванти, които се прилагат при процеси по повърхностно прилагане
|
30.
|
Процесите по повърхностно прилагане по отношение на образци от дървесина за изпитване включват тяхното потапяне, напръскване или нанасяне с четка. Процесът и приложеното количество (напр. в литри/m2) следва да са такива, каквито са специфицирани за повърхностното прилагане на консерванта.
|
|
31.
|
Също така следва да се отбележи в този случай, че в това изпитване може да се използва дървен материал, третиран в инсталация за промишлено третиране. Процедурите, които се използват, трябва да бъдат записани и поемането на материал, третиран по този начин, трябва да бъде анализирано и записано.
|
Кондициониране на образците за изпитване след третирането
|
32.
|
След третирането, третираните образци за изпитване следва да бъдат кондиционирани в съответствие с препоръките на доставчика на изпитвания консервант според изискванията, посочени върху етикета на консерванта, или в съответствие с търговските практики при третирането, или в съответствие със стандарт EN 252.
|
Приготвяне и подбор на образци за изпитване
|
33.
|
След кондиционирането, следващо третирането, се изчислява средното поемане в групата от образци за изпитване и, с цел измерване на отмиването, на случаен принцип се избират три представителни серии от образци със стойност на поемането в рамките на 5 % от средната стойност за групата.
|
ПРОЦЕДУРА ЗА ИЗМЕРВАНЕ НА ЕМИСИИТЕ НА КОНСЕРВАНТИ
Метод чрез накисване
|
34.
|
Образците за изпитване се претеглят и след това се накисват изцяло във водата, като се записват датата и времето. Контейнерът се покрива, за да се намали изпарението.
|
|
35.
|
Водата се заменя на следните интервали: 6 часа, 1 ден, 2 дни, 4 дни, 8 дни, 15 дни, 22 дни, 29 дни (Забележка: това е общо време, не интервали от време). Часът и датата на замяната на водата, както и масата на водата, извлечена от контейнера, следва да бъдат записани.
|
|
36.
|
За последващ химичен анализ, след всяка замяна на вода се взема проба от водата, в която е била накисната серията от образци.
|
|
37.
|
Процедурата по вземане на проби позволява изчисляването на профила на количеството емисии спрямо времето. Пробите следва да се съхраняват при условия, които запазват аналита, напр. в хладилник на тъмно с оглед намаляване на микробния растеж в пробата преди анализа.
|
ИЗМЕРВАНИЯ НА ЕМИСИИ
Третирани проби
|
38.
|
Извършва се химичен анализ на взетата вода за активното вещество и/или относими продукти от разграждане/трансформация, ако е приложимо.
|
Нетретирани проби
|
39.
|
Вземането на проба от водата (средата за емисии) в тази система, и последващият анализ на химикалите, отмити от пробите от нетретирана дървесина проби, позволяват оценка на възможния емисионен поток от консерванти от нетретирана дървесина. Вземането на проби от средата за емисии и анализът им след периоди на експозиция с увеличаваща се продължителност дава възможност за оценка на скоростта на изменение във времето на емисионния поток. Този анализ е процедура за контрол, за да се определят фонови нива на изпитвания химикал в нетретирана дървесина, за да се потвърди, че дървесината, използвана като източник на пробите, не е била предварително третирана с консерванта.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Химични анализи
|
40.
|
Извършва се химичен анализ на взетата проба от водата и резултатът от анализа на водата се изразява в подходящи мерни единици, например в μg/l.
|
Протоколиране на данни
|
41.
|
Всички резултати се записват. В допълнението е даден пример за препоръчителен формуляр за една серия от третирани образци за изпитване, както и обобщена таблица за изчисляване на средните стойности на емисиите за всеки интервал на пробовземане.
|
|
42.
|
Дневното преминаване на емисии в mg/m2/ден се изчислява, като се вземе средната стойност от трите измервания от трите повторения и се раздели на броя на дните на накисване.
|
Протокол от изпитването
|
43.
|
В протокола от изпитването следва да бъде предоставена най-малко следната информация:
|
—
|
името на доставчика на изпитвания консервант;
|
|
—
|
специфичното и уникално наименование или кодът на изпитвания консервант;
|
|
—
|
търговското или общоприетото наименование на активната съставка (или съставки) с общо описание на другите коформуланти (напр. съразтворител, смола), и състава в % (m/m) на компонентите;
|
|
—
|
относимата стойност на поемането или нанасянето (в kg/m3 или l/m2 съответно), определена за дървесина, използвана при контакт с вода;
|
|
—
|
биологичният вид за използваната дървесина, с плътност и скорост на растеж в брой годишни пръстени на 10 mm;
|
|
—
|
стойностите на нанасянето или поемането на изпитвания консервант, и формулата, използвана за изчисляване на поемането, изразени в l/m2 или kg/m3;
|
|
—
|
методът на прилагане на консерванта, определянето на график на третирането, използван за процеса на проникване, и методът на прилагане, ако е използвано повърхностно третиране;
|
|
—
|
датата на прилагане на консерванта и оценка на съдържанието на влага на образците за изпитване, изразено като процент;
|
|
—
|
използваните процедури на кондициониране, с посочване на типа, условията и продължителността;
|
|
—
|
посочване на използвания химикал за запечатване и колко пъти е приложен;
|
|
—
|
посочване на всякакво последващо третиране на дървесината, напр. спецификация на доставчика, тип, характеристики и нанасяне на боя;
|
|
—
|
часът и датата на всяко накисване, количеството вода, което се използва за накисване на образците за изпитване при всяко потапяне, и количеството на водата, абсорбирана от дървесината по време на накисването;
|
|
—
|
Всяко отклонение от описания метод и всякакви фактори, които може да са повлияли на резултатите.
|
|
ЛИТЕРАТУРА
|
(1)
|
European Standard, EN 84 — 1997. Wood preservatives. Accelerated ageing of treated wood prior to biological testing. Leaching procedure.
|
|
(2)
|
European Standard, EN 113/A1 — 2004. Wood preservatives. Test method for determining the protective effectiveness against wood destroying basidiomycetes. Determination of the toxic values.
|
|
(3)
|
European Standard, EN 252 — 1989. Field test method for testing the relative protective effectiveness of a wood preservative in ground contact.
|
|
(4)
|
European Standard, EN 335 — Part 1: 2006. Durability of wood and wood-based products — Definition of use classes — Part1: General.
|
|
(5)
|
American Society for Testing and Materials Standards, ASTM D 1141 — 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
(6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II — 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
Допълнение 1
Формуляр за записване за метод за изпитване
Оценка на емисиите в околната среда от дървесина, третирана с консерванти: лабораторен метод за стоки от дървесина, които не са покрити и са в контакт със сладка или морска вода
|
Изпитваща лаборатория
|
|
|
Консервант за дървесина
|
|
Доставчик на консерванта
|
|
|
Специфично и уникално наименование или код на консерванта;
|
|
|
Търговско или общоприето наименование на консерванта
|
|
|
Коформуланти
|
|
|
Относимо поемане за дървесина, използвана в контакт с вода
|
|
|
Прилагане
|
|
Метод за прилагане
|
|
|
Дата на прилагане
|
|
|
Формула, използвана за изчисляване на поемането:
|
|
|
Процедура по кондициониране
|
|
|
Продължителност на кондиционирането
|
|
|
Химикал за запечатване/колко пъти е приложен
|
|
|
Последващо третиране
|
ако е приложимо
|
|
Образци за изпитване
|
|
Дървесни видове
|
|
|
Плътност на дървесината
|
(минимална … средна … максимална стойност)
|
|
Скорост на растеж (пръстени на 10 mm)
|
(минимална … средна … максимална стойност)
|
|
Съдържание на влага
|
|
|
Установки за изпитване
(67)
|
Поемане (напр. kg/m3)
|
|
Третирано „x“
|
Средна стойност и стандартно отклонение, или размах за 5 образеца
|
|
Третирано „y“
|
Средна стойност и стандартно отклонение, или размах за 5 образеца
|
|
Третирано „z“
|
Средна стойност и стандартно отклонение, или размах за 5 образеца
|
|
Нетретирано
|
|
|
Вариране на параметрите на метода за изпитване
|
Например качество на водата, размери на образците за изпитване и др.
|
|
Време
|
Замяна на вода
|
Маса на образеца
|
Поемане на вода
|
Водна проба
|
|
Третиран (средно)
|
Нетретиран
|
Третиран (средно)
|
Нетретиран
|
|
Вода за изпитването
|
x
|
y
|
z
|
|
|
Дата
|
g
|
g
|
g
|
g
|
№
|
pH
|
pH
|
pH
|
pH
|
|
Стартиране
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6h
|
|
|
|
|
|
1
|
|
|
|
|
|
24h
|
|
|
|
|
|
2
|
|
|
|
|
|
2 d
|
|
|
|
|
|
3
|
|
|
|
|
|
4 d
|
|
|
|
|
|
4
|
|
|
|
|
|
8 d
|
|
|
|
|
|
5
|
|
|
|
|
|
15 d
|
|
|
|
|
|
6
|
|
|
|
|
|
22 d
|
|
|
|
|
|
7
|
|
|
|
|
|
29 d
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
Изготвят се отделни таблици за всяка активна съставка (акт.с.)
|
Време
|
Замяна на вода
|
Резултати от анализа
|
|
Нетретирани образци
|
Третирани образци
|
|
Концентрация акт.с. във вода:
mg/l
|
Количество емисии
mg/m2
|
Емисионен поток
mg/m2/d
|
Концентрация акт.с. във вода:
|
Количество емисии
|
Емисионен поток
|
|
x
|
y
|
z
|
Средна
|
x
|
y
|
z
|
Средна
|
x
|
y
|
z
|
Средна
|
|
|
Дата
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
|
6h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Забележка: Тъй като може да се наложи резултатите от нетретираните проби да се използват за коригиране на емисионния поток от третирани проби, резултатите за нетретираните трябва да са на първо място и всички стойности за третираните проби би следвало да бъдат „коригирани стойности“. Също така може да има корекция за първоначалния анализ на водата.
Допълнение 2
Определения
Химикал
: Вещество или смес.
Изпитван химикал
: Всяко вещество или смес, изпитвано(а) с използване на настоящия метод за изпитване.
В.46. БИОАКУМУЛАЦИЯ В БЕНТОСНИ ОЛИГОХЕТИ, ОБИТАВАЩИ СЕДИМЕНТИ
УВОД
|
1.
|
Настоящият метод за изпитване е еквивалентен на насоките за изпитване на ОИСР (TG) 315 (2008) Хранещият се със седименти ендобентос може да бъде експониран на свързани със седиментите вещества (1). Сред тези хранещи се със седименти водните олигохети играят важна роля на дъното на водните системи. Те обитават седименти и често са най-разпространените видове, най-вече в местообитанията с условия на околната среда, неблагоприятни за други животни. Чрез биотурбация на седиментите и като служат за жертви на други животни, тези животни могат да окажат силно влияние върху бионаличността на такива вещества за други организми, като рибите, хранещи се с бентос. За разлика от епибентосните организми, ендобентосните водни олигохети се заравят в седимента и поглъщат частици от него под повърхността му. Поради това тези организми са експонирани на вещества чрез много пътища на поемане, включително пряк контакт, поглъщане на замърсени частици от седимента, водата между частиците на седимента и водата над седимента. Някои видове бентосни олигохети, които понастоящем се използват в екотоксикологичните изпитвания, са описани в допълнение 6.
|
|
2.
|
Параметрите, които характеризират биоакумулацията на дадено вещество, включват най-напред коефициента на биоакумулация (BAF), константата на скоростта на поглъщане от седимента (ks) и константата на скоростта на елиминиране (ke). Подробни определения на тези параметри са дадени в допълнение 1.
|
|
3.
|
За оценка на потенциала за биоакумулация на веществата като цяло, и за проучване на биоакумулацията на веществата, които имат склонност към разпределение във или върху седиментите, е необходим метод за изпитване, специфичен за компонента от средата (1) (2) (3) (4).
|
|
4.
|
Настоящият метод за изпитване е предназначен за оценка на биоакумулацията на свързани със седимента вещества в ендобентосни олигохети. Изпитваното вещество се добавя към седимента. Използването на седимент с добавка цели да симулира замърсен седимент.
|
|
5.
|
Настоящият метод се основава на съществуващите методи за изпитване на токсичността на седименти и биоакумулацията (1)(4)(5)(6)(7)(8)(9). Други полезни документи са: обсъжданията и резултатите от международен семинар (11) и резултатите от международно кръгово изпитване (12).
|
|
6.
|
Настоящото изпитване се прилага по отношение на стабилни, неутрални органични вещества, които имат склонност да се свързват със седименти. Биоакумулацията на свързани със седименти стабилни органометални съединения също може да бъдат измерена с настоящия метод (12). Той не се прилага за метали и други микроелементи (11) без модифициране на плана на изпитването по отношение на субстрата и обема на водата, и евентуално на размера на тъканната проба.
|
НЕОБХОДИМО УСЛОВИЕ И ИНФОРМАЦИЯ ЗА ИЗПИТВАНОТО ВЕЩЕСТВО
|
7.
|
Понастоящем на разположение са само няколко добре установени количествени зависимости структура-активност (QSAR) по отношение на процесите на биоакумулация (14). Най-широко използваната зависимост е корелацията между биоакумулацията и биоконцентрацията на стабилни органични вещества и съответно тяхната липофилност (изразена като логаритъм от коефициента на разпределение октанол-вода (log Kow); вж. допълнение 1 за определение), която е разработена за описание на разпределението на дадено вещество между вода и риби. С използване на тази зависимост са установени също и корелации за седимента като компонент (15) (16) (17) (18). Корелацията log Kow-log BCF като основна QSAR може да бъде полезна за първоначална предварителна оценка на потенциала за биоакумулация на свързани със седимента вещества. Независимо от това BAF може да бъде повлиян от съдържанието на липиди в изпитвания организъм и от съдържанието на органичен въглерод в седимента. Поради това като основен фактор за определяне на биоакумулацията на свързани със седимента органични вещества също може да се използва коефициентът на разпределение органичен въглерод-вода (Koc).
|
|
8.
|
Настоящото изпитване е приложимо за:
|
—
|
стабилни органични вещества със стойности на log Kow между 3,0 и 6,0 (5)(19) и свръхлипофилни вещества, при които log Kow е по-голям от 6,0 (5);
|
|
—
|
вещества, принадлежащи към клас органични вещества, за които е известно, че имат потенциал за биоакумулация в живи организми, напр. повърхностноактивни или силно адсорбиращи се вещества (напр., такива с високо Koc).
|
|
|
9.
|
Информация за изпитваното вещество като напр. мерки за безопасност, правилни условия за съхранение и стабилност, и методи за анализ, следва да бъде получена преди започването на изследването. Насоки относно изпитвани вещества, чиито физични и химични свойства затрудняват тяхното изпитване, са дадени в (20) и (21). Преди извършването на изпитване за биоакумулация с водни олигохети следва да е налице следната информация за изпитваното вещество:
|
—
|
общоприето наименование, химично наименование (за предпочитане по IUPAC) структурна формула, номер по CAS, чистота;
|
|
—
|
разтворимост във вода [метод за изпитване А.6 (22)];
|
|
—
|
коефициент на разпределение октанол-вода, Kow [методи за изпитване А.8 и А.24 (22)];
|
|
—
|
коефициент на разпределение седимент-вода, изразен като Kd или Koc [метод за изпитване В.19 (22)];
|
|
—
|
хидролиза [метод за изпитване В.7 (22)];
|
|
—
|
фототрансформация във вода (23);
|
|
—
|
парно налягане [метод за изпитване А.4 (22)];
|
|
—
|
пълна биоразградимост [методи за изпитване В.4 и В.29 (22)];
|
|
—
|
повърхностно напрежение [метод за изпитване А.5 (22)];
|
|
—
|
критична концентрация на мицели (24).
|
В допълнение би била относима и следната информация, където е на разположение:
|
—
|
биоразграждане във водна среда [методи за изпитване В.24 и В.25 (22)];
|
|
—
|
константа по закона на Хенри.
|
|
|
10.
|
Изотопно белязаните изпитвани вещества могат да улеснят анализа на водата, седимента и биологичните проби, и могат да се използват за определяне дали да се правят идентификация и количествено определяне на продукти от разграждането. Описаният тук метод е валидиран в международно кръгово изпитване (12) на вещества, белязани с изотоп 14C. Ако се измерват общите радиоактивни остатъци, коефициентът на биоакумулация (BAF) се основава на базовото вещество, включително всеки задържан продукт от разграждането. Възможно е също да се комбинира изследване на метаболизма с проучване за биоакумулация чрез анализ и количественото определяне на процентното съдържание на базовото вещество и продуктите от разграждането му в проби, взети в края на фазата на поглъщане или при максимална степен на биоакумулация. Във всички случаи се препоръчва изчислението на BAF да се прави въз основа на концентрацията на базовото вещество в организмите, а не само в общите радиоактивни остатъци.
|
|
11.
|
В допълнение към свойствата на изпитваното вещество, друга изисквана информация е токсичността към видовете олигохети, които ще се използват в изпитването, като медианна летална концентрация (LC50) за времето, необходимо за фазата на поглъщане, за да се гарантира, че подбраните концентрации на експозиция са много по-ниски от токсичните нива. Следва да се предпочитат, ако такива са налице, стойности на токсичността, изведени от дългосрочни изследвания върху сублетални крайни точки (EC50). Ако не са налице такива данни, полезна информация може да предоставят изпитване за остра токсичност при условия, идентични с условията на изпитването за биоакумулация, или данни за токсичността на други заместващи биологични видове.
|
|
12.
|
Следва да е наличен подходящ метод за анализ, чиито точност, прецизност и чувствителност при количественото определяне на веществото в изпитвателните разтвори, в седиментите и в биологичния материал, са известни, както и подробни данни за подготовката на пробата и нейното съхранение, а също и информационните листове за безопасност на веществата. Аналитичните граници на откриване за изпитваното вещество във водата, в седиментите и в тъканите на червеите трябва също да са известни. Когато се използва изотопно белязано изпитвано вещество, трябва да се познава специфичната радиоактивност (т.е., Bq mol– 1), разположението на белязания атом и процентът радиоактивност, свързан с онечистванията. Специфичната радиоактивност на изпитваното вещество следва да е колкото е възможно по-висока, за да се откриват възможно най-ниски стойности на концентрациите на изпитване (11).
|
|
13.
|
Трябва да е на разположение информация относно характеристиките на седименти, предназначени да бъдат използвани (напр. произход на седимента или съставките му, рН и концентрация на амоняк във водата между частиците на седимента (седименти в полеви условия), съдържание на органичен въглерод (TOC), зърнометричен състав (процент на пясък, прах и глина), и % сухо тегло) (6).
|
ПРИНЦИП НА ИЗПИТВАНЕТО
|
14.
|
Тестът се състои от две фази: фаза на поглъщане (експозиция) и фаза на елиминиране (след експозиция). По време на фазата на поглъщане червеите се експонират на седимент с добавка от изпитваното вещество, покрит с възстановена вода и при достигнато равновесие, както е подходящо (11). Контролни групи от червеи се държат при идентични условия, но без изпитваното вещество.
|
|
15.
|
За фазата на елиминиране червеите се прехвърлят в система седимент-вода, несъдържаща изпитваното вещество. Фазата на елиминиране е необходима за получаване на информация за скоростта, при която изпитваното вещество се екскретира от изпитваните организми (19)(25). Фазата на елиминиране е необходима във всички случаи, освен ако поглъщането на изпитваното вещество по време на фазата на експозиция не е било значимо (напр. няма статистическа разлика между концентрацията на изпитваното вещество в изпитваните червеи и в червеите от контролите). Ако по време на фазата на поглъщане не бъде достигнато стационарно състояние, определянето на кинетичните параметри — BAFk, константата/ите на скоростта на поглъщане и елиминиране — може да се извърши с използване на резултатите от фазата на елиминиране. Изменението на концентрацията на изпитваното вещество във/върху червеите се следи по време на цялото изпитване в двете му фази.
|
|
16.
|
По време на фазата на поглъщане измерванията се извършват до достигането от BAF на плато или стационарно състояние. По подразбиране, продължителността на фазата на поглъщане следва да е 28 дни. Практическият опит показва, че фаза на поглъщане от 12 до 14 дни е достатъчна за достигане на стационарно състояние при няколко стабилни, неутрални органични вещества (6) (8) (9).
|
|
17.
|
Ако обаче не е достигнато стационарно състояние в рамките на 28 дни, фазата на елиминиране се започва чрез прехвърляне на експонираните олигохети в съдове, които съдържат същата среда без изпитваното вещество. Фазата на елиминиране се прекратява от момента, когато се достигне 10 % ниво на концентрация, измерена в червеите в ден 28 от фазата на поглъщане, или след максимален срок от 10 дни (d). Нивото на остатъци в червеите в края на фазата на елиминиране се отчита като допълнителна крайна точка, например като неелиминирани остатъци (NER). За предпочитане е коефициентът на биоакумулация (BAFss) да се изчислява както като съотношение между концентрацията в червеите (Ca) и концентрацията в седимента (Cs) при видимо стационарно състояние, така и като кинетичен коефициент на биоакумулация BAFK, т.е., като съотношение между константата на скоростта на поглъщане от седимента (ks) и константата на скоростта на елиминиране (ke), като се предполага кинетика от първи порядък. Когато не е достигнато стационарно състояние в рамките на 28 дни, BAFK се изчислява от константата(ите) на скоростта на поглъщане и на елиминиране. За изчисление вж. допълнение 2. Ако не е приложима кинетика от първи порядък, следва да се използват по-сложни модели (допълнение 2 и препратка (25)).
|
|
18.
|
Ако не е достигнато стационарно състояние в рамките на 28 дни, фазата на поглъщане може по избор да се удължи чрез подлагане на експонираните групи червеи — при наличност — на последващи измервания, докато не бъде достигнато стационарно състояние; успоредно с това и независимо от това фазата на елиминиране следва все пак да бъде започната в ден 28 от фазата на поглъщане.
|
|
19.
|
Константата на скоростта на поглъщане, константата на скоростта на елиминиране (или константите, когато се използват по-сложни модели), кинетичният коефициент на биоакумулация (BAFK), и, когато е възможно, доверителните граници на всеки един от тези параметри, се изчисляват с помощта на уравнения от информатизирани модели (вж. допълнение 2 за модели). Пригодността на даден модел може да се определи от коефициента на корелация или от коефициента на детерминация (коефициенти, чиито стойности са близки до единица, показват добра пригодност).
|
|
20.
|
За да се намали варирането на резултатите от изпитването за органични вещества с висока липофилност, коефициентите на биоакумулация следва да се изразяват в допълнение по отношение на съдържанието на липиди в изпитваните организми и към съдържанието на органичен въглерод (TOC) в седимента (коефициент на акумулация биота-седимент, или BSAF, в kg TOC в седимента на kg (kg– 1) съдържание на липиди в червеите). Този подход се основава на опита и на теоретични корелации за водната среда като компонент на околната среда, при които — за някои класове химични вещества — има ясна зависимост между потенциала за биоакумулация на веществото и липофилността му, което е добре изяснено при използване на риби като организми за модела (14) (25) (27). Има също и връзка между съдържанието на липиди в изпитваните риби и наблюдаваната биоакумулация на такива вещества. За бентосните организми са установени сходни корелации (15)(16)(17)(18). Ако е налице достатъчно количество тъкан от червеи, липидното съдържание на изпитваните животни може да се определи върху същия биологичен материал като използвания за определяне на концентрацията на изпитваното вещество. Независимо от това е практично да се използват аклиматизирани контролни животни най-малко в началото или — за предпочитане — в края на фазата на поглъщане, за измерване на съдържанието на липиди, стойността от което да се използва за нормализиране на стойностите на BAF.
|
ВАЛИДНОСТ НА ИЗПИТВАНЕТО
|
21.
|
За да бъде тестът валиден, се прилагат следните условия:
|
—
|
Кумулативната смъртност на червеите (контроли и третирани проби) до края на изпитването не трябва да превишава 20 % от първоначалния брой.
|
|
—
|
Освен това следва да се докаже, че червеите се заравят в седимента, за да се даде възможност за максимална експозиция. За подробно обяснение вж. точка 28.
|
|
ОПИСАНИЕ НА МЕТОДА
Животински видове за изпитването
|
22.
|
За изпитването могат да се използват няколко вида водни олигохети. Най-често използваните видове са изброени в допълнение 6.
|
|
23.
|
Изпитвания за токсичност (96 h, само във вода) следва да се извършват на редовни интервали (например всеки месец) с референтно токсично вещество като калиев хлорид (KCl) или меден сулфат (CuSO4) (1) за доказване на здравословното състояние на изследваните животни (1) (6). Ако референтните токсикологични изпитвания не се извършват на редовни интервали от време, партидата на организми, които трябва да се използват за изпитване на биоакумулацията в седимента, трябва да се провери с помощта на референтно токсично вещество. Измерването на съдържанието на липиди може също да предостави полезна информация относно състоянието на животните.
|
Отглеждане на изпитваните организми
|
24.
|
С цел да се разполага с достатъчен брой червеи за провеждане на изпитвания за биоакумулация, може да е необходимо червеите да се държат като постоянни едновидови култури, отглеждани в лабораторни условия. За избраните за изпитване биологични видове, методите за отглеждани в лабораторни условия култури са обобщени в допълнение 6. За подробности вж. позовавания (8)(9)(10)(18)(28)(29)(30)(31)(32).
|
Апаратура
|
25.
|
Трябва внимателно да се избягва използването на материали за всички части от оборудването, които могат да разтворят или абсорбират изпитваните вещества, или да освободят други вещества и да окажат неблагоприятно въздействие върху изпитваните животни. Могат да се използват стандартни правоъгълни или цилиндрични камери, изработени от химически инертен материал и с подходящ капацитет в зависимост от степента на зареждане, т.е., на броя на изпитваните червеи. Използването на тръби от мека пластмаса за подаване на вода или въздух следва да се избягва. За оборудването, което влиза в контакт с изпитвателната среда, следва да се използват политетрафлуороетилен, неръждаема стомана и/или стъкло. За вещества с висок коефициент на адсорбция, като синтетични пиретроиди например, може да се наложи използването на силанизирани стъкла. В такива ситуации оборудването трябва да се изхвърли след употреба (5). За изотопно белязани изпитвани вещества и за летливи вещества се полагат грижи да се избегне отстраняването и изпускането на отстраненото изпитвано вещество. Следва да се използват уловители (напр. стъклени бутилки за промиване на газове), които съдържат подходящи абсорбенти за задържане на остатъците, изпаряващи се от изпитвателните камери.
|
Вода
|
26.
|
Водата над седимента трябва да има качество, което да позволява преживяването на избраните изпитвани видове за периодите на аклиматизация и изпитване, без те да показват необичаен външен вид или поведение. Водата, възстановена съгласно метод за изпитване В.1 (25), се препоръчва за използване като вода над седимента при изпитванията, както и в лабораторните култури от червеи. Доказано е, че няколко изпитвани вида могат да преживеят, нарастват и се размножават в този вид вода (8), и е предоставено максимално стандартизиране на условията на изпитване и отглеждане. Водата трябва да се характеризира поне чрез pH, проводимост и твърдост. Анализът на водата за микрозамърсители преди нейната употреба би могъл да предостави полезна информация (допълнение 4).
|
|
27.
|
Водата трябва да има постоянно качество по време на целия период на изпитването. Стойността на рН на водата над седимента следва да бъде между 6 и 9. Общата твърдост следва да е между 90 и 400 mg/l калциев карбонат (CaCO3) в началото на изпитването (7). Диапазоните на рН и твърдостта в споменатата възстановена вода са дадени в метод за изпитване В.1 (25). Ако се предполага взаимодействие между отговорните за твърдостта йони и изпитваното вещество, следва да се използва вода с по-ниска твърдост. В допълнение 4 са обобщени допълнителните критерии за вода, приемлива за използване за разреждане в съответствие с насоки ОИСР № 210 (34).
|
Седимент
|
28.
|
Седиментът трябва да е с качество, което да позволява преживяването и, за предпочитане, размножаването на изпитваните организми по време на периодите на аклиматизация и изпитване, без те да показват необичаен външен вид или поведение. Червеите трябва да се заравят в седимента. Поведението на червеите във връзка със заравянето може да окаже влияние върху експозицията, а оттам и върху BAF. Поради това избягването на седимента или поведението на червеите по отношение на заравянето следва да се записват, когато мътността на водата над седимента позволява такива наблюдения. Червеите (контролни и третирани) трябва да се заравят в седимента в срок от 24 h след добавянето в съдовете за изпитване. Ако се наблюдава постоянно незаравяне или избягване на седимента (напр. повече от 20 % за повече от половината от фазата на поглъщане), това означава, че условията на изпитването не са подходящи или че изпитваните организми не са здрави, или че концентрацията на изпитваното вещество води до това поведение. В такъв случай изпитването трябва да се прекрати и повтори при подобрени условия. Допълнителна информация за поглъщане на седимент може да бъде получена чрез използването на методи, описани в (35)(36), в които се уточняват поглъщането на седимент или изборът на частици при изпитваните организми. Наличието или отсъствието, ако се наблюдава такова, на фекални пелети по повърхността на седимента, които показват поглъщане на седимент от червеите, следва да бъдат записвани и вземани предвид при интерпретирането на резултатите от изпитването по отношение на пътищата на експозиция.
|
|
29.
|
Изкуствен седимент въз основа на изкуствената почва, описана в метод за изпитване В.8 (40), се препоръчва за употреба както в изпитванията, така и в лабораторните култури от червеи (допълнение 5), тъй като естествени седименти с подходящо качество може да не са налични през цялата година. В допълнение, местни организми, както и евентуалното наличие на микрозамърсители в естествени седименти, могат да повлияят на изпитването. Някои изпитвани биологични видове могат да преживеят, нарастват и се размножават в изкуствен седимент (8).
|
|
30.
|
Изкуственият седимент следва да бъде характеризиран най-малко по отношение на произхода на съставките, механичния състав (процент на пясък, прах и глина), общото съдържание на органичен въглерод (ТОС), съдържанието на вода и pH. Измерването на редокси потенциала е по избор. Естествени седименти от незамърсени места обаче могат да бъдат използвани като седимент за изпитванията или за отглеждане (1). Естествените седименти следва да бъдат характеризирани най-малко по отношение на произхода им (място, от което са взети), рН и амоняк във водата между частиците на седимента, съдържанието на органичен въглерод (TOC), механичния състав (процент на пясък, прах и глина) и процента на съдържание на вода (6). Препоръчва се, преди добавянето на изпитваното вещество, естественият седимент да бъде аклиматизиран в продължение на седем дни при същите условия, които ще преобладават при последващото провеждане на изпитване, ако се очаква изменение в стойностите на амоняка. В края на този период за аклиматизация водата над седимента следва да се отстрани и изхвърли. Полезна информация преди използването на седимент може да се получи от анализа на седимента или на компонентите му за микрозамърсители.
|
Приготвяне
|
31.
|
Боравенето с естествени седименти преди употребата им в лабораториите е описано в (1), (6) и (44). Приготвянето на изкуствен седимент е описано в допълнение 5.
|
Съхранение
|
32.
|
Съхранението на естествените седименти в лабораторията следва да бъде възможно най-кратко. EPA на САЩ (6) препоръчва максимален срок на съхранение от 8 седмици при 4 ± 2 °C на тъмно. Не следва да има свободно пространство над седимента в съдовете за съхранение. Препоръки за съхранение на изкуствен седимент са дадени в допълнение 5.
|
Прилагане на изпитваното вещество
|
33.
|
Към седимента се добавя изпитваното вещество. Процедурата за добавяне, включва покриване на една или повече от съставките на седимента с изпитваното вещество. Например, кварцовият пясък, или част от него (напр. 10 g кварцов пясък за всеки съд за изпитване), може да бъде накиснат в разтвор на изпитваното вещество в подходящ органичен разтворител, който след това бавно се изпарява до изсушаване. След това така нанесената фракция се смесва с влажния седимент. Количеството пясък, добавен чрез сместа изпитвано вещество—пясък, трябва да се вземе предвид при приготвянето на седимента, т.е. седиментът трябва следователно да се приготвя с по-малко количество пясък (6).
|
|
34.
|
При естествен седимент изпитваното вещество може да се прибави чрез добавяне в изсушена част от седимента, както е описано по-горе за изкуствения седимент, или чрез размесване на изпитваното вещество във влажния седимент с последващо изпаряване на евентуалното използвано средство за повишаване на разтворимостта. Подходящи разтворители за добавяне към влажен седимент са етанол, метанол, монометилов етер на етиленгликол, диметилов етер на етиленгликол, диметилформамид и триетиленгликол (5)(34). Токсичността и летливостта на разтворителя, а също и разтворимостта на изпитваното вещество в избрания разтворител следва да са главните критерии за избор на подходящо средство за повишаване на разтворимостта. Допълнителни насоки относно процедурите за добавяне се съдържат в „Environment Canada (1995)“ (41). Трябва да се внимава изпитваното вещество, добавено към седимента, да бъде старателно и равномерно разпределено в рамките на седимента. Повторните подпроби от седимент с добавка следва да бъдат анализирани, за да се проверят концентрациите на изпитваното вещество в седимента и да се определи степента на хомогенност на разпределението на изпитваното вещество.
|
|
35.
|
След като е приготвен седиментът с добавка, заедно с водата над седимента, желателно е да се даде възможност изпитваното вещество да се разпредели между седимента и течната фаза. За препоръчване е това да стане при температурата и аерирането, използвани при изпитването. Подходящото време за установяване на равновесие зависи от седимента и веществото и може да варира от няколко часа до дни, дори до няколко (4—5) седмици в редки случаи (28)(42). В това изпитване не се чака до достигане на равновесие, но се препоръчва период за достигане на равновесие от 48 часа до 7 дни. В зависимост от целта на изследването, например когато трябва да се симулират условията в околната среда, седиментът с добавката може да се остави за по-дълъг период с оглед достигане на равновесие или зреене (11).
|
ПРОВЕЖДАНЕ НА ИЗПИТВАНЕТО
Предварително изпитване
|
36.
|
Може да е полезно да се извърши предварителен опит с цел да се оптимизират условията на изпитване при окончателното изпитване, например избор на концентрация(и) на изпитваното вещество и продължителност на фазите на поглъщане и елиминиране. Поведението на червеите, например избягването на седимента (т.е., червеите напускат седимента), което може да се дължи на изпитваното вещество и/или на седимента, следва да се наблюдава и записва по време на предварителното изпитване. Избягването на седимента може също да бъде използвана като сублетален параметър в предварително изпитване за оценка на концентрация(и) на изпитваното вещество, които да се използват при изпитване за биоакумулация.
|
Условия на експозиция
Продължителност на фазата на поглъщане
|
37.
|
Изпитваните организми се излагат на въздействието на изпитваното вещество по време на фазата на поглъщане. Първата проба следва да се вземе от 4 до 24 часа след началото на фазата на поглъщане. Фазата на поглъщане следва да се провежда до 28 дни (1)(6)(11), освен ако може да се докаже, че равновесието е постигнато по-рано. Стационарното състояние е достигнато, когато: i) кривата на коефициентите на биоакумулация през всеки период на пробовземане като функция на времето стане успоредна на оста на времето; ii) три последователни анализа на BAF, извършени върху проби, взети на интервали от най-малко два дни, варират с не повече от ± 20 % един от друг; и iii) не съществуват значими разлики между трите периода на вземане на проби (въз основа на статистически сравнения, напр. дисперсионен анализ и регресионен анализ). Ако стационарното състояние не се постигне за 28 дни, фазата на поглъщането може да бъде преустановена чрез започване на фазата на елиминиране, и BAFK може да се изчисли въз основа на константите на скоростта на поглъщане и елиминиране (вж. също точки 16-18).
|
Продължителност на фазата на елиминиране
|
38.
|
Първата проба следва да се вземе от 4 до 24 часа след началото на фазата на елиминиране, тъй като през началния период могат да възникнат бързи промени в тъканните остатъци. Препоръчва се фазата на елиминиране да се прекрати или когато концентрацията на изпитваното вещество стане по-малко от 10 % от концентрацията в стационарно състояние, или след максимален срок от 10 дни. Нивото на остатъците в червеите в края на фазата на елиминиране се протоколира като вторична крайна точка. Периодът може обаче да се регулира чрез периода, през който концентрацията на изпитваното вещество в червеите остава над границата на откриване на метода за анализ.
|
Изпитвани организми
Брой на изпитваните червеи
|
39.
|
Броят на червеите във всяка проба трябва да предоставя маса от тъкани на червеи по такъв начин, че масата на изпитваното вещество на проба съответно в началото на фазата на поглъщане и в края на фазата на елиминиране да е значително по-висока от границата на откриване за изпитваното вещество в биологичен материал. В посочените етапи на фазите на поглъщане и елиминиране концентрацията в опитните животни обикновено е относително ниска (6) (8) (18). Тъй като индивидуалните тегла на много видове водни олигохети са много ниски (5-10 mg влажно тегло на индивид за Lumbriculus variegatus и Tubifex tubifex), червеите от дадена камера за изпитване, съдържаща повторение, могат да бъдат обединени за претеглянето и химичния анализ при изпитването. За изпитвани видове с по-високо индивидуално тегло (напр. Branchiura sowerbyi) може да се използват повторения, съдържащи един индивид, но в такива случаи броят на повторенията следва да бъде увеличен до пет на точка за пробовземане (11). Независимо това следва да се отбележи, че видът B. sowerbyi не е бил включен в кръговото изпитване (12) и следователно не се препоръчва като предпочитан биологичен вид в метода.
|
|
40.
|
Следва да бъдат използвани червеи със сходен размер (за L. variegatus вж. допълнение 6). Те трябва да идват от един и същ източник, и да бъдат полово зрели или големи животни от същия възрастов клас (вж. допълнение 6). Теглото и възрастта на животното могат да имат значимо въздействие върху стойностите на BAF (напр. поради различното съдържание на липиди и/или наличието на яйца); тези параметри следва да се записват старателно. За измерване средното влажно и средното сухо тегло подизвадка от червеи следва да се претегли преди началото на изпитването.
|
|
41.
|
При Tubifex tubifex и Lumbriculus variegatus през периода на изпитването се очаква размножение. Липсата на размножаване в изпитването за биоакумулация трябва да бъде записана и да се вземе под внимание, когато се интерпретират резултатите от изпитването.
|
Зареждане
|
42.
|
Следва да се използват високи съотношения „седимент към червеи“ и „вода към червеи“, за да се сведе до минимум намаляването на концентрацията на изпитваното вещество в седимента по време на фазата на поглъщане, и за да се избегне намаляване на концентрацията на разтворения кислород. Избраната скорост на зареждане следва също да съответства на естествено срещащи се стойности на гъстотата на популациите на избраните видове (43). Например, за Tubifex tubifex се препоръчва скорост на зареждане от 1 до 4 mg тъкан от червеи (мокро тегло) на всеки грам влажен седимент (8) (11). В позовавания (1) и (6) за L. variegatus се препоръчва скорост на зареждане ≤ 1 g сухо тегло на тъкан от червеи на 50 g органичен въглерод в седимента.
|
|
43.
|
Червеите, които трябва да се използват при дадено изпитване, се отстраняват от културата чрез пресяване на седимента от културата. Животните (полово зрели или големи червеи, които не показват признаци на неотдавнашно разкъсване) се прехвърлят в стъклени блюда (напр. блюда на Петри), съдържащи чиста вода. Ако условията на изпитването се различават от условията на отглеждане, фаза на аклиматизация от 24 h следва да е достатъчна. Преди претеглянето следва да се отстрани излишната вода от червеите. Това може да се извърши чрез внимателно поставяне на червеите върху предварително навлажнена хартия тип тишу. Не се препоръчва да се използва абсорбираща хартия за подсушаване на червеите, тъй като това може да причини стрес или увреждане на червеите. Brunson et al. (1998) препоръчва използване на червеи, при които не е приложено попиване, с биомаса, приблизително равна на 1,33 пъти целевата биомаса. Тези допълнителни 33 % съответстват на разликата между червеите, при които е приложено попиване, и тези, при които не е приложено (28).
|
|
44.
|
В началото на фазата на поглъщане (ден 0 от изпитването) изпитваните организми се отстраняват от камерата за аклиматизация и се разпределят на случаен принцип в съдове(напр. блюда на Петри), съдържащи възстановена вода, чрез добавяне на групи от по два червея във всеки съд, докато във всеки съд се съберат 10 червея. Всяка от тези групи от червеи след това се прехвърля на случаен принцип в отделни съдове за изпитване, например с помощта на меки стоманени пинсети. Съдовете, в които се извършва изпитването, впоследствие се инкубират при условията на изпитването.
|
Хранене
|
45.
|
С оглед на ниското съдържание на хранителни вещества в изкуствения седимент, седиментът трябва да бъде допълнен с източник на храна. За да не се подцени експозицията на изпитваните организми, например чрез селективно хранене с незамърсени храни, храната, необходима за размножаването и растежа на изпитваните организми, следва да бъде прибавена към седимента веднъж преди или по време на прилагането на изпитваното вещество (вж. приложение 5).
|
Съотношение седимент-вода
|
46.
|
Препоръчителното съотношение седимент-вода е 1:4 (45). Това съотношение се считат за подходящо за поддържане на подходящи нива на концентрацията на кислород, и с оглед избягване на натрупването на амоняк във водата над седимента. Съдържанието на кислород във водата над седимента следва да се поддържа на ≥ 40 % от стойността на насищане. Водата над седимента в съдовете за изпитване следва леко да се аерира (напр. 2-4 мехурчета в секунда) с помощта на пипета „Пастьор“, разположена на приблизително 2 cm над повърхността на седимента, за да се ограничи максимално нарушаването на седимента.
|
Светлина и температура
|
47.
|
Продължителността на излагане на светлина в културата и при изпитването е 16 часа (1) (6). Светлинният интензитет в зоната на изпитването следва да се поддържа на около 500-1 000 lx. Температурата трябва да бъде 20 ± 2 °C по време на цялото изпитване.
|
Концентрации на изпитване
|
48.
|
Една изпитвана концентрация (възможно най-ниска) се използва за определяне на кинетиката на поглъщане, но може да се използва втора (по-висока) концентрация (напр. (46)). В този случай пробите се вземат и анализират в стационарно състояние или след 28 дни за потвърждаване на BAF, измерена при по-ниската концентрация (11). По-високата концентрация следва да се избере така, че неблагоприятните последици да могат да бъдат изключени (например чрез избирането на приблизително 1 % от най-ниската известна концентрация с хронично въздействие ECx, изведена при съответните изследвания за хронична токсичност). По-ниската изпитвана концентрация трябва да е значително по-висока от границата на откриване в седимент и в биологични проби за използвания метод за анализ. Ако ефективната концентрация на изпитваното вещество е близка до границата на откриване за използвания метод за анализ, препоръчва се използването на изотопно белязано изпитвано вещество с висока специфична радиоактивност.
|
Третирани и контролни повторения
|
49.
|
Минималният брой на третираните повторения за измервания на кинетиката следва да бъде три на точка за пробовземане (11) по време на фазите на поглъщане и на елиминиране. Следва да се използват допълнителни повторения, напр. за незадължителни допълнителни дати за вземане на проби. За фазата на елиминиране се приготвя съответен брой повторения със седимент, в който не е добавено изпитвано вещество, и с вода над седимента, така че третираните червеи да могат да бъдат прехвърлени от определените съдове с третиране в съдове без третиране в края на фазата на поглъщане. Общият брой на третираните повторения трябва да бъде достатъчен както за фазата на поглъщане, така и за фазата на елиминиране.
|
|
50.
|
Като алтернатива, червеите, определени за вземане на проби по време на фазата на елиминирането, могат да бъде експонирани в един голям контейнер, който съдържа седимент с добавено изпитвано вещество от същата партида, която е използвана за кинетиката на усвояването. Трябва да се докаже, че условията за изпитването (напр. дълбочина на седимента, съотношение седимент-вода, зареждане, температура, качество на водата), са сравними с тези в повторенията, определени за фазата на поглъщане. В края на фазата на поглъщане водата, седиментът и пробите с червеи следва да бъдат взети от този контейнер за анализ, и достатъчно на брой големи червеи, които не показват никакви признаци на неотдавнашно разкъсване, трябва да се отстранят внимателно и да се прехвърлят към повторенията, подготвени за фазата на елиминиране (напр. десет организма за един съд с повторение).
|
|
51.
|
Ако се използва разтворител, различен от вода, за биологичен анализ и за анализ на фона следва да бъдат приготвени поне 9 повторения с отрицателни контроли (най-малко 3 пробовзети в началото, 3 в края на фазата на поглъщане и 3 в края на фазата на елиминиране). Ако за прилагането на изпитваното вещество е използвано някакво средство за повишаване на разтворимостта, следва да бъде проведено изпитване на контрола на разтворител (най-малко 3 повторения се пробовземат в началото, 3 в края на фазата на поглъщане и 3 в края на фазата на елиминиране). В този случай най-малко 4 повторения с отрицателна контрола (без разтворител) следва да бъдат приготвени за вземане на проби в края на фазата на поглъщане. Тези повторения може да се сравнят биологично с контролата на разтворител, за да се добие информация за възможното влияние на разтворителя върху изпитваните организми. По-подробна информация е посочена в допълнение 3.
|
Честота на измерванията на качеството на водата
|
52.
|
Като минимум трябва да се измерят следните параметри за качество на водата във водата над седимента по време на фазата на поглъщане и на елиминиране:
|
Температура
|
в един съд от всяко ниво на третиране на всяка дата на пробовземане и в един съд с контрола веднъж седмично и в началото и в края на периодите на поглъщане и на елиминиране; температурата на заобикалящата среда (въздух от околната среда или водна баня) или в представителен съд за изпитване може също така да бъде записвана, например непрекъснато или на интервали от един час;
|
|
Съдържание на разтворения кислород
|
в един съд на всяко ниво на третиране, и в един съд с контрола на всяка дата на пробовземане; изразен като mg/l и % ASV (стойност на насищане при равновесие с атмосферния въздух);
|
|
Подаване на въздух
|
контролирано поне веднъж на ден (работни дни) и коригирано, ако е необходимо;
|
|
pH
|
в един съд с третиране от всяко ниво на третиране на всяка дата на пробовземане и в един съд с контрола веднъж седмично и в началото и в края на периодите на поглъщане и на елиминиране;
|
|
Обща твърдост на водата
|
поне в един съд с третиране и в един съд с контрола в началото и в края на периодите на поглъщане и на елиминиране, изразена като mg/l CaCO3;
|
|
Общо съдържание на амоняк
|
поне в един съд с третиране и в един съд с контрола в началото и в края на периодите на поглъщане и на елиминиране; изразено като mg/l NH4
+ или NH3 или общо азот от амоняк.
|
|
Пробовземане и анализ на червеи, седимент и вода
График за пробовземане
|
53.
|
В допълнение 3 са дадени примери за графици за вземане на проби при фаза на поглъщане с продължителност 28 дни и при фаза на елиминиране с продължителност 10 дни.
|
|
54.
|
Пробовзема се от водата и седимента от изпитвателните камери за определяне на концентрацията на изпитваното вещество преди добавянето на червеите и по време както на фазата на поглъщане, така и на фазата на елиминиране. По време на изпитването концентрациите на изпитваното вещество се определят в червеите, седимента и водата, за да може да се наблюдава разпределението на изпитваното вещество в подразделенията на изпитваната система.
|
|
55.
|
Пробовзема се от червеите, седимента и водата най-малко шест пъти по време на фазата на поглъщане, както и на фазата на елиминиране.
|
|
56.
|
Пробовземането продължава до достигане на плато (стационарно състояние) (вж. допълнение 1) или в продължение на 28 дни. Ако платото не е достигнато в рамките на 28 дни, започва се фазата на елиминиране. При започването на фазата на елиминиране определените червеи се прехвърлят в камери с повторения, съдържащи нетретирани седимент и вода (вж. също точки 17 и 18).
|
Пробовземане и приготвяне на пробите
|
57.
|
Пробите на водата се получават чрез декантиране, изпомпване или пипетиране на обем, достатъчен за измерване на количеството на изпитваното вещество в пробата.
|
|
58.
|
Останалата над седимента вода внимателно се декантира или изпомпва от изпитвателната камера (или камери). Пробите от седимента трябва да се вземат внимателно, така че да се причинява минимално смущаване на червеите.
|
|
59.
|
По време на пробовземане всички червеи се отстраняват от изпитваното повторение, напр. чрез суспендиране на седимента с водата над него и разпростиране на съдържанието на всяко повторение в плитка табла и хващане на червеите с помощта на меки стоманени пинсети. Те се изплакват за кратко време с вода в плитка стъклена или стоманена табла. Излишната вода се отстранява. Червеите внимателно се прехвърлят в предварително претеглен съд и се претеглят. Червеите се умъртвяват чрез замразяване (напр. ≤ – 18 °C). Наличието и броят на пашкулите и/или ювенилните екземпляри трябва да бъдат записани.
|
|
60.
|
Като цяло, червеите следва да се претеглят и умъртвяват непосредствено след пробовземането и се изваждат веднага след вземането на пробата без фаза на изхвърляне на чревното съдържимо, за да се получи консервативна стойност за BAF, която включва контаминирано чревно съдържание, и за да се избегне загубата на остатъци в организма по време на всяко изхвърляне на чревното съдържимо само във вода (8). Вещества с log Kow над 5 не се очаква да бъдат елиминирани в значима степен през никой от периодите на изхвърляне на чревното съдържимо само във вода, докато вещества със стойност на log Kow по-ниска от 4 могат да се загубят в забележими количества (47).
|
|
61.
|
По време на фазата на елиминиране червеите изхвърлят чревното съдържимо в чист седимент. Това означава, че измерванията непосредствено преди фазата на елиминиране включват контаминиран с чревното съдържимо седимент, докато след първите 4-24 h от фазата на елиминиране се допуска, че по-голямата част от съдържанието, контаминирано с чревно съдържимо, е заменено с чист седимент (11) (47). Концентрацията в червеите от тази проба тогава може да се смята за концентрация в тъканите след изхвърляне на чревното съдържимо. За да се вземе предвид разреждането на концентрацията на изпитваното вещество от незамърсен седимент по време на фазата на елиминиране, теглото на чревното съдържимо може да се оцени от съотношенията мокро тегло/тегло на пепелта на червеите или сухо тегло/тегло на пепелта на червеите.
|
|
62.
|
Ако целта на конкретно проучване е измерването на бионаличността и действителните тъканни остатъци в изпитваните организми, то поне подпроба от третирани животни (напр. от три допълнителни съда за повторения), за предпочитане пробовзети при достигнато стационарно състояние, трябва да бъдат претеглени, оставени да изхвърлят чревното съдържимо в чиста вода за период от 6 часа (47), и претеглени отново преди извършването на анализа. След това данните за теглото на червеите и концентрацията в тялото при тази подпроба могат да бъдат сравнени със стойностите, получени от червеи, които не са били оставени да изхвърлят чревното съдържимо. Червеите, определени за измерване на елиминирането, не трябва да се оставят да изхвърлят чревното съдържимо преди прехвърлянето в чист седимент, с оглед свеждане до минимум на допълнителния стрес за животните.
|
|
63.
|
Желателно е водата, седиментът и пробите с червеи да се анализират незабавно (т.е., в рамките на 1—2 дни) след отстраняването, с цел да се избегне разграждане или други загуби, и да се изчислят приблизителните скорости на поглъщане и елиминиране, докато продължава изпитването. Незабавните анализи също така избягват закъснението при определяне на достигането на плато.
|
|
64.
|
Ако не се извършат незабавни анализи, пробите следва да се съхраняват при подходящи условия. Информация относно стабилността и правилните условия за съхранение на конкретното изпитвано вещество се получава преди започването на изследването (напр. продължителност и температура на съхранение, процедури за екстракция и др.). Ако такава информация не е налична и е преценена за необходима, едновременно могат да бъдат проведени опити с контролни тъкани с добавка за определяне на стабилността при съхранение.
|
Качество на метода за анализ
|
65.
|
Понеже цялата процедура се обуславя по същество от точността, прецизността и чувствителността на метода за анализ, използван за изпитваното вещество, следва да се провери опитно дали прецизността и възпроизводимостта на химичния анализ, както и на аналитичния добив на изпитваното вещество от водата, седимента и пробите от червеите са задоволителни за конкретния метод. Следва да се провери също така дали изпитваното вещество не е откриваемо в камерите с контролите в концентрации, които са по-високи от фоновите. Ако е необходимо, стойностите на Cw, Cs и Ca се коригират със стойностите на аналитичния добив и фоновите стойности в контролите. По време на изпитването с всички проби следва да се борави по начин, който намалява до минимум замърсяването и загубите (които напр. могат да се получат при адсорбция на изпитваното вещество от устройството за пробовземане).
|
|
66.
|
Общият аналитичен добив и аналитичният добив на изпитваното вещество от червеите, седимента, водата, и ако са използвани, от уловителите, съдържащи абсорбенти за улавяне на изпареното изпитвано вещество, следва да се запишат и протоколират.
|
|
67.
|
Тъй като използването на изотопно белязани вещества се препоръчва, може да се анализира общата радиоактивност (т.е., базово вещество и продукти от разграждането му). Ако обаче е осъществимо при анализа, количественото определяне на базовото вещество и на продуктите от разграждането му в стационарно състояние или в края на фазата на поглъщането, може да предостави важна информация. Ако се възнамерява извършване на такива измервания, след това пробите трябва да бъдат подложени на подходящи процедури за екстракция, така че базовото вещество да може да бъде количествено определено отделно. Когато бъде открит продукт от разграждане, представляващ значим процент (напр. > 10 %) от радиоактивността, измервана в изпитваните организми при стационарно състояние или в края на фазата на поглъщане, препоръчва се този продукт от разграждане да бъде идентифициран (5).
|
|
68.
|
Поради ниската стойност на индивидуалната биомаса, често не е възможно да се определи концентрацията на изпитваното вещество във всеки отделен червей, освен в случаите, когато като вид за изпитване се използва Branchiura sowerbyi (40-50 mg мокро тегло на червей) (11). Поради това обединяването на индивиди, пробовзети от даден изпитвателен съд, се допуска, но това ограничава статистическите процедури, които могат да се приложат към данните. Ако дадена специфична статистическа процедура и мощност представляват важни съображения, тогава в изпитването следва да се включат достатъчен брой изпитвани животни и/или изпитвателни камери с повторения, които да съответстват на желаните обединяване, процедура и мощност (6)(7).
|
|
69.
|
Препоръчва се BAF да се изразява като функция както от общото мокро тегло, така и от общото сухо тегло и, когато се изисква (т.е., за силно липофилни вещества), като функция от съдържанието на липиди и на TOC в седимента. За определянето на съдържанието на липиди следва да се използват подходящи методи (48)(49). Техниката за екстракция с хлороформ/метанол (50) може да се препоръча като стандартен метод (48). За да се избегне употребата на хлорирани разтворители обаче, може да се използва изпитана при кръгово изпитване модификация на метода на Bligh и Dyer (50), описана в (51). Тъй като различните методи не дават идентични стойности (48), важно е да се дадат подробности за използвания метод. Когато е възможно, т.е., ако е налице достатъчно тъкан от червеи, съдържанието на липиди се измерва в същата проба или същия екстракт като използвания за анализа за изпитваното вещество, понеже липидите често трябва да се отстраняват от екстракта, преди той да бъде анализиран хроматографски (5). Независимо от това е практично да се използват аклиматизирани контролни животни най-малко в началото или — за предпочитане — в края на фазата на поглъщане, за измерване на съдържанието на липиди, например в три проби.
|
ДАННИ И ПРОТОКОЛИРАНЕ
Обработка на резултатите
|
70.
|
Кривата на поглъщането на изпитваното вещество се получава чрез начертаване върху аритметична скала на неговата концентрация във/върху червеите във фазата на поглъщането спрямо времето. Ако кривата достигне до плато, следва да се изчисли стационарно състояние BAFss:

|
|
71.
|
Определя се кинетичният коефициент на биоакумулация (BAFK) като съотношението ks/ke. Константата на скоростта на елиминиране (ke) обикновено се определя чрез кривата на елиминиране (т.е., графика на концентрацията на изпитваното вещество в червеите по време на фазата на елиминирането). След това константата на скоростта на поглъщане ks се изчислява от кинетиката на кривата на поглъщането. Предпочитаният метод за получаване на BAFK и константите за скорост ks и ke, е да се използват нелинейни методи за оценка на параметри с помощта на компютър (виж допълнение 2). Ако е очевидно, че към елиминирането не може да се приложи кинетика от първи порядък, следва да се използват по-сложни модели (25)(27)(52).
|
|
72.
|
Коефициентът на акумулация биота-седимент (BSAF) се определя чрез нормализиране на BAFK за липидното съдържание на червеите и общото съдържание на органичен въглерод на седимента.
|
Интерпретиране на резултатите
|
73.
|
Резултатите трябва да се интерпретират с внимание, когато измерените концентрации на изпитване са на равнища, близки до границата на откриване на използвания метод за анализ.
|
|
74.
|
Ясно определените криви на поглъщане и на елиминиране са показател за данни за биоакумулацията, които са с добро качество. Обикновено доверителните граници за стойностите на BAF при добре планирани проучвания не трябва да надвишават 25 % (5).
|
Протокол от изпитването
|
75.
|
Протоколът от изпитването трябва да включва следната информация:
|
|
Изпитвано вещество
|
—
|
физична природа и физични и химични свойства — напр. log Kow, разтворимост във вода;
|
|
—
|
данни за неговата химична идентификация; източник на изпитваното вещество, идентичност и концентрация на използвания разтворител, ако има такъв;
|
|
—
|
ако е изотопно белязано — точно положение на белязаните атом, специфичната радиоактивност и процентът на радиоактивността, свързан с онечистванията.
|
|
|
|
Животински видове за изпитването
|
—
|
научно наименование, щам, източник, всякаква предварителна обработка, аклиматизация, възраст, размах на размерите и т.н.
|
|
|
|
Условия на изпитването
|
—
|
използвана процедура на изпитване (напр. статична, полустатична или проточна);
|
|
—
|
тип и характеристики на използваното осветление и фотопериода(ите),
|
|
—
|
планиране на изпитването (например брой, материал и размер на камерите за изпитване, обем на водата, маса и обем на седимента, скорост на подмяна на обема вода (за проточна или полустатична процедури), всякакво аериране, използвано преди и по време на изпитването, брой на повторенията, брой червеи на повторение, брой на концентрациите на изпитване, продължителност на фазите на поглъщане и на елиминиране, честота на пробовземането);
|
|
—
|
метод за приготвяне на изпитваното вещество и метод за прилагането му, както и обосновка за избора на конкретен метод;
|
|
—
|
номиналните концентрации на изпитване;
|
|
—
|
източник на съставките на изкуствената вода и седимент или — ако е използвана естествена среда — произход на водата и седимента, описание на предварителната подготовка, резултати от всички доказателства за способността на изпитваните животни за живот и/или размножаване в използваната среда, характеристики на седимента (рН и амоняк във водата между частиците на седимента (естествени седименти), съдържание на органичен въглерод (TOC), зърнометричен състав (процент на пясък, прах и глина) и процент на съдържание на вода, и всички други извършени измервания), и характеристики на водата (рН, твърдост, проводимост, температура, концентрация на разтворен кислород, остатъчни нива на хлор (ако се измерват) и всички други направени измервания);
|
|
—
|
номиналното и измереното сухо тегло в % от мокрото тегло (или съотношение сухо тегло към мокро тегло) на изкуствения седимент; измереното сухо тегло в % от мокрото тегло (или съотношение сухо тегло към мокро тегло) на седименти в полеви условия;
|
|
—
|
качество на водата в камерите за изпитване, характеризирано чрез температура, pH, твърдост, амониеви йони, обща твърдост и концентрация на разтворен кислород;
|
|
—
|
подробна информация за третирането на пробите от водата, седимента и червеите, включително подробности за приготвяне, съхранение, процедури на добавяне, екстракция и процедури за анализ (и прецизност) за изпитваното вещество и съдържанието на липиди, както и аналитичен добив на изпитваното вещество.
|
|
|
|
Резултати
|
—
|
смъртност на контролните червеи и на червеите във всяка изпитвателна камера и всякакви наблюдавани сублетални ефекти, включително необичайно поведение (напр. избягване на седимента, наличие или липса на фекални пелети, липса на размножаване);
|
|
—
|
измереното сухо тегло в % от мокрото тегло (или съотношение сухо тегло към мокро тегло) на седимента и изпитваните организми (полезно за нормализацията);
|
|
—
|
съдържанието на липиди в червеите;
|
|
—
|
криви, показващи кинетиката на поглъщане и елиминиране на изпитваното вещество в червеите, както и времето за достигане до стационарно състояние;
|
|
—
|
Ca, Cs и Cw (със стандартно отклонение и размах, ако е уместно) за всички времена на вземане на проби (Ca изразено в g kg– 1 мокро и сухо тегло на цялото тяло, Cs изразено в g kg– 1 мокро и сухо тегло на седимента, и Cw в mg l– 1). Ако се изисква коефициент на акумулация биота-седимент (BSAF; вж. допълнение 1 за определение) (напр. за сравняване на резултатите от две или повече изпитвания, проведени с животни с различно съдържание на липиди), Ca може допълнително да се изрази като g kg– 1 липидно съдържание на организма, а Cs може да се изрази като g kg– 1 органичен въглерод (ОС) на седимента;
|
|
—
|
BAF (изразено в kg мокро тегло на седимент kg– 1 мокро тегло на червеи), константа на скоростта на поглъщане от седимента ks (изразена в g мокро тегло на седимент g– 1 мокро тегло на червеи d– 1), и константа на скоростта на елиминиране ke (изразена в d– 1); BSAF (изразен в kg OC в седимент kg– 1 липидно съдържание на червеите) може да се протоколира допълнително;
|
|
—
|
Неелиминирани остатъци (NER) в края на фазата на елиминиране;
|
|
—
|
ако е измервано: проценти на базовото вещество, продукти от разграждането и свързани остатъци (т.е., процентът от изпитваното вещество, който не може да бъде екстрахиран с помощта на обичайните методи за екстракция), открити в изпитваните животни;
|
|
—
|
Методи, използвани за статистически анализи на данните.
|
|
|
|
Оценка на резултатите
|
—
|
съответствие на резултатите с критериите за валидност, изброени в точка 21;
|
|
—
|
неочаквани или необичайни резултати, напр. непълно елиминиране на изпитваното вещество от изпитваните животни; в такива случаи резултатите от всички предварителни проучвания могат да предоставят полезна информация.
|
|
|
Допълнение 1
Определения и мерни единици
|
|
Изкуствен седимент или формулиран, възстановен или синтетичен седимент, е смес от материали, използвани за симулиране на физичните съставки на естествения седимент.
|
|
|
Биоакумулация е увеличаването на концентрацията на изпитваното вещество във или върху организъм, отнесено към концентрацията на изпитваното вещество в заобикалящата среда. Биоакумулацията настъпва в резултат на процесите на биоконцентрация и биомагнификация (вж. по-долу).
|
|
|
Коефициент на биоакумулация (BAF) по всяко време във фазата на поглъщане в настоящото изпитване за биоакумулация е концентрацията на изпитваното вещество във/върху изпитвания организъм (Ca в g kg– 1 мокро или сухо тегло), разделена на концентрацията на веществото в заобикалящата среда (Cs като g kg– 1 мокро или сухо тегло на седимент); За съответствие с мерните единици на Ca и Cs, BAF се измерва в kg седимент kg– 1 червеи (15).
|
|
|
Коефициентите на биоакумулация, изчислявани директно от съотношението, изразено чрез константата на скоростта на поглъщане от седимента, разделена на константите на скоростта на елиминиране (съответно ks и ke, вж. по-долу), се наричат кинетичен коефициент на биоакумулация (BAFK).
|
|
|
Биоконцентрация е увеличаването на концентрацията на изпитваното вещество във или върху организъм, което настъпва изцяло в резултат от поглъщане чрез повърхността на тялото, отнесено към концентрацията на изпитваното вещество в заобикалящата среда.
|
|
|
Биомагнификация е увеличаването на концентрацията на изпитваното вещество във или върху организъм, което настъпва в резултат главно на поглъщане от замърсени храна или плячка, отнесено към концентрацията на изпитваното вещество в храната или плячката. Биомагнификацията може да доведе до пренос или акумулация на изпитваното вещество в хранителните мрежи.
|
|
|
Коефициент на акумулация биота-седимент (BSAF) е нормализираната по отношение на липидите концентрация на изпитваното вещество във/върху изпитвания организъм при достигнато стационарно състояние, разделена на нормализираната по отношение на органичния въглерод концентрация на веществото в седимента при достигнато стационарно състояние. Ca се изразява в g kg– 1 липидно съдържание на организма, а Cs като g kg– 1 органично съдържание на седимента;
|
|
|
Периодът на кондициониране се използва за стабилизиране на микробния компонент на седимента и за отстраняване, например, на амоняка с произход от компоненти на седимента; той предшества добавянето на изпитваното вещество към седимента. Обикновено след кондиционирането водата над седимента се изхвърля.
|
|
|
Елиминиране на изпитваното вещество е загубата на това вещество от тъканите на изпитвания организъм благодарение на активни или пасивни процеси, което се получава независимо от наличието или липсата на изпитваното вещество в заобикалящата среда.
|
|
|
Фаза на елиминиране е времето, което следва след прехвърлянето на изпитваните организми от замърсена среда в среда, несъдържаща изпитваното вещество, през което време се изследва елиминирането (или нетната загуба) на веществото от изпитваните организми.
|
|
|
Константата на скоростта на елиминиране (ke) е числена стойност, определяща скоростта на намаляване на концентрацията на изпитваното вещество във/върху изпитвания организъм, настъпващо след прехвърлянето на изпитваните организми от среда, съдържаща изпитваното вещество, в среда, несъдържаща веществото. ke се изразява в d– 1.
|
|
|
Периодът за достигане на равновесие се използва, за да се даде възможност за разпределение на изпитваното вещество между твърдата фаза, водата между частиците на седимента и водата над седимента; той следва добавянето на изпитваното вещество към седимента и предшества добавянето на изпитваните организми.
|
|
|
Коефициентът на разпределение октанол-вода (Kow) е съотношението на разтворимостта на веществото в n-октанол и вода при достигнато равновесие, понякога изразяван също като Pow. Логаритъмът от Kow (log Kow) се използва като указание на потенциала на веществото за биоакумулация във водни организми.
|
|
|
Коефициент на разпределение органичен въглерод-вода (Koc) е съотношението между концентрацията на веществото във/върху съдържащата органичен въглерод част от седимента и концентрацията на веществото във вода при достигнато равновесие.
|
|
|
Вода над седимента е водата, намираща се над седимента в съда за изпитване.
|
|
|
Състояние на плато или стационарно състояние се определя като състояние на равновесие между процесите на поглъщане и елиминиране, които протичат едновременно по време на фазата на експозиция. Стационарното състояние е достигнато в графиката на BAF във всеки период на пробовземане като функция от времето, когато кривата стане успоредна на оста на времето и три последователни анализа на BAF върху проби, взети на интервали от най-малко два дни, не се различават с повече от 20 % един от друг, и няма статистически значима разлика между трите периода на вземане на проби. За изпитвани вещества, които се поглъщат бавно, е по-подходящо интервалите да бъдат по седем дни (5).
|
|
|
Вода между частиците на седимента или интерстициална вода е водата, която заема пространството между частиците на седимента или на почвата.
|
|
|
Константата на скоростта на поглъщане от седимента (ks) е числена стойност, определяща скоростта на нарастване на концентрацията на изпитваното вещество във/върху изпитвания организъм, настъпващо в резултат на поглъщане от фазата на седимента. ks се изразява в g седимент kg-1 червеи d-1.
|
|
|
Седимент с добавка е седимент, към който е добавено изпитваното вещество.
|
|
|
Коефициент на биоакумулация в стационарно състояние (BCFSS) е BAF при достигнато стационарно състояние и не се променя значимо за дълъг период от време, като концентрацията на изпитваното вещество в заобикалящата среда (Cs като g kg– 1 мокро или сухо тегло на седимента) през този период е константа.
|
|
|
Фазата на поглъщане или експозиция е времето, през което изпитваните организми са експонирани на изпитваното вещество.
|
Допълнение 2
Изчисляване на параметрите на поглъщане и елиминиране
Основната крайна точка на изпитването за биоакумулация е коефициентът на биоакумулация, BAF. Измереният BAF може да се изчисли като се раздели концентрацията на изпитваното вещество в опитния организъм, Ca, на концентрацията на изпитваното вещество в седимента, Cs, при стационарно състояние. Ако по време на фазата на поглъщане не е достигнато стационарно състояние, BAF се изчислява по същия начин за ден 28. Следва обаче да се отбележи дали BAF се основава на концентрациите при стационарно състояние, или не.
Предпочитаният начин за получаване на кинетичния коефициент на биоакумулация (BAFK), константата на скоростта на поглъщане от седимента (ks) и константата на скоростта на елиминиране (ke) е да се използват нелинейни методи за оценка на параметри с помощта на компютър. Като се има предвид динамичният ред на средните коефициенти на акумулация (Ca, средни стойности на всяка дата на вземане на проба/Cs, средни стойности на всяка дата на вземане на проба = AF) във фазата на поглъщането, основани на мокрото тегло на червеите и седимента, и уравнението на модела
|
AF(t) = BAF × (1 – eke × t)
|
(уравнение 1)
|
където AF(t) е съотношението на концентрацията на изпитваното вещество в червеите и неговата концентрация в седимента във всеки даден момент във времето (t) от фазата на поглъщане, тези компютърни програми изчисляват стойностите на BAFK, ks и ke.
Когато е достигнато стационарно състояние по време на фазата на поглъщане (т.е., t = ∞), уравнение 1 може да се сведе до:
|

|
(уравнение 2)
|
където
|
ks
|
=
|
константа на скоростта на поглъщане в тъкани [g седимент kg– 1 червеи d– 1]
|
|
ke
|
=
|
константата на скоростта на елиминиране [d– 1]
|
Тогава ks/ke × Cs е приблизителна стойност на концентрацията на изпитваното вещество в тъканите на червеите при стационарно състояние (Ca,ss).
Коефициентът на акумулация биота-седимент (BSAF) трябва да се изчислява по следния начин:

където foc е частта органичен въглерод в седимента, а flip е частта липиди в червеите, основана или на сухото, или на мокрото тегло.
Като се има предвид даден динамичен ред от стойности на концентрацията, кинетиката на елиминирането може да се моделира, като се използват следните уравнения на модели, както и нелинеен метод за оценка на параметрите, основан на компютърни изчисления.
Измерената средна стойност на остатъци в организма в края на фазата на поглъщане се препоръчва като отправна точка по подразбиране. Стойността, изчислена по модела/оценена от фазата на поглъщане, следва да се използва само ако например измерената стойност се отклонява значимо от изчисления по модела остатък в организма. Вж. също точка 50 за алтернативни дейности преди експозицията на червеи, предназначени за фазата на елиминиране; при този подход се смята, че пробите от тези предварително експонирани червеи в ден 0 от фазата на елиминиране дават реалистични стойности на остатъка в организма за започване на кинетиката на елиминирането.
Ако графиката на данните като функция от времето сочи постоянно експоненциално намаляване на концентрацията на изпитваното вещество в животните, за описване на развитието на елиминирането във времето може да се използва модел с един компартмент (уравнение 4).
|

|
(уравнение 3)
|
Процесите на елиминиране понякога изглеждат двуфазови, с бързо намаляване на Ca през ранните фази, което в по-късните фази на елиминирането се променя към по-бавна загуба на изпитвани вещества (8)(19)(25). Двете фази могат да се тълкуват чрез допускането, че в организма има два компартмента, от които изпитваното вещество се елиминира с различна скорост. В такива случаи следва да се проучи специализираната литература, напр. (15) (16) (17) (25).
Елиминирането чрез два компартмента е описано напр. чрез следното уравнение (25):
|

|
(уравнение 4)
|
A и B представляват размерите на компартментите (в % от общия тъканен остатък), където A е компартментът с бързата загуба на вещество, а B е компартментът с бавна загуба на изпитвано вещество. Сумата от A и B е равна на 100 % от общия обем на компартментите на животното при стационарно състояние. ka и kb представляват съответните константи на елиминиране [d– 1]. Ако моделът с два компартмента бъде изгладен с данните от елиминирането, константата на скоростта на поглъщане ks може да бъде определена както следва (53) (54):
|

|
(уравнение 5)
|
Независимо от това, тези уравнения на модели следва да се използват внимателно, по-специално когато по време на изпитването се променя бионаличността на изпитваното вещество (42).
Като алтернатива на уравненията на моделите, посочени по-горе, кинетиката (ks и ke) може да се изчисли наведнъж, като се приложи моделът с кинетика от първи порядък едновременно към всички данни — към тези от фазата на поглъщане и към тези от фазата на елиминиране. За описание на метод, който може да позволи подобно комбинирано изчисляване на константите на скоростта на поглъщане и елиминиране, могат да бъдат консултирани източници (55), (56) и (57).
Неелиминираните остатъци (NER) следва да се изчисляват като вторична крайна точка чрез умножаване по 100 на отношението на средната стойност на концентрацията в червеите (Ca) в ден 10 от фазата на елиминиране и средната стойност на концентрацията в червеите (Ca) при стационарно състояние (ден 28 от фазата на поглъщане):

Допълнение 3
Примерен график за пробовземане за 28-дневно изпитване на биоакумулация
а) Фаза на поглъщане (включително 4-дневна фаза на уравновесяване)
|
Ден
|
Дейности
|
|
– 6
|
Подготовка на торфена суспензия за седимент; кондициониране на суспензията в продължение на 48 h;
|
|
– 4
|
Добавяне на седимент или фракция от седимент; смесване на всички съставки на седимента; отстраняване на пробите от третирания седимент и от седимента в контролата на разтворител, за определяне на концентрацията на изпитваното вещество; добавяне на водата над седимента; инкубиране при условията на изпитването (фаза на уравновесяване);
|
|
– 3/– 2
|
Отделяне на изпитваните организми от културата за аклиматизиране;
|
|
0
|
Измерване на качеството на водата (вж. точка 52); отстраняване на повторенията за вземане на проби от вода и седимент за определяне на концентрацията на изпитваното вещество; разпределение на червеите в изпитвателните камери на случаен принцип; отделяне на достатъчно подпроби от червеи за аналитично определяне на фоновите стойности; проверка на подаването на въздух, ако се използва затворена система;
|
|
1
|
Отстраняване на повторенията за вземане на проби; проверка на подаването на въздух, на поведението на червеите, качеството на водата (вж. точка 56); вземане на проби вода, седимент и червеи за определяне на концентрация на изпитваното вещество;
|
|
2
|
Проверка на подаването на въздух, на поведението на червеите и на стойността на температурата;
|
|
3
|
Същото като ден 1;
|
|
4 — 6
|
Същото като ден 2;
|
|
7
|
Същото като ден 1; компенсиране на загубите на вода от изпаряване, ако е необходимо;
|
|
8 — 13
|
Същото като ден 2;
|
|
14
|
Същото като ден 1; компенсиране на загубите на вода от изпаряване, ако е необходимо;
|
|
15 — 20
|
Същото като ден 2;
|
|
21
|
Същото като ден 1; компенсиране на загубите на вода от изпаряване, ако е необходимо;
|
|
22 — 27
|
Същото като ден 2;
|
|
28
|
Същото като ден 1; измерване на качеството на водата (вж. точка 52); край на фазата на поглъщане; отделяне на достатъчно количество подпроби червеи за аналитично определяне на фоновите стойности, на мокрото и сухото тегло и на съдържанието на липиди; прехвърляне на червеите от оставащите подложени на експозиция повторения в съдове с чист седимент за фазата на елиминиране (без изхвърляне на чревното съдържимо); вземане на проби от вода, седимент и червеи от контролите на разтворител. пробовземане от разтворите за улавяне, ако има такива.
|
|
|
Дейностите преди експозицията (фаза на уравновесяване) следва да се планират, като се вземат предвид свойствата на изпитваното вещество. Ако е необходимо, приготвеният седимент се кондиционира под водата над седимента при температура 20 ± 2 °C в продължение на 7 дни; в този случай — по-ранно приготвяне на седимента!
|
|
|
Дейностите, описани за ден 2, следва да се извършват ежедневно (най-малкото в работни дни).
|
б) Фаза на елиминиране
|
Ден
|
Дейности
|
|
– 6
|
Подготовка на торфена суспензия за седимент; кондициониране на суспензията в продължение на 48 h;
|
|
– 4
|
смесване на всички съставки на седимента; отстраняване на пробите от третирания седимент и от седимента в контролата на разтворител, за определяне на концентрацията на изпитваното вещество; добавяне на водата над седимента; инкубиране при условията на изпитването;
|
|
0 (ден 28 от фазата на поглъщане)
|
Измерване на качеството на водата (вж. точка 52); прехвърляне на червеите от оставащите подложени на експозиция повторения в съдове с чист седимент; след 4 — 6 h отстраняване на повторенията за вземане на проби от вода, седимент и червеи за определяне на концентрацията на изпитваното вещество; разпределение на червеите в изпитвателните камери на случаен принцип;
|
|
1
|
Отстраняване на повторенията за вземане на проби; проверка на подаването на въздух, на поведението на червеите, качеството на водата (вж. точка 52); вземане на проби вода, седимент и червеи за определяне на концентрация на изпитваното вещество;
|
|
2
|
Проверка на подаването на въздух, на поведението на червеите и на стойността на температурата;
|
|
3
|
Същото като ден 1;
|
|
4
|
Същото като ден 2;
|
|
5
|
Същото като ден 1;
|
|
6
|
Същото като ден 2;
|
|
7
|
Същото като ден 1; компенсиране на загубите на вода от изпаряване, ако е необходимо;
|
|
8 — 9
|
Същото като ден 2;
|
|
10
|
Същото като ден 1; край на фазата на елиминиране; измерване на качеството на водата (вж. точка 52); вземане на проби от вода, седимент и червеи от контролите на разтворител; пробовземане от разтворите за улавяне, ако има такива.
|
|
|
Приготвянето на седимента преди началото на фазата на елиминиране се извършва по същия начин, по който се извършва преди фазата на поглъщане.
|
|
|
Дейностите, описани за ден 2, следва да се извършват ежедневно (най-малкото в работни дни).
|
Допълнение 4
Някои физични и химични характеристики на приемлива вода за разреждане
|
СЪСТАВКА
|
КОНЦЕНТРАЦИИ
|
|
Твърди частици
|
< 20 mg/l
|
|
Общ органичен въглерод
|
< 2 μg/l
|
|
Нейонизиран амоняк
|
< 1 μg/l
|
|
Остатъчен хлор
|
< 10 μg/l
|
|
Общо органофосфорни пестициди
|
< 50 ng/l
|
|
Общо органохлорни пестициди плюс полихлорирани бифенили
|
< 50 ng/l
|
|
Общ органичен хлор
|
< 25 ng/l
|
СЪСТАВ НА ПРЕПОРЪЧАНАТА ВЪЗСТАНОВЕНА ВОДА
|
а)
|
Разтвор от калциев хлорид
В дейонизирана вода се разтварят 11,76 g CaCl2 · 2H2O; допълва се до 1 l с дейонизирана вода
|
|
б)
|
Разтвор на магнезиев сулфат
В дейонизирана вода се разтварят 4,93 g MgSO4 · 7H2O; допълва се до 1 l с дейонизирана вода
|
|
в)
|
Разтвор на натриев бикарбонат
В дейонизирана вода се разтварят 2,59 g NaHCO3; допълва се до 1 l с дейонизирана вода
|
|
г)
|
Разтвор на калиев хлорид
В дейонизирана вода се разтварят 0,23 g KCl; допълва се до 1 l с дейонизирана вода
|
Всички химикали следва да са с квалификация „чист“.
Проводимостта на дестилираната или дейонизираната вода не следва да надвишава 10 μScm– 1.
25 ml от всеки от разтвори а)—г) се смесват и общият обем се допълва до 1 литър с дейонизирана вода. Сборът от калциевите и магнезиевите йони в този разтвор е 2,5 mmol/l.
Съотношението на Ca:Mg йони е 4:1, а на Na:K йони — 10:1. Алкалността на този разтвор до достигане на pH 4,3 (KS4.3) е 0,8 mmol/l.
Водата за разреждане се аерира до насищане с кислород, след това се съхранява около два дни без допълнително аериране преди употреба.
Стойността на рН на приемлива вода за разреждане следва да бъде в интервала от 6 до 9.
Допълнение 5
Изкуствен седимент — препоръки за приготвяне и съхранение
За разлика от изискванията в метод за изпитване В.8 (40), за съдържанието на торф в изкуствения седимент се препоръчва стойност 2 % вместо 10 % от сухото тегло, за да съответства на ниските до умерени стойности на съдържанието на органична материя в естествените седименти (58).
Процентно съдържание на сухите съставки на изкуствения седимент:
|
Съставка
|
Характеристики
|
% от сухия седимент
|
|
Торф
|
Торф от торфен мъх, степен на разграждане: „средна“, изсушен на въздух, без видими остатъци от растения, фино смлян (размер на частиците ≤ 0,5 mm)
|
2 ± 0,5
|
|
Кварцов пясък
|
Размер на зърната: ≤ 2 mm, но > 50 % от частиците следва да бъдат в диапазон 50—200 μm
|
76
|
|
Каолин
|
Съдържание на каолинит ≤ 30 %
|
22 ± 1
|
|
Източник на храна
|
Folia urticae, стрити на прах листа от Urtica sp. (коприва), фино смляни (размер на частиците ≤ 0,5 mm), или смес от стрити на прах листа от Urtica sp. с алфа-целулоза, (1: 1); в съответствие с аптечните стандарти, за консумация от човека; в допълнение към сухия седимент
|
0,4 — 0,5 %
|
|
Калциев карбонат
|
CaCO3, на прах, химически чист, в допълнение към сухия седимент
|
0,05 — 1
|
|
Дейонизирана вода
|
Проводимост ≤ 10 μS/cm, в допълнение към сухия седимент
|
30 — 50
|
Ако се очакват повишени концентрации на амоняк, например ако за изпитваното вещество е известно, че потиска нитрификацията, може да се окаже полезно 50 % от богатия на азот прах от Urtica да се заменят с целулоза (напр. α-целулоза на прах, химически чиста, размер на частиците ≤ 0,5 mm;
Приготвяне
Торфът се изсушава на въздух и се смила на фин прах (размер на частиците ≤ 0,5 mm, без видими остатъци от растения). Приготвя се суспензия от изискваното количество торф на прах, като се използва част от дейонизираната вода, която ще се добави към сухия седимент (установено е, че воден обем от 11,5 × сухото тегло на торфа е полезен за приготвяне на торфена каша, която може да бъде разбърквана (8)), като се използва високопроизводително хомогенизиращо устройство.
Стойността на рН на тази суспензия се коригира до 5,5 ± 0,5 с CaCO3. Суспензията се аклиматизира най-малко два дни при 20 ± 2 °C, като се разбърква леко, за да се стабилизира рН и да се установи стабилна микробна съставка. Измерва се отново рН и, ако е необходимо, се коригира до 6,0 ± 0,5 с CaCO3. След това цялата суспензия се смесва с другите сухи съставки, като се взема под внимание всяка част, използвана за добавка. Останалата дейонизирана вода се добавя, за да се получи хомогенен седимент. Измерва се отново рН и, ако е необходимо, се коригира от 6,5 до 7,5 с CaCO3. Независимо от това, ако се очаква изменение в стойностите на амоняка, може да бъде полезно рН на седимента да се поддържа под 7,0 (например между 6,0 и 6,5). Вземат се проби от седимента, за да се определи сухото тегло и съдържанието на органичен въглерод. Ако се очаква изменение в стойностите на амоняка, изкуственият седимент може да бъде кондициониран в продължение на седем дни при същите условия, които преобладават в последващото изпитване (напр. съотношение седимент—вода от 1: 4, височина на слоя седимент както в съдовете за изпитване), преди към него да бъде добавено изпитваното вещество, т.е., следва към него да бъде допълнена вода, която трябва да е аерирана. В края на периода за кондициониране водата над седимента следва да се отстрани и изхвърли. Вземат се проби от седимента, за да се определи сухото тегло и общото съдържание на органичен въглерод (напр. 3 проби).
След това кварцовият пясък с добавка се смесва със седимента за всяко равнище на третиране, седиментът се разпределя по съдовете за повторенията и се залива с водата за изпитването (напр. съотношение седимент—вода от 1: 4, височина на слоя седимент както в съдовете за изпитване). След това съдовете се инкубират при същите условия, които преобладават в последващото изпитване. Оттук започва периодът на достигане на равновесие. Водата над седимента следва да бъде аерирана.
Избраният източник на храна следва да се добави преди или по време на добавянето на изпитваното вещество към седимента. Тя може първоначално да се смеси с торфената суспензия (вж. по-горе). Независимо от това, прекомерното разграждане на източника на храна преди да бъдат добавени изпитваните организми — например в случай на дълго време за достигане на равновесие — може да се избегне чрез поддържане на максимално кратък времеви интервал между добавянето на храната и началото на експозицията. За да се гарантира, че храната е в достатъчен контакт с изпитваното вещество, източникът на храна следва да бъде смесен със седимента не по-късно от деня, в който изпитваното вещество се добавя към седимента. Могат да се направят изключения, когато продължителността на периода за уравновесяване води до прекомерно микробно разграждане на храната преди добавянето на изпитваните организми. Вземат се проби от седимента, за да се определи сухото тегло и общото съдържание на органичен въглерод (напр. 3 проби от седимент с добавка или седимент от контрола).
Сухото тегло на компонентите (торф, пясък, каолин) следва да се протоколира в g и в % от общото сухо тегло.
Обемът на водата за добавяне към сухите компоненти по време на приготвянето на седимента следва също да бъде протоколиран в % от общото сухо тегло (например 100 % сухо тегло + 46 % вода означава, че към 1 000 g сухо тегло се добавя общо 460 ml вода, което води до получаване на 1 460 g мокър седимент).
Съхранение
Сухите съставки на изкуствения седимент могат да се съхраняват в сухо и хладно място при стайна температура. Приготвеният мокър седимент може да се съхранява (за по-нататъшно използване само в култури) при 4 ± 2 °C на тъмно в продължение 2 до 4 седмици от деня на приготвянето (8).
Седиментът с добавено изпитваното вещество следва да се използва незабавно, освен ако има информация, че конкретният седимент може да се съхранява, без да се наруши токсичността или бионаличността на изпитваното вещество. До анализа пробите от седимент с добавено изпитвано вещество могат да се съхраняват при условията, препоръчани за конкретното изпитвано вещество.
Допълнение 6
Видове олигохети, препоръчвани за изпитването за биоакумулация
Tubifex tubifex (Müller),Tubificidae, Oligochaeta
Олигохетите от вида Tubifex tubifex (Müller) са представители на семейство Tubificidae (Tubificidae, Oligochaeta), обитават сладководните седименти, живеят в тръбички, обвити отвътре със слуз. В тези тръбички червеите живеят с главата надолу, поглъщайки частици от седимента, като усвояват съответните микроорганизми и органични отпадъци. Задната част обикновено извършва вълнообразни движения в надстоящата вода с цел дишане. Въпреки че този вид обитава широка гама от видове седименти навсякъде в северното полукълбо, Tubifex tubifex предпочита субстрат с относително фини частици (59). Пригодността на този вид за екотоксикологични изпитвания е описана например в (8)(29)(31)(39)(60)(62)(63).
Методи за отглеждане
С цел да се разполага с достатъчен брой Tubifex tubifex за провеждане на изпитвания за биоакумулация, червеите трябва да се държат като постоянни едновидови култури, отглеждани в лабораторни условия. За отглеждане на T. tubifex се препоръчва система, състояща се от изкуствен седимент на основата на изкуствената почва в съответствие с метод за изпитване В.8 (40) и възстановена вода съгласно метод за изпитване В.1 (8).
Като съдове за отглеждане могат да се използват контейнери от стъкло или неръждаема стомана, с височина от 12 до 20 cm. Всеки контейнер за отглеждане се зарежда със слой от мокър изкуствен седимент, приготвен както е посочено в допълнение 5. Дълбочината на слоя седимент трябва да дава възможност за проявяване на естественото поведение на червеите (минимум 2 cm дълбочина за T. tubifex). Към системата се добавя възстановена вода. Трябва да се внимава за минимално нарушаване на седимента. Водното тяло леко се аерира (напр. 2 мехурчета в секунда с въздух, филтруван през 0,45 μm) с помощта на пипета „Пастьор“, разположена на 2 cm над повърхността на седимента. Препоръчителната температура на културата е 20 ± 2 °C.
Червеите се добавят към системата с културата с максимално зареждане от 20 000 екземпляра/m2 площ на седимента. По-голямо зареждане може да предизвика спад в процентите на растежа и размножаването (43).
В културите с изкуствен седимент червеите следва да бъдат хранени. Хранителен режим, съставен от фино смляна храна за риби, напр. TetraMin® може да служи като допълнително хранене (8); Klerks 1994, лично съобщение. Скоростите на подаване на храната трябва да дават възможност за достатъчен растеж и размножаване и следва да поддържат на минимално равнище натрупването на амоняк и развитието на гъбички в културата. Храна може да се дава два пъти седмично (например 0,6-0,8 mg на cm2 от площта на седимента). Практическият опит е показал, че прилагането на храна, суспендирана и хомогенизирана в дейонизирана вода, може да улесни хомогенното разпределяне на храна върху площта на седимента в контейнерите с културата.
За да се избегне натрупване на амоняк, водата над седимента следва да се обменя, като се използва проточна система, или ръчно поне веднъж седмично. Седиментът в изходните култури трябва да се сменя на всеки три месеца.
Вземане на проби от червеи от културата може да бъде правено чрез прекарване на седимента с културата през сито с отвори 1 mm, ако са необходими само полово зрели екземпляри. За задържане на пашкулчетата е подходящ отвор от 0,5 mm мрежа, а за ювенилните екземпляри — отвор от 0,25 mm. Ситата могат да се поставят във възстановена вода, след като е преминал седиментът. Червеите напускат мрежата и след това могат да се съберат от водата с меки стоманени пиниети или пипета с ръбове с огнева полировка.
Само интактни и ясно идентифицирани образци от Tubifex tubifex (напр. (64)) се използват за започване на изпитването или за нови култури. Болните или ранени червеи, както и пашкулите, заразени с гъбни хифи, трябва да бъдат изхвърляни.
Дадена синхронизирана култура може да осигури червеи на определена възраст в подходящи интервали, когато са необходими. Нови съдове за отглеждане се приготвят в избраните интервали (например веднъж на всеки две седмици), като се започне с животни на определена възраст (напр. пашкули). При условията на отглеждане, описани тук, червеите достигат полова зрялост след 8-10 седмици. Клетъчните култури могат да се събират, когато червеите са отделили нови пашкули, напр. след десет седмици. Пробовзетите полово зрели екземпляри могат да се използват за изпитвания, а с пашкулчетата могат да се стартират нови култури.
Lumbriculus variegatus (Müller), Lumbriculidae, Oligochaeta
Lumbriculus variegatus (Müller), Lumbriculidae, Oligochaeta също обитава сладководни седименти в целия свят и широко се използва при екотоксикологични изпитвания. Информация за биологичните особености, условията за отглеждане и чувствителност на видовете може да бъде получена от (1) (6) (9) (36). Lumbriculus variegatus също може да бъде отглеждан в изкуствения седимент, препоръчан за T. tubifex според (8), в рамките на определени ограничения. Тъй като в естествени условия L. variegatus предпочита седименти с по-едри частици, отколкото T. tubifex (59), отглеждането в лабораторни условия с изкуствения седимент, използван за T. tubifex, може да спре след 4 до 6 месеца. Практическият опит показва, че L. variegatus могат да бъдат държани в пясъчен субстрат (напр. кварцов пясък, фин чакъл) при проточна система, с използване на храна за риби като хранителен източник, в продължение на няколко години без подновяване на субстрата. Основно предимство на L. variegatus в сравнение с други видове водни олигохети е бързото му размножаване, водещо до бързо увеличаване на биомасата в отглеждани в лабораторни условия популации (1)(6)(9)(10).
Методи за отглеждане
Условията на отглеждане на Lumbriculus variegatus са подробно описани във Phipps et al. (1993) (10), Brunson et al. (1998) (28), ASTM (2000) (1), U.S. EPA (2000) (6). По-долу е дадено кратко резюме на тези условия.
Червеите могат да бъдат отглеждани в големи аквариуми (57—80 l) при 23 °С, с времетраене на осветлението 16 L:8 D (100—1 000 lux), като се използва ежедневно подновявана природна вода (45—50 l на аквариум). Субстратът се приготвя чрез нарязване на ленти на салфетки от неизбелена кафява хартия, които могат впоследствие да бъдат смесени с вода за отглеждането за няколко секунди, за получаване на малки парчета хартиен субстрат. След това субстратът може да бъде пряко използван в аквариумите за отглеждане на Lumbriculus чрез покриване на дънната област на съда, или да се съхранява замразен в дейонизирана вода за по-късна употреба. Новият субстрат в съда обикновено е с трайност около два месеца.
Всяко отглеждане на червеи започва с 500—1 000 червея и се захранва с 10 ml суспензия, съдържаща 6 g стартерни фуражи за пъстърва 3 пъти седмично в условия на прилагане на метод с обновяване или или проточен метод. Скоростите на подаване на храната за статичните или полустатичните култури следва да бъдат по-малки, за да се предотврати развитието на бактерии и патогенни гъбички. Храната и хартиеният субстрат следва да бъдат анализирани за веществата, които ще бъдат използвани в изпитванията за биоакумулация.
При тези условия броят на индивидите в културата по принцип се удвоява приблизително за 10 до 14 дни.
Lumbriculus variegatus може да бъде отстранен от културите в отделна бехерова чаша, например чрез прехвърляне на субстрат с фина мрежа, или на организми с помощта на стъклена пипета с широк отвор с огнева полировка (приблизително 5 mm в диаметър). Ако заедно с това в тази бехерова чаша бъде прехвърлен субстрат, бехеровата чаша, съдържаща червеите и субстрата, се оставя за една нощ при проточни условия, което ще отстрани субстрата от бехеровата чаша, а червеите ще останат на дъното на съда. След това те могат да бъдат въведени в наскоро приготвени съдове за отглеждане, или да бъдат допълнително обработени за изпитването, както е посочено в (1) и (6). Следва да се избягват наранявания или автотомия при червеите, напр. чрез боравене с тези червеи с използване на пипети с ръбове, полирани с огнева полировка, или с направени от неръждаема стомана клечки.
Един въпрос, който следва да бъде разгледан критично при използването на L. variegatus в изпитвания за биоакумулация със седимент, е начинът му на размножаване (архитомия, последвана от морфалаксис). В резултат от това безполово размножаване се получават два фрагмента, които не се хранят в продължение на определен период от време, докато не регенерира частта откъм главата или опашката (напр. (36)(37)). Това означава, че при L. variegatus поглъщането на седимент и замърсители може да не се осъществява непрекъснато, като при представителите на Tubificidae, които не се размножават чрез фрагментация.
Поради това следва да се извърши синхронизация с цел свеждане до минимум на неконтролираното размножаване и регенерация и следващото от това голямо вариране на резултатите от изпитването. Известно вариране може да се получи, когато някои от индивидите, които са се разделили на фрагменти и поради това не се хранят в продължение на определен период, са по-малко експонирани на изпитваното вещество в сравнение с другите индивиди, които не се разделят на фрагменти по време на изпитването, напр. (38). От 10 до 14 дни преди началото на експозицията червеите следва да бъдат изкуствено фрагментирани (синхронизация). Следва да се използват големи червеи, които за предпочитане не показват признаци на неотдавнашна фрагментация. Тези червеи могат да бъдат поставени върху предметно стъкло в капка вода за отглеждане и им се извършва дисекция със скалпел в средната част на тялото. Следва да се вземат мерки задните краища да са със сходен размер. След това задните краища се оставят, до началото на експозицията, за регенерация на нови глави в съд за отглеждане, съдържащ същия субстрат, като използвания при отглеждането, и възстановена вода. Има показания за регенерация на нови глави, когато синхронизираните червеи се заравят в субстрата (наличието на регенерирани глави може да бъде потвърдено чрез инспектиране на представителна подпроба с бинокулярен микроскоп). След това се очаква изпитваните организми да са със сходен физиологичен статус. Това означава, че когато по време на изпитването се извърши регенериране чрез морфалаксис в синхронизирани червеи, почти всички животни се очаква да бъдат еднакво експонирани на седимента с добавка. Храненето на синхронизираните червеи следва да се извърши веднага след като червеите започнат да се заравят в субстрата, или 7 дни след дисекцията. Режимът на хранене следва да бъде съпоставим с този при редовните култури, но може да е препоръчително синхронизираните червеи да се хранят със същия източник на храна, който ще се използва по време на изпитването. Червеите следва да се държат при температурата на изпитването, на 20 ± 2 °C. След регенерацията, за изпитването следва да се използват интактни цели червеи със сходни размери, които активно плуват или пълзят след лек механичен стимул. Следва да се избягват наранявания или автотомия при червеите, напр. чрез боравене с тези червеи с използване на пипети с ръбове, полирани с огнева полировка, или с направени от неръждаема стомана клечки.
Когато се използва Lumbriculus variegatus, поради специфичния за този вид начин на размножаване, следва да настъпи увеличаване на броя на червеите по време на изпитването, ако условията са подходящи (6). Липсата на размножаване в изпитването за биоакумулация с L. variegatus трябва да бъде записана и да се вземе под внимание, когато се интерпретират резултатите от изпитването.
Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (не е валидиран при кръгово изпитване)
Branchiura sowerbyi обитава различни типове седименти в резервоари, езера, блата и реки, първоначално в тропически райони. Те също така могат да се намерят в топли водни обекти в северното полукълбо. Обилието им обаче е по-голямо в седименти от тиня и глина с високо съдържание на органична материя. Освен това червеите обитават слоя седимент. Дори и задният край на червеите обикновено е заровен. Този вид се идентифицира лесно по хрилните нишки в задната си част. Полово зрелите индивиди могат да достигнат дължина 9-11 cm и мокро тегло от 40-50 mg. Червеите имат висока скорост на размножаване, с време за удвояване на популацията по-малко от 2 седмици и при условия на температурата и хранене, описани по-долу (Aston et al., 1982, (65)). B. sowerbyi е използван при изследвания както за токсичност, така и за биоакумулация (съответно Marchese & Brinkhurst 1996, (31) Roghair et al. 1996, (67)).
Методи за отглеждане
Обобщение на условията за отглеждане на Branchiura sowerbyi са дадени по-долу (предоставени от Mercedes R. Marchese, INALI, Аржентина, и Carla J. Roghair, RIVM, Нидерландия).
Не се изисква отделна техника за отглеждане на изпитваните организми. Организмите могат да бъдат отглеждани с използване на незаразен естествен седимент (31). Практическият опит е показал, че среда от естествен седимент и пясък подобрява състоянието на червеите в сравнение с това на чист естествен седимент (32) (67). За културата могат да се използват бехерови чаши от 3 l, съдържащи 1 500 ml среда седимент/вода, състояща се от 375 ml естествен незамърсен седимент (около 10 % общо съдържание на органичен въглерод; около 17 % от частиците са ≤ 63 μm), 375 ml чист пясък (M32) и 750 ml възстановена или дехлорирана чешмяна вода (31) (32) (67). Хартиени салфетки също могат да се използват като субстрат за отглеждането, но растежът на популацията е по-бавен от този в естествен седимент. При полустатични системи слоят вода в бехеровата чаша бавно се аерира и водата над седимента следва да бъде обновявана веднъж седмично.
За започването всяка бехерова чаша съдържа 25 млади червеи. След два месеца големите червеи се отстраняват от седимента с пинсета и се поставят в нова бехерова чаша с прясно приготвена среда седимент/вода. Старата бехерова чаша съдържа също така пашкули и млади червеи. По този начин могат да се съберат до 400 млади червея на чаша. Полово зрелите червеи могат да се използват за размножаване поне една година.
Културите следва да бъдат поддържани при температура от 21 до 25 °C. Варирането на температурата следва да се поддържа под ± 2 °C. Времето, необходимо за ембрионално развитие от полагането на яйцето до напускането на пашкулчето е около три седмици при 25 °C. Установено е, че получените яйца на преживял червей при B. sowerbyi варират от 6,36 (31) до 11,2 (30) в кал при 25 °C. Броят на яйцата на пашкулче варира от 1,8 до 2,8 (66) (69) или до 8 (68).
Разтвореният кислород, твърдостта на водата, температурата и pH трябва да се измерват всяка седмица. Храна за риби (напр. TetraMin®) може да бъде допълвана като суспензия два или три пъти седмично ad libitum. Червеите могат също така да бъдат хранени с размразена маруля ad libitum.
Основно предимство на този вид е високата индивидуална биомаса (до 40-50 mg мокро тегло на индивид). Поради това този вид може да се използва за изпитване на биоакумулацията на изпитвани вещества, които не са изотопно белязани. Той може да бъде експониран в системите, използвани за T. tubifex или L. variegatus с един-единствен индивид на повторение (11). Тогава обаче повторенията следва да бъдат увеличени, освен ако не се използват по-големи камери за изпитване (11). Освен това критерият за валидност, свързан с поведението на червеите при заравяне, трябва да бъде коригиран за този вид.
ЛИТЕРАТУРА
|
(1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(2)
|
European Commission (EC) (2003). Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I — IV. Office for Official Publications of the European Communities, Luxembourg.
|
|
(3)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(4)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(5)
|
Глава В.13 от настоящото приложение, Биоконцентрация: проточен тест за риби.
|
|
(6)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(7)
|
Глава В.27 от настоящото приложение, „Изпитване за токсичност за хирономиди в система вода–седимент с използване на седимент с добавка“.
|
|
(8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(9)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(10)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on „Bioaccumulation: Sediment test using benthic oligochaetes“, 26.-27.4.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(12)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
(13)
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. & Morton, R.D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301-310.
|
|
(14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim
|
|
(15)
|
Landrum, P.F., Lee II, H., & Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709-1725.
|
|
(16)
|
Markwell, R.D., Connell, D.W. & Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443-1450.
|
|
(17)
|
Gabric, A.J., Connell, D.W. & Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24, 1225-1231.
|
|
(18)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. and Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501-1514.
|
|
(20)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(21)
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
(22)
|
Следните глави от настоящото приложение:
|
|
Глава А.4, парно налягане
|
|
|
Глава А.5, повърхностно напрежение
|
|
|
Глава А.6, разтворимост във вода
|
|
|
Глава А.8, коефициент на разпределение, метод „разклащане в стъкленица“
|
|
|
Глава А.24, коефициент на разпределение, метод ВЕТХ
|
|
|
Глава В.7, Разграждане — абиотично разграждане: хидролиза като функция от рН
|
|
|
Глава В.4. „Определяне на пряката биологична разградимост“ (методи от А до Е)
|
|
|
Глава В.19, Изчисляване коефициента на адсорбция (Koc) на почвата и на утайката от отпадъчни води с използване на високоефективна течна хроматография (ВЕТХ)
|
|
|
Глава В.29, Лесна биоразградимост — CO2 в запечатани съдове
|
|
|
(23)
|
OECD (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OECD, Paris.
|
|
(24)
|
Antoine, M.D., Dewanathan, S. & Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165-172.
|
|
(25)
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke & G. Studinger (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation — New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235-276.
|
|
(26)
|
Spacie, A. & Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309-320.
|
|
(27)
|
Hawker, D.W. & Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22, 701-707.
|
|
(28)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(29)
|
Reynoldson, T.B., Thompson, S.P. and Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061-1072.
|
|
(30)
|
Aston, R.J. & Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155-160.
|
|
(31)
|
Marchese, M.R. & Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163-168.
|
|
(32)
|
Roghair, C.J. & Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
(33)
|
Глава В.1 от настоящото приложение, Изпитване за остра токсичност при риби.
|
|
(34)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(35)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(36)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(37)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(38)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
(39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(40)
|
Глава В.8 от настоящото приложение, Токсичност за земни червеи.
|
|
(41)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(42)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588-595.
|
|
(43)
|
Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). In: R.O. Brinkhurst and D.G. Cook (eds.): Aquatic Oligochaeta Biology, 175-184. Plenum Press, New York.
|
|
(44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
|
|
(45)
|
Hooftman, R.N., van de Guchte, K. & Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
(46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, 1897-1905.
|
|
(47)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
(48)
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431-1436.
|
|
(49)
|
Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099-1105.
|
|
(50)
|
Bligh, E.G. & Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911-917.
|
|
(51)
|
De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
(52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
(53)
|
Zok, S., Görge, G., Kalsch, W. & Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411-421
|
|
(54)
|
Nagel, R. (1988). Umweltchemikalien und Fische — Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Germany.
|
|
(55)
|
Janssen, M.P.M., A Bruins, T.H. De Vries & Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305-312.
|
|
(56)
|
Van Brummelen, T.C. & Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277-285.
|
|
(57)
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167-1171.
|
|
(58)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
(59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310-386.
|
|
(60)
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785-790.
|
|
(61)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47-67.
|
|
(62)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69-78.
|
|
(63)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(64)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(65)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(66)
|
Aston, R.J., Sadler, K. & Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137-145.
|
|
(67)
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. & Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
(68)
|
Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89-94.
|
|
(69)
|
Bonacina, C., Pasteris, A., Bonomi, G. & Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267-274
|
“ |