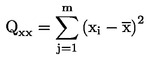ПРИЛОЖЕНИЕ
В приложение V към Регламент (ЕО) № 152/2009 част Б „ОПРЕДЕЛЯНЕ НА НИВАТА НА ДИОКСИНИ (PCDD/PCDF) И РСВ“ се заменя със следното:
„Б. ОПРЕДЕЛЯНЕ НА НИВАТА НА ДИОКСИНИ (PCDD/PCDF) И PCB
ГЛАВА I
Методи за вземане на проби и тълкуване на резултатите от анализа
1. Цел и обхват
Пробите, предназначени за официалния контрол на нивата на полихлорирани дибензо-р-диоксини (PCDD), полихлорирани дибензофурани (PCDF), диоксиноподобни полихлорирани бифенили (PCB) (1) и недиоксиноподобни PCB във фуражите, се вземат в съответствие с разпоредбите на приложение I. Прилагат се количествените изисквания във връзка с контрола на равномерно разпределени във фуражите вещества или продукти, посочени в точка 5.1 от приложение I. Така получените съставни проби се разглеждат като представителни за партидите или подпартидите, от които са взети. Съответствието с максимално допустимите количества, посочени в Директива 2002/32/ЕО, се определя въз основа на количествата, установени в лабораторните проби.
За целите на част Б се прилагат определенията от приложение I към Решение 2002/657/ЕО на Комисията (2).
Освен посочените определения за целите на настоящия регламент се прилагат следните определения:
|
|
„Скрининг методи“ означава методи, използвани за отсяване на пробите с нива на PCDD/PCDF и на диоксиноподобни PCB, които надвишават максимално допустимите количества или праговете. Те позволяват икономически целесъобразна обработка на голям брой проби, като по този начин се увеличава вероятността за откриване на нови инциденти с висока степен на изложеност и рискове за здравето на потребителите. Скрининг методите се основават на биоаналитични методи или методи на GC-MS. Резултатите от пробите, които надвишават граничната стойност за проверка на съответствието спрямо максимално допустимото количество, се проверяват посредством пълен повторен анализ от оригиналната проба чрез метод за потвърждение. |
|
|
„Методи за потвърждение“ означава методи, които дават пълна или допълнителна информация, позволяваща идентифицирането и еднозначното количествено определяне на PCDD/PCDF и диоксиноподобни PCB по отношение на максимално допустимото количество или при необходимост, на прага. При тези методи се използва газова хроматография/масспектрометрия с висока разделителна способност (GC-HRMS) или газова хроматография/тандемна масспектрометрия (GC-MS/MS). |
2. Съответствие на партидата или подпартидата с максимално допустимото количество
2.1. По отношение на недиоксиноподобните PCB
Партидата съответства на максимално допустимото количество, ако резултатът от анализа не надвишава максимално допустимото количество на недиоксиноподобни PCB, установено с Директива 2002/32/ЕО, като се отчита неопределеността на измерването.
Партидата не съответства на максимално допустимото количество, ако горнограничният (3) резултат от анализа, потвърден с повторен анализ (4), надвишава максимално допустимото количество, установено с Директива 2002/32/ЕО, като се отчита неопределеността на измерването. За проверка на съответствието се използва средната стойност от две определяния, като се отчита неопределеността на измерването.
Неопределеността на измерването се взема предвид, като се приложи един от следните подходи:
|
— |
като се изчисли разширената неопределеност, използвайки фактор на покриване 2, който дава доверителна вероятност приблизително 95 %. Дадена партида или подпартида не съответства на разпоредбите, ако измерената стойност минус U е над максимално допустимото количество; |
|
— |
като се установи критична граница (CCα) в съответствие с точка 3.1.2.5 от приложение I към Решение 2002/657/ЕО. Партидата или подпартидата не отговаря на изискванията, ако измерената стойност е по-голяма или равна на CCα. |
Параграфи 1, 2 и 3 се прилагат по отношение на резултата, получен при анализа на пробата за целите на официалния контрол. При извършване на анализ с цел защита или за справка се прилагат националните правила.
2.2. По отношение на PCDD/PCDF и диоксиноподобните PCB
Партидата съответства на максимално допустимите количества, ако резултатът от еднократен анализ:
|
— |
извършен чрез скрининг метод с дял на фалшивите резултати за съответствие под 5 %, сочи, че нивото не надвишава съответното максимално допустимо количество на PCDD/PCDF, нито сумата от PCDD/PCDF и диоксиноподобните PCB, както е предвидено в Директива 2002/32/ЕО; |
|
— |
извършен чрез метод за потвърждение, не надвишава съответното максимално допустимо количество на PCDD/PCDF, нито сумата от PCDD/PCDF и диоксиноподобните PCB, както е предвидено в Директива 2002/32/ЕО, като се отчита неопределеността на измерването. |
При скрининг анализите трябва да се установят гранични стойности с оглед определянето на съответствието на пробата на максимално допустимите количества, установени за PCDD/PCDF или за сумата от PCDD/PCDF и диоксиноподобните PCB.
Партидата не съответства на максимално допустимото количество, ако горнограничният (5) резултат от анализа, получен чрез метод за потвърждение и потвърден с повторен анализ, надвишава максимално допустимото количество, установено с Директива 2002/32/ЕО, като се отчита неопределеността на измерването (6). За проверка на съответствието се използва средната стойност от две определяния, като се отчита неопределеността на измерването.
Неопределеността на измерването се взема предвид, като се приложи един от следните подходи:
|
— |
като се изчисли разширената неопределеност, използвайки фактор на покриване 2, който дава доверителна вероятност приблизително 95 %. Дадена партида или подпартида не съответства на разпоредбите, ако измерената стойност минус U е над максимално допустимото количество. В случай че PCDD/PCDF и диоксиноподобните PCB се определят поотделно, за сумата от PCDD/PCDF и диоксиноподобните PCB се използва сумата от оценената разширена неопределеност на отделните резултати от анализа на PCDD/PCDF и на диоксиноподобните PCB. |
|
— |
като се установи критична граница (CCα) в съответствие с точка 3.1.2.5 от приложение I към Решение 2002/657/ЕО. Партидата или подпартидата не отговаря на изискванията, ако измерената стойност е по-голяма или равна на CCα. |
Параграфи 1 — 4 се прилагат по отношение на резултата, получен при анализа на пробата за целите на официалния контрол. При извършване на анализ с цел защита или за справка се прилагат националните правила.
3. Резултати, превишаващи праговете, определени в приложение II към Директива 2002/32/ЕО
Праговете са инструмент за отсяване на проби в случаите, в които е необходимо да се идентифицира източник на замърсяване и да се вземат мерки за неговото намаляване или отстраняване. Чрез скрининг методите трябва да се установят подходящи гранични стойности за отсяване на посочените проби. В случай че са необходими значителни усилия за идентифициране на източника или за намаляване или отстраняване на замърсяването, може да е целесъобразно надвишаването на праговете да се потвърди чрез повторен анализ при използване на метод за потвърждение и като се отчита неопределеността на измерването (7).
ГЛАВА II
Подготовка на пробите и изисквания към методите за анализ, използвани за целите на официалния контрол на съдържанието на диоксини (PCDD/PCDF) и на диоксиноподобни PCB във фуражите
1. Приложно поле
Изискванията, изложени в настоящата глава, се прилагат при анализа на фуражи за целите на официалния контрол на съдържанието на заместените на 2,3,7,8 позиция полихлорирани дибензо-р-диоксини и полихлорирани дибензофурани (PCDD/PCDF) и диоксиноподобни полихлорирани бифенили (диоксиноподобни PCB), както и за други регулаторни цели.
Наблюдението за наличие на PCDD/PCDF и на диоксиноподобни PCB във фуражите може да се извършва чрез два различни вида аналитични методи:
|
а) |
Скрининг методи Целта на скрининг методите е отсяване на пробите с нива на PCDD/PCDF и на диоксиноподобни PCB, които надвишават максимално допустимите количества или праговете. Тези методи позволяват икономически целесъобразна обработка на голям брой проби, като по този начин се увеличава вероятността за откриване на нови инциденти с висока степен на изложеност и рискове за здравето на потребителите. С прилагането им се цели избягване на фалшивите резултати за съответствие. Скрининг методите могат да включват биоаналитични методи и методи GC-MS. Чрез тях се извършва сравнение на резултата от анализа с граничната стойност и се получава отговор от вида „да/не“ относно евентуалното надвишаване на максимално допустимото количество или прага. Концентрацията на PCDD/PCDF и сумата от PCDD/PCDF и диоксиноподобните PCB в пробите, за които има съмнение за несъответствие спрямо максимално допустимото количество, трябва да бъдат определени/потвърдени чрез метод за потвърждение. Освен това скрининг методите може да дадат индикация за количествата на PCDD/PCDF и диоксиноподобните PCB, които се съдържат в пробата. При прилагане на биоаналитични скрининг методи резултатът се изразява като биоаналитични еквиваленти (BEQ), докато при прилагане на физикохимични GC-MS той се изразява като токсични еквиваленти (TEQ). Цифрово изразените резултати от скрининг методите са подходящи за доказване на съответствието или на съмненията за несъответствие или надвишаване на праговете и при проследяване чрез методи за потвърждение показват диапазона на нивата. Те не са подходящи за цели като извършване на оценка на фоновите нива, предварителна оценка на количеството, проследяване на тенденции във времето при нивата или повторна оценка на праговете и на максимално допустимите количества. |
|
б) |
Методи за потвърждение Методите за потвърждение позволяват еднозначното идентифициране и количествено определяне на съдържащите се в дадена проба PCDD/PCDF и диоксиноподобни PCB и предоставят пълна информация на ниво конгенери. Следователно тези методи позволяват извършването на контрол на максимално допустимите количества и праговете, в т.ч. потвърждаване на резултатите, получени чрез скрининг методите. Освен това резултатите могат да бъдат използвани за други цели, като например определяне на ниски фонови нива при мониторинг на фуражите, проследяване на тенденции във времето, извършване на оценка на експозицията и създаване на база данни за евентуална повторна оценка на праговете и на максимално допустимите количества. Те са важни също така за установяването на модели на конгенери с оглед идентифицирането на източника на евентуално замърсяване. При тези методи се използва GC-HRMS. За потвърждаване на съответствието или несъответствието спрямо максимално допустимите количества може да се използва и GC-MS/MS. |
2. Контекст
За да се изчислят концентрациите на токсичните еквиваленти (ТЕQ), концентрациите на отделните вещества в дадена проба се умножават по съответния им фактор за токсична еквивалентност (TEF) (вж. бележка под линия (1)* от глава I) и след това се сумират, за да се получи общата концентрация на диоксиноподобните съединения, изразени като ТЕQ.
„За целите на част Б приетата специфична граница за количествено определяне на отделен конгенер“ означава най-ниското съдържание на аналита, което може да бъде измерено при разумна степен на статистическа сигурност, при изпълнение на критериите за идентифициране, описани в международно признати стандарти, например в стандарт EN 16215:2012 (Фуражи. Определяне на диоксини, диоксин-подобни PCB и на индикаторни PCB чрез GC/HRMS и/или в последната редакция на методи EPA 1613 и 1668.
Границата за количествено определяне на отделен конгенер може да бъде определена като
|
а) |
концентрацията на даден аналит в екстракта от дадена проба, който предизвиква реакция от страна на техническото устройство за два различни йона, която трябва да се следи при съотношение S/N (сигнал/шум), равно на 3:1 за по-малко интензивния сигнал на необработени данни; или |
|
б) |
ако поради технически причини изчислението на съотношението сигнал/шум не дава надеждни резултати, най-ниската точка на концентрация на калибрационна крива, която дава приемливо (≤ 30 %) и постоянно (измерено поне в началото и в края на дадена аналитична серия от проби) отклонение спрямо средния относителен фактор на отговор, изчислен за всички точки по калибрационната крива при всяка серия от проби. Границата за количествено определяне (LOQ) се изчислява от най-ниската точка на концентрация, като се отчете аналитичният добив от вътрешните стандарти и количеството на пробата. |
Биоаналитичните скрининг методи не отчитат резултати на ниво конгенери, а само показват (8) нивото на токсичния еквивалент (ТЕQ), изразено в биоаналитични еквиваленти (BEQ), като потвърждават факта, че не всички съдържащи се в екстракта от проби съединения, които предизвикват отговор при изпитването, могат да се подчиняват на всички изисквания на принципа на ТЕQ.
Скрининг методите и методите за потвърждение могат да се използват за контрол на определена матрица само ако са достатъчно чувствителни с оглед надеждното откриване на количества на нивото на прага или максимално допустимото количество.
3. Изисквания за осигуряване на качеството
3.1. Вземат се мерки за избягване на кръстосано замърсяване на всеки етап от процедурата за вземане на проби и от анализа.
3.2. Пробите се съхраняват и транспортират в контейнери от стъкло, алуминий, полипропилен или полиетилен, подходящи за съхранение без да се оказва никакво влияние върху нивата на PCDD/PCDF и диоксиноподобните PCB в пробите. От контейнера за съхранение на пробата се премахват следите от хартиен прах.
3.3. Съхранението и транспортирането на пробите се извършват по начин, при който се запазва целостта на фуражната проба.
3.4. Доколкото е уместно, всяка лабораторна проба се смила фино и се смесва оптимално чрез използване на процес, с който е доказано, че се постига пълно хомогенизиране (например смилане, което позволява преминаване през сито с размер на отворите 1 mm). Пробите се изсушават преди смилането, ако съдържанието на влага в тях е твърде високо.
3.5. Осъществява се контрол на реагентите, лабораторната стъклария и оборудването от гледна точка на възможното им влияние върху резултатите на база ТЕQ или BEQ.
3.6. Извършва се анализ на празна проба, като се изпълнява цялата аналитична процедура и се пропуска единствено пробата.
3.7. При биоаналитичните методи цялата стъклария и разтворителите, използвани при анализа, преминават изпитвания за отсъствие на съединения, които интерферират при откриването на целевите съединения в работния обхват. Стъкларията се изплаква с разтворители или се загрява до температури, подходящи за отстраняване на следи от PCDD/PCDF, диоксиноподобни и интерфериращи съединения от нейната повърхност.
3.8. Количеството на пробата, използвано за екстракцията, е достатъчно, за да отговаря на изискванията за достатъчно нисък работен обхват, включително концентрациите на максимално допустимото количество или на прага.
3.9. Специфичните процедури за подготовка на пробите, използвани при разглежданите продукти, се основават на международно приетите насоки.
4. Изисквания към лабораториите
4.1. В съответствие с разпоредбите на Регламент (ЕО) № 882/2004 лабораториите трябва да бъдат акредитирани от признат орган, действащ в съответствие с Ръководство 58 на ISO, с цел да се гарантира осигуряване на качеството при анализите. Лабораториите трябва да бъдат акредитирани в съответствие със стандарт EN ISO/IEC 17025.
4.2. Компетентността на лабораторията трябва да бъде доказана чрез постоянно успешно участие в междулабораторни изследвания за определяне на PCDD/PCDF и диоксиноподобни PCB в съответните матрици от фуражи и диапазони на концентрация.
4.3. Лабораториите, които прилагат скрининг методи за целите на рутинния контрол на пробите, трябва да установяват тясно сътрудничество с лаборатории, прилагащи метода за потвърждение, както за целите на контрола на качеството, така и за потвърждаване на аналитичния резултат за проби, за които съществува съмнение за несъответствие.
5. Основни изисквания, на които трябва да отговаря аналитичната процедура за диоксини (PCDD/PCDF) и диоксиноподобни PCB
5.1. Нисък работен обхват и граници за количествено определяне
Подлежащите на откриване количества от PCDD/PCDF са в горната граница на фемтограма (10–15g) поради изключително високата токсичност на някои от тези съединения. За повечето конгенери на PCB е достатъчна граница за количествено определяне от порядъка на нанограма (10–9g). За измерването на по-токсичните диоксиноподобни конгенери на PCB (и по-специално не-ортозаместените) долната граница на работния обхват достига до ниските стойности от порядъка на пикограма (10–12g). За повечето от останалите конгенери на PCB граница на количествено определяне от порядъка на нанограмите (10–9g) е достатъчна.
5.2. Висока избирателност (специфичност)
5.2.1. Необходимо е разграничаване между PCDD/PCDF и диоксиноподобните PCB и множество други налични съвместно екстрахирани и вероятно интерфериращи съединения, чиито концентрации са до няколко степени по-високи от тези на аналитите от значение. При методите GC-MS се изисква разграничаване между отделните видове конгенери, например между токсичните конгенери (напр. седемнадесетте заместени на 2,3,7,8 позиция PCDD/PCDF и дванадесетте диоксиноподобни PCB) и други видове конгенери.
5.2.2. Биоаналитичните методи трябва да позволяват откриването на целевите съединения като сумата на PCDD/PCDF и/или диоксиноподобните PCB. С пречистването на пробите се цели отстраняване на съединения, предизвикващи фалшиви резултати за несъответствие или на съединения, които могат да доведат до понижаване на отговора, като предизвикат фалшиви резултати за съответствие.
5.3. Висока точност (истинност и прецизност, експериментално измерен аналитичен добив при биоанализ)
5.3.1. При методите GC-MS определянето дава валидна оценка за истинската концентрация в дадена проба. Необходима е висока степен на точност, за да се избегне отхвърляне на резултата за дадена проба поради на ниска надеждност на определеното ниво на TEQ. Точността се изразява като истинност (разлика между средната стойност, измерена за даден аналит в сертифициран материал и неговата сертифицирана стойност, изразена като процент от тази стойност) и прецизност (RSDR, относително стандартно отклонение, което се изчислява на базата на резултатите, получени при възпроизводими условия).
5.3.2. За биоаналитичните методи трябва да се определи експериментално измереният аналитичен добив при биоанализ. „Експериментално измерен аналитичен добив при биоанализ“ означава нивото на BEQ, изчислено от калибрационната крива на TCDD или на PCB 126, коригирано с резултатите от празната проба и след това разделено на нивото на ТЕQ, определено чрез метода за потвърждение. Целта му е коригирането на фактори като загубата на PCDD/PCDF и диоксиноподобни съединения по време на извличането и пречистването, успоредно извлечени съединения, които увеличават или намаляват силата на отговора (агонистичен и антагонистичен ефект), качеството на напасването на кривата или разликите между фактора за токсична еквивалентност (TEF) и стойностите на относителен потенциал (REP). Експериментално измереният аналитичен добив при биоанализ се изчислява от подходящи референтни проби с представителни модели на конгенерите около нивото от значение.
5.4. Валидиране в диапазона на максимално допустимите количества и общи мерки за контрол на качеството
5.4.1. По време на процедурата за валидиране и по време на рутинните анализи лабораториите трябва да докажат ефективността на даден метод в диапазона на максимално допустимото количество, например на нива 0,5, 1 и 2 пъти по-високи от максимално допустимото количество при приемлив коефициент на вариация за повтарящи се анализи.
5.4.2. Като вътрешни мерки за контрол на качеството трябва да се извършват редовни изпитвания на празни проби и експерименти с добавка на референтен материал или анализи на контролни проби (за предпочитане е сертифициран референтен материал, ако е наличен). С цел да се гарантира, че анализите се извършват в съответствие с изискванията, диаграмите за контрола на качеството за изпитванията на празни проби, експериментите с добавка на референтен материал или анализа на контролните проби трябва да се регистрират и проверяват.
5.5. Граница за количествено определяне
5.5.1. За биоаналитичните скрининг методи установяването на граница за количествено определяне (LOQ) не е задължително изискване, но трябва да бъде доказано, че методът може да разграничи стойността при празна проба и граничната стойност. При представяне на нивото на BEQ трябва да се установи ниво на отчитане за обработването на проби, чийто отговор е под това ниво. Нивото на отчитане трябва доказано да се различава най-малко три пъти от нивото при процедурите с празни проби, като отговорът е под работния обхват. Следователно това ниво се изчислява от проби, в които целевите съединения се съдържат на равнище около изискваното минимално ниво, а не от съотношението S/N или от аналитична празна проба.
5.5.2. При методите за потвърждение LOQ е около 1/5 от максимално допустимото количество.
5.6. Аналитични критерии
За да се получат надеждни резултати чрез методите за потвърждение или скрининг методите, в диапазона на максимално допустимото количество или на прага трябва да бъдат изпълнени следните критерии по отношение на стойността съответно на ТЕQ или на BEQ, независимо дали е определена като общ ТЕQ (като сума от PCDD/PCDF и диоксиноподобните PCB), или поотделно за PCDD/PCDF и за диоксиноподобните PCB:
|
|
Скрининг чрез биоаналитични или физикохимични методи |
Методи за потвърждение |
|
Дял на фалшивите резултати за съответствие (9) |
< 5 % |
|
|
Истинност |
|
– 20 % до + 20 % |
|
Повторяемост (RSDr) |
< 20 % |
|
|
Вътрешнолабораторна възпроизводимост (RSDR) |
< 25 % |
< 15 % |
5.7. Специфични изисквания относно скрининг методите
5.7.1. За целите на скрининга могат да се използват както GC-MS, така и биоаналитични методи. По отношение на методите GC-MS трябва да бъдат изпълнени изискванията, посочени в точка 6. Специфичните изисквания по отношение на клетъчните биоаналитични методи са изложени в т. 7.
5.7.2. Лабораториите, които прилагат скрининг методи за целите на рутинния контрол на пробите, трябва да установят тясно сътрудничество с лаборатории, които прилагат метода за потвърждение.
5.7.3. По време на рутинните анализи се изисква проверка на ефективността на скрининг метода чрез аналитичен контрол на качеството и текущо валидиране на метода. Необходима е непрекъсната програма за контрол на резултатите, които отговарят на изискванията.
5.7.4. Проверка за възможно потискане на клетъчния отговор и цитотоксичност:
20 % от екстрактите от проби трябва да бъдат измерени при рутинен скрининг без и със добавяне на 2,3,7,8-TCDD в съответствие с максимално допустимото количество или прага с цел да се провери възможността за евентуално потискане на отговора в резултат на интерфериращите вещества, намиращи се в екстракта от пробата. Измерената концентрация на пробата с добавен референтен материал се сравнява със сумата от концентрацията на екстракта без добавка плюс концентрацията на добавката. Ако тази измерена концентрация е по-ниска от изчислената (сумарната) концентрация с повече от 25 %, това е показател за потенциално потискане на сигнала и съответната проба трябва да бъде подложена на анализ за потвърждаване чрез GC-HRMS. Резултатите трябва да се наблюдават посредством диаграми за контрол на качеството.
5.7.5. Контрол на качеството на проби, съответстващи на изискванията
В зависимост от матричната проба и опита на лабораторията приблизително между 2 и 10 % от пробите, които съответстват на изискванията, трябва да бъдат потвърдени чрез GC-HRMS.
5.7.6. Определяне на дела на грешните резултати за съответствие въз основа на данните от контрола на качеството:
Определя се делът на фалшивите резултати за съответствие при скрининг на проби под и над максимално допустимото количество или прага. Действителният дял на фалшивите резултати за съответствие трябва да бъде под 5 %. Когато от контрола на качеството на съответстващите проби бъдат получени минимум 20 потвърдени резултата за всяка матрица/група матрици, въз основа на тази база данни се правят заключения относно дела на фалшивите резултати на съответствие. Резултатите от проби с диапазон на концентрацията например до 2 пъти максимално допустимото количество, анализирани при кръгови изследвания или при инциденти със замърсяване, също могат да бъдат включени в минимума от 20 резултата за оценка на дела на фалшивите резултати на съответствие. Пробите трябва да обхващат най-често срещаните модели на конгенери, които представляват различни източници.
Въпреки че целта на скрининг анализите трябва да бъде преди всичко откриването на проби, в които е надвишен прагът, критерият за определяне на дела на фалшивите резултати за съответствие е максимално допустимото количество, като се отчита неопределеността на измерването на метода за потвърждение.
5.7.7. Пробите със съмнение за несъответствие предвид резултатите, получени при скрининга, винаги се проверяват чрез пълен повторен анализ на оригиналната проба чрез метод за потвърждение. Тези проби могат да бъдат използвани също така за оценка на дела на фалшивите резултати за несъответствие. При скрининг методите делът на фалшивите резултати за несъответствие е частта от резултатите, потвърдени като съответстващи чрез потвърдителен анализ, като при предишен скрининг за пробата са били установени съмнения за несъответствие. Оценката на ползата от скрининг метода трябва да се основава на сравнение на пробите с фалшиво несъответствие с общия брой на проверените проби. Това съотношение трябва да бъде достатъчно ниско, за да може използването на скрининг метода да бъде от полза.
5.7.8. Биоаналитичните методи трябва да предоставят валидна индикация за нивото на TEQ, изчислено и изразено като BEQ, поне при валидирането.
Освен това при биоаналитичните методи, прилагани в условия на повторяемост, вътрешнолабораторното RSDr обикновено е по-малко от RSDR.в условия на възпроизводимост.
6. Специфични изисквания към методите gc-ms, които трябва да бъдат изпълнени за целите на скрининга или потвърждаването
6.1. Приемливи разлики между горнограничните и долнограничните резултати за WHO-TEQ
Разликата между горнограничното и долнограничното ниво не надвишава 20 % за потвърждение на надвишаването на максимално допустимото количество или при необходимост, на прага.
6.2. Контрол на аналитичния добив
6.2.1. За да се валидира аналитичната процедура, още в самото начало на аналитичния метод, например преди фазата на екстракция, се добавят вътрешни стандарти за PCDD/PCDF, маркирани с 13C и заместени с хлор на 2,3,7,8- позиции, както и вътрешни стандарти за диоксиноподобни РСВ, маркирани с 13C. Добавя се най-малко един конгенер за всяка от тетра- до октахлорираните хомоложни групи за PCDD/PCDF и най-малко един конгенер за всяка от хомоложните групи за диоксиноподобните РСВ (или най-малко един конгенер за всяка избрана йонозаписваща функция при масспектрометрията за наблюдение на PCDD/PCDF и диоксиноподобни РСВ). При методите за потвърждение се използват всички седемнадесет вътрешни стандарта за PCDD/PCDF, маркирани с 13C и заместени на 2,3,7,8- позиции, и всички дванадесет вътрешни стандарта за диоксиноподобни PCB, маркирани с 13C.
6.2.2. За конгенерите, за които не се добавя маркиран с 13C аналог, също трябва да се определят относителните фактори на отговор чрез използване на подходящи калибриращи разтвори.
6.2.3. За фуражи от растителен произход и фуражи от животински произход със съдържание на мазнини под 10 % добавянето на вътрешните стандарти трябва задължително да се извърши преди екстракцията. За фуражи от животински произход със съдържание на мазнини над 10 % вътрешните стандарти се добавят или преди, или след екстракцията на мазнините. Ефикасността на екстракцията трябва да бъде валидирана по подходящ начин в зависимост от етапа, на който са били добавени вътрешните стандарти, и от това дали резултатите са били отчетени за продукта или на база мазнини.
6.2.4. Преди анализа с GC-MS се прибавят един или два стандарта за аналитичния добив (сурогат).
6.2.5. Изисква се да се извършва контрол на аналитичния добив. При методите за потвърждение стойностите на аналитичния добив за отделните вътрешни стандарти трябва да бъдат в интервала от 60 % до 120 %. Допустими са по-ниски или по-високи проценти на аналитичен добив за отделни конгенери, по-специално определени хепта- и октахлорирани дибензо-р-диоксини и дибензофурани, при условие че участието им в стойността на TEQ не надхвърля 10 % от общата стойност на TEQ (на база сумата от PCDD/PCDF и диоксиноподобните PCB). За скрининг методите чрез GC-MS процентите за аналитичния добив следва да бъдат в интервала от 30 до 140 %.
6.3. Отстраняване на интерфериращи вещества
|
— |
Отделянето на PCDD/PCDF от интерфериращите хлорирани съединения като недиоксиноподобни PCB и хлорирани дифенилови етери се извършва чрез подходящи хроматографски техники (за предпочитане с флоризилова, алуминиева и/или въглеродна колона). |
|
— |
Отделянето на изомерите чрез газова хроматография трябва да бъде < 25 % от пик до пик между 1,2,3,4,7,8-HxCDF и 1,2,3,6,7,8-HxCDF. |
6.4. Калибриране чрез стандартна крива
Обхватът на калибрационната крива трябва да покрива съответния диапазон на максимално допустимите количества или праговете.
6.5. Специфични критерии по отношение на методите за потвърждение
|
— |
За GC-HRMS:
|
|
— |
За GC-MS/MS:
|
7. Специфични изисквания по отношение на биоаналитичните методи
Биоаналитичните методи са методи, основани на използването на биологични принципи като клетъчни анализи, рецепторни анализи или имуноанализи. В настоящата точка 7 се установяват изискванията по отношение на биоаналитичните методи като цяло.
По принцип при скрининг метода дадена проба се класифицира като съответстваща проба или като проба, за която има съмнение за несъответствие. За тази цел изчисленото ниво на BEQ се сравнява с граничната стойност (вж. точка 7.3). Пробите със стойност под граничната се определят като съответстващи, а за пробите със стойност, равна на граничната или над нея, има съмнение за несъответствие и се налага анализ чрез метод за потвърждение. На практика ниво на BEQ, което отговаря на 2/3 от максимално допустимото количество, може да послужи като гранична стойност, при условие че е осигурен дял на фалшивите резултати за съответствие под 5 % и приемлив дял на резултатите за фалшиво несъответствие. При различни максимално допустими количества за PCDD/PCDF и за сумата от PCDD/PCDF и диоксиноподобните PCB проверката на съответствието на проби без разделяне на части изисква биоанализът да има подходящи гранични стойности за PCDD/PCDF. За гранична стойност при проверката на пробите, които надвишават праговете, може да послужи подходящ процент от съответния праг.
Освен това при някои биоаналитични методи може да се определи ориентировъчно ниво, изразено в BEQ, за проби в рамките на работния обхват, които превишават границата на отчитане (вж. точки 7.1.1 и 7.1.6).
7.1. Оценка на отговора на изследването
7.1.1. Общи изисквания
|
— |
При изчисляване на концентрациите от калибрационна крива за TCDD стойностите в ниската и високата част на кривата ще показват висока вариация (висок коефициент на вариация (CV)). Работният обхват е областта, в която CV е под 15 %. Долната граница на работния обхват (границата на отчитане) трябва да бъде зададена на ниво поне три пъти над равнището при процедурите с празни проби. Горната граница на работния обхват обикновено се представя чрез стойност EC70 (70 % от максимална ефективна концентрация), но с по-ниска стойност, ако в този интервал CV е над 15 %. Работният обхват се определя по време на валидирането. Граничните стойности (вж. точка 7.3) трябва задължително да бъдат в рамките на работния обхват. |
|
— |
За стандартните разтвори и екстрактите от проби се провеждат поне два анализа. При повторните анализи стандартният разтвор или контролният екстракт, изследвани в 4 до 6 ямки, разпределени върху лабораторната плака, дават отговор или концентрация (възможно само в рамките на работния обхват) на база CV < 15 %. |
7.1.2. Калибриране
7.1.2.1. Калибриране чрез стандартна крива
|
— |
Нивата в пробите се оценяват чрез сравняване на отговора на изследването с калибрационна крива на TCDD (или PCB 126 или стандартна смес от PCDD/PCDF/диоксиноподобни PCB), за да се изчисли нивото на BEQ в екстракта, а след това и в пробата. |
|
— |
Калибрационните криви съдържат 8 до 12 концентрации (поне при повторните анализи) с достатъчно концентрации в долната част на кривата (работния обхват). Трябва да се обърне специално внимание на качеството на съответствието на кривата спрямо работния обхват. При оценката на степента на съответствие при нелинейна регресия стойността R2 като такава има малко или никакво значение. По-голямо съответствие се постига чрез свеждане до минимум на разликата между изчислените и наблюдаваните нива в работния обхват на кривата, например чрез свеждане до минимум на сбора от квадратите на остатъците. |
|
— |
Впоследствие оцененото ниво в екстракта от пробата се коригира за нивото на BEQ, изчислено за матрица/празна проба разтворител (за да се вземат предвид примесите от използваните разтворители и химикали), както и за експериментално измерения аналитичен добив (изчислено от нивото на BEQ на подходящи референтни проби с представителни модели на конгенерa около максимално допустимото количество или прага). За извършване на корекция за аналитичен добив експериментално измереният аналитичен добив трябва да бъде в рамките на необходимия обхват (вж. точка 7.1.4.). Референтните проби, които се използват за корекция за аналитичен добив, следва да отговарят на изискванията, посочени в точка 7.2. |
7.1.2.2. Калибриране с референтни проби
Като алтернатива може да се използва калибрационна крива, съставена въз основа на поне четири референтни проби (вж. точка 7.2.4: една празна проба от матрица плюс три референтни проби със стойност 0,5, 1 и 2 пъти нивото на максимално допустимото количество или прага), като така не се налага корекция за празна проба и за аналитичен добив. В този случай отговорът на изследването, съответстващ на 2/3 от максимално допустимото количество (вж. точка 7.3), може да бъде изчислен пряко от тези проби и да бъде използван като гранична стойност. За гранична стойност при проверката на пробите, които надвишават праговете, би могъл да се използва подходящ процент от тези прагове.
7.1.3. Отделно определяне на PCDD/PCDF и диоксиноподобните PCB
Екстрактите могат да бъдат разделени на части, съдържащи PCDD/PCDF и диоксиноподобни PCB, което позволява отчитане на нивата на ТЕQ (изразени като BEQ) поотделно за PCDD/PCDF и за диоксиноподобните PCB. За предпочитане е да се използва калибрационна крива със стандарт PCB 126 при оценката на резултатите за частта, която съдържа диоксиноподобни PCB.
7.1.4. Експериментално измерени аналитични добиви при биоанализ
„Експериментално измереният аналитичен добив при биоанализ“ се изчислява от подходящи референтни проби с представителни модели на конгенери около максимално допустимото количество или прага и се изразява като процент от нивото на BEQ спрямо нивото на ТЕQ. В зависимост от вида на анализа и на използваните TEF (10) разликите между факторите TEF и REP за диоксиноподобните PCB могат да доведат до ниски експериментално измерени аналитични добиви за диоксиноподобните PCB в сравнение с PCDD/PCDF. Следователно ако се извършва отделно определяне на PCDD/PCDF и на диоксиноподобните PCB, експериментално измереният аналитичен добив при биоанализ е: за диоксиноподобни PCB — от 20 до 60 %, за PCDD/PCDF — от 50 до 130 % (интервалите се прилагат за калибрационната крива за TCDD). Тъй като делът на диоксиноподобните PCB в сумата от PCDD/PCDF и диоксиноподобни PCB може да варира между различните матрици и проби, експериментално измереният аналитичен добив при биоанализ за сумата от PCDD/PCDF и диоксиноподобни PCB отразява тези разлики и трябва да бъде между 30 % и 130 %. Всяко отражение на преразгледаните в значителна степен стойности на TEF върху законодателството на Съюза, свързано с PCDD/PCDF и диоксиноподобните PCB, изисква преразглеждане на тези интервали.
7.1.5. Контрол на аналитичния добив при пречистване
Загубата на съединения по време на пречистването трябва да бъде проверена при валидирането. Празна проба, към която е добавена смес от различните конгенери, се подлага на пречистване (най-малко n = 3), а аналитичният добив и вариациите се проверяват чрез метод за потвърждение. Аналитичният добив трябва да бъде между 60 % и 120 % особено за конгенери, чийто дял в нивото на ТЕQ в различни смеси е над 10 %.
7.1.6. Граница на отчитане
При отчитане на равнищата на BEQ границата на отчитане се определя от съответните матрични проби, които включват типични модели на конгенери, а не от калибрационната крива на стандартите поради ниската прецизност в долната част на кривата. Взема се предвид въздействието на екстракцията и на пречистването. Границата на отчитане се установява поне три пъти над нивото при процедурите с празни проби.
7.2. Използване на референтни проби
7.2.1. Референтните проби представляват матрични проби, модели на конгенери и интервали на концентрация за PCDD/PCDF и диоксиноподобни PCB около максимално допустимото количество или прага.
7.2.2. Във всяка серия от изпитвания се включва празна проба от матрица, а когато това не е възможно — процедура с празна проба, както и референтна проба с ниво, равно на максимално допустимото количество или на прага. Тези проби се подлагат на екстракция и се изследват по едно и също време при еднакви условия. Референтната проба следва да покаже много по-ясен отговор в сравнение с празната проба, като по този начин се гарантира пригодността на изпитването. Тези проби могат да се използват за корекция за празна проба и за аналитичен добив.
7.2.3. Референтните проби, които са избрани за корекция за аналитичен добив, трябва да бъдат представителни по отношение на пробите за изпитване, което означава, че моделите на конгенерите не може да водят до подценяване на нивата.
7.2.4. При контрола на максимално допустимото количество или прага могат да се включат допълнителни референтни проби със стойности например 0,5 и 2 пъти стойността на максимално допустимото количество или прага с цел установяване ефективността на изпитването в интервала от значение. Съчетани, тези проби могат да се използват за изчисляване на равнищата на BEQ в пробите за изпитване (вж. точка 7.1.2.2).
7.3. Определяне на гранични стойности
Установява се връзката между биоаналитичните резултати, изразени в BEQ, и резултатите от методите за потвърждение, изразени в ТЕQ,например чрез калибрационни експерименти, при които се отчита влиянието на матрицата върху калибрационните прави и които включват референтни проби с добавка 0, 0,5, 1 и 2 пъти максимално допустимото количество с 6 повторения на всяко ниво (n = 24). Факторите за корекция (за празна проба и за аналитичен добив) могат да бъдат оценени въз основа на посочената връзка, но те трябва да бъдат проверявани в съответствие с точка 7.2.2.
Граничните стойности се установяват с оглед вземане на решение за съответствието на пробите спрямо максимално допустимите количества или за контрол на праговете, ако е от значение, като съответните максимално допустими количества или прагове се задават или поотделно за PCDD/PCDF и за диоксиноподобните PCB, или за сумата от PCDD/PCDF и диоксиноподобните PCB. Тези стойности са представени чрез долната крайна точка на разпределението на биоаналитичните резултати (коригирани за празна проба и за аналитичен добив), съответстваща на критичната граница при метода за потвърждение въз основа на 95-процентна доверителна вероятност, което предполага процент на фалшивите резултати за съответствие < 5 %, и при RSDR < 25 %. Критичната граница при метода за потвърждение е максимално допустимото количество, като се отчита неопределеността на измерването.
Граничната стойност (изразена в BEQ) може да бъде изчислена в съответствие с някой от подходите, изложени в точки 7.3.1, 7.3.2 и 7.3.3 (вж. графика 1).
7.3.1. Използване на долната граница на 95-процентния интервал на предвиждане при критична граница при метода за потвърждение:

където:
|
BEQDL |
BEQ съответства на критичната граница при метода за потвърждение, която представлява максимално допустимото количество при отчитане на неопределеността на измерването |
|
sy,x |
остатъчно стандартно отклонение |
|
t α,f = m-2 |
коефициент на Стюдънт (α = 5 %, f = степени на свобода, едностранни) |
|
m |
общ брой калибрационни точки (индекс j) |
|
n |
брой повторения на всяко ниво |
|
xi |
Концентрация на пробата (изразена в TEQ) в калибрационна точка i, определена чрез метода за потвърждение |
|
|
средна стойност на концентрациите (изразена в TEQ) на всички калибрационни проби |
|
|
параметър за сумата на квадрат, i = индекс за калибрационна точка i |
7.3.2. Изчисляване въз основа на биоаналитични резултати (коригирани за празна проба и за аналитичен добив) от множество анализи на проби (n≥ 6), замърсени на нивото на критичната граница при метода за потвърждение, като долната крайна точка на разпределението на данните при съответната осреднена стойност на BEQ:
Гранична стойност = BEQDL – 1.64 × SDR
където:
|
SDR |
стандартно отклонение на резултатите на биоанализа при BEQDL, измерено в условия на вътрешнолабораторна възпроизводимост |
7.3.3. Изчисляване като средна стойност на биоаналитични резултати (изразени в BEQ, коригирани за празна проба и за аналитичен добив) от множество анализи на проби (n≥ 6), замърсени на ниво 2/3 от максимално допустимото количество или прага, като се има предвид наблюдението, че това ниво ще бъде около граничната стойност, определена съгласно точка 7.3.1 или 7.3.2.:
Графика 1
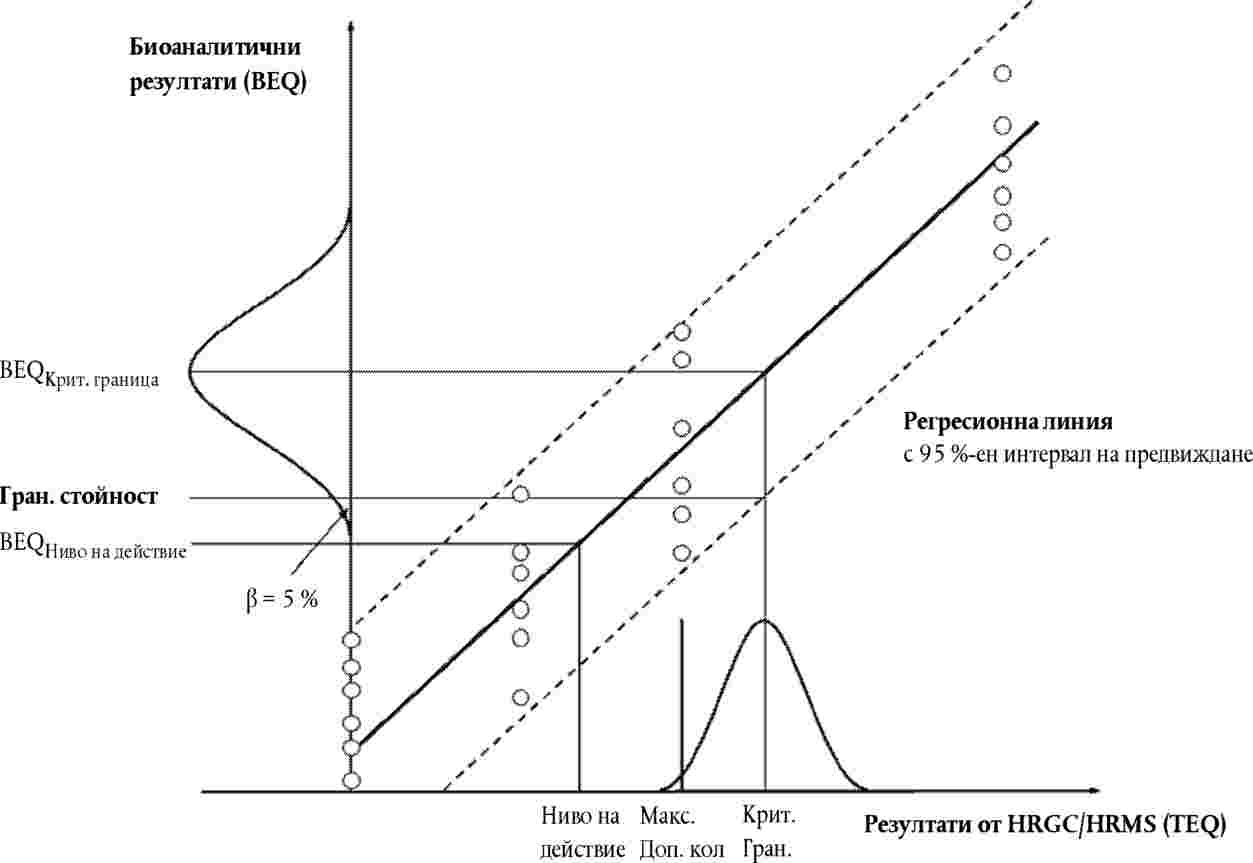
Графика 1. Изчисляване на гранични стойности въз основа на 95-процентна доверителна вероятност, при което делът на фалшивите резултати на съответствие е < 5 %, а RSDR е < 25 %:
|
1. |
от долната граница на 95-процентния интервал на предвиждане при критичната граница при метода за потвърждение |
|
2. |
от множество анализи на проби (n≥ 6), замърсени на нивото на критичната граница при метода за потвърждение, като долната крайна точка на разпределението на данните (представен на графиката чрез камбановидна крива) при съответната осреднена стойност на BEQ. |
7.3.4. Ограничения за граничните стойности:
Граничните стойности на база BEQ, които са изчислени от RSDR, постигнато по време на валидирането при използване на ограничен брой проби с различни модели на матриците/конгенерите, могат да бъдат по-високи от максимално допустимите количества или праговете на база ТЕQ поради по-голямата прецизност в сравнение с постиганата при рутинни условия, при които трябва да се контролира неизвестен спектър от възможни модели на конгенери. В такива случаи граничните стойности се изчисляват при RSDR = 25 % или, за предпочитане — на две трети от максимално допустимото количество или прага.
7.4. Характеристики за ефективност
7.4.1. Тъй като при биоаналитичните методи не могат да се използват вътрешни стандарти, за да се получат данни за стандартното отклонение в рамките на изпитванията и между различните серии изпитвания, се извършват изпитвания за повторяемост на биоаналитичните методи. Повторяемостта трябва да бъде под 20 %, а вътрешнолабораторната възпроизводимост — под 25 %. Това се базира на изчислените като BEQ нива след корекция за празна проба и за аналитичен добив.
7.4.2. Като част от процеса на валидиране следва да се докаже, че чрез изследването се постига разграничаване между празна проба и ниво, равно на граничната стойност, което позволява да се идентифицират пробите над съответната гранична стойност (вж. точка 7.1.2).
7.4.3. Определят се целевите съединения, възможните интерференции, както и максимално допустимите количества в празната проба.
7.4.4. Процентното стандартно отклонение в отговора или в концентрацията, изчислена от отговора (възможно само в работния обхват) при трикратно определяне на екстракт от проба, не може да надхвърля 15 %.
7.4.5. Некоригираните резултати от референтната/референтните проба/проби, изразени в BEQ (празна проба и на нивото на максимално допустимото количество или на прага), се използват за оценка на ефективността на биоаналитичния метод спрямо постоянен период от време.
7.4.6. За да се гарантира, че анализите се провеждат в съответствие с изискванията, се регистрират и проверяват диаграми за контрол на качеството за процедурите с празни проби, както и за всеки вид референтна проба; за процедурите с празни проби по-специално това се извършва по отношение на изискваната минимална разлика спрямо ниската част на работния обхват, а за референтните проби — по отношение на вътрешнолабораторната възпроизводимост. Процедурите с празни проби се контролират стриктно, за да се избегнат фалшиви резултати за съответствие при приспадането.
7.4.7. Получените чрез методите за потвърждение резултати на проби, за които има съмнение за несъответствие, както и 2 % — 10 % от съответстващите на изискванията проби (минимум 20 проби за матрица) се събират и се използват за оценка на ефективността на скрининг метода и на връзката между BEQ и ТЕQ. Тази база данни може да бъде използвана за повторната оценка на граничните стойности, които се прилагат при рутинните проби за валидираните матрици.
7.4.8. Ефикасността на метода може да бъде доказана също и чрез участие в кръгови изпитвания. Резултатите от пробите с концентрация например до 2 пъти максимално допустимото количество, анализирани при кръговите изпитвания, също могат да бъдат включени при оценяването на дела на фалшивите резултати за съответствие, ако лабораторията докаже своята ефективност. Пробите трябва да обхващат най-често срещаните модели на конгенери, които представляват различни източници.
7.4.9. При инциденти граничните стойности могат да бъдат подлагани на преоценка, която да отрази специфичната матрица и модела на конгенера при конкретния инцидент.
8. Представяне на резултатите
8.1. Методи за потвърждение
8.1.1. Доколкото позволява аналитичната процедура, резултатите от анализа следва да включват количествата на отделните конгенери на PCDD/PCDF и диоксиноподобни PCB и да се отбелязват като долна граница, горна граница и средна граница с цел да се включи максимално възможната информация при изразяването на резултатите, позволяваща интерпретирането им в съответствие със специфичните изисквания.
8.1.2. Отчетът включва информация за метода, използван при екстракцията на PCDD/PCDF и диоксиноподобните PCB.
8.1.3. Данните за аналитичния добив за отделните вътрешни стандарти се представят в случаите, в които аналитичният добив е извън обхвата, посочен в точка 6.2.5, когато максимално допустимото количество е надвишено (в този случай — аналитичния добив за един от двата повторни анализа) или в други случаи при поискване.
8.1.4. Тъй като при установяването на съответствието на пробата неопределеността на измерването трябва да бъде взета предвид, този параметър трябва да бъде представен. Така аналитичните резултати трябва да бъдат представени като х +/– U, където х е аналитичният резултат, а U — разширената неопределеност на измерването, като се използва фактор на покриване 2, който дава доверителна вероятност приблизително 95 %. В случай че PCDD/PCDF и диоксиноподобните PCB се определят поотделно, за разширената неопределеност на сумата от PCDD/PCDF и диоксиноподобните PCB се използва сумата от оценената разширена неопределеност на отделните резултати от анализа на PCDD/PCDF и на диоксиноподобните PCB.
8.1.5. Ако неопределеността на измерването се взема предвид чрез прилагане на ССα (както е описано в настоящата част Б, глава I, точка 2.2), този параметър трябва да бъде представен.
8.1.6. Резултатите трябва да бъдат изразени в същите единици и най-малко със същия брой значещи цифри като определените в Директива 2002/32/ЕО максимално допустими количества.
8.2. Биоаналитични скрининг методи
8.2.1. Резултатът от скрининга се представя като „съответства“ или „със съмнение за несъответствие“.
8.2.2. В допълнение резултатът за PCDD/PCDF и/или за диоксиноподобните PCB може да се представи като изразен в BEQ, а не в ТЕQ.
8.2.3. Пробите, чийто отговор е под границата на отчитане, се представят като „проби под границата на отчитане“.
8.2.4. За всеки тип матрична проба в отчета се посочва максимално допустимото количество или прага, на което/който се базира оценката.
8.2.5. В отчета се посочва видът на използваното изследване, принципът, на който той се базира, както и видът на калибрирането.
8.2.6. Отчетът включва информация за метода, използван при екстракцията на PCDD/PCDF и диоксиноподобните PCB.
8.2.7. При проби, за които има съмнение за несъответствие, отчетът трябва да включва бележка относно действията, които да бъдат предприети. Концентрацията на PCDD/PCDF и сумата от PCDD/PCDF и диоксиноподобните PCB в пробите с повишени количества трябва да бъдат определени/потвърдени чрез метод за потвърждение.
ГЛАВА III
Подготовка на пробите и изисквания към методите за анализ, използвани при официалния контрол на съдържанието на недиоксиноподобни PCB (PCB № 28, 52, 101, 138, 153, 180)
1. Приложно поле
Посочените в настоящата глава изисквания се прилагат за анализа на фуражите за целите на официалния контрол на нивата на недиоксиноподобни полихлорирани бифенили (недиоксиноподобни PCB) и за други регулаторни цели.
2. Приложими методи за откриване
Газова хроматография/Електроноулавяща детекция (GC/ECD), GC-LRMS, GC-MS/MS, GC/HRMS или еквивалентни методи.
3. Идентифициране и потвърждаване на аналитите от значение
3.1. Време на относително задържане спрямо вътрешните стандарти или референтните стандарти (допустимо отклонение от +/- 0,25 %).
3.2. Отделяне посредством газова хроматография на всички шест индикаторни PCB (PCB 28, PCB 52, PCB 101, PCB 138, PCB 153 и PCB 180) от интерфериращите вещества, по-специално съвместно елуиращи PCB, особено ако количествата в пробите са в рамките на законово установените ограничения и несъответствието трябва да бъде потвърдено.
[Конгенери, за които е установено, че често елуират съвместно, са например PCB 28/31, PCB 52/69 и PCB 138/163/164. При GC-MS трябва да се вземат предвид и възможните интерференции, причинени от фрагменти от конгенери с по-високо съдържание на хлор.]
3.3. Изисквания към техниките GC-MS
Наблюдение най-малко на:
|
а) |
два специфични йона за HRMS; |
|
б) |
два специфични йона при m/z > 200 или три специфични йона при m/z > 100 за LRMS; |
|
в) |
1 прекурсор и 2 производни йона за MS-MS. |
Максимално допустим толеранс за интензитетното съотношение за избраните масови фрагменти:
Относително отклонение на интензитетното съотношение на избрани масови фрагменти от теоретичния интензитет или калибрационния стандарт за базовия йон (най-силно присъстващия наблюдаван йон) и за потвърдителния/потвърдителните йон/йони:
|
Относителен интензитет на потвърдителния/ите йон/и в сравнение с базовия йон |
GC-EI-MS (относително отклонение) |
GC-CI-MS, GC-MSn (относително отклонение) |
|
> 50 % |
± 10 % |
± 20 % |
|
> 20 % до 50 % |
± 15 % |
± 25 % |
|
> 10 % до 20 % |
± 20 % |
± 30 % |
|
≤ 10 % |
± 50 % (11) |
± 50 % (11) |
3.4. Изисквания към техниките GC-ECD
Резултатите, които надхвърлят толеранса, трябва да бъдат потвърдени с две GC колони с неподвижни фази с различна полярност.
4. Доказване на ефективността на метода
Ефективността на метода се валидира в диапазона на максимално допустимото количество (от 0,5 до 2 пъти максимално допустимото количество) с приемлив коефициент на вариация за повтарящите се анализи (вж. изисквания за междинна прецизност в точка 9).
5. Граница за количествено определяне
Стойностите от изпитвания на празни проби не трябва да бъдат над 30 % от нивото на замърсяване, съответстващо на максималната граница (12).
6. Контрол на качеството
Редовни контролни изпитвания на празни проби, анализ на проби с добавка на референтен материал, проби за контрол на качеството, участие в междулабораторни изследвания за съответните матрици.
7. Контрол на аналитичния добив
7.1. Използват се подходящи вътрешни стандарти с физикохимични свойства, сравними с тези на аналитите от значение.
7.2. Добавяне на вътрешни стандарти:
Добавяне към продукти (преди екстракцията и пречистването).
7.3. Изисквания към методите, при които се използват всички шест изотопно белязани конгенери на индикаторни PCB:
|
а) |
резултатите се коригират за аналитичен добив при вътрешни стандарти; |
|
б) |
аналитичният добив при изотопно белязани вътрешни стандарти е между 50 и 120 %; |
|
в) |
допустима е по-ниска или по-висока степен на аналитичен добив за отделни конгенери, при които участието в сумата от шестте индикаторни PCB е под 10 %. |
7.4. Изисквания към методите, при които не всички шест изотопно белязани вътрешни стандарта се използват, или при които се използват други вътрешни стандарти:
|
а) |
възстановяването при вътрешния/вътрешните стандарт/стандарти се контролира за всяка проба; |
|
б) |
възстановяването при вътрешния/вътрешните стандарт/стандарти е между 60 и 120 %; |
|
в) |
резултатите се коригират за аналитичен добив при вътрешни стандарти |
7.5. Аналитичният добив при небелязани конгенери се проверява чрез проби с добавен референтен материал или проби за контрол на качеството с концентрации в диапазона на максимално допустимото количество. Аналитичният добив за посочените конгенери се счита за приемлив, когато е между 70 и 120 %.
8. Изисквания към лабораториите
В съответствие с разпоредбите на Регламент (ЕО) № 882/2004 лабораториите трябва да бъдат акредитирани от признат орган, действащ в съответствие с Ръководство 58 на ISO, с цел да се гарантира осигуряване на качеството при анализите. Лабораториите трябва да бъдат акредитирани в съответствие със стандарт EN ISO/IEC 17025.
9. Характеристики за ефективност: критерии за сумата от шестте индикаторни PCB на нивото на максимално допустимото количество
|
Истинност |
– 30 % до + 30 % |
|
Междинна прецизност (% RSD) |
≤ 20 % |
|
Разлика между изчислението за горна и долна граница |
≤ 20 % |
10. Представяне на резултатите
10.1. Доколкото аналитичната процедура позволява, резултатите от анализа трябва да включват нивата на отделните конгенери на PCB и да бъдат представени като долна граница, горна граница и средна граница с цел при представянето им да бъде включена възможно най-много информация, което да позволи тълкуване в съответствие със специфични изисквания.
10.2. Отчетът трябва да включва данни за метода, използван за екстракция на PCB и на мазнини.
10.3. Данните за аналитичния добив за отделните вътрешни стандарти се представят в случаите, в които аналитичният добив е извън обхвата, посочен в точка 7, когато максимално допустимото количество е надвишено или в други случаи при поискване.
10.4. Тъй като при установяването на съответствието на пробата неопределеността на измерването трябва да бъде взета предвид, този параметър трябва също да бъде представен. Така аналитичните резултати трябва да бъдат представени като х +/– U, където х е аналитичният резултат, а U — разширената неопределеност на измерването, като се използва фактор на покриване 2, който дава доверителна вероятност приблизително 95 %.
10.5. Ако неопределеността на измерването се взема предвид чрез прилагане на ССα (както е описано в глава I, точка 2.1), този параметър трябва да бъде представен.
10.6. Резултатите трябва да бъдат изразени в същите единици и най-малко със същия брой значещи цифри като определените в Директива 2002/32/ЕО максимално допустими количества.
(9) Спрямо максимално допустимите количества.
(11) Налице е достатъчен брой масови фрагменти с относителен интензитет > 10 %, следователно не е препоръчително използването на потвърдителния/потвърдителните йон/йони с относителен интензитет, по-малък от 10 % в сравнение с целевия йон.