
|
03/ 68 |
BG |
Официален вестник на Европейския съюз |
3 |
32005R2074
|
L 338/27 |
ОФИЦИАЛЕН ВЕСТНИК НА ЕВРОПЕЙСКИЯ СЪЮЗ |
РЕГЛАМЕНТ (ЕО) № 2074/2005 НА КОМИСИЯТА
от 5 декември 2005 година
за установяване на мерки за прилагане по отношение на някои продукти съгласно Регламент (ЕО) № 853/2004 на Европейския парламент и на Съвета и по отношение на организацията на официалния контрол съгласно Регламент (ЕО) № 854/2004 на Европейския парламент и на Съвета и Регламент (ЕО) № 882/2004 на Европейския парламент и на Съвета, за дерогиране от Регламент (ЕО) № 852/2004 на Европейския парламент и на Съвета и за изменение на Регламенти (ЕО) № 853/2004 и (ЕО) № 854/2004
(текст от значение за ЕИП)
КОМИСИЯТА НА ЕВРОПЕЙСКИТЕ ОБЩНОСТИ,
като взе предвид Договора за създаване на Европейската общност,
като взе предвид Регламент (ЕО) № 852/2004 на Европейския парламент и на Съвета от 29 април 2004 г. относно хигиената на храните (1), и по-специално член 13, параграф 2 от него,
като взе предвид Регламент (ЕО) № 853/2004 на Европейския парламент и на Съвета от 29 април 2004 г. относно определяне на специфични хигиенни правила за храните от животински произход (2), и по-специално членове 9, 10 и 11 от него,
като взе предвид Регламент (ЕО) № 854/2004 на Европейския парламент и на Съвета от 29 април 2004 г. относно определяне на специфичните правила за организирането на официален контрол върху продуктите от животински произход, предназначени за човешка консумация (3), и по-специално членове 16, 17 и 18 от него,
като взе предвид Регламент (ЕО) № 882/2004 на Европейския парламент и на Съвета от 29 април 2004 г. относно официалния контрол, провеждан с цел осигуряване на проверка на съответствието със законодателството в областта на фуражите и храните и правилата за опазване здравето на животните и хуманното отношение към животните (4), и по-специално член 63 от него,
като има предвид, че:
|
(1) |
Регламент (ЕО) № 853/2004 установява специфични изисквания по отношение на правилата на хигиената за храните от животински произход. Необходимо е да се установят определени мерки за прилагане за месо, живи двучерупчести мекотели, рибни продукти, мляко, яйца, жабешки бутчета и охлюви и преработени продукти от тях. |
|
(2) |
Регламент (ЕО) № 854/2004 установява специфични правила за организацията на официален контрол на продукти от животински произход, предназначени за консумация от човека. Необходимо е да се разработят определени правила и по-нататък да се специфицират други изисквания. |
|
(3) |
Регламент (ЕО) № 882/2004 определя на общностно равнище хармонизирана рамка от общи правила за организацията на официалния контрол. Необходимо е да се разработят определени правила и по-нататък да се специфицират други изисквания. |
|
(4) |
Решение 20XX/…/ЕО на Комисията (5) отменя някои решения за изпълнение на мерките, предвидени в директивите, отменени с Директива 2004/41/ЕО на Европейския парламент и на Съвета от 21 април 2004 г. за отмяна на някои директиви, отнасящи се до хигиената на храните и здравните условия при производството и пускането на пазара на някои продукти от животински произход, предназначени за консумация от човека, и за изменение на Директиви 89/662/ЕИО и 92/118/ЕИО на Съвета и Решение 95/408/ЕО на Съвета (6). Някои части на свързаните решения бе следвало поради това да бъдат задържани в настоящия регламент. |
|
(5) |
Регламент (ЕО) № 852/2004 изисква бизнес операторите на храни да поддържат и съхраняват записи и при поискване да предоставят на разположение съответната информация в тези записи на компетентните органи и получаващия бизнес оператор на храна. |
|
(6) |
Регламент (ЕО) № 853/2004 също изисква операторът на кланица да изисква, получава, проверява и да действува по информация за хранителната верига за всички животни, различни от див дивеч, изпратен или предназначен да бъде изпратен в кланицата. Освен това той следва да осигури, че информацията за хранителната верига предвижда всички подробности, които се изискват съгласно Регламент (ЕО) № 853/2004. |
|
(7) |
Информацията за хранителната верига подпомага оператора на кланицата да организира кланичните операции и да подпомага официалния ветеринарен лекар да определи изискваните процедури за инспекция. Информацията за хранителната верига следва да бъде анализирана от официалния ветеринарен лекар и използвана като неделима част от процедурите за инспекция. |
|
(8) |
Съществуващите системи за информационен поток следва да бъдат използвани, колкото е възможно, и адаптирани, за да съответстват на изискванията за информацията за хранителната верига, установен в Регламент (ЕО) № 854/2004. |
|
(9) |
За да се подобри управлението на животните на равнище стопанство и в съответствие с Регламент (ЕО) № 854/2004, официалният ветеринарен лекар следва да записва и, ако е необходимо, да съобщава на бизнес оператора на храни на стопанството, от което произхождат животните, и на всеки ветеринарен лекар, посещаващ стопанството, от което са доставени животните или на всеки участващ в процеса компетентен орган, за всяка болест или наблюдавано условие в кланицата по отношение на отделни животни или стадото/птичето стадо и която може да се отрази неблагоприятно върху общественото здраве или здравето на животните или застрашава благосъстоянието на животните. |
|
(10) |
Регламенти (ЕО) № 853/2004 и (ЕО) № 854/2004 установяват изискванията, които регулират проверките за паразити по време на обработване на рибни продукти на брега или на борда на корабите. От бизнес операторите на храни зависи да извършват свои собствени проверки на всички етапи от производството на рибни продукти в съответствие с правилата в глава V, точка Г от раздел VIII на приложение III към Регламент (ЕО) № 853/2004, така че риба, която очевидно е заразена с паразити, да не се пуска на пазара за консумация от човека. Приемането на подробни правила, отнасящи се до визуални инспекции, пораждат концепциите за видими паразити и визуална инспекция да бъде дефинирана и видът и честотата на наблюденията да бъдат определени. |
|
(11) |
Проверките, предвидени в Регламент (ЕО) № 853/2004 с цел да предотвратят предлагане на пазара на рибни продукти, които не са годни за консумация от човека, могат да включват някои химични проверки, включително проверки за общ летлив основен азот (TVB-N). Необходимо е да се установят нивата на TVB-N, които не трябва да бъдат превишавани в случай на определени видове категории и да се специфицират методи за анализ, които трябва да се използват. Методите за анализ, които са научно признати за проверка на TVB-N, следва да продължат да бъдат ползвани като рутинен начин, но референтният метод следва да бъде точно определен за използване, когато съществува съмнение относно резултатите или в случай на спор. |
|
(12) |
Ограниченията за паралитична отрова от черупчести мекотели (PSP), амнезна отрова на черупчести мекотели (ASP) или липофилни токсини са установени в Регламент (ЕО) № 853/2004. Биообразци са референтния метод за откриване на определени токсини и предотвратяване събирането на отровни черупчести мекотели. Максималните нива и методи на анализ следва да бъдат хармонизирани и изпълнявани от държавите-членки за опазване здравето на човека. В допълнение към биологичните методи за тестване би следвало да бъдат разрешени алтернативни методи за откриване, като химични методи и in vitro образци за анализ, ако е показано, че представянето на избраните методи е най-малко толкова ефективно, колкото и биологичния метод, и че тяхното изпълнение осигурява еквивалентно ниво на опазване на общественото здраве. Предложените максимални нива на липофилни токсини са основани на предварителни данни и следва да бъдат оценени отново, след като стане достъпно ново научно доказателство. Липсата на референтен материал и единственото използване на небиологични образци за тестове понастоящем означава, че нивото на предвиденото опазване на общественото здраве по отношение на всички специфични токсини не е еквивалентно на това, достъпно чрез биологични тестове. Следва да бъде приета разпоредба за заместване на биологичните тестове колкото е възможно по-скоро. |
|
(13) |
Механично отделеното месо (MОМ), произведено чрез използване на техники, които не променят структурата на използваните кости при производството на МОМ, следва да бъде обработено различно от МОМ, произведено чрез използване на техники, които променят структурата на костите. |
|
(14) |
МОМ от предишния вид, произведено при точно определени условия и специфицирано съдържание, следва да бъде разрешено за използване в месни заготовки, за които е ясно, че не са предназначени за консумация, без първоначално да са подложени на топлинна обработка. Тези условия са свързани, по-специално със съдържанието на калций в МОМ, което следва да бъде определено в съответствие с член 11, параграф 2 от Регламент (ЕО) № 853/2004. Коригиране следва да бъде направено към специфицираното максимално съдържание на калций, установено в настоящия регламент, след като веднъж е налична подробна информация относно появяващите се вариации, където се използват различни видове суровина. |
|
(15) |
Член 31, параграф 2, буква е) от Регламент (ЕО) № 882/2004 предвижда държавите-членки да поддържат актуализирани списъци с одобрените предприятия. Обща рамка следва да бъде установена за представянето на свързана информация на други държави-членки и на обществеността. |
|
(16) |
Раздел XI от приложение III към Регламент (ЕО) № 853/2004 установява изискванията, регулиращи приготвянето на жабешки бутчета и охлюви, предназначени за консумация от човека. Специфични изисквания, включително образец за здравни сертификати, следва да бъдат определени за вноса от трети страни на жабешки бутчета и охлюви, предназначени за консумация от човека. |
|
(17) |
Раздели XIV и XV от приложение III към Регламент (ЕО) № 853/2004 определят правила относно производството и пускането на пазара на желатин и колаген, предназначени за консумация от човека. Специфични изисквания, включително образец на здравни сертификати, следва също да бъдат установени за вноса от трети страни на желатин и колаген и на суровини за производство на желатин и колаген, предназначени за консумация от човека. |
|
(18) |
Необходима е гъвкавост, така че храните с традиционни характеристики да могат да продължават да бъдат произвеждани. Държавите-членки вече предоставиха дерогации за широк обхват от такива храни в законодателството, което е в сила преди 1 януари 2006 г. Бизнес операторите на храни следва да са в състояние да продължат без прекъсване да прилагат съществуващите практики след тази дата. Процедура, позволяваща на държавите-членки да прилагат гъвкавост, е предвидени в Регламенти (ЕО) № 852/2004, (ЕО) № 853/2004 и (ЕО) № 854/2004. Въпреки това в повечето случаи, където такива дерогации вече са предоста вени, е въпрос само на продължаване на установените практики, така че прилагането на пълна процедура за нотифициране, включително и пълен анализ на опасността, може да създаде ненужна и непропорционална тежест за държавите-членки. Следователно храните с традиционни характеристики трябва да бъдат определени и общите условия, приложими за такива храни, да бъдат установени чрез дерогация от структурните изисквания, определени в Регламент (ЕО) № 852/2004, с необходимото вземане под внимание на здравните цели за безопасност на храните. |
|
(19) |
Тъй като Регламенти (ЕО) № 853/2004 и (ЕО) № 854/2004 бяха приети преди присъединяването от 1 май 2004 г., те не се отнасяха за новите държави-членки. Кодовете по ISO за тези държави-членки и съкращенията за Европейската общност на техните езици следователно трябва да бъдат добавени към съответните разпоредби от тези регламенти. |
|
(20) |
Раздел I от приложение III към Регламент (ЕО) № 853/2004 установява правила относно производството и пускането на пазара на месо от домашни еднокопитни животни. Изключенията от цялостно одиране на каркасите и други части на тялото, предназначени за консумация от човека, са посочени в глава IV, точка 8 от упоменатия раздел. Разпоредба, която да разшири тези изключения по отношение на крака на възрастни животни от рода на едрия рогат добитък, следва да бъде приета, при условие че те отговарят на същите условия, както тези, приложени по отношение на крака от телета. |
|
(21) |
Някои практики могат да заблудят консуматора по отношение на състава на някои продукти. И по-специално, за да не се разочароват очакванията на потребителите, продажбата на месо, обработено с водозадържащи агенти, като прясно птиче месо, следва бъде забранена. |
|
(22) |
Становището на Европейския орган по безопасност на храните, прието на 30 август 2004 г., показа, че рибни продукти, принадлежащи към семейства Gempylidae, и по-специално Ruvettus pretiosus и Lepidocybium flavobrunneum, могат да имат вредно гастроентерологично въздействие, ако се консумират при определени условия. Следователно рибните продукти, принадлежащи към това семейство, трябва да бъдат предмет на условията за търговия. |
|
(23) |
Раздел IX от приложение III към Регламент (ЕО) № 853/2004 установява специфични правила за хигиена на суровото мляко и млечните продукти. Съгласно част II, точка Б, точка 1, буква e) от глава I чашки или други продукти за почистване на вимето могат да бъдат използвани само ако са одобрени от компетентния орган. Въпреки това никаква подробна разрешителна схема не е предвидени в тази част. Следователно е необходимо, за да се гарантира хармонизиран подход от държави-членки, да се изяснят процедурите, при които такива разрешения следва да бъдат предоставяни. |
|
(24) |
Регламент (ЕО) № 853/2004 изисква бизнес операторите на храни да гарантират, че използваните топлинни обработки за преработка на сурово мляко и млечни продукти отговарят на международно признат стандарт. Въпреки това поради спецификата на някои топлинни обработки, използвани в този сектор, и тяхното въздействие върху безопасността на храните и здравето на животните, следва на бизнес операторите с храни да се даде по-ясно указание в това отношение. |
|
(25) |
Регламент (ЕО) № 853/2004 въвежда нова дефиниция, обхващаща продукти, получени от яйца, които след отстраняване на черупката, все още не са преработени. Следователно е необходимо да се изяснят правилата, приложими по отношение на тези продукти и да се измени съответно раздел X, глава II от приложение III към Регламент (ЕО) № 853/2004. |
|
(26) |
Раздел XIV от приложение III към Регламент (ЕО) № 853/2004 установява специфични здравни правила за желатин. Тези правила включват изисквания, обхващащи вида на суровините, които могат да бъдат използвани за производство на желатин и транспортирането и съхранението на такива материали. Те също установяват спецификации, приложими при производството на желатин. Въпреки това правилата, които се прилагат по отношение на етикетиране на желатин, следва да бъдат установени. |
|
(27) |
Научният прогрес доведе до създаването на ISO 16649-3 като един съгласуван за позоваване метод за анализ на E. coli в двучерупчести мекотели. Този референтен метод вече е създаден за живи двучерупчести мекотели от зони A в съответствие с Регламент (ЕО) № 2073/2005 на Комисията относно микробиологични критерии за хранителни продукти (7). Следователно ISO 16649-3 трябва да бъде специфициран като референтен MPN (най-вероятно число) метод за анализ на E. coli в двучерупчести мекотели с произход от зони Б и В. Използването на алтернативни методи следва да бъде разрешено само ако те се считат за еквивалентни на референтния метод. |
|
(28) |
Регламенти (ЕО) № 853/2004 и № 854/2004 следва да бъдат съответно изменени. |
|
(29) |
Мерките, предвидени в настоящия регламент, са в съответствие със становището на Постоянния комитет по хранителната верига и здравето на животните, |
ПРИЕ НАСТОЯЩИЯ РЕГЛАМЕНТ:
Член 1
Изисквания относно информация за хранителната верига по смисъла на Регламенти (ЕО) № 853/2004 и (ЕО) № 854/2004
Изискванията, отнасящи се до информация за хранителната верига, както са посочени в раздел III от приложение II към Регламент (ЕО) № 853/2004 и в глава II, точка A от раздел I на приложение I към Регламент (ЕО) № 854/2004, са установени в приложение I към настоящия регламент.
Член 2
Изисквания, относно рибни продукти по смисъла на Регламенти (ЕО) № 853/2004 и (ЕО) № 854/2004
Изискванията, отнасящи се до рибни продукти, както е посочено в член 11, параграф 9 от Регламент (ЕО) № 853/2004 и член 18, параграфи 14 и 15 от Регламент (ЕО) № 854/2004, са установени в приложение II към настоящия регламент.
Член 3
Признати методи за изпитване на морски биотоксини по смисъла на Регламенти (ЕО) № 853/2004 и (ЕО) № 854/2004
Признатите методи за тестване за откриване на морски биотоксини, както са посочени в член 11, параграф 4 от Регламент (ЕО) № 853/2004 и член 18, параграф 13, буква a) от Регламент (ЕО) № 854/2004, са установени в приложение III към настоящия регламент.
Член 4
Съдържание на калций в механично отделено месо по смисъла на Регламент (ЕО) № 853/2004
Съдържанието на калций в механично отделено месо, както е посочено в член 11, параграф 2 от Регламент (ЕО) № 853/2004, е определено в приложение IV към настоящия регламент.
Член 5
Списък с предприятията по смисъла на Регламент (ЕО) № 882/2004
Изискванията, отнасящи се до списъци с предприятия, както са посочени в член 31, параграф 2, буква е) от Регламент (ЕО) № 882/2004, са посочени в приложение V към настоящия регламент.
Член 6
Образец на здравни сертификати за жабешки бутчета, охлюви, желатин и колаген по смисъла на Регламент (ЕО) № 853/2004
Образецът за здравни сертификати за внос на жабешки бутчета, охлюви, желатин и колаген, както са посочени в член 6, параграф 1, буква г) от Регламент (ЕО) № 853/2004 и на суровини за производството на желатин и колаген, са посочени в приложение VI към настоящия регламент.
Член 7
Дерогация от Регламент (ЕО) № 852/2004 за храни с традиционни характеристики
1. По смисъла на настоящия регламент „храни с традиционни характеристики“ означава храни, които в държавата-членка, в която те са традиционно произвеждани, са:
|
а) |
y;ознати исторически като традиционни продукти, или |
|
б) |
произведени съгласно кодифицирани или регистрирани технически позовавания на традиционния процес или съгласно традиционни производствени методи, или |
|
в) |
защитени като традиционни хранителни продукти от общностно, национално, регионално или местно законодателство. |
2. Държавите-членки могат да предоставят на предприятия, произвеждащи храни с традиционни характеристики, индивидуални или общи дерогации от изискванията, установени в:
|
a) |
глава II, точка 1 от приложение II към Регламент (ЕО) № 852/2004 по отношение на помещенията, където такива продукти са изложени на влиянието на околната среда, необходима за частично развитие на техните характеристики. Такива помещения могат в частност да включват стени, тавани и врати, които не са гладки, непроницаеми, неабсорбиращи или от корозионно устойчив материал и естествени геологични стени, тавани и подове; |
|
б) |
глава II, точка 1, буква е) и глава V, точка 1 от приложение II към Регламент (ЕО) № 852/2004 по отношение на вида на материали, от които са направени инструментите и оборудването, използвани по-специално за приготвянето, опаковането на тези продукти. Мерките за почистване и дезинфекция за помещенията, посочени в буква a), и честотата, с която те се изпълняват, се адаптират към дейността, за да се има предвид тяхната специфична заобикаляща флора. Инструментите и оборудването, посочени в буква б), се поддържат през цялото време в задоволително хигиенно състояние и редовно се почистват и дезинфектират. |
3. Държавите-членки, предоставящи дерогациите, предвидени в параграф 2, нотифицират Комисията и останалите държави-членки за това не по-късно от 12 месеца след предоставяне на индивидуални или общи дерогации. Всяко нотификация трябва да:
|
а) |
y;арантира кратко описание на изискванията, които са били адаптирани; |
|
б) |
описва хранителните продукти и съответните предприятия; и |
|
в) |
предоставя всякаква друга свързана с това информация. |
Член 8
Изменения на Регламент (ЕО) № 853/2004
Приложения II и III към Регламент (ЕО) № 853/2004 се изменят в съответствие с приложение VII към настоящия регламент.
Член 9
Изменения на Регламент (ЕО) № 854/2004
Приложения I, II и III към Регламент (ЕО) № 854/2004 се изменят в съответствие с приложение VIII към настоящия регламент.
Член 10
Влизане в сила и прилагане
Настоящия регламент влиза в сила на двадесетия ден след публикуването му в Официален вестник на Европейския съюз.
Той се прилага от 1 януари 2006 г., с изключение на глави II и III от приложение V, които се прилагат от 1 януари 2007 г.
Настоящият регламент е задължителен в своята цялост и се прилага пряко във всички държави-членки.
Съставено в Брюксел на 5 декември 2005 година.
За Комисията
Markos KYPRIANOU
Член на Комисията
(1) ОВ L 139, 30.4.2004 г., стр. 1. Поправен в ОВ L 226, 25.6.2004 г., стр. 3.
(2) ОВ L 139, 30.4.2004 г., стр. 55. Поправен в ОВ L 226, 25.6.2004 г., стр. 22.
(3) ОВ L 139, 30.4.2004 г., стр. 206. Поправен в ОВ L 226, 25.6.2004 г., стр. 83.
(4) ОВ L 165, 30.4.2004 г., стр. 1. Поправен в ОВ L 191, 28.5.2004 г., стр. 1.
(5) Все още непубликувано в Официален вестник.
(6) ОВ L 157, 30.4.2004 г., стр. 33. Поправена в ОВ L 195, 2.6.2004 г., стр. 12.
(7) ОВ L 338, 22.12.2005 г., стр. 1.
ПРИЛОЖЕНИЕ I
ИНФОРМАЦИЯ ЗА ХРАНИТЕЛНАТА ВЕРИГА
РАЗДЕЛ I
ЗАДЪЛЖЕНИЯ НА БИЗНЕС ОПЕРАТОРИТЕ НА ХРАНИ
Бизнес оператори на храни, отглеждащи животни, предназначени за клане, гарантират, че информацията за хранителната верига, посочена в Регламент (ЕО) № 853/2004, е включена, когато е уместно, в документацията, отнасяща за доставените животните, по такъв начин, че да бъде достъпна за съответния оператор на кланицата.
РАЗДЕЛ II
ЗАДЪЛЖЕНИЯ НА КОМПЕТЕНТНИТЕ ОРГАНИ
ГЛАВА I
ПРЕДОСТАВЯНЕ НА ИНФОРМАЦИЯ ЗА ХРАНИТЕЛНАТА ВЕРИГА
|
1. |
Компетентният орган на мястото на изпращане информира изпращащия бизнес оператор на храни за минимума елементи на информацията за хранителната верига, които да бъдат предоставени на кланицата в съответствие с раздел III от приложение II към Регламент (ЕО) № 853/2004. |
|
2. |
Компетентният орган на мястото на клане проверява дали:
|
|
3. |
Когато животните са изпратени за клане в друга държава-членка, компетентните органи в мястото на изпращане и клане на животните си сътрудничат, за да гарантират, че предоставената информация от изпращащия бизнес оператор на храни е лесно достъпна за оператора на кланицата, който я получава. |
ГЛАВА II
ОБРАТНА ВРЪЗКА СЪС СТОПАНСТВОТО ПО ПРОИЗХОД
|
1. |
Официалният ветеринарен лекар може да използва образеца на документ, установен в допълнение I, за свързаните резултати от инспекции, които трябва да бъдат съобщени на стопанството, където животните са отгледани преди клането в същата държава-членка в съответствие с глава I от раздел II на приложение I към Регламент (ЕО) № 854/2004. |
|
2. |
Компетентният орган е отговорен за съобщаването на съответните резултати от инспекции, в случаите когато животните са отгледани в стопанство в друга държава-членка и трябва да използват версия на образеца на документ, определен в приложението, както на езика на изпращащата държава, така и на езика на страната получател. |
Допълнение към приложение I
ОБРАЗЕЦ НА ДОКУМЕНТ
|
1. |
Идентификационни елементи |
|
|
|
1.1. |
стопанство по произхода (например собственик или управител) |
|
|
|
име/номер |
|
|
|
пълен адрес |
|
|
|
телефонен номер |
|
|
1.2. |
идентификационни номера (приложете отделен списък) |
|
|
|
общ брой животни (по видове) |
|
|
|
идентификационни проблеми (ако има такива) |
|
|
1.3. |
стадо/стадо птици/идентификация на клетка (ако е приложимо) |
|
|
1.4. |
видове животни |
|
|
1.5. |
референтен номер на здравен сертификат |
|
2. |
Предкланични констатации |
|
|
|
2.1. |
благосъстояние |
|
|
|
брой на засегнати животни |
|
|
|
вид/клас/възраст |
|
|
|
наблюдения (например ухапване на опашката) |
|
|
2.2. |
животни, доставени мръсни |
|
|
2.3. |
клинични констатации (болест) |
|
|
|
брой на засегнатите животни |
|
|
|
вид/клас/възраст |
|
|
|
наблюдения |
|
|
|
дата на инспекция |
|
|
2.4. |
лабораторни резултати (1) |
|
3. |
Постмортални констатации |
|
|
|
3.1. |
брой на засегнати животни |
|
|
|
вид/клас/възраст |
|
|
|
орган или части на засегнато/и животно/и |
|
|
|
дата на клане |
|
|
3.2. |
болест (могат да бъдат използвани кодове (2)) |
|
|
|
брой на засегнати животни |
|
|
|
вид/клас/възраст |
|
|
|
орган или части на животно/и, които са засегнати |
|
|
|
частично или цялостно отхвърлен каркас (посочете причина) |
|
|
|
дата на клане |
|
|
3.3. |
лабораторни резултати (3) |
|
|
3.4. |
други резултати (например паразити, чужди тела и пр.) |
|
|
3.5. |
констатации по отношение на благосъстоянието (например счупени крака) |
|
4. |
Допълнителна информация |
|
|
5. |
Подробности за контакт |
|
|
|
5.1. |
кланица (номер на одобрението) |
|
|
|
име |
|
|
|
пълен адрес |
|
|
|
телефонен номер |
|
|
5.2. |
електронен адрес, ако е наличен |
|
6. |
Официален ветеринарен лекар (напечатайте име) |
|
|
|
|
подпис и печат |
|
7. |
Дата |
|
|
8. |
Брой страници, приложени към настоящия формуляр: |
|
(1) Микробиологични, химични, серологични и т.н. (включете резултатите, както са приложени).
(2) Компетентните органи могат да въведат следните кодове: Код А за МБЕ — изброени болести; кодове В100 и В200 за въпроси по отношение на благосъстоянието на животните (глава II, точка В от раздел I на приложение I към Регламент (ЕО) № 854/2004) и C100—C290 за решения относно месото (глава V, точка 1, букви а)—ф) от раздел II на приложение I към Регламент (ЕО) № 854/2004). Системата за кодифициране, ако е необходимо, може да включва по-нататъшни подразделения (например C141 за слабо генерализирана болест, C142 за по-остра болест и т.н.). Ако се използват кодове, те би следвало да бъдат готови за бизнес оператора храни с подходящо обяснение за тяхното значение.
(3) Микробиологични, химични, серологични и т.н. (включете резултатите, както са приложени).
ПРИЛОЖЕНИЕ II
РИБНИ ПРОДУКТИ
РАЗДЕЛ I
ЗАДЪЛЖЕНИЯ НА БИЗНЕС ОПЕРАТОРИТЕ НА ХРАНИ
Настоящият раздел определя правила, отнасящи се до визуални инспекции за откриване на паразити в рибни продукти
ГЛАВА I
ОПРЕДЕЛЕНИЯ
|
1. |
„Видими паразити“ означава паразит или група паразити, които имат размер, цвят или текстура, която е ясно разграничима от рибна тъкан. |
|
2. |
„Визуална инспекция“ означава изследване на риба или рибни продукти, което не нарушава целостта, със или без оптически средства за увеличаване и при добро осветление за човешкото зрение, включително, ако е необходимо, просветляване. |
|
3. |
„Просветляване“ означава, по отношение на плоска риба или рибно филе, държане на рибата високо на светлина в затъмнена стая за откриване на паразити. |
ГЛАВА II
ВИЗУАЛНА ИНСПЕКЦИЯ
|
1. |
Визуална инспекция се извършва за представителен брой проби. Лицата, отговарящи за предприятия на сушата, и квалифицирани лица на борда на корабите фабрики определят обхвата и честотата на инспекциите чрез позоваване на вида рибни продукти, техния географски произход и тяхната употреба. По време на производство визуална инспекция на изкормена риба трябва да се извършва от квалифицирани лица върху коремната кухина и черен дроб и хайвер, предназначени за консумация от човека. В зависимост от използваната система за изкормване трябва да се извършва визуална инспекция:
|
|
2. |
Визуалната инспекция на рибно филе или рибни парчета трябва да бъде извършвана от квалифицирани лица по време на почистване и след нарязване на филета или парчета. Където не е възможно индивидуално изследване поради размера на филетата или операциите по правене на филета, трябва да бъде съставен план за вземане на проби и да е на разположение на компетентните органи в съответствие с глава II, точка 4 от раздел VIII на приложение III към Регламент (ЕО) № 853/2004. Където е необходимо просветляване на филета от техническа гледна точка, това трябва да бъде включено в плана за вземане на проби. |
РАЗДЕЛ II
ЗАДЪЛЖЕНИЯ НА КОМПЕТЕНТНИТЕ ОРГАНИ
ГЛАВА I
ОБЩИ МАКСИМАЛНО ДОПУСТИМИ ГРАНИЦИ НА ЛЕТЛИВ ОСНОВЕН АЗОТ (TVB-N) ЗА НЯКОИ КАТЕГОРИИ РИБНИ ПРОДУКТИ И МЕТОДИ ЗА АНАЛИЗ, КОИТО ДА БЪДАТ ИЗПОЛЗВАНИ
|
1. |
Непреработени рибни продукти, които принадлежат към видовете категории, изброени в глава II, се считат като негодни за консумация от човека, където органолептичната оценка е повдигнала съмнения по отношение на тяхната преснота и химически проверки, които разкриват, че следните TVB-N максимално допустими граници са превишени:
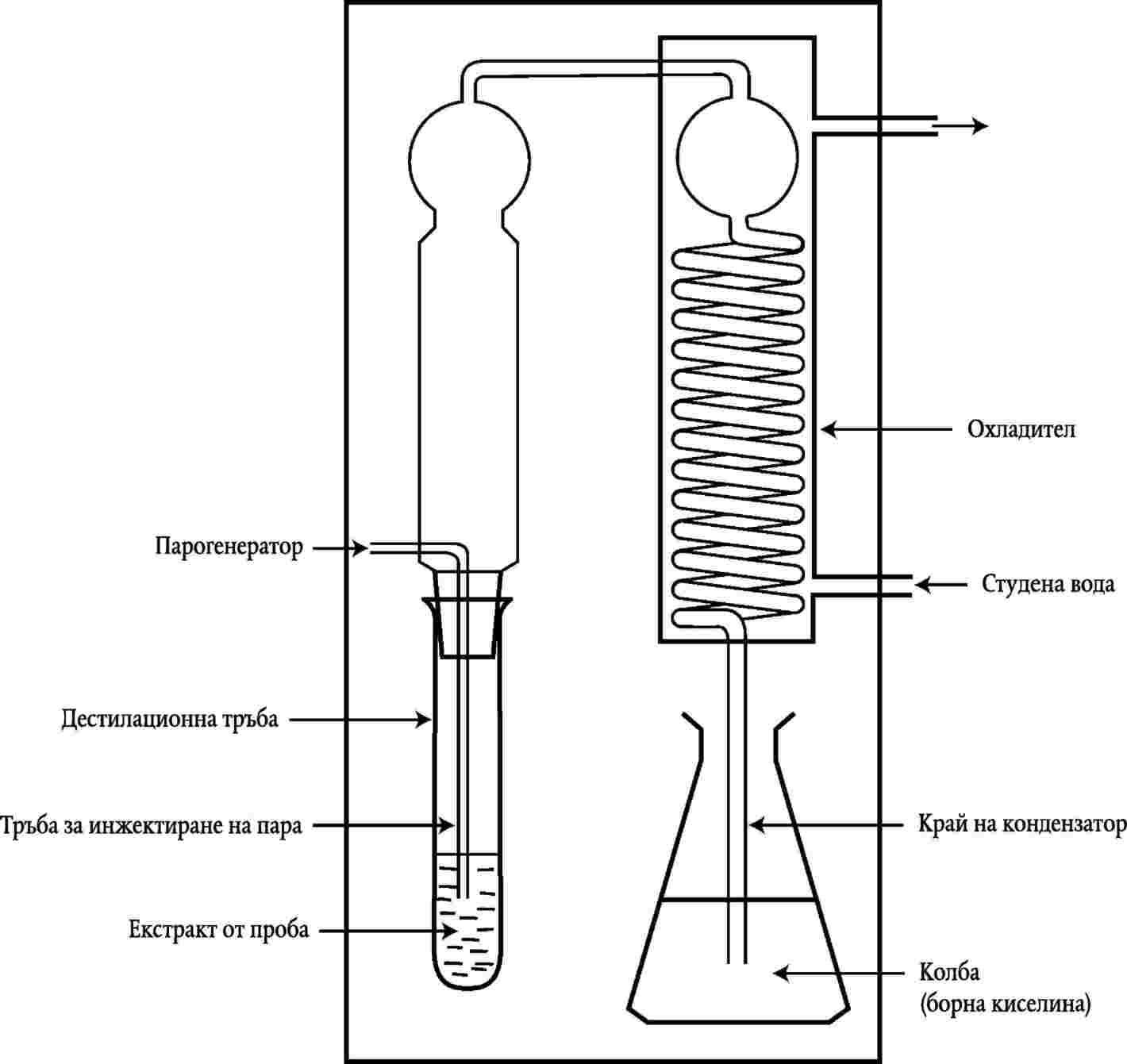
Референтният метод, който трябва да се използва за проверка на максимално допустимите граници на TVB-N, включва дестилиране на екстракт, депротеинизирана чрез перхлорна киселина, както е установено в глава III. |
|
2. |
Дестилиране, както е посочено в точка 1, трябва да бъде изпълнено, като се използва апарат, който съответства на диаграмата в глава IV. |
|
3. |
Рутинните методи, които могат да бъдат използвани за проверка на максимално допустимите граници на TVB-N, са, както следва:
|
|
4. |
Пробата трябва да се състои от около 100 g плът, взета от най-малко три различни точки и смесена заедно чрез смилане. Държавите-членки препоръчват официалните лаборатории да използват, като една рутинна практика, референтния метод, посочен по-горе. Когато резултатите са със съмнителна точност или в случая на спор относно резултатите от направения анализ чрез един от рутинните методи, само референтният метод може да бъде използват за проверка на резултатите. |
ГЛАВА II
ВИДОВИ КАТЕГОРИИ, ЗА КОИТО МАКСИМАЛНО ДОПУСТИМИ ГРАНИЦИ НА TVB-N СА ФИКСИРАНИ
|
1. |
Sebastes spp., Helicolenus dactylopterus, Sebastichthys capensis. |
|
2. |
Видове, принадлежащи към семейството Pleuronectidae (с изключение на камбала: Hippoglossus spp.). |
|
3. |
Salmo salar, видове, принадлежащи към семейството Merlucciidae, видове принадлежащи към семейството Gadidae. |
ГЛАВА III
ОПРЕДЕЛЯНЕ НА КОНЦЕНТРАЦИЯТА НА TVB-N В РИБА И РИБНИ ПРОДУКТИ
Референтна процедура
1. Цел и област на приложение
Този метод описва една референтна процедура за идентифициране на азотна концентрация на TVB-N в риба и рибни продукти. Тази процедура е приложима при TVB-N концентрация от 5 mg/100 g до най-малко 100 mg/100 g.
2. Дефиниция
„Концентрация на TVB-N“ означава съдържанието на азот от летлива азотна база, както е определено от описаната процедура.
Концентрацията се изразява в mg/100 g.
3. Кратко описание
Летливите азотни бази се извличат от проба, като се използва разтвор от 0,6 mol перхлорна киселина. След алкалинизация екстрактът се подлага на парна дестилация и летливите базови компоненти се абсорбират от киселинен приемник. Концентрацията на TVB-N се определя чрез титрируване на абсорбираните бази.
4. Химикали
Освен ако не е посочено друго, следва да бъдат използвани реактивен клас химикали. Използваната вода трябва да бъде или дестилирана, или деминерализирана и най-малко със същата чистота. Освен ако не е посочено друго, „разтвор“ означава воден разтвор, както следва:
|
а) |
разтвор на перхлорна киселина = 6 g/100 ml; |
|
б) |
разтвор от натриев хидроксид = 20 g/100 ml; |
|
в) |
обикновен разтвор на солна киселина 0,05 mol/l (0,05 N),
|
|
г) |
разтвор на борна киселина = 3 g/100 ml; |
|
д) |
силиконов антиразпенващ агент; |
|
е) |
разтвор на фенолфталейн = 1 g/100 ml 95 % етанол; |
|
ж) |
индикаторен разтвор (смесен индикатор Tashiro) 2 g метил-червен и 1 g метилен-син се разварят в 1 000 ml 95 % етанол. |
5. Инструменти и аксесоари
|
a) |
Месомелачка за производство на достатъчно хомогенна рибна кайма. |
|
б) |
Високоскоростен смесител със скорост между 8 000 и 45 000 оборота/минута. |
|
в) |
Нагънат филтър, диаметър 150 mm, бързо филтриране. |
|
г) |
Бюрета, 5 ml, градуирана до 0,01 ml. |
|
д) |
Апарат за парно дестилиране. Апаратът трябва да може до регулира различни количества пара и да произвежда постоянно количество пара за даден период от време. Той трябва да гарантира, че по време на добавяне на алкализиращите субстанции, получаваните свободни бази не могат да се изплъзнат. |
6. Изпълнение
Предупреждение: когато се работи с хлорна киселина, която е силно корозираща, следва да бъдат взети необходимите и предпазни мерки. Пробите следва, ако въобще е възможно, да бъдат приготвени, колкото е възможно по-скоро след тяхното пристигане в съответствие със следните инструкции:
|
a) |
Пробата за анализ би следвало да бъде внимателно смляна, като се използва месомелачка, както е описано в точка 5, буква a). Точно 10 g ± 0,1 g смляната проба се претегля в подходящ съд и се смества с 90,0 ml разтвор на хлорна киселина, както е определено в точка 4, буква a), хомогенизира се за две минути със смесител, както е описано в точка 5, буква б), и след това се филтрира. Полученият екстракт може да се държи за най-малко седем дни при температура приблизително между 2 °C и 6 °C; |
|
б) |
50,0 ml на получения екстракт в съответствие с буква a) се поставят в апарат за парна дестилация, както е описано в точка 5, буква д). За по-късна проверка на алкализацията на екстракта се добавят няколко капки фенолфталеин, както е описано в точка 4, буква е). След добавяне на няколко капки силиконов антиразпенващ агент 6,5 ml от разтвор на натриев хидроксид, както е описано в точка 4, буква б), се добавят към екстракта и парната дестилация започва незабавно. Парната дестилация се регулира така че около 100 ml дестилат се прави за 10 минути. Дестилационна изходяща тръба е потопена в приемник със 100 ml разтвор на борна киселина, както е специфицирано в точка 4, буква г), към което три до четири капки от индикиращия разтвор се добавят, както е описано в точка 4, буква ж). Точно след 10 минути дестилацията е завършена. Изходящата дестилационна тръба се отстранява от приемника и се измива с вода. Летливите бази, съдържащи се в разтвора приемник, се определят чрез титруване със стандартен хлороводороден разтвор, както е специфицирано в точка 4, буква в). pH на крайната точка следва да бъде 5,0 ± 0,1. |
|
в) |
Изискват се дублиращи анализи. Прилаганият метод е коректен, ако разликата между дубликатите не е по-голяма от 2 mg/100 g. |
|
г) |
Извършва се пробен тест, както е описано в буква б). Вместо екстракта се използват 50,0 ml разтвор на хлорна киселина, както е описано в точка 4, буква a). |
7. Изчисляване на TVB-N
Чрез титруване на приемащия разтвор със солна киселина, както е описано в точка 4, буква в), концентрацията на TVB-N се изчислява, като се използва следната формула:

|
V1 |
= |
обем от 0,01 mol разтвор на солна киселина в ml за проба |
|
V0 |
= |
обем oт 0,01 mol разтвор на солна киселина в ml за пробен тест |
|
M |
= |
тегло на пробата в g. |
Забележки
|
1. |
Изискват се дублирани анализи. Прилаганият метод е коректен, ако разликата между дубликати не е по-голяма от 2 mg/100 g. |
|
2. |
Проверете оборудването чрез дестилиращ разтвор на NH4Cl равен на 50 mg TVB-N/100 g. |
|
3. |
Стандартно отклонение на възпроизводимост Sr = 1,20 mg/100 g. Стандартно отклонение на сравнимост SR = 2,50 mg/100 g. |
ГЛАВА IV
TVB-N АПРАТ ЗА ПАРНО ДЕСТИЛИРАНЕ
ПРИЛОЖЕНИЕ III
ПРИЗНАТИ МЕТОДИ ЗА ИЗПИТВАНЕ ЗА ОТКРИВАНЕ НА МОРСКИ БИОТОКСИНИ
Следните аналитични методи се използват от компетентните органи за проверка на съответствие с установените ограничения в глава V, точка 2 от раздел VII на приложение III към Регламент (ЕО) № 853/2004 и, когато е уместно, от бизнес оператори на храни.
В съответствие с член 7, параграфи 2 и 3 от Директива 86/609/ЕИО на Съвета (1) елементи на заменяне, рафиниране и редуциране трябва да се вземат предвид, когато се използват биологични методи.
ГЛАВА I
МЕТОД ЗА ОТКРИВАНЕ НА ПАРАЛИТИЧНА ОТРОВА В ЧЕРУПЧЕСТИ МЕКОТЕЛИ (PSP)
|
1. |
Съдържание на паралитичната отрова в черупчести мекотели (PSP) в ядливите части от тях (цялото тяло или отделни ядливи части) трябва да бъде открито в съответствие с метода на биологично изпитване или някой друг международно признат метод. Методът на биологично изпитване може да се извършва във връзка, ако е нужно, с друг метод за откриване Saxitoxin и някой от неговите аналози, за които са налични стандарти. |
|
2. |
Ако резултатите са съмнителни, референтният метод ще бъде биологичният метод. |
ГЛАВА II
МЕТОД ЗА ОТКРИВАНЕ НА АМНЕЗНА ОТРОВА В ЧЕРУПЧЕСТИ МЕКОТЕЛИ (ASP)
Общото съдържание на амнезна отрова в черупчести мекотели (ASP) в ядливите части от тях (цялото тяло или някоя отделна ядлива част) трябва да бъде открито, като се използва признат метод на високоефективна течна хроматография (HPLC) или някой друг признат метод.
Ако резултатите са съмнителни, референтният метод ще бъде методът HPLC.
ГЛАВА III
МЕТОД ЗА ОТКРИВАНЕ НА ЛИПОФИЛНИ ТОСКИНИ
A. Биологични методи
|
1. |
Серия от процедури за образци от мишки за изследване, различни в тестовата порция (хепатопанкреас или цяло тяло), и използвани разтвори за екстракция и пречистване могат да бъдат използвани за откриване на морски токсини, посочени в глава V, точка 2, букви в), г) и д) от раздел VII на приложение III към Регламент (ЕО) № 853/2004. Чувствителност и селективност зависят от избора на използваните разтворители за екстракция и пречистване и това следва да се има предвид, когато се взима решение относно метода, който да бъде използван, за да се покрие цялата гама. |
|
2. |
Единичен образец от мишки за изследване, включващ ацетонова екстракция, може да бъде използван за откриване на окадаична киселина, динофисистоксини, пектенотоксини и йесотоксини. Този образец за изследване може да се допълни, ако е необходимо, с течни/течно разделени стъпки с етил ацетат/вода или дихлорметан/вода за отстраняване на потенциални намеси. Откриване с азаспирова киселина на редовни нива чрез средствата на тази процедура включва използване на цялото тяло като порция за тест. |
|
3. |
Три мишки се използват за всеки тест. Където две от три мишки умират в рамките на 24 часа от инокулация с екстракт, еквивалент на 5 g хепатопанкреас или 25 g за цяло тяло, това се счита за положителен резултат за присъствието на един или повече токсини, както е посочено в глава V, точка 2, букви в), г) и д) от приложение III към Регламент (ЕО) № 853/2004, на нива над установените такива. |
|
4. |
Образец от мишки за изпитване с ацетонова екстракция, следвана от течност/течно разделяне с диетилетер може да бъде използвана за откриване на окадаична киселина, динофисистоксини, пектенотоксини и азаспирови киселини, но не може да открива йесотоксини, тъй като загуби на тези токсини могат да се случат по време на разделянето. Три мишки се използват за всеки тест. Където три мишки умрат в рамките на 24 часа от заразяване с екстракт, еквивалент на 5 g хепатопанкреас или 25 g цяло тяло, това се счита за положителен резултат за наличието на окадаична киселина, динофисистоксини, пектенотоксини и азаспирова киселина на равнища над тези, установени в глава V, точка 2, букви в) и д) от раздел VII на приложение III към Регламент (ЕО) № 853/2004. |
|
5. |
Опитен образец на плъх може да бъде използван за откриване на окадаична киселина, динофисистоксини и азаспирови киселини. Три плъха се използват за всеки тест. Диарична реакция при някой от трите плъха се счита за положителен резултат за наличието на окадаична киселина, динофисистоксини и азаспирови киселини на равнища над онези, установени глава V, точка 2, букви в) и д) от раздел VII на приложение III към Регламент (ЕО) № 853/2004. |
Б. Алтернативни методи за откриване
|
1. |
Серия от методи, такива като високоефективна течна хроматография (HPLC) с флуорометрично откриване, течна хроматография (LC), масова спектометрия (MS), имуно-образци и функционални образци, такива като фосфатен инхибиращ образец, се използват като алтернативни или допълващи към методите за биологичното изпитване, при условие че или самостоятелно, или комбинирано те могат да открият най-малко следните аналози, че те не са по-малко ефективни от биологичните методи и че тяхното изпълнение осигурява еквивалентно равнище на опазване на общественото здраве:
|
|
2. |
Ако се открият нови аналози от значение за общественото здраве, следва да бъдат включени в анализа. Трябва да има стандарти, преди да е възможен химически анализ. Обща токсичност се изчислява, като се използват конверсионни фактори, основани на наличните данните за всеки токсин. |
|
3. |
Изпълнителната характеристика на тези методи се дефинира след валидиране, следващо един международно съгласуван протокол. |
|
4. |
Биологични методи се заменят с алтернативни методи на откриване толкова скоро, колкото са действително налични референтни материали за откриване на токсини, предписани в глава V от раздел VI на приложение III към Регламент (ЕО) № 853/2004, методите са били валидирани и настоящата глава е била съответно изменена. |
(1) ОВ L 358, 18.12.1986 г., стр. 1.
ПРИЛОЖЕНИЕ IV
СЪДЪРЖАНИЕ НА КАЛЦИЙ В МЕХАНИЧНО ОТДЕЛЕНО МЕСО
Съдържанието на калций на МОМ, както е посочено в Регламент (ЕО) № 853/2004:
|
1. |
не превишава 0,1 % (= 100 mg/100 g или 1 000 ppm) за пресен продукт; |
|
2. |
ще бъде определяно по стандартизиран международен метод. |
ПРИЛОЖЕНИЕ V
СПИСЪЦИ НА ОДОБРЕНИ ПРЕДПРИЯТИЯ ЗА ХРАНИ
ГЛАВА I
ДОСТЪП ДО СПИСЪЦИ НА ОДОБРЕНИ ПРЕДПРИЯТИЯ ЗА ХРАНИ
За да помогне на държавите-членки при съставянето на актуални списъци на одобрени предприятия за храни, достъпни за други държави-членки и обществеността, Комисията осигурява интернет страница, към която всяка държава-членка ще има връзка към нейната национална интернет страница.
ГЛАВА II
ФОРМАТ ЗА НАЦИОНАЛНИ ИНТЕРНЕТ СТРАНИЦИ
A. Официален списък
|
1. |
Всяка държава-членка предоставя на Комисията включен адрес към една национална интернет страница, съдържаща официален списък с одобрените хранителни предприятия за продукти от животински произход, както са определени в точка 8.1 от приложение I към Регламент (ЕО) № 853/2004. |
|
2. |
Основният списък, посочен в точка 1, съдържа един лист и се попълва на един или повече официални езици на Общността. |
Б. Оперативна схема
|
1. |
Интернет страницата, съдържаща основния списък, се разработва от компетентния орган или, когато е уместно, от един от компетентните органи, посочени в член 4 от Регламент (ЕО) № 882/2004. |
|
2. |
Списъкът включва връзки към:
|
ГЛАВА III
ОФОРМЛЕНИЕ И КОДОВЕ ЗА СПИСЪЦИ НА ОДОБРЕНИТЕ ПРЕДПРИЯТИЯ
Оформления, включително релевантна информация и кодове, се съставят, за да гарантират широка достъпност на информацията, засягаща одобрени хранителни предприятия и за подобряване на четивността на списъците.
ГЛАВА IV
ТЕХНИЧЕСКИ СПЕЦИФИКАЦИИ
Задачите и дейностите, посочени в глави II и III, се изпълняват в съответствие с техническите спецификации, публикувани от Комисията.
ПРИЛОЖЕНИЕ VI
ОБРАЗЦИ НА ЗДРАВНИ СЕРТИФИКАТИ ЗА ВНОС НА ЖАБЕШКИ БУТЧЕТА, ОХЛЮВИ, ЖЕЛАТИН И КОЛАГЕН
РАЗДЕЛ I
ЗАБЕШКИ БУТЧЕТА И ОХЛЮВИ
Здравните сертификати, както са посочени в член 6, параграф 1, буква г) от Регламент (ЕО) № 853/2004, за внос на жабешки бутчета и охлюви, съответстват на образците, определени съответно в част A и част Б на допълнение I към настоящото приложение.
РАЗДЕЛ II
ЖЕЛАТИН
Без да се накърнява останалото специфично законодателство на Общността, най-малко включващо, но не ограничено, до трансмисивни спонгиформни енцефалопатии и хормони, здравните сертификати, както са посочени в член 6, параграф 1, буква г) от Регламент (ЕО) № 853/2004, за внос на желатин и суровини за производството на желатин, спазват образците, установени респективно в част A и част Б на приложение II към настоящото приложение.
РАЗДЕЛ III
КОЛАГЕН
Без да се засяга останалото специфично законодателство на Общността, най-малко включващо, но не ограничено, до трансмисивни спонгиформни енцефалопатии и хормони, здравни сертификати, както е посочено в член 6, параграф 1, буква г) от Регламент (ЕО) № 853/2004, за внос на колаген и суровини за производството на колаген, спазват образците, установени респективно в част A и част Б на допълнение III към настоящото приложение.
Допълнение I към приложение VI
ЧАСТ A
ОБРАЗЕЦ НА ЗДРАВЕН СЕРТИФИКАТ ЗА ВНОС НА ОХЛАДЕНИ, ЗАМРАЗЕНИ ИЛИ ГОТОВИ ЖАБЕШКИ БУТЧЕТА, ПРЕДНАЗНАЧЕН ЗА КОНСУМАЦИЯ ОТ ЧОВЕКА


ЧАСТ Б
ОБРАЗЕЦ НА ЗДРАВЕН СЕРТИФИКАТ ЗА ВНОС НА ОХЛЮВИ БЕЗ ЧЕРУПКИ, СГОТВЕНИ, ПРИГОТВЕНИ ИЛИ КОНСЕРВИРАНИ, ПРЕДНАЗНАЧЕНИ ЗА КОНСУМАЦИЯ ОТ ЧОВЕКА


Допълнение II към приложение VI
ЧАСТ A
ОБРАЗЕЦ НА ЗДРАВЕН СЕРТИФИКАТ ЗА ВНОС НА ЖЕЛАТИН, ПРЕДНАЗНАЧЕН ЗА КОНСУМАЦИЯ ОТ ЧОВЕКА


ЧАСТ Б
ОБРАЗЕЦ НА ЗДРАВЕН СЕРТИФИКАТ ЗА ВНОС НА СУРОВИНИ ЗА ПРОИЗВОДСТВО НА ЖЕЛАТИН, ПРЕДНАЗНАЧЕН ЗА КОНСУМАЦИЯ ОТ ЧОВЕКА


Допълнение III към приложение VI
ЧАСТ A
ОБРАЗЕЦ НА ЗДРАВЕН СЕРТИФИКАТ ЗА ВНОС НА КОЛАГЕН, ПРЕДНАЗНАЧЕН ЗА КОНСУМАЦИЯ ОТ ЧОВЕКА


ЧАСТ B
ОБРАЗЕЦ НА ЗДРАВЕН СЕРТИФИКАТ ЗА ВНОС НА СУРОВИНИ ЗА ПРОИЗВОДСТВОТО НА КОЛАГЕН, ПРЕДНАЗНАЧЕН ЗА КОНСУМАЦИЯ ОТ ЧОВЕКА


ПРИЛОЖЕНИЕ VII
ИЗМЕНЕНИЯ НА РЕГЛАМЕНТ (ЕО) № 853/2004
Приложения II и III към Регламент (ЕО) № 853/2004 се изменят, както следва:
|
1. |
Приложение II, раздел I, точка Б се изменя, както следва:
|
|
2. |
Приложение III се изменя, както следва:
|
(1) ОВ L 123, 24.4.1998 г., стр. 1.“
ПРИЛОЖЕНИЕ VIII
ИЗМЕНЕНИЯ НА РЕГЛАМЕНТ (ЕО) № 854/2004
Приложения I, II и III към Регламент (ЕО) № 854/2004 се изменят, както следва:
|
1. |
Приложение I, раздел I, глава III, точка 3 се изменя, както следва:
|
|
2. |
В приложение II, глава II, част A точки 4 и 5 се заменят със следния текст:
|
|
3. |
В приложение III, глава II, точка Ж точка 1 се заменя със следния текст:
|