|
10.
|
dodajo se poglavja C.27, C.28, C.29 in C.30:
„C.27 PRESKUS STRUPENOSTI S TRZAČAMI V SISTEMU VODE IN USEDLINE Z UPORABO USEDLINE S PRIMEŠANO PRESKUSNO SNOVJO
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 218 (2004). Zasnovana je za oceno učinkov daljše izpostavljenosti kemikalijam na ličinke sladkovodne trzače Chironomus sp., ki živijo v usedlinah. Temelji na obstoječih protokolih za preskušanje strupenosti za Chironomus riparius in Chironomus tentans, ki so bili razviti v Evropi (1) (2) (3) in Severni Ameriki (4) (5) (6) (7) (8) ter krožno preskušeni (1) (6) (9). Uporabijo se lahko tudi druge dobro dokumentirane vrste trzače, npr. Chironomus yoshimatsui (10) (11).
|
|
2.
|
Scenarij izpostavljenosti, uporabljen v tej preskusni metodi, je primešanje preskusne snovi v usedlino. Izbira ustreznega scenarija izpostavljenosti je odvisna od namena uporabe preskusa. Namen primešanja snovi v usedlino je simulirati nakopičene ravni kemikalij, ki ostajajo v usedlini. Ta sistem izpostavljenosti vključuje primešanje snovi v usedlino v preskusnem sistemu vode in usedline.
|
|
3.
|
Snovi, ki jih je treba preskusiti v zvezi z organizmi, živečimi v usedlinah, se običajno v tem delu zelo dolgo obdržijo. Organizmi, živeči v usedlinah, so lahko izpostavljeni na številne načine. Relativni pomen vsakega načina izpostavljenosti in čas, da ta prispeva k skupnim strupenim učinkom, sta odvisna od fizikalno-kemijskih lastnosti zadevne kemikalije. Pri snoveh, ki se močno adsorbirajo (npr. z log Kow > 5), ali snoveh, ki se kovalentno vežejo na usedlino, je lahko zaužitje kontaminirane hrane pomemben način izpostavljenosti. Da ne bi podcenili strupenosti visoko lipofilnih snovi, se lahko predvidi uporaba hrane, dodane usedlini pred uporabo preskusne snovi. Da bi se upoštevali vsi morebitni načini izpostavljenosti, je ta preskusna metoda osredotočena na dolgoročno izpostavljenost. Preskus za C. riparius in C. yoshimatsui traja 20 do 28 dni, za C. tentans pa 28 do 65 dni. Če so za določen namen potrebni kratkoročni podatki, na primer da se raziščejo učinki nestabilne kemikalije, se lahko dodatne ponovitve umaknejo po 10 dneh.
|
|
4.
|
Izmerjene končne točke so skupno število preobraženih odraslih osebkov in čas do preobrazbe. Če so potrebni dodatni kratkoročni podatki, je priporočljivo, da se preživetje in rast ličink izmerita šele po 10-dnevnem obdobju, po potrebi z dodatnimi ponovitvami.
|
|
5.
|
Priporoča se uporaba formulirane usedline. Ta ima pred naravnimi usedlinami več prednosti:
|
—
|
variabilnost pri poskusih je manjša, saj formulirana usedlina pomeni ponovljivo ‚standardizirano matrico‘, poleg tega ni več treba iskati nekontaminiranih in čistih virov usedlin,
|
|
—
|
preskusi se lahko začnejo kadar koli, ne da bi se bilo treba ukvarjati s sezonsko variabilnostjo v preskusni usedlini, poleg tega usedline ni treba predhodno obdelati, da bi se odstranila domorodna favna; s formulirano usedlino se tudi znižajo stroški, povezani z zbiranjem zadostne količine usedline na terenu za rutinsko preskušanje,
|
|
—
|
uporaba formulirane usedline omogoča primerjave strupenosti in ustrezno razvrstitev snovi.
|
|
|
6.
|
Uporabljene opredelitve pojmov so navedene v Dodatku 1.
|
NAČELO PRESKUSA
|
7.
|
Ličinke trzače prvega stadija so izpostavljene razponu koncentracije preskusne kemikalije v sistemih vode in usedline. Preskusna snov se primeša v usedlino, ličinke prvega stadija pa se nato vnesejo v preskusne čaše, v katerih so bile koncentracije usedline in vode stabilizirane. Hitrost preobrazbe in razvoja trzač se izmeri ob koncu preskusa. Preživetje in teža ličink se lahko izmerita tudi po 10 dneh, če je to potrebno (z dodatnimi ponovitvami, kot je ustrezno). Ti podatki se analizirajo bodisi z regresijskim modelom, da se oceni koncentracija, ki bi povzročila x-odstotno zmanjšanje preobrazbe, ali preživetja, ali rasti ličink (npr. EC15, EC50 itd.), bodisi s preskušanjem statističnih domnev za določitev NOEC/LOEC. Slednje zahteva primerjavo vrednosti učinkov s kontrolnimi vrednostmi, za kar se uporabijo statistični preskusi.
|
INFORMACIJE O PRESKUSNI SNOVI
|
8.
|
Znani morajo biti vodotopnost preskusne snovi, njen parni tlak, izmerjeni ali izračunani koeficient porazdelitve v usedlini ter stabilnost v vodi in usedlini. Za določitev količine preskusne snovi v vodi nad usedlino, porni vodi in usedlini mora biti na voljo zanesljiva analitska metoda z znano in izpričano natančnostjo ter mejo zaznave. Koristni informaciji sta tudi strukturna formula in čistost preskusne snovi. Prav tako je koristno poznati obnašanje preskusne snovi v okolju (npr. disipacija, abiotska in biotska razgradnja itd.). Dodatne smernice za preskušanje snovi s fizikalno-kemijskimi lastnostmi, zaradi katerih je preskus otežen, so navedene v (12).
|
REFERENČNE KEMIKALIJE
|
9.
|
Redno se lahko preskušajo referenčne kemikalije, da se tako zagotavlja zanesljivost protokola za preskušanje in preskusnih pogojev. Primeri referenčnih strupenih snovi, ki so bile uspešno uporabljene v krožnih preskusih in potrditvenih raziskavah, so: lindan, trifluralin, pentaklorofenol, kadmijev klorid in kalijev klorid (1) (2) (5) (6) (13).
|
VELJAVNOST PRESKUSA
|
10.
|
Za veljavnost preskusa morajo biti izpolnjeni naslednji pogoji:
|
—
|
preobrazba v kontrolnih posodah ob koncu preskusa mora biti vsaj 70-odstotna (1) (6),
|
|
—
|
C. riparius in C. yoshimatsui v kontrolnih posodah se morajo v odrasle osebke preobraziti med 12. in 23. dnem po vnosu v posode; C. tentans potrebujejo 20 do 65 dni,
|
|
—
|
ob koncu preskusa je treba v vsaki posodi izmeriti pH in koncentracijo raztopljenega kisika. Koncentracija kisika mora biti vsaj 60 % nasičenosti zraka (ASV) pri uporabljeni temperaturi, pH vode nad usedlino pa mora biti v vseh preskusnih posodah med 6 in 9,
|
|
—
|
temperatura vode se ne sme razlikovati za več kot ± 1,0 °C; temperaturo vode bi bilo mogoče nadzorovati z izotermalnim prostorom; v takem primeru je treba temperaturo v prostoru potrjevati v ustreznih časovnih presledkih.
|
|
OPIS METODE
Preskusne posode
|
11.
|
Raziskava se izvaja v steklenih 600-mililitrskih čašah z 8-centimetrskim premerom. Primerne so tudi druge posode, vendar morajo zagotavljati primerno globino usedline in vode nad njo. Površina usedline mora biti dovolj velika, da zagotavlja 2 do 3 cm2 na ličinko. Razmerje med debelino usedline in globino vode nad njo mora biti 1 : 4. Preskusne posode in druge naprave, ki bodo prišle v stik s preskusnim sistemom, morajo biti v celoti iz stekla ali drugega kemijsko inertnega materiala (npr. teflona).
|
Izbira vrst
|
12.
|
Če je mogoče, naj se v preskusu uporabi vrsta Chironomus riparius. Chironomus tentans je prav tako primerna, vendar je z njo težje delati in zahteva daljše preskusno obdobje. Uporabi se lahko tudi Chironomus yohimatsui. Podrobnosti o metodah gojenja za Chironomus riparius so navedene v Dodatku 2. Informacije o pogojih gojenja so na voljo tudi za druge vrste, npr. Chironomus tentans (4) in Chironomus yoshimatsui (11). Identifikacijo vrst je treba potrditi pred preskusom, ni pa to potrebno pred vsakim preskusom, če organizmi prihajajo iz internega gojišča.
|
Usedlina
|
13.
|
Če je mogoče, je treba uporabiti formulirano usedlino (imenovano tudi rekonstituirana, umetna ali sintetična usedlina). Če se uporabi naravna usedlina, je treba določiti njene lastnosti (vsaj pH in vsebnost organskega ogljika, priporoča se tudi določitev drugih parametrov, kot sta razmerje C/N in granulometrija), poleg tega ne sme biti onesnažena in ne sme vsebovati drugih organizmov, ki bi lahko tekmovali s trzačami ali jih požrli. Prav tako se priporoča, naj se naravna usedlina pred uporabo v preskusu strupenosti s trzačami 7 dni kondicionira v enakih pogojih, kakršni vladajo v poznejšem preskusu. Za uporabo v tem preskusu (1) (15) (16) se priporoča naslednja formulirana usedlina, ki temelji na umetni zemljini, uporabljeni v preskusni metodi C.8 (14):
|
(a)
|
4–5 % (suhe teže) šote: čim bližje vrednosti pH 5,5 do 6,0; pomembno je uporabiti fino mleto šoto v prahu (velikost delcev ≤ 1 mm), sušeno samo na zraku;
|
|
(b)
|
20 % (suhe teže) kaolinske gline (vsebnost kaolinita po možnosti nad 30 %);
|
|
(c)
|
75–76 % (suhe teže) kremenovega peska (prevladovati mora fini pesek, pri katerem je več kot 50 % delcev velikih 50 do 200 μm);
|
|
(d)
|
doda se deionizirana voda, tako da je v končni mešanici vsebnost vlage 30- do 50-odstotna;
|
|
(e)
|
doda se kemijsko čist kalcijev karbonat (CaCO3), da se pH v končni mešanici usedline uravna na 7,0 ± 0,5. Vsebnost organskega ogljika v končni mešanici mora biti 2 % (± 0,5 %), uravnava pa se z ustreznimi količinami šote in peska v skladu s točkama (a) in (c).
|
|
|
14.
|
Vir šote, kaolinske gline in peska mora biti znan. Preveriti je treba, da sestavine usedline niso kemično onesnažene (npr. da ne vsebujejo težkih kovin, organoklornih spojin, organofosfornih spojin itd.). Primer priprave formulirane usedline je opisan v Dodatku 3. Sprejemljiva je tudi mešanica suhih sestavin, če se dokaže, da se sestavine usedline po dodatku vode nad usedlino ne začnejo ločevati (npr. lebdenje šotnih delcev) in da je šota ali usedlina zadostno kondicionirana.
|
Voda
|
15.
|
Za preskusno vodo je primerna vsaka voda, ki ustreza kemijskim značilnostim sprejemljive vode za redčenje, ki so navedene v dodatkih 2 in 4. Za gojiščno vodo in preskusno vodo je sprejemljiva vsaka primerna voda, naravna voda (površinska ali podzemna voda), obdelana voda (glej Dodatek 2) ali deklorirana vodovodna voda, če trzače čas gojenja in preskušanja v njej preživijo brez znakov stresa. Na začetku preskusa mora biti pH preskusne vode med 6 in 9, skupna trdota pa ne sme biti višja od 400 mg/l kot CaCO3. Če se domneva, da bo prišlo do interakcije med ioni, ki povzročajo trdoto vode, in preskusno snovjo, je treba uporabiti vodo z manjšo trdoto (v takem primeru se torej ne sme uporabiti medij Elendt M4). Ves čas raziskave je treba uporabljati isto vrsto vode. Lastnosti vode, navedene v Dodatku 4, je treba izmeriti vsaj dvakrat na leto ali kadar se sumi, da so se morda te lastnosti bistveno spremenile.
|
Založne raztopine – usedline s primešano preskusno snovjo
|
16.
|
Usedline s primešano preskusno snovjo izbrane koncentracije se običajno pripravijo z dodatkom raztopine preskusne snovi neposredno v usedlino. osnovna raztopina preskusne snovi, raztopljene v deionizirani vodi, se zmeša s formulirano usedlino z valjčnim mlinom, mešalnikom za krmo ali ročno. Če je preskusna snov slabo topna v vodi, se lahko raztopi v čim manjši količini ustreznega organskega topila (npr. heksana, acetona ali kloroforma). Ta raztopina se nato zmeša z 10 g finega kremenovega peska za eno preskusno posodo. Topilo je treba pustiti, da izhlapi, in mora biti v celoti odstranjeno iz peska; pesek se nato zmeša z ustrezno količino usedline na preskusno čašo. Za raztapljanje, razpršitev ali emulgiranje preskusne snovi se lahko uporabijo samo tista sredstva, ki hitro izhlapijo. Ne smemo pozabiti, da je treba pri pripravi usedline upoštevati količino peska, prinesenega z mešanico preskusne snovi in peska (tj. usedlino je torej treba pripraviti z manj peska). Paziti je treba, da je preskusna snov, dodana usedlini, v njej temeljito in enakomerno razporejena. Po potrebi se lahko analizirajo podvzorci, da se ugotovi stopnja homogenosti.
|
NAČRT PRESKUSA
|
17.
|
Načrt preskusa se nanaša na izbiro števila preskusnih koncentracij in razmikov med njimi, število posod za vsako koncentracijo in število ličink na posodo. Opisani so načrti za točkovno oceno EC, oceno NOEC in izvedbo mejnega preskusa.
|
Načrt za regresijsko analizo
|
18.
|
S koncentracijami, vključenimi v preskus, bi morala biti zajeta efektivna koncentracija (npr. EC15, EC50) in razpon koncentracije, v katerem je zanimiv vpliv preskusne snovi. Na splošno se natančnost in zlasti veljavnost, ki ju je mogoče doseči pri ocenah efektivnih koncentracij (ECx), izboljšata, kadar je efektivna koncentracija v okviru preskušanega razpona koncentracij. Izogibati se je treba ekstrapolaciji veliko pod najnižjo pozitivno koncentracijo ali veliko nad najvišjo koncentracijo. Kot pomoč pri izbiri razpona koncentracij, ki bo uporabljen (glej odstavek 27), se lahko izvede predhodni preskus za ugotavljanje razpona.
|
|
19.
|
Če je treba oceniti ECx, je treba preskusiti vsaj 5 koncentracij in izvesti 3 ponovitve za vsako koncentracijo. Vsekakor je priporočljivo uporabiti dovolj preskusnih koncentracij, da se omogoči dobra ocena modela. Faktor med koncentracijami ne sme biti večji od 2 (izjema je dopustna, kadar naklon krivulje odmerek-učinek ni strm). Število ponovitev na posamezno posodo s preskusno snovjo se lahko zmanjša, če se poveča število preskusnih koncentracij z različnimi učinki. Povečanje števila ponovitev ali zmanjšanje velikosti razmikov med preskusnimi koncentracijami običajno vodi do ožjih intervalov zaupanja za preskus. Dodatne ponovitve so potrebne, če se ocenjujeta 10-dnevno preživetje in rast ličink.
|
Načrt za oceno NOEC/LOEC
|
20.
|
Če je treba oceniti LOEC ali NOEC, bi bilo treba uporabiti pet preskusnih koncentracij in izvesti vsaj štiri ponovitve, faktor med koncentracijami pa ne sme biti večji od 2. Število ponovitev mora zadostovati, da se zagotovi ustrezna statistična vrednost za ugotovitev 20-odstotne razlike v primerjavi s kontrolno enoto pri 5-odstotni stopnji značilnosti (p = 0,05). Pri hitrosti razvoja je običajno ustrezna analiza variance (ANOVA), kot sta Dunnettov preskus in Williamsov preskus (17) (18) (19) (20). Pri koeficientu preobrazbe se lahko uporabijo Cochran-Armitageev preskus, Fisherjev eksaktni preskus (z Bonferronijevim popravkom) ali Mantel-Haenszelov preskus.
|
Mejni preskus
|
21.
|
Če v predhodnem preskusu za ugotavljanje razpona ni bilo opaženih učinkov, se lahko opravi mejni preskus (ena preskusna koncentracija in kontrolna enota). Namen mejnega preskusa je izvesti preskus pri dovolj visoki koncentraciji, da lahko nosilci odločanja izključijo mogoče strupene učinke preskusne snovi, meja pa je določena pri koncentraciji, za katero ni pričakovati, da bi se pojavila v katerem koli primeru. Priporoča se 1 000 mg/kg (suhe teže). Običajno je potrebnih vsaj šest ponovitev za preskusne in kontrolne posode. Izkazati je treba ustrezno statistično vrednost za ugotovitev 20-odstotne razlike v primerjavi s kontrolno enoto pri 5-odstotni stopnji značilnosti (p = 0,05). Kar zadeva učinek na hitrost razvoja in težo, je t-test primerna statistična metoda, če podatki izpolnjujejo zahteve za ta preskus (normalnost, homogenost varianc). Če te zahteve niso izpolnjene, se lahko uporabi t-preskus za neenake variance ali neparametrični preskus, kot je Wilcoxon-Mann-Whitneyjev preskus. Pri koeficientu preobrazbe je primeren Fisherjev eksaktni preskus.
|
POSTOPEK
Pogoji izpostavljenosti
Priprava sistema vode in usedline, v katerem je preskusna snov primešana v usedlino
|
22.
|
Za uporabo preskusne snovi (14) se priporoča postopek primešanja, opisan v preskusni metodi C.8: Strupenost za deževnike. Usedline s primešano preskusno snovjo se vnesejo v posode, nad usedlino pa se doda voda, da nastane volumensko razmerje med usedlino in vodo 1 : 4 (glej odstavka 11 in 15). Plast usedline mora biti debela 1,5 do 3 cm. Da se prepreči ločevanje sestavin usedline in ponovna suspenzija finega materiala med dodajanjem preskusne vode v vodni stolpec, se lahko usedlina med točenjem vode prekrije s plastičnim pokrovom, ki se takoj nato odstrani. Primerna so lahko tudi druga sredstva.
|
|
23.
|
Preskusne posode je treba pokriti (npr. s steklenimi ploščami). Po potrebi se med raziskavo voda dotoči do prvotne količine, da se nadomesti izhlapela voda. Za to je treba uporabiti destilirano ali deionizirano vodo, da se prepreči kopičenje soli.
|
Stabilizacija
|
24.
|
Ko je usedlina s primešano preskusno snovjo in vodo nad njo pripravljena, je zaželeno, da se omogoči porazdelitev preskusne snovi iz vodne faze v usedlino (3) (4) (6) (13). To je po možnosti treba storiti v temperaturnih in prezračevalnih pogojih, ki bodo uporabljeni v preskusu. Ustrezen čas za vzpostavitev ravnotežja je odvisen od usedline in kemikalije, lahko pa traja od več ur do več dni in v redkih primerih do več tednov (4 do 5 tednov). Ker bi bil tako na voljo čas za razgradnjo številnih kemikalij, se na vzpostavitev ravnotežja ne sme čakati, ampak se za to priporoča 48-urno obdobje. Po koncu tega dodatnega obdobja za vzpostavitev ravnotežja je treba izmeriti koncentracijo preskusne snovi v vodi nad usedlino, porni vodi in usedlini vsaj pri najvišji in nižji koncentraciji (glej odstavek 38). Te analitske določitve preskusne snovi omogočajo izračun masne bilance in izražanje rezultatov na podlagi izmerjenih koncentracij.
|
Dodajanje preskusnih organizmov
|
25.
|
Od 4 do 5 dni pred vnosom preskusnih organizmov v preskusne posode je treba iz gojišč vzeti jajčna legla in jih vstaviti v majhne posode v gojitvenem mediju. Uporabi se lahko starejši medij iz osnovne kulture ali sveže pripravljeni medij. Če se uporabi slednji, je treba v gojitveni medij dodati majhno količino hrane, npr. zelenih alg in/ali nekaj kapljic filtrata suspenzije iz fino mlete ribje hrane v kosmičih (glej Dodatek 2). Uporabiti je treba samo sveže odložena jajčna legla. Običajno se ličinke izležejo nekaj dni po tem, ko so bila jajčeca odložena (2 do 3 dni za Chironomus riparius pri 20 °C ter 1 do 4 dni za Chironomus tentans pri 23 °C in Chironomus yoshimatsui pri 25 °C), rast ličink pa poteka v 4 stadijih, od katerih vsak traja 4 do 8 dni. V preskusu je treba uporabiti ličinke prvega stadija (2 do 3 ali 1 do 4 dni po tem, ko se izležejo). Stadij trzač se lahko po možnosti preveri z merjenjem širine glave (6).
|
|
26.
|
20 ličink prvega stadija se s topo pipeto naključno vnese v vsako preskusno posodo, ki vsebuje usedlino s primešano preskusno snovjo in vodo. Med dodajanjem ličink v preskusne posode je treba ustaviti prezračevanje vode, ki se ne sme izvajati še 24 ur potem, ko so bile ličinke dodane (glej odstavka 25 in 32). Glede na uporabljeni načrt preskusa (glej odstavka 19 in 20) se za točkovno oceno EC uporabi vsaj 60 ličink na koncentracijo, za določitev NOEC pa 80.
|
Preskusne koncentracije
|
27.
|
Preskus za ugotavljanje razpona je lahko koristen za določitev razpona koncentracij za končni preskus. Za ta namen se uporabi niz široko razmaknjenih koncentracij preskusne snovi. Da se zagotovi enaka gostota površine na trzačo, kot bo uporabljena za končni preskus, se trzače izpostavijo vsaki koncentraciji preskusne snovi za obdobje, ki omogoča oceno ustreznih preskusnih koncentracij, pri čemer ponovitve niso potrebne.
|
|
28.
|
Preskusne koncentracije za končni preskus se določijo na podlagi rezultata preskusa za ugotavljanje razpona. Izbrati in uporabiti je treba vsaj pet koncentracij, kot je opisano v odstavkih 18 do 20.
|
Kontrolne enote
|
29.
|
V preskus je treba vključiti kontrolne posode, v katerih ni preskusne snovi, toda ki vsebujejo usedlino, z ustreznim številom ponovitev (glej odstavka 19 in 20). Če je bilo za aplikacijo preskusne snovi uporabljeno topilo (glej odstavek 16), je treba dodati kontrolno posodo, katere usedlina vsebuje tudi topilo.
|
Preskusni sistem
|
30.
|
Uporabljajo se statični sistemi. Polstatični ali pretočni sistemi z občasnim ali kontinuiranim obnavljanjem vode nad usedlino se lahko uporabijo v izjemnih primerih, na primer če specifikacije kakovosti vode postanejo neprimerne za preskusni organizem ali vplivajo na kemijsko ravnotežje (npr. ravni raztopljenega kisika se preveč znižajo, koncentracija izločkov se preveč poviša ali minerali iztekajo iz usedline in vplivajo na pH in/ali trdoto vode). Vendar za izboljšanje kakovosti vode nad usedlino običajno zadoščajo in se prednostno uporabljajo druge metode, kot je prezračevanje.
|
Hrana
|
31.
|
Ličinke je treba hraniti, po možnosti vsak dan ali vsaj trikrat na teden. Za mlade ličinke v prvih desetih dneh ustreza 0,25–0,5 mg (0,35–0,5 mg za C. yoshimatsui) ribje hrane (suspenzija v vodi ali fino mleta hrana, npr. TetraMin ali TetraPhyll; glej podrobnosti v Dodatku 2) na ličinko na dan. Nekoliko več hrane bodo morda potrebovale starejše ličinke: za preostanek preskusa mora zadostovati 0,5–1 mg na ličinko na dan. Obrok hrane je treba zmanjšati v vseh preskusnih in kontrolnih posodah, če se opazi rast glivic ali smrtnost v kontrolnih posodah. Če razvoja glivic ni mogoče ustaviti, je treba preskus ponoviti. Kadar se preskušajo snovi, ki se močno adsorbirajo (npr. z log Kow > 5), ali snovi, ki se kovalentno vežejo na usedlino, se lahko količina hrane, potrebna za zagotovitev preživetja in naravne rasti organizmov, doda formulirani usedlini pred obdobjem stabilizacije. Za to je treba namesto ribje hrane uporabiti rastlinski material, npr. dodatek 0,5 % (suhe teže) fino mletih listov npr. velike koprive (Urtica dioica), bele murve (Morus alba), plazeče detelje (Trifolium repens), špinače (Spinacia oleracea) ali drugega rastlinskega materiala (Cerophyl ali alfa celuloza).
|
Pogoji inkubacije
|
32.
|
Zagotovi se rahlo prezračevanje vode nad usedlino v preskusnih posodah, po možnosti 24 ur po vnosu ličink, in se izvaja ves čas preskusa (paziti je treba, da koncentracija raztopljenega kisika ne pade pod 60 % ASV). Prezračevanje se zagotavlja prek steklene pasteurjeve pipete, pritrjene 2 do 3 cm nad plastjo usedline (tj. 1 ali nekaj mehurčkov/s). Kadar se preskušajo hlapne kemikalije, je mogoče razmisliti o tem, da se sistem vode in usedline ne bi prezračeval.
|
|
33.
|
Preskus se izvaja pri konstantni temperaturi 20 °C (± 2 °C). Za C. tentans in C. yoshimatsui sta priporočeni temperaturi 23 °C oziroma 25 °C (± 2 °C). Uporablja se 16-urno obdobje osvetljenosti, jakost svetlobe pa mora biti 500 do 1 000 lux.
|
Trajanje izpostavljenosti
|
34.
|
Izpostavljenost se začne z vnosom ličink v posode s primešano preskusno snovjo in kontrolne posode. Najdaljši čas izpostavljenosti za C. riparius in C. yoshimatsui je 28 dni, za C. tentans pa 65 dni. Če se ličinke v odrasle osebke preobrazijo prej, se lahko preskus konča najmanj pet dni po preobrazbi zadnjega odraslega osebka v kontrolni posodi.
|
Opažanja
Preobrazba
|
35.
|
Določita se čas razvoja in skupno število v celoti preobraženih samcev in samic trzače. Samce je mogoče preprosto prepoznati po pahljačastih tipalkah.
|
|
36.
|
Preskusne posode je treba opazovati vsaj trikrat na teden, da se ugotovi kakršno koli neobičajno obnašanje (npr. zapuščanje usedline, nenavadno plavanje) v primerjavi s kontrolno posodo. V obdobju pričakovane preobrazbe je potrebno dnevno štetje preobraženih trzač. Spol in število v celoti preobraženih trzač se zapišeta dnevno. Po identifikaciji se trzače odstranijo iz posod. Vsa jajčna legla, odložena pred zaključkom preskusa, je treba evidentirati in nato odstraniti, da se prepreči vnovični vnos ličink v usedlino. Evidentira se tudi število vidnih bub, ki se niso preobrazile. Napotek za spremljanje preobrazbe je v Dodatku 5.
|
Rast in preživetje
|
37.
|
Če je treba zagotoviti podatke o 10-dnevnem preživetju in rasti ličink, je treba na začetku vključiti dodatne preskusne posode, ki se lahko uporabijo pozneje. Usedlina iz teh dodatnih posod se preseje skozi sito z 250 μm velikimi luknjicami, da se zadržijo ličinke. Merili za pogin sta negibnost ali neodzivnost na mehanske dražljaje. Ličinke, ki ostanejo v usedlini, je prav tako treba šteti za mrtve (ličinke, ki so poginile na začetku preskusa, so morda razgradili mikrobi). Določi se suha teža (brez pepela) preživelih ličink na preskusno posodo in izračuna srednja suha teža posamezne ličinke na posodo. Koristno je določiti, v kateri stadij spadajo preživele ličinke; za to se lahko izmeri širina glave vsakega osebka.
|
Analitske meritve
Koncentracija preskusne snovi
|
38.
|
Pred začetkom preskusa (tj. dodatkom ličink) se za analitsko določitev koncentracije preskusne snovi v usedlini odvzamejo vzorci usedline vsaj iz ene posode na posamezno obdelavo. Priporoča se, da se na začetku in koncu preskusa analizirajo vsaj vzorci vode nad usedlino, porne vode in usedline (glej odstavek 24), in sicer pri najvišji in nižji koncentraciji. Te določitve koncentracije preskusne snovi pokažejo obnašanje/porazdelitev preskusne snovi v sistemu vode in usedline.
|
|
39.
|
Kadar se izvajajo vmesne meritve (npr. 7. dan) in če so za analize potrebni veliki vzorci, ki jih ni mogoče vzeti iz preskusnih posod, ne da bi to vplivalo na preskusni sistem, je treba analitske določitve izvesti na vzorcih iz dodatnih preskusnih posod, ki se obdelujejo enako (vključno s prisotnostjo preskusnih organizmov), vendar se za biološka opažanja ne uporabljajo.
|
|
40.
|
Za izolacijo intersticijske vode se priporoča 30-minutno centrifugiranje pri npr. 10 000 g in 4 °C. Če pa se za preskusno snov izkaže, da se ne adsorbira na filtre, je lahko sprejemljivo tudi filtriranje. V nekaterih primerih koncentracij v porni vodi zaradi premajhnega vzorca morda ne bo mogoče analizirati.
|
Fizikalno-kemijski parametri
|
41.
|
Vrednost pH in temperaturo v preskusnih posodah je treba ustrezno meriti (glej odstavek 10). Trdoto in amonij je treba izmeriti v kontrolnih posodah in eni preskusni posodi pri najvišji koncentraciji na začetku in koncu preskusa.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
42.
|
Namen tega preskusa je določiti učinek preskusne snovi na hitrost razvoja in skupno število v celoti preobraženih samcev in samic trzače oziroma, pri 10-dnevnem preskusu, učinke na preživetje in težo ličink. Če ni znakov o statistično različni občutljivosti spolov, se lahko rezultati za samce in samice za statistične analize združijo. Razlike v občutljivosti med spoloma je mogoče statistično oceniti, na primer s preskusom χ2-r × 2. Po potrebi je treba po 10 dneh določiti preživetje ličink in srednjo suho težo posamezne ličinke na posodo.
|
|
43.
|
Če je mogoče, se efektivne koncentracije, ki so izražene in temeljijo na suhi teži, izračunajo na podlagi izmerjenih koncentracij v usedlini na začetku preskusa (glej odstavek 38).
|
|
44.
|
Za točkovno oceno EC50 ali druge ECx se lahko statistični podatki po posodah uporabijo kot dejanske ponovitve. Pri izračunu intervala zaupanja za ECx je treba upoštevati variabilnost med posodami ali pa dokazati, da je ta zanemarljiva. Če se model prilega po metodi najmanjših kvadratov, je treba statistične podatke po posameznih posodah transformirati, da se izboljša homogenost variance. Vendar je treba vrednosti ECx izračunati po tem, ko so bili rezultati transformirani nazaj na prvotno vrednost.
|
|
45.
|
Kadar je namen statistične analize določiti NOEC/LOEC s preskušanjem domnev, je treba upoštevati variabilnost med posodami, npr. z vgnezdeno ANOVO. Alternativno se lahko uporabijo robustnejši preskusi (21), kadar so običajne predpostavke ANOVE kršene.
|
Koeficient preobrazbe
|
46.
|
Koeficient preobrazbe da odgovor ‚vse ali nič‘ in se lahko analizira s Cochran-Armitageevim preskusom, uporabljenim regresivno (step-down), kadar se pričakuje monotono razmerje odmerek-učinek in so ti podatki v skladu s tem pričakovanjem. Če niso, se lahko uporabi Fisherjev eksaktni preskus ali Mantel-Haenszelov preskus z Bonferroni-Holmovimi popravljenimi p-vrednostmi. Če se izkaže, da je variabilnost med ponovitvami v okviru iste koncentracije večja, kot bi kazala binomska porazdelitev (pogosto imenovana ‚ekstra-binomska‘ variacija), potem je treba uporabiti robustni Cochran-Armitageev preskus ali Fisherjev eksaktni preskus, kot je predlagano v (21).
Vsota preobraženih trzač na posodo ne se določi in deli s številom vnesenih ličink na:
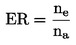
pri čemer je:
|
ER
|
=
|
koeficient preobrazbe,
|
|
ne
|
=
|
število preobraženih trzač na posodo,
|
|
na
|
=
|
število vnesenih ličink na posodo.
|
|
|
47.
|
Druga možnost, ki je najprimernejša za velike vzorce, kadar obstaja ekstra binomska varianca, je, da se koeficient preobrazbe obravnava kot zvezni odgovor in se uporabijo postopki, kot je Williamsov preskus, kadar se pričakuje monotono razmerje odmerek-učinek in kadar je to v skladu s temi podatki o koeficientu preobrazbe. Dunettov preskus je primeren, kadar monotonost ne drži. Velik vzorec je tu opredeljen kot število preobraženih osebkov in število nepreobraženih osebkov po posameznih ponovitvah (posodah), pri čemer je obojih več kot pet.
|
|
48.
|
Za uporabo metod ANOVA je treba vrednosti ER najprej transformirati z arkus sinus-korensko transformacijo ali Freeman-Tukeyevo transformacijo, da se dobi približna normalna porazdelitev in da se variance izenačijo. Cochran-Armitageev preskus, Fisherjev eksaktni preskus (Bonferroni) ali Mantel-Haenszelov preskus se lahko uporabijo, kadar se uporabljajo absolutne pogostosti. Pri arkus sinus-korenski transformaciji se izračuna arkus sinus (sin-1) kvadratnega korena ER.
|
|
49.
|
Za koeficiente preobrazbe se vrednosti ECx izračunajo z regresijsko analizo (ali npr. probit (22), logit, Weibull, ustrezno programsko opremo itd.). Če regresijska analiza ni uspešna (npr. kadar sta manj kot dva delna odgovora), se uporabijo druge neparametrične metode, kot sta drseče povprečje ali linearna interpolacija.
|
Hitrost razvoja
|
50.
|
Srednji čas razvoja pomeni srednji časovni razpon med vnosom ličink (dan 0 preskusa) in preobrazbo poskusne kohorte trzač. (Za izračun dejanskega časa razvoja je treba upoštevati starost ličink ob vnosu.) Hitrost razvoja je obratna času razvoja (enota: 1/dan) in predstavlja tisti delež razvoja ličink, ki se zgodi na dan. Za oceno teh raziskav strupenosti v usedlini je primernejša hitrost razvoja, saj je njena varianca manjša, poleg tega je bolj homogena in bližje normalni porazdelitvi v primerjavi s časom razvoja. Zato so učinkoviti parametrični preskusi primernejši za hitrost razvoja kot za čas razvoja.Če se hitrost razvoja obravnava kot zvezni odgovor, se lahko vrednosti ECx ocenijo z regresijsko analizo (npr. (23), (24)).
|
|
51.
|
Za naslednje statistične preskuse se za število trzač, opaženih na dan opazovanja x, domneva, da so se preobrazile na sredini časovnega intervala med dnevom × in dnevom x – 1 (l = dolžina intervala opazovanja, običajno 1 dan). Srednja hitrost razvoja na posodo (x) se izračuna z enačbo:
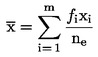
pri čemer je:
|

|
:
|
srednja hitrost razvoja za posodo,
|
|
i
|
:
|
indeks intervala opazovanja,
|
|
m
|
:
|
največje število intervalov opazovanja,
|
|

|
:
|
število trzač, preobraženih v intervalu opazovanja i,
|
|
ne
|
:
|
skupno število preobraženih trzač ob koncu poskusa, (= 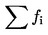 ) )
|
|
xi
|
:
|
hitrost razvoja trzač, preobraženih v intervalu i.
|
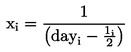
pri čemer je:
|
dayi
|
:
|
dan opazovanja (dnevi od vnosa),
|
|
li
|
:
|
dolžina intervala opazovanja i (dnevi, običajno 1 dan).
|
|
Poročilo o preskusu
|
52.
|
V poročilu o preskusu morajo biti navedene vsaj naslednje informacije:
|
|
Preskusna snov:
|
—
|
fizikalno stanje, in kjer je ustrezno, fizikalno-kemijske lastnosti (vodotopnost, parni tlak, porazdelitveni koeficient v tleh (ali v usedlini, če je na voljo), stabilnost v vodi itd.),
|
|
—
|
kemijski identifikacijski podatki (splošno ime, kemijsko ime, strukturna formula, številka CAS itd.), vključno s čistostjo in analitsko metodo za količinsko določanje preskusne snovi.
|
|
|
|
Preskusne vrste:
|
—
|
uporabljene preskusne živali: vrsta, znanstveno ime, vir organizmov in pogoji razmnoževanja,
|
|
—
|
informacije o ravnanju z jajčnimi legli in ličinkami,
|
|
—
|
starost preskusnih živali ob vnosu v preskusne posode.
|
|
|
|
Preskusni pogoji:
|
—
|
uporabljena usedlina, tj. naravna ali formulirana,
|
|
—
|
za naravno usedlino lokacija in opis mesta vzorčenja usedline, vključno, če je mogoče, s preteklim onesnaženjem; značilnosti: pH, vsebnost organskega ogljika, razmerje C/N in granulometrija (če je ustrezno),
|
|
—
|
priprava formulirane usedline: sestavine in značilnosti (vsebnost organskega ogljika, pH, vlaga itd. na začetku preskusa),
|
|
—
|
priprava preskusne vode (če se uporablja obdelana voda) in značilnosti (koncentracija kisika, pH, prevodnost, trdota itd. na začetku preskusa),
|
|
—
|
globina usedline in vode nad njo,
|
|
—
|
količina vode nad usedlino in porne vode; teža mokre usedline s porno vodo in brez nje,
|
|
—
|
preskusne posode (material in velikost),
|
|
—
|
metoda primešanja preskusne snovi v usedlino: uporabljene preskusne koncentracije, število ponovitev in uporaba topila, če je bilo uporabljeno,
|
|
—
|
faza stabilizacije za vzpostavitev ravnotežja sistema vode in usedline: trajanje in pogoji,
|
|
—
|
pogoji inkubacije: temperatura, svetlobni ciklus in jakost svetlobe, prezračevanje (pogostost in jakost),
|
|
—
|
podrobne informacije o hranjenju, vključno z vrsto hrane, pripravo, količino in načinom.
|
|
|
|
Rezultati:
|
—
|
nazivne preskusne koncentracije, izmerjene preskusne koncentracije in rezultati vseh analiz za določitev koncentracije preskusne snovi v preskusni posodi,
|
|
—
|
kakovost vode v preskusnih posodah, tj. pH, temperatura, raztopljeni kisik, trdota in amonij,
|
|
—
|
morebitna nadomestitev izhlapele preskusne vode,
|
|
—
|
število preobraženih samcev in samic trzače na posodo in na dan,
|
|
—
|
število ličink, ki se niso preobrazile v trzače, na posodo,
|
|
—
|
srednja suha teža posamezne ličinke na posodo in po stadijih, če je ustrezno,
|
|
—
|
delež preobrazbe na ponovitev in preskusno koncentracijo (združeni samci in samice trzače),
|
|
—
|
srednja hitrost razvoja v celoti preobraženih trzač na ponovitev in stopnjo koncentracije (združeni samci in samice trzače),
|
|
—
|
ocene strupenih končnih točk, npr. ECx (in s tem povezani intervali zaupanja), NOEC in/ali LOEC, ter statistične metode, uporabljene za njihovo določitev,
|
|
—
|
obravnava rezultatov, vključno z vsemi vplivi na rezultat preskusa, ki izvirajo iz odstopanj od te preskusne metode.
|
|
|
VIRI:
|
(1)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Uredila M. Streloke in H. Köpp. Berlin 1995.
|
|
(2)
|
Fleming, R., idr. (1994). Sediment Toxicity Tests for Poorly Water-Soluble Substances. Končno poročilo za Evropsko komisijo. Poročilo št.: EC 3738. Avgust 1994. WRc, Združeno kraljestvo.
|
|
(3)
|
SETAC (1993). Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments. Z delavnice WOSTA, ki je potekala na Nizozemskem.
|
|
(4)
|
ASTM International/E1706-00 (2002). Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, str. 1125–1241. V ASTM International 2002 Annual Book of Standards. Zvezek 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM. International, West Conshohocken, PA.
|
|
(5)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
(6)
|
US-EPA (2000). Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates. Druga izdaja. EPA 600/R-99/064. Marec 2000. Sprememba prve izdaje iz junija 1994.
|
|
(7)
|
US-EPA/OPPTS 850.1735. (1996): Whole Sediment Acute Toxicity Invertebrates.
|
|
(8)
|
US-EPA/OPPTS 850.1790. (1996): Chironomid Sediment toxicity Test.
|
|
(9)
|
Milani, D., Day, K. E., McLeay, D. J., in Kirby, R. S. (1996). Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada’s biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius). Technical Report. Environment Canada. National Water Research Institute. Burlington, Ontario, Kanada.
|
|
(10)
|
Sugaya, Y. (1997). Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui. Jp. J. Sanit. Zool. 48 (4): 345–350.
|
|
(11)
|
Kawai, K. (1986). Fundamental studies on Chironomid allergy. I. Culture methods of some Japanese Chironomids (Chironomidae, Diptera). Jp. J. Sanit. Zool. 37(1): 47–57.
|
|
(12)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(13)
|
Environment Canada (1995). Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant. Report EPS 1/RM/30. September 1995.
|
|
(14)
|
Preskusna metoda C.8 iz te priloge, Strupenost za deževnike.
|
|
(15)
|
Suedel, B. C., in Rodgers, J. H. (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13: 1163–1175.
|
|
(16)
|
Naylor, C., in Rodrigues, C. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291–3303.
|
|
(17)
|
Dunnett, C. W. (1964). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096–1121.
|
|
(18)
|
Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics, 20: 482–491.
|
|
(19)
|
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103–117.
|
|
(20)
|
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28: 510–531.
|
|
(21)
|
Rao, J. N. K., in Scott, A. J. (1992). A simple method for the analysis of clustered binary data. Biometrics 48: 577–585.
|
|
(22)
|
Christensen, E. R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18: 213–221.
|
|
(23)
|
Bruce in Versteeg (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11: 1485–1494.
|
|
(24)
|
Slob, W. (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci. 66: 298–312.
|
Dodatek 1
OPREDELITEV POJMOV
Za to preskusno metodo se uporabljajo naslednje opredelitve pojmov:
|
|
formulirana usedlina ali rekonstituirana, umetna ali sintetična usedlina je zmes snovi, uporabljenih za posnemanje fizičnih sestavin naravne usedline;
|
|
|
voda nad usedlino je voda, ki se nalije nad usedlino v preskusni posodi;
|
|
|
intersticijska voda ali porna voda je voda, ki zavzema prostor med delci usedline in zemljine;
|
|
|
usedlina s primešano snovjo je usedlina, ki ji je bila dodana preskusna snov;
|
|
|
preskusna kemikalija je snov ali zmes, preskušana z uporabo te preskusne metode.
|
Dodatek 2
Priporočila za gojenje Chironomus riparius
|
1.
|
Ličinke Chironomus se lahko gojijo v kristalizirkah ali večjih vsebnikih. Na dno vsebnika se nanese tanka plast finega kremenovega peska (debela približno 5 do 10 mm). Za primeren substrat se je izkazal tudi kieselguhr (npr. Merck, Art 8117) (zadošča tanjša plast, debela samo nekaj mm). Nato se doda primerna voda do globine več cm. Vodo je treba po potrebi dotočiti, da se nadomestijo izgube zaradi izhlapevanja in prepreči izsušitev. Voda se po potrebi lahko zamenja. Zagotoviti je treba rahlo prezračevanje. Posode, v katerih se gojijo ličinke, morajo biti v primerni kletki, ki bo preprečila pobeg odraslih preobraženih osebkov. Kletka mora biti dovolj velika, da lahko preobraženi odrasli osebki rojijo, sicer se lahko zgodi, da ne bo parjenja (najmanjša velikost je približno 30 × 30 × 30 cm).
|
|
2.
|
Kletke morajo biti v prostoru s sobno temperaturo ali prostoru s stalnim ozračjem pri 20 ± 2 °C s 16-urnim obdobjem svetlobe (jakost približno 1 000 lux) in 8-urno temo. Po poročilih lahko manj kot 60-odstotna relativna vlažnost zraka ovira razmnoževanje.
|
Voda za redčenje
|
3.
|
Uporabi se lahko vsaka primerna naravna ali sintetična voda. Običajno se uporabljajo voda iz vodnjaka, deklorirana vodovodna voda in umetni mediji (npr. medij Elendt ‚M4‘ ali ‚M7‘, glej spodaj). Vodo je treba pred uporabo prezračiti. Voda za gojenje se lahko po potrebi obnovi, tako da se uporabljena voda iz gojitvenih posod skrbno pretoči ali izsesa, ne da bi pri tem uničili ovoj ličink.
|
Hranjenje ličink
|
4.
|
Ličinke Chironomus je treba hraniti s približno 250 mg ribje hrane v kosmičih (TetraMin®, TetraPhyll® ali druga podobna zaščitena znamka ribje hrane) na posodo na dan. Hrana se lahko daje v obliki suhega mletega prahu ali kot suspenzija v vodi: 1,0 g hrane v kosmičih se doda 20 ml vode za redčenje in zmeša, da nastane homogena mešanica. Ta pripravek se lahko daje v količini približno 5 ml na posodo na dan (pred uporabo ga je treba pretresti). Starejše ličinke lahko dobijo več hrane.
|
|
5.
|
Hranjenje se prilagaja kakovosti vode. Če gojitveni medij postane ‚moten‘, je treba hranjenje zmanjšati. Dodajanje hrane je treba skrbno spremljati. Premalo hrane bo povzročilo selitev ličink v vodni stolpec, preveč hrane pa povečano mikrobno dejavnost in zmanjšane koncentracije kisika. Oboje lahko privede do počasnejše rasti.
|
|
6.
|
Ko se pripravijo nove gojitvene posode, se lahko dodajo tudi celice nekaterih zelenih alg (npr. Scenedesmus subspicatus, Chlorella vulgaris).
|
Hranjenje preobraženih odraslih osebkov
|
7.
|
Nekateri raziskovalci so predlagali, da se lahko kot hrana za odrasle preobražene osebke uporabi vatna blazinica, namočena v nasičeno raztopino saharoze.
|
Preobrazba
|
8.
|
Pri 20 ± 2 °C se bo preobrazba v odrasle osebke iz posod za gojenje ličink začela po približno 13 do 15 dneh. Samce je mogoče preprosto prepoznati po pahljačastih tipalkah.
|
Jajčna legla
|
9.
|
Ko so v kletki za razmnoževanje odrasli osebki, je treba vse posode za gojenje ličink trikrat tedensko preveriti zaradi morebitnih odloženih želatinastih jajčnih legel, ki jih je treba previdno odstraniti. Prenesti jih je treba v majhno posodo, ki vsebuje vzorec vode za razmnoževanje. Jajčna legla se uporabijo za pripravo nove gojitvene posode (npr. 2 do 4 jajčna legla/posodo) ali za preskuse strupenosti.
|
|
10.
|
Ličinke prvega stadija bi se morale izleči po 2 ali 3 dneh.
|
Priprava novih gojitvenih posod
|
11.
|
Ko so gojišča vzpostavljena, bi moralo biti mogoče novo gojitveno posodo za ličinke pripraviti vsak teden ali manj pogosto, odvisno od zahtev preskušanja, stare posode pa odstraniti, ko se ličinke preobrazijo v odrasle osebke. S takim sistemom bo najpreprosteje zagotovljena redna oskrba z odraslimi osebki.
|
Priprava preskusnih raztopin ‚M4‘ in ‚M7‘
|
12.
|
Elendt (1990) je opisal medij ‚M4‘. Medij ‚M7‘ se pripravi kot medij ‚M4‘, z izjemo snovi, navedenih v preglednici 1, za katere so koncentracije pri ‚M7‘ štirikrat nižje kot pri ‚M4‘. Publikacija o mediju ‚M7‘ je v pripravi (Elendt, osebno sporočilo). Preskusna raztopina se ne sme pripraviti po Elendt in Bias (1990), saj koncentracije NaSiO3 5 H2O, NaNO3, KH2PO4 in K2HPO4, navedene za pripravo osnovnih raztopin, niso ustrezne.
|
Priprava medija ‚M7‘
|
13.
|
Vsaka osnovna raztopina (I) se pripravi posebej, sestavljena osnovna raztopina (II) pa se pripravi iz teh osnovnih raztopin (I) (glej preglednico 1). V 50 ml sestavljene osnovne raztopine (II), ki ji je dodana količina vsake osnovne raztopine makrohranilnih snovi, navedena v preglednici 2, se dolije deionizirana voda do 1 litra, da se pripravi medij ‚M7‘. Založna raztopina vitaminov se pripravi tako, da se trije vitamini dodajo v deionizirano vodo, kot je navedeno v preglednici 3, 0,1 ml sestavljene osnovne raztopine vitaminov pa se doda končnemu mediju ‚M7‘ malo pred uporabo. (Založna raztopina vitaminov se shranjuje zamrznjena v majhnih alikvotih.) Medij se prezračuje in stabilizira.
|
VIRI:
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Uredila M. Streloke in H. Köpp. Berlin 1995.
Preglednica 1
Založne raztopine elementov v sledeh za medija M4 in M7
|
Založne raztopine (I)
|
Količina (mg) za pripravo 1 litra z deionizirano vodo
|
Za pripravo sestavljene osnovne raztopine (II): zmešajte naslednje količine (ml) osnovnih raztopin (I) in dopolnite do 1 litra z deionizirano vodo
|
Končne koncentracije v preskusnih raztopinah (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(15)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4 H2O (15)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (15)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (15)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6 H2O (15)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (15)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2 H2O (15)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2 H2O (15)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6 H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2 H2O (15)
(16)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7 H2O (15)
(16)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Preglednica 2
Založne raztopine makrohranilnih snovi za medija M4 in M7
|
|
Količina za pripravo 1 litra z deionizirano vodo
(mg)
|
Količina osnovnih raztopin makrohranilnih snovi za pripravo medijev M4 in M7
(ml/l)
|
Končne koncentracije v preskusnih raztopinah M4 in M7
(mg/l)
|
|
CaCl2 · 2 H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7 H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9 H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Preglednica 3
Založna raztopina vitaminov za medija M4 in M7. Vse tri raztopine vitaminov so združene v eno.
|
|
Količina za pripravo 1 litra z deionizirano vodo
(mg)
|
Količina dodane osnovne raztopine vitaminov za pripravo medijev M4 in M7
(ml/l)
|
Končne koncentracije v preskusnih raztopinah M4 in M7
(mg/l)
|
|
Tiamin hidroklorid
|
750
|
0,1
|
0,075
|
|
Cianokobalamin (B12)
|
10
|
0,1
|
0,0010
|
|
Biotin
|
7,5
|
0,1
|
0,00075
|
VIRI:
Elendt, B. P. (1990). Selenium Deficiency in Crustacean. Protoplasma 154: 25–33.
Elendt, B. P. in Bias, W.-R. (1990). Trace Nutrient Deficiency in Daphnia magna Cultured in Standard Medium for Toxicity Testing. Effects on the Optimization of Culture Conditions on Life History Parameters of D. magna. Water Research 24 (9): 1157–1167.
Dodatek 3
PRIPRAVA FORMULIRANE USEDLINE
Sestava usedline
Sestava formulirane usedline mora biti naslednja:
|
Sestavina
|
Značilnosti
|
Delež suhe
teže usedline v %
|
|
Šota
|
Šotni mah, čim bližje pH 5,5 do 6,0, brez vidnih ostankov rastlin, fino mlet (velikost delcev ≤ 1 mm) in sušen na zraku.
|
4–5
|
|
Kremenov pesek
|
Velikost zrn: > 50 % delcev mora biti velikih 50–200 μm.
|
75–76
|
|
Kaolinska glina
|
Vsebnost kaolinita ≥ 30 %.
|
20
|
|
Organski ogljik
|
Uravnava se z dodatkom šote in peska.
|
2 (± 0,5)
|
|
Kalcijev karbonat
|
CaCO3, zdrobljen v prah, kemijsko čist.
|
0,05–0,1
|
|
Voda
|
Prevodnost ≤ 10 μS/cm.
|
30–50
|
Priprava
Šota se posuši na zraku in zmelje v fin prah. Pripravi se suspenzija potrebne količine šote v prahu v deionizirani vodi, za kar se uporabi visoko zmogljiva naprava za homogenizacijo. pH te suspenzije se s CaCO3 uravna na 5,5 ± 0,5. Suspenzija se vsaj 2 dneva kondicionira z rahlim mešanjem pri 20 ± 2 °C, da se stabilizira pH in vzpostavi stabilna mikrobna komponenta. Vrednost pH se znova izmeri in mora biti 6,0 ± 0,5. Šotna suspenzija se nato zmeša z drugimi sestavinami (peskom in kaolinsko glino) in deionizirano vodo, da nastane homogena usedlina z vsebnostjo vode v razponu 30 do 50 % suhe teže usedline. pH končne mešanice se znova izmeri in po potrebi uravna na 6,5 do 7,5 s CaCO3. Vzamejo se vzorci usedline, da se določita suha teža in vsebnost organskega ogljika. Priporoča se, da se formulirana usedlina pred uporabo v preskusu strupenosti s trzačami 7 dni kondicionira v enakih pogojih, kakršni vladajo v poznejšem preskusu.
Shranjevanje
Suhe sestavine za pripravo umetne usedline se lahko shranjujejo v suhem in hladnem prostoru pri sobni temperaturi. Formulirana (mokra) usedlina se pred uporabo v preskusu ne sme shranjevati. Uporabiti jo je treba takoj po 7-dnevnem obdobju kondicioniranja, s katerim se njena priprava konča.
VIRI:
Poglavje C.8 te priloge. Strupenost za deževnike.
Meller, M., Egeler, P., Rombke, J., Schallnass, H., Nagel, R., Streit, B. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulfate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety 39: 10–20.
Dodatek 4
Kemijske lastnosti sprejemljive vode za redčenje
|
Snov
|
Koncentracije
|
|
Delci
|
< 20 mg/l
|
|
Celotni organski ogljik
|
< 2 mg/l
|
|
Neionizirani amoniak
|
< 1 μg /l
|
|
Trdota kot CaCO3
|
< 400 mg/l (17)
|
|
Ostanek klora
|
< 10 μg /l
|
|
Skupni organofosforni pesticidi
|
< 50 ng/1
|
|
Skupni organoklorni pesticidi in poliklorirani bifenili
|
< 50 ng/1
|
|
Skupni organski klor
|
< 25 ng/1
|
Dodatek 5
Napotek za spremljanje preobrazbe ličink trzače
Na preskusne čaše se namestijo lovilniki za preobražene osebke. Potrebni so od 20. dne do konca preskusa. Primer lovilnika je narisan spodaj:

A: najlonska mrežica
B: obrnjen plastični lonček
C: poskusna čaša brez ustja
D: mrežasti okenci za izmenjavo vode
E: voda
F: usedlina
C.28 PRESKUS STRUPENOSTI S TRZAČAMI V SISTEMU VODE IN USEDLINE Z UPORABO VODE S PRIMEŠANO PRESKUSNO SNOVJO
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD TG 219 (2004). Zasnovana je za oceno učinkov daljše izpostavljenosti kemikalijam na ličinke sladkovodne trzače Chironomus sp., ki živijo v usedlinah. Temelji predvsem na smernici BBA, v kateri je scenarij izpostavljenosti uporaba sistema vode in usedline, sestavljenega iz umetne zemljine in vodnega stolpca (1). Upošteva tudi obstoječe protokole za preskušanje strupenosti za Chironomus riparius in Chironomus tentans, ki so bili razviti v Evropi in Severni Ameriki (2) (3) (4) (5) (6) (7) (8) ter krožno preskušeni (1) (6) (9). Uporabijo se lahko tudi druge dobro dokumentirane vrste trzače, npr. Chironomus yoshimatsui (10) (11).
|
|
2.
|
Scenarij izpostavljenosti, uporabljen v tej preskusni metodi, je primešanje preskusne snovi v vodo. Izbira ustreznega scenarija izpostavljenosti je odvisna od namena uporabe preskusa. Scenarij izpostavljenosti, ki vključuje primešanje preskusne snovi v vodni stolpec, je namenjen simulaciji pojava zanašanja pesticidov in zajema začetne najvišje koncentracije v porni vodi. Uporaben je tudi za druge vrste izpostavljenosti (vključno z razlitji kemikalij), razen za procese kopičenja, ki trajajo dlje od preskusnega obdobja.
|
|
3.
|
Snovi, ki jih je treba preskusiti v zvezi z organizmi, živečimi v usedlinah, se običajno v tem delu zelo dolgo obdržijo. Organizmi, živeči v usedlinah, so lahko izpostavljeni na številne načine. Relativni pomen vsakega načina izpostavljenosti in čas, da ta prispeva k skupnim strupenim učinkom, sta odvisna od fizikalno-kemijskih lastnosti zadevne kemikalije. Pri snoveh, ki se močno adsorbirajo (npr. z log Kow > 5), ali snoveh, ki se kovalentno vežejo na usedlino, je lahko zaužitje kontaminirane hrane pomemben način izpostavljenosti. Da ne bi podcenili strupenosti visoko lipofilnih snovi, se lahko predvidi uporaba hrane, dodane usedlini pred uporabo preskusne snovi. Da bi se upoštevali vsi morebitni načini izpostavljenosti, je ta preskusna metoda osredotočena na dolgoročno izpostavljenost. Preskus za C. riparius in C. yoshimatsui traja 20 do 28 dni, za C. tentans pa 28 do 65 dni. Če so za določen namen potrebni kratkoročni podatki, na primer da se raziščejo učinki nestabilne kemikalije, se lahko dodatne ponovitve umaknejo po 10 dneh.
|
|
4.
|
Izmerjene končne točke so skupno število preobraženih odraslih osebkov in čas do preobrazbe. Če so potrebni dodatni kratkoročni podatki, je priporočljivo, da se preživetje in rast ličink izmerita šele po 10-dnevnem obdobju, po potrebi z dodatnimi ponovitvami.
|
|
5.
|
Priporoča se uporaba formulirane usedline. Ta ima pred naravnimi usedlinami več prednosti:
|
—
|
variabilnost pri poskusih je manjša, saj formulirana usedlina pomeni ponovljivo ‚standardizirano matrico‘, poleg tega ni več treba iskati nekontaminiranih in čistih virov usedlin,
|
|
—
|
preskusi se lahko začnejo kadar koli, ne da bi se bilo treba ukvarjati s sezonsko variabilnostjo v preskusni usedlini, poleg tega usedline ni treba predhodno obdelati, da bi se odstranila domorodna favna; s formulirano usedlino se tudi znižajo stroški, povezani z zbiranjem zadostne količine usedline na terenu za rutinsko preskušanje,
|
|
—
|
uporaba formulirane usedline omogoča primerjave strupenosti in ustrezno razvrstitev snovi: podatki o strupenosti iz preskusov z naravnimi in umetnimi usedlinami so bili primerljivi za več kemikalij (2).
|
|
|
6.
|
Uporabljene opredelitve pojmov so navedene v Dodatku 1.
|
NAČELO PRESKUSA
|
7.
|
Ličinke trzače prvega stadija so izpostavljene razponu koncentracije preskusne kemikalije v sistemih vode in usedline. Preskus se začne z vnosom ličink prvega stadija v preskusne čaše, ki vsebujejo sistem vode in usedline, nato pa se preskusna snov primeša v vodo. Hitrost preobrazbe in razvoja trzač se izmerita ob koncu preskusa. Preživetje in teža ličink se lahko izmerita tudi po 10 dneh, če je to potrebno (z dodatnimi ponovitvami, kot je ustrezno). Ti podatki se analizirajo bodisi z regresijskim modelom, da se oceni koncentracija, ki bi povzročila x-odstotno zmanjšanje preobrazbe, preživetja ali rasti ličink (npr. EC15, EC50 itd.), bodisi s preskušanjem statističnih domnev za določitev NOEC/LOEC. Slednje zahteva primerjavo vrednosti učinkov s kontrolnimi vrednostmi, za kar se uporabijo statistični preskusi.
|
INFORMACIJE O PRESKUSNI SNOVI
|
8.
|
Znani morajo biti vodotopnost preskusne snovi, njen parni tlak, izmerjeni ali izračunani koeficient porazdelitve v usedlini ter stabilnost v vodi in usedlini. Za določitev količine preskusne snovi v vodi nad usedlino, porni vodi in usedlini mora biti na voljo zanesljiva analitska metoda z znano in izpričano natančnostjo in mejo zaznave. Med Koristni informaciji sta tudi strukturna formula in čistost preskusne snovi. Prav tako je koristno poznati obnašanje preskusne snovi v okolju (npr. disipacija, abiotska in biotska razgradnja itd.). Dodatne smernice za preskušanje snovi s fizikalno-kemijskimi lastnostmi, zaradi katerih je preskušanje oteženo, so navedene v (12).
|
REFERENČNE KEMIKALIJE
|
9.
|
Redno se lahko preskušajo referenčne kemikalije, da se tako zagotavlja zanesljivost protokola za preskušanje in preskusnih pogojev. Primeri referenčnih strupenih snovi, ki so bile uspešno uporabljene v krožnih preskusih in potrditvenih raziskavah, so: lindan, trifluralin, pentaklorofenol, kadmijev klorid in kalijev klorid (1) (2) (5) (6) (13).
|
VELJAVNOST PRESKUSA
|
10.
|
Za veljavnost preskusa morajo biti izpolnjeni naslednji pogoji:
|
—
|
preobrazba v kontrolnih posodah ob koncu preskusa mora biti vsaj 70-odstotna (1) (6),
|
|
—
|
C. riparius in C. yoshimatsui v kontrolnih posodah se morajo v odrasle osebke preobraziti med 12. in 23. dnem po vnosu v posode; C. tentans potrebujejo 20 do 65 dni,
|
|
—
|
ob koncu preskusa je treba v vsaki posodi izmeriti pH in koncentracijo raztopljenega kisika. Koncentracija kisika mora biti vsaj 60 % nasičenosti zraka (ASV) pri uporabljeni temperaturi, pH vode nad usedlino pa mora biti v vseh preskusnih posodah med 6 in 9,
|
|
—
|
temperatura vode se ne sme razlikovati za več kot ± 1,0 °C. Temperaturo vode bi bilo mogoče nadzorovati z izotermalnim prostorom; v takem primeru je treba temperaturo v prostoru potrjevati v ustreznih časovnih presledkih.
|
|
OPIS METODE
Preskusne posode
|
11.
|
Raziskava se izvaja v steklenih 600-mililitrskih čašah z 8-centimetrskim premerom. Primerne so tudi druge posode, vendar morajo zagotavljati primerno globino usedline in vode nad njo. Površina usedline mora biti dovolj velika, da zagotavlja 2 do 3 cm2 na ličinko. Razmerje med debelino usedline in globino vode nad njo mora biti 1 : 4. Preskusne posode in druge naprave, ki bodo prišle v stik s preskusnim sistemom, morajo biti v celoti iz stekla ali drugega kemijsko inertnega materiala (npr. teflona).
|
Izbira vrst
|
12.
|
Če je mogoče, naj se v preskusu uporabi vrsta Chironomus riparius. Chironomus tentans je prav tako primerna, vendar je z njo težje delati in zahteva daljše preskusno obdobje. Uporabi se lahko tudi Chironomus yohimatsui. Podrobnosti o metodah gojenja za Chironomus riparius so navedene v Dodatku 2. Informacije o pogojih gojenja so na voljo tudi za druge vrste, npr. Chironomus tentans (4) in Chironomus yoshimatsui (11). Identifikacijo vrst je treba potrditi pred preskusom, ni pa to potrebno pred vsakim preskusom, če organizmi prihajajo iz internega gojišča.
|
Usedlina
|
13.
|
Če je mogoče, je treba uporabiti formulirano usedlino (imenovano tudi rekonstituirana, umetna ali sintetična usedlina). Če se uporabi naravna usedlina, je treba določiti njene lastnosti (vsaj pH in vsebnost organskega ogljika, priporoča se tudi določitev drugih parametrov, kot sta razmerje C/N in granulometrija), poleg tega ne sme biti onesnažena in ne sme vsebovati drugih organizmov, ki bi lahko tekmovali s trzačami ali jih požrli. Prav tako se priporoča, naj se naravna usedlina pred uporabo v preskusu strupenosti s trzačami 7 dni kondicionira v enakih pogojih, kakršni vladajo v poznejšem preskusu. Za uporabo v tem preskusu (1) (15) (16) se priporoča naslednja formulirana usedlina, ki temelji na umetni zemljini, uporabljeni v preskusni metodi C.8 (14):
|
(a)
|
4–5 % (suhe teže) šote: čim bližje vrednosti pH 5,5 do 6,0; pomembno je uporabiti fino mleto šoto v prahu (velikost delcev ≤ 1 mm), sušeno samo na zraku;
|
|
(b)
|
20 % (suhe teže) kaolinske gline (vsebnost kaolinita po možnosti nad 30 %);
|
|
(c)
|
75–76 % (suhe teže) kremenovega peska (prevladovati mora fini pesek, pri katerem je več kot 50 % delcev velikih 50 do 200 μm);
|
|
(d)
|
doda se deionizirana voda, tako da je v končni mešanici vlaga 30- do 50-odstotna;
|
|
(e)
|
doda se kemijsko čist kalcijev karbonat (CaCO3), da se pH v končni mešanici usedline uravna na 7,0 ± 0,5;
|
|
(f)
|
vsebnost organskega ogljika v končni mešanici mora biti 2 % (± 0,5 %), uravnava pa se z ustreznimi količinami šote in peska v skladu s točkama (a) in (c).
|
|
|
14.
|
Vir šote, kaolinske gline in peska mora biti znan. Preveriti je treba, da sestavine usedline niso kemično onesnažene (npr. da ne vsebujejo težkih kovin, organoklornih spojin, organofosfornih spojin itd.). Primer priprave formulirane usedline je opisan v Dodatku 3. Sprejemljiva je tudi mešanica suhih sestavin, če se dokaže, da se sestavine usedline po dodatku vode nad usedlino ne začnejo ločevati (npr. lebdenje šotnih delcev) in da je šota ali usedlina zadostno kondicionirana.
|
Voda
|
15.
|
Za preskusno vodo je primerna vsaka voda, ki ustreza kemijskim značilnostim sprejemljive vode za redčenje, ki so navedene v dodatkih 2 in 4. Za gojiščno vodo in preskusno vodo je sprejemljiva vsaka primerna voda, naravna voda (površinska ali podzemna voda), obdelana voda (glej Dodatek 2) ali deklorirana vodovodna voda, če trzače čas gojenja in preskušanja v njej preživijo brez znakov stresa. Na začetku preskusa mora biti pH preskusne vode med 6 in 9, skupna trdota pa ne sme biti višja od 400 mg/l kot CaCO3. Če se domneva, da bo prišlo do interakcije med ioni, ki povzročajo trdoto vode, in preskusno snovjo, je treba uporabiti vodo z manjšo trdoto (v takem primeru se torej ne sme uporabiti medij Elendt M4). Ves čas raziskave je treba uporabljati isto vrsto vode. Lastnosti vode, navedene v Dodatku 4, je treba izmeriti vsaj dvakrat na leto ali kadar se sumi, da so se morda te lastnosti bistveno spremenile.
|
Založne raztopine – voda s primešano preskusno snovjo
|
16.
|
Preskusne koncentracije se izračunajo na podlagi koncentracij v vodnem stolpcu, tj. vodi nad usedlino. Preskusne raztopine izbranih koncentracij se običajno pripravijo z redčenjem osnovne raztopine. Založne raztopine je po možnosti treba pripraviti tako, da se preskusna snov raztopi v preskusnem mediju. V nekaterih primerih bo morda treba uporabiti topila ali disperzijska sredstva, da se pripravi primerno koncentrirana osnovna raztopina. Primerna topila so na primer aceteon, etanol, metanol, etilen glikol monoetil eter, etilen glikol dimetil eter, dimetil formamid in trietilen glikol. Disperzijska sredstva, ki se lahko uporabijo, so Cremaphor RH40, Tween 80, metil celuloza 0,01 % in HCO-40. Koncentracija topila v končnem preskusnem mediju mora biti minimalna (tj. ≤ 0,1 ml/l) in mora biti enaka v vseh posodah s preskusno snovjo. Kadar se uporabi topilo, to ne sme bistveno vplivati na preživetje ličink trzače ali imeti vidnih škodljivih učinkov nanje, kar se pokaže s kontrolno enoto, v kateri je le topilo. Vendar si je treba čim bolj prizadevati, da se taki materiali ne uporabijo.
|
NAČRT PRESKUSA
|
17.
|
Načrt preskusa se nanaša na izbiro števila preskusnih koncentracij in razmikov med njimi, število posod za vsako koncentracijo in število ličink na posodo. Opisani so načrti za točkovno oceno EC, oceno NOEC in izvedbo mejnega preskusa. Regresijska analiza je primernejša od pristopa s preskušanjem domnev.
|
Načrt preskusa za regresijsko analizo
|
18.
|
S koncentracijami, vključenimi v preskus, bi morala biti zajeta efektivna koncentracija (npr. EC15, EC50) in razpon koncentracije, v katerem je zanimiv vpliv preskusne snovi. Na splošno se natančnost in zlasti veljavnost, ki ju je mogoče doseči pri ocenah efektivnih koncentracij (ECx), izboljšata, kadar je efektivna koncentracija v okviru preskušanega razpona koncentracij. Izogibati se je treba ekstrapolaciji veliko pod najnižjo pozitivno koncentracijo ali veliko nad najvišjo koncentracijo. Kot pomoč pri izbiri razpona koncentracij, ki bo uporabljen (glej odstavek 27), se lahko izvede predhodni preskus za ugotavljanje razpona.
|
|
19.
|
Če je treba oceniti ECx, je treba preskusiti vsaj 5 koncentracij in izvesti 3 ponovitve za vsako koncentracijo. Vsekakor je priporočljivo uporabiti dovolj preskusnih koncentracij, da se omogoči dobra ocena modela. Faktor med koncentracijami ne sme biti večji od 2 (izjema je dopustna, kadar naklon krivulje odmerek-učinek ni strm). Število ponovitev na posamezno posodo s preskusno snovjo se lahko zmanjša, če se poveča število preskusnih koncentracij z različnimi učinki. Povečanje števila ponovitev ali zmanjšanje velikosti razmikov med preskusnimi koncentracijami običajno vodi do ožjih intervalov zaupanja za preskus. Dodatne ponovitve so potrebne, če se ocenjujeta 10-dnevno preživetje in rast ličink.
|
Načrt za oceno NOEC/LOEC
|
20.
|
Če je treba oceniti LOEC/NOEC, bi bilo treba uporabiti pet preskusnih koncentracij in izvesti vsaj štiri ponovitve, faktor med koncentracijami pa ne sme biti večji od 2. Število ponovitev mora zadostovati, da se zagotovi ustrezna statistična vrednost za ugotovitev 20-odstotne razlike v primerjavi s kontrolno enoto pri 5-odstotni stopnji značilnosti (p = 0,05). Pri hitrosti razvoja je običajno ustrezna analiza variance (ANOVA), kot sta Dunnettov preskus in Williamsov preskus (17) (18) (19) (20). Pri koeficientu preobrazbe se lahko uporabijo Cochran-Armitageev preskus, Fisherjev eksaktni preskus (z Bonferronijevim popravkom) ali Mantel-Haenszelov preskus.
|
Mejni preskus
|
21.
|
Če v predhodnem preskusu za ugotavljanje razpona ni bilo opaženih učinkov, se lahko opravi mejni preskus (ena preskusna koncentracija in kontrolna enota). Namen mejnega preskusa je pokazati, da je toksična vrednost preskusne snovi večja od preskušene mejne koncentracije. Pri tej preskusni metodi priporočene koncentracije ni mogoče predlagati; to je prepuščeno presoji regulatorjev. Običajno je potrebnih vsaj šest ponovitev za preskusne in kontrolne posode. Izkazati je treba ustrezno statistično vrednost za ugotovitev 20-odstotne razlike v primerjavi s kontrolno enoto pri 5-odstotni stopnji značilnosti (p = 0,05). Kar zadeva učinek na hitrost razvoja in težo, je t-preskus primerna statistična metoda, če podatki izpolnjujejo zahteve tega preskusa (normalnost, homogenost varianc). Če te zahteve niso izpolnjene, se lahko uporabi t-preskus za neenake variance ali neparametrični preskus, kot je Wilcoxon-Mann-Whitneyjev preskus. Pri koeficientu preobrazbe je primeren Fisherjev eksaktni preskus.
|
POSTOPEK
Pogoji izpostavljenosti
Priprava sistema vode in usedline, v katerem je preskusna snov primešana v vodo
|
22.
|
V preskusne posode se dodajo ustrezne količine formulirane usedline (glej odstavka 13 in 14 ter Dodatek 3), da nastane plast, debela vsaj 1,5 cm. Doda se voda do globine 6 cm (glej odstavek 15). Razmerje med debelino usedline in globino vode ne sme biti večje od 1 : 4, usedlina pa ne sme biti debelejša od 3 cm. Sistem vode in usedline je treba sedem dni rahlo prezračevati, preden se dodajo preskusni organizmi (glej odstavek 14 in Dodatek 3). Da se prepreči ločevanje sestavin usedline in ponovna suspenzija finega materiala med dodajanjem preskusne vode v vodni stolpec, se lahko usedlina med točenjem vode prekrije s plastičnim pokrovom, ki se takoj nato odstrani. Primerna so lahko tudi druga sredstva.
|
|
23.
|
Preskusne posode je treba pokriti (npr. s steklenimi ploščami). Po potrebi se med raziskavo voda dotoči do prvotne količine, da se nadomesti izhlapela voda. Za to je treba uporabiti destilirano ali deionizirano vodo, da se prepreči kopičenje soli.
|
Dodajanje preskusnih organizmov
|
24.
|
Od 4 do 5 dni pred vnosom preskusnih organizmov v preskusne posode je treba iz gojišč vzeti jajčna legla in jih vstaviti v majhne posode v gojitvenem mediju. Uporabi se lahko starejši medij iz osnovne kulture ali sveže pripravljeni medij. Če se uporabi slednji, je treba v gojitveni medij dodati majhno količino hrane, npr. zelenih alg in/ali nekaj kapljic filtrata suspenzije iz fino mlete ribje hrane v kosmičih (glej Dodatek 2). Uporabiti je treba samo sveže odložena jajčna legla. Običajno se ličinke izležejo nekaj dni po tem, ko so bila jajčeca odložena (2 do 3 dni za Chironomus riparius pri 20 °C ter 1 do 4 dni za Chironomus tentans pri 23 °C in Chironomus yoshimatsui pri 25 °C), rast ličink pa poteka v 4 stadijih, od katerih vsak traja 4 do 8 dni. V preskusu je treba uporabiti ličinke prvega stadija (2 do 3 ali 1 do 4 dni po tem, ko se izležejo). Stadij trzač se lahko po možnosti preveri z merjenjem širine glave (6).
|
|
25.
|
20 ličink prvega stadija se s topo pipeto naključno vnese v vsako preskusno posodo, ki vsebuje usedlino in vodo s primešano preskusno snovjo. Med dodajanjem ličink v preskusne posode je treba ustaviti prezračevanje vode, ki se ne sme izvajati še 24 ur po tem, ko so bile ličinke dodane (glej odstavka 24 in 32). Glede na uporabljeni načrt preskusa (glej odstavka 19 in 20) se za točkovno oceno EC uporabi vsaj 60 ličink na koncentracijo, za določitev NOEC pa 80.
|
|
26.
|
24 ur po vnosu ličink se preskusna snov vmeša v vodni stolpec nad usedlino, znova se zagotovi prezračevanje. Pod površino vodnega stolpca se s pipeto vnesejo majhne količine raztopine preskusne snovi. Vodo nad usedlino je nato treba premešati, pri čemer je treba paziti, da se ne premeša še usedlina.
|
Preskusne koncentracije
|
27.
|
Preskus za ugotavljanje razpona je lahko koristen za določitev razpona koncentracij za končni preskus. Za ta namen se uporabi niz široko razmaknjenih koncentracij preskusne snovi. Da se zagotovi enaka gostota površine na trzačo, kot bo uporabljena za končni preskus, se trzače izpostavijo vsaki koncentraciji preskusne snovi za obdobje, ki omogoča oceno ustreznih preskusnih koncentracij, pri čemer ponovitve niso potrebne.
|
|
28.
|
Preskusne koncentracije za končni preskus se določijo na podlagi rezultata preskusa za ugotavljanje razpona. Izbrati in uporabiti je treba vsaj pet koncentracij, kot je opisano v odstavkih 18 do 20.
|
Kontrolne enote
|
29.
|
V preskus je treba vključiti kontrolne posode, v katerih ni preskusne snovi, toda ki vsebujejo usedlino, z ustreznim številom ponovitev (glej odstavka 19 in 20). Če je bilo za aplikacijo preskusne snovi uporabljeno topilo (glej odstavek 16), je treba dodati kontrolno posodo, katere usedlina vsebuje tudi topilo.
|
Preskusni sistem
|
30.
|
Uporabljajo se statični sistemi. Polstatični ali pretočni sistemi z občasnim ali kontinuiranim obnavljanjem vode nad usedlino se lahko uporabijo v izjemnih primerih, na primer če specifikacije kakovosti vode postanejo neprimerne za preskusni organizem ali vplivajo na kemijsko ravnotežje (npr. ravni raztopljenega kisika se preveč znižajo, koncentracija izločkov se preveč poviša ali minerali iztekajo iz usedline in vplivajo na pH in/ali trdoto vode). Vendar za izboljšanje kakovosti vode nad usedlino običajno zadoščajo in se prednostno uporabljajo druge metode, kot je prezračevanje.
|
Hrana
|
31.
|
Ličinke je treba hraniti, po možnosti vsak dan ali vsaj trikrat na teden. Za mlade ličinke v prvih desetih dneh ustreza 0,25–0,5 mg (0,35–0,5 mg za C. yoshimatsui) ribje hrane (suspenzija v vodi ali fino mleta hrana, npr. TetraMin ali TetraPhyll; glej podrobnosti v Dodatku 2) na ličinko na dan. Nekoliko več hrane bodo morda potrebovale starejše ličinke: za preostanek preskusa mora zadostovati 0,5–1 mg na ličinko na dan. Obrok hrane je treba zmanjšati v vseh preskusnih in kontrolnih posodah, če se opazi rast glivic ali smrtnost v kontrolnih posodah. Če razvoja glivic ni mogoče ustaviti, je treba preskus ponoviti. Kadar se preskušajo snovi, ki se močno adsorbirajo (npr. z log Kow > 5), ali snovi, ki se kovalentno vežejo na usedlino, se lahko količina hrane, potrebna za zagotovitev preživetja in naravne rasti organizmov, doda formulirani usedlini pred obdobjem stabilizacije. Za to je treba namesto ribje hrane uporabiti rastlinski material, npr. dodatek 0,5 % (suhe teže) fino mletih listov npr. velike koprive (Urtica dioica), bele murve (Morus alba), plazeče detelje (Trifolium repens), špinače (Spinacia oleracea) ali drugega rastlinskega materiala (Cerophyl ali alfa celuloza).
|
Pogoji inkubacije
|
32.
|
Zagotovi se rahlo prezračevanje vode nad usedlino v preskusnih posodah, po možnosti 24 ur po vnosu ličink, in se izvaja ves čas preskusa (paziti je treba, da koncentracija raztopljenega kisika ne pade pod 60 % ASV). Prezračevanje se zagotavlja prek steklene pasteurjeve pipete, pritrjene 2 do 3 cm nad plastjo usedline (tj. 1 ali nekaj mehurčkov/s). Kadar se preskušajo hlapne kemikalije, je mogoče razmisliti o tem, da se sistem vode in usedline ne bi prezračeval.
|
|
33.
|
Preskus se izvaja pri konstantni temperaturi 20 °C (± 2 °C). Za C. tentans in C. yoshimatsui sta priporočeni temperaturi 23 °C oziroma 25 °C (± 2 °C). Uporablja se 16-urno obdobje osvetljenosti, jakost svetlobe pa mora biti 500 do 1 000 lux.
|
Trajanje izpostavljenosti
|
34.
|
Izpostavljenost se začne z vnosom ličink v posode s primešano preskusno snovjo in kontrolne posode. Najdaljši čas izpostavljenosti za C. riparius in C. yoshimatsui je 28 dni, za C. tentans pa 65 dni. Če se ličinke v odrasle osebke preobrazijo prej, se lahko preskus konča najmanj pet dni po preobrazbi zadnjega odraslega osebka v kontrolni posodi.
|
OPAŽANJA
Preobrazba
|
35.
|
Določita se čas razvoja in skupno število v celoti preobraženih samcev in samic trzače. Samce je mogoče preprosto prepoznati po pahljačastih tipalkah.
|
|
36.
|
Preskusne posode je treba opazovati vsaj trikrat na teden, da se ugotovi kakršno koli neobičajno obnašanje (npr. zapuščanje usedline, nenavadno plavanje) v primerjavi s kontrolno posodo. V obdobju pričakovane preobrazbe je potrebno dnevno štetje preobraženih trzač. Spol in število v celoti preobraženih trzač se zapišeta dnevno. Po identifikaciji se trzače odstranijo iz posod. Vsa jajčna legla, odložena pred zaključkom preskusa, je treba evidentirati in nato odstraniti, da se prepreči vnovični vnos ličink v usedlino. Evidentira se tudi število vidnih bub, ki se niso preobrazile. Napotek za spremljanje preobrazbe je v Dodatku 5.
|
Rast in preživetje
|
37.
|
Če je treba zagotoviti podatke o 10-dnevnem preživetju in rasti ličink, je treba na začetku vključiti dodatne preskusne posode, ki se lahko uporabijo pozneje. Usedlina iz teh dodatnih posod se preseje skozi sito z 250 μm velikimi luknjicami, da se zadržijo ličinke. Merili za pogin sta negibnost ali neodzivnost na mehanske dražljaje. Ličinke, ki ostanejo v usedlini, je prav tako treba šteti za mrtve (ličinke, ki so poginile na začetku preskusa, so morda razgradili mikrobi). Določi se suha teža (brez pepela) preživelih ličink na preskusno posodo in izračuna srednja suha teža posamezne ličinke na posodo. Koristno je določiti, v kateri stadij spadajo preživele ličinke; za to se lahko izmeri širina glave vsakega osebka.
|
Analitske meritve
Koncentracija preskusne snovi
|
38.
|
Na začetku (po možnosti 1 uro po vnosu preskusne snovi) in koncu preskusa je treba analizirati vsaj vzorce vode nad usedlino, porne vode in usedline, in sicer pri najvišji in nižji koncentraciji. Te določitve koncentracije preskusne snovi pokažejo obnašanje/porazdelitev preskusne snovi v sistemu vode in usedline. Vzorčenje usedline na začetku preskusa lahko vpliva na preskusni sistem (npr. odstranitev preskusnih ličink), zato je treba za analitske določitve na začetku preskusa in med njim po potrebi uporabiti dodatne preskusne posode (glej odstavek 39). Meritve v usedlini morda ne bodo potrebne, če je bila porazdelitev preskusne snovi med vodo in usedlino jasno določena z raziskavo vode/usedline v primerljivih pogojih (npr. razmerje usedline in vode, vrsta uporabe, vsebnost organskega ogljika v usedlini).
|
|
39.
|
Kadar se izvajajo vmesne meritve (npr. sedmi dan) in če so za analize potrebni veliki vzorci, ki jih ni mogoče vzeti iz preskusnih posod, ne da bi to vplivalo na preskusni sistem, je treba analitske določitve izvesti na vzorcih iz dodatnih preskusnih posod, ki se obdelujejo enako (vključno s prisotnostjo preskusnih organizmov), vendar se za biološka opažanja ne uporabljajo.
|
|
40.
|
Za izolacijo intersticijske vode se priporoča 30-minutno centrifugiranje pri npr. 10 000 g in 4 °C. Če pa se za preskusno snov izkaže, da se ne adsorbira na filtre, je sprejemljivo tudi filtriranje. V nekaterih primerih morda koncentracij v porni vodi zaradi premajhnega vzorca ne bo mogoče analizirati.
|
Fizikalno-kemijski parametri
|
41.
|
Vrednost pH, raztopljeni kisik v preskusni vodi in temperaturo preskusnih posod je treba ustrezno meriti (glej odstavek 10). Trdoto in amonij je treba izmeriti v kontrolnih posodah in eni preskusni posodi pri najvišji koncentraciji na začetku in koncu preskusa.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
42.
|
Namen tega preskusa je določiti učinek preskusne snovi na hitrost razvoja in skupno število v celoti preobraženih samcev in samic trzače oziroma, pri 10-dnevnem preskusu, učinke na preživetje in težo ličink. Če ni znakov o statistično različni občutljivosti spolov, se lahko rezultati za samce in samice za statistične analize združijo. Razlike v občutljivosti med spoloma je mogoče statistično oceniti, na primer s preskusom χ2-r × 2. Po potrebi je treba po 10 dneh določiti preživetje ličink in srednjo suho težo posamezne ličinke na posodo.
|
|
43.
|
Če je mogoče, se efektivne koncentracije, izražene kot koncentracije v vodi nad usedlino, izračunajo na podlagi izmerjenih koncentracij na začetku preskusa (glej odstavek 38).
|
|
44.
|
Za točkovno oceno EC50 ali druge ECx se lahko statistični podatki po posameznih posodah uporabijo kot dejanske ponovitve. Pri izračunu intervala zaupanja za ECx je treba upoštevati variabilnost med posodami ali pa dokazati, da je ta zanemarljiva. Če se model prilega po metodi najmanjših kvadratov, je treba statistične podatke po posameznih posodah transformirati, da se izboljša homogenost variance. Vendar je treba vrednosti ECx izračunati po tem, ko so bili rezultati transformirani nazaj na prvotno vrednost.
|
|
45.
|
Kadar je namen statistične analize določiti NOEC/LOEC s preskušanjem domnev, je treba upoštevati variabilnost med posodami, npr. z vgnezdeno ANOVO. Alternativno se lahko uporabijo robustnejši preskusi (21), kadar so običajne predpostavke ANOVE kršene.
|
Koeficient preobrazbe
|
46.
|
Koeficient preobrazbe da odgovor ‚vse ali nič‘ in se lahko analizira s Cochran-Armitageevim preskusom, uporabljenim regresivno (step-down), kadar se pričakuje monotono razmerje odmerek-učinek in so ti podatki v skladu s tem pričakovanjem. Če niso, se lahko uporabi Fisherjev eksaktni preskus ali Mantel-Haenszelov preskus z Bonferroni-Holmovimi popravljenimi p-vrednostmi. Če se izkaže, da je variabilnost med ponovitvami v okviru iste koncentracije večja, kot bi kazala binomska porazdelitev (pogosto imenovana ‚ekstra-binomska‘ variacija), potem je treba uporabiti robustni Cochran-Armitageev preskus ali Fisherjev eksaktni preskus, kot je predlagano v (21).
|
|
47.
|
Vsota preobraženih trzač na posodo ne se določi in deli s številom vnesenih ličink na:
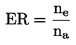
pri čemer je:
|
ER
|
=
|
koeficient preobrazbe,
|
|
ne
|
=
|
število preobraženih trzač na posodo,
|
|
na
|
=
|
število vnesenih ličink na posodo.
|
|
|
48.
|
Druga možnost, ki je najprimernejša za velike vzorce, kadar obstaja ekstra binomska varianca, je, da se koeficient preobrazbe obravnava kot zvezni odgovor in se uporabijo postopki, kot je Williamsov preskus, kadar se pričakuje monotono razmerje odmerek-učinek in kadar podatki ER potrjujejo to predpostavko. Dunettov preskus je primeren, kadar monotonost ne drži. Velik vzorec je tu opredeljen kot število preobraženih osebkov in število nepreobraženih osebkov po posameznih ponovitvah (posodah), pri čemer je obojih več kot pet.
|
|
49.
|
Za uporabo metod ANOVA je treba vrednosti ER najprej transformirati z arkus sinus-korensko transformacijo ali Freeman-Tukeyevo transformacijo, da se dobi približna normalna porazdelitev in da se variance izenačijo. Cochran-Armitageev preskus, Fisherjev eksaktni preskus (Bonferroni) ali Mantel-Haenszelov preskus se lahko uporabijo, kadar se uporabljajo absolutne pogostosti. Pri arkus sinus-korenski transformaciji se izračuna arkus sinus (sin–1) kvadratnega korena ER.
|
|
50.
|
Za koeficiente preobrazbe se vrednosti ECx izračunajo z regresijsko analizo (ali npr. probit (22), logit, Weibull, ustrezno programsko opremo itd.). Če regresijska analiza ni uspešna (npr. kadar sta manj kot dva delna odgovora), se uporabijo druge neparametrične metode, kot sta drseče povprečje ali linearna interpolacija.
|
Hitrost razvoja
|
51.
|
Srednji čas razvoja pomeni srednji časovni razpon med vnosom ličink (dan 0 preskusa) in preobrazbo poskusne kohorte trzač. (Za izračun dejanskega časa razvoja je treba upoštevati starost ličink ob vnosu.) Hitrost razvoja je obratna času razvoja (enota: 1/dan) in predstavlja tisti delež razvoja ličink, ki se zgodi na dan. Za oceno teh raziskav strupenosti v usedlini je primernejša hitrost razvoja, saj je njena varianca manjša, poleg tega je bolj homogena in bližje normalni porazdelitvi v primerjavi s časom razvoja. Zato so učinkoviti parametrični preskusi primernejši za hitrost razvoja kot za čas razvoja. Če se hitrost razvoja obravnava kot zvezni odgovor, se lahko vrednosti ECx ocenijo z regresijsko analizo (npr. (23) (24)).
|
|
52.
|
Za naslednje statistične preskuse se za število trzač, opaženih na dan opazovanja x, domneva, da so se preobrazile na sredini časovnega intervala med dnevom × in dnevom x – 1 (l = dolžina intervala opazovanja, običajno 1 dan). Srednja hitrost razvoja na posodo (x) se izračuna z enačbo:
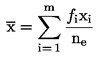
pri čemer je:
|
|
:
|
srednja hitrost razvoja na posodo,
|
|
i
|
:
|
indeks intervala opazovanja,
|
|
m
|
:
|
največje število intervalov opazovanja,
|
|

|
:
|
število trzač, preobraženih v intervalu opazovanja i,
|
|
ne
|
:
|
skupno število preobraženih trzač ob koncu poskusa, (=  ) )
|
|
x
|
:
|
hitrost razvoja trzač, preobraženih v intervalu i.
|

pri čemer je:
|
dayi
|
:
|
dan opazovanja (dnevi od vnosa),
|
|
li
|
:
|
dolžina intervala opazovanja i (dnevi, običajno 1 dan).
|
|
Poročilo o preskusu
|
53.
|
V poročilu o preskusu morajo biti vsaj naslednje informacije:
|
|
Preskusna snov:
|
—
|
fizikalno stanje, in kjer je ustrezno, fizikalno-kemijske lastnosti (vodotopnost, parni tlak, porazdelitveni koeficient v tleh (ali v usedlini, če je na voljo), stabilnost v vodi itd.),
|
|
—
|
kemijski identifikacijski podatki (splošno ime, kemijsko ime, strukturna formula, številka CAS itd.), vključno s čistostjo in analitsko metodo za količinsko določanje preskusne snovi.
|
|
|
|
Preskusne vrste:
|
—
|
uporabljene preskusne živali: vrsta, znanstveno ime, vir organizmov in pogoji razmnoževanja,
|
|
—
|
informacije o ravnanju z jajčnimi legli in ličinkami,
|
|
—
|
starost preskusnih živali ob vnosu v preskusne posode.
|
|
|
|
Preskusni pogoji:
|
—
|
uporabljena usedlina, tj. naravna ali formulirana,
|
|
—
|
za naravno usedlino lokacija in opis mesta vzorčenja usedline, vključno, če je mogoče, s preteklim onesnaženjem, značilnosti: pH, vsebnost organskega ogljika, razmerje C/N in granulometrija (če je ustrezno),
|
|
—
|
priprava formulirane usedline: sestavine in značilnosti (vsebnost organskega ogljika, pH, vlaga itd. na začetku preskusa),
|
|
—
|
priprava preskusne vode (če se uporablja obdelana voda) in značilnosti (koncentracija kisika, pH, prevodnost, trdota itd. na začetku preskusa),
|
|
—
|
globina usedline in vode nad njo,
|
|
—
|
količina vode nad usedlino in porne vode; teža mokre usedline s porno vodo in brez nje,
|
|
—
|
preskusne posode (material in velikost),
|
|
—
|
način priprave osnovnih raztopin in preskusnih koncentracij,
|
|
—
|
uporaba preskusne snovi: uporabljene preskusne koncentracije, število ponovitev in uporaba topila, če je bilo uporabljeno,
|
|
—
|
pogoji inkubacije: temperatura, svetlobni ciklus in jakost svetlobe, prezračevanje (pogostost in jakost),
|
|
—
|
podrobne informacije o hranjenju, vključno z vrsto hrane, pripravo, količino in načinom.
|
|
|
|
Rezultati:
|
—
|
nazivne preskusne koncentracije, izmerjene preskusne koncentracije in rezultati vseh analiz za določitev koncentracije preskusne snovi v preskusni posodi,
|
|
—
|
kakovost vode v preskusnih posodah, tj. pH, temperatura, raztopljeni kisik, trdota in amonij,
|
|
—
|
morebitna nadomestitev izhlapele preskusne vode,
|
|
—
|
število preobraženih samcev in samic trzače na posodo in na dan,
|
|
—
|
število ličink, ki se niso preobrazile v trzače, na posodo,
|
|
—
|
srednja suha teža posamezne ličinke na posodo in po stadijih, če je ustrezno,
|
|
—
|
delež preobrazbe na ponovitev in preskusno koncentracijo (združeni samci in samice trzače),
|
|
—
|
srednja hitrost razvoja v celoti preobraženih trzač na ponovitev in stopnjo koncentracije (združeni samci in samice trzače),
|
|
—
|
ocene strupenih končnih točk, npr. ECx (in s tem povezani intervali zaupanja), NOEC in/ali LOEC, ter statistične metode, uporabljene za njihovo določitev,
|
|
—
|
obravnava rezultatov, vključno z vsemi vplivi na rezultat preskusa, ki izvirajo iz odstopanj od te preskusne metode.
|
|
|
VIRI:
|
(1)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Uredila M. Streloke in H. Köpp. Berlin 1995.
|
|
(2)
|
Fleming, R., idr. (1994). Sediment Toxicity Tests for Poorly Water-Soluble Substances. Končno poročilo za Evropsko komisijo. Poročilo št.: EC 3738. Avgust 1994. WRc, Združeno kraljestvo.
|
|
(3)
|
SETAC (1993). Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments. Z delavnice WOSTA, ki je potekala na Nizozemskem.
|
|
(4)
|
ASTM International/E1706-00 (2002). Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates. pp 1125-1241. V ASTM International 2002 Annual Book of Standards. Zvezek 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
(6)
|
US-EPA (2000). Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates. Druga izdaja. EPA 600/R-99/064. Marec 2000. Sprememba prve izdaje iz junija 1994.
|
|
(7)
|
US-EPA/OPPTS 850.1735. (1996): Whole Sediment Acute Toxicity Invertebrates.
|
|
(8)
|
US-EPA/OPPTS 850.1790. (1996): Chironomid Sediment toxicity Test.
|
|
(9)
|
Milani, D., Day, K. E., McLeay, D. J., Kirby, R. S. (1996). Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada’s biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius). Technical Report. Environment Canada. National Water Research Institute. Burlington, Ontario, Canada.
|
|
(10)
|
Sugaya, Y. (1997). Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui. Jp. J. Sanit. Zool. 48 (4): 345–350.
|
|
(11)
|
Kawai, K. (1986). Fundamental studies on Chironomid allergy. I. Culture methods of some Japanese Chironomids (Chironomidae, Diptera). Jp. J. Sanit. Zool. 37(1): 47–57.
|
|
(12)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(13)
|
Environment Canada (1995). Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant. Report EPS 1/RM/30. September 1995.
|
|
(14)
|
Poglavje C.8 te priloge, Strupenost za deževnike.
|
|
(15)
|
Suedel, B. C., in Rodgers, J. H. (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13: 1163–1175.
|
|
(16)
|
Naylor, C., in Rodrigues, C. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291–3303.
|
|
(17)
|
Dunnett, C. W. (1964). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc. 50: 1096–1121.
|
|
(18)
|
Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics 20: 482–491.
|
|
(19)
|
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103–117.
|
|
(20)
|
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 510–531.
|
|
(21)
|
Rao, J. N. K., in Scott, A. J. (1992). A simple method for the analysis of clustered binary data. Biometrics 48: 577–585.
|
|
(22)
|
Christensen, E. R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18: 213–221.
|
|
(23)
|
Bruce in Versteeg (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11: 1485–1494.
|
|
(24)
|
Slob, W. (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci. 66: 298–312.
|
Dodatek 1
OPREDELITEV POJMOV
Za to metodo se uporabljajo naslednje opredelitve pojmov:
|
|
formulirana usedlina ali rekonstituirana, umetna ali sintetična usedlina je zmes snovi, uporabljenih za posnemanje fizičnih sestavin naravne usedline;
|
|
|
voda nad usedlino je voda, ki se nalije nad usedlino v preskusni posodi;
|
|
|
intersticijska voda ali porna voda je voda, ki zavzema prostor med delci usedline in zemljine;
|
|
|
voda s primešano snovjo je preskusna voda, ki ji je bila dodana preskusna snov;
|
|
|
preskusna kemikalija je snov ali zmes, preskušana z uporabo te preskusne metode.
|
Dodatek 2
Priporočila za gojenje Chironomus riparius
|
1.
|
Ličinke Chironomus se lahko gojijo v kristalizirkah ali večjih vsebnikih. Na dno vsebnika se nanese tanka plast finega kremenovega peska (debela približno 5 do 10 mm). Za primeren substrat se je izkazal tudi kieselguhr (npr. Merck, Art 8117) (zadošča tanjša plast, debela samo nekaj mm). Nato se doda primerna voda do globine več cm. Vodo je treba po potrebi dotočiti, da se nadomestijo izgube zaradi izhlapevanja in prepreči izsušitev. Voda se po potrebi lahko zamenja. Zagotoviti je treba rahlo prezračevanje. Posode, v katerih se gojijo ličinke, morajo biti v primerni kletki, ki bo preprečila pobeg odraslih preobraženih osebkov. Kletka mora biti dovolj velika, da lahko preobraženi odrasli osebki rojijo, sicer se lahko zgodi, da ne bo parjenja (najmanjša velikost je približno 30 × 30 × 30 cm).
|
|
2.
|
Kletke morajo biti v prostoru s sobno temperaturo ali prostoru s stalnim ozračjem pri 20 ± 2 °C s 16-urnim obdobjem svetlobe (jakost približno 1 000 lux) in 8-urno temo. Po poročilih lahko manj kot 60-odstotna relativna vlažnost zraka ovira razmnoževanje.
|
Voda za redčenje
|
3.
|
Uporabi se lahko vsaka primerna naravna ali sintetična voda. Običajno se uporabljajo voda iz vodnjaka, deklorirana vodovodna voda in umetni mediji (npr. medij Elendt ‚M4‘ ali ‚M7‘, glej spodaj). Vodo je treba pred uporabo prezračiti. Voda za gojenje se lahko po potrebi obnovi, tako da se uporabljena voda iz gojitvenih posod skrbno pretoči ali izsesa, ne da bi pri tem uničili ovoj ličink.
|
Hranjenje ličink
|
4.
|
Ličinke Chironomus je treba hraniti s približno 250 mg ribje hrane v kosmičih (TetraMin®, TetraPhyll® ali druga podobna zaščitena znamka ribje hrane) na posodo na dan. Hrana se lahko daje v obliki suhega mletega prahu ali kot suspenzija v vodi: 1,0 g hrane v kosmičih se doda 20 ml vode za redčenje in zmeša, da nastane homogena mešanica. Ta pripravek se lahko daje v količini približno 5 ml na posodo na dan (pred uporabo ga je treba pretresti). Starejše ličinke lahko dobijo več hrane.
|
|
5.
|
Hranjenje se prilagaja kakovosti vode. Če gojitveni medij postane ‚moten‘, je treba hranjenje zmanjšati. Dodajanje hrane je treba skrbno spremljati. Premalo hrane bo povzročilo selitev ličink v vodni stolpec, preveč hrane pa povečano mikrobno dejavnost in zmanjšane koncentracije kisika. Oboje lahko privede do počasnejše rasti.
|
|
6.
|
Ko se pripravijo nove gojitvene posode, se lahko dodajo tudi celice nekaterih zelenih alg (npr. Scenedesmus subspicatus, Chlorella vulgaris).
|
Hranjenje preobraženih odraslih osebkov
|
7.
|
Nekateri raziskovalci so predlagali, da se lahko kot hrana za odrasle preobražene osebke uporabi vatna blazinica, namočena v nasičeno raztopino saharoze.
|
Preobrazba
|
8.
|
Pri 20 ± 2 °C se bo preobrazba v odrasle osebke iz posod za gojenje ličink začela po približno 13 do 15 dneh. Samce je mogoče preprosto prepoznati po pahljačastih tipalkah.
|
Jajčna legla
|
9.
|
Ko so v kletki za razmnoževanje odrasli osebki, je treba vse posode za gojenje ličink trikrat tedensko preveriti zaradi morebitnih odloženih želatinastih jajčnih legel, ki jih je treba previdno odstraniti. Prenesti jih je treba v majhno posodo, ki vsebuje vzorec vode za razmnoževanje. Jajčna legla se uporabijo za pripravo nove gojitvene posode (npr. 2 do 4 jajčna legla/posodo) ali za preskuse strupenosti.
|
|
10.
|
Ličinke prvega stadija bi se morale izleči po 2 ali 3 dneh.
|
Priprava novih gojitvenih posod
|
11.
|
Ko so gojišča vzpostavljena, bi moralo biti mogoče novo gojitveno posodo za ličinke pripraviti vsak teden ali manj pogosto, odvisno od zahtev preskušanja, stare posode pa odstraniti, ko se ličinke preobrazijo v odrasle osebke. S takim sistemom bo najpreprosteje zagotovljena redna oskrba z odraslimi osebki.
|
Priprava preskusnih raztopin ‚M4‘ in ‚M7‘
|
12.
|
Elendt (1990) je opisal medij ‚M4‘. Medij ‚M7‘ se pripravi kot medij ‚M4‘, razen za snovi, navedene v preglednici 1, za katere so koncentracije pri ‚M7‘ štirikrat nižje kot pri ‚M4‘. Publikacija o mediju ‚M7‘ je v pripravi (Elendt, osebno sporočilo). Preskusna raztopina se ne sme pripraviti po Elendt in Bias (1990), saj koncentracije NaSiO3 5 H2O, NaNO3, KH2PO4 in K2HPO4, navedene za pripravo osnovnih raztopin, niso ustrezne.
|
Priprava medija ‚M7‘
|
13.
|
Vsaka osnovna raztopina (I) se pripravi posebej, sestavljena osnovna raztopina (II) pa se pripravi iz teh osnovnih raztopin (I) (glej preglednico 1). V 50 ml sestavljene osnovne raztopine (II), ki ji je dodana količina vsake osnovne raztopine makrohranilnih snovi, navedena v preglednici 2, se dolije do 1 litra deionizirana voda, da se pripravi medij ‚M7‘. Založna raztopina vitaminov se pripravi tako, da se trije vitamini dodajo v deionizirano vodo, kot je navedeno v preglednici 3, 0,1 ml sestavljene osnovne raztopine vitaminov pa se doda končnemu mediju ‚M7‘ malo pred uporabo. (Založna raztopina vitaminov se shranjuje zamrznjena v majhnih alikvotih.) Medij se prezračuje in stabilizira.
Preglednica 1
Založne raztopine elementov v sledeh za medija M4 in M7
|
Založne raztopine (I)
|
Količina (mg) za pripravo 1 litra z deionizirano vodo
|
Za pripravo sestavljene osnovne raztopine (II): zmešajte naslednje količine (ml) osnovnih raztopin (I) in dopolnite do 1 litra z deionizirano vodo
|
Končne koncentracije v preskusnih raztopinah (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(18)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4 H2O (18)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (18)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (18)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6 H2O (18)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (18)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2 H2O (18)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2 H2O (18)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6 H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2 H2O (18)
(19)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7 H2O (18)
(19)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Preglednica 2
Založne raztopine makrohranilnih snovi za medija M4 in M7
|
|
Količina za pripravo 1 litra z deionizirano vodo
(mg)
|
Količina osnovnih raztopin makrohranilnih snovi za pripravo medijev M4 in M7
(ml/l)
|
Končne koncentracije v preskusnih raztopinah M4 in M7
(mg/l)
|
|
CaCl2 · 2 H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7 H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9 H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Preglednica 3
Založna raztopina vitaminov za medija M4 in M7
Vse tri raztopine vitaminov so združene v eno.
|
|
Količina za pripravo 1 litra z deionizirano vodo
(mg)
|
Količina dodane osnovne raztopine vitaminov za pripravo medijev M4 in M7
(ml/l)
|
Končne koncentracije v preskusnih raztopinah M4 in M7
(mg/l)
|
|
Tiamin hidroklorid
|
750
|
0,1
|
0,075
|
|
Cianokobalamin (B12)
|
10
|
0,1
|
0,0010
|
|
Biotin
|
7,5
|
0,1
|
0,00075
|
|
VIRI:
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Uredila M. Streloke in H. Köpp. Berlin 1995.
Elendt, B. P. (1990). Selenium Deficiency in Crustacean. Protoplasma 154: 25–33.
Elendt, B. P., in Bias, W.-R. (1990). Trace Nutrient Deficiency in Daphnia magna Cultured in Standard Medium for Toxicity Testing. Effects on the Optimization of Culture Conditions on Life History Parameters of D. magna. Water Research 24 (9): 1157–1167.
Dodatek 3
PRIPRAVA FORMULIRANE USEDLINE
Sestava usedline
Sestava formulirane usedline mora biti naslednja:
|
Sestavina
|
Značilnosti
|
Delež suhe
teže usedline v %
|
|
Šota
|
Šotni mah, čim bližje pH 5,5 do 6,0, brez vidnih ostankov rastlin, fino mlet (velikost delcev ≤ 1 mm) in sušen na zraku.
|
4–5
|
|
Kremenov pesek
|
Velikost zrn: > 50 % delcev mora biti velikih 50–200 μm.
|
75–76
|
|
Kaolinska glina
|
Vsebnost kaolinita ≥ 30 %.
|
20
|
|
Organski ogljik
|
Uravnava se z dodatkom šote in peska.
|
2 (± 0,5)
|
|
Kalcijev karbonat
|
CaCO3, zdrobljen v prah, kemijsko čist.
|
0,05–0,1
|
|
Voda
|
Prevodnost ≤ 10 μS/cm.
|
30–50
|
Priprava
Šota se posuši na zraku in zmelje v fin prah. Pripravi se suspenzija potrebne količine šote v prahu v deionizirani vodi, za kar se uporabi visoko zmogljiva naprava za homogenizacijo. pH te suspenzije se s CaCO3 uravna na 5,5 ± 0,5. Suspenzija se vsaj 2 dneva kondicionira z rahlim mešanjem pri 20 ± 2 °C, da se stabilizira pH in vzpostavi stabilna mikrobna komponenta. Vrednost pH se znova izmeri in mora biti 6,0 ± 0,5. Šotna suspenzija se nato zmeša z drugimi sestavinami (peskom in kaolinsko glino) in deionizirano vodo, da nastane homogena usedlina z vsebnostjo vode v razponu 30 do 50 % suhe teže usedline. pH končne mešanice se znova izmeri in po potrebi uravna na 6,5 do 7,5 s CaCO3. Vzamejo se vzorci usedline, da se določita suha teža in vsebnost organskega ogljika. Priporoča se, da se formulirana usedlina pred uporabo v preskusu strupenosti s trzačami 7 dni kondicionira v enakih pogojih, kakršni vladajo v poznejšem preskusu.
Shranjevanje
Suhe sestavine za pripravo umetne usedline se lahko shranjujejo v suhem in hladnem prostoru pri sobni temperaturi. Formulirana (mokra) usedlina se pred uporabo v preskusu ne sme shranjevati. Uporabiti jo je treba takoj po 7-dnevnem obdobju kondicioniranja, s katerim se njena priprava konča.
VIRI:
Poglavje C.8 te priloge. Strupenost za deževnike.
Meller, M., Egeler, P., Rombke, J., Schallnass, H., Nagel, R., Streit, B. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulfate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety 39: 10–20.
Dodatek 4
Kemijske lastnosti sprejemljive vode za redčenje
|
Snov
|
Koncentracije
|
|
Delci
|
< 20 mg/l
|
|
Celotni organski ogljik
|
< 2 mg/l
|
|
Neionizirani amoniak
|
< 1 μg /l
|
|
Trdota kot CaCO3
|
< 400 mg/l (20)
|
|
Ostanek klora
|
< 10 μg /l
|
|
Skupni organofosforni pesticidi
|
< 50 ng/1
|
|
Skupni organoklorni pesticidi in poliklorirani bifenili
|
< 50 ng/1
|
|
Skupni organski klor
|
< 25 ng/1
|
Dodatek 5
Napotek za spremljanje preobrazbe ličink trzače
Na preskusne čaše se namestijo lovilniki za preobražene osebke. Potrebni so od 20. dne do konca preskusa. Primer lovilnika je narisan spodaj:

|
A
|
:
|
najlonska mrežica
|
|
B
|
:
|
obrnjen plastični lonček
|
|
C
|
:
|
poskusna čaša brez ustja
|
|
D
|
:
|
mrežasti okenci za izmenjavo vode
|
|
E
|
:
|
voda
|
|
F
|
:
|
usedlina
|
C.29. DOBRA BIORAZGRADLJIVOST – CO2 V ZAPRTIH POSODAH (PRESKUS NADPROSTORA)
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 310 (2006). Je presejalna metoda za ocenjevanje dobre biološke razgradljivosti kemikalij in daje podobne informacije kot šest preskusnih metod, opisanih v poglavju C.4, A–F, te priloge. Zato se lahko kemikalija, pri kateri so rezultati te preskusne metode pozitivni, šteje za dobro biološko razgradljivo in zato hitro razgradljivo v okolju.
|
|
2.
|
Uveljavljena metoda z ogljikovim dioksidom (CO2) (1), ki temelji na izvirnem Sturmovem preskusu (2) za ocenjevanje biološke razgradljivosti organskih kemikalij z merjenjem ogljikovega dioksida, ki je nastal zaradi mikrobne dejavnosti, je običajno prva izbira za preskušanje slabo topnih in močno adsorptivnih kemikalij. Izbere se tudi za topne (vendar ne hlapne) kemikalije, ker številni menijo, da je nastajanje ogljikovega dioksida edini nedvoumni dokaz mikrobne dejavnosti. Raztopljeni organski ogljik se lahko odstrani s fizikalno-kemijskimi procesi (adsorpcija, izhlapevanje, obarjanje, hidroliza) in mikrobno dejavnostjo, pri številnih nebioloških reakcijah pa se porablja kisik; CO2 redko nastane abiotsko iz organskih kemikalij. Pri izvirnem in prilagojenem Sturmovem preskusu (1) (2) se CO2 odstrani iz tekoče faze v posode za absorpcijo s prepihovanjem (tj. uvajanjem mehurčkov obdelanega zraka za odstranitev CO2 prek tekočega medija), pri Larsonovi različici (3) (4) pa se CO2 prenese iz reakcijske posode v absorberje s spuščanjem zraka brez CO2 skozi nadprostor in dodatno z nenehnim stresanjem preskusne posode. Reaktorska posoda se stresa samo pri prilagojeni Larsonovi različici; v ISO 9439 (5) in izvirni ameriški različici (6), ki oba določata prepihovanje in ne zamenjave v nadprostoru, je mešanje predpisano samo za netopne snovi. Pri drugi uradni metodi Agencije za varstvo okolja Združenih držav (US EPA) (7), ki temelji na Gledhillovi metodi (8), je reakcijska posoda, ki se stresa, zaprta za ozračje, nastali CO2 pa se zbira v notranjem alkalnem lovilniku neposredno iz plinske faze kot pri klasičnih Warburgovih/Barcroftovih respirometrih.
|
|
3.
|
Toda pokazalo se je, da se pri uporabi standardnega prilagojenega Sturmovega preskusa pri številnih kemikalijah (9) v mediju nabira anorganski ogljik (IC). Pri razgradnji 20 mg C/l anilina je bila ugotovljena koncentracija IC kar 8 mg/l. Zato zbiranje CO2 v alkalnih lovilnikih ni pravilno pokazalo količine mikrobiološko nastalega CO2 pri vmesnih časih med razgradnjo. Zato pogoja, da je treba za uvrstitev preskusne kemikalije med dobro biološko razgradljive v ‚10-dnevnem obdobju‘ (10 dneh, ki neposredno sledijo dosegu 10-odstotne biološke razgradljivosti) nabrati > 60 % teoretično največje količine nastalega CO2 (ThCO2), ne izpolnjujejo nekatere kemikalije, ki bi se med dobro biološko razgradljive uvrstile ob odstranjevanju raztopljenega organskega ogljika (DOC).
|
|
4.
|
Kadar je delež razgradnje manjši, kot je bilo pričakovano, se v preskusni raztopini morda nabira IC. V takem primeru se lahko razgradljivost oceni z drugimi preskusi dobre biološke razgradljivosti.
|
|
5.
|
Zaradi drugih pomanjkljivosti Sturmove metodologije (okornost, dolgotrajnost, nagnjenost k eksperimentalnim napakam in neuporabnost za hlapne kemikalije) se je že prej poleg Gledhillove metode iskala tehnika z zaprtimi posodami, in ne s pretokom plina. Boatman idr. (12) so pregledali prejšnje metode in uporabili zaprt sistem z nadprostorom, pri čemer je bil CO2 sproščen v nadprostor ob koncu inkubacije z zakisanjem medija. CO2 se je meril z analizo s plinsko kromatografijo (GC)/IC v samodejno odvzetih vzorcih iz nadprostora, a se pri tem ni upošteval raztopljeni anorganski ogljik (DIC) v tekoči fazi. Poleg tega so bile uporabljene posode zelo majhne (20 ml) in so vsebovale samo 10 ml medija, kar je povzročalo težave, npr. pri dodajanju nujno zelo majhnih količin netopnih preskusnih kemikalij in/ali pa v inokuliranem mediju ni bilo (dovolj) mikroorganizmov, ki so sposobni razgraditi preskusne kemikalije.
|
|
6.
|
Te težave so v neodvisnih raziskavah premagali Struijs in Stoltenkamp (13) ter Birch in Fletcher (14), pri čemer so slednja navdihnile njune izkušnje z napravo, ki se uporablja pri preskusu anaerobne biološke razgradnje (15). Pri prvi metodi (13) se CO2 meri v nadprostoru po zakisanju in uravnoteženju, pri drugi (14) pa je bil DIC izmerjen v plinski in tekoči fazi, brez obdelave; več kot 90 % nastalega IC je bilo v tekoči fazi. Obe metodi imata prednosti pred Sturmovim preskusom, ker je preskusni sistem bolj priročen in lažje obvladljiv, ker je mogoče preskusiti hlapne kemikalije in ker je preprečena možnost zakasnitve pri merjenju nastalega CO2.
|
|
7.
|
Pristopa sta bila združena v standard ISO za CO2 v nadprostoru (16), ki je bil krožno preskušen (17), na njem pa temelji tudi ta preskusna metoda. Podobno sta pristopa uporabljena v metodi US EPA (18). Priporočeni sta dve metodi merjenja CO2, in sicer CO2 v nadprostoru po zakisanju (13) in IC v tekoči fazi po dodajanju presežne baze. Drugo metodo je uvedel Peterson pri krožnem preskusu CONCAWE (19) te metode z nadprostorom, prilagojene za merjenje inherentne biološke razgradljivosti. Spremembe iz revizije teh metod iz leta 1992 (20) v poglavju C.4 te priloge za dobro biološko razgradljivost so bile vključene v to preskusno metodo, tako da so pogoji (medij, trajanje itd.) sicer enaki kot pri revidiranem Sturmovem preskusu (20). Birch in Fletcher (14) sta pokazala, da ta preskus nadprostora daje zelo podobne rezultate, kot so bili za iste kemikalije ugotovljeni v krožnem preskusu OECD (21) revidiranih preskusnih metod.
|
NAČELO PRESKUSA
|
8.
|
Preskusna kemikalija, običajno 20 mg C/l, se kot edini vir ogljika in energije inkubira v pufrskem mediju z mineralnimi solmi, ki je inokuliran z mešano populacijo mikroorganizmov. Preskus se opravi v zaprtih steklenicah z nadprostorom, v katerem je zrak, ki predstavlja zalogo kisika za aerobno biološko razgradnjo. Nastajanje CO2 zaradi popolne aerobne biološke razgradnje preskusne kemikalije se določi z merjenjem nastalega IC v preskusnih steklenicah, ki presega IC, ki nastane v posodah s slepim vzorcem, ki vsebujejo samo inokuliran medij. Obseg biološke razgradnje se izrazi kot delež teoretično največje količine nastalega IC (ThIC) na podlagi prvotno dodane količine preskusne kemikalije (kot organski ogljik).
|
|
9.
|
Merita se lahko tudi odstranitev DOC in/ali obseg primarne biološke razgradnje preskusne kemikalije (2).
|
INFORMACIJE O PRESKUSNI KEMIKALIJI
|
10.
|
Za izračun deleža razgradnje je treba poznati vsebnost organskega ogljika (% w/w) v preskusni kemikaliji, ki se določi na podlagi njene kemične strukture ali z merjenjem. Pri hlapnih preskusnih kemikalijah je izmerjena ali izračunana Henryjeva konstanta koristna za določanje ustreznega volumskega razmerja med nadprostorom in tekočino. Informacije o strupenosti preskusne kemikalije za mikroorganizme so koristne pri izbiri ustrezne preskusne koncentracije in za razlago rezultatov, ki kažejo slabo biološko razgradljivost. Priporoča se vključitev kontrole zaviranja, razen če je znano, da preskusna kemikalija ne zavira mikrobne dejavnosti (glej odstavek 24).
|
UPORABA METODE
|
11.
|
Preskus se uporablja za vodotopne in netopne preskusne kemikalije, vendar je treba zagotoviti njihovo dobro porazdelitev. S priporočenim volumskim razmerjem med nadprostorom in tekočino 1 : 2 se lahko preskusijo hlapne kemikalije s Henryjevo konstanto do 50 Pa.m3.mol-1, saj delež preskusne kemikalije v nadprostoru ne preseže 1 % (13). Pri preskušanju bolj hlapnih kemikalij se lahko uporabi manjša prostornina nadprostora, vendar je lahko njihova biološka razpoložljivost omejujoča, zlasti če so slabo topne v vodi. Toda uporabniki morajo zagotoviti, da sta volumsko razmerje med nadprostorom in tekočino ter koncentracija preskusne kemikalije taka, da je na voljo dovolj kisika za popolno aerobno biološko razgradnjo (npr. treba se je izogibati visoki koncentraciji substrata in majhni prostornini nadprostora). Navodila glede tega so na voljo v (13) (23).
|
REFERENČNE KEMIKALIJE
|
12.
|
Za preverjanje preskusnega postopka je treba vzporedno preskusiti referenčno kemikalijo z znano biološko razgradljivostjo. Za ta namen se lahko pri preskušanju vodotopnih preskusnih kemikalij uporabijo anilin, natrijev benzoat ali etilen glikol, pri preskušanju slabo topnih preskusnih kemikalij pa 1-oktanol (13). Biološka razgradnja teh kemikalij mora v 14 dneh doseči > 60 % ThIC.
|
PONOVLJIVOST
|
13.
|
Pri krožnem preskusu metode po ISO (17) so bili pri priporočenih pogojih, vključno z 20 mg C preskusne kemikalije/l, dobljeni spodnji rezultati.
|
Preskusna kemikalija
|
Povprečni delež biološke razgradnje v %
(28d)
|
Koeficient variacije
(%)
|
Število laboratorijev
|
|
Anilin
|
90
|
16
|
17
|
|
1-oktanol
|
85
|
12
|
14
|
Variabilnost znotraj preskusa (ponovljivost) pri uporabi anilina je bila majhna, pri čemer koeficienti variacije niso presegli 5 % v skoraj nobeni izvedbi preskusa. V dveh primerih, v katerih je bila ponovljivost slabša, je bilo za večjo variabilnost verjetno krivo večje nastajanje IC v slepih vzorcih. Pri 1-oktanolu je bila ponovljivost slabša, vendar je bila še vedno manjša od 10 % pri 79 % izvedenih preskusov. Za to večjo variabilnost znotraj preskusa so lahko krive napake pri odmerjanju, saj je treba v zaprte preskusne steklenice vbrizgati majhno količino 1-oktanola (3 do 4 μl). Višji koeficienti variacije nastanejo pri nižjih koncentracijah preskusne kemikalije, zlasti pri koncentracijah pod 10 mg C/l. Temu se je mogoče delno izogniti z znižanjem koncentracije skupnega anorganskega ogljika (TIC) v inokulumu.
|
|
14.
|
Pri krožnem preskusu EU (24) petih površinsko aktivnih snovi, dodanih v 10 mg C/l, so bili dobljeni naslednji rezultati:
|
Preskusna kemikalija
|
Povprečni delež biološke razgradnje v %
(28d)
|
Koeficient variacije
(%)
|
Število laboratorijev
|
|
Tetrapropilen
benzen sulfonat
|
17
|
45
|
10
|
|
Diizooktilsulfo-sukcinat
(anionski)
|
72
|
22
|
9
|
|
Heksadecil-trimetil (21)
amonijev klorid
(kationski)
|
75
|
13
|
10
|
|
Izononilfenol-(etoksilat)9
(neionski)
|
41
|
32
|
10
|
|
Kokoamidopropil
dimetilhidroksi
sulfobetain
(amfoteričen)
|
60
|
23
|
11
|
Rezultati kažejo, da je bila na splošno variabilnost večja pri slabše razgrajenih površinsko aktivnih snoveh. Variabilnost znotraj poskusa je bila manjša od 15 % v 90 % primerov, dosegla pa je največ 30–40 %.
|
OPOMBA:
|
večine površinsko aktivnih snovi ne sestavlja ena sama molekulska vrsta, temveč so mešanica izomerov, homologov itd., ki se razgradijo po različnih značilnih časih prilagajanja in z različno kinetično hitrostjo, zaradi česar nastanejo ‚zabrisane‘ oslabele krivulje, tako da v 10-dnevnem obdobju ni mogoče doseči praga 60 %, čeprav bi vsaka posamezna molekulska vrsta v 10 dneh dosegla > 60 %, če bi se preskušala sama. To je bilo ugotovljeno tudi pri drugih kompleksnih mešanicah.
|
|
OPIS METODE
Oprema
|
15.
|
Običajna laboratorijska oprema in:
|
(a)
|
steklene serumske steklenice, zatesnjene z zamaški iz butilne gume in stisnjenimi aluminijskimi tesnili. Priporočena velikost je ‚125 ml‘, pri čemer je celotna prostornina takih steklenic 160 ml (v tem primeru bi moralo biti znano, da je prostornina posamezne steklenice 160 ± 1 ml). Manjše steklenice se lahko uporabijo, kadar rezultati izpolnjujejo pogoje iz odstavkov 66 in 67;
|
|
(b)
|
analizator ogljika ali drug instrument (npr. plinski kromatograf) za merjenje anorganskega ogljika;
|
|
(c)
|
zelo natančne brizge za plinaste in tekoče vzorce;
|
|
(d)
|
krožni stresalnik v temperaturno nadzorovanem okolju;
|
|
(e)
|
dotok zraka brez CO2 – pripravi se lahko s spuščanjem zraka skozi zrnca zmesi natrijevega in kalcijevega hidroksida ali z uporabo plinske mešanice 80 % N2 / 20 % 02 (neobvezno) (glej odstavek 28);
|
|
(f)
|
naprava za membransko filtracijo poroznosti od 0,20 do 0,45 μm (neobvezno);
|
|
(g)
|
analizator organskega ogljika (neobvezno).
|
|
Reagenti
|
16.
|
Ves čas se uporabljajo analitsko čisti reagenti.
|
Voda
|
17.
|
Uporabljati je treba destilirano ali deionizirano vodo, ki vsebuje ≤ 1 mg/l skupnega organskega ogljika. To predstavlja ≤ 5 % začetne vsebnosti organskega ogljika, uvedene s priporočenim odmerkom preskusne kemikalije.
|
Založne raztopine za medij z mineralnimi solmi
|
18.
|
Založne raztopine in medij z mineralnimi solmi so podobni kot pri preskusih ISO 14593 (16) in C.4 ‚dobra biološka razgradljivost‘ (20). Večja koncentracija amonijevega klorida (2,0 g/l namesto 0,5 g/l) bi morala biti potrebna samo v zelo izjemnih primerih, npr. kadar je koncentracija preskusne kemikalije > 40 mg C/l. Založne raztopine je treba hraniti na hladnem in jih zavreči po šestih mesecih ali prej, če se pokažejo znaki obarjanja ali mikrobne rasti. Pripravijo se naslednje osnovne raztopine:
|
(a)
|
kalijev dihidrogen fosfat (KH2PO4) 8,50 g
dikalijev hidrogen fosfat (K2HPO4) 21,75 g
dinatrijev hidrogen fosfat dihidrat (Na2HPO4.2H2O) 33,40 g
amonijev klorid (NH4Cl) 0,50 g
Raztopijo se v vodi in dopolnijo do 1 litra. pH te raztopine mora biti 7,4 (± 0,2). Če ni, je treba pripraviti novo raztopino.
|
|
(b)
|
kalcijev klorid dihidrat (CaCl2.2H2O) 36,40 g
Raztopi se v vodi in dopolni do 1 litra.
|
|
(c)
|
magnezijev sulfat heptahidrat (MgSO4.7H2O) 22,50 g
Raztopi se v vodi in dopolni do 1 litra.
|
|
(d)
|
železov (III) klorid heksahidrat (FeCl3.6H20) 0,25 g
Raztopi se v vodi in dopolni do 1 litra ter doda kapljica koncentrirane HCl.
|
|
Priprava mineralnega medija
|
19.
|
Zmeša se 10 ml raztopine (a) in približno 800 ml vode (odstavek 17), nato se doda po 1 ml raztopin (b), (c) in (d) ter dopolni z vodo do 1 litra (odstavek 17).
|
Drugi reagenti
|
20.
|
Koncentrirana ortofosforna kislina (H3PO4) (> 85 % mase na volumen).
|
Raztopina natrijevega hidroksida 7M
|
21.
|
280 g natrijevega hidroksida (NaOH) se raztopi v 1 litru vode (odstavek 17). Določi se koncentracija DIC za to raztopino, ta vrednost pa se upošteva pri izračunu rezultata preskusa (glej odstavka 55 in 61), zlasti ob upoštevanju merila veljavnosti iz odstavka 66(b). Če je koncentracija DIC previsoka, se pripravi sveža raztopina.
|
Preskusna kemikalija
|
22.
|
Pripravi se osnovna raztopina preskusne kemikalije, ki se dovolj dobro topi v vodi (odstavek 17) ali preskusnem mediju (odstavek 19), s koncentracijo, ki je po možnosti 100-krat višja od končne koncentracije, ki bo uporabljena v preskusu; morda bo treba pH osnovne raztopine prilagoditi. Založno raztopino je treba dodati mineralnemu mediju, da nastane končna koncentracija organskega ogljika, ki znaša med 2 in 40 mg C/l, po možnosti 20 mg C/l. Če se uporabijo nižje koncentracije, se lahko natančnost poslabša. V posode se lahko neposredno z zelo natančnimi brizgami dodajo topne in netopne tekoče kemikalije. Pri slabo topnih in netopnih preskusnih kemikalijah je lahko potrebna posebna obdelava (25). Na izbiro so:
|
(a)
|
neposredno dodajanje znanih tehtanih količin;
|
|
(b)
|
ultrazvočno dispergiranje pred dodajanjem;
|
|
(c)
|
dispergiranje z emulgatorji; pred dodajanjem je treba ugotoviti, ali imajo zaviralne ali spodbujevalne učinke na mikrobno dejavnost;
|
|
(d)
|
adsorpcija tekočih preskusnih kemikalij ali raztopine v primernem hlapnem topilu na inertni medij ali nosilec (npr. filter iz steklenih vlaken), ki ji sledi izhlapevanje topila, če je uporabljeno, in neposredno dodajanje znanih količin;
|
|
(e)
|
dodajanje znanih količin raztopine preskusne kemikalije v lahko hlapnem topilu v prazno preskusno posodo, ki mu sledi izhlapevanje topila.
|
Preskusiti je treba spodbujevalni ali zaviralni učinek sredstev in topil, uporabljenih v (c), (d) in (e), na mikrobno dejavnost (glej odstavek 42(b)).
|
Referenčna kemikalija
|
23.
|
Pripravi se osnovna raztopina (topne) referenčne kemikalije v vodi (odstavek 17) s koncentracijo, ki je po možnosti 100-krat višja od končne koncentracije, ki bo uporabljena v preskusu (20 mg C/l).
|
Preverjanje zaviranja
|
24.
|
Preskusne kemikalije pogosto ne pokažejo znatne razgradnje v pogojih, uporabljenih pri ocenjevanjih dobre biološke razgradljivosti. Eden od mogočih vzrokov je ta, da preskusna kemikalija zavira inokulum pri koncentraciji, ki je uporabljena v preskusu. V načrt preskusa se lahko vključi preverjanje zaviranja, da se omogoči ugotavljanje (za nazaj) zaviranja kot mogočega vzroka ali prispevajočega dejavnika. S preverjanjem zaviranja je mogoče tudi ovreči take motnje in pokazati, da se lahko nična ali rahla razgradnja pripiše izključno nedovzetnosti za napad mikrobov v pogojih preskusa. Za pridobitev informacij o strupenosti preskusne kemikalije za (aerobne) mikroorganizme se pripravi raztopina v preskusnem mediju, ki vsebuje enako koncentracijo preskusne kemikalije in referenčne kemikalije (odstavek 19), kot je bila dodana (glej odstavka 22 in 23).
|
Inokulum
|
25.
|
Inokulum se lahko pridobi iz različnih virov: aktivnega blata, komunalnih odplak (nekloriranih), površinskih voda in tal ali zmesi teh sestavin (20). Biorazgradno aktivnost vira je treba preveriti z referenčno kemikalijo. Ne glede na vir se ne smejo uporabiti mikroorganizmi, ki so bili že prej izpostavljeni preskusni kemikaliji, če se postopek uporablja kot preskus dobre biološke razgradljivosti.
|
Opozorilo:
|
aktivno blato, odpadne vode in komunalne odplake vsebujejo patogene organizme, zato je treba z njimi ravnati previdno.
|
|
|
26.
|
Glede na izkušnje je optimalna količina inokuluma taka, ki:
|
—
|
zadostuje za primerno biološko razgradno aktivnost,
|
|
—
|
razgradi predpisani delež referenčne kemikalije (glej odstavek 66),
|
|
—
|
daje 102 do 105 enot, ki tvorijo kolonije, na mililiter končne mešanice,
|
|
—
|
pri uporabi aktivnega blata običajno daje koncentracijo 4 mg/l neraztopljenih trdnih snovi v končni mešanici; uporabijo se lahko koncentracije do 30 mg/l, vendar lahko te znatno povečajo nastajanje CO2 v slepih vzorcih (26),
|
|
—
|
prispeva manj kot 10 % začetne koncentracije organskega ogljika, uvedenega s preskusno kemikalijo,
|
|
—
|
običajno znaša 1–10 ml inokuluma za 1 liter preskusne raztopine.
|
|
Aktivno blato
|
27.
|
Iz prezračevalnega bazena čistilne naprave ali laboratorijske enote, v kateri se čistijo predvsem gospodinjske odplake, se vzame svež vzorec aktivnega blata. Po potrebi se grobi delci odstranijo s presejanjem (npr. s sitom z 1 mm2 velikimi luknjicami), blato pa je treba do uporabe ohranjati v aerobnem stanju.
|
|
28.
|
Po odstranitvi grobih delcev se lahko tudi pusti, da se usede, ali se centrifugira (npr. 10 minut pri 1 100 × g). Supernatantna tekočina se zavrže. Blato se lahko spere v mineralni raztopini. Koncentrirano blato se suspendira v mineralnem mediju tako, da bo koncentracija neraztopljenih trdnih snovi 3–5 g/l. Nato se prezračuje do uporabe.
|
|
29.
|
Blato je treba odvzeti iz pravilno delujoče konvencionalne čistilne naprave. Če ga je bilo treba odvzeti iz čistilne naprave z visoko stopnjo čiščenja ali če se domneva, da vsebuje zaviralce, ga je treba sprati. Resuspendirano blato se po temeljitem mešanju pusti, da se usede, ali se centrifugira, supernatantna tekočina se zavrže, sprano blato pa znova suspendira v dodatni količini mineralnega medija. Postopek se ponavlja, dokler se ne šteje, da je blato brez presežnega substrata ali zaviralcev.
|
|
30.
|
Tik pred uporabo popolnoma resuspendiranega ali neobdelanega blata se odvzame vzorec za določitev suhe teže neraztopljenih trdnih snovi.
|
|
31.
|
Dodatna možnost je, da se aktivno blato homogenizira (3–5 g neraztopljenih trdnih snovi/l). Blato se 2 minuti obdeluje z Waringovim mešalnikom pri srednji hitrosti. Zmešano blato se mora usedati 30 minut, če je potrebno, pa tudi dlje, nato pa se odlije tekočina, ki se uporabi kot inokulum v koncentraciji približno 10 mg/l mineralnega medija.
|
|
32.
|
Nastajanje CO2 v slepih vzorcih je mogoče dodatno zmanjšati, če se blato čez noč prezračuje z zrakom brez CO2. Kot koncentracija inokuluma pri tem preskusu (13) se uporabi 4 mg/l aktivnega blata v obliki trdnih snovi.
|
Sekundarni komunalni iztok
|
33.
|
Inokulum se lahko pridobi tudi iz sekundarnega iztoka iz čistilne naprave ali laboratorijske enote, v katero priteka predvsem gospodinjska odpadna voda. Vzorec se hrani v aerobnih pogojih in uporabi na dan odvzema ali pa se po potrebi aklimatizira. Iztok je treba filtrirati skozi grobi filter, da se odstranijo večji delci, in izmeriti vrednost pH.
|
|
34.
|
Za zmanjšanje vsebnosti IC se filtrat 1 uro prepihuje z zrakom brez CO2 (odstavek 15(e)) ob ohranjanju vrednosti pH 6,5 z ortofosforno kislino (odstavek 20). Vrednost pH se vrne na prvotno vrednost z natrijevim hidroksidom (odstavek 21). Po približno 1-urnem usedanju se vzame primerna količina supernatanta za inokulacijo. Ta postopek prepihovanja zmanjša vsebnost IC v inokulumu. Ko je bila na primer kot inokulum uporabljena največja priporočena količina filtriranega prepihanega iztoka (100 ml) na liter, je bilo v posodah s slepim kontrolnim vzorcem med 0,4 in 1,3 mg/l IC (14), kar je predstavljalo 2–6,5 % C iz preskusne kemikalije pri 20 mg C/l in 4–13 % pri 10 mg C/l.
|
Površinske vode
|
35.
|
Vzame se vzorec primerne površinske vode. Hrani se v aerobnih pogojih in uporabi na dan odvzema. Po potrebi se koncentrira s filtriranjem ali centrifugiranjem. Količina inokuluma, ki se uporabi v posamezni preskusni posodi, mora izpolnjevati merila iz odstavka 26.
|
Tla
|
36.
|
V globini do 20 cm pod površino se vzame vzorec ustreznih tal. Iz njega je treba pred presejanjem skozi sito z 2 mm velikimi luknjicami odstraniti kamne, ostanke rastlin in nevretenčarje (če je vzorec prevlažen za takojšnje presejanje, se za lažje presejanje delno posuši na zraku). Hraniti ga treba v aerobnih pogojih in uporabiti na dan jemanja (če se vzorec prevaža v ohlapno zavezani polietilenski vrečki, se lahko največ en mesec hrani v vrečki pri 2 do 4 °C).
|
Aklimatizacija inokuluma
|
37.
|
Inokulum se lahko aklimatizira na preskusne pogoje, ne sme pa se prilagoditi na preskusno kemikalijo. Z aklimatizacijo je mogoče zmanjšati nastajanje CO2 v slepem vzorcu. Aklimatizacija vključuje prezračevanje aktivnega blata po razredčitvi v preskusnem mediju na 30 m/l z vlažnim zrakom brez CO2 5–7 dni pri temperaturi preskusa.
|
PRESKUSNI POSTOPEK
Število steklenic
|
38.
|
Število steklenic (odstavek 15(a)), potrebnih za preskus, je odvisno od pogostosti analize in trajanja preskusa.
|
|
39.
|
Priporoča se, da se po zadostnem številu časovnih intervalov analizirajo po tri steklenice, tako da je mogoče določiti 10-dnevno obdobje. Ob koncu preskusa se analizira tudi vsaj pet preskusnih steklenic (odstavek 15(a)) iz skupin (a), (b) in (c) (glej odstavek 42), da je mogoče izračunati 95-odstotne intervale zaupanja za srednjo vrednost deleža biološke razgradnje.
|
Inokulirani medij
|
40.
|
Inokulum se uporabi v koncentraciji 4 mg/l aktivnega blata v obliki suhih trdnih snovi. Tik pred uporabo se pripravi dovolj inokuliranega medija tako, da se na primer 1 litru medija z mineralnimi solmi (odstavek 19) doda 2 ml ustrezno obdelanega aktivnega blata (odstavki 27 do 32) pri 2 000 mg/l. Pri uporabi sekundarnega komunalnega iztoka se v 900 ml medija z mineralnimi solmi (odstavek 19) doda do 100 ml iztoka (odstavek 33) in z medijem razredči na 1 liter.
|
Priprava steklenic
|
41.
|
Alikvoti inokuliranega medija se odmerijo v ponovitvene steklenice, da nastane razmerje med nadprostorom in tekočino 1 : 2 (npr. v 160-mililitrske steklenice se da 107 ml). Uporabijo se lahko tudi druga razmerja, vendar je treba upoštevati opozorilo iz odstavka 11. Pri uporabi katere koli vrste inokuluma je treba poskrbeti za to, da je inokulirani medij primerno zmešan, tako da se zagotovi njegova enakomerna porazdeljenost po preskusnih steklenicah.
|
|
42.
|
Pripravijo se skupine steklenic (odstavek 15(a)), ki vsebujejo naslednje:
|
(a)
|
preskusne posode (označene s FT), ki vsebujejo preskusno kemikalijo;
|
|
(b)
|
slepe kontrolne vzorce (označene s FB), ki vsebujejo samo preskusni medij in inokulum; dodati je treba tudi vse kemikalije, topila, sredstva ali filtre iz steklenih vlaken, ki se uporabljajo za uvajanje preskusne kemikalije v preskusne posode;
|
|
(c)
|
posode (označene s FC) za preverjanje postopka, ki vsebujejo referenčno kemikalijo;
|
|
(d)
|
po potrebi posode (označene s FI) za preverjanje morebitnega zaviralnega učinka preskusne kemikalije, ki vsebujejo enako koncentracijo preskusne kemikalije in referenčne kemikalije (odstavek 24) kot v steklenicah FT oziroma FC;
|
|
(e)
|
posode (označene s FS) za preverjanje morebitne abiotske razgradnje, enako kot (a) z dodatkom 50 mg/l HgCl2 ali se sterilizirajo drugače (npr. z avtoklaviranjem).
|
|
|
43.
|
Vodotopne preskusne kemikalije in referenčne kemikalije se dodajo kot vodne osnovne raztopine (odstavki 22, 23 in 24), da nastane koncentracija 10 do 20 mg C/l.
|
|
44.
|
Netopne preskusne kemikalije in netopne referenčne kemikalije se dodajo v steklenice na različne načine (glej odstavek 22(a–e)), glede na naravo preskusne kemikalije bodisi pred dodatkom inokuliranega medija ali po njem, odvisno od načina obdelave preskusne kemikalije. Če se uporabi eden od postopkov iz odstavka 22(a–e), je treba s steklenicami FB s slepim vzorcem (odstavek 42(b)) ravnati podobno, vendar brez preskusne kemikalije in referenčne kemikalije.
|
|
45.
|
Hlapne preskusne kemikalije je treba vbrizgati v zaprte posode (odstavek 47) z mikrobrizgo. Odmerek se izračuna iz vbrizgane količine in gostote preskusne kemikalije.
|
|
46.
|
Po potrebi je treba v posode dodati vodo, da je v vsaki posodi enaka količina tekočine. Treba je zagotoviti, da sta razmerje med nadprostorom in tekočino (običajno 1 : 2) ter koncentracija preskusne kemikalije taka, da je v nadprostoru na voljo dovolj kisika za popolno biološko razgradnjo.
|
|
47.
|
Vse steklenice se nato zatesnijo, na primer s septumi iz butilne gume in aluminijastimi pokrovčki. V tej fazi je treba dodati hlapne preskusne kemikalije (odstavek 45). Če je treba spremljati zniževanje koncentracije DOC v preskusni raztopini in če je treba za začetno koncentracijo IC (sterilni kontrolni vzorci, odstavek 42(e)) ali druge determinante opraviti analizo ob času nič, se iz preskusne posode odvzame ustrezni vzorec. Preskusna posoda in njena vsebina se nato zavržeta.
|
|
48.
|
Zaprte posode se položijo na rotacijski stresalnik (odstavek 15(d)), pri čemer mora biti hitrost stresanja zadostna, da vsebina steklenic ostaja dobro premešana in v obliki suspenzije (npr. 150 do 200 vrtljajev na minuto), ter se inkubirajo v temi pri 20 °C, pri čemer se temperatura ohranja v razponu ± 1 °C.
|
Vzorčenje
|
49.
|
Način vzorčenja je odvisen od časa prilagajanja in kinetične hitrosti biološke razgradnje preskusne kemikalije. Steklenice se za analizo žrtvujejo na dan vzorčenja, kar bi moralo biti vsaj tedensko ali pogosteje (npr. dvakrat tedensko), če je potrebna popolna krivulja razgradnje. Iz stresalnika se vzame potrebno število ponovitvenih steklenic, ki predstavljajo FT, FB in FC ter FI in FS, če sta uporabljena (glej odstavek 42). Preskus običajno traja 28 dni. Če krivulja biološke razgradnje kaže, da je bila konstantna raven dosežena pred 28. dnem, se lahko preskus konča prej kot v 28 dneh. Vzamejo se vzorci iz petih steklenic, prihranjenih za 28. dan preskusa za analizo, rezultati pa se uporabijo za izračun intervala zaupanja ali koeficienta variacije deleža biološke razgradnje. Steklenic, ki se uporabljajo za preverjanje zaviranja in abiotske razgradnje, ni treba vzorčiti tako pogosto kot druge steklenice; zadostuje vzorčenje 1. in 28. dan.
|
Analiza anorganskega ogljika (IC)
|
50.
|
Nastajanje CO2 v steklenicah se določi z merjenjem povečanja koncentracije anorganskega ogljika (IC) med inkubacijo. Za merjenje količine IC, ki nastane pri preskusu, sta na voljo dve priporočeni metodi, ki sta opisani spodaj. Ker se lahko njuni rezultati med seboj nekoliko razlikujejo, naj se v posameznem preskusu uporabi samo ena od njiju.
|
|
51.
|
Metoda (a) je priporočena, če medij verjetno vsebuje ostanke, na primer, filtrirnega papirja iz steklenih vlaken in/ali netopne preskusne kemikalije. Ta analiza se lahko izvede s plinskim kromatografom, če ni na voljo analizator organskega ogljika. Pomembno je, da imajo steklenice pri analizi plina v nadprostoru preskusno temperaturo ali da je njihova temperatura blizu preskusne temperature. Metoda (b) je morda lažja za laboratorije, ki za merjenje IC uporabljajo analizator ogljika. Pomembno je, da je raztopina natrijevega hidroksida (odstavek 21), ki se uporablja za pretvorbo CO2 v karbonat, bodisi sveže pripravljena ali pa je znana vsebnost IC v njej, tako da se ta lahko upošteva pri izračunavanju preskusnih rezultatov (glej odstavek 66(b)).
|
Metoda (a): zakisanje na pH < 3
|
52.
|
Pred vsako serijo analiz se analizator IC umeri z ustreznim standardom za IC (npr. 1 % w/w CO2 v N2). Koncentrirana ortofosforna kislina (odstavek 20) se vbrizga skozi septum posamezne vzorčene steklenice, da se pH medija zniža na < 3 (npr. 107 ml preskusnega medija dodamo 1 ml). Steklenice se vrnejo na stresalnik. Po enournem stresanju pri preskusni temperaturi se odstranijo s stresalnika, iz nadprostora posamezne steklenice pa se odvzamejo alikvoti (npr. 1 ml) plina in vbrizgajo v analizator IC. Izmerjene koncentracije IC se zapišejo kot mg C/l.
|
|
53.
|
Načelo te metode je, da je po zakisanju na pH < 3 in uravnoteženju pri 20 °C konstanta ravnotežja za porazdelitev CO2 med tekočinsko in plinsko fazo v preskusnih steklenicah 1,0, če je merjena kot koncentracija (13). To je treba za preskusni sistem dokazati vsaj enkrat na naslednji način:
Pripravijo se steklenice, ki vsebujejo 5 in 10 mg/l IC, tako da se uporabi raztopina brezvodnega natrijevega karbonata (Na2CO3) v vodi brez CO2, ki se pripravi z zakisanjem vode na pH 6,5 s koncentrirano ortofosforno kislino (odstavek 20), prepihovanjem z zrakom brez CO2 čez noč in povišanjem pH na nevtralno vrednost z bazo. Zagotovi se, da je razmerje med prostornino nadprostora in količino tekočine enako kot pri preskusih (npr. 1 : 2). Tekočina se zakisa in uravnoteži, kot je opisano v odstavku 52, nato se izmerijo koncentracije IC v nadprostoru in tekoči fazi. Preveri se, da sta koncentraciji enaki znotraj preskusne napake. Če nista, bi moral izvajalec pregledati postopke. Porazdelitve IC med tekočo in plinasto fazo ni treba preverjati vsakokrat, ko se izvaja preskus; verjetno se lahko preveri pri umerjanju.
|
|
54.
|
Če je treba izmeriti odstranjeni DOC (samo pri vodotopnih preskusnih kemikalijah), je treba iz ločenih (nezakisanih) steklenic vzeti vzorce tekoče faze, jih filtrirati skozi membranski filter in vbrizgati v analizator DOC. Te steklenice se lahko po potrebi uporabijo za druge analize za merjenje primarne biološke razgradnje.
|
Metoda (b): pretvorba CO2 v karbonat
|
55.
|
Pred vsako serijo analiz se analizator IC umeri z ustreznim standardom, na primer raztopino natrijevega bikarbonata (NaHCO3) v vodi brez CO2 (glej odstavek 53) v razponu od 0 do 20 mg/l kot IC. Skozi septum posamezne vzorčene steklenice se vbrizga raztopina natrijevega hidroksida (7M, odstavek 21) (npr. 1 ml se doda 107 ml medija), nato se steklenice eno uro stresajo pri preskusni temperaturi. Pri vseh steklenicah, žrtvovanih na določeni dan, se uporabi enaka raztopina NaOH, ni pa nujno, da se enaka raztopina uporabi pri vsakem vzorčenju v preskusu. Če so pri vseh vzorčenjih potrebne absolutne vrednost IC v slepem vzorcu, je treba ob vsaki uporabi raztopine NaOH v njej določiti IC. Steklenice se odstranijo s stresalnika, da se vsebina usede. Z brizgo se iz vsake posode odvzame ustrezna količina (npr. 50 do 1 000 μl) tekoče faze. Vzorci se vbrizgajo v analizator IC, nato se zapišejo koncentracije IC. Treba je zagotoviti, da je uporabljeni analizator ustrezno opremljen za uporabo bazičnih vzorcev, ki nastanejo pri tej metodi.
|
|
56.
|
Načelo te metode je, da je koncentracija IC v nadprostoru po dodajanju baze in stresanju zanemarljiva. To je treba za preskusni sistem preveriti vsaj enkrat s standardi za IC, dodajanjem baze in uravnoteženjem ter merjenjem koncentracije IC v nadprostoru in tekoči fazi (glej odstavek 53). Koncentracija v nadprostoru bi morala biti blizu nič. Tega preverjanja skoraj popolne absorpcije CO2 ni treba opravljati pri vsakem preskusu.
|
|
57.
|
Če je treba izmeriti odstranitev DOC (samo pri vodotopnih preskusnih kemikalijah), je treba iz ločenih steklenic (ki ne vsebujejo dodane baze) vzeti vzorce tekoče faze, jih filtrirati skozi membranski filter in vbrizgati v analizator DOC. Te steklenice se lahko po potrebi uporabijo pri drugih analizah za merjenje primarne biološke razgradljivosti.
|
PODATKI IN POROČANJE
Izračun rezultatov
|
58.
|
Ob predpostavki, da je mineralizacija preskusne kemikalije v CO2 100-odstotna, je presežni ThIC, ki nastane v slepih kontrolnih vzorcih, enak TOC, dodanemu posamezni preskusni steklenici na začetku preskusa, in sicer:
 . .
Skupna masa (mg) anorganskega ogljika (TIC) v posamezni steklenici je:
|

|
enačba [1],
|
pri čemer je:
|
VL
|
=
|
količina tekočine v steklenici (l),
|
|
CL
|
=
|
koncentracija IC v tekočini (ogljik v mg/l),
|
|
VH
|
=
|
prostornina nadprostora (l),
|
|
CH
|
=
|
koncentracija IC v nadprostoru (ogljik v mg/l).
|
Izračuni TIC za dve analitični metodi, uporabljeni za merjenje IC v tem preskusu, so opisani spodaj v odstavkih 60 in 61. Delež biološke razgradnje (% D) v posameznem primeru se dobi na naslednji način:
|

|
enačba [2],
|
pri čemer je:
|
TICt
|
=
|
mg TIC v preskusni steklenici ob času t,
|
|
TICb
|
=
|
srednja vrednost mg TIC v steklenicah s slepim vzorcem ob času t,
|
|
TOC
|
=
|
mg TOC, dodanega v preskusno posodo na začetku.
|
Delež biološke razgradnje % D se izračuna za preskusne steklenice (FT), referenčne steklenice (FC) in kontrolne steklenice za spremljanje zaviranja (FI), če so vključene, iz zadevnih količin TIC, nastalega do posameznega časa vzorčenja.
|
|
59.
|
Če se je v sterilnih kontrolnih vzorcih (FS) vsebnost TIC v preskusnem obdobju znatno povečala, je mogoče sklepati o abiotski razgradnji preskusne kemikalije, kar je treba upoštevati pri izračunu D v enačbi [2].
|
Zakisanje na pH < 3
|
60.
|
Ker se z zakisanjem na pH < 3 in uravnoteženjem koncentracije TIC v tekoči in plinasti fazi izenači, je treba izmeriti samo koncentracijo IC v plinasti fazi. Tako iz enačbe [1] sledi

, pri čemer je VB = prostornina serumske steklenice. |
Pretvorba CO2 v karbonat
|
61.
|
Pri tej metodi se izračuni izvedejo kot pri enačbi [1], vendar se zanemarljiva količina IC v plinasti fazi zanemari, tako da je

,

. |
Prikaz rezultatov
|
62.
|
Krivulja biološke razgradnje se dobi z grafičnim prikazom deleža biološke razgradnje D v odvisnosti od časa inkubacije, po možnosti pa se prikažejo faza prilagajanja, faza biološke razgradnje, 10-dnevno obdobje in faza konstantne ravni, ki je faza, v kateri je dosežena največja razgradnja, krivulja biološke razgradnje pa se zravna. Če se za vzporedne preskusne posode FT dobijo primerljivi rezultati (< 20-odstotna razlika), se grafično prikaže srednja krivulja (glej Dodatek 2, slika 1); če ne, se krivulje prikažejo za vsako posamezno posodo. Določi se srednja vrednost deleža biološke razgradnje v fazi konstantne ravni ali oceni najvišja vrednost (npr. kadar krivulja v fazi konstantne vrednosti pada), vendar je pomembno oceniti, da vrednost v slednjem primeru ni izjema. V poročilu o preskusu se ta najvišja raven biološke razgradnje navede kot ‚stopnja biološke razgradnje preskusne kemikalije‘. Če je bilo število preskusnih posod nezadostno za označitev faze konstantne ravni, se za izračun srednje vrednosti uporabijo izmerjeni podatki za zadnji dan preskusa. Ta zadnja vrednost, srednja vrednost petih ponovitev, se uporabi za označitev natančnosti, s katero je bil določen delež biološke razgradnje. Poroča se tudi o vrednosti, dobljeni na koncu 10-dnevnega obdobja.
|
|
63.
|
Enako se grafično prikaže krivulja za referenčno kemikalijo FC ter preverjanje abiotskega izločanja FS in kontrola zaviranja FI, če sta vključena.
|
|
64.
|
Količine TIC v slepih kontrolnih vzorcih (FB) in bučkah FS (abiotsko preverjanje) se zapišejo, če so te posode vključene v preskus.
|
|
65.
|
Na podlagi teoretično nastalega IC, pričakovanega samo glede na referenčno sestavino mešanice, se izračuna D za posode FI. Če je 28. dan [(DFC
(22) – DFI
(23))/DFC] × 100 > 25 %, je mogoče sklepati, da je preskusna kemikalija zavrla aktivnost inokuluma, kar je lahko razlog za nizke vrednosti DFT, dobljene v pogojih preskusa. V tem primeru se lahko preskus ponovi pri nižji preskusni koncentraciji ter po možnosti z zmanjšanjem DIC v inokulumu in TIC, ki nastane v slepih kontrolnih vzorcih, saj se bo sicer zaradi nižje koncentracije zmanjšala natančnost metode. Uporabiti pa je mogoče tudi drug inokulum. Če je v bučki FS (abiotski) opaženo bistveno povečanje (> 10-odstotno) količine TIC, je morda prišlo do procesa abiotske razgradnje.
|
Veljavnost rezultatov
|
66.
|
Šteje se, da je preskus veljaven, če:
|
(a)
|
je srednji delež razgradnje v posodah FC, ki vsebujejo referenčno kemikalijo, > 60-odstoten do 14. dneva inkubacije, in
|
|
(b)
|
če je srednja količina TIC v slepih kontrolnih vzorcih FB ob koncu preskusa > 3 mg C/l.
|
Če so te omejitve presežene, je treba preskus ponoviti z inokulumom iz drugega vira in/ali pregledati postopke. Če je na primer težava velika količina nastajanja IC v slepem vzorcu, je treba uporabiti postopek iz odstavkov 27 do 32.
|
|
67.
|
Če preskusna kemikalija ne doseže 60 % ThIC in zanjo ni dokazan zaviralni učinek (odstavek 65), je mogoče preskus ponoviti s povečano koncentracijo inokuluma (do 30 mg/l aktivnega blata in 100 ml iztoka/l) ali z inokulumi iz drugih virov, zlasti če je bila razgradnja 20- do 60-odstotna.
|
Razlaga rezultatov
|
68.
|
Če je pri tem preskusu v 10-dnevnem obdobju biološka razgradnja ThIC > 60-odstotna, to pomeni, da je preskusna kemikalija v aerobnih pogojih dobro razgradljiva.
|
|
69.
|
Če prag 60 % ThIC ni dosežen, se določi vrednost pH v medijih v steklenicah, ki niso bile zakisane ali alkalizirane; vrednost pod 6,5 lahko nakazuje, da je prišlo do nitrifikacije. V tem primeru se preskus ponovi s pufrsko raztopino z višjo koncentracijo.
|
Poročilo o preskusu
|
70.
|
Oblikuje se preglednica, ki prikazuje odstotni delež D za vsako preskusno steklenico (FT), referenčno steklenico (FC) in steklenico za kontrolo zaviranja (FI), če je vključena, za vsak dan vzorčenja. Če so za ponovitvene steklenice rezultati primerljivi, se grafično prikaže krivulja srednjega odstotnega deleža D v odvisnosti od časa. Zapišejo se količina TIC v slepih vzorcih (FB) in sterilnih kontrolnih vzorcih (FS), DOC in/ali drugi determinanti ter njihov delež odstranitve.
|
|
71.
|
Določi se srednja vrednost deleža D v fazi konstantne ravni ali uporabi največja vrednost, če krivulja biološke razgradnje v fazi konstantne ravni pada, ter se navede kot ‚stopnja biološke razgradnje preskusne kemikalije‘. Pomembno je zagotoviti, da v slednjem primeru najvišja vrednost ni izjema.
|
|
72.
|
V poročilu o preskusu morajo biti naslednji podatki:
|
|
Preskusna kemikalija:
|
—
|
splošno ime, kemijsko ime, številka CAS, strukturna formula in pomembne fizikalno-kemijske lastnosti,
|
|
—
|
čistost (nečistote) preskusne kemikalije.
|
|
|
|
Preskusni pogoji:
|
—
|
sklicevanje na to preskusno metodo,
|
|
—
|
opis uporabljenega preskusnega sistema (npr. prostornina posode, razmerje med nadprostorom in tekočino, način mešanja itd.),
|
|
—
|
uporaba preskusne in referenčne kemikalije v preskusnem sistemu: uporabljena preskusna koncentracija in količina ogljika, odmerjena v posamezno preskusno steklenico, ter morebitna uporaba topil,
|
|
—
|
podrobnosti o uporabljenem inokulumu, morebitna predobdelava in aklimatizacija,
|
|
—
|
inkubacijska temperatura,
|
|
—
|
validacija načela analize IC,
|
|
—
|
glavne značilnosti uporabljenega analizatorja IC (in drugih uporabljenih analitičnih metod),
|
|
|
|
Rezultati:
|
—
|
neobdelani podatki in izračunane vrednosti biološke razgradljivosti v obliki preglednice,
|
|
—
|
graf odstotnega deleža razgradnje v odvisnosti od časa za preskusne in referenčne kemikalije, faza prilagajanja, faza razgradnje, 10-dnevno obdobje in naklon,
|
|
—
|
odstotni delež odstranitve v fazi konstantne ravni, ob koncu preskusa in po 10-dnevnem obdobju,
|
|
—
|
razlogi za morebitno zavrnitev rezultatov preskusa,
|
|
—
|
drugi dejavniki, ki so pomembni za uporabljeni postopek,
|
|
|
VIRI:
|
(1)
|
Poglavje C.4 te priloge, Določanje ‚dobre‘ biorazgradljivosti – preskus razvijanja CO2 (metoda C.4-C)
|
|
(2)
|
Sturm, R. N. (1973). Biodegradability of Nonionic surfactants: screening test for predicting rate and ultimate biodegradation. J.A,. Oil Chem Soc. 50: 159–167.
|
|
(3)
|
Larson, R. J. (1979). Estimation of biodegradation potential of xenobiotic organic chemicals. Appl Env. Microbiol. 38: 1153–1161.
|
|
(4)
|
Larson, R. J., Hansmann, M. A. in Bookland, E. A. (1996). Carbon dioxide recovery in ready biodegradability tests: mass transfer and kinetic constants, Chemosphere 33: 1195–1210.
|
|
(5)
|
ISO 9439 (1990; revidiran leta 1999). Kakovost vode – Vrednotenje popolne aerobne biološke razgradljivosti organskih snovi v vodi – Preskus z merjenjem sproščenega ogljikovega dioksida (Sturm)
|
|
(6)
|
US EPA (1996). Fate, Transport and Transformation Test Guideline. 835. 3110 Carbon dioxide evolution test. Office, Prevention Pesticides and Toxic Substances Washington, DC.
|
|
(7)
|
US EPA (1996). Fate, Transport and Transformation Test Guideline. 835. 3100. Aerobic aquatic biodegradation. Office, Prevention Pesticides and Toxic Substances Washington, DC.
|
|
(8)
|
Gledhill, W. E. (1975). Screening test for assessment of biodegradability: Linear alkyl benzene sulfonate. Appl Microbiol. 30: 922–929.
|
|
(9)
|
Weytjens, D., Van Ginneken, I., in Painter, H. A. (1994). The recovery of carbon dioxide in the Sturm test for ready biodegradability. Chemosphere 28: 801–812.
|
|
(10)
|
Ennis, D. M., in Kramer, A. (1975). A rapid microtechnique for testing biodegradability of nylons and polyamides. J. Food Sci. 40: 181–185.
|
|
(11)
|
Ennis, D. M., Kramer, A., Jameson, C. W., Mazzoccki, P. H., in Bailey, P. H. (1978). Appl. Env. Microbiol. 35: 51–53.
|
|
(12)
|
Boatman, R. J., Cunningham, S. L., in Ziegler, D. A. (1986). A method for measuring the biodegradation of organic chemicals, Env. Toxicol. Chem. 5: 233–243.
|
|
(13)
|
Struijs, J., in Stoltenkamp, J. (1990). Head space determination of evolved carbon dioxide in a biodegradability screening test. Ecotox. Env. Safety 19: 204–211.
|
|
(14)
|
Birch, R. R., in Fletcher, R. J. (1991). The application of dissolved inorganic carbon measurements to the study of aerobic biodegradability. Chemosphere 23: 507–524.
|
|
(15)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W. E., Pagga, U., Steber, J., Reust, H., in Bontinck, W. J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19: 1527–1550.
|
|
(16)
|
ISO 14593 (1999). Kakovost vode – Vrednotenje popolne aerobne biorazgradljivosti organskih spojin v aerobnem mediju – Metoda z analizo anorganskega ogljika v zaprtih posodah (preskus CO2 v nadprostoru).
|
|
(17)
|
Battersby, N. S. (1997). The ISO headspace CO2 biodegradation test, Chemosphere 34: 1813–1822.
|
|
(18)
|
US EPA (1996). Fate, Transport and Transportation. 835.3120. Sealed vessel carbon dioxide production test. Office, Prevention Pesticides and Toxic Substance, Washington, DC.
|
|
(19)
|
Battersby, N. S., Ciccognani, D., Evans, M. R., King, D., Painter, H.A., Peterson, D. R. in Starkey, M. (1999). An ‚inherent‘ biodegradability test for oil products: description and results of an international ring test. Chemosphere 38: 3219–3235.
|
|
(20)
|
Poglavje C.4 te priloge, Določanje ‚dobre‘ biološke razgradljivosti.
|
|
(21)
|
OECD (1988). OECD Ring-test of methods for determining ready biodegradability: Chairman’s report (M. Hashimoto; MITI) and final report (M. Kitano in M. Takatsuki; CITI). Pariz.
|
|
(22)
|
Poglavje C.11 te priloge, Preskus zaviranja dihanja aktivnega blata.
|
|
(23)
|
Struijs, J., Stoltenkamp-Wouterse, M. J., in Dekkers, A. L. M. (1995). A rationale for the appropriate amount of inoculum in ready biodegradability tests. Biodegradation 6: 319–327.
|
|
(24)
|
EU (1999). Ring-test of the ISO Headspace CO2 method: application to surfactants: Surfactant Ring Test-1, Report EU4697, Water Research Centre, maj 1999, Medmenham, SL7 2HD, Združeno kraljestvo.
|
|
(25)
|
ISO 10634 (1996). Kakovost vode – Navodilo za pripravo in obdelavo v vodi slabo topnih organskih spojin za nadaljnje vrednotenje njihove biorazgradljivosti v vodi.
|
Dodatek 1
OKRAJŠAVE IN OPREDELITEV POJMOV
IC: anorganski ogljik;
ThCO2: teoretični ogljikov dioksid (mg) je količina ogljikovega dioksida, izračunana iz znane ali izmerjene vsebnosti ogljika v preskusni kemikaliji, ki se proizvede ob njeni popolni mineralizaciji; izražena tudi v mg ogljikovega dioksida, nastalega na mg preskusne kemikalije;
DOC: raztopljeni organski ogljik je organski ogljik, ki je prisoten v raztopini, ali gre skozi 0,45-mikrometrski filter, ali ostane v supernatantu po 15-minutnem centrifugiranju pri približno 4 000 g (40 000 m s-2);
DIC: raztopljeni anorganski ogljik;
ThIC: teoretični anorganski ogljik;
TIC: skupni anorganski ogljik;
dobro biološko razgradljivo: arbitrarna razvrstitev kemikalij, ki so uspešno opravile nekatere specifične presejalne preskuse za popolno biološko razgradljivost; ker so ti preskusi dovolj strogi, se predpostavlja, da se bodo take kemikalije v vodnem okolju in aerobnih pogojih hitro in povsem biološko razgradile;
10-dnevno obdobje: obdobje 10 dni, ki se začne takoj, ko je dosežena 10-odstotna biološka razgradnja;
inherentna biološka razgradljivost: razvrstitev snovi, za katere obstajajo nedvoumni dokazi biološke razgradljivosti (primarni ali popolni) iz katerega koli preskusa biološke razgradljivosti;
popolna aerobna biološka razgradnja: raven biološke razgradnje, ki je dosežena, ko mikroorganizmi povsem porabijo preskusno kemikalijo, pri čemer nastanejo ogljikov dioksid, voda, mineralne soli in nove mikrobne celične sestavine (biomasa);
mineralizacija: popolna razgradnja organske kemikalije v CO2 in H2O v aerobnih pogojih oziroma CH4, CO2 in H2O v anaerobnih pogojih;
faza prilagajanja: čas, ki preteče od začetka preskusa do aklimatizacije in/ali prilagoditve razgradnih mikroorganizmov in do povišanja stopnje biološke razgradnje preskusne kemikalije ali organske snovi do zaznavne ravni (npr. 10 % največje teoretične biološke razgradnje ali manj, odvisno od točnosti merilne tehnike);
faza razgradnje: čas od konca obdobja prilagajanja do trenutka, ko se doseže 90 % najvišje ravni razgradnje;
faza konstantne ravni: faza, v kateri se doseže največja razgradnja, krivulja biološke razgradnje pa se zravna;
preskusna kemikalija: snov ali zmes, preskušana z uporabo te preskusne metode.
Dodatek 2
Primer krivulje biološke razgradnje
Slika 1
Biološka razgradnja 1-oktanola v preskusu CO2 v nadprostoru

Glosar:
Biološka razgradnja
Faza razgradnje
Najvišja stopnja biološke razgradnje
Faza konstantne ravni
10-dnevno obdobje
Čas preskusa (dnevi)
C.30 BIOAKUMULACIJA V KOPENSKIH MALOŠČETINCIH
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 317 (2010). Med preskusnimi metodami, ki se nanašajo na okoljsko usodo, je bila leta 1996 objavljena Biokoncentracija: pretočni preskus na ribah (poglavje C.13 te priloge (49)), leta 2008 pa Bioakumulacija v bentoških maloščetincih, ki živijo v usedlinah (53). Ekstrapolacija podatkov o bioakumulaciji v vodnih organizmih na kopenske organizme, kot so deževniki, je zahtevna, če je sploh mogoča. Za ocenjevanje bioakumulacije kemikalij v tleh se trenutno uporabljajo modelni izračuni na podlagi lipofilnosti preskusne kemikalije, npr. (14) (37), kot na primer v tehničnih smernicah EU (19). Potreba po preskusni metodi za posamezna področja se je že začela obravnavati, npr. (55). Taka metoda je zlasti pomembna za ocenjevanje sekundarne zastrupitve v kopenskih prehranjevalnih verigah (4). Več nacionalnih preskusnih metod se ukvarja z vprašanjem bioakumulacije v organizmih, ki niso ribe, npr. (2) in (72). Ameriško združenje za preskušanje in materiale (American Society for Testing and Materials) je razvilo metodo za merjenje bioakumulacije v deževnikih (Eisenia fetida, Savigny) in enhitrejih iz kontaminiranih tal (3). Mednarodno priznana metoda za določanje bioakumulacije v tleh s primešano preskusno snovjo bo izboljšala ocenjevanje tveganja kemikalij v kopenskih ekosistemih, npr. (25) (29).
|
|
2.
|
Nevretenčarji, ki jedo prst, so izpostavljeni kemikalijam v tleh. Med temi živalmi imajo kopenski maloščetinci pomembno vlogo pri strukturi in funkciji tal (15) (20). Živijo v tleh in delno ob površju (zlasti v plasti rastlinskega odpada); pogosto so najštevilnejša vrsta v biomasi (54). Z bioturbacijo tal in kot plen lahko te živali močno vplivajo na biološko razpoložljivost kemikalij za druge organizme, kot so nevretenčarji (npr. plenilske pršice in hrošči; npr. (64)) ali plenilski vretenčarji (npr. lisice in galebi) (18) (62). Nekatere vrste kopenskih maloščetincev, ki se trenutno uporabljajo pri ekotoksikološkem preskušanju, so opisane v Dodatku 5.
|
|
3.
|
V Standardnih smernicah ASTM za izvajanje laboratorijskih preskusov strupenosti tal ali bioakumulacije z deževniki Eisenia fetida (Lumbricidae) in enhitrejev Enchytraeus albidus (Enchytraeidae) (3) so navedene številne bistvene in koristne podrobnosti za izvajanje te preskusne metode za bioakumulacijo v tleh. Nadaljnja dokumenta, ki sta navedena v tej preskusni metodi, sta poglavje C.13 te priloge Biokoncentracija: pretočni preskus na ribah (49) in Smernica za preskušanje OECD št. 315: Bioakumulacija v bentoških maloščetincih, ki živijo v usedlinah (53). Za to preskusno metodo so pomembni viri informacij tudi praktične izkušnje iz raziskav o bioakumulaciji v tleh in objave iz virov, npr. (1) (5) (11) (12) (28) (40) (43) (45) (57) (59) (76) (78) (79).
|
|
4.
|
Ta preskusna metoda se v glavnem uporablja za stabilne nevtralne organske kemikalije, ki se rade adsorbirajo na zemljino. S to preskusno metodo je mogoče preskušanje bioakumulacije stabilnih organokovinskih spojin, vezanih v tleh. Uporabi se lahko tudi za kovine in druge elemente v sledeh.
|
OSNOVNI POGOJ
|
5.
|
Preskusi za merjenje bioakumulacije kemikalije v kopenskih maloščetincih se izvajajo s težkimi kovinami (glej npr. (63)) in obstojnimi organskimi kemikalijami z vrednostmi log Kow med 3,0 in 6,0, npr. (40). Uporabljajo se tudi za:
|
—
|
kemikalije, pri katerih je vrednost log Kow večja od 6,0 (superhidrofobne kemikalije),
|
|
—
|
kemikalije, ki spadajo v razred organskih kemikalij, za katere je znano, da se lahko kopičijo v živih organizmih, npr. površinsko aktivne ali močno adsorptivne kemikalije,
|
|
—
|
kemikalije, katerih strukturne značilnosti kažejo na možnost bioakumulacije, npr. analogi kemikalij z znanim bioakumulacijskim potencialom, in
|
|
|
6.
|
Pred začetkom raziskave je treba pridobiti informacije o preskusni kemikaliji, kot so splošno ime, kemijsko ime (po možnosti ime IUPAC), strukturna formula, registrska številka CAS, čistost, varnostni ukrepi, ustrezni pogoji shranjevanja in analitske metode. Poleg tega bi bilo treba poznati naslednje podatke:
|
(b)
|
koeficient porazdelitve oktanol/voda, Kow;
|
|
(c)
|
koeficient porazdelitve zemljina/voda, izražen kot Koc;
|
|
(e)
|
razgradljivost (npr. v tleh, vodi);
|
|
|
7.
|
Uporabiti je mogoče tudi radioaktivno označene in neoznačene preskusne kemikalije. Za lažjo analizo se priporoča uporaba radioaktivno označene preskusne kemikalije. Odločitev se sprejme na podlagi meja zaznavnosti ali zahteve glede merjenja matične preskusne kemikalije in metabolitov. Če se uporabi radioaktivno označena preskusna kemikalija in merijo skupni radioaktivni ostanki, je pomembno, da se radioaktivno označeni ostanki v tleh in preskusnih organizmih opredelijo glede deležev matične preskusne kemikalije in tiste, ki je označena za nematično, npr. v vzorcih, vzetih v stabilnem stanju ali ob koncu faze absorpcije, da je mogoče izračunati bioakumulacijski faktor (BAF) za matično preskusno kemikalijo in zadevne metabolite v tleh (glej odstavek 50). Za merjenje radioaktivno neoznačenih organskih preskusnih kemikalij ali kovin je tu opisano metodo morda treba prilagoditi, npr. za zagotovitev zadostne biomase. Pri merjenju skupnih radioaktivnih ostankov (s tekočinskim scintilacijskim štetjem po ekstrakciji, sežigu ali omogočitvi topnosti tkiva) bioakumulacijski faktor temelji na matični preskusni kemikaliji in metabolitih. Izračun BAF mora po možnosti temeljiti na koncentraciji matične preskusne kemikalije v organizmih in skupnih radioaktivnih ostankov. Nato je treba za primerljivost rezultatov iz različnih preskusov bioakumulacije iz BAF izračunati faktor akumulacije v organizmih glede na tla (BSAF), normaliziran na vsebnost lipidov v črvih in vsebnost organskega ogljika (OC) v tleh.
|
|
8.
|
Znana mora biti strupenost preskusne kemikalije za vrsto, uporabljeno v preskusu, npr. koncentracija z učinkom (ECx) ali smrtna koncentracija (LCx) v fazi absorpcije (npr. (19)). Izbrana koncentracija preskusne kemikalije mora biti po možnosti približno 1 % njenega akutnega asimptotičnega LC50 in vsaj desetkrat višja kot meja njenega zaznavanja v tleh z uporabljeno analitsko metodo. Prednost je treba dati vrednostim strupenosti, ki izhajajo iz dolgotrajnih raziskav subletalnih končnih točk, če so na voljo (51) (52). Če taki podatki niso na voljo, je koristne informacije mogoče dobiti s preskusom akutne strupenosti (glej npr. (23)).
|
|
9.
|
Na voljo mora biti ustrezna analitska metoda znane točnosti, natančnosti in občutljivosti za količinsko opredelitev kemikalije v preskusnih raztopinah, tleh in biološkem materialu, pa tudi podrobnosti o pripravi in shranjevanju vzorcev ter varnostni listi za snov. Znane morajo biti tudi analitske meje zaznavnosti preskusne snovi v tleh in tkivu črvov. Pri uporabi preskusne kemikalije, označene s 14C, je treba poznati specifično radioaktivnost (tj. Bq mol-1) in delež radioaktivnosti, povezan z nečistotami. Specifična radioaktivnost preskusne kemikalije mora biti dovolj visoka, da omogoča analizo, uporabljene preskusne koncentracije pa ne smejo sprožiti strupenih učinkov.
|
|
10.
|
Preskus se lahko izvaja z umetnimi ali naravnimi zemljinami. Pred začetkom preskusa je treba poznati informacije o značilnostih uporabljene naravne zemljine, npr. izvor zemljine ali njenih sestavin, pH, vsebnost organskega ogljika, velikostno porazdelitev delcev (delež peska, mulja in gline) in zmogljivost zadrževanja vode (WHC) (3) (48).
|
NAČELO PRESKUSA
|
11.
|
Med parametri, ki so značilni za bioakumulacijo preskusne kemikalije, so bioakumulacijski faktor (BAF), konstanta hitrosti absorpcije (ks) in konstanta hitrosti izločanja (ke). Opredelitve so navedene v Dodatku 1.
|
|
12.
|
Preskus sestavljata dve fazi: faza absorpcije (izpostavljenosti) in faza izločanja (po izpostavljenosti). V fazi absorpcije so ponovitvene skupine črvov izpostavljene zemljini, ki ji je dodana preskusna kemikalija. Poleg preskusnih živali so v enakih pogojih kontrolne skupine črvov, le brez preskusne kemikalije. Izmerita se suha teža preskusnih organizmov in vsebnost lipidov v njih. Pri tem je mogoče uporabiti črve iz kontrolne skupine. Analitske vrednosti ozadja (slepi vzorec) je mogoče dobiti z analizo kontrolnih vzorcev črvov in tal. Za fazo izločanja se črvi prenesejo v tla, v katerih ni preskusne kemikalije. Faza izločanja je vedno potrebna, razen če je absorpcija preskusne kemikalije v fazi izpostavljenosti zanemarljiva. Faza izločanja zagotavlja informacije o hitrosti, s katero se preskusna kemikalija izloča iz preskusnih organizmov (npr. (27)). Če v fazi absorpcije stabilno stanje ni doseženo, mora določitev kinetičnih parametrov – kinetičnega bioakumulacijskega faktorja BAFk, konstante hitrosti absorpcije in konstante hitrosti izločanja – po možnosti temeljiti na hkratnem prilagajanju rezultatov iz faze absorpcije in faze izločanja. Koncentracija preskusne kemikalije v/na črvih se spremlja ves čas trajanja obeh faz preskusa.
|
|
13.
|
V fazi absorpcije se meritve opravljajo ob časih vzorčenja do največ 14 dni (enhitreji) oziroma 21 dni (deževniki), dokler ni doseženo stabilno stanje (11) (12) (67). Stabilno stanje je vzpostavljeno, ko je krivulja koncentracije v črvih v odvisnosti od časa vzporedna s časovno osjo in se tri zaporedne analize koncentracije vzorcev, vzetih v vsaj dvodnevnih intervalih, med seboj ne razlikujejo za več kot ± 20 % glede na statistične primerjave (npr. analiza variance, regresijska analiza).
|
|
14.
|
V fazi izločanja se preskusni organizmi prenesejo v posode z istim substratom brez preskusne kemikalije. V fazi izločanja se meritve opravljajo 14 dni (enhitreji) oziroma 21 dni (deževniki) ob časih vzorčenja, razen če je prejšnje analitsko določanje pokazalo 90-odstotno zmanjšanje ostankov preskusne kemikalije v črvih. O koncentraciji preskusne kemikalije v črvih ob koncu faze izločanja se poroča kot o neizločenih ostankih. Bioakumulacijski faktor stabilnega stanja (BAFss) se izračuna po možnosti kot razmerje med koncentracijo v črvih (ca) in tleh (Cs) v očitnem stabilnem stanju ter kot kinetični bioakumulacijski faktor (BAFK) oziroma razmerje med konstanto hitrosti absorpcije iz tal (ks) in konstanto hitrosti izločanja (ke) (za opredelitve glej Dodatek 1) ob predpostavki kinetike prvega reda (za izračune glej Dodatek 2). Če kinetika prvega reda očitno ni ustrezna, je treba uporabiti druge modele.
|
|
15.
|
Konstanta hitrosti absorpcije, konstanta hitrosti izločanja (ali konstante pri uporabi drugih modelov), kinetični bioakumulacijski faktor (BAFK), in kjer je to mogoče, intervali zaupanja za vse te parametre se izračunajo po računalniških modelnih enačbah (za navodila glej Dodatek 2). Ustreznost prileganja modela je mogoče ugotoviti na primer na podlagi korelacijskega koeficienta ali determinacijskega koeficienta (koeficienti blizu ena pomenijo dobro prileganje) ali hi-kvadrata. Kažeta jo lahko tudi velikost standardne napake ali interval zaupanja za ocenjene parametre.
|
|
16.
|
Za zmanjšanje variabilnosti rezultatov preskusa za preskusne kemikalije z visoko lipofilnostjo je treba bioakumulacijske faktorje izraziti v odvisnosti od vsebnosti lipidov in vsebnosti organskega ogljika (vsebnost organskega ogljika (OC) v kg zemljine, vsebnost lipidov v kg-1 črvov). Ta pristop temelji na dejstvu, da pri nekaterih razredih kemikalij obstaja jasna povezanost med potencialom bioakumulacije in lipofilnostjo; to je že dobro dokazano pri ribah (47). Obstaja povezanost med vsebnostjo lipidov v ribah in bioakumulacijo takih kemikalij. Podobna medsebojna odvisno je bila ugotovljena pri bentoških organizmih, npr. (30) (44), dokazana pa je tudi za kopenske maloščetince, npr. (5) (6) (7) (14). Če je na voljo dovolj črvjega tkiva, je mogoče vsebnost lipidov v preskusnih živalih določiti z uporabo istega biološkega materiala kot za določanje koncentracije preskusne kemikalije. Sicer se lahko za meritev vsebnosti lipidov uporabijo kontrolne živali.
|
VELJAVNOST PRESKUSA
|
17.
|
Da je preskus veljaven, morajo kontrolni in tretirani vzorci izpolnjevati naslednja merila:
|
—
|
ob koncu preskusa skupna smrtnost v fazah absorpcije in izločanja ne sme presegati 10 % (deževniki) oziroma 20 % (enhitreji) skupnega števila uporabljenih črvov,
|
|
—
|
pri Eisenia fetida in Eisenia andrei srednja izguba teže, merjena ob koncu faze absorpcije in ob koncu faze izločanja, ne sme presegati 20 % v primerjavi z začetno svežo težo (f.w.) na začetku posamezne faze.
|
|
OPIS METODE
Preskusne vrste
|
18.
|
Za preskušanje bioakumulacije je priporočenih več vrst kopenskih maloščetincev. Največkrat uporabljene vrste Eisenia fetida, ali Eisenia andrei (Lumbricidae), ali Enchytraeus albidus, Enchytraeus crypticus, ali Enchytraeus luxuriosus (Enchytraeidae) so opisane v Dodatku 5.
|
Oprema
|
19.
|
Pri vseh delih opreme se je treba izogibati uporabi materialov, ki se lahko raztopijo, adsorbirajo preskusno kemikalijo ali iz katerih se lahko izlužijo druge kemikalije in ki škodljivo učinkujejo na preskusne živali. Uporabiti je mogoče standardne pravokotne ali valjaste posode iz kemijsko inertne snovi in s primerno prostornino, ki ustrezajo stopnji obremenitve, tj. številu preskusnih črvov. Za opremo, ki je v stiku s preskusnimi mediji, se lahko uporabijo nerjavno jeklo, plastika ali steklo. Preskusne posode je treba ustrezno pokriti, da se prepreči uhajanje črvov, hkrati pa omogoči zadosten dotok zraka. Pri kemikalijah z visokimi adsorpcijskimi koeficienti, kot so sintetični piretroidi, je lahko potrebno silanizirano steklo. V teh primerih je treba opremo po uporabi zavreči (49). Preprečiti je treba uhajanje radioaktivno označenih preskusnih snovi in hlapnih kemikalij. Uporabiti je treba lovilnike (npr. steklene plinske izpiralke), ki vsebujejo ustrezne absorbente za zadrževanje morebitnih ostankov, ki izparijo iz preskusnih posod.
|
Tla
|
20.
|
Tla morajo biti take kakovosti, ki omogoča preživetje in po možnosti razmnoževanje preskusnih organizmov med aklimatizacijo in preskušanjem, ne da bi bili pri tem videti nenormalno ali bi se nenormalno obnašali. Črvi se morajo zariti v tla.
|
|
21.
|
Umetna zemljina, opisana v poglavju C.8 te priloge (48), je priporočena za uporabo kot substrat v preskusih. V Dodatku 4 so podani opis priprave umetne zemljine za uporabo pri preskusu bioakumulacije in priporočila za shranjevanje umetne zemljine. Na zraku posušena umetna zemljina se lahko do uporabe hrani pri sobni temperaturi.
|
|
22.
|
Za preskusna tla in/ali tla za gojenje je mogoče uporabiti tudi naravno zemljino z neonesnaženih območij. Pri naravni zemljini je treba opredeliti vsaj izvor (mesto odvzema), pH, vsebnost organskega ogljika, velikostno porazdelitev delcev (delež peska, mulja in gline), največjo zmogljivost zadrževanja vode (WHCmax) in delež vsebnosti vode (3). Analiza tal ali njihovih sestavin, kar zadeva mikro onesnaževala, pred uporabo bi morala dati koristne informacije. Če se uporabi zemljina s kmetijskih zemljišč, se že vsaj eno leto pred vzorčenjem ne smejo obdelovati z izdelki za zaščito pridelka ali gnojem tretiranih živali kot gnojili, z organskimi gnojili pa že vsaj šest mesecev pred vzorčenjem (50). Postopki ravnanja z naravno zemljino pred uporabo v ekotoksikoloških preskusih z maloščetinci v laboratoriju so opisani v (3). Pri naravni zemljini mora biti čas shranjevanja v laboratoriju čim krajši.
|
Uporaba preskusne kemikalije
|
23.
|
Preskusna kemikalija se vnese v tla. Pri tem je treba upoštevati njene fizikalno-kemijske lastnosti. Preskusno kemikalijo, ki se topi v vodi, je treba pred mešanjem z zemljino povsem raztopiti v vodi. Priporočeni postopek dodajanja preskusnih kemikalij, ki se slabo topijo v vodi, vključuje prekrivanje ene ali več sestavin (umetne) zemljine s preskusno kemikalijo. Kremenov pesek ali del kremenovega peska je mogoče na primer namočiti v raztopini preskusne kemikalije v primernem organskem topilu ter jo nato počasi izpariti do suhega. Prekriti del se lahko nato vmeša v vlažna tla. Velika prednost tega postopka je, da se v tla ne vnese topilo. Pri uporabi naravne zemljine je mogoče preskusno kemikalijo dodati s primešanjem k delu na zraku posušene zemljine, kot je opisano zgoraj za umetno zemljino, ali z vmešanjem preskusne kemikalije v vlažno zemljino, z naknadnim izparevanjem, če je uporabljeno topilo. Na splošno se je treba čim bolj izogibati stiku vlažne zemljine s topili. Treba je upoštevati naslednje (3):
|
—
|
če se uporabi topilo, ki ni voda, mora biti tako, da se lahko meša z vodo in/ali da ga je mogoče odstraniti (na primer upariti), tako da v tleh ostane samo preskusna kemikalija,
|
|
—
|
če se uporabi kontrolni vzorec s topilom, negativna kontrola ni potrebna. Kontrolni vzorec s topilom mora vsebovati največjo koncentracijo topila, dodano zemljini, uporabiti pa je treba topilo iz iste šarže kot za osnovno raztopino. Strupenost in hlapnost topila ter topnost preskusne kemikalije v izbranem topilu bi morale biti glavna merila za izbiro primernega topila.
|
|
|
24.
|
Pri kemikalijah, ki so slabo topne v vodi in organskih topilih, je mogoče 2,0–2,5 g drobno mletega kremenovega peska na preskusno posodo zmešati z določeno količino preskusne kemikalije, npr. s terilnico in pestilom, da nastane želena preskusna koncentracija. Ta mešanica kremenovega peska in preskusne kemikalije se lahko doda predhodno navlaženi zemljini in temeljito zmeša z ustrezno količino deionizirane vode, da nastane potrebna vsebnost vlage. Končna mešanica se porazdeli v preskusne posode. Postopek se ponovi za vsako preskusno koncentracijo in pripravi tudi ustrezni kontrolni vzorec z 2,0–2,5 g drobno mletega kremenovega peska na preskusno posodo.
|
|
25.
|
Koncentracijo preskusne kemikalije v tleh je treba določiti po primešanju. Pred uvedbo preskusnih organizmov je treba preveriti homogeno porazdelitev preskusne kemikalije v tleh. Poročati je treba o metodi, uporabljeni za primešanje, in razlogih za izbiro posebnega postopka primešanja (24).
|
|
26.
|
Idealno je, če se pred dodajanjem organizmov vzpostavi ravnotežje med zemljino in fazo porne vode; priporočeno je štiridnevno obdobje pri 20 °C. Pri številnih organskih kemikalijah, ki so slabo topne v vodi, se lahko čas, potreben za vzpostavitev resničnega ravnotežja med adsorbiranimi in raztopljenimi delci, šteje v dnevih ali mesecih. Glede na namen raziskave, na primer pri posnemanju razmer v okolju, se lahko zemljina s primešano preskusno snovjo ‚stara‘ dlje, npr. pri kovinah tri tedne pri 20 °C (22).
|
Gojenje preskusnih organizmov
|
27.
|
Črvi se po možnosti gojijo v trajni laboratorijski kulturi. Navodila o metodah laboratorijskega gojenja za vrste Eisenia fetida in Eisenia andrei ter Enchytraeid so podana v Dodatku 5 (glej tudi (48) (51) (52)).
|
|
28.
|
Črvi, uporabljeni v preskusih, morajo biti brez ugotovljivih bolezni, bolezenskih sprememb in zajedavcev.
|
IZVEDBA PRESKUSA
|
29.
|
Preskusni organizmi so preskusni kemikaliji izpostavljeni v fazi absorpcije. Ta mora trajati 14 dni (enhitreji) oziroma 21 dni (deževniki), razen če se dokaže, da je bilo vzpostavljeno stabilno stanje.
|
|
30.
|
Za fazo izločanja se črvi prenesejo v tla, v katerih ni preskusne kemikalije. Prvi vzorec je treba vzeti 4–24 h po začetku faze izločanja. Primeri časovnih razporedov vzorčenja za 21-dnevno fazo absorpcije in 21-dnevno fazo izločanja so podani v Dodatku 3.
|
Preskusni organizmi
|
31.
|
Pri številnih vrstah kopenskih enhitrejev je teža posameznih osebkov zelo majhna (npr. 5–10 mg mokre teže na posamezno žival vrste Enchytraeus albidus in manj pri vrstah Enchytraeus crypticus ali Enchytraeus luxuriosus); za meritev teže in kemično analizo je včasih treba združevati črve iz ponovitvenih preskusnih posod (tj. uporabijo se vsi črvi iz ponovitvene posode, da se dobi en analitski rezultat za tkivo). Vsaki ponovitvi se doda 20 posameznih enhitrejev, uporabiti pa je treba vsaj tri ponovitve. Če je analitska meja zaznavnosti preskusne kemikalije visoka, je lahko potrebnih več črvov. Pri preskusnih vrstah z večjo težo posameznega osebka (Eisenia fetida in Eisenia andrei) je mogoče uporabiti ponovitvene posode z enim osebkom.
|
|
32.
|
Deževniki, uporabljeni v preskusu, morajo imeti podobno težo (npr. posamezne živali vrst Eisenia fetida in Eisenia andrei bi morale tehtati 250–600 mg). Enhitreji (npr. Enchytraeus albidus) morajo biti dolgi približno 1 cm. Vsi črvi, uporabljeni v posameznem preskusu, morajo biti iz istega vira in biti odrasle živali s klitelumom (glej Dodatek 5). Ker lahko teža in starost živali vplivata na vrednosti BAF (npr. zaradi različnih vsebnosti lipidov in/ali prisotnosti jajčec), je treba te parametre natančno zapisovati in jih upoštevati pri razlagi rezultatov. Poleg tega lahko živali v obdobju izpostavljenosti odložijo kokone, kar tudi vpliva na vrednosti BAF. Priporočeno je pred preskusom stehtati podvzorec preskusnih črvov, da se ocenita srednja mokra in suha teža.
|
|
33.
|
Uporabiti je treba visoko razmerje med zemljino in črvi, da se v fazi absorpcije čim bolj zmanjša zniževanje koncentracije preskusne kemikalije v tleh. Za vrsti Eisenia fetida in Eisenia andrei je priporočenih najmanj 50 g suhe teže (d.w.) zemljine na črva, za enhitreje pa najmanj 10–20 g d.w. zemljine na preskusno posodo. Posode morajo vsebovati 2–3-centimetrski (enhitreji) oziroma 4–5-centimetrsko plast zemljine (deževniki).
|
|
34.
|
Črvi, uporabljeni v preskusu, se odstranijo iz gojišča (npr. enhitreji se odstranijo s pinceto z zaobljeno konico). Odrasle živali se prestavijo v neobdelana preskusna tla za aklimatizacijo in nahranijo (glej odstavek 36). Če se preskusni pogoji razlikujejo od pogojev gojenja, bi morala aklimatizacijska faza, ki traja 24–72 h, zadostovati za prilagoditev črvov na preskusne pogoje. Po aklimatizaciji se deževniki s premestitvijo sperejo v steklene posode (npr. petrijevke), ki vsebujejo čisto vodo, nato pa se stehtajo, preden se dodajo v preskusna tla. Pred tehtanjem je treba odstraniti odvečno vodo s črvov tako, da se nežno pritisnejo ob rob posode ali pa se voda previdno popivna z njih z rahlo navlaženo papirnato brisačo.
|
|
35.
|
Opazovati in zapisovati je treba obnašanje preskusnih organizmov v zvezi z zarivanjem. Pri preskusih z deževniki se živali (kontrolni in tretirani vzorci) običajno zarijejo v tla v nekaj urah; to je treba preveriti najpozneje 24 h po tem, ko se črvi dajo v preskusne posode. Če se deževniki ne zarijejo v tla (npr. več kot 10 % v več kot polovici faze absorpcije), to pomeni, da preskusni pogoji niso ustrezni ali da preskusni organizmi niso zdravi. V takem primeru je treba preskus ustaviti in ponoviti. Enhitreji večinoma živijo v intersticijskih porah v tleh, njihov integument pa je pogosto samo delno v stiku s substratom v okolju; izpostavljenost enhitrejev, ki se zarijejo v tla, in tistih, ki se ne, se šteje za enakovredno, če se enhitreji ne zarijejo v tla, pa to ne pomeni nujno, da je treba preskus ponoviti.
|
Hranjenje
|
36.
|
Pri uporabi zemljine z majhno vsebnostjo skupnega organskega ogljika je treba predvideti hranjenje. Pri uporabi umetne zemljine je za deževnike priporočena tedenska količina hrane (črvi naj se hranijo enkrat tedensko), ki znaša 7 mg posušenih iztrebkov na g suhe teže zemljine, za enhitreje pa tedenska količina 2–2,5 mg mletih ovsenih kosmičev na g suhe teže zemljine (11). Prvi obrok hrane je treba primešati v zemljino tik pred dodajanjem preskusnih organizmov. Po možnosti se uporabi ista vrsta hrane kot v gojiščih (glej Dodatek 5).
|
Svetloba in temperatura
|
37.
|
Preskuse je treba izvajati v kontroliranem ciklusu 16 ur svetlobe in 8 ur teme, po možnosti pri 400–800 lux na mestu s preskusnimi posodami (3). Preskusna temperatura mora biti ves čas preskusa 20 ± 2 °C.
|
Preskusne koncentracije
|
38.
|
Uporabi se samo ena koncentracija. Uporabo dodatnih koncentracij je treba utemeljiti. Če je strupenost (ECx) preskusne kemikalije blizu analitski meji zaznavnosti, je priporočena uporaba radioaktivno označene preskusne kemikalije z visoko specifično radioaktivnostjo. Pri kovinah mora biti koncentracija nad ravnjo ozadja v tkivu in tleh.
|
Ponovitve
|
39.
|
Za kinetične meritve (fazi absorpcije in izločanja) morajo biti najmanj tri ponovitvene posode s tretiranim vzorcem na točko vzorčenja. Skupno število pripravljenih ponovitev mora zadostovati za vse čase vzorčenja v fazi absorpcije in fazi izločanja.
|
|
40.
|
Za biološka opazovanja in meritve (npr. razmerje med suho in mokro težo, vsebnost lipidov) ter analizo koncentracij ozadja v črvih in tleh je treba zagotoviti vsaj 12 ponovitvenih posod z negativnim kontrolnim vzorcem (štiri, vzorčene na začetku, štiri na koncu absorpcije in štiri na koncu izločanja), če se ne uporablja drugo topilo kot voda. Če se za dodajanje preskusne kemikalije uporabi drugo topilo, je treba poleg tretiranih ponovitev pripraviti tudi kontrolni vzorec s topilom (štiri ponovitvene posode je treba vzorčiti na začetku, štiri na koncu faze absorpcije in štiri na koncu faze izločanja), ki vsebuje vse sestavine, razen preskusne snovi. V tem primeru je mogoče uporabiti tudi štiri dodatne ponovitvene posode z negativnim kontrolnim vzorcem (brez topila) za neobvezno vzorčenje na koncu faze absorpcije. Te ponovitve je mogoče biološko primerjati s kontrolnim vzorcem s topilom, da se dobijo informacije o morebitnem vplivu topila na preskusne organizme. Priporočeno je pripraviti zadostno število dodatnih rezervnih ponovitvenih posod (npr. osem) za tretirane in kontrolne vzorce.
|
Pogostost meritev kakovosti tal
|
41.
|
Na začetku in koncu faz absorpcije in izločanja je treba izmeriti vrednost pH tal, vsebnost vlage v tleh in temperaturo (stalno) v sobi, v kateri se izvaja preskus. Enkrat tedensko je treba preveriti vsebnost vlage v tleh s tehtanjem preskusnih posod in primerjanjem dejanskih tež z začetnimi težami na začetku preskusa. Izgubo vode je treba nadomestiti z dodajanjem deionizirane vode.
|
Vzorčenje in analiza črvov in tal
|
42.
|
Primer časovne razporeditve faz absorpcije in izločanja v preskusih bioakumulacije v deževnikih in enhitrejih je podan v Dodatku 3.
|
|
43.
|
Vzorci tal se odvzamejo iz preskusnih posod za določitev koncentracije preskusne kemikalije pred vnosom črvov ter v fazah absorpcije in izločanja. Med preskusom se določajo koncentracije preskusne kemikalije v črvih in tleh. Na splošno se merijo skupne koncentracije v tleh. Mogoče je meriti tudi koncentracije v porni vodi; v takem primeru je treba pred začetkom raziskave podati razloge za to in zagotoviti ustrezne metode ter jih vključiti v poročilo.
|
|
44.
|
Črvi in tla se vzorčijo vsaj šestkrat v fazah absorpcije in izločanja. Če se dokaže stabilnost preskusne kemikalije, je lahko analiz tal manj. Priporočeno je analizirati vsaj tri ponovitve na začetku in koncu faze absorpcije. Če koncentracija v tleh, izmerjena na koncu faze absorpcije, odstopa od začetne koncentracije za več kot za 30 %, je treba analizirati tudi vzorce tal, vzete v drugih dneh.
|
|
45.
|
Ob vsakem času vzorčenja se črvi iz ponovitve odstranijo iz tal (npr. ko se zemljina iz ponovitve razporedi na plitev pladenj, se črvi poberejo z mehko pinceto z zaobljeno konico) in na hitro sperejo z vodo v plitvem steklenem ali jeklenem pladnju. Odvečna voda se odstrani (glej odstavek 34). Črvi se pazljivo premestijo v predhodno stehtano posodo in takoj stehtajo, vključno z vsebino prebavil.
|
|
46.
|
Deževnikom (Eisenia sp.) je nato treba omogočiti, da čez noč praznijo prebavila, npr. na vlažnem filtrirnem papirju v pokriti petrijevki (glej odstavek 34). Po tem je treba določiti težo črvov, da se oceni morebitno zmanjšanje biomase med preskusom (glej merila veljavnosti v odstavku 17). Tkiva enhitrejev se tehtajo in analizirajo brez praznjenja prebavil, saj je to tehnično zahtevno, ker so ti črvi tako majhni. Po določitvi končne teže jih je treba takoj ubiti z najprimernejšo metodo (npr. s tekočim dušikom ali zamrznjenjem pri temperaturi pod –18 °C).
|
|
47.
|
Črvi v fazi izločanja nadomestijo kontaminirano vsebino prebavil s čisto zemljino. To pomeni, da meritve pri črvih z neizpraznjenimi prebavili (v tem primeru enhitrejih), vzorčenih tik pred fazo izločanja, vključujejo kontaminirano zemljino v prebavilih. Pri vodnih maloščetincih se predpostavlja, da se po začetnih 4–24 h faze izločanja večina kontaminirane vsebine prebavil nadomesti s čistim sedimentom, npr. (46). O podobnih ugotovitvah se je poročalo v zvezi z deževniki v raziskavah o kopičenju radioaktivno označenega kadmija in cinka (78). Pri enhitrejih z neizpraznjenimi prebavili se lahko koncentracija tega prvega vzorca v fazi izločanja šteje za koncentracijo v tkivu po praznjenju prebavil. Da bi upoštevali razredčenje koncentracije preskusne snovi z nekontaminirano zemljino v fazi izločanja, je mogoče oceniti težo vsebnosti prebavil iz razmerja med mokro težo črvov in težo pepela črvov ali razmerja med suho težo črvov in težo pepela črvov.
|
|
48.
|
Vzorci tal in črvov se po možnosti analizirajo takoj po odstranitvi (tj. v 1–2 dneh), da se preprečijo razgradnja ali druge izgube. Priporočljivo je že med izvajanjem preskusa izračunati približne hitrosti absorpcije in izločanja. Če se analiza odloži, je treba vzorce ustrezno shraniti, npr. z globokim zamrzovanjem (≤ –18 °C).
|
|
49.
|
Preveriti je treba, ali so natančnost in ponovljivost kemijske analize ter rekuperacija preskusne kemikalije iz vzorcev tal in črvov zadovoljivi za zadevno metodo; poročati je treba o učinkovitosti ekstrakcije, meji zaznavnosti (LOD) in meji količinske opredelitve (LOQ). Poleg tega je treba preveriti, da preskusna kemikalija v kontrolnih posodah ni zaznavna v koncentracijah, ki so višje kot v ozadju. Če je pri kontrolnih črvih koncentracija preskusne kemikalije v preskusnem organizmu Ca > 0, je to treba vključiti v izračun kinetičnih parametrov (glej Dodatek 2). V celotnem preskusu je treba z vsemi vzorci ravnati tako, da se kontaminacija in izguba čim bolj zmanjšata (npr. zaradi adsorpcije preskusne kemikalije na napravo za vzorčenje).
|
|
50.
|
Pri delu z radioaktivno označenimi preskusnimi kemikalijami je mogoče analizirati matične snovi in metabolite. Količinska opredelitev matične preskusne kemikalije in metabolitov v stabilnem stanju ali na koncu faze absorpcije vsebuje pomembne informacije. Vzorce je nato treba ‚očistiti‘, da je mogoče matično preskusno kemikalijo količinsko ločeno opredeliti. Če posamezni metaboliti presegajo 10 % skupne radioaktivnosti v analiziranih vzorcih, se priporoča identifikacija teh metabolitov.
|
|
51.
|
Navesti je treba skupno rekuperacijo ter rekuperacijo preskusne kemikalije v črvih, tleh in lovilnikih, ki vsebujejo absorbente za zadrževanje uparjene preskusne kemikalije, če se uporabijo, in poročati o njiju.
|
|
52.
|
Združevanje posameznih vzorčenih živali iz dane preskusne posode je sprejemljivo pri enhitrejih, ki so manjši od deževnikov. Če združevanje vključuje zmanjševanje števila ponovitev, to omejuje statistične postopke, ki jih je mogoče uporabiti za podatke. Če sta potrebna posebna statistični postopek in vrednost, je treba v preskus vključiti primerno število ponovitvenih preskusnih posod za prilagoditev želenemu združevanju, postopku in vrednosti.
|
|
53.
|
Priporoča se, naj se BAF izrazi v odvisnosti od skupne suhe teže, in kadar je to potrebno (tj. pri močno hidrofobnih kemikalijah), v odvisnosti od vsebnosti lipidov. Za določanje vsebnosti lipidov je treba uporabiti primerne metode (za ta namen je treba prilagoditi nekatere obstoječe metode, npr. (31) (58)), pri katerih se uporablja tehnika ekstrakcije s kloroformom/metanolom. Da bi se izognili uporabi kloriranih topil, pa je treba uporabiti prilagojeno metodo Bligha in Dyerja (9), kot je opisana v (17). Ker različne metode ne dajo nujno enakih vrednosti, je pomembno navesti podrobnosti o uporabljeni metodi. Kadar je to mogoče, tj. če je na voljo dovolj črvjega tkiva, je analizo lipidov najbolje opraviti na istem vzorcu ali ekstraktu, na katerem je bila analizirana preskusna kemikalija, ker je treba lipide pogosto odstraniti iz ekstrakta, preden ga je mogoče kromatografsko analizirati (49). Sicer je mogoče za merjenje vsebnosti lipidov uporabiti kontrolne živali, kar je mogoče nato uporabiti za normalizacijo vrednosti BAF. Pri slednjem pristopu se zmanjša kontaminacija opreme s preskusno kemikalijo.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
54.
|
Krivulja absorpcije preskusne kemikalije se dobi tako, da se njena koncentracija v/na črvih v fazi absorpcije grafično prikaže v odvisnosti od časa na aritmetični lestvici. Ko krivulja doseže konstantno raven ali stabilno stanje (glej opredelitve v Dodatku 1), se bioakumulacijski faktor stabilnega stanja BAFss izračuna iz:

Ca je koncentracija preskusne kemikalije v preskusnem organizmu,
Cs je koncentracija preskusne kemikalije v tleh.
|
|
55.
|
Kadar stabilno stanje ni doseženo, je treba namesto BAFss določiti BAFK na podlagi konstant hitrosti, kot je opisano spodaj:
|
—
|
akumulacijski faktor (BAFK) se določi kot razmerje med ks in ke,
|
|
—
|
hitrosti absorpcije in izločanja se po možnosti izračunata hkrati (glej enačbo 11 v Dodatku 2),
|
|
—
|
konstanta hitrosti izločanja (ke) se običajno določi na podlagi krivulje izločanja (tj. grafičnega prikaza koncentracije preskusne snovi v črvih v fazi izločanja). Konstanta hitrosti absorpcije ks se nato izračuna iz ke in vrednosti Ca, ki se dobi iz krivulje absorpcije – za opis teh metod glej Dodatek 2. Za izračun faktorja BAFK in konstant hitrosti ks in ke je najbolje uporabiti računalniške metode za ocenjevanje nelinearnih parametrov. Če izločanje očitno ni prvega reda, je treba uporabiti kompleksnejše modele.
|
|
Poročilo o preskusu
|
56.
|
V poročilu o preskusu morajo biti naslednje informacije:
|
|
Preskusna kemikalija:
|
—
|
vse razpoložljive informacije o akutni ali dolgotrajni strupenosti (npr. ECx, LCx“ NOEC) preskusne kemikalije za maloščetince, ki živijo v tleh,
|
|
—
|
čistost, fizikalno stanje in fizikalno-kemijske lastnosti, npr. log Kow, vodotopnost,
|
|
—
|
kemijski identifikacijski podatki, vir preskusne snovi, identiteta in koncentracija uporabljenega topila,
|
|
—
|
če je uporabljena radioaktivno označena preskusna kemikalija, točen položaj označenih atomov, specifična radioaktivnost in radiokemijska čistost.
|
|
|
|
Preskusna vrsta:
|
—
|
znanstveno ime, sev, vir, morebitna predobdelava, aklimatizacija, starost, red velikosti itd.
|
|
|
|
Preskusni pogoji:
|
—
|
uporabljeni preskusni postopek,
|
|
—
|
tip in lastnosti uporabljene svetlobe in obdobja osvetljenosti,
|
|
—
|
načrt preskusa (npr. število in velikost preskusnih posod, teža zemljine in debelina plasti tal, število ponovitev, število črvov na ponovitev, število preskusnih koncentracij, trajanje faz absorpcije in izločanja, pogostost vzorčenja),
|
|
—
|
razlogi za izbiro materiala, iz katerega so preskusne posode,
|
|
—
|
metoda priprave in dodajanja preskusne snovi ter razlogi za izbiro metode,
|
|
—
|
nazivne preskusne koncentracije, srednje izmerjene vrednosti in njihovi standardni odkloni v preskusnih posodah ter metoda, s katero so bile te vrednosti pridobljene,
|
|
—
|
vir sestavin umetne zemljine ali – pri uporabi naravnih medijev – izvor zemljine, opis morebitne predobdelave, rezultati kontrol (preživetje, razvoj biomase, razmnoževanje), lastnosti tal (pH, vsebnost skupnega organskega ogljika, velikostna porazdelitev delcev (odstotni delež peska, mulja in gline), WHCmax, odstotni delež vsebnosti vode na začetku in koncu preskusa ter druge opravljene meritve),
|
|
—
|
podrobne informacije o obdelavi vzorcev tal in črvov, vključno s podrobnostmi o pripravi, shranjevanju, postopkih dodajanja snovi, ekstrakciji in analitskih postopkih (in natančnosti) za preskusno snov v črvih in tleh ter o vsebnosti lipidov (če je bila izmerjena) in rekuperaciji preskusne snovi.
|
|
|
|
Rezultati:
|
—
|
smrtnost kontrolnih črvov in črvov v vsaki preskusni posodi ter opaženo nenormalno obnašanje (npr. izogibanje tlom, slabo razmnoževanje pri preskusu bioakumulacije v enhitrejih),
|
|
—
|
razmerje med suho in mokro težo zemljine in preskusnih organizmov (koristno za normalizacijo),
|
|
—
|
mokre teže črvov ob vsakem času vzorčenja; za deževnike mokre teže na začetku preskusa ter ob vsakem času vzorčenja pred praznjenjem prebavil in po njem,
|
|
—
|
vsebnost lipidov v preskusnih organizmih (če je bila določena),
|
|
—
|
krivulje, ki prikazujejo kinetiko absorpcije in izločanja preskusne kemikalije pri črvih ter čas do vzpostavitve stabilnega stanja,
|
|
—
|
Ca in Cs (s standardnim odklonom in razponom, če je ustrezno) za vse čase vzorčenja (Ca izražen v g·kg-1 mokre in suhe teže celega telesa, Cs izražen v g·kg-1 mokre in suhe teže zemljine). Če je potreben faktor akumulacije v organizmih glede na tla (BSAF) (npr. za primerjavo rezultatov dveh ali več preskusov, opravljenih z živalmi z različno vsebnostjo lipidov), je lahko Ca dodatno izražen v g·kg-1 vsebnosti lipidov v organizmu, Cs pa je lahko izražen v g·kg-1 organskega ogljika (OC) v tleh,
|
|
—
|
BAF (izražen v kg zemljine·kg-1 črvov), konstanta hitrosti absorpcije zemljine ks (izražena v g zemljine kg-1 črvov dan-1) in konstanta hitrosti izločanja ke (izražena v dan-1); v poročilu je lahko dodatno naveden BSAF (izražen v kg zemljine OC kg-1 vsebnosti lipidov v črvih),
|
|
—
|
če so bili izmerjeni: odstotni deleži matične kemikalije, metabolitov in vezanih ostankov (tj. odstotni delež preskusne kemikalije, ki ga ni mogoče ekstrahirati z običajnimi metodami ekstrakcije), zaznani v tleh in preskusnih živalih,
|
|
—
|
metode, uporabljene za statistično analizo podatkov.
|
|
|
|
Vrednotenje rezultatov:
|
—
|
skladnost rezultatov z merili veljavnosti, navedenimi v odstavku 17,
|
|
—
|
nepričakovani ali nenavadni rezultati, npr. nepopolno izločanje preskusne kemikalije iz preskusnih živali.
|
|
|
VIRI:
|
(1)
|
Amorim, M. (2000). Chronic and toxicokinetic behavior of Lindane (γ-HCH) in the Enchytraeid Enchytraeus albidus. Master thesis, University Coimbra.
|
|
(2)
|
ASTM (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates. American Society for Testing and Materials, E 1688–00a.
|
|
(3)
|
ASTM International (2004). Standard guide for conducting laboratory soil toxicity or bioaccumulation tests with the Lumbricid earthworm Eisenia fetida and the Enchytraeid potworm Enchytraeus albidus. ASTM International, E1676–04: str. 26.
|
|
(4)
|
Beek, B., Boehling, S., Bruckmann, U., Franke, C., Joehncke, U., Studinger, G. (2000). The assessment of bioaccumulation. In Hutzinger, O. (urednik), The Handbook of Environmental Chemistry, Vol. 2 Part J (urednik zvezka: B. Beek): Bioaccumulation - New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235–276.
|
|
(5)
|
Belfroid, A., Sikkenk, M., Seinen, W., Van Gestel, C., Hermens, J. (1994). The toxicokinetic behavior of chlorobenzenes in earthworms (Eisenia andrei): Experiments in soil. Environ. Toxicol. Chem. 13: 93–99.
|
|
(6)
|
Belfroid, A., Van Wezel, A., Sikkenk, M., Van Gestel, C., Seinen, W. & Hermens, J. (1993). The toxicokinetic behavior of chlorobenzenes in earthworms (Eisenia andrei): Experiments in water. Ecotox. Environ. Safety 25: 154–165.
|
|
(7)
|
Belfroid, A., Meiling, J., Drenth, H., Hermens, J., Seinen, W., Van Gestel, C. (1995). Dietary uptake of superlipophilic compounds by earthworms (Eisenia andrei). Ecotox. Environ. Safety 31: 185–191.
|
|
(8)
|
Bell, A. W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902: 1–13.
|
|
(9)
|
Bligh, E. G., in Dyer, W. J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Pysiol. 37: 911–917.
|
|
(10)
|
Bouche, M. (1972). Lombriciens de France. Ecologie et Systematique. INRA, Annales de Zoologie-Ecologie animale, Paris, str. 671.
|
|
(11)
|
Bruns, E., Egeler, Ph., Moser, T., Römbke, J., Scheffczyk, A., Spörlein, P. (2001a). Standardisierung und Validierung eines Bioakkumulationstests mit terrestrischen Oligochaeten. Report to the German Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 298 64 416.
|
|
(12)
|
Bruns, E., Egeler, Ph., Römbke, J. Scheffczyk, A., Spörlein, P. (2001b). Bioaccumulation of lindane and hexachlorobenzene by the oligochaetes Enchytraeus luxuriosus and Enchytraeus albidus (Enchytraeidae, Oligochaeta, Annelida). Hydrobiologia 463: 185–196.
|
|
(13)
|
Conder, J. M., in Lanno, R. P. (2003). Lethal critical body residues as measures of Cd, Pb, and Zn bioavailability and toxicity in the earthworm Eisenia fetida. J. Soils Sediments 3: 13–20.
|
|
(14)
|
Connell, D. W., in Markwell, R. D. (1990). Bioaccumulation in the Soil to Earthworm System. Chemosphere 20: 91–100.
|
|
(15)
|
Didden, W. A. M. (1993). Ecology of Terrestrial Enchytraeidae. Pedobiologia 37: 2–29.
|
|
(16)
|
Didden, W. (2003). Oligochaeta, In: Bioindicators and biomonitors. Markert, B.A., Breure, A.M. & Zechmeister, H.G. (ur.). Elsevier Science Ltd., The Netherlands, str. 555–576.
|
|
(17)
|
De Boer, J., Smedes, F., Wells, D., Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2, Exercise 1000, EU, Standards, Measurement and Testing Programme.
|
|
(18)
|
Dietrich, D. R., Schmid, P., Zweifel, U., Schlatter, C., Jenni-Eiermann, S., Bachmann, H., Bühler, U., Zbinden, N. (1995). Mortality of birds of prey following field application of granular carbofuran: A Case Study. Arch. Environ. Contam. Toxicol. 29: 140–145.
|
|
(19)
|
Uredba (ES) št. 1907/2006 Evropskega parlamenta in Sveta z dne 18. decembra 2006 o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH), o ustanovitvi Evropske agencije za kemikalije ter spremembi Direktive 1999/45/ES ter razveljavitvi Uredbe Sveta (EGS) št. 793/93 in Uredbe Komisije (ES) št. 1488/94 ter Direktive Sveta 76/769/EGS in direktiv Komisije 91/155/EGS, 93/67/EGS, 93/105/ES in 2000/21/ES (UL L 396, 30.12.2006, str. 1).
|
|
(20)
|
Edwards, C. A., in Bohlen, P. J. (1996). Biology and ecology of earthworms. Third Edition, Chapman & Hall, London, str. 426.
|
|
(21)
|
OECD (2008), Bioakumulacija v bentoških maloščetincih, ki živijo v usedlinah, Smernica za preskušanje št. 315, Smernice za preskušanje kemikalij, OECD, Pariz.
|
|
(22)
|
Egeler, Ph., Gilberg, D., Scheffczyk, A., Moser, Th., in Römbke, J. (2009). Validation of a Soil Bioaccumulation Test with Terrestrial Oligochaetes by an International Ring Test (Validierung einer Methode zur standardisierten Messung der Bioakkumulation mit terrestrischen Oligochaeten). Report to the Federal Environmental Agency (Umweltbundesamt Dessau-Rosslau), R&D No.: 204 67 458: str. 149. Na voljo za prenos na: http://www.oecd.org/dataoecd/12/20/42552727.pdf.
|
|
(23)
|
Elmegaard, N., in Jagers op Akkerhuis, G. A. J. M. (2000). Safety factors in pesticide risk assessment, Differences in species sensitivity and acute-chronic relations. National Environmental Research Institute, NERI Technical Report 325: str. 57.
|
|
(24)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(25)
|
EPPO (2003). Environmental Risk Assessment scheme for plant protection products. Soil organisms and functions, EPPO (European Plant Protection Organization) Standards, Bull, OEPP/EPPO 33: 195–208.
|
|
(26)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment? Chemosphere 32: 1897–1905.
|
|
(27)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D., Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29: 1501–1514.
|
|
(28)
|
Füll, C. (1996). Bioakkumulation und Metabolismus von -1,2,3,4,5,6-Hexachlorcyclohexan (Lindan) und 2-(2,4-Dichlorphenoxy)-propionsäure (Dichlorprop) beim Regenwurm Lumbricus rubellus (Oligochaeta, Lumbricidae). Dissertation University Mainz, str. 156.
|
|
(29)
|
Füll, C., Schulte, C., Kula, C. (2003). Bewertung der Auswirkungen von Pflanzenschutzmitteln auf Regenwürmer. UWSF - Z. Umweltchem, Ökotox. 15: 78–84.
|
|
(30)
|
Gabric, A. J., Connell, D. W., Bell, P. R. F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24: 1225–1231.
|
|
(31)
|
Gardner, W. S., Frez, W. A., Cichocki, E. A., Parrish, C. C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography 30: 1099–1105.
|
|
(32)
|
Hawker, D. W., in Connell, D. W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22: 701–707.
|
|
(33)
|
Hund-Rinke, K., in Wiechering, H. (2000). Earthworm avoidance test for soil assessments: An alternative for acute and reproduction tests. J. Soils Sediments 1: 15–20.
|
|
(34)
|
Hund-Rinke, K., Römbke, J., Riepert, F., Achazi, R. (2000). Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (ur.), Spektrum Verl., Heidelberg, 59–81.
|
|
(35)
|
ISO 11268-2 (1998). Kakovost tal – Vpliv onesnaževal na deževnike (Eisenia fetida). Del 2: Določanje vplivov na razmnoževanje.
|
|
(36)
|
Jaenike, J. (1982). ‚Eisenia foetida‘ is two biological species. Megadrilogica 4: 6–8.
|
|
(37)
|
Jager, T. (1998). Mechanistic approach for estimating bioconcentration of organic chemicals in earthworms (Oligochaeta). Environ. Toxicol. Chem. 17: 2080–2090.
|
|
(38)
|
Jager, T., Sanchez, P. A., Muijs, B., van der Welde, E., Posthuma, L. (2000). Toxicokinetics of polycyclic aromatic hydrocarbons in Eisenia andrei (Oligochaeta) using spiked soil. Environ. Toxicol. Chem. 19: 953–961.
|
|
(39)
|
Jager, T., Baerselman, R., Dijkman, E., De Groot, A. C., Hogendoorn, E. A., DeJong, A., Kruitbosch, J. A. W., Peijnenburg, W. J. G. M (2003a). Availability of polycyclic aromatic hydrocarbons to earthworms (Eisenia andrei, Oligochaeta) in field-polluted soils and soil-sediment mixtures. Environ. Toxicol. Chem. 22: 767–775.
|
|
(40)
|
Jager, T., Fleuren, R. L. J., Hoogendoorn, E., de Korte, G. (2003b). Elucidating the routes of exposure for organic chemicals in the earthworm, Eisenia andrei (Oligochaeta). Environ. Sci. Technol. 37: 3399–3404.
|
|
(41)
|
Janssen, M. P. M., Bruins, A., De Vries, T. H., Van Straalen, N. M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305–312.
|
|
(42)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23: 217–232.
|
|
(43)
|
Khalil, A. M. (1990). Aufnahme und Metabolismus von 14C-Hexachlorbenzol und 14C-Pentachlornitrobenzol in Regenwürmern. Dissertation University München, str. 137.
|
|
(44)
|
Landrum, P. F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23: 588–595.
|
|
(45)
|
Marinussen, M. P. J. C., Van der Zee, S. E. A. T. M., De Haan, F. A. (1997). Cu accumulation in Lumbricus rubellus under laboratory conditions compared with accumulation under field conditions. Ecotox. Environ. Safety 36: 17–26.
|
|
(46)
|
Mount, D. R., Dawson, T. D., Burkhard, L. P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegates. Environ. Toxicol. Chem. 18: 1244–1249.
|
|
(47)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations, In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems, Contributions to the assessment, Proceedings of an international workshop, Berlin 1990, VCH, Weinheim.
|
|
(48)
|
Poglavje C.8 te priloge, Strupenost za deževnike.
|
|
(49)
|
Poglavje C.13 te priloge, Biokoncentracija: pretočni preskus na ribah.
|
|
(50)
|
Poglavje C.21 te priloge, Talni mikroorganizmi: preskus transformacije dušika.
|
|
(51)
|
OECD (2004a), Preskus razmnoževanja enhitrejev, Smernica za preskušanje št. 220, Smernice za preskušanje kemikalij, OECD, Pariz.
|
|
(52)
|
OECD (2004b), Preskus razmnoževanja deževnikov (Eisenia fetida/Eisenia Andrei), Smernica za preskušanje št. 222, Smernice za preskušanje kemikalij, OECD, Pariz.
|
|
(53)
|
OECD (2008), Bioakumulacija v bentoških maloščetincih, ki živijo v usedlinah, Smernica za preskušanje št. 315, Smernice za preskušanje kemikalij, OECD, Pariz.
|
|
(54)
|
Petersen, H., in Luxton, M. (1982). A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287–388.
|
|
(55)
|
Phillips, D. J. H. (1993). Bioaccumulation. In: Handbook of Ecotoxicology Vol. 1. Calow P. (ur.). Blackwell Scientific Publ., Oxford. 378–396.
|
|
(56)
|
Pflugmacher, J. (1992). Struktur-Aktivitätsbestimmungen (QSAR) zwischen der Konzentration von Pflanzenschutzmitteln und dem Octanol-Wasser-Koeffzienten UWSF- Z. Umweltchem. Ökotox. 4: 77–81.
|
|
(57)
|
Posthuma, L., Weltje, L., Anton-Sanchez, F. A. (1996). Joint toxic effects of cadmium and pyrene on reproduction and growth of the earthworm Eisenia fetida. RIVM Report No. 607506001, Bilthoven.
|
|
(58)
|
Randall, R. C., Lee, II. H., Ozretich, R. J., Lake, J. L., Pruell, R. J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10: 1431–1436.
|
|
(59)
|
Römbke, J., Egele, P., Füll, C. (1998). Literaturstudie über Bioakkumulationstests mit Oligochaeten im terrestrischen Medium. UBA-Texte 28/98, 84 S.
|
|
(60)
|
Römbke, J. in Moser, Th. (1999). Organisation and performance of an international ring-test for the validation of the Enchytraeid reproduction test. UBA-Texte 4/99: str. 373.
|
|
(61)
|
Römbke, J., Riepert, F., Achazi, R. (2000). Enchytraeen als Testorganismen, In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (ur.). Spektrum Verl., Heidelberg. 105–129.
|
|
(62)
|
Romijn, C. A. F. M., Luttik, R., Van De Meent, D., Slooff, W., Canton, J. H. (1993). Presentation of a General Algorithm to Include Effect Assessment on Secondary Poisoning in the Derivation of Environmental Quality Criteria, Part 2: Terrestrial food chains. Ecotox. Envir. Safety 27: 107–127.
|
|
(63)
|
Sample, B. E., Suter, D. W., Beauchamp, J. J., Efroymson, R. A. (1999). Literature-derived bioaccumulation models for earthworms: Development and validation. Environ. Toxicol. Chem. 18: 2110–2120.
|
|
(64)
|
Schlosser, H.-J., in Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina), Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. NF 34: 413–433.
|
|
(65)
|
Schmelz, R., in Collado, R. (1999). Enchytraeus luxuriosus sp. nov., a new terrestrial oligochaete species (Enchytraeide, Clitellata, Annelida). Carolinea 57: 93–100.
|
|
(66)
|
Sims, R. W., in Gerard, B. M. (1985). Earthworms, In: Kermack, D. M. & Barnes, R. S. K. (Hrsg.): Synopses of the British Fauna (New Series) No. 31. 171 S. London: E. J. Brill/Dr. W. Backhuys.
|
|
(67)
|
Sousa, J. P., Loureiro, S., Pieper, S., Frost, M., Kratz, W., Nogueira, A. J. A., Soares, A. M. V. M. (2000). Soil and plant diet exposure routes and toxicokinetics of lindane in a terrestrial isopod. Environ. Toxicol. Chem. 19: 2557–2563.
|
|
(68)
|
Spacie, A. in Hamelink, J. L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309–320.
|
|
(69)
|
Stephenson, G. L., Kaushik, A., Kaushik, N. K., Solomon, K. R., Steele, T., Scroggins, R. P. (1998). Use of an avoidance-response test to assess the toxicity of contaminated soils to earthworms. In: Advances in earthworm ecotoxicology. S. Sheppard, J. Bembridge, M. Holmstrup, L. Posthuma (ur.). Setac Press, Pensacola, 67–81.
|
|
(70)
|
Sterenborg, I., Vork, N. A., Verkade, S. K., Van Gestel, C. A. M., Van Straalen, N. M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167–1171.
|
|
(71)
|
UBA (Umweltbundesamt) (1991). Bioakkumulation - Bewertungskonzept und Strategien im Gesetzesvollzug. UBA-Texte 42/91. Berlin.
|
|
(72)
|
US EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition, EPA 600/R-99/064, US, Environmental Protection Agency, Duluth, MN, marec 2000.
|
|
(73)
|
Van Brummelen, T. C. in Van Straalen, N. M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277–285.
|
|
(74)
|
Van Gestel, C. A. M. (1992). The influence of soil characteristics on the toxicity of chemicals for earthworms; a review, In: Ecotoxicology of Earthworms (Ur. Becker, H, Edwards, PJ, Greig-Smith, PW & Heimbach, F). Intercept Press, Andover (GB).
|
|
(75)
|
Van Gestel, C. A., in Ma, W.-C. (1990). An approach to quantitative structure-activity relationships (QSARs) in earthworm toxicity studies. Chemosphere 21: 1023–1033.
|
|
(76)
|
Van Straalen, N. M., Donker, M. H., Vijver, M. G., van Gestel, C. A. M. (2005). Bioavailability of contaminants estimated from uptake rates into soil invertebrates. Environmental Pollution 136: 409–417.
|
|
(77)
|
Venter, J. M. in Reinecke, A. J. (1988). The life-cycle of the compost-worm Eisenia fetida (Oligochaeta). South African J. Zool. 23: 161–165.
|
|
(78)
|
Vijver, M. G., Vink, J. P. M., Jager, T., Wolterbeek, H. T., van Straalen, N. M., van Gestel, C. A. M. (2005). Biphasic elimination and uptake kinetics of Zn and Cd in the earthworm Lumbricus rubellus exposed to contaminated floodplain soil. Soil Biol, Biochem. 37: 1843–1851.
|
|
(79)
|
Widianarko, B., in Van Straalen, N. M. (1996). Toxicokinetics-based survival analysis in bioassays using nonpersistent chemicals, Environ. Toxicol. Chem. 15: 402–406.
|
Dodatek 1
OPREDELITEV POJMOV
|
|
Bioakumulacija je povečanje koncentracije preskusne kemikalije v organizmu ali na njem, glede na koncentracijo preskusne kemikalije v okoliškem mediju. Izhaja iz procesov biokoncentracije in biomagnifikacije (glej spodaj);
|
|
|
biokoncentracija je povečanje koncentracije preskusne kemikalije v organizmu ali na njem zaradi absorpcije kemikalije izključno iz okoliškega medija (tj. prek telesne površine in z zaužitjem), ki je odvisna od koncentracije preskusne kemikalije v okoliškem mediju;
|
|
|
biomagnifikacija je povečanje koncentracije preskusne kemikalije v organizmu ali na njem predvsem zaradi absorpcije iz kontaminirane hrane ali plena, ki je odvisna od koncentracije preskusne kemikalije v hrani ali plenu. Biomagnifikacija lahko vodi do prenosa ali kopičenja preskusne snovi v prehranjevalnem spletu;
|
|
|
izločanje preskusne kemikalije je odstranitev te kemikalije iz tkiva preskusnega organizma z aktivnimi ali pasivnimi procesi, ki se pojavijo neodvisno od prisotnosti ali odsotnosti preskusne snovi v okoliškem mediju;
|
|
|
bioakumulacijski faktor (BAF) ob katerem koli času v fazi absorpcije tega preskusa bioakumulacije je koncentracija preskusne kemikalije v/na preskusnem organizmu (Ca v g·kg-1 suhe teže črva), deljena s koncentracijo kemikalije v okoliškem mediju (Cs v g·kg-1 suhe teže zemljine); BAF se izrazi v enotah kg zemljine·kg-1 črvov;
|
|
|
bioakumulacijski faktor stabilnega stanja (BAFss) je BAF v stabilnem stanju in se ne spreminja znatno v daljšem časovnem obdobju, saj je koncentracija preskusne kemikalije v okoliškem mediju (Cs v g·kg-1 suhe teže zemljine) v tem obdobju konstantna;
|
|
|
bioakumulacijski faktorji, izračunani neposredno iz razmerja med konstanto hitrosti absorpcije tal in konstanto hitrosti izločanja (ks in ke, glej spodaj), se imenujejo kinetični bioakumulacijski faktor (BAFK);
|
|
|
faktor akumulacije v organizmih glede na tla (BSAF) je na lipide normalizirana koncentracija preskusne kemikalije v/na preskusnem organizmu, deljena s koncentracijo preskusne kemikalije v tleh v stabilnem stanju, normalizirano na organski ogljik. Ca se tako izrazi kot g·kg-1 vsebnosti lipidov v organizmu, Cs pa kot g·kg-1 vsebnosti organskega ogljika v tleh; BSAF se izrazi v enotah kg OC·kg-1 lipidov;
|
|
|
konstantna raven ali stabilno stanje je opredeljeno kot ravnotežje med procesoma absorpcije in izločanja, ki potekata hkrati v fazi izpostavljenosti. Stabilno stanje je v grafičnem prikazu BAF v odvisnosti od časa doseženo, ko krivulja postane vzporedna s časovno osjo in se tri zaporedne analize BAF na vzorcih, vzetih v razmiku najmanj dveh dni, druga od druge ne razlikuje za več kot 20 % ter ni statistično značilnih razlik med tremi obdobji vzorčenja. Za preskusne kemikalije, ki se počasi absorbirajo, so primernejši sedemdnevni razmiki (49);
|
|
|
koeficient porazdelitve organski ogljik/voda (Koc) je razmerje med koncentracijo kemikalije v/na delu tal z organskim ogljikom in koncentracijo kemikalije v vodi v ravnotežju;
|
|
|
koeficient porazdelitve oktanol/voda (Kow) je uravnoteženo razmerje topnosti kemikalije v n-oktanolu in vodi, včasih izraženo tudi kot Pow. Logaritem Kow (log Kow) se uporablja kot kazalnik potenciala kemikalije za kopičenje v vodnih organizmih;
|
|
|
faza absorpcije ali izpostavitve je čas, v katerem so preskusni organizmi izpostavljeni preskusni kemikaliji;
|
|
|
konstanta hitrosti absorpcije tal (ks) je numerična vrednost, ki opredeljuje stopnjo povišanja koncentracije preskusne snovi v/na preskusnem organizmu zaradi absorpcije iz talne faze. Konstanta ks se izrazi v g zemljine kg-1 črvov d-1;
|
|
|
faza izločanja je čas po prenosu preskusnih organizmov iz kontaminiranega medija v medij brez preskusne snovi, v katerem se preučuje izločanje (ali neto izguba) kemikalije iz preskusnih organizmov;
|
|
|
konstanta hitrosti izločanja (ke) je numerična vrednost, ki opredeljuje stopnjo znižanja koncentracije preskusne snovi v/na preskusnih organizmih po prenosu preskusnih organizmov iz medija s preskusno snovjo v medij brez kemikalije; ke se izrazi v d-1;
|
|
|
preskusna kemikalija: snov ali zmes, preskušana z uporabo te preskusne metode.
|
Dodatek 2
Izračun parametrov absorpcije in izločanja
Glavni cilj preskusa bioakumulacije je določitev bioakumulacijskega faktorja BAF. Izmerjeni BAF je mogoče izračunati z deljenjem koncentracije v preskusnem organizmu Ca s koncentracijo v tleh Cs v stabilnem stanju. Če v fazi absorpcije stabilno stanje ni doseženo, se BAFK izračuna iz konstant hitrosti namesto iz BAFss. Vendar je treba navesti, ali BAF temelji na koncentracijah v stabilnem stanju ali ne.
Kinetični bioakumulacijski faktor (BAFK), konstanta hitrosti absorpcije tal (ks) in konstanta hitrosti izločanja (ke) se običajno dobijo z računalniškimi metodami za ocenjevanje nelinearnih parametrov, npr. na podlagi modelov, opisanih v (68). Na podlagi skupine podatkov o zaporednih koncentracijah v odvisnosti od časa in modelnih enačb:
|
|
0 < t < tc
|
[enačba 1]
|
ali
|
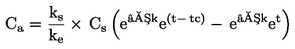
|
t > tc
|
[enačba 2]
|
pri čemer je:
|
Ca
|
=
|
koncentracija kemikalije v črvih [g·kg-1 mokre ali suhe teže],
|
|
ks
|
=
|
konstanta hitrosti absorpcije v tkivu [g zemljine kg-1 črvov d-1],
|
|
Cs
|
=
|
koncentracija kemikalije v tleh [g·kg-1 mokre ali suhe teže],
|
|
ke
|
=
|
konstanta hitrosti izločanja [d-1],
|
|
tc
|
=
|
čas na koncu faze absorpcije,
|
ti računalniški programi izračunajo vrednosti BAFK, ks in ke.
Kadar se koncentracija ozadja pri neizpostavljenih črvih, npr. na dan 0, znatno razlikuje od nič (tako je lahko na primer pri kovinah), mora biti ta koncentracija ozadja (Ca,0) vključena v te enačbe, tako da se glasijo:
|

|
0 < t < tc
|
[enačba 3]
|
in
|
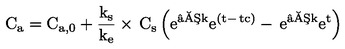
|
t > tc
|
[enačba 4]
|
Kadar se v fazi absorpcije ugotovi znatno zmanjšanje koncentracije preskusne kemikalije v tleh v odvisnosti od časa, je mogoče uporabiti naslednje modele, npr. (67) (79):
|
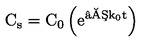
|
[enačba 5]
|
pri čemer je:
|
Cs
|
=
|
koncentracija kemikalije v tleh [g·kg-1 mokre ali suhe teže],
|
|
k0
|
=
|
konstanta hitrosti razgradnje v tleh [d-1],
|
|
C0
|
=
|
začetna koncentracija kemikalije v tleh [g·kg-1 mokre ali suhe teže].
|
|

|
0 < t < tc
|
[enačba 6]
|
|
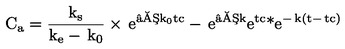
|
t > tc
|
[enačba 7]
|
pri čemer je:
|
Ca
|
=
|
koncentracija kemikalije v črvih [g·kg-1 mokre ali suhe teže],
|
|
ks
|
=
|
konstanta hitrosti absorpcije v tkivu [g zemljine kg-1 črvov d-1],
|
|
k0
|
=
|
konstanta hitrosti razgradnje v tleh [d-1],
|
|
ke
|
=
|
konstanta hitrosti izločanja [d-1],
|
|
tc
|
=
|
čas na koncu faze absorpcije.
|
Kadar je v fazi absorpcije doseženo stabilno stanje (tj. t = ∞), je mogoče enačbo 1
|
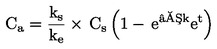
|
0 < t < tc
|
[enačba 1]
|
skrajšati na:
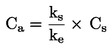
ali
|

|
[enačba 8]
|
Nato je ks/ke x Cs pristop za ugotavljanje koncentracije preskusne snovi v črvjem tkivu v stabilnem stanju (Ca,ss).
Faktor akumulacije v organizmih glede na tla (BSAF) je mogoče izračunati na naslednji način:
|

|
[enačba 9]
|
pri čemer je foc del organskega ogljika v tleh, flip pa del lipidov v črvih, pri čemer sta oba po možnosti določena na vzorcih, vzetih v preskusu, ter temeljita na suhi teži oziroma mokri teži.
Model kinetike izločanja je mogoče oblikovati na podlagi podatkov iz faze izločanja ter z uporabo spodnje modelne enačbe in računalniške metode za ocenjevanje nelinearnih parametrov. Če podatkovne točke, grafično prikazane v odvisnosti od časa, nakazujejo konstantno eksponentno padanje koncentracije preskusne snovi v živalih, je mogoče za opis časovnega poteka izločanja uporabiti enodelni model (enačba 9).
|

|
[enačba 10]
|
Procesi izločanja so včasih videti dvofazni, pri čemer v zgodnjih fazah Ca hitro upada, kar se v poznejših fazah izločanja spremeni v počasnejšo izgubo preskusnih snovi, npr. (27) (68). Dve fazi je mogoče razložiti s predpostavko, da sta v organizmu dva različna dela, iz katerih se preskusna snov izloča z različno hitrostjo. V takih primerih je treba preučiti posebne vire, npr. (38) (39) (40) (78).
Z zgornjimi modelnimi enačbami je mogoče kinetična parametra (ks in ke) izračunati tudi naenkrat z modelom kinetike prvega reda za vse podatke iz faz absorpcije in izločanja hkrati. Opis metode, ki lahko omogoča tak združeni izračun konstant hitrosti absorpcije in izločanja, je na voljo v virih (191), (223) in (220).
|
|
[enačba 11]
|
|
Opomba:
|
kadar se parametra absorpcije in izločanja ocenjujeta hkrati iz združenih podatkov o absorpciji in izločanju, je ‚m‘, kot je prikazan v enačbi 11, deskriptor, ki računalniškemu programu omogoča, da podizraze v enačbi pripiše skupinam podatkov iz zadevne faze in da pravilno izvede ocenjevanje (m = 1 za fazo absorpcije; m = 2 za fazo izločanja).
|
Vseeno je treba te modelne enačbe uporabljati previdno, zlasti kadar se med preskusom pojavijo spremembe v biološki razpoložljivosti preskusne kemikalije ali (biološki) razgradnji (glej npr. (79)).
Dodatek 3
PRIMERI ČASOVNIH RAZPOREDOV ZA PRESKUSE BIOAKUMULACIJE V TLEH
Preskus z deževniki
|
(a)
|
Faza absorpcije z 8 datumi vzorčenja za izračun kinetike
|
Dan
|
Dejavnost
|
|
– 6
|
48-urno kondicioniranje pripravljene zemljine;
|
|
– 4
|
dodajanje raztopine preskusne kemikalije v del zemljine; izparevanje morebitnega topila; mešanje sestavin zemljine; razporejanje zemljine v preskusne posode; 4-dnevno vzpostavljanje ravnotežja v preskusnih pogojih (3 tedne za zemljine s primešano kovino);
|
|
– 3 do – 1
|
izločevanje preskusnih organizmov iz gojišča za aklimatizacijo; priprava in vlaženje sestavin zemljine;
|
|
0
|
merjenje temperature in vrednosti pH tal; odstranjevanje vzorcev tal iz tretiranih posod in kontrolnih vzorcev s topilom za določitev koncentracije preskusne kemikalije; dodajanje obroka hrane; tehtanje in naključna razporeditev črvov v preskusne posode; zadržanje zadostnih podvzorcev črvov za določanje analitskih vrednosti ozadja, mokre in suhe teže ter vsebnosti lipidov; tehtanje vseh preskusnih posod za kontrolo vlage v tleh; kontrola dotoka zraka, če se uporabi zaprt preskusni sistem;
|
|
1
|
kontrola dotoka zraka, zapisovanje obnašanja črvov in temperature; jemanje vzorcev tal in črvov za določitev koncentracije preskusne snovi;
|
|
2
|
enako kot 1. dan;
|
|
3
|
kontrola dotoka zraka, obnašanja črvov in temperature;
|
|
4
|
enako kot 1. dan;
|
|
5–6
|
enako kot 3. dan;
|
|
7
|
enako kot 1. dan; dodajanje obroka hrane; kontrola vlage v tleh s ponovnim tehtanjem preskusnih posod in nadomeščanje izhlapele vode;
|
|
8–9
|
enako kot 3. dan;
|
|
10
|
enako kot 1. dan;
|
|
11–13
|
enako kot 3. dan;
|
|
14
|
enako kot 1. dan; dodajanje obroka hrane; kontrola vlage v tleh s ponovnim tehtanjem preskusnih posod in nadomeščanje izhlapele vode;
|
|
15–16
|
enako kot 3. dan;
|
|
17
|
enako kot 1. dan;
|
|
18–20
|
enako kot 3. dan;
|
|
21
|
enako kot 1. dan; merjenje temperature in vrednosti pH tal; kontrola vlage v tleh s ponovnim tehtanjem preskusnih posod; konec faze absorpcije; premestitev črvov iz preostalih izpostavljenih ponovitev v posode s čisto zemljino za fazo izločanja (brez praznjenja prebavil); vzorčenje tal in črvov iz kontrolnih vzorcev s topilom.
|
|
|
Dejavnosti pred izpostavljenostjo (faza uravnoteženja) je treba časovno načrtovati ob upoštevanju lastnosti preskusne kemikalije.
|
|
|
Dejavnosti, opisane za 3. dan, je treba izvajati dnevno (vsaj ob delovnikih).
|
|
|
(b)
|
Faza izločanja
|
Dan
|
Dejavnost
|
|
– 6
|
Priprava in vlaženje sestavin zemljine; 48-urno kondicioniranje pripravljene zemljine;
|
|
– 4
|
mešanje sestavin zemljine; razporejanje zemljine v preskusne posode; 4-dnevna inkubacija v preskusnih pogojih;
|
|
0 (konec faze absorpcije)
|
merjenje temperature in vrednosti pH tal; tehtanje in naključna razporeditev črvov v preskusne posode; dodajanje obroka hrane; premestitev črvov iz preostalih izpostavljenih ponovitev v posode s čisto zemljino; jemanje vzorcev tal in črvov po 4–6 urah za določitev koncentracije preskusne kemikalije;
|
|
1
|
kontrola dotoka zraka, zapisovanje obnašanja črvov in temperature; jemanje vzorcev tal in črvov za določitev koncentracije preskusne kemikalije;
|
|
2
|
enako kot 1. dan;
|
|
3
|
kontrola dotoka zraka, obnašanja črvov in temperature;
|
|
4
|
enako kot 1. dan;
|
|
5–6
|
enako kot 3. dan;
|
|
7
|
enako kot 1. dan; dodajanje obroka hrane; kontrola vlage v tleh s ponovnim tehtanjem preskusnih posod in nadomeščanje izhlapele vode;
|
|
8–9
|
enako kot 3. dan;
|
|
10
|
enako kot 1. dan;
|
|
11–13
|
enako kot 3. dan;
|
|
14
|
enako kot 1. dan; dodajanje obroka hrane; kontrola vlage v tleh s ponovnim tehtanjem preskusnih posod in nadomeščanje izhlapele vode;
|
|
15–16
|
enako kot 3. dan;
|
|
17
|
enako kot 1. dan;
|
|
18–20
|
enako kot 3. dan;
|
|
21
|
enako kot 1. dan; merjenje temperature in vrednosti pH tal; kontrola vlage v tleh s ponovnim tehtanjem preskusnih posod; vzorčenje tal in črvov iz kontrolnih vzorcev s topilom.
|
|
|
Tla pred začetkom faze izločanja je treba pripraviti enako kot pred fazo absorpcije.
|
|
|
Dejavnosti, opisane za 3. dan, je treba izvajati dnevno (vsaj ob delovnikih).
|
|
Preskus z enhitreji
|
(a)
|
Faza absorpcije z 8 datumi vzorčenja za izračun kinetike
|
Dan
|
Dejavnost
|
|
– 6
|
48-urno kondicioniranje pripravljene zemljine;
|
|
– 4
|
dodajanje raztopine preskusne kemikalije v del zemljine; izparevanje morebitnega topila; mešanje sestavin zemljine; razporejanje zemljine v preskusne posode; 4-dnevno vzpostavljanje ravnotežja v preskusnih pogojih (3 tedne za zemljinela s primešano kovino);
|
|
–3 do –1
|
izločevanje preskusnih organizmov iz gojišča za aklimatizacijo; priprava in vlaženje sestavin zemljine;
|
|
0
|
merjenje temperature in vrednosti pH tal; odstranjevanje vzorcev tal iz tretiranih posod in kontrolnih vzorcev s topilom za določitev koncentracije preskusne kemikalije; dodajanje obroka hrane v tla; tehtanje in naključna razporeditev črvov v preskusne posode; zadržanje zadostnih podvzorcev črvov za določanje analitskih vrednosti ozadja, mokre in suhe teže ter vsebnosti lipidov; tehtanje vseh preskusnih posod za kontrolo vlage v tleh; kontrola dotoka zraka, če se uporabi zaprt preskusni sistem;
|
|
1
|
kontrola dotoka zraka, zapisovanje obnašanja črvov in temperature; jemanje vzorcev tal in črvov za določitev koncentracije preskusne snovi;
|
|
2
|
enako kot 1. dan;
|
|
3
|
kontrola dotoka zraka, obnašanja črvov in temperature;
|
|
4
|
enako kot 1. dan;
|
|
5–6
|
enako kot 3. dan;
|
|
7
|
enako kot 1. dan; dodajanje obroka hrane v tla; kontrola vlage v tleh s ponovnim tehtanjem preskusnih posod in nadomeščanje izhlapele vode;
|
|
9
|
enako kot 1. dan;
|
|
10
|
enako kot 3. dan;
|
|
11
|
enako kot 1. dan;
|
|
12–13
|
enako kot 3. dan;
|
|
14
|
enako kot 1. dan; dodajanje obroka hrane v tla; merjenje temperature in vrednosti pH tal; kontrola vlage v tleh s ponovnim tehtanjem preskusnih posod; konec faze absorpcije; premestitev črvov iz preostalih izpostavljenih ponovitev v posode s čisto zemljino za fazo izločanja (brez praznjenja prebavil); vzorčenje tal in črvov iz kontrolnih vzorcev s topilom.
|
|
|
Dejavnosti pred izpostavljenostjo (faza uravnoteženja) je treba časovno načrtovati ob upoštevanju lastnosti preskusne kemikalije.
|
|
|
Dejavnosti, opisane za 3. dan, je treba izvajati dnevno (vsaj ob delovnikih).
|
|
Dodatek 4
Umetna zemljina – priporočila glede priprave in shranjevanja
Ker naravna zemljina iz določenega vira ni nujno na voljo vse leto in ker lahko domorodni organizmi in prisotna mikroonesnaževala vplivajo na preskus, se za ta preskus priporoča umetni substrat – umetna zemljina v skladu s poglavjem C.8 te priloge, Strupenost za deževnike (48). V takih tleh lahko preživi, raste in se razmnožuje več preskusnih vrst, zagotovljeni pa so tudi največja mogoča standardizacija ter primerljivost preskusnih pogojev in pogojev gojenja znotraj laboratorija in med laboratoriji.
Sestavine zemljine
|
Šota:
|
10 %
|
Šotni mah, v skladu s smernico OECD 207 (48).
|
|
Kremenov pesek:
|
70 %
|
Industrijski kremenov pesek (sušen na zraku); velikost zrnc: več kot 50 % delcev mora biti velikih 50 do 200 μm, vsi delci pa morajo biti ≤ 2 mm.
|
|
Kaolinska glina:
|
20 %
|
Vsebnost kaolinita ≥ 30-odstotna.
|
|
Kalcijev karbonat:
|
≤ 1 %
|
CaCO3, zdrobljen v prah, kemijsko čist.
|
Lahko se tudi zmanjša vsebnost organskega ogljika v umetni zemljini, npr. z zmanjšanjem vsebnosti šote na 4–5 % suhe zemljine in ustreznim povečanjem vsebnosti peska. S takim zmanjšanjem vsebnosti organskega ogljika se lahko zmanjšajo možnosti adsorpcije preskusne kemikalije na zemljino (organski ogljik), razpoložljivost preskusne kemikalije za črve pa se lahko poveča (74). Dokazano je, da lahko Enchytraeus albidus in Eisenia fetida izpolnjujeta merila veljavnosti v zvezi z razmnoževanjem, če se preskus izvaja z naravno zemljino z manjšo vsebnostjo organskega ogljika, npr. 2,7 % (33), (211), izkušnje pa kažejo, da je to mogoče doseči tudi pri umetni zemljini s 5 % šote.
Priprava
Suhe sestavine zemljine se temeljito premešajo (npr. v velikem laboratorijskem mešalniku). To je treba storiti približno en teden pred začetkom preskusa. Zmešane suhe sestavine zemljine je treba navlažiti z deionizirano vodo vsaj 48 h pred primešanjem preskusne snovi, da se kislost uravnoteži/stabilizira. Za določitev pH se uporabi mešanica zemljine in 1 M raztopine KCl v razmerju 1 : 5. Če vrednost pH ni znotraj zahtevanega obsega (6,0 ± 0,5), se zemljini doda zadostna količina CaCO3 ali pripravi nova šarža zemljine.
Največja zmogljivost zadrževanja vode (WHC) v umetni zemljini se določi v skladu z ISO 11268-2 (35). Vsaj dva dneva pred začetkom preskusa se suha umetna zemljina navlaži z dovolj deionizirane ali rekonstituirane vode, da nastane približno polovica končne vsebnosti vode. Končna vsebnost vode mora biti med 40 in 60 % največje WHC. Na začetku preskusa se predhodno navlažena zemljina razdeli na toliko šarž, kot je preskusnih koncentracij in kontrolnih vzorcev, uporabljenih v preskusu, vsebnost vlage pa se prilagodi na 40–60 % WHCmax z raztopino preskusne snovi in/ali dodajanjem deionizirane ali rekonstituirane vode. Vsebnost vlage se določi na začetku in koncu preskusa (pri 105 °C). Biti mora optimalna za potrebe uporabljenih vrst živali (vsebnost vlage je mogoče preveriti tudi na naslednji način: če se zemljina nežno stisne v roki, se morajo med prsti pojaviti majhne kapljice vode).
Shranjevanje
Suhe sestavine umetne zemljine se lahko do uporabe hranijo pri sobni temperaturi. Pripravljena predhodno navlažena zemljina se lahko hrani na hladnem do tri dni pred primešanjem preskusne kemikalije; paziti je treba, da je izhlapevanje vode čim manjše. Zemljino s primešano preskusno snovjo je treba uporabiti takoj, razen če obstajajo podatki o tem, da je mogoče določeno zemljino shranjevati, ne da bi to vplivalo na strupenost in biološko razpoložljivost preskusne snovi. Vzorci zemljine s primešano preskusno snovjo se lahko nato do analize hranijo v pogojih, priporočenih za zadevno preskusno snov.
Dodatek 5
Vrste kopenskih maloščetincev, priporočene za preskušanje bioakumulacije iz tal
Deževniki
Priporočena preskusna vrsta je Eisenia fetida (Savigny 1826), ki spada v družino Lumbricidae. Od leta 1972 se deli na dve podvrsti (Eisenia fetida in Eisenia andrei (10)). Jaenike trdi (36), da sta to pravi ločeni vrsti. Vrsto Eisenia fetida je mogoče brez težav prepoznati po svetlih rumenih črtah med kolobarji, Eisenia andrei pa je enotne temno rdeče barve. Izvirajo verjetno iz črnomorske regije, danes pa so razširjeni po vsem svetu, zlasti v antropogeno prilagojenih habitatih, kot so kompostni kupi. Obe podvrsti je mogoče uporabljati za ekotoksikološke in bioakumulacijske preskuse.
Eisenia fetida in Eisenia andrei sta komercialno dostopni vrsti, npr. kot vaba za ribe. V primerjavi z drugimi deževniki iz družine Lumbricidae imajo kratek življenjski ciklus in dosežejo zrelost pri približno 2–3 mesecih (pri sobni temperaturi). Njihova optimalna temperatura je približno 20–24 °C. Najraje imajo razmeroma vlažne substrate s skoraj nevtralno vrednostjo pH in visoko vsebnostjo organske snovi. Ker se ti vrsti zelo pogosto uporabljata v standardiziranih ekotoksikoloških preskusih že približno 25 let, je njuno gojenje dobro uveljavljeno (48) (77).
Obe vrsti je mogoče gojiti v zelo različnih živalskih odpadkih. Medij za gojenje, priporočen v ISO (35), je mešanica konjskega ali govejega gnoja in šote v razmerju 50: 50. Medij mora imeti vrednost pH približno 6–7 (uravnavano s kalcijevim karbonatom), majhno ionsko prevodnost (manj kot 6 mS/cm ali manj kot 0,5-odstotna koncentracija soli) in ne sme biti pretirano kontaminiran z amonijem ali živalskim urinom. Uporabiti je mogoče tudi komercialno vrtno prst brez aditivov ali umetno zemljino v skladu z OECD (48) ali mešanico obeh v razmerju 50: 50. Substrat mora biti vlažen, vendar ne preveč moker. Primerne so škatle za gojenje s prostornino 10 do 50 litrov.
Za črve standardne starosti in teže je gojenje najbolje začeti s kokoni. Zato se v škatle za gojenje s svežim substratom dajo odrasli črvi, da naredijo kokone. Praktične izkušnje so pokazale, da so pri gostoti populacije približno 100 odraslih črvov na kg substrata (mokra teža) dobre stopnje razmnoževanja. Po 28 dneh se odrasli črvi odstranijo. Deževniki, ki se izležejo iz kokonov, se uporabijo za preskušanje, ko so zreli, po vsaj 2 mesecih, vendar prej kot v 12 mesecih.
Črve zgoraj opisanih vrst je mogoče šteti za zdrave, če se premikajo skozi substrat, ga ne poskušajo zapustiti in se stalno razmnožujejo. Zelo počasno premikanje ali rumen zadnji del (pri vrsti Eisenia fetida) kaže na izčrpanje substrata. V tem primeru se priporoča svež substrat in/ali manjše število živali na škatlo.
Dodatni izbrani viri
Gerard, B. M. (1964). Synopsis of the British fauna. No. 6 Lumbricidae. Linnean Soc. London, 6: 1–58.
Graff, O. (1953). Die Regenwürmer Deutschlands. Schr. Forsch. Anst. Landwirtsch. 7: 1–81.
Römbke, J., Egeler, P., Füll, C. (1997). Literaturstudie über Bioakkumulationstests mit Oligochaeten im terrestrischen Medium. Bericht für das UBA F + E 206 03 909, 86 S.
Rundgren, S. (1977). Seasonality of emergence in lumbricids in southern Sweden. Oikos 28: 49–55.
Satchell, J. E. (1955). Some aspects of earthworm ecology. Soil Zoology (Kevan): 180–201.
Sims, R. W., in Gerard, B. M. (1985). A synopsis of the earthworms. Linnean Soc. London 31: 1–171.
Tomlin, A. D. (1984). The earthworm bait market in North America. In: Earthworm Ecology – from Darwin to vermiculture. Satchell, J.E. (ur.), Chapman & Hall, London. str. 331–338.
Enhitreji
Priporočena preskusna vrsta je Enchytraeus albidus Henle 1837 (enhitrej). Enchytraeus albidus je ena od največjih (do 15 mm) vrst maloščetinarjev kolobarnikov iz družine Enchytraeidae in je razširjena po vsem svetu, npr. (8). Živi v morskih, sladkovodnih in kopenskih habitatih, večinoma v razpadajoči organski snovi (morske alge, kompost), redko pa na travnikih (42). Ta široka ekološka toleranca in nekatere morfološke variacije kažejo na to, da morda obstajajo različne podvrste te vrste.
Enchytraeus albidus je komercialno dostopna vrsta in se prodaja kot hrana za ribe. Treba je preveriti, ali je kultura kontaminirana z drugimi, običajno manjšimi vrstami (60). Ob kontaminaciji je treba vse črve oprati z vodo v petrijevki. Nato se (s stereomikroskopom) izberejo veliki odrasli osebki vrste Enchytraeus albidus, da se iz njih vzgoji nova kultura. Vsi drugi črvi se zavržejo. Življenjski ciklus enhitrejev je kratek, saj zrelost dosežejo v starosti med 33 dnevi (pri 18 °C) in 74 dnevi (pri 12 °C). Za preskus se uporabijo samo kulture, ki so bile v laboratoriju brez težav že vsaj 5 tednov (ena generacija).
Primerne so tudi druge vrste rodu Enchytraeus, zlasti Enchytraeus luxuriosus. Ta vrsta je pravi prebivalec tal, ki je bil na novo opisan v (65). Če se uporabijo druge vrste Enchytraeus, jih je treba jasno identificirati in poročati o razlogih za izbiro.
Enchytraeus crypticus (Westheide in Graefe 1992) je vrsta, ki spada v isto skupino kot Enchytraeus luxuriosus. Ni bilo nedvomno ugotovljeno, da obstaja v naravnem okolju, saj je bila opisana samo v kulturah deževnikov in kompostnih kupih (Römbke 2003). Njene izvirne ekološke potrebe zato niso znane. Toda nedavne laboratorijske raziskave z različnimi naravnimi zemljinami so potrdile, da ta vrsta dobro prenaša različne lastnosti tal, kot so pH in tekstura (Jänsch idr. 2005). V zadnjih letih se ta vrsta pogosto uporablja v ekotoksikoloških raziskavah, ker jo je preprosto gojiti in preskušati, npr. Kuperman idr. 2003. Vendar so te živali majhne (3–12 mm; povprečno 7 mm (Westheide in Müller 1996)), zato je z njimi težje ravnati kot z vrsto Enchytraeus albidus. Če se uporablja ta vrsta namesto vrste Enchytraeus albidus, je lahko preskusna posoda manjša, ni pa to nujno. Poleg tega je treba upoštevati, da se ta vrsta zelo hitro razmnožuje in da je obdobje ene generacije krajše od 20 dni pri 20 ± 2 °C (Achazi idr. 1999), pri višjih temperaturah pa še krajše.
Enchytraeidae vrste Enchytraeus albidus (in druge vrste roda Enchytraeus) je mogoče gojiti v velikih plastičnih škatlah (npr. 30 × 60 × 10 cm ali 20 × 12 × 8 cm, kar je primerno za kulturo majhnih črvov), napolnjenih z mešanico umetne zemljine in komercialne dostopne nekontaminirane vrtne prsti brez aditivov. Kompostnemu materialu se je treba izogibati, saj lahko vsebuje strupene kemikalije, kot so težke kovine. Živali je treba pred uporabo odstraniti iz zemljine za gojenje s trikratnim globokim zamrzovanjem. Uporabiti je mogoče tudi čisto umetno zemljino, vendar je lahko razmnoževanje počasnejše v primerjavi z mešanimi substrati. Substrat mora imeti pH 6,0 ± 0,5. Kultura se goji v inkubatorju pri temperaturi 15 ± 2 °C brez svetlobe. Vsekakor se je treba izogibati temperaturi, višji od 23 °C. Umetna/naravna zemljina mora biti vlažna, vendar ne mokra. Če se nežno stisne v roki, bi se morale pojaviti samo majhne kaplje vode. Vsekakor se je treba izogibati anoksičnim pogojem (npr. če se uporabi pokrov, mora število lukenj v pokrovu zadostovati za zadostno izmenjavo zraka). Tla za gojenje je treba enkrat tedensko prezračevati s pazljivim mešanjem.
Črve je treba vsaj enkrat tedensko hraniti ad libitum z ovsenimi kosmiči, položenimi v luknjo na površini tal in pokritimi s prstjo. Če hrana, dodana na zadnji datum hranjenja, ostane v posodi, je treba količino hrane ustrezno prilagoditi. Če na preostali hrani zrasejo glive, jo je treba nadomestiti z novo količino ovsenih kosmičev. Za spodbujanje razmnoževanja se lahko ovsenim kosmičem vsaka dva tedna doda komercialno dostopen proteinski prah, obogaten z vitamini. Po treh mesecih se živali premestijo v sveže pripravljeno gojišče ali substrat za gojenje. Ovsene kosmiče, ki morajo biti shranjeni v zatesnjenih posodah, je treba pred uporabo avtoklavirati ali segreti, da se preprečijo okužbe s pršicami iz moke (npr. Glyzyphagus sp., Astigmata, Acarina) ali predatorskimi pršicami (npr. Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina). Ko je hrana razkužena, jo je treba zmleti, da jo je mogoče z lahkoto potresti po površini tal. Vir hrane je lahko tudi pekovski kvas ali hrana za ribe TetraMin®.
Na splošno so pogoji gojenja zadovoljivi, če črvi ne poskušajo zapustiti substrata, se skozi tla hitro gibljejo, imajo bleščečo zunanjo površino brez delcev zemljine, ki bi se je držali, in so bolj ali manj belkaste barve ter če so vidni črvi različnih starosti. Dejansko je mogoče črve šteti za zdrave, če se stalno razmnožujejo.
Dodatni izbrani viri
Achazi, R. K., Fröhlich, E., Henneken, M., Pilz, C. (1999). The effect of soil from former irrigation fields and of sewage sludge on dispersal activity and colonizing success of the annelid Enchytraeus crypticus (Enchytraeidae, Oligochaeta). Newsletter on Enchytraeidae 6: 117–126.
Jänsch, S., Amorim, M. J. B., Römbke, J. (2005). Identification of the ecological requirements of important terrestrial ecotoxicological test species. Environ. Reviews 13: 51–83.
Kuperman, R. G., Checkai, R. T., Simini, M., Phillips, C. T., Kolakowski, J. E., Kurnas, C. W., Sunahara, G. I. (2003). Survival and reproduction of Enchytraeus crypticus (Oligochaeta, Enchytraeidae) in a natural sandy loam soil amended with the nitro-heterocyclic explosives RDX and HMX. Pedobiologia 47: 651–656.
Römbke, J. (2003). Ecotoxicological laboratory tests with enchytraeids: A review. Pedobiologia 47: 607–616.
Westheide, W., in Graefe, U. (1992). Two new terrestrial Enchytraeus species (Oligochaeta, Annelida). J. Nat. Hist. 26: 479–488.
Westheide, W., in Müller, M. C. (1996). Cinematographic documentation of enchytraeid morphology and reproductive biology. Hydrobiologia 334: 263–267.
“ |

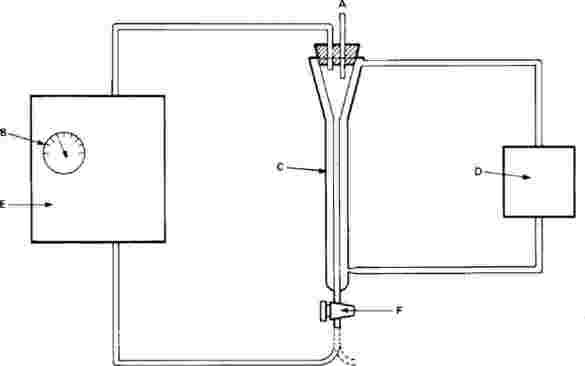


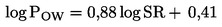
 (v molih),
(v molih),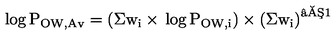
 ).
).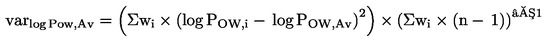
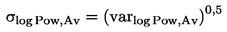
 . V primeru nižjih koncentracij so potrebni večji volumni,
. V primeru nižjih koncentracij so potrebni večji volumni,

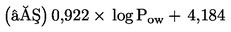
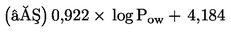

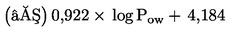












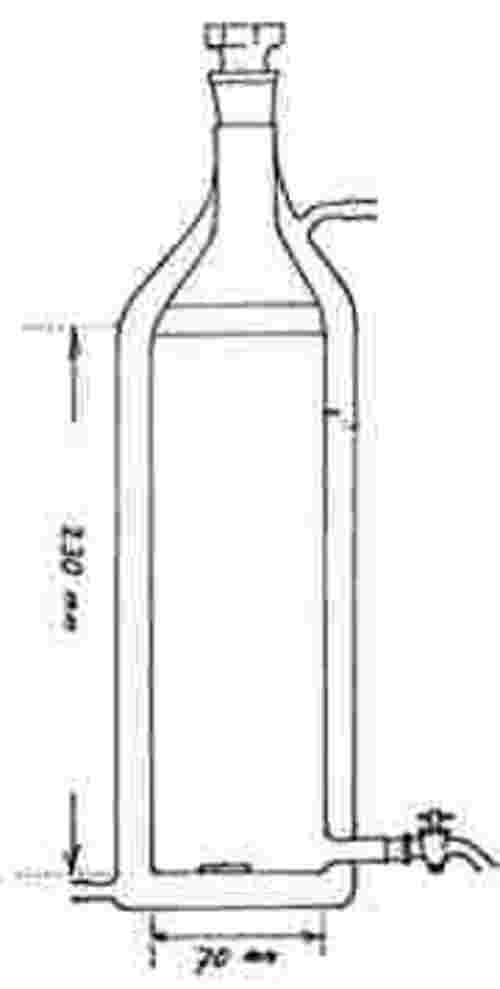





 ,
,
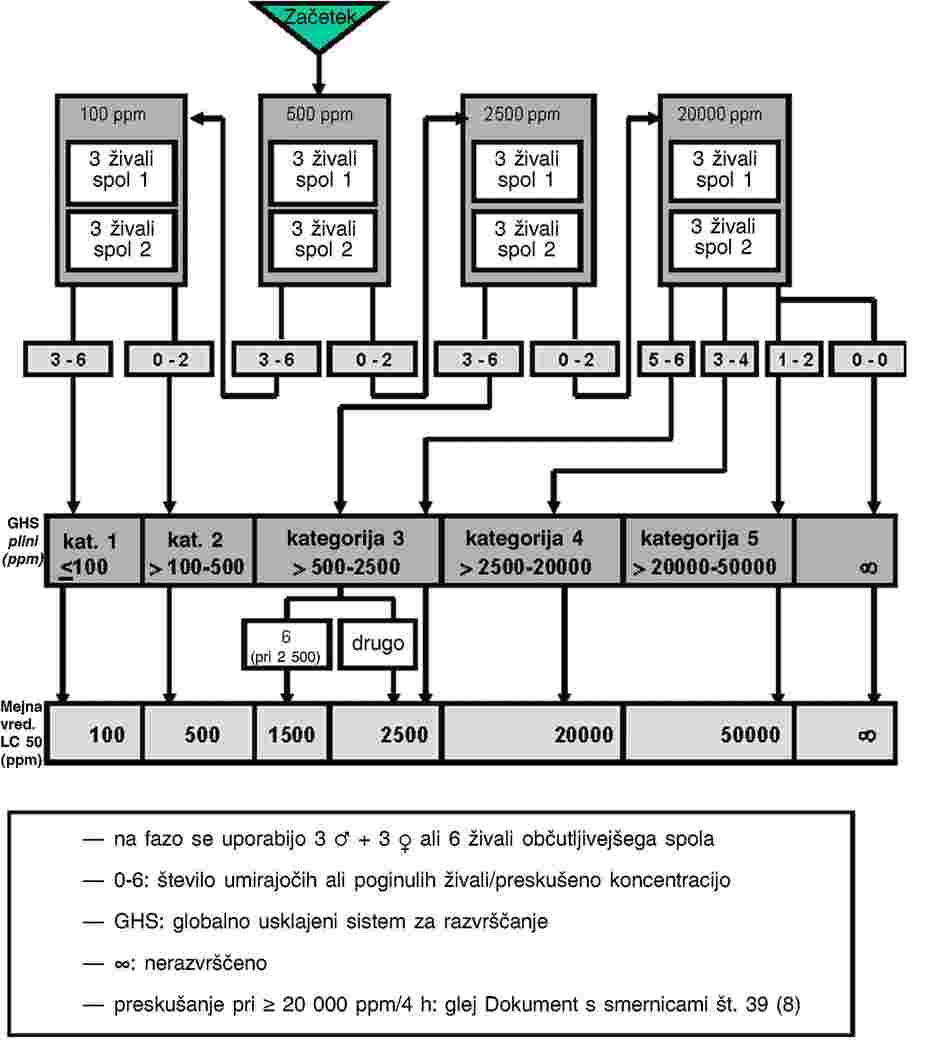
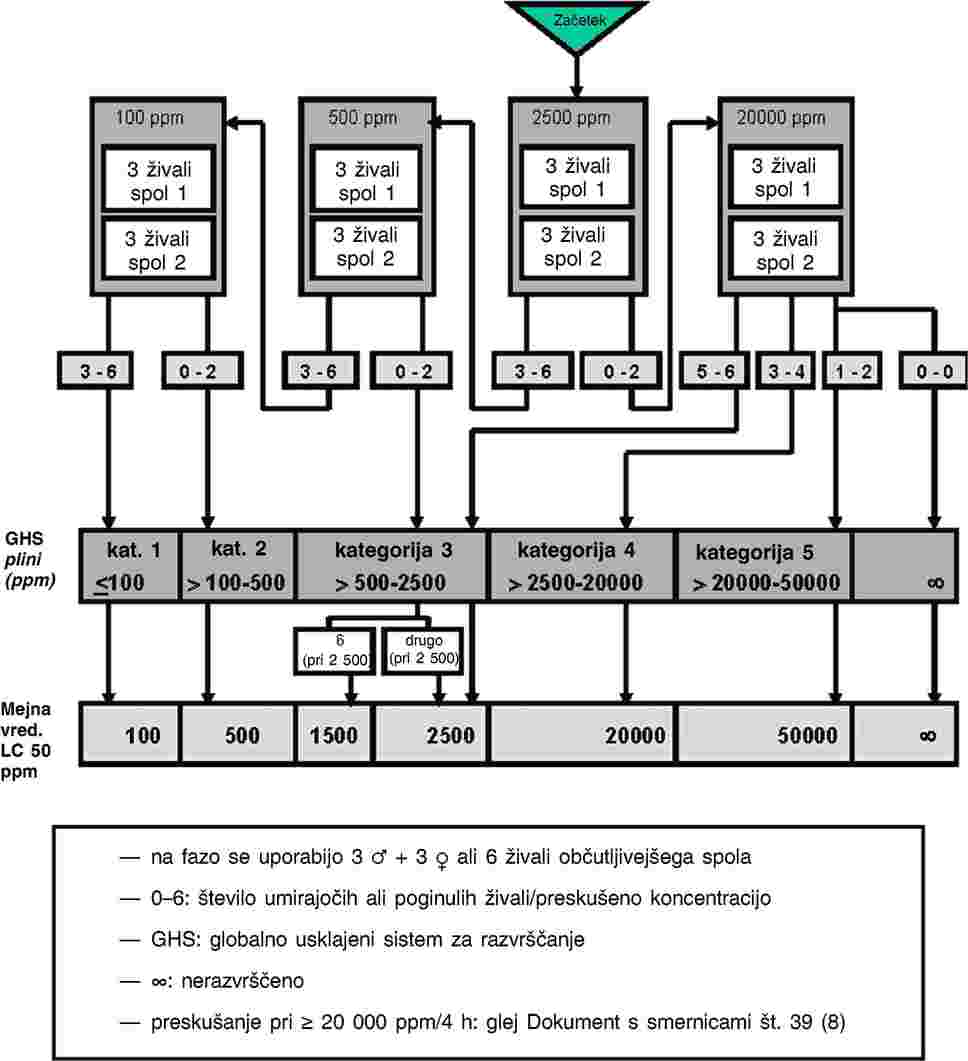




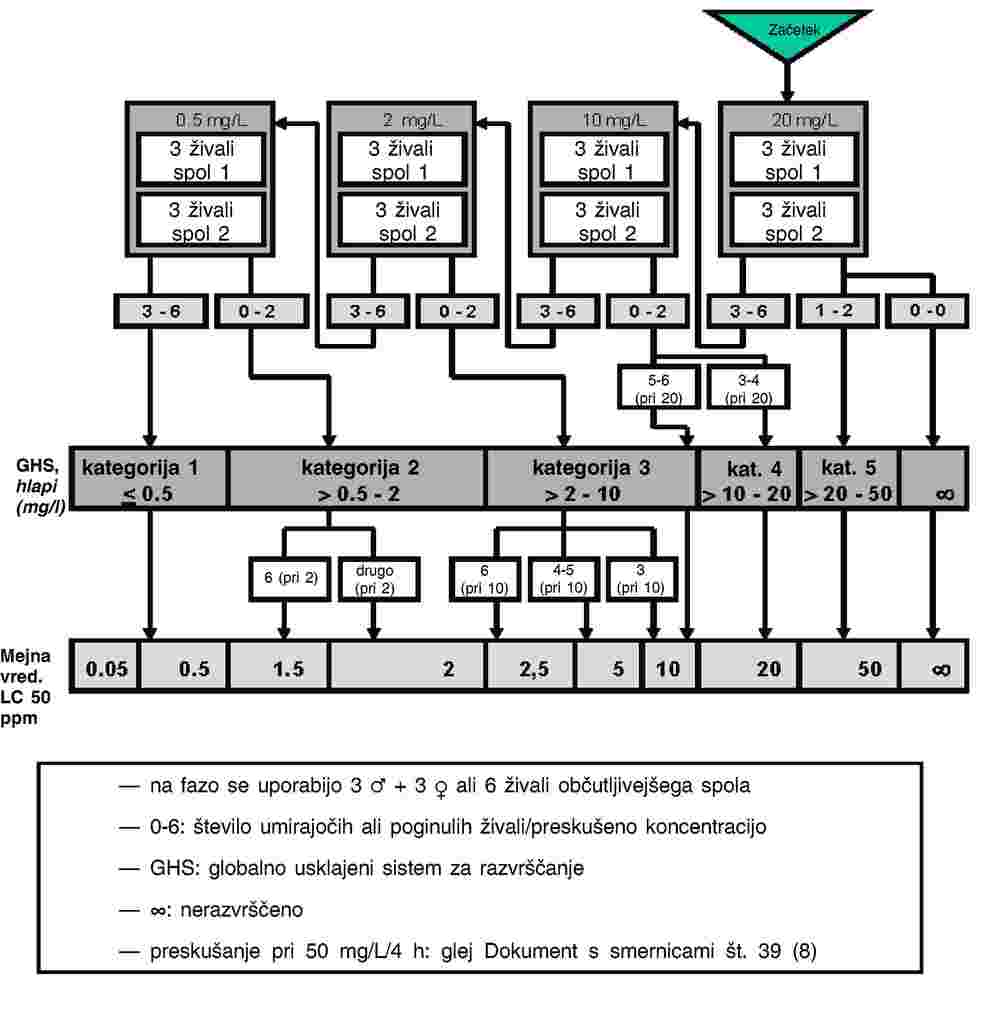



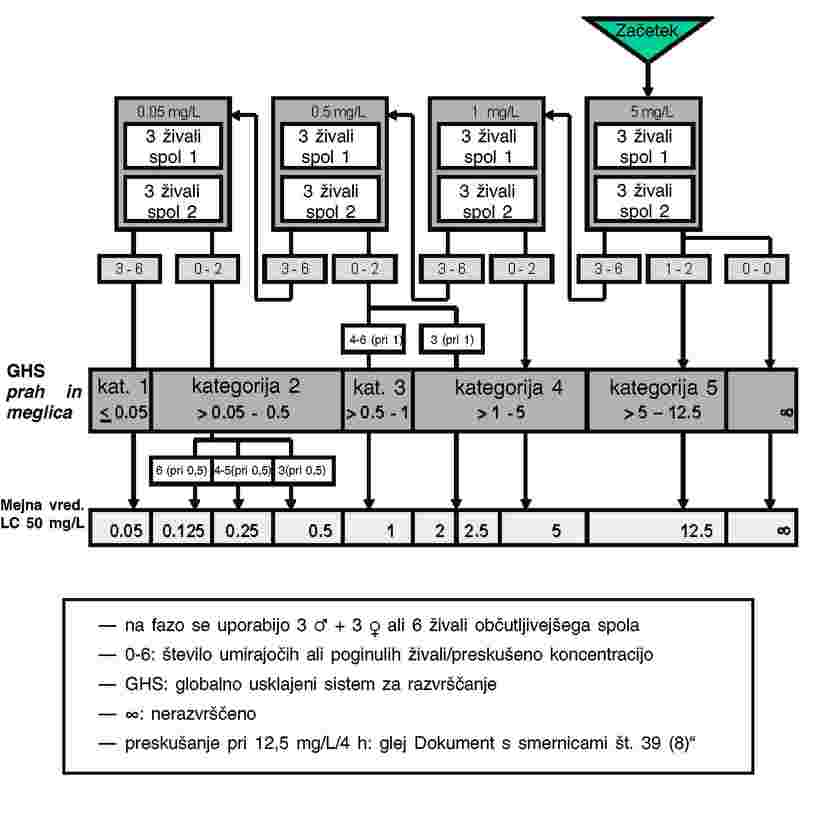
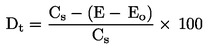
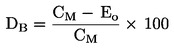
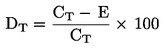

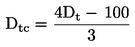


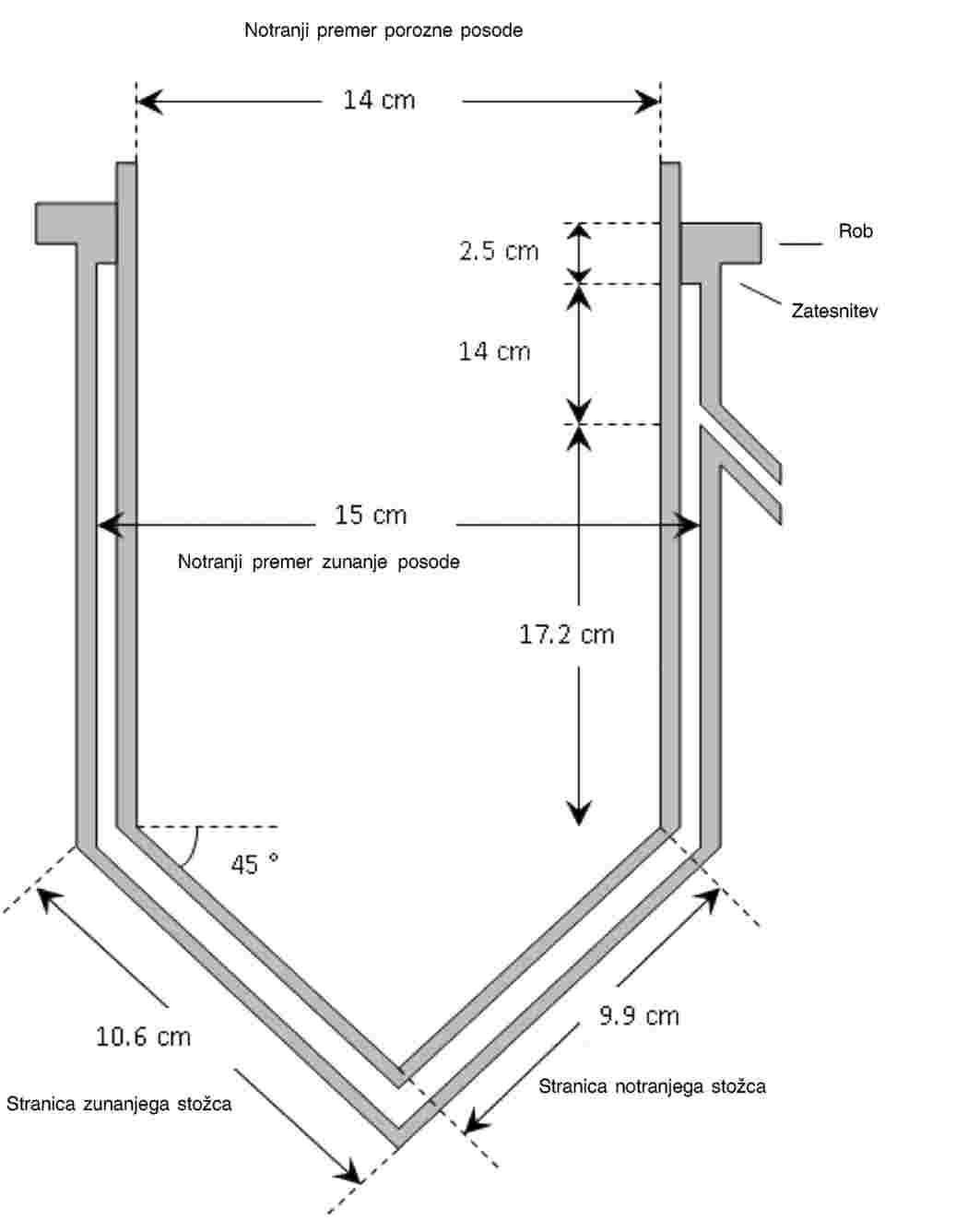




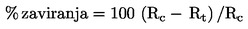



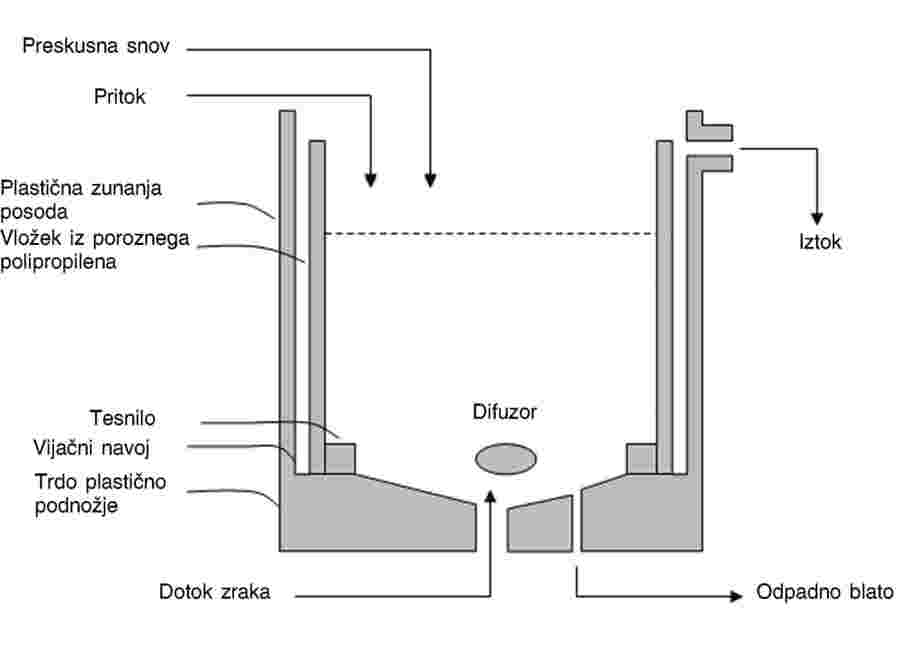

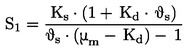



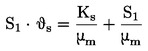






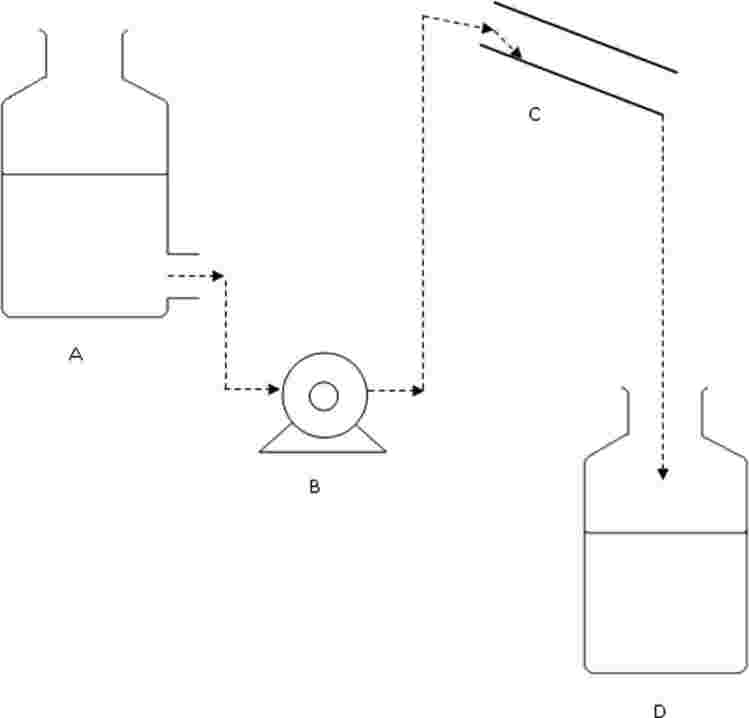
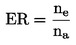
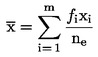


 )
)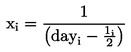

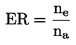
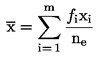

 )
)

 .
.